Истмико-цервикальная недостаточность — что это такое
Автор статьи:
БАТАЕВА РОЗА САИДОВНА
ГЛАВНЫЙ ВРАЧ ЦЕНТРА МЕДИЦИНЫ ПЛОДА В МОСКВЕ, СПЕЦИАЛИСТ ПО ПРЕНАТАЛЬНОЙ ДИАГНОСТИКЕ (МЕДИЦИНЕ ПЛОДА), ВРАЧ УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ, КАНДИДАТ МЕДИЦИНСКИХ НАУК.
Содержание
- Причины истмико-цервикальной недостаточности
- Симптомы и диагностика ИЦН
- Способы лечения ИЦН
- Прогноз лечения ИЦН
- Профилактика истмико-цервикальной недостаточности
Невынашивание беременности является серьезной проблемой в современном акушерстве. Около 10-20 % беременностей заканчиваются самопроизвольными выкидышами или преждевременными родами. Возможных причин невынашивания беременности множество. Это и гормональные расстройства, и заболевания матери, и генетические нарушения, и воздействие факторов внешней среды. Одной из серьезных проблем, приводящих к невынашиванию беременности, является так называемая истмико-цервикальная недостаточность

Матка по форме напоминает грушу. В ее строении выделяют тело и шейку. Во время беременности плод находится внутри тела матки, а благодаря наличию мышечных клеток, тело матки значительно увеличивается в течение беременности. Шейка матки имеет форму цилиндра. Со стороны тела матки она ограничена внутренним зевом, в области которого кроме мышечных клеток находится большое количество соединительной ткани, и формируется кольцо, способствующее удержанию плода в матке (сфинктер). Участок перехода тела матки в шейку называется перешейком (истмус). Во влагалище шейка матки открывается наружным зевом. Во время родов происходит сглаживание шейки матки, расслабление мышечных клеток и открытие шейки матки, которая формирует родовой канал.
При нарушении целостности или функции сфинктера и внутреннего зева шейки матки, недостаточной замыкательной функции истмуса, развивается так называемая истмико-цервикальная недостаточность.
При истмико-цервикальной недостаточности во время беременности происходит самопроизвольное сглаживание и раскрытие шейки матки, не связанное с сократительной активностью матки. Плодное яйцо при этом лишается необходимой опоры в нижнем маточном сегменте. При увеличении давления внутри матки плодные оболочки начинают выпячиваться в расширенный канал шейки матки, что приводит к преждевременным родам. Обычно роды начинаются с преждевременного излития околоплодных вод. Это происходит потому, что выбухающие в канал шейки матки плодные оболочки могут инфицироваться бактериями, находящимися в составе микрофлоры влагалища. Вследствие этого оболочки теряют эластичность, происходит их самопроизвольный разрыв, излитие околоплодных вод и инфицирование малыша внутриутробно бактериями, находящимися во влагалище беременной женщины.
Плодное яйцо при этом лишается необходимой опоры в нижнем маточном сегменте. При увеличении давления внутри матки плодные оболочки начинают выпячиваться в расширенный канал шейки матки, что приводит к преждевременным родам. Обычно роды начинаются с преждевременного излития околоплодных вод. Это происходит потому, что выбухающие в канал шейки матки плодные оболочки могут инфицироваться бактериями, находящимися в составе микрофлоры влагалища. Вследствие этого оболочки теряют эластичность, происходит их самопроизвольный разрыв, излитие околоплодных вод и инфицирование малыша внутриутробно бактериями, находящимися во влагалище беременной женщины.
Причины истмико-цервикальной недостаточности
Предшествующие травмы
Прежде всего, это предшествующие травмы. Они приводят к так называемой травматической или органической ИЦН. Чаще всего это травматичные роды, при которых происходит разрыв шейки матки, предшествующие аборты или диагностические выскабливания полости матки, во время которых производится инструментальное расширение шейки матки.
Гормональные нарушения
Функциональная истмико-цервикальная недостаточность формируется в результате гормональных нарушений в организме беременной женщины. Это могут быть выраженное недоразвитие внутренних половых органов, дефицит половых гормонов, снижение нормальной функции яичников, иногда ИЦН формируется при повышенном уровне мужских половых гормонов в крови. Все перечисленные причины приводят к нарушению соотношения мышечной и соединительной ткани в перешейке и шейке матки, изменяется реакция мышечных клеток шейки матки на нервные импульсы.
Врожденная истмико-цервикальная недостаточность
В редких случаях, при пороках развития матки может встречаться врожденная истмико-цервикальная недостаточность.
Симптомы и диагностика ИЦН
Специфических симптомов истмико-цервикальной недостаточности нет. Беременную женщину могут беспокоить тяжесть внизу живота или в поясничной области, могут участиться позывы к мочеиспусканию за счет давления плода на мочевой пузырь.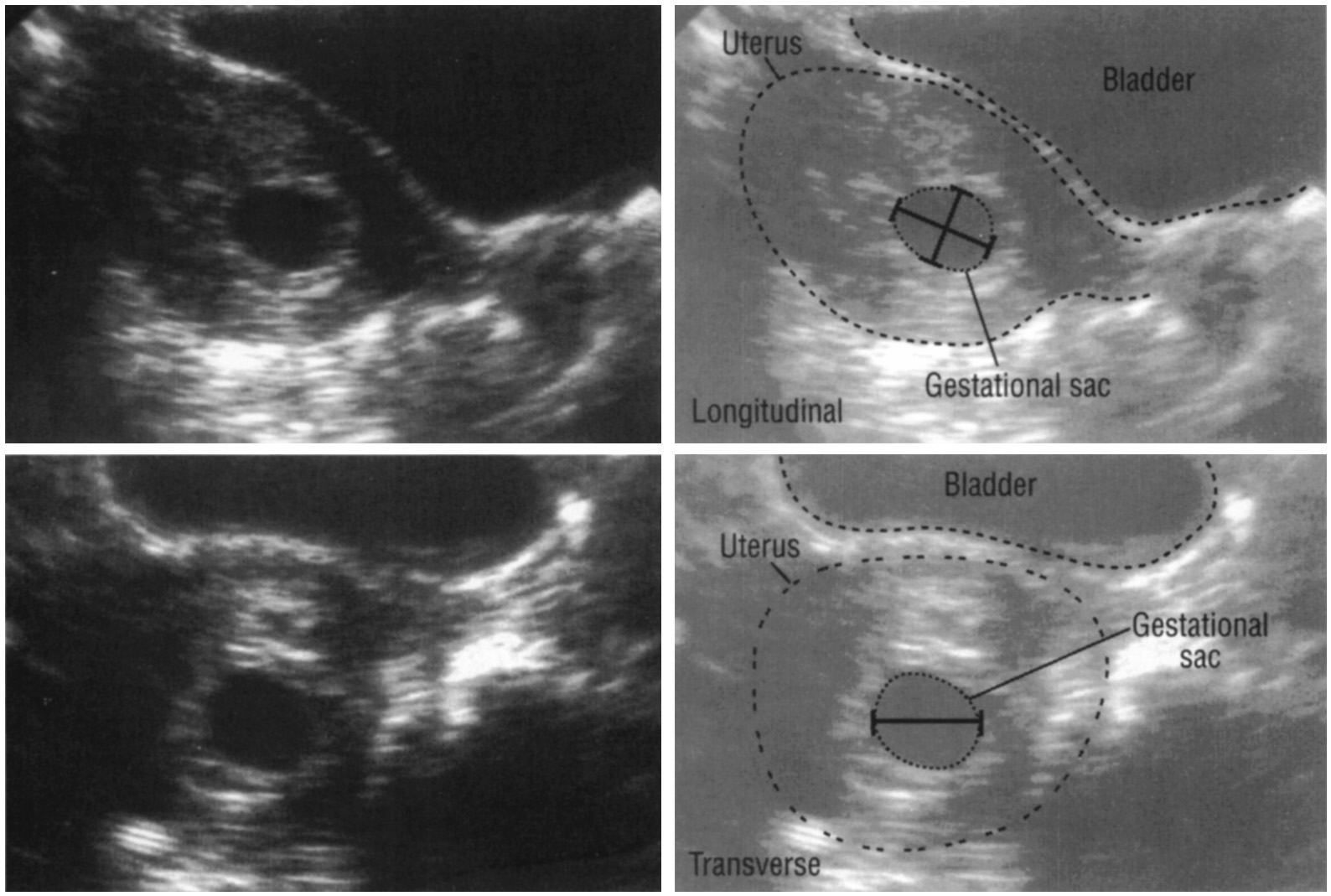
Постановка диагноза истмико-цервикальной недостаточности производится преимущественно во время беременности, поскольку только во время беременности имеются объективные условия оценки функции шейки матки и ее истмического отдела. Вне беременности врачи предпринимают ряд специальных проб для выявления ИЦН. Проводится рентгенологическое исследование матки на 18-20 день цикла, производится оценка степени расширения канала шейки матки во вторую фазу менструального цикла с помощью специальных инструментов.
Во время беременности в качестве мониторинга состояния шейки матки используется трансвагинальное ультразвуковое исследование
У женщин, вынашивающих двойню или тройню до 28 недель беременности нормальной считается длина шейки матки более 37 мм у первобеременных и более 45 мм у повторнобеременных пацеинток. У многорожавших женщин длина шейки матки в сроке 17-20 недель беременности должна быть более 29 мм.
У многорожавших женщин длина шейки матки в сроке 17-20 недель беременности должна быть более 29 мм.
Абсолютным признаком наличия истмико-цервикальной недостаточности является укорочение шейки матки до 2 см и менее
При осмотре шейки матки через брюшную стенку, то есть трансабдоминально, измерения длины шейки примерно на полсантиметра превышают таковые при трансвагинальном осмотре, кроме того, на изменение ее длины влияет степень наполнения мочевого пузыря. Кроме длины шейки матки, при проведении ультразвукового исследования оценивается состояние внутреннего зева, имеется ли открытие зева и выбухание в канал шейки матки плодного пузыря.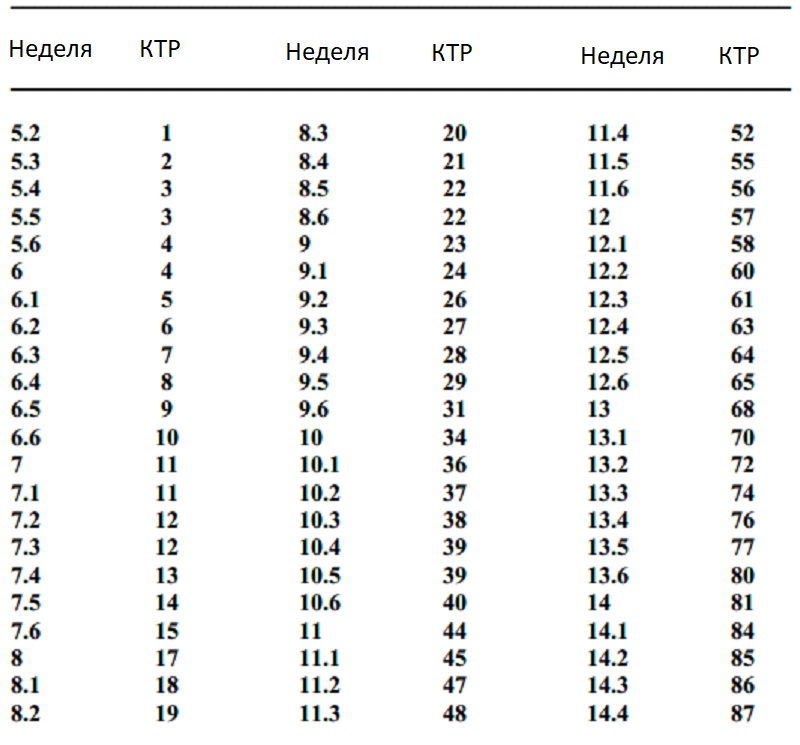
Однако ставить диагноз истмико-цервикальной недостаточности только по результатам ультразвукового исследования не правильно. Более точную информацию дает осмотр шейки матки врачом-гинекологом. Осмотр производится в гинекологическом кресле. При этом врач оценивает длину влагалищной части шейки матки, ее плотность, степень открытия канала шейки матки.
Способы лечения ИЦН
С целью профилактики преждевременных родов при истмико-цервикальной недостаточности с 20 по 34 недели беременности назначаются препараты прогестерона (ДЮФАСТОН, УТРОЖЕСТАН) – гормона, вырабатывающегося в плаценте и поддерживающего беременность.
Существуют два способа лечения истмико-цервикальной недостаточности. Это нехирургические методы и хирургические.
Нехирургические методы
К нехирургическим методам относят введение во влагалище специальных акушерских пессариев – колец, которые надеваются на шейку матки и препятствуют ее дальнейшему раскрытию, поддерживая предлежащую часть плода.
Хирургические методы
При выраженной истмико-цервикальной недостаточности применение колец неэффективно. Не используют их также при выбухании плодного пузыря в канал шейки матки. В этих случаях лечение осуществляется путем зашивания шейки матки.
Показания к хирургической коррекции ИЦН:
- наличие ранее самопроизвольных выкидышей и преждевременных родов во 2-3 триместрах
- прогрессирующая по данным клинического обследования недостаточность шейки матки, длина шейки матки менее 25 мм по данным трансвагинального УЗИ.

Противопоказания к хирургическому лечению:
- повышенная возбудимость матки, тонус
- заболевания, являющиеся противопоказанием для сохранения беременности, например тяжелые заболевания печени, сердечно-сосудистой системы, инфекционные, генетические заболевания,
- кровотечение,
- пороки развития плода,
- наличие патогенной флоры во влагалище, воспаление влагалища.
Наложение швов на шейку матки обычно проводится с 13 до 27 недели беременности. Сроки проведения операции определяются индивидуально лечащим врачом. Наиболее благоприятны для оперативного лечения срок с 15 по 19 неделю беременности, когда открытие шейки матки не очень выражено и плодный пузырь не выбухает в канал.
Наложение швов на шейку матки производят под общим наркозом. В ряде случаев, например при выбухании нижнего полюса плодного яйца в канал шейки матки, после операции, в целях профилактики возможного инфицирования плодных оболочек, назначаются курс антибиотиков. При неосложненном течении послеоперационного периода беременная выписывается домой через 5-7 дней после операции. Однако каждые 2 недели врач женской консультации должен осматривать шейку матки и брать мазки на флору.
При неосложненном течении послеоперационного периода беременная выписывается домой через 5-7 дней после операции. Однако каждые 2 недели врач женской консультации должен осматривать шейку матки и брать мазки на флору.
Самым частым осложнением после хирургической коррекции истмико-цервикальной недостаточности является прорезывание тканей шейки матки нитью. Это может наступить, если шейка поражена воспалительным процессом или если начинаются сокращения матки, то есть родовая деятельность. Чтобы избежать сокращений матки после наложения швов многим пациенткам назначаются токолитики – препараты снимающие тонус матки.
Швы с шейки матки снимают в 37 – 38 недель беременности. Это производят при осмотре шейки матки в гинекологическом кресле. Процедура снятия швов обычно совершенно безболезненна.
Прогноз лечения ИЦН
Своевременная диагностика истмико-цервикальной недостаточности и своевременная хирургическая или нехирургическая коррекция данного состояния способствуют пролонгированию беременности и прогноз для вынашивания плода благоприятный.
Профилактика истмико-цервикальной недостаточности
Профилактика ИЦН включает ведение здорового образа жизни, отказ от абортов, профилактику воспалительных заболеваний влагалища и шейки матки.
Сохранить любой ценой: причины прерывания беременности
По данным Википедии, самопроизвольным абортом заканчиваются 15-20 % клинически установленных случаев беременности. Эти цифры являются нижней оценочной границей, так как во многих случаях выкидыш происходит на ранних стадиях — до того, как женщина поймет, что она забеременела. Ведь часто клинические признаки выкидыша ошибочно принимают за обильные месячные или за их задержку.
Каковы причины прерывания беременности на разных сроках? Как подготовиться к беременности после неудачного опыта, завершившегося выкидышем? На эти вопросы ответил врач акушер-гинеколог высшей категории МЦ «Bullfinch» АЛЕКСАНДР ГИЛЬ.
— Александр Вадимович, большинство выкидышей случается в начале беременности, и многие женщины недоумевают: отчего это могло произойти?
— Главная причина выкидышей на сроке до 6 недель — это естественный отбор. Идет закладка беременности с врожденными пороками эмбриона, который уже не жизнеспособен — таким образом, осуществляется естественный отбор, в который мы не можем вмешаться.
Идет закладка беременности с врожденными пороками эмбриона, который уже не жизнеспособен — таким образом, осуществляется естественный отбор, в который мы не можем вмешаться.
Вы никогда не узнаете точную причину выкидыша на этом сроке, даже если после абразии (выскабливания слизистой оболочки матки), содержимое отправят на исследование. Как правило, приходит ответ: «беременность на малом сроке» и больше ничего.
Есть еще одна причина прерывания беременности, особенно если она не первая, — резус-конфликт (когда у женщины кровь резус-отрицательная, а мужчины — резус-положительная). Но в нашей стране применяется эффективная профилактика резус-конфликта, так что неприятностей можно избежать на этапе планирования беременности.
В структуре раннего прерывания беременности никто не исключает инфекции и проблемы, связанные с гормонами. На сроке 6-8 недель перспективные беременности часто прерываются в связи с нехваткой гормонов. При нормальной беременности у женщины в одном из яичников есть так называемое желтое тело, которое вырабатывает эндогенный прогестерон.
К сожалению, функционирование желтого тела заканчивается примерно к 7 неделям беременности, и если изначально не хватало эндогенного прогестерона, беременность перестает развиваться: происходит отслойка плодного яйца и наступает так называемая замершая беременность.
В некоторых случаях при отслойке плодного яйца, беременность можно сохранить, главное: обратиться вовремя к специалисту. Если по результатам УЗИ-исследования врач видит, что эмбрион ещё живой, беременным женщинам назначают экзогенный прогестерон в таблетках или в свечах. Также существует этот гормон в виде инъекций, — используется, чтобы быстрее насытить организм и предотвратить выкидыш.
— Согласитесь, когда женщина забеременела, она не может подозревать, что у неё в организме не хватает прогестерона. Что должно её насторожить? Какие признаки на это указывают?
— Любые выделения от скудных тёмно-коричневых до более обильных кровянистых — плохой признак. Стоит, не медля, обратиться к гинекологу.
При появлении мажущих кровянистых выделений показано ультразвуковое исследование, анализ крови на прогестерон.
Хочу сказать, что нехватка прогестерона может быть причиной выкидыша до 15 недель. В 15-16 недель окончательно формируется плацента, которая будет выделять (продуцировать) этот гормон.
— Александр Вадимович, а какие проблемы могут возникнуть с плацентой во время беременности?
— На ранних сроках хорион (несформировавшаяся плацента) может перекрывать внутренний зев, может быть краевое его расположение — это большой риск прерывания беременности. В таком случае женщину кладут в больницу и наблюдают до 16 недель — к этому сроку хорион, как правило, поднимается. Но остается процент беременных, у которых плацента перекрывает зев матки — это называется «центральное расположение плаценты». Для сохранения беременности такие женщины, как правило, все время должны находиться в клинике и под наблюдением.
— Какова тактика лечения инфекций, появившихся на фоне беременности?
— Инфекции могут появиться даже у тех женщин, которые до беременности тщательно обследовались. Нередко такая проблема возникает из-за кровянистых выделений — это благоприятная среда для развития инфекций.
Эктопия (эрозия) шейки матки — это тоже инфекция, которая является явной угрозой для беременности. Поэтому так важно перед зачатием пройти кольпоскопию и пролечиться от эктопии, если её обнаружат.
Инфекция восходящим путём может проникать внутриутробно и негативным образом отражаться на здоровье плода. Есть такое осложнение, как внутриутробная пневмония плода, которая лечится очень плохо и занимает большой процент в структуре младенческой смертности.
И мы лечим инфекции по возможности любым способом, который прописан в протоколе. Есть такая тактика, которая заключается в приёме антибиотиков. Бояться их не нужно, так как врач назначит только разрешенные для беременных лекарства. Иногда приходится использовать те препараты, польза от которых больше, чем риск появления побочных реакций.
— Какие угрозы могут повлиять на беременность в середине срока?
— Среди многих причин, которые приводят к самопроизвольным выкидышам — истмико-цервикальная недостаточность.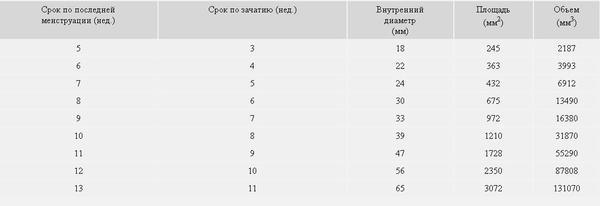 Это состояние, при котором перешеек и шейка матки не справляются с возрастающей нагрузкой (растущий плод, околоплодные воды), начинают раскрываться — и ребенок рождается преждевременно.
Это состояние, при котором перешеек и шейка матки не справляются с возрастающей нагрузкой (растущий плод, околоплодные воды), начинают раскрываться — и ребенок рождается преждевременно.
Есть показания для профилактики этого состояния — наложение кругового подслизистого шва на шейку матки. Самый лучший срок — 16-17 недель. Можно сделать данную процедуру и после 20 недель, но эффект будет меньше.
В середине беременности у женщины может произойти отслойка плаценты. В части случаев беременность можно сохранить при помощи препаратов, влияющих на свёртываемость крови. Но нередко врачи вынуждены прибегать к операции малое кесарево сечение. Как правило, роды до 22 недель заканчиваются гибелью плода, и здесь уже идет речь о спасении жизни матери.
Я призываю женщин в положении воздержаться от перелётов на самолете. В моей врачебной практике было несколько случаев, когда отслойка плаценты у пациенток случилась во время полета. Кто вам окажет квалифицированную помощь в таком случае? Советую не рисковать.
В Беларуси, как и в других европейских странах, роды начинаются со срока 22 недель, но они считаются преждевременными. Врачи делают всё возможное, чтобы любыми способами сохранить перспективную беременность. Главное, всегда быть под наблюдением у специалиста и соблюдать все его рекомендации.
— Александр Вадимович, самовольное прерывание желаемой беременности — всегда большая психологическая травма для женщины. Пережить такое повторно никому не хочется. Каковы особенности подготовки к следующей беременности после выкидыша?
— Прежде, чем задумываться о повторной беременности, женщинам, которые испытывают душевные муки, целесообразно пройти курс психотерапии. Это очень важно, потому как проблемы психического характера могут быть очень серьезными, особенно у женщин после неудачного экстракорпорального оплодотворения (ЭКО).
Главное правило: не беременеть после выкидыша 6 месяцев. Предохраняться в это время лучше всего оральными контрацептивами, которые назначит врач. Это нужно для того, чтобы восстановить нормальную детородную функцию.
Это нужно для того, чтобы восстановить нормальную детородную функцию.
Набор обследований для женщин, у которых был выкидыш, назначается индивидуально. Но общие рекомендации такие:
1. Диагностика инфекций, передающихся половым путем: микоплазмоз, уреаплазмоз, хламидиоз, вирус простого герпеса, папилломавирус человека (ВПЧ).
Также нужно обследоваться на те инфекции, которые были возможной причиной выкидыша при предыдущей беременности.
2. Анализ на половые гормоны — если назначит врач.
3. Гормоны щитовидной железы (ТТГ, Т4 свободный, АТПО), УЗИ щитовидной железы, консультация эндокринолога.
4. По необходимости, консультация терапевта и других специалистов, анализ крови на сахар, на сифилис, ВИЧ.
5. УЗИ брюшной полости и почек. При беременности многие хронические заболевания обостряются, в т.ч. и заболевания почек. Нужно пролечиться до зачатия.
6. Кольпоскопия (осмотр шейки матки под микроскопом).
7. Анализ спермограммы партнера.
Обследование у врача-генетика показано, если при планировании беременности женщине 36 лет, а мужчине 45 лет и выше. Также данного доктора нужно посетить паре, у которой были подряд две неразвивающиеся беременности на раннем сроке.
— Когда женщина забеременела после выкидыша, должна ли она более тщательно наблюдаться у врача?
— Конечно, ведь эта женщина уже входит в группу риска по какой-то определенной группе (невынашивание, инфицирование, преждевременная отслойка и т.д.).
Врачи рекомендуют в такой ситуации женщинам вести более размеренный и спокойный образ жизни, т.е. беречься. Важно оградить беременную от переживаний, не давать ей впечатляться «страшилками» по поводу беременности. Надо четко настроиться, что в этот раз всё будет хорошо.
Еще один совет из практики. Многие женщины, едва забеременев, спешат подтвердить это на УЗИ. Конечно, нет прямых доказательств того, что подобное исследование приносит вред плоду, однако нет и обратных доказательств, что оно абсолютно безвредно. Раз вы так желаете эту беременность, рисковать не стоит и грамотный доктор обязательно предостережет женщину от того, чтобы делать УЗИ на раннем сроке без особых к тому показаний.
Раз вы так желаете эту беременность, рисковать не стоит и грамотный доктор обязательно предостережет женщину от того, чтобы делать УЗИ на раннем сроке без особых к тому показаний.
Определить беременность и её перспективность можно при помощи анализа крови на ХГЧ (хорионический гонадотропин человека), а проще — гормон беременности. Это абсолютно безвредно для беременности. Целесообразно сдать кровь в начале задержки, через неделю — ещё раз. Если прибавка по ХГЧ нормальная, значит, беременность перспективная, не внематочная — и показаний к УЗИ нет.
Первый раз на УЗИ-диагностику женщина должна прийти на сроке беременности — 11-12 недель.
Источник: infodoktor.by
Интервью давал врач акушер-гинеколог высшей гкатегории/врач УЗИ МЦ «Bullfinch» Гиль Александр Вадимович
Другие статьи по этой теме
28 Июня 2021 Стоматология
Восстановление коронковой части зуба Наддесневые или коронковые части зубов формируют зубной ряд. Функциональная состоятельность жевательного аппарата зависит от целостности всех его элементов. Утрата или разрушение даже одной коронки является не только косметическим дефектом, но также провокатором функциональных нарушений. Восстановление наддесневой зоны возможно при условии удовлетворительного состояния корней.
Функциональная состоятельность жевательного аппарата зависит от целостности всех его элементов. Утрата или разрушение даже одной коронки является не только косметическим дефектом, но также провокатором функциональных нарушений. Восстановление наддесневой зоны возможно при условии удовлетворительного состояния корней.
28 Июня 2021 Стоматология
Порядок протезирования зубов Протезирование зубов подразумевает замену утраченных жевательных единиц на искусственные. Восстановление целостности ряда возможно с помощью съемных или несъемных протезов. Способ протезирования определяется индивидуально, с учетом размеров, локализации дефекта, состояния мягких тканей полости рта и сохранившихся зубов, наличия у пациента сопутствующих заболевания и его личных пожеланий.
Анэмбриония – беременность или нет?
К сожалению, далеко не все наступившие беременности завершаются деторождением. Репродуктивные потери при этом могут быть обусловлены различными причинами. И одной из них является неразвивающаяся или замершая беременность. Н долю этой патологии приходится до 15-20% репродуктивных потерь. В настоящее время выделяют 2 варианта замершей беременности: гибель эмбриона и анэмбриония. Важно понимать, что дифференциальная диагностика между ними не влияет на последующую лечебную тактику, но учитывается при оценке прогноза. Чаще определяется анэмбриония, причем это состояние во многих случаях не сопровождается самопроизвольным абортом и потому требует искусственного прерывания замершей беременности.
Анэмбриония – что это такое?
Анэмбриония – это отсутствие эмбриона в развивающемся плодном яйце. Такое состояние называют также синдромом пустого плодного яйца.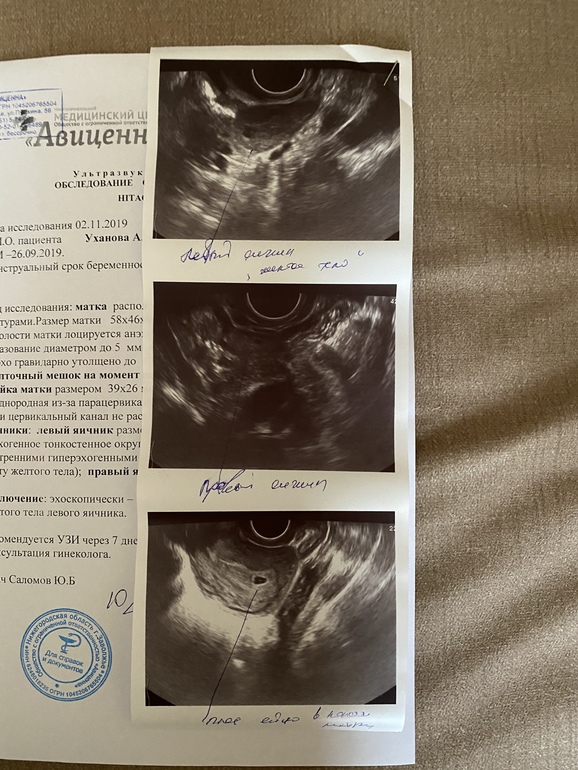 Это отнюдь не редкая патология, которая может быть диагностирована у первобеременных и у женщин, уже имеющих здоровых детей.
Это отнюдь не редкая патология, которая может быть диагностирована у первобеременных и у женщин, уже имеющих здоровых детей.
В настоящее время выделено достаточно много возможных причин анэмбрионии. К ним относят:
- Генетические аномалии, которые отмечаются почти в 80% патологического состояния. Обычно они связаны с грубыми и/или множественными хромосомными нарушениями. Причем при анэмбрионии такие аномалии носят качественный характер, а при гибели эмбриона и его аборте – преимущественно количественный. Возможны также нежизнеспособные комбинации родительских генов или мутации в ключевых зонах, отвечающих за ранние этапы эмбриогенеза и синтез основных структурных белков клеточных мембран.
- Некоторые острые вирусные и бактериальные заболевания, протекающие на ранних сроках беременности и приводящие к поражению эмбриональных тканей или трофобласта. Наиболее опасны в этом плане ТОРЧ-инфекции, хотя и другие возбудители могут проявлять эмбриотропность.

- Персистирующие вирусно-бактериальные инфекции органов репродуктивной системы, приводящие к развитию хронического эндометрита. И в большинстве случаев такая патология протекает без явных клинических симптомов и выявляется уже после замершей беременности.
- Радиационное воздействие на развивающийся эмбрион.
- Экзогенные интоксикации: прием препаратов с эмбриотоксическим действием, наркомания, воздействие некоторых промышленных и сельскохозяйственных ядов (токсинов).
- Эндокринные расстройства у беременной женщины. И наиболее критичным является дефицит прогестерона и нарушения его обмена, что является основной причиной патологии децидуализации эндометрия и аномальной имплантации плодного яйца.
В целом причины возникновения патологии в большинстве случаев остаются не диагностированными. Обычно удается определить лишь предположительную этиологию.
Проведение генетической диагностики абортированных тканей может выявить явные аномалии наследственного материала.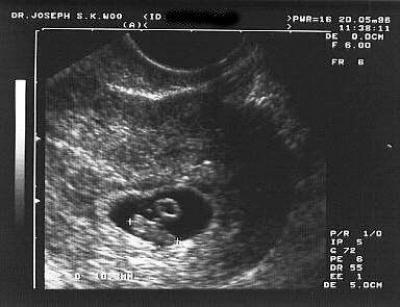 Но такое исследование, к сожалению, проводится в очень небольшом проценте случаев. В основном оно показано при отягощенном акушерском анамнезе у женщины, когда у нее в прошлом уже были замершие или самопроизвольно прервавшиеся на ранних сроках гестации. Но и такая диагностика не всегда бывает достаточно информативной, что связано с ограниченными возможностями современной генетики и высокой вероятностью воздействия других этиологических факторов.
Но такое исследование, к сожалению, проводится в очень небольшом проценте случаев. В основном оно показано при отягощенном акушерском анамнезе у женщины, когда у нее в прошлом уже были замершие или самопроизвольно прервавшиеся на ранних сроках гестации. Но и такая диагностика не всегда бывает достаточно информативной, что связано с ограниченными возможностями современной генетики и высокой вероятностью воздействия других этиологических факторов.
Патогенез
Анэмбриония является следствием прекращения размножения и дифференцировки эмбриобласта или внутренней клеточной массы – группы клеток, в норме дающих начало тканям плода. И происходит это на самых ранних этапах беременности (обычно на 2-4 неделях гестации), причем без нарушения развития плодных оболочек из трофобласта. В результате образуется так называемое пустое плодное яйцо, которое продолжает расти даже при отсутствии в нем эмбриона.
К патогенетически важным факторам развития заболевания относят:
- Унаследованные от родителей или приобретенные хромосомные аберрации и другие генетические аномалии.
 Они могут приводить к грубой десинхронизации развития эмбриональных тканей, критичным изменениям структуры коллагена и других белков, нарушению индукции дифференцировки и миграции делящихся клеток. Чаще всего встречаются аутосомные трисомии, моносомии, триплоидии, тетраплоидии.
Они могут приводить к грубой десинхронизации развития эмбриональных тканей, критичным изменениям структуры коллагена и других белков, нарушению индукции дифференцировки и миграции делящихся клеток. Чаще всего встречаются аутосомные трисомии, моносомии, триплоидии, тетраплоидии. - Избыточное образование в организме женщины циркулирующих иммунных комплексов. Их отложение в стенках мелких сосудов приводит к тромбоэмболиям и другим критическим нарушениям микроциркуляции в зоне имплантирующего яйца. Наибольшее клиническое значение придается антифосфолипидным антителам.
- Чрезмерная активация Т-хелперов с повышением концентрации и агрессии секретируемых ими цитокинов. Эти вещества способны оказывать прямое и опосредованное повреждающее действие на эмбриональные ткани с нарушением их пролиферации и дифференцировки. Фактически плодное яйцо в этом случае выступает мишенью для клеточного звена иммунитета. Причиной такого аномального иммунного ответа организма женщины может быть хроническая инфекция эндометрия, гормональные отклонения, некоторые другие эндогенные факторы.

Важно понимать, что при анэмбрионии в организме женщины вырабатываются вещества, способствующие пролонгации беременности. Поэтому в значительной части случаев самопроизвольный аборт не происходит. У пациентки появляются и поддерживаются признаки беременности, происходит прирост ХГЧ в сыворотке крови. Поэтому базальная температура при анэмбрионии обычно не имеет характерных особенностей. А на первом раннем УЗИ подтверждается факт успешной имплантации плодного яйца в полости матки. Ведь беременность действительно наступает, но развивается она без ключевого компонента – эмбриона.
В последующем возможно отторжение аномального плодного яйца. При этом могут быть диагностированы угроза прерывания беременности (в том числе с образованием отслаивающих ретрохориальных гематом) или самопроизвольный аборт (выкидыш). Но нередко анэмбриония диагностируется лишь при плановом обследовании, в этом случае диагноз является абсолютно неожиданным и шокирующим известием. Такая беременность требует искусственного прерывания.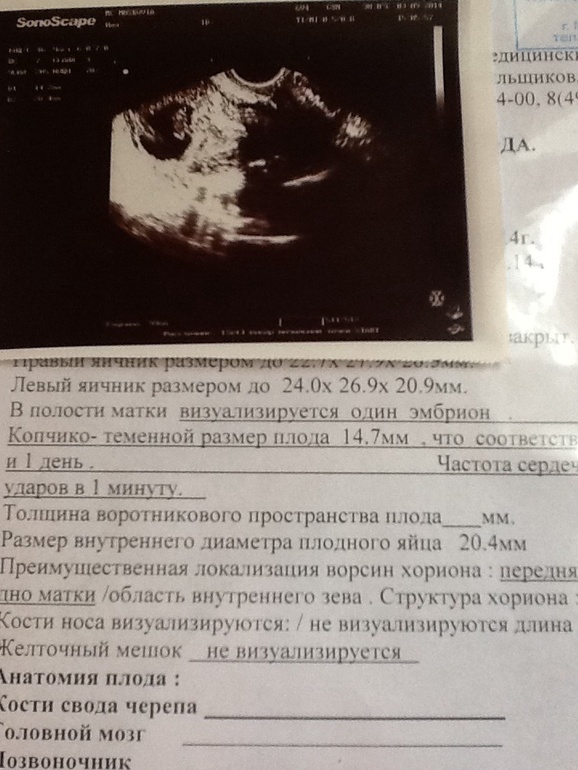
Как это проявляется?
Анэмбриония не имеет собственных клинических симптомов, все появляющиеся нарушения связаны обычно с угрозой прерывания такой патологической беременности. И к настораживающим признакам можно отнести наличие клинических проявлений относительной прогестероновой недостаточности, что создает предпосылки для самопроизвольного аборта. Поэтому поводом для обращения к врачу могут стать боли внизу живота и кровянистые выделения, при анэмбрионии они могут появиться практически на любом сроке в течение 1-го триместра. Но зачастую об имеющейся патологии женщина узнает лишь при проведении скринингового УЗИ на сроке 10-14 недель.
Диагностика
Как и другие формы замершей беременности, анэмбриония выявляется в первом триместре гестации. И основным диагностическим инструментом при этом является УЗИ, ведь именно это исследование позволяет визуализировать имеющиеся отклонения.
При этом достоверно выявить симптомы можно лишь после 8-ой недели гестации.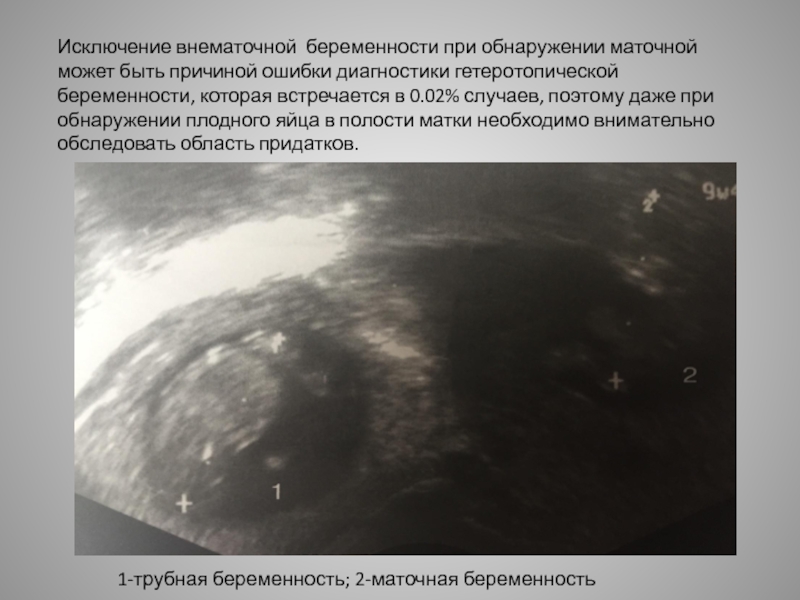 На более ранних сроках визуализация нередко недостаточна вследствие слишком малых размеров плодного яйца, так что не исключен ошибочный диагноз. Поэтому при подозрении на замершую беременность и анэмбрионию рекомендуется проводить обследование несколько раз, повторяя процедуру на аппаратуре экспертного класса с интервалом в 6-8 дней. При этом первично поставленный диагноз пустого плодного яйца может быть снят, если на последующих УЗИ удается визуализировать эмбрион с признаками сердцебиения и достаточной динамикой развития.
На более ранних сроках визуализация нередко недостаточна вследствие слишком малых размеров плодного яйца, так что не исключен ошибочный диагноз. Поэтому при подозрении на замершую беременность и анэмбрионию рекомендуется проводить обследование несколько раз, повторяя процедуру на аппаратуре экспертного класса с интервалом в 6-8 дней. При этом первично поставленный диагноз пустого плодного яйца может быть снят, если на последующих УЗИ удается визуализировать эмбрион с признаками сердцебиения и достаточной динамикой развития.
Основные эхографические признаки:
- отсутствие желточного мешка при диаметре плодного яйца 8-25мм;
- отсутствие эмбриона в плодном яйце диаметром более 25 мм.
К дополнительным признакам замершей беременности относят неправильную форму плодного яйца, недостаточный прирост его диаметра в динамике, слабую выраженность децидуальной реакции, отсутствие сердцебиения на сроке гестации 7 и более недель. А признаками угрозы ее прерывания служат изменение тонуса матки и появление участков отслойки хориона с появлением субхориальных гематом.
А признаками угрозы ее прерывания служат изменение тонуса матки и появление участков отслойки хориона с появлением субхориальных гематом.
Заподозрить анэмбрионию можно также при динамической оценке уровня ХГЧ в крови. Прирост уровня этого гормона по нижней границе нормы должен быть основанием для дальнейшего обследования женщины с проведением УЗИ. Важно понимать, что ХГЧ вырабатывается и при синдроме пустого плодного яйца. Причем его уровень при этой патологии будет практически нормальным, в отличие замершей беременности с гибелью нормально развивающегося эмбриона. Поэтому отслеживание косвенных признаков беременности и рост ХГЧ при анэмбрионии нельзя отнести к достоверным методам диагностики.
Разновидности
Возможны несколько вариантов синдрома пустого плодного яйца:
- Анэмбриония I типа. Эмбрион и его остатки не визуализируются, размеры плодного яйца и матки не соответствуют предполагаемому сроку беременности. Диаметр яйца составляет обычно не более 2,5 мм, а матка увеличена лишь до 5-7 недели гестации.

- Анэмбриония II типа. Эмбриона нет, но плодное яйцо и матка соответствуют сроку гестации.
- Резорбция одного или нескольких эмбрионов при многоплодной беременности. При этом одновременно визуализируются нормально развивающиеся и регрессирующие плодные яйца. По этому типу нередко протекает анэмбриония после ЭКО, если женщине были подсажены несколько эмбрионов.
Все эти разновидности определяются лишь с помощью УЗИ, характерных клинических особенностей они не имеют.
Что делать?
Подтвержденная анэмбриония является показанием для искусственного прерывания беременности. При этом не учитывается срок гестации, самочувствие женщины и наличие у нее признаков возможного самопроизвольного аборта. Исключение составляет ситуация, когда диагностируется анэмбриония второго плодного яйца при многоплодной беременности. В этом случае предпринимают выжидательную тактику, оценивая в динамике развитие сохранившегося эмбриона.
Прерывание замершей беременности проводится только в стационаре. После процедуры эвакуации плодного яйца женщина должна находиться под врачебным наблюдением. Во многих случаях после неё назначается дополнительное медикаментозное и иногда физиотерапевтическое лечение, направленное на нормализацию гормонального фона, профилактику воспалительных и геморрагических осложнений, ликвидацию выявленной инфекции.
Для проведения медицинского аборта при этой патологии возможно использование нескольких методик. Могут быть использованы:
- медикаментозный аборт – прерывание беременности с помощью гормональных препаратов, провоцирующих отторжение эндометрия вместе с имплантированным плодным яйцом;
- вакуумная аспирация содержимого полости матки;
- выскабливание – операция, включающая механическое удаление плодного яйца и эндометрия специальным инструментом (кюреткой) после принудительного расширения канала шейки матки бужами.
Медикаментозный аборт при анэмбрионии возможен лишь на сроке 6-8 недель.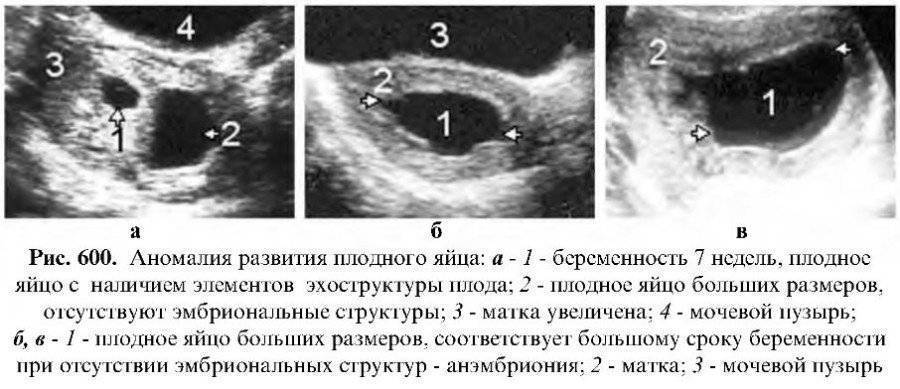 В более поздние сроки гестации предпочтение отдают механическим методам, что требует применения общей анестезии. От выбора способа искусственного аборта зависит, болит ли живот после прерывания беременности, продолжительность реабилитационного периода, вероятность развития ранних и поздних осложнений.
В более поздние сроки гестации предпочтение отдают механическим методам, что требует применения общей анестезии. От выбора способа искусственного аборта зависит, болит ли живот после прерывания беременности, продолжительность реабилитационного периода, вероятность развития ранних и поздних осложнений.
Обследование после искусственного аборта обязательно включает УЗ-контроль. Это позволяет подтвердить полную эвакуацию плодных оболочек и эндометрия, исключить нежелательные последствия аборта в виде гематометры, перфорации и эндометрита.
Прогноз
Может ли повториться анэмбриония? Смогу ли еще иметь детей? Эти вопросы беспокоят всех пациенток, перенесших эту патологию. К счастью, в большинстве случаев состояние не повторяется, женщине в последующем удается благополучно забеременеть и выносить ребенка. Но при этом ее относят к группе риска по возможному развитию осложнений беременности и родов. Поэтому в первом триместре ей обычно назначается динамический УЗИ-контроль развития плодного яйца, определение гормонального профиля и оценка состояния системы гемостаза.
Беременность после анэмбрионии теоретически возможна уже в следующем овариально-менструальном цикле. Но желательно дать организму восстановиться. Поэтому планирование повторного зачатия рекомендуют начинать не ранее, чем через 3 месяца после проведенного искусственного аборта. Если же он протекал с осложнениями, реабилитационный период с соблюдением репродуктивного покоя продлевают на срок до полугода. При выявлении у женщины хронического эндометрита и различных инфекций, через 2 месяца после завершения лечения проводят контрольное обследование и лишь тогда определяют возможные сроки повторного зачатия.
Для предупреждения наступления беременности предпочтение отдают барьерному методу и гормональной контрацепции. Подбор средства при этом осуществляется индивидуально. Внутриматочные спирали сразу после перенесенной замершей беременности не используют во избежание развития эндометрита.
Профилактика
Первичная профилактика анэмбрионии включает тщательное планирование беременности с проведением комплексного обследования. При выявлении отклонений проводится их коррекция. Конечно, такая подготовка не позволяет на 100% исключить вероятность патологии, но снижает риск ее развития.
При выявлении отклонений проводится их коррекция. Конечно, такая подготовка не позволяет на 100% исключить вероятность патологии, но снижает риск ее развития.
Вторичная профилактика проводится при наличии у женщины в анамнезе самопроизвольных абортов и анэмбрионии. Первая беременность с синдромом пустого плодного яйца – повод для последующего обследования женщины на инфекции и нарушения гемостаза. При повторении ситуации показано проведение также генетического обследования супругов для исключения у них аномалий наследственного материала. В некоторых случаях последующее зачатие предпочтительно проводить с помощью ЭКО, что позволит использовать преимплантационную диагностику для выявления у эмбрионов хромосомных нарушений.
Анэмбриония диагностируется достаточно часто. И, к сожалению, в настоящее время пока не удается полностью исключить такую патологию уже на этапе планирования беременности. Ведь она может развиться даже у полностью здоровых и обследованных пациенток. При этом перенесенная замершая беременность не означает невозможность повторного успешного зачатия, большинству женщин после анэмбрионии удается благополучно родить здорового ребенка.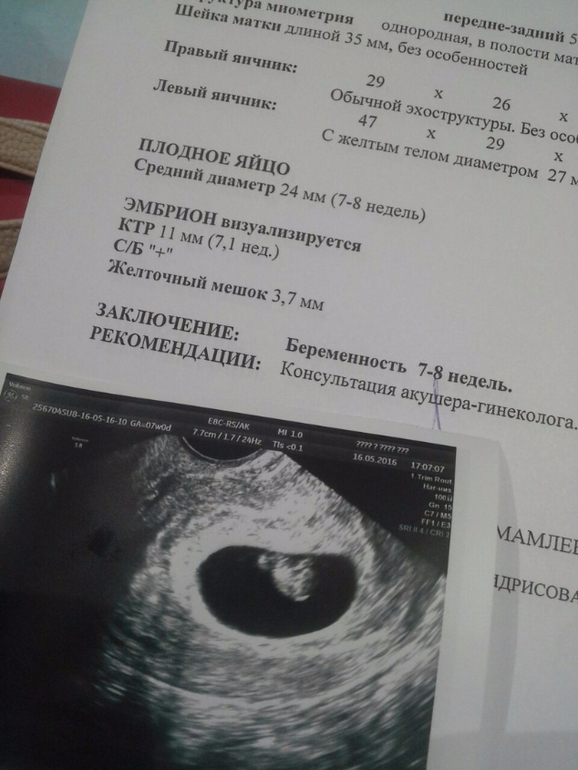
Сделать аборт СПб, цена, записаться на аборт. Аборт на ранних сроках
Сколько стоит аборт на 3 неделе?
Прерывание на ранних сроках позволяет избавиться от нежелательной беременности с минимальными рисками для здоровья женщины и избежать серьезных последствий. Цена процедуры зависит от вида аборта. На 3 неделе преимущественно назначается медикаментозный аборт. Его стоимость зависит от используемого препарата и дозировки. На сегодняшний день Выяснить этот вопрос можно во время консультации у гинеколога.
Какой способ прерывания подойдет?
При определении беременности сроком 3 недели для ее прерывания чаще всего применяется медикаментозный метод. Он отличается простотой выполнения и максимальной безопасностью для здоровья женщины в сравнении с другими видами абортов, так как не предполагает инвазивных вмешательств.
Медикаментозный аборт подразумевает употребление специальных препаратов, которые приводят к естественному выкидышу – замиранию плодного яйца и его выходу из матки. Процедура не требует госпитализации и длительного восстановления. Стоимость ее тоже доступна.В Клинике “На Сенной” есть комплексные программы по медикаментозному аборту:
Процедура не требует госпитализации и длительного восстановления. Стоимость ее тоже доступна.В Клинике “На Сенной” есть комплексные программы по медикаментозному аборту:
1)с препаратами ,производства Китай или Россия,но со сниженной дозировкой
2)с препаратами ,производства Россия по французской технологии
3)с препаратами ,производства Франция
Подробнее можно ознакомиться здесь.
Для определения комплексной услуги необходимо записаться на консультацию гинеколога или УЗИ для определения срока беременности.
Однако в некоторых случаях выполнение медикаментозного аборта противопоказано. В такой ситуации прибегают к методу вакуум-аспирации. Это малоинвазивная процедура, подразумевающая извлечение плодного яйца с помощью специального аппарата. Он создает в матке отрицательное давление и убирает плод вместе с оболочками.
Однако при 3 неделях беременности выполнять вакуум-аспирацию сложно. На таком сроке плодное яйцо еще не достигло размера в 7 мм, по данной причине его трудно поймать канюлей и полностью удалить.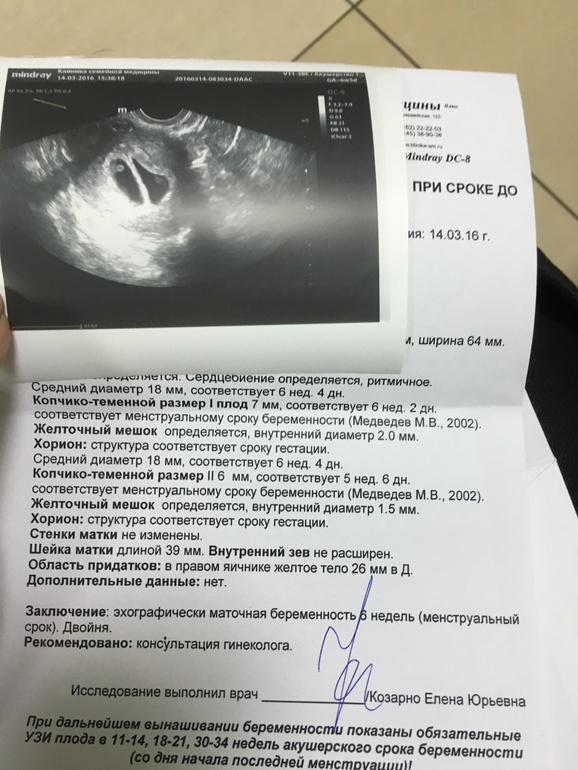 Поэтому женщине рекомендуется подождать, пока срок беременности достигнет 5-6 недель, чтобы потом выполнить мини-аборт.
Поэтому женщине рекомендуется подождать, пока срок беременности достигнет 5-6 недель, чтобы потом выполнить мини-аборт.
Можно ли сделать аборт на 3 неделях бесплатно?
Бесплатное выполнение прерывания беременности по страховому полису возможно выполнить только через участкового гинеколога хирургическим методом. Безопасные виды абортов (вакуум-аспирация и медикаментозный) за счет ФОМС не выполняются. Финансируется только хирургический метод прерывания беременности, подразумевающий выскабливание маточной полости, так как он отличается самой низкой ценой.
При этом женщина должна помнить, что хирургический аборт несет огромную угрозу репродуктивной функции и может привести к бесплодию. Выполнить медикаментозное прерывание беременности пациентки могут только за свой счет.
Где сделать аборт в СПб на ранних сроках?
Избавиться от нежелательной беременности на ранних сроках вы можете в медицинском центре на Сенной. Мы располагаем современным оборудованием,опыт оказания услуги прерывания беременности более 15 лет ,высококвалифицированные врачи-гинекологи, которые помогут подобрать наиболее безопасный вид аборта.
Почему стоит обратиться в медицинский центр «На Сенной»?
Обратившись в нашу клинику для прерывания нежелательной беременности, вы оцените такие ее преимущества:
- выполняем медикаментозные аборты более 20 лет;
- медицинскую помощь предоставляют квалифицированные гинекологи;
- присутствие положительных отзывов наших клиентов, ознакомиться с которыми вы можете на внешних ресурсах;
- мы имеем лицензию на выполнение абортов, что подтверждает их безопасность;
- закупка препаратов для медикаментозного прерывания выполняется напрямую у поставщиков, что позволяет нам сохранять доступную стоимость на эту процедуру;
- в стоимость аборта включены все необходимые растраты, никаких скрытых платежей;
- для медикаментозного прерывания используются только сертифицированные препараты производства Франции и России.
Если случается так, что медикаментозный аборт произошел неполностью, вакуумная аспирация остатков плодного яйца выполняется под наркозом абсолютно бесплатно.
Восстановление после прерывания беременности
Медикаментозный аборт является наиболее щадящим, поэтому требует минимальной реабилитации. Первые 10 дней после процедуры нельзя посещать сауну, баню, бассейн. Также стоит исключить физические нагрузки, позаботиться о правильном питании, чтобы организм получал достаточно питательных компонентов.
Восстановить половую жизнь можно спустя 4 недели после медикаментозного аборта. Что касается повторной беременности, то планировать зачатие рекомендуется не ранее, чем через полгода после прерывания.
Если после медикаментозного аборта женщина испытывает резкую боль в животе, слабость, общее недомогание или наблюдается кровотечение, следует незамедлительно обратиться за медицинской помощью.
При правильном выполнении медикаментозного аборта удается избежать возможных осложнений и сохранить репродуктивную функцию женщины.
Миома матки. Влияние на беременность. Лечение в НИИ ОММ
МИОМА МАТКИ
Что такое миома матки?
Миома (фибромиома) матки — самая распространенная доброкачественная опухоль половых органов женщины. Миому можно обнаружить у каждой третьей женщины репродуктивного возраста, и более 70% женщин являются ее бессимптомными носителями.
Миому можно обнаружить у каждой третьей женщины репродуктивного возраста, и более 70% женщин являются ее бессимптомными носителями.
К сожалению, миома матки может протекать бессимптомно, пока не достигнет достаточно больших размеров. Либо бывает так, что симптомы сглажены и часто воспринимаются женщиной как вариант нормы. Многие женщины даже не знают о наличии у них данного заболевания и обращаются к врачу только тогда, когда миома достигает значительных размеров.
Когда обратиться к врачу?
Возможные проявления миомы матки, которые должны Вас насторожить:
- Нарушения менструальной функции — менструации становятся продолжительными, нерегулярными, обильными. Нередко бывают кровотечения, не связанные с менструацией. Кровопотери приводят к железодефицитной анемии — уровень гемоглобина постепенно снижается. Появляется слабость, бледность кожных покровов, что не всегда бывает заметно сразу, и воспринимается как обычное недомогание.

- Боли, чувство тяжести внизу живота и в пояснице. Если нарушается кровообращение в миоматозном узле, то боли носят острый характер. Однако чаще опухоль растет постепенно, и боли бывают скорее ноющего характера, даже если миома имеет большие размеры.
- Увеличение живота, чувство чего-то лишнего внутри.
- Нарушение функции соседних органов — мочевыводящих путей и органов желудочно-кишечного тракта. В частности, это относится к мочевому пузырю и к прямой кишке — опухоль сдавливает эти органы. В результате могут возникнуть затруднения с мочеиспусканием, хронические запоры.
- Дискомфорт при половом акте.
- Бесплодие. Расположение и размеры миомы матки существенным образом влияют на локальное кровообращение в детородном органе, обкрадывая зону имплантации и приводя к нарушению инвазии плодного яйца в стенку матки.
- Невынашивание беременности. Изменение формы и размеров полости матки может приводить к нарушению развития плодного яйца, формированию плацентарной недостаточности, угрозе прерывания беременности, несостоятельности шейки матки при вынашивании беременности.

Как влияет миома матки на беременность?
Женщины с миомой матки часто страдают бесплодием.
Узлы миомы, растущие в полость матки, деформируют ее и нарушают процесс прикрепления оплодотворённой яйцеклетки к стенке матки.
Если же беременность наступает, то она нередко заканчивается самопроизвольным выкидышем или рождением недоношенного ребенка, так как узлы миомы, занимая значительное место в полости матки, мешают развитию плода.
Во время беременности узлы миомы обычно увеличиваются в размерах за счёт отёка и изменения гормонального фона, причиняя женщине боль и дискомфорт.
Роды у женщин с миомой матки, как правило, протекают тяжело, с развитием аномалий родовой деятельности. В таких ситуациях миома матки является показанием к проведению операции кесарева сечения. Кроме того, послеродовый период в ряде случаев осложняется кровотечением.
Поэтому, при планировании беременности наилучшим считается хирургическое удаление узла с последующим надежным ушиванием стенки матки. Только тогда возможен благополучный исход беременности.
Только тогда возможен благополучный исход беременности.
Что происходит с миомой матки без лечения?
Однажды появившись, опухоль имеет свойство увеличиваться в размерах, появляются все новые и новые узлы. Рост миомы у каждой женщины идёт с различной скоростью. Растущая миома может разрушить матку и заполнить собой всю полость малого таза и даже брюшную полость. Миома матки рано или поздно приводит к маточным кровотечениям с развитием анемии, болям, нарушениям работы соседних органов, бесплодию и прерыванию беременности при ее возникновении.
Иногда могут возникнуть серьёзные осложнения, связанные с перекрутом ножки узла и развитием воспаления в брюшной полости. В этих ситуациях требуется экстренная операция. В редких случаях (1 из 100) в узле миомы может появиться злокачественная опухоль — саркома.
С наступлением менопаузы, как правило, происходит уменьшение размеров опухоли. Яичники прекращают свою работу. Из-за отсутствия женских половых гормонов, миома начинает «усыхать». Но, при наличии достаточно больших опухолей, и здесь женщину подстерегает опасность — в результате нарушения питания миомы может возникать ее отмирание и сильное воспаление. А это приводит к необходимости экстренного оперативного вмешательства.
Но, при наличии достаточно больших опухолей, и здесь женщину подстерегает опасность — в результате нарушения питания миомы может возникать ее отмирание и сильное воспаление. А это приводит к необходимости экстренного оперативного вмешательства.
Можно ли сохранить матку при оперативном лечении миомы?
Вопрос о возможности сохранения матки решает оперирующий врач-гинеколог. При миоме почти всегда ее можно сохранить. Наши гинекологи-хирурги обладают рядом методик, которые позволяют перед операцией миому уменьшить, на время операции обескровить матку, и, соответственно, свести к минимуму риск потери органа.
Какие виды оперативного лечения при миоме матки применяют в гинекологической клинике Уральского НИИ Охраны материнства и младенчества?
Подавляющее большинство операций в гинекологической клинике Уральского НИИ Охраны материнства и младенчества выполняется с помощью щадящих органосохраняющих технологий: лапароскопия (эндоскопическая операция через проколы брюшной стенки размером 5−10 мм), гистероскопия (через цервикальный канал шейки матки). Удаление миом, растущих в полость матки, возможно при гистерорезектоскопии через влагалище без разрезов и проколов.
Удаление миом, растущих в полость матки, возможно при гистерорезектоскопии через влагалище без разрезов и проколов.
В нашей клинике разработаны уникальные технологии оперативного лечения миомы матки, которые позволяют не только оставить матку, но и сохранить ее способность к вынашиванию малыша и благополучным родам.
В настоящее время мы работаем с уникальным шовным материалом – так называемой гарпунной нитью. Эта технология позволяет адекватно восстанавливать целостность стенки матки без наложения множества швов и узлов на матке. Таким образом, минимизируется травматическое воздействие на стенку матки, уменьшается время операции и, что самое ценное, создаются условия для формирования качественного полноценного послеоперационного рубца на матке. А именно это определяет течение последующей беременности.
Какие преимущества у лапароскопической (эндоскопической) операции?
- Органосохраняющие технологии операций.

- Вместо широкого разреза брюшной стенки (от 7 до 30 см в длину) выполняется несколько проколов от 3 до 10 мм. Поэтому практически отсутствуют послеоперационные боли, косметические дефекты, нет необходимости соблюдать строгий постельный режим, строгую диету.
- Длительность госпитализации составляет 1−3 дня. Быстро восстанавливается нормальное самочувствие и способность к обычной бытовой и трудовой деятельности.
- За счет отсутствия большого разреза очень редко возникают послеоперационные грыжи.
- Оптика, используемая при лапароскопических вмешательствах, дает многократное увеличение, поэтому оперативное вмешательство выполняется, более деликатно, практически микрохирургически.
- При помощи лапароскопа у хирурга обзор органов живота намного лучше, чем при большом разрезе. В результате уровень интраоперационной кровопотери в несколько раз ниже, меньше травма тканей, имеется возможность уточнения существующего диагноза, мгновенное изменение тактики лечения при необходимости, возможность диагностики сопутствующей патологии.

- В нашей клинике возможно проведение интраоперационного УЗИ исследования с доплерометрией, которая позволяет уточнять режим кровообращения в узле и в матке в режиме реального времени, что позволяет оперировать практически без кровопотери.
- При эндохирургическом вмешательстве нет контакта тканей с перчатками хирурга, на органы и брюшину не попадает тальк, меньше манипуляций с кишечником, не используются марлевые салфетки — все это исключает развитие инфекционных осложнений и уменьшает возможность образования послеоперационного спаечного процесса, приводящего к бесплодию, кишечной непроходимости и другим тяжелым патологиям.
- Использование современного шовного материала и безузловой методики внутреннего наложения шва на матку позволяет минимизировать травматическое воздействие на стенку матки, уменьшить время операции и реабилитации, улучшить качество послеоперационного рубца на матке и течение последующей беременности.
Мы готовы помочь каждой женщине, страдающей миомой матки, и при этом найти тот самый индивидуальный путь, следуя которому каждая женщина сможет стать матерью и родить здорового малыша.
Прием женщин для диагностики и решения вопроса о необходимости оперативного лечения осуществляется в нашей научной поликлинике ФГБУ «Уральский НИИ Охраны материнства и младенчества» МЗ РФ, по адресу: Екатеринбург, ул. Репина, 1, 2 подъезд.
Прием ведут высококвалифицированные специалисты:
| д.м.н. Михельсон А.А. | ведущий научный сотрудник научного отдела сохранения репродуктивной функции женщин, врач акушер гинеколог высшей категории | понедельник 16.00-19.00 |
| к.м.н. Мелкозерова О.А. | руководитель научного отдела сохранения репродуктивной функции женщин, врач акушер гинеколог высшей категории | среда 16.00-19.00 |
| к.м.н. Волкова Е.В. | врач акушер гинеколог , гинеколог детского и подросткового возраста | пятница 16. 00-19.00 00-19.00 |
Запись на консультацию в Консультативно-диагностическое отделение в рабочие дни с 9:00 до 16:00 по телефону 8 (343) 371 08 78, обратиться в Отдел госпитализации по телефону 8 (343) 371-17-24 или направить свои медицинские документы по электронной почте Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.
В ожидании чуда | Клинический диагностический центр
Беременность – это волшебные 9 месяцев, особо значимые в жизни в каждой женщины, поскольку это период подготовки к появлению новой жизни. Эта часть жизни требует особого медицинского контроля, поскольку от полной и своевременной диагностики в данном случае зависит здоровье не только мамы, но и будущего малыша.
В Диагностическом центре представлены все виды лабораторной диагностики, функциональные и ультразвуковые исследования, которые назначают беременным женщинам.
В акушерстве особое место занимает ультразвук. Он дает возможность акушерам-гинекологам наблюдать за внутриутробным развитием плода и принимать экстренные меры при малейших отклонениях от нормы. Обычно, при нормальном течении беременности, проводится 3 плановых ультразвуковых исследования (по одному в каждом триместре: при сроках 10-14, 20-24 и 32-34 недель). Этот трехкратный ультразвуковой скрининг необходим с целью выявления различных отклонений в течение беременности на разных этапах, а также аномалий и пороков развития плода и признаков его внутриутробного страдания. Но при наличии клинических показаний УЗИ может проводиться в любые сроки беременности с той периодичностью, которую назначит врач, наблюдающий будущую маму.
Почему нельзя отказываться от УЗИ во время беременности?
Вот несколько аргументов, говорящих в пользу необходимости ультразвукового контроля за протеканием беременности:
- Пороки развития плода в 90% случаев развиваются у совершенно здоровых людей, без каких-либо факторов риска.
 Т.е. своевременно выявляются такие пороки только лишь при УЗИ, проведенном в профилактических целях.
Т.е. своевременно выявляются такие пороки только лишь при УЗИ, проведенном в профилактических целях. - Могут иметь место значительные пороки развития плода при внешнем благополучном протекании беременности.
- Клиническое обследование (т.е. пальпация наружными приемами) не является достоверным при установлении многоплодной беременности, не говоря уже о контроле нормального (ассоциированного) внутриутробного развития близнецов.
- Беременные с низким расположением и предлежанием плаценты, как правило, не догадываются об этом до тех пор, пока не начинается кровотечение.
- До 50% женщин, утверждающих, что точно знают срок беременности («по сроку зачатия»), ошибаются более чем на 2 недели, а именно эти 2 недели могут оказаться очень важны, особенно в ситуации преждевременных родов для недоношенных детей.
УЗИ в первом триместре беременности (на сроках 10-14 недель)
В первом триместре УЗИ необходимо для установки срока беременности, при подозрении на угрозу выкидыша или внематочную беременность. При сроке 10-12 недель можно определить правильность формирования костного скелета пода, выявить грубую патологию головного мозга и других органов. Диагностика беременности на УЗИ с использованием трансвагинального датчика возможна уже при задержке менструации 3-5 дней (срок 4,5 недель, считая от первого дня последней менструации, как это принято в акушерстве). В это время в полости матки визуализируется плодное яйцо, диаметр которого в миллиметрах примерно равен числу дней задержки. В сроке 5-6 недель становится видным эмбрион.
При сроке 10-12 недель можно определить правильность формирования костного скелета пода, выявить грубую патологию головного мозга и других органов. Диагностика беременности на УЗИ с использованием трансвагинального датчика возможна уже при задержке менструации 3-5 дней (срок 4,5 недель, считая от первого дня последней менструации, как это принято в акушерстве). В это время в полости матки визуализируется плодное яйцо, диаметр которого в миллиметрах примерно равен числу дней задержки. В сроке 5-6 недель становится видным эмбрион.
Сердцебиение может быть выявлено уже у эмбриона длиной 4-5 мм. Головка различима в 7-8, конечности в 9 недель. Такая высокая информативность УЗИ позволяет выявлять многие пороки развития плода уже в первом триместре беременности, когда возможно ее прерывание путем медицинского аборта.
Диагностика пола плода на УЗИ нередко бывает возможна уже в сроке 13-16 недель. Наиболее точно срок беременности можно установить в 1-м триместре, когда измеряется копчико-теменной размер эмбриона (т.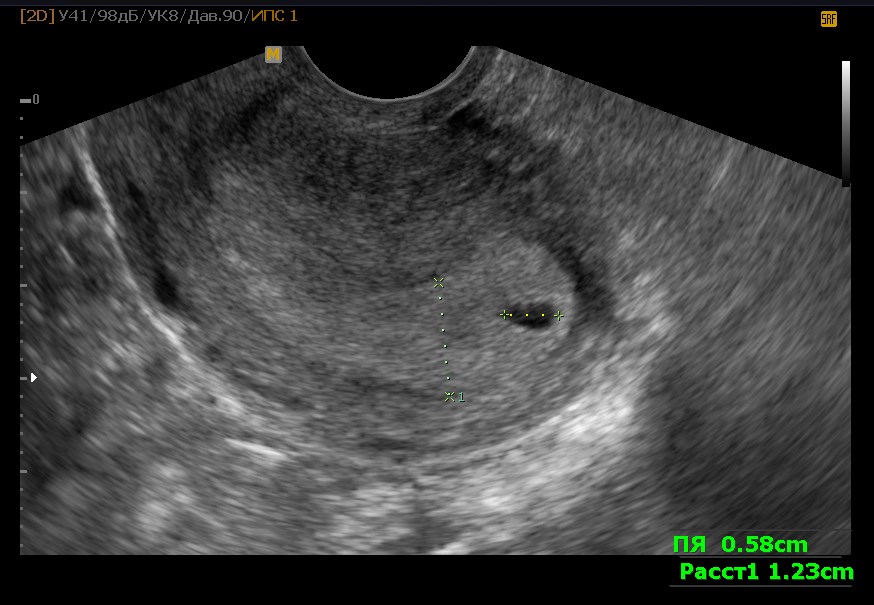 е. его длина). В этом случае ошибка, как правило, не превышает 3 дней. В большем сроке погрешность возрастает.
е. его длина). В этом случае ошибка, как правило, не превышает 3 дней. В большем сроке погрешность возрастает.
Поэтому всем беременным рекомендуется первый раз проходить УЗИ в ранние сроки (до 12 недель). Это важно и в плане выявления таких осложнений, как неразвивающаяся беременность, при этом наблюдается пустое плодное яйцо (анэмбриония) или отсутствие сердцебиения у эмбриона. Важное значение имеет выявление тонуса матки и других признаков угрозы прерывания беременности.
При УЗИ хорошо выявляется и такое серьезное заболевание, как пузырный занос. Многоплодная беременность диагностируется, начиная с самых ранних сроков, что позволяет определить дальнейшую тактику ее ведения.
На 18-20 неделе возможно достоверное определение пола плода.
Срок 20-24 недели является очень важным для оценки всех внутренних органов плода и выявления большинства существующих врожденных пороков развития. Возможно выявление и признаков различных генетических отклонений и синдромов, например, имеется целый ряд четко определенных УЗ-маркеров синдрома Дауна. В последнем, третьем триместре оценивается плацента, положение плода, его функциональное состояние, вес, рост, соответствие размеров сроку беременности.
В последнем, третьем триместре оценивается плацента, положение плода, его функциональное состояние, вес, рост, соответствие размеров сроку беременности.
На больших сроках при ультразвуковом исследовании обязательно измеряются основные размеры плода: бипариетальный размер или окружность головки, средний диаметр или окружность живота и длина бедра, и множество других не менее важных биометрических показателей плода. В некоторых случаях определяют и другие размеры.
При осмотре также определяют расположение, размеры, толщину и степень «зрелости»; плаценты, что имеет важное практическое значение в плане выявления предлежания плаценты, ее отслойки, признаков гемолитической болезни плода, плацентарной недостаточности и других серьезных осложнений беременности, в том числе особенно актуального в последнее время внутриутробного инфицирования.
Ультразвуковое обследование – одно из важнейших диагностических исследований, обязательных во время беременности. Игнорируя УЗИ, можно поставить под угрозу успешные роды, жизнь и здоровье как матери, так и будущего малыша.
Игнорируя УЗИ, можно поставить под угрозу успешные роды, жизнь и здоровье как матери, так и будущего малыша.
Сверхточное 4D-УЗИ: знакомимся с будущим малышом
В Диагностическом центре установлен новый УЗИ-аппарат с режимом HDlive. Самая современная разработка американской компании General Electric Healthcare Voluson E10 позволяет врачам получить сверхточное четырехмерное изображение для исключения серьезных патологий, а родителям — понаблюдать за жизнью малыша в режиме реального времени. На 4D-снимках можно разглядеть даже черты лица будущего малыша.
Каждая мамочка, нося своё сокровище под сердцем на протяжении 9 месяцев, мечтает скорее увидеть своего малыша, разглядеть его лицо, определить, на кого он похож. На обычных УЗИ-аппаратах эти задачи не решаются, поскольку изображение не достаточно четкое. А технические возможности Voluson E10 позволяют сделать первую полноценную фотографию малыша, пока он находится в животике – настолько высоки разрешающие способности оборудования.
Заведующая отделом ультразвуковых методов исследований Клинического Диагностического Центра Анна Ерофеева рассказывает о возможностях исследований для беременных в КДЦ: «Voluson E10 – это первый аппарат УЗИ, который позволил врачам и их пациентам увидеть максимально реалистичное изображение, которое позволяет разглядеть не только физиологические особенности, но даже мелкие черты лица, мимику, оттенок кожи ребенка в момент его нахождения в утробе матери. Благодаря оборудованию такого класса, мы значительно повышаем уровень пренатальной диагностики в целом».
Voluson E10 позволяет рассмотреть на экране сверхточное изображение малыша, получить очень подробную информацию о работе мозга, сердца, сосудистой системы плода с возможностью изучения кровотока. Крайне важно, что уже в первом триместре беременности можно диагностировать заболевания и, при необходимости, назначить необходимое лечение, ведь нет ничего важнее, чем здоровье будущего малыша.
Максимальная детализация и сверхточное качество изображения позволяют врачам получить полную информацию о состоянии здоровья малыша и мамы. Даже самые незначительные отклонения могут быть установлены на минимальном сроке беременности. Новая 4D технология радикально меняет качество визуализации сердца плода. Технология HDlive улучшает коммуникацию врача и пациента и повышает достоверность диагностики, поднимая планку оказания медицинских услуг на качественно новый уровень.
Даже самые незначительные отклонения могут быть установлены на минимальном сроке беременности. Новая 4D технология радикально меняет качество визуализации сердца плода. Технология HDlive улучшает коммуникацию врача и пациента и повышает достоверность диагностики, поднимая планку оказания медицинских услуг на качественно новый уровень.
Новая ультразвуковая система разработана для передовых учреждений в области женского здоровья, она обеспечивает инновационную четкость, скорость и гибкость акушерско-гинекологических исследований.
Диагностический центр приглашает будущих мамочек на 4D-УЗИ и желает крепкого здоровья Вам и Вашему малышу!
Диаметр гестационного мешка на очень ранних сроках беременности как предиктор исхода для плода
Цель: Чтобы определить, может ли трансвагинальное сонографическое измерение диаметра гестационного мешка у беременных через 28-42 дня после последней менструации предсказать, приведет ли беременность к нормальным доношенным родам или к самопроизвольному выкидышу.
Дизайн: Диаметр гестационного мешка был измерен в течение 4-й и 5-й недель беременности, начиная с последней менструации, у 67 женщин, которым было выполнено 102 ультразвуковых сканирования.За этими беременностями наблюдали до тех пор, пока не наступил один из двух исходов: срок беременности (n = 32) или самопроизвольный выкидыш (n = 35). Диаметр гестационного мешка как функция гестационного возраста сравнивали в каждой из групп.
Результаты: Средний диаметр гестационного мешка через 28-35 дней после последней менструации среди нормальных беременностей существенно не отличался от такового у тех, у которых впоследствии произошел выкидыш (2.6 мм против 2,7 мм; P = 1,00). При беременности через 36-42 дня после последней менструации средний диаметр мешка значительно различается между двумя группами (нормальная группа, средний диаметр мешочка 8,2 мм и группа выкидыша, средний диаметр мешочка 4,5 мм; P <0,001).
Вывод: Нет разницы в диаметре гестационного мешка через 28-35 дней после последней менструации при нормальной и патологической беременности.Однако меньший, чем ожидалось, диаметр мешка у беременных через 36-42 дня после последней менструации является признаком самопроизвольного выкидыша.
Гестационный мешок — обзор
БИОМЕТРИЧЕСКИЕ ПАРАМЕТРЫ
ГЕСТАЦИОННЫЙ мешок
Гестационный мешок можно увидеть трансвагинально уже на 4 неделе беременности, когда его больший диаметр составляет 2 мм с соответствующими уровнями хорионического гонадотропина человека (ХГЧ) около 1000 мМЕ / мл (международный эталонный препарат или IRP).Его средний диаметр имеет линейную зависимость от GA и увеличивается на 1,0–1,2 мм / день до появления полюса плода с его сердцебиением размером 10 мм с соответствующими уровнями ХГЧ около 12000 мМЕ / мл (IRP).
ДЛИНА КОРОНЫ – ПАЛЬЦА
CRL — это наибольшая длина эмбриона или плода, которую можно измерить, за исключением конечностей и желточного мешка. 14 Эмбрион становится плодом через 10 недель беременности (71 полный день на основе LMP). Точность CRL при датировании беременности зависит от хорошей корреляции между этим измерением и возрастом плода в период, когда рост происходит быстро и минимально зависит от патологии плода.CRL позволяет прогнозировать возраст плода с погрешностью 3 дня (доверительный интервал 90%) от 7 до 10 недель и 5 дней от 10 до 14 недель беременности. CRL увеличивается примерно на 10 мм в неделю с 8 по 12 недели, и простое правило для получения GA следующее: GA (неделя) = CRL (см) + 6,5. 14,22
ИЗМЕРЕНИЕ ГОЛОВКИ
Размер головки плода был одним из наиболее полезных и проверенных измерений для определения GA. БЛД является наиболее широко используемым показателем с наибольшей точностью в период от 12 до 22 недель, снижаясь после этого периода из-за более широкой индивидуальной вариации. БЛД демонстрирует линейный рост на 3 мм в неделю с 14 по 28 недели и на 2 мм в неделю до родов. 5,22 Измерение проводится на уровне плоскости, определяемой следующими внутримозговыми ориентирами: передние рога бокового желудочка и прозрачная полая перегородка спереди, таламус и третий желудочек по центру, а также затылочные рога желудочка головного мозга. , cisterna venae magnae cerebri и островок сзади. Измерение проводится от внешнего стола проксимального отдела черепа до внешнего стола дистального отдела черепа, при этом кости черепа перпендикулярны ультразвуковому лучу. 14 Затылочно-лобный диаметр (OFD) измеряется в той же плоскости, что и BPD, с помощью штангенциркуля, размещенного на внешнем столе черепа. Этот параметр можно использовать для расчета окружности головы (HC) и головного индекса (CI). Вариации формы головки плода (долихоцефалия, брахицефалия) и положения плода могут влиять на диагностическую точность БЛД. В случае аномального CI, определяемого как отношение BPD к OFD (нормальное значение 0,75–0,85), HC можно использовать вместо BPD, чтобы избежать этой ловушки.
БЛД демонстрирует линейный рост на 3 мм в неделю с 14 по 28 недели и на 2 мм в неделю до родов. 5,22 Измерение проводится на уровне плоскости, определяемой следующими внутримозговыми ориентирами: передние рога бокового желудочка и прозрачная полая перегородка спереди, таламус и третий желудочек по центру, а также затылочные рога желудочка головного мозга. , cisterna venae magnae cerebri и островок сзади. Измерение проводится от внешнего стола проксимального отдела черепа до внешнего стола дистального отдела черепа, при этом кости черепа перпендикулярны ультразвуковому лучу. 14 Затылочно-лобный диаметр (OFD) измеряется в той же плоскости, что и BPD, с помощью штангенциркуля, размещенного на внешнем столе черепа. Этот параметр можно использовать для расчета окружности головы (HC) и головного индекса (CI). Вариации формы головки плода (долихоцефалия, брахицефалия) и положения плода могут влиять на диагностическую точность БЛД. В случае аномального CI, определяемого как отношение BPD к OFD (нормальное значение 0,75–0,85), HC можно использовать вместо BPD, чтобы избежать этой ловушки.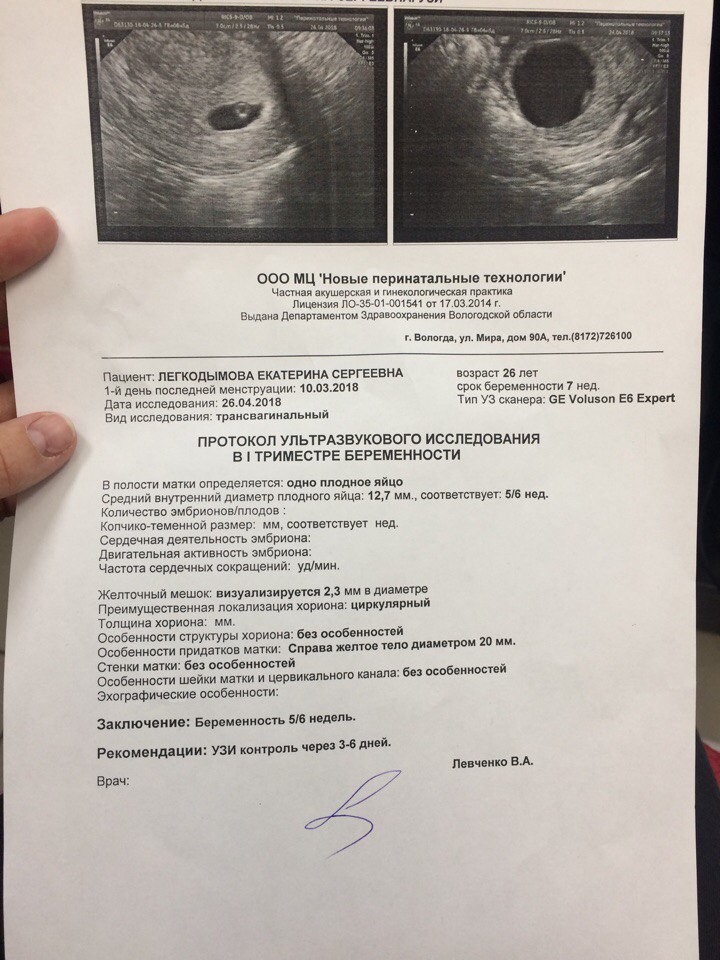 22 У плодов с преждевременным разрывом плодных оболочек, тазовым предлежанием или многоплодной беременностью БЛД ненадежна для оценки истинного ГА. 19,22
22 У плодов с преждевременным разрывом плодных оболочек, тазовым предлежанием или многоплодной беременностью БЛД ненадежна для оценки истинного ГА. 19,22
HC измеряется либо на том же уровне BPD непосредственно с помощью измерителей трассировки, либо косвенно вычисляется с использованием такой формулы, как: HC = (BPD + OFD) × 1,57. Прямой метод систематически завышает расчетную УВ менее чем на 1,5%. HC вырастает примерно на 14 мм в неделю между 14 и 17 неделями и на 5 мм в неделю в ближайшем будущем. 22 Измерение головы — плохой метод скрининга аномалий роста плода, поскольку его обычно не применяют до позднего срока, как при симметричном ограничении роста, так и при микроцефалии.
РАЗМЕР АБДОМИНАЛА
Размер живота оценивается путем измерения среднего диаметра живота (MAD) или окружности живота (AC) (рис. 9.1) на уровне желудка и разветвления главной воротной вены на правую и левую. ветви, следя за тем, чтобы сечение было как можно более круглым и не деформировалось под давлением зонда. Самый точный AC — это наименьший полученный результат, поскольку он более точно соответствует плоскости, перпендикулярной позвоночнику, на уровне печеночной вены. Подобно вычислению HC, измерение может быть прямым (эллипс или след) или производным от поперечного диаметра живота и переднезаднего диаметра живота (MAD). Из-за неправильной формы живота плода прямой метод оценивает косвенный примерно на 5%; это изменение может иметь значение при оценке веса плода. 24
Самый точный AC — это наименьший полученный результат, поскольку он более точно соответствует плоскости, перпендикулярной позвоночнику, на уровне печеночной вены. Подобно вычислению HC, измерение может быть прямым (эллипс или след) или производным от поперечного диаметра живота и переднезаднего диаметра живота (MAD). Из-за неправильной формы живота плода прямой метод оценивает косвенный примерно на 5%; это изменение может иметь значение при оценке веса плода. 24
AC демонстрирует линейный рост в среднем на 11–12 мм в неделю на протяжении всей беременности. 22 Этот параметр является наиболее чувствительным при прогнозировании проблем с питанием плода, на него влияют толщина брюшной стенки и количество запасов гликогена в печени, и он используется для оценки веса плода. По той же причине AC не следует использовать для расчета композитного GA после начала второго триместра. 22 К сожалению, на его измерение влияют самые большие вариации между и внутри наблюдателя, что объясняет очень разные пределы референсных значений, о которых сообщают разные исследователи. Фактически, положение плода и его дыхательные движения, сжатие зонда и маловодие могут повлиять на точность этого измерения.
Фактически, положение плода и его дыхательные движения, сжатие зонда и маловодие могут повлиять на точность этого измерения.
КОНЕЧНОСТИ
Длину бедра (FL) можно измерить начиная с 10 недель, и ее можно воспроизвести от 15 недель беременности до доношенных. Он представляет собой линейный рост плода, связанный с длиной макушки до пятки при рождении. 15 Первоначально он был измерен для диагностики карликовости конечностей и редко затрагивается проблемами питания плода, предлежанием или маловодием. 14,22 является хорошим параметром для определения возраста беременности.Его измеряют (рис. 9.2) от начала до дистального конца диафиза, от большого вертела до латерального мыщелка. Головка бедренной кости и дистальный эпифиз не учитываются при измерении, а кость должна быть перпендикулярна ультразвуковому лучу. Бедренная кость увеличивается на 3 мм в неделю с 14 до 27 недель и на 1 мм в неделю в третьем триместре. 22 Сообщенная точность датирования беременности колеблется от 1 недели во втором триместре до 3-4 недель при доношении. 22
22
Плечевая, большеберцовая, лучевая и локтевая кости могут быть измерены так же, как и FL, но они традиционно не используются для определения срока беременности.Большеберцовая и малоберцовая кости могут быть дифференцированы, поскольку малоберцовая кость расположена латеральнее большеберцовой кости. Лучевая и локтевая кости хорошо различимы и измеряются, когда рука находится в положении лежа на спине, потому что две кости лежат строго параллельно, но в положении лежа на животе пересечение двух костей требует двух разных плоскостей сонара для получения измерений. Локтевая кость кажется длиннее лучевой кости проксимально, но дистально обе кости заканчиваются на одном уровне. 6 На точность измерения длинной кости влияют несколько факторов, таких как угол луча к длинной оси кости (должен быть получен угол, близкий к 90 °) и тип датчика (линейный и выпуклый. зонды лучше секторных). 12
Некоторые исследователи предположили, что своего рода пренатальный весовой индекс может быть получен из длины бедренной кости, но, скорее всего, этот расчет добавляет мало информации к другим обычно используемым биометрическим параметрам. 14,22
14,22
ДРУГИЕ ИЗМЕРЕНИЯ И ДАТИРОВКА
Бинокулярное расстояние следует измерять как наименьший диаметр между глазами плода в плоскости, включая обе орбиты, которые должны казаться симметричными и равными по размеру, показывая их максимальную ширину.
Это может быть полезно для датирования в случаях затылочно-заднего положения плода, когда измерение БЛД затруднено. Это измерение коррелирует с GA, но его рост нелинейный. Вариабельность в прогнозировании ГА составляет 14 дней между 14 и 27 неделями и 24 дня между 29 и 40 неделями. Бинокулярное расстояние важно для пациентов с риском врожденных аномалий и синдромов. 14,22
Поперечный диаметр мозжечка (TCD), измеренный на уровне субокципито-брегматической плоскости головы (рис.9.3) имеет криволинейную связь с GA и не сильно зависит от формы головы или нарушений роста. 22 Размер середины беременности в миллиметрах отражает GA в неделях.
Ключица имеет линейный рост на протяжении второго и третьего триместров и была предложена в качестве полезного измерения для датирования, ее длина в миллиметрах очень близка к GA, выраженному в неделях. 14,22 Имея внутримембранное окостенение вместо эндохондрального окостенения, ключица отличается от других длинных костей тела и не страдает теми же заболеваниями.
14,22 Имея внутримембранное окостенение вместо эндохондрального окостенения, ключица отличается от других длинных костей тела и не страдает теми же заболеваниями.
Было показано, что измерения лопатки, крестца, подвздошной кости и стопы хорошо коррелируют с GA. 14
Многие органы плода были измерены и связаны с ГА, такие как почки, сердце, аортальные и легочные артерии. 2,10
ОТЧЕТ ПО ДАННЫМ
Размер плода более однороден на ранних сроках беременности, чем на более поздних. Было показано, что ранняя оценка общего состояния (сканирование 11/0–13/6 недель) или при плановом осмотре плода (16–18 недель) имеет большое значение. 26 Оценка дня родов не должна производиться позже 22 недель (BPD 60 мм). Точность снижается с 7 дней до 16 недель до 28 дней после 28 недель. Если было выполнено раннее сканирование, а второе сканирование дает более позднюю оценку, чем первое, не рекомендуется изменять исходную оценку. Задержка, скорее всего, связана с ограничением роста.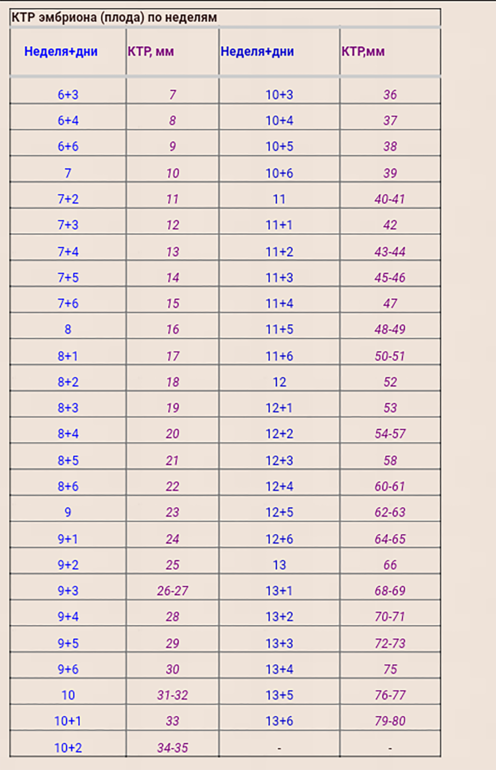 Ультразвуковой составной возраст используется после первого триместра, чтобы получить измерения как можно большего числа параметров, за исключением AC, чтобы повысить точность оценки.Большинство авторов предпочитают указывать нижний пятый и верхний 95-й пределы достоверности для прогноза каждого измерения, поскольку это может иметь юридические последствия в случае использования при принятии управленческих решений. 13 При многоплодной беременности большинство авторов согласны с тем, что таблицы, используемые для одноплодной беременности, подходят для двойни, по крайней мере, в первом и втором триместрах. Рекомендуется основывать оценку ГА на большем близнеце. Задержка роста плода при многоплодной беременности становится очевидной между 25 и 36 неделями беременности и более выражена у тройни по сравнению с беременностью двойней. 22
Ультразвуковой составной возраст используется после первого триместра, чтобы получить измерения как можно большего числа параметров, за исключением AC, чтобы повысить точность оценки.Большинство авторов предпочитают указывать нижний пятый и верхний 95-й пределы достоверности для прогноза каждого измерения, поскольку это может иметь юридические последствия в случае использования при принятии управленческих решений. 13 При многоплодной беременности большинство авторов согласны с тем, что таблицы, используемые для одноплодной беременности, подходят для двойни, по крайней мере, в первом и втором триместрах. Рекомендуется основывать оценку ГА на большем близнеце. Задержка роста плода при многоплодной беременности становится очевидной между 25 и 36 неделями беременности и более выражена у тройни по сравнению с беременностью двойней. 22
Что такое фолликулы и почему они важны для моей фертильности?
Что такое фолликулы яичников?
Фолликулы яичников — это небольшие мешочки, заполненные жидкостью, которые находятся внутри яичников женщины.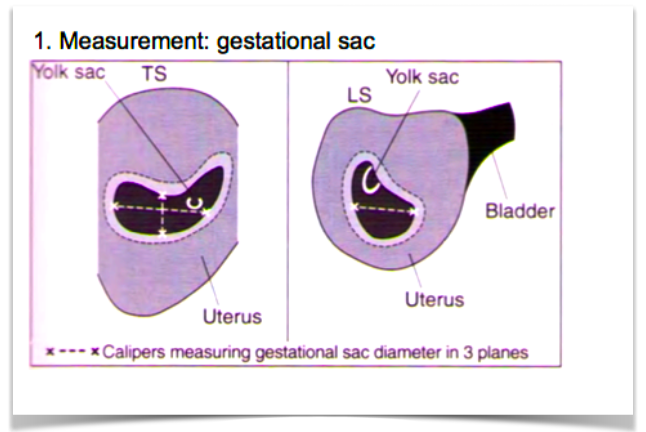 Они выделяют гормоны, которые влияют на этапы менструального цикла, и женщины начинают половое созревание примерно с 300 000 до 400 000 из них. Каждый из них может выпустить яйцеклетку для оплодотворения. Фолликулы, их размер и статус являются важной частью оценки лечения бесплодия и бесплодия.
Они выделяют гормоны, которые влияют на этапы менструального цикла, и женщины начинают половое созревание примерно с 300 000 до 400 000 из них. Каждый из них может выпустить яйцеклетку для оплодотворения. Фолликулы, их размер и статус являются важной частью оценки лечения бесплодия и бесплодия.
Оценка фолликулов включает УЗИ органов малого таза матки и яичников, а также анализ крови на анти-мюллеровский гормон. Ультразвуковое исследование органов малого таза позволит оценить размер и количество фолликулов в яичниках, что называется подсчетом антральных фолликулов. Результаты этого сканирования, а также анализ крови позволят специалисту по фертильности оценить вашу фертильность и, следовательно, вашу способность к зачатию.
Как могут быть яйца в фолликуле?
В нормальном менструальном цикле вырастет один фолликул, содержащий одну яйцеклетку.Фолликул будет увеличиваться в размерах до тех пор, пока не разорвется во время овуляции, в результате чего произойдет высвобождение яйцеклетки. Обычно это происходит примерно через 14 дней после начала менструального цикла.
Обычно это происходит примерно через 14 дней после начала менструального цикла.
Все ли фолликулы выпустят яйцеклетку?
Обычно да. В большинстве случаев фолликулы выделяют яйцеклетку. Однако вопрос о том, достаточно ли зрелая яйцеклетка или достаточно хорошего качества для оплодотворения.
Сколько фолликулов в норме?
Относится к возрасту, общему состоянию здоровья и образу жизни женщины.Однако большее количество фолликулов не обязательно гарантирует успешное оплодотворение. Качество яйцеклеток является ключевым фактором, и многие женщины с меньшим количеством фолликулов могут успешно зачать ребенка с помощью ЭКО из-за качества яйцеклеток.
Сколько осталось фолликулов на 30?
На качество и количество яйцеклеток женщины влияет ее возраст, а также другие проблемы со здоровьем и образом жизни. Количество фолликулов яичников у женщины уменьшается с возрастом, как и качество ее яйцеклеток.Однако после 35 лет фертильность женщины начинает значительно снижаться, и к возрасту от 30 до 25 лет шансы на успешную беременность невелики.
Как фолликулы связаны с моими шансами на зачатие ребенка?
Есть два основных фактора, которые следует учитывать, когда речь идет о женской мужественности:
- Качество яиц
- Количество фолликулов
Количество фолликулов, присутствующих в ваших яичниках, скажет специалисту по репродуктивной системе о состоянии вашей фертильности.Это потому, что фолликулы содержат незрелые яйца. Эти незрелые яйца развиваются и увеличиваются в размере до тех пор, пока фолликул, в котором они удерживаются, не достигнет оптимального размера, после чего они высвобождаются (овуляция). Если у вас много фолликулов, у вас есть потенциал для выделения большего количества яйцеклеток, что увеличивает вероятность того, что одна из этих яйцеклеток будет достаточно здоровой, чтобы привести к успешной беременности.
Качество яиц зависит от вашего возраста, а также от вашего образа жизни. По мере того, как женщина становится старше, качество яйцеклеток снижается, особенно после 35 лет, и, как правило, примерно с 40 лет большинство женщин не могут зачать ребенка естественным путем. К сожалению, проверить качество ваших яиц невозможно.
К сожалению, проверить качество ваших яиц невозможно.
Если вы хотите понять свои шансы на зачатие ребенка, мы рекомендуем пройти MOT по фертильности.
Почему происходит с моими фолликулами во время ЭКО?
Во время ЭКО вам назначат курс лекарств, чтобы стимулировать яичники к производству большего количества яйцеклеток. Наблюдение за фолликулами яичников является частью процесса лечения бесплодия. Во время фазы стимуляции вам сделают несколько ультразвуковых исследований органов малого таза, чтобы оценить правильность дозировки лекарств и время готовности к сбору яйцеклеток.Это включает в себя наблюдение за количеством и размером фолликулов на каждом яичнике.
Когда ваши фолликулы достигают 18-20 мм в диаметре, они считаются готовыми для сбора яйцеклеток. Вам сделают инъекцию триггерного гормона, чтобы стимулировать фолликулы к высвобождению зрелых яйцеклеток, которые были подготовлены в ваших фолликулах. Мы рассчитаем время вашей процедуры сбора яиц примерно через 36 часов после триггерной инъекции, чтобы мы могли собрать ваши яйца в наиболее удобное время.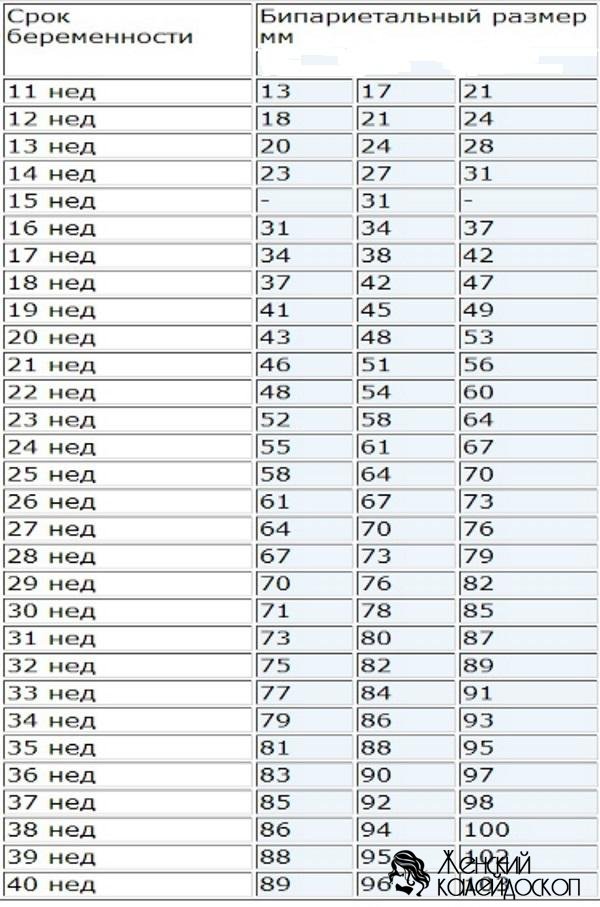 Собранные зрелые яйцеклетки будут перенесены в лабораторию для оплодотворения спермой для создания эмбрионов.
Собранные зрелые яйцеклетки будут перенесены в лабораторию для оплодотворения спермой для создания эмбрионов.
Могут ли ЭКО повлиять на мои фолликулы?
Синдром гиперстимуляции яичников может возникнуть, если яичники очень чувствительны к стимуляции и производят необычно большое количество фолликулов и, следовательно, яйцеклеток (обычно более 15) или высокий уровень эстрадиола. Это потенциально опасная ситуация, хотя СГЯ в тяжелой форме встречается только у 0,5% пациентов. Во время фазы моделирования вашего цикла лечения ваши фолликулы будут тщательно контролироваться ультразвуковым сканированием.Если мы думаем, что вы подвержены риску развития тяжелого СГЯ, вам и вашему специалисту по фертильности необходимо будет рассмотреть ряд вариантов, включая отказ от цикла, отсрочку сбора яйцеклеток или замораживание всех эмбрионов для переноса в более позднем цикле.
Что такое синдром поликистозных яичников?
Синдром поликистозных яичников (СПКЯ) — это заболевание, которое влияет на работу яичников. Обычно это означает, что на яичниках можно увидеть кисты или высокий уровень (мужских) гормонов в организме может помешать яичнику высвобождать яйцеклетку.
Обычно это означает, что на яичниках можно увидеть кисты или высокий уровень (мужских) гормонов в организме может помешать яичнику высвобождать яйцеклетку.
СПКЯ очень распространено и может поражать каждую пятую женщину. Симптомы СПКЯ могут включать нерегулярные менструации или их отсутствие, трудности с беременностью, рост волос, увеличение веса и прыщи. Хотя СПКЯ нельзя вылечить, его можно вылечить путем похудания или с помощью лекарств. Если вы пытаетесь зачать ребенка, существует множество способов зачать ребенка, включая лекарства, внутриматочное оплодотворение (ВМИ) или ЭКО. В большинстве случаев женщины с СПКЯ могут забеременеть.
Еще вопросы о вашей фертильности?
Если вам интересно узнать о своей фертильности или вы хотите узнать, где вы находитесь с точки зрения ваших общих шансов на зачатие, почему бы не заказать у нас сейчас женское MOT по фертильности.Это так же просто, как заполнить форму или позвонить нам по телефону 020 7563 4309.
Корреляция между толщиной эндометрия и исходами беременности в новых циклах АРТ с разными возрастными группами: ретроспективное исследование | Журнал Ближневосточного общества фертильности
Мы изучили свежий цикл ЭКО / ИКСИ у 1000 пациенток и определили влияние Ent в день окончательного запуска на исход беременности. Наши результаты показали, что существует значительная корреляция между толщиной эндометрия и частотой наступления беременности.
Наши результаты показали, что существует значительная корреляция между толщиной эндометрия и частотой наступления беременности.
В то время как несколько исследований подтвердили связь тонкого эндометрия с низким уровнем клинической беременности, точка отсечения Ent для исхода беременности ЭКО – ЭТ не была определена. Исследования показали, что частота клинических беременностей и частота продолжающихся беременностей значительно снижаются, когда Ent составляет менее 7 мм в день ХГЧ [7, 8], что соответствовало результатам нашего исследования. Сообщалось, что частота самопроизвольных абортов значительно увеличивается, когда Ent> 14 мм [9], тогда как другое исследование предполагает, что при Ent> 14 мм неблагоприятного воздействия на исход беременности не наблюдается [7].В нашем исследовании мы наблюдали, что частота наступления беременности увеличилась с Ent = 8 мм до Ent = 11 мм, затем снизилась, а при Ent> 14 мм частота наступления беременности была нулевой.
Чтобы получить более точное соотношение между толщиной эндометрия и результатом ЭКО, Bu et al. продемонстрировали, что у пациенток, перенесших ЭКО с различной реакцией яичников, тонкая толщина эндометрия в день введения ХГЧ связана с более низкой частотой наступления беременности [10]. Толстый эндометрий более спорен.Несколько предыдущих исследователей предположили, что толстый эндометрий (> 16 или ≥ 17 мм) связан с улучшением скорости зачатия, в то время как другие сообщили о пагубном влиянии толстого эндометрия (> 14 мм) на скорость зачатия [11, 12] . Юань и др. В своем исследовании обнаружили устойчивую положительную корреляцию между Ent и уровнем зачатия, при этом у пациентов с Ent больше 15 мм самый высокий уровень оплодотворения — 53,3% [3]. Однако важно отметить, что утолщение эндометрия связано с рядом внутриутробных патологий, таких как полипы или миомы, которые, как было показано, отрицательно влияют на имплантацию и снижают частоту наступления беременности [13].Таким образом, у женщин с аномально утолщенным эндометрием целесообразно провести дополнительные исследования, такие как гистероскопия, для исключения и лечения любых внутриполостных поражений.
продемонстрировали, что у пациенток, перенесших ЭКО с различной реакцией яичников, тонкая толщина эндометрия в день введения ХГЧ связана с более низкой частотой наступления беременности [10]. Толстый эндометрий более спорен.Несколько предыдущих исследователей предположили, что толстый эндометрий (> 16 или ≥ 17 мм) связан с улучшением скорости зачатия, в то время как другие сообщили о пагубном влиянии толстого эндометрия (> 14 мм) на скорость зачатия [11, 12] . Юань и др. В своем исследовании обнаружили устойчивую положительную корреляцию между Ent и уровнем зачатия, при этом у пациентов с Ent больше 15 мм самый высокий уровень оплодотворения — 53,3% [3]. Однако важно отметить, что утолщение эндометрия связано с рядом внутриутробных патологий, таких как полипы или миомы, которые, как было показано, отрицательно влияют на имплантацию и снижают частоту наступления беременности [13].Таким образом, у женщин с аномально утолщенным эндометрием целесообразно провести дополнительные исследования, такие как гистероскопия, для исключения и лечения любых внутриполостных поражений.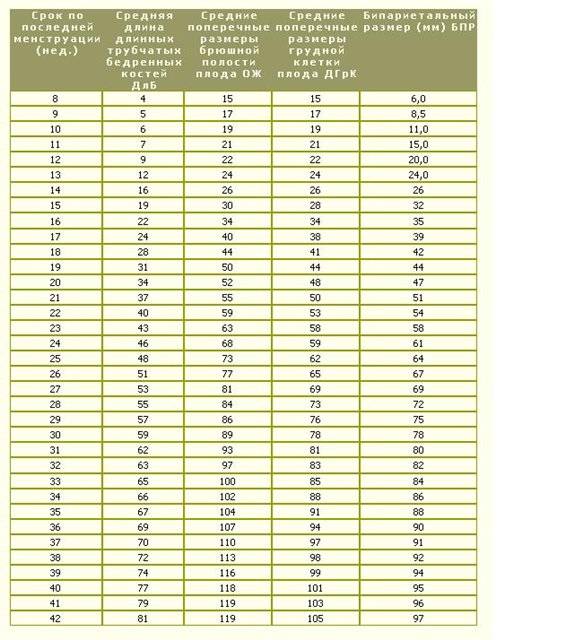
Вания Коста Рибера и его коллеги в исследовании оценили, влияет ли Ent на исход переноса свежего эмбриона, в ретроспективной одноцентровой когорте из 3350 циклов ЭКО. В многофакторном регрессионном анализе Ent нелинейно ассоциировался с живорождением, при этом коэффициент живорождения был самым низким с Ent менее 7.0 мм (21,6%; p <0,001), а затем от 7,0 до 9,0 мм (30,2%; p = 0,008). Значение Ent менее 7,0 мм также было связано со снижением массы тела новорожденного при рождении z — баллов. Они пришли к выводу, что использование Ent является потенциальным прогностическим инструментом для показателей живорождений и массы новорожденных при рождении [4].
Мохаммади и его коллеги в своем исследовании оценили влияние комбинированной толщины и структуры эндометрия на успех циклов интрацитоплазматической инъекции сперматозоидов (ИКСИ) и пришли к выводу, что толщина эндометрия составляет 10–12.9 мм с триламинарным рисунком ассоциируется с более высокой СЛР с циклами ИКСИ [14].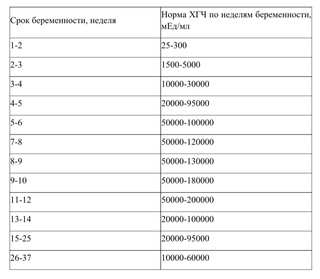
Julian et al. в своем исследовании оценили влияние структуры эндометрия в день запуска на имплантацию [15]. Паттерн эндометрия (Enp) был зарегистрирован как относящийся к одной из следующих трех категорий, как описано Grunfeld et al. [16]: (1) поздняя пролиферация (гиперэхогенный эндометрий, составляющий <50% Ent, с гиперэхогенным базисом и гипоэхогенной функциональной), (2) ранний секреторный (гиперэхогенный базальный и функциональный, распространяющийся на> 50% Ent, но не покрывающий всю полость эндометрия) и (3) средне-поздний секреторный (гомогенный гиперэхогенный функционализирующийся, простирающийся от базальной части до просвета).В исследуемой популяции Ent не имел значимой связи с клиническими исходами эуплоидных ET. Энп 3 типа в день триггера предполагает преждевременно закрытое окно имплантации [15].
Чжао и его коллеги показали значительную разницу в толщине эндометрия в день введения ХГЧ и изменение толщины эндометрия с третьего дня стимуляции гонадотропинами до дня введения ХГЧ между беременными и небеременными женщинами. Это открытие указывает на то, что адекватное развитие эндометрия способствует увеличению частоты наступления беременности.Они предполагают, что эндометрий небеременных женщин может быть связан с патологическими аномалиями, такими как плоскоклеточная метаплазия или отсутствие нормального пролиферативного ответа на повышение уровня эстрадиола. В модели бинарной логистической регрессии толщина эндометрия на 3-й день стимуляции гонадотропинами, толщина эндометрия в день введения ХГЧ и изменение толщины эндометрия с третьего дня стимуляции гонадотропинами до дня введения ХГЧ были независимыми прогностическими факторами для беременность [1] Хотя во многих исследованиях оценивалась взаимосвязь между толщиной эндометрия и исходом ЭКО, результаты все еще остаются противоречивыми.Некоторые авторы не сообщали о взаимосвязи между толщиной эндометрия и частотой наступления беременности у пациенток, перенесших ЭКО [17, 18].
Это открытие указывает на то, что адекватное развитие эндометрия способствует увеличению частоты наступления беременности.Они предполагают, что эндометрий небеременных женщин может быть связан с патологическими аномалиями, такими как плоскоклеточная метаплазия или отсутствие нормального пролиферативного ответа на повышение уровня эстрадиола. В модели бинарной логистической регрессии толщина эндометрия на 3-й день стимуляции гонадотропинами, толщина эндометрия в день введения ХГЧ и изменение толщины эндометрия с третьего дня стимуляции гонадотропинами до дня введения ХГЧ были независимыми прогностическими факторами для беременность [1] Хотя во многих исследованиях оценивалась взаимосвязь между толщиной эндометрия и исходом ЭКО, результаты все еще остаются противоречивыми.Некоторые авторы не сообщали о взаимосвязи между толщиной эндометрия и частотой наступления беременности у пациенток, перенесших ЭКО [17, 18].
Из-за основных параметров пациента, таких как количество извлеченных ооцитов, качество и количество перенесенных эмбрионов, в большинстве исследований не оценивались должным образом, и их результаты были сомнительными. В нашем исследовании мы показали, что существует значительная разница между клиническими параметрами, такими как АМГ, уровень эстрадиола в день окончательного запуска и количество извлеченных ооцитов и зрелых ооцитов у беременных и небеременных пациенток.Также наблюдалась положительная корреляция между Ent и этими клиническими параметрами. Энт является решающим фактором для беременности, но есть вероятность, что эти параметры могут быть более важными, чем Энт, и могут на него влиять. Фактически, овариальный резерв и внутренняя выработка эстрадиола вызывают рост эндометрия. АМГ считается признаком овариального резерва; например, он обычно экспрессируется теми фолликулами, которые недавно прогрессируют из пула примордиальных фолликулов. Следовательно, сывороточные уровни АМГ демонстрируют количество и особенности фолликулярного пула яичников [19].Кроме того, AMH связан с количеством зрелых ооцитов и скоростью оплодотворения. С другой стороны, между энтом и женским возрастом наблюдалась отрицательная корреляция.
В нашем исследовании мы показали, что существует значительная разница между клиническими параметрами, такими как АМГ, уровень эстрадиола в день окончательного запуска и количество извлеченных ооцитов и зрелых ооцитов у беременных и небеременных пациенток.Также наблюдалась положительная корреляция между Ent и этими клиническими параметрами. Энт является решающим фактором для беременности, но есть вероятность, что эти параметры могут быть более важными, чем Энт, и могут на него влиять. Фактически, овариальный резерв и внутренняя выработка эстрадиола вызывают рост эндометрия. АМГ считается признаком овариального резерва; например, он обычно экспрессируется теми фолликулами, которые недавно прогрессируют из пула примордиальных фолликулов. Следовательно, сывороточные уровни АМГ демонстрируют количество и особенности фолликулярного пула яичников [19].Кроме того, AMH связан с количеством зрелых ооцитов и скоростью оплодотворения. С другой стороны, между энтом и женским возрастом наблюдалась отрицательная корреляция. Мы обнаружили, что женский возраст является важным фактором фертильности, и его увеличение, хотя и незначительно, приводит к снижению частоты клинической беременности. Keane et al. в соответствии с нашим исследованием, как AFC, так и AMH сильно зависят от возраста пациента и могут оценивать исходы ЭКО, включая беременность и частоту живорождений [20]. Райхман и его коллеги показали, что АМГ является достаточно надежным показателем для прогнозирования отмены АРТ и того, сколько ооцитов может быть извлечено после стимуляции, но, наоборот, они показали, что это умеренно плохой тест для прогнозирования беременности после любого данного цикла лечения.Пациенты с чрезвычайно низким уровнем АМГ все еще могут достичь приемлемых результатов лечения, и им не следует препятствовать попыткам ЭКО исключительно на основании значения АМГ [21]. Исследования показали, что увеличение общего количества ооцитов, зигот и качества эмбрионов связано с рождением живого ребенка после циклов ЭКО донорских ооцитов [10, 22].
Мы обнаружили, что женский возраст является важным фактором фертильности, и его увеличение, хотя и незначительно, приводит к снижению частоты клинической беременности. Keane et al. в соответствии с нашим исследованием, как AFC, так и AMH сильно зависят от возраста пациента и могут оценивать исходы ЭКО, включая беременность и частоту живорождений [20]. Райхман и его коллеги показали, что АМГ является достаточно надежным показателем для прогнозирования отмены АРТ и того, сколько ооцитов может быть извлечено после стимуляции, но, наоборот, они показали, что это умеренно плохой тест для прогнозирования беременности после любого данного цикла лечения.Пациенты с чрезвычайно низким уровнем АМГ все еще могут достичь приемлемых результатов лечения, и им не следует препятствовать попыткам ЭКО исключительно на основании значения АМГ [21]. Исследования показали, что увеличение общего количества ооцитов, зигот и качества эмбрионов связано с рождением живого ребенка после циклов ЭКО донорских ооцитов [10, 22]. Barton et al. обнаружили, что возраст и E2 в день введения ХГЧ были предикторами зрелых ооцитов и извлеченных эмбрионов, а ФСГ — нет [23].
Barton et al. обнаружили, что возраст и E2 в день введения ХГЧ были предикторами зрелых ооцитов и извлеченных эмбрионов, а ФСГ — нет [23].
1 | Хильгерс, Т.W., K. D. Daly, et al. (1992). «Совокупная частота наступления беременности у пациенток с нормальной фертильностью и половым актом, ориентированным на фертильность». J Reprod Med 37 (10): 864-6. |
2 | Wilcox, A.J., C.R. Weinberg, et al. (1995). «Время полового акта относительно овуляции. Влияние на вероятность зачатия, выживаемость беременности и пол ребенка». N Engl J Med 333 (23): 1517-21. |
3 | Mosher, W.и В. Пратт (1991). «Плодовитость и бесплодие в Соединенных Штатах: заболеваемость и тенденции». Плодовитость и бесплодие 56: 1517-1521. |
4 | Руководство ASRM. |
5 | Белисл, С. и Р. А. Э. Пирсон (2002). Консенсусный документ CFAS по расследованию бесплодия.Монреаль, Квебек, Канадское общество фертильности и андрологии. |
6 | Чизен, Д. Р. и Р. А. Пирсон (2004). Транвагинальное УЗИ на первой консультации помогает лечению бесплодия. Международная федерация обществ фертильности 18-й Всемирный конгресс по фертильности и бесплодию, Монреаль, Квебек, IFFS 2004. |
7 | Тимор-Тритч, И. и С. Руттем (1989).Трансвагинальное ультразвуковое исследование в лечении бесплодия. В: Куржак А. (ред.) Ультразвук и бесплодие. . Бока Ратон, CRC Press. |
8 | Erdem, M., A. Erdem, et al. (2003). «Возрастные изменения объема яичников, количества антральных фолликулов и уровней базального фолликулостимулирующего гормона: сравнение фертильных и бесплодных женщин». |
9 | Санторо, Н., Б. Исаак и др. (2003). «Нарушение фолликулогенеза и овуляции у женщин старшего репродуктивного возраста». J Clin Endocrinol Metab 88 (11): 5502-9. |
10 | Чоу, Г. Э., А. Р. Кринити и др. (2004). «Подсчет антральных фолликулов и уровни фолликулостимулирующего гормона в сыворотке для оценки функционального возраста яичников». Акушерский гинекол 104 (4): 801-4. |
11 | Fossum, G., V. Davajan, et al.(1988). «Раннее выявление беременности с помощью трансвагинального УЗИ». Фертильность и бесплодие 49: 788-791. |
12 | Goldstein, S., S. JR, et al. (1988). «Очень раннее выявление беременности с помощью эндовагинального УЗИ». Акушерство и гинекология (72): 200-204. |
13 | Ремпен, А. |
14 | Baerwald, A.R., G.P. Adams, et al. (2003). «Характеристика динамики фолликулярной волны яичников у женщин». Биол Репрод 69 (3): 1023-31. |
15 | Baerwald, A.R., G.P. Adams, et al. (2003). «Новая модель развития фолликулов яичников во время менструального цикла человека». Fertil Steril 80 (1): 116-22. |
16 | Гужон, А.и Б. Лефевр (1983). «Эволюция диаметров самых больших здоровых и атретических фоллилий во время менструального цикла человека». Воспроизводство и плодородие 69: 497-502. |
17 | Gougeon, A. (1993). Динамика роста фолликулов человека: морфологическая перспектива. Комплексная эндокринология: яичник. |
18 | Пеллисер, А., П. Гайтин и др. (1998). «Фолликулярная динамика яичников: от фундаментальной науки к клинической практике». Журнал репродуктивной иммунологии 39: 29-61. |
19 | McGee, E. and A. Hsueh (2000). «Первоначальный и циклический набор фолликулов яичников». Endocrine Reviews 21 (2): 200-214. |
20 | Baerwald, A.R., R.A. Уокер, Р.А. Пирсон, Скорость роста фолликулов яичников во время естественных менструальных циклов, циклов оральной контрацепции и циклов стимуляции яичников.Fertil Steril, 2009. 91 (2): с. 440-9. |
21 | Бомзель-Гельмрайх, О. (1985). «Ультразвук и преовуляторный фолликул человека». Оксфорд Рев Репрод Биол 7: 1-72. |
22 | Hanna, M. |
23 | Гужон, А.(1979). «Качественные изменения средних и крупных антральных фолликулов яичника человека во время менструального цикла». Анналы Биол Аним Биох Биофиз 19 (5): 1464-1468. |
24 | Бэрд, Д. Т. (1987). «Модель фолликулярного отбора и овуляции: уроки суперовуляции». Дж. Стероид Биохим 27: 15-23. |
25 | Адамс, Г. П., Р. Л. Маттери и др. (1992).«Связь между выбросами фолликулостимулирующего гормона и возникновением фолликулярных волн у телок». Журнал репродукции и фертильности 94: 177-188. |
26 | Адамс, Г. П. и Р. А. Пирсон (1995). «Модель крупного рогатого скота для изучения фолликулярной динамики яичников у людей». |
27 | Бервальд, А. Р. и Р. А. Пирсон (2004).«Развитие эндометрия в связи с фолликулярными волнами яичников во время менструального цикла». Ультразвуковой акушерский гинеколь 24 (4): 453-60. |
28 | Ginther, O.J., E.L. Gastal, et al. (2004). «Сравнительное исследование динамики фолликулярных волн у кобыл и женщин». Биол Репрод 71 (4): 1195-201. |
29 | Гинтер, О. Дж., М. А. Бег и др. (2005). «Системные концентрации гормонов при развитии фолликулярных волн у кобыл и женщин: сравнительное исследование.»Репродукция 130 (3): 379-88. |
30 | Гинтер, О. Дж. (2000). «Выбор доминирующего фолликула у крупного рогатого скота и лошадей». Anim Reprod Sci 60-61: 61-79. |
31 | Гинтер, О. |
32 | Гужон, А.(1986). «Динамика роста фолликулов у человека: модель по предварительным результатам». Hum Reprod 1: 81-87. |
33 | Гринвальд, Г. С. и П. Ф. Терранова (1988). Фолликулярный отбор и его контроль. Физиология репродукции. Э. Нобил и Дж. Нил. Нью-Йорк, Raven Press: 387-446. |
34 | Rezaei, E., A. R. Baerwald, et al. (2007). Анализ ультрасонографических изображений доминантных и первых подчиненных фолликулов яичников человека.Материалы 53-й ежегодной конференции Канадского общества фертильности и андрологии, Галифакс, Новая Шотландия, Канада, Канадское общество фертильности и андрологии |
35 | Гурая С.С. (1985). Биология фолликулов яичников у млекопитающих. |
36 | Carson, R., J. Findlay, et al. (1986). «Относительные уровни текального кровотока в атретических и неатретических фолликулах яичников сознательной овцы.»Aust J Exper Biol Med Sci 64: 381-387. |
37 | Моор, Р. М. и Р. Ф. Симарк (1986). «Передача сигналов клеток, проницаемость и микрососудистые изменения во время развития фолликулов у млекопитающих. 69: 927-943». J Dairy Sci 69: 927-943. |
38 | Пирсон, Р. А. (1992). От овуляции до имплантации. Цветная допплеровская визуализация в акушерстве и гинекологии. Р. Джаффе и С.Л. Варсоф. Нью-Йорк, McGraw Hill, Inc .: 35–59. |
39 | Пирсон, Р. и Д. Чизен (1994). Ультрасонография нормальной и аберрантной овуляции. Визуализация в бесплодии и репродуктивной эндокринологии. |
40 | Brannstrom, M., U. Zackrisson, et al. (1998). «Преовуляторные изменения кровотока в различных областях фолликула человека.»Fertil Steril 69: 435-442. |
41 | Kuspesic, S., L. Merce, et al. (2000). Цветное допплеровское исследование от овуляции до имплантации. Иллюстрированный учебник и справочник для врачей. Издательская группа Парфенон, Нью-Йорк |
42 | Ван Блерком, Дж. (2000). «Внутрифолликулярное влияние на компетентность человеческого ооцита в развитии: перифолликулярная васкуляризация, метаболизм ооцитов и функция митохондрий.»Hum Reprod 15 Suppl 2: 173-88. |
43 | Borini, A., A. Maccolini, et al. (2001). «Перифолликулярная васкуляризация и ее связь со зрелостью ооцитов и исходом ЭКО». |
44 | Borini, A., A. Tallarini, et al. (2004). «Мониторинг и оценка перифолликулярной васкуляризации: клинический инструмент для выбора наилучшего ооцита». Eur J Obstet Gynecol Reprod Biol 115 Приложение 1: S102-5. |
45 | Shrestha, S. M., M. F. Costello, et al. (2004). «Продольная оценка перифолликулярности яичников и васкуляризации эндометрия с помощью ультразвуковой допплерографии у беременных и небеременных циклов в условиях ЭКО». J Assist Reprod Genet 21 (11): 387-95. |
46 | Shrestha, S. M., M. F. Costello, et al. (2006). «Power Doppler ультразвуковая оценка сосудистости фолликулов в ранней фолликулярной фазе и ее взаимосвязь с исходом экстракорпорального оплодотворения.»J Assist Reprod Genet 23 (4): 161-9. |
47 | Jayaprakasan, K. |
48 | Palomba, S., T. Russo, et al. (2008). «Оценка перифолликулярной васкуляризации для выбора лучших ооцитов для программ экстракорпорального оплодотворения у пожилых пациентов.»Fertil Steril 90 (4): 1305-9. |
49 | Робсон, С. Дж., М. Барри и др. (2008). «Оценка сосудистого состояния фолликулов с помощью энергетического допплера во время извлечения ооцитов в циклах экстракорпорального оплодотворения». Fertil Steril 90 (6): 2179-82. |
50 | Мартинюк С.Д., Чизен Д.Р. и др. (1992). «Ультрасонографическая морфология преовуляторной стенки фолликула человека до овуляции. |
51 | Abramowicz, J. S., R. Jaffe, et al. (1994). Трансвагинальное УЗИ с цветным допплером в оценке кровотока в матке и яичниках. В кн .: Визуализация в бесплодии и репродуктивной эндокринологии. Р. Яффе, Р. А. Пирсон и Дж. А. Абрамович. Филадельфия, Дж. Б. Липпинкотт: 167-178. |
52 | Van Blerkom, J., M. Antczak, et al.(1997). «Потенциал развития человеческого ооцита связан с содержанием растворенного кислорода в фолликулярной жидкости: ассоциация с уровнями фактора роста эндотелия сосудов и характеристиками перифолликулярного кровотока». Hum Reprod 12: 1047-1055. |
53 | Вассена Р., Г. П. Адамс и др. (2003). «Характеристики ультразвукового изображения фолликулов яичников в зависимости от компетентности ооцитов и статуса фолликулов у крупного рогатого скота». Anim Reprod Sci 76 (1-2): 25-41. |
54 | Siddiqui, M.A., M. Almamun, et al. (2009). «Кровоток в стенке преовуляторного фолликула и его связь с установлением беременности у телок». Anim Reprod Sci 113 (1-4): 287-92. |
55 | Acosta, T. J., K. G. Hayashi, et al. (2003). «Локальные изменения кровотока в преовуляторной стенке фолликула и в раннем желтом теле у коров.»Репродукция 125 (5): 759-67. |
56 | Кан А., Э. Х. Нг и др. (2006). «Перифолликулярная васкуляризация у плохо реагирующих яичников во время ЭКО». Hum Reprod 21 (6): 1539-1544. |
57 | Palomba, S., T. Russo, et al. (2006). «Клиническое использование оценки перифолликулярной васкуляризации в циклах ЭКО: пилотное исследование». Репродукция Человека 21 (4): 1055-61. |
58 | Leerentveld, R. |
59 | Hackelöer, B.J., R. Fleming, et al. (1979). «Взаимосвязь ультразвуковой и эндокринологической оценки развития фолликулов человека». Am J Obstet Gynecol 135: 122-129. |
60 | Nitschke-Dabelstein, S.и Б. Хакелёр (1980). «Овуляция и формирование желтого тела, наблюдаемые при ультразвуковом исследовании». Ультразвук в медицине и биологии 1: 33-39. |
61 | Queenan, J. T., G. D. O’Brien, et al. (1980). «Ультразвуковое сканирование яичников для выявления овуляции у женщин». Fertil Steril 34: 99-105. |
62 | Ленц, С. (1985). «Ультразвуковое исследование созревания фолликулов, овуляции и развития желтого тела во время нормальных менструальных циклов. |
63 | Пирсон, Р., С. Мартинюк, и др. (1990). Ультрасонографическая визуализация овуляции человека. 7-й симпозиум Рейнира де Граафа, Маастрихт, Нидерланды, Excerpta Medica. |
64 | Hanna, M. D., D. R. Chizen, et al. (1994). «Характеристики фолликулярной эвакуации во время овуляции человека». J Ultrasound Obstet Gynaecol 4: 488-493. |
65 | Baerwald, A.R., G.P. Adams, et al. (2005). «Форма и функция желтого тела во время менструального цикла человека». Ультразвуковой акушерский гинеколь 25 (5): 498-507. |
66 | Стоуфер Р. (1996). Формирование и гибель желтого тела. Филадельфия. |
67 | Парсонс, А. К. (2001).«Визуализация желтого тела человека». |
68 | Bourne, T.H., H. Hagstrom, et al. (1996). «Ультразвуковые исследования сосудистых и морфологических изменений желтого тела человека во время менструального цикла». Fertil Steril 65 (4): 753-8. |
69 | Guerriero, S., S. Ajossa, et al. (2005). «Лютеиновая динамика во время менструального цикла человека: новый взгляд на визуализацию.«Ультразвуковой акушерский гинеколь 25 (5): 425-7. |
70 | Geisthovel, F., U. Skubsch, et al. (1983). «Ультрасонографические и эндокринологические исследования функции яичников». Ультразвук Med Biol Suppl 2: 603-8. |
71 | Корнер, Г. У., младший (1956). «Гистологическое датирование желтого тела во время менструации». Ам Дж. Анат 98 (3): 377-401. |
72 | Hagstrom, H. |
73 | Залуд И. и А. Курьяк (1990). «Оценка лютеинового кровотока у беременных и небеременных женщин с помощью трансвагинального цветного допплера». Журнал J Perinat Med 18 (3): 215-21. |
74 | Миядзаки Т., М. Танака и др. (1998). «Энергетическая и цветная допплерография для оценки сосудистой сети желтого тела человека.»Hum Reprod 13 (1O): 2836-41. |
75 | Джерми К., К. Луиза и др. (2001). «Характеристика общих кист яичников у женщин в пременопаузе». Ультразвуковой акушерский гинеколь 17 (2): 140-4. |
76 | de Silva, K. S., S. Kanumakala, et al. (2004). «Поражения яичников у детей и подростков — обзор за 11 лет». |
77 | Comerci, J.T., Jr., F. Licciardi, et al. (1994). «Зрелая кистозная тератома: клинико-патологическая оценка 517 случаев и обзор литературы». Акушерский гинекол 84 (1): 22-8. |
78 | Стюарт, Г. К. и Дж. П. Смит (1983). «Разорванные доброкачественные кистозные тератомы, имитирующие гинекологические злокачественные новообразования». Гинекол Онкол 16 (1): 139-43. |
79 | Phupong, V., T. Sueblinvong, et al.(2004). «Тератома яичника с диффузными перитонеальными реакциями, имитирующими прогрессирующее злокачественное новообразование яичников». Arch Gynecol Obstet 270 (3): 189-91. |
80 | Maiti, S., Z. Fatima, et al. (2008). «Разрыв кистозной тератомы яичника при беременности с диффузной реакцией брюшины, имитирующей прогрессирующее злокачественное новообразование яичников: отчет о болезни». |
81 | Бал, А., Х. Мохан и др. (2007). «Злокачественная трансформация зрелой кистозной тератомы яичника: отчет о пяти случаях и обзор литературы». Arch Gynecol Obstet 275 (3): 179-82. |
82 | Caspi, B., U. Elchalal, et al. (1995). «Предоперационная сонография при обнаружении небольших доброкачественных кистозных тератом». Int J Gynaecol Obstet 48 (1): 75-8. |
83 | Каспи, Б., З.Аппельман и др. (1997). «Модель роста дермоидных кист яичников: проспективное исследование у женщин в пременопаузе и постменопаузе». Fertil Steril 68 (3): 501-5. |
84 | Yamanaka, Y., Y. Tateiwa, et al. (2005). «Предоперационная диагностика злокачественной трансформации зрелой кистозной тератомы яичника». Eur J Gynaecol Oncol 26 (4): 391-2. |
85 | Залель, Ю., Б. Каспи и др. (1997). «Характеристики допплеровского течения дермоидных кист: уникальный внешний вид зоба яичников». J Ultrasound Med 16 (5): 355-8. |
86 | Kurjak, A., S. Kupesic, et al. (2002). «Ультразвуковая оценка яичников в пери- и постменопаузе». Maturitas 41 (4): 245-54. |
87 | Fleischer, A.C., A. Lyshchik, et al. (2008). «Трансвагинальная сонография с контрастированием доброкачественных и злокачественных новообразований яичников: предварительные результаты.»J Ultrasound Med 27 (7): 1011-8; викторина 1019-21. |
88 | Купешич, С. и Б. М. Плавшич (2006). «Ранний рак яичников: трехмерный энергетический допплер». Визуализация брюшной полости 31 (5): 613-9. |
89 | Kinkel, K., K. A. Frei, et al. (2006). «Диагностика эндометриоза с помощью изображений: обзор». Eur Radiol 16 (2): 285-98. |
90 | АСРМ, Т.P. C. o. т. A. S. f. Р. М. (2006). «Эндометриоз и бесплодие». Бесплодие 86 (Suppl4): s156-60. |
91 | ASRM, A. S. f. Р. М. (1997). «Пересмотренная классификация эндометриоза Американским обществом репродуктивной медицины:». Fertil Steril 67:: 817-21. |
92 | Acien, P., G. Perez-Albert, et al. (2005). «Лечение эндометриоза с помощью трансвагинального дренажа под контролем УЗИ под аналогами ГнРГ и рекомбинантным интерлейкином-2, оставшимся в кистах.«Гинекол Обстет Инвест 60 (4): 224-31. |
93 | Пиннелли, А. и М. Ди Чезаре (2005). «Человеческая фертильность: социально-демографические аспекты». Контрацепция 72 (4): 303-7. |
94 | Dechaud H, Dechanet C, Brunet C, Reyffmann L, Hamamah S, Hedon B. Эндометриоз и экстракорпоральное оплодотворение: обзор. Гинекологическая эндокринология 11: 717-721 (2009) |
95 | Куряк, А., Х. Шалан и др. (1993). «Рак яичников I стадии по данным трансвагинальной цветной допплерографии: отчет о 18 случаях». Ультразвуковой акушерский гинекол 3 (3): 195-8. |
96 | Tarlatzis, B.C. и L. Zepiridis (2003). «Перименопаузальное зачатие». Энн Н. И Акад. Sci 997: 93-104. |
97 | Свэнтон, А. и Т. Чайлд (2005). «Репродукция и старение яичников». J Br Menopause Soc 11 (4): 126-31. |
98 | Аллен В. М., Р. Д. Уилсон и др. (2006). «Исходы беременности после вспомогательных репродуктивных технологий». J Obstet Gynaecol Can 28 (3): 220-50. |
99 | Роу, Т. (2006). «Фертильность и возраст женщины». J Reprod Med 51 (3): 157-63. |
100 | Букман А. и М. Дж. Хейнеман (2001).«Тестирование яичникового резерва и использование прогностических моделей у пациенток с субфертильностью». Hum Reprod Update 7 (6): 581-90. |
101 | Букулмез, О. и А. Ариси (2004). «Оценка овариального резерва». Curr Opin Obstet Gynecol 16 (3): 231-7. |
102 | Уоллес, У. Х. и Т. У. Келси (2004). «Яичниковый резерв и репродуктивный возраст могут быть определены путем измерения объема яичников с помощью трансвагинальной сонографии.»Hum Reprod 19 (7): 1612-7. |
103 | Broekmans, F. J., M. Faddy, et al. (2005). «Яичниковый резерв и репродуктивный возраст могут быть определены путем измерения объема яичников с помощью трансвагинальной сонографии». Репродукция Человека 20 (4): 1114-5; ответ автора 1115-6. |
104 | Владимиров И.К., Тачева Д.М. и др. (2005). «Прогностическая ценность некоторых тестов яичникового резерва у плохо ответивших».»Arch Gynecol Obstet 272 (1): 74-9. |
105 | Syrop, C.H., J. D. Dawson, et al. (1999). «Объем яичников может лучше прогнозировать вспомогательные репродуктивные результаты, чем концентрация фолликулостимулирующего гормона на 3-й день». Репродукция Человека 14 (7): 1752-6. |
106 | Bancsi, L. F., F. J. Broekmans, et al. (2002). «Предикторы плохого ответа яичников при экстракорпоральном оплодотворении: проспективное исследование, сравнивающее базальные маркеры резерва яичников.»Fertil Steril 77 (2): 328-36. |
107 | Erdem, A., M. Erdem, et al. (2002). «Возрастные изменения объема яичников, количества антральных фолликулов и базального уровня ФСГ у женщин с нормальным репродуктивным здоровьем». J Reprod Med 47 (10): 835-9. |
108 | Tufan, E., K. Elter, et al. (2004). «Оценка репродуктивного старения с помощью гормональных и ультразвуковых тестов яичников.»Hum Reprod 19 (11): 2484-9. |
109 | Lass, A., J. Skull, et al. (1997). «Измерение объема яичников с помощью трансвагинальной сонографии перед индукцией овуляции с помощью менопаузального гонадотропина человека для экстракорпорального оплодотворения может предсказать плохой ответ». Репродукция Человека 12 (2): 294-7. |
110 | Ласс, А. и П. Бринсден (1999). «Роль объема яичников в репродуктивной медицине.»Hum Reprod Update 5 (3): 256-66. |
111 | Bancsi, L. F., F. J. Broekmans, et al. (2004). «Влияние повторного антрального фолликула на предсказание плохой реакции яичников у женщин, подвергающихся экстракорпоральному оплодотворению». Fertil Steril 81 (1): 35-41. |
112 | Дерман, С. Г. и Д. Б. Сейфер (2003). «Экстракорпоральное оплодотворение у пожилого пациента». Curr Womens Health Rep 3 (5): 375-83. |
113 | Durmusoglu, F., K. Elter, et al. (2004). «Комбинирование количества фолликулов на 7-й день цикла с подсчетом базальных антральных фолликулов улучшает прогнозирование реакции яичников». Fertil Steril 81 (4): 1073-8. |
114 | Hendriks, D. J., B. W. Mol, et al. (2005). «Подсчет антральных фолликулов в прогнозировании плохой реакции яичников и беременности после экстракорпорального оплодотворения: метаанализ и сравнение с базальным уровнем фолликулостимулирующего гормона.»Fertil Steril 83 (2): 291-301. |
115 | Erdem, M., A. Erdem, et al. (2004). «Сравнение базальных и индуцированных кломифен цитратом ФСГ и ингибина В, объема яичников и антральных фолликулов в качестве тестов яичникового резерва и предикторов плохой реакции яичников при ЭКО». J Assist Reprod Genet 21 (2): 37-45. |
116 | Hansen, K.R., A.C. Thyer, et al. (2005).«Репродуктивное старение и функция яичников: необходимо ли повышение уровня ФСГ в ранней фолликулярной фазе для поддержания адекватной секреторной функции у пожилых женщин с овуляцией?» Hum Reprod 20 (1): 89-95. |
117 | Роттердамский консенсус 2003 СПКЯ. Пересмотренный консенсус 2003 г. по диагностическим критериям и долгосрочным рискам для здоровья, связанным с синдромом поликистозных яичников (СПКЯ) Hum Reprod 19: (1) 41-47. |
118 | Паче, Т.D., et al., Морфология яичников у женщин-транссексуалов, длительное время леченных андрогенами. Человеческая модель для изучения синдрома поликистозных яичников? Гистопатология, 1991. 19 (5): с. 445-52. |
119 | Паче, Т. Человеческая модель для изучения синдрома поликистозных яичников? Гистопатология, 1991. 19 (5): с. 445-52. |
120 | Бервальд, А.Р., Р. А. Уокер и др. (2004). «Скорость роста и регресса фолликулов яичников во время естественных менструальных циклов и циклов оральной контрацепции». Материалы 18-го Всемирного конгресса по фертильности и бесплодию Международной федерации обществ фертильности, тезисы: 115. |
121 | Baerwald, A.R., R.A. Уокер, Р.А. Пирсон, Скорость роста фолликулов яичников во время естественных менструальных циклов, циклов оральной контрацепции и циклов стимуляции яичников.Fertil Steril, 2009. 91 (2): с. 440-9. |
122 | Carnevale, E., C. Checura, et al. (2002). Использование компьютерного анализа изображений для определения интервала до и после овуляции у кобыл. 48-я ежегодная конференция Американской ассоциации коневодов, Орландо, Флорида. |
123 | Collins, W., D. Jurkovic, et al. (1991). «Морфология яичников, эндокринная функция и внутрифолликулярный кровоток в периовуляторный период.»Hum Reprod 6: 319-324. |
124 | Tinkanen, H., E. Kujansuu, et al. (1995). «Связь между уровнями гормонов и сосудистым сопротивлением в маточных и яичниковых артериях при спонтанных менструальных циклах — ультразвуковое допплеровское исследование». Acta Obstet Gynecol Scand 74: 297-301. |
125 | Балакьер, Х. и Р. Д. Стронелл (1994). «Цветовая допплеровская оценка фолликулогенеза у пациентов с экстракорпоральным оплодотворением.»Fertil Steril 62: 1211-1216. |
126 | Наргунд, Г., Т. Борн и др. (1996). «Связь между ультразвуковыми показателями фолликулярного кровотока, восстановления ооцитов и доимплантационного качества эмбриона». Hum Reprod 11: 109-113. |
127 | Oyesanya, O.A., J.H. Parsons, et al. (1996). «Прогнозирование скорости восстановления ооцитов с помощью трансвагинального ультразвукового исследования и цветного допплера до введения хорионического гонадотропина человека в циклах оплодотворения in vitro.»Fertil Steril 65: 806-809. |
128 | Ловреч, В.Г., В. Влайсавлевич и др. (2001). «Зависимость способности ооцита к оплодотворению in vitro от перифолликулярного потока в преовуляторный период нестимулированных циклов». Wien Klin Wochenschr 113 Suppl 3: 21-6. |
129 | Altundag, M., R. Levi, et al. (2002). «Внутриовариальные показатели допплера стромальной артерии в прогнозировании ответа яичников.»J Reprod Med 47 (11): 886-90. |
130 | Гударзи, М. О. и Р. Аззиз (2006). «Диагностика, эпидемиология и генетика синдрома поликистозных яичников». Лучшая практика Res Clin Endocrinol Metab 20 (2): 193-205. |
131 | Pache, T. D., W. C. Hop, et al. (1991). «Трансвагинальная сонография и аномальный внешний вид яичников при нарушениях менструального цикла». Ультразвук Med Biol 17 (6): 589-93. |
132 | Dewailly, D., A. Duhamel, et al. (1993). «Взаимосвязь ультразвукового исследования и биологии в диагностике синдрома поликистозных яичников». Энн Н. И Акад. Sci 687: 206-16. |
133 | Atiomo, W. U., S. Pearson, et al. (2000). «Ультразвуковые критерии в диагностике синдрома поликистозных яичников (СПКЯ)». Ультразвук Med Biol 26 (6): 977-80. |
134 | Глюк, К.J., R. Papanna и др. (2003). «Заболеваемость и лечение метаболического синдрома у впервые направленных женщин с подтвержденным синдромом поликистозных яичников». Метаболизм 52 (7): 908-15. |
135 | Goodarzi, M.O., S. Erickson, et al. (2003). «Относительное влияние инсулинорезистентности и ожирения на факторы риска сердечно-сосудистых заболеваний при синдроме поликистозных яичников». Метаболизм 52 (6): 713-9. |
136 | Гударзи, М.О. и С. Г. Коренман (2003). «Важность инсулинорезистентности при синдроме поликистозных яичников». Fertil Steril 80 (2): 255-8. |
137 | Ibanez, L., A. Ferrer, et al. (2004). «Сенсибилизация к инсулину в начале менархе предотвращает прогрессирование от преждевременного лобка до синдрома поликистозных яичников». J Pediatr 144 (1): 23-9. |
138 | Салми, Д. Дж., Х. К. Зиссер и др.(2004). «Скрининг и лечение синдрома поликистозных яичников у подростков». Exp Biol Med (Maywood) 229 (5): 369-77. |
139 | Штоссер, К. (2004). «Лечение синдрома поликистозных яичников у подростков». Am Fam Physician 70 (3): 447. |
140 | Chang, W. Y., E. S. Knochenhauer, et al. (2005). «Фенотипический спектр синдрома поликистозных яичников: клинико-биохимическая характеристика трех основных клинических подгрупп.»Fertil Steril 83 (6): 1717-23. |
141 | Pettitt, D. J., P. H. Bennett, et al. (1991). «Аномальная толерантность к глюкозе во время беременности у женщин индейцев пима. Долгосрочные последствия для потомства». Диабет 40 Приложение 2: 126-30. |
142 | Mingrone, G., M. Manco, et al. (2008). «Влияние материнского ожирения на чувствительность к инсулину и секрецию у потомства». Уход за диабетом 31 (9): 1872-6. |
143 | Митчелл, Г. А. (2009). «Генетика, физиология и перинатальные факторы детского ожирения: взгляд из кафедры». Int J Obes (Lond) 33 Дополнение 1: S41-7. |
144 | Perez-Pastor, E. M., B. S. Metcalf, et al. (2009). «Ассортативный набор веса в парах мать-дочь и отец-сын: новый источник детского ожирения. Продольное исследование троек (EarlyBird 43).»Int J Obes (Лондон). |
145 | Райт, С.С., С.Л. Рифас-Шиман и др. (2009). «Внутриутробное воздействие гестационного диабета, ожирения у детей и артериального давления». Am J Hypertens 22 (2): 215-20. |
146 | Pache, T. D., J. W. Wladimiroff, et al. (1992). «Как отличить нормальные яичники от поликистоза: трансвагинальное УЗИ». Радиология 183 (2): 421-3. |
147 | Jonard, S., Y. Robert, et al. (2003). «Ультразвуковое исследование поликистозных яичников: стоит ли считать фолликулы?» Hum Reprod 18 (3): 598-603. |
148 | Balen, A.H., J.S. Laven, et al. (2003). «Ультразвуковая оценка поликистозных яичников: определения международного консенсуса». Hum Reprod Update 9 (6): 505-14. |
149 | Байаржеон, Дж.П., М. Дж. Юорно и др. (2003). «Сенсибилизаторы инсулина при синдроме поликистозных яичников». Clin Obstet Gynecol 46 (2): 325-40. |
150 | Барбьери, Р. Л. (2003). «Метформин для лечения синдрома поликистозных яичников». Акушерский гинекол 101 (4): 785-93. |
151 | Хаас Д. А., Б. Р. Карр и др. (2003). «Влияние метформина на индекс массы тела, менструальную цикличность и индукцию овуляции у женщин с синдромом поликистозных яичников.»Fertil Steril 79 (3): 469-81. |
152 | Lord, J. M., I. H. Flight, et al. (2003). «Метформин при синдроме поликистозных яичников: систематический обзор и метаанализ». Bmj 327 (7421): 951-3. |
153 | Сели, Э. и А. Дж. Дулеба (2004). «Лечение СПКЯ метформином и другими инсулино-сенсибилизирующими агентами». Curr Diab Rep 4 (1): 69-75. |
154 | Тасдемир, С., C. Ficicioglu, et al. (2004). «Влияние лечения метформином на ответ яичников при СПКЯ». Arch Gynecol Obstet 269 (2): 121-4. |
155 | Hahn, S., S. Benson, et al. (2006). «Лечение метформином синдрома поликистозных яичников улучшает качество жизни, связанное со здоровьем, эмоциональные расстройства и сексуальность». Hum Reprod. |
156 | Бален А. (2000).«Индукция овуляции при синдроме поликистозных яичников». Hum Fertil (Camb) 3 (2): 106-111. |
157 | Sovino, H., T. Sir-Petermann, et al. (2002). «Цитрат кломифена и индукция овуляции». Репродукция Biomed Online 4 (3): 303-10. |
158 | Бален А. (2003). «Индукция овуляции — оптимизация результатов и минимизация рисков». Hum Fertil (Camb) 6 (2 Suppl): S42-51. |
159 | Кублан, Х. С. и Х. Ю. Малкави (2005). «Метформин в лечении устойчивых к кломифен цитрату женщин с высоким ИМТ и первичным бесплодием: клинические результаты и репродуктивный исход». J Obstet Gynaecol 25 (1): 55-9. |
160 | Amin, M., O. Abdel-Kareem, et al. (2003). «Мини-обзор: Современное лечение пациентов, не отвечающих на цитрат кломифена при синдроме поликистозных яичников.»Kobe J Med Sci 49 (3-4): 59-73. |
161 | Кардоне, В. С. (2003). «Антагонисты ГнРГ для лечения синдрома поликистозных яичников». Fertil Steril 80 Suppl 1: S25-31; обсуждение S32-4. |
162 | Chang, W. Y., E. S. Knochenhauer, et al. (2005). «Фенотипический спектр синдрома поликистозных яичников: клинико-биохимическая характеристика трех основных клинических подгрупп.»Fertil Steril 83 (6): 1717-23. |
163 | Тесслер, Ф. Н., Р. Р. Перрелла и др. (1989). «Эндовагинальная сонографическая диагностика расширенных маточных труб». AJR Am J Roentgenol 153 (3): 523-5. |
164 | Strandell, A., A. Lindhard, et al. (2001). «Результат гидросальпинкса и ЭКО: совокупные результаты после сальпингэктомии в рандомизированном контролируемом исследовании». Hum Reprod 16 (11): 2403-10. |
165 | Сабатини, Л. и К. Дэвис (2005). «Лечение гидросальпинга: трубная хирургия или сальпингэктомия?» Curr Opin Obstet Gynecol 17 (4): 323-8. |
166 | Ричард, Х. М., 3-й, Р. Б. Парсонс и др. (1998). «Перекрут маточной трубы: прогрессирование сонографических признаков». J Clin Ultrasound 26 (7): 374-6. |
167 | Baerwald AR, Adams GP, Pierson RA.Форма и функция желтого тела во время менструального цикла человека. Ультразвуковой акушерский гинекол. 2005 25 (5): 498-507. |
168 | ван ден Дрише С., Смит В. М., Майерс М., Дункан В. Экспрессия и регуляция рецепторов эстрогена в желтом теле человека. Репродукция. 2008 135 (4): 509-17. |
169 | Wuttke W, Theiling K, Hinney B, Pitzel L. 1998. Регулирование производства стероидов и его функция в желтом теле.Стероиды 1998 63 (5): 299-305. |
170 | Валентин Л., Сладкявичюс П., Лаурини Р., Содерберг Х., Марсал К. Маточно-плацентарное и лютеиновое кровообращение при нормальной беременности в первом триместре: ультразвуковое допплерографическое и морфологическое исследование. Am J Obstet Gynecol. 1996 Февраль; 174 (2): 768-75. |
171 | Fleischer, A.C., C.M. Herbert, et al. (1986). «Сонография эндометрия во время цикла зачатия и отсутствия зачатия при экстракорпоральном оплодотворении и переносе эмбриона.»Fertil Steril 46 (3): 442-7. |
172 | Fleischer, A.C., G.C. Kalemeris, et al. (1986). «Сонографическое изображение эндометрия во время нормального цикла». Ультразвук Med Biol 12 (4): 271-7. |
173 | Форрест Т.С., Эльядерани М.К. и др. (1988). «Циклические изменения эндометрия: УЗИ с гистологической корреляцией». Радиология 167 (1): 233-7. |
174 | Персади, Р.J. (2002). «Ультрасонографическая оценка толщины эндометрия: обзор». J Obstet Gynaecol Can 24 (2): 131-6. |
175 | Линденберг А. (1994). Ультрасонографическая оценка эндометрия во время нормального менструального цикла. Визуализация при бесплодии и репродуктивной эндокринологии Р. Яффе, Р. А. Пирсон и Дж. А. Абрамович. Филадельфия, Дж. Б. Липпинкотт: 47-61. |
176 | Бервальд, А.Р., Р. А. Уокер и др. (2004). «Скорость роста и регресса фолликулов яичников во время естественных менструальных циклов и циклов оральной контрацепции». Материалы 18-го Всемирного конгресса по фертильности и бесплодию Международной федерации обществ фертильности, тезисы: 115. |
177 | Baerwald, A.R., R.A. Walker, et al. (2004). «Скорость роста фолликулов яичников во время естественных менструальных циклов и циклов стимуляции яичников.»Материалы 50-й ежегодной конференции Канадского общества фертильности и андрологии: 68. |
178 | Fleischer, A.C. (1997). «Оптимизация точности трансвагинального ультразвукового исследования эндометрия». N Engl J Med 337 (25): 1839-40. |
179 | Пирсон, Р. (2003). «Визуализация эндометрия: существуют ли предикторы восприимчивости эндометрия?». Журнал акушерства и гинекологии Канада 25: 360-368. |
180 | Пирсон, Р. А. (2003). «Визуализация эндометрия: есть ли предикторы восприимчивости матки?» J Obstet Gynaecol Can 25 (5): 360-8. |
181 | de Vries, K., E.A. Lyons, et al. (1990). «Сокращения внутренней трети миометрия». Am J Obstet Gynecol 162 (3): 679-82. |
182 | Тейлор, Э.и В. Гомель (2008). «Матка и плодородие». Fertil Steril 89 (1): 1-16. |
183 | Malini, S., C. Valdes, et al. (1984). «Сонографическая диагностика и классификация аномалий женских половых путей». J Ultrasound Med 3 (9): 397-404. |
184 | Дайя, А. (1994). Ультрасонографическая оценка аномалий матки. Визуализация в бесплодии и репродуктивной эндокринологии.Р. Яффе, Р. А. Пирсон и Дж. А. Абрамович. Филадельфия, Дж. Б. Липпинкотт: 63-94. |
185 | Reuter, K. L., D. C. Daly, et al. (1989). «Перегородка матки по сравнению с двустворчатой маткой: ошибки в диагностике изображений». Радиология 172 (3): 749-52. |
186 | Браун П., Ф. В. Грау и др. (2005). «Может ли гистеросальпингография правильно диагностировать все пороки развития матки? Ретроспективное исследование.»Eur J Radiol 53 (2): 274-9. |
187 | Valdes, C., S. Malini, et al. (1984). «Ультразвуковая оценка аномалий женских половых путей: обзор 64 случаев». Am J Obstet Gynecol 149 (3): 285-92. |
188 | Salle, B., P. Sergeant, et al. (1996). «Трансвагинальная гистеросонографическая оценка перегородки матки: предварительный отчет». Репродукция Человека 11 (5): 1004-7. |
189 | Siedler, D., F.C. Laing, et al. (1987). «Аденомиоз матки. Сложный сонографический диагноз». J Ultrasound Med 6 (7): 345-9. |
190 | Lo, S. T., P. Ramsay, et al. (2008). «Толщина эндометрия измеряется ультразвуковым сканированием у женщин с обструкцией выходного отверстия матки из-за внутриматочных спаек или спаек верхней шейки матки». Hum Reprod 23 (2): 306-9. |
191 | Ю. Д., Ю. М. Вонг и др. (2008). «Синдром Ашермана — столетие спустя». Fertil Steril 89 (4): 759-79. |
192 | Khopkar, U., R.M. Williams, et al. (2006). «Патологическое сращение плаценты после гистероскопического лизиса внутриматочных спаек». Fertil Steril 86 (5): 1513 e1-3. |
193 | Беллингхэм, Ф.Р. (1996). «Внутриматочные спайки: гистероскопический лизис и дополнительные методы». Aust N Z J Obstet Gynaecol 36 (2): 171-4. |
194 | Янг, Дж. Х., М. Дж. Чен и др. (2008). «Офисный гистероскопический ранний лизис внутриматочной спайки после трансцервикальной резекции множественных подслизистых миом». Fertil Steril 89 (5): 1254-9. |
195 | Танигучи, Ф.и Х. Сугинами (2008). «Беременность и роды после соногистерографического лизиса для лечения рецидива после гистероскопического лизиса тяжелых внутриматочных спаек: описание случая». Clin Exp Obstet Gynecol 35 (3): 215-7. |
196 | Марч, К. М. и Р. Исраэль (1981). «Гестационный результат после гистероскопического лизиса спаек». Fertil Steril 36 (4): 455-9. |
197 | Зиглер, А.М. и В. Г. Контопулос (1981). «Лизис внутриматочных спаек под гистероскопическим контролем. Отчет о 25 операциях». J Reprod Med 26 (7): 372-4. |
198 | Preutthipan, S. and V. Linasmita (2000). «Репродуктивный результат после гистероскопического лизиса внутриматочных спаек: результат 65 случаев в больнице Раматибоди». J Med Assoc Thai 83 (1): 42-6. |
199 | Тамай, К., К. Тогаши и др. (2005). «Результаты МРТ аденомиоза: корреляция с гистопатологическими особенностями и диагностическими ошибками». Радиография 25 (1): 21-40. |
200 | Атри, М., К. Рейнхольд и др. (2000). «Аденомиоз: особенности США с гистологической корреляцией в исследовании in vitro». Радиология 215 (3): 783-90. |
201 | Bromley, B., T. D. Shipp, et al.(2000). «Аденомиоз: сонографические данные и диагностическая точность». J Ultrasound Med 19 (8): 529-34; викторина 535-6. |
202 | Атзори, Э. (2003). «Сонография для диагностики аденомиоза». Ультразвуковой акушерский гинекол 21 (6): 626-7. |
203 | Дуэхольм, М. (2006). «Трансвагинальное УЗИ для диагностики аденомиоза: обзор». Лучшая практика Res Clin Obstet Gynaecol. |
204 | Lone, F. W., M. Balogun, et al. (2006). «Аденомиоз: уже не такой неуловимый диагноз». J Obstet Gynaecol 26 (3): 225-8. |
205 | Ascher, S. M., R. C. Jha, et al. (2003). «Доброкачественные состояния миометрия: лейомиомы и аденомиоз». Верхняя магнитно-резонансная томография 14 (4): 281-304. |
206 | Харманлы, О.Х., С. А. Бевилаква и др. (2005). «Аденомиоз мешает точному ультразвуковому обнаружению лейомиомы матки». Arch Gynecol Obstet 273 (3): 146-9. |
207 | Berghella, V., L. Pereira, et al. (2004). «Предыдущая биопсия конуса: прогнозирование преждевременных родов с помощью УЗИ шейки матки». Am J Obstet Gynecol 191 (4): 1393-7. |
208 | Крейн, Дж. М. и С. Хили (2006).«Использование мизопростола перед гистероскопией: систематический обзор». J Obstet Gynaecol Can 28 (5): 373-9 |
209 | Парих Р., Броцман С. и др. (2007). «Разрывы шейки матки: некоторые удивительные факты». Am J Obstet Gynecol 196 (5): e17-8. |
210 | Sung, P. L., K. C. Chao, et al. (2007). «Постконизационная перфорация шейки матки при лапароскопической операции». Тайвань J Obstet Gynecol 46 (1): 71-2. |
211 | Hefler, L., A. Lemach, et al. (2009). «Частота интраоперационных осложнений неакушерской дилатации и выскабливания». Акушер-гинекол 113 (6): 1268-71. |
212 | Меламед Н., А. Бен-Харуш и др. (2009). «Внутриродовые разрывы шейки матки: характеристики, факторы риска и влияние на последующие беременности». Am J Obstet Gynecol 200 (4): 388 e1-4. |
213 | Spitzer, M., A.E. Chernys, et al. (1998). «Показания к биопсии конуса: патологическая взаимосвязь». Am J Obstet Gynecol 178 (1, часть 1): 74-9. |
214 | Эль-Тухи, Т.А., С. Махадеван и др. (2001). «Биопсия конуса холодным ножом — действенный диагностический инструмент и вариант лечения поражений шейки матки». J Obstet Gynaecol 21 (2): 175-8. |
215 | Мирошниченко, Г.Г., Парва М. и др. (2009). «Интерпретируемость эксцизионной биопсии шейки матки: конусная биопсия и иссечение петли». Дж. Низкий отдел мочеполовых путей 13 (1): 10-2. |
216 | Althuisius, S.M., G.A. Dekker, et al. (2000). «Рандомизированное серкляжное исследование профилактики цервикальной недостаточности (CIPRACT): дизайн исследования и предварительные результаты». Am J Obstet Gynecol 183 (4): 823-9. |
217 | Гусман, Э.Р., А. М. Винцилеос и др. (1997). «Естественная история положительной реакции на трансфундальное давление у женщин с риском цервикальной недостаточности». Am J Obstet Gynecol 176 (3): 634-8. |
218 | Шериф, Л. С. и Х. М. Шалан (1997). «Выявление беременных женщин с риском несостоятельности шейки матки с помощью трансвагинальной сонографии во время натуживания». Журнал J Obstet Gynaecol Res 23 (4): 353-7. |
219 | Такеда, С., К. Куромаки и др. (1997). «Управление цервикальной недостаточностью с выступающими мембранами во влагалище путем орошения влагалища ингибитором гранулоцитарной эластазы: улинастатином и раствором PVP-йода». J Obstet Gynaecol 17 (1): 45-8. |
220 | Campioni, P., S. Goletti, et al. (1998). «Диагностическая визуализация при цервикальной недостаточности». Лучи 23 (4): 637-48. |
221 | Кассанос, Д., Э. Саламалекис и др. (2001). «Значение трансвагинального ультразвукового исследования в диагностике и лечении цервикальной недостаточности». Clin Exp Obstet Gynecol 28 (4): 266-8. |
222 | Drakeley, A.J., D. Roberts, et al. (2003). «Цервикальный шов (серкляж) для предотвращения выкидыша у женщин». Кокрановская база данных Syst Rev (1): CD003253. |
223 | Оуэн, Дж., Дж.Д. Ямс и др. (2003). «Вагинальная сонография и несостоятельность шейки матки». Am J Obstet Gynecol 188 (2): 586-96. |
224 | Хиггинс, С. П., Л. Х. Корнман и др. (2004). «Наблюдение за шейкой матки как альтернатива плановому серкляжу шейки матки для ведения беременности с подозрением на цервикальную недостаточность». Aust N Z J Obstet Gynaecol 44 (3): 228-32. |
225 | Альтуизиус, С.М. и Г. А. Деккер (2005). «Пятивековая эволюция цервикальной недостаточности как клинической сущности». Curr Pharm Des 11 (6): 687-97. |
226 | Tudur-Smith, C., A. L. Jorgensen, et al. (2005). «Метаанализ индивидуальных данных пациентов: шейный шов (серкляж) для предотвращения потери беременности у женщин». BMC по беременности и родам 5 (1): 5. |
227 | Чао, А.С., Чао А. и др. (2008). «Ультразвуковая оценка длины шейки матки при беременности». Тайвань J Obstet Gynecol 47 (3): 291-5. |
228 | Acharya, G., B. Eschler, et al. (2006). «Неинвазивный серкляж для лечения цервикальной недостаточности: проспективное исследование». Arch Gynecol Obstet 273 (5): 283-7. |
229 | Audu, B.M., C.M. Chama, et al. (2003). «Осложнения цервикального серкляжа у женщин с цервикальной недостаточностью.»Int J Gynaecol Obstet 83 (3): 299-300. |
230 | Флигнер, Дж. Р. (1997). «Экстренный цервикальный серкляж при цервикальной недостаточности». J Obstet Gynaecol 17 (6): 602. |
231 | Куруп М. и Дж. В. Голдкранд (1999). «Несостоятельность шейки матки: плановый, неотложный или срочный серкляж». Am J Obstet Gynecol 181 (2): 240-6. |
232 | Матиевич, Р., Б. Олуйич и др. (2001). «Несостоятельность шейки матки: использование выборочного и экстренного серкляжа». J Perinat Med 29 (1): 31-5. |
233 | Althuisius, S.M., G.A. Dekker, et al. (2003). «Рандомизированное исследование серкляжа по профилактике цервикальной недостаточности: экстренный серкляж с постельным режимом или только постельный режим». Am J Obstet Gynecol 189 (4): 907-10. |
234 | Коквелл, Х.А. и Г. Н. Смит (2005). «Несостоятельность шейки матки и роль экстренного серкляжа». J Obstet Gynaecol Can 27 (2): 123-9. |
235 | Энтони Г. С., Р. Г. Уокер и др. (1997). «Трансабдоминальный шейно-истмический серкляж в лечении цервикальной недостаточности». Eur J Obstet Gynecol Reprod Biol 72 (2): 127-30. |
236 | Kjollesdal, M., S. Nielsen, et al.(2005). «Лапароскопический шейно-маточный серкляж с использованием полипропиленовой сетки для лечения цервикальной недостаточности». Acta Obstet Gynecol Scand 84 (8): 823-4. |
237 | Althuisius, S., G. Dekker, et al. (2002). «Рандомизированное испытание серкляжа по профилактике цервикальной недостаточности (CIPRACT): влияние терапевтического серкляжа с постельным режимом по сравнению с постельным режимом только на длину шейки матки». Ультразвуковой акушерский гинеколь 20 (2): 163-7. |
238 | Альтуизиус, С.М., Г. А. Деккер и др. (2002). «Несостоятельность шейки матки: переоценка акушерских противоречий». Obstet Gynecol Surv 57 (6): 377-87. |
239 | Шейнер Э., Башири А. и др. (2004). «Преждевременные роды у женщин с серкляжем Макдональда, выполненные из-за цервикальной недостаточности». Fetal Diagn Ther 19 (4): 361-5. |
240 | Шеперд, Дж. Х., Р. А. Кроуфорд и др.(1998). «Радикальная трахелэктомия: способ сохранить фертильность при лечении раннего рака шейки матки». Br J Obstet Gynaecol 105 (8): 912-6. |
241 | Abu-Rustum, N. R., N. Neubauer, et al. (2008). «Хирургические и патологические результаты радикальной абдоминальной трахелэктомии с сохранением фертильности при раке шейки матки стадии IB1 по классификации FIGO». Гинекол Онкол 111 (2): 261-4. |
242 | Чуанг, Л.Т., Д. Л. Лернер и др. (2008). «Роботизированная радикальная трахелэктомия с сохранением фертильности и двусторонняя тазовая лимфаденэктомия при раке шейки матки на ранней стадии». J Minim Invasive Gynecol 15 (6): 767-70. |
243 | Abu-Rustum, N. R., N. Neubauer, et al. (2008). «Хирургические и патологические результаты радикальной абдоминальной трахелэктомии с сохранением фертильности при раке шейки матки стадии IB1 по классификации FIGO». Гинекол Онкол 111 (2): 261-4. |
244 | Пареха, Ф.Р., П. Т. Рамирес и др. (2008). «Абдоминальная радикальная трахелэктомия при инвазивном раке шейки матки: серия клинических случаев и обзор литературы». Гинекол Онкол 111 (3): 555-60. |
245 | Плант, М. (2008). «Вагинальная радикальная трахелэктомия: обновленная информация». Gynecol Oncol 111 (2 приложения): S105-10. |
246 | Olawaiye, A., M. Del Carmen, et al. (2009). «Абдоминальная радикальная трахелэктомия: успехи и недостатки общей гинекологической онкологической практики.«Гинекол Онкол 112 (3): 506-10. |
247 | Wong, I., W. Justin, et al. (2009). «Вспомогательное зачатие после радикальной трахелэктомии». Hum Reprod 24 (4): 876-9. |
248 | Ishioka, S., T. Endo, et al. (2007). «Осложнения, связанные с беременностью, после вагинальной радикальной трахелэктомии по поводу ранней стадии инвазивного рака шейки матки». Int J Clin Oncol 12 (5): 350-5. |
249 | Джолли, Дж. А., Л. Баттиста и др. (2007). «Ведение беременности после радикальной трахелэктомии: истории болезни и систематический обзор литературы». Am J Perinatol 24 (9): 531-9. |
250 | Ли, К. Ю., Х. А. Джун и др. (2007). «Успешная двойная беременность после вагинальной радикальной трахелэктомии с использованием трансабдоминального цервикоистмического серкляжа». Am J Obstet Gynecol 197 (3): e5-6. |
251 | Boss, E. A., R. J. van Golde, et al. (2005). «Беременность после радикальной трахелэктомии: реальный вариант?» Gynecol Oncol 99 (3 приложения 1): S152-6. |
252 | Petignat, P., C. Stan, et al. (2004). «Беременность после трахелэктомии: состояние высокого риска преждевременных родов. Отчет о случае и обзор литературы». Gynecol Oncol 94 (2): 575-7. |
253 | Гримбизис, Г., М. Камю и др. (2001). «Клинические последствия пороков развития матки и результаты гистероскопического лечения». Обновление репродукции человека 7 (1): 161-174. |
254 | Медицина, P. C. o. т. A. S. f. Р. (2004). «Оптимальная оценка бесплодной самки». Фертильность и бесплодие 82 (Приложение 1): S169-S172. |
255 | Коллинз, Дж. И П. Вудворды (1995). «Радиологическая оценка бесплодия.«Семинары по УЗИ, КТ и МРТ 16: 304-316. |
256 | Alatas, C., E. Aksoy, et al. (1997). «Оценка внутриматочных аномалий у бесплодных пациентов с помощью соногистерографии». Обновление репродукции человека 12 (3): 487-490. |
257 | Wolman, I., A. Groutz, et al. (1999). «Сроки проведения соногистерографии у менструирующих женщин». Gynecol Obstet Invest 48 (4): 254-8. |
258 | Рома Далфо, А., Б. Убеда и др. (2004). «Диагностическая ценность гистеросальпингографии в обнаружении внутриматочных аномалий: сравнение с гистероскопией». AJR Am J Roentgenol 183 (5): 1405-9. |
259 | Simpson, W. L., Jr., L. G. Beitia, et al. (2006). «Гистеросальпингография: новое исследование». Радиография 26 (2): 419-31. |
260 | Гамильтон, Дж.А., А. Дж. Ларсон и др. (1998). «Регулярное использование гистеросонографии с физиологическим раствором у 500 бесплодных женщин подряд без отбора». Репродукция Человека 13 (9): 2463-73. |
261 | Соарес, С. Р., М. М. Барбоса душ Рейс и др. (2000). «Диагностическая точность соногистерографии, трансвагинальной сонографии и гистеросальпингографии у пациентов с заболеваниями полости матки». Fertil Steril 73 (2): 406-11. |
262 | Флейшер, А., Дж. Куллинан и др. (1997). Специальные процедуры в гинекологии: соногистерография и соногистеросальпингография. Нью-Йорк, Липпинкотт, Уильямс и Уильямс. |
263 | Dessole, S., M. Farina, et al. (2001). «Определение лучшего катетера для соногистерографии». Fertil Steril 76 (3): 605-9. |
264 | Schwarzler, P., H. Concin, et al. (1998). «Оценка соногистерографии и диагностической гистероскопии для оценки внутриутробной патологии.«Ультразвуковой акушерский гинекол 11 (5): 337-42. |
265 | Exacoustos, C., E. Zupi, et al. (2003). «Гистеросальпинго-контрастная сонография по сравнению с гистеросальпингографией и лапароскопической пертубацией красителем для оценки проходимости маточных труб». J Am Assoc Gynecol Laparosc 10 (3): 367-72. |
266 | Sladkevicius, P., K. Ojha, et al. (2000). «Трехмерная энергетическая допплеровская визуализация в оценке проходимости маточных труб.«Ультразвуковой акушер-гинеколь 16 (7): 644-7. |
267 | Залель Ю., Сориано Д. и др. (2000). «Вклад цветного допплеровского потока в ультразвуковую диагностику трубных аномалий». J Ultrasound Med 19 (9): 645-9. |
268 | Volpe, E., G. Zuccaro, et al. (1996). «Трансвагинальное ультразвуковое исследование проходимости маточных труб с использованием воздуха и физиологического раствора в качестве контрастного вещества в обычных условиях клиники бесплодия.»Журнал ультразвука в акушерстве и гинекологии 7: 43-48. | »
269 | Chenia, F., G. J. Hofmeyr, et al. (1997). «Сонографическая гидротубация с использованием перемешиваемого физиологического раствора: новый метод улучшения визуализации маточных труб». Br J Radiol 70 (836): 833-6. |
270 | Brown, S., C. Coddington, et al. (2000). «Оценка амбулаторной гистероскопии, гистеросонографии с инфузией физиологического раствора и гистеросальпингографии у женщин с бесплодием: проспективное рандомизированное исследование.»Фертильность и бесплодие 74: 1029-1034. |
271 | Sparac, V., S. Kupesic, et al. (2001). «Гистологическая архитектура и васкуляризация гистероскопически иссеченных внутриматочных перегородок». J Am Assoc Gynecol Laparosc 8 (1): 111-6. |
272 | Lev-Toaff, A. S., L. W. Pinheiro, et al. (2001). «Трехмерная мультипланарная соногистерография: сравнение с традиционной двумерной соногистерографией и рентгеновской гистеросальпингографией.»J Ultrasound Med 20 (4): 295-306. |
273 | Dietrich, M., A. Suren, et al. (1996). «Оценка проходимости маточных труб с помощью гистероконтрастной сонографии (HyCoSy, Echovist) и ее корреляция с результатами лапароскопии». J Clin Ultrasound 24 (9): 523-7. |
274 | Дайя, С. (2003). «Методологические ошибки в оценке эффективности рекомбинантного фолликулостимулирующего гормона по сравнению с менопаузальным гонадотропином человека при вспомогательной репродукции.»Фертильность и бесплодие 80 (5): 1100-1104. |
275 | Tarlatzis, B.C., N. Laufer, et al. (1984). «Использование ультразвукового исследования яичников для мониторинга индукции овуляции». J. In vitro Fert Embryo Transf 1 (4): 226-32. |
276 | Requena, A., F. Neuspiller, et al. (2001). «Эндокринологические и ультразвуковые вариации после извлечения незрелых ооцитов в естественном цикле.»Hum Reprod 16 (9): 1833-7. |
277 | Nagai, S., T. Yasumizu, et al. (1997). «Эффект извлечения ооцитов из небольшого ведущего фолликула в программе экстракорпорального оплодотворения по фиксированному графику». Журнал J Obstet Gynaecol Res 23 (2): 165-9. |
278 | van Gestel, I., M. M. Ijland, et al. (2005). «Волны эндометрия в циклах экстракорпорального оплодотворения: валидационное исследование». Fertil Steril 83 (2): 491-3. |
279 | Китаи, Х., Н. Инагаки и др. (1997). «Исследование взаимосвязи между созреванием и качеством человеческих ооцитов». Hum Cell 10 (4): 263-70. |
280 | Salha, O., D. Nugent, et al. (1998). «Взаимосвязь между объемом аспирата фолликулярной жидкости и зрелостью ооцитов в циклах экстракорпорального оплодотворения». Репродукция Человека 13 (7): 1901-6. |
281 | Хуанг, Ф.J., H. W. Huang и др. (2002). «Зрелость человеческих ооцитов без кумулюсов положительно связана с развитием и жизнеспособностью бластоцист». J Assist Reprod Genet 19 (12): 555-60. |
282 | Merce, L. T., S. Bau, et al. (2006). «Оценка объема яичников, количества и объема фолликулов и сосудистой системы яичников с помощью трехмерного ультразвукового исследования и энергетической допплерографии в день приема ХГЧ для прогнозирования результатов циклов ЭКО / ИКСИ.»Hum Reprod 21 (5): 1218-26. |
283 | Lin, Y.C., S.Y. Chang, et al. (2003). «Зрелость человеческих ооцитов in vivo определяет исход развития бластоцист in vitro». J Assist Reprod Genet 20 (12): 506-12. |
284 | Пиктон, Х. М., М. А. Данфур и др. (2003). «Рост и созревание ооцитов in vitro». Reprod Suppl 61: 445-62. |
285 | Triwitayakorn, A., С. Суваджанакорн и др. (2003). «Корреляция между диаметром фолликула человека и результатами ооцитов в программе ИКСИ». J Assist Reprod Genet 20 (4): 143-7. |
286 | Рассел, Дж. Б. (1998). «Извлечение незрелых ооцитов в сочетании с созреванием ооцитов in vitro». Hum Reprod 13 Suppl 3: 63-70; обсуждение 71-5. |
287 | Торнтон М. Х., М. М. Фрэнсис и др.(1998). «Извлечение незрелых ооцитов: уроки нестимулированных циклов ЭКО». Fertil Steril 70 (4): 647-50. |
288 | Рассел, Дж. Б. (1999). «Извлечение незрелых ооцитов с созреванием ооцитов in vitro». Curr Opin Obstet Gynecol 11 (3): 289-96. |
289 | Пиктон, Х. М., С. Е. Харрис и др. (2008). «Рост и созревание фолликулов in vitro». Репродукция 136 (6): 703-15. |
290 | Baerwald, A.R., R.A. Walker, et al. (2009). «Скорость роста фолликулов яичников во время естественных менструальных циклов, циклов оральной контрацепции и циклов стимуляции яичников». Fertil Steril 91 (2): 440-9. |
291 | Аль-Шаваф, Т. и Дж. Г. Грудзинскас (2003). «Профилактика и лечение синдрома гиперстимуляции яичников». Передовая практика Res Clin Obstet Gynaecol 17 (2): 249-61. |
292 | Delbaere, A., G. Smits, et al. (2004). «Новое понимание патофизиологии синдрома гиперстимуляции яичников. В чем разница между спонтанным и ятрогенным синдромом?» Hum Reprod 19 (3): 486-9. |
293 | Delbaere, A., G. Smits, et al. (2005). «Понимание синдрома гиперстимуляции яичников». Эндокринная 26 (3): 285-90. |
294 | ДеЧерни, А.Х. и Н. Лауфер (1984). «Мониторинг индукции овуляции с помощью ультразвука и эстрогена». Clin Obstet Gynecol 27 (4): 993-1002. |
295 | Россавик И.К. и У.Э. Гиббонс (1985). «Вариабельность роста фолликулов яичников в естественных менструальных циклах». Fertil Steril 44 (2): 195-9. |
296 | Zegers-Hochschild, F., C. Gomez Lira, et al. (1984). «Сравнительное исследование профиля роста фолликулов в циклах зачатия и отсутствия зачатия.»Fertil Steril 41 (2): 244-7. |
297 | Сингх Дж., Г. П. Адамс и др. (2003). «Перспективы новых технологий визуализации для оценки функции яичников». Anim Reprod Sci 78 (3-4): 371-99. |
298 | Сарти, Г. Э. и Р. А. Пирсон (2005). «Математическое моделирование роста фолликулов яичников для прогнозирования реакции яичников на суперстимуляцию». Математические биологические науки 198: 80-96. |
299 | Smits, G., O. Olatunbosun, et al. (2003). «Синдром гиперстимуляции яичников из-за мутации рецептора фолликулостимулирующего гормона». N Engl J Med 349 (8): 760-6. |
300 | Avecillas, J. F., T. Falcone, et al. (2004). «Синдром гиперстимуляции яичников». Crit Care Clin 20 (4): 679-95, ix. |
301 | Будев, М.М., А. С. Арролига и др. (2005). «Синдром гиперстимуляции яичников». Crit Care Med 33 (10 приложение): S301-6. |
302 | Delvigne, A. and S. Rozenberg (2003). «Обзор клинического течения и лечения синдрома гиперстимуляции яичников (СГЯ)». Hum Reprod Update 9 (1): 77-96. |
303 | Delvigne, A. and S. Rozenberg (2002). «Эпидемиология и профилактика синдрома гиперстимуляции яичников (СГЯ): обзор.»Hum Reprod Update 8 (6): 559-77. |
304 | Абулгар М. (2009). «Профилактика СГЯ». Репродукция Biomed Online 19 (1): 33-42. |
305 | Пирсон, Р. и Д. Чизен (1994). Ультрасонография нормальной и аберрантной овуляции. Визуализация в бесплодии и репродуктивной эндокринологии. Р. Яффе, Р. Пирсон и Дж. Абрамович. Филадельфия, Дж. Б. Липпинкотт: 155–166. |
306 | Даннингер, Б., М. Бруннер и др. (1996). «Прогнозирование синдрома гиперстимуляции яичников с помощью ультразвуковой объемной оценки [скорректированного] исходного объема яичников до стимуляции». Hum Reprod 11 (8): 1597-9. |
307 | Ласс, А. (2003). «Мониторинг циклов экстракорпоральное оплодотворение-перенос эмбриона с помощью ультразвука в сравнении с ультразвуком и гормональными уровнями: проспективное, многоцентровое, рандомизированное исследование». Fertil Steril 80 (1): 80-5. |
308 | Орвието, Р.(2005). «Можем ли мы устранить тяжелый синдром гиперстимуляции яичников?» Репродукция Человека 20 (2): 320-2. |
309 | Д’Анджело, А. и Н. Амсо (2002). «Обгон (задержка гонадотропинов) для предотвращения синдрома гиперстимуляции яичников». Кокрановская база данных Syst Rev (3): CD002811. |
310 | Д’Анджело, А. и Н. Н. Амсо (2002). «Замораживание эмбрионов для предотвращения синдрома гиперстимуляции яичников: Кокрановский обзор.»Hum Reprod 17 (11): 2787-94. |
311 | Chen, D., L. Burmeister, et al. (2003). «Синдром гиперстимуляции яичников: стратегии профилактики». Репродукция Biomed Online 7 (1): 43-9. |
312 | Mansour, R., M. Aboulghar, et al. (2005). «Критерии успешного каботажного протокола для предотвращения тяжелого синдрома гиперстимуляции яичников». Hum Reprod 20 (11): 3167-72. |
313 | Гарсия-Веласко, Дж. А., В. Исаза и др. (2006). «Выбег для профилактики синдрома гиперстимуляции яичников: много шума из ничего?» Fertil Steril 85 (3): 547-54. |
314 | Fukaya, T., S. Chida, et al. (1994). «Лечение тяжелого синдрома гиперстимуляции яичников путем ультрафильтрации и реинфузии асцитической жидкости». Fertil Steril 61 (3): 561-4. |
315 | Delvigne, A. and S. Rozenberg (2002). «Эпидемиология и профилактика синдрома гиперстимуляции яичников (СГЯ): обзор». Hum Reprod Update 8 (6): 559-77. |
316 | Mikkelsen AL. Стратегии созревания человека in vitro и их клинические результаты. Репродукция Биомед онлайн. 2005 Май; 10 (5): 593-9. |
317 | Буссо, К.Э., Х. Гарсия-Веласко и др. (2009). «Профилактика СГЯ — агонисты дофамина». Репродукция Biomed Online 19 (1): 43-51. |
318 | Кол, С. и Дж. Дор (2009). «Профилактика СГЯ: агонист ГнРГ по сравнению с ХГЧ, чтобы вызвать овуляцию». Репродукция Biomed Online 19 (1): 59-60. |
319 | Myrianthefs, P., C. Ladakis, et al. (2000). «Синдром гиперстимуляции яичников (СГЯ): диагностика и лечение.»Intensive Care Med 26 (5): 631-4. |
320 | Cobellis, L., E. Pecori, et al. (2003). «Синдром гиперстимуляции яичников: различие между местным и системным заболеванием». Гинекол эндокринол 17 (2): 95-9. |
321 | Jakimiuk, A.J., A. Fritz, et al. (2007). «Диагностика и лечение ятрогенного синдрома гиперстимуляции яичников (СГЯ) средней и тяжелой степени тяжести в клинических материалах.»Folia Histochem Cytobiol 45 Suppl 1: S105-8. |
322 | Jayaprakasan, K., M. Herbert, et al. (2007). «Оценка рисков синдрома гиперстимуляции яичников (СГЯ): значение донорства яйцеклеток для исследований». Hum Fertil (Camb) 10 (3): 183-7. |
323 | Chen, S.U., C.D. Chen, et al. (2008). «Синдром гиперстимуляции яичников (СГЯ): новые стратегии профилактики и лечения.»J Formos Med Assoc 107 (7): 509-12. |
324 | Auslender, R., O. Lavie, et al. (2002). «Скручивание сосудов яичника: цветной допплеровский признак перекрута придатков без удушения». Ультразвуковой акушерский гинеколь 20 (1): 96-7. |
325 | Ben-Ami, M., Y. Perlitz, et al. (2002). «Эффективность спектрального и цветного допплера в прогнозировании перекрута яичников.Перспективное исследование. «Eur J Obstet Gynecol Reprod Biol 104 (1): 64-6. |
326 | Dellenbach, P., I. Nisand, et al. (1985). «Трансвагинальная пункция фолликулов под контролем сонографии для извлечения ооцитов». Fertil Steril 44 (5): 656-62. |
327 | Schulman, J. D., A. Dorfmann, et al. (1985). «Амбулаторное экстракорпоральное оплодотворение с использованием трансвагинального извлечения ооцитов и местной анестезии.»N Engl J Med 312 (25): 1639. |
328 | Cohen, J., C. Debache, et al. (1986). «Трансвагинальная пункция яичников под контролем сонографии для извлечения ооцитов для экстракорпорального оплодотворения». J In vitro Fert Embryo Transf 3 (5): 309-13. |
329 | Hamberger, L., M. Wikland, et al. (1986). «Лапароскопия по сравнению с пункцией под контролем УЗИ для извлечения ооцитов». Acta Eur Fertil 17 (3): 195-8. |
330 | Hammarberg, K., L. Enk, et al. (1987). «Извлечение яйцеклеток под контролем вагинального датчика: оценка согласия пациента». Hum Reprod 2 (6): 487-90. |
331 | Рассел, Дж. Б., А. Х. ДеЧерни и др. (1987). «Новый трансвагинальный зонд и руководство по биопсии для получения ооцитов». Fertil Steril 47 (2): 350-2. |
332 | Шульман, Дж.Д., А. Д. Дорфманн и др. (1987). «Амбулаторное экстракорпоральное оплодотворение с использованием трансвагинального извлечения ооцитов под контролем УЗИ». Акушерский гинекол 69 (4): 665-8. |
333 | Feldberg, D., J. A. Goldman, et al. (1988). «Трансвагинальное извлечение ооцитов под контролем вагинального зонда для экстракорпорального оплодотворения: сравнительное исследование». J Ultrasound Med 7 (6): 339-43. |
334 | Gembruch, U., К. Дидрих и др. (1988). «Трансвагинальное извлечение ооцитов под сонографическим контролем для экстракорпорального оплодотворения». Hum Reprod 3 Suppl 2: 59-63. |
335 | Wikland, M., L. Enk, et al. (1988). «Извлечение яйцеклеток под контролем вагинального датчика». Ann N Y Acad Sci 541: 103-10. |
336 | Wiseman, D. A., W. B. Short, et al. (1989). «Получение ооцитов в программе экстракорпорального оплодотворения-переноса эмбрионов: сравнение четырех методов.»Радиология 173 (1): 99-102. |
337 | Feichtinger, W. (1992). «Современные технологии извлечения ооцитов». Curr Opin Obstet Gynecol 4 (5): 697-701 |
338 | Kemeter, P. and W. Feichtinger (1986). «Трансвагинальное извлечение ооцитов с использованием зонда трансвагинального секторного сканирования в сочетании с автоматическим устройством для пункции». Hum Reprod 1 (1): 21-4. |
339 | Стерзик, К., W. Jonatha и др. (1987). «Аспирация фолликулов под ультразвуковым контролем для извлечения ооцитов в программе экстракорпорального оплодотворения: дальнейшее упрощение». Int J Gynaecol Obstet 25 (4): 309-14. |
340 | Yuzpe, A. A., S. E. Brown, et al. (1989). «Трансвагинальное извлечение ооцитов под контролем УЗИ для экстракорпорального оплодотворения». J Reprod Med 34 (12): 937-42. |
341 | Рагни, Г., Г. С. Ломброзо и др. (1991). «Трансвагинальное извлечение яйцеклеток под эхом: эффективный и простой в освоении метод». Acta Eur Fertil 22 (2): 89-90. |
342 | Kingsland, C. R., C. T. Taylor, et al. (1991). «Требуется ли промывание фолликулов для получения ооцитов? Рандомизированное исследование». Репродукция Человека 6 (3): 382-3. |
343 | Knight, D. C., J. P. Tyler, et al. (2001).«Промывание фолликулов при извлечении ооцитов: переоценка». Aust N Z J Obstet Gynaecol 41 (2): 210-3. |
344 | Барак Ю., Дж. Б. Лессинг и др. (1988). «Разработка эффективной программы амбулаторного экстракорпорального оплодотворения (ЭКО) и переноса эмбрионов (ЭТ) с использованием извлечения ооцитов под ультразвуковым контролем». Acta Obstet Gynecol Scand 67 (7): 585-8. |
345 | Christiaens, F., К. Янссенсвиллен и др. (1998). «Сравнение эффективности вспомогательных репродуктивных технологий после извлечения яйцеклеток под общей анестезией (пропофол) с блокадой парацервикального местного анестетика: исследование случай-контроль». Репродукция Человека 13 (9): 2456-60. |
346 | Ng, E.H., B. Miao, et al. (2002). «Анксиолитическая премедикация снижает предоперационную тревогу и боль при извлечении ооцитов. Рандомизированное двойное слепое плацебо-контролируемое исследование.»Hum Reprod 17 (5): 1233-8. |
347 | Эль-Шаварби, С., Р. Маргара и др. (2004). «Обзор осложнений после трансвагинального извлечения ооцитов для экстракорпорального оплодотворения». Hum Fertil (Camb) 7 (2): 127-33. |
348 | Tummon, I., C. Newton, et al. (2004). «Вагинальный гель с лидокаином в сравнении с парацервикальным блоком лидокаина для обезболивания при извлечении ооцитов.»Hum Reprod 19 (5): 1116-20. |
349 | Бустильо, М. (2004). «Неудачное извлечение ооцитов: технический артефакт или настоящий« синдром пустого фолликула »?» Репродукция Biomed Online 8 (1): 59-67. |
350 | Кан, А.К., Х.И. Абдалла и др. (1999). «Перенос эмбрионов: под контролем УЗИ или на ощупь». Репродукция Человека 14 (5): 1259-61. |
351 | Линдхейм, С.Р., М. А. Коэн и др. (1999). «Перенос эмбрионов под контролем ультразвука значительно улучшает показатели беременности у женщин, перенесших донорство ооцитов». Int J Gynaecol Obstet 66 (3): 281-4. |
352 | Prapas, Y., N. Prapas, et al. (2001). «Перенос эмбрионов под контролем ультразвука увеличивает результаты ЭКО на 3-й и 4-й день переноса эмбрионов, но не влияет на 5-й день». Hum Reprod 16 (9): 1904-8. |
353 | Короле, Б., П. Н. Барри и др. (2002). «Влияние глубины замещения эмбриона в полость матки на частоту имплантации после ЭКО: контролируемое исследование под контролем ультразвука». Hum Reprod 17 (2): 341-6. |
354 | Coroleu, B., P. N. Barri, et al. (2002). «Полезность ультразвукового контроля при переносе замороженных-размороженных эмбрионов: проспективное рандомизированное клиническое исследование». Hum Reprod 17 (11): 2885-90. |
355 | Гарсия-Веласко, Дж.А., Исаза В. и др. (2002). «Трансабдоминальный перенос эмбрионов под контролем УЗИ не увеличивает частоту наступления беременности у реципиентов ооцитов». Fertil Steril 78 (3): 534-9. |
356 | де Камарго Мартинс, А. М., Р. Л. Баруффи и др. (2004). «Ультразвуковое наблюдение не требуется во время простого переноса эмбрионов». J Assist Reprod Genet 21 (12): 421-5. |
357 | Саллам, Х.Н. (2004). «Всегда ли перенос эмбрионов должен выполняться под контролем УЗИ?» Ультразвуковой акушерский гинекол 24 (4): 383-6. |
358 | Шамонки М.И., Спандорфер С.Д. и др. (2005). «Перенос эмбрионов под контролем ультразвука и точность пробного переноса эмбрионов». Hum Reprod 20 (3): 709-16. |
359 | Matorras, R., E. Urquijo, et al. (2002). «Перенос эмбрионов под контролем УЗИ улучшает показатели наступления беременности и увеличивает частоту простых переносов.»Hum Reprod 17 (7): 1762-6. |
360 | Баккет, В. М. (2003). «Мета-анализ переноса эмбрионов под контролем УЗИ и клинического прикосновения». Fertil Steril 80 (4): 1037-41. |
361 | Саллам, Х. Н. и С. С. Садек (2003). «Перенос эмбрионов под контролем ультразвука: метаанализ рандомизированных контролируемых исследований». Fertil Steril 80 (4): 1042-6. |
362 | Ли Р., Л. Лу и др. (2005). «Перенос эмбрионов под контролем УЗИ брюшной полости улучшает показатели клинической беременности после экстракорпорального оплодотворения: опыт 330 клинических исследований». J Assist Reprod Genet 22 (1): 3-8. |
363 | Strickler, R.C., C. Christianson, et al. (1985). «Ультразвуковое руководство для переноса человеческого эмбриона». Fertil Steril 43 (1): 54-61. |
364 | Леонг, М., C. Leung, et al. (1986). «Перенос эмбрионов с помощью ультразвука». J. In vitro Fert Embryo Transf 3 (6): 383-5. |
365 | al-Shawaf, T., R. Dave, et al. (1993). «Перенос эмбрионов в матку: насколько технические факторы влияют на частоту наступления беременности?» J Assist Reprod Genet 10 (1): 31-6. |
366 | al-Shawaf, T., D. Yang, et al. (1993). «Ультразвуковой мониторинг при замене замороженных / размороженных эмбрионов в естественных и гормональных циклах.»Hum Reprod 8 (12): 2068-74. |
367 | Баба К., О. Исихара и др. (2000). «Трехмерный ультразвук при переносе эмбрионов». Ультразвуковой акушерский гинеколь 16 (4): 372-3. |
368 | Coroleu, B., O. Carreras, et al. (2000). «Перенос эмбрионов под контролем ультразвука улучшает показатели наступления беременности после экстракорпорального оплодотворения». Репродукция Человека 15 (3): 616-20. |
369 | Рейндерс, Р.J., B. W. Mol, et al. (2000). «Использование ультразвукового контроля во время переноса эмбрионов». Репродукция Человека 15 (11): 2449. |
370 | Андерсон Р. Э., Н. Л. Ньюджент и др. (2002). «Трансвагинальный перенос эмбрионов под контролем УЗИ улучшает исход у пациентов с предыдущими неудачными циклами экстракорпорального оплодотворения». Fertil Steril 77 (4): 769-75 |
371 | Biervliet, F. P., P.Лесный и др. (2002). «Трансмиометриальный перенос эмбриона и сокращения зоны соединения». Репродукция Человека 17 (2): 347-50. |
372 | Tang, O. S., E. H. Ng, et al. (2001). «Перенос эмбрионов под контролем ультразвука: проспективное рандомизированное контролируемое исследование». Репродукция Человека 16 (11): 2310-5. |
373 | Letterie, G. S., L. Marshall, et al. (1999). «Новая коаксиальная катетерная система с эхоплотным наконечником для переноса эмбрионов под ультразвуковым контролем.»Fertil Steril 72 (2): 266-8. |
374 | Мансур, Р. Т. и М. А. Абулгар (2002). «Оптимизация техники переноса эмбрионов». Репродукция Человека 17 (5): 1149-53. |
375 | Кодзима К., М. Номияма и др. (2001). «Трансвагинальный перенос эмбрионов под контролем УЗИ улучшает показатели беременности и имплантации после ЭКО». Репродукция Человека 16 (12): 2578-82. |
376 | Хейл, Л.(2001). «Перенос эмбриона: как обеспечить правильное размещение в утробе матери». Репрод Фертил Дев 13 (1): 95-8. |
377 | Скулкрафт, У. Б., Э. С. Суррей и др. (2001). «Перенос эмбриона: методы и переменные, влияющие на успех». Fertil Steril 76 (5): 863-70. |
378 | Поуп, С.С., Э.К. Кук и др. (2004). «Влияние глубины переноса эмбрионов на экстракорпоральное оплодотворение и результаты переноса эмбрионов.»Fertil Steril 81 (1): 51-8. |
379 | Zagzebski, J. (1996). Основы ультразвуковой физики. Нью-Йорк, C.V. Мосби. |
380 | Купешич С., Бекавац И. и др. (2001). «Оценка восприимчивости эндометрия с помощью трансвагинального цветного допплера и трехмерной ультразвуковой допплерографии у пациентов, перенесших процедуры экстракорпорального оплодотворения». J Ultrasound Med 20 (2): 125-34. |
381 | Sterzik, K., D. Grab, et al. (1989). «Результаты допплерографии и их взаимосвязь с имплантацией в программе экстракорпорального оплодотворения». Fertil Steril 52 (5): 825-8. |
382 | Стир, К. В., С. Кэмпбелл и др. (1992). «Использование трансвагинальной визуализации цветного потока после экстракорпорального оплодотворения для определения оптимального состояния матки перед переносом эмбриона.»Fertil Steril 57 (2): 372-6. |
383 | Serafini, P., J. Batzofin, et al. (1994). «Сонографические маточные предикторы беременности у женщин, подвергающихся индукции овуляции для вспомогательных репродуктивных методов лечения». Fertil Steril 62 (4): 815-22. |
384 | Tekay, A., H. Martikainen, et al. (1995). «Изменения кровотока в сосудистой сети матки и яичников, а также прогностическая ценность трансвагинальной импульсной цветной допплерографии в программе экстракорпорального оплодотворения.»Hum Reprod 10 (3): 688-93. |
385 | Bassil, S., J. P. Magritte, et al. (1995). «Васкуляризация матки во время стимуляции и ее корреляция с имплантацией при экстракорпоральном оплодотворении». Hum Reprod 10 (6): 1497-501. |
386 | Cacciatore, B., N. Simberg, et al. (1996). «Трансвагинальное допплеровское исследование кровотока в маточной артерии в циклах экстракорпорального оплодотворения и переноса эмбриона.»Fertil Steril 66 (1): 130-4. |
387 | Айтоз А., Убалди Ф. и др. (1997). «Прогностическая ценность измерений кровотока в маточной артерии для восприимчивости матки в программе интрацитоплазматической инъекции сперматозоидов». Fertil Steril 68 (5): 935-7. |
388 | Friedler, S., J. G. Schenker, et al. (1996). «Роль ультразвукового исследования в оценке восприимчивости эндометрия после вспомогательных репродуктивных методов лечения: критический обзор.»Hum Reprod Update 2 (4): 323-35. |
389 | Yokota, A., A. Nakai, et al. (2000). «Изменения в маточном и яичниковом артериальном импедансе в периовуляторный период в циклах зачатия и отсутствия зачатия». Журнал J Obstet Gynaecol Res 26 (6): 435-40. |
390 | Zaidi, J., S. Campbell, et al. (1995). «Толщина эндометрия, морфология, сосудистое проникновение и велосиметрия в прогнозировании имплантации в программе экстракорпорального оплодотворения.«Ультразвуковой акушер-гинекол 6 (3): 191-8. |
391 | Yang, J., M. Wu, et al. (1999). «Связь эндометриального кровотока, определенного с помощью модифицированной методики цветного допплера, с последующим результатом экстракорпорального оплодотворения». Репродукция человека 14 (6): 361-366. |
392 | Maugey-Laulom, B., M. Commenges-Ducos, et al. (2002). «Васкуляризация эндометрия и продолжающаяся беременность после ЭКО.»Eur J Obstet Gynecol Reprod Biol 104 (2): 137-43. |
393 | Schild, R. L., C. Knobloch, et al. (2001). «Восприимчивость эндометрия в программе экстракорпорального оплодотворения, оцениваемая по кровотоку спиральной артерии, толщине эндометрия, объему эндометрия и кровотоку в маточной артерии». Fertil Steril 75 (2): 361-6. |
394 | Эпплбаум, М. (1995). «Биофизический профиль матки.«Ультразвуковой акушерский гинекол 5 (1): 67-8. |
395 | Salle, B., V. Bied-Damon, et al. (1998). «Предварительный отчет об УЗИ и цветном допплеровском исследовании матки для прогнозирования восприимчивости матки в программе экстракорпорального оплодотворения». Репродукция Человека 13 (6): 1669-73. |
396 | Пирсон, Р. А. (1999). Трехмерное ультразвуковое исследование эмбриона и плода.Ультрасонография плода и новорожденного. Р. Яффе и Т. Х. Буй. Нью-Йорк, издательская группа «Парфенон»: 317-326. |
397 | Raga, F., F. Bonilla-Musoles, et al. (1999). «Оценка объема эндометрия с помощью трехмерного ультразвука до переноса эмбриона: ключи к восприимчивости эндометрия». Репродукция Человека 14 (11): 2851-4. |
398 | Schild, R. L., D. Indefrei, et al.(1999). «Трехмерный расчет объема эндометрия и частота наступления беременности в программе экстракорпорального оплодотворения». Hum Reprod 14 (5): 1255-8. |
399 | Schild, R. L., S. Holthaus, et al. (2000). «Количественная оценка субэндометриального кровотока с помощью трехмерного ультразвука является важным прогностическим фактором имплантации в программе экстракорпорального оплодотворения». Hum Reprod 15 (1): 89-94. |
400 | Wu, H.М., Ч. Х. Чанг и др. (2003). «Определение индекса потока субэндометриальной васкуляризации с помощью трехмерного ультразвука может быть полезно для прогнозирования частоты наступления беременности у пациенток, перенесших экстракорпоральное оплодотворение и перенос эмбриона». Fertil Steril 79 (3): 507-11. |
401 | Купешич, С. (2001). «Настоящая и будущая роль трехмерного ультразвука в искусственном оплодотворении». Ультразвуковой акушерский гинеколь 18 (3): 191-4. |
402 | Мартинес-Гаудио, М., Т. Йошида и др. (1973). «Распространение и нераспространение сокращений миометрия в нормальном менструальном цикле». Am J Obstet Gynecol 115 (1): 107-11. |
403 | Lyons, E. A., P. J. Taylor, et al. (1991). «Характеристика сокращений субэндометрия миометрия на протяжении менструального цикла у нормальных фертильных женщин». Fertil Steril 55 (4): 771-4 |
404 | Иджланд, М.М., Дж. Л. Эверс и др. (1996). «Волнообразные движения эндометрия во время менструального цикла». Fertil Steril 65 (4): 746-9. |
405 | IJland, M. M., J. L. Evers, et al. (1997). «Скорость волнообразной активности эндометрия в спонтанных циклах». Fertil Steril 68 (1): 72-5. |
406 | Fanchin, R., C. Righini, et al. (2000). «Новый взгляд на эхогенность эндометрия: объективные компьютерные измерения позволяют прогнозировать восприимчивость эндометрия при экстракорпоральном оплодотворении и переносе эмбриона.»Фертил Стерил 74 (2): 274-81. |
407 | van Gestel, I., I. J. MM, et al. (2003). «Волнообразная активность эндометрия в небеременной матке». Обновление Hum Reprod 9 (2): 131-8. |
408 | Лесни П. и С. Р. Киллик (2004). «Соединительная зона матки и ее сокращения». Bjog 111 (11): 1182-9. |
409 | Фанчин, Р., К. Ригини и др. (1998). «Сокращения матки во время переноса эмбриона изменяют частоту наступления беременности после экстракорпорального оплодотворения». Hum Reprod 13 (7): 1968-74. |
410 | Лесни П., Киллик С.Р. и др. (1998). «Сокращения зоны соединения матки во время циклов вспомогательной репродукции». Hum Reprod Update 4 (4): 440-5. |
411 | Fanchin, R., J. M. Ayoubi, et al.(2000). «Гормональное влияние на сократительную способность матки при стимуляции яичников». Hum Reprod 15 Suppl 1: 90-100. |
412 | Fanchin, R., J. M. Ayoubi, et al. (2001). «Сократимость матки снижается во время переноса бластоцисты». Репродукция Человека 16 (6): 1115-9. |
413 | Fanchin, R., C. Righini, et al. (2001). «Влияние вагинального введения прогестерона на сократительную способность матки во время переноса эмбриона.»Fertil Steril 75 (6): 1136-40. |
414 | Bulletti, C. and D. de Ziegler (2005). «Сократимость матки и имплантация эмбриона». Curr Opin Obstet Gynecol 17 (3): 265-76. |
415 | Fanchin, R., C. Righini, et al. (1998). «Сокращения матки во время переноса эмбриона изменяют частоту наступления беременности после экстракорпорального оплодотворения». Hum Reprod 13 (7): 1968-74. |
416 | Влайсавлевич, В., M. Reljic и др. (2001). «Сократимость субендометрия не является предиктором исхода экстракорпорального оплодотворения (ЭКО)». Ультразвуковой акушерский гинекол 17 (3): 239-44. |
417 | Baruffi, R., A. L. Mauri, et al. (2003). «Влияние вагинального введения прогестерона, начиная с дня забора яйцеклеток, на частоту наступления беременности». J Assist Reprod Genet 20 (12): 517-20. |
418 | Sieck, U.В., К. А. Джаруди и др. (1997). «Перенос эмбрионов под контролем ультразвука не предотвращает внематочную беременность после экстракорпорального оплодотворения». Репродукция Человека 12 (9): 2081-2. |
419 | Леттери, Г. С. (2005). «Трехмерный перенос эмбрионов под контролем ультразвука: предварительное исследование». Am J Obstet Gynecol 192 (6): 1983-7; обсуждение 1987-8. |
Значение мониторинга при лечении бесплодия
Для многих пар, которые проводят лечение бесплодия, особенно внутриматочное оплодотворение (ВМИ) или экстракорпоральное оплодотворение (ЭКО), обычным ритуалом становятся посещения для утреннего наблюдения во время цикла лечения.Целью этих, иногда частых приемов является внесение необходимых промежуточных корректировок в ваш протокол лечения и определение наилучшего времени для овуляции или извлечения яйцеклеток путем мониторинга уровня эстрогена и размера фолликула. Это помогает нам достичь наилучшего результата для вас, избегая при этом возможных осложнений.
Мониторинг перед началом циклаНа вашем пути к фертильности с Shady Grove Fertility есть общие начальные этапы — первичная консультация с врачом, встреча с медсестрой медсестрой, первичный анализ крови на третий день, УЗИ, HSG и анализ спермы.Некоторые из этих тестов могли быть сделаны до посещения врача Shady Grove Fertility и могут быть включены без повторения.
После того, как ваш врач принял решение о плане лечения, начинается новый протокол. Этот визит очень важен, потому что он предоставляет вашему врачу базовые показатели уровня гормонов, а также возможность осмотреть матку и яичники с помощью ультразвука.
«Ультразвук дает нам представление о форме и мускулатуре матки, позволяет увидеть, есть ли какие-либо кисты, а также визуализировать слизистую оболочку матки», — поясняет д-р.Лорна Тиммрек из офиса Shady Grove Fertility в Колумбии. «Кроме того, яйцеклетки должны быть« незрелыми », а фолликулы — в« состоянии покоя »».
Типичный исходный уровень гормонов в крови до начала приема лекарств для ВМИ и ЭКО должен составлять:
- Эстроген — <50 пг / мл
- ХГЧ — <1 мМЕ / мл
- Прогестерон — <1 нг / мл
После того, как ваш врач изучит результаты анализа крови и УЗИ, вам позвонят из вашего медсестра, обычно во второй половине дня, чтобы подтвердить протокол приема лекарств и назначить встречу для следующего контрольного приема.
Какой объем мониторинга необходим?Это вопрос, который обычно задают пациенты, когда начинают свой протокол лечения. Поскольку цикл лечения каждого пациента составляется индивидуально для каждого пациента, необходим и объем мониторинга. Пациенту, принимающему пероральные препараты для стимуляции овуляции, такие как цитрат кломифена (кломид или серофен), с циклом ВМИ может потребоваться всего 2-3 сеанса мониторинга, тогда как женщинам, принимающим инъекционные препараты в сочетании с ВМИ или ЭКО, может потребоваться осмотр. до семи раз в двухнедельный период.
«Количество случаев, когда мы приводим пациента для наблюдения, коррелирует с силой лекарства в их протоколе лечения», — сказал д-р Роберт Стилман. «Пациентам, принимающим слабые стимулирующие препараты, такие как кломид, возможно, потребуется реже наблюдать. Напротив, за пациентами, принимающими более сильные инъекционные препараты, необходимо более внимательно наблюдать, чтобы вносить коррективы в количество принимаемых лекарств для обеспечения безопасности и эффективности ».
Что означает весь этот мониторинг?По мере продвижения цикла лечения многие пациенты задаются вопросом, каким должен быть идеальный размер фолликула и надлежащая толщина слизистой оболочки матки, прежде чем запускать IUI или извлечение яйцеклетки.При каждом посещении наши врачи ищут баланс между уровнем гормонов и реакцией яичников. А поскольку гормон эстроген является основным фактором как увеличения размера фолликула, так и наращивания слизистой оболочки матки, ключевым фактором является постоянный рост уровня гормона на протяжении всего цикла.
«Я всегда говорю пациентам:« Не нужно слишком много хорошего », — поясняет доктор Стиллман. «Мы следим за тем, чтобы фолликулы и слизистая оболочка матки росли с соответствующей скоростью. Поэтому, если мы видим пациента со слишком высокой реакцией на лекарство, мы скорректируем его, чтобы немного замедлить его, в то время как мы увеличим дозу лекарства для пациента, который может реагировать более медленными темпами.”
При первом наблюдении яичники пациента должны быть неактивными или «в состоянии покоя», что означает, что ни один из фолликулов не начал созревать. По мере введения лекарства фолликулы начинают расти, в среднем примерно на 2 мм в день на более поздних этапах стимуляции. Повышение уровня эстрогена в крови является гормональным свидетельством созревания фолликулов в яичниках.
«Скорость роста фолликулов зависит от фазы цикла стимуляции», — пояснил д-р.Тиммрек. «На раннем этапе рост фолликулов может быть минимальным, но как только фолликул (ы) перейдет в« активный »рост, они могут увеличиваться на 1-3 мм в день».
Количество образующихся фолликулов также зависит от варианта лечения. Для женщин, которые используют цикл ВМИ, врачи будут стремиться поддерживать меньшее количество фолликулов, чтобы избежать риска многоплодной беременности, в то время как в более контролируемом цикле ЭКО женщина может производить большее количество фолликулов, потому что мы можем ограничить количество фолликулов. эмбрионы переносятся позже на «задний конец».”
«Ожидаемое количество фолликулов зависит от многих факторов, в первую очередь от возраста и общего овариального резерва», — сказал д-р Тиммрек. «Определение« хорошего »количества фолликулов варьируется от пациента к пациенту и основывается на их индивидуальном протоколе лечения и типе стимуляции, которой они подвергаются».
По мере роста фолликула яйцеклетка внутри начинает созревать. Многие пациенты спрашивают, «каков идеальный размер фолликула», чтобы вызвать овуляцию.
Доктор Тиммрек предлагает: «Зрелость яйцеклетки в фолликуле частично отражается размером фолликула; в среднем идеальный размер фолликулов составляет от 18 до 20 миллиметров или больше, в зависимости от типа используемых лекарств.”
Повышающийся уровень эстрогена также отвечает за формирование слизистой оболочки матки. Оптимальное измерение толщины для имплантации оплодотворенной яйцеклетки составляет более 7 мм и предпочтительно более 8 мм, независимо от типа лечения, которому подвергаются.
«Помимо толщины, мы ищем так называемый« узор из трех линий », — говорит д-р Тиммрек. «Это должно быть похоже на красивое перышко. Вот как мы называем красивую подкладку в середине цикла, которая должным образом насыщена эстрогеном.”
Когда размер свинцового фолликула (ов) достигает примерно 20 мм, эстроген повышается и слизистая оболочка матки представляет собой утолщенный «узор пера» в цикле приема лекарств, пора вводить ХГЧ или, для некоторых пациентов, подвергающихся ЭКО, Люпрон . ХГЧ (или лупрон) вызывает заключительные важные фазы созревания яйцеклетки в фолликуле, а также овуляцию для цикла ВМИ или для планирования правильного времени для извлечения яйцеклетки в цикле ЭКО. Именно в это время фолликул, эстроген, который он производит, и отвечающая на него слизистая оболочка матки должны работать вместе, чтобы создать наилучшую среду для внедрения оплодотворенной яйцеклетки.
«За счет частой проверки важных переменных в цикле лечения бесплодия во время этих мониторинговых визитов, мы можем предоставить пациентке наилучшие шансы на достижение своих целей по успешному зачатию здоровой беременности и, в конечном итоге, к рождению здорового ребенка, будь то с помощью ВМИ или ЭКО », — поясняет доктор Стиллман.
Специалист по сохранению бесплодия и фертильности
ВОПРОС:
Мне 39 лет, сделала 3 ЭКО.Во время первых двух ЭКО половина яйцеклеток оказалась незрелой. У меня было 25 извлеченных (возраст 37 лет) в первый раз и 16 извлеченных (возраст 38 лет) в следующий раз с 50-процентной зрелостью в обоих случаях. Однако у меня только что была операция по извлечению яиц, в ходе которой было извлечено 15 яиц и только 2 яйца были зрелыми. В этом случае они использовали общий ХГЧ, и доктор, кажется, хочет, чтобы я попробовал перенести довольно дрянные эмбрионы, появившиеся в результате этого извлечения. Он не предлагает ответов, почему при извлечении созрели только 2 яйца, а качество эмбрионов было еще хуже.
Имеет ли значение тип триггера ХГЧ? Для второго извлечения я использовал не общий ХГЧ, а Novarel. Я думаю, что использовал Овидрел для первого триггера. Как вы думаете, у меня есть генетический дефект, и мне нужно пройти обследование? Я также думаю, что у меня есть некоторые из признаков СПКЯ (прыщи и некоторые бакенбарды, которые я удаляю), но врачи не считают, что у меня СПКЯ, потому что у меня регулярные периоды и у меня нет лишнего веса. Тем не менее, я слышал, что многие женщины с СПКЯ производят незрелые яйцеклетки. Также думаю, что у меня может быть инсулинорезистентность, и я слышал связь между этим и незрелыми яйцами.
Был бы признателен за ваше понимание. Эмма из Калифорнии
ОТВЕТ: Привет, Эмма из США (Калифорния),
Зрелость яйцеклетки на момент извлечения зависит от двух факторов: (1) размера фолликула при срабатывании и (2) адекватной стимуляции ХГЧ.
Сначала позвольте мне ответить на вопрос о HCG . Если ХГЧ представляет собой недостаточную дозировку или некачественный продукт, то вполне возможно, что фолликул и, следовательно, яйцеклетка внутри не получат адекватной гормональной стимуляции для прохождения финальной фазы созревания.Иногда яйцо не отрывается от стенки, и поэтому яйцо не извлекается, но в противном случае оно не созреет. Что касается размера фолликула, обычно требуется, чтобы фолликул достигал минимум 16 мм, чтобы гарантировать созревание внутренней яйцеклетки. Физиологически, когда фолликул растет от стимуляции ФСГ, яйцеклетка растет к зрелости. Когда яйцо достигает зрелого размера, заключительным действием является ХГЧ или ЛГ, который является физиологическим триггером, заставляет яйцо пройти заключительную фазу созревания и высвобождения из стенки.Если размер фолликула меньше 16 мм, яйцеклетка все еще может быть извлечена, но она не созреет. Здесь вступает в игру «искусство» и опыт Врача. Это его / ее решение относительно того, когда наступит оптимальное время для срабатывания. Цель или то, что должно быть целью, состоит в том, чтобы сработать, когда большинство фолликулов достигли зрелого размера, но не позволять этому продолжаться так долго, чтобы вы начали терять более крупные фолликулы. Этот баланс является ключевым. В моем случае я использую 50% зрелости в качестве базовой меры, поскольку фолликулы имеют тенденцию расти с разной скоростью.То есть я стремлюсь к тому, чтобы по крайней мере 50% извлеченных яиц были зрелыми. В большинстве случаев это гораздо больше.
Вы правы, что у пациентов с PCOD, как правило, много незрелых яйцеклеток, но это потому, что у них очень много фолликулов, образовавшихся в результате стимуляции . Если у нормальной женщины может быть 15-20 фолликулов, у пациента с PCOD часто образуется 30-40 фолликулов. Поскольку они развиваются с разной скоростью, это приводит к разным уровням зрелости. Что касается лекарств, я предпочитаю Овидрел.По моему опыту (22 года), у меня были случаи, когда яйца не созревали из-за Novarel или Generic HCG, поэтому я отказался от них. Кроме того, Овидрел вводится подкожно, тогда как ХГЧ вводится внутримышечно, он причиняет больше боли.
Удачи,
Д-р Эдвард Дж. Рамирес, доктор медицины, FACOG
———- ПОСЛЕДУЮЩИЕ ДЕЙСТВИЯ ———-
ВОПРОС: Спасибо, доктор Рамирес. Я забыл включить еще одну информацию. Перед тем, как я начал этот последний курс, я принимал трехмесячную дозу лупрона.Я начал стимуляцию ровно через три месяца до дня инъекции люпрона, хотя у меня все еще были приливы и у меня было только шесть фолликулов. Фолликулы выросли с 6 до 8 на 12 день срабатывания триггера. Обычно количество фолликулов у меня в начале цикла находится в подростковом возрасте. Я даже рассказала об этом врачу и сказала ему, что у меня все еще приливы. Возможно ли, что мои яичники были чрезмерно подавлены, что привело только к двум незрелым яйцеклеткам из 15?
Спасибо,
Эмма
Ответ:
Привет снова,
Обычно стимуляции, если вводить в адекватной дозировке, достаточно, чтобы преодолеть подавление Луптона, но я думаю, что ваше мышление может быть правильным, и что ваши яичники, возможно, были подавлены достаточно, чтобы не работать так хорошо в последнем цикле и стимуляции было недостаточно, чтобы преодолеть это подавление.
Удачи,
Д-р Эдвард Дж. Рамирес, доктор медицины, FACOG
Монтерей, Калифорния, США
.
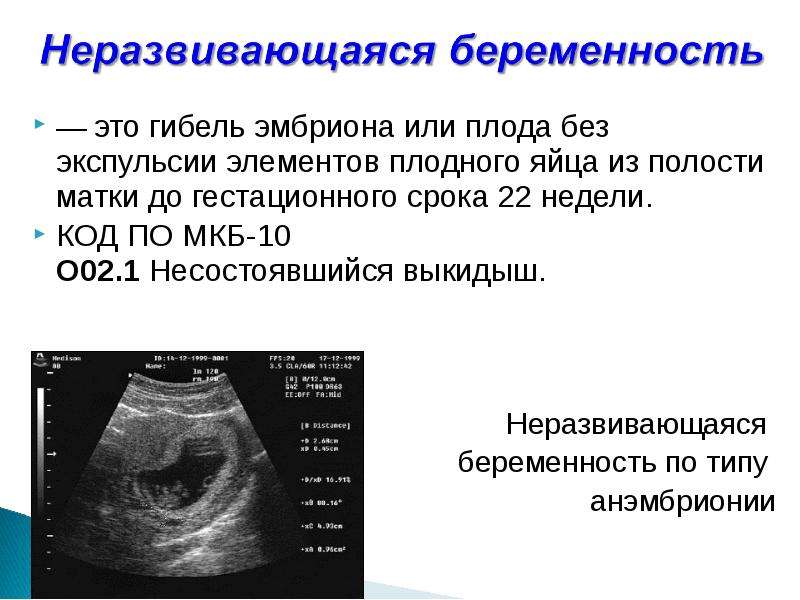

 Они могут приводить к грубой десинхронизации развития эмбриональных тканей, критичным изменениям структуры коллагена и других белков, нарушению индукции дифференцировки и миграции делящихся клеток. Чаще всего встречаются аутосомные трисомии, моносомии, триплоидии, тетраплоидии.
Они могут приводить к грубой десинхронизации развития эмбриональных тканей, критичным изменениям структуры коллагена и других белков, нарушению индукции дифференцировки и миграции делящихся клеток. Чаще всего встречаются аутосомные трисомии, моносомии, триплоидии, тетраплоидии.
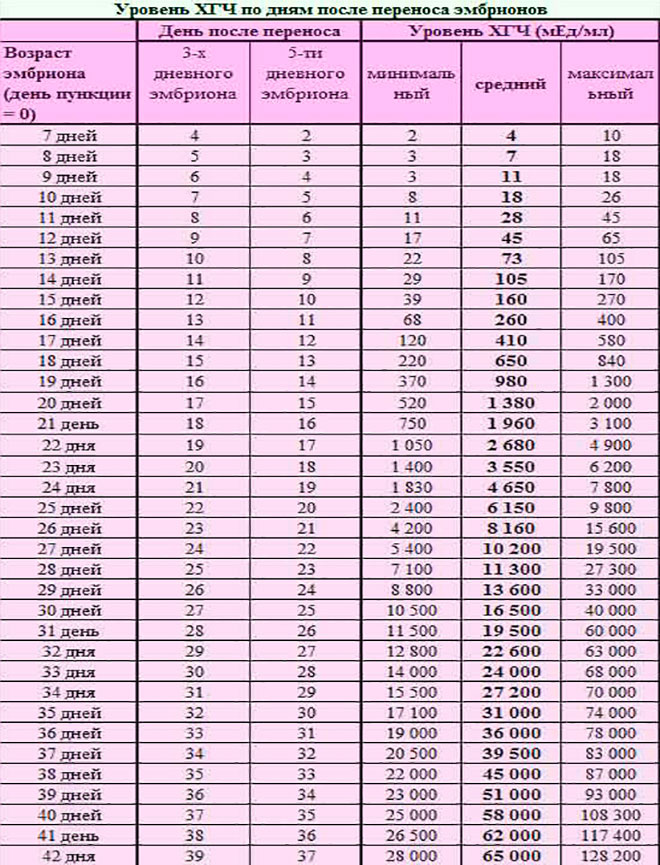
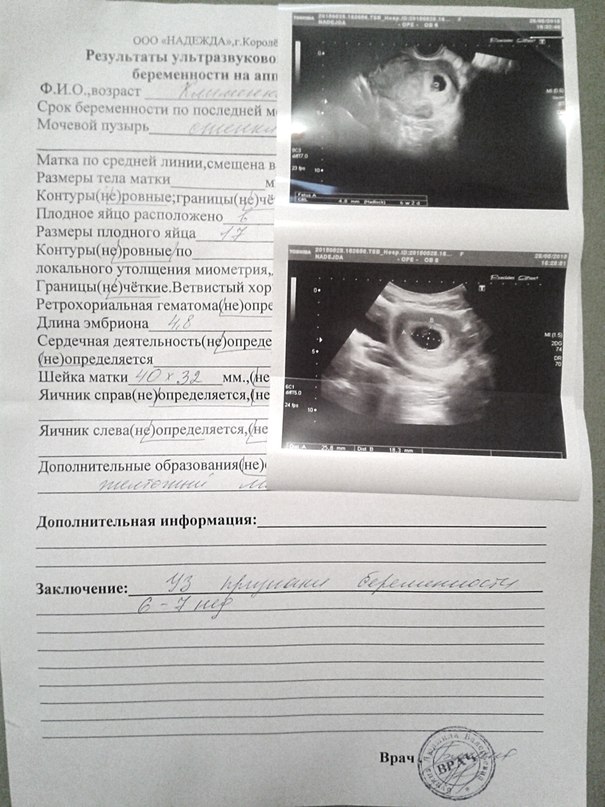
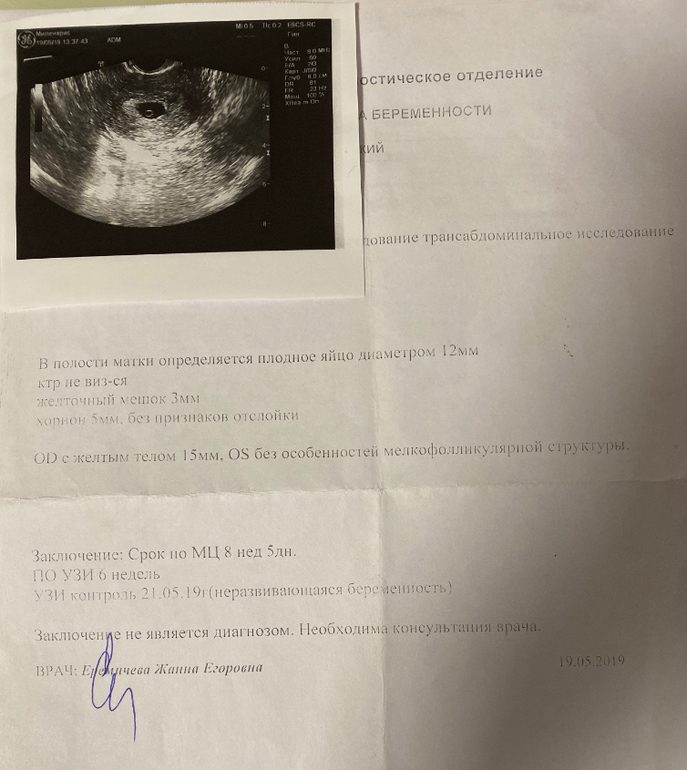


 Т.е. своевременно выявляются такие пороки только лишь при УЗИ, проведенном в профилактических целях.
Т.е. своевременно выявляются такие пороки только лишь при УЗИ, проведенном в профилактических целях. Старение и бесплодие у женщин. Fertil Steril, 2006. 86 (5 Приложение 1): с. С248-52.
Старение и бесплодие у женщин. Fertil Steril, 2006. 86 (5 Приложение 1): с. С248-52. Гинекол Эндокринол 17 (3): 199-205.
Гинекол Эндокринол 17 (3): 199-205.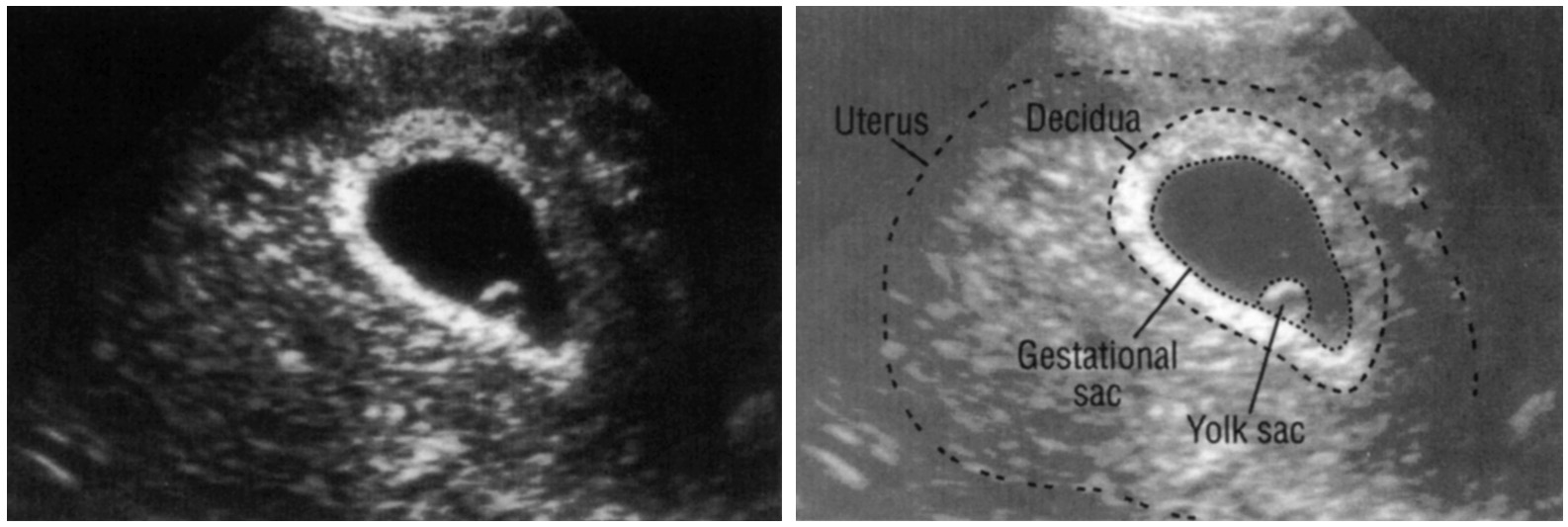 (1990). «Диагностика жизнеспособности на ранних сроках беременности с помощью вагинальной сонографии». Журнал ультразвука в медицине 9: 711-715.
(1990). «Диагностика жизнеспособности на ранних сроках беременности с помощью вагинальной сонографии». Журнал ультразвука в медицине 9: 711-715. Э. Адаши и П. Люнг. Нью-Йорк, Raven Press: 21-39.
Э. Адаши и П. Люнг. Нью-Йорк, Raven Press: 21-39.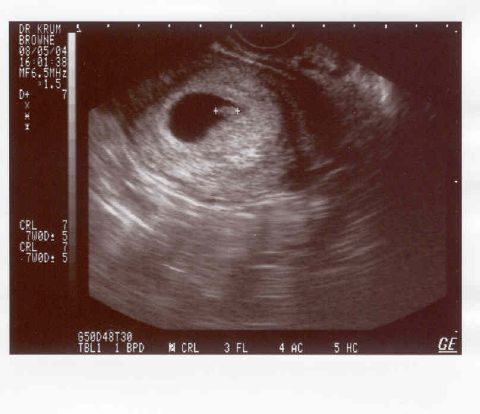 D., D. R. Chizen, et al. (1994). «Характеристики фолликулярной эвакуации во время овуляции человека». J Ultrasound Obstet Gynaecol 4: 488-493.
D., D. R. Chizen, et al. (1994). «Характеристики фолликулярной эвакуации во время овуляции человека». J Ultrasound Obstet Gynaecol 4: 488-493.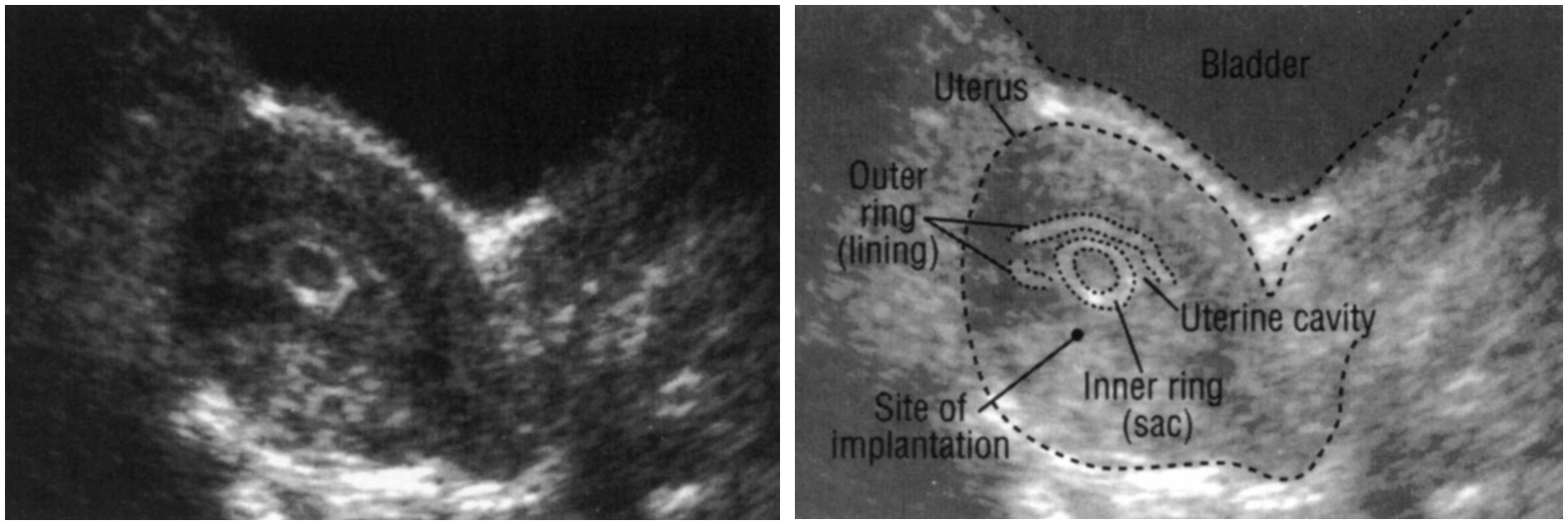 Териогенология 43: 113-120.
Териогенология 43: 113-120. Дж., М. А. Бег и др. (2001). «Выбор фолликулов у моновулярных видов». Биол Репрод 65 (3): 638-47.
Дж., М. А. Бег и др. (2001). «Выбор фолликулов у моновулярных видов». Биол Репрод 65 (3): 638-47. Нью-Йорк, Спрингер-Верлаг.
Нью-Йорк, Спрингер-Верлаг.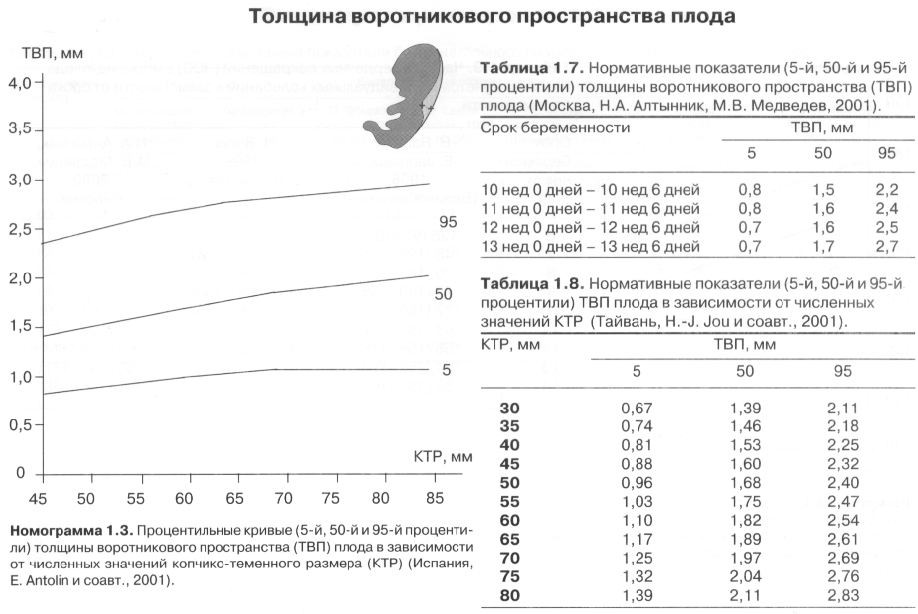 Р. Яффе, Р. Пирсон и Дж. Абрамович. Филадельфия, Дж. Б. Липпинкотт: 155–166.
Р. Яффе, Р. Пирсон и Дж. Абрамович. Филадельфия, Дж. Б. Липпинкотт: 155–166. Ann N Y Acad Sci 943: 64-7.
Ann N Y Acad Sci 943: 64-7. , H. Al-Hasie, et al. (2008). «Трехмерное ультразвуковое исследование сосудов яичников у женщин, у которых развивается плохая реакция яичников во время лечения вспомогательной репродуктивной системой, и его прогностическая ценность». Fertil Steril.
, H. Al-Hasie, et al. (2008). «Трехмерное ультразвуковое исследование сосудов яичников у женщин, у которых развивается плохая реакция яичников во время лечения вспомогательной репродуктивной системой, и его прогностическая ценность». Fertil Steril. «Клин Анат 5: 1-14.
«Клин Анат 5: 1-14.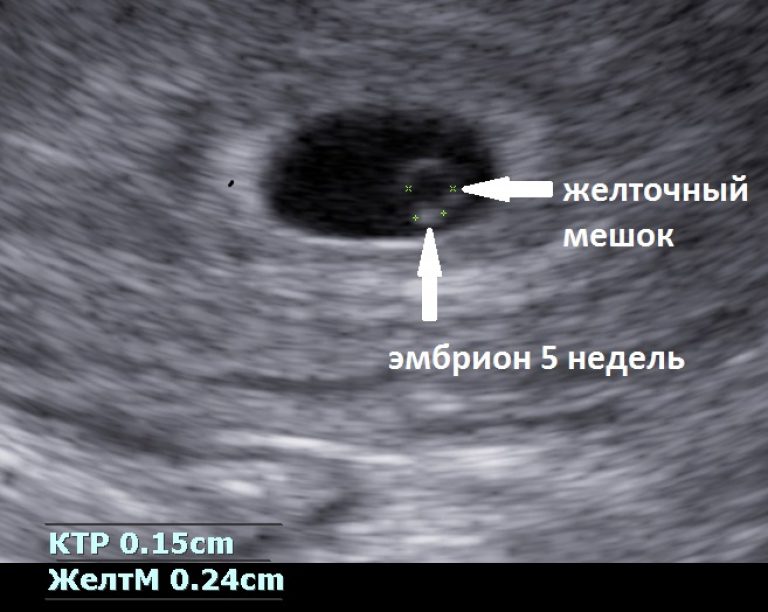
 A., I. VanGent, et al. (1985). «Ультрасонографическая оценка роста графических фолликулов в монофолликулярных и мультифолликулярных условиях в циклах, стимулированных кломифен цитратом». Fertil Steril 40: 461-65.
A., I. VanGent, et al. (1985). «Ультрасонографическая оценка роста графических фолликулов в монофолликулярных и мультифолликулярных условиях в циклах, стимулированных кломифен цитратом». Fertil Steril 40: 461-65. «Acta Obstet Gynecol Scand 64 (1): 15-9.
«Acta Obstet Gynecol Scand 64 (1): 15-9. J Ultrasound Med 20 (8): 811-9.
J Ultrasound Med 20 (8): 811-9. Г., М. Халин и др. (1996). «Регулирование функции желтого тела на ранних сроках беременности человека». Fertil Steril 65 (1): 81-6.
Г., М. Халин и др. (1996). «Регулирование функции желтого тела на ранних сроках беременности человека». Fertil Steril 65 (1): 81-6. J Pediatr Endocrinol Metab 17 (7): 951-7.
J Pediatr Endocrinol Metab 17 (7): 951-7.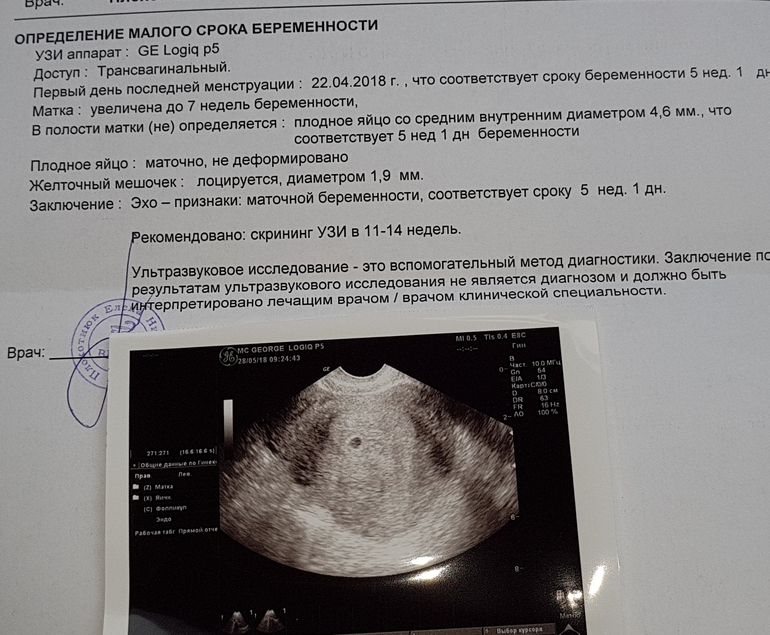 J Med Case Reports 2: 203.
J Med Case Reports 2: 203.