Третий период 3 период, периоды — периодическая система химических элементов
- Главная
- Статьи
- Периодическая система элементов — Периодическая система химических элементов, периодическая система элементов Менделеева
- Третий период 3 период, периоды — периодическая система химических элементов
+++++
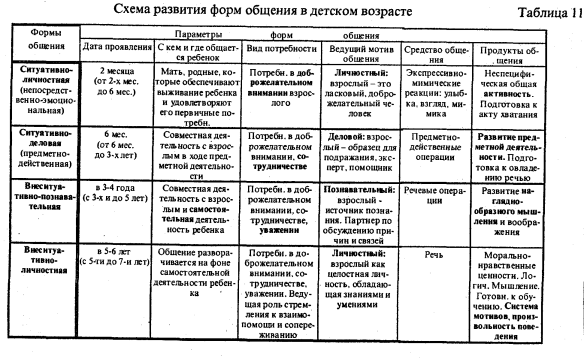
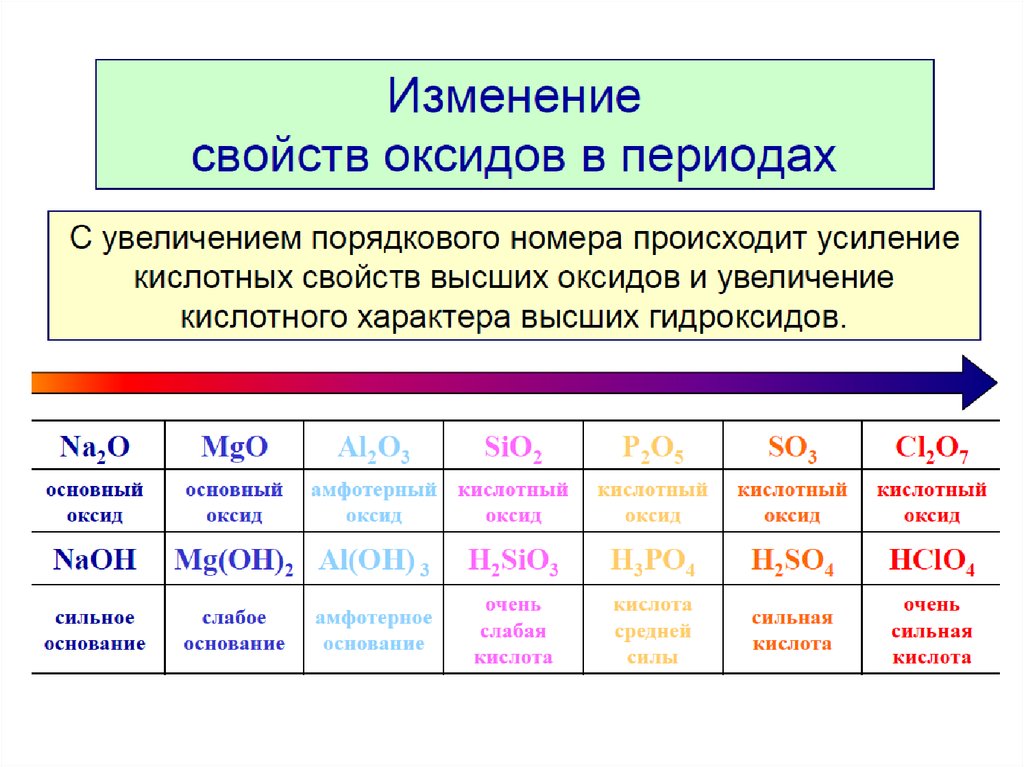
Третий период периодической системы элементов
Третий период (Na — Ar) также содержит 8 элементов, характер изменения свойств которых во многом аналогичен наблюдающемуся во втором периоде. Однако Mg, в отличие от Be, более металличен, равно как и Al по сравнению с В, хотя Al присуща амфотерность. Si, Р, S, Cl, Ar — типичные неметаллы, но все они (кроме Ar) проявляют высшие степени окисления, равные номеру группы. Таким образом, в обоих периодах по мере увеличения Z наблюдается ослабление металлического и усиление неметаллического характера элементов.
Si, Р, S, Cl, Ar — типичные неметаллы, но все они (кроме Ar) проявляют высшие степени окисления, равные номеру группы. Таким образом, в обоих периодах по мере увеличения Z наблюдается ослабление металлического и усиление неметаллического характера элементов.
Менделеев называл элементы второго и третьего периодов (малых, по его терминологии) типическими. Существенно, что они принадлежат к числу наиболее распространённых в природе, а С, N и O являются наряду с H основными элементами органической материи (органогенами). Все элементы первых трёх периодов входят в подгруппы а.
Современная терминология — элементы этих периодов относятся к s-элементам (щелочные и щёлочноземельные металлы), составляющим Ia- и IIa-подгруппы (выделены на цветной таблице красным цветом), и р-элементам (В — Ne, At — Ar), входящим в IIIa — VIIIa-подгруппы (их символы выделены оранжевым цветом). Для элементов малых периодов с возрастанием порядковых номеров сначала наблюдается уменьшение атомных радиусов, а затем, когда число электронов в наружной оболочке атома уже значительно возрастает, их взаимное отталкивание приводит к увеличению атомных радиусов.
Третий период периодической системы химических элементов
|
IA |
IIA |
IIIB |
IVB |
VB |
VIB |
VIIB |
—- |
VIIIB |
—- |
IB |
IIB |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
| Период | ||||||||||||||||||
| 3 |
11
Na |
12
Mg |
13
Al |
14
Si |
P |
16
S |
17
Cl |
18
Ar |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
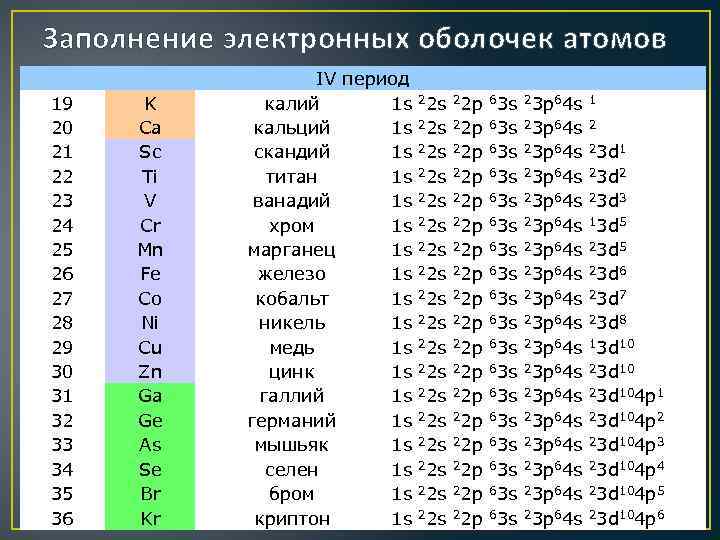
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Полуметаллы — полуметаллы, металл, химия, уровень и свойства.
Полуметаллы, Полуметаллы.
Полуметаллы (металлоиды, амфотерные металлы) — химические элементы, расположенные в периодической системе на границе между металлами и неметаллами. Для них характерно образование ковалентной кристаллической решётки и наличие металлической проводимости.
В физике твёрдого тела полуметаллами называются различные вещества, занимающие по электрическим свойствам промежуточное положение между металлами и полупроводниками.
К полуметаллам относят Bi, Sb, Po, иногда — As, Te, Ge, которые по своим химическим свойствам являются неметаллами, но по типу проводимости относятся к проводникам, а также Sn, имеющее полупроводниковую форму, и аллотропную модификацию углерода — графит.
Группа элементов, металлов относящихся к Полуметаллам:
Bi
Sb
Po
As
Te
Ge
Отличие от полупроводников полуметаллы обладают электрической проводимостью при абсолютном нуле температуры, и в отличие от металлов их проводимость с температурой возрастает. Характерной особенностью полуметаллов является слабое перекрытие валентной зоны и зоны проводимости, что приводит, с одной стороны, к тому, что полуметаллы остаются проводниками электрического тока вплоть до абсолютного нуля температуры, а с другой стороны — с повышением температуры число носителей тока (электронов и дырок) возрастает, но всё-таки остаётся небольшим, достигая концентрации 1018—1020 см–3, или 10–3 на атом.
Характерной особенностью полуметаллов является слабое перекрытие валентной зоны и зоны проводимости, что приводит, с одной стороны, к тому, что полуметаллы остаются проводниками электрического тока вплоть до абсолютного нуля температуры, а с другой стороны — с повышением температуры число носителей тока (электронов и дырок) возрастает, но всё-таки остаётся небольшим, достигая концентрации 1018—1020 см–3, или 10–3 на атом.
Носители тока в полуметаллах отличаются большой подвижностью и малой эффективной массой. Благодаря этому полуметаллы — наиболее подходящие объекты для наблюдения размерных эффектов, фазовых переходов полуметалл — диэлектрик в сильных магнитных полях и ряда других явлений.
Близки к группе неметаллы — химическим элементам с неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
Нас находят по запросам:
— полуметаллы
— уровень ферми
— полуметаллах
— полуметалл и его свойства
— химия и полуметаллы
— Полуметаллы и физика
— Физика твёрдого тела
Полный пошаговый ответ:
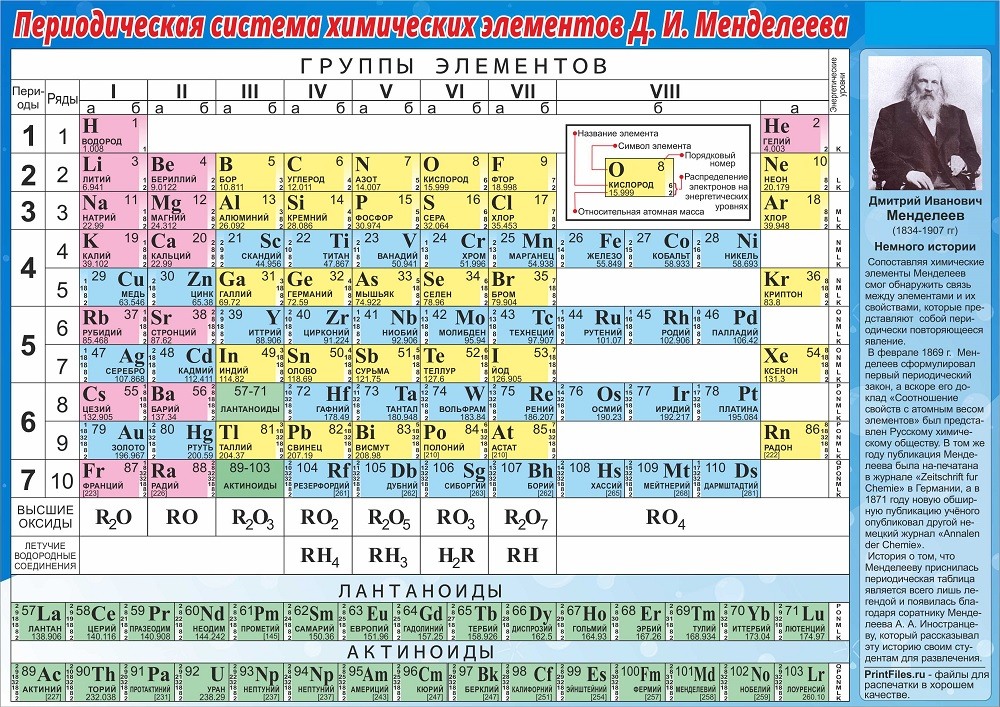
Периодическая таблица представляет собой систематизированное расположение элементов в соответствии с их атомным номером.
Периодическая таблица состоит из:
1) Вертикального столбца ИЛИ групп
2) Горизонтальных рядов ИЛИ периода
Группы расположены в порядке возрастания атомных номеров, так что каждый атом имеет одинаковое количество валентных электронов. Группа III-A называется семейством бора. Общая электронная конфигурация последней оболочки для элементов группы III-A имеет вид: 9{\text{1}}}\text{ }$.
Период — это горизонтальное расположение элементов в периодической таблице. Элементы располагаются по главному квантовому числу. Главное квантовое число «n» определяет электрон с самой высокой энергией в элементе.
Третий период:
| Элемент | $\text{Na}$ | $\text{Mg}$ | $\text{Al}$ | $\text{Si} $ | $\text{P}$ | $\text{S}$ | 9{6}}$
Для третьего периода главное квантовое число $\text{ n = 3}$. Третья оболочка далее подразделяется на подоболочки s, p и d.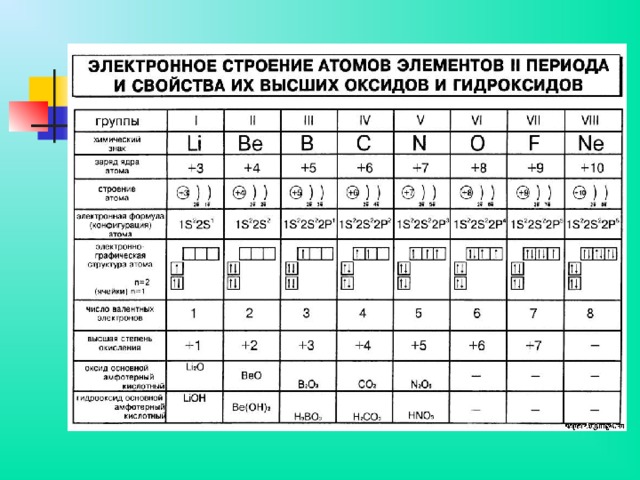 {\text{1}}}\text{ }$. 9{\text{1}}}\text{ }$
{\text{1}}}\text{ }$. 9{\text{1}}}\text{ }$
Алюминий является элементом третьего периода (так как $\text{ n = 3}$) и относится к III группе.
Следовательно, (D) правильный вариант.
Примечание: Группы используются для объединения элементов с одинаковыми свойствами. Элементы в группе имеют сходные свойства, так как элементы группы 1 являются хорошими проводниками электричества. Периоды не обладают подобными свойствами. Каждый соседний элемент отличается по свойствам. Например, в элементах третьего периода натрий — металл, а хлор — неметалл.
Как читать Периодическую таблицу | Группы и периоды
Основные понятия:
В этом уроке вы научитесь читать периодическую таблицу. Мы внимательно рассмотрим группы периодической таблицы. Кроме того, вы узнаете о различных свойствах групп периодической таблицы, периодов и семейств. Если вам понравилась эта статья, обязательно ознакомьтесь с нашими другими!
Связанные статьи:
- Периодические тенденции, сделанные легко
- Элементы
- Как записывать конфигурации электронных оболочек
- Тенденция атомного радиуса
- Тенденция энергии ионизации
- Периодическая таблица с названиями элементов
Словарь
- Элементы: Чистое вещество, состоящее из одного атома с уникальным номером.

- Группы: Вертикальный столбец периодической таблицы, который обозначает количество валентных электронов в элементе.
- Периоды: горизонтальные ряды в периодической таблице, которые обозначают количество электронных оболочек в элементе.
- Семейства: Элементы с одинаковым количеством валентных электронов и, следовательно, со схожими свойствами.
Просмотр трендов, семей и групп в интерактивном режиме!
Мы считаем нашу периодическую таблицу одной из лучших в мире! Посетите нашу новую интерактивную периодическую таблицу. Вы можете просматривать всевозможные тенденции, свойства, магнетизм, электроны и даже статьи обо всех элементах!
Периодическая таблица и периодические тенденции
Периодическая таблица разделена на группы (вертикальные столбцы), периоды (горизонтальные строки) и семейства (группы сходных элементов). Элементы в том же группы имеют одинаковое количество валентных электронов. Между тем, элементы в одном и том же периоде 90 194 90 195 имеют одинаковое количество заполненных электронных оболочек. В 1869 году русский химик Дмитрий Менделеев заметил, что существует врожденная модель организации химических элементов. Из этого вывода он составил периодическую таблицу. Важно отметить, как расположение элементов в этой таблице говорит нам об их свойствах. Быстрый способ понять химические и физические свойства элемента — это знать периодические тренды. Эти тенденции говорят вам, где в периодической таблице сосредоточены самые высокие и самые низкие типы свойств. Для более подробного объяснения периодических тенденций нажмите здесь.
В 1869 году русский химик Дмитрий Менделеев заметил, что существует врожденная модель организации химических элементов. Из этого вывода он составил периодическую таблицу. Важно отметить, как расположение элементов в этой таблице говорит нам об их свойствах. Быстрый способ понять химические и физические свойства элемента — это знать периодические тренды. Эти тенденции говорят вам, где в периодической таблице сосредоточены самые высокие и самые низкие типы свойств. Для более подробного объяснения периодических тенденций нажмите здесь.
Группа и период
Группы — это столбцы периодической таблицы, а периоды — это строки. Есть 18 групп и 7 периодов плюс лантаноиды и актиноиды.
Периоды в периодической таблице
Так что же такое период в периодической таблице? Периоды — это горизонтальные строки периодической таблицы. Всего периодов семь, и каждый элемент периода имеет одинаковое количество атомных орбиталей. Верхний период, содержащий водород и гелий, имеет только две орбитали. По мере продвижения вниз по ряду количество орбиталей увеличивается. Ниже приведена таблица, помогающая визуализировать периодическое число и соответствующие ему орбитали.
По мере продвижения вниз по ряду количество орбиталей увеличивается. Ниже приведена таблица, помогающая визуализировать периодическое число и соответствующие ему орбитали.
| Period Number | Number of Orbitals | Number of Elements |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 8 |
| 4 | 4 | 18 |
| 5 | 5 | 18 |
| 6 | 6 | 32 |
| 7 | 7 | 32 |
Группы периодической таблицы
Как упоминалось ранее, вертикальные столбцы периодической таблицы называются «группами».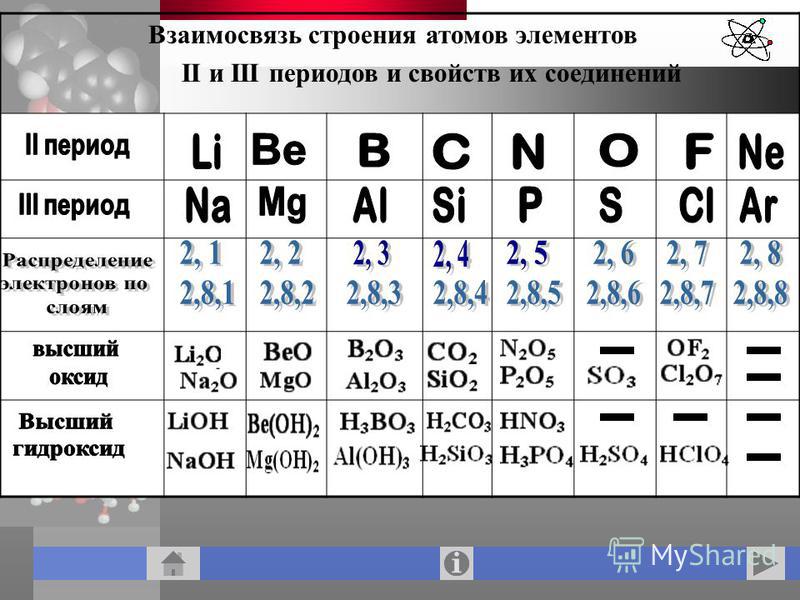 Всего в периодической таблице восемнадцать групп, и в каждой по группа таблицы Менделеева содержит элементы с одинаковым количеством валентных электронов.
Всего в периодической таблице восемнадцать групп, и в каждой по группа таблицы Менделеева содержит элементы с одинаковым количеством валентных электронов.
Количество присутствующих валентных электронов определяет свойства элемента. Причина этого в том, что валентные электроны, то есть электроны на самой внешней оболочке, участвуют в химических реакциях. Эти электроны либо отдают, либо принимают, либо делятся. При этом чем более заполнена валентная оболочка, тем устойчивее элемент.
Сколько групп в периодической таблице?
В таблице Менделеева 18 групп, по одной на каждый столбец таблицы Менделеева. Первый столбец слева — группа 1, а последний столбец справа — группа 18.
Группы и валентные электроны
Первая группа наименее стабильна, так как имеет только один валентный электрон. Между тем восемнадцатая группа является наиболее стабильной, так как эти элементы имеют полную валентную оболочку (восемь валентных электронов). Ниже приведена таблица, связывающая номера групп с числом валентных электронов.
| Group Number | Number of Valence Electrons |
| 1 | 1 |
| 2 | 2 |
| 3-12 | 2 |
| 13 | 3 |
| 14 | 4 |
| 15 | 5 |
| 16 | 6 |
| 17 | 7 |
| 18 | 8 |
Families of the Периодическая таблица
В периодической таблице есть семейства , которые представляют собой группы элементов со схожими свойствами. К этим семействам относятся щелочные металлы, щелочноземельные металлы, переходные металлы, постпереходные металлы, металлоиды, галогены, благородные металлы и благородные газы. Многие из этих семейств принадлежат к одной группе периодической таблицы. Однако не все семейства пересекаются с группами периодической таблицы. Например, переходные металлы содержат все элементы от третьей до двенадцатой группы. Ниже приведена таблица Менделеева, в которой указано местонахождение каждой семьи.
К этим семействам относятся щелочные металлы, щелочноземельные металлы, переходные металлы, постпереходные металлы, металлоиды, галогены, благородные металлы и благородные газы. Многие из этих семейств принадлежат к одной группе периодической таблицы. Однако не все семейства пересекаются с группами периодической таблицы. Например, переходные металлы содержат все элементы от третьей до двенадцатой группы. Ниже приведена таблица Менделеева, в которой указано местонахождение каждой семьи.
Щелочные металлы (группа 1)
Щелочные металлы состоят из всех элементов первой группы, за исключением водорода. Эти элементы чрезвычайно реакционноспособны и по этой причине обычно находятся в соединениях. Кроме того, они чувствительны к воде (бурно реагируют с водой), поэтому их необходимо хранить в масле. Наиболее реакционноспособным щелочным металлом является франций, и его активность уменьшается по мере продвижения вверх по группе. Это означает, что литий наименее реактивен. Физически семейство щелочных металлов серебристое, белое и светлое. Они также имеют низкую температуру плавления и низкую температуру кипения.
Они также имеют низкую температуру плавления и низкую температуру кипения.
Щелочноземельные металлы (группа 2)
Щелочноземельные металлы являются вторым наиболее реакционноспособным семейством в периодической таблице (после щелочных металлов). Кроме того, они являются сильными восстановителями, что означает, что они отдают электроны в химических реакциях. Они также являются хорошими тепловыми и электрическими проводниками. Физически они имеют низкую плотность, низкую температуру плавления и низкую температуру кипения.
Редкоземельные металлы: лантаниды
Лантаниды представляют собой семейство редкоземельных металлов, содержащих один валентный электрон в 5d-оболочке. Они очень реакционноспособны и являются сильным восстановителем в реакциях. Кроме того, они представляют собой серебристо-яркий металл и относительно мягки. Они также имеют как высокие температуры плавления, так и высокие температуры кипения. К редкоземельным элементам относятся такие элементы, как неодим и эрбий.
Редкоземельные металлы: актиниды
Актиниды — еще одно семейство редкоземельных металлов. Как и лантаноиды, эти элементы очень реакционноспособны. Они также обладают высокой электроположительностью и радиоактивны. Кроме того, эти элементы обладают парамагнитными, пироморфными и аллотропными свойствами. Физически они очень похожи на лантаноиды. Это серебристые металлы, мягкие, ковкие и пластичные.
Переходные металлы (группы 3-11)
Переходные металлы обычно имеют две или более степеней окисления. Они имеют низкую энергию ионизации и высокую проводимость. Кроме того, они имеют высокие температуры плавления, высокие температуры кипения и высокую проводимость. Физически они металлические и податливые.
Постпереходный металл
Постпереходные металлы расположены между переходными металлами и металлоидами. При стандартной температуре они находятся в твердом состоянии. Они, как правило, имеют высокую плотность, а также высокую проводимость. Физически они податливы и пластичны.
Металлоиды
Металлоиды проявляют свойства как металлов, так и неметаллов. Например, металлы являются хорошими проводниками, а неметаллы — плохими проводниками. Это означает, что металлоиды являются полупроводниками (проводят электричество только при высоких температурах). Кроме того, они более хрупкие, чем металлы, но менее хрупкие, чем неметаллы. Физически они могут быть как блестящими, так и тусклыми, обычно пластичными и податливыми.
Галогены (группа 17)
Название «галоген» в переводе с греческого означает «солеобразующие». Это очевидно в природе, поскольку галогены взаимодействуют с металлами с образованием различных солей. С другой стороны, галогены представляют собой уникальную группу элементов. Это единственное периодическое семейство, которое содержит элементы в трех состояниях вещества при стандартной температуре. Существует 6 галогенов, и они расположены в группе 17. Эти элементы включают фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Это высокореактивные, высокоэлектроотрицательные и высокотоксичные неметаллы.
Это высокореактивные, высокоэлектроотрицательные и высокотоксичные неметаллы.
Благородные металлы
Благородные металлы состоят из рутения (Ru), осмия (Os), родия (Rh), иридия (Ir), Pd, платины (Pt), золота (Au), серебра (Ag). Как и благородные газы, они инертны из-за полной валентной оболочки. Кроме того, благородные металлы обладают каталитическими свойствами. Кроме того, они очень устойчивы к коррозии, потускнению и окислению. Наконец, как и многие другие металлы, они мягкие и пластичные.
Инертные газы (группа 18)
Инертные газы, также называемые аэрогенами, являются инертными газами. Некоторые примеры включают аргон, криптон и неон. Их можно найти в восемнадцатой группе периодической таблицы. Точно так же это означает, что они имеют полную валентную оболочку. По этой причине они стабильны и относительно инертны. Кроме того, благородные газы имеют низкие температуры кипения и низкие температуры плавления. Физически они бесцветны и не имеют запаха.
Посмотрите несколько интересных элементов
Короткое видео, показывающее различные элементы из периодической таблицы, все из коллекции элементов ChemTalk! Пожалуйста, поставьте лайк и подпишитесь на наш канал Youtube. Скоро будет еще много интересных видео по химии!Сводная таблица свойств семейства
| Тип семейства | Свойства | ||
| Щелочные металлы | – высокореактивный – водочувствительный – мягкий | 5 – низкая плотность0005 – низкая температура плавления – низкая температура кипения | |
| Щелочноземельные металлы | – Сильные восстановители – Серебристый, блестящий металл – Хорошие проводники – Низкая плотность – Низкая температура плавления – Низкая температура кипения | 99Переходные металлы | – 2 или более степеней окисления – Обычно образует парамагнитные соединения – Низкие энергии ионизации – Высокая температура плавления – Высокая температура кипения – Высокая электропроводность – Metallic – Malleable |
| Post Transition Metals | – Solid at standard temperature – Malleable – Ductile – High conductivity – High density | ||
| Metalloids | – Semi-conductors (conducts only at high температуры) – Более хрупкие, чем металлы, но менее хрупкие, чем неметаллы – Свойства представляют собой смесь металлов и неметаллов – Блестящие или матовые – Пластичные и ковкие | ||
| Lanthanides | — 1 валентный электрон в 5D Shell — Высокореактивный — Сильный восстановительный агент — серебристый яркий металл — относительно мягкий — высокие точки плавления — высокие точки кипения | ||
| ACTININIDES — высокие точки кипения | |||
| ACTINIDIDESIDIDES — | |||
| ACTINDIDEDIDES — | |||
. Высокореактивные Высокореактивные – Высокоэлектроположительные – Парамагнитные – Пироморфные – Аллотропные – Радиоактивные – Серебристые металлы – Пластичные – Ковкие – Мягкие | |||
| Halogens | – Highly reactive – High electronegativity – Non-metal – Toxic | ||
| Noble Metals | – Relatively unreactive – Complete valence shell (8 valence electrons) – Inert – Catalytic – Устойчив к коррозии, потускнению и окислению – Мягкий и пластичный | ||
| Благородные газы | – Относительно нереактивный – Полная валентная оболочка (8 валентных электронов) – Низкая электроотрицательность — Бесцветный и без запаха — Газы при стандартных условиях — Неметалл — Низкая температура кипения — Низкая температура плавления — Плотность увеличивается при понижении температуры |
См.