Антитела IgG к цитомегаловирусу, ЦМВ
Метод определения Иммуноферментный анализ (ИФА).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Антитела класса G к цитомегаловирусу; АТ-ЦМВ-IgG.
Anti-CMV-IgG; CMV Antibody, IgG.
Краткая характеристика определяемого аналита Антитела класса G к цитомегаловирусу (Anti-CMV-IgG)
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВИ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию. Особенности инфекции. Цитомегаловирусная (ЦМВ) инфекция – это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3-5 лет жизни, беременные – чаще во 2 и 3 триместрах), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т.
При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВИ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию. Особенности инфекции. Цитомегаловирусная (ЦМВ) инфекция – это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3-5 лет жизни, беременные – чаще во 2 и 3 триместрах), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т.
Цитомегаловирус – вирус семейства герпес-вирусов. Так же, как и другие представители семейства, после инфицирования сохраняется в организме практически пожизненно. Устойчив во влажной среде. Группу риска составляют дети 5-6 лет, взрослые 16-30 лет, а также лица, практикующие анальный секс. Дети восприимчивы к передаче инфекции воздушно-капельным путём от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов. ЦМВ-инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра.
Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта. При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. Возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. Возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
Цитомегаловирусная инфекция у беременных, обследование при беременности
При первичном инфицировании беременной цитомегаловирусом (в 35-50% случаев) или реактивации инфекции в период беременности (в 8-10% случаев) развивается внутриутробная инфекция. При развитии внутриутробной инфекции на сроке до 10 недель есть риск возникновения пороков развития, возможно самопроизвольное прерывание беременности. При инфицировании на 11-28 неделе возникают задержка внутриутробного развития, гипо- или дисплазии внутренних органов. Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определённый орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит и т.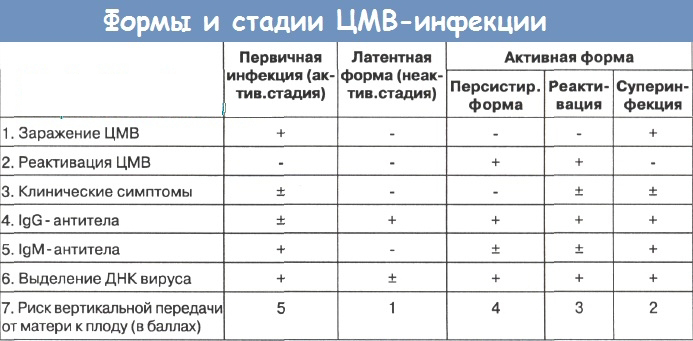
Особое значение лабораторная диагностика цитомегаловирусной инфекции имеет у следующих категорий обследуемых:
| Категория | Причины |
| Женщины, при подготовке к беременности | 1. Латентное течение заболевания Латентное течение заболевания
2. Сложность дифференциальной диагностики первичного инфицирования и рецидива инфекции при обследовании во время беременности |
| Беременные женщины | Тяжёлые последствия внутриутробной инфекции у новорожденных |
| Иммунодефицитные состояния | Генерализованные формы |
Последовательное многократное определение уровня IgG-антител у новорожденных позволяет отличить врождённое заражение (постоянный уровень) от неонатального (нарастание титров). Если титр IgG антител при повторном (через две недели) анализе не увеличивается, то причин для тревоги нет, если титр IgG растёт, следует рассмотреть вопрос об аборте.
С какой целью определяют Антитела класса G к цитомегаловирусу (Anti-CMV-IgG)
Антитела класса IgG к цитомегаловирусу – специфические иммуноглобулины, вырабатываемые в организме человека в период выраженных клинических проявлений цитомегаловирусной инфекции и являющиеся серологическим маркером этого заболевания, а также перенесенной в прошлом цитомегаловирусной инфекции.
Важно! CMV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях – Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребёнка.
В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2-3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Анализ на цитомегаловирус, Cytomegalovirus, антитела IgG
Общая характеристика
Цитомегаловирус это вирус из семейства герпесвирусов.
Характеризуется многообразием клинических проявлений.
Относится к так называемым оппортунистическим инфекциям.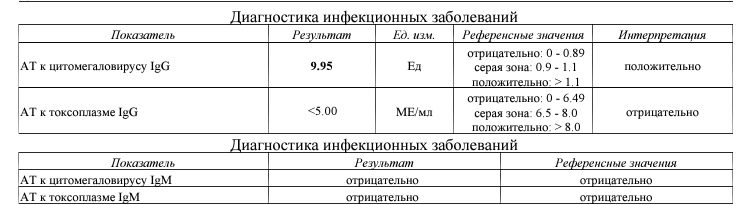
Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию.
Их продукция начинается с 10-14 дня после инфицирования.
Обнаружение данных антител будет сохраняться пожизненно (серопозитивность).
Не обеспечивают стойкого иммунитета и защиты от реактивации.
IgG проникают через фетоплацентарный барьер. Поэтому, наличие данных иммуноглобулинов у новорожденных не является однозначным признаком инфицирования, антитела могут быть материнскими.
В данном случае необходимо сравнение уровней IgG у ребенка и матери, определение их в динамике у ребенка ( уровень «материнских» иммуноглобулинов в динамике снижается).
Показания для назначения
1. Подготовка к беременности.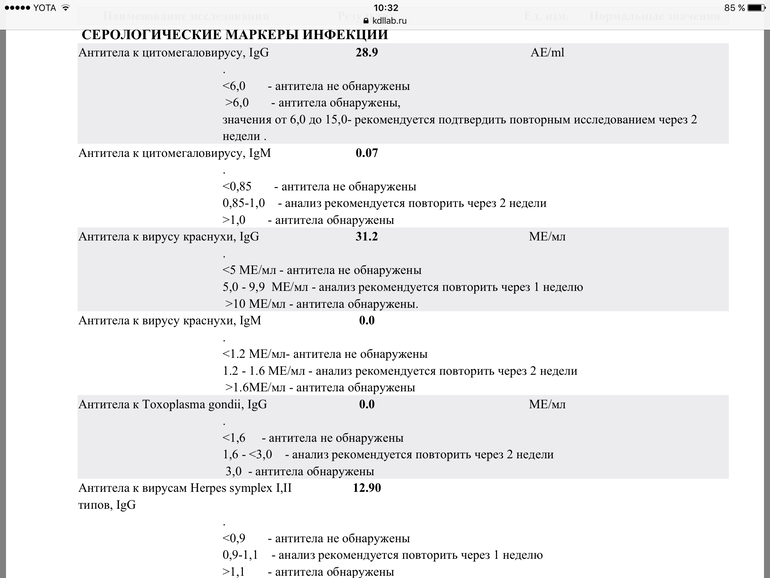
2. Признаки внутриутробной инфекции, фето-плацентарная недостаточность.
3. Состояние иммуносупрессии при ВИЧ-инфекции, неопластических заболеваниях, приёме цитостатических препаратов и т. д.
4. Клиническая картина инфекционного мононуклеоза, в отсутствие инфекции вируса Эпштейн-Барра.
6. Лихорадка неясной этиологии.
7. Повышение уровня печёночных трансаминаз, гамма-ГТ, ЩФ в отсутствие маркеров вирусных гепатитов.
8. Атипичное течение пневмонии у детей.
9. Невынашивание беременности (замершая беременность, привычные выкидыши).
Маркер
Серологический маркер иммунной памяти к цитомегаловирусу.
Клиническая значимость
1. Определение цитомегаловирусной инфекции в прошлом (особенно доноры органов, доноры крови и перспективные реципиенты).
2. Исключение текущей CMV-инфекции (пуповинная кровь).
Состав показателей:
Антитела к цитомегаловирусу IgG
: Хемилюминесцентный иммуноанализДиапазон измерений: 0-0
Единица измерения: Единиц на миллилитр
Референтные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
сыворотка ВК
Условия доставки:
24 час. при температуре от 2 до 25 градусов Цельсия
при температуре от 2 до 25 градусов Цельсия
Контейнер:
Вакутейнер с разделительным гелем
Объем:
3.5 Миллилитров
Правила подготовки пациента
Стандартные условия подготовки (если иное не определено врачом): За 4 часа Выдержать голодание, исключить жирную пищу. Можно пить воду.
Можно пить воду.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Не обнаружена.

- Не обнаружена.
Интерпретация:
- Положительный результат: Предшествующее или текущее инфицирование цитомегаловирусом.
- Отрицательный результат: Отсутствие инфицирования цитомегаловирусом, инфицирование произошло в течение предыдущих 3-4 недель.
Anti-CMV IgG (антитела класса IgG к Цитомегаловирусу)
Цитомегаловирус «вирус, увеличивающий размер клеток» (Cytomegalovirus hominis) – ДНК-содержащий вирус, относится к семейству герпесвирусов. Относится к оппортунистической инфекции, то есть, вызывающей заболевание только при благоприятных для нее условиях (снижение иммунитета). Вирус способен долгие годы находиться в организме в «спящем» латентном состоянии и дает о себе знать в самый неподходящий момент.
Серологическая диагностика цитомегаловирусной инфекции основана на обнаружении специфических антител класса IgG к цитомегаловирусу (ЦМВ). Данные антитела вырабатывается организмов в ответ на внедрение инфекции для борьбы с ней. Каждому классу антител свойственны свои функции и сроки появления. IgG продуцируется через 2-3 недели после заражения, однако обеспечить стойкий иммунитет против цитомегаловируса IgG не может. Следовательно, анализ отображает хроническую стадию течения цитомегаловирусной инфекции, а также свидетельствует о развитии иммунитета к возбудителю. К ЦМВ у человека развивается нестойкий слабый иммунитет, поэтому возможно повторное заражение. Чтобы отличить хронический процесс от слабого иммунитета, необходимо проведение исследования в динамике с интервалом в 2 недели. Если количество антител не изменилось или повысилось, то это свидетельствует о хроническом течении.
Данные антитела вырабатывается организмов в ответ на внедрение инфекции для борьбы с ней. Каждому классу антител свойственны свои функции и сроки появления. IgG продуцируется через 2-3 недели после заражения, однако обеспечить стойкий иммунитет против цитомегаловируса IgG не может. Следовательно, анализ отображает хроническую стадию течения цитомегаловирусной инфекции, а также свидетельствует о развитии иммунитета к возбудителю. К ЦМВ у человека развивается нестойкий слабый иммунитет, поэтому возможно повторное заражение. Чтобы отличить хронический процесс от слабого иммунитета, необходимо проведение исследования в динамике с интервалом в 2 недели. Если количество антител не изменилось или повысилось, то это свидетельствует о хроническом течении.
К прочим диагностическим способам обнаружение ЦМВ относится: обнаружение ЦМВ методом ПЦР в крови или в соскобе из мочеполовых путей.
Цитомегаловирусная инфекция протекает по трем вариантам:
ОРВИ-подобный вариант (лихорадка, чувство першения в горле, насморк, общая слабость, головная боль, набухание слюнных желез!)
Поражение органов мочеполовой системы (уретрит, цистит…)
Генерализованная форма (поражение отдельных органов — легких, печени, почек, кишечника, головного мозга и т. д.)
д.)
При обследовании слюны практически здоровых лиц, согласно статистическим данным, цитомегаловирусная инфекция выявляется практически в шестидесяти процентах случаях, а у людей старше пятидесятилетнего возраста, практически в ста процентах случаях, но при этом люди продолжают оставаться совершенно здоровыми, так как вирус находится в неактивном состоянии. Цитомегаловирус входит в потенциально опасную для внутриутробного развития плода группу TORCH-инфекции (токсоплазма, вирус краснухи, цитомегаловирус, герпес).
Основным источником распространения инфекции является человек-носитель вируса. Так как цитомегаловирус способен выживать в различных средах организма, то его передача становится возможным:
Через поцелуи, за счет содержания вируса в слюне;
Через кровь, в частности при переливании цельной крови и ее компонентов;
От матери к ребенку через молоко во время лактации;
При половом контакте.
Клиническая картина цитомегаловирусной инфекции весьма разнообразна и зависит в первую очередь от того, какой орган или система вовлечены в патологический процесс.
Цитомегаловирус IgG (Anti-CMV-IgG, антитела класса IgG к цитомегаловирусу, ЦМВ, CMV)
ОписаниеПодготовкаПоказанияИнтерпретация результатов
Цитомегаловирус относится к семейству вирусов герпеса. Он способен персистировать у человека в течение всей жизни.
У здоровых людей иммунитет справляется с инфекцией и она часто протекает бессимптомно, но у беременных и у людей с иммунодефицитом цитомегаловирус может вызывать тяжелые клинические проявления и протекать с осложнениями.
Инфицирование происходит с кровью, слюной, мочой, спермой. От матери ЦМВ — инфекция может передаваться ребенку во время беременности, родов или кормления).
Клинические проявления могут отсутствовать, но иногда заболевание по клиническим проявлениям похоже на инфекционный мононуклеоз, вызываемый вирусом Эпштейна — Барр: лихорадка, увеличение лимфоузлов, миндалин, боль в горле, увеличение печени. После этого вирус может долго сохранятся в организме пациента.
Во время беременности возможно развитие внутриутробной инфекции, при этом существует возможность самопроизвольного прерывания беременности, задержке внутриутробного развития, появление пороков развития и даже летальному исходу. Вакцина для ЦМВ — инфекции пока что не разработана, но своевременная терапия может снизить вероятность рецидива к минимуму, а также обеспечит благоприятное вынашивание ребенка.
Таким образом, необходимо сдать анализ на антитела к цитомегаловирусу IgG при планировании беременности.
В качестве защитной реакции организм вырабатывает антитела к цитомегаловирусу — IgG и IgM. Антитела к цитомегаловирусу IgG указывают на текущую или ранее перенесенную инфекцию, их гораздо больше в крови, чем других фракций, чем других фракций иммуноглобулинов. Динамическое исследование IgG к цитомегаловирусу позволяет определить произошло врожденное заражение (при этом титр антител будет иметь постоянное значение) или неонатальное (титр антител будет нарастать). При нарастании титра рассматривается вопрос об аборте. При первичной инфекции уровень антител к цитомегаловирусу постепенно повышается и позже может оставаться долгие годы на высоком уровне.
При первичной инфекции уровень антител к цитомегаловирусу постепенно повышается и позже может оставаться долгие годы на высоком уровне.
Антитела подкласса IgG к цитомегаловирусу человека (ЦМВ) в нормальных образцах плазмы человека и иммуноглобулины и их нейтрализующая активность
Был разработан твердофазный иммуноферментный анализ (ИФА) для количественного определения антител подкласса IgG к цитомегаловирусу человека (ЦМВ) в образцах сыворотки или плазмы человека и в препаратах иммуноглобулина (ИГ). Анализ был основан на параллельном титровании известных концентраций очищенных белков миеломы подкласса IgG и специфической антисыворотки к ЦМВ.Очищенные белки миеломы подкласса IgG захватывают на планшете для ELISA, предварительно покрытом антителами против каппа- и лямбда-антител человека или смесью антител против каппа- и лямбда-человека, и титруют специфическую антисыворотку против антигена ЦМВ, нанесенного на планшет. Антитела подкласса IgG, захваченные или связанные с антигеном, количественно определяли с помощью моноклональных антител, специфичных для тяжелой цепи подкласса IGG. Метод отличался высокой воспроизводимостью, специфичностью и чувствительностью. Используя этот метод, 257 образцов человеческой плазмы и 50 препаратов ИГ были проанализированы на наличие специфических к ЦМВ подкласса IgG и антител IgM.Основным антителом подкласса IgG к ЦМВ был IgG1, который представлял более 96% антител IgG ЦМВ, за которым следовал IgG3 (среднее содержание антител IgG3 ЦМВ составляло 3% антител IgG в препаратах IG и 1,8% в образцах плазмы). Большинство образцов имели низкие уровни антител IgG2, а несколько образцов демонстрировали низкие уровни антител IgG4. Препараты IG показали очень низкие уровни антител CMV IgM, тогда как образцы плазмы содержали 14,2% антител CMV (IgG и IgM) в виде антител IgM. Вируснейтрализующая (Nt) активность этих образцов показала значительную корреляцию с антителами IgG1 ЦМВ.Девять образцов плазмы и IG дополнительно оценивали на Nt-активность антител IgG1 и IgG3 путем отделения IgG3 от остальных антител с помощью агарозы с протеином А.
Антитела подкласса IgG, захваченные или связанные с антигеном, количественно определяли с помощью моноклональных антител, специфичных для тяжелой цепи подкласса IGG. Метод отличался высокой воспроизводимостью, специфичностью и чувствительностью. Используя этот метод, 257 образцов человеческой плазмы и 50 препаратов ИГ были проанализированы на наличие специфических к ЦМВ подкласса IgG и антител IgM.Основным антителом подкласса IgG к ЦМВ был IgG1, который представлял более 96% антител IgG ЦМВ, за которым следовал IgG3 (среднее содержание антител IgG3 ЦМВ составляло 3% антител IgG в препаратах IG и 1,8% в образцах плазмы). Большинство образцов имели низкие уровни антител IgG2, а несколько образцов демонстрировали низкие уровни антител IgG4. Препараты IG показали очень низкие уровни антител CMV IgM, тогда как образцы плазмы содержали 14,2% антител CMV (IgG и IgM) в виде антител IgM. Вируснейтрализующая (Nt) активность этих образцов показала значительную корреляцию с антителами IgG1 ЦМВ.Девять образцов плазмы и IG дополнительно оценивали на Nt-активность антител IgG1 и IgG3 путем отделения IgG3 от остальных антител с помощью агарозы с протеином А. Антитела IgG3 показали гораздо более высокую активность Nt, чем антитела IgG1, что позволяет предположить, что обогащение антителами IgG3 в препаратах IG может быть полезным для получения CMV-специфического IG.
Антитела IgG3 показали гораздо более высокую активность Nt, чем антитела IgG1, что позволяет предположить, что обогащение антителами IgG3 в препаратах IG может быть полезным для получения CMV-специфического IG.
Цитомегаловирус (ЦМВ) симптомы, лечение и определение
Ахтер, Каузер.«Обработка цитомегаловируса (ЦМВ)». Медскейп.com. 5 мая 2018. .Azevedo, L.S., et al. «Цитомегаловирусная инфекция в реципиенты трансплантатов». Clinics (Sao Paulo) 70.7 July 2015: 515-23. doi: 10.6061/клиника/2015(07)09. Epub 2015 1 июля. Обзор. PubMed PMID: 26222822; Центральный PMCID в PubMed: PMC4496754.
Былсма, С.С., К.Л. Ахим и К.А. Уайли. «Прогностическое значение цитомегаловирусного ретинита для цитомегаловирусного энцефалита при синдроме приобретенного иммунодефицита. Arch Ophthalmol 113 (1995): 89-95. [Medline].
Du, Y., G. Zhang, and Z. Liu. Цитомегаловирусная инфекция человека и ишемическая болезнь сердца
Болезнь: систематический обзор».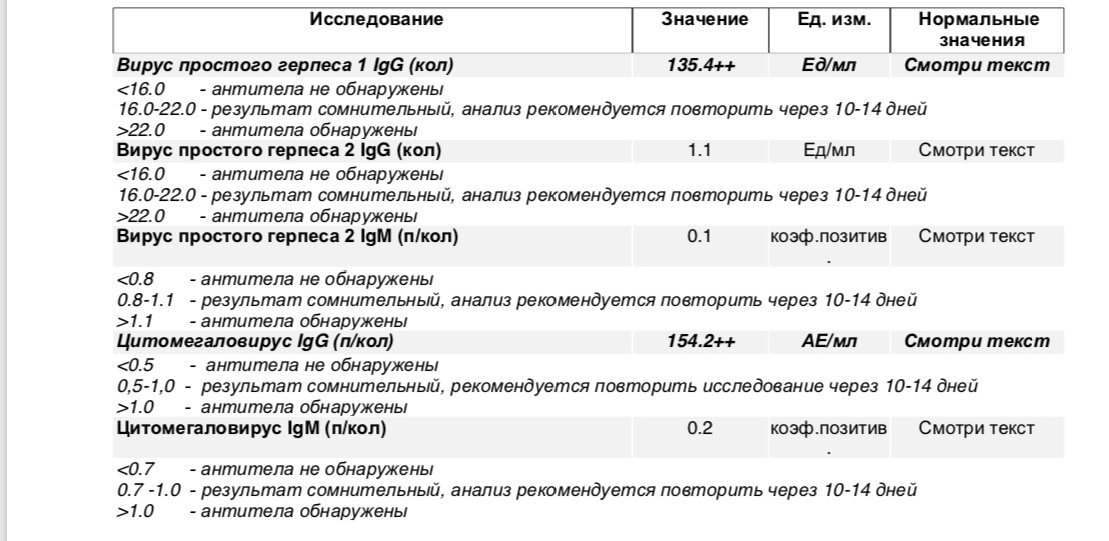 Medline].
Medline].
Ji, YN, L. An, P. Zhan и др. «Цитомегаловирусная инфекция и риск ишемической болезни сердца: метаанализ. Mol Biol Rep 39 (2012): 6537. https://doi.org/10.1007/s11033-012-1482-6.
Lazzarotto, T., et al. профилактика, диагностика и лечение цитомегаловирусной инфекции во время беременности». Clin Microbiol Infect 17 сентября 2011 г.: 1285-93.
McCutchan, JA «Цитомегаловирусные инфекции нервной системы у больных СПИДом». Clin Infect Dis 20 апреля 1995 г.: 747-54. [ Medline]
Styczynski, J. «Кто является пациентом с риском рецидива ЦМВ: обзор текущих научных данных с акцентом на трансплантацию гемопоэтических клеток. Infectious Diseases and Therapy 7.1 (2018): 1-16. doi:10.1007/s40121-017-0180-z.
США. Центры по контролю и профилактике заболеваний. «Цитомегаловирус (ЦМВ) и врожденная ЦМВ-инфекция. 31 мая 2019 г.
30811 — Цитомегаловирус (ЦМВ) IgG ИФА | Клинический
Клиническая утилита Для выявления антител IgG человека к цитомегаловирусу в сыворотке крови человека методом иммуноферментного анализа, в качестве вспомогательного средства в определении острой или реактивированной инфекции ЦМВ. При использовании в качестве качественного теста ИФА CMV IgG помогает в оценке иммунологического ответа пациента на ЦМВ. Эти реагенты не получили разрешения FDA на использование при тестировании доноров крови или плазмы.
При использовании в качестве качественного теста ИФА CMV IgG помогает в оценке иммунологического ответа пациента на ЦМВ. Эти реагенты не получили разрешения FDA на использование при тестировании доноров крови или плазмы.
О цитомегаловирусе
Цитомегаловирус (ЦМВ) является возбудителем цитомегалической болезни включения, генерализованной инфекции младенцев, вызванной внутриутробной или ранней постнатальной инфекцией. Заболевание может вызывать тяжелые врожденные аномалии, такие как микроцефалия, двигательная инвалидность и умственная отсталость у младенцев. 1-3 Цитомегаловирусная инфекция также связана с приобретенной гемолитической анемией, острым и хроническим гепатитом и синдромом, подобным инфекционному мононуклеозу. Субклиническая инфекция может возникать у взрослых. 4 ЦМВ-инфекция может передаваться людям с иммунодефицитом или ослабленным иммунитетом в результате переливания крови5 или трансплантации органов. 6
Серологические тесты, такие как тест ИФА CMV IgG, который выявляет присутствие антител CMV IgG, могут помочь в диагностике заболеваний, вызванных цитомегаловирусом. Результаты теста получают через полтора часа инкубации. Они объективны и нормализованы как значения индекса, что обеспечивает единообразие или отчетность.
Результаты теста получают через полтора часа инкубации. Они объективны и нормализованы как значения индекса, что обеспечивает единообразие или отчетность.
Разведенные образцы инкубируют в лунках, покрытых антигеном. В разбавитель были включены абсорбенты для нейтрализации действия ревматоидного фактора и антител IgG к ЦМВ. Антитела к ЦМВ (если они присутствуют) иммобилизуют в лунках. Остаточный образец удаляют промыванием и обработкой дождем, добавляют конъюгат (меченые ферментом антитела к человеческому IgM) и инкубируют.При наличии антител IgM к ЦМВ конъюгат будет иммобилизован в лунках. Остаточный конъюгат удаляют промыванием и сливом, добавляют меченый ферментом субстрат и инкубируют. В присутствии фермента субстрат превращается в конечный продукт желтого цвета, который определяется фотометрически.
Тест, проведенный VRL Eurofins, 6933 S. Revere Parkway, Centennial, CO 80112. Этот тест не был одобрен или одобрен для диагностического использования Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. См. вкладыш в упаковку для получения дополнительной информации.
См. вкладыш в упаковку для получения дополнительной информации.
Набор для ИФА IgG человека к цитомегаловирусу (CMV) (ab108724)
Обзор
Название продукта
Набор для ИФА IgG человека против цитомегаловируса (CMV)
Метод обнаружения
Колориметрический
Точность
Внутритестовый Образец п Среднее SD CV% Поз.Сыворотка 12 1,9% Интеранализ Образец п Среднее SD CV% Поз.  Сыворотка
Сыворотка4 6,2% Тип образца
Сыворотка, Hep плазма, Cit плазма
Тип анализа
Косвенный
Продолжительность анализа
Многоэтапный стандартный анализ
Реактивность видов
Реагирует с: Человек
Обзор продукта
Набор Abcam против цитомегаловируса (CMV) IgG Human in vitro ELISA (иммуноферментный анализ) предназначен для качественного измерения антител класса IgG против цитомегаловируса в сыворотке и плазме человека.

96-луночный планшет был предварительно покрыт антигенами цитомегаловируса для связывания родственных антител. В лунки добавляют контроли или тестовые образцы и инкубируют. После промывки в лунки добавляют меченный пероксидазой хрена (HRP) конъюгат против человеческого IgG, который связывается с иммобилизованными цитомегаловирус-специфическими антителами. Затем TMB катализируется HRP с образованием продукта синего цвета, который меняется на желтый после добавления кислого стоп-раствора. Плотность желтого окрашивания прямо пропорциональна количеству образца цитомегаловируса IgG, захваченного в планшете.
Платформа
Микропланшет
Свойства
Инструкции по хранению
Хранить при +4°C. Пожалуйста, обратитесь к протоколам.
Компоненты Идентификатор 1 x 96 тестов Моющий раствор 20X Белая крышка 1 x 50 мл Защитная пленка 1 шт. 
Антигены цитомегаловируса Микропланшет с покрытием (12 x 8 лунок) 1 шт. Цитомегаловирусный конъюгат анти-IgG HRP Черная крышка 1 x 20 мл Контроль отсечки IgG к цитомегаловирусу Зеленый колпачок 1 x 3 мл Цитомегаловирус IgG отрицательный контроль Синий колпачок 1 x 2 мл Цитомегаловирус IgG положительный контроль Красная кепка 1 x 2 мл Разбавитель образца IgG Белая крышка 1 x 100 мл Стоп раствор красный колпачок 1 x 15 мл Держатель полосок 1 шт. 
Раствор субстрата TMB Желтый колпачок 1 х 15 мл Области исследований
Спецификации и документы
скачать паспорт безопасности
Страна/регионВыберите страну/регион
ЯзыкВыберите язык
Скачать спецификацию
Каталожные номера (10)
ab108724 упоминается в 10 публикациях.
- Ciencewicki JM et al. Доноры плазмы на юго-западе США вносят положительный вклад в разнообразие терапевтических профилей антител иммуноглобулиновых препаратов.
 Научный представитель 10:6850 (2020). ПабМед: 32321978
Научный представитель 10:6850 (2020). ПабМед: 32321978 - Smith SL и др. Разнообразие NK-клеток периферической крови человека, идентифицированное с помощью секвенирования одноклеточной РНК. Blood Adv 4:1388-1406 (2020). ПабМед: 32271902
- Хамейри Боуэн Д и др. Цитомегаловирус-специфический иммуноглобулин G ассоциирован с хроническими заболеваниями легких у детей и подростков из стран Африки к югу от Сахары с перинатальной ВИЧ-инфекцией. Clin Infect Dis N/A:N/A (2020). ПабМед: 33242076
- Bowyer G и др. Снижение ответа на вакцину против Эболы у ЦМВ+ молодых людей связано с экспансией Т-клеток CD57+KLRG1+. J Exp Med 217: н/д (2020). ПабМед: 32413101
- Стили JN и др. Цитомегаловирусные инфекции человека связаны с повышенным уровнем биомаркеров сосудистого повреждения.
 Front Cell Infect Microbiol 10:334 (2020). ПабМед: 32733818
Front Cell Infect Microbiol 10:334 (2020). ПабМед: 32733818 - Саловин А и др. Анти-NMDA-рецепторный энцефалит и неэнцефалитическая инфекция HSV-1. Neurol Neuroimmunol Neuroinflamm 5:e458 (2018). ПабМед: 29629396
- Пшемска-Косицка А и др. Возрастные изменения в ответе естественных клеток-киллеров на сезонную вакцинацию против гриппа не зависят от синбиотика: рандомизированное контролируемое исследование. Фронт Иммунол 9:591 (2018). ПабМед: 29662493
- Энани С и др. Влияние старения и синбиотика на иммунный ответ на вакцинацию против сезонного гриппа; рандомизированное контролируемое исследование. Клин Нутр 37:443-451 (2018). ПабМед: 28215759
- Славинский Б.Л. и др. Серопозитивность материнского цитомегаловируса и симптомы аутизма у детей.
 Am J Reprod Immunol 79:e12840 (2018). ПабМед: 29520885
Am J Reprod Immunol 79:e12840 (2018). ПабМед: 29520885 - Пшемска-Косицка А и др. Влияние синбиотика на ответ на вакцинацию против сезонного гриппа сильно зависит от степени иммуносенесценции. Иммунное старение 13:6 (2016). ПабМед: 26985232
Отзывы клиентов и ответы на вопросы
1 — 6 из 6 Сокращения или вопросы и ответы
Просмотров: 10Просмотров: 50Просмотров: 100Сортировать по: Наибольшему количеству голосовСортировать по: Наименьшему количеству голосовСортировать по: Сначала новыеСортировать по: Сначала самому старому
Количественное определение IgG человека против ЦМВ в образцах плазмы с ЭДТА (свежезамороженной и хранившейся при -80°С) тестировали с использованием набора ELISA ab108724. В информации, прилагаемой к набору, говорилось, что ранее тестировались только образцы сыворотки и образцы цитратной плазмы. Мы хотели проверить, позволяет ли набор проводить точное количественное определение IgG человека против ЦМВ в плазме с ЭДТА. Образцы плазмы
В информации, прилагаемой к набору, говорилось, что ранее тестировались только образцы сыворотки и образцы цитратной плазмы. Мы хотели проверить, позволяет ли набор проводить точное количественное определение IgG человека против ЦМВ в плазме с ЭДТА. Образцы плазмы
разводили в соотношении 1:100 разбавителем для образцов, входящим в комплект (в соответствии с инструкциями производителя), и анализировали в двух повторностях. Двойные лунки для положительного контроля, отсечки и отрицательного контроля, а также холостые лунки были включены в соответствии с предоставленным протоколом.Все шаги следовали инструкциям, прилагаемым к набору ELISA.
Поглощение (оптическую плотность, OD) определяли с помощью планшет-ридера, настроенного на 450 нм с эталонной длиной волны 650 нм. Поглощение пустых лунок усредняли и вычитали из всех остальных лунок. Значения абсорбции были преобразованы в стандартные единицы в соответствии с инструкциями производителя (пороговое значение = 10 положительных единиц > 11 отрицательных единиц). Набор четко различал IgG анти-ЦМВ положительные и отрицательные образцы и позволял количественно определять эти антитела в образцах плазмы с ЭДТА (см. рисунок). ).
Набор четко различал IgG анти-ЦМВ положительные и отрицательные образцы и позволял количественно определять эти антитела в образцах плазмы с ЭДТА (см. рисунок). ).
Протокол, прилагаемый к набору, был четким и простым для понимания и содержал всю информацию, необходимую для проведения анализа.
Сообщество пользователей Abcam
Проверенный клиент
Опубликовано 04 сент. 2019 г.
Спасибо за письмо.Приношу свои извинения за задержку с ответом на ваше письмо.
К сожалению, мы не продаем антигены для этих наборов отдельно.
Спасибо за письмо.
Продукт, который я определил для вас, выглядит следующим образом;
ab108776
ab108778
ab108767
мы не против краснухи IgM Комплект
ab108724
ab108725
ab108737
ab108738
ab108739
ab108740
ab108742
Я связался со своим коллегой, который даст вам объемную цитату для этот комплект.Пожалуйста, дайте мне знать, если вы не получите от нас ответа в течение 24 часов с момента получения этого письма.
Надеюсь, эта информация будет вам полезна. Если вам потребуется дополнительная информация, пожалуйста, не стесняйтесь обращаться ко мне.
Читать далее Спасибо за ваш запрос.
Я рад подтвердить, что планшеты ab108724 покрыты антигенами штамма CMV AD-169.
Надеюсь, эта информация окажется полезной. Пожалуйста, не стесняйтесь обращаться к ним снова с любыми дополнительными вопросами.
Читать далее A1: ИФА ЦМВ, ab108724, является качественным и поэтому не имеет известного предела обнаружения.Чувствительность анализа определяется как вероятность положительного результата анализа в присутствии определенного аналита. Чувствительность анализа для этого набора составляет 98%. A2: Контроль отсечки используется для определения порога оптической плотности, при котором образцы считаются положительными или отрицательными. Подробнее об этом расчете см. на вкладыше к продукту. A3: Элементы управления в этом наборе поставляются в жидкой форме, готовые к использованию.
Спасибо за терпение.Лаборатория, разработавшая ИФА, прислала следующую информацию. Если это не полностью отвечает на ваши вопросы, пожалуйста, свяжитесь со мной. CMV IgG ELISA – это качественный тест. Поэтому у нас нет данных о пределе обнаружения или всплесках. Тепловая инактивация образцов не рекомендуется, так как это отрицательно влияет на результаты испытаний. Перекрестной реактивности с антителами против HSV1-2, кори, эпидемического паротита или VZV не наблюдалось. Специфичность диагностики определяется как вероятность отрицательного результата анализа при отсутствии специфического аналита.Для этого он составляет 97,5%. Диагностическая чувствительность определяется как вероятность положительного результата анализа в присутствии определенного аналита.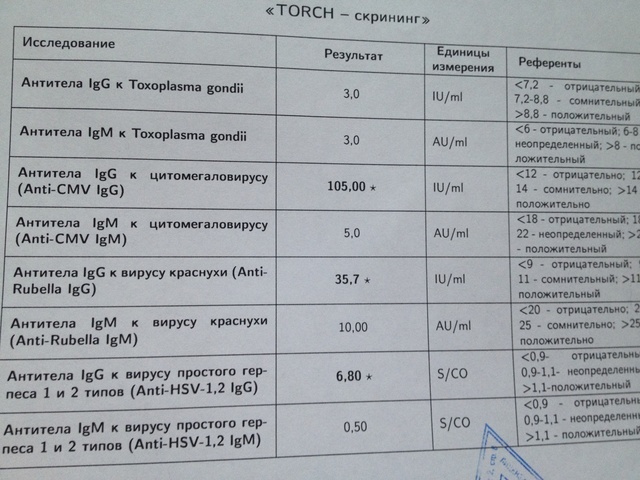 Чувствительность этого анализа составляет 98%. Интерференция с гемолитической, липемической или желтушной сыворотками не наблюдается до концентрации гемоглобина 10 мг/мл, триглицеридов 5 мг/мл и билирубина 0,2 мг/мл.
Чувствительность этого анализа составляет 98%. Интерференция с гемолитической, липемической или желтушной сыворотками не наблюдается до концентрации гемоглобина 10 мг/мл, триглицеридов 5 мг/мл и билирубина 0,2 мг/мл.
Цитомегаловирус IgG Avidity
Авидность цитомегаловируса IgG
Лаборатория коммерческой рассылки
5231 РКП
356-8593
Носитель коллекции:
| Пробирка с красной крышкой 5 мл (активатор свертывания крови) |
Минимум:
Предпочтительный минимум: 0.5 мл сыворотки
Абсолютный минимум: 0,15 мл сыворотки
Инструкции по доставке:
Отправьте образец в лабораторию как можно скорее после сбора.Повернуться Время:
1-8 дней при поступлении в референс-лабораторию
Диапазон задания:
0,50 Индекс или меньше: низкая авидность
0,51-0,59 Индекс: Промежуточная авидность
Индекс 0,60 или выше: High Avidity
Данные интерпретации:
Выявление ЦМВ-инфекции у беременных при первом
триместр имеет большое значение для клинической помощи. Острый
Инфекция обычно характеризуется повышенным содержанием IgM, специфичных к ЦМВ, и
антитела IgG. Однако антитела IgM ЦМВ могут сохраняться в течение нескольких
месяцев или даже лет после первоначального заражения, что ограничивает их
полезность в точной диагностике недавней ЦМВ-инфекции. ЦМВ IgM
антитела также могут быть обнаружены во время реактивации вируса, таким образом
осложняет диагностику недавней первичной инфекции. Следовательно,
измерение авидности антител IgG к антигенам ЦМВ может помочь в
отличить недавнюю ЦМВ-инфекцию от предшествующей.Значение индекса 0,5
или реже указывают на недавнюю инфекцию (в течение предыдущих 3-х до
4 месяца). Однако низкие значения авидности не могут исключать возможности
персистентных IgG-антител с низкой авидностью. Значения индекса 0,6 или
больше указывает на инфекцию, возникшую более чем за 3 месяца до
тестирование. Поскольку тестирование авидности IgG на ЦМВ после первого триместра
не легко интерпретируется, обнаружение высокоавидных CMV IgG
антитела в первом триместре (12-16 недель беременности) помогают
исключить диагноз острой ЦМВ-инфекции после зачатия.
Острый
Инфекция обычно характеризуется повышенным содержанием IgM, специфичных к ЦМВ, и
антитела IgG. Однако антитела IgM ЦМВ могут сохраняться в течение нескольких
месяцев или даже лет после первоначального заражения, что ограничивает их
полезность в точной диагностике недавней ЦМВ-инфекции. ЦМВ IgM
антитела также могут быть обнаружены во время реактивации вируса, таким образом
осложняет диагностику недавней первичной инфекции. Следовательно,
измерение авидности антител IgG к антигенам ЦМВ может помочь в
отличить недавнюю ЦМВ-инфекцию от предшествующей.Значение индекса 0,5
или реже указывают на недавнюю инфекцию (в течение предыдущих 3-х до
4 месяца). Однако низкие значения авидности не могут исключать возможности
персистентных IgG-антител с низкой авидностью. Значения индекса 0,6 или
больше указывает на инфекцию, возникшую более чем за 3 месяца до
тестирование. Поскольку тестирование авидности IgG на ЦМВ после первого триместра
не легко интерпретируется, обнаружение высокоавидных CMV IgG
антитела в первом триместре (12-16 недель беременности) помогают
исключить диагноз острой ЦМВ-инфекции после зачатия.
Комментарии:
Порядок оказания помощи в диагностике цитомегаловирусной (ЦМВ) инфекции во время беременности после первоначального тестирования на ЦМВ IgM и IgG выполненный. Различие между недавним (первичным) и перенесенным цитомегаловирусом (ЦМВ)
инфекция может быть важным инструментом в клиническом лечении
реципиенты трансплантатов и беременные женщины. Хотя почти все
лица с недавней инфекцией ЦМВ положительны на ЦМВ IgM,
люди с ЦМВ в прошлом могут также экспрессировать ЦМВ IgM после вирусного
реактивация; таким образом, обнаружение CMV IgM не является надежным индикатором
недавней инфекции.Измерение авидности CMV IgG может помочь в
отличить недавнюю ЦМВ-инфекцию от прошлой. Несмотря на низкую жадность
индекс является надежным показателем инфицирования ЦМВ в течение предшествующих 6 лет.
месяцев, высокий индекс авидности более значим с клинической точки зрения.
точка зрения; высокий индекс авидности практически исключает возможность
что заражение произошло в течение предыдущих 4 месяцев.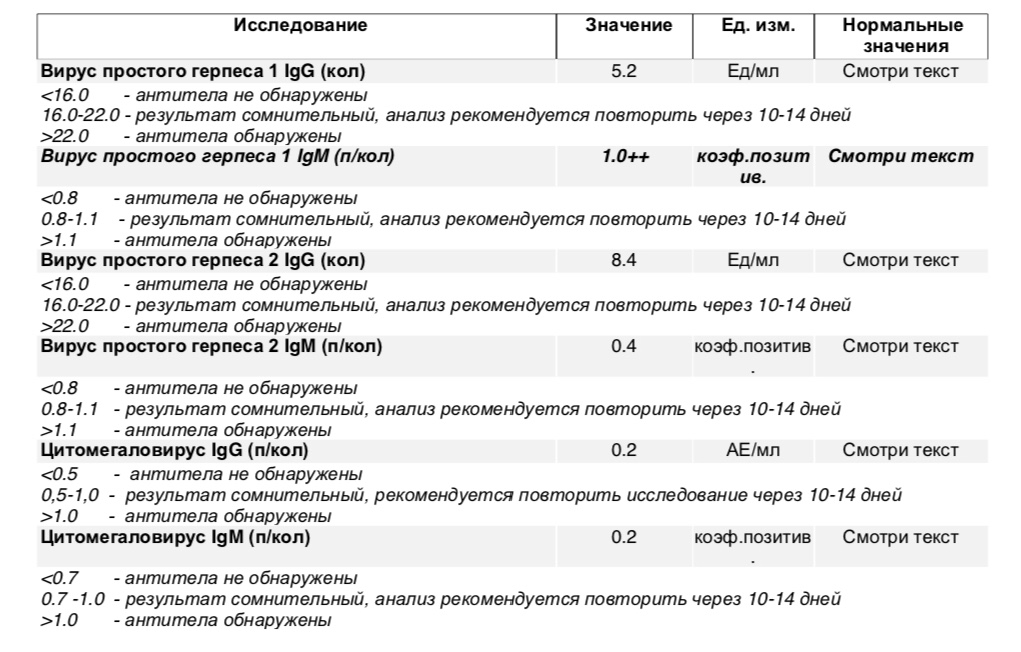
Таким образом, оценка авидности IgG, специфичных к цитомегаловирусу, чрезвычайно важна. мощный инструмент для оценки времени инфицирования ЦМВ.Такой информация особенно важна для клинического ведения беременных женщин, у которых впервые обнаружены антитела к цитомегаловирусу. предродовой визит. Определение времени первичного заражения может помочь принимать решения относительно противовирусной терапии, выявляя таких женщин кто должен или не должен лечиться во время беременности. Авидность IgG цитомегаловируса измерение также имеет широкое применение для управления другими группы пациентов с повышенным риском изнурительной ЦМВ-инфекции, таких как реципиенты трансплантатов паренхиматозных органов.Примерно 50% беременных женщин с первичной ЦМВ-инфекцией передают ЦМВ своим детям. Измерение авидности CMV IgG позволяет надежно отличить первичную инфекцию от активной латентной инфекции во время беременности.
Методология:
Полуколичественный твердофазный иммуноферментный анализ
Анализ крови на ЦМВ
Определение
adam.com»> Анализ крови на ЦМВ определяет наличие в крови веществ (белков), называемых антителами к вирусу, называемому цитомегаловирусом (ЦМВ).Альтернативные названия
Тесты на антитела к ЦМВ
Как проводится тест
Необходим образец крови.
Как подготовиться к тесту
Специальной подготовки к тесту нет.
Ощущения при проведении теста
При введении иглы для забора крови некоторые люди чувствуют умеренную боль, в то время как другие ощущают только укол или покалывание. После этого может быть некоторая пульсация или небольшой синяк. Это скоро проходит.
Зачем проводится тест
ЦМВ-инфекция — это заболевание, вызываемое одним из типов вируса герпеса.
Анализ крови на ЦМВ проводится для выявления текущей активной ЦМВ-инфекции или перенесенной ЦМВ-инфекции у людей, подверженных риску реактивации инфекции.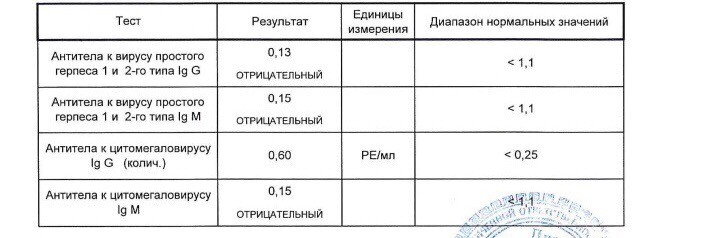 К таким людям относятся реципиенты трансплантированных органов и люди с подавленной иммунной системой. Тест также может быть выполнен для выявления ЦМВ-инфекции у новорожденных.
К таким людям относятся реципиенты трансплантированных органов и люди с подавленной иммунной системой. Тест также может быть выполнен для выявления ЦМВ-инфекции у новорожденных.
Нормальные результаты
Люди, которые никогда не были инфицированы ЦМВ, не имеют обнаруживаемых антител к ЦМВ.
Диапазоны нормальных значений могут незначительно различаться в разных лабораториях.Некоторые лаборатории используют разные измерения или тестируют разные образцы. Поговорите со своим лечащим врачом о значении ваших конкретных результатов теста.
Что означают ненормальные результаты
Наличие антител к ЦМВ указывает на текущую или перенесенную инфекцию ЦМВ. Если количество антител (называемое титром антител) повышается в течение нескольких недель, это может означать, что у вас текущая или недавняя инфекция.
Долгосрочная (хроническая) ЦМВ-инфекция (при которой количество антител остается примерно одинаковым с течением времени) может реактивироваться у человека с подавленной иммунной системой.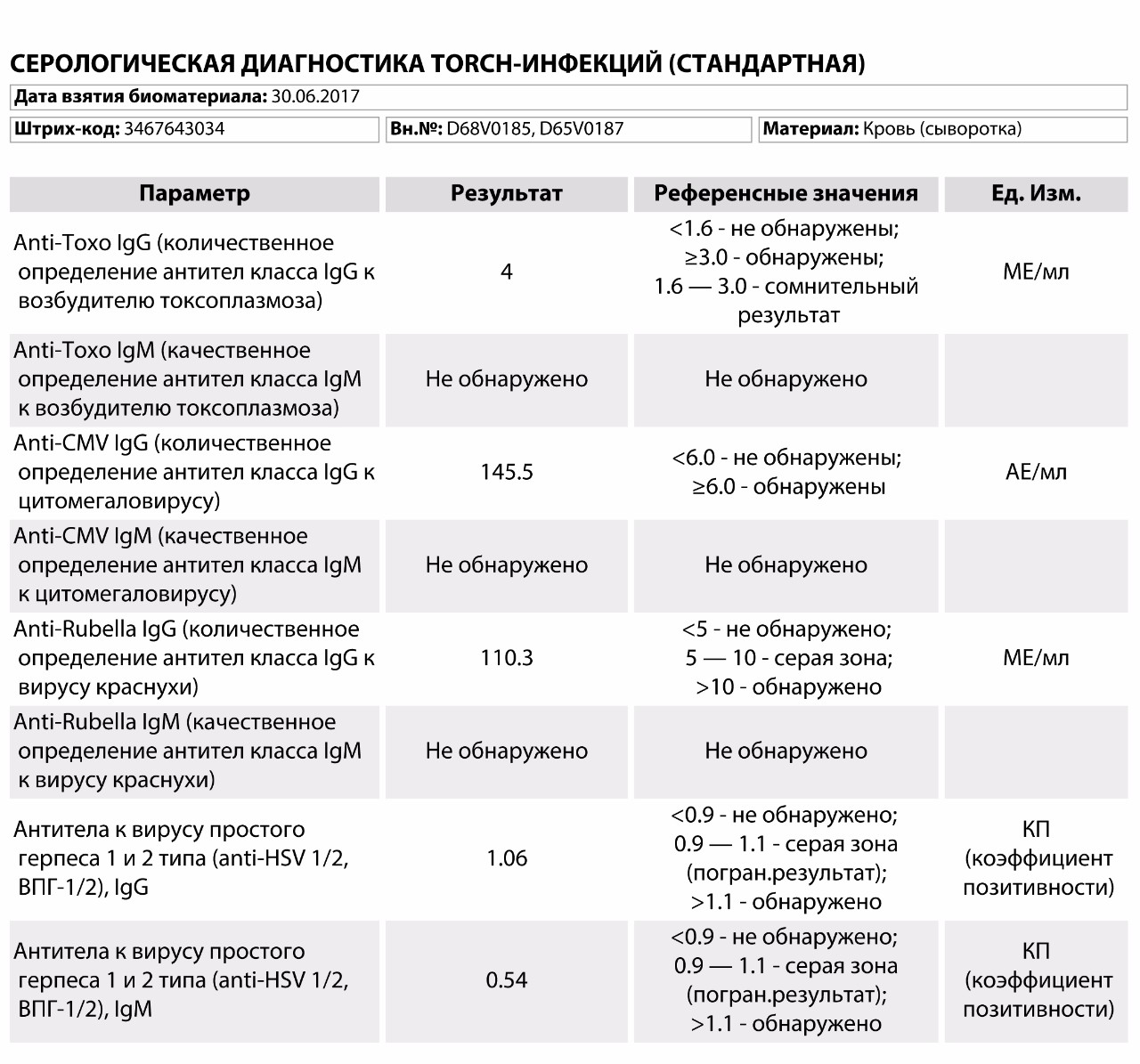
Риски
Взятие крови сопряжено с небольшим риском. Вены и артерии различаются по размеру от одного человека к другому и от одной стороны тела к другой. Взять кровь у одних людей может быть сложнее, чем у других.
Другие риски, связанные с забором крови, незначительны, но могут включать:
- Чрезмерное кровотечение
- Обморок или ощущение головокружения
- Множественные проколы для обнаружения вен
- Гематома (кровь, скопившаяся под кожей) каждый раз, когда кожа повреждена)
Соображения
Чтобы обнаружить инфекцию крови или органов, вызванную ЦМВ, поставщик может проверить наличие самого ЦМВ в крови или конкретном органе.
Каталожные номера
Britt WJ. Цитомегаловирус. В: Bennett JE, Dolin R, Blaser MJ, ред. Принципы и практика инфекционных болезней Манделла, Дугласа и Беннета . 9-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 137.
9-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 137.
Мазур Л.Дж., Костелло М. Вирусные инфекции. В: Макферсон Р.А., Пинкус М.Р., ред. Клиническая диагностика Генри и лечение с помощью лабораторных методов . 23-е изд. Сент-Луис, Миссури: Elsevier; 2017: глава 56.
Frontiers | Протективный цитомегаловирусный (ЦМВ)-специфический Т-клеточный иммунитет часто встречается у пациентов с трансплантацией почки без антител к ЦМВ в сыворотке
Введение
Реципиенты трансплантата почки (КТ) подвергаются повышенному риску инфекций после трансплантации, одной из основных угроз является цитомегаловирус (ЦМВ).Первичная инфекция или реактивация ЦМВ может вызвать виремию и привести к тяжелому ЦМВ заболеванию с поражением органов (1). Пациенты с повышенным риском инфекции ЦМВ получают либо профилактическую, либо упреждающую противовирусную терапию (валганцикловир) после трансплантации почки (2). Классификация риска ЦМВ-инфекции перед КТ основана на наличии у пациента анти-ЦМВ-иммуноглобулина G (IgG) в сочетании с ЦМВ-серостатусом донора почки. Иммунитет к вирусам, например, ЦМВ, зависит от адекватной помощи со стороны ЦМВ-специфичных CD4 + Т-клеток, обеспечивающих выработку нейтрализующих антител ЦМВ-специфическими В-клетками/бластами плазмы и эффективных цитотоксических CD8 + Т-клеток (CTL). ) ответы (3–5).Отсутствие нейтрализующих антител не обязательно означает, что антиген ранее не встречался, так как клеточный иммунитет все еще может присутствовать. Кроме того, известно, что у больных с терминальной стадией почечной недостаточности (ТХПН) протективный гуморальный иммунитет не поддерживается и часто не достигается (6, 7). Поэтому несколько групп предложили включить оценку клеточного иммунитета против ЦМВ в стратегию оценки риска для более точной оценки сенсибилизации перед трансплантацией (8–10).Данных о том, защищает ли наличие ограниченного клеточного иммунитета от виремии ЦМВ после трансплантации почки, недостаточно, и нет подробных сведений о том, какие подмножества Т-клеток участвуют в достаточной защите, поскольку клеточный иммунитет в основном оценивается с помощью ELISpot (11).
Иммунитет к вирусам, например, ЦМВ, зависит от адекватной помощи со стороны ЦМВ-специфичных CD4 + Т-клеток, обеспечивающих выработку нейтрализующих антител ЦМВ-специфическими В-клетками/бластами плазмы и эффективных цитотоксических CD8 + Т-клеток (CTL). ) ответы (3–5).Отсутствие нейтрализующих антител не обязательно означает, что антиген ранее не встречался, так как клеточный иммунитет все еще может присутствовать. Кроме того, известно, что у больных с терминальной стадией почечной недостаточности (ТХПН) протективный гуморальный иммунитет не поддерживается и часто не достигается (6, 7). Поэтому несколько групп предложили включить оценку клеточного иммунитета против ЦМВ в стратегию оценки риска для более точной оценки сенсибилизации перед трансплантацией (8–10).Данных о том, защищает ли наличие ограниченного клеточного иммунитета от виремии ЦМВ после трансплантации почки, недостаточно, и нет подробных сведений о том, какие подмножества Т-клеток участвуют в достаточной защите, поскольку клеточный иммунитет в основном оценивается с помощью ELISpot (11).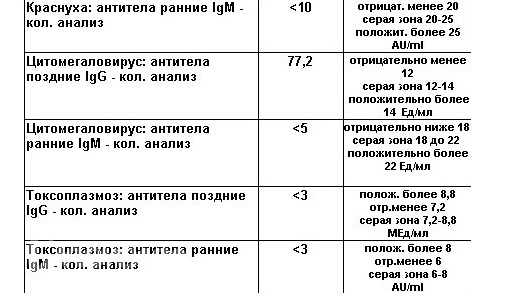 .
.
Дифференцировку Т-клеток можно оценить с помощью экспрессии CD45RO или CD45RA и хемокинового рецептора CCR7 самонаведения лимфатических узлов, который способен идентифицировать наивные Т-клетки и различные подмножества Т-клеток памяти, т.е.е., центральная память (CM), эффекторная память (EM) и, наконец, терминально дифференцированная EM CD45RA + (EMRA) (12). Это сопровождается потерей костимулирующего маркера CD28. В частности, эффективный ЦМВ-специфический Т-клеточный ответ дает много высокодифференцированных CD28 нулевых Т-клеток (13, 14). Как мы показали ранее, этот Т-клеточный ответ усиливает иммунологическое старение Т-клеток, наблюдаемое в кровотоке пациентов с терминальной почечной недостаточностью, что приводит к сдвигу в сторону более дифференцированных Т-клеток памяти и усиленному истощению теломер (14, 15).Неизвестно, влияет ли наличие ограниченного клеточного иммунитета к ЦМВ на характеристики старения Т-клеток у пациентов с тХПН.
Целью данного исследования является оценка ЦМВ-специфического Т-клеточного иммунитета, включая стадию дифференцировки ЦМВ-специфических Т-клеток, и определение его клинической значимости в отношении защиты от ЦМВ-виремии после трансплантации в когорте ЦМВ-серонегативных пациентов. Кроме того, оценивалось влияние на параметры старения Т-клеток.
Кроме того, оценивалось влияние на параметры старения Т-клеток.
Материалы и методы
Исследуемая группа
В когорте стабильных ЦМВ-серонегативных и, в качестве контроля, сопоставимых по возрасту и полу ЦМВ-серопозитивных реципиентов почки от ЦМВ-серопозитивного донора (D + /R − и D + / R + соответственно), ЦМВ-специфический иммунитет оценивали до трансплантации и связывали с ЦМВ-виремией после КТ.Большинство пациентов (86%) получали индукционную терапию базиликсимабом (Simulect ® , Novartis). Стандартная тройная иммуносупрессия, назначаемая после трансплантации, состояла из такролимуса (Prograf ® , Astellas Pharma), микофенолата мофетила (Cellcept ® , Roche) и преднизолона (первые 3 месяца после КТ); последние два для всех пациентов. Первые 6 месяцев после трансплантации противовирусная профилактика валганцикловиром 450 мг 1 раз в сутки.д. давали и при необходимости корректировали в связи с нарушением функции почек.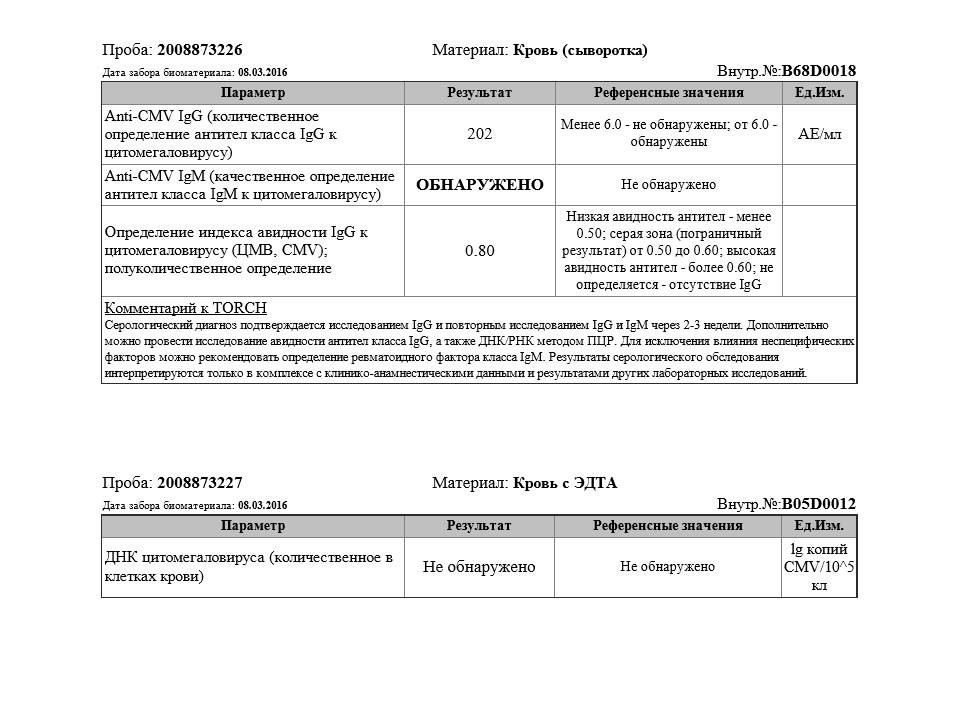 Характеристики пациентов перечислены в таблице 1. Все пациенты дали письменное информированное согласие на участие в этом исследовании. Исследование было одобрено Комитетом по медицинской этике Erasmus MC (номер METC 2010-080) и проводилось в соответствии с Хельсинкской декларацией и Стамбульской декларацией.
Характеристики пациентов перечислены в таблице 1. Все пациенты дали письменное информированное согласие на участие в этом исследовании. Исследование было одобрено Комитетом по медицинской этике Erasmus MC (номер METC 2010-080) и проводилось в соответствии с Хельсинкской декларацией и Стамбульской декларацией.
Таблица 1 . Демографические и клинические характеристики изучаемой популяции.
Обнаружение виремии ЦМВ и ЦМВ-специфических антител
Сывороточные антитела IgG к ЦМВ [выраженные в условных единицах/мл (AU/мл)] измеряли с помощью иммуноферментного анализа (Biomerieux, VIDAS, Лион, Франция).Результат ≥6 AU/мл считался положительным. В течение первого года после трансплантации пациентов контролировали с интервалом в 3 месяца на наличие ДНК ЦМВ. Диагноз ЦМВ-виремического эпизода основывался на наличии копий [выраженных в международных единицах/мл (МЕ/мл)] ДНК ЦМВ в крови и устанавливался количественной полимеразной цепной реакцией в отделении вирусологии МЦ Эразмус. Результат >50 МЕ/мл свидетельствовал о виремии ЦМВ.
Результат >50 МЕ/мл свидетельствовал о виремии ЦМВ.
Изоляция периферических мононуклеарных клеток (МКПК)
До КТ РВМС выделяли, как подробно описано ранее (16), из гепаринизированных образцов крови, взятых у ЦМВ-серонегативных и ЦМВ-серопозитивных пациентов, и хранили по 10 миллионов РВМС во флаконе при -150°C до дальнейшего использования.
Обнаружение ЦМВ-специфических CD137-экспрессирующих цитокин-продуцирующих Т-клеток
Периферические мононуклеарные клетки 28 ЦМВ-серонегативных и 14 ЦМВ-серопозитивных пациентов размораживали, оставляли на 8 ч при 37°C и стимулировали (5 × 10 6 РВМС/мл) в RPMI-1640, содержащем глутамакс (GibcoBRL, Пейсли, Шотландия) с добавлением 100 МЕ/мл пенициллина, 100 мкг/мл стрептомицина и 10% объединенной сыворотки человека, инактивированной нагреванием, далее называемой стандартной культуральной средой. Стимуляцию проводили в полистироловых пробирках (BD Pharmingen, Erembodegem, Бельгия) в присутствии костимуляции CD49d (1 мкг/мл; BD) без (фона) или со смесью перекрывающихся пулов пептидов, охватывающих весь pp65 и IE-1. белок ЦМВ (1 мкг/мл; PepTivator-CMV pp65 и IE-1; Miltenyi Biotec GmbH, Бергиш-Гладбах, Германия) и брефельдин А (Golgiplug; BD Pharmingen) в течение 12 ч.Этот анализ внутриклеточного окрашивания цитокинов облегчает детальную характеристику CMV-специфических CD4 + , а также CD8 + Т-клеток, поскольку они могут быть идентифицированы по экспрессии de novo CD137 в сочетании с эффекторными молекулами (17). В качестве положительного контроля РВМС 10 ЦМВ-серонегативных и 5 ЦМВ-серопозитивных пациентов стимулировали комбинацией ацетата форболмиристата (ФМА; 50 нг/мл; Sigma Aldrich, Сент-Луис, Миссури, США) и иономицина (1 мкг). /мл; Sigma Aldrich) и обработаны, как описано ранее.
белок ЦМВ (1 мкг/мл; PepTivator-CMV pp65 и IE-1; Miltenyi Biotec GmbH, Бергиш-Гладбах, Германия) и брефельдин А (Golgiplug; BD Pharmingen) в течение 12 ч.Этот анализ внутриклеточного окрашивания цитокинов облегчает детальную характеристику CMV-специфических CD4 + , а также CD8 + Т-клеток, поскольку они могут быть идентифицированы по экспрессии de novo CD137 в сочетании с эффекторными молекулами (17). В качестве положительного контроля РВМС 10 ЦМВ-серонегативных и 5 ЦМВ-серопозитивных пациентов стимулировали комбинацией ацетата форболмиристата (ФМА; 50 нг/мл; Sigma Aldrich, Сент-Луис, Миссури, США) и иономицина (1 мкг). /мл; Sigma Aldrich) и обработаны, как описано ранее.
Затем было выполнено поверхностное окрашивание для идентификации наивных (CD45RO — CCR7 + ) и субпопуляций Т-клеток памяти (12). Т-клетки CM представляют собой CD45RO + CCR7 + , эффекторную память (EM) CD45RO + CCR7 — и терминально дифференцированную эффекторную память (EMRA) CD45RO — CCR7 — . Кроме того, все более и более дифференцированные подмножества Т-клеток также были идентифицированы по CD28 (т. е. менее дифференцированные, имеющие CD28 + , и более дифференцированные, лишенные CD28, обозначенные как CD28 null ).Использовали следующие моноклональные антитела: анти-CD4, меченые бриллиантовым фиолетовым (BV)-510 (Biolegend Europe BV, Uithoorn, Нидерланды), анти-CD45RO, меченые синим пацификом (Biolegend), аллофикоцианин-Cy7 (APC-Cy7)- меченные анти-CD8 (BD, Erembodegem, Бельгия), анти-CD28, меченные перидинином хлорофилл-Cy5.5 (PerCP-Cy5.5) (BD), и анти-CCR7, меченные фикоэритрин-Cy7 (PE)-Cy7 (BD ). После фиксации и пермеабилизации клетки окрашивали внутриклеточно с использованием анти-CD137, меченного APC (BD), и анти-IFNγ, меченного PE (BD Pharmingen).Клетки, продуцирующие ИЛ-2, оценивали только у части протестированных пациентов, то есть у 12 ЦМВ-серонегативных и 6 ЦМВ-серопозитивных пациентов, путем совместного внутриклеточного окрашивания с использованием анти-ИЛ-2 (BD), меченного изотиоцианатом флуоресцеина.
Кроме того, все более и более дифференцированные подмножества Т-клеток также были идентифицированы по CD28 (т. е. менее дифференцированные, имеющие CD28 + , и более дифференцированные, лишенные CD28, обозначенные как CD28 null ).Использовали следующие моноклональные антитела: анти-CD4, меченые бриллиантовым фиолетовым (BV)-510 (Biolegend Europe BV, Uithoorn, Нидерланды), анти-CD45RO, меченые синим пацификом (Biolegend), аллофикоцианин-Cy7 (APC-Cy7)- меченные анти-CD8 (BD, Erembodegem, Бельгия), анти-CD28, меченные перидинином хлорофилл-Cy5.5 (PerCP-Cy5.5) (BD), и анти-CCR7, меченные фикоэритрин-Cy7 (PE)-Cy7 (BD ). После фиксации и пермеабилизации клетки окрашивали внутриклеточно с использованием анти-CD137, меченного APC (BD), и анти-IFNγ, меченного PE (BD Pharmingen).Клетки, продуцирующие ИЛ-2, оценивали только у части протестированных пациентов, то есть у 12 ЦМВ-серонегативных и 6 ЦМВ-серопозитивных пациентов, путем совместного внутриклеточного окрашивания с использованием анти-ИЛ-2 (BD), меченного изотиоцианатом флуоресцеина. Образцы измеряли на FACSCanto II (BD Pharmingen) с целью получения 0,5–1 × 10 6 Т-клеток и анализировали с использованием программного обеспечения FACSDiva версии 6.1.2 (BD). Стратегия гейтирования для выявления CMV-специфических CD137 + CD4 + Т-клеток в различных подмножествах и в сочетании с продукцией цитокинов показана на рисунке S1 в дополнительном материале, аналогичный подход применялся для CD8 + Т-клеток.Медиана (диапазон IQ) для CD137-экспрессирующих CD4 + Т-клеток всех образцов составила 0,05% (0,03–0,07%), тогда как для CD137-экспрессирующих CD8 + Т-клеток она была выше и составила 0,44% (0,03–0,07%). 0,23–1,02%). Среднее фоновое значение для CD137 + IFNγ + CD4 + и CD8 + и CD137 + IL-2 + CD4 + T-клеток всех образцов были ), 0,04% (0–0,09%) и 0,01% (0,01–0,01%) соответственно.Большая часть фонового сигнала в Т-клетках CD4 + наблюдалась в клетках, коэкспрессирующих CD28 и имеющих фенотип CM/EM, тогда как в клетках, наблюдаемых для Т-клеток CD8 + , преобладало отсутствие CD28 и фенотип EM/EMRA.
Образцы измеряли на FACSCanto II (BD Pharmingen) с целью получения 0,5–1 × 10 6 Т-клеток и анализировали с использованием программного обеспечения FACSDiva версии 6.1.2 (BD). Стратегия гейтирования для выявления CMV-специфических CD137 + CD4 + Т-клеток в различных подмножествах и в сочетании с продукцией цитокинов показана на рисунке S1 в дополнительном материале, аналогичный подход применялся для CD8 + Т-клеток.Медиана (диапазон IQ) для CD137-экспрессирующих CD4 + Т-клеток всех образцов составила 0,05% (0,03–0,07%), тогда как для CD137-экспрессирующих CD8 + Т-клеток она была выше и составила 0,44% (0,03–0,07%). 0,23–1,02%). Среднее фоновое значение для CD137 + IFNγ + CD4 + и CD8 + и CD137 + IL-2 + CD4 + T-клеток всех образцов были ), 0,04% (0–0,09%) и 0,01% (0,01–0,01%) соответственно.Большая часть фонового сигнала в Т-клетках CD4 + наблюдалась в клетках, коэкспрессирующих CD28 и имеющих фенотип CM/EM, тогда как в клетках, наблюдаемых для Т-клеток CD8 + , преобладало отсутствие CD28 и фенотип EM/EMRA. Поскольку частоты, полученные для различных параметров, значительно различались среди пациентов, мы вычли нестимулированное значение для каждого пациента из значения после стимуляции пептидом ЦМВ, чтобы рассчитать чистый сигнал, как показано в результатах. Положительный поддающийся обнаружению ЦМВ-специфический ответ определяли, если чистый ответ превышал 0.Только определяемые CD4 + и CD8 + CD137 + CMV-специфические Т-клеточные ответы были проанализированы более подробно в отношении продукции цитокинов и фенотипических аспектов.
Поскольку частоты, полученные для различных параметров, значительно различались среди пациентов, мы вычли нестимулированное значение для каждого пациента из значения после стимуляции пептидом ЦМВ, чтобы рассчитать чистый сигнал, как показано в результатах. Положительный поддающийся обнаружению ЦМВ-специфический ответ определяли, если чистый ответ превышал 0.Только определяемые CD4 + и CD8 + CD137 + CMV-специфические Т-клеточные ответы были проанализированы более подробно в отношении продукции цитокинов и фенотипических аспектов.
Обнаружение ЦМВ-специфических пролиферирующих Т-клеток
Периферические мононуклеарные клетки 12 ЦМВ-серонегативных и 6 ЦМВ-серопозитивных пациентов были разморожены и помечены сукцинимидиловым эфиром карбоксифлуоресцеиндиацетата в соответствии с инструкциями производителя (CFSE; Molecular Probes ® , Нидерланды) и впоследствии стимулированы в трех экземплярах в стандартной культуральной среде. при 5 × 10 4 на лунку (96 лунок — планшет с круглым дном) без или с лизатом ЦМВ (30 мкг/мл; Microbix Biosystems Inc., ON, Канада) или смесью перекрывающихся пептидных пулов, охватывающих весь белок pp65 и IE-1 CMV (оба в конечной концентрации 1 мкг/мл; PepTivator-CMV pp65 и IE-1; Miltenyi Biotec). Стимуляция лизатом ЦМВ может позволить охарактеризовать общий пул ЦМВ-специфических CD4 + Т-клеток, поскольку пулы перекрывающихся пептидов охватывают только два (хотя и доминирующих) пептида белка ЦМВ. Пролиферацию CMV-специфических CD8 + Т-клеток анализировали только после стимуляции перекрывающимися пулами пептидов pp65 и IE-1, а не целым лизатом CMV из-за их ограничения по длине (количеству аминокислот) пептидов, представленных в контекст HLA класса I.Через 6 дней клетки собирали, окрашивали с использованием моноклональных антител, направленных против CD3, CD4, CD8 и CD28 (опять же для выявления менее дифференцированных по сравнению с более дифференцированными субпопуляциями среди пролиферирующих Т-клеток), и мертвые клетки исключали с помощью 7-аминоактиномицина D.
при 5 × 10 4 на лунку (96 лунок — планшет с круглым дном) без или с лизатом ЦМВ (30 мкг/мл; Microbix Biosystems Inc., ON, Канада) или смесью перекрывающихся пептидных пулов, охватывающих весь белок pp65 и IE-1 CMV (оба в конечной концентрации 1 мкг/мл; PepTivator-CMV pp65 и IE-1; Miltenyi Biotec). Стимуляция лизатом ЦМВ может позволить охарактеризовать общий пул ЦМВ-специфических CD4 + Т-клеток, поскольку пулы перекрывающихся пептидов охватывают только два (хотя и доминирующих) пептида белка ЦМВ. Пролиферацию CMV-специфических CD8 + Т-клеток анализировали только после стимуляции перекрывающимися пулами пептидов pp65 и IE-1, а не целым лизатом CMV из-за их ограничения по длине (количеству аминокислот) пептидов, представленных в контекст HLA класса I.Через 6 дней клетки собирали, окрашивали с использованием моноклональных антител, направленных против CD3, CD4, CD8 и CD28 (опять же для выявления менее дифференцированных по сравнению с более дифференцированными субпопуляциями среди пролиферирующих Т-клеток), и мертвые клетки исключали с помощью 7-аминоактиномицина D. Образцы были измерены на FACSCanto II (BD) и проанализированы с использованием программного обеспечения FACS Diva версии 6.1.2 (BD), процент CMV-специфичных пролиферирующих Т-клеток рассчитывали путем вычитания процентного содержания Т-клеток, пролиферирующих в отсутствие этих стимулов.Медиана (диапазон IQ) пролиферирующих CD4 + и CD8 + Т-клеток в отсутствие стимула составила 0,83% (0,50–2,48%) и 1,42% (0,69–3,36%) соответственно. Положительный обнаруживаемый ответ определялся, если чистый ответ превышал 0,
Образцы были измерены на FACSCanto II (BD) и проанализированы с использованием программного обеспечения FACS Diva версии 6.1.2 (BD), процент CMV-специфичных пролиферирующих Т-клеток рассчитывали путем вычитания процентного содержания Т-клеток, пролиферирующих в отсутствие этих стимулов.Медиана (диапазон IQ) пролиферирующих CD4 + и CD8 + Т-клеток в отсутствие стимула составила 0,83% (0,50–2,48%) и 1,42% (0,69–3,36%) соответственно. Положительный обнаруживаемый ответ определялся, если чистый ответ превышал 0,
Суммарные и CMV-специфические клетки, секретирующие антитела IgG (ASC)
Периферические мононуклеарные клетки 11 ЦМВ-серонегативных и, в качестве положительного контроля, 4 ЦМВ-серопозитивных пациентов размораживали и впоследствии стимулировали при плотности 2 × 10 6 /мл в течение 5 дней с R848 и рекомбинантным IL-2, согласно инструкции производителя (U-Cytech BV, Утрехт, Нидерланды).На 4-й день лунки 96-луночного планшета покрывали на ночь при 4°С в соответствии с инструкцией производителя.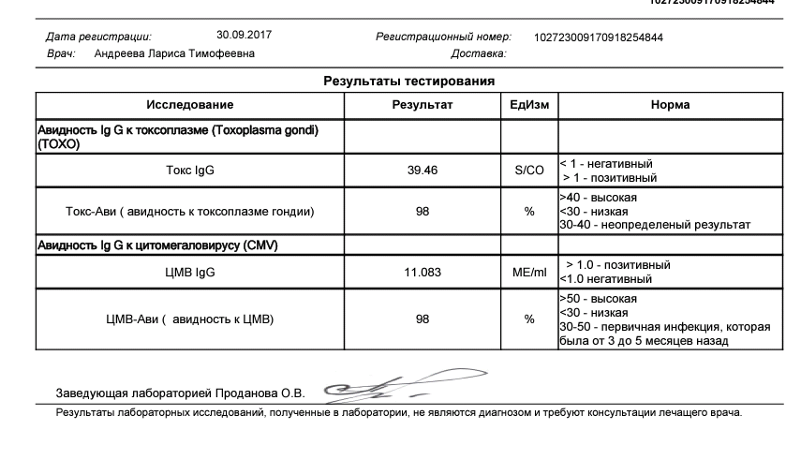 Покрытие состояло либо из антитела против человеческого IgG для подсчета общего IgG ASC, либо из лизата ЦМВ (30 мкг/мл Microbix Biosystems Inc., ON, Канада) для подсчета CMV-специфических IgG ASC. После стимуляции клетки собирали, подсчитывали и добавляли в планшет ELISpot с покрытием в различных концентрациях, каждую в трех экземплярах. После 7-часовой инкубации (37°C, 5% CO 2 ) клетки лизировали, а дебрис удаляли с помощью PBS/0.05% Твин-20. Затем лунки планшета ELISpot инкубировали в течение 1 ч при 37°C с биотинилированным антителом против IgG человека (обнаружение) и после промывки инкубировали с phi-меченым антителом против биотина (ГАМК) в течение 1 ч при 37°C. С. Наконец, ASC визуализировали после процедуры промывки с использованием активационного раствора (U-Cytech BV), что приводило к осадку серебра при инкубации в темноте при комнатной температуре. Развитие окраски останавливали с помощью диионизированной воды и подсчитывали пятна с помощью считывателя ELISpot (Bioreader ® -600V, BIO-SYS GmbH, Карбен, Германия).
Покрытие состояло либо из антитела против человеческого IgG для подсчета общего IgG ASC, либо из лизата ЦМВ (30 мкг/мл Microbix Biosystems Inc., ON, Канада) для подсчета CMV-специфических IgG ASC. После стимуляции клетки собирали, подсчитывали и добавляли в планшет ELISpot с покрытием в различных концентрациях, каждую в трех экземплярах. После 7-часовой инкубации (37°C, 5% CO 2 ) клетки лизировали, а дебрис удаляли с помощью PBS/0.05% Твин-20. Затем лунки планшета ELISpot инкубировали в течение 1 ч при 37°C с биотинилированным антителом против IgG человека (обнаружение) и после промывки инкубировали с phi-меченым антителом против биотина (ГАМК) в течение 1 ч при 37°C. С. Наконец, ASC визуализировали после процедуры промывки с использованием активационного раствора (U-Cytech BV), что приводило к осадку серебра при инкубации в темноте при комнатной температуре. Развитие окраски останавливали с помощью диионизированной воды и подсчитывали пятна с помощью считывателя ELISpot (Bioreader ® -600V, BIO-SYS GmbH, Карбен, Германия). CMV-IgG ASC выражены как количество/10 5 клеток и частота общего IgG ASC.
CMV-IgG ASC выражены как количество/10 5 клеток и частота общего IgG ASC.
В дополнение к анализу ASC образец до и после стимуляции был проанализирован на образование бластов В-клеток с помощью проточной цитометрии. Использовалась следующая панель моноклональных антител: анти-CD19, меченое BV510 (Biolegend), анти-CD38, меченное BV421 (BD), и анти-CD27, меченное PE-Cy7 (eBioscience). Взрывы плазмы были CD19 + CD38 высокий CD27 + .
Абсолютное количество CD4
+ и CD8 + Т-клеток и статус дифференцировки Т-клеток по данным проточной цитометрииАбсолютное количество подмножеств Т-клеток (18) и статус дифференцировки Т-клеток (19) определяли с помощью окрашивания цельной крови, как подробно описано ранее.
Анализ длины теломер
Относительную длину теломер CD4 + и CD8 + Т-клеток определяли с помощью Flow fluorescent гибридизации in situ (flow-FISH), как описано ранее (15, 20).
Статистический анализ
Статистический анализ выполнен с использованием GraphPad Prism версии 5.01. Непараметрический критерий Манна-Уитни U или критерий Крускала-Уоллиса с последующим апостериорным анализом (критерий множественных сравнений Даннса).Категориальные переменные сравнивались с использованием точного критерия Фишера. Для оценки ассоциаций между различными параметрами использовали непараметрический коэффициент ранговой корреляции Спирмена (ро Спирмена, R с). P — значения <0,05 для двух сторон считались статистически значимыми.
Результаты
Изучение характеристик популяции
Демографические и клинические характеристики исследуемой популяции представлены в таблице 1. В исследование были включены 28 ЦМВ-серонегативных и 14 ЦМВ-серопозитивных пациентов того же возраста и пола.Обе группы были хорошо сопоставимы без существенных различий в клинических характеристиках. Приблизительно у половины ЦМВ-серонегативных пациентов по сравнению с ни одним из ЦМВ-серопозитивных пациентов не наблюдалось ЦМВ-виремии в течение 12 месяцев после трансплантации ( P < 0,01).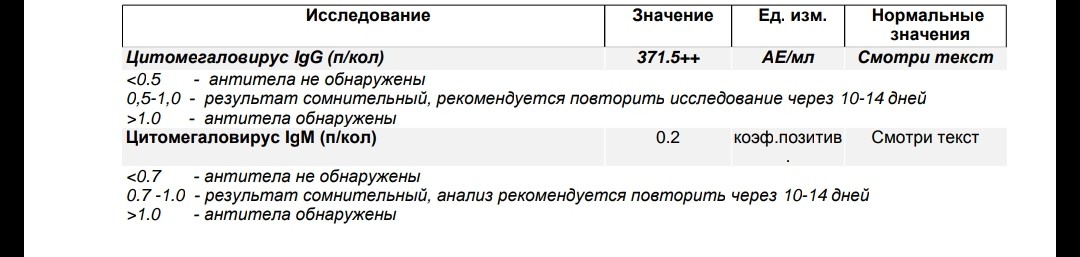
ЦМВ-серонегативные пациенты часто имеют ЦМВ-специфические Т-клетки
Цитомегаловирус-специфические CD4 + и CD8 + Т-клетки, идентифицированные по экспрессии CD137 при стимуляции пептидным пулом двух иммунодоминантных белков pp65 и IE-1 (CD137 + CD4 + и CD137 + CD8 + ) присутствовали у 16 из 28 ЦМВ-серонегативных пациентов.Медиана (диапазон IQ) положительных ответов составила 0,03% (0,01–0,11%) и 0,10% (0,03–0,18%) для Т-клеток CD4 + и CD8 + соответственно (рис. 1А, С, черный цвет). точки). Положительная корреляция наблюдалась между уровнями CD4 + и CD8 + ЦМВ-специфического Т-клеточного ответа у ЦМВ-серонегативных пациентов ( R с = 0,50, P < 0,05). Процент CMV-специфических CD137-позитивных CD4 + и CD8 + Т-клеток (присутствующих у 14 и 11 из 14 ЦМВ-серопозитивных пациентов соответственно) был значительно ( P < 0.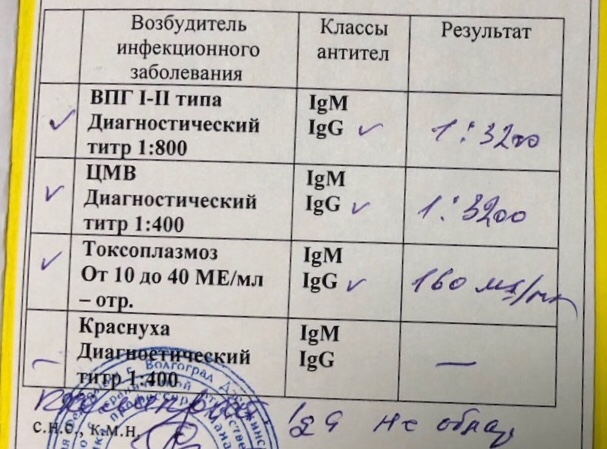 001) выше у ЦМВ-серопозитивных пациентов и составляли 0,61% (0,11–1,04%) и 1,45% (0,44–8,69%) (рис. 1А, С, светлые точки) соответственно.
001) выше у ЦМВ-серопозитивных пациентов и составляли 0,61% (0,11–1,04%) и 1,45% (0,44–8,69%) (рис. 1А, С, светлые точки) соответственно.
Рисунок 1 . Цитомегаловирус (CMV)-специфические Т-клетки, экспрессирующие CD137 и продуцирующие цитокины. Периферические мононуклеарные клетки пациентов стимулировали в течение 12 часов в присутствии брефельдина А и αCD49d по отдельности или в смеси пулов перекрывающихся пептидов ppp65 и IE-1. Затем клетки окрашивают клеточной поверхностью и внутриклеточно, чтобы определить частоты и фенотипические характеристики CMV-специфических Т-клеток, экспрессирующих CD137, а также клеток, продуцирующих цитокины.CMV-специфические CD137-экспрессирующие CD4 + (A) и CD8 + (C) Т-клетки, с поправкой на фон (только αCD49d), представлены в процентах от общего числа CD4 + или CD8 + Т-клетки и нескорректированные значения принимают за 100% и препарируют на CD4 + (B) или CD8 + (D) Т-клетки, коэкспрессирующие или лишенные CD28, и различные наивные Т-клетки и Т-клетки памяти подмножества ячеек. Аналогичный подход применяется для CMV-специфических CD137-экспрессирующих IFN-γ и IL-2-продуцирующих CD4 + [ (E,G) и рассечение в (F,H) ] и CD8 + [ (I) и рассечение на панели (J) ] Т-клеток соответственно.Закрытые и открытые символы/столбцы представляют ЦМВ-серонегативных (с обнаруживаемым ответом) и ЦМВ-серопозитивных пациентов, соответственно, а столбцы отображают медианы и межквартильный диапазон групп пациентов. * Р < 0,05; ** Р < 0,01, *** Р < 0,001.
Аналогичный подход применяется для CMV-специфических CD137-экспрессирующих IFN-γ и IL-2-продуцирующих CD4 + [ (E,G) и рассечение в (F,H) ] и CD8 + [ (I) и рассечение на панели (J) ] Т-клеток соответственно.Закрытые и открытые символы/столбцы представляют ЦМВ-серонегативных (с обнаруживаемым ответом) и ЦМВ-серопозитивных пациентов, соответственно, а столбцы отображают медианы и межквартильный диапазон групп пациентов. * Р < 0,05; ** Р < 0,01, *** Р < 0,001.
Цитомегаловирус-специфические CD137 + CD4 + и CD137 + CD8 + Т-клетки имели преимущественно фенотип памяти как у ЦМВ-серопозитивных, так и у ЦМВ-серонегативных пациентов.Однако значительно более высокие проценты ( P <0,05) CD137 + CD4 + и CD137 + CD8 + Т-клеток у ЦМВ-серонегативных пациентов имели наивный фенотип по сравнению с ЦМВ-серопозитивными пациентами (рис. 1Б,Г соответственно). Никаких различий не наблюдалось при сравнении максимальной способности Т-клеток экспрессировать CD137 между ЦМВ-серонегативными и ЦМВ-серопозитивными пациентами при стимуляции PMA/иономицином (рисунки S2A, B в дополнительных материалах).
1Б,Г соответственно). Никаких различий не наблюдалось при сравнении максимальной способности Т-клеток экспрессировать CD137 между ЦМВ-серонегативными и ЦМВ-серопозитивными пациентами при стимуляции PMA/иономицином (рисунки S2A, B в дополнительных материалах).
ЦМВ-специфические Т-клетки у ЦМВ-серонегативных пациентов продуцируют IFNγ и IL-2
Затем было изучено присутствие и распределение IFNγ- и IL-2-продуцирующих Т-клеток, специфичных для ЦМВ. У 13 из 28 ЦМВ-серонегативных пациентов присутствовали ЦМВ-специфические IFNγ + CD137 + CD4 + Т-клетки, а медиана (диапазон IQ) частот составила 0,01% (0,01–0,04%) по сравнению с 0,58% ( 0,16–0,87%) для ЦМВ-серопозитивных пациентов, все из которых имели ЦМВ-специфический IFNγ + CD137 + CD4 + Т-клетки (рис. 1E, P < 0.001). У ЦМВ-серонегативных пациентов примерно 37% ЦМВ-специфических CD137-экспрессирующих CD4 + Т-клеток продуцировали IFNγ по сравнению с 69% у ЦМВ-серопозитивных пациентов ( P < 0,05). IFNγ-продуцирующие CMV-специфические CD137 + CD4 + Все Т-клетки коэкспрессировали CD28, и сходные частоты присутствовали в подгруппах CM и EM у CMV-серонегативных пациентов. У ЦМВ-серопозитивных пациентов наблюдался несколько более дифференцированный фенотип — 16% ( P < 0.01) этих клеток отсутствовал CD28, и 75% были классифицированы как Т-клетки ЭМ (рис. 1F).
IFNγ-продуцирующие CMV-специфические CD137 + CD4 + Все Т-клетки коэкспрессировали CD28, и сходные частоты присутствовали в подгруппах CM и EM у CMV-серонегативных пациентов. У ЦМВ-серопозитивных пациентов наблюдался несколько более дифференцированный фенотип — 16% ( P < 0.01) этих клеток отсутствовал CD28, и 75% были классифицированы как Т-клетки ЭМ (рис. 1F).
У 12 ЦМВ-серонегативных и 6 ЦМВ-серопозитивных пациентов была оценена частота IL-2-продуцирующих CD4 + Т-клеток, специфичных для ЦМВ, поскольку мы ранее показали, что они связаны с титрами анти-ЦМВ IgG (6). CMV-специфические CD137 + CD4 + IL-2 + Т-клетки были обнаружены у 9 из 12 (75%) ЦМВ-серонегативных пациентов по сравнению со всеми ЦМВ-серопозитивными пациентами, а медиана (диапазон IQ) частот составила до 0.01% (0,01–0,01%) и 0,26% (0,01–0,87%) для ЦМВ-серонегативных и ЦМВ-серопозитивных пациентов ( P <0,05; рисунок 1G). Сорок процентов ЦМВ-специфических CD137-экспрессирующих CD4 + Т-клеток ЦМВ-серонегативных пациентов продуцировали ИЛ-2 по сравнению с 37% ЦМВ-серопозитивных пациентов.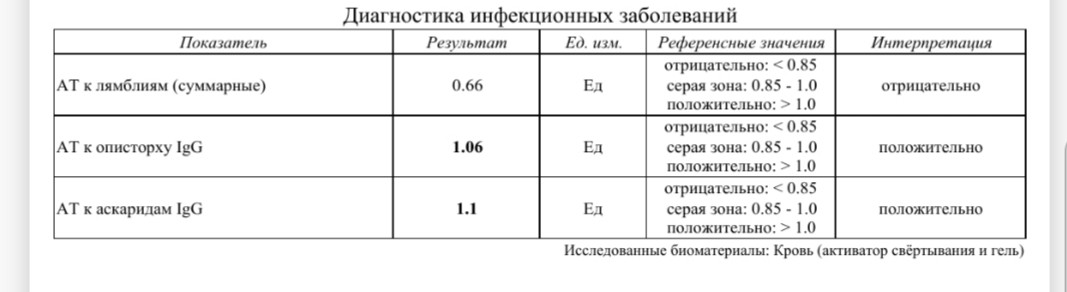 У ЦМВ-серонегативных пациентов почти все ИЛ-2-продуцирующие клетки коэкспрессировали CD28, в отличие от наличия CD28 нулевых ЦМВ-специфических ИЛ-2-продуцирующих клеток (10%) в ЦМВ-серопозитивной группе ( P < 0.01; Рисунок 1Н).
У ЦМВ-серонегативных пациентов почти все ИЛ-2-продуцирующие клетки коэкспрессировали CD28, в отличие от наличия CD28 нулевых ЦМВ-специфических ИЛ-2-продуцирующих клеток (10%) в ЦМВ-серопозитивной группе ( P < 0.01; Рисунок 1Н).
IFN-γ-продуцирующие CD137 + CD8 + Т-клетки были обнаружены у 11 из 28 (39%) ЦМВ-серонегативных и 11 из 14 (79%) ЦМВ-серопозитивных пациентов. Медианы (диапазон IQ) частоты составили 0,05% (0,01–0,12%) и 0,64% (0,22–1,90%) в общей популяции CD8 + Т-клеток для ЦМВ-серонегативных и ЦМВ-серопозитивных пациентов соответственно (рис. 1I, P < 0,01). Только 9% CD137-экспрессирующих CD8 + Т-клеток продуцировали IFNγ у ЦМВ-серонегативных пациентов по сравнению с 36% ЦМВ-серопозитивных пациентов ( P < 0.01). Статус дифференцировки этих клеток был одинаковым для обеих групп, и большинство IFNγ + CD137 + CD8 + Т-клеток были обнаружены в подмножествах EM и высокодифференцированных EMRA (рис. 1J). У ЦМВ-серонегативных пациентов 65% ЦМВ-специфических IFNγ-продуцирующих клеток коэкспрессировали CD28, в отличие от наличия 89% CD28 нулевых IFNγ-продуцирующих клеток у ЦМВ-серопозитивных пациентов ( P < 0,05; рис. 1J). Частота ЦМВ-специфических CD137 + CD8 + Т-клеток, продуцирующих ИЛ-2, была низкой, т.е.е., медиана и диапазон IQ составили: 0,001% (0,001–0,001%) и 0,024% (0,01–0,05%) от суммы CD8 + Т-клеток для ЦМВ-серонегативных и ЦМВ-серопозитивных пациентов соответственно. Поскольку менее 5% экспрессирующих CD137 Т-клеток CD8 + продуцировали IL-2, дальнейшее разделение на подмножества Т-клеток не проводилось.
1J). У ЦМВ-серонегативных пациентов 65% ЦМВ-специфических IFNγ-продуцирующих клеток коэкспрессировали CD28, в отличие от наличия 89% CD28 нулевых IFNγ-продуцирующих клеток у ЦМВ-серопозитивных пациентов ( P < 0,05; рис. 1J). Частота ЦМВ-специфических CD137 + CD8 + Т-клеток, продуцирующих ИЛ-2, была низкой, т.е.е., медиана и диапазон IQ составили: 0,001% (0,001–0,001%) и 0,024% (0,01–0,05%) от суммы CD8 + Т-клеток для ЦМВ-серонегативных и ЦМВ-серопозитивных пациентов соответственно. Поскольку менее 5% экспрессирующих CD137 Т-клеток CD8 + продуцировали IL-2, дальнейшее разделение на подмножества Т-клеток не проводилось.
CMV-специфические CD137 + CD4 + и CD8 + Т-клетки с наивным фенотипом, присутствующие с большей частотой у ЦМВ-серонегативных пациентов (рис. 1B, D), не продуцировали IL-2 (рис. 1H) или IFNγ (рис. 1F, J).
В совокупности эти данные показывают, что у значительной части ЦМВ-серонегативных пациентов клетки, продуцирующие цитокины, присутствуют в ЦМВ-специфических Т-клетках, экспрессирующих CD137, хотя и с меньшей частотой. Подобно CMV-серопозитивным пациентам, они в основном имеют фенотип памяти, хотя и менее дифференцированы, поскольку они более CD28 + . Никаких различий не наблюдалось при сравнении максимальной способности Т-клеток экспрессировать CD137 (рисунки S2A, B в дополнительном материале) и продуцировать цитокины между ЦМВ-серонегативными и ЦМВ-серопозитивными пациентами (рисунки S2C-E в дополнительном материале).
Подобно CMV-серопозитивным пациентам, они в основном имеют фенотип памяти, хотя и менее дифференцированы, поскольку они более CD28 + . Никаких различий не наблюдалось при сравнении максимальной способности Т-клеток экспрессировать CD137 (рисунки S2A, B в дополнительном материале) и продуцировать цитокины между ЦМВ-серонегативными и ЦМВ-серопозитивными пациентами (рисунки S2C-E в дополнительном материале).
ЦМВ-специфическая пролиферация Т-клеток у ЦМВ-серонегативных пациентов
В дополнение к измерению способности проявлять эффекторную функцию путем продукции цитокинов, мы оценили пролиферацию Т-клеток, специфичных к ЦМВ, с использованием как лизата ЦМВ, так и пула пептидов иммунодоминантных белков pp65 и IE-1 (рис. 2А, В, типичная проточная цитометрия). пример). Индуцированная лизатом ЦМВ пролиферация наблюдалась у 10 из 12 ЦМВ-серонегативных КТ-реципиентов по CD4 + Т-клеток соответственно.Медиана (диапазон IQ) процент пролиферирующих CD4 + Т-клеток составила 2,2,55% (0,88–7,09%) (рис. 2С). Пролиферация в ответ на смесь pp65- и IE-1-перекрывающихся пептидных пулов наблюдалась у меньшей части ЦМВ-серонегативных пациентов, т.е. у 7 и 3 из 12 КТ-реципиентов для CD4 + и CD8 + T клеток [медиана и диапазон IQ: 0,35 и 0,09–0,64% (рис. 2C) и 0,33 и 0,19–1,00% (рис. 2E) соответственно]. CD4 + Т-клетки ЦМВ-серопозитивных пациентов энергично пролиферировали до ЦМВ-лизата.Средний процент пролиферирующих CD4 + Т-клеток составил 36% (рис. 2С). Пролиферация в ответ на смесь pp65- и IE-1-перекрывающихся пептидных пулов составила 6,34% (3,47–24,32%) и 9,64% (4,26–43,63%) для CD4 + и CD8 + Т-клеток соответственно. (рис. 2С, Е). У ЦМВ-серонегативных пациентов большинство (>97%) пролиферирующих CD4 + Т-клеток коэкспрессировали CD28, что свидетельствует о менее дифференцированном фенотипе. У CMV-серопозитивных пациентов примерно 10% всех пролиферирующих CD4 + Т-клеток были нулевыми CD28 (рис.
2С). Пролиферация в ответ на смесь pp65- и IE-1-перекрывающихся пептидных пулов наблюдалась у меньшей части ЦМВ-серонегативных пациентов, т.е. у 7 и 3 из 12 КТ-реципиентов для CD4 + и CD8 + T клеток [медиана и диапазон IQ: 0,35 и 0,09–0,64% (рис. 2C) и 0,33 и 0,19–1,00% (рис. 2E) соответственно]. CD4 + Т-клетки ЦМВ-серопозитивных пациентов энергично пролиферировали до ЦМВ-лизата.Средний процент пролиферирующих CD4 + Т-клеток составил 36% (рис. 2С). Пролиферация в ответ на смесь pp65- и IE-1-перекрывающихся пептидных пулов составила 6,34% (3,47–24,32%) и 9,64% (4,26–43,63%) для CD4 + и CD8 + Т-клеток соответственно. (рис. 2С, Е). У ЦМВ-серонегативных пациентов большинство (>97%) пролиферирующих CD4 + Т-клеток коэкспрессировали CD28, что свидетельствует о менее дифференцированном фенотипе. У CMV-серопозитивных пациентов примерно 10% всех пролиферирующих CD4 + Т-клеток были нулевыми CD28 (рис. 2D).Это различие в статусе дифференцировки было еще более выраженным в пролиферирующих CD8 + Т-клетках, поскольку 78% этих клеток у ЦМВ-серонегативных пациентов экспрессировали CD28 по сравнению с примерно 34% ЦМВ-серопозитивных пациентов ( P <0,05) (рис. 2F). ). Частота ЦМВ-специфических IFNγ-продуцирующих CD137 + CD4 + Т-клеток и IL-2-продуцирующих CD137 + CD4 + Т-клеток положительно коррелировала с процентом пролиферирующих CD4 + Т-клеток [для IFNγ] : R с = 0.63; P = 0,02 (ЦМВ-лизат) и R с = 0,71; P = 0,02 (пептиды pp65/IE-1), для IL-2: R s = 0,62; P = 0,02 (ЦМВ-лизат) и R с = 0,74; P = 0,01 (пептиды pp65/IE-1)].
2D).Это различие в статусе дифференцировки было еще более выраженным в пролиферирующих CD8 + Т-клетках, поскольку 78% этих клеток у ЦМВ-серонегативных пациентов экспрессировали CD28 по сравнению с примерно 34% ЦМВ-серопозитивных пациентов ( P <0,05) (рис. 2F). ). Частота ЦМВ-специфических IFNγ-продуцирующих CD137 + CD4 + Т-клеток и IL-2-продуцирующих CD137 + CD4 + Т-клеток положительно коррелировала с процентом пролиферирующих CD4 + Т-клеток [для IFNγ] : R с = 0.63; P = 0,02 (ЦМВ-лизат) и R с = 0,71; P = 0,02 (пептиды pp65/IE-1), для IL-2: R s = 0,62; P = 0,02 (ЦМВ-лизат) и R с = 0,74; P = 0,01 (пептиды pp65/IE-1)].
Рисунок 2 . Цитомегаловирусная (ЦМВ) специфическая пролиферация Т-клеток. Показан типичный пример стратегии гейтирования для анализа пролиферации Т-клеток, специфичных для ЦМВ. Вкратце, на основе характеристик прямого/бокового движения живые клетки гейтируются и изображаются на точечной диаграмме для дальнейшего отбора живых (7AAD-негативных) CD3 + Т-клеток (A) . Затем их дополнительно разрезали на CD4 + и CD8 + Т-клетки (A) . CD4 + и CD8 + Т-клетки, наконец, нанесены на график для визуализации пролиферации (разведение CFSE) и экспрессии CD28, и типичный пример фоновой пролиферации в CD4 + и CD8 + Т-клетки показан на последних двух графиках. на панели A. На панели (B) типичные (выявляемые) пролиферативные ответы CD4 + и CD8 + Т-клеток на ЦМВ-лизат (только CD4 + Т-клетки; верхние графики) или смесь перекрывающиеся пептиды для pp65/IE-1 (как CD4 + , так и CD8 + Т-клетки; средний и нижний графики соответственно) изображены для ЦМВ-серонегативного (левая панель) и ЦМВ-серопозитивного пациента (правая панель).Процент CMV-специфичных пролиферирующих CD4 + и CD8 + Т-клеток, с поправкой на частоту пролиферирующих CD4 + или CD8 + Т-клеток в отсутствие стимула, изображен на панелях (C, E).
Затем их дополнительно разрезали на CD4 + и CD8 + Т-клетки (A) . CD4 + и CD8 + Т-клетки, наконец, нанесены на график для визуализации пролиферации (разведение CFSE) и экспрессии CD28, и типичный пример фоновой пролиферации в CD4 + и CD8 + Т-клетки показан на последних двух графиках. на панели A. На панели (B) типичные (выявляемые) пролиферативные ответы CD4 + и CD8 + Т-клеток на ЦМВ-лизат (только CD4 + Т-клетки; верхние графики) или смесь перекрывающиеся пептиды для pp65/IE-1 (как CD4 + , так и CD8 + Т-клетки; средний и нижний графики соответственно) изображены для ЦМВ-серонегативного (левая панель) и ЦМВ-серопозитивного пациента (правая панель).Процент CMV-специфичных пролиферирующих CD4 + и CD8 + Т-клеток, с поправкой на частоту пролиферирующих CD4 + или CD8 + Т-клеток в отсутствие стимула, изображен на панелях (C, E).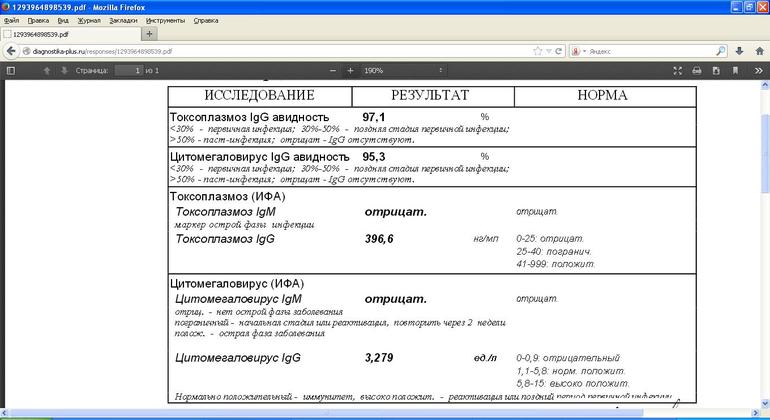 соответственно. Разделение нескорректированных пролиферирующих Т-клеток, индуцированных лизатом или пептидом ЦМВ (установлено на 100%), на клетки, лишенные или экспрессирующие CD28, показаны на панелях (D, F) для CD4 + и CD8 + Т-клеток, соответственно.ЦМВ-серонегативные (с обнаруживаемым ответом) и ЦМВ-серопозитивные пациенты показаны закрытыми и незакрашенными символами соответственно, а столбцы представляют собой медианы и межквартильный размах групп пациентов. * Р < 0,05; ** Р < 0,01.
соответственно. Разделение нескорректированных пролиферирующих Т-клеток, индуцированных лизатом или пептидом ЦМВ (установлено на 100%), на клетки, лишенные или экспрессирующие CD28, показаны на панелях (D, F) для CD4 + и CD8 + Т-клеток, соответственно.ЦМВ-серонегативные (с обнаруживаемым ответом) и ЦМВ-серопозитивные пациенты показаны закрытыми и незакрашенными символами соответственно, а столбцы представляют собой медианы и межквартильный размах групп пациентов. * Р < 0,05; ** Р < 0,01.
Низкая частота ЦМВ-специфических IgG ASC у ЦМВ-серонегативных пациентов
Затем мы оценили, могут ли ЦМВ-специфические В-клетки памяти быть обнаружены в кровообращении ЦМВ-серонегативных пациентов. Частота плазменных бластов в кровотоке очень низкая, но они могут быть вызваны В-клетками при поликлональной стимуляции.Общее количество В-клеток и ответы могут быть отрицательно затронуты у пациентов с терминальной почечной недостаточностью, и поэтому мы впервые задокументировали, что этот протокол действительно может индуцировать плазменные бласты.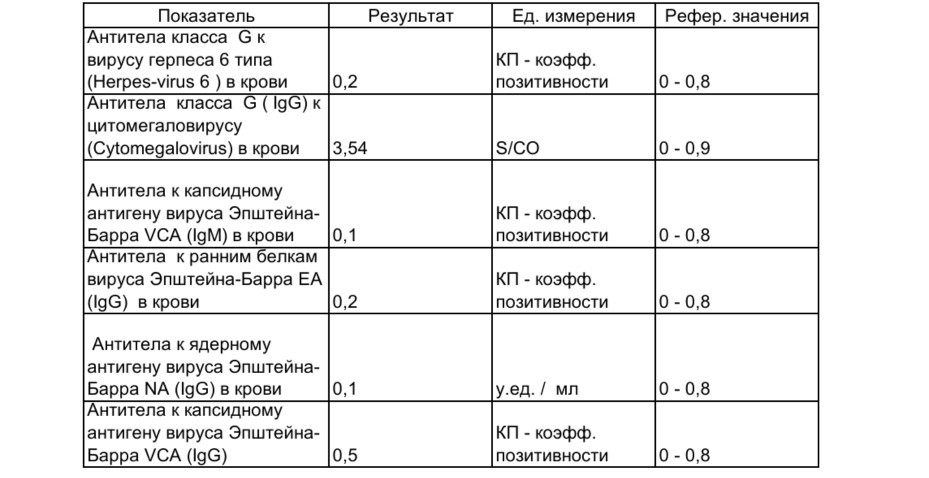 Как показано на фиг.3А, бласты плазмы индуцировались (CD27 + CD38 высокая CD19 + , от 1,4 до 48,1%) после 5-дневной поликлональной стимуляции. Затем с помощью ELISpot количественно определяли общий IgG и CMV-IgG ASC. CMV-IgG ASC были обнаружены выше фона у 4 из 11 (36%) ЦМВ-серонегативных пациентов, а чистая медиана (диапазон IQ) CMV-специфических IgG ASC составила только 1/10 5 (1–10/10 5 ), т.е.е., 0,08% (0,02–0,14%) от общего IgG ASC (рис. 3B, C). Все ЦМВ-серопозитивные пациенты имели обнаруживаемые CMV-IgG ASC [медиана 45 клеток/10 5 (7–114/10 5 ), 0,38% (0,11–1,70%) от общего IgG ASC]. Интересно, что CMV-специфические IFNγ-, а также IL-2-продуцирующие CD137 + CD4 + Т-клетки всей группы пациентов (ЦМВ-серопозитивные и ЦМВ-серонегативные пациенты) положительно коррелировали с количеством ЦМВ-специфических IgG. ASC ( R s = 0,52; P < 0.05 и R с = 0,53; P < 0,05 соответственно).
Как показано на фиг.3А, бласты плазмы индуцировались (CD27 + CD38 высокая CD19 + , от 1,4 до 48,1%) после 5-дневной поликлональной стимуляции. Затем с помощью ELISpot количественно определяли общий IgG и CMV-IgG ASC. CMV-IgG ASC были обнаружены выше фона у 4 из 11 (36%) ЦМВ-серонегативных пациентов, а чистая медиана (диапазон IQ) CMV-специфических IgG ASC составила только 1/10 5 (1–10/10 5 ), т.е.е., 0,08% (0,02–0,14%) от общего IgG ASC (рис. 3B, C). Все ЦМВ-серопозитивные пациенты имели обнаруживаемые CMV-IgG ASC [медиана 45 клеток/10 5 (7–114/10 5 ), 0,38% (0,11–1,70%) от общего IgG ASC]. Интересно, что CMV-специфические IFNγ-, а также IL-2-продуцирующие CD137 + CD4 + Т-клетки всей группы пациентов (ЦМВ-серопозитивные и ЦМВ-серонегативные пациенты) положительно коррелировали с количеством ЦМВ-специфических IgG. ASC ( R s = 0,52; P < 0.05 и R с = 0,53; P < 0,05 соответственно).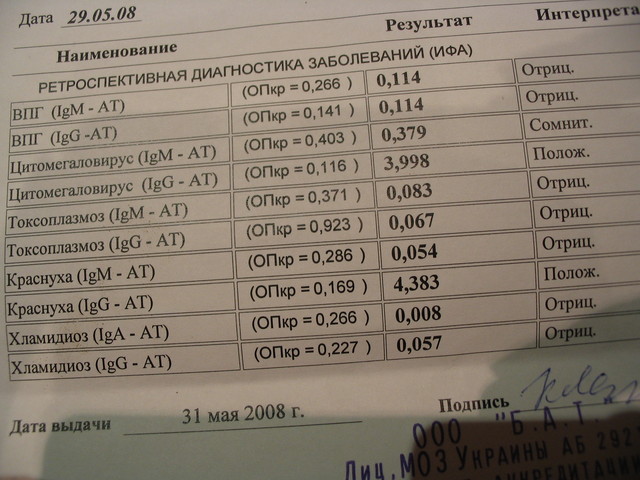
Рисунок 3 . Цитомегаловирус (ЦМВ)-специфические В-клеточные ответы. Анализ B-клеток ELISpot проводили для подсчета клеток, секретирующих антитела, секретирующие CMV-специфический и общий иммуноглобулин G (IgG) (ASC). На панели (A) приведен типичный пример проточной цитометрии бластов В-клеток, идентифицированных как клетки CD19 + CD27 + CD38 high , перед последующей 5-дневной стимуляцией R848 и рекомбинантным IL-. 2 с левой стороны.Справа показаны индивидуальные и медианные частоты В-клеточных бластов до стимуляции и после 5-дневной стимуляции у 15 реципиентов почечного трансплантата (11 ЦМВ-серонегативных и 4 ЦМВ-серопозитивных пациента). После стимуляции В-клеток клетки переносили в различном количестве на лунку в лунки 96-луночного планшета B-ELISpot, покрытые лизатом ЦМВ или антителом против человеческого IgG или непокрытые (содержащие PBS; фоновые клетки, продуцирующие IgG). На панели (B) показаны репрезентативные примеры фоновых, CMV-специфических и общих IgG ASC, определенных у CMV-серопозитивных и CMV-серонегативных пациентов. На панели (C) индивидуальные и средние (выявляемые) CMV-специфические и общие IgG ASC, с поправкой на фон (количество пятен в отсутствие покрывающих антител) для CMV-серопозитивных (незаштрихованные символы) и CMV-серонегативных (закрытые символы) символы) изображены больные. * Р < 0,05; *** Р < 0,001.
На панели (C) индивидуальные и средние (выявляемые) CMV-специфические и общие IgG ASC, с поправкой на фон (количество пятен в отсутствие покрывающих антител) для CMV-серопозитивных (незаштрихованные символы) и CMV-серонегативных (закрытые символы) символы) изображены больные. * Р < 0,05; *** Р < 0,001.
ЦМВ-специфический CD137
+ IFNγ + CD4 + Т-клеточный ответ защищает от виремии ЦМВ ЦМВ-специфический Т-клеточный ответ у ЦМВ-серонегативных пациентов оценивали на клиническую значимость, связывая его с возникновением ЦМВ-виремии после трансплантации.У 13 из 28 (46%) ЦМВ-серонегативных пациентов в течение первого года после трансплантации ЦМВ-серопозитивной донорской почки развилась ЦМВ-виремия. ЦМВ-серонегативные пациенты с ЦМВ-специфическими CD137 + IFNγ + CD4 + Т-лимфоциты до трансплантации имели более низкий риск развития ЦМВ-виремии после трансплантации с ЦМВ-серопозитивной донорской почкой по сравнению с пациентами без (относительный риск: 0,43, P = 0,03).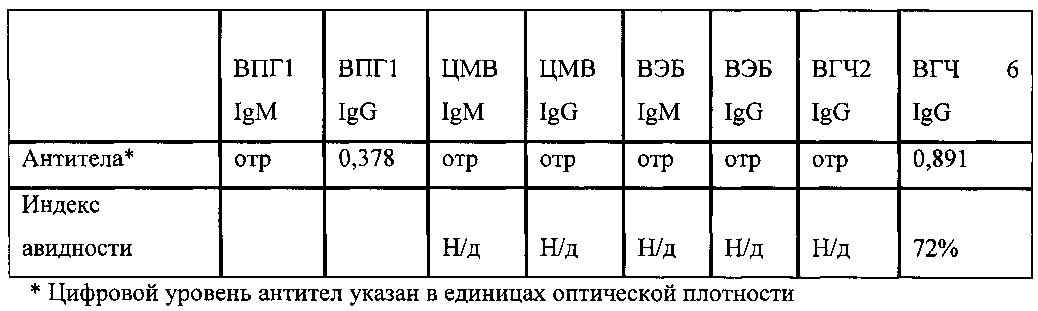 Не наблюдалось различий в процентном содержании ЦМВ-специфических IFNγ-продуцирующих CD137 + CD4 + Т-клеток между ЦМВ-серонегативными пациентами без и с ЦМВ-виремией (данные не показаны).
Не наблюдалось различий в процентном содержании ЦМВ-специфических IFNγ-продуцирующих CD137 + CD4 + Т-клеток между ЦМВ-серонегативными пациентами без и с ЦМВ-виремией (данные не показаны).
ЦМВ-ассоциированные дефекты Т-клеток, имитирующие старение Т-клеток, отсутствуют у ЦМВ-серонегативных пациентов с ЦМВ-специфичными Т-клетками
Латентность цитомегаловируса оставляет четкий отпечаток пальца на Т-клеточной иммунной системе. Связанные с ЦМВ изменения в компартменте циркулирующих Т-клеток у ЦМВ-серопозитивных пациентов с ТХПН включают уменьшение длины теломер, значительное увеличение пула Т-клеток CD8 + и повышение статуса дифференцировки Т-клеток памяти, особенно индукцию CD28. нулевые Т-клетки как в CD4 + , так и в CD8 + Т-клетках (21, 22).Однако таких изменений не наблюдалось при сравнении ЦМВ-серонегативных пациентов с определяемыми ЦМВ-специфичными CD137-экспрессирующими IFNγ-продуцирующими CD4 + Т-клетками и без них (таблица 2).
Таблица 2 . Влияние ЦМВ-иммунитета на параметры Т-клеток перед трансплантацией.
Обсуждение
В этом исследовании мы оценили наличие ЦМВ-специфического клеточного и гуморального иммунитета в когорте ЦМВ-серонегативных пациентов и оценили клиническую значимость в отношении риска ЦМВ-виремии после трансплантации почки.Данные выявили наличие низкой частоты ЦМВ-специфических Т-клеток более чем у половины этих пациентов. Интересно, что, в частности, IFNγ-продуцирующие ЦМВ-специфические CD4 + Т-клетки были связаны с защитой от ЦМВ-виремии после трансплантации почки от ЦМВ-серопозитивного донора. Таким образом, защитный клеточный иммунитет против ЦМВ может существовать в отсутствие сывороточных анти-ЦМВ IgG.
Нередко наличие клеточного иммунитета при отсутствии защитных антител.Возможные объяснения этой диссоциации могут заключаться в том, что либо клеточный иммунитет неэффективен для индукции адекватного гуморального иммунитета (6, 7), либо недостаточно поддерживаются защитные антитела.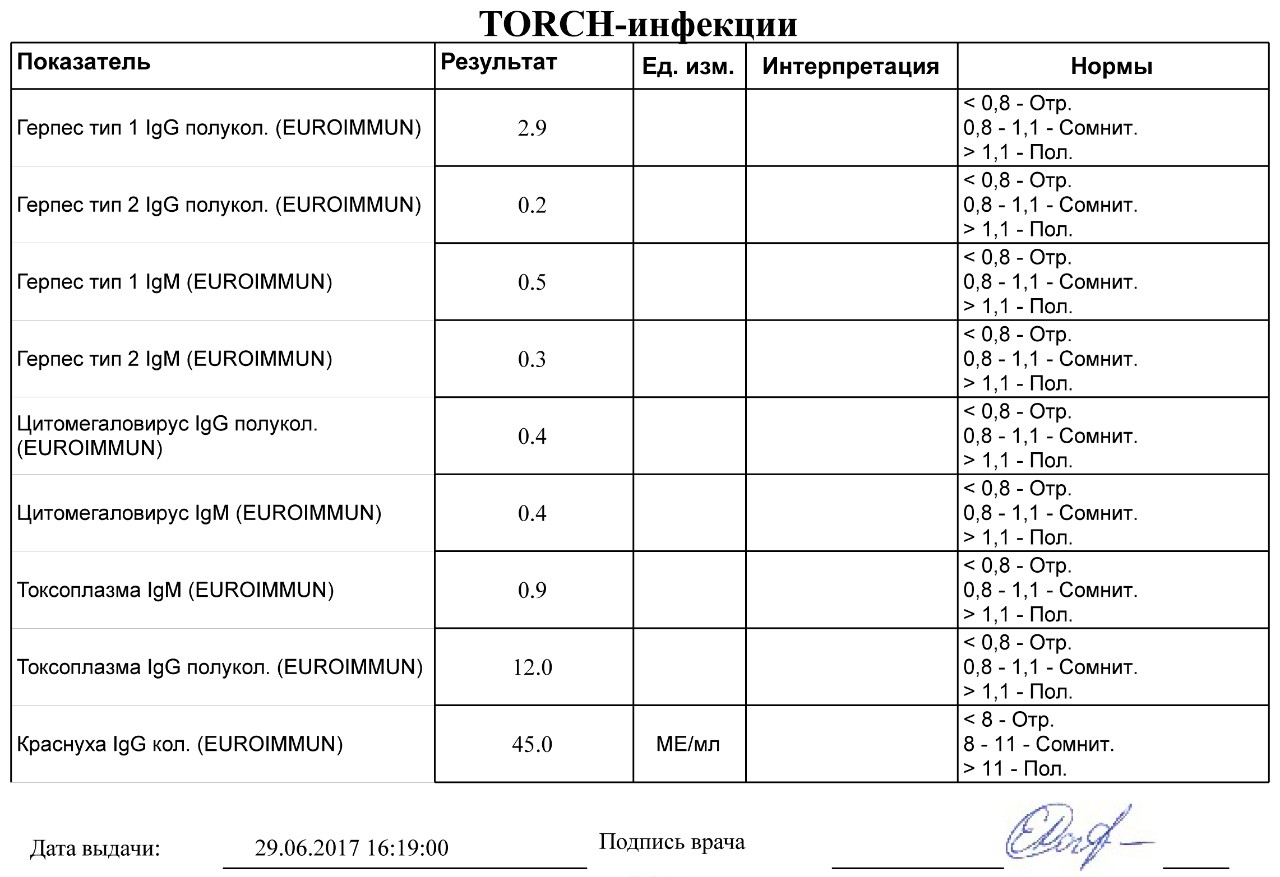 Оба эти механизма могут быть справедливы для пациентов с терминальной почечной недостаточностью. Известно, что зависимые от Т-клеток вакцины (например, HBsAg, столбнячный анатоксин и дифтерийная вакцина) плохо индуцируют защитные титры антител у этих пациентов, и титры антител плохо поддерживаются (23–25). Детальный анализ динамики и качества антигенспецифического Т-клеточного ответа после вакцинации HBsAg у пациентов с ХПН показал плохую генерацию Т-клеток памяти CD4 + (6, 7).В частности, присутствие антиген-специфических Т-клеток CD4 + EM значительно коррелировало с титрами анти-HBsAg, и аналогичная связь может быть показана для анти-ЦМВ IgG. Результаты этого исследования также показали статистически значимую связь между наличием IL-2 или IFNγ-продуцирующих CMV-специфических CD4 + T-клеток и анти-CMV IgG ASC. Таким образом, слабая индукция ЦМВ-специфического Т-клеточного ответа может лежать в основе неадекватной генерации анти-ЦМВ гуморального ответа.
Оба эти механизма могут быть справедливы для пациентов с терминальной почечной недостаточностью. Известно, что зависимые от Т-клеток вакцины (например, HBsAg, столбнячный анатоксин и дифтерийная вакцина) плохо индуцируют защитные титры антител у этих пациентов, и титры антител плохо поддерживаются (23–25). Детальный анализ динамики и качества антигенспецифического Т-клеточного ответа после вакцинации HBsAg у пациентов с ХПН показал плохую генерацию Т-клеток памяти CD4 + (6, 7).В частности, присутствие антиген-специфических Т-клеток CD4 + EM значительно коррелировало с титрами анти-HBsAg, и аналогичная связь может быть показана для анти-ЦМВ IgG. Результаты этого исследования также показали статистически значимую связь между наличием IL-2 или IFNγ-продуцирующих CMV-специфических CD4 + T-клеток и анти-CMV IgG ASC. Таким образом, слабая индукция ЦМВ-специфического Т-клеточного ответа может лежать в основе неадекватной генерации анти-ЦМВ гуморального ответа. Кроме того, все еще возможно, что слабый, но обнаруживаемый анти-ЦМВ гуморальный ответ был изначально генерирован, но не поддерживался должным образом.
Кроме того, все еще возможно, что слабый, но обнаруживаемый анти-ЦМВ гуморальный ответ был изначально генерирован, но не поддерживался должным образом.
Хотя могут возникнуть проблемы, связанные с надежным измерением низких частот ЦМВ-специфических Т-клеток, многопараметрический проточный цитометрический анализ CD137, как описано ранее (17), позволяет получить подробную характеристику общего пула антиген-специфических Т-клеток, который связан с другими параметрами, проанализированными в этой статье, и связан с клиническим исходом, т.е.д., ЦМВ-виремия. Детальный анализ ЦМВ-специфического ответа в субпопуляциях Т-клеток показал, что ЦМВ-специфические Т-клетки памяти CD4 + и CD8 + были менее дифференцированы у ЦМВ-серонегативных пациентов, чем у ЦМВ-позитивных пациентов. Это было очевидно по относительно большему количеству CD28 + Т-клеток памяти и меньшему количеству ЦМВ-специфических Т-клеток, продуцирующих эффекторные цитокины, такие как IFNγ и IL-2.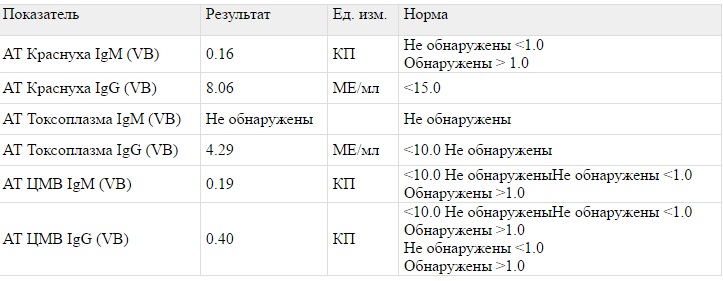 Интерес представляет обнаружение CMV-специфического ответа CD137 + в фенотипически наивных Т-клетках, не продуцирующих цитокины.Эти клетки могут быть частью так называемых ранних разветвленных Т-клеток памяти, которые фенотипически являются наивными Т-клетками, но на самом деле являются Т-клетками памяти на ранней стадии развития, некоторые из которых способны выполнять эффекторные функции (26). Опять же, это открытие поддерживает концепцию менее дифференцированного Т-клеточного ответа, специфичного для ЦМВ. В этом отношении статья Redeker et al. (27) хорошо проиллюстрировали на мышиной модели, что большие межиндивидуальные различия в высоте CMV-специфического ответа Т-клеток зависят от исходной вирусной нагрузки, которая также влияет на степень раздувания Т-клеток памяти и фенотип ЦМВ-специфические Т-клетки.ЦМВ-инфекция обычно приводит к длительным существенным изменениям в циркулирующих Т-клетках, особенно у пациентов с тХПН (13, 28–31). В частности, высокодифференцированные Т-клетки EMRA, лишенные Т-клеток CD28, размножаются в популяции Т-клеток CD8 + и в меньшей степени в популяции Т-клеток CD4 + (13–15).
Интерес представляет обнаружение CMV-специфического ответа CD137 + в фенотипически наивных Т-клетках, не продуцирующих цитокины.Эти клетки могут быть частью так называемых ранних разветвленных Т-клеток памяти, которые фенотипически являются наивными Т-клетками, но на самом деле являются Т-клетками памяти на ранней стадии развития, некоторые из которых способны выполнять эффекторные функции (26). Опять же, это открытие поддерживает концепцию менее дифференцированного Т-клеточного ответа, специфичного для ЦМВ. В этом отношении статья Redeker et al. (27) хорошо проиллюстрировали на мышиной модели, что большие межиндивидуальные различия в высоте CMV-специфического ответа Т-клеток зависят от исходной вирусной нагрузки, которая также влияет на степень раздувания Т-клеток памяти и фенотип ЦМВ-специфические Т-клетки.ЦМВ-инфекция обычно приводит к длительным существенным изменениям в циркулирующих Т-клетках, особенно у пациентов с тХПН (13, 28–31). В частности, высокодифференцированные Т-клетки EMRA, лишенные Т-клеток CD28, размножаются в популяции Т-клеток CD8 + и в меньшей степени в популяции Т-клеток CD4 + (13–15). Этот типичный след ЦМВ-инфекции в составе циркулирующих Т-клеток не был обнаружен в ЦМВ-специфических Т-клетках ЦМВ-серонегативных пациентов. Это указывает на то, что эти пациенты столкнулись с ЦМВ, но получили лишь ограниченный Т-клеточный ответ.Наиболее вероятным объяснением является низкий уровень воздействия вирусных антигенов, который может не приводить к специфическому отпечатку, индуцированному высоким воздействием вирусного антигена, что приводит к устойчивым титрам ЦМВ-специфических IgG в сыворотке (32, 33). Кроме того, часть ЦМВ-серопозитивных пациентов не имела или имела низкую частоту ЦМВ-специфических CD8 + Т-клеток, но имела ЦМВ-специфические CD4 + Т-клетки, а также ЦМВ-IgG-продуцирующие клетки перед трансплантацией, которые были достаточно для предотвращения реактивации ЦМВ.Это контрастировало с работой Tey et al. в котором описаны реципиенты трансплантата гемопоэтических стволовых клеток, другая группа пациентов с ослабленным иммунитетом, дефицит восстановления специфического иммунитета к ЦМВ с более высокой вирусной нагрузкой (34).
Этот типичный след ЦМВ-инфекции в составе циркулирующих Т-клеток не был обнаружен в ЦМВ-специфических Т-клетках ЦМВ-серонегативных пациентов. Это указывает на то, что эти пациенты столкнулись с ЦМВ, но получили лишь ограниченный Т-клеточный ответ.Наиболее вероятным объяснением является низкий уровень воздействия вирусных антигенов, который может не приводить к специфическому отпечатку, индуцированному высоким воздействием вирусного антигена, что приводит к устойчивым титрам ЦМВ-специфических IgG в сыворотке (32, 33). Кроме того, часть ЦМВ-серопозитивных пациентов не имела или имела низкую частоту ЦМВ-специфических CD8 + Т-клеток, но имела ЦМВ-специфические CD4 + Т-клетки, а также ЦМВ-IgG-продуцирующие клетки перед трансплантацией, которые были достаточно для предотвращения реактивации ЦМВ.Это контрастировало с работой Tey et al. в котором описаны реципиенты трансплантата гемопоэтических стволовых клеток, другая группа пациентов с ослабленным иммунитетом, дефицит восстановления специфического иммунитета к ЦМВ с более высокой вирусной нагрузкой (34). Наши данные удивительно согласуются с недавним исследованием Lucia et al. (11), которые идентифицировали ЦМВ-специфические Т-клеточные ответы у 30% ЦМВ-серонегативных лиц. Однако их данные были получены с помощью ELISpot, и поэтому в них отсутствует более глубокий анализ вовлеченных подмножеств Т-клеток.Они также заявляют об обнаружении CMV-специфических В-клеток памяти, но, к сожалению, о частотах не сообщалось.
Наши данные удивительно согласуются с недавним исследованием Lucia et al. (11), которые идентифицировали ЦМВ-специфические Т-клеточные ответы у 30% ЦМВ-серонегативных лиц. Однако их данные были получены с помощью ELISpot, и поэтому в них отсутствует более глубокий анализ вовлеченных подмножеств Т-клеток.Они также заявляют об обнаружении CMV-специфических В-клеток памяти, но, к сожалению, о частотах не сообщалось.
В заключение, оценка анти-ЦМВ-IgG, по-видимому, недостаточна для правильной идентификации ЦМВ-наивных индивидуумов, так как значительная часть имеет слабый клеточный ЦМВ-специфический ответ, который связан с защитой от ЦМВ-виремии после трансплантации ЦМВ. — серопозитивная донорская почка. Поэтому мы предлагаем включить оценку клеточного иммунитета в оценку риска перед трансплантацией почки.Кроме того, мониторинг ЦМВ-специфического клеточного иммунитета после трансплантации, то есть в конце анти-ЦМВ профилактики, может быть полезен для дальнейшего выявления пациентов с риском ЦМВ-виремии, которым требуется дополнительная противовирусная терапия или коррекция иммунодепрессантов (35).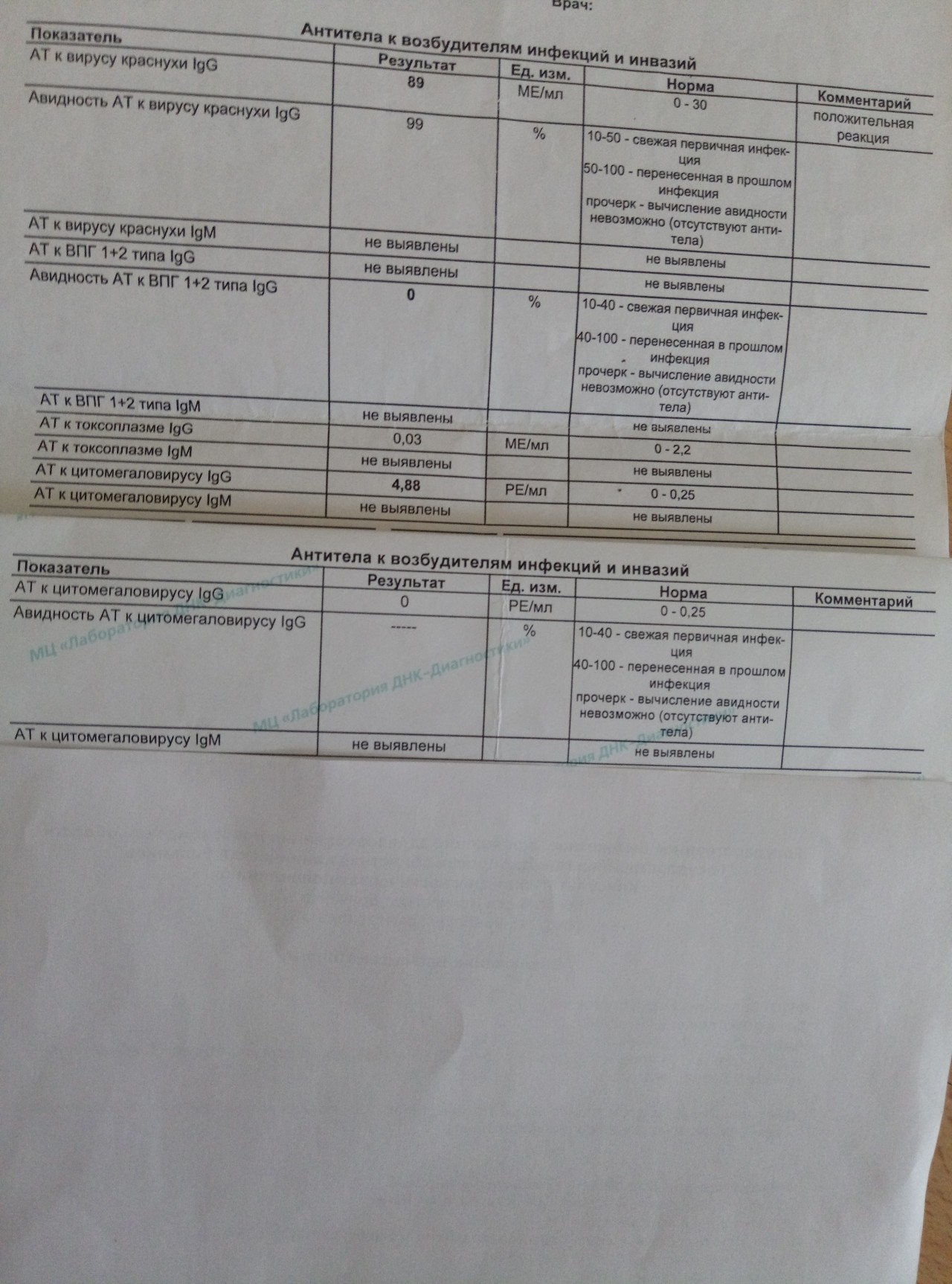
Заявление об этике
Все пациенты дали письменное информированное согласие на участие в этом исследовании. Исследование было одобрено Комитетом по медицинской этике Erasmus MC (номер METC 2010-080) и проводилось в соответствии с Хельсинкской декларацией и Стамбульской декларацией.
Вклад авторов
NL разработала эксперименты, провела и проанализировала данные и написала рукопись; LH, BD и RM провели эксперименты и проанализировали данные; JK интерпретировал данные и отредактировал рукопись; и МБ разработали эксперименты и отредактировали рукопись.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Финансирование
Это исследование проводилось при финансовой поддержке Голландского почечного фонда (KSPB.10.12) и Китайского стипендиального совета, финансирующего стипендию доктора философии LH (номер файла: 201307720043).
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу https://www.frontiersin.org/article/10.3389/fimmu.2017.01137/full#supplementary-material.
Рисунок S1 . Типичная стратегия гейтирования для специфичных для цитомегаловируса (ЦМВ) CD137-экспрессирующих и цитокин-продуцирующих CD4 + Т-клеток.Типичный пример проточной цитометрии изображен для анализа CMV-специфических экспрессирующих CD137 и продуцирующих цитокины CD4 + Т-клеток для CMV-серопозитивных (A–C) и CMV-серонегативных (D–F) пациент. Вкратце, на основе характеристик прямого/бокового движения живые клетки гейтируют и изображают на точечной диаграмме для дальнейшего отбора Т-клеток CD4 + и CD8 + . CMV-специфические CD137-экспрессирующие CD4 + Т-клетки отбирают [ (A,D) , первый график], а также клетки IFNγ и IL-2 в CD137-экспрессирующих CD4 + Т-клетках [ ( A,D) , второй участок]. CD 137 + +  CD137-экспрессирующие CD4 + Т-клетки впоследствии разделяют на наивные и разные подмножества Т-клеток памяти [ (A,D) , третий график] с использованием экспрессии CCR7 и CD45RO [CCR7 + CD45RO — : наивные, CCR7 + CD45RO + : Центральная память (см), CCR7 — CD45RO + : эффекторная память (EM) и CCR7 — CD45RO — : EMRA] или CD28 + и CD28 NULL Т-клетки [ (A,D) , четвертый график].IFNγ (B,E) и IL-2 (C,F) -продуцирующие CD137-экспрессирующие CD4 + Т-клетки анализировали аналогичным образом. Кроме того, тот же подход был также применен для анализа CMV-специфических экспрессирующих CD137 и продуцирующих цитокины Т-клеток CD8 + (не показано). Процент CD137-экспрессирующих CD4 + Т-клеток от общего количества CD4 + Т-клеток и процент цитокинов + в CD137 + CD4 + Т-клеток представлен как доля CD137 +
CD137-экспрессирующие CD4 + Т-клетки впоследствии разделяют на наивные и разные подмножества Т-клеток памяти [ (A,D) , третий график] с использованием экспрессии CCR7 и CD45RO [CCR7 + CD45RO — : наивные, CCR7 + CD45RO + : Центральная память (см), CCR7 — CD45RO + : эффекторная память (EM) и CCR7 — CD45RO — : EMRA] или CD28 + и CD28 NULL Т-клетки [ (A,D) , четвертый график].IFNγ (B,E) и IL-2 (C,F) -продуцирующие CD137-экспрессирующие CD4 + Т-клетки анализировали аналогичным образом. Кроме того, тот же подход был также применен для анализа CMV-специфических экспрессирующих CD137 и продуцирующих цитокины Т-клеток CD8 + (не показано). Процент CD137-экспрессирующих CD4 + Т-клеток от общего количества CD4 + Т-клеток и процент цитокинов + в CD137 + CD4 + Т-клеток представлен как доля CD137 +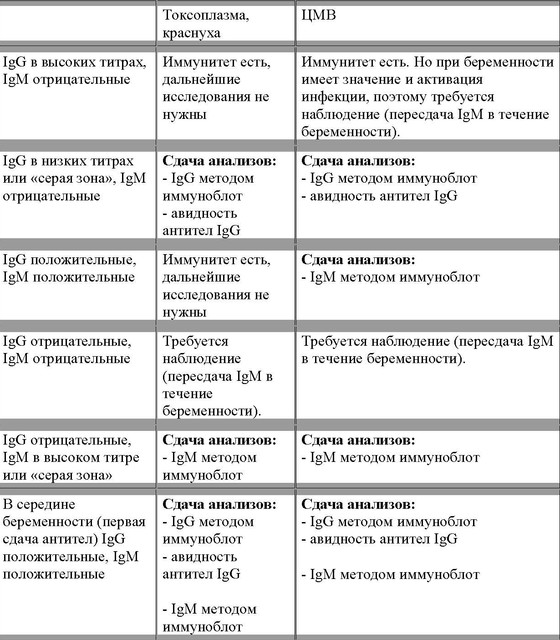 Вскрытие в отношении определенного фенотипа Т-клеток проводят путем установления % CD137 + или CD137 + цитокинов + CD4 + Т-клеток за 100%.
Вскрытие в отношении определенного фенотипа Т-клеток проводят путем установления % CD137 + или CD137 + цитокинов + CD4 + Т-клеток за 100%.
Рисунок S2 . CD137-экспрессирующие и цитокин-продуцирующие Т-клетки при стимуляции ацетатом форболмиристата (ФМА) и иономицином. Периферические мононуклеарные клетки пациентов стимулировали в течение 12 часов в присутствии брефельдина А и αCD49d по отдельности или в смеси ФМА и иономицина. Затем клетки окрашивают клеточной поверхностью и внутриклеточно, чтобы определить максимальную способность Т-клеток экспрессировать CD137 и продуцировать цитокины.ФМА/иономицин-индуцированные CD137-экспрессирующие CD4 + (A) и CD8 + (B) Т-клетки, с поправкой на фон (только αCD49d), представлены в процентах от общего количества CD4 + или CD8 + Т-клетки. Аналогичный подход применяется для индуцированных ФМА/иономицином CD137-экспрессирующих IFN-γ- и IL-2-продуцирующих CD4 + (C, E) и CD137-экспрессирующих IFN-γ CD8 + Т-клеток (D ) .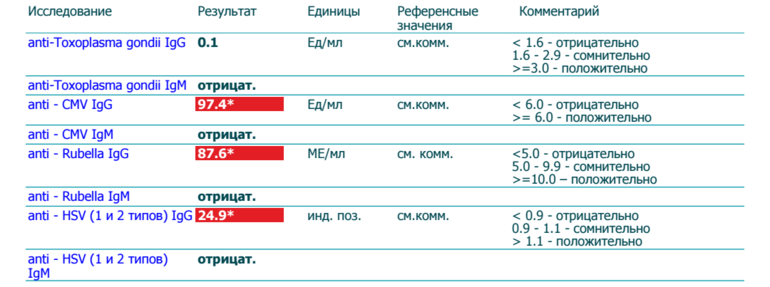 Закрытые и незакрашенные символы/столбики представляют цитомегаловирусных (ЦМВ)-серонегативных и ЦМВ-серопозитивных пациентов, соответственно.
Закрытые и незакрашенные символы/столбики представляют цитомегаловирусных (ЦМВ)-серонегативных и ЦМВ-серопозитивных пациентов, соответственно.
Каталожные номера
1. Fiala M, Payne JE, Berne TV, Moore TC, Henle W, Montgomerie JZ, et al. Эпидемиология цитомегаловирусной инфекции после трансплантации и иммуносупрессии. J Infect Dis (1975) 132(4):421–33. doi: 10.1093/infdis/132.4.421
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
2. Harvala H, Stewart C, Muller K, Burns S, Marson L, MacGilchrist A, et al. Высокий риск цитомегаловирусной инфекции после трансплантации паренхиматозных органов, несмотря на профилактическую терапию. J Med Virol (2013) 85(5):893–8. дои: 10.1002/jmv.23539
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
3. Jonjic S, Mutter W, Weiland F, Reddehase MJ, Koszinowski UH. Персистирующая цитомегаловирусная инфекция с ограниченным сайтом после селективного длительного истощения CD4+ Т-лимфоцитов. J Exp Med (1989) 169(4):1199–212. дои: 10.1084/jem.169.4.1199
J Exp Med (1989) 169(4):1199–212. дои: 10.1084/jem.169.4.1199
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
4. Каламс С.А., Уокер Б.Д.Критическая потребность в помощи CD4 в поддержании эффективного ответа цитотоксических Т-лимфоцитов. J Exp Med (1998) 188(12):2199–204. дои: 10.1084/jem.188.12.2199
Полнотекстовая перекрестная ссылка | Академия Google
5. Малой К.Дж., Буркхарт С., Фрир Г., Рулике Т., Пирчер Х., Коно Д.Х. и соавт. Качественные и количественные требования к противовирусной защите, опосредованной CD4+ Т-клетками. J Immunol (1999) 162(5):2867–74.
Реферат PubMed | Академия Google
6.Литьенс Н.Х., Хьюсман М., Хидждра Д., Ламбрехт Б.М., Ститтелар К.Дж., Бетжес М.Г. ИЛ-2, продуцирующие CD4+ Т-лимфоциты памяти, тесно связаны с образованием IgG-секретирующих плазматических клеток. J Immunol (2008) 181(5):3665–73. doi:10.4049/jиммунол.181.5.3665
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
7. Litjens NH, Huisman M, van den Dorpel M, Betjes MG. Нарушение иммунного ответа и антиген-специфической памяти CD4+ Т-клеток у гемодиализных больных. J Am Soc Nephrol (2008) 19(8):1483–90.дои: 10.1681/ASN.20070
Litjens NH, Huisman M, van den Dorpel M, Betjes MG. Нарушение иммунного ответа и антиген-специфической памяти CD4+ Т-клеток у гемодиализных больных. J Am Soc Nephrol (2008) 19(8):1483–90.дои: 10.1681/ASN.20070
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
8. Кумар Д., Черненко С., Мусса Г., Кобос И., Мануэль О., Прейксайтис Дж. и соавт. Клеточный иммунитет для прогнозирования цитомегаловирусной болезни у реципиентов паренхиматозных органов высокого риска. Am J Transplant (2009) 9(5):1214–22. doi:10.1111/j.1600-6143.2009.02618.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9. Мануэль О., Хусейн С., Кумар Д., Зайас С., Маухортер С., Леви М.Е. и соавт.Оценка цитомегаловирус-специфического клеточного иммунитета для прогнозирования цитомегаловирусной болезни у реципиентов паренхиматозных органов высокого риска: многоцентровое когортное исследование. Clin Infect Dis (2013) 56(6):817–24. doi: 10.1093/cid/cis993
doi: 10.1093/cid/cis993
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10. Sester M, Gartner BC, Sester U, Girndt M, Mueller-Lantzsch N, Kohler H. Всегда ли точен серологический статус цитомегаловируса? Сравнительный анализ гуморального и клеточного иммунитета. Трансплантация (2003) 76(8):1229–30. дои: 10.1097/01.TP.0000083894.61333.56
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
11. Lucia M, Crespo E, Melilli E, Cruzado JM, Luque S, Llaudo I, et al. Предварительно сформированные частоты Т- и В-клеток памяти, специфичных для цитомегаловируса (ЦМВ), выявляют защищенных ЦМВ-сенсибилизированных лиц среди серонегативных реципиентов почечного трансплантата. Clin Infect Dis (2014) 59(11):1537–45. doi:10.1093/cid/ciu589
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
12.Саллусто Ф., Лангенкамп А., Гегинат Дж., Ланзавеккья А. Функциональные подмножества Т-клеток памяти, идентифицированные по экспрессии CCR7.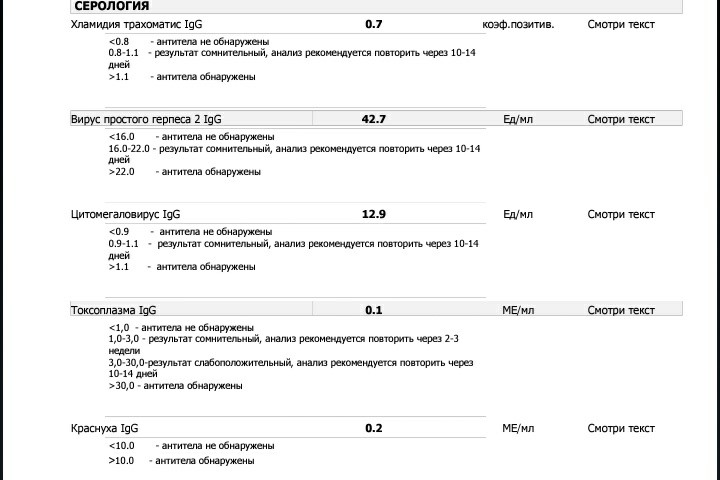 Curr Top Microbiol Immunol (2000) 251:167–71.
Curr Top Microbiol Immunol (2000) 251:167–71.
Академия Google
14. Litjens NH, de Wit EA, Betjes MG. Дифференциальное влияние возраста, цитомегаловирусной серопозитивности и терминальной стадии почечной недостаточности (ESRD) на циркулирующие субпопуляции Т-лимфоцитов. Immun Aging (2011) 8(1):2. дои: 10.1186/1742-4933-8-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
15.Meijers RW, Litjens NH, de Wit EA, Langerak AW, van der Spek A, Baan CC, et al. Цитомегаловирус частично способствует преждевременному иммунологическому старению Т-клеточного компартмента, связанному с уремией. Clin Exp Immunol (2013) 174(3):424–32. doi:10.1111/cei.12188
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
16. Litjens NH, Huisman M, Baan CC, van Druningen CJ, Betjes MG. CD4(+) Т-клетки, специфичные для вакцины против гепатита В, могут быть обнаружены и охарактеризованы на уровне отдельных клеток: ограниченная полезность дендритных клеток в качестве усилителей сигнала. J Immunol Methods (2008) 330(1–2):1–11. doi:10.1016/j.jim.2007.10.013
J Immunol Methods (2008) 330(1–2):1–11. doi:10.1016/j.jim.2007.10.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
17. Litjens NH, de Wit EA, Baan CC, Betjes MG. Индуцированный активацией CD137 представляет собой быстрый анализ для идентификации и многопараметрического проточного цитометрического анализа аллореактивных Т-клеток. Clin Exp Immunol (2013) 174(1):179–191. doi:10.1111/cei.12152
Полнотекстовая перекрестная ссылка | Академия Google
18. Bouvy AP, Kho MM, Klepper M, Litjens NH, Betjes MG, Weimar W, et al.Кинетика гомеостатической пролиферации и тимопоэза после индукционной терапии рАТГ у пациентов с трансплантацией почки. Трансплантация (2013) 96(10):904–13. дои: 10.1097/TP.0b013e3182a203e4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
19. Betjes MG, Langerak AW, van der Spek A, de Wit EA, Litjens NH. Преждевременное старение циркулирующих Т-клеток у пациентов с терминальной стадией почечной недостаточности. Kidney Int (2011) 80(2):208–17. doi:10.1038/ki.2011.110
Kidney Int (2011) 80(2):208–17. doi:10.1038/ki.2011.110
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
20.Baerlocher GM, Vulto I, de Jong G, Lansdorp PM. Проточная цитометрия и FISH для измерения средней длины теломер (flow FISH). Nat Protoc (2006) 1(5):2365–76. doi:10.1038/nprot.2006.263
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
21. Дерхованесян Э., Ларби А., Павелец Г. Биомаркеры иммуностарения человека: влияние цитомегаловирусной инфекции. Curr Opin Immunol (2009) 21(4):440–5. doi:10.1016/j.coi.2009.05.012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
22.Викби А., Йоханссон Б., Олссон Дж., Лофгрен С., Нильссон Б.О., Фергюсон Ф. Расширение субпопуляций CD8 Т-лимфоцитов периферической крови и связь с серопозитивностью к цитомегаловирусу у пожилых людей: шведское иммунное исследование NONA. Exp Gerontol (2002) 37 (2–3): 445–53. дои: 10.1016/S0531-5565(01)00212-1
дои: 10.1016/S0531-5565(01)00212-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
23. Crosnier J, Jungers P, Courouce AM, Laplanche A, Benhamou E, Degos F, et al. Рандомизированное плацебо-контролируемое исследование вакцины против поверхностного антигена гепатита В во французских отделениях гемодиализа: I, Медицинский персонал. Ланцет (1981) 1(8218):455–9.
Академия Google
24. Stevens CE, Alter HJ, Taylor PE, Zang EA, Harley EJ, Szmuness W. Вакцина против гепатита B у пациентов, получающих гемодиализ. Иммуногенность и эффективность. N Engl J Med (1984) 311(8):496–501. дои: 10.1056/NEJM198408233110803
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
25. Гирндт М., Питч М., Колер Х. Иммунизация против столбняка и ее связь с вакцинацией против гепатита В у пациентов с хронической почечной недостаточностью. Am J Kidney Dis (1995) 26(3):454–60.
Реферат PubMed | Академия Google
26.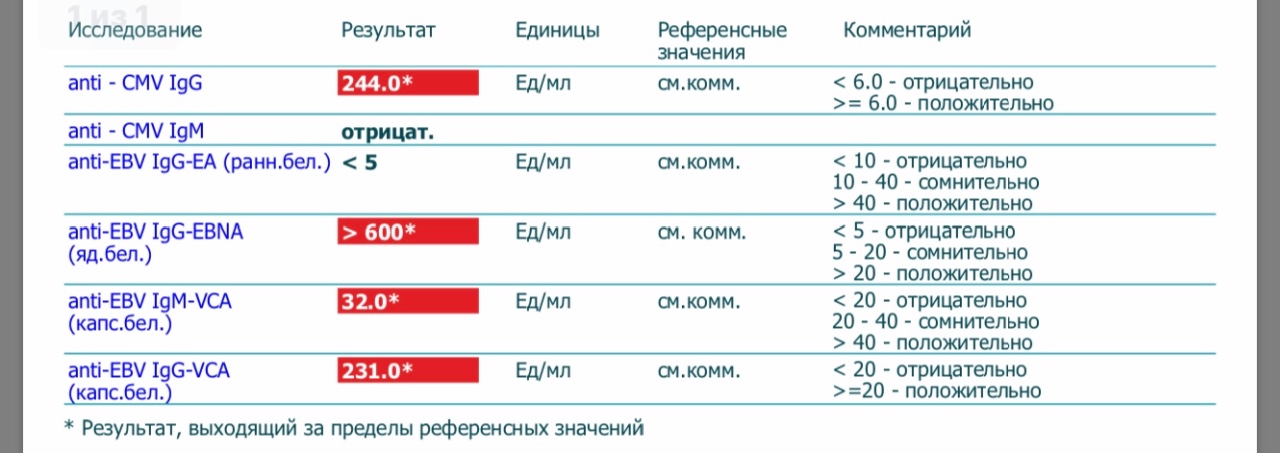 Song K, Rabin RL, Hill BJ, De Rosa SC, Perfetto SP, Zhang HH, et al. Характеристика субпопуляций CD4+ Т-клеток памяти выявляет ранние разветвленные пути дифференцировки Т-клеток у человека. Proc Natl Acad Sci U S A (2005) 102(22):7916–21. doi:10.1073/pnas.0409720102
Song K, Rabin RL, Hill BJ, De Rosa SC, Perfetto SP, Zhang HH, et al. Характеристика субпопуляций CD4+ Т-клеток памяти выявляет ранние разветвленные пути дифференцировки Т-клеток у человека. Proc Natl Acad Sci U S A (2005) 102(22):7916–21. doi:10.1073/pnas.0409720102
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
28. Meijers RW, Litjens NH, Hesselink DA, Langerak AW, Baan CC, Betjes MG.Первичная цитомегаловирусная инфекция значительно влияет на циркулирующие Т-клетки у реципиентов почечного трансплантата. Am J Transplant (2015) 15 (12): 3143–56. doi:10.1111/ajt.13396
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29. Гамадия Л.Е., Рентенаар Р.Дж., Баарс П.А., Реммерсвал Э.Б., Сурачно С., Вел Дж.Ф. и соавт. Дифференцировка цитомегаловирус-специфических CD8(+) Т-клеток у здоровых и иммуносупрессивных носителей вируса. Кровь (2001) 98(3):754–61. дои: 10.1182/кровь.В98.3.754
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
30. ван Леувен Э.М., Реммерсваль Э.Б., Хемскерк М.Х., тен Берге И.Дж., ван Лиер Р.А. Сильная селекция вирусспецифических цитотоксических CD4+ Т-клеточных клонов при первичной цитомегаловирусной инфекции человека. Кровь (2006) 108(9):3121–7. дои: 10.1182/кровь-2006-03-006809
ван Леувен Э.М., Реммерсваль Э.Б., Хемскерк М.Х., тен Берге И.Дж., ван Лиер Р.А. Сильная селекция вирусспецифических цитотоксических CD4+ Т-клеточных клонов при первичной цитомегаловирусной инфекции человека. Кровь (2006) 108(9):3121–7. дои: 10.1182/кровь-2006-03-006809
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
31. Ван Леувен Э.М., Реммерсваль Э.Б., Фоссен М.Т., Рошани А.Т., Вертхайм-ван Диллен П.М., Ван Лиер Р.А. и соавт.Появление CD4+CD28-гранзима B+, специфичной для цитомегаловируса субпопуляции Т-клеток после выздоровления от первичной цитомегаловирусной инфекции. J Immunol (2004) 173(3):1834–41. doi:10.4049/jиммунол.173.3.1834
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
32. Utzschneider DT, Alfei F, Roelli P, Barras D, Chennupati V, Darbre S, et al. Высокие уровни антигена индуцируют истощенный фенотип при хронической инфекции, не нарушая экспансии и выживания Т-клеток. J Exp Med (2016) 213(9):1819–34. doi:10.1084/jem.20150598
doi:10.1084/jem.20150598
Полнотекстовая перекрестная ссылка | Академия Google
33. Mayer BT, Krantz EM, Swan D, Ferrenberg J, Simmons K, Selke S, et al. Транзиторные оральные цитомегаловирусные инфекции человека указывают на неэффективное распространение вируса из очень небольшого числа первоначально инфицированных клеток. J Virol (2017) 91(12):e00380–17. doi:10.1128/ОВИ.00380-17
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
34. Tey SK, Kennedy GA, Cromer D, Davenport MP, Walker S, Jones LI, et al.Клиническая оценка противовирусного CD8+ Т-клеточного иммунного мониторинга с использованием анализа QuantiFERON-CMV(R) для выявления пациентов с аллогенной трансплантацией гемопоэтических стволовых клеток высокого риска с осложнениями ЦМВ-инфекции. PLoS One (2013) 8(10):e74744. doi:10.1371/journal.pone.0074744
Полнотекстовая перекрестная ссылка | Академия Google
35. Barabas S, Spindler T, Kiener R, Tonar C, Lugner T, Batzilla J, et al.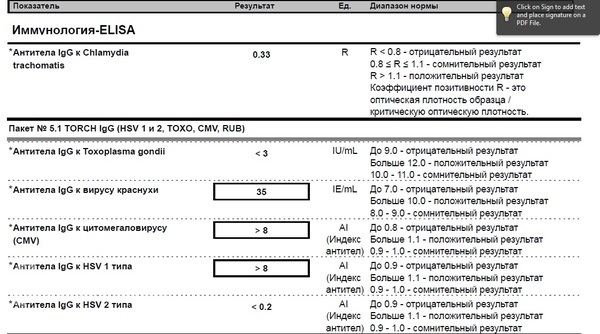


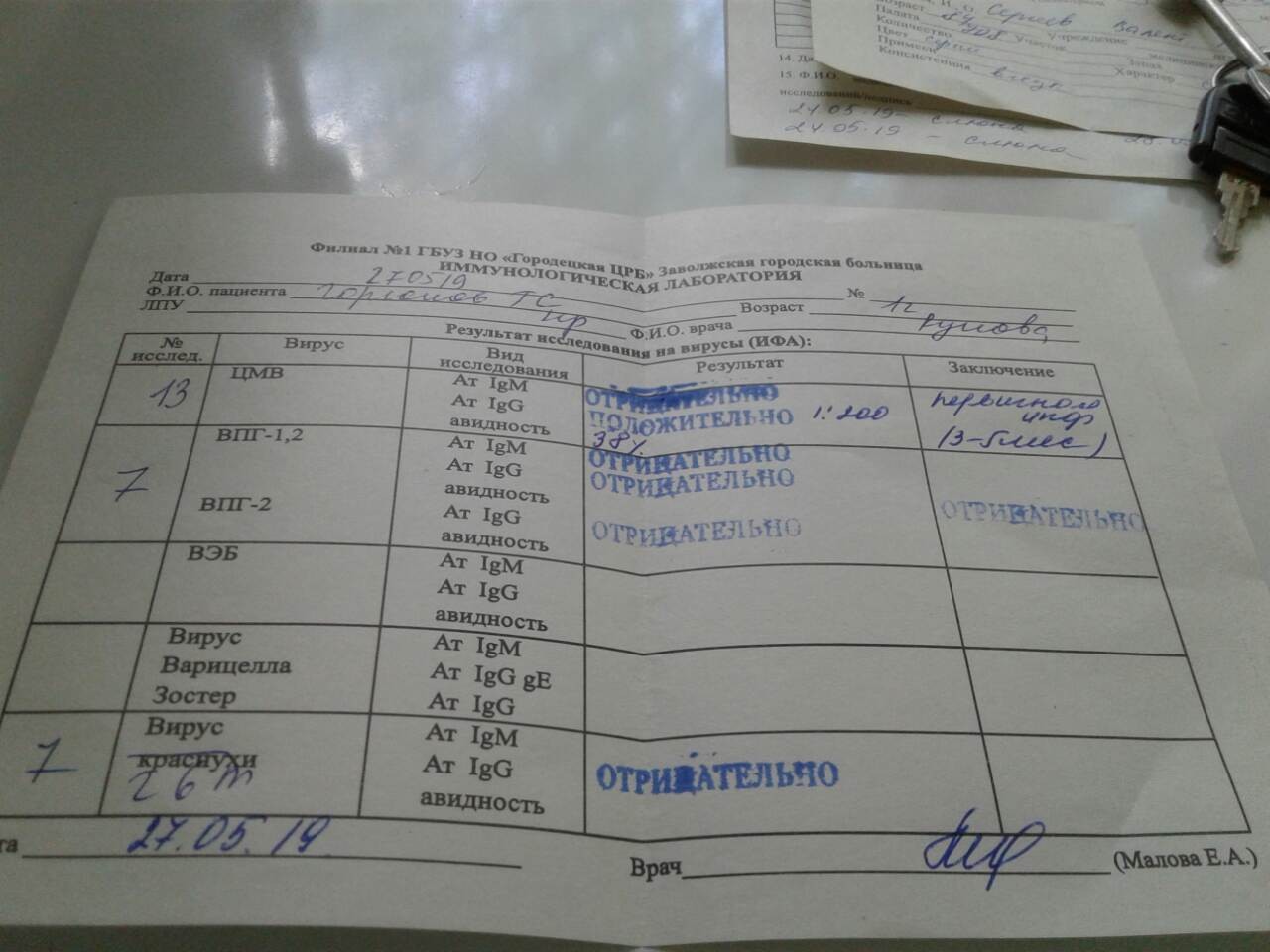 Сыворотка
Сыворотка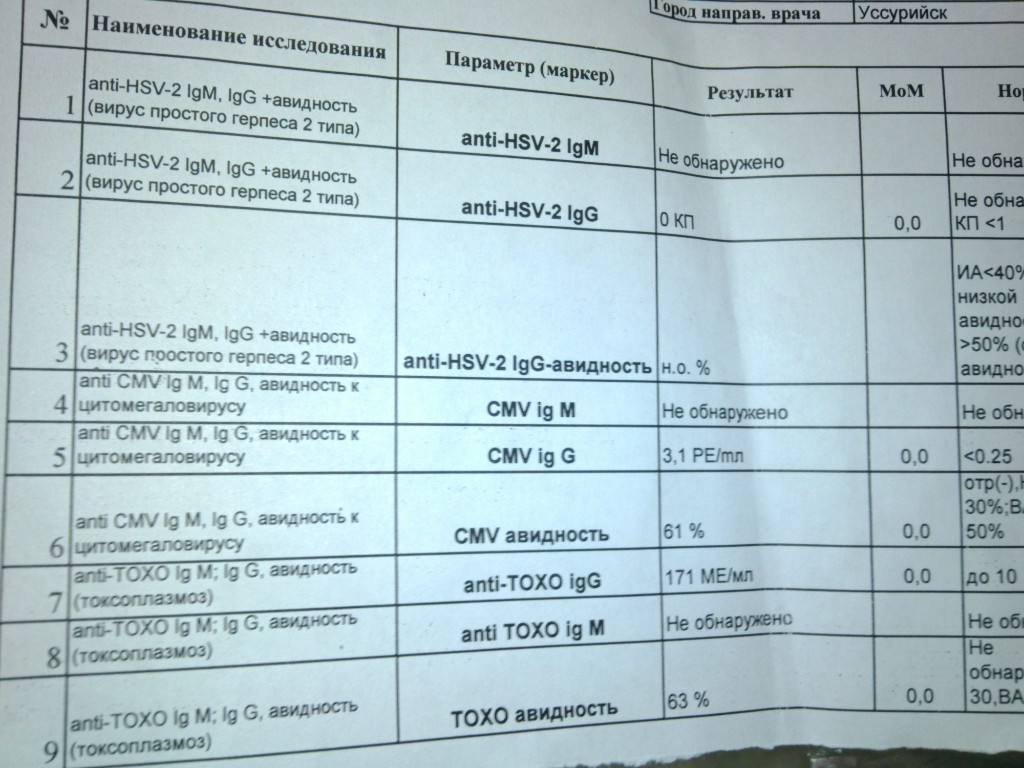

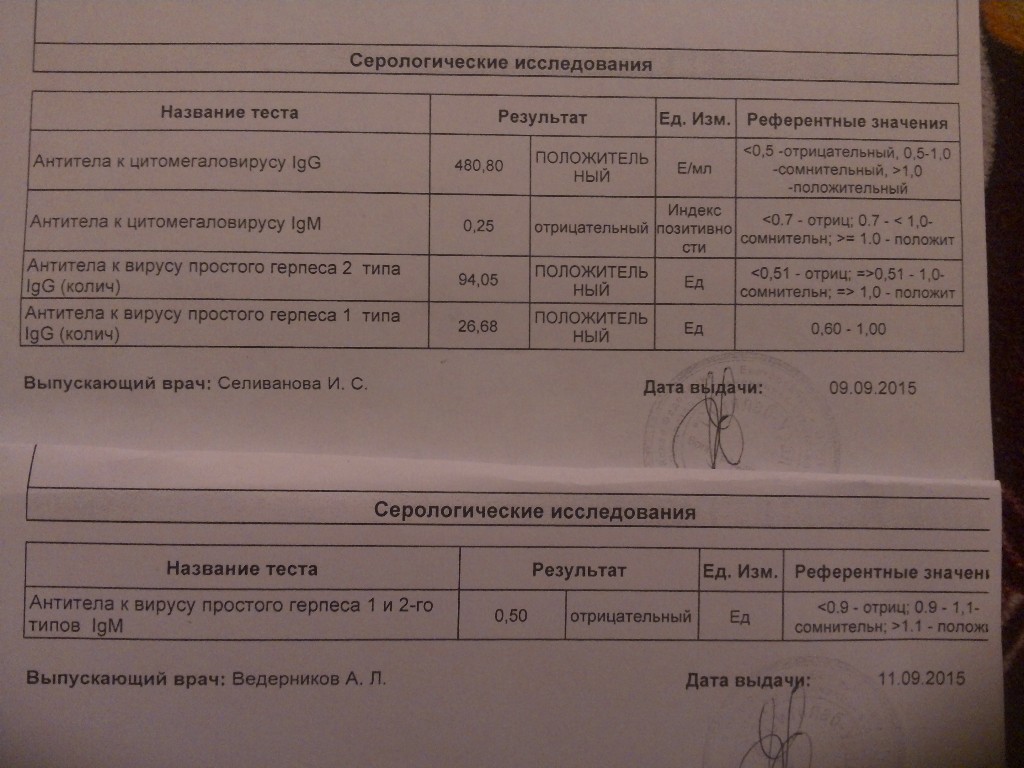
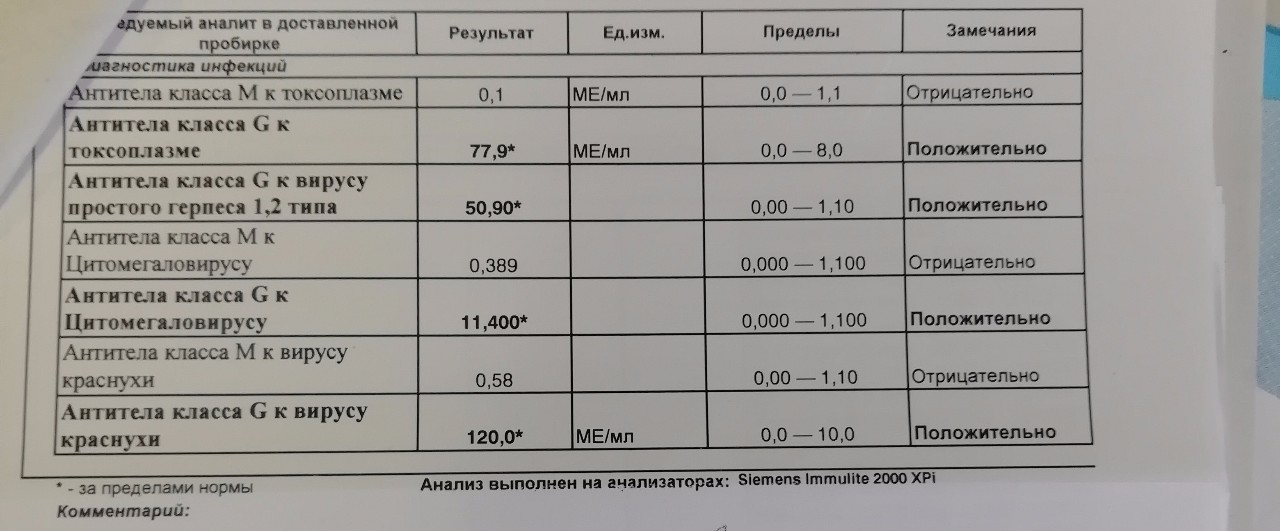 Научный представитель 10:6850 (2020). ПабМед: 32321978
Научный представитель 10:6850 (2020). ПабМед: 32321978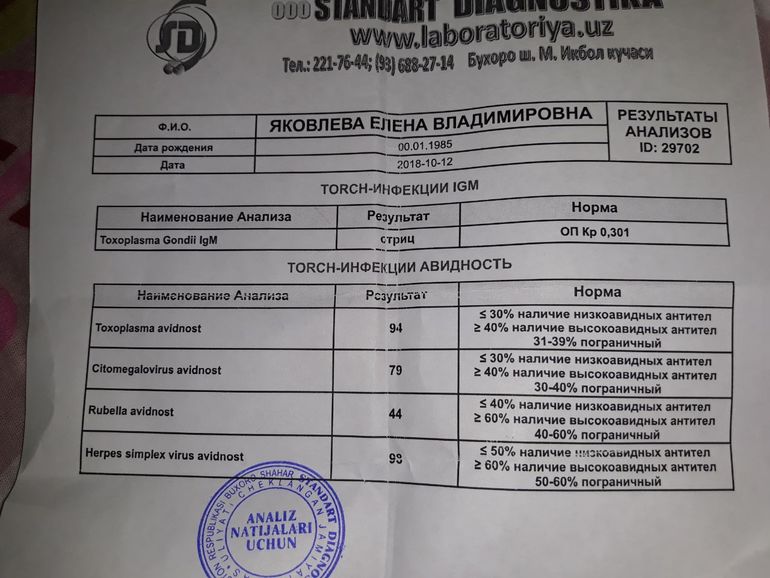 Front Cell Infect Microbiol 10:334 (2020). ПабМед: 32733818
Front Cell Infect Microbiol 10:334 (2020). ПабМед: 32733818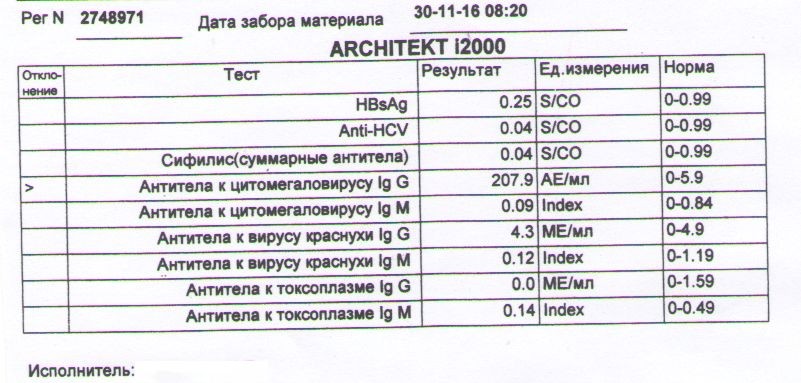 Am J Reprod Immunol 79:e12840 (2018). ПабМед: 29520885
Am J Reprod Immunol 79:e12840 (2018). ПабМед: 29520885