Преждевременное старение плаценты: возможные причины, терапия, последствия
Преждевременное старение плаценты – термин, который пугает многих беременных.
Плацента – это важный временный орган, который снабжает малыша питательными веществами и защищает его от вредных факторов. От ее состояния зависит здоровье ребенка.
Формирование ее начинается примерно на третьей неделе беременности, затем активно растет ткань и сосудистое русло, а в конце беременности начинается обратный процесс, закупорка сосудов и деформация, отмирание тканей – именно его и называют «старение плаценты».
Если это происходит раньше срока, то врачи ставят диагноз «преждевременное старение плаценты». Чем опасно это состояние, какие причины его возникновения и как оно лечится?
О плаценте
Плацента на протяжении беременности проходит несколько этапов развития. Так, в начале беременности она растет и развивается, окончательно же формируется примерно к 10-12 неделе и с этого момента начинает полноценно выполнять свои функции.
Ослабление токсикоза в конце первого триместра связано именно с деятельностью плаценты.
В конце беременности клетки и сосуды постепенно начинают отмирать и деформироваться. Это обычно происходит к 38 неделе, когда все органы и системы ребенка окончательно сформированы.
Но бывают случаи, когда плацента отмирает на более раннем сроке. Это повод для срочной госпитализации, так как беременность надо сохранять, а это можно сделать только медикаментозно.
Степень зрелости плаценты
Самым достоверным способом диагностики зрелости этого временного органа является УЗИ и измерение кровотока.
Степень зрелости классифицируется:
- 0 степень – в норме она характерна до 30 недели беременности. Это период ее активной работы, ткани плаценты надежно защищают от вредных токсинов малыша, фильтруют продукты обмена. Сосуды хорошо наполняются кровью, ребенок в необходимом количестве получает кислород и питательные вещества.
- 1 степень – наблюдается примерно с 28 по 34 неделю беременности.
 Это период продолжения роста плаценты, она достигает своих окончательных размеров.
Это период продолжения роста плаценты, она достигает своих окончательных размеров. - 2 степень – наблюдается примерно с 35 по 38 неделю, это нормальная работа уже зрелого органа. К концу 38 недели начинаются сосудистые изменения, которые не оказывают влияние на ток крови. Поверхность плаценты становится бугристой, неровной, плотной.
- 3 стадия – этап, когда орган достигает максимальной степени зрелости, примерно 38-40 неделя. Этап связан с естественным износом сосудов и тканей. Есть признаки изменения тока крови и отложения солей.
Если УЗИ показывает, что у малыша нормальная частота сокращений сердца, он активен, а рост его соответствует сроку беременности, то волноваться не имеет смысла.
Но если изменения в структуре плаценты обнаружены на более ранних сроках, говорят о преждевременном старении плаценты. В таком случае необходимы сосудистые препараты и витаминотерапия, они позволят восстановить кровоснабжение и обеспечат плод необходимыми веществами.
Значение плаценты
Плацента – это элемент, который сохраняет беременность и поддерживает развитие организма ребенка. Она выполняет следующие важные функции:
Она выполняет следующие важные функции:
- Дыхательную – малыш не дышит самостоятельно, газообмен происходит за счет сосудов плаценты. Благодаря ей в кровь ребенка поступает кислород и удаляется углекислый газ.
- Питательную – через плаценту кровь малыша обогащается необходимыми веществами: жирами, витаминами, белками, углеводами.
- Иммунную – через плаценту проникают материнские антитела, которые защищают малыша от микробов.
- Эндокринную — синтезирует гормоны (прогестерон и ХГЧ), которые поддерживают беременность и стимулируют роды.
- Защитную — плацента способна разрушать опасные для плода вещества.
- Барьерную — препятствует попаданию микроорганизмов к малышу.
Последствия преждевременного старения плаценты – это ухудшение газообмена и питания малыша. Раннее созревание во время беременности плаценты приводит к снижению качества выполнения всех функций.
Причины старения
Причины преждевременного старения плаценты могут быть связаны со здоровьем женщины или с ее вредными привычками. Основные из них:
Основные из них:
- Курение – никотин оказывает негативное влияние на сосуды, вызывая спазмы. Но пассивное курение так же вредно, как и активное. Если женщина регулярно вдыхает табачный дым, у малыша повышается потребность в кислороде, а, следовательно, сосуды плаценты начинают работать в усиленном режиме.
- Хронические заболевания матери (холестерин в крови, сахарный диабет) приводят к закупорке сосудов.
- Почечная или сердечная недостаточность — при этих патологиях нарушено кровообращение у мамы, и это сказывается на работе плаценты. В таких случаях маме назначают терапию, улучшающую кровоток.
- Инфекции — такие как герпес, токсоплазмоз — токсичны для тканей и вызывают преждевременное старение плаценты. Некоторые из них могут находиться в «спящем» режиме и активизироваться при снижении иммунитета в период беременности.
- Аборты и другие операции на матке в анамнезе приводят к уменьшению эндометрия, поэтому плацента с самого начала развивается слабо, не достигает нужной толщины и быстро стареет.

- Резус-конфликт ребенка и матери ведет к образованию в крови антител, которые усложняют работу плаценты и вызывают ее старение.
- Затянувшийся токсикоз, особенно если многоплодная беременность.
Также причинами преждевременного старения плаценты являются:
- Нарушение диеты.
- Несоблюдение режима сна и бодрствования.
- Отеки.
- Избыточный вес.
- Многоводие.
- Неблагоприятная экология.
Чтобы не допустить развития этого неблагоприятного явления, необходимо профилактическое лечение, которое замедлит процесс и поддержит нормальное функционирование временного органа.
Признаки старения
Симптомов и признаков развития данной патологии не существует. Диагностировать явление может только специалист с помощью УЗИ. Но наблюдая за шевелениями малыша и подсчитывая их количество, беременная женщина сама может заподозрить преждевременное старение плаценты.
Снижение или учащение активности малыша может быть симптомом гипоксии – кислородной недостаточности. Эта патология развивается при преждевременном старении плаценты на 32 неделе — 2-3 стадии. Если женщина заметила чрезмерную активность малыша, нужно обратиться к специалистам и пройти УЗИ.
Эта патология развивается при преждевременном старении плаценты на 32 неделе — 2-3 стадии. Если женщина заметила чрезмерную активность малыша, нужно обратиться к специалистам и пройти УЗИ.
Последствия
Чем опасно преждевременное старение плаценты? При таком явлении нарушается снабжение ребенка питательными веществами и кислородом, сильно ухудшается фильтрационная функция, плацента уже не является надежным барьером. Малыш подвергается влиянию токсинов и вирусов, которые могут привести к порокам развития.
Преждевременное старение плаценты на 32 неделе беременности и ранее очень опасно, так как это может привести к остановке развития плода и даже его смерти.
Эта патология на более поздних сроках может привести к гипотрофии плода и нарушению развития определенных систем организма.
Если же появляются некротические участки, то в результате старения ткани может произойти отслойка плаценты – это чрезвычайно опасное состояние для ребенка и матери.
3 степень преждевременного старения плаценты может привести к развитию серьезных патологий. Это отслойка плаценты, излитие околоплодных вод, преждевременные роды и самое страшное – гибель ребенка.
Это отслойка плаценты, излитие околоплодных вод, преждевременные роды и самое страшное – гибель ребенка.
Диагностика
На УЗИ врач может обнаружить, что ткань стала более плотной, произошло изменение тока крови (допплер-УЗИ). При старении плаценты хорошо заметна четкая граница между стенкой матки и телом плаценты.
Если у малыша сердцебиение в норме и нет признаков гипоксии, то не стоит волноваться. Но нужно все время контролировать рост плода.
Дополнительным методом диагностики является допплер-УЗИ, с его помощью можно оценить плацентарный кровоток и степень снабжения ребенка кислородом.
Также врачи часто применяют кардиотокографию — с ее помощью можно понаблюдать за жизнедеятельностью малыша, метод показывает шевеления ребенка и его сердцебиение, и их взаимосвязь. На основании результатов этого метода можно оценить степень гипоксии малыша.
Лечение
Преждевременное старение плаценты несет угрозу здоровью и жизни плода, поэтому необходима поддерживающая терапия. Прежде всего следует устранить причины, которые вызвали такое состояние. Иначе медикаментозное лечение не будет эффективно. Лечение преждевременного старения плаценты проводится в стационаре, где есть возможность врачебного контроля.
Прежде всего следует устранить причины, которые вызвали такое состояние. Иначе медикаментозное лечение не будет эффективно. Лечение преждевременного старения плаценты проводится в стационаре, где есть возможность врачебного контроля.
Необходимо:
- Будущей матери бросить курить, избегать пассивного курения.
- Если причина в заболевании матери (холестерин в крови, диабет), то скорректировать дозы лекарственных препаратов, это снизит скорость старения плаценты.
- Если причина в инфекции — пройти курс лечения.
- Если причина в позднем токсикозе — начать принимать препараты, которые уменьшат токсическое поражение тканей.
Лечение начать нужно как можно раньше. Комплекс мер по восстановлению кровотока в плаценте и по сохранению беременности включает:
- Сосудистые препараты и лекарства, которые улучшают ток крови.
- Витамины С, А, Е.
- Препараты для минимизации тонуса матки.
Кроме того, беременной женщине нужно больше проводить время на свежем воздухе, избегать стрессовых ситуаций, перенапряжения.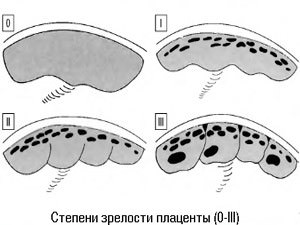 Будущей матери следует пересмотреть свой рацион, не употреблять жирное, копченое, соленое, полуфабрикаты. Употреблять как можно больше фруктов и овощей, рыбы, молочных продуктов, злаков.
Будущей матери следует пересмотреть свой рацион, не употреблять жирное, копченое, соленое, полуфабрикаты. Употреблять как можно больше фруктов и овощей, рыбы, молочных продуктов, злаков.
Если медикаментозное лечение дало эффективные результаты, то женщина может родить самостоятельно, но если диагностируется прогрессивное старение плаценты, врачи рекомендуют провести кесарево сечение.
Профилактика
Чтобы избежать такой патологии, необходимо заблаговременно готовиться к зачатию, пройти обследования, вовремя лечить инфекции, делать необходимые прививки.
Во время беременности обязательно нужно принимать поливитаминные препараты, отказаться от вредных привычек, выполнять все рекомендации врача, своевременно проходить УЗИ, вовремя лечить все осложнения (анемия, гестоз, гипертония), больше отдыхать, заниматься гимнастикой и йогой. И самое главное — это позитивно относиться к жизни и пребывать в хорошем настроении!
Преждевременное созревание плаценты — причины, симптомы, диагностика и лечение
Преждевременное созревание плаценты — появление эхографических признаков зрелости плацентарной ткани раньше гестационного срока, для которого такие изменения являются физиологическими. Клинически никак не проявляется, диагностируется только при плановом скрининге. При постановке диагноза используют данные УЗИ. Исследование дополняют допплерографией плацентарного кровотока, КТГ, фетометрией, фонокардиографией плода. Лечение предполагает терапию основного заболевания и назначение препаратов, улучшающих кровообращение между беременной и ребенком, — антиагрегантов, сосудорасширяющих средств, эссенциальных фосфолипидов, аминокислотных комплексов.
Клинически никак не проявляется, диагностируется только при плановом скрининге. При постановке диагноза используют данные УЗИ. Исследование дополняют допплерографией плацентарного кровотока, КТГ, фетометрией, фонокардиографией плода. Лечение предполагает терапию основного заболевания и назначение препаратов, улучшающих кровообращение между беременной и ребенком, — антиагрегантов, сосудорасширяющих средств, эссенциальных фосфолипидов, аминокислотных комплексов.
Общие сведения
В норме детское место проходит несколько этапов (стадий) развития, соответствующих особенностям роста и созревания плода на определенных сроках гестации. Физиологические изменения, происходящие в тканях плаценты, позволяют ей эффективно справляться с выполнением питательной, дыхательной, выводящей и барьерной функции. При наличии некоторых провоцирующих факторов, вызывающих перенапряжение компенсаторных процессов, детское место растет и созревает ускоренными темпами. В подобных случаях говорят о ПСП — преждевременном созревании (старении) плаценты. Актуальность своевременной диагностики расстройства обусловлена высокой вероятностью его осложнения фетоплацентарной недостаточностью, представляющей угрозу для физиологичного развития ребенка.
В подобных случаях говорят о ПСП — преждевременном созревании (старении) плаценты. Актуальность своевременной диагностики расстройства обусловлена высокой вероятностью его осложнения фетоплацентарной недостаточностью, представляющей угрозу для физиологичного развития ребенка.
Преждевременное созревание плаценты
Причины преждевременного созревания плаценты
Раннее начало процессов старения плацентарной ткани провоцируется любым фактором, приводящим к усиленному функционированию системы «мать-плод». Пусковым моментом в развитии нарушения могут послужить изменения в материнском организме, неблагоприятные факторы окружающей среды, патологическое течение беременности. По мнению специалистов в сфере акушерства и гинекологии, наиболее распространенными причинами преждевременного начала процессов старения детского места являются:
- Экстрагенитальная патология. Ускоренное развитие плацентарной ткани чаще наблюдается у беременных, страдающих соматическими и эндокринными заболеваниями (болезнями почек, артериальными гипертензиями, сахарным диабетом, гипотиреозом, гипертиреозом).
 Это связано с повышенной нагрузкой на функционально несостоятельные органы и системы, а также изменениями микроциркуляции во время беременности.
Это связано с повышенной нагрузкой на функционально несостоятельные органы и системы, а также изменениями микроциркуляции во время беременности. - Хронические заболевания репродуктивных органов. К нарушению процессов плацентации, а затем и функционирования плаценты приводят структурные изменения стенки матки, возникшие после абортов, вследствие хронического эндометрита, аденомиоза, субслизистых миом. Преждевременное начало созревания возможно при дисгормональных расстройствах на фоне заболеваний яичников (оофоритов, аднекситов, склерокистозного синдрома).
- Гестозы. Характерные изменения кровообращения в стенке матки и маточно-плацентарном комплексе, возникающие при длительном течении гестозов, усиливают функциональную нагрузку на детское место. На начальных этапах компенсаторные механизмы позволяют поддерживать нормальное кровоснабжение плода. Однако в последующем срыв компенсации ускоряет рост плаценты, стимулирует ее преждевременное развитие, созревание и старение.

- Инфекционные заболевания. Значительная нагрузка на плацентарную ткань, которая выполняет защитную функцию, появляется при угрозе поражения плода инфекционными агентами. Провоцирующими факторами становятся возбудители специфических генитальных инфекций (простого герпеса, микоплазмоза, уреаплазмоза, хламидиоза), других инфекционных болезней (ОРВИ, краснухи, токсоплазмоза, цитомегаловирусной инфекции).
- Изосерологическая несовместимость матери и плода. Ребенок, у которого вследствие AB0- или Rh-конфликта возникла гемолитическая болезнь, нуждается в более интенсивном поступлении питательных веществ и кислорода, что повышает нагрузку на ткань плаценты. Усиленное функционирование в сочетании с типичными дисциркуляторными нарушениями потенцирует ускоренный рост и раннее старение элементов фетоплацентарного комплекса.
Предпосылками для развития патологии также являются влияние повреждающих факторов окружающей среды (химических и вибрационных производственных вредностей, радиационных воздействий), наличие у беременной вредных привычек (курение, употребление психоактивных веществ).
Патогенез
Преждевременное созревание плаценты является частью компенсаторных механизмов, возникающих при фетоплацентарной недостаточности и впоследствии усугубляющих ее течение. При увеличении потребностей плода в питательных веществах, угрозе его заражения инфекционными агентами, нарушениях микроциркуляции в маточно-плацентарном или фето-плацентарном комплексе формирование и рост детского места происходят более интенсивно, в результате ее ткани раньше достигают этапа, когда начинается их созревание, а потом и старение с образованием кист, кальцинатов, тромбозов, инфарктов. Как следствие, функциональные возможности плаценты уменьшаются, фетоплацентарная недостаточность нарастает.
Классификация
Систематизация стадий зрелости плаценты основана на особенностях ее физиологического развития, учитывает изменения структуры органа, характерные для определенных этапов беременности.
- 0 — нулевая (формирование). Длится со 2-й до 30-й недели гестации. Плацентарная ткань по мере роста ворсинчатого дерева постепенно увеличивается в массе и объеме, на УЗИ имеет гомогенную эхонегативную паренхиму без каких-либо включений.
- I — первая (рост). На 30-34-й неделях беременности в плаценте появляется небольшое количество эхогенных включений за счет коллагенизации стромы, наблюдается небольшая волнистость хориальной пластины, ткани начинают уплотняться.
- II — вторая (зрелость). К 35-39-й неделям гестационного срока усиливается волнистость хориальной мембраны, акустическая плотность повышена, в тканях определяется множество мелких эхопозитивных включений. Орган функционирует нормально.

- III — третья (старение). С 37-й недели беременности хориальная пластина становится извилистой, структура плаценты представлена округлыми плотными дольками с разрежением в центре. Обменная площадь и объем органа уменьшаются.
Созревание считается преждевременным, если признаки первой степени зрелости появляются до 27 недели гестации, второй степени — до 32 недели, третьей — до 36 недели. Подобная динамика развития свидетельствует о высокой вероятности возникновения функциональной недостаточности органа и декомпенсации адаптивных возможностей комплекса «мать-плод».
Симптомы преждевременного созревания плаценты
Изменения, происходящие при раннем старении в плацентарной ткани, клинически не определяются и могут быть обнаружены только инструментально. При отсутствии острых заболеваний, явного обострения хронических болезней или признаков осложнения беременности пациентка обычно не предъявляет каких-либо жалоб. В остальных случаях превалирует симптоматика основной патологии. При значительной плацентарной недостаточности, вызванной преждевременным созреванием тканей плаценты, возможно изменение двигательной активности плода — учащение шевелений и увеличение их интенсивности. О более серьезных расстройствах свидетельствуют редкие шевеления ребенка вплоть до их полного прекращения.
В остальных случаях превалирует симптоматика основной патологии. При значительной плацентарной недостаточности, вызванной преждевременным созреванием тканей плаценты, возможно изменение двигательной активности плода — учащение шевелений и увеличение их интенсивности. О более серьезных расстройствах свидетельствуют редкие шевеления ребенка вплоть до их полного прекращения.
Осложнения
Поскольку старение детского места сопряжено со снижением его функциональных возможностей, патология обычно сопровождается появлением или усилением признаков плацентарной недостаточности. По данным наблюдений, декомпенсация нарушений в системе «плацента-плод» в 64% случаев вызвана именно преждевременным созреванием органа. Ретроспективные исследования свидетельствуют, что появление признаков ПСП на 22-26 неделях беременности практически всегда ассоциировано с выраженной задержкой развития плода и внутриутробной гипоксией в начале III триместра. В крайних случаях патология приводит к антенатальной гибели ребенка. При раннем начале дистрофических и склеротических процессов чаще наблюдаются преждевременная отслойка плаценты, досрочное излитие околоплодных вод и преждевременные роды.
При раннем начале дистрофических и склеротических процессов чаще наблюдаются преждевременная отслойка плаценты, досрочное излитие околоплодных вод и преждевременные роды.
Диагностика
Обнаружение при УЗИ-скрининге изменений, типичных для преждевременного созревания плаценты, является основанием для выполнения комплексной оценки состояния фетоплацентарной системы с последующим тщательным мониторингом беременности. Основные мероприятия направлены на выявление структурных изменений и оценку функциональных возможностей органа. Наиболее ценными в диагностическом плане являются:
- УЗИ матки, плаценты и плода. Метод признан «золотым стандартом» диагностики, позволяет определить толщину плацентарной ткани, обнаружить характерные структурные изменения, свидетельствующие об уплотнении детского места, его структуризации на дольки, появлении кист, отложений солей, участков с нарушенным кровоснабжением.
- Допплерометрия маточно-плацентарного кровотока.
 Отражение ультразвука кровью, которая движется в сосудах плаценты, зависит от скорости кровотока в системе. С помощью допплерограммы легко оценивать как количественные показатели кровоснабжения, так и качественные характеристики, косвенно свидетельствующие о состоянии сосудов.
Отражение ультразвука кровью, которая движется в сосудах плаценты, зависит от скорости кровотока в системе. С помощью допплерограммы легко оценивать как количественные показатели кровоснабжения, так и качественные характеристики, косвенно свидетельствующие о состоянии сосудов.
С учетом высокого риска развития фетоплацентарной недостаточности необходимо обеспечить контроль роста ребенка при помощи фетометрии, КТГ, фонокардиографии плода. Поскольку преждевременные дистрофические изменения плаценты обычно является вторичными и провоцируется другими расстройствами, важно определить основную патологию. С этой целью рекомендована лабораторная диагностика инфекционных процессов — исследование мазка, микробиологический анализ посева на питательные среды, РИФ, ИФА, ПЦР, TORCH-комплекс, консультации смежных специалистов — уролога, эндокринолога, терапевта, кардиолога, инфекциониста, дерматолога, ревматолога, иммунолога, гематолога и др. Дифференциальная диагностика проводится с инфарктами детского места, кальцинатами, его гиперплазией и новообразованиями (хориоангиомой, пузырным заносом).
Лечение преждевременного созревания плаценты
Основными врачебными задачами при ведении беременной с ПСП являются коррекция расстройств, вызвавших патологию, нормализация кровообращения в маточно-плацентарной системе, выбор оптимального способа и времени родоразрешения. Тактика ведения пациентки на дородовом этапе определяется сроком, на котором было диагностировано преждевременное старение:
- Раннее выявление ПСП

Независимо от сроков выявления преждевременного созревания ткани плаценты акушер-гинеколог или профильный специалист активно лечат основное генитальное или экстрагенитальное заболевание с использованием антибиотиков, гормонотерапии, иммуннокорректоров, сердечно-сосудистых и других медикаментозных средств. Параллельно с коррекцией ведущего расстройства назначают препараты для улучшения кровоснабжения плода — сосудорасширяющие препараты, антиагреганты, аминокислотные комплексы, эссенциальные фосфолипиды. Лекарственная терапия дополняется немедикаментозными методами — рациональной двигательной активностью, коррекцией диеты, нормализацией режима сна и отдыха.
Лекарственная терапия дополняется немедикаментозными методами — рациональной двигательной активностью, коррекцией диеты, нормализацией режима сна и отдыха.
Прогноз и профилактика
Своевременный скрининг и правильная врачебная тактика позволяют снизить риски фетоплацентарной недостаточности при старении плаценты, замедлить этот процесс и пролонгировать беременность до безопасных для рождения ребенка сроков. Первичная профилактика предполагает планирование беременности пациентками с генитальными и экстрагенитальными заболеваниями, защищенный секс для предохранения от специфических инфекций, обоснованное назначение инвазивных гинекологических процедур, отказ от курения, употребления алкоголя и наркотиков. Во время гестации для нормального развития плаценты важно позаботиться о защите от возможного заражения ОРВИ и другими инфекционными болезнями, поддержании уровня гемоглобина, достаточной двигательной активности и рациональной диете. Вторичная профилактика направлена на раннюю диагностику расстройства, включает своевременную постановку на учет в женской консультации, регулярное прохождение плановых осмотров и УЗИ.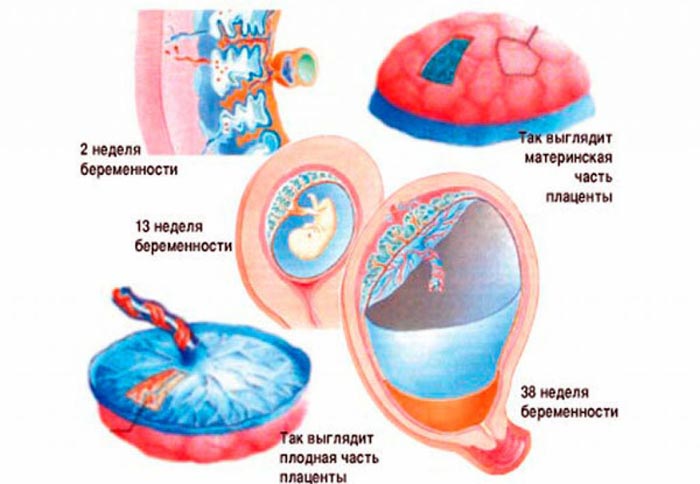
Преждевременное старение плаценты — в 32, 33, 34 недели, чем опасно, последствия
Что нужно знать о преждевременном старении плаценты
Преждевременное старение плаценты — этим термином пугают российские врачи многих будущих мам. Чем же так опасен этот диагноз, на каком основании он ставится и как лечится патология?
Плацента, а в народе — «детское место», это орган, который образуется у беременной женщины и функционирует до момента рождения ребенка. Именно благодаря плаценте возможна доставка к ребенку питательных веществ и кислорода. И от состояния плаценты зависит развитие малыша. Если ему не будет хватать питания — велика вероятность задержки его развития, а в тяжелых случаях — даже гибели.
Как и почему стареет плацента
В течение беременности плацента видоизменяется и потихоньку вырабатывает свой ресурс. Врачам известны 4 степени зрелости плаценты: 0,1,2,3. 0 — плацента в полном порядке. 3 степень обычно бывает на сроке 38 недель и более. Эти степени определяются врачом УЗ-диагностики. Во внимание принимается строение плаценты, ее структура, толщина. Преждевременное созревание плаценты ставят при малейшем отклонении от нормы.
0 — плацента в полном порядке. 3 степень обычно бывает на сроке 38 недель и более. Эти степени определяются врачом УЗ-диагностики. Во внимание принимается строение плаценты, ее структура, толщина. Преждевременное созревание плаценты ставят при малейшем отклонении от нормы.
Почему же «детское место» у некоторых женщин быстро «стареет»? Обычно в этом виноват целый комплекс проблем. Это бесконтрольный прием различных лекарственных средств (в том числе биологически активных добавок, витаминов), вирусные заболевания (грипп, ОРЗ, ОРВИ и пр.), курение, прием алкоголя и наркотиков и пр. Но чаще причины преждевременного старения плаценты так и остаются не выясненными.
Чем опасна патология и каковы ее последствия
Пожалуй, нужно начать с того, как правильно ставится этот диагноз. Многие врачи его пишут безосновательно. А созревание «детского места» считается ускоренным, если степень зрелости на сроке до 32 недель превышает вторую, либо врач ставит третью степень при сроке менее 36 недель. И то, данный «диагноз» вовсе не диагноз, а момент, на который следует обратить внимание врачу, и, вероятнее всего, провести дополнительное обследование. А это УЗИ с исследованием кровотока плода и кардиотокография (КТГ). То есть преждевременное старение плаценты в 32, 33, 34 недели — это еще совсем не приговор, и часто даже не повод для волнения. Что же касается неверно выставленных диагнозов, то наши российские врачи очень любят говорить про данную патологию, выставляя на сроке до 30 недель вместо нулевой степени созревания первую. Это неправильно. Какие последствия преждевременного старения плаценты все-таки возможны? Все зависит от того, насколько плохим было состояние плаценты и к каким конкретно нарушениям в развитии ребенка привело. Чаще всего, это рождение детей с низким весом.
И то, данный «диагноз» вовсе не диагноз, а момент, на который следует обратить внимание врачу, и, вероятнее всего, провести дополнительное обследование. А это УЗИ с исследованием кровотока плода и кардиотокография (КТГ). То есть преждевременное старение плаценты в 32, 33, 34 недели — это еще совсем не приговор, и часто даже не повод для волнения. Что же касается неверно выставленных диагнозов, то наши российские врачи очень любят говорить про данную патологию, выставляя на сроке до 30 недель вместо нулевой степени созревания первую. Это неправильно. Какие последствия преждевременного старения плаценты все-таки возможны? Все зависит от того, насколько плохим было состояние плаценты и к каким конкретно нарушениям в развитии ребенка привело. Чаще всего, это рождение детей с низким весом.
Чем лечить?
К сожалению, вернуть первоначальное состояние «детского места» не получится. Многие мамы, начитавшись о том, чем опасно преждевременное старение плаценты, просят своего врача назначить лекарства, которые помогут ребенку получить недостающие ему питательные вещества и кислород. Но пытаться что-то предпринимать нужно только в том случае, если есть признаки страдания плода. А выявляются они при допплерографии и КТГ, УЗИ также оказывает помощь в диагностике, ведь с его помощью можно измерить все части тела ребенка и сказать с очень большой долей вероятности о том, есть ли у него задержка в развитии. Если да, причем она составляет более 2 недель, женщину положат для лечения в стационар. В тяжелых ситуациях может быть предложено кесарево сечение до наступления предполагаемой даты родов.
Но пытаться что-то предпринимать нужно только в том случае, если есть признаки страдания плода. А выявляются они при допплерографии и КТГ, УЗИ также оказывает помощь в диагностике, ведь с его помощью можно измерить все части тела ребенка и сказать с очень большой долей вероятности о том, есть ли у него задержка в развитии. Если да, причем она составляет более 2 недель, женщину положат для лечения в стационар. В тяжелых ситуациях может быть предложено кесарево сечение до наступления предполагаемой даты родов.
Как же эта патология лечится? Как мы уже писали ранее, плаценту не «вылечить». Но малышу можно немного помочь. Для этого женщине вводятся препараты глюкозы, некоторые лекарства, которые назначаются при дыхательной недостаточности, а также снижающие тонус матки.
Чем грозит преждевременное созревание плаценты? | mamaclub
Звено, которое связывает мать и дитя – это плацента. Любое ее аномальное развитие, каким является преждевременное созревание плаценты, может пагубно повлиять на ребенка.
Плацента создана для того, чтобы обеспечивать полноценное развитие плода во время беременности. Плаценту еще называют «детским местом». Она растет и развивается на пару с ребеночком.
В норме, плацента имеет четыре стадии созревания. К ним относятся:
- Стадия формирования – от 0 до 30 недель;
- стадия роста – до 32-ой недели;
- стадия зрелости – от 34 – ой до 39 — ой недели;
- стадия старения – с 37 недели.
Характеристика преждевременного созревания плаценты
Видео дняОднако время от времени происходит так, что плацента созревает ранее установленного срока. Такое преждевременное созревание плаценты имеет следующие характеристики. Толщина плаценты уменьшается либо увеличивается, в некоторых ее участках может наблюдаться ухудшение кровообращения, как следствие, происходит недостаточное поступление кислорода к стенкам плаценты, и она стареет раньше времени. Преждевременное созревание плаценты может привести к преждевременным родам, а также может способствовать появлению хронической внутриутробной гипоксии плода. В большинстве случаев преждевременное созревание плаценты развивается у женщин с малым либо избыточным весом, при наличии разного рода инфекций, особенно инфекций, передающихся через половую систему.
В большинстве случаев преждевременное созревание плаценты развивается у женщин с малым либо избыточным весом, при наличии разного рода инфекций, особенно инфекций, передающихся через половую систему.
В случае, если у вас установили преждевременное созревание плаценты, в обязательном порядке необходимо провести специальное обследование на гемодинамику системы плод – мать – плацента. Исследование получило название допплерометрии. Также необходимо сделать УЗИ и исследовать сердце ребенка, а также сдать анализ на специальные гормоны беременности. Анализы лучше сдавать периодичностью через две недели.
Каким образом проводится лечение?
Каких-либо единых схем лечения еще не обнаружено. Здесь следует учитывать индивидуальные сочетания причин, факторов и механизмов развития данного патологического состояния плаценты. Поскольку состояние признано опасным для здоровья матери и ребенка, необходимо своевременно проходить все назначенные лечащим врачом-гинекологом обследования, а также четко следовать его предписаниям.
Постарайтесь составить себе белковую схему питания и придерживаться ее. Не избегайте медикаментозного лечения, которое назначил вам врач. Лечение способствует улучшению процессов обмена и метаболизма в системе мать – плод – плацента, оптимизирует ее.
Многоводие, преждевременное старение плаценты — Вопрос гинекологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 74 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского онколога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, липидолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
В настоящий момент на сайте можно получить консультацию по 74 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского онколога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, липидолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.43% вопросов.
Оставайтесь с нами и будьте здоровы!
Укорочение теломер, клеточное старение и дисфункция митохондрий
Преэклампсия — полисистемное заболевание беременных, являющееся основной причиной материнской и неонатальной заболеваемости и смертности во всем мире. Точная патофизиология преэклампсии остается неясной; однако предполагается, что различные патологии могут быть связаны с нарушением ремоделирования сосудов и повышенным окислительным стрессом в плаценте. Окислительный стресс играет ключевую роль в старении клеток, а постоянное присутствие повышенного окислительного стресса ускоряет клеточное старение и митохондриальную дисфункцию, что приводит к преждевременному старению плаценты.Преждевременное старение плаценты связано с плацентарной недостаточностью, что снижает функциональные возможности этого важнейшего органа и приводит к аномальным исходам беременности. Изменения, вызванные окислительными повреждениями, необратимы и часто приводят к вредным модификациям макромолекул, таких как липиды и белки, мутациям ДНК и изменению функционирования и динамики митохондрий. В этом обзоре мы обобщили современные знания о старении плаценты в этиологии неблагоприятных исходов беременности и обсудили признаки старения, которые могут быть потенциальными маркерами преэклампсии и задержки роста плода.
В этом обзоре мы обобщили современные знания о старении плаценты в этиологии неблагоприятных исходов беременности и обсудили признаки старения, которые могут быть потенциальными маркерами преэклампсии и задержки роста плода.
1. Введение
Преэклампсию можно определить как артериальную гипертензию de novo после 20 недель беременности при наличии протеинурии и дисфункции материнских органов/маточно-плацентарной [1]. Это одна из ведущих причин материнской и неонатальной заболеваемости и смертности, затрагивающая от 3 до 8% беременностей во всем мире [2]. Преждевременные роды в результате ятрогенных родов являются частым фактором преэклампсии, при этом до 25% детей, рожденных от матерей с преэклампсией, имеют задержку роста [2, 3].Преэклампсия и ЗВУР являются специфическими для беременных заболеваниями, связанными с плацентарной недостаточностью [4]. Осложнения, связанные с преэклампсией, являются причиной около 15% материнской смертности и высоких показателей перинатальной смертности во всем мире [5]. Органы неизбежно испытывают старение; однако при преэклампсии наличие стойкого окислительного стресса ускоряет этот процесс, что приводит к преждевременному старению плаценты [6]. В различных исследованиях сообщалось, что преждевременное старение плаценты связано с укорочением теломер, клеточным старением и митохондриальной дисфункцией [7-10].
Органы неизбежно испытывают старение; однако при преэклампсии наличие стойкого окислительного стресса ускоряет этот процесс, что приводит к преждевременному старению плаценты [6]. В различных исследованиях сообщалось, что преждевременное старение плаценты связано с укорочением теломер, клеточным старением и митохондриальной дисфункцией [7-10].
2. Физиология старения
Старение – это однонаправленное явление, неизбежно переживаемое каждой тканью. Его можно охарактеризовать как клеточное старение из-за снижения функциональности и митохондриальной дисфункции из-за измененного метаболизма и передачи сигналов.
2.1. Cellular Senescence
Клетки способны к репликации, делясь на две точные копии родительской клетки. Это включает в себя разделение генетического материала путем раскручивания и расщепления цепей ДНК с целью образования двух новых копий в качестве дочерних цепей.Теломеры представляют собой кэп-подобные нуклеотидные повторы (TTAGGG), присутствующие на конце каждой цепи. Повреждение цепей ДНК активирует сигнальные каскады (пути, связанные с атаксией телеангиэктазией (ATM) и атаксией телеангиэктазией и Rad3-родственными (ATR)), которые останавливают деление клеток, вызывают клеточное старение и способствуют гибели клеток [11]. Теломеры с другими белками, такими как шелтерин, защищают концы ядер от распознавания в качестве двухцепочечной поврежденной области (DDR) [11]. Показано, что теломеры укорачиваются после каждого цикла репликации [12].С увеличением пролиферации и уменьшением размера теломер клетки вступают в фазу старения или замедления роста (предел Хейфлика), что в конечном итоге приводит к гибели клеток [12]. Укорочение теломер связано с различными генетическими заболеваниями, такими как прогерия или преждевременное старение и синдром Хатчинсона-Гилфорда [13].
Повреждение цепей ДНК активирует сигнальные каскады (пути, связанные с атаксией телеангиэктазией (ATM) и атаксией телеангиэктазией и Rad3-родственными (ATR)), которые останавливают деление клеток, вызывают клеточное старение и способствуют гибели клеток [11]. Теломеры с другими белками, такими как шелтерин, защищают концы ядер от распознавания в качестве двухцепочечной поврежденной области (DDR) [11]. Показано, что теломеры укорачиваются после каждого цикла репликации [12].С увеличением пролиферации и уменьшением размера теломер клетки вступают в фазу старения или замедления роста (предел Хейфлика), что в конечном итоге приводит к гибели клеток [12]. Укорочение теломер связано с различными генетическими заболеваниями, такими как прогерия или преждевременное старение и синдром Хатчинсона-Гилфорда [13].
В некоторых случаях, например при раке, клетки могут не стареть и продолжать размножаться, становясь бессмертными. Однако даже раковые клетки не делятся бесконечно и вступают в кризисную стадию, которая приводит либо к клеточной гибели, либо к стабилизации длины теломер с последующей активацией фермента теломеразы для поддержания длины теломер [14]. Теломераза представляет собой РНК-белковый комплекс, восполняющий утраченные нуклеотиды для сохранения длины теломеры [15]. В соматических клетках теломеразы выключены как защитный механизм для предотвращения неопластических изменений [16], но их активность более выражена в половых, стволовых клетках и 90% раковых клеток [17].
Теломераза представляет собой РНК-белковый комплекс, восполняющий утраченные нуклеотиды для сохранения длины теломеры [15]. В соматических клетках теломеразы выключены как защитный механизм для предотвращения неопластических изменений [16], но их активность более выражена в половых, стволовых клетках и 90% раковых клеток [17].
2.2. Митохондриальная дисфункция
Митохондрии являются ключевыми регуляторами метаболизма, окислительно-восстановительного баланса и апоптоза. Во время электрон-транспортной цепи (ЭТЦ) электроны перекачиваются через внутреннюю митохондриальную мембрану (от восстановленных соединений до молекулярного кислорода), создавая отток для синтеза энергии [18].Согласно свободнорадикальной или окислительной гипотезе старения, существует ряд событий, происходящих во время окислительного фосфорилирования, что приводит к выщелачиванию электронов из митохондриальных мембран, которые вступают в реакцию с кислородом, образуя свободные радикалы, такие как супероксид, что в конечном итоге нарушает окислительно-восстановительный баланс [19, 20]. На смену свободнорадикальной теории пришла гипотеза теории повреждений, которая предполагает, что старение может быть связано с частыми и неизбежными кумулятивными повреждениями на молекулярном уровне, вызванными накоплением активных форм кислорода (АФК) и их побочными продуктами и ферментами [21].Накопление активных форм кислорода (АФК) приводит к обратимым и необратимым изменениям внутри клеток, что приводит к потере молекулярного функционирования и усилению окислительного стресса, феномену, часто связанному со старением, как показано на рисунке 1 [19, 20].
На смену свободнорадикальной теории пришла гипотеза теории повреждений, которая предполагает, что старение может быть связано с частыми и неизбежными кумулятивными повреждениями на молекулярном уровне, вызванными накоплением активных форм кислорода (АФК) и их побочными продуктами и ферментами [21].Накопление активных форм кислорода (АФК) приводит к обратимым и необратимым изменениям внутри клеток, что приводит к потере молекулярного функционирования и усилению окислительного стресса, феномену, часто связанному со старением, как показано на рисунке 1 [19, 20].
Функционирование митохондрий при старении широко изучалось; в ряде статей сообщалось, что плотность митохондрий, дыхательная способность и продукция АТФ снижаются при клеточном старении [22–24].Помимо снижения функциональности, старение сопровождается повреждением митохондриальной ДНК (мтДНК), мутациями и митофагией [22, 25].
Нарушение передачи окислительно-восстановительных сигналов вызывает различные модификации в макромолекулах и мутации в мтДНК; однако вредные эффекты этих мутаций мтДНК до сих пор полностью не выяснены [26-28]. Эффект бутылочного горлышка, который объясняет генетические дрейфы и вариации в небольших подмножествах популяций, как в случае с мутациями мтДНК, может передавать небольшие вариации в зародышевых линиях, которые усиливаются на более поздних стадиях оогенеза [29, 30].В нескольких исследованиях сообщается, что мутации в мтДНК дрожжей приводят к сокращению продолжительности жизни при ингибировании митофагии [31, 32]. Снижение числа копий мтДНК было связано со старением и сопутствующими заболеваниями, включая сердечно-сосудистые заболевания (кардиомиопатия, атеросклероз), нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), рак и преждевременное старение яичников у женщин [33, 34].
Эффект бутылочного горлышка, который объясняет генетические дрейфы и вариации в небольших подмножествах популяций, как в случае с мутациями мтДНК, может передавать небольшие вариации в зародышевых линиях, которые усиливаются на более поздних стадиях оогенеза [29, 30].В нескольких исследованиях сообщается, что мутации в мтДНК дрожжей приводят к сокращению продолжительности жизни при ингибировании митофагии [31, 32]. Снижение числа копий мтДНК было связано со старением и сопутствующими заболеваниями, включая сердечно-сосудистые заболевания (кардиомиопатия, атеросклероз), нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), рак и преждевременное старение яичников у женщин [33, 34].
Митофагия представляет собой защитный механизм для поддержания качества митохондрий, удаления мутантной мтДНК и обеспечения митохондриального гомеостаза [35].Кроме того, митохондриальная динамика поддерживается за счет частого деления и слияния митохондрий [36]. Окислительное повреждение митохондрий может вызвать нарушение деления с асимметричными мембранными потенциалами дочерних митохондрий, которые не могут эффективно сливаться, что приводит к накоплению деформированных митохондриальных белков со сниженной аутофагической способностью [37]. Паликарас и др. показали, что митофагия необходима для долголетия у C. elegans в результате снижения передачи сигналов инсулина/IGF-1 или нарушения митохондриальной функции [38].
Паликарас и др. показали, что митофагия необходима для долголетия у C. elegans в результате снижения передачи сигналов инсулина/IGF-1 или нарушения митохондриальной функции [38].
Кроме того, потеря митохондриального биогенеза из-за дисбаланса митофагии и митохондриального деления/слияния и накопления митохондриального дебриса приводит к старению сердца у мышей [39, 40].
Нарушение функционирования митохондрий отражает реакцию митохондриальных развернутых белков (UPR mt ) [41], которая регулируется связью между митохондриальными и ядерными белками, где для активации UPR mt требуется ядерное ремоделирование [42].Когда стресс индуцируется внутри клеток, UPR mt активируется, чтобы способствовать репарации, но в случаях длительного действия UPR mt могут индуцироваться мутации в мтДНК [42]. Эксперименты на C. elegans показали, что активация UPR mt и дисбаланс митонуклеарного ответа вызывают долголетие [43, 44].
Старение клеток является результатом повреждения ядер, обычно связанного с высоким окислительным стрессом и накоплением АФК, дебриса или неправильно свернутых белков.Врожденные иммунные медиаторы с секреторными фенотипами, ассоциированными со старением (SASP), включая цитокины, хемокины, факторы роста и протеазы, ответственны за удаление дебриса из мертвых или умирающих клеток, которые могут активировать проапоптотические пути передачи сигналов p53 и AKT [45–47]. В нескольких исследованиях удаление медиаторов воспаления и последующая передача сигналов приводили к обращению вспять клеточного старения, указывая на то, что воспаление может быть как причиной, так и следствием клеточного старения [48-50].
3.Патофизиология преэклампсии
Даже после десятилетий исследований патофизиология преэклампсии до конца не изучена. Преэклампсию можно охарактеризовать как раннее начало, составляющее менее 20% всех случаев, или позднее начало, составляющее оставшиеся 80% [51]. Было предложено несколько гипотез для полного выяснения лежащих в основе патологических механизмов [51-54]. Гипотеза плацентарного происхождения преэклампсии описывает неэффективную инвазию трофобласта и ремоделирование спиральных артерий матери, вызывая «плацентарный синдром», который впоследствии приводит к преэклампсии и задержке роста плода [51, 54].
Гипотеза плацентарного происхождения преэклампсии описывает неэффективную инвазию трофобласта и ремоделирование спиральных артерий матери, вызывая «плацентарный синдром», который впоследствии приводит к преэклампсии и задержке роста плода [51, 54].
Более поздняя теория, предложенная Thilaganathan, предполагает, что аномальная сердечно-сосудистая функция вызывает аномальную плацентацию, которая возникает при преэклампсии, а плацентарное происхождение преэклампсии верно только в случае раннего начала заболевания [52, 54]. Поздняя преэклампсия может быть связана с основной сердечно-сосудистой дисфункцией матери, которая не отвечает гемодинамическим и метаболическим потребностям беременности, а также приводит к неблагоприятным послеродовым сердечно-сосудистым исходам более чем у 50% пациенток, возможно, из-за того, что преэклампсия и сердечно-сосудистые заболевания имеют сходные генетические и экологические факторы риска [52].
Подтверждая связь между плацентарно-опосредованной патофизиологией ПЭ с ранним началом, Yung et al. исследовали образцы плаценты от недоношенных, доношенных и беременных во втором триместре и продемонстрировали, что при преэклампсии с ранним началом патология плаценты связана с усилением пути ответа на развернутый белок (UPR) и активацией стресса ER наряду с депрессией пути AKT, снижая клеточные пролиферация [55]. Эти авторы продемонстрировали молекулярные различия между двумя фенотипами доношенной и недоношенной преэклампсии [55].
исследовали образцы плаценты от недоношенных, доношенных и беременных во втором триместре и продемонстрировали, что при преэклампсии с ранним началом патология плаценты связана с усилением пути ответа на развернутый белок (UPR) и активацией стресса ER наряду с депрессией пути AKT, снижая клеточные пролиферация [55]. Эти авторы продемонстрировали молекулярные различия между двумя фенотипами доношенной и недоношенной преэклампсии [55].
Roberts и Hubel, среди прочих, предложили двухэтапную модель преэклампсии, которая позже была модифицирована Redman et al. до шести стадий. [53, 56]. Редман объясняет, что стадии 1 и 2 могут быть ранним явлением, таким как толерантность матери к отцовской сперме до зачатия или короткий промежуток времени между половым актом и зачатием, что приводит к плохой плацентации и влияет на здоровье и рост плода [53]. Стадия 3 начинается примерно на 8 неделе беременности, когда в неосложненных случаях трофобластические пробки, закупоривающие материнские спиральные артерии, отступают и начинается установление маточно-плацентарного кровообращения [53, 57].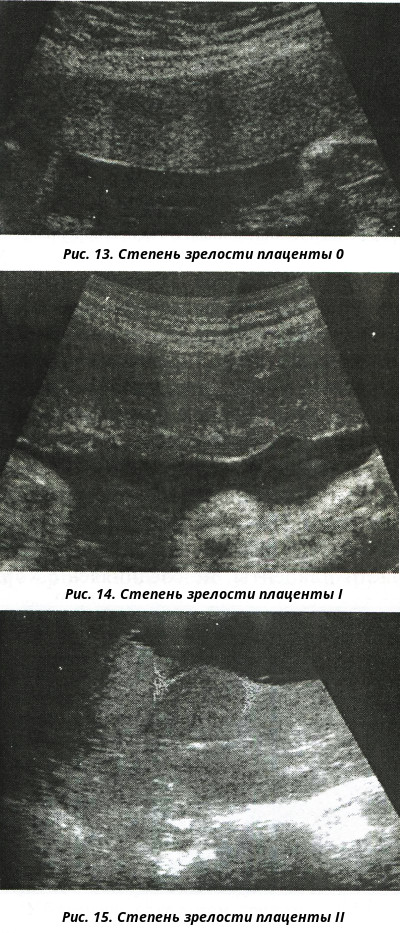 Однако при преэклампсии происходит преждевременное раскрытие трофобластических пробок с притоком артериальной крови, что увеличивает стресс внутри плаценты и приводит к дефектной плацентации [53]. Стадия 4 модели Редмана характеризуется снижением плацентарных факторов роста при преэклампсии, что приводит к нарушению ремоделирования спиральных артерий матери в более крупные сосуды с низким сопротивлением кровотоку трофобластом [53, 58, 59]. Кроме того, Redman также утверждает, что при повышенном повреждении плаценты и эндотелия клинические симптомы преэклампсии проявляются на стадиях 5 и 6 [53].
Однако при преэклампсии происходит преждевременное раскрытие трофобластических пробок с притоком артериальной крови, что увеличивает стресс внутри плаценты и приводит к дефектной плацентации [53]. Стадия 4 модели Редмана характеризуется снижением плацентарных факторов роста при преэклампсии, что приводит к нарушению ремоделирования спиральных артерий матери в более крупные сосуды с низким сопротивлением кровотоку трофобластом [53, 58, 59]. Кроме того, Redman также утверждает, что при повышенном повреждении плаценты и эндотелия клинические симптомы преэклампсии проявляются на стадиях 5 и 6 [53].
Развитие плаценты начинается с децидуальной реакции, вызванной бластоцистой в материнском эндометрии, что в конечном итоге приводит к формированию базальной пластинки [60, 61]. Трофобласты дифференцируются на два типа: инвазивный вневорсинчатый цитотрофобласт (EVT) или ворсинчатый цитотрофобласт, которые позже сливаются, образуя многоядерный синцитиотрофобласт [61, 62]. Вневорсинчатые цитотрофобласты ответственны за установление маточно-плацентарного кровообращения и регуляцию материнской врожденной иммунной системы [63, 64]. При неосложненной беременности экстраворсинчатые цитотрофобласты (EVT) проникают в спиральные артерии, вены и лимфатические сосуды эндометрия матери в течение первого триместра [65, 66]. Скопления EVT также локализовались в лимфатических узлах без каких-либо неопластических изменений, что свидетельствует о регуляции иммунных клеток трофобластами [65, 66].
При неосложненной беременности экстраворсинчатые цитотрофобласты (EVT) проникают в спиральные артерии, вены и лимфатические сосуды эндометрия матери в течение первого триместра [65, 66]. Скопления EVT также локализовались в лимфатических узлах без каких-либо неопластических изменений, что свидетельствует о регуляции иммунных клеток трофобластами [65, 66].
Дефект плаценты приводит к снижению ангиогенного сосудистого эндотелиального фактора роста (VEGF) и плацентарного фактора роста (PLGF) и высвобождению вредных плацентарных факторов, таких как растворимая fms-подобная тирозинкиназа 1 (sFIt1), в кровоток матери, вызывая генерализованное эндотелиальное дисфункции [56, 57].Циркулирующий sFlt1 обилен у женщин с преэклампсией, что связано с сосудистым сопротивлением и повышением артериального давления [67]. Недавние исследования у женщин с задержкой роста плода (ЗРП) без симптомов преэклампсии показали высокое соотношение sFlt1/PLGF [68, 69]. Протеинурия при преэклампсии также может быть связана с высоким уровнем плацентарных факторов, таких как sFlt1, провоцирующих гломерулярный эндотелиоз [70]. Измененная гемодинамика и снижение сосудистого кровотока приводят к стойким гипоксически-оксигенированным состояниям, что приводит к высокому окислительному стрессу в плацентарной ткани [55, 71-74].Несмотря на то, что повышенный окислительный стресс проявляется в трофобластах при неосложненной беременности, длительный окислительный стресс подавляет активность трофобласта, ухудшая ситуацию при осложнениях беременности [75].
Измененная гемодинамика и снижение сосудистого кровотока приводят к стойким гипоксически-оксигенированным состояниям, что приводит к высокому окислительному стрессу в плацентарной ткани [55, 71-74].Несмотря на то, что повышенный окислительный стресс проявляется в трофобластах при неосложненной беременности, длительный окислительный стресс подавляет активность трофобласта, ухудшая ситуацию при осложнениях беременности [75].
Синцитиотрофобласт представляет собой самый наружный слой ворсинчатого трофобласта, находящийся в непосредственном контакте с материнской кровью, а синцитиальный мусор в виде узелков или ядерных агрегатов может обнаруживаться в материнском кровотоке с увеличением гестационного возраста [76, 77]. Постоянный сосудистый приток к синцитиотрофобласту вызывает быстрые возрастные изменения и требует активации аутофагии для их устранения при неосложненной беременности [8, 78, 79].Во время преэклампсии синцитиотрофобласт подвергается ускоренному старению с усилением апоптотического каскада, некротическим разрушением с высвобождением некротического мусора и увеличением синцитиальных агрегатов [77, 80]. Было замечено, что синцитиотрофобласт секретирует связанную со старением бета-галактозидазу (SA β -Gal) наряду с повышением уровня проапоптотических ингибиторов p53 и CDK, что указывает на прекращение клеточного цикла и старение [81, 82].
Было замечено, что синцитиотрофобласт секретирует связанную со старением бета-галактозидазу (SA β -Gal) наряду с повышением уровня проапоптотических ингибиторов p53 и CDK, что указывает на прекращение клеточного цикла и старение [81, 82].
В недавнем обзоре Cox и Redman описаны биохимические пути и механизм старения плацентарных клеток после окислительного стресса [8].Они подчеркивают, что раннее начало старения при преэклампсии может быть связано с чрезмерным накоплением АФК и стрессом окислительного/эндоплазматического ретикулума (ЭР), что приводит к активации пути mTORC (регулятор клеточного цикла) и выработке белков секреторного фенотипа, ассоциированного со старением (SASP), которые затем активирует циклооксигеназный путь и усиливает выработку провоспалительных цитокинов и хемокинов [8].
4. Клеточное старение при неблагоприятных исходах беременности
Трофобласты имитируют раковые клетки, проявляя инвазивность, чтобы поддерживать рост плода.Подобно опухолевым клеткам, трофобласты сохраняют длину своих теломер и уровень теломеразы обратной транскриптазы человека (hTERT) при неосложненной беременности [83, 84]. В течение первого триместра трофобласт испытывает низкое напряжение кислорода или физиологическое гипоксическое состояние, связанное с активацией HIF-1 α . Это состояние с низким напряжением кислорода отвечает за моделирование архитектуры ворсинок и поддержание клеточной целостности за счет сохранения длины теломер и активации теломеразных ферментов [85, 86].Это физиологическое состояние изменяется в конце первого триместра, когда плацента насыщается кислородом [87]. Длина теломер остается постоянной на протяжении всей нормальной беременности, но при определенных состояниях, таких как задержка роста плода и неконтролируемый диабет, длина теломер значительно уменьшается [88, 89]. Изменения теломер могут быть связаны с повышенным окислительным стрессом, приводящим к повреждению ДНК и активации ответа на повреждение (DDR) через путь р53 и способствующему старению трофобласта [9, 84].В 2010 г. Biron-Shental et al. были первыми, кто сообщил о признаках клеточного старения при преэклампсии и задержке роста плода.
В течение первого триместра трофобласт испытывает низкое напряжение кислорода или физиологическое гипоксическое состояние, связанное с активацией HIF-1 α . Это состояние с низким напряжением кислорода отвечает за моделирование архитектуры ворсинок и поддержание клеточной целостности за счет сохранения длины теломер и активации теломеразных ферментов [85, 86].Это физиологическое состояние изменяется в конце первого триместра, когда плацента насыщается кислородом [87]. Длина теломер остается постоянной на протяжении всей нормальной беременности, но при определенных состояниях, таких как задержка роста плода и неконтролируемый диабет, длина теломер значительно уменьшается [88, 89]. Изменения теломер могут быть связаны с повышенным окислительным стрессом, приводящим к повреждению ДНК и активации ответа на повреждение (DDR) через путь р53 и способствующему старению трофобласта [9, 84].В 2010 г. Biron-Shental et al. были первыми, кто сообщил о признаках клеточного старения при преэклампсии и задержке роста плода. Они продемонстрировали, что при преэклампсии и беременностях с ЗВУР теломеры значительно короче в трофобласте со сниженной экспрессией hTERT и повышенной частотой скопления теломер по сравнению с неосложненной беременностью [90]. Эти плацентарные изменения отсутствовали на 37-41 неделе беременности, что указывает на преждевременное старение плаценты при этих осложнениях беременности [90].
Они продемонстрировали, что при преэклампсии и беременностях с ЗВУР теломеры значительно короче в трофобласте со сниженной экспрессией hTERT и повышенной частотой скопления теломер по сравнению с неосложненной беременностью [90]. Эти плацентарные изменения отсутствовали на 37-41 неделе беременности, что указывает на преждевременное старение плаценты при этих осложнениях беременности [90].
Плацента стареет постепенно, и присутствие маркеров старения, таких как белки p21, p16, p53 и Rb ближе к сроку, подтверждает гипотезу старения нормальной плаценты [91]. Недавно исследование Nuzzo et al. показаны изменения клеточного цикла с активацией циклина D1 (регулятор клеточного цикла) и PARP1 (выражается в повреждении ДНК и возрастных изменениях) с подавлением JunB (гена-супрессора старения) в плацентарных мезенхимальных стромальных клетках (PMSC), выделенных из преэклампсии плаценты, при сравнении к нормальной плаценте [92].Кроме того, Шарп и соавт. обнаружили дисбаланс между передачей сигналов p53 (ген, индуцирующий старение и проапоптоз) и MDM2 (супрессор p53) в плацентарных белках в синцитиотрофобласте, но не в цитотрофобласте у пациентов с ранним началом преэклампсии [93]. Наконец, Гао и соавт. сообщили об усилении передачи сигналов р53 и остановке клеточного цикла с активацией проапоптотических белков BAX и каспаз в эндотелиальных клетках пупочной вены человека (HUVEC), взятых у пациентов с преэклампсией, по сравнению с контрольной группой при неосложненной беременности [94].
Наконец, Гао и соавт. сообщили об усилении передачи сигналов р53 и остановке клеточного цикла с активацией проапоптотических белков BAX и каспаз в эндотелиальных клетках пупочной вены человека (HUVEC), взятых у пациентов с преэклампсией, по сравнению с контрольной группой при неосложненной беременности [94].
Активация путей DDR, мутации мтДНК и эндогенный стресс, такой как накопление АФК и передача сигналов окислительно-восстановительного потенциала, могут вызывать эпигенетические модификации. Эпигенетику можно определить как физиологические изменения, которые нельзя отнести к генетическому коду, а скорее к модификациям, таким как фосфорилирование, ацетилирование или метилирование ДНК или гистоновых белков в ядре [95]. Либо эти изменения могут быть адаптивным ответом на постоянные раздражители, либо они могут быть вирулентными модификациями, приводящими к необратимым изменениям в зародышевых клетках [96].Связь между эпигенетикой, старением и возрастными расстройствами была продемонстрирована в нескольких исследованиях.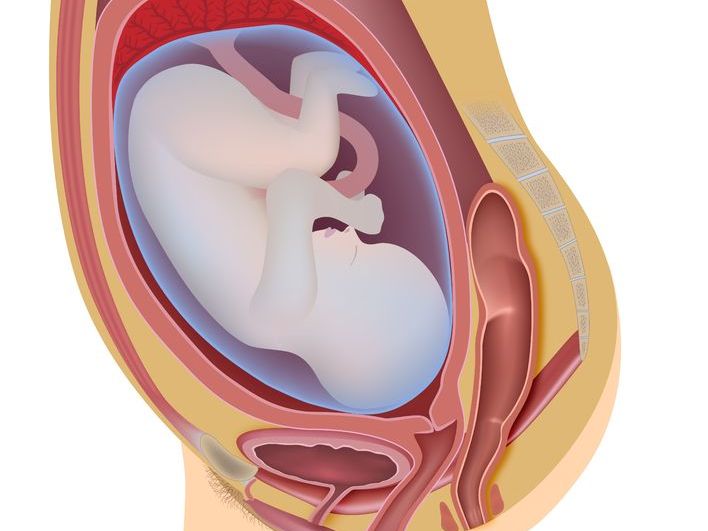 Ремоделирование хроматина может включать метилирование или деметилирование остатков гистонов в определенных сайтах, что может вызывать эпигенетические изменения внутри клеток [95, 96]. Лоу и др., исследуя эндотелиальные клетки, взятые из коронарной артерии 19-летнего мужчины, обсудили, что клеточное старение можно точно оценить по внутренним свойствам клеток, известным как эпигенетические часы, на которые указывает специфическое метилирование ДНК или цитозин. метилирование CpG-островков, что при определенных условиях может ускорять старение [97].Madrigano et al. в своем лонгитюдном исследовании пожилых людей показали, что ген-специфическое метилирование ДНК тесно связано со старением и возрастными расстройствами [98].
Ремоделирование хроматина может включать метилирование или деметилирование остатков гистонов в определенных сайтах, что может вызывать эпигенетические изменения внутри клеток [95, 96]. Лоу и др., исследуя эндотелиальные клетки, взятые из коронарной артерии 19-летнего мужчины, обсудили, что клеточное старение можно точно оценить по внутренним свойствам клеток, известным как эпигенетические часы, на которые указывает специфическое метилирование ДНК или цитозин. метилирование CpG-островков, что при определенных условиях может ускорять старение [97].Madrigano et al. в своем лонгитюдном исследовании пожилых людей показали, что ген-специфическое метилирование ДНК тесно связано со старением и возрастными расстройствами [98].
Эпигенетические изменения были продемонстрированы в плацентарной ткани, включая паттерны метилирования ДНК, связывающую способность ДНК-связывающих белков или ДБФ (особенно в гене цитохрома р450), паттерны метилирования импринтированных областей в генах h29/IGF2 и метилирование гистоновых белков в гормон роста человека в плацентарном хроматине [99]. В недавнем исследовании Eddy et al. модификации гистонов были очевидны в трофобласте плаценты BeWo при воздействии гипоксических условий с выраженным гипометилированием цитозина, эпигенетических изменений, обычно проявляющихся при возрастных патологиях [100].
В недавнем исследовании Eddy et al. модификации гистонов были очевидны в трофобласте плаценты BeWo при воздействии гипоксических условий с выраженным гипометилированием цитозина, эпигенетических изменений, обычно проявляющихся при возрастных патологиях [100].
5. Старческие изменения в плаценте, связанные с митохондриальной дисфункцией
Плацента является органом с высокой степенью метаболизма, требующим активной митохондриальной активности. Даже при нормальной функции митохондрий непрерывные изменения в экстраворсинчатом трофобласте (EVT) и ремоделирование сосудов приводят к увеличению продукции АТФ за счет окислительного фосфорилирования [101, 102].
Накопление АФК, таких как супероксид, оксиды азота и пероксинитрит, приводит к окислительному стрессу на ранних сроках беременности [101]. АФК представляют собой сигнальные молекулы, которые имеют преобладание над апоптотическими, окислительно-восстановительными и воспалительными сигнальными путями соответственно [103, 104]. АФК могут генерироваться из ряда источников, включая митохондрии (мАФК), НАДФН-оксидазы, ксантиноксидазу или фермент р450 [105, 106]. Активные формы кислорода (АФК) изменяют макромолекулы за счет окислительного повреждения белков, влияющих на функционирование генов, перекисного окисления липидов с усилением циркуляции полиненасыщенных жирных кислот и потери целостности клеточных мембран [107–109].Повышенная регуляция АФК и образование их побочных продуктов, отсутствие клиренса и окислительно-восстановительная передача сигналов имеют прямую связь как с митохондриальным, так и с клеточным старением. В дополнение к этим изменениям окислительный стресс активирует путь митоген-активируемой протеинкиназы (MAPK) через активируемую стрессом протеинкиназу/N-концевую киназу Jun (SAPK/JNK) или путь p38 в ответ на повреждение ДНК, что в дальнейшем приводит к прекращение пролиферации клеток и клеточное старение [110].
АФК могут генерироваться из ряда источников, включая митохондрии (мАФК), НАДФН-оксидазы, ксантиноксидазу или фермент р450 [105, 106]. Активные формы кислорода (АФК) изменяют макромолекулы за счет окислительного повреждения белков, влияющих на функционирование генов, перекисного окисления липидов с усилением циркуляции полиненасыщенных жирных кислот и потери целостности клеточных мембран [107–109].Повышенная регуляция АФК и образование их побочных продуктов, отсутствие клиренса и окислительно-восстановительная передача сигналов имеют прямую связь как с митохондриальным, так и с клеточным старением. В дополнение к этим изменениям окислительный стресс активирует путь митоген-активируемой протеинкиназы (MAPK) через активируемую стрессом протеинкиназу/N-концевую киназу Jun (SAPK/JNK) или путь p38 в ответ на повреждение ДНК, что в дальнейшем приводит к прекращение пролиферации клеток и клеточное старение [110].
Было показано, что в плаценте нитрация белков и перекисное окисление липидов значительно выше в тканях, выделенных от пациенток с преэклампсией, по сравнению с неосложненной беременностью [111–113].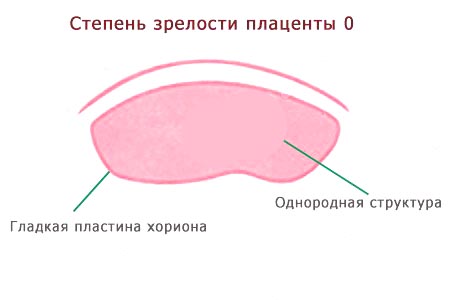 Перекисное окисление липидов может быть как ферментативным, катализируемым ферментами липоксигеназами, так и неферментативным в присутствии свободных радикалов [114]. Неферментативное перекисное окисление липидов усиливается с возрастом, и его продукты сильно экспрессируются при возрастных заболеваниях, таких как атеросклероз [115]. В 1998 г. Wang и Walsh описали, что перекисное окисление липидов в плаценте было значительно выше при преэклампсии [111]. Они установили, что высокие уровни перекисного окисления липидов являются результатом эскалации митохондриальной массы при плохом кровотоке для удовлетворения энергетических потребностей при преэклампсии [111].
Перекисное окисление липидов может быть как ферментативным, катализируемым ферментами липоксигеназами, так и неферментативным в присутствии свободных радикалов [114]. Неферментативное перекисное окисление липидов усиливается с возрастом, и его продукты сильно экспрессируются при возрастных заболеваниях, таких как атеросклероз [115]. В 1998 г. Wang и Walsh описали, что перекисное окисление липидов в плаценте было значительно выше при преэклампсии [111]. Они установили, что высокие уровни перекисного окисления липидов являются результатом эскалации митохондриальной массы при плохом кровотоке для удовлетворения энергетических потребностей при преэклампсии [111].
Различные систематические обзоры указывают на повышенный уровень окисления липидов в преэклампсии материнской сыворотки и плазмы, обычно связанный с нарушением антиоксидантной защиты по сравнению с неосложненной беременностью [116, 117].
Низкая васкуляризация плаценты приводит к уменьшению размера, количества и активности митохондрий [118, 119]. Недавнее исследование Venkata et al. с использованием модели преэклампсии со сниженным маточным перфузионным давлением (RUPP) у крыс показало значительное снижение митохондриального дыхания, особенно на стадии 3, и увеличение продукции перекиси водорода по сравнению с контрольными крысами [118].
Недавнее исследование Venkata et al. с использованием модели преэклампсии со сниженным маточным перфузионным давлением (RUPP) у крыс показало значительное снижение митохондриального дыхания, особенно на стадии 3, и увеличение продукции перекиси водорода по сравнению с контрольными крысами [118].
Передача сигналов оксида азота регулирует клеточные процессы, такие как апоптоз, дифференцировка и деление [120]. На вневорсинчатую трофобластическую активность, такую как миграция и инвазия, могут влиять два подтипа оксидов азота, eNOS (эндотелиальная синтаза оксида азота) и iNOS (индуцируемая синтаза оксида азота) [120]. Нитрование белков может либо не иметь никакого эффекта, либо демонстрировать потерю/приобретение функциональности. В плаценте пероксинитрит может изменять сосудистую реактивность и маточно-плацентарное кровообращение при осложнениях беременности, таких как преэклампсия [91, 121].Повышение активности NOS и накопление пероксинитрита при преэклампсии может привести к подавлению митохондриальной активности за счет ингибирования цепи транспорта электронов и нитрования митохондриальных белков и антиоксидантов, таких как митохондриальная супероксиддисмутаза (MnSOD), наряду с активацией трофобластического апоптоза [122].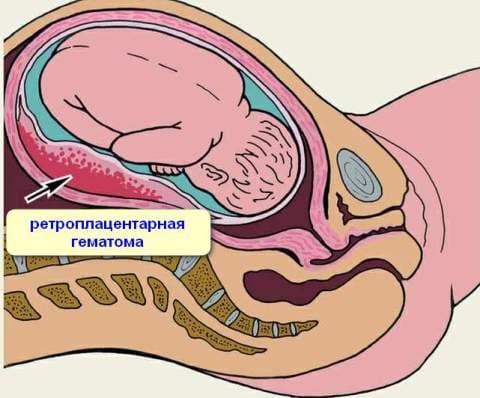
Как показано на рисунке 1, старение обычно связано с митохондриальной дисфункцией как прямым следствием потери митохондриальной динамики и увеличения митохондриального повреждения [122, 123].Митохондрии подвергаются непрерывному делению и слиянию для поддержания митохондриальной динамики, нарушение которой может привести к накоплению митохондриального мусора и ухудшению функционирования митохондрий [122, 123]. Считается, что митохондриальная динамика изменяется при преэклампсии с измененной экспрессией генов-регуляторов митохондриальной аутофагии, таких как OPA1, SIRT3 и MNF2/1, но для полного понимания процесса передачи сигналов было проведено ограниченное количество исследований [124, 125]. Недавно Осман и др. сообщили, что митохондриальная динамика при преэклампсии склонна к делению митохондрий с повышенным фосфорилированием гена DERP1 в митохондриях, выделенных из преэклампсии плаценты [126].Эти изменения сопровождались накоплением церамидов, которые активировали BOK, проапоптотический белок в тканях преэклампсии плаценты по сравнению с нормальной плацентой, что указывает на усиление трофобластической аутофагии при преэклампсии и ЗВУР [126].
Антиоксиданты вырабатываются клетками для нейтрализации продуктов АФК путем их преобразования в кислород и перекись водорода, которые далее расщепляются с образованием воды. Антиоксиданты также считаются антивозрастными агентами и могут быть разделены на подтипы: ферментативные, такие как супероксиддисмутазы (СОД), каталазы и пероксидазы, или неферментативные, такие как витамины (А, С и Е), билирубин и мочевая кислота [127, 128]. ].Окислительный стресс возникает, когда существует дисбаланс между продуцируемыми побочными продуктами АФК и продуктами, удаляемыми антиоксидантами [128, 129]. Все основные антиоксиданты локализованы в плаценте для уменьшения окислительного стресса, и их активность зависит от степени стресса, испытываемого клетками [71]. При преэклампсии и ЗВУР антиоксидантная активность снижается по сравнению с неосложненной беременностью, как показано на рис. 1 [127].
6. Маркеры старения в неблагоприятных исходах беременности
Серьезной акушерской задачей было установить биомаркеры для выявления осложнений беременности, таких как преэклампсия и ЗВУР, в жидкостях организма матери. Различные маркеры митохондриальной дисфункции и окислительного стресса были исследованы в качестве ранних биомаркеров нарушений беременности, как показано в таблице 1. В 2012 г. Qiu et al. были первыми, кто сообщил о повышении уровня мтДНК в периферической крови матери при преэклампсии, что указывает на высокий окислительный стресс и митохондриальную дисфункцию [132]. Недавнее исследование случай-контроль, проведенное Williamson, McCarthy и Kenny, выявило повышенное количество копий мтДНК в материнской плазме на 15-20 неделе беременности в случаях преэклампсии по сравнению с контрольной группой при неосложненной беременности [133, 134].Кроме того, это исследование также продемонстрировало значительное снижение уровня антиоксидантной митохондриальной супероксиддисмутазы (mSOD) на 15-й неделе беременности у женщин, у которых позже развилась преэклампсия, тем самым подтверждая митохондриальную дисфункцию как патофизиологическое явление при преэклампсии [134]. Другое подобное исследование Marschalek et al.
Различные маркеры митохондриальной дисфункции и окислительного стресса были исследованы в качестве ранних биомаркеров нарушений беременности, как показано в таблице 1. В 2012 г. Qiu et al. были первыми, кто сообщил о повышении уровня мтДНК в периферической крови матери при преэклампсии, что указывает на высокий окислительный стресс и митохондриальную дисфункцию [132]. Недавнее исследование случай-контроль, проведенное Williamson, McCarthy и Kenny, выявило повышенное количество копий мтДНК в материнской плазме на 15-20 неделе беременности в случаях преэклампсии по сравнению с контрольной группой при неосложненной беременности [133, 134].Кроме того, это исследование также продемонстрировало значительное снижение уровня антиоксидантной митохондриальной супероксиддисмутазы (mSOD) на 15-й неделе беременности у женщин, у которых позже развилась преэклампсия, тем самым подтверждая митохондриальную дисфункцию как патофизиологическое явление при преэклампсии [134]. Другое подобное исследование Marschalek et al. показали аналогичные результаты с повышенным числом копий мтДНК в материнской сыворотке, обнаруживаемым при преэклампсии с ранним началом [135].
показали аналогичные результаты с повышенным числом копий мтДНК в материнской сыворотке, обнаруживаемым при преэклампсии с ранним началом [135].
| ||||||||||||||||||||

 Это период продолжения роста плаценты, она достигает своих окончательных размеров.
Это период продолжения роста плаценты, она достигает своих окончательных размеров.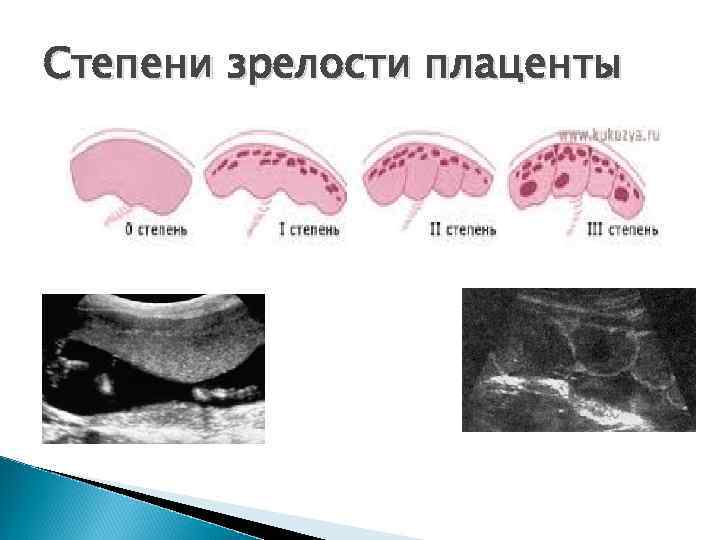
 Это связано с повышенной нагрузкой на функционально несостоятельные органы и системы, а также изменениями микроциркуляции во время беременности.
Это связано с повышенной нагрузкой на функционально несостоятельные органы и системы, а также изменениями микроциркуляции во время беременности.
 Отражение ультразвука кровью, которая движется в сосудах плаценты, зависит от скорости кровотока в системе. С помощью допплерограммы легко оценивать как количественные показатели кровоснабжения, так и качественные характеристики, косвенно свидетельствующие о состоянии сосудов.
Отражение ультразвука кровью, которая движется в сосудах плаценты, зависит от скорости кровотока в системе. С помощью допплерограммы легко оценивать как количественные показатели кровоснабжения, так и качественные характеристики, косвенно свидетельствующие о состоянии сосудов.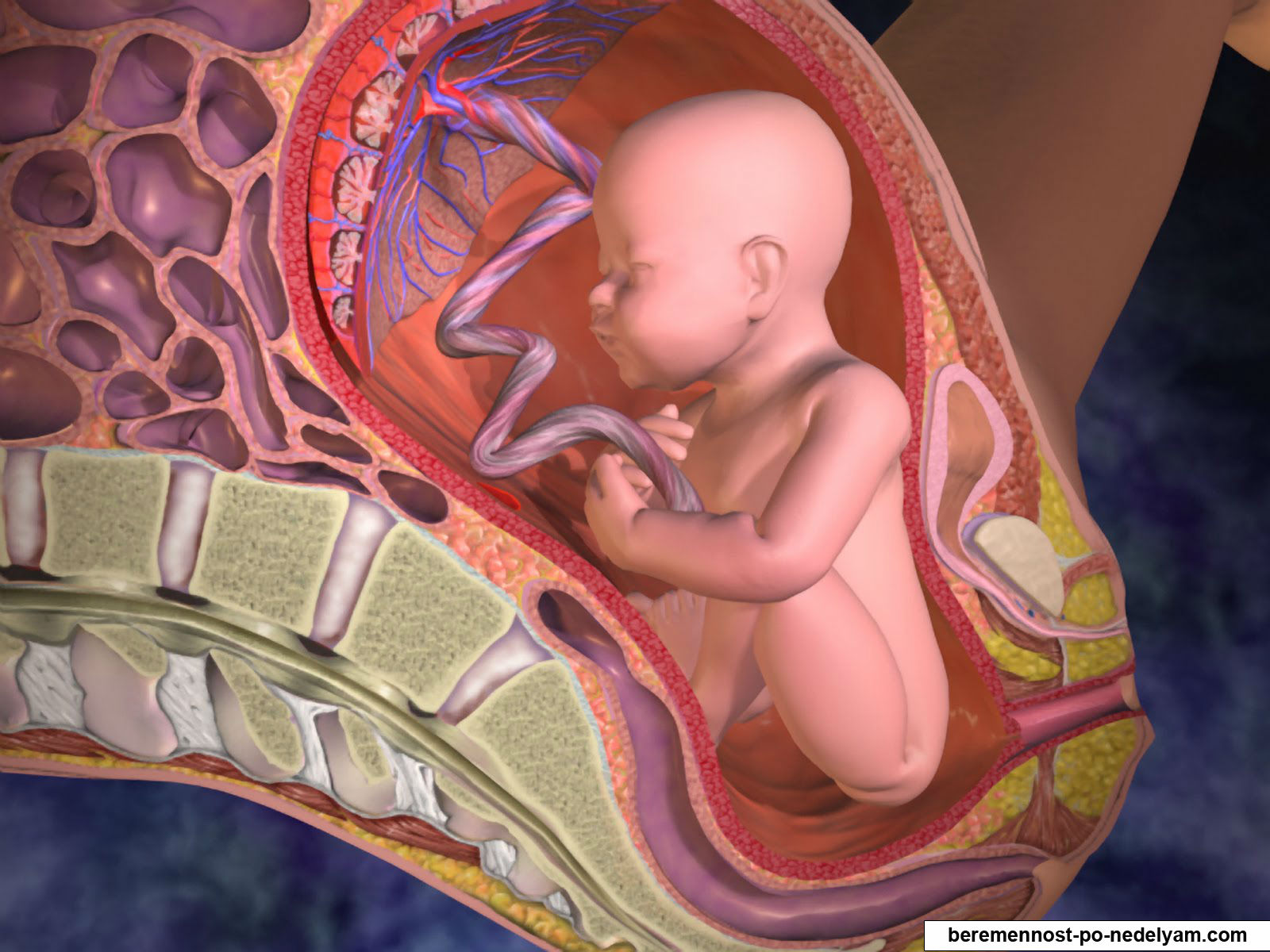
 Некоторые связанные со старением воспалительные маркеры, такие как секреторные фенотипы, связанные со старением (SASP), повышены при преэклампсии [136].
Некоторые связанные со старением воспалительные маркеры, такие как секреторные фенотипы, связанные со старением (SASP), повышены при преэклампсии [136]. микроРНК доступны в жидкостях организма и в настоящее время регулярно исследуются как биомаркеры и перспективные терапевтические средства. В матке микроРНК контролируются стероидными гормонами и отвечают за эффективную плацентацию.Недавняя работа Tan et al. заявили, что при неблагоприятных плацентарных состояниях, таких как преэклампсия, длинная некодирующая РНК, lncRNA DLX6-AS1, сверхэкспрессируется в трофобластических клеточных линиях, что приводит к усилению экспрессии mir-376c, ответственного за остановку клеточного цикла [142].
микроРНК доступны в жидкостях организма и в настоящее время регулярно исследуются как биомаркеры и перспективные терапевтические средства. В матке микроРНК контролируются стероидными гормонами и отвечают за эффективную плацентацию.Недавняя работа Tan et al. заявили, что при неблагоприятных плацентарных состояниях, таких как преэклампсия, длинная некодирующая РНК, lncRNA DLX6-AS1, сверхэкспрессируется в трофобластических клеточных линиях, что приводит к усилению экспрессии mir-376c, ответственного за остановку клеточного цикла [142]. При осложнениях беременности хронический окислительный стресс приводит к митохондриальной дисфункции, что приводит к потере стабильности митохондриальной передачи сигналов [102]. Антиоксидантные добавки, такие как витамины С и Е, принимаемые во время беременности, не продемонстрировали каких-либо значительных эффектов в снижении окислительного стресса.
При осложнениях беременности хронический окислительный стресс приводит к митохондриальной дисфункции, что приводит к потере стабильности митохондриальной передачи сигналов [102]. Антиоксидантные добавки, такие как витамины С и Е, принимаемые во время беременности, не продемонстрировали каких-либо значительных эффектов в снижении окислительного стресса. демонстрирует, что беременные крысы, получавшие митохондриально-направленный антиоксидант MitoQ, демонстрируют нормализованные объемы плаценты и восстановленное ограничение роста плода в условиях гипоксии [144]. Кроме того, они обсудили, что MitoQ может регулировать клеточный цикл через сигнальный путь пролиферации MAPK [144].
демонстрирует, что беременные крысы, получавшие митохондриально-направленный антиоксидант MitoQ, демонстрируют нормализованные объемы плаценты и восстановленное ограничение роста плода в условиях гипоксии [144]. Кроме того, они обсудили, что MitoQ может регулировать клеточный цикл через сигнальный путь пролиферации MAPK [144]. При неблагоприятных исходах беременности, таких как преэклампсия и задержка роста плода, плацентарная недостаточность сопровождается аберрантной сигнализацией преждевременного старения плаценты и апоптоза.Как показано на рисунке 1, в этом обзоре освещаются современные знания о роли плацентарной митохондриальной дисфункции, клеточного старения и оси старения плаценты в неблагоприятных исходах беременности.
При неблагоприятных исходах беременности, таких как преэклампсия и задержка роста плода, плацентарная недостаточность сопровождается аберрантной сигнализацией преждевременного старения плаценты и апоптоза.Как показано на рисунке 1, в этом обзоре освещаются современные знания о роли плацентарной митохондриальной дисфункции, клеточного старения и оси старения плаценты в неблагоприятных исходах беременности.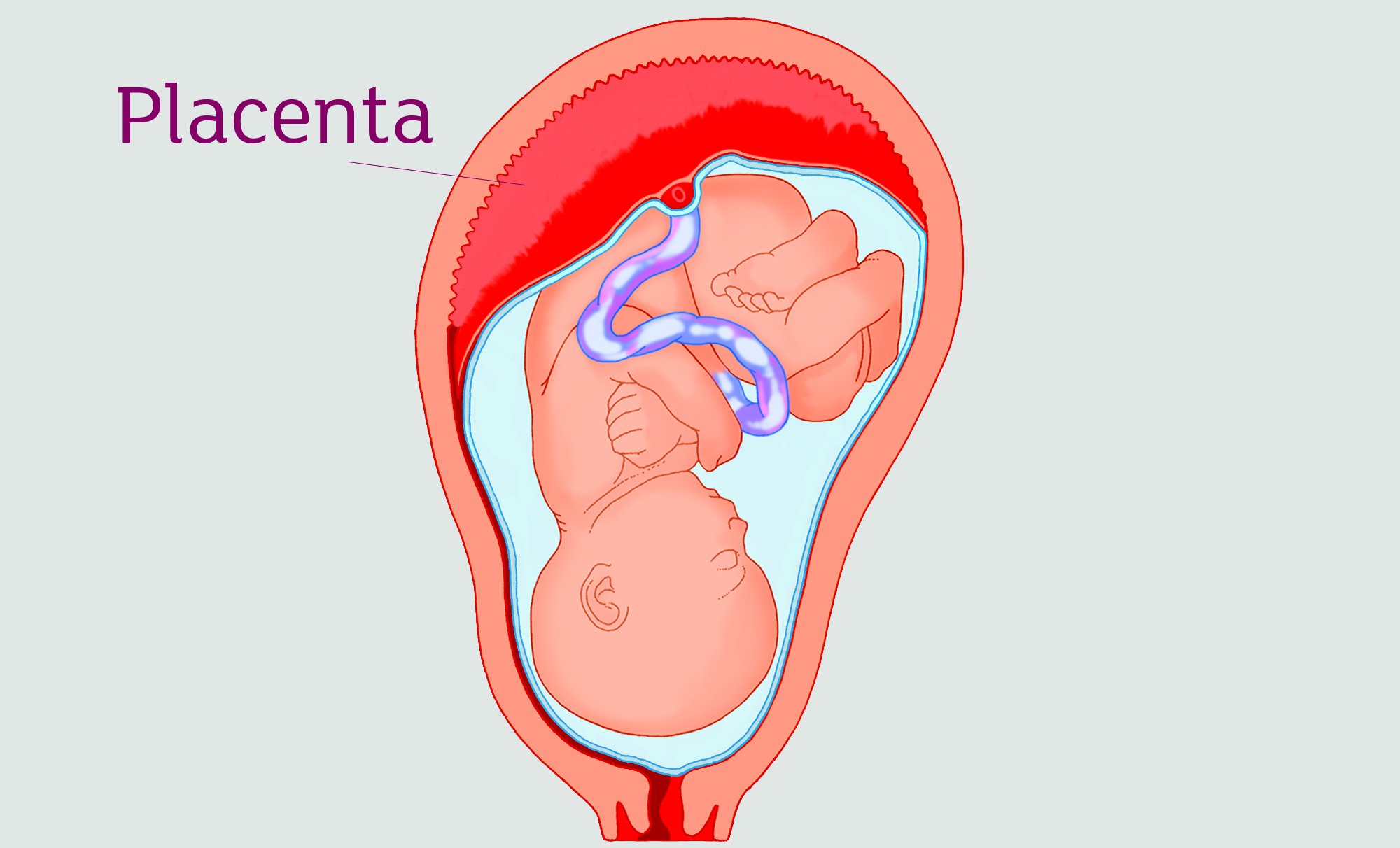 .iplacenta.eu).
.iplacenta.eu).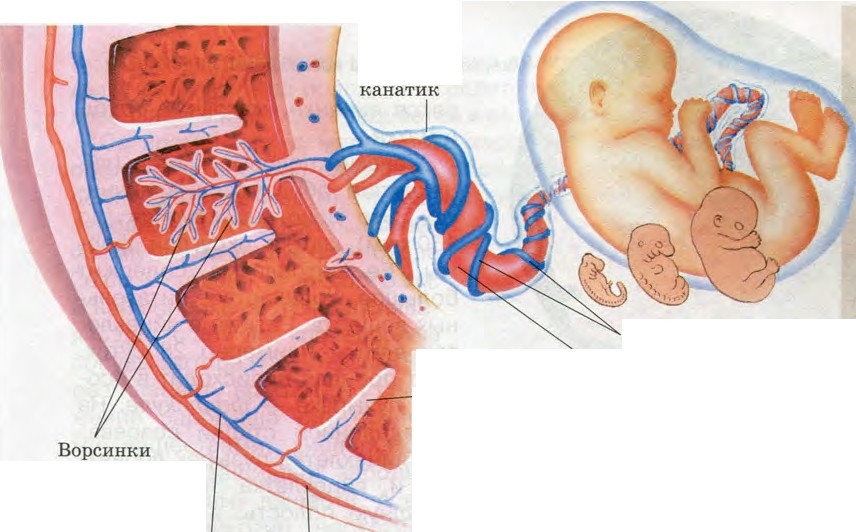
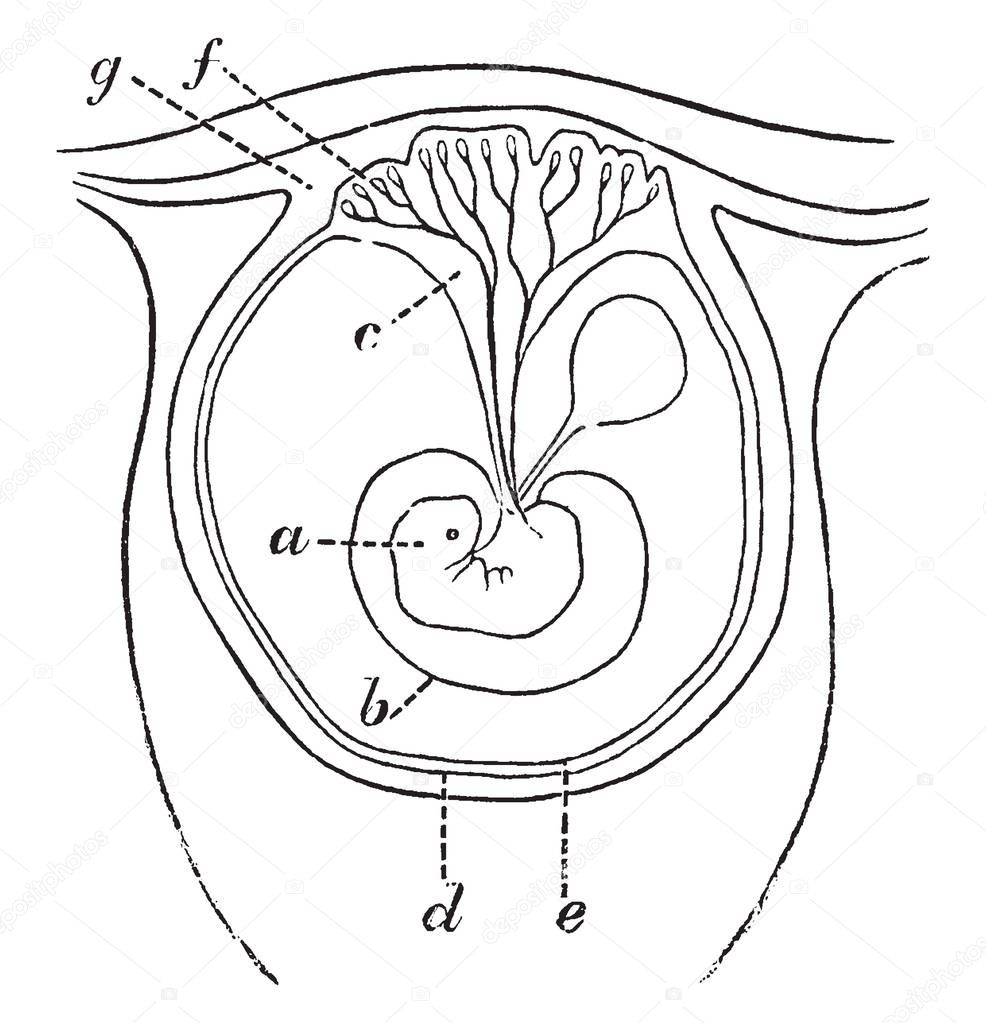 Чаще встречается у небелых женщин, у женщин старше 35 лет и у пациентов, которые курят или употребляют кокаин.
Чаще встречается у небелых женщин, у женщин старше 35 лет и у пациентов, которые курят или употребляют кокаин. Причиной также может быть быстрая потеря амниотической жидкости, которая смягчает положение ребенка в матке.
Причиной также может быть быстрая потеря амниотической жидкости, которая смягчает положение ребенка в матке. Иногда часть или все это зависает. Его удаление может привести к сильной кровопотере после родов.Иногда в таком случае врач должен выполнить гистерэктомию.
Иногда часть или все это зависает. Его удаление может привести к сильной кровопотере после родов.Иногда в таком случае врач должен выполнить гистерэктомию. Так мы улучшаем результаты».
Так мы улучшаем результаты».


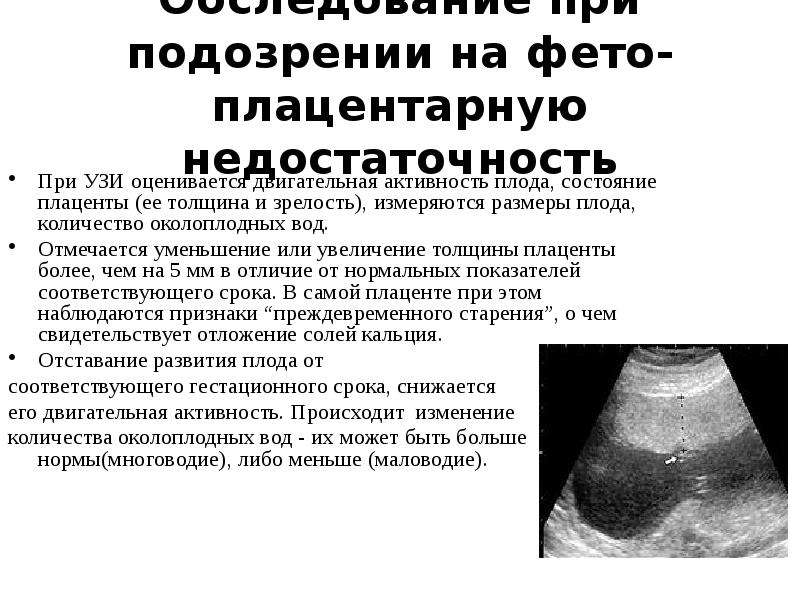 в журнале «Происхождение развития здоровья и болезней». Исследование было поддержано грантами Национального института старения для Crimmins (P30-AG017265) и Finch (R01-AG051521, P01-AG055367).
в журнале «Происхождение развития здоровья и болезней». Исследование было поддержано грантами Национального института старения для Crimmins (P30-AG017265) и Finch (R01-AG051521, P01-AG055367). Мы исследовали маркеры старения при нормальной беременности, а также при патологической и переношенной беременности. Индукторы окислительного стресса использовали для имитации изменений старения у доношенных эксплантатов.
Мы исследовали маркеры старения при нормальной беременности, а также при патологической и переношенной беременности. Индукторы окислительного стресса использовали для имитации изменений старения у доношенных эксплантатов.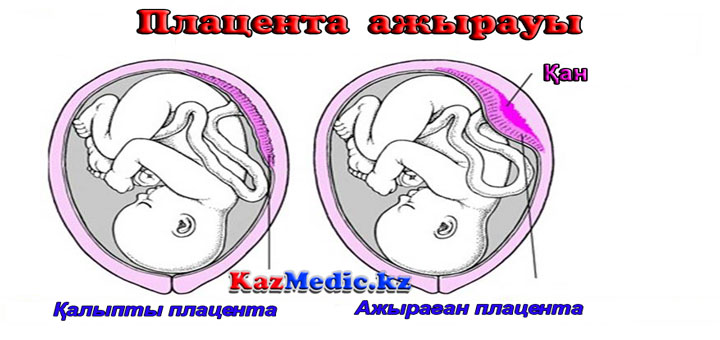 Аномальные проявления ядер наблюдались в перезрелых плацентах. Окрашивание Суданом-Блэком-В продемонстрировало обильный липофусцин, совокупность окисленных белков, липидов и металлов, в перезрелых и патологических плацентах. Процент ядер, положительных на 8-гидрокси-2′-дезоксигуанозин, маркер окисленной ДНК/РНК, был увеличен в патологических плацентах по сравнению с контрольной группой того же возраста. Эти изменения могут быть воспроизведены путем заражения HR или H 2 O 2 .
Аномальные проявления ядер наблюдались в перезрелых плацентах. Окрашивание Суданом-Блэком-В продемонстрировало обильный липофусцин, совокупность окисленных белков, липидов и металлов, в перезрелых и патологических плацентах. Процент ядер, положительных на 8-гидрокси-2′-дезоксигуанозин, маркер окисленной ДНК/РНК, был увеличен в патологических плацентах по сравнению с контрольной группой того же возраста. Эти изменения могут быть воспроизведены путем заражения HR или H 2 O 2 . Опубликовано Elsevier Ltd.
Опубликовано Elsevier Ltd.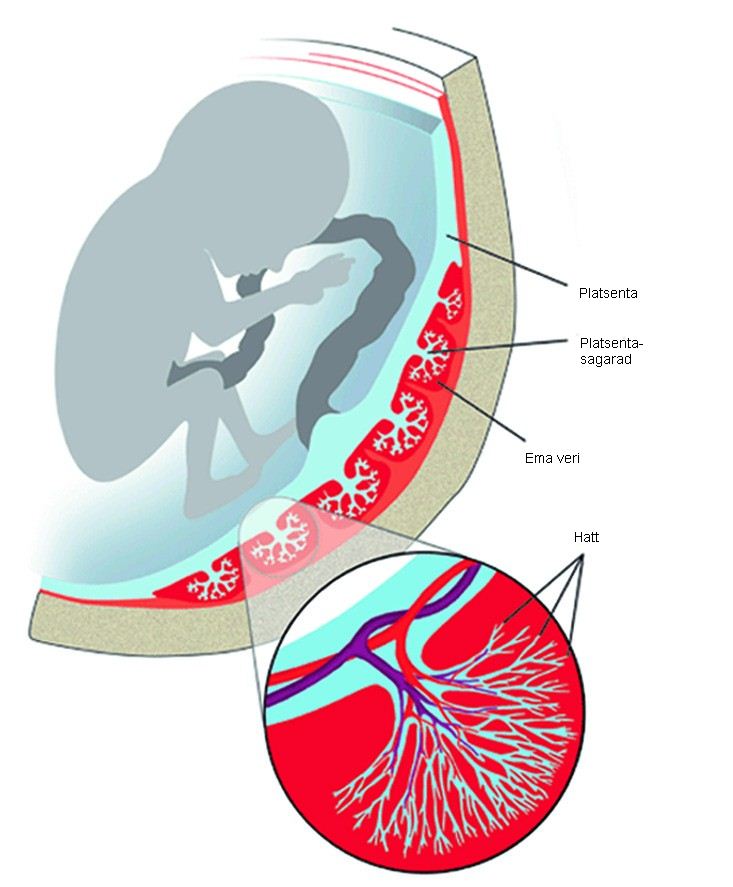 Некоторые из этих вопросов включают.
Некоторые из этих вопросов включают.
 Убедитесь, что вы получаете хороший дородовой уход, и проконсультируйтесь со своим акушером, если вы считаете, что что-то не так.
Убедитесь, что вы получаете хороший дородовой уход, и проконсультируйтесь со своим акушером, если вы считаете, что что-то не так. Педиатрия. 2004; 113 (4 Приложение): 1037–43.
Педиатрия. 2004; 113 (4 Приложение): 1037–43. , Пателару Э., Порта Д., Постма Д., Раашу-Нильсен О., Руднаи П., Суньер Дж., Стефану Э., Соренсен М., Тьеринг Э., Таффнелл Д., Варро М.Дж., Врижкотте Т.Г., Вийга А., Вильгельм М., Райт Дж., Ньювенхейсен М.Дж., Персхаген Г., Брунекриф Б., Когевинас М., Слама Р.Загрязнение атмосферного воздуха и низкая масса тела при рождении: европейское когортное исследование (ESCAPE). Ланцет Респир Мед. 2013;1(9):695–704.
, Пателару Э., Порта Д., Постма Д., Раашу-Нильсен О., Руднаи П., Суньер Дж., Стефану Э., Соренсен М., Тьеринг Э., Таффнелл Д., Варро М.Дж., Врижкотте Т.Г., Вийга А., Вильгельм М., Райт Дж., Ньювенхейсен М.Дж., Персхаген Г., Брунекриф Б., Когевинас М., Слама Р.Загрязнение атмосферного воздуха и низкая масса тела при рождении: европейское когортное исследование (ESCAPE). Ланцет Респир Мед. 2013;1(9):695–704. Л., Бонзини М., Брауэр М., Дэрроу Л.А., Геринг У., Глинианаия С.В., Гувейя Н., Ха Э.Х., Лим Дж.Х., ван ден Хувен Э.Х., Джалалудин Б., Джесдейл Б.М., Лепель Дж., Морелло-Фрош Р., Морган Г.Г., Песатори А.С., Пиерик Ф.Х., Плесс-Муллоли Т., Рич Д.К., Сатьянараяна С., Сео Дж., Слама Р., Стрикленд М., Тамбурик Л., Вартенберг Д., Ньювенхуйсен М.Дж., Вудрафф Т.Дж.Воздействие на матерей загрязнения воздуха твердыми частицами и масса тела при рождении в срок: многострановая оценка воздействия и неоднородности. Перспектива охраны окружающей среды. 2013;121(3):267–373.
Л., Бонзини М., Брауэр М., Дэрроу Л.А., Геринг У., Глинианаия С.В., Гувейя Н., Ха Э.Х., Лим Дж.Х., ван ден Хувен Э.Х., Джалалудин Б., Джесдейл Б.М., Лепель Дж., Морелло-Фрош Р., Морган Г.Г., Песатори А.С., Пиерик Ф.Х., Плесс-Муллоли Т., Рич Д.К., Сатьянараяна С., Сео Дж., Слама Р., Стрикленд М., Тамбурик Л., Вартенберг Д., Ньювенхуйсен М.Дж., Вудрафф Т.Дж.Воздействие на матерей загрязнения воздуха твердыми частицами и масса тела при рождении в срок: многострановая оценка воздействия и неоднородности. Перспектива охраны окружающей среды. 2013;121(3):267–373.
/imgs/2019/01/11/16/2881868/c7d1b6ab8d63ffb85af044be08754d2629267215.jpg)
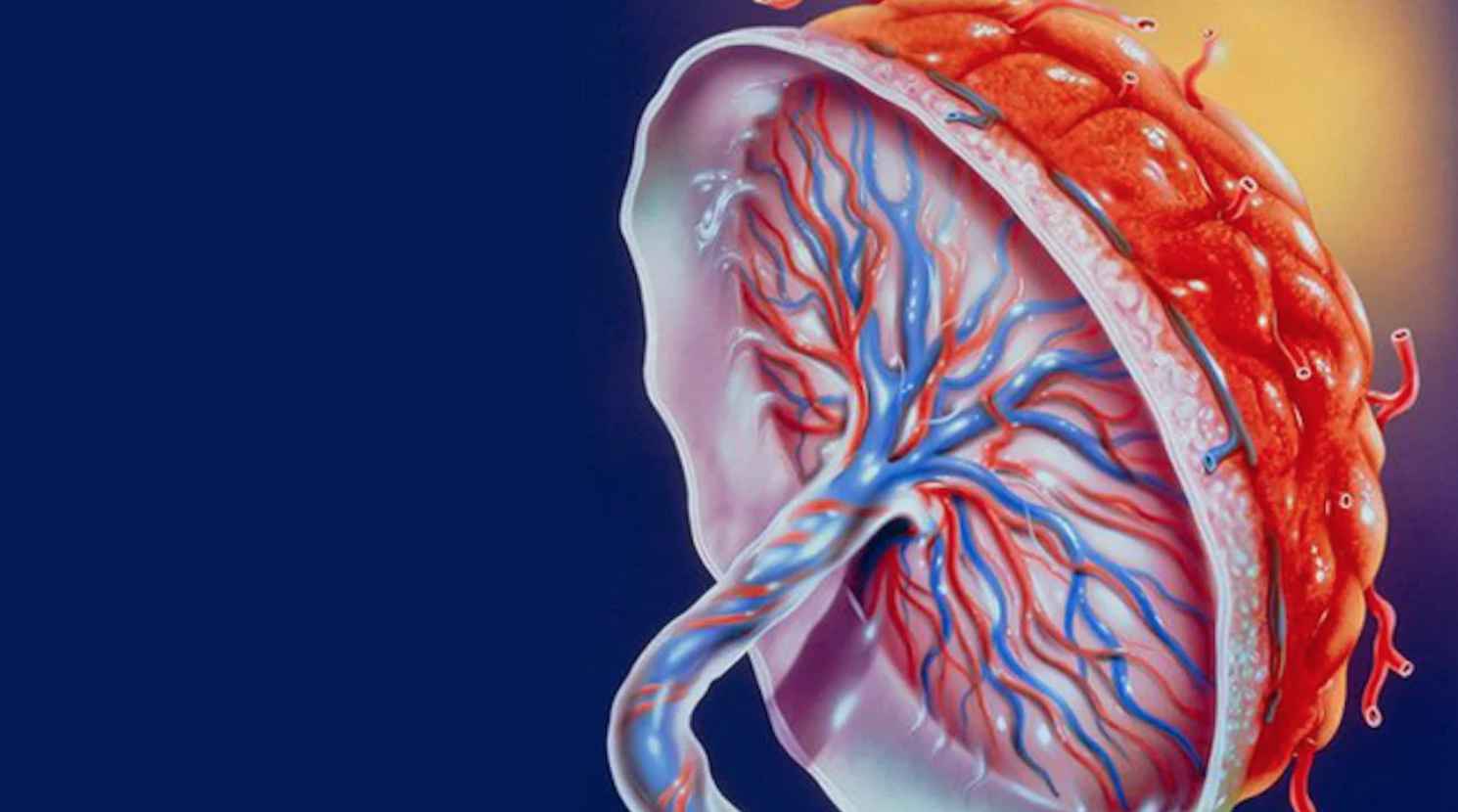 Окружающая среда Интерн. 2017; 100:139–47.
Окружающая среда Интерн. 2017; 100:139–47. , Фоккенс П.Х., Агьер Л., Буре Дж.А., Кэсси Ф.Р., Слама Р., Чаватт-Палмер П.Воздействие на мать разбавленных выхлопных газов дизельного двигателя изменяет функцию плаценты и вызывает межпоколенческие эффекты у кроликов. Часть клетчатки Toxicol. 2016;13(1):39.
, Фоккенс П.Х., Агьер Л., Буре Дж.А., Кэсси Ф.Р., Слама Р., Чаватт-Палмер П.Воздействие на мать разбавленных выхлопных газов дизельного двигателя изменяет функцию плаценты и вызывает межпоколенческие эффекты у кроликов. Часть клетчатки Toxicol. 2016;13(1):39. 2017;196(7):873–81.
2017;196(7):873–81.
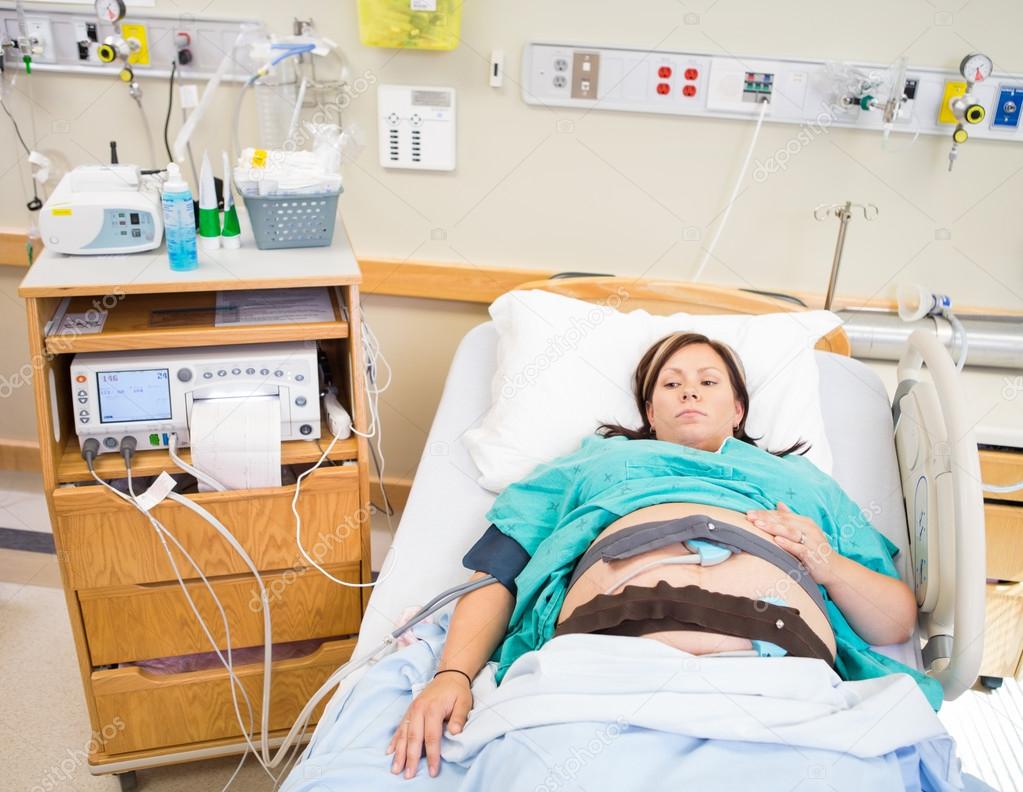 , Янссен Б.Г., Ванпоук К., Лефевр В., Ходжа М., Боллати В., Наврот Т.С. Окислительное повреждение митохондриальной ДНК и воздействие загрязнения воздуха твердыми частицами у пар мать-новорожденный. Здоровье окружающей среды. 2016;15:10.
, Янссен Б.Г., Ванпоук К., Лефевр В., Ходжа М., Боллати В., Наврот Т.С. Окислительное повреждение митохондриальной ДНК и воздействие загрязнения воздуха твердыми частицами у пар мать-новорожденный. Здоровье окружающей среды. 2016;15:10.
 , Робинсон О., Суньер Дж., Вермеулен Р., Вриенс А., Фрихайд М., Хендерсон Дж., Винейс П.Метилом ДНК указывает на воздействие твердых частиц в трех временных точках в раннем возрасте. Технологии экологических наук. 2018;52(9):5427–37.
, Робинсон О., Суньер Дж., Вермеулен Р., Вриенс А., Фрихайд М., Хендерсон Дж., Винейс П.Метилом ДНК указывает на воздействие твердых частиц в трех временных точках в раннем возрасте. Технологии экологических наук. 2018;52(9):5427–37.
 Воздействие твердых частиц в воздухе на ранних сроках беременности связано с метилированием плацентарной ДНК.Научная общая среда. 2017; 607–608:1103–8.
Воздействие твердых частиц в воздухе на ранних сроках беременности связано с метилированием плацентарной ДНК.Научная общая среда. 2017; 607–608:1103–8.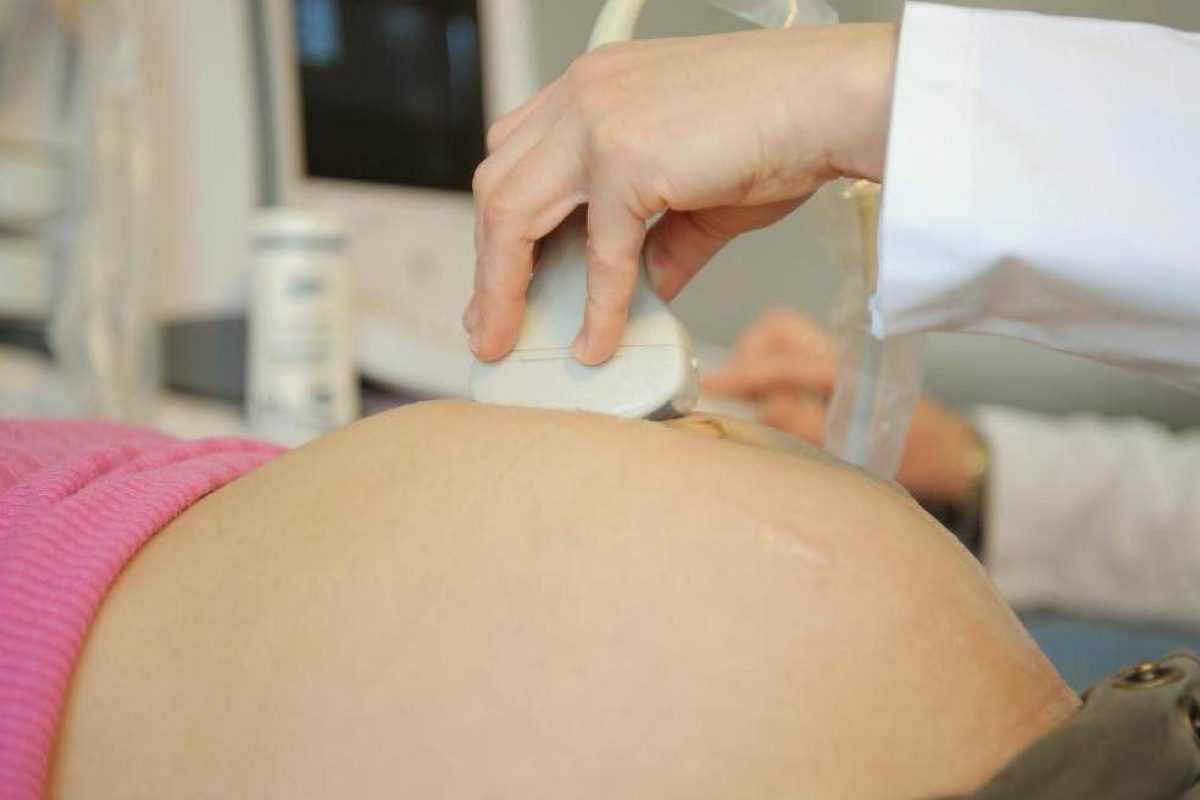 Окружающая среда Интерн. 2018; 118: 334–47.
Окружающая среда Интерн. 2018; 118: 334–47.
 2018;2(4):e174–e83.
2018;2(4):e174–e83. , Лефевр В., Де Боевер П., Наврот Т.С. Более низкое метилирование промотора плацентарного лептина в связи с загрязнением воздуха мелкодисперсными частицами во время беременности и плацентарным нитрозативным стрессом при рождении в когорте ENVIRONAGE. Перспектива охраны окружающей среды. 2017;125(2):262–8.
, Лефевр В., Де Боевер П., Наврот Т.С. Более низкое метилирование промотора плацентарного лептина в связи с загрязнением воздуха мелкодисперсными частицами во время беременности и плацентарным нитрозативным стрессом при рождении в когорте ENVIRONAGE. Перспектива охраны окружающей среды. 2017;125(2):262–8. 2013;10:18.
2013;10:18.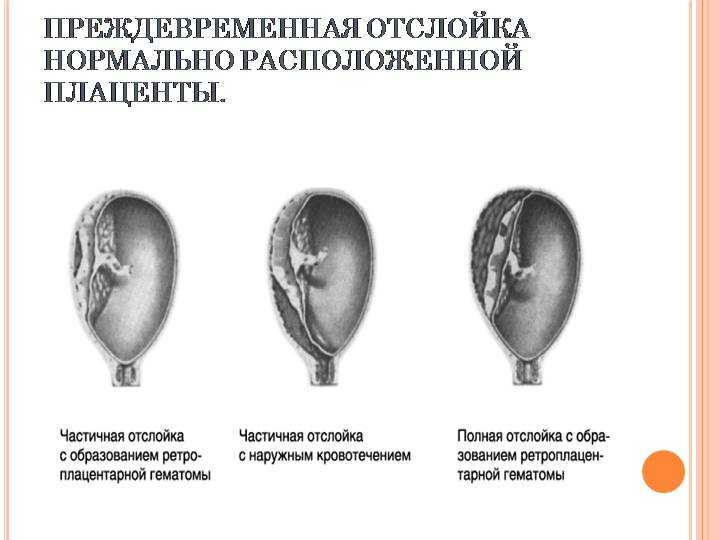 J Cell Mol Med. 2018;22(5):2760–73.
J Cell Mol Med. 2018;22(5):2760–73.

 Загрязнение окружающей среды. 2018; 242 (часть A: 182–90.
Загрязнение окружающей среды. 2018; 242 (часть A: 182–90. Эпигенетика. 2018;13(2):135–46.
Эпигенетика. 2018;13(2):135–46. бмж. 2014;349:g4227.
бмж. 2014;349:g4227. Aging Res Rev. 2018; 48:11–20.
Aging Res Rev. 2018; 48:11–20. Перспектива охраны окружающей среды. 2012;120(9):1346–52.
Перспектива охраны окружающей среды. 2012;120(9):1346–52. ПЛОС Один. 2013;8(4):e60815.
ПЛОС Один. 2013;8(4):e60815.

 Научный доклад 2017; 7 (1): 4210.
Научный доклад 2017; 7 (1): 4210.


 Nat Struct Mol Biol. 2008;15(9):998.
Nat Struct Mol Biol. 2008;15(9):998. Вызванное старением нарушение регуляции dicer1-зависимой микроРНК экспрессия ухудшает ангиогенную способность цереброваскулярных эндотелиальных клеток крыс.J Gerontol A Biol Sci Med Sci. 2013;68(8):877–91.
Вызванное старением нарушение регуляции dicer1-зависимой микроРНК экспрессия ухудшает ангиогенную способность цереброваскулярных эндотелиальных клеток крыс.J Gerontol A Biol Sci Med Sci. 2013;68(8):877–91. Окружающая среда Интерн. 2017;98:198–203.
Окружающая среда Интерн. 2017;98:198–203. Энвайрон Мол Мутаген. 2014;55(5):428–35.
Энвайрон Мол Мутаген. 2014;55(5):428–35. Curr Environ Health Rep. 2018;5(4):544-578.
Curr Environ Health Rep. 2018;5(4):544-578.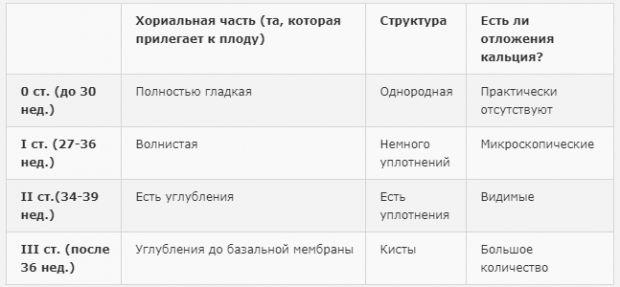 , Марсит С.Дж., Макардл В., Мелен Э., Мелтон П., Мерфи С.К., Наврот Т.С., Нистико Л., Нор Э.А. , Nordlund B, Nystad W, Oh SS, Oken E, Page CM, Perron P, Pershagen G, Pizzi C, Plu Сквин М., Райкконен К., Риз С.Е., Райшл Э., Ричиарди Л., Ринг С., Рой Р.П., Рзехак П., Шотерс Г., Шварц Д.А., Себерт С., Снидер Х., Соренсен Т.И.А., Старлинг А.П., Суньер Дж., Тейлор Дж.А., Тимейер Х. , Уллемар В., Вафиади М., Ван Айзендорн М.Х., Вонк Дж.М., Вриенс А., Врийхейд М., Ван П., Вимелс Дж.Л., Уилкокс А.Дж., Райт Р.Дж., Сюй СиДжей, Сюй З., Ян И.В., Юсефи П., Чжан Х., Чжан В., Чжао С., Ага Г., Релтон С.Л., Джаддо VWV, Лондон С.Дж.Профиль когорты: Консорциум эпигенетики беременности и детства (PACE). Int J Эпидемиол. 2018;47(1):22–3у.
, Марсит С.Дж., Макардл В., Мелен Э., Мелтон П., Мерфи С.К., Наврот Т.С., Нистико Л., Нор Э.А. , Nordlund B, Nystad W, Oh SS, Oken E, Page CM, Perron P, Pershagen G, Pizzi C, Plu Сквин М., Райкконен К., Риз С.Е., Райшл Э., Ричиарди Л., Ринг С., Рой Р.П., Рзехак П., Шотерс Г., Шварц Д.А., Себерт С., Снидер Х., Соренсен Т.И.А., Старлинг А.П., Суньер Дж., Тейлор Дж.А., Тимейер Х. , Уллемар В., Вафиади М., Ван Айзендорн М.Х., Вонк Дж.М., Вриенс А., Врийхейд М., Ван П., Вимелс Дж.Л., Уилкокс А.Дж., Райт Р.Дж., Сюй СиДжей, Сюй З., Ян И.В., Юсефи П., Чжан Х., Чжан В., Чжао С., Ага Г., Релтон С.Л., Джаддо VWV, Лондон С.Дж.Профиль когорты: Консорциум эпигенетики беременности и детства (PACE). Int J Эпидемиол. 2018;47(1):22–3у. Острые изменения метилирования ДНК в связи с 24-часовыми измерениями личного воздействия загрязнения воздуха: панельное исследование в четырех европейских странах.Окружающая среда Интерн. 2018;120:11–21.
Острые изменения метилирования ДНК в связи с 24-часовыми измерениями личного воздействия загрязнения воздуха: панельное исследование в четырех европейских странах.Окружающая среда Интерн. 2018;120:11–21. Эпигенетика окружающей среды. 2016;2(2):dvw005.
Эпигенетика окружающей среды. 2016;2(2):dvw005.
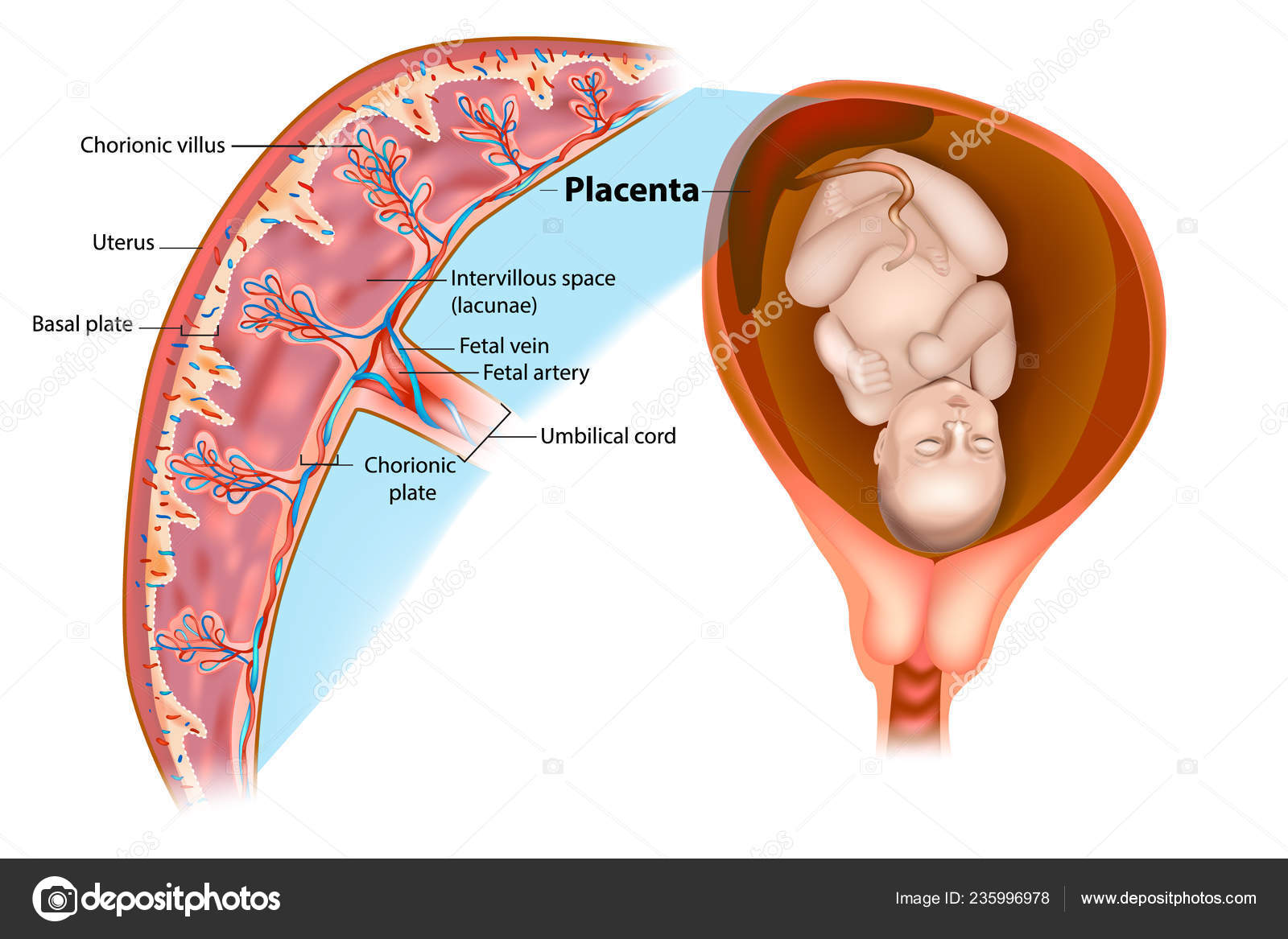 Этот мешок обеспечивает питание ребенка до тех пор, пока через несколько недель полностью не сформируется плацента. К 18-20 неделе беременности плацента полностью развивается и берет на себя передачу кислорода и питательных веществ к оплодотворенной яйцеклетке, обеспечивая полноценное питание плода.
Этот мешок обеспечивает питание ребенка до тех пор, пока через несколько недель полностью не сформируется плацента. К 18-20 неделе беременности плацента полностью развивается и берет на себя передачу кислорода и питательных веществ к оплодотворенной яйцеклетке, обеспечивая полноценное питание плода.