причины появления, симптомы заболевания, диагностика и способы лечения
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.Определение
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений — от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Резервуаром и источником инфекции является только человек.
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% — то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.

- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело — вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования — общие и специфические:
- общий анализ крови;
Инструментальные исследования (УЗИ, рентген, КТ, МРТ, ЭЭГ, ЭКГ и ЭХО-КГ) назначают в зависимости от симптоматики и локализации поражения.
К каким врачам обращаться
С первичными жалобами пациенты обращаются к
врачу-терапевту или врачу общей практики (семейному врачу), детей ведет
врач-педиатр. Могут потребоваться консультации инфекциониста — для верификации диагноза, стоматолога — при поражениях слизистой оболочки рта,
кардиолога — при наличии врожденного порока сердца, нейрохирурга — при пороках центральной нервной системы,
невропатолога — для оценки неврологической патологии, гематолога — при выраженных гематологических изменениях и геморрагическом синдроме, окулиста — для исследования глазного дна, отоларинголога — для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию — для восстановления обмена веществ в организме;
- симптоматическую терапию — для купирования воспалительных и токсических проявлений заболевания.

У людей с ослабленным иммунитетом (у ВИЧ-инфицированных, у пациентов после химиотерапии по поводу злокачественных новообразований, иммуносупрессивной терапии при трансплантации внутренних органов) цитомегаловирус способен вызвать тяжелые осложнения (поражение центральной нервной системы, глаз, легких, пищеварительной системы).
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Источники:
- Клинические рекомендации «Цитомегаловирусная болезнь у взрослых». Некоммерческая корпоративная организация «Международная ассоциация специалистов в области инфекций. Утв. Минздравом России, 2019.
- Извекова И.Я., Михайленко М.А., Краснова Е И. Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения. Лечащий врач № 4/2018. С. 90-95.
- Заплатников А.Л., Шахгильдян В.И., Подзолкова Н.М. Возможно ли предупредить последствия врожденной цитомегаловирусной инфекции? (взгляд акушера-гинеколога, инфекциониста и неонатолога). РМЖ «Медицинское обозрение» № 10 от 10.12.2018. С. 45-50.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информация проверена экспертом
Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Определение антител класса M (IgM) к цитомегаловирусу (Cytomegalovirus) в крови
Цитомегаловирусная инфекция относится к группе TORCH-инфекций. TORCH-инфекции — это особая категория инфекционных патологий, возбудители которых склонны к преодолению фетоплацентарного барьера и поражению ребенка в момент закладки основных органов и тканей, результатом чего является развитие разнообразных аномалий и дисфункций внутренних органов плода и даже внутриутробная гибель. Название образовано начальными буквами в латинских наименованиях инфекций — Toxoplasma, Rubella, Cytomegalovirus, Herpes.
Название образовано начальными буквами в латинских наименованиях инфекций — Toxoplasma, Rubella, Cytomegalovirus, Herpes.
Антитела класса IgM к цитомегаловирусу (ЦМВ) появляются в течение 1−2 недель после начала заболевания и свидетельствуют о свежем инфицировании или реактивации латентной и персистентной инфекции. Однако следует иметь в виду, что
у части больных повышения содержания антител класса IgM может не происходить в течение первых 4 недель после начала заболевания. Повышенное содержание антител класса IgM к ЦМВ может сохраняться в течение 12 месяцев у 24% пациентов.
Общая информация об инфекции
Цитомегаловирусная инфекция вызывается вирусом (CMV), относящимся к семейству вирусов герпеса человека типа 5. Эта повсеместно распространенная инфекция, которая характеризуется пожизненной персистенцией вируса в организме, при этом в некоторых случаях может происходить реактивация и рецидивы инфекции.
В крови взрослых людей присутствуют антитела к ЦМВ в 40 – 100% популяции, причем частота обнаружения серопозитивных результатов находится в обратной корреляции с социально-экономическим статусом человека.
В зависимости от сроков и механизмов инфицирования различают:
I. Перинатальное инфицирование.
Пренатальное:
выкидыши, мертворождения;
пороки развития;
врожденная цитомегаловирусная инфекция.
2. Интра- и постнатальное:
острое инфекционное заболевание;
латентное носительство, субклинические формы хронической инфекции;
реактивация инфекции.
II. Инфицирование через кровь, слюну, мочу, при сексуальном контакте.
Острое инфекционное заболевание.
Латентное носительство.
Реактивация инфекции.
Цитомегаловирусная инфекция, как правило, протекает в мягкой бессимптомной форме. Однако, при первичном инфицировании женщины во время беременности существует высокий риск внутриутробной передачи, что может привести к тяжелым поражениям плода, включая задержку роста и умственного развития, желтуху и аномалии развития центральной нервной системы. У детей с бессимптомной врожденной цитомегаловирусной инфекцией могут развиваться поздние проявления, такие как нарушения слуха и обучаемости. Доля пренатально инфицированных составляет примерно 0,2-2,5% всех живорожденных детей, 10% из которых погибают в течении первого года жизни.
Доля пренатально инфицированных составляет примерно 0,2-2,5% всех живорожденных детей, 10% из которых погибают в течении первого года жизни.
Примерно у 10% сероположительных женщин происходит реактивация ЦМВ-инфекции во время беременности, однако частота инфицирования плода в случае реактивации инфекции составляет около 1%, по сравнению с 40% вероятностью вертикальной передачи в случаях первичного заражения беременной женщины.
Риск развития тяжелой формы заболевания существует также для пациентов с иммунодефицитными состояниями: пациенты отделений трансплантации органов, ВИЧ-инфицированные, онкологические больные. Для лечения таких больных должны применяться только серонегативные продукты крови.
Показания для назначения данного исследования:
1. При подготовке к беременности и во время контроля за ней (согласно приложению 2 приказа Минздрава РФ от 10 февраля 2003 г. №50 «Схемы динамического наблюдения беременных и родильниц»).
2. Скрининг серонегативных доноров крови и ее компонентов.
3.Клиническая картина острой формы ЦМВ-инфекции (лихорадка, атипичная пневмония у детей, гепато- и спленомегалия).
4. Оценка серологического статуса по отношению к ЦМВ у новорожденных при подозрении на перинатальное инфицирование.
3. Иммунодефицитные состояния.
Литература:
1. Инфекционные болезни и эпидемиология: Учебник / В.И. Покровский, С.Г. Пак, Н.И. Брико, Б.К. Данилкин. -2-е изд. — М.: ГЭОТАР — Медиа, 2007.
2.Кишкун А.А. Иммунологические исследования и методы диагностики инфекционных заболеваний в клинической практике. — М.: ООО «Медицинское информационное агентство», 2009. С. 428-434.
3. Приказ Министерства Здравоохранения РФ от 10 февраля 2003 года №50 «О совершенствовании акушерско-гинекологической помощи в амбулаторно-поликлинических учреждениях». Приложение 2. Схемы динамического наблюдения беременных и родильниц.
Сдать анализ: Цитомегаловирус (CMV) плазма ПЦР – количественное исследование
Описание анализа:
Цитомегаловирус (CMV) (плазма крови, слюна) количественное исследование методом ПЦР – анализ, применяемый для определения наличия в крови или слюне ДНК цитомегаловируса. Это очень распространенный вирус, родственный герпесу, а потому так же способный скрыто существовать в организме годами.
Это очень распространенный вирус, родственный герпесу, а потому так же способный скрыто существовать в организме годами.
Незаметности CMV способствует тот факт, что даже первичное заражение, в отличие от герпеса, может произойти без ощутимых для пациента симптомов. При адекватной реакции иммунитета инфицированный человек обычно ощущает легкое недомогание, схожее с началом простуды, которому, как правило, не придает особого значения.
Картина меняется при ослабленном иммунитете, тогда зараженный человек может жаловаться на головные боли, повышение температуры и увеличение лимфоузлов. Что характерно, чем слабее иммунитет – тем ярче выражены симптомы, а в случае тяжелых иммунодефицитов (такой бывает, к примеру, при ВИЧ) цитомегаловирусная инфекция способна вызвать смерть пациента.
Отдельную опасность цитомегаловирус составляет для беременных женщин и вынашиваемого ими ребенка, провоцируя замершую беременность, выкидыши и врожденные патологии развития (микроцефалия, поражения печени, селезенки, глухота, отставание в развитии). Такое негативное влияние на плод позволяет отнести цитомегаловирус к группе TORCH-инфекций и включить в пакет обследований, рекомендованных при планировании беременности и обязательных после её начала.
Такое негативное влияние на плод позволяет отнести цитомегаловирус к группе TORCH-инфекций и включить в пакет обследований, рекомендованных при планировании беременности и обязательных после её начала.
Показания к количественному исследованию на цитомегаловирус
Обследование обычно назначают гинекологи, а также терапевты, педиатры (или неонатологи) и инфекционисты.
В гинекологии анализ обычно назначают:
- женщинам, планирующим беременность или уже беременным;
- в случае подозрения на внутриутробную инфекцию;
- если у обследуемой женщины ранее были случаи замирания беременности или выкидыши;
- при фетоплацентарной недостаточности.
Неонатолог назначает обследование при:
- заражении матери во время беременности;
- наличии проявлений врожденной инфекции.
Педиатр может назначить анализ при атипичном течении пневмонии у ребенка, а инфекционист — в случае инфекционного мононуклеоза при негативном тесте на вирус Эпштейна-Барр.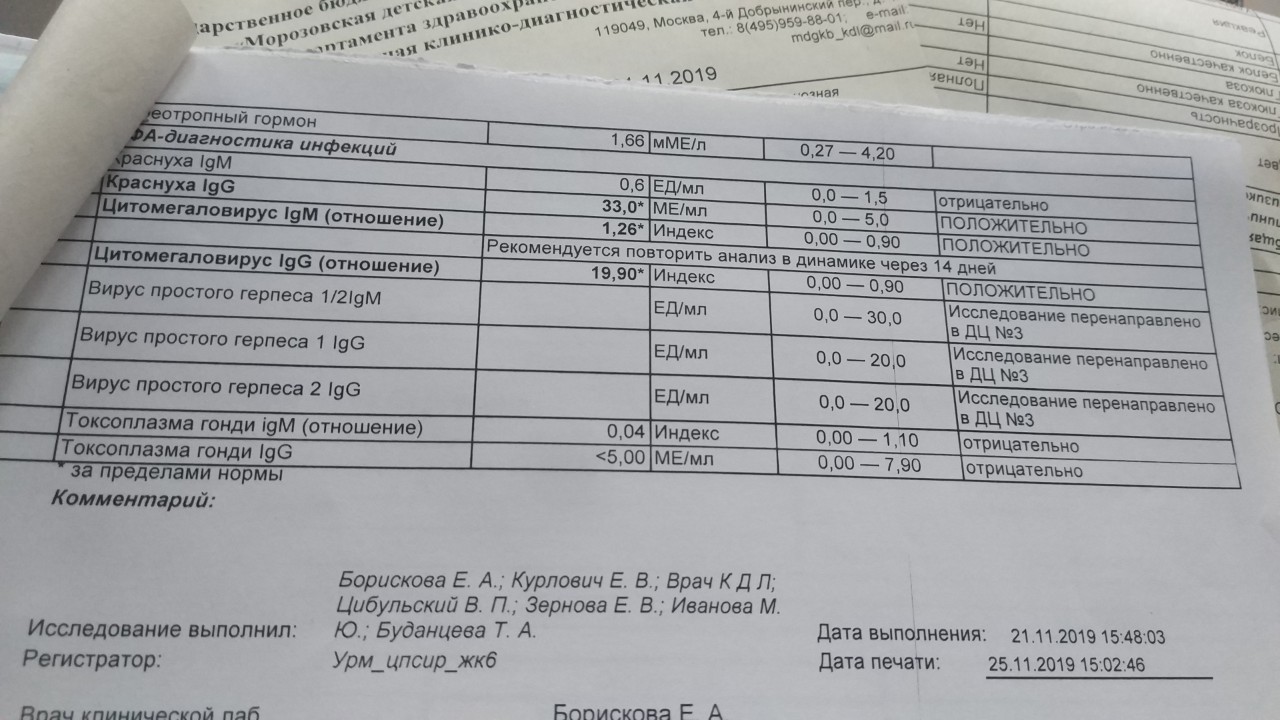
Количественное определение количества ДНК вируса в обследуемом материале необходимо для контроля успешности лечения и наблюдения инфекции в динамике.
Результаты анализа
Количество генетического материала цитомегаловируса измеряется в количестве копий ДНК на миллилитр. Если данный показатель менее 400, значит, анализ считается негативным, а пациент здоровым. В результате при этом указывается, что ДНК цитомегаловируса не обнаружено.
Если результат анализа выше 400, значит, пациент заражен вирусом и в результатах указывается количество копий ДНК вируса на миллилитр. Если повторять анализ со временем, то по изменению количества копий ДНК вируса, можно понять, эффективно ли лечение от цитомегаловирусной инфекции или нет.
Подготовка к обследованию: не требуется.
Материал исследования: кровь из вены или слюна.
Метод исследования: полимеразно-цепная реакция (ПЦР).
Срок готовности: 3 рабочих дня.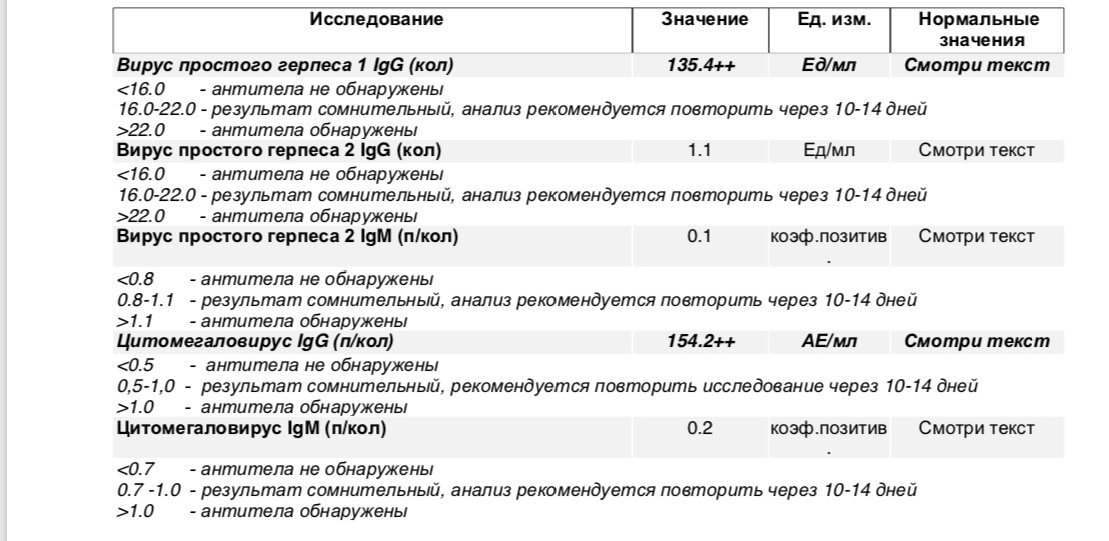
Анализ cytomegalovirus (кровь) – сдать по цене 320 руб. в Москве
Стоимость забора биоматериалаНастоящим уведомляем Вас о том, что с 01 марта 2016 года Лаборатория «Литех» изменяет порядок и стоимость забора биоматериала. Прейскурант
*Цены у Партнеров могут отличаться.
|
Методы исследования:
•7 ПЦР (прямое выявление возбудителя)
•8 ИФА (определение антител)
Цитомегаловирус — широко распространенный вирус семейства герпесвирусов. Предается CMV воздушно-капельным и трансфузионным путями. Так же как и другие представители семейства, после инфицирования сохраняется в организме практически пожизненно. При обострении CMV-инфекции вирус персистирует в клетках слизистых оболочек, вызывая их гиперплазию. CMV-инфекция приводит к системным поражениям органов и тканей: пневмонии, гепатитам, заболеваниям верхних дыхательных путей (ринит, лорингит и т.д.), а так же урогенитальным патологиям. Однажды попав в организм, вирус находится в латентном состоянии и может оставаться в таком состоянии в течение всей жизни человека, не вызывая серьезных проблем. Однако CMV-инфекция представляет серьезную опасность для групп высокого риска, в которые входят беременные, с риском заражения плода и лица с пониженным иммунитетом. К последней группе относятся пациенты, подвергшиеся операции по пересадке органов, проходящие гемодиализ, паценты, больные раком, получающие иммуносупрессанты и ВИЧ-инфицированные больные. В этой группе риска CMV-инфекция является одной из основных причин болезни и смерти пациентов.
Однако CMV-инфекция представляет серьезную опасность для групп высокого риска, в которые входят беременные, с риском заражения плода и лица с пониженным иммунитетом. К последней группе относятся пациенты, подвергшиеся операции по пересадке органов, проходящие гемодиализ, паценты, больные раком, получающие иммуносупрессанты и ВИЧ-инфицированные больные. В этой группе риска CMV-инфекция является одной из основных причин болезни и смерти пациентов.
После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинические проявления CMV-инфекции отмечаются чаще всего у пациентов с врожденными или приобретенными иммунодефицитами (в том числе вследствие ВИЧ-инфекции, применения иммунодепрессантов при трансплантации органов, и др.), а также на фоне физиологических иммунодефицитных состояний (дети первых 3-5 лет жизни, беременные). Первичная инфекция или (в меньшей степени) реактивации инфекции в период беременности связаны с риском внутриутробной инфекции, опасной для развития плода. Проявления инфекции зависят от особенностей иммунитета матери, вирулентности и локализации вируса.
Первичная инфекция или (в меньшей степени) реактивации инфекции в период беременности связаны с риском внутриутробной инфекции, опасной для развития плода. Проявления инфекции зависят от особенностей иммунитета матери, вирулентности и локализации вируса.
ЦМВ-инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра. Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта. При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении). Заболевание может заканчиваться летально.
Заболевание может заканчиваться летально.
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВИ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию.
Цитомегаловирусная инфекция у беременных, обследование при беременности
При первичном инфицировании беременной цитомегаловирусом (в 35-50% случаев) или реактивации инфекции в период беременности (в 8-10% случаев) развивается внутриутробная инфекция.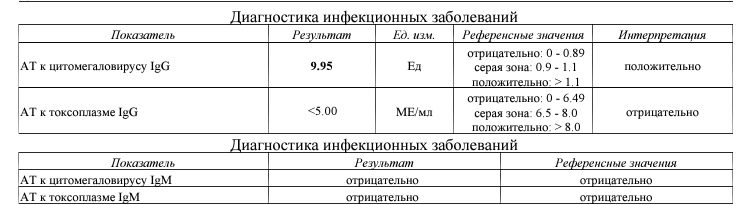 При развитии внутриутробной инфекции на сроке до 10 недель есть риск возникновения пороков развития, возможно самопроизвольное прерывание беременности. При инфицировании на 11-28 неделе возникают задержка внутриутробного развития, гипо- или дисплазии внутренних органов. Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определенный орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит и т.д.). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса.
При развитии внутриутробной инфекции на сроке до 10 недель есть риск возникновения пороков развития, возможно самопроизвольное прерывание беременности. При инфицировании на 11-28 неделе возникают задержка внутриутробного развития, гипо- или дисплазии внутренних органов. Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определенный орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит и т.д.). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса.
На сегодняшний момент вакцина против цитомегаловируса не разработана. Полностью излечить это заболевание невозможно: нельзя удалить цитомегаловирус из организма. Медикаментозная терапия позволяет увеличить период ремиссии и воздействовать на рецидив инфекции, но не позволяет элиминировать вирус из организма. Однако при своевременном обращении к врачу можно долгие годы удерживать инфекцию в «спящем» состоянии. Это обеспечит нормальное вынашивание беременности и роды здорового ребенка.
Это обеспечит нормальное вынашивание беременности и роды здорового ребенка.
Особое значение лабораторная диагностика цитомегаловирусной инфекции имеет для женщин при подготовке к беременности и дщля беременных — для предотвращения тяжелых последствий внутриутробной инфекции новорожденных.
Последовательное многократное определение уровня IgG-антител у новорожденных позволяет отличить врожденное заражение (постоянный уровень) от неонатального (нарастание титров). Если титр IgG антител при повторном (через две недели) анализе не увеличивается, то причин для тревоги нет, если титр IgG растет, следует рассмотреть вопрос об аборте.
В целях выявления возможной инфицированности организма цитомегаловирусом, оценки риска возникновения острой инфекции, распознавания первичной инфекции целесообразно использование тестов: определение антител классов IgG и IgM в сыворотке крови и выявление вирусной ДНК методом ПЦР.
CMV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребенка. Лабораторное обследование на TORCH-инфекции наиболее целесообразно проводить за 2-3 месяца до планируемой беременности. Это дает возможность предпринять необходимые лечебные или профилактические меры, и служит точкой сравнения с результатами обследований во время беременности.
Лабораторное обследование на TORCH-инфекции наиболее целесообразно проводить за 2-3 месяца до планируемой беременности. Это дает возможность предпринять необходимые лечебные или профилактические меры, и служит точкой сравнения с результатами обследований во время беременности.
Анализы в лаборатории «ЛИТЕХ»:
Прямое выявление наличия вируса в организме:
Метод исследования: Полимераная цепная реакция (ПЦР) (выявление специфического фрагмента ДНК возбудителя)
Материал для исследования: соскоб эпителиальных клеток из уретрального и цервикального каналов; моча; слюна; лейкоцитарная масса крови
Соскоб помещается в пробирку с реагентом «ДНК-ЭКСПРЕСС».
Моча: 20 мл утренней мочи собирается в емкость с завинчивающейся крышкой. До получения осадка мочу нельзя охлаждать или замораживать.
Слюна: 1-1,5 мл слюны отобрать в сухую чистую пробирку типа Эппендорфф объемом 1,5мл. Материал должен быть свежим, не замораживать.
Лейкоцитарная масса крови: кровь отбирается в пробирку с ЭДТА (пробирка с сиреневой крышкой).
Показания к назначению анализа:
•9 Подготовка к беременности;
•10 Признаки внутриутробной инфекции, фето-плацентарная недостаточность;
•11 Состояние иммуносупрессии при ВИЧ-инфекции, неопластических заболеваниях, приеме цитостатических препаратов и т.д.;
•12 Клиническая картина инфекционного мононуклеоза в отсутствие инфекции, вызванной вирусом Эпштейна -Барра;
•13 Гепато-спленомегалия неясной природы;
•14 Лихорадка неясной этиологии;
•15 Повышение уровня печеночных трансаминаз, гамма-ГТ, ЩФ в отсутствие маркеров вирусных гепатитов;
•16 Атипичное течение пневмонии у детей;
•17 Невынашивание беременности (замершая беременность, привычные выкидыши).
Анализ: Определение антител класса G (IgG) к цитомегаловирусу (Cytomegalovirus) в крови
Описание
Описание: Цитомегаловирусная инфекция (ЦМВИ) широко распространенная инфекционная болезнь человека.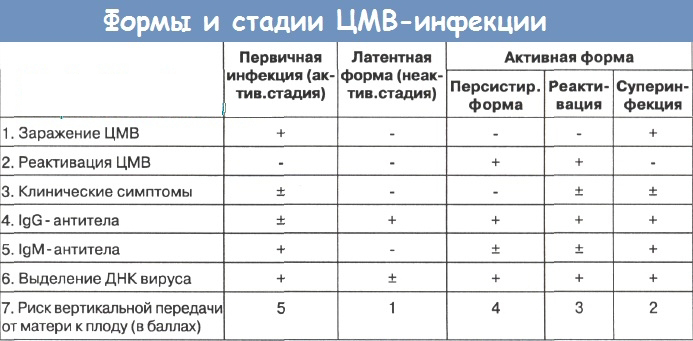 Носителями цитомегаловируса (ЦМВ) на слизистых верхних дыхательных путей, половых органов, в слюне, моче, сперме и других биологических жидкостях являются многие люди. В подавляющем большинстве случае ЦМВИ протекает в виде бессимптомного носительства или в виде самопроходящих симптомов ОРЗ, лимфоденита и др. Лабораторные исследования показывают наличие в крови антител к ЦМВИ у 80% обследуемых лиц старше 30 лет. Это значит, что они когда-то перенесли ЦМВИ. Опасность представляет первичная ЦМВИ для беременных женщин, т.к. может служить причиной внутриутробного поражения плода или инфицирования новорожденного. Особенно высока чувствительность плода к ЦМВИ на ранних стадиях развития (первые 3 месяца), т.к. в этом случае вероятность внутриутробного заражения достигает 50%. Клинические проявления ЦМВИ у новорожденных разнообразны: патология сердца, печени, пневмония. Задержка в росте, умственном развитии, микроцефалия и т.д. Серологическое исследование крови методом ИФА является в настоящее время наиболее распространенным анализом при данных инфекциях.
Носителями цитомегаловируса (ЦМВ) на слизистых верхних дыхательных путей, половых органов, в слюне, моче, сперме и других биологических жидкостях являются многие люди. В подавляющем большинстве случае ЦМВИ протекает в виде бессимптомного носительства или в виде самопроходящих симптомов ОРЗ, лимфоденита и др. Лабораторные исследования показывают наличие в крови антител к ЦМВИ у 80% обследуемых лиц старше 30 лет. Это значит, что они когда-то перенесли ЦМВИ. Опасность представляет первичная ЦМВИ для беременных женщин, т.к. может служить причиной внутриутробного поражения плода или инфицирования новорожденного. Особенно высока чувствительность плода к ЦМВИ на ранних стадиях развития (первые 3 месяца), т.к. в этом случае вероятность внутриутробного заражения достигает 50%. Клинические проявления ЦМВИ у новорожденных разнообразны: патология сердца, печени, пневмония. Задержка в росте, умственном развитии, микроцефалия и т.д. Серологическое исследование крови методом ИФА является в настоящее время наиболее распространенным анализом при данных инфекциях. Диагностическое значение при первичной герпетической инфекции имеет выявление IgM. Обнаружение IgG (при отсутствующих IgM) свидетельствует, как правило, о перенесенной в прошлом ЦМВИ или ее реактивации. Диагностических титров для IgG при герпетических инфекциях не существует, поэтому одним из методов, позволяющем дифференцировать стадии инфекции является четырехкратное нарастание титра IgG при исследовании парных образцов сывороток крови, взятых с интервалом 10-12 дней. В настоящее время разработан тест, который позволяет быстро и достоверно установить стадию инфекции — определение авидности IgG. Выявление в испытуемой сыворотке низкоавидных IgG указывает на свежую первичную инфекцию, высокоавидных антител — на персистирующую инфекцию (вне фазы реактивации). Показатель индекса авидности в интервале «серой зоны» является промежуточным и указывает либо на позднюю стадию первичной инфекции, либо на возможность реактивации вируса. Сроки исполнения: До 3 дней. Подготовка к исследованию: Кровь сдается натощак (спустя 4-5 часов после приема пищи).
Диагностическое значение при первичной герпетической инфекции имеет выявление IgM. Обнаружение IgG (при отсутствующих IgM) свидетельствует, как правило, о перенесенной в прошлом ЦМВИ или ее реактивации. Диагностических титров для IgG при герпетических инфекциях не существует, поэтому одним из методов, позволяющем дифференцировать стадии инфекции является четырехкратное нарастание титра IgG при исследовании парных образцов сывороток крови, взятых с интервалом 10-12 дней. В настоящее время разработан тест, который позволяет быстро и достоверно установить стадию инфекции — определение авидности IgG. Выявление в испытуемой сыворотке низкоавидных IgG указывает на свежую первичную инфекцию, высокоавидных антител — на персистирующую инфекцию (вне фазы реактивации). Показатель индекса авидности в интервале «серой зоны» является промежуточным и указывает либо на позднюю стадию первичной инфекции, либо на возможность реактивации вируса. Сроки исполнения: До 3 дней. Подготовка к исследованию: Кровь сдается натощак (спустя 4-5 часов после приема пищи).
Цитомегаловирус (Cytomegalovirus,CMV)(определение ДНК)(вирусная нагрузка)
Цитомегаловирус или вирус герпеса 5 типа — широко распространённый представитель семейства герпесвирусов с различным механизмом передачи. Многообразие клинических проявлений заболевания обусловлено способностью цитомегаловируса инфицировать практически все клетки организма. Часто цитомегаловирус поражает лиц с иммунодефицитным состоянием. Следствием этого является продолжающийся рост цитомегаловирусной инфекции (ЦМВИ) не только среди детей, но и среди взрослых.
Заболевания, вызываемые цитомегаловирусом (ЦМВ) отличаются разнообразием клинических проявлений: от латентного течения до генерализованных форм с поражением нервной системы и внутренних органов. ЦМВИ относится к так называемым оппортунистическим инфекциям, клиническое проявление которых возможно лишь в условиях первичного или вторичного иммунодефицита. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. В среднем у 90-95% взрослого населения обнаруживают антитела к ЦМВ, являющиеся маркером инфицированности вирусом.
У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. В среднем у 90-95% взрослого населения обнаруживают антитела к ЦМВ, являющиеся маркером инфицированности вирусом.
Источником инфекции является больной человек или хронический вирусоноситель, который наиболее опасен в активной фазе первичного инфицирования или в период обострения инфекции.
Путями передачи ЦМВИ являются: вертикальный, половой, воздушно-капельный, парентеральный, аспирационный, фекально-оральный.
Факторами передачи являются кровь, цервикальный и вагинальный секреты, сперма, женское молоко. Заражение может происходить также через донорские органы и ткани, трансплантируемые реципиентам. ЦМВ длительно сохраняется в лейкоцитах, что обеспечивает длительное персистирование вируса. При персистенции ЦМВ в организме человека выделяют две стадии, которые сменяют друг друга – продуктивную (с репликацией вируса) и латентную. Выход вируса из латентной стадии означает реактивацию, что может быть предопределено снижением иммунорезистентности или появлением иных факторов, способствующих его репродукции. Выявление прямых маркеров репликации вируса (ДНК) свидетельствует об активности процесса.
Выход вируса из латентной стадии означает реактивацию, что может быть предопределено снижением иммунорезистентности или появлением иных факторов, способствующих его репродукции. Выявление прямых маркеров репликации вируса (ДНК) свидетельствует об активности процесса.
Первичная инфекция или реактивации инфекции в период беременности связаны с риском внутриутробной инфекции у плода. Чем меньше срок беременности, тем неблагоприятнее последствия инфекции для будущего ребенка.
Клиническая диагностика ЦМВИ в большинстве случаев затруднена, поэтому лабораторная диагностика позволяет, используя современные методы, правильно поставить диагноз. Современным методом диагностики ЦМВИ является полимеразная цепная реакция в режиме реального времени, позволяющая выявлять ДНК на ранних этапах заболевания. Особенностью метода является возможность выявлять ДНК цитомегаловируса даже при малом содержании её в исследуемом биологическом материале в острую, текущую ЦМВИ у детей и взрослых, у людей с патологией иммунной системы, у беременных женщин, врождённую форму ЦМВИ или при инфицировании матери. Используется для дифференциальной диагностики инфекции, вызванной цитомегаловирусом, и других вирусных инфекций
Используется для дифференциальной диагностики инфекции, вызванной цитомегаловирусом, и других вирусных инфекций
Количественное определение ДНК цитомегаловируса в крови (вирусная нагрузка) позволяет врачу выявлять минимальные концентрации вируса и определять эффективность проводимой терапии.
Показания к назначению:
- диагностика острой фазы и периода реактивации инфекции, вызванной цитомегаловирусом;
- диагностика первичной инфекции.
Референсные значения: Отрицательный.
Необходимо воздержаться от приема пищи в течение 2-3 часов.
ДНК Цитомегаловирус (CMV)
Анализ крови
Для получения достоверных результатов исследования необходимо предоставить информацию работнику лаборатории о систематическом приёме лекарственных средств, сроке беременности, дне МОЦ, диагнозе.
Основные правила:
- Кровь следует сдавать натощак, рекомендуется соблюдение 8-12-часового периода голодания, возможно употребление небольшого количества воды.
- Важно отказаться от приема алкоголя и курения за 12 часов до cдачи анализов;
- Свести к минимуму физическую активность.
- Исключить прием медицинских препаратов; в случае невозможности отмены лекарств необходимо уведомить об этом представителя лаборатории.
- Все анализы крови сдают до проведения рентгенографии, КТ, УЗИ и физиотерапевтических процедур.
- Детей младше 5-ти лет перед сдачей крови желательно поить теплой кипяченой водой (до 200мл).
- Для грудных детей перед сдачей крови необходимо выдержать максимально возможную паузу между кормлениями.
Исследование системы гемостаза (коагулограмма)
- Повторную сдачу крови на исследование ПТИ желательно проводить в одно и тоже время.
- Пациенты, которые принимают антитромботические препараты, не должны нарушать график приёма в день сдачи, если нет особых рекомендаций врача.

- Кровь сдается натощак, после 8-12 часов голодания. За двое суток до сдачи крови следует придерживаться диеты, исключить жирную, острую и солёную пищу.
Липидный комплекс
Для сдачи крови на липидный обмен (холестерин, липопротеины, триглицериды) за 2 суток стоит начать соблюдать диету, исключить жирную, жареную, острую и солёную пищу, не злоупотреблять углеводами и отказаться от алкоголя.
Пролактин
- Кровь следует сдавать утром, в течение трех часов после пробуждения.
- Важен половой покой за сутки до сдачи, отсутствие физических нагрузок и нервного напряжения.
- Перед сдачей крови исключить перегрев и переохлаждение тела (не посещать баню, сауну, массажи).
- Перед исследованием исключить пальпацию молочных желез.
Половые гормоны
Женские половые гормоны сдаются в определенные дни менструального цикла (ЛГ, ФСГ — на 3-5 день цикла, эстрадиол — на 5-7 или на 21-23 день цикла; прогестерон — на 21-23 день цикла, тестостерон и пролактин — в любой день), если врач не назначил другие дни.
При сдаче тестов репродуктивной панели женщинам следует обязательно указывать день менструального цикла или срок беременности с целью учета цикличности гормональных колебаний.
Пренатальный скрининг 1 и 2 триместра
Необходимо строго соблюдать рекомендации врача относительно дат и времени прохождения ультразвукового исследования (УЗИ) и забора крови.
Пренатальный скрининг 1-го триместра проводится на 8-13 неделе беременности.
Пренатальный скрининг 2-го триместра – на 14-19 неделе беременности.
PRISCA I триместра – 10-13 неделя беременности.
PRISCA IІ триместра – 14-22 неделя беременности.
Тестостерон
- Важно согласовать день сдачи крови на тестостерон со своим лечащим врачом.
- Следует воздержаться от сдачи анализа в течение суток после УЗИ, флюорографии или рентгена, а также физиотерапевтических процедур и ректального обследования.
- При приеме гормональных препаратов обязательно сообщить об этом представителю лаборатории.

ПСА (простатический специфический антиген)
- В течение 2 суток перед сдачей крови необходимо воздержаться от эякуляции.
- После любых урологических манипуляций, ректального обследования, массажа простаты, цисто- и колоноскопии выдержать минимальный трехдневный срок. Оптимальным является посещение лаборатории через 6-7 дней. После биопсии простаты сдачу анализа стоит отложить на месяц.
- В течение 3 дней до забора биоматериала рекомендуется воздержаться от походов в сауну и занятий спортом (особенно велосипедным).
Чувствительность теста сухой капли крови для выявления врожденной цитомегаловирусной инфекции | Инфекционные болезни | JAMA Педиатрия
Ключевые моментыВопрос Какова чувствительность теста полимеразной цепной реакции на врожденный цитомегаловирус, развернутого на высушенных каплях крови, полученных для универсального скрининга новорожденных с использованием лучших современных методов?
Выводы Это когортное исследование 12554 новорожденных, прошедших скрининг в многоцентровом исследовании в Миннесоте, включало 56 (4. 5 на 1000) с подтвержденной врожденной цитомегаловирусной инфекцией. Чувствительность теста полимеразной цепной реакции сухих пятен крови составила 85,7% при объединении результатов двух лабораторных исследований, что значительно выше, чем сообщалось в предыдущих исследованиях.
5 на 1000) с подтвержденной врожденной цитомегаловирусной инфекцией. Чувствительность теста полимеразной цепной реакции сухих пятен крови составила 85,7% при объединении результатов двух лабораторных исследований, что значительно выше, чем сообщалось в предыдущих исследованиях.
Значение Относительно высокая чувствительность высушенных пятен крови в промежуточном анализе этого исследования предполагает их потенциальную полезность для универсального скрининга цитомегаловируса, поскольку методологии выделения ДНК и полимеразной цепной реакции продолжают совершенствоваться.
Важность Чувствительность высушенных пятен крови (DBS) для выявления новорожденных с врожденной цитомегаловирусной (cCMV) инфекцией не оценивалась в скрининговых исследованиях с использованием современных высокочувствительных методов обработки DBS.
Цель Оценить чувствительность полимеразной цепной реакции (ПЦР) DBS для скрининга новорожденных на инфекцию цМВ с использованием слюны в качестве эталонного стандарта для скрининга с последующим сбором образца мочи для подтверждения врожденной инфекции.
Дизайн, сеттинг и участники Это популяционное когортное исследование проводилось в 5 родильных домах для новорожденных и 3 отделениях интенсивной терапии новорожденных в районе Миннеаполиса/Сент-Пола в Миннесоте с апреля 2016 г. по июнь 2019 г. Новорожденные, зарегистрированные с согласия родителей, прошли скрининг на цМВ с использованием DBS, полученного для рутинного скрининга новорожденных. и слюна, собранная через 1-2 дня после рождения. Высушенные пятна крови были протестированы на наличие ДНК ЦМВ с помощью ПЦР как в Университете Миннесоты (UMN), так и в Центрах по контролю и профилактике заболеваний США (CDC).Мазки слюны тестировались методом ПЦР на ДНК ЦМВ только в лаборатории UMN. У новорожденных с положительным результатом скрининга по слюне или DBS врачи первичной медико-санитарной помощи взяли диагностический образец мочи и проверили его с помощью ПЦР в течение 3 недель после рождения. Анализ начался в июле 2019 года.
Воздействие Обнаружение ЦМВ в мазке слюны методом ПЦР.
Основные результаты и показатели Количество детей с подтвержденным в моче ЦМВ и доля из них, у которых ЦМВ-положительный результат скрининга DBS.
Результаты Из 12 554 человек, зарегистрированных до июня 2019 г. (из 25 000 запланированных зачислений), у 56 новорожденных был подтвержден цЦМВ (4,5 на 1000 [95% ДИ, 3,3–5,7]). Комбинированные результаты DBS либо из UMN, либо из CDC имели чувствительность 85,7% (48 из 56; 95% ДИ, 74,3–92,6%), специфичность 100,0% (95% ДИ, 100,0–100,0%), положительную прогностическую ценность ( PPV) 98,0 % (95 % ДИ, 89,3–99,6 %) и отрицательная прогностическая ценность (NPV) 99,9 % (95 % ДИ, 99,9–100,0 %). Результаты сухого пятна крови от UMN имели чувствительность 73.2% (95% ДИ, 60,4–83,0%), специфичность 100,0% (100,0–100,0%), PPV 100,0% (95% ДИ, 91,4–100,0%) и NPV 99,9% (95% ДИ, 99,8%-99,9%). Результаты сухих пятен крови из CDC имели чувствительность 76,8 % (95 % ДИ, 64,2–85,9 %), специфичность 100,0 % (95 % ДИ, 100,0–100,0 %), PPV 97,7 % (95 % ДИ, 88,2 %). %-99,6%), и NPV 99,9% (95% ДИ, 99,8%-99,9%). Результаты мазка слюны имели чувствительность 92,9 % (52 из 56; 95 % ДИ, 83,0–97,2 %), специфичность 99,9 % (95 % ДИ, 99,9–100,0 %), ППЗ 86,7 % (95 % ДИ, 75,8%-93.1%) и NPV 100,0% (95% ДИ, 99,9%-100,0%).
%-99,6%), и NPV 99,9% (95% ДИ, 99,8%-99,9%). Результаты мазка слюны имели чувствительность 92,9 % (52 из 56; 95 % ДИ, 83,0–97,2 %), специфичность 99,9 % (95 % ДИ, 99,9–100,0 %), ППЗ 86,7 % (95 % ДИ, 75,8%-93.1%) и NPV 100,0% (95% ДИ, 99,9%-100,0%).
Выводы и актуальность Это исследование демонстрирует относительно высокую аналитическую чувствительность для DBS по сравнению с предыдущими исследованиями, в которых проводился популяционный скрининг. Поскольку продолжают появляться более чувствительные методы выделения ДНК и ПЦР, тестирование на основе DBS должно оставаться в стадии изучения в качестве потенциально недорогого и высокопроизводительного варианта скрининга цМВ.
Врожденный цитомегаловирус (цЦМВ) с предполагаемой распространенностью при рождении 4.5 на 1000 живорождений, 1 , является наиболее распространенной врожденной вирусной инфекцией в Соединенных Штатах, но остается недостаточно распознанной. Долгосрочные исходы, связанные с cCMV, включают нейросенсорную тугоухость, умственную отсталость, церебральный паралич, судорожные расстройства и задержки в обучении, которые могут развиться у 20% всех инфицированных детей. 2 ,3 Учитывая бремя, связанное с ЦМВ, и доказанные преимущества лечения и раннего вмешательства для некоторых пораженных младенцев, 4 ,5 интерес к всеобщему скринингу новорожденных растет. 6
Долгосрочные исходы, связанные с cCMV, включают нейросенсорную тугоухость, умственную отсталость, церебральный паралич, судорожные расстройства и задержки в обучении, которые могут развиться у 20% всех инфицированных детей. 2 ,3 Учитывая бремя, связанное с ЦМВ, и доказанные преимущества лечения и раннего вмешательства для некоторых пораженных младенцев, 4 ,5 интерес к всеобщему скринингу новорожденных растет. 6
Оптимальная стратегия скрининга для выявления новорожденных с риском отдаленных последствий, связанных с ЦМВ, остается неопределенной. В настоящее время врожденная инфекция диагностируется в ограниченных случаях, когда подозревается инфекция cCMV, путем проведения полимеразной цепной реакции (ПЦР) на ДНК цитомегаловируса (ЦМВ) в детской моче, слюне или (реже) крови, собранных в течение 3 недель после рождения. Моча обладает наибольшей чувствительностью и специфичностью, но сбор ее затруднен.Слюна обеспечивает высокую чувствительность, хотя и с меньшей специфичностью, чем моча.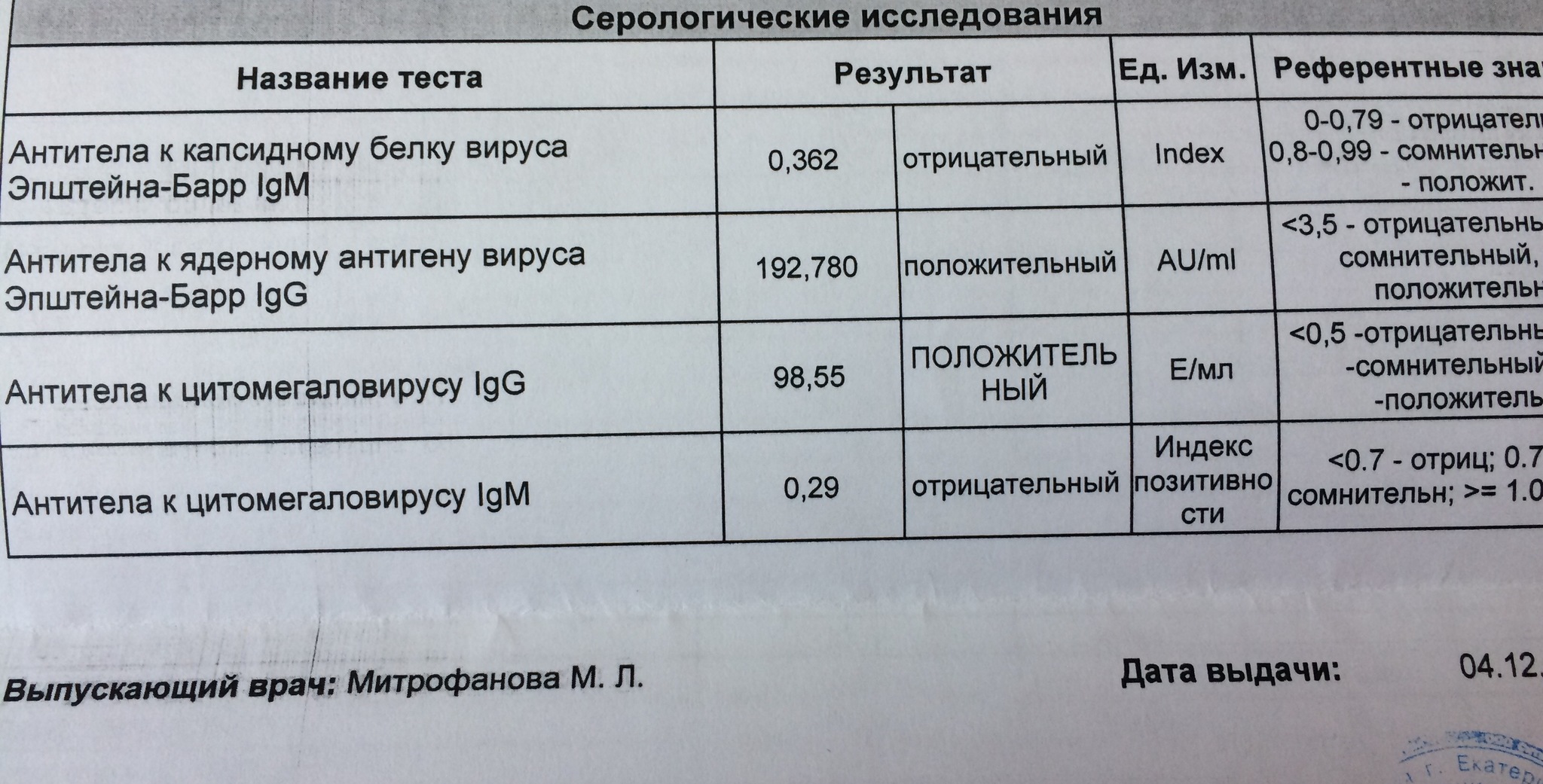 7 -12 Поскольку слюну гораздо удобнее собирать, чем мочу, она является предпочтительным образцом для большинства скрининговых исследований cCMV с положительным результатом слюны, обычно подтверждаемым анализом мочи. 7 -9,13 Для универсального скрининга цМВ моча или слюна повлекут за собой значительные новые расходы и создание инфраструктуры для сбора и обработки образцов.
7 -12 Поскольку слюну гораздо удобнее собирать, чем мочу, она является предпочтительным образцом для большинства скрининговых исследований cCMV с положительным результатом слюны, обычно подтверждаемым анализом мочи. 7 -9,13 Для универсального скрининга цМВ моча или слюна повлекут за собой значительные новые расходы и создание инфраструктуры для сбора и обработки образцов.
Сухие пятна крови (СКК) уже собираются практически у всех новорожденных в Соединенных Штатах. 14 Однако вирусная нагрузка ЦМВ в крови примерно на 2 log ниже, чем вирусная нагрузка в моче или слюне. 15 Сообщаемая чувствительность тестирования ЦМВ на DBS по сравнению с мочой или слюной сильно различалась в зависимости от используемых методов. 16 ,17 Исследование ЦМВ и многоцентрового скрининга слуха (CHIMES) 18 сообщило о 34% чувствительности DBS к ЦМВ по сравнению со слюной в подгруппе новорожденных, зарегистрированных с 2007 по 2008 год. С тех пор методы диагностики ЦМВ, включая Извлечение ДНК из DBS значительно улучшилось. 17 С точки зрения общественного здравоохранения, прежде чем будет определена их полезность, необходимо провести тщательную оценку DBS с использованием наилучших современных методов скрининга cCMV. В этом исследовании мы сообщаем о промежуточных результатах аналитической чувствительности DBS для выявления новорожденных с инфекцией cCMV с использованием ПЦР слюны в качестве эталонного стандарта для скрининга с последующим сбором образца мочи для клинического подтверждения.
С тех пор методы диагностики ЦМВ, включая Извлечение ДНК из DBS значительно улучшилось. 17 С точки зрения общественного здравоохранения, прежде чем будет определена их полезность, необходимо провести тщательную оценку DBS с использованием наилучших современных методов скрининга cCMV. В этом исследовании мы сообщаем о промежуточных результатах аналитической чувствительности DBS для выявления новорожденных с инфекцией cCMV с использованием ПЦР слюны в качестве эталонного стандарта для скрининга с последующим сбором образца мочи для клинического подтверждения.
Это проспективное исследование было проведено в 5 яслях для новорожденных Миннеаполиса/Сент-Пола в системе здравоохранения Fairview (Масонская детская больница Университета Миннесоты [UMN], больница Fairview Ridges, больница Fairview Southdale) и Allina Health System (Abbott Northwestern Hospital and United Health System). больнице) и 3 отделения интенсивной терапии новорожденных в системе здравоохранения Fairview. Согласитель исследования обращался к родителям потенциальных участников с апреля 2016 года по июнь 2019 года (согласные в основном присутствовали с понедельника по пятницу) перед выпиской из больницы, обычно через 24–48 часов после родов. У новорожденных, родители которых дали письменное информированное согласие, был взят образец слюны до выписки или в течение 2 недель после рождения (для младенцев в отделениях интенсивной терапии новорожденных). Мазки слюны были протестированы лабораторией UMN в течение 1 недели после сбора. Сухие пятна крови, используемые в этом исследовании, были собраны в возрасте от 24 до 48 часов в рамках обычного скрининга новорожденных в рамках программы скрининга новорожденных (NBS) Министерства здравоохранения Миннесоты (MDH).Срезы из DBS зарегистрированных новорожденных были отправлены MDH в лаборатории UMN и Центров по контролю и профилактике заболеваний США (CDC). Результаты анализов слюны и DBS из UMN и CDC были переданы непосредственно в MDH. Лаборатории UMN и CDC не были осведомлены обо всей клинической информации о новорожденных и результатах скрининговых тестов другой лаборатории до тех пор, пока их результаты не были представлены в MDH.
Согласитель исследования обращался к родителям потенциальных участников с апреля 2016 года по июнь 2019 года (согласные в основном присутствовали с понедельника по пятницу) перед выпиской из больницы, обычно через 24–48 часов после родов. У новорожденных, родители которых дали письменное информированное согласие, был взят образец слюны до выписки или в течение 2 недель после рождения (для младенцев в отделениях интенсивной терапии новорожденных). Мазки слюны были протестированы лабораторией UMN в течение 1 недели после сбора. Сухие пятна крови, используемые в этом исследовании, были собраны в возрасте от 24 до 48 часов в рамках обычного скрининга новорожденных в рамках программы скрининга новорожденных (NBS) Министерства здравоохранения Миннесоты (MDH).Срезы из DBS зарегистрированных новорожденных были отправлены MDH в лаборатории UMN и Центров по контролю и профилактике заболеваний США (CDC). Результаты анализов слюны и DBS из UMN и CDC были переданы непосредственно в MDH. Лаборатории UMN и CDC не были осведомлены обо всей клинической информации о новорожденных и результатах скрининговых тестов другой лаборатории до тех пор, пока их результаты не были представлены в MDH. Сотрудники программы MDH NBS связались со специалистами первичной медико-санитарной помощи новорожденных с ЦМВ-положительным результатом слюны или DBS, чтобы обсудить результаты скрининговых тестов и порекомендовать повторный анализ мочи в течение 3 недель после рождения и консультацию со специалистом по инфекционным заболеваниям.ПЦР на цитомегаловирус в образцах мочи проводили в диагностической лаборатории, сертифицированной в соответствии с требованиями по улучшению клинической лаборатории. Специалист первичной медико-санитарной помощи уведомил семью новорожденного о результате анализа мочи на ЦМВ и обсудил варианты последующего наблюдения за новорожденными с подтвержденным ЦМВ. Исследование было одобрено экспертными советами учреждений UMN, Allina Health, MDH и CDC.
Сотрудники программы MDH NBS связались со специалистами первичной медико-санитарной помощи новорожденных с ЦМВ-положительным результатом слюны или DBS, чтобы обсудить результаты скрининговых тестов и порекомендовать повторный анализ мочи в течение 3 недель после рождения и консультацию со специалистом по инфекционным заболеваниям.ПЦР на цитомегаловирус в образцах мочи проводили в диагностической лаборатории, сертифицированной в соответствии с требованиями по улучшению клинической лаборатории. Специалист первичной медико-санитарной помощи уведомил семью новорожденного о результате анализа мочи на ЦМВ и обсудил варианты последующего наблюдения за новорожденными с подтвержденным ЦМВ. Исследование было одобрено экспертными советами учреждений UMN, Allina Health, MDH и CDC.
Аппликаторы с полиэфирным наконечником (Puritan) с индивидуальными трубками-носителями использовались для сбора образцов слюны у новорожденных.Тампоны помещали между щекой и челюстью и вращали в течение 5 секунд с каждой стороны, затем помещали в пробирки для транспортировки в зону, где тампоны высушивали на воздухе в течение 1 часа и хранили при комнатной температуре до транспортировки в лабораторию UMN один раз в неделю для тестирования. . Высушенные капли крови собирали в рамках рутинного скрининга новорожденных и предоставляли в исследование после письменного информированного согласия родителей. В 96-луночные планшеты (Masterblock Deep Well Microplates; Greiner Bio-One) пробивали по три 3-мм перфоратора на лунку с использованием автоматического перфоратора Panthera (PerkinElmer).Из каждой карты пятен крови готовили 2 комплекта из 3 штампов DBS для транспортировки в лаборатории UMN и CDC для тестирования.
. Высушенные капли крови собирали в рамках рутинного скрининга новорожденных и предоставляли в исследование после письменного информированного согласия родителей. В 96-луночные планшеты (Masterblock Deep Well Microplates; Greiner Bio-One) пробивали по три 3-мм перфоратора на лунку с использованием автоматического перфоратора Panthera (PerkinElmer).Из каждой карты пятен крови готовили 2 комплекта из 3 штампов DBS для транспортировки в лаборатории UMN и CDC для тестирования.
Высушенные мазки слюны обработаны для ПЦР на ЦМВ в лаборатории UMN. Первые 4027 мазков слюны из исследования элюировали 300 мкл стерильной дистиллированной воды, как описано в исследовании CHIMES. 13 Из-за первоначальных опасений по поводу возможной более низкой чувствительности при элюировании водой метод был изменен на гидратацию высушенного тампона в 300 мкл QuantaBio Extracta, инкубированного при 95 °C в течение 30 минут в термомиксере при слабом перемешивании. Затем пробирки охлаждали до 4°С и кратковременно центрифугировали. Элюат использовали непосредственно для ПЦР или хранили при -80°С до ПЦР-тестирования. Для ПЦР использовали 5 мкл элюата при реакционном объеме 25 мкл. Праймеры, зонды и условия ПЦР выполняли, как описано ранее, 19 , с использованием системы ПЦР LightCycler 96 (Roche). Внутренние контроли для полного извлечения образца ДНК были включены, как описано ранее. 19 Полимеразная цепная реакция проводилась в двух экземплярах, и образцы считались положительными, если 2 из 2 повторов были положительными или если 3 из 4 повторов были положительными для образцов, протестированных дважды.Для расчета копий на миллилитр слюны объем слюны, элюированной из тампона, оценивался в 75 мкл на основании предыдущих исследований. 20 Для количественного определения ЦМВ в слюне и DBS в полимеразной цепной реакции в обеих лабораториях использовался международный стандарт ЦМВ Всемирной организации здравоохранения.
Затем пробирки охлаждали до 4°С и кратковременно центрифугировали. Элюат использовали непосредственно для ПЦР или хранили при -80°С до ПЦР-тестирования. Для ПЦР использовали 5 мкл элюата при реакционном объеме 25 мкл. Праймеры, зонды и условия ПЦР выполняли, как описано ранее, 19 , с использованием системы ПЦР LightCycler 96 (Roche). Внутренние контроли для полного извлечения образца ДНК были включены, как описано ранее. 19 Полимеразная цепная реакция проводилась в двух экземплярах, и образцы считались положительными, если 2 из 2 повторов были положительными или если 3 из 4 повторов были положительными для образцов, протестированных дважды.Для расчета копий на миллилитр слюны объем слюны, элюированной из тампона, оценивался в 75 мкл на основании предыдущих исследований. 20 Для количественного определения ЦМВ в слюне и DBS в полимеразной цепной реакции в обеих лабораториях использовался международный стандарт ЦМВ Всемирной организации здравоохранения. 21
21
Для DBS, обработанных в UMN, ДНК выделяли из трех 3-мм пуансонов с использованием экстрактора QIAcube HT с набором ДНК QIAamp 96 (Qiagen) с небольшими модификациями.Вкратце, 240 мкл буфера ATL (Qiagen) с 10% раствором протеиназы К добавляли к каждому образцу DBS и расщепляли в течение ночи в инкубаторе Thermomixer (Eppendorf) при 56 °C при 400 оборотах в минуту (об/мин). Затем материал переносили в 96-луночный планшет с глубокими лунками (S-блок; Qiagen) и проводили автоматическую экстракцию с использованием протокола ДНК QIAamp (Qiagen) 96 версии 1, слегка модифицированного для элюирования 100 мкл воды. Тестирование ДНК DBS методом полимеразной цепной реакции проводили в трех повторностях, как описано ранее 19 , с использованием 10 мкл элюата.DBS считался положительным на ЦМВ, если не менее 2 из 3 повторений были положительными или не менее 3 из 6 для образцов, протестированных дважды. Вирусную нагрузку выражали в международных единицах на миллиметр крови. Чтобы рассчитать международные единицы на миллиметр крови для DBS, объемы крови были экстраполированы из диаметра штампов DBS на основе установленных рекомендаций. 22
Чтобы рассчитать международные единицы на миллиметр крови для DBS, объемы крови были экстраполированы из диаметра штампов DBS на основе установленных рекомендаций. 22
Экстракция ДНК из высушенного пятна крови в лаборатории CDC была быстрым ручным процессом с использованием буфера Quanta Extracta DBS (QuantaBio).Высушенные пятна крови в 96-луночных планшетах промывали добавлением 200 мкл буфера Quanta DBS на лунку и центрифугированием планшетов при 3500 об/мин в течение 5 минут. Буфер удаляли и выбрасывали, добавляли 60 мкл свежего буфера на лунку и инкубировали при 95 ° С на термомиксере в течение 25 минут без встряхивания. Планшеты быстро охлаждали на предварительно охлажденном блоке, затем центрифугировали при 3500 об/мин в течение 5 минут. Элюат использовали непосредственно для ПЦР. ПЦР на цитомегаловирус проводили с использованием мастер-микса PerfeCTa Fastmix II Low ROX (QuantaBio) с внутренним положительным контролем TaqMan для контроля ингибирования (ThermoFisher). Зонд CMV Taqman MGBNFQ (ThermoFisher) и праймеры (Integrated DNA Technologies) нацелены на непосредственно раннюю область вируса. 13 Ген рибонуклеазы P человека амплифицировали отдельно для контроля эффективности экстракции ДНК. Образцы тестировали в трех экземплярах с использованием термоциклера Aria MX (Agilent), и результаты интерпретировались, как описано выше для метода UMN. Чувствительность анализа составляла 5 или менее копий реакции ЦМВ/ПЦР.
Зонд CMV Taqman MGBNFQ (ThermoFisher) и праймеры (Integrated DNA Technologies) нацелены на непосредственно раннюю область вируса. 13 Ген рибонуклеазы P человека амплифицировали отдельно для контроля эффективности экстракции ДНК. Образцы тестировали в трех экземплярах с использованием термоциклера Aria MX (Agilent), и результаты интерпретировались, как описано выше для метода UMN. Чувствительность анализа составляла 5 или менее копий реакции ЦМВ/ПЦР.
Наша прогнозируемая выборка из 25 000 новорожденных была основана на размерах групп, необходимых для оценки клинической чувствительности DBS, т. е. способности теста выявлять случаи ЦМВ-заболевания, присутствующие при рождении или проявляющиеся в возрасте от 3 до 4 лет.Мы предположили, что DBS выявит большинство случаев заболевания cCMV; таким образом, клиническая чувствительность DBS приблизится к чувствительности слюны, несмотря на более низкую аналитическую чувствительность DBS. Мы предположили, что аналитическая чувствительность DBS по сравнению со скринингом по слюне составляет 60%, а доля с ЦМВ-заболеванием составила 17,5% среди новорожденных, выявленных при скрининге по слюне, и 37,5% среди выявленных при скрининге по DBS. Размер групповой выборки из 90 новорожденных с ЦМВ, обнаруженных при скрининге слюны, и 54 новорожденных при скрининге DBS позволит достичь мощности 80% для выявления 20%-ной разницы между групповыми пропорциями заболевания с α .05, используя односторонний критерий Мантеля-Генцеля. Мы предположили, что распространенность cCMV составляет 4,5 на 1000 человек; таким образом, для достижения размера выборки в 90 новорожденных с подтвержденным цЦМВ, выявленным при скрининге слюны в заключительном исследовании, с учетом исключения и потери наблюдения, мы стремились провести скрининг 25000 новорожденных.
Мы предположили, что аналитическая чувствительность DBS по сравнению со скринингом по слюне составляет 60%, а доля с ЦМВ-заболеванием составила 17,5% среди новорожденных, выявленных при скрининге по слюне, и 37,5% среди выявленных при скрининге по DBS. Размер групповой выборки из 90 новорожденных с ЦМВ, обнаруженных при скрининге слюны, и 54 новорожденных при скрининге DBS позволит достичь мощности 80% для выявления 20%-ной разницы между групповыми пропорциями заболевания с α .05, используя односторонний критерий Мантеля-Генцеля. Мы предположили, что распространенность cCMV составляет 4,5 на 1000 человек; таким образом, для достижения размера выборки в 90 новорожденных с подтвержденным цЦМВ, выявленным при скрининге слюны в заключительном исследовании, с учетом исключения и потери наблюдения, мы стремились провести скрининг 25000 новорожденных.
Поскольку слюна считалась эталонным стандартом для скрининга на ЦМВ, подтверждающий анализ мочи на ЦМВ проводился только у младенцев специалистами первичной медико-санитарной помощи для тех младенцев, у которых был положительный результат скрининга ЦМВ либо в слюне, либо в DBS. Для оценки эффективности теста мы включали только ЦМВ-позитивных новорожденных либо по положительному тесту слюны, либо по DBS с последующим анализом мочи, и предполагали, что те, у кого были отрицательные тесты слюны и DBS в обоих лабораторных результатах, были истинно отрицательными. Мы рассчитали чувствительность и специфичность ПЦР слюны и ПЦР DBS в комбинированных и индивидуальных лабораторных результатах. Мы также рассчитали долю истинно положительных (прогностическое значение положительное), ложноположительных, истинно отрицательных (прогностическое значение отрицательное) и ложноотрицательных результатов.Мы оценили 95% CI, используя метод Wilson Score. Статистический анализ проводился с использованием Open Epi версии 3. Анализ начался в июле 2019 г.
Для оценки эффективности теста мы включали только ЦМВ-позитивных новорожденных либо по положительному тесту слюны, либо по DBS с последующим анализом мочи, и предполагали, что те, у кого были отрицательные тесты слюны и DBS в обоих лабораторных результатах, были истинно отрицательными. Мы рассчитали чувствительность и специфичность ПЦР слюны и ПЦР DBS в комбинированных и индивидуальных лабораторных результатах. Мы также рассчитали долю истинно положительных (прогностическое значение положительное), ложноположительных, истинно отрицательных (прогностическое значение отрицательное) и ложноотрицательных результатов.Мы оценили 95% CI, используя метод Wilson Score. Статистический анализ проводился с использованием Open Epi версии 3. Анализ начался в июле 2019 г.
Исследуемая популяция и распространенность цЦМВ
Уровень согласия родителей, принявших участие в исследовании, составил 70% (12554 из 17822). Демографические характеристики 12554 новорожденных, включенных в этот промежуточный анализ, показаны в таблице 1; 9480 (75,5%) родились от белых матерей неиспаноязычного происхождения. Мазки слюны были собраны в течение 3 дней жизни у 11968 обследованных новорожденных (95,3%) и в течение 3 недель жизни у остальных 586 (4,7%). Среди обследованных новорожденных 65 (0,52%) были ЦМВ-позитивными по слюне, DBS или тому и другому. Когда о положительных результатах скрининга ЦМВ сообщили специалисту первичной медико-санитарной помощи, 64 из 65 семей (98%) согласились на повторный анализ мочи.Пятьдесят шесть новорожденных были ЦМВ-положительными в моче, и у них было подтверждено наличие ЦМВ с распространенностью 4,5 (95% ДИ, 3,4-5,8) на 1000 живорождений.
Демографические характеристики 12554 новорожденных, включенных в этот промежуточный анализ, показаны в таблице 1; 9480 (75,5%) родились от белых матерей неиспаноязычного происхождения. Мазки слюны были собраны в течение 3 дней жизни у 11968 обследованных новорожденных (95,3%) и в течение 3 недель жизни у остальных 586 (4,7%). Среди обследованных новорожденных 65 (0,52%) были ЦМВ-позитивными по слюне, DBS или тому и другому. Когда о положительных результатах скрининга ЦМВ сообщили специалисту первичной медико-санитарной помощи, 64 из 65 семей (98%) согласились на повторный анализ мочи.Пятьдесят шесть новорожденных были ЦМВ-положительными в моче, и у них было подтверждено наличие ЦМВ с распространенностью 4,5 (95% ДИ, 3,4-5,8) на 1000 живорождений.
Из 56 новорожденных с подтвержденным cCMV 44 (78,6%) дали положительный результат как по слюне, так и по DBS, 8 (14,3%) дали положительный результат только по слюне и 4 (7,1%) дали положительный результат только по DBS. Чувствительность составила 85,7% (48 из 56) для теста DBS с объединенными результатами UMN и CDC, 73,2% (41 из 56) для теста UMN DBS и 76.8% (43 из 56) при тестировании CDC DBS (таблица 2). Среди 49 новорожденных с положительным скринингом DBS 1 имел ЦМВ-отрицательную мочу и был определен как ложноположительный, в общей сложности 2,0% (1 из 49) ложноположительных результатов DBS. Этот DBS позже был отправлен в CDC вслепую и повторно протестирован как CMV-отрицательный. Результаты в зависимости от типа образца приведены в таблице 2.
Чувствительность составила 85,7% (48 из 56) для теста DBS с объединенными результатами UMN и CDC, 73,2% (41 из 56) для теста UMN DBS и 76.8% (43 из 56) при тестировании CDC DBS (таблица 2). Среди 49 новорожденных с положительным скринингом DBS 1 имел ЦМВ-отрицательную мочу и был определен как ложноположительный, в общей сложности 2,0% (1 из 49) ложноположительных результатов DBS. Этот DBS позже был отправлен в CDC вслепую и повторно протестирован как CMV-отрицательный. Результаты в зависимости от типа образца приведены в таблице 2.
Среди 60 новорожденных с положительным результатом скрининга слюны 8 имели ЦМВ-отрицательную мочу и были определены как ложноположительные результаты, в общей сложности 13,3% (8 из 60) ложноположительных результатов слюны.У четырех новорожденных были ложноотрицательные результаты анализа слюны на цитомегаловирус, но они были положительными при скрининге с помощью DBS и были подтверждены положительными по моче; следовательно, слюна была чувствительна на 92,9% (52 из 56) (таблица 2).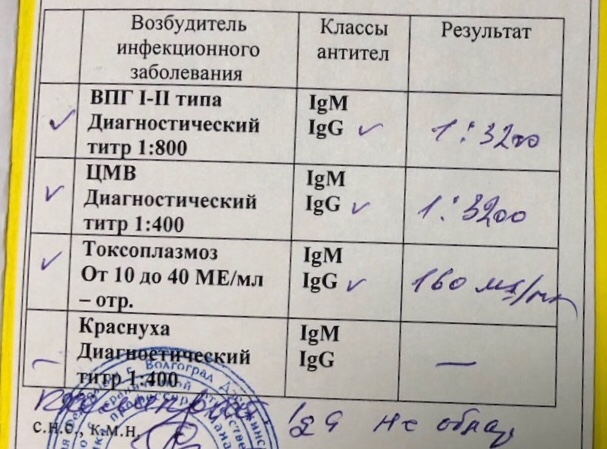 Это побудило провести дополнительное тестирование образцов слюны для выявления возможных технических объяснений. Три из 4 ложноотрицательных мазков слюны были среди первых 4027 образцов исследования, элюированных водой. Первый образец имел чрезвычайно высокую вирусную нагрузку ЦМВ, предположительно вызывающую ингибирование ПЦР, и после 10-кратного разведения оказался ЦМВ-положительным.Второй образец оказался ЦМВ-положительным после того, как мазок был перенесен из воды в буфер для квантов. В третьем образце было очень мало человеческих клеток, что указывает на неправильный сбор образца. У четвертого образца не было выявлено технических проблем, и он оставался отрицательным по ДНК ЦМВ в нескольких повторных тестах. Для дальнейшего устранения ложноотрицательных результатов слюны мы сравнили уровни клеточной ДНК в мазках, элюированных водой, с мазками, элюированными буфером Quanta. Восстановление клеточной ДНК с помощью воды было на 87% ниже, чем с Quanta (средний [межквартильный диапазон], 2.
Это побудило провести дополнительное тестирование образцов слюны для выявления возможных технических объяснений. Три из 4 ложноотрицательных мазков слюны были среди первых 4027 образцов исследования, элюированных водой. Первый образец имел чрезвычайно высокую вирусную нагрузку ЦМВ, предположительно вызывающую ингибирование ПЦР, и после 10-кратного разведения оказался ЦМВ-положительным.Второй образец оказался ЦМВ-положительным после того, как мазок был перенесен из воды в буфер для квантов. В третьем образце было очень мало человеческих клеток, что указывает на неправильный сбор образца. У четвертого образца не было выявлено технических проблем, и он оставался отрицательным по ДНК ЦМВ в нескольких повторных тестах. Для дальнейшего устранения ложноотрицательных результатов слюны мы сравнили уровни клеточной ДНК в мазках, элюированных водой, с мазками, элюированными буфером Quanta. Восстановление клеточной ДНК с помощью воды было на 87% ниже, чем с Quanta (средний [межквартильный диапазон], 2. 3 × 10 3 [4,05 × 10 2 до 9,74 × 10 3 ] Клетки на ML для воды против 9,2 × 10 5 [8,65 × 10 5 до 1,07 × 10 6 ] Клетки мл для Quanta [ P < .001]).
3 × 10 3 [4,05 × 10 2 до 9,74 × 10 3 ] Клетки на ML для воды против 9,2 × 10 5 [8,65 × 10 5 до 1,07 × 10 6 ] Клетки мл для Quanta [ P < .001]).
Вирусная нагрузка ЦМВ в слюне и DBS
Вирусная нагрузка для всех образцов с положительным результатом скрининга показана на рисунке.Медиана (межквартильный диапазон) вирусной нагрузки для 60 положительных образцов слюны составляла от 1,34×10 6 МЕ/мл (от 1,87×10 3 до 3,09×10 7 МЕ/мл). Медиана (межквартильный диапазон) вирусной нагрузки для 49 положительных образцов DBS составляла 6,6 × 10 3 МЕ/мл (от 2,97 × 10 3 до 1,60 × 10 4 МЕ/мл). Значения DBS, которые были положительными как в лабораториях CDC, так и в лабораториях UMN, представляют собой среднее значение МЕ/мл для этого новорожденного.
В этой статье мы описываем промежуточные результаты аналитической чувствительности DBS-ПЦР для скрининга цМВ на основе невыбранной когорты из 12554 новорожденных, включенных в многоцентровое исследование в городах-побратимах Миннеаполиса и Сент-Пола в Миннесоте.Основным выводом нашего исследования была повышенная чувствительность DBS-ПЦР для идентификации цМВ (86% для комбинированных лабораторных результатов, 73% и 77% для отдельных результатов из UM и CDC соответственно) по сравнению с предыдущими исследованиями. 18 Основные причины повышенной чувствительности, скорее всего, связаны с усовершенствованными методологиями. В частности, было показано, что экстрактор ДНК, представленный Qiagen в 2003 году и используемый в CHIMES 18 , дает значительно меньше ДНК, чем другие системы очистки. 17 Буфер для элюции Quanta DBS, используемый лабораторией CDC, имеет высокий выход ДНК, является быстрым и недорогим, 23 и в настоящее время используется в нескольких государственных программах NBS (включая Колорадо, Мичиган, Миннесоту, Висконсин и Вашингтон) для ДНК тестирование на основе. 24
24
В нашем исследовании оценивалась распространенность ЦМВ среди населения Среднего Запада США, которое было преимущественно белым неиспаноязычным населением. 25 Исследование CHIMES 18 показало, что распространенность cCMV существенно различается в зависимости от расы и латиноамериканского происхождения: 9.5 на 1000 среди чернокожих новорожденных и 2,7 на 1000 среди неиспаноязычных белых новорожденных. Несмотря на более высокую долю белых новорожденных неиспаноязычного происхождения в нашем исследовании по сравнению с популяцией CHIMES (75,5% против 37,1%), наша распространенность ЦМВ была аналогичной и составляла 4,5 на 1000. 13 Размер нашей выборки в настоящее время слишком мал, чтобы дать надежные оценки. для демографических подгрупп. Более крупный размер выборки и дополнительные данные будут доступны через 2 года, что поможет прояснить факторы риска и клинические исходы ЦМВ в нашей когорте.
Наше исследование предлагает полезные наблюдения о приемлемости и осуществимости скрининга на ЦМВ. Несмотря на то, что период новорожденности был беспокойным и напряженным для родителей, 70% опрошенных согласились, что согласуется с опросами, сообщающими в целом о положительном отношении родителей к скринингу на ЦМВ. 26 ,27 Мы отметили, что существуют минимальные барьеры для сообщения положительных результатов скрининга специалистам первичной медико-санитарной помощи. Получив уведомление о положительном результате, клиницисты и члены семьи были очень согласны с повторным анализом мочи.Эти наблюдения подтверждают потенциальную приемлемость и полезность включения скрининга на ЦМВ в программы NBS департамента здравоохранения штата.
Несмотря на то, что период новорожденности был беспокойным и напряженным для родителей, 70% опрошенных согласились, что согласуется с опросами, сообщающими в целом о положительном отношении родителей к скринингу на ЦМВ. 26 ,27 Мы отметили, что существуют минимальные барьеры для сообщения положительных результатов скрининга специалистам первичной медико-санитарной помощи. Получив уведомление о положительном результате, клиницисты и члены семьи были очень согласны с повторным анализом мочи.Эти наблюдения подтверждают потенциальную приемлемость и полезность включения скрининга на ЦМВ в программы NBS департамента здравоохранения штата.
Хотя наше исследование было разработано для использования слюны в качестве эталонного стандарта, скрининг слюны давал как ложноположительные, так и ложноотрицательные результаты, аналогичные результатам других исследований. 5 ,9 Доля положительных результатов слюны в нашем исследовании, которые оказались ложноположительными (13. 3%), аналогичен данным, полученным в других исследованиях, в которых проводился скрининг цМВ со слюной. 9 ,10 Ложноположительные результаты анализа слюны, скорее всего, связаны с колонизацией ротоглотки новорожденного ДНК ЦМВ из молозива. 28 Среди 12554 новорожденных, прошедших скрининг в нашем исследовании, 8 результатов анализа слюны были ложноположительными, что соответствует частоте ложноположительных результатов 0,06%, что сравнимо с частотой ложноположительных результатов 0,03, 0,14%, описанной в когорте CHIMES. 29 Недавнее одобрение Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США теста неонатальной слюны на цитомегаловирус (Meridan Bioscience) подчеркивает важность дальнейшего уточнения роли ложноположительных результатов теста слюны на цитомегаловирус и подчеркивает необходимость подтверждения мочи для диагностики ЦМВ. 9 ,30
3%), аналогичен данным, полученным в других исследованиях, в которых проводился скрининг цМВ со слюной. 9 ,10 Ложноположительные результаты анализа слюны, скорее всего, связаны с колонизацией ротоглотки новорожденного ДНК ЦМВ из молозива. 28 Среди 12554 новорожденных, прошедших скрининг в нашем исследовании, 8 результатов анализа слюны были ложноположительными, что соответствует частоте ложноположительных результатов 0,06%, что сравнимо с частотой ложноположительных результатов 0,03, 0,14%, описанной в когорте CHIMES. 29 Недавнее одобрение Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США теста неонатальной слюны на цитомегаловирус (Meridan Bioscience) подчеркивает важность дальнейшего уточнения роли ложноположительных результатов теста слюны на цитомегаловирус и подчеркивает необходимость подтверждения мочи для диагностики ЦМВ. 9 ,30
В заключение, наши промежуточные результаты обеспечивают основу для дальнейшего развития DBS PCR в качестве метода скрининга cCMV.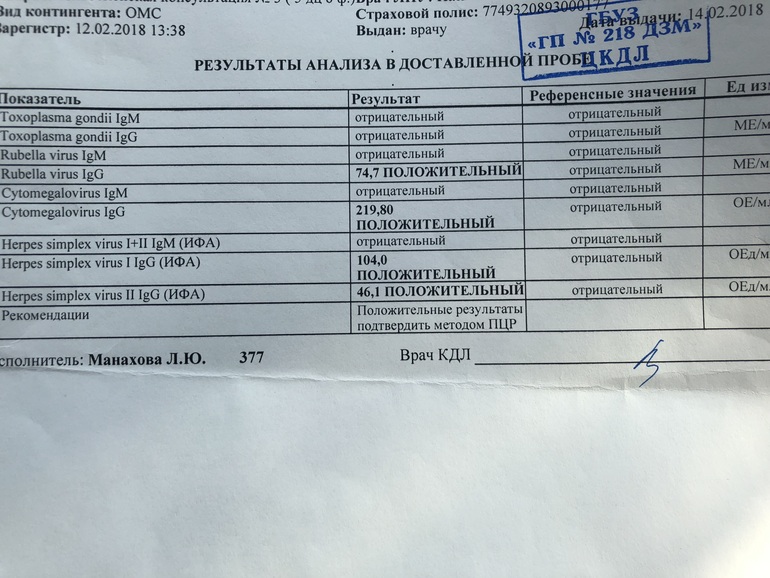 Хотя средняя чувствительность DBS для двух тестов в нашем исследовании, составляющая 75%, остается субоптимальной для скрининга, дальнейшее совершенствование методологий выделения ДНК и ПЦР должно позволить повысить чувствительность отдельных тестов. Клиническая чувствительность DBS, т. е. способность выявлять новорожденных с цЦМВ или с высоким риском, еще предстоит определить, и она может быть выше, чем аналитическая чувствительность.В нашем исследовании мы будем наблюдать за младенцами с подтвержденным cCMV в возрасте до 4 лет, чтобы оценить все клинические исходы. Методы диагностики постоянно совершенствуются, и поэтому наши результаты показывают потенциал DBS для обеспечения недорогого скрининга ЦМВ с плавной интеграцией сбора образцов, лабораторных исследований и последующего наблюдения. 14
Хотя средняя чувствительность DBS для двух тестов в нашем исследовании, составляющая 75%, остается субоптимальной для скрининга, дальнейшее совершенствование методологий выделения ДНК и ПЦР должно позволить повысить чувствительность отдельных тестов. Клиническая чувствительность DBS, т. е. способность выявлять новорожденных с цЦМВ или с высоким риском, еще предстоит определить, и она может быть выше, чем аналитическая чувствительность.В нашем исследовании мы будем наблюдать за младенцами с подтвержденным cCMV в возрасте до 4 лет, чтобы оценить все клинические исходы. Методы диагностики постоянно совершенствуются, и поэтому наши результаты показывают потенциал DBS для обеспечения недорогого скрининга ЦМВ с плавной интеграцией сбора образцов, лабораторных исследований и последующего наблюдения. 14
Автор, ответственный за переписку: Шейла С. Доллард, доктор философии, Отдел вирусных заболеваний, Центры по контролю и профилактике заболеваний, 1600 Clifton Rd, Atlanta, GA 30329 (sdollard@cdc. правительство).
правительство).
Принято к публикации: 18 августа 2020 г.
Опубликовано в Интернете: 1 февраля 2021 г. doi:10.1001/jamapediatrics.2020.5441
0 Лицензия CC-BY. © 2021 Dollard SC et al. JAMA Pediatrics .
Вклад авторов: Д-р Доллард и Шляйсс имели полный доступ ко всем данным исследования и несут ответственность за целостность данных и точность анализа данных.
Концепция и дизайн: Доллард, Дреон, Эрнандес-Альварадо, Амин, Ланциери, Макканн, Шляйсс.
Сбор, анализ или интерпретация данных: Доллард, Дреон, Эрнандес-Альварадо, Вонг, Ланциери, Остерхольм, Сайдботтом, Розендаль, Шляйсс.
Составление рукописи: Доллард, Вонг, Макканн, Шляйсс.
Критический пересмотр рукописи на предмет важного интеллектуального содержания: Доллард, Дреон, Эрнандес-Альварадо, Амин, Ланзиери, Остерхольм, Сайдботтом, Розендаль, Шляйсс.
Статистический анализ: Lanzieri, Schleiss.
Получено финансирование: Dollard, Dreon, Lanzieri, Schleiss.
Административная, техническая или материальная поддержка: Все авторы.
Надзор: Доллард, Дреон, Сайдботтом, Шляйсс.
Раскрытие информации о конфликте интересов: Г-жа Дреон, г-жа Розендаль и г-н Макканн сообщили о грантах от Центров по контролю и профилактике заболеваний США (CDC) во время проведения исследования.Доктор Сайдботтом сообщил о грантах Университета Миннесоты во время проведения исследования. Д-р Schleiss сообщил о грантах от CDC, Национальных институтов здравоохранения и Центра исследований и распространения информации об инвалидности Университета Южной Каролины (DRDC) во время проведения исследования; и персональные гонорары от Moderna Vaccines, Sanofi Vaccines, GlaxoSmithKline Vaccines и Merck Vaccines, не входящие в представленную работу. Других раскрытий не поступало.
Финансирование/поддержка: Финансирование этого исследования было предоставлено Центрами США по контролю и профилактике заболеваний (CDC), Управлением национальной программы вакцинации, Программой скрининга новорожденных Министерства здравоохранения Миннесоты и Университетом исследований инвалидности Университета Южной Каролины. и Центр распространения (DRDC) в рамках соглашения о сотрудничестве (6U19DD001218) с CDC.Финансовая поддержка этого исследования была предоставлена CDC, Министерством здравоохранения Миннесоты, Управлением национальной программы вакцинации (федеральное правительство США) и Центром исследований и распространения информации об инвалидности Университета Южной Каролины.
и Центр распространения (DRDC) в рамках соглашения о сотрудничестве (6U19DD001218) с CDC.Финансовая поддержка этого исследования была предоставлена CDC, Министерством здравоохранения Миннесоты, Управлением национальной программы вакцинации (федеральное правительство США) и Центром исследований и распространения информации об инвалидности Университета Южной Каролины.
Роль спонсора/спонсора: Спонсоры не участвовали в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; и решение представить рукопись для публикации.
Заявление об ограничении ответственности: Выводы и заключения в этой статье принадлежат авторам и не обязательно отражают официальную позицию Центров США по контролю и профилактике заболеваний или Центра исследований и распространения информации об инвалидности Университета Южной Каролины.
Дополнительные взносы: Мы хотели бы выразить благодарность семьям, участвовавшим в исследовании, и следующему персоналу больницы за их важную роль в получении согласия семей: лица, дающие согласие, из Allina Health Care Delivery Research в Миннеаполисе, штат Миннесота: Whitney Вундерлих, Массачусетс (руководитель), Димфо Орионзи, MS, Сирри Нгва, MS, Анна Шелли, MS, CGC, и Джессика Тагон, MHA, а также участники Программы клинических исследований педиатрии Миннесотского университета в Миннеаполисе, Миннесота: Эмили Граупманн, бакалавр наук ( ведущий), Эми Эш, BA, Кристин Чу, BS, Дженсина Эриксен, RN, BSN, Бриттани Фаанес, MPS, CCRP, Эми Хэнсон, CCRC, Мишель Хаггетт, BS, Эшли Кемп, BA, Мэри Пэт Осборн, RN, BSN, Лорали Петерсон, магистр здравоохранения, Анджела Типп, бакалавр наук, и Дженна Вассенаар, бакалавр наук, CCRP.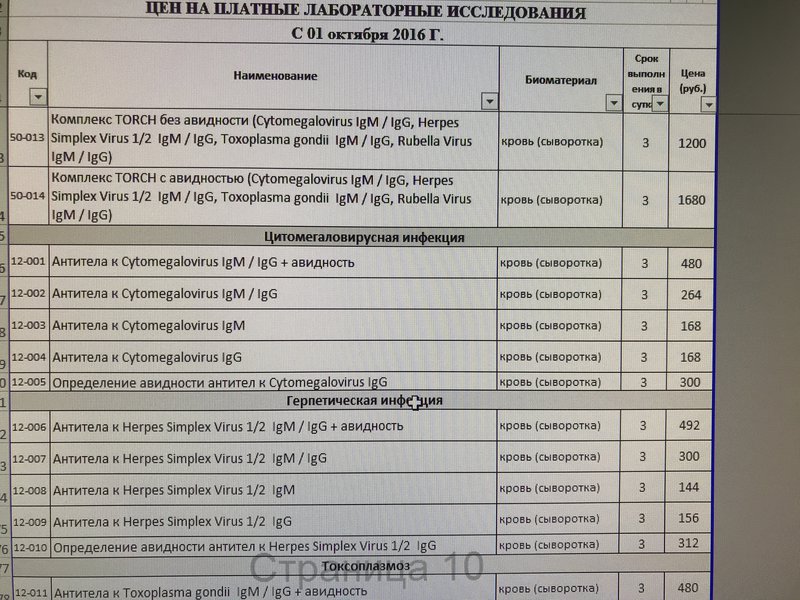 Консентеры получали вознаграждение за свою службу.
Консентеры получали вознаграждение за свою службу.
 Всеобщий скрининг новорожденных на врожденную ЦМВ-инфекцию: каковы доказательства потенциальной пользы? Rev Med Virol . 2014;24(5):291-307.doi:10.1002/rmv.1790PubMedGoogle ScholarCrossref 7.Eventov-Friedman
С, Усадьба
H, Бар-Оз
Б,
и другие. Полимеразная цепная реакция слюны в режиме реального времени для целевого скрининга врожденной цитомегаловирусной инфекции. J Заразить Dis . 2019;220(11):1790-1796. doi: 10.1093/infdis/jiz373PubMedGoogle ScholarCrossref 9.Exler
С, Даймингер
А, Гроте
М, Шаласта
Г, Эндерс
Г, Эндерс
М. Первичная цитомегаловирусная (ЦМВ) инфекция при беременности: диагностическая ценность ПЦР ЦМВ в слюне по сравнению с мочой при рождении. Дж Клин Вирол . 2019;117:33-36. doi:10.1016/j.jcv.2019.05.015PubMedGoogle ScholarCrossref 10.Yamamoto
АЙ, Мусси-Пинхата
ММ, Марин
LJ, британец
РМ, Оливейра
ПФ, Коэльо
ТБ.
Всеобщий скрининг новорожденных на врожденную ЦМВ-инфекцию: каковы доказательства потенциальной пользы? Rev Med Virol . 2014;24(5):291-307.doi:10.1002/rmv.1790PubMedGoogle ScholarCrossref 7.Eventov-Friedman
С, Усадьба
H, Бар-Оз
Б,
и другие. Полимеразная цепная реакция слюны в режиме реального времени для целевого скрининга врожденной цитомегаловирусной инфекции. J Заразить Dis . 2019;220(11):1790-1796. doi: 10.1093/infdis/jiz373PubMedGoogle ScholarCrossref 9.Exler
С, Даймингер
А, Гроте
М, Шаласта
Г, Эндерс
Г, Эндерс
М. Первичная цитомегаловирусная (ЦМВ) инфекция при беременности: диагностическая ценность ПЦР ЦМВ в слюне по сравнению с мочой при рождении. Дж Клин Вирол . 2019;117:33-36. doi:10.1016/j.jcv.2019.05.015PubMedGoogle ScholarCrossref 10.Yamamoto
АЙ, Мусси-Пинхата
ММ, Марин
LJ, британец
РМ, Оливейра
ПФ, Коэльо
ТБ.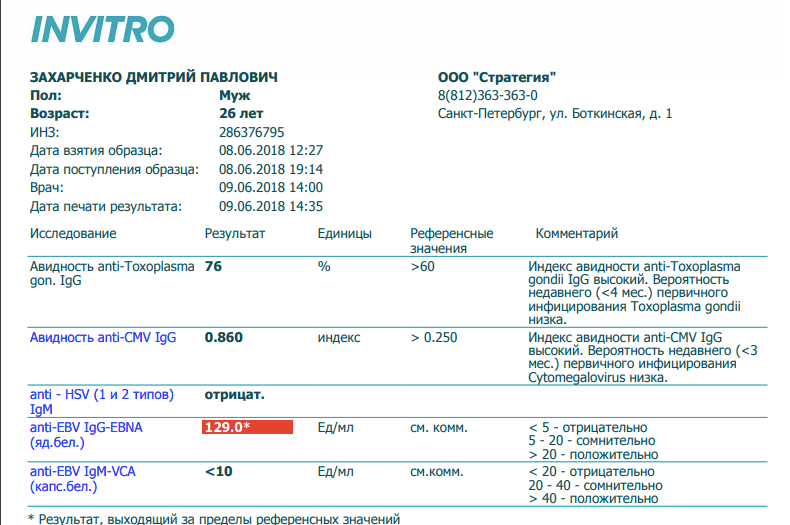 Является ли слюна столь же надежной, как и моча, для обнаружения ДНК цитомегаловируса для неонатального скрининга врожденной ЦМВ-инфекции? Дж Клин Вирол . 2006;36(3):228-230. doi:10.1016/j.jcv.2006.03.011PubMedGoogle ScholarCrossref 11.Nagel
А, Димитракопулу
Э, Тейг
Н,
и другие.Характеристика универсального подхода к скринингу врожденной ЦМВ-инфекции, основанного на высокочувствительной количественной мультиплексной ПЦР в реальном времени. PLoS One . 2020;15(1):e0227143. doi:10.1371/journal.pone.0227143PubMedGoogle Scholar12.Cardoso
Эс, Иисус
БЛ, Гомеш
LG, Соуза
С.М., Гаделья
СР, Марин
ЖЖ. Использование слюны в качестве практической и осуществимой альтернативы моче при крупномасштабном скрининге на врожденную цитомегаловирусную инфекцию повышает показатели включения и выявления. Бюстгальтеры Rev Soc Med Trop .
Является ли слюна столь же надежной, как и моча, для обнаружения ДНК цитомегаловируса для неонатального скрининга врожденной ЦМВ-инфекции? Дж Клин Вирол . 2006;36(3):228-230. doi:10.1016/j.jcv.2006.03.011PubMedGoogle ScholarCrossref 11.Nagel
А, Димитракопулу
Э, Тейг
Н,
и другие.Характеристика универсального подхода к скринингу врожденной ЦМВ-инфекции, основанного на высокочувствительной количественной мультиплексной ПЦР в реальном времени. PLoS One . 2020;15(1):e0227143. doi:10.1371/journal.pone.0227143PubMedGoogle Scholar12.Cardoso
Эс, Иисус
БЛ, Гомеш
LG, Соуза
С.М., Гаделья
СР, Марин
ЖЖ. Использование слюны в качестве практической и осуществимой альтернативы моче при крупномасштабном скрининге на врожденную цитомегаловирусную инфекцию повышает показатели включения и выявления. Бюстгальтеры Rev Soc Med Trop . 2015;48(2):206-207. doi: 10.1590/0037-8682-0200-2014PubMedGoogle ScholarCrossref 13.Boppana
СБ, Росс
ЮАР, Шимамура
М,
и другие; Исследование Национального института глухоты и других коммуникативных расстройств. Анализ полимеразной цепной реакции слюны для скрининга цитомегаловируса у новорожденных. N Engl J Med . 2011;364(22):2111-2118. doi:10.1056/NEJMoa1006561PubMedGoogle ScholarCrossref 14. Служение семье от рождения до медицинского дома: отчет Целевой группы по скринингу новорожденных, созванной в Вашингтоне, округ Колумбия, 10–11 мая 1999 г. Педиатрия 2000;106(2 pt 2):383-427.Google Scholar15.Cannon
MJ, Хайд
ТБ, Шмид
ДС. Обзор выделения цитомегаловируса в жидкостях организма и связи с врожденной цитомегаловирусной инфекцией. Rev Med Virol . 2011;21(4):240-255. doi: 10.1002/rmv.695PubMedGoogle ScholarCrossref 16.
2015;48(2):206-207. doi: 10.1590/0037-8682-0200-2014PubMedGoogle ScholarCrossref 13.Boppana
СБ, Росс
ЮАР, Шимамура
М,
и другие; Исследование Национального института глухоты и других коммуникативных расстройств. Анализ полимеразной цепной реакции слюны для скрининга цитомегаловируса у новорожденных. N Engl J Med . 2011;364(22):2111-2118. doi:10.1056/NEJMoa1006561PubMedGoogle ScholarCrossref 14. Служение семье от рождения до медицинского дома: отчет Целевой группы по скринингу новорожденных, созванной в Вашингтоне, округ Колумбия, 10–11 мая 1999 г. Педиатрия 2000;106(2 pt 2):383-427.Google Scholar15.Cannon
MJ, Хайд
ТБ, Шмид
ДС. Обзор выделения цитомегаловируса в жидкостях организма и связи с врожденной цитомегаловирусной инфекцией. Rev Med Virol . 2011;21(4):240-255. doi: 10.1002/rmv.695PubMedGoogle ScholarCrossref 16. de Vries
JJC, Клаас
ECJ, Кроес
ACM, Фоссен
АС. Оценка методов выделения ДНК сухих пятен крови в диагностике врожденной цитомегаловирусной инфекции. Дж Клин Вирол . 2009;46(доп.4):S37-S42. doi:10.1016/j.jcv.2009.09.001PubMedGoogle ScholarCrossref 17.Koontz
Д, Бехер
К, Амин
М, Николова
С, Галлахер
М, Доллард
С. Оценка методов выделения ДНК для обнаружения цитомегаловируса в высушенных пятнах крови. Дж Клин Вирол . 2015;66:95-99. doi:10.1016/j.jcv.2015.03.015PubMedGoogle ScholarCrossref 18.Boppana
СБ, Росс
С.А., Новак
Z,
и другие; Исследование Национального института глухоты и других коммуникативных расстройств ЦМВ и многоцентрового скрининга слуха (CHIMES).Анализ полимеразной цепной реакции в режиме реального времени с использованием сухой капли крови для скрининга новорожденных на врожденную цитомегаловирусную инфекцию.
de Vries
JJC, Клаас
ECJ, Кроес
ACM, Фоссен
АС. Оценка методов выделения ДНК сухих пятен крови в диагностике врожденной цитомегаловирусной инфекции. Дж Клин Вирол . 2009;46(доп.4):S37-S42. doi:10.1016/j.jcv.2009.09.001PubMedGoogle ScholarCrossref 17.Koontz
Д, Бехер
К, Амин
М, Николова
С, Галлахер
М, Доллард
С. Оценка методов выделения ДНК для обнаружения цитомегаловируса в высушенных пятнах крови. Дж Клин Вирол . 2015;66:95-99. doi:10.1016/j.jcv.2015.03.015PubMedGoogle ScholarCrossref 18.Boppana
СБ, Росс
С.А., Новак
Z,
и другие; Исследование Национального института глухоты и других коммуникативных расстройств ЦМВ и многоцентрового скрининга слуха (CHIMES).Анализ полимеразной цепной реакции в режиме реального времени с использованием сухой капли крови для скрининга новорожденных на врожденную цитомегаловирусную инфекцию. ДЖАМА . 2010;303(14):1375-1382. doi:10.1001/jama.2010.423PubMedGoogle ScholarCrossref 19.Meyer
Л, Шэрон
Б, Хуан
ТС,
и другие. Анализ архивных сухих пятен крови (DBS) новорожденных идентифицирует врожденный цитомегаловирус как основную причину необъяснимой сенсоневральной тугоухости у детей. Am J Отоларингол . 2017;38(5):565-570.doi:10.1016/j.amjoto.2017.06.002PubMedGoogle ScholarCrossref 20.Cannon
MJ, Стоуэлл
Джей Ди, Кларк
Р,
и другие. Изучение повторных измерений еженедельного и суточного выделения цитомегаловируса в слюне и моче здоровых цитомегаловирус-серопозитивных детей. BMC Infect Dis . 2014;14:569. doi: 10.1186/s12879-014-0569-1PubMedGoogle ScholarCrossref 21. Хайден
РТ, вс.
Ю, Тан
Л,
и другие. Прогресс в количественном тестировании вирусной нагрузки: изменчивость и влияние количественных международных стандартов ВОЗ.
ДЖАМА . 2010;303(14):1375-1382. doi:10.1001/jama.2010.423PubMedGoogle ScholarCrossref 19.Meyer
Л, Шэрон
Б, Хуан
ТС,
и другие. Анализ архивных сухих пятен крови (DBS) новорожденных идентифицирует врожденный цитомегаловирус как основную причину необъяснимой сенсоневральной тугоухости у детей. Am J Отоларингол . 2017;38(5):565-570.doi:10.1016/j.amjoto.2017.06.002PubMedGoogle ScholarCrossref 20.Cannon
MJ, Стоуэлл
Джей Ди, Кларк
Р,
и другие. Изучение повторных измерений еженедельного и суточного выделения цитомегаловируса в слюне и моче здоровых цитомегаловирус-серопозитивных детей. BMC Infect Dis . 2014;14:569. doi: 10.1186/s12879-014-0569-1PubMedGoogle ScholarCrossref 21. Хайден
РТ, вс.
Ю, Тан
Л,
и другие. Прогресс в количественном тестировании вирусной нагрузки: изменчивость и влияние количественных международных стандартов ВОЗ. J Clin Microbiol . 2017;55(2):423-430. doi:10.1128/JCM.02044-16PubMedGoogle ScholarCrossref 29.Росс
С.А., Майклс
МГ, Ахмед
А,
и другие. Вклад грудного вскармливания в ложноположительную полимеразную цепную реакцию слюны при скрининге новорожденных на врожденный цитомегаловирус. J Заразить Dis . 2018;217(10):1612-1615. doi: 10.1093/infdis/jiy057PubMedGoogle ScholarCrossref 30.Gantt
С, Гольдфарб
ДМ, парк
А,
и другие.Эффективность анализа Alethia CMV для обнаружения цитомегаловируса с использованием мазков неонатальной слюны. J Clin Microbiol . 2020;58(4):e01951-19. doi:10.1128/JCM.01951-19PubMedGoogle Scholar
J Clin Microbiol . 2017;55(2):423-430. doi:10.1128/JCM.02044-16PubMedGoogle ScholarCrossref 29.Росс
С.А., Майклс
МГ, Ахмед
А,
и другие. Вклад грудного вскармливания в ложноположительную полимеразную цепную реакцию слюны при скрининге новорожденных на врожденный цитомегаловирус. J Заразить Dis . 2018;217(10):1612-1615. doi: 10.1093/infdis/jiy057PubMedGoogle ScholarCrossref 30.Gantt
С, Гольдфарб
ДМ, парк
А,
и другие.Эффективность анализа Alethia CMV для обнаружения цитомегаловируса с использованием мазков неонатальной слюны. J Clin Microbiol . 2020;58(4):e01951-19. doi:10.1128/JCM.01951-19PubMedGoogle ScholarНеонатальная цитомегаловирусная нагрузка крови и риск осложнений у симптоматических и бессимптомных врожденно инфицированных новорожденных | Педиатрия
ЦЕЛЬ. Цитомегаловирус человека (ЦМВ) представляет собой повсеместно распространенный ДНК-вирус, специфичный для человека, и является основной причиной врожденной вирусной инфекции в развитых странах, приводящей к психомоторным нарушениям и глухоте. Диагностические методы обнаружения ЦМВ значительно улучшились за последние годы с появлением сложных серологических и вирусологических методов. Целью настоящего исследования была оценка диагностической и прогностической ценности обнаружения и количественного определения вируса в неонатальных образцах крови симптомных и бессимптомных новорожденных с врожденной ЦМВ-инфекцией.
Диагностические методы обнаружения ЦМВ значительно улучшились за последние годы с появлением сложных серологических и вирусологических методов. Целью настоящего исследования была оценка диагностической и прогностической ценности обнаружения и количественного определения вируса в неонатальных образцах крови симптомных и бессимптомных новорожденных с врожденной ЦМВ-инфекцией.
МЕТОДЫ. В период с января 1997 г. по декабрь 2003 г. мы обследовали 99 новорожденных, рожденных женщинами с первичной, рецидивирующей и неустановленной ЦМВ-инфекцией во время беременности.Врожденную ЦМВ-инфекцию идентифицировали по выделению вируса в моче в течение второй недели жизни. Пятьдесят восемь из 99 младенцев были инфицированы и прошли клиническую оценку заболевания в период новорожденности и классифицировались как имеющие симптоматическую или бессимптомную инфекцию на основании физикальных, инструментальных и лабораторных данных. Младенцы наблюдались с рождения в соответствии с протоколом третичного отделения интенсивной терапии Болонского университета в проспективном исследовании отдаленных последствий врожденной инфекции.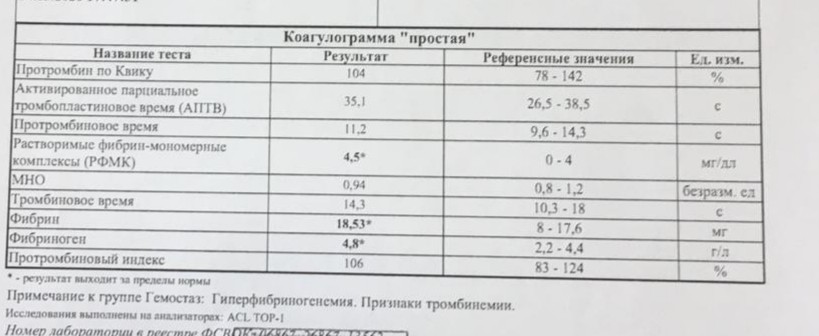 Было получено 47 образцов крови от 47 детей в неонатальном периоде: 34 исследованы на антигенемию pp65 и 44 на качественную и количественную полимеразную цепную реакцию (ПЦР и кПЦР). Последствия через 12 месяцев были оценены в группе из 50 младенцев.
Было получено 47 образцов крови от 47 детей в неонатальном периоде: 34 исследованы на антигенемию pp65 и 44 на качественную и количественную полимеразную цепную реакцию (ПЦР и кПЦР). Последствия через 12 месяцев были оценены в группе из 50 младенцев.
РЕЗУЛЬТАТЫ. Антигенемия была положительной только в 10 из 34 образцов инфицированных новорожденных (чувствительность 29,4%). ПЦР была проведена в 44 образцах инфицированных новорожденных и во всех была положительной (100% чувствительность). КПЦР показала обнаружение ≥100 копий на 10 5 полиморфноядерных лейкоцитов (PMNL) в 39 из 44 образцов; в остальных 5 случаях число копий на 10 5 PMNL было <100.Между симптомными и бессимптомными новорожденными средние значения вирусной нагрузки крови, определенные с помощью количественной ПЦР, оказались значительно выше у симптомных новорожденных. Средние значения неонатальной вирусной нагрузки в крови были статистически выше у новорожденных, у которых развились осложнения, чем у тех, у кого их не было.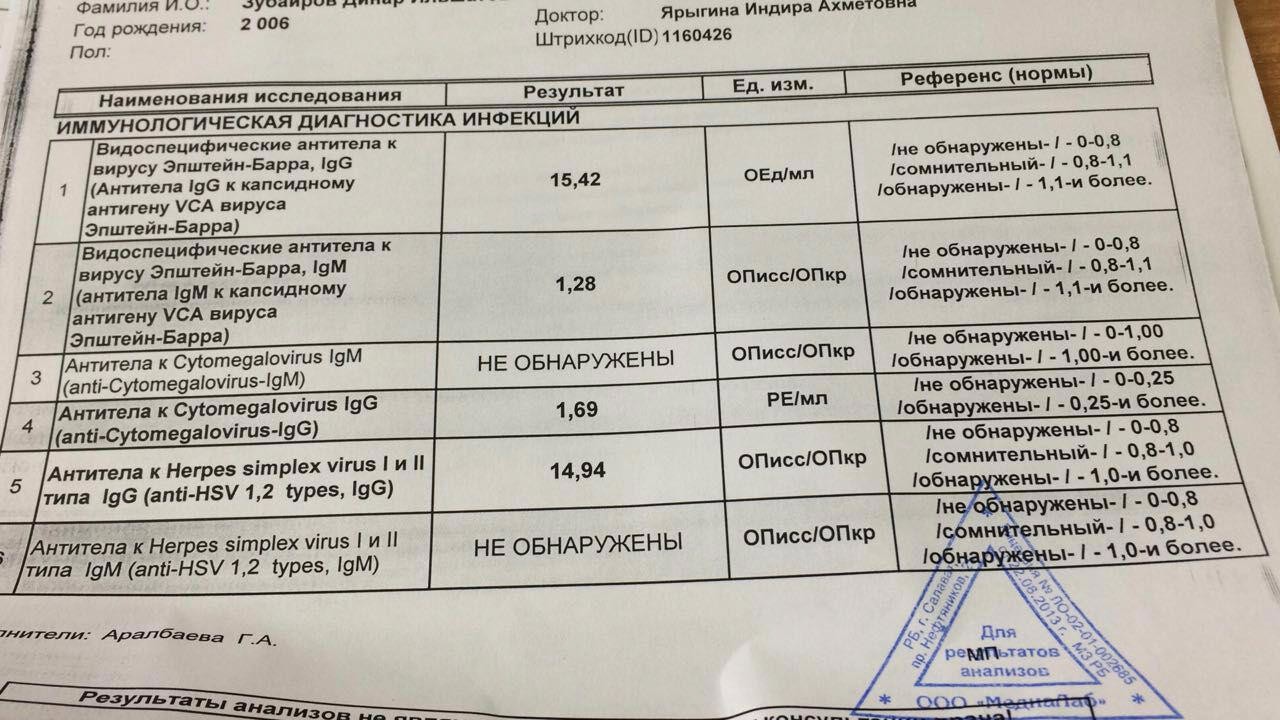 Из 20 детей с неонатальной вирусной нагрузкой <1000 копий на 10 5 ПМЯЛ у 19 не развились осложнения (отрицательная прогностическая ценность: 95%), тогда как у 2 из 3 детей с вирусной нагрузкой >10000 копий развились осложнения .
Из 20 детей с неонатальной вирусной нагрузкой <1000 копий на 10 5 ПМЯЛ у 19 не развились осложнения (отрицательная прогностическая ценность: 95%), тогда как у 2 из 3 детей с вирусной нагрузкой >10000 копий развились осложнения .
ВЫВОДЫ. Различные диапазоны значений виремии коррелируют с различным риском осложнений: около 70% осложнений были обнаружены у новорожденных с qPCR выше 10000 копий на 10 5 PMNL. Низкая неонатальная вирусная нагрузка в крови, обнаруженная с помощью теста на антигенемию pp65 и количественной ПЦР, в высокой степени предсказывала отсутствие осложнений: ДНКемия <1000 копий на 10 5 PMNL имеет отрицательную прогностическую ценность 95%. Как независимый прогностический фактор исхода неонатальная виремия является еще одним полезным элементом неонатального консультирования и выбора терапии у симптомных и бессимптомных новорожденных.
Цитомегаловирус – сложная тема
Печать (PDF)
Цитомегаловирус, или ЦМВ, представляет собой вирус, который не вызывает каких-либо заметных симптомов у большей части населения в целом или у большинства пациентов. Около 40–50% взрослых подверглись воздействию ЦМВ без каких-либо клинических последствий. Сообщается, что после воздействия ЦМВ остается в наших белых кровяных тельцах и может вызвать инфекцию, если иммунная система будет скомпрометирована. ЦМВ может передаваться через различные биологические жидкости, половую жизнь, переливание крови и трансплантацию или от матери к ребенку.
Около 40–50% взрослых подверглись воздействию ЦМВ без каких-либо клинических последствий. Сообщается, что после воздействия ЦМВ остается в наших белых кровяных тельцах и может вызвать инфекцию, если иммунная система будет скомпрометирована. ЦМВ может передаваться через различные биологические жидкости, половую жизнь, переливание крови и трансплантацию или от матери к ребенку.
Особую озабоченность вызывает ЦМВ, который может вызывать опасную для жизни пневмонию у пациентов из группы риска.
Риск передачи ЦМВ при переливании крови можно снизить, используя специальные фильтры для удаления большинства лейкоцитов из клеточных компонентов крови. Процесс называется лейкоредукцией. Компоненты крови с пониженным лейкоцитозом также называют «безопасными для ЦМВ». В июне 1999 года Служба крови Канады внедрила универсальное снижение лейкоредуктивности путем фильтрации перед хранением. Они также предлагают «ЦМВ-серонегативные» компоненты крови, полученные от доноров с отрицательным результатом теста на антитела к ЦМВ, чтобы еще больше снизить риск передачи ЦМВ при переливании.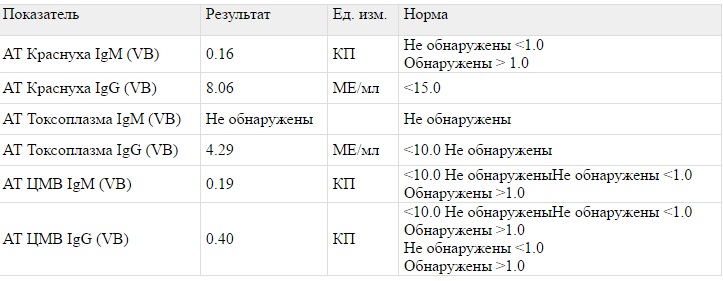 Существуют противоречивые данные о пользе предоставления компонентов крови с пониженным содержанием лейкоцитов, а также серонегативных компонентов крови по ЦМВ для предотвращения инфекции у пациентов из группы риска. Для получения дополнительной информации см. «Использование продуктов ЦМВ» доктора Кристин Черти-Газдевич.
Существуют противоречивые данные о пользе предоставления компонентов крови с пониженным содержанием лейкоцитов, а также серонегативных компонентов крови по ЦМВ для предотвращения инфекции у пациентов из группы риска. Для получения дополнительной информации см. «Использование продуктов ЦМВ» доктора Кристин Черти-Газдевич.
Стремясь внести ясность в эту тему для специалистов по переливанию крови, Национальный консультативный комитет по крови и продуктам крови разместил на своем веб-сайте заявление (от августа 2014 г.) относительно целесообразности использования ЦМВ-серонегативных продуктов по сравнению с ЦМВ-безопасными продуктами.
«Национальный консультативный комитет рекомендует считать безопасные для ЦМВ и серонегативные по ЦМВ IgG продукты эквивалентными для большинства групп пациентов, включая взрослых и детей, реципиентов гемопоэтических стволовых клеток, серонегативных по ЦМВ пациентов, которым в будущем может потребоваться трансплантация, и пациентов с иммунодефицитом. В связи со значительными разногласиями и отсутствие доказательств необходимости предоставления ЦМВ-серонегативных продуктов в дополнение к лейкодеплеции в следующих группах пациентов — внутриутробное переливание, новорожденным в возрасте до 28 дней и при плановом переливании ЦМВ-серонегативных беременных женщин, NAC рекомендует следовать местным правилам.»
В связи со значительными разногласиями и отсутствие доказательств необходимости предоставления ЦМВ-серонегативных продуктов в дополнение к лейкодеплеции в следующих группах пациентов — внутриутробное переливание, новорожденным в возрасте до 28 дней и при плановом переливании ЦМВ-серонегативных беременных женщин, NAC рекомендует следовать местным правилам.»
В целях содействия оптимальному использованию серонегативных по ЦМВ тромбоцитов Служба крови Канады в марте 2015 г. выпустила сводку крови по тромбоцитам ЦМВ. Данные, содержащиеся в сводке крови, подчеркивают различную потребность больниц в Канаде в серонегативных по ЦМВ компонентах крови.
В последнее время некоторые больницы решили внедрить политику, которая не требует серонегативных компонентов крови по ЦМВ ни для одного из своих пациентов. Список этих больниц можно найти здесь.
При отсутствии точных данных по этому вопросу больницы будут продолжать следовать местным правилам, которые, по их мнению, наиболее подходят для их пациентов.
Цитомегаловирус (ЦМВ) Серонегативные продукты крови
Цитомегаловирус (ЦМВ) является распространенной вирусной инфекцией, которая легко передается в общественных условиях и обычно протекает в легкой форме и самоограничивается, хотя потенциально может иметь серьезные последствия для беременных женщин, детей и некоторые группы пациентов с ослабленным иммунитетом. ЦМВ также может передаваться при переливании крови.
Все австралийские клеточные продукты крови (кроме гранулоцитов) содержат лейкофиллы (удаление лейкоцитов).
В январе 2014 г. JBC одобрил создание рабочей группы JBC для надзора за разработкой вариантов подготовки национального заявления о показаниях и приоритетности афереза и тромбоцитов цельной крови и серонегативных продуктов крови ЦМВ.
В апреле 2016 года JBC утвердила Клинические показания для афереза и тромбоцитов цельной крови — национальное заявление и согласилась с рабочей группой JBC подготовить заявление о клиническом использовании серонегативных продуктов крови ЦМВ, поскольку уже было опубликовано несколько источников рекомендаций. на основании имеющихся доказательств и различных мнений экспертов.Рабочая группа рассмотрела международную практику, текущую литературу и местные руководящие документы с целью разработки национального подхода к клиническому использованию серонегативных по ЦМВ продуктов.
на основании имеющихся доказательств и различных мнений экспертов.Рабочая группа рассмотрела международную практику, текущую литературу и местные руководящие документы с целью разработки национального подхода к клиническому использованию серонегативных по ЦМВ продуктов.
Позиция рабочей группы, одобренная JBC и основанная на мнениях экспертов в Руководстве по управлению кровью пациентов, заключается в том, что только лаборатории, поставляющие продукты крови педиатрическим службам или службам по беременности и родам, должны иметь серонегативные ЦМВ-серонегативные материалы.
(pdf) (docx)
НБА будет работать в сотрудничестве с ключевыми заинтересованными сторонами над выполнением рекомендаций, включая обучение и обучение рискам передачи ЦМВ при переливании крови по сравнению с внебольничной инфекцией, а также разработку аудитов для служб здравоохранения, чтобы понять, где используются серонегативные по ЦМВ продукты крови.Дополнительная информация будет предоставлена после завершения.
Тест на цитомегаловирус (ЦМВ) IgM
Тест на цитомегаловирус (ЦМВ) IgM Национальный лидер в области доступных лабораторных испытаний непосредственно для потребителей- Шаг 1
Заказ
Ваши тесты - Шаг 2
Отправляйтесь в
Лабораторию - Шаг 3
Получите результаты
- Шаг 1
Заказ
Ваши тесты - Шаг 2
Отправляйтесь в
Лабораторию - Шаг 3
Получите результаты
Анализ крови на цитомегаловирус (ЦМВ) IgM
Код проверки: 096727
Тип образца: Кровь
Описание:
Анализ крови на цитомегаловирус (ЦМВ) IgM Тест IgM цитомегаловируса (ЦМВ) используется, чтобы помочь определить, есть ли у человека недавняя или активная ЦМВ-инфекция. Антитела IgM обычно развиваются в течение 1-2 недель после первоначального заражения и перестают обнаруживаться через несколько месяцев. Антитела IgG обычно начинают вырабатываться через несколько недель после заражения и остаются на протяжении всей жизни человека. После первоначального заражения вирус обычно становится неактивным, но может реактивироваться позже в жизни человека. Дополнительные антитела IgM вырабатываются, когда латентная инфекция становится активной.
Антитела IgM обычно развиваются в течение 1-2 недель после первоначального заражения и перестают обнаруживаться через несколько месяцев. Антитела IgG обычно начинают вырабатываться через несколько недель после заражения и остаются на протяжении всей жизни человека. После первоначального заражения вирус обычно становится неактивным, но может реактивироваться позже в жизни человека. Дополнительные антитела IgM вырабатываются, когда латентная инфекция становится активной.
CMV принадлежит к семейству вирусов герпеса , которое также включает вирусы, вызывающие ветряную оспу и мононуклеоз.ЦМВ передается при тесном контакте с кровью или жидкостями организма, в том числе при половом контакте. ЦМВ-инфекция очень распространена, и большинство людей в Соединенных Штатах будут заражены к тому времени, когда им исполнится 40 лет. У большинства здоровых взрослых нет проблем со здоровьем от ЦМВ. Некоторые могут испытывать легкие симптомы гриппа, такие как усталость, боль в горле, лихорадка, увеличение лимфатических узлов, головные и мышечные боли, которые проходят через пару недель. Однако у очень маленьких детей или людей с ослабленной иммунной системой, например у ВИЧ-инфицированных, ЦМВ может вызывать 90 003 серьезных осложнений для здоровья 90 004 .
Однако у очень маленьких детей или людей с ослабленной иммунной системой, например у ВИЧ-инфицированных, ЦМВ может вызывать 90 003 серьезных осложнений для здоровья 90 004 .
Этот тест обычно назначают, когда у человека появляются симптомы, которые могут указывать на активную ЦМВ-инфекцию. Тестирование на ЦМВ также обычно назначают беременным женщинам из-за риска передачи вируса их младенцам, а также людям, у которых диагностирован ВИЧ или другие заболевания, влияющие на иммунную систему.
Тест CMV IgM выявляет только те антитела, которые указывают на недавнюю или активную инфекцию. Тест IgG на цитомегаловирус (ЦМВ) можно использовать, чтобы определить, подвергался ли кто-либо воздействию ЦМВ в прошлом или имеет ли он латентную инфекцию.
Тест на цитомегаловирус (ЦМВ) IgM обычно дает результаты через 1-2 рабочих дня.
Примечание. Время обработки результатов является приблизительным и не гарантируется. Нашей референс-лаборатории может потребоваться дополнительное время из-за погодных условий, праздников, подтверждения/повторного тестирования или технического обслуживания оборудования.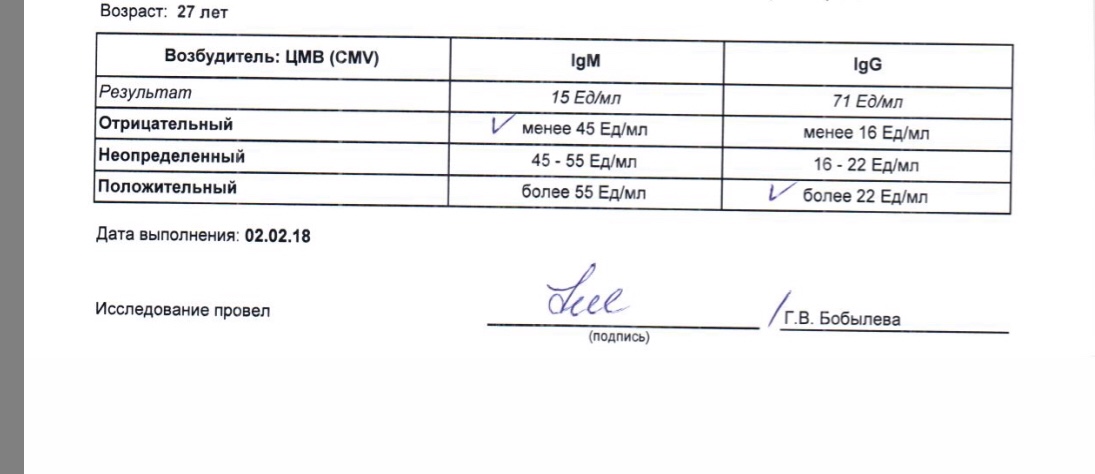
Период обнаружения:
IgM-антитела обычно обнаруживаются через 1–2 недели после первоначального заражения, а у некоторых людей могут обнаруживаться раньше.Обычно антитела IgM падают ниже определяемого уровня через несколько месяцев. В случае, если латентная инфекция становится активной, антитела IgM снова повысятся до обнаруживаемого уровня.
Требования:
Тест на цитомегаловирус (ЦМВ), IgM не требуется натощак.
Категории:
Анализ крови на цитомегаловирус (ЦМВ) IgM
Код теста: 8503
Тип образца: Кровь
Описание:
Анализ крови на цитомегаловирус (ЦМВ) IgM Тест IgM цитомегаловируса (ЦМВ) используется, чтобы помочь определить, есть ли у человека недавняя или активная ЦМВ-инфекция.Антитела IgM обычно развиваются в течение 1-2 недель после первоначального заражения и перестают обнаруживаться через несколько месяцев.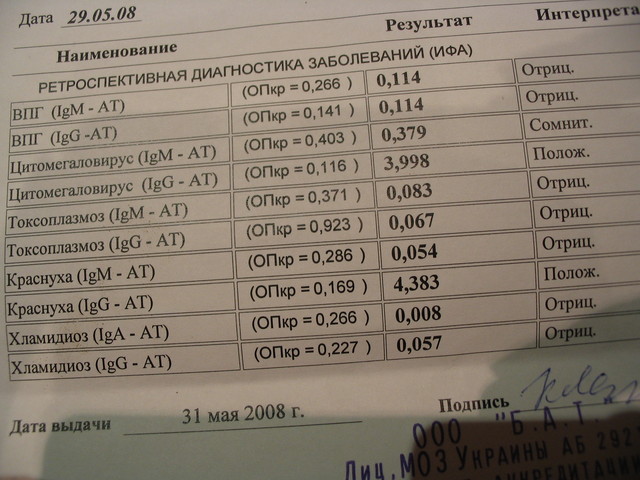 Антитела IgG обычно начинают вырабатываться через несколько недель после заражения и остаются на протяжении всей жизни человека. После первоначального заражения вирус обычно становится неактивным, но может реактивироваться позже в жизни человека. Дополнительные антитела IgM вырабатываются, когда латентная инфекция становится активной.
Антитела IgG обычно начинают вырабатываться через несколько недель после заражения и остаются на протяжении всей жизни человека. После первоначального заражения вирус обычно становится неактивным, но может реактивироваться позже в жизни человека. Дополнительные антитела IgM вырабатываются, когда латентная инфекция становится активной.
CMV принадлежит к семейству вирусов герпеса , которое также включает вирусы, вызывающие ветряную оспу и мононуклеоз.ЦМВ передается при тесном контакте с кровью или жидкостями организма, в том числе при половом контакте. ЦМВ-инфекция очень распространена, и большинство людей в Соединенных Штатах будут заражены к тому времени, когда им исполнится 40 лет. У большинства здоровых взрослых нет проблем со здоровьем от ЦМВ. Некоторые могут испытывать легкие симптомы гриппа, такие как усталость, боль в горле, лихорадка, увеличение лимфатических узлов, головные и мышечные боли, которые проходят через пару недель. Однако у очень маленьких детей или людей с ослабленной иммунной системой, например у ВИЧ-инфицированных, ЦМВ может вызывать 90 003 серьезных осложнений для здоровья 90 004 .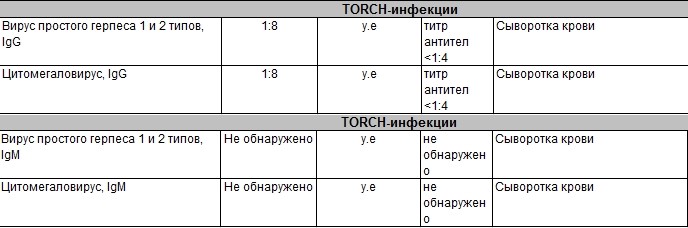
Этот тест обычно назначают, когда у человека появляются симптомы, которые могут указывать на активную ЦМВ-инфекцию. Тестирование на ЦМВ также обычно назначают беременным женщинам из-за риска передачи вируса их младенцам, а также людям, у которых диагностирован ВИЧ или другие заболевания, влияющие на иммунную систему.
Тест CMV IgM выявляет только те антитела, которые указывают на недавнюю или активную инфекцию. Тест IgG на цитомегаловирус (ЦМВ) можно использовать, чтобы определить, подвергался ли кто-либо воздействию ЦМВ в прошлом или имеет ли он латентную инфекцию.
Тест на цитомегаловирус (ЦМВ) IgM обычно дает результаты через 3–6 рабочих дней.
Примечание. Время обработки результатов является приблизительным и не гарантируется. Нашей референс-лаборатории может потребоваться дополнительное время из-за погодных условий, праздников, подтверждения/повторного тестирования или технического обслуживания оборудования.
Период обнаружения:
IgM-антитела обычно обнаруживаются через 1–2 недели после первоначального заражения, а у некоторых людей могут обнаруживаться раньше.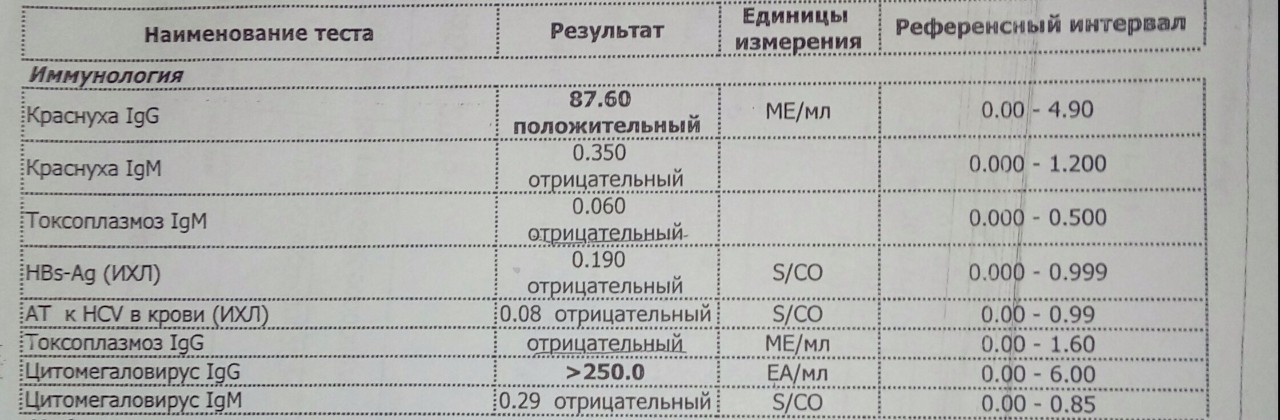 Обычно антитела IgM падают ниже определяемого уровня через несколько месяцев. В случае, если латентная инфекция становится активной, антитела IgM снова повысятся до обнаруживаемого уровня.
Обычно антитела IgM падают ниже определяемого уровня через несколько месяцев. В случае, если латентная инфекция становится активной, антитела IgM снова повысятся до обнаруживаемого уровня.
Требования:
Тест на цитомегаловирус (ЦМВ), IgM не требуется натощак.
Категории:
Код проверки: 096727
Тип образца: Кровь
Описание:
Анализ крови на цитомегаловирус (ЦМВ) IgM Тест IgM цитомегаловируса (ЦМВ) используется, чтобы помочь определить, есть ли у человека недавняя или активная ЦМВ-инфекция.Антитела IgM обычно развиваются в течение 1-2 недель после первоначального заражения и перестают обнаруживаться через несколько месяцев. Антитела IgG обычно начинают вырабатываться через несколько недель после заражения и остаются на протяжении всей жизни человека. После первоначального заражения вирус обычно становится неактивным, но может реактивироваться позже в жизни человека. Дополнительные антитела IgM вырабатываются, когда латентная инфекция становится активной.
Дополнительные антитела IgM вырабатываются, когда латентная инфекция становится активной.
CMV принадлежит к семейству вирусов герпеса , которое также включает вирусы, вызывающие ветряную оспу и мононуклеоз.ЦМВ передается при тесном контакте с кровью или жидкостями организма, в том числе при половом контакте. ЦМВ-инфекция очень распространена, и большинство людей в Соединенных Штатах будут заражены к тому времени, когда им исполнится 40 лет. У большинства здоровых взрослых нет проблем со здоровьем от ЦМВ. Некоторые могут испытывать легкие симптомы гриппа, такие как усталость, боль в горле, лихорадка, увеличение лимфатических узлов, головные и мышечные боли, которые проходят через пару недель. Однако у очень маленьких детей или людей с ослабленной иммунной системой, например у ВИЧ-инфицированных, ЦМВ может вызывать 90 003 серьезных осложнений для здоровья 90 004 .
Этот тест обычно назначают, когда у человека появляются симптомы, которые могут указывать на активную ЦМВ-инфекцию.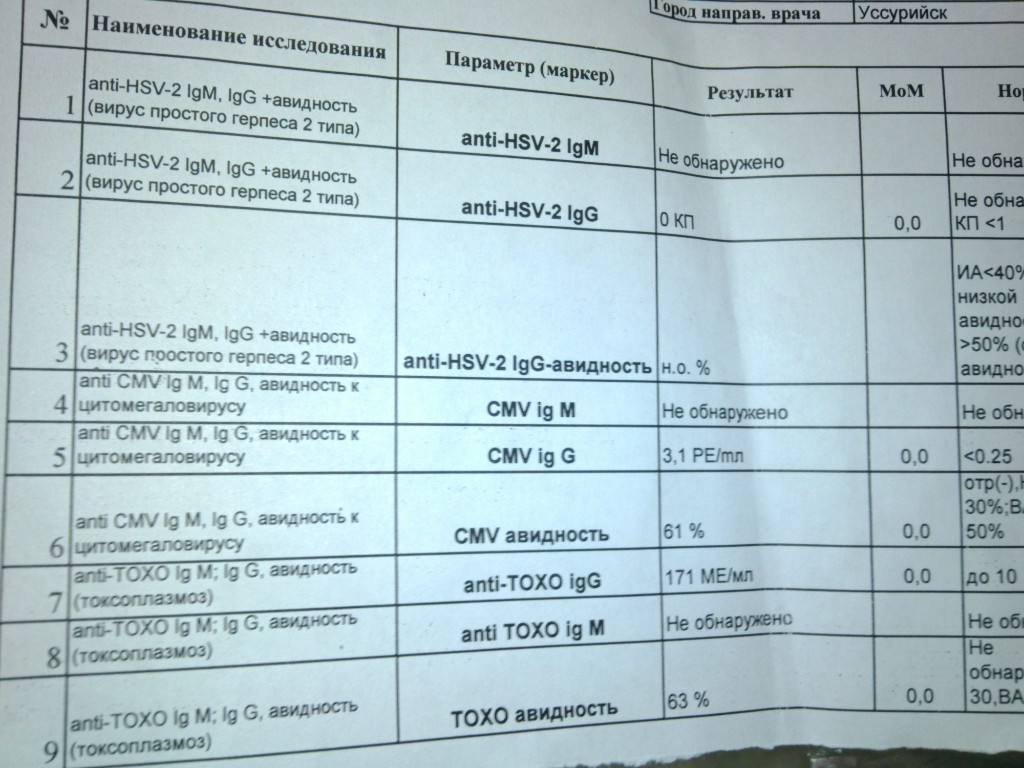 Тестирование на ЦМВ также обычно назначают беременным женщинам из-за риска передачи вируса их младенцам, а также людям, у которых диагностирован ВИЧ или другие заболевания, влияющие на иммунную систему.
Тестирование на ЦМВ также обычно назначают беременным женщинам из-за риска передачи вируса их младенцам, а также людям, у которых диагностирован ВИЧ или другие заболевания, влияющие на иммунную систему.
Тест CMV IgM выявляет только те антитела, которые указывают на недавнюю или активную инфекцию. Тест IgG на цитомегаловирус (ЦМВ) можно использовать, чтобы определить, подвергался ли кто-либо воздействию ЦМВ в прошлом или имеет ли он латентную инфекцию.
Тест на цитомегаловирус (ЦМВ) IgM обычно дает результаты через 1-2 рабочих дня.
Примечание. Время обработки результатов является приблизительным и не гарантируется. Нашей референс-лаборатории может потребоваться дополнительное время из-за погодных условий, праздников, подтверждения/повторного тестирования или технического обслуживания оборудования.
Период обнаружения:
IgM-антитела обычно обнаруживаются через 1–2 недели после первоначального заражения, а у некоторых людей могут обнаруживаться раньше. Обычно антитела IgM падают ниже определяемого уровня через несколько месяцев. В случае, если латентная инфекция становится активной, антитела IgM снова повысятся до обнаруживаемого уровня.
Обычно антитела IgM падают ниже определяемого уровня через несколько месяцев. В случае, если латентная инфекция становится активной, антитела IgM снова повысятся до обнаруживаемого уровня.
Требования:
Тест на цитомегаловирус (ЦМВ), IgM не требуется натощак.
Категории:
Анализ крови на цитомегаловирус (ЦМВ) IgM
Код теста: 8503
Тип образца: Кровь
Описание:
Анализ крови на цитомегаловирус (ЦМВ) IgM Тест IgM цитомегаловируса (ЦМВ) используется, чтобы помочь определить, есть ли у человека недавняя или активная ЦМВ-инфекция.Антитела IgM обычно развиваются в течение 1-2 недель после первоначального заражения и перестают обнаруживаться через несколько месяцев. Антитела IgG обычно начинают вырабатываться через несколько недель после заражения и остаются на протяжении всей жизни человека.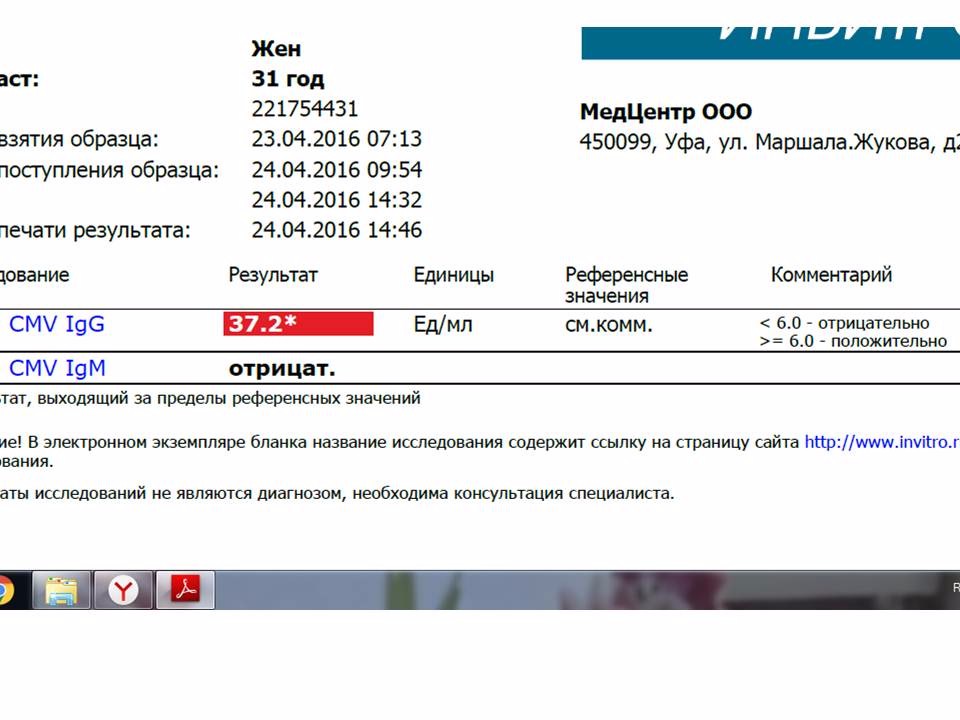 После первоначального заражения вирус обычно становится неактивным, но может реактивироваться позже в жизни человека. Дополнительные антитела IgM вырабатываются, когда латентная инфекция становится активной.
После первоначального заражения вирус обычно становится неактивным, но может реактивироваться позже в жизни человека. Дополнительные антитела IgM вырабатываются, когда латентная инфекция становится активной.
CMV принадлежит к семейству вирусов герпеса , которое также включает вирусы, вызывающие ветряную оспу и мононуклеоз.ЦМВ передается при тесном контакте с кровью или жидкостями организма, в том числе при половом контакте. ЦМВ-инфекция очень распространена, и большинство людей в Соединенных Штатах будут заражены к тому времени, когда им исполнится 40 лет. У большинства здоровых взрослых нет проблем со здоровьем от ЦМВ. Некоторые могут испытывать легкие симптомы гриппа, такие как усталость, боль в горле, лихорадка, увеличение лимфатических узлов, головные и мышечные боли, которые проходят через пару недель. Однако у очень маленьких детей или людей с ослабленной иммунной системой, например у ВИЧ-инфицированных, ЦМВ может вызывать 90 003 серьезных осложнений для здоровья 90 004 .
Этот тест обычно назначают, когда у человека появляются симптомы, которые могут указывать на активную ЦМВ-инфекцию. Тестирование на ЦМВ также обычно назначают беременным женщинам из-за риска передачи вируса их младенцам, а также людям, у которых диагностирован ВИЧ или другие заболевания, влияющие на иммунную систему.
Тест CMV IgM выявляет только те антитела, которые указывают на недавнюю или активную инфекцию. Тест IgG на цитомегаловирус (ЦМВ) можно использовать, чтобы определить, подвергался ли кто-либо воздействию ЦМВ в прошлом или имеет ли он латентную инфекцию.
Тест на цитомегаловирус (ЦМВ) IgM обычно дает результаты через 3–6 рабочих дней.
Примечание. Время обработки результатов является приблизительным и не гарантируется. Нашей референс-лаборатории может потребоваться дополнительное время из-за погодных условий, праздников, подтверждения/повторного тестирования или технического обслуживания оборудования.
Период обнаружения:
IgM-антитела обычно обнаруживаются через 1–2 недели после первоначального заражения, а у некоторых людей могут обнаруживаться раньше. Обычно антитела IgM падают ниже определяемого уровня через несколько месяцев. В случае, если латентная инфекция становится активной, антитела IgM снова повысятся до обнаруживаемого уровня.
Обычно антитела IgM падают ниже определяемого уровня через несколько месяцев. В случае, если латентная инфекция становится активной, антитела IgM снова повысятся до обнаруживаемого уровня.
Требования:
Тест на цитомегаловирус (ЦМВ), IgM не требуется натощак.
Категории:
Популярные сопутствующие товары
Просмотр всех Посмотреть только LabCorp Только просмотр квеста
Цитомегаловирусная инфекция вызывает повышение артериального давления
Abstract
Цитомегаловирусная (ЦМВ) инфекция является распространенной инфекцией у взрослых (60–99% серопозитивных случаев во всем мире) и связана с сердечно-сосудистыми заболеваниями наряду с такими факторами риска, как гипертония и атеросклероз. Несколько вирусных инфекций связаны с гипертонией, включая вирус герпеса человека 8 (HHV-8) и ВИЧ-1. Механизмы того, как вирусная инфекция способствует гипертензии или повышению артериального давления, не определены. В этом сообщении рассматривается роль ЦМВ-инфекции как причины повышения артериального давления и формирования атеросклеротических бляшек в аорте. Используя in vivo модель мыши и in vitro молекулярно-биологический анализ, мы обнаружили, что ЦМВ-инфекция сама по себе вызывала значительное повышение артериального давления (АД) ( p <0.01~0,05), измеренный методом микронаконечника катетера. Это повышение артериального давления при мышином CMV (MCMV) не зависело от образования атеросклеротических бляшек в аорте, определяемого гистологическими анализами. ДНК MCMV была обнаружена в образцах кровеносных сосудов мышей, инфицированных вирусом, но не у контрольных мышей с помощью гнездовой ПЦР. MCMV значительно увеличивал экспрессию провоспалительных цитокинов IL-6, TNF-α и MCP-1 в сыворотке мыши с помощью твердофазного иммуноферментного анализа (ELISA).
Несколько вирусных инфекций связаны с гипертонией, включая вирус герпеса человека 8 (HHV-8) и ВИЧ-1. Механизмы того, как вирусная инфекция способствует гипертензии или повышению артериального давления, не определены. В этом сообщении рассматривается роль ЦМВ-инфекции как причины повышения артериального давления и формирования атеросклеротических бляшек в аорте. Используя in vivo модель мыши и in vitro молекулярно-биологический анализ, мы обнаружили, что ЦМВ-инфекция сама по себе вызывала значительное повышение артериального давления (АД) ( p <0.01~0,05), измеренный методом микронаконечника катетера. Это повышение артериального давления при мышином CMV (MCMV) не зависело от образования атеросклеротических бляшек в аорте, определяемого гистологическими анализами. ДНК MCMV была обнаружена в образцах кровеносных сосудов мышей, инфицированных вирусом, но не у контрольных мышей с помощью гнездовой ПЦР. MCMV значительно увеличивал экспрессию провоспалительных цитокинов IL-6, TNF-α и MCP-1 в сыворотке мыши с помощью твердофазного иммуноферментного анализа (ELISA). Используя количественную ПЦР с обратной транскриптазой в реальном времени (Q-RT-PCR) и вестерн-блоттинг, мы обнаружили, что CMV стимулировал экспрессию ренина в клетках мыши и человека инфекционным дозозависимым образом.Анализы совместного окрашивания и иммунофлуоресцентной микроскопии показали, что инфекция MCMV стимулировала экспрессию ренина на уровне одной клетки. Дальнейшее исследование ангиотензина-II (Ang II) в сыворотке и артериальных тканях мышей с помощью ELISA показало повышенную экспрессию Ang II при инфицировании MCMV. В соответствии с результатами исследования на мышах, ЦМВ человека (HCMV) инфекция эндотелиальных клеток кровеносных сосудов (EC) индуцировала экспрессию ренина нелитической инфекцией. Кинетика репликации вируса и анализ образования бляшек показали, что активная персистирующая ЦМВ-инфекция в РЭ и экспрессия вирусных генов могут лежать в основе молекулярного механизма.Эти результаты показывают, что ЦМВ-инфекция является фактором риска повышения артериального давления и кофактором атеросклероза аорты.
Используя количественную ПЦР с обратной транскриптазой в реальном времени (Q-RT-PCR) и вестерн-блоттинг, мы обнаружили, что CMV стимулировал экспрессию ренина в клетках мыши и человека инфекционным дозозависимым образом.Анализы совместного окрашивания и иммунофлуоресцентной микроскопии показали, что инфекция MCMV стимулировала экспрессию ренина на уровне одной клетки. Дальнейшее исследование ангиотензина-II (Ang II) в сыворотке и артериальных тканях мышей с помощью ELISA показало повышенную экспрессию Ang II при инфицировании MCMV. В соответствии с результатами исследования на мышах, ЦМВ человека (HCMV) инфекция эндотелиальных клеток кровеносных сосудов (EC) индуцировала экспрессию ренина нелитической инфекцией. Кинетика репликации вируса и анализ образования бляшек показали, что активная персистирующая ЦМВ-инфекция в РЭ и экспрессия вирусных генов могут лежать в основе молекулярного механизма.Эти результаты показывают, что ЦМВ-инфекция является фактором риска повышения артериального давления и кофактором атеросклероза аорты. В основе механизма может лежать персистирующая вирусная инфекция ЭК. Борьба с ЦМВ-инфекцией может быть разработана для ограничения гипертонии и атеросклероза в сердечно-сосудистой системе.
В основе механизма может лежать персистирующая вирусная инфекция ЭК. Борьба с ЦМВ-инфекцией может быть разработана для ограничения гипертонии и атеросклероза в сердечно-сосудистой системе.
Резюме автора
Цитомегаловирусная (ЦМВ) инфекция связана с сердечно-сосудистыми заболеваниями. Однако точные механизмы еще предстоит определить. Используя как мышиную модель, так и анализ клеточных культур, мы обнаружили, что сама по себе ЦМВ-инфекция вызывает повышение артериального давления.Кроме того, ЦМВ-инфекция увеличивает повышенное кровяное давление, вызванное диетой с высоким содержанием холестерина. Однако сама по себе ЦМВ-инфекция не вызывает атеросклероза аорты. Однако ЦМВ-инфекция наряду с диетой с высоким содержанием холестерина вызывает классическое образование атеросклеротических бляшек в главной артерии, соединенной с сердцем. Дальнейшие исследования показывают, что ЦМВ-инфекция индуцирует экспрессию ренина и ангиотензина II (Ang II) в крови и в клетках сосудов в виде персистирующей инфекции. Известно, что повышенная экспрессия ренина и Ang II вызывает повышение кровяного давления или гипертензию у людей.Экспрессия вирусных генов и персистирующая вирусная инфекция эндотелиальных клеток кровеносных сосудов, приводящая к повышенной экспрессии воспалительных цитокинов, включая ренин и Ang II, могут лежать в основе молекулярного механизма, с помощью которого ЦМВ-инфекция вызывает повышение артериального давления.
Известно, что повышенная экспрессия ренина и Ang II вызывает повышение кровяного давления или гипертензию у людей.Экспрессия вирусных генов и персистирующая вирусная инфекция эндотелиальных клеток кровеносных сосудов, приводящая к повышенной экспрессии воспалительных цитокинов, включая ренин и Ang II, могут лежать в основе молекулярного механизма, с помощью которого ЦМВ-инфекция вызывает повышение артериального давления.
Образец цитирования: Cheng J, Ke Q, Jin Z, Wang H, Kocher O, Morgan JP, et al. (2009) Цитомегаловирусная инфекция вызывает повышение артериального давления. PLoS Патог 5(5): е1000427.https://doi.org/10.1371/journal.ppat.1000427
Редактор: Клаус Фрю, Орегонский университет здравоохранения и науки, Соединенные Штаты Америки
Получено: 1 декабря 2008 г.; Принято: 13 апреля 2009 г.; Опубликовано: 15 мая 2009 г.
Авторские права: © 2009 Cheng et al.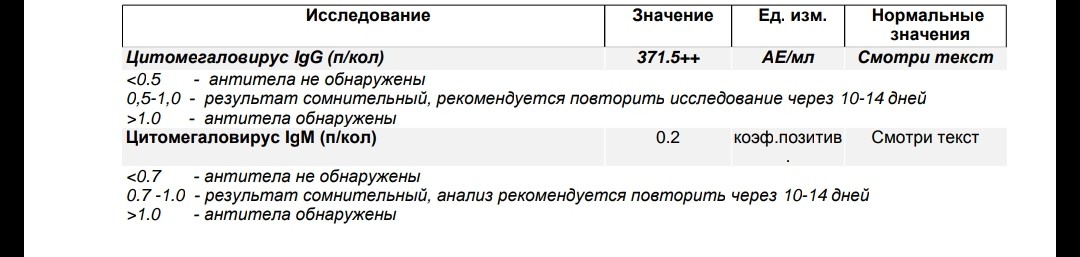 Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эти исследования были поддержаны грантом NIH HL71859 для CSC, а JZ была частично поддержана наградой AI-055313 K-18. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Цитомегаловирус человека (ЦМВ) относится к семейству вирусов герпеса, и ЦМВ-инфекция считается одной из наиболее распространенных инфекций у взрослых с серопозитивными показателями в диапазоне от 60 до 99% во всем мире.Однажды приобретенная инфекция сохраняется на всю жизнь и может подвергаться периодической реактивации.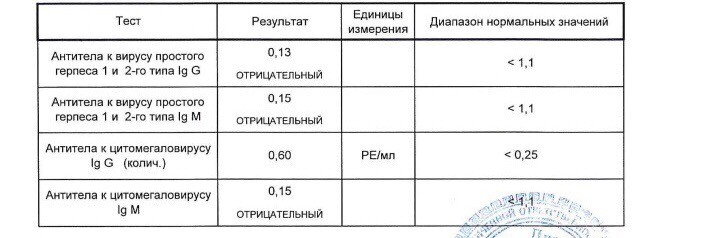 Заражение HCMV связано с сердечно-сосудистыми заболеваниями, и в некоторых странах зарегистрированы низкие показатели серопозитивности HCMV и высокая частота атеросклероза [1]–[4]. Кроме того, несколько вирусных инфекций связаны с гипертонией или повышением артериального давления, включая вирус герпеса человека 8 (HHV-8) и ВИЧ-1 при первичной легочной гипертензии [5]–[7]. Механизмы, лежащие в основе того, как вирусы способствуют гипертензии, не были идентифицированы.На мышиной модели легочной гипертензии в недавней статье исследовался механизм мускулизации легочной артерии и ремоделирования артерий за счет воспаления и иммунного ответа Th3 [8]. Показано, что клинические изоляты ЦМВ инфицируют эндотелиальные клетки, а присутствие антигенов ЦМВ в эндотелиальных клетках запускает воспаление и иммунный ответ посредством секреции хемокинов СХС и рекрутирования нейтрофилов, которые инфицируются ЦМВ в процессе трансэндотелиальной миграции нейтрофилов [9]. .
Заражение HCMV связано с сердечно-сосудистыми заболеваниями, и в некоторых странах зарегистрированы низкие показатели серопозитивности HCMV и высокая частота атеросклероза [1]–[4]. Кроме того, несколько вирусных инфекций связаны с гипертонией или повышением артериального давления, включая вирус герпеса человека 8 (HHV-8) и ВИЧ-1 при первичной легочной гипертензии [5]–[7]. Механизмы, лежащие в основе того, как вирусы способствуют гипертензии, не были идентифицированы.На мышиной модели легочной гипертензии в недавней статье исследовался механизм мускулизации легочной артерии и ремоделирования артерий за счет воспаления и иммунного ответа Th3 [8]. Показано, что клинические изоляты ЦМВ инфицируют эндотелиальные клетки, а присутствие антигенов ЦМВ в эндотелиальных клетках запускает воспаление и иммунный ответ посредством секреции хемокинов СХС и рекрутирования нейтрофилов, которые инфицируются ЦМВ в процессе трансэндотелиальной миграции нейтрофилов [9]. .
HCMV-инфекция также связана с атеросклерозом, как в отчете о том, что HCMV-серопозитивные люди имеют эндотелиальную дисфункцию и повышенное бремя атеросклероза [10]. Использование препарата против ЦМВ, ганцикловира, по-видимому, снижает атеросклероз, связанный с трансплантацией сердца [11]. Исследования на мышах с нокаутом по аполипопротеину Е также показывают, что инфекция MCMV усиливает атеросклероз [12]. Другие клинические исследования, однако, не обнаружили связи между инфекцией HCMV и сосудистым атеросклерозом [13]–[17].Поэтому важным предметом исследования остается определение роли ЦМВ в повреждении сосудов и атеросклерозе. Это также может быть опосредовано ЦМВ, вызывающим повреждение сосудов и вызывающим гипертензию, которая служит кофактором для взаимодействия с другими факторами, вызывающими атеросклероз. Поскольку атеросклероз является сложным явлением, в котором решающую роль играют липидный обмен, генетические факторы и пути воспаления, важно определить, что широко распространенный вирус, такой как ЦМВ, может инициировать атеросклероз или воспалительную реакцию, приводящую к повреждению сосудов.Это может привести к новым методам лечения сосудистых заболеваний, направленным на противовирусную терапию ЦМВ или профилактику с помощью вакцины против ЦМВ.
Использование препарата против ЦМВ, ганцикловира, по-видимому, снижает атеросклероз, связанный с трансплантацией сердца [11]. Исследования на мышах с нокаутом по аполипопротеину Е также показывают, что инфекция MCMV усиливает атеросклероз [12]. Другие клинические исследования, однако, не обнаружили связи между инфекцией HCMV и сосудистым атеросклерозом [13]–[17].Поэтому важным предметом исследования остается определение роли ЦМВ в повреждении сосудов и атеросклерозе. Это также может быть опосредовано ЦМВ, вызывающим повреждение сосудов и вызывающим гипертензию, которая служит кофактором для взаимодействия с другими факторами, вызывающими атеросклероз. Поскольку атеросклероз является сложным явлением, в котором решающую роль играют липидный обмен, генетические факторы и пути воспаления, важно определить, что широко распространенный вирус, такой как ЦМВ, может инициировать атеросклероз или воспалительную реакцию, приводящую к повреждению сосудов.Это может привести к новым методам лечения сосудистых заболеваний, направленным на противовирусную терапию ЦМВ или профилактику с помощью вакцины против ЦМВ. Кроме того, разграничение роли ЦМВ-инфекции в сосудистых клетках и атеросклероза способствует выяснению механизма ЦМВ-ассоциированных сердечно-сосудистых заболеваний (ССЗ), поскольку сообщается, что ЦМВ-инфекция является первичным фактором и напрямую связана с СС, как при инфаркте миокарда, инсульте, коронарном рестенозе. , или сердечно-сосудистая смерть [18]–[20].
Кроме того, разграничение роли ЦМВ-инфекции в сосудистых клетках и атеросклероза способствует выяснению механизма ЦМВ-ассоциированных сердечно-сосудистых заболеваний (ССЗ), поскольку сообщается, что ЦМВ-инфекция является первичным фактором и напрямую связана с СС, как при инфаркте миокарда, инсульте, коронарном рестенозе. , или сердечно-сосудистая смерть [18]–[20].
В этом исследовании мы использовали экспериментальные системы in vivo и in vitro и определили, что инфекция MCMV сама по себе приводит к значительному повышению артериального давления.Молекулярно-биологический анализ показывает, что инфекция MCMV стимулирует экспрессию провоспалительных цитокинов, которые, как было показано ранее, играют роль в повышении артериального давления [21]–[23]. В частности, мы определили, что ЦМВ-инфекция индуцирует экспрессию ренина в зависимости от дозы инфекции в почечных клетках мышей и в эндотелиальных клетках сосудов человека. Кроме того, повышенный уровень ангиотензина II (Ang II) был обнаружен в сыворотке мыши и в тканях артериальных сосудов после инфицирования MCMV. Это представляет большой интерес, поскольку ренин известен как скорость-лимитирующий белок системы ренин-Ang-II (RAS), а Ang II является эффекторным пептидом, который непосредственно связывается с кровеносными сосудами, вызывает вазоконстрикцию и приводит к системной гипертензии у человека [24]. ]–[27]. Наши исследования определили, что ЦМВ-инфекция сама по себе приводит к повышению артериального давления, тогда как ЦМВ действует как кофактор, наряду с диетой с высоким содержанием холестерина, вызывая атеросклероз в аорте мыши. Персистирующая ЦМВ-инфекция ЭК и повышенная экспрессия провоспалительных цитокинов, включая ренин и AngII, могут лежать в основе молекулярного механизма, с помощью которого ЦМВ-инфекция вызывает повышение артериального давления.
Это представляет большой интерес, поскольку ренин известен как скорость-лимитирующий белок системы ренин-Ang-II (RAS), а Ang II является эффекторным пептидом, который непосредственно связывается с кровеносными сосудами, вызывает вазоконстрикцию и приводит к системной гипертензии у человека [24]. ]–[27]. Наши исследования определили, что ЦМВ-инфекция сама по себе приводит к повышению артериального давления, тогда как ЦМВ действует как кофактор, наряду с диетой с высоким содержанием холестерина, вызывая атеросклероз в аорте мыши. Персистирующая ЦМВ-инфекция ЭК и повышенная экспрессия провоспалительных цитокинов, включая ренин и AngII, могут лежать в основе молекулярного механизма, с помощью которого ЦМВ-инфекция вызывает повышение артериального давления.
Результаты
Инфекция MCMV значительно повышает артериальное давление
in vivo Чтобы определить взаимосвязь между ЦМВ-инфекцией и повышением артериального давления, мы провели пробное исследование с использованием 48 мышей в 4 группах, чтобы сравнить ЦМВ-инфекцию с двумя другими известными факторами риска гипертонии: диетой с высоким содержанием холестерина и атеросклерозом.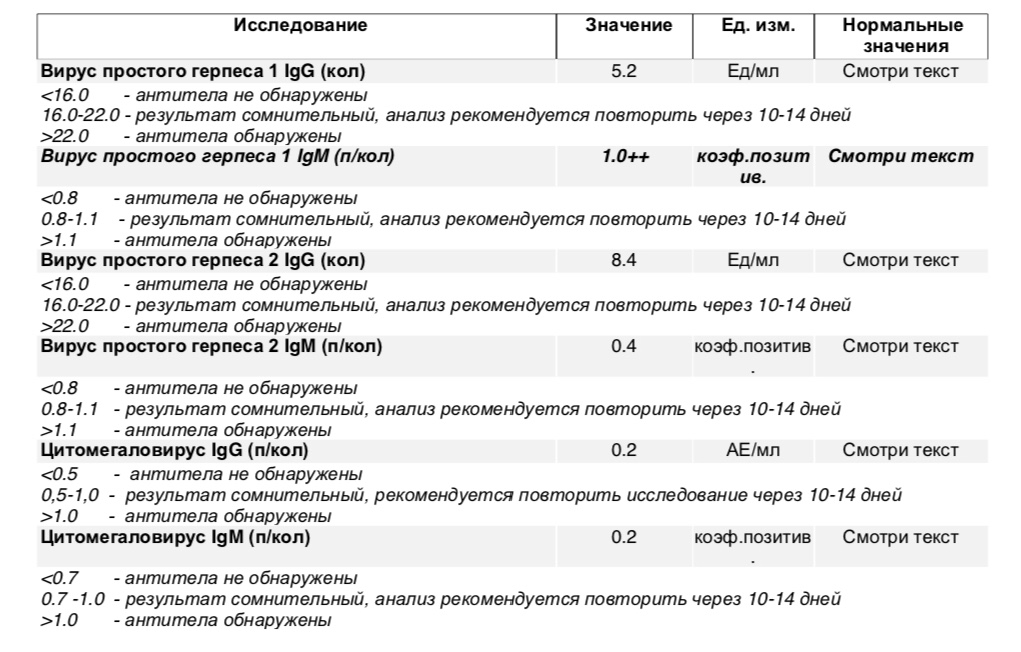 Мышей в группе 1 заражали MCMV и кормили обычным рационом. Мыши в группе 2 были ложно инфицированы и получали обычную диету (контрольная группа).Мышей в группе 3 заражали MCMV и кормили пищей с высоким содержанием холестерина. Мыши в группе 4 были ложно инфицированы и получали диету с высоким содержанием холестерина (контрольная группа).
Мышей в группе 1 заражали MCMV и кормили обычным рационом. Мыши в группе 2 были ложно инфицированы и получали обычную диету (контрольная группа).Мышей в группе 3 заражали MCMV и кормили пищей с высоким содержанием холестерина. Мыши в группе 4 были ложно инфицированы и получали диету с высоким содержанием холестерина (контрольная группа).
Артериальное давление сонной артерии (АД) у каждой мыши измеряли через 6 недель после инфицирования путем введения катетера с микронаконечником в правую сонную артерию под анестезией. Как систолическое (каждый пик), так и диастолическое (каждый надир) АД измерялись и записывались в режиме реального времени [28], [29]. Экспериментальные результаты показывают, что инфекция MCMV сама по себе значительно повышала артериальное давление по сравнению с их аналогами в каждой контрольной группе (рис.1A–E, V-HD по сравнению с HD; В против М).
Рисунок 1. Отслеживание артериального давления катетером сонной артерии.
Показана репрезентативная кривая артериального давления у мышей из каждой группы анализа (по 12 мышей в каждой группе).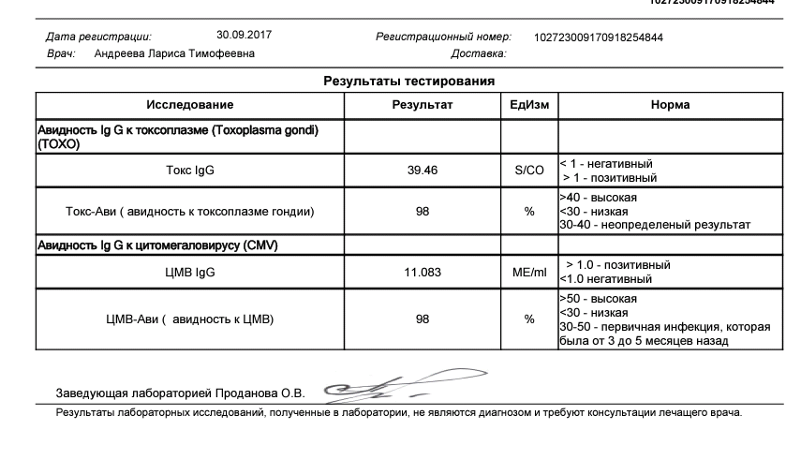 (A) Мышь, зараженная MCMV. (B) Псевдоинфекция. (C) Мышь, инфицированная MCMV и получавшая диету с высоким содержанием холестерина. (D) Имитация инфицирования мыши и кормление пищей с высоким содержанием холестерина. (E) Среднее значение ABp из каждой группы анализа (мм рт.ст.). V-HD: мыши, инфицированные MCMV и получавшие диету с высоким содержанием холестерина.HD: мыши, ложно инфицированные и получавшие диету с высоким содержанием холестерина. V: мыши, инфицированные MCMV и получавшие обычный рацион. М: мыши, ложно инфицированные и получающие обычную диету. Артериальное давление в каждой группе измеряли на 10-й неделе эксперимента. Средние значения систолического и диастолического давления были определены и рассчитаны с помощью программного обеспечения Chart v4.1.2 соответственно. Статистическую значимость между группами анализа определяли с помощью теста Стьюдента t . Исходное кровяное давление мыши из каждой группы анализа до инфицирования MCMV показано в таблице S1.
(A) Мышь, зараженная MCMV. (B) Псевдоинфекция. (C) Мышь, инфицированная MCMV и получавшая диету с высоким содержанием холестерина. (D) Имитация инфицирования мыши и кормление пищей с высоким содержанием холестерина. (E) Среднее значение ABp из каждой группы анализа (мм рт.ст.). V-HD: мыши, инфицированные MCMV и получавшие диету с высоким содержанием холестерина.HD: мыши, ложно инфицированные и получавшие диету с высоким содержанием холестерина. V: мыши, инфицированные MCMV и получавшие обычный рацион. М: мыши, ложно инфицированные и получающие обычную диету. Артериальное давление в каждой группе измеряли на 10-й неделе эксперимента. Средние значения систолического и диастолического давления были определены и рассчитаны с помощью программного обеспечения Chart v4.1.2 соответственно. Статистическую значимость между группами анализа определяли с помощью теста Стьюдента t . Исходное кровяное давление мыши из каждой группы анализа до инфицирования MCMV показано в таблице S1.
https://doi. org/10.1371/journal.ppat.1000427.g001
org/10.1371/journal.ppat.1000427.g001
Повышение артериального давления при инфекции MCMV не зависит от диеты с высоким содержанием холестерина и атеросклероза
Как сообщалось ранее, диета с высоким содержанием холестерина повышает артериальное давление, а повышенное артериальное давление способствует атеросклерозу, который еще больше усугубляет гипертонию [30]–[33]. Однако влияние ЦМВ-инфекции в связи с этими двумя факторами на повышение кровяного давления еще предстоит определить.В этом исследовании мы проанализировали роль инфекции MCMV в повышении артериального давления и связь с двумя известными факторами риска, которые приводят к гипертонии.
Изучая четыре группы мышей, мы обнаружили, что независимо от диеты с высоким содержанием холестерина инфекция MCMV вызывала значительное повышение артериального давления, поскольку у мышей, инфицированных MCMV и получавших обычную диету, наблюдалось значительное повышение артериального давления по сравнению с их контрольные аналоги (рис. 1E, V vs.М, р<0,01). Кроме того, инфекция MCMV усугубляла повышение артериального давления, вызванное диетой с высоким содержанием холестерина, поскольку у мышей, инфицированных MCMV и получавших диету с высоким содержанием холестерина, кровяное давление было значительно выше, чем у контрольных мышей с ложным инфицированием, получавших ту же диету (рис. 1E, V-HD по сравнению с HD, p<0,05).
1E, V vs.М, р<0,01). Кроме того, инфекция MCMV усугубляла повышение артериального давления, вызванное диетой с высоким содержанием холестерина, поскольку у мышей, инфицированных MCMV и получавших диету с высоким содержанием холестерина, кровяное давление было значительно выше, чем у контрольных мышей с ложным инфицированием, получавших ту же диету (рис. 1E, V-HD по сравнению с HD, p<0,05).
При определении роли инфекции MCMV в атеросклерозе и повышении артериального давления наши данные показывают, что инфекция MCMV и диета с высоким содержанием холестерина вместе индуцируют образование атеросклеротических бляшек в аорте мышей (рис.2А-Г). Однако ни инфекция MCMV, ни диета с высоким содержанием холестерина сами по себе не вызывали атеросклероза в течение периода анализа. Хотя образование атеросклеротических бляшек требовало воздействия как инфекции MCMV, так и диеты с высоким содержанием холестерина, атеросклероз не был основным фактором, повышающим артериальное давление, поскольку инфекция MCMV сама по себе значительно повышала кровяное давление без влияния на атеросклероз (рис. 1E, V по сравнению с M). , р<0,01 и табл. 1). Наши результаты показывают, что инфекция MCMV сама по себе играет важную роль в повышении артериального давления in vivo .Кроме того, увеличение веса не было фактором, вызывающим высокое кровяное давление в контексте инфекции MCMV, поскольку мыши, получавшие обычную диету, весили одинаково, независимо от того, инфицированы ли MCMV или ложно инфицированы. Мыши, которых кормили пищей с высоким содержанием холестерина, весили одинаково, независимо от того, инфицированы они MCMV или нет (рис. S1).
1E, V по сравнению с M). , р<0,01 и табл. 1). Наши результаты показывают, что инфекция MCMV сама по себе играет важную роль в повышении артериального давления in vivo .Кроме того, увеличение веса не было фактором, вызывающим высокое кровяное давление в контексте инфекции MCMV, поскольку мыши, получавшие обычную диету, весили одинаково, независимо от того, инфицированы ли MCMV или ложно инфицированы. Мыши, которых кормили пищей с высоким содержанием холестерина, весили одинаково, независимо от того, инфицированы они MCMV или нет (рис. S1).
Рисунок 2. Повышение артериального давления при инфекции MCMV не зависит от атеросклероза.
(A) Срез корня аорты мыши, ложно инфицированной и получавшей диету с высоким содержанием холестерина, без видимого атеросклероза.(B) Срез корня аорты от мыши, инфицированной MCMV и получавшей диету с высоким содержанием холестерина, демонстрирующую типичную атеросклеротическую бляшку с многочисленными пенистыми клетками и случайными холестериновыми расщелинами.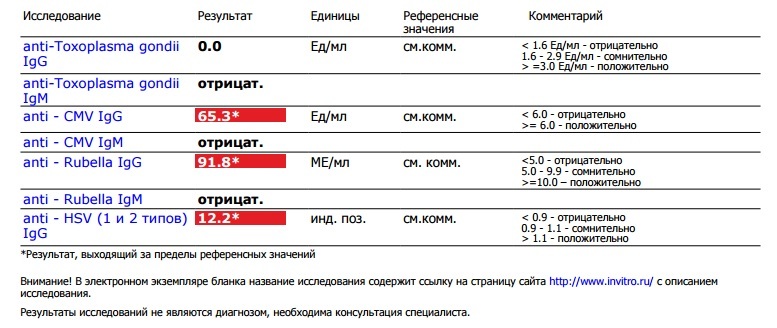 (C) Срез корня аорты мыши, ложно инфицированной и получавшей обычную диету, без видимого атеросклероза. (D) Срез корня аорты мыши, инфицированной MCMV и получавшей обычную диету, с утолщением интимы (указано стрелкой) и отсутствием видимого атеросклероза. В каждой группе было по 12 мышей. Все снимки были сделаны с 20-кратным увеличением, масштаб показан на столбиках.Стенку сосуда измеряли в том же месте (указана красной стрелкой) корня аорты у животных, получавших только диету с высоким содержанием холестерина (4 мм), инфицированных MCMV и получавших диету с высоким содержанием холестерина (7 мм), получавших только обычную диету. (3 мм) и инфицированных MCMV плюс кормили на обычном рационе (6 мм).
(C) Срез корня аорты мыши, ложно инфицированной и получавшей обычную диету, без видимого атеросклероза. (D) Срез корня аорты мыши, инфицированной MCMV и получавшей обычную диету, с утолщением интимы (указано стрелкой) и отсутствием видимого атеросклероза. В каждой группе было по 12 мышей. Все снимки были сделаны с 20-кратным увеличением, масштаб показан на столбиках.Стенку сосуда измеряли в том же месте (указана красной стрелкой) корня аорты у животных, получавших только диету с высоким содержанием холестерина (4 мм), инфицированных MCMV и получавших диету с высоким содержанием холестерина (7 мм), получавших только обычную диету. (3 мм) и инфицированных MCMV плюс кормили на обычном рационе (6 мм).
https://doi.org/10.1371/journal.ppat.1000427.g002
Инфекция MCMV повышает уровень провоспалительных цитокинов в крови мышей
Ранее сообщалось, что стимуляция экспрессии провоспалительных цитокинов повышает артериальное давление [21]–[23].Чтобы определить, вызвала ли инфекция MCMV экспрессию провоспалительных цитокинов и способствовала ли она повышению артериального давления, мы изучили уровни трех цитокинов в крови мышей с помощью цитокин-специфического ELISA.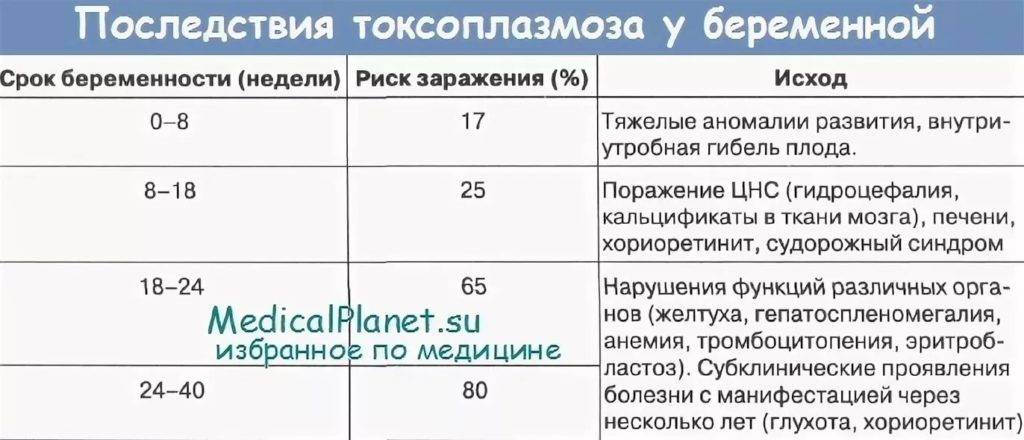
Сывороточные уровни IL-6, TNF-α и MCP-1 были значительно повышены у мышей, инфицированных MCMV, по сравнению с ложно инфицированными мышами (рис. 3A–C; P <0,001, <0,001 и <0,01 соответственно). ). В частности, диета не влияла на экспрессию этих цитокинов у мышей, инфицированных MCMV, по сравнению с контрольными мышами ( P >0.05). Эти результаты показывают, что инфекция MCMV вызывает значительное увеличение экспрессии провоспалительных цитокинов в крови мышей, что может участвовать в повышении артериального давления, вызванном инфекцией CMV in vivo .
Рисунок 3. Инфекция MCMV стимулировала экспрессию провоспалительных цитокинов в сыворотке мыши.
Системные изменения уровней IL-6, TNF-α и MCP-1 в 4 экспериментальных группах определяли с помощью ИФА (каждый незаштрихованный кружок представляет мышь).(A) IL-6 у мышей, инфицированных MCMV, был значительно выше, чем в группах ложно инфицированных, получавших любую диету ( P <0,001). (B) Уровень TNF-α у мышей, инфицированных MCMV, был значительно выше, чем в группах ложно инфицированных, получавших любую диету ( P <0,001). (C) Уровень MCP-1 у мышей, инфицированных MCMV, был значительно выше, чем в группах ложно инфицированных, получавших любую диету ( P <0,01). Статистическую значимость между группами анализа определяли с помощью теста Стьюдента t , и каждая группа содержала 12 мышей.
(B) Уровень TNF-α у мышей, инфицированных MCMV, был значительно выше, чем в группах ложно инфицированных, получавших любую диету ( P <0,001). (C) Уровень MCP-1 у мышей, инфицированных MCMV, был значительно выше, чем в группах ложно инфицированных, получавших любую диету ( P <0,01). Статистическую значимость между группами анализа определяли с помощью теста Стьюдента t , и каждая группа содержала 12 мышей.
https://doi.org/10.1371/journal.ppat.1000427.g003
Инфекция MCMV стимулирует экспрессию ренина
Помимо определения повышенной экспрессии воспалительных цитокинов, мы исследовали, вызывают ли ЦМВ-инфекцию факторы, которые, как известно, регулируют артериальное давление. Ренин является первым и ступенчато-лимитирующим белком РАС. РАС играет центральную роль в регуляции артериального давления. Повышенная активность РАС приводит к повышению артериального давления или системной гипертензии [24]–[27].
Чтобы определить, увеличивает ли инфекция MCMV экспрессию ренина, мы провели исследование in vitro с использованием клеток As4.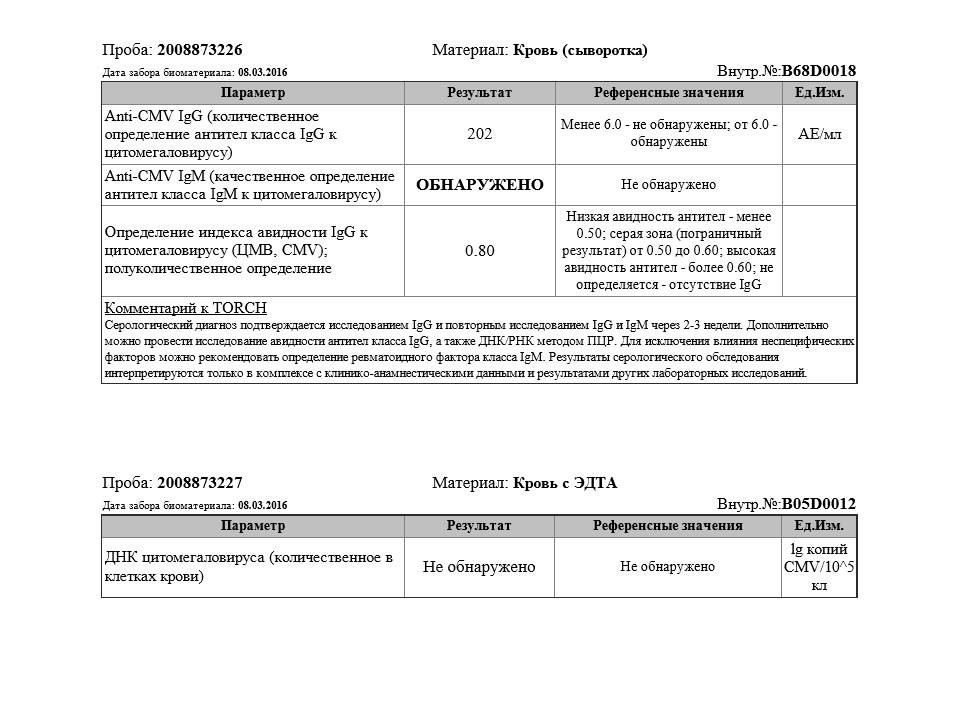 1. Эти клетки имеют базальный уровень экспрессии ренина из эндогенного локуса Ren-1c, а клетки As4.1 являются клетками почек. Мы заразили клетки As4.1 с помощью MCMV с различной множественностью заражения (MOI) и обнаружили экспрессию ренина с помощью иммунофлуоресцентной микроскопии. Инфекция MCMV стимулировала экспрессию ренина в клетках в зависимости от дозы инфекции MCMV (рис.4А-Г). Клетки с имитацией инфекции имели только базальную экспрессию ренина. Поскольку ренин, образующийся в почечных клетках, является ключевым компонентом циркуляторной РАС, наши данные свидетельствуют о том, что ЦМВ-инфекция стимулировала активность РАС и способствовала повышению кровяного давления in vivo .
1. Эти клетки имеют базальный уровень экспрессии ренина из эндогенного локуса Ren-1c, а клетки As4.1 являются клетками почек. Мы заразили клетки As4.1 с помощью MCMV с различной множественностью заражения (MOI) и обнаружили экспрессию ренина с помощью иммунофлуоресцентной микроскопии. Инфекция MCMV стимулировала экспрессию ренина в клетках в зависимости от дозы инфекции MCMV (рис.4А-Г). Клетки с имитацией инфекции имели только базальную экспрессию ренина. Поскольку ренин, образующийся в почечных клетках, является ключевым компонентом циркуляторной РАС, наши данные свидетельствуют о том, что ЦМВ-инфекция стимулировала активность РАС и способствовала повышению кровяного давления in vivo .
Рисунок 4. Инфекция MCMV индуцирует экспрессию ренина дозозависимым образом.
(А) Контроль антител. Клетки окрашивали на 6-й день после инфицирования ЦМВ при множественности заражения (MOI) = 10 с неспецифическим IgG в качестве первого антитела.(B) Имитация инфекционного контроля (MOI = 0). Клетки окрашивали на 6-й день после имитации заражения ренин-специфическим IgG в качестве первого антитела. Ренин был обнаружен на низком уровне с положительными мелкими гранулами, разлитыми в цитоплазме, поскольку клетки As4.1 имеют базальный уровень экспрессии ренина из локуса Ren-1c. (C) Инфекция MCMV в низкой дозе (MOI = 1). Клетки окрашивали на 6-й день после инфицирования. Ренинположительные гранулы крупные, вокруг ядра. (D) Инфекция MCMV в высокой дозе (MOI = 10). Клетки окрашивались на 6-й день после инфицирования, и ренин-положительные гранулы были крупнее и плотнее, окружая ядро.(E-G) Совместное окрашивание MCMV и ренина. (E) Антигены MCMV окрашивались TRITC в красный цвет антителами против MCMV. (F) Ренин окрашивался в зеленый цвет с помощью FTIC антителами против ренина. (G) Наложение окрашивания TRITC и FTIC, чтобы показать совместную локализацию MCMV и ренина в клетках. Желтые пятна, представляющие совместное окрашивание антигена MCMV и ренина, окружали ядро (указано стрелкой).
Клетки окрашивали на 6-й день после имитации заражения ренин-специфическим IgG в качестве первого антитела. Ренин был обнаружен на низком уровне с положительными мелкими гранулами, разлитыми в цитоплазме, поскольку клетки As4.1 имеют базальный уровень экспрессии ренина из локуса Ren-1c. (C) Инфекция MCMV в низкой дозе (MOI = 1). Клетки окрашивали на 6-й день после инфицирования. Ренинположительные гранулы крупные, вокруг ядра. (D) Инфекция MCMV в высокой дозе (MOI = 10). Клетки окрашивались на 6-й день после инфицирования, и ренин-положительные гранулы были крупнее и плотнее, окружая ядро.(E-G) Совместное окрашивание MCMV и ренина. (E) Антигены MCMV окрашивались TRITC в красный цвет антителами против MCMV. (F) Ренин окрашивался в зеленый цвет с помощью FTIC антителами против ренина. (G) Наложение окрашивания TRITC и FTIC, чтобы показать совместную локализацию MCMV и ренина в клетках. Желтые пятна, представляющие совместное окрашивание антигена MCMV и ренина, окружали ядро (указано стрелкой). (H – J) Контроль иммунофлуоресцентного окрашивания. (H) Имитация инфицированных клеток, окрашенных антителами против MCMV с помощью TRITC, антиген MCMV не обнаружен.(I) Имитация зараженных клеток, окрашенных антителом против ренина с помощью FTIC, была обнаружена только базальная экспрессия ренина. (J) Наложение TRITC и FTIC в ложно инфицированных клетках, сигнал антигена MCMV не обнаружен.
(H – J) Контроль иммунофлуоресцентного окрашивания. (H) Имитация инфицированных клеток, окрашенных антителами против MCMV с помощью TRITC, антиген MCMV не обнаружен.(I) Имитация зараженных клеток, окрашенных антителом против ренина с помощью FTIC, была обнаружена только базальная экспрессия ренина. (J) Наложение TRITC и FTIC в ложно инфицированных клетках, сигнал антигена MCMV не обнаружен.
https://doi.org/10.1371/journal.ppat.1000427.g004
Чтобы дополнительно определить взаимосвязь между инфекцией MCMV и экспрессией ренина, мы провели анализ совместного окрашивания, чтобы измерить инфекцию MCMV, индуцирующую экспрессию ренина за один раз. клеточный уровень. Мы обнаружили, что индуцированная экспрессия ренина происходила только в клетках, инфицированных MCMV, а антигены MCMV были совместно локализованы с ренином в инфицированных клетках, которые выявлялись антителами, специфичными к MCMV и ренину, соответственно (рис.4E-G). Имитация зараженных клеток имела только базальную экспрессию ренина, и антигены MCMV не были обнаружены (рис.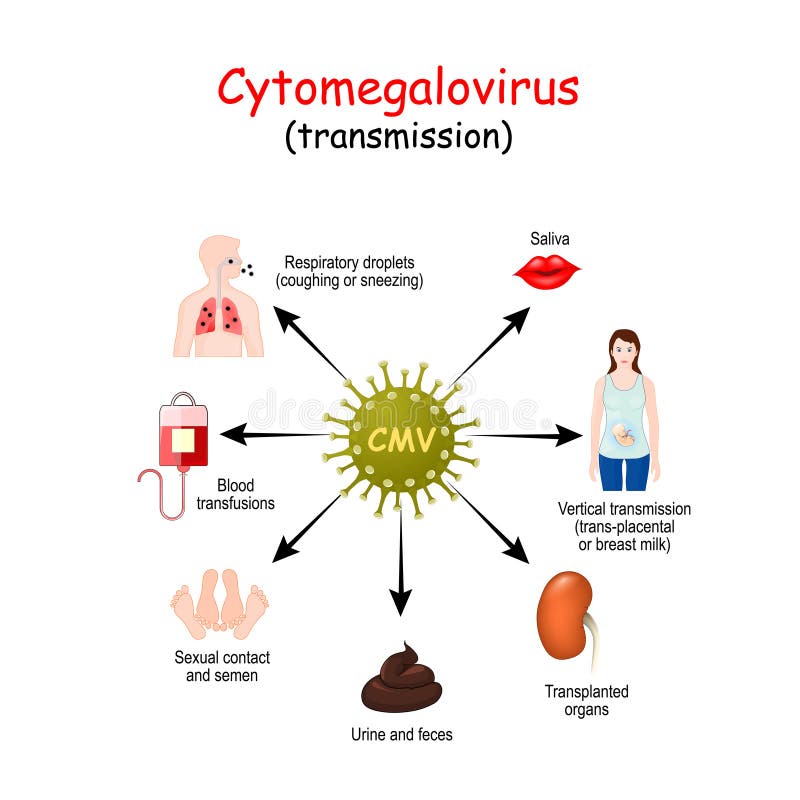 4H-J). Когда УФ-инактивированный MCMV использовали в качестве контроля инфекции, не было обнаружено увеличения экспрессии ренина (данные не показаны).
4H-J). Когда УФ-инактивированный MCMV использовали в качестве контроля инфекции, не было обнаружено увеличения экспрессии ренина (данные не показаны).
Инфекция MCMV индуцировала экспрессию Ang II в крови и тканях артерий мышей
Ang II является основным эффекторным пептидом РАС. Ang II напрямую связывается с рецепторами на кровеносных сосудах и вызывает сужение сосудов и повышение артериального давления [24]–[27].Чтобы определить, изменила ли инфекция MCMV также экспрессию Ang II, мы исследовали уровни Ang II в сыворотке мыши и в тканях артерий. Сама по себе инфекция MCMV повышала уровень ангиотензина II (Ang II) в сыворотке мыши. Кроме того, инфекция MCMV усугубляла повышенный уровень Ang II, вызванный диетой с высоким содержанием холестерина (рис. 5А). Аналогичная картина уровня Ang II была обнаружена в образцах артериальной ткани. Несмотря на высокий базальный уровень экспрессии Ang II в тканях артерий, инфекция MCMV сама по себе увеличивала экспрессию Ang II в образцах аорты, а также усиливала повышенную экспрессию Ang II, вызванную диетой с высоким содержанием холестерина (рис.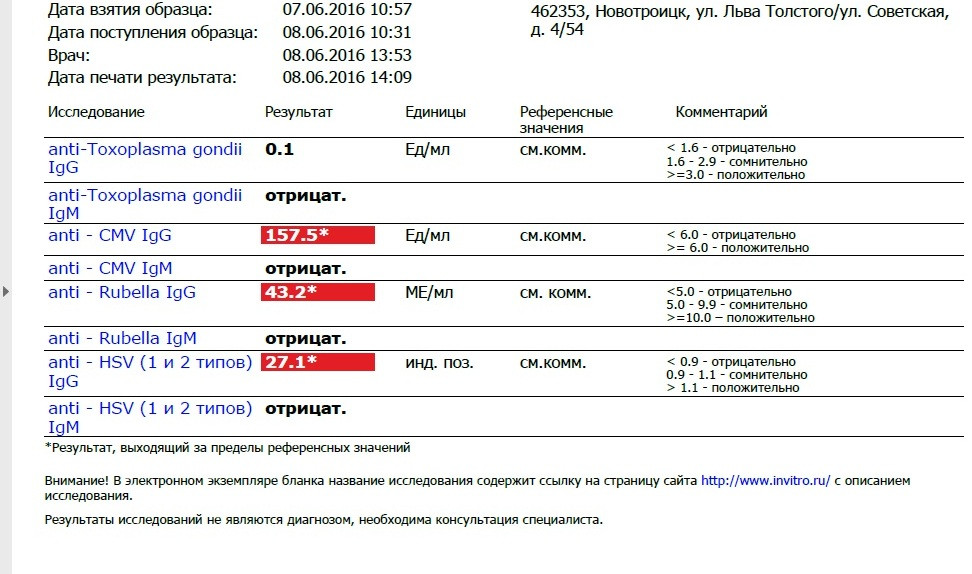 5Б). Эти результаты позволяют предположить, что ЦМВ-инфекция индуцирует экспрессию ренина и Ang II, и это лежит в основе молекулярного механизма, с помощью которого ЦМВ-инфекция вызывает повышение артериального давления.
5Б). Эти результаты позволяют предположить, что ЦМВ-инфекция индуцирует экспрессию ренина и Ang II, и это лежит в основе молекулярного механизма, с помощью которого ЦМВ-инфекция вызывает повышение артериального давления.
Рисунок 5. Инфекция MCMV повышает уровень Ang II в сыворотке мыши и тканях артерий.
(A) Инфекция MCMV повышала уровень ангиотензина II (Ang II) в сыворотке мыши и усугубляла уровень Ang II, вызванный диетой с высоким содержанием холестерина. В каждой группе было по 12 мышей. (B) Инфекция MCMV повышала уровни Ang II в тканях аорты и усугубляла уровень Ang II, вызванный диетой с высоким содержанием холестерина.Каждая точка представляет мышь из каждой группы анализа.
https://doi.org/10.1371/journal.ppat.1000427.g005
Обнаружение РНК и ДНК MCMV в кровеносных сосудах после инфицирования
В течение экспериментального периода все мыши демонстрировали нормальное поведение, активность в отношении еды и питья без симптомов острой инфекции MCMV, таких как воспаление/язвы роговицы или недостаточность органов, характерная для лиц с ослабленным иммунитетом. Эти наблюдения позволяют предположить, что у экспериментальных мышей возникла персистирующая или нелитическая вирусная инфекция, которая обычно наблюдается у иммунокомпетентных субъектов с ЦМВ-инфекцией [1], [34]–[36].Чтобы проверить, так ли это, мы исследовали три вида образцов кровеносных сосудов всех 48 мышей с помощью гистологического анализа. В образцах кровеносных сосудов инфицированных вирусом мышей не было обнаружено повреждений литической инфекции MCMV по сравнению с их контрольными аналогами. Репрезентативный результат гистологического исследования срезов аорты мышей, инфицированных MCMV, по сравнению с ложно инфицированными мышами показан на рис. 2C и D.
Эти наблюдения позволяют предположить, что у экспериментальных мышей возникла персистирующая или нелитическая вирусная инфекция, которая обычно наблюдается у иммунокомпетентных субъектов с ЦМВ-инфекцией [1], [34]–[36].Чтобы проверить, так ли это, мы исследовали три вида образцов кровеносных сосудов всех 48 мышей с помощью гистологического анализа. В образцах кровеносных сосудов инфицированных вирусом мышей не было обнаружено повреждений литической инфекции MCMV по сравнению с их контрольными аналогами. Репрезентативный результат гистологического исследования срезов аорты мышей, инфицированных MCMV, по сравнению с ложно инфицированными мышами показан на рис. 2C и D.
Чтобы подтвердить, что ЦМВ-инфекция действительно происходила в кровеносных сосудах испытуемых мышей, мы исследовали экспрессию вирусной мРНК в аорте мыши в отдельном эксперименте.На 3 неделе инфекции по две мыши в каждой из четырех групп исследовали на предмет экспрессии мРНК MCMV IE1 в тканях аорты. мРНК MCMV IE1 была обнаружена только у инфицированных вирусом мышей, но не у контрольных мышей с помощью анализа ОТ-ПЦР (рис. S2). Затем мы исследовали экспрессию вирусной геномной ДНК в кровеносных сосудах экспериментальных мышей через 6 недель после заражения, поскольку ЦМВ представляет собой ДНК-вирус, который реплицируется путем амплификации своей геномной ДНК в клетках-мишенях даже при нелитической инфекции. После исследования ДНК MCMV в образцах корня аорты, грудной аорты, сонной артерии и задней полой вены с помощью ПЦР-анализа мы обнаружили, что 23 из 24 мышей, инфицированных MCMV, имели ДНК вируса , т.е.1 , обнаруженную в большинстве аорт (96). %) и в посткавальных венозных тканях (100%, рис.6, табл. 2). ДНК MCMV не была обнаружена у мышей, которые были ложно инфицированы (рис. 6, табл. 2). Эти результаты подтверждают, что ЦМВ-инфекция клеток кровеносных сосудов и экспрессия вирусной РНК и ДНК играли важную роль в индукции повышения кровяного давления, возможно, путем изменения экспрессии генов клетки-хозяина, которые участвуют в экспрессии провоспалительных цитокинов, ренина и Ang II, влияющий на функцию клеток сосудов и приводящий к повышению артериального давления.
S2). Затем мы исследовали экспрессию вирусной геномной ДНК в кровеносных сосудах экспериментальных мышей через 6 недель после заражения, поскольку ЦМВ представляет собой ДНК-вирус, который реплицируется путем амплификации своей геномной ДНК в клетках-мишенях даже при нелитической инфекции. После исследования ДНК MCMV в образцах корня аорты, грудной аорты, сонной артерии и задней полой вены с помощью ПЦР-анализа мы обнаружили, что 23 из 24 мышей, инфицированных MCMV, имели ДНК вируса , т.е.1 , обнаруженную в большинстве аорт (96). %) и в посткавальных венозных тканях (100%, рис.6, табл. 2). ДНК MCMV не была обнаружена у мышей, которые были ложно инфицированы (рис. 6, табл. 2). Эти результаты подтверждают, что ЦМВ-инфекция клеток кровеносных сосудов и экспрессия вирусной РНК и ДНК играли важную роль в индукции повышения кровяного давления, возможно, путем изменения экспрессии генов клетки-хозяина, которые участвуют в экспрессии провоспалительных цитокинов, ренина и Ang II, влияющий на функцию клеток сосудов и приводящий к повышению артериального давления.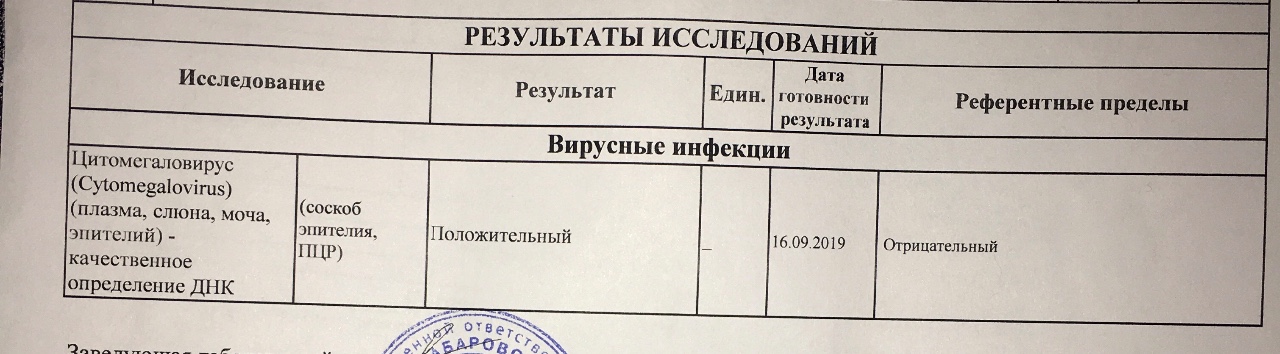
Рисунок 6. Обнаружение ДНК MCMV в образцах кровеносных сосудов.
ДНК вирусного непосредственно раннего гена-1 (IE-1) была обнаружена в тканях кровеносных сосудов мышей, инфицированных MCMV. Вирус IE-1 не был обнаружен у мышей, ложно инфицированных и получавших любую диету. В анализе гнездовой ПЦР использовались две пары специфичных для вируса праймеров, которые амплифицируют ген MCMV IE-1 в фрагмент ДНК размером 310 п.н. (A–L) Дорожки 1–12, ткани кровеносных сосудов двенадцати мышей из каждой экспериментальной группы. Р — положительный контроль ПЦР; N, отрицательный контроль ПЦР. Положительные показатели MCMV IE-1 в кровеносных сосудах мышей, инфицированных MCMV, показаны в таблице 2.
https://doi.org/10.1371/journal.ppat.1000427.g006
Инфекция HCMV стимулирует экспрессию ренина в эндотелиальных клетках сосудов (EC)
ЦМВ-инфекция обладает высокой клеточной и видоспецифичностью, а ЦМВ поражает только клетки человека, но не клетки мыши, и наоборот. Чтобы определить, является ли инфекция ЦМВ фактором риска, вызывающим повышение артериального давления у людей, мы определили инфекцию ЦМВ эндотелиальных клеток как артериальных, так и венозных сосудов с помощью установленной системы культивирования in vitro .Кроме того, экспрессия ренина в ЭК признана ключевым компонентом локальной РАС [24]–[27].
Чтобы определить, является ли инфекция ЦМВ фактором риска, вызывающим повышение артериального давления у людей, мы определили инфекцию ЦМВ эндотелиальных клеток как артериальных, так и венозных сосудов с помощью установленной системы культивирования in vitro .Кроме того, экспрессия ренина в ЭК признана ключевым компонентом локальной РАС [24]–[27].
Используя клетки пупочной вены человека (HUVEC, ATCC) и эндотелиальные клетки брюшной аорты (HAAE, ATCC), мы обнаружили, что инфекция HCMV стимулирует экспрессию ренина в EC в зависимости от инфекционной дозы, определяемой по экспрессии мРНК ренина с Q-RT- ПЦР и экспрессия белка ренина с помощью вестерн-блоттинга (рис. 7А-С). Напротив, лабораторный штамм HCMV AD-169, который не реплицируется в ЭК и экспрессирует минимальный уровень pol , не индуцировал экспрессию ренина (фиг.7С и D). Когда EC подвергались воздействию УФ-инактивированного HCMV, не было обнаружено повышенной экспрессии мРНК ренина (данные не показаны). Кроме того, в соответствии с результатами нашего исследования на мышах, инфицирование HCMV как артериальных, так и венозных EC показало нелитическую инфекцию, определяемую отсутствием клеточного цитопатического эффекта (CPE) или образования вирусных бляшек (рис. S3, рис. S4). ).
Кроме того, в соответствии с результатами нашего исследования на мышах, инфицирование HCMV как артериальных, так и венозных EC показало нелитическую инфекцию, определяемую отсутствием клеточного цитопатического эффекта (CPE) или образования вирусных бляшек (рис. S3, рис. S4). ).
Рис. 7. Заражение HCMV человека, вызывающее экспрессию ренина.
(A) Инфекция HCMV индуцировала экспрессию мРНК ренина, определяемую с помощью Q-RT-PCR в реальном времени.Экспрессия мРНК ренина в клетках коррелировала с интенсивностью MOI 10>MOI 1, а клетки с ложной инфекцией (MOI 0) служили исходной линией (RQ = 1). (B) Продукты Q-RT-PCR были подтверждены гель-электрофорезом, показывающим, что мРНК ренина была высоко экспрессирована в клетках, инфицированных MOI 10, в отличие от клеток, инфицированных MOI 1 и MOI 0 (ложная инфекция). (C) Инфекция HCMV индуцировала экспрессию ренина как в венозных (CRL-1730), так и в артериальных (CRL-2472) ЭК, определяемую с помощью ПЦР, ОТ-ПЦР и вестерн-блоттинга.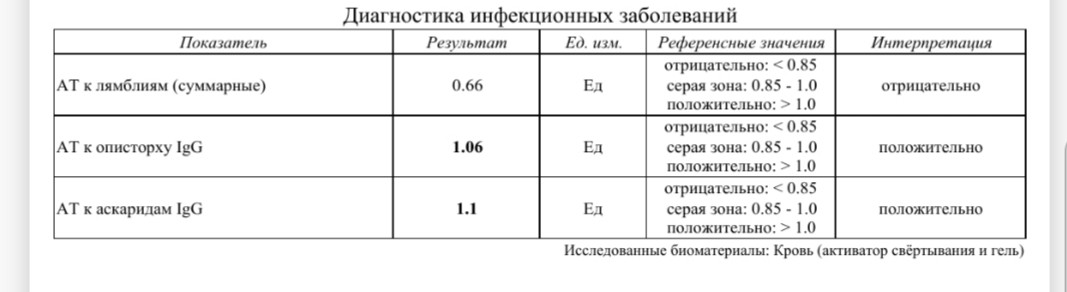 Для точного измерения репликации вируса и экспрессии ренина ген ДНК-полимеразы HCMV ( pol ) и уровни мРНК ренина в инфицированных клетках определяли с помощью ПЦР и ОТ-ПЦР соответственно. Экспрессию белка ренина определяли с помощью вестерн-блоттинга в этих клетках. ДНК HCMV pol была четко обнаружена в инфицированных BI-5 (клинический изолят HCMV) венозных и артериальных клетках. AD169, лабораторный штамм, который, как известно, не способен расти в эндотелиальных клетках сосудов, служил в качестве контроля вирусной инфекции, который не экспрессировал вирусный ген pol и не индуцировал экспрессию ренина.(D) HCMV BI-5 индуцирует экспрессию мРНК ренина в венозных и артериальных EC, определяемую анализами Q-RT-PCR в реальном времени.
Для точного измерения репликации вируса и экспрессии ренина ген ДНК-полимеразы HCMV ( pol ) и уровни мРНК ренина в инфицированных клетках определяли с помощью ПЦР и ОТ-ПЦР соответственно. Экспрессию белка ренина определяли с помощью вестерн-блоттинга в этих клетках. ДНК HCMV pol была четко обнаружена в инфицированных BI-5 (клинический изолят HCMV) венозных и артериальных клетках. AD169, лабораторный штамм, который, как известно, не способен расти в эндотелиальных клетках сосудов, служил в качестве контроля вирусной инфекции, который не экспрессировал вирусный ген pol и не индуцировал экспрессию ренина.(D) HCMV BI-5 индуцирует экспрессию мРНК ренина в венозных и артериальных EC, определяемую анализами Q-RT-PCR в реальном времени.
https://doi.org/10.1371/journal.ppat.1000427.g007
HCMV постоянно инфицирует EC
Чтобы уточнить, что ЦМВ инфицирует ЭК персистирующим образом, мы определили транскрипты ранних генов ЦМВ в ЭК, заразив клетки клиническими изолятами ЦМВ BI-4 и BI-5, в отличие от лабораторного штамма AD169. Наши данные показывают, что по сравнению с AD169 клинические изоляты HCMV инфицировали EC и экспрессировали два ключевых гена, важных для репликации CMV, ie2 и pol .мРНК CMV ie2 и pol была обнаружена в ЭК, инфицированных клиническими изолятами HCMV (BI-4 и BI-5), но не лабораторным штаммом (AD169) (рис. 8). Кроме того, в многоточечном кинетическом исследовании ЦМВ-инфекции мы определили, что клинические изоляты HCMV инфицированы EC в виде персистирующей инфекции, при которой копии гена pol были количественно обнаружены в супернатанте клеточной культуры, в отличие от количества копий. экспрессии pol из AD169, которая, как известно, не способна реплицироваться в ЭК (фиг.С5).
Наши данные показывают, что по сравнению с AD169 клинические изоляты HCMV инфицировали EC и экспрессировали два ключевых гена, важных для репликации CMV, ie2 и pol .мРНК CMV ie2 и pol была обнаружена в ЭК, инфицированных клиническими изолятами HCMV (BI-4 и BI-5), но не лабораторным штаммом (AD169) (рис. 8). Кроме того, в многоточечном кинетическом исследовании ЦМВ-инфекции мы определили, что клинические изоляты HCMV инфицированы EC в виде персистирующей инфекции, при которой копии гена pol были количественно обнаружены в супернатанте клеточной культуры, в отличие от количества копий. экспрессии pol из AD169, которая, как известно, не способна реплицироваться в ЭК (фиг.С5).
. Рис. 8. Обнаружение мРНК HCMV ie1 , ie2 , pol и pp65 в ЭК человека.
Экспрессию вирусного гена определяли с помощью ОТ-ПЦР через 14 дней после инфицирования. Экспрессия гена pp65 служила контролем. (A–E) Экспрессия РНК HCMV в инфицированных клетках пупочной вены (CRL-1730). (F – J) Экспрессия РНК HCMV в клетках брюшной аорты (CRL-2472). Данные показывают, что клинические изоляты HCMV, BI-4 и BI-5, экспрессируют специфичные для вируса гены и персистентно инфицируют EC, тогда как лабораторный штамм HCMV, AD-169, этого не делает.Продукты ОТ-ПЦР, исследованные с помощью агарозного геля, показаны на левой панели, а с помощью денситометра — на правой панели.
(A–E) Экспрессия РНК HCMV в инфицированных клетках пупочной вены (CRL-1730). (F – J) Экспрессия РНК HCMV в клетках брюшной аорты (CRL-2472). Данные показывают, что клинические изоляты HCMV, BI-4 и BI-5, экспрессируют специфичные для вируса гены и персистентно инфицируют EC, тогда как лабораторный штамм HCMV, AD-169, этого не делает.Продукты ОТ-ПЦР, исследованные с помощью агарозного геля, показаны на левой панели, а с помощью денситометра — на правой панели.
https://doi.org/10.1371/journal.ppat.1000427.g008
В совокупности наши исследования показали, что персистирующая, а не литическая инфекция ЦМВ играет центральную роль в повреждении сосудов, связанном с ЦМВ. В частности, литическая инфекция определяется как свидетельство репликации вируса, которая приводит к цитопатическому эффекту, образованию вирусной чумы в культуре тканей и лизису клеток с гистологическими признаками морфологических цитопатических изменений в стенках сосудов мыши.Персистирующая или нелитическая инфекция определяется как свидетельство экспрессии вирусного гена на уровне ДНК, РНК или белка при отсутствии вирусного цитопатического эффекта, лизиса клеток или гистологических изменений.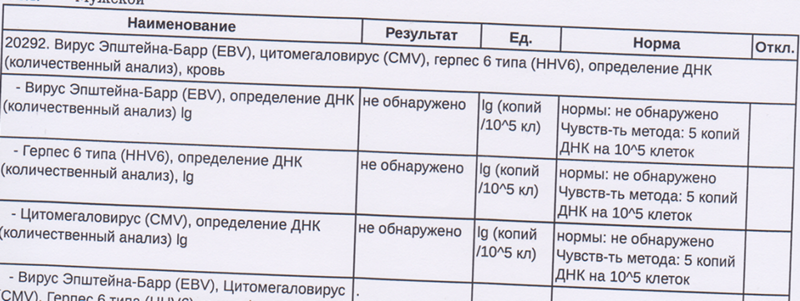 Мы обнаружили, что результаты анализа клеточной культуры согласуются с наблюдениями исследования in vivo на модели мыши , поскольку в клеточной культуре не было обнаружено образования бляшек, а при микроскопическом анализе в аортах мышей не наблюдалось литических поражений. Кроме того, инфицирование EC HCMV также показало, что инфекция CMV нарушает экспрессию генов клетки-хозяина, а хронические воспалительные реакции играют ключевую роль в сердечно-сосудистых заболеваниях человека, инициированных инфекцией HCMV, в частности, повышение артериального давления, которое было идентифицировано нашим in vivo. исследования моделей мышей.
Мы обнаружили, что результаты анализа клеточной культуры согласуются с наблюдениями исследования in vivo на модели мыши , поскольку в клеточной культуре не было обнаружено образования бляшек, а при микроскопическом анализе в аортах мышей не наблюдалось литических поражений. Кроме того, инфицирование EC HCMV также показало, что инфекция CMV нарушает экспрессию генов клетки-хозяина, а хронические воспалительные реакции играют ключевую роль в сердечно-сосудистых заболеваниях человека, инициированных инфекцией HCMV, в частности, повышение артериального давления, которое было идентифицировано нашим in vivo. исследования моделей мышей.
Обсуждение
Инфекция MCMV вызывала значительное повышение артериального давления in vivo , независимо от диеты с высоким содержанием холестерина и образования атеросклеротических бляшек в аорте мыши (рис. 1, рис. 2, таблицы 1 и 2). Кроме того, мы обнаружили, что помимо стимуляции экспрессии воспалительных цитокинов, которые, как сообщается, повышают кровяное давление, ЦМВ-инфекция стимулировала экспрессию ренина, первого компонента РАС, как в клетках почек, так и в ЭК дозозависимым образом (рис. 4, рис. 7). ЦМВ-инфекция также повышала уровни Ang II в крови мышей и тканях артерий. Ang II известен как эффекторный пептид RAS, который напрямую связывается с кровеносными сосудами и вызывает вазоконстрикцию. Наши экспериментальные результаты показывают, что ЦМВ-инфекция является фактором риска сердечно-сосудистых заболеваний, в частности повышения артериального давления или гипертонии. Нелитическая ЦМВ-инфекция и нарушенная экспрессия клеточных генов, особенно компонентов РАС, лежат в основе молекулярного механизма, с помощью которого ЦМВ-инфекция вызывает повышение артериального давления.
4, рис. 7). ЦМВ-инфекция также повышала уровни Ang II в крови мышей и тканях артерий. Ang II известен как эффекторный пептид RAS, который напрямую связывается с кровеносными сосудами и вызывает вазоконстрикцию. Наши экспериментальные результаты показывают, что ЦМВ-инфекция является фактором риска сердечно-сосудистых заболеваний, в частности повышения артериального давления или гипертонии. Нелитическая ЦМВ-инфекция и нарушенная экспрессия клеточных генов, особенно компонентов РАС, лежат в основе молекулярного механизма, с помощью которого ЦМВ-инфекция вызывает повышение артериального давления.
В исследовании in vivo на модели мышей мы исследовали 48 мышей одного вида, одинакового возраста, одинаковой массы тела и равномерно распределенных самцов и самок в 4 группах анализа. Мы определили, что заражение MCMV вызывает повышение артериального давления, и сравнили это с известными факторами риска гипертонии: диетой с высоким содержанием холестерина и атеросклерозом. Мы использовали катетерный метод для измерения кровяного давления у всех испытуемых мышей в правой сонной артерии под анестезией, чтобы получить точные показания и уменьшить боль у экспериментальных животных. Средние значения кровяного давления мышей, инфицированных MCMV, сравнивали с контрольными группами, в которых кровяное давление измеряли тем же методом и той же процедурой. Экспериментальные результаты показывают статистически значимые различия между группами, инфицированными MCMV, и контрольными группами. Очевидно, что наше исследование in vivo на модели мышей демонстрирует, что инфекция MCMV вызывает значительное повышение артериального давления, независимо от двух других известных факторов риска, диеты с высоким содержанием холестерина и атеросклероза, у мышей, которые были иммунокомпетентными и с нормальными функциями метаболизма липидов. .
Средние значения кровяного давления мышей, инфицированных MCMV, сравнивали с контрольными группами, в которых кровяное давление измеряли тем же методом и той же процедурой. Экспериментальные результаты показывают статистически значимые различия между группами, инфицированными MCMV, и контрольными группами. Очевидно, что наше исследование in vivo на модели мышей демонстрирует, что инфекция MCMV вызывает значительное повышение артериального давления, независимо от двух других известных факторов риска, диеты с высоким содержанием холестерина и атеросклероза, у мышей, которые были иммунокомпетентными и с нормальными функциями метаболизма липидов. .
Диета с высоким содержанием холестерина вызывает повышение артериального давления в связи с увеличением веса [30]. Инфекция MCMV не способствовала увеличению веса мыши (рис. S1, P >0,05). Вес двух групп мышей C57BL/6J, получавших диету с высоким содержанием холестерина, был выше, чем у двух групп, получавших обычную диету ( P <0,05), и в обеих группах мышей с высоким содержанием холестерина, инфицированных вирусом или нет, наблюдалось увеличение массы тела. артериального давления (рис. 1Е). Высокое кровяное давление у мышей с избыточным весом свидетельствует о том, что ожирение играет важную роль в развитии гипертонии у мышей, которых кормили пищей с высоким содержанием холестерина.Ожирение вызывает гиперхолестеринемию, что приводит к повышению вязкости крови, динамическим изменениям крови и механистическому повреждению эндотелия сосудов. В нашем исследовании у мышей, инфицированных MCMV, было значительно повышенное кровяное давление по сравнению с ложно инфицированными мышами в обеих диетических группах ( P <0,01 и P <0,05). Группа, инфицированная MCMV, весила не больше, чем в контрольных группах, получавших ту же диету (рис. S1, P >0,05). Таким образом, ЦМВ-инфекция не способствовала увеличению веса мышей, но вызывала повышение артериального давления, по-видимому, за счет изменения экспрессии клеточных генов, сверхэкспрессии воспалительных цитокинов, ренина и Ang II в сосудистой системе.
артериального давления (рис. 1Е). Высокое кровяное давление у мышей с избыточным весом свидетельствует о том, что ожирение играет важную роль в развитии гипертонии у мышей, которых кормили пищей с высоким содержанием холестерина.Ожирение вызывает гиперхолестеринемию, что приводит к повышению вязкости крови, динамическим изменениям крови и механистическому повреждению эндотелия сосудов. В нашем исследовании у мышей, инфицированных MCMV, было значительно повышенное кровяное давление по сравнению с ложно инфицированными мышами в обеих диетических группах ( P <0,01 и P <0,05). Группа, инфицированная MCMV, весила не больше, чем в контрольных группах, получавших ту же диету (рис. S1, P >0,05). Таким образом, ЦМВ-инфекция не способствовала увеличению веса мышей, но вызывала повышение артериального давления, по-видимому, за счет изменения экспрессии клеточных генов, сверхэкспрессии воспалительных цитокинов, ренина и Ang II в сосудистой системе.
Мышей инфицировали MCMV путем внутрибрюшинной инъекции. ДНК вируса IE-1 была обнаружена на 6-й неделе после инфицирования в 100% аорты инфицированных мышей, получавших пищу с высоким содержанием холестерина, и в 92% аорты инфицированных мышей, получавших обычную диету. Мы также исследовали ДНК MCMV в других кровеносных сосудах. Большинство крупных сосудов у мышей, инфицированных вирусом, были положительными на вирусную ДНК, и MCMV имеет сродство к заражению клеток сосудов, даже если порт вирусной инфекции находится во внутрибрюшинном пространстве (рис.6, табл. 2). Аорта и посткавальная вена являются основными резервуарами ЦМВ. Не было существенной разницы в инфицировании клеток сосудов MCMV у мышей, получавших диету с высоким содержанием холестерина, по сравнению с мышами, получавшими обычную диету ( P >0,05). Nerheim et al., однако, сообщили, что активная инфекция HCMV усиливается в атеросклеротических кровеносных сосудах по сравнению с сосудистыми эквивалентами без атеросклероза, и эта вирусная активность ограничена субпопуляциями интимальных и адвентициальных клеток [37].
ДНК вируса IE-1 была обнаружена на 6-й неделе после инфицирования в 100% аорты инфицированных мышей, получавших пищу с высоким содержанием холестерина, и в 92% аорты инфицированных мышей, получавших обычную диету. Мы также исследовали ДНК MCMV в других кровеносных сосудах. Большинство крупных сосудов у мышей, инфицированных вирусом, были положительными на вирусную ДНК, и MCMV имеет сродство к заражению клеток сосудов, даже если порт вирусной инфекции находится во внутрибрюшинном пространстве (рис.6, табл. 2). Аорта и посткавальная вена являются основными резервуарами ЦМВ. Не было существенной разницы в инфицировании клеток сосудов MCMV у мышей, получавших диету с высоким содержанием холестерина, по сравнению с мышами, получавшими обычную диету ( P >0,05). Nerheim et al., однако, сообщили, что активная инфекция HCMV усиливается в атеросклеротических кровеносных сосудах по сравнению с сосудистыми эквивалентами без атеросклероза, и эта вирусная активность ограничена субпопуляциями интимальных и адвентициальных клеток [37].
Ренин является ступенчато-лимитирующим белком РАС. Повышенная активность РАС приводит к системной гипертензии, а экспрессия эктопических молекул антиренина или антиангиотензина снижает гипертензию [24]–[27]. Мы определили экспрессию ренина как в клетках мыши, так и в клетках человека после ЦМВ-инфекции и обнаружили, что ЦМВ-инфекция увеличивает экспрессию ренина в клетках в зависимости от множественности инфекций (рис. 4, рис. 7).
Кроме того, у иммунокомпетентных лиц ЦМВ вызывает персистирующие инфекции в определенных типах клеток, включая РЭ.Течение инфекции бессимптомное и ограничено на клеточном уровне. В наших исследованиях за всеми 4 группами мышей наблюдали в течение 10 недель, и никаких симптомов ЦМВ-инфекции не наблюдалось. Исследование образцов мышей и заражение культуры ЭК ЦМВ подтвердило, что нелитическая инфекция произошла в клетках кровеносных сосудов (рис. 2, рис. 8, рис. S3, рис. S4, рис. S5).
Таким образом, ЦМВ-инфекция сама по себе вызывала значительное повышение артериального давления. Повышенная экспрессия провоспалительных цитокинов, ренина и Ang II лежит в основе патогенетического механизма активной ЦМВ-инфекции по повышению артериального давления и обострению атеросклероза.Таким образом, контроль ЦМВ-инфекции для ограничения развития гипертонии и атеросклероза может стать новой стратегией профилактики сердечно-сосудистых заболеваний, связанных с ЦМВ-инфекцией.
Повышенная экспрессия провоспалительных цитокинов, ренина и Ang II лежит в основе патогенетического механизма активной ЦМВ-инфекции по повышению артериального давления и обострению атеросклероза.Таким образом, контроль ЦМВ-инфекции для ограничения развития гипертонии и атеросклероза может стать новой стратегией профилактики сердечно-сосудистых заболеваний, связанных с ЦМВ-инфекцией.
Материалы и методы
Вирусы
Цитомегаловирус мыши (MCMV, штамм Smith MSGV) был приобретен в Американской коллекции типовых культур (ATTC, VR-1399). Сырье MCMV готовили путем инфицирования эмбриональных фибробластов мыши (ATCC CRL-1404) и сбора культурального супернатанта после проявления цитопатического эффекта (CPE) на клеточном монослое.Супернатанты центрифугировали при 1400 об/мин в течение 15 мин, чтобы избавиться от клеточного дебриса, и супернатанты хранили аликвотами при -80°С. Титр штамма вируса определяли с помощью стандартного анализа бляшек [38]. Клинические изоляты цитомегаловируса человека (ЦМВ), BI-4 и BI-5, были получены из образцов пациентов, как описано ранее и любезно предоставлено доктором Лурейном (Медицинский центр Университета Раш, Чикаго, Иллинойс) [39]. Вирусный пул лабораторного штамма AD169 ATCC готовили из культуры клеток фибробластов легких плода человека (MRC-5, ATCC).Вирусы титровали на клетках крайней плоти человека (HF, ATCC) в соответствии с согласованным протоколом титрования HCMV [40].
Вирусный пул лабораторного штамма AD169 ATCC готовили из культуры клеток фибробластов легких плода человека (MRC-5, ATCC).Вирусы титровали на клетках крайней плоти человека (HF, ATCC) в соответствии с согласованным протоколом титрования HCMV [40].
Объекты исследования
Двухнедельные мыши C57BL/6J (n = 48) были получены из лаборатории Джексона (Бар-Харбор, Мэн). В экспериментах использовались 2-недельные мыши, размещенные в нашем животноводческом помещении по 3 мыши (одного пола) в одной клетке. Мыши имели свободный доступ к водопроводной воде и получали обычный или коммерческий атерогенный рацион (1,25% холестерина, 0,5% холевой кислоты и 15% жира), приобретенный в лаборатории Джексона.Все эксперименты на животных проводились в соответствии с рекомендациями Национального института здравоохранения. Протоколы были одобрены комитетами по уходу и использованию животных Медицинского центра Beth Israel Deaconess и Гарвардской медицинской школы.
Экспериментальный план исследования на мышах
Как показано в таблице 3.
Измерение артериального давления у мышей и сбор образца
Через шесть недель после заражения MCMV (на 10-й неделе эксперимента) мышей анестезировали пентобарбиталом натрия (40 мг/кг, внутрибрюшинно).Сонная артерия была выделена и канюлирована с помощью высокоточного катетера с микронаконечником диаметром 1,4 Fr (SPR-671), подключенного к системе сбора данных (PowerLab ML820, ADInstrument, Колорадо-Спрингс) через блок интерфейса давления (Millar Instrument, Transducer Balance, ТСВ 600). Катетер с микронаконечником продвигали в сонную артерию и регистрировали артериальное давление в сонной артерии. Данные артериального давления были собраны и проанализированы с использованием программного обеспечения Chart v4.1.2 AD-instrument [28], [29]. Затем перевязывали конец сонной артерии, направленный к сердцу, и артерии пересекали между двумя перевязками (один конец к сердцу, а другой конец к мозгу).Фрагмент сонной артерии однократно промывали в PBS, а белок в среде O.C.T затем хранили в жидком азоте. После этого отбирали 200-400 мкл крови из яремной вены и вращали при 7000 об/мин в течение 10 минут для удаления клеток. Плазму хранили при -80°С. Также собирали аорту и посткавальную вену, промывали PBS для удаления крови из сосудов и хранили в жидком азоте. Всю аорту разделяли на три части, из которых корень использовали для приготовления замороженных срезов и окрашивания гематоксилин-эозином для выявления патологии; верхний и нижний грудной фрагмент (ок.от 5 до 1 см) использовали для выделения РНК/генного анализа и выделения ДНК/анализа ПЦР соответственно.
После этого отбирали 200-400 мкл крови из яремной вены и вращали при 7000 об/мин в течение 10 минут для удаления клеток. Плазму хранили при -80°С. Также собирали аорту и посткавальную вену, промывали PBS для удаления крови из сосудов и хранили в жидком азоте. Всю аорту разделяли на три части, из которых корень использовали для приготовления замороженных срезов и окрашивания гематоксилин-эозином для выявления патологии; верхний и нижний грудной фрагмент (ок.от 5 до 1 см) использовали для выделения РНК/генного анализа и выделения ДНК/анализа ПЦР соответственно.
Статистический анализ
Сравнения между 2 экспериментальными группами были обработаны с помощью критерия Стьюдента t (двусторонний) и критерия Chisquare ( х 2 ). Значение P ≤0,05 считалось статистически значимым для различия между группами.
Иммунофлуоресцентное окрашивание экспрессии ренина и антигена MCMV
Интрапаренхиматозная клеточная линия мышиной почки CRL-2193 (As4. 1) был куплен в ATCC. Клетки имеют базальный уровень внутриклеточно секретируемого проренина. Чтобы изучить влияние инфекции MCMV на экспрессию ренина, клетки инфицировали MCMV, а затем позволяли расти в предметных стеклах с камерами в течение 5 дней. Срезы культуры дважды промывали PBS, клетки фиксировали 10% формальдегидом и пермеабилизировали в 0,2% растворе тритона-Х-100 в PBS. Клетки инкубировали с 5% BSA (блокирующий реагент), а затем дополнительно инкубировали в PBS/5% BSA с разбавленными 1∶200 первичными антителами мыши против ренина (Serotec) и мышиными антителами против мышиного CMV (Express Biotech).После промывки клетки инкубировали с 1∶300 разбавленными FITC-связанными антимышиными IgG (Delta Biolabs) или TRITC-связанными антимышиными IgG (Invitrogen). Клетки наблюдали под флуоресцентным микроскопом (Olympus, DP70) после добавления монтажной среды, содержащей DAPI.
1) был куплен в ATCC. Клетки имеют базальный уровень внутриклеточно секретируемого проренина. Чтобы изучить влияние инфекции MCMV на экспрессию ренина, клетки инфицировали MCMV, а затем позволяли расти в предметных стеклах с камерами в течение 5 дней. Срезы культуры дважды промывали PBS, клетки фиксировали 10% формальдегидом и пермеабилизировали в 0,2% растворе тритона-Х-100 в PBS. Клетки инкубировали с 5% BSA (блокирующий реагент), а затем дополнительно инкубировали в PBS/5% BSA с разбавленными 1∶200 первичными антителами мыши против ренина (Serotec) и мышиными антителами против мышиного CMV (Express Biotech).После промывки клетки инкубировали с 1∶300 разбавленными FITC-связанными антимышиными IgG (Delta Biolabs) или TRITC-связанными антимышиными IgG (Invitrogen). Клетки наблюдали под флуоресцентным микроскопом (Olympus, DP70) после добавления монтажной среды, содержащей DAPI.
Ангиотензин II ИФА
Набор ELISA для ангиотензина II был приобретен у Bachem (Торранс, Калифорния), и тестирование образцов проводилось в соответствии с инструкциями производителя. Сыворотку мыши готовили, как описано в разделе о сборе образцов.Для обнаружения Ang II в образцах сосудов 0,2-дюймовый фрагмент аорты 3 случайно выбранных мышей из каждой группы нарезали кубиками и помещали в 2-мл пробирку с 470 мкл лизирующего буфера соответственно (20 мМ HEPES, pH 7,5, 150 мМ). NaCl, 1% Triton X-100, 0,1% SDS, 1 мМ ЭДТА, 1 мМ DTT, 2 таблетки ингибитора протеазы Roche/50 мл). Затем ткани вручную разрушали в лизирующем буфере с помощью небольшого пестика соответственно. Затем раствор инкубировали при 55°С в течение ночи. После центрифугирования супернатант клеточного лизата собирали из каждой пробирки и затем использовали для обнаружения Ang II с помощью ELISA.
Сыворотку мыши готовили, как описано в разделе о сборе образцов.Для обнаружения Ang II в образцах сосудов 0,2-дюймовый фрагмент аорты 3 случайно выбранных мышей из каждой группы нарезали кубиками и помещали в 2-мл пробирку с 470 мкл лизирующего буфера соответственно (20 мМ HEPES, pH 7,5, 150 мМ). NaCl, 1% Triton X-100, 0,1% SDS, 1 мМ ЭДТА, 1 мМ DTT, 2 таблетки ингибитора протеазы Roche/50 мл). Затем ткани вручную разрушали в лизирующем буфере с помощью небольшого пестика соответственно. Затем раствор инкубировали при 55°С в течение ночи. После центрифугирования супернатант клеточного лизата собирали из каждой пробирки и затем использовали для обнаружения Ang II с помощью ELISA.
Гнездовой ПЦР-тест ДНК MCMV в клетках кровеносных сосудов
Ткани сосудов разрушали пестиком в буфере для переваривания тканей (50 мМ Tris-HCl, 100 мМ NaCl, 5 мМ EDTA, 1% SDS, 10 мг/мл протеазы K) и расщепляли при 50°C в течение ночи. После экстракции фенолом и хлороформом осадок ДНК промывали 70%-ным спиртом, растворяли в 100 мкл ddH 2 O и выдерживали при -80°C до проведения ПЦР. Праймеры вложенной ПЦР, которые амплифицируют ранний ген-1 MCMV (IE-1), описаны ранее [41]–[43].
Праймеры вложенной ПЦР, которые амплифицируют ранний ген-1 MCMV (IE-1), описаны ранее [41]–[43].
Количественная ОТ-ПЦР в реальном времени
ОТ-ПЦР в реальном времени выполняли с помощью системы быстрой ПЦР в реальном времени Applied Biosystems 7300 с использованием зонда TaqMan и методов на основе праймеров. Зонд и праймеры специфичны к кДНК ренина мыши и человека, соответственно, и были разработаны и приобретены у Applied Biosystems с идентификационными номерами анализа 433734 (мышь) и 418327 (человек). Эксперименты относительного количественного определения (RQ) были выполнены в соответствии с протоколом RQ, и результаты экспериментов RQ представлены в виде нормализованной флуоресценции репортерного красителя (Rn) в зависимости от номера цикла для каждого образца по сравнению с внутренним контролем.
Клетки и инфекция HCMV
Линия эндотелиальных клеток пупочной вены (CRL-1730) и линия эндотелиальных клеток брюшной аорты (CRL-2472) были приобретены в ATCC. Логарифм роста клеток разделяли на 6-луночные планшеты за два дня до инфицирования ЦМВ. После формирования монослоя клетки инфицировали при множественности заражения (MOI) 10 каждым вирусом, а неадсорбированный вирус после инкубации отмывали PBS. Супернатант по 0,5 мл от каждой культуры собирали на 0, 3, 7, 10 и 14 день после инфицирования и заменяли на 0.5 мл свежей среды. Вирус-индуцированный цитолитический эффект исследовали в каждый момент времени с помощью фазово-контрастного микроскопа. Мониторный тест COBAS amplicor CMV был адаптирован для измерения количества копий ДНК HCMV pol в культуральных супернатантах с использованием анализатора COBAS AMPLICOR (Roche Molecular Systems). Этот количественный ДНК-ПЦР специфически обнаруживает фрагмент из 365 оснований в гене pol HCMV, который не гомологичен другим вирусам герпеса. Набор для амплификации был приобретен у Roche Diagnostic Systems, Inc.(Бранчбург, штат Нью-Джерси), подготовка образцов, ПЦР-амплификация и количественный анализ ДНК ЦМВ следовали инструкциям производителя.
Логарифм роста клеток разделяли на 6-луночные планшеты за два дня до инфицирования ЦМВ. После формирования монослоя клетки инфицировали при множественности заражения (MOI) 10 каждым вирусом, а неадсорбированный вирус после инкубации отмывали PBS. Супернатант по 0,5 мл от каждой культуры собирали на 0, 3, 7, 10 и 14 день после инфицирования и заменяли на 0.5 мл свежей среды. Вирус-индуцированный цитолитический эффект исследовали в каждый момент времени с помощью фазово-контрастного микроскопа. Мониторный тест COBAS amplicor CMV был адаптирован для измерения количества копий ДНК HCMV pol в культуральных супернатантах с использованием анализатора COBAS AMPLICOR (Roche Molecular Systems). Этот количественный ДНК-ПЦР специфически обнаруживает фрагмент из 365 оснований в гене pol HCMV, который не гомологичен другим вирусам герпеса. Набор для амплификации был приобретен у Roche Diagnostic Systems, Inc.(Бранчбург, штат Нью-Джерси), подготовка образцов, ПЦР-амплификация и количественный анализ ДНК ЦМВ следовали инструкциям производителя.
ОТ-ПЦР для изучения экспрессии мРНК pp65, IE1, IE2 и pol в инфицированных клетках
Праймеры для ОТ-ПЦР были разработаны на основе последовательностей экзонов HCMV pp65 , ie1 и ie2 (IE 55/86) соответственно [42], [43]. HCMV pp65 прямой праймер: 5′-CACCTGTCACCGCTGCTATATT TGC-3′; обратный праймер: 5′-CACCACGCAGCGGCCCTTGATGTTT-3′.Прямые праймеры ie1 : 5′-CTTAATACAAGCCATCCACA-3′; обратный праймер: 5′-TAGATAAGGTTCATGAGCCT-3′. Прямой праймер ie2 : 5′-GCACACCCAACGTGCAGACTCGGC-3; обратный праймер: 5′-TGGCTGCCTCGA TGGCCAGGCTC-3′. Набор праймеров для амплификации HCMV pol такой же, как и используемый в анализе COBAS, за исключением процесса обратной транскрипции, и он амплифицирует фрагмент из 365 оснований в гене HCMV pol , который не гомологичен другим вирусам герпеса. ОТ-ПЦР проводили с использованием набора OneStep RT-PCR (Qiagen, Valencia, CA) в соответствии с инструкциями производителя.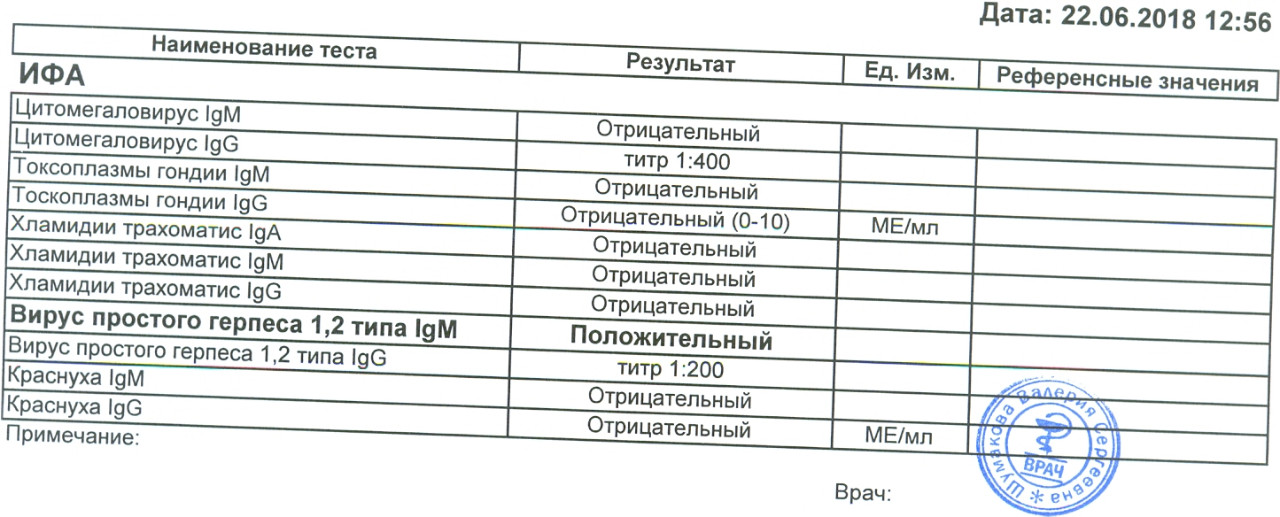 Реакционные смеси инкубировали в термоциклере 9600 при следующих условиях: 50°С в течение 30 минут, 95°С в течение 15 минут, затем 94°С в течение 30 секунд, 55°С в течение 30 секунд и 72°С в течение 1 минута, всего 35 циклов, наконец, 72°C в течение 10 минут.
Реакционные смеси инкубировали в термоциклере 9600 при следующих условиях: 50°С в течение 30 минут, 95°С в течение 15 минут, затем 94°С в течение 30 секунд, 55°С в течение 30 секунд и 72°С в течение 1 минута, всего 35 циклов, наконец, 72°C в течение 10 минут.
Экстракция тотальной РНК из инфицированных клеток
Клетки из каждых двух лунок (дубликатов) соскребали, и экстракцию и очистку РНК проводили в соответствии с протоколом очистки тотальной РНК из тканей животных (RNeasy Mini Kit, Qiagen Company).Расщепление ДНКазы на колонке применяли для удаления оставшейся ДНК из образцов РНК (набор ДНКазы без РНКазы, Qiagen Company). Концентрацию РНК измеряли по поглощению O.D. 260, и чистоту дополнительно проверяли электрофорезом.
Дополнительная информация
Рисунок S1.
Изменение веса мыши до и после эксперимента. Изменения веса мышей C57BL/6J до и после эксперимента. HD, среднее значение веса в группе мышей, ложно инфицированных и получавших только диету с высоким содержанием холестерина. V + HD, MCMV-инфицированные и получавшие диету с высоким содержанием холестерина. M, ложно инфицированный и питающийся только обычной пищей. V, инфицированный MCMV и получающий обычный рацион.
V + HD, MCMV-инфицированные и получавшие диету с высоким содержанием холестерина. M, ложно инфицированный и питающийся только обычной пищей. V, инфицированный MCMV и получающий обычный рацион.
https://doi.org/10.1371/journal.ppat.1000427.s001
(0,32 МБ TIF)
Рисунок S2.
Обнаружение мРНК MCMV IE1 в аорте мыши. мРНК MCMV IE1 в мышиной аорте из 4 групп мышей, протестированных с помощью ОТ-ПЦР. M, маркер молекулярного веса. Дорожки 1–2: MCMV IE1 не был обнаружен в образцах РНК 2 мышей, получавших обычную диету. Дорожки 3–4: мРНК MCMV IE1 была обнаружена в образцах РНК 2 мышей в группе с инфекцией MCMV плюс обычная диета.Дорожки 5–6: MCMV IE1 не был обнаружен в образцах РНК 2 мышей, получавших диету с высоким содержанием холестерина. Дорожки 7–8: MCMV IE1 был обнаружен в образцах РНК 2 мышей в группе с инфекцией MCMV и диетой с высоким содержанием холестерина. P, положительный контроль ОТ-ПЦР. N, отрицательный контроль ОТ-ПЦР. Экстракция тотальной РНК была такой же, как описано ранее. Праймеры для ОТ-ПЦР, вперед: 5′ CTCGAGTCTGGAACCGAAA 3′; реверс: 5′ TACAGGACAAC AGAACGCTC 3′. Суммарную клеточную РНК подвергали обратной транскрипции, а продукт кДНК амплифицировали с помощью ПЦР при 50°C в течение 30 минут, 95°C в течение 15 минут, а затем при 94°C в течение 30 секунд, 55°C в течение 30 секунд и 72°C в течение 1 минуты в течение 35 минут. циклов, с окончательным удлинением при 72°С 10 минут.
Праймеры для ОТ-ПЦР, вперед: 5′ CTCGAGTCTGGAACCGAAA 3′; реверс: 5′ TACAGGACAAC AGAACGCTC 3′. Суммарную клеточную РНК подвергали обратной транскрипции, а продукт кДНК амплифицировали с помощью ПЦР при 50°C в течение 30 минут, 95°C в течение 15 минут, а затем при 94°C в течение 30 секунд, 55°C в течение 30 секунд и 72°C в течение 1 минуты в течение 35 минут. циклов, с окончательным удлинением при 72°С 10 минут.
https://doi.org/10.1371/journal.ppat.1000427.s002
(0,41 МБ TIF)
Рисунок S3.
Нелитическая инфекция венозных ЭК HCMV BI-4, BI-5 и AD169. Морфология клеток CRL-1730 после инфицирования HCMV. (A) День 1 после имитации заражения. (B) День 1 после заражения BI-4. (C) День 1 после заражения BI-5. (D) День 1 после заражения AD169. (E) День 14 после имитации заражения. (F) День 14 после заражения BI-4. (G) День 14 после заражения BI-5. (H) День 14 после заражения AD169.
https://doi.org/10.1371/journal.ppat.1000427.s003
(1,61 МБ TIF)
Рисунок S4.

Нелитическая инфекция артериальных ЭК HCMV BI-4, BI-5 и AD169. Морфология клеток CRL-2472 после инфицирования HCMV. (A) День 1 после имитации заражения. (B) День 1 после заражения BI-4. (C) День 1 после заражения BI-5. (D) День 1 после заражения AD169. (E) День 14 после имитации заражения. (F) День 14 после заражения BI-4. (G) День 14 после заражения BI-5. (H) День 14 после заражения AD169.
https://doi.org/10.1371/journal.ppat.1000427.s004
(2,2 МБ TIF)
Рисунок S5.
HCMV персистентно инфицирует EC. Кинетическая детекция ЦМВ-инфекции ЭК по экспрессии гена pol . (A) Обнаружение экспрессии гена pol в венозных EC (CRL-1730), инфицированных BI-4, BI-5 и AD169. (B) Обнаружение экспрессии гена pol в артериальных EC (CRL-2472), инфицированных BI-4, BI-5 и AD169. КЭ инфицировали клиническими изолятами БИ-4, БИ-5 и лабораторным штаммом AD-169 при множественности инфекций 10 соответственно.Супернатанты инфицированных вирусом культур собирали в каждый момент времени, и количества копий ДНК HCMV pol определяли с помощью количественного анализа ДНК HCMV-ПЦР (COBAS). Показанные результаты были получены из репрезентативного эксперимента из трех проведенных, и данные показывают, что клинические изоляты HCMV выделяют персистентно инфицированные EC, в отличие от лабораторного штамма AD169.
Показанные результаты были получены из репрезентативного эксперимента из трех проведенных, и данные показывают, что клинические изоляты HCMV выделяют персистентно инфицированные EC, в отличие от лабораторного штамма AD169.
https://doi.org/10.1371/journal.ppat.1000427.s005
(0,54 МБ TIF)
Таблица S1.
Артериальное давление мышей C57BL/6J на 4-й и 10-й неделе эксперимента (*базовый уровень).* Исходный уровень артериального давления измеряли в правой сонной артерии каждой мыши за 4 недели до инфицирования MCMV, и мышей случайным образом отбирали из каждой группы. С этими мышами обращались так же, как с другими мышами в остальной части эксперимента. На 10-й неделе эксперимента у этих мышей снова измеряли артериальное давление на левой сонной артерии. Значения АД у этих мышей на 10-й неделе не включали в среднее значение измерения АД в каждой из четырех экспериментальных групп, состоящих из 12 мышей в каждой группе.
https://doi.org/10.1371/journal.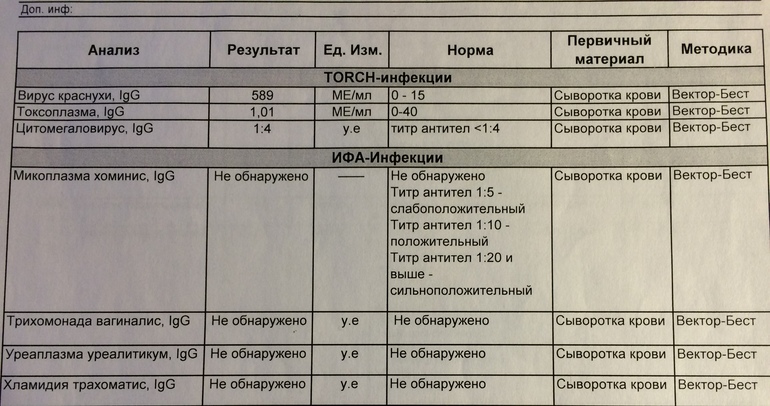 ppat.1000427.s006
ppat.1000427.s006
(0,03 МБ DOC)
Благодарности
Мы благодарны д-ру Цзяньхуа Хуан, д-ру Юйчжэнь Лю, г-же Цзинли Донг и Вудро Вайсу за щедрую помощь в подготовке замороженных срезов тканей аорты и окрашивании гематоксилин-эозином. Мы благодарим Юань Чэн за прекрасную научную поддержку.
Вклад авторов
Идея и разработка экспериментов: JZ CSC. Выполняли эксперименты: JC QK ZJ HW.Проанализированы данные: JC QK ZJ OK JPM JZ CSC. Предоставленные реагенты/материалы/инструменты анализа: JPM. Написал статью: JZ CSC.
Каталожные номера
- 1. Перевал РФ (2001) Цитомегаловирус. В: Knipe DM, Howley PM, редакторы. Вирусология Филдса. Нью-Йорк: Липпинкотт Уильямс и Уилкинс. Том. 2. С. 2675–730.
- 2. Петерслунд Н.А. (1991)Герпесвирусная инфекция: обзор клинических проявлений. Scand J Infect Dis (Приложение) 80: 15–20.
- 3.Takei H, Strong JP, Yutani C, Malcom GT (2005)Сравнение коронарного и аортального атеросклероза у молодежи из Японии и США.
 Атеросклероз 180: 171–179.
Атеросклероз 180: 171–179. - 4. Nascimento MM, Pecoits-Filho R, Lindholm B, Riella MC, Stenvinkel P (2002)Воспаление, недоедание и атеросклероз при терминальной стадии почечной недостаточности: глобальная перспектива. Очищение крови 20: 454–458.
- 5. Cool CD, Rai PR, Yeager ME, Hernandez-Saavedra D, Serls AE и др. (2003)Экспрессия вируса герпеса человека 8 при первичной легочной гипертензии.N Engl J Med 349: 1113–1122.
- 6. Рой В.П., Прабхакар С., Пулвиренти Дж., Мэтью Дж. (1999)Частота и факторы, связанные с кардиомиопатией у пациентов с инфекцией, вызванной вирусом иммунодефицита человека, в городской больнице. J Natl Med Assoc 91: 502–504.
- 7. Weiss JR, Pietra GG, Scharf SM (1995)Первичная легочная гипертензия и вирус иммунодефицита человека. Отчет о двух случаях и обзор литературы. Arch Intern Med 155: 2350–2354.
- 8.Daley E, Emson C, Guignabert C, de Waal Malefyt R, Louten J, et al. (2008)Ремоделирование легочных артерий, вызванное иммунным ответом Th3.
 J Exp Med 205: 361–372.
J Exp Med 205: 361–372. - 9. Grundy JE, Lawson KM, MacCormac LP, Fletcher JM, Yong KL (1998)Инфицированные цитомегаловирусом эндотелиальные клетки рекрутируют нейтрофилы за счет секреции хемокинов CXC и передают вирус путем прямого контакта нейтрофилов с эндотелиальными клетками и во время трансэндотелиальной миграции нейтрофилов. J Infect Dis 177: 1465–1474.
- 10. Grahame-Clarke C, Chan NN, Andrew D, Ridgway GL, Betteridge DJ и др. (2003) Серопозитивность на цитомегаловирус человека связана с нарушением сосудистой функции. Тираж 108: 678–683.
- 11. Валантин Х.А., Гао С.З., Менон С.Г., Ренлунд Д.Г., Хант С.А. и др. (1999) Влияние профилактического ганцикловира сразу после трансплантации на развитие атеросклероза трансплантата: постфактум анализ рандомизированного плацебо-контролируемого исследования. Тираж 100: 61–66.
- 12.
Hsich E, Zhou YF, Paigen B, Johnson TM, Burnett MS, et al. (2001) Цитомегаловирусная инфекция увеличивает развитие атеросклероза у мышей с нокаутом по аполипопротеину-Е.
 Атеросклероз 156: 23–28.
Атеросклероз 156: 23–28. - 13. Zhou YF, Leon MB, Waclawiw MA, Popma JJ, Yu ZX и соавт. (1996) Связь между предшествующей цитомегаловирусной инфекцией и риском рестеноза после коронарной атерэктомии. N Engl J Med 335: 624–630.
- 14. Adler SP, Hur JK, Wang JB, Vetrovec GW (1998) Предшествующая инфекция цитомегаловирусом не является основным фактором риска ангиографически продемонстрированного атеросклероза коронарных артерий.J Infect Dis 177: 209–212.
- 15. Saetta A, Fanourakis G, Agapitos E, Davaris PS (2000)Атеросклероз сонной артерии: отсутствие доказательств участия ЦМВ в образовании атеромы. Сердечно-сосудистый патол. 9: 181–183.
- 16. Stassen FR, Vega-Cordova X, Vliegen I, Bruggeman CA (2006)Иммунная активация после цитомегаловирусной инфекции: важнее прямых вирусных эффектов при сердечно-сосудистых заболеваниях? Дж. Клин Вирол 35: 349–353.
- 17.Даус Х., Озбек С., Сааге Д., Шеллер Б., Шиффер Х.
 и др. (1998) Отсутствие доказательств патогенной роли Chlamydia pneumoniae и цитомегаловирусной инфекции в формировании коронарной атеромы. Кардиология 90: 83–88.
и др. (1998) Отсутствие доказательств патогенной роли Chlamydia pneumoniae и цитомегаловирусной инфекции в формировании коронарной атеромы. Кардиология 90: 83–88. - 18. Смиея М., Гнарпе Дж., Лонн Э., Гнарпе Х., Олссон Г. и др. (2003) Множественные инфекции и последующие сердечно-сосудистые события в исследовании оценки предотвращения сердечных исходов (HOPE). Тираж 107: 251–257.
- 19. Ziemann M, Sedemund-Adib B, Reiland P, Schmucker P, Hennig H (2008)Повышение смертности у пациентов с длительной интенсивной терапией с активной цитомегаловирусной инфекцией.Crit Care Med 36: 3145–3150.
- 20. Кито В., Вуоринен Т., Саукко П., Лаутеншлагер И., Лигниц Э. и др. (2005) Цитомегаловирусная инфекция сердца часто встречается у пациентов с фатальным миокардитом. Clin Infect Dis 40: 683–688.
- 21.
Коулз Б., Филдинг К.А., Роуз-Джон С., Шеллер Дж., Джонс С.А. и соавт. (2007)Классическая передача сигналов рецептора интерлейкина-6 и транс-сигнализация интерлейкина-6 по-разному контролируют ангиотензин II-зависимую гипертензию, преобразователь сердечного сигнала и активатор активации транскрипции-3 и гипертрофию сосудов in vivo.
 Ам Дж. Патол 171: 315–325.
Ам Дж. Патол 171: 315–325. - 22. Manhiani MM, Quigley JE, Socha MJ, Motamed K, Imig JD (2007) Подавление IL6 обеспечивает защиту почек независимо от артериального давления в мышиной модели солечувствительной гипертензии. Пресса для почечной крови, рез. 30: 195–202.
- 23. Шрирамула С., Хак М., Маджид Д.С., Фрэнсис Дж. (2008)Участие фактора некроза опухоли-альфа в опосредованных ангиотензином II эффектах на солевой аппетит, гипертонию и сердечную гипертрофию. Гипертония 51: 1345–1351.
- 24. Хакенталь Э., Пол М., Гантен Д., Таугнер Р. (1990)Морфология, физиология и молекулярная биология секреции ренина. Physiol Rev 70: 1067–1116.
- 25. Hall JE (2003)Историческая перспектива ренин-ангиотензиновой системы. Мол Биотехнолог 24: 27–39.
- 26. Ibrahim MM (2006)Ингибирование RAS при гипертонии. J Hum Hypertens 20: 101–108.
- 27.
Sachetelli S, Liu Q, Zhang SL, Liu F, Hsieh TJ, et al.
 (2006)Блокада РАС снижает кровяное давление и протеинурию у трансгенных мышей с гиперэкспрессией крысиного гена ангиотензиногена в почках.Kidney Int 69: 1016–1023.
(2006)Блокада РАС снижает кровяное давление и протеинурию у трансгенных мышей с гиперэкспрессией крысиного гена ангиотензиногена в почках.Kidney Int 69: 1016–1023. - 28. Chen Y, Ke Q, Xiao YF, Wu G, Kaplan E, et al. (2005)Кокаин и катехоламины усиливают удержание воспалительных клеток в коронарном кровообращении мышей за счет активации молекул адгезии. Am J Physiol Heart Circ Physiol 288: h3323–h3331.
- 29. Ke Q, Yang Y, Rana JS, Chen Y, Morgan JP и др. (2005)Эмбриональные стволовые клетки, культивированные в биоразлагаемом каркасе, восстанавливают инфаркт миокарда у мышей. Шэн Ли Сюэ Бао 57: 673–681.
- 30. Wilde DW, Massey KD, Walker GK, Vollmer A, Grekin RJ (2000)Диета с высоким содержанием жиров повышает кровяное давление и ток Ca(2+) в цереброваскулярных мышцах. Гипертония 35: 832–837.
- 31.
Sipahi I, Tuzcu EM, Schoenhagen P, Wolski KE, Nicholls SJ, et al. (2006) Влияние нормального, предгипертензивного и гипертензивного уровней артериального давления на прогрессирование коронарного атеросклероза.
 J Am Coll Cardiol 48: 833–838.
J Am Coll Cardiol 48: 833–838. - 32. Su TC, Jeng JS, Chien KL, Sung FC, Hsu HC и др.(2001)Статус гипертонии является основной детерминантой атеросклероза сонных артерий: исследование на базе сообщества в Тайване. Инсульт 32: 2265–2271.
- 33. Меллен П.Б., Блейер А.Дж., Эрлингер Т.П., Эванс Г.В., Нието Ф.Дж. и др. (2006)Уровень мочевой кислоты в сыворотке предсказывает возникновение гипертонии в биэтнической когорте: исследование риска атеросклероза в сообществах. Гипертония 48: 1037–1042.
- 34. Marwick C (1991) Национальный глазной институт выпускает клиническое предупреждение о ЦМВ ретините при СПИДе.JAMA 266: 2665.
- 35. Fish KN, Soderberg-Naucler C, Mills LK, Stenglei S, Nelson JA (1998) Цитомегаловирус человека постоянно инфицирует эндотелиальные клетки аорты. Дж. Вирол 72: 5661–5668.
- 36.
Gerna G, Percivalle E, Sarasini A, Revello MG (2002)Цитомегаловирус человека и эндотелиальные клетки пупочной вены человека: ограничение первичной изоляции образцами крови и восприимчивость клинических изолятов из других источников к адаптации.
 J Clin Microbiol 40: 233–238.
J Clin Microbiol 40: 233–238. - 37. Nerheim PL, Meier JL, Vasef MA, Li WG, Hu L, et al. (2004)Усиленная цитомегаловирусная инфекция в атеросклеротических кровеносных сосудах человека. Ам Дж. Патол 164: 589–600.
- 38. Zhang JL, Hanff PA, Rutherford CJ, Churchill WH, Crumpacker CS (1995)Обнаружение ДНК, РНК и антител цитомегаловируса человека в нормальной донорской крови. J Infec Dis 171: 1002–1006.
- 39. Лурейн Н.С., Фокс А.М., Личи Х.М., Бхорад С.М., Уэр С.Ф. и др. (2006) Анализ геномной области цитомегаловируса человека от UL146 до UL147A выявил гипервариабельность последовательности, генотипическую стабильность и перекрывающиеся транскрипты.Вирол Ж 3:4.
- 40.
Лэндри М.Л., Станат С., Бирон К., Брамбилла Д., Бритт В. и др. (2000) Стандартизированный анализ уменьшения бляшек для определения лекарственной чувствительности клинических изолятов цитомегаловируса. Противомикробные агенты Chemother 44: 688–692.

- 41. Коффрон А.Дж., Хаммель М., Паттерсон Б.К., Ян С., Кауфман Д.Б. и др. (1998)Клеточная локализация латентного мышиного цитомегаловируса. Дж. Вирол 72: 95–103.
- 42. Блок М.Дж., Лаутеншлагер И., Гуссенс В.Дж., Мидделдорп Дж.М., Винк С. и др.(2000) Диагностические последствия немедленного раннего обнаружения мРНК цитомегаловируса человека-1 и pp67 в образцах цельной крови пациентов с трансплантацией печени с использованием амплификации на основе последовательности нуклеиновых кислот. J Clin Microbiol 38: 4485–4491.
- 43. Ahn JH, Hayward GS (2000)Разрушение связанных с PML ядерных телец IE1 коррелирует с эффективными ранними стадиями экспрессии вирусных генов и репликации ДНК при цитомегаловирусной инфекции человека. Вирусология 274: 39–55.
Цитомегаловирус (кровь) – AHealthyMe – Blue Cross Blue Shield of Massachusetts
Есть ли у этого теста другие названия?
ЦМВ (сыворотка), серологический тест на цитомегаловирус, антитела к цитомегаловирусу, антитела к ЦМВ, ЦМВ IgG, ЦМВ IgM
Что это за тест?
Этот тест ищет в крови антитела к цитомегаловирусу (ЦМВ), вирусу семейства герпеса.
ЦМВ настолько широко распространен, что большинство людей в США заражаются к тому времени, когда им исполняется 40 лет. Но многие этого не осознают. Вы можете заразиться вирусом при контакте с биологическими жидкостями, такими как слюна, кровь, моча, грудное молоко и сперма, или при обмене ими. Вирус обычно вызывает только легкое заболевание. Но он может нанести серьезный вред нерожденным детям, людям с ВИЧ/СПИДом или людям со слабой иммунной системой.
Антитела — это молекулы для борьбы с микробами, которые ваша иммунная система вырабатывает в ответ на инфекцию.Если в крови есть специфические антитела к ЦМВ, возможно, у вас ЦМВ-инфекция.
Как и другие вирусы семейства герпеса, ЦМВ после первого заражения скрывается в организме и может снова вспыхнуть. Более поздние инфекции, как правило, протекают легче. Фактически, у взрослых со здоровой иммунной системой первая инфекция может не иметь никаких симптомов.
Зачем мне этот тест?
Вам может понадобиться этот тест, если у вас есть необъяснимые симптомы, напоминающие грипп. Если вы заразились вирусом, у вас могут быть следующие признаки и симптомы:
Если вы заразились вирусом, у вас могут быть следующие признаки и симптомы:
Вы также можете пройти этот тест, если вы беременны, инфицированы ВИЧ или являетесь донором или реципиентом трансплантата.Если у вас есть текущая инфекция, ваш лечащий врач может дать вам определенные лекарства для снижения риска врожденного ЦМВ у младенцев или активного заболевания у людей с ослабленной иммунной системой.
Только лабораторный анализ может подтвердить, что у вас ЦМВ.
Какие еще тесты можно пройти вместе с этим тестом?
Ваш лечащий врач может также заказать другие анализы на антитела к ЦМВ. К ним относятся анализы спинномозговой жидкости (ЦСЖ) и мочи. Ваш лечащий врач может также назначить анализы для поиска антигенов ЦМВ, с которыми должны бороться антитела ЦМВ.Тест на антиген ЦМВ может называться анализом на антиген ЦМВ или тестом на антиген ЦМВ. (Ag расшифровывается как антигенемия, что означает наличие антигена в крови.)
Ваш лечащий врач может также назначить тест, называемый полимеразной цепной реакцией (ПЦР), для поиска ДНК ЦМВ в моче, слюне, крови, спинномозговой жидкости или ткани биопсии. Он или она может также заказать тест на вирусную культуру из любого из этих типов образцов.
Он или она может также заказать тест на вирусную культуру из любого из этих типов образцов.
Ваш поставщик медицинских услуг может также заказать:
Он или она может также пройти тест на пневмонию, гепатит и проблемы с желудочно-кишечным трактом.
Что означают результаты моего теста?
Результаты теста могут различаться в зависимости от вашего возраста, пола, истории болезни, метода, использованного для теста, и других факторов. Результаты вашего теста могут не означать, что у вас есть проблема. Спросите своего поставщика медицинских услуг, что результаты ваших анализов означают для вас.
Результаты приведены в количестве двух видов антител: иммуноглобулина М (IgM) и иммуноглобулина G (IgG).
Тест положительный, если присутствуют антитела IgM.Но это означает только то, что вы когда-то в жизни были инфицированы ЦМВ. Когда произошло заражение, не сообщается. Кроме того, если ваши уровни IgM и IgG высоки, это может означать, что у вас ЦМВ. Ваш поставщик медицинских услуг, скорее всего, снова назначит вам тест через 2 недели, чтобы подтвердить инфекцию. Если ваш уровень IgG повышается между первым и вторым тестом, это может означать, что у вас активная инфекция. Тот факт, что ваш уровень IgG увеличивается, важнее, чем количество найденных IgG. Это увеличение показывает, что ваша иммунная система занята борьбой с инфекцией и что антитела не просто остались от более ранней борьбы.
Ваш поставщик медицинских услуг, скорее всего, снова назначит вам тест через 2 недели, чтобы подтвердить инфекцию. Если ваш уровень IgG повышается между первым и вторым тестом, это может означать, что у вас активная инфекция. Тот факт, что ваш уровень IgG увеличивается, важнее, чем количество найденных IgG. Это увеличение показывает, что ваша иммунная система занята борьбой с инфекцией и что антитела не просто остались от более ранней борьбы.
Если ваши результаты выше, это также может означать, что у вас аутоиммунное заболевание соединительной ткани, такое как ревматоидный артрит или системная красная волчанка.
Если ваша иммунная система ослаблена, у вас могут быть более низкие результаты даже при активной инфекции.
Как проводится этот тест?
Тест проводится с образцом крови. Игла используется для забора крови из вены на руке или кисти.
Представляет ли этот тест какие-либо риски?
Анализ крови с помощью иглы сопряжен с определенным риском. К ним относятся кровотечение, инфекция, кровоподтеки и головокружение. Когда игла уколет вашу руку или кисть, вы можете почувствовать легкое жжение или боль. После этого сайт может болеть.
К ним относятся кровотечение, инфекция, кровоподтеки и головокружение. Когда игла уколет вашу руку или кисть, вы можете почувствовать легкое жжение или боль. После этого сайт может болеть.
Что может повлиять на результаты моего теста?
Другие факторы вряд ли повлияют на ваши результаты.
Как мне подготовиться к этому тесту?
Вам не нужно готовиться к этому тесту. Убедитесь, что ваш лечащий врач знает обо всех лекарствах, травах, витаминах и добавках, которые вы принимаете.Это включает в себя лекарства, которые не требуют рецепта, и любые запрещенные наркотики, которые вы можете использовать.
.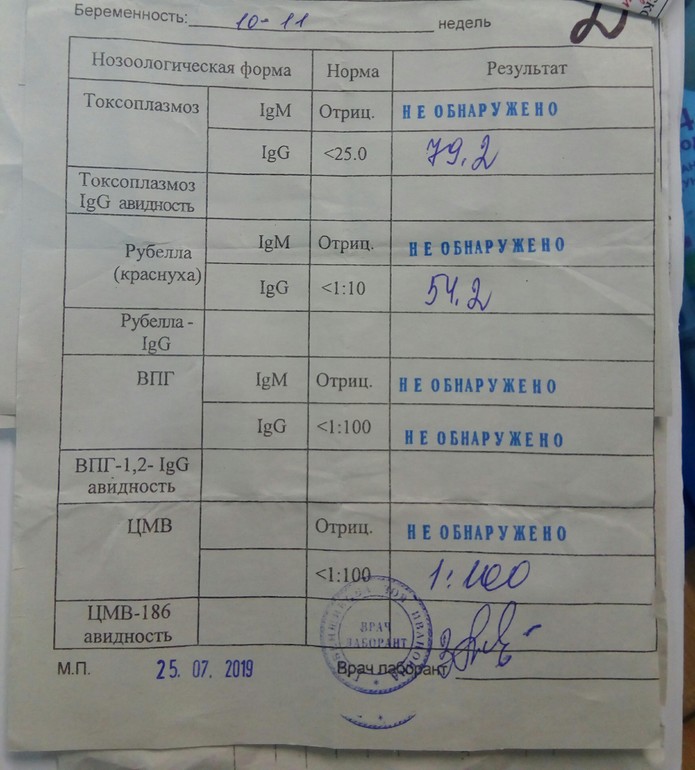




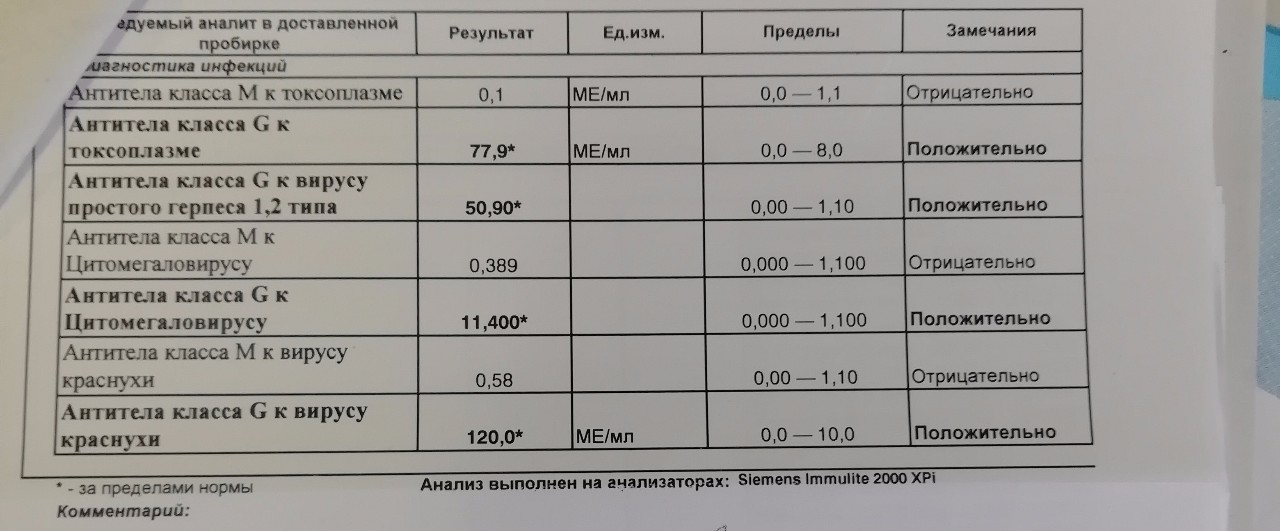
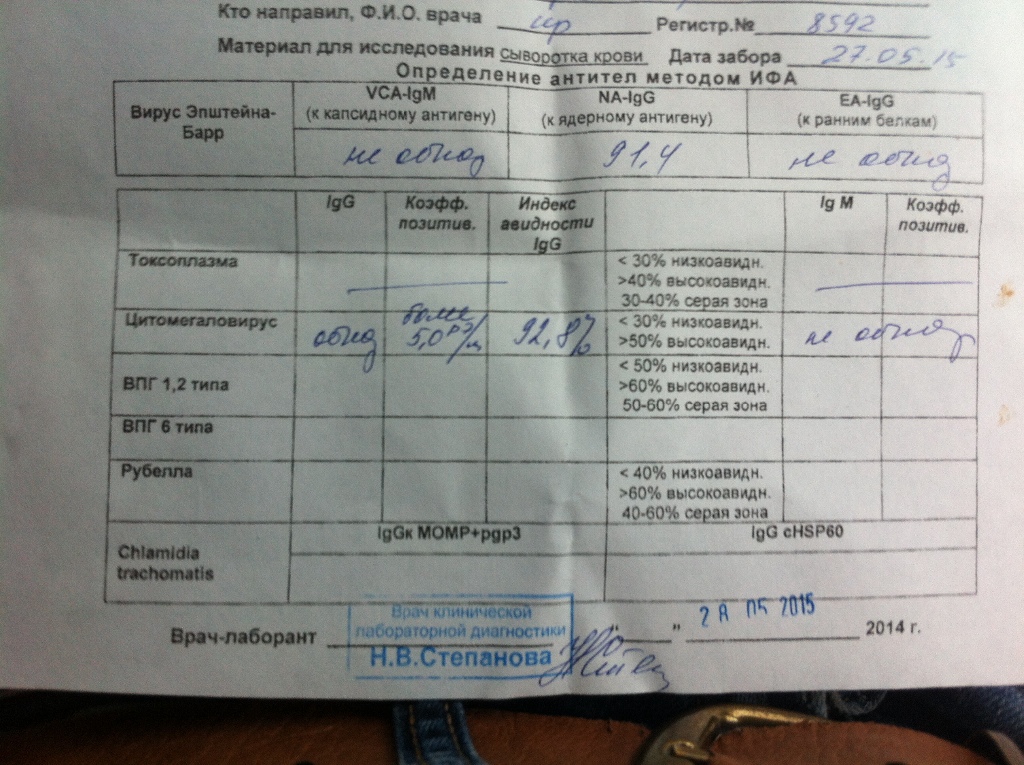
 Атеросклероз 180: 171–179.
Атеросклероз 180: 171–179.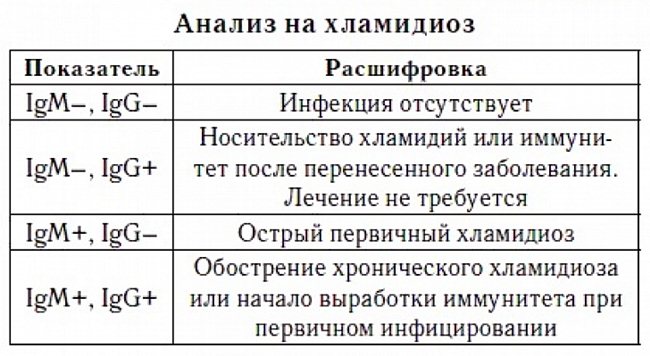 J Exp Med 205: 361–372.
J Exp Med 205: 361–372. Атеросклероз 156: 23–28.
Атеросклероз 156: 23–28. и др. (1998) Отсутствие доказательств патогенной роли Chlamydia pneumoniae и цитомегаловирусной инфекции в формировании коронарной атеромы. Кардиология 90: 83–88.
и др. (1998) Отсутствие доказательств патогенной роли Chlamydia pneumoniae и цитомегаловирусной инфекции в формировании коронарной атеромы. Кардиология 90: 83–88.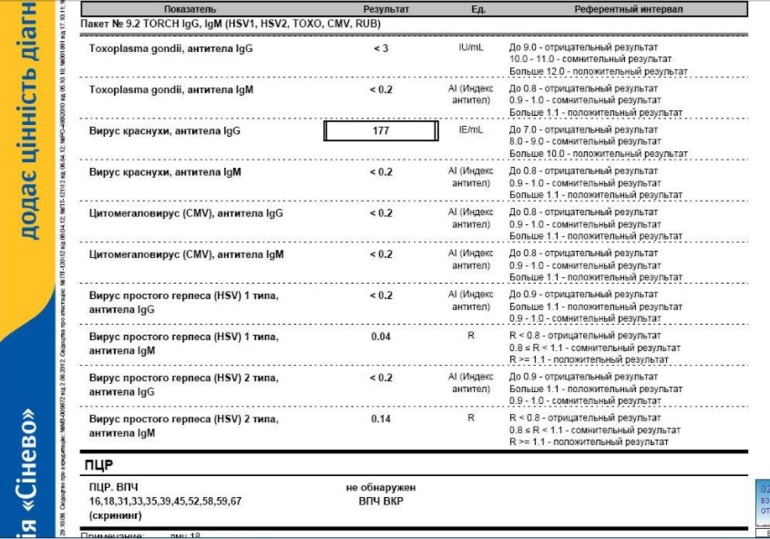 Ам Дж. Патол 171: 315–325.
Ам Дж. Патол 171: 315–325.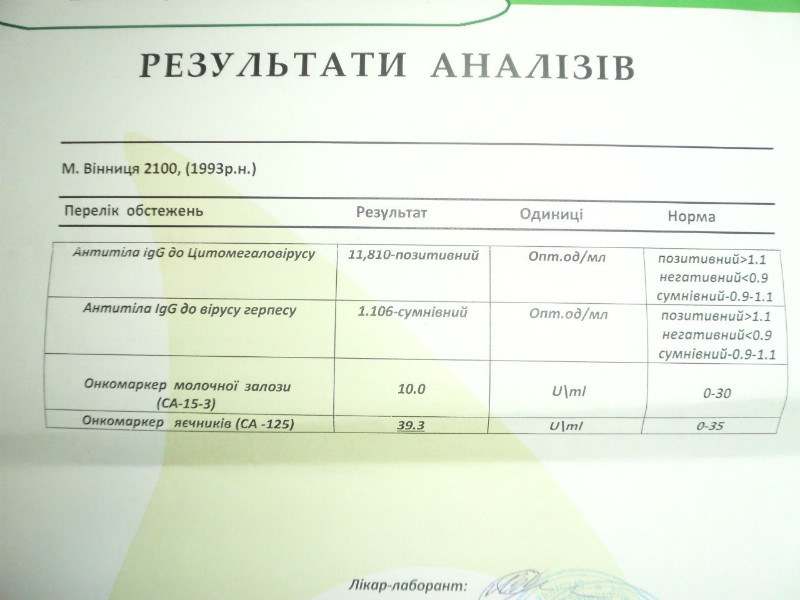 (2006)Блокада РАС снижает кровяное давление и протеинурию у трансгенных мышей с гиперэкспрессией крысиного гена ангиотензиногена в почках.Kidney Int 69: 1016–1023.
(2006)Блокада РАС снижает кровяное давление и протеинурию у трансгенных мышей с гиперэкспрессией крысиного гена ангиотензиногена в почках.Kidney Int 69: 1016–1023. J Am Coll Cardiol 48: 833–838.
J Am Coll Cardiol 48: 833–838. J Clin Microbiol 40: 233–238.
J Clin Microbiol 40: 233–238.