динамика роста хгч по дням — 19 рекомендаций на Babyblog.ru
Забеременев, женщина сдает множество анализов, причем некоторые даже по несколько раз. Это может стать причиной для беспокойства: может быть, что-то не так? Одним из таких анализов, которые, возможно, придется сдавать неоднократно, является анализ ХГЧ при беременности.
Что такое ХГЧ
ХГЧ (хорионический гонадотропин человека) – это гормон, выделяемый хорионом после прикрепления оплодотворенной яйцеклетки к стенке матки. Происходит это практически с момента зачатия, поэтому именно ХГЧ является надежным показателем при ранней диагностике беременности, при условии, что результат анализа является достоверным.
Тогда для чего измеряется уровень ХГЧ при беременности не только в
1-м, но и во 2-м, и даже 3-м триместре? Дело в том, что существуют
определенные нормы показателей ХГЧ в различные периоды беременности,
позволяющие выяснить, нормально ли она протекает и нет ли у плода
каких-нибудь патологий.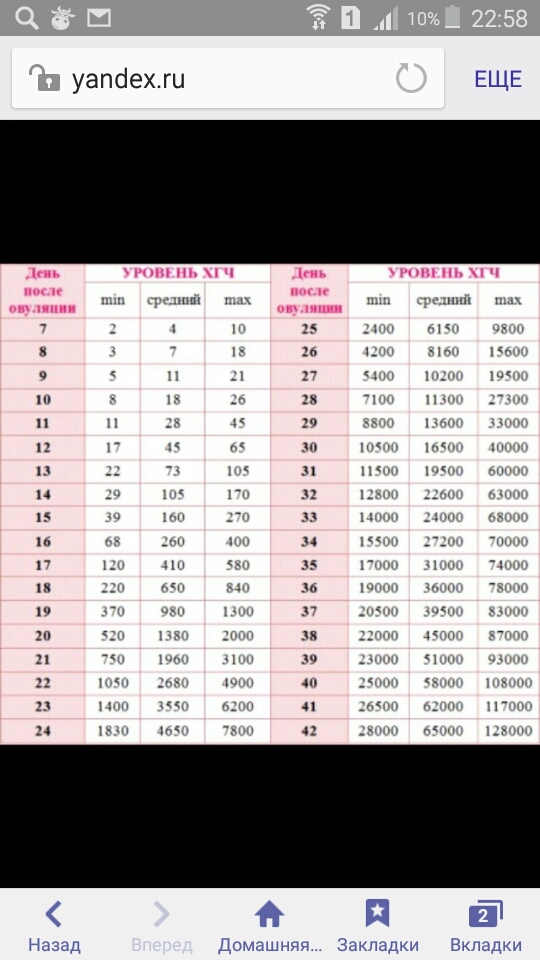
В состав ХГЧ входят альфа- и бета-частицы. Именно бета-единица имеет уникальную структуру, поэтому имеет значение как раз b-ХГЧ при беременности. Данное лабораторное исследование может проводиться уже на 2-3 день задержки менструации, если зачатие произошло, и с этого момента прошло уже 6-10 дней, уровень ХГЧ обязательно будет повышенным. Если нужна более высокая точность, рекомендуется повторение анализа и ультравагинальное УЗИ.
Кстати, домашние экспресс-тесты на беременность (что бы мы без них делали?) тоже основаны на выявлении ХГЧ при беременности, правда, на гормон, содержащийся не в крови, а в моче, где его концентрация вполовину ниже, поэтому и точность такого метода уступает лабораторному обследованию, но все же является достаточно достоверной.
Уровни ХГЧ при беременности
После оплодотворения яйцеклетки ее внешняя мембрана (хорион) начинает
активно выделять гонадотропин, причем очень быстрыми темпами: в 1-м
триместре уровень ХГЧ при беременности каждые 2 дня увеличивается вдвое.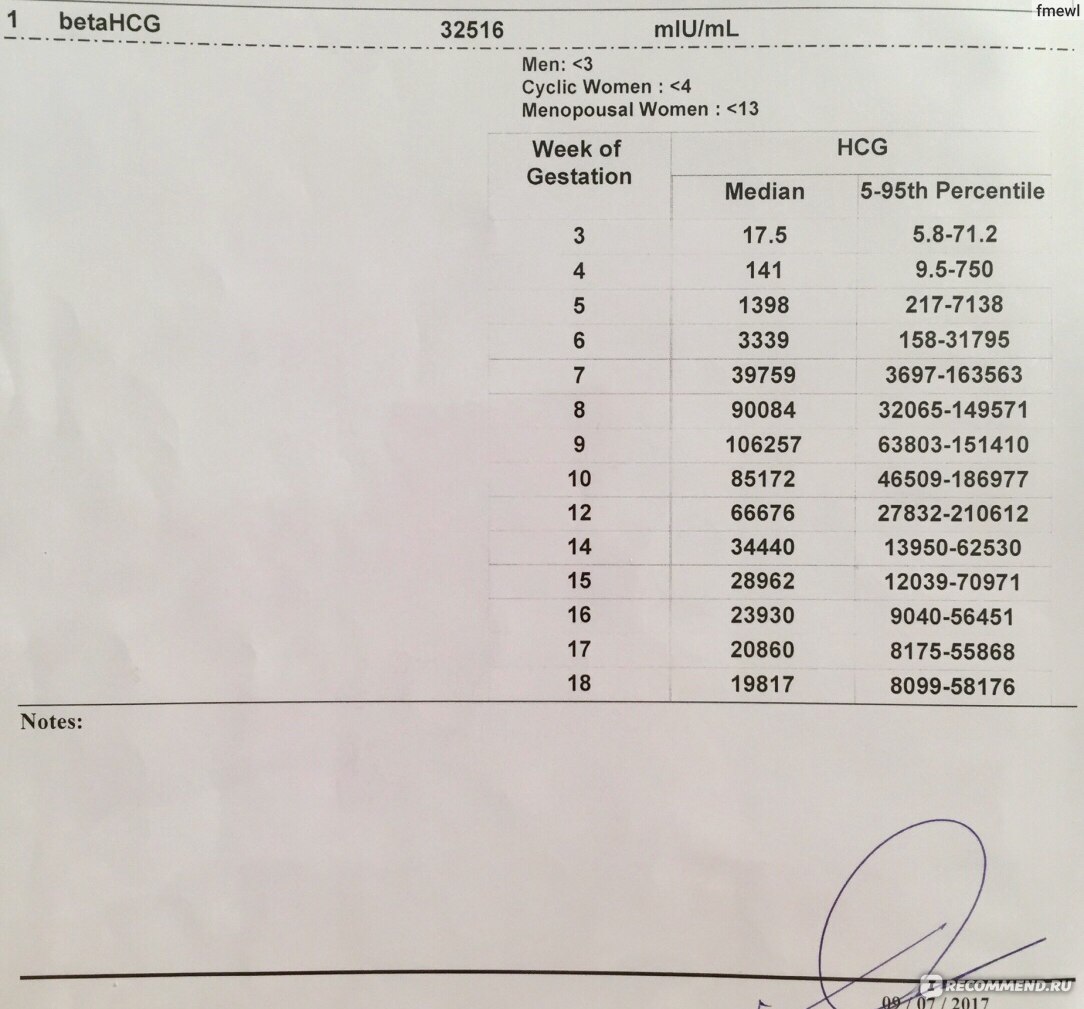 На 7-10 неделе этот показатель достигает своего пика, а потом
постепенно снижается, не изменяясь существенно во 2-й половине
беременности. Вот почему по скорости роста ХГЧ при беременности врачи
могут судить о ее нормальном развитии или отставании. На 14-18 неделе
этот показатель может сигнализировать о развитии патологии. Поэтому
назначая этот анализ повторно, ваш врач просто перестраховывается,
поэтому не пугайтесь.
На 7-10 неделе этот показатель достигает своего пика, а потом
постепенно снижается, не изменяясь существенно во 2-й половине
беременности. Вот почему по скорости роста ХГЧ при беременности врачи
могут судить о ее нормальном развитии или отставании. На 14-18 неделе
этот показатель может сигнализировать о развитии патологии. Поэтому
назначая этот анализ повторно, ваш врач просто перестраховывается,
поэтому не пугайтесь.
Что же касается норм ХГЧ, то это весьма относительное понятие. Дело в том, что практически в каждой лаборатории установлены свои нормы. Для примера приведем таблицу норм ХГЧ, она поможет вам приблизительно сориентироваться в этом вопросе. Однако помните, что решающие слово о соответствии или отклонениях от нормы ваших анализов, может сказать только квалифицированный специалист.
Нормы уровня ХГЧ по дням после овуляции
Отклонения от нормы ХГЧ при беременности
А что, если анализ ХГЧ при беременности показал некое отклонение от
нормы в ту или иную сторону? Конечно, это не слишком хорошо — и
повышенный, и пониженный показатель должен насторожить, ведь все это
свидетельствует о каких-то проблемах и осложнениях в организме женщины.
Слишком высокий уровень ХГЧ при беременности – это, в лучшем случае, показатель многоплодной беременности: обычно уровень гормона в крови увеличивается пропорционально количеству эмбрионов.
Кроме того, уровень ХГЧ выше нормы может указывать на следующие патологии:
- токсикоз;
- гестоз;
- аномалии развития плода, например, синдром Дауна;
- перенашивание беременности.
Уровень ХГЧ может повыситься, если будущая мать страдает сахарным диабетом и принимает синтетические гестагены.
Ложноположительный результат анализа ХГЧ
Если выясняется, что вы не беременны, а уровень ХГЧ высок (ложноположительный результат анализа), возможно, на него повлиял один из следующих факторов:
- прием некоторых гормональных препаратов, в том числе оральных контрацептивов;
- остаточное явление после предыдущей беременности или аборта;
- хорионкарцинома;
- пузырный занос или его рецидив;
- опухоль яичников, матки, почек, легких.

В любом случае это – повод для обращения к врачу.
Пониженный ХГЧ при беременности может свидетельствовать о внематочной беременности, об угрозе выкидыша, перенашивании. Также это может являться симптомом такого неприятного явления, как хроническая плацентарная недостаточность.
ХГЧ при замершей беременности
Также уровень ХГЧ падает при замершей беременности. Замершая или регрессирующая беременность — это случай, когда плод по тем или иным причинам погиб. Гормон перестает вырабатываться, и анализ показывает падение уровня ХГЧ. Обычно при подозрении на замершую беременность проводится исследования в динамике, то есть анализы сдаются несколько раз, а врач наглядно может определить, как изменяется уровень гормона в крови.
Однако не спешите паниковать – возможно, показатели ХГЧ выходят за
пределы нормы для вашего срока беременности лишь потому, что он был
установлен неправильно. Такое случается, поэтому для определения
регрессирующей беременности назначается УЗИ, только не его основе
выносится окончательное заключение. Кроме того, известны случаи, когда
при замершей беременности ХГЧ растет, хотя другие признаки уже сошли на
нет. Подробнее о замершей беременности→
Кроме того, известны случаи, когда
при замершей беременности ХГЧ растет, хотя другие признаки уже сошли на
нет. Подробнее о замершей беременности→
Иногда результаты анализа показывают ХГЧ 0 (отрицательный) при беременности, скорее всего – это тоже ошибка и вам нужно будет сделать анализ повторно.
Как сдавать анализ на ХГЧ
Для того чтобы анализ был максимально точным и достоверным, его нужно правильно сдать. О том, как подготовиться к этому, вам сообщит ваш врач, но знайте, что анализ на содержание в крови b-ХГЧ при беременности сдается натощак. Чаще всего рекомендуют делать это утром, но можно и в другое время суток – при условии, что до этого вы ничего не ели в течение 4-6 часов.
Кровь сдается из вены. За день до этого исключите физические нагрузки
– так результат будет более достоверным. Важный момент — если вы
принимаете гормональные препараты, они обязательно повлияют на результат
анализа, поэтому не забудьте сообщить об этом сотруднику лаборатории,
где вы будете сдавать кровь.
В любом случае, даже если результаты анализа на ХГЧ настораживают вас, не спешите паниковать, не делайте далеко идущих выводов – правильно интерпретировать показатели может только врач, который расскажет вам, что делать дальше и, возможно, назначит повторный анализ.
динамика роста хгч — 25 рекомендаций на Babyblog.ru
Я не паникую … Ну, чуток может)
********************************************************************************************
ПРИМЕЧАНИЕ: посадка 2 эмбрионов 3-ёх дневок
ДИНАМИКА РОСТА ХГЧ (в МЕ/л):
9 ДПП, только тест — вторая полоска еле-еле заметный призрак, ее видела только я), ТТ=37,3
10 ДПП = 22,6 (11.06.2014), тест — электронный с высокой чувствительностью — положительный результат «1-2 недели»
11 ДПП = 70,1 (12.06.2014), тест — вторая полоска уже более выраженная, ТТ =37,1
12 ДПП = 117 (13.06.2014), тест — вторая прекрасно просматривается
14 ДПП = 304,2 (15.
16 ДПП = 680,7 (17.06.2014), тест — очень даже беременный (уже 2 дня задержки получается), ТТ=37,1
18 ДПП = 1908,5 :-)) (19.06.2014), ТТ=37,2
20 ДПП = 4854,2 (21.06.2014), ТТ=37,2
22 ДПП = 8492 (23.06.2014), ТТ=37,3
23 ДПП — УЗИ, Беременность маточная, 1 ПЯ 8мм, ЖМ 2,5 мм
Дальше сдавала по инерции.. пока не остановиться
Первоначально для удвоения уровня ХГЧ требуется всего 2 дня. Начиная с 5-6 недели этот показатель уже равен 3 дням, в 7-8 недель — 4 дня. К сроку 9-10 недель концентрация ХГЧ достигает своего пика и в дальнейшем несколько снижается, достигая к 16 неделям нормы для 6-7 недели. Во второй половине беременности динамика уровеня ХГЧ по неделям не подвержена резким колебаниям: все оставшееся время его показатель составляет всего порядка 10% от своего максимума в 10 недель, слегка увеличиваясь накануне родов.
Сегодня у меня уже 5 недель и 4 дня (24 ДПП) и вот мой ХГЧ (действительно замедлил свой рост, как и полагается на 5-6 неделе).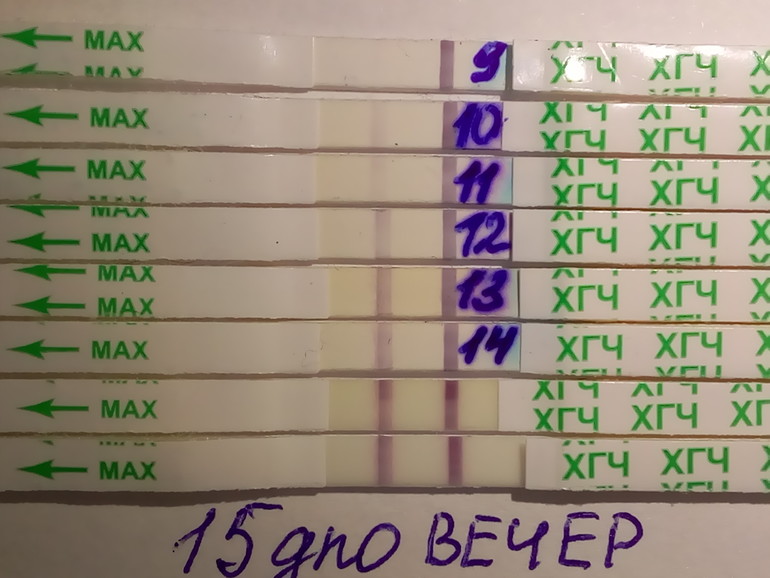 ..
..
24 ДПП = 12844,5 (25.06.2014), ТТ=36,9, БТ= 37,3
27 ДПП = 26070,0 (28.06.2014), ТТ=37,1, БТ= 37,1
30 ДПП = 44067,8 (01.07.2014), ТТ=37,2, БТ= 37,5
33 ДПП = 65161,8 (04.07.2014), ТТ=37,0, БТ= 37,0
ХГЧ замедлился.. Блин. Теперь мне страшно стало.
Но ведь он и должен уже замедляться в росте…на таких сроках! Поэтому, приняла решение, чтобы больше не трепать себе нервы, больше не буду сдавать. А если и буду — на динамику смотреть не буду, буду просто ориентироваться на нормы лаборатории! Вот.
Растут малыши Растет малышка)
Определение уровня ХГЧ (Хорионического Гонадотропина Человека) при беременности. — «Сначала рост ХГЧ как по учебнику, а вот потом… Что будет, если динамика роста ХГЧ и сам показатель перестали соответствовать норме? Личный опыт»
Свою вторую беременность планировала от и до — прием витаминов, продвинутые тесты на овуляцию, ну и конечно, отслеживание наступившей беременности с помощью сдачи анализа на ХГЧ.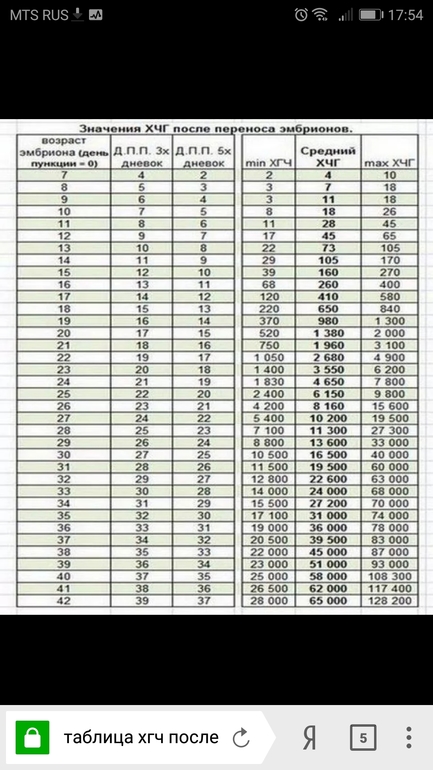
Что такое ХГЧ и для чего его сдавать.
Гормон ХГЧ (Хорионический Гонадотропин Человека) начинает вырабатываться уже на 6-10 день после оплодотворения яйцеклетки. В первые недели уровень ХГЧ должен удваиваться примерно каждые 2 дня, по мере увеличения срока беременности скорость его роста замедляется.
ХГЧ __________ ДПО__________ Время удвоения
< 1200 <21 дпо 2-3 дня (48-72 часов)
1200-6000 21-28 дпо 3-4 дня (72-96 часов)
> 6000 >28 дпо более 4 дней (96 часов)
ДПО — дней после овуляции.
Концентрация ХГЧ достигает максимума на 9-11 неделях беременности, затем уровень ХГЧ начинает медленно снижаться.
До девятого дня после овуляции (ДПО) я баловалась тестами, разглядывая призраки второй полоски.
И вот, на 10й ДПО побежала в клинику сдавать анализ на ХГЧ и прогестерон:
- 10 ДПО: ХГЧ 20, прогестерон 87.

«Документальное» подтверждение было получено и дальше я стала раз в несколько дней мониторить ХГЧ. Боялась внематочной. Через 4 дня сдала ещё раз ХГЧ и прогестерон:
- 14 ДПО: ХГЧ 172, прогестерон 105. Динамика роста ХГЧ:
Но как же тут успокоишься, беременные поймут
- 18 ДПО: ХГЧ 907, прогестерон не сдавала. Динамика роста ХГЧ:
Действительно, надо успокоиться. Растёт и растёт.
- 23 ДПО: ХГЧ 4380, прогестерон не сдавала. Динамика роста ХГЧ:
Отлично, все в норме. К гинекологу решила идти в 7 акушерских недель, чтобы уже было слышно сердце на УЗИ.
К гинекологу решила идти в 7 акушерских недель, чтобы уже было слышно сердце на УЗИ.
- 29 ДПО: ХГЧ 15487, прогестерон не сдавала. Динамика роста ХГЧ:
Ну, прям как по учебнику.
В 7 акушерских недель, решила сдать опять прогестерон, исключительно потому, что шла к гинекологу и хотела показать свежую цифру. Была уверена что все ок.
И тут…
- 35 ДПО: ХГЧ 28712, прогестерон… 53 . Динамика роста ХГЧ:
Гинеколог, увидав анализы, запихала меня с порога под аппарат УЗИ. Сердцебиение есть, отслойки нет, выдыхаем немного. Но, естественно, угроза. Отказалась от госпитализации, получила двухнедельный больничный, курс папаверина и начать дюфастон.
Через неделю решила глянуть, как там дела.
- 42 ДПО: ХГЧ 42371, прогестерон 59. Динамика роста ХГЧ:
Ну все, приехали. ХГЧ вообще замедлился, опять ниже норм. Прогестерон чуть лучше, правда.
По этой таблице видно, в какой момент все пошло не так — переломной оказалась 7 акушерская неделя:
- 49 ДПО: ХГЧ 48696, прогестерон 60. Динамика роста ХГЧ:
Это было ровно 9 акушерских недель, и последняя сдача анализов. В этот же день пошла на внеплановое УЗИ. Желточный мешочек меньше нормы, в остальном все хорошо — сердцебиение на месте, отслойки нет.
Решила больше не мотать себе нервы замедлением и падением всего на свете и просто ждать, скрестив всё что можно, первого УЗИ скрининга и биопсии хориона.
Первое УЗИ прошло без замечаний, предположили пол, который в дальнейшем подтвердился.
Ну, а результат замедленного ХГЧ и рухнувшего прогестерона сидит у меня на коленях и выпрашивает пельмени из маминой тарелки
В случае с отклонением ХГЧ не нужно отчаиваться, при этом обязательно обращение к неравнодушному врачу. Исход беременности может быть благополучным и вне определённой статистики, рамок и калькуляторов.
Исход беременности может быть благополучным и вне определённой статистики, рамок и калькуляторов.
Сдачу анализа на определение уровня ХГЧ однозначно рекомендую, главное не впадать в панику от цифр. Для тех, кто любит держать всё на контроле.
●•●•●•●•●•●•●•●• С уважением, Lisiya ●•●•●•●•●•●•●•●•
Калькулятор ХГЧ при беременности онлайн
Калькулятор ХГЧ используется для расчета прироста ХГЧ (разница между двумя анализами, сданными в разное время).
Прирост ХГЧ важен для оценки развития беременности. В норме на ранних сроках беременности ХГЧ увеличивается примерно в 2 раза каждые двое суток. По мере увеличения уровня гормона скорость увеличения снижается.
Для чего нужен калькулятор ХГЧ
Калькулятор ХГЧ используется для расчета прироста ХГЧ (разница между двумя анализами, сданными в разное время).
Прирост ХГЧ важен для оценки развития беременности. В норме на ранних сроках беременности ХГЧ увеличивается примерно в 2 раза каждые двое суток. По мере увеличения уровня гормона скорость увеличения снижается.
В норме на ранних сроках беременности ХГЧ увеличивается примерно в 2 раза каждые двое суток. По мере увеличения уровня гормона скорость увеличения снижается.
Как использовать калькулятор
Для расчета увеличения ХГЧ введите первое и второе значение ХГЧ, количество дней после овуляции и количество часов между двумя анализами.
Калькулятор посчитает разницу между двумя анализами, время удвоения ХГЧ и возрастание уровня гормона за двое суток.
На графике Вы увидите возможные (минимальное, среднее и максимальное) значения для Вашего срока от овуляции и свои значения ХГЧ. В норме уровень ХГЧ должен находится между верхней и нижней частями графика.
КАЛЬКУЛЯТОР
Нормальное время удвоения ХГЧ
| Уровень ХГЧ | Время удвоения |
| 1200 мМЕ/мл | 36-72 часа |
| 1200 – 6000 мМЕ/мл | 72-96 часов |
| Больше 6000 мМЕ/мл | Более 96 часов |
Что делать, если уровень ХГЧ очень высокий или низкий, или прирост ХГЧ недостаточный?
Высокое значение ХГЧ может быть связано с ошибкой в оценке срока беременности, проблемами в течении беременности, многоплодностью.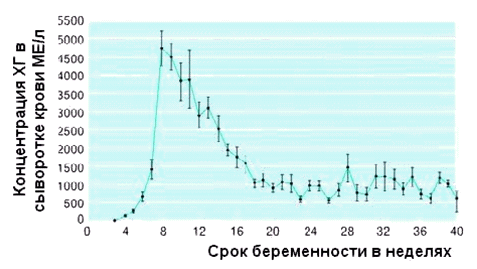
Недостаточный рост ХГЧ может говорить о неблагополучном развитии беременности.
После анализов для определения плана обследования необходимо обратиться к врачу.
Читать больше про нормы ХГЧ
Записаться на консультацию акушера-гинеколога
Рост ХГЧ на ранних сроках беременности: динамика
ХГЧ-хорионический гонадотропин. Это гормон, который начинает вырабатываться с того момента, как начинает делиться зигота (оплодотворенная яйцеклетка).
Роль гормона заключается в сцеплении зародыша со стенкой матки, после оплодотворения сперматозоидом. Очень важно держать под контролем и отслеживать колебания концентрации гормона в крови и динамику его изменений, так как от него зависит дальнейшее развитие беременности и ее исход.
Хорионический гонадотропин на ранних сроках беременности отвечает за выработку женского гормона, который будет катализировать беременность на протяжении 9 месяцев. На более поздних сроках этот гормон будет влиять на формирование пола будущего ребенка, а также выработку гормонов в плаценте.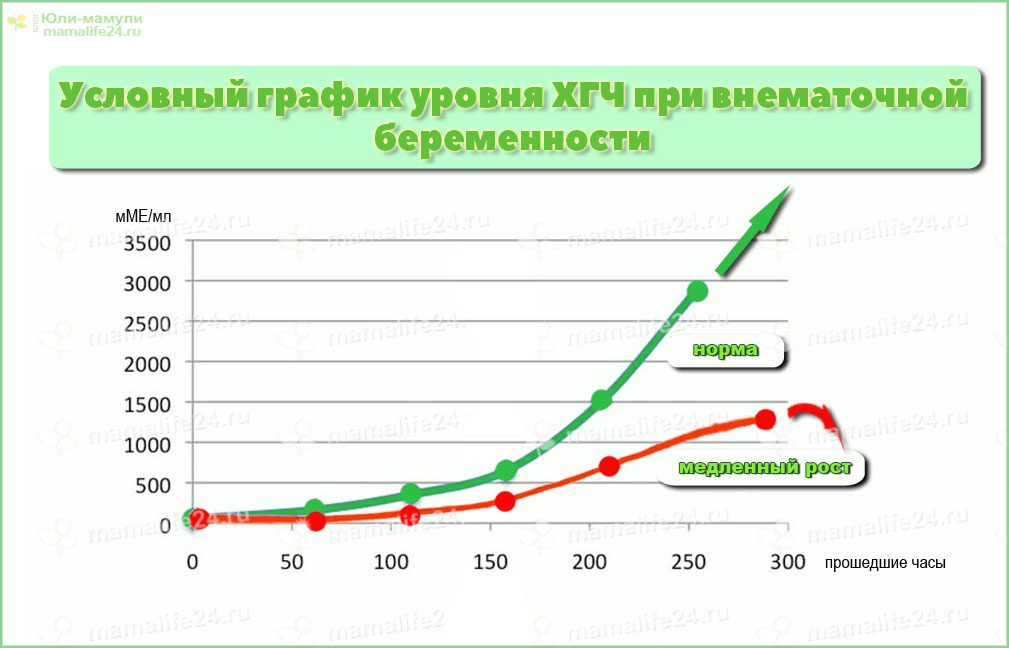
Наиболее важно отслеживать уровень бета-ХГЧ, так как на ранних сроках можно выявить отклонения у эмбриона. ХГЧ также является показателем беременности, когда на тесте появляется вторая полоска.
В клинических условиях тест на ХГЧ отлеживается через взятую венозную кровь. Так как концентрация гормона в крови выше, чем в моче, лабораторные анализы обычно показывают более точный результат.
Стоит заметить, что ХГЧ может вырабатываться в незначительном количестве в организме небеременных женщин и даже мужчин (в среднем показатель 10 МЕ/л).
ХГЧ при беременности
С момента зачатия уровень гормона в крови повышается в два раза и продолжает расти каждые двое суток. Такой темп сохраняется на протяжении 7 недель, к 10-11 неделе ХГЧ достигает наивысшего показателя, а затем начинает спадать и остается неизменным до конца беременности.
В течение всей беременности необходимо отслеживать уровень гормона в крови, так как резкое уменьшение или повышение его концентрации может указывать на наличие патологии.
Во время сдачи анализов необходимо установить точную дату зачатия, иначе показания могут иметь большие отклонения. В этом случае тест будет ошибочным.
Обычно соотношение ведется относительно среднего значения (0,5-2 МЕ/л). Если его концентрация превышает значение в 2 или 3 раза, то есть большая вероятность того, что потомство в 2 или 3 раза будет больше.
Низкий уровень ХГЧ
Низкий уровень гормона в крови беременной женщины может указывать на проблемы, возникшие на момент овуляции. Резкое понижение гормона может означать внутриутробную гибель плода, прерванную беременность (или же “замершую”, когда клетки хориона перестают вырабатывать ткани), выкидыш, а также внематочную беременность, при которой уровень гормона будет повышаться медленнее или же начнет вообще понижаться.
Заниженный уровень ХГЧ может проявляться у больных диабетом.
Высокий уровень хорионического гонадотропина
Уровень гормона будет повышаться с течением беременности, но слишком высокий уровень (выше допустимой нормы) может свидетельствовать о возможных патологиях у зародыша и сказаться как на здоровье матери, так и на здоровье плода.
- В случае, если оплодотворение было искусственным, уровень ХГЧ может изначально быть повышен. Высокая концентрация гормона в крови может свидетельствовать об образовании пузырного заноса (яйцеклетка оплодотворяется двумя сперматозоидами. В этом случае плод является нежизнеспособным).
- Хорионический гонадотропин может быть маркером развития злокачественных образований у людей любого пола, так как его уровень тоже будет повышен.
К сожалению, изменения уровня ХГЧ не смогут указать на точный диагноз, однако с высокой точностью помогут определить категорию риска у матери и будущего ребенка.
Для того, чтобы избежать негативных последствий не стоит пренебрегать плановыми обследованиями у специалиста. Для того, чтобы все было в порядке рекомендуется делать регулярные анализы крови и отслеживать динамику изменений уровня гормона.
Поделиться ссылкой:
Что означает низкий ХГЧ. Беременность и низкий ХГЧ
ХГЧ и его функции
ХГЧ часто называют гормоном беременности, так как он появляется только после успешной имплантации оплодотворенной яйцеклетки и вырабатывается хорионом, а точнее его трофобластом (предшественником плаценты). Уровень ХГЧ является важным показателем, указывающим на течение беременности и развитие плода.
Непосредственно после зачатия зародыш представляет собой небольшой пузырек, стенки которого включают активно размножающиеся клетки. Часть из них в дальнейшем формирует эмбрион, а другая трофобласт, который развивается в хорион (оболочку зародыша) и потом в плаценту.
Хорион после успешной имплантации зародыша в эндометрий начинает синтезировать ХГЧ, влияющий на организм женщины и плода. ХГЧ во время беременности необходим для создания благополучных условий развития плода, формирования плаценты, активации желтого тела, отвечающего за синтез прогестерона. Стоит отметить, что именно прогестерон поддерживает оптимальное состояние эндометрия, обеспечивает прочную фиксацию зародыша и его питание. В норме при отсутствии оплодотворения желтое тело подвергается обратному развитию и рассасывается, но ХГЧ способствует его сохранению и стимулирует его работоспособность.
Поэтому высокий и низкий ХГЧ являются одними из признаков развития патологии беременности, позволяющих выявить ее на ранних сроках и предотвратить формирование негативных последствий, в частности гибель плода.
Нормы ХГЧ
ХГЧ определяется в крови на 6-8 сутки после успешной имплантации зародыша. Нормы ХГЧ довольно условны и зависят не только от срока беременности, но и количества плодов, приема лекарственных препаратов, методик выявления гормона, оснащенности лаборатории и других факторов. Поэтому в каждой лаборатории для расшифровки результатов представляют свои таблицы. К тому же рекомендуется проводить анализ на ХГЧ в одной и той же лаборатории для получения достоверных и правдивых данных.
Первый анализ на ХГЧ проводится для выявления факта наступления беременности. Его можно провести в домашних условиях при помощи экспресс тестов. Конечно, в моче ХГЧ появляется позднее, чем в крови, но этот простой метод диагностики доступен многим женщинам и эффективен в 98% случаев. При этом при помощи экспресс теста можно заподозрить низкий ХГЧ – полоска будет неяркая и слабовыраженная. Уровень гормона также можно определить, сдав анализ крови – это самый точный метод диагностики.
Второй анализ проводится на 10-12 неделе беременности одновременно с УЗИ. Именно в этот период определяется максимально высокий уровень ХГЧ в крови. При получении плохих результатов исследование повторяют, иногда анализ назначают вплоть до самых родов.
Стоит отметить, что важен не только уровень ХГЧ, но и степень его прироста. Ведь в первом триместре его концентрация удваивается каждые 2-3 дня, достигая максимума на 10-12 неделе. Поэтому для выявления патологических состояний нередко назначают анализы с интервалом в 2-3 суток.
Низкий ХГЧ
Низкий ХГЧ – показатель, который выявляется при различных патологиях беременности и плода. Хотя стоит отметить, что не исключаются ложноотрицательные результаты, полученные в результате неправильно поставленного срока гестации или же лабораторных ошибок.
Низкий ХГЧ обусловлен неполноценностью хориона, снижением его функциональности, гормональными нарушениями матери и плода, отслойкой плаценты, неправильным прикреплением зародыша и другими причинами.
Низкий ХГЧ выявляется при следующих состояниях:
- Внематочная беременность;
- Замершая беременность;
- Задержка внутриутробного развития плода;
- Угроза выкидыша;
- Гибель плода;
- Хроническая плацентарная недостаточность;
- Перенашивание беременности;
- Проблемы имплантации после ЭКО (экстракорпорального оплодотворения).
Но данные хорионического гонадотропина не могут служить причиной постановки неутешительного диагноза, при получении негативных результатов следует пройти дополнительные методы обследования для уточнения и выявления патологии.
Низкий ХГЧ и замершая беременность
Замершая беременность – это прекращение развития и формирования плода, заканчивающееся его смертью. Выявить патологию на раннем сроке довольно сложно, так как симптомы гибели зародыша появляются спустя несколько недель. Но низкий ХГЧ позволяет заподозрить замершую беременность и предотвратить развитие грозных осложнений. После получения данных анализа необходимо провести повторные исследования для определения динамики роста ХГЧ.
При нормальной беременности наблюдается активный рост показателей ХГЧ, но при замершей он не характерен, нередко уровень гормона может стать меньше первоначальных данных. Не исключается незначительный рост концентрации ХГЧ, но прирост уровня минимальный и отличается от нормы. Конечно, нельзя точно сказать значения гормона, свидетельствующего о патологии, так как каждая женщина индивидуальна.
Низкий ХГЧ и внематочная беременность
Внематочная беременность – это патология, при которой зародыш прикрепляется вне полости матки: в маточных трубах, в области шейки или брюшной полости. Низкий ХГЧ при внематочной беременности выявляется после сдачи первого анализа на гормоны, в том числе после экспресс теста. Сниженный уровень ХГЧ при этой патологии обусловлен неполноценным функционированием хориона. Это связано с тем, что адекватно выполнять свою работу он может только после прикрепления к эндометрию, в других частях недостаточно питания и отсутствуют нормальные условия, поэтому хорион становится слабым и вырабатывает низкий ХГЧ.
Динамика роста гормона во время внематочной беременности также отрицательная, хотя по некоторым данным, низкие показатели ХГЧ и его прирост могут определяться во время нормальной беременности. Поэтому основанием для постановки диагноза служит проведение дополнительных методов диагностики, в частности УЗИ.
Низкий ХГЧ, задержка развития плода и плацентарная недостаточность
Задержка развития плода – это снижение веса и размеров ребенка. Низкий ХГЧ – это неспецифический маркер патологии, поэтому обязательно проводят другие методы обследования. Но стоит отметить, что предшествует этому состоянию плацентарная недостаточность, которая вызывает гипоксию плода, нарушение питания и кровоснабжения и другие негативные реакции.
Так как при плацентарной недостаточности снижаются все функции защитной оболочки, то уменьшается и синтез ХГЧ. Поэтому на основании полученных данных можно заподозрить эту патологию. При этом при ее начальных стадиях диагностическое значение имеет снижение не только ХГЧ, но и прогестерона и пролактина.
Низкий ХГЧ при перенашивании беременности тоже связан с недостаточностью плаценты, так как непосредственно перед родами начинается снижаться функциональность плаценты, она стареет, следовательно, вырабатывается меньшее количество ХГЧ.
Низкий ХГЧ, угроза выкидыша и генетические аномалии
Угроза выкидыша может быть связана с недостаточностью плаценты, ненадежной имплантацией плодной яйца, отслоением хориона, неправильным местом его прикрепления и другими состояниями. Большинство из них приводит к уменьшению функциональности хориона и плаценты, которые заканчиваются уменьшением синтеза ХГЧ.
ХГЧ может выступать как маркер генетических аномалий. Часто подобные заболевания вызывают резкий рост уровня ХГЧ, но возможно его снижение, в частности при синдроме Эдвардса и Патау. В этих случаях необходима консультация генетика.
Низкий ХГЧ и нормальная беременность
Иногда низкий ХГЧ может соответствовать нормальной беременности, поэтому не стоит пугаться результатов анализов, но и оставлять все без контроля врача также не надо. Сниженные значения ХГЧ могут быть вызваны неправильным сроком беременности, а незначительный прирост концентрации появится из-за индивидуальных особенностей организма. В некоторых ситуациях низкий ХГЧ обусловлен недостаточностью секреторной функции хориона. Для коррекции этого состояния назначают прием хорионического гонадотропина в виде лекарственного препарата.
На основании многочисленных исследований специалисты выявили, что в среднем прирост ХГЧ за два дня должен равняться 66%. Но при этом в 15% случаев рост концентрации на меньшее значение наблюдался при нормальной беременности. Ученые доказали, что даже при росте ХГЧ на 53% не исключается полноценное формирование и вынашивание плода, а избыточный рост может формироваться и при патологических состояниях.
Сдать анализы на ХГЧ и провести другие исследования при лечении бесплодия можно в клинике «Центр ЭКО» в Смоленске.
Калькулятор ХГЧ онлайн при беременности в динамике: показатели, расшифровка
Результат программы ЭКО оценивается на основании анализа крови на уровень ХГЧ и УЗИ органов малого таза, в ходе которого в полости матки визуализируется плодное яйцо.
Хорионический гонадотропин человека – гормон, который продуцируется внешней оболочкой эмбриона и выявляется в крови и моче будущей мамы, а также в амниотической жидкости.
Используя онлайн-калькулятор, вы сможете самостоятельно оценить, как развивается беременность. Чтобы получить результат, введите данные тестов на ХГЧ, а также укажите, на какой день после переноса эмбрионов было проведено первое исследование и сколько часов прошло между двумя анализами.
Посчитать Обнулить
Беременность и ХГЧ
ХГЧ необходим для нормального развития беременности. Гормон поддерживает функционирование желтого тела, стимулирует продукцию эстрогенов и прогестерона, принимает участие в формировании половых желез будущего ребенка, а также способствует снижению иммунитета женщины (это нужно, чтобы не произошло отторжения плода).
Калькулятор уровня ХГЧ, размещенный на этой странице, поможет:
- выяснить, наступила ли беременность;
- определить срок гестации;
- оценить, как развивается беременность, на основании увеличения показателей гормона;
- выявить аномалии развития плода, исходя из оценки уровня ХГЧ по неделям.
Отдельно следует отметить, что повышение уровня хорионического гонадотропина возможно вне периода беременности и в этом случае свидетельствует о различных патологиях (в большинстве случаев о наличии злокачественного новообразования).
Показатели и расшифровка
Гормон начинает вырабатываться, как только эмбрион имплантируется в стенку матки, то есть примерно на 5-7 сутки после оплодотворения яйцеклетки сперматозоидом. Анализ на ХГЧ в программе ЭКО сдают спустя 10-14 суток после переноса.
Изменение уровня ХГЧ у беременных женщин по неделям:
| Гестационная неделя | Диапазон нормы (мЕд/мл) |
| 1 | 20 — 150 |
| 2-3 | 100 — 4 870 |
| 4 | 2 500 — 82 000 |
| 5 | 151 000 |
| 6 | 233 000 |
| 7-10 | 20 900 — 291 000 |
| 11-16 | 6 150 — 103 000 |
| 17-20 | 4 730 — 80 000 |
| 21-39 | 2 700 — 78 000 |
После имплантации эмбриона уровень гормона начинает резко увеличиваться (вдвое каждые 2 дня), достигая максимальных значений ближе к концу 1 триместра (на 10-11 неделе). Концентрация хорионического гонадотропина растет до 2 триместра, а затем понемногу начинает снижаться. Спустя неделю после родов ХГЧ в организме женщины уже, как правило, не обнаруживается.
Анализ крови на определение уровня гормона сдают натощак. Для оценки динамики проводят несколько исследований в одной и той же лаборатории.
Накануне рекомендуется отказаться от курения и приема спиртных напитков. За неделю до сдачи крови желательно избегать значительных физических нагрузок и стрессовых ситуаций.
Записаться на прием к врачу
Фертильность и бесплодие
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
Если адрес совпадает с действующей учетной записью, на __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
Фертильность и бесплодие
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
Если адрес совпадает с действующей учетной записью, на __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
Бета-субъединица хорионического гонадотропина — обзор
Оценка жизнеспособности беременности
Диагностическая классификация выкидышей зависит от клинических данных (см. Таблицу 12.2).
Первоначальная оценка жизнеспособности беременности должна включать сбор анамнеза, бимануальное исследование и анализ мочи на ХГЧ. Однако, хотя эта оценка может помочь врачам в принятии решения, только ультразвуковое исследование и тест на бета-ХГЧ в сыворотке крови помогут подтвердить диагноз жизнеспособной беременности или выкидыша.
ХГЧ — это гормон, вырабатываемый трофобластом при имплантации. ХГЧ может быть обнаружен в моче и крови матери вскоре после имплантации.Беременность подтверждается, если уровень бета-ХГЧ ≥ 5 МЕ / л. 152 Уровень ХГЧ ≥ 150 МЕ / л на 15-й день после переноса эмбриона ЭКО является хорошим предиктором жизнеспособной беременности. 153 Уровни ХГЧ между 25 и 50 МЕ / л через 16 дней после овуляции могут указывать на низкую вероятность продолжения беременности (<35%), тогда как уровни> 500 МЕ / л были связаны с высокой вероятностью продолжения беременности (> 95%). 154
Уровни бета-ХГЧ в сыворотке удваиваются каждые 48 часов в большинстве, но не во всех, здоровых беременностях.Повышение на <53% обычно связано с ненормальной беременностью. 155 Медленный рост ХГЧ может указывать на внематочную беременность. Высокий для гестационного возраста уровень ХГЧ может указывать на молярную беременность. Снижение уровня ХГЧ предполагает неудачную беременность, но также может указывать на внематочную беременность. В зависимости от исходного уровня ХГЧ при неудачной беременности уровень ХГЧ снижается на 21–35% каждые 2 дня.
Клинические советы
Медленное повышение уровня ХГЧ и акупунктура
По нашему опыту, иглоукалывание и мокса на REN4 и REN6 могут помочь в тех случаях, когда ХГЧ повышается слишком медленно.
Трансвагинальное ультразвуковое исследование помогает визуализировать беременность и классифицировать ее. Это наиболее точный метод диагностики в первом триместре беременности 156 и превосходит трансабдоминальное УЗИ. Это может помочь определить место и срок беременности, а также увидеть сердцебиение плода. Следующие дискриминационные результаты применяются на ранних сроках беременности: 157
- •
~ 4–5 недель беременности: гестационный мешок должен быть виден при ультразвуковом исследовании.
- •
~ 5–6 недель беременности
- ■
желточный мешок виден при диаметре гестационного мешка> 10 мм
- ■
эмбрион должен быть виден, когда диаметр гестационный мешок> 18 мм
- ■
сердцебиение плода должно быть обнаружено, когда длина коронки и крестца эмбриона> 5 мм
Когда уровень бета-ХГЧ превышает 1500 МЕ / л (известный как дискриминационный уровень), при ультразвуковом исследовании должно быть доказательство беременности.Если на УЗИ у женщин с уровнем ХГЧ выше 1500 МЕ / л гестационный мешок не выявляется, это может указывать на полный выкидыш или внематочную беременность. 155
При многоплодной беременности уровень дискриминации устанавливается выше и составляет 2300 МЕ / л, потому что уровни бета-ХГЧ обычно выше при многоплодной беременности. Многоплодная беременность чаще встречается после лечения АРТ. Следовательно, гестационный мешок можно не увидеть на УЗИ, пока уровень бета-ХГЧ не превысит 2300 МЕ / л. 158
Другими показаниями УЗИ при неудачной беременности являются аномальная форма или размер гестационного мешка по сравнению с беременностью. Если сердцебиение плода не наблюдается, УЗИ следует повторить в течение 3–7 дней. Медленное сердцебиение плода (≤ 110 ударов в минуту) на сроке беременности 6–8 недель является плохим прогностическим признаком. 159 Наличие сердцебиения плода снижает риск выкидыша до 4,5% у женщин в возрасте <36 лет, 10% у женщин в возрасте 36–39 лет и 29% у женщин в возрасте ≥ 40 лет. 160
Ведение неудавшейся беременности зависит от диагностической классификации выкидыша. В случае неизбежного выкидыша может быть показано выжидательное ведение (когда у женщины ожидается самопроизвольный выкидыш). Эти женщины должны находиться под тщательным наблюдением, если у них развиваются такие осложнения, как сильное кровотечение или инфекция. Если у женщины не происходит выкидыша естественным путем или если выкидыш был неполным или пропущенным, то показано хирургическое и фармакологическое лечение.Выкидыш во втором триместре может потребовать индукции родов. Rh-отрицательным женщинам необходимо вводить RhoGAM для предотвращения гемолитической болезни у новорожденного при этой или будущих беременностях. Если возможно, ткань плода может быть отправлена на анализ.
Отчет о мировом рынке хорионического гонадотропина человека (ХГЧ) за 2021 год, фактор роста, динамический фактор рынка, основные проблемы, возможности, стратегии выхода на рынок, влияние Covid-19, страны-лидеры, рыночный потенциал, цена акций и прогноз к 2021-2026 гг.
Отдел новостей MarketWatch не участвовал в создании этого контента.
9 июня 2021 г. (Expresswire) — Анализ глобального исследовательского отчета «Рынок хорионического гонадотропина человека (ХГЧ) » (2021-2026): — Этот отчет охватывает данные производителей, включая отгрузку, цену, выручку, валовую прибыль, записи интервью, распределение бизнеса и т. Д., эти данные помогают покупателю лучше понять конкурентов. Этот отчет о человеческом хорионическом гонадотропине (ХГЧ) также охватывает все регионы и страны планеты и показывает статус регионального развития, включая размер рынка, объем и стоимость, а также данные о ценах.Кроме того, в отчете также приводятся данные по сегментам, включая типовой сегмент, отраслевой сегмент, сегмент канала и т. Д., Охватывающие различные размеры сегмента рынка, как по объему, так и по стоимости. Также охватываем информацию о клиентах из разных отраслей, что чрезвычайно важно для производителей.
Это исследование рынка охватывает глобальные и региональные рынки с углубленным анализом общих перспектив роста на рынке. Кроме того, он проливает свет на всеобъемлющую конкурентную среду на мировом рынке.Отчет также предлагает обзор на панели инструментов ведущих компаний, охватывающий их успешные маркетинговые стратегии, вклад на рынок, последние события как в историческом, так и в настоящем контексте.
Получить образец PDF-файла Рынок хорионического гонадотропина человека (ХГЧ) в 2021 году
Краткое описание рынка хорионического гонадотропина человека (ХГЧ) за 2021-2026 гг.
Хорионический гонадотропин человека (ХГЧ), продуцируемый женским плацента после имплантации яйцеклетки, поэтому ее можно обнаружить с помощью нескольких тестов на беременность.Кроме того, он может быть извлечен из мочи беременных женщин или произведен из культур генетически модифицированных клеток с использованием технологии рекомбинантной ДНК.
Основными факторами, способствующими росту рынка, являются рост числа случаев бесплодия среди мужчин и женщин, а также увеличение возраста материнства среди женщин. Кроме того, растущее предпочтение гормональной лекарственной терапии способствует росту рынка.
Прогнозируется, что объем мирового рынка хорионического гонадотропина человека (ХГЧ) достигнет миллионов долларов США к 2026 году по сравнению с миллионами долларов США в 2020 году при среднегодовом темпе роста в течение 2021-2026 годов.
В этом отчете основное внимание уделяется объему и стоимости хорионического гонадотропина человека (ХГЧ) на глобальном, региональном и корпоративном уровнях. С глобальной точки зрения, в этом отчете представлен общий объем рынка хорионического гонадотропина человека (ХГЧ) путем анализа исторических данных и будущих перспектив. На региональном уровне этот отчет сосредоточен на нескольких ключевых регионах: Северная Америка, Европа, Япония, Китай, Юго-Восточная Азия, Индия и т. Д.
Глобальный рынок хорионического гонадотропина человека (ХГЧ): сегментный анализ
Отчет об исследовании включает отдельные сегменты по регионам ( страна), по компаниям, по типам и по приложениям.Это исследование предоставляет информацию о продажах и доходах за исторический и прогнозируемый период с 2015 по 2026 год. Понимание сегментов помогает определить важность различных факторов, способствующих росту рынка.
Читатели найдут этот отчет очень полезным для понимания рынка через информацию, и поэтому информация о рынке взята из надежных источников, таких как веб-сайты , годовые отчеты предприятий, журналы и др. . и были проверены и утверждены отраслевыми экспертами.
Получите образец отчета в формате PDF @ https://www.360marketupdates.com/enquiry/request-sample/16929860
Список ведущих производителей / ключевых игроков рынка хорионического гонадотропина человека (ХГЧ) (2021 — 2026 гг.): —
- EMD Serono, Inc
- Ferring B.V
- Мерк и Ко., Инк.
- Компания Bristol Myers Squibb
- Фрезениус Каби АГ, ООО
- Scrippslabs
- Либио
- Камия Биомедицинская Компания
- Sanzyme
- Cigna
На основе типа продукта мы исследуем производство, выручку, цену, долю на рынке и темпы роста, в основном разделяя на: —
- Добыча из природного источника
- Технология рекомбинантной ДНК
Для конечных пользователей / приложений в этом отчете основное внимание уделяется состоянию и перспективам основных приложений / конечных пользователей, потреблению (продажам), рыночной доле и темпам роста рынка хорионического гонадотропина человека (ХГЧ) для каждого приложения, включая: —
- Лечение женского бесплодия
- Олигоспермическое лечение
- Лечение крипторхизма
- Другие
Узнайте больше и поделитесь вопросами, если таковые имеются, до покупки в этом отчете @ https: // www.360marketupdates.com/enquiry/pre-order-enquiry/16929860
Этот отчет об исследовании рынка хорионического гонадотропина человека (ХГЧ) содержит ответы на следующие вопросы
- Какая технология производства используется для производства хорионического гонадотропина человека (ХГЧ)? Какие разработки происходят в технологии? Какие тенденции вызывают эти изменения?
- Кто является мировыми ключевыми игроками на рынке хорионического гонадотропина человека (ХГЧ)? Каков профиль их компании, информация о продукте, контактная информация?
- Каков был статус мирового рынка хорионического гонадотропина человека (ХГЧ)? Каковы были емкость, производственная стоимость, стоимость и ПРИБЫЛЬ рынка хорионического гонадотропина человека (ХГЧ)?
- Каково текущее состояние рынка индустрии хорионического гонадотропина человека (ХГЧ)? Какова рыночная конкуренция в этой отрасли, как в компании, так и в стране? Что такое маркетинговое исследование рынка хорионического гонадотропина человека (ХГЧ) с учетом приложений и видов?
- Каковы прогнозы мировой индустрии хорионического гонадотропина человека (ХГЧ) с учетом производственных мощностей, производства и производственной ценности? какова будет оценка затрат и прибыли? что будет с долей рынка, предложением и потреблением? А как насчет импорта и экспорта?
- Что такое анализ рыночной цепочки хорионического гонадотропина человека (ХГЧ) по добывающим сырьевым и перерабатывающим отраслям?
- Каково экономическое влияние на промышленность хорионического гонадотропина человека (ХГЧ)? Каковы результаты анализа глобальной макроэкономической среды? Каковы глобальные тенденции развития макроэкономической среды?
- Какова динамика рынка хорионического гонадотропина человека (ХГЧ)? Какие проблемы и возможности?
- Какими должны быть стратегии входа, меры противодействия экономическому воздействию, маркетинговые каналы для индустрии хорионического гонадотропина человека (ХГЧ)?
Ключевые преимущества покупки данного отчета о рынке человеческого хорионического гонадотропина (ХГЧ):
- Чтобы получить глубокий анализ рынка хорионического гонадотропина человека (ХГЧ) и получить всестороннее представление о мировом рынке и его коммерческой среде.
- Оцените процессы сборки, основные проблемы и решения для снижения риска события.
- Понимать главные движущие и сдерживающие силы на рынке и их влияние на глобальный рынок.
- Узнайте о рыночных стратегиях, применяемых ведущими соответствующими организациями.
- Чтобы понять долгосрочные перспективы и перспективы рынка хорионического гонадотропина человека (ХГЧ).
- Помимо отчетов о структуре качества, мы также проводим индивидуальные исследования в соответствии с конкретными требованиями.
Приобрести этот отчет (цена 2900 долларов США за однопользовательскую лицензию) @ https://www.360marketupdates.com/purchase/16929860
Основные моменты из содержания:
Global Human Отчет об исследовании рынка хорионического гонадотропина (ХГЧ) (2021-2026) по производителям, регионам, типам и областям применения
1 Охват исследования
1.1 Продукт
с хорионическим гонадотропином человека (ХГЧ) 1.2 Ключевые сегменты рынка в этом исследовании
1.3 Основные производители, охваченные
1.4 Рынок по типу
1.4.1 Размер мирового рынка хорионического гонадотропина (ХГЧ) по типу
1.5 Рынок по приложениям
1.5 .1 Объем мирового рынка хорионического гонадотропина человека (ХГЧ) Скорость роста по приложениям
1.6 Цели исследования
1,7 рассматриваемых года
2 Краткое содержание
2.1 Мировое производство хорионического гонадотропина человека (ХГЧ)
2.1.1 Глобальный доход от хорионического гонадотропина человека (ХГЧ) в 2015-2026 гг.
2.1.2 Глобальное производство хорионического гонадотропина человека (ХГЧ) в 2015-2026 гг.
2.1.3 Глобальный потенциал хорионического гонадотропина человека (ХГЧ) 2015-2026 гг.
2.1.4 Глобальный объем хорионического гонадотропина человека (ХГЧ) (ХГЧ) Маркетинговые цены и тенденции
2.2 Скорость роста хорионического гонадотропина человека (ХГЧ) (CAGR) 2021-2026
2.3 Анализ конкурентной среды
2.3.1 Коэффициент концентрации рынка производителей (CR5 и HHI)
2.3.2 Основной хорионический гонадотропин человека (HCG) Производители
2.4 Драйверы рынка, тенденции и проблемы
2.5 Макроскопический индикатор
2.5.1 ВВП в основных регионах
2.5.2 Цена сырья в долларах: эволюция
3 Размер рынка по производителям
3.1 Производство хорионического гонадотропина человека (ХГЧ) производителями
3.1.1 Производство хорионического гонадотропина человека (ХГЧ) производителями
3.1.2 Доля рынка производства хорионического гонадотропина человека (ХГЧ) производителями
3.2 Доходы производителей от хорионического гонадотропина человека (ХГЧ)
3.2.1 Выручка от хорионического гонадотропина человека (ХГЧ) по производителям (2015-2021)
3.2.2 Доля выручки от хорионического гонадотропина человека (ХГЧ) по производителям (2015-2021)
3.3 Цена на хорионический гонадотропин человека (ХГЧ) по производителям
3.4 Слияния и поглощения , Планы расширения
4 Производство хорионического гонадотропина человека (ХГЧ) по регионам
4.1 Мировое производство хорионического гонадотропина человека (ХГЧ) по регионам
4.1.1 Доля мирового рынка производства хорионического гонадотропина человека (ХГЧ) по регионам
4.1.2 Глобальный доход от хорионического гонадотропина человека (ХГЧ) по регионам
4.2 США
4.2.1 Производство хорионического гонадотропина человека (ХГЧ) в США
4.2.2 Выручка от хорионического гонадотропина человека (ХГЧ) в США
4.2.3 Основные игроки в США
4.2.4 Импорт и экспорт хорионического гонадотропина человека (ХГЧ) в США
4,3 Европа
4.3.1 Европа Производство хорионического гонадотропина человека (ХГЧ)
4.3.2 Европа Доходы от хорионического гонадотропина человека (ХГЧ)
4.3.3 Основные игроки в Европе
4.3.4 Европа Импорт и экспорт хорионического гонадотропина человека (ХГЧ)
4,4 Китай
4.4.1 Производство хорионического гонадотропина человека (ХГЧ) в Китае
4.4.2 Выручка от хорионического гонадотропина человека (ХГЧ) в Китае
4.4.3 Ключевые игроки в Китае
4.4.4 Китай Импорт и экспорт хорионического гонадотропина человека (ХГЧ)
4,5 Япония
4.5.1 Япония Производство хорионического гонадотропина человека (ХГЧ)
4.5.2 Япония Доходы от хорионического гонадотропина человека (ХГЧ)
4.5.3 Ключевые Игроки в Японии
4.5.4 Япония Импорт и экспорт хорионического гонадотропина человека (ХГЧ)
4.6 Другие регионы
4.6.1 Южная Корея
4.6.2 Индия
4.6.3 Юго-Восточная Азия
5 Потребление хорионического гонадотропина человека (ХГЧ) по регионам
5.1 Глобальный хорионический гонадотропин человека (ХГЧ) Потребление по регионам
5.1.1 Глобальное потребление хорионического гонадотропина человека (ХГЧ) по регионам
5.1.2 Доля мирового рынка потребления хорионического гонадотропина (ХГЧ) по регионам
5.2 Северная Америка
5.2.1 Потребление хорионического гонадотропина человека (ХГЧ) в Северной Америке по приложениям
5.2.2 Потребление хорионического гонадотропина человека (ХГЧ) в Северной Америке по странам
5.2.3 США
5.2.4 Канада
5.2.5 Мексика
5.3 Европа
5.3.1 Потребление хорионического гонадотропина человека (ХГЧ) в Европе в разрезе приложений
5.3.2 Потребление хорионического гонадотропина человека (ХГЧ) в Европе по странам
5.3.3 Германия
5.3.4 Франция
5.3.5 Великобритания
5.3.6 Италия
5.3.7 Россия
5.4 Азиатско-Тихоокеанский регион
5.4.1 Потребление хорионического гонадотропина человека (ХГЧ) в Азиатско-Тихоокеанском регионе по применению
5.4.2 Потребление хорионического гонадотропина человека (ХГЧ) в Азиатско-Тихоокеанском регионе по странам
5.4.3 Китай
5.4.4 Япония
5.4.5 Южная Корея
5.4.6 Индия
5.4.7 Австралия
5.4.8 Индонезия
5.4.9 Таиланд
5.4.10 Малайзия
5.4.11 Филиппины
5.4.12 Вьетнам
5.5 Центральная и Южная Америка
5.5.1 Центральная и Южная Америка Хорионик человека Потребление гонадотропинов (ХГЧ) по приложениям
5.5.2 Потребление хорионического гонадотропина человека (ХГЧ) в Центральной и Южной Америке по странам
5.5.3 Бразилия
5.6 Ближний Восток и Африка
5.6.1 Ближний Восток и Африка Потребление хорионического гонадотропина человека (ХГЧ) по приложениям
5.6.2 Средний Восток и Африка Потребление хорионического гонадотропина человека (ХГЧ) по странам
5.6.3 Турция
5.6.4 Страны ССЗ
5.6.5 Египет
5.6.6 Южная Африка
6 Размер рынка по типу
6,1 Глобальный хорионический гонадотропин человека (ХГЧ) Разбивка Дада по типу
6.2 Глобальный доход от хорионического гонадотропина человека (ХГЧ) по типу
6.3 Цена на хорионический гонадотропин человека (ХГЧ) по типу
7 Размер рынка по приложениям
7.1 Обзор
7.2 Глобальная разбивка по хорионическому гонадотропину человека (ХГЧ) по приложениям
7.2.1 Глобальный Потребление человеческого хорионического гонадотропина (ХГЧ) по приложениям
7.2.2 Доля мирового рынка потребления хорионического гонадотропина (ХГЧ) по приложениям (2015-2021)
Продолжение….
Информация о 360 Market Updates:
360 Market Updates — надежный источник для получения рыночных отчетов, которые помогут вам определить, в чем нуждается ваш бизнес.Наша цель 360 Market Updates — предоставить платформу для многих первоклассных исследовательских фирм по всему миру, чтобы они могли публиковать свои исследовательские отчеты, а также помочь лицам, принимающим решения, найти наиболее подходящие решения для исследования рынка под одной крышей. Наша цель — предоставить лучшее решение, которое точно соответствует требованиям заказчика. Это побуждает нас предоставлять вам индивидуальные или синдицированные отчеты об исследованиях.
Контактная информация: —
360 Обновления рынка
Mr.Ajay More
США: +1424 253 0807
Великобритания: +44 203239 8187
Рынок автомобильных систем предотвращения столкновений 2021-2025 гг. Обзор, рост, развитие и прогноз на
Рынок автомобильных систем предотвращения столкновений 2021-2025 гг. С данными ведущих стран по отраслевым тенденциям, размеру, доле, Обзор компании, рост, развитие и прогноз на
Рынок автомобильных систем предотвращения столкновений 2021-2025 с Данные ведущих стран по отраслевым тенденциям, размеру, доле, обзору компании, росту, развитию и прогнозу на
Рынок автомобильных систем предотвращения столкновений 2021-2025 гг. С данными ведущих стран по отраслевым тенденциям, размеру, доле, обзору компании, росту, развитию и прогнозу by
Объем мирового рынка нервных биоподобных биологических препаратов 2021-2026 гг. с данными по ведущим странам Размер отрасли, будущие тенденции, ключевые факторы роста, D emand, Доля бизнеса, Продажи и доходы, Производители, Применение, Объем и возможности
Пресс-релиз, распространяемый The Express Wire
Чтобы просмотреть исходную версию на Express Wire, посетите Глобальный отчет о рынке хорионического гонадотропина человека (ХГЧ) за 2021 год, Фактор роста, фактор динамики рынка, основные проблемы, возможности, стратегии выхода на рынок, влияние Covid-19, страны-лидеры, рыночный потенциал, цена акций и прогноз на 2021-2026 годы
COMTEX_388025742 / 2598 / 2021-06-09T03: 26: 13
Есть ли проблемы с этим пресс-релизом? Свяжитесь с поставщиком исходного кода Comtex по адресу editorial @ comtex.com. Вы также можете связаться со службой поддержки клиентов MarketWatch через наш Центр поддержки клиентов.
Отдел новостей MarketWatch не участвовал в создании этого контента.
Совместное моделирование продольно измеренного хорионического гонадотропина человека в моче и исходов беременности на ранних сроках
Основные выводы
Этот анализ основан на двухэтапном модельном подходе, реализованном Marriott et al . 15 . Используя более совершенную совместную модель продольной выживаемости, моделируется связь между продольным измерением уровня ХГЧ в моче и временем до выкидыша с учетом как ошибки измерения, так и периодичности наблюдений.Это улучшает двухэтапную модель, в которой предполагалось, что измерения оставались постоянными между периодами наблюдения.
Теперь, когда упор делается на персонализированный уход, стандартной практикой становится использование совместной модели в пользу единичного или двухэтапного анализа для моделирования связи между продольными процессами и процессами отказов, как для максимизации эффективности, так и для минимизации возможности смещения 16 . Повсеместное использование совместных моделей совпадает с усовершенствованиями в программном обеспечении, что делает эти сложные модели все более простыми в использовании, с пакетами, доступными как в R (JM, JoineRML), так и в Stata (stjm, merlin) 13,17,18,19 .Это делает оценку условной вероятности выживания с помощью таких моделей более доступной.
В этой статье исследуется, можно ли использовать ХГЧ в моче для проспективного мониторинга жизнеспособности беременности на ранних сроках беременности с момента первого обнаружения ХГЧ. Отслеживание на этой ранней стадии представляет собой дополнение к диагностике с помощью УЗИ на более поздних сроках беременности. Этот анализ перекликается с исследованиями, предполагающими, что снижение ХГЧ может быть отмечено еще до появления других симптомов 20 . Также существует вероятность того, что этот мониторинг будет проводиться до зачатия: недавнее исследование показало, что отставание между лютеиновой фазой и производством ХГЧ может указывать на биохимическую беременность, возможно, из-за ранней или отсроченной имплантации 21 .
Отслеживание ХГЧ беременными женщинами возможно, как продемонстрировали Foo et al . которые использовали монитор фертильности, который также обеспечивает полуколичественный анализ уровней ХГЧ в тестах на беременность, которые использовались ежедневно у беременных женщин 21 . Ретроспективный анализ полуколичественных данных показал, что у нежизнеспособных беременностей профили ХГЧ отличаются от профилей жизнеспособных беременностей. Последовательное отслеживание может потенциально вызвать стресс, хотя женщины, использующие тесты для отслеживания овуляции в целях фертильности, по-видимому, не имеют более высоких уровней стресса, чем те, кто не использует тесты 22,23 .Тем не менее, вероятно, что отслеживание поначалу принесет пользу при беременностях с высоким риском, когда уровень тревожности уже высок и для отслеживания будут желание и причина. Для понимания психологического воздействия слежения потребуются дальнейшие исследования.
Мониторинг с момента первого обнаружения может быть полезен в случаях повторного выкидыша, особенно по мере того, как исследования в области лечения становятся все более популярными. Недавно опубликованное технико-экономическое обоснование, оценивающее эффективность лекарства от диабета ситаглиптина в качестве лечения повторяющегося выкидыша, представило многообещающие результаты 24 .Это испытание основано на предыдущих исследованиях, которые показали, что в некоторых случаях повторного выкидыша именно разрушение стволовых клеток в матке приводит к потере беременности. С поправкой на возраст и исходное количество колониеобразующих единиц (КОЕ) количество КОЕ было выше (ОР 1,52, 95% ДИ 1,32, 1,75) в группе ситаглиптина по сравнению с плацебо, что указывает на успешную регенерацию клеток. Эти результаты могут произвести революцию в лечении невынашивания беременности без объяснения причин, особенно потому, что более устоявшаяся терапия прогестероном не показала значительного влияния на частоту живорождений (испытания PROMISE и PRISM) 25,26 .
Не все выкидыши можно предсказать из-за разнообразной этиологии состояния. Некоторые причины могут быть напрямую связаны со снижением уровня ХГЧ, например: состояния, влияющие на скорость эмбрионального развития, такие как хромосомные аномалии или неадекватная плацентация. Другие причины, например, инфекционные агенты или травмы, могут не иметь никаких предупреждений.
Демографические факторы, которые добавляют в модель, правдоподобны. Связь между хронологическим возрастом и выкидышем хорошо задокументирована, а короткая фолликулярная фаза также была связана с выкидышем другими авторами 27,28 .Короткая длина цикла может представлять собой суррогатный маркер продвинутого репродуктивного возраста, поскольку начальный переход к перименопаузе может характеризоваться сокращением длины цикла 29 .
Сильные стороны и ограничения
Двухэтапная модель не позволила исследовать природу связи между выкидышем и ХГЧ, что возможно с совместной моделью. Несмотря на попытки, было невозможно разумно подогнать совместную модель с первой производной ассоциативной структурой, возможно, из-за небольшого размера выборки.Это то, что требует дальнейшего исследования в более широком наборе данных, особенно потому, что в литературе есть доказательства, которые предполагают, что общий профиль ХГЧ важен, а не изменения в абсолютных значениях ХГЧ. Конечно, как недавние статьи, использующие байесовские непараметрические модели, так и подходы к модели сплайнов со смешанными эффектами, сосредоточены на классификации каждого типа беременности на основе полных продольных профилей 30,31 .
Модель Вейбулла использовалась для моделирования базовой опасности, однако в идеале была бы желательна большая гибкость.Этого можно достичь, используя ограниченные кубические шлицы для моделирования базовой опасности. Выбор модели проводился с использованием пошагового прямого выбора, который, как известно, вносит смещение 32 . В будущем следует рассмотреть альтернативные методы выбора, специфичные для контекста совместного моделирования. Был предложен выбор на основе вклада логарифма правдоподобия для продольной части и модели условной выживаемости, но в настоящее время он реализован только в статистическом программном обеспечении SAS 33 .Набор данных в качестве примера был относительно небольшим, поэтому подобрать такую сложную модель, как совместная модель, было непросто. Поэтому результаты следует интерпретировать с осторожностью. Поскольку это был ретроспективный анализ данных с ограниченными последующими измерениями, было невозможно обновить прогнозы, поскольку измерения наблюдались. Следовательно, прогнозы были неточными для более широких периодов времени. При небольшом размере выборки было также невозможно разделить набор данных для разработки и проверки модели. Попытка использовать такие данные для целей диагностики или мониторинга также требует тщательного рассмотрения возможности ложных срабатываний.Это исследование не принимало во внимание чувствительность и специфичность подобранной модели, однако это важный компонент для запланированного будущего анализа в соответствии с разработками в методологии совместной модели 34,35 .
При использовании совместной модели важно подумать о корректировках, которые необходимо внести в модель, чтобы действительно отразить биологическую реальность биомаркеров и процессов болезни. В этом анализе были рассмотрены временные рамки, на которых моделировался выкидыш, и то, как это повлияло на включение фиксированных и случайных эффектов.Из-за ограничений программного обеспечения модели включали фиксированные и случайные точки пересечения, хотя в нулевой момент времени ХГЧ не мог быть обнаружен. Дата зачатия также будет неизвестна при естественной беременности, что делает этот анализ более подходящим для условий ЭКО. Это, однако, можно скорректировать, используя последний менструальный период (LMP) в качестве временной шкалы в условиях естественной беременности.
Использование двух отдельных методов моделирования для продольных данных и данных о выживаемости требует большего размера выборки в условиях клинических испытаний.Повышенная эффективность одновременного моделирования двух результатов имеет преимущество в поддержании желаемой мощности при меньшем размере выборки 36 . Это делает разработку клинических испытаний на основе совместной модели привлекательной перспективой.
Биологические функции ХГЧ и молекул, связанных с ХГЧ | Репродуктивная биология и эндокринология
Aschner B: Ueber die function der hypophyse. Pflug Arch Gest Physiol. 1912, 146: 1-147. 10.1007 / BF01681114.
Артикул Google Scholar
Fellner OO: Experimentelle untersuchungen uber die wirkung von gewebsextrakten aus der plazenta und den weiblichen sexorganen auf das genital. Арка Гынаколь. 1913, 100: 641-10.1007 / BF01702558.
Артикул Google Scholar
Hirose T: Experimentalle histologische studie zur genese corpus luteum. Mitt Med Fakultd Univ ZU. 1919, 23: 63-70.
Google Scholar
Aschheim S, Zondek B: Das Hormon des hypophysenvorderlappens: testobjekt zum Nachweis des гормоны. Klin Wochenschr. 1927, 6: 248-252. 10.1007 / BF01710709.
Артикул Google Scholar
Хосина М., Бойме И., Мочизуки М.: Цитологическая локализация hPL, hCG и мРНК в ткани хориона с использованием гибридизации in situ. Acta Obstet Gynaecol Japonica. 1984, 36: 397-404.
CAS Google Scholar
Handschuh K, Guibourdenche J, Tsatsaris V, Guesnon M, Laurendeau I, Evain-Brion D, Fournier T. Хорионический гонадотропин человека, продуцируемый инвазивным трофобластом, но не ворсинчатым трофобластом, способствует инвазии клеток и подавляется пролифератором пероксисомы. рецептор-а. Эндокринол. 2007, 148: 5011-5019. 10.1210 / en.2007-0286.
CAS Статья Google Scholar
Ковалевская Г., Генбацев О., Фишер С.Дж., Касере Э., О’Коннор Дж.Ф .: Трофобластное происхождение изоформ ХГЧ: цитотрофобласты являются основным источником хориокарциномоподобного ХГЧ.Mol Cellular Endocrinol. 2002, 194: 147-155. 10.1016 / S0303-7207 (02) 00135-1.
CAS Статья Google Scholar
Сасаки Ю., Ладнер Д.Г., Коул Л.А.: Гипергликозилированный ХГЧ — источник неудач при беременности. Fertil Steril. 2008, 89: 1871-1786. 10.1016 / j.fertnstert.2007.03.010.
Google Scholar
Коул Л.А., Дай Д., Батлер С.А., Лесли К.К., Кохорн Э.И.: Гестационные трофобластические заболевания: 1.Патофизиология гипергликозилированной неоплазии, регулируемой ХГЧ. Gynecol Oncol. 2006, 102: 144-149.
Google Scholar
Коул Л.А.: Структуры свободной α-субъединицы и свободной β-субъединицы. В: Хорионический гонадотропин человека (ХГЧ). Отредактировал: Коул Л.А. 2010, Эльзевир, Оксфорд
Google Scholar
Батлер С.А., Икрам М.С., Матье С., Ильес Р.К .: Увеличение популяции клеток карциномы мочевого пузыря, индуцированное свободной бета-субъединицей ХГЧ, является результатом антиапоптозного эффекта, а не пролиферации клеток.Брит Дж. Рак. 2000, 82: 1553-1556. 10.1054 / bjoc.2000.1177.
PubMed Central CAS PubMed Статья Google Scholar
Ильес Р.К., Эктопическая экспрессия ХГЧβ эпителиальным раком: метастазирование злокачественного поведения и ингибирование апоптоза опухолевых клеток. Molec Cellul Endocrinol. 2007, 260: 264-270. 10.1016 / j.mce.2006.02.019.
Артикул CAS Google Scholar
Коул Л.А., Ladner DG: Общие сведения о ХГЧ у небеременных лиц: необходимость в более чувствительных тестах на беременность и в тестах на беременность, отпускаемых без рецепта. Clin Biochem. 2009, 42: 168-175. 10.1016 / j.clinbiochem.2008.09.107.
CAS PubMed Статья Google Scholar
Коул Л.А.: фоновый ХГЧ. Хорионический гонадотропин человека (ХГЧ). Отредактировал: Коул Л.А. 2010, Эльзевир, Оксфорд
Google Scholar
Schalch DS, Parlow AF, Boon RC, Reichlin S: Измерение лютеинизирующего гормона человека в плазме с помощью радиоиммуноанализа. J Clin Invest. 1968, 47: 665-678.
PubMed Central CAS PubMed Статья Google Scholar
Файман С., Райан Р.Дж., Звирек С.Дж., Рубин М.Е.: ФСГ и ХГЧ в сыворотке крови во время беременности и в послеродовой период у человека. J Clin Endocrinol Metab. 1968, 28: 1323-1329. 10.1210 / jcem-28-9-1323.
CAS PubMed Статья Google Scholar
Рао CV, Гриффин Л.П., Карман FR: Сайты связывания альфа простагландина F2 в желтых телах человека. J Clin Endocrinol Metab. 1977, 44: 1032-1037. 10.1210 / jcem-44-6-1032.
CAS PubMed Статья Google Scholar
Стротт К.А., Йошими Т., Росс Г.Т., Липсетт МБ: Физиология яичников: взаимосвязь между ЛГ в плазме и стероидогенезом фолликулом и желтым телом; эффект ХГЧ. J Clin Endocrinol Metab. 1969, 29: 1157-1167.10.1210 / jcem-29-9-1157.
CAS PubMed Статья Google Scholar
Cedard L, Varangot J, Yannotti S: метаболизм эстрогенов в плаценте человека, искусственно поддерживаемый в процессе выживания за счет перфузии in vitro. Comptes Rendus Hebdomadaires Seances de l’Academie des Sci. 1962, 254: 1870–1871.
CAS Google Scholar
Азума К., Кальдерон И., Бесанко М., Маклахлан В., Хили Д.Л.: Лютео-плацентарный сдвиг — это миф? Анализ низкого уровня прогестерона при успешных арт-беременностях.J Clin Endocrinol Metab. 1993, 77: 195-198. 10.1210 / jc.77.1.195.
CAS PubMed Google Scholar
Mayerhofer A, Fritz S, Grunert R, Sanders SL, Duffy DM, Ojeda SR, Stouffer RL: D1-Receptor, DARPP-32 и PP-1 в желтом теле приматов и лютеинизированных гранулезных клетках: доказательства для фосфорилирования DARPP-32 дофамином и хорионическим гонадотропином человека. J Clin Endocrinol Metab. 2000, 85: 4750-4757. 10.1210 / jc.85.12,4750.
CAS PubMed Статья Google Scholar
Пирс Дж. Г., Парсонс Т.Ф.: Гликопротеиновые гормоны: структура и функция. Энн Рев Биохим. 1981, 50: 65-95. 10.1146 / annurev.bi.50.070181.002341.
Артикул Google Scholar
Рао CV: Дифференциальные свойства связывания хорионического гонадотропина человека и лютеинизирующего гормона человека с плазматическими мембранами желтого тела крупного рогатого скота.Acta Endocrinol. 1979, 90: 696-710.
CAS PubMed Google Scholar
Berndt S, Blacher S, d’Hauterive PS, Thiry M, Tsampalas M, Cruz A, Pequeux C, Lorquet S, Munaut C, Noel A, Foidart JM: Стимуляция хорионическими гонадотропинами ангиогенеза и рекрутирования перицитов. J Clin Endocrinol Metab. 2009, 94: 4567-4574. 10.1210 / jc.2009-0443.
CAS PubMed Статья Google Scholar
Toth P, Li X, Rao CV, Lincoln SR, Sanfillipino JS, Spinnato JA, Yussman MA: Экспрессия функционального гена рецептора хорионического гонадотропина человека / лютеинизирующего гормона человека в маточных артериях человека. J Clin Endocrinol Metab. 1994, 79: 307-315. 10.1210 / jc.79.1.307.
CAS PubMed Google Scholar
Лей З.М., Решеф Э., Рао К.В.: Экспрессия рецепторов хорионического гонадотропина / лютеинизирующего гормона человека в кровеносных сосудах эндометрия и миометрия человека.J Clin Endocrinol Metab. 1992, 75: 651-659. 10.1210 / jc.75.2.651.
CAS PubMed Google Scholar
Zygmunt M, Herr F, Keller-Schoenwetter S, Kunzi-Rapp K, Munstedt K, Rao CV, Lang U, Preissner KT: Характеристика человеческого хорионического гонадотропина как нового ангиогенного фактора. J Clin Endocrinol Metab. 2002, 87: 290-5296. 10.1210 / jc.2002-020642.
Google Scholar
Herr F, Baal N, Reisinger K, Lorenz A, McKinnon T, Preissner KT, Zygmunt M: ХГЧ в регуляции плацентарного ангиогенеза. Результаты исследования in vitro. Плацента. 2007, 28 (Приложение A): S85-93. 10.1016 / j.placenta.2007.02.002.
PubMed Статья CAS Google Scholar
Zygmunt M, Herr F, Munstedt K, Lang U, Liang OD: Ангиогенез и васкулогенез во время беременности. Euro J Obstet Gynecol Reprod Biol. 2003, 110 (Приложение 1): S10-18.10.1016 / S0301-2115 (03) 00168-4.
CAS Статья Google Scholar
Toth P, Lukacs H, Gimes G, Sebestyen A, Pasztor N, Paulin F, Rao CV: Обзор клинического значения сосудистых рецепторов ХГЧ / ЛГ-А. Репрод Биол. 2001, 1: 5-11.
CAS PubMed Google Scholar
Ши QJ, Lei ZM, Rao CV, Lin J: Новая роль хорионического гонадотропина человека в дифференцировке цитотрофобластов человека.Эндокринол. 1993, 132: 387-395. 10.1210 / en.132.3.1387.
Google Scholar
Cronier L, Bastide B, Herve JC, Deleze J, Malassine A: Связь через разрыв соединения во время дифференцировки трофобласта человека: влияние хорионического гонадотропина человека. Эндокринология. 1994, 135: 402-408. 10.1210 / en.135.1.402.
CAS PubMed Google Scholar
Akoum A, Metz CN, Morin M: Заметное увеличение синтеза и секреции фактора ингибирования миграции макрофагов в клетках эндометрия человека в ответ на гормон хорионического гонадотропина человека.J Clin Endocrinol Metab. 2005, 90: 2904-2910. 10.1210 / jc.2004-1900.
CAS PubMed Статья Google Scholar
Мацуура Т., Сугимура М., Иваки Т., Охаши Р., Канаяма Н., Нишихира Дж .: Антитело против фактора ингибирования макрофагов ингибирует индуцированный PMSG-hCG рост фолликулов и овуляцию у мышей. J Assist Reprod Genet. 2002, 19: 591-595. 10.1023 / А: 1021219317155.
PubMed Central PubMed Статья Google Scholar
Ван Х., Марьян А., Чунг В.В., Линен П.Дж.М., Хан Н.А., Беннер Р., Кикенс РКМ: Хорионический гонадотропин может повышать врожденный иммунитет, стимулируя функцию макрофагов. J Leukocyte Biol. 2007, 82: 926-933. 10.1189 / jlb.0207092.
CAS PubMed Статья Google Scholar
Kamada M, Ino H, Naka O, Irahara M, Daitoh T, Mori K, Maeda N, Maegawa M, Hirano K, Aono T: иммуносупрессивный белок 30 кДа в моче беременных женщин и пациентов с трофобластом. болезни.Eur J Obstet Gynecol Reprod Biol. 1993, 50: 219-225. 10.1016 / 0028-2243 (93)
-П.
CAS PubMed Статья Google Scholar
Нунан Ф.П., Халлидей В.Дж., Мортон Х., Клуни Г.Дж.: Фактор ранней беременности является иммунодепрессивным. Природа. 1879, 278: 649-651. 10.1038 / 278649a0.
Артикул Google Scholar
Majumdar S, Bapna BC, Mapa MK, Gupta AN, Devi PK, Subrahmanyam D: Белки, специфичные для беременности: подавление бластогенного ответа in vitro на митоген этими белками.Int J Fertil. 1982, 27: 66-69.
CAS PubMed Google Scholar
Решеф Э., Лей З.М., Рао К.В., Придхам Д.Д., Чегини Н., Люборски Д.Л.: Присутствие рецепторов гонадотропина в матке небеременного человека, плаценте человека, плодных оболочках и децидуальной оболочке. J Clin Endocrinol Metab. 1990, 70: 421-430. 10.1210 / jcem-70-2-421.
CAS PubMed Статья Google Scholar
Zuo J, Lei ZM, Rao CV: Рецепторы хорионического гонадотропина / лютеинизирующего гормона миометрия человека при преждевременных и доношенных родах. J Clin Endocrinol Metab. 1994, 79: 907-911. 10.1210 / jc.79.3.907.
CAS PubMed Google Scholar
Eta E, Ambrus G, Rao V: Прямая регуляция сокращений миометрия человека с помощью хорионического гонадотропина человека. J Clin Endocrinol Metab. 1994, 79: 1582-1586. 10.1210 / jc.79.6.1582.
CAS PubMed Google Scholar
Doheny HC, Houlihan DD, Ravikumar N, Smith TJ, Morrison JJ: Расслабление хорионического гонадотропина миометрия беременной человека и активация канала BKCa. J Clin Endocrinol Metab. 2003, 88: 4310-4315. 10.1210 / jc.2003-030221.
CAS PubMed Статья Google Scholar
Edelstam G, Karlsson C, Westgren M, Löwbeer C, Swahn ML: Хорионический гонадатропин человека (ХГЧ) во время третьего триместра беременности.Сканд Дж. Клин Лаб Инвест. 2007, 67: 519-525. 10.1080 / 00365510601187765.
PubMed Статья CAS Google Scholar
Goldsmith PC, McGregor WG, Raymoure WJ, Kuhn RW, Jaffe RB: Клеточная локализация хорионического гонадотропина в почках и печени плода человека. J Clin Endocrinol Metab. 1983, 57: 54-61. 10.1210 / jcem-57-3-654.
Google Scholar
Абдалла М.А., Лей З.М., Ли Х, Гринволд Н., Накаджима С.Т., Яунио Э., Рао К.В.: Негонадальные ткани плода человека содержат рецепторы хорионического гонадотропина / лютеинизирующего гормона человека.J Clin Endocrinol Metab. 2004, 89: 952-956. 10.1210 / jc.2003-030917.
CAS PubMed Статья Google Scholar
Рао CV: Смена парадигмы в отношении целей действий ХГЧ. Хорионический гонадотропин человека (ХГЧ). Отредактировал: Коул Л.А. 2010, Elsevier, Oxford UK, Chapter 11
Google Scholar
Рао CV: Негонадные действия ЛГ и ХГЧ в репродуктивной биологии и медицине.Sem Reprod Med. 2001, 19: 1-119.
Google Scholar
Рао CV: Обзор прошлого, настоящего и будущего негонадального действия ХГЧ / ЛГ в репродуктивной биологии и медицине. Сем Репрод Эндокринол. 2001, 19: 7-17. 10.1055 / с-2001-13906.
CAS Статья Google Scholar
Рао К.В., Лей З.М.: Прошлое, настоящее и будущее негонадальных действий ХГЧ / ЛГ в репродуктивной биологии и медицине.Molec Cell Endocrinol. 2007, 269: 2-8. 10.1016 / j.mce.2006.07.007.
CAS PubMed Статья Google Scholar
МакГрегор В.Г., Раймур В.Дж., Кун Р.В., Яффе Р.Б .: Ткани плода могут синтезировать плацентарный гормон. Доказательства синтеза β-субъединицы хорионического гонадотропина почками плода человека. J Clin Invest. 1981, 68: 306-309. 10.1172 / JCI110249.
PubMed Central CAS PubMed Статья Google Scholar
Рао К.В., Ли Х, Тот П., Лей З.М.: Экспрессия эпидермального фактора роста, трансформирующего фактора роста-альфа и их общих рецепторных генов в пуповине человека. J Clin Endocrinol Metab. 1995, 80: 1012-1020. 10.1210 / jc.80.3.1012.
CAS PubMed Google Scholar
Рао К.В., Ли X, Тот П., Лей З.М., Кук В.Д.: Новая экспрессия функционального рецептора хорионического гонадотропина / лютеинизирующего гормона человека в пуповине человека.J Clin Endocrinol Metab. 1993, 77: 1706-1714. 10.1210 / jc.77.6.1706.
CAS PubMed Google Scholar
Wasowicz, Derecka K, Stepien A, Pelliniemi L, Doboszynska T, Gawronska B, Ziecik AJ: Доказательства присутствия рецепторов лютеинизирующего гормона и хорионического гонадотропина в пуповине свиньи. J Reprod Fertil. 1999, 117: 1-9. 10.1530 / jrf.0.1170001.
CAS PubMed Статья Google Scholar
Ohlsson R, Larsson E, Nilsson O, Wahlstrom T, Sundstrom P: Имплантация бластоцисты предшествует индукции экспрессии гена инсулиноподобного фактора роста II в трофобластах человека. Developm. 1989, 106: 555-559.
CAS Google Scholar
d’Hauterive SP, Berndt BS, Tsampalas M, Charlet-Renard C, Dubois M, Bourgain C, Hazout A, Foidart JB, Geenen V: Диалог между ХГЧ бластоцисты и рецептором ХГЧ / ЛГ эндометрия: Какая роль в имплантации ?.Gynecol Obstet Invest. 2007, 64: 156-160. 10.1159 / 000101740.
Артикул CAS Google Scholar
Джоши Н.Дж., Нандедкар Т.Д.: Эффекты внутриматочной инстилляции антисыворотки к ХГЧ на ранних сроках беременности у мышей. Acta Endocrinol. 1984, 107: 268-274.
CAS PubMed Google Scholar
Srisuparp S, Strakova Z, Fazleabas AT: Роль хорионического гонадотропина (CG) в имплантации бластоцисты.Arch Med Res. 2001, 32: 627-634. 10.1016 / S0188-4409 (01) 00330-7. 58. Eblan A, Bao S, Lei ZM, Nakajima ST, Rao CV 2001 Присутствие функционального рецептора лютеинизирующего гормона / хорионического гонадотропина в сперме человека J Clin Endocrinol Metab 86: 2643-2648
CAS PubMed Статья Google Scholar
Цампаласа М., Гриделета В., Берндт С., Фойдарт Дж. М., Джинена В., д’Отерив С.П .: Хорионический гонадотропин человека: гормон с иммунологическими и ангиогенными свойствами.J Repod Immunol. 2010
Google Scholar
d’Hauterive SP: Имплантация: первое перекрестное взаимодействие между эмбрионом и матерью. [http://hdl.handle.net/2268/28418/]
Лихт П., Руссу В., Вильдт Л.: О роли хорионического гонадотропина человека (ХГЧ) в эмбрио-эндометриальном микроокружении: последствия для дифференциация и имплантация. Semin Reprod Med. 2001, 19 (1): 37-47. 10.1055 / с-2001-13909.
CAS PubMed Статья Google Scholar
Lei ZM, Toth P, Rao CV, Pridham D: Новая коэкспрессия хорионического гонадотропина человека (ХГЧ) / рецепторов лютеинизирующего гормона человека и их лиганда ХГЧ в фаллопиевых трубах человека. J Clin Endocrinol Metab. 1993, 77: 863-872. 10.1210 / jc.77.3.863.
CAS PubMed Google Scholar
Рао CV: физиологическое и патологическое значение человеческих маточных рецепторов ХГЧ / ЛГ. J Soc Gynecol Invest. 2006, 13: 77-78. 10.1016 / j.jsgi.2005.12.005.
Артикул CAS Google Scholar
Gawronska B, Paukku T, Huhtaniemi I, Wasowicz G, Ziecik AJ: Эстроген-зависимая экспрессия рецепторов ХГЧ / ЛГ в маточной трубе свиньи и их роль в расслаблении яйцевода. J Reprod Fertil. 1999, 115: 293-301. 10.1530 / jrf.0.1150293.
CAS PubMed Статья Google Scholar
Licht P, Fluhr H, Neuwinger J, Wallwiener D, Wildt L: Участвует ли хорионический гонадотропин человека непосредственно в регуляции имплантации человека ?.Molec Cellul Endocrinol. 2007, 269: 85-92. 10.1016 / j.mce.2006.09.016.
CAS Статья Google Scholar
Fluhr H, Bischof-Islami D, Krenzer S, Licht P, Bischof P, Zygmunt M: Хорионический гонадотропин человека стимулирует матриксные металлопротеиназы-2 и -9 в цитотрофобластных клетках и снижает тканевый ингибитор металлопротеиназы-1 2 и -3 в децидуализированных стромальных клетках эндометрия. Fertil Steril. 2008, 90: 1390-1395.10.1016 / j.fertnstert.2007.08.023.
CAS PubMed Статья Google Scholar
Рейс Ф.М., Кобеллис Л., Луизи С., Дриул Л., Флорио П., Фалетти А., Петраглиа Ф .: Паракринный / аутокринный контроль женского воспроизводства. Гинекол Эндокринол. 2000, 14: 464-475. 10.3109 / 095135
167720.
CAS PubMed Статья Google Scholar
Ticconi C, Zicari A, Belmonte A, Realacci M, Rao ChV, Piccione E: Стимулирующие беременность действия ХГЧ в миометрии человека и плодных оболочках.Плацента. 2009, 28: S137-143. 10.1016 / j.placenta.2007.01.002.
Артикул CAS Google Scholar
Lei ZM, Rao CV, Kornyei J, Licht P, Hiatt ES: Новая экспрессия гена рецептора хорионического гонадотропина / лютеинизирующего гормона человека в головном мозге. Эндокринол. 1993, 132: 262-270. 10.1210 / en.132.5.2262.
Google Scholar
Рао CV: Иммуноцитохимическая локализация гонадотропных и гонадных стероидных рецепторов в шишковидной железе человека.J Clin Endocrinol Metab. 1997, 82: 2756-2757. 10.1210 / jc.82.8.2756-б.
CAS PubMed Статья Google Scholar
Wu H, Lustbader JW, Liu Y, Canfield RE, Hendrickson WA: Структура хорионического гонадотропина человека с разрешением 2,6 Å из анализа MAD селенометионилового белка. Состав. 1994, 2: 545-58. 10.1016 / S0969-2126 (00) 00054-Х.
CAS PubMed Статья Google Scholar
Hamade AL, Nakabayashi K, Sato A, Kiyoshi K, Takamatsu Y, Laoag-Fernandez JB, Ohara N, Maruo T. Трансфекция гена антисмыслового хорионического гонадотропина β в клетки хориокарциномы подавляет пролиферацию клеток и индуцирует апоптоз. J Clin Endocrinol Metab. 2005, 90: 4873-4879. 10.1210 / jc.2004-2458.
Артикул CAS Google Scholar
Коул Л.А.: Биологические функции гипергликозилированного ХГЧ. Хорионический гонадотропин человека (ХГЧ).Отредактировал: Коул Л.А. 2010, Elsevier, Oxford UK, Chapter 13
Google Scholar
Schuster N, Krieglstein K: Механизмы апоптоза, опосредованного TGF-β. Cell Tissue Res. 2002, 307: 1-14. 10.1007 / s00441-001-0479-6.
CAS PubMed Статья Google Scholar
Kamijo T, Rajabi MR, Mizunuma H, Ibuki Y: Биохимические доказательства аутокринной / паракринной регуляции апоптоза в культивируемых эпителиальных клетках матки во время имплантации эмбриона мыши in vitro.Molec Human Reprod. 1998, 4: 990-8. 10.1093 / моль / ч / 4.10.990.
CAS Статья Google Scholar
Pampferf S: Апоптоз периимплантационных эмбрионов грызунов: дифференциальная чувствительность внутренней клеточной массы и клонов клеток трофэктодермы — обзор. Плацента. 2000, 21: S3-S10. 10.1053 / plac.1999.0519.
Артикул Google Scholar
Shooner C, Caron PC, Fréchette-Frigon G, Leblanc V, Déry MC, Asselin E: экспрессия TGF-бета во время беременности крысы и активность в отношении выживаемости децидуальных клеток.Репрод Биол Эндокринол. 2005, 3: 20-10.1186 / 1477-7827-3-20.
PubMed Central PubMed Статья CAS Google Scholar
Liu YX, Gao F, Wei P, Chen XL, Gao HJ, Zou RZ, Siao LJ, Xu FH, Feng Q, Liu K, Hu ZY: участие молекул, связанных с ангиогенезом, протеолизом и апоптозом, в имплантация макакам-резусам и мышам. Контрацепция. 2005, 71: 249-62. 10.1016 / j.contraception.2004.12.008.
PubMed Статья CAS Google Scholar
Knittel T, Mehde M, Kobold D, Saile B, Dinter C, Ramadori G: паттерны экспрессии матриксных металлопротеиназ и их ингибиторов в паренхимных и непаренхимных клетках печени крыс, регулирующих TNF-альфа и TGF-beta1. J Hepatol. 1999, 30: 48-60. 10.1016 / S0168-8278 (99) 80007-5.
CAS PubMed Статья Google Scholar
Мерфи Дж., Рейнольдс Дж. Дж., Уизэм С. Е., Дочерти А. Дж., Энджел П., Хит Дж. К. Трансформирующий фактор роста бета модулирует экспрессию коллагеназы и ингибитора металиопротеиназы.Euro Molec Biol Org J. 1987, 6: 1899-1904.
Google Scholar
Qureshi HY, Sylvester J, El Mabrouk M, Zafarullah M: TGF-бета-индуцированная экспрессия тканевого ингибитора гена металлопротеиназы-3 в хондроцитах опосредуется внеклеточным сигнальным путем киназного пути и фактором транскрипции Sp1. J. Cell Physiol. 2005, 203: 345-52. 10.1002 / jcp.20228.
CAS PubMed Статья Google Scholar
Stetler-Stevenson WG, Brown PD, Onisto M, Levy AT, Liotta LA: Тканевый ингибитор экспрессии мРНК металлопротеиназы-2 (TIMP-2) в линиях опухолевых клеток и опухолевых тканях человека. J Biol Chem. 1990, 265: 13933-13938.
CAS PubMed Google Scholar
Прингл К., Робертс К. Новый свет на раннюю постимплантационную беременность у мышей: роль инсулиноподобного фактора роста-II (IGF-II) ?. Плацента. 2007, 28: 286-97. 10.1016 / j.плацента.2006.04.006.
CAS PubMed Статья Google Scholar
Hwang JH, Koh SH, Han DI, Chung SR, Park MI, Hwang YY, Jang SJ: Экспрессия трансформирующего фактора роста-1, 2 в децидуальной оболочке на ранних сроках беременности: Сравнение decidua basalis и decidua париеталис. Корейский J Obstet Gynecol. 2001, 44: 1145-9.
Google Scholar
Кингсли-Каллесен М., Джонсон Л., Шольц Б., Келли Д., Риццино А: Регуляция транскрипции гена TGF-бета 2 в клетках хориокарциномы и клетках карциномы молочной железы: Дифференциальное использование цис-регуляторных элементов.In vitro Cell Dev Bio Anim. 1997, 33: 294-301. 10.1007 / s11626-997-0050-1.
CAS Статья Google Scholar
Стаун-Рам Э., Шалеу Э. Функция человеческого трофобласта в процессе имплантации. Репрод Биол Эндокринол. 2005, 3: 56-68. 10.1186 / 1477-7827-3-56.
PubMed Central PubMed Статья CAS Google Scholar
Фишер SJ, Tian-yi C, Li Z, Hartman L, Grahl K, Zhang G-Y, Tarpey J, Damsky CH: Адгезивные и деградационные свойства клеток плацентарного цитотрофобласта человека in vitro.J Cell Biol. 1989, 109: 891-902. 10.1083 / jcb.109.2.891.
CAS PubMed Статья Google Scholar
Коул Л.А., Ханлиан С.А., Райли Дж. М., Батлер С.А.: Гипергликозилированный ХГЧ (ХГЧ-Н) при гестационной имплантации, а также при хориокарциноме и опухолевых заболеваниях зародышевых клеток яичка. J Reprod Med. 2006, 51: 919-929.
CAS PubMed Google Scholar
Lei ZM, Taylor DD, Gercel-Taylor C, Rao CV: Хорионический гонадотропин человека способствует онкогенезу клеток JAR хориокарциномы. Troph Res. 1999, 13: 147-159.
CAS Google Scholar
Norwitz ER, Schust DJ, Fisher SJ: Имплантация и выживаемость на ранних сроках беременности. N Engl J Med. 2001, 345: 1400-8. 10.1056 / NEJMra000763.
CAS PubMed Статья Google Scholar
Jauniaux E, Poston L, Burton GJ: Связанное с плацентой заболевание беременности: участие оксидантного стресса и последствия для эволюции человека. Обновление Hum Reprod. 2006, 12: 747-56. 10.1093 / humupd / dml016.
PubMed Central CAS PubMed Статья Google Scholar
Ковалевская Г., Биркен С., Какума Т., Одзаки Н., Зауэр М., Линдхейм С., Коэн М., Келли А., Шлаттерер Дж., О’Коннор Дж. Ф .: Дифференциальная экспрессия хорионического гонадотропина (ХГЧ) в изоформах гликозилирования неудачные и продолжающиеся беременности: предварительная характеристика гипергликозилированного эпитопа ХГЧ.J Endocrinol. 2002, 172: 497-506. 10.1677 / joe.0.1720497.
CAS PubMed Статья Google Scholar
Burton GJ: Плацентарный оксидативный стресс: от выкидыша до преэклампсии. J Soc Gyn Invest. 2004, 11: 342-52. 10.1016 / j.jsgi.2004.03.003.
CAS Статья Google Scholar
Салас СП: Что вызывает преэклампсию ?. Clin Obstet Gyncol.1999, 13: 141-57.
Google Scholar
Bahado-Singh RO, Oz U, Isozaki T, Seli E, Kovanci E, Hsu CD, Cole LA: Уровни ядра β-субъединицы мочи в середине триместра и последующее развитие преэклампсии. Am J Obstet Gynecol. 1998, 179: 738-741. 10.1016 / S0002-9378 (98) 70074-2.
CAS PubMed Статья Google Scholar
Коул Л.А.: Структуры свободной α-субъединицы и свободной β-субъединицы.Хорионический гонадотропин человека (ХГЧ). Отредактировал: Коул Л.А. 2010, Elsevier, Oxford UK, Chapter 7
Google Scholar
Valmu L, Alfthan H, Hotakainen K, Birken S, Stenman UH: Сайт-специфический гликановый анализ β-субъединицы хорионического гонадотропина человека от злокачественных новообразований и беременности методом жидкостной хроматографии — масс-спектрометрии с электрораспылением. Гликобиология. 2006, 16: 1207-1218. 10.1093 / гликоб / cwl034.
CAS PubMed Статья Google Scholar
Acevedo HF, Tong JY, Hartsock RJ: Заявление гена субъединицы хорионического гонадотропина-бета человека в культивируемых человеческих эмбриональных и раковых клетках различного типа и происхождения. Рак. 1995, 76: 1467-1475. 10.1002 / 1097-0142 (19951015) 76: 8 <1467 :: AID-CNCR2820760826> 3.0.CO; 2-A.
CAS PubMed Статья Google Scholar
Acevedo HF, Hartstock RJ: Метастатический фенотип коррелирует с высокой экспрессией мембраносвязанного полного β-хорионического гонадотропина человека in vivo.Рак. 1996, 78: 2388-2399. 10.1002 / (SICI) 1097-0142 (19961201) 78:11 <2388 :: AID-CNCR18> 3.0.CO; 2-X.
CAS PubMed Статья Google Scholar
Li D, Wen X, Ghali L, Al-Shalabi FM, Docherty SM, Purkis P, Iles RK: экспрессия hCGβ плоскоклеточной карциномой шейки матки — гистологическая связь in vivo с инвазией опухоли и апоптозом. Гистопатология. 2008, 53: 147-155. 10.1111 / j.1365-2559.2008.03082.x.
CAS PubMed Статья Google Scholar
Iles RK: Эктопическая экспрессия hCGβ эпителиальным раком: метастазирование злокачественного поведения и ингибирование апоптоза опухолевых клеток. Molec Cellul Endocrinol. 2007, 260: 264-270. 10.1016 / j.mce.2006.02.019.
Артикул CAS Google Scholar
Ильес РК: Хорионический гонадотропин человека и его фрагменты как маркеры прогноза рака мочевого пузыря. Там Марк Upd. 1995, 7: 161-166.
Google Scholar
Cole LA: фрагмент β-ядра (UGP или UGF β-ядра). Там Марк Upd. 1994, 6: 69-75.
Google Scholar
Mountzouris G, Yannapoulis D, Barbatis C, Zaharof A, Theodorou C: Производство β-хорионического гонадотропина человека переходно-клеточной карциномой мочевого пузыря маркером агрессивного заболевания и устойчивости к лучевой терапии ?. Br J Urol. 1993, 72: 907-909. 10.1111 / j.1464-410X.1993.tb16294.x.
Артикул Google Scholar
Батлер С.А., Ильес РК: Внематочная секреция β-хорионического гонадотропина человека эпителиальными опухолями и индуцированный β-хорионическим гонадотропином апоптоз при саркоме Карпози Есть ли связь ?. Clin Cancer Res. 2003, 9: 4666-4673.
CAS PubMed Google Scholar
Bellet D, Lazar V, Bleche I, Paradis V, Giovangrandi Y, Paterliru P: Злокачественная трансформация нетрофобластных клеток в ассоциации с экспрессией генов хорионического гонадотропина β, обычно транскрибируемых в трофобластных клетках.Cancer Res. 1997, 57: 516-523.
CAS PubMed Google Scholar
Cosgrove DE, Campain JA, Cox GS: Синтез хорионического гонадотропина линиями опухолевых клеток человека: исследование устойчивых уровней накопления субъединиц мРНК и структуры гена. Biochem Biophys Acta. 1989, 1007: 44-54.
CAS PubMed Google Scholar
Батлер С.А., Икрам М.С., Матье С., Ильес Р.К. Увеличение популяции клеток карциномы мочевого пузыря, индуцированное свободной бета-субъединицей ХГЧ, является результатом антиапоптозного эффекта, а не пролиферации клеток.Брит Дж. Рак. 2000, 82: 1553-1556. 10.1054 / bjoc.2000.1177.
PubMed Central CAS PubMed Статья Google Scholar
Коул Л.А., Перини Ф., Биркен С., Руддон Р.В.: Олигосахарид О-связанного типа отличает свободную форму альфа-субъединицы ХГЧ от комбинированной. Biochem Biophys Res Comm. 1984, 122: 1260-1267. 10.1016 / 0006-291X (84)
CAS PubMed Статья Google Scholar
Gillott DJ, Iles RK, Chard T: Влияние хорионического гонадотропина человека на саркому карпоза, вызванную СПИДом. N Engl J Med. 1996, 335: 1261-1269. 10.1056 / NEJM199610243351702.
Артикул Google Scholar
Делвес П.Дж., Ильес Р.К., Ройтт И.М., Лунд Т.: Разработка нового поколения вакцин против ХГЧ для лечения рака. Molec Cellular Endocrinol. 2007, 260: 276-281. 10.1016 / j.mce.2006.02.018.
Артикул CAS Google Scholar
Делвес П.Дж., Ройтт И.М.: Вакцины для контроля воспроизводства — статус у млекопитающих и аспекты, представляющие сравнительный интерес. Developm Biologic. 2005, 121: 265-273.
CAS Google Scholar
Guan QD, Wang Y, Chu YW, Wang LX, Ni J, Guo Q, Xiong SD: отчетливые эффекты трех тандемных повторов C3d в иммунных ответах против ассоциированного с опухолью антигена hCGbeta посредством иммунизации ДНК. Cancer Immunol Immunother. 2007, 56: 875-884.10.1007 / s00262-006-0238-3.
CAS PubMed Статья Google Scholar
Иверсен П.Л., Моурич Д.В., Моултон Х.М.: Моноклональные антитела к двум эпитопам β-хорионического гонадотропина человека для лечения рака. Cur Opin Molec Therap. 2003, 5: 156-160.
CAS Google Scholar
Moulton HM, Yoshihara PH, Mason DH, Iversen PL, Triozzi PL: Активная специфическая иммунотерапия с использованием пептидной вакцины β-хорионического гонадотропина человека у пациентов с метастатическим колоректальным раком: ответ антител связан с улучшением выживаемости.Clin Cancer Res. 2002, 8: 2044-2051.
CAS PubMed Google Scholar
Картер В.Б., Сехарем М., Коппола Д.: Хорионический гонадотропин человека вызывает апоптоз при раке молочной железы. Лечение рака груди. 2006, 100: S243-S244.
Google Scholar
Khoo NK, Bechberger JF, Shepherd T, Bond SL, McCrae KR, Hamilton GS, Lala PK: SV40 Tag Преобразование нормального инвазивного трофобласта приводит к предраковому фенотипу I. инвазивное действие TGFβ.Международный Рак. 1998, 77: 429-39. 10.1002 / (SICI) 1097-0215 (19980729) 77: 3 <429 :: AID-IJC20> 3.0.CO; 2-1.
CAS Статья Google Scholar
Khoo NK, Bechberger JF, Shepherd T, Bond SL, McCrae KR, Hamilton GS, Lala PK: SV40 Tag Преобразование нормального инвазивного трофобласта приводит к предраковому фенотипу I. инвазивное действие TGFβ. Международный Рак.1998, 77: 429-39. 10.1002 / (SICI) 1097-0215 (19980729) 77: 3 <429 :: AID-IJC20> 3.0.CO; 2-1.
CAS Статья Google Scholar
Кармакар С., Дас С: Регулирование инвазии трофобластов IL-1β и TGF-β1. Am J Reprod Immunol. 2002, 48: 210-219. 10.1034 / j.1600-0897.2002.01151.x.
PubMed Статья Google Scholar
Грэм Ч., Лала ПК: Механизм контроля инвазии трофобластов in situ.J. Cell Physiol. 1991, 148: 228-34. 10.1002 / jcp.1041480207.
CAS PubMed Статья Google Scholar
Смит А. Характеристика TGFβ-чувствительной клеточной линии, полученной из трофобласта человека. Плацента. 2001, 22: 425-431. 10.1053 / plac.2001.0653.
CAS PubMed Статья Google Scholar
Стаун-Рам Э., Шалеу Э .: Функция человеческого трофобласта в процессе имплантации.Репрод Биол Эндокринол. 2005, 3: 56-10.1186 / 1477-7827-3-56.
PubMed Central PubMed Статья CAS Google Scholar
Батлер С.А., Стэйт Э.М., Ильес РК: Снижение роста клеток рака мочевого пузыря в ответ на сыворотку мыши, вакцинированную ХГЧ бета CTP37. Oncol Res. 2003, 14: 93-100.
CAS PubMed Google Scholar
Асеведо Х.Ф., Слифкин М., Пуше Г.Р., Пардо М.: Иммунохимическая локализация хориогонадотропиноподобного белка в бактериях, выделенных от больных раком.Рак. 1978, 41: 1217-29. 10.1002 / 1097-0142 (197804) 41: 4 <1217 :: AID-CNCR2820410401> 3.0.CO; 2-A.
CAS PubMed Статья Google Scholar
Backus BT, Affronti LF: ассоциированные с опухолью бактерии, способные продуцировать вещество, подобное хориогонадотропину человека. Заражение иммунной. 1981, 32: 1211-15.
PubMed Central CAS PubMed Google Scholar
Маруо Т., Сегал С.Дж., Койде С.С.: Исследования очевидного человеческого хорионического гонадотропного фактора у краба Ovalipes ocellatus. Эндокринол. 1979, 104: 932-9. 10.1210 / эндо-104-4-932.
CAS Статья Google Scholar
Коул Л.А., Мюллер Y: ХГЧ в лечении трофобластических заболеваний гестации в состоянии покоя и химиорезистентности. Gyn Oncol. 2010, 116: 3-9. 10.1016 / j.ygyno.2009.09.028.
CAS Статья Google Scholar
Коул Л.А., Лейдлер Л.Л.: Унаследованный ХГЧ. J Reprod Med. 2010, 55: 99-102.
CAS PubMed Google Scholar
Matsuura S, Ohashi M, Chen HC, Shownkeen RC, Hartree AS, Reichert LE, Stevens VC, Powell JE: Физико-химическая и иммунологическая характеристика ХГЧ-подобного вещества из гипофиза человека. Природа. 1980, 286: 740-1. 10.1038 / 286740a0.
CAS PubMed Статья Google Scholar
Коул Л.А., Ханлиан С.А., Мюллер К.Ю.: Обнаружение ХГЧ в пери- или постменопаузе — ненужный источник тревоги. Am J Obstet Gynecol. 2008, 198: 275-9. 10.1016 / j.ajog.2007.09.034.
PubMed Google Scholar
Коул Л.А., Сасаки Ю., Мюллер К.Ю.: Нормальное производство ХГЧ в менопаузе: дилемма медицинского управления. N Eng J Med. 2007, 356: 1184-6. 10.1056 / NEJMc066500.
CAS Статья Google Scholar
Gronowski AM, Fantz CR, Parvin CA, Sokoll LJ, Wiley CL, Wener MH, Grenache D: Использование сывороточного ФСГ для выявления женщин в перименопаузе с гипофизарным ХГЧ. Clin Chem. 2008, 54: 652-6. 10.1373 / Clinchem.2007.100305.
CAS PubMed Статья Google Scholar
Коул Л.А., Ханлиан С.А.: Неправильное ведение женщин с устойчиво низкими результатами ХГЧ. J Reprod Med. 2004, 49: 423-32.
PubMed Google Scholar
Birken S, Maydelman Y, Gawinowicz MA, Pound A, Liu Y, Hartree AS: Выделение и характеристика хорионического гонадотропина гипофиза человека. Эндокринол. 1996, 137: 1402-11. 10.1210 / en.137.4.1402.
CAS Google Scholar
Hoermann R, Spoettl G, Moncayo R, Mann K: Доказательства присутствия человеческого хорионического гонадотропина (ХГЧ) и свободной бета-субъединицы ХГЧ в гипофизе человека. J Clin Endocrinol Metab. 1990, 71: 179-86.10.1210 / jcem-71-1-179.
CAS PubMed Статья Google Scholar
Оделл В.Д., Гриффин Дж .: Пульсирующая секреция хорионического гонадотропина человека у здоровых взрослых. N Engl J Med. 1987, 317: 1688-91. 10.1056 / NEJM198712313172702.
CAS PubMed Статья Google Scholar
Оделл В.Д., Гриффин Дж .: Пульсирующая секреция хорионического гонадотропина во время нормального менструального цикла.J Clin Endocrinol Metab. 1989, 69: 528-32. 10.1210 / jcem-69-3-528.
CAS PubMed Статья Google Scholar
Policastro PF, Daniels-McQueen S, Carle G, Boime I: карта кластера генов бета-ЛГ бета ХГЧ. J Biol Chem. 1986, 13: 5907-5916.
Google Scholar
Gougeon A: Динамика роста фолликулов у человека: Модель на основе предварительных результатов.Репродукция человека. 1986, 1: 81-7.
CAS Google Scholar
Богович К., Ричардс Дж. С., Райхерт Л. Е.: Обязательная роль лютеинизирующего гормона (ЛГ) в инициации преовуляторного роста фолликулов у беременных крыс: специфические эффекты хорионического гонадотропина человека и фолликулостимулирующего гормона на рецепторы ЛГ и стероидогенез в теках, гранулезных и лютеиновых клетках. Эндокринол. 1981, 109: 860-7. 10.1210 / эндо-109-3-860.
CAS Статья Google Scholar
Motola S, Popliker M, Tsafriri A: Стероиды, обязательные медиаторы ХГЧ / ЛГ, вызывают возобновление мейоза у млекопитающих ?. Биол Репрод. 2007, 77: 167-8.
Google Scholar
Hegele-Hartung C, Grütznera M, Lessla M, Grøndahl C, Ottesen JL, Brännström M: Активация мейотического созревания в ооцитах крыс после обработки стерином, активирующим мейоз фолликулярной жидкости in vitro и ex vivo.Биол Репрод. 2001, 64: 418-24. 10.1095 / биолрепрод64.2.418.
CAS PubMed Статья Google Scholar
Робкера Р.Л., Расселла Д.Л., Йошиокаб С., Шармаа С.К., Лидона Дж. П., О’Маллея Б.В., Эспейб Л.Л., Ричардс Дж.С.: Овуляция: многогенный, многоступенчатый процесс. Стероиды. 2000, 65: 559-70. 10.1016 / S0039-128X (00) 00114-8.
Артикул Google Scholar
Батлер Т.А., Чжу С., Мюллер Р.А., Фуллер Г.К., Лемэр В.Дж., Весснер Дж.Ф.: Ингибирование овуляции в перфузируемом яичнике крысы синтетическим ингибитором коллагеназы SC 44463.Биол Репрод. 1991, 44: 1183-8. 10.1095 / биолрепрод44.6.1183.
CAS PubMed Статья Google Scholar
Акоста Дж. Т., Миямото А: Сосудистый контроль функции яичников: овуляция, формирование и регресс желтого тела. Anim Reprod Sci. 2004, 82-83. 127-40
Google Scholar
Налбандов А.В., Бахр Ю.М.: Овуляция, формирование желтого тела и стероидогенез.Basic Life Sci. 1974, 4: 399-407.
CAS PubMed Google Scholar
Hartree AS, Shownkeen RC, Stevens VC, Matsuura S, Ohashi M, Chen H-C: Исследования человеческого хорионического гонадотропного вещества гипофиза человека и его значение. J Clin Endocrinol Metab. 1983, 96: 115-26.
CAS Google Scholar
Коул Л.А.: Индивидуальные отклонения концентрации ХГЧ во время беременности.Am J Obstet Gynecol. 2010
Google Scholar
Коул Л.А., Ладнер Д.Г., Бирн Ф.В.: Нормальные изменения менструального цикла и менструального цикла, ведущего к беременности. Fertil Steril. 2009, 91: 522-527. 10.1016 / j.fertnstert.2007.11.073.
CAS PubMed Статья Google Scholar
Madsen BW: Запасные рецепторы. Clin Exper Pharm Phys. 1979, 6: 713-714.10.1111 / j.1440-1681.1979.tb00049.x.
CAS Статья Google Scholar
Siebers JW, Wuttke W, Engel W: связывание ХГЧ яичника крысы во время беременности. Acta Endocrinol. 1977, 86: 173-179.
CAS PubMed Google Scholar
Марунака М., Нийсато Н., Миядзаки Х .: Новая концепция запасных рецепторов и эффекторов. J Membr Biol. 2005, 203: 31-35.10.1007 / s00232-004-0729-0.
CAS PubMed Статья Google Scholar
Хан С.В., Лей З.М., Рао К.В.: Гомологическое подавление рецепторов лютеинизирующего гормона / хорионического гонадотропина за счет увеличения деградации транскриптов рецепторов в стромальных клетках эндометрия матки человека. Биол Репрод. 1997, 57: 158-164. 10.1095 / биолрепрод57.1.158.
CAS PubMed Статья Google Scholar
Rao CV, Sanfillippo JS: Новое понимание биохимии имплантации. Возможные прямые роли лютеинизирующего гормона и хорионического гонадотропина человека. Эндокринолог. 1997, 7: 107-111. 10.1097 / 00019616-199707020-00007.
Артикул Google Scholar
Jauniaux E, Bao S, Eblen A, Li X, Liu ZM, Meuris S, Rao ChV: концентрация ХГЧ и экспрессия гена рецептора в ткани плаценты при трисомии 18 и 21. Molec Human Reprod.2000, 6: 5-10. 10,1093 / мольхр / 6.1.5.
CAS Статья Google Scholar
Коул Л.А.: Новые открытия в биологии и обнаружении хорионического гонадотропина человека. Репрод Биол Эндокринол. 2009, 7: 1-37. 10.1186 / 1477-7827-7-8.
Артикул CAS Google Scholar
Рао CV: Дифференциальные свойства связывания хорионического гонадотропина человека и лютеинизирующего гормона человека с плазматическими мембранами желтого тела крупного рогатого скота.Acta Endocrinol. 1979, 90: 696-710.
CAS PubMed Google Scholar
Dufau ML, Kusuda S: Очистка и характеристика яичниковых рецепторов ХГЧ / ЛГ и пролактина. J Recept Res. 1987, 7: 167-193.
CAS PubMed Google Scholar
Jia XC, Oikawa M, Bo M, Tanaka T., Ny T., Boime I, Hsueh AJ: Экспрессия рецептора лютеинизирующего гормона человека (LH): взаимодействие с LH и хрионическим гонадотропином человека, но не лошади, виды крыс и овец.Мол Эндокринол. 1991, 5: 759-768. 10.1210 / mend-5-6-759.
CAS PubMed Статья Google Scholar
Сегалофф Д.Л., Асколи М: Рецептор лутропина / хориогонадотропина — 4 года спустя. Endocr Rev.1993, 14: 324-347.
CAS PubMed Google Scholar
McFarland RC, Sprengel R, Phillips HS, Kohler M, Resemblit N, Nikolics R, Segaloff DL, Seeburg PH: Рецептор лютопина-хориогонадотропина: необычный член семейства рецепторов, связанных с G-белком.Наука. 1989, 245: 494-499. 10.1126 / science.2502842.
CAS PubMed Статья Google Scholar
Ascoli M, Fanelli F, Segaloff DL: Рецептор лутропина / хориогонадотропина, перспектива 2002 года. Endocr Rev.2002, 23: 141-174. 10.1210 / er.23.2.141.
CAS PubMed Статья Google Scholar
Fanelli F, Puett D: Структурные аспекты рецептора лютеинизирующего гормона.Эндокринная. 2002, 18: 285-293. 10.1385 / ENDO: 18: 3: 285.
CAS PubMed Статья Google Scholar
Fanelli F, Themman APN, Puett D: Функция рецептора лутропина: выводы из естественных, искусственно созданных и смоделированных на компьютере мутаций. Международный союз биохимии Molec Bio Life. 2001, 51: 149-155. 10.1080 / 152165401753544214.
CAS Статья Google Scholar
Пуэтт Д., Ли Й., Агелова К., ДеМарс Г., Михан Т.П., Ганелли Ф., Нараян П. Взаимосвязи между структурой и функцией рецептора лютеинизирующего гормона. Ann New York Acad Sci. 2005, 1061: 41-54. 10.1196 / Анналы.1336.006.
CAS Статья Google Scholar
McFarland KC, Sprengel R, Phillips HS, Kohler M, Rosemblit N, Nikolies K, Segaloff DL, Seeburg PH: Рецептор лутропина и хориогонадотропина: необычный член семейства рецепторов, связанных с G-белками.Наука. 1989, 245: 494-499. 10.1126 / science.2502842.
CAS PubMed Статья Google Scholar
Loosfelt H, Salesse R, Jallal B, Garnier J, Milgrom E: Клонирование и секвенирование кДНК рецептора LH-hCG свиньи: варианты без трансмембрантного домена. Наука. 1989, 245: 525-528. 10.1126 / science.2502844.
CAS PubMed Статья Google Scholar
Ангелова К., Фанелли Ф., Пуэтт Д.: Модель конститутивной активации рецептора лутропина, основанная на молекулярном моделировании и сконструированных мутациях в трансмембранных спиралях 6 и 7. J Biol Chem. 2002, 277: 32202-32213. 10.1074 / jbc.M203272200.
CAS PubMed Статья Google Scholar
Ангелова К., Нараян П., Саймон Дж. П., Пуэтт Д.: Функциональная роль трансмембранной спирали 7 в активации рецептора гепталического лутропина.Мол Эндокринол. 2000, 14: 459-471. 10.1210 / me.14.4.459.
CAS PubMed Статья Google Scholar
Davis JS, Westa LA, Weaklanda LL, Faresea RV: Хорионический гонадотропин человека активирует внутриклеточную сигнальную систему инозитол 1,4,5-трифосфат-Ca2 + в лютеиновых клетках крупного рогатого скота. Письма FEBS. 1986, 208: 287-291. 10.1016 / 0014-5793 (86) 81034-1.
CAS PubMed Статья Google Scholar
Guderman T, Birnbaumer M, Birnbaumer L: Доказательства двойного связывания рецептора лютеинизирующего гормона с аденилилциклазой и расщеплением фосфоинозитидов и мобилизацией Ca2 +. J Biol Chem. 1992, 267: 4479-4488.
Google Scholar
Кейн Н., Келли Е., Филиппа Сондерс Т.К., Кричли ХОД: пролиферация маточных естественных клеток-киллеров индуцируется ХГЧ и опосредуется рецептором маннозы. Эндокринол. 2009, 150: 2882-2888.10.1210 / en.2008-1309.
CAS Статья Google Scholar
Влияние беременности на динамику роста нейрофибром при нейрофиброматозе 1 типа
Аннотация
Введение
У пациентов с нейрофиброматозом 1 типа (NF1) развиваются плексиформные нейрофибромы (PNF) и кожные нейрофибромы. Эти опухоли являются основной причиной заболеваемости и смертности пациентов. Было высказано предположение о влиянии эстрогена и прогестерона на рост опухоли, но сообщения о росте или злокачественной трансформации опухолей во время беременности остаются анекдотическими.Целью этого исследования было количественное определение роста кожных и плексиформных нейрофибром у пациенток с NF1 во время беременности и оценка появления симптомов, связанных с NF1.
Материалы и методы
Ретроспективно, 13 матерей с NF1 были включены и сравнивались с первородящими, нерожавшими, женщинами того же возраста с NF1. Все женщины прошли магнитно-резонансную томографию (МРТ) всего тела до и после беременности или после соответствующего периода времени. Оценивали наличие плексиформных и кожных нейрофибром.PNF подвергали полуавтоматической волюметрии (MedX). Сумма самых длинных диаметров (SLD) репрезентативных кожных нейрофибром была определена для обеих групп. Оценивались клинические симптомы и субъективный рост опухоли.
Результаты
PNF выявлено у 12 из 26 женщин (46,2%). Последующее наблюдение не выявило ни новых PNF, ни значительных различий в скорости роста (средний рост опухоли в год: беременная группа — 0,38% (IQR -1,1–5,4%) по сравнению с контрольной группой 3,59% (IQR -2,1–5,5%; P ) = 0.69). Злокачественной трансформации PNF не наблюдалось. Наблюдался значительный рост кожных нейрофибром в обеих группах (среднее увеличение SLD: беременная группа 17 мм; P = 0,0026 / контрольная группа 12 мм; P = 0,0004). Разница в увеличении SLD не была значимой ( P = 0,48). Единичные кожные нейрофибромы в группе беременных показали высокий уровень роста опухоли (> 20% / год). Симптомы, связанные с NF1, и субъективный рост опухоли у беременных существенно не увеличивались.
Выводы
Рост плексиформных и кожных нейрофибром у беременных существенно не отличается по сравнению с небеременными пациентами. Кожные нейрофибромы демонстрируют значительное увеличение роста с течением времени как у беременных, так и у небеременных пациенток, а клинические симптомы, связанные с NF1, существенно не усугубляются во время беременности.
Образец цитирования: Well L, Jaeger A, Kehrer-Sawatzki H, Farschtschi S, Avanesov M, Sauer M, et al.(2020) Влияние беременности на динамику роста нейрофибром при нейрофиброматозе 1 типа. PLoS ONE 15 (4): e0232031. https://doi.org/10.1371/journal.pone.0232031
Редактор: Фрэнк Т. Спрэдли, Медицинский центр Университета Миссисипи, США
Поступила: 24 января 2020 г .; Одобрена: 6 апреля 2020 г .; Опубликовано: 28 апреля 2020 г.
Авторские права: © 2020 Well et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Это исследование было поддержано грантом «Bundesverband Neurofibromatose e.V.» Иоганну М. Саламону (https://bv-nf.de/). Спонсор не имел никакого отношения к дизайну исследования, сбору и анализу данных, принятию решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Нейрофиброматоз 1 типа (NF1) — это аутосомно-доминантно наследуемый синдром предрасположенности к опухоли, встречающийся у 1 на 2500 новорожденных [1]. Отличительной чертой NF1 является развитие нейрофибром, например кожные нейрофибромы (NF) и плексиформные нейрофибромы (PNF) [2,3]. Большие PNF могут вызывать неврологические, скелетные, сосудистые или обструктивные аномалии [4]. Рост PNF обратно коррелирует с возрастом пациентов, демонстрируя значительный рост более 20% в год у пациентов в возрасте до 18 лет [5].Кроме того, большой объем опухоли всего тела связан с повышенным ростом опухоли [5]. Предполагаемые факторы риска для большого объема опухоли всего тела — женский пол и большое количество подкожных нейрофибром [6,7]. PNF может трансформироваться в злокачественные опухоли оболочки периферических нервов (MPNST) у 8–13% пациентов с NF1 [8]. MPNST являются основной причиной смерти пациентов с NF1, и было показано, что большой объем опухоли всего тела является фактором риска злокачественной трансформации [9,10]. Таким образом, пациенты с NF1 неоднократно проходят магнитно-резонансную томографию (МРТ) всего тела для оценки опухолевой нагрузки и злокачественной трансформации [11,12]
Было высказано предположение, что беременность у пациенток с NF1 может вызывать увеличение объема как кожных, так и подкожных нейрофибром [13,14].Dugoff и др. Сообщили, что 52,4% женщин заметили рост ранее существовавших нейрофибром во время беременности [13]. Отдельные данные указывают на возможность увеличения размера PNF во время беременности с последующим послеродовым регрессом [15]. Потенциальной причиной изменения объема опухоли во время беременности является гормонозависимый рост [16,17]. Исследования in vitro показали, что большинство нейрофибром экспрессируют рецепторы прогестерона [18] и что воздействие на ксенотрансплантаты опухоли эстрогена или прогестерона приводит к гетерогенным эффектам на пролиферацию и апоптоз [16,19].Кроме того, сообщалось о значительном росте нейрофибром у пациентов, принимавших высокие дозы синтетических прогестероновых депо-контрацептивов [20]. Другие эффекты беременности у пациентов с NF1 включают повышенный риск гестационной гипертензии, преэклампсии, задержки внутриутробного развития или преждевременных родов, что приводит к общей повышенной заболеваемости пациентов с NF1 по сравнению с пациентами без NF1 [13,21,22]. Точная оценка и количественная оценка роста опухолей, связанных с беременностью, и связанных рисков желательна, поскольку более глубокое понимание динамики роста PNF во время беременности представляет собой неудовлетворенную клиническую потребность.
Таким образом, целью данного исследования было количественное определение роста кожных и плексиформных нейрофибром у пациенток с NF1 во время беременности и оценка клинических симптомов, связанных с NF1.
Материалы и методы
Это ретроспективное исследование, соответствующее Закону о переносимости и подотчетности медицинского страхования (HIPAA), было одобрено Комиссией по этическому надзору Ärztekammer Hamburg и соответствовало местным руководящим принципам защиты данных, а также Декларации Хельсинки.Письменное информированное согласие было получено от всех участников.
Изученная популяция NF1
Мы исследовали 13 пациенток NF1 до и после беременности (группа беременных; средний возраст при родах 25,3 года; SD ± 5,88 лет; диапазон 17–37 лет) и контрольную группу женщин соответствующего возраста (контрольная группа, средний возраст 24,6 года; SD ± 6,04 года; диапазон 16–36 лет) нерожавших, нерожавших женщин с NF1. Критериями включения были: выполнение диагностических критериев NF1 Национального института здоровья (NIH) [23], наличие в анамнезе беременности или отсутствия беременности в контрольной группе, а также наличие МРТ всего тела, выполненных до и после беременности или после подобранной период времени в контрольной группе.Критерии исключения: невозможность пройти МРТ или пропуск МРТ до или после беременности. Срок клинического наблюдения для исключения злокачественной трансформации PNF составлял не менее 18 месяцев. Результаты скрининга мутаций гена нейрофибромина были доступны для 11/13 пациенток из группы беременных и для 12/13 пациенток из контрольной группы (таблица S1) .
МРТ-исследований были выполнены за 35,3 месяца (стандартное отклонение ± 22,7 месяца; диапазон 11–55 месяцев) и 36.9 месяцев после (стандартное отклонение ± 36,9 месяцев; диапазон 6–108 месяцев) беременности. Средний общий период наблюдения в группе беременных составил 60,9 месяца (стандартное отклонение ± 60,9 месяца; диапазон 24–123 месяцев) по сравнению с 51,8 месяца (стандартное отклонение 24,5 ± диапазон 23–101 месяца) в контрольной группе. Общая сумма наблюдаемых пациенто-лет составила 142,7 пациенто-лет.
Получение изображения
МРТ всего тела была выполнена при 1,5 Тл (Siemens Magnetom, Siemens Healthineers, Эрланген, Германия) в период с сентября 2014 г. по июль 2017 г. МРТ-последовательности включали коронарный T1w TSE (TR 731 мс; TE 11 мс; FA 160 °; матрица 512×448; Поле зрения 500×400 мм; толщина среза 7 мм; зазор пересечения 8.8 мм), T2w TIRM коронковой (TR 4000 мс; TE 45 мс; FA 130 °; матрица 384×384; FOV 499×399 мм; толщина среза 7 мм; зазор 8,8 мм), T2w HASTE TIRM осевой (TR 1200 мс; TE 85 мс, FA 148 °; матрица 384×384 ; FOV 450×450 мм; толщина среза 8 мм; зазор пересечения 10 мм) и T2w TSE sagittal (TR 4600ms; TE 96ms; FA 160 °; Matrix 512×504; FOV 350×320 мм; толщина среза 3 мм; зазор пересечения 3,3 мм) последовательностей. Внутривенное введение контрастного вещества не применялось.
Анализ изображения и объемность
Все обследования оценивались на предмет наличия PNF или NF.PNF были определены на основании их характерного внешнего вида в виде полилобулированных масс с интенсивным сигналом на T2-взвешенных последовательностях с ростом вдоль периферических нервов [5,24]. Кожная или подкожная НФ определялась как единичные поражения округлой формы, локализованные на коже или подкожно, со случайным распределением, сильно гиперинтенсивным сигналом на T2-взвешенных и гипоинтенсивных сигналах на T1-взвешенных последовательностях [24,25].
Волюметрию PNF проводили на изображениях, взвешенных по T2, с использованием программного обеспечения MedX (v.3.42). MedX использует полуавтоматический метод на основе эвристики для сегментации и измерения [26]. Различия в интенсивности сигналов в окружающих тканях (низкая интенсивность) и опухолях (высокая интенсивность) используются для определения границ опухоли на каждом осевом срезе. После этого выполняется автоматический расчет объема. Эта объемная оценка чувствительна и воспроизводима, давая результаты, аналогичные результатам ручного отслеживания [26] (Рис. 1) . Если автоматическое отслеживание границ было невозможно для конкретной опухоли, выполнялось отслеживание вручную.
Рис. 1. Иллюстрация процесса волюметрии.
Корональные Т2-взвешенные STIR-изображения 18-летнего пациента с нейрофиброматозом 1 типа из группы нерожавших. Обратите внимание на диффузные гиперинтенсивные плексиформные нейрофибромы Т2, растущие вдоль поясничных и крестцовых нервов (а). Волюметрию выполняли, вручную рисуя интересующие области по краям опухоли (b). Затем программа MedX определила точные границы опухоли для оценки объема опухоли (c).
https: // doi.org / 10.1371 / journal.pone.0232031.g001
Диаметры 78 репрезентативных кожных или подкожных NF были измерены вручную, и сумма самых длинных диаметров (SLD) была рассчитана до и после беременности или при первоначальном осмотре и последующем наблюдении, соответственно. Скорость роста опухоли, определенная с помощью измерения объема и изменений SLD, рассчитывалась для каждого пациента и каждой опухоли отдельно.
Клиническая информация
Клинические симптомы пациенток оценивали с помощью анкеты по 4-балльной шкале Лайкерта по аналогии с ранее опубликованными анкетами по NF1 [27] после завершения беременности / в период наблюдения.Следующие пункты были включены в обе группы: начало NF1-ассоциированных скелетно-мышечных симптомов, субъективный рост нейрофибром и развитие новых кожных нейрофибром, история или развитие MPNST. Пациентам в группе беременных дополнительно предлагалось ответить на вопросы, касающиеся гестационной гипертензии, преждевременных родов и осложнений, связанных с опухолями во время родов. Пункты оценивались следующим образом: 0 = нет; 1 = мягкий; 2 = умеренный; 3 = обширный.
Статистический анализ
Непрерывные переменные, полученные из объема опухоли, представлены как медиана ± диапазон.Нормальное распределение всех переменных оценивали с помощью теста Шапиро-Уилка. Для попарного сравнения непрерывных нормально распределенных данных применялся t-критерий для независимых выборок. Для данных, не имеющих нормального распределения, использовался критерий суммы рангов Манна-Уитни. Парные t-критерии Стьюдента были выполнены для определения значительных различий в объеме опухоли или SLD с течением времени. Увеличение объема опухоли более чем на 20% в год считалось значительным ростом опухоли [5,26]. Категориальные переменные между разными группами сравнивались с помощью точного критерия Фишера для попарных сравнений.Статистический анализ выполняли с использованием GraphPad Prism 5.0 для Windows (GraphPad Software Inc., Ла-Холла, Калифорния). Статистическая значимость была принята для значений P менее 0,05.
Результаты
Распространение нейрофибром
Кожные или подкожные нейрофибромы были обнаружены у 17 из 26 пациентов с NF1 (65,4%), у 8 из 13 пациентов (61,5%) в группе беременных и у 9 из 13 пациентов (69,2%) в группе контроля. В группе беременных PNF располагались в области головы / шеи (4/11; 36%), грудной клетки (1/11; 9%), живота (2/11; 18%) и нижних конечностей (4/11%). ; 36%).В контрольной группе PNF располагались в области головы / шеи (2/9; 22%), грудной клетки (1/9; 11%), живота (3/9; 33%) и нижних конечностей (3/9 ; 33%). Во время интервала исследования и последующего наблюдения ни у одного из пациентов не развились новые PNF. Ни у одного пациента не развилась злокачественная опухоль оболочки периферических нервов, и хирургическая резекция опухоли не проводилась.
Динамика роста плексиформных нейрофибром при беременности
Анализ пациента.
В общей популяции исследования медиана опухолевой нагрузки PNF на все тело составляла 108.1 мл (IQR 59,1–202,6 мл) на исходном уровне и 124 мл (IQR 59,9–225,1 мл) при последующем наблюдении ( P = 0,39).
Медиана опухолевого бремени PNF всего тела у беременных составляла 89,3 мл (IQR 47,6–150,1 мл) на исходном уровне по сравнению с 107,9 мл (IQR 47,5–146,4 мл) при последующем наблюдении ( P = 0,67) (Рис. ) , тогда как медиана опухолевой нагрузки PNF всего тела в контроле составляла 167 мл (IQR 78,3–2911 мл) на исходном уровне по сравнению с 183,2 мл (IQR 82,8–2547 мл) при последующем наблюдении ( P = 0.41) (рис.2) . Не было существенной разницы между изменением опухолевой нагрузки PNF на все тело с течением времени между беременной группой (общий средний рост опухолевой нагрузки — 1,7% (IQR -6–23%) и контрольной группой (14,3%; IQR -12). –22,2%) ( P = 0,69) (Таблица 1) . Аналогичным образом, темпы роста беременных (-0,38%; IQR -1,1-5,4%) и контрольной группы (3,59%; IQR -2,1-5,5%) ) достоверно не различались (P = 0,69) (Таблица 1) . Ни у одного пациента не наблюдалось увеличения опухолевой нагрузки на ≥20% в год.Изменения объема или диаметра опухоли и скорости роста для отдельных пациентов и опухолей приведены в таблицах S2 – S5.
Рис. 2.
Графики в виде прямоугольников и усов объемов плексиформных нейрофибром (PNF) (a, b) и диаметров кожных нейрофибром (c, d) беременных и контрольных пациентов при первоначальном обследовании и последующем наблюдении. Объемы отображаются для каждого пациента (a) и для опухоли (b), диаметры даны как сумма самых длинных диаметров (SLD) на пациента (c) и диаметров отдельных NF (d).Не было значительных различий в объеме опухоли между первоначальным обследованием и последующим наблюдением как у беременных пациенток, так и у контрольной группы (a, b). SLD и индивидуальные диаметры NF значительно различались между первоначальным обследованием и последующим наблюдением в обеих группах. NF: нейрофиброма; нс: не имеет значения; PNF: плексиформная нейрофиброма; SLD: сумма наибольшего диаметра; *: P <0,05; ** P <0,01; ***: P <0,0001.
https://doi.org/10.1371 / journal.pone.0232031.g002
Анализ очагов поражения.
В общей популяции исследования средний объем поражения PNF составлял 69,6 мл (IQR 21,6–190,3 мл) на исходном уровне и 99,6 мл (IQR 24,1–227,3 мл) при последующем наблюдении ( P = 0,80).
Поражения у беременных продемонстрировали средний объем 35,2 мл (IQR 15,8–77 мл) на исходном уровне по сравнению с 30,3 мл (IQR 16,5–133,1 мл) при последующем наблюдении ( P = 0,64), тогда как поражения в контрольной группе продемонстрировали средний объем 199.4 мл (IQR 81,5–2734 мл) на исходном уровне по сравнению с 251,3 мл (IQR 99,6–2728 мл) при последующем наблюдении ( P = 0,41). В группе беременных 6/11 PNF (54,5%) увеличились в объеме, а 5/11 PNF (45,5%) уменьшились в объеме с течением времени, тогда как в контрольной группе 6/9 PNF (66,6%) увеличились в объеме и на 3/9 PNF (33,3%) уменьшился в объеме ( P = 0,67).
Однако не было существенной разницы между изменением индивидуального объема PNF с течением времени между беременными группами (средняя скорость роста опухоли 0.3%; IQR -5,8-15,9%) и контрольной группы (14,6%; IQR -12,1-42,4%) ( P = 0,45) в целом или на годовой основе (средняя скорость роста опухоли в год; беременные пациенты: -0,6%; IQR -3,4–0,9% по сравнению с контрольными пациентами: 4,9%; IQR -2,2–8,2%) ( P = 0,22) (Таблица 1) . Ни один из отдельных PNF не продемонстрировал увеличения объема на ≥20% в год (таблица S3) .
Динамика роста кожных и подкожных нейрофибром при беременности
На анализ пациента.
В общей популяции исследования медиана SLD составляла 48,5 мм (IQR 36–62,5 мм) на исходном уровне и 65 мм (IQR 45–74,5 мм) при последующем наблюдении ( P <0,0001). Медиана SLD кожных нейрофибром у беременных составляла 48 мм (IQR 16–55 мм) на исходном уровне по сравнению с 65 мм (IQR 34–66 мм) при последующем наблюдении ( P = 0,0026) (Рис. 2) , тогда как медиана SLD в контроле составляла 58 мм (IQR 36–67,5 мм) на исходном уровне по сравнению с 70 мм (IQR 46–85 мм) при последующем наблюдении ( P = 0.0004) (Рис.2) .
Хотя обе группы продемонстрировали значительное увеличение SLD с течением времени, не было существенной разницы между увеличением SLD между беременной группой на 32% (IQR 25,4–37,1%) и контрольной группой 22,2% (IQR 17–32,2%) ( Р = 0,24). Среднее увеличение SLD за год составило 5,9% (IQR 3,5–9,8%) в группе беременных и 5,1% (IQR 3,9–7,4%) в контрольной группе ( P = 0,48) (Таблица 1) .
Анализ очагов поражения.
В общей популяции исследования средний диаметр кожных нейрофибром составлял 10 мм (IQR 8–13 мм) на исходном уровне и 13 мм (IQR 10–16 мм) при последующем наблюдении ( P = 0,0002). Поражения у беременных пациенток продемонстрировали средний диаметр 10 мм (IQR 8–13 мм) на исходном уровне по сравнению с 12,5 мм (IQR 11–15 мм) при последующем наблюдении ( P <0,0001) (Рис. 2) . Поражения в контрольной группе имели средний диаметр 11 мм (IQR 8–13 мм) на исходном уровне по сравнению с 13 мм (IQR 9–17 мм) при последующем наблюдении ( P <0.0001) (Рис.2) . Не было существенной разницы в увеличении диаметра с течением времени между беременной группой (средняя скорость увеличения диаметра 20% (IQR 0–57,1%) и контрольной группой (22,2%; IQR 8,3–33,3%) ( P = 0,98). Средняя скорость роста опухоли в год составила 4,7% (IQR 0,2–10%) в группе беременных и 5,2% (IQR 1,6-8,5%) в контрольной группе ( P = 0,93). диаметры увеличивались более чем на 20% в год у четырех нейрофибром в группе беременных и у одной нейрофибромы в контрольной группе ( P = 0.19). Диаметры отдельных кожных нейрофибром приведены в таблице S4 , а соответствующие скорости роста показаны в таблицах S5 и S6 .
Оценка клинических симптомов и исхода беременности, о которых сообщают пациенты
Семь из 13 беременных пациенток (53,8%), но ни одна из контрольных пациенток ( P = 0,0052) сообщили о росте ранее существовавших кожных нейрофибром и / или появлении новых нейрофибром (Таблица 2) . Трое из 13 беременных пациенток (23.1%), но ни один из контрольных пациентов ( P = 0,22) не испытал обширной скелетно-мышечной боли, тогда как пациенты из контрольной группы сообщили только о слабой (46,2%) или умеренной (23,1%) скелетно-мышечной боли. Три из 13 (23,1%) беременных пациенток сообщили о гестационной гипертензии в анамнезе. Ни у одной из беременных пациенток не было ни преждевременных родов (т.е. <37 недель беременности), ни осложнений, связанных с опухолью во время родов.
Обсуждение
В этом ретроспективном исследовании мы исследовали влияние беременности на опухолевую нагрузку у пациенток с NF1.Рост плексиформных и кожных нейрофибром у беременных существенно не отличался от небеременных. Некоторые пациенты с NF1 испытывают субъективное усиление клинических симптомов, связанных с NF1, и роста опухоли во время беременности. Однако это увеличение роста опухоли или клинических симптомов существенно не отличалось от контрольной группы.
PNF присутствовали у 46,2% пациентов с NF1 в нашем исследовании, что соответствует ранее опубликованным данным [5,6,28]. Объемный анализ PNF не показал значительного роста опухолей как в группе беременных, так и в контрольной группе.Более того, ни у одного пациента не развился новый PNF, и ни один PNF не подвергся злокачественной трансформации.
Объемы PNF, наблюдаемые в нашем исследовании, аналогичны результатам предыдущих исследований [5]. Однако объем опухоли в нашей группе беременных (диапазон 31,1–198,1 мл) невелик по сравнению с другими, которые определили объемы до 7553 мл у пациенток с NF1 [28]. Кроме того, общая скорость роста PNF в год в нашем исследовании была сравнительно низкой, при отсутствии PNF, показывающей значительный рост ≥ 20% в год. Другие авторы обнаружили значительную общую скорость роста PNF, равную 14.3% в год с максимальными темпами роста до 111% [5,28]. Мы не выявили развития новой PNF в нашем коллективе пациентов в течение 142,7 пациенто-лет. Это согласуется с предыдущим исследованием, которое не обнаружило развития новой PNF в течение 273,0 пациенто-лет [5]. Это также согласуется с ранее опубликованными сообщениями о том, что клинически очевидные PNF редко развиваются у пациентов с NF1 после раннего детства [5]. При общем пожизненном риске развития MPNST в 8–15% можно ожидать наблюдения, что ни одна PNF не подверглась злокачественной трансформации в исследуемой небольшой группе пациентов.Для сравнения, Nguyen et al не обнаружили злокачественную трансформацию PNF у своих пациентов с обследованными 273,0 пациенто-годами. Из-за частично длинного интервала между сканированиями МРТ нельзя полностью исключить потенциально краткосрочное влияние беременности на рост опухоли (или объем, например, отек). Однако данные тщательно отслеживаемого коллектива пациентов со средним интервалом между обследованиями МРТ 3,9 месяца и средним числом обследований МРТ 7 на пациента показали, что плексиформные нейрофибромы не демонстрируют беспорядочного роста [28].
Гетерогенная скорость роста PNF в нашем исследовании и особенно слегка подчеркнутое уменьшение объема опухоли у беременных пациенток является интересным наблюдением. Мы обнаружили, что большее количество PNF у беременных, чем у контрольных пациенток, показало уменьшение объема и что общая скорость роста PNF у беременных была снижена по сравнению с контрольной группой. Этот эффект может быть связан с беременностью, поскольку было описано гормонозависимое уменьшение объема некоторых, но не всех PNF [16].Однако оба вышеупомянутых эффекта не были значительными, и для подтверждения нашего наблюдения необходимы более масштабные исследования. Кроме того, другие авторы описали уменьшение объема опухоли у небеременных пациенток с NF1 в 35,5% случаев и отрицательную скорость роста -3,6% [5,28]
Кожные нейрофибромы показали значительный рост в обеих группах, в то время как скорость роста между группами существенно не различалась. Значительный рост кожных нейрофибром в нашем исследовании согласуется с предыдущими сообщениями, которые указывают на увеличение размера этих опухолей во время беременности [13,14].Единственная заметная разница между двумя группами заключалась в значительном росте четырех отдельных нейрофибром во время беременности по сравнению со значительным ростом только одной нейрофибромы в контрольной группе. Это может указывать на то, что беременность действительно может повлиять на отдельные нейрофибромы, что согласуется с опубликованными данными анкетирования и ранее описанными гетерогенными реакциями роста опухоли на воздействие гормонов in vitro [13,16,19].
Клинические данные, оцененные с помощью анкет, показали увеличение субъективного роста опухоли, развитие новых нейрофибром и скелетно-мышечную боль, связанную с NF1, у некоторых беременных.Однако объемный анализ опухолей не подтвердил эти субъективные данные, а статистический анализ не подтвердил значительного увеличения скелетно-мышечной боли у беременных пациенток по сравнению с контрольной группой. Это несоответствие между субъективным ростом опухоли и объемом может быть вызвано повышенной осведомленностью беременных пациенток о связанных с NF1 и физиологических изменениях организма, связанных с беременностью. Однако усиление клинических симптомов и рост опухоли аналогичны предыдущим сообщениям [13].Частота гестационной гипертензии была выше, чем в ранее опубликованных данных, в то время как частота преждевременных родов — нет [21]. В отличие от других авторов, мы не выявили осложнений, связанных с NF1, во время родов [21,22].
Наше исследование имеет клиническое значение. По нашим данным, в усиленном мониторинге беременных пациенток с NF1 на предмет роста PNF, по-видимому, нет необходимости. Пациенты должны быть осведомлены о том, что рост кожных нейрофибром во время беременности существенно не отличается от роста у небеременных пациенток и что популяционные исследования показывают увеличение заболеваемости, связанной с беременностью, по сравнению с популяцией без NF1 [21].
У нашего исследования есть несколько ограничений. Прежде всего, это исследование было проведено ретроспективно. Последовательно наблюдаемый период времени между исходным и последующим МРТ-исследованиями, а также между МРТ-исследованиями и беременностью варьировался между включенными пациентами и в некоторых случаях был довольно длинным. Следовательно, краткосрочного изменения роста опухоли не было бы обнаружено. Эти ограничения могут быть уменьшены в перспективных условиях с контролируемыми периодами времени между обследованием МРТ и беременностью.Еще одним ограничением является относительно небольшое количество включенных беременных пациенток с NF1, что вызвано не только редкостью самого NF1, но и довольно специфическими критериями включения. Однако, что касается конкретных критериев включения, совокупность пациентов сопоставима с другими исследованиями, посвященными беременности при NF1 [29,30]. Еще одно ограничение — меньший объем опухолей в группе беременных по сравнению с контрольной группой. Причиной такой разницы в объеме опухоли между двумя группами может быть общее снижение шансов на беременность у пациенток с тяжелыми проявлениями NF1, поскольку высокая степень видимости NF1 может привести к незащищенности и сексуальной неудовлетворенности [29].Можно предположить, что у пациенток с большим объемом опухолей могут возникнуть более или более серьезные осложнения во время беременности. Кроме того, было описано, что общий большой объем опухоли коррелирует с повышенным ростом опухоли. Таким образом, можно было ожидать увеличения роста опухолей в контрольной группе по сравнению с беременной группой в нашем исследовании. Однако эта разница в среднем объеме опухоли между беременной группой и контрольной группой не была значимой и в основном была вызвана одной пациенткой в контрольной группе с большой опухолевой массой 10 858.5 мл.
В заключение, наши данные показывают, что рост плексиформных и кожных нейрофибром у беременных существенно не отличается по сравнению с небеременными пациентами. Кожные нейрофибромы демонстрируют значительное увеличение роста с течением времени как у беременных, так и у небеременных пациенток, а клинические симптомы, связанные с NF1, существенно не усугубляются во время беременности. Эти результаты должны быть подтверждены в более крупных многоцентровых исследованиях и могут быть полезны пациентам с нейрофиброматозом типа 1, которые обращаются за консультацией до или во время беременности.
Вспомогательная информация
S2 Таблица. Объемы отдельных плексиформных нейрофибром и объем опухоли на пациента у беременных и небеременных пациенток с NF1 при исходных и последующих обследованиях.
Данные приведены в мл. NF1: нейрофиброматоз типа 1 — PNF: плексиформная нейрофиброма.
https://doi.org/10.1371/journal.pone.0232031.s002
(DOCX)
S3 Таблица. Скорость роста плексиформных нейрофибром у беременных и небеременных пациенток с NF1.
Скорость роста выражается в процентах от общего объема опухолей, измеренных при первоначальном обследовании. Период наблюдения дается в годах и указывает время между исходным и последующим обследованием. Разница в объеме опухоли указывается в мл. PNF: плексиформная нейрофиброма.
https://doi.org/10.1371/journal.pone.0232031.s003
(DOCX)
S4 Таблица. Диаметры и сумма наибольших диаметров (SLD) кожных нейрофибром у беременных и небеременных пациенток с NF1 при исходных и последующих обследованиях.
Данные указаны в мм. NF1: нейрофиброматоз 1 типа –NF: нейрофиброма.
https://doi.org/10.1371/journal.pone.0232031.s004
(DOCX)
S5 Таблица. Скорость роста кожных нейрофибром у беременных пациенток с NF1.
Скорость роста выражается в процентах диаметров опухолей, измеренных при первоначальном обследовании. Период наблюдения дается в годах и указывает время между исходным и последующим обследованием. Разница в диаметре опухоли указана в мм.
https://doi.org/10.1371/journal.pone.0232031.s005
(DOCX)
S6 Таблица. Скорость роста кожных нейрофибром у небеременных пациенток с NF1.
Скорость роста выражается в процентах от общего объема опухолей, измеренных при первоначальном обследовании. Период наблюдения дается в годах и указывает время между исходным и последующим обследованием. Разница в диаметре опухоли указана в мм.
https://doi.org/10.1371/journal.pone.0232031.s006
(DOCX)
Ссылки
- 1. Хусон С.М., Компстон Д.А., Харпер П.С. Генетическое исследование нейрофиброматоза фон Реклингхаузена на юго-востоке Уэльса. II. Рекомендации по генетическому консультированию. J Med Genet. 1989; 26: 712–21. Доступно: http://www.ncbi.nlm.nih.gov/pubmed/2511319 pmid: 2511319
- 2. Фридман Дж. М., Берч РН. Нейрофиброматоз 1 типа: описательный анализ заболевания у 1728 пациентов. Am J Med Genet. 1997; 70: 138–43.Доступно: http://www.ncbi.nlm.nih.gov/pubmed/
- 32 pmid:
- 32
- 3. Фридман Дж. М., Гутманн Д. Х., Макколлин М. Р. В.. Нейрофиброматоз: фенотип, естественное течение и патогенез. Нейрофиброматоз: фенотип, естественная история и патогенез 3-е изд. 1999. С. 29–86.
- 4. Корф BR. Обзорная статья: Клинические особенности и патобиология нейрофиброматоза 1. J Child Neurol. 2002; 17: 573–577. pmid: 12403555
- 5. Нгуен Р., Домби Е., Видеманн BC, Соломон Дж., Фюнстерер С., Клуве Л. и др.Динамика роста плексиформных нейрофибром: ретроспективное когортное исследование 201 пациента с нейрофиброматозом 1. Orphanet J Rare Dis. 2012; 7: 75. pmid: 23035791
- 6. Плоткин С.Р., Бределла М.А., Цай В., Кассарджян А., Харрис Г.Дж., Эспарза С. и др. Количественная оценка опухолевой нагрузки всего тела у взрослых пациентов с нейрофиброматозом. Херхольц К., редактор. PLoS One. 2012; 7: e35711. pmid: 22558206
- 7. Джетт К., Нгуен Р., Арман Д., Берч П., Чохан Х., Фаршчи С. и др.Количественные ассоциации подкожных нейрофибром кожи головы и тела с внутренними плексиформными опухолями при нейрофиброматозе 1. Am J Med Genet Part A. 2015; 167: 1518–1524. pmid: 252
- 8. Evans DGR, Baser ME, McGaughran J, Sharif S, Howard E, Moran A. Злокачественные опухоли оболочки периферических нервов при нейрофиброматозе 1. J. Med Genet. 2002; 39: 311–4. pmid: 12011145
- 9. Нгуен Р., Джетт К., Харрис Дж. Дж., Кай В., Фридман Дж. М., Маутнер В. Ф. Объем доброкачественной опухоли всего тела является фактором риска злокачественных опухолей оболочки периферических нервов при нейрофиброматозе 1 типа.J Neurooncol. 2014; 116: 307–13. pmid: 24166582
- 10. Расмуссен С.А., Ян К., Фридман Дж. М.. Смертность при нейрофиброматозе 1: анализ с использованием свидетельств о смерти в США. Am J Hum Genet. 2001; 68: 1110–1118. pmid: 11283797
- 11. Cai W., Kassarjian A, Bredella MA, Harris GJ, Yoshida H, Mautner VF и др. Опухолевая нагрузка у пациентов с нейрофиброматозом 1 и 2 типов и шванноматозом: определение на МРТ всего тела. Радиология. 2009; 250: 665–73. pmid: 19244040
- 12.Маутнер В.Ф., Бреннер В., Фюнстерер С., Хагель С., Гавад К., Фридрих Р.Э. Клиническая значимость позитронно-эмиссионной томографии и магнитно-резонансной томографии в прогрессировании внутренней плексиформной нейрофибромы при NF1. Anticancer Res. 2007; 27: 1819–22. Доступно: http://www.ncbi.nlm.nih.gov/pubmed/17649778 pmid: 17649778
- 13. Дугофф Л., Суджанский Э. Нейрофиброматоз 1 типа и беременность. Am J Med Genet. 1996; 66: 7–10. pmid: 8957502
- 14. Посма Э., Альберс Р., Курниаван Ю.С., ван Эссен А.Дж., Пеэтерс PMJG, ван Лун А.Дж.Нейрофиброматоз I типа и беременность: фатальное влечение? Развитие злокачественной шванномы во время беременности у пациентки с нейрофиброматозом I. BJOG. 2003; 110: 530–2. Доступно: http://www.ncbi.nlm.nih.gov/pubmed/12742342 pmid: 12742342
- 15. Исикоглу М., Хас Р., Коркмаз Д., Бебек Н. Плексиформная нейрофиброма во время и после беременности. Arch Gynecol Obstet. 2002; 267: 41–42. pmid: 12410373
- 16. Фишбейн Л., Чжан Икс, Фишер Л.Б., Ли Х., Кэмпбелл-Томпсон М., Ячнис А. и др.Исследования in vitro стероидных гормонов в опухолях нейрофиброматоза 1 и шванновских клетках. Mol Carcinog. 2007. 46: 512–523. pmid: 17393410
- 17. Рот TM, Петти Э.М., Баральд К.Ф. Роль стероидных гормонов в фенотипе NF1: внимание к беременности. Am J Med Genet Часть A. 2008; 146A: 1624–1633. pmid: 18481270
- 18. Маклафлин М.Э., Джекс Т. Экспрессия рецептора прогестерона в нейрофибромах. Cancer Res. 2003. 63: 752–755. Доступно: http: //cancerres.aacrjournals.org / content / 63/4 / 752.long pmid: 125
- 19. Ли Х, Чжан Х, Фишбейн Л., Кве Ф., Кэмпбелл-Томпсон М., Перрин Г. К. и др. Анализ действия стероидных гормонов на ксенотрансплантаты шванновских клеток опухоли NF1 человека. Cancer Biol Ther. 2010. 10: 758–64. pmid: 20699653
- 20. Ламмерт М., Маутнер В.Ф., Клуве Л. Стимулируют ли гормональные контрацептивы рост нейрофибром? Обследование 59 пациентов с NF1. BMC Рак. 2005; 5:16. Pmid: 15703081
- 21. Терри А.Р., Баркер Ф.Г., Лефферт Л., Бейтман Б.Т., Сутер И., Плоткин С.Р.Нейрофиброматоз 1 типа и осложнения беременности: популяционное исследование. Am J Obstet Gynecol. 2013; 209: 46.e1–8. pmid: 23535241
- 22. Вайсман А., Якоби П., Зайдис И., Друган А. Нейрофиброматоз и беременность. Обновление. J Reprod Med. 1993; 38: 890–6. Доступно: http://www.ncbi.nlm.nih.gov/pubmed/8277488 pmid: 8277488
- 23. Заявление конференции по развитию консенсуса Национального института здравоохранения: нейрофиброматоз. Бетесда, штат Мэриленд, США, 13–15 июля 1987 г.Нейрофиброматоз. 1988; 1: 172–8. Доступно: http://www.ncbi.nlm.nih.gov/pubmed/3152465
- 24. Фридрих Р.Э., Корф Б., Фюнстерер С., Маутнер В.Ф. Тип роста плексиформных нейрофибром в NF1 определен на магнитно-резонансных изображениях. Anticancer Res. 2003; 23: 949–52. Доступно: http://www.ncbi.nlm.nih.gov/pubmed/12820328 pmid: 12820328
- 25. Саламон Дж., Маутнер В.Ф., Адам Дж., Дерлин Т. Мультимодальная визуализация при опухолях нервной оболочки, связанных с нейрофиброматозом 1-го типа.Рофо. 2015; 187: 1084–1092. pmid: 26333104
- 26. Соломон Дж., Уоррен К., Домби Е., Патронас Н., Уайдеманн Б. Автоматическое обнаружение и измерение объема плексиформных нейрофибром при нейрофиброматозе 1 с использованием магнитно-резонансной томографии. Comput Med Imaging Graph. 2004. 28: 257–265. pmid: 15249071
- 27. Фернер Р. Э., Томас М., Мерсер Г., Уильямс В., Лешцинер Г. Д., Африди С. К. и др. Оценка качества жизни взрослых с нейрофиброматозом 1 (NF1) с использованием опросника «Влияние NF1 на качество жизни» (INF1-QOL).Результаты здорового качества жизни. 2017; 15: 4–9.
- 28. Домби Э., Соломон Дж., Гиллеспи А.Дж., Фокс Э., Балис Ф.М., Патронас Н. и др. Скорость роста плексиформной нейрофибромы NF1 по данным объемной МРТ: зависимость от возраста и массы тела. Неврология. 2007. 68: 643–7. pmid: 17215493
- 29. Гранстрём С., Лангенбрух А., Огюстен М., Маутнер В.Ф. Психологическое бремя у взрослых пациентов с нейрофиброматозом 1 типа: влияние видимости болезни на изображение тела. Дерматология. 2012; 224: 160–167.pmid: 22508340
- 30. Шарма Дж. Б., Гулати Н., Малик С. Материнские и перинатальные осложнения при нейрофиброматозе во время беременности. Int J Gynecol Obstet. 1991; 34: 221–227.


