Проба манту и Диаскин тест
Туберкулез – хроническая, тяжело протекающая инфекция, возбудителем которой
является микобактерия туберкулеза (палочка Коха).
За развитием туберкулёза во всех странах внимательно следят. Поэтому кроме всеобщей вакцинации, проводят регулярный контроль детей с целью узнать, как реагирует организм на эту инфекцию.
В клиниках МЕДИКА используют 2 вида тестирования на туберкулез – проба Манту и Диаскинтест.
Диаскинтест (ДСТ) — это современный тест на туберкулез, результаты которого, в отличие от пробы Манту, не зависят от вакцинации БЦЖ. Положительный ответ на ДСТ означает активную фазу туберкулеза, требующую медикаментозного лечения.
*Оценка результатов проводится через 72 часа.
Постановка пробы Манту — 3 000 р.
(с оценкой результата)
Проведение Диаскин теста — 4 300 р.
(с оценкой результата)
Для получения услуги по специальной цене необходимо предъявить распечатанный купон администраторам клиники.
Подробная информация и предварительная запись по телефону
Единого контакт-центра клиники «МЕДИКА» + 7(812)458-00-00.
Акция действует по адресам:
- ул. Бадаева, д. 6, к.1
- ул. Гжатская, 22 к.4, лит. А
- ул. Пулковская, д. 8, к.1
Распечатать купон
Елена Ивановна
Врач — неонатолог, педиатр
Рамзи
Диляра Рафиковна
Врач-педиатр
Сенькин
Иван Геннадиевич
Врач-педиатр
Черных
Ирина Юрьевна
Врач-педиатр
Все специалисты
Адрес:
ул. Бадаева, д. 6, к.1
Бадаева, д. 6, к.1
Адрес:
ул. Пулковская, д. 8, к.1
Адрес:
ул. Гжатская, 22 к.4, лит. А
Многопрофильная клиника на Гжатской
Адрес:
ул. Гжатская, 22 к.4, лит. А
Академическая
Режим работы:
пн-пт с 8:00 до 21:00
сб, вс с 9:00 до 21:00
Телефон:
Для записи: +7 (812) 458-00-00 Для справок: +7 (921) 992-22-79
О филиале
В филиале доступны:
Многопрофильные клиники Сеть кардиоцентров Центры медицины плода
Многопрофильная клиника на Бадаева
Адрес:
ул. Бадаева, д. 6, к.1
Бадаева, д. 6, к.1
Большевиков
Режим работы:
пн-пт с 8:00 до 21:00
сб-вс с 9:00 до 21:00
Телефон:
Для записи: +7 (812) 458-00-00 Для справок: +7 (921) 952-52-20
О филиале
В филиале доступны:
Многопрофильные клиники Сеть кардиоцентров Центры медицины плода Клиника эстетической медицины
Многопрофильная клиника на Пулковской
Адрес:
ул.
Звездная
Режим работы:
пн-пт с 8:00 до 21:00
сб-вс с 9:00 до 21:00
Телефон:
Для записи:+7 (812) 458-00-00 Для справок: +7 (921) 965-78-28
О филиале
В филиале доступны:
Многопрофильные клиники Сеть кардиоцентров Центры медицины плода Клиника эстетической медицины
Спасибо за обращение! Мы свяжемся с Вами в ближайшее время.
Оставить отзыв
Спасибо, ваш отзыв очень важен для нас
Откликнуться на вакансию
Спасибо за обращение! Мы свяжемся с Вами в ближайшее время.
Записаться на курс
Спасибо, ваша заявка успешно отправлена
Регистрация на конференцию
Спасибо, ваша заявка успешно отправлена
Задать вопрос
Спасибо, мы передали ваш вопрос
Диаскинтест / Вакцинопрофилактика / Услуги
Диаскинтест – современный препарат, позволяющий выявить латентные формы туберкулеза. В сравнении с пробой Манту этот способ первичной диагностики позволяет практически без ошибок выявлять инфицированность пациента туберкулезными бактериями. Тест может определить присутствие палочек Коха в организме еще на стадиях, когда опасная болезнь себя пока не проявила.
ЧТО ТАКОЕ ДИАСКИНТЕСТ
Как и проба Манту, Диаскин не является прививкой. Это тестовая проба, которая показывает реакцию на туберкулез в активной, неактивной форме. Для проведения иммунологического теста под кожу вводят белковые аллергены или антигены. С их помощью устанавливается иммунный ответ организма. Если он положительный, пациент находится на активной стадии болезни или инфицирован. Положительная реакция – подтверждение того, что иммунитет человека знаком с антигенами.
С их помощью устанавливается иммунный ответ организма. Если он положительный, пациент находится на активной стадии болезни или инфицирован. Положительная реакция – подтверждение того, что иммунитет человека знаком с антигенами.
КАК ПРОВОДЯТ ТЕСТ
Диаскинтест выполняют таким же способом, как и остальные виды проб. Препарат вводят в область предплечья на любую руку. Обычно для правшей пробу ставят в левую руку, чтобы минимизировать механическое раздражение. Важно, чтобы человек не расчесывал зону введения препарата. Проба вводится внутрикожно тонкой иглой.
ДЛЯ ЧЕГО НУЖЕН ДИАСКИН
Многие люди путают Диаскинтест с вакциной. Но это совсем не так. Отказываться от проведения пробы не стоит, поскольку до 95 % взрослых людей сегодня инфицированы палочкой Коха. То есть, они являются носителями туберкулезных бактерий. Это носительство называют латентной формой заболевания – когда человек не болен, но болезнь может развиться при определенных условиях. Такой вариант наблюдается у 1 % пациентов. Причем инфекционный процесс долго может протекать бессимптомно. Без проведения проб выявить его только по внешним признакам невозможно. И чем раньше будет выявлен туберкулезный процесс, тем выше у пациента будут шансы на выздоровление.
Причем инфекционный процесс долго может протекать бессимптомно. Без проведения проб выявить его только по внешним признакам невозможно. И чем раньше будет выявлен туберкулезный процесс, тем выше у пациента будут шансы на выздоровление.
ПЕРИОДИЧНОСТЬ ВЫПОЛНЕНИЯ ПРОБЫ
Согласно рекомендации российского Министерства здравоохранения, Диаскинтест в обязательном порядке выполняют один раз в год в возрасте 8-17 лет. Решая, как часто можно ставить пробу, учитывают некоторые нюансы:
- Тест можно делать не раньше, чем через месяц после любой вакцинации.
- После выздоровления от любой инфекционной болезни должен пройти месяц.
- Если предыдущий результат пробы был отрицательным, следующий тест можно сделать через 2 месяца.
Контрольная проба для людей, стоящих на учете в противотуберкулезном диспансере, проводится раз в 3-6 месяцев.
Если у ребенка была положительной проба Манту, выполнять Диаскинтест ему можно с 1 года.
ПОДГОТОВКА К ПРОБЕ
Как и при Манту, постановка Диаскинтеста не требует подготовки. Необходимо лишь исключить наличие инфекционных заболеваний – за месяц до тестирования и на момент его проведения.
Необходимо лишь исключить наличие инфекционных заболеваний – за месяц до тестирования и на момент его проведения.
СОСТАВ ПРЕПАРАТА
Препарат содержит:
- Белки бактерий туберкулеза CFP10 ESAT6, подготовленные специальным образом.
- Фенол как консервант.
- Полисорбат как стабилизатор.
- Фосфорно-кислые натрий, калий.
- Хлорид натрия.
- Вода.
Диаскинтест является российским препаратом. Пройти тестирование можно в различных учреждениях. Чаще всего пробу выполняют в детских садах, школах, поликлиниках или же в противотуберкулезных институтах, центрах, диспансерах. Для взрослых обследование назначается при наличии контакта с больными или в случаях, когда человек стоит на учете в диспансере.
КАК ОЦЕНИВАЮТ РЕЗУЛЬТАТЫ
Проверка реакции выполняется на 3-4 день после проведения теста. Результат может быть положительным, отрицательным или ложноположительным (сомнительным). Отрицательный результат – норма для детей и взрослых. При полном отсутствии реакции не должно быть папул, покраснений.
При полном отсутствии реакции не должно быть папул, покраснений.
Первая реакция может наблюдаться через 6 часов после введения препарата. Результат теста – ответ иммунитета человека. Воспаления, покраснения могут наблюдаться в первый же день после тестирования. Реакция может возрастать в течение 72 часов, максимальный результат наблюдается на третий день у взрослых и детей. Затем реакция угасает.
ОТРИЦАТЕЛЬНЫЙ РЕЗУЛЬТАТ
Нормой при отрицательной реакции считают:
- Следы от иглы.
- Небольшой синяк на месте укола.
- Бесцветное уплотнение на месте укола размером менее 1 см.
СОМНИТЕЛЬНАЯ РЕАКЦИЯ
Ложноположительный результат устанавливается в случаях, когда у человека не появилась папула, но есть покраснения. В этих ситуациях пациенту назначают повторный тест через 2 месяца. Также необходимо пройти консультацию в противотуберкулезном диспансере, сдать флюорографию, дополнительные анализы.
ПОЛОЖИТЕЛЬНЫЙ РЕЗУЛЬТАТ
Наличие папулы любого размера говорит об инфицировании пациента туберкулезными бактериями. У взрослых размер воспалительной папулы не имеет решающего значения. Однако для простоты оценки используется общая классификация размеров припухлостей:
У взрослых размер воспалительной папулы не имеет решающего значения. Однако для простоты оценки используется общая классификация размеров припухлостей:
- Менее 5 мм – слабая.
- Не более 9 мм – умеренная.
- Свыше 10 мм – сильная.
Чем более выражена реакция, тем больше возбудителя присутствует в организме человека. Пациенту обязательно нужно обратиться в диспансер для лечения, постановки на учет.
У детей наличие папулы также требует незамедлительного обращения к врачу. Понадобятся дополнительные исследования для оценки формы заболевания – активная или латентная. Используется и специальное лечение.
ПОБОЧНЫЕ ЭФФЕКТЫ, ОСЛОЖНЕНИЯ
Диаскинтест безвреден для пациентов любого возраста, поэтому можно не опасаться реакции у детей и взрослых. Какие-либо побочные эффекты могут наблюдаться лишь в редких случаях в виде симптомов, указывающих на общую интоксикацию. К ним относят головную боль и слабость, общее недомогание, возрастание температуры. Это нормальная реакция. Не относят к поводам для беспокойства и небольшие синяки на месте укола.
Не относят к поводам для беспокойства и небольшие синяки на месте укола.
Может возникать и гиперергическая реакция организма на введение препарата – образование крупной папулы диаметром более 15 мм. К такой же реакции относят сильное воспаление, раздражение ткани вокруг папулы.
ПРОТИВОПОКАЗАНИЯ К ТЕСТУ
Диаскинтест нельзя выполнять в нескольких случаях:
- Аллергии.
- Вакцинация любыми прививками в течение месяца до пробы.
- Любые заболевания в фазе обострения, острые заболевания.
- Эпилепсия.
- Заболевания кожи.
Диаскинтест, как и Манту, нельзя ставить при простуде, ОРВИ. Аллергические реакции на препарат являются противопоказанием к тестированию.
ПОВЕДЕНИЕ ПОСЛЕ ПРОБЫ
После постановки Диаскинтеста можно мочить руку, принимать душ или ванну. Категорически не рекомендуется расчесывать место укола, заклеивать эту зону пластырем, обматывать бинтом. Также не стоит смазывать место укола кремами, моющими и другими косметическими средствами. Ограничений по питанию не существует.
Ограничений по питанию не существует.
Диаскинтест имеет высокую чувствительность – около 80 %, а точность достигает почти 100 %. Но, как и любая медицинская тестовая методика, и эта проба может ошибаться.
Диаскинтест в разы точнее Манту, поскольку он не показывает положительные реакции у людей с приобретенным противотуберкулезным иммунитетом. Вот почему эта проба считается наиболее достоверной и безопасной. С ее помощью можно узнать, не болен ли пациент на данный момент, проанализировать, не заболеет ли человек через 1-2 года.
Цены
Уважаемые посетители нашего сайта, так как прайс регулярно обновляется (вынуждены заметить, что довольно часто в сторону уменьшения), цены на все услуги размещены на отдельной странице, воспользовавшись поиском по которой, вы легко сможете найти цены на интересующие услуги. Мы стараемся пристально следить за актуальностью цен на сайте!
Также вы можете просто позвонить нашим специалистам и они быстро вас проконсультируют:
+7 (495) 577-09-41
Перейти ко всем ценам
Тестирование лекарственной чувствительности при туберкулезе: методы и достоверность результатов
S.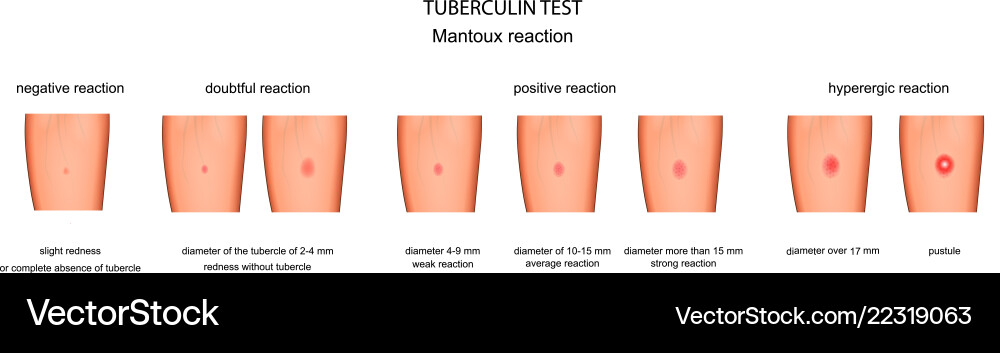 J. Kim
J. Kim
European Respiratory Journal 2005 25: 564-569; Doi: 10.1183/0
36.05.001111304
- Статья
- Рисунки и данные
- Info & Metrics
Аннотация
Спрос на злоупотребление на лекарственное средство. эпиднадзор за резистентностью и необходимостью соответствующего лечения туберкулеза с множественной лекарственной устойчивостью, заболеваемость которым постепенно увеличивается во многих частях мира. Однако достоверность результатов ТЛЧ, полученных широко используемыми методами, не соответствует приемлемым уровням, за исключением ТЛЧ к изониазиду и рифампицину.
В общем, результаты чувствительности в высокой степени предсказуемы, в то время как результаты резистентности имеют низкую прогностическую ценность, когда распространенность резистентности составляет <10%. Низкая надежность связана со слабой корреляцией с клиническим ответом и низкой воспроизводимостью из-за плохой стандартизации сложных и хрупких тестовых процедур. Таким образом, in vitro критерии резистентности для тестирования чувствительности должны быть тщательно определены с репрезентативными клиническими образцами Mycobacterium tuberculosis , выделенный от пациентов, никогда не получавших никакого противотуберкулезного препарата, и от пациентов, у которых лечение по схеме, содержащей тестируемый препарат, оказалось неэффективным; Затем следует тщательно стандартизировать ТЛЧ для получения воспроизводимых результатов.
Таким образом, in vitro критерии резистентности для тестирования чувствительности должны быть тщательно определены с репрезентативными клиническими образцами Mycobacterium tuberculosis , выделенный от пациентов, никогда не получавших никакого противотуберкулезного препарата, и от пациентов, у которых лечение по схеме, содержащей тестируемый препарат, оказалось неэффективным; Затем следует тщательно стандартизировать ТЛЧ для получения воспроизводимых результатов.
Критическая концентрация некоторых препаратов близка к минимальной ингибирующей концентрации для диких восприимчивых штаммов, и поэтому тестирование на чувствительность к лекарствам может давать плохо воспроизводимые результаты. Эти вопросы требуют внимания врачей при использовании результатов тестирования на лекарственную чувствительность для ведения пациентов.
- Лекарственная устойчивость
- Тест на чувствительность к лекарственным препаратам
- Туберкулез
Во многих странах широкое использование стандартной краткосрочной схемы лечения привело к росту заболеваемости туберкулезом (ТБ) с множественной лекарственной устойчивостью (МЛУ), определенным как устойчивость по крайней мере к изониазиду (INH) и рифампицину (RFP) 1–3.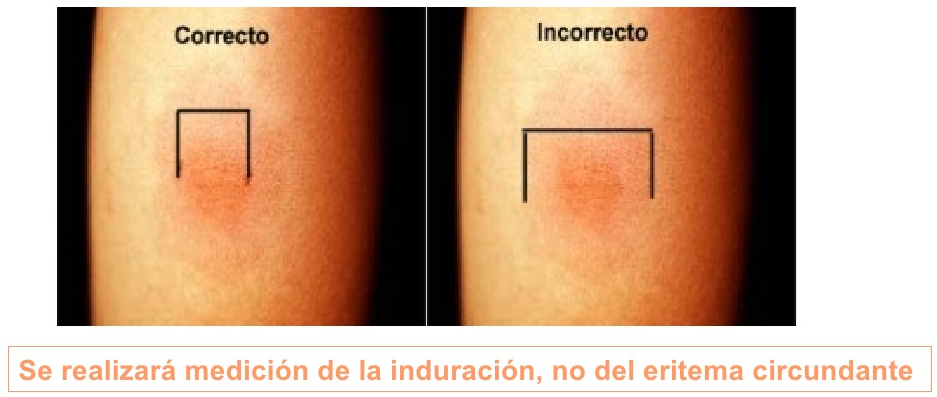 Значительно высокие показатели МЛУ-ТБ наблюдались в некоторых частях мира не только среди ранее леченных больных ТБ из-за плохого ведения случаев, но и среди новых случаев из-за передачи инфекции в обществе. Ситуация превратилась в острую потребность в тестах на лекарственную чувствительность (ТЛЧ) для осуществления эпиднадзора за лекарственной устойчивостью (ДРС), а также для разработки эффективных схем адекватного лечения отдельных случаев. А. Торрес и Дж. Каминеро номер 4 в этой серии
Значительно высокие показатели МЛУ-ТБ наблюдались в некоторых частях мира не только среди ранее леченных больных ТБ из-за плохого ведения случаев, но и среди новых случаев из-за передачи инфекции в обществе. Ситуация превратилась в острую потребность в тестах на лекарственную чувствительность (ТЛЧ) для осуществления эпиднадзора за лекарственной устойчивостью (ДРС), а также для разработки эффективных схем адекватного лечения отдельных случаев. А. Торрес и Дж. Каминеро номер 4 в этой серии
В результате неправильного и/или неадекватного лечения резистентность к лекарственным средствам возникает путем селективного размножения устойчивых мутантов в очагах поражения, несмотря на наличие ингибирующих рост концентраций лекарственного средства. Частота устойчивых к лекарственным средствам мутантов и уровни их устойчивости варьируют в зависимости от лекарственного средства и мутировавших генов и сайтов, фенотипические выражения которых включают следующее: изменения сайта связывания молекул-мишеней лекарственного средства; потеря ферментов, активирующих молекулы лекарств; изменение проницаемости препарата, в том числе эффлюкс; и производство ферментов, инактивирующих лекарственные средства, таких как β-лактамаза. Существует множество методов определения восприимчивости Mycobacterium tuberculosis к противотуберкулезным препаратам, но ни один из них не совершенен, и их результаты не удовлетворяют клиницистов для эффективного лечения больных туберкулезом.
Существует множество методов определения восприимчивости Mycobacterium tuberculosis к противотуберкулезным препаратам, но ни один из них не совершенен, и их результаты не удовлетворяют клиницистов для эффективного лечения больных туберкулезом.
Большинство используемых в настоящее время методов ТЛЧ страдают низкой предсказуемостью, связанной с клинической неуместностью результатов, и неприемлемо низкой надежностью, обусловленной плохой воспроизводимостью. В этом обзоре основное внимание уделяется общим характеристикам методов ТЛЧ, касающихся клинической значимости и воспроизводимости метода.
МЕТОДЫ ИССЛЕДОВАНИЯ НА ЛЕКАРСТВЕННУЮ ЧУВСТВИТЕЛЬНОСТЬ
Лекарственная чувствительность M.tuberculosis может быть определена либо путем наблюдения роста или ингибирования метаболизма в среде, содержащей противотуберкулезный препарат, либо путем обнаружения на молекулярном уровне мутаций в генах, родственных к действию наркотиков. С технической точки зрения чувствительность к лекарственным средствам определяется на основе ингибирования роста (или метаболизма), вызываемого лекарственным средством, посредством: 1) макроскопического наблюдения за ростом в средах, не содержащих и содержащих лекарство; 2) обнаружение или измерение метаболической активности или продуктов; 3) лизис микобактериофагом; и 4) обнаружение генетических мутаций с использованием молекулярных методов.
Традиционные методы культивирования с использованием сред на основе яиц или агара по-прежнему наиболее широко используются во многих странах 4, 5. Хотя долгое время обработки результатов ТЛЧ не нравится врачам в целях ведения пациентов, они подходят для DRS. Стандартные методы с использованием среды Левенштейна-Йенсена включают метод пропорции, метод абсолютной концентрации и метод отношения резистентности, которые достаточно хорошо стандартизированы для клинических образцов, по крайней мере, для основных противотуберкулезных препаратов 4. Среди традиционных методов метод пропорции является наиболее предпочтительный выбор, но метод абсолютной концентрации также широко используется из-за его технической простоты для приготовления инокулята и для чтения результатов.
Чтобы сократить время обработки и сделать его более удобным для ведения пациентов, появилось множество новых методов, направленных на как можно более раннее обнаружение задержки роста. Наиболее часто используются системы для определения производства CO 2 , такие как BACTEC 460 6 или MB/Bact 7, и потребления кислорода, такие как пробирка для индикатора роста микобактерий 8; есть и другие, находящиеся на стадии разработки, такие как окислительно-восстановительные индикаторы, такие как резазурин или бромид тетразолия 9, 10, а также методы на основе фагов 11, 12. Иммуноанализ с подсчетом частиц 13 также может сократить время оборота за счет обнаружения низкого уровня умножения М. туберкулёз . Многие из этих новых методов трудно внедрить в странах, где они нужны больше всего, из-за высокой стоимости, технической сложности и отсутствия должным образом подготовленных людских ресурсов. Кроме того, им по-прежнему требуется клиническая оценка для подтверждения их заявленной эффективности в различных условиях. Прежде всего, ни один из этих методов не был хорошо откалиброван с репрезентативными клиническими образцами M.tuberculosis для определения клинически значимых критериев резистентности (9).0022, т.е. точки отсечки).
Иммуноанализ с подсчетом частиц 13 также может сократить время оборота за счет обнаружения низкого уровня умножения М. туберкулёз . Многие из этих новых методов трудно внедрить в странах, где они нужны больше всего, из-за высокой стоимости, технической сложности и отсутствия должным образом подготовленных людских ресурсов. Кроме того, им по-прежнему требуется клиническая оценка для подтверждения их заявленной эффективности в различных условиях. Прежде всего, ни один из этих методов не был хорошо откалиброван с репрезентативными клиническими образцами M.tuberculosis для определения клинически значимых критериев резистентности (9).0022, т.е. точки отсечки).
Имеются многочисленные сообщения о молекулярных методах обнаружения генных мутаций, связанных с устойчивостью, включая гибридизацию 14–20 амплифицированных генных сегментов или другие методы, основанные на ПЦР. Однако не все гены устойчивости к различным противотуберкулезным препаратам и места их мутации были обнаружены, за исключением мутаций гена rpoB, которые приводят к устойчивости к RFP. Эти молекулярные методы обычно требуют первичной амплификации, и поэтому, когда они используются на регулярной основе в течение длительных периодов времени, они не свободны от ложных результатов из-за загрязнения ампликонов и/или хромосомной ДНК.
Эти молекулярные методы обычно требуют первичной амплификации, и поэтому, когда они используются на регулярной основе в течение длительных периодов времени, они не свободны от ложных результатов из-за загрязнения ампликонов и/или хромосомной ДНК.
НАДЕЖНОСТЬ РЕЗУЛЬТАТОВ ТЕСТИРОВАНИЯ НА ЛЕКАРСТВЕННУЮ ЧУВСТВИТЕЛЬНОСТЬ
Всемирная организация здравоохранения и Международный союз по борьбе с туберкулезом и болезнями легких учредили Наднациональную сеть референс-лабораторий по ТБ, через которую они намереваются обеспечить квалификационное тестирование ТЛЧ в странах, внедряющих DRS 1–3. Результаты проверки квалификации по результатам девяти циклов, проведенных в 1994–2002 гг., показали, что средняя чувствительность для выявления устойчивости к изониазиду, РФП, стрептомицину (СМ) и этамбутолу (ЭМБ) составила 98,7 %, 97,2 %, 90,8 % и 89,3 % соответственно. 3. Соответствующая чувствительность для выявления чувствительности к INH, RFP, SM и EMB составила 98,5 %, 96,8 %, 93,9 % и 94,0 % соответственно. 3. Прогностические значения Результаты ТЛЧ на чувствительность, которые были рассчитаны на основе вышеупомянутых цифр, были высокими для всех четырех препаратов (>93%), даже при распространенности 40%, в то время как прогностические значения результатов ТЛЧ на устойчивость сильно различались между четырьмя основными препаратами ( рис 1⇓ и 2⇓). При распространенности резистентности менее 10% прогностические значения для EMB и SM были значительно ниже, чем для INH и RFP. Прогностическая ценность резистентности при медиане распространенности резистентности к конкретным препаратам среди больных легочным ТБ, как было опубликовано ранее 3 , составила 80,6% для изониазида при 5,9% медианная распространенность устойчивости, 30,4% для RFP при 1,4%, 50,0% для SM при 6,3% и 10,4% для EMB при 0,8%. Среди ранее леченных случаев прогностические значения были, конечно, выше из-за более высокой медианы распространенности резистентности, а именно: 91,6% для изониазида при медиане распространенности 14,4%; 74,6% для ЗП на уровне 8,4%; 65,8% для СМ при 11,4%; и 34,8% для EMB при 3,5%.
3. Прогностические значения Результаты ТЛЧ на чувствительность, которые были рассчитаны на основе вышеупомянутых цифр, были высокими для всех четырех препаратов (>93%), даже при распространенности 40%, в то время как прогностические значения результатов ТЛЧ на устойчивость сильно различались между четырьмя основными препаратами ( рис 1⇓ и 2⇓). При распространенности резистентности менее 10% прогностические значения для EMB и SM были значительно ниже, чем для INH и RFP. Прогностическая ценность резистентности при медиане распространенности резистентности к конкретным препаратам среди больных легочным ТБ, как было опубликовано ранее 3 , составила 80,6% для изониазида при 5,9% медианная распространенность устойчивости, 30,4% для RFP при 1,4%, 50,0% для SM при 6,3% и 10,4% для EMB при 0,8%. Среди ранее леченных случаев прогностические значения были, конечно, выше из-за более высокой медианы распространенности резистентности, а именно: 91,6% для изониазида при медиане распространенности 14,4%; 74,6% для ЗП на уровне 8,4%; 65,8% для СМ при 11,4%; и 34,8% для EMB при 3,5%.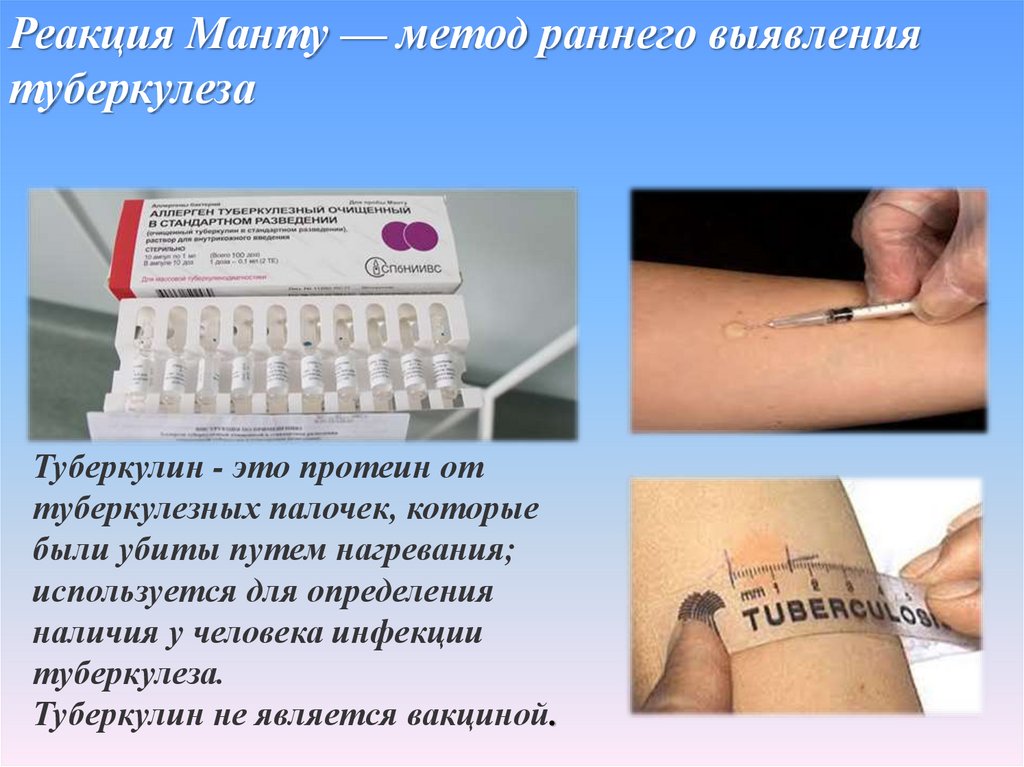 Понятно, что результаты резистентности для EMB и SM менее надежны, чем для INH и RFP. Аналогичные результаты были получены с помощью систем быстрого обнаружения роста 8.
Понятно, что результаты резистентности для EMB и SM менее надежны, чем для INH и RFP. Аналогичные результаты были получены с помощью систем быстрого обнаружения роста 8.
Рис. 1—
Прогностические значения результатов определения чувствительности к изониазиду (INH) и стрептомицину (SM). ○: чувствительность к INH; •: устойчивость к изониазиду; ⋄: восприимчивость к СМ; ♦: сопротивление СМ. Данные взяты из 3.
Рис. 2—
Прогностические значения результатов тестирования чувствительности к рифампицину (RFP) и этамбутолу (EMB). □: восприимчивость к RFP; ▪: устойчивость к RFP; ▵: восприимчивость к ЭМБ; ▴: сопротивление EMB. Данные взяты из 3.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕЗУЛЬТАТЫ ИСПЫТАНИЙ НА ЛЕКАРСТВЕННУЮ ЧУВСТВИТЕЛЬНОСТЬ
Методы ТЛЧ и интерпретация их результатов сильно различаются; однако следует отметить, что для получения клинически значимых и надежных результатов для ведения больных вероятность неправильной классификации клинически чувствительных или клинически устойчивых штаммов должна быть минимальной или отсутствовать.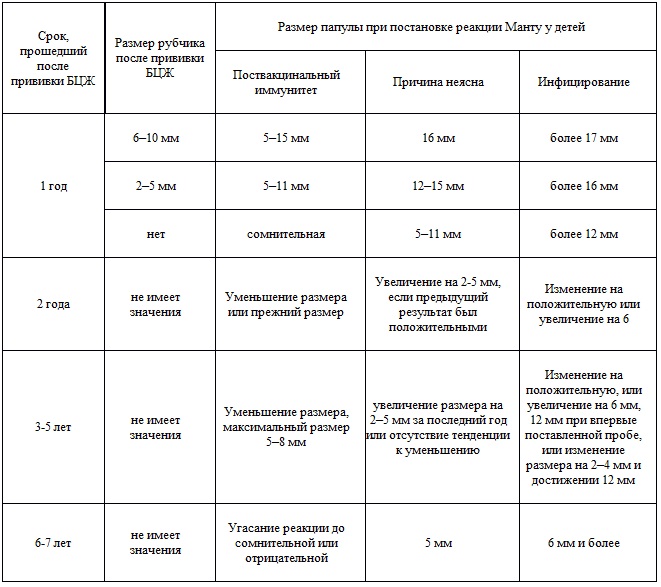 Стремясь выполнить это требование, было предложено зафиксировать критерии на уровне минимальной ингибирующей концентрации (МИК) и 1% от доли критической резистентности M.tuberculosis 9.0023, выделенных от никогда не получавших лечения пациентов 4, 21. Однако первичная лекарственная устойчивость, включая естественную резистентность, может помешать этому подходу. Другим методом могло бы быть сравнение клинических ответов штаммов, несущих все возможные уровни устойчивости, чтобы найти клинически значимый критический уровень устойчивости. Такой подход может показаться идеальным, но он нереалистичен. По этой причине рекомендуется определить критерии in vitro , которые можно использовать для прогнозирования клинической резистентности и чувствительности с приемлемой точностью путем тестирования четко определенных и репрезентативных клинических штаммов штаммов.0022 M. tuberculosis 4, 22, выделенные от пациентов, получавших лечение в хорошо контролируемых и надлежащим образом зарегистрированных клинических условиях.
Стремясь выполнить это требование, было предложено зафиксировать критерии на уровне минимальной ингибирующей концентрации (МИК) и 1% от доли критической резистентности M.tuberculosis 9.0023, выделенных от никогда не получавших лечения пациентов 4, 21. Однако первичная лекарственная устойчивость, включая естественную резистентность, может помешать этому подходу. Другим методом могло бы быть сравнение клинических ответов штаммов, несущих все возможные уровни устойчивости, чтобы найти клинически значимый критический уровень устойчивости. Такой подход может показаться идеальным, но он нереалистичен. По этой причине рекомендуется определить критерии in vitro , которые можно использовать для прогнозирования клинической резистентности и чувствительности с приемлемой точностью путем тестирования четко определенных и репрезентативных клинических штаммов штаммов.0022 M. tuberculosis 4, 22, выделенные от пациентов, получавших лечение в хорошо контролируемых и надлежащим образом зарегистрированных клинических условиях.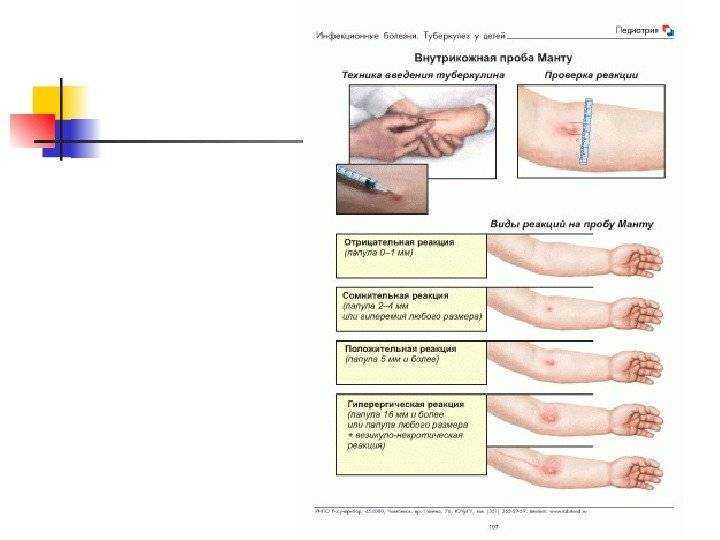 Оцениваемый метод ТЛЧ должен быть откалиброван путем сравнения МИК вероятно чувствительных (PS) штаммов, полученных от пациентов, никогда не получавших лечения, с МИК вероятно устойчивых (PR) штаммов, полученных от пациентов, у которых явно была неэффективность лечения схемами, содержащими соответствующий препарат. Разница в кумулятивных процентах чувствительности между клиническими изолятами PS и PR (при различных концентрациях) была больше при 0,2 мкг·мл -1 с INH и при 40,0 мкг·мл -1 с RFP 23; значения мощности дискриминации составили 75,8% и 85,8% соответственно (рис. 3⇓ и 4⇓). При тех же концентрациях критическая устойчивая пропорция 1% могла наиболее разумно различать PS и PR для обоих препаратов, демонстрируя способность различения 77,1% для INH и 85,6% для RFP 23. Mitchison 24 обнаружил, что устойчивые к SM штаммы отличались от восприимчивых. штаммов при 16 мкг·мл -1 с разницей 52,4%. Леффорд и Митчисон 22 сообщили, что резистентность к этионамиду (ЭТН) была обнаружена при 40,0 мкг·мл −1 с разницей в 46,7%.
Оцениваемый метод ТЛЧ должен быть откалиброван путем сравнения МИК вероятно чувствительных (PS) штаммов, полученных от пациентов, никогда не получавших лечения, с МИК вероятно устойчивых (PR) штаммов, полученных от пациентов, у которых явно была неэффективность лечения схемами, содержащими соответствующий препарат. Разница в кумулятивных процентах чувствительности между клиническими изолятами PS и PR (при различных концентрациях) была больше при 0,2 мкг·мл -1 с INH и при 40,0 мкг·мл -1 с RFP 23; значения мощности дискриминации составили 75,8% и 85,8% соответственно (рис. 3⇓ и 4⇓). При тех же концентрациях критическая устойчивая пропорция 1% могла наиболее разумно различать PS и PR для обоих препаратов, демонстрируя способность различения 77,1% для INH и 85,6% для RFP 23. Mitchison 24 обнаружил, что устойчивые к SM штаммы отличались от восприимчивых. штаммов при 16 мкг·мл -1 с разницей 52,4%. Леффорд и Митчисон 22 сообщили, что резистентность к этионамиду (ЭТН) была обнаружена при 40,0 мкг·мл −1 с разницей в 46,7%. Также интересно отметить, что наиболее разумные критерии устойчивости могут различаться в разных лабораториях, даже если они применяют один и тот же метод. Штаммы EMB PR были отличены от штаммов PS при 2 мкг·мл -1 в лаборатории Корейского института туберкулеза, Сеул, Южная Корея, в то время как они лучше отличались при 4 мкг·мл -1 в лаборатории Королевской медицинской школы последипломного образования, Лондон, Великобритания, с использованием той же среды и метода и тестирования тех же штаммов PR (личное общение, Д. А. Митчисон, Отдел лабораторных исследований туберкулеза Совета медицинских исследований, Королевская медицинская школа последипломного образования, больница Хаммерсмит, Лондон , Великобритания; рис. 5⇓). Эти данные, по-видимому, указывают на то, что различия в критической концентрации могли быть результатом различных уровней восприимчивости штаммов PS и различий в тестовой среде. Уровни устойчивости штаммов PR сильно различаются, за исключением RFP; поэтому невозможно определить приемлемую точку отсечки без тщательной калибровки чувствительности штаммов PS.
Также интересно отметить, что наиболее разумные критерии устойчивости могут различаться в разных лабораториях, даже если они применяют один и тот же метод. Штаммы EMB PR были отличены от штаммов PS при 2 мкг·мл -1 в лаборатории Корейского института туберкулеза, Сеул, Южная Корея, в то время как они лучше отличались при 4 мкг·мл -1 в лаборатории Королевской медицинской школы последипломного образования, Лондон, Великобритания, с использованием той же среды и метода и тестирования тех же штаммов PR (личное общение, Д. А. Митчисон, Отдел лабораторных исследований туберкулеза Совета медицинских исследований, Королевская медицинская школа последипломного образования, больница Хаммерсмит, Лондон , Великобритания; рис. 5⇓). Эти данные, по-видимому, указывают на то, что различия в критической концентрации могли быть результатом различных уровней восприимчивости штаммов PS и различий в тестовой среде. Уровни устойчивости штаммов PR сильно различаются, за исключением RFP; поэтому невозможно определить приемлемую точку отсечки без тщательной калибровки чувствительности штаммов PS. Эти исследования ясно показывают, что различие между штаммами PR и PS более надежно для INH и RFP, чем для других препаратов. Также ясно, что разработка метода ТЛЧ, способного на 100 % различать штаммы PR и PS, на самом деле неосуществима из-за технических вариаций, возникающих из-за физико-химически лабильной среды теста.
Эти исследования ясно показывают, что различие между штаммами PR и PS более надежно для INH и RFP, чем для других препаратов. Также ясно, что разработка метода ТЛЧ, способного на 100 % различать штаммы PR и PS, на самом деле неосуществима из-за технических вариаций, возникающих из-за физико-химически лабильной среды теста.
Рис. 3—
Определение а) критической концентрации и б) критической доли устойчивости к изониазиду (INH) с использованием вероятно чувствительных (——; n = 99) и вероятно устойчивых штаммов (сплошная линия; n = 117). МИК: минимальная ингибирующая концентрация. # : 13,1% как стойкий; ¶ : 75,8%; + : 11,1% как восприимчивые; § : 77,1%. Данные взяты из 23.
Рис. 4—
Определение а) критической концентрации и б) критической доли резистентности к рифампицину (РФП) с использованием вероятно чувствительных (——; n = 99) и вероятно резистентные штаммы (сплошная линия; n = 108).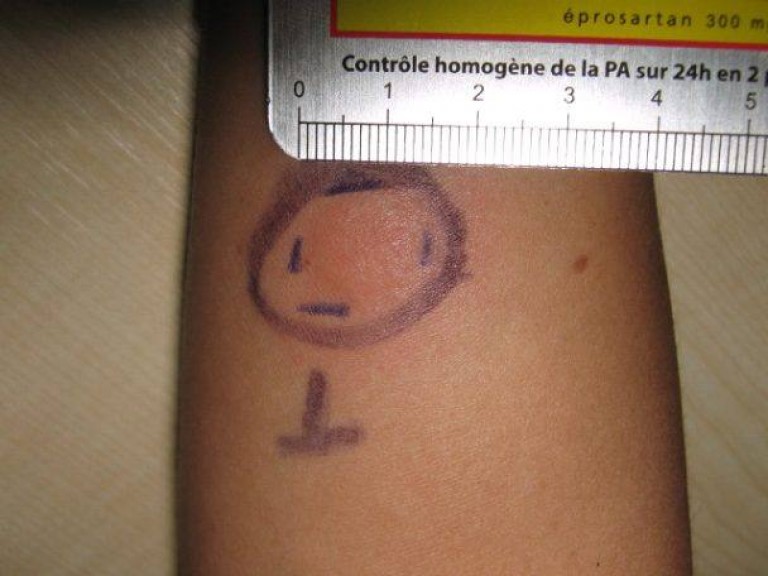 МИК: минимальная ингибирующая концентрация. # : 85,8%; ¶ : 85,6%. Данные взяты из 23.
МИК: минимальная ингибирующая концентрация. # : 85,8%; ¶ : 85,6%. Данные взяты из 23.
. 104; вероятно устойчивые британские штаммы (BPR): сплошная линия, n = 124, и b) Королевская медицинская школа последипломного образования, Лондон, Великобритания (вероятно восприимчивые гонконгские штаммы: ·····, n = 333; BPR: n = 106), применяя тот же метод. МИК: минимальная ингибирующая концентрация. # : 41,9%; ¶ : 38,8%. Данные получены из личного общения с Д.А. Mitchison (Отдел лабораторных исследований туберкулеза Совета медицинских исследований, Королевская медицинская школа последипломного образования, больница Хаммерсмит, Лондон, Великобритания).
Недавнее исследование текущей практики ТЛЧ к препаратам второго ряда в 10 наднациональных референс-лабораториях выявило важные различия в отношении критических концентраций препаратов и критических долей резистентности 25, подчеркнув необходимость стандартизации методов и критериев с целью оптимизации клинической значимости результатов ТЛЧ.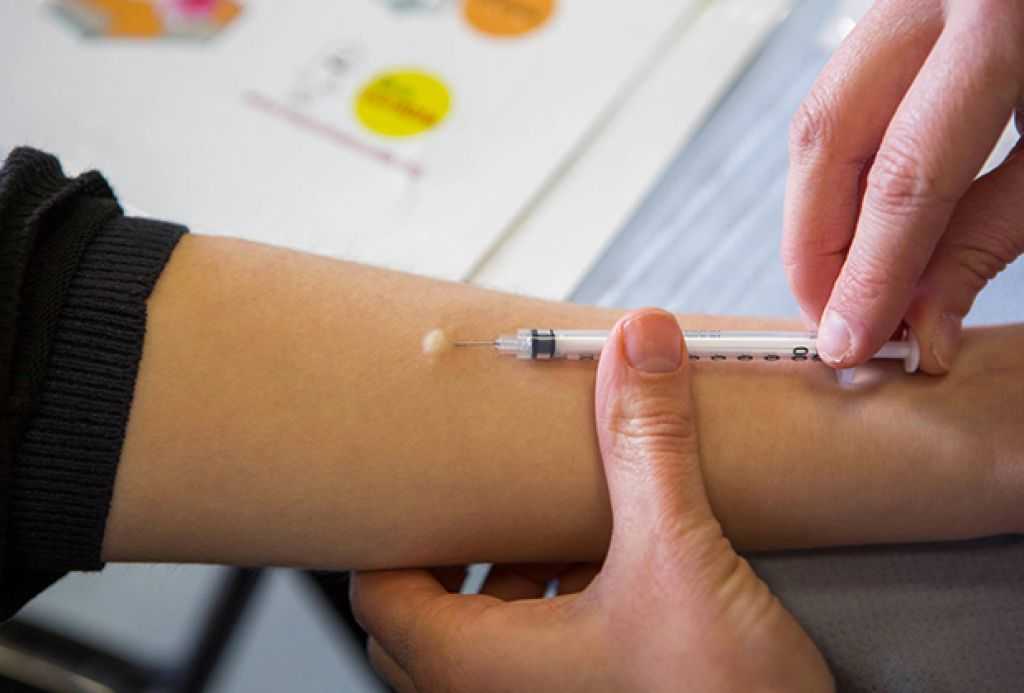
Развитие лекарственной устойчивости путем селективного размножения резистентных мутантов, существующих в популяции диких бацилл, определяется исходным размером активно размножающихся организмов в очагах поражения, временем воздействия лекарственного средства и концентрацией лекарственного средства 4, 24, 26, 27. Абсорбция диффузия в очаги поражения и поддерживающий уровень лекарственного средства являются важными факторами возникновения лекарственной устойчивости. INH и RFP, результаты тестирования чувствительности которых достаточно надежны, показывают пиковую концентрацию в сыворотке более чем в 100 раз выше, чем MIC, и, безусловно, возможно поддерживать их на достаточно высоком уровне в поражениях на протяжении всего лечения, если только пациент не прерывает лечение. прием лекарств (рис. 6⇓) 27, 28. И наоборот, пиковые уровни циклосерина, ЭМБ, ципрофлоксацина, офлоксацина и ЭТГ в сыворотке ближе к МПК (рис. 6⇓). Как следствие, у некоторых пациентов период ингибирующей концентрации лекарственного средства в очагах поражения может быть коротким и/или уровень лекарственного средства может оставаться субингибирующим в течение большей части времени.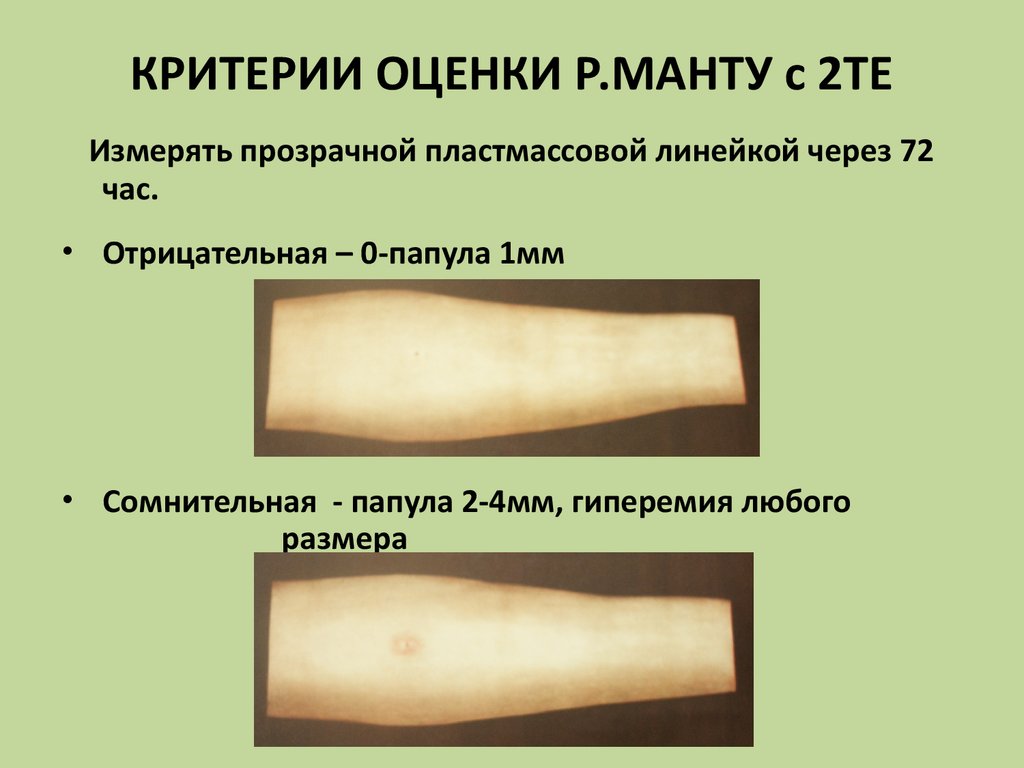 В целом результаты ТЛЧ к последним препаратам малонадежны.
В целом результаты ТЛЧ к последним препаратам малонадежны.
Рис. 6—
Приблизительное отношение среднего пика в сыворотке к минимальной ингибирующей концентрации (МПК) противотуберкулезных препаратов. Данные представлены как средние (высокие/низкие). ▪: ципрофлоксацин; □: офлоксацин; •: этионамид; о: этамбутол; ♦: изониазид; ⋄: циклосерин; ▴: рифампицин; ▵: стрептомицин; ▾: парааминосалициловая кислота; ▿: капреомицин;
: канамицин. Данные взяты из 27, 28.
Многие из недавно разработанных методов ТЛЧ не были тщательно откалиброваны для определения in vitro критерии устойчивости с соответствующими клиническими образцами, репрезентативными для клинического исхода пациента в текущих клинических условиях; вместо этого эти критерии часто выбирались произвольно с использованием лабораторных штаммов. Если не будет проведена тщательная калибровка, клиническая значимость результатов ТЛЧ остается неопределенной.
На воспроизводимость результатов in vitro ТЛЧ в значительной степени влияет физико-химическая среда теста 4, 28, что требует соответствующей стандартизации и контроля процедуры теста. Плохая воспроизводимость обычно связана с процедурной сложностью; таким образом, его можно улучшить за счет процедурного упрощения.
Соответствующая стандартизация подготовки инокулята является важной предпосылкой для получения надежных результатов ТЛЧ, поскольку количество (размер), дисперсия и жизнеспособность микроорганизмов в инокуляте оказывают значительное влияние на результаты ТЛЧ. Частые субкультуры могут искажать уровни чувствительности к лекарственным препаратам и структуру штаммов по сравнению с таковыми из первичных культур. Питательные среды должны обеспечивать адекватный рост всех инокулированных организмов; однако, когда они содержат некоторые антагонистические соединения или химические вещества, препятствующие действию лекарства, результаты будут ненадежными, если только эти вещества не будут удалены или сведены к минимуму. Изменения концентрации лекарственного средства, включенного в среду, происходят из-за связывания с белком, тепловой инактивации, потери различных количеств лекарственного средства во время стерилизации фильтром, неполного растворения из-за использования неподходящих растворителей, неточного расчета активности и неточного разведения. pH среды, температура инкубации и время инкубации также являются важными факторами, влияющими на результаты ТЛЧ. Тщательная стандартизация и контроль этих физико-химических факторов тестовой среды необходимы для достижения приемлемой воспроизводимости результатов ТЛЧ.
Изменения концентрации лекарственного средства, включенного в среду, происходят из-за связывания с белком, тепловой инактивации, потери различных количеств лекарственного средства во время стерилизации фильтром, неполного растворения из-за использования неподходящих растворителей, неточного расчета активности и неточного разведения. pH среды, температура инкубации и время инкубации также являются важными факторами, влияющими на результаты ТЛЧ. Тщательная стандартизация и контроль этих физико-химических факторов тестовой среды необходимы для достижения приемлемой воспроизводимости результатов ТЛЧ.
ЗАКЛЮЧЕНИЕ
Тестирование лекарственной чувствительности по-прежнему широко используется в качестве инструмента для выбора эффективных схем успешного лечения больных туберкулезом (особенно туберкулезом с множественной лекарственной устойчивостью), а также для оценки эффективности программ и разработки стратегий борьбы с проблема лекарственно-устойчивого туберкулеза. Однако для получения надежных результатов оцениваемый метод определения лекарственной чувствительности для рутинного использования должен быть тщательно откалиброван с использованием репрезентативных клинических изолятов 9 штаммов.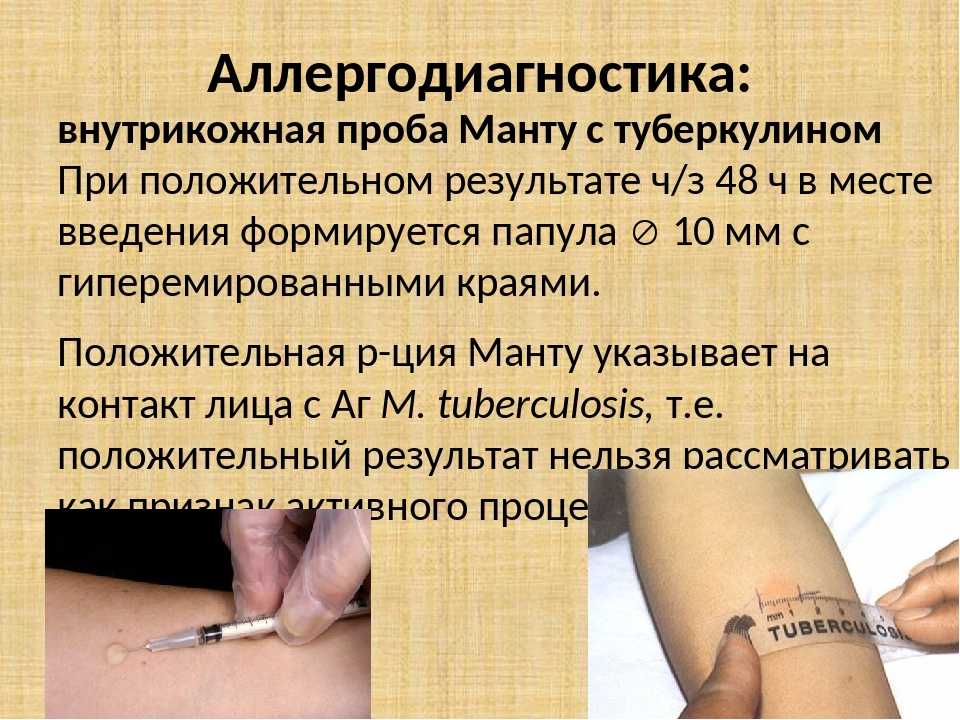 0022 Mycobacterium tuberculosis для определения тестовых критериев in vitro , которые можно было бы использовать для прогнозирования, в лучшем случае, клинического исхода пациента. Процедура испытаний затем должна быть стандартизирована с максимальным упрощением, чтобы получить результаты с приемлемой воспроизводимостью в отношении этих критериев.
0022 Mycobacterium tuberculosis для определения тестовых критериев in vitro , которые можно было бы использовать для прогнозирования, в лучшем случае, клинического исхода пациента. Процедура испытаний затем должна быть стандартизирована с максимальным упрощением, чтобы получить результаты с приемлемой воспроизводимостью в отношении этих критериев.
Сноски
Предыдущие статьи из этой серии: № 1: Cardona P-J, Ruiz-Manzano J. О природе
- Принята 25 сентября 2004 г.

- Принята 6 октября 2004 г.
Литература
- ↵
Всемирная организация здравоохранения. Устойчивость к противотуберкулезным препаратам в мире. Глобальный проект ВОЗ/IUATLD по эпиднадзору за устойчивостью к противотуберкулезным препаратам (WHO/TB/97.229). Женева, документ Всемирной организации здравоохранения, 1997 г.
Всемирная организация здравоохранения. Устойчивость к противотуберкулезным препаратам в мире. Отчет № 2: распространенность и тенденции. Глобальный проект ВОЗ/IUATLD по надзору за устойчивостью к противотуберкулезным препаратам (WHO/CDC/TB/2000.278). Женева, документ Всемирной организации здравоохранения, 2000 г.
- ↵
Всемирная организация здравоохранения. Устойчивость к противотуберкулезным препаратам в мире. Третий глобальный отчет. Глобальный проект ВОЗ/IUATLD по надзору за устойчивостью к противотуберкулезным препаратам (WHO/CDC/TB/2004).

- ↵
Канетти Г., Фокс В., Хоменко А., и др. Достижения в методах тестирования чувствительности микобактерий к лекарствам и использование тестов на чувствительность в программах борьбы с туберкулезом. Бык Всемирный орган здравоохранения 1969;41:21–43.
- ↵
Кент ТК, Кубица ГП. Микобактериология общественного здравоохранения. Руководство для лаборатории уровня III. Атланта, Центр контроля заболеваний, 1985 г.
- ↵
Хокинс Дж. Э., Уоллес Р. Дж. Мл., Браун Б. А. Тесты на чувствительность к антибактериальным препаратам: микобактерии. In : Balows A, Hausler WJ, Herrmann KL, Isenberg HD, Shadommy HJ, ред. Руководство по клинической микробиологии. 5-е изд. Вашингтон, округ Колумбия, Американское общество микробиологии, 19 лет.91; стр. 1138–1152
- ↵
Диас-Инфантес М.
 С., Руис-Серрано М.Дж., Мартинес-Санчес Л., и др. Оценка системы обнаружения микобактерий MB/BacT для определения чувствительности Mycobacterium tuberculosis . J Clin Microbiol 2000; 38:1988–1989.
С., Руис-Серрано М.Дж., Мартинес-Санчес Л., и др. Оценка системы обнаружения микобактерий MB/BacT для определения чувствительности Mycobacterium tuberculosis . J Clin Microbiol 2000; 38:1988–1989. - ↵
Бемер П., Паликова Ф.Р., Руш-Гердес С., Другеон Х.Б., Пфиффер Г.Э. Многоцентровая оценка полностью автоматизированной пробирки индикатора роста микобактерий BACTEC 960 система для определения чувствительности Mycobacterium tuberculosis . J Clin Microbiol 2002;40:150–154.
- ↵
Palomino JC, Martin A, Camacho M, Guerra H, Swings J, Portaels F. Планшет для микротитрования резазурина: простой и недорогой метод определения лекарственной устойчивости у Mycobacterium tuberculosis . Противомикробные агенты Chemotherap 2002;46:2720–2722.
- ↵
Abate G, Mshana RN, Miörner H. Оценка колориметрического анализа на основе бромида 3-(4,5-диметил-2-ил)-2,5-дифенилтетразолия для быстрого выявления устойчивости к рифампицину у Микобактерии туберкулеза .
 Int J Tuberc Lung Dis 1998; 2:1011–1016.
Int J Tuberc Lung Dis 1998; 2:1011–1016. - ↵
Риска П.Ф., Су Ю., Бардаров С., и др. Экспресс-пленочное определение чувствительности к антибиотикам штаммов Mycobacterium tuberculosis с использованием репортерного фага люциферазы и Bronx box. Дж. Клин Миробиол 1999; 37:1144–1149.
- ↵
Гали Н., Домингес Х., Бланко С., и др. Использование собственного анализа на основе микобактериофагов для быстрого выявления устойчивости к рифампицину в клинических изолятах Mycobacterium tuberculosis . J Clin Microbiol 2003;41:2647–2649.
- ↵
Дроварт А., Камбиасо С.Л., Хьюген К., и др. Обнаружение устойчивости к рифампицину и изониазиду штаммов Mycobacterium tuberculosis с помощью иммуноанализа с подсчетом частиц. Int J Tuberc Lung Dis 1997; 1: 284–288.
- ↵
Лебрун Л.
 , Гёнюллю Н., Бутрос Н., и др. Использование анализа INNO-LIPA для быстрой идентификации микобактерий. Diagn Microbiol Infect Dis 2003;46:151–153.
, Гёнюллю Н., Бутрос Н., и др. Использование анализа INNO-LIPA для быстрой идентификации микобактерий. Diagn Microbiol Infect Dis 2003;46:151–153. El-Haji HH, Marras SAE, Tyagi S, Kramer FR, Alland D. Обнаружение устойчивости к рифампицину у Mycobacterium tuberculosis в одной пробирке с молекулярными маяками. J Clin Microbiol 2001;39:4131–4137.
Ким Б.Дж., Ли К.Х., Парк Б.Н., и др. Обнаружение устойчивых к рифампицину Mycobacterium tuberculosis в мокроте с помощью вложенной ПЦР-связанной одноцепочечной конформации полиморфизма и секвенирования ДНК. J Clin Microbiol 2001;39:2610–2617.
Лин Ю.П., Бер М.А., Смолл П.М., Курн Н. Генотипическое определение устойчивости к антибиотикам Mycobacterium tuberculosis с использованием нового метода обнаружения мутаций, подавление миграции ветвей M.
 tuberculosis Тест на устойчивость к антибиотикам. J Clin Microbiol 2000;38:3656–3662.
tuberculosis Тест на устойчивость к антибиотикам. J Clin Microbiol 2000;38:3656–3662. Мокроусов И., Оттен Т., Филипенко М., и др. Обнаружение штаммов Mycobacterium tuberculosis , устойчивых к изониазиду, с помощью мультиплексного аллель-специфического ПЦР-тестирования вариации кодона 315 kat G. J Clin Microbiol 2002;40:2509–2512.
Torres MJ, Criado A, Palomares JC, Aznar J. Использование ПЦР в реальном времени и флуориметрии для быстрого обнаружения мутаций, связанных с устойчивостью к рифампину и изониазиду, в Микобактерии туберкулеза . J Clin Microbiol 2000;38:3194–3199.
- ↵
Ван Дер Занден А.Г., Те Коппеле-Визе Э.М., Виджая Бхану Н., Ван Сулинген Д., Шоулс Л.М. Использование экстрактов ДНК из окрашенных по Цилю-Нильсену слайдов для молекулярного обнаружения устойчивости к рифампину и сполиготипирования Mycobacterium tuberculosis .
 J Clin Microbiol 2003;41:1101–1108.
J Clin Microbiol 2003;41:1101–1108. - ↵
Pfyffer GE, Bonato DA, Ebrahimzadeh A, и др. Многоцентровая лабораторная валидация тестирования чувствительности Mycobacterium tuberculosis к классическим противомикробным препаратам второго ряда и более новым с использованием радиометрического метода BACTEC 460 и пропорционального метода с твердыми средами. J Clin Microbiol 1999;37:3179–3186.
- ↵
Леффорд М.Дж., Митчисон Д.А. Сравнение методов определения чувствительности Mycobacterium tuberculosis к этионамиду. Бугорок 1966;47:250–262.
- ↵
Корейский институт туберкулеза, Корейская национальная противотуберкулезная ассоциация. Определение лекарственной чувствительности микобактерий методом пропорций. Отчет об исследовании, 1994 г.
- ↵
Митчисон Д.А. Что такое лекарственная устойчивость? Туберкул 1969; 50: 44–47.

- ↵
Kim SJ, Espinal MA, Abe C, et al. Надежно ли определение чувствительности к противотуберкулезным препаратам второго ряда? Int J Tuberc Lung Dis 2004; 8: 1157–1158.
- ↵
Канетти Г. Лекция Дж. Бернса Амберсона: представить аспекты бактериальной резистентности при туберкулезе. Am Rev Respir Dis 1966; 92: 687–703.
- ↵
Иваински Х. Механизм действия, биотрансформация и фармакокинетика противотуберкулезных препаратов у животных и человека. В : Бартманн К., изд. Противотуберкулезные препараты. Нью-Йорк, Springer-Verlag, 1988; стр. 399–553
- ↵
Хейфец ЛБ. Лекарственная чувствительность при химиотерапии микобактериальных инфекций. Бока-Ратон, CRC Press, 1991
Просмотреть резюме
ПредыдущийСледующий
Наверх
Тестирование чувствительности к противомикробным препаратам (AST) для комплекса Mycobacterium tuberculosis | Государственная лаборатория общественного здравоохранения
Краткое описание
Тест на чувствительность к противомикробным препаратам (AST) определяет способность четырех основных противотуберкулезных препаратов ингибировать рост (in vitro) Комплекс Mycobacterium tuberculosis (MTBC) в матрице макроразведения бульона, в которой используются критические концентрации тестируемого лекарственного средства. АСТ важна для правильного лечения и ведения больных туберкулезом (ТБ). ТЧА помогает врачу выбрать наиболее подходящую схему медикаментозного лечения и предупреждает врача, когда лекарственная устойчивость может быть рассмотрена при лечении пациента.
АСТ важна для правильного лечения и ведения больных туберкулезом (ТБ). ТЧА помогает врачу выбрать наиболее подходящую схему медикаментозного лечения и предупреждает врача, когда лекарственная устойчивость может быть рассмотрена при лечении пациента.
Лабораторный блок
Туберкулез
Методология
Макроразведение бульона с использованием системы BACTEC™ MGIT™
Коллекция образцов
Жизнеспособный изолят MTBC в чистой культуре на твердой или жидкой среде
Смешанные или нежизнеспособные микроорганизмы MTBC приемлемы для ТЧА на молекулярной основе; однако ТЧА, основанная на росте, может быть недоступна.
См. «Молекулярное обнаружение лекарственной устойчивости (MDDR) для комплекса Mycobacterium tuberculosis » для молекулярной ТЧА.
Хранение/транспортировка
Отправляйте изоляты, используя носитель туберкулеза (ТБ) категории А, предоставленный MSPHL, в соответствии с правилами перевозки инфекционных веществ категории А.
Допустимые типы образцов
Предоставьте скошенный (L-J, Middlebrook или Mitchison) или жидкий бульон (MGIT, VersaTREK или MP).
Форма запроса на тестирование
Форма запроса на обследование на туберкулез
Возможные результаты
Восприимчивый
Устойчивый
Неприемлемые условия
Отсутствие имени или идентификатора пациента на образце
Образец просочился во время транспортировки в лабораторию
Смешанный или нежизнеспособный микроорганизм
Мешающие вещества
Н/Д
Результат сообщен
4–17 дней после выявления МТБК
Сборы
Н/Д
Коды CPT
87188 x5
LOINC/SNOMED Коды
29579-0
Дополнительная информация
MTBC, проявляющие устойчивость к какому-либо лекарственному средству, направляются в Центры по контролю и профилактике заболеваний (CDC) для получения AST второго ряда.
19 CSR 20-20.080 Обязанности лабораторий
«Изоляты или образцы, положительные на [ M.tuberculosis комплекс] должен быть представлен в Государственную лабораторию общественного здравоохранения для эпидемиологических или подтверждающих целей»
Ссылки по теме
Краткое руководство по меню тестирования Индекс от А до Я Дыхание Алкоголь Сертификаты Возможности трудоустройства Информационные бюллетени Онлайн платеж Услуги по теме Доставка образцов / Курьер Наборы образцов Уставы и положения Формы запросов на тестирование Подготовка Обратная связь Отчеты о результатах испытаний
Контактный телефон
Государственная лаборатория общественного здравоохранения101 N. Chestnut Street
PO Box 570
Jefferson City, MO 65102-0570
Как добраться до лаборатории
Телефон: 573-751-3334
Факс: 573-526-2751@904labwe62 Электронная почта: 904labwe62 health.


