(PDF) Effectiveness of Tuberculous Recombinant Allergen Skin Tests for Detecting Tuberculosis in Children and Adolescents of Moscow in 2013
103
ПЕДИАТРИЧЕСКАЯ ФАРМАКОЛОГИЯ /2015/ ТОМ 12/ № 1
с осложнениями вакцинации БЦЖ, что позволило диф-
ференцировать это состояние. Высокая чувствительность
метода способствует выявлению подавляющего числа
лиц, больных туберкулезом.
Дети, у которых при положительной реакции на пробу
с препаратом ДСТ не были выявлены локальные изме-
нения, подлежали превентивной терапии при наблюде-
нии в группах риска. Назначение превентивной терапии
только лицам с положительной реакцией на пробу с пре-
паратом ДСТ, а не всем лицам с виражом, усилением
и гиперергией на пробу Манту, позволило в 5 раз сокра-
тить число пролеченных детей и обеспечить контролируе-
мое лечение в условиях санатория. Это особенно важно,
учитывая токсичность и длительность приема, а также
опасность селекции и мутации микобактерий туберкуле-
за при бесконтрольном и прерывистом приеме противо-
туберкулезных препаратов. Такая практика назначения
Такая практика назначения
превентивной терапии показала свою эффективность:
заболеваемость в этих группах существенно снизилась.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы данной статьи подтвердили отсутствие финан-
совой поддержки/конфликта интересов, который необхо-
димо обнародовать.
1. Lein A., von Reyn C., Ravn P. et al. Cellular immune responses to
ESAT-6 discriminate between patients with pulmonary disease due
to Mycobacterium avium complex and those with pulmonary disease
due to Mycobacterium tuberculosis. Clin Diagn Lab Immunol.
1999; 6: 606–609.
2. Mahairas G., Sabo P., Hickey M. et al. Molecular analysis of
genetic differences between Mycobacterium bovis BCG and virulent
M. bovis. J Bacteriol. 1996; 178: 1274–1282.
3. Andersen P., Doherty T., Pai M., Weldingh K. The prognosis of
latent tuberculosis: can disease be predicted? Trends Mol Med.
2007; 13 (5): 175–182.
4. Ewer K.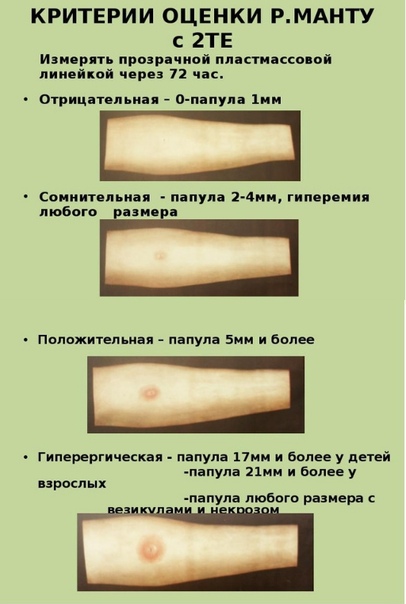 , Deeks J., Alvarez L. et al. Comparison of T-cell-based
, Deeks J., Alvarez L. et al. Comparison of T-cell-based
assay with tuberculin skin test for diagnosis of Mycobacterium
tuberculosis infection in a school tuberculosis outbreak. Lancet.
2003; 361: 1168–1173.
5. Arend S., Thijsen S., Leyten E. et al. Comparison of two interferon-
gamma assays and tuberculin skin test for tracing tuberculosis
contacts. Am J Respir Crit Care Med. 2007; 175 (6): 618–627.
6.
Menzies D., Pai M., Comstock G. Meta-analysis: new tests for the
diagnosis of latent tuberculosis infection: areas of uncertainty and
recommendations for research. Ann Intern Med. 2007; 146: 340–354.
7. Mack U., Migliori G., Sester M. et al. LTBI: latent tuberculosis
infection or lasting immune responses to Mycobacterium
tuberculosis? A TBNET consensus statement. Eur Respir J. 2009;
33: 956–973.
8. Pai M., Zwerling A., Menzies D. Systematic review: T-cell-based
assays for the diagnosis of latent tuberculosis infection: an update.
Ann Intern Med. 2008; 149 (3): 177–184.
9. Andersen P., Andersen A., Sorensen A., Nagai S. Recall of long-
lived immunity to Mycobacterium tuberculosis infection in mice.
J Immunol. 1995; 154 (7): 3359–72.
10. Vordermeier H., Chambers M., Cockle P. et al. Correlation of
ESAT-6-specific gamma interferon production with pathology in cattle
following Mycobacterium bovis BCG vaccination against experimental
bovine tuberculosis. Infect Immun. 2002; 70: 3026–3032.
11. Dietrich J., Aagaard C., Leah R. et al. Exchanging ESAT6 with
ТВ 10.4 in an Ag85B fusion molecule-based tuberculosis
subunit vaccine: efficient protection and ESAT6-based sensitive
monitoring of vaccine efficacy. J Immunol. 2005; 174: 6332–6339.
12. Bakir M., Millington K., Soysal A. et al. Prognostic value of a
T-cell-based, interferon- biomarker in children with tuberculosis
contact. Ann Intern Med. 2008; 149: 777–787.
13.
Diel R., Loddenkemper R., Meywald-Walter K. et al. Predictive
value of a whole blood IFN-gamma assay for the development of
active tuberculosis disease after recent infection with Mycobacterium
tuberculosis. Am J Respir Crit Care Med. 2008; 177 (10): 1164–1170.
14. Doherty T., Demissie A., Olobo J. et al. Immune responses to
the Mycobacterium tuberculosis-specific antigen ESAT-6 signal
subclinical infection among contacts of tuberculosis patients. J Clin
Microbiol. 2002; 40 (2): 704–706.
15. Lienhardt C., Fielding K., Hane A. et al. Evaluation of the
Prognostic Value of IFN- Release Assay and Tuberculin Skin
Test in Household Contacts of Infectious Tuberculosis Cases in
Senegal. PLoS ONE. 2010; 5 (5): e10508. Doi: 10.1371/journal.
pone.0010508.
16. Mazurek G., Weis S., Moonan P. et al. Prospective comparison
of the tuberculin skin test and two whole-blood interferon-gamma
release assays in persons with suspected tuberculosis. Clin Infect
Clin Infect
Dis. 2007; 45: 837–845.
17. Diel R., Nienhaus A., Schaberg T. Cost-effectiveness of
isoniazid chemoprevention in close contacts. Eur Respir J. 2005;
26: 465–473.
18. Dosanjh D., Hinks T., Innes J. et al. Improved diagnostic
evaluation of suspected tuberculosis. Ann Intern Med. 2008;
148: 325–336.
19. Goletti D., Stefania C., Butera O. et al. Accuracy of immuno-
diagnostic tests for active tuberculosis using single and combined
results: a multicenter TBNET Study. PLoS ONE. 2008; 3: e3417.
20. Brandli O., Desgrandchamps D., Gabathuler U. et al. Manual of
Tuberculosis. Bern, Swiss Lung League. 2007. URL: www.lung.ch
21.
National Institute for Health and Clinical Excellence. Tuberculosis:
Clinical Diagnosis and Management of Tuberculosis, and Measures
for its Prevention and Control. London, National Institute for Health
and Clinical Excellence. 2006. URL: www.nice.org. uk.
uk.
22. The National Collaborating Centre for Chronic Conditions.
Tuberculosis. Clinical Diagnosis and Management of Tuberculosis,
and Measures for its Prevention and Control. London, Royal College
of Physicians. 2006.
23. Борисов С. Е., Лукина Г. В., Слогоцкая Л. В., Кочетков Я. А.,
Гунтупова Л. Д., Куликовская Н. В. Скрининг и мониторинг тубер-
кулезной инфекции у ревматологических больных, получаю-
щих генно-инженерные биологические препараты. Туберкулез
и болезни легких. 2011; 6: 42–50.
24. Mazurek G., Jereb J., Lobue P. et al. Guidelines for using the
Quanti FERON-TB Gold test for detecting Mycobacterium tuberculosis
infection, United States. MMWR Recomm Rep. 2005; 54: 49–55.
25. Киселев В. И., Барановский П. М., Пупышев С. А. и др. Новый
кожный тест для диагностики туберкулеза на основе рекомбинант-
ного белка ESAT-CFP. Молекулярная медицина. 2008; 4: 4–6.
26. Lalvani A., Millington K. A. T cell-based diagnosis of childhood
A. T cell-based diagnosis of childhood
tuberculosis infection. Curr Opin Infect Dis. 2007; 20: 264–271.
27. Lalvani A. Diagnosing tuberculosis infection in the 21st century:
new tools to tackle an old enemy. Chest. 2007; 131: 1898–1906.
28. Mori T., Sakatani M., Yamagishi F. et al. Specific detection of
tuberculosis infection: an interferon-c-based assay using new
antigens. Am J Respir Crit Care Med. 2004; 170: 59–64.
29. Pai M., Kalantri S., Dheda K. New tools and emerging techno-
logies for the diagnosis of tuberculosis: part I. Latent tuberculosis.
Expert Rev Mol Diagn. 2006; 6: 413–422.
30.
Richeldi L., Ewer K., Losi M. et al. Early diagnosis of subclinical
multidrug-resistant tuberculosis. Ann Intern Med. 2004; 140: 709–713.
31. Слогоцкая Л. В., Сенчихина О. Ю., Богородская Е. М. Чувстви-
тельность теста с аллергеном туберкулезным рекомбинантным,
содержащим белок ESAT6-CFP10, у впервые выявленных боль-
ных туберкулезом детей и подростков в г. Москве. Туберкулез
Москве. Туберкулез
и социально значимые заболевания. 2013; 1: 37–44.
СПИСОК ЛИТЕРАТУРЫ
Анализ эффективности Диаскинтеста как метода верификации туберкулеза у детей
АННОТАЦИЯ
Действующим законодательством Российской Федерации определен порядок туберкулинодиагностики среди детского населения. Однако является ли Диаскинтест столь специфичным и высокоэффективным маркером туберкулеза, чтобы полностью на него полагаться. Данному вопросу посвящена статья на основании имеющихся данных научных исследований за последние 5 лет.
ABSTRACT
The current legislation of the Russian Federation defines the procedure for tuberculin diagnosis among the child population. However, is Diaskintest such a specific and highly effective marker of tuberculosis to rely on it completely. This article is devoted to the article on the basis of available research data for the last 5 years.
Ключевые слова: Диаскинтест, проба Манту, туберкулинодиагностика, антиген туберкулезный рекомбинантный.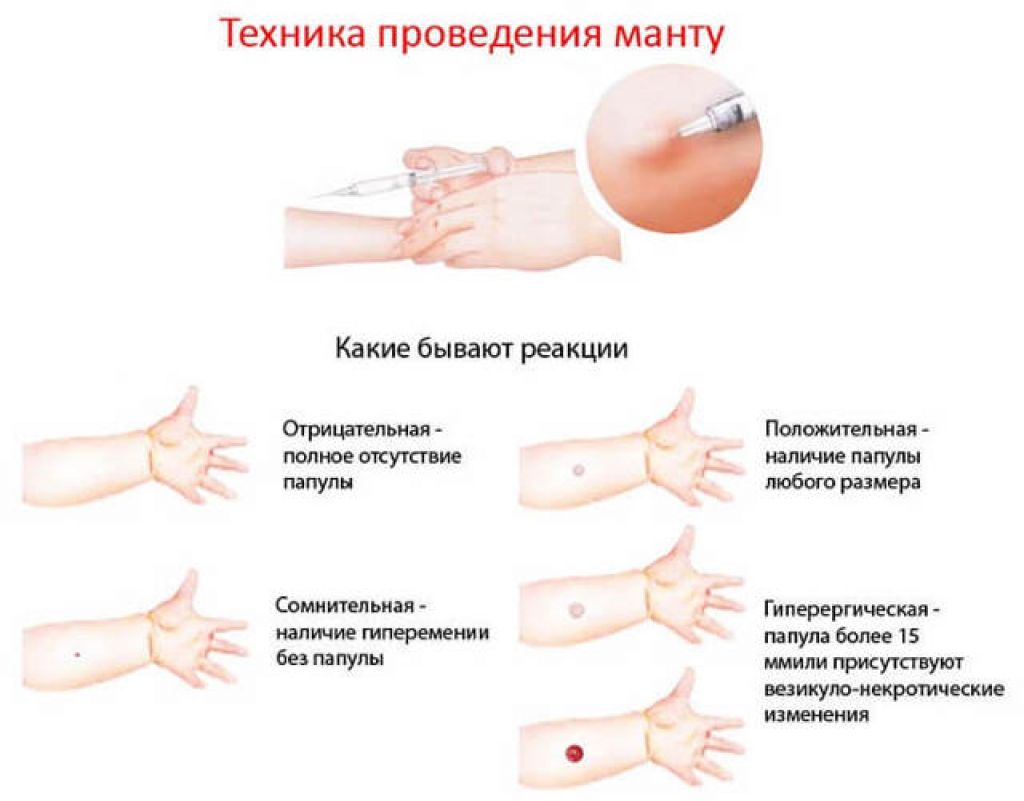
Keywords: Diaskintest, Mantoux test, tuberculin diagnosis, recombinant tuberculosis antigen.
Актуальность. По данным ВОЗ ежегодно диагноз туберкулеза устанавливается 10,4 млн человек, на 100 тысяч населения приходится 142 случая [12]. В настоящее время, в связи с полиморфизмом клинических проявлений туберкулёза, его патоморфологическими особенностями, схожестью с неспецифическими заболеваниями органов дыхания и отсутствием выделения МБТ у большинства детей диагностика этой патологии затруднительна [16]. В связи с этим актуальной проблемой фтизиатрии является улучшение качества превентивной диагностики и химиопрофилактики туберкулеза у детей и подростков [14].
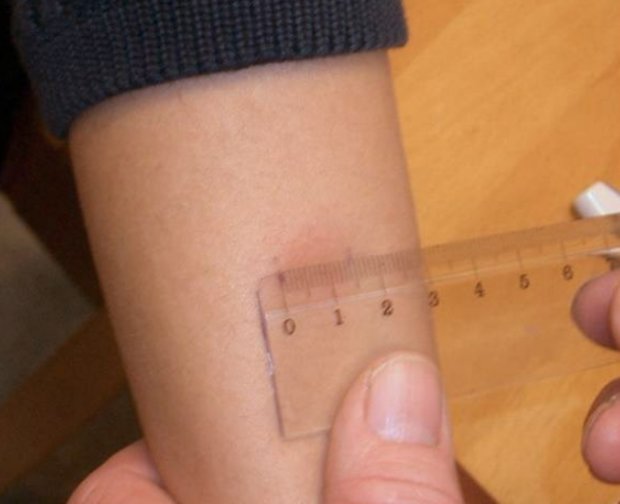
Согласно приказу МЗ РФ № 951 иммунологическая диагностика туберкулеза у детей и подростков в настоящее время проводится посредством специфических диагностических тестов: пробу Манту проводят детям от 12 месяцев до 7 лет, далее с 8 до 17 лет включительно один раз в год с препаратом Диаскинтест (ДСТ) [15].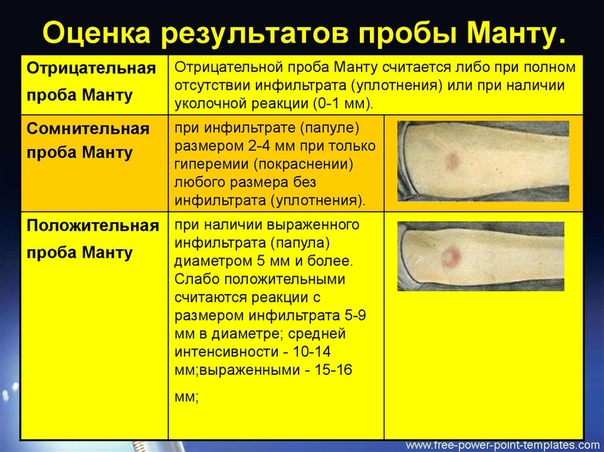
Определенные трудности в интерпретации пробы Манту возникают из-за её низкой специфичности, обусловленной перекрестной сенсибилизацией с вакцинным штаммом БЦЖ, за счет чего до 59,0% реакций бывают ложноположительными. Дифференцировка при оценке реакции на туберкулин представляет трудности. В случае лиц с локальными формами туберкулеза, при аллергической патологии и имеющихся очагах неспецифической инфекции, а также впервые инфицированных микобактериями или ранее переболевших и вакцинированных БЦЖ лиц, положительная проба Манту может сохраняться длительное время [46]. В результате избыточной диагностики туберкулезной инфекции происходит безосновательное назначение превентивной терапии, а также ненадлежащая оценка положительных реакций, трактуемых как показатель поствакцинальной аллергии [5, 37].
В настоящее время при положительных результатах пробы Манту для дифференциальной диагностики вакцинальной и инфекционной аллергии используется кожная проба с препаратом ДСТ. Положительный результат пробы ДСТ является показателем активности туберкулезной инфекции и показанием для проведения химиопрофилактики [43].
Внедрение пробы с ДСТ в практику позволяет достаточно четко разграничить два состояния. Первое – состояние инфицированности организма с присутствием в нем персистирующих, не вирулентных МБТ, возможно в виде L-форм. В этом случае туберкулиновая проба будет положительной, а проба с ДСТ – отрицательной. Состояние инфицированности не требует диагностики (в клиническом плане) и, следовательно, лечения. Второе – состояние латентной туберкулёзной инфекции (ЛТИ) с наличием в организме вирулентных МБТ без клинико-рентгенологических проявлений. В данной ситуации будут положительными пробы и с туберкулином, и с ДСТ. Состояние ЛТИ требует диагностики и превентивного лечения. [17]. Трансформация состояния зараженности в состояние ЛТИ допустима при изменении реактивности организма, снижении его общей резистентности и специфического иммунитета [17].
Между тем, анализируя реальные эпидемиологические данные, независимые фтизиатры полагают, что именно широкое внедрение ДСТ привело к занижению точных показателей заболеваемости туберкулезом.
Кроме того, рядовых врачей-фтизиатров и педиатров тревожат разной степени тяжести нежелательные реакции на ДСТ, не предусмотренные инструкцией [21]. При клинических испытаниях препарата подобных реакций не выявили. В соответствии с «Рекомендациями по применению аллергена туберкулезного рекомбинантного в стандартном разведении (раствора для внутрикожного введения)» эпизодически отмечаются непродолжительные признаки общей неспецифической реакции в виде гипертермии, цефалгии и недомогания [38].
Таким образом, в связи с насущной эпидемиологической ситуацией актуализируется вопрос раннего выявления и отслеживания динамики течения туберкулеза, а так же верной оценки результатов туберкулиновых проб в зависимости от индивидуальных особенностей пациентов (иммунный статус, аллергоанамнез, клиническая форма туберкулеза и др. ).
).
Цель: провести сравнительный анализ диагностической эффективности проб Диаскинтест и Манту у детей на основании обзора актуальной литературы.
Материалы и методы: Проанализирован 61 литературный источник за 2013 — 2018 г. по вопросу туберкулинодиагностики у детей.
Результаты. Рассмотренные нами работы на тему туберкулинодиагностики с помощью ДСТ противоречивы.
Барминой Н.А. ретроспективно исследованы результаты ежегодного обследования на туберкулез 22037 школьников с III, IV, V группами здоровья с использованием сплошного метода. Использование ДСТ в 8,4 раз показало снижение числа случаев, требующих консультации фтизиатра, против диагностики с пробой Манту. В сравнении с традиционным методом гиперергические реакции на пробу с Диаскинтестом определяют в 6 раз реже. В результате, диспансерному наблюдению у врача-фтизиатра подлежали 99,2% детей от числа направленных на консультацию, тогда как только 23,4% детей направлены по результатам массовой туберкулинодиагностики.
Следует уделить внимание прежде всего раннему выявлению туберкулёза, в том числе среди контактных лиц из очагов туберкулезной инфекции. Этому аспекту посвящена работа Шовкуна Л.А [56]. Автор исследовал с помощью туберкулинодиагностики 220 контактных детей. При проверке результатов пробы Манту у 10 человек проба была отрицательной, у 18 – сомнительная реакция, у 174 – положительная, у 18 – гиперэргическая реакция. Результаты ДСТ отличались – 145 проб были отрицательными, 4 пробы сомнительны, 64 результата положительных, 6 гиперэргических реакций. Контактных с гиперэргическими, сомнительными, положительными результами ДСТ (74 (33,8%± 3,2) обследованных), обследовали методом КТ.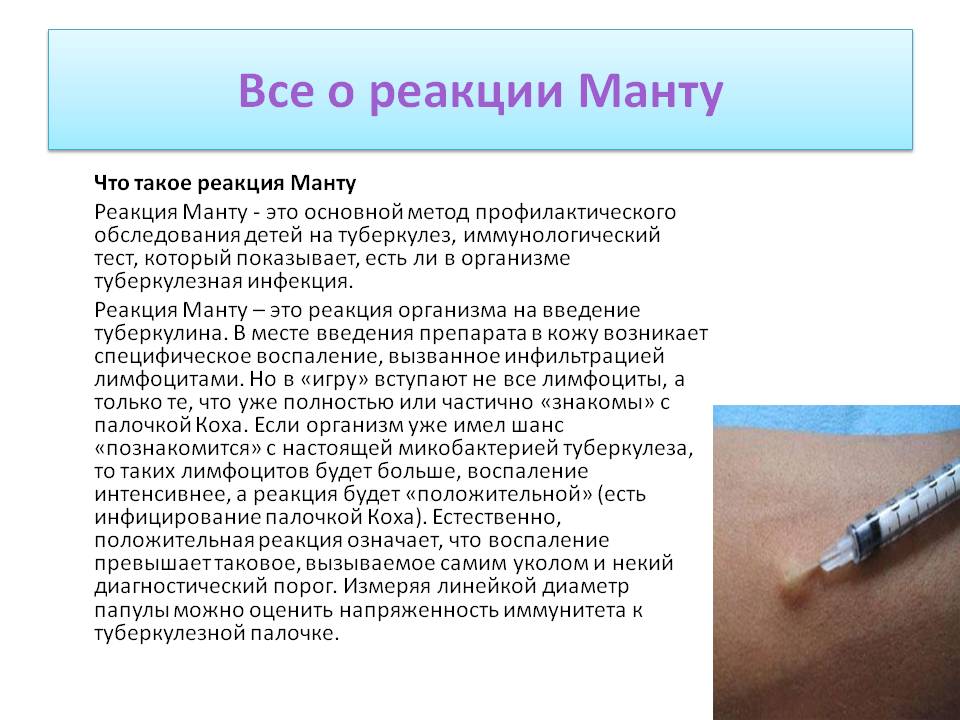
Также Шовкун Л.А. считает, что ДСТ можно использовать для определения высокого риска развития активного туберкулеза и о необходимости в превентивной терапии. Выделение обследуемых согласно показателям пробы ДСТ сделает возможным снизить медикаментозную нагрузку на организм больных с МБТ-позитивными результатами на пробу Манту при МБТ-негативном результате на ДСТ [55].
Согласно результатам сплошного многоцентрового ретроспективного анализа, проделанного Научно Исследовательским Инмтитутом фтизиопульмонологии Первого МГМУ им. И.М. Сеченова, каждый второй пациент в лечебном учреждении всвязи с заболеванием туберкулезом получает превентивную терапию без доказанного основания. Большая доля позитивных результатов на туберкулиновую реакцию обнаружена у 80,1% соматических пациентов, вдобавок нет характерных показателей «виража» туберкулиновых реакций, что не дает качественно определить пациентов с подозрением на туберкулезную инфекцию. По условиям исследования профилактическое лечение проводилось детям с сомнительными и положительными результатами пробы с ДСТ. Применение Диаскинтеста позволило выявить локальный туберкулез у каждого четвертого пациента с позитивными реакциями на тест в стационаре [5].
О значимости ДСТ в диагностике локальных форм туберкулеза говорит Ахмедова Т.Е. В её исследовании из 61 ребенка, получающих лечение в детском противотуберкулезном отделении, с помощью ДСТ в 88,5% выявлено активный туберкулезный процесс, однако, как подчеркивает автор, отрицательный результат ДСТ не исключает наличие туберкулеза [7].
Так, Дьяченко О.А. выделил из 1165 детей группы риска от 1 до 14 лет из VIA, VIБ, VIВ ГДН посредством оценки реакции на пробу Манту и ДСТ [13]. Проведенный анализ показал, что внедрение ДСТ у детей с целью определения туберкулезной инфекции (из 61,4% с положительной пробой Манту только 3,5% положительны по ДСТ) и выявления локальных форм туберкулеза дает возможность использовать данный метод при отборе групп риска на участке врача-фтизиатра и педиатра, для осуществления эффективной превентивной терапии и углубленной диагностики на туберкулез.
Идентификация с помощью пробы с препаратом ДСТ, по мнению Труна Е.В., повысила эффективность диагностики локальных форм туберкулеза на 22,9%, что позволило избежать гипердиагностики туберкулезной инфекции в 20,7%. С помощью туберкулинодиагностики он проанализировал 111 детей в возрасте до 17 лет, поступивших из общей лечебной сети с подозрением на туберкулёз. У большинства пациентов зафиксированы положительные (76,6%) и гиперергические (20,7%) результаты пробы Манту. Отрицательный результат отмечен лишь у одного пациента (0,9%), а сомнительный – у двух (1,8%). Все варианты результатов пробы ДСТ имели место примерно в равных отношениях и только незначительно превалировали гиперергические результаты. Отрицательный результат зафиксирован у 25 человек (22,5%), сомнительный – у 25 человек (22,5%), положительный – у 26 человек (23,4%), гиперергический – у 35 (31,5%) [46]. Соотношения двух проб отражены в таблице 1.
Отрицательный результат отмечен лишь у одного пациента (0,9%), а сомнительный – у двух (1,8%). Все варианты результатов пробы ДСТ имели место примерно в равных отношениях и только незначительно превалировали гиперергические результаты. Отрицательный результат зафиксирован у 25 человек (22,5%), сомнительный – у 25 человек (22,5%), положительный – у 26 человек (23,4%), гиперергический – у 35 (31,5%) [46]. Соотношения двух проб отражены в таблице 1.
Таблица 1.
Соотношение реакции на пробу Манту и ДСТ в исследуемой группе
|
Проба Манту |
ДСТ |
|
Отрицат. (1 чел) |
Отрицат. (1 чел) |
|
Сомнит (2 чел) |
Сомнит (2 чел) |
|
Положит. |
Отрицат. (18 чел.) Сомнит. (21 чел.) Положит. Нормергич. (23 чел.) Гиперергич. (23 чел.). |
|
Гиперергич. (23 чел) |
Отрицат. (4 чел.) сомнит. (4 чел.) положит.нормергич. (3 чел.) гиперергич. (12 чел.). |
ДСТ показал высокую диагностическую значимость при проведении диагностических мероприятий. Положительный результат при наличии клинико-рентгенологических данных за туберкулез и при отсутствии МБТ позволяет сократить сроки перевода в профильное лечебное учреждение пациентов с туберкулезом. По данным Поваляевой Л.В. и её соавторов из 258 пациентов пульмонологического отделения с подозрением на туберкулез у 73% был подтвержден развивающийся туберкулезный процесс, ложноположительный результат ДСТ выявлен в 23,5% случаев. Соответственно, ДСТ может быть включен в диагностический минимум при диагностике туберкулеза в пульмонологическом центре. Благодаря применению этого метода сроки выявления туберкулеза можно сократить до недели [35].
Соответственно, ДСТ может быть включен в диагностический минимум при диагностике туберкулеза в пульмонологическом центре. Благодаря применению этого метода сроки выявления туберкулеза можно сократить до недели [35].
Также заслуживает отдельного внимания вопрос детей с отягощенным аллергоанамнезом [32, 33, 40, 41]. Амосова Е.А. отметила, что среди исследуемых 111 детей, направляемых к фтизиатру по результатам скрининга по пробе Манту для диагностики туберкулезной инфекции, значительную часть составляют дети с аллергическими заболеваниями (43 человека) [6]. Для дифференциальной диагностики инфекционного и вакцинального характера пробы проводился ДСТ [37,52]. В раннем периоде первичной туберкулезной инфекции не обнаружилось существенной разницы в возрасте и половой пренадлежности среди детей страдающих атопическим дерматитом и детей без аллергии. Среди факторов риска по туберкулезу в обеих группах социальные факторы составляют 30,2–32,3%, у детей с атопическим дерматитом чаще отмечается неэффективная вакцинация (13,6%). По результатам иммунодиагностики, у детей с атопическим дерматитом отмечается более низкая (60%) чувствительность к туберкулину по пробе Манту по сравнению с детьми без аллергических заболеваний (21,5%). Пробы ДСТ у всех детей с атопическим дерматитом были отрицательные, у детей без аллергических заболеваний положительные в 20,6% случаев. У детей с атопическим дерматитом в двух случаях (4,6%) отмечалась неспецифическая реакция в виде «волдыря» с последующим исчезновением. Реакции были связаны с приемом пищевых продуктов (в одном случае шоколад, в другом цитрусовые) [18,34].
По результатам иммунодиагностики, у детей с атопическим дерматитом отмечается более низкая (60%) чувствительность к туберкулину по пробе Манту по сравнению с детьми без аллергических заболеваний (21,5%). Пробы ДСТ у всех детей с атопическим дерматитом были отрицательные, у детей без аллергических заболеваний положительные в 20,6% случаев. У детей с атопическим дерматитом в двух случаях (4,6%) отмечалась неспецифическая реакция в виде «волдыря» с последующим исчезновением. Реакции были связаны с приемом пищевых продуктов (в одном случае шоколад, в другом цитрусовые) [18,34].
ДСТ можно использовать также в качестве маркера для продолжения терапии. Казаринова З.В. провела анализ медицинской документации 40 пациентов в возрасте от 2 до 17 лет. Обследуемые подразделялись группы по 20 человек в зависимости от активности туберкулезного процесса. Результативность лечения на стационарном этапе были проанализированы данные иммунодиагностических проб Манту с 2 ТЕ ППД-Л и ДСТ через 1 и 3 месяца [16].
При диагностике заболевания туберкулезом в 1-й и во 2-й группах результаты пробы Манту (гиперергическая чувствительность 42,8% и 47,7% соответственно) и ДСТ (гиперергическая чувствительность 70% и 83% соответственно) достоверно различаются.
Через 1 месяц терапии у пациентов группы с активным туберкулезом по результатам реакции с туберкулином превалировала положительная выраженная (31,2%) и умеренная (43,7%) чувствительность, а по ДСТ – гиперергическая (50%). У пациентов группы 2 (туберкулез в стадии клинического излечения) по результатам обеих проб преобладала только гиперергическая (88,9%) чувствительность. То есть значимого снижения иммунологических проб не происходило. Через 3 месяца после терапии у пациентов 1-ой группы при оценке размеров папулы пробы Манту преобладала положительная выраженная (62,5%) чувствительность и гиперпробы (37,5%), а по ДСТ достоверное снижение чувствительности до позитивных выраженных (63,8%) и умеренных (27,2%) результатов. У пациентов группы 2 и при реакции с туберкулином и при ДСТ доминировала выраженная положительная (100% и 20% соответственно) и гиперергическая (у ДСТ 80%) чувствительность. Что свидетельствует о сохранении активности туберкулеза и более медленной регрессии иммунологических проб в данной группе пациентов. У лиц 1-й группы реакция Манту и ДСТ достоверно уменьшаются по истечении 3 месяцев терапии, но снижение проб с ДСТ более значительно. У лиц 2-й группы установлено незначительное снижение чувствительности по пробе Манту, а реакция на ДСТ напротив нарастает, как спустя 4 недели, так и после 3 месяцев, что предполагает продления терапии и наблюдения в этой группе.
Что свидетельствует о сохранении активности туберкулеза и более медленной регрессии иммунологических проб в данной группе пациентов. У лиц 1-й группы реакция Манту и ДСТ достоверно уменьшаются по истечении 3 месяцев терапии, но снижение проб с ДСТ более значительно. У лиц 2-й группы установлено незначительное снижение чувствительности по пробе Манту, а реакция на ДСТ напротив нарастает, как спустя 4 недели, так и после 3 месяцев, что предполагает продления терапии и наблюдения в этой группе.
Также существует ряд работ, которые показывают, что роль ДСТ как универсального метода туберкулинодиагностики преувеличена.
Исследование Савватеевой В.Г. подтверждает опубликованный ВОЗ в 2011 г документ о низкой прогностической ценности ДСТ при выявлении лиц «с высоким риском прогрессирования ЛТИ в активное заболевание» [29]. В своём она выделила две группы. Первая (46 детей) – дети 4-9 лет с туберкулезом в анамнезе, вторая – группа сравнения (45 детей) без туберкулеза (с отрицательной пробой Манту). В исследуемой группе реакция на ДСТ у 54,3% была отрицательной, у 4,4% – сомнительной, только у 30,4% пациентов – сформировалась папула более 5 мм. Автор объясняет это наличием в препарате только двух антигенов, в то время как в туберкулине более 16 природных белков, определяющих патогенность М. Tuberculosis, что объясняет диагностику посредством Диаскинтеста только высшей степени специфической чувствительности к чужеродным белкам микобактерии [2,50]. Таким образом, по мнению Савватеевой В.Г. этот тест не решает проблему выявления ЛТИ, раннего периода первичной туберкулезной инфекции, риск активации туберкулеза [44]. А соответственно при широком использовании ДСТ у детей старше 8 лет будет затруднительно диагностировать первоначальные стадии прогрессирования туберкулезной инфекции, как результат своевременно не будут проведены лечебно-профилактические мероприятия, ухудшится выявление детей с активным туберкулезом в ранней стадии.
В исследуемой группе реакция на ДСТ у 54,3% была отрицательной, у 4,4% – сомнительной, только у 30,4% пациентов – сформировалась папула более 5 мм. Автор объясняет это наличием в препарате только двух антигенов, в то время как в туберкулине более 16 природных белков, определяющих патогенность М. Tuberculosis, что объясняет диагностику посредством Диаскинтеста только высшей степени специфической чувствительности к чужеродным белкам микобактерии [2,50]. Таким образом, по мнению Савватеевой В.Г. этот тест не решает проблему выявления ЛТИ, раннего периода первичной туберкулезной инфекции, риск активации туберкулеза [44]. А соответственно при широком использовании ДСТ у детей старше 8 лет будет затруднительно диагностировать первоначальные стадии прогрессирования туберкулезной инфекции, как результат своевременно не будут проведены лечебно-профилактические мероприятия, ухудшится выявление детей с активным туберкулезом в ранней стадии.
Особого внимания заслуживает вопрос отрицательного ДСТ при подтвержденной туберкулезной инфекции. К примеру, Яровой Ю.А. исследовано 54 ребенка с туберкулезом и отрицательным ДСТ. У 50,0% детей – инфицирование МБТ; у 29,6% детей – сформированы остаточные посттуберкулезные изменения и у 20,4% детей – активный туберкулез. В структуре форм активного туберкулеза преобладал туберкулез ВЛУ с очагами отсева в легочную ткань – у 36,4% детей; генерализованный туберкулез был у 27,3% детей; ограниченные формы: туберкулеза ВЛУ – в 27,3% и в 9,1% случаев – ПТК. У 27,3% детей имело место сочетание заболевания туберкулезом с ВИЧ-инфекцией. Из этого следует, что отсутствие бактериовыделения при пробе ДСТ наблюдается при разнообразном течении туберкулезной инфекции у детей, что требует комплексной оценки данных углубленной фтизиатрической диагностики [58].
К примеру, Яровой Ю.А. исследовано 54 ребенка с туберкулезом и отрицательным ДСТ. У 50,0% детей – инфицирование МБТ; у 29,6% детей – сформированы остаточные посттуберкулезные изменения и у 20,4% детей – активный туберкулез. В структуре форм активного туберкулеза преобладал туберкулез ВЛУ с очагами отсева в легочную ткань – у 36,4% детей; генерализованный туберкулез был у 27,3% детей; ограниченные формы: туберкулеза ВЛУ – в 27,3% и в 9,1% случаев – ПТК. У 27,3% детей имело место сочетание заболевания туберкулезом с ВИЧ-инфекцией. Из этого следует, что отсутствие бактериовыделения при пробе ДСТ наблюдается при разнообразном течении туберкулезной инфекции у детей, что требует комплексной оценки данных углубленной фтизиатрической диагностики [58].
Михайловым С.Г. были ретроспективно оценены 18 детей 3-13 лет с локальными формами туберкулёза с отрицательным ДСТ. Период от момента, когда было необходимо, но не проведено тщательное клиническое обследование у детей IV и VI групп риска с отрицательной̆ реакцией̆ на ДСТ, до ее конверсии в положительную с последующим проведением КТ и выявлением специфического туберкулезного процесса составлял от одного до трех лет.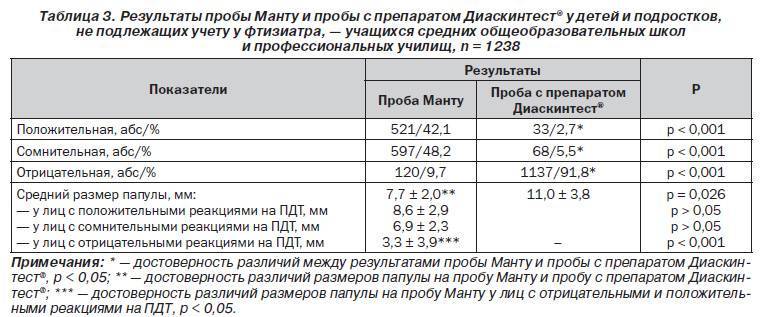 Поэтому всем детям из групп риска (в соответствии с данными реакции Манту и фактом контакта) не смотря на показатели ДСТ требуется клинический мониторинг с необходимым выполнением КТ. Согласно полученным данным, детям с монотонной̆ нормергической реакцией̆ на пробу Манту без дополнительных факторов риска следует делать ДСТ каждые два года для дальнейшей̆ оценки и исследования [24].
Поэтому всем детям из групп риска (в соответствии с данными реакции Манту и фактом контакта) не смотря на показатели ДСТ требуется клинический мониторинг с необходимым выполнением КТ. Согласно полученным данным, детям с монотонной̆ нормергической реакцией̆ на пробу Манту без дополнительных факторов риска следует делать ДСТ каждые два года для дальнейшей̆ оценки и исследования [24].
Корецкой Н.М. проанализировано обследование детей с впервые выявленными посттуберкулезными изменениями легких и ВЛУ в возрастной группе от 0 до 14 лет при постановки их на учет в IIIА ГДУ [19]. При применении пробы Манту отмечались позитивные результаты у всех обследуемых, а при ДСТ лишь в 45,7±7,3%. В соответствии с исследованиями в случае ДСТ, наблюдалась умеренно выраженная чувствительность (6,5±3,6) в меньшей степени, чем по пробе Манту (47,8±7,3%). Эти данные не дают 100% значимости как критерия формирования IIIА ГДУ в случае ДСТ, по сравнению с пробой Манту. Автор считает сомнительным предположение о возможности использования ДСТ в диагностике активности туберкулезного процесса, выявляемого в фазе регресса.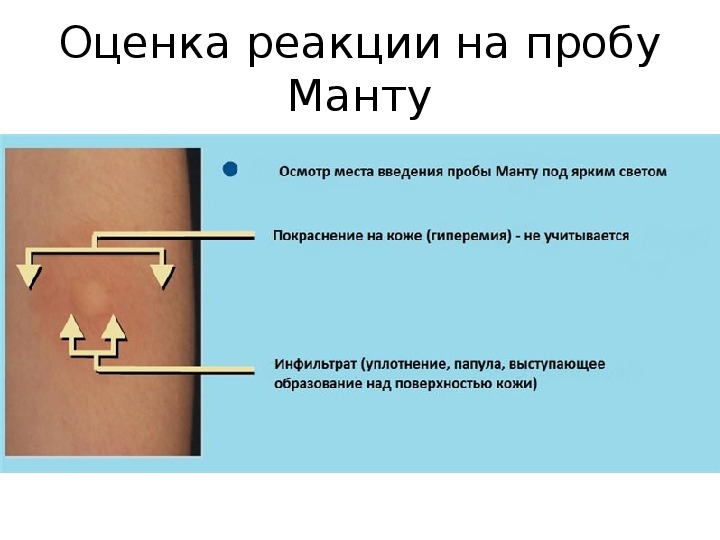 Возможно это может помочь в более достоверной оценке детской пораженности туберкулезом. По мнению автора, применение только ДСТ для скринингового обследования детей, не дает в полной мере организовать полноценную группу риска рецидива туберкулеза, так как в 59,3% случаев дети с признаками спонтанно излеченного туберкулеза не наблюдаются в диспансерной группе по причине отрицательного результата ДСТ [27,39]. Таким образом, пробу Манту как скрининговый метод требуется применять и в дальнейшем всем детям данной возрастной группы [19,26,30].
Возможно это может помочь в более достоверной оценке детской пораженности туберкулезом. По мнению автора, применение только ДСТ для скринингового обследования детей, не дает в полной мере организовать полноценную группу риска рецидива туберкулеза, так как в 59,3% случаев дети с признаками спонтанно излеченного туберкулеза не наблюдаются в диспансерной группе по причине отрицательного результата ДСТ [27,39]. Таким образом, пробу Манту как скрининговый метод требуется применять и в дальнейшем всем детям данной возрастной группы [19,26,30].
Михеевой И.В. был проведен ретроспективный анализ частоты развития активных форм туберкулеза на основании результатов первичной диагностики групп 1705 детей с положительной реакцией на пробу Манту и отрицательной на ДСТ [25]. У 1,7% пациентов при обследовании был диагностирован туберкулез, в том числе с выделением МБТ. При повторной диагностике у некоторых лиц изменились результаты ДСТ, однако у основной массы исследуемых по истечении 4 и 12 месяцев не обнаружены положительные результаты. Отсюда следует, что в результате замены пробы Манту на ДСТ дети без видимых клинических проявлений могут долгое время оставаться без требующейся медицинской помощи [3] Отрицательные показатели при ДСТ имеют место как при генерализованных процессах с выраженным иммунодефицитом, так и при локализованном процессе легочной и внелегочной формах [30]. При однократной первичной диагностике препаратом ДСТ не были выявлены все подлежащие диспансерному учету дети с виражом туберкулиновой пробы. Данные проблемы способствуют несвоевременному назначению или отсутствию превентивного лечения [23].
Отсюда следует, что в результате замены пробы Манту на ДСТ дети без видимых клинических проявлений могут долгое время оставаться без требующейся медицинской помощи [3] Отрицательные показатели при ДСТ имеют место как при генерализованных процессах с выраженным иммунодефицитом, так и при локализованном процессе легочной и внелегочной формах [30]. При однократной первичной диагностике препаратом ДСТ не были выявлены все подлежащие диспансерному учету дети с виражом туберкулиновой пробы. Данные проблемы способствуют несвоевременному назначению или отсутствию превентивного лечения [23].
Низкая чувствительность ДСТ в раннем периоде туберкулезного инфицирования объясняется недостаточным уровнем в организме сенсибилизированных Т-клеток. Таким образом, правомерно появление положительных реакций после латентного периода инфекции или в конце него, когда кумуляция сенсибилизированных Т-клеток достаточна. В случае пробы Манту в составе имеется 20 небольших природных белков МБТ, идентичных соответствующим протеинам возбудителя. Благодаря этим белкам возникает иммунный ответ в организме. По мнению автора, необоснованно исключать пробу Манту из скрининга туберкулезной инфекции [20].
Благодаря этим белкам возникает иммунный ответ в организме. По мнению автора, необоснованно исключать пробу Манту из скрининга туберкулезной инфекции [20].
Следовательно, пробы Манту и ДСТ являются взаимодополняющими и ДСТ не должен заменять пробу Манту в диагностике туберкулеза. Проба Манту может служить информативным методом диагностики на протяжении многих лет при условии ее систематической реализации [42,60].
Согласно исследованию Мякишевой Т.В., также имеет смысл назначение обоих проб одновременно для оценки эффективности превентивной терапии туберкулеза и выполнение контрольной иммунодиагностики через 3 и 6 месяцев после курса лечения [4,28,45,48]. Сниженная чувствительность пробы с ДСТ у больных туберкулезом объясняется тем, что на выраженность реакции ГЗТ, определяемой в этом методе, влияет состояние клеточного иммунитета организма [17]. Большая часть отрицательных реакций на ДСТ обнаружены у лиц с выраженным снижением клеточного иммунитета при туберкулезном процессе (эмпиема, диссеминированная и генерализованная форма). В свою очередь специфичность пробы с ДСТ была ниже у онкологических больных (67%), чем у пациентов с неспецифическими заболеваниями легких. Автор считает возможным изменение реактивности организма при онкологическом процессе, а также снижение его резистентности и иммунитета [49]. В данных условиях персистирующие МБТ могут прогрессивно размножаться и постепенно усиливается сенсибилизация организма к МБТ, что проявляется положительной реакцией пробы с ДСТ [31].
В свою очередь специфичность пробы с ДСТ была ниже у онкологических больных (67%), чем у пациентов с неспецифическими заболеваниями легких. Автор считает возможным изменение реактивности организма при онкологическом процессе, а также снижение его резистентности и иммунитета [49]. В данных условиях персистирующие МБТ могут прогрессивно размножаться и постепенно усиливается сенсибилизация организма к МБТ, что проявляется положительной реакцией пробы с ДСТ [31].
Отдельно следует поговорить о иммунокомпрометированных пациентах. В исследование Ванеева Т.В. включила 75 больных туберкулезом легких в сочетании с ВИЧ-инфекцией, которым была выполнена кожная проба с ДСТ [11]. У всех пациентов туберкулезный процесс был выявлен впервые и в подавляющем количестве случаев (97,3%) был определен как активная форма. Для всех лиц была характерна поздняя стадия ВИЧ-инфекции и в 40,0% случаев определена как 4Б, а в 60,0% как 4В. У большинства больных выявлено прогрессирование процесса (77,3%), при этом антиретровирусную терапию на момент исследования принимали 57,3% больных.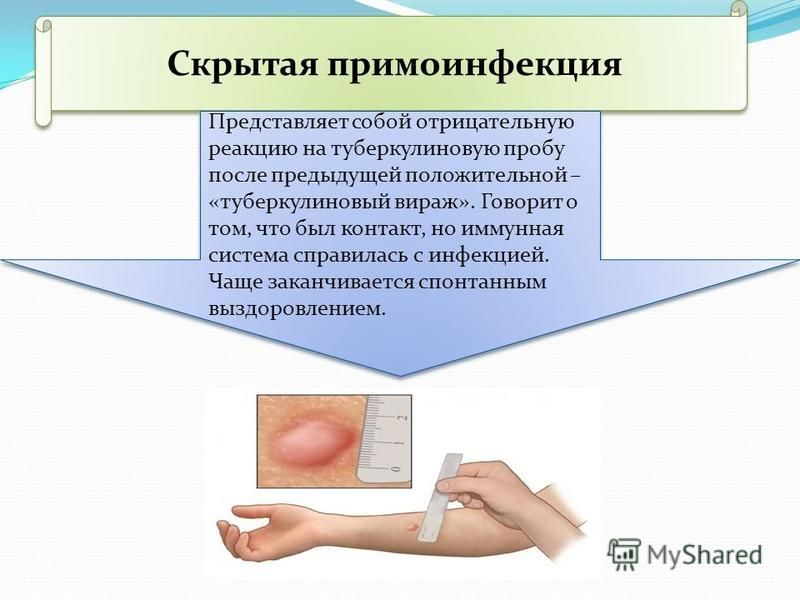 ДСТ показал низкую эффективность у этой группы пациентов, что дало только 22,7% положительных результата. Так, выраженная иммуносупрессия с количеством CD4+ Т-клеток менее 50 кл/мкл. стала ограничением для применения этого метода. В связи со сложностью диагностики вторичных заболеваний у ВИЧ-инфицированных на поздних стадиях, предполагается, что использование ДСТ не сможет значительно расширить возможности лабораторной диагностики в диагностике активного туберкулеза у этой группы больных [36,59].
ДСТ показал низкую эффективность у этой группы пациентов, что дало только 22,7% положительных результата. Так, выраженная иммуносупрессия с количеством CD4+ Т-клеток менее 50 кл/мкл. стала ограничением для применения этого метода. В связи со сложностью диагностики вторичных заболеваний у ВИЧ-инфицированных на поздних стадиях, предполагается, что использование ДСТ не сможет значительно расширить возможности лабораторной диагностики в диагностике активного туберкулеза у этой группы больных [36,59].
Диаскинтест может быть использован в исследовании туберкулёза мочеполовой системы, но положительный результат не является достоверным для постановки диагноза, а лишь служит причиной для проведения более глубокого обследования с применением пробы Манту, представляющую высокую диагностическую эффективность [51]. Чувствительность ДСТ и пробы Манту можно сопоставить (78,6% и 82,8%), при небольшом превосходстве классического метода. Специфичность пробы Манту выявлена в 92,3%, в результате чего она является важной в дифференциальной диагностике туберкулеза мочеполовой системы и неспецифических урогенитальных инфекций. Меньшей специфичностью (23,1%) отличился ДСТ, что свидетельствует о большом числе ложноположительных результатов. По данным исследований известно, что аллерген туберкулезный рекомбинантный в стандартном разведении вырабатывается генетически модифицированной культурой кишечной палочки BL21(DE3)/pCFP-ESAT. Так как кишечная палочка имеет ведущую роль в развитии инфекций мочевыводящих путей, автор предполагает, что причина ложнопозитивных результатов определена перекрестной иммунологической реакцией организма на антигены E. coli, которые могут входить в состав ДСТ [61].
Меньшей специфичностью (23,1%) отличился ДСТ, что свидетельствует о большом числе ложноположительных результатов. По данным исследований известно, что аллерген туберкулезный рекомбинантный в стандартном разведении вырабатывается генетически модифицированной культурой кишечной палочки BL21(DE3)/pCFP-ESAT. Так как кишечная палочка имеет ведущую роль в развитии инфекций мочевыводящих путей, автор предполагает, что причина ложнопозитивных результатов определена перекрестной иммунологической реакцией организма на антигены E. coli, которые могут входить в состав ДСТ [61].
Помимо этого, Кривохиж В.Н. представил к рассмотрению иные случаи негативных реакций на аллерген внутрикожный рекомбинантный в виде повышения температуры, болевых ощущений в руке, сопровождаемых отеком верхней конечности от кисти до локтя с яркой гиперемией кожных покровов, обширного отека с высыпаниями по типу герпетических. Аллерген туберкулезный рекомбинантный, безусловно, может вызывать у доли обследуемых непредвиденные нежелательные локальные и общие реакции гиперчувствительности I типа [21].
В развитии основных проявлений реакций чрезмерной чувствительности следует обозначить анафилактические реакции и парагиперергические состояния, спровоцированные глобулинами, входящими в состав препаратов генной инженерии, а также компонентами микробиологического синтеза или питательной среды. С профилактической целью ввиду более опасных побочных явлений требуется наблюдение лиц, которым проводится постановка пробы не меньше 15 минут после постановки проб и иметь необходимую готовность для проведения неотложных мероприятий. По мнению автора, уместным будет внедрение в нашей стране регистрации побочных реакций немедленного типа после проведения иммунологических проб Манту с 2 ТЕ ППД-Л и Диаскинтеста, принимая во внимание при этом степень тяжести.
Заключение. Аллерген туберкулезный рекомбинантный дает возможность значительно увеличить эффективность скрининга туберкулезной инфекции и определить группы риска следи больных, не наблюдаемых в противотуберкулезном диспансере, к которым относятся больные с неспецифическими заболеваниями дыхательных путей и мочеполовой системы, сахарным диабетом, а также пациенты получающие терапию гормональными препаратами и т. д. Рациональность диагностического обследования всех детей школьного возраста и подростков, при помощи пробы с препаратом ДСТ доказывается высокой специфичностью пробы, тогда как каждый пятый школьник с положительными реакциями болел локальным туберкулезом [5].
д. Рациональность диагностического обследования всех детей школьного возраста и подростков, при помощи пробы с препаратом ДСТ доказывается высокой специфичностью пробы, тогда как каждый пятый школьник с положительными реакциями болел локальным туберкулезом [5].
При диагностике локальных форм туберкулеза с использованием препарата ДСТ показатель эффективности значительно выше, чем при использовании пробы Манту с 2 ТЕ ППД-Л. По данным авторов, чувствительность аллергена туберкулезного рекомбинантного у детей с активной туберкулезной инфекцией составляет 88,5–100%, что в сравнении с пробой Манту 2 ТЕ ППД-Л обусловливает более высокую специфичность ДСТ (90-100%). При использовании ДСТ отсутствуют реакции у здоровых людей, среди которых могут определяться и положительные реакции у вакцинированных БЦЖ лиц [16].
Выявляемость положительных реакций данной пробы ДСТ варьирует при разной активности туберкулезного процесса у детей в 6 ГДУ — 27–19%, у детей с активным туберкулезным прцессом в 1 группе учета -88,5–96,9%, в 3а группе учета — 59–66%. В общем у 13-15% детей с высокой вероятностью может быть интерпретирована ЛТИ [48].
В общем у 13-15% детей с высокой вероятностью может быть интерпретирована ЛТИ [48].
Чувствительность аллергена туберкулезного рекомбинантного увеличивается при пребывании обследуемого в очаге инфекции, при контакте с бактериовыделителем, высокой микобактериальной нагрузки, а также на поздних стадиях заболевания, когда целью массового скрининга служит выявление ранних стадий инфицирования детей и подростков, в т.ч. с неустановленным контактом с бактериовыделителем.
Выраженная чувствительность и специфика ДСТ дает возможность применять кожную пробу с препаратом в целях дифференциальной диагностики и детализации активности туберкулезного процесса, диагностики ЛТИ [47]. Высокая восприимчивость и специфичность аллергена туберкулезного рекомбинантного объясняет его применение в группах высокого риска, в очагах туберкулёзной инфекции [39]. При ДСТ чаще выявляется положительный результат при активном туберкулезном процессе, чем при инфицировании МБТ — у инфицированных МБТ детей без заболевания – 34,5%, при развившемся туберкулезе – 80,8% [22].
Авторы отмечают, что использование ДСТ ограничено если у пациента интерпретированы различные заболевания кожи и аллергические патологии, а также незадолго перенесенные инфекционные болезни. Тем не менее отрицательная реакция зачастую выявляется и у больных активными формами [29,33,60].
В соответствии с данным Шилец Ю.Г., у пациентов с различными формами туберкулезного процесса такими как диссеминированная, инфильтрат, очаговая, туберкулема, туберкулезный плеврит, диагностировались ошибочно отрицательные реакции [53].
Увеличение выявления МБТ-негативных реакций на аллерген туберкулезный рекомбинантный отмечается при специфической терапии и в фазах начинающегося регресса туберкулезного процесса [57]. На начальных стадиях инфицирования микобактериями и начальных этапах развития туберкулезного процесса, а также в отдельных случаях у лиц с установленным диагнозом реакция на ДСТ может быть отрицательной [1].В случае с больными ВИЧ-инфекцией, данная категория является группой, чувствительность которой проявляется в меньшей степени чему у пациента не имеющего ВИЧ-инфекции [49,54,58].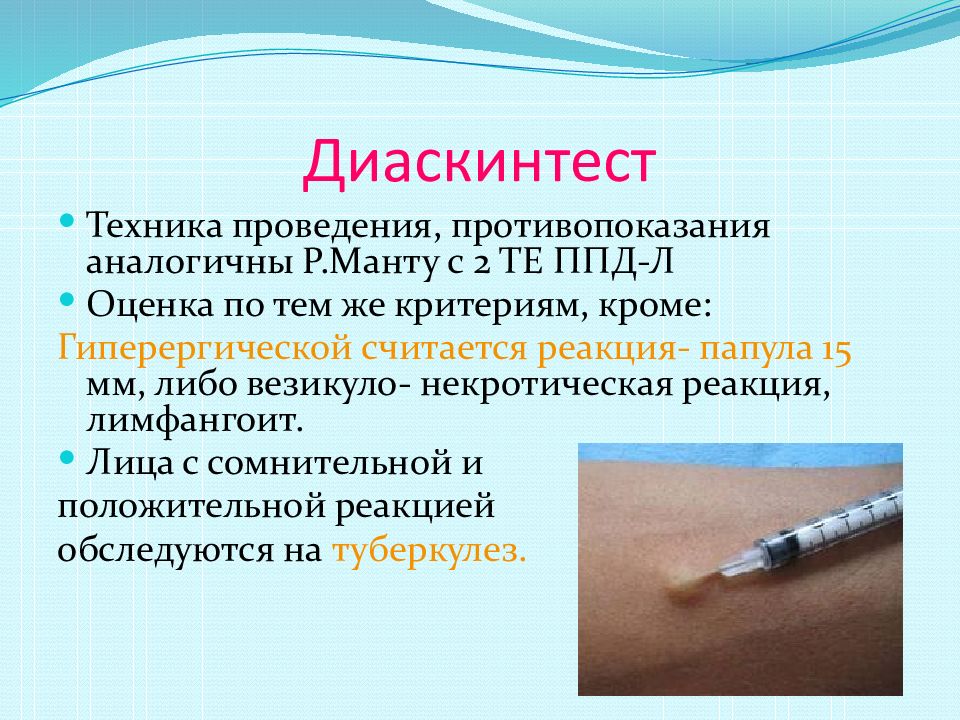
Список литературы:
1. Аксенова В. А., Барышникова Л. А., Клевно Н. И. Современные подходы к скринингу туберкулезной инфекции у детей и подростков в России // Мед. совет. – 2015. – No 4. – С. 30-35.
2. Аксенова В.А. Барышникова Л.А., Клевно Н.И., Довгалюк И. Ф. Федеральные клинические рекомендации по диагностике и лечению туберкулеза органов дыхания у детей // Мед. альянс. – 2015. – № 3. – C. 10-23.
3. Аксенова В.А., Барышникова Л.А. Эффективность аллергена туберкулезного рекомбинантного при раннем выявлении туберкулезной инфекции у детей и подростков в условиях общей лечебной сети. Вопросы современной педиатрии. 2015; 3: 358–362.
4. Аксенова В.А., Клевно Н.И., Кавтарашвили С.М., Казаков А.В., Пахлавонова А.Д. Очаг туберкулезной инфекции как риск развития у детей туберкулеза с множественной лекарственной устойчивостью // Туберкулез и болезни легких. – 2018. – Т.96, No1. – С. 11-17.
5. Аксенова, В.А. Современные подходы к скринингу туберкулезной инфекции у детей и подростков в России. / Аксенова В.А., Барышникова Л.А, Клевно Н.И. // Медицинский совет. – 2015. — No.4, С.30-35.; Медицинский альянс. – 2015. – No 2, С. 5-11.
/ Аксенова В.А., Барышникова Л.А, Клевно Н.И. // Медицинский совет. – 2015. — No.4, С.30-35.; Медицинский альянс. – 2015. – No 2, С. 5-11.
6. Амосова Е.А. Особенности иммунодиагностики туберкулезной инфекции у детей с атопическим дерматитом. / Амосова Е.А., Зонтова Е.А., Бородулин Б.Е., Еременко Е.П., Ахмерова Т.Е., Мигачева Н.Б. // Аллергология и иммунология в педиатрии. – 2018. — № 2 (53). С. 25-31.
7. Ахмерова Т.Е. проба манту и диаскинтест в диагностике туберкулеза у детей / Актуальные проблемы фтизиатрии и пульмонологии : сборник научных трудов / [Ред. коллегия – Б.Е Бородулин, Е.А. Бородулина, И.Л. Цыганков, Л.В. Поваляева. – Самара : ООО «Офорт» : ГБОУ ВПО СамГМУ Минздрава России, 2014. – 120 с
8. Бармина Н.А., Барышникова Л.А., Шурыгин А.А., Рейхардт В.В. Скрининг латентной туберкулезной инфекции с применением аллергена туберкулезного рекомбинантного. Туберкулез и болезни легких. 2016;94(5):56-60.
9. Барышникова Л.А., Аксенова В.А. Туберкулез у детей и подростков в приволжском федеральном округе и современные тенденции его выявления // Туберкулез и социально значимые заболевания.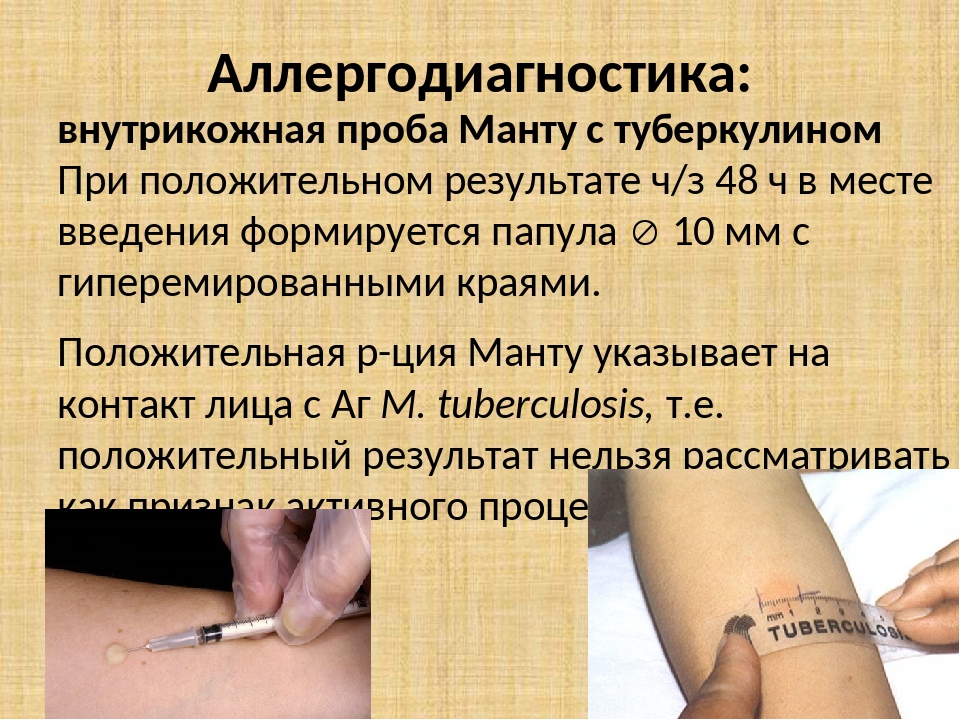 2016. №3. С. 22–24.
2016. №3. С. 22–24.
10. Бородулина, Е.А. Особенности иммунодиагностики локальных форм туберкулезa у детей. / Бородулина Е.А., Ахмерова Т.E., Васнева Ж.П., Еременко Е.С., Бородулин Б.Е., Амосова Е.А. // Эпидемиология и Вакцинопрофилактика. — 2015. — No 4 (83), С. 18-22.
11. Ванеева, Т.В. Результаты применения иммунологических методов диагностики туберкулеза in vivo и in vitro у больных ВИЧ-инфекцией. / Ванеева Т.В., Куликовская Н.В., Краснова М.А., Бондаренко Г.В., Рыманова И.В., Собкин А.Л., Сафонова С.Г. // Туберкулез и социально-значимые заболевания. — 2016. — № 2. С. 66-71.
12. Васильева И. А. Остановить болезнь века! // Здоровье человека. — 2017. — № 7. — С. 2-7.
13. Дьяченко, О.А. Сравнительный анализ чувствительности теста с аллергеном туберкулезным рекомбинантным и пробы Манту с 2 ТЕ ППД-Л у детей г. Хабаровска из групп высокого риска по туберкулезу. / Дьяченко О.А., Дрибенец Е.С. // Здравоохранение Дальнего Востока. – 2015. – No 2, С. 45-47.
14. Золотарева А.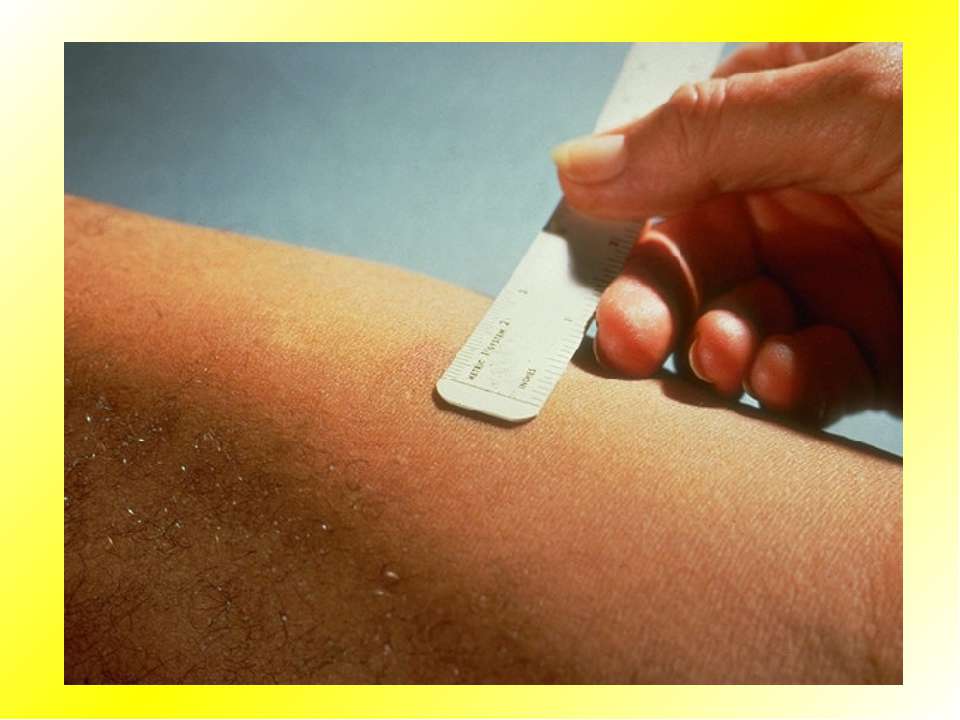 В., Эназарова Н.О., Байке Д.Е. Применение метода «диаскинтест» в диагностике туберкулеза в забайкальском крае. В сборнике: Медицина завтрашнего дня Материалы XVII межрегиональной научно-практической конференции студентов и молодых ученых, посвященной 65-летию Читинской государственной медицинской академии : сборник научных трудов. Читинская государственная медицинская академия . 2018. С. 207-209.
В., Эназарова Н.О., Байке Д.Е. Применение метода «диаскинтест» в диагностике туберкулеза в забайкальском крае. В сборнике: Медицина завтрашнего дня Материалы XVII межрегиональной научно-практической конференции студентов и молодых ученых, посвященной 65-летию Читинской государственной медицинской академии : сборник научных трудов. Читинская государственная медицинская академия . 2018. С. 207-209.
15. Кабанец, Н.Н. Сравнительная оценка эффективности иммунологических тестов у детей из групп риска в томской области. / Кабанец Н.Н., Филинюк О.В., Уразова О.И., Морозова К.С., Колоколова О.В. // Бюллетень сибирской медицины. — 2016. — 15. (№ 5). С. 30-38.
16. Казаринова, З.В. Сравнительная характеристика использования пробы Манту и Диаскинтеста для оценки эффективности лечения туберкулёза органов дыхания у детей и подростков. / Казаринова З.В., Пылаева А.А. // Смоленский медицинский альманах. -2018. — № 1. С. 142-144.
17. Кибрик, Б.С. Результаты использования пробы с аллергеном туберкулезным рекомбинантным среди здорового населения, у находившихся в контакте с больными туберкулезом лиц и пациентов фтизиатрического стационара. / Кибрик Б.С., Мельников В.П. // Туберкулез и социально-значимые заболевания. — 2015. — № 1. С. 36-39.
/ Кибрик Б.С., Мельников В.П. // Туберкулез и социально-значимые заболевания. — 2015. — № 1. С. 36-39.
18. Кожные иммунологические тесты для диагностики туберкулезной инфекции у детей и подростков: аналитический обзор / Е.С. Овсянкина, М.Ф. Губкина, Л.В. Панова и др. // Эпидемиология и вакцинопрофилактика. 2016. № 2 (87). С. 26–33.
19. Корецкая, Н.М. Значение пробы манту с 2 ТЕ ППД-Л и диаскинтеста в формировании группы риска рецидива туберкулеза у детей со спонтанным излечением специфического процесса. /Корецкая Н.М., Загорулько О.В., Логунова Н.А., Наркевич А.Н. // Педиатрия. -2016. — 95 (No 2), С. 72-77.
20. Королюк А.М. Анализ причинно-следственных связей запаздывающей и реактогенной туберкулинодиагностики у детей и подростков / А.М. Королюк, В.Н. Кривохиж // Детская медицина Северо-Запада. – 2018. — Т. 7 № 1. – С.161-162.
21. Кривохиж В.Н. Риск развития у детей непредвиденных побочных реакций на аллерген туберкулезный рекомбинантный. / Кривохиж В.Н., Королюк А.М. // Детские инфекции. — 2016. — Т. 15. № 1. С. 55-59.
— 2016. — Т. 15. № 1. С. 55-59.
22. Лозовская, М.Э. Сопоставление лабораторных тестов quantiferon, тубинферон и диаскинтеста у детей с туберкулезной инфекцией. / Лозовская М.Э., Белушков В.В., Гурина О.П., Дементьева Е.А., Шибакова Н.Д., Васильева Е.Б., Клочкова Л.В. // Клиническая лабораторная диагностика. — 2016. — 61 (№ 12). С. 838-842.
23. Методические рекомендации по совершенствованию диагностики и лечения туберкулеза органов дыхания (утв. приказом Министерства здравоохранения РФ от 29 декабря 2014 г. № 951). М.: МЗ РФ, 2014.
24. Михайлов, С.Г. Сравнительный анализ результатов туберкулинового теста с 2 ТЕ PPD-L у детей из групп риска с различными реакциями на тест с аллергеном туберкулезным рекомбинантным «диаскинтест». / Михайлов С.Г. // Вестник Центрального научно-исследовательского института туберкулеза. — 2017. — № 1. С. 59-61.
25. Михеева, И.В. Ранняя диагностика туберкулеза у детей на современном этапе. / Михеева И.В., Бурдова Е.Ю. // Педиатрия. -2016. — 95 (No 3), С.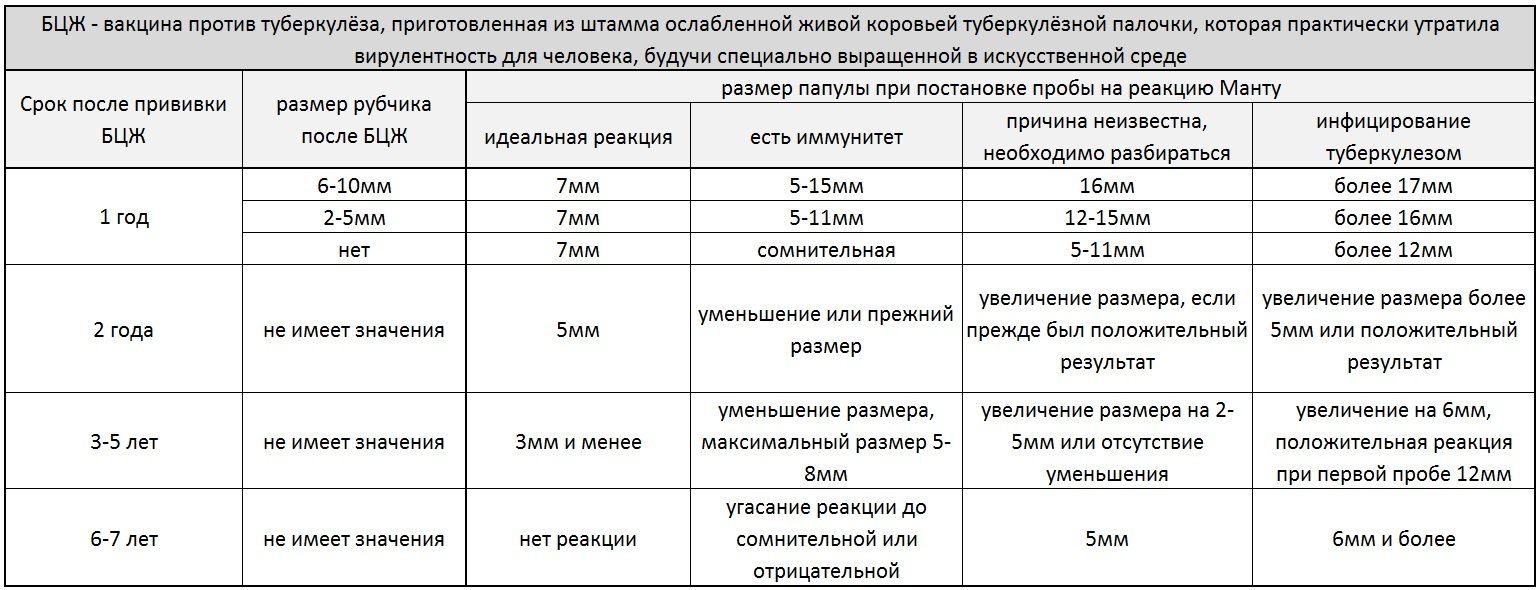 135-139.
135-139.
26. Мордык А.В., Цыганкова Е.А., Ароян А.Р. Методы выявления туберкулеза у детей раннего возраста в разные временные периоды. Поликлиника. 2015; спецвыпуск № 1: 38–42.
27. Мотанова Л.Н., Коваленко Г.Е., Попова Ю.В. Опыт применения диаскинтеста на территории с неблагоприятной ýпидемической ситуацией // Туберкулез и болезни легких. 2014; 4: 34–39.
28. Мякишева, Т.В. Оптимизация применения кожных тестов для диагностики и оценки эффективности лечения различных форм туберкулезной инфекции у детей. / Мякишева Т.В., Рашкевич Е.Е., Авдеева Т.Г. // Вестник Смоленской государственной медицинской академии. — 2018. — 17 (№ 4). С. 101-106.
29. Овсянкина Е.С., Губкина М.Ф., Панова Л.В., Юхименко Н. В. Кожные иммунологические пробы для диагностики туберкулезной инфекции у детей и подростков (аналитический обзор) // Эпидемиология и вакцинопрофилактика. – 2016. – Т. 15. – № 2 (87). – С. 26-32.
30. Овсянкина Е.С., Губкина М.Ф., Панова Л.В., Юхименко Н.В. Анализ эффективности кожных туберкулиновых проб для диагностики туберкулиновой инфекции у детей и подростков. Вопросы практической педиатрии. 2015; 10 (5): 36–43.
Вопросы практической педиатрии. 2015; 10 (5): 36–43.
31. Овсянкина Е.С., Ерохин В.В., Губкина М.Ф. и др. Опыт применения Диаскинтеста для дифференциальной диагностики туберкулеза и нетуберкулезных заболеваний органов дыхания у детей и подростков // Туберкулез и болезни легких. – 2011. – № 5. – С. 81
32. Особенности иммунного ответа и роль некоторых цитокинов при атопическом дерматите / О.Г. Елисютина, Е.С. Феденко, М.Н. Болдырева и др. // Российский аллергологический журнал. 2015. № 1. С. 3–14.
33. Особенности иммунного реагирования при атопии у детей / О.П. Гурина, Е. А. Дементьева, А. Е. Блинов и др. // Педиатрия. 2014. № 4. С. 95–102.
34. Особенности иммунодиагностики локальных форм туберкулеза у детей / Е.А. Бородулина, Т.Е. Ахмерова, Ж.П. Васнева и др. // Эпидемиология и вакцинопрофилактика. 2015. Т. 14, № 4. С. 18–22.
35. Поваляева Л.В., Виктор Н.Н., Бородулин Б.Е. Опыт применения Диаскинтест® в работе пульмонологического отделения. В сборнике: Актуальные проблемы фтизиатрии и пульмонологии: сборник научных трудов.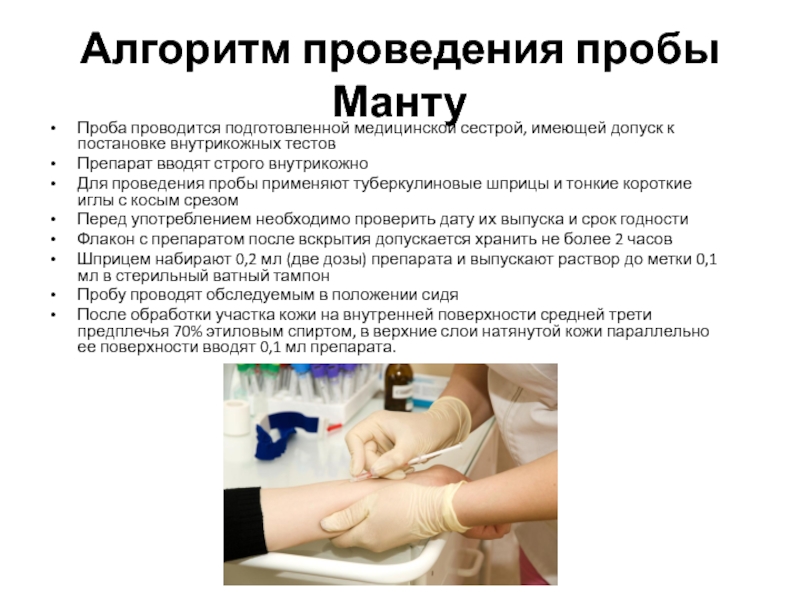 ГБОУ ВПО СамГМУ. Самара, 2014. С. 77-82.
ГБОУ ВПО СамГМУ. Самара, 2014. С. 77-82.
36. Поддубная Л.В., Чикурова Т.Н., Федорова М.В. и др. Чувствительность кожной пробы с аллергеном туберкулезом у больных туберкулезом и ВИЧ-инфекцией. // Туберкулез и болезни легких. – 2015. – № 11. – С. 16-20.
37. Поддубная Л.В., Шилова Е.П., Степченко И.М. и др. Иммунологические пробы у детей, их роль в формировании групп риска по туберкулезу // Туберкулез и социально значимые заболевания. 2016; 1: 20–23.
38. Приказ Минздрава РФ от 21 марта 2003 г. N 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации» (с изменениями и дополнениями) N 2. Рекомендации по применению аллергена туберкулезного рекомбинантного в стандартном разведении (раствора для внутрикожного введения)
39. Приказ Министерства Здравоохранения № 951 от 29.12.2014 года «Об утверждении методических рекомендаций по совершенствованию диагностики и лечения туберкулёза органов дыхания»
40. Противотуберкулезный иммунитет и механизмы его формирования : обзор литературы / А. В. Мордык, Е.А. Цыганкова, Л.В. Пузырева и др. // Дальневосточный медицинский журнал. 2014. № 1. С. 126–130.
В. Мордык, Е.А. Цыганкова, Л.В. Пузырева и др. // Дальневосточный медицинский журнал. 2014. № 1. С. 126–130.
41. Репкина О.В. Атопические дерматиты у детей // Управление качеством медицинской помощи. 2016. № 1–2. С. 104–113.
42. Савватеева Слогоцкая Л.В., Сенчихина О.Ю., Богородская Е.М. Чувствительность теста с аллергеном туберкулёзным рекомбинантным, содержащим белок ESAT6-CFP10, у впервые выявленных больных туберкулёзом детей и подростков в городе Москве. Туберкулез и социально-значимые заболевания. 2013; 1: 37 – 43., В.Г.
43. Серегина В.А., Будрицкий А.М. Современные возможности диагностики туберкулеза легких // Вестник Витебского государственного медицинского университета. 2016. Т.15, № 4. С.7–17
44. Старшинова А. А., Ананьев С. М., Овчинникова Ю. Э., Корнева Н. В., Довгалюк И. Ф. Результаты применения иммунологических тестов нового поколения у детей в условиях массовой вакцинации против туберкулеза // Туберкулёз и болезни лёгких. – 2017. – Т. 95, № 5. – С. 46-52.
45. Стасько Е.Ю. Анализ применения кожной пробы с препаратом аллергеном туберкулезным рекомбинантным как скринингового метода обследования на туберкулезную инфекцию у детей старше 7 лет в Пензенской области в 2014-2016 гг. // Туберкулез и болезни легких. – 2018. – Т.96, No3. – С. 29-34.
Стасько Е.Ю. Анализ применения кожной пробы с препаратом аллергеном туберкулезным рекомбинантным как скринингового метода обследования на туберкулезную инфекцию у детей старше 7 лет в Пензенской области в 2014-2016 гг. // Туберкулез и болезни легких. – 2018. – Т.96, No3. – С. 29-34.
46. Трун, Е.В. Опыт применения пробы с препаратом Диаскинтест® и спиральной компьютерной томографии в диагностике первичного туберкулеза. / Трун Е.В., Мякишева Т.В., Василевская О.В., Алексеенцева Е.И., Новикова И.А. // Туберкулез и социально-значимые заболевания. — 2015. — № 2, С. 68-69.
47. Федеральные клинические рекомендации «Латентная туберкулезная инфекция у детей». Утверждены Общероссийской общественной организацией «Российское общество фтизиатров». Москва, 2016 г.
48. Федеральные клинические рекомендации по диагностике и лечению латентной туберкулезной инфекции у детей. – М., 2015
49. Филимонов П.Н. К дискуссии о латентной туберкулезной инфекции // Туберкулез и болезни легких. – 2014. – No 5. – С. 69-73.
– 2014. – No 5. – С. 69-73.
50. Фтизиатрия. Национальные клинические рекомендации / ред. П. К. Яблонского. – М.: ГЭОТАР-Медиа, 2016. – 240 с.
51. Шевченко, С.Ю. Информативность Диаскинтеста в скрининге мочеполового туберкулеза. / Шевченко С.Ю., Алексеева Т.В., Баранчукова А.А. // Сибирский медицинский вестник. — 2017. — № 1. С. 42-44.
52. Шелкова Е.С. Диагностика туберкулеза с использованием кожных иммунологических тестов. Реальность и перспектива // Медицинский алфавит. 2017. № 1. С. 3–7.
53. Шилец, Ю.Г. Диагностическая значимость Диаскинтеста у взрослых с подозрением на туберкулез. / Шилец Ю.Г., Шилец О.Г., Ивасивка А.Р., Козина А.А. // Авиценна. — 2018.- № 18. С. 57-60.
54. Шилова М.В. Проблемы туберкулеза у детей и подростков. Поликлиника. 2014; 1 (3): 73 — 80
55. Шовкун, Л.А. Диагностика активной и латентной туберкулезной инфекции у детей и подростков с применением Диаскинтеста. / Шовкун Л.А., Франчук И.М., Кампос Е.Д. // Медицинский вестник Юга России. – 2014.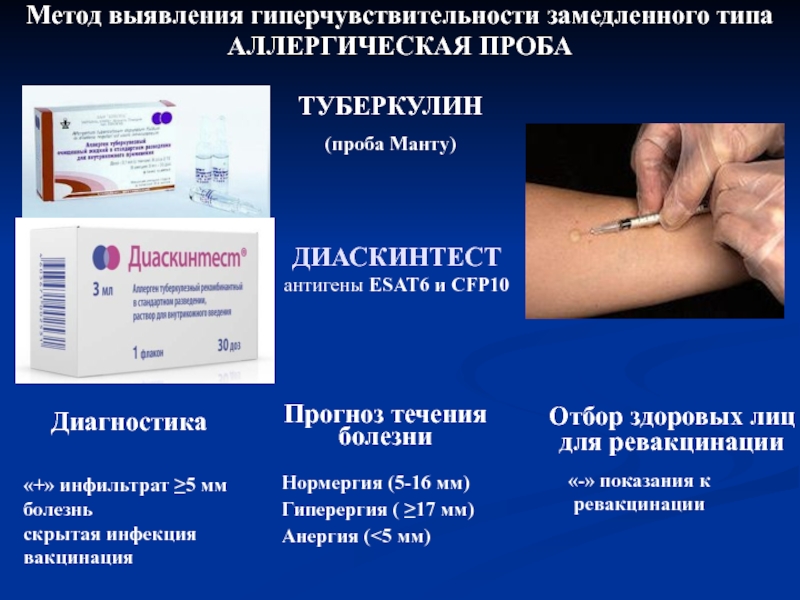 – No 1, С. 124-129.
– No 1, С. 124-129.
56. Шовкун, Л.А. Инновационные технологии в иммунологической диагностике туберкулеза у контактных лиц из очагов туберкулезной инфекции. / Шовкун Л.А., Франчук И.М., Е.Д. Кампос, Константинова А.В., Ильина О.В. // Медицинский вестник Юга России. – 2015. – No 3, С. 116-119.
57. Яровая, Ю. А. Туберкулезная инфекция у детей с отрицательной пробой Диаскинтест. / Яровая Ю. А., Мосина А. В., Васильева Е. Б., Клочкова Л. В., Степанов Г. А. // Здоровье детей: Современная стратегия профилактики и терапии ведущих заболеваний Сборник материалов XII Российского Форума. 2018. С. 61-62.
58. Яровая, Ю.А. Течение туберкулезной инфекции у детей с отрицательными результатами пробы Диаскинтест. / Яровая Ю.А. // Социально-значимые и особо опасные инфекционные заболевания: Материалы V Всероссийской междисциплинарной научно-практической конференции с международным участием. — 2018. — С. 291-293.
59. Cai R., Chen J., Guan L. et al. Relationship between T-Spot.TB responses and numbers of circulating CD4+ T-cells in HIV infected patients with active tuberculosis. // Biosci. Trends. – 2014. – Vol. 8. – N. 3. – P. 163-168.
// Biosci. Trends. – 2014. – Vol. 8. – N. 3. – P. 163-168.
60. Chiang S. S., Swanson S. D., Jeffrey R. S. New diagnostics for childhood tuberculosis review // Chiang S. S., Swanson S. D., Jeffrey R. S Infect. Dis. Clin. North Am. – 2015. – Vol. 29, Iss. 3.
61. Salmanzadeh S., Abbasissifar H., Alavi S. M. Comparison study of QuantiFERON test with tuberculin skin testing to diagnose latent tuberculosis infection among nurses working in teaching hospitals of Ahvaz // Iran. Caspian J Intern Med. 2016 Spring; 7(2):82–7.
Манту заменят на Диаскинтест
15 сентября 2016
Доказавшие за многие годы свою эффективность пробы на раннее обнаружение опасной для общества болезни — туберкулеза — уходят в прошлое. Осенью 2016 года в России вступают в силу новые правила диагностики туберкулеза, в соответствии с которыми вместо пробы Манту будет использоваться Диаскинтест (ДСТ) для всех групп населения за исключением дошкольников. В настоящее время Министерство здравоохранения России выставило на общественное обсуждение проект приказа об изменении схемы диагностики туберкулеза у детей и подростков. Документ пока собирает преимущественно негативные отзывы.
Документ пока собирает преимущественно негативные отзывы.
Диаскинтест появился на российском рынке в 2009 году. Если в пробе Манту используется туберкулин — препарат из микобактерий всех восьми видов, то в ДСТ — белок, полученный генно-инженерным способом из микобактерии одного, «человеческого» вида.
В соответствии с документом «Об утверждении порядка и сроков проведения профилактических медицинских осмотров граждан в целях выявления туберкулеза», проба на реакцию Манту (иммунодиагностика с применением аллергена бактерий с 2 туберкулиновыми единицами очищенного туберкулина в стандартном разведении) будет проводиться только детям до 7 лет.
Школьникам с 8 до 14 лет диагностику туберкулеза предлагается проводить с помощью Диаскинтеста (иммунодиагностика с применением аллергена туберкулезного рекомбинантного в стандартном разведении). Для подростков в возрасте 15-17 лет схема диагностики туберкулеза включает Диаскинтест и флюорографию.
Сейчас приказ, опубликованный на Едином портале раскрытия информации, собрал больше голосов «против», чем «за». Многие фтизиатры сомневаются в эффективности изменения схемы диагностики.
Многие фтизиатры сомневаются в эффективности изменения схемы диагностики.
По мнению главного научного сотрудника отдела организации противотуберкулезной помощи НИИ фтизиопульмонологии Первого МГМУ имени Сеченова Маргариты Шиловой, Диаскинтест не подходит для массовой диагностики. Он выявляет туберкулез лишь в 50% случаев, и имеет ряд других недостатков. Замена им реакции Манту может привести к тому, что тысячи диагнозов не будут поставлены вовремя, считает она.
Препарат Диаскинтест – оригинальная разработка российской фармацевтической компании «Генериум». В декабре 2015 года производитель по предложению Росздравнадзора приостанавливал производство и реализацию одной из серий препарата в связи с проверкой, начатой после смерти шестилетней девочки, которая получила инъекцию в противотуберкулезном диспансере в Смоленске. 2 июня 2016 года продажа этой серии была возобновлена.
фото с сайта: news.sputnik.ru
Новость с сайта vladmedicina. ru
ru
Прямое определение лекарственной чувствительности Mycobacterium tuberculosis для быстрого выявления множественной лекарственной устойчивости с использованием системы Bactec MGIT 960: многоцентровое исследование
J Clin Microbiol. 2012 февраль; 50(2): 435–440.
, A , b , b , c , , c , , , d , c , e , d , f , e , c и F F FSalman Siddiqi
A Becton Dickinson, Sparks, Maryland, USA
ALTAF AHMED
B INDUS Больница, Карачи, Пакистан
Sunil ASIF
B Indus Больница, Карачи, Pakistan
Digamber Beera
C LRS Институт туберкулеза и респираторных заболеваний, Нью-Дели, Индия
Mona Javaid
B INDUS Больница, Карачи, Пакистан
Жасмин Яни
D BD Диагностические системы, Гургаон, Индия
Арора Джиоти
c LRS Институт туберкулеза и респираторных заболеваний, Нью-Дели, Индия
Радхика Махатре
e P. D. Hinduja National Hospital and Medical Research Center, Mumbai, India
D. Hinduja National Hospital and Medical Research Center, Mumbai, India
Dewanand Mahto
d BD Diagnostic Systems, Gurgaon, India
Elvira Richter
f Национальный справочный центр Mycobacteria, Borstel, Германия
2 Родригес
и ПД Национальный госпиталь и медицинский исследовательский центр Хиндуджа, Мумбаи, Индия
Potharaju Visalakshi
c LRS Институт туберкулеза и респираторных заболеваний, Нью-Дели, Индия
Sabine Rüsch-Gerdes
f Национальный справочный центр по микобактериям Borstelcobacteria , Германия
A
A Becton Dickinson, Sparks, Мэриленд, США
B INDUS Больница, Карачи, Пакистан
C LRS Институт туберкулеза и респираторных заболеваний, Нью-Дели, Индия
D BD Диагностика Systems, Гургаон, Индия
и P.D. Национальная больница и центр медицинских исследований Хиндуджа, Мумбаи, Индия
f Национальный справочный центр микобактерий, Борстель, Германия
Автор, ответственный за переписку.
Поступила в редакцию 29 сентября 2011 г.; Запрошенные изменения 2011 г. 26 октября; Принято 29 ноября 2011 г.
Copyright © 2012, Американское общество микробиологии. Все права защищены. Эта статья цитировалась в других статьях PMC.Abstract
Обычное непрямое определение лекарственной чувствительности Mycobacterium tuberculosis с помощью жидкой среды хорошо зарекомендовало себя и дает надежные результаты, позволяющие сэкономить время.Это многоцентровое исследование было проведено для оценки того, можно ли успешно проводить тестирование лекарственной чувствительности (ТЛЧ) непосредственно из обработанных образцов с положительным мазком (прямое ТЛЧ) и может ли этот подход обеспечить существенную экономию времени. Образцы мокроты расщепляли, деконтаминировали и концентрировали в соответствии с обычной лабораторной процедурой и инокулировали в среду Bactec MGIT 960, а также в среду Левенштейна-Йенсена (LJ) для первичной изоляции. Все обработанные образцы с положительным мазком на кислотоустойчивые бактерии (КУБ) использовались для постановки прямого ТЛЧ на изониазид (INH) и рифампицин (RIF). После добавления противомикробной смеси полимиксина В, амфотерицина В, налидиксовой кислоты, триметоприма и азлоциллина (PANTA) пробирки вводили в прибор MGIT 960 по 21-дневному протоколу (протокол Bactec 960 пиразинамид [PZA]). Результаты, полученные с помощью прямого ТЛЧ, сравнивали с результатами, полученными с помощью непрямого ТЛЧ, чтобы установить точность и экономию времени при использовании этого подхода. Из 360 образцов мокроты с положительным мазком на КУМ, подготовленных для прямого ТЛЧ в четырех центрах в трех разных странах, 307 (85%) образцов дали отчетные результаты.Среднее время отчетности для прямого ТЛЧ составило 11 дней (диапазон от 10 до 12 дней). Средняя экономия времени при прямом ТЛЧ по сравнению с непрямым ТЛЧ, включая время на выделение культуры и проведение ТЛЧ, составила 8 дней (диапазон от 6 до 9 дней). При сравнении результатов прямого ТЛЧ с результатами непрямого ТЛЧ было выявлено соответствие 95,1% для изониазида и 96,1% для рифампина. Эти результаты показывают, что прямое ТЛЧ с помощью системы Bactec MGIT 960 обеспечивает дополнительную экономию времени и является быстрым методом надежного выявления случаев множественной лекарственной устойчивости (МЛУ).
После добавления противомикробной смеси полимиксина В, амфотерицина В, налидиксовой кислоты, триметоприма и азлоциллина (PANTA) пробирки вводили в прибор MGIT 960 по 21-дневному протоколу (протокол Bactec 960 пиразинамид [PZA]). Результаты, полученные с помощью прямого ТЛЧ, сравнивали с результатами, полученными с помощью непрямого ТЛЧ, чтобы установить точность и экономию времени при использовании этого подхода. Из 360 образцов мокроты с положительным мазком на КУМ, подготовленных для прямого ТЛЧ в четырех центрах в трех разных странах, 307 (85%) образцов дали отчетные результаты.Среднее время отчетности для прямого ТЛЧ составило 11 дней (диапазон от 10 до 12 дней). Средняя экономия времени при прямом ТЛЧ по сравнению с непрямым ТЛЧ, включая время на выделение культуры и проведение ТЛЧ, составила 8 дней (диапазон от 6 до 9 дней). При сравнении результатов прямого ТЛЧ с результатами непрямого ТЛЧ было выявлено соответствие 95,1% для изониазида и 96,1% для рифампина. Эти результаты показывают, что прямое ТЛЧ с помощью системы Bactec MGIT 960 обеспечивает дополнительную экономию времени и является быстрым методом надежного выявления случаев множественной лекарственной устойчивости (МЛУ).
ВВЕДЕНИЕ
По данным ВОЗ, лекарственная устойчивость туберкулеза (ТБ) является глобальной проблемой (30). Резистентность к изониазиду (INH) и рифампицину (RIF), определяемая как множественная лекарственная устойчивость (MDR), растет во многих странах (3, 4, 31). Если эти случаи не лечить должным образом, у них может развиться устойчивость и к другим препаратам, таким как фторхинолоны и инъекционные аминогликозиды, определяемая как широкая лекарственная устойчивость (ШЛУ), и, в свою очередь, они могут заразить других лекарственно-устойчивым штаммом (5, 10). , 22).Для лучшего ведения случаев с лекарственной устойчивостью крайне важно раннее выявление резистентности, чтобы можно было назначить эффективное лечение. Экспресс-тестирование на лекарственную чувствительность играет важную роль в выявлении и контроле МЛУ/ШЛУ ТБ (23, 31).
Тест на лекарственную чувствительность (ТЛЧ) Mycobacterium tuberculosis обычно проводится после выделения культуры из клинического образца. Это занимает много времени, сначала для выделения культуры, а затем для проведения теста на лекарственную чувствительность (непрямое ТЛЧ).Если бы ТЛЧ можно было проводить одновременно с инокуляцией обработанного образца в твердую и/или жидкую среду (прямое ТЛЧ), это могло бы значительно сэкономить время для выявления лекарственной устойчивости.
Это занимает много времени, сначала для выделения культуры, а затем для проведения теста на лекарственную чувствительность (непрямое ТЛЧ).Если бы ТЛЧ можно было проводить одновременно с инокуляцией обработанного образца в твердую и/или жидкую среду (прямое ТЛЧ), это могло бы значительно сэкономить время для выявления лекарственной устойчивости.
Прямая ТЛЧ в обычной твердой среде хорошо зарекомендовала себя (9, 14, 15). Единственным недостатком является длительное получение результатов на твердой среде, так как скорость роста на такой среде ниже. С введением жидкой среды Bactec 12B (Becton Dickinson Diagnostic Systems, Sparks, MD) время представления результатов значительно сократилось (13, 19, 24, 25).В 1993 г. CDC рекомендовал использовать жидкую среду, основываясь на ее лучшей эффективности и более ранних результатах (27). Прямая ТЛЧ с жидкостной системой Bactec 460 была успешно опробована (16). Однако использование радиометрического метода Bactec 460 прекращается из-за опасений по поводу захоронения радиоактивных отходов. Эта система заменяется нерадиометрической системой Bactec MGIT 960 (Becton Dickinson Diagnostic Systems, Sparks, MD). Непрямой ТЛЧ хорошо зарекомендовал себя в этой жидкой системе (1, 2, 6–8, 12, 20).В 2001 г. было сообщено о небольшом исследовании с использованием ручной системы BBL MGIT по прямому ТЛЧ на изониазид и рифампицин с отличными результатами (11). В 2007 г. ВОЗ опубликовала программное заявление с рекомендациями по использованию жидких сред для стран с низким и средним уровнем дохода (32).
Эта система заменяется нерадиометрической системой Bactec MGIT 960 (Becton Dickinson Diagnostic Systems, Sparks, MD). Непрямой ТЛЧ хорошо зарекомендовал себя в этой жидкой системе (1, 2, 6–8, 12, 20).В 2001 г. было сообщено о небольшом исследовании с использованием ручной системы BBL MGIT по прямому ТЛЧ на изониазид и рифампицин с отличными результатами (11). В 2007 г. ВОЗ опубликовала программное заявление с рекомендациями по использованию жидких сред для стран с низким и средним уровнем дохода (32).
Это многоцентровое исследование было разработано с целью установить осуществимость прямого ТЛЧ в четырех различных клинических лабораториях с разными группами пациентов и тестовыми параметрами. Основная цель этого исследования заключалась в разработке стандартного протокола для прямого ТЛЧ с использованием автоматизированной системы Bactec MGIT 960.Результаты сравнивались с косвенными результатами ТЛЧ, чтобы установить точность, а также экономию времени при таком подходе.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования.
Это исследование проводилось в четырех разных центрах в трех странах: (i) сайт 1, P.D. Национальная больница и центр медицинских исследований Хиндуджа, больница третичного уровня, Мумбаи, Индия; (ii) участок 2, Институт туберкулеза и болезней легких LRS, специализированная противотуберкулезная больница и национальная справочная лаборатория (NRL), Нью-Дели, Индия; (iii) участок 3, больница Инда, благотворительная больница общего профиля, специализирующаяся на ТБ, особенно на лечении МЛУ, Карачи, Пакистан; (iv) участок 4, Национальный референс-центр микобактерий, национальный центр (с доступом к клиническим образцам из районов с высокой эндемичностью по МЛУ в других странах), Борстель, Германия.
Образцы.
В это исследование были включены только образцы мокроты от пациентов с сильным подозрением на туберкулез, а также от пациентов с давними хроническими случаями, особенно от тех, у кого подозревается МЛУ ТБ. В исследование были включены образцы с положительным мазком на кислотоустойчивые бактерии (КУБ) независимо от степени положительного мазка. Образцы мокроты доставлялись в лабораторию с минимальной задержкой и охлаждались, если обработка не проводилась немедленно.
Образцы мокроты доставлялись в лабораторию с минимальной задержкой и охлаждались, если обработка не проводилась немедленно.
Обработка образцов.
Все образцы были обработаны в соответствии со стандартным методом NALC-NaOH для расщепления, обеззараживания и концентрирования (14, 26). Концентрированный осадок ресуспендировали примерно в 2-3 мл фосфатного буфера (pH 6,8) и тщательно перемешивали. Готовили мазок для кислотоустойчивой окраски и засевают питательные среды в соответствии со стандартной лабораторной процедурой первичного выделения. Следили за тем, чтобы для прямого ТЛЧ оставалось чуть более 1 мл взвеси.
Мазки КУМ.
Все мазки окрашивали по Цилю-Нильсену и/или флуорохромным методом. Мазки классифицировали в соответствии с рекомендациями ВОЗ (28) и на основании количества КУМ, обнаруженного во время исследования. Мазки оценивались как скудные (от 1 до 9 КУМ/100 полей), 1+ (от 10 до 99/100 полей), 2+ (от 1 до 10 КУМ/поле) или 3+ (более 10 КУМ/поле). Две лаборатории не имели мизерной категории в своей системе оценок (эти мазки были включены в категорию 1+).
Две лаборатории не имели мизерной категории в своей системе оценок (эти мазки были включены в категорию 1+).
Инокуляция питательных сред для первичной изоляции.
На всех четырех площадках использовалась система Bactec MGIT 960 для жидкости, а для твердой среды — наклонная система Lowenstein-Jensen (LJ). Эти среды инокулировали в соответствии с установленной для каждой лаборатории стандартной операционной процедурой (СОП). Для среды MGIT следовали стандартным рекомендуемым процедурам (рекомендации производителя и руководство MGIT от FIND [26]). После подготовки мазков и посевов для посева оставшуюся часть образца немедленно охлаждали при температуре от 2°C до 8°C и использовали для постановки прямого ТЛЧ, как только были доступны результаты исследования мазка.
Прямая процедура DST.
В прямой процедуре ТЛЧ было три основных отличия от стандартной непрямой процедуры ТЛЧ для MGIT 960: (i) прямой ТЛЧ был протоколом от 4 до 21 дня, тогда как непрямой ТЛЧ был протоколом от 4 до 13 дней.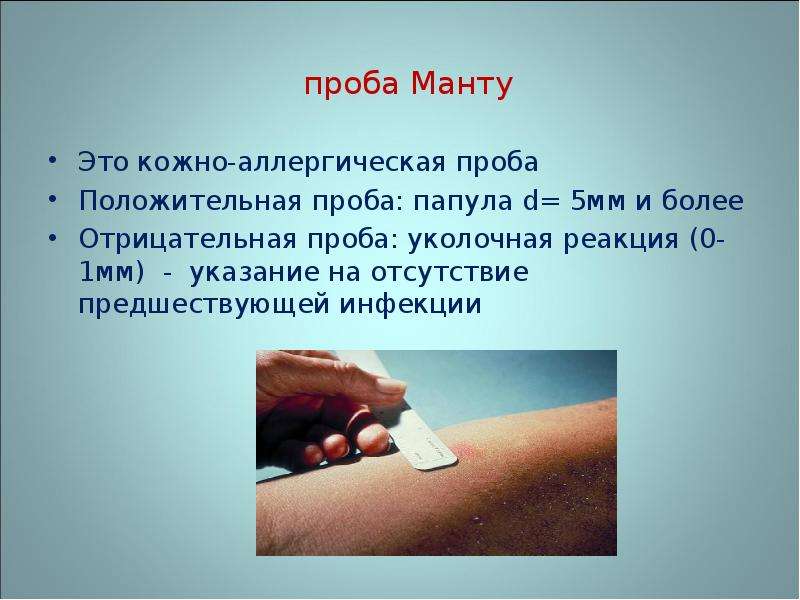 ; (ii) контроль разбавляли 1:10 при прямом ТЛЧ, а при непрямом ТЛЧ разбавляли 1:100; (iii) при прямом ТЛЧ противомикробная смесь полимиксина В, амфотерицина В, налидиксовой кислоты, триметоприма и азлоциллина (PANTA) (Becton Dickinson Diagnostic Systems, Sparks, MD) добавлялась к контролю, а также к препарату- с трубками MGIT для подавления загрязнения.
; (ii) контроль разбавляли 1:10 при прямом ТЛЧ, а при непрямом ТЛЧ разбавляли 1:100; (iii) при прямом ТЛЧ противомикробная смесь полимиксина В, амфотерицина В, налидиксовой кислоты, триметоприма и азлоциллина (PANTA) (Becton Dickinson Diagnostic Systems, Sparks, MD) добавлялась к контролю, а также к препарату- с трубками MGIT для подавления загрязнения.
Все среды и другие реагенты были такими же, как те, которые использовались для рутинного непрямого ТЛЧ: среда MGIT (пробирки MGIT со штрих-кодом на 7 мл), добавка SIRE для ТЛЧ и лиофилизированные препараты Bactec MGIT INH и RIF (Becton Dickinson Системы диагностики, Спаркс, Мэриленд).
Перед проведением прямого ТЛЧ лиофилизированный PANTA был восстановлен с использованием 15 мл добавки SIRE (не добавки для роста) (Becton Dickinson Diagnostic Systems, Sparks, MD) и хорошо перемешан до полного растворения.Флаконы с лекарствами (лиофилизированные препараты, такие же, как те, которые используются в непрямом ТЛЧ MGIT) INH и RIF восстанавливали 4 мл стерильной деионизированной (DI) воды и хорошо перемешивали.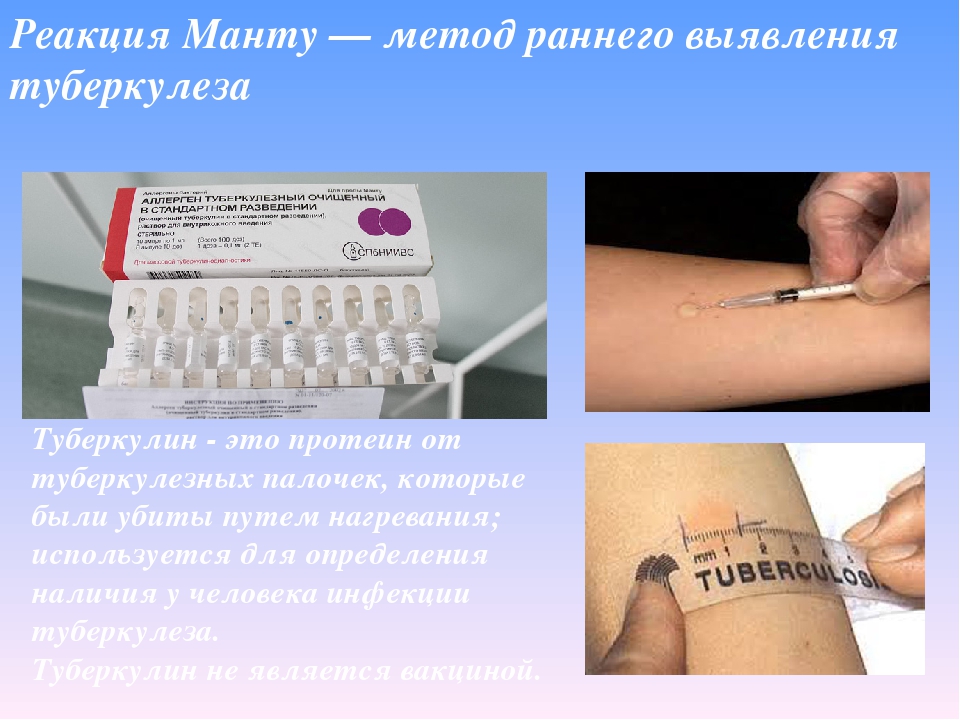 Наборы из четырех пробирок MGIT были приготовлены на образец для проведения прямого ТЛЧ. Две пробирки были помечены как «контроль роста» (GC), одна для INH, а другая для RIF. Третья пробирка была помечена как «INH», а четвертая — как «RIF».
Наборы из четырех пробирок MGIT были приготовлены на образец для проведения прямого ТЛЧ. Две пробирки были помечены как «контроль роста» (GC), одна для INH, а другая для RIF. Третья пробирка была помечена как «INH», а четвертая — как «RIF».
После растворения 0,8 мл смеси добавок PANTA-SIRE добавляли в каждую из четырех промаркированных пробирок MGIT.Следующим шагом было добавление наркотиков. В пробирку с меткой INH добавляли 0,1 мл восстановленного лиофилизированного препарата INH (конечная концентрация 0,1 мкг/мл). Подобным образом в пробирку с RIF-меченым добавляли 0,1 мл восстановленного RIF (1,0 мкг/мл). Эти концентрации были такими же, как и при непрямой процедуре ТЛЧ (вкладыш [26]). После перемешивания среды в каждую из двух пробирок с лекарственным средством вносили по 0,5 мл хорошо перемешанного восстановленного осадка. Для контроля ресуспендированный осадок разбавляли 1:10 добавлением 0.2 мл хорошо перемешанного осадка в 1,8 мл стерильного физиологического раствора или воды.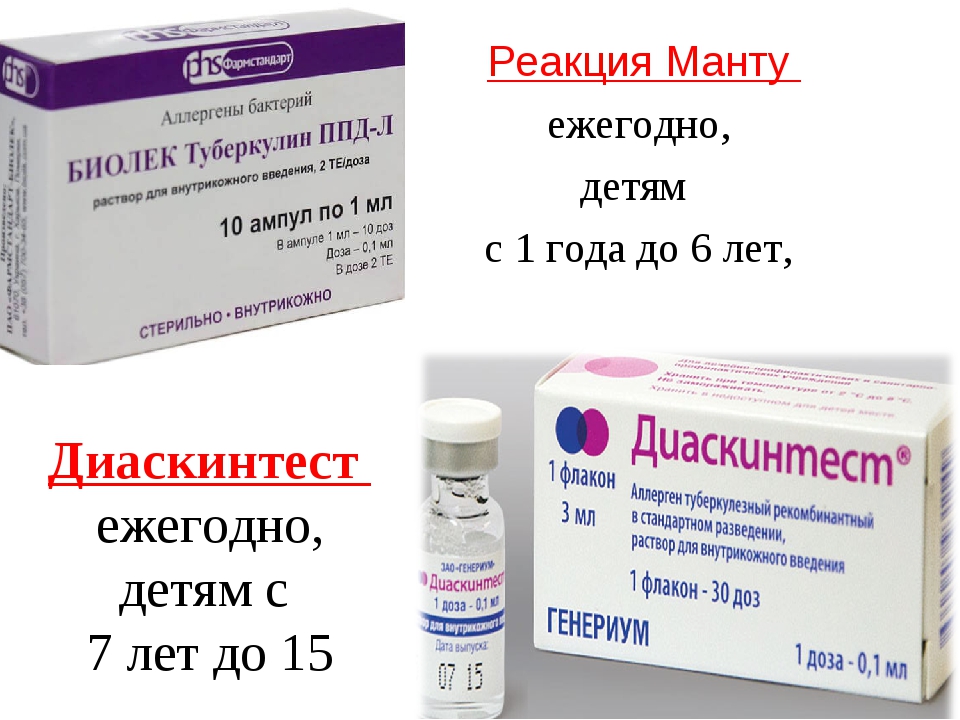 После тщательного перемешивания в каждую из двух пробирок для ГХ вносили по 0,5 мл. Пробирки снова перемешивали, несколько раз переворачивая.
После тщательного перемешивания в каждую из двух пробирок для ГХ вносили по 0,5 мл. Пробирки снова перемешивали, несколько раз переворачивая.
Для прямого ТЛЧ использовался расширенный протокол, который обычно используется для непрямой настройки ТЛЧ PZA, поскольку для прямого ТЛЧ требуется 21-дневный протокол для завершения теста (18, 26). Использовались два держателя набора для ТЛЧ с двумя пробирками. Пробирки для контроля роста и INH помещали в один держатель набора (GC и INH), а пробирки контроля роста и RIF помещали в другой держатель набора (GC и RIF).Эти установленные носители были введены в прибор как тест PZA. Первой пробиркой в держателе набора всегда была контрольная пробирка.
В одном центре применялся другой подход к обработке 21-дневного протокола. Во втором варианте прямого ТЛЧ процедуры были такими же, за исключением того, что использовался только один ГХ. Пробирки для ГХ и ИНГ были помещены в один двухпробирочный держатель и введены как PZA DST. Пробирку RIF вводили как обычную пробирку для роста (42-дневный протокол) и помещали рядом с держателем набора INH.
Меры предосторожности.
Все четыре объекта имеют хорошо оборудованные лаборатории BSL III. Соблюдались стандартные меры предосторожности при обработке образцов, инокуляции и ТЛЧ (29).
Интерпретация прямых тестов на лекарственную чувствительность.
Когда ГХ достигает значения единицы роста (ЕП) 400 или более, прибор показывает, что тест завершен, после сканирования набор чувствительности удаляется и отчет об инвентаризации распечатывается. Результаты чувствительности как для INH, так и для RIF (в первом варианте) интерпретировались прибором как «S» или «R.” В то время, когда значение GU GC составляло 400 или более, и если значение GU тюбика с лекарством было меньше 100, результат теста сообщался как «чувствительный», а если значение GU тюбика с лекарством составляло 100 или больше результат был интерпретирован как «устойчивый». Значения GU обоих наборов DST были извлечены и записаны. В случае, если значение GU контроля не достигало 400 в течение 21 дня, прибор указывал на ошибку X200, указывающую на недостаточный рост. С другой стороны, если GU достигал 400 раньше, чем на 4-й день, прибор выдавал ошибку X400, что указывало на контаминацию или чрезмерную инокуляцию.
С другой стороны, если GU достигал 400 раньше, чем на 4-й день, прибор выдавал ошибку X400, что указывало на контаминацию или чрезмерную инокуляцию.
Во втором варианте пробирки для ГХ и изониазида извлекались после того, как прибор показал, что тест завершен и получены результаты. Были извлечены значения GU набора INH. Поскольку пробирка RIF инкубировалась отдельно в системе как обычная пробирка для выращивания, прибор не интерпретировал результаты. В этот момент значение GU пробирки RIF также было получено путем печати отчета об инвентаризации прибора. Результаты интерпретировались вручную в соответствии с критериями, приведенными выше.
Для расчета времени получения непосредственных результатов ТЛЧ записывалось время, которое потребовалось прибору для завершения теста ТЛЧ. Поскольку прибор показывает время в часах, за полные сутки принималось любое время, равное половине суток и более.
Референтный метод: непрямой тест на лекарственную чувствительность.
Первичные изоляционные пробирки образцов, которые были включены в исследование, были обследованы. После того, как инокулированный образец дал положительную культуру в MGIT и было подтверждено наличие чистой культуры M.tuberculosis непрямое ТЛЧ было настроено в соответствии с процедурами, рекомендованными производителем для системы MGIT 960. Результаты непрямого ТЛЧ и время до завершения теста были извлечены из прибора и записаны.
После того, как инокулированный образец дал положительную культуру в MGIT и было подтверждено наличие чистой культуры M.tuberculosis непрямое ТЛЧ было настроено в соответствии с процедурами, рекомендованными производителем для системы MGIT 960. Результаты непрямого ТЛЧ и время до завершения теста были извлечены из прибора и записаны.
Для расчета времени, необходимого для отчетных непрямых результатов ТЛЧ для образца, к общему времени добавлялось время, необходимое для получения положительного результата посева, плюс время, необходимое для получения непрямых результатов ТЛЧ. Так как непрямое летнее время устанавливается через 1-5 дней после того, как прибор дал положительный сигнал, к общему времени дополнительно добавлялось в среднем 2 дня.Иногда ТЛЧ не устанавливали в течение 5 дней после положительного результата посева в MGIT, и требовалось пересев. Это время не было задокументировано. Время, необходимое для непрямого ТЛЧ, сравнивали со временем прямого ТЛЧ того же образца. Разницей считалась экономия времени.
Разницей считалась экономия времени.
В центре 4 было также проведено рутинное непрямое ТЛЧ на среде LJ, но результаты не были включены в этот анализ.
Идентификация выделенных микобактерий.
Метод MGIT 960 DST рекомендуется для M.tuberculosis , поэтому выделенные микобактерии из культурально-положительных образцов были идентифицированы с использованием стандартного метода, используемого в лабораториях для идентификации M. tuberculosis . В это исследование были включены только те культуры, которые были подтверждены как M.tuberculosis . Прямые результаты ТЛЧ на тех образцах, которые были контаминированы или в которых была обнаружена микобактерия, отличная от M.tuberculosis , были исключены.
Тестирование расхождений.
Образцы, показавшие несоответствие результатов прямого и непрямого методов, были повторно протестированы путем повторения непрямого метода.Если результаты второго тестирования были такими же, как и первые косвенные результаты, прямые результаты чувствительности считались несоответствующими. Если результаты повторного тестирования расходились с предыдущими косвенными результатами и согласовывались с прямыми результатами, то результаты считались правильными.
Если результаты повторного тестирования расходились с предыдущими косвенными результатами и согласовывались с прямыми результатами, то результаты считались правильными.
Контроль качества.
Штамм h47Rv M.tuberculosis (ATCC 27294) использовали для тестирования контроля качества (КК) при ТЛЧ. Этот штамм вводили каждый раз при подготовке партии ТЛЧ или в качестве каждого шестого изолята в цикле.Если в штамме QC наблюдалась какая-либо устойчивость, все остальные результаты в этой партии считались недействительными.
РЕЗУЛЬТАТЫ
Из общего числа обработанных 360 образцов 307 (85%) результатов ТЛЧ подлежат регистрации (). Большинство из тех, о которых не сообщалось, были теми, в которых контроль не достиг требуемого порога (ошибка X200), а некоторые были контаминированы (ошибка X400). Центр 1 обработал 126 образцов мокроты и сообщил о 113 результатах (90%), Центр 2 обработал 122 образца и сообщил о 103 результатах (84%), Центр 3 обработал 74 образца и сообщил о 58 результатах (84%), в то время как Центр 4 предоставил 33 отчетных результата.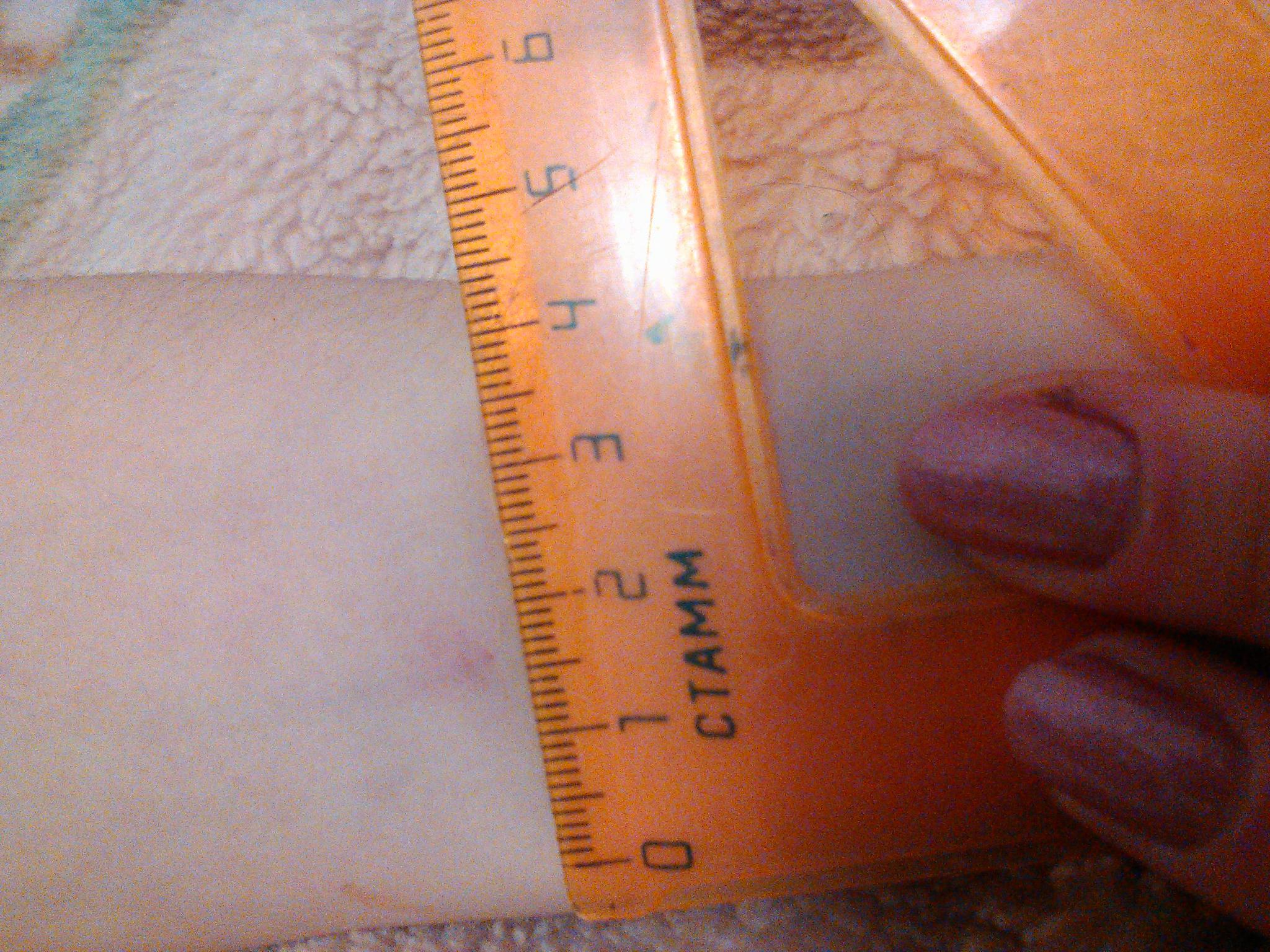 из 38 обработанных образцов (87%).Образцы, которые были отрицательными для посева, были загрязнены или содержали нетуберкулезные микобактерии (НТМ), были исключены из расчета результатов, подлежащих регистрации. Всего было 15 образцов с загрязнением, 8 были идентифицированы как NTM, 19 имели ошибку X200 и 5 имели ошибку X400.
из 38 обработанных образцов (87%).Образцы, которые были отрицательными для посева, были загрязнены или содержали нетуберкулезные микобактерии (НТМ), были исключены из расчета результатов, подлежащих регистрации. Всего было 15 образцов с загрязнением, 8 были идентифицированы как NTM, 19 имели ошибку X200 и 5 имели ошибку X400.
Таблица 1
Таблица 1
Общая сводка тестирования
| сайт A | Количество тестов Настройки | № отчетных результатов |
|---|---|---|
| 1 | 126 | 113 |
| 2 | 122 | 103 |
| 3 | 74 | 58 |
| 4 | 38 | 33 |
| Итого | 360 | 307 (85%) |
Время до сообщения результатов положительных посевов анализировалось в зависимости от степени положительности мазка на КУМ (). Большинство образцов имели от 2 до 3+ положительных мазков на всех участках. Время до обнаружения положительной культуры существенно не отличалось между разными классами мазка. В целом, посевы были положительными в среднем через 8 дней, в диапазоне от 8 до 10 дней.
Большинство образцов имели от 2 до 3+ положительных мазков на всех участках. Время до обнаружения положительной культуры существенно не отличалось между разными классами мазка. В целом, посевы были положительными в среднем через 8 дней, в диапазоне от 8 до 10 дней.
Таблица 2
Время для выявления MGIT-положительных культур
| Классификация мазков по местам | Количество образцов, ставших положительными через несколько дней: | Общее количество образцов стали положительными | Среднее время до обнаружения (кол.дней) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 3-7 | 8-14 | 15-21 | > 21 | ||||||
| Сайт | 1 | ||||||||
| Скудное | 4 | 4 | 6 | 0 | 0 | 11 | 9 | ||
| 9 | 7 | 9 | 3 | 0 | 24 | 9 | |||
| 2+ | 14 | 14 | 10 | 29 | 8 | ||||
| 3+ 45 | 3 | 1 | 0 | 49 | |||||
| Итого | 77 | 30 | 6 | 6 | 0 | 113 | 8 | 8 | |
| сайт 2 | Скудная | 0 0 | 0 | 0 | 0 | 0 | |||
| 1+ 10 | 18 | 4 0 | 32 | 10 | |||||
| 2 + | 17 | 112 0 | 30 | 8 | |||||
| 3+ 35 | 6 | 0 | 0 | 41 | |||||
| Итого 62 | 35 | 6 | 0 | 103 | 8 | ||||
| сайта 3 | |||||||||
| Скудная | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||
| 1+ | 8 | 15 | 3 | 0 | 26 | 10 9026 4 | |||
| 2+ | 1 | 1 | 1 | 0 | 6 | 8 | |||
| 3+ | 21 | 3 | 1 | 1 | 26 | 6 | |||
| Итого | 33 | 19 | 5 | 1 | 58 | 8 | |||
| сайта 4 | |||||||||
| Скудная | 1 | 4 | 1 0 | 6 12 | |||||
| 1+ 1 | 6 | 0 | 1 8 | 12 | |||||
| 2+ 2 | 3 1 | 0 | 0 | 6 | 11 | 11 | |||
| 3+ | 10 | 3 | 0 | 0 | 13 | 7 9 0264 | |||
| Всего | 14 | 14 | 16 | 2 | 2 | 1 | 33 | 33 | 10 |
На момент проведения прямых DST от обрабатываемых образцов было рассчитано в соответствии с положительными категориями ()Не было существенной разницы между временем получения прямых результатов ТЛЧ в различных категориях с положительным мазком. Большинство результатов были готовы в течение 8-14 дней, в среднем 10 дней в центре 1, 11 дней в центрах 2 и 3 и 12 дней в центре 4. результаты обработанных образцов
Большинство результатов были готовы в течение 8-14 дней, в среднем 10 дней в центре 1, 11 дней в центрах 2 и 3 и 12 дней в центре 4. результаты обработанных образцов
| Мазок (число образцов) | Количество тестов после дней: | Среднее время обнаружения (числоДНЕЙ) | ||||
|---|---|---|---|---|---|---|
| 3-7 | 8-14 | 8-14 | 15-21 | Scanty (11) | 1 | 7 | 3 | 12 |
| 1+ (24 ) | 0 | 20 | 4 | 4 | 12 | 9 |
| 2+ (29) | 2 | 21 | 6 | 11 | ||
| 3+ (49) | 18 | 31 | 0 | 8 | ||
| Среднее время для обнаружения общего | 10 | |||||
| Site 2 | ||||||
| Скудная | 0 | 0 | 0 | 0 | 0 | |
| 1+ (32) | 3 | 21 | 8 | 13 | ||
| 2+ (30) | 3 | 23 | 4 | 9026 3 11|||
| 3+ (41) | 17 | 21 | 21 | 3 | 9 | |
| AVG Время обнаружить всего | 11 | |||||
| сайт 3 | + | + | + | +|||
| Скудная | 0 0 | 0 | 0 | |||
| 1+ (26) | 3 13 | 10 | 13 | |||
| 2+ (6) | 2 | 4 | 4 | 0 | 9 | 9 |
| 3+ (26) | 8 | 16 | 2 | 10 | ||
| AVG Время обнаружения всего | 11 | 11 | ||||
| сайт 4 | ||||||
| Scanty (6) | 0 | 4 | 90 263 215 | 9 | 9 | |
| 1+ (8) | 0 | 3 | 5 | 14 | ||
| 2+ (6) | 0 | 6 | 0 | 11 | ||
| 3+ (13) | 1 | 11 | 11 | 1 | 10 | 10 |
| AVG Время для обнаружения всего | 12 | |||||
In, среднее время для завершения косвенного ТЛЧ из изолированных культур сообщается без учета времени до положительного результата посева. Среднее время сообщения о непрямом ТЛЧ из выделенной культуры колебалось от 6 дней (центр 4) до 10 дней (сайт 2).
Среднее время сообщения о непрямом ТЛЧ из выделенной культуры колебалось от 6 дней (центр 4) до 10 дней (сайт 2).
Таблица 4
Таблица 4
Время отчета о результатах косвенного восприимчивости из изолированных культур A
| сайт | Количество тестов с репортажными результатами после нескольких дней: | AVG Время для отчета ( No. дней) | ||||
|---|---|---|---|---|---|---|
| 4-7 | 8-13 | 9-13 | ||||
| 1 | 27 | 8 9 9 | 8 | |||
| 2 | 16 | 87 | 10 | |||
| 3 | 18 | 18 | 40 | 9 | 9 | 9 |
| 4 | 30 | 3 | 6 | 6 | ||
Общее время, необходимое с момента обработки образца, когда были доступны косвенные DST входит в . Он колебался от 18 до 20 дней.
Он колебался от 18 до 20 дней.
Таблица 6
Таблица сбережений с прямой чувствительностью
от обработанных образцов
| Site | AVG Время отчета (дни) | Сбереганца по времени (№ дней) | ||||
|---|---|---|---|---|---|---|
| Repirct | Прямая | |||||
| 1 | 18 | 10 | 8 | |||
| 2 | 20 | 11 | 9 | |||
| 3 | 19 | 11 | 8 | |||
| 4 | 18 | 12 | 12 | 12 | 6 | 6 |
| Все сайты | 19 | 11 | 8 | 8 | ||
Расхожденные результаты были проанализированы на всех прямых испытаниях DST, на которых были подтвержденные косвенные результаты DST доступный (). Из 113 образцов, зарегистрированных в центре 1, в 5 образцах результаты прямых и непрямых методов определения изониазида были расхождениями (4,4%): три результата были зарегистрированы как ложно устойчивые, а два – как ложно чувствительные. Для RIF было получено три противоречивых результата (2,7%), два из которых были ложно чувствительными, а один — ложно устойчивыми к RIF. На участке 2 из 103 образцов три показали противоречивые результаты для INH (2,9%), все ложно чувствительные. Также для РИФ было всего три несовпадающих результата (2.9%): два ложноустойчивых и один ложночувствительный. В центре 3 было получено шесть противоречивых результатов из 58 тестов на изониазид (10,3%), четыре из которых были ложно устойчивыми и два ложно восприимчивыми. Для RIF было получено пять противоречивых результатов (8,6%), два из которых были ложно устойчивыми, а три ложно восприимчивыми. На участке 4 из 33 тестов был только один (3,0%) ложно устойчивый к изониазиду и один (3,0%) ложно чувствительный к РИФ.
Из 113 образцов, зарегистрированных в центре 1, в 5 образцах результаты прямых и непрямых методов определения изониазида были расхождениями (4,4%): три результата были зарегистрированы как ложно устойчивые, а два – как ложно чувствительные. Для RIF было получено три противоречивых результата (2,7%), два из которых были ложно чувствительными, а один — ложно устойчивыми к RIF. На участке 2 из 103 образцов три показали противоречивые результаты для INH (2,9%), все ложно чувствительные. Также для РИФ было всего три несовпадающих результата (2.9%): два ложноустойчивых и один ложночувствительный. В центре 3 было получено шесть противоречивых результатов из 58 тестов на изониазид (10,3%), четыре из которых были ложно устойчивыми и два ложно восприимчивыми. Для RIF было получено пять противоречивых результатов (8,6%), два из которых были ложно устойчивыми, а три ложно восприимчивыми. На участке 4 из 33 тестов был только один (3,0%) ложно устойчивый к изониазиду и один (3,0%) ложно чувствительный к РИФ. Таким образом, в целом по всем сайтам было 4,9% расхождений в результатах для INH и 3,9% для RIF.
Таким образом, в целом по всем сайтам было 4,9% расхождений в результатах для INH и 3,9% для RIF.
Таблица 5
Расхождения между прямым и косвенным методами ТЛЧ
| ЦентрТестов) | № (%) образцов | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| inth | RIF | |||||||||||
| False S | False R | Всего | False S | False R | Всего | |||||||
| 1 (113) | 2 (1.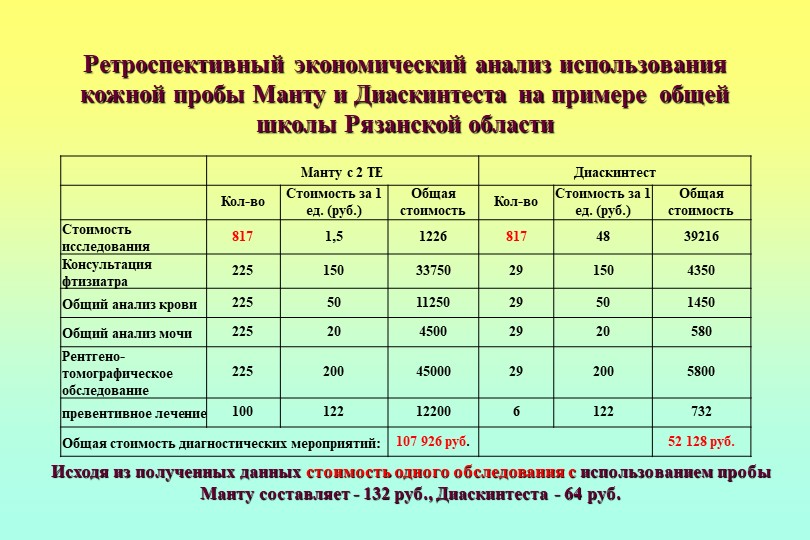 8) 8) | 3 (2.7) | 2 (1.8) | 1 (0,9) | 1 (0,9) | |||||||
| 2 (103) | 3 (2.9) | 0 | 1 (1) | 2 (1.9) | ||||||||
| 3 (58) | 2 (3.4) | 4 (7) | 4 (7) | 83 (5.2) | 2 (3. 4) 4) | |||||||
| 4 (33) | 0 | 1 (3) | 1 (3) | 0 | 0 | |||||||
| Всего (307) | 7 (2.3) | 8 (2.6) | 15 (4.9) | 7 ( 2.5) | 5 (1.6) | 12 (3.9) | ||||||
Выводы об экономии времени за счет прямого ТЛЧ приведены в .Общая экономия времени составила 8 дней, от 6 до 9 дней на всех сайтах.
Для контроля качества был создан h47Rv вместе с партиями прямого и непрямого ТЛЧ. Не было ни одного случая в каком-либо центре, где h47 Rv не дал ожидаемых результатов.
ОБСУЖДЕНИЕ
Результаты, полученные с помощью традиционных непрямых методов тестирования чувствительности, особенно с твердыми средами, становятся доступными слишком поздно, чтобы повлиять на своевременное решение о лечении пациента. Следовательно, необходимы более быстрые тесты на восприимчивость к ТБ, применяемые непосредственно к клиническим образцам.Некоторые из некоммерческих прямых тестов включают анализ нитратредуктазы (NRA) и анализ лекарственной чувствительности под микроскопом (MODS). Эти тесты были разработаны как «внутренние» анализы с целью преодоления высокой стоимости коммерчески доступных методов. В NRA добавление реагента NRA требует регулярного открытия пробирок, что создает значительный риск образования аэрозолей. Чтение пластин MODS должно выполняться ежедневно, это трудоемко и требует много времени (34). Имеющиеся в продаже молекулярные тесты, такие как Genotype MTBDR Plus (Hain Lifescience, Nehren, Germany), можно применять непосредственно к образцам с положительным мазком, и они требуют меньшего времени для обработки, что позволяет сэкономить несколько недель. Однако ни один из общепризнанных молекулярных тестов не нацелен на все возможные гены, участвующие в резистентности, и, таким образом, переменная доля резистентных штаммов может быть не обнаружена (17, 33). Жидкая культура считается золотым стандартом и является наиболее быстрой для фенотипического ТЛЧ. Это исследование было разработано для установления экономии времени при прямом подходе ТЛЧ по сравнению с обычным непрямым подходом в жидкой среде, поэтому молекулярное тестирование не было включено в исследование.
Имеющиеся в продаже молекулярные тесты, такие как Genotype MTBDR Plus (Hain Lifescience, Nehren, Germany), можно применять непосредственно к образцам с положительным мазком, и они требуют меньшего времени для обработки, что позволяет сэкономить несколько недель. Однако ни один из общепризнанных молекулярных тестов не нацелен на все возможные гены, участвующие в резистентности, и, таким образом, переменная доля резистентных штаммов может быть не обнаружена (17, 33). Жидкая культура считается золотым стандартом и является наиболее быстрой для фенотипического ТЛЧ. Это исследование было разработано для установления экономии времени при прямом подходе ТЛЧ по сравнению с обычным непрямым подходом в жидкой среде, поэтому молекулярное тестирование не было включено в исследование.
Жидкая культура представляет собой более чувствительный и быстрый метод выделения M.tuberculosis и проведения тестов на чувствительность к различным противотуберкулезным препаратам первого и второго ряда (13, 21). Однако большинство исследований ТЛЧ проводилось рутинным непрямым методом с использованием изолированных культур. Это первое крупномасштабное многоцентровое исследование по оценке прямого тестирования чувствительности M.tuberculosis из клинических образцов с использованием автоматизированной системы жидкостных культур MGIT 960.
Однако большинство исследований ТЛЧ проводилось рутинным непрямым методом с использованием изолированных культур. Это первое крупномасштабное многоцентровое исследование по оценке прямого тестирования чувствительности M.tuberculosis из клинических образцов с использованием автоматизированной системы жидкостных культур MGIT 960.
Поскольку МЛУ-туберкулез является одной из основных проблем в программе борьбы с ТБ, а результаты ТЛЧ играют важную роль в борьбе с ТБ, мы сосредоточились на прямом ТЛЧ только для двух препаратов, изониазида и рифампицина. Это не означает, что данный подход применим только к этим двум противомикробным препаратам. Ожидается, что это исследование может стать руководством для быстрого прямого ТЛЧ на основе бульона для других противотуберкулезных препаратов первого и второго ряда, что поможет, особенно если у пациента подозревается устойчивость к этим препаратам.
Одна из главных проблем заключалась в том, как провести прямое летнее время. Ранее было установлено, что для прямого ТЛЧ с использованием жидкой среды продолжительность протокола испытаний следует увеличить с 14 сут до 21 сут, так как М.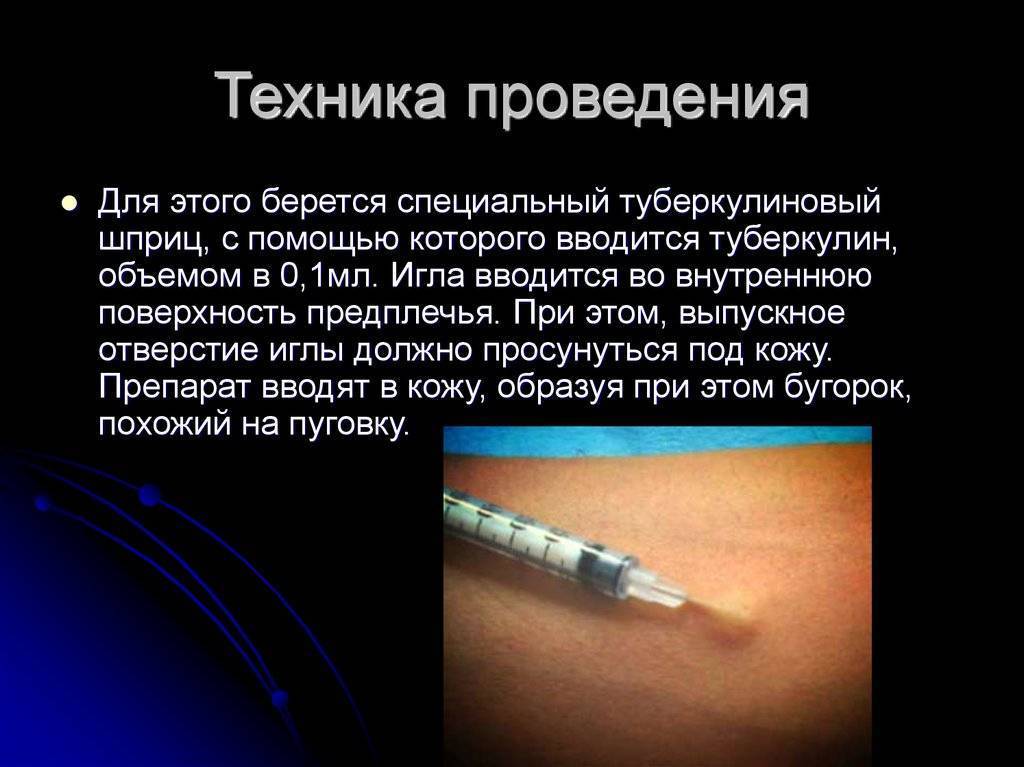 tuberculosis , присутствующие в клиническом образце, растут не так быстро, как из изолированная культура (16). В предлагаемом протоколе прямое ТЛЧ проводится из образца с положительным мазком на КУМ с любой степенью положительного мазка при любой процедуре окрашивания; таким образом, в некоторых случаях количество бактерий, присутствующих в инокуляте, низкое, и может потребоваться более 14 дней для достижения необходимого уровня роста или GU.Процедура непрямого ТЛЧ MGIT 960 разработана с протоколом от 4 до 13 дней, за исключением PZA DST, который представляет собой тест от 4 до 21 дня. Однако тест PZA предназначен только для двухтрубной системы. Мы попробовали несколько различных подходов к рабочему процессу для достижения результатов с 21-дневным протоколом. Первый подход заключался в том, чтобы установить для каждого препарата свой собственный контроль, а затем ввести его в прибор в держателе набора из двух пробирок в качестве теста PZA. Это простая, прямая и предпочтительная процедура, и прибор автоматически интерпретирует результаты.
tuberculosis , присутствующие в клиническом образце, растут не так быстро, как из изолированная культура (16). В предлагаемом протоколе прямое ТЛЧ проводится из образца с положительным мазком на КУМ с любой степенью положительного мазка при любой процедуре окрашивания; таким образом, в некоторых случаях количество бактерий, присутствующих в инокуляте, низкое, и может потребоваться более 14 дней для достижения необходимого уровня роста или GU.Процедура непрямого ТЛЧ MGIT 960 разработана с протоколом от 4 до 13 дней, за исключением PZA DST, который представляет собой тест от 4 до 21 дня. Однако тест PZA предназначен только для двухтрубной системы. Мы попробовали несколько различных подходов к рабочему процессу для достижения результатов с 21-дневным протоколом. Первый подход заключался в том, чтобы установить для каждого препарата свой собственный контроль, а затем ввести его в прибор в держателе набора из двух пробирок в качестве теста PZA. Это простая, прямая и предпочтительная процедура, и прибор автоматически интерпретирует результаты. Однако некоторые исследователи считали этот подход дорогостоящим, поскольку для каждого препарата необходим контроль, что означает потребность в большем количестве пробирок MGIT. Чтобы сократить расходы, мы придумали другой подход, при котором первый препарат, в данном случае контроль роста и изониазид, вводится в прибор с протоколом PZA. Другая пробирка с препаратом, а именно РИФ, вводится в прибор как пробирка для роста, а не как пробирка для ТЛЧ. Пробирка находится в том же ящике рядом с пробирками INH DST. Как только набор INH готов (GU контроля достигает 400 или более), прибор помечает его как завершенный и интерпретирует результаты как «S» или «R.В это время значения GU пробирки RIF извлекаются путем запроса инвентарных значений GU инкубационных пробирок в приборе, а затем записывается значение GU пробирки RIF. Это делается путем печати отчета об инвентаризации без сканирования пробирки из прибора перед печатью, так как значения GU могут быть потеряны. В случае, если трудно найти одну пробирку в ящике, есть еще одна возможность поместить эту пробирку с RIF в держатель набора для двух пробирок для ТЛЧ, поместив сначала пустую пробирку с незасеянной средой MGIT в качестве контроля роста, а затем пробирку с RIF.
Однако некоторые исследователи считали этот подход дорогостоящим, поскольку для каждого препарата необходим контроль, что означает потребность в большем количестве пробирок MGIT. Чтобы сократить расходы, мы придумали другой подход, при котором первый препарат, в данном случае контроль роста и изониазид, вводится в прибор с протоколом PZA. Другая пробирка с препаратом, а именно РИФ, вводится в прибор как пробирка для роста, а не как пробирка для ТЛЧ. Пробирка находится в том же ящике рядом с пробирками INH DST. Как только набор INH готов (GU контроля достигает 400 или более), прибор помечает его как завершенный и интерпретирует результаты как «S» или «R.В это время значения GU пробирки RIF извлекаются путем запроса инвентарных значений GU инкубационных пробирок в приборе, а затем записывается значение GU пробирки RIF. Это делается путем печати отчета об инвентаризации без сканирования пробирки из прибора перед печатью, так как значения GU могут быть потеряны. В случае, если трудно найти одну пробирку в ящике, есть еще одна возможность поместить эту пробирку с RIF в держатель набора для двух пробирок для ТЛЧ, поместив сначала пустую пробирку с незасеянной средой MGIT в качестве контроля роста, а затем пробирку с RIF. Этот носитель набора вводится в прибор как PZA DST и размещается рядом с набором INH. Поскольку контроль не инокулирован, этот носитель набора следует удалить одновременно с носителем набора INH. Значения GU извлекаются и записываются перед сканированием этого второго набора несущих; в противном случае значения GU будут потеряны. Интерпретация RIF DST выполняется вручную на основе формулы, приведенной в предыдущем разделе. Незасеянную пробирку для контроля роста можно использовать снова и снова. Описанной выше процедуре можно следовать для любых и стольких лекарств, сколько необходимо.
Этот носитель набора вводится в прибор как PZA DST и размещается рядом с набором INH. Поскольку контроль не инокулирован, этот носитель набора следует удалить одновременно с носителем набора INH. Значения GU извлекаются и записываются перед сканированием этого второго набора несущих; в противном случае значения GU будут потеряны. Интерпретация RIF DST выполняется вручную на основе формулы, приведенной в предыдущем разделе. Незасеянную пробирку для контроля роста можно использовать снова и снова. Описанной выше процедуре можно следовать для любых и стольких лекарств, сколько необходимо.
Это исследование проводилось в хорошо зарекомендовавших себя лабораториях. Уровень положительности посева образца с положительным мазком был очень высоким (выше 95%), с приемлемыми показателями контаминации (от 4 до 8%) и очень низкой распространенностью НТМ. Общий показатель успеха ТЛЧ из образцов с положительным мазком составил 85%. Это означает, что только от 10 до 15% всех настроек ТЛЧ были не интерпретируемы по нескольким причинам, таким как загрязнение или наличие НТМ (ошибки X400) или отсутствие роста или недостаточный рост в контроле (ошибки X200). Некоторые из них, несмотря на положительный результат мазка на КУМ (даже 3+), либо не росли в пробирке для первичной изоляции и были отрицательными по культуре, либо рост был недостаточным для интерпретации прямых результатов ТЛЧ (ошибка X200). Информация об успешности прямого ТЛЧ важна для оценки экономической эффективности метода прямого ТЛЧ.
Некоторые из них, несмотря на положительный результат мазка на КУМ (даже 3+), либо не росли в пробирке для первичной изоляции и были отрицательными по культуре, либо рост был недостаточным для интерпретации прямых результатов ТЛЧ (ошибка X200). Информация об успешности прямого ТЛЧ важна для оценки экономической эффективности метода прямого ТЛЧ.
Наиболее важным аспектом наших выводов является экономия времени за счет прямого ТЛЧ. Время для сообщения о непрямом ТЛЧ Bactec MGIT из положительных культур варьировалось от 6 до 10 дней, что согласуется со многими более ранними отчетами (1, 2, 7, 20).Это время для сообщения варьируется в зависимости от многих факторов, включая вариабельность стандартной процедуры, используемой в лаборатории, популяцию пациентов и распространенность лекарственной устойчивости. Известно, что изоляты, устойчивые к лекарственным препаратам, обычно растут дольше, чем изоляты, чувствительные к лекарственным препаратам. Общее время для сообщения о непрямом ТЛЧ рассчитывалось как время выделения культуры, время, необходимое для настройки ТЛЧ, и время, необходимое для получения результатов теста на чувствительность из положительной культуры. С другой стороны, время для отчета о прямом ТЛЧ было временем получения результатов ТЛЧ после инокуляции обработанного образца.Экономия времени за счет прямого перехода на летнее время составила в целом 8 дней и не сильно отличалась от сайта к сайту. Эта экономия времени очень важна, так как в случае MDR на счету каждый день. Результаты показывают, что прямое ТЛЧ значительно сокращает время, затрачиваемое на отчет о результатах определения чувствительности. После прямого ТЛЧ в среднем центры 1 и 4 сообщали о результатах прямого ТЛЧ через 2 дня после получения положительных результатов посева, а сайты 2 и 3 сообщали через три дня после получения положительных результатов посева. Эти центры занимаются большим количеством случаев МЛУ, и, таким образом, среди всех изученных нами случаев была хорошая репрезентативность случаев с лекарственной устойчивостью.
С другой стороны, время для отчета о прямом ТЛЧ было временем получения результатов ТЛЧ после инокуляции обработанного образца.Экономия времени за счет прямого перехода на летнее время составила в целом 8 дней и не сильно отличалась от сайта к сайту. Эта экономия времени очень важна, так как в случае MDR на счету каждый день. Результаты показывают, что прямое ТЛЧ значительно сокращает время, затрачиваемое на отчет о результатах определения чувствительности. После прямого ТЛЧ в среднем центры 1 и 4 сообщали о результатах прямого ТЛЧ через 2 дня после получения положительных результатов посева, а сайты 2 и 3 сообщали через три дня после получения положительных результатов посева. Эти центры занимаются большим количеством случаев МЛУ, и, таким образом, среди всех изученных нами случаев была хорошая репрезентативность случаев с лекарственной устойчивостью.
Еще одной целью данного исследования была оценка точности результатов, полученных прямым методом. В этом расчете непрямое ТЛЧ считалось золотым стандартом, и в случае несоответствия результатов непрямое ТЛЧ повторялось. В целом среди четырех центров только 4,9% результатов были противоречивыми в случае изониазида и 3,9% в случае рифампицина, с 2,3% ложной чувствительности (очень большая ошибка) для изониазида и 2,5% для рифампина. Ложная резистентность (основная ошибка) составила 2,6% для изониазида и 1,6% для рифампина.На одном сайте несоответствие было выше, чем на трех других сайтах. Не было четкой картины несогласованных результатов, поскольку как ложная устойчивость, так и ложная чувствительность наблюдались при использовании изониазида и рифампицина.
В целом среди четырех центров только 4,9% результатов были противоречивыми в случае изониазида и 3,9% в случае рифампицина, с 2,3% ложной чувствительности (очень большая ошибка) для изониазида и 2,5% для рифампина. Ложная резистентность (основная ошибка) составила 2,6% для изониазида и 1,6% для рифампина.На одном сайте несоответствие было выше, чем на трех других сайтах. Не было четкой картины несогласованных результатов, поскольку как ложная устойчивость, так и ложная чувствительность наблюдались при использовании изониазида и рифампицина.
Таким образом, это многоцентровое исследование установило стандартный протокол для проведения прямой чувствительности с помощью автоматизированной системы Bactec MGIT. О результатах ТЛЧ можно сообщить через 2–3 дня после получения положительных результатов посева. Эта значительная экономия времени может значительно помочь в назначении эффективного лечения, особенно в случаях МЛУ.Если стоимость является проблемой, а распространенность монорезистентности к РИФ не является обычным явлением, можно тестировать только РИФ, который может считаться суррогатным маркером МЛУ.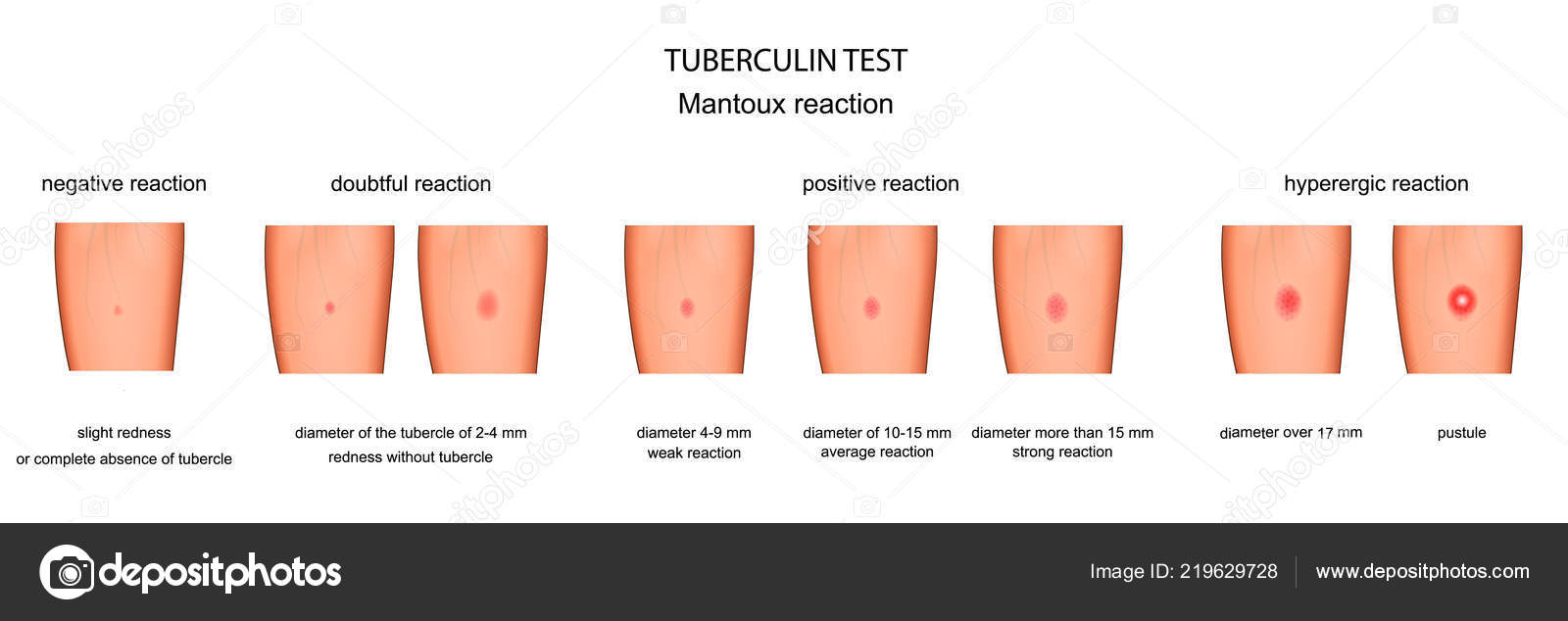 Прямой ТЛЧ является надежным тестом, так как результаты, полученные прямым ТЛЧ, на 95-96% совпадают с результатами, полученными непрямым методом.
Прямой ТЛЧ является надежным тестом, так как результаты, полученные прямым ТЛЧ, на 95-96% совпадают с результатами, полученными непрямым методом.
БЛАГОДАРНОСТЬ
Мы благодарим Кирстен Отт (Национальный справочный центр микобактерий, Борстель, Германия) за ценный вклад в это исследование. Мы благодарим Becton Dickinson за поставку реагентов.
Салман Сиддики имеет консультационное соглашение с BD, а также с несколькими другими организациями, занимающимися диагностикой туберкулеза. Остальные авторы сообщают об отсутствии конфликта интересов.
Сноски
Опубликовано до печати 7 декабря 2011 г.
ССЫЛКИ
1. Аджерс-Коскела К., Катила М.Л. 2003. Тестирование чувствительности с помощью ручной индикаторной пробирки для роста микобактерий (MGIT) и системы MGIT 960 обеспечивает быструю и надежную проверку полирезистентного туберкулеза.Дж. Клин. микробиол. 41:1235–1239 [бесплатная статья PMC] [PubMed] [Google Scholar]2. Ардито Ф. и др. 2001. Оценка автоматизированной системы индикатора роста микобактерий BACTEC (MGIT 960) для тестирования лекарственной чувствительности Mycobacterium tuberculosis. Дж. Клин. микробиол. 39:4440–4444 [бесплатная статья PMC] [PubMed] [Google Scholar]3.
Азиз М.А. и соавт. 2006. Эпидемиология устойчивости к противотуберкулезным препаратам (глобальный проект по эпиднадзору за устойчивостью к противотуберкулезным препаратам): обновленный анализ.Lancet 368:2142–2154 [PubMed] [Google Scholar]4.
Балабанова Ю. и др. 2005. Туберкулез с множественной лекарственной устойчивостью в России: клиническая характеристика, анализ устойчивости к препаратам второго ряда и разработка стандартизированной терапии. Евро. Дж. Клин. микробиол. Заразить. Дис. 24:136–139 [PubMed] [Google Scholar]5.
Банерджи Р., Шектер Г. Ф., Флад Дж., Порко Т. С. 2008. Туберкулез с широкой лекарственной устойчивостью: новые штаммы, новые проблемы. Эксперт преподобный Anti Infect. тер. 6:713–724 [PubMed] [Google Scholar]6.
Бастиан И.
и др. 2001. Оценка автоматизированной системы индикатора роста микобактерий BACTEC (MGIT 960) для тестирования лекарственной чувствительности Mycobacterium tuberculosis. Дж. Клин. микробиол. 39:4440–4444 [бесплатная статья PMC] [PubMed] [Google Scholar]3.
Азиз М.А. и соавт. 2006. Эпидемиология устойчивости к противотуберкулезным препаратам (глобальный проект по эпиднадзору за устойчивостью к противотуберкулезным препаратам): обновленный анализ.Lancet 368:2142–2154 [PubMed] [Google Scholar]4.
Балабанова Ю. и др. 2005. Туберкулез с множественной лекарственной устойчивостью в России: клиническая характеристика, анализ устойчивости к препаратам второго ряда и разработка стандартизированной терапии. Евро. Дж. Клин. микробиол. Заразить. Дис. 24:136–139 [PubMed] [Google Scholar]5.
Банерджи Р., Шектер Г. Ф., Флад Дж., Порко Т. С. 2008. Туберкулез с широкой лекарственной устойчивостью: новые штаммы, новые проблемы. Эксперт преподобный Anti Infect. тер. 6:713–724 [PubMed] [Google Scholar]6.
Бастиан И. , Ригутс Л., Паломино Х.С., Портаэлс Ф.2001. Тестирование чувствительности микобактерий туберкулеза к канамицину с использованием индикаторной трубки роста микобактерий и колориметрического метода. Антимикроб. Агенты Чемотер. 45:1934–1936 [бесплатная статья PMC] [PubMed] [Google Scholar]7.
Бемер П., Паликова Ф., Рюш-Гердес С., Другеон Х.Б., Пфиффер Г.Э. 2002. Многоцентровая оценка полностью автоматизированной системы BACTEC Mycobacteria Growth Indicator Tube 960 для тестирования чувствительности Mycobacterium tuberculosis. Дж. Клин. микробиол. 40:150–154 [бесплатная статья PMC] [PubMed] [Google Scholar]8.Камбау Э. и др. 2000. Пробирка-индикатор роста микобактерий в сравнении с пропорциональным методом на среде Левенштейна-Йенсена для тестирования чувствительности Mycobacterium tuberculosis к антибиотикам. Евро. Дж. Клин. микробиол. Заразить. Дис. 19:938–942 [PubMed] [Google Scholar]9.
КЛСИ
2007. Тестирование чувствительности микобактерий, нокардий и аэробных актиномицетов: утвержденные стандарты, второе издание, том 26, № 23.
, Ригутс Л., Паломино Х.С., Портаэлс Ф.2001. Тестирование чувствительности микобактерий туберкулеза к канамицину с использованием индикаторной трубки роста микобактерий и колориметрического метода. Антимикроб. Агенты Чемотер. 45:1934–1936 [бесплатная статья PMC] [PubMed] [Google Scholar]7.
Бемер П., Паликова Ф., Рюш-Гердес С., Другеон Х.Б., Пфиффер Г.Э. 2002. Многоцентровая оценка полностью автоматизированной системы BACTEC Mycobacteria Growth Indicator Tube 960 для тестирования чувствительности Mycobacterium tuberculosis. Дж. Клин. микробиол. 40:150–154 [бесплатная статья PMC] [PubMed] [Google Scholar]8.Камбау Э. и др. 2000. Пробирка-индикатор роста микобактерий в сравнении с пропорциональным методом на среде Левенштейна-Йенсена для тестирования чувствительности Mycobacterium tuberculosis к антибиотикам. Евро. Дж. Клин. микробиол. Заразить. Дис. 19:938–942 [PubMed] [Google Scholar]9.
КЛСИ
2007. Тестирование чувствительности микобактерий, нокардий и аэробных актиномицетов: утвержденные стандарты, второе издание, том 26, № 23. Документ CLSI M24-2. Институт клинических и лабораторных стандартов, Уэйн, Пенсильвания [Google Scholar]10.Ганди Н.Р. и др. 2006. Туберкулез с широкой лекарственной устойчивостью как причина смерти пациентов с сочетанной инфекцией туберкулеза и ВИЧ в сельской местности Южной Африки. Lancet 368:1575–1580 [PubMed] [Google Scholar]11.
Голубева В, и соавт. 2001. Оценка пробирки-индикатора роста микобактерий для прямого и непрямого тестирования лекарственной чувствительности микобактерий туберкулеза из респираторных образцов в сибирской тюремной больнице. Дж. Клин. микробиол. 39:1501–1505 [бесплатная статья PMC] [PubMed] [Google Scholar]12.Идигорас П. и др. 2000. Сравнение автоматизированной нерадиометрической системы BACTEC MGIT 960 с твердыми средами Lowenstein-Jensen, Coletsos и Middlebrook 7h21 для выделения микобактерий. Евро. Дж. Клин. микробиол. Заразить. Дис. 19:350–354 [PubMed] [Google Scholar]13.
Кам К.М. и др. 2010. Определение критических концентраций противотуберкулезных препаратов второго ряда с клинической и микробиологической значимостью.
Документ CLSI M24-2. Институт клинических и лабораторных стандартов, Уэйн, Пенсильвания [Google Scholar]10.Ганди Н.Р. и др. 2006. Туберкулез с широкой лекарственной устойчивостью как причина смерти пациентов с сочетанной инфекцией туберкулеза и ВИЧ в сельской местности Южной Африки. Lancet 368:1575–1580 [PubMed] [Google Scholar]11.
Голубева В, и соавт. 2001. Оценка пробирки-индикатора роста микобактерий для прямого и непрямого тестирования лекарственной чувствительности микобактерий туберкулеза из респираторных образцов в сибирской тюремной больнице. Дж. Клин. микробиол. 39:1501–1505 [бесплатная статья PMC] [PubMed] [Google Scholar]12.Идигорас П. и др. 2000. Сравнение автоматизированной нерадиометрической системы BACTEC MGIT 960 с твердыми средами Lowenstein-Jensen, Coletsos и Middlebrook 7h21 для выделения микобактерий. Евро. Дж. Клин. микробиол. Заразить. Дис. 19:350–354 [PubMed] [Google Scholar]13.
Кам К.М. и др. 2010. Определение критических концентраций противотуберкулезных препаратов второго ряда с клинической и микробиологической значимостью. Междунар. Дж. Туберк. легкие дис. 14:282–288 [PubMed] [Google Scholar]14.
Кент ПТ, Кубица ГП.1985. Микробиология общественного здравоохранения, руководство для лабораторий уровня III. Центры по контролю за заболеваниями, Отдел лабораторного обучения и консультаций, Атланта, Джорджия [Google Scholar]15.
Ким СЖ. 2005. Тестирование лекарственной чувствительности при туберкулезе: методы и достоверность результатов. Евро. Дыхание J. 25:564–569 [PubMed] [Google Scholar]16.
Libonati JP, Stager CE, Davis JR, Siddiqi SH. 1988. Прямое определение чувствительности микобактерий туберкулеза к противомикробным препаратам радиометрическим методом. Диагн. микробиол.Заразить. Дис. 10:41–48 [PubMed] [Google Scholar]17.
Линг Д.И., Цверлинг А.А., Пай М. 2008. Анализ генотипа MTBDR для диагностики туберкулеза с множественной лекарственной устойчивостью; метаанализ. Евро. Дыхание 32:1165–1174 [PubMed] [Google Scholar]18.
Pfyffer GE, Palicova F, Rüsch-Gerdes S. 2002. Тестирование чувствительности Mycobacterium tuberculosis к пиразинамиду с помощью нерадиометрической системы BACTEC MGIT 960.
Междунар. Дж. Туберк. легкие дис. 14:282–288 [PubMed] [Google Scholar]14.
Кент ПТ, Кубица ГП.1985. Микробиология общественного здравоохранения, руководство для лабораторий уровня III. Центры по контролю за заболеваниями, Отдел лабораторного обучения и консультаций, Атланта, Джорджия [Google Scholar]15.
Ким СЖ. 2005. Тестирование лекарственной чувствительности при туберкулезе: методы и достоверность результатов. Евро. Дыхание J. 25:564–569 [PubMed] [Google Scholar]16.
Libonati JP, Stager CE, Davis JR, Siddiqi SH. 1988. Прямое определение чувствительности микобактерий туберкулеза к противомикробным препаратам радиометрическим методом. Диагн. микробиол.Заразить. Дис. 10:41–48 [PubMed] [Google Scholar]17.
Линг Д.И., Цверлинг А.А., Пай М. 2008. Анализ генотипа MTBDR для диагностики туберкулеза с множественной лекарственной устойчивостью; метаанализ. Евро. Дыхание 32:1165–1174 [PubMed] [Google Scholar]18.
Pfyffer GE, Palicova F, Rüsch-Gerdes S. 2002. Тестирование чувствительности Mycobacterium tuberculosis к пиразинамиду с помощью нерадиометрической системы BACTEC MGIT 960. Дж. Клин. микробиол. 40:1670–1674 [бесплатная статья PMC] [PubMed] [Google Scholar]19.
Робертс Г.Д. и соавт.1983. Оценка радиометрического метода BACTEC для выделения микобактерий и тестирования чувствительности Mycobacterium tuberculosis к лекарственным средствам из кислотоустойчивых образцов с положительным мазком. Дж. Клин. микробиол. 18:689–696 [бесплатная статья PMC] [PubMed] [Google Scholar]20.
Рюш-Гердес С. и соавт. 1999. Многоцентровая оценка пробирки-индикатора роста микобактерий для определения чувствительности Mycobacterium tuberculosis к препаратам первого ряда. Дж. Клин. микробиол. 37:45–48 [бесплатная статья PMC] [PubMed] [Google Scholar]21.Rüsch-Gerdes S, Pfyffer GE, Casal M, Chadwick M, Siddiqi S. 2006. Многоцентровая лабораторная валидация метода BACTEC MGIT 960 для тестирования чувствительности Mycobacterium tuberculosis к классическим препаратам второго ряда и новым противомикробным препаратам. Дж. Клин. микробиол. 44:688–692 [бесплатная статья PMC] [PubMed] [Google Scholar]23.
Дж. Клин. микробиол. 40:1670–1674 [бесплатная статья PMC] [PubMed] [Google Scholar]19.
Робертс Г.Д. и соавт.1983. Оценка радиометрического метода BACTEC для выделения микобактерий и тестирования чувствительности Mycobacterium tuberculosis к лекарственным средствам из кислотоустойчивых образцов с положительным мазком. Дж. Клин. микробиол. 18:689–696 [бесплатная статья PMC] [PubMed] [Google Scholar]20.
Рюш-Гердес С. и соавт. 1999. Многоцентровая оценка пробирки-индикатора роста микобактерий для определения чувствительности Mycobacterium tuberculosis к препаратам первого ряда. Дж. Клин. микробиол. 37:45–48 [бесплатная статья PMC] [PubMed] [Google Scholar]21.Rüsch-Gerdes S, Pfyffer GE, Casal M, Chadwick M, Siddiqi S. 2006. Многоцентровая лабораторная валидация метода BACTEC MGIT 960 для тестирования чувствительности Mycobacterium tuberculosis к классическим препаратам второго ряда и новым противомикробным препаратам. Дж. Клин. микробиол. 44:688–692 [бесплатная статья PMC] [PubMed] [Google Scholar]23. Шинник ТМ, Ладемарко МФ, Риддерхоф Ю.С. 2005 г. Национальный план надежных лабораторных служб по туберкулезу с использованием системного подхода. Рекомендации CDC и Целевой группы Ассоциации лабораторий общественного здравоохранения по туберкулезным лабораторным службам.MMWR Рекоменд. Отчет 54:1–12 [PubMed] [Google Scholar]24.
Siddiqi SH, Hawkins JE, Laszlo A. 1985. Межлабораторное определение лекарственной чувствительности Mycobacterium tuberculosis с помощью радиометрической процедуры и двух традиционных методов. Дж. Клин. микробиол. 22:919–923 [бесплатная статья PMC] [PubMed] [Google Scholar]25.
Siddiqi SH, Libonati JP, Middlebrook G. 1981. Оценка экспресс-радиометрического метода определения лекарственной чувствительности Mycobacterium tuberculosis. Дж. Клин. микробиол. 13:908–912 [бесплатная статья PMC] [PubMed] [Google Scholar]26.Сиддики С.Х., Рюш-Гердес С. 2006. Руководство по процедурам MGIT. Фонд инновационной новой диагностики (FIND), Женева, Швейцария [Google Scholar]28.
Всемирная организация здравоохранения
1998.
Шинник ТМ, Ладемарко МФ, Риддерхоф Ю.С. 2005 г. Национальный план надежных лабораторных служб по туберкулезу с использованием системного подхода. Рекомендации CDC и Целевой группы Ассоциации лабораторий общественного здравоохранения по туберкулезным лабораторным службам.MMWR Рекоменд. Отчет 54:1–12 [PubMed] [Google Scholar]24.
Siddiqi SH, Hawkins JE, Laszlo A. 1985. Межлабораторное определение лекарственной чувствительности Mycobacterium tuberculosis с помощью радиометрической процедуры и двух традиционных методов. Дж. Клин. микробиол. 22:919–923 [бесплатная статья PMC] [PubMed] [Google Scholar]25.
Siddiqi SH, Libonati JP, Middlebrook G. 1981. Оценка экспресс-радиометрического метода определения лекарственной чувствительности Mycobacterium tuberculosis. Дж. Клин. микробиол. 13:908–912 [бесплатная статья PMC] [PubMed] [Google Scholar]26.Сиддики С.Х., Рюш-Гердес С. 2006. Руководство по процедурам MGIT. Фонд инновационной новой диагностики (FIND), Женева, Швейцария [Google Scholar]28.
Всемирная организация здравоохранения
1998. Лабораторная серия по борьбе с туберкулезом. Часть II, микроскопия. ВОЗ/ТБ/98.258. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]29.
Всемирная организация здравоохранения
2004. Руководство по биобезопасности в лабораториях, 3-е изд. ВОЗ/CDS/CSR/LYO/2004.11; Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]30.
Всемирная организация здравоохранения
2004.Устойчивость к противотуберкулезным препаратам в мире. Отчет № 3. Глобальный проект ВОЗ/IUATLD по эпиднадзору за устойчивостью к противотуберкулезным препаратам. ВОЗ/НТМ/ТБ/2004.343. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]31.
Всемирная организация здравоохранения
2006. Руководство по программному ведению лекарственно-устойчивого туберкулеза. ВОЗ/HTM/ТБ/2006.361. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]32.
Всемирная организация здравоохранения
2007 г. Использование жидких культур ТБ и тестов на чувствительность к лекарственным препаратам (ТЛЧ) в странах с низким и средним уровнем дохода.
Лабораторная серия по борьбе с туберкулезом. Часть II, микроскопия. ВОЗ/ТБ/98.258. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]29.
Всемирная организация здравоохранения
2004. Руководство по биобезопасности в лабораториях, 3-е изд. ВОЗ/CDS/CSR/LYO/2004.11; Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]30.
Всемирная организация здравоохранения
2004.Устойчивость к противотуберкулезным препаратам в мире. Отчет № 3. Глобальный проект ВОЗ/IUATLD по эпиднадзору за устойчивостью к противотуберкулезным препаратам. ВОЗ/НТМ/ТБ/2004.343. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]31.
Всемирная организация здравоохранения
2006. Руководство по программному ведению лекарственно-устойчивого туберкулеза. ВОЗ/HTM/ТБ/2006.361. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]32.
Всемирная организация здравоохранения
2007 г. Использование жидких культур ТБ и тестов на чувствительность к лекарственным препаратам (ТЛЧ) в странах с низким и средним уровнем дохода. Краткий отчет о совещании группы экспертов по использованию жидких питательных сред. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]33.
Всемирная организация здравоохранения
2008. Программное заявление. Молекулярные линейные зондовые анализы для быстрого скрининга пациентов с риском развития туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ). Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]34.
Всемирная организация здравоохранения
2010. Программное заявление. Некоммерческий посев и тест на лекарственную чувствительность для быстрого скрининга пациентов с риском МЛУ-ТБ.Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]
Краткий отчет о совещании группы экспертов по использованию жидких питательных сред. Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]33.
Всемирная организация здравоохранения
2008. Программное заявление. Молекулярные линейные зондовые анализы для быстрого скрининга пациентов с риском развития туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ). Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]34.
Всемирная организация здравоохранения
2010. Программное заявление. Некоммерческий посев и тест на лекарственную чувствительность для быстрого скрининга пациентов с риском МЛУ-ТБ.Всемирная организация здравоохранения, Женева, Швейцария [Google Scholar]Тестирование лекарственной чувствительности при туберкулезе: методы и надежность результатов
Abstract
Потребность в надежных тестах на лекарственную чувствительность (ТЛЧ) возрастает с расширением эпиднадзора за устойчивостью к противотуберкулезным препаратам и необходимостью соответствующего лечения туберкулеза с множественной лекарственной устойчивостью, заболеваемость которым постепенно увеличивается во многих частях мира. Однако достоверность результатов ТЛЧ, полученных широко используемыми методами, не соответствует приемлемым уровням, за исключением ТЛЧ к изониазиду и рифампицину.
Однако достоверность результатов ТЛЧ, полученных широко используемыми методами, не соответствует приемлемым уровням, за исключением ТЛЧ к изониазиду и рифампицину.
В целом, результаты восприимчивости в высокой степени предсказуемы, в то время как результаты резистентности имеют низкую прогностическую ценность, когда распространенность резистентности составляет <10%. Низкая надежность связана со слабой корреляцией с клиническим ответом и низкой воспроизводимостью из-за плохой стандартизации сложных и хрупких тестовых процедур. Таким образом, критерии устойчивости in vitro для тестирования чувствительности должны быть тщательно определены с репрезентативными клиническими образцами Mycobacterium tuberculosis , выделенными от пациентов, никогда не получавших противотуберкулезные препараты, и от пациентов, у которых лечение по схеме, содержащей тестируемый препарат, было неэффективным; Затем следует тщательно стандартизировать ТЛЧ для получения воспроизводимых результатов.
Критическая концентрация некоторых лекарств близка к минимальной ингибирующей концентрации для диких восприимчивых штаммов, и, таким образом, тестирование лекарственной чувствительности часто дает плохо воспроизводимые результаты. Эти вопросы требуют внимания врачей при использовании результатов тестирования на лекарственную чувствительность для ведения пациентов.
Во многих странах широкое использование стандартной краткосрочной схемы лечения привело к росту заболеваемости туберкулезом (ТБ) с множественной лекарственной устойчивостью (МЛУ), определяемым как устойчивость как минимум к изониазиду (INH) и рифампицину (RFP) 1– 3.Значительно высокие показатели МЛУ-ТБ наблюдались в некоторых частях мира не только среди ранее леченных больных ТБ из-за плохого ведения случаев, но и среди новых случаев из-за передачи инфекции в обществе. Ситуация превратилась в острую потребность в тестах на лекарственную чувствительность (ТЛЧ) для осуществления эпиднадзора за лекарственной устойчивостью (ДРС), а также для разработки эффективных схем адекватного лечения отдельных случаев. А.Торрес и Дж. Каминеро номер 4 в этой серии
А.Торрес и Дж. Каминеро номер 4 в этой серии
В результате неправильного и/или неадекватного лечения резистентность к лекарственным препаратам возникает путем селективного размножения резистентных мутантов в очагах поражения, несмотря на наличие ингибирующих рост концентраций препарата. Частота устойчивых к лекарственным средствам мутантов и уровни их устойчивости варьируют в зависимости от лекарственного средства и мутировавших генов и сайтов, фенотипические выражения которых включают следующее: изменения сайта связывания молекул-мишеней лекарственного средства; потеря ферментов, активирующих молекулы лекарств; изменение проницаемости препарата, в том числе эффлюкс; и производство ферментов, инактивирующих лекарственные средства, таких как β-лактамаза.Существует множество методов определения чувствительности Mycobacterium tuberculosis к противотуберкулезным препаратам, но ни один из них не является совершенным, а их результаты не удовлетворяют клиницистов для эффективного лечения больных туберкулезом.
Большинство используемых в настоящее время методов ТЛЧ страдают низкой предсказуемостью, связанной с клинической нерелевантностью результатов, и неприемлемо низкой надежностью, обусловленной плохой воспроизводимостью. В этом обзоре основное внимание уделяется общим характеристикам методов ТЛЧ, касающихся клинической значимости и воспроизводимости метода.
МЕТОДЫ ТЕСТИРОВАНИЯ НА ЛЕКАРСТВЕННУЮ ЧУВСТВИТЕЛЬНОСТЬ
Лекарственная чувствительность M.tuberculosis может быть определена либо путем наблюдения роста или ингибирования метаболизма в среде, содержащей противотуберкулезный препарат, либо путем обнаружения на молекулярном уровне мутаций в генах, связанных с действием препарата. С технической точки зрения чувствительность к лекарственным средствам определяется на основе ингибирования роста (или метаболизма), вызываемого лекарственным средством, посредством: 1) макроскопического наблюдения за ростом в средах, не содержащих и содержащих лекарство; 2) обнаружение или измерение метаболической активности или продуктов; 3) лизис микобактериофагом; и 4) обнаружение генетических мутаций с использованием молекулярных методов.
Традиционные методы культивирования с использованием сред на основе яиц или агара по-прежнему наиболее широко используются во многих странах 4, 5. Хотя долгое время обработки результатов ТЛЧ не нравится врачам для целей ведения пациентов, они подходят для ДРС. Стандартные методы с использованием среды Левенштейна-Йенсена включают метод пропорции, метод абсолютной концентрации и метод отношения резистентности, которые достаточно хорошо стандартизированы для клинических образцов, по крайней мере, для основных противотуберкулезных препаратов 4.Среди традиционных методов наиболее предпочтительным является метод пропорций, но метод абсолютной концентрации также широко используется из-за его технической простоты для приготовления инокулята и для чтения результатов.
Чтобы сократить время обработки и сделать его более удобным для ведения пациентов, появилось множество новых методов, направленных на как можно более раннее обнаружение задержки роста. Наиболее часто используются системы для определения производства CO 2 , такие как BACTEC 460 6 или MB/Bact 7, и потребления кислорода, такие как пробирка для индикатора роста микобактерий 8; есть и другие, находящиеся на стадии разработки, такие как окислительно-восстановительные индикаторы, такие как резазурин или бромид тетразолия 9, 10, и методы на основе фагов 11, 12. Иммуноанализ с подсчетом частиц 13 также может сократить время обработки за счет обнаружения низкого уровня размножения M. tuberculosis . Многие из этих новых методов трудно внедрить в странах, где они нужны больше всего, из-за высокой стоимости, технической сложности и отсутствия должным образом подготовленных людских ресурсов. Кроме того, им по-прежнему требуется клиническая оценка для подтверждения их заявленной эффективности в различных условиях. Прежде всего, ни один из этих методов не был хорошо откалиброван с репрезентативными клиническими образцами 90 141 M.tuberculosis для определения клинически значимых критериев резистентности (, т.е. точки отсечения).
Иммуноанализ с подсчетом частиц 13 также может сократить время обработки за счет обнаружения низкого уровня размножения M. tuberculosis . Многие из этих новых методов трудно внедрить в странах, где они нужны больше всего, из-за высокой стоимости, технической сложности и отсутствия должным образом подготовленных людских ресурсов. Кроме того, им по-прежнему требуется клиническая оценка для подтверждения их заявленной эффективности в различных условиях. Прежде всего, ни один из этих методов не был хорошо откалиброван с репрезентативными клиническими образцами 90 141 M.tuberculosis для определения клинически значимых критериев резистентности (, т.е. точки отсечения).
Имеются многочисленные сообщения о молекулярных методах обнаружения генных мутаций, связанных с устойчивостью, включая гибридизацию 14–20 амплифицированных генных сегментов или другие методы, основанные на ПЦР. Однако не все гены устойчивости к различным противотуберкулезным препаратам и места их мутации были обнаружены, за исключением мутаций гена rpoB, которые приводят к устойчивости к RFP. Эти молекулярные методы обычно требуют первичной амплификации, и поэтому, когда они используются на регулярной основе в течение длительного периода времени, они не свободны от ложных результатов из-за загрязнения ампликонов и/или хромосомной ДНК.
Эти молекулярные методы обычно требуют первичной амплификации, и поэтому, когда они используются на регулярной основе в течение длительного периода времени, они не свободны от ложных результатов из-за загрязнения ампликонов и/или хромосомной ДНК.
НАДЕЖНОСТЬ РЕЗУЛЬТАТОВ РЕЗУЛЬТАТОВ НА ЛЕКАРСТВЕННУЮ ЧУВСТВИТЕЛЬНОСТЬ
Всемирная организация здравоохранения и Международный союз по борьбе с туберкулезом и болезнями легких учредили Наднациональную сеть референс-лабораторий по ТБ, с помощью которой они намереваются обеспечить квалификационное тестирование ТЛЧ в странах, внедряющих DRS 1–3.Результаты проверки квалификации по результатам девяти циклов, проведенных в 1994–2002 гг., показали, что средняя чувствительность для выявления устойчивости к изониазиду, РФП, стрептомицину (СМ) и этамбутолу (ЭМБ) составила 98,7%, 97,2%, 90,8% и 89,3% соответственно 3. Соответствующая чувствительность для выявления чувствительности к INH, RFP, SM и EMB составила 98,5%, 96,8%, 93,9% и 94,0% соответственно. 3. Прогностические значения результатов чувствительности ТЛЧ, рассчитанные на основе вышеупомянутых цифр , были высокими для всех четырех препаратов (>93%), даже при распространенности 40%, в то время как прогностические значения результатов ТЛЧ устойчивости сильно различались между четырьмя основными препаратами (рис. 1⇓ и 2⇓).При распространенности резистентности ниже 10% прогностические значения для EMB и SM были значительно ниже, чем для INH и RFP. Прогностическая ценность резистентности при медианной распространенности резистентности к конкретным препаратам среди больных туберкулезом легких, как было опубликовано ранее 3, составила 80,6% для изониазида при медиане распространенности резистентности 5,9%, 30,4% для РФП при 1,4%, 50,0 % для SM при 6,3% и 10,4% для EMB при 0,8%. Среди ранее леченных случаев прогностические значения были, конечно, выше из-за более высокой медианы распространенности резистентности, а именно: 91.6% для INH при медиане распространенности 14,4%; 74,6% для ЗП на уровне 8,4%; 65,8% для СМ при 11,4%; и 34,8% для EMB при 3,5%.
3. Прогностические значения результатов чувствительности ТЛЧ, рассчитанные на основе вышеупомянутых цифр , были высокими для всех четырех препаратов (>93%), даже при распространенности 40%, в то время как прогностические значения результатов ТЛЧ устойчивости сильно различались между четырьмя основными препаратами (рис. 1⇓ и 2⇓).При распространенности резистентности ниже 10% прогностические значения для EMB и SM были значительно ниже, чем для INH и RFP. Прогностическая ценность резистентности при медианной распространенности резистентности к конкретным препаратам среди больных туберкулезом легких, как было опубликовано ранее 3, составила 80,6% для изониазида при медиане распространенности резистентности 5,9%, 30,4% для РФП при 1,4%, 50,0 % для SM при 6,3% и 10,4% для EMB при 0,8%. Среди ранее леченных случаев прогностические значения были, конечно, выше из-за более высокой медианы распространенности резистентности, а именно: 91.6% для INH при медиане распространенности 14,4%; 74,6% для ЗП на уровне 8,4%; 65,8% для СМ при 11,4%; и 34,8% для EMB при 3,5%.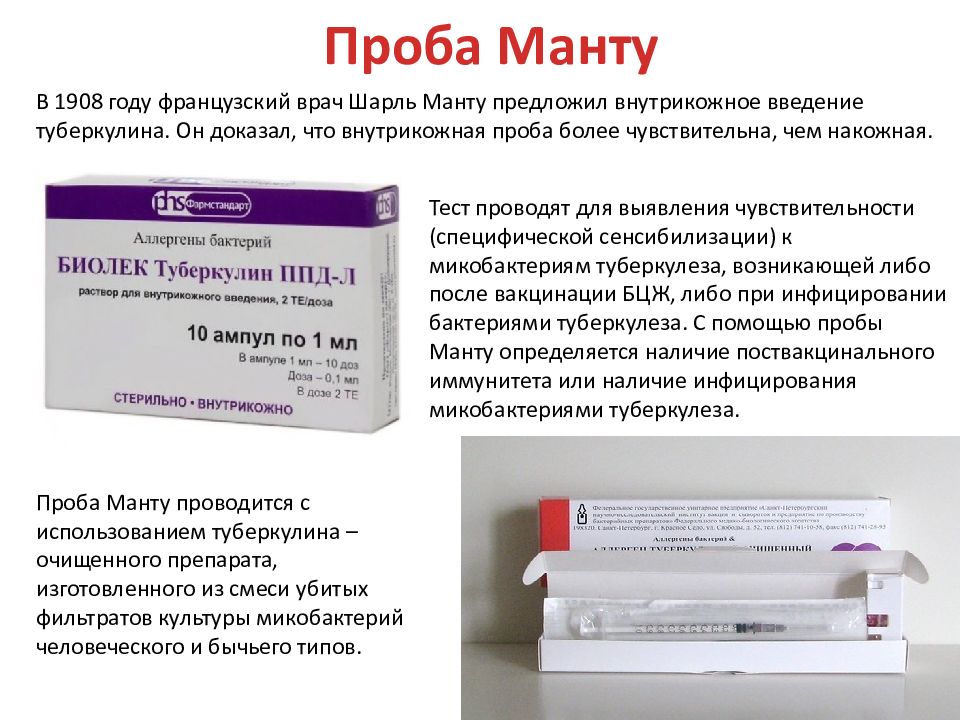 Понятно, что результаты резистентности для ЭМБ и СМ менее надежны, чем для изониазида и РФП. Аналогичные результаты были получены с помощью систем быстрого обнаружения роста 8.
Понятно, что результаты резистентности для ЭМБ и СМ менее надежны, чем для изониазида и РФП. Аналогичные результаты были получены с помощью систем быстрого обнаружения роста 8.
Прогностические значения результатов тестирования чувствительности к изониазиду (INH) и стрептомицину (SM). ○: чувствительность к INH; •: устойчивость к изониазиду; ⋄: восприимчивость к СМ; ♦: сопротивление СМ. Данные взяты с 3.
Рис.2—Прогностические значения результатов тестирования чувствительности к рифампицину (RFP) и этамбутолу (EMB). □: восприимчивость к RFP; ▪: устойчивость к RFP; ▵: восприимчивость к ЭМБ; ▴: сопротивление EMB. Данные взяты с 3.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕЗУЛЬТАТЫ ТЕСТА НА ЧУВСТВИТЕЛЬНОСТЬ К ЛЕКАРСТВЕННЫМ СРЕДСТВАМ
Методы ТЛЧ и интерпретация их результатов сильно различаются; однако следует отметить, что для получения клинически значимых и надежных результатов для ведения больных вероятность неправильной классификации клинически чувствительных или клинически устойчивых штаммов должна быть минимальной или отсутствовать. Стремясь выполнить это требование, было предложено зафиксировать критерии на уровне минимальной ингибирующей концентрации (МИК) и 1% критической резистентности штаммов M.tuberculosis , выделенных от никогда не получавших лечения пациентов 4, 21. Однако первичные резистентность к лекарствам, включая естественную резистентность, будет мешать этому подходу. Другим методом могло бы быть сравнение клинических ответов штаммов, несущих все возможные уровни устойчивости, чтобы найти клинически значимый критический уровень устойчивости.Такой подход может показаться идеальным, но он нереалистичен. По этой причине рекомендуется определить критерии in vitro , которые можно использовать для прогнозирования клинической резистентности и чувствительности с приемлемой точностью путем тестирования четко определенных и репрезентативных клинических штаммов M. tuberculosis 4, 22, выделенных от пациентов. лечение в хорошо контролируемых и должным образом зарегистрированных клинических условиях.
Стремясь выполнить это требование, было предложено зафиксировать критерии на уровне минимальной ингибирующей концентрации (МИК) и 1% критической резистентности штаммов M.tuberculosis , выделенных от никогда не получавших лечения пациентов 4, 21. Однако первичные резистентность к лекарствам, включая естественную резистентность, будет мешать этому подходу. Другим методом могло бы быть сравнение клинических ответов штаммов, несущих все возможные уровни устойчивости, чтобы найти клинически значимый критический уровень устойчивости.Такой подход может показаться идеальным, но он нереалистичен. По этой причине рекомендуется определить критерии in vitro , которые можно использовать для прогнозирования клинической резистентности и чувствительности с приемлемой точностью путем тестирования четко определенных и репрезентативных клинических штаммов M. tuberculosis 4, 22, выделенных от пациентов. лечение в хорошо контролируемых и должным образом зарегистрированных клинических условиях. Оцениваемый метод ТЛЧ должен быть откалиброван путем сравнения МИК вероятно чувствительных (PS) штаммов, полученных от пациентов, никогда не получавших лечения, с МИК вероятно устойчивых (PR) штаммов, полученных от пациентов, у которых явно была неэффективность лечения схемами, содержащими соответствующий препарат.Разница в кумулятивном проценте чувствительности между клиническими изолятами PS и PR (в различных концентрациях) была больше при 0,2 мкг·мл -1 с INH и при 40,0 мкг·мл -1 с RFP 23; значения мощности дискриминации составили 75,8% и 85,8% соответственно (рис. 3⇓ и 4⇓). При тех же концентрациях критическая устойчивая пропорция 1% могла наиболее разумно различать PS и PR для обоих препаратов, демонстрируя способность различения 77,1% для INH и 85,6% для RFP 23. Mitchison 24 обнаружил, что устойчивые к SM штаммы отличались от восприимчивых. штаммы при 16 мкг·мл -1 с разницей 52.4%. Леффорд и Митчисон 22 сообщили, что резистентность к этионамиду (ЭТН) различалась при 40,0 мкг·мл -1 с разницей в 46,7%.
Оцениваемый метод ТЛЧ должен быть откалиброван путем сравнения МИК вероятно чувствительных (PS) штаммов, полученных от пациентов, никогда не получавших лечения, с МИК вероятно устойчивых (PR) штаммов, полученных от пациентов, у которых явно была неэффективность лечения схемами, содержащими соответствующий препарат.Разница в кумулятивном проценте чувствительности между клиническими изолятами PS и PR (в различных концентрациях) была больше при 0,2 мкг·мл -1 с INH и при 40,0 мкг·мл -1 с RFP 23; значения мощности дискриминации составили 75,8% и 85,8% соответственно (рис. 3⇓ и 4⇓). При тех же концентрациях критическая устойчивая пропорция 1% могла наиболее разумно различать PS и PR для обоих препаратов, демонстрируя способность различения 77,1% для INH и 85,6% для RFP 23. Mitchison 24 обнаружил, что устойчивые к SM штаммы отличались от восприимчивых. штаммы при 16 мкг·мл -1 с разницей 52.4%. Леффорд и Митчисон 22 сообщили, что резистентность к этионамиду (ЭТН) различалась при 40,0 мкг·мл -1 с разницей в 46,7%. Также интересно отметить, что наиболее разумные критерии устойчивости могут различаться в разных лабораториях, даже если они применяют один и тот же метод. Штаммы EMB PR были отличены от штаммов PS при 2 мкг·мл -1 в лаборатории Корейского института туберкулеза, Сеул, Южная Корея, в то время как они лучше отличались при 4 мкг·мл -1 в лаборатории Королевской медицинской школы последипломного образования, Лондон, Великобритания, используя ту же среду и метод и тестируя те же штаммы PR (личное сообщение, D.A. Mitchison, Отдел лабораторных исследований туберкулеза Совета медицинских исследований, Королевская медицинская школа последипломного образования, больница Хаммерсмит, Лондон, Великобритания; инжир. 5⇓). Эти данные, по-видимому, указывают на то, что различия в критической концентрации могли быть результатом различных уровней восприимчивости штаммов PS и различий в тестовой среде. Уровни устойчивости штаммов PR сильно различаются, за исключением RFP; поэтому невозможно определить приемлемую точку отсечки без тщательной калибровки чувствительности штаммов PS.
Также интересно отметить, что наиболее разумные критерии устойчивости могут различаться в разных лабораториях, даже если они применяют один и тот же метод. Штаммы EMB PR были отличены от штаммов PS при 2 мкг·мл -1 в лаборатории Корейского института туберкулеза, Сеул, Южная Корея, в то время как они лучше отличались при 4 мкг·мл -1 в лаборатории Королевской медицинской школы последипломного образования, Лондон, Великобритания, используя ту же среду и метод и тестируя те же штаммы PR (личное сообщение, D.A. Mitchison, Отдел лабораторных исследований туберкулеза Совета медицинских исследований, Королевская медицинская школа последипломного образования, больница Хаммерсмит, Лондон, Великобритания; инжир. 5⇓). Эти данные, по-видимому, указывают на то, что различия в критической концентрации могли быть результатом различных уровней восприимчивости штаммов PS и различий в тестовой среде. Уровни устойчивости штаммов PR сильно различаются, за исключением RFP; поэтому невозможно определить приемлемую точку отсечки без тщательной калибровки чувствительности штаммов PS. Эти исследования ясно показывают, что различие между штаммами PR и PS более надежно для INH и RFP, чем для других препаратов. Также ясно, что разработка метода ТЛЧ, способного на 100 % различать штаммы PR и PS, на самом деле неосуществима из-за технических вариаций, возникающих из-за физико-химически лабильной среды теста.
Эти исследования ясно показывают, что различие между штаммами PR и PS более надежно для INH и RFP, чем для других препаратов. Также ясно, что разработка метода ТЛЧ, способного на 100 % различать штаммы PR и PS, на самом деле неосуществима из-за технических вариаций, возникающих из-за физико-химически лабильной среды теста.
Определение а) критической концентрации и б) критической доли устойчивости к изониазиду (INH) с использованием вероятно чувствительных (——; n = 99) и вероятно устойчивых штаммов (сплошная линия; n = 117) ).МИК: минимальная ингибирующая концентрация. # : 13,1% как стойкий; ¶ : 75,8%; + : 11,1% как чувствительные; § : 77,1%. Данные взяты из 23.
Рис. 4—Определение а) критической концентрации и б) критической доли резистентности к рифампицину (RFP) с использованием вероятно чувствительных (——; n = 99) и вероятно резистентных штаммов (твердые линия; n = 108). МИК: минимальная ингибирующая концентрация. # : 85,8%; ¶ : 85,6%. Данные взяты с 23.
Рис. 5—Сравнение критических концентраций этамбутола, наблюдаемых в лабораториях а) Корейского института туберкулеза, Сеул, Южная Корея (вероятно чувствительные корейские штаммы: ——, n = 104; вероятно устойчивые британские штаммы ( BPR): сплошная линия, n = 124) и b) Королевская медицинская школа последипломного образования, Лондон, Великобритания (вероятно восприимчивые гонконгские штаммы: ·····, n = 333; BPR: n = 106), применяя те же метод. МИК: минимальная ингибирующая концентрация. # : 41.9%; ¶ : 38,8%. Данные получены из личного общения с Д.А. Mitchison (Отдел лабораторных исследований туберкулеза Совета медицинских исследований, Королевская медицинская школа последипломного образования, больница Хаммерсмит, Лондон, Великобритания).
Недавнее исследование текущей практики ТЛЧ к препаратам второго ряда в 10 наднациональных референс-лабораториях выявило важные различия в отношении критических концентраций препаратов и критических долей резистентности 25, подчеркнув необходимость стандартизации методов и критериев с целью оптимизации клинической значимости результатов ТЛЧ.
Развитие лекарственной устойчивости путем селективного размножения резистентных мутантов, существующих в популяции диких бацилл, определяется начальным размером активно размножающихся организмов в очагах поражения, временем воздействия препарата и концентрацией препарата 4, 24, 26, 27. Абсорбция, диффузия в очаги поражения и поддерживающий уровень лекарственного средства являются важными факторами возникновения лекарственной устойчивости. INH и RFP, результаты тестирования чувствительности которых достаточно надежны, показывают пиковую концентрацию в сыворотке более чем в 100 раз выше, чем MIC, и, безусловно, возможно поддерживать их на достаточно высоком уровне в поражениях на протяжении всего лечения, если только пациент не прерывает лечение. прием наркотиков (рис.6⇓) 27, 28. И наоборот, пиковые уровни в сыворотке циклосерина, EMB, ципрофлоксацина, офлоксацина и ETH ближе к MIC (рис. 6⇓). Как следствие, у некоторых пациентов период ингибирующей концентрации лекарственного средства в очагах поражения может быть коротким и/или уровень лекарственного средства может оставаться субингибирующим в течение большей части времени. В целом результаты ТЛЧ к последним препаратам малонадежны.
Рис. 6—Приблизительное отношение среднего пика в сыворотке к минимальной ингибирующей концентрации (МПК) противотуберкулезных препаратов.Данные представлены как средние (высокие/низкие). ▪: ципрофлоксацин; □: офлоксацин; •: этионамид; о: этамбутол; ♦: изониазид; ⋄: циклосерин; ▴: рифампицин; ▵: стрептомицин; ▾: парааминосалициловая кислота; ▿: капреомицин; : канамицин. Данные взяты с 27, 28.
Многие из недавно разработанных методов ТЛЧ не были тщательно откалиброваны для определения in vitro критериев резистентности с соответствующими клиническими образцами, репрезентативными для клинического исхода пациента в текущих клинических условиях; вместо этого эти критерии часто выбирались произвольно с использованием лабораторных штаммов.Если не будет проведена тщательная калибровка, клиническая значимость результатов ТЛЧ остается неопределенной.
На воспроизводимость результатов in vitro ТЛЧ в значительной степени влияет физико-химическая среда теста 4, 28, что требует соответствующей стандартизации и контроля процедуры теста. Плохая воспроизводимость обычно связана с процедурной сложностью; таким образом, его можно улучшить за счет процедурного упрощения.
Надлежащая стандартизация подготовки инокулята является важной предпосылкой для получения надежных результатов ТЛЧ, поскольку количество (размер), дисперсия и жизнеспособность микроорганизмов в инокуляте оказывают значительное влияние на результаты ТЛЧ.Частые субкультуры могут искажать уровни чувствительности к лекарственным препаратам и структуру штаммов по сравнению с таковыми из первичных культур. Питательные среды должны обеспечивать адекватный рост всех инокулированных организмов; однако, когда они содержат некоторые антагонистические соединения или химические вещества, препятствующие действию лекарства, результаты будут ненадежными, если только эти вещества не будут удалены или сведены к минимуму. Различия в концентрации лекарственного средства, включенного в среду, возникают из-за связывания с белком, тепловой инактивации, потери различных количеств лекарственного средства во время стерилизации фильтром, неполного растворения из-за использования неподходящих растворителей, неточного расчета эффективности и неточного разбавления.pH среды, температура инкубации и время инкубации также являются важными факторами, влияющими на результаты ТЛЧ. Тщательная стандартизация и контроль этих физико-химических факторов тестовой среды необходимы для достижения приемлемой воспроизводимости результатов ТЛЧ.
ЗАКЛЮЧЕНИЕ
Тестирование на лекарственную чувствительность до сих пор широко используется в качестве инструмента для выбора эффективных схем для успешного лечения больных туберкулезом (особенно туберкулезом с множественной лекарственной устойчивостью), а также для оценки эффективности программ и разработки стратегий решения проблемы лекарств. -резистентный туберкулез.Однако, чтобы получить надежные результаты, оцениваемый для рутинного использования метод определения лекарственной чувствительности должен быть тщательно откалиброван с репрезентативными клиническими изолятами штаммов Mycobacterium tuberculosis , чтобы определить критерии теста in vitro , которые можно использовать для прогнозирования , в лучшем случае, клинический исход пациента. Процедура испытаний затем должна быть стандартизирована с максимальным упрощением, чтобы получить результаты с приемлемой воспроизводимостью в отношении этих критериев.
Сноски
Предыдущие статьи из этой серии: № 1: Кардона П.-Дж., Руис-Мансано Дж. О природе Mycobacterium tuberculosis -латентных бацилл. Eur Respir J 2004; 24: 1044–1051. № 2: Rieder H. Годовой риск инфицирования Mycobacterium tuberculosis . Eur Respir J 2005; 25: 181–185. № 3: Митчисон Д.А. Лекарственная устойчивость при туберкулезе. Eur Respir J 2005; 25: 376–379.
- Получено 25 сентября 2004 г.
- Принято 6 октября 2004 г.
Ссылки
- ↵
Всемирная организация здравоохранения. Устойчивость к противотуберкулезным препаратам в мире. Глобальный проект ВОЗ/IUATLD по эпиднадзору за устойчивостью к противотуберкулезным препаратам (WHO/TB/97.229). Женева, документ Всемирной организации здравоохранения, 1997 г.
Всемирная организация здравоохранения. Устойчивость к противотуберкулезным препаратам в мире.Отчет № 2: распространенность и тенденции. Глобальный проект ВОЗ/IUATLD по надзору за устойчивостью к противотуберкулезным препаратам (WHO/CDC/TB/2000.278). Женева, документ Всемирной организации здравоохранения, 2000 г.
- ↵
Всемирная организация здравоохранения. Устойчивость к противотуберкулезным препаратам в мире. Третий глобальный отчет. Глобальный проект ВОЗ/IUATLD по надзору за устойчивостью к противотуберкулезным препаратам (WHO/CDC/TB/2004). Женева, документ Всемирной организации здравоохранения, 2004 г. (в печати)
- ↵
Канетти Г., Фокс В., Хоменко А., и др. Достижения в методах тестирования чувствительности микобактерий к лекарствам и использование тестов на чувствительность в программах борьбы с туберкулезом. Bull World Health Organ 1969; 41:21–43.
- ↵
Кент ТК, Кубица ГП. Микобактериология общественного здравоохранения. Руководство для лаборатории уровня III. Атланта, Центр контроля заболеваний, 1985 г.
- ↵
Хокинс Дж. Э., Уоллес Р. Дж. Мл., Браун Б. А. Тесты на чувствительность к антибактериальным препаратам: микобактерии. В : Балоуз А., Хауслер В.Дж., Херрманн К.Л., Изенберг Х.Д., Шадомми Х.Дж., ред. Руководство по клинической микробиологии. 5-е изд. Вашингтон, округ Колумбия, Американское общество микробиологии, 1991 г.; стр. 1138–1152
- ↵
Диас-Инфантес М.С., Руис-Серрано М.Дж., Мартинес-Санчес Л., и др. Оценка системы обнаружения микобактерий MB/BacT для определения чувствительности Mycobacterium tuberculosis . J Clin Microbiol 2000; 38:1988–1989.
- ↵
Бемер П., Паликова Ф.Р., Руш-Гердес С., Другеон Х.Б., Пфиффер Г.Э.Многоцентровая оценка полностью автоматизированной системы BACTEC Mycobacteria Growth Indicator Tube 960 для тестирования чувствительности Mycobacterium tuberculosis . J Clin Microbiol 2002;40:150–154.
- ↵
Palomino JC, Martin A, Camacho M, Guerra H, Swings J, Portaels F. Планшет для микротитрования резазурина: простой и недорогой метод определения лекарственной устойчивости у Mycobacterium tuberculosis . Противомикробные агенты Chemotherap 2002;46:2720–2722.
- ↵
Abate G, Mshana RN, Miörner H. Оценка колориметрического анализа на основе бромида 3-(4,5-диметил-2-ил)-2,5-дифенилтетразолия для быстрого выявления устойчивости к рифампицину у Mycobacterium tuberculosis . Int J Tuberc Lung Dis 1998; 2:1011–1016.
- ↵
Риска П.Ф., Су Ю., Бардаров С., и др. Экспресс-пленочное определение чувствительности к антибиотикам штаммов Mycobacterium tuberculosis с использованием репортерного фага люциферазы и Bronx box.Дж. Клин Миробиол 1999; 37:1144–1149.
- ↵
Гали Н., Домингес Х., Бланко С., и др. Использование собственного анализа на основе микобактериофагов для быстрого выявления устойчивости к рифампицину в клинических изолятах Mycobacterium tuberculosis . J Clin Microbiol 2003;41:2647–2649.
- ↵
Дроварт А., Камбиазо С.Л., Хьюген К., и др. Обнаружение устойчивости к рифампицину и изониазиду штаммов Mycobacterium tuberculosis с помощью иммуноанализа с подсчетом частиц.Int J Tuberc Lung Dis 1997; 1: 284–288.
- ↵
Лебрун Л., Гёнюллю Н., Бутрос Н., и др. Использование анализа INNO-LIPA для быстрой идентификации микобактерий. Diagn Microbiol Infect Dis 2003;46:151–153.
El-Haji HH, Marras SAE, Tyagi S, Kramer FR, Alland D. Обнаружение устойчивости к рифампицину у Mycobacterium tuberculosis в одной пробирке с молекулярными маяками.J Clin Microbiol 2001;39:4131–4137.
Ким Б.Дж., Ли К.Х., Парк Б.Н., и др. Обнаружение устойчивых к рифампицину Mycobacterium tuberculosis в мокроте с помощью вложенной ПЦР-связанной конформации одноцепочечного полиморфизма и секвенирования ДНК. J Clin Microbiol 2001;39:2610–2617.
Лин Ю.П., Бер М.А., Смолл П.М., Курн Н. Генотипическое определение устойчивости к антибиотикам Mycobacterium tuberculosis с использованием нового метода обнаружения мутаций, ингибирования миграции ветвей M.Туберкулез тест на устойчивость к антибиотикам. J Clin Microbiol 2000;38:3656–3662.
Мокроусов И., Оттен Т., Филипенко М., и др. Обнаружение штаммов Mycobacterium tuberculosis , устойчивых к изониазиду, с помощью мультиплексного аллель-специфического ПЦР-тестирования вариации кодона 315 kat G. J Clin Microbiol 2002;40:2509–2512.
Торрес М.Дж., Криадо А., Паломарес Х.К., Аснар Х.Использование ПЦР в реальном времени и флуориметрии для быстрого выявления мутаций, связанных с устойчивостью к рифампину и изониазиду, у Mycobacterium tuberculosis . J Clin Microbiol 2000;38:3194–3199.
- ↵
Van Der Zanden AG, Te Koppele-Vize EM, Vijaya Bhanu N, Van Soolingen D, Schouls LM. Использование экстрактов ДНК из окрашенных по Цилю-Нильсену слайдов для молекулярного обнаружения устойчивости к рифампину и сполиготипирования Mycobacterium tuberculosis .J Clin Microbiol 2003;41:1101–1108.
- ↵
Pfyffer GE, Bonato DA, Ebrahimzadeh A, et al. Многоцентровая лабораторная валидация тестирования чувствительности Mycobacterium tuberculosis к классическим противомикробным препаратам второго ряда и более новым с использованием радиометрического метода BACTEC 460 и пропорционального метода с твердыми средами. J Clin Microbiol 1999;37:3179–3186.
- ↵
Леффорд М.Дж., Митчисон Д.А.Сравнение методов определения чувствительности Mycobacterium tuberculosis к этионамиду. Туберкул 1966; 47: 250–262.
- ↵
Корейский институт туберкулеза, Корейская национальная противотуберкулезная ассоциация. Определение лекарственной чувствительности микобактерий методом пропорции. Отчет об исследовании, 1994 г.
- ↵
Митчисон Д.А. Что такое лекарственная устойчивость? Туберкул 1969; 50: 44–47.
- ↵
Kim SJ, Espinal MA, Abe C, и др. Надежны ли тесты на чувствительность к противотуберкулезным препаратам второго ряда? Int J Tuberc Lung Dis 2004; 8: 1157–1158.
- ↵
Канетти Г. Лекция Дж. Бернса Амберсона: представить аспекты бактериальной резистентности при туберкулезе. Am Rev Respir Dis 1966; 92: 687–703.
- ↵
Иваински Х. Механизм действия, биотрансформация и фармакокинетика противотуберкулезных препаратов у животных и человека. В : Бартманн К., изд.Противотуберкулезные препараты. Нью-Йорк, Springer-Verlag, 1988; стр. 399–553
- ↵
Хейфец ЛБ. Лекарственная чувствительность при химиотерапии микобактериальных инфекций. Бока-Ратон, CRC Press, 1991
Цветовой тест на МЛУ/ШЛУ-ТБ для определения лекарственной чувствительности Mycobacterium tuberculosis, Северо-Западная Эфиопия
https://doi.org/10.1016/j.ijid.2019.10.041Get rights and contentHighlights
- • 4 Цветовой тест на МЛУ/ШЛУ-ТБ был быстрым и простым и использовался для тестирования лекарственной чувствительности.
- •
Цветовой тест обладал высокой чувствительностью и специфичностью для выявления устойчивости к рифампицину, туберкулеза с множественной лекарственной устойчивостью и устойчивости к ципрофлоксацину.
- •
Цветовой тест имел низкую чувствительность и высокую специфичность для выявления устойчивости к изониазиду.
Резюме
Справочная информация
Для Mycobacterium tuberculosis тестирования лекарственной чувствительности (ТЛЧ) в условиях ограниченных ресурсов необходимы соответствующие технологические тесты.Это исследование было проведено для оценки цветного теста на МЛУ/ШЛУ-ТБ (цветной тест на тонкослойном агаре; TB-CX) для M. tuberculosis ТЛЧ путем непосредственного тестирования мокроты в больнице Университета Гондэра.
Методы
Каждый образец мокроты был разделен на две аликвоты. Одну аликвоту смешивали с дезинфицирующим средством и наносили непосредственно на чашку Петри квадранта TB-CX, содержащую культуральную среду с изониазидом, рифампицином или ципрофлоксацином и без них. Параллельно другую аликвоту обеззараживали гидроксидом натрия, центрифугировали и культивировали на среде Левенштейна-Йенсена; сохраненный М.Затем изоляты tuberculosis субкультивировали в пробирке BACTEC Mycobacteria Growth Indicator Tube (MGIT) 960 для эталонного ТЛЧ.
Результаты
Тест TB-CX дал результаты ТЛЧ для 94% (123/131) положительных образцов. Для парных результатов ТЛЧ среднее количество дней от обработки мокроты до ТЛЧ составило 12 дней для TB-CX по сравнению с 35 для LJ-MGIT ( p < 0,001). По сравнению с LJ-MGIT для изониазида, рифампицина и туберкулеза с множественной лекарственной устойчивостью, TB-CX имел чувствительность 59%, 96% и 95%; 96%, 94% и 98% специфичность; и 85%, 94% и 98% согласия соответственно.Все результаты ТЛЧ ципрофлоксацина были чувствительны к обоим методам.
Заключение
Тест TB-CX был простым и быстрым для M. tuberculosis ТЛЧ. Несоответствие результатов ТЛЧ могло быть результатом неоптимального хранения и различных концентраций изониазида, использованных в тесте TB-CX, по сравнению с эталонным стандартным тестом.
Ключевые слова
Цветовой тест на МЛУ/ШЛУ-ТБ
Тест на чувствительность к лекарствам
Лекарственно-устойчивый
Тонкослойный агар
Туберкулез
Рекомендованные статьиСсылки на статьи (0) 900sОпубликовано Elsevier Ltd от имени Международного общества инфекционных заболеваний.
Рекомендуемые статьи
Ссылки на статьи
Frontiers | Клиническая валидация системы QMAC-DST для тестирования лекарственной чувствительности Mycobacterium tuberculosis к препаратам первого и второго ряда
Введение
Туберкулез является серьезной глобальной проблемой здравоохранения, и появление Mycobacterium tuberculosis (МЛУ-ТБ) с множественной лекарственной устойчивостью и широкой лекарственной устойчивости M.туберкулез ТБ (ШЛУ-ТБ) представляет угрозу для усилий общественного здравоохранения по борьбе с туберкулезом. Поэтому Центры по контролю и профилактике заболеваний [CDC] (2006 г.) и Всемирная организация здравоохранения [ВОЗ] (2015 г.) рекомендуют проводить экспресс-тестирование на лекарственную чувствительность (ТЛЧ) для выявления МЛУ-ТБ и ШЛУ-ТБ. В настоящее время молекулярные методы обнаружения лекарственно-устойчивых MTB широко доступны в клинических лабораториях благодаря быстрой и надежной работе. Однако они лишь дополняют фенотипическое ТЛЧ, поскольку оно ограничено выявлением устойчивости к нескольким первичным препаратам, молекулярные механизмы которых хорошо известны (Boehme et al., 2010, 2011; Ханрахан и др., 2012). Всемирная организация здравоохранения [ВОЗ] одобрила два надежных фенотипических метода ТЛЧ, основанных на агаровой среде Ловенштейна-Йенсена (LJ-DST) или жидкой среде, такой как BACTEC MGIT 960 (BD Biosciences, Сан-Хосе, Калифорния, США). 2015) (Rodrigues et al., 2008; Boehme et al., 2010, 2011; Hanrahan et al., 2012). LJ-DST является золотым стандартом для большинства противотуберкулезных препаратов, но среднее время выполнения составляет 4 недели. Метод ТЛЧ на основе MGIT (MGIT-DST) обеспечивает 7-дневный оборот, что намного быстрее, чем LJ-DST (Kim, 2005), но он трудоемок и стандартизирован только для стрептомицина, изониазида, рифампина и этамбутол (SIRE).QMAC-DST (QuantaMatrix, Сеул, Корея) был разработан на основе технологии микрофлюидных чипов для мониторинга микроскопического роста колоний MTB (Choi et al., 2016). Он обладает высокой гибкостью в отношении типов и концентраций испытуемых препаратов, отсутствием эффектов инокулята в широком диапазоне 10 3 –10 8 клеток/мл, отличной воспроизводимостью при использовании лиофилизированных препаратов и коротким временем обработки в течение 7 дней ( Юнг и др., 2018). Для коммерциализации панель QMAC-DST адаптировала критические концентрации (КК) с автоматическим считыванием путем количественного определения микроскопического роста, в отличие от исходной конструкции (Jung et al., 2018; Таблица 1). Цель этого исследования состояла в том, чтобы сравнить эффективность системы QMAC-DST с двумя одобренными ВОЗ методами ТЛЧ, LJ-DST и MGIT-DST.
Таблица 1. Сравнение трех тестов на лекарственную чувствительность с использованием среды Левенштейна-Йенсена, QMAC-DST и BACTEC MGIT 960.
Материалы и методы
Бактериальные изоляты
клинических изолята MTB последовательно собирали в Медицинском центре Асан в течение 12 месяцев с января по декабрь 2015 г. и хранили при температуре 4 ± 2°C до дальнейшего тестирования.Все изоляты, использованные в этом исследовании, были идентифицированы как MTB с помощью ПЦР в реальном времени AdvanSure TM TB/NTM (LG Chem, Сеул, Корея) и были представлены для эталонного ТЛЧ, который был проанализирован Корейским институтом туберкулеза (Osong , Корея). Для исследования было собрано до 200 изолятов с обогащением лекарственно-устойчивыми изолятами. Были включены все лекарственно-устойчивые изоляты, а оставшиеся изоляты культивировались с чувствительными изолятами. Исследуемые изоляты пересевают на среду L-J для подтверждения жизнеспособности и чистоты для данного исследования.Это исследование было одобрено Институциональным наблюдательным советом Медицинского центра Асан (2015-1346). Кроме того, письменное согласие было отменено для пациента, от которого был получен изолят, в соответствии с рекомендациями протокола валидации метода испытаний in vitro с анонимностью.
QMAC-DST
Всего 178 клинических изолятов M.tuberculosis были подвергнуты QMAC-ТЛЧ к 13 противомикробным препаратам. Эталонный изолят, h47Rv (ATCC 27294), включали в каждый цикл испытаний в качестве контроля.Фосфатно-солевой буфер (PBS, pH 6,8) использовали для суспендирования клеток из колоний, выращенных на среде L-J, для приготовления мутной суспензии. Раствор агарозы (900 мкл, 0,5%; агароза Seakem ® LE, Lonza, Rockland, ME, США) готовили путем нагревания в микроволновой печи и помещали в термоблок при 37°C. Суспензию клеток смешивали с раствором агарозы в объемном соотношении 1:3 после охлаждения в течение 3 мин (рис. 1; Jung et al., 2018).
Рис. 1. Система QMAC-DST для автоматизированной покадровой визуализации CAT-микросхем с использованием анализа программного обеспечения для обработки изображений. (A) Схематическое изображение CAT-чипа с 24 интегрированными реакционными цепями, который состоит из перекрестного канала для заполнения клеток Mycobacterium tuberculosis , встроенных в агарозу, и лунки, содержащей каждый лиофилизированный противотуберкулезный препарат. (B) После добавления бульона 7H9, содержащего 10 % OADC, 0,5 % агарозная заглушка, заполняющая поперечный канал, позволяла растворенному лекарственному средству немедленно достигать целевой концентрации и контактировать с внедренными клетками Mycobacterium tuberculosis внутри контура. . (C) Для каждого контура были взяты два поля для покадровых изображений в фиксированных положениях вблизи центра левого плеча поперечного канала в 1, 2, 5 и 7 дни инкубации. Кумулятивный рост колоний на каждом поле измеряли для определения устойчивых (рост клеток) или восприимчивых (отсутствие роста) клеток в контуре с использованием программного обеспечения для анализа изображений.
Все 13 протестированных противомикробных препаратов, включая изониазид, рифампицин, стрептомицин, этамбутол, амикацин, капреомицин, этионамид, канамицин, левофлоксацин, моксифлоксацин, офлоксацин, пара -аминосалициловая кислота (ПАСК) и рифабутин, были приобретены у Sigma-Aldrich (St. .Луис, Миссури, США). Жидкая культуральная среда представляла собой бульон Миддлбрука 7H9 (BBL, BD Biosciences, Балтимор, Мэриленд, США) с добавлением 10% олеиновой кислоты, альбумина, декстрозы и каталазы (BD Biosciences). Чип Cross Agarose channel for Tuberculosis (CAT) состоял из CCs каждого препарата. КК были основаны на бульоне Миддлбрука 7H9, который был настроен для системы MGIT 960 (Всемирная организация здравоохранения [ВОЗ], 2009 г.), за исключением стрептомицина, амикацина и ПАСК, которые были скорректированы в соответствии с предыдущим исследованием (Jung et al. ., 2018). КК составляли 0,1, 1,0, 2,0, 5,0, 2,0, 2,5, 2,5, 1,5, 0,5, 2,0, 0,5, 4,0 и 5,0 мкг/мл для изониазида, рифампина, стрептомицина, этамбутола, амикацина, капреомицина, канамицина, левофлоксацина, моксифлоксацина. , офлоксацин, пара -аминосалициловая кислота (ПАСК), рифабутин и этионамид соответственно (Woodley, 1986; Kam et al., 2010; Jung et al., 2018). Суспензию клеток MTB инокулировали, как описано ранее (Jung et al., 2018). CAT-чип инкубировали при 37°C, и через 1, 2, 5 и 7 дней инкубации с помощью QDST TM (QuantaMatrix) автоматически снимали замедленные изображения.Рост колоний отдельных клеток отслеживали каждый день в поле зрения 20× с помощью инвертированного оптического микроскопа, который всегда был совмещен с одним и тем же локусом по метке фокусировки, выгравированной на дне чипа (рис. 1; Choi et al., 2014, 2016). Значение бинаризации изображений, снятых с полей, рассчитывали как сумму площади черного (суммарная площадь колоний) после черно-белого преобразования (бинаризации). Числа бинаризации каждой комбинации лекарственное средство-изолят интерпретировали как чувствительность (S) и резистентность (R) с использованием настройки порога программы QMAC-DST.Для каждой лунки интерпретацию восприимчивости дублировали показаниями двух отдельных полей и принимали, когда обе интерпретации совпадали. Результаты сравнивали с результатами LJ-DST, проведенного Корейским институтом туберкулеза. Категорическое согласие и частота ошибок были получены для каждой комбинации лекарственного средства и изолята (Институт клинических лабораторных стандартов [CLSI], 2016). Для устранения несоответствий между каждым методом все репрезентативные изоляты подвергали повторному тестированию и определению резистентных мутаций.
Пробирка-индикатор роста микобактерий (MGIT) Тест на чувствительность к лекарственным препаратам
MGIT-DST был проведен с тем же набором изолятов через несколько месяцев после завершения QMAC-DST с использованием набора BACTEC MGIT 960 SIRE в соответствии с инструкциями производителя. Вкратце, в каждую пробирку MGIT добавляли 800 мкл добавки OADC и 100 мкл лекарств. Несколько колоний на среде L-J собирали и суспендировали в PBS путем встряхивания, чтобы приготовить гомогенную суспензию McFarland 0,5. Из этой суспензии готовили разведение 1:5 с использованием PBS, образцы которого по 500 мкл инокулировали в каждую пробирку с лекарственным средством и пробирку для контроля роста (Siddiqi et al., 2012; Адами и др., 2017). Препараты применяли в конечных концентрациях, рекомендованных производителем: 1,0 мкг/мл стрептомицина, 0,1 мкг/мл изониазида, 1,0 мкг/мл рифампина и 5,0 мкг/мл этамбутола (Piersimoni et al., 2006). Данные MGIT-DST были доступны для 156 изолятов, за исключением тех, которые были контаминированы или не росли. Для каждого препарата рассчитывали основную ошибку (ME), очень большую ошибку (vME) и степень согласованности между тремя методами (LJ-DST, MGIT-DST, QMAC-DST) (таблица 3; Институт клинических лабораторных стандартов [CLSI]). , 2016).
Разрешение расхождений методом молекулярной диагностики
Для изолятов, показывающих противоречивые результаты, была проведена двойная идентификация QMAP (Quantamatrix, Сеул, Республика Корея) для выявления мутаций, устойчивых к рифампину. В этом исследовании использовали пять зондов дикого типа, представляющих последовательность дикого типа области горячей точки длиной 81 п.н. (кодон 509-534), и пять зондов мутантного типа (513CCA, 516TAC, 516GTC, 526TAC, 531TTG) (Wang et al. , 2017в).
ПЦРпроводили с использованием 10 мкл Taq HS Perfect Mix (TaKaRa Bio INC., Кусацу, Сига, Япония), 2 мкл смеси биотинилированных праймеров, 2–3 мкл образца ДНК и дистиллированную воду до конечного объема 20 мкл. Условия термоциклирования ПЦР были следующими: предварительная денатурация в течение 5 мин при 94°С, затем 40 циклов по 30 с при 94°С, 30 с при 65°С и окончательное удлинение 10 мин при 72°С. Биотинилированные продукты ПЦР денатурировали при 25°С в течение 5 мин в денатурирующем растворе. Добавьте 45 мкл предоставленного гибридизационного раствора и микродисков, связанных с зондом, в предоставленный стеклянный MatriPlate (Брукс, Челмсфорд, Массачусетс, США).Передача 1200 об/мин в течение 30 мин. Микродиски трижды промывали 100 мкл промывочного буфера, инкубировали с 50 мкл окрашивающего буфера (конъюгат стрептавидина R-фикоэритрина, ProZyme, Сан-Леандро, Калифорния, США) при 35°C в течение 10 мин и трижды промывали. Результаты были обнаружены как средние значения интенсивности флуоресценции с использованием изображений флуоресцентной микроскопии в сканере QMAP2.0 (QuantaMatrix) (Wang et al., 2017a,b,c).
Результаты
Сравнение QMAC-DST и MGIT-DST с LJ-DST
Результаты согласования QMAC-DST и MGIT-DST показаны в таблице 1.Общая степень совпадения QMAC-DST с LJ-DST для 13 препаратов составила 97,8%, а MGIT-DST для препаратов первого ряда — 95,5%. Все препараты показали уровень согласия более 90%, кроме ПАСК. vME QMAC-DST составил 25% среди устойчивых к PAS изолятов, поскольку среди четырех устойчивых изолятов было обнаружено одно несоответствие.
Сравнение трех методов для первичных лекарств
Несоответствие результатов для основных препаратов между каждым методом показано в таблице 2. Рифампицин показал самую низкую общую степень совпадения между QMAC-DST и эталонным методом.
Таблица 2. Несоответствующие результаты среди трех тестов на лекарственную чувствительность с использованием QMAC-DST, среды Левенштейна-Йенсена и BACTEC MGIT 960 для препаратов первого ряда.
По сравнению с LJ-DST были рассчитаны уровни ME и vME и общие уровни согласия QMAC-DST и MGIT DST (таблица 3). QMAC-DST показал МЭ у 2 (1,7%) для изониазида, у 10 (7,3%) для рифампина, у 1 (0,7%) для этамбутола и у 6 (4,2%) для стрептомицина, в результате чего общая МЭ составила 3,5%, но не vME.Таким образом, QMAC-DST показал наименьшую согласованность для рифампина на уровне 93,6%. MGIT-DST показал низкую МЭ 2,2%, но вМЭ наблюдалась у 3 (15,8%) для рифампина, у 7 (70%) для этамбутола и у 2 (14,3%) для стрептомицина, в результате чего общая вМЭ составила 19,8% ( Таблица 3). Среди четырех протестированных препаратов MGIT-DST показал наименьшую согласованность для этамбутола на уровне 93,6% из-за возникновения МЭ у 3 (2,1%) и вМЭ у 7 (70,0%). Показатели соответствия QMAC-DST и MGIT-DST составили 94,2% для изониазида, 91,0% для рифампина, 93,0% для этамбутола и 95.5% для стрептомицина. Общие показатели согласованности между методами были следующими: 95,5% (MGIT по сравнению с методом LJ), 97% (QMAC по сравнению с методом LJ) и 93,4% (QMAC по сравнению с MGIT).
Таблица 3. Очень серьезная ошибка, серьезная ошибка и категорическое согласие при тестировании лекарственной чувствительности с использованием QMAC-DST и BACTEC MGIT 960 по сравнению с тестированием лекарственной чувствительности с использованием среды Левенштейна-Йенсена.
Анализ случаев МЭ рифампина в QMAC-DST
Восемь из десяти изолятов, показывающих МЭ при ТЛЧ к рифампину, были подтверждены как устойчивые мутации с помощью метода QMAP Dual ID, и все они были устойчивы как при LJ-ТЛЧ, так и при MGIT-ТЛЧ (таблица 4).Чтобы исследовать механизм ME рифампина, мы проанализировали изображения случаев ME по сравнению с изолятами, которые были правильно интерпретированы как чувствительные или устойчивые (рис. 2A). Рост колоний в этих случаях МЭ был меньше, чем в случае устойчивых случаев, но явно больше, чем в случае истинной чувствительности. Значение бинаризации, обозначающее кумулятивную площадь колоний этих случаев МЭ, показало промежуточные значения между чувствительными и устойчивыми считываниями, которые в среднем составляли только половину устойчивых считываний (рис. 2B).
Таблица 4. Согласованность тестирования лекарственной чувствительности с использованием QMAC-DST по сравнению с тестированием лекарственной чувствительности с использованием BACTEC MGIT 960.
Рис. 2. Анализ изображений QMAC-DST изолятов, показывающий большую ошибку ТЛЧ к рифампину по сравнению с устойчивыми и чувствительными изолятами. (A) Рост колоний в случаях серьезных ошибок был выше, чем в восприимчивых случаях, но явно меньше, чем в устойчивых случаях. (B) Значение бинаризации обозначало совокупную площадь колоний.Величина случаев основных ошибок была промежуточной между устойчивыми и восприимчивыми случаями на пятый и седьмой день инкубации.
Обсуждение
В этом исследовании QMAC-DST показал высокую степень совпадения 97,8% по сравнению с методом золотого стандарта. Все препараты, кроме ПАСК, показали уровень соответствия более 90% как для чувствительных, так и для резистентных изолятов. Техника микрофлюидных чипов, применяемая в QMAC-DST, эффективна и очень удобна с точки зрения скорости и выбора тестируемых препаратов, поскольку она адаптировала ту же технологию, что и признанные системы быстрого автоматизированного тестирования чувствительности к противомикробным препаратам для бактериальных патогенов, QMAC-dRAST (QuantaMatrix) ( Ким и др., 2018). Таким образом, по сравнению с другими быстрыми культуральными методами, такими как MGIT, QMAC-DST имел преимущество высокой производительности, менее трудоемких процедур и широкой доступности различных препаратов первого и второго ряда за один проход, подобно QMAC-DST. дРАСТ. Несколько фенотипических методов ТЛЧ, отличных от MGIT-DST, были разработаны для быстрого выполнения работ. Планшет Sensititre MYCOTB MIC (Trek Diagnostic Systems, Кливленд, Огайо, США), метод исследования лекарственной чувствительности под микроскопом, колориметрический окислительно-восстановительный метод ТЛЧ (Woods et al., 2015) и технология амплификации фагов (Albay et al., 2003) в настоящее время доступны в клинических лабораториях. Однако они часто ограничиваются препаратами первой линии, трудоемкими, малопроизводительными или имеют плохие проблемы с безопасностью. Sensititre MYCOTB с использованием 96-луночных титрационных микропланшетов имеет преимущество в измерении реальной МИК и охватывает препараты первого и второго ряда в качестве QMAC-DST, но требует 3-недельной инкубации для окончательного считывания (Lee et al., 2019). Кроме того, высокая степень согласия с эталонным методом означает превосходную производительность в сочетании с его эффективностью, что делает QMAC-DST идеальной системой фенотипического ТЛЧ в клинической лаборатории, особенно в странах с высоким уровнем распространенности ТБ, таких как Корея.
Отсутствие vME, обнаруженного в QMAC-DST, показало большое преимущество в диагностической эффективности. Для PAS выявление выбросов ME требует дальнейшей оценки с большим количеством устойчивых к PAS изолятов, потому что только четыре устойчивых изолята были включены в это исследование, и один из них был пропущен в этом исследовании. Для сравнения, MGIT-DST показал более низкую согласованность, чем QMAC-DST, и значительное количество vME. Общий уровень совпадения MGIT-DST с LJ-DST составил 95,5%, что немного ниже, чем ранее сообщавшиеся значения 96–97% (Tukvadze et al., 2012; Лоусон и др., 2013). Этот более низкий уровень согласия может быть связан с более низким уровнем устойчивости протестированных изолятов в этом исследовании по сравнению с предыдущим исследованием. Поскольку в этом исследовании оценивалось только 10 устойчивых к этамбутолу изолятов, vME MGIT-DST достигал 70%, когда MGIT-DST пропускал семь изолятов. Устойчивость к этамбутолу трудно точно определить с помощью любого фенотипического метода, поскольку диапазоны минимальных ингибирующих концентраций чувствительных и устойчивых к этамбутолу изолятов близки друг к другу.Поэтому рекомендуемые ВОЗ эталонные методы основаны на различных концентрациях в диапазоне 2,0–7,5 мкг/мл (Rüsch-Gerdes et al., 1999; Said et al., 2012). В мета-анализе объединенное среднее значение, основанное на высокой концентрации этамбутола 5 мкг/мл, как и в этом исследовании, показало самое высокое соответствие с молекулярным ТЛЧ (Cheng et al., 2014). В этом исследовании и MGIT-DST, и QMAC-DST использовали 5 мкг/мл этамбутола. Напротив, в LJ-DST использовалось 2 мкг/мл этамбутола. Поэтому причина большой разницы между MGIT-DST и QMAC-DST остается неясной.Сравнение MGIT-DST и LJ-DST показало, что все препараты первого ряда показали высокие показатели соответствия, превышающие 95%, у восприимчивых изолятов, но относительно низкие показатели соответствия у резистентных изолятов. vME MGIT-DST для изониазида и рифампина достигала 10,5% и 15,8% соответственно. Поскольку эти два препарата показали очень низкую vME с MGIT-DST в предыдущих исследованиях (Piersimoni et al., 2006; Hwang et al., 2014; Zhao et al., 2014), относительно небольшое количество резистентных изолятов было принято как единственный причиной высокого уровня vME (Said et al., 2012; Чжао и др., 2014). Более высокая корреляция QMAC-DST с LJ-DST, чем MGIT-DST, может быть объяснена его адаптацией к тем же критическим концентрациям, что и LJ-DST. Поскольку vME является наиболее критической ошибкой, этот низкий уровень vME QMAC-DST требует диагностического использования.
Сравнение QMAC-ТЛЧ и LJ-ТЛЧ выявило высокую степень согласованности, превышающую 95 %, за исключением рифампина, у чувствительных изолятов и 100 %, за исключением этамбутола, рифабутина и ПАСК, у устойчивых изолятов. При ТЛЧ к рифампину было большое количество ложных показаний устойчивости.Анализ изображения показал, что резистентность была завышена из-за ошибочного определения роста в лунках с рифампином. Рифампицин является суррогатным маркером для выявления МЛУ при использовании в качестве резистентного и основного лекарственного средства для лечения туберкулеза. Поэтому ТЛЧ к рифампину имеет решающее значение (Pang et al., 2014), особенно в Корее, где в последнее время распространенность устойчивости к рифампину составляет 5,7% (Lee et al., 2015). Поскольку результаты QMAC-DST были получены путем наблюдения за ростом отдельных клеток с использованием микроскопических методов, установка пороговых значений для различения роста может быть затруднена, когда только часть клетки растет как естественная вариация каждого изолята (Ahmad et al., 2016). Однако большая часть ложной резистентности была обнаружена в лунках с рифампицином, и предполагалось, что субингибирующий эффект рифампина играет определенную роль. Рифампин является бактерицидным препаратом, который останавливает синтез белка путем ингибирования ДНК-зависимой РНК-полимеразы, однако рифампин также может активировать транскрипцию гена-чувствителя кворума в субингибирующих концентрациях (Acar and Goldstein, 1996). Более того, характер активации различался в жидкой и твердой средах (Goh et al., 2002). Следовательно, влияние условий, таких как погружение бактерий в агар в жидкую среду (т.э., QMAC), на ростовые характеристики МТБ остаются неясными. Следовательно, пограничная точка QMAC-DST была дополнительно оптимизирована для рифампина на основе этого исследования, и, таким образом, все ME были успешно скорректированы.
Ограничением этого исследования было то, что оно не содержало достаточного количества устойчивых изолятов ко всем лекарствам. Устойчивость к препаратам второго ряда по-прежнему очень низкая, в основном менее 3% в Корее (Lee et al., 2015). Другое ограничение заключается в том, что пиразинамид (ПЗА), препарат первой линии, не был включен в панель QMAC-DST.Поскольку (PZA) требует других значений pH, в отличие от других препаратов, в настоящее время он находится в стадии разработки, чтобы добавить его в панель QMAC-DST.
Заключение
В заключение, QMAC-DST — это быстрая и точная альтернатива обычному DST. Кроме того, QMAC-DST очень ценен в случаях неэффективности лечения или истории контактов с больными МЛУ-ТБ, поскольку с его помощью можно тестировать различные препараты первого и второго ряда. Эта полностью автоматизированная высокопроизводительная система ТЛЧ особенно подходит для лабораторий с большой производительностью.
Вклад авторов
M-NK и SHK в равной степени внесли свой вклад во всю обработку этого исследования в качестве соответствующих авторов. С.Л. руководил экспериментами и написал эту рукопись. DC, YC, EJ, SYK, HK, HJK, JC, HS и BJ способствовали проведению экспериментов и анализу данных. GK участвовал в анализе данных секвенирования. E-GK внесла свой вклад в разработку и производство чипа DST.
Финансирование
Это исследование было поддержано грантом Корейского проекта исследований и разработок в области технологий здравоохранения через Корейский институт развития индустрии здравоохранения (KHIDI), финансируемого Министерством здравоохранения и социального обеспечения Южной Кореи (грант №: HI16C1567).
Заявление о конфликте интересов
SL, EJ, SYK, HK, HJK, GK, BJ, E-GK и SHK работали в компании QuantaMatrix, Inc., которая занимается разработкой и коммерциализацией технологии ТЛЧ и имеет долю в QuantaMatrix, Inc.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Каталожные номера
Акар, Дж. Ф., и Гольдштейн, Ф.В. (1996). «Тестирование чувствительности дисков», в Антибиотики в лабораторной медицине , изд. В. Лориан (Балтимор, Мэриленд: Williams & Wilkins), 419–420. doi: 10.1016/j.diagmicrobio.2016.10.023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Адами, А. Г., Галло, Дж. Ф., Пинхата, Дж. М., Мартинс, М. К., Джампалья, К. М., и де Оливейра, Р. С. (2017). Модифицированный протокол для тестирования лекарственной чувствительности культур MGIT Mycobacterium tuberculosis с помощью MGIT 960. Диагн. микробиол. Заразить. Дис. 87, 108–111. doi: 10/1016/j.diagmicrobio.2016.10.023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ахмад С., Мокаддас Э., Аль-Мутаири Н., Элдин Х.С. и Мохаммади С. (2016). Несоответствие между фенотипическими и молекулярными методами определения лекарственной чувствительности лекарственно-устойчивых изолятов Mycobacterium tuberculosis в стране с низкой заболеваемостью туберкулезом. PLoS One 11:e0153563. doi: 10.1371/журнал.пон.0153563
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Албай, А., Киса, О., Байлан, О., и Доганчи, Л. (2003). Оценка теста FASTPlaqueTB для экспресс-диагностики туберкулеза. Диагн. микробиол. Заразить. Дис. 46, 211–215. doi: 10.1016/S0732-8893(03)00048-48
Полнотекстовая перекрестная ссылка | Академия Google
Беме, К.С., Набета, П., Хиллеманн, Д., Николь, М.П., Шанай, С., Крапп, Ф., и др. (2010). Быстрое молекулярное выявление туберкулеза и устойчивости к рифампину. Н. англ. Дж. Мед. 363, 1005–1015. дои: 10.1056/NEJMoa0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Беме, К.С., Николь, М.П., Набета, П., Майкл, Дж.С., Готуццо, Э., Тахирли, Р., и др. (2011). Осуществимость, диагностическая точность и эффективность децентрализованного использования теста Xpert MTB/RIF для диагностики туберкулеза и множественной лекарственной устойчивости: многоцентровое исследование внедрения. Ланцет 377, 1495–1505. doi: 10.1016/S0140-6736(11)60438-60438
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Центров по контролю и профилактике заболеваний [CDC] (2006 г.).Появление Mycobacterium tuberculosis с широкой устойчивостью к препаратам второго ряда во всем мире. 2000-2004 гг. MMWR Морб. Смертный. еженедельно. 55, 301–305.
Реферат PubMed | Академия Google
Ченг С., Цуй З., Ли Ю. и Ху З. (2014). Диагностическая точность метода молекулярного определения лекарственной чувствительности для противотуберкулезного препарата этамбутола: систематический обзор и метаанализ. Дж. Клин. микробиол. 52, 2913–2924. doi: 10.1128/JCM.00560-514.
Полнотекстовая перекрестная ссылка | Академия Google
Чой, Дж., Ким, Э.К., Ю, Дж., Ли, М., Ли, С., Джу, С., и др. (2014). Экспресс-тест на чувствительность к противомикробным препаратам, основанный на морфологическом анализе отдельных клеток. науч. Перевод Мед. 6:174. doi: 10.1126/scitranslmed.3009650
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чой, Дж., Ю, Дж., Ким, К.Дж., Ким, Э.Г., Парк, К.О., Ким, Х., и др. (2016). Экспресс-тест на лекарственную чувствительность Mycobacterium tuberculosis с использованием микроскопической покадровой визуализации в агарозной матрице. Заяв. микробиол. Биотехнолог. 100, 2355–2365. doi: 10.1007/s00253-015-7210-7210
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Институт клинических лабораторных стандартов [CLSI] (2016). «Утвержденное руководство M23-A4», в Разработка критериев тестирования чувствительности in vitro и параметров контроля качества , 4-е изд., изд. А. Мэтью (Уэйн, Пенсильвания: Институт стандартов клинических лабораторий). doi: 10.1073/pnas.252607699
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Го, Э.B., Yim, G., Tsui, W., McClure, J., Surette, M.G., Davies, J., et al. (2002). Транскрипционная модуляция экспрессии бактериальных генов субингибирующими концентрациями антибиотиков. Проц. Натл. акад. науч. США 99, 17025–17030. doi: 10.1073/pnas.252607699
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Hanrahan, C.F., Dorman, S.E., Erasmus, L., Koornhof, H., Coetzee, G., Golub, J.E., et al. (2012). Воздействие расширенного тестирования на туберкулез с множественной лекарственной устойчивостью с использованием генотипа MTBDRplus в Южной Африке: обсервационное когортное исследование. PLoS One 7:e49898. doi: 10.1371/journal.pone.0049898
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хван, С. М., Хван, К. С., Хонг, Ю. Дж., Ли, Х. Р., Ким, Т. С., Парк, К. У., и другие. (2014). Улучшение тестирования чувствительности к противотуберкулезным препаратам с использованием жидких сред. Энн. клин. лаборатория науч. 44, 123–130. doi: 10.1038/s41598-018-26419-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Юнг Ю. Г., Ким Х., Lee, S., Kim, S., Jo, E., Kim, E.G., et al. (2018). Система быстрого культивирования, на которую не влияет эффект инокулята, повышает надежность и удобство тестирования лекарственной чувствительности Mycobacterium tuberculosis . науч. Респ. 8:8651. doi: 10.1038/s41598-018-26419-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кам, К.М., Слуцкий, А., Йип, К.В., Буллед, Н., Сеунг, К.Дж., Зигнол, М., и соавт. (2010). Определение критических концентраций противотуберкулезных препаратов второго ряда, имеющих клиническое и микробиологическое значение. Междунар. Дж. Туберк. легкие дис. 14, 282–288. doi: 10.5145/ACM.2018.21.1.12
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ким, Х., Чжон, Х.Ю., Хан, С.К., Хан, С.Х., Чой, Дж., Джин, Б., и др. (2018). Клиническая оценка QMAC-dRAST для прямого и экспресс-теста на чувствительность к противомикробным препаратам с грамположительными кокками из флаконов с положительными культурами крови. Энн. клин. микробиол. 21, 12–19. doi: 10.5145/ACM.2018.21.1.12
Полнотекстовая перекрестная ссылка | Академия Google
Лоусон, Л., Эменёну, Н., Абдуррахман, С.Т., Лоусон, Дж.О., Узоевулу, Г.Н., Согаолу, О.М., и соавт. (2013). Сравнение лекарственной чувствительности Mycobacterium tuberculosis с использованием твердых и жидких культур в Нигерии. BMC Рез. Примечания 6:215. дои: 10.1186/1756-0500-6-215
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Lee, H.Y., Lee, J., Lee, Y.S., Kim, M.Y., Lee, H.K., Lee, Y.M., et al. (2015). Характер лекарственной устойчивости штаммов Mycobacterium tuberculosis от пациентов с легочным и внелегочным туберкулезом в период с 2006 по 2013 год в корейском третичном медицинском центре. Корейский Дж. Интерн. Мед. 30, 325–334. doi: 10.3904/kjim.2015.30.3.325
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Lee, J., Armstrong, D.T., Ssengouba, W., Park, J.A., Yu, Y., Mumbowa, F., et al. (2019). Планшет Sensititre MYCOTB MIC для тестирования чувствительности Mycobacterium tuberculosis к препаратам первого и второго ряда. Антимикроб. Агенты Чемотер. 58, 11–18. doi: 10.1128/AAC.01209-1213
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Панг, Ю., Ruan, Y.Z., Zhao, J., Chen, C., Xu, C.H., Su, W., et al. (2014). Диагностическая дилемма: результаты лечения больных туберкулезом с непостоянной чувствительностью к рифампицину. Междунар. Дж. Туберк. легкие дис. 18, 357–362. doi: 10.5588/ijtld.13.0459
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пьерсимони, К., Оливьери, А., Бенаккио, Л., и Скарпаро, К. (2006). Современные перспективы определения лекарственной чувствительности комплекса Mycobacterium tuberculosis : автоматизированные нерадиометрические системы. Дж. Клин. микробиол. 44, 20–28.
Реферат PubMed | Академия Google
Родригес, К., Яни, Дж., Шенаи, С., Таккар, П., Сиддики, С., и Мехта, А. (2008). Тестирование лекарственной чувствительности Mycobacterium tuberculosis к препаратам второго ряда с использованием системы bactec MGIT 960. Междунар. Дж. Туберк. легкие дис. 12, 1449–1455.
Реферат PubMed | Академия Google
Рюш-Гердес, С., Домель, К., Нарди, Г., Жисмондо, М. Р., Вельшер, Х.М. и Пфайффер, Г.Е. (1999). Многоцентровая оценка пробирки-индикатора роста микобактерий для определения чувствительности Mycobacterium tuberculosis к препаратам первого ряда. Дж. Клин. микробиол. 37, 45–48. дои: 10.1186/1471-2334-12-369
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Саид, Х.М., Кок, М.М., Исмаил, Н.А., Баба, К., Омар, С.В., Осман, А.Г., и соавт. (2012). Сравнение системы BACTEC MGIT 960 и метода пропорции агара для тестирования чувствительности штаммов туберкулеза с множественной лекарственной устойчивостью в условиях высокого бремени болезни в Южной Африке. BMC Заражение. Дис. 12:369. дои: 10.1186/1471-2334-12-369
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сиддики С., Ахмед А., Асиф С., Бехера Д., Джавид М., Джоти А. и др. (2012). Прямое тестирование лекарственной чувствительности Mycobacterium tuberculosis для быстрого выявления множественной лекарственной устойчивости с использованием системы Bactec MGIT 960: многоцентровое исследование. Дж. Клин. микробиол. 50, 435–440. doi: 10.1371/journal.pone.0031563
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Туквадзе Н., Кемпкер Р.Р., Каландадзе И., Курбатова Э., Леонард М.К., Апсиндзелашвили Р. и соавт. (2012). Использование молекулярного диагностического теста при подозрении на туберкулез с положительным мазком на КУМ значительно сокращает время до выявления туберкулеза с множественной лекарственной устойчивостью. PLoS One 7:e31563. doi: 10.1371/journal.pone.0031563
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван Х.Ю., Ух Ю., Ким С. и Ли Х. (2017a). Производительность системы мультиплексной аналитической платформы Quantamatrix для дифференциации и идентификации видов Mycobacterium . J. Med. микробиол. 66, 777–787. doi: 10.1099/jmm.0.000495
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван Х.Ю., Ух Ю., Ким С. и Ли Х. (2017b). Платформа для мультиплексного анализа Quantamatrix для прямого обнаружения бактерий и детерминант устойчивости к антибиотикам во флаконах с положительными культурами крови. клин. микробиол. Заразить. 23:333. doi: 10.1016/j.cmi.2016.12.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван, Х.Ю., Ух, Ю., Ким, С., Шим, Т.С., и Ли, Х. (2017c). Оценка платформы мультиплексного анализа Quantamatrix для одновременного обнаружения Mycobacterium tuberculosis и гена устойчивости к рифампицину с использованием культивируемых микобактерий. Междунар. Дж. Заразить. Дис. 61, 107–113. doi: 10.1016/j.ijid.2017.06.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вудли, CL (1986). Оценка концентраций стрептомицина и этамбутола для тестирования чувствительности Mycobacterium tuberculosis с помощью радиометрических и обычных процедур. Дж. Клин. микробиол. 23, 385–386.
Реферат PubMed | Академия Google
Вудс, Г.Л., Лин, С.Ю.Г., и Десмонд, Э.П. (2015). «Методы испытаний на чувствительность: Mycobacteria , Nocardia и другие актиномицеты» в Руководстве по клинической микробиологии , 11-е изд., изд. Дж. Х. Йоргенсен (Вашингтон, округ Колумбия: ASM Press).
Академия Google
Всемирная организация здравоохранения [ВОЗ] (2009 г.). Руководство по надзору за лекарственной устойчивостью при туберкулезе, 4-е изд.Женева: ВОЗ.
Академия Google
Всемирная организация здравоохранения [ВОЗ] (2015 г.). Глобальный отчет по туберкулезу. Женева: Всемирная организация здравоохранения.
Академия Google
Чжао, П., Фанг, Ф., Ю, К., Го, Дж., Чжан, Дж. Х., Цюй, Дж., и соавт. (2014). Оценка системы BACTEC MGIT 960 для тестирования чувствительности Mycobacterium tuberculosis к препаратам первого ряда в Китае. PLoS One 9:e99659. doi: 10.1371/journal.pone.0099
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Особенности лекарственной чувствительности микобактерий туберкулеза у взрослых больных туберкулезом с множественной лекарственной устойчивостью и значение для исследования бытовых контактно-профилактических препаратов | BMC Infectious Diseases
Участники исследования
Были опрошены триста двадцать восемь потенциальных участников, 321 из которых согласился пройти обследование.В период с октября 2015 г. по март 2016 г. было зачислено 308 человек из 16 участвующих сайтов в 8 странах: Ботсване, Бразилии, Гаити, Индии, Кении, Перу, Южной Африке и Таиланде. Все сайты являются клиническими исследовательскими центрами Группы клинических исследований СПИДа (ACTG) и/или сети Международных клинических исследований СПИДа среди матерей, детей и подростков (IMPAACT). Средний возраст составлял 36 лет, 57% мужчин; 41% участников были чернокожими, 32% смешанной расы/другими, 22% азиатами и 2% белыми; 112 (36%) были ВИЧ-инфицированы; и 43% были нынешними или бывшими курильщиками.у 87 (43%) была документально подтверждена полостная болезнь легких, а 161 (52%) ранее лечились от туберкулеза.
Количество и время сбора образцов
У 308 участников было получено от 1 до 4 результатов анализа образцов мокроты из доступной плановой программы, которая установила диагноз МЛУ-ТБ, всего 404 образца. Из 308 участников 27 (9%) не могли получить мокроту, 1 отказался предоставить образец для исследования, а у остальных 280 (91%) образец мокроты для исследования был собран в среднем (диапазон) 59 дней (0, 190). ) после начала лечения МЛУ-ТБ.
Выявление мазков и MTB с помощью Xpert, Hain и посевов
Для обычных образцов у 217/308 (71%) участников были доступны результаты мазков: 69% (149/217) были положительными. Все исследуемые образцы подвергались исследованию мазка; только 34% (94/280) были положительными на кислотоустойчивые бациллы с более низкими значениями оценки мазка (таблица 1). Результаты Xpert обычных образцов были доступны для 152/308 (49%) участников, и все, кроме 2, сообщили о MTB. Почти все исследуемые образцы были протестированы с помощью Xpert (99%; 278/280), но MTB был обнаружен только у 51% (141/278).Тестирование волос на обычных образцах или положительные культуры были зарегистрированы в 69% (214/308), при этом MTB был обнаружен в 99%. Хейн-тестирование было проведено только на 27 исследуемых образцах или положительных культурах (10%; 27/280) и выявило MTB в 21 (78%; 21/27). Жидкие и/или твердые культуры были доступны для 63% (193/308) обычных и 98% (274/280) исследуемых образцов, в то время как положительный результат на MTB был зарегистрирован в 93% (179/193) и 31% (85/275), соответственно. В целом MTB был обнаружен с помощью Xpert, Hain и/или посева у всех участников из обычных образцов и в 53% (147/280) образцов исследования, собранных во время лечения.
Таблица 1 Мазок, Xpert MTB/RIF, Hain MTBDR плюс и результаты посевов для индексных случаев МЛУ-ТБ из обычных и исследуемых образцов мокротыТест на чувствительность к рифампицину метод в таблице 2 и объединение результатов Xpert, Hain и фенотипа в таблице 3 и на рис. 1
. В стандартных образцах, положительных на MTB, резистентность к RIF была обнаружена в 99, 99 и 100% случаев при тестировании с помощью Xpert, Hain и фенотипического ТЛЧ соответственно.Если устойчивость к РИФ не выявлялась одним методом, ее выявляли другим. В целом для всех комбинированных методов доказательства устойчивости к RIF были обнаружены во всех 308 стандартных образцах. Для исследуемых образцов с обнаруженным MTB устойчивость к RIF была обнаружена у 89, 81 и 89% тех, которые были протестированы с помощью Xpert, Hain и фенотипического ТЛЧ соответственно. Подозрительные и/или противоречивые результаты наблюдались для всех трех методов. Было записано четырнадцать результатов Xpert с чувствительностью к RIF: 12 не тестировались каким-либо другим методом, а 2 также были фенотипически чувствительны.Три исследуемых образца имели резистентность к RIF, обнаруженную с помощью Xpert, но были фенотипически восприимчивы к RIF (таблица 3). В целом, из 280 исследуемых образцов у 147 (53%) был обнаружен MTB, и из них у 145 было проведено тестирование чувствительности к RIF любым из методов, из которых 128 (89%) имели признаки устойчивости к RIF. Таким образом, 46% из 280 исследуемых образцов имели задокументированную резистентность к RIF. Таблица 2. Методы определения чувствительности к рифампицину (RIF), изониазиду (INH) и препаратам второго ряда и результаты для индексных случаев МЛУ-ТБ из обычных и исследуемых образцов мокроты Таблица 3. Статус МЛУ для индексных случаев из стандартных и исследуемых образцов мокроты .Подробные результаты для рифампицина (РИФ) и изониазида (ИНГ) представлены слева, а комбинированный статус МЛУ — справа. и тестирование лекарственной чувствительности RIF. Условные обозначения: Определение лекарственной чувствительности проводили молекулярными и/или фенотипическими методами. Из 280 участников, предоставивших образцы мокроты во время лечения, MTB не был идентифицирован у 133, поэтому провести ТЛЧ не удалось, MTB был выявлен, но RIF DST не выполнялся у 2, MTB был выявлен, и RIF DST было выполнено у 145 участников.Площади кружков пропорциональны частотамТестирование чувствительности к INH
Для обычных образцов с выявленным MTB устойчивость к INH была обнаружена у 91 и 99% протестированных с помощью Hain и фенотипического ТЛЧ соответственно (таблица 2). Наблюдались чувствительные и противоречивые результаты: шесть участников были восприимчивы к INH по тесту Hain, но фенотипически устойчивы (таблица 3). В целом, во всех 308 рутинных образцах был обнаружен MTB. Из них у 246 (80%) был проведен тест на чувствительность к INH любым методом, из которых у 232 (94%) были доказательства устойчивости к INH.Таким образом, 75% стандартных образцов имели документально подтвержденную резистентность к INH (таблица 2). Для исследуемых образцов с выявленным MTB устойчивость к INH была выявлена у 67 и 91% протестированных по Hain и фенотипическому ТЛЧ соответственно. Наблюдались чувствительные и/или противоречивые результаты, такие как чувствительность к 4 INH от Hain, которые, однако, не тестировались с помощью фенотипического ТЛЧ. Было получено 5 чувствительных к INH результатов, фенотипически проверенных, а не Hain (таблица 3). В целом, для 280 исследуемых образцов у 147 был обнаружен MTB, и из них 69 (25% из 280) было проведено ТЛЧ к INH любым из методов, из которых 57 (83% из 69) имели признаки резистентности к INH.Таким образом, только у 20% исследуемых образцов была зарегистрирована резистентность к INH (таблица 2).
Тестирование чувствительности к фторхинолонам (FLQ) и инъекционным препаратам
Только у 108 (35%) из 308 участников были доступны результаты определения чувствительности к FLQ на обычных образцах либо с помощью Hain, либо с помощью фенотипического ТЛЧ, поскольку это не было стандартом в большинстве стран: 7 (6% ) продемонстрировал сопротивление. Из 280 исследуемых образцов только 41 (15%) показали результаты чувствительности к FLQ, при этом 6/41 (15%) продемонстрировали резистентность (данные не показаны).Резистентность к стрептомицину наблюдалась у 38 и 72% из 29 и 54 стандартных и исследуемых образцов соответственно. Что касается SLID, только 107 (35%) стандартных образцов прошли тест на чувствительность и получили результаты либо с помощью Hain, либо с помощью фенотипического ТЛЧ, при этом устойчивость была обнаружена в 8 (7%). Что касается исследуемых образцов, только 42 (15%) имели результаты чувствительности к SLID, при этом 5 (12%) были устойчивыми.
Статус МЛУ и ШЛУ
Подробные результаты для INH и RIF для обычных и исследуемых образцов представлены в таблице 3 и на рис.1. МЛУ-ТБ был подтвержден в 75% (232) из 308 рутинных образцов. В исследуемых образцах MTB был обнаружен Xpert, Hain или посевом в 50, 8 и 30% соответственно (таблица 2 и таблица 3), а определение чувствительности к INH было возможно только с помощью Hain или фенотипического ТЛЧ только в 20% (55/280). ) был подтвержден МЛУ-ТБ. Монорезистентность к INH (0% в обычном режиме, 0,7% в исследуемых образцах) и монорезистентность к RIF (0,3% в обычном и 1,4% в исследуемых образцах) при фенотипическом тестировании редко документировались. В 20% обычных и 23% исследуемых образцов была документирована только резистентность к RIF (в основном с помощью Xpert), а результаты по чувствительности к INH не были задокументированы.При добавлении информации о FLQ и SLID к статусу MDR у 43% (131/308) обычных образцов и 8,2% (23/280) исследуемых образцов была подтверждена MDR, но не было результатов для FLQ и SLID (данные не показаны). Только 35 % обычных образцов и 14 % исследуемых образцов прошли тестирование, достаточное для определения состояния участников до ШЛУ и ШЛУ. Приблизительно треть (88/308; 29%) обычных образцов и 9% (24/280) исследуемых образцов имели МЛУ с документально подтвержденной чувствительностью к FLQ и SLID. Очень немногие имели пре-ШЛУ (7/108 (7%) в плановом порядке и 5/39 (13%) в исследовании) или ШЛУ-ТБ (4/108 (4%) в обычном режиме и 2/39 (5%) в исследовании). (данные не показаны).
Анализ затрат на экспресс-диагностику лекарственно-устойчивого туберкулеза | BMC Infectious Diseases
Дизайн исследования
Дизайн исходного исследования и методы были ранее описаны в другом месте [9]. Вкратце, целью общего исследования было сравнение TTR и чувствительности/специфичности трех экспресс-тестов для диагностики туберкулеза с чрезвычайной лекарственной устойчивостью (ШЛУ-ТБ) с ТЛЧ MGIT. ШЛУ-ТБ определяется как устойчивость как к изониазиду, так и к рифампицину, а также к любому из фторхинолонов и любому из инъекционных противотуберкулезных препаратов [1].Диагностические тесты проводились параллельно на участниках исследования в трех крупных противотуберкулезных диспансерах, расположенных в районах с повышенной распространенностью ШЛУ-ТБ. Были зарегистрированы участники с подозрением на ШЛУ-ТБ (см. Дополнительный файл 1: Таблица S1 для критериев включения/исключения) [9]. Биологические образцы и данные интервью были собраны во время исходных и 52-недельных последующих посещений. Кроме того, обзоры медицинских карт были проведены на исходном уровне, через 30 дней после регистрации и через 52 недели после регистрации. Регистрация происходила в период с июня 2012 по июнь 2013 года.Участникам не выплачивалась компенсация за участие, но транспортные расходы возмещались, когда пациенты тратили час или более на визиты, связанные с исследованиями.
Исследовательские площадки
Три исследовательских площадки были расположены в Мумбаи, Индия; Порт-Элизабет, Южная Африка; и Кишинев, Молдова.
Индия
Департамент полиции Национальная больница Хиндуджа (PD-HNH) и Медицинский исследовательский центр (MRC) — это центр третичной медицинской помощи в центральном Мумбаи, Индия. Легочное отделение PD-HNH является самым загруженным в Мумбаи и является центром перенаправления больных МЛУ- и ШЛУ-ТБ из Мумбаи и штата Махараштра.В предыдущем исследовании популяции пациентов в этой клинике было обнаружено, что 80% полученных образцов устойчивы к одному или нескольким стандартным противотуберкулезным препаратам, а 51% были устойчивы более чем к одному препарату [16].
Молдова
Институт фтизиопульмонологии (ИФП) в Кишиневе, Молдова является центральным подразделением Национальной программы по борьбе с туберкулезом. Это медицинский консультационный, научно-исследовательский и учебный центр, который возглавляет все услуги по лечению туберкулеза в Молдове. В Молдове высока распространенность лекарственно-устойчивого ТБ: 24% новых и 62% ранее леченных больных ТБ имеют МЛУ-ТБ [17].
Южная Африка
По данным ВОЗ, в Южной Африке наблюдается большое число новых случаев ТБ и высокая распространенность лекарственно-устойчивого ТБ [9]. В центре Порт-Элизабет пациенты были зарегистрированы в шести учреждениях первичной медико-санитарной помощи и в одной региональной больнице. Децентрализованное зачисление привело к более низкой распространенности лекарственной устойчивости в этом центре [1].
Опыт и подготовка лабораторного персонала
В каждом из описанных выше исследовательских центров имелись действующие клинические лаборатории, которые функционировали в течение многих лет и соответствовали международным стандартам безопасности.В рамках исследования требовалось, чтобы в каждом учреждении был назначен лаборант с опытом проведения тестирования на ТБ не менее одного года. В каждом центре имелся постоянный опыт проведения тестирования лекарственной устойчивости на ТБ с использованием MGIT и линейного зонда. Для этих испытаний в каждую площадку был отправлен набор образцов для тестирования, и результаты сравнивались с ранее установленными данными в координационном центре (UCSD). Лаборанты из каждой лаборатории также приняли совместное участие в недельном тренинге по MODS в Перуанском университете Каетано Эредиа в Лиме, Перу, и в недельном тренинге по пиросеквенированию с доктором К.Грейс Лин из Калифорнийского департамента здравоохранения, Ричмонд, Калифорния. Обучение состояло из лекций, лабораторных занятий и практических занятий по внедрению стандартизированных процедур тестирования на разных площадках.
Критерии включения/исключения
Чтобы иметь право на участие в исследовании, участники должны были: а) быть не моложе 5 лет; б) дали информированное согласие или имели возможность и желание субъекта или законного опекуна/представителя дать информированное согласие; c) известно, что у них положительный мазок мокроты на КУМ (определяется как 1+ или выше в течение предшествующих 14 дней), положительный результат теста GeneXpert или клинические проявления с высоким подозрением на активный туберкулез и:
Ранее получали лечение > 1 месяца по поводу предшествующего эпизода туберкулеза или
Неэффективное лечение ТБ с положительным мазком или посевом мокроты после ≥3 месяцев стандартного лечения ТБ или
Имел тесный контакт с больным туберкулезом с известной лекарственной устойчивостью или
Имели новый диагноз МЛУ-ТБ в течение последних 30 дней или
Имели ранее диагностированный МЛУ-ТБ и неэффективное лечение ТБ с положительным результатом мазка мокроты или посева после ≥3 месяцев стандартной схемы лечения МЛУ-ТБ.
Критерии исключения: а) институционализированы; б) не может предоставить не менее 7,5 мл мокроты (объединенные 1-й и 2-й образцы) или в) имел результаты ТЛЧ второго ряда, проведенного в течение последних 3 месяцев.
Показатели исследования
Эффективность
TTR каждого анализа был первичным результатом эффективности. TTR определялся как «количество дней от начала тестирования до регистрации окончательных результатов всех семи препаратов для каждого теста».Дата отслеживалась и сообщалась на ключевых этапах обработки анализа. Чувствительность и специфичность каждого из трех новых тестов (MODS, LPA, PSQ) по сравнению с эталонным стандартом (MGIT) служили дополнительным показателем эффективности. Также фиксировалось наличие или отсутствие интерпретируемого результата.
Затраты
Расходы на материалы и персонал для испытаний
Местные расходы на лабораторные материалы для конкретных тестов и расходы на персонал были собраны в каждом центре с помощью опроса для каждого диагностического теста с использованием местной валюты.Чтобы обеспечить точность и единообразие сбора данных на разных объектах, персонал прошел обучение с помощью веб- и телеконференций тому, как заполнять опросы. Опросы проводились через 3–6 месяцев после начала регистрации, что позволяло сайтам повышать квалификацию в любых новых тестах. Затраты были указаны на партию, и была собрана информация о среднем размере партии. Персонал Зоны был проинструктирован исключить расходы, связанные с исследованиями. Когда процессы распределялись между тестами, полная стоимость этого процесса учитывалась для каждого теста.Заполненные опросы проверялись следователями на координирующем участке. Были выявлены отсутствующие данные или несоответствия, и сайтам было предложено уточнить данные.
Стоимость специального оборудования для испытаний
Несмотря на то, что некоторое оборудование уже принадлежало исследовательским площадкам, мы применили закупочную цену 2010 г. для всего необходимого оборудования и амортизировали эти затраты в течение рекомендуемого срока полезного использования в десять лет, чтобы обеспечить единообразие на разных площадках [18].
Стоимость одного образца для специального тестового оборудования была рассчитана путем деления общей стоимости на прогнозируемое количество образцов в течение десяти лет с использованием фактического объема испытаний. Затем была рассчитана стоимость специального оборудования для испытаний на образец. Также были оценены диапазоны, основанные на объеме из других мест исследования и максимальном объеме.
Общее лабораторное оборудование и накладные расходы
В дополнение к материалам и оборудованию, предназначенным для конкретных испытаний, в каждом центре имелось общее лабораторное оборудование, которое использовалось для исследования.Примерами являются стандартные мензурки, шкафы для хранения и т. д. Кроме того, существовали накладные расходы, связанные со строительными площадями, коммунальными услугами и текущим обслуживанием. Однако было невозможно точно отделить общее лабораторное оборудование и накладные расходы, используемые для текущего исследования, от тех, которые использовались для не связанных с исследованием клинических услуг. Кроме того, общие расходы на оборудование и накладные расходы в некоторых местах покрывались национальными государственными системами здравоохранения и были недоступны. Таким образом, накладные расходы были оценены в 69% от расходов на персонал, необходимых для проведения вмешательства.В смете накладных расходов учитываются расходы на оборудование, косвенный вспомогательный персонал и другие типичные косвенные расходы, связанные с работой медицинской клиники [19]. Эта цифра основана на данных, показывающих, что косвенные затраты еще на 69% превышают затраты на медицинский персонал [20]. Этот метод использовался в других анализах экономической эффективности [21, 22].
Анализ затрат
Все анализы проводились с точки зрения организации здравоохранения. Расходы пациентов не отслеживались.Все расходы в местной валюте были конвертированы в доллары США с использованием данных об обмене международной валюты, опубликованных на XE.com в июне 2013 года. лей и 9,70 южноафриканского ранда. После пересчета в доллары США затраты на персонал для Индии составили 1,52 долл. США, 1,82 долл. США и 4,55 долл. США в час для помощника лаборанта, лаборанта и руководителя лаборатории соответственно. Для Молдовы расходы на персонал составили 1 доллар.50, 2,50 или 3,50 доллара в час для уборщиков, лаборанта и руководителя лаборатории соответственно. В Южной Африке все работы проводились лаборантом с заработной платой 10,30 долл. США в час. Средние затраты на образец для материалов и персонала рассчитывались отдельно, а затем объединялись в первоначальном анализе эффективности дополнительных затрат «только для операций». Затем к анализу были добавлены затраты на оборудование для конкретных испытаний. Третий анализ отразил добавление накладных расходов.Для каждого анализа были рассчитаны дополнительные коэффициенты экономической эффективности (ICER).
Анализы чувствительности
Анализы чувствительности использовались для изучения того, как изменялись результаты дополнительного анализа эффективности затрат при изменении исходных данных. Входные данные, которые либо варьировались в зависимости от объекта, либо могут значительно различаться в других условиях, включали размер партии, почасовую заработную плату лабораторного персонала и образцы в течение всего срока службы, обработанные для специального тестового оборудования. Таким образом, информативно изучить влияние этих переменных на результаты исследования [23].Анализ чувствительности проводился путем ввода верхнего и нижнего значения из диапазона значений, описанного ниже, в электронные таблицы Excel, используемые для расчетов. Затем каждый компонент затрат (материалы, персонал, специальное оборудование для испытаний и накладные расходы) был пересчитан и объединен в общую стоимость/выборку. В каждом однофакторном анализе изучалась индивидуальная чувствительность результатов, когда партия, почасовая оплата и стоимость оборудования варьировались отдельно. Затем складывались высокие и низкие значения двух из трех переменных.Двусторонний анализ чувствительности проводился для парных переменных размер партии/средняя почасовая заработная плата и размер партии/средняя стоимость оборудования. Первая двусторонняя пара представляет интерес, потому что на двух исследовательских площадках была низкая средняя почасовая оплата и большие размеры партий. Вторая двусторонняя пара представляет интерес, поскольку в центрах с большими объемами, вероятно, максимизируется размер партии, а также снижается стоимость оборудования в расчете на одну пробу, в то время как в центрах с небольшими объемами тестирования справедливо обратное. Наконец, был проведен трехфакторный анализ чувствительности, в котором варьировался диапазон значений размера лабораторной партии, средней почасовой оплаты труда и средней стоимости оборудования.Диаграмма чувствительности торнадо была создана с использованием дополнительного программного обеспечения Microsoft Excel.
Размеры партий варьировались в разных учреждениях в зависимости от количества пациентов в каждом учреждении. Партии PSQ были ограничены максимум 12 на партию. Партии теста MGIT были ограничены восемью образцами на лунку. Каждый образец тестировался всеми четырьмя тестами, поэтому партии оставались в пределах 5–12 на партию, чтобы ни один тест не отставал. Мы варьировали размеры партий от минимального до максимального, указанного в нашем исследовании.Мы также варьировали расходы на персонал в соответствии с диапазонами, указанными в нашем исследовании.
Как описано выше, почасовая заработная плата варьировалась от 1,50 до 10,30 долларов в час. Однако на расходы на персонал также влияло время, затрачиваемое на выполнение каждой задачи, а предприятия с более низкой заработной платой, как правило, использовали несколько уровней укомплектования персоналом.
Поскольку фактический объем тестов, проведенных на нашем исследовательском оборудовании, мог значительно занижать общий потенциальный объем на машину, мы изменили объем от самого низкого, наблюдаемого в наших исследовательских центрах, до максимум 2000 тестов ТЛЧ в год.Мы подсчитали, что PSQ может использовать свои 96 лунок для тестирования 12 образцов x семи препаратов и одного контроля примерно каждые два дня, обеспечивая ТЛЧ примерно для 2000 образцов ежегодно. Хотя с помощью других диагностических инструментов можно было протестировать более 2000 образцов, мы использовали максимум 2000 тестов, чтобы стандартизировать сравнение тестов.
Руководство по проведению исследований по оценке точности экспресс-тестов на лекарственную чувствительность к туберкулезу | Журнал инфекционных болезней
Аннотация
Разработка и внедрение быстрой молекулярной диагностики туберкулеза (ТБ) с определением лекарственной чувствительности имеет решающее значение для информирования пациентов о лечении и предотвращения возникновения и распространения резистентности.Оптимальное планирование испытаний существующих и разрабатываемых тестов будет иметь решающее значение для быстрого сбора фактических данных, необходимых для обоснования обзора Всемирной организации здравоохранения и поддержки возможных рекомендаций по политике. Необходимые данные включают оценку эффективности выявления ТБ и резистентности, а также оценку рабочих характеристик этих платформ. Оценка эффективности должна включать аналитические исследования для подтверждения предела обнаружения и способности анализа обнаруживать мутации, придающие резистентность штаммам, репрезентативным в глобальном масштабе.За аналитической оценкой обычно следуют многоцентровые клинические оценочные исследования для подтверждения диагностической эффективности в местах и популяциях предполагаемого использования. В данной статье обобщены соображения по поводу дизайна этих аналитических и клинических исследований.
Быстрая и точная диагностика туберкулеза (ТБ) и определение чувствительности к лекарствам имеют решающее значение для лечения пациентов и предотвращения появления и распространения резистентных штаммов. В 2017 г. во всем мире менее трети новых больных туберкулезом прошли тест на лекарственную чувствительность (ТЛЧ) к рифампицину (РИФ), одному из наиболее важных препаратов первого ряда [1].Это приводит к недостаточному лечению лекарственно-устойчивого ТБ (ЛУ-ТБ), дальнейшей амплификации и передаче устойчивости и связанной с этим смертности [2]. Смоделированные данные предсказывают рост заболеваемости туберкулезом с множественной лекарственной устойчивостью (МЛУ) с увеличением на 9–33% только на Филиппинах, в Индии и России [3, 4]. В 2017 г. только 50% лиц, у которых в 2017 г. был диагностирован РИФ-устойчивый ТБ, прошли ТЛЧ второго ряда, даже при подозрении на МЛУ-ТБ [1]. Отсутствие информации о чувствительности к препаратам второго ряда, особенно к приоритетным соединениям профиля целевого продукта ТЛЧ (TPP), таким как фторхинолоны (FQ) [5], может привести к катастрофическим последствиям для пациентов, увеличению нагрузки на системы здравоохранения, и передача устойчивого ТБ.Без решения этих ключевых вопросов цель в области устойчивого развития к 2030 г. по прекращению эпидемии туберкулеза не будет достигнута.
Ввиду ограничений традиционных фенотипических методов разработка быстрой молекулярной диагностики ТБ ТЛЧ стала приоритетным направлением исследований и разработок [6]. Хотя внедрение и внедрение новых средств диагностики ЛУ-ТБ, таких как анализ Xpert MTB/RIF (Cepheid, Саннивейл, Калифорния), увеличило число выявленных и зарегистрированных случаев ТБ и ЛУ-ТБ [1, 7], важные вопросы диагностики и лечения пробелы остаются.В частности, существует острая потребность в быстрых молекулярных ТЛЧ, которые выявляют устойчивость к более широкому спектру лекарственных соединений, в том числе к тем, которые приоритетны в ТПП [5]. Несколько новых анализов были разработаны в соответствии с существующими TPP [5], и некоторые из них уже продемонстрировали многообещающую эффективность для комплекса Mycobacterium tuberculosis (MTBC) и обнаружения лекарственной устойчивости в ранних исследованиях [8–13]. Однако исследования этих технологий редко дают адекватную информацию для обзора Всемирной организации здравоохранения (ВОЗ) и поддерживают потенциальные политические рекомендации.Например, эти исследования (1) часто не включают хорошо охарактеризованные сравнительные анализы, (2) не проверяют адекватный выбор мутаций резистентности в штаммах с широкой географической дисперсией, (3) не включают достаточный размер выборки для достижения точности диагностики. цели, или (4) использовать поток выборки, который не позволяет проводить надежные сравнения между индексным тестом, эталонным тестом и компараторами.
В этой статье мы определяем стандарты для получения данных о решениях для ТЛЧ на ТБ, чтобы гарантировать, что аналитические и клинические оценки отвечают на ключевые вопросы и позволяют провести всесторонний технологический обзор.Мы суммируем наши рекомендации в таблице 1.
Таблица 1.Обзор рекомендаций по дизайну исследования
| Тема . | Рекомендация . |
|---|---|
| Анализ на индекс (например, пропускная способность, поливалентность, связность) в дизайне исследования | |
| Общие соображения по дизайну исследования | • Первоначальные лабораторные аналитические исследования должны подтверждать точность анализа для выявления МТРМЖ и резистентности (может быть охвачен более широкий диапазон мутаций, чем в клиническое исследование) |
| • Производители должны предоставлять данные об инклюзивности и эксклюзивности анализов, желательны данные об обнаружении резистентности в гетерорезистентных образцах | |
| тесты на чувствительность к лекарственным препаратам на образцах пациентов в условиях предполагаемого использования | |
| Население и условия | • В идеале следует выбрать как минимум 3 учреждения из 3 разных регионов ВОЗ, которые отражают эпидемию ТБ и ЛУ-ТБ в странах с высоким бременем |
| • Проведение тестирования в предполагаемых условиях использования (т. е. в референс-лабораториях центрального уровня для высокопроизводительных тестов и в центрах первичной медико-санитарной помощи для малопроизводительных или одноразовых тестов) | |
| • Необходимо установить целевые размеры выборки с учетом целевых показателей эффективности, определенных TPP, для каждого лекарственного средства, к которому в тесте заявлено определение устойчивости.В идеале ширина доверительных интервалов должна составлять ≤5% для оценок специфичности и ≤10% для оценок чувствительности. | |
| Эталонный стандарт и препараты сравнения | • Учитывая необходимость получения комплексной картины лекарственной устойчивости и разрешения расхождений, рекомендуется использование составного эталонного стандарта, который объединяет информацию о секвенировании генотипа и результаты тестирования фенотипической чувствительности |
| • Включить одобренные ВОЗ тесты (т. е. одобренные ВОЗ тесты линейных зондов и анализы Xpert MTB/RIF или Ultra) в качестве компараторов как в аналитических, так и в клинических исследованиях | |
| Проблемы с потоками и образцами индексный, эталонный и компараторный тесты должны выполняться на одном и том же образце, чтобы обеспечить сопоставимость результатов | |
| на культивированном изоляте вместе с эталонными и сравнительными тестами | |
| Ключ требования за пределами точности | • Различные технические и эксплуатационные параметры анализа, которые необходимо оценить, включают время до получения результата, долю недействительных и неопределенных результатов и другие факторы (таблица 2) |
| Тема . | Рекомендация . |
|---|---|
| Анализ на индекс (например, пропускная способность, поливалентность, связность) в дизайне исследования | |
| Общие соображения по дизайну исследования | • Первоначальные лабораторные аналитические исследования должны подтверждать точность анализа для выявления МТРМЖ и резистентности (может быть охвачен более широкий диапазон мутаций, чем в клиническое исследование) |
| • Производители должны предоставлять данные об инклюзивности и эксклюзивности анализов, желательны данные об обнаружении резистентности в гетерорезистентных образцах | |
| тесты на чувствительность к лекарственным препаратам на образцах пациентов в условиях предполагаемого использования | |
| Население и условия | • В идеале следует выбрать как минимум 3 учреждения из 3 разных регионов ВОЗ, которые отражают эпидемию ТБ и ЛУ-ТБ в странах с высоким бременем |
| • Проведение тестирования в предполагаемых условиях использования (т. е. в референс-лабораториях центрального уровня для высокопроизводительных тестов и в центрах первичной медико-санитарной помощи для малопроизводительных или одноразовых тестов) | |
| • Необходимо установить целевые размеры выборки с учетом целевых показателей эффективности, определенных TPP, для каждого лекарственного средства, к которому в тесте заявлено определение устойчивости.В идеале ширина доверительных интервалов должна составлять ≤5% для оценок специфичности и ≤10% для оценок чувствительности. | |
| Эталонный стандарт и препараты сравнения | • Учитывая необходимость получения комплексной картины лекарственной устойчивости и разрешения расхождений, рекомендуется использование составного эталонного стандарта, который объединяет информацию о секвенировании генотипа и результаты тестирования фенотипической чувствительности |
| • Включить одобренные ВОЗ тесты (т. е. одобренные ВОЗ тесты линейных зондов и анализы Xpert MTB/RIF или Ultra) в качестве компараторов как в аналитических, так и в клинических исследованиях | |
| Проблемы с потоками и образцами индексный, эталонный и компараторный тесты должны выполняться на одном и том же образце, чтобы обеспечить сопоставимость результатов | |
| на культивированном изоляте вместе с эталонными и сравнительными тестами | |
| Ключ требования за пределами точности | • Различные технические и рабочие параметры анализа, которые следует оценивать, включают время до получения результата, количество недействительных и неопределенных результатов и другие факторы (таблица 2) |
Обзор рекомендаций по дизайну исследования
| Тема . | Рекомендация . |
|---|---|
| Анализ на индекс (например, пропускная способность, поливалентность, связность) в дизайне исследования | |
| Общие соображения по дизайну исследования | • Первоначальные лабораторные аналитические исследования должны подтверждать точность анализа для выявления МТРМЖ и резистентности (может быть охвачен более широкий диапазон мутаций, чем в клиническое исследование) |
| • Производители должны предоставлять данные об инклюзивности и эксклюзивности анализов, желательны данные об обнаружении резистентности в гетерорезистентных образцах | |
| тесты на чувствительность к лекарственным препаратам на образцах пациентов в условиях предполагаемого использования | |
| Население и условия | • В идеале следует выбрать как минимум 3 учреждения из 3 разных регионов ВОЗ, которые отражают эпидемию ТБ и ЛУ-ТБ в странах с высоким бременем |
| • Проведение тестирования в предполагаемых условиях использования (т. е. в референс-лабораториях центрального уровня для высокопроизводительных тестов и в центрах первичной медико-санитарной помощи для малопроизводительных или одноразовых тестов) | |
| • Необходимо установить целевые размеры выборки с учетом целевых показателей эффективности, определенных TPP, для каждого лекарственного средства, к которому в тесте заявлено определение устойчивости.В идеале ширина доверительных интервалов должна составлять ≤5% для оценок специфичности и ≤10% для оценок чувствительности. | |
| Эталонный стандарт и препараты сравнения | • Учитывая необходимость получения комплексной картины лекарственной устойчивости и разрешения расхождений, рекомендуется использование составного эталонного стандарта, который объединяет информацию о секвенировании генотипа и результаты тестирования фенотипической чувствительности |
| • Включить одобренные ВОЗ тесты (т. е. одобренные ВОЗ тесты линейных зондов и анализы Xpert MTB/RIF или Ultra) в качестве компараторов как в аналитических, так и в клинических исследованиях | |
| Проблемы с потоками и образцами индексный, эталонный и компараторный тесты должны выполняться на одном и том же образце, чтобы обеспечить сопоставимость результатов | |
| на культивированном изоляте вместе с эталонными и сравнительными тестами | |
| Ключ требования за пределами точности | • Различные технические и эксплуатационные параметры анализа, которые необходимо оценить, включают время до получения результата, долю недействительных и неопределенных результатов и другие факторы (таблица 2) |
| Тема . | Рекомендация . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Анализ на индекс (например, пропускная способность, поливалентность, связность) в дизайне исследования | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие соображения по дизайну исследования | • Первоначальные лабораторные аналитические исследования должны подтверждать точность анализа для выявления МТРМЖ и резистентности (может быть охвачен более широкий диапазон мутаций, чем в клиническое исследование) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Производители должны предоставлять данные об инклюзивности и эксклюзивности анализов, желательны данные об обнаружении резистентности в гетерорезистентных образцах | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| тесты на чувствительность к лекарственным препаратам на образцах пациентов в условиях предполагаемого использования | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Население и условия | • В идеале следует выбрать как минимум 3 учреждения из 3 разных регионов ВОЗ, которые отражают эпидемию ТБ и ЛУ-ТБ в странах с высоким бременем | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Проведение тестирования в предполагаемых условиях использования (т. е. в референс-лабораториях центрального уровня для высокопроизводительных тестов и в центрах первичной медико-санитарной помощи для малопроизводительных или одноразовых тестов) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Необходимо установить целевые размеры выборки с учетом целевых показателей эффективности, определенных TPP, для каждого лекарственного средства, к которому в тесте заявлено определение устойчивости.В идеале ширина доверительных интервалов должна составлять ≤5% для оценок специфичности и ≤10% для оценок чувствительности. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эталонный стандарт и препараты сравнения | • Учитывая необходимость получения комплексной картины лекарственной устойчивости и разрешения расхождений, рекомендуется использование составного эталонного стандарта, который объединяет информацию о секвенировании генотипа и результаты тестирования фенотипической чувствительности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Включить одобренные ВОЗ тесты (т. е. одобренные ВОЗ тесты линейных зондов и анализы Xpert MTB/RIF или Ultra) в качестве компараторов как в аналитических, так и в клинических исследованиях | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Проблемы с потоками и образцами индексный, эталонный и компараторный тесты должны выполняться на одном и том же образце, чтобы обеспечить сопоставимость результатов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| на культивированном изоляте вместе с эталонными и сравнительными тестами | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ключ требования за пределами точности | • Различные технические и рабочие параметры анализа, которые необходимо оценить, включают время до получения результата, недействительные и неопределенные показатели и другие факторы (Таблица 2) ТРУБОПРОВОД ДЛЯ ИСПЫТАНИЯ НА ЧУВСТВИТЕЛЬНОСТЬ Тесты ТЛЧ на ТБ предназначены для выявления устойчивости к противотуберкулезным препаратам непосредственно в клинических образцах.Эти анализы могут использоваться в качестве предварительных тестов и включать обнаружение МТРМ или только как рефлекторный тест на положительный результат анализов на обнаружение МТРМ. Анализы ТЛЧ с высокой пропускной способностью обычно используются в референс-лабораториях центрального уровня, включая референс-лаборатории уровня 3 или районные больницы уровня 2, в то время как анализы ТЛЧ с меньшей пропускной способностью могут применяться в центрах уровня 1. Несколько недавно разработанных тестов, которые в настоящее время находятся на пути к одобрению ВОЗ и предназначены для использования в централизованных лабораториях, включают тесты Abbott RealTi m e MTB и MTB RIF/INH (Abbott, Северный Чикаго, Иллинойс), Roche COBAS MTB и Анализ MTB-RIF/INH (Roche Diagnostics, Базель, Швейцария), анализ Hain FluoroType MTBDR (Hain Lifescience GmbH, Нерен, Германия) и анализ BD MAX MDR-TB (Becton Dickinson, Franklin Lakes, NJ) [8– 11].Анализ Abbott RealTi m e MTB может диагностировать MTBC в 94 образцах, при этом положительные образцы возвращаются к анализу RIF/INH для диагностики МЛУ-ТБ в течение 10,5 часов [8, 14]. Анализ Roche COBAS MTB также использует полимеразную цепную реакцию (ПЦР) в реальном времени для обнаружения МТБК и может генерировать результаты для 96 тестов за один 3,5-часовой цикл, с положительными образцами, отраженными в анализе RIF/INH для диагностики МЛУ-ТБ. через 3,5 часа [15]. Анализ Hain FluoroType MTBDR основан на амплификации LATE-PCR и включении/выключении химии для обнаружения MTBC и устойчивости к изониазиду (INH) и RIF для 94 образцов в течение 4 часов [16].В настоящее время разрабатывается новый анализ, способный определять резистентность к FQ и инъекционным препаратам второго ряда (SLI) с использованием той же технологии [13]. Анализ BD Max MDR-TB — это еще один анализ ПЦР в реальном времени, который можно проводить на системе BD MAX для выявления устойчивости к MTBC, INH и RIF в 22 образцах мокроты за 4 часа [11]. Целенаправленные анализы секвенирования следующего поколения также станут вариантом универсального централизованного ТЛЧ на ТБ в ближайшей перспективе [17]. Одним из новых тестов, которые в настоящее время разрабатываются для расширенного ТЛЧ в децентрализованных условиях, является анализ Xpert MTB/XDR (Cepheid), который можно запускать на платформе GeneXpert для обнаружения резистентности к INH, FQ и SLI [12].Анализ Molbio Truenat (MolBio Diagnostics Pvt Ltd, Гоа, Индия), который позволяет обнаруживать резистентность к MTBC и RIF, был недавно одобрен для использования в Индии и проходит испытания для рассмотрения ВОЗ [18]. Обзор дополнительных тестов ТЛЧ, находящихся в разработке или проходящих валидацию или одобрение регулирующих органов, доступен в диагностическом конвейере FIND (Foundation for Innovative New Diagnostics) [19]. Все эти ТЛЧ для ТБ заявляют о высокой чувствительности и специфичности для выявления резистентности в клинических образцах ТБ.Многие из них обладают дополнительными характеристиками, которые имеют дополнительную ценность, в том числе поливалентность, т. е. обнаружение и дифференциация нетуберкулезных микобактерий (НТМ) и вирусов (например, вируса иммунодефицита человека) на одной и той же платформе и/или подключение платформы для облегчения отчетности и обмена результатами. Таблица 2) [5]. Производители должны по возможности предоставлять данные об этих дополнительных характеристиках. Учитывая недавнее обновление рекомендаций ВОЗ по лечению ЛУ-ТБ [20], вполне вероятно, что вскоре будут разработаны новые тесты, которые также будут тестировать устойчивость к более новым препаратам (например, бедаквилину и/или линезолиду), как только молекулярная основа устойчивости к этим препаратам будет определена. препаратов хорошо определен [21].К этим анализам применимы аналогичные соображения по поводу дизайна исследования. Таблица 2. Операционные характеристики анализаa
Аналистические характеристики
ОБЩИЕ ВОПРОСЫ ПРОЕКТИРОВАНИЯ ИССЛЕДОВАНИЯДля оценки точности и надежности новых тестов на ТЛЧ в поддержку процессов разработки политики ВОЗ и стран следует рассмотреть два типа исследований: (1) аналитические исследования в лабораторных условиях для подтверждения предела обнаружения МТБК и определения резистентности; и (2) клинические оценочные исследования для подтверждения диагностической эффективности клинических образцов, собранных из последовательных серий или случайных выборок невыбранных пациентов, нуждающихся в оценке на ТБ и ЛУ-ТБ в местах предполагаемого использования (Приложение 1: Глоссарий).В совокупности эти исследования могут предоставить репрезентативные данные о характеристиках анализов и инструментов для использования в странах с высоким бременем туберкулеза и применимости в различных клинических условиях и группах населения (таблица 3). Оценки простоты использования и другие оценки (см. Таблицу 1 в статье 1 Денкингера и др.) также являются обязательными, но здесь не рассматриваются. Таблица 3.Использование данных аналитических и клинических оценочных исследований для достижения целей a
Использование данных аналитических и клинических оценочных исследований для достижения целей a
АНАЛИТИЧЕСКИЕ ИССЛЕДОВАНИЯНезависимые аналитические исследования дополнят и подтвердят то, что производители производят для проверки своих анализов.Эти исследования следует проводить в лабораторных условиях с использованием анализа, привязанного к дизайну, для оценки пределов обнаружения MTBC и устойчивости, аналитической чувствительности и специфичности, инклюзивности и эксклюзивности, а также обнаружения гетерорезистентности в отношении ряда хорошо охарактеризованных образцов. Предел обнаруженияУчитывая, что проспективные клинические исследования страдают от изменчивости тестируемой популяции пациентов (с течением времени, в разных географических регионах или в разных областях охвата), аналитические исследования предела обнаружения (LoD), выполненные на стандартизированной панели и в сравнении с хорошо охарактеризованными анализами сравнения, могут обеспечить LoD, который можно сравнивать между анализами.В идеале тестирование ПО следует проводить в валидированной матрице мокроты для сбора достаточного количества данных, позволяющего подобрать кривую Пробит и оценить ПО с доверительным интервалом 95%. Учитывая обширные данные, доступные для Xpert MTB/RIF и Ultra, рекомендуется включение любого из анализов в качестве прямого сравнения, чтобы обеспечить сравнительный анализ. Результаты должны подтверждать, что LoD анализа для MTBC эквивалентен или превосходит, по крайней мере, тот, который сообщается для Xpert MTB/RIF [17], в соответствии с критериями TPP [5], хотя снижение чувствительности может быть приемлемым, если другие характеристики анализа значительно улучшат доступность и доступ [22].Тестирование предела обнаружения против Ultra может быть особенно полезным для высокочувствительных анализов ТЛЧ для информирования о включении в алгоритмы тестирования (например, использование в качестве предварительного или рефлекторного теста). Также следует подтвердить LoD для целевых показателей устойчивости к ТЛЧ, поскольку эти оценки, вероятно, будут отличаться от оценок для обнаружения MTBC из-за обнаружения разных и множественных генов-мишеней. В этой оценке, тестирование наиболее распространенных мутаций устойчивости (например, katG 315ACC для устойчивости к INH; rpoB 531TTG для устойчивости к RIF; gyrA 94GGC для устойчивости к FQ; rplC T460C для устойчивости к линезолиду; 901 a-11g для устойчивости к пиразинамиду и rrs A1401G для обнаружения устойчивости к SLI) можно использовать для установления LoD для тестирования устойчивости к некоторым соединениям первого и второго ряда, обнаруживаемым с помощью анализа [23].Анализ линейных зондов (LPA) может быть включен в качестве сравнения для соответствующих лекарственных соединений. В идеале результаты этого тестирования должны подтвердить, что LoD анализа для выявления устойчивости эквивалентен или превосходит одобренные ВОЗ препараты сравнения. Следует отметить, что для оценок ПО следует использовать только генетически и фенотипически хорошо охарактеризованные и количественно определенные образцы. В отсутствие международного стандарта ВОЗ стандартизированная панель для определения динамического диапазона и предела обнаружения доступна от FIND и Zeptometrix [24].Разработчики тестов должны рассмотреть возможность использования по крайней мере 1 лекарственно-чувствительного и 1 лекарственно-устойчивого штамма из такой панели для оценки LoD анализов ТЛЧ, чтобы повысить достоверность LoD анализа как для обнаружения МТБК, так и для обнаружения резистентности. Обнаружение мутаций, вызывающих устойчивостьВ ходе этого аналитического исследования следует также оценить способность обнаруживать мутации в резистентных штаммах. Это необходимо, потому что никакое клиническое исследование разумного масштаба не сможет достичь достаточного разнообразия штаммов и мутаций, придающих резистентность, чтобы адекватно оценить эффективность анализа.В идеале анализы должны быть сопоставлены с панелями мутаций, которые включают мутации устойчивости с высокой степенью достоверности, широко распространенные во всем мире, охватывающие примерно 80–90% известных механизмов устойчивости к любому лекарственному средству. Например, согласно последним данным классификации мутаций, мутации katG 315ACC и inhA C-15T составляют 80,8% глобальных механизмов устойчивости к INH [23]. В идеале, для каждой мутации следует протестировать 3 независимых штамма из разных регионов ВОЗ, чтобы гарантировать высокую воспроизводимость результатов анализа ТЛЧ для эпидемиологически разнообразного набора штаммов с этими соответствующими мутациями резистентности.Следует отметить, что эта оценка требует тестирования на панелях штаммов, которые были фенотипически охарактеризованы с помощью одобренных ВОЗ анализов, включая фенотипическое ТЛЧ на твердых или жидких средах в рекомендуемых критических концентрациях [25], а также секвенирование для определения генетической основы устойчивости. Существующие высококачественные банки штаммов ВОЗ включают Банк штаммов FIND TB с разнообразием генетически и клинически хорошо охарактеризованных устойчивых штаммов и соответствующими клиническими образцами [26], а также Институт тропической медицины (Антверпен, Бельгия) [27, 28], в котором содержится широкий спектр изолятов МТВС. Инклюзивность и эксклюзивностьАналитические исследования должны также оценивать инклюзивность и эксклюзивность анализа ТЛЧ, проверяя реактивность теста в отношении ряда вариантов MTBC (инклюзивность), а также в отношении других организмов (эксклюзивность). Хотя использование эпидемиологически разнообразного набора штаммов во время экспериментов с контрольным заражением мутацией может генерировать данные об инклюзивности анализа, следует позаботиться о том, чтобы анализ был адекватно протестирован против вариантов MTBC.Также должно быть подтверждено, что анализ идентифицирует всех различных представителей MTBC как ТБ. Для проверки исключительности следует протестировать ряд НТМ, а также грамположительных и -отрицательных бактерий, особенно тех, которые присутствуют в оральной флоре и мокроте [29]. Во время этой оценки рекомендуется протестировать не менее 20 клинически значимых НТМ и не менее 10 других бактерий без наблюдаемых перекрестных реакций. Такая панель доступна через Европейскую сеть референс-лабораторий по ТБ, и в настоящее время разрабатывается еще одна панель, которая будет доступна через FIND.Это тестирование может быть дополнено оценкой данных о последовательности in silico с учетом перекрестной реактивности праймеров и зондов для анализа со всеми известными клинически значимыми НТМ и патогенами. Наконец, необходимо оценить интерференционные эффекты НТМ или дезоксирибонуклеиновой кислоты (ДНК) человека в смешанных образцах, чтобы подтвердить функциональность анализа в этих случаях [5]. Обнаружение гетеросопротивленияВыявление гетерорезистентности также следует оценивать в ранних аналитических исследованиях.Репликативные смеси дикого типа и мутантных штаммов или ДНК следует тестировать с помощью анализа в контексте LoD в установленных соотношениях для наиболее распространенных мутаций устойчивости в каждой области гена, включенной в анализ [23]. Эти отношения могут быть более широкими или более узкими в зависимости от типа тестируемого анализа. Например, технология секвенирования следующего поколения, скорее всего, будет иметь более низкий порог для тестирования на устойчивость, и поэтому более узкий диапазон смесей (например, 0,5%, 1%, 2%, 5% и 10% мутант:дикий тип) может быть протестировано по сравнению с анализом в реальном времени (например, 10%, 25%, 50%, 75% и 90% мутант:дикий тип). КЛИНИЧЕСКИЕ ОЦЕНОЧНЫЕ ИССЛЕДОВАНИЯПосле подтверждения адекватной аналитической эффективности следует провести клинические исследования для оценки диагностической эффективности ТЛЧ на пробах пациентов в условиях предполагаемого использования. Данные, полученные в результате этих исследований по точности анализа, можно сопоставить с ранними данными LoD и аналитическими данными. Клинические исследования внесут существенный вклад в установление диагностической специфичности, подкрепят данные, полученные в ходе испытаний на эксклюзивность, и предоставят данные о рабочих характеристиках для определения политики использования. Население и обстановкаКлинические оценки следует проводить в различных условиях, репрезентативных для эпидемии ТБ в странах с высоким бременем, чтобы убедиться, что исследуемая популяция точно отражает целевую популяцию в условиях предполагаемого использования. В идеале для этих исследований следует выбрать как минимум 3 центра из разных регионов ВОЗ. Выбор площадок в различных географических регионах также обеспечит отражение данных об эксплуатационных характеристиках особых проблем, с которыми можно столкнуться в различных условиях.Включение пациентов на основе факторов риска ЛУ-ТБ (например, больных ТБ, ранее леченных) также может быть приемлемой стратегией для увеличения числа пациентов с М/ШЛУ-ТБ в исследованиях ТЛЧ (дополнительная информация о размере выборки приведена ниже). Стандартный образец и компараторыУчитывая важность оценок точности для принятия клинических решений и направления разработки диагностических алгоритмов и клинических руководств, крайне важно, чтобы в оценочные исследования были включены надежный эталонный стандарт и информативные компараторы (таблица 4).В настоящее время культуральные методы ТЛЧ являются наилучшим доступным эталонным стандартом для выявления МТБК и устойчивости, но эти методы не всегда воспроизводимы или точны, особенно для выявления устойчивости [30, 31]. Хотя генотипические методы, такие как секвенирование, можно считать надежным методом подтверждения наличия мутаций, обнаруживаемых с помощью ТЛЧ ТБ, не все механизмы генетической устойчивости известны для каждого препарата, и некоторые мутации могут не быть связаны с устойчивостью. Таблица 4.Преимущества и недостатки эталонных стандартов и компараторов для диагностических исследований ЛУ-ТБ
Преимущества и недостатки эталонных стандартов и компараторов для диагностических исследований ЛУ-ТБ
использование составного эталонного стандарта, объединяющего информацию о генотипическом секвенировании и результаты фенотипического ТЛЧ настоятельно рекомендуется.Преимущество составного эталонного стандарта заключается в том, что он помогает преодолеть ограничения отдельных эталонных тестов: если образец устойчив согласно фенотипическому ТЛЧ или имеет известную мутацию, придающую устойчивость, образец классифицируется как лекарственно-устойчивый, но если оба фенотипически ТЛЧ и секвенирование указывают на чувствительность, образец классифицируется как чувствительный к лекарственным средствам. Поскольку специфичность как фенотипического ТЛЧ, так и секвенирования высока, это создает более надежный эталонный стандарт и позволяет получить более полную картину эффективности диагностического анализа, как видно из недавней оценки Hain MTBDR plus Version 2 (Hain Lifescience GmbH, Nehren, Германия) и LPA Nipro NTM+MDRTB (Nipro Corporation, Осака, Япония) [32]. Включение одобренных ВОЗ тестов в качестве средств сравнения в оценочные исследования также дает возможность сопоставлять и получать более убедительные доказательства для обзора ВОЗ [33]. В частности, включение одобренных ВОЗ LPA и тестов Xpert MTB/RIF и/или Ultra может принести пользу как аналитическим, так и клиническим оценочным исследованиям, поскольку эти тесты, скорее всего, будут нацелены на те же гены-мишени, что и индексные тесты для препаратов первой линии и, в случае анализа второй линии Hain MTBDR sl (Hain Lifescience GmbH, Nehren, Germany) обнаружение резистентности к FQ и SLI.В идеале оценочное исследование должно оценивать диагностическую точность индексного теста по сравнению с фенотипическим ТЛЧ, секвенированием и составным эталонным стандартом, а также сравнивать диагностические характеристики анализа с включенными компараторами. Размер образцаРазмер выборки является критическим фактором при разработке клинических оценочных исследований. Размер выборки должен быть установлен для достижения целевой точности оценок точности. На рис. 1 показано, как повышается точность оценок в зависимости от увеличения размера выборки, а также показано, где повышение точности связано с большими затратами с точки зрения количества набранных пациентов.Для решений TB DST эти оценки могут быть основаны на оценках производительности TPP [5]. В идеале должны быть достигнуты чувствительность >95% и специфичность ≥98% по сравнению с секвенированием для всех препаратов, включенных в анализ, в соответствии с минимально приемлемыми рабочими характеристиками TPP [5]. Кроме того, чувствительность должна быть >90 % для INH, >95 % для RIF и >90 % для FQ по сравнению с фенотипическим ТЛЧ, а специфичность ≥98 % для выявления лекарственной устойчивости к препаратам первого и второго ряда, к которым предназначен тест. в состоянии идентифицировать резистентность [5], с выбранным размером выборки, обеспечивающим высокую достоверность полученных оценок диагностической эффективности.В идеале ширина целевых доверительных интервалов должна составлять ≤5% для оценок специфичности и ≤10% для оценок чувствительности (таблица 5). Оценки размера выборки также должны быть завышены, чтобы учесть количество прогонов индексных и эталонных тестов, которые, как ожидается, дадут неопределенные результаты или ошибки (например, <5% в соответствии с TPP). Расчеты также должны учитывать тот факт, что профили резистентности зарегистрированных пациентов, вероятно, будут различаться в зависимости от учреждения. Например, ожидаемые профили устойчивости к лекарственным препаратам у пациентов, зарегистрированных в справочном центре по ЛУ-ТБ, будут отличаться от профилей, зарегистрированных в централизованной лаборатории в условиях низкой распространенности ТБ. Таблица 5. Пример расчета размера выборкидля клинической оценки анализа ТЛЧ на туберкулез, выявляющего устойчивость к изониазиду и рифампицину
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Нормергич. (85 чел)
Нормергич. (85 чел)