Анестезия при кесаревом сечении | Kukuzya.ru
Эпидуральная анестезия
При операции кесарева сечения возможно использование следующих методик анестезии:
- Региональная анестезия (эпидуральная или спинальная). При таком методе обезболивается только нижняя половина туловища, включая место операции.
- Общая анестезия (эндотрахеальный наркоз).
Эпидуральная анестезия при кесаревом сечении
Эпидуральная анестезия в родах является одним из эффективных методов, однако технически сложнее, чем спинальная и требует наличия специального оборудования и определенной квалификации анестезиолога. Эпидуральную анестезию выполняют для обезболивания как при обычных родах, так и при кесаревом сечении.
Эпидуральную анестезию обычно выполняют, когда роженица сидит прямо или лежит на боку, свернувшись калачиком, чтобы анестезиолог получил оптимальный доступ к позвоночнику. Если пробная доза проходит успешно, то в перидуральном пространстве, обычно, оставляют катетер, через который по мере необходимости добавляется лекарство, доза которого варьируется по мере необходимости.
Показания для эпидуральной анестезии: гестоз — улучшает почечный и плацентарный кровоток; при патологии сердечно-сосудистой системы (снижает нагрузку на сердце и снижает риск осложнений), экстренное кесарево сечение с полным желудком и др.
Противопоказания для эпидуральной анестезии в родах не отличаются от общих противопоказаний: низкое артериальное давление, риск кровопотери, применение антикоагулянтов, воспалительные реакции в месте пункции, отказ пациентки, тяжелые деформации позвоночника, поражения центральной нервной системы.
Возможны осложнения при эпидуральной анестезии: головная боль, боль в спине, артериальная гипотензия, дыхательная недостаточность, нарушение функции мочевого пузыря, аллергия и др.
Спинальная (спинномозговая) анестезия при кесаревом сечении
В большинстве случаев при проведении планового кесарева сечения анестезиологи выбирают спинальную анестезию. При этом роженица находится в бодрствующем состоянии, что обеспечивает безопасность со стороны дыхательных путей, ребенок рождается в хорошем состоянии. Спинальная анестезия также показана при экстренной необходимости осуществления кесарева сечения.
Спинальная анестезия также показана при экстренной необходимости осуществления кесарева сечения.
Методика может использоваться даже при небольшом опыте со стороны анестезиолога; анестезия наступает быстро и обеспечивает хорошие условия для оперирующего хирурга.
Спинальная анестезия выполняется в том же месте, что и эпидуральная, но с некоторыми отличиями: используется более тонкая игла, доза анестетика для спинального блока значительно меньше и вводится он ниже уровня спинного мозга в пространство, содержащее спинномозговую жидкость.
Спинальный блок осуществляют в положении женщины сидя или на боку. Если женщина сидит на краю операционного стола, то ее ступни ног располагаются на подставке, а тело наклоняется вперед и она опирается локтями на колени. Процедура может выполняться и когда женщина лежит на левом боку с максимально согнутыми бедрами и коленями. В любом случае необходимо добиться максимального сгибания спины.
Небольшой участок спины обрабатывают раствором антисептика, затем в пространство между двумя позвонками вводится игла для спинальной анестезии. Через несколько минут после введения препарата наступает блокада нервных волокон в нижней части тела, роженица начинает ощущать тепло, постепенно возникает онемение, снижается чувствительность, расслабляются мышцы нижних конечностей, и хирург может начать операцию уже через 5-7 минут.
Через несколько минут после введения препарата наступает блокада нервных волокон в нижней части тела, роженица начинает ощущать тепло, постепенно возникает онемение, снижается чувствительность, расслабляются мышцы нижних конечностей, и хирург может начать операцию уже через 5-7 минут.
После окончания введения местного анестетка на место пункции накладывается стерильная марлевая салфетка, которая фиксируется лейкопластырем. Роженице никогда не позволяют лежать на спине, так как в таком положении матка сдавливает полую вену, вызывая гипотонию (снижение артериального давления). Поэтому женщина лежит на боку, это достигается или наклоном операционного стола или вставкой валика под правый бок. Матка смещается немного влево и полая вена не сдавливается. Во время операции под спинальной анестезией роженицы дают маску с кислородом.
Как правило, при спинальной анестезии качество обезболивание настолько высокое, что женщина даже не понимает, что ее оперируют, но при возникновении неприятных ощущений, что случается редко, анестезия немедленно будет дополнена введением мощных внутривенных аналгетиков или женщину переведут на общий наркоз.
В зависимости от выбранного препарата блокада может длиться от одного до трёх часов. После отхождения от наркоза возможны не очень приятные ощущения – сильный озноб.
Преимущества спинальной анестезии перед эпидуральной анестезией при кесаревом сечении.
- Эффект развивается в течение нескольких минут: пригодна для обеспечения большинства срочных операций.
- Качество обезболивания выше, чем при эпидуральной анестезии, реже возникает неполное обезболивание.
- Спинальная анестезия технически проще, следовательно, снижает количество неудачных попыток и осложнений.
- Меньшие дозы местных анестетиков в несколько раз сводит к нулю риск токсических реакций.
- Отсутствует такое грозное осложнение при эпидуральной анестезии, как тотальный спинальный блок при непреднамеренном проколе твердой мозговой оболочки.
- Значительно дешевле общей и эпидуральной анестезии.
Преимущества спинальной анестезии перед общей анестезией при кесаревом сечении
- Роженица находится в сознании при появлении на свет ребенка, может услышать первый крик малыша, взять его на руки, в некоторых роддомах разрешают приложить к груди сразу после обработки пуповины, что способствует более раннему появлению лактации и эффективному сокращению матки.

- После общего наркоза первичный восстановительный период длится несколько часов, в течение которых женщина может находиться в заторможенном (полусонном) состоянии, а после спинальной анестезии женщина остается активной и по прибытии в послеоперационную палату, например, может сообщить по телефону радостное известие или заняться ребенком.
- Смертность при спинальной анестезии в несколько раз ниже, чем при общем наркозе, так как нет проблем трудной интубации (введения в гортань через рот специальной трубки с целью устранения нарушения дыхания), полного желудка и т.п.
Противопоказания к спинальной анестезии
- Отказ пациента.
- Отсутствие условий, если нет под рукой средств для реанимации (нет мониторинга, необходимых медикаментов, недостаточная квалификация персонала).
- Кровопотеря, обезвоживание.
- Нарушение свертывания крови, в противном случае может развиться тяжелая гипотония.
- Лечение антикоагулянтами (гепарин, варфарин).
- Сепсис.

- Инфекция кожи в месте пункции.
- Повышенное внутричерепное давление.
- Аллергическая реакция на местные анестетики.
- Брадикардия, нарушения сердечного ритма.
- Дистресс, гипоксия плода.
- Обострение герпетической инфекции.
- Заболевания центральной нервной системы
А также:
- Экстренность, отсутствие времени.
- Пороки развития плода, гибель плода.
- Пороки сердца, декомпенсация сердечной деятельности.
Возможные осложнения при спинальной анестезии
После спинальной анестезии может возникать характерная головная боль, которая может усиливаться при вставании или при подъеме головы и уменьшаться при горизонтальном положении. Может появиться как в день операции, так и на второй или на третий день. Локализация боли может быть любой. В типичных случаях боль возникает в лобной области, переносице, над глазницами и в висках, реже — в других областях.
Боль в спине (в поясничном отделе позвоночника) после анестезии; проходит самостоятельно через несколько дней. Обычно не требуется даже аналгетиков.
Обычно не требуется даже аналгетиков.
Общая анестезия при кесаревом сечении
При кесаревом сечении общая анестезия проводится при наличии противопоказаний к региональной анестезии, а также в тех случаях, когда женщина или оперирующий хирург не хотят, чтобы у роженицы сохранялось сознание во время операции: когда есть угроза для жизни и требуется немедленная операция, поскольку общий наркоз действует быстрее, при подозрении на плотное прикрепление плаценты (если плаценту не удастся отделить вручную производят экстренное удаление матки, а удаление любого органа проводят только под общим наркозом), если местная анестезия не удается.
Основной риск общей анестезии связан с контролем проходимости дыхательных путей. Одно из наиболее грозных осложнений общей анестезии в акушерстве — аспирация желудочного содержимого (всего лишь 30 мл кислого желудочного сока может привести к фатальному пневмониту).
Если предстоит операция под общей анестезией, то препарат для обезболивания введут женщине внутривенно, и через несколько секунд она уснет.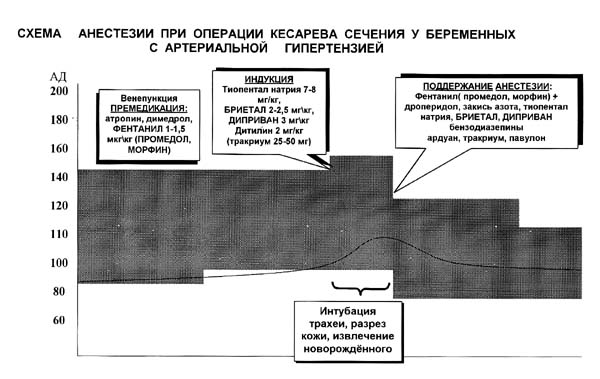 Как только ее мышцы расслабятся, анестезиолог введет в трахею трубку, чтобы обеспечить безопасность легких и контролировать дыхание. При этом женщина находится в бессознательном состоянии и подключена к аппарату для искусственного дыхания. Во время операции контролируется проходимость дыхательных путей и состояние жизненно важных систем организма: измеряется артериальное давление и пульс.
Как только ее мышцы расслабятся, анестезиолог введет в трахею трубку, чтобы обеспечить безопасность легких и контролировать дыхание. При этом женщина находится в бессознательном состоянии и подключена к аппарату для искусственного дыхания. Во время операции контролируется проходимость дыхательных путей и состояние жизненно важных систем организма: измеряется артериальное давление и пульс.
Общий наркоз – метод обезболивания, который на сегодняшний день применяется только в самых экстренных случаях.
© Copyright: kukuzya.ru
Запрещено любое копирование материала без согласия редакции.
Эпидуральная анестезия. В защиту разумного отношения к эпидуральной анестезии
Меня попросили ответить на два письма, полученные Центром традиционного акушерства как реплики на статью «Эпидуральная анестезия: за и против».
Ольга Ч.: «Создаётся ощущение, что подобная статья написана не женщиной, которая сама рожала или ей предстоит этот процесс, а бесчувственным медработником, для которого наблюдение за обезумевшими от мучений рожающими женщинами – явление повседневное, каждодневная работа, как у бухгалтера баланс.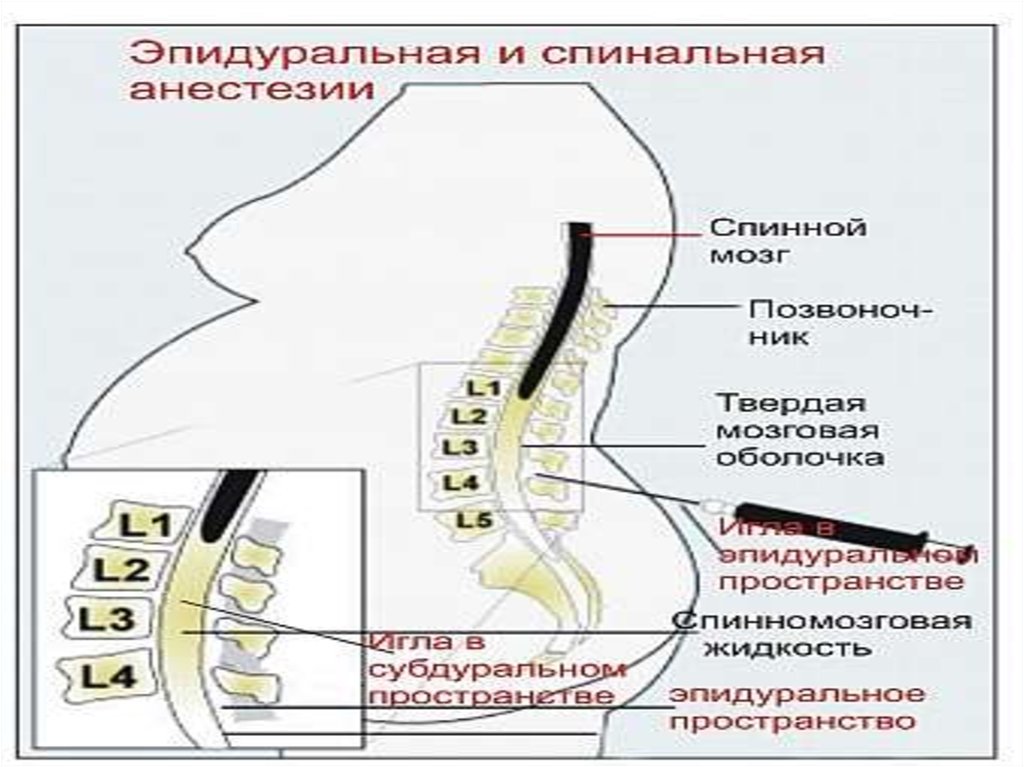 Зная себя, как человека терпеливого, я 17 лет назад пошла рожать с гордым чувством «уж мы-то не позволим себе позориться криком». Ад, который я пережила в ту ночь, не сравнится ни с какими болевыми ощущениями. В итоге всё это завершилось не обычным родовспоможением, как избавлением от нескончаемых мук, а наложением акушерских щипцов. Естественно, в своём полубессознательном состоянии, я и думать не могла, что я помогаю или врежу малышу своим диким криком (я просто этого не могла понимать и, соответственно, как-то регулировать). Не страх убивает разум, а бесконечная, изнуряющая сильная боль. Отчего ж в тот момент мне не сделали обезболивания? Ведь только тогда бы я смогла прочувствовать всю прелесть от осознания того, что я дарю жизнь, и не дала бы моему мальчику начать задыхаться. А последствия пережитого таковы, что не считая долговременной депрессии (это уже такие мелочи в сравнении с процессом и последствиями «родов на живую»), я не смогла стать той же полноценной женщиной для своего мужа ни через 2 месяца, ни через 9 лет, и в итоге мы расстались.
Зная себя, как человека терпеливого, я 17 лет назад пошла рожать с гордым чувством «уж мы-то не позволим себе позориться криком». Ад, который я пережила в ту ночь, не сравнится ни с какими болевыми ощущениями. В итоге всё это завершилось не обычным родовспоможением, как избавлением от нескончаемых мук, а наложением акушерских щипцов. Естественно, в своём полубессознательном состоянии, я и думать не могла, что я помогаю или врежу малышу своим диким криком (я просто этого не могла понимать и, соответственно, как-то регулировать). Не страх убивает разум, а бесконечная, изнуряющая сильная боль. Отчего ж в тот момент мне не сделали обезболивания? Ведь только тогда бы я смогла прочувствовать всю прелесть от осознания того, что я дарю жизнь, и не дала бы моему мальчику начать задыхаться. А последствия пережитого таковы, что не считая долговременной депрессии (это уже такие мелочи в сравнении с процессом и последствиями «родов на живую»), я не смогла стать той же полноценной женщиной для своего мужа ни через 2 месяца, ни через 9 лет, и в итоге мы расстались. Теперь я беременна во второй раз, пошла на это ради второго мужа. И теперь-то я точно знаю, что анестезия — единственно возможное решение, во всяком случае, для меня. Я хочу наслаждаться чудом, которое предстоит, радоваться появлению долгожданного ребёнка, улыбаться мужу, быть с ним вместе в момент появления, не стесняясь своего искажённого муками тела и лица. И после получать удовольствие от жизни, а не жить нескончаемым осознанием своей неполноценности, как женщины, и непроходимыми депрессивными состояниями. Не пойму до сих пор одного: почему только в России-матушке мы живём какими-то наигранными предубеждениями, и для того, чтобы что-то получить, всенепременно нужно сильно настрадаться. Это в наш-то век, когда изобрели способы избавления от мучений, наши врачи настойчиво будут убеждать тебя получить удовольствие от страданий! Под эту дудку и зубы можно по старинке без анестезии лечить, а почему бы и нет? Наши деды терпели и нам надо. А испытаний в жизни и так предостаточно, болью в том числе.
Теперь я беременна во второй раз, пошла на это ради второго мужа. И теперь-то я точно знаю, что анестезия — единственно возможное решение, во всяком случае, для меня. Я хочу наслаждаться чудом, которое предстоит, радоваться появлению долгожданного ребёнка, улыбаться мужу, быть с ним вместе в момент появления, не стесняясь своего искажённого муками тела и лица. И после получать удовольствие от жизни, а не жить нескончаемым осознанием своей неполноценности, как женщины, и непроходимыми депрессивными состояниями. Не пойму до сих пор одного: почему только в России-матушке мы живём какими-то наигранными предубеждениями, и для того, чтобы что-то получить, всенепременно нужно сильно настрадаться. Это в наш-то век, когда изобрели способы избавления от мучений, наши врачи настойчиво будут убеждать тебя получить удовольствие от страданий! Под эту дудку и зубы можно по старинке без анестезии лечить, а почему бы и нет? Наши деды терпели и нам надо. А испытаний в жизни и так предостаточно, болью в том числе. Так что ж вы агитируете (особенно неопытных и нерожавших) на такие муки, оправдывая это какими-то духовно-этическими моментами?! А стоит ли так страдать? Кому как не вам знать, что сильная боль вызывает выработку адреналина, который сокращает сосуды, как результат-гипоксия плода. Кому сделали лучше? И эти ваши лицемерные умозаключения, что любовь – лучшее обезболивающее уж никак не подходят к ситуации с родами. Будьте милосерднее, ведь вы же тоже женщины!»
Так что ж вы агитируете (особенно неопытных и нерожавших) на такие муки, оправдывая это какими-то духовно-этическими моментами?! А стоит ли так страдать? Кому как не вам знать, что сильная боль вызывает выработку адреналина, который сокращает сосуды, как результат-гипоксия плода. Кому сделали лучше? И эти ваши лицемерные умозаключения, что любовь – лучшее обезболивающее уж никак не подходят к ситуации с родами. Будьте милосерднее, ведь вы же тоже женщины!»
Kira: «На какие именно исследования и каких именно гинекологов вы опираетесь, позвольте узнать? Меня просто поражает откровенный цинизм наших медиков. В нашей дикой стране вообще торжество бесправия находит свое наивысшее воплощение, когда человек становится подследственным или пациентом. Все эти рассуждения о пользе боли при родах – просто смехотворны. Почему бы вам, уважаемые врачи, не полечить бы себе зубки без наркоза? Ведь раньше кузнецы их так и драли, а беднягу-пациента в этот момент держали 4 человека. Выживаемость тоже была неплохая, обезболивание при родах в цивилизованных странах применяется со времен королевы Виктории. А в нашей стране страдание, боль и унижение пациентов, в том числе и женщин в родильных домах, воспринимаются как неотъемлемая часть общего ритуала. Женщины в данном случае с этим мирятся просто потому, что им просто не с чем сравнивать, а желание вырваться из гестапо живой и здоровой и со здоровым (ну хотя бы относительно) ребенком подавляет чувство собственного достоинства. Отсюда результат: никто и не посмеет возразить на клизмы, бритье и отсутствие нормального обезболивания. Если же женщина просит обезболивание – она уже все: слабая, избалованная, наглая и вообще не «наша» женщина. Уважаемые врачи! Живите в ногу со временем, учитесь у западных коллег — они ушли от вас лет на 30 вперед во всех отношениях. Особенно учитесь отношению к пациентам. А если вы не умеете делать эпидуральную анестезию грамотно, так научитесь, а не охаивайте метод. Вы ссылаетесь на труды западных гинекологов, так чтобы быть до конца объективными, приведите статистику применения эпидуральной анестезии в западных странах, а также статистику кесаревых (последнее, кстати, делается в цивилизованных странах по желанию пациентки, в отличие от нашей страны, где врачи с пеной у рта доказывают, какая это сверхопасная и сложная операция, которая должна делаться строго по показаниям).
А в нашей стране страдание, боль и унижение пациентов, в том числе и женщин в родильных домах, воспринимаются как неотъемлемая часть общего ритуала. Женщины в данном случае с этим мирятся просто потому, что им просто не с чем сравнивать, а желание вырваться из гестапо живой и здоровой и со здоровым (ну хотя бы относительно) ребенком подавляет чувство собственного достоинства. Отсюда результат: никто и не посмеет возразить на клизмы, бритье и отсутствие нормального обезболивания. Если же женщина просит обезболивание – она уже все: слабая, избалованная, наглая и вообще не «наша» женщина. Уважаемые врачи! Живите в ногу со временем, учитесь у западных коллег — они ушли от вас лет на 30 вперед во всех отношениях. Особенно учитесь отношению к пациентам. А если вы не умеете делать эпидуральную анестезию грамотно, так научитесь, а не охаивайте метод. Вы ссылаетесь на труды западных гинекологов, так чтобы быть до конца объективными, приведите статистику применения эпидуральной анестезии в западных странах, а также статистику кесаревых (последнее, кстати, делается в цивилизованных странах по желанию пациентки, в отличие от нашей страны, где врачи с пеной у рта доказывают, какая это сверхопасная и сложная операция, которая должна делаться строго по показаниям).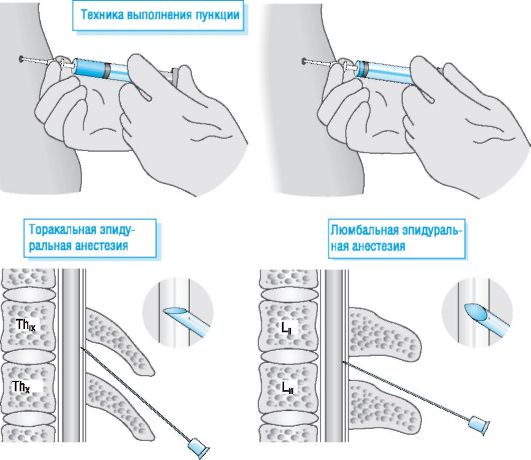 Ну, если эта эпидуральная анестезия так плоха, то почему же она так массово применяется в Европе и Америке? Или мы такие бедные потому, что такие умные? Ольга, Ч — всех вам благ. Выберете себе обезболивание по душе и родите ребенка с радостью и достоинством.
Ну, если эта эпидуральная анестезия так плоха, то почему же она так массово применяется в Европе и Америке? Или мы такие бедные потому, что такие умные? Ольга, Ч — всех вам благ. Выберете себе обезболивание по душе и родите ребенка с радостью и достоинством.
Ответ доктора Вероники Назаровой.
Обезболивание в родах: многоликая правда
Признаться, я разделяю негодование жестоко пострадавших мам по поводу бесчувственных врачей, родов, подобных пыткам, унижения женщин в нашем здравоохранении! И это они еще не все знают, мы как врачи знаем гораздо больше и от того нам еще больнее и страшнее. Именно это заставило нас решиться практиковать иное акушерство, а для этого обратиться к корням, к традиции. Поверьте, официально практиковать в нашей стране акушерство с индивидуальным, гуманным и щадящим подходом очень непросто. С обезболиванием все обстоит гораздо лучше.
К несчастью ли или к счастью, вы, дорогие Кира и Ольга, просто не в курсе всей сложности этой темы – обезболивания в акушерстве. Если б вы просто пребывали в своем счастливом неведении, я бы не стала вас разубеждать. Однако вы, сами того не ведая, проповедуете опасные вещи и публично обвиняете нас в намеренной жестокости. Поэтому мне придется ответить. Желающие оставаться при своем не слишком компетентном мнении могут дальше не читать.
Если б вы просто пребывали в своем счастливом неведении, я бы не стала вас разубеждать. Однако вы, сами того не ведая, проповедуете опасные вещи и публично обвиняете нас в намеренной жестокости. Поэтому мне придется ответить. Желающие оставаться при своем не слишком компетентном мнении могут дальше не читать.
Противники ли мы эпидуральной анестезии? Скажите, вы за протезирование ног у инвалида или против? Вы за бифокальные очки для слабовидящих или против? Вы сторонник использования кровезаменителей или противник? Что за дурацкие вопросы! Те, кто в этом нуждаются, должны это иметь, правда? Или в нормальной, «недикой» стране все это должно предлагаться или навязываться всем гражданам поголовно? Абсолютно то же с анестезией: те немногие, которые в ней действительно нуждаются, должны ее иметь. Ну, право же, поверьте: не всем в родах непереносимо больно, а кое-кому не больно вообще! Мерить же человечность и цивилизованность государства обилием анестезии в родах – примерно то же, что судить о ней по тому, насколько широко применяются там мощные антибиотики при насморке.
Это только кажется, что сделали тебе анестезию – и все проблемы решены: лежишь себе, ничего не чувствуя, а как придет время малышу родиться – так и рожаешь. На деле же почти всегда происходит следующее: под действием эпидуральной анестезии схватки становятся слабее, приходится их усиливать с помощью окситоцина. Вводимый внутривенно синтетический окситоцин вызывает неестественный для этих мамы и ребенка ритм схваток, что ведет к страданию ребенка (в схватку кислорода к нему поступает меньше) и его травматичному продвижению по родовым путям матери (ее ткани не успевают растянуться). К тому же мама обездвижена (и нередко уже вскрыт плодный пузырь), из-за чего у ребенка меньше возможности правильно вставить головку в отверстие таза матери). Очень часто при этой анестезии потуги не наступают самостоятельно, и мама недостаточно чувствует свое тело, чтобы тужиться произвольно. Тогда ребенка «выжимают» из материнского тела, давя на живот (этот прием запрещен в Европе). Таким образом, давление на шейные позвонки ребенка, и без того значительное, усиливается. Здесь советую вам обратиться к книге известного детского невролога проф. А. Ратнера «Неврология новорожденных», где показана связь между акушерскими манипуляциями и их последствиями в виде родовой травмы шейного отдела позвоночника у малыша (эта замечательная книга доступна для чтения в Интернете). Поскольку ткани мамы не растягиваются в своем ритме, во избежание сильных разрывов делают разрез промежности. Посчитайте сами количество медицинских вмешательств. Не обольщайтесь: одного обезболивания с последующим естественным течением процесса не будет. Роды будут медикаментозно-технологическим родоразрешением до конца.
Здесь советую вам обратиться к книге известного детского невролога проф. А. Ратнера «Неврология новорожденных», где показана связь между акушерскими манипуляциями и их последствиями в виде родовой травмы шейного отдела позвоночника у малыша (эта замечательная книга доступна для чтения в Интернете). Поскольку ткани мамы не растягиваются в своем ритме, во избежание сильных разрывов делают разрез промежности. Посчитайте сами количество медицинских вмешательств. Не обольщайтесь: одного обезболивания с последующим естественным течением процесса не будет. Роды будут медикаментозно-технологическим родоразрешением до конца.
Если делать эпидуральную анестезию по правилам, то нужно владеть искусством применить ее вовремя: не слишком рано и не слишком поздно. У здоровой женщины переходный период схваток, на этапе раскрытия 8 – 10 см, очень часто сопровождается ощущением «я больше не могу». Мамы требуют анестезии, но в этот момент делать ее нельзя: матери невозможно будет вытужить ребенка. Женщине тут нужно еще немного терпения – ребенок родится совсем скоро.
Готова вновь и вновь напоминать: роды – не пассивный процесс восприятия вами медицинского вмешательства, а рождение матерью своего ребенка. Роды – не медицинская процедура, а явление сексуальной жизни (это не метафора, с точки зрения гормонального баланса и необходимых условий это так). То, что иногда требуется медицинская помощь, сути не меняет. Массовое обращение к медицине в родах и поголовное применение акушерских вмешательств – это всего лишь культурный стереотип, а не необходимость.
Теперь о пользе и риске. К эпидуральной анестезии нельзя относиться как к услуге. Это медицинское вмешательство скорее можно сравнивать с операцией на спинном мозге, чем с косметической процедурой вроде липосакции. Даже при нынешней надежной, безопасной и вооруженной «до зубов» медицинской технологии здесь может быть большое количество осложнений, причем для двух человек. Неудивительно, ведь даже простое лекарство от кашля, даже таблетка от головной боли могут быть опасны (почитайте инструкцию!) Поэтому на эти операции в родах нужно именно решаться, выбирая из двух зол меньшее, а не производить всем подряд и не подавать «на заказ», как блюдо в ресторане. Кстати, врачи это прекрасно знают, поэтому перед этими вмешательствами вам предложат подписать документ, отражающий ваше согласие на них, а также то, что о возможных осложнениях вы предупреждены. Есть ситуации, когда эпидуральная анестезия может быть благотворна и спасительна.
Кстати, врачи это прекрасно знают, поэтому перед этими вмешательствами вам предложат подписать документ, отражающий ваше согласие на них, а также то, что о возможных осложнениях вы предупреждены. Есть ситуации, когда эпидуральная анестезия может быть благотворна и спасительна.
Эпидуральная анестезия: положительные стороны эпидуральной анестезии
- Облегчает боль в родах и дает возможность отдыха, когда боль объективно мучительна, а также при затяжных родах (например, ребенок неправильно вставляет головку в отверстие малого таза). Вероятно, это и был Ваш случай, Ольга. Я уверена в неадекватности медицинской помощи в Вашей ситуации: нужно было либо вовремя сделать обезболивание, либо решиться на кесарево сечение – иногда только так можно избежать тяжелой травмы у мамы и ребенка.
- Снижает уровень катехоламинов (адреналина).
- Показана при повышенном артериальном давлении (ведет к его снижению).
- Оптимальна для кесарева сечения.
- Может облегчить раскрытие шейки матки и приблизить потуги.

- Эпидуральная анестезия лучше внутривенного введения наркотических препаратов (промедола).
- Теперь перечислим, какие возможны осложнения.
Эпидуральная анестезия: отрицательные стороны эпидуральной анестезии для мамы
- Возможны многомесячные головные боли; если происходит прокол твердой мозговой оболочки. А такое случается у 3%, то есть 70% таких мам страдают головными болями.
- Возможны многомесячные боли в спине.
- Возможно снижение артериального давления, что потребует находиться в родах в положении лежа и, возможно, надо будет вводить жидкости внутривенно.
- Заставляет женщину лежать и тем самым убирает действие гравитации, помогающей продвижению ребенка, становится невозможно менять позы.
- Для продолжения родов может потребоваться стимуляция схваток – введение окситоцина (особенно в первых родах).

- Может возникнуть неприятная дрожь.
- Выше риск того, что потребуются щипцы и вакуум-экстракция (это увеличивает возможность травматизма, недержания кала и мочи у мамы впоследствии).
- Выше вероятность того, что потребуется кесарево сечение (особенно если эпидуральная анестезия сделана слишком рано, и в первых родах).
- Может вызвать послеродовую задержку мочи.
- Может вызвать подъем температуры у мамы до 38 С из-за нарушения терморегуляции через центральную нервную систему (такую лихорадку очень трудно отличить от инфекции, соответственно выше риск получить антибиотики после родов «на всякий случай»).
- Может затруднить потуги.
- Может вызвать зуд лица, шеи, груди.
- Может привести к септическому менингиту (внесение инфекции при проколе и длительном нахождении катетера).
- Может возникнуть гематома из-за повреждения сосудов эпидурального пространства.
- Может быть подтекание спинномозговой жидкости после родов.

- Может случиться гидротравма спинного мозга (лекарство вводится под давлением), а также повреждение иглой, с последующей невозможностью ходить, нарушениями процессов мочеиспускания и дефекации.
- Может проявиться аллергия на препараты для эпидуральной анестезии.
- Обезболивание может получиться неудовлетворительным: односторонним или сегментарным (участками), — а весь букет вышеперечисленных рисков – с вами.
Эпидуральная анестезия: отрицательные стороны эпидуральной анестезии для ребенка
- Нередко частота сокращений сердца ребенка падает, обычно на 40 минут; это требует мониторирования и часто трактуется как гипоксия (страдание от недостатка кислорода) и как показание к кесареву сечению. Падение ЧСС связано с падением давления у мамы и снижением маточно-плацентарного кровотока.
- Возможны дыхательные нарушения (в случае применения так называемой мобильной, «ходячей» эпидуральной анестезии, при которой вводятся наркотики) у родившегося ребенка; могут потребоваться механическая вентиляция, интубация, госпитализация.

- Нередко у ребенка возникает дезориентация, нарушение моторики, затруднение сосания, после эпидуральной анестезии у мамы детям в 5 раз чаще ставят диагноз энцефалопатии.
- Нарушается установление связи «мать-ребенок».
- Дети матерей, у которых повышалась температура, чаще получают антибиотики.
Я намеренно не расшифровываю всю медицинскую терминологию: тот, кто хочет – посмотрит в словаре, остальным будет достаточно бегло просмотреть, чтобы впечатлиться. Все эти сведения взяты из вполне открытых источников – авторитетных отечественных и зарубежных (краткий список литературы я привожу ниже). Посмотрите также форумы акушеров-гинекологов и анестезиологов на Русском Медицинском сервере: там вы увидите ситуацию такой, какой она видится специалистам – во всей сложности, непредсказуемости.
Как же несведущей в медицине маме разобраться, да еще и во время схваток: по делу предлагают ей анестезию или просто по заведенному порядку? Для этого у нее должна быть своя акушерка – не просто та, что сидит рядом как «психолог», не та, что лишь вытянет, вымоет и взвесит ребенка, а специалист в области физиологических (то есть нормальных, естественных родов), «медицинский адвокат», который всегда на ее стороне.
Теперь о сравнении со стоматологами, которое лежит на поверхности и потому так часто приводится. Лечение зубов под местной или общей анестезией сравнивать с анестезией в родах неправомерно, потому что:
- лечение зубов – борьба с болезнью, а роды – естественный физиологический процесс,
- лечение зубов не требует вашего активного участия, а роды – требуют.
Роды – это как управление автомобилем. Вы – машина, а ребенок водитель. Поставьте себя на место ребенка. При анестезии машина перестает слушаться руля! Ни сесть поудобнее в кресле, ни остановиться передохнуть, ни поменять скорость, ни заправиться вы не можете – вас несет чуждая неведомая сила. Попробуйте поразмышлять на эту тему.
Вы – машина, а ребенок водитель. Поставьте себя на место ребенка. При анестезии машина перестает слушаться руля! Ни сесть поудобнее в кресле, ни остановиться передохнуть, ни поменять скорость, ни заправиться вы не можете – вас несет чуждая неведомая сила. Попробуйте поразмышлять на эту тему.
С нашей точки зрения, эпидуральная анестезия нужна и оправдана примерно в 5-10 (максимум!) случаях из 100. Однако разве существует всего две возможности: роды с анестезией и роды, как вы пишете, «на живую»? Есть ли обезболивание в акушерстве, пригодное для большинства женщин, помимо эпидуральной анестезии, морфиноподобных анальгетиков (наркотиков) и общего наркоза? Да. И эти методы весьма действенны. Они не нарушают взаимодействия матери и ребенка, помогают маме расслабляться, раскрываться и принимать правильные позы, а ребенку продвигаться. Это различные позиции, дыхание, присутствие надежного и спокойного помощника, массаж, вода. В большинстве случаев этого достаточно! Об этом говорит наш многолетний акушерский опыт, мировой опыт традиционного акушерства, современные научные исследования.
Заметьте: мы не только не отрицаем, но высоко ценим достижения фармакологии и медицинской технологии, умеем ими пользоваться. Неоценимы антибиотики при тяжелых инфекциях, нет равных эпидуральной анестезии при кесаревом сечении, а последнее – бесценно для спасения жизни, гуманны наркотики в онкологии, поражают воображение возможности техники для реанимации и выхаживания недоношенных! Однако применять их в каждом втором случае? Или просто потому что «заказал» клиент? Придумайте сами, как такое явление назвать.
Что толку знать, что в некоторых (в том числе не самых развитых) странах количество случаев применения анестезии доходит до 80%, а кесарева сечения – до 40-70%? Цыплят по осени считают. Хорошо это или плохо – будет известно, когда вырастут эти дети.
Автор: Врач Вероника Назарова, семейный врач, акушер, мать троих детей, рожала самостоятельно, без вмешательств и анестезии, мечтаю родить еще.
Эпидуральная анестезия при кесаревом сечении у беременной женщины с синдромом Марфана и дуральной эктазией
2017; 2017: 2126310.Опубликовано в Интернете 22 мая 2017 г. doi: 10.1155/2017/2126310
, 1 , 2 , * , 3 , 3 , 4 и 4
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
Синдром Марфана (СМФ) представляет собой генетическое заболевание соединительной ткани, характеризующееся различными клиническими проявлениями и мультисистемными осложнениями. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
Синдром Марфана (MFS) представляет собой аутосомно-доминантное наследственное заболевание соединительной ткани; его заболеваемость оценивается примерно в 1 : 5000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинико-инструментальная диагностика основана на соблюдении Гентских критериев, предложенных в 1996, De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al. в 2010 году [3]. Некоторые проявления проявляются с детства (например, эктопия хрусталика), тогда как другие проявляются позднее, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом. В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинико-инструментальная диагностика основана на соблюдении Гентских критериев, предложенных в 1996, De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al. в 2010 году [3]. Некоторые проявления проявляются с детства (например, эктопия хрусталика), тогда как другие проявляются позднее, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом. В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Как сообщается в литературе, акушерское ведение женщин с MFS в настоящее время хорошо закодировано, с благоприятным исходом, если диаметр корня аорты менее 40 мм. Увеличение размера аорты во время беременности не является уникальным явлением у женщин с MFS, но известно, что оно происходит во время нормальной здоровой беременности и с повышенной степенью тяжести у женщин с преэклампсией [6].
В некоторых недавних рекомендациях женщинам с MFS рекомендуется избегать беременности или, в качестве альтернативы, пройти хирургическую замену восходящей аорты до зачатия, если размеры аорты > 4 см [7]. 9[8]. Риск повышается при диаметре корня аорты >40 мм, при быстром увеличении размеров аорты или в контексте расслоения в семейном анамнезе [9].
Однако наличие эктазии твердой мозговой оболочки считается основной причиной неудачи местно-регионарной анестезии во время кесарева сечения. Целью данного исследования является представление случая беременной женщины с MFS в сроке с обширной дуральной эктазией, у которой было успешное кесарево сечение с эпидуральной анестезией во время ее второй беременности.
Ф. С., 35 лет, рост 180 см, вес 85 кг, пациентка с MSF с пояснично-крестцовой твердой мозговой оболочкой, перенесшая кесарево сечение на сроке 37 недель и 3 дня беременности. Она сообщает, что мать была очень высока и внезапно умерла в возрасте до 50 лет; ее дедушка по материнской линии тоже был особенно высоким, а ее брат был миопиком и тяжелым сколиозом. Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия. На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Акушерский анамнез: предыдущее кесарево сечение в 2004 г. без осложнений. После спинномозговой анестезии была проведена спинно-блокадная анестезия, которая была переведена в общую. В послеоперационном периоде у нее было кровотечение из-за атонии матки, лечилась окситоцином и простагландинами и выздоравливала в реанимации. Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозным расширением некоторых нервных корешков. Это открытие является одним из основных диагностических критериев MFS. В 2009, у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты. Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия.
Это открытие является одним из основных диагностических критериев MFS. В 2009, у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты. Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии. Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением. Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3.
Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии. Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением. Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила. Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина. Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м.
Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила. Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина. Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату. Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте – 9., а через пять минут было 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату. Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте – 9., а через пять минут было 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
MFS представляет собой аутосомно-доминантное заболевание соединительной ткани, связанное с мутацией гена фибриллина, гликопротеина, который является основным компонентом внеклеточных микрофибрилл, чей ген картируется в хромосоме 15. MFS поражает различные органы и системы различной степени тяжести: для по этой причине его диагностика в основном клинико-инструментальная, а затем молекулярная. Он основан на наблюдении Гентских критериев и пересмотренных критериев [10].
Он основан на наблюдении Гентских критериев и пересмотренных критериев [10].
В литературе имеется много примеров ведения беременных с РС [9–13]. Беременность можно рассматривать как относящуюся к группе низкого риска при отсутствии выраженной дилатации аорты и митральной недостаточности. У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
Бета-адреноблокаторы снижают риск дилатации аорты и сердечных осложнений, но они, по-видимому, повышают тонус и сократительную способность матки и могут снижать кровоток в пупочной артерии, вызывая низкий вес новорожденных. У нашей беременной они не применялись.
У нашей беременной они не применялись.
Эктазия твердой мозговой оболочки является одним из основных критериев диагностики MFS и присутствует более чем у 2/3 пораженных взрослых [14–16], а распространенность тяжелого (степени 2 и 3) поражения твердой мозговой оболочки выше у пациенты, несущие преждевременные мутации терминирующего кодона, по сравнению с теми, кто несет миссенс-мутации [17]. Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18]. Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности. Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 9%.2%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19–21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16].
Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности. Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 9%.2%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19–21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов. Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов. Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Очевидно, что для наилучшего ведения родов и родоразрешения пациенток с MFS основной целью является снижение сердечно-сосудистого стресса, и кесарево сечение часто выполняется для предотвращения сердечно-сосудистых осложнений. Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22]. Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22].
Колебания гемодинамических параметров, вторичные по отношению к боли и тревоге при родах, могут оказывать негативное влияние на сердечно-сосудистую систему; высокое кровяное давление имеет тенденцию к развитию аневризм аорты из-за ослабления сосудистой среды у пациентов с MFS, а ишемия миокарда и сердечная недостаточность также могут быть вызваны повышенной потребностью миокарда в кислороде, что приводит к высокому кровяному давлению; таким образом, основной целью является предотвращение высокого кровяного давления [23]. По всем этим причинам часто планируют кесарево сечение.
Тип анестезии также обсуждался. Общая анестезия вызывает колебания артериального давления во время интубации; поэтому периферическая анестезия предпочтительнее из-за медленного начала и постепенного прогрессирования эпидуральной блокады. Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение.
В некоторых исследованиях регионарная анестезия успешно применялась у пациенток с MFS как во время обезболивания родов, так и во время кесарева сечения. Комбинированная спинально-эпидуральная анестезия предпочтительнее общей анестезии при кесаревом сечении у пациентов с MFS, поскольку комбинированная спинально-эпидуральная анестезия обеспечивает превосходную гемодинамическую стабильность, а адекватный послеоперационный контроль боли может быть достигнут с помощью эпидуральной анальгезии. Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25]. Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинальную анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS. Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS. Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Таким образом, обследование беременных женщин с MFS требует междисциплинарного подхода при тесном сотрудничестве гинеколога, кардиолога, анестезиолога и неонатолога. Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии.
Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
1. Пириц Р. Э., МакКьюсик В. А. Синдром Марфана: диагностика и лечение. Медицинский журнал Новой Англии . 1979; 300(14):772–777. doi: 10.1056/nejm197
3001406. [PubMed] [CrossRef] [Google Scholar]2. De Paepe A., Devereux R.B., Dietz H.C., Hennekam R.C.M., Pyeritz R.E. Пересмотренные диагностические критерии синдрома Марфана. Американский журнал медицинской генетики . 1996;62(4):417–426. doi: 10.1002/(sici)1096-8628(19960424)62:4<417::aid-ajmg15>3.0.co;2-r. [PubMed] [CrossRef] [Google Scholar]
3. Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10. 1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]
1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]
4. Paternoster D.M., Santarossa C., Vettore N., et al. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]
5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]
6. Истерлинг Т. Р., Бенедетти Т. Дж., Шумейкер Б. С. и соавт. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]
7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты. Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]
8. Regitz-Zagrosek V., Lundqvist C.B., Borghi C., et al. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) Европейский кардиологический журнал . 2011; 32:3147–3197. [PubMed] [Google Scholar]
Regitz-Zagrosek V., Lundqvist C.B., Borghi C., et al. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) Европейский кардиологический журнал . 2011; 32:3147–3197. [PubMed] [Google Scholar]
9. Meijboom L.J., Vos F.E., Timmermans J., Boers G.H., Zwinderman A.H., Mulder B.J.M. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование. Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar]
10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar]
11. Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed][CrossRef][Google Scholar]
Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed][CrossRef][Google Scholar]
12. Buser R.T., Mordecai M.M., Brull S.J. Комбинированная спинально-эпидуральная анальгезия в родах у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar]
13. Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана. Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar]
14. Pyeritz R.E., Fishman E.K., Bernhardt B.A., Siegelman S.S. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Fattori R. , Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar]
, Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar]
16. Ahn N.U., Sponseller PD, Ahn UM, Nallamshetty L., Kuszyk B.S., Zinreich S.J. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar]
17. Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике. Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar]
18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни. Журнал нейрохирургии: позвоночник . 2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar]
Журнал нейрохирургии: позвоночник . 2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar]
19. Lundby R., Rand-Hendriksen S., Hald J.K., et al. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ . Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar]
21. Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar]
22. Рахман Дж., Рахман Ф. З., Рахман В., Аль-Сулейман С. А., Рахман М. С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины . 2003; 48: 723–728. [PubMed] [Google Scholar]
З., Рахман В., Аль-Сулейман С. А., Рахман М. С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины . 2003; 48: 723–728. [PubMed] [Google Scholar]
23. Ким Д. В., Лим Ю. Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef] [Google Scholar]
24. МакКусик В.А. Синдром Марфана, МФС. Онлайн менделевское наследование у человека. OMIM, MIM № 154700, Балтимор (MD): Университет Джона Хопкинса, 2003.
25. Fettes P.D.W., Jansson J.-R., Wildsmith J.A.W. Неудачная спинальная анестезия: механизмы, лечение и профилактика. Британский журнал анестезии . 2009;102(6):739–748. doi: 10.1093/bja/aep096. [PubMed] [CrossRef] [Google Scholar]
26. Lacassie H.J., Millar S., Leithe L.G., et al. Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинномозговой анестезии у двух рожениц с синдромом Марфана. Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar]
Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar]
27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Эпидуральная анестезия при кесаревом сечении у беременной с синдромом Марфана и дуральной эктазией
На этой странице
) — генетическое заболевание соединительной ткани, характеризующееся вариабельными клиническими проявлениями и мультисистемными осложнениями. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
1. Введение
Синдром Марфана (СМФ) представляет собой аутосомно-доминантное наследственное заболевание соединительной ткани; его заболеваемость оценивается примерно в 1 : 5000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинико-инструментальная диагностика основана на соблюдении Гентских критериев, предложенных в 1996, De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al. в 2010 году [3]. Некоторые проявления проявляются с детства (например, эктопия хрусталика), тогда как другие проявляются позднее, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом. В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Клинико-инструментальная диагностика основана на соблюдении Гентских критериев, предложенных в 1996, De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al. в 2010 году [3]. Некоторые проявления проявляются с детства (например, эктопия хрусталика), тогда как другие проявляются позднее, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом. В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Как сообщается в литературе, акушерское ведение женщин с MFS в настоящее время хорошо закодировано, с благоприятным исходом, если диаметр корня аорты менее 40 мм. Увеличение размера аорты во время беременности не является уникальным явлением у женщин с MFS, но известно, что оно происходит во время нормальной здоровой беременности и с повышенной степенью тяжести у женщин с преэклампсией [6].
Увеличение размера аорты во время беременности не является уникальным явлением у женщин с MFS, но известно, что оно происходит во время нормальной здоровой беременности и с повышенной степенью тяжести у женщин с преэклампсией [6].
В некоторых недавних рекомендациях женщинам с MFS рекомендуется избегать беременности или, в качестве альтернативы, пройти хирургическую замену восходящей аорты до зачатия, если размеры аорты > 4 см [7]. 9[8]. Риск повышается при диаметре корня аорты >40 мм, при быстром увеличении размеров аорты или в контексте расслоения в семейном анамнезе [9].
Однако наличие эктазии твердой мозговой оболочки считается основной причиной неудачи местно-регионарной анестезии во время кесарева сечения. Целью данного исследования является представление случая беременной женщины с MFS в сроке с обширной дуральной эктазией, у которой было успешное кесарево сечение с эпидуральной анестезией во время ее второй беременности.
2. История болезни
Ф. С., 35 лет, рост 180 см, вес 85 кг, пациентка с MSF с эктазией пояснично-крестцовой твердой мозговой оболочки, перенесшая кесарево сечение на сроке 37 недель и 3 дня беременности. Она сообщает, что мать была очень высока и внезапно умерла в возрасте до 50 лет; ее дедушка по материнской линии тоже был особенно высоким, а ее брат был миопиком и тяжелым сколиозом. Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия. На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум.
С., 35 лет, рост 180 см, вес 85 кг, пациентка с MSF с эктазией пояснично-крестцовой твердой мозговой оболочки, перенесшая кесарево сечение на сроке 37 недель и 3 дня беременности. Она сообщает, что мать была очень высока и внезапно умерла в возрасте до 50 лет; ее дедушка по материнской линии тоже был особенно высоким, а ее брат был миопиком и тяжелым сколиозом. Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия. На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Акушерский анамнез: предыдущее кесарево сечение в 2004 г. без осложнений. После спинномозговой анестезии была проведена спинно-блокадная анестезия, которая была переведена в общую. В послеоперационном периоде у нее было кровотечение из-за атонии матки, лечилась окситоцином и простагландинами и выздоравливала в реанимации. Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозным расширением некоторых нервных корешков. Это открытие является одним из основных диагностических критериев MFS. В 2009, у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты. Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия.
Это открытие является одним из основных диагностических критериев MFS. В 2009, у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты. Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии. Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением. Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3.
Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии. Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением. Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила. Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина. Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м.
Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила. Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина. Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м.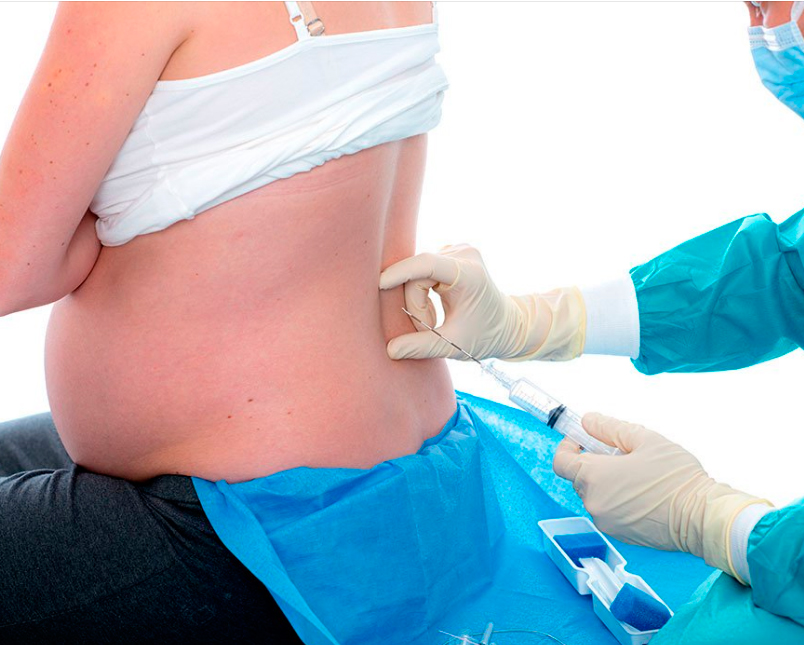 были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату. Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте – 9., а через пять минут было 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату. Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте – 9., а через пять минут было 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
3. Обсуждение
MFS — аутосомно-доминантное заболевание соединительной ткани, связанное с мутацией гена фибриллина, гликопротеина, который является основным компонентом внеклеточных микрофибрилл, чей ген картирован на хромосоме 15. MFS затрагивает различные органы и системы. с разной степенью тяжести: по этой причине ее диагностика в основном клинико-инструментальная, а затем молекулярная.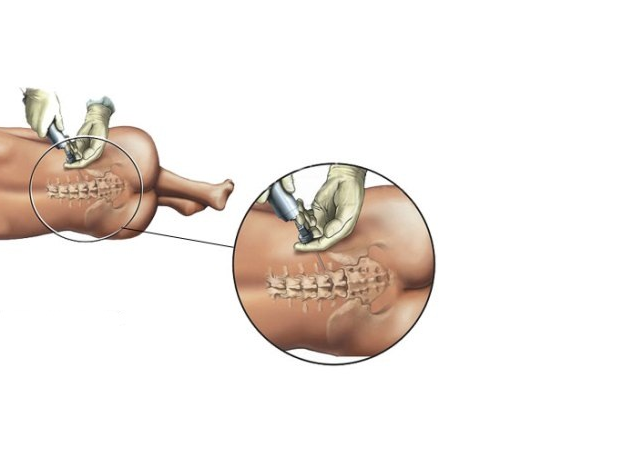 Он основан на наблюдении Гентских критериев и пересмотренных критериев [10].
Он основан на наблюдении Гентских критериев и пересмотренных критериев [10].
В литературе имеется много примеров ведения беременных с РС [9–13]. Беременность можно рассматривать как относящуюся к группе низкого риска при отсутствии выраженной дилатации аорты и митральной недостаточности. У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
Бета-адреноблокаторы снижают риск дилатации аорты и сердечных осложнений, но они, по-видимому, повышают тонус и сократительную способность матки и могут снижать кровоток в пупочной артерии, вызывая низкий вес новорожденных. У нашей беременной они не применялись.
У нашей беременной они не применялись.
Эктазия твердой мозговой оболочки является одним из основных критериев диагностики MFS и присутствует более чем у 2/3 пораженных взрослых [14–16], а распространенность тяжелого (степени 2 и 3) поражения твердой мозговой оболочки выше у пациенты, несущие преждевременные мутации терминирующего кодона, по сравнению с теми, кто несет миссенс-мутации [17]. Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация ликвора в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18]. Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности. Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 9%.2%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19–21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16].
Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности. Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 9%.2%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19–21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов. Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов. Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Очевидно, что для наилучшего ведения родов и родоразрешения пациенток с MFS основной целью является снижение сердечно-сосудистого стресса, и кесарево сечение часто выполняется для предотвращения сердечно-сосудистых осложнений. Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22]. Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22].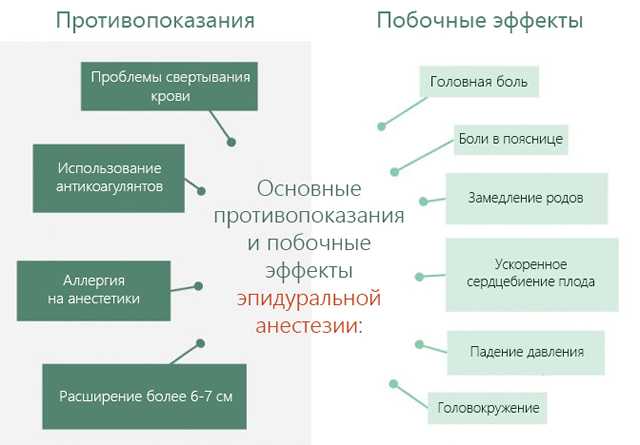
Колебания гемодинамических параметров, вторичные по отношению к боли и тревоге при родах, могут оказывать негативное влияние на сердечно-сосудистую систему; высокое кровяное давление имеет тенденцию к развитию аневризм аорты из-за ослабления сосудистой среды у пациентов с MFS, а ишемия миокарда и сердечная недостаточность также могут быть вызваны повышенной потребностью миокарда в кислороде, что приводит к высокому кровяному давлению; таким образом, основной целью является предотвращение высокого кровяного давления [23]. По всем этим причинам часто планируют кесарево сечение.
Тип анестезии также обсуждался. Общая анестезия вызывает колебания артериального давления во время интубации; поэтому периферическая анестезия предпочтительнее из-за медленного начала и постепенного прогрессирования эпидуральной блокады. Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение.
В некоторых исследованиях регионарная анестезия успешно применялась у пациенток с MFS как во время обезболивания родов, так и во время кесарева сечения. Комбинированная спинально-эпидуральная анестезия предпочтительнее общей анестезии при кесаревом сечении у пациентов с MFS, поскольку комбинированная спинально-эпидуральная анестезия обеспечивает превосходную гемодинамическую стабильность, а адекватный послеоперационный контроль боли может быть достигнут с помощью эпидуральной анальгезии. Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25]. Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинальную анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения.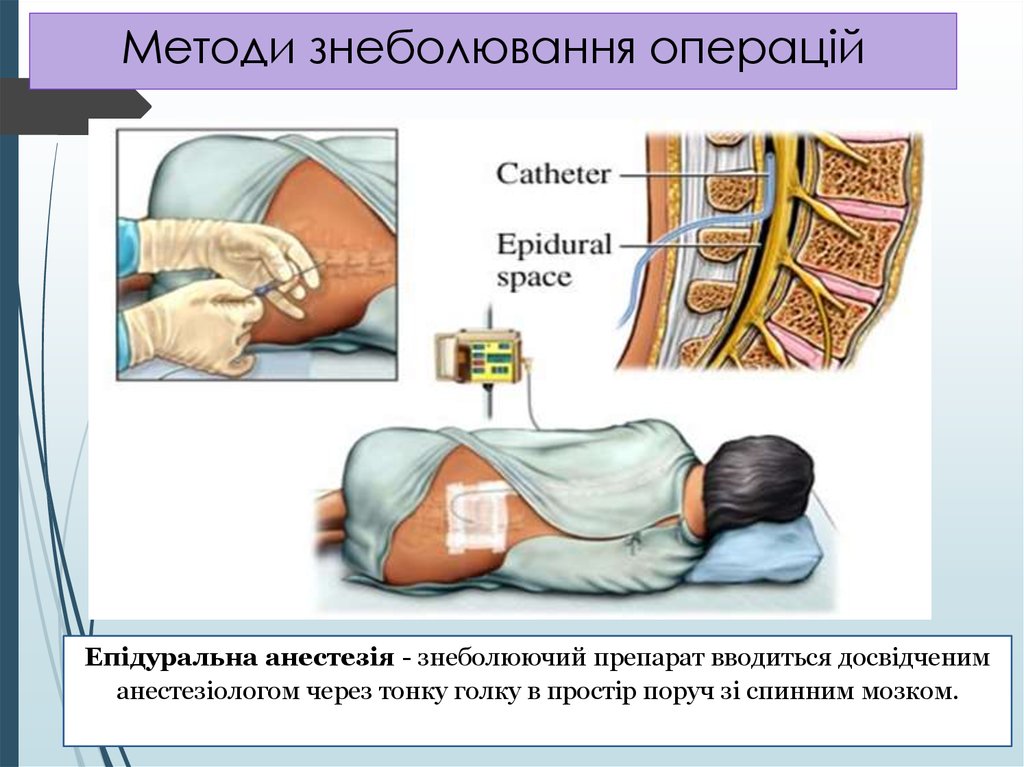 Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS. Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS. Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Таким образом, обследование беременных женщин с MFS требует междисциплинарного подхода при тесном сотрудничестве гинеколога, кардиолога, анестезиолога и неонатолога. Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии.
Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией этой статьи.
Ссылки
R. E. Pyeritz и V. A. McKusick, «Синдром Марфана: диагностика и лечение», The New England Journal of Medicine , vol. 300, нет. 14, стр. 772–777, 1979.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. De Paepe, R. B. Devereux, HC Dietz, RCM Hennekam и R. E. Pyeritz, «Пересмотренные диагностические критерии синдрома Марфана», Американский журнал медицинской генетики , том. 62, нет. 4, стр. 417–426, 1996.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Б.
 Л. Лоейс, Х. К. Дитц, А. К. Браверман и др., «Пересмотренная нозология Гента для синдрома Марфана», Journal of Medical Genetics , vol. 47, нет. 7, стр. 476–485, 2010.
Л. Лоейс, Х. К. Дитц, А. К. Браверман и др., «Пересмотренная нозология Гента для синдрома Марфана», Journal of Medical Genetics , vol. 47, нет. 7, стр. 476–485, 2010.Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. М. Патерностер, К. Сантаросса, Н. Ветторе и др., «Акушерские осложнения при беременности с синдромом Марфана», стр. 9.0221 Minerva Ginecologica , vol. 50, pp. 441–443, 1999.
Посмотреть по адресу:
Google Scholar
П. Бейгтон, А. Де Пэпе, Д. Данкс и др., «Международная нозология наследственных заболеваний соединительной ткани», Берлин , 1986», Американский журнал медицинской генетики , vol. 29, pp. 581–589, 1988.
Просмотр по адресу:
Google Scholar
Т. Р. Истерлинг, Т.
 Дж. Бенедетти, Б. К. Шумейкер и др., «Материнская гемодинамика и диаметр аорты при нормальной и гипертонической беременности», Акушерство и гинекология , том. 78, стр. 1073–1077, 1991.
Дж. Бенедетти, Б. К. Шумейкер и др., «Материнская гемодинамика и диаметр аорты при нормальной и гипертонической беременности», Акушерство и гинекология , том. 78, стр. 1073–1077, 1991.Посмотреть по адресу:
Google Scholar
Л. Ф. Хирацка, Г. Л. Бакрис, Дж. А. Бекман и др., «ACCF/AHA/AATS/ACR/ASA/SCA/SCA/SCA Рекомендации SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты», Journal of the American College of Cardiology , vol. 55, pp. e27–129, 2010.
Посмотреть по адресу:
Google Scholar
V. Regitz-Zagrosek, C.B. Lundqvist, C. Borghi et al., «Руководство ESC по лечению сердечно-сосудистых заболеваний во время беременности» : рабочая группа по лечению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC)», European Heart Journal , vol.
 32, pp. 3147–3197, 2011.
32, pp. 3147–3197, 2011.Просмотр по адресу:
Google Scholar
Л. Дж. Мейбум, Ф. Э. Вос, Дж. Тиммерманс, Г. Х. Бурс, А. Х. Цвиндерман и Б. Дж. М. Малдер, «Дж. М. синдром Марфана: проспективное исследование», European Heart Journal , vol. 26, нет. 9, стр. 914–920, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Лалчандани и М. Вингфилд, «Беременность у женщин с синдромом Марфана», стр. 9.0221 Европейский журнал акушерства, гинекологии и репродуктивной биологии , том. 110, нет. 2, стр. 125–130, 2003 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
U. Elkayam, E. Ostrzega, A. Shotan и A. Mehra, «Сердечно-сосудистые проблемы у беременных женщин с синдромом Марфана», Annals of Internal Medicine , vol.
 123, нет. 2, стр. 117–122, 1995.
123, нет. 2, стр. 117–122, 1995.Посмотреть по адресу:
Сайт издателя | Google Scholar
R. T. Buser, M. M. Mordecai, and S. J. Brull, «Комбинированная спинально-эпидуральная анальгезия при родах у пациентки с синдромом Марфана», Международный журнал акушерской анестезии , том. 16, нет. 3, стр. 274–276, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Дж. Липскомб, Дж. К. Смит, Б. Кларк, П. Доннай и Р. Харрис, «Исходы беременности у женщин с синдромом Марфана», , Международный журнал акушерства и гинекологии , том. 104, нет. 2, стр. 201–206, 1997.
Посмотреть по адресу:
Сайт издателя | Академия Google
Pyeritz R.E., Fishman E.K., Bernhardt B.A. и Siegelman S.S. «Эктазия твердой мозговой оболочки является общей чертой синдрома Марфана», American Journal of Human Genetics , vol.
 43, нет. 5, pp. 726–732, 1988.
43, нет. 5, pp. 726–732, 1988.Просмотр по адресу:
Google Scholar
Р. Фаттори, К. А. Нинабер, Б. Дескович и др., «Важность дуральной эктазии в фенотипической оценке синдрома Марфана», Ланцет , том. 354, нет. 9182, стр. 910–913, 1999.
Просмотр:
Сайт издателя | Google Scholar
Н. У. Ан, П. Д. Спонселлер, У. М. Ан, Л. Налламшетти, Б. С. Кушик и С. Дж. Зинрайх, «Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана», Spine , vol. 25, нет. 12, стр. 1562–1568, 2000.
Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Attanasio, E. Pratelli, M.C. Porciani et al., «Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике», Европейский журнал медицинской генетики , том.
 56, нет. 7, стр. 356–360, 2013.
56, нет. 7, стр. 356–360, 2013.Посмотреть по адресу:
Сайт издателя | Google Scholar
A. A. Sánchez, C. D. Iglesias, C. D. López et al., «Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: отчет о клиническом случае», Journal of Neurosurgery: Spine , vol. 8, нет. 5, стр. 487–489, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Лундби, С. Рэнд-Хендриксен, Дж. К. Халд и др., «Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль», Американский журнал нейрорадиологии , том. 30, нет. 8, стр. 1534–1540, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Г. М. Виллейрс, А. Дж. Ван Тонгерлоо, К. Л.
 Верстраете, М. Ф. Куннен и А. М. Де Паепе, «Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ», Neuroradiology , vol. 41, нет. 11, стр. 850–854, 1999.
Верстраете, М. Ф. Куннен и А. М. Де Паепе, «Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ», Neuroradiology , vol. 41, нет. 11, стр. 850–854, 1999.Посмотреть по адресу:
Сайт издателя | Академия Google
N. C. Ho, D. W. Hadley, P. K. Jain и C. A. Francomano, «Случай 47: дуральная эктазия, связанная с синдромом Марфана», Radiology , vol. 223, нет. 3, стр. 767–771, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Рахман, Ф. З. Рахман, В. Рахман, С. А. Аль-Сулейман и М. С. Рахман, «Акушерские и гинекологические осложнения у женщин под общей анестезией», Журнал репродуктивной медицины , том. 48, стр. 723–728, 2003.
Посмотреть по адресу:
Google Scholar
Д.
 В. Ким и Ю. Г. Лим, «Отчет о синдроме Марфана под общей анестезией», Korean Journal of Anesthesiology , vol. 26, нет. 5, стр. 1055–1058, 1993.
В. Ким и Ю. Г. Лим, «Отчет о синдроме Марфана под общей анестезией», Korean Journal of Anesthesiology , vol. 26, нет. 5, стр. 1055–1058, 1993.Посмотреть по адресу:
Сайт издателя | Google Scholar
В. А. МакКусик, синдром Марфана, МФС. Онлайн менделевское наследование у человека. OMIM, MIM № 154700, Балтимор (MD): Университет Джона Хопкинса, 2003 г.
P.D.W. Fettes, J.-R. Янссон и Дж. А. В. Уайлдсмит, «Неудачная спинномозговая анестезия: механизмы, лечение и профилактика», British Journal of Anesthesia , vol. 102, нет. 6, стр. 739–748, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х. Дж. Лакасси, С. Миллар, Л. Г. Лейте и др., «Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинальной анестезии у двух рожениц с синдромом Марфана», British Journal of Anesthesia , том.


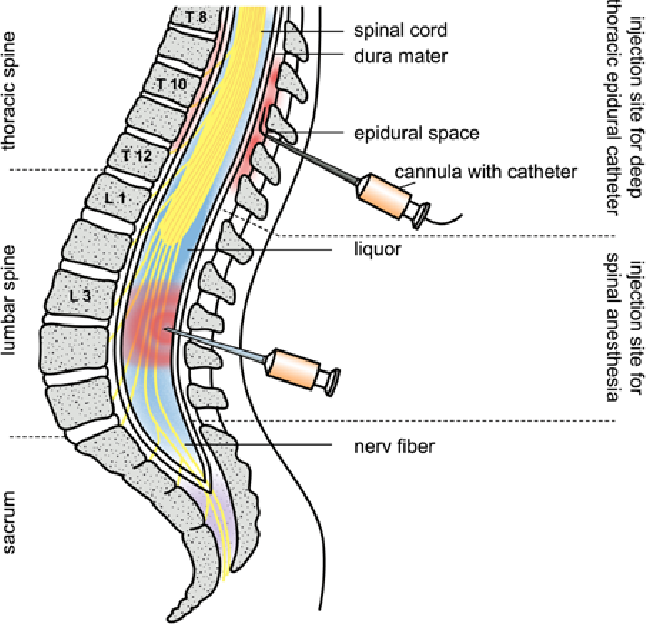


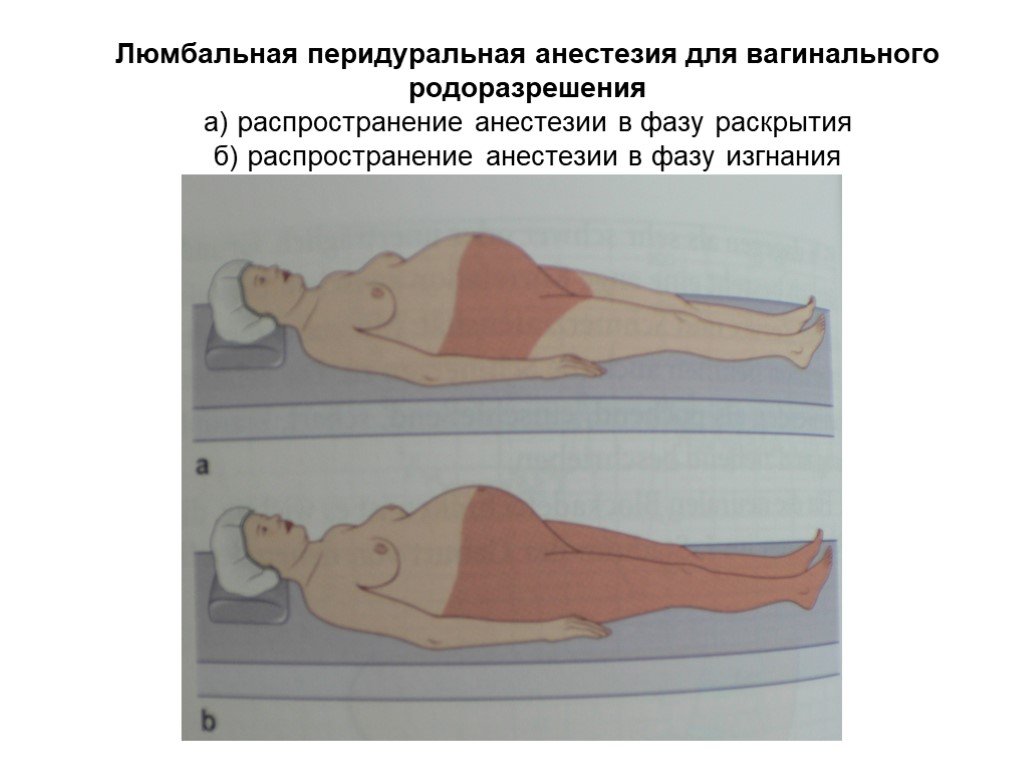
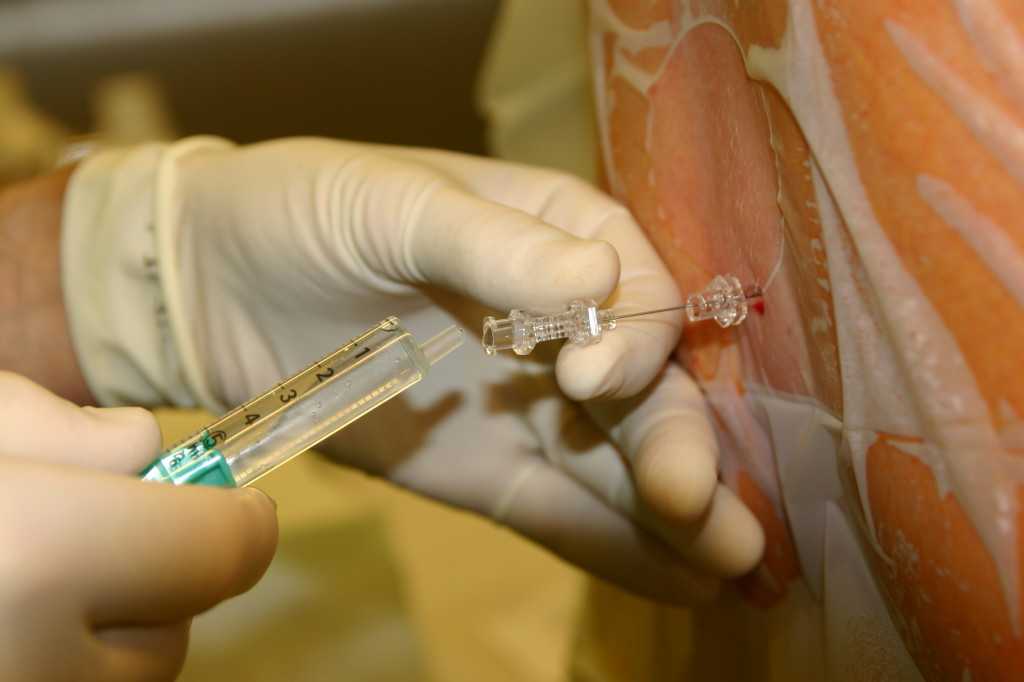
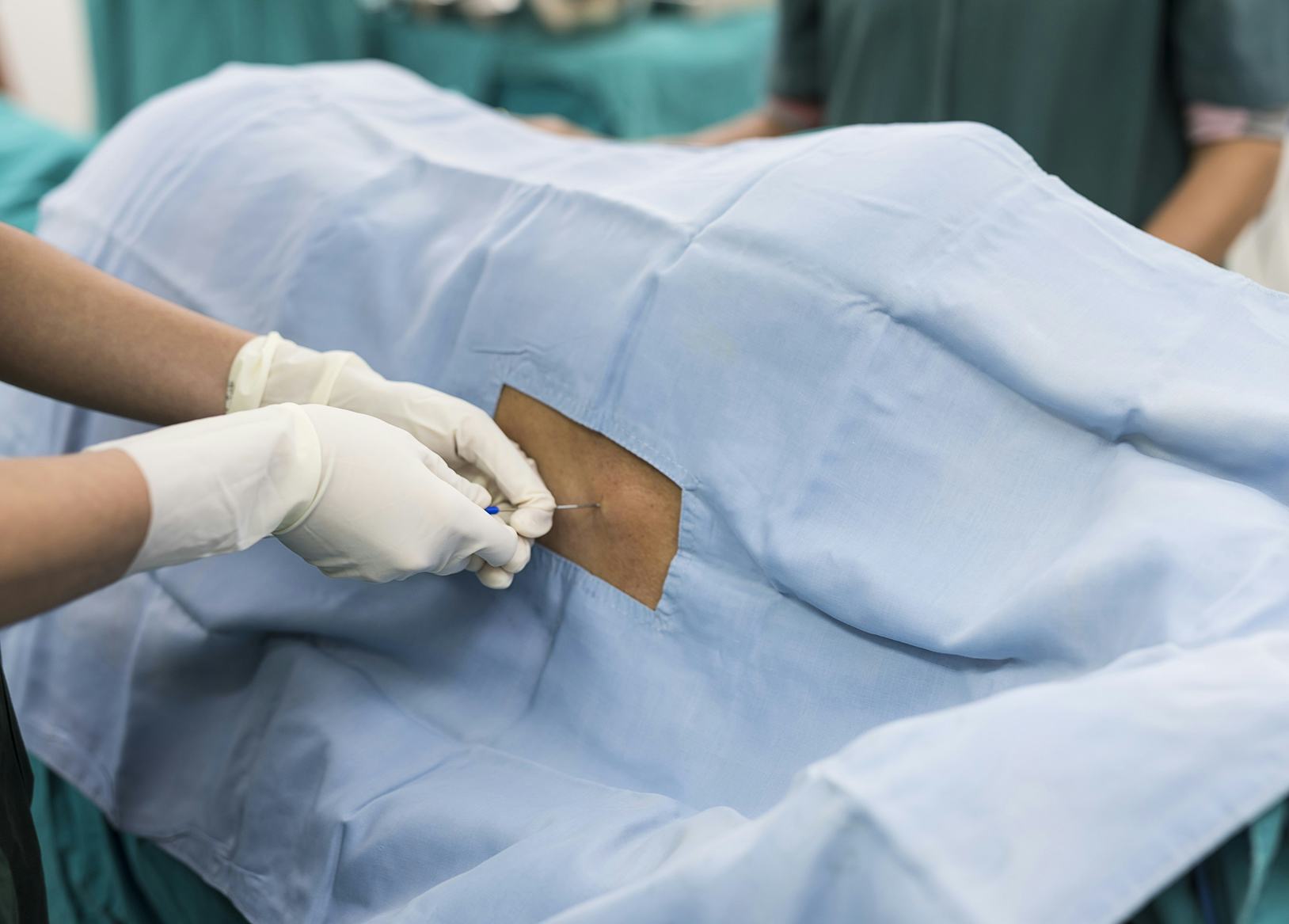
 Л. Лоейс, Х. К. Дитц, А. К. Браверман и др., «Пересмотренная нозология Гента для синдрома Марфана», Journal of Medical Genetics , vol. 47, нет. 7, стр. 476–485, 2010.
Л. Лоейс, Х. К. Дитц, А. К. Браверман и др., «Пересмотренная нозология Гента для синдрома Марфана», Journal of Medical Genetics , vol. 47, нет. 7, стр. 476–485, 2010. Дж. Бенедетти, Б. К. Шумейкер и др., «Материнская гемодинамика и диаметр аорты при нормальной и гипертонической беременности», Акушерство и гинекология , том. 78, стр. 1073–1077, 1991.
Дж. Бенедетти, Б. К. Шумейкер и др., «Материнская гемодинамика и диаметр аорты при нормальной и гипертонической беременности», Акушерство и гинекология , том. 78, стр. 1073–1077, 1991. 32, pp. 3147–3197, 2011.
32, pp. 3147–3197, 2011. 123, нет. 2, стр. 117–122, 1995.
123, нет. 2, стр. 117–122, 1995. 43, нет. 5, pp. 726–732, 1988.
43, нет. 5, pp. 726–732, 1988.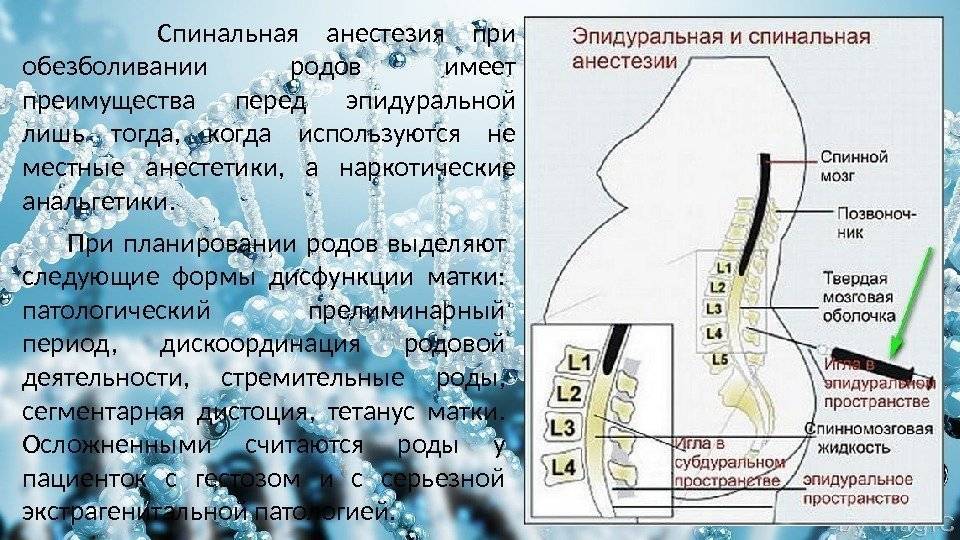 56, нет. 7, стр. 356–360, 2013.
56, нет. 7, стр. 356–360, 2013. Верстраете, М. Ф. Куннен и А. М. Де Паепе, «Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ», Neuroradiology , vol. 41, нет. 11, стр. 850–854, 1999.
Верстраете, М. Ф. Куннен и А. М. Де Паепе, «Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ», Neuroradiology , vol. 41, нет. 11, стр. 850–854, 1999. В. Ким и Ю. Г. Лим, «Отчет о синдроме Марфана под общей анестезией», Korean Journal of Anesthesiology , vol. 26, нет. 5, стр. 1055–1058, 1993.
В. Ким и Ю. Г. Лим, «Отчет о синдроме Марфана под общей анестезией», Korean Journal of Anesthesiology , vol. 26, нет. 5, стр. 1055–1058, 1993.