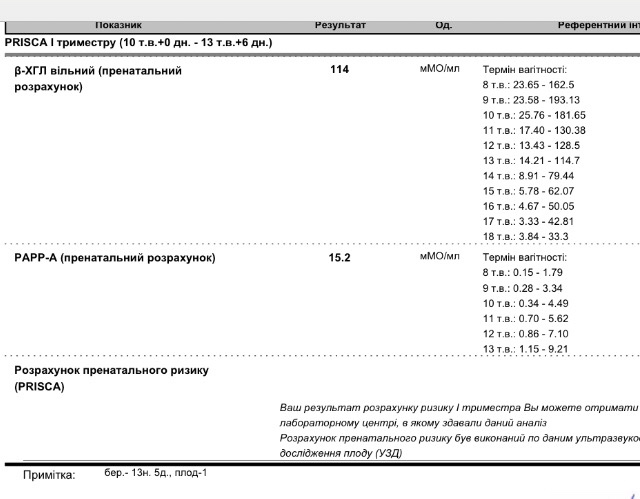
PAPP-A (ассоциированный с беременностью протеин А)
Зачем проходить обследование
Как и большинство исследований при беременности, данный анализ позволяет выявить патологии плода и оценить риски выкидыша, преждевременных родов и дать прогнозы по течению беременности.
В первую очередь исследование назначается для того, чтобы выявить или наоборот исключить хромосомные аномалии плода, такие как синдром Дауна.
Мы рекомендуем пройти данное обследование на 9–13 неделе беременности, поскольку именно в этот период анализ будет максимально информативным.
Показания к обследованию
Анализ PAPP-A входит в группу стандартных анализов на первом триместре беременности. При наличии следующих факторов риска, этому исследованию уделяется особое внимание:
- выкидыши и тяжелое течение беременности в прошлом;
- возраст выше 35 лет;
- хромосомные аномалии и другие патологии плода при предыдущих беременностях;
- наследственные патологии;
- облучение;
- перенесенные тяжелые инфекционные и другие заболевания;
- прием на ранних сроках беременности или незадолго до нее лекарств с тератогенным эффектом.

Подготовка к анализу
Правила подготовки к PAPP-А анализу такие же, как и к любому другому анализу крови. В первую очередь следует отказаться от жирной пищи и алкоголя за сутки до исследования. Кровь на анализ сдают утром, строго натощак.
Исказить результаты могут чрезмерные физические нагрузки и стрессы. Необходимо учитывать это при подготовки к анализу.
Показатели нормы
Норма РАРР-А в крови:
10 неделя — 0,58–1,73 мЕд/мл; 11 неделя — 0,92–2,78 мЕд/мл;
12 неделя — 1,50–4,50 мЕд/мл; 13 неделя — 2,42–7,26 мЕд/мл.
Норма РАРР-А при беременности — 0,5–2,0 МоМ.
Если РАРР-А повышен, то риск хромосомного заболевания у плода не высокий, а если снижен — обязательно пройти УЗИ и Бета ХГЧ, только о прохождении всех анализов, можно говорить о наличии или отсутствии патологии у плода.
Пренатальный скрининг — самая полная информация
В Центре иммунологии и репродукции уже много лет успешно работает программа пренатального скрининга
 Наших специалистов приглашают читать лекции на специализированных конференциях, в других клиниках. Наша лаборатория получает стабильно хорошие оценки в системе контроля качества. Специально обученные специалисты проводят расчет рисков.
Наших специалистов приглашают читать лекции на специализированных конференциях, в других клиниках. Наша лаборатория получает стабильно хорошие оценки в системе контроля качества. Специально обученные специалисты проводят расчет рисков.Содержание
Что такое пренатальная диагностика?
Слово «пренатальный» означает «дородовый». Поэтому термин «пренатальная диагностика» означает любые исследования, позволяющие уточнить состояние внутриутробного плода. Поскольку жизнь человека начинается с момента зачатия, различные проблемы со здоровьем могут быть не только после рождения, но и до рождения. Проблемы могут быть разными:
- довольно безобидными, с которыми плод может справиться сам,
- более серьезными, когда своевременная медицинская помощь сохранит здоровье и жизнь внутриутробного пациента,
- достаточно тяжелыми, с которыми современная медицина справиться не может.
Для выяснения состояния здоровья внутриутробного плода используются методы пренатальной диагностики, к которым относятся ультразвуковое исследование, кардиотокография, различные биохимические исследования и пр.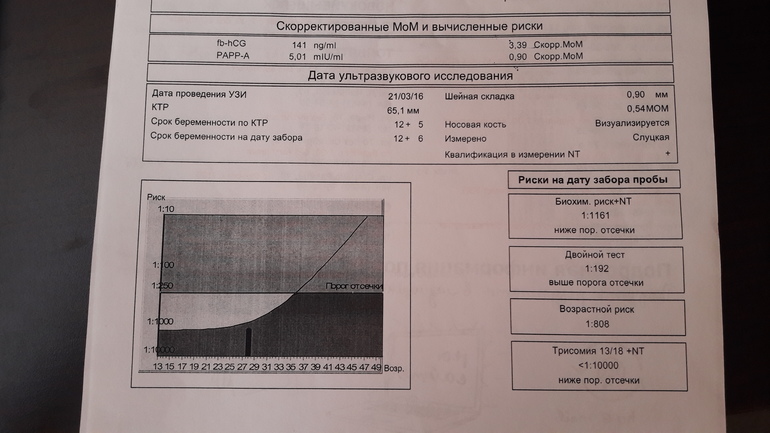 Все эти методы имеют разные возможности и ограничения. Некоторые методы вполне безопасны, как, например, ультразвуковое исследование. Некоторые сопряжены с определенным риском для внутриутробного плода, например, амниоцентез (проба околоплодных вод) или биопсия ворсинок хориона.
Все эти методы имеют разные возможности и ограничения. Некоторые методы вполне безопасны, как, например, ультразвуковое исследование. Некоторые сопряжены с определенным риском для внутриутробного плода, например, амниоцентез (проба околоплодных вод) или биопсия ворсинок хориона.
Понятно, что методы пренатальной диагностики, сопряженные с риском осложнений беременности, должны применяться только в том случае, когда для их использования имеются веские показания. Для того, чтобы максимально сузить круг пациенток, нуждающихся в инвазивных (т. е. связанных с вмешательством в организм) методах пренатальной диагностики, используется выделение групп риска развития тех или иных проблем у внутриутробного плода.
Что такое группы риска?
Группами риска являются такие группы пациенток, среди которых вероятность обнаружения той или иной патологии беременности выше, чем во всей популяции (среди всех женщин данного региона). Существуют группы риска по развитию невынашивания беременности, гестоза (позднего токсикоза), различных осложнений в родах и т.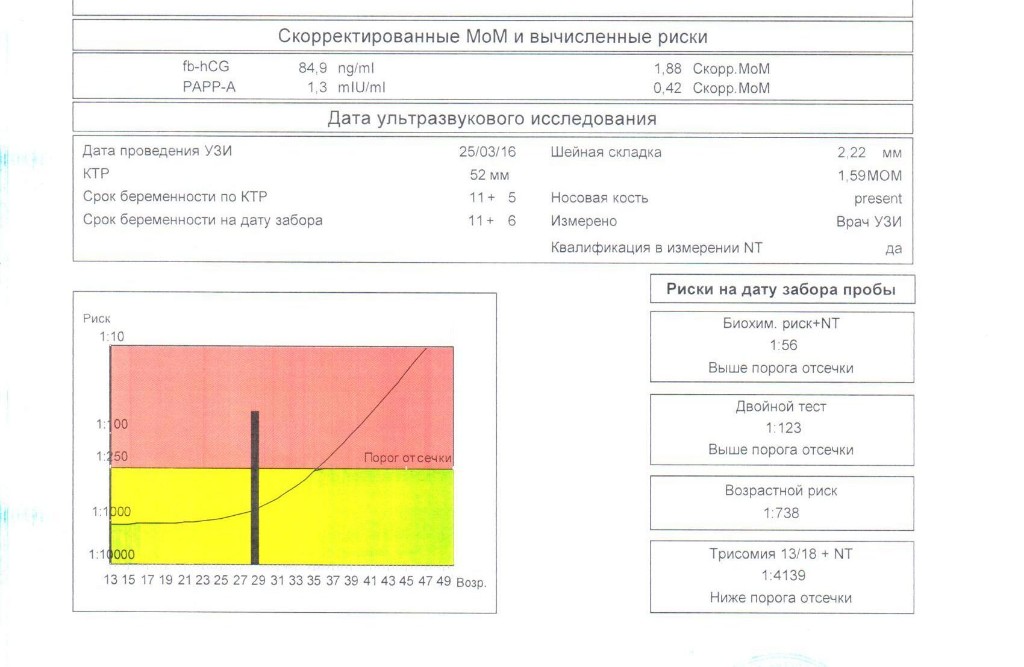
Зачем нужны группы риска?
Знание того, что пациентка входит в ту или иную группу риска, помогает врачу правильно спланировать тактику ведения беременности и родов. Выделение групп риска позволяет оградить пациенток, не входящих в группы риска, от ненужных медицинских вмешательств, и наоборот, позволяет обосновать назначение тех или иных процедур или исследований пациенткам, входящим в группы риска.
Что такое скрининг?
Слово скрининг означает «просеивание». В медицине под скринингом понимают проведение простых и безопасных исследований большим группам населения с целью выделения групп риска развития той или иной патологии. Пренатальным скринингом называются исследования, проводимые беременным женщинам с целью выявления групп риска осложнений беременности. Частным случаем пренатального скрининга является скрининг по выявлению групп риска развития врожденных пороков у плода. Скрининг не позволяет выявить всех женщин, у которых может быть та или иная проблема, но дает возможность выделить относительно небольшую группу пациенток, внутри которой будет сосредоточена бо́льшая часть лиц с данным видом патологии.
Зачем нужен скрининг пороков развития плода?
Некоторые виды врожденных пороков у плода встречаются довольно часто, например, синдром Дауна (трисомия по 21-й паре хромосом или трисомия 21) – в одном случае на 600 – 800 новорожденных. Это заболевание, так же как и некоторые другие врожденные заболевания, возникает в момент зачатия или на самых ранних стадиях развития зародыша и с помощью инвазивных методов пренатальной диагностики (биопсии ворсин хориона и амниоцентеза) может быть диагностировано на достаточно ранних сроках беременности. Однако такие методы сопряжены с риском целого ряда осложнений беременности: выкидыша, развития конфликта по резус-фактору и группе крови, инфицирования плода, развития тугоухости у ребенка и т. д. В частности, риск развития выкидыша после таких исследований составляет 1:200. Поэтому эти исследования следует назначать только женщинам высоких групп риска. К группам риска относятся женщины старше 35 и особенно старше 40 лет, а также пациентки с рождением детей с пороками развития в прошлом. Однако дети с синдром Дауна могут родиться и у совсем молодых женщин. Методы скрининга – совершенно безопасные исследования, проводимые в определенные сроки беременности, – позволяют с очень большой степенью вероятности выявить группы женщин с риском синдрома Дауна, которым может быть показано проведение биопсии ворсин хориона или амниоцентеза. Женщины, не попавшие в группы риска, не нуждаются в проведении дополнительных инвазивных исследований. Обнаружение повышенного риска развития пороков развития плода с помощью методов скрининга не является диагнозом.
Однако такие методы сопряжены с риском целого ряда осложнений беременности: выкидыша, развития конфликта по резус-фактору и группе крови, инфицирования плода, развития тугоухости у ребенка и т. д. В частности, риск развития выкидыша после таких исследований составляет 1:200. Поэтому эти исследования следует назначать только женщинам высоких групп риска. К группам риска относятся женщины старше 35 и особенно старше 40 лет, а также пациентки с рождением детей с пороками развития в прошлом. Однако дети с синдром Дауна могут родиться и у совсем молодых женщин. Методы скрининга – совершенно безопасные исследования, проводимые в определенные сроки беременности, – позволяют с очень большой степенью вероятности выявить группы женщин с риском синдрома Дауна, которым может быть показано проведение биопсии ворсин хориона или амниоцентеза. Женщины, не попавшие в группы риска, не нуждаются в проведении дополнительных инвазивных исследований. Обнаружение повышенного риска развития пороков развития плода с помощью методов скрининга не является диагнозом.
На какие виды врожденных пороков проводится скрининг?
В настоящее время рекомендуется проведение скрининга на следующие виды врожденных пороков у плода:
- Синдром Дауна (трисомия по двадцать первой паре хромосом)
- Синдром Эдвардса (трисомия по восемнадцатой паре)
- Дефекты нервной трубки (spina bifida и анэнцефалия)
- Риск трисомии по 13 хромосоме (синдром Патау)
- Триплоидия материнского происхождения
- Синдром Шерешевского-Тернера без водянки
- Синдрома Смита-Лемли-Опитца
- Синдром Корнели де Ланге
Какие виды исследований проводятся в рамках скрининга риска пороков развития у плода?
По видам исследований выделяют:
- Биохимический скрининг: анализ крови на различные показатели
- Ультразвуковой скрининг: выявление признаков аномалий развития с помощью УЗИ.

- Комбинированный скрининг
Общей тенденцией в развиитии пренатального скрининга является желание получать достоверную информацию о риске развития тех или иных нарушений на как можно ранних сроках беременности. Оказалось, что комбинированный скрининг в конце первого триместра беременности (сроки 10–13 недель) позволяет приблизиться к эффективности классического биохимического скрининга второго триместра беременности.
Ультразвуковой скрининг, используемый для математической обработки рисков аномалий плода, проводится только 1 раз: в конце первого триместра беременности.
Что касается биохимического скрининга, то набор показателей будет различным в разные сроки беременности. В сроки беременности 10-13 недель проверяются следующие показатели:
- свободная β-субъединица хорионического гормона человека (св. β-ХГЧ)
- PAPP-A (pregnancy associated plasma protein A), связанный с беременностью плазменный протеин A
Расчет риска измерения аномалий плода, проведенный на основании измерения этих показателей, называется двойным биохимическим тестом первого триместра беременности.
С помощью двойного теста в I триместре рассчитываются риск обнаружения у плода синдрома Дауна (T21) и синдрома Эдвардса (T18), трисомии по 13 хромосоме (синдром Патау), триплоидии материнского происхождения, синдрома Шерешевского-Тернера без водянки. Риск дефектов нервной трубки с помощью двойного теста посчитать нельзя, поскольку ключевым показателем для определения этого риска является α-фетопротеин, который начинают определять только со второго триместра беременности.
Специальные компьютерные программы позволяют рассчитать комбинированный риск аномалий развития плода с учетом биохимических показателей, определяемых в двойном тесте первого триместра и результатов УЗИ, сделанного в сроки 10-13 недель беременности. Такой тест называется комбинированным с ТВП двойным тестом первого триместра беременности или тройным тестом первого триместра беременности. Результаты расчета рисков, полученные с помощью комбинированного двойного теста, гораздо точнее, чем расчеты риска только на основании биохимических показателей или только на основании УЗИ.
Если результаты теста в первом триместре указывают на группу риска хромосомных аномалий плода, для исключения диагноза хромосомных аномалий пациентке может быть проведена биопсия ворсин хориона.
В сроки беременности 14 — 20 недель по последней менструации (рекомендуемые сроки: 16-18 недель) определяются следующие биохимические показатели:
- Общий ХГЧ или свободная β-субъединица ХГЧ
- α-фетопротеин (АФП)
- Свободный (неконъюгированный) эстриол
- Ингибин А
По этим показателям рассчитываются следующие риски:
- синдрома Дауна (трисомии 21)
- синдрома Эдвардса (трисомии 18)
- дефектов нервной трубки (незаращение спиномозгового канала (spina bifida) и анэнцефалия).
- Риск трисомии по 13 хромосоме (синдром Патау)
- Триплоидия материнского происхождения
- Синдром Шерешевского-Тернера без водянки
- Синдрома Смита-Лемли-Опитца
- Синдром Корнели де Ланге
Такой тест называется четверным тестом второго триместра беременности или четверным биохимическим скринингом во втором триместре беременности. Усеченным вариантом теста является так называемый тройной или двойной тесты второго триместра, включающий в себя 2 или показателя: ХГЧ или свободная β-субъединица ХГЧ, АФП, свободный эстриол. Понятно, что точность двойного или двойного тестов II триместра ниже, чем точность четверного теста II триместра.
Усеченным вариантом теста является так называемый тройной или двойной тесты второго триместра, включающий в себя 2 или показателя: ХГЧ или свободная β-субъединица ХГЧ, АФП, свободный эстриол. Понятно, что точность двойного или двойного тестов II триместра ниже, чем точность четверного теста II триместра.
Еще одним вариантом биохимического пренатального скрининга является биохимический скрининг риска только дефектов нервной трубки во втором триместре беременности. При этом производится определение только одного биохимического маркера: α-фетопротеин
В какие сроки беременности проводится скрининг второго триместра?
В 14 – 20 недель беременности. Оптимальным сроком является 16 – 18 недель беременности.
Что такое четверной тест второго триместра беременности?
Основным вариантом биохимического скрининга второго триместра в ЦИР является так называемый четверной или квадрупл-тест, когда к определению трех вышеперечисленных показателей добавляется определение ингибина А.
Ультразвуковой скрининг в первом триместре беременности.
В первом триместре беременности главным размером, используемым при расчете рисков является ширина шейной прозрачности (англ. «nuchal translucency» (NT) », франц. «clarté nuchale»). В русском медицинском обиходе данный термин часто переводится как «воротниковое пространство» (ТВП) или «шейная складка». Шейная прозрачность, воротниковое пространство и шейная складка – полные синонимы, с которыми можно встретиться в разных медицинских текстах и обозначающие одно и то же.
Шейная прозрачность – определение
- Шейная прозрачность – это то, как выглядит при ультразвуковом исследовании скопление подкожной жидкости на задней поверхности шеи плода в первом триместре беременности
- Термин «шейная прозрачность» используется независимо от того, имеются ли в ней перегородки или от того, ограничена ли она шейной областью или окружает плод целиком
- Частота хромосомных и иных аномалий связана прежде всего с шириной прозрачности, а не с тем, как она выглядит в целом
- В течение второго триместра прозрачность обычно рассасывается, но в некоторых случаях может превращаться либо в шейный отек, либо в кистозные гигромы в сочетании или без сочетания с генерализованным отеком.

Измерение шейной прозрачности
Сроки беременности и копчико-теменной размер
Оптимальным сроком беременности для измерения ШП является срок от 11 недель до 13 недель 6 дней. Минимальный размер КТР – 45 мм, максимальный – 84 мм.
Имеются две причины для выбора срока в 11 недель в качестве самого раннего срока для измерения ШП:
- Скрининг требует возможности выполнения биопсии ворсин хориона до того срока, когда это исследование может осложняться отсечением конечностей плода.
- С другой стороны, многие грубые дефекты плода могут быть обнаружены только после 11 недель беременности.
- Постановка диагноза омфалоцеле возможна только после 12 недель.
- Диагностика анэнцефалии возможна только после 11 недель беременности, поскольку только с этого срока появляются ультразвуковые признаки окостенения черепа плода.
- Оценка четырехкамерности сердца и крупных сосудов возможна только после 10 недель беременности.

- Мочевой пузырь визуализируется у 50% здоровых плодов в 10 недель, у 80% – в 11 недель и у всех плодов – в 12 недель.
Изображение и измерение
Для измерении ШП ультразвуковой аппарат должен иметь высокое разрешение с функцией видео-петли и калибраторами, которые могут измерять размер с точностью до десятых долей миллиметра. ШП можно измерить с помощью абдоминального датчика в 95% случаев, в случаях, когда это невозможно выполнить, следует использовать влагалищный датчик.
При измерении ШП в картинку должны попадать только голова и верхняя часть грудной клетки плода. Увеличение должно быть максимальным, так что небольшое смещение маркеров дает изменение в измерении не более чем на 0,1 мм. При увеличении картинки, до или после фиксации изображения, важно уменьшить гейн. Это позволяет избежать ошибки измерения, когда маркер попадает в размытую область и тем самым размер ШП будет недооценен.
Должен быть получен хороший саггитальный срез, такого же качества, как при измерении КТР.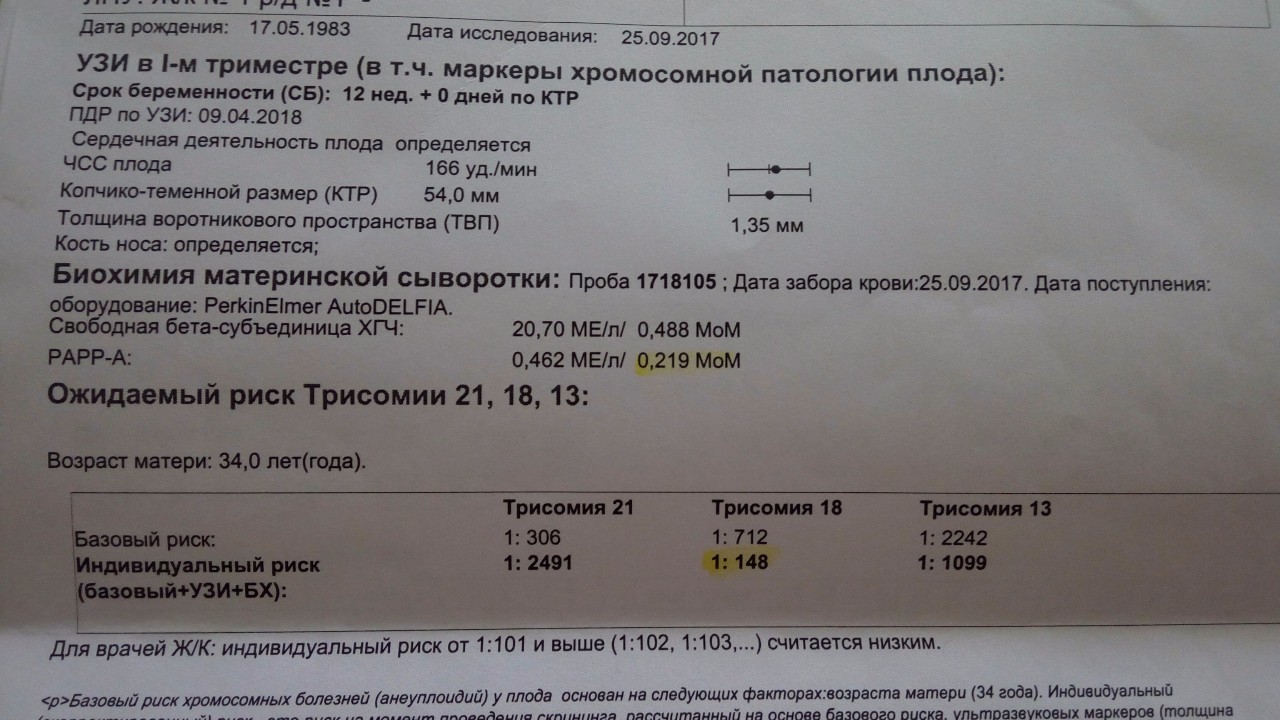 Измерение должно производиться в нейтральном положении головки плода: разгибание головки может увеличивать значение ТВП на 0,6 мм, сгибание головки – уменьшать показатель на 0,4 мм.
Измерение должно производиться в нейтральном положении головки плода: разгибание головки может увеличивать значение ТВП на 0,6 мм, сгибание головки – уменьшать показатель на 0,4 мм.
Важно не спутать кожу плода и амнион, поскольку в эти сроки беременности оба образования выглядят как тонкие мембраны. При сомнении следует дождаться момента, когда плод сделает движение и отойдет от амниона. Альтернативным способом является попросить беременную покашлять или легонько постучать по брюшной стенке беременной.
Замеряется наибольшее перпендикулярное расстояние между внутренними контурами шейной прозрачности (см. рисунок ниже). Замеры проводятся трижды, для расчета используется наибольшее значение размера. В 5-10% случаев обнаруживается обвитие пуповины вокруг шейки плода, что может значительно затруднить измерение. В таких случаях используется 2 измерения: выше и ниже места обвития пуповины, для расчета рисков используется среднее значение этих двух измерений.
Стандарты ультразвукового сканирования в конце первого триместра беременности разрабатываются базирующейся в Англии организацией Fetal Medicine Foundation (FMF). В группе компаний ЦИР УЗИ проводится по протоколу FMF.
В группе компаний ЦИР УЗИ проводится по протоколу FMF.
Дополнительные ультразвуковые признаки риска синдрома Дауна
В последнее время дополнительно к измерению ШП для диагностики синдрома Дауна в конце первого триместра беременности использутся следующие ультразвуковые признаки:
- Определение носовой кости. В конце первого триместра носовая кость не определяется с помощью УЗИ у 60–70% плодов с синдромом Дауна и только у 2% здоровых плодов.
- Оценка кровотока в аранциевом (венозном) протоке. Нарушения формы волны кровотока в аранциевом протоке обнаруживаются у 80% плодов с синдромом Дауна и только у 5% хромосомно нормальных плодов
- Уменьшение размеров верхнечелюстной кости
- Увеличение размеров мочевого пузыря (“мегацистит”)
- Умеренная тахикардия у плода
Форма кровотока в аранциевом протоке при допплерометрии. Вверху: норма; внизу: при трисомии 21.
Не только синдром Дауна!
Во время УЗИ в конце первого триместра оценка контура плода поставляет выявить также следующие аномалии плода:
- Экзенцефалия – анэнцефалия
- Кистозная гигрома (отечность на уровне шеи и спины плода), более чем в половине случаев обусловлена хромосомными аномалиями
- Омфалоцеле и гастросхизис. Диагноз омфалоцеле может быть поставлен только после 12 недель беременности, поскольку до этого срока физиологическая пупочная грыжа, довольно часто обнаруживаемая, не имеет клинического значения
- Единственная пупочная артерия (в большом проценте случаев сочетается с хромосомными аномалиями у плода)
Каким образом рассчитываются риски?
Для вычисления рисков используется специальное программное обеспечение. Простое определение уровня показателей в крови недостаточно для того, чтобы решить, повышен риск аномалий развития, или нет. Программное обеспечение должно быть сертифицировано для использования с целью пренатального скрининга. На первом этапе компьютерного обсчета цифры показателей, полученные при лабораторной диагностике, переводятся в так называемые MoM (multiple of median, кратное медианы), характеризующие степень отклонения того или иного показателя от медианы. На следующем этапе расчета производится поправка MoM на различные факторы (масса тела женщины, расовая принадлежность, наличие некоторых заболеваний, курение, многоплодная беременность и т. д.). В результате получаются так называемые скорректированные MoM. На третьем этапе расчета скорректированные MoM используются для расчета рисков. Программное обеспечение специальным образом настраивается под используемые в лаборатории методы определения показателей и реактивы. Недопустимо рассчитывать риски с использованием анализов, сделанных в другой лаборатории. Наиболее точным расчет рисков аномалий плода бывает при использовании данных ультразвукового исследования, выполненного в 10-13 недель беременности.
На первом этапе компьютерного обсчета цифры показателей, полученные при лабораторной диагностике, переводятся в так называемые MoM (multiple of median, кратное медианы), характеризующие степень отклонения того или иного показателя от медианы. На следующем этапе расчета производится поправка MoM на различные факторы (масса тела женщины, расовая принадлежность, наличие некоторых заболеваний, курение, многоплодная беременность и т. д.). В результате получаются так называемые скорректированные MoM. На третьем этапе расчета скорректированные MoM используются для расчета рисков. Программное обеспечение специальным образом настраивается под используемые в лаборатории методы определения показателей и реактивы. Недопустимо рассчитывать риски с использованием анализов, сделанных в другой лаборатории. Наиболее точным расчет рисков аномалий плода бывает при использовании данных ультразвукового исследования, выполненного в 10-13 недель беременности.
Что такое MoM?
MoM – английская аббревиатура термина “multiple of median”, что в переводе означает “кратное медианы”. Это коэффициент, показывающий степень отклонения значения того или иного показателя пренатального скрининга от среднего значения для срока беременности (медианы). MoM расчитывается по следующей формуле:
Это коэффициент, показывающий степень отклонения значения того или иного показателя пренатального скрининга от среднего значения для срока беременности (медианы). MoM расчитывается по следующей формуле:
MoM = [Значение показателя в сыворотке крови пациентки] / [Значение медианы показателя для срока беременности]
Поскольку значение показателя и медиана имеют одни и те же единицы измерения, значение MoM не имеет единиц измерения. Если значение MoM у пациентки близко к единице, то значение показателя близко к среднему в популяции, если выше единицы – выше среднего в популяции, если ниже единицы – ниже среднего в популяции. При врожденных пороках плода могут быть статистически значимые отклонения MoM маркеров. Однако в чистом виде MoM почти никогда не используются в расчете рисков аномалий плода. Дело в том, что при наличии целого ряда факторов, средние значения MoM отклоняются от средних в популяции. К таким факторам относятся масса тела пациентки, курение, расовая принадлежность, наступление беременности в результате ЭКО и др. Поэтому после получения значений MoM программа расчета рисков делает поправку на все эти факторы, в результате чего получается так называемое “скорригированное значение MoM”, которое и используется в формулах расчета рисков. Поэтому в бланках заключения по результатам анализа рядом с абсолютными значениями показателей указываются скорригированные значения MoM для каждого показателя.
Поэтому после получения значений MoM программа расчета рисков делает поправку на все эти факторы, в результате чего получается так называемое “скорригированное значение MoM”, которое и используется в формулах расчета рисков. Поэтому в бланках заключения по результатам анализа рядом с абсолютными значениями показателей указываются скорригированные значения MoM для каждого показателя.
Типичные профили MoM при патологии беременности
При различных аномалиях плода значения MoM сочетанно отклонены от нормы. Такие сочетания отклонений MoM называются профилями MoM при той или иной патологии. В таблицах ниже приведены типичные профили MoM при разных сроках беременности.
| Аномалия | PAPP-A | Своб. β-ХГЧ |
|---|---|---|
| Тр.21 (синдром Дауна) | 0,41 | 1,98 |
| Тр.18 (Синдром Эдвардса) | 0,16 | 0,34 |
| Триплоидия типа I/II | 0,75/0,06 | |
| Синдром Шерешевского-Тернера | 0,49 | 1,11 |
| Синдром Клайнфельтера | 0,88 | 1,07 |
Типичные профили MoM — Первый триместр
| Аномалия | АФП | Общ. ХГЧ ХГЧ | Св. эстриол | Ингибин A |
|---|---|---|---|---|
| Тр.21 (синдром Дауна) | 0,75 | 2,32 | 0,82 | 1,79 |
| Тр.18 (синдром Эдвардса) | 0,65 | 0,36 | 0,43 | 0,88 |
| Триплоидия типа I/II | 6,97 | 13 | 0,69 | |
| Синдром Шерешевского-Тернера | 0,99 | 1,98 | 0,68 | |
| Синдром Клайнфельтера | 1,19 | 2,11 | 0,60 | 0,64-3,91 |
Типичные профили MoM — Второй триместр
Показания к пренатальному скринингу I и II триместра на риск аномалий плода
В настоящее время пренатальный скрининг рекомендуется проводить всем беременным женщинам. Приказ Минздрава РФ от 2000 г. обязывает женские консультации проводить биохимический пренатальный скрининг всем беременным пациенткам во втором триместре беременности по двум показателям (АФП и ХГЧ).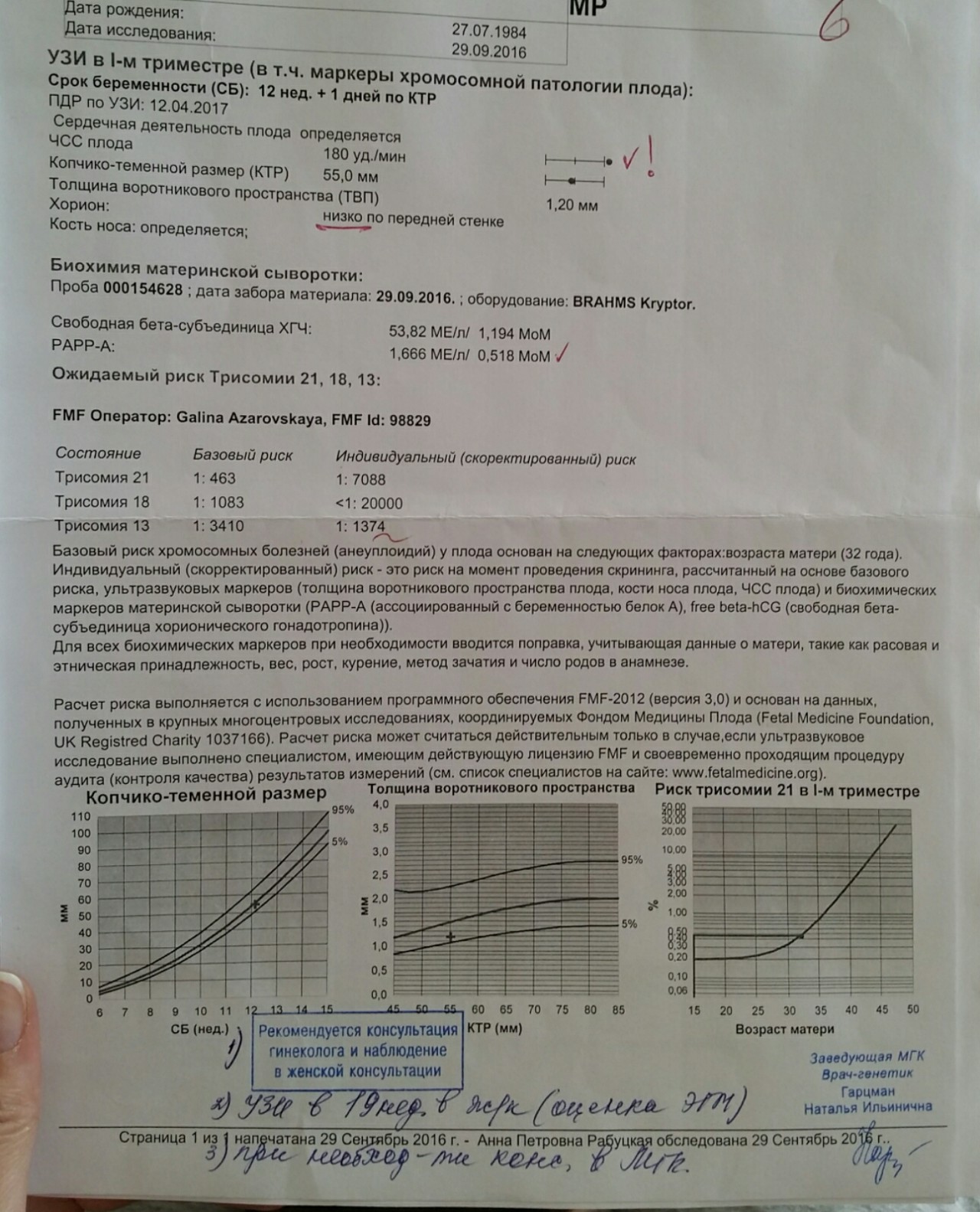
Приказ № 457 от 28.12.2000 г. «О совершенствовании пренатальной диагностики в профилактике наследственных и врожденных заболеваний у детей»:
Важность проводить мониторинг врожденных заболеваний на постоянной основе в г.Москве рассматривается также в постановлении правительства Москвы об учреждении городской программы «Здоровье детей» на 2003-2005 годы.
Постановление Правительства Москвы от 23 июля 2002 г. № 572-ПП
С другой стороны, пренатальный скрининг должен быть сугубо добровольным делом. В большинстве западных стран обязанностью врача является информирование пациентки о возможности проведения таких исследований и о целях, возможностях и ограничениях пренатального скрининга.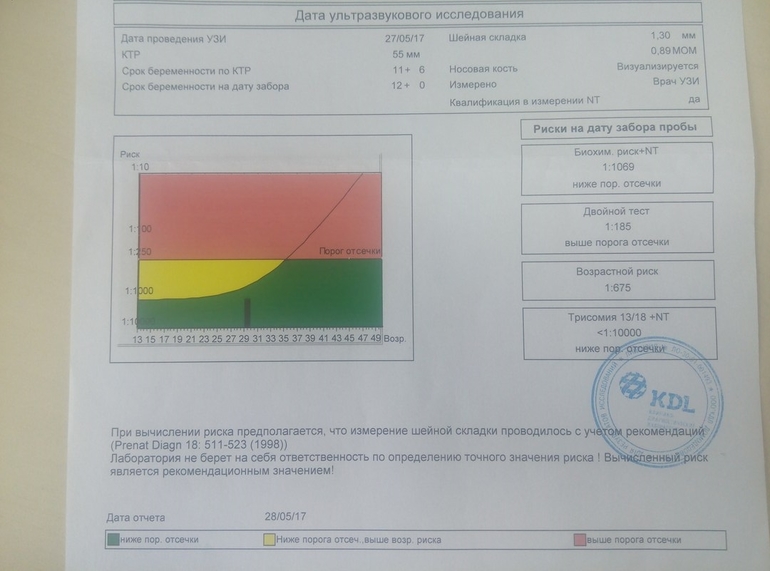 Сама пациентка решает, делать ей анализы, или нет. Такой же точки зрения придерживается и группа компаний ЦИР. Главной проблемой является то, что никакого лечения обнаруженных аномалий не существует. В случае подтверждения наличия аномалий супружеская пара становится перед выбором: прервать беременность или сохранить ее. Это нелегкий выбор.
Сама пациентка решает, делать ей анализы, или нет. Такой же точки зрения придерживается и группа компаний ЦИР. Главной проблемой является то, что никакого лечения обнаруженных аномалий не существует. В случае подтверждения наличия аномалий супружеская пара становится перед выбором: прервать беременность или сохранить ее. Это нелегкий выбор.
Что такое синдром Эдвардса?
Это состояние, обусловленное наличием в кариотипе лишней 18-й хромосомы (трисомия 18). Синдром характеризуется грубыми физическими аномалиями и умственной отсталостью. Это летальное состояние: 50% больных детей умирают в первые 2 месяца жизни, 95% – в течение первого года жизни. Девочки поражаются в 3-4 раза чаще, чем мальчики. Частота в популяции колеблется от 1 случая на 6000 родов до 1 случая на 10000 родов (примерно в 10 раз реже, чем синдром Дауна).
Что такое свободная β-субъединица ХГЧ?
Молекулы ряда гормонов гипофиза и плаценты (тиреотропного гормона (ТТГ), фолликул-стимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ) и хорионического гормона человека (ХГЧ)) имеют сходную структуру и состоят из α и β-субъединиц. Альфа-субъединицы этих гормонов очень сходны и основные различия между гормонами заключаются в строении β-субъединиц. ЛГ и ХГЧ являются очень сходными не только по строению α-субъединиц, но и по строению β-субъединиц. Вот почему они являются гормонами с одинаковым действием. Во время беременности выработка ЛГ гипофизом падает практически до нуля, а концентрации ХГЧ очень высоки. Плацента вырабатывает очень большие количества ХГЧ, и хотя в основном этот гормон поступает в кровь в собранном виде (димерная молекула, состоящая из обеих субъединиц), в небольшом количестве в кровь поступает также свободная (не связанная с α-субъединицей) β-субъединица ХГЧ. Концентрация ее в крови во много раз меньше, чем концентрация общего ХГЧ, но этот показатель гораздо надежнее может указывать на риск проблем у внутриутробного плода на ранних сроках беременности. Определение свободной β-субъединицы ХГЧ в крови имеет значение также для диагностики трофобластической болезни (пузырного заноса и хорионэпителиомы), некоторых опухолей яичка у мужчин, мониторинге успеха процедур экстракорпорального оплодотворения.
Альфа-субъединицы этих гормонов очень сходны и основные различия между гормонами заключаются в строении β-субъединиц. ЛГ и ХГЧ являются очень сходными не только по строению α-субъединиц, но и по строению β-субъединиц. Вот почему они являются гормонами с одинаковым действием. Во время беременности выработка ЛГ гипофизом падает практически до нуля, а концентрации ХГЧ очень высоки. Плацента вырабатывает очень большие количества ХГЧ, и хотя в основном этот гормон поступает в кровь в собранном виде (димерная молекула, состоящая из обеих субъединиц), в небольшом количестве в кровь поступает также свободная (не связанная с α-субъединицей) β-субъединица ХГЧ. Концентрация ее в крови во много раз меньше, чем концентрация общего ХГЧ, но этот показатель гораздо надежнее может указывать на риск проблем у внутриутробного плода на ранних сроках беременности. Определение свободной β-субъединицы ХГЧ в крови имеет значение также для диагностики трофобластической болезни (пузырного заноса и хорионэпителиомы), некоторых опухолей яичка у мужчин, мониторинге успеха процедур экстракорпорального оплодотворения.
Какой показатель: общий ХГЧ или свободная β-субъединица ХГЧ – предпочтительнее использовать в тройном тесте второго триместра?
Использование определения свободной β-субъединицы ХГЧ по сравнению с определением общего ХГЧ дает более точный расчет риска синдрома Дауна, однако в классических статистических расчетах риска синдрома Эдвардса в популяции использовалось определение уровня общего ХГЧ в крови матери. Для β-субъединицы ХГЧ таких расчетов не проводилось. Поэтому нужно делать выбор между более точным вычислением риска синдрома Дауна (в случае β-субъединицы) и возможностью вычисления риска синдрома Эдвардса (в случае общего ХГЧ). Напомним, что в первом триместре для вычисления риска синдрома Эдвардса используется толко свободная β-субъединицы ХГЧ, но не общий ХГЧ. Синдром Эдвардса характеризуется низкими цифрами всех 3-х показателей тройного теста, поэтому в подобных случаях можно сделать оба варианта тройного теста (с общим ХГЧ и со свободной β-субъединицей).
Что такое PAPP-A?
Ассоциированный с беременностью плазменный протеин A (pregnancy-associated plasma protein-A, PAPP-A) впервые был описан в 1974 г. в виде высокомолекулярной белковой фракции в сыворотке крови женщин на поздних сроках беременности. Оказалось, что это большой цинк-содержащий металогликопротеин с молекулярной массой около 800 кДа. Во время беременности PAPP-A вырабатывается синцитиотрофобластом (тканью, являющейся наружным слоем плаценты) и экстраворсинным цитотрофобластом (островками клеток плода в толще слизистой оболочки матки) и поступает в кровоток матери
в виде высокомолекулярной белковой фракции в сыворотке крови женщин на поздних сроках беременности. Оказалось, что это большой цинк-содержащий металогликопротеин с молекулярной массой около 800 кДа. Во время беременности PAPP-A вырабатывается синцитиотрофобластом (тканью, являющейся наружным слоем плаценты) и экстраворсинным цитотрофобластом (островками клеток плода в толще слизистой оболочки матки) и поступает в кровоток матери
Биологическое значение этого белка не до конца изучено. Было показано, что он связывает гепарин и является ингибитором эластазы гранулоцитов (фермента, индуцируемого при воспалении), поэтому предполагается, что PAPP-A модулирует иммунный ответ материнского организма и является одним из факторов, который обеспечивает развитие и выживание плаценты. Кроме того, было установлено, что он является протеазой, расщепляющей протеин 4, связывающий инсулиноподобный фактор роста. Существуют серьезные основания полагать, что PAPP-A является одним из факторов паракринной регуляции не только в плаценте, но и в некоторых других тканях, в частности в атеросклеротических бляшках. Предлагается использовать данный маркер как один из факторов риска ишемической болезни сердца.
Предлагается использовать данный маркер как один из факторов риска ишемической болезни сердца.
Концентрации PAPP-A в крови матери постоянно увеличиваются с увеличением срока беременности. Наибольший рост этого показателя отмечается в конце беременности.
В течение последних 15 лет PAPP-A изучался в качестве одного из трех маркеров риска трисомии 21 (синдром Дауна) (вместе со свободной β-субъединицей ХГЧ и толщиной воротникового пространства). Оказалось, что уровень этого маркера в конце первого триместра беременности (8-14 недель) значительно снижен при наличии у плода трисомии 21 или трисомии 18 (синдром Эдвардса). Уникальностью этого показателя является то, что значимость его как маркера синдрома Дауна исчезает после 14 недель беременности. Во втором триместре уровни его в материнской крови при наличии у плода трисомии 21 не отличаются от таковых у беременных со здоровым плодом. Если рассматривать PAPP-A в качестве изолированного маркера риска синдрома Дауна в первом триместре беременности, наиболее значимым было бы его определение в сроки 8–9 недель. Однако свободная β-субъединица ХГЧ является стабильным маркером риска синдрома Дауна в сроки 10–18 недель, т. е. позже PAPP-A. Поэтому оптимальным сроком сдачи крови для двойного теста первого триместра беременности – 10–12 недель.
Однако свободная β-субъединица ХГЧ является стабильным маркером риска синдрома Дауна в сроки 10–18 недель, т. е. позже PAPP-A. Поэтому оптимальным сроком сдачи крови для двойного теста первого триместра беременности – 10–12 недель.
Комбинация измерения уровня PAPP-A с определением концентрации свободной β-субъединицы ХГЧ в крови и определением ТВП с помощью УЗИ в конце первого триместра беременности позволяет выявить до 90% женщин с риском развития синдрома Дауна в старшей возрастной группе (после 35 лет). Вероятность ложноположительных результатов при этом составляет около 5%.
Кроме пренатального скрининга риска синдрома Дауна и синдрома Эдвардса, в акушерстве определение PAPP-A используется также при следующих видах патологии:
- Угроза выкидыша и остановки развития беременности на малых сроках
- Синдром Корнелии де Ланж.
Диагностика риска остановки развития плода на малых сроках беременности явилось исторически первым клиническим приложением определения PAPP-A в сыворотке крови, предложенным в начале 1980-х годов.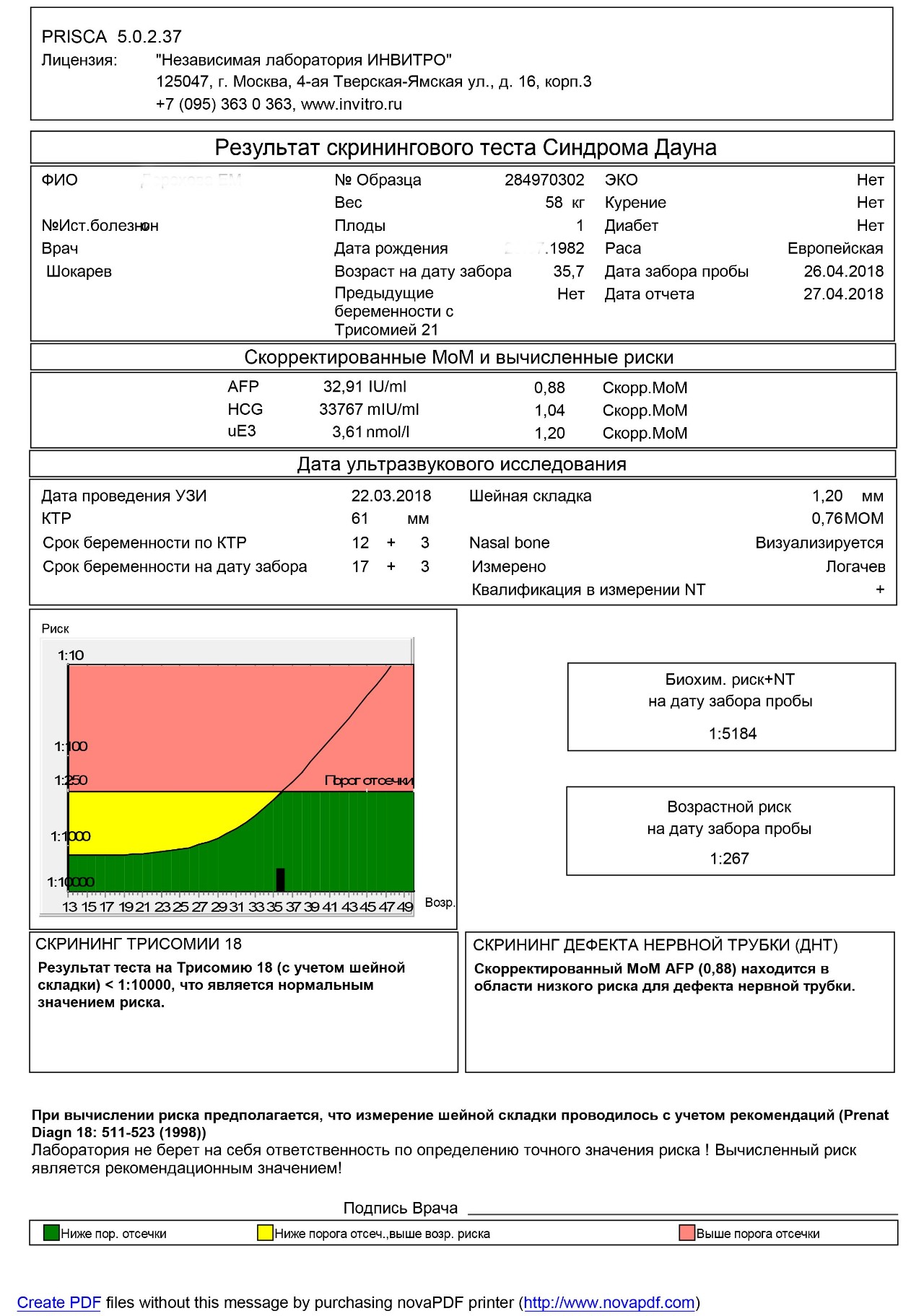 Было показано, что женщины с низкими уровнями PAPP-A на ранних сроках беременности попадают в группы риска последующей остановки развития беременности и тяжелых форм позднего токсикоза. Поэтому рекомендуется определение этого показателя в сроки 7–8 недель женщинам с тяжелыми осложнениями беременности в анамнезе.
Было показано, что женщины с низкими уровнями PAPP-A на ранних сроках беременности попадают в группы риска последующей остановки развития беременности и тяжелых форм позднего токсикоза. Поэтому рекомендуется определение этого показателя в сроки 7–8 недель женщинам с тяжелыми осложнениями беременности в анамнезе.
Синдром Корнелии де Ланж – это редкая форма врожденных пороков развития плода, обнаруживаемая в 1 случае на 40 000 родов. Синдром характеризуется отставанием умственного и физического развития, пороками сердца и конечностей и характерными особенностями черт лица. Было показано, что при данном состоянии уровни PAPP-A в крови в сроки 20–35 недель значимо ниже нормы. Исследование группы Эйткена в 1999 г. показало, что данный маркер может использоваться для скрининга на синдром Корнелии де Ланж и во втором триместре беременности, поскольку уровни показателя у таких беременных в среднем были в 5 раз ниже нормы.
Реактивы, используемые для определения PAPP-A и свободной β-субъединицы ХГЧ, на порядок дороже реактивов, используемых для большинства гормональных показателей, что делает данный тест более дорогим исследованием по сравнению с определением большинства гормонов репродуктивной системы.
Что такое α-фетопротеин?
Это гликопротеин плода, вырабатываемый вначале в желточном мешке, а потом в печени и желудочно-кишечном тракте плода. Это транспортный белок в крови плода, связывающий целый ряд различных факторов (билирубин, жирные кислоты, стероидные гормоны). Это двойной регулятор роста внутриутробного плода. У взрослого человека никаких известных функций АФП не выполняет, хотя может повышаться в крови при заболеваниях печени (цирроз, гепатит) и при некоторых опухолях (гепатоклеточная карцинома и герминативная карцинома). В крови матери уровень АФП постепенно повышается с увеличением срока беременности и достигает максимума к 30 неделям. Уровень АФП в крови матери повышается при дефектах нервной трубки у плода и при многоплодной беременности, понижается – при синдроме Дауна и при синдроме Эдвардса.
Что такое свободный эстриол?
Эстриол синтезируется в плаценте из 16α-гидрокси-дегидроэпиантростерон-сульфата, поступающего со стороны плода. Главный источник предшественников эстриола – надпочечники плода. Эстриол является главным эстрогенным гормоном беременности и обеспечивает рост матки и подготовку молочных желез к лактации.
Главный источник предшественников эстриола – надпочечники плода. Эстриол является главным эстрогенным гормоном беременности и обеспечивает рост матки и подготовку молочных желез к лактации.
90% эстриола после 20 недель беременности образуются из ДЭА-С плода. Большой выход ДЭА-С из надпочечника плода связан с низкой активностью 3β-гидроксистероид-дегидрогеназы у плода. Протективным механизмом, защищающим плод от избытка андрогенной активности, является быстрая конъюгация стероидов с сульфатом. В сутки плод вырабатывает более 200 мг ДЭА-С в день, в 10 раз больше матери. В печени матери эстриол быстро подвергается конъюгации с кислотами, в основном с гиалуроновой кислотой, и таким образом инактивируется. Наиболее точным методом определения активности надпочечников плода является определение уровня свободного (неконъюгированного) эстриола.
Уровень свободного эстриола постепенно повышается по мере развития беременности и в третьем триместре беременности может использоваться для диагностики благополучия плода. При ухудшении состояния плода в третьем триместре беременности может наблюдаться резкое падение уровня свободного эстриола. Уровень свободного эстриола часто понижен при синдроме Дауна и при синдроме Эдвардса. Прием дексаметазона, преднизолона или метипреда при беременности подавляет функцию надпочечников плода, поэтому уровень свободного эстриола у таких пациенток часто снижается (снижение поступления эстриола со стороны плода). При приеме антибиотиков усиливается скорость конъюгации эстриола в печени матери и снижается обратное всасывание конъюгатов из кишечника, поэтому уровень эстриола тоже снижается, но уже за счет ускорения его инактивации в организме матери. Для точной интерпретации данных тройного теста очень важно, чтобы пациентка указала полный список лекарств, принимавшихся или принимаемых во время беременности с дозами и сроками приема.
При ухудшении состояния плода в третьем триместре беременности может наблюдаться резкое падение уровня свободного эстриола. Уровень свободного эстриола часто понижен при синдроме Дауна и при синдроме Эдвардса. Прием дексаметазона, преднизолона или метипреда при беременности подавляет функцию надпочечников плода, поэтому уровень свободного эстриола у таких пациенток часто снижается (снижение поступления эстриола со стороны плода). При приеме антибиотиков усиливается скорость конъюгации эстриола в печени матери и снижается обратное всасывание конъюгатов из кишечника, поэтому уровень эстриола тоже снижается, но уже за счет ускорения его инактивации в организме матери. Для точной интерпретации данных тройного теста очень важно, чтобы пациентка указала полный список лекарств, принимавшихся или принимаемых во время беременности с дозами и сроками приема.
Алгоритм проведения пренатального скрининга I и II триместра беременности.
1. Рассчитываем срок беременности, лучше после консультации с врачом или с помощью консультанта.
Скрининг I триместра имеет свои особенности. Он проводится в сроки 10 – 13 недель беременности и достаточно жестко ограничен по срокам. Если сдать кровь слишком рано или слишком поздно, если ошибиться в расчете сроков беременности на момент сдачи крови, точность расчета резко уменьшится. Сроки беременности в акушерстве обычно рассчитываются по первому дню последней менструации, хотя зачатие происходит в день овуляции, т. е. при 28-дневном цикле – через 2 недели после первого дня менструации. Поэтому сроки 10 – 13 недель по дню менструации соответствуют 8 – 11 неделям по зачатию.
Для вычисления срока беременности мы рекомендуем воспользоваться акушерским календарем, размещенном на нашем сайте. Сложности в расчете сроков беременности могут быть при нерегулярном менструальном цикле, при беременности, наступившей вскоре после родов, при цикле, более чем на неделю отклоняющегося от 28 дней. Поэтому лучше всего довериться профессионалам, и для расчета сроков беременности, проведения УЗИ и сдачи крови обратиться к врачу.
2. Делаем УЗИ.
Следующим этапом должно быть проведение УЗИ в сроки 10 – 13 недель беременности. Данные этого исследования будут использованы программой расчета рисков как в первом, так и во втором триместре. Начинать обследование нужно именно с УЗИ, поскольку в процессе исследования могут выявиться проблемы с развитием беременности (например, остановка или отставание в развитии), многоплодная беременность, будут достаточно точно рассчитаны сроки зачатия. Врач, проводящий УЗИ, поможет пациентке расчитать сроки сдачи крови для биохимического скрининга. Если УЗИ окажется сделанным слишком рано по срокам беременности, то, возможно, врач рекомендует повторить исследование спустя какое-то время.
Для расчета рисков будут использоваться следующие данные из заключения УЗИ: дата УЗИ, копчико-теменной размер (КТР) и толщина воротникового пространства (ТВП) (английские сокращения соответственно CRL и NT), а также визуализация носовых костей.
3. Сдаем кровь.
Сдаем кровь.
Имея результаты УЗИ и зная точный срок беременности можно приходить для сдачи крови. Взятие крови для анализа на пренатальный скрининг в группе компаний ЦИР проводится ежедневно, включая выходные дни. В будние дни взятие крови проводится с 7:45 до 21:00, в выходные и праздничные дни: с 8:45 до 17:00. Взятие крови проводится через 3-4 часа после последнего приема пищи.
В сроки беременности 14 — 20 недель по последней менструации (рекомендуемые сроки: 16-18 недель) определяются следующие биохимические показатели:
- Общий ХГЧ или свободная β-субъединица ХГЧ
- α-фетопротеин (АФП)
- Свободный (неконъюгированный) эстриол
- Ингибин А
4. Получаем результат.
Теперь нужно получить результаты анализа. Сроки готовности результатов анализа пренатального скрининга в группе компаний ЦИР составляют один рабочий день (кроме четверного теста). Это означает, что анализы, сданные с понедельника по пятницу будут готовы в тот же день, а сданные с субботы по воскресенье – в понедельник.
Заключения по результатам исследования выдаются пациентке на русском языке.
Тиблица. Объяснения терминов и сокращений
| Дата отчета | Дата компьютерной обработки результатов |
| Срок беременности | Недели + дни |
| Дата УЗИ | Дата проведения УЗИ. Обычно не совпадает с датой сдачи крови. |
| Плоды | Количество плодов. 1 – одноплодная беременность; 2 – двойня; 3 – тройня |
| ЭКО | Беременность наступила в результате ЭКО |
| КТР | Копчико-теменной размер, определенный во время УЗИ |
| MoM | Кратное медианы (multiple of median), степень отклонения результата от среднего для данного срока беременности |
| Скорр. MoM | Скорригированное MoM. Значение MoM после коррекции по массе тела, возрасту, расовой принадлежности, количеству плодов, наличию диабета, курению, лечению бесплодия методом ЭКО. |
| NT | Толщина воротникового пространства (nuchal translucency). Синоним: шейная складка. В различных вариантах отчетов могут приводиться либо абсолютные значения в мм, либо степень отклонения от медианы (MoM) |
| Возрастной риск | Среднестатистический риск для данной возрастной группы. Не учитываются никакие факторы, кроме возраста. |
| Tr. 21 | Трисомия 21, синдром Дауна |
| Tr. 18 | Трисомия 18, синдром Эдвардса |
| Биохимический риск | Риск аномалий плода после компьютерной обработки данных анализа крови без учета данных УЗИ |
| Комбинированный риск | Риск аномалий плода после компьютерной обработки данных анализа крови с учетом данных УЗИ. Наиболее точный показатель степени риска. |
| fb-HCG | Свободная β-субъединица ХГЧ |
| ДПМ | Дата последней менструации |
| AFP | α-фетопротеин |
| HCG | Общий ХГЧ (human chorionic gonadotropin) |
| uE3 | Свободный эстриол (unconjugated estriol) |
| +NT | Расчет проводился с учетом данных УЗИ |
| mIU/ml | мМЕ/мл |
| ng/ml | нг/мл |
| IU/ml | МЕ/мл |
Дополнительная информация.
Информация для пациентов: обратите внимание, что если Вы планируете пройти пренатальный скрининг в группе компаний ЦИР, то данные УЗИ, сделанного в других учреждениях, будут приниматься в расчет только в случае наличия специального договора группы компаний ЦИР с этими учреждениями.
Информация для врачей
Уважаемые коллеги! В соответствии с Приказом Минздрава № 457 и Постановлением Правительства Москвы № 572 группа компаний ЦИР оказывает услуги другим лечебным учреждениям по проведению пренатального скрининга на риск хромосомных аномалий. Вы можете пригласить наших сотрудников приехать к вам с лекцией по данной программе. Для направления пациентки на скрининг лечащий врач должен заполнить специальное направление. Пациентка может приехать для сдачи крови самостоятельно, но возможно и взятие крови в других учреждениях с последующей доставкой в нашу лабораторию, в том числе и нашим курьером. Если вы хотите получать результаты двойных, тройных и четверных тестов первого и второго триместров беременности, комбинированных с данными УЗИ, пациентка должна приехать к нам для УЗИ, либо мы должны подписать с вашим учреждением специальный договор и включить в программу ваших специалистов УЗИ, но только после выезда нашего эксперта по функциональной диагностике в ваше учреждение и ознакомления с качеством аппаратуры и квалификацией специалистов.
PAPP-A (Ассоциированный с беременностью протеин-А плазмы, Pregnancy-associated)
Метод определения Иммуноанализ.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Ассоциированный с беременностью протеин-А плазмы. В пренатальном скрининге I триместра беременности – маркёр риска синдрома Дауна и других хромосомных аномалий плода.
PAPP-A — высокомолекулярный гликопротеин (м.в. около 800 кДа). При беременности вырабатывается в большом количестве трофобластом и поступает в материнскую систему циркуляции, концентрация его в сыворотке крови матери увеличивается с увеличением срока беременности. По биохимическим свойствам PAPP-A относят к металлопротеазам. Он обладает способностью расщеплять один из белков, связывающих инсулиноподобный фактор роста. Это вызывает повышение биодоступности инсулиноподобного фактора роста, который является важным фактором развития плода во время беременности. Предполагается, что РАРР-А участвует также в модуляции иммунного ответа материнского организма при беременности. Аналогичный белок в низких концентрациях присутствует также в крови мужчин и небеременных женщин. Физиологическая роль РАРР-А продолжает исследоваться.
По биохимическим свойствам PAPP-A относят к металлопротеазам. Он обладает способностью расщеплять один из белков, связывающих инсулиноподобный фактор роста. Это вызывает повышение биодоступности инсулиноподобного фактора роста, который является важным фактором развития плода во время беременности. Предполагается, что РАРР-А участвует также в модуляции иммунного ответа материнского организма при беременности. Аналогичный белок в низких концентрациях присутствует также в крови мужчин и небеременных женщин. Физиологическая роль РАРР-А продолжает исследоваться.
Ряд серьёзных клинических исследований свидетельствует о диагностической значимости РАРР-А в качестве скринингового маркёра риска хромосомных аномалий плода на ранних сроках беременности (в первом триместре), что является принципиально важным в диагностике хромосомных аномалий. Уровень РАРР-А значительно снижен при наличии у плода трисомии 21 (синдром Дауна) или трисомии 18 (синдром Эдвардса). Кроме того, этот тест информативен также при оценке угрозы выкидыша и остановки беременности на малых сроках.
Изолированное исследовние уровня РАРР-А в качестве маркёра риска синдрома Дауна имеет диагностическое значение, начиная с 8 — 9 недель беременности. В комплексе с определением бета-ХГЧ (хорионического гонадотропина человека) определение РАРР-А оптимально проводить на сроке около 12 недель беременности (11 — 14 недель). После 14 недель беременности диагностическая значимость РАРР-А в качестве маркёра риска синдрома Дауна теряется.
Установлено, что комбинация данного теста с определением свободной бета-субъединицы ХГЧ (или общего бета-ХГЧ), данными УЗИ (толщина воротникового пространства), оценкой возрастных факторов риска существенно увеличивает эффективность пренатального скрининга синдрома Дауна в первом триместре беременности, доводя его до 85 — 90% уровня выявления синдрома Дауна при 5% ложноположительных результатов. Исследование РАРР-А в качестве биохимического маркёра врождённой и наследственной патологии у плода в комплексе с определением ХГЧ на сроке 11 — 13 недель беременности в настоящее время Приказом департамента здравоохранения г. Москвы № 144 от 04.04.2005 года включено в схему скрининговых обследований беременных женщин в первом триместре.
Москвы № 144 от 04.04.2005 года включено в схему скрининговых обследований беременных женщин в первом триместре.
Выявление отклонений уровней биохимических маркёров в крови матери не является безусловным подтверждением патологии плода, но, в комплексе с оценкой других факторов риска является основанием для применения более сложных специальных методов диагностики аномалий развития плода.
Пределы определения: 0,03 мЕд/мл-100 мЕд/мл
Расшифровка анализов PAPP-A и b-ХГЧ — Вопрос гинекологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 73 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, липидолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.47% вопросов.
Оставайтесь с нами и будьте здоровы!
Ведение и наблюдение беременности в Москве. Гинекология. / Диламед
Наша клиника обеспечивает:
- постоянную связь с лечащим врачом;
- полное обследование;
- услуги дневного стационара;
- выдачу необходимой документации (обменной карты, больничного листа).
Ведение беременности
Ведение беременности — существенный этап в жизни женщины. Для квалифицированного наблюдения за течением беременности мало одного опыта — надо также излучать искреннюю заботу. Только в доброжелательной обстановке и с чувством полной уверенности женщина сможет подготовиться к нормальным родам.
Ваш лечащий врач поможет выяснить все связанные с ведением беременности нюансы, устранить риск возникновения проблем или решить существующие, выбрать родильный дом и продолжить наблюдение за состоянием здоровья после родов. Если необходимо, то после родов врач поможет подобрать наиболее подходящее вам средство контрацепции.
Если необходимо, то после родов врач поможет подобрать наиболее подходящее вам средство контрацепции.
Профилактика и лечение
Профилактика и лечение – еще одно направление работы нашей клиники. Немалую роль в сохранении здоровья женщины играет своевременное выявление и лечение гинекологических заболеваний, нарушений в работе молочных желез, щитовидной железы.
Кроме того, направление «Профилактика и лечение» включает в себя планирование беременности. Специалистами нашего Центра разработаны методики подготовки к беременности. В рамках программы подготовки исключают половые инфекции у супругов (если такие имеются), проводится УЗИ, гормональные и, когда возникает необходимость, иммунологические исследования.
Женщины с неблагоприятным анамнезом (самопроизвольные выкидыши, прерывание беременности по типу замершей, рождение ребенка, имеющего пороки развития или с болезнью Дауна) проходят генетическое обследование.
Кроме того, в нашей клинике женщины могут пройти лечение различных гинекологических заболеваний, таких как: нарушение менструального цикла, воспалительные заболевания, эрозия шейки матки, бесплодие.
По ряду этих заболеваний нашими специалистами также разработаны программы по обследованию и лечению.
Нежелательная беременность
При наступлении нежелательной беременности ваш лечащий врач поможет выбрать наиболее безопасный для вас вариант прерывания беременности (операционный или медикаментозный) и затем порекомендует оптимальный метод контрацепции.
Двери нашего Медицинского Центра всегда открыты для вас. У нас вы получите квалифицированную помощь и искреннюю заботу о здоровье!
Скрининг первого триместра беременности — результаты, норма, патология
Практически каждая беременная женщина что-то слышала о скрининге первого триместра беременности (пренатальный скрининг). Но часто даже те, кто его уже прошел, не знают, для чего конкретно его назначают.
А будущим мамам, которым это еще предстоит, это словосочетание вообще иногда кажется пугающим. А пугает оно лишь от того, что женщина не знает, как это делается, как трактовать потом полученные результаты, зачем это нужно врачу. На эти на многие другие вопросы, касающиеся данной темы, вы найдете ответы в этой статье.
На эти на многие другие вопросы, касающиеся данной темы, вы найдете ответы в этой статье.
Итак, не раз приходилось сталкиваться с тем, что женщина, услышав непонятное и незнакомое слово скрининг, начинала рисовать в своей голове ужасные картины, которые пугали ее, вызывая у нее желание, отказаться от проведения данной процедуры. Поэтому, первое, что мы расскажем вам, что же означает слово «скрининг».
Скрининг (англ. screening — сортировка) – это различные методы исследования, которые ввиду своей простоты, безопасности и доступности, могут применяться массово у больших групп лиц, для выявления ряда признаков. Пренатальный, означает, дородовый. Таким образом, можно дать следующее определение понятию «пренатальный скрининг».
Скрининг первого триместра беременности – это комплекс диагностических исследований, применяемых у беременных женщин на определенном сроке беременности, для выявления грубых пороков развития плода, а также наличия или отсутствия косвенных признаков патологий развития плода или генетических аномалий.
Допустимый срок для проведения скрининга 1 триместра – это 11 недель – 13 недель и 6 дней (см. калькулятор расчета срока беременности по неделям). Ранее или позднее скрининг не проводится, так как в таком случае полученные результаты не будут информативными и достоверными. Наиболее оптимальным сроком считается 11-13 акушерских недель беременности.
Кто направляется на скрининг первого триместра беременности?
Согласно приказу №457 Министерства здравоохранения Российской Федерации от 2000 года, пренатальный скрининг рекомендуется проводить всем женщинам. Отказаться от него женщина может, никто насильно ее не поведет на эти исследования, но делать это крайне опрометчиво и говорит лишь о неграмотности женщины и халатном отношении к себе и прежде всего к своему ребенку.
Группы риска, которым пренатальный скрининг должен проводиться в обязательном порядке:
- Женщины, чей возраст 35 лет и более.
- Наличие угрозы прерывания беременности на ранних сроках.

- Самопроизвольный
(е) выкидыш(и) в анамнезе. - Замершая(ие) или регрессирующая(и
е) беременность(и) в анамнезе. - Наличие профессиональных вредностей.
- Ранее диагностированны
е хромосомные аномалии и (или) пороки развития у плода по результатам скрининга в прошлые беременности, либо наличие рожденных детей с такими аномалиями. - Женщины, перенесшие инфекционное заболевание на ранних сроках беременности.
- Женщины, принимавшие лекарственные препараты, запрещенные к приему беременным, на ранних сроках беременности.
- Наличие алкоголизма, наркомании.
- Наследственные заболевания в семье у женщины или в семье отца ребенка.
- Близкородственна
я связь между матерью и отцом ребенка.
Пренатальный скрининг на сроке 11-13 недель беременности, состоит из двух методов исследования – это УЗИ скрининг 1 триместра и биохимический скрининг.
Ультразвуковое исследование в рамках скрининга
Подготовка к исследованию: Если УЗИ проводится трансвагинально (датчик вводится во влагалище), то особой подготовки не требуется. Если УЗИ проводится трансабдоминальн
Если УЗИ проводится трансабдоминальн
Необходимые условия для получения достоверных данных УЗИ. Согласно нормам скрининг первого триместра в виде УЗИ проводится:
- Не ранее, чем в 11 акушерских недель и не позже 13 недель и 6 дней.
- КТР (копчико-теменно
й размер) плода не меньше 45 мм. - Положение ребенка должно позволять врачу адекватно провести все измерения, в ином случае, необходимо покашлять, подвигаться, походить некоторое время, чтобы плод изменил свое положение.
В результате УЗИ исследуются следующие показатели:
- КТР (копчико-теменно
й размер) – измеряется от теменной кости до копчика - Окружность головы
- БПР (бипариетальный размер) – расстояние между теменными буграми
- Расстояние от лобной кости до затылочной кости
- Симметричность полушарий головного мозга и его структура
- ТВП (толщина воротникового пространства)
- ЧСС (частота сердечных сокращений) плода
- Длина плечевых, бедренных костей, а также костей предплечья и голени
- Расположение сердца и желудка у плода
- Размеры сердца и крупных сосудов
- Расположение плаценты и ее толщина
- Количество вод
- Количество сосудов в пуповине
- Состояние внутреннего зева шейки матки
- Наличие или отсутствие гипертонуса матки
Расшифровка полученных данных:
| КТР, мм | ТВП, мм | Носовая кость, мм | ЧСС, ударов в минуту | БПР, мм | |
| 10 недель | 33-41 | 1,5-2,2 | Видна, размер не оценивается | 161-179 | 14 |
| 11 недель | 42-50 | 1,6-2,4 | Видна, размер не оценивается | 153-177 | 17 |
| 12 недель | 51-59 | 1,6-2,5 | Более 3 мм | 150-174 | 20 |
| 13 недель | 62-73 | 1,7-2,7 | Более 3 мм | 147-171 | 26 |
Какие патологии могут быть выявлены в результате УЗИ?
По результатам УЗИ скрининга 1 триместра можно говорить об отсутствии или наличие следующих аномалий:
- Синдром Дауна – трисомия по 21 хромосоме, самое распространенное генетическое заболевание.
 Распространеннос
Распространенность выявления 1:700 случаев. Благодаря пренатальному скринингу рождаемость детей с синдромом Дауна снизилась до 1:1100 случаев. - Патологии развития нервной трубки (менингоцеле, менингомиелоцеле
, энцефалоцеле и другие). - Омфалоцеле – патология, при которой часть внутренних органов находится под кожей передней брюшной стенки в грыжевом мешке.
- Синдром Патау – трисомия по 13 хромосоме. Частота встречаемости в среднем 1:10000 случаев. 95% рожденных детей с этим синдромом умирают в течение нескольких месяцев в связи с тяжелым поражением внутренних органов. На УЗИ – учащенное сердцебиение плода, нарушение развития головного мозга, омфалоцеле, замедление развития трубчатых костей.
- Синдром Эдвардса – трисомия по 18 хромосоме. Частота встречаемости 1:7000 случаев. Чаще встречается у детей, чьи матери старше 35 лет. На УЗИ наблюдается урежение сердцебиения плода, омфалоцеле, не видны носовые кости, одна пуповинная артерия вместо двух.
- Триплоидия – генетическая аномалия, при которой наблюдается тройной набор хромосом, вместо двойного набора.
 Сопровождается множественными пороками развития у плода.
Сопровождается множественными пороками развития у плода. - Синдром Корнелии де Ланге – генетическая аномалия, при которой у плода наблюдаются различные пороки развития, а в будущем и умственная отсталость. Частота встречаемости 1:10000 случаев.
- Синдром Смита-Опица – аутосомно-рецесс
ивное генетическое заболевание, проявляющееся нарушением метаболизма. В результате чего у ребенка наблюдается множественные патологии, умственная отсталость, аутизм и другие симптомы. Частота встречаемости в среднем 1:30000 случаев.
Подробнее о диагностике синдрома Дауна
Главным образом, ультразвуковое исследование на сроке 11-13 недель беременности, проводится для выявления синдрома Дауна. Основным показателем для диагностики становится:
- Толщина воротникового пространства (ТВП). ТВП – это расстояние между мягкими тканями шеи и кожей. Увеличение толщины воротникового пространства может говорить не только об увеличении риска рождения ребенка с синдромом Дауна, но и о том, что возможны другие генетические патологии у плода.

- У детей с синдромом Дауна чаще всего на сроке 11-14 недель не визуализируется носовая кость. Контуры лица сглажены.
До 11 недель беременности толщина воротникового пространства настолько мала, что невозможно адекватно и достоверно ее оценить. После 14 недели у плода формируется лимфатическая система и это пространство может в норме заполняться лимфой, поэтому измерение также не является достоверным. Частота встречаемости хромосомных аномалий у плода в зависимости от толщины воротникового пространства.
| ТВП, мм | Частота аномалий, % | Увеличенная ТВП | Нормальная ТВП |
| 3 | 7 | ||
| 4 | 27 | ||
| 5 | 53 | ||
| 6 | 49 | ||
| 7 | 83 | ||
| 8 | 70 | ||
| 9 | 78 |
При расшифровке данных скрининга 1 триместра следует помнить, что один лишь показатель толщины воротникового пространства не является руководством к действию и не говорит о 100% вероятности наличия заболевания у ребенка.
Поэтому проводится следующий этап скрининга 1 триместра — взятие крови для определения уровня β-ХГЧ и РАРР-А. Исходя из полученных показателей, рассчитывается риск наличия хромосомной патологии. Если риск по результатам этих исследований высокий, то предлагают провести амниоцентез. Это взятие околоплодных вод для проведения более точной диагностики.
В особо трудных случаях может потребоваться кордоцентез – взятие пуповиной крови на анализ. Также могут использовать биопсию ворсин хориона. Все эти методы являются инвазивными и сопряжены с рисками для матери и плода. Поэтому решение о их проведении решается женщиной и ее врачом совместно, с учетом всех рисков проведения и отказа от процедуры.
Биохимический скрининг первого триместра беременности
Проводится этот этап исследования обязательно после УЗИ. Это важное условие, потому что все биохимические показатели зависят от срока беременности вплоть до дня. Каждый день нормы показателей изменяются. А УЗИ позволяет определить срок беременности с той точностью, что и необходима для проведения правильного исследования. На момент сдачи крови, у вас уже должны быть результаты УЗИ с указанным сроком беременности исходя из КТР. Также на УЗИ может выявиться замершая беременность, регрессирующая беременность, в таком случае дальнейшее обследование не имеет смысла.
На момент сдачи крови, у вас уже должны быть результаты УЗИ с указанным сроком беременности исходя из КТР. Также на УЗИ может выявиться замершая беременность, регрессирующая беременность, в таком случае дальнейшее обследование не имеет смысла.
Подготовка к исследованию
Взятие крови проводится натощак! Нежелательно даже пить воду утром этого дня. Если исследование проводится слишком поздно, разрешается выпить немного воды. Лучше взять с собой еду и перекусить сразу после забора крови, нежели нарушать это условие.
За 2 дня до назначенного дня исследования следует исключить из рациона все продукты, которые являются сильными аллергенами, даже если у вас никогда на них не было аллергии – это шоколад, орехи, морепродукты, а также очень жирные блюда и копчености.
В ином случае риск получить недостоверные результаты значительно повышается.
Рассмотрим, о чем могут свидетельствоват
β-ХГЧ – хорионический гонадотропин
Этот гормон вырабатывается хорионом («оболочкой» плода), благодаря именно этому гормону возможно определение наличия беременности на ранних сроках. Уровень β-ХГЧ постепенно повышается в первые месяцы беременности, максимальный его уровень наблюдается в 11-12 недель беременности. Затем уровень β-ХГЧ постепенно снижается, оставаясь неизменным на протяжении второй половины беременности.
Уровень β-ХГЧ постепенно повышается в первые месяцы беременности, максимальный его уровень наблюдается в 11-12 недель беременности. Затем уровень β-ХГЧ постепенно снижается, оставаясь неизменным на протяжении второй половины беременности.
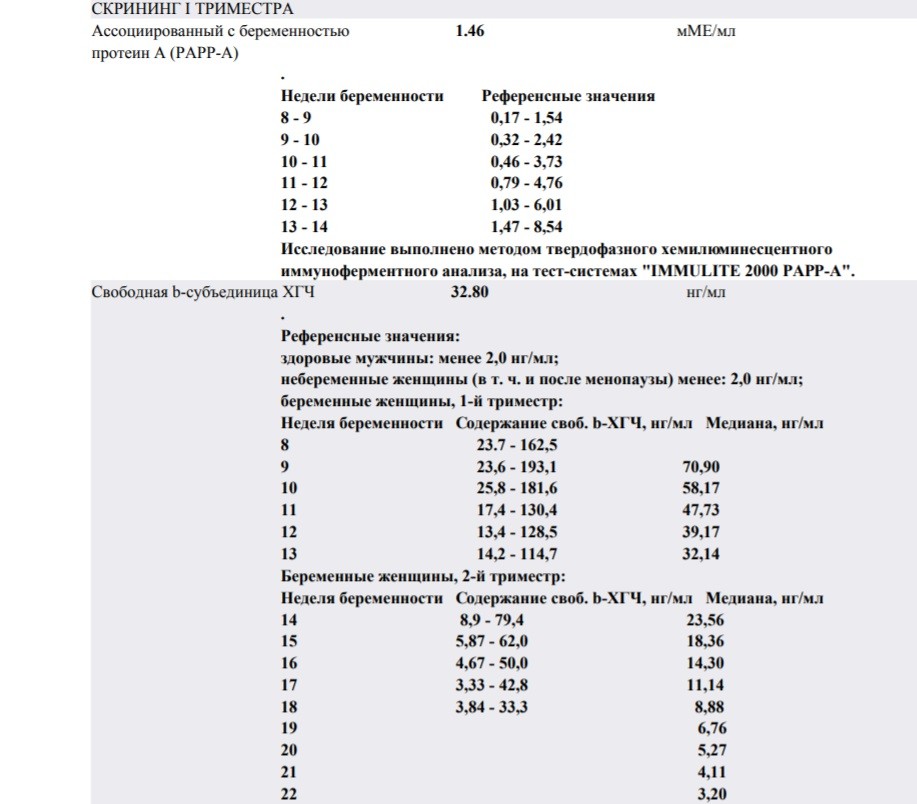
| Нормальные показатели уровня хорионического гонадотропина, в зависимости от срока беременности: | Повышение уровня β-ХГЧ наблюдается в следующих случаях: | Понижение уровня β-ХГЧ наблюдается в следующих случаях: | |
| Недели | β-ХГЧ, нг/мл |
|
|
| 10 | 25,80-181,60 | ||
| 11 | 17,4-130,3 | ||
| 12 | 13,4-128,5 | ||
| 13 | 14,2-114,8 | ||
PAPP-A – протеин-A, ассоциированный с беременностью
Это белок, вырабатывающийся плацентой в организме беременной женщины, отвечает за иммунный ответ во время беременности, а также отвечает за нормальное развитие и функционирование плаценты.
| Нормальные показатели уровня PAPP-A, в зависимости от срока беременности: | Отклонения показателя | |
| Недели | PAPP-A, мЕД/мл | «-» При снижении его уровня увеличивается риск следующих патологий:
«+» Изолированное повышение уровня этого белка не имеет клинического и диагностического значения. |
| 10-11 | 0,45 – 3,73 | |
| 11-12 | 0,78 – 4,77 | |
| 12-13 | 1,03 – 6,02 | |
| 13-14 | 1,47 – 8,55 | |
МоМ коэффициент
После получения результатов, врач оценивает их, рассчитывая МоМ-коэффициент. Данный коэффициент показывает отклонение уровня показателей у данной женщины от средней нормальной величины. В норме МоМ-коэфициент составляет 0,5-2,5 (при многоплодной беременности до 3,5).
Данные коэффициента и показателей могут отличаться в разных лабораториях, уровень гормона и белка может быть рассчитан и в других единицах измерения. Не следует использовать данные в статье, как нормы именно к Вашему исследованию. Необходимо результаты трактовать вместе с вашим врачом!
Далее с помощью компьютерной программы PRISCA, с учетом всех полученных показателей, возраста женщины, ее вредных привычек (курение), наличия сахарного диабета и прочих заболеваний, веса женщины, количества плодов или наличие ЭКО — рассчитывается риск рождения ребенка с генетическими аномалиями. Высокий риск – это риск менее 1:380.
Пример: Если в заключении указано высокий риск 1:280, это означает, что из 280 беременных женщин с такими же показателями, у одной родится ребенок с генетической патологией.
Особенные ситуации, когда показатели могут быть иными.
- ЭКО – значения β-ХГЧ будут выше, а РАРР-А – ниже средних.
- При ожирении у женщины уровень гормонов может повышаться.

- При многоплодной беременности β-ХГЧ выше и нормы для таких случаев пока не установлены точно.
- Сахарный диабет у матери может вызвать повышение уровня гормонов.
Скрининг материнской сыворотки в первом триместре беременности с использованием биохимических маркеров PAPP-A и свободного β-ХГЧ для выявления синдрома Дауна, синдрома Патау и синдрома Эдварда
Indian J Clin Biochem. 2013 январь; 28(1): 3–12.
, , , , иС. Шифа
SRL Diagnostics, Fortis Healthcare Enterprise, Unit4, A0 Razi 6. Clinical Biochemist, A0 Razi 6. Box 505143, Dubai Health Care City, United Arab Emirates
M.Amargandhi
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
J. Bhupendra
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.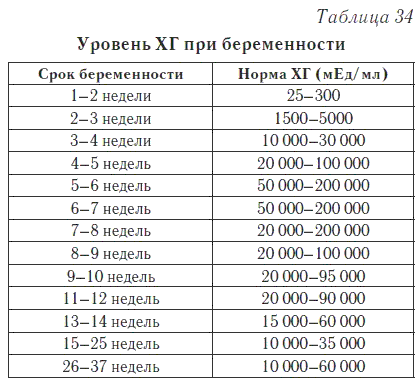 O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
S. Moulali
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
T. Kristine
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
Автор, ответственный за переписку.Поступила в редакцию 8 июля 2012 г.; Принято 30 сентября 2012 г.
Авторские права © Ассоциация клинических биохимиков Индии, 2012 г. Эта статья цитировалась другими статьями в PMC.Abstract
Программа скрининга в первом триместре предлагает неинвазивный метод раннего выявления анеуплоидии беременных. Этот скрининг проводится с помощью комбинации двух биохимических маркеров, т. е. свободного β-хорионического гонадотропина человека в сыворотке (свободный β-ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-A), возраста матери и толщины воротникового пространства плода (NT) в возрасте 11 + лет. 0–13 + 6 недель беременности.Полезным последствием скрининга является ранняя диагностика трисомий 21, 18 и 13. В 11 + 0–13 + 6 недель относительная распространенность трисомий 18 и 13 по сравнению с трисомией 21 составляет один к трем и один к семи, соответственно. Все три трисомии связаны с увеличением возраста матери, увеличением NT плода и снижением РАРР-А, но при трисомии 21 уровень свободного β-ХГЧ в сыворотке повышен, тогда как при трисомиях 18 и 13 уровень свободного β-ХГЧ снижен.
Этот скрининг проводится с помощью комбинации двух биохимических маркеров, т. е. свободного β-хорионического гонадотропина человека в сыворотке (свободный β-ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-A), возраста матери и толщины воротникового пространства плода (NT) в возрасте 11 + лет. 0–13 + 6 недель беременности.Полезным последствием скрининга является ранняя диагностика трисомий 21, 18 и 13. В 11 + 0–13 + 6 недель относительная распространенность трисомий 18 и 13 по сравнению с трисомией 21 составляет один к трем и один к семи, соответственно. Все три трисомии связаны с увеличением возраста матери, увеличением NT плода и снижением РАРР-А, но при трисомии 21 уровень свободного β-ХГЧ в сыворотке повышен, тогда как при трисомиях 18 и 13 уровень свободного β-ХГЧ снижен.
Ключевые слова: РАРР-А, Свободный β-ХГЧ, Затылочная прозрачность, Синдром Дауна, Синдром Патау, Синдром Эдвардса во многих странах.Недавний интерес к пренатальному скринингу трисомий был сосредоточен на первом триместре.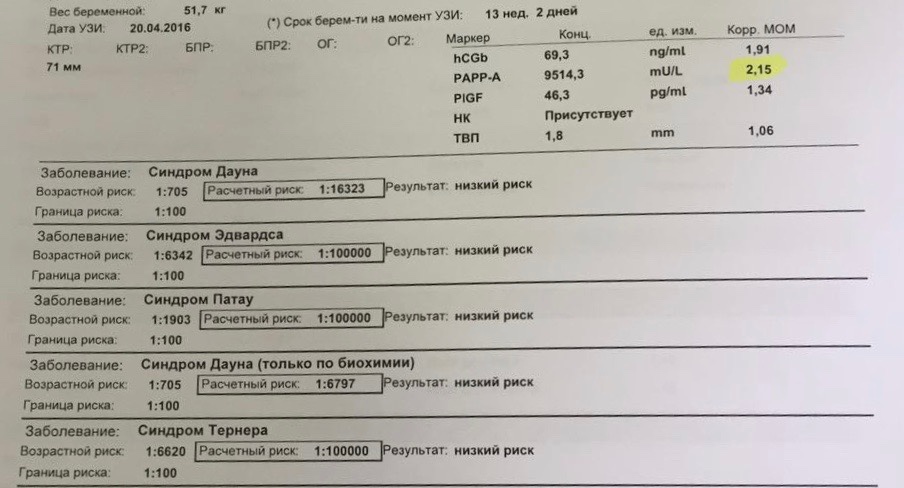 Было показано, что из исследованных биохимических маркеров только материнский свободный от сыворотки β-хорионический гонадотропин человека (свободный β-ХГЧ) и ассоциированный с беременностью белок плазмы-А (РАРР-А) имеют значение. Целью программ скрининга материнской сыворотки в первом триместре является выявление женщин с повышенным риском рождения ребенка с дефектами синдрома Дауна, синдрома Патау и синдрома Эдвардса, а также тех, кому будет полезно тестирование.
Было показано, что из исследованных биохимических маркеров только материнский свободный от сыворотки β-хорионический гонадотропин человека (свободный β-ХГЧ) и ассоциированный с беременностью белок плазмы-А (РАРР-А) имеют значение. Целью программ скрининга материнской сыворотки в первом триместре является выявление женщин с повышенным риском рождения ребенка с дефектами синдрома Дауна, синдрома Патау и синдрома Эдвардса, а также тех, кому будет полезно тестирование.
Связь между увеличением возраста матери [1] и повышенным риском трисомии 21 (таблица ) хорошо известна, и беременным женщинам старше 35 лет на момент родов обычно предлагается инвазивное пренатальное диагностическое тестирование. Наиболее часто используемым тестом для генетической диагностики является амниоцентез, но частота спонтанных потерь плода, связанных с амниоцентезом, составляет в среднем около одной на каждые 200 [2] процедур. Из-за этого риска анализ сывороточных аналитов стал важным неинвазивным первым шагом в выявлении пациентов с риском врожденных аномалий.
Таблица 1
Таблица 1
Распространенность трисомии 21 по возрасту матери и гестационным возрастом
| Материн (лет) | Гестационный возраст (недели) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 10 | 12 | 14 | 16 | 20 | 40 | ||||||
| 20 | 1: 983 | 1: 1 0684 | 1: 1 140084 | 1: 1 1200 | 1: 1 200 | 1: 1,295 | 1: 1 527 | ||||
| 25 | 1: 870 | 1: 946 | 1: 1,009 | 1: 1 062 | 1: 1,147 | 1: 1,352 | 1: 1,352 | ||||
| 30 | 1: 576 | 1: 626 | 1: 668 | 1: 703 | 1: 759 | 1: 895 | |||||
| 31 | 1: 500 | 1: 583 | 1: 580 | 1: 610 | 1: 658 | 1: 776 | |||||
| 32 | 1:424 | 1:461 | 1:492 | 9 0083 1: 5181: 559 | 1: 659 | ||||||
| 33 | 1: 332 | 1: 383 | 1: 383 | 1: 409 | 1: 430 | 1: 464 | 1: 547 | ||||
| 34 | 34 | 1: 287 | 1: 312 | 1: 312 | 1: 333 | 1: 350 | 1: 350 | 1: 378 | 1: 446 | ||
| 35 | 1: 229 | 1: 249 | 1: 266 | 1: 280 | 1: 302 | 1: 302 | 1: 302 | ||||
| 36 | 1: 180 | 1: 196 | 1: 209 | 1: 220 | 1: 238 | 1: 280 | |||||
| 37 | 1: 140 | 1: 140 | 1: 152 | 1: 163 | 1: 171 | 1: 171 | 1: 185 | 1: 218 | |||
| 38 | 1: 108 | 1: 117 | 1: 125 | 1: 131 | 1: 142 | 1: 142 | 1: 167 | ||||
| 39 | 1:82 | 1:89 | 1:95 900 84 | 1: 100 | 1: 108 | 1: 128 | 1: 128 | ||||
| 40 | 1:62 | 1:68 | 1:72 | 1:72 | 1:76 | 1:82 | 1:97 | ||||
| 41 | 1:47 | 1:51 | 1:51 | 1:54 | 1:57 | 1:57 | 1:62 | 1:73 | |||
| 42 | 1:35 | 1:38 | 1:41 | 1:43 | 1:43 | 1:46 | 1:55 | ||||
| 43 | 1:26 | 1:29 | 1:30 | 1:32 | 1:35 | 1:41 | 1:41 | ||||
| 44 | 1:20 | 1:21 | 1:21 | 1:23 | 1:24 | 1:26 | 1:30 | ||||
| 45 | 1:15 | 1:16 | 1:17 | 1:18 | 1:19 | 1:23 | |||||
Текущие исследования, проведенные в первом триместре беременности, показали, что двойной маркерный тест помогает выявить 90 % женщин с риском развития синдрома Дауна, 94 % всех основных хромосомных дефектов, таких как синдром Патау, синдром Эдвардса, триплоидия и синдром Тернера, и 60 % других хромосомных дефектов, таких как делеции, частичные трисомии , несбалансированные транслокации и анеуплоидии половых хромосом, отличные от тернеров [3]. Некоторые из преимуществ биохимического скрининга в первом триместре по сравнению с биохимическим скринингом во втором триместре включают предоставление клиницистам и пациентам существенного преимущества более ранней диагностики, более высоких показателей выявления синдрома Дауна у плода, т.е. 90 % [4] или даже выше, по сравнению с 80 % для квадро-теста второго триместра [5, 6] и 70 % для более раннего тройного скрининг-теста [7], и обнаружение большинства серьезных хромосомных аномалий, кроме трисомии 21. также выступает в качестве неспецифического маркера других врожденных дефектов, включая некоторые серьезные пороки сердца и синдромальные состояния.Он может обнаружить ряд основных структурных врожденных дефектов, связанных с нормальными хромосомами.
Некоторые из преимуществ биохимического скрининга в первом триместре по сравнению с биохимическим скринингом во втором триместре включают предоставление клиницистам и пациентам существенного преимущества более ранней диагностики, более высоких показателей выявления синдрома Дауна у плода, т.е. 90 % [4] или даже выше, по сравнению с 80 % для квадро-теста второго триместра [5, 6] и 70 % для более раннего тройного скрининг-теста [7], и обнаружение большинства серьезных хромосомных аномалий, кроме трисомии 21. также выступает в качестве неспецифического маркера других врожденных дефектов, включая некоторые серьезные пороки сердца и синдромальные состояния.Он может обнаружить ряд основных структурных врожденных дефектов, связанных с нормальными хромосомами.
Скрининг материнской сыворотки имеет некоторые ограничения. Одним из недостатков является то, что для обнаружения дефекта нервной трубки потребуется либо отдельный тест на АФП через 15 недель, либо опора на сканирование аномалий плода в 18–22 недель, также известное как морфологическое сканирование. Другим недостатком является то, что ранний скрининг предпочтительно выявляет те хромосомные аномалии беременности, которые обречены на выкидыш. Приблизительно 30 % пораженных плодов погибают в период между 12 недельами беременности и сроком [1].Таким образом, женщины без необходимости вынуждены принимать решение о прерывании беременности, которая грозит выкидышем. Следует помнить, что тест на двойные маркеры является лишь скрининговым тестом, который дает риск генетического нарушения, но не диагноз.
Другим недостатком является то, что ранний скрининг предпочтительно выявляет те хромосомные аномалии беременности, которые обречены на выкидыш. Приблизительно 30 % пораженных плодов погибают в период между 12 недельами беременности и сроком [1].Таким образом, женщины без необходимости вынуждены принимать решение о прерывании беременности, которая грозит выкидышем. Следует помнить, что тест на двойные маркеры является лишь скрининговым тестом, который дает риск генетического нарушения, но не диагноз.
Комбинированный скрининг в первом триместре беременности
Скрининг в первом триместре проводится между 10 и 14 неделями беременности (рис. ). Маркеры, используемые для расчета риска, представляют собой 2 сывороточных маркера: РАРР-А и свободный β-ХГЧ). Снижение уровня РАРР-А до 14-й недели беременности связано с повышенным риском синдрома Дауна и трисомии 18.В то время как повышенный уровень ХГЧ связан с повышенным риском синдрома Дауна. Третьим маркером является прозрачность воротникового пространства плода (NT, область, содержащая жидкость за шеей плода), которую определяют с помощью ультразвука. Измерение воротникового пространства должно выполняться опытными сонографистами в период между 10 и 13 неделями и 6 днями беременности. Большинство плодов с синдромом Дауна имеют повышенное значение NT по сравнению с нормальными плодами того же гестационного возраста.
Измерение воротникового пространства должно выполняться опытными сонографистами в период между 10 и 13 неделями и 6 днями беременности. Большинство плодов с синдромом Дауна имеют повышенное значение NT по сравнению с нормальными плодами того же гестационного возраста.
Скрининг материнской сыворотки в первом триместре
Белки материнской крови в первом триместре Скрининг
Ряд белков в материнском кровотоке был обнаружен во время беременности. Многие из этих белков производятся или модифицируются плацентой. Различия в уровнях некоторых белков наблюдались у пациенток, вынашивающих плод с синдромом Дауна и некоторыми другими хромосомными аномалиями. Обнаружение этих незначительных различий в уровнях белка формирует основу для их использования в протоколах скрининга.Их называют биохимическими маркерами. Определенные образцы биохимических маркеров были связаны с синдромом Дауна плода, а также с другими состояниями. Уровни этих белков изменяются во время беременности, поэтому интерпретация требует знания гестационного возраста. Кроме того, эффективность этих белков зависит от гестационного возраста. Например, различия в уровнях белка могут наблюдаться во втором триместре, но не в первом, в то время как другие белки показывают различия в первом триместре, но не во втором.
Кроме того, эффективность этих белков зависит от гестационного возраста. Например, различия в уровнях белка могут наблюдаться во втором триместре, но не в первом, в то время как другие белки показывают различия в первом триместре, но не во втором.
Материнская сыворотка PAPP-A
PAPP-A — это один из двух маркеров материнской сыворотки, используемых в настоящее время для скрининга в возрасте от 10 до 14 недель. Он продуцируется плацентарным синцитиотрофобластом и децидуальной оболочкой. Он увеличивает биодоступность инсулиноподобного фактора роста, который, в свою очередь, опосредует инвазию трофобласта и модулирует транспорт глюкозы и аминокислот в плаценте. PAPP-A также экспрессируется в гранулезных клетках яичников и в нерепродуктивных тканях, таких как фибробласты, остеобласты и гладкомышечные клетки сосудов.
Химия РАРР-А
РАРР-А представляет собой гликопротеин, первоначально обнаруженный Lin et al. [8] в плазме беременной женщины. Белок секретируется в виде дисульфид-связанного гомодимера (рис.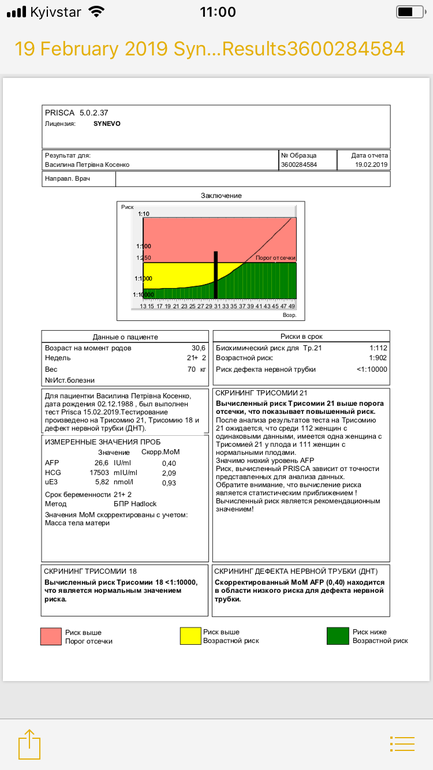 ) с молекулярной массой 400 кДа. Каждая субъединица происходит от препро-PAPP-A, содержащего 1627 белковых остатков [9–11], который процессируется в зрелый PAPP-A из 1547 аминокислотных остатков и 14 предполагаемых сайтов N-гликозилирования [9, 10]. Он секретируется как активная протеаза после внутриклеточного расщепления С-концевой стороны полипептида РАРР-А [9].Это цинксвязывающая металлопротеиназа, принадлежащая к суперсемейству метцинцинов металлопротеиназ [8]. В плазме PAPP-A циркулирует либо в свободной форме, либо в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (proMBP), образуя приблизительно 500 кДа и называемого PAPP-A/proMBP (рис. ) [12, 13]. ProMBP замещен как N-, так и O-связанным углеводом в дополнение к одному фрагменту гепарансульфата, который, как полагают, занимает сайт связывания PAPP-A на поверхности клетки в циркулирующем комплексе PAPP-A/proMBP [14, 15]. .Ген PAPP-A был отнесен к хромосоме 9q33.1 человека, охватывающей более 200 т.
) с молекулярной массой 400 кДа. Каждая субъединица происходит от препро-PAPP-A, содержащего 1627 белковых остатков [9–11], который процессируется в зрелый PAPP-A из 1547 аминокислотных остатков и 14 предполагаемых сайтов N-гликозилирования [9, 10]. Он секретируется как активная протеаза после внутриклеточного расщепления С-концевой стороны полипептида РАРР-А [9].Это цинксвязывающая металлопротеиназа, принадлежащая к суперсемейству метцинцинов металлопротеиназ [8]. В плазме PAPP-A циркулирует либо в свободной форме, либо в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (proMBP), образуя приблизительно 500 кДа и называемого PAPP-A/proMBP (рис. ) [12, 13]. ProMBP замещен как N-, так и O-связанным углеводом в дополнение к одному фрагменту гепарансульфата, который, как полагают, занимает сайт связывания PAPP-A на поверхности клетки в циркулирующем комплексе PAPP-A/proMBP [14, 15]. .Ген PAPP-A был отнесен к хромосоме 9q33.1 человека, охватывающей более 200 т.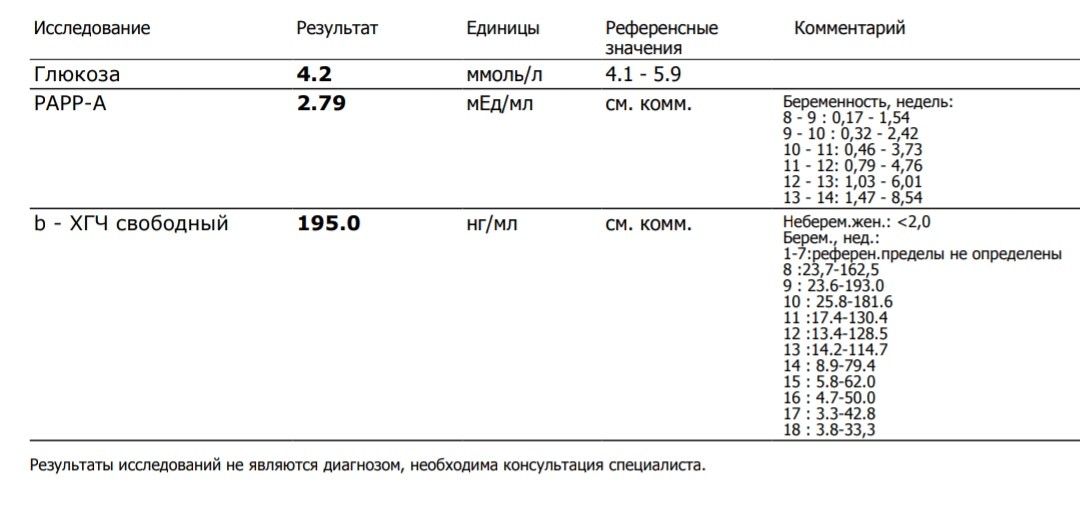 п.н. ДНК, и содержит 22 экзона [13].
п.н. ДНК, и содержит 22 экзона [13].
Ассоциированный с беременностью белок плазмы А или PAPP-A в виде дисульфид-связанного гомодимера в свободной форме и в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (ProMBP), т.е. PAPP-A/ProMBP при беременности
PAPP-A при беременности
Во время беременности как PAPP-A, так и proMBP обильно экспрессируются в плаценте человека, но в разных типах клеток. Большая часть PAPP-A синтезируется в плацентарном синцитиотрофобласте [16], а весь proMBP синтезируется во вневорсинчатых цитотрофобластах [17], откуда он секретируется без расщепления пропептида.Процесс образования комплекса РАРР-А/проМВР происходит во внеклеточном пространстве, вероятно, на поверхности синцитиотрофобласта. При нормальной беременности концентрация РАРР-А в кровотоке матери увеличивается с гестационным возрастом. Его концентрация увеличивается экспоненциально со временем удвоения 3–4 дня в течение первых триместров (рис. ), затем уровень продолжает расти на протяжении всей беременности до родов.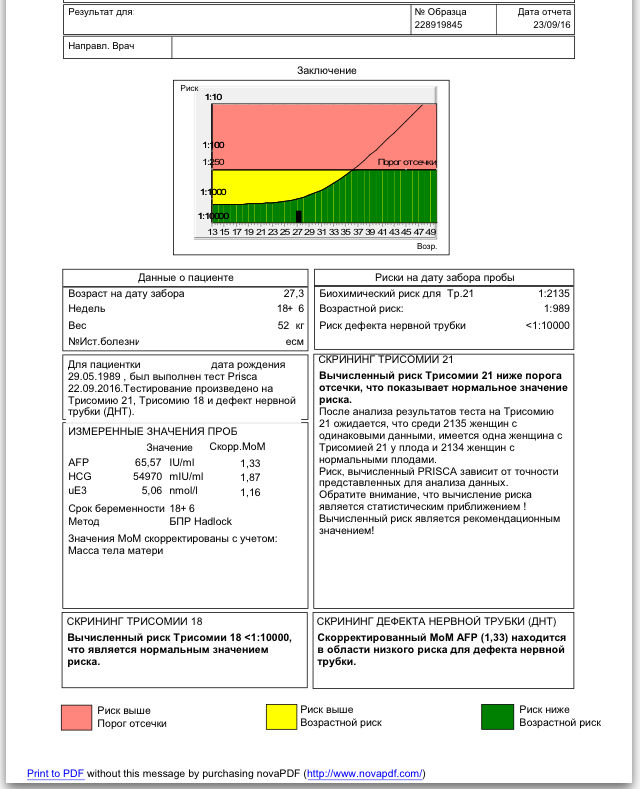 Быстрое повышение уровня РАРР-А в течение первого триместра приводит к тому, что интерпретация данного значения сильно зависит от гестационного возраста.Поэтому общепринятой практикой является использование единицы, кратной медиане (МоМ), в качестве зависящего от гестационного возраста выражения концентрации РАРР-А. Средний период полувыведения РАРР-А после нормальных родов составляет 53 ± 26 ч (среднее значение плюс стандартное отклонение) [18]. Концентрации РАРР-А в 100 и 1000 раз ниже в крови плода и в амниотической жидкости соответственно по сравнению с материнской кровью [19].
Быстрое повышение уровня РАРР-А в течение первого триместра приводит к тому, что интерпретация данного значения сильно зависит от гестационного возраста.Поэтому общепринятой практикой является использование единицы, кратной медиане (МоМ), в качестве зависящего от гестационного возраста выражения концентрации РАРР-А. Средний период полувыведения РАРР-А после нормальных родов составляет 53 ± 26 ч (среднее значение плюс стандартное отклонение) [18]. Концентрации РАРР-А в 100 и 1000 раз ниже в крови плода и в амниотической жидкости соответственно по сравнению с материнской кровью [19].
Экспоненциальное повышение РАРР-А в первом триместре нормальной беременности
Около 99 % РАРР-А ковалентно связано в комплексе 2:2 с проформой основного основного белка эозинофилов (proMBP) во время беременности.proMBP функционирует как эндогенный ингибитор протеолитической активности PAPP-A (ингибитор протеазы in vivo), механизм ингибирования которого в настоящее время неизвестен. Субстраты PAPP-A включают белки, связывающие инсулиноподобный фактор роста (IGFBP) 4 и 5, роль которых заключается в ингибировании биологической активности инсулиноподобных факторов роста 1 и 2.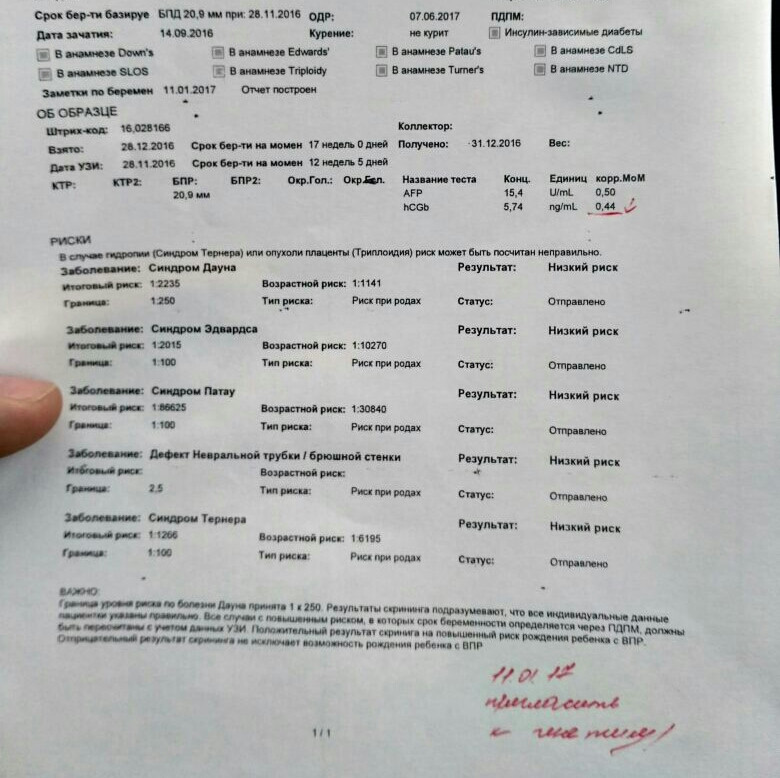 PAPP-A действует как «протеаза» для IGFBPs [20], помогая высвобождению IGF из этих связывающих белков, так что он может свободно взаимодействовать со своим клеточным рецептором аутокринным или паракринным образом (рис.). Считается, что IGF играет важную роль в инвазии трофобласта и, следовательно, в раннем развитии и васкуляризации плаценты и плацентарного ложа.
PAPP-A действует как «протеаза» для IGFBPs [20], помогая высвобождению IGF из этих связывающих белков, так что он может свободно взаимодействовать со своим клеточным рецептором аутокринным или паракринным образом (рис.). Считается, что IGF играет важную роль в инвазии трофобласта и, следовательно, в раннем развитии и васкуляризации плаценты и плацентарного ложа.
Протеолитическая активность РАРР-А у человека. Связь между PAPP-A, IGF и IGFBP-4. a Замещенные гепаринсульфатом рецепторы в клетке-мишени иммобилизуют РАРР-А в положении, близком к рецептору ИФР. Затем PAPP-A отщепляет IGF от IGFBP-4 в непосредственной близости от рецептора IGF. Затем свободный ИФР связывается с рецептором ИФР, индуцируя пролиферацию клеток, инвазию трофобласта, транспорт глюкозы и аминокислот в плаценту. b GAG-цепь ProMBP связывается там с доменом PAPP-A, высвобождая PAPP-A с клеточной поверхности. ProMBP инактивирует протеолитическую активность PAPP-A
Снижение уровня PAPP-A обнаруживается в связи с нарушением функции плаценты, что легло в основу скрининга в первом триместре плода на синдром Дауна [13, 16].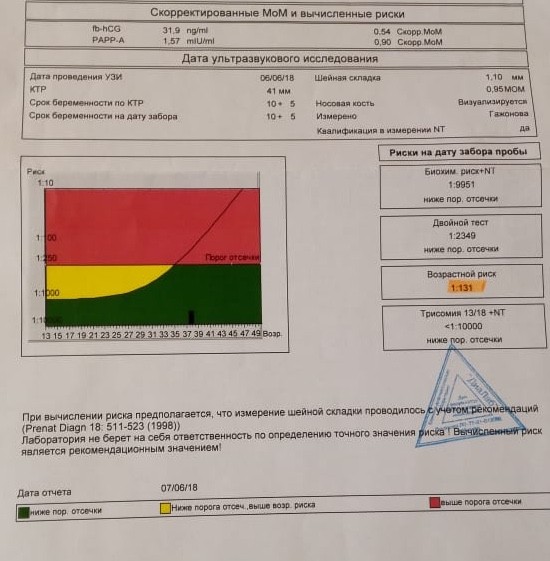 Низкий уровень материнской сыворотки в первом триместре обнаруживается не только при трисомии 21, трисомии 18 и трисомии 13, но и при анеуплоидии плода без синдрома Дауна.Также сообщается, что PAPP-A имеет положительную связь с массой тела при рождении [21]. По мере снижения PAPP-A риск рождения детей с малым весом для гестационного возраста увеличивается. Установлено, что уровни РАРР-А в кровотоке снижаются при внематочной беременности. Некоторые из осложнений, связанных с необъяснимым изолированным низким РАРР-А, включают преждевременные роды, задержку внутриутробного развития, гестационную гипертензию, гестационную гипертензию с протеинурией [22].
Низкий уровень материнской сыворотки в первом триместре обнаруживается не только при трисомии 21, трисомии 18 и трисомии 13, но и при анеуплоидии плода без синдрома Дауна.Также сообщается, что PAPP-A имеет положительную связь с массой тела при рождении [21]. По мере снижения PAPP-A риск рождения детей с малым весом для гестационного возраста увеличивается. Установлено, что уровни РАРР-А в кровотоке снижаются при внематочной беременности. Некоторые из осложнений, связанных с необъяснимым изолированным низким РАРР-А, включают преждевременные роды, задержку внутриутробного развития, гестационную гипертензию, гестационную гипертензию с протеинурией [22].
Исследования показали, что одной из причин самопроизвольного аборта у этих женщин может быть снижение доступности инсулиноподобного фактора роста-II из-за снижения уровня PAPP-A в сыворотке крови [23].Снижение PAPP-A в материнской сыворотке не связано с каким-либо изменением плацентарного синтеза этого белка, поскольку экспрессия мРНК PAPP-A существенно не снижена в плацентах с синдромом Дауна.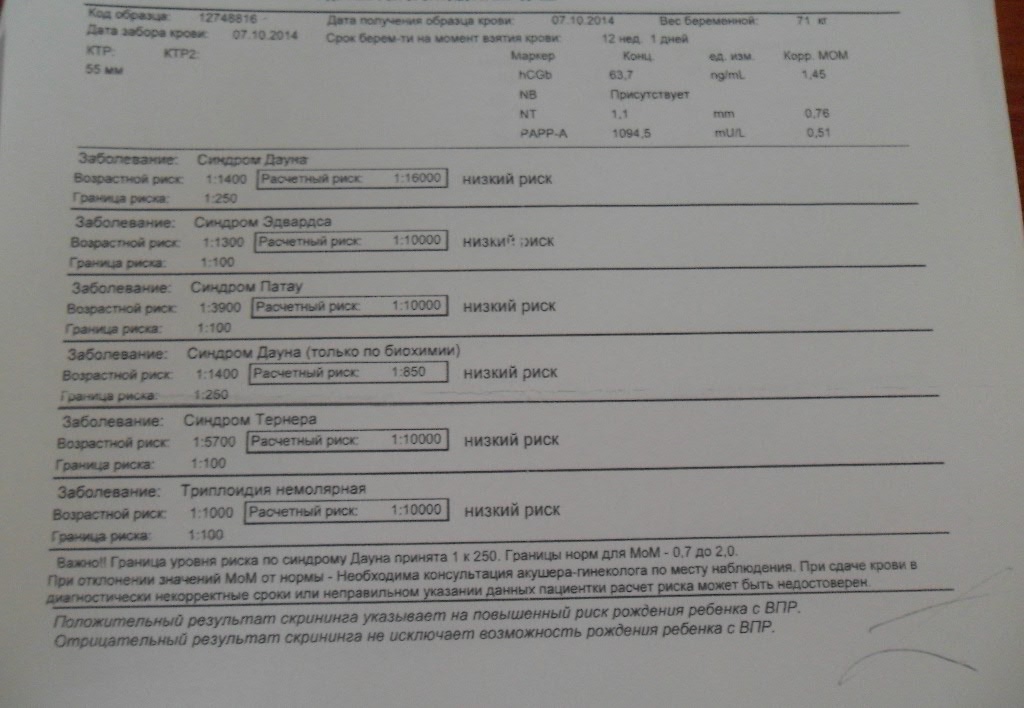 Кроме того, корреляция между уровнями экспрессии РАРР-А в сыворотке и тканях теряется при беременности Дауна. Эти наблюдения предполагают, что снижение PAPP-A в материнской сыворотке является посттрансляционным и может быть вызвано изменением механизмов высвобождения плаценты или модификацией стабильности секретируемого белка [24].Установлено, что РАРР-А значительно выше при беременности двойней. В среднем значения РАРР-А у близнецов в 1,86 раза выше, чем у одноплодных. Значимых акушерских исходов при повышенном РАРР-А в первом триместре не описано [22]. Измеримые уровни были обнаружены у мужчин и небеременных женщин. У небеременных лиц PAPP-A обнаруживается в виде гомодимера 400 кДа.
Кроме того, корреляция между уровнями экспрессии РАРР-А в сыворотке и тканях теряется при беременности Дауна. Эти наблюдения предполагают, что снижение PAPP-A в материнской сыворотке является посттрансляционным и может быть вызвано изменением механизмов высвобождения плаценты или модификацией стабильности секретируемого белка [24].Установлено, что РАРР-А значительно выше при беременности двойней. В среднем значения РАРР-А у близнецов в 1,86 раза выше, чем у одноплодных. Значимых акушерских исходов при повышенном РАРР-А в первом триместре не описано [22]. Измеримые уровни были обнаружены у мужчин и небеременных женщин. У небеременных лиц PAPP-A обнаруживается в виде гомодимера 400 кДа.
Гормон бета-ХГЧ, не содержащий материнской сыворотки
Хорионический гонадотропин человека представляет собой гликопротеиновый гормон с молекулярной массой 39 500 Да, обычно обнаруживаемый в крови и моче только во время беременности.В 1987 г. Богарт и соавт. [25] сообщили о повышенных уровнях ХГЧ в материнской сыворотке при беременности с синдромом Дауна, и с тех пор ХГЧ был введен в большинство программ скрининга. Для инициации и поддержания беременности ХГЧ опосредует множественные функции плаценты, матки и плода. Некоторые из них включают развитие клеток синцитиотрофобласта, митотический рост и дифференцировку эндометрия, локализованное подавление материнской иммунной системы, модуляцию морфологии матки и экспрессии генов, а также координацию сложной передачи сигналов между эндометрием [26].
Для инициации и поддержания беременности ХГЧ опосредует множественные функции плаценты, матки и плода. Некоторые из них включают развитие клеток синцитиотрофобласта, митотический рост и дифференцировку эндометрия, локализованное подавление материнской иммунной системы, модуляцию морфологии матки и экспрессии генов, а также координацию сложной передачи сигналов между эндометрием [26].
Химия
Хорионический гонадотропин человека состоит из двух нековалентно связанных субъединиц, α и β, и вырабатывается клетками синцитиотрофобласта плаценты. ХГЧ имеет одну β-субъединицу, которая содержит 145 аминокислот, связанных шестью дисульфидными мостиками, и α-субъединицу, содержащую 92 аминокислоты, связанные 5 дисульфидными мостиками, которая также является общей для трех других гликопротеиновых гормонов: ЛГ, ФСГ и ТТГ. β-субъединица уникальна и отличает ХГЧ от других гликопротеиновых гормонов (рис.). Он содержит две N-связанные боковые цепи олигосахаридов, присоединенные к остаткам 13 и 30 [27]. Он также имеет четыре О-связанных олигосахаридных звена, расположенных на уникальном С-концевом участке, богатом пролином и серином (остатки 122–145). α-субъединица имеет две N-связанные олигосахаридные боковые цепи, присоединенные к аминокислотным остаткам 52 и 78 [27]. В материнской сыворотке присутствуют пять родственных ХГЧ молекул: ХГЧ без разрыва, который представляет собой активный гормон; порезанный ХГЧ; свободная α-субъединица; свободная β-субъединица; и свободная от разрыва субъединица β [28].Свободная β-субъединица может образовываться из трех источников: прямой продукции клеток трофобласта, диссоциации ХГЧ на свободные α- и свободные β-субъединицы, а также ферментов макрофагов или нейтрофилов, разрывающих молекулу ХГЧ [29]. Свободный β-ХГЧ, циркулирующий в материнской сыворотке, составляет всего около 0,3–4 % от общего количества ХГЧ [29]. Один ген на хромосоме 6 кодирует субъединицу α всех четырех гликопротеиновых гормонов (ТТГ, ЛГ, ФСГ и ХГ). Хромосома 19 содержит семейство генов, кодирующих субъединицу CGβ [29].
Он также имеет четыре О-связанных олигосахаридных звена, расположенных на уникальном С-концевом участке, богатом пролином и серином (остатки 122–145). α-субъединица имеет две N-связанные олигосахаридные боковые цепи, присоединенные к аминокислотным остаткам 52 и 78 [27]. В материнской сыворотке присутствуют пять родственных ХГЧ молекул: ХГЧ без разрыва, который представляет собой активный гормон; порезанный ХГЧ; свободная α-субъединица; свободная β-субъединица; и свободная от разрыва субъединица β [28].Свободная β-субъединица может образовываться из трех источников: прямой продукции клеток трофобласта, диссоциации ХГЧ на свободные α- и свободные β-субъединицы, а также ферментов макрофагов или нейтрофилов, разрывающих молекулу ХГЧ [29]. Свободный β-ХГЧ, циркулирующий в материнской сыворотке, составляет всего около 0,3–4 % от общего количества ХГЧ [29]. Один ген на хромосоме 6 кодирует субъединицу α всех четырех гликопротеиновых гормонов (ТТГ, ЛГ, ФСГ и ХГ). Хромосома 19 содержит семейство генов, кодирующих субъединицу CGβ [29].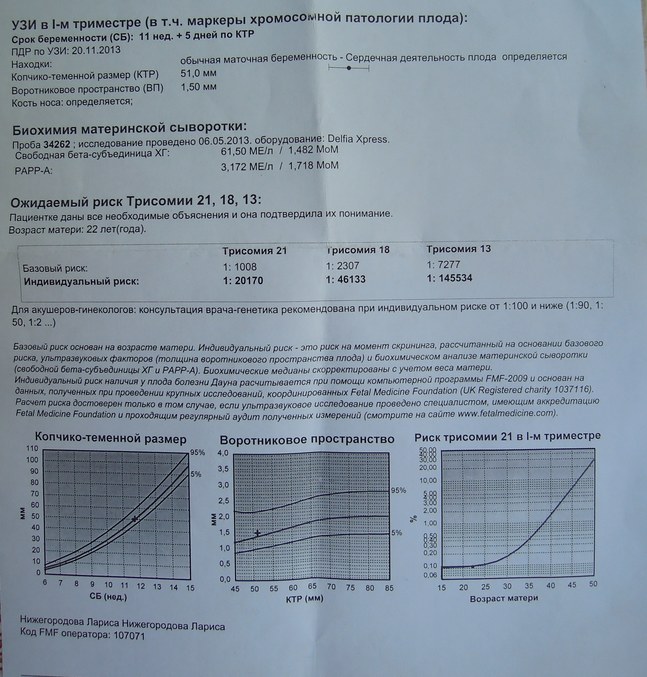 С каждого транскрибируются отдельные матричные РНК (мРНК). Субъединицы спонтанно объединяются в шероховатой эндоплазматической сети и затем непрерывно секретируются в материнский кровоток.
С каждого транскрибируются отдельные матричные РНК (мРНК). Субъединицы спонтанно объединяются в шероховатой эндоплазматической сети и затем непрерывно секретируются в материнский кровоток.
Структура интактного ХГЧ и ХГЧβ
Свободный β-ХГЧ при беременности
ХГЧ в материнской сыворотке достигает максимума на 8–10 неделях, а затем снижается, достигая плато на 18–20 неделях (рис. ) беременности, и остается довольно постоянным до тех пор, пока срок. β-ХГЧ не обладает активностью ХГЧ, но несколько направлений исследований показывают, что он оказывает ростостимулирующее действие.Было высказано предположение, что β-ХГЧ препятствует ингибирующему рост эффекту трансформирующего фактора роста β, фактора роста тромбоцитов-В и фактора роста нервов [30]. Период полувыведения введенного ХГЧ является двухфазным; период полураспада быстрой фазы составляет 5–6 часов, тогда как период более медленной фазы составляет 24–33 часа. Период полувыведения очищенного β-ХГЧ, введенного человеку, составляет 0,7 и 10 ч, что короче, чем у ХГЧ. Однако после доношенной беременности или аборта β-ХГЧ фактически исчезает медленнее, чем ХГЧ.Таким образом, доля β-ХГЧ в общей иммунореактивности ХГЧ увеличивается с 0,8 % в сроке до 27 % через 3 недели. Молекулярно-биологические исследования показали, что трофобласты с трисомией 21 показывают заметное увеличение мРНК β-ХГЧ и меньшее увеличение мРНК α-ХГЧ, что позволяет предположить, что одной из причин высоких уровней ХГЧ в материнской сыворотке является повышенная продукция и секреция ХГЧ плацента [31]. Эти наблюдения подтверждаются относительной незрелостью плаценты, которая продолжает выделять большое количество ХГЧ, как и в первом триместре [32].
Однако после доношенной беременности или аборта β-ХГЧ фактически исчезает медленнее, чем ХГЧ.Таким образом, доля β-ХГЧ в общей иммунореактивности ХГЧ увеличивается с 0,8 % в сроке до 27 % через 3 недели. Молекулярно-биологические исследования показали, что трофобласты с трисомией 21 показывают заметное увеличение мРНК β-ХГЧ и меньшее увеличение мРНК α-ХГЧ, что позволяет предположить, что одной из причин высоких уровней ХГЧ в материнской сыворотке является повышенная продукция и секреция ХГЧ плацента [31]. Эти наблюдения подтверждаются относительной незрелостью плаценты, которая продолжает выделять большое количество ХГЧ, как и в первом триместре [32].
Общий ХГЧ и свободный бета-ХГЧ в первом триместре беременности
Методы измерения РАРР-А и свободного β-ХГЧ
Новая технология биохимического анализа, обеспечивающая автоматизированное, точное и репродуктивное измерение в короткие сроки после получения Образец крови позволяет комбинировать биохимическое и ультразвуковое исследование для ранней оценки, чтобы снизить нагрузку на пациентов. Необходимо выделение сыворотки для скрининга синдрома Дауна через 4 ч после отмены.Охлаждение во время любого хранения, включая транспортировку, настоятельно рекомендуется, так как преаналитическая фаза оказывает большое влияние на анализ.
Необходимо выделение сыворотки для скрининга синдрома Дауна через 4 ч после отмены.Охлаждение во время любого хранения, включая транспортировку, настоятельно рекомендуется, так как преаналитическая фаза оказывает большое влияние на анализ.
Образцы сыворотки на свободный β-ХГЧ и РАРР-А стабильны при 4 °C для цельной крови или отделенной сыворотки в течение 1 недели. Надежные результаты получаются при хранении отделенных образцов сыворотки при температуре 20°С до 2 суток и 1 суток для цельной крови. При 30 °C надежные результаты были получены только в том случае, если образцы были проанализированы в течение 2 ч сбора.
В цельной крови уровни свободного β-ХГЧ увеличивались быстрее по сравнению с сывороткой, особенно при 30 °C [33].В нескольких исследованиях сообщалось, что высокая температура хранения и длительный интервал между сбором и анализом образца приводят к увеличению концентрации свободного β-ХГЧ, поскольку он высвобождается при диссоциации или деградации интактного ХГЧ [34]. Сообщалось, что в цельной крови, хранившейся при комнатной температуре, средняя концентрация свободного β-ХГЧ в сыворотке увеличивалась на 10–15 % через 24 часа, примерно на 25 % через 3 дня и на 45 % через 4 дня [34]. Другое исследование показало, что уровни PAPP-A в сыворотке стабильны в течение 142 дней при 2–8°, 37 дней при комнатной температуре и 20 дней при 30 °C.Существенных изменений ни для одного из аналитов не наблюдалось после хранения при температуре -20 °C до 240 дней или после шести повторных циклов замораживания-оттаивания [33]. В настоящее время практически все коммерческие анализы основаны на технологии хемилюминесцентной амплификации ферментами. Материнская сыворотка PAPP-A и свободный β-hCG также могут быть измерены с использованием анализатора иммунологического анализа случайного доступа с использованием технологии эмиссии амплифицированного криптата с временным разрешением.
Сообщалось, что в цельной крови, хранившейся при комнатной температуре, средняя концентрация свободного β-ХГЧ в сыворотке увеличивалась на 10–15 % через 24 часа, примерно на 25 % через 3 дня и на 45 % через 4 дня [34]. Другое исследование показало, что уровни PAPP-A в сыворотке стабильны в течение 142 дней при 2–8°, 37 дней при комнатной температуре и 20 дней при 30 °C.Существенных изменений ни для одного из аналитов не наблюдалось после хранения при температуре -20 °C до 240 дней или после шести повторных циклов замораживания-оттаивания [33]. В настоящее время практически все коммерческие анализы основаны на технологии хемилюминесцентной амплификации ферментами. Материнская сыворотка PAPP-A и свободный β-hCG также могут быть измерены с использованием анализатора иммунологического анализа случайного доступа с использованием технологии эмиссии амплифицированного криптата с временным разрешением.
Nuchal Translucency
Наиболее важным ультразвуковым маркером при скрининге хромосомных аномалий в первом триместре является измерение толщины NT между 10 и 14 неделями беременности, о котором впервые сообщили Schulte-Valentine и Schindler в 1992 году [35]. NT измеряет заполненное подкожной жидкостью пространство между задней частью позвоночника и кожей шеи плода (рис. ). NT увеличивается с гестационным возрастом примерно на 17 % в неделю. Полупрозрачная область исчезает после 14 недель гестационного возраста, когда подкожная клетчатка становится более эхогенной. Таким образом, НТ является преходящим явлением [36]. Используя только измерение NT и возраст матери, можно определить 81% (таблица) пораженных беременностей с частотой ложноположительных результатов 5% [37]. Измерение воротникового пространства должно выполняться опытными специалистами по УЗИ и должно быть получено между 10 и 13 неделями 6 дней беременности, что эквивалентно длине темени-крестца от 38 до 84 мм.NT можно обнаружить у 99 % плодов в конце первого триместра. 50-й процентиль NT увеличивается с 1,2 мм на неделе 11 + 0 (длина темени-крестца 45 мм) до 1,5 мм на неделе 13 + 6 (длина темени-крестца 82 мм). 95-й процентиль колеблется от 2 мм на 11-й неделе до 2,6 мм на 13 + 6 неделе.
NT измеряет заполненное подкожной жидкостью пространство между задней частью позвоночника и кожей шеи плода (рис. ). NT увеличивается с гестационным возрастом примерно на 17 % в неделю. Полупрозрачная область исчезает после 14 недель гестационного возраста, когда подкожная клетчатка становится более эхогенной. Таким образом, НТ является преходящим явлением [36]. Используя только измерение NT и возраст матери, можно определить 81% (таблица) пораженных беременностей с частотой ложноположительных результатов 5% [37]. Измерение воротникового пространства должно выполняться опытными специалистами по УЗИ и должно быть получено между 10 и 13 неделями 6 дней беременности, что эквивалентно длине темени-крестца от 38 до 84 мм.NT можно обнаружить у 99 % плодов в конце первого триместра. 50-й процентиль NT увеличивается с 1,2 мм на неделе 11 + 0 (длина темени-крестца 45 мм) до 1,5 мм на неделе 13 + 6 (длина темени-крестца 82 мм). 95-й процентиль колеблется от 2 мм на 11-й неделе до 2,6 мм на 13 + 6 неделе. У большинства плодов с синдромом Дауна NT увеличивается по сравнению с нормальными плодами того же гестационного возраста. Кроме того, увеличение NT связано с сужением перешейка аорты, сердечно-сосудистыми дефектами, которые вызывают гиперперфузию головы и шеи, или аномальным/задержкой развития лимфатической системы [38, 39].Повышенное значение NT также может быть связано с невынашиванием беременности [36, 40] и аномальными кариотипами [41].
У большинства плодов с синдромом Дауна NT увеличивается по сравнению с нормальными плодами того же гестационного возраста. Кроме того, увеличение NT связано с сужением перешейка аорты, сердечно-сосудистыми дефектами, которые вызывают гиперперфузию головы и шеи, или аномальным/задержкой развития лимфатической системы [38, 39].Повышенное значение NT также может быть связано с невынашиванием беременности [36, 40] и аномальными кариотипами [41].
NUCHAL Измерение прозрачности
Таблица 2
Таблица обнаружения 2
Уровень обнаружения Трисомии 21, 18 и 13 для данной ложной положительной скорости (FPR)
Скаривание| Трисомия 21 | Трисомия 18 | FPR: 0,5% Трисомия 13 | FPR: 0,5% |
|---|---|---|---|
| Maternal Age (MA) и FETAL NT | 81 | 68 | 61 |
| мА и сыворотки бесплатно β-HCG и PAPP-A | 67 | 80 | 59 | 59
| MA, NT и сыворотка β-HCG и PAPP-A | 91 | 97 | 84 |
Устойчивый к пациенту Риск хромосомной аномалии
некоторый риск того, что ее плод может быть затронут хромосомным дефектом.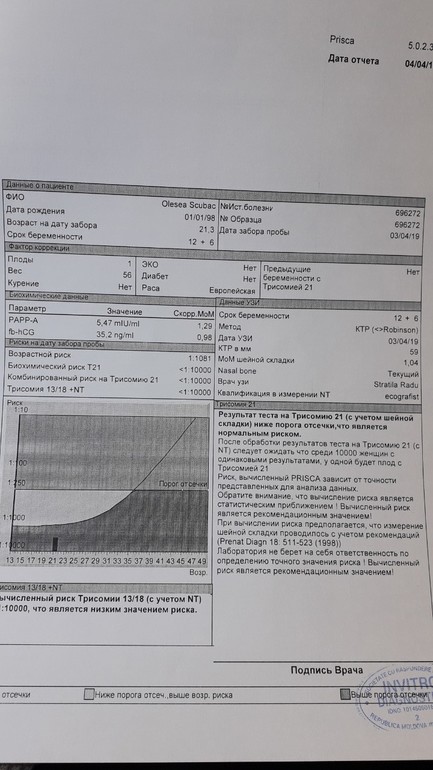 Чтобы рассчитать этот индивидуальный риск, необходимо сначала принять во внимание априорный риск женщины, исходя из ее возраста и срока беременности (таблица). Затем этот априорный риск умножается на отношение правдоподобия, рассчитанное на основании данных УЗИ и/или результатов биохимии сыворотки, полученных во время текущей беременности. Произведение априорного риска и отношения правдоподобия дает специфический риск пациента.
Чтобы рассчитать этот индивидуальный риск, необходимо сначала принять во внимание априорный риск женщины, исходя из ее возраста и срока беременности (таблица). Затем этот априорный риск умножается на отношение правдоподобия, рассчитанное на основании данных УЗИ и/или результатов биохимии сыворотки, полученных во время текущей беременности. Произведение априорного риска и отношения правдоподобия дает специфический риск пациента.
Кратность медианы (МоМ)
При скрининге с использованием биохимических маркеров материнской сыворотки измеренная концентрация маркеров преобразуется в МоМ незатронутых беременностей при той же беременности.Это сделано для того, чтобы учесть тот факт, что уровни маркеров варьируются в зависимости от гестационного возраста. Значения MoM рассчитываются путем деления индивидуального уровня маркера на средний уровень этого маркера для всей популяции в этом гестационном возрасте в этой лаборатории. Использование значений MoM, а не абсолютных уровней, также позволяет последовательно интерпретировать результаты из разных лабораторий.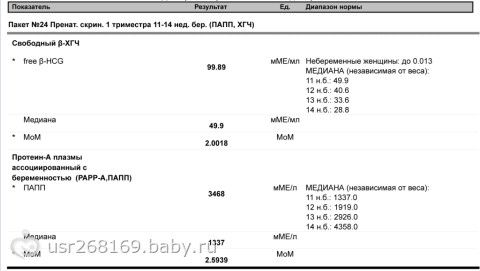 При эуплоидной беременности среднее скорректированное значение как для свободного β-ХГЧ, так и для РАРР-А составляет 1,0 МоМ при всех сроках беременности. В исследовании, проведенном Spencer et al.[42] при изменении уровней биохимических маркеров первого триместра у женщин азиатского происхождения (индианка, Пакистан, Бангладеш) по сравнению с женщиной европеоидной расы (контрольная группа) было обнаружено, что в азиатской популяции медиана PAPP-A была увеличена на 9 %, а свободный β- ХГЧ на 6 % от контрольной группы (таблица ). Было обнаружено, что азиатское население на 6,9 кг легче, чем европейская женщина. При трисомиях наблюдаются низкие значения РАРР-А, которые обычно составляют 0,15 МоМ для трисомии 21, то есть синдрома Дауна; 0,25 МоМ для трисомии 13 или синдрома Патау; 0.18 МоМ для трисомии 18 или синдрома Эдвардса; и 0,49 для синдрома Тернера (таблица).
При эуплоидной беременности среднее скорректированное значение как для свободного β-ХГЧ, так и для РАРР-А составляет 1,0 МоМ при всех сроках беременности. В исследовании, проведенном Spencer et al.[42] при изменении уровней биохимических маркеров первого триместра у женщин азиатского происхождения (индианка, Пакистан, Бангладеш) по сравнению с женщиной европеоидной расы (контрольная группа) было обнаружено, что в азиатской популяции медиана PAPP-A была увеличена на 9 %, а свободный β- ХГЧ на 6 % от контрольной группы (таблица ). Было обнаружено, что азиатское население на 6,9 кг легче, чем европейская женщина. При трисомиях наблюдаются низкие значения РАРР-А, которые обычно составляют 0,15 МоМ для трисомии 21, то есть синдрома Дауна; 0,25 МоМ для трисомии 13 или синдрома Патау; 0.18 МоМ для трисомии 18 или синдрома Эдвардса; и 0,49 для синдрома Тернера (таблица).
Таблица 3
Таблица 3
Вариация в первом триместре биохимические уровни маркера в азиатских женщинах по сравнению с кавказской женщиной
| маркер (мама) | 4 Caucasian4 индийцы||||
|---|---|---|---|---|
| не веса корреляции | корреляция веса | корреляция веса | ||
| свободный β-ХГЧ | 1.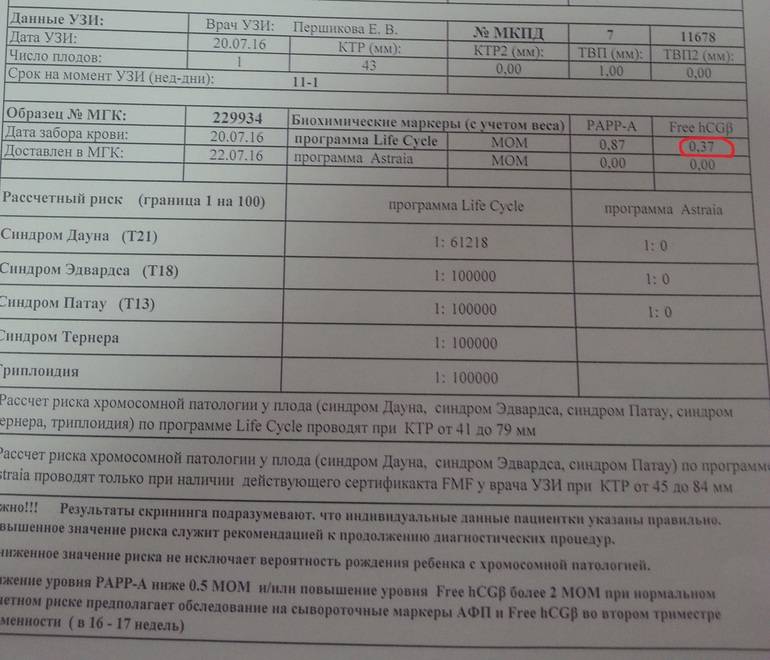 53 53 | +1,038 | 1,002 | 0,925 |
| РАРР-А | 1,032 | 1,029 | 1,187 | 1,082 |
Таблица 4
шаблон Маркер в нескольких срединных и обнаружения скоростей в различных анеуплоидий
| Aneuploidy | NT | Свободный β-HCG | PAPP-A | Уровень обнаружения (%) | |
|---|---|---|---|---|---|
| Трисомия 21 | 2. 67 MOM 67 MOM | 215 MOM | 0.15 MOM | ||
| TRISOMY 13 | 0.50 MAM | 0,25 мама | |||
| Трисомия 18 | 3,27 мама | 0,28 мама | 0,18 Мама | ||
| 45, | 4,76 мама | 1.11 Мама | 0,11 мама | 0,49 мама | 0,49 |
| Triploidy Maternal | 0. 88 MOM 88 MOM | 0.18 MOM | 0,06 MOM | 0.06 MOM | |
| Triploidy Paternal | 2,76 мама | 8.04 MOM | 0,75 мама | 0,75 мама |
Лаборатория использует различную математическую модель для расчета риск женщины родить ребенка с синдромом Дауна, трисомией 18 и трисомией 13. Некоторые из математических моделей включают Prisca, Viewpoint, Astria и т. д. Эти математические модели учитывают возраст матери, уровни различных биохимических маркеров в сыворотке и данные УЗИ плода. измерения.Кроме того, ряд факторов играет важную роль в расчете риска, поскольку они будут влиять на значения биохимических анализов материнской сыворотки. Это включает в себя гестационный возраст, вес, расу, курение, диабетический статус человека, количество присутствующих плодов и использовалось ли лечение ЭКО для зачатия. В некоторых редких случаях, таких как расчеты риска анеуплоидии при беременности донора яйцеклетки, использование возраста донора яйцеклетки вместо возраста реципиента снижает частоту ложноположительных результатов и повышает эффективность скрининга.
Это включает в себя гестационный возраст, вес, расу, курение, диабетический статус человека, количество присутствующих плодов и использовалось ли лечение ЭКО для зачатия. В некоторых редких случаях, таких как расчеты риска анеуплоидии при беременности донора яйцеклетки, использование возраста донора яйцеклетки вместо возраста реципиента снижает частоту ложноположительных результатов и повышает эффективность скрининга.
Неточная информация может привести к значительным изменениям оценки риска. Следовательно, очень важно, чтобы при отправке образца в лабораторию для анализа была предоставлена точная информация. Для скрининга сыворотки в первом триместре положительный или отрицательный результат основан на пороговых значениях, специфичных для лаборатории. С учетом возраста матери оценочный риск трисомии плода 21, 18 и 13 для женщины в возрасте 20 лет на 12 недель беременности составляет примерно 1 на 1 000, 1 на 2 500 и 1 на 8 000 соответственно, а риск такой женщины родить пораженный доношенный ребенок составляет 1 из 1500, 1 из 18 000 и 1 из 42 000 соответственно. Соответствующие риски этих анеуплоидий для женщины в возрасте 35 лет при сроке беременности 12 недель составляют примерно 1 из 250, 1 из 600 и 1 из 1 800, а риск того, что такая женщина родит больного ребенка в срок, составляет 1 из 350, 1 из 1 800. 4000 и 1 из 10000.
Соответствующие риски этих анеуплоидий для женщины в возрасте 35 лет при сроке беременности 12 недель составляют примерно 1 из 250, 1 из 600 и 1 из 1 800, а риск того, что такая женщина родит больного ребенка в срок, составляет 1 из 350, 1 из 1 800. 4000 и 1 из 10000.
При скрининге трисомии 21 по возрасту матери и бессывороточному β-ХГЧ и РАРР-А частота обнаружения составляет около 65 % при частоте ложноположительных результатов 5 %. Показатели лучше на 9–10 неделе, чем на 13 неделе, потому что разница в РАРР-А между трисомной и эуплоидной беременностью больше на более ранних сроках беременности [43, 44].Хотя разница в свободном β-ХГЧ между трисомными и эуплоидными беременностями увеличивается с течением беременности, величина этой разницы меньше, чем у противоположного соотношения РАРР-А. При трисомиях 18 и 13 снижены уровни свободного β-ХГЧ и РАРР-А в материнской сыворотке [45, 46]. В случаях половых хромосомных аномалий уровень свободного β-ХГЧ в материнской сыворотке нормальный, а РАРР-А низкий [46]. Общая эффективность скрининга с помощью комбинированного теста лучше на 11 неделе, чем на 13 неделе, с большим вкладом РАРР-А в 11 недель и свободного β-ХГЧ в 13 недель.При трисомии 21 беременности медиана свободного β-ХГЧ в МоМ увеличивается с 1,8 на 11 неделе до 2,09 на 13 неделе, а соответствующие значения для РАРР-А составляют 0,38 и 0,65 МоМ.
Общая эффективность скрининга с помощью комбинированного теста лучше на 11 неделе, чем на 13 неделе, с большим вкладом РАРР-А в 11 недель и свободного β-ХГЧ в 13 недель.При трисомии 21 беременности медиана свободного β-ХГЧ в МоМ увеличивается с 1,8 на 11 неделе до 2,09 на 13 неделе, а соответствующие значения для РАРР-А составляют 0,38 и 0,65 МоМ.
Скрининг для биохимического тестирования и ультразвукового сканирования также можно проводить в два отдельных посещения, первое из которых проводится в 9–10 недель, а второе – в 12 недель [44, 47, 48]. Было подсчитано, что этот подход повысит уровень обнаружения с 90 % до 93–94 %. Другим вариантом может быть выполнение сканирования в 12 недель и оптимизация эффективности биохимического тестирования путем измерения РАРР-А в 9 недель и свободного β-ХГЧ во время сканирования в 12 недель или даже позже с предполагаемой частотой обнаружения 95 недель. %.
Ссылки
1. Snijders RJM, Sundberg K, Holzgreve W, Henry G, Nicolaides KH.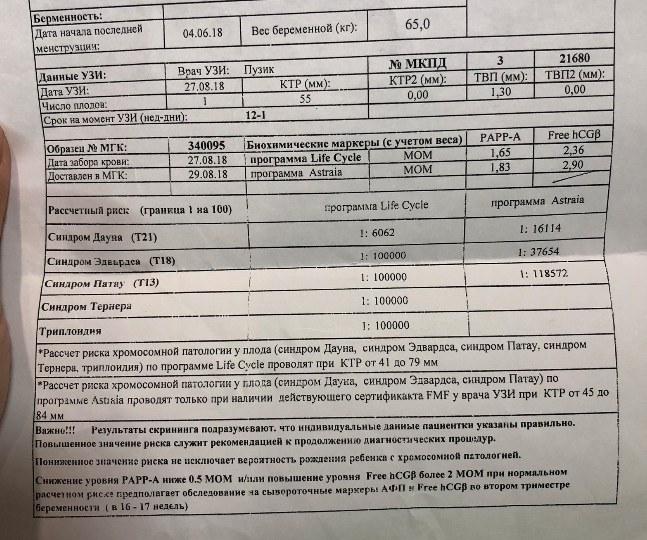 Риск трисомии в зависимости от возраста и беременности у матери 21. Ультразвуковая акушерская гинекология. 1999; 13: 167–170. doi: 10.1046/j.1469-0705.1999.13030167.x. [PubMed] [CrossRef] [Google Scholar]2. Уилсон РД. Канадские рекомендации по пренатальной диагностике с поправками (2005 г.) изменены на 2005 г. — методы пренатальной диагностики. Руководство по клинической практике SOGC, № 168, ноябрь 2005 г. J Obstet Gynaecol Can. 2005; 27:1048–1054. [PubMed] [Google Scholar]3.Биндра Р., Ляо В.А., Спенсер К., Николаидес К.Х. Универсальная клиника для оценки риска трисомии 21 на сроке 11–14 недель: проспективное исследование 15 030 беременностей. УЗИ Акушерство Гинекол. 2002; 20: 219–225. doi: 10.1046/j.1469-0705.2002.00808.x. [PubMed] [CrossRef] [Google Scholar]4. Николаидес К.Х. Скрининг на анеуплоиды плода в возрасте от 11 до 13 недель. Пренат Диагн. 2011;1(31):7–15. doi: 10.1002/pd.2637. [PubMed] [CrossRef] [Google Scholar]5. Дугофф Л., Хоббинс Дж. К., Мэлоун Ф. Д. и др. Квадратный скрининг как предиктор неблагоприятного исхода беременности.
Риск трисомии в зависимости от возраста и беременности у матери 21. Ультразвуковая акушерская гинекология. 1999; 13: 167–170. doi: 10.1046/j.1469-0705.1999.13030167.x. [PubMed] [CrossRef] [Google Scholar]2. Уилсон РД. Канадские рекомендации по пренатальной диагностике с поправками (2005 г.) изменены на 2005 г. — методы пренатальной диагностики. Руководство по клинической практике SOGC, № 168, ноябрь 2005 г. J Obstet Gynaecol Can. 2005; 27:1048–1054. [PubMed] [Google Scholar]3.Биндра Р., Ляо В.А., Спенсер К., Николаидес К.Х. Универсальная клиника для оценки риска трисомии 21 на сроке 11–14 недель: проспективное исследование 15 030 беременностей. УЗИ Акушерство Гинекол. 2002; 20: 219–225. doi: 10.1046/j.1469-0705.2002.00808.x. [PubMed] [CrossRef] [Google Scholar]4. Николаидес К.Х. Скрининг на анеуплоиды плода в возрасте от 11 до 13 недель. Пренат Диагн. 2011;1(31):7–15. doi: 10.1002/pd.2637. [PubMed] [CrossRef] [Google Scholar]5. Дугофф Л., Хоббинс Дж. К., Мэлоун Ф. Д. и др. Квадратный скрининг как предиктор неблагоприятного исхода беременности. Акушерство Гинекол. 2005; 106: 260–267. doi: 10.1097/01.AOG.0000172419.37410.eb. [PubMed] [CrossRef] [Google Scholar]6. Николас Дж.В., Уэйн Дж.Х., Аллан К.Х. Антенатальный скрининг синдрома Дауна с помощью четырехкратного теста. Ланцет. 2003;361(9360):835–836. doi: 10.1016/S0140-6736(03)12680-3. [PubMed] [CrossRef] [Google Scholar]7. Wald NJ, Kennard A, Hackshaw A, McGuire A. Антенатальный скрининг синдрома Дауна, опубликованная опечатка появляется в J Med Screen. 1998;5:110. [Google Академия]8. Петрович И., Марина Д., Хуан К.К.Роль ассоциированного с беременностью белка плазмы –А (РАРР-А) в выявлении активности ишемической болезни сердца. Акта Фак Мед Найсенсис. 2007;24(4):183–188. [Google Академия]9. Фиалова Л, Мальбохан ИМ. Ассоциированный с беременностью белок плазмы А (РАРР-А): теоретические и клинические аспекты. Братислав Лек Листы. 2002; 103: 194–205. [PubMed] [Google Scholar] 10. Overgaard MT, Oxvig C, Christiansen M, Lawrence JB, Conover CA, Gleich GJ. Уровни рибонуклеиновой кислоты-мессенджера белка-А плазмы, связанного с беременностью, и проформа основного основного белка эозинофилов: экспрессия в репродуктивных и нерепродуктивных тканях человека.
Акушерство Гинекол. 2005; 106: 260–267. doi: 10.1097/01.AOG.0000172419.37410.eb. [PubMed] [CrossRef] [Google Scholar]6. Николас Дж.В., Уэйн Дж.Х., Аллан К.Х. Антенатальный скрининг синдрома Дауна с помощью четырехкратного теста. Ланцет. 2003;361(9360):835–836. doi: 10.1016/S0140-6736(03)12680-3. [PubMed] [CrossRef] [Google Scholar]7. Wald NJ, Kennard A, Hackshaw A, McGuire A. Антенатальный скрининг синдрома Дауна, опубликованная опечатка появляется в J Med Screen. 1998;5:110. [Google Академия]8. Петрович И., Марина Д., Хуан К.К.Роль ассоциированного с беременностью белка плазмы –А (РАРР-А) в выявлении активности ишемической болезни сердца. Акта Фак Мед Найсенсис. 2007;24(4):183–188. [Google Академия]9. Фиалова Л, Мальбохан ИМ. Ассоциированный с беременностью белок плазмы А (РАРР-А): теоретические и клинические аспекты. Братислав Лек Листы. 2002; 103: 194–205. [PubMed] [Google Scholar] 10. Overgaard MT, Oxvig C, Christiansen M, Lawrence JB, Conover CA, Gleich GJ. Уровни рибонуклеиновой кислоты-мессенджера белка-А плазмы, связанного с беременностью, и проформа основного основного белка эозинофилов: экспрессия в репродуктивных и нерепродуктивных тканях человека. Биол Репрод. 1999;61:1083–1089. doi: 10.1095/biolreprod61.4.1083. [PubMed] [CrossRef] [Google Scholar] 11. Overgaard MT, Boldt HT, Laursen LS, Sottrup-Jensen L, Conover CA, Oxvig C. Ассоциированный с беременностью белок плазмы A2 (PAPP-A2), новая протеиназа белка-5, связывающая инсулиноподобный фактор роста. Дж. Биол. Хим. 2001; 276:21849–21853. doi: 10.1074/jbc.M1021. [PubMed] [CrossRef] [Google Scholar] 12. Qin Q-P, Kokkala S, Lund J, Tamm N, Voipio-Pulkki LM, Pettersson K. Молекулярные различия циркулирующего связанного с беременностью плазменного белка-A при инфаркте миокарда и беременности.Клин Хим. 2005; 51: 75–83. doi: 10.1373/clinchem.2004.036467. [PubMed] [CrossRef] [Google Scholar] 13. Overgaard MT, Sorensen ES, Stachowiak D, Boldt HB, Kristensen L, Sottrup-Jensen L, et al. Комплекс ассоциированного с беременностью плазменного белка-А и проформы дисульфидной структуры основного основного белка эозинофилов и мест прикрепления углеводов. Дж. Биол. Хим. 2003; 278:2106–2117. doi: 10.
Биол Репрод. 1999;61:1083–1089. doi: 10.1095/biolreprod61.4.1083. [PubMed] [CrossRef] [Google Scholar] 11. Overgaard MT, Boldt HT, Laursen LS, Sottrup-Jensen L, Conover CA, Oxvig C. Ассоциированный с беременностью белок плазмы A2 (PAPP-A2), новая протеиназа белка-5, связывающая инсулиноподобный фактор роста. Дж. Биол. Хим. 2001; 276:21849–21853. doi: 10.1074/jbc.M1021. [PubMed] [CrossRef] [Google Scholar] 12. Qin Q-P, Kokkala S, Lund J, Tamm N, Voipio-Pulkki LM, Pettersson K. Молекулярные различия циркулирующего связанного с беременностью плазменного белка-A при инфаркте миокарда и беременности.Клин Хим. 2005; 51: 75–83. doi: 10.1373/clinchem.2004.036467. [PubMed] [CrossRef] [Google Scholar] 13. Overgaard MT, Sorensen ES, Stachowiak D, Boldt HB, Kristensen L, Sottrup-Jensen L, et al. Комплекс ассоциированного с беременностью плазменного белка-А и проформы дисульфидной структуры основного основного белка эозинофилов и мест прикрепления углеводов. Дж. Биол. Хим. 2003; 278:2106–2117. doi: 10. 1074/jbc.M208777200. [PubMed] [CrossRef] [Google Scholar] 14. Оксвиг К., Санд О., Кристенсен Т., Кристенсен Л., Соттруп-Йенсен Л.Выделение и характеристика циркулирующего комплекса между белком-А плазмы человека, ассоциированным с беременностью, и проформой основного основного белка эозинофилов. Биохим Биофиз Акта. 1994;1201:415–423. doi: 10.1016/0304-4165(94)
1074/jbc.M208777200. [PubMed] [CrossRef] [Google Scholar] 14. Оксвиг К., Санд О., Кристенсен Т., Кристенсен Л., Соттруп-Йенсен Л.Выделение и характеристика циркулирующего комплекса между белком-А плазмы человека, ассоциированным с беременностью, и проформой основного основного белка эозинофилов. Биохим Биофиз Акта. 1994;1201:415–423. doi: 10.1016/0304-4165(94) Экспрессия рекомбинантного белка-А плазмы человека, связанного с беременностью, и идентификация проформы основного основного белка эозинофилов в качестве его физиологического ингибитора. Дж. Биол. Хим. 2000;275(40):31128–31133. дои: 10.1074/jbc.M001384200. [PubMed] [CrossRef] [Google Scholar] 18. Бишоф П., ДюБерг С., Херрманн В., Сизоненко П.С. Ассоциированный с беременностью протеин-А плазмы (РАРР-А) и ХГЧ на ранних сроках беременности. Br J Obstet Gynaecol. 1981; 88: 973–975. doi: 10.1111/j.1471-0528.1981.tb01683.x. [PubMed] [CrossRef] [Google Scholar] 19. Bischof P, Amandruz M, Weil-Franck C, Baeriswyl JP, Weil A, Hermann WL, et al. Скорость исчезновения ассоциированного с беременностью плазменного белка-А (РАРР-А) после окончания нормальной и аномальной беременности.Арка Гинеколь. 1984; 236: 93–98. doi: 10.1007/BF02134005. [PubMed] [CrossRef] [Google Scholar] 20. Болдт Х.Б., Коновер, Калифорния. Ассоциированный с беременностью плазменный белок-А (РАРР-А): локальный регулятор биодоступности ИФР посредством расщепления ИФРСБ.
Экспрессия рекомбинантного белка-А плазмы человека, связанного с беременностью, и идентификация проформы основного основного белка эозинофилов в качестве его физиологического ингибитора. Дж. Биол. Хим. 2000;275(40):31128–31133. дои: 10.1074/jbc.M001384200. [PubMed] [CrossRef] [Google Scholar] 18. Бишоф П., ДюБерг С., Херрманн В., Сизоненко П.С. Ассоциированный с беременностью протеин-А плазмы (РАРР-А) и ХГЧ на ранних сроках беременности. Br J Obstet Gynaecol. 1981; 88: 973–975. doi: 10.1111/j.1471-0528.1981.tb01683.x. [PubMed] [CrossRef] [Google Scholar] 19. Bischof P, Amandruz M, Weil-Franck C, Baeriswyl JP, Weil A, Hermann WL, et al. Скорость исчезновения ассоциированного с беременностью плазменного белка-А (РАРР-А) после окончания нормальной и аномальной беременности.Арка Гинеколь. 1984; 236: 93–98. doi: 10.1007/BF02134005. [PubMed] [CrossRef] [Google Scholar] 20. Болдт Х.Б., Коновер, Калифорния. Ассоциированный с беременностью плазменный белок-А (РАРР-А): локальный регулятор биодоступности ИФР посредством расщепления ИФРСБ.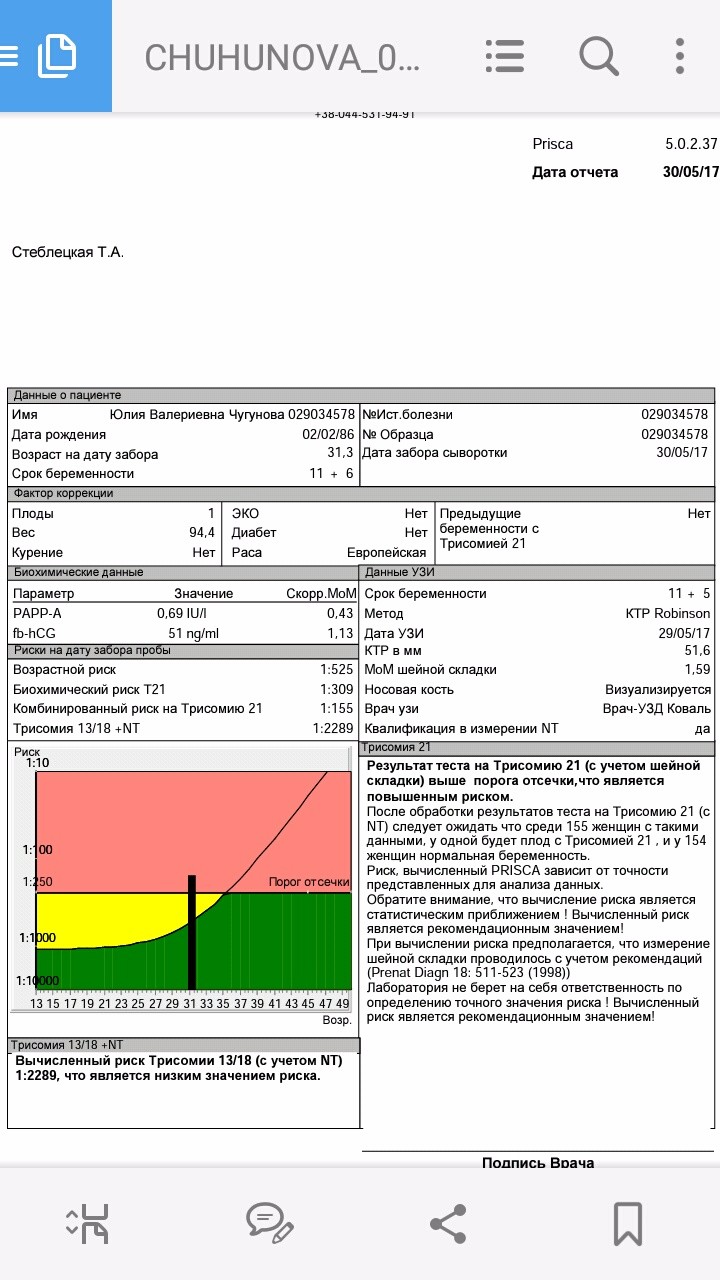 Гормон роста IGF Res. 2007; 17:10–18. doi: 10.1016/j.ghir.2006.11.003. [PubMed] [CrossRef] [Google Scholar] 21. Петерсон С.Э., Симхан Х.Н. Белок плазмы А, связанный с беременностью в первом триместре, и последующие аномалии роста плода. Am J Obstet Gynecol. 2008;198(5):43–5.[В паблике] 22. Ганьон А., Дуглас Р.В. Акушерские осложнения, связанные с аномальными маркерами анализов материнской сыворотки. J Obstet Gynaecol Can. 2008;30(10):918–932. [PubMed] [Google Scholar] 23. Сантолая-Форгас И., Леон Дж. А. Д., Каллен Хопкинс Р., Кастракан В. Д., Кауфман Р. П., Сифуэнтес Г. П. Низкий уровень протеина А плазмы, связанный с беременностью, на сроке от 10 + 1 до 14 + 6 недель беременности и возможный механизм, ведущий к выкидышу. Диагностика плода Тер. 2004; 19: 456–461. doi: 10.1159/000079000. [PubMed] [CrossRef] [Google Scholar] 24.Brizot ML, Hyett JA, Mckie AT, Bersinger NA, Farzaneh F, Nicolaides KH. Экспрессия гена связанного с беременностью белка плазмы человека-А в плаценте при трисомной беременности.
Гормон роста IGF Res. 2007; 17:10–18. doi: 10.1016/j.ghir.2006.11.003. [PubMed] [CrossRef] [Google Scholar] 21. Петерсон С.Э., Симхан Х.Н. Белок плазмы А, связанный с беременностью в первом триместре, и последующие аномалии роста плода. Am J Obstet Gynecol. 2008;198(5):43–5.[В паблике] 22. Ганьон А., Дуглас Р.В. Акушерские осложнения, связанные с аномальными маркерами анализов материнской сыворотки. J Obstet Gynaecol Can. 2008;30(10):918–932. [PubMed] [Google Scholar] 23. Сантолая-Форгас И., Леон Дж. А. Д., Каллен Хопкинс Р., Кастракан В. Д., Кауфман Р. П., Сифуэнтес Г. П. Низкий уровень протеина А плазмы, связанный с беременностью, на сроке от 10 + 1 до 14 + 6 недель беременности и возможный механизм, ведущий к выкидышу. Диагностика плода Тер. 2004; 19: 456–461. doi: 10.1159/000079000. [PubMed] [CrossRef] [Google Scholar] 24.Brizot ML, Hyett JA, Mckie AT, Bersinger NA, Farzaneh F, Nicolaides KH. Экспрессия гена связанного с беременностью белка плазмы человека-А в плаценте при трисомной беременности.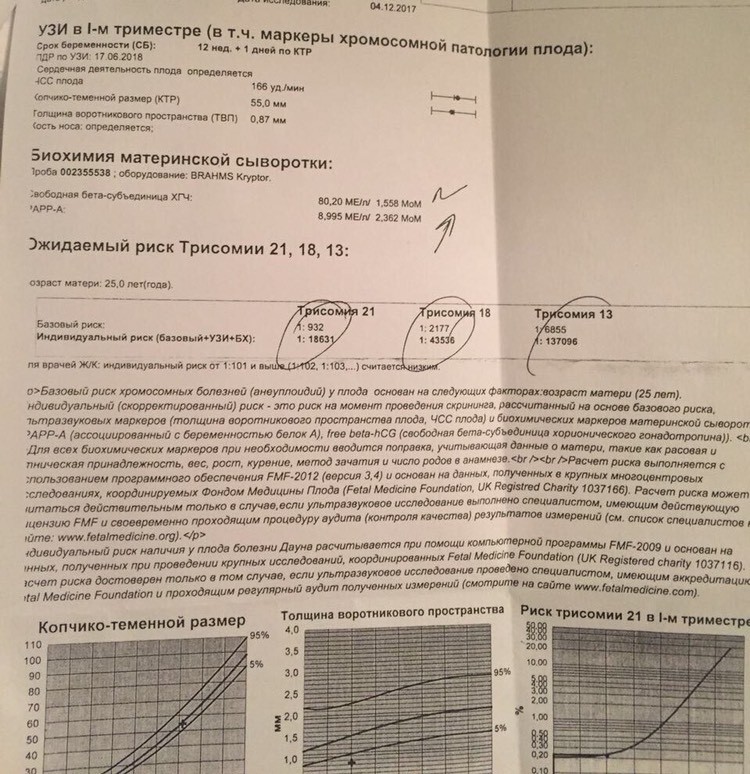 Плацента. 1996; 17:33–36. doi: 10.1016/S0143-4004(05)80641-1. [PubMed] [CrossRef] [Google Scholar] 25. Богарт М.Х., Пандиан М.Р., Джонс О.В. Аномальные уровни хорионического гонадотропина в сыворотке крови матери при беременности с хромосомными аномалиями плода. Пренат Диагн. 1987; 7: 623–630. doi: 10.1002/pd.1970070904. [PubMed] [CrossRef] [Google Scholar] 27.Ульф-Хокан С., Айла Т., Хенрик А., Лина В. Классификация, функции и клиническое использование различных изоформ ХГЧ. Обновление воспроизведения гула. 2006;12(6):769–784. doi: 10.1093/humupd/dml029. [PubMed] [CrossRef] [Google Scholar] 28. Тренти Т., Алоэ Р., Сервеллин Г., Липпи Г. Хорионический гонадотропин человека в диагностике беременности. Клин Чим Акта. 2011;412(17–18):1515–1520. [PubMed] [Google Scholar] 29. Фернандо М.Р., Донато Д., Феличе П. Прогностическая ценность измерений гормонов при осложнениях беременности у матери и плода.Эндокринный. 2006;23(2):230–57. [В паблике] 30. Батлер С.А., Иль РК. Свободная мономерная бета-субъединица хорионического гонадотропина человека (бета-ХГЧ) и недавно идентифицированная гомодимерная бета-субъединица бета-бета (бета-ХГЧ) обладают эффектами аутокринного роста.
Плацента. 1996; 17:33–36. doi: 10.1016/S0143-4004(05)80641-1. [PubMed] [CrossRef] [Google Scholar] 25. Богарт М.Х., Пандиан М.Р., Джонс О.В. Аномальные уровни хорионического гонадотропина в сыворотке крови матери при беременности с хромосомными аномалиями плода. Пренат Диагн. 1987; 7: 623–630. doi: 10.1002/pd.1970070904. [PubMed] [CrossRef] [Google Scholar] 27.Ульф-Хокан С., Айла Т., Хенрик А., Лина В. Классификация, функции и клиническое использование различных изоформ ХГЧ. Обновление воспроизведения гула. 2006;12(6):769–784. doi: 10.1093/humupd/dml029. [PubMed] [CrossRef] [Google Scholar] 28. Тренти Т., Алоэ Р., Сервеллин Г., Липпи Г. Хорионический гонадотропин человека в диагностике беременности. Клин Чим Акта. 2011;412(17–18):1515–1520. [PubMed] [Google Scholar] 29. Фернандо М.Р., Донато Д., Феличе П. Прогностическая ценность измерений гормонов при осложнениях беременности у матери и плода.Эндокринный. 2006;23(2):230–57. [В паблике] 30. Батлер С.А., Иль РК. Свободная мономерная бета-субъединица хорионического гонадотропина человека (бета-ХГЧ) и недавно идентифицированная гомодимерная бета-субъединица бета-бета (бета-ХГЧ) обладают эффектами аутокринного роста.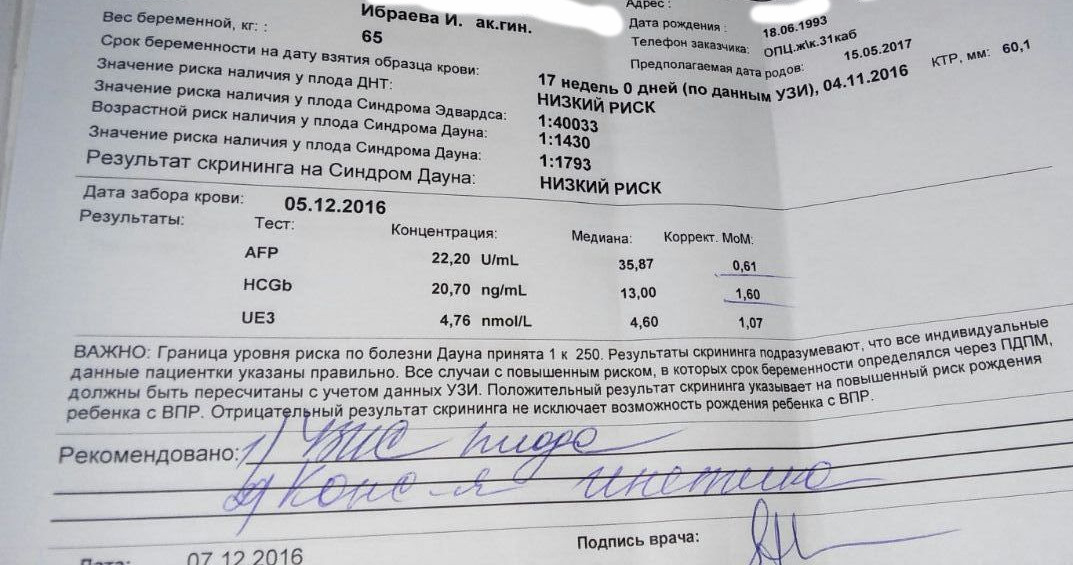 Опухоль биол. 2004; 25:18–23. doi: 10.1159/000077719. [PubMed] [CrossRef] [Google Scholar] 31. Эльдар-Гева Т., Хохберг А., деГрут Н., Вайнштейн Д. Высокий уровень хорионического гонадотропина в материнской сыворотке при беременности с синдромом Дауна вызван повышением уровня обеих субъединиц мессенджера рибонуклеиновой кислоты в трофобластах.J Clin Endocrinol Metab. 1995; 80: 3528–3531. doi: 10.1210/jc.80.12.3528. [PubMed] [CrossRef] [Google Scholar] 32. Oberweis D, Gillerot Y, Koulischer L, Hustin J, Philippe E. Трисомия плаценты в последнем триместре беременности. J Gynecol Obstet Biol Reprod. 1993; 12: 345–349. [PubMed] [Google Scholar] 33. Cowans NJ, Stamatopoulou A, Hellström J, Mäkelä MM, Spencer K. Стабильность PAPP-A и свободного ss-hCG в сыворотке первого триместра с использованием систем PerkinElmer AutoDELFIA и DELFIA Xpress. Пренат Диагн. 2010;30(2):127–132.doi: 10.1002/pd.2423. [PubMed] [CrossRef] [Google Scholar] 34. Круз Дж., Круз Г., Минеркава Р., Мази Н., Николаидес К.
Опухоль биол. 2004; 25:18–23. doi: 10.1159/000077719. [PubMed] [CrossRef] [Google Scholar] 31. Эльдар-Гева Т., Хохберг А., деГрут Н., Вайнштейн Д. Высокий уровень хорионического гонадотропина в материнской сыворотке при беременности с синдромом Дауна вызван повышением уровня обеих субъединиц мессенджера рибонуклеиновой кислоты в трофобластах.J Clin Endocrinol Metab. 1995; 80: 3528–3531. doi: 10.1210/jc.80.12.3528. [PubMed] [CrossRef] [Google Scholar] 32. Oberweis D, Gillerot Y, Koulischer L, Hustin J, Philippe E. Трисомия плаценты в последнем триместре беременности. J Gynecol Obstet Biol Reprod. 1993; 12: 345–349. [PubMed] [Google Scholar] 33. Cowans NJ, Stamatopoulou A, Hellström J, Mäkelä MM, Spencer K. Стабильность PAPP-A и свободного ss-hCG в сыворотке первого триместра с использованием систем PerkinElmer AutoDELFIA и DELFIA Xpress. Пренат Диагн. 2010;30(2):127–132.doi: 10.1002/pd.2423. [PubMed] [CrossRef] [Google Scholar] 34. Круз Дж., Круз Г., Минеркава Р., Мази Н., Николаидес К. Х. Влияние температуры на свободный β-хорионический гонадотропин человека и концентрацию белка-А в плазме, связанного с беременностью. УЗИ Акушерство Гинекол. 2010; 36: 141–146. doi: 10.1002/uog.7688. [PubMed] [CrossRef] [Google Scholar] 35. Шульте-Валентин М., Шиндлер Х. Неэхогенный затылочный отек как маркер скрининга трисомии 21. Ланцет. 1992; 339:1053. doi: 10.1016/0140-6736(92)
Х. Влияние температуры на свободный β-хорионический гонадотропин человека и концентрацию белка-А в плазме, связанного с беременностью. УЗИ Акушерство Гинекол. 2010; 36: 141–146. doi: 10.1002/uog.7688. [PubMed] [CrossRef] [Google Scholar] 35. Шульте-Валентин М., Шиндлер Х. Неэхогенный затылочный отек как маркер скрининга трисомии 21. Ланцет. 1992; 339:1053. doi: 10.1016/0140-6736(92)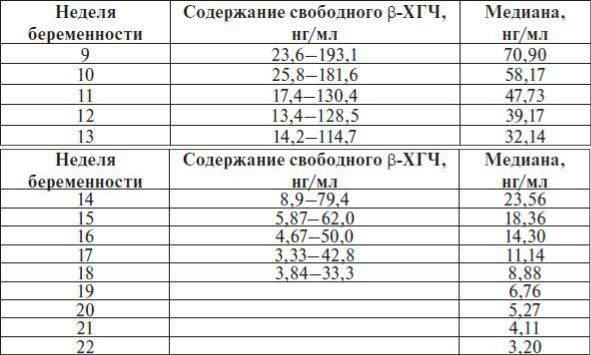 Аномалии сердца и магистральных артерий у плодов с хромосомными аномалиями в первом триместре. Am J Med Genet. 1997; 69: 207–216. doi: 10.1002/(SICI)1096-8628(19970317)69:2<207::AID-AJMG18>3.0.CO;2-P. [PubMed] [CrossRef] [Google Scholar] 39. фон Кайзенберг К.С., Николаидес К.Х., Бранд-Сабери Б. Гипоплазия лимфатических сосудов у плодов с синдромом Тернера. Хум Репрод. 1999; 14:823–826. doi: 10.1093/humrep/14.3.823. [PubMed] [CrossRef] [Google Scholar]40. Hyett JA, Sebire NJ, Snijders RJ, Nicolaides KH.Внутриутробная летальность плодов с трисомией 21 с увеличенной толщиной воротникового пространства. УЗИ Акушерство Гинекол. 1996; 7: 101–103. doi: 10.1046/j.1469-0705.1996.07020101.x. [PubMed] [CrossRef] [Google Scholar]41. Халил Асма, Пандья Пранав. Скрининг на синдром Дауна. J Obstet Gynecol Индия. 2006;56(3):205–211. [Google Академия]42. Спенсер К., Хит В., Эль-Шейха А., Онг ЦИТ, Николаидес К.Х. Этническая принадлежность и необходимость коррекции биохимических и ультразвуковых маркеров хромосомных аномалий в первом триместре: исследование восточно-азиатского и афро-карибского населения.
Аномалии сердца и магистральных артерий у плодов с хромосомными аномалиями в первом триместре. Am J Med Genet. 1997; 69: 207–216. doi: 10.1002/(SICI)1096-8628(19970317)69:2<207::AID-AJMG18>3.0.CO;2-P. [PubMed] [CrossRef] [Google Scholar] 39. фон Кайзенберг К.С., Николаидес К.Х., Бранд-Сабери Б. Гипоплазия лимфатических сосудов у плодов с синдромом Тернера. Хум Репрод. 1999; 14:823–826. doi: 10.1093/humrep/14.3.823. [PubMed] [CrossRef] [Google Scholar]40. Hyett JA, Sebire NJ, Snijders RJ, Nicolaides KH.Внутриутробная летальность плодов с трисомией 21 с увеличенной толщиной воротникового пространства. УЗИ Акушерство Гинекол. 1996; 7: 101–103. doi: 10.1046/j.1469-0705.1996.07020101.x. [PubMed] [CrossRef] [Google Scholar]41. Халил Асма, Пандья Пранав. Скрининг на синдром Дауна. J Obstet Gynecol Индия. 2006;56(3):205–211. [Google Академия]42. Спенсер К., Хит В., Эль-Шейха А., Онг ЦИТ, Николаидес К.Х. Этническая принадлежность и необходимость коррекции биохимических и ультразвуковых маркеров хромосомных аномалий в первом триместре: исследование восточно-азиатского и афро-карибского населения. Пренат Диагн. 2005; 25: 365–369. doi: 10.1002/pd.1153. [PubMed] [CrossRef] [Google Scholar]43. Каган К.О., Райт Д., Спенсер К., Молина Ф.С., Николаидес К.Х. Скрининг первого триместра на трисомию 21 с помощью свободного бета-хорионического гонадотропина человека и связанного с беременностью плазменного белка-А: влияние характеристик матери и беременности. УЗИ Акушерство Гинекол. 2008; 31: 493–502. doi: 10.1002/uog.5332. [PubMed] [CrossRef] [Google Scholar]44. Райт Д., Спенсер К., Каган К.О., Торринг Н., Петерсен О.Б., Кристоу А. и др.Комбинированный скрининг первого триместра на трисомию 21 на сроке беременности 7–14 недель. УЗИ Акушерство Гинекол. 2010; 36: 404–411. doi: 10.1002/uog.7755. [PubMed] [CrossRef] [Google Scholar]45. Тул Н., Спенсер К., Ноубл П., Чан С., Николаидес К.Х. Скрининг трисомии 18 по прозрачности воротникового пространства плода и содержанию бета-ХГЧ и РАРР-А в материнской сыворотке на 10–14 неделе беременности. Пренат Диагн. 1999;19:1035–1042. doi: 10.1002/(SICI)1097-0223(199911)19:11<1035::AID-PD694>3.
Пренат Диагн. 2005; 25: 365–369. doi: 10.1002/pd.1153. [PubMed] [CrossRef] [Google Scholar]43. Каган К.О., Райт Д., Спенсер К., Молина Ф.С., Николаидес К.Х. Скрининг первого триместра на трисомию 21 с помощью свободного бета-хорионического гонадотропина человека и связанного с беременностью плазменного белка-А: влияние характеристик матери и беременности. УЗИ Акушерство Гинекол. 2008; 31: 493–502. doi: 10.1002/uog.5332. [PubMed] [CrossRef] [Google Scholar]44. Райт Д., Спенсер К., Каган К.О., Торринг Н., Петерсен О.Б., Кристоу А. и др.Комбинированный скрининг первого триместра на трисомию 21 на сроке беременности 7–14 недель. УЗИ Акушерство Гинекол. 2010; 36: 404–411. doi: 10.1002/uog.7755. [PubMed] [CrossRef] [Google Scholar]45. Тул Н., Спенсер К., Ноубл П., Чан С., Николаидес К.Х. Скрининг трисомии 18 по прозрачности воротникового пространства плода и содержанию бета-ХГЧ и РАРР-А в материнской сыворотке на 10–14 неделе беременности. Пренат Диагн. 1999;19:1035–1042. doi: 10.1002/(SICI)1097-0223(199911)19:11<1035::AID-PD694>3.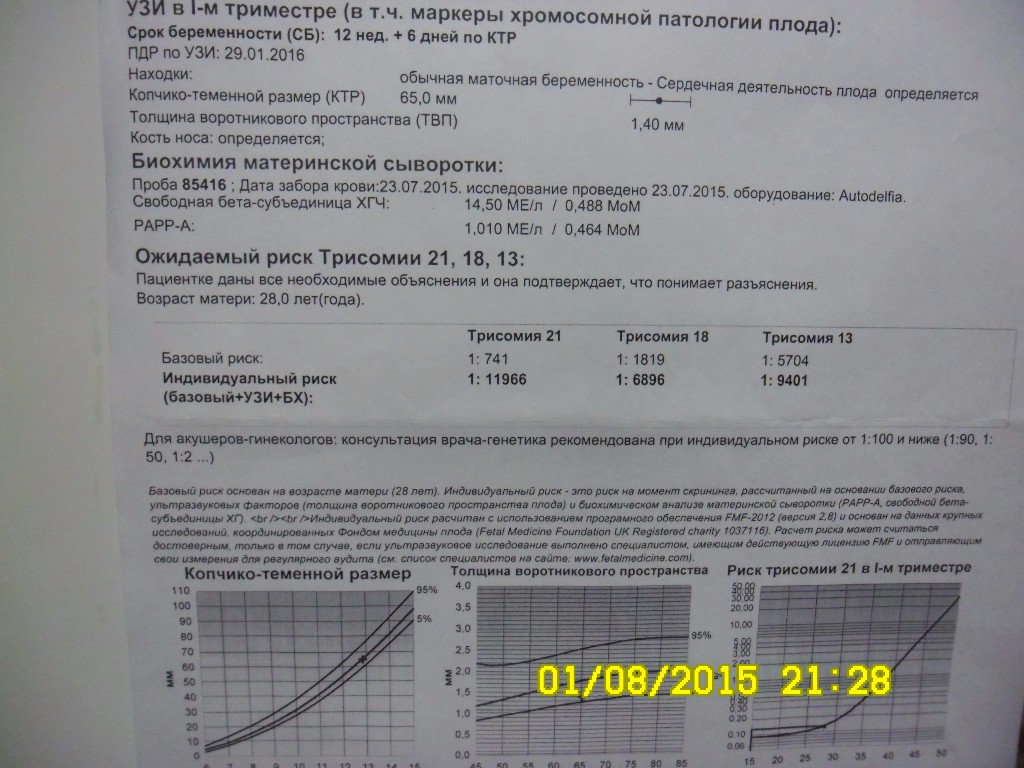 0.CO;2-2. [PubMed] [CrossRef] [Google Scholar]46.Спенсер К., Тул Н., Николаидес К.Х. Бета-ХГЧ и РАРР-А в материнской сыворотке при дефектах половых хромосом плода в первом триместре. Пренат Диагн. 2000;20:390–394. doi: 10.1002/(SICI)1097-0223(200005)20:5<390::AID-PD824>3.0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]47. Боррелл А., Казальс Э., Фортуни А., Фарре М.Т., Гонсе А., Санчес А. и др. Скрининг первого триместра на трисомию 21, сочетающий биохимию и ультразвук в индивидуально оптимальных сроках беременности: интервенционное исследование. Пренат Диагн.2004; 24: 541–545. doi: 10.1002/pd.949. [PubMed] [CrossRef] [Google Scholar]48. Каган К.О., Райт Д., Бейкер А., Сахота Д., Николаидес К.Х. Скрининг трисомии 21 по возрасту матери, толщине воротникового пространства плода, свободному бета-человеческому хорионическому гонадотропину и ассоциированному с беременностью плазменному белку-А. УЗИ Акушерство Гинекол. 2008; 31: 618–24. [ПубМед] 49. Бернд Э., Глаубиц Ральф. Скрининг первого триместра: обзор.
0.CO;2-2. [PubMed] [CrossRef] [Google Scholar]46.Спенсер К., Тул Н., Николаидес К.Х. Бета-ХГЧ и РАРР-А в материнской сыворотке при дефектах половых хромосом плода в первом триместре. Пренат Диагн. 2000;20:390–394. doi: 10.1002/(SICI)1097-0223(200005)20:5<390::AID-PD824>3.0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]47. Боррелл А., Казальс Э., Фортуни А., Фарре М.Т., Гонсе А., Санчес А. и др. Скрининг первого триместра на трисомию 21, сочетающий биохимию и ультразвук в индивидуально оптимальных сроках беременности: интервенционное исследование. Пренат Диагн.2004; 24: 541–545. doi: 10.1002/pd.949. [PubMed] [CrossRef] [Google Scholar]48. Каган К.О., Райт Д., Бейкер А., Сахота Д., Николаидес К.Х. Скрининг трисомии 21 по возрасту матери, толщине воротникового пространства плода, свободному бета-человеческому хорионическому гонадотропину и ассоциированному с беременностью плазменному белку-А. УЗИ Акушерство Гинекол. 2008; 31: 618–24. [ПубМед] 49. Бернд Э., Глаубиц Ральф. Скрининг первого триместра: обзор. J Гистохим Цитохим. 2005;53(3):281–283. doi: 10.1369/jhc.4B6420.2005. [PubMed] [CrossRef] [Google Scholar]
J Гистохим Цитохим. 2005;53(3):281–283. doi: 10.1369/jhc.4B6420.2005. [PubMed] [CrossRef] [Google Scholar]Скрининг материнской сыворотки в первом триместре беременности с использованием биохимических маркеров PAPP-A и свободного β-ХГЧ для выявления синдрома Дауна, синдрома Патау и синдрома Эдварда
Indian J Clin Biochem.2013 январь; 28(1): 3–12.
, , , , иС. Шифа
SRL Diagnostics, Fortis Healthcare Enterprise, Unit4, A0 Razi 6. Clinical Biochemist, A0 Razi 6. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
M. Amargandhi
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
J.Bhupendra
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
S.
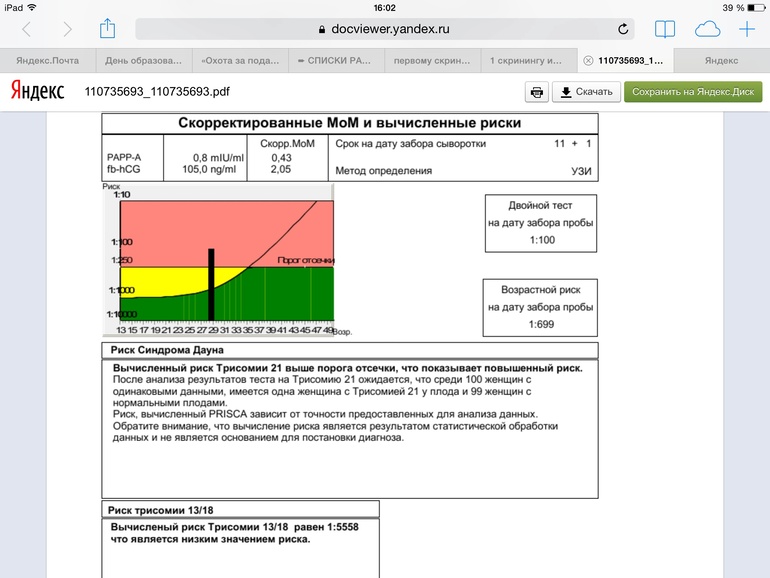 Moulali
MoulaliSRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
T. Kristine
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
Автор, ответственный за переписку.Поступила в редакцию 8 июля 2012 г.; Принято 30 сентября 2012 г.
Авторские права © Ассоциация клинических биохимиков Индии, 2012 г. Эта статья цитировалась другими статьями в PMC.Abstract
Программа скрининга в первом триместре предлагает неинвазивный метод раннего выявления анеуплоидии беременных.Этот скрининг проводится с помощью комбинации двух биохимических маркеров, т.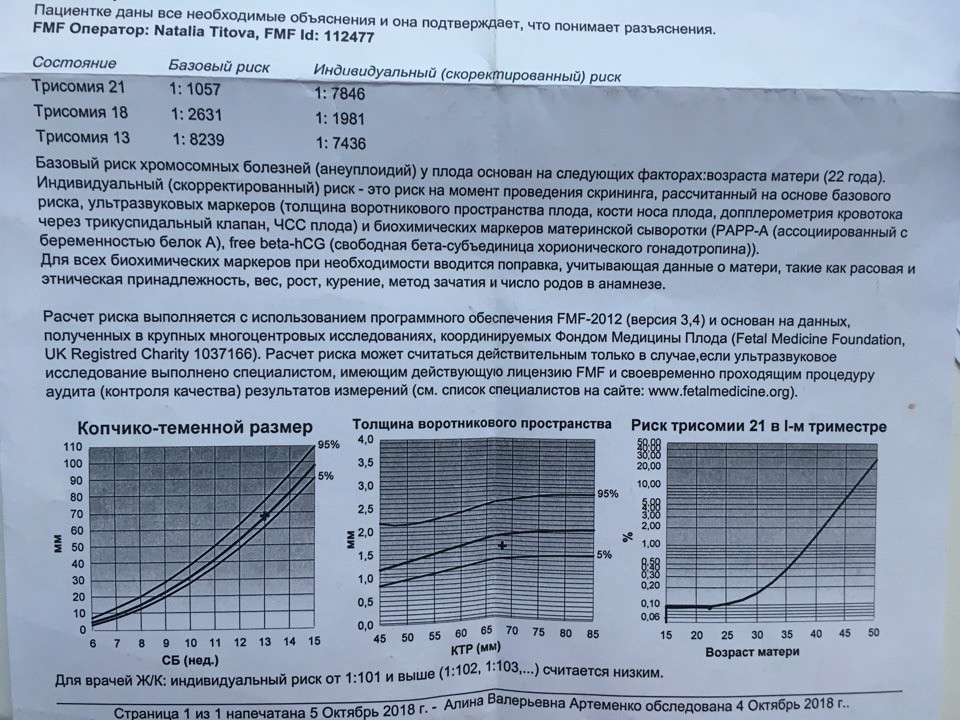 е. свободного β-хорионического гонадотропина человека в сыворотке (свободный β-ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-A), возраста матери и толщины воротникового пространства плода (NT) в возрасте 11 + лет. 0–13 + 6 недель беременности. Полезным последствием скрининга является ранняя диагностика трисомий 21, 18 и 13. В 11 + 0–13 + 6 недель относительная распространенность трисомий 18 и 13 по сравнению с трисомией 21 составляет один к трем и один к семи, соответственно.Все три трисомии связаны с увеличением возраста матери, увеличением NT плода и снижением РАРР-А, но при трисомии 21 уровень свободного β-ХГЧ в сыворотке повышен, тогда как при трисомиях 18 и 13 уровень свободного β-ХГЧ снижен.
е. свободного β-хорионического гонадотропина человека в сыворотке (свободный β-ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-A), возраста матери и толщины воротникового пространства плода (NT) в возрасте 11 + лет. 0–13 + 6 недель беременности. Полезным последствием скрининга является ранняя диагностика трисомий 21, 18 и 13. В 11 + 0–13 + 6 недель относительная распространенность трисомий 18 и 13 по сравнению с трисомией 21 составляет один к трем и один к семи, соответственно.Все три трисомии связаны с увеличением возраста матери, увеличением NT плода и снижением РАРР-А, но при трисомии 21 уровень свободного β-ХГЧ в сыворотке повышен, тогда как при трисомиях 18 и 13 уровень свободного β-ХГЧ снижен.
Ключевые слова: РАРР-А, Свободный β-ХГЧ, Затылочная прозрачность, Синдром Дауна, Синдром Патау, Синдром Эдвардса во многих странах.Недавний интерес к пренатальному скринингу трисомий был сосредоточен на первом триместре. Было показано, что из исследованных биохимических маркеров только материнский свободный от сыворотки β-хорионический гонадотропин человека (свободный β-ХГЧ) и ассоциированный с беременностью белок плазмы-А (РАРР-А) имеют значение.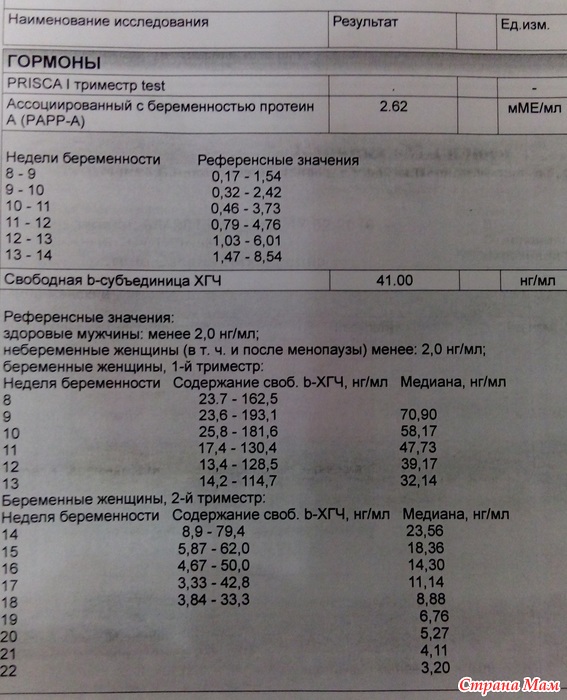 Целью программ скрининга материнской сыворотки в первом триместре является выявление женщин с повышенным риском рождения ребенка с дефектами синдрома Дауна, синдрома Патау и синдрома Эдвардса, а также тех, кому будет полезно тестирование.
Целью программ скрининга материнской сыворотки в первом триместре является выявление женщин с повышенным риском рождения ребенка с дефектами синдрома Дауна, синдрома Патау и синдрома Эдвардса, а также тех, кому будет полезно тестирование.
Связь между увеличением возраста матери [1] и повышенным риском трисомии 21 (таблица ) хорошо известна, и беременным женщинам старше 35 лет на момент родов обычно предлагается инвазивное пренатальное диагностическое тестирование. Наиболее часто используемым тестом для генетической диагностики является амниоцентез, но частота спонтанных потерь плода, связанных с амниоцентезом, составляет в среднем около одной на каждые 200 [2] процедур. Из-за этого риска анализ сывороточных аналитов стал важным неинвазивным первым шагом в выявлении пациентов с риском врожденных аномалий.
Таблица 1
Таблица 1
Распространенность трисомии 21 по возрасту матери и гестационным возрастом
| Материн (лет) | Гестационный возраст (недели) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 10 | 12 | 14 | 16 | 20 | 40 | ||||||
| 20 | 1: 983 | 1: 1 0684 | 1: 1 140084 | 1: 1 1200 | 1: 1 200 | 1: 1,295 | 1: 1 527 | ||||
| 25 | 1: 870 | 1: 946 | 1: 1,009 | 1: 1 062 | 1: 1,147 | 1: 1,352 | 1: 1,352 | ||||
| 30 | 1: 576 | 1: 626 | 1: 668 | 1: 703 | 1: 759 | 1: 895 | |||||
| 31 | 1: 500 | 1: 583 | 1: 580 | 1: 610 | 1: 658 | 1: 776 | |||||
| 32 | 1:424 | 1:461 | 1:492 | 9 0083 1: 5181: 559 | 1: 659 | ||||||
| 33 | 1: 332 | 1: 383 | 1: 383 | 1: 409 | 1: 430 | 1: 464 | 1: 547 | ||||
| 34 | 34 | 1: 287 | 1: 312 | 1: 312 | 1: 333 | 1: 350 | 1: 350 | 1: 378 | 1: 446 | ||
| 35 | 1: 229 | 1: 249 | 1: 266 | 1: 280 | 1: 302 | 1: 302 | 1: 302 | ||||
| 36 | 1: 180 | 1: 196 | 1: 209 | 1: 220 | 1: 238 | 1: 280 | |||||
| 37 | 1: 140 | 1: 140 | 1: 152 | 1: 163 | 1: 171 | 1: 171 | 1: 185 | 1: 218 | |||
| 38 | 1: 108 | 1: 117 | 1: 125 | 1: 131 | 1: 142 | 1: 142 | 1: 167 | ||||
| 39 | 1:82 | 1:89 | 1:95 900 84 | 1: 100 | 1: 108 | 1: 128 | 1: 128 | ||||
| 40 | 1:62 | 1:68 | 1:72 | 1:72 | 1:76 | 1:82 | 1:97 | ||||
| 41 | 1:47 | 1:51 | 1:51 | 1:54 | 1:57 | 1:57 | 1:62 | 1:73 | |||
| 42 | 1:35 | 1:38 | 1:41 | 1:43 | 1:43 | 1:46 | 1:55 | ||||
| 43 | 1:26 | 1:29 | 1:30 | 1:32 | 1:35 | 1:41 | 1:41 | ||||
| 44 | 1:20 | 1:21 | 1:21 | 1:23 | 1:24 | 1:26 | 1:30 | ||||
| 45 | 1:15 | 1:16 | 1:17 | 1:18 | 1:19 | 1:23 | |||||
Текущие исследования, проведенные в первом триместре беременности, показали, что двойной маркерный тест помогает выявить 90 % женщин с риском развития синдрома Дауна, 94 % всех основных хромосомных дефектов, таких как синдром Патау, синдром Эдвардса, триплоидия и синдром Тернера, и 60 % других хромосомных дефектов, таких как делеции, частичные трисомии , несбалансированные транслокации и анеуплоидии половых хромосом, отличные от тернеров [3]. Некоторые из преимуществ биохимического скрининга в первом триместре по сравнению с биохимическим скринингом во втором триместре включают предоставление клиницистам и пациентам существенного преимущества более ранней диагностики, более высоких показателей выявления синдрома Дауна у плода, т.е. 90 % [4] или даже выше, по сравнению с 80 % для квадро-теста второго триместра [5, 6] и 70 % для более раннего тройного скрининг-теста [7], и обнаружение большинства серьезных хромосомных аномалий, кроме трисомии 21. также выступает в качестве неспецифического маркера других врожденных дефектов, включая некоторые серьезные пороки сердца и синдромальные состояния.Он может обнаружить ряд основных структурных врожденных дефектов, связанных с нормальными хромосомами.
Некоторые из преимуществ биохимического скрининга в первом триместре по сравнению с биохимическим скринингом во втором триместре включают предоставление клиницистам и пациентам существенного преимущества более ранней диагностики, более высоких показателей выявления синдрома Дауна у плода, т.е. 90 % [4] или даже выше, по сравнению с 80 % для квадро-теста второго триместра [5, 6] и 70 % для более раннего тройного скрининг-теста [7], и обнаружение большинства серьезных хромосомных аномалий, кроме трисомии 21. также выступает в качестве неспецифического маркера других врожденных дефектов, включая некоторые серьезные пороки сердца и синдромальные состояния.Он может обнаружить ряд основных структурных врожденных дефектов, связанных с нормальными хромосомами.
Скрининг материнской сыворотки имеет некоторые ограничения. Одним из недостатков является то, что для обнаружения дефекта нервной трубки потребуется либо отдельный тест на АФП через 15 недель, либо опора на сканирование аномалий плода в 18–22 недель, также известное как морфологическое сканирование.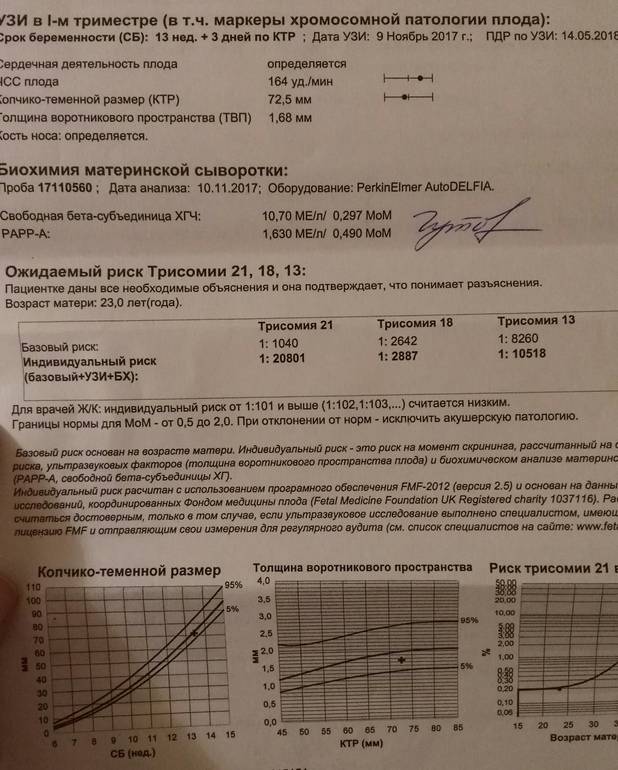 Другим недостатком является то, что ранний скрининг предпочтительно выявляет те хромосомные аномалии беременности, которые обречены на выкидыш. Приблизительно 30 % пораженных плодов погибают в период между 12 недельами беременности и сроком [1].Таким образом, женщины без необходимости вынуждены принимать решение о прерывании беременности, которая грозит выкидышем. Следует помнить, что тест на двойные маркеры является лишь скрининговым тестом, который дает риск генетического нарушения, но не диагноз.
Другим недостатком является то, что ранний скрининг предпочтительно выявляет те хромосомные аномалии беременности, которые обречены на выкидыш. Приблизительно 30 % пораженных плодов погибают в период между 12 недельами беременности и сроком [1].Таким образом, женщины без необходимости вынуждены принимать решение о прерывании беременности, которая грозит выкидышем. Следует помнить, что тест на двойные маркеры является лишь скрининговым тестом, который дает риск генетического нарушения, но не диагноз.
Комбинированный скрининг в первом триместре беременности
Скрининг в первом триместре проводится между 10 и 14 неделями беременности (рис. ). Маркеры, используемые для расчета риска, представляют собой 2 сывороточных маркера: РАРР-А и свободный β-ХГЧ). Снижение уровня РАРР-А до 14-й недели беременности связано с повышенным риском синдрома Дауна и трисомии 18.В то время как повышенный уровень ХГЧ связан с повышенным риском синдрома Дауна. Третьим маркером является прозрачность воротникового пространства плода (NT, область, содержащая жидкость за шеей плода), которую определяют с помощью ультразвука. Измерение воротникового пространства должно выполняться опытными сонографистами в период между 10 и 13 неделями и 6 днями беременности. Большинство плодов с синдромом Дауна имеют повышенное значение NT по сравнению с нормальными плодами того же гестационного возраста.
Измерение воротникового пространства должно выполняться опытными сонографистами в период между 10 и 13 неделями и 6 днями беременности. Большинство плодов с синдромом Дауна имеют повышенное значение NT по сравнению с нормальными плодами того же гестационного возраста.
Скрининг материнской сыворотки в первом триместре
Белки материнской крови в первом триместре Скрининг
Ряд белков в материнском кровотоке был обнаружен во время беременности. Многие из этих белков производятся или модифицируются плацентой. Различия в уровнях некоторых белков наблюдались у пациенток, вынашивающих плод с синдромом Дауна и некоторыми другими хромосомными аномалиями. Обнаружение этих незначительных различий в уровнях белка формирует основу для их использования в протоколах скрининга.Их называют биохимическими маркерами. Определенные образцы биохимических маркеров были связаны с синдромом Дауна плода, а также с другими состояниями. Уровни этих белков изменяются во время беременности, поэтому интерпретация требует знания гестационного возраста.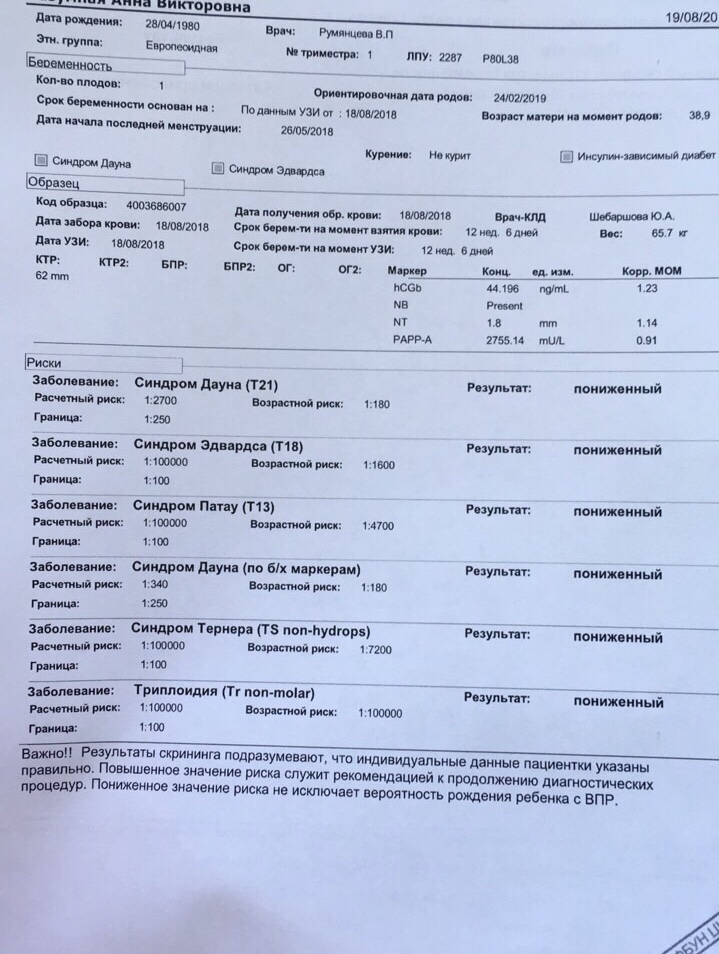 Кроме того, эффективность этих белков зависит от гестационного возраста. Например, различия в уровнях белка могут наблюдаться во втором триместре, но не в первом, в то время как другие белки показывают различия в первом триместре, но не во втором.
Кроме того, эффективность этих белков зависит от гестационного возраста. Например, различия в уровнях белка могут наблюдаться во втором триместре, но не в первом, в то время как другие белки показывают различия в первом триместре, но не во втором.
Материнская сыворотка PAPP-A
PAPP-A — это один из двух маркеров материнской сыворотки, используемых в настоящее время для скрининга в возрасте от 10 до 14 недель. Он продуцируется плацентарным синцитиотрофобластом и децидуальной оболочкой. Он увеличивает биодоступность инсулиноподобного фактора роста, который, в свою очередь, опосредует инвазию трофобласта и модулирует транспорт глюкозы и аминокислот в плаценте. PAPP-A также экспрессируется в гранулезных клетках яичников и в нерепродуктивных тканях, таких как фибробласты, остеобласты и гладкомышечные клетки сосудов.
Химия РАРР-А
РАРР-А представляет собой гликопротеин, первоначально обнаруженный Lin et al. [8] в плазме беременной женщины. Белок секретируется в виде дисульфид-связанного гомодимера (рис.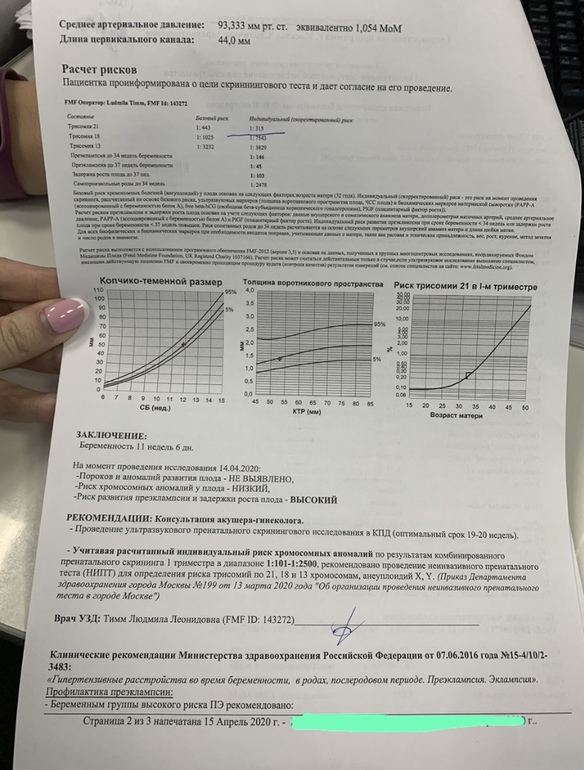 ) с молекулярной массой 400 кДа. Каждая субъединица происходит от препро-PAPP-A, содержащего 1627 белковых остатков [9–11], который процессируется в зрелый PAPP-A из 1547 аминокислотных остатков и 14 предполагаемых сайтов N-гликозилирования [9, 10]. Он секретируется как активная протеаза после внутриклеточного расщепления С-концевой стороны полипептида РАРР-А [9].Это цинксвязывающая металлопротеиназа, принадлежащая к суперсемейству метцинцинов металлопротеиназ [8]. В плазме PAPP-A циркулирует либо в свободной форме, либо в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (proMBP), образуя приблизительно 500 кДа и называемого PAPP-A/proMBP (рис. ) [12, 13]. ProMBP замещен как N-, так и O-связанным углеводом в дополнение к одному фрагменту гепарансульфата, который, как полагают, занимает сайт связывания PAPP-A на поверхности клетки в циркулирующем комплексе PAPP-A/proMBP [14, 15]. .Ген PAPP-A был отнесен к хромосоме 9q33.1 человека, охватывающей более 200 т.
) с молекулярной массой 400 кДа. Каждая субъединица происходит от препро-PAPP-A, содержащего 1627 белковых остатков [9–11], который процессируется в зрелый PAPP-A из 1547 аминокислотных остатков и 14 предполагаемых сайтов N-гликозилирования [9, 10]. Он секретируется как активная протеаза после внутриклеточного расщепления С-концевой стороны полипептида РАРР-А [9].Это цинксвязывающая металлопротеиназа, принадлежащая к суперсемейству метцинцинов металлопротеиназ [8]. В плазме PAPP-A циркулирует либо в свободной форме, либо в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (proMBP), образуя приблизительно 500 кДа и называемого PAPP-A/proMBP (рис. ) [12, 13]. ProMBP замещен как N-, так и O-связанным углеводом в дополнение к одному фрагменту гепарансульфата, который, как полагают, занимает сайт связывания PAPP-A на поверхности клетки в циркулирующем комплексе PAPP-A/proMBP [14, 15]. .Ген PAPP-A был отнесен к хромосоме 9q33.1 человека, охватывающей более 200 т. п.н. ДНК, и содержит 22 экзона [13].
п.н. ДНК, и содержит 22 экзона [13].
Ассоциированный с беременностью белок плазмы А или PAPP-A в виде дисульфид-связанного гомодимера в свободной форме и в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (ProMBP), т.е. PAPP-A/ProMBP при беременности
PAPP-A при беременности
Во время беременности как PAPP-A, так и proMBP обильно экспрессируются в плаценте человека, но в разных типах клеток. Большая часть PAPP-A синтезируется в плацентарном синцитиотрофобласте [16], а весь proMBP синтезируется во вневорсинчатых цитотрофобластах [17], откуда он секретируется без расщепления пропептида.Процесс образования комплекса РАРР-А/проМВР происходит во внеклеточном пространстве, вероятно, на поверхности синцитиотрофобласта. При нормальной беременности концентрация РАРР-А в кровотоке матери увеличивается с гестационным возрастом. Его концентрация увеличивается экспоненциально со временем удвоения 3–4 дня в течение первых триместров (рис. ), затем уровень продолжает расти на протяжении всей беременности до родов.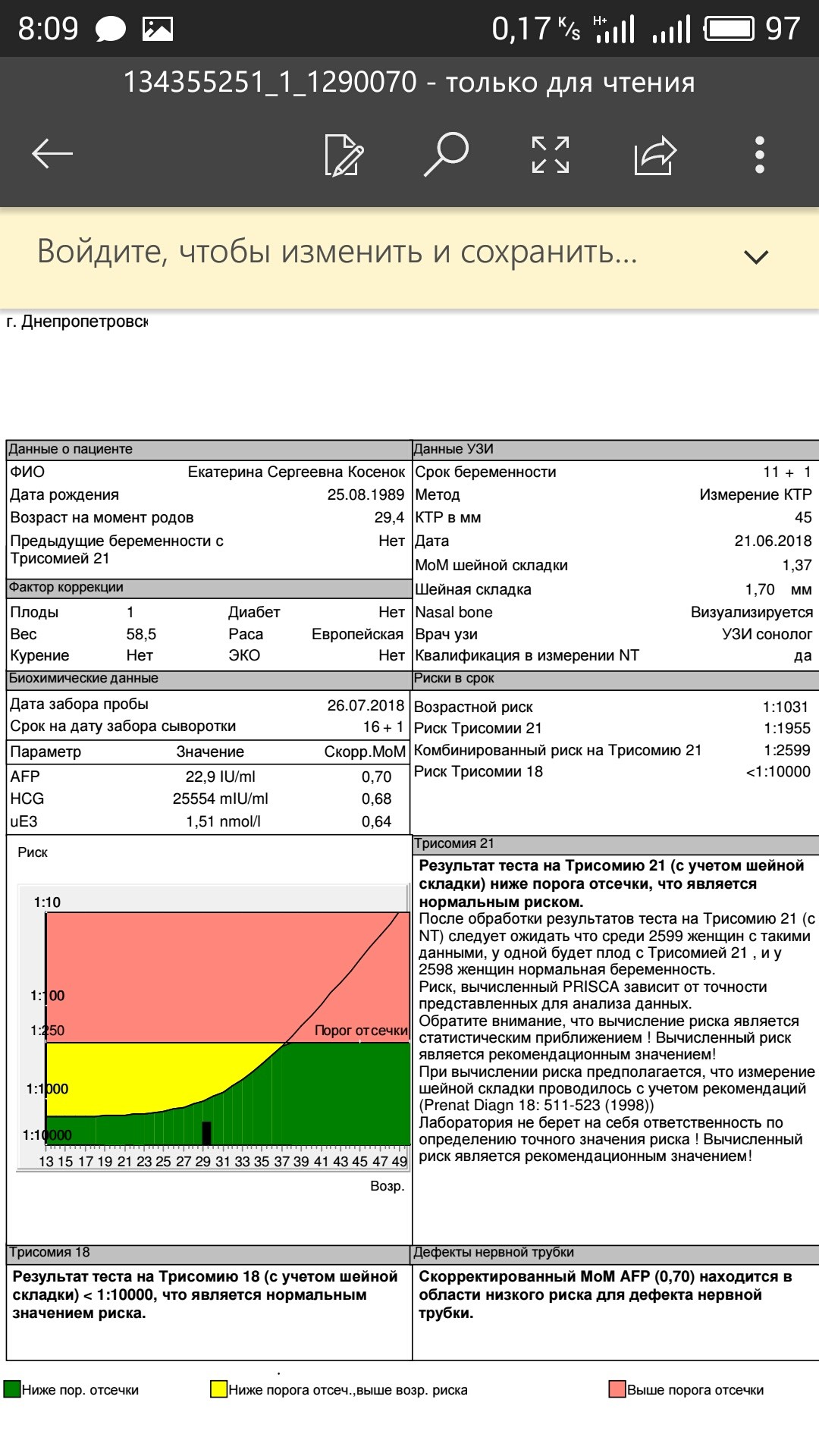 Быстрое повышение уровня РАРР-А в течение первого триместра приводит к тому, что интерпретация данного значения сильно зависит от гестационного возраста.Поэтому общепринятой практикой является использование единицы, кратной медиане (МоМ), в качестве зависящего от гестационного возраста выражения концентрации РАРР-А. Средний период полувыведения РАРР-А после нормальных родов составляет 53 ± 26 ч (среднее значение плюс стандартное отклонение) [18]. Концентрации РАРР-А в 100 и 1000 раз ниже в крови плода и в амниотической жидкости соответственно по сравнению с материнской кровью [19].
Быстрое повышение уровня РАРР-А в течение первого триместра приводит к тому, что интерпретация данного значения сильно зависит от гестационного возраста.Поэтому общепринятой практикой является использование единицы, кратной медиане (МоМ), в качестве зависящего от гестационного возраста выражения концентрации РАРР-А. Средний период полувыведения РАРР-А после нормальных родов составляет 53 ± 26 ч (среднее значение плюс стандартное отклонение) [18]. Концентрации РАРР-А в 100 и 1000 раз ниже в крови плода и в амниотической жидкости соответственно по сравнению с материнской кровью [19].
Экспоненциальное повышение РАРР-А в первом триместре нормальной беременности
Около 99 % РАРР-А ковалентно связано в комплексе 2:2 с проформой основного основного белка эозинофилов (proMBP) во время беременности.proMBP функционирует как эндогенный ингибитор протеолитической активности PAPP-A (ингибитор протеазы in vivo), механизм ингибирования которого в настоящее время неизвестен. Субстраты PAPP-A включают белки, связывающие инсулиноподобный фактор роста (IGFBP) 4 и 5, роль которых заключается в ингибировании биологической активности инсулиноподобных факторов роста 1 и 2. PAPP-A действует как «протеаза» для IGFBPs [20], помогая высвобождению IGF из этих связывающих белков, так что он может свободно взаимодействовать со своим клеточным рецептором аутокринным или паракринным образом (рис.). Считается, что IGF играет важную роль в инвазии трофобласта и, следовательно, в раннем развитии и васкуляризации плаценты и плацентарного ложа.
PAPP-A действует как «протеаза» для IGFBPs [20], помогая высвобождению IGF из этих связывающих белков, так что он может свободно взаимодействовать со своим клеточным рецептором аутокринным или паракринным образом (рис.). Считается, что IGF играет важную роль в инвазии трофобласта и, следовательно, в раннем развитии и васкуляризации плаценты и плацентарного ложа.
Протеолитическая активность РАРР-А у человека. Связь между PAPP-A, IGF и IGFBP-4. a Замещенные гепаринсульфатом рецепторы в клетке-мишени иммобилизуют РАРР-А в положении, близком к рецептору ИФР. Затем PAPP-A отщепляет IGF от IGFBP-4 в непосредственной близости от рецептора IGF. Затем свободный ИФР связывается с рецептором ИФР, индуцируя пролиферацию клеток, инвазию трофобласта, транспорт глюкозы и аминокислот в плаценту. b GAG-цепь ProMBP связывается там с доменом PAPP-A, высвобождая PAPP-A с клеточной поверхности. ProMBP инактивирует протеолитическую активность PAPP-A
Снижение уровня PAPP-A обнаруживается в связи с нарушением функции плаценты, что легло в основу скрининга в первом триместре плода на синдром Дауна [13, 16]. Низкий уровень материнской сыворотки в первом триместре обнаруживается не только при трисомии 21, трисомии 18 и трисомии 13, но и при анеуплоидии плода без синдрома Дауна.Также сообщается, что PAPP-A имеет положительную связь с массой тела при рождении [21]. По мере снижения PAPP-A риск рождения детей с малым весом для гестационного возраста увеличивается. Установлено, что уровни РАРР-А в кровотоке снижаются при внематочной беременности. Некоторые из осложнений, связанных с необъяснимым изолированным низким РАРР-А, включают преждевременные роды, задержку внутриутробного развития, гестационную гипертензию, гестационную гипертензию с протеинурией [22].
Низкий уровень материнской сыворотки в первом триместре обнаруживается не только при трисомии 21, трисомии 18 и трисомии 13, но и при анеуплоидии плода без синдрома Дауна.Также сообщается, что PAPP-A имеет положительную связь с массой тела при рождении [21]. По мере снижения PAPP-A риск рождения детей с малым весом для гестационного возраста увеличивается. Установлено, что уровни РАРР-А в кровотоке снижаются при внематочной беременности. Некоторые из осложнений, связанных с необъяснимым изолированным низким РАРР-А, включают преждевременные роды, задержку внутриутробного развития, гестационную гипертензию, гестационную гипертензию с протеинурией [22].
Исследования показали, что одной из причин самопроизвольного аборта у этих женщин может быть снижение доступности инсулиноподобного фактора роста-II из-за снижения уровня PAPP-A в сыворотке крови [23].Снижение PAPP-A в материнской сыворотке не связано с каким-либо изменением плацентарного синтеза этого белка, поскольку экспрессия мРНК PAPP-A существенно не снижена в плацентах с синдромом Дауна. Кроме того, корреляция между уровнями экспрессии РАРР-А в сыворотке и тканях теряется при беременности Дауна. Эти наблюдения предполагают, что снижение PAPP-A в материнской сыворотке является посттрансляционным и может быть вызвано изменением механизмов высвобождения плаценты или модификацией стабильности секретируемого белка [24].Установлено, что РАРР-А значительно выше при беременности двойней. В среднем значения РАРР-А у близнецов в 1,86 раза выше, чем у одноплодных. Значимых акушерских исходов при повышенном РАРР-А в первом триместре не описано [22]. Измеримые уровни были обнаружены у мужчин и небеременных женщин. У небеременных лиц PAPP-A обнаруживается в виде гомодимера 400 кДа.
Кроме того, корреляция между уровнями экспрессии РАРР-А в сыворотке и тканях теряется при беременности Дауна. Эти наблюдения предполагают, что снижение PAPP-A в материнской сыворотке является посттрансляционным и может быть вызвано изменением механизмов высвобождения плаценты или модификацией стабильности секретируемого белка [24].Установлено, что РАРР-А значительно выше при беременности двойней. В среднем значения РАРР-А у близнецов в 1,86 раза выше, чем у одноплодных. Значимых акушерских исходов при повышенном РАРР-А в первом триместре не описано [22]. Измеримые уровни были обнаружены у мужчин и небеременных женщин. У небеременных лиц PAPP-A обнаруживается в виде гомодимера 400 кДа.
Гормон бета-ХГЧ, не содержащий материнской сыворотки
Хорионический гонадотропин человека представляет собой гликопротеиновый гормон с молекулярной массой 39 500 Да, обычно обнаруживаемый в крови и моче только во время беременности.В 1987 г. Богарт и соавт. [25] сообщили о повышенных уровнях ХГЧ в материнской сыворотке при беременности с синдромом Дауна, и с тех пор ХГЧ был введен в большинство программ скрининга. Для инициации и поддержания беременности ХГЧ опосредует множественные функции плаценты, матки и плода. Некоторые из них включают развитие клеток синцитиотрофобласта, митотический рост и дифференцировку эндометрия, локализованное подавление материнской иммунной системы, модуляцию морфологии матки и экспрессии генов, а также координацию сложной передачи сигналов между эндометрием [26].
Для инициации и поддержания беременности ХГЧ опосредует множественные функции плаценты, матки и плода. Некоторые из них включают развитие клеток синцитиотрофобласта, митотический рост и дифференцировку эндометрия, локализованное подавление материнской иммунной системы, модуляцию морфологии матки и экспрессии генов, а также координацию сложной передачи сигналов между эндометрием [26].
Химия
Хорионический гонадотропин человека состоит из двух нековалентно связанных субъединиц, α и β, и вырабатывается клетками синцитиотрофобласта плаценты. ХГЧ имеет одну β-субъединицу, которая содержит 145 аминокислот, связанных шестью дисульфидными мостиками, и α-субъединицу, содержащую 92 аминокислоты, связанные 5 дисульфидными мостиками, которая также является общей для трех других гликопротеиновых гормонов: ЛГ, ФСГ и ТТГ. β-субъединица уникальна и отличает ХГЧ от других гликопротеиновых гормонов (рис.). Он содержит две N-связанные боковые цепи олигосахаридов, присоединенные к остаткам 13 и 30 [27].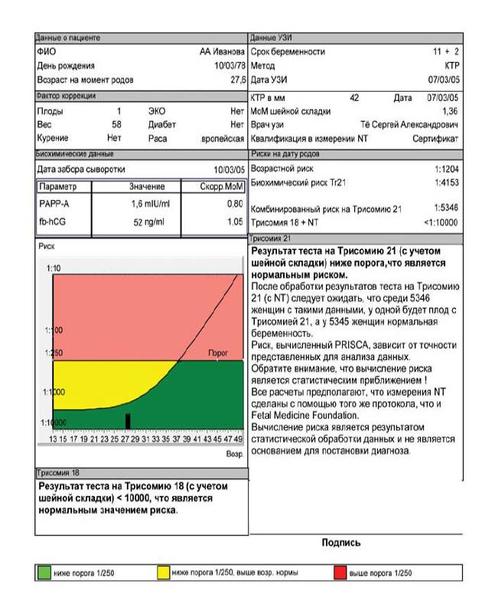 Он также имеет четыре О-связанных олигосахаридных звена, расположенных на уникальном С-концевом участке, богатом пролином и серином (остатки 122–145). α-субъединица имеет две N-связанные олигосахаридные боковые цепи, присоединенные к аминокислотным остаткам 52 и 78 [27]. В материнской сыворотке присутствуют пять родственных ХГЧ молекул: ХГЧ без разрыва, который представляет собой активный гормон; порезанный ХГЧ; свободная α-субъединица; свободная β-субъединица; и свободная от разрыва субъединица β [28].Свободная β-субъединица может образовываться из трех источников: прямой продукции клеток трофобласта, диссоциации ХГЧ на свободные α- и свободные β-субъединицы, а также ферментов макрофагов или нейтрофилов, разрывающих молекулу ХГЧ [29]. Свободный β-ХГЧ, циркулирующий в материнской сыворотке, составляет всего около 0,3–4 % от общего количества ХГЧ [29]. Один ген на хромосоме 6 кодирует субъединицу α всех четырех гликопротеиновых гормонов (ТТГ, ЛГ, ФСГ и ХГ). Хромосома 19 содержит семейство генов, кодирующих субъединицу CGβ [29].
Он также имеет четыре О-связанных олигосахаридных звена, расположенных на уникальном С-концевом участке, богатом пролином и серином (остатки 122–145). α-субъединица имеет две N-связанные олигосахаридные боковые цепи, присоединенные к аминокислотным остаткам 52 и 78 [27]. В материнской сыворотке присутствуют пять родственных ХГЧ молекул: ХГЧ без разрыва, который представляет собой активный гормон; порезанный ХГЧ; свободная α-субъединица; свободная β-субъединица; и свободная от разрыва субъединица β [28].Свободная β-субъединица может образовываться из трех источников: прямой продукции клеток трофобласта, диссоциации ХГЧ на свободные α- и свободные β-субъединицы, а также ферментов макрофагов или нейтрофилов, разрывающих молекулу ХГЧ [29]. Свободный β-ХГЧ, циркулирующий в материнской сыворотке, составляет всего около 0,3–4 % от общего количества ХГЧ [29]. Один ген на хромосоме 6 кодирует субъединицу α всех четырех гликопротеиновых гормонов (ТТГ, ЛГ, ФСГ и ХГ). Хромосома 19 содержит семейство генов, кодирующих субъединицу CGβ [29]. С каждого транскрибируются отдельные матричные РНК (мРНК). Субъединицы спонтанно объединяются в шероховатой эндоплазматической сети и затем непрерывно секретируются в материнский кровоток.
С каждого транскрибируются отдельные матричные РНК (мРНК). Субъединицы спонтанно объединяются в шероховатой эндоплазматической сети и затем непрерывно секретируются в материнский кровоток.
Структура интактного ХГЧ и ХГЧβ
Свободный β-ХГЧ при беременности
ХГЧ в материнской сыворотке достигает максимума на 8–10 неделях, а затем снижается, достигая плато на 18–20 неделях (рис. ) беременности, и остается довольно постоянным до тех пор, пока срок. β-ХГЧ не обладает активностью ХГЧ, но несколько направлений исследований показывают, что он оказывает ростостимулирующее действие.Было высказано предположение, что β-ХГЧ препятствует ингибирующему рост эффекту трансформирующего фактора роста β, фактора роста тромбоцитов-В и фактора роста нервов [30]. Период полувыведения введенного ХГЧ является двухфазным; период полураспада быстрой фазы составляет 5–6 часов, тогда как период более медленной фазы составляет 24–33 часа. Период полувыведения очищенного β-ХГЧ, введенного человеку, составляет 0,7 и 10 ч, что короче, чем у ХГЧ. Однако после доношенной беременности или аборта β-ХГЧ фактически исчезает медленнее, чем ХГЧ.Таким образом, доля β-ХГЧ в общей иммунореактивности ХГЧ увеличивается с 0,8 % в сроке до 27 % через 3 недели. Молекулярно-биологические исследования показали, что трофобласты с трисомией 21 показывают заметное увеличение мРНК β-ХГЧ и меньшее увеличение мРНК α-ХГЧ, что позволяет предположить, что одной из причин высоких уровней ХГЧ в материнской сыворотке является повышенная продукция и секреция ХГЧ плацента [31]. Эти наблюдения подтверждаются относительной незрелостью плаценты, которая продолжает выделять большое количество ХГЧ, как и в первом триместре [32].
Однако после доношенной беременности или аборта β-ХГЧ фактически исчезает медленнее, чем ХГЧ.Таким образом, доля β-ХГЧ в общей иммунореактивности ХГЧ увеличивается с 0,8 % в сроке до 27 % через 3 недели. Молекулярно-биологические исследования показали, что трофобласты с трисомией 21 показывают заметное увеличение мРНК β-ХГЧ и меньшее увеличение мРНК α-ХГЧ, что позволяет предположить, что одной из причин высоких уровней ХГЧ в материнской сыворотке является повышенная продукция и секреция ХГЧ плацента [31]. Эти наблюдения подтверждаются относительной незрелостью плаценты, которая продолжает выделять большое количество ХГЧ, как и в первом триместре [32].
Общий ХГЧ и свободный бета-ХГЧ в первом триместре беременности
Методы измерения РАРР-А и свободного β-ХГЧ
Новая технология биохимического анализа, обеспечивающая автоматизированное, точное и репродуктивное измерение в короткие сроки после получения Образец крови позволяет комбинировать биохимическое и ультразвуковое исследование для ранней оценки, чтобы снизить нагрузку на пациентов.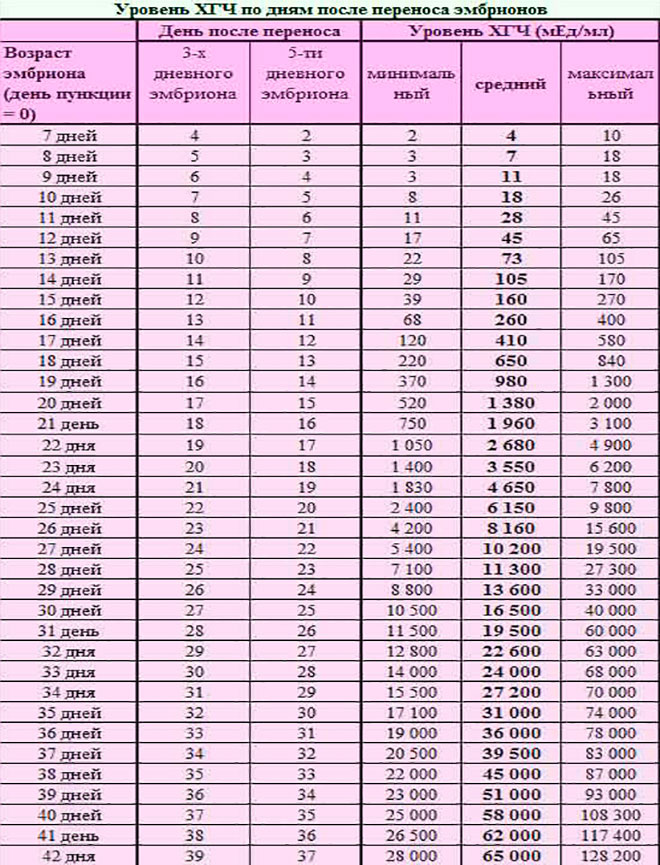 Необходимо выделение сыворотки для скрининга синдрома Дауна через 4 ч после отмены.Охлаждение во время любого хранения, включая транспортировку, настоятельно рекомендуется, так как преаналитическая фаза оказывает большое влияние на анализ.
Необходимо выделение сыворотки для скрининга синдрома Дауна через 4 ч после отмены.Охлаждение во время любого хранения, включая транспортировку, настоятельно рекомендуется, так как преаналитическая фаза оказывает большое влияние на анализ.
Образцы сыворотки на свободный β-ХГЧ и РАРР-А стабильны при 4 °C для цельной крови или отделенной сыворотки в течение 1 недели. Надежные результаты получаются при хранении отделенных образцов сыворотки при температуре 20°С до 2 суток и 1 суток для цельной крови. При 30 °C надежные результаты были получены только в том случае, если образцы были проанализированы в течение 2 ч сбора.
В цельной крови уровни свободного β-ХГЧ увеличивались быстрее по сравнению с сывороткой, особенно при 30 °C [33].В нескольких исследованиях сообщалось, что высокая температура хранения и длительный интервал между сбором и анализом образца приводят к увеличению концентрации свободного β-ХГЧ, поскольку он высвобождается при диссоциации или деградации интактного ХГЧ [34]. Сообщалось, что в цельной крови, хранившейся при комнатной температуре, средняя концентрация свободного β-ХГЧ в сыворотке увеличивалась на 10–15 % через 24 часа, примерно на 25 % через 3 дня и на 45 % через 4 дня [34]. Другое исследование показало, что уровни PAPP-A в сыворотке стабильны в течение 142 дней при 2–8°, 37 дней при комнатной температуре и 20 дней при 30 °C.Существенных изменений ни для одного из аналитов не наблюдалось после хранения при температуре -20 °C до 240 дней или после шести повторных циклов замораживания-оттаивания [33]. В настоящее время практически все коммерческие анализы основаны на технологии хемилюминесцентной амплификации ферментами. Материнская сыворотка PAPP-A и свободный β-hCG также могут быть измерены с использованием анализатора иммунологического анализа случайного доступа с использованием технологии эмиссии амплифицированного криптата с временным разрешением.
Сообщалось, что в цельной крови, хранившейся при комнатной температуре, средняя концентрация свободного β-ХГЧ в сыворотке увеличивалась на 10–15 % через 24 часа, примерно на 25 % через 3 дня и на 45 % через 4 дня [34]. Другое исследование показало, что уровни PAPP-A в сыворотке стабильны в течение 142 дней при 2–8°, 37 дней при комнатной температуре и 20 дней при 30 °C.Существенных изменений ни для одного из аналитов не наблюдалось после хранения при температуре -20 °C до 240 дней или после шести повторных циклов замораживания-оттаивания [33]. В настоящее время практически все коммерческие анализы основаны на технологии хемилюминесцентной амплификации ферментами. Материнская сыворотка PAPP-A и свободный β-hCG также могут быть измерены с использованием анализатора иммунологического анализа случайного доступа с использованием технологии эмиссии амплифицированного криптата с временным разрешением.
Nuchal Translucency
Наиболее важным ультразвуковым маркером при скрининге хромосомных аномалий в первом триместре является измерение толщины NT между 10 и 14 неделями беременности, о котором впервые сообщили Schulte-Valentine и Schindler в 1992 году [35]. NT измеряет заполненное подкожной жидкостью пространство между задней частью позвоночника и кожей шеи плода (рис. ). NT увеличивается с гестационным возрастом примерно на 17 % в неделю. Полупрозрачная область исчезает после 14 недель гестационного возраста, когда подкожная клетчатка становится более эхогенной. Таким образом, НТ является преходящим явлением [36]. Используя только измерение NT и возраст матери, можно определить 81% (таблица) пораженных беременностей с частотой ложноположительных результатов 5% [37]. Измерение воротникового пространства должно выполняться опытными специалистами по УЗИ и должно быть получено между 10 и 13 неделями 6 дней беременности, что эквивалентно длине темени-крестца от 38 до 84 мм.NT можно обнаружить у 99 % плодов в конце первого триместра. 50-й процентиль NT увеличивается с 1,2 мм на неделе 11 + 0 (длина темени-крестца 45 мм) до 1,5 мм на неделе 13 + 6 (длина темени-крестца 82 мм). 95-й процентиль колеблется от 2 мм на 11-й неделе до 2,6 мм на 13 + 6 неделе.
NT измеряет заполненное подкожной жидкостью пространство между задней частью позвоночника и кожей шеи плода (рис. ). NT увеличивается с гестационным возрастом примерно на 17 % в неделю. Полупрозрачная область исчезает после 14 недель гестационного возраста, когда подкожная клетчатка становится более эхогенной. Таким образом, НТ является преходящим явлением [36]. Используя только измерение NT и возраст матери, можно определить 81% (таблица) пораженных беременностей с частотой ложноположительных результатов 5% [37]. Измерение воротникового пространства должно выполняться опытными специалистами по УЗИ и должно быть получено между 10 и 13 неделями 6 дней беременности, что эквивалентно длине темени-крестца от 38 до 84 мм.NT можно обнаружить у 99 % плодов в конце первого триместра. 50-й процентиль NT увеличивается с 1,2 мм на неделе 11 + 0 (длина темени-крестца 45 мм) до 1,5 мм на неделе 13 + 6 (длина темени-крестца 82 мм). 95-й процентиль колеблется от 2 мм на 11-й неделе до 2,6 мм на 13 + 6 неделе. У большинства плодов с синдромом Дауна NT увеличивается по сравнению с нормальными плодами того же гестационного возраста. Кроме того, увеличение NT связано с сужением перешейка аорты, сердечно-сосудистыми дефектами, которые вызывают гиперперфузию головы и шеи, или аномальным/задержкой развития лимфатической системы [38, 39].Повышенное значение NT также может быть связано с невынашиванием беременности [36, 40] и аномальными кариотипами [41].
У большинства плодов с синдромом Дауна NT увеличивается по сравнению с нормальными плодами того же гестационного возраста. Кроме того, увеличение NT связано с сужением перешейка аорты, сердечно-сосудистыми дефектами, которые вызывают гиперперфузию головы и шеи, или аномальным/задержкой развития лимфатической системы [38, 39].Повышенное значение NT также может быть связано с невынашиванием беременности [36, 40] и аномальными кариотипами [41].
NUCHAL Измерение прозрачности
Таблица 2
Таблица обнаружения 2
Уровень обнаружения Трисомии 21, 18 и 13 для данной ложной положительной скорости (FPR)
Скаривание| Трисомия 21 | Трисомия 18 | FPR: 0,5% Трисомия 13 | FPR: 0,5% |
|---|---|---|---|
| Maternal Age (MA) и FETAL NT | 81 | 68 | 61 |
| мА и сыворотки бесплатно β-HCG и PAPP-A | 67 | 80 | 59 | 59
| MA, NT и сыворотка β-HCG и PAPP-A | 91 | 97 | 84 |
Устойчивый к пациенту Риск хромосомной аномалии
некоторый риск того, что ее плод может быть затронут хромосомным дефектом. Чтобы рассчитать этот индивидуальный риск, необходимо сначала принять во внимание априорный риск женщины, исходя из ее возраста и срока беременности (таблица). Затем этот априорный риск умножается на отношение правдоподобия, рассчитанное на основании данных УЗИ и/или результатов биохимии сыворотки, полученных во время текущей беременности. Произведение априорного риска и отношения правдоподобия дает специфический риск пациента.
Чтобы рассчитать этот индивидуальный риск, необходимо сначала принять во внимание априорный риск женщины, исходя из ее возраста и срока беременности (таблица). Затем этот априорный риск умножается на отношение правдоподобия, рассчитанное на основании данных УЗИ и/или результатов биохимии сыворотки, полученных во время текущей беременности. Произведение априорного риска и отношения правдоподобия дает специфический риск пациента.
Кратность медианы (МоМ)
При скрининге с использованием биохимических маркеров материнской сыворотки измеренная концентрация маркеров преобразуется в МоМ незатронутых беременностей при той же беременности.Это сделано для того, чтобы учесть тот факт, что уровни маркеров варьируются в зависимости от гестационного возраста. Значения MoM рассчитываются путем деления индивидуального уровня маркера на средний уровень этого маркера для всей популяции в этом гестационном возрасте в этой лаборатории. Использование значений MoM, а не абсолютных уровней, также позволяет последовательно интерпретировать результаты из разных лабораторий. При эуплоидной беременности среднее скорректированное значение как для свободного β-ХГЧ, так и для РАРР-А составляет 1,0 МоМ при всех сроках беременности. В исследовании, проведенном Spencer et al.[42] при изменении уровней биохимических маркеров первого триместра у женщин азиатского происхождения (индианка, Пакистан, Бангладеш) по сравнению с женщиной европеоидной расы (контрольная группа) было обнаружено, что в азиатской популяции медиана PAPP-A была увеличена на 9 %, а свободный β- ХГЧ на 6 % от контрольной группы (таблица ). Было обнаружено, что азиатское население на 6,9 кг легче, чем европейская женщина. При трисомиях наблюдаются низкие значения РАРР-А, которые обычно составляют 0,15 МоМ для трисомии 21, то есть синдрома Дауна; 0,25 МоМ для трисомии 13 или синдрома Патау; 0.18 МоМ для трисомии 18 или синдрома Эдвардса; и 0,49 для синдрома Тернера (таблица).
При эуплоидной беременности среднее скорректированное значение как для свободного β-ХГЧ, так и для РАРР-А составляет 1,0 МоМ при всех сроках беременности. В исследовании, проведенном Spencer et al.[42] при изменении уровней биохимических маркеров первого триместра у женщин азиатского происхождения (индианка, Пакистан, Бангладеш) по сравнению с женщиной европеоидной расы (контрольная группа) было обнаружено, что в азиатской популяции медиана PAPP-A была увеличена на 9 %, а свободный β- ХГЧ на 6 % от контрольной группы (таблица ). Было обнаружено, что азиатское население на 6,9 кг легче, чем европейская женщина. При трисомиях наблюдаются низкие значения РАРР-А, которые обычно составляют 0,15 МоМ для трисомии 21, то есть синдрома Дауна; 0,25 МоМ для трисомии 13 или синдрома Патау; 0.18 МоМ для трисомии 18 или синдрома Эдвардса; и 0,49 для синдрома Тернера (таблица).
Таблица 3
Таблица 3
Вариация в первом триместре биохимические уровни маркера в азиатских женщинах по сравнению с кавказской женщиной
| маркер (мама) | 4 Caucasian4 индийцы||||
|---|---|---|---|---|
| не веса корреляции | корреляция веса | корреляция веса | ||
| свободный β-ХГЧ | 1. 53 53 | +1,038 | 1,002 | 0,925 |
| РАРР-А | 1,032 | 1,029 | 1,187 | 1,082 |
Таблица 4
шаблон Маркер в нескольких срединных и обнаружения скоростей в различных анеуплоидий
| Aneuploidy | NT | Свободный β-HCG | PAPP-A | Уровень обнаружения (%) | |
|---|---|---|---|---|---|
| Трисомия 21 | 2. 67 MOM 67 MOM | 215 MOM | 0.15 MOM | ||
| TRISOMY 13 | 0.50 MAM | 0,25 мама | |||
| Трисомия 18 | 3,27 мама | 0,28 мама | 0,18 Мама | ||
| 45, | 4,76 мама | 1.11 Мама | 0,11 мама | 0,49 мама | 0,49 |
| Triploidy Maternal | 0. 88 MOM 88 MOM | 0.18 MOM | 0,06 MOM | 0.06 MOM | |
| Triploidy Paternal | 2,76 мама | 8.04 MOM | 0,75 мама | 0,75 мама |
Лаборатория использует различную математическую модель для расчета риск женщины родить ребенка с синдромом Дауна, трисомией 18 и трисомией 13. Некоторые из математических моделей включают Prisca, Viewpoint, Astria и т. д. Эти математические модели учитывают возраст матери, уровни различных биохимических маркеров в сыворотке и данные УЗИ плода. измерения.Кроме того, ряд факторов играет важную роль в расчете риска, поскольку они будут влиять на значения биохимических анализов материнской сыворотки. Это включает в себя гестационный возраст, вес, расу, курение, диабетический статус человека, количество присутствующих плодов и использовалось ли лечение ЭКО для зачатия. В некоторых редких случаях, таких как расчеты риска анеуплоидии при беременности донора яйцеклетки, использование возраста донора яйцеклетки вместо возраста реципиента снижает частоту ложноположительных результатов и повышает эффективность скрининга.
Это включает в себя гестационный возраст, вес, расу, курение, диабетический статус человека, количество присутствующих плодов и использовалось ли лечение ЭКО для зачатия. В некоторых редких случаях, таких как расчеты риска анеуплоидии при беременности донора яйцеклетки, использование возраста донора яйцеклетки вместо возраста реципиента снижает частоту ложноположительных результатов и повышает эффективность скрининга.
Неточная информация может привести к значительным изменениям оценки риска. Следовательно, очень важно, чтобы при отправке образца в лабораторию для анализа была предоставлена точная информация. Для скрининга сыворотки в первом триместре положительный или отрицательный результат основан на пороговых значениях, специфичных для лаборатории. С учетом возраста матери оценочный риск трисомии плода 21, 18 и 13 для женщины в возрасте 20 лет на 12 недель беременности составляет примерно 1 на 1 000, 1 на 2 500 и 1 на 8 000 соответственно, а риск такой женщины родить пораженный доношенный ребенок составляет 1 из 1500, 1 из 18 000 и 1 из 42 000 соответственно. Соответствующие риски этих анеуплоидий для женщины в возрасте 35 лет при сроке беременности 12 недель составляют примерно 1 из 250, 1 из 600 и 1 из 1 800, а риск того, что такая женщина родит больного ребенка в срок, составляет 1 из 350, 1 из 1 800. 4000 и 1 из 10000.
Соответствующие риски этих анеуплоидий для женщины в возрасте 35 лет при сроке беременности 12 недель составляют примерно 1 из 250, 1 из 600 и 1 из 1 800, а риск того, что такая женщина родит больного ребенка в срок, составляет 1 из 350, 1 из 1 800. 4000 и 1 из 10000.
При скрининге трисомии 21 по возрасту матери и бессывороточному β-ХГЧ и РАРР-А частота обнаружения составляет около 65 % при частоте ложноположительных результатов 5 %. Показатели лучше на 9–10 неделе, чем на 13 неделе, потому что разница в РАРР-А между трисомной и эуплоидной беременностью больше на более ранних сроках беременности [43, 44].Хотя разница в свободном β-ХГЧ между трисомными и эуплоидными беременностями увеличивается с течением беременности, величина этой разницы меньше, чем у противоположного соотношения РАРР-А. При трисомиях 18 и 13 снижены уровни свободного β-ХГЧ и РАРР-А в материнской сыворотке [45, 46]. В случаях половых хромосомных аномалий уровень свободного β-ХГЧ в материнской сыворотке нормальный, а РАРР-А низкий [46]. Общая эффективность скрининга с помощью комбинированного теста лучше на 11 неделе, чем на 13 неделе, с большим вкладом РАРР-А в 11 недель и свободного β-ХГЧ в 13 недель.При трисомии 21 беременности медиана свободного β-ХГЧ в МоМ увеличивается с 1,8 на 11 неделе до 2,09 на 13 неделе, а соответствующие значения для РАРР-А составляют 0,38 и 0,65 МоМ.
Общая эффективность скрининга с помощью комбинированного теста лучше на 11 неделе, чем на 13 неделе, с большим вкладом РАРР-А в 11 недель и свободного β-ХГЧ в 13 недель.При трисомии 21 беременности медиана свободного β-ХГЧ в МоМ увеличивается с 1,8 на 11 неделе до 2,09 на 13 неделе, а соответствующие значения для РАРР-А составляют 0,38 и 0,65 МоМ.
Скрининг для биохимического тестирования и ультразвукового сканирования также можно проводить в два отдельных посещения, первое из которых проводится в 9–10 недель, а второе – в 12 недель [44, 47, 48]. Было подсчитано, что этот подход повысит уровень обнаружения с 90 % до 93–94 %. Другим вариантом может быть выполнение сканирования в 12 недель и оптимизация эффективности биохимического тестирования путем измерения РАРР-А в 9 недель и свободного β-ХГЧ во время сканирования в 12 недель или даже позже с предполагаемой частотой обнаружения 95 недель. %.
Ссылки
1. Snijders RJM, Sundberg K, Holzgreve W, Henry G, Nicolaides KH. Риск трисомии в зависимости от возраста и беременности у матери 21. Ультразвуковая акушерская гинекология. 1999; 13: 167–170. doi: 10.1046/j.1469-0705.1999.13030167.x. [PubMed] [CrossRef] [Google Scholar]2. Уилсон РД. Канадские рекомендации по пренатальной диагностике с поправками (2005 г.) изменены на 2005 г. — методы пренатальной диагностики. Руководство по клинической практике SOGC, № 168, ноябрь 2005 г. J Obstet Gynaecol Can. 2005; 27:1048–1054. [PubMed] [Google Scholar]3.Биндра Р., Ляо В.А., Спенсер К., Николаидес К.Х. Универсальная клиника для оценки риска трисомии 21 на сроке 11–14 недель: проспективное исследование 15 030 беременностей. УЗИ Акушерство Гинекол. 2002; 20: 219–225. doi: 10.1046/j.1469-0705.2002.00808.x. [PubMed] [CrossRef] [Google Scholar]4. Николаидес К.Х. Скрининг на анеуплоиды плода в возрасте от 11 до 13 недель. Пренат Диагн. 2011;1(31):7–15. doi: 10.1002/pd.2637. [PubMed] [CrossRef] [Google Scholar]5. Дугофф Л., Хоббинс Дж. К., Мэлоун Ф. Д. и др. Квадратный скрининг как предиктор неблагоприятного исхода беременности.
Риск трисомии в зависимости от возраста и беременности у матери 21. Ультразвуковая акушерская гинекология. 1999; 13: 167–170. doi: 10.1046/j.1469-0705.1999.13030167.x. [PubMed] [CrossRef] [Google Scholar]2. Уилсон РД. Канадские рекомендации по пренатальной диагностике с поправками (2005 г.) изменены на 2005 г. — методы пренатальной диагностики. Руководство по клинической практике SOGC, № 168, ноябрь 2005 г. J Obstet Gynaecol Can. 2005; 27:1048–1054. [PubMed] [Google Scholar]3.Биндра Р., Ляо В.А., Спенсер К., Николаидес К.Х. Универсальная клиника для оценки риска трисомии 21 на сроке 11–14 недель: проспективное исследование 15 030 беременностей. УЗИ Акушерство Гинекол. 2002; 20: 219–225. doi: 10.1046/j.1469-0705.2002.00808.x. [PubMed] [CrossRef] [Google Scholar]4. Николаидес К.Х. Скрининг на анеуплоиды плода в возрасте от 11 до 13 недель. Пренат Диагн. 2011;1(31):7–15. doi: 10.1002/pd.2637. [PubMed] [CrossRef] [Google Scholar]5. Дугофф Л., Хоббинс Дж. К., Мэлоун Ф. Д. и др. Квадратный скрининг как предиктор неблагоприятного исхода беременности.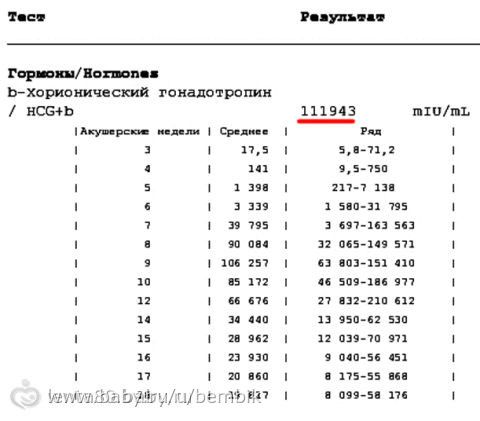 Акушерство Гинекол. 2005; 106: 260–267. doi: 10.1097/01.AOG.0000172419.37410.eb. [PubMed] [CrossRef] [Google Scholar]6. Николас Дж.В., Уэйн Дж.Х., Аллан К.Х. Антенатальный скрининг синдрома Дауна с помощью четырехкратного теста. Ланцет. 2003;361(9360):835–836. doi: 10.1016/S0140-6736(03)12680-3. [PubMed] [CrossRef] [Google Scholar]7. Wald NJ, Kennard A, Hackshaw A, McGuire A. Антенатальный скрининг синдрома Дауна, опубликованная опечатка появляется в J Med Screen. 1998;5:110. [Google Академия]8. Петрович И., Марина Д., Хуан К.К.Роль ассоциированного с беременностью белка плазмы –А (РАРР-А) в выявлении активности ишемической болезни сердца. Акта Фак Мед Найсенсис. 2007;24(4):183–188. [Google Академия]9. Фиалова Л, Мальбохан ИМ. Ассоциированный с беременностью белок плазмы А (РАРР-А): теоретические и клинические аспекты. Братислав Лек Листы. 2002; 103: 194–205. [PubMed] [Google Scholar] 10. Overgaard MT, Oxvig C, Christiansen M, Lawrence JB, Conover CA, Gleich GJ. Уровни рибонуклеиновой кислоты-мессенджера белка-А плазмы, связанного с беременностью, и проформа основного основного белка эозинофилов: экспрессия в репродуктивных и нерепродуктивных тканях человека.
Акушерство Гинекол. 2005; 106: 260–267. doi: 10.1097/01.AOG.0000172419.37410.eb. [PubMed] [CrossRef] [Google Scholar]6. Николас Дж.В., Уэйн Дж.Х., Аллан К.Х. Антенатальный скрининг синдрома Дауна с помощью четырехкратного теста. Ланцет. 2003;361(9360):835–836. doi: 10.1016/S0140-6736(03)12680-3. [PubMed] [CrossRef] [Google Scholar]7. Wald NJ, Kennard A, Hackshaw A, McGuire A. Антенатальный скрининг синдрома Дауна, опубликованная опечатка появляется в J Med Screen. 1998;5:110. [Google Академия]8. Петрович И., Марина Д., Хуан К.К.Роль ассоциированного с беременностью белка плазмы –А (РАРР-А) в выявлении активности ишемической болезни сердца. Акта Фак Мед Найсенсис. 2007;24(4):183–188. [Google Академия]9. Фиалова Л, Мальбохан ИМ. Ассоциированный с беременностью белок плазмы А (РАРР-А): теоретические и клинические аспекты. Братислав Лек Листы. 2002; 103: 194–205. [PubMed] [Google Scholar] 10. Overgaard MT, Oxvig C, Christiansen M, Lawrence JB, Conover CA, Gleich GJ. Уровни рибонуклеиновой кислоты-мессенджера белка-А плазмы, связанного с беременностью, и проформа основного основного белка эозинофилов: экспрессия в репродуктивных и нерепродуктивных тканях человека.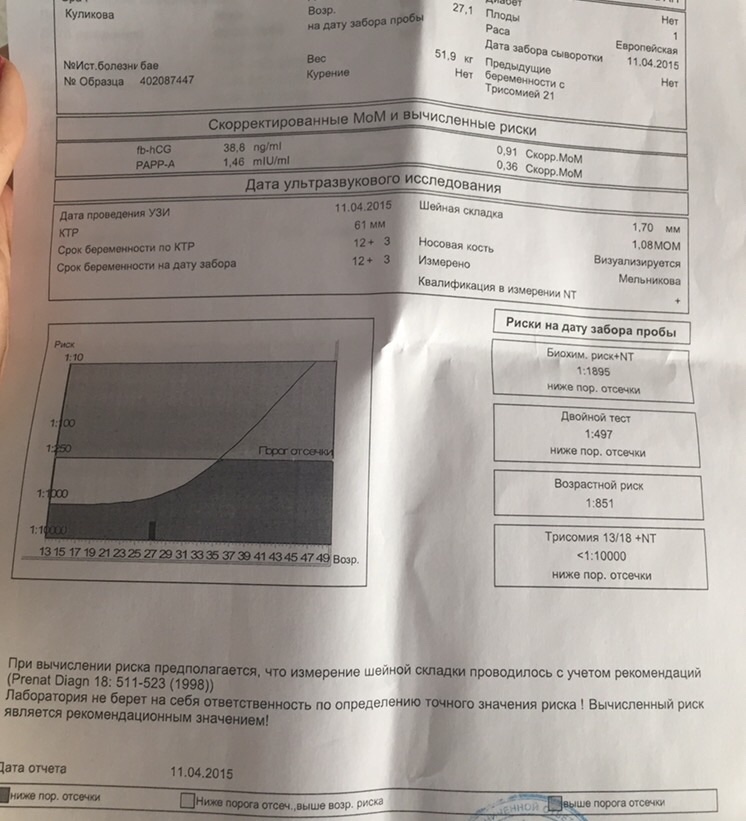 Биол Репрод. 1999;61:1083–1089. doi: 10.1095/biolreprod61.4.1083. [PubMed] [CrossRef] [Google Scholar] 11. Overgaard MT, Boldt HT, Laursen LS, Sottrup-Jensen L, Conover CA, Oxvig C. Ассоциированный с беременностью белок плазмы A2 (PAPP-A2), новая протеиназа белка-5, связывающая инсулиноподобный фактор роста. Дж. Биол. Хим. 2001; 276:21849–21853. doi: 10.1074/jbc.M1021. [PubMed] [CrossRef] [Google Scholar] 12. Qin Q-P, Kokkala S, Lund J, Tamm N, Voipio-Pulkki LM, Pettersson K. Молекулярные различия циркулирующего связанного с беременностью плазменного белка-A при инфаркте миокарда и беременности.Клин Хим. 2005; 51: 75–83. doi: 10.1373/clinchem.2004.036467. [PubMed] [CrossRef] [Google Scholar] 13. Overgaard MT, Sorensen ES, Stachowiak D, Boldt HB, Kristensen L, Sottrup-Jensen L, et al. Комплекс ассоциированного с беременностью плазменного белка-А и проформы дисульфидной структуры основного основного белка эозинофилов и мест прикрепления углеводов. Дж. Биол. Хим. 2003; 278:2106–2117. doi: 10.
Биол Репрод. 1999;61:1083–1089. doi: 10.1095/biolreprod61.4.1083. [PubMed] [CrossRef] [Google Scholar] 11. Overgaard MT, Boldt HT, Laursen LS, Sottrup-Jensen L, Conover CA, Oxvig C. Ассоциированный с беременностью белок плазмы A2 (PAPP-A2), новая протеиназа белка-5, связывающая инсулиноподобный фактор роста. Дж. Биол. Хим. 2001; 276:21849–21853. doi: 10.1074/jbc.M1021. [PubMed] [CrossRef] [Google Scholar] 12. Qin Q-P, Kokkala S, Lund J, Tamm N, Voipio-Pulkki LM, Pettersson K. Молекулярные различия циркулирующего связанного с беременностью плазменного белка-A при инфаркте миокарда и беременности.Клин Хим. 2005; 51: 75–83. doi: 10.1373/clinchem.2004.036467. [PubMed] [CrossRef] [Google Scholar] 13. Overgaard MT, Sorensen ES, Stachowiak D, Boldt HB, Kristensen L, Sottrup-Jensen L, et al. Комплекс ассоциированного с беременностью плазменного белка-А и проформы дисульфидной структуры основного основного белка эозинофилов и мест прикрепления углеводов. Дж. Биол. Хим. 2003; 278:2106–2117. doi: 10.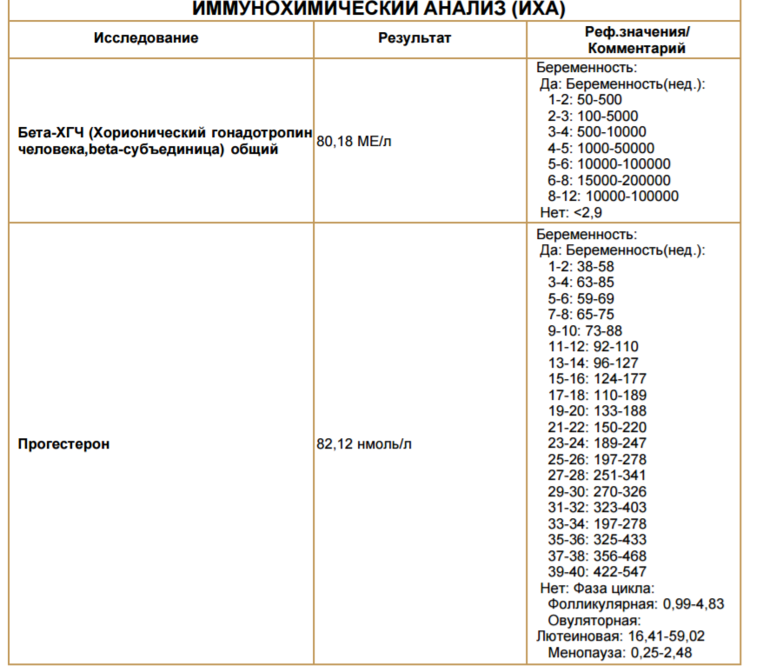 1074/jbc.M208777200. [PubMed] [CrossRef] [Google Scholar] 14. Оксвиг К., Санд О., Кристенсен Т., Кристенсен Л., Соттруп-Йенсен Л.Выделение и характеристика циркулирующего комплекса между белком-А плазмы человека, ассоциированным с беременностью, и проформой основного основного белка эозинофилов. Биохим Биофиз Акта. 1994;1201:415–423. doi: 10.1016/0304-4165(94)
1074/jbc.M208777200. [PubMed] [CrossRef] [Google Scholar] 14. Оксвиг К., Санд О., Кристенсен Т., Кристенсен Л., Соттруп-Йенсен Л.Выделение и характеристика циркулирующего комплекса между белком-А плазмы человека, ассоциированным с беременностью, и проформой основного основного белка эозинофилов. Биохим Биофиз Акта. 1994;1201:415–423. doi: 10.1016/0304-4165(94)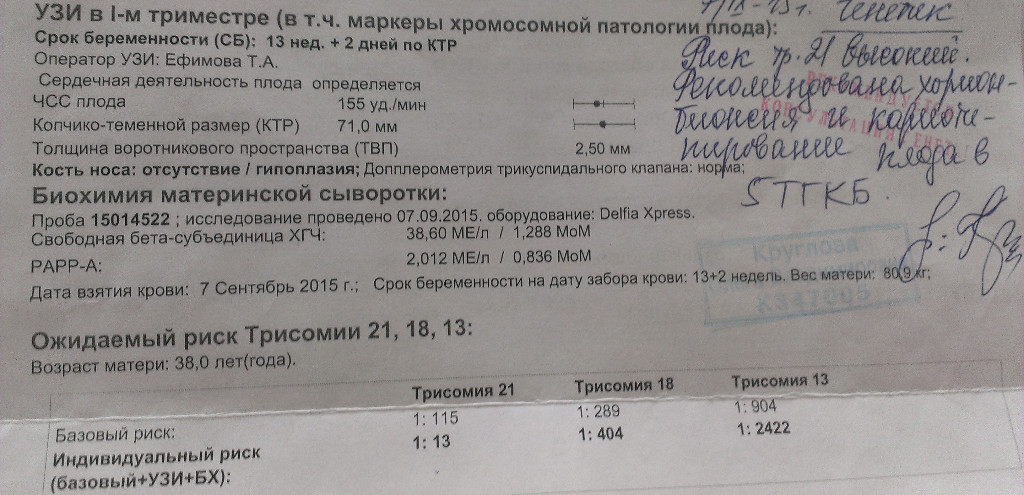 Экспрессия рекомбинантного белка-А плазмы человека, связанного с беременностью, и идентификация проформы основного основного белка эозинофилов в качестве его физиологического ингибитора. Дж. Биол. Хим. 2000;275(40):31128–31133. дои: 10.1074/jbc.M001384200. [PubMed] [CrossRef] [Google Scholar] 18. Бишоф П., ДюБерг С., Херрманн В., Сизоненко П.С. Ассоциированный с беременностью протеин-А плазмы (РАРР-А) и ХГЧ на ранних сроках беременности. Br J Obstet Gynaecol. 1981; 88: 973–975. doi: 10.1111/j.1471-0528.1981.tb01683.x. [PubMed] [CrossRef] [Google Scholar] 19. Bischof P, Amandruz M, Weil-Franck C, Baeriswyl JP, Weil A, Hermann WL, et al. Скорость исчезновения ассоциированного с беременностью плазменного белка-А (РАРР-А) после окончания нормальной и аномальной беременности.Арка Гинеколь. 1984; 236: 93–98. doi: 10.1007/BF02134005. [PubMed] [CrossRef] [Google Scholar] 20. Болдт Х.Б., Коновер, Калифорния. Ассоциированный с беременностью плазменный белок-А (РАРР-А): локальный регулятор биодоступности ИФР посредством расщепления ИФРСБ.
Экспрессия рекомбинантного белка-А плазмы человека, связанного с беременностью, и идентификация проформы основного основного белка эозинофилов в качестве его физиологического ингибитора. Дж. Биол. Хим. 2000;275(40):31128–31133. дои: 10.1074/jbc.M001384200. [PubMed] [CrossRef] [Google Scholar] 18. Бишоф П., ДюБерг С., Херрманн В., Сизоненко П.С. Ассоциированный с беременностью протеин-А плазмы (РАРР-А) и ХГЧ на ранних сроках беременности. Br J Obstet Gynaecol. 1981; 88: 973–975. doi: 10.1111/j.1471-0528.1981.tb01683.x. [PubMed] [CrossRef] [Google Scholar] 19. Bischof P, Amandruz M, Weil-Franck C, Baeriswyl JP, Weil A, Hermann WL, et al. Скорость исчезновения ассоциированного с беременностью плазменного белка-А (РАРР-А) после окончания нормальной и аномальной беременности.Арка Гинеколь. 1984; 236: 93–98. doi: 10.1007/BF02134005. [PubMed] [CrossRef] [Google Scholar] 20. Болдт Х.Б., Коновер, Калифорния. Ассоциированный с беременностью плазменный белок-А (РАРР-А): локальный регулятор биодоступности ИФР посредством расщепления ИФРСБ.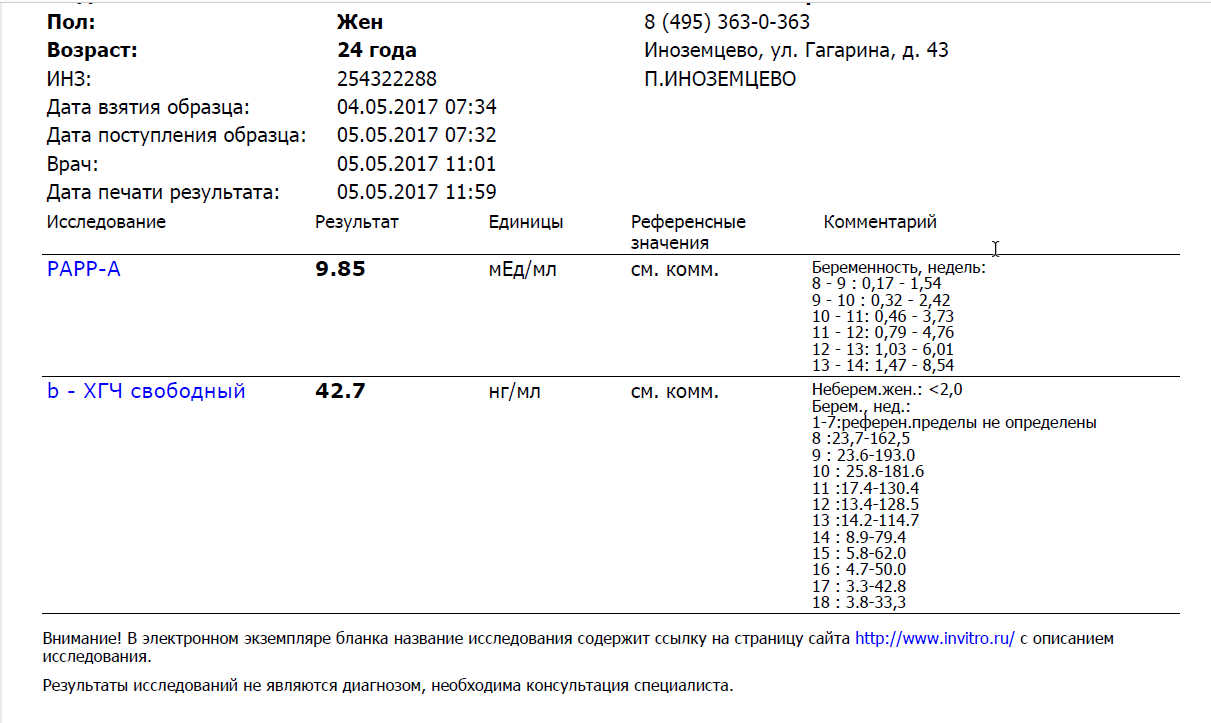 Гормон роста IGF Res. 2007; 17:10–18. doi: 10.1016/j.ghir.2006.11.003. [PubMed] [CrossRef] [Google Scholar] 21. Петерсон С.Э., Симхан Х.Н. Белок плазмы А, связанный с беременностью в первом триместре, и последующие аномалии роста плода. Am J Obstet Gynecol. 2008;198(5):43–5.[В паблике] 22. Ганьон А., Дуглас Р.В. Акушерские осложнения, связанные с аномальными маркерами анализов материнской сыворотки. J Obstet Gynaecol Can. 2008;30(10):918–932. [PubMed] [Google Scholar] 23. Сантолая-Форгас И., Леон Дж. А. Д., Каллен Хопкинс Р., Кастракан В. Д., Кауфман Р. П., Сифуэнтес Г. П. Низкий уровень протеина А плазмы, связанный с беременностью, на сроке от 10 + 1 до 14 + 6 недель беременности и возможный механизм, ведущий к выкидышу. Диагностика плода Тер. 2004; 19: 456–461. doi: 10.1159/000079000. [PubMed] [CrossRef] [Google Scholar] 24.Brizot ML, Hyett JA, Mckie AT, Bersinger NA, Farzaneh F, Nicolaides KH. Экспрессия гена связанного с беременностью белка плазмы человека-А в плаценте при трисомной беременности.
Гормон роста IGF Res. 2007; 17:10–18. doi: 10.1016/j.ghir.2006.11.003. [PubMed] [CrossRef] [Google Scholar] 21. Петерсон С.Э., Симхан Х.Н. Белок плазмы А, связанный с беременностью в первом триместре, и последующие аномалии роста плода. Am J Obstet Gynecol. 2008;198(5):43–5.[В паблике] 22. Ганьон А., Дуглас Р.В. Акушерские осложнения, связанные с аномальными маркерами анализов материнской сыворотки. J Obstet Gynaecol Can. 2008;30(10):918–932. [PubMed] [Google Scholar] 23. Сантолая-Форгас И., Леон Дж. А. Д., Каллен Хопкинс Р., Кастракан В. Д., Кауфман Р. П., Сифуэнтес Г. П. Низкий уровень протеина А плазмы, связанный с беременностью, на сроке от 10 + 1 до 14 + 6 недель беременности и возможный механизм, ведущий к выкидышу. Диагностика плода Тер. 2004; 19: 456–461. doi: 10.1159/000079000. [PubMed] [CrossRef] [Google Scholar] 24.Brizot ML, Hyett JA, Mckie AT, Bersinger NA, Farzaneh F, Nicolaides KH. Экспрессия гена связанного с беременностью белка плазмы человека-А в плаценте при трисомной беременности. Плацента. 1996; 17:33–36. doi: 10.1016/S0143-4004(05)80641-1. [PubMed] [CrossRef] [Google Scholar] 25. Богарт М.Х., Пандиан М.Р., Джонс О.В. Аномальные уровни хорионического гонадотропина в сыворотке крови матери при беременности с хромосомными аномалиями плода. Пренат Диагн. 1987; 7: 623–630. doi: 10.1002/pd.1970070904. [PubMed] [CrossRef] [Google Scholar] 27.Ульф-Хокан С., Айла Т., Хенрик А., Лина В. Классификация, функции и клиническое использование различных изоформ ХГЧ. Обновление воспроизведения гула. 2006;12(6):769–784. doi: 10.1093/humupd/dml029. [PubMed] [CrossRef] [Google Scholar] 28. Тренти Т., Алоэ Р., Сервеллин Г., Липпи Г. Хорионический гонадотропин человека в диагностике беременности. Клин Чим Акта. 2011;412(17–18):1515–1520. [PubMed] [Google Scholar] 29. Фернандо М.Р., Донато Д., Феличе П. Прогностическая ценность измерений гормонов при осложнениях беременности у матери и плода.Эндокринный. 2006;23(2):230–57. [В паблике] 30. Батлер С.А., Иль РК. Свободная мономерная бета-субъединица хорионического гонадотропина человека (бета-ХГЧ) и недавно идентифицированная гомодимерная бета-субъединица бета-бета (бета-ХГЧ) обладают эффектами аутокринного роста.
Плацента. 1996; 17:33–36. doi: 10.1016/S0143-4004(05)80641-1. [PubMed] [CrossRef] [Google Scholar] 25. Богарт М.Х., Пандиан М.Р., Джонс О.В. Аномальные уровни хорионического гонадотропина в сыворотке крови матери при беременности с хромосомными аномалиями плода. Пренат Диагн. 1987; 7: 623–630. doi: 10.1002/pd.1970070904. [PubMed] [CrossRef] [Google Scholar] 27.Ульф-Хокан С., Айла Т., Хенрик А., Лина В. Классификация, функции и клиническое использование различных изоформ ХГЧ. Обновление воспроизведения гула. 2006;12(6):769–784. doi: 10.1093/humupd/dml029. [PubMed] [CrossRef] [Google Scholar] 28. Тренти Т., Алоэ Р., Сервеллин Г., Липпи Г. Хорионический гонадотропин человека в диагностике беременности. Клин Чим Акта. 2011;412(17–18):1515–1520. [PubMed] [Google Scholar] 29. Фернандо М.Р., Донато Д., Феличе П. Прогностическая ценность измерений гормонов при осложнениях беременности у матери и плода.Эндокринный. 2006;23(2):230–57. [В паблике] 30. Батлер С.А., Иль РК. Свободная мономерная бета-субъединица хорионического гонадотропина человека (бета-ХГЧ) и недавно идентифицированная гомодимерная бета-субъединица бета-бета (бета-ХГЧ) обладают эффектами аутокринного роста. Опухоль биол. 2004; 25:18–23. doi: 10.1159/000077719. [PubMed] [CrossRef] [Google Scholar] 31. Эльдар-Гева Т., Хохберг А., деГрут Н., Вайнштейн Д. Высокий уровень хорионического гонадотропина в материнской сыворотке при беременности с синдромом Дауна вызван повышением уровня обеих субъединиц мессенджера рибонуклеиновой кислоты в трофобластах.J Clin Endocrinol Metab. 1995; 80: 3528–3531. doi: 10.1210/jc.80.12.3528. [PubMed] [CrossRef] [Google Scholar] 32. Oberweis D, Gillerot Y, Koulischer L, Hustin J, Philippe E. Трисомия плаценты в последнем триместре беременности. J Gynecol Obstet Biol Reprod. 1993; 12: 345–349. [PubMed] [Google Scholar] 33. Cowans NJ, Stamatopoulou A, Hellström J, Mäkelä MM, Spencer K. Стабильность PAPP-A и свободного ss-hCG в сыворотке первого триместра с использованием систем PerkinElmer AutoDELFIA и DELFIA Xpress. Пренат Диагн. 2010;30(2):127–132.doi: 10.1002/pd.2423. [PubMed] [CrossRef] [Google Scholar] 34. Круз Дж., Круз Г., Минеркава Р., Мази Н., Николаидес К.
Опухоль биол. 2004; 25:18–23. doi: 10.1159/000077719. [PubMed] [CrossRef] [Google Scholar] 31. Эльдар-Гева Т., Хохберг А., деГрут Н., Вайнштейн Д. Высокий уровень хорионического гонадотропина в материнской сыворотке при беременности с синдромом Дауна вызван повышением уровня обеих субъединиц мессенджера рибонуклеиновой кислоты в трофобластах.J Clin Endocrinol Metab. 1995; 80: 3528–3531. doi: 10.1210/jc.80.12.3528. [PubMed] [CrossRef] [Google Scholar] 32. Oberweis D, Gillerot Y, Koulischer L, Hustin J, Philippe E. Трисомия плаценты в последнем триместре беременности. J Gynecol Obstet Biol Reprod. 1993; 12: 345–349. [PubMed] [Google Scholar] 33. Cowans NJ, Stamatopoulou A, Hellström J, Mäkelä MM, Spencer K. Стабильность PAPP-A и свободного ss-hCG в сыворотке первого триместра с использованием систем PerkinElmer AutoDELFIA и DELFIA Xpress. Пренат Диагн. 2010;30(2):127–132.doi: 10.1002/pd.2423. [PubMed] [CrossRef] [Google Scholar] 34. Круз Дж., Круз Г., Минеркава Р., Мази Н., Николаидес К.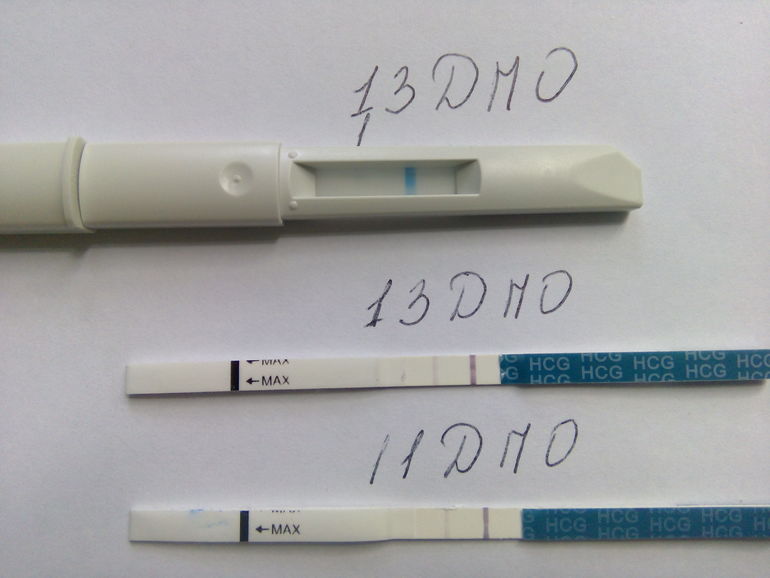 Х. Влияние температуры на свободный β-хорионический гонадотропин человека и концентрацию белка-А в плазме, связанного с беременностью. УЗИ Акушерство Гинекол. 2010; 36: 141–146. doi: 10.1002/uog.7688. [PubMed] [CrossRef] [Google Scholar] 35. Шульте-Валентин М., Шиндлер Х. Неэхогенный затылочный отек как маркер скрининга трисомии 21. Ланцет. 1992; 339:1053. doi: 10.1016/0140-6736(92)
Х. Влияние температуры на свободный β-хорионический гонадотропин человека и концентрацию белка-А в плазме, связанного с беременностью. УЗИ Акушерство Гинекол. 2010; 36: 141–146. doi: 10.1002/uog.7688. [PubMed] [CrossRef] [Google Scholar] 35. Шульте-Валентин М., Шиндлер Х. Неэхогенный затылочный отек как маркер скрининга трисомии 21. Ланцет. 1992; 339:1053. doi: 10.1016/0140-6736(92) Аномалии сердца и магистральных артерий у плодов с хромосомными аномалиями в первом триместре. Am J Med Genet. 1997; 69: 207–216. doi: 10.1002/(SICI)1096-8628(19970317)69:2<207::AID-AJMG18>3.0.CO;2-P. [PubMed] [CrossRef] [Google Scholar] 39. фон Кайзенберг К.С., Николаидес К.Х., Бранд-Сабери Б. Гипоплазия лимфатических сосудов у плодов с синдромом Тернера. Хум Репрод. 1999; 14:823–826. doi: 10.1093/humrep/14.3.823. [PubMed] [CrossRef] [Google Scholar]40. Hyett JA, Sebire NJ, Snijders RJ, Nicolaides KH.Внутриутробная летальность плодов с трисомией 21 с увеличенной толщиной воротникового пространства. УЗИ Акушерство Гинекол. 1996; 7: 101–103. doi: 10.1046/j.1469-0705.1996.07020101.x. [PubMed] [CrossRef] [Google Scholar]41. Халил Асма, Пандья Пранав. Скрининг на синдром Дауна. J Obstet Gynecol Индия. 2006;56(3):205–211. [Google Академия]42. Спенсер К., Хит В., Эль-Шейха А., Онг ЦИТ, Николаидес К.Х. Этническая принадлежность и необходимость коррекции биохимических и ультразвуковых маркеров хромосомных аномалий в первом триместре: исследование восточно-азиатского и афро-карибского населения.
Аномалии сердца и магистральных артерий у плодов с хромосомными аномалиями в первом триместре. Am J Med Genet. 1997; 69: 207–216. doi: 10.1002/(SICI)1096-8628(19970317)69:2<207::AID-AJMG18>3.0.CO;2-P. [PubMed] [CrossRef] [Google Scholar] 39. фон Кайзенберг К.С., Николаидес К.Х., Бранд-Сабери Б. Гипоплазия лимфатических сосудов у плодов с синдромом Тернера. Хум Репрод. 1999; 14:823–826. doi: 10.1093/humrep/14.3.823. [PubMed] [CrossRef] [Google Scholar]40. Hyett JA, Sebire NJ, Snijders RJ, Nicolaides KH.Внутриутробная летальность плодов с трисомией 21 с увеличенной толщиной воротникового пространства. УЗИ Акушерство Гинекол. 1996; 7: 101–103. doi: 10.1046/j.1469-0705.1996.07020101.x. [PubMed] [CrossRef] [Google Scholar]41. Халил Асма, Пандья Пранав. Скрининг на синдром Дауна. J Obstet Gynecol Индия. 2006;56(3):205–211. [Google Академия]42. Спенсер К., Хит В., Эль-Шейха А., Онг ЦИТ, Николаидес К.Х. Этническая принадлежность и необходимость коррекции биохимических и ультразвуковых маркеров хромосомных аномалий в первом триместре: исследование восточно-азиатского и афро-карибского населения. Пренат Диагн. 2005; 25: 365–369. doi: 10.1002/pd.1153. [PubMed] [CrossRef] [Google Scholar]43. Каган К.О., Райт Д., Спенсер К., Молина Ф.С., Николаидес К.Х. Скрининг первого триместра на трисомию 21 с помощью свободного бета-хорионического гонадотропина человека и связанного с беременностью плазменного белка-А: влияние характеристик матери и беременности. УЗИ Акушерство Гинекол. 2008; 31: 493–502. doi: 10.1002/uog.5332. [PubMed] [CrossRef] [Google Scholar]44. Райт Д., Спенсер К., Каган К.О., Торринг Н., Петерсен О.Б., Кристоу А. и др.Комбинированный скрининг первого триместра на трисомию 21 на сроке беременности 7–14 недель. УЗИ Акушерство Гинекол. 2010; 36: 404–411. doi: 10.1002/uog.7755. [PubMed] [CrossRef] [Google Scholar]45. Тул Н., Спенсер К., Ноубл П., Чан С., Николаидес К.Х. Скрининг трисомии 18 по прозрачности воротникового пространства плода и содержанию бета-ХГЧ и РАРР-А в материнской сыворотке на 10–14 неделе беременности. Пренат Диагн. 1999;19:1035–1042. doi: 10.1002/(SICI)1097-0223(199911)19:11<1035::AID-PD694>3.
Пренат Диагн. 2005; 25: 365–369. doi: 10.1002/pd.1153. [PubMed] [CrossRef] [Google Scholar]43. Каган К.О., Райт Д., Спенсер К., Молина Ф.С., Николаидес К.Х. Скрининг первого триместра на трисомию 21 с помощью свободного бета-хорионического гонадотропина человека и связанного с беременностью плазменного белка-А: влияние характеристик матери и беременности. УЗИ Акушерство Гинекол. 2008; 31: 493–502. doi: 10.1002/uog.5332. [PubMed] [CrossRef] [Google Scholar]44. Райт Д., Спенсер К., Каган К.О., Торринг Н., Петерсен О.Б., Кристоу А. и др.Комбинированный скрининг первого триместра на трисомию 21 на сроке беременности 7–14 недель. УЗИ Акушерство Гинекол. 2010; 36: 404–411. doi: 10.1002/uog.7755. [PubMed] [CrossRef] [Google Scholar]45. Тул Н., Спенсер К., Ноубл П., Чан С., Николаидес К.Х. Скрининг трисомии 18 по прозрачности воротникового пространства плода и содержанию бета-ХГЧ и РАРР-А в материнской сыворотке на 10–14 неделе беременности. Пренат Диагн. 1999;19:1035–1042. doi: 10.1002/(SICI)1097-0223(199911)19:11<1035::AID-PD694>3.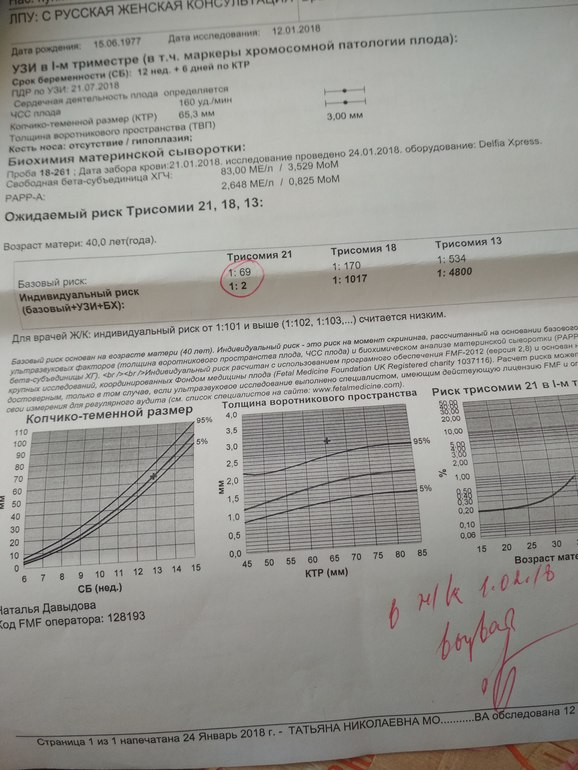 0.CO;2-2. [PubMed] [CrossRef] [Google Scholar]46.Спенсер К., Тул Н., Николаидес К.Х. Бета-ХГЧ и РАРР-А в материнской сыворотке при дефектах половых хромосом плода в первом триместре. Пренат Диагн. 2000;20:390–394. doi: 10.1002/(SICI)1097-0223(200005)20:5<390::AID-PD824>3.0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]47. Боррелл А., Казальс Э., Фортуни А., Фарре М.Т., Гонсе А., Санчес А. и др. Скрининг первого триместра на трисомию 21, сочетающий биохимию и ультразвук в индивидуально оптимальных сроках беременности: интервенционное исследование. Пренат Диагн.2004; 24: 541–545. doi: 10.1002/pd.949. [PubMed] [CrossRef] [Google Scholar]48. Каган К.О., Райт Д., Бейкер А., Сахота Д., Николаидес К.Х. Скрининг трисомии 21 по возрасту матери, толщине воротникового пространства плода, свободному бета-человеческому хорионическому гонадотропину и ассоциированному с беременностью плазменному белку-А. УЗИ Акушерство Гинекол. 2008; 31: 618–24. [ПубМед] 49. Бернд Э., Глаубиц Ральф. Скрининг первого триместра: обзор.
0.CO;2-2. [PubMed] [CrossRef] [Google Scholar]46.Спенсер К., Тул Н., Николаидес К.Х. Бета-ХГЧ и РАРР-А в материнской сыворотке при дефектах половых хромосом плода в первом триместре. Пренат Диагн. 2000;20:390–394. doi: 10.1002/(SICI)1097-0223(200005)20:5<390::AID-PD824>3.0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]47. Боррелл А., Казальс Э., Фортуни А., Фарре М.Т., Гонсе А., Санчес А. и др. Скрининг первого триместра на трисомию 21, сочетающий биохимию и ультразвук в индивидуально оптимальных сроках беременности: интервенционное исследование. Пренат Диагн.2004; 24: 541–545. doi: 10.1002/pd.949. [PubMed] [CrossRef] [Google Scholar]48. Каган К.О., Райт Д., Бейкер А., Сахота Д., Николаидес К.Х. Скрининг трисомии 21 по возрасту матери, толщине воротникового пространства плода, свободному бета-человеческому хорионическому гонадотропину и ассоциированному с беременностью плазменному белку-А. УЗИ Акушерство Гинекол. 2008; 31: 618–24. [ПубМед] 49. Бернд Э., Глаубиц Ральф. Скрининг первого триместра: обзор. J Гистохим Цитохим. 2005;53(3):281–283. doi: 10.1369/jhc.4B6420.2005. [PubMed] [CrossRef] [Google Scholar]
J Гистохим Цитохим. 2005;53(3):281–283. doi: 10.1369/jhc.4B6420.2005. [PubMed] [CrossRef] [Google Scholar]Скрининг материнской сыворотки в первом триместре беременности с использованием биохимических маркеров PAPP-A и свободного β-ХГЧ для выявления синдрома Дауна, синдрома Патау и синдрома Эдварда
Indian J Clin Biochem.2013 январь; 28(1): 3–12.
, , , , иС. Шифа
SRL Diagnostics, Fortis Healthcare Enterprise, Unit4, A0 Razi 6. Clinical Biochemist, A0 Razi 6. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
M. Amargandhi
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
J.Bhupendra
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
S.
 Moulali
MoulaliSRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
T. Kristine
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
Автор, ответственный за переписку.Поступила в редакцию 8 июля 2012 г.; Принято 30 сентября 2012 г.
Авторские права © Ассоциация клинических биохимиков Индии, 2012 г. Эта статья цитировалась другими статьями в PMC.Abstract
Программа скрининга в первом триместре предлагает неинвазивный метод раннего выявления анеуплоидии беременных.Этот скрининг проводится с помощью комбинации двух биохимических маркеров, т.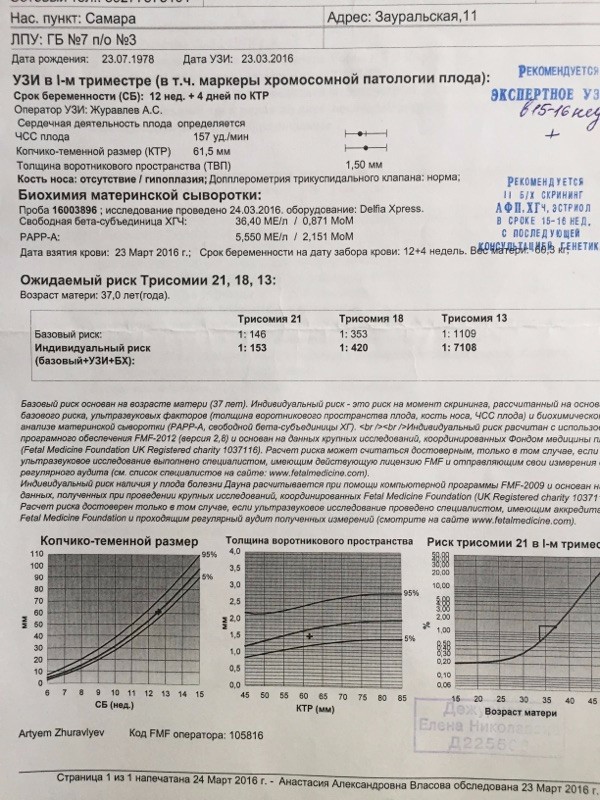 е. свободного β-хорионического гонадотропина человека в сыворотке (свободный β-ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-A), возраста матери и толщины воротникового пространства плода (NT) в возрасте 11 + лет. 0–13 + 6 недель беременности. Полезным последствием скрининга является ранняя диагностика трисомий 21, 18 и 13. В 11 + 0–13 + 6 недель относительная распространенность трисомий 18 и 13 по сравнению с трисомией 21 составляет один к трем и один к семи, соответственно.Все три трисомии связаны с увеличением возраста матери, увеличением NT плода и снижением РАРР-А, но при трисомии 21 уровень свободного β-ХГЧ в сыворотке повышен, тогда как при трисомиях 18 и 13 уровень свободного β-ХГЧ снижен.
е. свободного β-хорионического гонадотропина человека в сыворотке (свободный β-ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-A), возраста матери и толщины воротникового пространства плода (NT) в возрасте 11 + лет. 0–13 + 6 недель беременности. Полезным последствием скрининга является ранняя диагностика трисомий 21, 18 и 13. В 11 + 0–13 + 6 недель относительная распространенность трисомий 18 и 13 по сравнению с трисомией 21 составляет один к трем и один к семи, соответственно.Все три трисомии связаны с увеличением возраста матери, увеличением NT плода и снижением РАРР-А, но при трисомии 21 уровень свободного β-ХГЧ в сыворотке повышен, тогда как при трисомиях 18 и 13 уровень свободного β-ХГЧ снижен.
Ключевые слова: РАРР-А, Свободный β-ХГЧ, Затылочная прозрачность, Синдром Дауна, Синдром Патау, Синдром Эдвардса во многих странах.Недавний интерес к пренатальному скринингу трисомий был сосредоточен на первом триместре. Было показано, что из исследованных биохимических маркеров только материнский свободный от сыворотки β-хорионический гонадотропин человека (свободный β-ХГЧ) и ассоциированный с беременностью белок плазмы-А (РАРР-А) имеют значение. Целью программ скрининга материнской сыворотки в первом триместре является выявление женщин с повышенным риском рождения ребенка с дефектами синдрома Дауна, синдрома Патау и синдрома Эдвардса, а также тех, кому будет полезно тестирование.
Целью программ скрининга материнской сыворотки в первом триместре является выявление женщин с повышенным риском рождения ребенка с дефектами синдрома Дауна, синдрома Патау и синдрома Эдвардса, а также тех, кому будет полезно тестирование.
Связь между увеличением возраста матери [1] и повышенным риском трисомии 21 (таблица ) хорошо известна, и беременным женщинам старше 35 лет на момент родов обычно предлагается инвазивное пренатальное диагностическое тестирование. Наиболее часто используемым тестом для генетической диагностики является амниоцентез, но частота спонтанных потерь плода, связанных с амниоцентезом, составляет в среднем около одной на каждые 200 [2] процедур. Из-за этого риска анализ сывороточных аналитов стал важным неинвазивным первым шагом в выявлении пациентов с риском врожденных аномалий.
Таблица 1
Таблица 1
Распространенность трисомии 21 по возрасту матери и гестационным возрастом
| Материн (лет) | Гестационный возраст (недели) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 10 | 12 | 14 | 16 | 20 | 40 | ||||||
| 20 | 1: 983 | 1: 1 0684 | 1: 1 140084 | 1: 1 1200 | 1: 1 200 | 1: 1,295 | 1: 1 527 | ||||
| 25 | 1: 870 | 1: 946 | 1: 1,009 | 1: 1 062 | 1: 1,147 | 1: 1,352 | 1: 1,352 | ||||
| 30 | 1: 576 | 1: 626 | 1: 668 | 1: 703 | 1: 759 | 1: 895 | |||||
| 31 | 1: 500 | 1: 583 | 1: 580 | 1: 610 | 1: 658 | 1: 776 | |||||
| 32 | 1:424 | 1:461 | 1:492 | 9 0083 1: 5181: 559 | 1: 659 | ||||||
| 33 | 1: 332 | 1: 383 | 1: 383 | 1: 409 | 1: 430 | 1: 464 | 1: 547 | ||||
| 34 | 34 | 1: 287 | 1: 312 | 1: 312 | 1: 333 | 1: 350 | 1: 350 | 1: 378 | 1: 446 | ||
| 35 | 1: 229 | 1: 249 | 1: 266 | 1: 280 | 1: 302 | 1: 302 | 1: 302 | ||||
| 36 | 1: 180 | 1: 196 | 1: 209 | 1: 220 | 1: 238 | 1: 280 | |||||
| 37 | 1: 140 | 1: 140 | 1: 152 | 1: 163 | 1: 171 | 1: 171 | 1: 185 | 1: 218 | |||
| 38 | 1: 108 | 1: 117 | 1: 125 | 1: 131 | 1: 142 | 1: 142 | 1: 167 | ||||
| 39 | 1:82 | 1:89 | 1:95 900 84 | 1: 100 | 1: 108 | 1: 128 | 1: 128 | ||||
| 40 | 1:62 | 1:68 | 1:72 | 1:72 | 1:76 | 1:82 | 1:97 | ||||
| 41 | 1:47 | 1:51 | 1:51 | 1:54 | 1:57 | 1:57 | 1:62 | 1:73 | |||
| 42 | 1:35 | 1:38 | 1:41 | 1:43 | 1:43 | 1:46 | 1:55 | ||||
| 43 | 1:26 | 1:29 | 1:30 | 1:32 | 1:35 | 1:41 | 1:41 | ||||
| 44 | 1:20 | 1:21 | 1:21 | 1:23 | 1:24 | 1:26 | 1:30 | ||||
| 45 | 1:15 | 1:16 | 1:17 | 1:18 | 1:19 | 1:23 | |||||
Текущие исследования, проведенные в первом триместре беременности, показали, что двойной маркерный тест помогает выявить 90 % женщин с риском развития синдрома Дауна, 94 % всех основных хромосомных дефектов, таких как синдром Патау, синдром Эдвардса, триплоидия и синдром Тернера, и 60 % других хромосомных дефектов, таких как делеции, частичные трисомии , несбалансированные транслокации и анеуплоидии половых хромосом, отличные от тернеров [3]. Некоторые из преимуществ биохимического скрининга в первом триместре по сравнению с биохимическим скринингом во втором триместре включают предоставление клиницистам и пациентам существенного преимущества более ранней диагностики, более высоких показателей выявления синдрома Дауна у плода, т.е. 90 % [4] или даже выше, по сравнению с 80 % для квадро-теста второго триместра [5, 6] и 70 % для более раннего тройного скрининг-теста [7], и обнаружение большинства серьезных хромосомных аномалий, кроме трисомии 21. также выступает в качестве неспецифического маркера других врожденных дефектов, включая некоторые серьезные пороки сердца и синдромальные состояния.Он может обнаружить ряд основных структурных врожденных дефектов, связанных с нормальными хромосомами.
Некоторые из преимуществ биохимического скрининга в первом триместре по сравнению с биохимическим скринингом во втором триместре включают предоставление клиницистам и пациентам существенного преимущества более ранней диагностики, более высоких показателей выявления синдрома Дауна у плода, т.е. 90 % [4] или даже выше, по сравнению с 80 % для квадро-теста второго триместра [5, 6] и 70 % для более раннего тройного скрининг-теста [7], и обнаружение большинства серьезных хромосомных аномалий, кроме трисомии 21. также выступает в качестве неспецифического маркера других врожденных дефектов, включая некоторые серьезные пороки сердца и синдромальные состояния.Он может обнаружить ряд основных структурных врожденных дефектов, связанных с нормальными хромосомами.
Скрининг материнской сыворотки имеет некоторые ограничения. Одним из недостатков является то, что для обнаружения дефекта нервной трубки потребуется либо отдельный тест на АФП через 15 недель, либо опора на сканирование аномалий плода в 18–22 недель, также известное как морфологическое сканирование. Другим недостатком является то, что ранний скрининг предпочтительно выявляет те хромосомные аномалии беременности, которые обречены на выкидыш. Приблизительно 30 % пораженных плодов погибают в период между 12 недельами беременности и сроком [1].Таким образом, женщины без необходимости вынуждены принимать решение о прерывании беременности, которая грозит выкидышем. Следует помнить, что тест на двойные маркеры является лишь скрининговым тестом, который дает риск генетического нарушения, но не диагноз.
Другим недостатком является то, что ранний скрининг предпочтительно выявляет те хромосомные аномалии беременности, которые обречены на выкидыш. Приблизительно 30 % пораженных плодов погибают в период между 12 недельами беременности и сроком [1].Таким образом, женщины без необходимости вынуждены принимать решение о прерывании беременности, которая грозит выкидышем. Следует помнить, что тест на двойные маркеры является лишь скрининговым тестом, который дает риск генетического нарушения, но не диагноз.
Комбинированный скрининг в первом триместре беременности
Скрининг в первом триместре проводится между 10 и 14 неделями беременности (рис. ). Маркеры, используемые для расчета риска, представляют собой 2 сывороточных маркера: РАРР-А и свободный β-ХГЧ). Снижение уровня РАРР-А до 14-й недели беременности связано с повышенным риском синдрома Дауна и трисомии 18.В то время как повышенный уровень ХГЧ связан с повышенным риском синдрома Дауна. Третьим маркером является прозрачность воротникового пространства плода (NT, область, содержащая жидкость за шеей плода), которую определяют с помощью ультразвука.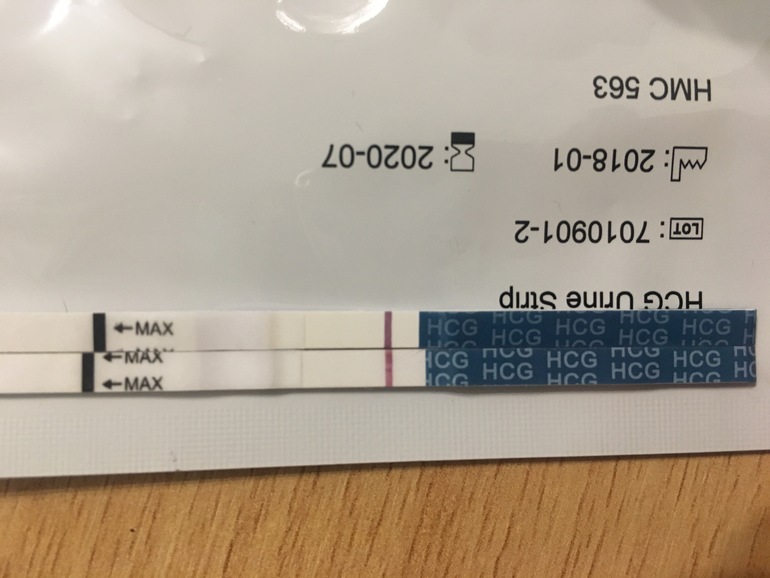 Измерение воротникового пространства должно выполняться опытными сонографистами в период между 10 и 13 неделями и 6 днями беременности. Большинство плодов с синдромом Дауна имеют повышенное значение NT по сравнению с нормальными плодами того же гестационного возраста.
Измерение воротникового пространства должно выполняться опытными сонографистами в период между 10 и 13 неделями и 6 днями беременности. Большинство плодов с синдромом Дауна имеют повышенное значение NT по сравнению с нормальными плодами того же гестационного возраста.
Скрининг материнской сыворотки в первом триместре
Белки материнской крови в первом триместре Скрининг
Ряд белков в материнском кровотоке был обнаружен во время беременности. Многие из этих белков производятся или модифицируются плацентой. Различия в уровнях некоторых белков наблюдались у пациенток, вынашивающих плод с синдромом Дауна и некоторыми другими хромосомными аномалиями. Обнаружение этих незначительных различий в уровнях белка формирует основу для их использования в протоколах скрининга.Их называют биохимическими маркерами. Определенные образцы биохимических маркеров были связаны с синдромом Дауна плода, а также с другими состояниями. Уровни этих белков изменяются во время беременности, поэтому интерпретация требует знания гестационного возраста. Кроме того, эффективность этих белков зависит от гестационного возраста. Например, различия в уровнях белка могут наблюдаться во втором триместре, но не в первом, в то время как другие белки показывают различия в первом триместре, но не во втором.
Кроме того, эффективность этих белков зависит от гестационного возраста. Например, различия в уровнях белка могут наблюдаться во втором триместре, но не в первом, в то время как другие белки показывают различия в первом триместре, но не во втором.
Материнская сыворотка PAPP-A
PAPP-A — это один из двух маркеров материнской сыворотки, используемых в настоящее время для скрининга в возрасте от 10 до 14 недель. Он продуцируется плацентарным синцитиотрофобластом и децидуальной оболочкой. Он увеличивает биодоступность инсулиноподобного фактора роста, который, в свою очередь, опосредует инвазию трофобласта и модулирует транспорт глюкозы и аминокислот в плаценте. PAPP-A также экспрессируется в гранулезных клетках яичников и в нерепродуктивных тканях, таких как фибробласты, остеобласты и гладкомышечные клетки сосудов.
Химия РАРР-А
РАРР-А представляет собой гликопротеин, первоначально обнаруженный Lin et al. [8] в плазме беременной женщины. Белок секретируется в виде дисульфид-связанного гомодимера (рис.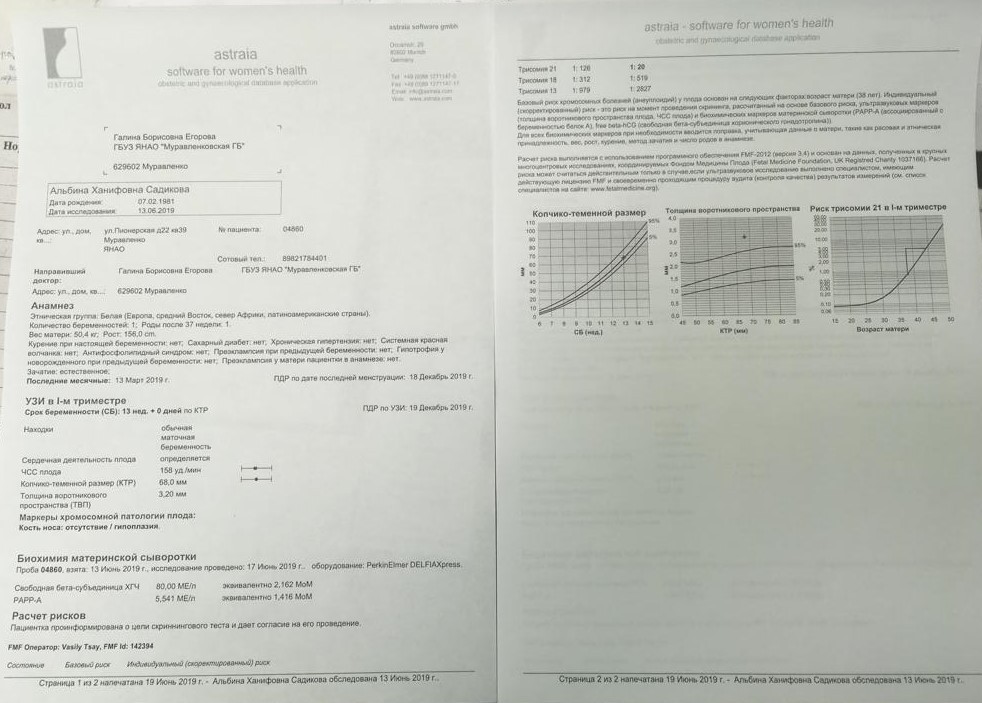 ) с молекулярной массой 400 кДа. Каждая субъединица происходит от препро-PAPP-A, содержащего 1627 белковых остатков [9–11], который процессируется в зрелый PAPP-A из 1547 аминокислотных остатков и 14 предполагаемых сайтов N-гликозилирования [9, 10]. Он секретируется как активная протеаза после внутриклеточного расщепления С-концевой стороны полипептида РАРР-А [9].Это цинксвязывающая металлопротеиназа, принадлежащая к суперсемейству метцинцинов металлопротеиназ [8]. В плазме PAPP-A циркулирует либо в свободной форме, либо в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (proMBP), образуя приблизительно 500 кДа и называемого PAPP-A/proMBP (рис. ) [12, 13]. ProMBP замещен как N-, так и O-связанным углеводом в дополнение к одному фрагменту гепарансульфата, который, как полагают, занимает сайт связывания PAPP-A на поверхности клетки в циркулирующем комплексе PAPP-A/proMBP [14, 15]. .Ген PAPP-A был отнесен к хромосоме 9q33.1 человека, охватывающей более 200 т.
) с молекулярной массой 400 кДа. Каждая субъединица происходит от препро-PAPP-A, содержащего 1627 белковых остатков [9–11], который процессируется в зрелый PAPP-A из 1547 аминокислотных остатков и 14 предполагаемых сайтов N-гликозилирования [9, 10]. Он секретируется как активная протеаза после внутриклеточного расщепления С-концевой стороны полипептида РАРР-А [9].Это цинксвязывающая металлопротеиназа, принадлежащая к суперсемейству метцинцинов металлопротеиназ [8]. В плазме PAPP-A циркулирует либо в свободной форме, либо в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (proMBP), образуя приблизительно 500 кДа и называемого PAPP-A/proMBP (рис. ) [12, 13]. ProMBP замещен как N-, так и O-связанным углеводом в дополнение к одному фрагменту гепарансульфата, который, как полагают, занимает сайт связывания PAPP-A на поверхности клетки в циркулирующем комплексе PAPP-A/proMBP [14, 15]. .Ген PAPP-A был отнесен к хромосоме 9q33.1 человека, охватывающей более 200 т.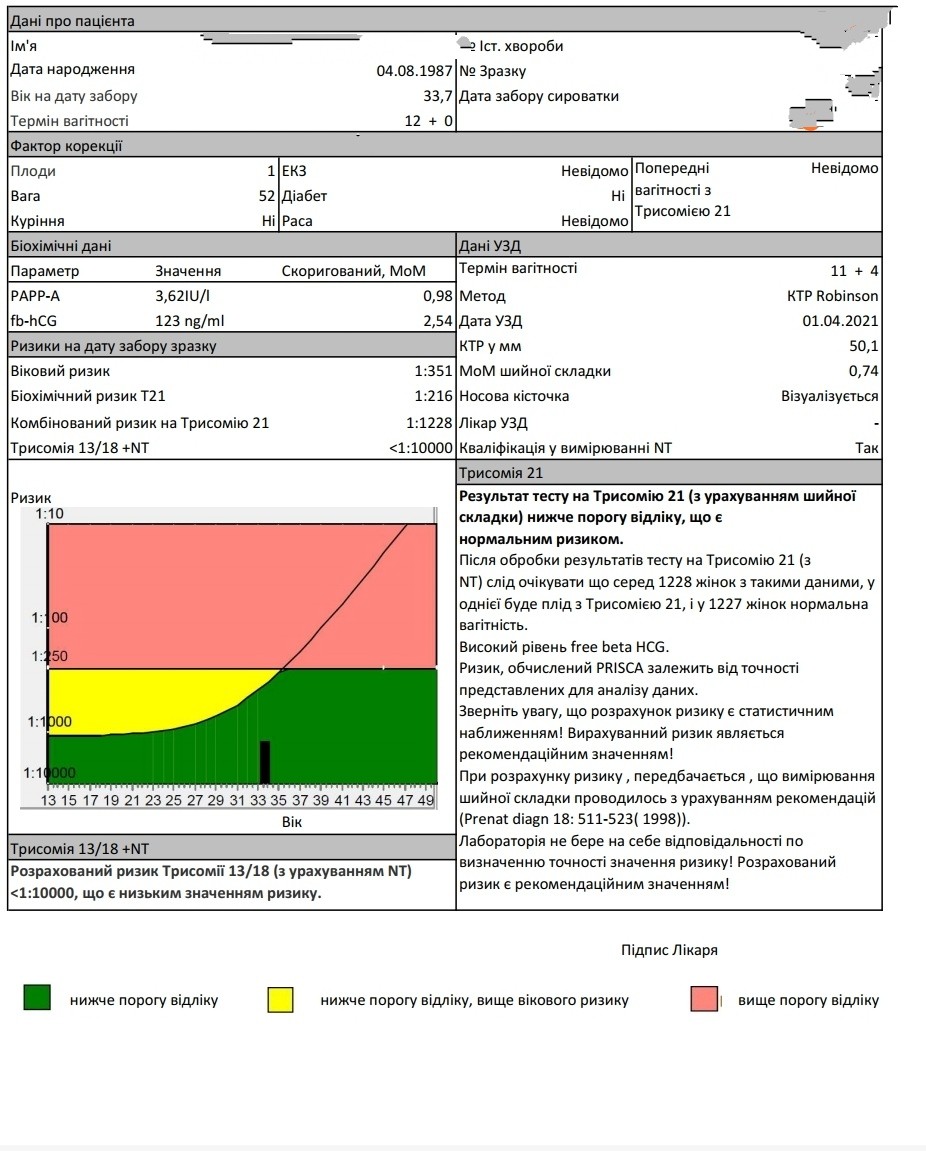 п.н. ДНК, и содержит 22 экзона [13].
п.н. ДНК, и содержит 22 экзона [13].
Ассоциированный с беременностью белок плазмы А или PAPP-A в виде дисульфид-связанного гомодимера в свободной форме и в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (ProMBP), т.е. PAPP-A/ProMBP при беременности
PAPP-A при беременности
Во время беременности как PAPP-A, так и proMBP обильно экспрессируются в плаценте человека, но в разных типах клеток. Большая часть PAPP-A синтезируется в плацентарном синцитиотрофобласте [16], а весь proMBP синтезируется во вневорсинчатых цитотрофобластах [17], откуда он секретируется без расщепления пропептида.Процесс образования комплекса РАРР-А/проМВР происходит во внеклеточном пространстве, вероятно, на поверхности синцитиотрофобласта. При нормальной беременности концентрация РАРР-А в кровотоке матери увеличивается с гестационным возрастом. Его концентрация увеличивается экспоненциально со временем удвоения 3–4 дня в течение первых триместров (рис. ), затем уровень продолжает расти на протяжении всей беременности до родов. Быстрое повышение уровня РАРР-А в течение первого триместра приводит к тому, что интерпретация данного значения сильно зависит от гестационного возраста.Поэтому общепринятой практикой является использование единицы, кратной медиане (МоМ), в качестве зависящего от гестационного возраста выражения концентрации РАРР-А. Средний период полувыведения РАРР-А после нормальных родов составляет 53 ± 26 ч (среднее значение плюс стандартное отклонение) [18]. Концентрации РАРР-А в 100 и 1000 раз ниже в крови плода и в амниотической жидкости соответственно по сравнению с материнской кровью [19].
Быстрое повышение уровня РАРР-А в течение первого триместра приводит к тому, что интерпретация данного значения сильно зависит от гестационного возраста.Поэтому общепринятой практикой является использование единицы, кратной медиане (МоМ), в качестве зависящего от гестационного возраста выражения концентрации РАРР-А. Средний период полувыведения РАРР-А после нормальных родов составляет 53 ± 26 ч (среднее значение плюс стандартное отклонение) [18]. Концентрации РАРР-А в 100 и 1000 раз ниже в крови плода и в амниотической жидкости соответственно по сравнению с материнской кровью [19].
Экспоненциальное повышение РАРР-А в первом триместре нормальной беременности
Около 99 % РАРР-А ковалентно связано в комплексе 2:2 с проформой основного основного белка эозинофилов (proMBP) во время беременности.proMBP функционирует как эндогенный ингибитор протеолитической активности PAPP-A (ингибитор протеазы in vivo), механизм ингибирования которого в настоящее время неизвестен. Субстраты PAPP-A включают белки, связывающие инсулиноподобный фактор роста (IGFBP) 4 и 5, роль которых заключается в ингибировании биологической активности инсулиноподобных факторов роста 1 и 2.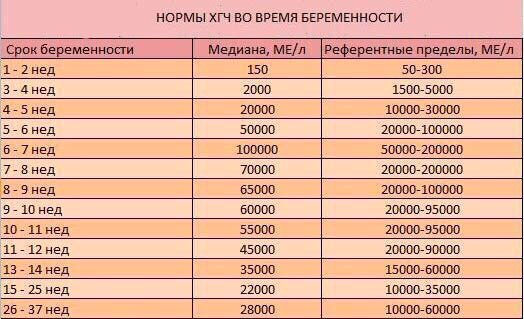 PAPP-A действует как «протеаза» для IGFBPs [20], помогая высвобождению IGF из этих связывающих белков, так что он может свободно взаимодействовать со своим клеточным рецептором аутокринным или паракринным образом (рис.). Считается, что IGF играет важную роль в инвазии трофобласта и, следовательно, в раннем развитии и васкуляризации плаценты и плацентарного ложа.
PAPP-A действует как «протеаза» для IGFBPs [20], помогая высвобождению IGF из этих связывающих белков, так что он может свободно взаимодействовать со своим клеточным рецептором аутокринным или паракринным образом (рис.). Считается, что IGF играет важную роль в инвазии трофобласта и, следовательно, в раннем развитии и васкуляризации плаценты и плацентарного ложа.
Протеолитическая активность РАРР-А у человека. Связь между PAPP-A, IGF и IGFBP-4. a Замещенные гепаринсульфатом рецепторы в клетке-мишени иммобилизуют РАРР-А в положении, близком к рецептору ИФР. Затем PAPP-A отщепляет IGF от IGFBP-4 в непосредственной близости от рецептора IGF. Затем свободный ИФР связывается с рецептором ИФР, индуцируя пролиферацию клеток, инвазию трофобласта, транспорт глюкозы и аминокислот в плаценту. b GAG-цепь ProMBP связывается там с доменом PAPP-A, высвобождая PAPP-A с клеточной поверхности. ProMBP инактивирует протеолитическую активность PAPP-A
Снижение уровня PAPP-A обнаруживается в связи с нарушением функции плаценты, что легло в основу скрининга в первом триместре плода на синдром Дауна [13, 16].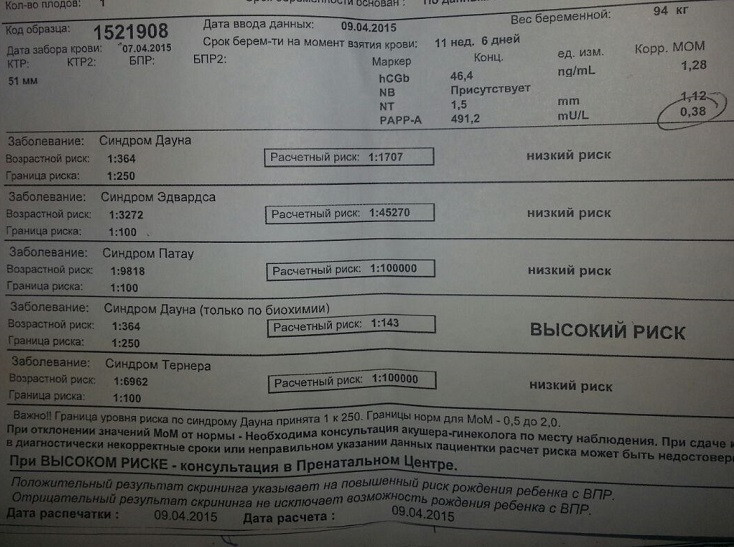 Низкий уровень материнской сыворотки в первом триместре обнаруживается не только при трисомии 21, трисомии 18 и трисомии 13, но и при анеуплоидии плода без синдрома Дауна.Также сообщается, что PAPP-A имеет положительную связь с массой тела при рождении [21]. По мере снижения PAPP-A риск рождения детей с малым весом для гестационного возраста увеличивается. Установлено, что уровни РАРР-А в кровотоке снижаются при внематочной беременности. Некоторые из осложнений, связанных с необъяснимым изолированным низким РАРР-А, включают преждевременные роды, задержку внутриутробного развития, гестационную гипертензию, гестационную гипертензию с протеинурией [22].
Низкий уровень материнской сыворотки в первом триместре обнаруживается не только при трисомии 21, трисомии 18 и трисомии 13, но и при анеуплоидии плода без синдрома Дауна.Также сообщается, что PAPP-A имеет положительную связь с массой тела при рождении [21]. По мере снижения PAPP-A риск рождения детей с малым весом для гестационного возраста увеличивается. Установлено, что уровни РАРР-А в кровотоке снижаются при внематочной беременности. Некоторые из осложнений, связанных с необъяснимым изолированным низким РАРР-А, включают преждевременные роды, задержку внутриутробного развития, гестационную гипертензию, гестационную гипертензию с протеинурией [22].
Исследования показали, что одной из причин самопроизвольного аборта у этих женщин может быть снижение доступности инсулиноподобного фактора роста-II из-за снижения уровня PAPP-A в сыворотке крови [23].Снижение PAPP-A в материнской сыворотке не связано с каким-либо изменением плацентарного синтеза этого белка, поскольку экспрессия мРНК PAPP-A существенно не снижена в плацентах с синдромом Дауна.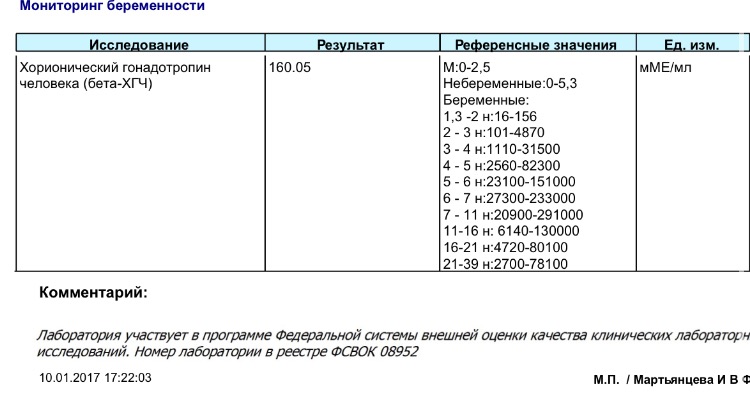 Кроме того, корреляция между уровнями экспрессии РАРР-А в сыворотке и тканях теряется при беременности Дауна. Эти наблюдения предполагают, что снижение PAPP-A в материнской сыворотке является посттрансляционным и может быть вызвано изменением механизмов высвобождения плаценты или модификацией стабильности секретируемого белка [24].Установлено, что РАРР-А значительно выше при беременности двойней. В среднем значения РАРР-А у близнецов в 1,86 раза выше, чем у одноплодных. Значимых акушерских исходов при повышенном РАРР-А в первом триместре не описано [22]. Измеримые уровни были обнаружены у мужчин и небеременных женщин. У небеременных лиц PAPP-A обнаруживается в виде гомодимера 400 кДа.
Кроме того, корреляция между уровнями экспрессии РАРР-А в сыворотке и тканях теряется при беременности Дауна. Эти наблюдения предполагают, что снижение PAPP-A в материнской сыворотке является посттрансляционным и может быть вызвано изменением механизмов высвобождения плаценты или модификацией стабильности секретируемого белка [24].Установлено, что РАРР-А значительно выше при беременности двойней. В среднем значения РАРР-А у близнецов в 1,86 раза выше, чем у одноплодных. Значимых акушерских исходов при повышенном РАРР-А в первом триместре не описано [22]. Измеримые уровни были обнаружены у мужчин и небеременных женщин. У небеременных лиц PAPP-A обнаруживается в виде гомодимера 400 кДа.
Гормон бета-ХГЧ, не содержащий материнской сыворотки
Хорионический гонадотропин человека представляет собой гликопротеиновый гормон с молекулярной массой 39 500 Да, обычно обнаруживаемый в крови и моче только во время беременности.В 1987 г. Богарт и соавт. [25] сообщили о повышенных уровнях ХГЧ в материнской сыворотке при беременности с синдромом Дауна, и с тех пор ХГЧ был введен в большинство программ скрининга. Для инициации и поддержания беременности ХГЧ опосредует множественные функции плаценты, матки и плода. Некоторые из них включают развитие клеток синцитиотрофобласта, митотический рост и дифференцировку эндометрия, локализованное подавление материнской иммунной системы, модуляцию морфологии матки и экспрессии генов, а также координацию сложной передачи сигналов между эндометрием [26].
Для инициации и поддержания беременности ХГЧ опосредует множественные функции плаценты, матки и плода. Некоторые из них включают развитие клеток синцитиотрофобласта, митотический рост и дифференцировку эндометрия, локализованное подавление материнской иммунной системы, модуляцию морфологии матки и экспрессии генов, а также координацию сложной передачи сигналов между эндометрием [26].
Химия
Хорионический гонадотропин человека состоит из двух нековалентно связанных субъединиц, α и β, и вырабатывается клетками синцитиотрофобласта плаценты. ХГЧ имеет одну β-субъединицу, которая содержит 145 аминокислот, связанных шестью дисульфидными мостиками, и α-субъединицу, содержащую 92 аминокислоты, связанные 5 дисульфидными мостиками, которая также является общей для трех других гликопротеиновых гормонов: ЛГ, ФСГ и ТТГ. β-субъединица уникальна и отличает ХГЧ от других гликопротеиновых гормонов (рис.). Он содержит две N-связанные боковые цепи олигосахаридов, присоединенные к остаткам 13 и 30 [27]. Он также имеет четыре О-связанных олигосахаридных звена, расположенных на уникальном С-концевом участке, богатом пролином и серином (остатки 122–145). α-субъединица имеет две N-связанные олигосахаридные боковые цепи, присоединенные к аминокислотным остаткам 52 и 78 [27]. В материнской сыворотке присутствуют пять родственных ХГЧ молекул: ХГЧ без разрыва, который представляет собой активный гормон; порезанный ХГЧ; свободная α-субъединица; свободная β-субъединица; и свободная от разрыва субъединица β [28].Свободная β-субъединица может образовываться из трех источников: прямой продукции клеток трофобласта, диссоциации ХГЧ на свободные α- и свободные β-субъединицы, а также ферментов макрофагов или нейтрофилов, разрывающих молекулу ХГЧ [29]. Свободный β-ХГЧ, циркулирующий в материнской сыворотке, составляет всего около 0,3–4 % от общего количества ХГЧ [29]. Один ген на хромосоме 6 кодирует субъединицу α всех четырех гликопротеиновых гормонов (ТТГ, ЛГ, ФСГ и ХГ). Хромосома 19 содержит семейство генов, кодирующих субъединицу CGβ [29].
Он также имеет четыре О-связанных олигосахаридных звена, расположенных на уникальном С-концевом участке, богатом пролином и серином (остатки 122–145). α-субъединица имеет две N-связанные олигосахаридные боковые цепи, присоединенные к аминокислотным остаткам 52 и 78 [27]. В материнской сыворотке присутствуют пять родственных ХГЧ молекул: ХГЧ без разрыва, который представляет собой активный гормон; порезанный ХГЧ; свободная α-субъединица; свободная β-субъединица; и свободная от разрыва субъединица β [28].Свободная β-субъединица может образовываться из трех источников: прямой продукции клеток трофобласта, диссоциации ХГЧ на свободные α- и свободные β-субъединицы, а также ферментов макрофагов или нейтрофилов, разрывающих молекулу ХГЧ [29]. Свободный β-ХГЧ, циркулирующий в материнской сыворотке, составляет всего около 0,3–4 % от общего количества ХГЧ [29]. Один ген на хромосоме 6 кодирует субъединицу α всех четырех гликопротеиновых гормонов (ТТГ, ЛГ, ФСГ и ХГ). Хромосома 19 содержит семейство генов, кодирующих субъединицу CGβ [29].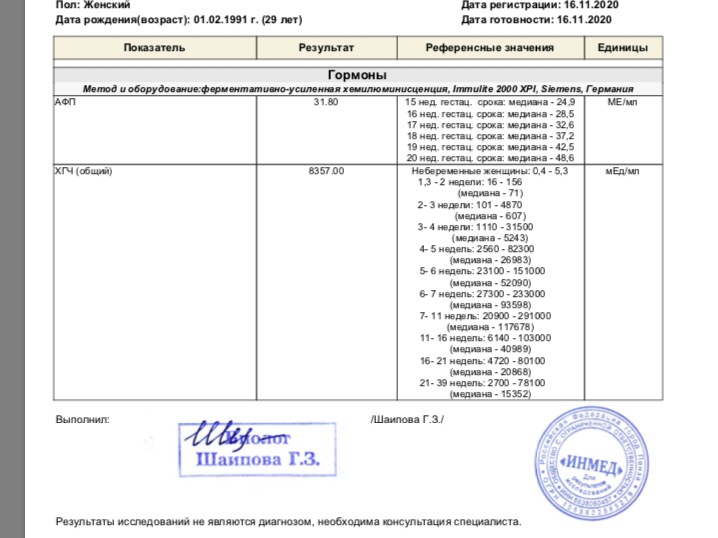 С каждого транскрибируются отдельные матричные РНК (мРНК). Субъединицы спонтанно объединяются в шероховатой эндоплазматической сети и затем непрерывно секретируются в материнский кровоток.
С каждого транскрибируются отдельные матричные РНК (мРНК). Субъединицы спонтанно объединяются в шероховатой эндоплазматической сети и затем непрерывно секретируются в материнский кровоток.
Структура интактного ХГЧ и ХГЧβ
Свободный β-ХГЧ при беременности
ХГЧ в материнской сыворотке достигает максимума на 8–10 неделях, а затем снижается, достигая плато на 18–20 неделях (рис. ) беременности, и остается довольно постоянным до тех пор, пока срок. β-ХГЧ не обладает активностью ХГЧ, но несколько направлений исследований показывают, что он оказывает ростостимулирующее действие.Было высказано предположение, что β-ХГЧ препятствует ингибирующему рост эффекту трансформирующего фактора роста β, фактора роста тромбоцитов-В и фактора роста нервов [30]. Период полувыведения введенного ХГЧ является двухфазным; период полураспада быстрой фазы составляет 5–6 часов, тогда как период более медленной фазы составляет 24–33 часа. Период полувыведения очищенного β-ХГЧ, введенного человеку, составляет 0,7 и 10 ч, что короче, чем у ХГЧ. Однако после доношенной беременности или аборта β-ХГЧ фактически исчезает медленнее, чем ХГЧ.Таким образом, доля β-ХГЧ в общей иммунореактивности ХГЧ увеличивается с 0,8 % в сроке до 27 % через 3 недели. Молекулярно-биологические исследования показали, что трофобласты с трисомией 21 показывают заметное увеличение мРНК β-ХГЧ и меньшее увеличение мРНК α-ХГЧ, что позволяет предположить, что одной из причин высоких уровней ХГЧ в материнской сыворотке является повышенная продукция и секреция ХГЧ плацента [31]. Эти наблюдения подтверждаются относительной незрелостью плаценты, которая продолжает выделять большое количество ХГЧ, как и в первом триместре [32].
Однако после доношенной беременности или аборта β-ХГЧ фактически исчезает медленнее, чем ХГЧ.Таким образом, доля β-ХГЧ в общей иммунореактивности ХГЧ увеличивается с 0,8 % в сроке до 27 % через 3 недели. Молекулярно-биологические исследования показали, что трофобласты с трисомией 21 показывают заметное увеличение мРНК β-ХГЧ и меньшее увеличение мРНК α-ХГЧ, что позволяет предположить, что одной из причин высоких уровней ХГЧ в материнской сыворотке является повышенная продукция и секреция ХГЧ плацента [31]. Эти наблюдения подтверждаются относительной незрелостью плаценты, которая продолжает выделять большое количество ХГЧ, как и в первом триместре [32].
Общий ХГЧ и свободный бета-ХГЧ в первом триместре беременности
Методы измерения РАРР-А и свободного β-ХГЧ
Новая технология биохимического анализа, обеспечивающая автоматизированное, точное и репродуктивное измерение в короткие сроки после получения Образец крови позволяет комбинировать биохимическое и ультразвуковое исследование для ранней оценки, чтобы снизить нагрузку на пациентов.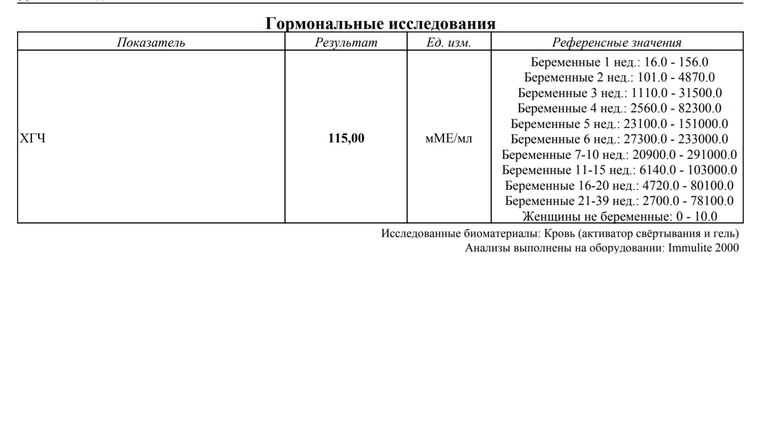 Необходимо выделение сыворотки для скрининга синдрома Дауна через 4 ч после отмены.Охлаждение во время любого хранения, включая транспортировку, настоятельно рекомендуется, так как преаналитическая фаза оказывает большое влияние на анализ.
Необходимо выделение сыворотки для скрининга синдрома Дауна через 4 ч после отмены.Охлаждение во время любого хранения, включая транспортировку, настоятельно рекомендуется, так как преаналитическая фаза оказывает большое влияние на анализ.
Образцы сыворотки на свободный β-ХГЧ и РАРР-А стабильны при 4 °C для цельной крови или отделенной сыворотки в течение 1 недели. Надежные результаты получаются при хранении отделенных образцов сыворотки при температуре 20°С до 2 суток и 1 суток для цельной крови. При 30 °C надежные результаты были получены только в том случае, если образцы были проанализированы в течение 2 ч сбора.
В цельной крови уровни свободного β-ХГЧ увеличивались быстрее по сравнению с сывороткой, особенно при 30 °C [33].В нескольких исследованиях сообщалось, что высокая температура хранения и длительный интервал между сбором и анализом образца приводят к увеличению концентрации свободного β-ХГЧ, поскольку он высвобождается при диссоциации или деградации интактного ХГЧ [34]. Сообщалось, что в цельной крови, хранившейся при комнатной температуре, средняя концентрация свободного β-ХГЧ в сыворотке увеличивалась на 10–15 % через 24 часа, примерно на 25 % через 3 дня и на 45 % через 4 дня [34]. Другое исследование показало, что уровни PAPP-A в сыворотке стабильны в течение 142 дней при 2–8°, 37 дней при комнатной температуре и 20 дней при 30 °C.Существенных изменений ни для одного из аналитов не наблюдалось после хранения при температуре -20 °C до 240 дней или после шести повторных циклов замораживания-оттаивания [33]. В настоящее время практически все коммерческие анализы основаны на технологии хемилюминесцентной амплификации ферментами. Материнская сыворотка PAPP-A и свободный β-hCG также могут быть измерены с использованием анализатора иммунологического анализа случайного доступа с использованием технологии эмиссии амплифицированного криптата с временным разрешением.
Сообщалось, что в цельной крови, хранившейся при комнатной температуре, средняя концентрация свободного β-ХГЧ в сыворотке увеличивалась на 10–15 % через 24 часа, примерно на 25 % через 3 дня и на 45 % через 4 дня [34]. Другое исследование показало, что уровни PAPP-A в сыворотке стабильны в течение 142 дней при 2–8°, 37 дней при комнатной температуре и 20 дней при 30 °C.Существенных изменений ни для одного из аналитов не наблюдалось после хранения при температуре -20 °C до 240 дней или после шести повторных циклов замораживания-оттаивания [33]. В настоящее время практически все коммерческие анализы основаны на технологии хемилюминесцентной амплификации ферментами. Материнская сыворотка PAPP-A и свободный β-hCG также могут быть измерены с использованием анализатора иммунологического анализа случайного доступа с использованием технологии эмиссии амплифицированного криптата с временным разрешением.
Nuchal Translucency
Наиболее важным ультразвуковым маркером при скрининге хромосомных аномалий в первом триместре является измерение толщины NT между 10 и 14 неделями беременности, о котором впервые сообщили Schulte-Valentine и Schindler в 1992 году [35].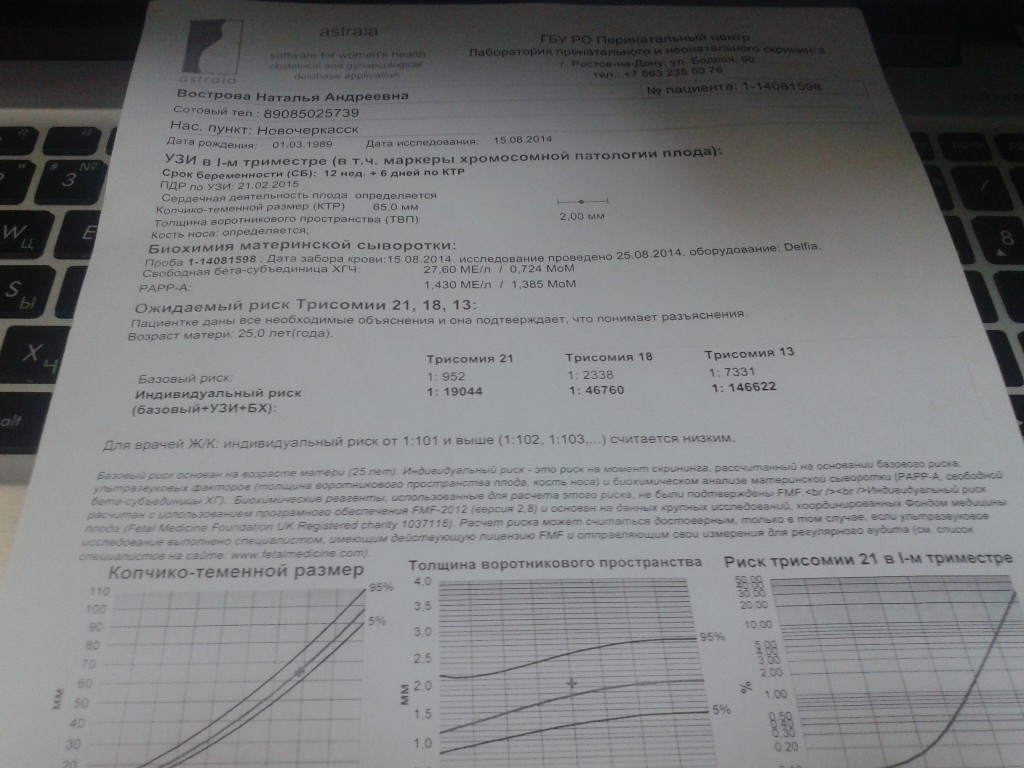 NT измеряет заполненное подкожной жидкостью пространство между задней частью позвоночника и кожей шеи плода (рис. ). NT увеличивается с гестационным возрастом примерно на 17 % в неделю. Полупрозрачная область исчезает после 14 недель гестационного возраста, когда подкожная клетчатка становится более эхогенной. Таким образом, НТ является преходящим явлением [36]. Используя только измерение NT и возраст матери, можно определить 81% (таблица) пораженных беременностей с частотой ложноположительных результатов 5% [37]. Измерение воротникового пространства должно выполняться опытными специалистами по УЗИ и должно быть получено между 10 и 13 неделями 6 дней беременности, что эквивалентно длине темени-крестца от 38 до 84 мм.NT можно обнаружить у 99 % плодов в конце первого триместра. 50-й процентиль NT увеличивается с 1,2 мм на неделе 11 + 0 (длина темени-крестца 45 мм) до 1,5 мм на неделе 13 + 6 (длина темени-крестца 82 мм). 95-й процентиль колеблется от 2 мм на 11-й неделе до 2,6 мм на 13 + 6 неделе.
NT измеряет заполненное подкожной жидкостью пространство между задней частью позвоночника и кожей шеи плода (рис. ). NT увеличивается с гестационным возрастом примерно на 17 % в неделю. Полупрозрачная область исчезает после 14 недель гестационного возраста, когда подкожная клетчатка становится более эхогенной. Таким образом, НТ является преходящим явлением [36]. Используя только измерение NT и возраст матери, можно определить 81% (таблица) пораженных беременностей с частотой ложноположительных результатов 5% [37]. Измерение воротникового пространства должно выполняться опытными специалистами по УЗИ и должно быть получено между 10 и 13 неделями 6 дней беременности, что эквивалентно длине темени-крестца от 38 до 84 мм.NT можно обнаружить у 99 % плодов в конце первого триместра. 50-й процентиль NT увеличивается с 1,2 мм на неделе 11 + 0 (длина темени-крестца 45 мм) до 1,5 мм на неделе 13 + 6 (длина темени-крестца 82 мм). 95-й процентиль колеблется от 2 мм на 11-й неделе до 2,6 мм на 13 + 6 неделе.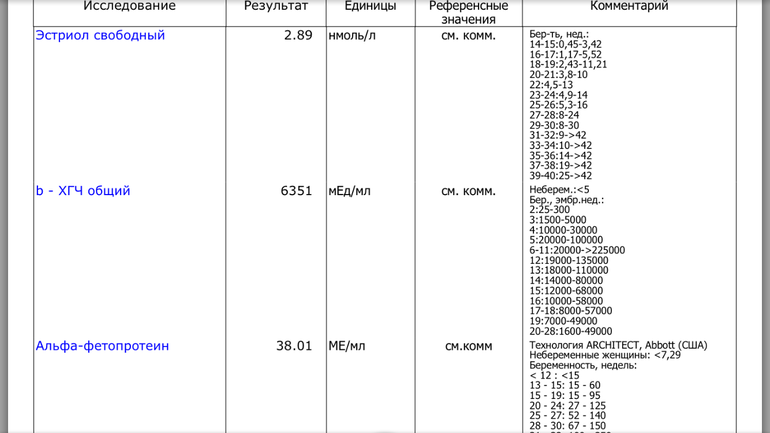 У большинства плодов с синдромом Дауна NT увеличивается по сравнению с нормальными плодами того же гестационного возраста. Кроме того, увеличение NT связано с сужением перешейка аорты, сердечно-сосудистыми дефектами, которые вызывают гиперперфузию головы и шеи, или аномальным/задержкой развития лимфатической системы [38, 39].Повышенное значение NT также может быть связано с невынашиванием беременности [36, 40] и аномальными кариотипами [41].
У большинства плодов с синдромом Дауна NT увеличивается по сравнению с нормальными плодами того же гестационного возраста. Кроме того, увеличение NT связано с сужением перешейка аорты, сердечно-сосудистыми дефектами, которые вызывают гиперперфузию головы и шеи, или аномальным/задержкой развития лимфатической системы [38, 39].Повышенное значение NT также может быть связано с невынашиванием беременности [36, 40] и аномальными кариотипами [41].
NUCHAL Измерение прозрачности
Таблица 2
Таблица обнаружения 2
Уровень обнаружения Трисомии 21, 18 и 13 для данной ложной положительной скорости (FPR)
Скаривание| Трисомия 21 | Трисомия 18 | FPR: 0,5% Трисомия 13 | FPR: 0,5% |
|---|---|---|---|
| Maternal Age (MA) и FETAL NT | 81 | 68 | 61 |
| мА и сыворотки бесплатно β-HCG и PAPP-A | 67 | 80 | 59 | 59
| MA, NT и сыворотка β-HCG и PAPP-A | 91 | 97 | 84 |
Устойчивый к пациенту Риск хромосомной аномалии
некоторый риск того, что ее плод может быть затронут хромосомным дефектом. Чтобы рассчитать этот индивидуальный риск, необходимо сначала принять во внимание априорный риск женщины, исходя из ее возраста и срока беременности (таблица). Затем этот априорный риск умножается на отношение правдоподобия, рассчитанное на основании данных УЗИ и/или результатов биохимии сыворотки, полученных во время текущей беременности. Произведение априорного риска и отношения правдоподобия дает специфический риск пациента.
Чтобы рассчитать этот индивидуальный риск, необходимо сначала принять во внимание априорный риск женщины, исходя из ее возраста и срока беременности (таблица). Затем этот априорный риск умножается на отношение правдоподобия, рассчитанное на основании данных УЗИ и/или результатов биохимии сыворотки, полученных во время текущей беременности. Произведение априорного риска и отношения правдоподобия дает специфический риск пациента.
Кратность медианы (МоМ)
При скрининге с использованием биохимических маркеров материнской сыворотки измеренная концентрация маркеров преобразуется в МоМ незатронутых беременностей при той же беременности.Это сделано для того, чтобы учесть тот факт, что уровни маркеров варьируются в зависимости от гестационного возраста. Значения MoM рассчитываются путем деления индивидуального уровня маркера на средний уровень этого маркера для всей популяции в этом гестационном возрасте в этой лаборатории. Использование значений MoM, а не абсолютных уровней, также позволяет последовательно интерпретировать результаты из разных лабораторий.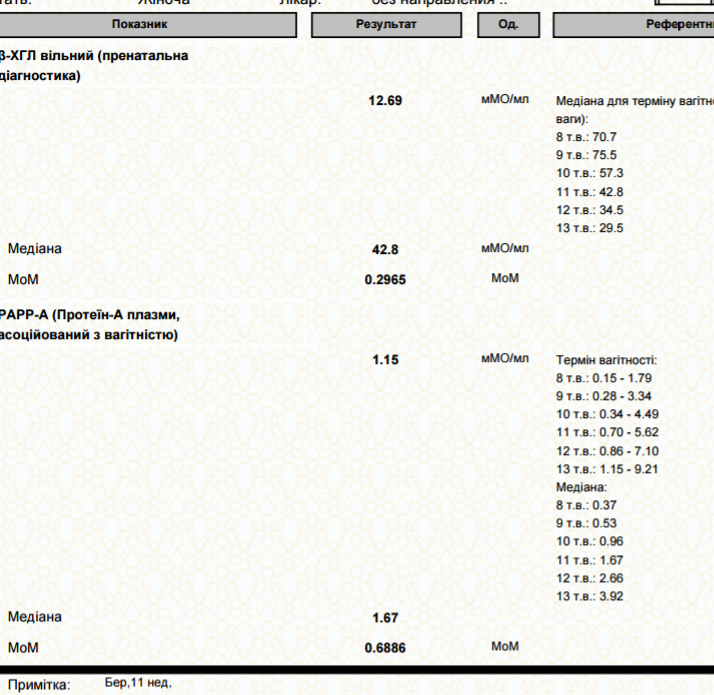 При эуплоидной беременности среднее скорректированное значение как для свободного β-ХГЧ, так и для РАРР-А составляет 1,0 МоМ при всех сроках беременности. В исследовании, проведенном Spencer et al.[42] при изменении уровней биохимических маркеров первого триместра у женщин азиатского происхождения (индианка, Пакистан, Бангладеш) по сравнению с женщиной европеоидной расы (контрольная группа) было обнаружено, что в азиатской популяции медиана PAPP-A была увеличена на 9 %, а свободный β- ХГЧ на 6 % от контрольной группы (таблица ). Было обнаружено, что азиатское население на 6,9 кг легче, чем европейская женщина. При трисомиях наблюдаются низкие значения РАРР-А, которые обычно составляют 0,15 МоМ для трисомии 21, то есть синдрома Дауна; 0,25 МоМ для трисомии 13 или синдрома Патау; 0.18 МоМ для трисомии 18 или синдрома Эдвардса; и 0,49 для синдрома Тернера (таблица).
При эуплоидной беременности среднее скорректированное значение как для свободного β-ХГЧ, так и для РАРР-А составляет 1,0 МоМ при всех сроках беременности. В исследовании, проведенном Spencer et al.[42] при изменении уровней биохимических маркеров первого триместра у женщин азиатского происхождения (индианка, Пакистан, Бангладеш) по сравнению с женщиной европеоидной расы (контрольная группа) было обнаружено, что в азиатской популяции медиана PAPP-A была увеличена на 9 %, а свободный β- ХГЧ на 6 % от контрольной группы (таблица ). Было обнаружено, что азиатское население на 6,9 кг легче, чем европейская женщина. При трисомиях наблюдаются низкие значения РАРР-А, которые обычно составляют 0,15 МоМ для трисомии 21, то есть синдрома Дауна; 0,25 МоМ для трисомии 13 или синдрома Патау; 0.18 МоМ для трисомии 18 или синдрома Эдвардса; и 0,49 для синдрома Тернера (таблица).
Таблица 3
Таблица 3
Вариация в первом триместре биохимические уровни маркера в азиатских женщинах по сравнению с кавказской женщиной
| маркер (мама) | 4 Caucasian4 индийцы||||
|---|---|---|---|---|
| не веса корреляции | корреляция веса | корреляция веса | ||
| свободный β-ХГЧ | 1.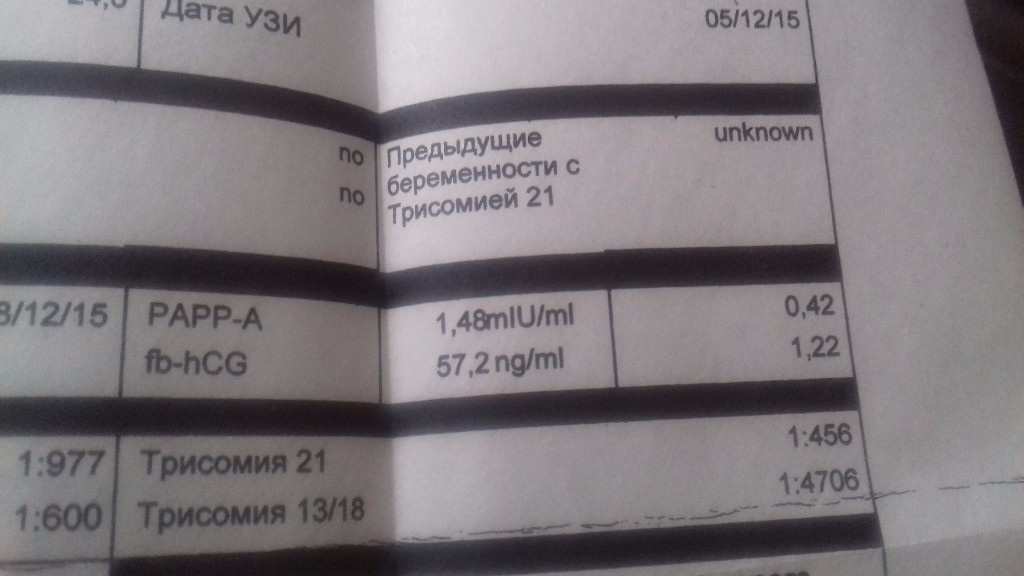 53 53 | +1,038 | 1,002 | 0,925 |
| РАРР-А | 1,032 | 1,029 | 1,187 | 1,082 |
Таблица 4
шаблон Маркер в нескольких срединных и обнаружения скоростей в различных анеуплоидий
| Aneuploidy | NT | Свободный β-HCG | PAPP-A | Уровень обнаружения (%) | |
|---|---|---|---|---|---|
| Трисомия 21 | 2. 67 MOM 67 MOM | 215 MOM | 0.15 MOM | ||
| TRISOMY 13 | 0.50 MAM | 0,25 мама | |||
| Трисомия 18 | 3,27 мама | 0,28 мама | 0,18 Мама | ||
| 45, | 4,76 мама | 1.11 Мама | 0,11 мама | 0,49 мама | 0,49 |
| Triploidy Maternal | 0. 88 MOM 88 MOM | 0.18 MOM | 0,06 MOM | 0.06 MOM | |
| Triploidy Paternal | 2,76 мама | 8.04 MOM | 0,75 мама | 0,75 мама |
Лаборатория использует различную математическую модель для расчета риск женщины родить ребенка с синдромом Дауна, трисомией 18 и трисомией 13. Некоторые из математических моделей включают Prisca, Viewpoint, Astria и т. д. Эти математические модели учитывают возраст матери, уровни различных биохимических маркеров в сыворотке и данные УЗИ плода. измерения.Кроме того, ряд факторов играет важную роль в расчете риска, поскольку они будут влиять на значения биохимических анализов материнской сыворотки. Это включает в себя гестационный возраст, вес, расу, курение, диабетический статус человека, количество присутствующих плодов и использовалось ли лечение ЭКО для зачатия. В некоторых редких случаях, таких как расчеты риска анеуплоидии при беременности донора яйцеклетки, использование возраста донора яйцеклетки вместо возраста реципиента снижает частоту ложноположительных результатов и повышает эффективность скрининга.
Это включает в себя гестационный возраст, вес, расу, курение, диабетический статус человека, количество присутствующих плодов и использовалось ли лечение ЭКО для зачатия. В некоторых редких случаях, таких как расчеты риска анеуплоидии при беременности донора яйцеклетки, использование возраста донора яйцеклетки вместо возраста реципиента снижает частоту ложноположительных результатов и повышает эффективность скрининга.
Неточная информация может привести к значительным изменениям оценки риска. Следовательно, очень важно, чтобы при отправке образца в лабораторию для анализа была предоставлена точная информация. Для скрининга сыворотки в первом триместре положительный или отрицательный результат основан на пороговых значениях, специфичных для лаборатории. С учетом возраста матери оценочный риск трисомии плода 21, 18 и 13 для женщины в возрасте 20 лет на 12 недель беременности составляет примерно 1 на 1 000, 1 на 2 500 и 1 на 8 000 соответственно, а риск такой женщины родить пораженный доношенный ребенок составляет 1 из 1500, 1 из 18 000 и 1 из 42 000 соответственно. Соответствующие риски этих анеуплоидий для женщины в возрасте 35 лет при сроке беременности 12 недель составляют примерно 1 из 250, 1 из 600 и 1 из 1 800, а риск того, что такая женщина родит больного ребенка в срок, составляет 1 из 350, 1 из 1 800. 4000 и 1 из 10000.
Соответствующие риски этих анеуплоидий для женщины в возрасте 35 лет при сроке беременности 12 недель составляют примерно 1 из 250, 1 из 600 и 1 из 1 800, а риск того, что такая женщина родит больного ребенка в срок, составляет 1 из 350, 1 из 1 800. 4000 и 1 из 10000.
При скрининге трисомии 21 по возрасту матери и бессывороточному β-ХГЧ и РАРР-А частота обнаружения составляет около 65 % при частоте ложноположительных результатов 5 %. Показатели лучше на 9–10 неделе, чем на 13 неделе, потому что разница в РАРР-А между трисомной и эуплоидной беременностью больше на более ранних сроках беременности [43, 44].Хотя разница в свободном β-ХГЧ между трисомными и эуплоидными беременностями увеличивается с течением беременности, величина этой разницы меньше, чем у противоположного соотношения РАРР-А. При трисомиях 18 и 13 снижены уровни свободного β-ХГЧ и РАРР-А в материнской сыворотке [45, 46]. В случаях половых хромосомных аномалий уровень свободного β-ХГЧ в материнской сыворотке нормальный, а РАРР-А низкий [46]. Общая эффективность скрининга с помощью комбинированного теста лучше на 11 неделе, чем на 13 неделе, с большим вкладом РАРР-А в 11 недель и свободного β-ХГЧ в 13 недель.При трисомии 21 беременности медиана свободного β-ХГЧ в МоМ увеличивается с 1,8 на 11 неделе до 2,09 на 13 неделе, а соответствующие значения для РАРР-А составляют 0,38 и 0,65 МоМ.
Общая эффективность скрининга с помощью комбинированного теста лучше на 11 неделе, чем на 13 неделе, с большим вкладом РАРР-А в 11 недель и свободного β-ХГЧ в 13 недель.При трисомии 21 беременности медиана свободного β-ХГЧ в МоМ увеличивается с 1,8 на 11 неделе до 2,09 на 13 неделе, а соответствующие значения для РАРР-А составляют 0,38 и 0,65 МоМ.
Скрининг для биохимического тестирования и ультразвукового сканирования также можно проводить в два отдельных посещения, первое из которых проводится в 9–10 недель, а второе – в 12 недель [44, 47, 48]. Было подсчитано, что этот подход повысит уровень обнаружения с 90 % до 93–94 %. Другим вариантом может быть выполнение сканирования в 12 недель и оптимизация эффективности биохимического тестирования путем измерения РАРР-А в 9 недель и свободного β-ХГЧ во время сканирования в 12 недель или даже позже с предполагаемой частотой обнаружения 95 недель. %.
Ссылки
1. Snijders RJM, Sundberg K, Holzgreve W, Henry G, Nicolaides KH. Риск трисомии в зависимости от возраста и беременности у матери 21. Ультразвуковая акушерская гинекология. 1999; 13: 167–170. doi: 10.1046/j.1469-0705.1999.13030167.x. [PubMed] [CrossRef] [Google Scholar]2. Уилсон РД. Канадские рекомендации по пренатальной диагностике с поправками (2005 г.) изменены на 2005 г. — методы пренатальной диагностики. Руководство по клинической практике SOGC, № 168, ноябрь 2005 г. J Obstet Gynaecol Can. 2005; 27:1048–1054. [PubMed] [Google Scholar]3.Биндра Р., Ляо В.А., Спенсер К., Николаидес К.Х. Универсальная клиника для оценки риска трисомии 21 на сроке 11–14 недель: проспективное исследование 15 030 беременностей. УЗИ Акушерство Гинекол. 2002; 20: 219–225. doi: 10.1046/j.1469-0705.2002.00808.x. [PubMed] [CrossRef] [Google Scholar]4. Николаидес К.Х. Скрининг на анеуплоиды плода в возрасте от 11 до 13 недель. Пренат Диагн. 2011;1(31):7–15. doi: 10.1002/pd.2637. [PubMed] [CrossRef] [Google Scholar]5. Дугофф Л., Хоббинс Дж. К., Мэлоун Ф. Д. и др. Квадратный скрининг как предиктор неблагоприятного исхода беременности.
Риск трисомии в зависимости от возраста и беременности у матери 21. Ультразвуковая акушерская гинекология. 1999; 13: 167–170. doi: 10.1046/j.1469-0705.1999.13030167.x. [PubMed] [CrossRef] [Google Scholar]2. Уилсон РД. Канадские рекомендации по пренатальной диагностике с поправками (2005 г.) изменены на 2005 г. — методы пренатальной диагностики. Руководство по клинической практике SOGC, № 168, ноябрь 2005 г. J Obstet Gynaecol Can. 2005; 27:1048–1054. [PubMed] [Google Scholar]3.Биндра Р., Ляо В.А., Спенсер К., Николаидес К.Х. Универсальная клиника для оценки риска трисомии 21 на сроке 11–14 недель: проспективное исследование 15 030 беременностей. УЗИ Акушерство Гинекол. 2002; 20: 219–225. doi: 10.1046/j.1469-0705.2002.00808.x. [PubMed] [CrossRef] [Google Scholar]4. Николаидес К.Х. Скрининг на анеуплоиды плода в возрасте от 11 до 13 недель. Пренат Диагн. 2011;1(31):7–15. doi: 10.1002/pd.2637. [PubMed] [CrossRef] [Google Scholar]5. Дугофф Л., Хоббинс Дж. К., Мэлоун Ф. Д. и др. Квадратный скрининг как предиктор неблагоприятного исхода беременности.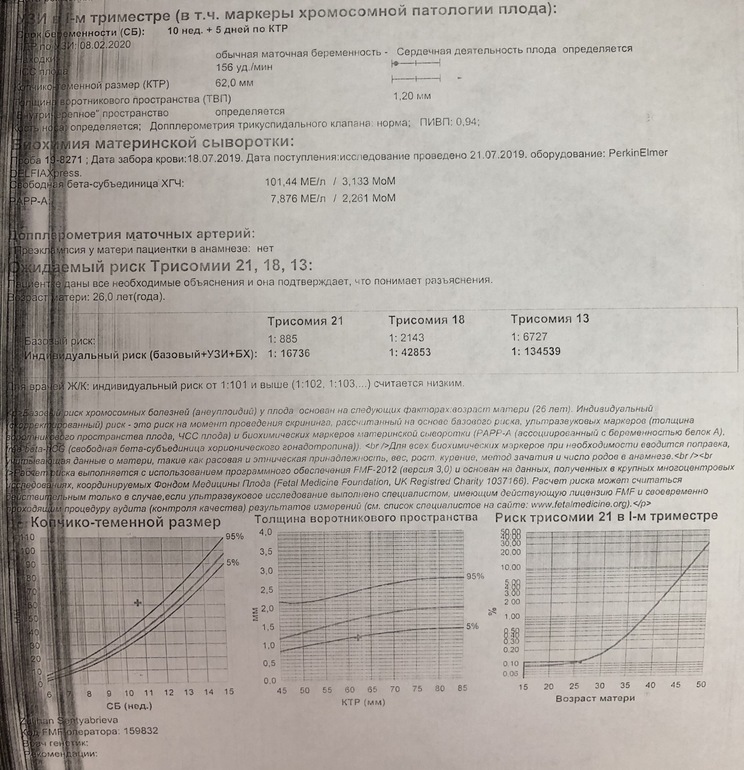 Акушерство Гинекол. 2005; 106: 260–267. doi: 10.1097/01.AOG.0000172419.37410.eb. [PubMed] [CrossRef] [Google Scholar]6. Николас Дж.В., Уэйн Дж.Х., Аллан К.Х. Антенатальный скрининг синдрома Дауна с помощью четырехкратного теста. Ланцет. 2003;361(9360):835–836. doi: 10.1016/S0140-6736(03)12680-3. [PubMed] [CrossRef] [Google Scholar]7. Wald NJ, Kennard A, Hackshaw A, McGuire A. Антенатальный скрининг синдрома Дауна, опубликованная опечатка появляется в J Med Screen. 1998;5:110. [Google Академия]8. Петрович И., Марина Д., Хуан К.К.Роль ассоциированного с беременностью белка плазмы –А (РАРР-А) в выявлении активности ишемической болезни сердца. Акта Фак Мед Найсенсис. 2007;24(4):183–188. [Google Академия]9. Фиалова Л, Мальбохан ИМ. Ассоциированный с беременностью белок плазмы А (РАРР-А): теоретические и клинические аспекты. Братислав Лек Листы. 2002; 103: 194–205. [PubMed] [Google Scholar] 10. Overgaard MT, Oxvig C, Christiansen M, Lawrence JB, Conover CA, Gleich GJ. Уровни рибонуклеиновой кислоты-мессенджера белка-А плазмы, связанного с беременностью, и проформа основного основного белка эозинофилов: экспрессия в репродуктивных и нерепродуктивных тканях человека.
Акушерство Гинекол. 2005; 106: 260–267. doi: 10.1097/01.AOG.0000172419.37410.eb. [PubMed] [CrossRef] [Google Scholar]6. Николас Дж.В., Уэйн Дж.Х., Аллан К.Х. Антенатальный скрининг синдрома Дауна с помощью четырехкратного теста. Ланцет. 2003;361(9360):835–836. doi: 10.1016/S0140-6736(03)12680-3. [PubMed] [CrossRef] [Google Scholar]7. Wald NJ, Kennard A, Hackshaw A, McGuire A. Антенатальный скрининг синдрома Дауна, опубликованная опечатка появляется в J Med Screen. 1998;5:110. [Google Академия]8. Петрович И., Марина Д., Хуан К.К.Роль ассоциированного с беременностью белка плазмы –А (РАРР-А) в выявлении активности ишемической болезни сердца. Акта Фак Мед Найсенсис. 2007;24(4):183–188. [Google Академия]9. Фиалова Л, Мальбохан ИМ. Ассоциированный с беременностью белок плазмы А (РАРР-А): теоретические и клинические аспекты. Братислав Лек Листы. 2002; 103: 194–205. [PubMed] [Google Scholar] 10. Overgaard MT, Oxvig C, Christiansen M, Lawrence JB, Conover CA, Gleich GJ. Уровни рибонуклеиновой кислоты-мессенджера белка-А плазмы, связанного с беременностью, и проформа основного основного белка эозинофилов: экспрессия в репродуктивных и нерепродуктивных тканях человека. Биол Репрод. 1999;61:1083–1089. doi: 10.1095/biolreprod61.4.1083. [PubMed] [CrossRef] [Google Scholar] 11. Overgaard MT, Boldt HT, Laursen LS, Sottrup-Jensen L, Conover CA, Oxvig C. Ассоциированный с беременностью белок плазмы A2 (PAPP-A2), новая протеиназа белка-5, связывающая инсулиноподобный фактор роста. Дж. Биол. Хим. 2001; 276:21849–21853. doi: 10.1074/jbc.M1021. [PubMed] [CrossRef] [Google Scholar] 12. Qin Q-P, Kokkala S, Lund J, Tamm N, Voipio-Pulkki LM, Pettersson K. Молекулярные различия циркулирующего связанного с беременностью плазменного белка-A при инфаркте миокарда и беременности.Клин Хим. 2005; 51: 75–83. doi: 10.1373/clinchem.2004.036467. [PubMed] [CrossRef] [Google Scholar] 13. Overgaard MT, Sorensen ES, Stachowiak D, Boldt HB, Kristensen L, Sottrup-Jensen L, et al. Комплекс ассоциированного с беременностью плазменного белка-А и проформы дисульфидной структуры основного основного белка эозинофилов и мест прикрепления углеводов. Дж. Биол. Хим. 2003; 278:2106–2117. doi: 10.
Биол Репрод. 1999;61:1083–1089. doi: 10.1095/biolreprod61.4.1083. [PubMed] [CrossRef] [Google Scholar] 11. Overgaard MT, Boldt HT, Laursen LS, Sottrup-Jensen L, Conover CA, Oxvig C. Ассоциированный с беременностью белок плазмы A2 (PAPP-A2), новая протеиназа белка-5, связывающая инсулиноподобный фактор роста. Дж. Биол. Хим. 2001; 276:21849–21853. doi: 10.1074/jbc.M1021. [PubMed] [CrossRef] [Google Scholar] 12. Qin Q-P, Kokkala S, Lund J, Tamm N, Voipio-Pulkki LM, Pettersson K. Молекулярные различия циркулирующего связанного с беременностью плазменного белка-A при инфаркте миокарда и беременности.Клин Хим. 2005; 51: 75–83. doi: 10.1373/clinchem.2004.036467. [PubMed] [CrossRef] [Google Scholar] 13. Overgaard MT, Sorensen ES, Stachowiak D, Boldt HB, Kristensen L, Sottrup-Jensen L, et al. Комплекс ассоциированного с беременностью плазменного белка-А и проформы дисульфидной структуры основного основного белка эозинофилов и мест прикрепления углеводов. Дж. Биол. Хим. 2003; 278:2106–2117. doi: 10. 1074/jbc.M208777200. [PubMed] [CrossRef] [Google Scholar] 14. Оксвиг К., Санд О., Кристенсен Т., Кристенсен Л., Соттруп-Йенсен Л.Выделение и характеристика циркулирующего комплекса между белком-А плазмы человека, ассоциированным с беременностью, и проформой основного основного белка эозинофилов. Биохим Биофиз Акта. 1994;1201:415–423. doi: 10.1016/0304-4165(94)
1074/jbc.M208777200. [PubMed] [CrossRef] [Google Scholar] 14. Оксвиг К., Санд О., Кристенсен Т., Кристенсен Л., Соттруп-Йенсен Л.Выделение и характеристика циркулирующего комплекса между белком-А плазмы человека, ассоциированным с беременностью, и проформой основного основного белка эозинофилов. Биохим Биофиз Акта. 1994;1201:415–423. doi: 10.1016/0304-4165(94) Экспрессия рекомбинантного белка-А плазмы человека, связанного с беременностью, и идентификация проформы основного основного белка эозинофилов в качестве его физиологического ингибитора. Дж. Биол. Хим. 2000;275(40):31128–31133. дои: 10.1074/jbc.M001384200. [PubMed] [CrossRef] [Google Scholar] 18. Бишоф П., ДюБерг С., Херрманн В., Сизоненко П.С. Ассоциированный с беременностью протеин-А плазмы (РАРР-А) и ХГЧ на ранних сроках беременности. Br J Obstet Gynaecol. 1981; 88: 973–975. doi: 10.1111/j.1471-0528.1981.tb01683.x. [PubMed] [CrossRef] [Google Scholar] 19. Bischof P, Amandruz M, Weil-Franck C, Baeriswyl JP, Weil A, Hermann WL, et al. Скорость исчезновения ассоциированного с беременностью плазменного белка-А (РАРР-А) после окончания нормальной и аномальной беременности.Арка Гинеколь. 1984; 236: 93–98. doi: 10.1007/BF02134005. [PubMed] [CrossRef] [Google Scholar] 20. Болдт Х.Б., Коновер, Калифорния. Ассоциированный с беременностью плазменный белок-А (РАРР-А): локальный регулятор биодоступности ИФР посредством расщепления ИФРСБ.
Экспрессия рекомбинантного белка-А плазмы человека, связанного с беременностью, и идентификация проформы основного основного белка эозинофилов в качестве его физиологического ингибитора. Дж. Биол. Хим. 2000;275(40):31128–31133. дои: 10.1074/jbc.M001384200. [PubMed] [CrossRef] [Google Scholar] 18. Бишоф П., ДюБерг С., Херрманн В., Сизоненко П.С. Ассоциированный с беременностью протеин-А плазмы (РАРР-А) и ХГЧ на ранних сроках беременности. Br J Obstet Gynaecol. 1981; 88: 973–975. doi: 10.1111/j.1471-0528.1981.tb01683.x. [PubMed] [CrossRef] [Google Scholar] 19. Bischof P, Amandruz M, Weil-Franck C, Baeriswyl JP, Weil A, Hermann WL, et al. Скорость исчезновения ассоциированного с беременностью плазменного белка-А (РАРР-А) после окончания нормальной и аномальной беременности.Арка Гинеколь. 1984; 236: 93–98. doi: 10.1007/BF02134005. [PubMed] [CrossRef] [Google Scholar] 20. Болдт Х.Б., Коновер, Калифорния. Ассоциированный с беременностью плазменный белок-А (РАРР-А): локальный регулятор биодоступности ИФР посредством расщепления ИФРСБ. Гормон роста IGF Res. 2007; 17:10–18. doi: 10.1016/j.ghir.2006.11.003. [PubMed] [CrossRef] [Google Scholar] 21. Петерсон С.Э., Симхан Х.Н. Белок плазмы А, связанный с беременностью в первом триместре, и последующие аномалии роста плода. Am J Obstet Gynecol. 2008;198(5):43–5.[В паблике] 22. Ганьон А., Дуглас Р.В. Акушерские осложнения, связанные с аномальными маркерами анализов материнской сыворотки. J Obstet Gynaecol Can. 2008;30(10):918–932. [PubMed] [Google Scholar] 23. Сантолая-Форгас И., Леон Дж. А. Д., Каллен Хопкинс Р., Кастракан В. Д., Кауфман Р. П., Сифуэнтес Г. П. Низкий уровень протеина А плазмы, связанный с беременностью, на сроке от 10 + 1 до 14 + 6 недель беременности и возможный механизм, ведущий к выкидышу. Диагностика плода Тер. 2004; 19: 456–461. doi: 10.1159/000079000. [PubMed] [CrossRef] [Google Scholar] 24.Brizot ML, Hyett JA, Mckie AT, Bersinger NA, Farzaneh F, Nicolaides KH. Экспрессия гена связанного с беременностью белка плазмы человека-А в плаценте при трисомной беременности.
Гормон роста IGF Res. 2007; 17:10–18. doi: 10.1016/j.ghir.2006.11.003. [PubMed] [CrossRef] [Google Scholar] 21. Петерсон С.Э., Симхан Х.Н. Белок плазмы А, связанный с беременностью в первом триместре, и последующие аномалии роста плода. Am J Obstet Gynecol. 2008;198(5):43–5.[В паблике] 22. Ганьон А., Дуглас Р.В. Акушерские осложнения, связанные с аномальными маркерами анализов материнской сыворотки. J Obstet Gynaecol Can. 2008;30(10):918–932. [PubMed] [Google Scholar] 23. Сантолая-Форгас И., Леон Дж. А. Д., Каллен Хопкинс Р., Кастракан В. Д., Кауфман Р. П., Сифуэнтес Г. П. Низкий уровень протеина А плазмы, связанный с беременностью, на сроке от 10 + 1 до 14 + 6 недель беременности и возможный механизм, ведущий к выкидышу. Диагностика плода Тер. 2004; 19: 456–461. doi: 10.1159/000079000. [PubMed] [CrossRef] [Google Scholar] 24.Brizot ML, Hyett JA, Mckie AT, Bersinger NA, Farzaneh F, Nicolaides KH. Экспрессия гена связанного с беременностью белка плазмы человека-А в плаценте при трисомной беременности. Плацента. 1996; 17:33–36. doi: 10.1016/S0143-4004(05)80641-1. [PubMed] [CrossRef] [Google Scholar] 25. Богарт М.Х., Пандиан М.Р., Джонс О.В. Аномальные уровни хорионического гонадотропина в сыворотке крови матери при беременности с хромосомными аномалиями плода. Пренат Диагн. 1987; 7: 623–630. doi: 10.1002/pd.1970070904. [PubMed] [CrossRef] [Google Scholar] 27.Ульф-Хокан С., Айла Т., Хенрик А., Лина В. Классификация, функции и клиническое использование различных изоформ ХГЧ. Обновление воспроизведения гула. 2006;12(6):769–784. doi: 10.1093/humupd/dml029. [PubMed] [CrossRef] [Google Scholar] 28. Тренти Т., Алоэ Р., Сервеллин Г., Липпи Г. Хорионический гонадотропин человека в диагностике беременности. Клин Чим Акта. 2011;412(17–18):1515–1520. [PubMed] [Google Scholar] 29. Фернандо М.Р., Донато Д., Феличе П. Прогностическая ценность измерений гормонов при осложнениях беременности у матери и плода.Эндокринный. 2006;23(2):230–57. [В паблике] 30. Батлер С.А., Иль РК. Свободная мономерная бета-субъединица хорионического гонадотропина человека (бета-ХГЧ) и недавно идентифицированная гомодимерная бета-субъединица бета-бета (бета-ХГЧ) обладают эффектами аутокринного роста.
Плацента. 1996; 17:33–36. doi: 10.1016/S0143-4004(05)80641-1. [PubMed] [CrossRef] [Google Scholar] 25. Богарт М.Х., Пандиан М.Р., Джонс О.В. Аномальные уровни хорионического гонадотропина в сыворотке крови матери при беременности с хромосомными аномалиями плода. Пренат Диагн. 1987; 7: 623–630. doi: 10.1002/pd.1970070904. [PubMed] [CrossRef] [Google Scholar] 27.Ульф-Хокан С., Айла Т., Хенрик А., Лина В. Классификация, функции и клиническое использование различных изоформ ХГЧ. Обновление воспроизведения гула. 2006;12(6):769–784. doi: 10.1093/humupd/dml029. [PubMed] [CrossRef] [Google Scholar] 28. Тренти Т., Алоэ Р., Сервеллин Г., Липпи Г. Хорионический гонадотропин человека в диагностике беременности. Клин Чим Акта. 2011;412(17–18):1515–1520. [PubMed] [Google Scholar] 29. Фернандо М.Р., Донато Д., Феличе П. Прогностическая ценность измерений гормонов при осложнениях беременности у матери и плода.Эндокринный. 2006;23(2):230–57. [В паблике] 30. Батлер С.А., Иль РК. Свободная мономерная бета-субъединица хорионического гонадотропина человека (бета-ХГЧ) и недавно идентифицированная гомодимерная бета-субъединица бета-бета (бета-ХГЧ) обладают эффектами аутокринного роста.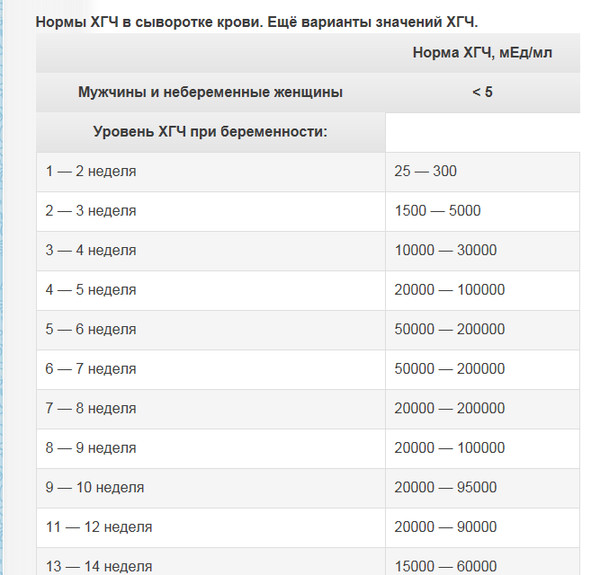 Опухоль биол. 2004; 25:18–23. doi: 10.1159/000077719. [PubMed] [CrossRef] [Google Scholar] 31. Эльдар-Гева Т., Хохберг А., деГрут Н., Вайнштейн Д. Высокий уровень хорионического гонадотропина в материнской сыворотке при беременности с синдромом Дауна вызван повышением уровня обеих субъединиц мессенджера рибонуклеиновой кислоты в трофобластах.J Clin Endocrinol Metab. 1995; 80: 3528–3531. doi: 10.1210/jc.80.12.3528. [PubMed] [CrossRef] [Google Scholar] 32. Oberweis D, Gillerot Y, Koulischer L, Hustin J, Philippe E. Трисомия плаценты в последнем триместре беременности. J Gynecol Obstet Biol Reprod. 1993; 12: 345–349. [PubMed] [Google Scholar] 33. Cowans NJ, Stamatopoulou A, Hellström J, Mäkelä MM, Spencer K. Стабильность PAPP-A и свободного ss-hCG в сыворотке первого триместра с использованием систем PerkinElmer AutoDELFIA и DELFIA Xpress. Пренат Диагн. 2010;30(2):127–132.doi: 10.1002/pd.2423. [PubMed] [CrossRef] [Google Scholar] 34. Круз Дж., Круз Г., Минеркава Р., Мази Н., Николаидес К.
Опухоль биол. 2004; 25:18–23. doi: 10.1159/000077719. [PubMed] [CrossRef] [Google Scholar] 31. Эльдар-Гева Т., Хохберг А., деГрут Н., Вайнштейн Д. Высокий уровень хорионического гонадотропина в материнской сыворотке при беременности с синдромом Дауна вызван повышением уровня обеих субъединиц мессенджера рибонуклеиновой кислоты в трофобластах.J Clin Endocrinol Metab. 1995; 80: 3528–3531. doi: 10.1210/jc.80.12.3528. [PubMed] [CrossRef] [Google Scholar] 32. Oberweis D, Gillerot Y, Koulischer L, Hustin J, Philippe E. Трисомия плаценты в последнем триместре беременности. J Gynecol Obstet Biol Reprod. 1993; 12: 345–349. [PubMed] [Google Scholar] 33. Cowans NJ, Stamatopoulou A, Hellström J, Mäkelä MM, Spencer K. Стабильность PAPP-A и свободного ss-hCG в сыворотке первого триместра с использованием систем PerkinElmer AutoDELFIA и DELFIA Xpress. Пренат Диагн. 2010;30(2):127–132.doi: 10.1002/pd.2423. [PubMed] [CrossRef] [Google Scholar] 34. Круз Дж., Круз Г., Минеркава Р., Мази Н., Николаидес К. Х. Влияние температуры на свободный β-хорионический гонадотропин человека и концентрацию белка-А в плазме, связанного с беременностью. УЗИ Акушерство Гинекол. 2010; 36: 141–146. doi: 10.1002/uog.7688. [PubMed] [CrossRef] [Google Scholar] 35. Шульте-Валентин М., Шиндлер Х. Неэхогенный затылочный отек как маркер скрининга трисомии 21. Ланцет. 1992; 339:1053. doi: 10.1016/0140-6736(92)
Х. Влияние температуры на свободный β-хорионический гонадотропин человека и концентрацию белка-А в плазме, связанного с беременностью. УЗИ Акушерство Гинекол. 2010; 36: 141–146. doi: 10.1002/uog.7688. [PubMed] [CrossRef] [Google Scholar] 35. Шульте-Валентин М., Шиндлер Х. Неэхогенный затылочный отек как маркер скрининга трисомии 21. Ланцет. 1992; 339:1053. doi: 10.1016/0140-6736(92) Аномалии сердца и магистральных артерий у плодов с хромосомными аномалиями в первом триместре. Am J Med Genet. 1997; 69: 207–216. doi: 10.1002/(SICI)1096-8628(19970317)69:2<207::AID-AJMG18>3.0.CO;2-P. [PubMed] [CrossRef] [Google Scholar] 39. фон Кайзенберг К.С., Николаидес К.Х., Бранд-Сабери Б. Гипоплазия лимфатических сосудов у плодов с синдромом Тернера. Хум Репрод. 1999; 14:823–826. doi: 10.1093/humrep/14.3.823. [PubMed] [CrossRef] [Google Scholar]40. Hyett JA, Sebire NJ, Snijders RJ, Nicolaides KH.Внутриутробная летальность плодов с трисомией 21 с увеличенной толщиной воротникового пространства. УЗИ Акушерство Гинекол. 1996; 7: 101–103. doi: 10.1046/j.1469-0705.1996.07020101.x. [PubMed] [CrossRef] [Google Scholar]41. Халил Асма, Пандья Пранав. Скрининг на синдром Дауна. J Obstet Gynecol Индия. 2006;56(3):205–211. [Google Академия]42. Спенсер К., Хит В., Эль-Шейха А., Онг ЦИТ, Николаидес К.Х. Этническая принадлежность и необходимость коррекции биохимических и ультразвуковых маркеров хромосомных аномалий в первом триместре: исследование восточно-азиатского и афро-карибского населения.
Аномалии сердца и магистральных артерий у плодов с хромосомными аномалиями в первом триместре. Am J Med Genet. 1997; 69: 207–216. doi: 10.1002/(SICI)1096-8628(19970317)69:2<207::AID-AJMG18>3.0.CO;2-P. [PubMed] [CrossRef] [Google Scholar] 39. фон Кайзенберг К.С., Николаидес К.Х., Бранд-Сабери Б. Гипоплазия лимфатических сосудов у плодов с синдромом Тернера. Хум Репрод. 1999; 14:823–826. doi: 10.1093/humrep/14.3.823. [PubMed] [CrossRef] [Google Scholar]40. Hyett JA, Sebire NJ, Snijders RJ, Nicolaides KH.Внутриутробная летальность плодов с трисомией 21 с увеличенной толщиной воротникового пространства. УЗИ Акушерство Гинекол. 1996; 7: 101–103. doi: 10.1046/j.1469-0705.1996.07020101.x. [PubMed] [CrossRef] [Google Scholar]41. Халил Асма, Пандья Пранав. Скрининг на синдром Дауна. J Obstet Gynecol Индия. 2006;56(3):205–211. [Google Академия]42. Спенсер К., Хит В., Эль-Шейха А., Онг ЦИТ, Николаидес К.Х. Этническая принадлежность и необходимость коррекции биохимических и ультразвуковых маркеров хромосомных аномалий в первом триместре: исследование восточно-азиатского и афро-карибского населения. Пренат Диагн. 2005; 25: 365–369. doi: 10.1002/pd.1153. [PubMed] [CrossRef] [Google Scholar]43. Каган К.О., Райт Д., Спенсер К., Молина Ф.С., Николаидес К.Х. Скрининг первого триместра на трисомию 21 с помощью свободного бета-хорионического гонадотропина человека и связанного с беременностью плазменного белка-А: влияние характеристик матери и беременности. УЗИ Акушерство Гинекол. 2008; 31: 493–502. doi: 10.1002/uog.5332. [PubMed] [CrossRef] [Google Scholar]44. Райт Д., Спенсер К., Каган К.О., Торринг Н., Петерсен О.Б., Кристоу А. и др.Комбинированный скрининг первого триместра на трисомию 21 на сроке беременности 7–14 недель. УЗИ Акушерство Гинекол. 2010; 36: 404–411. doi: 10.1002/uog.7755. [PubMed] [CrossRef] [Google Scholar]45. Тул Н., Спенсер К., Ноубл П., Чан С., Николаидес К.Х. Скрининг трисомии 18 по прозрачности воротникового пространства плода и содержанию бета-ХГЧ и РАРР-А в материнской сыворотке на 10–14 неделе беременности. Пренат Диагн. 1999;19:1035–1042. doi: 10.1002/(SICI)1097-0223(199911)19:11<1035::AID-PD694>3.
Пренат Диагн. 2005; 25: 365–369. doi: 10.1002/pd.1153. [PubMed] [CrossRef] [Google Scholar]43. Каган К.О., Райт Д., Спенсер К., Молина Ф.С., Николаидес К.Х. Скрининг первого триместра на трисомию 21 с помощью свободного бета-хорионического гонадотропина человека и связанного с беременностью плазменного белка-А: влияние характеристик матери и беременности. УЗИ Акушерство Гинекол. 2008; 31: 493–502. doi: 10.1002/uog.5332. [PubMed] [CrossRef] [Google Scholar]44. Райт Д., Спенсер К., Каган К.О., Торринг Н., Петерсен О.Б., Кристоу А. и др.Комбинированный скрининг первого триместра на трисомию 21 на сроке беременности 7–14 недель. УЗИ Акушерство Гинекол. 2010; 36: 404–411. doi: 10.1002/uog.7755. [PubMed] [CrossRef] [Google Scholar]45. Тул Н., Спенсер К., Ноубл П., Чан С., Николаидес К.Х. Скрининг трисомии 18 по прозрачности воротникового пространства плода и содержанию бета-ХГЧ и РАРР-А в материнской сыворотке на 10–14 неделе беременности. Пренат Диагн. 1999;19:1035–1042. doi: 10.1002/(SICI)1097-0223(199911)19:11<1035::AID-PD694>3. 0.CO;2-2. [PubMed] [CrossRef] [Google Scholar]46.Спенсер К., Тул Н., Николаидес К.Х. Бета-ХГЧ и РАРР-А в материнской сыворотке при дефектах половых хромосом плода в первом триместре. Пренат Диагн. 2000;20:390–394. doi: 10.1002/(SICI)1097-0223(200005)20:5<390::AID-PD824>3.0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]47. Боррелл А., Казальс Э., Фортуни А., Фарре М.Т., Гонсе А., Санчес А. и др. Скрининг первого триместра на трисомию 21, сочетающий биохимию и ультразвук в индивидуально оптимальных сроках беременности: интервенционное исследование. Пренат Диагн.2004; 24: 541–545. doi: 10.1002/pd.949. [PubMed] [CrossRef] [Google Scholar]48. Каган К.О., Райт Д., Бейкер А., Сахота Д., Николаидес К.Х. Скрининг трисомии 21 по возрасту матери, толщине воротникового пространства плода, свободному бета-человеческому хорионическому гонадотропину и ассоциированному с беременностью плазменному белку-А. УЗИ Акушерство Гинекол. 2008; 31: 618–24. [ПубМед] 49. Бернд Э., Глаубиц Ральф. Скрининг первого триместра: обзор.
0.CO;2-2. [PubMed] [CrossRef] [Google Scholar]46.Спенсер К., Тул Н., Николаидес К.Х. Бета-ХГЧ и РАРР-А в материнской сыворотке при дефектах половых хромосом плода в первом триместре. Пренат Диагн. 2000;20:390–394. doi: 10.1002/(SICI)1097-0223(200005)20:5<390::AID-PD824>3.0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]47. Боррелл А., Казальс Э., Фортуни А., Фарре М.Т., Гонсе А., Санчес А. и др. Скрининг первого триместра на трисомию 21, сочетающий биохимию и ультразвук в индивидуально оптимальных сроках беременности: интервенционное исследование. Пренат Диагн.2004; 24: 541–545. doi: 10.1002/pd.949. [PubMed] [CrossRef] [Google Scholar]48. Каган К.О., Райт Д., Бейкер А., Сахота Д., Николаидес К.Х. Скрининг трисомии 21 по возрасту матери, толщине воротникового пространства плода, свободному бета-человеческому хорионическому гонадотропину и ассоциированному с беременностью плазменному белку-А. УЗИ Акушерство Гинекол. 2008; 31: 618–24. [ПубМед] 49. Бернд Э., Глаубиц Ральф. Скрининг первого триместра: обзор. J Гистохим Цитохим. 2005;53(3):281–283. doi: 10.1369/jhc.4B6420.2005. [PubMed] [CrossRef] [Google Scholar]
J Гистохим Цитохим. 2005;53(3):281–283. doi: 10.1369/jhc.4B6420.2005. [PubMed] [CrossRef] [Google Scholar]Скрининг материнской сыворотки в первом триместре беременности с использованием биохимических маркеров PAPP-A и свободного β-ХГЧ для выявления синдрома Дауна, синдрома Патау и синдрома Эдварда
Indian J Clin Biochem.2013 январь; 28(1): 3–12.
, , , , иС. Шифа
SRL Diagnostics, Fortis Healthcare Enterprise, Unit4, A0 Razi 6. Clinical Biochemist, A0 Razi 6. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
M. Amargandhi
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
J.Bhupendra
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
S.
 Moulali
MoulaliSRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
T. Kristine
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
SRL Diagnostics, Fortis Healthcare Enterprise, Clinical Biochemist, 64, Al Razi Unit 1007, Block A, P.O. Box 505143, Dubai Health Care City, Объединенные Арабские Эмираты
Автор, ответственный за переписку.Поступила в редакцию 8 июля 2012 г.; Принято 30 сентября 2012 г.
Авторские права © Ассоциация клинических биохимиков Индии, 2012 г. Эта статья цитировалась другими статьями в PMC.Abstract
Программа скрининга в первом триместре предлагает неинвазивный метод раннего выявления анеуплоидии беременных.Этот скрининг проводится с помощью комбинации двух биохимических маркеров, т. е. свободного β-хорионического гонадотропина человека в сыворотке (свободный β-ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-A), возраста матери и толщины воротникового пространства плода (NT) в возрасте 11 + лет. 0–13 + 6 недель беременности. Полезным последствием скрининга является ранняя диагностика трисомий 21, 18 и 13. В 11 + 0–13 + 6 недель относительная распространенность трисомий 18 и 13 по сравнению с трисомией 21 составляет один к трем и один к семи, соответственно.Все три трисомии связаны с увеличением возраста матери, увеличением NT плода и снижением РАРР-А, но при трисомии 21 уровень свободного β-ХГЧ в сыворотке повышен, тогда как при трисомиях 18 и 13 уровень свободного β-ХГЧ снижен.
е. свободного β-хорионического гонадотропина человека в сыворотке (свободный β-ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-A), возраста матери и толщины воротникового пространства плода (NT) в возрасте 11 + лет. 0–13 + 6 недель беременности. Полезным последствием скрининга является ранняя диагностика трисомий 21, 18 и 13. В 11 + 0–13 + 6 недель относительная распространенность трисомий 18 и 13 по сравнению с трисомией 21 составляет один к трем и один к семи, соответственно.Все три трисомии связаны с увеличением возраста матери, увеличением NT плода и снижением РАРР-А, но при трисомии 21 уровень свободного β-ХГЧ в сыворотке повышен, тогда как при трисомиях 18 и 13 уровень свободного β-ХГЧ снижен.
Ключевые слова: РАРР-А, Свободный β-ХГЧ, Затылочная прозрачность, Синдром Дауна, Синдром Патау, Синдром Эдвардса во многих странах.Недавний интерес к пренатальному скринингу трисомий был сосредоточен на первом триместре. Было показано, что из исследованных биохимических маркеров только материнский свободный от сыворотки β-хорионический гонадотропин человека (свободный β-ХГЧ) и ассоциированный с беременностью белок плазмы-А (РАРР-А) имеют значение.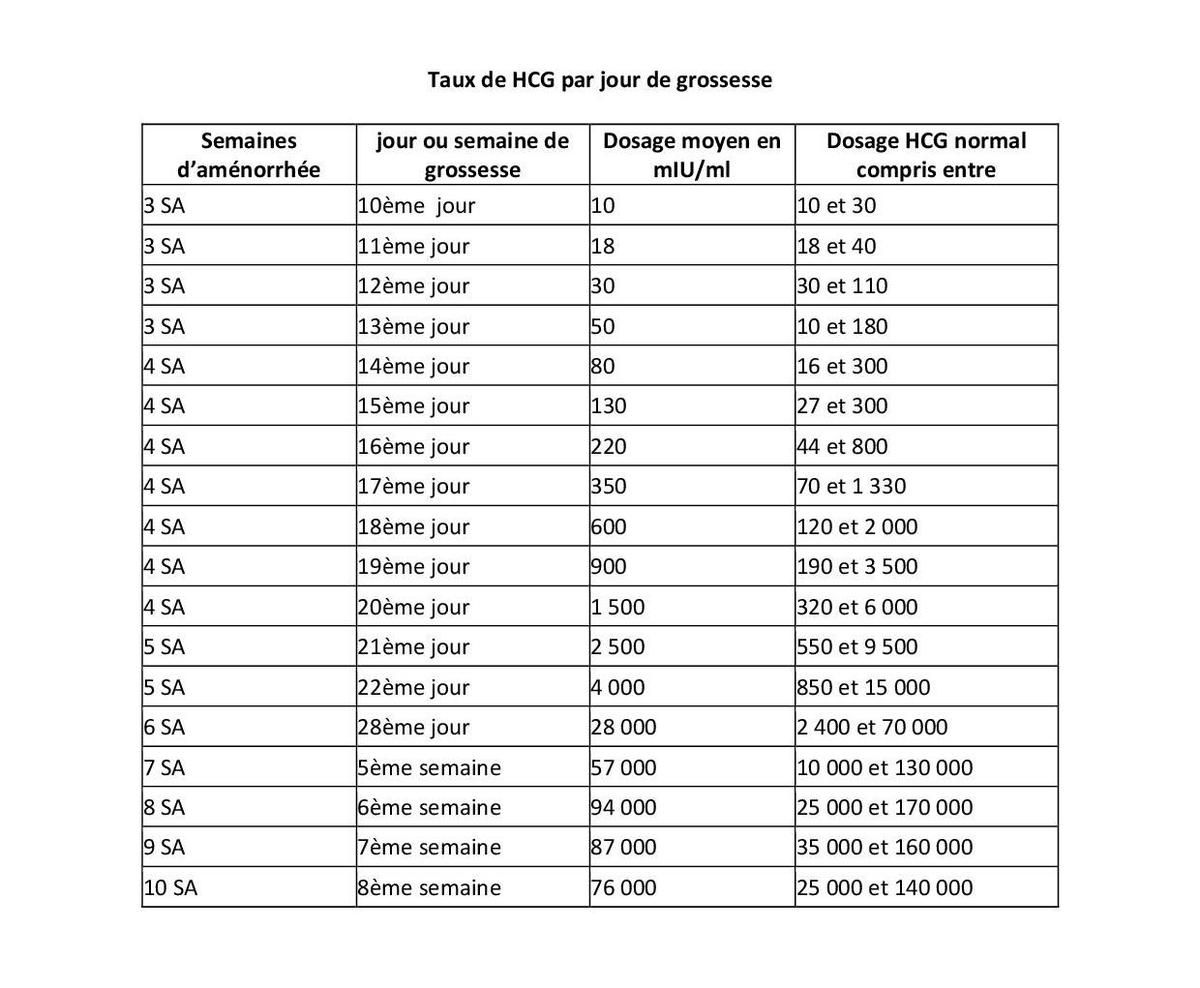 Целью программ скрининга материнской сыворотки в первом триместре является выявление женщин с повышенным риском рождения ребенка с дефектами синдрома Дауна, синдрома Патау и синдрома Эдвардса, а также тех, кому будет полезно тестирование.
Целью программ скрининга материнской сыворотки в первом триместре является выявление женщин с повышенным риском рождения ребенка с дефектами синдрома Дауна, синдрома Патау и синдрома Эдвардса, а также тех, кому будет полезно тестирование.
Связь между увеличением возраста матери [1] и повышенным риском трисомии 21 (таблица ) хорошо известна, и беременным женщинам старше 35 лет на момент родов обычно предлагается инвазивное пренатальное диагностическое тестирование. Наиболее часто используемым тестом для генетической диагностики является амниоцентез, но частота спонтанных потерь плода, связанных с амниоцентезом, составляет в среднем около одной на каждые 200 [2] процедур. Из-за этого риска анализ сывороточных аналитов стал важным неинвазивным первым шагом в выявлении пациентов с риском врожденных аномалий.
Таблица 1
Таблица 1
Распространенность трисомии 21 по возрасту матери и гестационным возрастом
| Материн (лет) | Гестационный возраст (недели) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 10 | 12 | 14 | 16 | 20 | 40 | ||||||
| 20 | 1: 983 | 1: 1 0684 | 1: 1 140084 | 1: 1 1200 | 1: 1 200 | 1: 1,295 | 1: 1 527 | ||||
| 25 | 1: 870 | 1: 946 | 1: 1,009 | 1: 1 062 | 1: 1,147 | 1: 1,352 | 1: 1,352 | ||||
| 30 | 1: 576 | 1: 626 | 1: 668 | 1: 703 | 1: 759 | 1: 895 | |||||
| 31 | 1: 500 | 1: 583 | 1: 580 | 1: 610 | 1: 658 | 1: 776 | |||||
| 32 | 1:424 | 1:461 | 1:492 | 9 0083 1: 5181: 559 | 1: 659 | ||||||
| 33 | 1: 332 | 1: 383 | 1: 383 | 1: 409 | 1: 430 | 1: 464 | 1: 547 | ||||
| 34 | 34 | 1: 287 | 1: 312 | 1: 312 | 1: 333 | 1: 350 | 1: 350 | 1: 378 | 1: 446 | ||
| 35 | 1: 229 | 1: 249 | 1: 266 | 1: 280 | 1: 302 | 1: 302 | 1: 302 | ||||
| 36 | 1: 180 | 1: 196 | 1: 209 | 1: 220 | 1: 238 | 1: 280 | |||||
| 37 | 1: 140 | 1: 140 | 1: 152 | 1: 163 | 1: 171 | 1: 171 | 1: 185 | 1: 218 | |||
| 38 | 1: 108 | 1: 117 | 1: 125 | 1: 131 | 1: 142 | 1: 142 | 1: 167 | ||||
| 39 | 1:82 | 1:89 | 1:95 900 84 | 1: 100 | 1: 108 | 1: 128 | 1: 128 | ||||
| 40 | 1:62 | 1:68 | 1:72 | 1:72 | 1:76 | 1:82 | 1:97 | ||||
| 41 | 1:47 | 1:51 | 1:51 | 1:54 | 1:57 | 1:57 | 1:62 | 1:73 | |||
| 42 | 1:35 | 1:38 | 1:41 | 1:43 | 1:43 | 1:46 | 1:55 | ||||
| 43 | 1:26 | 1:29 | 1:30 | 1:32 | 1:35 | 1:41 | 1:41 | ||||
| 44 | 1:20 | 1:21 | 1:21 | 1:23 | 1:24 | 1:26 | 1:30 | ||||
| 45 | 1:15 | 1:16 | 1:17 | 1:18 | 1:19 | 1:23 | |||||
Текущие исследования, проведенные в первом триместре беременности, показали, что двойной маркерный тест помогает выявить 90 % женщин с риском развития синдрома Дауна, 94 % всех основных хромосомных дефектов, таких как синдром Патау, синдром Эдвардса, триплоидия и синдром Тернера, и 60 % других хромосомных дефектов, таких как делеции, частичные трисомии , несбалансированные транслокации и анеуплоидии половых хромосом, отличные от тернеров [3].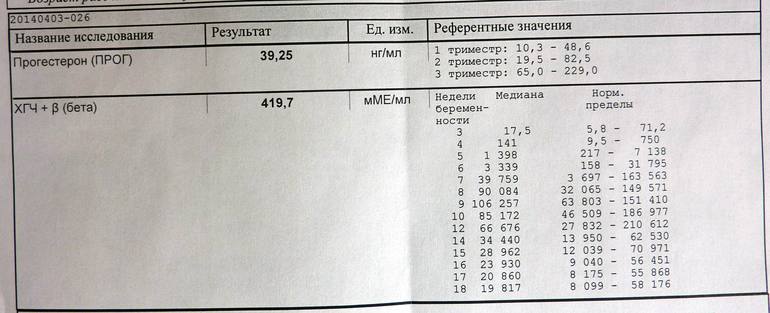 Некоторые из преимуществ биохимического скрининга в первом триместре по сравнению с биохимическим скринингом во втором триместре включают предоставление клиницистам и пациентам существенного преимущества более ранней диагностики, более высоких показателей выявления синдрома Дауна у плода, т.е. 90 % [4] или даже выше, по сравнению с 80 % для квадро-теста второго триместра [5, 6] и 70 % для более раннего тройного скрининг-теста [7], и обнаружение большинства серьезных хромосомных аномалий, кроме трисомии 21. также выступает в качестве неспецифического маркера других врожденных дефектов, включая некоторые серьезные пороки сердца и синдромальные состояния.Он может обнаружить ряд основных структурных врожденных дефектов, связанных с нормальными хромосомами.
Некоторые из преимуществ биохимического скрининга в первом триместре по сравнению с биохимическим скринингом во втором триместре включают предоставление клиницистам и пациентам существенного преимущества более ранней диагностики, более высоких показателей выявления синдрома Дауна у плода, т.е. 90 % [4] или даже выше, по сравнению с 80 % для квадро-теста второго триместра [5, 6] и 70 % для более раннего тройного скрининг-теста [7], и обнаружение большинства серьезных хромосомных аномалий, кроме трисомии 21. также выступает в качестве неспецифического маркера других врожденных дефектов, включая некоторые серьезные пороки сердца и синдромальные состояния.Он может обнаружить ряд основных структурных врожденных дефектов, связанных с нормальными хромосомами.
Скрининг материнской сыворотки имеет некоторые ограничения. Одним из недостатков является то, что для обнаружения дефекта нервной трубки потребуется либо отдельный тест на АФП через 15 недель, либо опора на сканирование аномалий плода в 18–22 недель, также известное как морфологическое сканирование. Другим недостатком является то, что ранний скрининг предпочтительно выявляет те хромосомные аномалии беременности, которые обречены на выкидыш. Приблизительно 30 % пораженных плодов погибают в период между 12 недельами беременности и сроком [1].Таким образом, женщины без необходимости вынуждены принимать решение о прерывании беременности, которая грозит выкидышем. Следует помнить, что тест на двойные маркеры является лишь скрининговым тестом, который дает риск генетического нарушения, но не диагноз.
Другим недостатком является то, что ранний скрининг предпочтительно выявляет те хромосомные аномалии беременности, которые обречены на выкидыш. Приблизительно 30 % пораженных плодов погибают в период между 12 недельами беременности и сроком [1].Таким образом, женщины без необходимости вынуждены принимать решение о прерывании беременности, которая грозит выкидышем. Следует помнить, что тест на двойные маркеры является лишь скрининговым тестом, который дает риск генетического нарушения, но не диагноз.
Комбинированный скрининг в первом триместре беременности
Скрининг в первом триместре проводится между 10 и 14 неделями беременности (рис. ). Маркеры, используемые для расчета риска, представляют собой 2 сывороточных маркера: РАРР-А и свободный β-ХГЧ). Снижение уровня РАРР-А до 14-й недели беременности связано с повышенным риском синдрома Дауна и трисомии 18.В то время как повышенный уровень ХГЧ связан с повышенным риском синдрома Дауна. Третьим маркером является прозрачность воротникового пространства плода (NT, область, содержащая жидкость за шеей плода), которую определяют с помощью ультразвука. Измерение воротникового пространства должно выполняться опытными сонографистами в период между 10 и 13 неделями и 6 днями беременности. Большинство плодов с синдромом Дауна имеют повышенное значение NT по сравнению с нормальными плодами того же гестационного возраста.
Измерение воротникового пространства должно выполняться опытными сонографистами в период между 10 и 13 неделями и 6 днями беременности. Большинство плодов с синдромом Дауна имеют повышенное значение NT по сравнению с нормальными плодами того же гестационного возраста.
Скрининг материнской сыворотки в первом триместре
Белки материнской крови в первом триместре Скрининг
Ряд белков в материнском кровотоке был обнаружен во время беременности. Многие из этих белков производятся или модифицируются плацентой. Различия в уровнях некоторых белков наблюдались у пациенток, вынашивающих плод с синдромом Дауна и некоторыми другими хромосомными аномалиями. Обнаружение этих незначительных различий в уровнях белка формирует основу для их использования в протоколах скрининга.Их называют биохимическими маркерами. Определенные образцы биохимических маркеров были связаны с синдромом Дауна плода, а также с другими состояниями. Уровни этих белков изменяются во время беременности, поэтому интерпретация требует знания гестационного возраста. Кроме того, эффективность этих белков зависит от гестационного возраста. Например, различия в уровнях белка могут наблюдаться во втором триместре, но не в первом, в то время как другие белки показывают различия в первом триместре, но не во втором.
Кроме того, эффективность этих белков зависит от гестационного возраста. Например, различия в уровнях белка могут наблюдаться во втором триместре, но не в первом, в то время как другие белки показывают различия в первом триместре, но не во втором.
Материнская сыворотка PAPP-A
PAPP-A — это один из двух маркеров материнской сыворотки, используемых в настоящее время для скрининга в возрасте от 10 до 14 недель. Он продуцируется плацентарным синцитиотрофобластом и децидуальной оболочкой. Он увеличивает биодоступность инсулиноподобного фактора роста, который, в свою очередь, опосредует инвазию трофобласта и модулирует транспорт глюкозы и аминокислот в плаценте. PAPP-A также экспрессируется в гранулезных клетках яичников и в нерепродуктивных тканях, таких как фибробласты, остеобласты и гладкомышечные клетки сосудов.
Химия РАРР-А
РАРР-А представляет собой гликопротеин, первоначально обнаруженный Lin et al. [8] в плазме беременной женщины. Белок секретируется в виде дисульфид-связанного гомодимера (рис. ) с молекулярной массой 400 кДа. Каждая субъединица происходит от препро-PAPP-A, содержащего 1627 белковых остатков [9–11], который процессируется в зрелый PAPP-A из 1547 аминокислотных остатков и 14 предполагаемых сайтов N-гликозилирования [9, 10]. Он секретируется как активная протеаза после внутриклеточного расщепления С-концевой стороны полипептида РАРР-А [9].Это цинксвязывающая металлопротеиназа, принадлежащая к суперсемейству метцинцинов металлопротеиназ [8]. В плазме PAPP-A циркулирует либо в свободной форме, либо в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (proMBP), образуя приблизительно 500 кДа и называемого PAPP-A/proMBP (рис. ) [12, 13]. ProMBP замещен как N-, так и O-связанным углеводом в дополнение к одному фрагменту гепарансульфата, который, как полагают, занимает сайт связывания PAPP-A на поверхности клетки в циркулирующем комплексе PAPP-A/proMBP [14, 15]. .Ген PAPP-A был отнесен к хромосоме 9q33.1 человека, охватывающей более 200 т.
) с молекулярной массой 400 кДа. Каждая субъединица происходит от препро-PAPP-A, содержащего 1627 белковых остатков [9–11], который процессируется в зрелый PAPP-A из 1547 аминокислотных остатков и 14 предполагаемых сайтов N-гликозилирования [9, 10]. Он секретируется как активная протеаза после внутриклеточного расщепления С-концевой стороны полипептида РАРР-А [9].Это цинксвязывающая металлопротеиназа, принадлежащая к суперсемейству метцинцинов металлопротеиназ [8]. В плазме PAPP-A циркулирует либо в свободной форме, либо в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (proMBP), образуя приблизительно 500 кДа и называемого PAPP-A/proMBP (рис. ) [12, 13]. ProMBP замещен как N-, так и O-связанным углеводом в дополнение к одному фрагменту гепарансульфата, который, как полагают, занимает сайт связывания PAPP-A на поверхности клетки в циркулирующем комплексе PAPP-A/proMBP [14, 15]. .Ген PAPP-A был отнесен к хромосоме 9q33.1 человека, охватывающей более 200 т. п.н. ДНК, и содержит 22 экзона [13].
п.н. ДНК, и содержит 22 экзона [13].
Ассоциированный с беременностью белок плазмы А или PAPP-A в виде дисульфид-связанного гомодимера в свободной форме и в виде гетеротетрамерного комплекса проформы основного основного белка эозинофилов (ProMBP), т.е. PAPP-A/ProMBP при беременности
PAPP-A при беременности
Во время беременности как PAPP-A, так и proMBP обильно экспрессируются в плаценте человека, но в разных типах клеток. Большая часть PAPP-A синтезируется в плацентарном синцитиотрофобласте [16], а весь proMBP синтезируется во вневорсинчатых цитотрофобластах [17], откуда он секретируется без расщепления пропептида.Процесс образования комплекса РАРР-А/проМВР происходит во внеклеточном пространстве, вероятно, на поверхности синцитиотрофобласта. При нормальной беременности концентрация РАРР-А в кровотоке матери увеличивается с гестационным возрастом. Его концентрация увеличивается экспоненциально со временем удвоения 3–4 дня в течение первых триместров (рис. ), затем уровень продолжает расти на протяжении всей беременности до родов. Быстрое повышение уровня РАРР-А в течение первого триместра приводит к тому, что интерпретация данного значения сильно зависит от гестационного возраста.Поэтому общепринятой практикой является использование единицы, кратной медиане (МоМ), в качестве зависящего от гестационного возраста выражения концентрации РАРР-А. Средний период полувыведения РАРР-А после нормальных родов составляет 53 ± 26 ч (среднее значение плюс стандартное отклонение) [18]. Концентрации РАРР-А в 100 и 1000 раз ниже в крови плода и в амниотической жидкости соответственно по сравнению с материнской кровью [19].
Быстрое повышение уровня РАРР-А в течение первого триместра приводит к тому, что интерпретация данного значения сильно зависит от гестационного возраста.Поэтому общепринятой практикой является использование единицы, кратной медиане (МоМ), в качестве зависящего от гестационного возраста выражения концентрации РАРР-А. Средний период полувыведения РАРР-А после нормальных родов составляет 53 ± 26 ч (среднее значение плюс стандартное отклонение) [18]. Концентрации РАРР-А в 100 и 1000 раз ниже в крови плода и в амниотической жидкости соответственно по сравнению с материнской кровью [19].
Экспоненциальное повышение РАРР-А в первом триместре нормальной беременности
Около 99 % РАРР-А ковалентно связано в комплексе 2:2 с проформой основного основного белка эозинофилов (proMBP) во время беременности.proMBP функционирует как эндогенный ингибитор протеолитической активности PAPP-A (ингибитор протеазы in vivo), механизм ингибирования которого в настоящее время неизвестен. Субстраты PAPP-A включают белки, связывающие инсулиноподобный фактор роста (IGFBP) 4 и 5, роль которых заключается в ингибировании биологической активности инсулиноподобных факторов роста 1 и 2. PAPP-A действует как «протеаза» для IGFBPs [20], помогая высвобождению IGF из этих связывающих белков, так что он может свободно взаимодействовать со своим клеточным рецептором аутокринным или паракринным образом (рис.). Считается, что IGF играет важную роль в инвазии трофобласта и, следовательно, в раннем развитии и васкуляризации плаценты и плацентарного ложа.
PAPP-A действует как «протеаза» для IGFBPs [20], помогая высвобождению IGF из этих связывающих белков, так что он может свободно взаимодействовать со своим клеточным рецептором аутокринным или паракринным образом (рис.). Считается, что IGF играет важную роль в инвазии трофобласта и, следовательно, в раннем развитии и васкуляризации плаценты и плацентарного ложа.
Протеолитическая активность РАРР-А у человека. Связь между PAPP-A, IGF и IGFBP-4. a Замещенные гепаринсульфатом рецепторы в клетке-мишени иммобилизуют РАРР-А в положении, близком к рецептору ИФР. Затем PAPP-A отщепляет IGF от IGFBP-4 в непосредственной близости от рецептора IGF. Затем свободный ИФР связывается с рецептором ИФР, индуцируя пролиферацию клеток, инвазию трофобласта, транспорт глюкозы и аминокислот в плаценту. b GAG-цепь ProMBP связывается там с доменом PAPP-A, высвобождая PAPP-A с клеточной поверхности. ProMBP инактивирует протеолитическую активность PAPP-A
Снижение уровня PAPP-A обнаруживается в связи с нарушением функции плаценты, что легло в основу скрининга в первом триместре плода на синдром Дауна [13, 16]. Низкий уровень материнской сыворотки в первом триместре обнаруживается не только при трисомии 21, трисомии 18 и трисомии 13, но и при анеуплоидии плода без синдрома Дауна.Также сообщается, что PAPP-A имеет положительную связь с массой тела при рождении [21]. По мере снижения PAPP-A риск рождения детей с малым весом для гестационного возраста увеличивается. Установлено, что уровни РАРР-А в кровотоке снижаются при внематочной беременности. Некоторые из осложнений, связанных с необъяснимым изолированным низким РАРР-А, включают преждевременные роды, задержку внутриутробного развития, гестационную гипертензию, гестационную гипертензию с протеинурией [22].
Низкий уровень материнской сыворотки в первом триместре обнаруживается не только при трисомии 21, трисомии 18 и трисомии 13, но и при анеуплоидии плода без синдрома Дауна.Также сообщается, что PAPP-A имеет положительную связь с массой тела при рождении [21]. По мере снижения PAPP-A риск рождения детей с малым весом для гестационного возраста увеличивается. Установлено, что уровни РАРР-А в кровотоке снижаются при внематочной беременности. Некоторые из осложнений, связанных с необъяснимым изолированным низким РАРР-А, включают преждевременные роды, задержку внутриутробного развития, гестационную гипертензию, гестационную гипертензию с протеинурией [22].
Исследования показали, что одной из причин самопроизвольного аборта у этих женщин может быть снижение доступности инсулиноподобного фактора роста-II из-за снижения уровня PAPP-A в сыворотке крови [23].Снижение PAPP-A в материнской сыворотке не связано с каким-либо изменением плацентарного синтеза этого белка, поскольку экспрессия мРНК PAPP-A существенно не снижена в плацентах с синдромом Дауна. Кроме того, корреляция между уровнями экспрессии РАРР-А в сыворотке и тканях теряется при беременности Дауна. Эти наблюдения предполагают, что снижение PAPP-A в материнской сыворотке является посттрансляционным и может быть вызвано изменением механизмов высвобождения плаценты или модификацией стабильности секретируемого белка [24].Установлено, что РАРР-А значительно выше при беременности двойней. В среднем значения РАРР-А у близнецов в 1,86 раза выше, чем у одноплодных. Значимых акушерских исходов при повышенном РАРР-А в первом триместре не описано [22]. Измеримые уровни были обнаружены у мужчин и небеременных женщин. У небеременных лиц PAPP-A обнаруживается в виде гомодимера 400 кДа.
Гормон бета-ХГЧ, не содержащий материнской сыворотки
Хорионический гонадотропин человека представляет собой гликопротеиновый гормон с молекулярной массой 39 500 Да, обычно обнаруживаемый в крови и моче только во время беременности.В 1987 г. Богарт и соавт. [25] сообщили о повышенных уровнях ХГЧ в материнской сыворотке при беременности с синдромом Дауна, и с тех пор ХГЧ был введен в большинство программ скрининга. Для инициации и поддержания беременности ХГЧ опосредует множественные функции плаценты, матки и плода. Некоторые из них включают развитие клеток синцитиотрофобласта, митотический рост и дифференцировку эндометрия, локализованное подавление материнской иммунной системы, модуляцию морфологии матки и экспрессии генов, а также координацию сложной передачи сигналов между эндометрием [26].
Химия
Хорионический гонадотропин человека состоит из двух нековалентно связанных субъединиц, α и β, и вырабатывается клетками синцитиотрофобласта плаценты. ХГЧ имеет одну β-субъединицу, которая содержит 145 аминокислот, связанных шестью дисульфидными мостиками, и α-субъединицу, содержащую 92 аминокислоты, связанные 5 дисульфидными мостиками, которая также является общей для трех других гликопротеиновых гормонов: ЛГ, ФСГ и ТТГ. β-субъединица уникальна и отличает ХГЧ от других гликопротеиновых гормонов (рис.). Он содержит две N-связанные боковые цепи олигосахаридов, присоединенные к остаткам 13 и 30 [27]. Он также имеет четыре О-связанных олигосахаридных звена, расположенных на уникальном С-концевом участке, богатом пролином и серином (остатки 122–145). α-субъединица имеет две N-связанные олигосахаридные боковые цепи, присоединенные к аминокислотным остаткам 52 и 78 [27]. В материнской сыворотке присутствуют пять родственных ХГЧ молекул: ХГЧ без разрыва, который представляет собой активный гормон; порезанный ХГЧ; свободная α-субъединица; свободная β-субъединица; и свободная от разрыва субъединица β [28].Свободная β-субъединица может образовываться из трех источников: прямой продукции клеток трофобласта, диссоциации ХГЧ на свободные α- и свободные β-субъединицы, а также ферментов макрофагов или нейтрофилов, разрывающих молекулу ХГЧ [29]. Свободный β-ХГЧ, циркулирующий в материнской сыворотке, составляет всего около 0,3–4 % от общего количества ХГЧ [29]. Один ген на хромосоме 6 кодирует субъединицу α всех четырех гликопротеиновых гормонов (ТТГ, ЛГ, ФСГ и ХГ). Хромосома 19 содержит семейство генов, кодирующих субъединицу CGβ [29].С каждого транскрибируются отдельные матричные РНК (мРНК). Субъединицы спонтанно объединяются в шероховатой эндоплазматической сети и затем непрерывно секретируются в материнский кровоток.
Структура интактного ХГЧ и ХГЧβ
Свободный β-ХГЧ при беременности
ХГЧ в материнской сыворотке достигает максимума на 8–10 неделях, а затем снижается, достигая плато на 18–20 неделях (рис. ) беременности, и остается довольно постоянным до тех пор, пока срок. β-ХГЧ не обладает активностью ХГЧ, но несколько направлений исследований показывают, что он оказывает ростостимулирующее действие.Было высказано предположение, что β-ХГЧ препятствует ингибирующему рост эффекту трансформирующего фактора роста β, фактора роста тромбоцитов-В и фактора роста нервов [30]. Период полувыведения введенного ХГЧ является двухфазным; период полураспада быстрой фазы составляет 5–6 часов, тогда как период более медленной фазы составляет 24–33 часа. Период полувыведения очищенного β-ХГЧ, введенного человеку, составляет 0,7 и 10 ч, что короче, чем у ХГЧ. Однако после доношенной беременности или аборта β-ХГЧ фактически исчезает медленнее, чем ХГЧ.Таким образом, доля β-ХГЧ в общей иммунореактивности ХГЧ увеличивается с 0,8 % в сроке до 27 % через 3 недели. Молекулярно-биологические исследования показали, что трофобласты с трисомией 21 показывают заметное увеличение мРНК β-ХГЧ и меньшее увеличение мРНК α-ХГЧ, что позволяет предположить, что одной из причин высоких уровней ХГЧ в материнской сыворотке является повышенная продукция и секреция ХГЧ плацента [31]. Эти наблюдения подтверждаются относительной незрелостью плаценты, которая продолжает выделять большое количество ХГЧ, как и в первом триместре [32].
Общий ХГЧ и свободный бета-ХГЧ в первом триместре беременности
Методы измерения РАРР-А и свободного β-ХГЧ
Новая технология биохимического анализа, обеспечивающая автоматизированное, точное и репродуктивное измерение в короткие сроки после получения Образец крови позволяет комбинировать биохимическое и ультразвуковое исследование для ранней оценки, чтобы снизить нагрузку на пациентов. Необходимо выделение сыворотки для скрининга синдрома Дауна через 4 ч после отмены.Охлаждение во время любого хранения, включая транспортировку, настоятельно рекомендуется, так как преаналитическая фаза оказывает большое влияние на анализ.
Образцы сыворотки на свободный β-ХГЧ и РАРР-А стабильны при 4 °C для цельной крови или отделенной сыворотки в течение 1 недели. Надежные результаты получаются при хранении отделенных образцов сыворотки при температуре 20°С до 2 суток и 1 суток для цельной крови. При 30 °C надежные результаты были получены только в том случае, если образцы были проанализированы в течение 2 ч сбора.
В цельной крови уровни свободного β-ХГЧ увеличивались быстрее по сравнению с сывороткой, особенно при 30 °C [33].В нескольких исследованиях сообщалось, что высокая температура хранения и длительный интервал между сбором и анализом образца приводят к увеличению концентрации свободного β-ХГЧ, поскольку он высвобождается при диссоциации или деградации интактного ХГЧ [34]. Сообщалось, что в цельной крови, хранившейся при комнатной температуре, средняя концентрация свободного β-ХГЧ в сыворотке увеличивалась на 10–15 % через 24 часа, примерно на 25 % через 3 дня и на 45 % через 4 дня [34]. Другое исследование показало, что уровни PAPP-A в сыворотке стабильны в течение 142 дней при 2–8°, 37 дней при комнатной температуре и 20 дней при 30 °C.Существенных изменений ни для одного из аналитов не наблюдалось после хранения при температуре -20 °C до 240 дней или после шести повторных циклов замораживания-оттаивания [33]. В настоящее время практически все коммерческие анализы основаны на технологии хемилюминесцентной амплификации ферментами. Материнская сыворотка PAPP-A и свободный β-hCG также могут быть измерены с использованием анализатора иммунологического анализа случайного доступа с использованием технологии эмиссии амплифицированного криптата с временным разрешением.
Nuchal Translucency
Наиболее важным ультразвуковым маркером при скрининге хромосомных аномалий в первом триместре является измерение толщины NT между 10 и 14 неделями беременности, о котором впервые сообщили Schulte-Valentine и Schindler в 1992 году [35].NT измеряет заполненное подкожной жидкостью пространство между задней частью позвоночника и кожей шеи плода (рис. ). NT увеличивается с гестационным возрастом примерно на 17 % в неделю. Полупрозрачная область исчезает после 14 недель гестационного возраста, когда подкожная клетчатка становится более эхогенной. Таким образом, НТ является преходящим явлением [36]. Используя только измерение NT и возраст матери, можно определить 81% (таблица) пораженных беременностей с частотой ложноположительных результатов 5% [37]. Измерение воротникового пространства должно выполняться опытными специалистами по УЗИ и должно быть получено между 10 и 13 неделями 6 дней беременности, что эквивалентно длине темени-крестца от 38 до 84 мм.NT можно обнаружить у 99 % плодов в конце первого триместра. 50-й процентиль NT увеличивается с 1,2 мм на неделе 11 + 0 (длина темени-крестца 45 мм) до 1,5 мм на неделе 13 + 6 (длина темени-крестца 82 мм). 95-й процентиль колеблется от 2 мм на 11-й неделе до 2,6 мм на 13 + 6 неделе. У большинства плодов с синдромом Дауна NT увеличивается по сравнению с нормальными плодами того же гестационного возраста. Кроме того, увеличение NT связано с сужением перешейка аорты, сердечно-сосудистыми дефектами, которые вызывают гиперперфузию головы и шеи, или аномальным/задержкой развития лимфатической системы [38, 39].Повышенное значение NT также может быть связано с невынашиванием беременности [36, 40] и аномальными кариотипами [41].
NUCHAL Измерение прозрачности
Таблица 2
Таблица обнаружения 2
Уровень обнаружения Трисомии 21, 18 и 13 для данной ложной положительной скорости (FPR)
Скаривание| Трисомия 21 | Трисомия 18 | FPR: 0,5% Трисомия 13 | FPR: 0,5% |
|---|---|---|---|
| Maternal Age (MA) и FETAL NT | 81 | 68 | 61 |
| мА и сыворотки бесплатно β-HCG и PAPP-A | 67 | 80 | 59 | 59
| MA, NT и сыворотка β-HCG и PAPP-A | 91 | 97 | 84 |
Устойчивый к пациенту Риск хромосомной аномалии
некоторый риск того, что ее плод может быть затронут хромосомным дефектом.Чтобы рассчитать этот индивидуальный риск, необходимо сначала принять во внимание априорный риск женщины, исходя из ее возраста и срока беременности (таблица). Затем этот априорный риск умножается на отношение правдоподобия, рассчитанное на основании данных УЗИ и/или результатов биохимии сыворотки, полученных во время текущей беременности. Произведение априорного риска и отношения правдоподобия дает специфический риск пациента.
Кратность медианы (МоМ)
При скрининге с использованием биохимических маркеров материнской сыворотки измеренная концентрация маркеров преобразуется в МоМ незатронутых беременностей при той же беременности.Это сделано для того, чтобы учесть тот факт, что уровни маркеров варьируются в зависимости от гестационного возраста. Значения MoM рассчитываются путем деления индивидуального уровня маркера на средний уровень этого маркера для всей популяции в этом гестационном возрасте в этой лаборатории. Использование значений MoM, а не абсолютных уровней, также позволяет последовательно интерпретировать результаты из разных лабораторий. При эуплоидной беременности среднее скорректированное значение как для свободного β-ХГЧ, так и для РАРР-А составляет 1,0 МоМ при всех сроках беременности. В исследовании, проведенном Spencer et al.[42] при изменении уровней биохимических маркеров первого триместра у женщин азиатского происхождения (индианка, Пакистан, Бангладеш) по сравнению с женщиной европеоидной расы (контрольная группа) было обнаружено, что в азиатской популяции медиана PAPP-A была увеличена на 9 %, а свободный β- ХГЧ на 6 % от контрольной группы (таблица ). Было обнаружено, что азиатское население на 6,9 кг легче, чем европейская женщина. При трисомиях наблюдаются низкие значения РАРР-А, которые обычно составляют 0,15 МоМ для трисомии 21, то есть синдрома Дауна; 0,25 МоМ для трисомии 13 или синдрома Патау; 0.18 МоМ для трисомии 18 или синдрома Эдвардса; и 0,49 для синдрома Тернера (таблица).
Таблица 3
Таблица 3
Вариация в первом триместре биохимические уровни маркера в азиатских женщинах по сравнению с кавказской женщиной
| маркер (мама) | 4 Caucasian4 индийцы||||
|---|---|---|---|---|
| не веса корреляции | корреляция веса | корреляция веса | ||
| свободный β-ХГЧ | 1.53 | +1,038 | 1,002 | 0,925 |
| РАРР-А | 1,032 | 1,029 | 1,187 | 1,082 |
Таблица 4
шаблон Маркер в нескольких срединных и обнаружения скоростей в различных анеуплоидий
| Aneuploidy | NT | Свободный β-HCG | PAPP-A | Уровень обнаружения (%) | |
|---|---|---|---|---|---|
| Трисомия 21 | 2.67 MOM | 215 MOM | 0.15 MOM | ||
| TRISOMY 13 | 0.50 MAM | 0,25 мама | |||
| Трисомия 18 | 3,27 мама | 0,28 мама | 0,18 Мама | ||
| 45, | 4,76 мама | 1.11 Мама | 0,11 мама | 0,49 мама | 0,49 |
| Triploidy Maternal | 0.88 MOM | 0.18 MOM | 0,06 MOM | 0.06 MOM | |
| Triploidy Paternal | 2,76 мама | 8.04 MOM | 0,75 мама | 0,75 мама |
Лаборатория использует различную математическую модель для расчета риск женщины родить ребенка с синдромом Дауна, трисомией 18 и трисомией 13. Некоторые из математических моделей включают Prisca, Viewpoint, Astria и т. д. Эти математические модели учитывают возраст матери, уровни различных биохимических маркеров в сыворотке и данные УЗИ плода. измерения.Кроме того, ряд факторов играет важную роль в расчете риска, поскольку они будут влиять на значения биохимических анализов материнской сыворотки. Это включает в себя гестационный возраст, вес, расу, курение, диабетический статус человека, количество присутствующих плодов и использовалось ли лечение ЭКО для зачатия. В некоторых редких случаях, таких как расчеты риска анеуплоидии при беременности донора яйцеклетки, использование возраста донора яйцеклетки вместо возраста реципиента снижает частоту ложноположительных результатов и повышает эффективность скрининга.
Неточная информация может привести к значительным изменениям оценки риска. Следовательно, очень важно, чтобы при отправке образца в лабораторию для анализа была предоставлена точная информация. Для скрининга сыворотки в первом триместре положительный или отрицательный результат основан на пороговых значениях, специфичных для лаборатории. С учетом возраста матери оценочный риск трисомии плода 21, 18 и 13 для женщины в возрасте 20 лет на 12 недель беременности составляет примерно 1 на 1 000, 1 на 2 500 и 1 на 8 000 соответственно, а риск такой женщины родить пораженный доношенный ребенок составляет 1 из 1500, 1 из 18 000 и 1 из 42 000 соответственно.Соответствующие риски этих анеуплоидий для женщины в возрасте 35 лет при сроке беременности 12 недель составляют примерно 1 из 250, 1 из 600 и 1 из 1 800, а риск того, что такая женщина родит больного ребенка в срок, составляет 1 из 350, 1 из 1 800. 4000 и 1 из 10000.
При скрининге трисомии 21 по возрасту матери и бессывороточному β-ХГЧ и РАРР-А частота обнаружения составляет около 65 % при частоте ложноположительных результатов 5 %. Показатели лучше на 9–10 неделе, чем на 13 неделе, потому что разница в РАРР-А между трисомной и эуплоидной беременностью больше на более ранних сроках беременности [43, 44].Хотя разница в свободном β-ХГЧ между трисомными и эуплоидными беременностями увеличивается с течением беременности, величина этой разницы меньше, чем у противоположного соотношения РАРР-А. При трисомиях 18 и 13 снижены уровни свободного β-ХГЧ и РАРР-А в материнской сыворотке [45, 46]. В случаях половых хромосомных аномалий уровень свободного β-ХГЧ в материнской сыворотке нормальный, а РАРР-А низкий [46]. Общая эффективность скрининга с помощью комбинированного теста лучше на 11 неделе, чем на 13 неделе, с большим вкладом РАРР-А в 11 недель и свободного β-ХГЧ в 13 недель.При трисомии 21 беременности медиана свободного β-ХГЧ в МоМ увеличивается с 1,8 на 11 неделе до 2,09 на 13 неделе, а соответствующие значения для РАРР-А составляют 0,38 и 0,65 МоМ.
Скрининг для биохимического тестирования и ультразвукового сканирования также можно проводить в два отдельных посещения, первое из которых проводится в 9–10 недель, а второе – в 12 недель [44, 47, 48]. Было подсчитано, что этот подход повысит уровень обнаружения с 90 % до 93–94 %. Другим вариантом может быть выполнение сканирования в 12 недель и оптимизация эффективности биохимического тестирования путем измерения РАРР-А в 9 недель и свободного β-ХГЧ во время сканирования в 12 недель или даже позже с предполагаемой частотой обнаружения 95 недель. %.
Ссылки
1. Snijders RJM, Sundberg K, Holzgreve W, Henry G, Nicolaides KH. Риск трисомии в зависимости от возраста и беременности у матери 21. Ультразвуковая акушерская гинекология. 1999; 13: 167–170. doi: 10.1046/j.1469-0705.1999.13030167.x. [PubMed] [CrossRef] [Google Scholar]2. Уилсон РД. Канадские рекомендации по пренатальной диагностике с поправками (2005 г.) изменены на 2005 г. — методы пренатальной диагностики. Руководство по клинической практике SOGC, № 168, ноябрь 2005 г. J Obstet Gynaecol Can. 2005; 27:1048–1054. [PubMed] [Google Scholar]3.Биндра Р., Ляо В.А., Спенсер К., Николаидес К.Х. Универсальная клиника для оценки риска трисомии 21 на сроке 11–14 недель: проспективное исследование 15 030 беременностей. УЗИ Акушерство Гинекол. 2002; 20: 219–225. doi: 10.1046/j.1469-0705.2002.00808.x. [PubMed] [CrossRef] [Google Scholar]4. Николаидес К.Х. Скрининг на анеуплоиды плода в возрасте от 11 до 13 недель. Пренат Диагн. 2011;1(31):7–15. doi: 10.1002/pd.2637. [PubMed] [CrossRef] [Google Scholar]5. Дугофф Л., Хоббинс Дж. К., Мэлоун Ф. Д. и др. Квадратный скрининг как предиктор неблагоприятного исхода беременности.Акушерство Гинекол. 2005; 106: 260–267. doi: 10.1097/01.AOG.0000172419.37410.eb. [PubMed] [CrossRef] [Google Scholar]6. Николас Дж.В., Уэйн Дж.Х., Аллан К.Х. Антенатальный скрининг синдрома Дауна с помощью четырехкратного теста. Ланцет. 2003;361(9360):835–836. doi: 10.1016/S0140-6736(03)12680-3. [PubMed] [CrossRef] [Google Scholar]7. Wald NJ, Kennard A, Hackshaw A, McGuire A. Антенатальный скрининг синдрома Дауна, опубликованная опечатка появляется в J Med Screen. 1998;5:110. [Google Академия]8. Петрович И., Марина Д., Хуан К.К.Роль ассоциированного с беременностью белка плазмы –А (РАРР-А) в выявлении активности ишемической болезни сердца. Акта Фак Мед Найсенсис. 2007;24(4):183–188. [Google Академия]9. Фиалова Л, Мальбохан ИМ. Ассоциированный с беременностью белок плазмы А (РАРР-А): теоретические и клинические аспекты. Братислав Лек Листы. 2002; 103: 194–205. [PubMed] [Google Scholar] 10. Overgaard MT, Oxvig C, Christiansen M, Lawrence JB, Conover CA, Gleich GJ. Уровни рибонуклеиновой кислоты-мессенджера белка-А плазмы, связанного с беременностью, и проформа основного основного белка эозинофилов: экспрессия в репродуктивных и нерепродуктивных тканях человека.Биол Репрод. 1999;61:1083–1089. doi: 10.1095/biolreprod61.4.1083. [PubMed] [CrossRef] [Google Scholar] 11. Overgaard MT, Boldt HT, Laursen LS, Sottrup-Jensen L, Conover CA, Oxvig C. Ассоциированный с беременностью белок плазмы A2 (PAPP-A2), новая протеиназа белка-5, связывающая инсулиноподобный фактор роста. Дж. Биол. Хим. 2001; 276:21849–21853. doi: 10.1074/jbc.M1021. [PubMed] [CrossRef] [Google Scholar] 12. Qin Q-P, Kokkala S, Lund J, Tamm N, Voipio-Pulkki LM, Pettersson K. Молекулярные различия циркулирующего связанного с беременностью плазменного белка-A при инфаркте миокарда и беременности.Клин Хим. 2005; 51: 75–83. doi: 10.1373/clinchem.2004.036467. [PubMed] [CrossRef] [Google Scholar] 13. Overgaard MT, Sorensen ES, Stachowiak D, Boldt HB, Kristensen L, Sottrup-Jensen L, et al. Комплекс ассоциированного с беременностью плазменного белка-А и проформы дисульфидной структуры основного основного белка эозинофилов и мест прикрепления углеводов. Дж. Биол. Хим. 2003; 278:2106–2117. doi: 10.1074/jbc.M208777200. [PubMed] [CrossRef] [Google Scholar] 14. Оксвиг К., Санд О., Кристенсен Т., Кристенсен Л., Соттруп-Йенсен Л.Выделение и характеристика циркулирующего комплекса между белком-А плазмы человека, ассоциированным с беременностью, и проформой основного основного белка эозинофилов. Биохим Биофиз Акта. 1994;1201:415–423. doi: 10.1016/0304-4165(94)Материнская сыворотка PAPP-A и свободный β-ХГЧ на 12, 22 и 32 неделе беременности при скрининге преэклампсии — Райт — 2016 — Ультразвук в акушерстве и гинекологии
Основные результаты исследования
Результаты этого исследования демонстрируют, что при беременностях с развитием ПЭ по сравнению с беременностями без патологии материнский сывороточный РАРР-А снижается в течение первого триместра, существенно не отличается во втором триместре и повышается в начале третьего триместра, а свободный β-ХГЧ существенно не отличается в первом триместре, но увеличивается во втором и третьем триместрах, причем отклонение от нормы увеличивается с увеличением гестационного возраста при скрининге.Разница в значениях МоМ от нормы больше в более раннем, чем в более позднем гестационном возрасте, когда становится необходимым родоразрешение по поводу ПЭ; следовательно, эффективность скрининга выше при недоношенной ПЭ, чем при доношенной ПЭ.
Сильные стороны и ограничения
Сильные стороны этого скринингового исследования ПЭ в три триместра беременности: во-первых, обследование большой популяции беременных женщин, обращающихся за плановой медицинской помощью, во-вторых, запись данных о материнских характеристиках и истории болезни для выявления известных факторов риска, связанных с ПЭ. , в-третьих, измерение РАРР-А в сыворотке и свободного β-ХГЧ с помощью автоматических машин, которые обеспечивают воспроизводимые результаты, в-четвертых, выражение значений РАРР-А в сыворотке и свободного β-ХГЧ в виде МоМ после поправки на факторы, влияющие на измерения и, в-пятых, , использование теоремы Байеса для объединения предшествующего риска от материнских факторов с РАРР-А и свободным β-ХГЧ для оценки специфических рисков для пациента и эффективности скрининга ПЭ при родах на разных сроках беременности.
Ограничением исследования является оптимистичная предвзятость результатов из-за создания и тестирования модели с использованием одного и того же набора данных. Мы использовали пятикратную перекрестную проверку, чтобы уменьшить такое смещение.
Клинические последствия исследования
В предложенной новой пирамиде ухода за беременными25 оценка в 12 недель направлена на выявление лиц с высоким риском развития преждевременной ПЭ и посредством фармакологического вмешательства снижение распространенности заболевания26, 27.Оценка в 22 и/или 32 недели направлена на оценку специфического для пациента риска развития ТЭЛА и на основе такого риска определение времени и содержания последующих посещений для улучшения перинатального исхода.
На сроке беременности 11–13 недель свободный β-ХГЧ в сыворотке крови не является полезным маркером ПЭ. РАРР-А в сыворотке улучшает прогноз преждевременной ПЭ, обеспечиваемый только материнскими факторами, но улучшение небольшое. Ранее мы сообщали, что сывороточный PAPP-A не улучшает показатели, обеспечиваемые комбинированным скринингом с материнскими факторами, индексом пульсации маточных артерий (UtA-PI), средним артериальным давлением (MAP) и сывороточным плацентарным фактором роста (PlGF), который выявляет 75 % преждевременной ПЭ и 47% доношенной ПЭ при FPR 10%5.
На сроке беременности 19–24 недели сывороточный РАРР-А не является полезным маркером ПЭ. Свободный от сыворотки β-ХГЧ улучшает прогноз преждевременной ПЭ только благодаря материнским факторам, но улучшение незначительно. Ранее мы сообщали, что эффективный скрининг на ПЭ в этом гестационном возрасте обеспечивается комбинацией материнских факторов, UtA-PI, MAP и PlGF, которые выявляют 85% преждевременной ПЭ и 46% доношенной ПЭ при FPR 10%28. .
На 30-34 неделе беременности комбинированный скрининг материнских факторов, PAPP-A в сыворотке и свободного β-ХГЧ может улучшить прогнозирование преждевременной ПЭ, вызванной только материнскими факторами, с 44% до 63% при FPR 10%.Однако такое улучшение незначительно по сравнению со скринингом с использованием комбинации материнских факторов, UtA-PI, MAP, PlGF и растворимой в сыворотке fms-подобной тирозинкиназы-1, которая выявляет 99% преждевременной ПЭ и 66% доношенной ПЭ при FPR 10%29.
Влияние материнского злоупотребления алкоголем и наркотиками на анализы первого триместра скрининга: ретроспективное когортное исследование | BMC Беременность и роды
Это ретроспективное когортное исследование беременных женщин, участвующих в рутинной комбинированной FTS по поводу трисомии 21 в районе университетской больницы Куопио в Центральной Финляндии.Беременности, зарегистрированные во время FTS в плановом медицинском обслуживании в период с июня 2010 г. по июнь 2011 г., были найдены в медицинской базе данных. Были оценены исходы беременности и родов, и было отобрано 544 образца для исследования из всех беременностей за это время в районе университетской больницы Куопио (всего около 2500 беременностей) (рис. 1). Соотношение рисков < 1:250 считалось нормальным. Матери с повышенным коэффициентом риска (включая трисомии, аномалии плода, исчезающие близнецы) были исключены из контрольной группы, чтобы сохранить ее как можно более «нормальной» для выявления возможного влияния воздействия алкоголя и наркотиков на параметры скрининга.
Рис. 1Блок-схема, показывающая количество включенных и исключенных субъектов. Несоответствие количества курильщиков в разных коробках объясняется определением конечной группы Курильщиков (≥ 5 сигарет в день). Матери контрольной группы с повышенным коэффициентом риска были исключены. Каждая 8-я мать была выбрана случайным образом из всех критериев, соответствующих некурящим матерям, для получения соответствующего количества контролей. Тридцать три (42,3%) из 71 Абьюзера курили (≥ 5 сигарет в день) во время беременности
Окончательная группа исследования включала 71 мать, злоупотребляющую алкоголем и, возможно, наркотиками («Альбильщики»), и для сравнения все 88 Курильщиков (пять или более сигарет в день во время беременности), не имеющие истории злоупотребления алкоголем или наркотиками, и все 168 некурящих (не злоупотребляющих алкоголем или наркотиками) матерей, впоследствии родивших ребенка SGA (определяемого здесь как масса тела при рождении ниже 10-го процентиль для гестационного возраста и) («матери SGA»).Эти группы сравнения были включены, поскольку рождение ребенка с SGA и курение являются обычным явлением среди злоупотребляющих алкоголем матерей. Мы сравнили исследуемые группы с 217 некурящими контрольными матерями, позже родившими новорожденного нормального размера (вес при рождении между 10-м и 90-м процентилями) («Контроль»). Критериями включения в контрольную группу были одноплодная беременность, неосложненные вагинальные роды (головное предлежание) и нормальный исход: мать или новорожденный не требовали пре- или послеродового наблюдения, ухода или вмешательств, превышающих обычные.Контрольную группу составляли здоровые женщины, у которых на момент родов не было иного диагноза, кроме самопроизвольных, нормальных родов по критериям МКБ-10. Каждая 8-я мать была выбрана случайным образом из всех критериев, соответствующих некурящим матерям, для получения соответствующего количества контролей. Все матери были кавказками по национальности.
Беременные женщины, употребляющие алкоголь и наркотики, наблюдаемые в родильном доме университетской больницы Куопио, были направлены к врачам общей практики в связи с опасениями, вызванными злоупотреблением алкоголем или наркотиками.Тест идентификации расстройств, связанных с употреблением алкоголя (AUDIT) [4, 5], применялся для выявления матерей с вредными моделями употребления алкоголя. Анкета AUDIT — это утвержденный тест, используемый для определения того, подвержен ли человек риску злоупотребления алкоголем. Критериями включения для Злоумышленников были общий балл AUDIT восемь или более, употребление алкоголя во время продолжающейся беременности или любое злоупотребление алкоголем/наркотиками до или во время текущей беременности. Предыдущие пользователи риска были определены как матери, которые ранее принимали наркотики внутривенно, реабилитировались из-за злоупотребления наркотиками или длительного употребления опиоидов, стимуляторов или других наркотиков.Матери, которые были положительными на антитела к вирусу гепатита С, проходили лечение заменителями наркотиков или алкоголя или взяли на себя обязательство воздерживаться от наркотиков и/или алкоголя, а также матери, которые прекратили употребление наркотиков, когда заметили, что беременны, также были определены как ранее употреблявшие наркотики. После сбора данных и исходов мы не наблюдали ни матерей, ни детей.
FTS выполняли в соответствии с рекомендациями Министерства социальных дел и здравоохранения Финляндии [13]. Параметры скрининга включали анализы РАРР-А и свободного β-ХГЧ из материнской сыворотки, а также измерения NTT плода.Образцы сыворотки для измерений РАРР-А и свободного β-ХГЧ собирали в отделениях родовспоможения между 9 неделями гестации 9 + 0 и 11 + 6. Образцам крови давали свернуться при комнатной температуре в течение 30 минут, центрифугировали, разделяли и хранили при + 4 °С. Образцы сыворотки были доставлены в Лабораторный центр Восточной Финляндии в Куопио в охлажденном или замороженном виде и хранились при температуре -20 °C. Сывороточные концентрации свободного β-ХГЧ и РАРР-А анализировали с помощью флюороиммуноанализа с временным разрешением в соответствии с инструкциями производителя (PerkinElmer Life and Analytical Sciences, Wallac, Турку, Финляндия) и стандартным протоколом скрининга анеуплоидии в первом триместре.Внутри- и межтестовые коэффициенты вариации (CV) были < 1,8% и < 3,7% для PAPP-A и < 2,3% и < 4,1% для свободного β-ХГЧ соответственно. CV определяли в 20 аликвотах двух пулов сыворотки, проанализированных либо в одном, либо в последовательных циклах. Калибраторы охватывали диапазоны 10-2000 мЕд/л для PAPP-A и 2-200 нг/мл для свободного β-ХГЧ. Образцы сыворотки разбавляли в 5 раз перед определением РАРР-А.
Измерения NTT плода проводились в медицинских центрах или университетской больнице Куопио акушерками и гинекологами, прошедшими обучение по УЗИ, между 11 + 0 и 13 + 6 неделями гестации.Длина макушки-крестца плода, полученная при ультразвуковом исследовании, определила срок беременности. Концентрации сывороточных маркеров и показатели NTT плода были преобразованы в кратные медианы (MoM). Общий риск трисомии для трисомии 21, свободного β-hCG MoM, PAPP-A MoM и NTT MoM рассчитывали с использованием программного обеспечения LifeCycle версии 2.2 (PerkinElmer Life and Analytical Sciences). Поправочными факторами для свободного β-ХГЧ были вес матери, диабет и статус курения, а для PAPP-A вес матери и статус диабета.На момент проведения анализа поправочный коэффициент курения для свободного β-ХГЧ составлял 0,82.
Это исследование было одобрено Комитетом по этике исследований университетской больницы Куопио. Все участники исследования дали информированное письменное согласие.
Статистический анализ
Управление данными и статистический анализ выполнялись с использованием программ SPSS 19 и 21 (SPSS Inc., Чикаго, Иллинойс, США). Непрерывные переменные были проверены с помощью t-критерия независимых выборок, если они нормально распределены.Исследуемые группы сравнивали с контролем. PAPP-A, свободный β-hCG и NT показали нормальное распределение. Общий риск трисомии показал нормальное распределение после log10-трансформации. Критерий хи-квадрат использовался для анализа дихотомических переменных. Если в каком-либо из классов было менее пяти единиц, использовался точный критерий Фишера.
Пошаговый множественный линейный регрессионный анализ применялся для объяснения вариаций свободного β-ХГЧ и РАРР-А. P — значение менее 0,05 считалось значимым.В анализ были включены следующие факторы: подтвержденное употребление алкоголя матерью, курение, злоупотребление наркотиками и рождение ребенка с SGA. Кроме того, в регрессионный анализ была включена комбинация (1) употребления алкоголя и курения матерью и (2) употребления алкоголя матерью и рождения ребенка с SGA. Результаты регрессионного анализа были представлены в виде бета-коэффициентов (В) и стандартизированных коэффициентов (бета).
%PDF-1.6 % 1 0 объект > эндообъект 4 0 объект > эндообъект 2 0 объект > ручей 2013-05-24T10:26:41+02:002013-05-24T10:26:37+02:002013-05-24T10:26:41+02:00Adobe InDesign CS5 (7.0)application/pdfuuid:4e9982d9-18e3-430a-857d-dce0e0ea795buuid:3b5d3a81-ff4e-493b-9616-29ad8e6ebea7Adobe PDF Library 9.9 конечный поток эндообъект 3 0 объект > эндообъект 5 0 объект > эндообъект 6 0 объект > эндообъект 7 0 объект > эндообъект 8 0 объект > /XОбъект > >> /Анноты [27 0 R] /Родитель 5 0 Р /MediaBox [0 0 595 842] >> эндообъект 9 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /XОбъект > >> /Повернуть 0 /TrimBox[29.5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 10 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /XОбъект > >> /Повернуть 0 /TrimBox [29,5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 11 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /Затенение > /XОбъект > >> /Повернуть 0 /TrimBox [29,5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 12 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /XОбъект > >> /Повернуть 0 /TrimBox[29.5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 13 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /Затенение > /XОбъект > >> /Повернуть 0 /TrimBox [29,5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 14 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /Свойства > >> /XОбъект > >> /Повернуть 0 /TrimBox [29,5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 15 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /Затенение > /XОбъект > >> /Повернуть 0 /TrimBox[29.5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 16 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /XОбъект > >> /Повернуть 0 /TrimBox [29,5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 17 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /Затенение > /XОбъект > >> /Повернуть 0 /TrimBox [29,5039 29,504 511,394 709,819] /Тип /Страница >> эндообъект 18 0 объект > /ExtGState > /Шрифт > /ProcSet [/PDF /текст] /XОбъект > >> /Повернуть 0 /TrimBox[29.

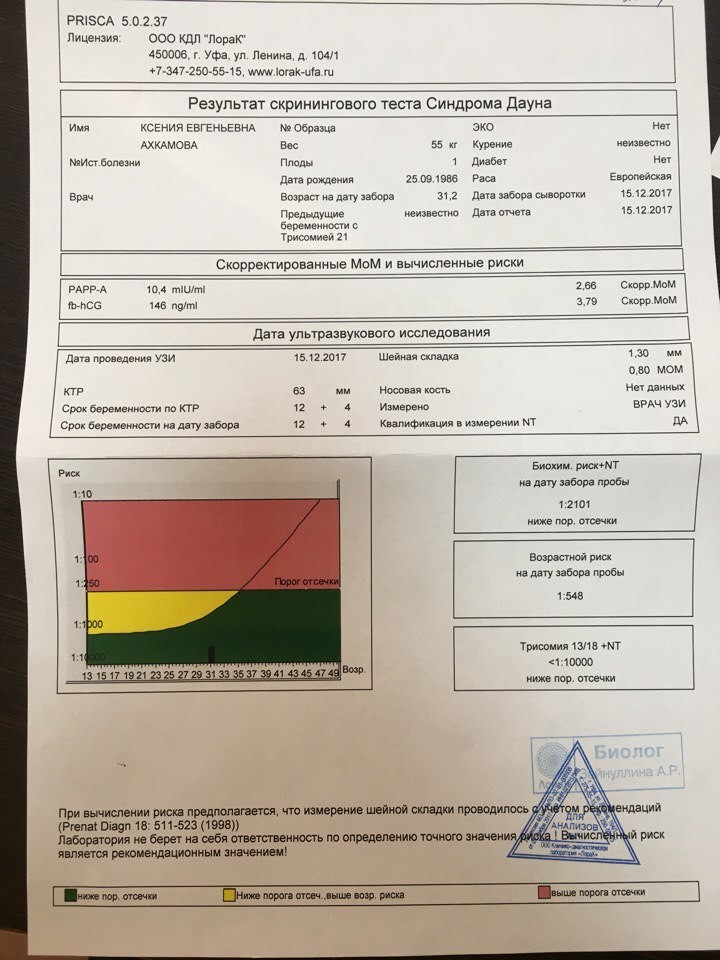
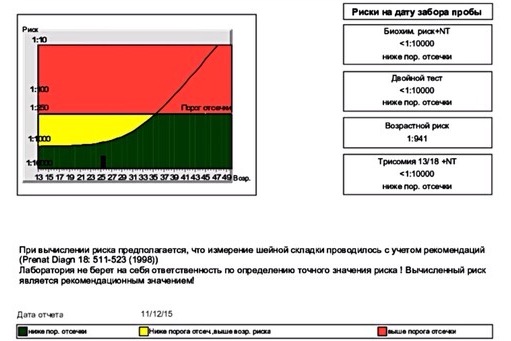

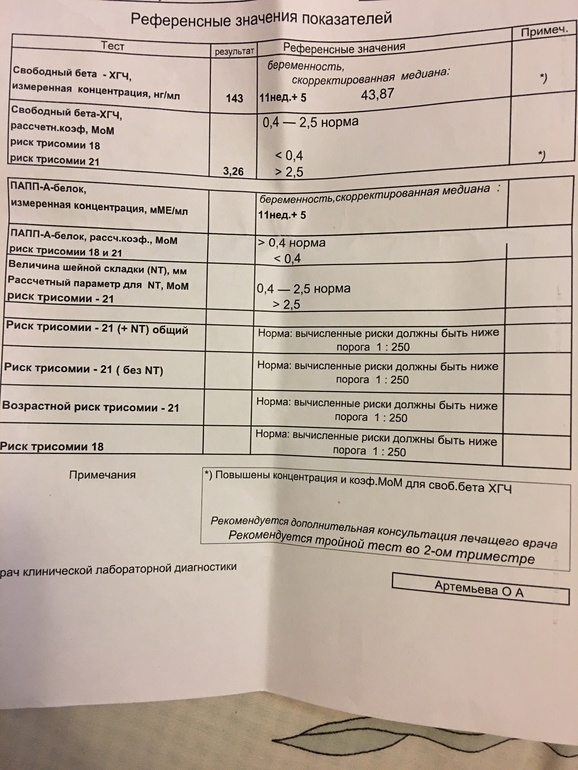


 Распространеннос
Распространеннос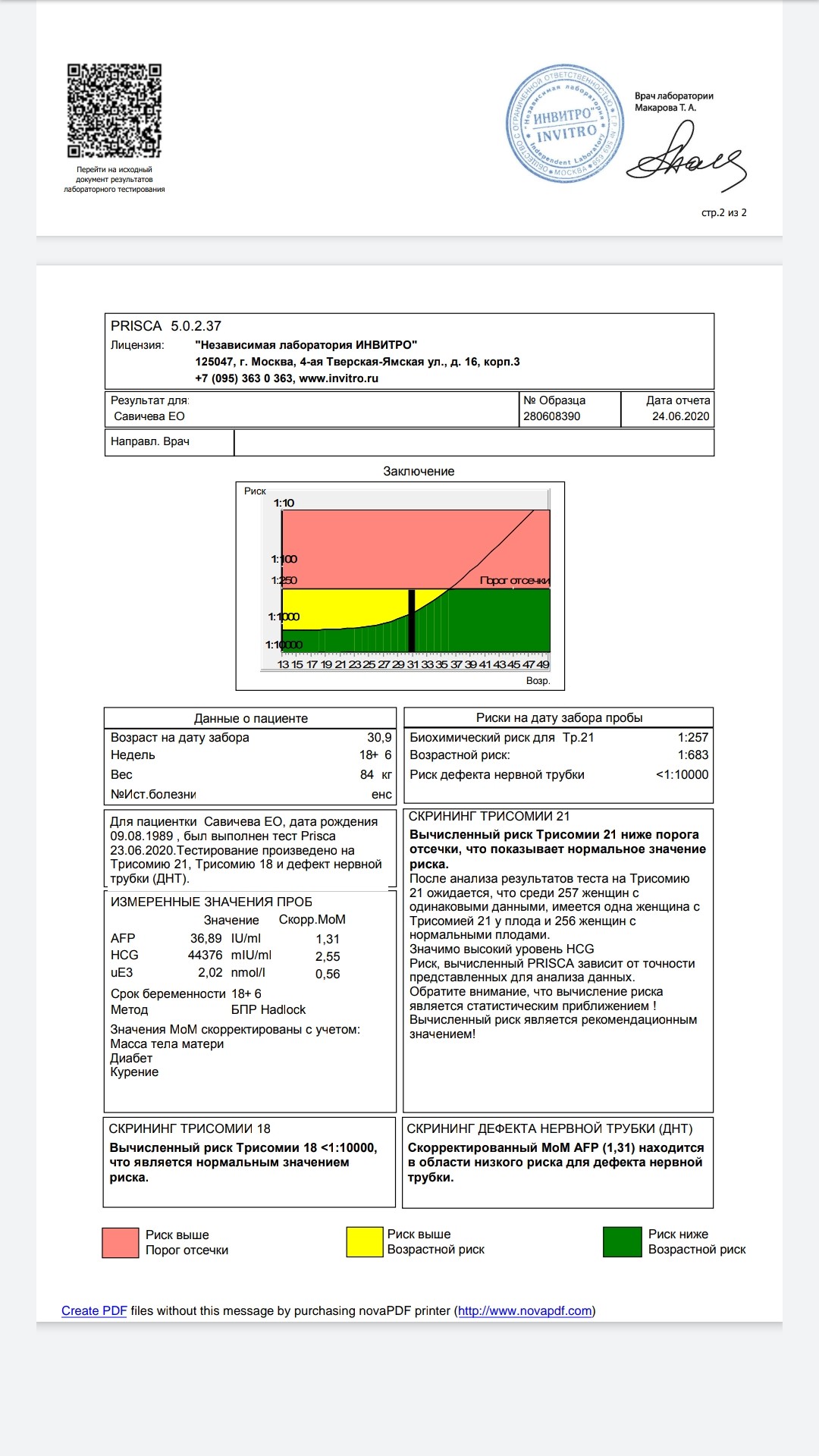 Сопровождается множественными пороками развития у плода.
Сопровождается множественными пороками развития у плода.