Анализ крови Екатеринбург. СМТ — СМТ Клиника
Анализ крови – самый популярный вид лабораторной диагностики.
Кровь содержит информацию о происходящих в организме процессах и «сигнализирует» о наличии сбоев. Анализ крови является основой для диагностики многих заболеваний, даёт представление о работе организма в целом, помогает подобрать подходящее лечение. Это — наиболее простое, но информативное исследование.
Анализ крови определяет наличие:
- вирусов
- бактериальных или грибковых инфекций
- антител к определенным белкам
- гормонов
- генетических рисков
- беременности раньше, чем другие тесты.
Направляют пациента в лабораторию для сдачи анализа крови разные специалисты:
- терапевт
- гастроэнтеролог
- дерматолог
- гормонов
- гинеколог
- эндокринолог
- многие другие специалисты
Современные методики позволяют по анализу крови оценить работу внутренних органов, получить информацию об обмене веществ, понять, нуждается ли организм человека в микроэлементах.
Полное представление о происходящих в организме гормональных процессах получают после анализа крови на гормоны. Его назначают эндокринолог, гинеколог, уролог-андролог и другие врачи. Благодаря анализу оценивают работу щитовидной железы, половой системы.
Как подготовиться к анализу крови?
- кровь сдают натощак, желательно в утреннее время;
- перед сдачей нужно выпить 200мл воды (за исключением детей), исключить кофе, чай, соки.
Забор анализа длится меньше минуты – медицинская сестра дезинфицирует место укола, с помощью иглы забирает из вены требуемое количество крови, делает перевязку.
Результаты большинства анализов будут готовы в этот же день, часто – уже через несколько часов.
Расшифровку результатов анализа проводит врач, он же ставит диагноз. Не нужно самостоятельно или с помощью интернета ставить себе диагноза на остывании анализов.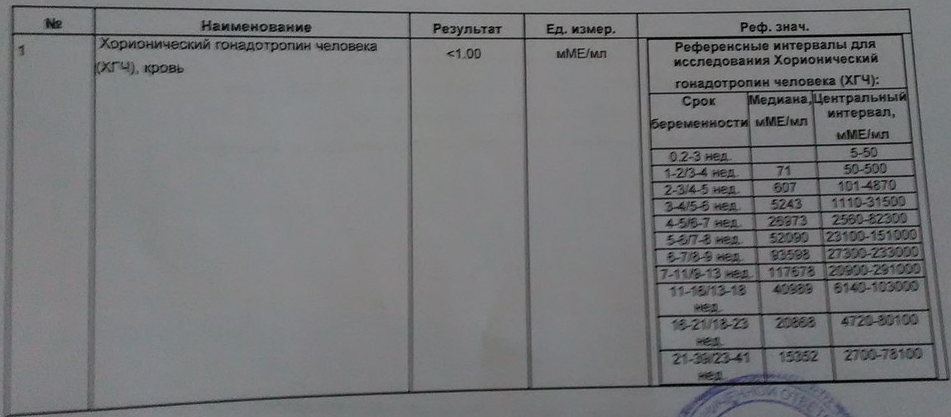 Это бесполезно.
Это бесполезно.
СМТ-Клинике сдача крови на анализ происходит быстро, комфортно и без очередей. Клиника гарантирует точность лабораторной диагностики.
В нашей клиники забор осуществляется бесплатно и входит стоимость анализа.
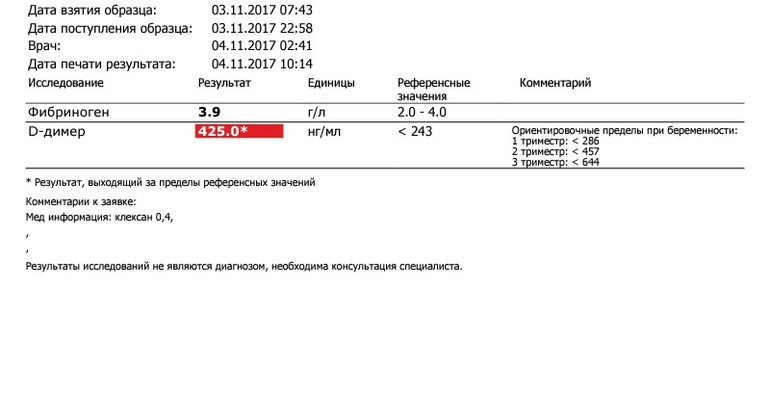
Расшифровка результатов 1 скрининга при беременности
Комбинированный пренатальный скрининг проводится на 11-14 неделе беременности при размере эмбриона не менее 45 мм и не более 84 мм. Это комплексное обследование плода для оценки параметров его развития. Основная его задача – раннее выявление пороков развития плода, профилактика детской инвалидности, снижение младенческой и детской смертности.
Первый скрининг состоит из инструментальной части – проведение УЗИ и лабораторной – анализ крови на определение концентрации хорионического гонадотропина (βХГЧ) и ассоциированного с беременностью протеина А (РАРР-А). Совокупные результаты этих показателей позволяют спланировать тактику ведения беременности.
Почему обследование проводится на сроке 11-14 недель
Первый триместр – это период формирования всех органов и структур организма. К концу первого триместра заканчивается эмбриональный и начинается фетальный период развития плода. Именно в сроке от 11 недель 1 дня до 13 недель 6 дней беременности наиболее хорошо визуализируются эхографические маркеры хромосомных аномалий.
Кому нужно пройти обследование
По результатам исследования можно судить о риске рождения детей с хромосомными болезнями и врожденными пороками развития, поэтому рекомендуется внимательно отнестись к вопросу и обследоваться всем беременным. Показаниями к обязательному пренатальному скринингу первого триместра являются:
- Женщины, у которых в анамнезе есть самопроизвольные аборты, внематочные и замершие беременности, преждевременные роды, мертворождение, рождение ребенка с аномалиями развития.
- Наследственные заболевания в семье у матери или отца ребенка
- Перенесенное в первом триместре заболевание с лечением антибиотиками или препаратами, противопоказанными во время беременности.

- Брак между родственниками.
- Возраст женщины старше 35 лет.
- Наличие профессиональных вредностей
Как подготовиться
Подготовка к первому скринингу выражается в щадящей диете. Погрешности питания могут сказаться на общем состоянии женщины и снизить точность результатов. За неделю до обследования:
- Из рациона нужно исключить соленое, острое, жирное, жареное.
- Не употреблять аллергенных продуктов.
- Отказаться от газированных напитков.
За сутки до скрининга:
- Не есть шоколад, морепродукты, жирное мясо, мучное, ограничить сладости.
- Если исследование назначено на утро, съесть легкий ужин не позже 20:00 часов.
Желательно соблюдать умеренную физическую активность, если для этого нет противопоказаний. Также важны прогулки, полноценный отдых.
Проведение обследования
Анализ крови и УЗИ выполняются в один день, чтобы избежать погрешностей из-за разницы срока.
- УЗИ-скрининг проводится первым, так как его результаты позволяют установить точный срок гестации, который влияет на нормативные значения уровня гормонов. Исследование проводят как трансабдоминальным доступом, так и трансвагинально. Процедура безболезненна, безопасна для женщины и ребенка, не имеет противопоказаний.
- Кровь сдается из вены натощак или через 4 часа после приема пищи. Забор материала производится в день проведения УЗИ. Исследование определяет концентрацию гормонов и сравнивает с нормативными показателями.
Только по расшифровке результатов УЗИ и анализа на гормоны делается вывод о возможных рисках.
Что показывает УЗИ
На скрининге при беременности производится фетометрия плода – определение размеров частей тела и оцениваются все анатомические структуры.
Полученные результаты сравниваются со статистической таблицей, в которой указан процентиль попадания в выборку нормативных значений.
Во время ультразвукового исследования в 1 триместре оценивают следующие параметры: кости свода черепа и головной мозг, позвоночник, передняя брюшная стенка, конечности плода, структуры лица, органы грудной клетки и брюшной полости, а также основные эхографические маркеры хромосомных аномалий.
Толщина воротникового пространства (ТВП)
Область между внутренней поверхностью кожи плода и наружной поверхностью мягких тканей, покрывающих шейный отдел позвоночника. ТВП считается наиболее важным маркером хромосомных аномалий.
Это пространство после 13 недели начинает уменьшаться, поэтому возможность его оценить есть только на первом скрининге.
| Срок беременности | Толщина воротниковой зоны в мм | |||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | ||
| 11 недель | 0,8 | 1,6 | 2,4 | |
| 12 недель | 0,7 | 1,6 | 2,5 | |
| 13 недель | 0,7 | 1,7 | 2,7 | |
Несоответствие результатов нормативным значениям говорит о повышенном риске развития хромосомных патологий.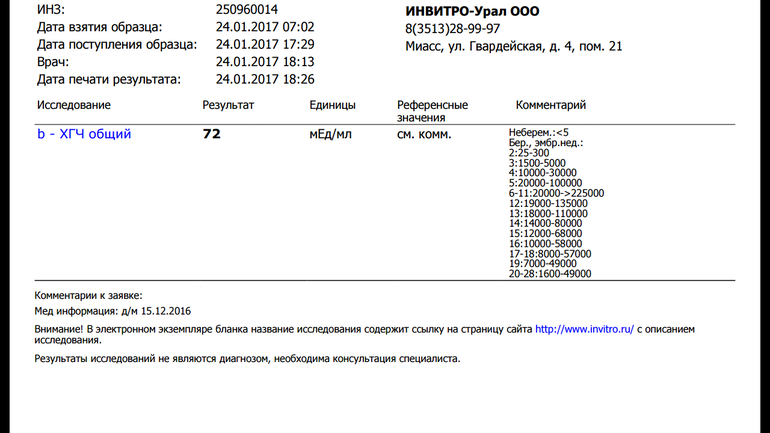 В зависимости от сформировавшегося набора хромосом, это могут быть синдром Дауна, Патау, Эдвардса, Шерешевского-Тернера. Для уточнения диагноза в этом случае могут быть назначены биопсия хориона или плаценты, анализ пуповинной крови, околоплодных вод. Только после проведения дополнительных исследований можно поставить точный диагноз.
В зависимости от сформировавшегося набора хромосом, это могут быть синдром Дауна, Патау, Эдвардса, Шерешевского-Тернера. Для уточнения диагноза в этом случае могут быть назначены биопсия хориона или плаценты, анализ пуповинной крови, околоплодных вод. Только после проведения дополнительных исследований можно поставить точный диагноз.
Копчико-теменной размер (КТР)
Показывает расстояние между копчиковой и теменной костями. По этому параметру на УЗИ определяют точный срок гестации, а также устанавливают соотношение массы плода к его КТР.
Незначительное отклонение от норм говорит об особенностях телосложения и не является поводом для беспокойства.
| Срок беременности | Копчико-теменной размер в мм | |||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | ||
| 11 недель | 34 | 42 | 50 | |
| 12 недель | 42 | 51 | 59 | |
| 13 недель | 51 | 63 | 75 | |
Если скрининг при беременности показал результаты, превышающие нормы, это указывает, что плод достаточно крупный. Показатель существенно меньше говорит либо о неправильно определенном сроке гестации (в этом случае проводится повторное обследование через 1-1,5 недели), либо о замедлении развития вследствие внутриутробной гибели, нарушенного гормонального фона или инфекционного заболевания матери, генетических отклонений.
Показатель существенно меньше говорит либо о неправильно определенном сроке гестации (в этом случае проводится повторное обследование через 1-1,5 недели), либо о замедлении развития вследствие внутриутробной гибели, нарушенного гормонального фона или инфекционного заболевания матери, генетических отклонений.
Кости свода черепа и головной мозг
Уже с 11 недели при УЗ-исследовании можно обнаружить дефекты костей черепа, что говорит о тяжелых пороках развития плода, несовместимых с жизнью. Оценка головного мозга основана на изучении так называемой «бабочки» – сосудистых сплетений боковых желудочков. Четкая визуализация и ее симметричность говорит о нормальном развитии головного мозга.
| Срок беременности | БПР, ЛЗР в мм | |||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | ||
| 11 недель | 13,19 | 17,21 | 21,23 | |
| 12 недель | 19,22 | 21,24 | 24,26 | |
| 13 недель | 20,26 | 24,29 | 28,32 | |
Носовая кость
К концу триместра она должна быть сформирована, четко визуализироваться.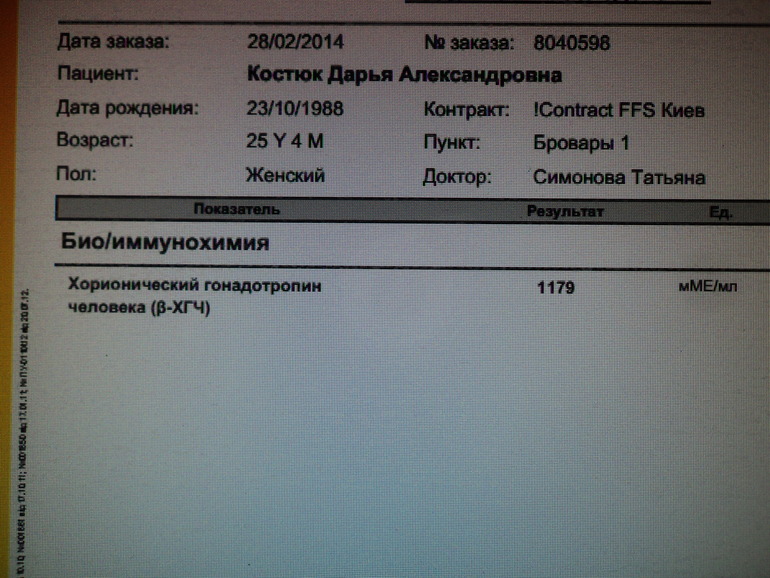
| Срок беременности | Носовая кость в мм | |||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | ||
| 11 недель | визуализируется, не измеряется | визуализируется, не измеряется | визуализируется, не измеряется | |
| 12 недель | 2 | 3,1 | 4,2 | |
| 13 недель | 2 | 3,1 | 4,2 | |
Патологией носовой кости считается ее отсутствие, гипоплазия (очень маленькие размеры) и изменение ее эхогенности.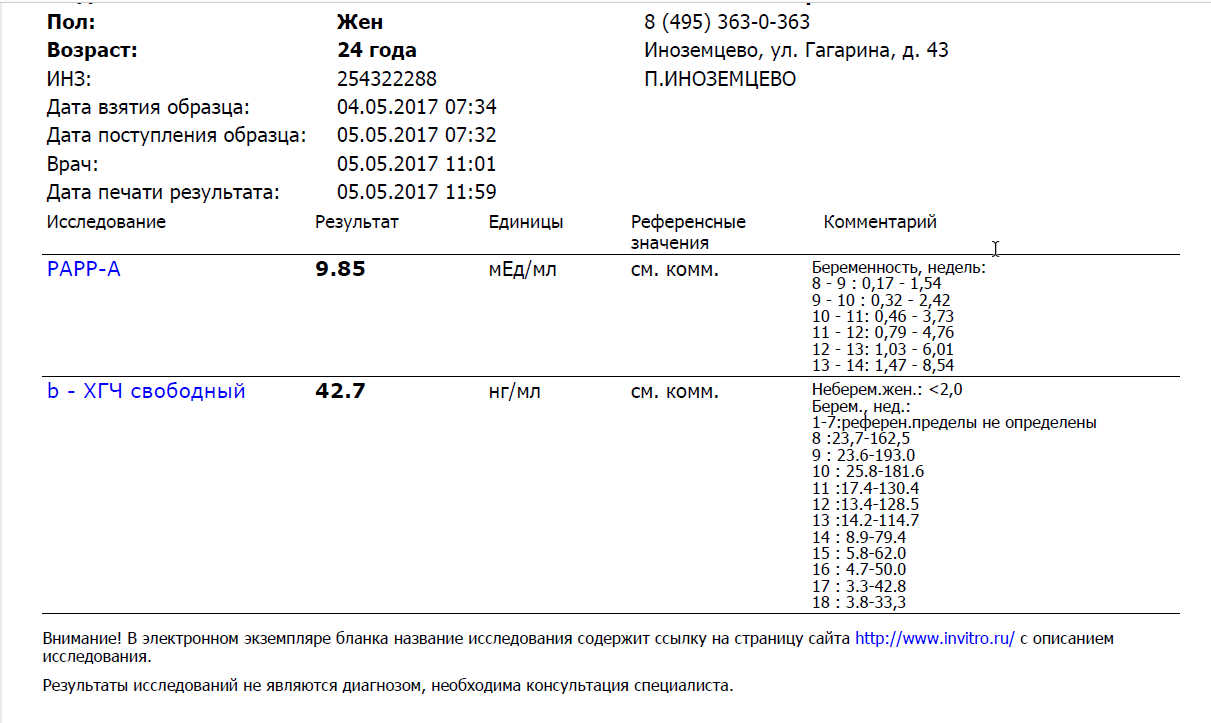
Диаметр грудной клетки, окружность головы и живота, длина бедренной кости также позволяют судить о пропорциональности развития.
Состояние сердца
При исследовании сердца оценивается его расположение, устанавливается наличие четырех камер сердца – два предсердия и два желудочка и оценивается их симметричность. Измеряется частота сердечных сокращений.
| Срок беременности | Частота сердечных сокращений в ударах за минуту | |||
| Процентиль 5 | Процентиль 50 | Процентиль 95 | ||
| 11 недель | 153 | 165 | 177 | |
| 12 недель | 150 | 162 | 174 | |
| 13 недель | 147 | 159 | 171 | |
Венозный проток (ВП) – прямая коммуникация между пупочной веной и центральной венозной системой. При нормально развивающейся беременности кровоток в ВП представляет собой трехфазную кривую. Появление реверсного кровотока может говорить о наличии патологии плода.
При нормально развивающейся беременности кровоток в ВП представляет собой трехфазную кривую. Появление реверсного кровотока может говорить о наличии патологии плода.
Что показывает анализ крови
Результаты УЗИ сопоставляются с показателями ассоциированного с беременностью протеина А из плазмы матери (PAPP-A) и хорионическим гонадотропином человека (ХГЧ). Значения приведены в таблице:
| Срок беременности | ХГЧ в нг/мл | PAPP-A в мЕд/л |
| 11 недель | 17,4 – 130,4 | 0,46 – 3,73 |
| 12 недель | 13,4 – 128,5 | 0,79 – 4,76 |
| 13 недель | 14,2 – 114,7 | 1,03 – 6,01 |
Отличия от референсных значений может говорить о патологиях матери или плода.
| Отклонение | ХГЧ | PAPP-A |
| Выше нормы |
|
|
| Ниже нормы |
|
|
Интерпретация обследования
Первое исследование оценивается только по совокупности всех показателей. Отдельно взятый параметр не может стать основанием для точного заключения. В протоколе фиксируются данные УЗИ, анализа на гормоны, отражаются риски вероятных заболеваний и комплексный медианный коэффициент MoM. Он указывает совокупное отклонение полученных результатов от средних значений. Коэффициент должен находиться в интервале от 0,5 до 2,5. Рассчитывается он специализированными программами.
Что может повлиять на результат
- Неправильная подготовка, особенности состояния женщины.
- Устаревшее оборудование с низкой точностью измерений и недостаточным разрешением.
- Квалификация врача кабинета УЗИ, ошибки в расшифровке.
- Правильность алгоритмов расчета MoM.
Современное диагностическое оборудование позволяет оценить более 15 параметров плода, построить его объемную реконструкцию для исследования органов на ранних периодах развития, рассчитать возможные риски с высокой точностью.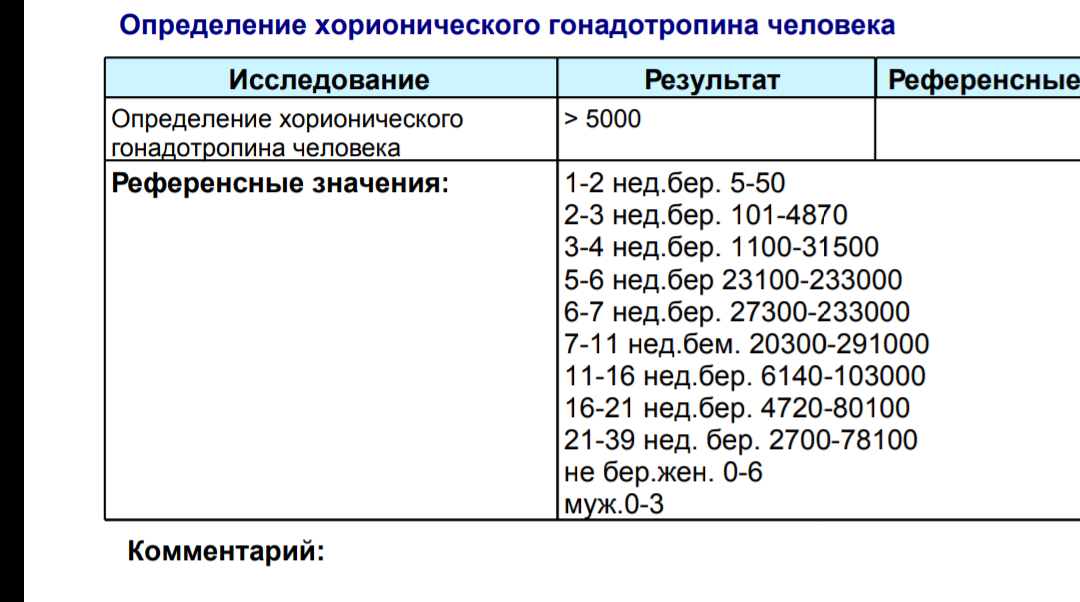 Обращайтесь в хорошо оснащенные клиники и доверяйте специалистам с подтвержденной квалификацией.
Обращайтесь в хорошо оснащенные клиники и доверяйте специалистам с подтвержденной квалификацией.
Расшифровка результата анализа крови на хгч — Вопрос гинекологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 74 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского онколога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, липидолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.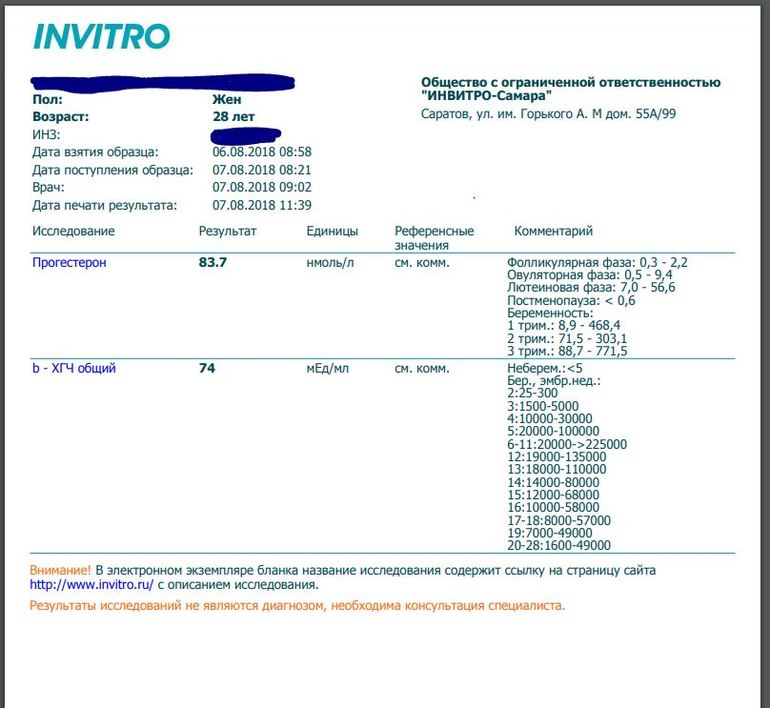
Мы отвечаем на 97.42% вопросов.
Оставайтесь с нами и будьте здоровы!
Гормоны ХГЧ: что такое гормоны ХГЧ и как они влияют на беременность
Каждая здоровая беременность требует определенного уровня гормона ХГЧ, который можно определить с помощью теста на беременность. Уровни вашего гормона ХГЧ могут сказать, беременны ли вы, но уровни ХГЧ могут рассказать о вашей беременности больше. Читайте дальше, чтобы узнать больше.Что такое ХГЧ?
Полной формой ХГЧ является хорионический гонадотропин человека, который вырабатывается внешним слоем структуры ранней беременности и до эмбриона, называемой бластоцистой.Этот внешний слой снабжает эмбрион питательными веществами, а затем образует часть плодных оболочек и плаценты. Наличие гормона ХГЧ обычно является признаком беременности, но также может означать внематочную беременность. Внематочная беременность – это когда оплодотворенная яйцеклетка имплантируется не в матку, а в другое место.

Как измерить ХГЧ? Легкодоступные домашние тесты на беременность могут определить ХГЧ в моче, как только он достигнет 25 мМЕ/мл или более. Существуют также наборы, известные как наборы для раннего обнаружения, которые могут обнаруживать, даже когда уровень ХГЧ составляет всего 10 мМЕ/мл.Эти тесты не сообщают точные уровни гормона ХГЧ, а просто показывают, достаточно ли они высоки, чтобы указать на беременность.
Хотя анализы крови более чувствительны, поскольку они могут определить беременность раньше, чем анализ мочи. Уровни также могут подтвердить точную стадию беременности. Если у вас нет каких-либо осложнений беременности, вам не нужно будет проверять уровень ХГЧ после подтверждения беременности.
Что такое здоровый уровень ХГЧ?
Уровни ХГЧ сильно различаются в течение всей беременности.Во время здоровой беременности уровень ХГЧ повышается на 50% каждые 48 часов. Пик уровня ХГЧ приходится на 10 недель.
Вот график диапазона ожидаемых уровней в разное время:
Менее 1 недели от 5 до 50 мМЕ/мл
1–2 недели 50–500 мМЕ/мл
2–3 недели 100–5000 мМЕ/мл
3–4 недели 500–10 000 мМЕ/мл
4–5 недель 1000–50 000 мМЕ/мл
5–6 недель 10 000–100 000 мМЕ/мл
от 6 до 8 недель от 15 000 до 200 000 мМЕ/мл
от 8 до 12 недель от 10 000 до 100 000 мМЕ/мл
Что делать, если уровень ХГЧ слишком низкий?
Низкий уровень ХГЧ может быть просто признаком ранней беременности.
 Но если через несколько дней они не увеличиваются, это может свидетельствовать о внематочной беременности. Вы можете это сделать только тогда, когда сделаете два анализа крови с промежутком в несколько дней.
Но если через несколько дней они не увеличиваются, это может свидетельствовать о внематочной беременности. Вы можете это сделать только тогда, когда сделаете два анализа крови с промежутком в несколько дней. Что делать, если уровень ХГЧ слишком высок?
Высокие уровни ХГЧ могут сигнализировать о двойне или тройне, но также могут указывать на гестационную трофобластическую болезнь (ГТЗ). Если ваши ранние показания ХГЧ слишком высоки, вам необходимо обратиться к врачу, чтобы узнать точную причину. Ваш врач может также попросить вас проверить уровень ХГЧ на более поздних сроках беременности, если вы испытываете гиперемезис беременных (сильную утреннюю тошноту), тиреоидный шторм и вагинальное кровотечение, которые являются симптомами ГТД.
Когда уровень ХГЧ вернется к уровню до беременности?
При нормально протекающей беременности уровень ХГЧ возвращается к норме через шесть недель после родов.
Что такое тест на беременность с ХГЧ?
Анализ крови на общий ХГЧ используется для ранней диагностики беременности, когда тест-полоска еще не способна определить результат. При отсутствии патологий уровень гормона в первые недели беременности удваивается каждые 2 дня, максимум достигается к 10-11 неделе.
При отсутствии патологий уровень гормона в первые недели беременности удваивается каждые 2 дня, максимум достигается к 10-11 неделе.
Рекомендуется проводить исследование не ранее чем на 3-6 день задержки менструации во избежание ложноотрицательных результатов. В случае сомнительных результатов тест следует провести дважды с интервалом в 2-3 дня. При определении полноты удаления внематочной беременности или аборта тест на ХГЧ проводят через 1-2 дня после операции, для исключения ложноположительного результата.
Исследование проводят утром натощак. С момента последнего приема пищи должно пройти не менее 8 часов.
Для разных категорий пациентов нормальный уровень ХГЧ индивидуален. Самостоятельно расшифровать анализ можно, но достоверность ваших выводов будет под вопросом. В любом случае диагностировать результат должен специалист.
Учитывать нормативные значения:
- У здоровых мужчин уровень ХГЧ в крови должен быть в пределах до 2,5 мЕд/мл.

- У здоровых женщин, не вынашивающих ребенка, результат теста покажет от 0 до 5 мЕд/мл
Беременным результат исследования хорионического гонадотропина меняется буквально каждые 1-2 недели:
- в 1-ю неделю колеблется от 20 до 150 мЕд/мл;
- на 2-3-й неделе растет со 100 до 4870 мЕд/мл;
- на 4 неделе результат примерно 2500–82 000 мЕд/мл;
- на 5-й неделе уровень ХГЧ в крови может достигать 151 000 МЕ/мл;
- на 6 неделе развития плода верхний показатель может составлять 233 000 МЕ/мл; показатели
- 7-10 недель — 20900-2 мЕд/мл;
- к 16 неделе уровень ХГЧ падает и может колебаться от 6150 до 103000 мЕд/мл;
- к 20 неделе в анализе беременной значения ХГЧ колеблются от 4730 до 80000 мЕд/мл;
- с 21 по 39 неделю, интервал показателей 2700–78000 мЕд/мл.
Следует учитывать, что нормы исследовательских центров могут отличаться. Поэтому рекомендуется обратиться в ту же лабораторию, где проводилось обследование, для расшифровки результатов анализа.
Опосредованные хорионическим гонадотропином человека иммунные реакции, способствующие имплантации эмбриона и плацентации
Abstract
Хорионический гонадотропин человека (ХГЧ) служит одним из первых сигналов, подаваемых эмбрионом матери.Именно в то время, когда начинается первый этап процесса имплантации и бластоциста прикрепляется к материнскому эндометрию, эмбриональная ткань начинает активно секретировать ХГЧ. Вскоре после этого гормон может быть обнаружен в материнском кровотоке, где его концентрация неуклонно увеличивается на протяжении всей ранней беременности, поскольку он постоянно высвобождается формирующейся плацентой. Накапливающиеся данные подчеркивают критическую функцию ХГЧ для имплантации эмбриона и плацентации. ХГЧ не только регулирует биологические аспекты этих ранних событий беременности, но также поддерживает материнские иммунные клетки в их функции помощников в установлении адекватных отношений между эмбрионом и эндометрием.Ввиду своего раннего присутствия в материнском кровотоке, ХГЧ может влиять как на местные популяции иммунных клеток матки, так и на периферические. Настоящий обзор призван обобщить недавнюю литературу об участии врожденных и адаптивных иммунных клеток в имплантации эмбриона и плацентации с особым акцентом на их регуляцию с помощью ХГЧ.
Настоящий обзор призван обобщить недавнюю литературу об участии врожденных и адаптивных иммунных клеток в имплантации эмбриона и плацентации с особым акцентом на их регуляцию с помощью ХГЧ.
Ключевые слова: хорионический гонадотропин человека, иммунные клетки матки, имплантация эмбриона, плацентация, толерантность плода, беременность стадия морулы входит в полость матки.Здесь, превратившись в бластоцисту, эмбрион начинает имплантироваться в материнский эндометрий (). Процесс имплантации инициируется реакцией аппозиции с последующей адгезией клеток трофобласта бластоцисты к эпителиальному слою эндометрия. Впоследствии клетки трофобласта начинают пролиферировать, дифференцироваться, пересекать базальную мембрану эпителия и проникать в строму эндометрия, образуя плаценту (1). Спиральные артерии матки (ССА), расположенные в строме, становятся мишенью для инвазивных клеток трофобласта, которые замещают слой эндотелиальных клеток и провоцируют изменения белков внеклеточного матрикса.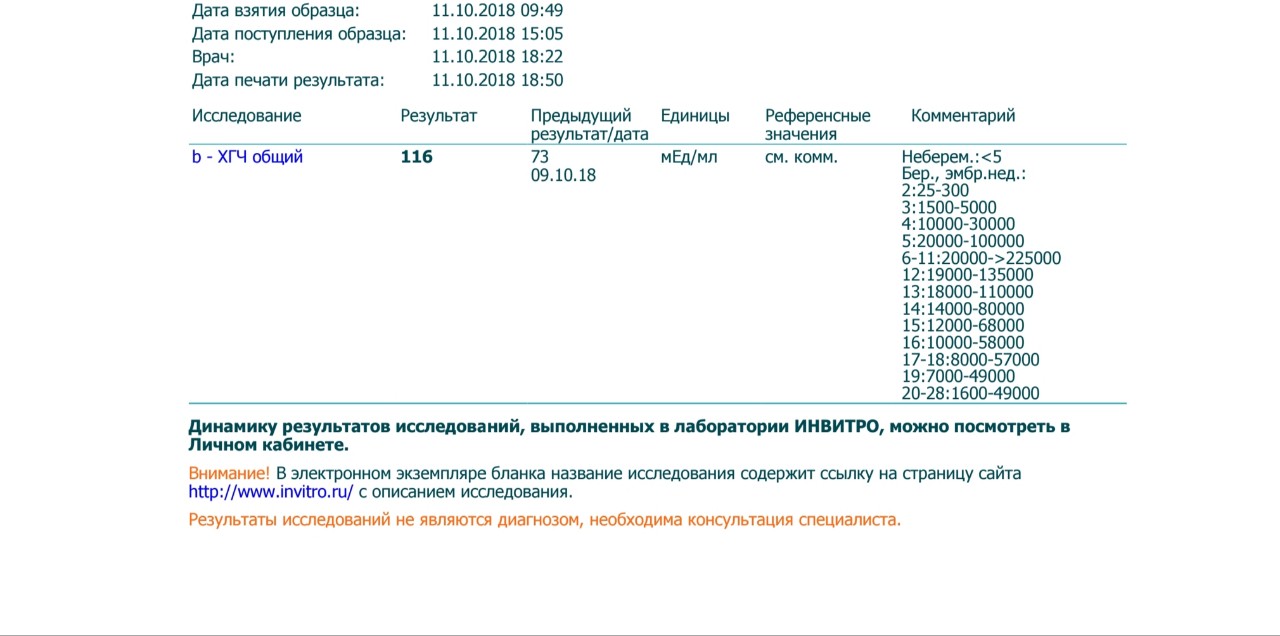 Следовательно, материнские СА перестраиваются из сосудов с высоким сопротивлением в сосуды с низким сопротивлением с целью гарантировать высокий кровоток от матери к плоду к середине второго триместра и убедиться, что плод снабжается достаточным количеством питательных веществ для адекватного развития плода. развитие (2). Нарушения плацентации из-за неглубокой инвазии трофобласта связаны с поздними неблагоприятными исходами беременности, такими как задержка внутриутробного развития (ЗВУР) и преэклампсия с ранним началом (ПЭ) (3) ().Кроме того, на материнской стороне стромальные клетки эндометрия дифференцируются в специализированный тип клеток, называемый клетками децидуальной оболочки, посредством процесса, называемого децидуализацией (4). Это структурное и функциональное ремоделирование маточного ложа сильно опосредовано стероидными гормонами прогестероном (Р4) и эстрогеном (Е2) (5). Кроме того, различные факторы роста, цитокины, простагландины, ферменты, разрушающие матрикс, и их ингибиторы, а также молекулы адгезии организуют диалог между плодом и матерью и обеспечивают своевременное четко определенное развитие очень сложного процесса имплантации (6).
Следовательно, материнские СА перестраиваются из сосудов с высоким сопротивлением в сосуды с низким сопротивлением с целью гарантировать высокий кровоток от матери к плоду к середине второго триместра и убедиться, что плод снабжается достаточным количеством питательных веществ для адекватного развития плода. развитие (2). Нарушения плацентации из-за неглубокой инвазии трофобласта связаны с поздними неблагоприятными исходами беременности, такими как задержка внутриутробного развития (ЗВУР) и преэклампсия с ранним началом (ПЭ) (3) ().Кроме того, на материнской стороне стромальные клетки эндометрия дифференцируются в специализированный тип клеток, называемый клетками децидуальной оболочки, посредством процесса, называемого децидуализацией (4). Это структурное и функциональное ремоделирование маточного ложа сильно опосредовано стероидными гормонами прогестероном (Р4) и эстрогеном (Е2) (5). Кроме того, различные факторы роста, цитокины, простагландины, ферменты, разрушающие матрикс, и их ингибиторы, а также молекулы адгезии организуют диалог между плодом и матерью и обеспечивают своевременное четко определенное развитие очень сложного процесса имплантации (6). Однако имплантация эмбриона и плацентация зависят не только от наличия отдельных молекул, но также зависят от наличия различных популяций иммунных клеток. Эти популяции иммунных клеток находятся в децидуальной ткани и часто являются высокоспециализированными по сравнению с их периферическими аналогами. Уникальные фенотипические и функциональные особенности позволяют им не только переносить чужеродные отцовские антигены, экспрессируемые тканью плода, но и активно участвовать в различных этапах процедуры имплантации.Иммунологические нарушения регуляции часто становятся причиной случаев идиопатического бесплодия и невынашивания беременности, лежащих в основе значения материнской иммунной системы для здорового течения беременности.
Однако имплантация эмбриона и плацентация зависят не только от наличия отдельных молекул, но также зависят от наличия различных популяций иммунных клеток. Эти популяции иммунных клеток находятся в децидуальной ткани и часто являются высокоспециализированными по сравнению с их периферическими аналогами. Уникальные фенотипические и функциональные особенности позволяют им не только переносить чужеродные отцовские антигены, экспрессируемые тканью плода, но и активно участвовать в различных этапах процедуры имплантации.Иммунологические нарушения регуляции часто становятся причиной случаев идиопатического бесплодия и невынашивания беременности, лежащих в основе значения материнской иммунной системы для здорового течения беременности.
Гипотетический сценарий участия хорионического гонадотропина человека и иммунных клеток в овуляции и имплантации эмбриона. (A) Вырабатываемые гипофизом ЛГ и p-hCG индуцируют секрецию CCL20 яичников, что, в свою очередь, способствует притоку лейкоцитов с периферии в яичник.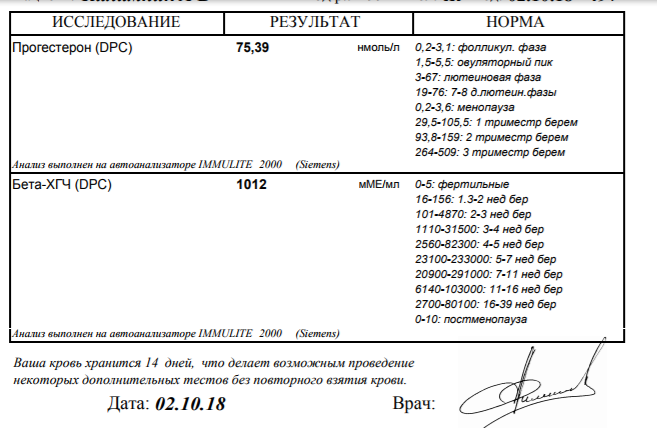 Предполагается, что DC и MØ яичников активно участвуют в процессе овуляции. B -2 и -9, а также путем ингибирования эндометриальной экспрессии ПРЛ, IGFBP-1, M-CSF и TIMP. (C) Децидуальные врожденные и адаптивные иммунные клетки поддерживают имплантацию эмбриона, продуцируя и секретируя различные факторы, указанные помимо каждого типа иммунных клеток и частично индуцируемые ХГЧ.Кроме того, ХГЧ обеспечивает толерантность плода, усиливая NK-клетки матки, клетки M2, толерогенные DC, клетки Th3, Treg и Breg, способствуя образованию NET нейтрофилами и индуцируя защитные AAb для плода в B-клетках. (D) Нейтрофилы, M0, MC, NK-клетки и Treg-клетки предложены для поддержки ремоделирования USA и питания плода. Недостаток или дисфункция этих иммунных клеток может привести к неправильному ремоделированию США с последующим недоеданием плода и ограничением роста плода. AAb, асимметричные антитела; АНГ-1/2, ангиопоэтин-1/2; AP, передняя доля гипофиза; Breg, регуляторная В-клетка; CCL20, CC-хемокиновый лиганд 20; КТ, цитотрофобласт; DC, дендритная клетка; PDGF, тромбоцитарный фактор роста; FGF, фактор роста фибробластов; ГАЛ-1/3, галектин-1/3; ГД, гликоделин; IGFBP-1, белок-1, связывающий инсулиноподобный фактор роста; H-hCG, гипергликозилированный хорионический гонадотропин человека; ИЛ, интерлейкин; ЛГ, лютеинизирующий гормон; MØ, макрофаг; МС, тучная клетка; M-CSF, макрофагальный колониестимулирующий фактор; MIF, фактор ингибирования миграции; ММР-2/9, матриксная металлопротеиназа-2/9; NETs, нейтрофильные внеклеточные ловушки; NK-клетка, естественная клетка-киллер; p-hCG, гипофизарный хорионический гонадотропин человека; PGF, плацентарный фактор роста; PP, задняя доля гипофиза; ПРЛ, пролактин; р-ХГЧ, обычный хорионический гонадотропин человека; ST, синцитиотрофобласт; TGF-β, трансформирующий фактор роста-β; ТИМПы, тканевые ингибиторы матриксных металлопротеиназ; Treg, регуляторные Т-клетки; США, маточная спиральная артерия; VEGF, фактор роста эндотелия сосудов.
Предполагается, что DC и MØ яичников активно участвуют в процессе овуляции. B -2 и -9, а также путем ингибирования эндометриальной экспрессии ПРЛ, IGFBP-1, M-CSF и TIMP. (C) Децидуальные врожденные и адаптивные иммунные клетки поддерживают имплантацию эмбриона, продуцируя и секретируя различные факторы, указанные помимо каждого типа иммунных клеток и частично индуцируемые ХГЧ.Кроме того, ХГЧ обеспечивает толерантность плода, усиливая NK-клетки матки, клетки M2, толерогенные DC, клетки Th3, Treg и Breg, способствуя образованию NET нейтрофилами и индуцируя защитные AAb для плода в B-клетках. (D) Нейтрофилы, M0, MC, NK-клетки и Treg-клетки предложены для поддержки ремоделирования USA и питания плода. Недостаток или дисфункция этих иммунных клеток может привести к неправильному ремоделированию США с последующим недоеданием плода и ограничением роста плода. AAb, асимметричные антитела; АНГ-1/2, ангиопоэтин-1/2; AP, передняя доля гипофиза; Breg, регуляторная В-клетка; CCL20, CC-хемокиновый лиганд 20; КТ, цитотрофобласт; DC, дендритная клетка; PDGF, тромбоцитарный фактор роста; FGF, фактор роста фибробластов; ГАЛ-1/3, галектин-1/3; ГД, гликоделин; IGFBP-1, белок-1, связывающий инсулиноподобный фактор роста; H-hCG, гипергликозилированный хорионический гонадотропин человека; ИЛ, интерлейкин; ЛГ, лютеинизирующий гормон; MØ, макрофаг; МС, тучная клетка; M-CSF, макрофагальный колониестимулирующий фактор; MIF, фактор ингибирования миграции; ММР-2/9, матриксная металлопротеиназа-2/9; NETs, нейтрофильные внеклеточные ловушки; NK-клетка, естественная клетка-киллер; p-hCG, гипофизарный хорионический гонадотропин человека; PGF, плацентарный фактор роста; PP, задняя доля гипофиза; ПРЛ, пролактин; р-ХГЧ, обычный хорионический гонадотропин человека; ST, синцитиотрофобласт; TGF-β, трансформирующий фактор роста-β; ТИМПы, тканевые ингибиторы матриксных металлопротеиназ; Treg, регуляторные Т-клетки; США, маточная спиральная артерия; VEGF, фактор роста эндотелия сосудов.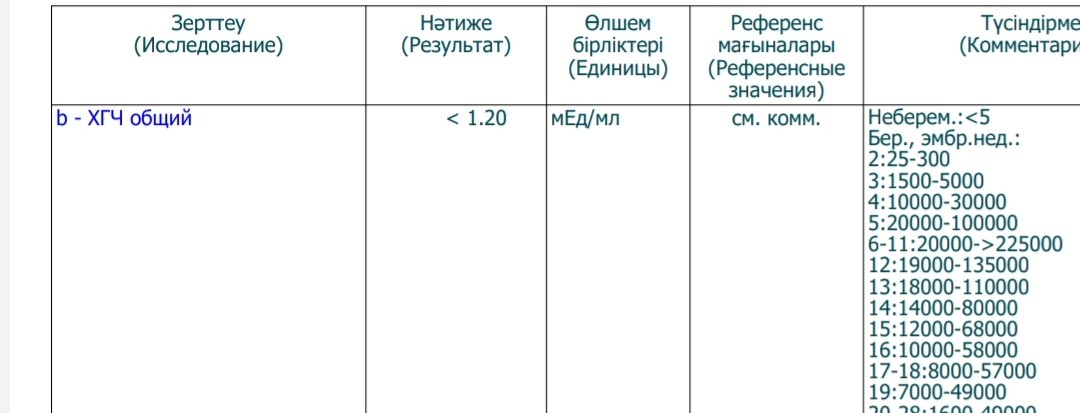
В этом обзоре будет обсуждаться современное состояние участия популяций врожденных и адаптивных иммунных клеток в имплантации эмбриона и плацентации, и особое внимание будет уделено роли гормона хорионического гонадотропина человека (ХГЧ) как иммуномодулирующего фактора в этих процессах. процессы.
ХГЧ при имплантации эмбрионов и плацентации
ХГЧ представляет собой одно из первых молекулярных сообщений, посылаемых эмбрионом перед имплантацией, для модуляции места имплантации и обеспечения своевременного начала процесса нидации.Несмотря на то, что экспрессия гена CGB была доказана уже на стадии 8-клеточного эмбриона (7), активная секреция гормона начинается на стадии бластоцисты (8) и позволяет обнаруживать ХГЧ в материнском кровотоке через 10 дней после оплодотворения. Позже ХГЧ вырабатывается в больших количествах клетками трофобласта (9), что приводит к самым высоким значениям ХГЧ между 10-й и 11-й неделями беременности. К концу первого триместра уровень ХГЧ снижается, но остается повышенным по сравнению с небеременными женщинами. Примечательно, что снижение уровня ХГЧ, по-видимому, необходимо для нормального течения беременности. Недавний метаанализ предоставил доказательства того, что повышенные уровни ХГЧ могут быть обнаружены уже в конце первого триместра у женщин с преждевременной ПЭ (10), и ХГЧ был предложен в качестве полезного предиктора развития и тяжести ПЭ (11, 12). .
Примечательно, что снижение уровня ХГЧ, по-видимому, необходимо для нормального течения беременности. Недавний метаанализ предоставил доказательства того, что повышенные уровни ХГЧ могут быть обнаружены уже в конце первого триместра у женщин с преждевременной ПЭ (10), и ХГЧ был предложен в качестве полезного предиктора развития и тяжести ПЭ (11, 12). .
К настоящему времени описано пять различных изоформ ХГЧ: обычный ХГЧ (р-ХГЧ), свободный β-ХГЧ (hCGβ), гипергликозилированный ХГЧ (H-hCG), гипергликозилированный свободный β-ХГЧ (H-hCGβ) и гипофизарный ХГЧ. (p-hCG) (13), все они имеют различные биологические функции.
r-ХГЧ, продуцируемый клетками синцитиотрофобласта, наиболее известен своей функцией спасения желтого тела и поддержания продукции P4 на ранних сроках беременности (14). Однако, хотя р-ХГЧ часто игнорируется, он оказывает более широкое влияние на пути плода и матери, обеспечивая правильную имплантацию и плацентацию. Это включает слияние клеток цитотрофобласта в многоядерную структуру синцитиотрофобласта (15), формирование пупочного кровообращения в ворсинчатой ткани и формирование пуповины (16, 17), рост органов плода (18), вклад в ангиогенез путем форсирования развития и роста аденомы (19–21) и подавления сокращений миометрия (22). Таким образом, ХГЧ нацеливается на несколько молекул, которые участвуют в децидуализации, имплантации, васкуляризации и ремоделировании тканей, таких как пролактин, инсулиноподобный фактор роста, связывающий белок-1, колониестимулирующий фактор макрофагов, фактор, ингибирующий лейкемию (LIF), фактор роста эндотелия сосудов (VEGF). ), матриксная металлопротеиназа (ММП)-9, тканевые ингибиторы ММП (ТИМП), галектин-3 и гликоделин (23–26) ().
Таким образом, ХГЧ нацеливается на несколько молекул, которые участвуют в децидуализации, имплантации, васкуляризации и ремоделировании тканей, таких как пролактин, инсулиноподобный фактор роста, связывающий белок-1, колониестимулирующий фактор макрофагов, фактор, ингибирующий лейкемию (LIF), фактор роста эндотелия сосудов (VEGF). ), матриксная металлопротеиназа (ММП)-9, тканевые ингибиторы ММП (ТИМП), галектин-3 и гликоделин (23–26) ().
H-hCG продуцируется клетками цитотрофобласта и является наиболее распространенной изоформой hCG после имплантации (27).Его основная функция заключается в том, чтобы индуцировать пролиферацию и инвазию клеток цитотрофобласта, и было сообщено, что для успешной имплантации эмбриона необходимы пропорции H-hCG, превышающие 50% от общего количества hCG (28) (). В то время как факторы роста тканей и коллагеназы положительно модулируют экспрессию H-hCG, эндотелин-1 и простагландин F2α являются отрицательными модуляторами экспрессии H-hCG (29).
Высокие уровни hCGβ и H-hCGβ также указывают на высокоинвазивные процессы, поскольку обе изоформы hCG способствуют росту и выживанию опухолевых клеток, а их присутствие связано с неблагоприятным прогнозом для пациентов (30).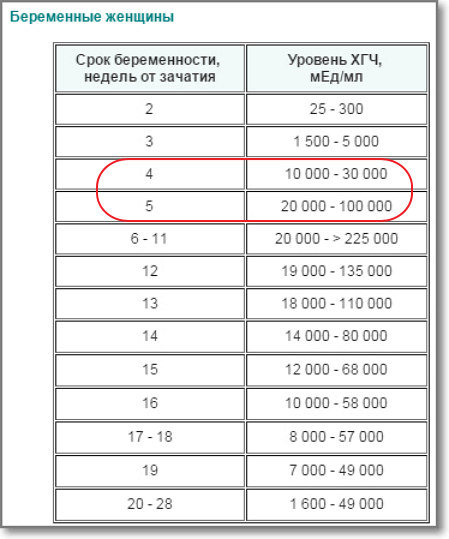 Наконец, р-ХГЧ в сотрудничестве с лютеинизирующим гормоном (ЛГ) способствует овуляции и образованию желтого тела во время менструального цикла (31).
Наконец, р-ХГЧ в сотрудничестве с лютеинизирующим гормоном (ЛГ) способствует овуляции и образованию желтого тела во время менструального цикла (31).
Клиническое применение ХГЧ в искусственных репродуктивных технологиях (ВРТ) — преимущество или недостаток?
Все больше непреднамеренно бездетных пар обращаются за помощью в медицинские центры репродукции, чтобы осуществить свое желание иметь собственного ребенка. После нескольких циклов экстракорпорального оплодотворения (ЭКО)/интрацитоплазматической инъекции сперматозоида (ИКСИ) с использованием общепринятых клинических протоколов, после которых пациенткам не удавалось забеременеть или сохранить беременность, спрос на нетрадиционные варианты лечения возрастает.Тем не менее, для большинства этих вариантов лечения до сих пор нет четких доказательств общего более высокого показателя успеха, или только определенные группы пациентов получают пользу от этих вмешательств (32). Таким образом, персонализированная медицина и разработка новых стратегий лечения пациентов с бесплодием и невынашиванием беременности крайне желательны, и ХГЧ может представлять собой многообещающую цель в этом отношении.
ХГЧ обычно применяется в двух различных препаратах, либо в виде препарата, полученного из мочи (uhCG), либо в виде рекомбинантного препарата (rhCG) в протоколах агонистов или антагонистов гонадотропин-рилизинг-гормона (33).В качестве стандартной процедуры ХГЧ вводят после стимуляции яичников, чтобы вызвать окончательное созревание ооцитов. Кроме того, некоторые пациенты получают внутриутробную инъекцию ХГЧ перед переносом эмбрионов с целью улучшения показателей имплантации (IR) и показателей живорождения (LBR). В большинстве недавно опубликованных исследований мХГЧ или рХГЧ вводят в полость матки с помощью катетера для осеменения после удаления цервикальной слизи ватным тампоном или шприцем (34–36). Некоторые дизайны исследований также включают этап промывания физиологическим раствором перед инфузией ХГЧ (37).ХГЧ вводят в различных дозах от 500 до 1000 МЕ, растворенных либо в среде, либо в физиологическом растворе, а время введения варьируется от <5 минут до нескольких дней до переноса эмбриона (38).
Как четко указано Makrigiannakis et al. в их обзорной статье 2017 г. эффективность ХГЧ при внутриматочном применении ХГЧ обсуждается неоднозначно (39). С 2011 года в нескольких метаанализах сообщалось о различных исходах в отношении ИР, частоты клинической беременности (CPR), частоты продолжающейся беременности (OPR), частоты выкидышей (MR) и LBR.Неоднородность среди различных метаанализов может быть связана со временем внутриутробного введения ХГЧ, что означает точное время введения ХГЧ до переноса эмбриона, а также время переноса эмбриона (стадия раннего дробления или стадия бластоцисты). ), выбор препарата ХГЧ и применяемой дозы ХГЧ. Подтверждающие данные об улучшении клинических параметров после внутриутробного введения ХГЧ были получены в результате метаанализа, опубликованного Ye et al. (40) и потенциальное объяснение клинической пользы представлено Strug et al.(41). Последнее предположило, что ХГЧ противодействует диссинхронии эндометрия, возникающей в результате стимуляции яичников, и способствует экспрессии маркеров, необходимых для выживания стромы эндометрия (41).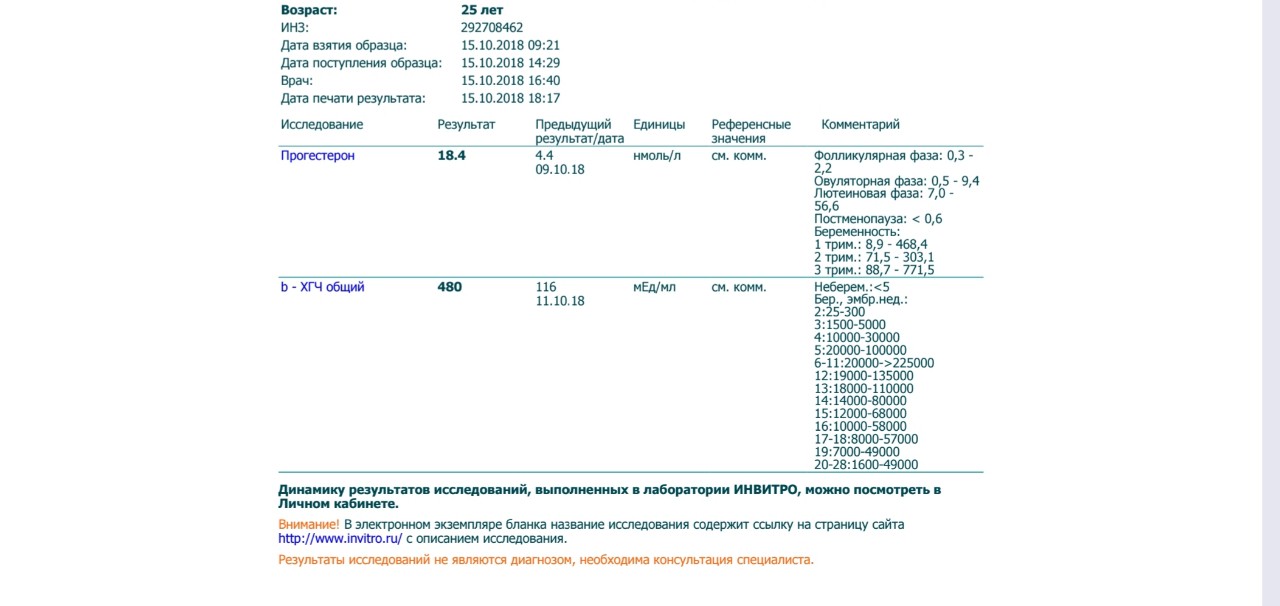 Напротив, Осман и др. (42) и Хоу и соавт. (43) не обнаружили положительного влияния на все клинические параметры или продемонстрировали улучшение только по некоторым из них. Примечательно, что Воловски и др. (44) даже продемонстрировали негативное влияние на сердечно-легочную реанимацию после внутриутробного применения ХГЧ, и это было особенно верно для пациентов без установленной повторной неудачи имплантации (RIF).
Напротив, Осман и др. (42) и Хоу и соавт. (43) не обнаружили положительного влияния на все клинические параметры или продемонстрировали улучшение только по некоторым из них. Примечательно, что Воловски и др. (44) даже продемонстрировали негативное влияние на сердечно-легочную реанимацию после внутриутробного применения ХГЧ, и это было особенно верно для пациентов без установленной повторной неудачи имплантации (RIF).
В недавнем Кокрановском обзоре Craciunas et al. (45), предполагается, что, в частности, пациенты, подвергающиеся переносу эмбрионов на стадии дробления, получающие дозу ХГЧ выше 500 МЕ, получают пользу от внутриутробной инъекции ХГЧ, но не пациенты, подвергающиеся переносу бластоцисты. Последний метаанализ 2019 года пришел к выводу, что внутриутробное введение ХГЧ перед переносом эмбрионов может значительно улучшить IR, CPR, OPR и LBR и значительно снизить MR. Эти авторы предположили, что у пациентов, получавших 500 МЕ ХГЧ за 15 минут до переноса эмбриона, можно достичь оптимальных результатов (46). Более того, недавнее исследование Huang et al. (37) предположили, что количество предшествующих неудач имплантации может влиять на эффективность внутриматочного лечения ХГЧ.
Более того, недавнее исследование Huang et al. (37) предположили, что количество предшествующих неудач имплантации может влиять на эффективность внутриматочного лечения ХГЧ.
В целом можно констатировать, что общий благоприятный эффект внутриматочной инъекции ХГЧ перед переносом эмбриона точно не доказан, и в этой области необходимо провести дополнительные исследования.
Благоприятная роль ХГЧ при беременности и в АРТ — вовлечена ли иммунная система?
Нет сомнений в том, что ХГЧ обладает разнообразными иммуномодулирующими свойствами (47, 48).Однако то, как ХГЧ поддерживает иммунные клетки в их функции контроля за имплантацией эмбриона и плацентацией, далеко от понимания. Участие иммунных клеток в процессах, связанных с беременностью, не ограничивается самой беременностью, а начинается уже во время менструального цикла, до наступления овуляции. При выбросе ЛГ индуцируется воспалительная реакция, при которой лейкоциты активно рекрутируются в яичники посредством механизма, включающего хемоаттрактант лейкоцитов CCL20.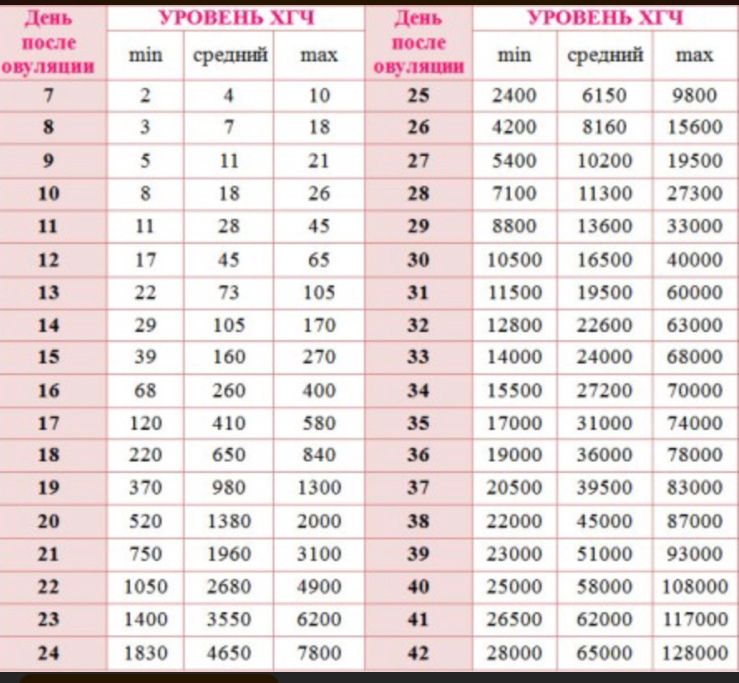 Среди этих лейкоцитов есть нейтрофилы, моноциты, естественные клетки-киллеры (NK), дендритные клетки (DC), B-клетки и T-клетки, и для некоторых из них была доказана критическая роль в процессе овуляции (49, 50).Примечательно, что ХГЧ также увеличивает экспрессию CCL20 в яичниках и тем самым стимулирует CCL20-управляемый приток лейкоцитов (51). Скорее всего, эта функция приписывается изоформе р-ХГЧ (). Более того, р-ХГЧ может индуцировать экспрессию фактора, ингибирующего миграцию макрофагов (MIF), в стромальных клетках эндометрия человека во время менструального цикла (12). Известно, что MIF модулирует иммунные реакции с его стороны и действует как фактор роста и ангиогенеза (52), особенности, которые очень важны для поддержки ремоделирования эндометриального ложа.
Среди этих лейкоцитов есть нейтрофилы, моноциты, естественные клетки-киллеры (NK), дендритные клетки (DC), B-клетки и T-клетки, и для некоторых из них была доказана критическая роль в процессе овуляции (49, 50).Примечательно, что ХГЧ также увеличивает экспрессию CCL20 в яичниках и тем самым стимулирует CCL20-управляемый приток лейкоцитов (51). Скорее всего, эта функция приписывается изоформе р-ХГЧ (). Более того, р-ХГЧ может индуцировать экспрессию фактора, ингибирующего миграцию макрофагов (MIF), в стромальных клетках эндометрия человека во время менструального цикла (12). Известно, что MIF модулирует иммунные реакции с его стороны и действует как фактор роста и ангиогенеза (52), особенности, которые очень важны для поддержки ремоделирования эндометриального ложа.
Позже, в предимплантационном периоде, локальные иммунные клеточные популяции, по-видимому, берут на себя критические функции по подготовке места имплантации. Подходы, при которых пациенты с RIF получали аутологичные мононуклеарные клетки периферической крови (PBMC) до переноса эмбрионов, приводили к значительному увеличению IR и CPR (53, 54). PBMC выделяли из периферической крови с помощью центрифугирования в градиенте плотности либо в день овуляции в циклах переноса свежих эмбрионов, либо за 5 дней до запланированных циклов переноса замороженных-оттаивающих эмбрионов.Затем PBMC культивировали и контролировали в течение 3 дней, поскольку было показано, что качество культур PBMC предсказывает эффективность переноса PBMC. В каждом случае 1 × 10 6 или 4 × 10 7 РВМС переносили в полость матки за 2 дня до переноса эмбрионов (53, 54).
PBMC выделяли из периферической крови с помощью центрифугирования в градиенте плотности либо в день овуляции в циклах переноса свежих эмбрионов, либо за 5 дней до запланированных циклов переноса замороженных-оттаивающих эмбрионов.Затем PBMC культивировали и контролировали в течение 3 дней, поскольку было показано, что качество культур PBMC предсказывает эффективность переноса PBMC. В каждом случае 1 × 10 6 или 4 × 10 7 РВМС переносили в полость матки за 2 дня до переноса эмбрионов (53, 54).
Примечательно, что РВМС, которые были активированы ХГЧ до их переноса в пациентов с РИФ, также значительно улучшали ИР, СЛР и НТР независимо от того, были ли пациенты перенесены свежие или замороженные/размороженные эмбрионы или были ли перенесены эмбрионы или бластоцисты на ранней стадии дробления ( 55–57).Более того, стало очевидным, что пациенты с более чем тремя неудачными имплантациями могут быть группой, которая особенно выигрывает от этой иммунотерапии. Было проведено несколько исследований для оценки основных механизмов регуляции имплантации ХГЧ-активированными РВМС. В одном исследовании был использован чистый мышиный материал, и было обнаружено, что адоптивный перенос РВМС от небеременных мышей мышам, страдающим дисфункцией имплантации, повышает частоту наступления беременности и увеличивает экспрессию VEGF и LIF в эндометрии во время окна имплантации (58).Другое исследование объединило РВМС человека и эмбрионы мыши. Авторы показали, что РВМС от ранних беременных женщин усиливают распространение и инвазию эмбрионов мышей в большей степени, чем РВМС от небеременных женщин. Интересно, что когда РВМС от небеременных женщин ранее подвергались воздействию ХГЧ, они обладали более высокой способностью стимулировать рост эмбриона по сравнению с необработанными РВМС (59). Кроме того, два исследования, посвященные материалу образцов человека, показали, что РВМС, полученные от женщин на раннем сроке беременности, увеличивали инвазию клеток трофобласта человека in vitro , в то время как РВМС от небеременных женщин этого не делали.После того как РВМС от небеременных женщин были обработаны ХГЧ, они продемонстрировали сравнимое воздействие на клетки трофобласта человека с РВМС от беременных женщин (60, 61), что позволяет предположить, что для инвазии трофобласта, вызванной РВМС, требуется предварительное воздействие ХГЧ.
В одном исследовании был использован чистый мышиный материал, и было обнаружено, что адоптивный перенос РВМС от небеременных мышей мышам, страдающим дисфункцией имплантации, повышает частоту наступления беременности и увеличивает экспрессию VEGF и LIF в эндометрии во время окна имплантации (58).Другое исследование объединило РВМС человека и эмбрионы мыши. Авторы показали, что РВМС от ранних беременных женщин усиливают распространение и инвазию эмбрионов мышей в большей степени, чем РВМС от небеременных женщин. Интересно, что когда РВМС от небеременных женщин ранее подвергались воздействию ХГЧ, они обладали более высокой способностью стимулировать рост эмбриона по сравнению с необработанными РВМС (59). Кроме того, два исследования, посвященные материалу образцов человека, показали, что РВМС, полученные от женщин на раннем сроке беременности, увеличивали инвазию клеток трофобласта человека in vitro , в то время как РВМС от небеременных женщин этого не делали.После того как РВМС от небеременных женщин были обработаны ХГЧ, они продемонстрировали сравнимое воздействие на клетки трофобласта человека с РВМС от беременных женщин (60, 61), что позволяет предположить, что для инвазии трофобласта, вызванной РВМС, требуется предварительное воздействие ХГЧ.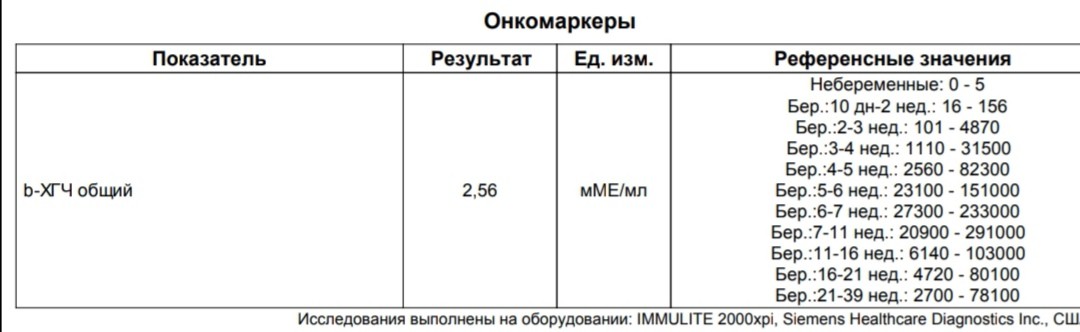 Ю и др. (61) также указали, что ХГЧ-активированные РВМС значительно увеличивали ММР-2, ММР-9 и VEGF и снижали экспрессию ТИМП-1 и ТИМП-2 в клетках трофобласта человека.
Ю и др. (61) также указали, что ХГЧ-активированные РВМС значительно увеличивали ММР-2, ММР-9 и VEGF и снижали экспрессию ТИМП-1 и ТИМП-2 в клетках трофобласта человека.
Эти результаты позволяют предположить, что введение ХГЧ пациенткам, проходящим ВРТ, будет поддерживать беременность в два этапа, которые включают материнскую иммунную систему.Во-первых, введение ХГЧ вызовет активную иммиграцию иммунных клеток в репродуктивные ткани и тем самым направит эти клетки к месту действия. Во-вторых, ХГЧ будет активировать популяции иммигрировавших и остаточных иммунных клеток в преимплантационной фазе, чтобы поддержать эти клетки в продвижении прикрепления и инвазии эмбриона, а также в форсировании процесса децидуализации.
ХГЧ-опосредованная иммунная регуляция, способствующая имплантации эмбриона и плацентации
Типы врожденных и адаптивных иммунных клеток играют ключевую роль на ранних и поздних стадиях имплантации эмбриона, а также в плацентации.ХГЧ признан ключевым фактором в этой иммуноопосредованной регуляции.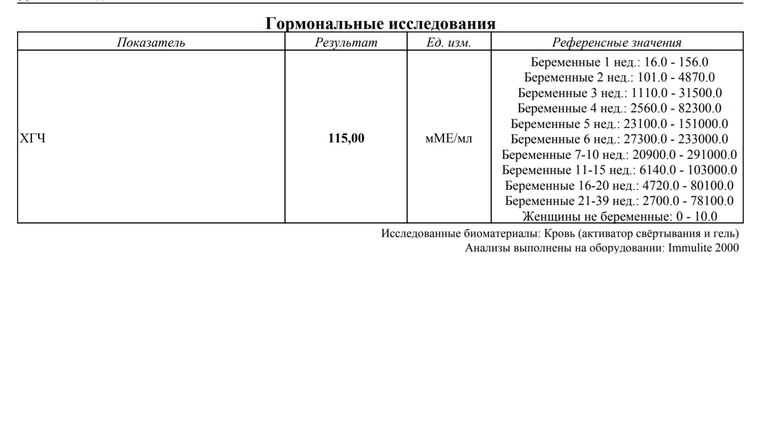 Однако еще предстоит выяснить, какие конкретные популяции иммунных клеток являются мишенями для ХГЧ и как они регулируются.
Однако еще предстоит выяснить, какие конкретные популяции иммунных клеток являются мишенями для ХГЧ и как они регулируются.
Нейтрофилы
Нейтрофилы находятся на первой линии врожденной защиты от патогенов, чтобы защитить мать и ее будущего ребенка. Их функциональный репертуар включает: фагоцитоз, продукцию гранул с мощной протеолитической активностью и микробицидных пептидов, синтез активных форм кислорода, образование нейтрофильных внеклеточных ловушек (НЭТ) и секрецию провоспалительных цитокинов и хемокинов.Кроме того, они напрямую взаимодействуют с макрофагами, ДК, NK-клетками, В-клетками и Т-клетками (62). Во время беременности образование НЭО с микробицидным воздействием считается еще одним защитным механизмом для защиты тканей плода от инфекций (63), и сообщалось, что ХГЧ стимулирует этот путь (64). У небеременных людей нейтрофилы могут быть обнаружены в шейке матки, эндометрии и фаллопиевых трубах (65, 66), в то время как у беременных нейтрофилы дополнительно проникают в децидуальную оболочку, плаценту и плодные оболочки (67, 68). При осеменении нейтрофилы специфически мигрируют и накапливаются вокруг эпителия матки (69). Здесь они берут на себя различные критические функции, связанные с ангиогенезом, ремоделированием США и инвазией трофобласта (70, 71) (10). Одной из основных молекул, вовлеченных в активность нейтрофилов в отношении процессов ремоделирования тканей, является MMP-9 (72) (3). Более того, нейтрофилы человека под влиянием Р4 и Е2 индуцируют специфическую субпопуляцию регуляторных Т (Treg) клеток с проангиогенными свойствами (73).Неизвестно, влияет ли ХГЧ на нейтрофилы подобным образом. Однако было описано, что низкие дозы ХГЧ ингибируют пролиферацию и вызывают апоптоз нейтрофилов человека (74, 75). Таким образом, ХГЧ может контролировать функцию нейтрофилов, поскольку их чрезмерная активация была доказана при неблагоприятных исходах беременности, таких как потеря плода и ПЭ (67, 76).
При осеменении нейтрофилы специфически мигрируют и накапливаются вокруг эпителия матки (69). Здесь они берут на себя различные критические функции, связанные с ангиогенезом, ремоделированием США и инвазией трофобласта (70, 71) (10). Одной из основных молекул, вовлеченных в активность нейтрофилов в отношении процессов ремоделирования тканей, является MMP-9 (72) (3). Более того, нейтрофилы человека под влиянием Р4 и Е2 индуцируют специфическую субпопуляцию регуляторных Т (Treg) клеток с проангиогенными свойствами (73).Неизвестно, влияет ли ХГЧ на нейтрофилы подобным образом. Однако было описано, что низкие дозы ХГЧ ингибируют пролиферацию и вызывают апоптоз нейтрофилов человека (74, 75). Таким образом, ХГЧ может контролировать функцию нейтрофилов, поскольку их чрезмерная активация была доказана при неблагоприятных исходах беременности, таких как потеря плода и ПЭ (67, 76).
Моноциты и макрофаги
После образования в костном мозге моноциты обычно циркулируют в периферическом кровотоке в течение нескольких дней, прежде чем они попадают в ткани и дифференцируются в тканеспецифические макрофаги. Здесь макрофаги выполняют множество различных функций, включая удаление мертвых клеток и клеточного детрита, а также представление чужеродных антигенов во время воспалительных процессов (77). Описаны два основных подтипа макрофагов: провоспалительные клетки М1 и противовоспалительные клетки М2 (78). Поскольку имплантация эмбриона представляет собой состояние контролируемого воспаления, клетки M1 являются основным подтипом макрофагов в этот период. Сразу после оплодотворения макрофаги активно рекрутируются в эндометрий, миометрий и децидуальную оболочку и представляют собой вторую по численности популяцию иммунных клеток (79).Они поддерживают ангиогенез, секретируя проангиогенные факторы, такие как VEGF-A, фактор роста фибробластов, фактор роста, полученный из тромбоцитов, и ангиопоэтин-1 и-2. Более того, хотя и не влияя непосредственно на инвазию трофобласта или организацию клеток гладкой мускулатуры, клетки M1 способствуют ремоделированию UA, индуцируя распад внеклеточного матрикса и фагоцитируя апоптотические гладкомышечные клетки сосудов (80).
Здесь макрофаги выполняют множество различных функций, включая удаление мертвых клеток и клеточного детрита, а также представление чужеродных антигенов во время воспалительных процессов (77). Описаны два основных подтипа макрофагов: провоспалительные клетки М1 и противовоспалительные клетки М2 (78). Поскольку имплантация эмбриона представляет собой состояние контролируемого воспаления, клетки M1 являются основным подтипом макрофагов в этот период. Сразу после оплодотворения макрофаги активно рекрутируются в эндометрий, миометрий и децидуальную оболочку и представляют собой вторую по численности популяцию иммунных клеток (79).Они поддерживают ангиогенез, секретируя проангиогенные факторы, такие как VEGF-A, фактор роста фибробластов, фактор роста, полученный из тромбоцитов, и ангиопоэтин-1 и-2. Более того, хотя и не влияя непосредственно на инвазию трофобласта или организацию клеток гладкой мускулатуры, клетки M1 способствуют ремоделированию UA, индуцируя распад внеклеточного матрикса и фагоцитируя апоптотические гладкомышечные клетки сосудов (80). После имплантации макрофаги должны переключиться на иммуномодулирующий фенотип М2, чтобы обеспечить толерантность к повышающимся уровням чужеродных фетальных антигенов.Этот сдвиг клеток M1 в M2, по-видимому, частично поддерживается ХГЧ, как показано в экспериментальных условиях на людях и мышах (81, 82) (81, 82). С другой стороны, ХГЧ стимулирует провоспалительные функции моноцитов и макрофагов человека (83, 84), что свидетельствует о том, что в случае инфекции ХГЧ помогает защитить плод от нападения. Примечательно, что плацентарные макрофаги человека способны продуцировать большое количество провоспалительного цитокина IL-1, который, в свою очередь, стимулирует секрецию ХГЧ клетками трофобласта человека (85), что указывает на реципрокную взаимосвязь между макрофагами и ХГЧ во время беременности.
После имплантации макрофаги должны переключиться на иммуномодулирующий фенотип М2, чтобы обеспечить толерантность к повышающимся уровням чужеродных фетальных антигенов.Этот сдвиг клеток M1 в M2, по-видимому, частично поддерживается ХГЧ, как показано в экспериментальных условиях на людях и мышах (81, 82) (81, 82). С другой стороны, ХГЧ стимулирует провоспалительные функции моноцитов и макрофагов человека (83, 84), что свидетельствует о том, что в случае инфекции ХГЧ помогает защитить плод от нападения. Примечательно, что плацентарные макрофаги человека способны продуцировать большое количество провоспалительного цитокина IL-1, который, в свою очередь, стимулирует секрецию ХГЧ клетками трофобласта человека (85), что указывает на реципрокную взаимосвязь между макрофагами и ХГЧ во время беременности.
Не менее важны макрофаги плода, называемые клетками Хофбауэра, которые инфильтрируют строму ворсинок и располагаются вблизи капилляров плода (86). Клетки Хофбауэра представляют собой фенотип М2 и в основном продуцируют IL-10 и TGF-β (87). Они способствуют плацентарному ангиогенезу, росту и ветвлению ворсинок и защищают плод от иммунологического отторжения (88, 89). Подобно децидуальным макрофагам человека (90), клетки Хофбауэра экспрессируют рецептор ЛГ/ХГ (91), что позволяет им связываться и включать ХГЧ.Эта способность имеет принципиальное значение для регулирования уровней ХГЧ на границе плода и матери и для предотвращения аберрантной генитальной дифференцировки на ранних сроках беременности (92).
Они способствуют плацентарному ангиогенезу, росту и ветвлению ворсинок и защищают плод от иммунологического отторжения (88, 89). Подобно децидуальным макрофагам человека (90), клетки Хофбауэра экспрессируют рецептор ЛГ/ХГ (91), что позволяет им связываться и включать ХГЧ.Эта способность имеет принципиальное значение для регулирования уровней ХГЧ на границе плода и матери и для предотвращения аберрантной генитальной дифференцировки на ранних сроках беременности (92).
Тучные клетки
Роль тучных клеток (ТК) в установлении, поддержании и прерывании беременности долгое время вызывала споры (93–96). Однако в настоящее время накапливаются данные о том, что ТК действительно имеют решающее значение для успеха беременности и, в частности, регулируют фундаментальные процессы на ранних сроках беременности.ТК присутствуют в матках человека (97) и грызунов (98, 99), демонстрируя смешанную популяцию различных типов ТК (97, 100). Мы показали, что самки мышей, лишенные ТК, были либо полностью неспособны к имплантации, либо были имплантированы, но демонстрировали недостаточное ремоделирование СА и аномальную плацентацию (100), что приводило к ЗВУР (101) (). Наши и другие данные также показали, что такие факторы, как VEGF (102), галектин-1 (100) и химазы (103), участвуют в опосредованной ТК активности (10). Поскольку ТК человека и мыши экспрессируют стероидные рецепторы (97, 104), предполагается, что на их функциональность влияет локальная гормональная среда.Фактически, E2 и P4 усиливают экспрессию хемокиновых рецепторов на ТК и способствуют их иммиграции в плодно-материнские границы, индуцируют продукцию медиаторов ТК и их высвобождение путем дегрануляции (104). Однако неизвестно, обладает ли ХГЧ аналогичным действием на ТК, поскольку исследовательская деятельность в этой области очень ограничена.
Наши и другие данные также показали, что такие факторы, как VEGF (102), галектин-1 (100) и химазы (103), участвуют в опосредованной ТК активности (10). Поскольку ТК человека и мыши экспрессируют стероидные рецепторы (97, 104), предполагается, что на их функциональность влияет локальная гормональная среда.Фактически, E2 и P4 усиливают экспрессию хемокиновых рецепторов на ТК и способствуют их иммиграции в плодно-материнские границы, индуцируют продукцию медиаторов ТК и их высвобождение путем дегрануляции (104). Однако неизвестно, обладает ли ХГЧ аналогичным действием на ТК, поскольку исследовательская деятельность в этой области очень ограничена.
Натуральные клетки-киллеры
Маточные NK-клетки обладают уникальным профилем, принципиально отличающим эти клетки от их периферических аналогов.Для маточных NK-клеток характерны высокий цитокиновый и ангиогенный секреторный профиль, а также низкий цитотоксический потенциал (105). В течение первого триместра беременности NK-клетки представляют собой наиболее многочисленную популяцию иммунных клеток в децидуальной ткани (105). Однако вопрос о том, происходят ли децидуальные NK-клетки из периферических NK-клеток, которые проникают в фетально-материнскую среду и превращаются в децидуальный фенотип и/или разрастаются из остаточных NK-клеток, окончательно не решен (106, 107). Недавно было высказано предположение, что под влиянием Р4 и ИЛ-15 периферические NK-клетки начинают пролиферировать, мигрируют в место имплантации по хемотаксическому и гормональному градиентам, обеспечиваемым клетками трофобласта и эндометрия, и, наконец, превращаются в децидуальные NK-клетки за счет высоких уровней местного TGF-β и IL-11 (106).
Однако вопрос о том, происходят ли децидуальные NK-клетки из периферических NK-клеток, которые проникают в фетально-материнскую среду и превращаются в децидуальный фенотип и/или разрастаются из остаточных NK-клеток, окончательно не решен (106, 107). Недавно было высказано предположение, что под влиянием Р4 и ИЛ-15 периферические NK-клетки начинают пролиферировать, мигрируют в место имплантации по хемотаксическому и гормональному градиентам, обеспечиваемым клетками трофобласта и эндометрия, и, наконец, превращаются в децидуальные NK-клетки за счет высоких уровней местного TGF-β и IL-11 (106).
ХГЧ, по-видимому, влияет на периферические и эндометриальные NK-клетки несколькими способами, хотя влияние ХГЧ на периферические NK-клетки неубедительно. В то время как исследования 80-х годов показали ингибирующее действие ХГЧ на активность периферических NK-клеток человека (108, 109), более поздние исследования показали стимулирующий эффект ХГЧ на активность и количество NK-клеток (110). Ширшев и др. предположили, что уровни ХГЧ, характерные для первого триместра, стимулировали экспрессию специфических микроРНК в периферических NK-клетках, известных как положительные регуляторы выживания NK-клеток, цитолитической активности и продукции провоспалительных цитокинов (111).Примечательно, что более высокое число KIR2DL4 + периферических NK-клеток и более низкая частота имплантации были обнаружены у пациенток, перенесших ЭКО и получающих ХГЧ для окончательного созревания ооцитов, что позволяет предположить, что у этих пациенток лечение ХГЧ может поставить под угрозу успешность беременности (112). Напротив, ХГЧ повышает количество эндометриальных NK-клеток через маннозный рецептор и, следовательно, может положительно влиять на имплантацию эмбриона (113) ().
предположили, что уровни ХГЧ, характерные для первого триместра, стимулировали экспрессию специфических микроРНК в периферических NK-клетках, известных как положительные регуляторы выживания NK-клеток, цитолитической активности и продукции провоспалительных цитокинов (111).Примечательно, что более высокое число KIR2DL4 + периферических NK-клеток и более низкая частота имплантации были обнаружены у пациенток, перенесших ЭКО и получающих ХГЧ для окончательного созревания ооцитов, что позволяет предположить, что у этих пациенток лечение ХГЧ может поставить под угрозу успешность беременности (112). Напротив, ХГЧ повышает количество эндометриальных NK-клеток через маннозный рецептор и, следовательно, может положительно влиять на имплантацию эмбриона (113) ().
Наряду с макрофагами и ТК маточные NK-клетки являются ключевыми регуляторами имплантации эмбриона и плацентации.Как у людей, так и у мышей маточные NK-клетки контролируют инвазию трофобласта, поддерживают ангиогенез и вносят вклад в правильное ремоделирование usA (4).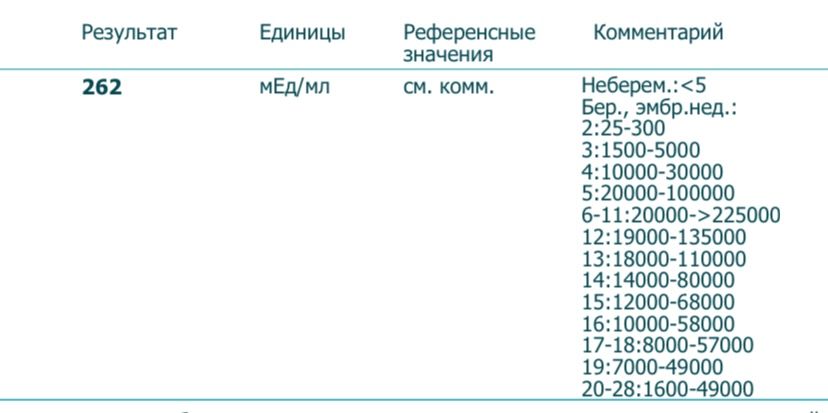 Более конкретно, NK-клетки матки человека либо напрямую вызывают ремоделирование сосудистого русла эндометрия посредством секреции MMPs (114), либо косвенно, регулируя инвазивные клетки трофобласта, которые, в свою очередь, способствуют трансформации сосудов (115). NK-клетки матки человека также продуцируют и секретируют различные проангиогенные факторы, включая VEGF, плацентарный фактор роста, ангиопоэтин-1 и ангиогенин-2 (116) (116).У мышей маточные NK-клетки подразделяются на две основные подгруппы на основе экспрессии Dolichos biflorus агглютинина (DBA). В то время как uNK-клетки DBA – секретируют большое количество IFN-γ и, таким образом, способствуют ремоделированию сосудов (117), uNK-клетки DBA + преимущественно продуцируют проангиогенные факторы (118). В отличие от человеческих маточных NK-клеток, которые, как предполагается, либо усиливают, либо ингибируют инвазию трофобласта, мышиные uNK-клетки, по-видимому, в первую очередь подавляют подвижность трофобласта (119).
Более конкретно, NK-клетки матки человека либо напрямую вызывают ремоделирование сосудистого русла эндометрия посредством секреции MMPs (114), либо косвенно, регулируя инвазивные клетки трофобласта, которые, в свою очередь, способствуют трансформации сосудов (115). NK-клетки матки человека также продуцируют и секретируют различные проангиогенные факторы, включая VEGF, плацентарный фактор роста, ангиопоэтин-1 и ангиогенин-2 (116) (116).У мышей маточные NK-клетки подразделяются на две основные подгруппы на основе экспрессии Dolichos biflorus агглютинина (DBA). В то время как uNK-клетки DBA – секретируют большое количество IFN-γ и, таким образом, способствуют ремоделированию сосудов (117), uNK-клетки DBA + преимущественно продуцируют проангиогенные факторы (118). В отличие от человеческих маточных NK-клеток, которые, как предполагается, либо усиливают, либо ингибируют инвазию трофобласта, мышиные uNK-клетки, по-видимому, в первую очередь подавляют подвижность трофобласта (119).
Наши собственные исследования показали, что гем-катаболизирующий фермент гемоксигеназа-1 (HO-1) является регулятором количества и функциональности маточных NK-клеток. У самок мышей с дефицитом HO-1 было обнаружено меньше маточных NK-клеток и более низкая экспрессия ангиогенных факторов, связанных с маточными NK-клетками. Более того, у беременных самок мышей с дефицитом HO-1 обнаруживались недостаточные ремоделированные uSA, IUGR плодов и гестационная гипертензия (120, 121). Введение газообразного монооксида углерода, продукта деградации HO-1, нормализовало число uNK и восстанавливало ремоделирование uSA, предполагая, что клетки uNKs ответственны за ремоделирование SA.Тем не менее, нарушения плода связаны не только с отсутствием NK, поскольку их истощение, хотя и мешает ремоделированию USA, не приводит к ограничению роста плода (103). Однако этот вывод противоречит наблюдениям, сделанным другими исследовательскими группами (122, 123). Интересно, что в нашей модели мышей с дефицитом NK-клеток у самок увеличивается количество ТК матки, которые могут компенсировать эффекты NK-клеток и предотвращать серьезное повреждение плода (124).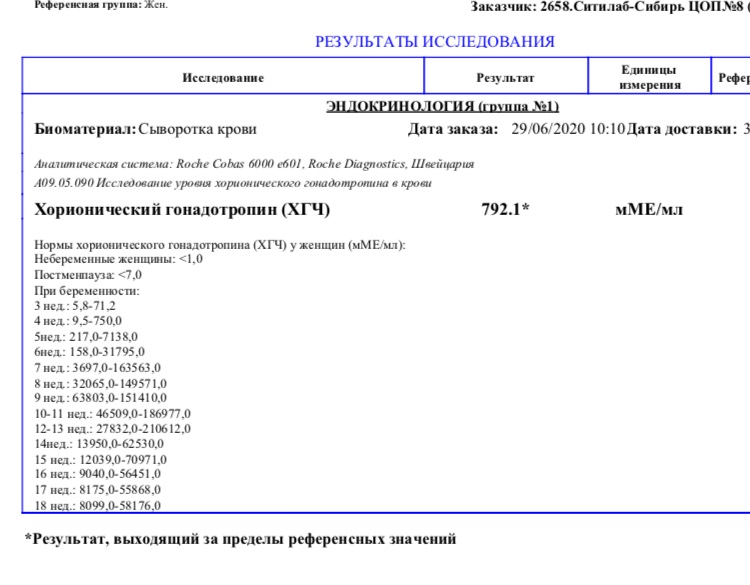 Соответственно, у беременных самок, лишенных обеих популяций врожденных иммунных клеток, наблюдается заметное нарушение ремоделирования аорты и высокое сосудистое сопротивление, что приводит к нарушению развития плода и задержке роста новорожденных (101).Это было связано с химазой Mcpt5, секретируемой обоими типами клеток (103). Следовательно, мыши без клеток Mcpt5 + демонстрируют сходный фенотип нарушения ремоделирования uSA и IUGR, но не гипертонии (103).
Соответственно, у беременных самок, лишенных обеих популяций врожденных иммунных клеток, наблюдается заметное нарушение ремоделирования аорты и высокое сосудистое сопротивление, что приводит к нарушению развития плода и задержке роста новорожденных (101).Это было связано с химазой Mcpt5, секретируемой обоими типами клеток (103). Следовательно, мыши без клеток Mcpt5 + демонстрируют сходный фенотип нарушения ремоделирования uSA и IUGR, но не гипертонии (103).
Дендритные клетки
ДК связывают врожденную и адаптивную иммунную систему и поэтому играют решающую роль в индукции поздних иммунных ответов. Хотя они обнаруживаются в тканях матки до и во время беременности, по сравнению с макрофагами и NK-клетками, ДК представляют собой небольшую популяцию иммунных клеток.ДК накапливаются в тканях матки, когда эмбрион устанавливает свои первые контакты с материнским эндометрием (125). В это время ДК матки принимают решающее участие в изменениях эндометрия, без которых невозможно дальнейшее течение беременности. Было показано, что у самок мышей, лишенных децидуальных ДК, пролиферация и дифференцировка децидуальных клеток заметно нарушены. Кроме того, у этих самок обнаружен нарушенный ангиогенез, характеризующийся сниженным расширением сосудов и ослабленным созреванием (125).В согласии с этим, нарушение самонаведения CXCR4 + DCs в децидуальную ткань приводит к дезорганизованной сосудистой сети с неправильным ремоделированием USA позже (126). В результате децидуальные самки с дефицитом ДК не могли имплантироваться (125).
Было показано, что у самок мышей, лишенных децидуальных ДК, пролиферация и дифференцировка децидуальных клеток заметно нарушены. Кроме того, у этих самок обнаружен нарушенный ангиогенез, характеризующийся сниженным расширением сосудов и ослабленным созреванием (125).В согласии с этим, нарушение самонаведения CXCR4 + DCs в децидуальную ткань приводит к дезорганизованной сосудистой сети с неправильным ремоделированием USA позже (126). В результате децидуальные самки с дефицитом ДК не могли имплантироваться (125).
ДК также участвуют в процессе овуляции. В фолликулярной жидкости эти клетки составляют основную часть всех иммунных клеток яичников, и было доказано, что они обладают противовоспалительной способностью, которая, вероятно, служит для ограничения воспаления, связанного с овуляцией (127).Кроме того, яичниковые ДК необходимы для расширения кумулюсно-ооцитарного комплекса, высвобождения яйцеклетки из фолликула яичника, образования желтого тела и усиленного лимфангиогенеза (49). Гонадотропины, включая ХГЧ, индуцируют иммиграцию ДК в яичники, тем самым поддерживая опосредованный ДК контроль овуляции (49) (4).
Гонадотропины, включая ХГЧ, индуцируют иммиграцию ДК в яичники, тем самым поддерживая опосредованный ДК контроль овуляции (49) (4).
Помимо своей неиммунологической активности во время беременности, ДК, естественно, участвуют в принятии решений о том, являются ли ткани плода иммунологически переносимыми или отвергнутыми.Как правило, ДК поглощают антигены в периферических тканях, подвергаются созреванию, иммигрируют в лимфоидные органы и, наконец, представляют пептиды, полученные из антигена, Т-клеткам. Поступая таким образом, ДК эффективно запускают Т-клеточные ответы либо с про-, либо с противовоспалительным профилем. Поскольку презентация фетальных аллоантигенов может спровоцировать подавляющий аллореактивный Т-клеточный ответ, приводящий к отторжению плода, фенотип и функции ДК модулируются во время нормальной беременности, чтобы ограничить вредное воздействие на плод.Это объясняет, в частности, децидуальные ДК, которые, в отличие от их периферических аналогов, обладают толерантным иммунорегуляторным фенотипом, характеризующимся сниженной способностью стимулировать Т-клетки (128) и высокой экспрессией IL-10 и TGF-β (129). Децидуальные дендритные клетки способны индуцировать Treg-клетки и ответы Th3, способствуя общей противовоспалительной среде плода (130) (). Как децидуальные, так и трофобластные факторы, такие как E2, растворимый HLA-G, гликопротеин 1a, стромальный лимфопоэтин тимуса и галектин-1 инструктируют ДК принимать толерогенный фенотип (131-135).Более того, в нескольких исследованиях на людях и мышах ХГЧ был идентифицирован как регулятор ДК во время беременности, хотя и с противоречивыми результатами (131, 136–138). Наши собственные анализы показали, что применение ХГЧ, а также адоптивное введение обработанных ХГЧ толерогенных дендритных клеток женщинам, склонным к абортам, значительно снижало периферическую и локальную частоту зрелых дендритных клеток, увеличивало количество Treg-клеток и защищало плод от отторжения (139, 140). Примечательно, что толерогенные ДК должны присутствовать при оплодотворении для обеспечения защиты (140), подчеркивая их роль на очень ранних стадиях беременности.У людей мы предположили, что ХГЧ является фактором, поддерживающим зрелые периферические дендритные клетки и, в частности, миелоидные дендритные клетки типа 1 на низком уровне, но не в качестве общего регулятора частоты дендритных клеток во время беременности (141, 142).
Децидуальные дендритные клетки способны индуцировать Treg-клетки и ответы Th3, способствуя общей противовоспалительной среде плода (130) (). Как децидуальные, так и трофобластные факторы, такие как E2, растворимый HLA-G, гликопротеин 1a, стромальный лимфопоэтин тимуса и галектин-1 инструктируют ДК принимать толерогенный фенотип (131-135).Более того, в нескольких исследованиях на людях и мышах ХГЧ был идентифицирован как регулятор ДК во время беременности, хотя и с противоречивыми результатами (131, 136–138). Наши собственные анализы показали, что применение ХГЧ, а также адоптивное введение обработанных ХГЧ толерогенных дендритных клеток женщинам, склонным к абортам, значительно снижало периферическую и локальную частоту зрелых дендритных клеток, увеличивало количество Treg-клеток и защищало плод от отторжения (139, 140). Примечательно, что толерогенные ДК должны присутствовать при оплодотворении для обеспечения защиты (140), подчеркивая их роль на очень ранних стадиях беременности.У людей мы предположили, что ХГЧ является фактором, поддерживающим зрелые периферические дендритные клетки и, в частности, миелоидные дендритные клетки типа 1 на низком уровне, но не в качестве общего регулятора частоты дендритных клеток во время беременности (141, 142).
В-клетки
В-клетки являются одним из двух основных типов иммунных клеток, принадлежащих к адаптивной ветви иммунной системы. Наиболее известные своей способностью продуцировать иммуноглобулины, В-клетки также участвуют в презентации антигена и в продукции цитокинов. Ранние исследования 70-х и 80-х годов изучали развитие антиотцовского гуморального иммунного ответа во время беременности мышей и обнаружили, что этот ответ был ограничен специфическими комбинациями аллогенных спариваний и становился очевидным только после повторных циклов спаривания.Bell и Billingham (143) далее определили плаценту как ткань, провоцирующую антиотцовский гуморальный иммунный ответ. В настоящее время все большее внимание уделяется участию В-клеток в основных процессах беременности, и следует предположить, что эти клетки также участвуют в имплантации эмбриона и плацентации. Недавно мы заметили, что беременные самки мышей, лишенные В-клеток, были более восприимчивы к липополисахаридам, что означает, что их зародыши умирали при дозах, совместимых с плодами самок мышей, способных к В-клеткам. Это подразумевает критическую роль В-клеток в контроле бактериальных инфекций во время беременности (144). В стабильных условиях исследования на мышах, проведенные в 80-х годах, показали, что дефицит В-клеток во время беременности не влияет на частоту резорбции, размер приплода и выживаемость новорожденных (145–147). Наши собственные предыдущие результаты показывают, что плоды самок мышей с дефицитом В-клеток были меньше по сравнению с плодами самок мышей, компетентных по В-клеткам, уже в первой половине беременности (144). Это означает, что недостаток В-клеток во время беременности, хотя и не приводит к полной потере плода, ставит под угрозу рост плода и, таким образом, может повлиять на здоровье потомства в долгосрочной перспективе.
Это подразумевает критическую роль В-клеток в контроле бактериальных инфекций во время беременности (144). В стабильных условиях исследования на мышах, проведенные в 80-х годах, показали, что дефицит В-клеток во время беременности не влияет на частоту резорбции, размер приплода и выживаемость новорожденных (145–147). Наши собственные предыдущие результаты показывают, что плоды самок мышей с дефицитом В-клеток были меньше по сравнению с плодами самок мышей, компетентных по В-клеткам, уже в первой половине беременности (144). Это означает, что недостаток В-клеток во время беременности, хотя и не приводит к полной потере плода, ставит под угрозу рост плода и, таким образом, может повлиять на здоровье потомства в долгосрочной перспективе.
У людей дефицит В-клеток, вызванный медицинским вмешательством до или во время беременности, привел к повышенной частоте связанных с беременностью осложнений, таких как самопроизвольные аборты, ПЭ, ЗВУР и преждевременные роды (148–150), что позволяет предположить участие В-клеток в ранних путях беременности, определяющих исход беременности.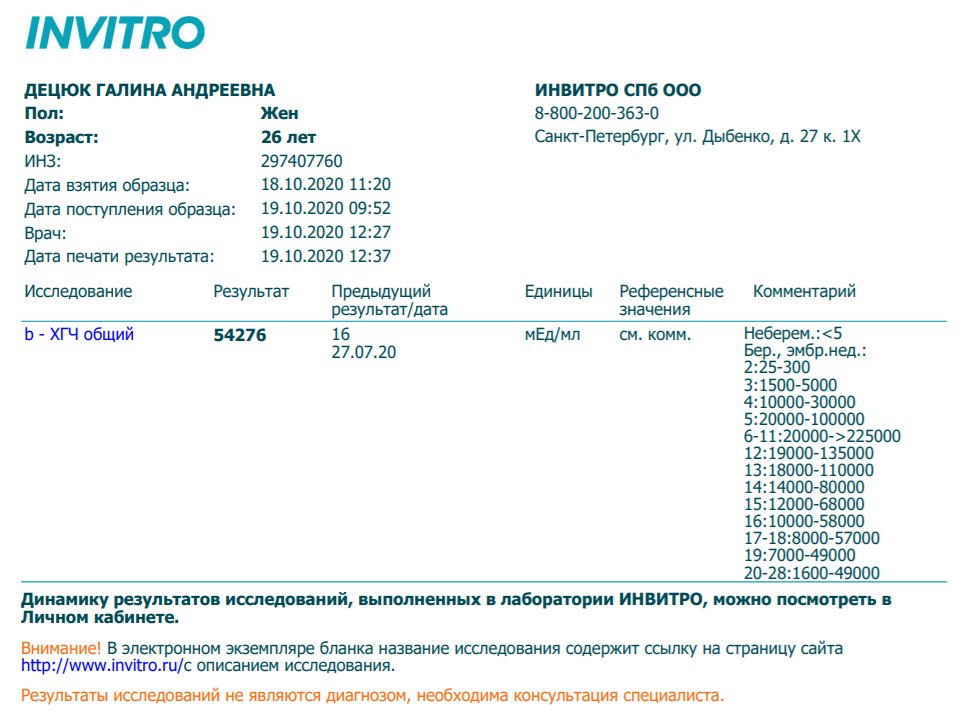 Однако изучение фенотипических и функциональных характеристик популяций В-клеток матки затруднено из-за их дефицита на границе плода и матери (151). Анализ частоты В-клеток во время беременности у мышей и человека выявил около 1% В-клеток мыши и <5% В-клеток человека в децидуальной ткани (152, 153).Кроме того, связанные с беременностью изменения числа В-клеток на всех стадиях развития в костном мозге, крови, селезенке и лимфатических узлах (154–160) могут влиять на локальные частоты В-клеток и при нарушении регуляции могут вызывать неблагоприятные исходы беременности. Действительно, есть доказательства того, что не только отсутствие, но и чрезмерное представительство отдельных популяций В-клеток в разные сроки беременности может нанести вред плоду. Например, снижение частоты регуляторных В (Breg) клеток на ранних сроках беременности у людей и мышей связано со спонтанными абортами (161, 162).Breg-клетки включают все В-клетки, которые негативно регулируют иммунный ответ и способны секретировать большое количество иммуносупрессивных цитокинов, таких как IL-10, IL-35 и TGF-β (4).
Однако изучение фенотипических и функциональных характеристик популяций В-клеток матки затруднено из-за их дефицита на границе плода и матери (151). Анализ частоты В-клеток во время беременности у мышей и человека выявил около 1% В-клеток мыши и <5% В-клеток человека в децидуальной ткани (152, 153).Кроме того, связанные с беременностью изменения числа В-клеток на всех стадиях развития в костном мозге, крови, селезенке и лимфатических узлах (154–160) могут влиять на локальные частоты В-клеток и при нарушении регуляции могут вызывать неблагоприятные исходы беременности. Действительно, есть доказательства того, что не только отсутствие, но и чрезмерное представительство отдельных популяций В-клеток в разные сроки беременности может нанести вред плоду. Например, снижение частоты регуляторных В (Breg) клеток на ранних сроках беременности у людей и мышей связано со спонтанными абортами (161, 162).Breg-клетки включают все В-клетки, которые негативно регулируют иммунный ответ и способны секретировать большое количество иммуносупрессивных цитокинов, таких как IL-10, IL-35 и TGF-β (4). Мы и другие исследовательские группы продемонстрировали, что ХГЧ не только подавляет пролиферацию В-клеток селезенки мыши, но также индуцирует образование клеток Breg, продуцирующих ИЛ-10 мыши и человека, а также выработку асимметричных антител, защищающих беременность (163, 164). (). Таким образом, ХГЧ поддерживает иммуносупрессивные характеристики В-клеток и способствует материнской иммунной толерантности на ранних сроках беременности.
Мы и другие исследовательские группы продемонстрировали, что ХГЧ не только подавляет пролиферацию В-клеток селезенки мыши, но также индуцирует образование клеток Breg, продуцирующих ИЛ-10 мыши и человека, а также выработку асимметричных антител, защищающих беременность (163, 164). (). Таким образом, ХГЧ поддерживает иммуносупрессивные характеристики В-клеток и способствует материнской иммунной толерантности на ранних сроках беременности.
Но у медали две стороны. У мышей часто сообщается, что клетки Breg являются частью популяции клеток CD19 + CD5 + B1a (165), однако В-клетки B1a в зависимости от их фенотипа, по-видимому, играют двойственную роль во время беременности. Мы обнаружили, что мышиные перитонеальные B1a B-клетки, экспрессирующие высокие уровни аллоантигена 1 плазматических клеток и IL-10, поддерживают выживание плода, тогда как B1a B-клетки, экспрессирующие низкие уровни обеих маркерных молекул, могут вызывать отторжение плода (166).Кроме того, у пациенток с ТЭЛА была обнаружена повышенная частота В1а-клеток человека в третьем триместре беременности, которая была связана с патологически повышенным уровнем ХГЧ, что свидетельствует о довольно пагубном влиянии ХГЧ в этом отношении.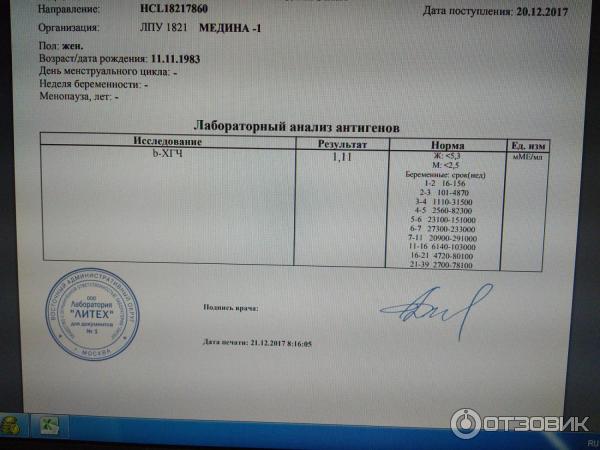 Поскольку В-клетки B1a обладают способностью продуцировать аутоантитела против рецептора ангиотензина II типа 1, предполагается, что они способствуют развитию симптомов, связанных с ТЭЛА (12). Точно так же продукция аутоантител повышенным количеством плазматических клеток, присутствующих в очагах поражения эндометрия у пациенток с эндометриозом, была связана с бесплодием (167).
Поскольку В-клетки B1a обладают способностью продуцировать аутоантитела против рецептора ангиотензина II типа 1, предполагается, что они способствуют развитию симптомов, связанных с ТЭЛА (12). Точно так же продукция аутоантител повышенным количеством плазматических клеток, присутствующих в очагах поражения эндометрия у пациенток с эндометриозом, была связана с бесплодием (167).
В целом физиологические повышенные уровни ХГЧ на ранних сроках беременности способствуют индукции толерантности плода, способствуя образованию и функционированию клеток Breg, в то время как высокие уровни ХГЧ на более поздних сроках беременности могут поставить под угрозу благополучие плода, усиливая аутореактивные В-клетки. Побуждает ли ХГЧ В-клетки к имплантации эмбриона и плацентации, еще предстоит выяснить.
Т-клетки
Т-клетки, являющиеся вторым основным типом адаптивных иммунных клеток, более распространены на границе плода и матери, чем В-клетки, и гораздо лучше изучены.Приблизительно 10–20% всех децидуальных лейкоцитов являются Т-клетками, причем CD8 + Т-клеток больше, чем CD4 + Т-клеток, включая классические, а также регуляторные подмножества (168). У мышей CD4 + Т-хелперы (Th) и CD8 + Т-клетки составляют до 2% децидуальных лейкоцитов на ранних и средних сроках беременности (169). Предполагается, что децидуальные Т-клетки человека высоко дифференцированы, экспрессируют широкий спектр цитокинов и цитотоксических маркеров и демонстрируют уникальный профиль транскрипции, характеризующийся сильной экспрессией генов, участвующих в передаче сигналов интерферона (170).Более того, несмотря на способность распознавать чужеродные трофобластические антигены, децидуальные Т-клетки не атакуют клетки трофобласта, а скорее поддерживают их рост и инвазивность (171). Среди всех децидуальных Т-клеток лучше всего описаны провоспалительные клетки Th2 и Th27, а также противовоспалительные клетки Th3 и Foxp3 + Treg, и нарушения регуляции в этих подмножествах Th указывают на несколько осложнений беременности (172, 173). Тем не менее, функциональные свойства децидуальных Т-клеток еще недостаточно изучены.
У мышей CD4 + Т-хелперы (Th) и CD8 + Т-клетки составляют до 2% децидуальных лейкоцитов на ранних и средних сроках беременности (169). Предполагается, что децидуальные Т-клетки человека высоко дифференцированы, экспрессируют широкий спектр цитокинов и цитотоксических маркеров и демонстрируют уникальный профиль транскрипции, характеризующийся сильной экспрессией генов, участвующих в передаче сигналов интерферона (170).Более того, несмотря на способность распознавать чужеродные трофобластические антигены, децидуальные Т-клетки не атакуют клетки трофобласта, а скорее поддерживают их рост и инвазивность (171). Среди всех децидуальных Т-клеток лучше всего описаны провоспалительные клетки Th2 и Th27, а также противовоспалительные клетки Th3 и Foxp3 + Treg, и нарушения регуляции в этих подмножествах Th указывают на несколько осложнений беременности (172, 173). Тем не менее, функциональные свойства децидуальных Т-клеток еще недостаточно изучены.
Нормальное течение беременности является результатом своевременно регулируемых локальных сдвигов между провоспалительными и противовоспалительными иммунными реакциями, обеспечивающими имплантацию и плацентацию в провоспалительной среде, рост плода в противовоспалительной среде и, наконец, индукцию родов и родоразрешение снова при провоспалительных состояниях (174). Было показано, что ХГЧ влияет на Th-клетки несколькими способами, и предполагается, что гормон способствует переходу из локальной среды с преобладанием Th2 в Th3-доминирование в конце первого триместра.Предполагается, что ХГЧ нарушает пролиферацию и вызывает апоптоз обычных Т-клеток (175–179), тем самым уменьшая количество аллореактивных Т-клеток, которые могут нанести вред плоду. Более того, ХГЧ помогает Т-лимфоцитам принять фенотип супрессора и секретировать преимущественно иммунорегуляторные цитокины, такие как IL-10 и TGF-β (139, 175, 180, 181). Это верно как для человеческих, так и для мышиных Т-клеток, поскольку они экспрессируют высококонсервативные молекулы рецептора ЛГ/ХГ (139, 182) и восприимчивы к передаче сигналов ХГЧ. В свою очередь было высказано предположение, что передача сигналов ХГЧ осуществляется через сигнальные молекулы AKT и ERK (183).
Было показано, что ХГЧ влияет на Th-клетки несколькими способами, и предполагается, что гормон способствует переходу из локальной среды с преобладанием Th2 в Th3-доминирование в конце первого триместра.Предполагается, что ХГЧ нарушает пролиферацию и вызывает апоптоз обычных Т-клеток (175–179), тем самым уменьшая количество аллореактивных Т-клеток, которые могут нанести вред плоду. Более того, ХГЧ помогает Т-лимфоцитам принять фенотип супрессора и секретировать преимущественно иммунорегуляторные цитокины, такие как IL-10 и TGF-β (139, 175, 180, 181). Это верно как для человеческих, так и для мышиных Т-клеток, поскольку они экспрессируют высококонсервативные молекулы рецептора ЛГ/ХГ (139, 182) и восприимчивы к передаче сигналов ХГЧ. В свою очередь было высказано предположение, что передача сигналов ХГЧ осуществляется через сигнальные молекулы AKT и ERK (183).
Примечательно, что введение ХГЧ in vivo мышам и людям может значительно улучшить исход беременности. Мы показали, что инъекция ХГЧ во время периимплантационного периода мышам, склонным к абортам, увеличивала частоту Treg-клеток и значительно снижала частоту отторжения плода (139). В согласии с этим, пациенты ЭКО, получавшие ХГЧ, демонстрировали значительно повышенные уровни периферических Treg-клеток, связанные с улучшением IR и LBR, по сравнению с контрольной группой, не получавшей ХГЧ (36).Аналогичным образом, пациентки со спонтанным абортом показали более низкие периферические числа клеток Th27 и повышенную частоту клеток Treg после воздействия ХГЧ (184, 185), что указывает на то, что ХГЧ способен корректировать иммунологические дисбалансы, связанные с неблагоприятными исходами беременности. Стоит предположить, что ХГЧ не только увеличивает периферические клетки Treg, но также увеличивает местный пул клеток Treg. Таким образом, ХГЧ может действовать тремя различными путями: (А) активное рекрутирование периферических клеток Treg в плодно-материнском интерфейсе (186), (B) локальная экспансия децидуальных клеток Treg (82) и (C) преобразование обычные Т-клетки в клетки Treg (181, 183) (181, 183).
В согласии с этим, пациенты ЭКО, получавшие ХГЧ, демонстрировали значительно повышенные уровни периферических Treg-клеток, связанные с улучшением IR и LBR, по сравнению с контрольной группой, не получавшей ХГЧ (36).Аналогичным образом, пациентки со спонтанным абортом показали более низкие периферические числа клеток Th27 и повышенную частоту клеток Treg после воздействия ХГЧ (184, 185), что указывает на то, что ХГЧ способен корректировать иммунологические дисбалансы, связанные с неблагоприятными исходами беременности. Стоит предположить, что ХГЧ не только увеличивает периферические клетки Treg, но также увеличивает местный пул клеток Treg. Таким образом, ХГЧ может действовать тремя различными путями: (А) активное рекрутирование периферических клеток Treg в плодно-материнском интерфейсе (186), (B) локальная экспансия децидуальных клеток Treg (82) и (C) преобразование обычные Т-клетки в клетки Treg (181, 183) (181, 183).
Недавно Робертсон и его коллеги представили новое понимание функциональности децидуальных клеток Treg. Авторы предположили роль децидуальных Treg-клеток в предотвращении чрезмерных воспалительных реакций, вызываемых локальными эффекторными Т-клетками, поддерживающую функцию других лейкоцитов и некроветворных клеток в процессе имплантации и прямое участие децидуальных Treg-клеток в адаптации материнского сосудистого русла. кровать (187) (). Все эти механизмы имеют решающее значение для успешного прохождения эмбрионом первых шагов своего развития, и из-за их модуляции ХГЧ можно утверждать, что этот уникальный гормон имеет решающее значение.
Авторы предположили роль децидуальных Treg-клеток в предотвращении чрезмерных воспалительных реакций, вызываемых локальными эффекторными Т-клетками, поддерживающую функцию других лейкоцитов и некроветворных клеток в процессе имплантации и прямое участие децидуальных Treg-клеток в адаптации материнского сосудистого русла. кровать (187) (). Все эти механизмы имеют решающее значение для успешного прохождения эмбрионом первых шагов своего развития, и из-за их модуляции ХГЧ можно утверждать, что этот уникальный гормон имеет решающее значение.
Расшифровка влияния временного интервала между ХГЧ и ВМИ и подготовки спермы и ВМИ | Агравал
Группа мастерских ESHRE Capri. Внутриматочная инсеминация. Обновление Hum Reprod. 2009;1(1):1-13.
Cantineau AE, Janssen MJ, Cohlen BJ, Allersma T. Синхронизированный подход к внутриматочной инсеминации у субфертильных пар. Cochrane Data Syst Rev. 2014;12:CD006942.
Kamel AM, Hussien AM, Salah E. Влияние задержки внутриматочной инсеминации до 48 часов после инъекции ХГЧ на частоту наступления беременности. Ближний Восток Fertil Soc J. 2015;20:290-4.
Ближний Восток Fertil Soc J. 2015;20:290-4.
Солиман БС. Влияние временного интервала между инъекцией хорионического гонадотропина человека и внутриматочной инсеминацией на частоту наступления беременности. Ближний Восток Fertil Soc J. 2016;21:222-7.
Гаутам А.Н. Влияет ли временной интервал между сбором спермы, ее обработкой и внутриматочной инсеминацией на результаты ВМИ? J Obstet Gynecol Индия. 2009;59(5):407-9.
Александр С.Дж., Кинг Дж., Липари С., Чжао Ю., Уоллах Э.Е. Влияние временных интервалов между сбором, обработкой и внутриматочной инсеминацией (ВМИ) на частоту наступления беременности в циклах кломифен-цитрат-ВМИ.Фертил Стерил. 2005;84:S279.
Koyun E, Okyay RE, Dogan OE, Koval M, Dogan SS, Guleki B. Влияние времени внутриматочной инсеминации на параметры спермы. J Turk Ger Gynecol Assoc. 2014;15:82-5.
Рахман С.М., Кармакар Д., Малхотра Н., Кумар С. Сроки внутриматочной инсеминации: попытка разгадать загадку. Arch Gynecol Obstet. 2011;284:1023e7.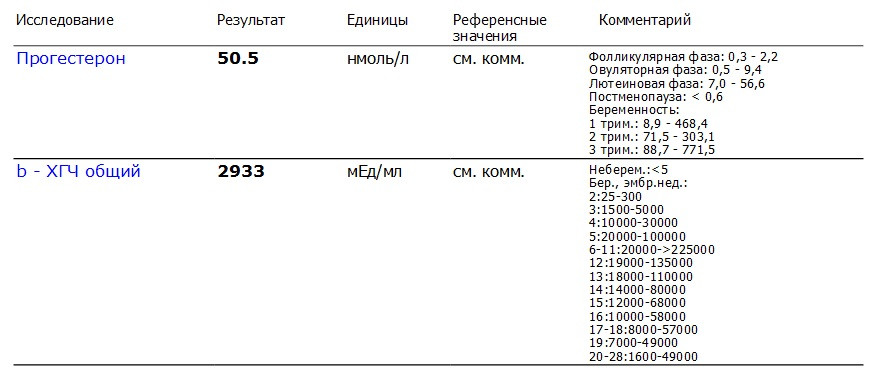
Aboul Gheit S. Показатели беременности после трех разных сроков внутриматочной инсеминации для женщин с необъяснимым бесплодием: рандомизированное контролируемое исследование.Ближний Восток Fertil Soc J. 2010;15:265-8.
Ван Ю.К., Чанг Ю.К., Чен И.С., Цниен Х.Х., Ву Г.Дж. Сравнение сроков IUI в циклах стимуляции яичников. Арх Андрол. 2006;52:371-4.
Хуан Ф.Дж., Чанг С.И., Лу Ю.Дж., Кунг Ф.Т., Цай М.Ю., Ву Д.Ф. Два разных срока внутриматочной инсеминации при немужском бесплодии. J Assist Reprod Genet. 2000;17:213e7.
Yumusak OH, Kahyaoglu S, Pekcan MK, Isci E, Cinar M, Tasci Y. Имеет ли значение время внутриматочной инсеминации для достижения беременности во время индукции овуляции с помощью гонадотропинов? Ретроспективное когортное исследование.J Chin Med Assoc. 2017 1 июня; 80 (6): 366-70.
Кучук Т. Внутриматочная инсеминация: правильный выбор времени? J Assist Reprod Genet. 2008; 25:427-30.
Ghanem ME, Bakre NI, Emam MA, Boghdady LA, Helal AS, Elmetwally AG, et al.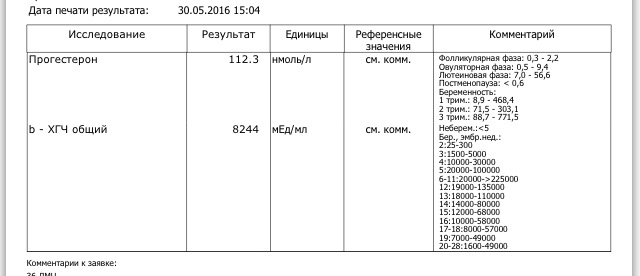 Влияние сроков внутриматочной инсеминации на овуляцию и количество инсеминаций на частоту циклических беременностей при бесплодии общей этиологии. Репродукция человека. 2011;26(3):576-83.
Влияние сроков внутриматочной инсеминации на овуляцию и количество инсеминаций на частоту циклических беременностей при бесплодии общей этиологии. Репродукция человека. 2011;26(3):576-83.
Киличдаг Э.Б. Влияние интервалов от подготовки спермы до времени внутриматочной инсеминации (ВМИ) на частоту наступления беременности.J Turk Soc Obstet Gynecol. 2012;9(3):159-63.
Явас Ю., Селуб М.Р. Исход беременности при внутриматочной инсеминации (ВМИ) улучшается за счет более коротких интервалов от сбора спермы до подготовки спермы, от подготовки спермы до времени ВМИ и от сбора спермы до времени ВМИ. Фертил Стерил. 2004;82(6):1638-47.
Слабая линия на тесте на беременность: что это значит?
Означает ли слабая полоска на тесте на беременность положительный или отрицательный результат? Узнайте наверняка, а также узнайте, чем она отличается от линии выпаривания.
Может быть, вы уже несколько месяцев пользуетесь TTC, и вам не терпится увидеть эти две розовые линии. Или, может быть, у вас немного задержались месячные, и вы задаетесь вопросом, не ждет ли вас ребенок-сюрприз. В любом случае вам понадобится тест на беременность, чтобы дать вам некоторые ответы.
Или, может быть, у вас немного задержались месячные, и вы задаетесь вопросом, не ждет ли вас ребенок-сюрприз. В любом случае вам понадобится тест на беременность, чтобы дать вам некоторые ответы.
Но что, если вы получите слабую линию?! Что означает , что ? У вас есть вопросы, а у нас есть ответы. В этом посте мы рассмотрим:
Вот видео!
Как выглядит слабая полоска на тесте на беременность?
Бледная линия выглядит по-разному в зависимости от используемого теста.В большинстве тестов на беременность для обозначения беременности используются две параллельные линии или знак «плюс».
- Если вы пройдете тест со знаком плюс, , вы будете искать одну темную вертикальную линию (контрольную линию) и одну тусклую горизонтальную линию, пересекающую ее.

- Если вы выполняете тест с параллельными линиями, вы будете искать одну более темную линию рядом с одной слабой линией.
Если вы проводите тестирование на ранней стадии (еще до того, как у вас наступила менструация), слабая полоска может быть настолько слабой, что едва заметна — почти как крошечное пятнышко.Чем дальше вы находитесь, тем темнее обычно становится линия. Вы можете увидеть, как выглядит эта прогрессия на изображении ниже:
Ваш положительный тест на беременность на самом деле Узнайте сейчас – Mama Natural – Женевьева Возьмите первое в мире руководство по беременности
по неделям
с естественной точки зрения! – Промо книги [В статье]
Что означает слабая линия?
Истинная слабая линия — в отличие от линии испарения — обычно является истинным положительным результатом.
Положительный результат (даже слабый положительный результат) означает, что, вероятно, произошла имплантация и ваш организм начинает вырабатывать ХГЧ — гормон, необходимый для поддержания беременности.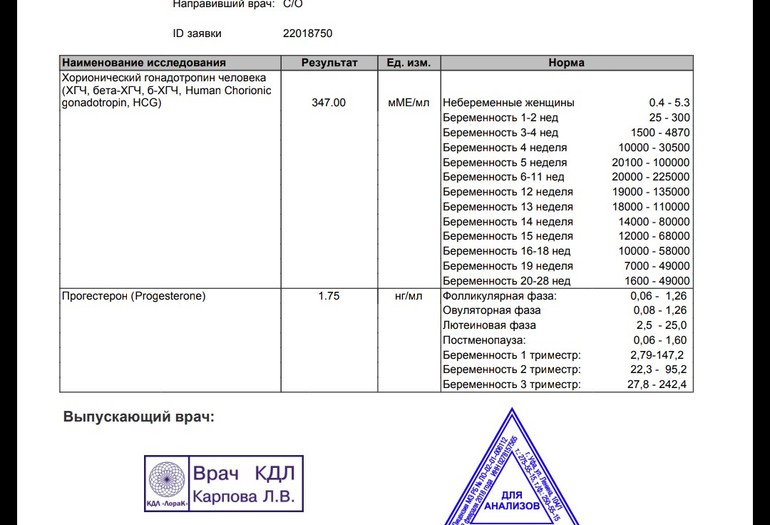 Это также означает, что вы находитесь на очень ранних стадиях беременности.
Это также означает, что вы находитесь на очень ранних стадиях беременности.
Если вы продолжите тестирование после того, как получите слабую линию, вы должны заметить, что линия становится темнее с течением времени.
Может ли слабая линия быть отрицательной?
Тесты на беременность преследуют одну цель: выявить ХГЧ.Когда ваш тест показывает слабую линию, это означает, что ваш организм обнаруживает некоторое количество ХГЧ, что обычно указывает на беременность. Согласно немецкому исследованию тестов на беременность, анализы мочи должны показывать положительный результат при обнаружении 25 мМЕ/мл ХГЧ.
К сожалению, можно увидеть слабую линию, которая исчезает. Месячные также могут начаться вскоре после появления слабой линии. Это может указывать на очень раннюю потерю, например биохимическую беременность.
В некоторых случаях (помимо прерывания беременности на ранних сроках) может появиться слабая полоска, даже если вы на самом деле не беременны.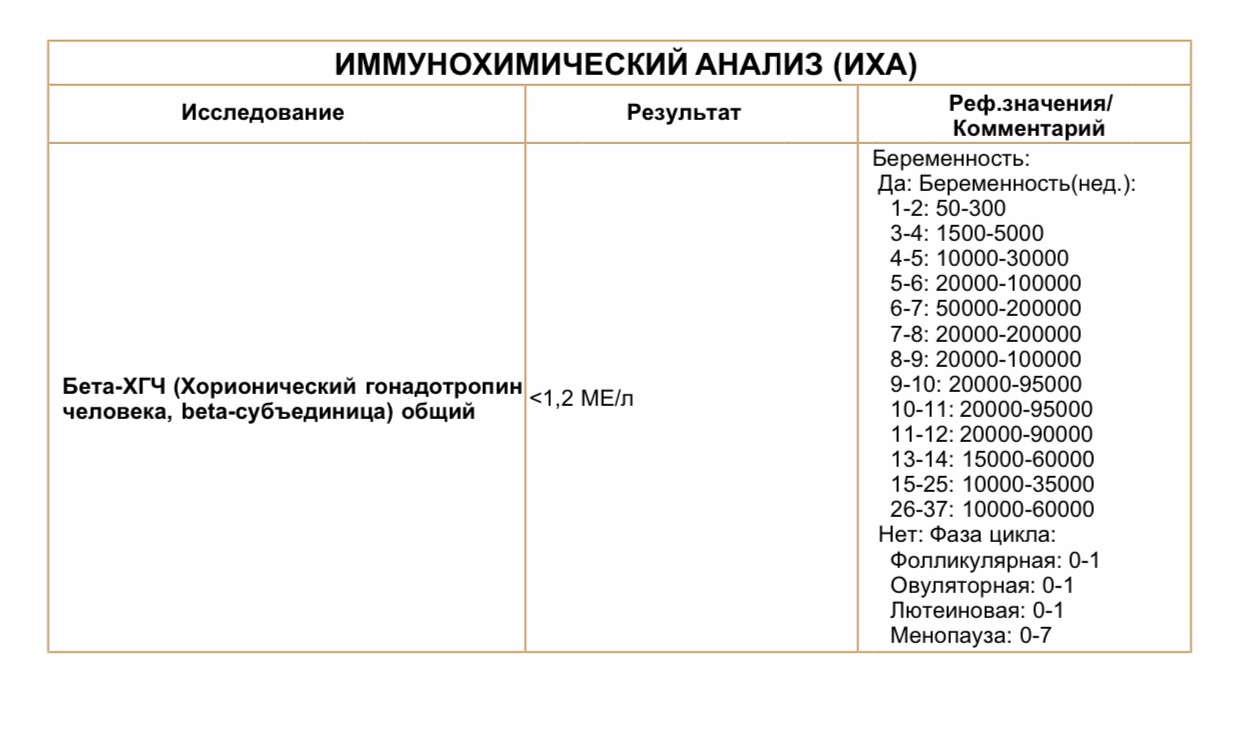 К таким ситуациям относятся:
К таким ситуациям относятся:
- Гормональный дисбаланс, такой как СПКЯ: Иногда кисты яичников могут выделять гормоны (включая ХГЧ), даже если беременность не наступает.
- Лекарство от бесплодия: Некоторые лекарства от бесплодия могут вызвать положительные результаты до того, как вы действительно забеременеете. Если вы в настоящее время проходите лечение от бесплодия, рекомендуется делать тест на беременность только по рекомендации вашего врача.
- Недавний выкидыш: Если уровень ХГЧ не вернулся к 0 мМЕ/мл ХГЧ, возможно, тест на беременность все еще обнаруживает остаточный ХГЧ.
- Менопауза: Ранняя менопауза также может вызвать повышение уровня ХГЧ, что может привести к ложноположительному результату.
- Болезни: В частности, лекарства, используемые для лечения болезни Паркинсона и эпилепсии, могут вызвать ложноположительный результат.
- Диета с ХГЧ: Диета с ХГЧ — это диета для похудения, включающая этот гормон в план лечения.
 Неудивительно, что если вы сидите на диете с ХГЧ, вы, скорее всего, получите положительные результаты беременности, поскольку тест определяет уровень этих гормонов.
Неудивительно, что если вы сидите на диете с ХГЧ, вы, скорее всего, получите положительные результаты беременности, поскольку тест определяет уровень этих гормонов.
Разница между слабой линией и линией испарения
Или слабая линия может вообще не быть слабой линией. Это может быть линия испарения…
Линия испарения — это линия, которая появляется, когда моча испаряется с палочки теста на беременность. Вот как определить разницу между слабой линией и линией испарения:
Толщина
Линия испарения имеет тенденцию быть тоньше, чем контрольная линия; слабые линии, как правило, имеют ту же толщину, что и контрольная линия.
Цвет линии
Большинство линий испарения будут серого цвета, а не розового или синего, как контрольная линия. (Хотя были сообщения о том, что тесты на беременность с синей обводкой могут показывать голубую линию испарения. Тьфу!)
Время теста
Вы также должны учитывать время проведения теста. Линии испарения появляются по мере испарения мочи, что означает, что для этого требуется несколько минут.
Линии испарения появляются по мере испарения мочи, что означает, что для этого требуется несколько минут.
- Если вы делаете тест и сразу видите слабую полоску , скорее всего, это положительный тест, хотя и слабый.
- Если пройти тест и проверить результаты после отведенного времени тестирования , это, вероятно, линия испарения.
Многие мамочки сдавали анализы, получали отрицательный результат, выбрасывали тест, а потом замечали полоску. Это может вызвать некоторую путаницу, но, как правило, это линии испарения, которые появляются поздно. Всегда проверяйте тест в течение указанного периода времени, чтобы уменьшить вероятность того, что вы увидите линию испарения.
Как насчет цифровых тестов на беременность?
Цифровые тесты намного легче читать. Цифровые тесты визуально отображают слова «Беременна» или «Не беременна» — нет строк для расшифровки.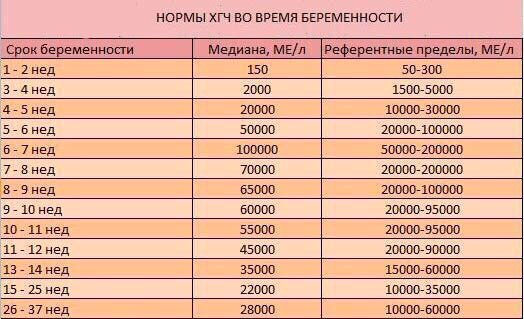
Обратная сторона? Цифровые тесты могут быть очень дорогими, особенно если вы хотите провести тест до задержки менструации (и, следовательно, можете использовать больше). Цифровые тесты также требуют более высокой концентрации ХГЧ для получения положительного результата, что может привести к ложноотрицательному результату, если вы проведете тест слишком рано.
Думаете, у вас положительный тест на беременность?
Поздравляем! Прочтите этот пост, чтобы узнать больше о положительном тесте на беременность.
После того, как вы получили положительный результат теста, пришло время обратиться к акушерке или акушеру-гинекологу. Во время вашего первого визита ваш врач возьмет анализ крови (который более чувствителен, чем анализы мочи), чтобы подтвердить вашу беременность, после чего вы сможете приступить к дородовому уходу.
Minireview: Пространственное программирование активности рецептора, связанного с G-белком: расшифровка передачи сигналов в норме и при заболевании | Молекулярная эндокринология
Аннотация
Исследование множества сигналов гормонов через рецепторы, связанные с G-белком (GPCR), продемонстрировало сложные сигнальные пути, лежащие в основе множества функций, которые эти рецепторы выполняют in vivo. Это очень актуально для GPCRs, ключевых в репродукции и беременности, которые подвергаются циклическим и динамическим изменениям в своей внеклеточной среде. Однако, как такая функциональная плейотропия в передаче сигналов GPCR транслируется в специфические нижестоящие клеточные ответы, в значительной степени неизвестно. Появляющиеся данные убедительно подтверждают механизмы центральной роли расположения рецепторов в регуляции сигналов через мембранный перенос. В этом обзоре мы обсуждаем текущий прогресс в нашем понимании роли мембранного переноса в локационном контроле передачи сигналов GPCR, от организованных сигнальных микродоменов плазматической мембраны, потенциально обеспечиваемых как отдельными эндоцитарными, так и экзоцитарными путями, до более поздних доказательств пространственного контроля внутри эндомембранная система.Также будет обсуждаться применение этих новых механизмов в их связи с активностью GPCR в физиологических и патофизиологических условиях, а также в улучшении терапевтических стратегий, использующих эти механизмы для программирования строго регулируемых и отличных профилей передачи сигналов.
Это очень актуально для GPCRs, ключевых в репродукции и беременности, которые подвергаются циклическим и динамическим изменениям в своей внеклеточной среде. Однако, как такая функциональная плейотропия в передаче сигналов GPCR транслируется в специфические нижестоящие клеточные ответы, в значительной степени неизвестно. Появляющиеся данные убедительно подтверждают механизмы центральной роли расположения рецепторов в регуляции сигналов через мембранный перенос. В этом обзоре мы обсуждаем текущий прогресс в нашем понимании роли мембранного переноса в локационном контроле передачи сигналов GPCR, от организованных сигнальных микродоменов плазматической мембраны, потенциально обеспечиваемых как отдельными эндоцитарными, так и экзоцитарными путями, до более поздних доказательств пространственного контроля внутри эндомембранная система.Также будет обсуждаться применение этих новых механизмов в их связи с активностью GPCR в физиологических и патофизиологических условиях, а также в улучшении терапевтических стратегий, использующих эти механизмы для программирования строго регулируемых и отличных профилей передачи сигналов.
В рамках любой сотовой сигнальной системы становится очевидным, что местоположение сигнала является для клеток критическим механизмом преобразования сложных сигнальных сетей на пространственном и временном уровне в специфические нижестоящие ответы.Мембранный перенос рецепторов и сигнальных молекул, которые они активируют, может направлять локализацию внутриклеточных сигналов и рассматривается как интегрированная кросс-регуляторная клеточная система (1). Т.о., перенос мембран может регулировать многие фундаментальные клеточные программы, и все большее количество клинических состояний, как сообщается, являются результатом дефектов в путях переноса мембран или сортировки грузов (1, 2). Роль локализации в регуляции сигналов через мембранный перенос очень актуальна для передачи сигналов, активируемых надсемейством рецепторов, связанных с G-белками (GPCRs).Хорошо установленным вкладом, который трафик играет в передаче сигналов GPCR, является способность регулировать паттерны сигналов гетеротримерных G-белков (3). Простым, но драматическим примером является дивергентная сортировка GPCR после индуцированного лигандом эндоцитоза либо по пути рециркуляции, либо по пути деградации/лизосомы (см. рис. 1), процесс, который по существу производит противоположные эффекты на передачу сигналов рецептора через родственные ему G-белки (3). Более того, способность перепрограммировать передачу сигналов путем изменения трафика или местоположения рецепторов может быть ключевым адаптивным механизмом для GPCR, которые подвергаются воздействию циклических и динамических гормональных условий, таких как те рецепторы, которые занимают центральное место в регуляции репродукции и беременности.В этом обзоре мы подчеркнем недавние достижения в нашем понимании того, что мембранный перенос играет роль в локационном контроле передачи сигналов GPCR, сосредоточив внимание, где это возможно, на репродуктивно-значимых GPCR, а также на потенциальном терапевтическом применении и использовании этих результатов.
Простым, но драматическим примером является дивергентная сортировка GPCR после индуцированного лигандом эндоцитоза либо по пути рециркуляции, либо по пути деградации/лизосомы (см. рис. 1), процесс, который по существу производит противоположные эффекты на передачу сигналов рецептора через родственные ему G-белки (3). Более того, способность перепрограммировать передачу сигналов путем изменения трафика или местоположения рецепторов может быть ключевым адаптивным механизмом для GPCR, которые подвергаются воздействию циклических и динамических гормональных условий, таких как те рецепторы, которые занимают центральное место в регуляции репродукции и беременности.В этом обзоре мы подчеркнем недавние достижения в нашем понимании того, что мембранный перенос играет роль в локационном контроле передачи сигналов GPCR, сосредоточив внимание, где это возможно, на репродуктивно-значимых GPCR, а также на потенциальном терапевтическом применении и использовании этих результатов.
Рисунок 1.
Клеточная модель пространственного контроля передачи сигналов GPCR через плазматическую мембрану и эндомембранную систему. После связывания с агонистом GPCR могут быть направлены в отдельные микродомены плазматической мембраны, такие как липидные рафты (Ai), или, после активации и последующей десенсибилизации (Aii), известно, что некоторые GPCR подвергаются эндоцитозу посредством клатринзависимых или независимых механизмов (B).CCP позволяют накапливать комплексы GPCR/arrestin, которые могут активировать опосредованную аррестином митогенную передачу сигналов (C). После интернализации GPCR будут накапливаться в эндосомальных компартментах, где они могут продолжать или реактивировать передачу сигналов гетеротримерного G-белка от эндосомальной мембраны, в дополнение к каркасному аррестину для активации независимых от G-белка сигнальных ответов (D и E). Некоторые GPCR по-разному сортируются в отдельную эндосомальную популяцию, называемую пре-EE или VEE (D), посредством рекрутирования и связывания белка PDZ GIPC в CCP.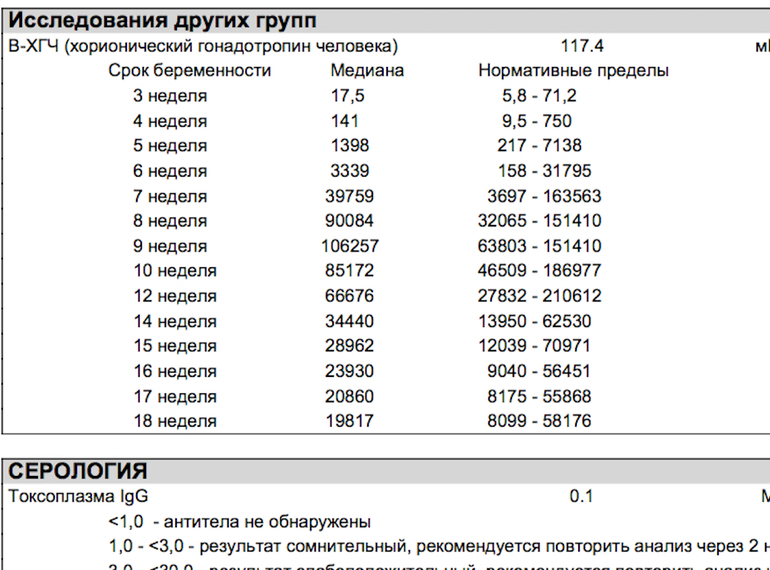 VEE сортирует рецепторы к регулируемому пути рециркуляции плазматической мембраны, направленному на последовательность, и нацеливание GPCR на этот компартмент вызывает устойчивый сигнальный ответ MAPK, хотя неизвестно, активируются ли в этом компартменте другие пути, включая передачу сигналов G-белка. Другие GPCRs направляются непосредственно в EE, где они по-разному сортируются между путями рециркуляции и деградации/лизосомами, что приводит к ресенсибилизации сигнала гетеротримерного G-белка плазматической мембраны или терминации сигнала, соответственно.Повторная вставка в плазматическую мембрану GPCRs, нацеленных на путь рециркуляции (F), демонстрирует отчетливые пространственно-временные паттерны вставки, либо преходящие, либо постоянные (см. текст), хотя ее роль в пространственном контроле передачи сигналов в дополнение к ресенсибилизации неизвестна. G-GTP, GTP-связанная форма G-белка; МВБ, мультивезикулярное тело.
VEE сортирует рецепторы к регулируемому пути рециркуляции плазматической мембраны, направленному на последовательность, и нацеливание GPCR на этот компартмент вызывает устойчивый сигнальный ответ MAPK, хотя неизвестно, активируются ли в этом компартменте другие пути, включая передачу сигналов G-белка. Другие GPCRs направляются непосредственно в EE, где они по-разному сортируются между путями рециркуляции и деградации/лизосомами, что приводит к ресенсибилизации сигнала гетеротримерного G-белка плазматической мембраны или терминации сигнала, соответственно.Повторная вставка в плазматическую мембрану GPCRs, нацеленных на путь рециркуляции (F), демонстрирует отчетливые пространственно-временные паттерны вставки, либо преходящие, либо постоянные (см. текст), хотя ее роль в пространственном контроле передачи сигналов в дополнение к ресенсибилизации неизвестна. G-GTP, GTP-связанная форма G-белка; МВБ, мультивезикулярное тело.
Рисунок 1.
Клеточная модель пространственного контроля передачи сигналов GPCR через плазматическую мембрану и эндомембранную систему. После связывания с агонистом GPCR могут быть направлены в отдельные микродомены плазматической мембраны, такие как липидные рафты (Ai), или, после активации и последующей десенсибилизации (Aii), известно, что некоторые GPCR подвергаются эндоцитозу посредством клатринзависимых или независимых механизмов (B).CCP позволяют накапливать комплексы GPCR/arrestin, которые могут активировать опосредованную аррестином митогенную передачу сигналов (C). После интернализации GPCR будут накапливаться в эндосомальных компартментах, где они могут продолжать или реактивировать передачу сигналов гетеротримерного G-белка от эндосомальной мембраны, в дополнение к каркасному аррестину для активации независимых от G-белка сигнальных ответов (D и E). Некоторые GPCR по-разному сортируются в отдельную эндосомальную популяцию, называемую пре-EE или VEE (D), посредством рекрутирования и связывания белка PDZ GIPC в CCP.VEE сортирует рецепторы к регулируемому пути рециркуляции плазматической мембраны, направленному на последовательность, и нацеливание GPCR на этот компартмент вызывает устойчивый сигнальный ответ MAPK, хотя неизвестно, активируются ли в этом компартменте другие пути, включая передачу сигналов G-белка.
После связывания с агонистом GPCR могут быть направлены в отдельные микродомены плазматической мембраны, такие как липидные рафты (Ai), или, после активации и последующей десенсибилизации (Aii), известно, что некоторые GPCR подвергаются эндоцитозу посредством клатринзависимых или независимых механизмов (B).CCP позволяют накапливать комплексы GPCR/arrestin, которые могут активировать опосредованную аррестином митогенную передачу сигналов (C). После интернализации GPCR будут накапливаться в эндосомальных компартментах, где они могут продолжать или реактивировать передачу сигналов гетеротримерного G-белка от эндосомальной мембраны, в дополнение к каркасному аррестину для активации независимых от G-белка сигнальных ответов (D и E). Некоторые GPCR по-разному сортируются в отдельную эндосомальную популяцию, называемую пре-EE или VEE (D), посредством рекрутирования и связывания белка PDZ GIPC в CCP.VEE сортирует рецепторы к регулируемому пути рециркуляции плазматической мембраны, направленному на последовательность, и нацеливание GPCR на этот компартмент вызывает устойчивый сигнальный ответ MAPK, хотя неизвестно, активируются ли в этом компартменте другие пути, включая передачу сигналов G-белка. Другие GPCRs направляются непосредственно в EE, где они по-разному сортируются между путями рециркуляции и деградации/лизосомами, что приводит к ресенсибилизации сигнала гетеротримерного G-белка плазматической мембраны или терминации сигнала, соответственно.Повторная вставка в плазматическую мембрану GPCRs, нацеленных на путь рециркуляции (F), демонстрирует отчетливые пространственно-временные паттерны вставки, либо преходящие, либо постоянные (см. текст), хотя ее роль в пространственном контроле передачи сигналов в дополнение к ресенсибилизации неизвестна. G-GTP, GTP-связанная форма G-белка; МВБ, мультивезикулярное тело.
Другие GPCRs направляются непосредственно в EE, где они по-разному сортируются между путями рециркуляции и деградации/лизосомами, что приводит к ресенсибилизации сигнала гетеротримерного G-белка плазматической мембраны или терминации сигнала, соответственно.Повторная вставка в плазматическую мембрану GPCRs, нацеленных на путь рециркуляции (F), демонстрирует отчетливые пространственно-временные паттерны вставки, либо преходящие, либо постоянные (см. текст), хотя ее роль в пространственном контроле передачи сигналов в дополнение к ресенсибилизации неизвестна. G-GTP, GTP-связанная форма G-белка; МВБ, мультивезикулярное тело.
Ямы, покрытые клатрином (ККТ). Больше, чем просто способ эндоцитоза?
Хорошо известно, что удаление GPCR с клеточной поверхности посредством процесса эндоцитоза регулирует передачу сигналов рецептора, способствуя десенсибилизации сигнала гетеротримерного G-белка.Описано несколько путей регуляции рецептор-опосредованного эндоцитоза.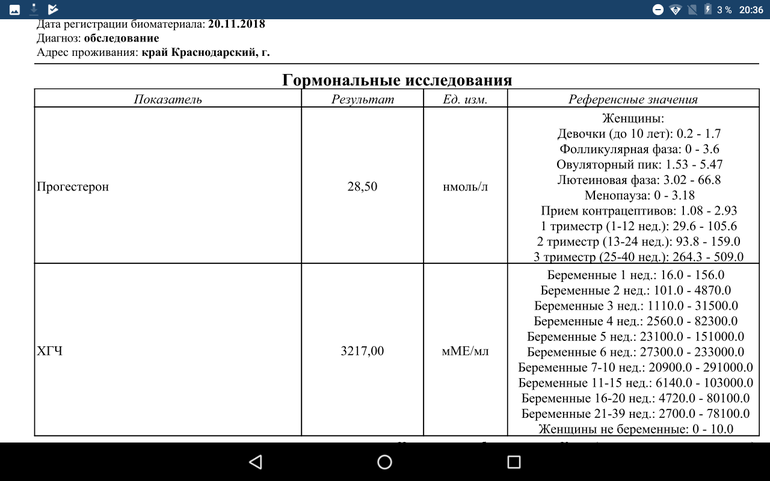 Однако наиболее широко охарактеризован клатрин-опосредованный эндоцитоз через ЦПК. CCPs формируются рекрутированием и упорядочением белков клатриновой оболочки с грузом, вспомогательными белками и адаптерами (Fig. 1B; рассмотрено в Refs. 4, 5). После отделения CCP от мембраны динаминовым семейством GTPases формируется новый везикул (6). Широко распространенная модель привлечения GPCR к CCP заключается в том, что активируемый лигандом рецептор сначала фосфорилируется (членом семейства киназ GPCR [GRKs]), что увеличивает аффинность цитоплазматических адапторных белков аррестина 2 и/или 3. к рецептору.Аррестины обладают способностью связывать тяжелую цепь клатрина, β(2)adaptin subunit клатринового адапторного белка 2 и GPCR, тем самым облегчая рекрутирование GPCR и кластеризацию в CCP для их последующей интернализации (rev. Ref. 7). Помимо разъединения передачи сигналов гетеротримерного G-белка от плазматической мембраны, аррестины также непосредственно активируют передачу сигналов GPCR независимо от родственных им G-белков, действуя как каркасы для различных сигнальных белков (Fig.
Однако наиболее широко охарактеризован клатрин-опосредованный эндоцитоз через ЦПК. CCPs формируются рекрутированием и упорядочением белков клатриновой оболочки с грузом, вспомогательными белками и адаптерами (Fig. 1B; рассмотрено в Refs. 4, 5). После отделения CCP от мембраны динаминовым семейством GTPases формируется новый везикул (6). Широко распространенная модель привлечения GPCR к CCP заключается в том, что активируемый лигандом рецептор сначала фосфорилируется (членом семейства киназ GPCR [GRKs]), что увеличивает аффинность цитоплазматических адапторных белков аррестина 2 и/или 3. к рецептору.Аррестины обладают способностью связывать тяжелую цепь клатрина, β(2)adaptin subunit клатринового адапторного белка 2 и GPCR, тем самым облегчая рекрутирование GPCR и кластеризацию в CCP для их последующей интернализации (rev. Ref. 7). Помимо разъединения передачи сигналов гетеротримерного G-белка от плазматической мембраны, аррестины также непосредственно активируют передачу сигналов GPCR независимо от родственных им G-белков, действуя как каркасы для различных сигнальных белков (Fig. 1C). Отдельные GPCR могут различаться по тому, как они участвуют в рецептор-опосредованном эндоцитозе, включая преимущественное рекрутирование аррестина, фосфорилирование с помощью различных киназ, лиганд-независимую интернализацию и даже аррестин- и/или независимую от клатрина интернализацию.Это было широко рассмотрено в другом месте (8–11). Вместо этого мы сосредоточимся на том, как эти пути, механизмы и отдельные клатрин-содержащие домены плазматической мембраны могут обеспечить жесткий контроль над организацией клеточной поверхности как механизм тонкой регуляции передачи клеточных сигналов.
1C). Отдельные GPCR могут различаться по тому, как они участвуют в рецептор-опосредованном эндоцитозе, включая преимущественное рекрутирование аррестина, фосфорилирование с помощью различных киназ, лиганд-независимую интернализацию и даже аррестин- и/или независимую от клатрина интернализацию.Это было широко рассмотрено в другом месте (8–11). Вместо этого мы сосредоточимся на том, как эти пути, механизмы и отдельные клатрин-содержащие домены плазматической мембраны могут обеспечить жесткий контроль над организацией клеточной поверхности как механизм тонкой регуляции передачи клеточных сигналов.
Разнообразие грузов и оборудования, которые, как сообщается, собираются в ККТ, подняло вопрос о том, существует ли гетерогенность в локализации в ККТ для разных рецепторов и, в свою очередь, влияет ли это на последующую сортировку и сигнальную активность рецептора.То, что отдельные рецепторы могут быть организованы в отдельные подмножества CCP, впервые было сообщено для β2-адренергического рецептора (β2AR) (12). Затем была продемонстрирована роль такой специализированной пространственной организации CCP, определяющая их последующую сортировку по пути рециркуляции или лизосомальным путям (13), как это также показано для пуринергических рецепторов, P2Y(1) и P2Y(12), которые идентифицировали 2 различные популяции CCP. (14, 15) также с функциональными последствиями в дифференциальной постэндоцитарной сортировке. Механически нацеливание рецепторов на эти различные CCP зависело от аррестина и фосфорилирования, при этом P2Y(12) и β2AR рекрутировались аррестин- и GRK-зависимым образом, а P2Y(1) — аррестин-независимым, но зависимым от протеинкиназы C способом. .Хорошо известно, что дополнительным GPCR, который интернализуется независимым от аррестина способом, является рецептор гонадотропин-рилизинг-гормона млекопитающих (GnRHR) (16). Хотя сообщалось, что этот рецептор локализуется в клатрине и кавеолах/липидных рафтах в зависимости от типа клеток (см. ниже), этот рецептор быстро рециркулирует после индуцированной лигандом интернализации (17), в отличие от ререстин-независимого P2Y(1), поэтому возможно, что он может быть дальнейшей субспециализацией ЦПК, что продиктовано ассоциированием адапторных молекул.
Затем была продемонстрирована роль такой специализированной пространственной организации CCP, определяющая их последующую сортировку по пути рециркуляции или лизосомальным путям (13), как это также показано для пуринергических рецепторов, P2Y(1) и P2Y(12), которые идентифицировали 2 различные популяции CCP. (14, 15) также с функциональными последствиями в дифференциальной постэндоцитарной сортировке. Механически нацеливание рецепторов на эти различные CCP зависело от аррестина и фосфорилирования, при этом P2Y(12) и β2AR рекрутировались аррестин- и GRK-зависимым образом, а P2Y(1) — аррестин-независимым, но зависимым от протеинкиназы C способом. .Хорошо известно, что дополнительным GPCR, который интернализуется независимым от аррестина способом, является рецептор гонадотропин-рилизинг-гормона млекопитающих (GnRHR) (16). Хотя сообщалось, что этот рецептор локализуется в клатрине и кавеолах/липидных рафтах в зависимости от типа клеток (см. ниже), этот рецептор быстро рециркулирует после индуцированной лигандом интернализации (17), в отличие от ререстин-независимого P2Y(1), поэтому возможно, что он может быть дальнейшей субспециализацией ЦПК, что продиктовано ассоциированием адапторных молекул. Воздействие такой субспециализации на активность рецептора и, следовательно, его нижестоящую физиологическую функцию может заключаться в функционировании в качестве добросовестных сигнальных микродоменов, например, посредством аррестин-зависимых сигнальных комплексов (рис. 1С).Потенциальная роль CCP в качестве сигнальных микродоменов подчеркивается способностью GPCR регулировать свое собственное время пребывания CCP. Для β2AR это достигается за счет взаимодействия с дополнительными белковыми каркасными белками, а именно белками постсинаптической плотности 95/большого диска/зонулы окклюденс-1 (PDZ), которые связывают GPCR с корковым актином и увеличивают время пребывания рецептора в CCP. задерживая набор динамина (15). Однако другие рецепторы, такие как μ-опиоидный рецептор, задерживают активность расщепления скорее, чем рекрутирование динамина, и независимым от PDZ образом (18).Функционально отсроченное время пребывания GPCR в CCP обеспечивает механизм регуляции митогенных сигналов во временном масштабе посредством формирования сигнальных каркасов аррестина, как было предложено в недавнем исследовании, измеряющем время пребывания с различными агонистами рецептора каннабиноидного рецептора типа 1 (CB1).
Воздействие такой субспециализации на активность рецептора и, следовательно, его нижестоящую физиологическую функцию может заключаться в функционировании в качестве добросовестных сигнальных микродоменов, например, посредством аррестин-зависимых сигнальных комплексов (рис. 1С).Потенциальная роль CCP в качестве сигнальных микродоменов подчеркивается способностью GPCR регулировать свое собственное время пребывания CCP. Для β2AR это достигается за счет взаимодействия с дополнительными белковыми каркасными белками, а именно белками постсинаптической плотности 95/большого диска/зонулы окклюденс-1 (PDZ), которые связывают GPCR с корковым актином и увеличивают время пребывания рецептора в CCP. задерживая набор динамина (15). Однако другие рецепторы, такие как μ-опиоидный рецептор, задерживают активность расщепления скорее, чем рекрутирование динамина, и независимым от PDZ образом (18).Функционально отсроченное время пребывания GPCR в CCP обеспечивает механизм регуляции митогенных сигналов во временном масштабе посредством формирования сигнальных каркасов аррестина, как было предложено в недавнем исследовании, измеряющем время пребывания с различными агонистами рецептора каннабиноидного рецептора типа 1 (CB1).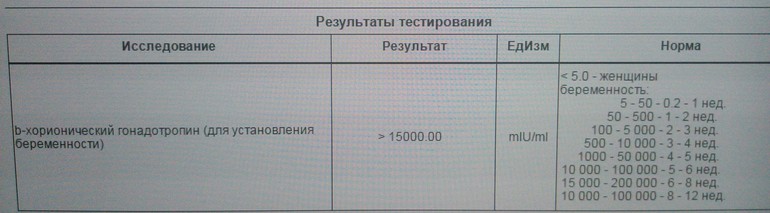 19). Каннабиноидный рецептор CB1, как часть эндоканабиноидной системы, модулирует синаптическую функцию, включая негативную регуляцию гамма-аминомасляной кислоты-эргического входа в нейроны GnRH, подавляя выход GnRH и фертильность (20), и, таким образом, такая пространственно-временная регуляция передачи сигналов CB1 может быть ключевым в его роли в модуляции высвобождения гамма-аминомасляной кислоты из пресинаптической мембраны в физиологических или патофизиологических условиях, например, способность каннабиса ингибировать секрецию лютеинизирующего гормона гипофиза (ЛГ).Дополнительные последующие клеточные последствия жесткого пространственного контроля передачи сигналов GPCR, такие как генерируемые CCP, недавно были продемонстрированы между активируемым протеазой рецептором 2 и рецептором нейрокинина-1 (NK1), чья аррестин-зависимая передача сигналов ERK опосредует либо миграцию клеток (протеаза -активированный рецептор 2) или пролиферацию (рецептор NK1) посредством дифференциальной локализации ERK (21).
19). Каннабиноидный рецептор CB1, как часть эндоканабиноидной системы, модулирует синаптическую функцию, включая негативную регуляцию гамма-аминомасляной кислоты-эргического входа в нейроны GnRH, подавляя выход GnRH и фертильность (20), и, таким образом, такая пространственно-временная регуляция передачи сигналов CB1 может быть ключевым в его роли в модуляции высвобождения гамма-аминомасляной кислоты из пресинаптической мембраны в физиологических или патофизиологических условиях, например, способность каннабиса ингибировать секрецию лютеинизирующего гормона гипофиза (ЛГ).Дополнительные последующие клеточные последствия жесткого пространственного контроля передачи сигналов GPCR, такие как генерируемые CCP, недавно были продемонстрированы между активируемым протеазой рецептором 2 и рецептором нейрокинина-1 (NK1), чья аррестин-зависимая передача сигналов ERK опосредует либо миграцию клеток (протеаза -активированный рецептор 2) или пролиферацию (рецептор NK1) посредством дифференциальной локализации ERK (21). Хотя рекрутирование аррестина или постэндоцитарный перенос GPCR может диктовать локализацию рецепторов в отдельных CCP, связанные с клатрином адаптеры, такие как аррестин и адаптерный белок 2, представляют собой основной механизм CCP, используемый многими видами рецепторов, но неясно, существуют ли являются дополнительным механизмом, который может направлять рецепторы в отдельные ямки.Было предположено, однако, что организация рецепторов через CCP может быть инициирована посредством дифференциального фосфорилирования внутриклеточных доменов GPCR (22), хотя еще предстоит определить, диктует ли это какую-либо специфичность адапторных белков в дополнение к аррестинам.
Хотя рекрутирование аррестина или постэндоцитарный перенос GPCR может диктовать локализацию рецепторов в отдельных CCP, связанные с клатрином адаптеры, такие как аррестин и адаптерный белок 2, представляют собой основной механизм CCP, используемый многими видами рецепторов, но неясно, существуют ли являются дополнительным механизмом, который может направлять рецепторы в отдельные ямки.Было предположено, однако, что организация рецепторов через CCP может быть инициирована посредством дифференциального фосфорилирования внутриклеточных доменов GPCR (22), хотя еще предстоит определить, диктует ли это какую-либо специфичность адапторных белков в дополнение к аррестинам.
Решетки и бляшки – новые клатринсодержащие структуры для регуляции передачи сигналов GPCR при репродукции?
Недавно сообщалось, что дополнительные покрытые клатрином структуры плазматической мембраны, клатриновые бляшки и клатриновые плоские решетки являются потенциальными местами организации GPCR на плазматической мембране (23, 24). Хотя клеточные биологи наблюдали в течение многих лет, эти недавние исследования показали, что они, возможно, являются беспрецедентными сигнальными микродоменами для GPCR. Эти большие и стабильные структуры, покрытые клатрином, с отличной от CCP морфологией, присутствуют в разных типах клеток и там, где могут локализоваться GPCR, такие как β2AR, μ-опиоидный рецептор и хемокиновый рецептор типа 5 (CCR5). Для CCR5 активация лиганда специфически реорганизовала рецептор в плоские клатриновые решетки. Стабильная природа этих структур по сравнению с CCP привела к предположению, что они представляют собой механизм функциональной компартментализации активированной формы рецептора в плазматической мембране и, таким образом, действуют как платформа для передачи сигналов рецептора и/или десенсибилизации (24).CCR5 является ключевым рецептором иммунной системы, и, хотя он экспрессируется в лейкоцитах, CCR5 и его лиганд обнаруживаются в других типах клеток репродуктивного тракта, где считается, что его экспрессия в эндометрии человека регулирует имплантацию бластоцисты (25).
Хотя клеточные биологи наблюдали в течение многих лет, эти недавние исследования показали, что они, возможно, являются беспрецедентными сигнальными микродоменами для GPCR. Эти большие и стабильные структуры, покрытые клатрином, с отличной от CCP морфологией, присутствуют в разных типах клеток и там, где могут локализоваться GPCR, такие как β2AR, μ-опиоидный рецептор и хемокиновый рецептор типа 5 (CCR5). Для CCR5 активация лиганда специфически реорганизовала рецептор в плоские клатриновые решетки. Стабильная природа этих структур по сравнению с CCP привела к предположению, что они представляют собой механизм функциональной компартментализации активированной формы рецептора в плазматической мембране и, таким образом, действуют как платформа для передачи сигналов рецептора и/или десенсибилизации (24).CCR5 является ключевым рецептором иммунной системы, и, хотя он экспрессируется в лейкоцитах, CCR5 и его лиганд обнаруживаются в других типах клеток репродуктивного тракта, где считается, что его экспрессия в эндометрии человека регулирует имплантацию бластоцисты (25). Помимо присутствия лиганда, регулируемого при активации, нормального T, экспрессируемого и секретируемого в фолликулярной жидкости, и CCR5 на сперме человека, его роль в хемотаксисе сперматозоидов человека (26) представляет интерес для пациентов с эндометриозом и воспалительными заболеваниями половых путей, где высокие уровни Регуляция при активации, нормальная экспрессия и секреция Т вызывает преждевременную акросомную реакцию и может лежать в основе снижения фертильности, наблюдаемого в этих группах пациентов (27).Эти физиологические/патофизиологические роли CCR5 могут отражать влияние устойчивого профиля сигнала CCR5 за счет локализации в таких структурах, покрытых плазматической мембраной. Интересно, что клеточная адгезия, как полагают, происходит на участках мембран, содержащих эти покрытые клатрином структуры (23, 24), и примерами, когда известно, что покрытые клатрином структуры существуют в местах межклеточных взаимодействий, являются тубулобульбарные комплексы в семенниках. Тубулобульбарные комплексы представляют собой удлиненные трубчатые отростки, которые выступают либо из сперматид, либо из клеток Сертоли в соответствующие инвагинации соседних клеток Сертоли в местах межклеточных соединений (28).
Помимо присутствия лиганда, регулируемого при активации, нормального T, экспрессируемого и секретируемого в фолликулярной жидкости, и CCR5 на сперме человека, его роль в хемотаксисе сперматозоидов человека (26) представляет интерес для пациентов с эндометриозом и воспалительными заболеваниями половых путей, где высокие уровни Регуляция при активации, нормальная экспрессия и секреция Т вызывает преждевременную акросомную реакцию и может лежать в основе снижения фертильности, наблюдаемого в этих группах пациентов (27).Эти физиологические/патофизиологические роли CCR5 могут отражать влияние устойчивого профиля сигнала CCR5 за счет локализации в таких структурах, покрытых плазматической мембраной. Интересно, что клеточная адгезия, как полагают, происходит на участках мембран, содержащих эти покрытые клатрином структуры (23, 24), и примерами, когда известно, что покрытые клатрином структуры существуют в местах межклеточных взаимодействий, являются тубулобульбарные комплексы в семенниках. Тубулобульбарные комплексы представляют собой удлиненные трубчатые отростки, которые выступают либо из сперматид, либо из клеток Сертоли в соответствующие инвагинации соседних клеток Сертоли в местах межклеточных соединений (28). Характерно, что каждый мембранный комплекс покрыт структурой, покрытой клатрином, которая очень стабильна и не подвергается расщеплению; особенности более стабильных клатриновых решеток и бляшек, а не классических CCP, которыми они, как предполагается, являются (28). На сегодняшний день не было идентифицировано присутствие GPCR в этих покрытых клатрином структурах. Однако, учитывая экспрессию рецептора фолликулостимулирующего гормона (ФСГ) (FSHR) в клетках Сертоли и многочисленные GPCR, о которых сообщалось, что они экспрессируются в сперме (29–31), они могут представлять собой важный пространственный механизм межклеточной коммуникации. для GPCR и транслокации и высвобождения сперматоцитов.
Характерно, что каждый мембранный комплекс покрыт структурой, покрытой клатрином, которая очень стабильна и не подвергается расщеплению; особенности более стабильных клатриновых решеток и бляшек, а не классических CCP, которыми они, как предполагается, являются (28). На сегодняшний день не было идентифицировано присутствие GPCR в этих покрытых клатрином структурах. Однако, учитывая экспрессию рецептора фолликулостимулирующего гормона (ФСГ) (FSHR) в клетках Сертоли и многочисленные GPCR, о которых сообщалось, что они экспрессируются в сперме (29–31), они могут представлять собой важный пространственный механизм межклеточной коммуникации. для GPCR и транслокации и высвобождения сперматоцитов.
Зависимая от аррестина передача сигналов и ее роль в репродукции
Способность опосредованного аррестином транспорта активировать клеточную сигнализацию, в дополнение к десенсибилизации сигнала G-белка, была предметом обширных исследований в течение многих лет и в настоящее время представляет большой интерес как действенный путь для фармацевтического нацеливания с клиническими преимуществами (32, 33).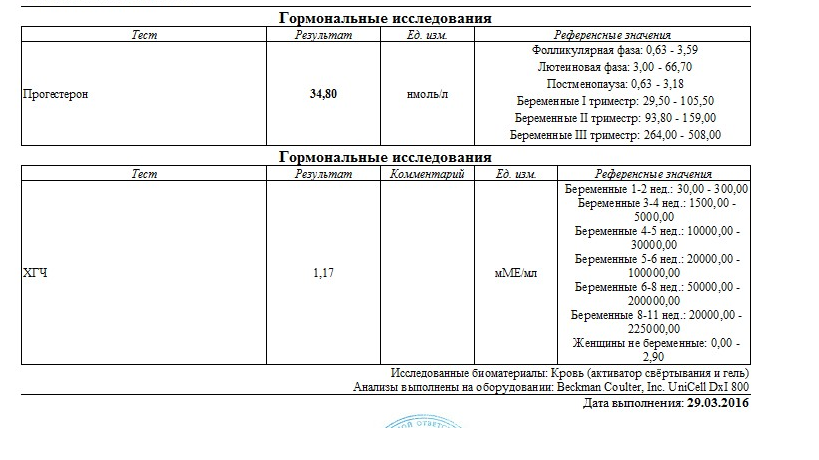 Аррестины могут связывать ряд эффекторов со связанными с агонистами GPCR, например, тирозинкиназы семейства Src, компоненты каскада MAPK (ERK и c-Jun N-концевые киназы) и убиквитинлигазы (гомолог двойной минуты 2 мыши) (34), что приводит к характерным временным и пространственно регулируемым режимам передачи сигналов, индуцированным GPCR.Эти различные модальности сигналов обеспечивают механизм диверсификации передачи сигналов через один класс белков, а для рецепторов, подвергающихся воздействию динамической гормональной среды, например, при репродукции и беременности, способ потенциального перепрограммирования сигнальных путей GPCR в качестве физиологического адаптивного механизма.
Аррестины могут связывать ряд эффекторов со связанными с агонистами GPCR, например, тирозинкиназы семейства Src, компоненты каскада MAPK (ERK и c-Jun N-концевые киназы) и убиквитинлигазы (гомолог двойной минуты 2 мыши) (34), что приводит к характерным временным и пространственно регулируемым режимам передачи сигналов, индуцированным GPCR.Эти различные модальности сигналов обеспечивают механизм диверсификации передачи сигналов через один класс белков, а для рецепторов, подвергающихся воздействию динамической гормональной среды, например, при репродукции и беременности, способ потенциального перепрограммирования сигнальных путей GPCR в качестве физиологического адаптивного механизма.
Рецепторы гонадотропиновых гормонов, FSHR и LH рецептор (LHR), привлекают аррестин для десенсибилизации индуцированной гонадотропиновыми гормонами передачи сигналов, а также для активации не-G-белков-опосредованных путей в яичниках и яичках.Для LHR всплеск ЛГ в середине цикла приводит к десенсибилизации передачи сигналов Gαs-аденилатциклазы-цАМФ в фолликулах яичников, процессу, опосредованному аррестином 2 и требующему открывателя сайта связывания нуклеотидов фактора рибозилирования АДФ (ARF).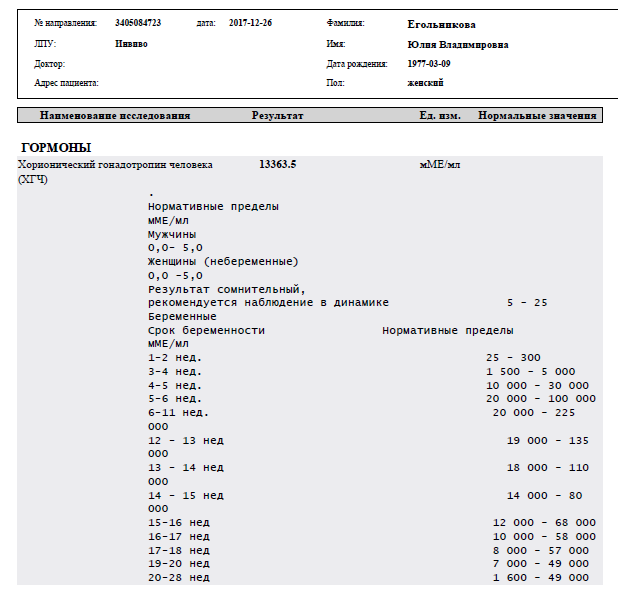 Открыватель сайта связывания нуклеотидов ARF высвобождает аррестин 2 из его сайта стыковки с мембраной, а фактор обмена гуаниновых нуклеотидов малых G-белков ARF6 способствует связыванию аррестина с LHR (35, 36). Десенсибилизация передачи сигналов Gαs во время всплеска ЛГ может «смещать» рецептор в сторону других путей G-белка, а именно Gαq/11, который участвует в овуляции (37), и/или путей MAPK, хотя участие аррестина в этих путях в яичники еще предстоит определить.Тем не менее, аррестин может опосредовать митогенную передачу сигналов от LHR в тестикулярных клетках Лейдига, где LHR активирует передачу сигналов MAPK посредством комплекса аррестин3/Fyn, который высвобождает факторы, подобные эпидермальному фактору роста, для активации ERK (38). Кроме того, это перекрестное взаимодействие рецепторов ЛГ и эпидермального фактора роста важно для стимулирования выработки тестостерона in vivo (39). Что касается FSHR, хотя он может рекрутировать аррестины и GRK для десенсибилизации передачи сигналов G-белка, он также может индуцировать передачу сигналов MAPK через аррестины.
Открыватель сайта связывания нуклеотидов ARF высвобождает аррестин 2 из его сайта стыковки с мембраной, а фактор обмена гуаниновых нуклеотидов малых G-белков ARF6 способствует связыванию аррестина с LHR (35, 36). Десенсибилизация передачи сигналов Gαs во время всплеска ЛГ может «смещать» рецептор в сторону других путей G-белка, а именно Gαq/11, который участвует в овуляции (37), и/или путей MAPK, хотя участие аррестина в этих путях в яичники еще предстоит определить.Тем не менее, аррестин может опосредовать митогенную передачу сигналов от LHR в тестикулярных клетках Лейдига, где LHR активирует передачу сигналов MAPK посредством комплекса аррестин3/Fyn, который высвобождает факторы, подобные эпидермальному фактору роста, для активации ERK (38). Кроме того, это перекрестное взаимодействие рецепторов ЛГ и эпидермального фактора роста важно для стимулирования выработки тестостерона in vivo (39). Что касается FSHR, хотя он может рекрутировать аррестины и GRK для десенсибилизации передачи сигналов G-белка, он также может индуцировать передачу сигналов MAPK через аррестины. Способность FSHR активировать передачу сигналов MAPK независимо от пути цАМФ, вероятно, лежит в основе фенотипа недостаточной фертильности при инактивирующей мутации FSHR (A189V), выявленной у пациентов мужского пола, которая демонстрирует нарушение передачи сигналов цАМФ, но поддерживает аррестин-зависимую активацию ERK (40).
Способность FSHR активировать передачу сигналов MAPK независимо от пути цАМФ, вероятно, лежит в основе фенотипа недостаточной фертильности при инактивирующей мутации FSHR (A189V), выявленной у пациентов мужского пола, которая демонстрирует нарушение передачи сигналов цАМФ, но поддерживает аррестин-зависимую активацию ERK (40).
Передача сигналов GPCR также строго контролируется во время беременности и претерпевает резкие адаптивные изменения во время родов, где рецептор окситоцина (OT) (OTR) играет центральную роль в этих процессах. Аррестины 2 и 3 в миометрии мышей негативно регулируют сокращения, индуцированные OTR, тогда как у мышей с нулевым аррестином 2/3 отсутствует десенсибилизация, индуцированная OT (41).Интересно, что в миоцитах человека аррестины 2 и 3 играют противоположные роли в десенсибилизации сигналов и активации передачи сигналов MAPK. Аррестин 2 участвует в десенсибилизации G-белка, тогда как аррестин 3 опосредует ответы передачи сигналов ERK (42). Такая специфическая для аррестина регуляция может быть механизмом для модулирования различных предродовых функций OTR, а именно сокращений и воспаления (43, 44).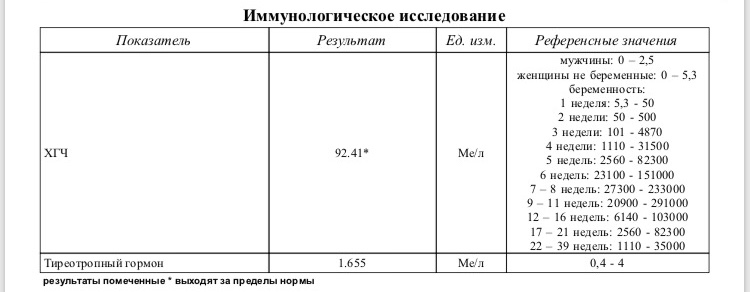 Совсем недавно была продемонстрирована центральная роль аррестинов в регуляции гипоталамо-гипофизарно-гонадной функции на уровне рецептора кисспептина, посредством чего мышиные модели с нокаутом аррестина 2 или аррестина 3 демонстрировали сниженную кисспептин-зависимую секрецию ЛГ (45).Это говорит о том, что активация опосредованной аррестином передачи сигналов ERK рецептором кисспептина является важным путем в репродукции и объясняет, почему известные инактивирующие мутации рецептора кисспептина (с точки зрения передачи сигналов Gαq/11) приводят только к частичному гонадотропному дефициту (45).
Совсем недавно была продемонстрирована центральная роль аррестинов в регуляции гипоталамо-гипофизарно-гонадной функции на уровне рецептора кисспептина, посредством чего мышиные модели с нокаутом аррестина 2 или аррестина 3 демонстрировали сниженную кисспептин-зависимую секрецию ЛГ (45).Это говорит о том, что активация опосредованной аррестином передачи сигналов ERK рецептором кисспептина является важным путем в репродукции и объясняет, почему известные инактивирующие мутации рецептора кисспептина (с точки зрения передачи сигналов Gαq/11) приводят только к частичному гонадотропному дефициту (45).
Липидные рафты и кавеолы как сигнальные микродомены GPCR
Липидные рафты и кавеолы определяются как плоские микродомены плазматической мембраны, обогащенные специфическими липидами и белками, такими как холестерин, сфинголипиды и белки, заякоренные гликозилфосфатидилинозитолом, или для кавеол — белками кавеолином (Cav) (рис. 1Ai).Известно, что липидные рафты участвуют в различных клеточных функциях, таких как гомеостаз холестерина, сортировка белков и липидов и везикулярный транспорт (46, 47). Важно отметить, что известно, что они регулируют клеточную передачу сигналов на плазматической мембране путем организации рецепторов с помощью своего сигнального механизма; гетеротримерные G-белки, эффекторные ферменты, такие как аденилатциклаза, и регуляторы передачи сигналов G-белка (например, регулятор передачи сигналов G-белка 16) (48). Таким образом, нарушение формирования липидного рафта может отменить передачу сигналов от некоторых GPCR, включая рецептор NK1 (49) и рецептор серотонина 1А (50).
1Ai).Известно, что липидные рафты участвуют в различных клеточных функциях, таких как гомеостаз холестерина, сортировка белков и липидов и везикулярный транспорт (46, 47). Важно отметить, что известно, что они регулируют клеточную передачу сигналов на плазматической мембране путем организации рецепторов с помощью своего сигнального механизма; гетеротримерные G-белки, эффекторные ферменты, такие как аденилатциклаза, и регуляторы передачи сигналов G-белка (например, регулятор передачи сигналов G-белка 16) (48). Таким образом, нарушение формирования липидного рафта может отменить передачу сигналов от некоторых GPCR, включая рецептор NK1 (49) и рецептор серотонина 1А (50).
Локализация GPCR на липидных рафтах может происходить конститутивным или лиганд-зависимым образом. Локализованные на рафтах GPCR демонстрируют небольшое количество конститутивного разделения на липидные рафты, которое затем увеличивается при стимуляции лигандом. Однако было показано, что мышиный GnRHR находится исключительно в богатых холестерином мембранных микродоменах в определенных типах клеток (51, 52).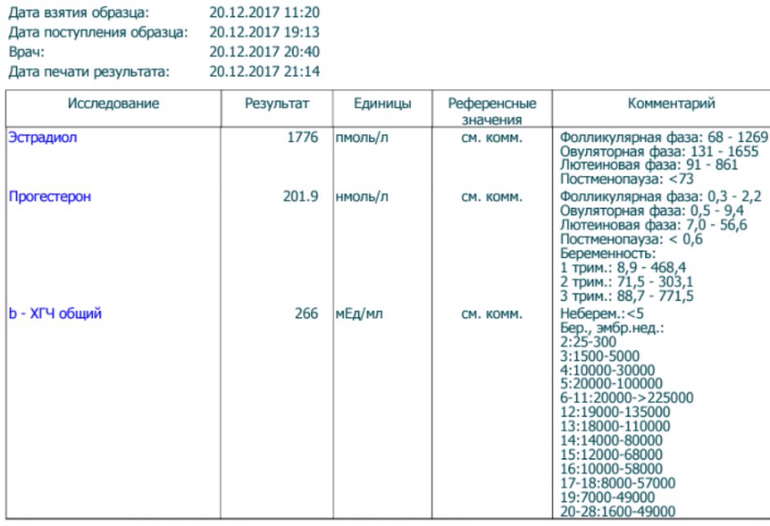 GnRHR млекопитающих уникальны для суперсемейства GPCR отсутствием внутриклеточного С-концевого хвоста. Однако было показано, что это не единственный фактор, участвующий в локализации липидного рафта, т.к. добавление С-концевого хвоста GnRHR курицы не влияло на локализацию рафта (53, 54).Напротив, С-концевой хвост нелипидного рафта, связанного с LHR, может реорганизовать GnRHR в неплотные области плазматической мембраны (53, 55), хотя было замечено, что LHR формирует упорядоченные микродомены плазматической мембраны после гормональной стимуляции (56, 55). 57). Интересно, что гипофизарные гонадотропы не содержат кавелоэ (54), однако липидный рафт-белок флоттилин-1 сильно экспрессируется и ассоциируется с GnRHRs (51), указывая на то, что природа липидных рафтов в гонадотропах различна.Роль этих микродоменов в передаче сигналов GnRH предлагается как механизм разделения передачи сигналов кальция через кальциевые каналы L-типа в гонадотропах в качестве необходимого элемента индуцированной GnRH передачи сигналов ERK.
GnRHR млекопитающих уникальны для суперсемейства GPCR отсутствием внутриклеточного С-концевого хвоста. Однако было показано, что это не единственный фактор, участвующий в локализации липидного рафта, т.к. добавление С-концевого хвоста GnRHR курицы не влияло на локализацию рафта (53, 54).Напротив, С-концевой хвост нелипидного рафта, связанного с LHR, может реорганизовать GnRHR в неплотные области плазматической мембраны (53, 55), хотя было замечено, что LHR формирует упорядоченные микродомены плазматической мембраны после гормональной стимуляции (56, 55). 57). Интересно, что гипофизарные гонадотропы не содержат кавелоэ (54), однако липидный рафт-белок флоттилин-1 сильно экспрессируется и ассоциируется с GnRHRs (51), указывая на то, что природа липидных рафтов в гонадотропах различна.Роль этих микродоменов в передаче сигналов GnRH предлагается как механизм разделения передачи сигналов кальция через кальциевые каналы L-типа в гонадотропах в качестве необходимого элемента индуцированной GnRH передачи сигналов ERK. Совсем недавно исследования с помощью микроскопии полного внутреннего отражения (TIRF-M) в гонадотропной клеточной линии αT3-1 предоставили прямые визуальные доказательства организованных событий притока кальция в плазматическую мембрану, называемых «кальциевыми искрами» (58). В конечном счете, такой пространственный контроль передачи сигналов кальция и ERK с помощью GnRHR может потребоваться для регуляции ключевых функций, таких как синтез и секреция LHβ (59).Кроме того, они также могут представлять собой платформу для перекрестных помех рецепторов. Действительно, сообщалось, что как глюкокортикоидный рецептор, так и рецепторы инсулина локализуются на GnRHR-содержащих липидных рафтах/микродоменах (53, 54). пролиферация посредством активации PKC и транскрипции киназы 1, регулируемой сывороткой/глюкокортикоидами (60). Интересно, что микродомены, содержащие инсулин и GnRHR, проявляют асимметричную функциональность, посредством чего инсулин усиливает индуцированную GnRH передачу сигналов ERK, тогда как GnRH ингибирует активацию опосредованного инсулином сигнального пути фосфоинозитид-3-киназы/протеинкиназы B (54).
Совсем недавно исследования с помощью микроскопии полного внутреннего отражения (TIRF-M) в гонадотропной клеточной линии αT3-1 предоставили прямые визуальные доказательства организованных событий притока кальция в плазматическую мембрану, называемых «кальциевыми искрами» (58). В конечном счете, такой пространственный контроль передачи сигналов кальция и ERK с помощью GnRHR может потребоваться для регуляции ключевых функций, таких как синтез и секреция LHβ (59).Кроме того, они также могут представлять собой платформу для перекрестных помех рецепторов. Действительно, сообщалось, что как глюкокортикоидный рецептор, так и рецепторы инсулина локализуются на GnRHR-содержащих липидных рафтах/микродоменах (53, 54). пролиферация посредством активации PKC и транскрипции киназы 1, регулируемой сывороткой/глюкокортикоидами (60). Интересно, что микродомены, содержащие инсулин и GnRHR, проявляют асимметричную функциональность, посредством чего инсулин усиливает индуцированную GnRH передачу сигналов ERK, тогда как GnRH ингибирует активацию опосредованного инсулином сигнального пути фосфоинозитид-3-киназы/протеинкиназы B (54).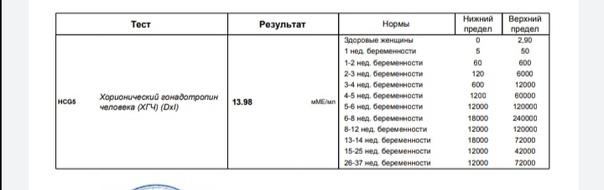 В этом исследовании подчеркивается важный вклад метаболических путей в репродуктивную функцию и, возможно, в такие состояния, как синдром поликистозных яичников (СПКЯ), где гиперинсулинемия может быть связана с высоким уровнем циркулирующего ЛГ, обнаруживаемым у женщин с СПКЯ (61). Тем не менее, большинство исследований проводится при длительном лечении ГнРГ, хотя стимуляция ГнРГ является одновременно пульсирующей и динамической, и недавно было показано, что это влияет на передачу сигналов МАРК (62). Следовательно, важным следующим шагом является понимание того, как эти микродомены способствуют его сигнальным ответам в таких динамических условиях in vivo.
В этом исследовании подчеркивается важный вклад метаболических путей в репродуктивную функцию и, возможно, в такие состояния, как синдром поликистозных яичников (СПКЯ), где гиперинсулинемия может быть связана с высоким уровнем циркулирующего ЛГ, обнаруживаемым у женщин с СПКЯ (61). Тем не менее, большинство исследований проводится при длительном лечении ГнРГ, хотя стимуляция ГнРГ является одновременно пульсирующей и динамической, и недавно было показано, что это влияет на передачу сигналов МАРК (62). Следовательно, важным следующим шагом является понимание того, как эти микродомены способствуют его сигнальным ответам в таких динамических условиях in vivo.
Несмотря на предостережения, связанные с биохимическим исследованием липидных рафтов (обзор см. в ссылке 63), идентификация того, что кавеолы содержат Cav-белки Cav1, Cav2 и/или Cav3 (последний специфичен для мышц) (64), обеспечила молекулярная «метка» для изучения этих микродоменов. Сообщалось, что некоторые GPCR интернализуются через кавеолы, хотя молекулярные детали того, как происходит этот процесс, недостаточно изучены (65). Однако, подобно липидным рафтам, они также могут действовать как сигналосомы GPCR, как средства пространственной десенсибилизации, так и локального усиления ответных сигналов.Было показано, что многие GPCR, субъединицы G-белка и системы эффекторных ферментов секвестрируются кавеолами (66, 67). Одним из примеров сигнального комплекса, опосредованного Cav1, является комплекс Gαq и фосфолипазы C, который приводит к повышенным уровням инозитолтрифосфата (68). Такое усиление передачи сигналов Gαq может лежать в основе зависимого от кавеол антипролиферативного действия OTR в простатических стромальных клетках с последствиями нарушения регуляции этого пути при старении и раке предстательной железы (69).
Однако, подобно липидным рафтам, они также могут действовать как сигналосомы GPCR, как средства пространственной десенсибилизации, так и локального усиления ответных сигналов.Было показано, что многие GPCR, субъединицы G-белка и системы эффекторных ферментов секвестрируются кавеолами (66, 67). Одним из примеров сигнального комплекса, опосредованного Cav1, является комплекс Gαq и фосфолипазы C, который приводит к повышенным уровням инозитолтрифосфата (68). Такое усиление передачи сигналов Gαq может лежать в основе зависимого от кавеол антипролиферативного действия OTR в простатических стромальных клетках с последствиями нарушения регуляции этого пути при старении и раке предстательной железы (69).
Плазмембранная организация рециклированных рецепторов
После эндоцитоза GPCR многие рецепторы направляются на путь рециркуляции обратно к плазматической мембране, что приводит к ресенсибилизации или восстановлению гормональной сигнализации (рис.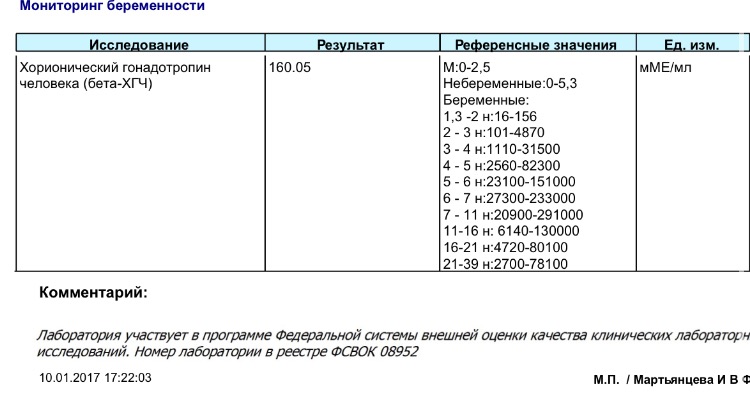 1F).GPCR сортируются по пути рециркуляции с помощью механизма, управляемого последовательностью, требующего специфических -цис--действующих сортирующих последовательностей в их С-концевых хвостах (3, 70, 71). Это отличается от рецепторов, которые рециркулируют в отсутствие последовательностей сортировки и возникают «по умолчанию» через объемный мембранный поток. Для некоторых рецепторов, таких как β2AR, рециклирующие последовательности представляют собой лиганды PDZ 1 типа (72, 73), а β2AR связывается с белком PDZ, сортирующим nexin-27 для его постэндоцитарного переноса (74).Однако большое разнообразие рециклирующих последовательностей в GPCR предполагает, что они связываются со специфическими цитоплазматическими белками (3). Мы отсылаем читателя к обзорам, описывающим эндосомальные механизмы, опосредующие постэндоцитарную сортировку по этим путям посредством очень разнообразных последовательностей рециклинга GPCR (3, 70). Что касается организации передачи сигналов GPCR на плазматической мембране, недавние сообщения об изучении событий ниже эндосомальной сортировки GPCR обратно на плазматическую мембрану могут указывать на то, что такие пути могут направлять рецепторы к определенным доменам плазматической мембраны.
1F).GPCR сортируются по пути рециркуляции с помощью механизма, управляемого последовательностью, требующего специфических -цис--действующих сортирующих последовательностей в их С-концевых хвостах (3, 70, 71). Это отличается от рецепторов, которые рециркулируют в отсутствие последовательностей сортировки и возникают «по умолчанию» через объемный мембранный поток. Для некоторых рецепторов, таких как β2AR, рециклирующие последовательности представляют собой лиганды PDZ 1 типа (72, 73), а β2AR связывается с белком PDZ, сортирующим nexin-27 для его постэндоцитарного переноса (74).Однако большое разнообразие рециклирующих последовательностей в GPCR предполагает, что они связываются со специфическими цитоплазматическими белками (3). Мы отсылаем читателя к обзорам, описывающим эндосомальные механизмы, опосредующие постэндоцитарную сортировку по этим путям посредством очень разнообразных последовательностей рециклинга GPCR (3, 70). Что касается организации передачи сигналов GPCR на плазматической мембране, недавние сообщения об изучении событий ниже эндосомальной сортировки GPCR обратно на плазматическую мембрану могут указывать на то, что такие пути могут направлять рецепторы к определенным доменам плазматической мембраны. В таких исследованиях использовалось N-концевое мечение GPCR с помощью суперэклиптического рН-флуорина (который флуоресцирует при нейтральном рН и не флуоресцирует при кислом рН [рН < 6,0], что происходит в кислом просвете эндосомы) в сочетании с визуализацией TIRF-M, что позволило прямая визуализация событий внедрения отдельных рецепторов в плазматическую мембрану с высоким временным разрешением (71, 75, 76). Как β2AR, так и μ-опиоидный рецептор подвергаются последовательно направленной рециркуляции, и эти исследования, визуализирующие отдельные события рециркуляции, показали, что рециркуляция GPCR 1) происходит с гораздо большей скоростью после стимуляции лигандом, чем ранее было обнаружено другими подходами, и 2) демонстрируют отчетливые пространственно-временные паттерны вставки. .Описаны как временные, так и «постоянные» события встраивания содержащих рецептор везикул, первые остаются менее 1 секунды, тогда как постоянные более 10 секунд, прежде чем рецептор латерально диффундирует в мембрану.
В таких исследованиях использовалось N-концевое мечение GPCR с помощью суперэклиптического рН-флуорина (который флуоресцирует при нейтральном рН и не флуоресцирует при кислом рН [рН < 6,0], что происходит в кислом просвете эндосомы) в сочетании с визуализацией TIRF-M, что позволило прямая визуализация событий внедрения отдельных рецепторов в плазматическую мембрану с высоким временным разрешением (71, 75, 76). Как β2AR, так и μ-опиоидный рецептор подвергаются последовательно направленной рециркуляции, и эти исследования, визуализирующие отдельные события рециркуляции, показали, что рециркуляция GPCR 1) происходит с гораздо большей скоростью после стимуляции лигандом, чем ранее было обнаружено другими подходами, и 2) демонстрируют отчетливые пространственно-временные паттерны вставки. .Описаны как временные, так и «постоянные» события встраивания содержащих рецептор везикул, первые остаются менее 1 секунды, тогда как постоянные более 10 секунд, прежде чем рецептор латерально диффундирует в мембрану. Тип проявляемых событий, по-видимому, зависит от типа клеток, потому что персистирующие события в первую очередь характерны для нейронов, а не для гетерологичных клеточных линий, таких как клетки НЕК 293 или астроциты и фибробласты (75, 77). Остается определить, проявляют ли другие типы клеток подобные события постоянного деления и какую функциональную роль они могут играть, хотя роль этих событий как специализированных сигнальных комплексов была предложена (75).Интересно, что оба события рециркуляции, по-видимому, регулируются различными механизмами, при этом временные события отрицательно регулируются протеинкиназой А (PKA) и агонистом, тогда как постоянные положительно регулируются агонистом, но не зависят от PKA. Учитывая роль GPCR-индуцированной передачи сигналов cAMP-PKA в этих событиях рециркуляции, одним возможным сигнальным комплексом, участвующим в регуляции и/или, возможно, интеграции функционального ответа от этих недавно рециклированных рецепторов, являются белки, закрепляющие A-киназы (AKAP).
Тип проявляемых событий, по-видимому, зависит от типа клеток, потому что персистирующие события в первую очередь характерны для нейронов, а не для гетерологичных клеточных линий, таких как клетки НЕК 293 или астроциты и фибробласты (75, 77). Остается определить, проявляют ли другие типы клеток подобные события постоянного деления и какую функциональную роль они могут играть, хотя роль этих событий как специализированных сигнальных комплексов была предложена (75).Интересно, что оба события рециркуляции, по-видимому, регулируются различными механизмами, при этом временные события отрицательно регулируются протеинкиназой А (PKA) и агонистом, тогда как постоянные положительно регулируются агонистом, но не зависят от PKA. Учитывая роль GPCR-индуцированной передачи сигналов cAMP-PKA в этих событиях рециркуляции, одним возможным сигнальным комплексом, участвующим в регуляции и/или, возможно, интеграции функционального ответа от этих недавно рециклированных рецепторов, являются белки, закрепляющие A-киназы (AKAP).
AKAPs представляют собой большое семейство каркасных белков, которые облегчают передачу сигналов GPCR путем связывания с регуляторными субъединицами PKA через их С-концевой мотив (rev. Refs. 78, 79). Помимо способности AKAP взаимодействовать с PKA, также известно, что AKAP опосредуют передачу сигнала с помощью сигнальных механизмов, таких как аденилатциклаза, серин/треонин и тирозинкиназы, а также молекулы завершения сигнала, такие как фосфатазы и фосфодиэстеразы. Следовательно, AKAP может формировать специализированные сигнальные микродомены или станции, которые могут обеспечивать пространственно-временную регуляцию передачи сигналов.Было показано, что AKAP, такие как AKAP12 (также называемый Gravin или AKAP250), предпочтительно связываются с β2AR на плазматической мембране и участвуют в регуляции рециркуляции этого GPCR (80, 81). Дополнительными AKAP, участвующими в регуляции активности рецептора β2AR, являются AKAP5 (также называемые AKAP79/150), которые, что интересно, особенно необходимы для активации ERK, не влияя на передачу сигналов или рециркуляцию цАМФ (82). Могут ли такие каркасные белки отражать потенциальную функциональную роль постоянных и/или транзиторных событий рециркуляции, еще предстоит определить.Тем не менее, AKAP5 и 7α участвуют в поддержании остановки мейоза ооцитов, и поскольку для GPCR, ответственных за поддержание этой передачи сигналов цАМФ, требуются как конститутивный эндоцитоз, так и рециркуляция (GPR3/6/12), это предполагает, что пространственные каркасы передачи сигналов цАМФ этих рециркуляция GPCR важна для созревания ооцитов (83–85).
Могут ли такие каркасные белки отражать потенциальную функциональную роль постоянных и/или транзиторных событий рециркуляции, еще предстоит определить.Тем не менее, AKAP5 и 7α участвуют в поддержании остановки мейоза ооцитов, и поскольку для GPCR, ответственных за поддержание этой передачи сигналов цАМФ, требуются как конститутивный эндоцитоз, так и рециркуляция (GPR3/6/12), это предполагает, что пространственные каркасы передачи сигналов цАМФ этих рециркуляция GPCR важна для созревания ооцитов (83–85).
Эндосомальная передача сигналов GPCR
Как описано выше, парадигматическая модель передачи сигналов GPCR изображает рецепторы, локализованные в плазматической мембране, активирующие отдельный путь передачи сигналов гетеротримерного G-белка, который, в свою очередь, сходится с общими нисходящими путями, такими как передача сигналов MAPK.Наше текущее понимание высокой сложности этих путей теперь включает хорошо описанную способность ключевых адапторных белков GPCR, т.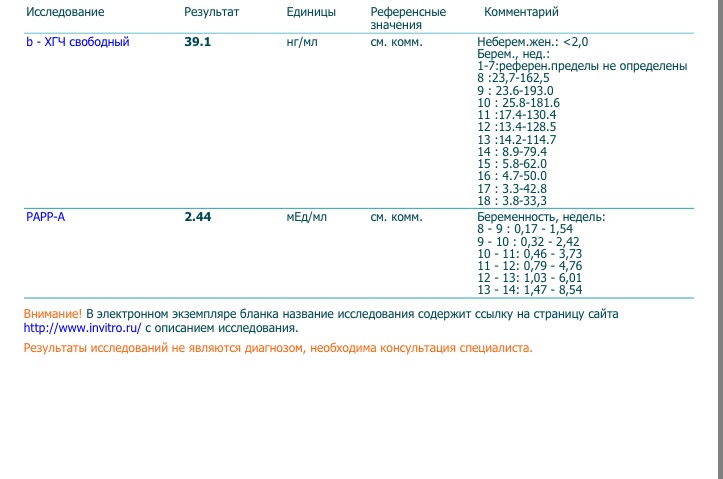 е. аррестинов, генерировать отчетливые паттерны передачи сигналов в специфических местах мембраны. Однако в последнее время появилось множество данных, демонстрирующих, что передача сигналов G-белком от рецепторов может происходить за пределами плазматической мембраны (т. е. на уровне эндосом) и что передача сигналов может регулироваться в эндосомальных популяциях, таким образом, передача сигналов GPCR может быть нарушена. широко подразделяются на 2 фазы: передача сигналов плазматической мембраны (фаза 1) и передача сигналов эндомембраны (фаза 2) (см. Рисунок 1).Ключевые исследования, демонстрирующие, что GPCR продолжают активировать или демонстрируют постоянную передачу сигналов гетеротримерного G-белка после интернализации, были показаны с 2 Gαs-связанными рецепторами, рецептором ТТГ и рецептором ПТГ (PTHR). В этих исследованиях использовались биосенсоры цАМФ, которые продемонстрировали, что постоянная передача сигналов цАМФ требует интернализации, механизмы для генерации таких устойчивых сигналов цАМФ, Gαs и аденилатциклазы были локализованы в ранних эндосомах (ЭЭ), и что эта постоянная эндосомальная передача сигналов потенциально физиологически значима (как показано для ТТГ).
е. аррестинов, генерировать отчетливые паттерны передачи сигналов в специфических местах мембраны. Однако в последнее время появилось множество данных, демонстрирующих, что передача сигналов G-белком от рецепторов может происходить за пределами плазматической мембраны (т. е. на уровне эндосом) и что передача сигналов может регулироваться в эндосомальных популяциях, таким образом, передача сигналов GPCR может быть нарушена. широко подразделяются на 2 фазы: передача сигналов плазматической мембраны (фаза 1) и передача сигналов эндомембраны (фаза 2) (см. Рисунок 1).Ключевые исследования, демонстрирующие, что GPCR продолжают активировать или демонстрируют постоянную передачу сигналов гетеротримерного G-белка после интернализации, были показаны с 2 Gαs-связанными рецепторами, рецептором ТТГ и рецептором ПТГ (PTHR). В этих исследованиях использовались биосенсоры цАМФ, которые продемонстрировали, что постоянная передача сигналов цАМФ требует интернализации, механизмы для генерации таких устойчивых сигналов цАМФ, Gαs и аденилатциклазы были локализованы в ранних эндосомах (ЭЭ), и что эта постоянная эндосомальная передача сигналов потенциально физиологически значима (как показано для ТТГ).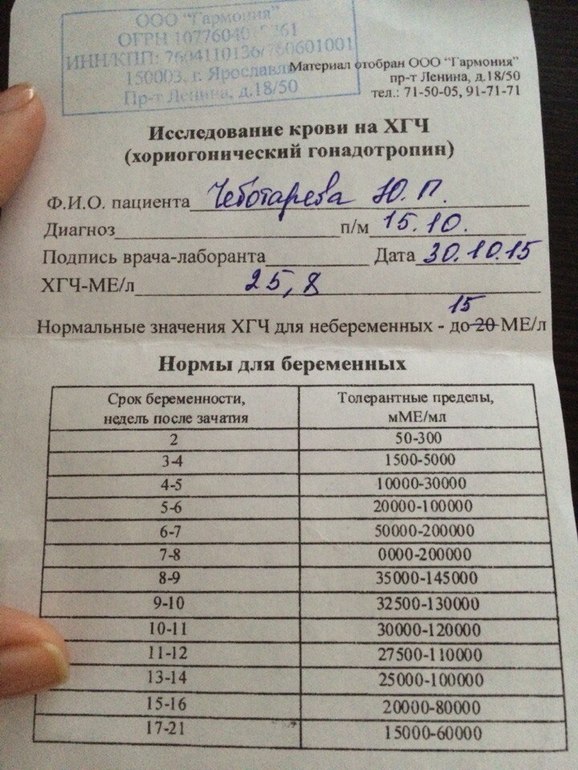 рецептор в трехмерных культурах фолликулов щитовидной железы) (86, 87).Было показано, что для PTHR генерация эндосомального цАМФ усиливается аррестином и ослабляется ретромерным комплексом, участвующим в рециркуляции рецепторов (88), и что эндосомальное закисление играет ключевую роль в этом деактивирующем переключении (89). PTHR играет критическую роль в регуляции гомеостаза Ca 2+ за счет его действия на кости и почки, а устойчивая передача сигналов, индуцированная различными лигандами PTH, в свою очередь влияет на трабекулярный объем кости, но вызывает большее увеличение метаболизма кортикальной кости. Такие особенности передачи сигналов PTHR могут быть использованы в терапевтических целях, например, при некоторых формах гипопаратиреоза, которые реагируют на ПТГ.Тем не менее, авторы предполагают, что аналоги ПТГ, которые индуцируют устойчивую передачу сигналов, приводят к усилению метаболизма кортикальной кости, поэтому такие состояния, как остеопороз, могут не иметь преимуществ от лигандов ПТГ с устойчивыми сигнальными свойствами (90).
рецептор в трехмерных культурах фолликулов щитовидной железы) (86, 87).Было показано, что для PTHR генерация эндосомального цАМФ усиливается аррестином и ослабляется ретромерным комплексом, участвующим в рециркуляции рецепторов (88), и что эндосомальное закисление играет ключевую роль в этом деактивирующем переключении (89). PTHR играет критическую роль в регуляции гомеостаза Ca 2+ за счет его действия на кости и почки, а устойчивая передача сигналов, индуцированная различными лигандами PTH, в свою очередь влияет на трабекулярный объем кости, но вызывает большее увеличение метаболизма кортикальной кости. Такие особенности передачи сигналов PTHR могут быть использованы в терапевтических целях, например, при некоторых формах гипопаратиреоза, которые реагируют на ПТГ.Тем не менее, авторы предполагают, что аналоги ПТГ, которые индуцируют устойчивую передачу сигналов, приводят к усилению метаболизма кортикальной кости, поэтому такие состояния, как остеопороз, могут не иметь преимуществ от лигандов ПТГ с устойчивыми сигнальными свойствами (90).
Прямые доказательства того, что GPCR могут активировать гетеротримерные G-белки из эндосом, были получены в основополагающем исследовании, в ходе которого был разработан биосенсор нанотел для обнаружения либо активной, не содержащей нуклеотидов формы Gαs, либо активируемой лигандом конформации β2AR (91).Эти нанотела первоначально были созданы как инструменты, помогающие кристаллизации этого GPCR в различных активных конформациях (92), но применение в качестве биосенсора для визуализации в живых клетках показало, что β2AR и Gα реактивируются при достижении мембраны EE (91). Недавно было продемонстрировано, что функциональная роль этой эндосомальной передачи сигналов Gαs-cAMP активирует различные нижележащие транскрипционные ответы (93). Интересно, что благодаря использованию оптогенетических аденилатциклазных зондов, направленных либо на плазматическую мембрану, либо на эндосому, либо на цитоплазму, эти транскрипционные ответы были полностью опосредованы локализацией сигнала цАМФ (93), что, возможно, позволяет предположить, что эндосомально генерируемый цАМФ «помечен» еще неизвестные механизмы для клетки, чтобы перевести эти события в изменения в экспрессии определенных генов.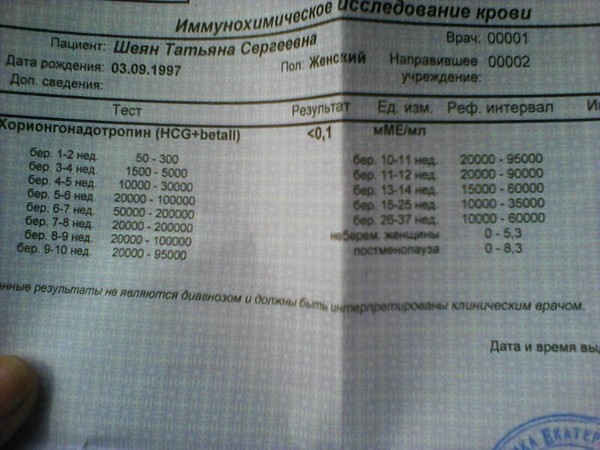
Пространственная организация передачи сигналов вторичных мессенджеров, вероятно, важна в более широком физиологическом контексте и для других путей GPCR и G-белков. В самом деле, устойчивая эндосомальная передача сигналов цАМФ также была зарегистрирована для рецептора глюкагоноподобного пептида 1 с потребностью в стимулированной глюкозой секреции инсулина (94, 95), рецептора вазопрессина V2, играющего роль в регуляции почечного транспорта воды и натрия, и дифференциальной антидиуретический эффект между вазопрессином и ОТ (96), гипофизарным рецептором полипептида 1 типа, активирующим аденилатциклазу, который играет роль в индуцированной полипептидом гипофиза аденилатциклазе возбудимости нейронов (95) и потенциально рецептором простагландина E2 EP4 для стимуляции продукции амилоида-β пептиды, участвующие в патогенезе болезни Альцгеймера (97).
Передача сигналов эндосомального G-белка также актуальна для репродуктивных систем, что было продемонстрировано для рецептора кисспептина, Gαq/11-связанного GPCR, который демонстрирует устойчивый профиль передачи сигналов кальция в клетках CHO и гипоталамической линии нейронов, экспрессирующих GnRH, GT1–7 (98).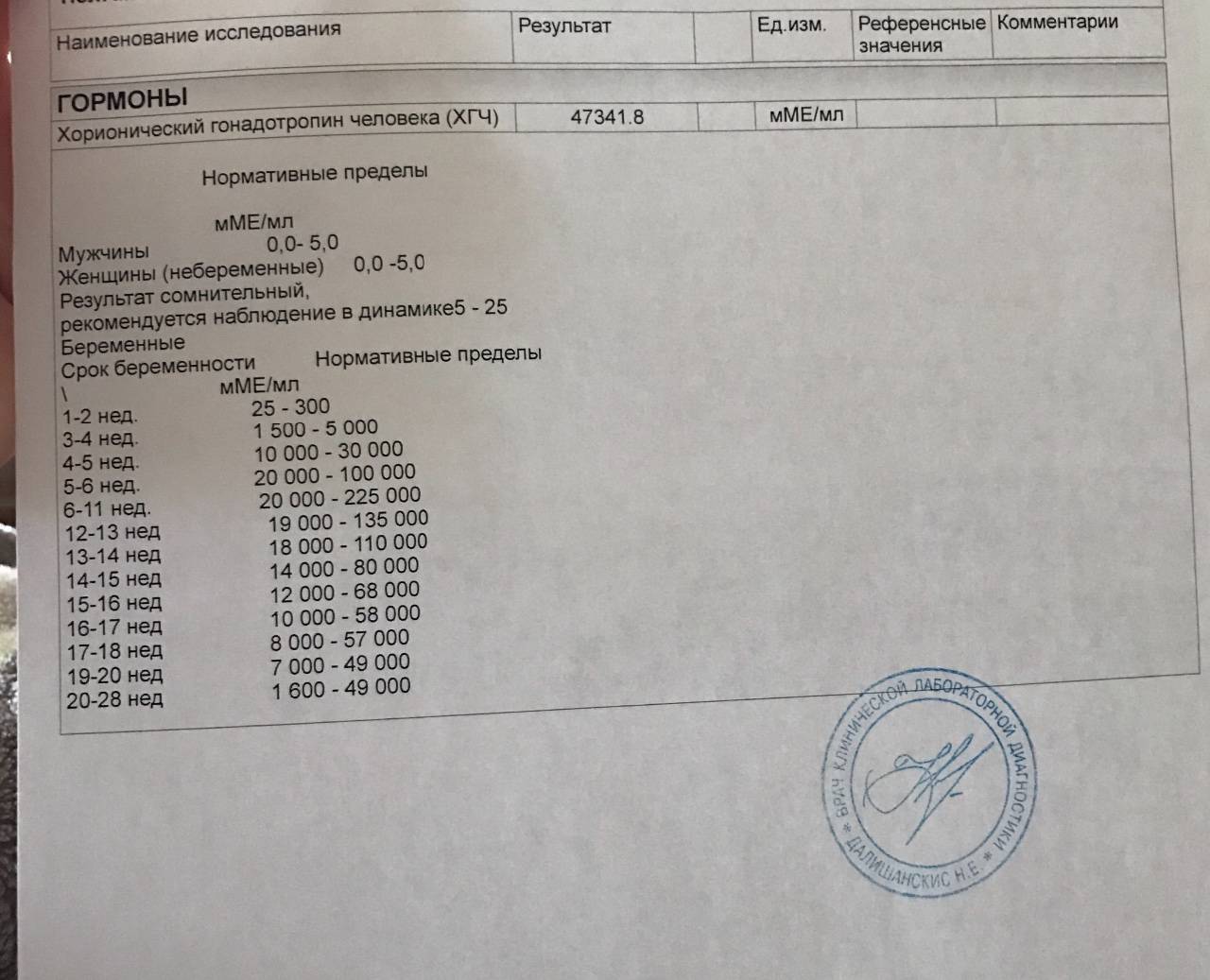 Этот постоянный сигнал полностью зависел от интернализации рецептора (98) и может частично лежать в основе повышенной активности мутации рецептора кисспептина R386P, которая вызывает центральное преждевременное половое созревание из-за снижения деградации рецептора/понижающей регуляции и чистого увеличения рециркуляции. и потенциально усиленная эндосомальная передача сигналов кальция (99).Интересно, что это исследование также демонстрирует, что эндосомальная передача сигналов от GPCR может происходить для дополнительных путей G-белка.
Этот постоянный сигнал полностью зависел от интернализации рецептора (98) и может частично лежать в основе повышенной активности мутации рецептора кисспептина R386P, которая вызывает центральное преждевременное половое созревание из-за снижения деградации рецептора/понижающей регуляции и чистого увеличения рециркуляции. и потенциально усиленная эндосомальная передача сигналов кальция (99).Интересно, что это исследование также демонстрирует, что эндосомальная передача сигналов от GPCR может происходить для дополнительных путей G-белка.
Пространственная регуляция передачи сигналов GPCR в дивергентных эндосомах. Тот самый ЭЭ (ВЭЭ)
Традиционно EE рассматривается как самая ранняя и основная платформа для приема, организации и сортировки различных наборов грузов. Тем не менее, наша недавняя работа продемонстрировала, что 2 Gαs-связанные GPCR, которые подвергаются рециклингу, направленному на последовательность, β2AR и человеческий LHR (LHR грызунов не имеют рециклирующей последовательности и в первую очередь сортируются для деградации) (100) по-разному сортируются по различным эндосомальные отделы.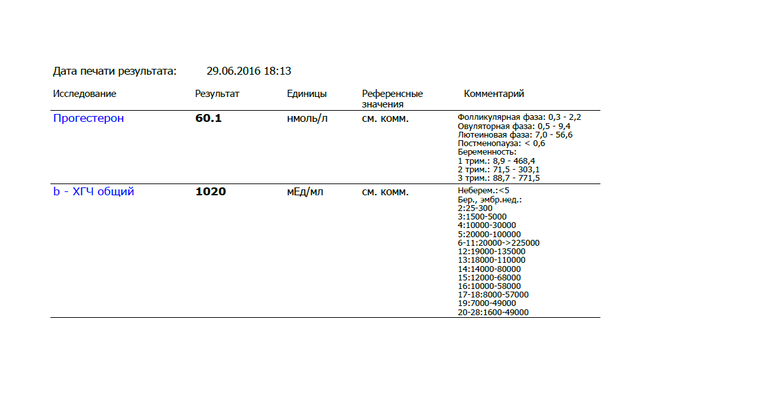 Хорошо известно, что β2AR быстро усваивается и отделяется от EE. Однако LHR интернализуется в физически меньший компартмент эндосомы, лишенный EE маркеров EE антиген 1 и фосфатидилинозитол-3 фосфат. Размер эндосомы и биохимический состав позволяют предположить, что LHR интернализуется в отдельный компартмент выше по течению от EE (101). Известно, что существует субпопуляция промежуточных продуктов EE, которые считаются предшественниками классических сортирующих эндосом и, в частности, рекрутируют эффекторный белок GTPase Ras-родственного белка Rab5, адапторный белок, содержащий домен PH, домен PTB и мотив лейциновой молнии (APPL1). 102).Хотя было обнаружено, что LHR перемещается в APPL-позитивные эндосомы, этот рецептор не нуждается в Rab5 для своей активности, указывая на то, что pre-EEs, в которые перемещается LHR, могут быть отдельным компартментом (101). Направление LHR в этот меньший компартмент pre-EE зависело от рецептора, взаимодействующего с C-концом белка, взаимодействующего с Gαi PDZ (GIPC), который, как ранее было показано, взаимодействует с карбоксиконцевым хвостом LHR и необходим для его рециркуляции.
Хорошо известно, что β2AR быстро усваивается и отделяется от EE. Однако LHR интернализуется в физически меньший компартмент эндосомы, лишенный EE маркеров EE антиген 1 и фосфатидилинозитол-3 фосфат. Размер эндосомы и биохимический состав позволяют предположить, что LHR интернализуется в отдельный компартмент выше по течению от EE (101). Известно, что существует субпопуляция промежуточных продуктов EE, которые считаются предшественниками классических сортирующих эндосом и, в частности, рекрутируют эффекторный белок GTPase Ras-родственного белка Rab5, адапторный белок, содержащий домен PH, домен PTB и мотив лейциновой молнии (APPL1). 102).Хотя было обнаружено, что LHR перемещается в APPL-позитивные эндосомы, этот рецептор не нуждается в Rab5 для своей активности, указывая на то, что pre-EEs, в которые перемещается LHR, могут быть отдельным компартментом (101). Направление LHR в этот меньший компартмент pre-EE зависело от рецептора, взаимодействующего с C-концом белка, взаимодействующего с Gαi PDZ (GIPC), который, как ранее было показано, взаимодействует с карбоксиконцевым хвостом LHR и необходим для его рециркуляции. 103). Эти исследования дополняют друг друга, поскольку потеря этого взаимодействия ингибирует рециркуляцию LHR из-за перенаправления этого рецептора от пре-EE к EE.Это указывало на необходимость сортировки этого отсека и, следовательно, может представлять собой VEE (рис. 1D). Это также продемонстрировало, что упорядоченная последовательность сортировка GPCR может происходить из компартментов, отличных от EE, как это недавно было продемонстрировано для β1AR (104).
103). Эти исследования дополняют друг друга, поскольку потеря этого взаимодействия ингибирует рециркуляцию LHR из-за перенаправления этого рецептора от пре-EE к EE.Это указывало на необходимость сортировки этого отсека и, следовательно, может представлять собой VEE (рис. 1D). Это также продемонстрировало, что упорядоченная последовательность сортировка GPCR может происходить из компартментов, отличных от EE, как это недавно было продемонстрировано для β1AR (104).
VEE также предоставил механизм для прямого пространственного управления передачей сигналов GPCR. Индуцированная LH активация LHR индуцировала устойчивый временной профиль передачи сигналов ERK, который требовал как интернализации, так и нацеливания на правильный эндосомальный компартмент, VEE (101).Т.о., в дополнение к компартментальной предвзятости в передаче сигналов гетеротримерного G-белка между плазматической мембраной и EEs, описанной в исследованиях выше, существует также компартментальная предвзятость в передаче сигналов GPCR через разные эндосомы.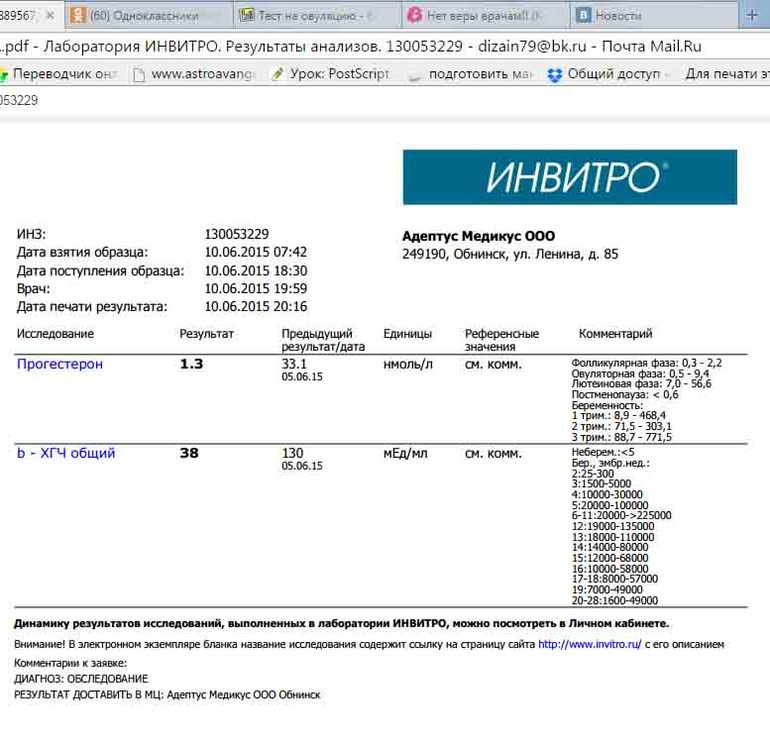 Было показано, что эндосомы APPL действуют как сигнальные центры для регуляции сигнальных каскадов MAPK и Akt с помощью рецепторов эпидермального фактора роста (EGFR), адипонектина и тропомиозиновых рецепторов киназы A и могут иметь решающее значение для выживания клеток в некоторых системах (105–109).Для LHR дальнейшая роль таргетинга на VEE еще предстоит определить. Тем не менее, ЛГ индуцирует устойчивый сигнальный профиль ERK в клетках гранулезы человека, который отрицательно регулирует экспрессию ароматазы (110), сигнальный профиль, который может быть результатом локализации и переноса из VEE. Тем не менее, известная гиперандрогенемия, которая является одним из диагностических признаков СПКЯ, может быть результатом изменения эндосомальной локализации LHR или сохранения в VEE, что может привести к измененному или усиленному сигнальному профилю, что приводит к известному увеличению продукции андростендиона LHR в тека-клетках (111). , 112).
Было показано, что эндосомы APPL действуют как сигнальные центры для регуляции сигнальных каскадов MAPK и Akt с помощью рецепторов эпидермального фактора роста (EGFR), адипонектина и тропомиозиновых рецепторов киназы A и могут иметь решающее значение для выживания клеток в некоторых системах (105–109).Для LHR дальнейшая роль таргетинга на VEE еще предстоит определить. Тем не менее, ЛГ индуцирует устойчивый сигнальный профиль ERK в клетках гранулезы человека, который отрицательно регулирует экспрессию ароматазы (110), сигнальный профиль, который может быть результатом локализации и переноса из VEE. Тем не менее, известная гиперандрогенемия, которая является одним из диагностических признаков СПКЯ, может быть результатом изменения эндосомальной локализации LHR или сохранения в VEE, что может привести к измененному или усиленному сигнальному профилю, что приводит к известному увеличению продукции андростендиона LHR в тека-клетках (111). , 112).
VEE может играть ключевую роль в регуляции активности GPCR в дополнение к LHR, как это было показано для β1AR и FSHR (101). Хотя β1AR является известным GPCR, взаимодействующим с GIPC (113), потребность GIPC в передаче сигналов FSHR не сообщалась, хотя APPL1 является хорошо известным партнером по связыванию FSHR (114), а APPL1 и GIPC также могут связываться (108 ), предполагая возможный механизм регуляции VEE этими GPCR. В целом, обнаружение того, что отдельные эндосомы могут обеспечивать определенный пространственный контроль передачи сигналов рецепторами, обеспечивает клеточную систему, в которой передача гормональных сигналов может быть изменена путем простого перенаправления рецепторов между компартментами как в физиологических, так и в патофизиологических условиях.
Хотя β1AR является известным GPCR, взаимодействующим с GIPC (113), потребность GIPC в передаче сигналов FSHR не сообщалась, хотя APPL1 является хорошо известным партнером по связыванию FSHR (114), а APPL1 и GIPC также могут связываться (108 ), предполагая возможный механизм регуляции VEE этими GPCR. В целом, обнаружение того, что отдельные эндосомы могут обеспечивать определенный пространственный контроль передачи сигналов рецепторами, обеспечивает клеточную систему, в которой передача гормональных сигналов может быть изменена путем простого перенаправления рецепторов между компартментами как в физиологических, так и в патофизиологических условиях.
Заключительные замечания и будущие направления
Пространственный контроль передачи сигналов GPCR — это больше, чем просто новая концепция, но теперь это рабочая клеточная модель (рис. 1), которую теперь можно использовать для понимания того, как клетки переводят сложные сигнальные ответы в определенные клеточные программы in vivo. Однако молекулярные детали этих путей для данного рецептора, вероятно, еще более сложны. Детальное понимание этих фундаментальных клеточных биологических механизмов, вероятно, ускорится с развитием технологий визуализации, таких как широкий спектр подходов микроскопии сверхвысокого разрешения, которые используются в настоящее время, позволяя визуализировать белки ниже дифракционного барьера стандартной иммунофлуоресцентной микроскопии, включая TIRF-микроскопию. M, и даже его адаптация к изучению молекулярных процессов непосредственно in vivo (115).
Однако молекулярные детали этих путей для данного рецептора, вероятно, еще более сложны. Детальное понимание этих фундаментальных клеточных биологических механизмов, вероятно, ускорится с развитием технологий визуализации, таких как широкий спектр подходов микроскопии сверхвысокого разрешения, которые используются в настоящее время, позволяя визуализировать белки ниже дифракционного барьера стандартной иммунофлуоресцентной микроскопии, включая TIRF-микроскопию. M, и даже его адаптация к изучению молекулярных процессов непосредственно in vivo (115).
GPCR остаются одной из наиболее успешных мишеней для лекарств, и использование или манипулирование пространственным контролем передачи сигналов GPCR уже является целью для новых терапевтических стратегий. Смещенные лиганды в настоящее время представляют большой интерес, некоторые из них находятся в клинической разработке (116, 117). Такие соединения могут стабилизировать подмножество множества возможных конформаций рецепторов, что приводит к высокой селективности их действия и потенциально меньшему количеству нецелевых эффектов.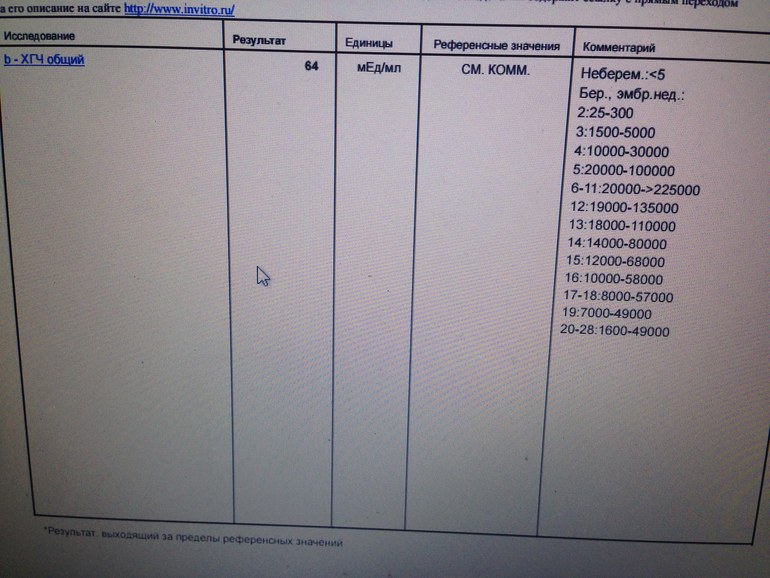 Эти лиганды могут нацеливаться либо на ортостерические, либо на аллостерические сайты связывания в рецепторе или даже на внутриклеточные области рецептора, как недавно было показано при использовании интрател или пепдуцинов (118-121).В настоящее время этот фармакологический «набор инструментов» направлен на смещение сигналов между различными путями G-белка или между G-белком и опосредованной аррестином передачей сигналов. По мере понимания механизмов и физиологической роли пространственного контроля передачи сигналов GPCR существующие соединения могут быть дополнительно усовершенствованы, чтобы учесть новую информацию об этих путях и/или представить платформу для скрининга новых лигандов с четко определенными свойствами в направлении расположения рецепторов и таким образом, пространственные изменения в передаче сигналов GPCR.Кроме того, эндогенные гормоны могут быть предвзятыми лигандами, такими как различные варианты гликозилирования хорионического гонадотропина человека и ФСГ, которые, как известно, обладают различной биологической активностью (122, 123).
Эти лиганды могут нацеливаться либо на ортостерические, либо на аллостерические сайты связывания в рецепторе или даже на внутриклеточные области рецептора, как недавно было показано при использовании интрател или пепдуцинов (118-121).В настоящее время этот фармакологический «набор инструментов» направлен на смещение сигналов между различными путями G-белка или между G-белком и опосредованной аррестином передачей сигналов. По мере понимания механизмов и физиологической роли пространственного контроля передачи сигналов GPCR существующие соединения могут быть дополнительно усовершенствованы, чтобы учесть новую информацию об этих путях и/или представить платформу для скрининга новых лигандов с четко определенными свойствами в направлении расположения рецепторов и таким образом, пространственные изменения в передаче сигналов GPCR.Кроме того, эндогенные гормоны могут быть предвзятыми лигандами, такими как различные варианты гликозилирования хорионического гонадотропина человека и ФСГ, которые, как известно, обладают различной биологической активностью (122, 123). С точки зрения фармацевтических разработок в отношении рецепторов, связанных с репродуктивной функцией, был разработан ряд низкомолекулярных аллостерических соединений для GnRHR, LHR и FSHR (124, 125). Хотя фармакошаперонные свойства некоторых из этих соединений, таких как GnRHR, хорошо описаны (126), роль этих малых молекул в пространственном контроле или предвзятой передаче сигналов еще предстоит определить.В дополнение к дизайну лекарств подход, который используется для характеристики мутаций или полиморфизмов GPCR, также должен быть пересмотрен, чтобы включить эти последние модели передачи сигналов GPCR, такие как мутация A189V FSHR (40) и мутация рецептора кисспептина R386P. что вызывает центральное преждевременное половое созревание (99).
С точки зрения фармацевтических разработок в отношении рецепторов, связанных с репродуктивной функцией, был разработан ряд низкомолекулярных аллостерических соединений для GnRHR, LHR и FSHR (124, 125). Хотя фармакошаперонные свойства некоторых из этих соединений, таких как GnRHR, хорошо описаны (126), роль этих малых молекул в пространственном контроле или предвзятой передаче сигналов еще предстоит определить.В дополнение к дизайну лекарств подход, который используется для характеристики мутаций или полиморфизмов GPCR, также должен быть пересмотрен, чтобы включить эти последние модели передачи сигналов GPCR, такие как мутация A189V FSHR (40) и мутация рецептора кисспептина R386P. что вызывает центральное преждевременное половое созревание (99).
Таким образом, пространственная организация и, следовательно, клеточное расположение GPCR может программировать многомерность передачи сигналов GPCR в строго регулируемые и четкие профили передачи сигналов, свойство, которое очень полезно для динамической передачи сигналов гормонов.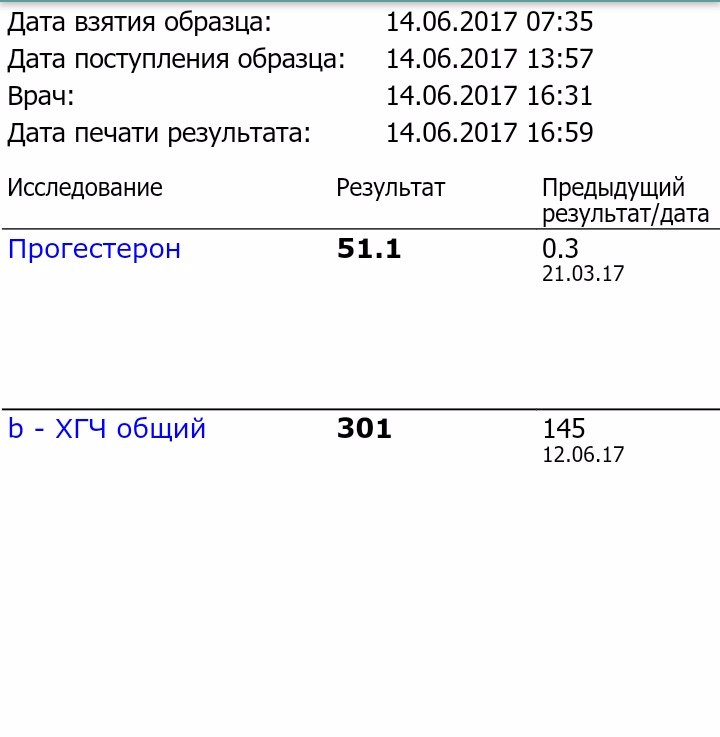 Теперь необходимо направить усилия на использование этой новой информации, чтобы получить важную информацию о сложных заболеваниях и состояниях, таких как СПКЯ, гонадотропин-зависимый рак и преждевременные роды, а также улучшить терапевтические стратегии, которые включают полную плейотропную природу этих рецепторов.
Теперь необходимо направить усилия на использование этой новой информации, чтобы получить важную информацию о сложных заболеваниях и состояниях, таких как СПКЯ, гонадотропин-зависимый рак и преждевременные роды, а также улучшить терапевтические стратегии, которые включают полную плейотропную природу этих рецепторов.
Благодарности
Эта работа была поддержана грантами Genesis Research Trust.
Раскрытие информации Резюме: Авторам нечего раскрывать.
Сокращения
AKAP
A-Kinase Ancharing белок
Appl1
адаптер белок, содержащий pH домен, домен PTB, и лейцин на молнии MOTIF
β2AR
ARF
CAV
CB1
Cannabinoid рецептор типа 1
CCP
CCR5
CCR5
EE
EE
FSH
фолликул-стимулирующий гормон
FSHR
GIPC
Gαi-взаимодействующий белок C CERSINUS
GNRHR
GNRHR
0
GPCR
г белкового рецептора
гр.

GRK
LH
LHR
ОТ
OTR
PCOS
PCOS PCOS
PLAYCYSTIC SAINMAINAM
PDZ
постсинаптическая плотность 95 / дисков Большой / Zonula Occludens-1
PKA
PTTR
TIRF-M
Total микроскопия внутреннего отражения
ВЭЭ
Литература
1.Scita
G
,Ди Фьоре
PP
.Эндоцитарный матрикс
.Природа
.2010
;463
:464
–473
.2. .Динамин 2 и болезни человека
.Дж Мол Мед
.2010
;88
:339
–350
.3.Ханьялоглу
АС
,фон Застров
М
.Регуляция GPCR посредством переноса эндоцитарной мембраны и ее потенциальные последствия
.
Annu Rev Pharmacol Toxicol
.2008
;48
:537
–568
.4.McMahon
HT
,Boucrot
E
.Молекулярный механизм и физиологические функции клатрин-опосредованного эндоцитоза
.Nat Rev Mol Cell Biol
.2011
;12
:517
–533
.5. .Ранние этапы эндоцитоза: от выделения груза до деформации мембраны
.Евро J Cell Biol
.2012
;91
:226
–233
.6.Фергюсон
СМ
,Де Камилли
П
.Динамин, ремоделирующая мембрану ГТФаза
.Nat Rev Mol Cell Biol
.2012
;13
:75
–88
.7.Reiter
E
,Лефковиц
RJ
.GRK и β-аррестины: роли в подавлении рецепторов, транспортировке и передаче сигналов
.Trends Endocrinol Metab
.2006
;17
:159
–165
. 8.
8.Шеной
СК
,Лефковиц
РЖ
.Многогранная роль β-аррестинов в регуляции переноса рецепторов, охватывающих семь мембран, и передачи сигналов
.Биохим J
.2003
;375
:503
–515
.9.DeWire
SM
,Ahn
S
,Lefkowitz
RJ
,Shenoy
SK
9.
β-аррестины и клеточная передача сигналов
.Annu Rev Physiol
.2007
;69
:483
–510
.10.Кан
ДС
,Тянь
X
,Бенович
JL
.Роль β-аррестинов и белков, содержащих домен аррестина, в переносе рецепторов, связанных с G-белками
.Curr Opin Cell Biol
.2014
;27
:63
–71
.11.Кан
ДС
,Тиан
Х
,Бенович
ДЖЛ
.Перенос β-аррестинов и рецепторов, связанных с G-белком
.
Методы Enzymol
.2013
;521
:91
–108
.12.Цао
TT
,Май
RW
,фон Застров
M
.Регулируемый эндоцитоз рецепторов, связанных с G-белком, с помощью биохимически и функционально отличной субпопуляции покрытых клатрином ямок
.J Биол Хим
.1998
;273
:24592
–24602
.13.Лакадамьяли
M
,Ржавчина
MJ
,Чжуан
X
.Лиганды клатрин-опосредованного эндоцитоза по-разному сортируются в отдельные популяции ранних эндосом
.Сотовый
.2006
;124
:997
–1009
.14.Mundell
SJ
,LUO
J
,J
,Benovic
JL
,Conley
PB
,Poole
AW
.Отдельные ямки, покрытые клатрином, сортируют различные грузы рецепторов, связанных с G-белком
.
Трафик
.2006
;7
:1420
–1431
.15.Путенведу
МА
,фон Застров
М
.Груз регулирует динамику ямы, покрытую клатрином
.Сотовый
.2006
;127
:113
–124
.16.McArdle
CA
,Franklin
J
,Зеленый
L
,Hislop
JN
.Передача сигналов, циклирование и десенсибилизация рецепторов гонадотропин-высвобождающего гормона
.J Эндокринол
.2002
;173
:1
–11
.17.VRECL
M
,M
,A
,Hanyaloglu
A
,Taylor
PL
,EIDNE
KA
.Кинетика интернализации рецептора гонадотропин-рилизинг-гормона (GnRH)
.Арка Пфлюгера
.2000
;439
:R19
–R20
.18.Soohoo
AL
,Puthenveedu
MA
.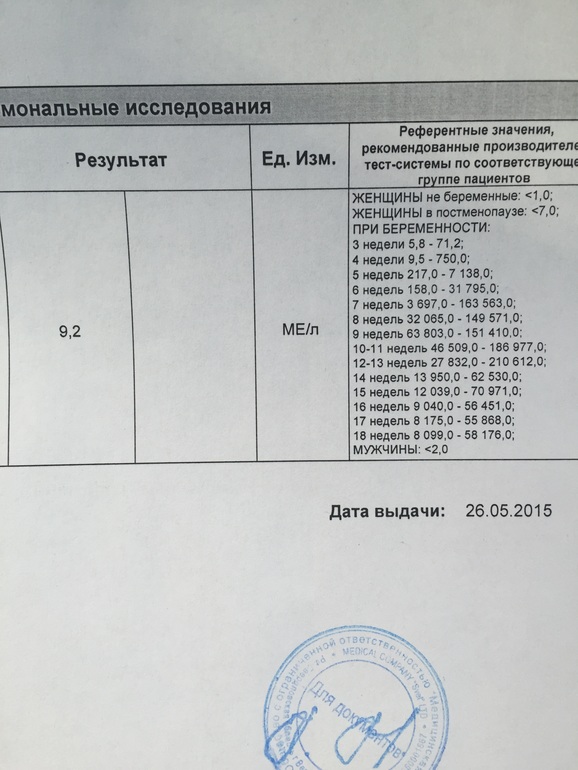
Дивергентные режимы для грузового управления динамикой ям, покрытых клатрином
.Мол Биол Селл
.2013
;24
:1725
–1734
,S1721
–S1712
.19.Flores-Otero
J
,J
,,
KH
,Delgado-Peraza
,F
,F
,MUCKIE
K
,Kendall
DA
,Yudowski
GA
.Лиганд-специфическое время пребывания в эндоцитах контролирует функциональную селективность каннабиноидного рецептора 1
.Нац Коммуна
.2014
;5
:4589
.20.Фаркаш
I
,Калло
I
,Дели
L
, и др. .Ретроградная эндоканнабиноидная передача сигналов снижает ГАМКергическую синаптическую передачу к нейронам, высвобождающим гонадотропин-высвобождающий гормон
.Эндокринология
.2010
;151
:5818
–5829
.21.
Пал
К
,Матхур
М
,Кумар
П
,ДеФеа
К
.Дивергентные β-аррестин-зависимые сигнальные события зависят от последовательностей внутри С-конца рецептора, связанного с G-белком
.J Биол Хим
.2013
;288
:3265
–3274
.22.Дворяне
КН
,Сяо
К
,Ан
S
, и др..Отдельные сайты фосфорилирования на β(2)-адренергическом рецепторе образуют штрих-код, кодирующий различные функции β-аррестина
.Научный сигнал
.2011
;4
:ra51
.23.Lampe
M
,Pierre
F
,F
,AL-SABAH
S
,S
,KRASEL
C
,Merrifield
CJ
.Двойной однократный анализ событий эндоцитоза конститутивного рецептора трансферрина (TfR) и эндоцитоза β2-адренергического рецептора (β2AR) или Mu-опиоидного рецептора (MOR), запускаемого лигандом
.
Мол Биол Селл
.2014
;25
:3070
–3080
.24.Grove
J
,Metcalf
DJ
,Knight
AE
, и др. .Плоские решетки клатрина: стабильные свойства плазматической мембраны
.Мол Биол Селл
.2014
;25
:3581
–3594
.25.Dominguez
F
,F
,Galan
A
,A
,Martin
JJ
,REMOHI
J
,J
,PELLICER
A
,Simón
C
.Гормональная и эмбриональная регуляция хемокиновых рецепторов CXCR1, CXCR4, CCR5 и CCR2B в эндометрии человека и бластоцисте человека
.Мол Гум Репрод
.2003
;9
:189
–198
.26.ISOBE
T
,T
,,
H
,Tanaka
K
,Shibahara
T
,T
,Hayashi
N
,Toyoda
N
.
Влияние RANTES на хемотаксис сперматозоидов человека
.Шум Репрод
.2002
;17
:1441
–1446
.27.Barbonetti
A
,Vassallo
MR
,Antonangelo
C
, и др. .RANTES и оплодотворяющая способность сперматозоидов человека: влияние на акросомную реакцию и слияние сперматозоидов и ооцитов
.Мол Гум Репрод
.2008
;14
:387
–391
.28.Vogl
AW
,Du
M
,Wang
XY
,Young
JS
.Новый эндоцитарный механизм на основе клатрина/актина, связанный с обменом соединений в семенном эпителии
.Semin Cell Dev Biol
.2014
;30
:55
–64
.29.Адеоя-Осигува
SA
,Фрейзер
LR
.Катин, родственное амфетамину соединение, действует на сперматозоиды млекопитающих через β1- и α2A-адренорецепторы в зависимости от состояния капацитации
.
Шум Репрод
.2007
;22
:756
–765
.30.Этковиц
N
,Тирош
Y
,Чазан
R
, и др. .Реакция акросом бычьей спермы, индуцированная агонистами рецептора, сопряженного с G-белком, опосредована трансактивацией рецептора эпидермального фактора роста
.Дев Биол
.2009
;334
:447
–457
.31.Шихан
М
,Буллдан
А
,Шайнер-Бобис
Г
.Неклассическая передача сигналов тестостерона опосредуется рецептором, связанным с G-белком, взаимодействующим с Gnα11
.Биохим Биофиз Акта
.2014
;1843
:1172
–1181
.32.Латтрелл
LM
,Лефковиц
RJ
.Роль β-аррестинов в терминации и передаче сигналов рецептора, связанного с G-белком
.J Cell Sci
.2002
;115
:455
–465
. 33.
33.Лефковиц
RJ
,Шеной
СК
.Передача сигналов рецепторов с помощью β-аррестинов
.Наука
.2005
;308
:512
–517
.34.Латтрелл
LM
,Гести-Палмер
D
.Помимо десенсибилизации: физиологическое значение аррестин-зависимой передачи сигналов
.Фармакол Ред.
.2010
;62
:305
–330
.35.Мукерджи
S
,Гуревич
В.В.
,Джонс
JC
, и др. .Фактор нуклеотидного обмена фактора рибозилирования АДФ ARNO способствует высвобождению β-аррестина, необходимого для десенсибилизации рецепторов лютеинизирующего гормона/хориогонадотропина
.Proc Natl Acad Sci USA
.2000
;97
:5901
–5906
.36.Сальвадор
LM
,Мукерджи
S
,Кан
RA
и др. .Активация рецептора лютеинизирующего гормона/хориогонадотропного гормона способствует активации фактора 6 рибозилирования АДФ в фолликулярных мембранах яичников свиней
.
J Биол Хим
.2001
;276
:33773
–33781
.37.Брин
СМ
,Андрик
Н
,Пинг
Т
и др..Овуляция включает зависимую от лютеинизирующего гормона активацию G(q/11) в клетках гранулезы
.Мол Эндокринол
.2013
;27
:1483
–1491
.38.Галет
С
,Асколи
М
.Аррестин-3 необходим для активации Fyn рецептором лютеинизирующего гормона (LHR) в клетках MA-10
.Сотовый сигнал
.2008
;20
:1822
–1829
.39.Evaul
K
,Hammes
SR
.Взаимодействия между рецепторами, связанными с G-белком, и рецепторами эпидермального фактора роста регулируют гонадотропин-опосредованный стероидогенез в клетках Лейдига
.J Биол Хим
.2008
;283
:27525
–27533
.40.Tranchant
T
,Durand
G
,Gauthier
C
, и др. .
.Преимущественная передача сигналов β-аррестина при низкой плотности рецепторов, выявленная функциональной характеристикой мутации A189 V рецептора ФСГ человека
.Мол Селл Эндокринол
.2011
;331
:109
–118
.41.Grotegut
CA
,Feng
L
,L
,MAO
L
,Heine
RP
,RP
,MURTHA
AP
,ROCKMAN
HA
.β-аррестин опосредует передачу сигналов рецептора окситоцина, который регулирует сократительную способность матки и миграцию клеток
.Am J Physiol Endocrinol Metab
.2011
;300
:E468
–E477
.42.Brighton
PJ
,RANA
S
,S
,SELFISS
RJ
,KONJE
JC
,ILLETS
JM
.Аррестины по-разному регулируют вызванную гистамином и окситоцином передачу сигналов фосфолипазы С и митоген-активируемой протеинкиназы в клетках миометрия
.
Бр Дж Фармакол
.2011
;162
:1603
–1617
.43.Terzidou
V
,Пробел
AM
,KIM
SH
,Thornton
S
,Bennett
PR
.Роды и воспаление увеличивают экспрессию рецептора окситоцина в амнионе человека
.Биол Репрод
.2011
;84
:546
–552
.44.Kim
SH
,MacIntyre
DA
,Firmino Da Silva
M
, et al..Окситоцин активирует NF-κB-опосредованные воспалительные пути в тканях плода человека
.Мол Селл Эндокринол
.2015
;403
:64
–77
.45.Ahow
M
,Min
L
,Pampillo
M
, и др. .Сигналы KISS1R независимо от Gαq/11 и запускают секрецию ЛГ через путь β-аррестина у самцов мышей
.Эндокринология
.2014
;155
:4433
–4446
.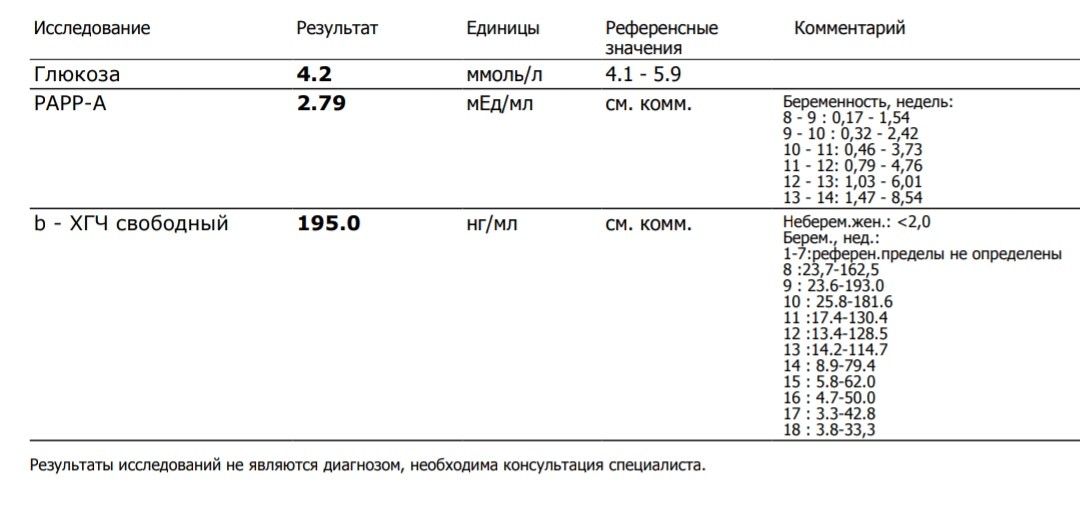 46.
46.Щука
ЖЖ
.Липидные плоты: наведение порядка в хаосе
.J Липидный рез
.2003
;44
:655
–667
.47.Лингвуд
Д
,Саймонс
К
.Липидные рафты как мембраноорганизующий принцип
.Наука
.2010
;327
:46
–50
.48.Hiol
A
,Davey
PC
,Osterhout
JL
, et al. .Пальмитоилирование регулирует функцию регуляторов передачи сигналов G-белка (RGS) 16 . I. Мутация амино-концевых остатков цистеина в RGS16 предотвращает его нацеливание на липидные рафты и пальмитоилирование внутреннего цистеинового остатка
.J Биол Хим
.2003
;278
:19301
–19308
.49.Монастырская
К
,Хостеттлер
А
,Буэрги
С
,Драгер
А
.Рецептор NK1 локализуется в микродоменах плазматической мембраны, и его активация зависит от целостности липидного рафта
.
J Биол Хим
.2005
;280
:7135
–7146
.50.Pucadyil
TJ
,Chattopadhyay
A
.Холестерин модулирует связывание лиганда и связывание G-белка с рецепторами серотонина (1А) из бычьего гиппокампа
.Биохим Биофиз Акта
.2004
;1663
:188
–200
.51.Навратил
AM
,Bliss
SP
,Berghorn
KA
и др. .Конститутивная локализация рецептора гонадотропин-рилизинг-гормона (GnRH) в мембранных микродоменах низкой плотности необходима для передачи сигналов GnRH к ERK
.J Биол Хим
.2003
;278
:31593
–31602
.52.BLISS
SP
,SP
,,AM
,,
м
,м
,Skinner
DC
,глины
см
,Roberson
MS
.Сигнальные комплексы, связанные с рецептором гонадотропин-рилизинг-гормона (GnRH) I типа: совместная локализация внеклеточно регулируемой киназы 2 и рецептора GnRH внутри мембранных рафтов
.
Мол Эндокринол
.2007
;21
:538
–549
.53.Navratil
AM
,Farmerie
TA
,TA
,Bogerd
J
,NETT
TM
,глины
см
.Дифференциальное влияние внутриклеточных карбоксильных концевых доменов на локализацию липидного слоя мышиного рецептора гонадотропин-высвобождающего гормона
.Биол Репрод
.2006
;74
:788
–797
.54.Навратил
AM
,Блисс
SP
,Роберсон
MS
.Мембранные рафты и передача сигналов рецептора ГнРГ
.Мозг Res
.2010
;1364
:53
–61
.55.Lei
Y
,Hagen
GM
,GM
,SMITH
SM
,BARISAS
BG
,Roess
DA
.Химерные рецепторы GnRH-LH и рецепторы LH, не имеющие сайтов пальмитоилирования на С-конце, не локализуются в рафтах плазматической мембраны
.
Biochem Biophys Res Commun
.2005
;337
:430
–434
.56.Wolf-Ringwall
AL
,Winter
PW
,Roess
DA
,Джордж Барисас
B9.
Рецепторы лютеинизирующего гормона ограничены микродоменами мезомасштабной плазматической мембраны на протяжении всего восстановления после десенсибилизации рецепторов
.Cell Biochem Biophys
.2014
;68
:561
–569
.57.Wolf-Regwall
AL
,AL
,,
,
,,
J
,VAN ORDEN
AK
,ROUSS
DE
,BARISAS
BG
.Ограниченная латеральная диффузия рецепторов лютеинизирующего гормона в мембранных микродоменах
.J Биол Хим
.2011
;286
:29818
–29827
.58.Dang
AK
,Murtazina
,DA
,DA
,,
C
,C
,Clay
Amber
,глиняная
см
,AMBERG
GC
.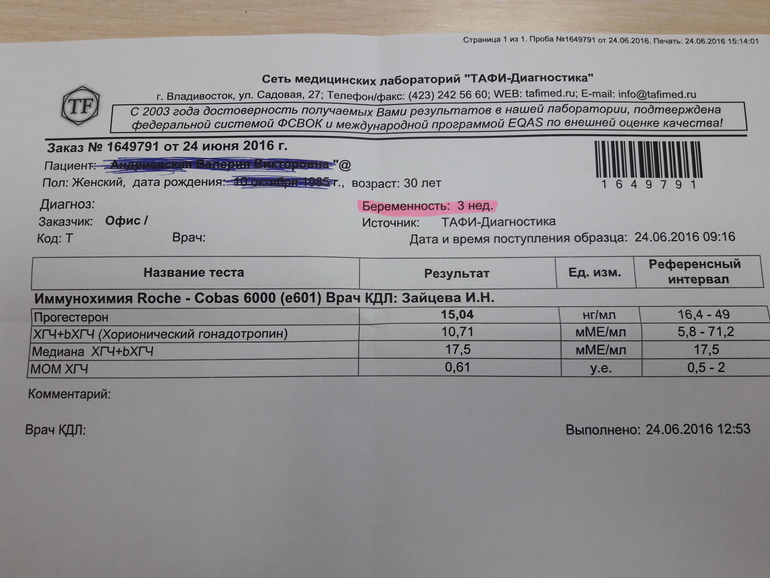
GnRH вызывает локальную субплазмалеммальную передачу сигналов кальция в гонадотропах
.Мол Эндокринол
.2014
;28
:2049
–2059
.59.LIU
F
,Austin
,Austin
DA
,Mellon
PL
,Olefsky
JM
,Webster
NJ
.GnRH активирует ERK1/2, что приводит к индукции экспрессии белка c-fos и LHβ в клетках LβT2
.Мол Эндокринол
.2002
;16
:419
–434
.60.Wehmeyer
L
,Du Toit
A
,Lang
DM
,Hapgood
JP
.Опосредованный липидным рафтом и протеинкиназой C синергизм между сигналами глюкокортикоидов и гонадотропин-высвобождающих гормонов приводит к снижению клеточной пролиферации
.J Биол Хим
.2014
;289
:10235
–10251
.61.Франкс
S
,Старк
J
,Харди
K
.
Динамика фолликулов и ановуляция при синдроме поликистозных яичников
.Обновление воспроизведения шума
.2008
;14
:367
–378
.62.Perrett
RM
,Voliotis
M
,Armstrong
SP
и др. .Пульсирующий гормональный сигнал к киназы, регулируемой внеклеточным сигналом: изучение чувствительности системы к частоте и ширине пульса гонадотропин-высвобождающего гормона
.J Биол Хим
.2014
;289
:7873
–7883
.63.Щука
ЖЖ
.Проба липидных рафтов
.J Липидный рез
.2009
;50
(доп.
):S323
–S328
.64.Song
KS
,Scherer
PE
,Tang
Z
и др. .Экспрессия кавеолина-3 в скелетных, сердечных и гладкомышечных клетках.Кавеолин-3 является компонентом сарколеммы и кофракционирует с дистрофином и дистрофин-ассоциированными гликопротеинами
.
J Биол Хим
.1996
;271
:15160
–15165
.65.Швец
Э
,Людвиг
А
,Николс
БЖ
.Новости из пещер: новая информация о структуре и функциях кавеол
.Curr Opin Cell Biol
.2014
;29
:99
–106
.66.О
P
,Шнитцер
JE
.Сегрегация гетеротримерных G-белков в микродоменах клеточной поверхности. G(q) связывает кавеолин, концентрируясь в кавеолах, тогда как G(i) и G(s) нацелены на липидные рафты по умолчанию
.Мол Биол Селл
.2001
;12
:685
–698
.67.Чини
Б
,Паренти
М
.Связанные с G-белком рецепторы в липидных рафтах и кавеолах: как, когда и почему они туда попадают?
Дж Мол Эндокринол
.2004
;32
:325
–338
.68.Сенгупта
P
,Филип
F
,Скарлата
S
.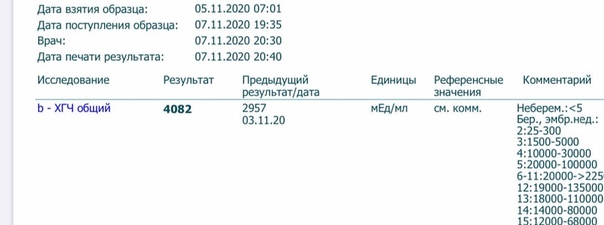
Кавеолин-1 изменяет продолжительность сигнала Ca(2+) за счет специфического взаимодействия с семейством G α q белков G
.J Cell Sci
.2008
;121
:1363
–1372
.69.Whittington
K
,K
,K
,B
,B
,King
K
,K
,,
S
,Hogarth
K
,Nicholson
H
.Влияние окситоцина на пролиферацию клеток в предстательной железе человека модулируется гонадными стероидами: значение для доброкачественной гиперплазии предстательной железы и карциномы предстательной железы
.Простата
.2007
;67
:1132
–1142
.70. .Сортировка рецепторов, связанных с G-белком, на эндосомы и лизосомы
.Annu Rev Pharmacol Toxicol
.2008
;48
:601
–629
.71.Юдовски
GA
,Путхенведу
MA
,Генри
AG
,фон Застров
М 90.
Карго-опосредованная регуляция быстрого Rab4-зависимого пути рециркуляции
.Мол Биол Селл
.2009
;20
:2774
–2784
.72.Seachrist
JL
,Anborgh
PH
,Ferguson
SS
.Интернализация β 2-адренергических рецепторов, эндосомальная сортировка и рециркуляция плазматической мембраны регулируются rab GTPases
.J Биол Хим
.2000
;275
:27221
–27228
.73.CAO
TT
,DEACON
HW
,Reckek
D
,BRECHER
A
,VON ZASTROW
M
.Регулируемое киназой взаимодействие PDZ-домена контролирует эндоцитарную сортировку β2-адренергического рецептора
.Природа
.1999
;401
:286
–290
.74.Lauffer
BE
,Melero
C
,Temkin
P
и др. .SNX27 опосредует PDZ-направленную сортировку от эндосом к плазматической мембране
.
J Cell Biol
.2010
;190
:565
–574
.75.Юдовски
GA
,Puthenveedu
MA
,фон Застров
M
.Различные способы введения регулируемых рецепторов в соматодендритную плазматическую мембрану
.Нат Нейроски
.2006
;9
:622
–627
.76.Ю.
YJ
,Dhavan
R
,R
,Chevalier
MW
,Yudowski
GA
,VOSTROW
M
.Быстрая доставка интернализованных сигнальных рецепторов на поверхность соматодендритов за счет локальной вставки, специфичной для последовательности
.Дж Нейроски
.2010
;30
:11703
–11714
.77.Жюлье
D
,Шоке
D
,Перре
D
.Рециклирующие эндосомы подвергаются быстрому закрытию поры слияния при экзоцитозе в дендритах нейронов
.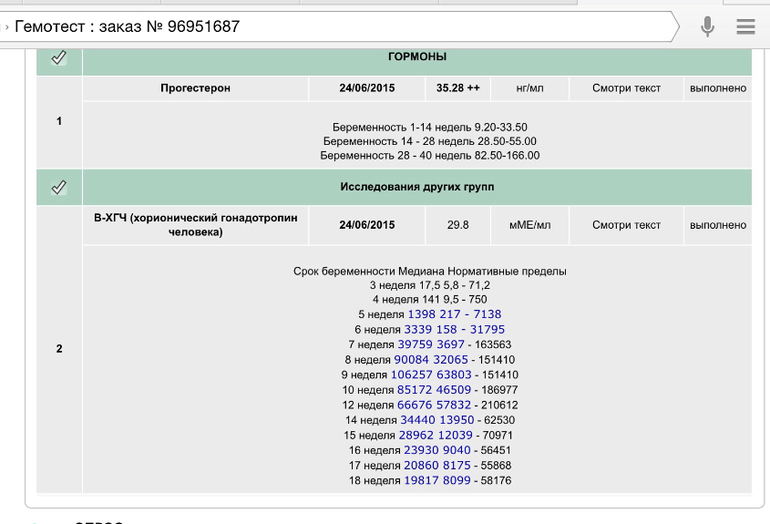
Дж Нейроски
.2014
;34
:11106
–11118
.78.Вонг
В
,Скотт
ДД
.Комплексы сигнализации АКАП: координатные точки в пространстве и времени
.Nat Rev Mol Cell Biol
.2004
;5
:959
–970
.79.Лог
JS
,Скотт
JD
.Организация передачи сигнала через заякоренные белки A-киназы (AKAP)
.ФЕБС J
.2010
;277
:4370
–4375
.80.TAO
J
,Shumay
E
,McLaughlin
S
,Wang
HY
,MALBON
CC
.Регуляция AKAP-мембранных взаимодействий кальцием
.J Биол Хим
.2006
;281
:23932
–23944
.81.SHIH
M
,LIN
F
,F
,SCOTT
JD
,Wang
HY
,CC
CC
.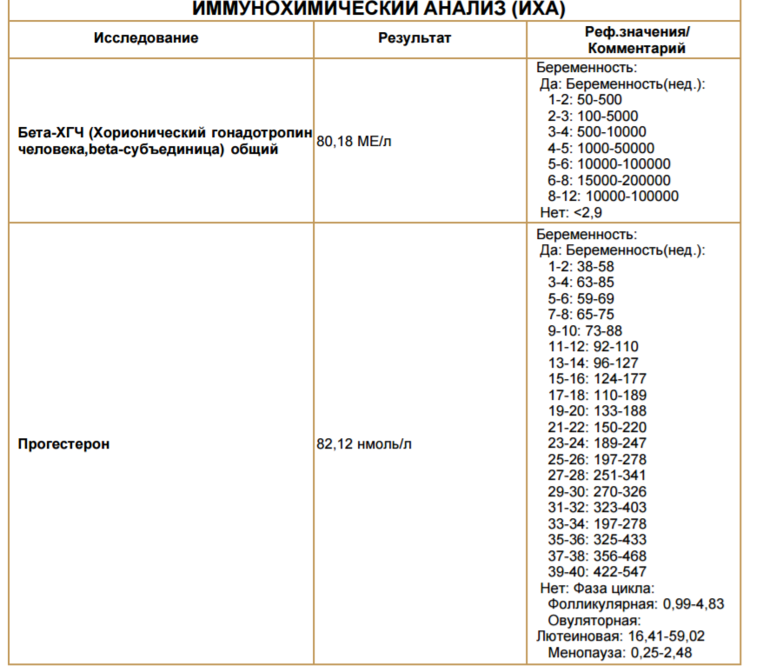
Динамические комплексы β2-адренорецепторов с протеинкиназами и фосфатазами и роль гравина
.J Биол Хим
.1999
;274
:1588
–1595
.82.Тао
Дж
,Мальбон
CC
.Связанные с G-белком рецептор-ассоциированные заякоривающие белки A-киназы AKAP5 и AKAP12: дифференциальная передача сигналов для рециркуляции MAPK и GPCR
.Дж Молярный Сигнал
.2008
;3
:19
.83.EL-JUOUNI
W
,W
,Haun
S
,Hodeify
R
,Hosein Walker
A
,Machaca
K
.Везикулярный трафик на клеточной мембране регулирует остановку мейоза ооцитов
.Разработка
.2007
;134
:3307
–3315
.84.Нисимура
T
,Fujii
W
,Sugiura
K
,Naito
K
.Цитоплазматическое закрепление цАМФ-зависимой протеинкиназы (PKA) с помощью якорных белков A-киназы (AKAP) необходимо для остановки мейоза у взрослых и растущих ооцитов свиньи
.
Биол Репрод
.2014
;90
:58
.85.Hinckley
M
,M
,Vaccari
S
,S
,Horner
K
,CHEN
R
,CONTI
M
.Связанные с G-белком рецепторы GPR3 и GPR12 участвуют в передаче сигналов цАМФ и поддержании остановки мейоза в ооцитах грызунов
.Дев Биол
.2005
;287
:249
–261
.86.Калебиро
Д
,Николаев
ВО
,Гальяни
МЦ
, и др. .Постоянные сигналы цАМФ, запускаемые интернализованными рецепторами, связанными с G-белком
.ПЛОС Биол
.2009
;7
:e1000172
.87.Ferrandon
S
,Feinstein
TN
,Castro
M
и др. .Устойчивая продукция циклического АМФ за счет эндоцитоза рецепторов паратиреоидного гормона
.Nat Chem Biol
.2009
;5
:734
–742
. 88.
88.Feinstein
TN
,Wehbi
VL
,Ardura
JA
, и др. .Retromer прекращает выработку цАМФ интернализованными рецепторами ПТГ
.Nat Chem Biol
.2011
;7
:278
–284
.89.Гидон
А
,Аль-Батайне
ММ
,Жан-Альфонс
FG
, и др..Передача сигналов эндосомального GPCR отключена действием отрицательной обратной связи PKA и v-ATPase
.Nat Chem Biol
.2014
;10
:707
–709
.90.Okazaki
M
,M
,S
,S
,Vilardaga
JP
,Bouxsein
млн
,мл
,POTTS
JT
JR,Gardella
TJ
.Длительная передача сигналов на рецепторе паратиреоидного гормона с помощью пептидных лигандов, нацеленных на специфическую конформацию рецептора
.Proc Natl Acad Sci USA
.2008
;105
:16525
–16530
.91.Ираннежад
R
,Томшайн
JC
,Томшайн
JR
, и др. .Конформационные биосенсоры обнаруживают передачу сигналов GPCR от эндосом
.Природа
.2013
;495
:534
–538
.92.Rasmussen
SG
,Choi
HJ
,Fung
JJ
, и др..Структура нанотела, стабилизированного активным состоянием β(2)-адренорецептора
.Природа
.2011
;469
:175
–180
.93.Цветанова
NG
,фон Застров
М
.Пространственное кодирование специфичности передачи сигналов циклического AMP эндоцитозом GPCR
.Nat Chem Biol
.2014
;10
:1061
–1065
.94.Kuna
RS
,Girada
SB
,Asalla
S
и др..Генерация эндосомального цАМФ, опосредованная рецептором глюкагона-подобного пептида-1, способствует стимулированной глюкозой секреции инсулина в β-клетках поджелудочной железы
.Am J Physiol Endocrinol Metab
.2013
;305
:E161
–E170
.95.Merriam
La
,Baran
CN
,CN
,Girard
BM
,Hardwick
JC
,,мая
V
,Parsons
RL
.Интернализация рецептора аденилатциклазы 1 гипофиза и эндосомальная передача сигналов опосредуют индуцированное полипептидом, активирующим аденилатциклазу гипофиза, повышение возбудимости сердечных нейронов морской свинки
.Дж Нейроски
.2013
;33
:4614
–4622
.96.Feinstein
TN
,Yui
N
,Webber
MJ
, и др. .Неканонический контроль передачи сигналов рецептора вазопрессина типа 2 с помощью ретромера и аррестина
.J Биол Хим
.2013
;288
:27849
–27860
.97.Хосино
T
,Намба
T
,Такехара
M
, и др. .Простагландин E2 стимулирует выработку β-амилоидных пептидов посредством интернализации рецептора EP4
.J Биол Хим
.2009
;284
:18493
–18502
.98.Min
L
,Soltis
K
,Reis
AC
, и др..Динамический перенос рецепторов кисспептина модулирует кисспептин-опосредованную передачу сигналов кальция
.Мол Эндокринол
.2014
;28
:16
–27
.99.Бьянко
SD
,Вандепас
Л
,Корреа-Медина
М
, и др. .Внутриклеточный перенос и деградация KISS1R: эффект связанной с заболеванием мутации Arg386Pro
.Эндокринология
.2011
;152
:1616
–1626
.100.Галет
С
,Хиракава
Т
,Асколи
М
.Постэндоцитозный перенос человеческого рецептора лютропина опосредован переносимым мотивом, состоящим из С-концевого цистеина и расположенного выше лейцина
.Мол Эндокринол
.2004
;18
:434
–446
.101.Jean-Alphonse
F
,Bowersox
S
,CHEN
S
,
S
,Beard
G
,,
MA
,Hanyaloglu
AC
.Пространственно ограниченная активность рецептора, связанного с G-белком, через расходящиеся эндоцитарные компартменты
.J Биол Хим
.2014
;289
:3960
–3977
.102.Мячинская
М
,Христофоридис
С
,Гинер
А
, и др. .Белки APPL связывают Rab5 с трансдукцией ядерного сигнала через эндосомальный компартмент
.Сотовый
.2004
;116
:445
–456
.103.Хиракава
Т
,Галет
С
,Киши
М
,Асколи
М
9.
GIPC связывается с человеческим лютропиновым рецептором (hLHR) посредством необычного мотива связывания домена PDZ и регулирует сортировку интернализированного хориогонадотропина человека и плотность клеточной поверхности hLHR
.J Биол Хим
.2003
;278
:49348
–49357
.104.Koliwer
J
,Park
M
,M
,Bauch
C
,VON ZASTROW
M
,Kreienkamp
HJ
.Гольджи-ассоциированный белок домена PDZ PIST/GOPC стабилизирует β1-адренергический рецептор во внутриклеточных компартментах после интернализации
.J Биол Хим
.2015
;290
(10
):6120
–6129
.105.Lin
DC
,Quevedo
C
,Brewer
NE
, и др..APPL1 ассоциирован с TrkA и GIPC1 и необходим для опосредованной фактором роста нервов передачи сигнала
.Мол Селл Биол
.2006
;26
:8928
–8941
.106.Мао
X
,Кикани
CK
,Риохас
RA
, и др. .APPL1 связывается с рецепторами адипонектина и опосредует передачу сигналов и функцию адипонектина
.Nat Cell Biol
.2006
;8
:516
–523
.107.Schenck
A
,Goto-Silva
L
,Collinet
C
, и др. .Эндосомальный белок Appl1 опосредует специфичность субстрата Akt и выживаемость клеток в развитии позвоночных
.Сотовый
.2008
;133
:486
–497
.108.Варсано
T
,Донг
MQ
,Нисман
I
, и др..GIPC рекрутируется с помощью APPL в периферические эндосомы TrkA и регулирует транспортировку TrkA и передачу сигналов
.Мол Селл Биол
.2006
;26
:8942
–8952
.109.ZONCU
R
,R
,,
RM
,RM
,Balkin
DM
,PIRRUCCELLO
M
,M
,TOOMRE
D
,de Camilli
P
.Фосфоинозитидный переключатель контролирует созревание и сигнальные свойства эндосом APPL
.Сотовый
.2009
;136
:1110
–1121
.110.Casarini
L
,Lispi
M
,Longobardi
S
и др. .Действие ЛГ и ХГЧ на один и тот же рецептор приводит к количественно и качественно разным внутриклеточным сигналам
.PLoS One
.2012
;7
:e46682
.111.Nelson
VL
,Legro
RS
,Strauss
JF
3rd,McAllister
JM
Повышенная продукция андрогенов является стабильным стероидогенным фенотипом размножающихся тека-клеток из поликистозных яичников
.Мол Эндокринол
.1999
;13
:946
–957
.112.Gilling-Smith
C
,Willis
DS
,Beard
RW
,Franks
S
.Гиперсекреция андростендиона изолированными тека-клетками из поликистозных яичников
.J Clin Endocrinol Metab
.1994
;79
:1158
–1165
.113.HU
La
,CHEN
W
,W
,Martin
NP
,Whalen
EJ
,Premont
RT
,rufkowitz
RJ
.GIPC взаимодействует с β1-адренорецептором и регулирует опосредованную β1-адренорецептором активацию ERK
.J Биол Хим
.2003
;278
:26295
–26301
.114.Dias
JA
,Mahale
SD
,SD
,Nechamen
CA Ca
,,
O
,THOMAS
RM
,Ulloa-Aguirre
A
.Новые роли адаптерного белка рецептора ФСГ APPL1 и перекрытие предполагаемого домена взаимодействия 14-3-3τ с каноническим сайтом взаимодействия G-белка
.Мол Селл Эндокринол
.2010
;329
:17
–25
.115.Berning
S
,Whilig
Ki
,STEFFENS
H
,DIBAJ
P
,ALL
SW
.Наноскопия мозга живой мыши
.Наука
.2012
;335
:551
.116.Хури
E
,Клемент
S
,Лапорт
SA
.Аллостерическая и предвзятая регуляция передачи сигналов рецептора, связанного с g-белком: возможности для новых терапевтических средств
.Фронт Эндокринол (Лозанна)
.2014
;5
:68
.117.Скрипка
JD
,Crombie
AL
,Soergel
DG
,Жаворонок
MW
.
Смещенные лиганды в рецепторах, связанных с G-белком: перспективы и прогресс
.Trends Pharmacol Sci
.2014
;35
:308
–316
.118.Carr
R
3-й,Du
Y
,Quoyer
J
и др. .Разработка и характеристика пепдуцинов как аллостерических агонистов, оказывающих влияние на Gs
.J Биол Хим
.2014
;289
:35668
–35684
.119.Quoyer
J
,Janz
JM
,Luo
J
и др..Пепдуцин, нацеленный на хемокиновый рецептор C-X-C типа 4, действует как предвзятый агонист, способствующий активации ингибирующего G-белка
.Proc Natl Acad Sci USA
.2013
;110
:E5088
–E5097
.120.Staus
DP
,Wingler
LM
,Strachan
RT
, и др. .Регуляция функции β2-адренергических рецепторов с помощью конформационно-селективных однодоменных интрател
.Мол Фармакол
.2014
;85
:472
–481
.121.Шукла
АК
.Смещение сигнализации GPCR изнутри
.Научный сигнал
.2014
;7
:ре3
.122.Фурнье
T
,Гибурданш
J
,Эвейн-Брион
D
.Обзор: ХГЧ: разные источники производства, разные гликоформы и функции
.Плацента
.2015
;36
(доп. 1
):S60
–S65
.123.Цзян
C
,Хоу
X
,Ван
C
и др. .Гипогликозилированный чФСГ обладает большей биологической активностью, чем полностью гликозилированный рекомбинантный чФСГ в клетках гранулезы человека
.J Clin Endocrinol Metab
.2015
;100
:E852
–E860
.124.Yu
HN
,Richardson
TE
,Nataraja
S
, et al. .Открытие замещенных бензамидов в качестве аллостерических модуляторов рецепторов фолликулостимулирующего гормона
.Bioorg Med Chem Lett
.2014
;24
:2168
–2172
.125. .Производные амилорида и непептидный антагонист связываются в двух разных аллостерических участках рецептора гонадотропин-высвобождающего гормона человека
.Мол Фармакол
.2008
;73
:1808
–1815
.126.Conn
PM
,Ulloa-Aguirre
A
,Ito
J
,Janovick
JA
.Перенос рецепторов, связанных с G-белком, в норме и при болезнях: извлеченные уроки для подготовки к терапевтическому спасению мутантов in vivo
.Фармакол Ред.
.2007
;59
:225
–250
.Copyright © 2015 Эндокринное общество
Расшифровка языка фертильности — термины фертильности, которые вы должны знать
Группа разработчиков медиаплатформ
Группа разработчиков медиаплатформ
Давайте будем честными: многие из нас, кто пытается забеременеть, получают медицинские советы на досках объявлений.От «Чего ожидать» до «Плодородных мыслей» до «Шишки» (и многого другого) женщины общаются и сочувствуют онлайн обо всем, от выкидышей до менопаузы. Эта тенденция, по-видимому, проистекает как из чувства безотлагательности информации, так и из потребности в сообществе; в конце концов, когда я ввожу в Google фразу «кровотечение на 8dp3dt» и нахожу ветки, полные женщин с той же проблемой, это мгновенно удовлетворяет мое любопытство и помогает мне убедиться, что я не одинок.
Хотя просмотр множества досок, безусловно, может быть полезным, он также может быть невероятно запутанным, когда вы новичок в вопросах бесплодия.Существует целый онлайн-язык для изучения, полный акронимов, сокращений и сленга, и на его освоение может уйти некоторое время. Так почему бы не сократить кривую обучения с помощью удобного справочного инструмента? Ниже приведены некоторые из наиболее распространенных терминов и их значение:
.[x]dp[x]dt : [x] количество дней после 3- или 5-дневного переноса эмбриона (часть процесса ЭКО). Использование : «Я получил свой BFP на 10dp5dt».
2WW : Страшное «двухнедельное ожидание» между овуляцией (или лечением бесплодия) и моментом, когда женщина узнает, беременна ли она. Использование : «Казалось, что Вторая мировая война никогда не закончится».
AF : Тетя Фло, она же начало менструации у женщины. Использование: «Появление AF действительно разрушило мои детские мечты в этом месяце.»
AMH : Антимюллеровский гормон, который показывает уровень овариального резерва женщины (или количество оставшихся яйцеклеток). Использование: «Мой АМГ составляет 0,45, поэтому мой врач поставил мне диагноз: сниженный овариальный резерв.»
BD : «Детский танец», a.к.а. что происходит между простынями при попытке зачать ребенка. Использование: «Мы с мужем слишком устали, чтобы заниматься сексом прошлой ночью. Надеюсь, мы не пропустили овуляцию.»
Бета : Анализ крови, проводимый врачом, который определяет уровень ХГЧ (хорионический гонадотропин человека, гормон, вырабатываемый во время беременности) и действительно ли женщина беременна.
BFP/BFN : Один из наиболее часто используемых терминов, обозначающий результаты домашнего теста на беременность, либо «Большой положительный результат», либо менее желательный «Большой отрицательный результат».»
CD : Относится к определенному дню менструального цикла. Использование: «Мне проверили прогестерон на CD21».
DPO : Количество дней после овуляции. Использование: «Мне так не терпелось сделать тест на беременность, что я сделала его раньше, на 8 ДПО!»
EWCM : Цервикальная слизь яичного белка или липкая слизь, которая появляется во время овуляции. Использование: «Сегодня я заметила EWCM, значит, мое тело готовится к овуляции.»
FET : Перенос замороженных эмбрионов, процедура ЭКО, в которой используются замороженные эмбрионы, а не свежие.
ICSI : Интрацитоплазматическая инъекция спермы, необязательная часть ЭКО, при которой один сперматозоид вводится непосредственно в яйцеклетку для ее оплодотворения. Часто это отличный вариант для тех, кто имеет дело с мужским бесплодием.
IUI : Внутриматочная инсеминация, лечение бесплодия, при котором сперматозоиды помещаются непосредственно в матку, чтобы облегчить оплодотворение.
ЭКО : Экстракорпоральное оплодотворение, лечение бесплодия, при котором яйцеклетки и сперматозоиды вручную объединяются в лабораторной посуде, после чего оплодотворенный эмбрион переносится в матку.
HPT : Домашний тест на беременность. Использование: « Я запасся HPT, потому что они были в продаже в аптеке!»
RE : Эндокринолог-репродуктолог или техническое название врача-репродуктолога. Использование: «Мы решили найти новый RE, потому что мне не нравился мой старый манер у постели больного.»
М/с : Выкидыш
PGD/PGS : Предимплантационная генетическая диагностика/предимплантационный генетический скрининг или проверка эмбриона перед переносом на наличие генетических заболеваний, таких как синдром Дауна или кистозный фиброз. Использование: «Мы решили сделать ПГД, потому что в моей семье распространена серповидноклеточная анемия.»
POAS : Акт «писания на палку» или использование HPT для определения беременности. Использование: «Я известен POAS в самых странных местах.»
Snowbabies (также называемые «Frosties»): Замороженные эмбрионы. Использование: «Мое первое ЭКО не помогло, но у меня все еще есть трое снежинок, так что я надеюсь сделать FET в ближайшем будущем.»
Стимминг : Процесс использования инъекционных препаратов для подготовки к процедурам IUI или IVF. Использование: «Я наконец-то получил все свои лекарства, так что я готов начать стимулирование на следующей неделе.»
Какие термины вы бы добавили в список?
Группа разработчиков медиаплатформ
Джен Джонс Донателли — автор и журналист, чьи работы и фотографии появились в Conde Nast Traveler , LA Confidential , Natural Health , Variety , San Francisco , Whole Life Times 9011 , Total Beauty и многие другие.Когда она не печатает весь день на своем ноутбуке, она также преподает журналистику в Университете Огайо, MediaBistro и StoryStudio Chicago. Специализируясь на всем, что касается образа жизни и хорошего самочувствия, Джен увлечена темой фертильности и рада более подробно изучить ее для REDBOOK . Она живет в Лос-Анджелесе со своим мужем Джо и любимым щенком спаниеля Таннером. Связанный:
Секретный мир бесплодия Совместное использование лекарств — и как в нем ориентироваться
«Как дела?» и другие фразы, которые гарантированно заставят вашу бесплодную подругу съежиться
Является ли икра суперпродуктом для фертильности?
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты.

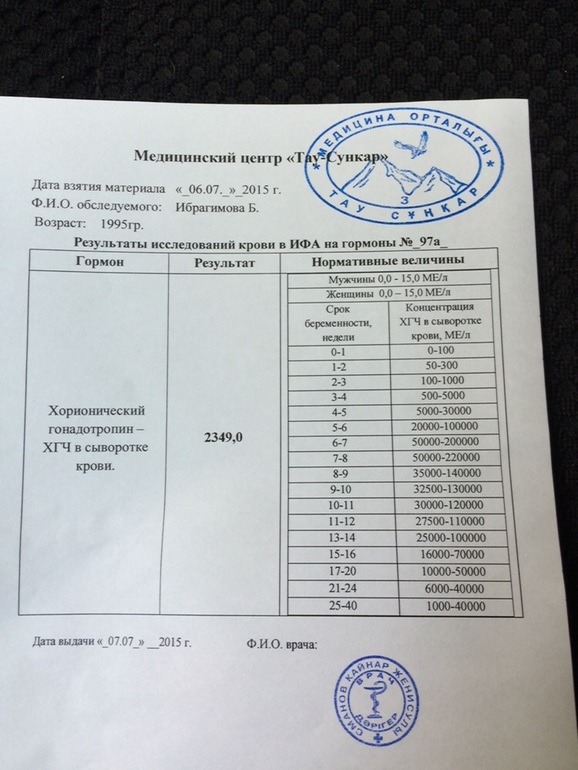
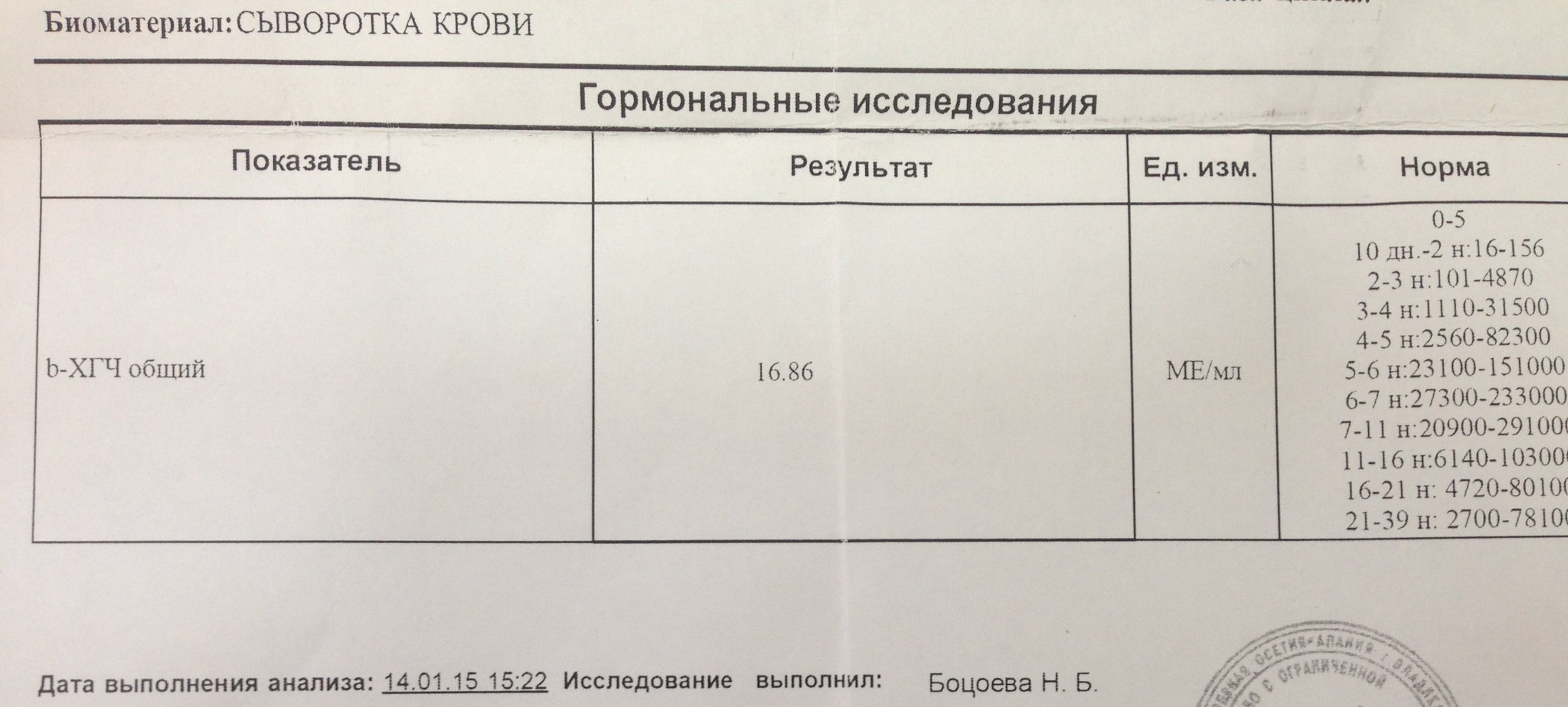

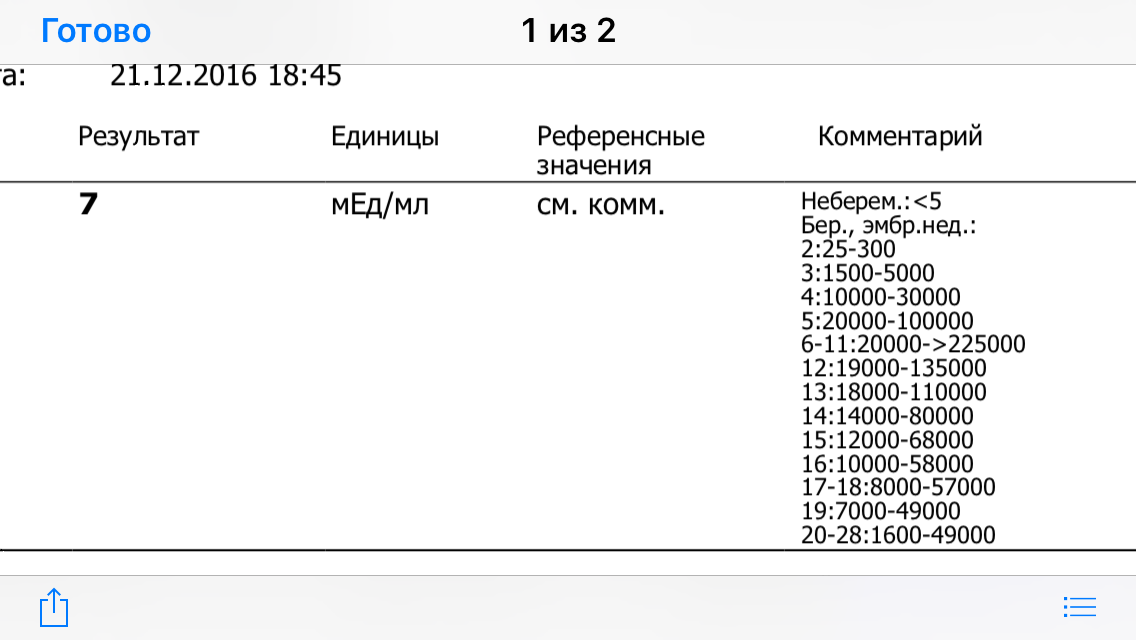
 Неудивительно, что если вы сидите на диете с ХГЧ, вы, скорее всего, получите положительные результаты беременности, поскольку тест определяет уровень этих гормонов.
Неудивительно, что если вы сидите на диете с ХГЧ, вы, скорее всего, получите положительные результаты беременности, поскольку тест определяет уровень этих гормонов.