сдать анализ в Москве, цены и адреса клиник АО Семейный доктор
Цитогенетическое исследование (кариотипирование)
Цитогенетическое исследование (или кариотипирование) – это метод лабораторной диагностики, позволяющий установить аномалии в структуре и количестве хромосом. Биологическим материалом для исследования является венозная кровь. Для оценки хромосомных нарушений необходимо наблюдать клетки в фазе деления (митоза), когда генетический материал передаётся дочерним клеткам. Переход к стадии митоза провоцируется искусственно с помощью специального вещества (митогена). Само исследование хромосомного набора проводится с помощью микроскопа.
Показания к цитогенетическому исследованию
Кариотипирование проводится, когда есть подозрения на генетическую природу бесплодия пары, а также с целью определения возможных патологий у будущего ребёнка в случае его зачатия.
Сдать кровь на цитогенетическое исследование супругам рекомендуется в следующих случаях:
-
при планировании ребёнка в возрасте старше 35 лет;
-
имеющиеся наследственные заболевания в семье;
-
проблемы с зачатием и вынашиванием детей (диагностированное бесплодие, безуспешные попытки искусственного оплодотворения, случаи замершей беременности, мертворождения, ранней детской смертности.

Также цитогенетическое исследование позволяет установить генетическую причину врожденных заболеваний у ребёнка (врожденных пороков развития, задержки физического развития (формирования половых признаков), отставание в психического развитии).
Подготовка к исследованию
Хромосомный состав у человека измениться не может, и в течение жизни вам может потребоваться только один такой анализ. Поэтому можно выбрать наиболее подходящее время для сдачи анализа.
Не надо сдавать кровь на кариотипирование на фоне воспалительных заболеваний. Подождите, пока выздоровеете (должно пройти минимум две недели после исчезновения симптомов острой инфекции).
В течение месяца перед анализом нельзя принимать антибиотики.
Накануне следует исключить употребление алкоголя, курение. Необходимо избегать серьёзных физических нагрузок и не слишком волноваться.
Важно! Перед тем, как идти сдавать кровь, надо поесть. В отличие от многих других анализов этот нельзя сдавать натощак! Поэтому не стоит совмещать анализ на кариотипирование с другими анализами и исследованиями, требующими серьёзной подготовки.
В отличие от многих других анализов этот нельзя сдавать натощак! Поэтому не стоит совмещать анализ на кариотипирование с другими анализами и исследованиями, требующими серьёзной подготовки.
Сдать кровь на цитогенетическое исследование можно в любой поликлинике Семейного доктора. Цены указаны ниже. Срок готовности анализа 20-30 дней.
ᐈ Кариотипирование в клинике репродукции ICLINIC в СПб
Подготовка к зачатию включает комплексное обследование обоих супругов для выявления и последующей коррекции факторов риска. Это существенно снижает риск рождения ребенка с различными патологиями и позволяет грамотно составить план ведения будущей беременности.
В такое разностороннее обследование может быть включено и кариотипирование супругов. Этот анализ не относится к широко распространенным и легкодоступным, и многие пары им пренебрегают. Но именно такой метод генетической диагностики дает важнейшую информацию о риске передачи ребенку основных хромосомных заболеваний, а в некоторых случаях позволяет выявить и причину бесплодия пары.
Что такое кариотипирование
Кариотипирование – анализ находящегося в ядре клетки хромосомного набора, который называют кариотипом. Это цитогенетическое исследование направлено на диагностику основных врожденных и приобретенных аномалий хромосом, даже если такие нарушения не стали причиной наследственных болезней у обследуемого человека.
Нормальный кариотип всех людей включает 46 пар хромосом, одна из которых является половой. Именно она дает различия полов. У женщин имеются 2 половые X-хромосомы, их кариотип записывается как 46XX. А у мужчин половые хромосомы разные, нормальный мужской кариотип 46XY.
Остальные хромосомы называются соматическими, закодированная в них информация востребована уже в эмбриональный период развития и используется в течение всей жизни человека. Содержащиеся здесь гены определяют индивидуальные телесные и нервно-психические особенности, порядок закладки и функционирования всех тканей и органов, базовые процессы метаболизма.
Любые хромосомные аномалии приводят к определенным нарушениям, хотя они не всегда явно заметны.
Следствием дефектов в кариотипе могут быть пороки развития и болезни разной степени тяжести, а также бесплодие и привычное невынашивание беременности. Около 20% выкидышей связаны с хромосомной патологией у эмбриона. Нередко хромосомные аномалии у одного из родителей сказываются на состоянии здоровья детей. Именно поэтому кариотипирование – важный компонент обследования супругов при планировании беременности.
Что можно выявить
Кариотипирование в СПб способно выявить различные изменения хромосомного набора:
-
Изменение количества отдельных соматических хромосом. Возможны несколько вариантов такой патологии: моносомия (наличие только одной хромосомы из пары), трисомия (удвоение одной хромосомы) и полисомии (увеличение числа более чем вдвое).

-
Изменение количества половых хромосом, что сопровождается формированием классических комплексов нарушений и развитием тяжелых заболеваний. Например, полисомия по Х-хромосоме у женщин и по Y-хромосоме у мужчин является причиной выраженных нарушений психики и снижения интеллекта. При удвоении Х-хромосомы у мужчин диагностируют синдром Клайнфельтера, а при отсутствии одной Х-хромосомы у женщин говорят о болезни Шерешевского-Тернера.
-
Структурные изменения хромосом или хромосомные перестройки. Самыми частыми из них являются дупликации (удвоение отдельного участка хромосомы), траслокации (перемещение части материала на хромосому из другой пары), делеции (потери участков хромосомы), инверсии (развороты части хромосомы на 180° без потери общей целостности).
 Возможно также образование кольцевых хромосомных структур.
Возможно также образование кольцевых хромосомных структур.
При кариотипировании взрослых людей чаще всего выявляются полисомии половых и соматических хромосом, а на структурные перестройки приходится около 10,4% случаев хромосомных болезней.
Но следует понимать, что большинство возникающих аномалий наследственного материала приводит к критичным и несовместимым с жизнью нарушениям. Эмбрионы с такими дефектами гибнут на разных этапах развития, что приводит к повторным выкидышам, мертворождениям. А многие дети с тяжелыми наследственными болезнями живут всего несколько лет, не достигая половозрелого возраста.
Кому и когда целесообразно исследовать кариотип
Кариотипирование в нашей Клинике в Санкт-Петербурге проводится по медицинским показаниям или по желанию пациента. В настоящее время этот анализ многие пары включают в план обследования при подготовке к беременности, даже если у них среди родственников не было никаких хромосомных болезней.
Медицинские показания для цитогенетического исследования:
- Выявление у родителя различных пороков развития, что может быть признаком хромосомной патологии.
- Подтвержденные хромосомные болезни в роду.
- Наличие в прошлом у женщины повторных спонтанных выкидышей на разных сроках, замершей беременности, мертворождений.
- Рождение в прошлом ребенка с пороками развития, нарушением интеллекта, множественными микроаномалиями и подтвержденными хромосомными болезнями. При этом учитывается и состояние здоровья детей и в предыдущих браках.
- Бесплодие в браке. Обследование желательно пройти не только женщине, для кариотипирования семьи требуется и генетический анализ супруга.
- Нарушение полового развития: гипогенитализм, первичные нарушения менструального цикла, недостаточная выраженность вторичных половых признаков.
- Работа на вредных производствах, радиоактивное облучение в прошлом.
 Это повышает риск нарушения процесса созревания половых клеток и развития хромосомных аномалий.
Это повышает риск нарушения процесса созревания половых клеток и развития хромосомных аномалий. - Планирование беременности, если хотя бы один из супругов старше 40 лет.
Анализ кариотипа у взрослых – достоверный способ выявления хромосомных дефектов, которые были унаследованы или появились в течение жизни.
Как проходит кариотипирование
Для анализа сдается венозная кровь, из которой выделяют лейкоциты. Их отбирают, фиксируют в мазках и особым образом окрашивают, после чего их ядра фотографируют под электронным микроскопом. На полученных снимках ищут хорошо расправленные и четко видимые хромосомы, оценивают их количество, размер и структуру, идентичность участков в парах и правильность положения отдельных частей. При кариотипировании семьи необходима и кровь супруга.
Возможно проведение цитогенетического анализа и на основе другого биологического материала. Но при этом используются более дорогостоящие технологии, и цена на такое исследование будет выше. Кариотипирование по клеткам периферической крови – доступный и достоверный метод диагностики, именно его используют для обследования взрослых.
Кариотипирование по клеткам периферической крови – доступный и достоверный метод диагностики, именно его используют для обследования взрослых.
Кариотип составляется в виде суммарного пронумерованного изображения всех соматических и половых хромосом. В заключении хромосомный набор выглядит как карта, а выявленные дефекты описываются специальными числовыми и знаковыми обозначениями, с указанием локализации аномалии. Например, 46XY21+ – это удвоение 21 хромосомы (болезнь Дауна) у мужчины, а 46X0 – отсутствие одной половой хромосомы у женщины (синдром Шерешевского-Тернера).
Чтобы определить кариотип, анализ необходимо проводить в метафазу деления клетки. В этот период нити ДНК плотно скручены и компактно структурированы в пределах ядра, а образуемые ими хромосомы расправлены и хорошо визуализируются. Поэтому для кариотипирования отбираются только активно делящиеся клетки, что представляет определенные технические сложности и требует времени.
Ведь поиск лейкоцитов в подходящей фазе деления, их фотографирование и тщательный анализ хромосомного набора проводятся врачом вручную.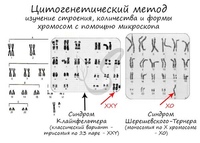 Средний срок выдачи заключения в СПб – 21 день.
Средний срок выдачи заключения в СПб – 21 день.
Где пройти такое исследование
Кариотипирование – высокотехнологичная процедура, требующая особого оборудования и специальных навыков. Проводится такое исследование в лаборатории только сертифицированным специалистом, причем не все медицинские учреждения предоставляют эту услугу.
В Ленинградской области пройти кариотипирование можно в Клинике репродуктивной медицины ICLINIC в СПб. Цитогенетический анализ мы проводим по лимфоцитам периферической крови, с оценкой количественных и структурных хромосомных аномалий. Опытные высококвалифицированные специалисты, высококачественное современное оборудование – все это обеспечивает достоверный результат и грамотную диагностику хромосомных патологий.
Анализ кариотипа 1 пациента (100 метафаз)
Цитогенетический метод кариотипирования, который позволяет оценить количество хромосом в хромосомной наборе человека, выявить изменения в морфологии (строении) отдельных хромосом, выявить полиплоидные состояния в кариотипе человека путем микроскопирования. Какие-либо отклонения от нормы в этих трех изучаемых позициях могут привести к развитию хромосомной патологии. О сущности самого метода цитогенетического анализа кариотипа вы можете прочесть в описании исследования «Анализ кариотипа (25 метафаз)».
Какие-либо отклонения от нормы в этих трех изучаемых позициях могут привести к развитию хромосомной патологии. О сущности самого метода цитогенетического анализа кариотипа вы можете прочесть в описании исследования «Анализ кариотипа (25 метафаз)».
В отличие от «Анализ кариотипа (25 метафаз)» количество исследуемых клеток в анализе кариотипа на основе 100 метафаз увеличено до 100, что повышает диагностическую результативность кариотипирования в условиях возможного кариотипного мозаицизма. Мозаичный кариотип – это когда ткани человека содержат генетически различающиеся клетки. При этом часть клеток, большая часть, покажет обычный полный кариотип, а определенный клон клеток – кариотип отличный от полного кариотипа. Мозаичным кариотип может быть как по аутосомам, так и по половым хромосомам, как числовым (значительно чаще) так и структурным.
С мозаичным кариотипом связаны некоторые генетические болезни человека, например, мозаичную форму могут иметь синдром Дауна, (не все клетки содержат трисомию по 21 хромосоме, около 2 % пациентов с синдромом), синдром Клайнфельтера, синдром Шерешевского — Тёрнера (20-50 % больных), синдром Эдвардса (около 10 %), Синдром де Ля Шапеля.
При мозаицизме обычно наблюдается менее выраженная клиническая картина синдромов, если число мутантных клеток составляет менее 10 %.
Самая частая причина мозаицизма — нерасхождение хромосом в ранних постзиготических митотических делениях. Пример — зигота с дополнительной хромосомой 21 может потерять дополнительную хромосому в одном из митотических делений и продолжить развитие как мозаик. Кариотип будет представлен как 46/47,+21. Если вы встречались с человеком, который имеет разный цвет глаз, то это тоже пример «мозаика», организма с мозаичным кариотипом.
Диагностика мозаицизма всегда представляет определенные трудности для цитогенетика, особенно, когда мозаицизм низкоуровневый. С появлением молекулярно-цитогенетических методов исследования хромосомной патологии человека эта проблема разрешена.
Кровь на анализ сдаётся в состоянии сытости. Должен быть статус без признаков воспалительного заболевания. Если вы принимали антибиотики, то до сдачи анализа должно пройти не менее 3-х недель с момента окончания приема антибиотиков (в идеале месяц). Рекомендуется воздержаться от приема алкоголя за 3 суток до сдачи анализа.
Рекомендуется воздержаться от приема алкоголя за 3 суток до сдачи анализа.
Хранение и транспортировка образца крови осуществляется при температуре +4 +8
Задать вопросЗаключение оформляется согласно международной цитогенетической номенклатуре (ISCN) в виде: указывается количество хромосом, далее какие половые хромосомы представлены в кариотипе, и если выявлены особенности – указывается хромосома, на которой это произошло, участок в хромосоме, специфика аберрации.
Пример: 46, XY, t(1;3)(p21;q21) . Представлен индивидуальный кариотип мужчины с транслокацией (t) 21-х участков короткого (p) и длинного плеч (q) 1-й и 3-й хромосом соответственно.
При выявлении каких-либо отклонений от нормы кариотипа обратитесь к нам за послетестовой консультацией.
Задать вопросЧто такое цитогенетическое исследование? — ЕМЦ
Цитогенетическое обследование — анализ на выявление нарушений хромосомного набора человека.
Хромосомы представляют собой плотно упакованные нити ДНК, которые содержат информацию о геноме человека. Количество и структура хромосом строго специфична для каждого вида. У человека в ядрах соматических (не половых) клеток содержится в норме 46 хромосом (23 пары). Одна из пар — половые хромосомы — определяет пол человека. У женщины имеется 2 X хромосомы, такой кариотип обозначается как 46XX, у мужчины есть одна X и одна Y хромосома (кариотип 46XY). Неполовые хромосомы называются аутосомами.
Хромосомы в обычном состоянии клетки в ядре не видны, они становятся видны под микроскопом только на определенных фазах деления клеток. Для изучения кариотипа используются клетки в метафазе митоза.
Для проведения исследования у пациента берут кровь и выделяют из нее лимфоциты. Для того, чтобы заставить их делиться нужна стимуляция. Однако при кариотипировании используются специальные вещества (митогены), которые заставляют лимфоциты делиться независимо от их специфичности. В этом главное отличие от СКЛ. (Там никакие химические стимуляторы не применяются).
В этом главное отличие от СКЛ. (Там никакие химические стимуляторы не применяются).
Через несколько дней деления культура обрабатывается специальным веществом, которое останавливает процесс деления клеток именно на той стадии, когда видны хромосомы. Из клеток культуры готовятся специальные мазки на стеклах, которые будут использованы для исследования. Для получения дополнительной информации о структуре хромосом используется специальная окраска (G-бэндинг) в результате которой каждая хромосома приобретает специфическую поперечную исчерченность.
Теперь хромосомы полностью готовы для анализа.
Первая стадия анализа называется кариологией. Специалист генетик анализирует под микроскопом 12-15 клеток . Например, так диагносцируется синдром Дауна, когда имеется лишняя 21-я хромосома. Структурные аберрации представляют собой изменение самих хромосом (инверсия — поворот участка хромосомы на 180, делеция — выпадение участка хромосомы, транслокация — перенос части одной хромосомы на другую хромосому, и т. д.). Аберрации могут носить регулярный и нерегулярный характер. Регулярные аберрации обнаруживаются в большом проценте клеток или во всех клетках. Они возникают в момент зачатия или в первые дни после зачатия. Нерегулярные мутации чаще всего являются свидетельством действия на организм неблагоприятных факторов (радиация, химические вредности и пр.).
д.). Аберрации могут носить регулярный и нерегулярный характер. Регулярные аберрации обнаруживаются в большом проценте клеток или во всех клетках. Они возникают в момент зачатия или в первые дни после зачатия. Нерегулярные мутации чаще всего являются свидетельством действия на организм неблагоприятных факторов (радиация, химические вредности и пр.).
Для выяснения следов действия вредных факторов на геном анализа 12-15 клеток бывает недостаточно.
Поэтому следующей стадией генетического обследования, которая очень важна для пациентов с бесплодием и невынашиванием беременности, является анализ на аберрации. Это расширенное генетическое обследование, при котором подробно анализируется 100 клеток, и расчитывается процент аномальных метафаз. Этот анализ хорошо выявляет возможные следы действия вредных факторов на геном человека. Из-за трудоемкости анализа сроки исполнения достаточно велики (на исследование одного человека уходит целый рабочий день специалиста очень высокой квалификации).
Цитогенетическое обследование позволяет
- Выявить такие случаи бесплодия или невынашивания беременности, когда шансы появления потомства у одного из супругов резко снижены или отсутствуют вовсе
- Выявить случаи значительного повышения нестабильности генома, когда специальное лечение позволяет в какой-то степени снизить риск развития сбоев при зачатии
Имеются противопоказания. Ознакомьтесь с инструкцией или проконсультируйтесь у специалиста.
АНАЛИЗ КАРИОТИПА
Для процедуры определения кариотипа могут быть использованы любые популяции делящихся клеток. Для определения человеческого кариотипа используется либо одноядерные лейкоциты, извлеченные из пробы крови, деление которых провоцируется добавлением митогенов либо культуры клеток, интенсивно делящихся в норме (фибробласты кожи, клетки костного мозга). Обогащение популяции клеточной культуры производится остановкой деления клеток на стадии метафазы митоза добавлением колхицина — алкалоида, блокирующего образование микротрубочек и «растягивание» хромосом к полюсам деления клетки и препятствующего тем самым завершению митоза.
Полученные клетки в стадии метафазы фиксируются, окрашиваются и фотографируются под микроскопом; из набора получившихся фотографий формируется систематизированный кариотип — нумерованный набор пар гомологичных хромосом (аутосом). Изображения хромосом при этом ориентируются вертикально короткими плечами вверх, их нумерация производится в порядке убывания размеров, пара половых хромосом помещается в конец набора.
Исторически первые недетализованные кариотипы, позволявшие проводить классификацию по морфологии хромосом, получались окраской по Романовскому—Гимзе, однако дальнейшая детализация структуры хромосом в кариотипах стала возможной с появлением методик их дифференциального окрашивания. Классический и спектральный кариотипы
Классический и спектральный кариотипы
Для получения классического кариотипа используется окраска хромосом различными красителями или их смесями: в силу различий в связывании красителя с различными участками хромосом окрашивание происходит неравномерно и образуется характерная полосчатая структура (комплекс поперечных меток, англ. banding), отражающая линейную неоднородность хромосомы и специфичная для гомологичных пар хромосом и их участков (за исключением полиморфных районов локализуются различные аллельные варианты генов). Первый метод окраски, позволяющий получить такие высокодетализированные изображения, был разработан шведским цитологом Касперссоном. Используются и другие красители. Такие методики получили общее название дифференциального окрашивания хромосом: Q-окрашивание — окрашивание по Касперссону акрихин-ипритом с исследованием под флуоресцентным микроскопом. Чаще всего применяется для исследования Y-хромосом (быстрое определения генетического пола, выявление транслокаций между X- и Y-хромосомами или между Y-хромосомой и аутосомами, скрининг мозаицизма с участием Y-хромосом)
banding), отражающая линейную неоднородность хромосомы и специфичная для гомологичных пар хромосом и их участков (за исключением полиморфных районов локализуются различные аллельные варианты генов). Первый метод окраски, позволяющий получить такие высокодетализированные изображения, был разработан шведским цитологом Касперссоном. Используются и другие красители. Такие методики получили общее название дифференциального окрашивания хромосом: Q-окрашивание — окрашивание по Касперссону акрихин-ипритом с исследованием под флуоресцентным микроскопом. Чаще всего применяется для исследования Y-хромосом (быстрое определения генетического пола, выявление транслокаций между X- и Y-хромосомами или между Y-хромосомой и аутосомами, скрининг мозаицизма с участием Y-хромосом)
G-окрашивание — модифицированное окрашивание по Романовскому—Гимзе. Чувствительность выше, чем у Q-окрашивания, поэтому используется как стандартный метод цитогенетического анализа. Применяется при выявлении небольших аберраций и маркерных хромосом (сегментированных иначе, нежели нормальные гомологичные хромосомы).
R-окрашивание — используется акридиновый оранжевый и подобные красители, при этом окрашиваются участки хромосом, нечувствительные к G-окрашиванию. Используется для выявления деталей гомологичных G- или Q-негативных участков сестринских хроматид или гомологичных хромосом.
C-окрашивание — применяется для анализа центромерных районов хромосом, содержащих конститутивный гетерохроматин, и вариабельной дистальной части Y-хромосомы.
T-окрашивание — применяют для анализа теломерных районов хромосом.
Анализ кариотипов
Сравнение комплексов поперечных меток в классической кариотипии или участков со специфичными спектральными характеристиками позволяет идентифицировать как гомологичные хромосомы, так и их отдельные участки, что позволяет детально определять хромосомные аберрации — внутри- и межхромосомные перестройки, сопровождающиеся нарушением порядка фрагментов хромосом (делеции, дупликации, инверсии, транслокации). Такой анализ имеет большое значение в медицинской практике, позволяя диагностировать ряд хромосомных заболеваний, вызванных как грубыми нарушениями кариотипов (нарушением числа хромосом), так и нарушением хромосомной структуры или множественностью клеточных кариотипов в организме (мозаицизмом).
Такой анализ имеет большое значение в медицинской практике, позволяя диагностировать ряд хромосомных заболеваний, вызванных как грубыми нарушениями кариотипов (нарушением числа хромосом), так и нарушением хромосомной структуры или множественностью клеточных кариотипов в организме (мозаицизмом).
Молекулярно-генетические исследования — экспертная диагностика от лаборатории АрхиМед
Синдром Жильбера – это наследственное заболевание, проявляющееся эпизодами желтухи и повышением уровня неконъюгированного (свободного, непрямого) билирубина в сыворотке крови. Его распространенность составляет около 5%.
Причина развития синдрома – снижение активности фермента печени уридиндифосфат-глюкуронилтрансферазы (УДФГТ), который кодируется геном UGT 1A1. Мутация в промоторной области гена UGT 1A1 характеризуется увеличением количества ТА-повторов (в норме их число не превышает 6). Если их становится 7 (или реже 8) в гомозиготном или гетерозиготном состоянии, функциональная активность фермента УДФГТ снижается – это обязательное условие для возникновения синдрома Жильбера. У гомозиготных носителей мутации заболевание характеризуется более высоким исходным уровнем билирубина и более тяжелыми клиническими проявлениями. У гетерозиготных носителей преобладает латентная форма заболевания.
У гомозиготных носителей мутации заболевание характеризуется более высоким исходным уровнем билирубина и более тяжелыми клиническими проявлениями. У гетерозиготных носителей преобладает латентная форма заболевания.
В норме при распаде эритроцитов выделяется непрямой билирубин, который необходимо вывести из организма. Поступив в клетки печени, он связывается с глюкуроновой кислотой под влиянием фермента уридиндифосфат-глюкуронилтрансферазы (УДФГТ). Соединение билирубина с глюкуроновой кислотой делает его растворимым в воде, что обеспечивает возможность его перехода в желчь и выделения с мочой. Из-за мутации в гене UGT1A1 и, как следствие, недостаточной активности УДФГТ конъюгация непрямого билирубина нарушается, что приводит к повышению его концентрации в крови. Увеличение содержания билирубина в крови, в свою очередь, способствует накоплению его в тканях, особенно в эластической ткани (содержится в стенке кровеносных сосудов, коже, склерах) – этим объясняется желтушность.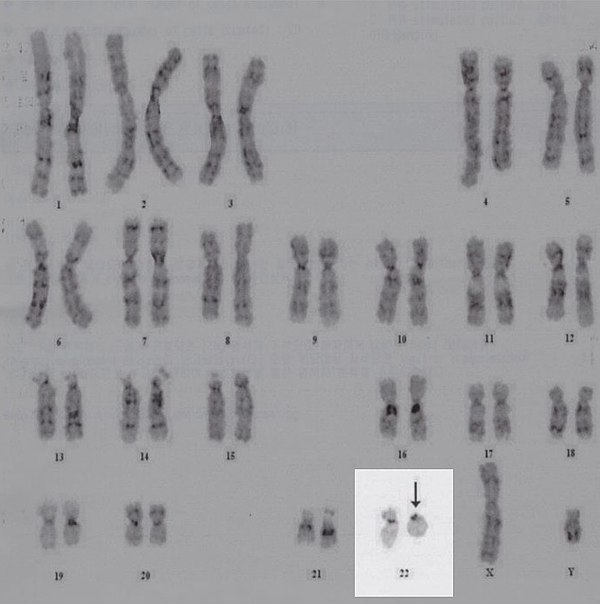
Проявления синдрома Жильбера могут возникать в любом возрасте и провоцируются физическими нагрузками, стрессовыми ситуациями, голоданием, вирусными инфекциями, приемом алкоголя, ряда лекарственных препаратов, обладающих гепатотоксическим эффектом. У заболевания неспецифические симптомы: боли в животе, тяжесть в правом подреберье, расстройства пищеварения (тошнота, отрыжка, запоры, диарея), усталость, общее недомогание, тревожность. Основной симптом – желтушное окрашивание кожи и слизистых оболочек и повышение уровня непрямого билирубина в крови. Гипербилирубинемия (повышение уровня билирубина) чаще всего может составлять не более 100 ммоль/л с преобладанием непрямой фракции. Остальные печеночные пробы, как правило, не изменены.
Под влиянием солнечного света у больных с синдромом Жильбера может отмечаться повышенная пигментация кожи.
Иногда заболевание проявляется в период новорожденности и расценивается как физиологическая желтуха новорожденных.
Возможно и постоянное бессимптомное течение, тогда синдром Жильбера может обнаруживаться при случайно выявленных отклонениях в биохимическом анализе крови (показатель билирубина).
Своевременная диагностика синдрома Жильбера позволяет отличить его от других заболеваний печени и крови, вовремя ограничить прием препаратов, обладающих гепатотоксическим действием, осуществить профилактику печеночных кризов, скорректировать образ жизни пациента до полного исчезновения дискомфорта, вызываемого гипербилирубинемией.
Самый быстрый способ выявить синдром Жильбера – прямая ДНК-диагностика, заключающаяся в определении числа TA-повторов в гене UGT1A1.
Факторы, провоцирующие обострение синдрома Жильбера:
- тяжелые физические нагрузки,
- погрешности в питании (консервированные, жареные, острые, копченые продукты, газированные напитки),
- голодание,
- алкоголь,
- стрессовые ситуации, переутомление,
- инсоляция,
- вирусные инфекции,
- лекарственные препараты, в метаболизме которых участвует фермент УДФГТ (анаболические стероиды, глюкокортикоиды, андрогены, этинилэстрадиол, рифампицин, циметидин, хлорамфеникол, стрептомицин, левомицетин, салицилат натрия, ампициллин, кофеин, парацетамол, иринотекан).

Состав исследования:
- УДФ-глюкуронозил трансфераза 1A1 (UGT1A1).
- Выявление мутации (TA) 6/7 (регуляторная область гена).
- Специальной подготовки не требуется.
Кариотипирование – о возможностях этого метода исследования рассказывает врач клиники ISIDA — Клиника ISIDA Киев, Украина
15 января 2018
Хромосомный паспорт ребенка – это документальное отражение результатов актуального исследования кариотипа ребенка, качественных и количественных особенностей строения его хромосом.
Хромосомный набор человека, с которым он рождается, остается неизменным на протяжении всей жизни. В норме он состоит из 46 хромосом, две из которых половые: XX – у женщин, XY – у мужчин. Отклонение по количеству хромосом или их структуры свидетельствует о наличии нарушений, которые могут сказаться на здоровье.
Отклонение по количеству хромосом или их структуры свидетельствует о наличии нарушений, которые могут сказаться на здоровье.
В то же время, встречаются случаи, когда человек является только носителем хромосомных сбалансированных перестроек и даже не догадывается об угрозе. Инновационные технологии позволяют заблаговременно выявить возможные риски и исследовать кариотип, как взрослого человека, так и младенца до его рождения и после – говорит Любовь Тавокина, заведующая молекулярно-цитогенетической лабораторией клиники ISIDA. – Лаборатория ISIDA трижды аттестована в Украине и ежегодно проходит внешний контроль качества. Команда врачей-лаборантов-генетиков – это специалисты высшей категории, обладающие многолетним опытом работы».
АЛГОРИТМ ДЕЙСТВИЯ
Создание хромосомного паспорта строится на базовом цитогенетическом исследовании под названием кариотипирование. Для диагностики используется биологический материал, содержащий клетки пациента. Лучшим объектом является периферийная кровь пациента. Из крови выделяют лимфоциты, в ядрах которых находятся хромосомы. С помощью светового микроскопа проверяются базовые показатели: количество и отсутствие структурных перестроек хромосом. Описание результатов предоставляется в виде формулы кариотипа с подробным разъяснением всех данных, а также общим цитогенетическим заключением. Только при отсутствии хромосомных аномалий кариотип считается нормальным.
Лучшим объектом является периферийная кровь пациента. Из крови выделяют лимфоциты, в ядрах которых находятся хромосомы. С помощью светового микроскопа проверяются базовые показатели: количество и отсутствие структурных перестроек хромосом. Описание результатов предоставляется в виде формулы кариотипа с подробным разъяснением всех данных, а также общим цитогенетическим заключением. Только при отсутствии хромосомных аномалий кариотип считается нормальным.
Но, определенные ограничения метода кариотипирования не всегда позволяют сделать окончательный вывод без применения более чувствительных методов исследования, особенно если у пациента наблюдается клиническая картина – пороки развития органов и систем органов, умственная отсталость и др.
В таком случае, проводятся дополнительные тесты, которые позволяют выяснить, где именно произошла поломка, идентифицировать конкретную хромосому или ее определенную часть. На основе результатов прописываются возможные риски и соответствующие рекомендации. Все эти данные вносятся в хромосомный паспорт ребенка, который остается актуальным на протяжении его жизни.
Все эти данные вносятся в хромосомный паспорт ребенка, который остается актуальным на протяжении его жизни.
В ЛАБОРАТОРИИ
Полный цикл создания хромосомного паспорта длится от 10 дней до нескольких недель, в зависимости от этапов исследования и сложности перестройки. Для проведения анализа обычно используется венозная кровь пациента. Если же речь идет о кариотипе будущего ребенка, то у беременной берутся клетки околоплодных вод или оболочек (ворсин хориона/ плаценты), окружающих плод. Путем ряда манипуляций с биологическим материалом добывают клетки, затем ядра, содержащие хромосомы. При нанесении зависи очищенных ядер на предметное стекло получают метафазные пластинки – объект для анализа хромосом.
Анализируют хромосомы под микроскопом с использованием компьютерных программ, а затем систематизируют в соответствии с Международной цитогенетической номенклатуры хромосом человека (International System for Cytogenetic Nomenclature, ISCN). В 90% случаев для установления кариотипа достаточно базового метода дифференциального окрашивания хромосом (GTG).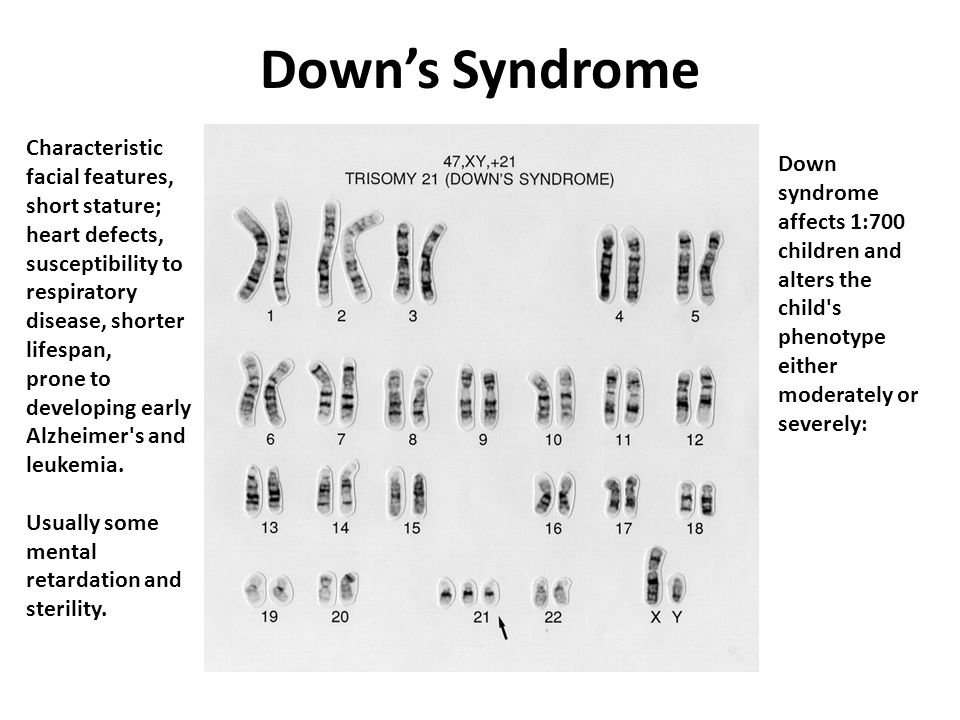 Он позволяет обнаружить большинство аномалий.
Он позволяет обнаружить большинство аномалий.
Более чувствительные методы позволяют выявлять те изменения, которые нельзя обнаружить в световом микроскопе (скрытые перестройки), или точно идентифицировать происхождение хромосомной перестройки. Это панель молекулярно-цитогенетических методов, так называемый, FISH-анализ. Он также обнаруживает нарушения, которые остаются незаметными для GTG. Поэтому, если есть проявления возможных хромосомных аномалий (клиническая картина), даже в условиях установления нормального кариотипа, врач рекомендует продолжить диагностику более чувствительными методами.
ГРУППЫ РИСКА
В общем, частота хромосомных патологий, которые могут быть унаследованными или возникать впервые, составляет 5-7 случаев на 1000. В то же время, среди пар, страдающих бесплодием, невынашивание беременности, этот показатель возрастает в разы: 7 случаев на 100, а в группах мужчин с тяжелыми нарушениями сперматогенеза – 15%. Даже здоровый человек может быть носителем хромосомных патологий, когда изменения в кариотипе не имеют никаких внешних и физиологических признаков. В таких случаях существует риск для будущего поколения унаследовать аномалию не только как носителя. Она может стать причиной хромосомных синдромов – заболеваний, обусловленных изменениями в количестве или структуре отдельных хромосом в кариотипе. Среди самых распространенных проявлений: нервно-психические расстройства, врожденные пороки различных систем и органов, нарушение полового созревания, отставание в росте и развитии.
В таких случаях существует риск для будущего поколения унаследовать аномалию не только как носителя. Она может стать причиной хромосомных синдромов – заболеваний, обусловленных изменениями в количестве или структуре отдельных хромосом в кариотипе. Среди самых распространенных проявлений: нервно-психические расстройства, врожденные пороки различных систем и органов, нарушение полового созревания, отставание в росте и развитии.
Хотите, чтобы Ваш ребенок был здоров? Доверьте наблюдение за его здоровьем и развитием врачам клиники ISIDA. Позвоните в клинику ISIDA по телефонам 0 800 60 80 80, +38 (044) 455 88 11 и мы с радостью ответим на все Ваши вопросы. Или задайте свой вопрос с помощью специальной формы – во всплывающем окне при заходе на наш сайт.
Кариотип: определение, расстройства и анализ — видео и стенограмма урока
Анализ кариотипа
Часто легче понять кариотип, если сделать снимок. Кариограмма — это фотография хромосом организма, на которой хромосомы отсортированы и расположены по размеру.
У человека всего 46 хромосом (по 23 от каждого родителя), что вы можете видеть на кариограммах.На кариограммах гомологичные хромосомы или пары хромосом одинакового размера и формы сгруппированы вместе. У людей 22 из этих пар, называемых аутосомами .
Аутосомы — это хромосомы, в которых есть гены всего, кроме определения пола. У людей аутосомы пронумерованы от 1 до 22, и у вас есть по два каждого номера, потому что один пришел от вашей мамы, а другой — от отца. Хромосома 1 самая большая, а хромосома 22 самая маленькая.
Аутосомы составляют только 44 из ваших хромосом, так какие две другие? Оставшиеся две хромосомы у человека называются половыми хромосомами , потому что именно они определяют, мужчина вы или женщина.На кариограмме они располагаются после аутосом.
Половые хромосомы не пронумерованы, вместо этого им присваиваются буквы X и Y. Если у кого-то есть две X-хромосомы, то они будут женскими. Если у кого-то есть X- и Y-хромосомы, то они будут мужчинами.
Если у кого-то есть X- и Y-хромосомы, то они будут мужчинами.
Заболевания
Анализ кариотипа может использоваться для определения того, имеют ли люди ненормальное количество хромосом или хромосомы ненормального размера. Эти отклонения могут быть вызваны:
- Нерасхождением : хромосомы не разделились в родительских клетках, что привело к тому, что у детей слишком много или слишком мало копий хромосом
- Удаление : фрагмент хромосомы отсутствует, что приводит к более короткой, чем обычно, хромосоме
- Дупликация : части хромосомы повторяются, в результате получается хромосома длиннее, чем обычно
- Транслокация : происходит, когда одна часть хромосомы отрывается и прикрепляется к другой хромосоме, в результате чего одна более короткая и одна более длинная хромосома
Аномальное количество или размер хромосом может привести ко многим генетическим нарушениям.Некоторые известные заболевания возникают из-за получения дополнительных копий хромосомы, в том числе синдром Дауна, синдром тройной Х-хромосомы, когда женщина получает дополнительную Х-хромосому, и синдром Клайнфельтера, когда мужчина получает дополнительную Х-хромосому. Некоторые расстройства возникают из-за отсутствующей хромосомы, например, синдром Тернера, когда женщина получает только одну Х-хромосому, а некоторые из-за транслокации, например, лейкоза, при котором образуются аномальные белые клетки.
Некоторые расстройства возникают из-за отсутствующей хромосомы, например, синдром Тернера, когда женщина получает только одну Х-хромосому, а некоторые из-за транслокации, например, лейкоза, при котором образуются аномальные белые клетки.
Краткое содержание урока
Количество и появление хромосом в клетке называется кариотипом .Кариотип можно увидеть и изучить только под микроскопом. Для облегчения понимания кариотипов часто делают кариограмм . На кариограммах гомологичные хромосомы расположены рядом, а затем расположены по размеру.
Половые хромосомы размещаются как последняя пара хромосом. Анализ кариотипа может выявить аномалии, такие как отсутствие хромосом, лишние хромосомы, делеции , дупликации и транслокации . Эти аномалии могут вызывать генетические нарушения, включая синдром Дауна, синдром Тернера, синдром Клайнфельтера и синдром ломкой Х-хромосомы.
Заметки о кариотипах
| Что это? | Почему изучается? |
|---|---|
| Кариотопия — это количество, размер и форма хромосом в организме | Кариотипы могут выявить хромосомные аномалии, включая: * нерасхождение * удаление * дупликацию * транслокацию |
Результаты обучения
После того, как вы закончите, вы сможете:
- Назвать кариотип
- Опишите процесс, используемый для определения кариотипа организма
- Определить кариограмму
- Обсудите некоторые аномалии, которые можно наблюдать с помощью анализа кариотипа
Биологический проект http://www.biology.arizona.edu КРЕДИТЫ |
Хромосомный анализ с использованием спектрального кариотипирования (SKY)
Cell Biochem Biophys.2012; 62(1): 13–17.
andGeorge Imataka
Department of Pediatrics, Dokkyo Medical University, 880 Mibu, Shimotsuga, Tochigi 321-0293 Japan
Osamu Arisaka
Department of Pediatrics, Dokkyo Medical University, 880 Mibu, Shimotsuga, Tochigi 321-0293 Japan
Department of Pediatrics, Dokkyo Medical University, 880 Mibu, Shimotsuga, Tochigi 321-0293 Japan
Corresponding author.
Эта статья распространяется в соответствии с условиями некоммерческой лицензии Creative Commons Attribution, которая разрешает любое некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора (авторов) и источника.
Эта статья цитируется в других статьях в PMC.Abstract
Спектральное кариотипирование — это новый метод хромосомного анализа, разработанный на основе подхода флуоресцентной гибридизации in situ.Спектральное кариотипирование позволяет диагностировать различные заболевания, так как его технология окрашивает каждую из 24 хромосом человека в разные цвета. В последние годы стало возможным использовать спектральное кариотипирование для исследований в общей клинической практике, и его применимость привлекла особое внимание при диагностике различных заболеваний. В этом обзоре мы объясним принцип спектрального кариотипирования, а также его специфичность и ограничения при обнаружении генетических дефектов в клиническом применении, представив два отчета о случаях.
Ключевые слова: Спектральное кариотипирование, флуоресцентная гибридизация in situ, хромосома SKY, многоцветная FISH
Введение
Первое сообщение о хромосомах человека было сделано в 1882 году Флеммингом, в котором 22–28 хромосом в делящихся клетках роговицы. эпителий [1]. Сорок лет спустя Пейнтер сообщил, что у человека было 48 хромосом и что пол определялся в зависимости от наличия или отсутствия Y-хромосомы [1]. Только после отчета «2 n = 46» в 1956 году Тьо и Леван установили природу человеческих хромосом [1].После этого отчета одна за другой была выявлена взаимосвязь между различными врожденными патологиями и хромосомными аномалиями. В 1959 г. Lejeune et al. [2] продемонстрировали, что синдром Дауна вызван наличием дополнительной 21-й хромосомы, то есть трисомией [3]. Это открытие хромосомы 21-трисомии стало поворотным моментом в последующем открытии нескольких других синдромов трисомии, включая хромосомы 18 [4, 5], 13 [6], 8 [7] и 22 [8, 9]. Помимо аберраций числа хромосом, аномалий, связанных с половыми хромосомами, а именно., Синдром Тернера [10] и синдром Клайнфельтера [11] и другие хромосомы [5, 12] описаны.
Помимо аберраций числа хромосом, аномалий, связанных с половыми хромосомами, а именно., Синдром Тернера [10] и синдром Клайнфельтера [11] и другие хромосомы [5, 12] описаны.
Повышенное понимание злокачественных заболеваний в 1960-х годах и появление более совершенных методов культивирования клеток, включая метод культивирования периферической крови [13], привели к первому открытию хромосомных аномалий в злокачественных опухолях, хромосомы Ph 1 , которая является специфичен для хронического миелолейкоза [14]. Исследования генетического анализа, представленные Human Genomic Project [15], привели к применению современных генетических инструментов в исследованиях биологических явлений, таких как развитие, эволюция и старение, а также аномальной клеточной дифференциации, включая рак.
Таким образом, в процессе изучения хромосом человека на протяжении более века было разработано много новых методов тестирования хромосом. В 1971 году Касперссон и др. [16] разработали Q-окрашивание с использованием хинакриновой горчицы, флуоресцентного красителя, который связывается с ДНК, что сыграло важную роль в открытии того, что хромосомы имеют полосы (полосы). Позже появились улучшенные методы окрашивания, в том числе R-, T-, C- и G-окрашивание. Анализ полосы получил дальнейшее развитие, и теперь он превратился в полосу хромосом с высоким разрешением [17].Кроме того, наряду с разработкой метода флуоресцентной гибридизации in situ (FISH) [18], который включает картирование хромосомы с использованием флуоресцентно меченного зонда, стало возможным идентифицировать хромосомные микроделеции и структурные аномалии, такие как дополнительная часть хромосомы. хромосома и хромосома-маркер. FISH также использовался для диагностики аномалий, вызванных хромосомной анеуплоидией, которые трудно обнаружить с помощью обычных методов тестирования.
Позже появились улучшенные методы окрашивания, в том числе R-, T-, C- и G-окрашивание. Анализ полосы получил дальнейшее развитие, и теперь он превратился в полосу хромосом с высоким разрешением [17].Кроме того, наряду с разработкой метода флуоресцентной гибридизации in situ (FISH) [18], который включает картирование хромосомы с использованием флуоресцентно меченного зонда, стало возможным идентифицировать хромосомные микроделеции и структурные аномалии, такие как дополнительная часть хромосомы. хромосома и хромосома-маркер. FISH также использовался для диагностики аномалий, вызванных хромосомной анеуплоидией, которые трудно обнаружить с помощью обычных методов тестирования.
Сравнительная геномная гибридизация (CGH) [19] и спектральное кариотипирование (SKY) [20], основанные на методе FISH, являются относительно недавними и усовершенствованными методами хромосомного анализа.SKY, как описано здесь, относится к методике многоцветной FISH, которая позволяет идентифицировать 24 хромосомы человека посредством однократной гибридизации, а затем окрашивать их разными цветами. В этой статье будет обсуждаться анализ хромосомных аномалий с помощью метода SKY и его ограничения для обнаружения.
В этой статье будет обсуждаться анализ хромосомных аномалий с помощью метода SKY и его ограничения для обнаружения.
Принцип НЕБО
В качестве основных принципов FISH используются два метода: окраска хромосом и многоцветная флуоресценция. Первый — это техника рисования полного изображения определенной хромосомы с помощью флуоресцентных сигналов.Последний представляет собой метод рисования изображений нескольких сигналов гибридизации с разными флуоресцентными красителями. Сочетая эти две техники, в 1996 году Schrock et al. Разработали технику SKY. [20].
В SKY цветовая эмиссия хромосом определяется комбинацией окрашивающих зондов и (флуоресцентных красителей). В этом методе новые цвета могут быть получены путем извлечения пары различных флуоресцентных красителей из пяти типов флуоресцентных красителей: оранжевый спектр, красный Техас, Cy5, зеленый спектр, Cy5.5, и смешивая каждую пару вместе. Таким образом, теоретически возможно создать 2 N -1 количество цветов из N типов флуоресцентных красителей. Таким образом, из пяти типов флуоресцентных красителей можно создать 31 тип цвета. В действительности, однако, поскольку некоторая флуоресценция имеет длину волны, близкую к длине волны в инфракрасном спектре, необходимо использовать систему спектроскопии двухмерного изображения (например, Spectral Bio-Imaging System SD-200, Applied Spectral Imaging Ltd., Израиль). для обработки спектральных изображений так, чтобы можно было создать 24 макроскопически различимых цвета (таблица).
Таким образом, из пяти типов флуоресцентных красителей можно создать 31 тип цвета. В действительности, однако, поскольку некоторая флуоресценция имеет длину волны, близкую к длине волны в инфракрасном спектре, необходимо использовать систему спектроскопии двухмерного изображения (например, Spectral Bio-Imaging System SD-200, Applied Spectral Imaging Ltd., Израиль). для обработки спектральных изображений так, чтобы можно было создать 24 макроскопически различимых цвета (таблица).
Таблица 1
Комбинация флуоресцентных красителей (окрашивающие зонды) в хромосомном анализе с использованием SKY
| Хромосома | Покраска зондов | |
|---|---|---|
| 1 | BCD | |
| 2 E | ||
| 3 | ACDE | |
| 4 | CD | |
| 5 | ABDE | |
| 6 | BCDE | |
| 7 | BC | |
| 8 | D 900 9 | ADE |
| 10 | CE | |
| 11 | ACD | |
| 12 | BE | |
| 13 | AD | |
| 14 | B | |
| 14 | B | |
| ABC | ||
| 16 | BD | |
| 17 | C | |
| 18 | ABD | |
| 19 | AC | |
| 20 | A | |
| 21 | DE | |
| 22 | ABCE | |
| X | AE YCDE |
Для теста требуется 3 образца. 0 мл обработанной гепарином крови в случае хромосомного анализа на регулярные врожденные аномалии и 1,0 мл жидкости костного мозга и 5,0 мл крови в случае заболеваний крови. В настоящее время не существует стандартизированного метода описания кариотипов хромосом на основе анализа SKY.
0 мл обработанной гепарином крови в случае хромосомного анализа на регулярные врожденные аномалии и 1,0 мл жидкости костного мозга и 5,0 мл крови в случае заболеваний крови. В настоящее время не существует стандартизированного метода описания кариотипов хромосом на основе анализа SKY.
Характеристики SKY в клиническом применении
Когда хромосома, происхождение которой не может быть идентифицировано, или наблюдается структурная аномалия частичной копии хромосомы с G-полосами, метод SKY позволяет распознавать каждую хромосому с разными цветовые тона.Кроме того, когда клетки культивируются в условиях, в которых получение изображения деления клеток затруднено, SKY позволяет отбеливать и окрашивать образец после того, как изображения деления были проверены.
SKY обеспечивает преимущество простой визуальной интерпретации при анализе результатов, но невозможно оценить структурные аномалии, такие как инверсия, делеция, вставка и дупликация в одной и той же хромосоме, потому что они показаны одним цветом. Кроме того, невозможно обнаружить ни Q-позитивный сегмент, ни сателлитную область длинного плеча Y-хромосомы вблизи центромеры.Предел разрешения обнаружения составляет приблизительно 1-2 Мб, аналогично обычным методам окраски хромосом, и незначительные структурные аномалии менее 1 полосы не могут быть обнаружены. Следовательно, чтобы проверить место хромосомного разрыва, обычно необходимо заранее использовать SKY в сочетании с G-бэндингом или хромосомным бэндингом высокого разрешения, вместо того, чтобы использовать только SKY для макроскопического наблюдения за паттернами полос.
Кроме того, невозможно обнаружить ни Q-позитивный сегмент, ни сателлитную область длинного плеча Y-хромосомы вблизи центромеры.Предел разрешения обнаружения составляет приблизительно 1-2 Мб, аналогично обычным методам окраски хромосом, и незначительные структурные аномалии менее 1 полосы не могут быть обнаружены. Следовательно, чтобы проверить место хромосомного разрыва, обычно необходимо заранее использовать SKY в сочетании с G-бэндингом или хромосомным бэндингом высокого разрешения, вместо того, чтобы использовать только SKY для макроскопического наблюдения за паттернами полос.
Кроме того, SKY дает следующие заметные преимущества.Обычно, когда хромосома неизвестного происхождения обнаруживается у ребенка, страдающего каким-либо отклонением от нормы, для окончательного диагноза данной хромосомы проводится хромосомный анализ обоих родителей. Если сбалансированная структурная аномалия обнаруживается в хромосоме любого из родителей, то это окончательно диагностируется как источник такой структурной аномалии. Обычно макроскопическая оценка будет выполняться на основе структуры полос в случае, если информированное согласие на участие в тесте кариотипа не может быть получено от родителей, и в случае транслокации de novo.В таких случаях SKY имеет то преимущество, что он способен легко уточнить хромосому неизвестного происхождения без выполнения кариотипирования родителей, а также может выявить, является ли один из родителей носителем сбалансированной структурной аномалии. Это преимущество SKY очень полезно в клинической практике генетического консультирования [9]. Обратитесь к Таблице для показаний к оценке с использованием SKY, когда структурные хромосомные аномалии действительно обнаруживаются с помощью G-бэндинга.
Обычно макроскопическая оценка будет выполняться на основе структуры полос в случае, если информированное согласие на участие в тесте кариотипа не может быть получено от родителей, и в случае транслокации de novo.В таких случаях SKY имеет то преимущество, что он способен легко уточнить хромосому неизвестного происхождения без выполнения кариотипирования родителей, а также может выявить, является ли один из родителей носителем сбалансированной структурной аномалии. Это преимущество SKY очень полезно в клинической практике генетического консультирования [9]. Обратитесь к Таблице для показаний к оценке с использованием SKY, когда структурные хромосомные аномалии действительно обнаруживаются с помощью G-бэндинга.
Таблица 2
Удобство использования при анализе отклонений, обнаруженных с помощью G-диапазона с помощью SKY
| Результат G-диапазона | Кариотип | Дополнительное примечание к SKY | Использование SKY | Дополнительная хромосома | добавить | Определяет производную хромосому дополнительной части | a |
|---|---|---|---|
| Производная хромосома | der | Идентифицирует родственные хромосомы | a |
| Вставка | ins | Идентифицирует производную хромосому вставляемого фрагмента | a |
| Сложная транслокация | Идентифицирует родственные хромосомы | a | |
| Генетическая амплификация | dimin / hsr | Идентифицирует производную хромосому области гомогенного окрашивания | |
| Дублирование? | ? Dup | Обнаруживает любые дубликаты | a |
| Реципрокная транслокация | t | Тот же уровень анализа G-бэндинга | b |
| Инверсия | inv | Трудно провести анализ, который лучше, чем G-banding | c |
| Удаление | del | Трудно провести анализ, который лучше, чем G-banding | c |
| Числовые аберрации | +/− | Трудно провести анализ лучше, чем G-banding | c |
| Неизвестная производная | мар | Идентифицирует производную хромосому в пределах чувствительности | c |
| Криптическая транслокация | Обнаруживает производную хромосому с ограничениями чувствительности | c |
Пример и обзор
В этом разделе представлены два случая, в которых можно использовать SKY, и обсуждаются преимущества и ограничения этого метода. Мы использовали 24-цветные зонды SKY [Applied Spectral Imaging (ASI), Inc., ASI, Карлсбад, Калифорния], протокол гибридизации и обнаружения skypaint ™ , SRL Inc., Токио, Япония.
Мы использовали 24-цветные зонды SKY [Applied Spectral Imaging (ASI), Inc., ASI, Карлсбад, Калифорния], протокол гибридизации и обнаружения skypaint ™ , SRL Inc., Токио, Япония.
Случай 1: Трисомия 11/22
Результаты хромосомного анализа трисомии 11/22 с использованием SKY показаны на рис. [8, 9]. SKY был проведен после того, как дополнительная маркерная хромосома была обнаружена в хромосомах группы G посредством G-бэндинга, и результаты показали трисомию хромосомы 22. Одна из дополнительных хромосом была выделена двумя цветами, и было установлено, что это производная хромосома [der (22)], вероятно, в результате реципрокной транслокации, при которой длинные плечи хромосомы 11 (q23.3) и хромосома 22 (q11.2) были точками разрыва. Кариотип этого случая описывается как + der (22) t (11:22) (q23.3; q11.2). Таким образом, в настоящее время SKY является одним из наиболее эффективных подходов для идентификации лишних хромосом неизвестного происхождения. Используя метод SKY, можно было поставить окончательный диагноз трисомии 11/22 у ребенка без проведения каких-либо хромосомных тестов на родителях, т. Е. Без изучения возможности структурных аномалий, которые были бы унаследованы от любого из них. родители.Это важно в клинической практике генетического консультирования родителей для поддержания отношений.
Е. Без изучения возможности структурных аномалий, которые были бы унаследованы от любого из них. родители.Это важно в клинической практике генетического консультирования родителей для поддержания отношений.
Хромосомный анализ трисомии 11/22 с использованием SKY
Случай 2: 13q-синдром
Результаты хромосомного анализа 13q-синдрома с использованием SKY (рис.) Указывают на структурные аномалии в хромосомах 2, 4 и 13 [12 , 21]. Для хромосом 2 и 4 легко различить реципрокную транслокацию t (2; 4) с точками разрыва на длинном плече хромосомы 2 (q24.2) и коротком плече хромосомы 4 (p14).Этот t (2; 4), однако, может включать [inv (4) (p15.1p15.32)], который представляет собой парацентрическую инверсию с точками останова на p15.1 и p15.32 в части короткого плеча хромосомы 4, которая был перемещен на хромосому 2, и это требует проверки с помощью связывания хромосом с высоким разрешением. Инверсии, происходящие в одной и той же хромосоме, не различаются по цвету, поэтому невозможно поставить окончательный диагноз с помощью SKY. Таким образом, в этом случае для дальнейшей детальной диагностики необходимо тестирование родительских хромосом с помощью связывания хромосом с высоким разрешением.
Таким образом, в этом случае для дальнейшей детальной диагностики необходимо тестирование родительских хромосом с помощью связывания хромосом с высоким разрешением.
Хромосомный анализ 13q-синдрома с использованием SKY, показывающий структурные аномалии в хромосомах 2, 4 и 13
Для хромосомы 13 можно диагностировать возникновение делеции, которая идентифицирована как синдром 13q минус, только с помощью SKY, но это не раскрывает информацию о точках останова. Путем одновременного объединения этой полученной из НЕБА информации с тестируемыми образцами полос можно диагностировать парацентрическую делецию с точками останова на q21.2 и q31.2. Кариотип Случая 2 описывается как 46, XX, der (2) t (2: 4) (q24.2; p14) inv (4) (p15.1p15.32), der (4) t (2 ; 4), del (13) (q21.2q31.2) или 46, XX, t (2; 4) (q24.2; p14), del (13) (q21.2q31.2). Как указывалось выше, сложно поставить окончательный диагноз только по результатам анализа SKY, а также необходимо соблюдать осторожность, потому что традиционный метод окрашивания G-полосы не может использоваться непосредственно в качестве самостоятельной замены. Таким образом, более надежная интерпретация и диагноз могут быть выполнены путем объединения информации из двух отдельных методов, поскольку ни один из них не может использоваться для однозначного диагноза.
Таким образом, более надежная интерпретация и диагноз могут быть выполнены путем объединения информации из двух отдельных методов, поскольку ни один из них не может использоваться для однозначного диагноза.
При выполнении тестов с использованием SKY необходимо понимать характеристики и ограничения этого анализа, а также объединять результаты теста с результатами окрашивания G-полосы или хромосомного бэндинга с высоким разрешением для комплексной кариотипической диагностики.
Заключение
С появлением SKY, новой технологии хромосомного анализа, точность тестирования повысилась, и теперь стало возможным разработать новые клинические исследования, которые ранее были невозможны с использованием традиционных методов тестирования.Области T-Band, такие как 1p, 11p15, 16p, 19p, 19q и 22q, известны как участки, которые трудно наблюдать в виде полос контрастного цвета, хотя считается, что эти области содержат много генов, согласно стандартному хромосомному анализу. . Кроме того, макроскопический анализ этой полосы человеческим глазом включает ограничение в распознавании второстепенных реципрокных транслокаций, и также возможно, что они останутся незамеченными. Идентификация с помощью окраски SKY преодолела слабость традиционного метода диагностики паттернов полос, и ожидается, что другие ранее нераспознанные специфические хромосомные транслокации, вероятно, будут обнаружены при широком использовании этого метода.
Идентификация с помощью окраски SKY преодолела слабость традиционного метода диагностики паттернов полос, и ожидается, что другие ранее нераспознанные специфические хромосомные транслокации, вероятно, будут обнаружены при широком использовании этого метода.
Кроме того, в последние годы было разработано спектральное цветовое разбиение как метод, преодолевший ограничения SKY [22], и в этом методе дифференциальное окрашивание G-полосы сочетается с технологией окрашивания SKY. Ожидается, что клиническое использование этого нового метода получит широкое распространение в области клинической генетики в будущем и внесет значительный вклад. Однако стоимость этой техники по-прежнему остается непомерно высокой. Принимая во внимание эти моменты, с точки зрения генетического консультирования, включение SKY в полосу хромосом G-диапазона или полосу хромосом с высоким разрешением по мере необходимости было бы наиболее практичным методом хромосомного тестирования.Фактически, когда структурная аномалия хромосомы неизвестного происхождения обнаруживается с помощью G-бэндинга, комбинированное использование SKY позволяет идентифицировать происхождение без выполнения кариотипирования родителей, которое могло бы определить, какой родитель является носителем сбалансированного структурная аномалия. Таким образом, в клинической практике генетического консультирования информированное согласие на исследование врожденных хромосомных аномалий можно легко получить от родителей. Кроме того, оценка результатов SKY выполняется на основе отображаемых цветов, поэтому врач может легко объяснить результаты родителям пациента.Это преимущество может потенциально снизить ненужную психологическую нагрузку на родителей, чей ребенок демонстрирует структурную аномалию в хромосоме.
Таким образом, в клинической практике генетического консультирования информированное согласие на исследование врожденных хромосомных аномалий можно легко получить от родителей. Кроме того, оценка результатов SKY выполняется на основе отображаемых цветов, поэтому врач может легко объяснить результаты родителям пациента.Это преимущество может потенциально снизить ненужную психологическую нагрузку на родителей, чей ребенок демонстрирует структурную аномалию в хромосоме.
Благодарности
Авторы хотели бы поблагодарить SRL Inc., Токио, Япония, за проведение цитогенного анализа методов SKY и FISH. Это исследование было поддержано грантом для исследователей медицинского университета Докке (№ 2010-01-6).
Открытый доступ
Эта статья распространяется на условиях Некоммерческой лицензии Creative Commons Attribution, которая разрешает любое некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора (авторов) и источника.
Список литературы
1. Харпер П.С. Открытие числа хромосом человека в Лунде, 1955–1956. Генетика человека. 2006; 119: 226–232. DOI: 10.1007 / s00439-005-0121-х. [PubMed] [CrossRef] [Google Scholar] 2. Леджен Дж, Турпин Р., Готье М. Монголизм; хромосомное заболевание (трисомия) Bulletin de l’Academie Nationale de Medecine. 1959; 143: 256–265. [PubMed] [Google Scholar] 3. Иматака Г., Мицуи М., Мицуи Н., Хирабаяси Х., Яманучи Х. и др. Синдром Дауна при остром эпиглоттите. Международная педиатрия.2005. 47: 333–335. DOI: 10.1111 / j.1442-200x.2005.02069.x. [PubMed] [CrossRef] [Google Scholar] 4. Эдвардс Дж. Х., Харден Д. Г., Кэмерон А. Х., Кросс В. М., Вольф Огайо. Новый трисомический синдром. Ланцет. 1960; 1: 787–790. DOI: 10.1016 / S0140-6736 (60) -9. [PubMed] [CrossRef] [Google Scholar] 5. Иматака Г., Нитта А., Судзумура Х., Ватанабе Х., Яманучи Х. и др. Выживаемость случаев трисомии 18 в Японии. Генетическая консультация. 2007. 18: 303–308. [PubMed] [Google Scholar] 6. Патау К.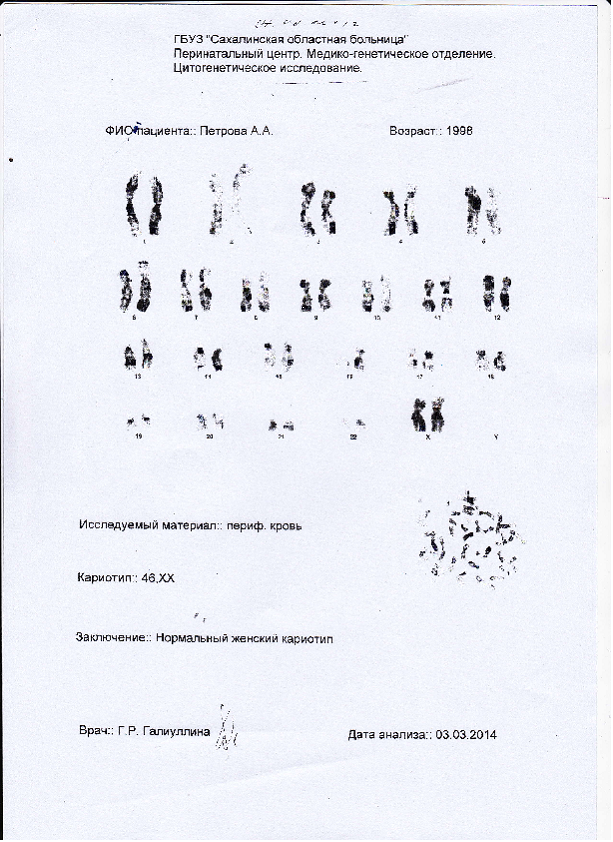 , Смит Д.В., Терман Э., Инхорн С.Л., Вагнер ХП. Множественная врожденная аномалия, вызванная дополнительной аутосомой.Ланцет. 1960; 1: 790–793. DOI: 10.1016 / S0140-6736 (60) -0. [PubMed] [CrossRef] [Google Scholar] 7. de Grouchy J, Turleau C, Leonard C. Исследование флуоресценции мозаики с трисомией C, вероятно, 8: 46, XY-47, XY,? 8+ Annales de Genetique. 1971; 14: 69–72. [PubMed] [Google Scholar] 8. Иселиус Л., Линдстен Дж., Ауриас А., Фраккаро М., Ублюдок С. и др. Транслокация 11q; 22q: совместное исследование 20 новых случаев и анализ 110 семей. Генетика человека. 1983; 64: 343–355. DOI: 10.1007 / BF00292366. [PubMed] [CrossRef] [Google Scholar] 9.Иматака Г., Такая Й., Хагисава С., Яманучи Х., Эгути М. Трисомия 11/22, диагностированная с помощью генетического консультирования с помощью спектрального кариотипирования (НЕБО). 2004. 15: 391–394. [PubMed] [Google Scholar] 10. Ford CE, Jones KW, Polani PE, De Almeida JC, Briggs JH. Аномалия половых хромосом при дисгенезии гонад (синдром Тернера).
, Смит Д.В., Терман Э., Инхорн С.Л., Вагнер ХП. Множественная врожденная аномалия, вызванная дополнительной аутосомой.Ланцет. 1960; 1: 790–793. DOI: 10.1016 / S0140-6736 (60) -0. [PubMed] [CrossRef] [Google Scholar] 7. de Grouchy J, Turleau C, Leonard C. Исследование флуоресценции мозаики с трисомией C, вероятно, 8: 46, XY-47, XY,? 8+ Annales de Genetique. 1971; 14: 69–72. [PubMed] [Google Scholar] 8. Иселиус Л., Линдстен Дж., Ауриас А., Фраккаро М., Ублюдок С. и др. Транслокация 11q; 22q: совместное исследование 20 новых случаев и анализ 110 семей. Генетика человека. 1983; 64: 343–355. DOI: 10.1007 / BF00292366. [PubMed] [CrossRef] [Google Scholar] 9.Иматака Г., Такая Й., Хагисава С., Яманучи Х., Эгути М. Трисомия 11/22, диагностированная с помощью генетического консультирования с помощью спектрального кариотипирования (НЕБО). 2004. 15: 391–394. [PubMed] [Google Scholar] 10. Ford CE, Jones KW, Polani PE, De Almeida JC, Briggs JH. Аномалия половых хромосом при дисгенезии гонад (синдром Тернера). Ланцет. 1959; 1: 711–713. DOI: 10.1016 / S0140-6736 (59) 91893-8. [PubMed] [CrossRef] [Google Scholar] 11. Таннер Дж. М., Прадер А., Хабич Х, Фергюсон-Смит Массачусетс. Гены Y-хромосомы, влияющие на скорость созревания у человека: исследования возраста скелета у детей с синдромами Клайнфельтера (XXY) и Тернера (XO).Ланцет. 1959; 2: 141–144. DOI: 10.1016 / S0140-6736 (59)
Ланцет. 1959; 1: 711–713. DOI: 10.1016 / S0140-6736 (59) 91893-8. [PubMed] [CrossRef] [Google Scholar] 11. Таннер Дж. М., Прадер А., Хабич Х, Фергюсон-Смит Массачусетс. Гены Y-хромосомы, влияющие на скорость созревания у человека: исследования возраста скелета у детей с синдромами Клайнфельтера (XXY) и Тернера (XO).Ланцет. 1959; 2: 141–144. DOI: 10.1016 / S0140-6736 (59) Журнал Национального института рака. 1960; 25: 85–109. [PubMed] [Google Scholar] 15. Watson JD. Проект генома человека: прошлое, настоящее и будущее. Наука. 1990; 248: 44–49. DOI: 10.1126 / science.2181665. [PubMed] [CrossRef] [Google Scholar] 16. Caspersson T, Castleman KR, Lomakka G, Modest EJ, Moller A, et al. Автоматическое кариотипирование хромосом человека, окрашенных хинакрином ипритом.Экспериментальные исследования клеток. 1971; 67: 233–235. DOI: 10.1016 / 0014-4827 (71)-8. [PubMed] [CrossRef] [Google Scholar] 17. Юнис JJ, Чендлер ME. Хромосомный анализ высокого разрешения в клинической медицине. Прогресс в клинической патологии. 1978; 7: 267–288. [PubMed] [Google Scholar] 18. Траск Б.Дж. Флуоресцентная гибридизация in situ: приложения в цитогенетике и картировании генов. Тенденции в генетике. 1991; 7: 149–154. [PubMed] [Google Scholar] 19. Каллиониеми А., Каллиониеми О.П., Судар Д., Рутовиц Д., Грей Дж. В. и др.Сравнительная геномная гибридизация для молекулярно-цитогенетического анализа солидных опухолей.
Журнал Национального института рака. 1960; 25: 85–109. [PubMed] [Google Scholar] 15. Watson JD. Проект генома человека: прошлое, настоящее и будущее. Наука. 1990; 248: 44–49. DOI: 10.1126 / science.2181665. [PubMed] [CrossRef] [Google Scholar] 16. Caspersson T, Castleman KR, Lomakka G, Modest EJ, Moller A, et al. Автоматическое кариотипирование хромосом человека, окрашенных хинакрином ипритом.Экспериментальные исследования клеток. 1971; 67: 233–235. DOI: 10.1016 / 0014-4827 (71)-8. [PubMed] [CrossRef] [Google Scholar] 17. Юнис JJ, Чендлер ME. Хромосомный анализ высокого разрешения в клинической медицине. Прогресс в клинической патологии. 1978; 7: 267–288. [PubMed] [Google Scholar] 18. Траск Б.Дж. Флуоресцентная гибридизация in situ: приложения в цитогенетике и картировании генов. Тенденции в генетике. 1991; 7: 149–154. [PubMed] [Google Scholar] 19. Каллиониеми А., Каллиониеми О.П., Судар Д., Рутовиц Д., Грей Дж. В. и др.Сравнительная геномная гибридизация для молекулярно-цитогенетического анализа солидных опухолей. Наука. 1992; 258: 818–821. DOI: 10.1126 / science.1359641. [PubMed] [CrossRef] [Google Scholar] 20. Шрок Э., дю Мануар С., Велдман Т., Шоелл Б., Винберг Дж. И др. Многоцветное спектральное кариотипирование хромосом человека. Наука. 1996; 273: 494–497. DOI: 10.1126 / science.273.5274.494. [PubMed] [CrossRef] [Google Scholar] 21. Allderdice PW, Davis JG, Miller OJ, Klinger HP, Warburton D и др. Синдром делеции 13q.Американский журнал генетики человека. 1969; 21: 499–512. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Какадзу Н., Ашихара Э, Хада С., Уэда Т., Сасаки Х. и др. Развитие спектральной окраски в цитогенетическом анализе. Ланцет. 2001; 357: 529–530. DOI: 10.1016 / S0140-6736 (00) 04051-4. [PubMed] [CrossRef] [Google Scholar]
Наука. 1992; 258: 818–821. DOI: 10.1126 / science.1359641. [PubMed] [CrossRef] [Google Scholar] 20. Шрок Э., дю Мануар С., Велдман Т., Шоелл Б., Винберг Дж. И др. Многоцветное спектральное кариотипирование хромосом человека. Наука. 1996; 273: 494–497. DOI: 10.1126 / science.273.5274.494. [PubMed] [CrossRef] [Google Scholar] 21. Allderdice PW, Davis JG, Miller OJ, Klinger HP, Warburton D и др. Синдром делеции 13q.Американский журнал генетики человека. 1969; 21: 499–512. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Какадзу Н., Ашихара Э, Хада С., Уэда Т., Сасаки Х. и др. Развитие спектральной окраски в цитогенетическом анализе. Ланцет. 2001; 357: 529–530. DOI: 10.1016 / S0140-6736 (00) 04051-4. [PubMed] [CrossRef] [Google Scholar]Гетерогенность кариотипа и неклассифицированные хромосомные аномалии — FullText — Cytogenetic and Genome Research 2013, Vol. 139, № 3
Аннотация
В отход от традиционного геноцентрического мышления в отношении цитогенетики и цитогеномики недавно представленная теория генома требует переориентации нашего внимания на кариотипический анализ болезненных состояний. Было продемонстрировано, что гетерогенность кариотипа напрямую участвует в процессе эволюции соматических клеток, который лежит в основе многих общих и сложных заболеваний, таких как рак. Чтобы правильно использовать гетерогенность кариотипа и применять ее для мониторинга нестабильности системы, нам необходимо включить в наш анализ многие, казалось бы, незначительные неспецифические хромосомные аберрации. Традиционно цитогенетический анализ был сосредоточен на выявлении повторяющихся типов аномалий, особенно тех, которые были связаны с конкретными заболеваниями.С этой точки зрения, опираясь на новую структуру 4D-геномики, мы кратко рассмотрим важность изучения гетерогенности кариотипа. Мы также перечислили ряд упускаемых из виду хромосомных аберраций, включая дефектные митотические фигуры, фрагментацию хромосом, а также хаос генома. Наконец, мы призываем к систематическому открытию / характеристике и классификации аномалий кариотипа при заболеваниях человека, поскольку гетерогенность кариотипа является общим фактором, который имеет важное значение для эволюции соматических клеток.
Было продемонстрировано, что гетерогенность кариотипа напрямую участвует в процессе эволюции соматических клеток, который лежит в основе многих общих и сложных заболеваний, таких как рак. Чтобы правильно использовать гетерогенность кариотипа и применять ее для мониторинга нестабильности системы, нам необходимо включить в наш анализ многие, казалось бы, незначительные неспецифические хромосомные аберрации. Традиционно цитогенетический анализ был сосредоточен на выявлении повторяющихся типов аномалий, особенно тех, которые были связаны с конкретными заболеваниями.С этой точки зрения, опираясь на новую структуру 4D-геномики, мы кратко рассмотрим важность изучения гетерогенности кариотипа. Мы также перечислили ряд упускаемых из виду хромосомных аберраций, включая дефектные митотические фигуры, фрагментацию хромосом, а также хаос генома. Наконец, мы призываем к систематическому открытию / характеристике и классификации аномалий кариотипа при заболеваниях человека, поскольку гетерогенность кариотипа является общим фактором, который имеет важное значение для эволюции соматических клеток.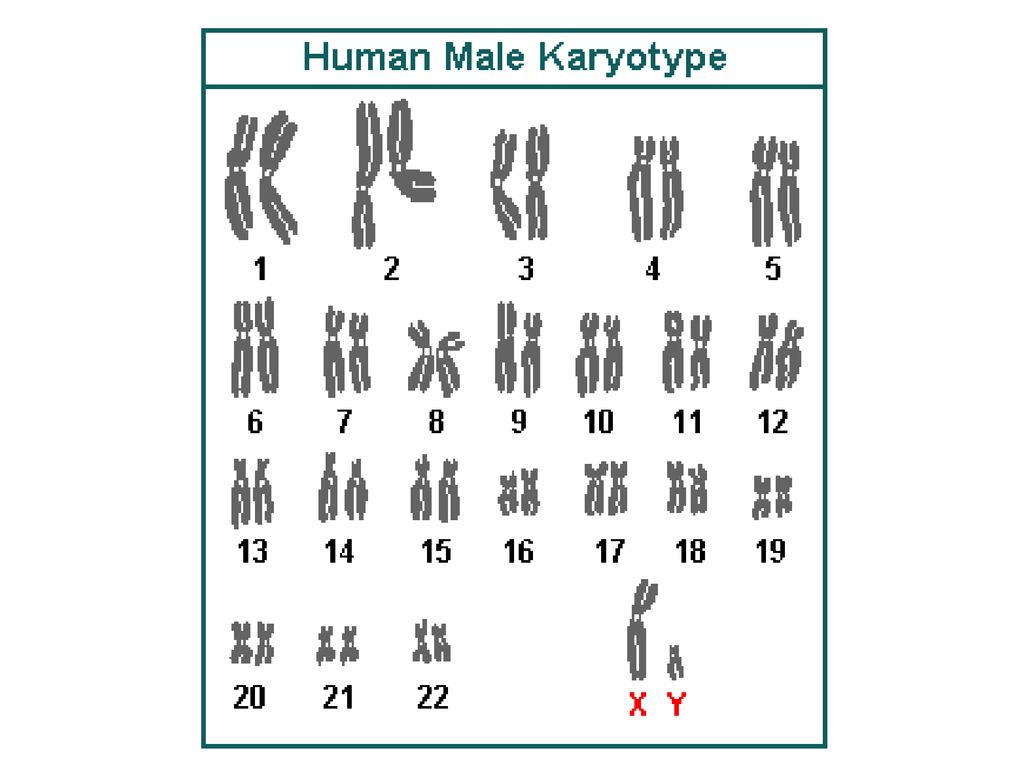
© 2013 S. Karger AG, Базель
В рамках различных крупномасштабных проектов был получен большой объем геномных данных, включая секвенирование ДНК, вариацию числа копий и массивные хромосомные изменения в геноме [Feuk et al., 2006; Heng et al., 2011b; Подлаха и др., 2012]. Эти данные подняли вопрос о том, скоро ли традиционный анализ кариотипа будет заменен молекулярными методологиями. Как ни парадоксально, этот поток информации привел к большой путанице [Hayden, 2010].Во-первых, эти исследования (особенно те, которые сосредоточены на патологических процессах) предоставили большое количество разнородных данных с несколькими четкими схемами, что ставит под сомнение клиническую применимость таких исследований. Сотни разнообразных мутаций существуют у каждого нормального, здорового человека, как показал проект личного генома [Консорциум проекта 1000 геномов, 2010]. Во-вторых, было сложно интегрировать различные типы информации, и еще сложнее было решить, какая информация более ценна в случае конфликта данных. Несмотря на предвзятость в пользу молекулярных методологий с более высоким разрешением, кариотипический анализ получает все большую поддержку, поскольку изменения кариотипа отражают изменения на уровне генома, и все больше аномалий кариотипа в значительной степени связаны с заболеваниями [Ye et al., 2007; Хэн, 2010; Heng et al., 2011a, b].
Несмотря на предвзятость в пользу молекулярных методологий с более высоким разрешением, кариотипический анализ получает все большую поддержку, поскольку изменения кариотипа отражают изменения на уровне генома, и все больше аномалий кариотипа в значительной степени связаны с заболеваниями [Ye et al., 2007; Хэн, 2010; Heng et al., 2011a, b].
Кариотипические анализы обладают рядом преимуществ по сравнению с молекулярными анализами, включая тот факт, что они предоставляют информацию как об отдельных клетках, так и о всей популяции. Это важно, потому что кариотип, а не другие подуровни генетической организации, определяет систему генома [Heng, 2009; Heng et al., 2011b]. Кариотипический анализ дает информацию о структурных изменениях, которые часто не удается получить молекулярными методами. Кроме того, большинство молекулярных методов основаны на среднем уровне клеточной популяции и не учитывают неклональные хромосомные аберрации (NCCA). Наконец, кариотипические анализы более рентабельны, чем большинство молекулярных анализов, когда анализы должны выполняться на большом количестве клеток из гетерогенной популяции.
Одним из новых достижений в анализе кариотипа было введение использования NCCA для изучения нестабильности генома и связанных с ним болезненных состояний, включая рак [Heng et al., 2004, 2006а-с; Ye et al., 2007]. Традиционно NCCA считались незначительным генетическим «шумом» в пользу клональных хромосомных аберраций (CCA) [Mitelman, 2000; Heng et al., 2006a, c]. Если рассматривать геном как систему, важность этих, казалось бы, случайных изменений генома становится очевидной, поскольку каждое изменение приводит к созданию новой клеточной системы, обеспечивающей изменчивость популяции. Таким образом, измерение стохастических изменений генома можно использовать в качестве индекса для изучения нестабильности системы и, в частности, нестабильности генома [Heng et al., 2006а, в; Ye et al., 2007].
Возможные связи между NCCA и многими заболеваниями человека значительны [Heng, 2010], и они предлагают новый подход к изучению эволюции соматических клеток. Основываясь на этом, мы разработали концепцию 4D-геномики, которая фокусируется на трехмерных особенностях контекста генома (гены плюс геномная топология) и объединяет это в рамках эволюционной временной шкалы [Heng, 2013a].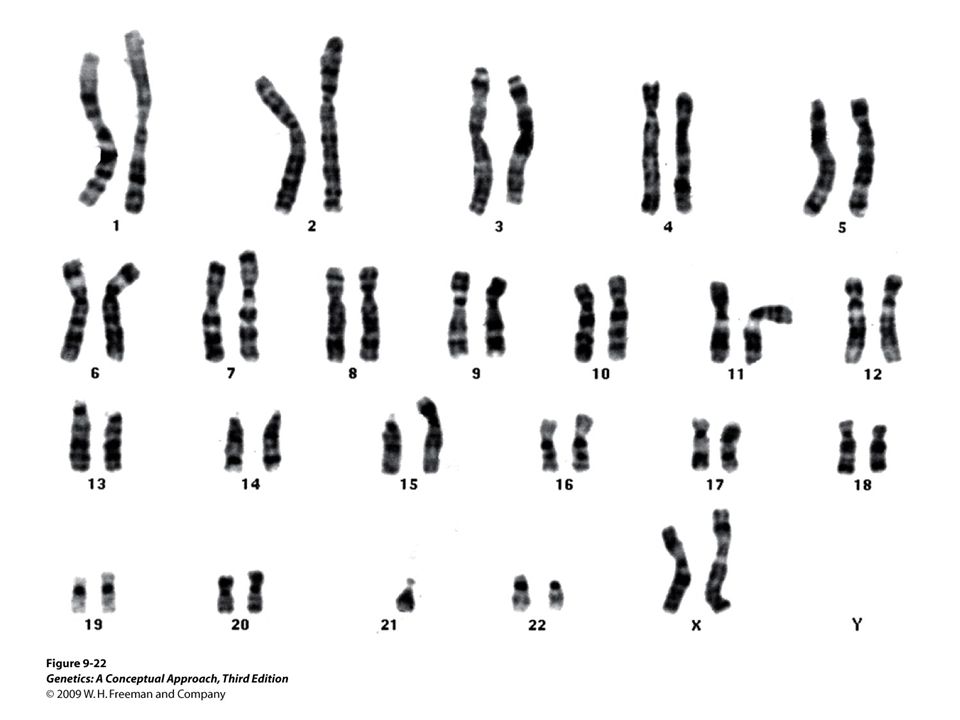 Значительные изменения кариотипа не только влияют на экспрессию сотен, если не тысяч генов, но также меняют общую структуру сети.Следовательно, изменение кариотипа создает новую систему [Heng et al., 2011a, b]. Чтобы облегчить включение основанных на кариотипе эволюционных принципов в текущую биологическую структуру, мы предложили подход 4D-геномики. Подход 4D-геномики помещает одномерные гены в реальность 4D-генома, объясняя важность вариации кариотипа в ряде заболеваний. Таким образом, логично переориентировать анализ кариотипа в исследованиях болезней, используя новую структуру отслеживания стохастических изменений генома в геноме и внутри клеточной популяции.
Значительные изменения кариотипа не только влияют на экспрессию сотен, если не тысяч генов, но также меняют общую структуру сети.Следовательно, изменение кариотипа создает новую систему [Heng et al., 2011a, b]. Чтобы облегчить включение основанных на кариотипе эволюционных принципов в текущую биологическую структуру, мы предложили подход 4D-геномики. Подход 4D-геномики помещает одномерные гены в реальность 4D-генома, объясняя важность вариации кариотипа в ряде заболеваний. Таким образом, логично переориентировать анализ кариотипа в исследованиях болезней, используя новую структуру отслеживания стохастических изменений генома в геноме и внутри клеточной популяции.
Чтобы признать важность и дальнейшее изучение NCCA, мы сначала кратко опишем концепцию 4D-геномики, важность стохастических изменений генома, а затем представим ряд неклассифицированных аномалий кариотипа, большинство из которых ранее игнорировалось. Наконец, мы описываем применение концепции 4D-геномики, призывая к систематическому анализу гетерогенности кариотипа болезней человека в поисках недостающей генетической связи.
Абсолютное значение кариотипов в эволюции естественных и соматических клеток — перспектива 4D-геномики
Генетика традиционно фокусировалась на гене, а анализ кариотипа служил мощным инструментом в попытке идентифицировать гены, ответственные за заболевание.Поскольку возможность прямого секвенирования и / или обнаружения вариации числа копий становится осуществимой и доступной, существует мнение, что анализ кариотипа будет устаревшим, поскольку он имеет более низкое разрешение, чем анализ на основе генов, не является « достаточно молекулярным » и более значительным. кропотливый.
Напротив, недавно созданная теория генома подчеркивает важность анализа кариотипа вместо профилирования генов, заявляя, что гены не служат в качестве независимых информационных единиц, поскольку истинная функция отдельных генов определяется данным геномом (таким образом, тот же ген могут иметь разные функции в разных контекстах генома) [Ye et al., 2007; Heng, 2009]. Неожиданно было обнаружено, что наследование системы достигается на уровне генома (гены, взаимодействующие в рамках геномной топологии) под влиянием конкретных кариотипов. Наследование частей (определяемое генами) имеет мало общего с наследованием всей системы (определяется кариотипом и поддерживается полом) [Heng, 2007b; Горелик и Хенг, 2011; Heng et al., 2011b; Хорн и др., 2013]. Такая важная концепция была недавно установлена как в эволюции соматических клеток, так и в эволюции организма.
Наследование частей (определяемое генами) имеет мало общего с наследованием всей системы (определяется кариотипом и поддерживается полом) [Heng, 2007b; Горелик и Хенг, 2011; Heng et al., 2011b; Хорн и др., 2013]. Такая важная концепция была недавно установлена как в эволюции соматических клеток, так и в эволюции организма.
Концепция клональной эволюции доминировала в исследованиях рака после основополагающей статьи Питера Новелла [Nowell, 1976]. На исследования рака повлияла успешная характеристика ХМЛ, когда гибридный ген BCR-ABL на филадельфийской хромосоме является поразительно клональным событием. С тех пор эта схема была применена к другим видам рака, и пошаговое прогрессирование рака было общепринятым [Vogelstein and Kinzler, 1993; Sjoblom et al., 2006]. Считается, что накопление мутаций в генах рака является движущей силой эволюции в этом процессе.Однако, наблюдая за эволюцией рака в действии в модели спонтанной клеточной иммортализации, мы неожиданно обнаружили, что эволюция рака происходит в 2 фазы [Heng et al. , 2006c]. Первая фаза — прерывистая, прерывистая фаза (неклональная фаза), когда происходят массивные изменения кариотипа, которые устраняются стохастически. Вторая фаза — это ступенчатая, постепенная фаза (клональная фаза), когда большинство клеток имеют сходные кариотипы, которые эволюционируют отслеживаемым образом. Дальнейший синтез связывает прерывистую фазу и ступенчатую фазу с макро- и микроэволюцией соответственно [Heng et al., 2006а-в, 2011а, б]. Важное сообщение здесь заключается в следующем: эволюция рака обусловлена процессом замены системы (замены кариотипа), и изменения генома, ведущие к гетерогенности популяции, более важны, чем генные мутации, которые доминируют на ступенчатой фазе эволюции соматических клеток [Ye et al., 2009 ]. В соответствии с этой концепцией повышенные уровни NCCA (включая структурные NCCA и числовые NCCA, такие как анеуплоидия) были связаны с онкогенностью и лекарственной устойчивостью in vitro [Heng, 2007c], а также в клинических исследованиях [Chandrakasan et al.
, 2006c]. Первая фаза — прерывистая, прерывистая фаза (неклональная фаза), когда происходят массивные изменения кариотипа, которые устраняются стохастически. Вторая фаза — это ступенчатая, постепенная фаза (клональная фаза), когда большинство клеток имеют сходные кариотипы, которые эволюционируют отслеживаемым образом. Дальнейший синтез связывает прерывистую фазу и ступенчатую фазу с макро- и микроэволюцией соответственно [Heng et al., 2006а-в, 2011а, б]. Важное сообщение здесь заключается в следующем: эволюция рака обусловлена процессом замены системы (замены кариотипа), и изменения генома, ведущие к гетерогенности популяции, более важны, чем генные мутации, которые доминируют на ступенчатой фазе эволюции соматических клеток [Ye et al., 2009 ]. В соответствии с этой концепцией повышенные уровни NCCA (включая структурные NCCA и числовые NCCA, такие как анеуплоидия) были связаны с онкогенностью и лекарственной устойчивостью in vitro [Heng, 2007c], а также в клинических исследованиях [Chandrakasan et al. , 2011].
, 2011].
Интересно, что кариотип является краеугольным камнем не только соматической эволюции, но и эволюции организма. В эволюции организма геном служит основным препятствием для поддержания системы. У видов, размножающихся половым путем, функция пола заключается в поддержании идентичности вида путем фильтрации всех значительно измененных геномов, обеспечивая точную передачу генома, поскольку только нормальные хромосомы могут быть правильно спарены во время мейоза, а также полностью подвергаться половому размножению. процесс [Heng, 2007b; Ye et al., 2007]. Осознание основной функции пола коренным образом изменило многовековую точку зрения на мейоз как основной механизм увеличения генетического разнообразия [Wilkins and Holliday, 2009]. Вероятно, что генетическая комбинация смешивания генов служит только второстепенной функцией. Таким образом, геном служит ключевым эволюционным препятствием как для эволюции соматических клеток, так и для эволюции организма [Heng, 2009; Горелик, Хенг, 2011]. В процессе эволюции соматических клеток, когда ограничения генома нарушаются, развитие болезни ускоряется [Heng, 2010; Heng et al., 2010, 2011а, б]. В эволюции организма ограничение генома поддерживает вид независимо от динамики генов. Когда формируется и передается новый геном, образуется новый вид [Heng, 2013a].
В процессе эволюции соматических клеток, когда ограничения генома нарушаются, развитие болезни ускоряется [Heng, 2010; Heng et al., 2010, 2011а, б]. В эволюции организма ограничение генома поддерживает вид независимо от динамики генов. Когда формируется и передается новый геном, образуется новый вид [Heng, 2013a].
Основываясь на вышеупомянутом синтезе, мы предлагаем новую основанную на геноме структуру геномики, называемую 4D-геномикой [Heng, 2013a]. 4D-геномика сочетает сложность 3D-генома со временем и служит биологической основой для передачи генетической информации и обеспечивает платформу для эволюции, включая эволюцию соматических клеток, которая движет прогрессированием заболевания [Heng, 2009, 2013a].Очевидно, что для понимания сложности генома необходимо категоризировать гетерогенность кариотипа, а не уделять пристальное внимание изменению на уровне генов. Несмотря на десятилетние исследования, посвященные описанию различных типов аномалий кариотипа, большинство усилий было сосредоточено на конкретных хромосомных аберрациях. Несмотря на то, что в клинических образцах обнаруживается большое количество неспецифических хромосомных изменений, большинство из них не зарегистрировано и игнорируется. Здесь мы называем эти структуры неклассифицированными хромосомными аберрациями.Они чрезвычайно важны, так как все они считаются NCCA, что можно использовать как показатель гетерогенности кариотипа. О применении 4D-геномики мы поговорим позже.
Несмотря на то, что в клинических образцах обнаруживается большое количество неспецифических хромосомных изменений, большинство из них не зарегистрировано и игнорируется. Здесь мы называем эти структуры неклассифицированными хромосомными аберрациями.Они чрезвычайно важны, так как все они считаются NCCA, что можно использовать как показатель гетерогенности кариотипа. О применении 4D-геномики мы поговорим позже.
Игнорируемые и неклассифицированные хромосомные аберрации
Выявление, характеристика различных хромосомных аномалий и их связь с заболеваниями были центральным направлением медицинской цитогенетики. Идентификация трисомии 21 и разработка различных методологий разбивки хромосом привели к распознаванию ряда хромосомных аберраций, связанных с заболеванием.С тех пор они служат важным инструментом для клинической диагностики. Исследователи часто отказываются от старых технологий в пользу новых, особенно молекулярных методов с высоким разрешением. Мы хотели бы отметить, что важным ключом к правильному дизайну исследования является определение правильного или наиболее влиятельного уровня исследования, а не всегда стремление к молекулярному уровню [Ye et al. , 2007; Хенг, 2013а, б]. В самом деле, даже на микроскопическом уровне все еще существует множество типов хромосомных аберраций, которые в значительной степени игнорируются из-за концептуальных ограничений, а не из-за самих методологий.Ниже приведены некоторые примеры.
, 2007; Хенг, 2013а, б]. В самом деле, даже на микроскопическом уровне все еще существует множество типов хромосомных аберраций, которые в значительной степени игнорируются из-за концептуальных ограничений, а не из-за самих методологий.Ниже приведены некоторые примеры.
Свободный хроматин
На предметных стеклах обычных цитогенетических препаратов (гипотоническая обработка, фиксация и сушка на воздухе) среди митотических фигур и интерфазных ядер видны веретеновидные или веревочные структуры (рис. 1). Первоначально считалось, что это артефакты, не связанные с загрязнением хроматином или препарированием предметных стекол. Мы продемонстрировали, что эти структуры представляют собой хроматин, высвобождаемый из интерфазных ядер, поскольку они содержат такое же количество ДНК, что и ядра, но у них отсутствуют ядерные оболочки [Heng and Chen, 1987].
Рис. 1
Примеры свободного хроматина. A Пример типичной морфологии свободного хроматина (формы веретена и веревки) и 3 интерфазных ядер, обнаруженных из стандартных препаратов хромосом без какой-либо обработки (изображение обратного окрашивания DAPI). B-I Сигнал FISH и морфологическое сравнение между интерфазными ядрами и различным свободным хроматином, генерируемым по протоколам, высвобождающим свободный хроматин [Heng et al., 1992]. Интерфазные ядра ( B , C ) и свободный хроматин ( D-I ) получали из линии гибридных клеток человека и хомяка 4AF / 106 / KO15, которая содержит измененную хромосому 7 человека. B , D , F , H Результаты обнаружения FISH. Желтые сигналы представляют хромосому человека (используемый зонд FISH — это общая ДНК человека). C , E , G , I Соответствующее окрашивание DAPI. От D до H наблюдается повышенная степень растяжения.
B-I Сигнал FISH и морфологическое сравнение между интерфазными ядрами и различным свободным хроматином, генерируемым по протоколам, высвобождающим свободный хроматин [Heng et al., 1992]. Интерфазные ядра ( B , C ) и свободный хроматин ( D-I ) получали из линии гибридных клеток человека и хомяка 4AF / 106 / KO15, которая содержит измененную хромосому 7 человека. B , D , F , H Результаты обнаружения FISH. Желтые сигналы представляют хромосому человека (используемый зонд FISH — это общая ДНК человека). C , E , G , I Соответствующее окрашивание DAPI. От D до H наблюдается повышенная степень растяжения.
Несмотря на то, что эти структуры использовались для разработки волоконного FISH высокого разрешения [Heng et al., 1992; Heng and Shi, 1997], которая внесла важный вклад в физическое картирование и использовалась в рамках проекта «Геном человека», их биологическое значение неясно даже сегодня из-за отсутствия дополнительных исследований. Эти структуры могут быть связаны с гипотоническими условиями и стадиями клеточного цикла, но в стандартных условиях подготовки слайдов обнаружение более высоких частот этих структур может быть связано с различными клеточными линиями, конкретными химическими реагентами и индивидуальными различиями. Например, некоторые клеточные линии имеют более высокие частоты свободного хроматина, и существует четкая доза-реакция между свободным хроматином и многими химиотерапевтическими средствами. Возможно, эти частоты связаны с нестабильностью ядерной оболочки и общей нестабильностью генома.Также было высказано предположение, что свободный хроматин можно использовать для мониторинга токсичности [Heng et al., 1988a, b; Хэн и Чжао, 1989; Хэн и Ши, 1997].
Эти структуры могут быть связаны с гипотоническими условиями и стадиями клеточного цикла, но в стандартных условиях подготовки слайдов обнаружение более высоких частот этих структур может быть связано с различными клеточными линиями, конкретными химическими реагентами и индивидуальными различиями. Например, некоторые клеточные линии имеют более высокие частоты свободного хроматина, и существует четкая доза-реакция между свободным хроматином и многими химиотерапевтическими средствами. Возможно, эти частоты связаны с нестабильностью ядерной оболочки и общей нестабильностью генома.Также было высказано предположение, что свободный хроматин можно использовать для мониторинга токсичности [Heng et al., 1988a, b; Хэн и Чжао, 1989; Хэн и Ши, 1997].
Дефектные митотические фигуры
Во время разработки методов группирования с высоким разрешением для хромосом лягушки [Heng et al., 1987] один из нас (H.H.Q.H.) обнаружил структуры, названные дефектными митотическими фигурами или DMF (рис.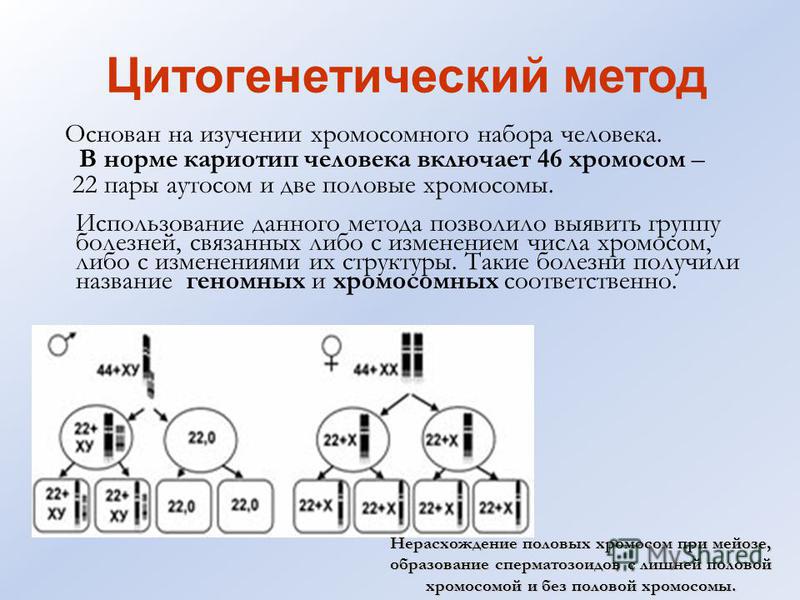 2). Первоначально ДМФ были описаны как «митотические фигуры с неполной упаковкой» [Heng and Chen, 1985; Heng et al., 1988b].Эта номенклатура была предложена на основе сосуществования конденсированных хромосом и недостаточно конденсированных волокон хроматина в пределах одной митотической фигуры.
2). Первоначально ДМФ были описаны как «митотические фигуры с неполной упаковкой» [Heng and Chen, 1985; Heng et al., 1988b].Эта номенклатура была предложена на основе сосуществования конденсированных хромосом и недостаточно конденсированных волокон хроматина в пределах одной митотической фигуры.
Рис. 2
Примеры различных типов DMF. A-E Типичные DMF, обнаруженные в обработанных культурах крови человека ( A-D ) и лягушки ( E ), соответственно. A , C SKY изображений. B , D Соответствующие обратные изображения DAPI. Стрелками показаны участки неконденсированного хроматина. E DAPI-изображение DMF лягушки, на котором четко показаны как конденсированные хромосомы, так и неконденсированные волокна хроматина. В этих DMF конденсированные митотические хромосомы распределены на одном конце, который является основной формой DMF. F DMF с нетипичным типом распределения, но очевидна дифференциальная конденсация между разными хромосомами./female_karyotype-58efe4b75f9b582c4d5dd803.jpg) Одна нормальная конденсированная хромосома указана стрелкой. G Новый тип DMF с диффузными хромосомами, обнаруженный у пациента с синдромом хронической усталости.Как показано стрелками, некоторые хромосомы кажутся деконденсированными. Для всех типов DMF общей ключевой особенностью является дифференциальная конденсация между хромосомами.
Одна нормальная конденсированная хромосома указана стрелкой. G Новый тип DMF с диффузными хромосомами, обнаруженный у пациента с синдромом хронической усталости.Как показано стрелками, некоторые хромосомы кажутся деконденсированными. Для всех типов DMF общей ключевой особенностью является дифференциальная конденсация между хромосомами.
DMF представляют собой идеальный инструмент для иллюстрации и определения модели хромосомной упаковки высокого порядка из-за переходных структур, которые соединяют конденсированные области хромосом и недостаточно конденсированные области. К сожалению, после нашего первоначального отчета почти 30 лет назад интерес к этим структурам был ограничен.Нежелательным аспектом DMF является то, что их существование затрудняет согласование общепринятой идеи о том, что существует каркас внутри метафазных хромосом, и было очень трудно представить, как формируются DMF, если в хромосомах есть каркас [Laemmli, pers. общ.]. Еще одна проблема заключалась в наведении DMF на высоких частотах. Индуцированные частоты часто бывают низкими, а отдельные образцы могут сильно различаться. Трудно точно определить механизм образования ДМФ; однако мы продемонстрировали, что прямой молекулярный механизм DMFs представляет собой комбинацию дефекта конденсации и дефекта контрольной точки G2-M.Интересно, что ДМФ обычно обнаруживаются в различных линиях раковых клеток и образцах пациентов, что позволяет предположить, что процесс хромосомной конденсации является важным фактором рака [unpubl. данные].
Индуцированные частоты часто бывают низкими, а отдельные образцы могут сильно различаться. Трудно точно определить механизм образования ДМФ; однако мы продемонстрировали, что прямой молекулярный механизм DMFs представляет собой комбинацию дефекта конденсации и дефекта контрольной точки G2-M.Интересно, что ДМФ обычно обнаруживаются в различных линиях раковых клеток и образцах пациентов, что позволяет предположить, что процесс хромосомной конденсации является важным фактором рака [unpubl. данные].
Следует отметить, что проблема дефектов конденсации решалась еще несколькими группами. Было обнаружено, что обработка клеток 5-Aza-dC может вызывать недостаточную конденсацию гетерохроматина. Пример индуцированной недостаточной конденсации гетерохроматина в гигантских Х-хромосомах Microtus agrestis очень поразителен [Haaf and Schmid, 1989].О феномене, сходном с DMFs, также сообщалось под заголовком задержки репликации и задержки конденсации [Smith et al., 2001]. DMFs может генерироваться многими факторами, но ошибка репликации не является основной причиной образования DMFs [Heng, 2013a]. Появление DMF поднимает интересный вопрос; существует ли порядок конденсации хромосом? Используя определенные линии раковых клеток, кажется, что некоторые хромосомы имеют более высокую, чем ожидалось, частоту DMF, что указывает на то, что эти хромосомы могут конденсироваться позже, чем другие.Например, в клеточной линии рака простаты одна копия хромосомы 1 часто находится среди нескольких неконденсированных хромосом (которые конденсируются одними из последних). Это наблюдение также было подтверждено FISH-окрашиванием с использованием зонда, специфичного для хромосомы 1. Интересно, что недавно мы обнаружили высокий уровень ДМФ и других связанных аномалий у пациентов с синдромом хронической усталости и иммунной дисфункции.
Появление DMF поднимает интересный вопрос; существует ли порядок конденсации хромосом? Используя определенные линии раковых клеток, кажется, что некоторые хромосомы имеют более высокую, чем ожидалось, частоту DMF, что указывает на то, что эти хромосомы могут конденсироваться позже, чем другие.Например, в клеточной линии рака простаты одна копия хромосомы 1 часто находится среди нескольких неконденсированных хромосом (которые конденсируются одними из последних). Это наблюдение также было подтверждено FISH-окрашиванием с использованием зонда, специфичного для хромосомы 1. Интересно, что недавно мы обнаружили высокий уровень ДМФ и других связанных аномалий у пациентов с синдромом хронической усталости и иммунной дисфункции.
Липкие хромосомы
Липкие хромосомы можно наблюдать после обработок, которые мешают репликации ДНК, хромосомной конденсации и метилированию.Известно, что липкие хромосомы могут наблюдаться с высокой частотой после лечения лекарствами, такими как бромистый этидий (EB). Некоторые образцы рака, которые демонстрируют высокие частоты DMF, также имеют повышенную частоту липких хромосом, возможно, из-за аномальной репликации и конденсации (рис. 3). Кажется, существует корреляция между липкими хромосомами и трудностями в приготовлении подходящих распределений митотических фигур. В некоторых случаях «нечеткие» хромосомы тесно связаны друг с другом, прилипая друг к другу, что не вызвано неправильной подготовкой слайда, а, вероятно, связано со статусом конденсации.Было высказано предположение, что изменение метилирования ДНК может предотвращать синхронизацию уплотнения хроматина, ведущую к неправильной конденсации [Flagiello et al., 2002]. Очевидно, что когда в анализе появляются высокие частоты липких хромосом, необходимо дополнительное внимание, например, проверка статуса метилирования и конденсации, а не игнорирование их как артефактов подготовки слайдов. Интересно, что извлечение одного ядрышка или хромосомы из интерфазных или митотических клеток с помощью микрохирургической техники в изотонических условиях приводит к последовательному удалению оставшихся ядрышек и хромосом, которые связаны между собой непрерывной эластичной нитью [Maniotis et al.
Некоторые образцы рака, которые демонстрируют высокие частоты DMF, также имеют повышенную частоту липких хромосом, возможно, из-за аномальной репликации и конденсации (рис. 3). Кажется, существует корреляция между липкими хромосомами и трудностями в приготовлении подходящих распределений митотических фигур. В некоторых случаях «нечеткие» хромосомы тесно связаны друг с другом, прилипая друг к другу, что не вызвано неправильной подготовкой слайда, а, вероятно, связано со статусом конденсации.Было высказано предположение, что изменение метилирования ДНК может предотвращать синхронизацию уплотнения хроматина, ведущую к неправильной конденсации [Flagiello et al., 2002]. Очевидно, что когда в анализе появляются высокие частоты липких хромосом, необходимо дополнительное внимание, например, проверка статуса метилирования и конденсации, а не игнорирование их как артефактов подготовки слайдов. Интересно, что извлечение одного ядрышка или хромосомы из интерфазных или митотических клеток с помощью микрохирургической техники в изотонических условиях приводит к последовательному удалению оставшихся ядрышек и хромосом, которые связаны между собой непрерывной эластичной нитью [Maniotis et al.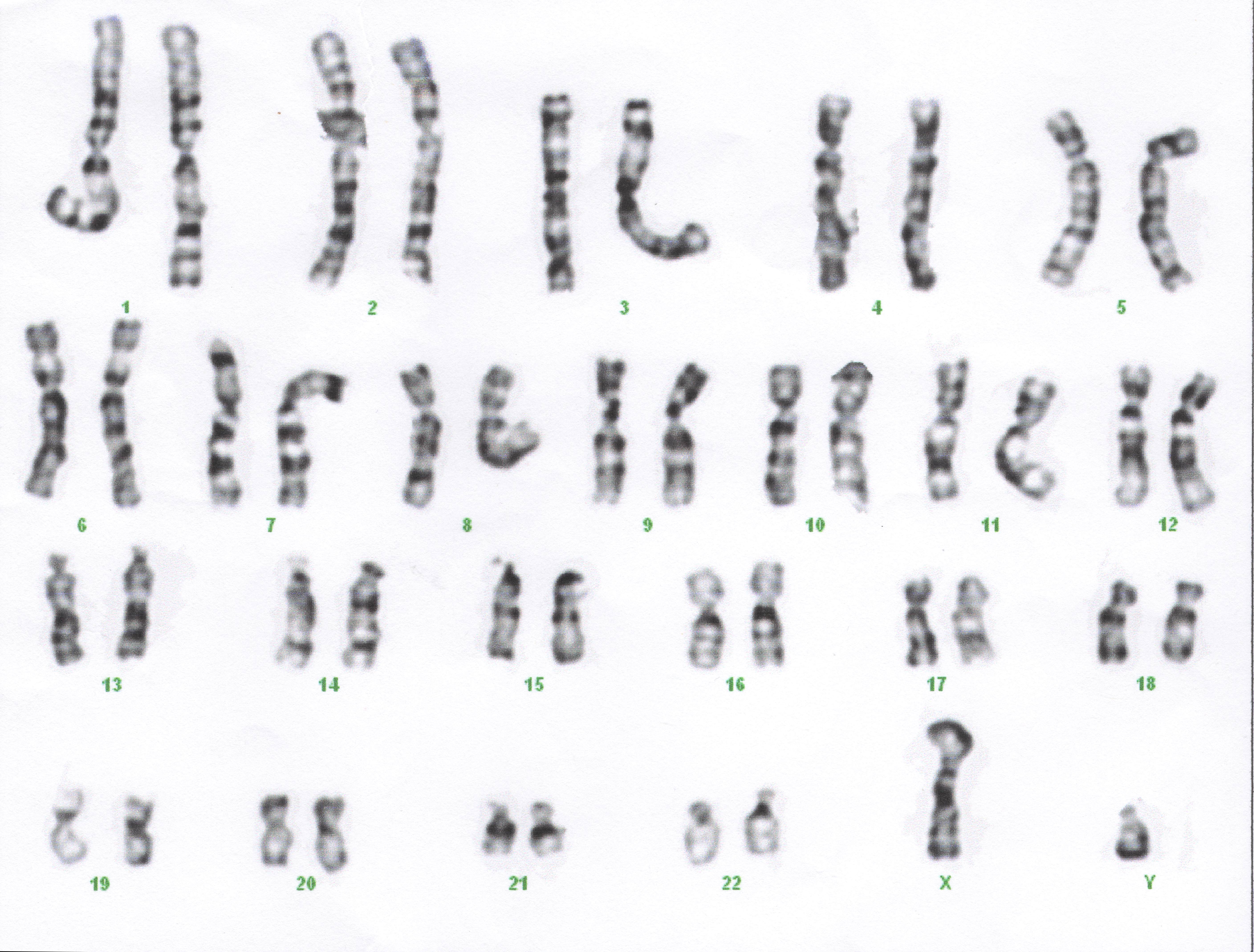 , 1997]. Это говорит о том, что существует структура, соединяющая все хромосомы в ядре. Возможным механизмом этого следует рассматривать общую липкость хромосом. Подход к этому может заключаться в использовании спектрального кариотипирования (SKY) для определения порядка цепочек хромосом. Согласованность порядка хромосом предоставит важную информацию.
, 1997]. Это говорит о том, что существует структура, соединяющая все хромосомы в ядре. Возможным механизмом этого следует рассматривать общую липкость хромосом. Подход к этому может заключаться в использовании спектрального кариотипирования (SKY) для определения порядка цепочек хромосом. Согласованность порядка хромосом предоставит важную информацию.
Рис. 3
A , B Пример липких хромосом. Хромосомы слипаются друг с другом и запутываются волокнами хроматина (стрелки).Если кластер запутанных хромосом наблюдается в хорошо распределенных хромосомах, это может указывать на липкие хромосомы. Когда хромосомы липкие, волокна хроматина часто видны среди хромосом. Эти липкие хромосомы также имеют нечеткую морфологию.
Unit Fibers
Используя методы выделения метафазных хромосом, Bak et al. [1979] описали «единичные волокна» как субструктуры метафазных хромосом. Эти «единичные волокна» имеют постоянный диаметр около 0,4 мкм, что примерно в 5 раз меньше, чем конечные конденсированные хроматиды в метафазных хромосомах. Интересно, что такие структуры также могут быть индуцированы медикаментозным лечением (например, ингибированием топоизомеразы II) в краткосрочных культурах лимфоцитов различных видов. В частности, хромосомы лягушки образуют единичные волокна с четкой морфологией (рис. 4). Химически индуцированные единичные волокна отличаются от единичных волокон Бака, изолированных от метафазных хромосом, тем, что первое производит 2 параллельных волокна, называемых сестринскими единичными волокнами, тогда как второе дает одно единичное волокно. Вероятно, что процедура выделения разделяет сестринские хроматиды метафазных хромосом до деконденсации на единичные волокна.Существование единичных волокон убедительно свидетельствует о том, что метафазные хромосомы упакованы на нескольких уровнях организации спиралей, а единичное волокно является субструктурой последнего уровня упаковки.
Интересно, что такие структуры также могут быть индуцированы медикаментозным лечением (например, ингибированием топоизомеразы II) в краткосрочных культурах лимфоцитов различных видов. В частности, хромосомы лягушки образуют единичные волокна с четкой морфологией (рис. 4). Химически индуцированные единичные волокна отличаются от единичных волокон Бака, изолированных от метафазных хромосом, тем, что первое производит 2 параллельных волокна, называемых сестринскими единичными волокнами, тогда как второе дает одно единичное волокно. Вероятно, что процедура выделения разделяет сестринские хроматиды метафазных хромосом до деконденсации на единичные волокна.Существование единичных волокон убедительно свидетельствует о том, что метафазные хромосомы упакованы на нескольких уровнях организации спиралей, а единичное волокно является субструктурой последнего уровня упаковки.
Рис. 4
Пример единичных волокон (дублированный из Heng et al., 1988a). Эти окрашенные по Гимзе единичные волокна получали из культуры хромосом лягушки, обработанной BrdU (2 ч) до подготовки слайдов. Есть несколько межфазных ядер. Пучок всех единичных волокон происходит из одной ячейки.Обратите внимание, что волокна сестринского блока существуют параллельно. Диаметр этих единичных волокон составляет приблизительно 0,2 мкм.
Есть несколько межфазных ядер. Пучок всех единичных волокон происходит из одной ячейки.Обратите внимание, что волокна сестринского блока существуют параллельно. Диаметр этих единичных волокон составляет приблизительно 0,2 мкм.
Ошибки сегрегации хромосом
Виг [1983] тщательно исследовал порядок сегрегации хромосом. Было замечено, что в мета-анафазе центромеры хромосом в данном геноме не разделяются случайным образом на 2 сестринских единицы. Такая контролируемая и видоспецифичная последовательность не зависит от длины хромосомы или положения центромеры, но очевидно зависит от количества и качества перицентрического гетерохроматина [Vig and Willcourt, 1998].Изменение физического состояния гетерохроматина, такое как деконденсация, связано с аберрациями в паттерне разделения центромер. Интересно, что ошибки разделения центромер связаны с болезнями человека. Этому направлению исследования следует следовать с использованием доступных методов, таких как SKY, для отслеживания изменений порядка сегрегации при раке и других заболеваниях.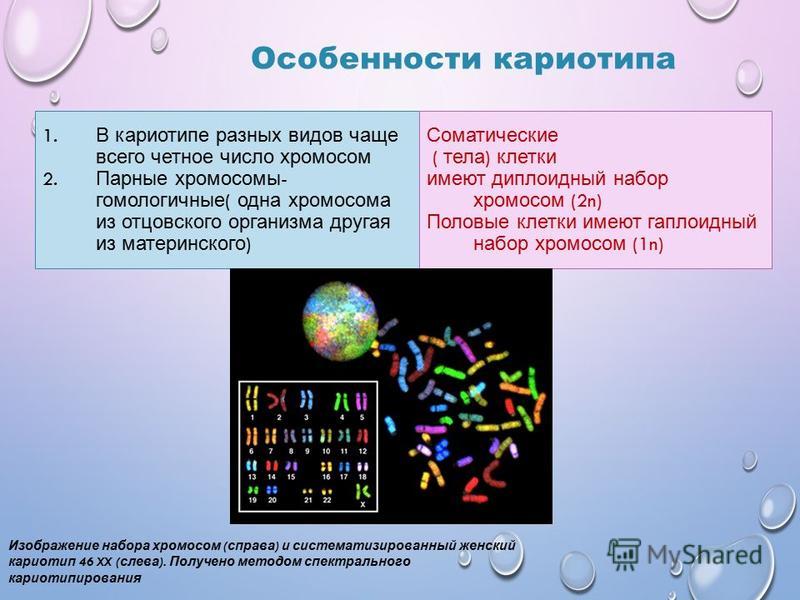
Фрагментация хромосомы
Фрагментация хромосомы (C-Frag) — это форма гибели митотических клеток, при которой конденсированные хромосомы постепенно разрушаются [Stevens et al., 2007, 2011]. C-Frag наблюдали в течение нескольких десятилетий, но его механизм ранее был неизвестен. Первоначально C-Frag путали с измельчением хромосом (также известным как преждевременная конденсация хромосом) [Stevens et al., 2010]. Недавно C-Frag был охарактеризован как основная форма гибели митотических клеток. Он отличается как от апоптоза, так и от митотической катастрофы (рис. 5) [Stevens et al., 2007]. Важно отметить, что C-Frag был связан с различными типами клеточного стресса, включая генные мутации, стресс ER, инфекцию, медикаментозное лечение и дисфункцию центросом.Таким образом, C-Frag представляет собой общий ответ на системный стресс, а не на определенный тип стресса [Stevens et al., 2011]. Это объясняет, почему так много индивидуальных молекулярных механизмов могут быть связаны с этим явлением [Stevens et al. , 2013]. C-Frag может приводить как к анеуплоидии (когда происходит фрагментация с участием только одной или нескольких хромосом), так и к хаосу генома (см. Следующий сеанс), и, таким образом, он может вносить вклад в аномалии кариотипа [Stevens et al., 2007, 2013].
, 2013]. C-Frag может приводить как к анеуплоидии (когда происходит фрагментация с участием только одной или нескольких хромосом), так и к хаосу генома (см. Следующий сеанс), и, таким образом, он может вносить вклад в аномалии кариотипа [Stevens et al., 2007, 2013].
Рис. 5
Примеры C-Frag. A На ранней стадии C-Frag многие отдельные хромосомы обычно конденсируются. B На поздней стадии C-Frag большинство хромосом фрагментировано. C-E Кроме того, C-Frag может встречаться как в ранних ( C ), так и в поздних митотических фигурах ( D , E ). F Небесное изображение C-Frag в E . D Интактные хромосомы и полностью фрагментированные части могут быть обнаружены по одной и той же митотической фигуре.
Хаос генома
Хаос генома или хаос кариотипа / хромосомы использовался для описания массовых, быстро приобретаемых изменений генома, которые происходят во время прерывистой фазы эволюции рака [Heng et al. , 2006c, Heng, 2007c, Duesberg, 2007]. Кариотипический хаос можно разделить на структурный хаос, числовой хаос или комбинацию обоих типов (рис. 6). Структурный хаос определяется либо процентом клеток, которые демонстрируют хаотический фенотип, либо наличием массового повторного соединения (например, более 5 событий транслокации на одной хромосоме) в каждой клетке. Типы хромосомных аберраций хаотического фенотипа разнообразны и включают разрыв хроматид, транслокации, кольца, отдельные хроматиды, C-Frag, крупномасштабное слияние хромосом, кольца, образованные хроматидами, комбинации структурных и числовых изменений и другие поразительные фенотипы.Хаос генома наблюдается в различных моделях прогрессирования рака и лекарственной устойчивости, а также в клинических образцах [Wahab et al., 2008].
, 2006c, Heng, 2007c, Duesberg, 2007]. Кариотипический хаос можно разделить на структурный хаос, числовой хаос или комбинацию обоих типов (рис. 6). Структурный хаос определяется либо процентом клеток, которые демонстрируют хаотический фенотип, либо наличием массового повторного соединения (например, более 5 событий транслокации на одной хромосоме) в каждой клетке. Типы хромосомных аберраций хаотического фенотипа разнообразны и включают разрыв хроматид, транслокации, кольца, отдельные хроматиды, C-Frag, крупномасштабное слияние хромосом, кольца, образованные хроматидами, комбинации структурных и числовых изменений и другие поразительные фенотипы.Хаос генома наблюдается в различных моделях прогрессирования рака и лекарственной устойчивости, а также в клинических образцах [Wahab et al., 2008].
Рис. 6
Примеры геномного хаоса. A- D SKY и DAPI изображения числового хаоса. В линиях раковых клеток человека ( A , B ) и мыши ( C , D ) количество хромосом может составлять сотни ( D с> 550 мышиными хромосомами). Обратите внимание, что эти хромосомы нормального размера и не являются фрагментами. E-H Изображения структурного хаоса, на которых видно большое количество хромосомных аномалий, включая массивные транслокации, длинные слитые хромосомы, указанные стрелками, одиночные сестринские хроматиды, кольцевые хромосомы и C-Frag. E , F Хаос генома, индуцированный линией раковых клеток человека. G , H Индуцировано из линии рака мыши. Стрелки указывают на вновь образованные длинные хромосомы, содержащие несколько частей других хромосом. Для всех изображений левые панели — это изображения НЕБО, где смешанный цвет указывает на множественные транслокации, правые панели — это изображения обратного DAPI.
Обратите внимание, что эти хромосомы нормального размера и не являются фрагментами. E-H Изображения структурного хаоса, на которых видно большое количество хромосомных аномалий, включая массивные транслокации, длинные слитые хромосомы, указанные стрелками, одиночные сестринские хроматиды, кольцевые хромосомы и C-Frag. E , F Хаос генома, индуцированный линией раковых клеток человека. G , H Индуцировано из линии рака мыши. Стрелки указывают на вновь образованные длинные хромосомы, содержащие несколько частей других хромосом. Для всех изображений левые панели — это изображения НЕБО, где смешанный цвет указывает на множественные транслокации, правые панели — это изображения обратного DAPI.
Недавно проект секвенирования генома рака выявил массовую реорганизацию, локализованную в пределах одной хромосомы в образцах пациентов. Этот подтип геномного хаоса получил название хромотрипсиса [Stephens et al., 2011]. Хотя открытие уникальной реорганизации хромотрипсиса путем глубокого секвенирования является захватывающим, мы хотели бы отметить, что массовая реорганизация генома хорошо задокументирована в цитогенетическом сообществе, хаос генома был обнаружен с помощью анализа кариотипа много лет назад, и, наконец, молекулярные цитогенетические методы. имеют решающее значение для понимания хаоса генома.Недавно мы представили модель, объясняющую механизм хаоса в геноме, в котором индуцированный стрессом C-Frag служит материалом для реорганизации генома [Heng et al., 2011a, b]. Хотя большинство хаотических геномов в конечном итоге будет устранено, разнообразие геномов, созданных в ходе этого важного процесса, увеличивает вероятность того, что будет выбран эволюционный победитель [Liu et al., Unpubl. наблюдение]. Очевидно, что необходимо систематически анализировать как процесс геномного хаоса, так и его клинические последствия, особенно для лечения рака.
Микронуклеусы
Микро- и множественные ядра могут возникать в результате ряда событий и являются нормальными для некоторых типов клеток, таких как мегакариоциты. Микроядра (MN) содержат целые хромосомы, фрагменты хромосом или их комбинации [Huang et al., 2011]. MN продуцируются как минимум 7 различными механизмами, включая хромосомы, смещенные во время метафазы, медленное разделение хромосом при переходе от биполярной и многополярной анафазы к телофазе, фрагменты разорванных хромосомных мостов, наследование от материнских клеток, ядерные фрагменты, которые движутся с той же скоростью, что и хромосомы, но слегка разделены во время анафазы, экструзии хромосомы в мини-клетку, которая затем сливается с дочерней клеткой, и ядерные зачатки во время интерфазы [Huang et al., 2011]. Пример почкующихся интерфазных ядер, а также MN из митотических хромосом показан на рисунке 7. Образование MN было связано с дисфункцией генных сетей, включающих ответы на повреждения ДНК, которые являются общими для рака, и были идентифицированы некоторые генетические полиморфизмы, которые увеличивают частоту MN. [Iarmarcovai et al., 2008; van Leeuwen et al., 2011], но точные механизмы образования MN еще не ясны. Кроме того, известно, что MN может быть связан, в частности, с различными типами гибели клеток.Следовательно, необходимо систематически анализировать MN и их связь с гибелью клеток.
Рис. 7
Примеры микроядер. A , B Иллюстрации различных MN, включая многодольчатые ядра ( A ). C , D НЕБО и обратные изображения DAPI MN. МН наименьшего размера часто отображаются одним цветом, что указывает на образование материала из одной хромосомы. Согласно обратному изображению DAPI ( D ), одноцветный MN принадлежит одной хромосоме, о чем судят по количеству центромерных сигналов в каждом MN.Более крупный MN связан с рядом хромосом. E , F Некоторые MN могут образовываться непосредственно из хромосом. Судя по морфологическим признакам ( F ), имеется смесь хромосом и MN, что указывает на то, что эти хромосомы были деконденсированы, а затем преобразованы в MN.
В течение 15 лет проект HUMN (International Human Micronucleus) координировал изучение образования MN, связанного с повреждением ДНК. Было показано, что частота МЯ в периферических лимфоцитах увеличивается с возрастом, особенно после 30 лет, у мужчин выше, чем у женщин, и повышается при воздействии вредных химических веществ и радиации [Bonassi et al., 2011; Fenech et al., 2011]. Интересно, что частота ЗН снижена у курильщиков, но повышена у курильщиков, которые в дальнейшем заболевают раком легких [Fenech et al., 2011]. Фактически, повышенная частота ЗН связана с раком в целом, особенно с раком мочеполовой системы и желудочно-кишечного тракта. Образование MN также применялось для выявления дефицита питания [Fenech, 2002]. Хотя точные результаты образования MN неизвестны, образование MN указывает на общую нестабильность генома. Присутствие MN указывает на изменение генома, но его отсутствие не указывает на обратное.Следовательно, необходимы дальнейшие исследования для определения точной взаимосвязи между ЗН и кариотипическим изменением. Тем временем, однако, MN следует рассматривать как NCCA, поскольку они изменяют топологию генома. В будущих исследованиях следует стремиться определить количественный вклад MN в общие NCCA.
Другие неклассифицированные структуры
Существует множество неклассифицированных типов хромосомных или ядерных аберраций, обнаруживаемых на обычных хромосомных слайдах, особенно на образцах рака. Многие из этих аберраций имеют неизвестные механизмы, но, по-видимому, связаны с различными видами лечения.Чтобы привлечь больше внимания к этим структурам, мы поделимся некоторыми наблюдениями о структурах, которые ранее не были тщательно изучены или рассмотрены. Ниже приведены примеры:
Ядрас маленькими отверстиями
Ядра с маленькими отверстиями или кольцами формы наблюдались во время подготовки хромосом костного мозга от облученных мышей. Это явление также возникает после медикаментозного лечения, например пингианимицина (противоопухолевый антибиотический комплекс, который принадлежит к семейству блеомицинов) или BrdU (рис.8А). По-видимому, существует связь «доза-реакция» с частотой этого типа ядер. Обработанные образцы показывают увеличение частоты в 20-25 раз по сравнению с необработанными животными.
Рис. 8
Неклассифицированные хромосомные или ядерные аномалии / вариации. Изображение DAPI ядра мыши с «дырками» после обработки BrdU. Отверстия обозначены двумя стрелками. Слайд изготавливали с помощью стандартной цитогенетической подготовки костного мозга мыши после обработки BrdU. Яркие пятна — гетерохроматин. B-E Ядра неправильной формы, наблюдаемые по линиям рака (как изображения SKY, так и обратные изображения DAPI). F Огромные интерфазные ядра в культуре клеток крови человека после лечения доксорубицином или EB. Большие ядра (обозначены стрелкой) явно больше, чем ядра среднего размера (остальные ядра). G , H Особая морфология ядер после обработки доксорубицином. Некоторые ядра имеют морфологию, аналогичную поздней стадии C-Frag.
Аномальная морфология ядра
Химиотерапевтические препараты, такие как доксорубицин, могут индуцировать интерфазные ядра странной морфологии (рис.8C-E, G, H). Картина конденсации хроматина весьма различна в зависимости от дозировки и продолжительности лечения.
Гигантские ядра
На нормальных цитогенетических слайдах мы можем наблюдать большие ядра, которые в несколько раз больше среднего. В частности, медикаментозное лечение (например, доксорубицин) увеличивает частоту гигантских ядер. Как показано на рисунке 8G, размер гигантского ядра намного больше, чем размер обычного межфазного ядра.
Дальнейшее понимание описанных выше структур открывает дверь в новую область интересов цитогенетических исследований.Очень тревожно не знать, что это за структуры, несмотря на частые наблюдения за этими структурами. Возможно, что некоторые из этих структур образуются только в результате определенного лекарственного лечения, но все же может быть важно рассмотреть возможность их использования для мониторинга эффектов и последствий лекарственного лечения. В связи с важностью идентификации DMF и C-Frag, мы уверены, что систематическая характеристика типов аберраций, которые способствуют гетерогенности кариотипа, очень ценна.
Значение использования NCCA для мониторинга неоднородности кариотипа
Многие из этих игнорируемых типов хромосомных аберраций являются NCCA, поскольку они часто затрагивают разные хромосомы и изменяют контекст генома. Используя в качестве примера исследования рака, мы отстаиваем важность изучения взаимосвязи между NCCA и CCA и применяем NCCA для измерения генетической нестабильности [Heng et al., 2004, 2006a-c]. Все чаще сообщения связывают общие изменения генома (аномалии кариотипа) со многими распространенными заболеваниями и конкретными физиологическими или патологическими состояниями [Ye et al., 2007; Юров и др., 2008; Astolfi et al., 2010; Дункан и др., 2010]. Для удобства читателей мы кратко резюмируем основные положения наших рассуждений.
Использование стохастических генетических изменений для мониторинга динамики системы
Клетки — это биосистемы, которые функционируют в основном сложным образом. Независимо от того, насколько мы посвящаем себя их изучению, эта сложность не может быть сведена к дискретным линейным отношениям, а конкретные генетические изменения не могут предсказать наиболее распространенные и сложные заболевания.В прошлом были успехи в определении причинных факторов болезней одного гена, но основная проблема заключается в том, чтобы точно определить конкретную причинную взаимосвязь в распространенных заболеваниях, таких как рак. При раке не существует фиксированного специфического молекулярного механизма, общего для популяции пациентов, из-за различных факторов, участвующих в прогрессировании, и вклада взаимодействия среды и времени. Чтобы обратиться к этой реальности, кажущиеся случайными изменения системы должны использоваться для изучения закономерностей системной динамики.Согласно принципу системного контроля, мониторинг неспецифических геномных изменений должен быть наиболее эффективным способом изучения общей динамики системы. Недавнее сообщение об использовании случайной экспрессии генов для прогнозирования рака представляет собой именно такой пример [Venet et al., 2011]. Интересно, что стохастичность на уровне генома должна быть лучшим предиктором, чем любое изменение на уровне гена, поскольку геном является высшим уровнем генетической организации и уровнем управления информацией биосистемы. Мы проиллюстрировали этот момент, связав NCCA с общей онкогенностью и приобретением лекарственной устойчивости.
Эволюционное значение гетерогенности кариотипа
Следующая фаза геномики, 4D-геномика, применяет эволюционные принципы к исследованию генома [Heng et al., 2011a; Стивенс и др., 2013]. Поскольку большинство заболеваний, включая рак, связаны с эволюционным процессом на уровне соматических клеток, необходимо понимать значение эволюции соматических клеток и гетерогенности кариотипа. Например, тремя ключевыми эволюционными компонентами эволюции рака являются: (а) должны быть вариации в популяции клеток, из которых возникает опухоль; (b) вариация должна быть наследуемой, и (c) вариация должна влиять на выживание или воспроизводство.Неоднородность кариотипа является важным аспектом этих ключевых компонентов.
Обсуждая изменчивость, нужно задаться вопросом, какие типы генетической изменчивости являются более доминирующими; и ответ, несомненно, — геном. При обсуждении наследования возникает вопрос: что определяет генетическое наследование, ген или геном? И ответ заключается в том, что наследование системы обеспечивается контекстом генома и может рассматриваться просто как целостность кариотипа (поскольку неизмененные кариотипы отражают неизменный контекст генома).Наконец, при обсуждении достижения физической формы необходимо задать вопрос о том, является ли это быстрым поэтапным или медленным пошаговым процессом, и ответом на этот вопрос будет и то, и другое. Существует 2 фазы эволюции, и наиболее важная фаза с прерывистыми интервалами обусловлена высоким уровнем гетерогенности кариотипа.
Недавно мы описали эволюционный механизм рака [Ye et al., 2009; Heng et al., 2011b; Heng, 2013a], которые можно свести к 3 ключевым компонентам, включая вызванную стрессом нестабильность системы, изменчивость популяции и макроэволюцию, опосредованную геномом.Опять же, прямая связь всех трех компонентов с гетерогенностью кариотипа предполагает его первостепенное значение в эволюции рака. Эволюционные механизмы объясняются широко варьирующимися и разными типами независимых молекулярных механизмов, которые также предполагают наличие самых разнообразных изменений на уровне генома. Таким образом, степень гетерогенности кариотипа можно рассматривать как показатель эволюционного потенциала популяции.
Крайне важно понимать, что генетическая гетерогенность и особенно гетерогенность кариотипа является движущей силой многих заболеваний.Эволюция происходит только при наличии генетической изменчивости и конкуренции, а возможность быстрой макроэволюции зависит от высокого уровня гетерогенности кариотипа. В общем, эволюция не зависит от конкретного пути (не только из-за множества путей в первую очередь, но также потому, что очень много факторов могут изменять функцию пути во время эволюции, делая его непредсказуемым процессом), а скорее зависит от наличие генетической гетерогенности, что является основанием для сосредоточения внимания на гетерогенности, а не на конкретных путях развития наиболее распространенных и сложных заболеваний.Этот подход полностью поддерживается результатами текущего проекта по секвенированию генома рака, который демонстрирует подавляющую генетическую гетерогенность на уровне генных мутаций, уровне вариации числа копий и уровне общего кариотипа во всех основных типах рака. При раке гетерогенность является правилом, а высокая степень проникновения любого конкретного генетического изменения является исключением. Мы предсказали эти результаты, когда только начинался проект генома рака [Heng, 2007a]. Этот прогноз был основан на оценке множества уровней генетической / эпигенетической гетерогенности, которая существует при большинстве видов рака [Heng, 2007a].Настало время, чтобы исследовательское сообщество приняло меры и переоценило общие концепции и стратегии, применяемые к раку и другим распространенным заболеваниям.
Возвращение анализа кариотипа на место водителя с помощью 4D-Genomics
Мы постоянно заявляли, что кариотип является важной особенностью биологической системы и не подлежит восстановлению. Следовательно, анализ кариотипа требует доминирующего положения в геномике и не может быть заменен молекулярными методами с более высоким разрешением, сосредоточенными на уровнях ниже генома.Эволюцию соматических клеток невозможно понять, если объяснение основано исключительно на частях генома. Если мы не осознаем определяющую роль кариотипа в процессе выработки целостного понимания эволюции соматических клеток, мы никогда не поймем сложные заболевания. Традиционные усилия, сфокусированные на гене, имеют смысл в рамках геноцентрической парадигмы, но, напротив, важность кариотипической гетерогенности освещается концепцией 4D-геномики. Конечно, мы приветствуем комбинационные подходы молекулярной цитогеномики, но кариотип должен оставаться ключевым фактором при изучении таких заболеваний, как рак, где изменения кариотипа являются движущей силой.Следовательно, области генетики в целом необходимо серьезно рассмотреть важность гетерогенности кариотипа и стратегии использования NCCA для этой цели.
Знание о существовании высоких уровней гетерогенности кариотипа in vivo является большим шоком для многих, поскольку биология научила нас, что существует высокий уровень точности в биологических системах, включая репарацию ДНК, уровни множественных проверок и механизм гибели клеток. для устранения любых измененных геномов. Один из часто задаваемых вопросов: почему вообще существует высокий уровень вариабельности генома и как биологические системы переносят эту неоднородность? Ответ связан с тем фактом, что существует большое количество событий клеточного деления и, казалось бы, неограниченный источник биостресса.В конце концов, это не идеальный мир, в котором можно избежать или исправить все внешние влияния. Об этом свидетельствует наличие многих болезней. Однако в нормальных ситуациях системный гомеостаз может допускать определенные уровни неоднородности, и ключевым может быть количественный уровень неоднородности по сравнению с повышенной вероятностью попадания в некоторые важные пути. Интересно отметить, что одна функция или побочный продукт гетерогенности кариотипа на уровне соматических клеток может заключаться в обеспечении повышенной адаптивности (системной динамики), что также может приводить к болезненным состояниям, когда она превышает определенный порог [Heng, 2013a] .
После прочтения этого отчета мы надеемся, что читатели вернутся к своим микроскопам или файлам фотографий и (повторно) обнаружат более интересные аномалии кариотипа, охарактеризовают, классифицируют и опубликуют их. Также есть несколько неотложных задач, которые включают: (1) подтвердить некоторые из вышеперечисленных результатов и обнаружить / классифицировать дополнительные аберрации. Чтобы более эффективно применять эту новую концепцию использования гетерогенности кариотипа для мониторинга эволюции системы, необходимы усилия для обнаружения оставшихся неизвестных NCCA и завершения всей картины.Это можно сделать, повторно изучив архивные слайды. (2) Из этих выборок мы должны установить базовый уровень частот NCCA в нормальных популяциях разного возраста. Хотя это большая задача, ее можно выполнить, о чем свидетельствует аналогичная цель проекта HUMN. (3) Охарактеризовать 4D-геномный ландшафт основных типов заболеваний, сравнительно проанализировать вклад различных уровней генетических изменений (ген, эпиген, геном) и оценить эффективность клинического прогнозирования анализов на различных уровнях.
Недавно мы начали применять концепцию 4D-геномики к другим распространенным заболеваниям, включая болезнь войны в Персидском заливе и синдром хронической усталости и иммунной дисфункции. Цель этих исследований — сосредоточить внимание на эволюционном процессе этих заболеваний и связать их с общей нестабильностью генома. Используя эти идиопатические заболевания в качестве примера, мы начали показывать, что гетерогенность кариотипа и, как следствие, нестабильность системы — это недостающая генетическая связь со многими заболеваниями [Heng, 2010, 2013a, b].
Заключение
Кратко суммируя различные формы гетерогенности кариотипа, эта статья не ставит своей целью предоставить исчерпывающий список хромосомных / ядерных аберраций, а вместо этого стремится повысить осведомленность об этих игнорируемых аномалиях и стимулировать дальнейшее обсуждение улучшения исследований. цитогенетических аберраций. Изменения на уровне генома — важная тема, и стохастические изменения генома, ранее считавшиеся несущественными, на самом деле являются универсальным открытием, в подавляющем большинстве случаев присутствующим в экспериментальных и клинических образцах; они явно не являются артефактами, и их больше нельзя игнорировать.Пришло время обсудить будущий путь цитогеномного анализа, особенно в свете того факта, что звучит призыв отойти от традиционного анализа кариотипа к более молекулярному профилированию. Систематический анализ гетерогенности кариотипа явно представляет собой важное новое направление в области цитогенетики и геномики.
Благодарности
Эта статья является частью серии исследований под названием «Механизмы эволюции соматических клеток и организма».Мы хотели бы поблагодарить Глорию Хеппнер, Лап-Чи Цуй и О.Дж. Миллера за их постоянную поддержку и интерес к этому проекту. Некоторые из этих аномальных структур были обнаружены под наблюдением доктора. W.-Y. Чен, Ю.-К. Ван, К. Маркерт, Ф.-Т. Као, Л.-К. Цуй и П. Моэнс. Процесс характеризации включал 7 лабораторий и занял более 3 десятилетий. Эта работа частично поддержана грантами Министерства обороны США (GW093028), Национального фонда CFIDS, Фонда Нэнси Тейлор по хроническим заболеваниям и SeeDNA Biotech Inc.
Список литературы
- Астольфи П.А., Саламини Ф., Сгарамелла В .: Мы — геномная мозаика? Вариации генома соматических клеток могут способствовать разнообразию наших фенотипов. Curr Genomics 11: 379-386 (2010).
- Бак А.Л., Бак П., Цойтен Дж .: Более высокие уровни организации в хромосомах.J Theor Biol 76: 205-217 (1979).
- Bonassi S, Coskun E, Ceppi M, Lando C, Bolognesi C, et al: Проект HUman MicroNucleus по извлеченным буккальным клеткам (HUMN (XL)): роль образа жизни, факторов хозяина, профессионального воздействия, состояния здоровья и протокол анализа. Mutat Res 728: 88-97 (2011).
- Чандракасан С., Йе С.Дж., Читлур М., Мохамед А.Н., Рабах Р. и др.: Злокачественная фиброзная гистиоцитома через два года после трансплантации аутологичных стволовых клеток для лимфомы Ходжкина: доказательства геномной нестабильности. Pediatr Blood Cancer 56: 1143-1145 (2011).
- Дюсберг П: Хромосомный хаос и рак.Sci Am 296: 52-59 (2007).
- Дункан А.В., Тейлор М.Х., Хики Р.Д., Хэнлон Ньюэлл А.Е., Лензи М.Л. и др.: Конвейер плоидности зрелых гепатоцитов как источник генетической изменчивости. Nature 467: 707-710 (2010).
- Fenech M: Микроэлементы и стабильность генома: новая парадигма рекомендуемых диетических добавок (RDA).Food Chem Toxicol 40: 1113-1117 (2002).
- Фенек М., Холланд Н., Зейгер Э., Чанг В.П., Бургаз С. и др.: Проекты международного сотрудничества HUMN и HUMNxL по анализу микроядер человека в лимфоцитах и буккальных клетках — прошлое, настоящее и будущее. Мутагенез 26: 239-245 (2011).
- Феук Л., Карсон А. Р., Шерер С. В.: Структурные вариации в геноме человека. Нат Рев Генет 7: 85-97 (2006).
- Flagiello D, Bernardino-Sgherri J, Dutrillaux B: Сложные отношения между 5-аза-dC индуцированным деметилированием ДНК и уплотнением хромосом при митозе.Хромосома 111: 37-44 (2002).
- Горелик Р., Хенг Х. Х .: Секс снижает генетическую изменчивость: междисциплинарный обзор. Evolution 65: 1088-1098 (2011).
- Haaf T, Schmid M: 5-азадеоксицитидин индуцировал недостаточную конденсацию в гигантских X-хромосомах Microtus agrestis .Хромосома 98: 93-98 (1989).
- Хайден ЭК: Человеческий геном в десять лет: жизнь сложна. Природа 464: 3 (2010).
- Хенг ХХ: Секвенирование генома рака: проблемы впереди.Bioessays 29: 783-794 (2007a).
- Хенг ХХ: Устранение измененных кариотипов половым воспроизводством сохраняет видовую идентичность. Геном 50: 517-524 (2007b).
- Хенг ХХ: Кариотипический хаос, форма неклональных хромосомных аберраций, играет ключевую роль в прогрессировании рака и устойчивости к лекарствам.Летние исследовательские конференции FASEB: Структура ядра и рак Вермонтская академия, Сакстон-Ривер, Вермонт, 16-21 июня (2007c).
- Хенг Х. Х .: Геном-центрическая концепция: ресинтез эволюционной теории. Биологические исследования 31: 512-525 (2009).
- Хенг ХХ: Отсутствует наследуемость и стохастические изменения генома.Нат Рев Генет 11: 812-812 (2010).
- Хенг Х. Х .: 4D-геномика: динамика генома и ограничения в эволюции (Springer, Heidelberg 2013a).
- Хенг Х.Х .: Биокомплекс: вызов редукционизму; in Sturmberg JP, Martin CM: Handbook of Systems and Complexity in Health, pp 193-208 (Springer, Heidelberg 2013b).
- Хэн Х. Х., Ши Х. М.: От анализа свободного хроматина до рыбного волокна с высоким разрешением. Cell Res 7: 119-124 (1997).
- Heng HH, Squire J, Tsui LC: Картирование генов млекопитающих с высоким разрешением путем гибридизации in situ со свободным хроматином.Proc Natl Acad Sci USA 89: 9509-9513 (1992).
- Хэн Х. Х., Стивенс Дж. Б., Лю Дж., Бремер С. В., Е С. Дж.: Визуализация аномалий генома в исследованиях рака. Хромосома клетки 3: 1 (2004).
- Хенг Х.Х., Бремер С.В., Стивенс Дж., Йе К.Дж., Миллер Ф. и др.: Прогрессирование рака из-за неклональных хромосомных аберраций.J. Cell Biochem. 98: 1424-1435 (2006a).
- Хэн Х. Х., Лю Дж., Бремер С., Е К. Дж., Стивенс Дж., Е С. Дж.: Клональные и неклональные хромосомные аберрации, вариации и аберрации генома. Геном 49: 195-204 (2006b).
- Хенг Х. Х., Стивенс Дж. Б., Лю Дж., Бремер С. В., Е К. Дж. И др.: Стохастическое прогрессирование рака, вызванное неклональными хромосомными аберрациями.J. Cell Physiol 208: 461-472 (2006c).
- Хэн Х. Х., Лю Дж., Стивенс Дж. Б., Бремер С. В., Е К. Дж., Е К. Дж.: Генетическая и эпигенетическая гетерогенность рака: основная проблема лекарственной терапии. Curr Drug Targets 11: 1304-1316 (2010).
- Хэн Х. Х., Лю Дж., Стивенс Дж. Б., Бремер С. В., Е К. Дж. И др.: Расшифровка генома за пределами секвенирования: новый этап геномных исследований.Genomics 98: 242-252 (2011a).
- Хенг Х. Х., Стивенс Дж. Б., Бремер С. В., Лю Дж., Абдалла Б. Ю., Е С. Дж.: Эволюционные механизмы и разнообразие рака. Adv Cancer Res 112: 217-253 (2011b).
- Heng HQ, Chen WY: Исследование хроматина и структуры хромосом для Bufo gargarizans с помощью светового микроскопа.J Sichuan Univ Nat Sci 2: 105-109 (1985).
- Heng HQ, Chen WY: Исследования поздней структуры хроматина G2 и формирования хромосом. Acta Genetica Sinica 14: 237-242 (1987).
- Heng HQ, Zhao XL: Свободная структура хроматина в культуре клеток крови.J Sichuan Univ Nat Sci 4: 480-485 (1989).
- Heng HQ, Chen WY, Yosida TH: Исследования хромосом амфибий с помощью полосатости высокого разрешения. Proc Japan Acad 62: 53-56 (1987).
- Heng HQ, Lin R, Zhao XL, Chen WY: Структура хромосомы и ее формирование.II. Исследования волокон сестринских единиц. Ядро 30: 2-9 (1988a).
- Heng HQ, Chen WY, Wang YC: Эффекты пингианимицина на хромосомах: возможная структурная основа хромосомной аберрации. Mutat Res 199: 199-205 (1988b).
- Хорн С.Д., Абдалла Б.Ю., Стивенс Дж. Б., Лю Дж., Е К. Дж. И др.: Ограничение генома посредством полового размножения: применение 4D-геномики в репродуктивной биологии.Syst Biol Reprod Med, Epub перед печатью (2013).
- Хуанг Ю., Фенек М., Ши В. Формирование микронуклеусов обнаружено с помощью визуализации живых клеток. Мутагенез 26: 133-138 (2011).
- Ярмарковай Г., Бонасси С., Ботта А., Баан Р. А., Орсьер Т.: Генетические полиморфизмы и образование микроядер: обзор литературы.Mutat Res 658: 215-233 (2008).
- Юров И.Ю., Ворсанова С.Г., Юров Ю.Б.: Хромосомный мозаицизм становится глобальным. Mol Cytogenet 1:26 (2008).
- Maniotis AJ, Bojanowski K, Ingber DE: Механическая непрерывность и обратимая разборка хромосом в интактных геномах, удаленных из живых клеток.J. Cell Biochem. 65: 114-130 (1997).
- Мительман Ф .: Рецидивирующие хромосомные аберрации при раке. Mutat Res 462: 247-253 (2000).
- Ноуэлл ПК: Клональная эволюция популяций опухолевых клеток.Science 194: 23-28 (1976).
- Podlaha O, Riester M, De S, Michor F: Эволюция генома рака. Тенденции Genet (2012).
- Сджоблом Т., Джонс С., Вуд Л.Д., Парсонс Д.В., Лин Дж. И др.: Консенсусные кодирующие последовательности рака груди и колоректального рака человека.Science 314: 268-274 (2006).
- Smith L, Plug A, Thayer M: Задержка времени репликации приводит к задержке конденсации митотических хромосом и хромосомной нестабильности хромосомных транслокаций. Proc Natl Acad Sci USA 98: 13300-13305 (2001).
- Стивенс П.Дж., Гринман С.Д., Фу Б., Янг Ф., Бигнелл Г.Р. и др.: Массивная геномная перестройка, полученная в результате одного катастрофического события во время развития рака.Cell 144: 27-40 (2011).
- Стивенс Дж. Б., Лю Дж., Бремер С. В., Йе К. Дж., Сюй В. и др.: Смерть митотических клеток в результате фрагментации хромосом. Cancer Res 67: 7686-7694 (2007).
- Стивенс Дж. Б., Абдаллах Б. Я., Реган С. М., Лю Дж., Бремер С. В. и др.: Сравнение гибели митотических клеток в результате фрагментации хромосомы с преждевременной конденсацией хромосом.Mol Cytogenet 3:20 (2010).
- Стивенс Дж. Б., Абдалла Б., Лю Дж., Йе К. Дж., Хорн С. Д. и др.: Разнообразные системные стрессы: общие механизмы фрагментации хромосом. Cell Death Dis 2: e178 (2011).
- Стивенс Дж. Б., Абдаллах Б. Я., Хорн С., Бремер С. В., Лю Г. и др.: Неоднородность гибели клеток.Cytogenet Genome Res, в печати (2013).
- Консорциум проекта «1000 геномов»: карта вариаций генома человека на основе популяционного секвенирования. Nature 467: 1061-1073 (2010).
- ван Леувен Д.М., Педерсен М., Кнудсен Л.Е., Бонасси С., Фенек М. и др.: Анализ транскриптомной сети генов, связанных с микроядрами: тематическое исследование.Мутагенез 26: 27-32 (2011).
- Venet D, Dumont JE, Detours V: Большинство случайных сигнатур экспрессии генов в значительной степени связаны с исходом рака груди. PLoS Comput Biol 7: e1002240 (2011).
- Виг Б.К.: Последовательность разделения центромер: возникновение, возможное значение и контроль.Cancer Genet Cytogenet 8: 249-274 (1983).
- Vig BK, Willcourt M: Деконденсация перицентрического гетерохроматина изменяет последовательность разделения центромер в клетках мыши. Хромосома 107: 417-423 (1998).
- Фогельштейн Б, Кинзлер К.В.: Многоступенчатая природа рака.Trends Genet 9: 138-141 (1993).
- Wahab MA, Nickless EM, Najar-M’kacher R, Parmentier C, Podd JV, Rowland RE: Повышенные частоты транслокаций хромосом у ветеранов ядерных испытаний Новой Зеландии. Cytogenet Genome Res 121: 79-87 (2008).
- Уилкинс А.С., Холлидей Р. Эволюция мейоза из митоза.Генетика 181: 3-12 (2009).
- Е CJ, Лю Г., Бремер С. В., Хэн Х. Х .: Динамика раковых хромосом и геномов. Cytogenet Genome Res 118: 237-246 (2007).
- Ye CJ, Stevens JB, Liu G, Bremer SW, Jaiswal AS и др.: Гетерогенность клеточной популяции на основе генома способствует онкогенности: эволюционному механизму рака.J. Cell Physiol 219: 288-300 (2009).
Автор Контакты
Генри, штаб-квартира Хенг
Центр молекулярной медицины и генетики
Медицинский факультет Государственного университета Уэйна
540 Э. Кэнфилд, Детройт, Мичиган 48201 (США)
Подробности статьи / публикации
Опубликовано онлайн: 2 апреля 2013 г.
Дата выпуска: апрель 2013 г.
Количество страниц для печати: 14
Количество рисунков: 8
Количество столов: 0
ISSN: 1424-8581 (печатный)
eISSN: 1424-859X (онлайн)
Для дополнительной информации: https: // www.karger.com/CGR
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным средством является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Исследование кариотипа группы видов Drosophila rohusta (Diptera: Drosophilidae)
ВВЕДЕНИЕ
Видовая группа Drosophila robusta, широко распространенная в Палеарктике и Неарктике, хорошо изучена с точки зрения микро- и макроэволюции зрения (обзор см. Левитан, 1982).Нараянан (1973) предложил гипотетическое филогенное дерево группы робуста, основанное, главным образом, на межвидовых сравнениях кариотипов и полосовых последовательностей хромосом слюнных желез. Однако ни один из видов его видовой подгруппы okadai не был изучен хромосомно из-за его упорства в лабораторном выращивании. Кроме того, недавно были обнаружены новые члены группы робуста на материковой части Китая, и новые знания о ее географическом распространении были накоплены в Китае и России (Watabe et al., 1990а; Ватабе и Пэн, 1991; Чен и Ватабе, 1993; Toda et al. , 1996).
В данной статье мы сначала исследовали результаты хромосомных наблюдений группы робуста, а затем обсудили форму предка, общую для группы робуста и ее сестринской видовой группы melanica, на основе полученных результатов и недавней информации о биогеография этих групп.
МАТЕРИАЛЫ И МЕТОДЫ
Все мухи были собраны банановыми ловушками и с деревянных куч с 1994 по 1996 год.Виды и географические штаммы, доступные для настоящего исследования, приведены в Таблице 1 вместе с результатами кариологических наблюдений и информацией о географическом распространении.
Таблица 1
Кариотипы видов-групп Drosophila robusta и D. melanica и их географическое распространение
Самок выращивали в стеклянных флаконах на солодово-дрожжевой среде. при температуре 18 ° C, и на поверхность корма для места откладки яиц кладут небольшой кусочек яблока.
Препараты митотических хромосом были сделаны с нейробластами 3-й личинки, обработанными 0,1 мг / мл раствора колхицина, окрашенными 4% раствором Гимзы и затем высушенными на воздухе (Imai et al. , 1977). У каждого вида наблюдалось около 100 ядерных пластинок.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 показаны метафазные конфигурации пяти видов группы видов робуста и D. moriwakii группы видов меланика. Кариотип D. okadai состоял из 3 пар метацентриков среднего размера (V-образные), 2 пар акроцентриков (стержневидные) и 1 пары точечных (D) хромосом (рис.1А). Его х-хромосома была акроцентрической, а Y — метацентрической. У Drosophila neokadai был тот же кариотип, что и у D. okadai, за исключением его субметацентрической (J-образной) Y-хромосомы (рис. 1B). У Drosophila gani 2n = 12 хромосом, состоящих из 4 пар метацентрических аутосом среднего размера, 1 пары акроцентрических аутосом и непарных половых хромосом, акроцентрических × и метацентрических Y (рис. 1С). Эти три вида принадлежат к подгруппе окадай вместе с D. unimaculata, распространенной в Восточной и Центральной Европе (Watabe and Nakata, 1989).Метафазные пластинки D. sordidula подгруппы robusta включали 2 пары метацентриков, 2 пары акроцентриков и 1 пару точечных хромосом (рис. 1E). Тот же результат был уже получен Киккавой и Пенгом (1938). Х-хромосома D. sordidula — самая большая метацентрическая, она примерно в два раза длиннее акроцентрических аутосом. Такой большой метацентрический × был обнаружен у трех видов подгруппы робуста, D, robusta, D. pseudosordidula и D. cheda (Tan et al. , 1949; Tokumitsu et al., 1967), а у одного вида подгруппы Lacertosa — D. lacertosa с некоторыми вариациями мелких аутосом (ср. Momma, 1956; рис. 1F).
Рис. 1
Мужские метафазные хромосомы группы видов Drosophila robusta и D. moriwakii. А , Д. Окадай; B , D. neokadai; C , D. gani; D , D. moriwakii; E , D. sordidula; F , D. lacertosa. Стрелки указывают на микрохромосомы. Штанги = 10 мкм.
Помимо группы robusta, кариотипы двух видов группы melanica, D.moriwakii и D. tsigana, были проверены на предмет следующего обсуждения. Drosophila moriwakii показывает небольшое изменение хромосомного набора, т. Е. 2n = 12 с 3V + 2R + 1D (Окада и Курокава, 1957), 2n = 12 с 1V + 1J + 4R (Tokumitsu et al. , 1967), 2n = 12 с 2V + 4R (рис. 1D) и 2n = 14 с 2V + 4R + 1D (Watabe, неопубликовано), но его × неизменно наблюдалось, чтобы быть акроцентрическим в этих статьях. Кариотип D. tsigana включал 2n = 10 (2V + 2R + 1D) с акроцентрической X среднего размера, и тот же результат был получен в «melanissima» Киккавы и Пэн (1938) и в «pengr» Окады. и Курокава (1957).
Палочковидный × считается примитивным, чем большой V-образный, так как центрическое слияние с потерей одной центромеры гораздо более вероятно произойдет в виде дрозофилы, чем центральное деление с добавлением одна центромера. Географические, исторические или генетические данные подтверждают это у различных групп Drosophila, например. у гавайских дрозофил (Carson, Yoon, 1982). Что касается группы робусты, все аутосомы среднего размера, тогда как большие метацентрические × встречаются как в подгруппах робусты, так и в подгруппах лацертозы.Одноэлементный стержень × был известен только у двух аллопатрических видов, азиатского D. moriwakii и североамериканского D. colorata, и поэтому Нараянан (1973) считал, что они «являются или представляют» виды-предки группы робуста. Беппу (1988) перевел D. moriwakii и D. colorata из группы робуста в ее близкородственную видовую группу melanica на основе генитального строения, хотя эти два вида имеют все диагностические признаки группы робуста, определенной Стертевантом (1942). .Если это так, примитивная форма группы робуста снова станет под вопросом. Настоящие результаты, то есть наличие акроцентрических × в подгруппе окада и большого V-образного подгруппы в других подгруппах, убедительно свидетельствуют о том, что первые могут занимать наследственное положение в группе робуста (рис. 2). Помимо морфологии X, хромосомный набор подгруппы окадай напоминает таковой у D. moriwakii и D. colorata, имея такое же количество хромосом (2n = 12) и не имея какой-либо из метацентрических хромосом большого размера (рис. .1A-D). Следовательно, сравнение внешних групп предполагает, что предок, общий как для групп робусты, так и для групп меланики, мог обладать стержнеобразной X, и впоследствии Робертсоновская транслокация и перицентрические инверсии могли иметь место в ходе дивергенции видов внутри группы робусты. и группа меланика.
Рис. 2
Схематическое изображение хромосом в группе Drosophila robusta и группе D. melanica.
Палочковидный × известен также у других видов группы melanica, Palearctic D.tsigana и североамериканский D, micromelanica (Сталкер, 1972). Drosophila tsigana в настоящее время демонстрирует дизъюнктивный паттерн географического распространения: Восточная Азия и Западная Европа (Watabe et al. , 1990b). Весьма вероятно, что D. tsigana когда-то могла обладать чрезвычайно широким диапазоном ареала и что его американские родственники могли появиться из «pre-tsigana» .
Замечательное понижение температуры, называемое «конечным эоценовым событием», имело место с позднего эоцена до раннего миоцена (ок.38,6–16,3 млн лет назад), что способствовало расширению ареала смешанных лесов умеренного пояса в средних широтах Евразии (Tanai, 1971,1990; Wolfe, 1978). Видовые группы robusta и melanica могли появиться в Восточной Азии в течение этого третичного периода (Throckmorton, 1975), поскольку обе группы относятся к видам с умеренным климатом в Голарктической области и сильно лесовидны. После этого леса умеренного пояса распространились на высокие широты Евразии в период от раннего до среднего миоцена (примерно 16,3-10,4 млн лет назад), когда произошло потепление температуры, и мухи робусты и группы меланика могли иммигрировать из Евразии в Северную Америку через Берингово море. Прямой.
Недавние исследования фауны на материковой части Китая и на Дальнем Востоке России выявили множество новых видов и большой объем знаний, доступных по биогеографии группы робуста и связанных с ней групп видов (Watabe et al. , 1990a). ; Watabe and Peng, 1991; Chen and Watabe, 1993; Toda et al. , 1996). Очевидно, желательно дальнейшее исследование с использованием молекулярных методов для точного отслеживания филогении и эволюции внутри и между группами видов robusta и melanica.
Благодарности
Мы благодарим профессора М.Дж. Тода (Университет Хоккайдо), доктора К. Тамура (Токийский столичный университет) и студентов Педагогического университета Хоккайдо (господа Н. Терая, К. Накано, К. Ямада) за помощь в полевом сборе и в лабораторном эксперименте. Эта работа была поддержана грантами на научные исследования Министерства образования, науки, спорта и культуры Японии (№№ 06640906, 07640920).
ССЫЛКИ
1.
К. Беппу 1988. Систематическое положение трех видов дрозофилы (Diptera: Drosophilidae) в излучении virilis-repleta. Proc Japan Soc Zool 37: 55–58. Google Scholar2.
Х. Л. Карсон и Дж. С. Юн . 1982. Генетика и эволюция гавайской дрозофилы. В «Генетике и биологии дрозофилы, том 3b». Эд М. Ашубурнер, Х. Л. Карсон и Дж. Н. Томпсон-младший , редакторы. Академическая пресса.Лондон. С. 295–344. Google Scholar3.
H-Z. Чен и Х. Ватабе . 1993. Раздел Drosophila virilis (Diptera, Drosophilidae) из Восточного Китая, с описанием двух новых видов. Jpn J Ent 61: 313–322. Google Scholar4.
H-T. Имаи, Р. Х. Крейзер и Р. В. Тейлор . 1977. Эволюция кариотипа австралийских муравьев. Хромосома (Берл) 59: 341–393. Google Scholar5.
Х. Киккава и Ф. Т. Пэн . 1938. Виды Drosophila Японии и прилегающих территорий. Яп. Ж. Зул 7: 507–55. Google Scholar6.
М. Левитан 1982. Группы робусты и меланики. В «Генетике и биологии дрозофилы, том 3b». Эд М. Ашубурнер, Х. Л. Карсон и Дж. Н. Томпсон-младший , редакторы. Академическая пресса. Лондон. С. 141–192. Google Scholar7.
E. мама 1956. Исследование дрозофил на Хоккайдо II. Хромосомы семи диких видов. J Fac Sci Hokkaido Univ Ser IV Zool 12: 200–208. Google Scholar8.
Ю. Нараянан 1973. Филогенетические взаимоотношения членов группы Drosophila robusta. Генетика 73: 319–350. Google Scholar9.
Х. Д. Сталкер 1972. Межгрупповые филогении у Drosophilaas определены сравнением паттернов полосатости слюны.Генетика 70: 457–474. Google Scholar10.
А. Х. Стертевант 1942. Классификация рода Drosophila с описанием девяти видов. Univ Texas Publ 4213: 5–51. Google Scholar11.
К. К. Тан, Т. С. Сюй и Т. К. Шэн . 1949. Известный вид Drosophila в Китае с описанием двенадцати новых видов. Univ Texas Publ 4920: 196–206. Google Scholar12.
Т. Танай 1971. Третичная фитогеография северного полушария (на японском языке с аннотацией на английском языке). Документы памяти профессора Х. Матусита из Университета Хоккайдо. С. 201–216. Google Scholar13.
Т. Танай 1990. Третичные изменения растительности в Восточной Азии. Monogr Mizunami Fossil Mus 7: 509–61. на японском. Google Scholar14.
Л. Х. Трокмортон 1975. Фитогения, экология и география дрозофилы.В «Справочнике по генетике, том 3». Эд Р. К. Кинг , редактор. Пленум Пресс. Нью-Йорк. С. 421–469. Google Scholar15.
М. Дж. Тода, Сидоренко В.С., Х. Ватабе, Холин С.К., Н. Н. Винокуров . 1996. Обзор Drosophilidae (Diptera) в Восточной Сибири и на Дальнем Востоке России: систематика и биогеография. Zool Sci 13: 455–477. Google Scholar16.
Т. Токумицу, Т.Шима и А. Канеко . 1967. Обследование дрозофил на Хоккайдо XXIII. Исследование кариотипа у семи видов групп quinaria и robusta. Jpn J Genet 42: 279–228. Google Scholar17.
Х. Ватабе и С. Наката . 1989. Сравнительное исследование гениталий видов-групп Drosophila robusta и D. melanica (Diptera: Drosophilidae). J Hokkaido Univ Edu Ser IIB 40: 1–18. Google Scholar18.
ЧАС.Ватабе, Х-С. Лян и З-Х. Чжан . 1990a. Видовая группа Drosophila robusta (Diptera: Drosophilidae) из провинции Юньнань, южный Китай, с пересмотром ее географического распространения. Zool Sci 7: 133–140. Google Scholar19.
Х. Ватабе, С. Наката и М. Дж. Тода . 1990b. Два новых синонима Drosophila tsigana Burla et Gloor (Diptera: Drosophilidae) с результатами перекрестных экспериментов. Jpn J Ent 58: 313–318.Google Scholar20.
Х. Ватабе и Т-Х. Пэн . 1991. Секция Drosophila virilis (Diptera: Drosophilidae) из провинции Гуандун, южный Китай. Zool Sci 8: 147–156. Google Scholar21.
Дж. А. Вулф 1978. Палеоботаническая интерпретация третичного климата в Северном полушарии. Amer Sci 66: 694–703. Google ScholarКариотипирование — обзор | ScienceDirect Topics
Острый миелоидный лейкоз со сложным кариотипом
Другая цитогенетическая подгруппа, постоянно связанная с очень плохим прогнозом, — это сложный кариотип, обнаруживаемый у 10–12% всех пациентов с ОМЛ (если сложный кариотип определяется как ≥3 аберраций) или от 8% до 9% (если определяется как ≥5 аберраций). 112 Пациенты со сложным кариотипом имели частоту полного ответа от 10% до 40% и частоту 5-летней общей выживаемости менее 10%. 112 Примечательно, что сложный кариотип определялся по-разному в разных исследованиях, как ≥5 несвязанных хромосомных аномалий, 96 > 3 аномалии, 97 ≥4 аномалии после исключения специфических аномалий, которые дают благоприятный или неблагоприятный прогноз 62 или ≥3 отклонений, обычно за исключением t (8; 21), inv (16) / t (16; 16) и t (15; 17). 60,61,90 Сложные кариотипы могут включать различное количество хромосомных аберраций у отдельных пациентов, которое иногда может достигать приблизительно 30, но возникновение конкретных структурных и числовых аномалий не является случайным. 112 Сбалансированные перестройки редки, и большинство аберраций несбалансированные, что приводит к потере хромосомного материала, чаще всего из плеч хромосом (в порядке убывания) 5q, 17p, 7q, 18q, 16q, 17q, 12p, 20q, 18p и 3п. Менее частые повторяющиеся приросты, часто скрытые в маркерных хромосомах или частично идентифицированные аномалии, в основном связаны с 8q, 11q, 21q, 22q, 1p, 9p и 13q. 112 Примерно 5% пациентов со сложным кариотипом имеют только числовые отклонения (например, +8, +13, +21, +14, +10 и +19), и в недавнем отчете у таких пациентов была лучшая ОС, чем у пациентов с кариотип гипердиплоидного комплекса с одной или несколькими структурными прогностически неблагоприятными аномалиями, то есть -5 / del (5q), -7 / del (7q), аномальным 3q или 17p, t (9; 22) и 11q23 / KMT2A ( MLL ) транслокаций, кроме t (11; 19). 113
Хотя молекулярные последствия большинства хромосомных изменений, обнаруженных у пациентов с ОМЛ со сложным кариотипом, все еще недостаточно хорошо изучены, связь между аномалиями 17p и утратой и / или мутациями в гене TP53 хорошо задокументирована. 114 Присутствие изменений TP53 делает плачевный клинический исход пациентов со сложным кариотипом еще хуже, и это было связано со значительно более низкими показателями полного ответа и более короткой безрецидивной выживаемостью и общей выживаемостью по сравнению с пациентами без TP53 переделки. 114 Почти у 50% пациентов с мутациями TP53 сложный кариотип может быть создан хромотрипсисом. 47 TP53 -мутировавшие пациенты с хромотрипсисом имеют худший прогноз, чем пациенты без признаков хромотрипсиса. 47
KaryoStat + Служба кариотипирования | Thermo Fisher Scientific
Генетическая нестабильность — известная проблема при длительном культивировании стволовых клеток. Возможность быстро и непрерывно контролировать геномную целостность вашей клеточной культуры имеет решающее значение для того, чтобы вы могли уверенно продвигаться вперед в своих исследованиях.
С помощью нашей службы кариотипирования KaryoStat +, мы предлагаем эффективную альтернативу типичному кариотипированию с G-полосой, которое использует набор Applied Biosystems CytoScan HT-CMA 96F Assay Kit на основе массивов, который предлагает охват всего генома для точного и экономичного обнаружения хромосомных аномалий.
Отправьте нам запрос
Наша служба KaryoStat предлагает:
- Быстрый и рентабельный — рабочий цикл составляет 3 недели или меньше, начиная с 395 долларов США за образец
- Простая подготовка образцов — в нашем анализе используется осадок замороженных клеток , устраняя необходимость в доставке живых клеток
- Более высокое разрешение — разрешение нашей микроматрицы в 5 раз выше, чем у традиционного G-диапазона
- Исключительная поддержка — специальный менеджер проекта для частого обмена информацией по проектам
| KaryoStat Service vs типичное G-бэндинг | ||
|---|---|---|
| Сервис | KaryoStat Кариотипирование | Кариотипирование G-бэндом |
| Сроки | ≤ 3 недель | Более 3 недель |
| Формат образца | 900 Осадок замороженных клетокТребуется живая культура (ранняя метафаза) | |
| Разрешение | > 1 Мб | > 5–10 Мб |
Проблема с генетической стабильностью
Долгосрочное культивирование линий человеческих эмбриональных стволовых клеток (hESC) и перепрограммирование индуцированных плюрипотентных стволовых клеток (iPSC) были связаны с накоплением хромосомных аномалий и изменением числа копий.Таким образом, возможность эффективно проверить отсутствие основных хромосомных аберраций является важным шагом контроля качества в ваших исследованиях стволовых клеток.
Рис. 1. Служба KaryoStat — это основанная на массивах альтернатива G-banding, которая предлагает охват всего генома для точного обнаружения хромосомных аберраций.
Результаты службы КариоСтат + Кариотипирование
Как часть службы кариотипирования KaryoStat, вы получите исчерпывающий отчет, включающий полный обзор генома (рис. 2) , который визуально выявляет обнаруженные хромосомные аберрации в вашем образце.Кроме того, вы получите файл данных с полной информацией о хромосомных аберрациях в отправленном вами образце.
Рис. 2. Пример полного генома, представленный как часть отчета службы кариотипирования KaryoStat. Полный просмотр генома отображает все соматические и половые хромосомы в одном кадре вместе с указанием количества копий.



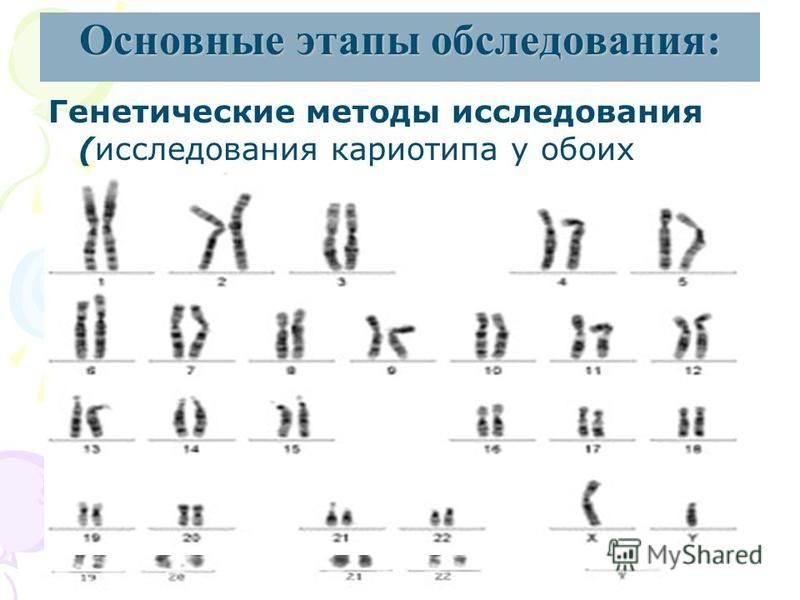 Возможно также образование кольцевых хромосомных структур.
Возможно также образование кольцевых хромосомных структур.
 Это повышает риск нарушения процесса созревания половых клеток и развития хромосомных аномалий.
Это повышает риск нарушения процесса созревания половых клеток и развития хромосомных аномалий.

 Вы будете организовывать хромосомы в законченный кариотип и интерпретировать свои результаты так, как если бы вы работали в
программа генетического анализа в больнице или клинике. Анализы кариотипа в США выполняются более 400000 раз в год.
и Канада. Представьте себе, что вы выполняете этот анализ на реальных людях, и ваши выводы решительно
влияют на их жизнь.
Вы будете организовывать хромосомы в законченный кариотип и интерпретировать свои результаты так, как если бы вы работали в
программа генетического анализа в больнице или клинике. Анализы кариотипа в США выполняются более 400000 раз в год.
и Канада. Представьте себе, что вы выполняете этот анализ на реальных людях, и ваши выводы решительно
влияют на их жизнь.
