📜 Инструкция по применению Интести®-бактериофаг 💊 Состав препарата Интести®-бактериофаг ✅ Применение препарата Интести®-бактериофаг 📅 Условия хранения Интести®-бактериофаг ⏳ Срок годности Интести®-бактериофаг Сохраните у себя Поиск аналогов ⚠️ Регистрационное удостоверение данного продукта заменено ⚠️ Внимание! Название данного продукта изменилось, новый продукт: Интестифаг® Описание лекарственного препарата Интести®-бактериофаг (Intesti-bacteriophage) Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2013 года, дата обновления: 2019. Владелец регистрационного удостоверения:НПО МИКРОГЕН, AO (Россия) Код ATX: V03A (Другие лечебные средства) Лекарственная форма
Форма выпуска, упаковка и состав препарата Интести®-бактериофаг
Вспомогательные вещества: хинозол 0.0001 г/мл 20 мл — флаконы (4) — пачки картонные. Клинико-фармакологическая группа: Иммунобиологический препарат — бактериофаг Фармако-терапевтическая группа: Отсутствует Фармакологическое действиеПрепарат вызывает специфический лизис бактерий Shigella flexneri 1, 2, 3, 4, 6 серовариантов, Shigella sonnei, Salmonella paratyphi A, Salmonella paratyphi В, Salmonella typhymurium, Salmonella infantis, Salmonella choleraesuis, Salmonella oranienburg, Salmonella enteritidis, Escherichia coli, Proteus vulgaris, Proteus mirabilis, Enterococcus, Staphylococcus, Pseudomonas aeruginosa. Показания препарата Интести®-бактериофагЛечение и профилактика заболеваний ЖКТ, вызванных бактериями дизентерии, Salmonella spp.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя. Открыть список кодов МКБ-10
Режим дозированияПрепарат предназначен для приема внутрь и ректального введения. Для лечения препарат принимают внутрь 4 раза в день за 0.5-1 ч до приема пищи с первого дня заболевания в течение 7-10 дней. Детям первых месяцев жизни в первые два дня приема препарат разводят кипяченой водой в два раза, в случае отсутствия побочных реакций (срыгивания, высыпаний на коже) в дальнейшем можно применять бактериофаг неразведенным. Рекомендуемые дозировки препарата
При отсутствии колитического синдрома рекомендуется замена одного приема внутрь на однократное ректальное введение разовой возрастной дозы препарата в виде клизмы после опорожнения кишечника. В профилактических целях оптимальная схема использования — ежедневный прием разовой возрастной дозы. Побочное действиеУ детей первых месяцев жизни в первые 2 дня приема препарата возможны срыгивания, высыпания на коже. Противопоказания к применению
Применение при беременности и кормлении грудьюПрименение данного медицинского препарата при беременности и в период кормления грудью возможно при наличии инфекций, вызванных фагочувствительными штаммами бактерий (по рекомендации врача). Применение у детейНазначают детям первых месяцев жизни Особые указанияПри помутнении препарат не применять! Вследствие содержания в препарате питательной среды, в которой могут развиваться бактерии из окружающей среды, вызывая помутнение препарата, необходимо при вскрытии флакона соблюдать следующие правила:
При использовании малых доз (2-8 капель) препарат необходимо отбирать стерильным шприцем в объеме 0,5-1 мл. Препарат из вскрытого флакона при соблюдении условий хранения, вышеперечисленных правил и отсутствии помутнения может быть использован в течение всего срока годности. Сведения о возможном влиянии лекарственного препарата на способность управлять транспортными средствами, механизмами. Отсутствуют. ПередозировкаСимптомы передозировки не установлены. Лекарственное взаимодействиеПрименение препарата возможно в сочетании с другими лекарственными средствами, в том числе с антибиотиками. Условия хранения препарата Интести®-бактериофагТранспортируют в соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8°С. Допускается транспортирование при температуре от 8 до 25°С не более 1 месяца. Препарат хранят в соответствии с СП 3.3.2.1248-03 в сухом, защищенном от света и недоступном для детей месте при температуре от 2 до 8°С. Срок годности препарата Интести®Срок годности — 2 года. Препарат с истекшим сроком годности применению не подлежит. Условия реализацииОтпускается без рецепта. Сохраните у себя | ||||||||||||||||||||||||||||||||||||||||||||||
Бактериофаги можно подогреть?
- Форум
- Архив
- Детское здоровье
Прописали пиовалентный бактериофаг комплексный. Хранить только в холодильнике!
А как же его пить ребенку, если он ледяной из холодильника (хотя стоит в дверке холодильника)? Можно ли подогреть каким-то образом его? Не «умрут ли от этого подогрева» все живые бактерии???? Если можно — то каким образом, не принося вред бактериям?
Как прописывают нам фаги — так постоянно мучаюсь этим вопросом
можно только поставить в ёмкость с тёплой водой (не выше 36 градусов). нагреется минут за 5
нагреется минут за 5
Зачем? Там же ложечку одну выпить, неужели ложка холодного болотца может сильно повредить?
Вот сперва подогревают все подряд, от еды до влажных салфеток, а потом жалуются, что болеет ребенок от каждого дуновения ветерка…
Врач нам сказал,что надо выставлять на 10 минут в темное,теплое место.Мы пили весь флакон.
Мы делали так — наливала в чашку горячую воду, грела там столовую ложку, наливала в нагретую ложку бактериофаг, размешивала чистым мизинцем Если было нужно, опускала эту ложку с бактериофагом в чашку с горячей водой (так, чтобы вода не залилась в ложку) и, помешивая мизинцем, грела до нужной температуры (чтобы пальцу тепло было, но не горячо).
В бактериофаге вирусы, не бактерии.
Может-может. Не за чем во время болезни остужать воспаленное горло. Закаляться в здоровом состоянии надо, а не в больном.
Я сейчас даю прям из холодильника чайной ложкой, мы почти целый пузырек выпиваем, ничего. Он ей холодный больше нравится, чем в теплом виде.
Он ей холодный больше нравится, чем в теплом виде.
бактериофаги пьют обычно при больных кишках, а не больном горле.
Да и больному горлу одна ложка помехой не будет, если не доводить подогревание всего до абсурда.
Закаливание- это не лечебная пятиминутная процедура, типа увч или ингаляции. Это образ жизни. Всей жизни.
гуано хоть теплое, хоть холодное, бырррр, толку-то?
Прописывали дочери в 6 месяцев, добавляла прямо в смесь. Она естественно теплая была. И все прекрасно вылечили — т.е. своих свойств лекарство не утратило.
Если кишечник лечат, то действительно греть не за чем. Мы при ларингитах пили, из холодильника при ларингите ни за что не дам питьё. Тем более, что бывали и ларингоспазмы.
Открыть тему в окнах
Знаменитости в тренде
На церемонии закрытия Международного театрального фестиваля Onlife iDEA Fest выбрали победителей осеннего сезона
Как вежливо отказать подвыпившему коллеге, даже если он главный бухгалтер
Ярослав Бойко разводится с женой
Turning A Phage
В связи с тем, что резистентность микробов к антибиотикам перерастает в крупный глобальный кризис в области здравоохранения, исследователи из Медицинской школы Калифорнийского университета в Сан-Диего в сотрудничестве с национальными исследовательскими институтами и частными предприятиями используют накопленный с таким трудом опыт для использования естественный вирусный враг патогенных бактерий, создав первый в Северной Америке Центр инновационных применений фагов и терапии (IPATH).
Бактериофаги или фаги — это вирусы, которые специально нацелены на бактерии и потребляют их. Они вездесущи, встречаются везде, где существуют бактерии, и когда-то считались многообещающим терапевтическим средством. Появление современных антибиотиков в 1930-е годы переориентировали исследовательские интересы, но с учетом того, что к 2050 году от «супербактерий» умрут 10 миллионов человек, они получают второй взгляд.
В 2016 году врачи и ученые Медицинской школы Калифорнийского университета в Сан-Диего предприняли драматическую, последнюю попытку спасти жизнь Тома Паттерсона, доктора философии, в то время 69-летнего профессора кафедры психиатрии в школе Калифорнийского университета в Сан-Диего. Медицинский работник, заразившийся полирезистентной бактерией во время отпуска на Ближнем Востоке.
Сканирующая электронная микрофотография двух бактериофагов. Изображение предоставлено Wellcome Images
В коме и при смерти группа, в которую входили эксперты из Калифорнийского университета в Сан-Диего, ВМС США, Техасского университета A&M, Университета штата Сан-Диего и частного сектора, разработала экспериментальные коктейли бактериофагов для лечения Паттерсона. Подход сработал; Паттерсон очнулся через несколько дней и полностью выздоровел. Он был первым пациентом в США с системной бактериальной инфекцией с множественной лекарственной устойчивостью, которого успешно лечили внутривенным введением бактериофагов. За два года с тех пор врачи из UC San Diego Health лечили пять других пациентов фагами от бактериальных инфекций в рамках срочного исследования нового препарата, одобренного Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
Подход сработал; Паттерсон очнулся через несколько дней и полностью выздоровел. Он был первым пациентом в США с системной бактериальной инфекцией с множественной лекарственной устойчивостью, которого успешно лечили внутривенным введением бактериофагов. За два года с тех пор врачи из UC San Diego Health лечили пять других пациентов фагами от бактериальных инфекций в рамках срочного исследования нового препарата, одобренного Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
«Все пациенты хорошо переносили фаготерапию без побочных эффектов», — говорится в сообщении.
Сайма Аслам, MBBS, адъюнкт-профессор медицины и медицинский директор службы инфекционных заболеваний трансплантации паренхиматозных органов в UC San Diego Health. «Комбинации фагов вводили путем прямой инстилляции в инфицированный участок, внутривенно и/или ингаляционным путем. Это привело к разрешению инфекции в трех случаях. В двух других это помогло облегчить инфекцию. В одном случае лечение было начато слишком поздно в ходе инфекции, и пациент был переведен в хоспис».
Ободренный в целом положительными результатами, полученными у этих первых пациентов, ректор Калифорнийского университета в Сан-Диего Прадип Хосла объявил о трехлетнем гранте в размере 1,2 миллиона долларов США для помощи в открытии центра.
«История о том, как фаги спасли жизнь Тому и помогли другим, огромная глубина научных знаний и медицинской практики в сочетании с интуицией, инновациями и просто смелостью — вот что такое Калифорнийский университет в Сан-Диего», — сказал Хосла. «IPATH воплощает в себе многие из наших самых заветных амбиций: надежное междисциплинарное исследование, которое продвигает науку, но также приносит ощутимую пользу пациентам и обществу. Фаговая терапия может спасти миллионы жизней».
Стефани Стратди, доктор медицинских наук, заместитель декана факультета наук о глобальном здравоохранении и профессор Гарольда Саймона медицинского факультета, и
Роберт Скули, доктор медицинских наук, профессор медицины и эксперт по инфекционным заболеваниям Медицинской школы Калифорнийского университета в Сан-Диего, станет содиректором IPATH. Именно Стратди, которая замужем за Паттерсоном, сотрудничала со Скули и другими, чтобы добиться чрезвычайного исключения для использования в целях сострадания для экспериментального лечения своего мужа фагами после того, как все стандартные методы лечения антибиотиками не сработали.
Именно Стратди, которая замужем за Паттерсоном, сотрудничала со Скули и другими, чтобы добиться чрезвычайного исключения для использования в целях сострадания для экспериментального лечения своего мужа фагами после того, как все стандартные методы лечения антибиотиками не сработали.
«IPATH основывается на том, что мы узнали, и будет применять строгие принципы, которые охватывают весь спектр процедур — от лабораторного до прикроватного, чтобы лучше понять потенциальную роль фаговой терапии в лечении пациентов с инфекциями, которые невозможно успешно вылечить с помощью доступных в настоящее время антибиотиков», — говорится в сообщении. Стратди.
«Он использует и расширяет широкий спектр существующих программ клинических и трансляционных исследований — в мире мало мест с аналогичными ресурсами для лечения бактериальных инфекций с множественной лекарственной устойчивостью — и способствует развитию сотрудничества с Центром медицинских исследований ВМС США, промышленностью. партнеры и сильные стороны системы здравоохранения Калифорнийского университета в Сан-Диего».
Центр будет начинаться с нескольких ключевых сотрудников:
- Strathdee
- Schooley
- Aslam
- Davey Smith, MD, руководитель отдела инфекционных заболеваний и глобального общественного здравоохранения
- Constance Benson, MD 9002 9002, профессор медицины Мишель Риттер, доктор медицины, доцент медицины
- Рэнди Таплитц, доктор медицины, профессор медицины и клинический директор отделения инфекционных заболеваний
- Шарон Рид, доктор медицины, профессор патологии и медицины
- Дэвид Прайд, доктор медицинских наук, доцент кафедры патологии и медицины
- Дарси Вутен, доктор медицинских наук, доцент медицины
- Дженифер Дэн, доктор медицинских наук, старший научный сотрудник, отделение инфекционных болезней
- Дуг Конрад, доктор медицинских наук, профессор медицины
- Роб Найт, доктор медицинских наук, директор Центра инноваций в области микробиома; профессор педиатрии, информатики и инженерии
- Бернд Шнабл, доктор медицинских наук, доцент гастроэнтерологии
- Виктор Низе, доктор медицинских наук, профессор, Школа фармации и фармацевтических наук Скаггса и кафедра педиатрии
- Питер Доррестейн, доктор медицинских наук, профессор Школы фармации и фармацевтических наук Скаггса и кафедры педиатрии и фармакологии
Стратди и Скули заявили, что IPATH будет использовать существующие ресурсы Центра противовирусных исследований Калифорнийского университета в Сан-Диего для создания инфраструктуры, необходимой для проверки фаговой терапии. для лечения полирезистентных бактериальных инфекций в клинических условиях.
для лечения полирезистентных бактериальных инфекций в клинических условиях.
Он также будет сотрудничать с другими учреждениями-единомышленниками, включая Центр фаговых технологий (CPT) Техасского университета A&M, Университет штата Сан-Диего и две биотехнологические компании, специализирующиеся на разработке терапевтических бактериофагов: Ampliphi Biosciences, базирующаяся в Сан-Диего. и Adaptive Phage Therapeutics, Inc. или APT, базирующаяся в Мэриленде.
Хроническая бактериальная инфекция помешала 65-летнему Джоэлу Гримвуду сделать пересадку сердца, в которой он отчаянно нуждался. Врачи UC San Diego Health использовали экспериментальную терапию бактериофагами — вирусами, которые поедают бактерии — для устранения инфекции. Гримвуд получил свое новое сердце.
«CPT разрабатывает фаги как средства для борьбы с бактериальными инфекциями у растений, животных и людей с 2010 года и продвигает передовой опыт этичного и устойчивого использования этой технологии», — сказал Райланд Ф. Янг III, директор CPT и регенты. Профессор Техасского университета A&M. «CPT полностью поддерживает создание IPATH в Калифорнийском университете в Сан-Диего, и, основываясь на нашем прошлом сотрудничестве, которое привело к успешному применению фаговой терапии, мы надеемся на плодотворное взаимодействие в будущем».
Скули сказал, что основной целью IPATH является проведение строгих клинических испытаний фаговой терапии, тем самым продвигая их потенциал к практическому применению: «Клинические исследования будут объединены с передовыми трансляционными и фундаментальными исследованиями, которые обеспечат критическое понимание механизмов с помощью которых фаги избирательно убивают свои бактериальные мишени, и это ускорит развитие более продвинутых клинических исследований, которые, как мы надеемся, приведут FDA к тому, чтобы сделать фаговую терапию более доступной.
«Для этого требуется много вещей: инфраструктура клинических испытаний и опыт проектирования, знания микробиома, популяция пациентов, нуждающихся в новых вмешательствах, таких как фаговая терапия, которые хотят присоединиться к нам в этом путешествии. Несмотря на то, что все эти элементы присутствуют, мы планируем работать с широким кругом партнеров по всему миру, чтобы превратить фаговую терапию из анекдота в глобально доступный инструмент для борьбы с растущей волной инфекций с множественной лекарственной устойчивостью».
Первоначальное исследование будет сосредоточено на пациентах с хроническими инфекциями с множественной лекарственной устойчивостью, связанными с кистозным фиброзом, трансплантацией органов и имплантируемым оборудованием, таким как кардиостимуляторы или протезы суставов.
«Запуск IPATH — важный и отрадный шаг», — сказал Юбер Мазур, правнук Феликса д’Эреля, французско-канадского микробиолога, открывшего бактериофаги в 1917 году в Институте Пастера и впервые экспериментировавшего с ними. их в лечении заболеваний человека, вызванных патогенными бактериями. «Это те усилия, которые необходимы, чтобы по-настоящему и полностью изучить целебный потенциал бактериофагов в современную эпоху».
их в лечении заболеваний человека, вызванных патогенными бактериями. «Это те усилия, которые необходимы, чтобы по-настоящему и полностью изучить целебный потенциал бактериофагов в современную эпоху».
Чтобы узнать больше о терапии бактериофагами и истории Тома Паттерсона, посетите Health.ucsd.edu/phage
Электронная почта IPATH на [email protected]
Литические и лизогенные – понимание жизненных циклов бактериофагов
Бактериофаги (фаги) – это облигатные внутриклеточные вирусы, которые специфически инфицируют бактерии. Они были обнаружены независимо друг от друга двумя исследователями, Фредериком Уильямом Туортом ( 1 ) в Лондонском университете в 1915 году и Феликсом д’Эрелем ( 2 ), которые подтвердили открытие и ввели термин «бактериофаг» в 1917 году и с тех пор активно изучаются.
Фаг имеет очень простую структуру (рис. 1). Их генетический материал содержится в головке в форме призмы, окруженной белковым капсидом. Он соединен с удлиненной оболочкой (иногда называемой хвостом) областью шеи или воротника.
Оболочка образует полую трубку, через которую вирусная ДНК/РНК вводится в клетку-хозяина и окружена защитными белками оболочки. Внизу оболочки находится базальная пластинка, к которой прикрепляются хвостовые волокна (обычно шесть), облегчающие прикрепление к клетке-хозяину.
Литик против лизогена: в чем разница?
Литический цикл, или вирулентная инфекция, заключается в том, что вирус берет под контроль клетку-хозяин и использует ее для производства своего вирусного потомства, убивая хозяина в процессе. Лизогенный цикл, или невирулентная инфекция, заключается в том, что вирус ассимилирует свой геном с геномом клетки-хозяина для достижения репликации, не убивая хозяина.
Чтобы размножаться, фаг должен сначала проникнуть в клетку-хозяин. Они связываются со специфическими рецепторами на поверхности бактериальной клетки своими хвостовыми волокнами (адсорбция) и создают отверстие, процесс, который, наряду с прикреплением, координируется базовой пластинкой 3 .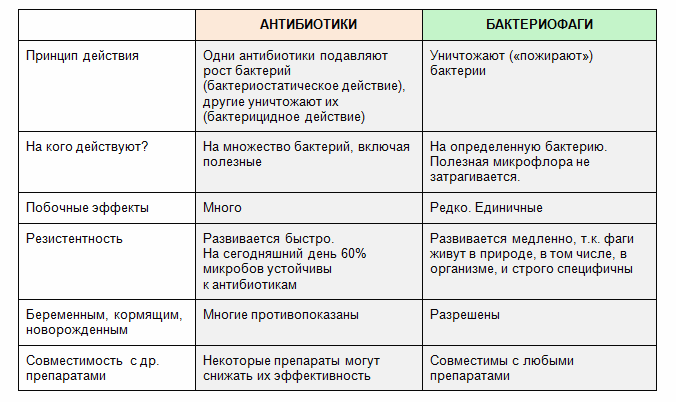 Жесткая трубка выдвигается из оболочки, прокалывая отверстие в мембране бактериальной клетки, через которое они вводят свой генетический материал (ДНК или РНК, двухцепочечные или одноцепочечные). Затем они могут захватить клеточный механизм клетки-хозяина для собственной репликации, если окружающие условия неблагоприятны в процессе, называемом литическим циклом. В качестве альтернативы они могут войти в состояние покоя, известное как лизогенный цикл, внутри клетки-хозяина, если условия благоприятны.
Жесткая трубка выдвигается из оболочки, прокалывая отверстие в мембране бактериальной клетки, через которое они вводят свой генетический материал (ДНК или РНК, двухцепочечные или одноцепочечные). Затем они могут захватить клеточный механизм клетки-хозяина для собственной репликации, если окружающие условия неблагоприятны в процессе, называемом литическим циклом. В качестве альтернативы они могут войти в состояние покоя, известное как лизогенный цикл, внутри клетки-хозяина, если условия благоприятны.
В литическом цикле (рис. 2), иногда называемом вирулентной инфекцией, заражающий фаг в конечном итоге убивает клетку-хозяина, производя множество собственных потомков. Сразу после инъекции в клетку-хозяин геном фага синтезирует ранние белки, которые расщепляют ДНК хозяина, позволяя фагу взять под контроль клеточный механизм.
Каковы этапы литического цикла? Литический цикл состоит из четырех стадий:
Понимание литического цикла – каковы шаги?
Затем фаг использует клетку-хозяина для синтеза оставшихся белков, необходимых для создания новых фаговых частиц. Головки и оболочки собираются отдельно, новый генетический материал упаковывается в головку и конструируются новые дочерние фаговые частицы. Во время этого процесса клетки-хозяева постепенно ослабевают под действием фаговых ферментов и в конце концов взрываются, высвобождая в окружающую среду в среднем 100-200 новых фаговых потомков.
Головки и оболочки собираются отдельно, новый генетический материал упаковывается в головку и конструируются новые дочерние фаговые частицы. Во время этого процесса клетки-хозяева постепенно ослабевают под действием фаговых ферментов и в конце концов взрываются, высвобождая в окружающую среду в среднем 100-200 новых фаговых потомков.
Рисунок 2. Изображение стадий литического цикла бактериофага.
Здесь можно посмотреть литический цикл в действии.
Лизогенный цикл
Лизогенный цикл (рис. 3), иногда называемый умеренной или невирулентной инфекцией, не убивает клетку-хозяина, а использует ее в качестве убежища, где она существует в спящем состоянии. После инъекции ДНК фага в клетку-хозяина она интегрируется в геном хозяина с помощью кодируемых фагом интеграз, где ее затем называют профагом. Затем геном профага пассивно реплицируется вместе с геномом хозяина, поскольку клетка-хозяин делится до тех пор, пока она остается там и не образует белков, необходимых для производства потомства. Поскольку геном фага обычно сравнительно невелик, бактериальные хозяева обычно относительно не повреждаются этим процессом.
Поскольку геном фага обычно сравнительно невелик, бактериальные хозяева обычно относительно не повреждаются этим процессом.
Рисунок 3. Изображение стадий лизогенного цикла бактериофага.
Переход от лизогенного к литическому
Если бактерия, содержащая профаг, подвергается воздействию стрессоров, таких как ультрафиолетовое излучение, условия с низким содержанием питательных веществ или химические вещества, такие как митомицин С, профаг может спонтанно выделиться из генома хозяина и войти в литический цикл в процесс, называемый индукцией.
Этот процесс, однако, не совершенен, и профаги могут иногда оставлять части своей ДНК или забирать с собой части ДНК хозяина, когда они повторно циркулируют. Если затем они заражают новую клетку-хозяина, они могут переносить бактериальные гены от одного штамма к другому в процессе, называемом трансдукцией. Это один из методов, с помощью которого гены устойчивости к антибиотикам, гены, кодирующие токсины и суперантигены, и другие признаки вирулентности могут распространяться в популяции бактерий.
Недавняя работа показала, что переход между литической и лизогенной инфекцией также зависит от обилия фагов в области, поскольку они способны продуцировать и воспринимать небольшие пептиды в процессе, похожем на определение кворума 4 .
Бактериальный иммунитет к фаговой инфекции
Не все бактерии беспомощны против фаговой атаки, обладая «иммунной системой», которая позволяет им дать отпор. CRISPR-Cas, который теперь является синонимом генетической модификации, был впервые предложен Франсиско Мохика в качестве бактериальной «адаптивной иммунной системы» 9.0085 5 и независимо группой из Université Paris-Sud 6 в 2005 г. Локус CRISPR представляет собой массив коротких повторяющихся последовательностей, разделенных спейсерами с уникальными последовательностями. Было обнаружено, что эти спейсерные последовательности имеют гомологию с вирусной и плазмидной ДНК, включая фаговую. При атаке ранее неизвестным фагом к одной стороне CRISPR добавляются новые спейсеры, что делает CRISPR хронологической записью фага, с которым столкнулась клетка и ее предки. В ответ на вторжение фага последовательности CRISPR транскрибируются и в партнерстве с белками Cas нацеливаются и разрушают последовательности фага, гомологичные последовательностям спейсеров.
При атаке ранее неизвестным фагом к одной стороне CRISPR добавляются новые спейсеры, что делает CRISPR хронологической записью фага, с которым столкнулась клетка и ее предки. В ответ на вторжение фага последовательности CRISPR транскрибируются и в партнерстве с белками Cas нацеливаются и разрушают последовательности фага, гомологичные последовательностям спейсеров.
Фаг как инструмент генетической и молекулярной биологии
Фаг Lambda, первоначально выделенный из Escherichia coli , является одним из наиболее изученных фагов и лег в основу многих генетических инструментов. Говорят даже, что использование фагов в качестве инструментов в конечном итоге привело к развитию молекулярной биологии как дисциплины 7 . В 1950-х годах способность фага рекомбинировать с ДНК хозяина была впервые использована для манипулирования геномами видов сальмонелл , и так родился процесс трансдукции 9.0085 8 . С тех пор он использовался в качестве средства для перемещения генетического материала между многими организмами, включая манипуляции с генами грибов 9 и даже с генами человека. Именно благодаря скромному фагу был впервые безопасно и дешево произведен человеческий инсулин. Он также открыл возможности для высокопроизводительного скрининга клонов, разработки наноматериалов 10 , антибактериальной обработки пищевых продуктов, в качестве диагностического инструмента и систем обнаружения и доставки лекарств 11 .
Именно благодаря скромному фагу был впервые безопасно и дешево произведен человеческий инсулин. Он также открыл возможности для высокопроизводительного скрининга клонов, разработки наноматериалов 10 , антибактериальной обработки пищевых продуктов, в качестве диагностического инструмента и систем обнаружения и доставки лекарств 11 .
Фаг ϕX174 стал невольным пионером в 1977 году, когда он стал первым организмом, полная последовательность нуклеотидов которого была определена благодаря Фреду Сенгеру и его коллегам 12 .
Фаговая терапия
До открытия антибиотиков Александром Флемингом в 1928 году фаги изучались как метод лечения бактериальных инфекций. В постантибиотическую эру удобный широкий спектр действия антибиотиков означал, что в большинстве организаций исследования фаговой терапии были заброшены. Однако во многих бывших советских странах, где не хватало западных антибиотиков, по необходимости продолжались исследования в области фаговой терапии. В связи с растущими глобальными проблемами устойчивости к антибиотикам в последние годы наблюдается возрождение в области фаготерапии. В то время как фаги способны заражать и уничтожать бактерии и успешно используются для лечения опасных для жизни инфекций 13 , их видовая и даже штаммовая специфичность, а также потенциал для ранее существовавшего иммунитета некоторых бактерий означают, что нацеливание на лечение фагами в настоящее время не является тривиальным процессом и должно быть адаптировано к индивидуальной инфекции. Это делает его дорогостоящим и длительным. Следовательно, в настоящее время это крайняя мера, и в этой области еще предстоит проделать большую работу.
В связи с растущими глобальными проблемами устойчивости к антибиотикам в последние годы наблюдается возрождение в области фаготерапии. В то время как фаги способны заражать и уничтожать бактерии и успешно используются для лечения опасных для жизни инфекций 13 , их видовая и даже штаммовая специфичность, а также потенциал для ранее существовавшего иммунитета некоторых бактерий означают, что нацеливание на лечение фагами в настоящее время не является тривиальным процессом и должно быть адаптировано к индивидуальной инфекции. Это делает его дорогостоящим и длительным. Следовательно, в настоящее время это крайняя мера, и в этой области еще предстоит проделать большую работу.
Генеалогическое древо фагов
С ростом доступности и доступности секвенирования нуклеотидов за последние два десятилетия произошел взрыв в количестве геномов фагов, представленных в базы данных 14 .
Фаги классифицируются Международным комитетом по таксономии вирусов (ICTV), по состоянию на их обновление 2017 года существует 19 семейств фагов, которые заражают бактерии и археи (таблица 1), но по мере секвенирования большего количества образцов из более отдаленных районов это в будущем может только расти.
Для мобильных пользователей выполните прокрутку влево и вправо, чтобы просмотреть данные таблицы ниже.
| Заказ | Семейство | Morphology | Nucleic acid | Examples | Subfamilies | Genera |
| Caudovirales | Ackermannviridae | dsDNA | 2 | 4 | ||
| Myoviridae | Безоболочечные, сократительный хвост | Линейная двухцепочечная ДНК | Фаг T4, Mu, PBSX, P1Puna-подобный, P2, I3, Bcep 1, Bcep 43, Bcep 78 | 6 | 41 | |
| Siphoviridae | Nonenveloped, noncontractile tail (long) | Linear dsDNA | λ phage, T5 phage, phi, C2, L5, HK97, N15 | 11 | 100 | |
| Podoviridae | Nonenveloped, noncontractile tail (short) | Linear dsDNA | T7 phage, T3 phage, Φ29, P22, P37 | 3 | 23 | |
| Ligamenvirales | Lipothrixviridae | Enveloped, rod-shaped | Linear dsDNA | Acidianus filamentous virus 1 | 3 | |
| Rudiviridae | Nonenveloped, rod-shaped | Linear dsDNA | Sulfolobus islandicus rod-shaped virus 1 | 1 | ||
| Не присвоено | Ампуллавирусы | Оболочечные, бутылковидные | Линейная дцДНК | 1 | 925 Budaviridae 6Nonenveloped, lemon-shaped | Circular dsDNA | 1 |
| Clavaviridae | Nonenveloped, rod-shaped | Circular dsDNA | 1 | |||
| Corticoviridae | Nonenveloped, isometric | Циркулярная дцДНК | 1 | |||
| Cystoviridae | Оболочечная, сферическая | Сегментированная дцРНК | 1 | |||
| Fuselloviridae | Nonenveloped, lemon-shaped | Circular dsDNA | 2 | |||
| Globuloviridae | Enveloped, isometric | Linear dsDNA | 1 | |||
| Guttaviridae | Безоболочечные, яйцевидные | Циркулярные двухцепочечные ДНК | 2 | |||
| Inoviridae | Безоболочечные, нитевидные | Circular ssDNA | M13 | 7 | ||
| Leviviridae | Nonenveloped, isometric | Linear ssRNA | MS2, Qβ | 2 | ||
| Microviridae | Nonenveloped, isometric | Circular ssDNA | ΦX174 | 2 | 6 | |
| Plasmaviridae | Оболочечные, плеоморфные | Циркулярная дц19 | 0252 | 1 | ||
| Tectiviridae | Nonenveloped, isometric | Linear dsDNA | 2 |
Table 1.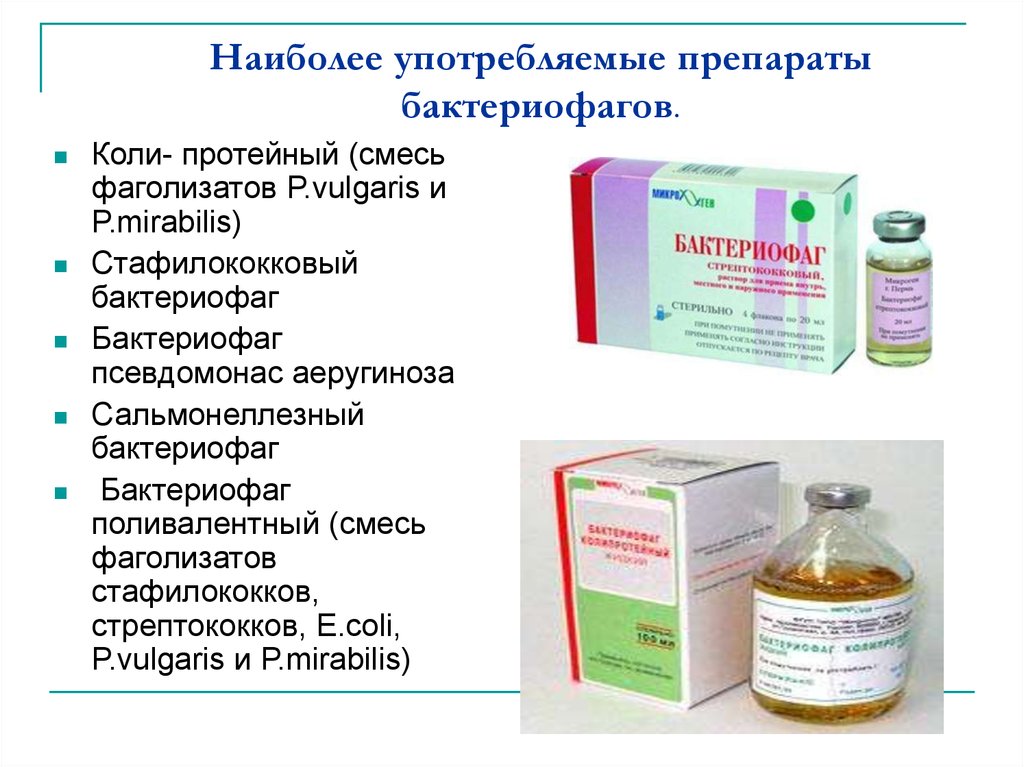 ICTV taxonomic classification of bacteriophage infecting bacteria and archaea.
ICTV taxonomic classification of bacteriophage infecting bacteria and archaea.
Ссылки
1. Twort FW. ИССЛЕДОВАНИЕ ПРИРОДЫ УЛЬТРАМИКРОСКОПИЧЕСКИХ ВИРУСОВ. Ланцет . 1915;186(4814):1241-1243. doi:10.1016/S0140-6736(01)20383-3
2. Д’Эрелль Ф. О невидимом микробе, антагонистическом по отношению к дизентерийным бациллам: краткая записка г-на Ф. Д’Эреля, представленная г-ном Ру. 1917. Res Microbiol . 2007;158(7):553-554. doi:10.1016/j.resmic.2007.07.005
3. Taylor NMI, Прохоров Н.С., Guerrero-Ferreira RC, et al. Структура базальной пластинки Т4 и ее функция в запуске сокращения влагалища. Природа . 2016;533(7603):346-352. doi:10.1038/nature17971
4. Эрез З., Стейнбергер-Леви И., Шамир М. и соавт. Коммуникация между вирусами определяет решения о лизисе-лизогении. Природа . 2017;541(7638):488-493. doi:10.1038/nature21049
5. Mojica FJM, Díez-Villaseñor C, García-Martínez J, Soria E. Промежуточные последовательности регулярно расположенных прокариотических повторов происходят из чужеродных генетических элементов. Дж Мол Эвол . 2005;60(2):174-182. doi:10.1007/s00239-004-0046-3
Промежуточные последовательности регулярно расположенных прокариотических повторов происходят из чужеродных генетических элементов. Дж Мол Эвол . 2005;60(2):174-182. doi:10.1007/s00239-004-0046-3
6. Pourcel C, Salvignol G, Vergnaud G. Элементы CRISPR в Yersinia pestis приобретают новые повторы за счет предпочтительного поглощения ДНК бактериофага и предоставляют дополнительные инструменты для эволюционных исследований. Микробиология (чтение) . 2005; 151 (часть 3): 653–663. doi:10.1099/mic.0.27437-0
7. Летний туалет. Бактериофаговая терапия. Annu Rev Microbiol . 2001;55:437-451. doi:10.1146/annurev.micro.55.1.437
8. Зиндер Н.Д., Ледерберг Дж. Генетический обмен у сальмонелл. J Бактериол . 1952;64(5):679-699. doi:10.1128/jb.64.5.679-699.1952
9. Chaveroche MK, Ghigo JM, d’Enfert C. Быстрый метод эффективной замены генов в нитчатом грибке Aspergillus nidulans. Рез. нуклеиновых кислот . 2000;28(22):E97. doi:10.1093/nar/28.22.e97
2000;28(22):E97. doi:10.1093/nar/28.22.e97
10. Чанг В.Дж., Сена М., Мерзляк А., Ли С.В. 2.206 — Фаги как инструмент для разработки функциональных наноматериалов. В: Дюшен П., изд. Комплексные биоматериалы . Эльзевир; 2011:95-111. doi:10.1016/B978-0-08-055294-1.00064-7
11. О’Салливан Л., Бутимер С., Маколифф О., Болтон Д., Коффи А. Инструменты на основе бактериофагов: последние достижения и новые применения. F1000Res . 2016;5:2782. doi: 10.12688/f1000research.9705.1
12. Сэнгер Ф., Эйр Г.М., Баррелл Б.Г. и др. Нуклеотидная последовательность ДНК бактериофага phi X174. Природа . 1977; 265(5596):687-695. doi:10.1038/265687a0
13. Scholey RT, Biswas B, Gill JJ, et al. Разработка и использование персонализированных лечебных коктейлей на основе бактериофагов для лечения пациентов с диссеминированной резистентной инфекцией Acinetobacter baumannii. Антимикробные агенты Chemother .

 10.14
10.14
 , Escherichia coli, Proteus spp., Enterococcus spp., Staphilococcus spp., Pseudomonas aeruginosa или их сочетанием:
, Escherichia coli, Proteus spp., Enterococcus spp., Staphilococcus spp., Pseudomonas aeruginosa или их сочетанием: 7
7 Препарат применяют через рот 3 раза в сутки за 30 минут до кормления. В случаях неукротимой рвоты препарат применяют в виде высоких клизм (через газоотводную трубку или катетер) ежедневно. Возможно сочетание ректального (в виде высоких клизм) и перорального применения препарата. Курс лечения 7 -10 дней.
Препарат применяют через рот 3 раза в сутки за 30 минут до кормления. В случаях неукротимой рвоты препарат применяют в виде высоких клизм (через газоотводную трубку или катетер) ежедневно. Возможно сочетание ректального (в виде высоких клизм) и перорального применения препарата. Курс лечения 7 -10 дней. Продолжительность приема препарата определяется условиями эпидситуации.
Продолжительность приема препарата определяется условиями эпидситуации.
