Реанимация отделения больницы №2 Отделение анастезиологии и реанимации
Отделение анестезиологии-реанимации №2
— Эпидуральная аналгезия при физиологических родах: выполняется как по желанию женщины, так и по медицинским показаниям. Суть метода заключается во введении местного анестетика, врачом анестезиологом, через тонкий катетер (трубочку) установленный в эпидуральном пространстве. Выполняется квалифицированными врачами анестезиологами-реаниматологами с использованием одноразовых наборов для эпидуральной аналгезии и импортных анестетиков. В результате действия анестетика на нервные корешки можно достигнуть различной степени обезболивания схваток, обезболивание продолжается до момента родов, что позволяет рожать в комфортных условиях. В течении всего процесса обезболивания проводится непрерывный мониторинг состояния матери и плода. Так как анестетик практически не поступает в кровоток влияние на плод отсутствует. В случае возникновения необходимости родоразрешения путем операции кесарево сечение ее чаще всего возможно провести применив более мощный анестетик через установленный эпидуральный катетер.
— Спинальная анестезия: является методом выбора при операции кесарево сечение и при многих гинекологических операциях при отсутствии противопоказаний к ней. Суть метода заключается во введении местного анестетика, врачом анестезиологом, через специальную иглу для спинальной анестезии. Позволяет добиться качественного обезболивания при минимальном воздействии на организм женщины (самостоятельное дыхание, сохраненное сознание, стабильное артериальное давление) и практически полном отсутствии влияния анестезии на плод. При нежелании пациентки во время операции находиться в сознании, возможно проведение седации (медикаментозный сон). Выполняется квалифицированными врачами анестезиологами-реаниматологами с использованием одноразовых супертонких игл для спинальной анестезии и импортных анестетиков. В течении всей операции и в послеоперационном периоде проводится непрерывный мониторинг состояния пациентки.
— Эндотрахеальный наркоз: один из методов обезболивания операции кесарево сечение (при противопоказаниях к спинальной и эпидуральной анестезии), а также при гинекологических операциях (в том числе лапароскопических). Суть метода заключается во введении препаратов для наркоза внутривенно и ингаляционно, что позволяет достичь качественного обезболивания на протяжении всей операции, при этом пациентка находится в состоянии медикаментозного сна, дыхание поддерживается путем искусственной вентиляции легких при помощи наркозно-дыхательного аппарата. Выполняется квалифицированными врачами анестезиологами-реаниматологами с использованием импортных анестетиков, а также одноразовых расходных материалов. В течении всей операции и в послеоперационном периоде проводится непрерывный мониторинг состояния пациентки.
Суть метода заключается во введении препаратов для наркоза внутривенно и ингаляционно, что позволяет достичь качественного обезболивания на протяжении всей операции, при этом пациентка находится в состоянии медикаментозного сна, дыхание поддерживается путем искусственной вентиляции легких при помощи наркозно-дыхательного аппарата. Выполняется квалифицированными врачами анестезиологами-реаниматологами с использованием импортных анестетиков, а также одноразовых расходных материалов. В течении всей операции и в послеоперационном периоде проводится непрерывный мониторинг состояния пациентки.
— Общее внутривенное обезболивание импортными лекарственными препаратами при малых гинекологических операциях
 Суть метода заключается во внутривенном введении анестетиков, что позволяет добиться качественного обезболивания при сохраненном самостоятельном дыхании, при этом пациентка находится в состоянии медикаментозного сна. Выполняется квалифицированными врачами анестезиологами-реаниматологами с использованием импортных анестетиков, а также одноразовых расходных материалов. Применение дорогостоящих анестетиков импортного производства позволяет достичь максимального комфорта пациентки во время операции, при пробуждении и в послеоперационном периоде.
Суть метода заключается во внутривенном введении анестетиков, что позволяет добиться качественного обезболивания при сохраненном самостоятельном дыхании, при этом пациентка находится в состоянии медикаментозного сна. Выполняется квалифицированными врачами анестезиологами-реаниматологами с использованием импортных анестетиков, а также одноразовых расходных материалов. Применение дорогостоящих анестетиков импортного производства позволяет достичь максимального комфорта пациентки во время операции, при пробуждении и в послеоперационном периоде.все «за» и «против» / «Жду малыша»
Олеся Бутузова
Любая беременная ждёт родов — долгожданного момента встречи со своим малышом. Однако многие при этом испытывают и противоречивое чувство — страх. Как правило, большинство женщин, наслушавшихся рассказов «бывалых» подруг, боятся боли. Именно поэтому современная беременная задумывается не только об имени для будущей крохи, но также и о…обезболивании.
Суть данной методики устранения боли заключается в введении местного анестетика под твёрдую оболочку спинного мозга, туда, где проходят корешки спинномозговых нервов. «Оглушив» их, можно избавить беременную от болевых ощущений.
Чем хороша эпидуральная анестезия?
Эпидуральная анестезия не зря так популярна как среди акушеров-гинекологов, так и среди рожениц. Она устраняет боль и даёт женщине возможность передохнуть. При небольшом введении препарата роженица может самостоятельно передвигаться, не испытывая при этом дискомфорта. Во время операции кесарево сечение мама находится в сознании и не пропускает чудесного момента первой встречи с малышом.
Как правило, введение препарата осуществляется дозированно, поступает он прямо по назначению — к нервным корешкам, поэтому и дозировки минимальны. Всё это позволяет печени быстро очищать кровь и утилизировать остатки, не пропуская лекарство к малышу. Таким образом, эпидуральная анестезия практически безопасна для малыша.
Всё это позволяет печени быстро очищать кровь и утилизировать остатки, не пропуская лекарство к малышу. Таким образом, эпидуральная анестезия практически безопасна для малыша.
Только обезболить?
- Таким образом, эпидуральная анестезия оказывает целый ряд полезных эффектов:
- Облегчает болевые ощущения в родах и даёт женщине возможность отдохнуть и поднабраться сил для важного периода потуг.
- Снижает повышенное артериальное давление, гипервентиляцию лёгких и уровень адреналина, что действует на организм успокаивающе. Эпидуральная анестезия облегчает раскрытие шейки матки и снижает травматизм при преждевременных родах, координирует схватки и работу мышц матки.

Как проводится процедура?
Чтобы произвести прокол, доктор сначала должен правильно расположить беременную (что бывает непросто при болезненных схватках). Роженице рекомендуется сесть на стул, лицом к спинке или лечь на бок, свернувшись калачиком.
Место прокола тщательно обрабатывается растворами антисептиков, дабы свести к минимуму риск инфицирования.
Кожа и подкожно-жировая клетчатка обкалываются местным анестетиком, чтобы обезболить введение иглы под твёрдую оболочку спинного мозга.
Специальной иглой доктор проникает в эпидуральное пространство и проводит по ней катетер, через который осуществляется доставка лекарственного препарата.
Медицинские показания для эпидуральной анестезии:
- Операция кесарево сечение.
- Болезни сердца, в том числе и пороки, — уменьшается нагрузка на сердце.
- Болезни почек.

- Сахарный диабет.
- Повышенное артериальное давление. Эпидуральная анестезия способствует его снижению.
- Недоношенная беременность. Эпидуральная анестезия способствует расслаблению мышц тазового дна и уменьшению сопротивления, оказываемого головке малыша. Ребёнок выходит плавно и мягко.
- Дискоординация родовой деятельности — состояние, при котором схватки становятся нерегулярными, частыми, болезненными и непродуктивными. Они изматывают женщину, но не способствуют рождению ребёнка. Эпидуральная анестезия приводит в порядок тонус матки и мышечные сокращения, координируя тем самым родовую деятельность.
Но эпидуральная анестезия подходит не всем. Существует целый перечень противопоказаний к проведению подобного обезболивания.
Наш эксперт
Алла Мисютина, врач отдела «Медицинские офисы ИНВИТРО»
Если роды протекают нормально, природа сама делает своё дело — любое вмешательство может стать лишним, в данной ситуации от анестезии вообще можно отказаться. Однако эпидуральная анестезия — одно из предпочтительных методов анестезии в акушерстве. Начало действия данного обезболивания постепенное и медленное. Обезболивание обычно развивается через 10-20 минут после эпидурального введения и может быть продолжено до конца родов, так как дополнительные дозы препаратов могут быть введены через эпидуральный катетер. После родов катетер извлекается и спустя несколько часов все ощущения возвращаются к норме. Анестезия предполагает полную блокировку ощущений и движений, используется чаще при проведении кесарева сечения.
Однако эпидуральная анестезия — одно из предпочтительных методов анестезии в акушерстве. Начало действия данного обезболивания постепенное и медленное. Обезболивание обычно развивается через 10-20 минут после эпидурального введения и может быть продолжено до конца родов, так как дополнительные дозы препаратов могут быть введены через эпидуральный катетер. После родов катетер извлекается и спустя несколько часов все ощущения возвращаются к норме. Анестезия предполагает полную блокировку ощущений и движений, используется чаще при проведении кесарева сечения.
Иногда при родах проводят эпидуральную аналгезию, с помощью которой снимаются только болезненные ощущения. Тогда нервы, отвечающие за моторные функции, остаются частично в рабочем состоянии, и при желании женщина может двигаться — переворачиваться, садиться, стоять. Схватки становятся безболезненными и ощущаются роженицей лишь как давление внизу, на прямую кишку. При грамотном подходе врачей — гинекологов и анестезиологов — риск минимален. Акушеры-гинекологи широко пропагандируют данный вид обезболивания, и многие женщины легко соглашаются на его применение.
Акушеры-гинекологи широко пропагандируют данный вид обезболивания, и многие женщины легко соглашаются на его применение.
О побочных эффектах
Но, как и любая другая полезная медицинская манипуляция, эпидуральная анестезия не лишена побочных эффектов.
Самым распространённым является снижение артериального давления. Это чревато нарушением плацентарного кровотока и гипоксией, то есть кислородным голоданием у малыша.
Второй серьёзной реакцией может быть аллергическая. Для профилактики анафилактического шока в начале процедуры проводят пробное введение препарата. Если роженица почувствовала боль, жжение или зуд в области прокола, то врачи «прикрывают» анестезию противоаллергическими средствами.
При прокалывании возможно попадание лекарства в спинномозговой канал, что чревато затруднением дыхания и падением артериального давления. Также возможно травмирование корешков спинномозговых нервов и болевые ощущения в конечностях. При введении препарата под твёрдую оболочку спинного мозга существует риск попадания в эпидуральные вены. В таких случаях развиваются тяжёлые осложнения — резкое падение артериального давления, нарушение сердечного ритма и головокружение. Часто подобная ситуация сопровождается онемением языка.
При введении препарата под твёрдую оболочку спинного мозга существует риск попадания в эпидуральные вены. В таких случаях развиваются тяжёлые осложнения — резкое падение артериального давления, нарушение сердечного ритма и головокружение. Часто подобная ситуация сопровождается онемением языка.
Проникновение бактерий в месте прокола может привести к менингиту.
При повреждении твёрдой мозговой оболочки и, как следствие, попадании в эпидуральное пространство спинномозговой жидкости может возникать головная боль. Она появляется через несколько дней после родов и может длиться до полутора месяцев.
Что касается побочных эффектов со стороны ребёнка, то это может быть угнетение дыхания, нарушение моторики, затруднение сосания.
Однако хочется заметить, что по статистике, все эти осложнения встречаются нечасто.
Таким образом, эпидуральная анестезия — эффективный способ обезболивания в родах, помогающий маме набраться сил перед встречей с крохой. А также лечебная процедура, устраняющая ряд осложнений во время родов. Хотя применять ли эпидуральную анестезию, если к ней нет показаний, решать, конечно же, вам.
А также лечебная процедура, устраняющая ряд осложнений во время родов. Хотя применять ли эпидуральную анестезию, если к ней нет показаний, решать, конечно же, вам.
Перечень противопоказаний к проведению эпидуральной анестезии:
- Высокое внутричерепное давление.
- Низкое артериальное давление (ниже 100 мм рт.ст.).
- Искривления позвоночника.
- Бессознательное состояние роженицы.
- Сепсис.
- Кровотечение или нарушение свёртываемости крови.
- Серьёзные неврологические или психические заболевания роженицы.
- Аллергия на медикаменты, применяемые для эпидуральной анестезии.
Эпидуральная анестезия. В защиту разумного отношения к эпидуральной анестезии
Меня попросили ответить на два письма, полученные Центром традиционного акушерства как реплики на статью «Эпидуральная анестезия: за и против».
Ольга Ч.: «Создаётся ощущение, что подобная статья написана не женщиной, которая сама рожала или ей предстоит этот процесс, а бесчувственным медработником, для которого наблюдение за обезумевшими от мучений рожающими женщинами – явление повседневное, каждодневная работа, как у бухгалтера баланс. Зная себя, как человека терпеливого, я 17 лет назад пошла рожать с гордым чувством «уж мы-то не позволим себе позориться криком». Ад, который я пережила в ту ночь, не сравнится ни с какими болевыми ощущениями. В итоге всё это завершилось не обычным родовспоможением, как избавлением от нескончаемых мук, а наложением акушерских щипцов. Естественно, в своём полубессознательном состоянии, я и думать не могла, что я помогаю или врежу малышу своим диким криком (я просто этого не могла понимать и, соответственно, как-то регулировать). Не страх убивает разум, а бесконечная, изнуряющая сильная боль. Отчего ж в тот момент мне не сделали обезболивания? Ведь только тогда бы я смогла прочувствовать всю прелесть от осознания того, что я дарю жизнь, и не дала бы моему мальчику начать задыхаться. А последствия пережитого таковы, что не считая долговременной депрессии (это уже такие мелочи в сравнении с процессом и последствиями «родов на живую»), я не смогла стать той же полноценной женщиной для своего мужа ни через 2 месяца, ни через 9 лет, и в итоге мы расстались. Теперь я беременна во второй раз, пошла на это ради второго мужа. И теперь-то я точно знаю, что анестезия — единственно возможное решение, во всяком случае, для меня. Я хочу наслаждаться чудом, которое предстоит, радоваться появлению долгожданного ребёнка, улыбаться мужу, быть с ним вместе в момент появления, не стесняясь своего искажённого муками тела и лица. И после получать удовольствие от жизни, а не жить нескончаемым осознанием своей неполноценности, как женщины, и непроходимыми депрессивными состояниями. Не пойму до сих пор одного: почему только в России-матушке мы живём какими-то наигранными предубеждениями, и для того, чтобы что-то получить, всенепременно нужно сильно настрадаться. Это в наш-то век, когда изобрели способы избавления от мучений, наши врачи настойчиво будут убеждать тебя получить удовольствие от страданий! Под эту дудку и зубы можно по старинке без анестезии лечить, а почему бы и нет? Наши деды терпели и нам надо.
А последствия пережитого таковы, что не считая долговременной депрессии (это уже такие мелочи в сравнении с процессом и последствиями «родов на живую»), я не смогла стать той же полноценной женщиной для своего мужа ни через 2 месяца, ни через 9 лет, и в итоге мы расстались. Теперь я беременна во второй раз, пошла на это ради второго мужа. И теперь-то я точно знаю, что анестезия — единственно возможное решение, во всяком случае, для меня. Я хочу наслаждаться чудом, которое предстоит, радоваться появлению долгожданного ребёнка, улыбаться мужу, быть с ним вместе в момент появления, не стесняясь своего искажённого муками тела и лица. И после получать удовольствие от жизни, а не жить нескончаемым осознанием своей неполноценности, как женщины, и непроходимыми депрессивными состояниями. Не пойму до сих пор одного: почему только в России-матушке мы живём какими-то наигранными предубеждениями, и для того, чтобы что-то получить, всенепременно нужно сильно настрадаться. Это в наш-то век, когда изобрели способы избавления от мучений, наши врачи настойчиво будут убеждать тебя получить удовольствие от страданий! Под эту дудку и зубы можно по старинке без анестезии лечить, а почему бы и нет? Наши деды терпели и нам надо. А испытаний в жизни и так предостаточно, болью в том числе. Так что ж вы агитируете (особенно неопытных и нерожавших) на такие муки, оправдывая это какими-то духовно-этическими моментами?! А стоит ли так страдать? Кому как не вам знать, что сильная боль вызывает выработку адреналина, который сокращает сосуды, как результат-гипоксия плода. Кому сделали лучше? И эти ваши лицемерные умозаключения, что любовь – лучшее обезболивающее уж никак не подходят к ситуации с родами. Будьте милосерднее, ведь вы же тоже женщины!»
А испытаний в жизни и так предостаточно, болью в том числе. Так что ж вы агитируете (особенно неопытных и нерожавших) на такие муки, оправдывая это какими-то духовно-этическими моментами?! А стоит ли так страдать? Кому как не вам знать, что сильная боль вызывает выработку адреналина, который сокращает сосуды, как результат-гипоксия плода. Кому сделали лучше? И эти ваши лицемерные умозаключения, что любовь – лучшее обезболивающее уж никак не подходят к ситуации с родами. Будьте милосерднее, ведь вы же тоже женщины!»
Kira: «На какие именно исследования и каких именно гинекологов вы опираетесь, позвольте узнать? Меня просто поражает откровенный цинизм наших медиков. В нашей дикой стране вообще торжество бесправия находит свое наивысшее воплощение, когда человек становится подследственным или пациентом. Все эти рассуждения о пользе боли при родах – просто смехотворны. Почему бы вам, уважаемые врачи, не полечить бы себе зубки без наркоза? Ведь раньше кузнецы их так и драли, а беднягу-пациента в этот момент держали 4 человека. Выживаемость тоже была неплохая, обезболивание при родах в цивилизованных странах применяется со времен королевы Виктории. А в нашей стране страдание, боль и унижение пациентов, в том числе и женщин в родильных домах, воспринимаются как неотъемлемая часть общего ритуала. Женщины в данном случае с этим мирятся просто потому, что им просто не с чем сравнивать, а желание вырваться из гестапо живой и здоровой и со здоровым (ну хотя бы относительно) ребенком подавляет чувство собственного достоинства. Отсюда результат: никто и не посмеет возразить на клизмы, бритье и отсутствие нормального обезболивания. Если же женщина просит обезболивание – она уже все: слабая, избалованная, наглая и вообще не «наша» женщина. Уважаемые врачи! Живите в ногу со временем, учитесь у западных коллег — они ушли от вас лет на 30 вперед во всех отношениях. Особенно учитесь отношению к пациентам. А если вы не умеете делать эпидуральную анестезию грамотно, так научитесь, а не охаивайте метод. Вы ссылаетесь на труды западных гинекологов, так чтобы быть до конца объективными, приведите статистику применения эпидуральной анестезии в западных странах, а также статистику кесаревых (последнее, кстати, делается в цивилизованных странах по желанию пациентки, в отличие от нашей страны, где врачи с пеной у рта доказывают, какая это сверхопасная и сложная операция, которая должна делаться строго по показаниям).
Выживаемость тоже была неплохая, обезболивание при родах в цивилизованных странах применяется со времен королевы Виктории. А в нашей стране страдание, боль и унижение пациентов, в том числе и женщин в родильных домах, воспринимаются как неотъемлемая часть общего ритуала. Женщины в данном случае с этим мирятся просто потому, что им просто не с чем сравнивать, а желание вырваться из гестапо живой и здоровой и со здоровым (ну хотя бы относительно) ребенком подавляет чувство собственного достоинства. Отсюда результат: никто и не посмеет возразить на клизмы, бритье и отсутствие нормального обезболивания. Если же женщина просит обезболивание – она уже все: слабая, избалованная, наглая и вообще не «наша» женщина. Уважаемые врачи! Живите в ногу со временем, учитесь у западных коллег — они ушли от вас лет на 30 вперед во всех отношениях. Особенно учитесь отношению к пациентам. А если вы не умеете делать эпидуральную анестезию грамотно, так научитесь, а не охаивайте метод. Вы ссылаетесь на труды западных гинекологов, так чтобы быть до конца объективными, приведите статистику применения эпидуральной анестезии в западных странах, а также статистику кесаревых (последнее, кстати, делается в цивилизованных странах по желанию пациентки, в отличие от нашей страны, где врачи с пеной у рта доказывают, какая это сверхопасная и сложная операция, которая должна делаться строго по показаниям). Ну, если эта эпидуральная анестезия так плоха, то почему же она так массово применяется в Европе и Америке? Или мы такие бедные потому, что такие умные? Ольга, Ч — всех вам благ. Выберете себе обезболивание по душе и родите ребенка с радостью и достоинством.
Ну, если эта эпидуральная анестезия так плоха, то почему же она так массово применяется в Европе и Америке? Или мы такие бедные потому, что такие умные? Ольга, Ч — всех вам благ. Выберете себе обезболивание по душе и родите ребенка с радостью и достоинством.
Ответ доктора Вероники Назаровой.
Обезболивание в родах: многоликая правда
Признаться, я разделяю негодование жестоко пострадавших мам по поводу бесчувственных врачей, родов, подобных пыткам, унижения женщин в нашем здравоохранении! И это они еще не все знают, мы как врачи знаем гораздо больше и от того нам еще больнее и страшнее. Именно это заставило нас решиться практиковать иное акушерство, а для этого обратиться к корням, к традиции. Поверьте, официально практиковать в нашей стране акушерство с индивидуальным, гуманным и щадящим подходом очень непросто. С обезболиванием все обстоит гораздо лучше.
К несчастью ли или к счастью, вы, дорогие Кира и Ольга, просто не в курсе всей сложности этой темы – обезболивания в акушерстве.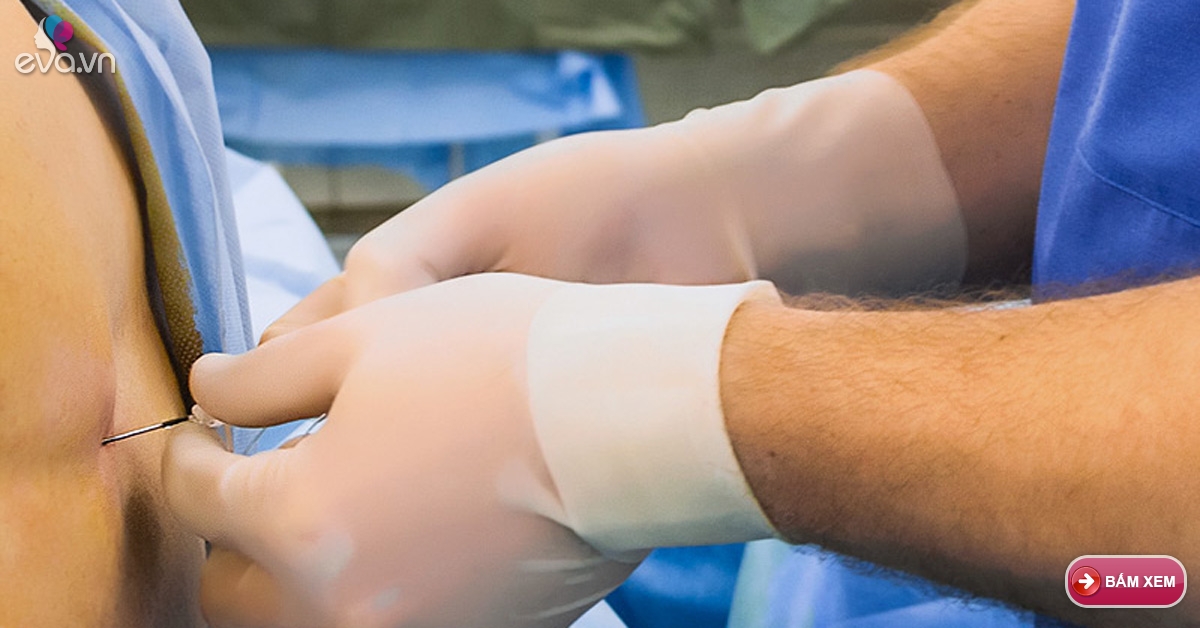 Если б вы просто пребывали в своем счастливом неведении, я бы не стала вас разубеждать. Однако вы, сами того не ведая, проповедуете опасные вещи и публично обвиняете нас в намеренной жестокости. Поэтому мне придется ответить. Желающие оставаться при своем не слишком компетентном мнении могут дальше не читать.
Если б вы просто пребывали в своем счастливом неведении, я бы не стала вас разубеждать. Однако вы, сами того не ведая, проповедуете опасные вещи и публично обвиняете нас в намеренной жестокости. Поэтому мне придется ответить. Желающие оставаться при своем не слишком компетентном мнении могут дальше не читать.
Противники ли мы эпидуральной анестезии? Скажите, вы за протезирование ног у инвалида или против? Вы за бифокальные очки для слабовидящих или против? Вы сторонник использования кровезаменителей или противник? Что за дурацкие вопросы! Те, кто в этом нуждаются, должны это иметь, правда? Или в нормальной, «недикой» стране все это должно предлагаться или навязываться всем гражданам поголовно? Абсолютно то же с анестезией: те немногие, которые в ней действительно нуждаются, должны ее иметь. Ну, право же, поверьте: не всем в родах непереносимо больно, а кое-кому не больно вообще! Мерить же человечность и цивилизованность государства обилием анестезии в родах – примерно то же, что судить о ней по тому, насколько широко применяются там мощные антибиотики при насморке.
Это только кажется, что сделали тебе анестезию – и все проблемы решены: лежишь себе, ничего не чувствуя, а как придет время малышу родиться – так и рожаешь. На деле же почти всегда происходит следующее: под действием эпидуральной анестезии схватки становятся слабее, приходится их усиливать с помощью окситоцина. Вводимый внутривенно синтетический окситоцин вызывает неестественный для этих мамы и ребенка ритм схваток, что ведет к страданию ребенка (в схватку кислорода к нему поступает меньше) и его травматичному продвижению по родовым путям матери (ее ткани не успевают растянуться). К тому же мама обездвижена (и нередко уже вскрыт плодный пузырь), из-за чего у ребенка меньше возможности правильно вставить головку в отверстие таза матери). Очень часто при этой анестезии потуги не наступают самостоятельно, и мама недостаточно чувствует свое тело, чтобы тужиться произвольно. Тогда ребенка «выжимают» из материнского тела, давя на живот (этот прием запрещен в Европе). Таким образом, давление на шейные позвонки ребенка, и без того значительное, усиливается. Здесь советую вам обратиться к книге известного детского невролога проф. А. Ратнера «Неврология новорожденных», где показана связь между акушерскими манипуляциями и их последствиями в виде родовой травмы шейного отдела позвоночника у малыша (эта замечательная книга доступна для чтения в Интернете). Поскольку ткани мамы не растягиваются в своем ритме, во избежание сильных разрывов делают разрез промежности. Посчитайте сами количество медицинских вмешательств. Не обольщайтесь: одного обезболивания с последующим естественным течением процесса не будет. Роды будут медикаментозно-технологическим родоразрешением до конца.
Здесь советую вам обратиться к книге известного детского невролога проф. А. Ратнера «Неврология новорожденных», где показана связь между акушерскими манипуляциями и их последствиями в виде родовой травмы шейного отдела позвоночника у малыша (эта замечательная книга доступна для чтения в Интернете). Поскольку ткани мамы не растягиваются в своем ритме, во избежание сильных разрывов делают разрез промежности. Посчитайте сами количество медицинских вмешательств. Не обольщайтесь: одного обезболивания с последующим естественным течением процесса не будет. Роды будут медикаментозно-технологическим родоразрешением до конца.
Если делать эпидуральную анестезию по правилам, то нужно владеть искусством применить ее вовремя: не слишком рано и не слишком поздно. У здоровой женщины переходный период схваток, на этапе раскрытия 8 – 10 см, очень часто сопровождается ощущением «я больше не могу». Мамы требуют анестезии, но в этот момент делать ее нельзя: матери невозможно будет вытужить ребенка. Женщине тут нужно еще немного терпения – ребенок родится совсем скоро.
Женщине тут нужно еще немного терпения – ребенок родится совсем скоро.
Готова вновь и вновь напоминать: роды – не пассивный процесс восприятия вами медицинского вмешательства, а рождение матерью своего ребенка. Роды – не медицинская процедура, а явление сексуальной жизни (это не метафора, с точки зрения гормонального баланса и необходимых условий это так). То, что иногда требуется медицинская помощь, сути не меняет. Массовое обращение к медицине в родах и поголовное применение акушерских вмешательств – это всего лишь культурный стереотип, а не необходимость.
Теперь о пользе и риске. К эпидуральной анестезии нельзя относиться как к услуге. Это медицинское вмешательство скорее можно сравнивать с операцией на спинном мозге, чем с косметической процедурой вроде липосакции. Даже при нынешней надежной, безопасной и вооруженной «до зубов» медицинской технологии здесь может быть большое количество осложнений, причем для двух человек. Неудивительно, ведь даже простое лекарство от кашля, даже таблетка от головной боли могут быть опасны (почитайте инструкцию!) Поэтому на эти операции в родах нужно именно решаться, выбирая из двух зол меньшее, а не производить всем подряд и не подавать «на заказ», как блюдо в ресторане. Кстати, врачи это прекрасно знают, поэтому перед этими вмешательствами вам предложат подписать документ, отражающий ваше согласие на них, а также то, что о возможных осложнениях вы предупреждены. Есть ситуации, когда эпидуральная анестезия может быть благотворна и спасительна.
Кстати, врачи это прекрасно знают, поэтому перед этими вмешательствами вам предложат подписать документ, отражающий ваше согласие на них, а также то, что о возможных осложнениях вы предупреждены. Есть ситуации, когда эпидуральная анестезия может быть благотворна и спасительна.
Эпидуральная анестезия: положительные стороны эпидуральной анестезии
- Облегчает боль в родах и дает возможность отдыха, когда боль объективно мучительна, а также при затяжных родах (например, ребенок неправильно вставляет головку в отверстие малого таза). Вероятно, это и был Ваш случай, Ольга. Я уверена в неадекватности медицинской помощи в Вашей ситуации: нужно было либо вовремя сделать обезболивание, либо решиться на кесарево сечение – иногда только так можно избежать тяжелой травмы у мамы и ребенка.
- Снижает уровень катехоламинов (адреналина).
- Показана при повышенном артериальном давлении (ведет к его снижению).
- Оптимальна для кесарева сечения.
- Может облегчить раскрытие шейки матки и приблизить потуги.

- Эпидуральная анестезия лучше внутривенного введения наркотических препаратов (промедола).
- Позволяет родить через естественные родовые пути тем, кто категорически отказывается терпеть какую бы то ни было боль.
- Теперь перечислим, какие возможны осложнения.
Эпидуральная анестезия: отрицательные стороны эпидуральной анестезии для мамы
- Возможны многомесячные головные боли; если происходит прокол твердой мозговой оболочки. А такое случается у 3%, то есть 70% таких мам страдают головными болями.
- Возможны многомесячные боли в спине.
- Возможно снижение артериального давления, что потребует находиться в родах в положении лежа и, возможно, надо будет вводить жидкости внутривенно.
- Заставляет женщину лежать и тем самым убирает действие гравитации, помогающей продвижению ребенка, становится невозможно менять позы.
- Для продолжения родов может потребоваться стимуляция схваток – введение окситоцина (особенно в первых родах).

- Может возникнуть неприятная дрожь.
- Выше риск того, что потребуются щипцы и вакуум-экстракция (это увеличивает возможность травматизма, недержания кала и мочи у мамы впоследствии).
- Выше вероятность того, что потребуется кесарево сечение (особенно если эпидуральная анестезия сделана слишком рано, и в первых родах).
- Может вызвать послеродовую задержку мочи.
- Может вызвать подъем температуры у мамы до 38 С из-за нарушения терморегуляции через центральную нервную систему (такую лихорадку очень трудно отличить от инфекции, соответственно выше риск получить антибиотики после родов «на всякий случай»).
- Может затруднить потуги.
- Может вызвать зуд лица, шеи, груди.
- Может привести к септическому менингиту (внесение инфекции при проколе и длительном нахождении катетера).
- Может возникнуть гематома из-за повреждения сосудов эпидурального пространства.
- Может быть подтекание спинномозговой жидкости после родов.

- Может случиться гидротравма спинного мозга (лекарство вводится под давлением), а также повреждение иглой, с последующей невозможностью ходить, нарушениями процессов мочеиспускания и дефекации.
- Может проявиться аллергия на препараты для эпидуральной анестезии.
- Обезболивание может получиться неудовлетворительным: односторонним или сегментарным (участками), — а весь букет вышеперечисленных рисков – с вами.
Эпидуральная анестезия: отрицательные стороны эпидуральной анестезии для ребенка
- Нередко частота сокращений сердца ребенка падает, обычно на 40 минут; это требует мониторирования и часто трактуется как гипоксия (страдание от недостатка кислорода) и как показание к кесареву сечению. Падение ЧСС связано с падением давления у мамы и снижением маточно-плацентарного кровотока.
- Возможны дыхательные нарушения (в случае применения так называемой мобильной, «ходячей» эпидуральной анестезии, при которой вводятся наркотики) у родившегося ребенка; могут потребоваться механическая вентиляция, интубация, госпитализация.

- Нередко у ребенка возникает дезориентация, нарушение моторики, затруднение сосания, после эпидуральной анестезии у мамы детям в 5 раз чаще ставят диагноз энцефалопатии.
- Нарушается установление связи «мать-ребенок».
- Дети матерей, у которых повышалась температура, чаще получают антибиотики.
Я намеренно не расшифровываю всю медицинскую терминологию: тот, кто хочет – посмотрит в словаре, остальным будет достаточно бегло просмотреть, чтобы впечатлиться. Все эти сведения взяты из вполне открытых источников – авторитетных отечественных и зарубежных (краткий список литературы я привожу ниже). Посмотрите также форумы акушеров-гинекологов и анестезиологов на Русском Медицинском сервере: там вы увидите ситуацию такой, какой она видится специалистам – во всей сложности, непредсказуемости.
Как же несведущей в медицине маме разобраться, да еще и во время схваток: по делу предлагают ей анестезию или просто по заведенному порядку? Для этого у нее должна быть своя акушерка – не просто та, что сидит рядом как «психолог», не та, что лишь вытянет, вымоет и взвесит ребенка, а специалист в области физиологических (то есть нормальных, естественных родов), «медицинский адвокат», который всегда на ее стороне. Та, которая не даст помешать правильному физиологическому течению процесса (а тем более жестоко обойтись) и даст грамотный совет относительно вмешательств. Такую акушерку не мы выдумали: сейчас в тех странах, где лучшим образом организована служба охраны материнства и детства и где наилучшие статистические показатели в этой области акушерка для мамы – главный специалист. Это Япония, Германия, Голландия, Великобритания, Скандинавские страны, Канада. У мамы есть своя акушерка (специалист по здоровью) а также свои акушер-гинеколог и педиатр (на случай болезней) – логично, не правда ли?
Та, которая не даст помешать правильному физиологическому течению процесса (а тем более жестоко обойтись) и даст грамотный совет относительно вмешательств. Такую акушерку не мы выдумали: сейчас в тех странах, где лучшим образом организована служба охраны материнства и детства и где наилучшие статистические показатели в этой области акушерка для мамы – главный специалист. Это Япония, Германия, Голландия, Великобритания, Скандинавские страны, Канада. У мамы есть своя акушерка (специалист по здоровью) а также свои акушер-гинеколог и педиатр (на случай болезней) – логично, не правда ли?
Теперь о сравнении со стоматологами, которое лежит на поверхности и потому так часто приводится. Лечение зубов под местной или общей анестезией сравнивать с анестезией в родах неправомерно, потому что:
- лечение зубов – борьба с болезнью, а роды – естественный физиологический процесс,
- лечение зубов не требует вашего активного участия, а роды – требуют.
Роды – это как управление автомобилем. Вы – машина, а ребенок водитель. Поставьте себя на место ребенка. При анестезии машина перестает слушаться руля! Ни сесть поудобнее в кресле, ни остановиться передохнуть, ни поменять скорость, ни заправиться вы не можете – вас несет чуждая неведомая сила. Попробуйте поразмышлять на эту тему.
Вы – машина, а ребенок водитель. Поставьте себя на место ребенка. При анестезии машина перестает слушаться руля! Ни сесть поудобнее в кресле, ни остановиться передохнуть, ни поменять скорость, ни заправиться вы не можете – вас несет чуждая неведомая сила. Попробуйте поразмышлять на эту тему.
С нашей точки зрения, эпидуральная анестезия нужна и оправдана примерно в 5-10 (максимум!) случаях из 100. Однако разве существует всего две возможности: роды с анестезией и роды, как вы пишете, «на живую»? Есть ли обезболивание в акушерстве, пригодное для большинства женщин, помимо эпидуральной анестезии, морфиноподобных анальгетиков (наркотиков) и общего наркоза? Да. И эти методы весьма действенны. Они не нарушают взаимодействия матери и ребенка, помогают маме расслабляться, раскрываться и принимать правильные позы, а ребенку продвигаться. Это различные позиции, дыхание, присутствие надежного и спокойного помощника, массаж, вода. В большинстве случаев этого достаточно! Об этом говорит наш многолетний акушерский опыт, мировой опыт традиционного акушерства, современные научные исследования. Многие акушерки владеют также рефлексотерапией, гомеопатическим и остеопатическим методом, ароматерапией, приемами психологической релаксации. Плохо не уметь делать эпидуральную анестезию, но не уметь делать ничего кроме нее – тоже непохвально.
Многие акушерки владеют также рефлексотерапией, гомеопатическим и остеопатическим методом, ароматерапией, приемами психологической релаксации. Плохо не уметь делать эпидуральную анестезию, но не уметь делать ничего кроме нее – тоже непохвально.
Заметьте: мы не только не отрицаем, но высоко ценим достижения фармакологии и медицинской технологии, умеем ими пользоваться. Неоценимы антибиотики при тяжелых инфекциях, нет равных эпидуральной анестезии при кесаревом сечении, а последнее – бесценно для спасения жизни, гуманны наркотики в онкологии, поражают воображение возможности техники для реанимации и выхаживания недоношенных! Однако применять их в каждом втором случае? Или просто потому что «заказал» клиент? Придумайте сами, как такое явление назвать.
Что толку знать, что в некоторых (в том числе не самых развитых) странах количество случаев применения анестезии доходит до 80%, а кесарева сечения – до 40-70%? Цыплят по осени считают. Хорошо это или плохо – будет известно, когда вырастут эти дети.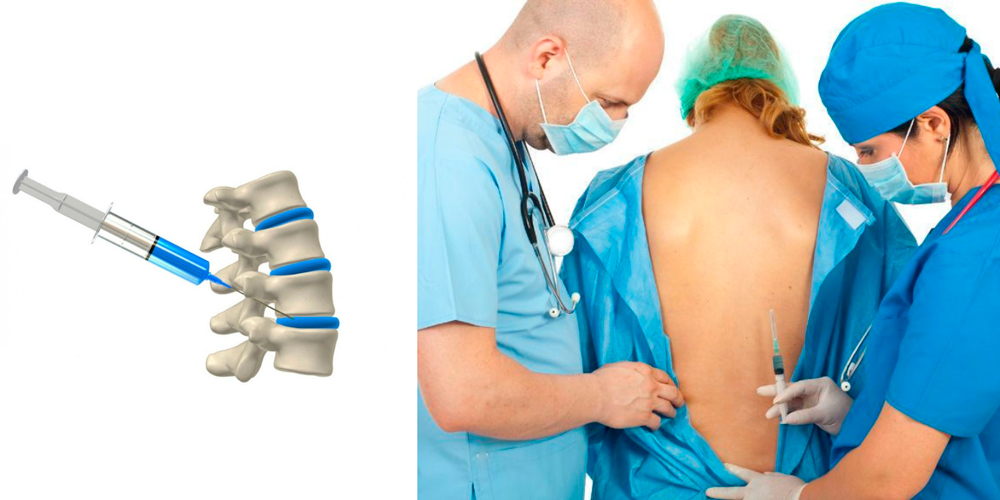 Почитайте у Мишеля Одена о связи акушерских вмешательств и развития у людей в последующем преступных и суицидальных наклонностей, наркомании, аутизма, неспособности нормально уживаться в обществе: ученые всего мира уже бьют тревогу… Широкой дорогой всеобщей и всяческой анестезии (и протезирования естественных функций) сейчас шагает все мировое акушерство. Агитировать за нее нет нужды, она и так популярна. Мы же просто представляем достойную альтернативу для тех, кто хочет иного. Мы – врачи, акушерки, матери (многие из нас многодетны) и сами рожаем так.
Почитайте у Мишеля Одена о связи акушерских вмешательств и развития у людей в последующем преступных и суицидальных наклонностей, наркомании, аутизма, неспособности нормально уживаться в обществе: ученые всего мира уже бьют тревогу… Широкой дорогой всеобщей и всяческой анестезии (и протезирования естественных функций) сейчас шагает все мировое акушерство. Агитировать за нее нет нужды, она и так популярна. Мы же просто представляем достойную альтернативу для тех, кто хочет иного. Мы – врачи, акушерки, матери (многие из нас многодетны) и сами рожаем так.
Автор: Врач Вероника Назарова, семейный врач, акушер, мать троих детей, рожала самостоятельно, без вмешательств и анестезии, мечтаю родить еще.
Эпидуральная анестезия в Иркутске в Клинике Эксперт
Эпидуральная анестезия – метод, при котором лекарственные препараты вводятся в эпидуральное пространство позвоночника через катетер.
При каких операциях и зачем делают эпидуральную анестезию? Метод используется при проведении таких вмешательств, как:
- кесарево сечение;
- удаление аппендикса;
- операции на мочевом пузыре, простате;
- операции на органах грудной клетки, костях, суставах.

При таком виде анестезии исчезает чувствительность к боли, расслабляются мышцы.
Основными показаниями к эпидуральной анестезии также являются:
- послеоперационный период;
- хронические боли у пациентов с онкологическими болезнями.
Основные противопоказания к эпидуральной анестезии следующие:
- патологии позвоночника;
- болезни нервной системы;
- артериальная гипотензия.
К абсолютным противопоказаниям относятся:
- воспаление в области предполагаемой пункции;
- плохая свёртываемость крови;
- непереносимость используемых препаратов.
У эпидуральной анестезии имеются побочные действия:
- непродолжительные боли в спине;
- повышение температуры;
- непродолжительное ощущение онемения ног.
Сколько длится эпидуральная анестезия? Продолжительность действия анестезии от 20 минут до 5 часов (в зависимости от типа анестезирующего средства и вводимого объёма).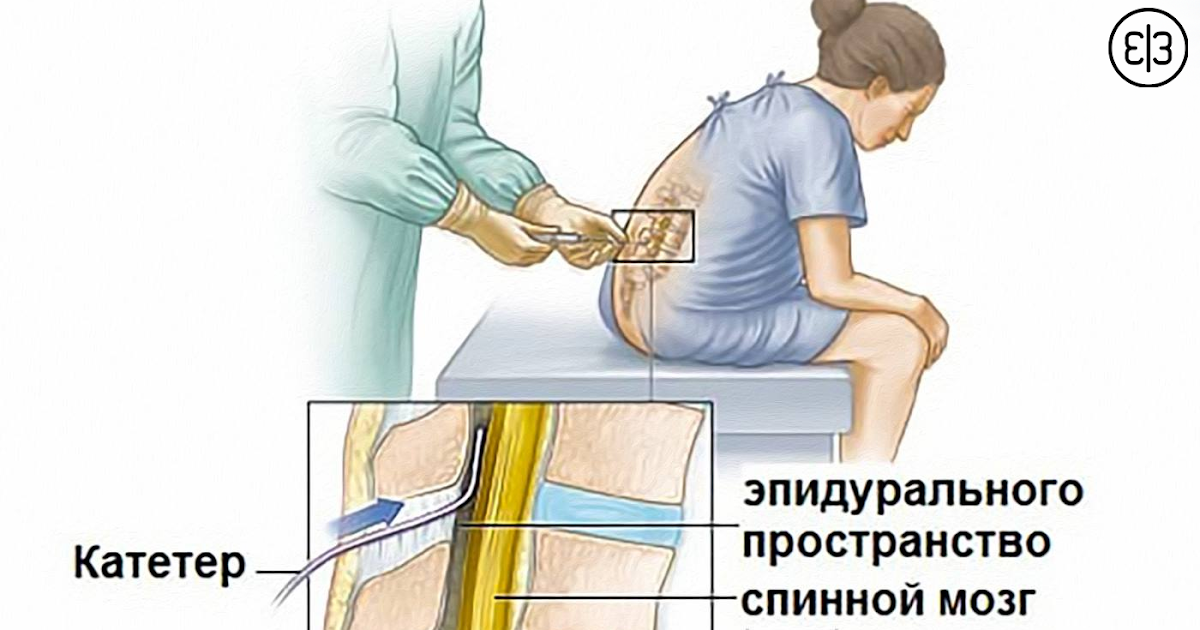
Чем отличается эпидуральная анестезия от спинальной анестезии? Разница между эпидуральной и спинальной анестезией состоит в анатомической области, в которую вводится препарат. Спинальная анестезия применяется, когда требуется кратковременный результат, эпидуральная длится, пока через катетер будет подаваться анестетик. При назначении общей или эпидуральной анестезии учитываются объём и локализация предполагаемой операции.
Уточнить, сколько стоит эпидуральная анестезия, можно по телефону, указанному в разделе «Контакты». Информацию о цене данной манипуляции вам предоставят наши сотрудники.
Эпидуральная анестезия и обезболивание родов. Показания, риски при естественных родах
Существует мнение, что роды всегда сопровождаются болью. Но это не так. Обезболивание родов — тема, вокруг которой кипят многочисленные дискуссии. Есть аргументы как за, так и против. В любом случае, решение о том, применять анестезию или нет, принимаете Вы. Врач может подсказать, объяснить, посоветовать, однако ни в коем случае не будет Вас к чему-либо принуждать.
Знакомство с врачом-анестезиологом происходит задолго до родов. На консультации перед предстоящими родами Вы вместе с доктором составите индивидуальный сценарий родов. Доктор постарается развеять Ваш страх, связанный с болью при родах, и настроить на благоприятное их завершение. Доказано, что интенсивность болезненных ощущений снижается и воспринимается как «терпимая», если будущая мама чувствует себя в безопасности, положительно настроена и доверяет врачам, принимающим роды.
Существуют медикаментозные и немедикаментозные способы обезболивания родов. К немедикаментозным можно отнести активное положение роженицы, массаж, использование мячей, а также специальную ванну для обезболивания первого периода родов. Как и при любых других дискомфортных физических ощущениях, во время родов Ваше тело само знает, как двигаться и вести себя, чтобы облегчить боль.
К медикаментозным способам относят эпидуральные аналгезию и анестезию. Эпидуральная аналгезия применяется по желанию пациентки и по ряду медицинских показаний. Этот метод считается наиболее современным и безопасным для женщины и ребенка, он высокоэффективен и удобен в применении. Суть метода заключается в том, что при помощи специальных препаратов блокируются болевые сигналы, которые идут от нижней части тела к головному мозгу. Для проведения эпидуральной аналгезии врач-анестезиолог делает прокол на уровне 3-4-го поясничных позвонков и вводит в эпидуральное пространство через специальную иглу гибкий катетер. Через него в организм роженицы вводят обезболивающие вещества.
Этот метод считается наиболее современным и безопасным для женщины и ребенка, он высокоэффективен и удобен в применении. Суть метода заключается в том, что при помощи специальных препаратов блокируются болевые сигналы, которые идут от нижней части тела к головному мозгу. Для проведения эпидуральной аналгезии врач-анестезиолог делает прокол на уровне 3-4-го поясничных позвонков и вводит в эпидуральное пространство через специальную иглу гибкий катетер. Через него в организм роженицы вводят обезболивающие вещества.
Эпидуральную аналгезию проводят в том случае, если требуется только снять болезненные ощущения. В этом случае нервы, отвечающие за моторные функции, остаются частично в рабочем состоянии, и при желании женщина может двигаться.
Эпидуральная анестезия подразумевает полную блокировку ощущений и движений, ее используют во время проведения кесарева сечения. При таком виде обезболивания будущая мама остается в сознании и принимает участие в процессе появления ребенка на свет. За исключением некоторых случаев, ребенка кладут маме на грудь.
За исключением некоторых случаев, ребенка кладут маме на грудь.
В мировой практике применение эпидуральной анестезии во время родов является распространенным явлением. Такой вид обезболивания применяют и при некоторых видах операций. Задача врача сделать все возможное для того, чтобы мама и ребенок были здоровы и чувствовали себя комфортно. Но каждая ситуация уникальна, и для того чтобы принять взвешенное решение, необходима консультация врача-анестезиолога о возможностях применения эпидуральной анестезии в Вашем конкретном случае.
98% кесаревых сечений выполняется под эпидуральной анестезией.
Нормы длительности родов предложили пересмотреть
10 февраля 2014
Второй период родов (изгнание плода) в норме является несколько более длительным процессом, чем это было принято думать до сих пор, а эпидуральная анестезия увеличивает его продолжительность в большей степени, чем традиционно считается. Такие результаты были получены в ходе масштабного исследования, проведенного учеными из Калифорнийского университета (Сан-Франциско). Авторы призывают пересмотреть действующие рекомендации, а до тех пор предлагают всем специалистам иметь в виду полученные данные и избегать неоправданного вмешательства в процесс родов, основываясь лишь на кажущейся излишней длительности второго периода. Работа опубликована в журнале Obstetrics and Gynecology.
Авторы призывают пересмотреть действующие рекомендации, а до тех пор предлагают всем специалистам иметь в виду полученные данные и избегать неоправданного вмешательства в процесс родов, основываясь лишь на кажущейся излишней длительности второго периода. Работа опубликована в журнале Obstetrics and Gynecology.
При эпидуральной (перидуральной) анестезии лекарственный препарат вводится через катетер в эпидуральное пространство позвоночника. Это приводит к потере болевой чувствительности благодаря блокаде прохождения нервных импульсов в спинной мозг. Считается, что этот вид анестезии в родах удлиняет процесс изгнания плода примерно на час. Согласно действующим рекомендациям Американского конгресса акушеров и гинекологов (ACOG)от 2003 года, продолжительность второго периода первых родов с эпидуральной анестезией считается аномальной, если она длится более трех часов, и без эпидуральной анестезии – более двух часов. В случае вторых и последующих родов эти цифры составляют два часа и один час соответственно.
Авторы исследования провели анализ массива данных с 1976 по 2008 год о 42268 прошедших без осложнений вагинальных родах. Примерно в половине случаев применялась эпидуральная анестезия. Исследователи сравнили среднюю продолжительность второго периода родов в случае применения эпидуральной анестезии и без нее, а также оценили наиболее распространенную частоту длительности этой стадии для обеих групп.
В результате было установлено, что продолжительность второго периода в 95 процентиле для первых родов с эпидуральной анестезией составляет 5 часов 36 минут, а без нее – 3 часа 17 минут. Для вторых и последующих родов эти цифры составляют 4 часа 15 минут и 1 час 21 минута соответственно. В целом, делают вывод авторы, получается, что применение эпидуральной анестезии удлиняет второй период не на один, а более, чем на два часа, как для первых, так и для последующих родов.
Кроме того, результаты исследования свидетельствуют, что процесс изгнания плода в норме продолжительнее, чем это принято считать, что подтверждает данные ACOG и Национальных институтов здоровья США (NIH), оглашенные в 2012 году. В ходе исследования авторы обнаружили, что, если исходить из действующих рекомендаций ACOG, аномальными можно признать 31 процент первых и 19 процентов последующих родов.
В ходе исследования авторы обнаружили, что, если исходить из действующих рекомендаций ACOG, аномальными можно признать 31 процент первых и 19 процентов последующих родов.
«Пришло время пересмотреть понятия о норме и скорректировать рекомендации в соответствии с новыми данными», — цитирует The New York Times ведущего автора исследования Ивонн Чен (Yvonne W. Cheng).
«Полученные результаты говорят о том, что врачам не следует торопиться применять такие меры, как окситоцин, щипцы, вакуум или кесарево сечение, — прокомментировала итоги работы группы Чен исследователь NIH Кэтрин Лафон (Katherine Laughon). – И медики, и сами роженицы в этом случае при принятии решения о вмешательстве должны нащупать баланс между пользой вагинальных родов и потенциальным риском для матери и ребенка».
«Эти результаты очень важны и ACOG следует пересмотреть рекомендации 2003 года, — заявил The New York Times глава отделения акушерства и гинекологии бостонской больницы Brigham and Women’s Роберт Барбиери (Robert L. Barbieri). – Я внесу изменения в свою практику и не буду особенно волноваться, если в первых родах второй период будет длиться пять с половиной часов после эпидуральной анестезии при нормальных показателях мониторинга состояния плода».
Barbieri). – Я внесу изменения в свою практику и не буду особенно волноваться, если в первых родах второй период будет длиться пять с половиной часов после эпидуральной анестезии при нормальных показателях мониторинга состояния плода».
Источник: medportal.ru
Эпидуральная анестезия при кесаревом сечении у беременной женщины с синдромом Марфана и дуральной эктазией
2017; 2017: 2126310. , 1 , 2 , * , 3 , 3 , 4 и 4Франко Пепе
1 U.O.C. Ostetricia e ginecologia e ps, ospedale santo bambino, catania, Италия
mariagrazia stracquadanio
2 Istituto di patologia ostetrica e ginecologica, Ospedale Santo Bambino, Catania, Италия
Francesco de Luca
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
Agata Privitera
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Италия
ELISABETTA SANALITRO
4 Modulo Dipartimentale Anestesia Ostetrica, Ospedale Santo Bambino, Catania, Италия
Puccio Scarpinati
4 Modulo Dipartimentale Anestesia Ostetrica, Ospedale Santo Bambino, Catania , Италия
1 У. О.К. Ostetricia e Ginecologia e PS, Ospedale Santo Bambino, Катания, Италия
О.К. Ostetricia e Ginecologia e PS, Ospedale Santo Bambino, Катания, Италия
2 Istituto di Patologia Ostetrica e Ginecologica, Ospedale Santo Bambino, Катания, Италия
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Italy
4 Modulo Dipartimental Anestesia Ostetrica, Ospedale Santo Bambino, Catania, Italy
Академический редактор: Michael Geary
Поступила в редакцию 18 февраля 2017 г.; Принято 19 апреля 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Abstract
Синдром Марфана (СМФ) представляет собой генетическое заболевание соединительной ткани, характеризующееся разнообразными клиническими проявлениями и мультисистемными осложнениями. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
1. Введение
Синдром Марфана (СМФ) представляет собой аутосомно-доминантное наследственное заболевание соединительной ткани; его заболеваемость оценивается примерно в 1 : 5. 000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинический и инструментальный диагноз основан на соблюдении Гентских критериев, предложенных в 1996 г. De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al.в 2010 году [3]. Некоторые проявления очевидны с детства (например, эктопия хрусталика), тогда как другие проявляются в более позднем возрасте, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.
000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинический и инструментальный диагноз основан на соблюдении Гентских критериев, предложенных в 1996 г. De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al.в 2010 году [3]. Некоторые проявления очевидны с детства (например, эктопия хрусталика), тогда как другие проявляются в более позднем возрасте, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом. В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Как сообщается в литературе, акушерское ведение женщин с MFS в настоящее время хорошо закодировано, с благоприятным исходом, если диаметр корня аорты менее 40 мм. Увеличение размера аорты во время беременности не является уникальным явлением у женщин с MFS, но известно, что оно происходит во время нормальной здоровой беременности и в большей степени у женщин с преэклампсией [6].
Некоторые недавние руководства рекомендуют женщинам с MFS избегать беременности или, в качестве альтернативы, пройти хирургическую замену восходящей аорты до зачатия, если размеры аорты > 4 см [7].
Литература предполагает 1% риск расслоения аорты или серьезного кардиального события у женщин с диаметром корня аорты <40 мм [8]. Риск повышается при диаметре корня аорты >40 мм, при быстром увеличении размеров аорты или в контексте расслоения в семейном анамнезе [9].
Однако наличие эктазии твердой мозговой оболочки считается основной причиной неудачи местно-регионарной анестезии во время кесарева сечения. Целью данного исследования является представление случая беременной женщины с MFS в сроке с обширной дуральной эктазией, у которой было успешное кесарево сечение с эпидуральной анестезией во время ее второй беременности.
2. История болезни
Ф. С., 35 лет, рост 180 см, вес 85 кг, пациентка с MSF с пояснично-крестцовой твердой мозговой оболочкой, перенесшая кесарево сечение на сроке 37 недель и 3 дня беременности.Она сообщает, что мать была очень высока и внезапно умерла в возрасте до 50 лет; ее дедушка по материнской линии тоже был особенно высоким, а ее брат был миопиком и тяжелым сколиозом. Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
В акушерском анамнезе: предыдущее кесарево сечение в 2004 г. без осложнений. После спинномозговой анестезии была проведена спинно-блокадная анестезия, которая была переведена в общую. В послеоперационном периоде у нее было кровотечение из-за атонии матки, лечилась окситоцином и простагландинами и выздоравливала в реанимации. Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозной дилатацией некоторых нервных корешков.Это открытие является одним из основных диагностических критериев MFS. В 2009 году у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.
Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозной дилатацией некоторых нервных корешков.Это открытие является одним из основных диагностических критериев MFS. В 2009 году у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты. Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии.
Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала.
Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения.
Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
3. Обсуждение
MFS — аутосомно-доминантное заболевание соединительной ткани, связанное с мутацией гена фибриллина, гликопротеина, который является основным компонентом внеклеточных микрофибрилл, чей ген картируется на хромосоме 15. MFS затрагивает различные органы и системы. с разной степенью тяжести: по этой причине ее диагностика в основном клинико-инструментальная, а затем молекулярная. Он основан на наблюдении Гентских критериев и пересмотренных критериев [10].
В литературе имеется большой опыт ведения беременных с РС [9–13].Беременность можно рассматривать как относящуюся к группе низкого риска при отсутствии выраженной дилатации аорты и митральной недостаточности. У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
Бета-блокаторы снижают риск дилатации аорты и сердечных осложнений, но они, по-видимому, повышают тонус и сократительную способность матки, а также могут снижать кровоток в пупочной артерии, вызывая низкий вес новорожденных. У нашей беременной они не применялись.
Эктазия твердой мозговой оболочки является одним из основных критериев диагностики MFS и присутствует более чем у 2/3 пораженных взрослых [14–16], а распространенность тяжелого (степени 2 и 3) поражения твердой мозговой оболочки выше у пациенты, несущие преждевременные мутации терминирующего кодона, по сравнению с теми, кто несет миссенс-мутации [17].Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.
Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности. Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Очевидно, что для наилучшего ведения родов и родоразрешения у пациенток с MFS основной целью является снижение сердечно-сосудистого стресса, и кесарево сечение часто выполняется для предотвращения сердечно-сосудистых осложнений. Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22].Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22].
Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22].Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22].
Колебания гемодинамических параметров, вторичные по отношению к боли и тревоге при родах, могут оказывать негативное влияние на сердечно-сосудистую систему; высокое кровяное давление имеет тенденцию к развитию аневризм аорты из-за ослабления сосудистой среды у пациентов с MFS, а ишемия миокарда и сердечная недостаточность также могут быть вызваны повышенной потребностью миокарда в кислороде, что приводит к высокому кровяному давлению; таким образом, основной целью является предотвращение высокого кровяного давления [23].По всем этим причинам часто планируют кесарево сечение.
Тип анестезии также обсуждался. Общая анестезия вызывает колебания артериального давления во время интубации; поэтому периферическая анестезия предпочтительнее из-за медленного начала и постепенного прогрессирования эпидуральной блокады. Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение.
Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение.
В некоторых исследованиях регионарная анестезия успешно применялась у пациенток с MFS как во время обезболивания родов, так и во время кесарева сечения. Комбинированная спинально-эпидуральная анестезия предпочтительнее общей анестезии при кесаревом сечении у пациентов с MFS, поскольку комбинированная спинально-эпидуральная анестезия обеспечивает превосходную гемодинамическую стабильность, а адекватный послеоперационный контроль боли может быть достигнут с помощью эпидуральной анальгезии. Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Таким образом, обследование беременных женщин с MFS требует междисциплинарного подхода при тесном сотрудничестве гинеколога, кардиолога, анестезиолога и неонатолога. Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты.Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.
Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты.Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Каталожные номера
1.Пириц Р. Э., МакКьюсик В. А. Синдром Марфана: диагностика и лечение. Медицинский журнал Новой Англии . 1979; 300(14):772–777. doi: 10.1056/nejm197
3001406. [PubMed] [CrossRef] [Google Scholar]2. De Paepe A., Devereux R.B., Dietz HC, Hennekam RCM, Pyeritz R.E. Пересмотренные диагностические критерии синдрома Марфана. Американский журнал медицинской генетики . 1996;62(4):417–426. doi: 10.1002/(sici)1096-8628(19960424)62:4<417::aid-ajmg15>3. О.К. Ostetricia e Ginecologia e PS, Ospedale Santo Bambino, Катания, Италия
О.К. Ostetricia e Ginecologia e PS, Ospedale Santo Bambino, Катания, Италия Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией. 000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинический и инструментальный диагноз основан на соблюдении Гентских критериев, предложенных в 1996 г. De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al.в 2010 году [3]. Некоторые проявления очевидны с детства (например, эктопия хрусталика), тогда как другие проявляются в более позднем возрасте, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.
000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинический и инструментальный диагноз основан на соблюдении Гентских критериев, предложенных в 1996 г. De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al.в 2010 году [3]. Некоторые проявления очевидны с детства (например, эктопия хрусталика), тогда как другие проявляются в более позднем возрасте, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом. В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
 Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации. Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозной дилатацией некоторых нервных корешков.Это открытие является одним из основных диагностических критериев MFS. В 2009 году у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.
Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозной дилатацией некоторых нервных корешков.Это открытие является одним из основных диагностических критериев MFS. В 2009 году у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты. Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии.
Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала.
Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения.
Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.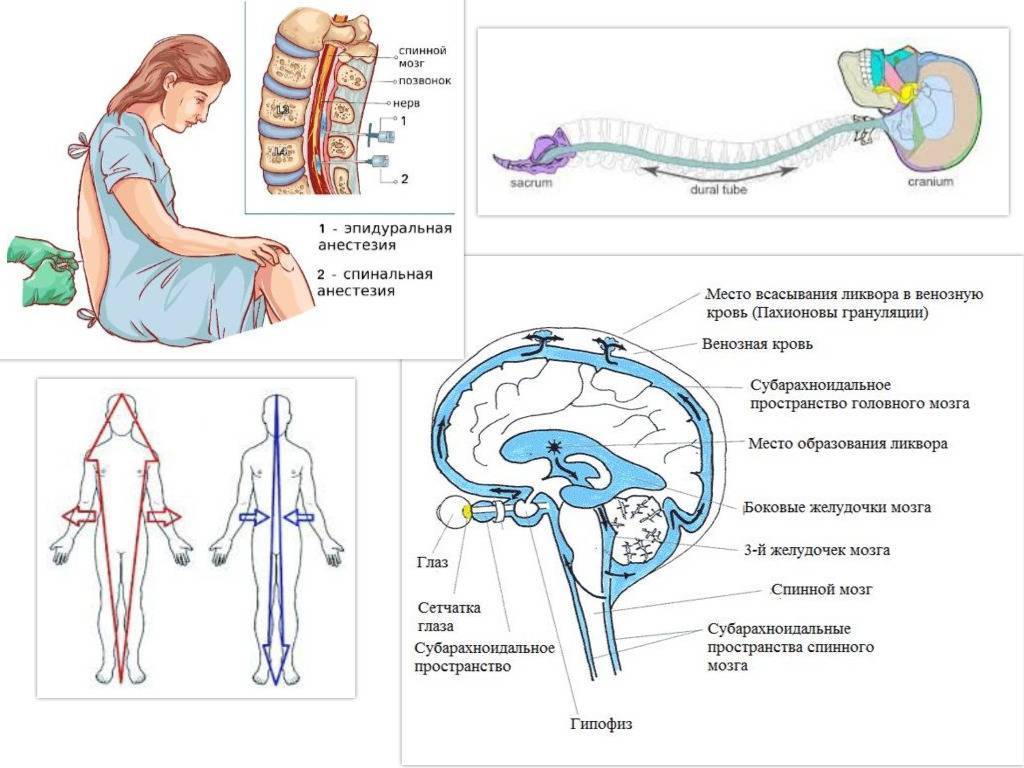 Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.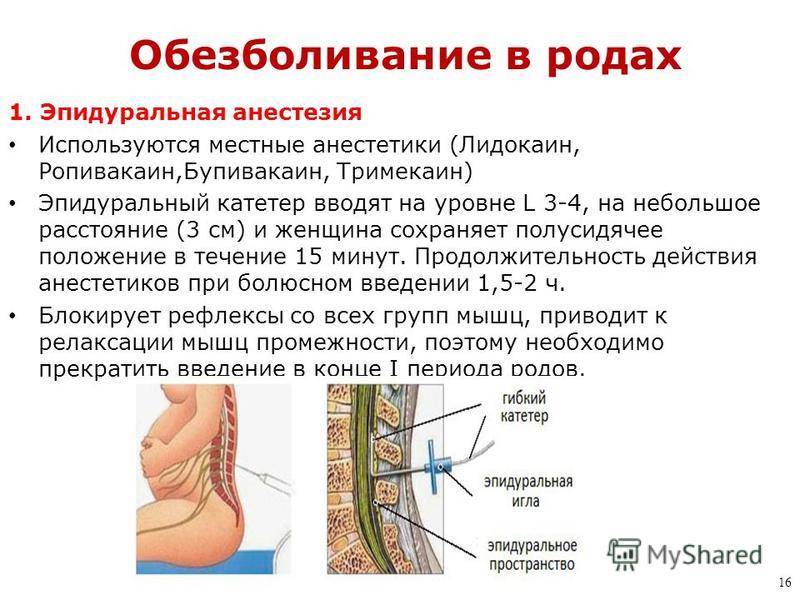 Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.
Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности. Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано. Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22].Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22].
Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22].Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22]. Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение.
Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг). Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты.Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.
Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты.Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений. Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.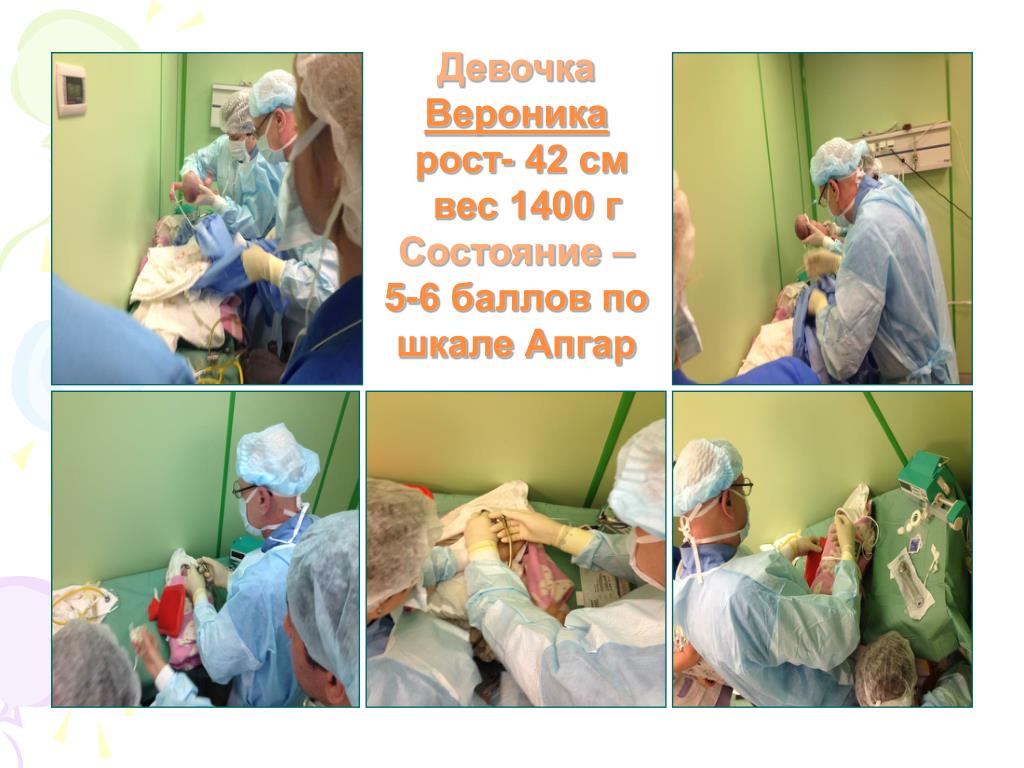 0.co;2-r. [PubMed] [CrossRef] [Google Scholar]3.Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10.1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]4. Патерностер Д. М., Сантаросса К., Ветторе Н. и соавт. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]6. Истерлинг Т.Р., Бенедетти Т.Дж., Шумейкер Б.С. и др. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты.
0.co;2-r. [PubMed] [CrossRef] [Google Scholar]3.Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10.1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]4. Патерностер Д. М., Сантаросса К., Ветторе Н. и соавт. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]6. Истерлинг Т.Р., Бенедетти Т.Дж., Шумейкер Б.С. и др. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты. Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]8. Регитц-Загросек В., Лундквист С. Б., Борги К. и соавт. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) European Heart Journal . 2011; 32:3147–3197. [PubMed] [Google Scholar]9. Мейбум Л. Дж., Вос Ф. Э., Тиммерманс Дж., Бурс Г. Х., Цвиндерман А.Х., Малдер Б.Дж. М. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование. Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar] 10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar] 11.
Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]8. Регитц-Загросек В., Лундквист С. Б., Борги К. и соавт. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) European Heart Journal . 2011; 32:3147–3197. [PubMed] [Google Scholar]9. Мейбум Л. Дж., Вос Ф. Э., Тиммерманс Дж., Бурс Г. Х., Цвиндерман А.Х., Малдер Б.Дж. М. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование. Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar] 10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar] 11./GettyImages-134106302-575338113df78c9b466e4147.jpg) Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed] [CrossRef] [Google Scholar] 12. Бусер Р. Т., Мордекай М. М., Брюлл С. Дж. Комбинированная спинально-эпидуральная анальгезия родов у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar] 13.Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана. Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar] 14. Пьериц Р. Э., Фишман Э. К., Бернхардт Б. А., Зигельман С. С. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732.
Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed] [CrossRef] [Google Scholar] 12. Бусер Р. Т., Мордекай М. М., Брюлл С. Дж. Комбинированная спинально-эпидуральная анальгезия родов у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar] 13.Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана. Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar] 14. Пьериц Р. Э., Фишман Э. К., Бернхардт Б. А., Зигельман С. С. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]15.Fattori R., Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar] 16. Ан Н.У., Спонселлер П.Д., Ан У.М., Налламшетти Л., Кушик Б.С., Зинрайх С.Дж. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar] 17.Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике. Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar] 18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни.
[Бесплатная статья PMC] [PubMed] [Google Scholar]15.Fattori R., Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar] 16. Ан Н.У., Спонселлер П.Д., Ан У.М., Налламшетти Л., Кушик Б.С., Зинрайх С.Дж. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar] 17.Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике. Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar] 18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни. Журнал нейрохирургии: позвоночник .2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar] 19. Лундби Р., Рэнд-Хендриксен С., Халд Дж. К. и др. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ. Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar] 21. Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar] 22. Рахман Дж., Рахман Ф.З., Рахман В., Аль-Сулейман С.
Журнал нейрохирургии: позвоночник .2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar] 19. Лундби Р., Рэнд-Хендриксен С., Халд Дж. К. и др. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ. Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar] 21. Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar] 22. Рахман Дж., Рахман Ф.З., Рахман В., Аль-Сулейман С. А., Рахман М.С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины .2003; 48: 723–728. [PubMed] [Google Scholar] 23. Ким Д.В., Лим Ю.Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef][Google Scholar]
А., Рахман М.С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины .2003; 48: 723–728. [PubMed] [Google Scholar] 23. Ким Д.В., Лим Ю.Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef][Google Scholar]24. МакКусик В.А. Синдром Марфана, МФС. Онлайн менделевское наследование у человека. OMIM, MIM № 154700, Балтимор (MD): Университет Джона Хопкинса, 2003.
25. Fettes P.D.W., Jansson J.-R., Wildsmith J.A.W. Неудачная спинальная анестезия: механизмы, лечение и профилактика. Британский журнал анестезии . 2009;102(6):739–748. doi: 10.1093/bja/aep096. [PubMed] [CrossRef] [Google Scholar] 26. Лакасси Х.Дж., Миллар С., Лейте Л.Г. и др. Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинномозговой анестезии у двух рожениц с синдромом Марфана. Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar] 27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar] 27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]Эпидуральная анестезия при кесаревом сечении у беременной женщины с синдромом Марфана и дуральной эктазией
Представитель акушерства Gynecol. 2017; 2017: 2126310.
, 1 , 2 , * , 3 , 3 , 4 и 4Франко Пепе
1 У.О.К. Ostetricia e ginecologia e ps, ospedale santo bambino, catania, Италия
mariagrazia stracquadanio
2 istituto di patologia ostetrica e ginecologica, Ospedale Santo Bambino, Catania, Италия
Francesco de Luca
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
Agata Privitera
3 U. O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Италия
O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Италия
ELISABETTA SANALITRO
4 Modulo Dipartimentale Anestesia Ostetrica, Ospedale Santo Bambino, Catania, Италия
Puccio Scarpinati
4 Modulo Dipartimentale Anestesia Ostetrica, Ospedale Santo Bambino, Catania , Италия
1 У.О.К. Ostetricia e Ginecologia e PS, Ospedale Santo Bambino, Катания, Италия
2 Istituto di Patologia Ostetrica e Ginecologica, Ospedale Santo Bambino, Катания, Италия
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Italy
4 Modulo Dipartimental Anestesia Ostetrica, Ospedale Santo Bambino, Catania, Italy
Академический редактор: Michael Geary
Поступила в редакцию 18 февраля 2017 г.; Принято 19 апреля 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Abstract
Синдром Марфана (СМФ) представляет собой генетическое заболевание соединительной ткани, характеризующееся разнообразными клиническими проявлениями и мультисистемными осложнениями. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
1. Введение
Синдром Марфана (СМФ) представляет собой аутосомно-доминантное наследственное заболевание соединительной ткани; его заболеваемость оценивается примерно в 1 : 5.000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинический и инструментальный диагноз основан на соблюдении Гентских критериев, предложенных в 1996 г. De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al.в 2010 году [3]. Некоторые проявления очевидны с детства (например, эктопия хрусталика), тогда как другие проявляются в более позднем возрасте, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Как сообщается в литературе, акушерское ведение женщин с MFS в настоящее время хорошо закодировано, с благоприятным исходом, если диаметр корня аорты менее 40 мм. Увеличение размера аорты во время беременности не является уникальным явлением у женщин с MFS, но известно, что оно происходит во время нормальной здоровой беременности и в большей степени у женщин с преэклампсией [6].
Некоторые недавние руководства рекомендуют женщинам с MFS избегать беременности или, в качестве альтернативы, пройти хирургическую замену восходящей аорты до зачатия, если размеры аорты > 4 см [7].
Литература предполагает 1% риск расслоения аорты или серьезного кардиального события у женщин с диаметром корня аорты <40 мм [8]. Риск повышается при диаметре корня аорты >40 мм, при быстром увеличении размеров аорты или в контексте расслоения в семейном анамнезе [9].
Однако наличие эктазии твердой мозговой оболочки считается основной причиной неудачи местно-регионарной анестезии во время кесарева сечения. Целью данного исследования является представление случая беременной женщины с MFS в сроке с обширной дуральной эктазией, у которой было успешное кесарево сечение с эпидуральной анестезией во время ее второй беременности.
2. История болезни
Ф. С., 35 лет, рост 180 см, вес 85 кг, пациентка с MSF с пояснично-крестцовой твердой мозговой оболочкой, перенесшая кесарево сечение на сроке 37 недель и 3 дня беременности.Она сообщает, что мать была очень высока и внезапно умерла в возрасте до 50 лет; ее дедушка по материнской линии тоже был особенно высоким, а ее брат был миопиком и тяжелым сколиозом. Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
В акушерском анамнезе: предыдущее кесарево сечение в 2004 г. без осложнений. После спинномозговой анестезии была проведена спинно-блокадная анестезия, которая была переведена в общую. В послеоперационном периоде у нее было кровотечение из-за атонии матки, лечилась окситоцином и простагландинами и выздоравливала в реанимации. Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозной дилатацией некоторых нервных корешков.Это открытие является одним из основных диагностических критериев MFS. В 2009 году у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства.
Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения.
К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи.
Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
3. Обсуждение
MFS — аутосомно-доминантное заболевание соединительной ткани, связанное с мутацией гена фибриллина, гликопротеина, который является основным компонентом внеклеточных микрофибрилл, чей ген картируется на хромосоме 15. MFS затрагивает различные органы и системы. с разной степенью тяжести: по этой причине ее диагностика в основном клинико-инструментальная, а затем молекулярная. Он основан на наблюдении Гентских критериев и пересмотренных критериев [10].
В литературе имеется большой опыт ведения беременных с РС [9–13].Беременность можно рассматривать как относящуюся к группе низкого риска при отсутствии выраженной дилатации аорты и митральной недостаточности. У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
Бета-блокаторы снижают риск дилатации аорты и сердечных осложнений, но они, по-видимому, повышают тонус и сократительную способность матки, а также могут снижать кровоток в пупочной артерии, вызывая низкий вес новорожденных. У нашей беременной они не применялись.
Эктазия твердой мозговой оболочки является одним из основных критериев диагностики MFS и присутствует более чем у 2/3 пораженных взрослых [14–16], а распространенность тяжелого (степени 2 и 3) поражения твердой мозговой оболочки выше у пациенты, несущие преждевременные мутации терминирующего кодона, по сравнению с теми, кто несет миссенс-мутации [17]. Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника.
Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом.
Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Очевидно, что для наилучшего ведения родов и родоразрешения у пациенток с MFS основной целью является снижение сердечно-сосудистого стресса, и кесарево сечение часто выполняется для предотвращения сердечно-сосудистых осложнений. Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22].Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22].
Колебания гемодинамических параметров, вторичные по отношению к боли и тревоге при родах, могут оказывать негативное влияние на сердечно-сосудистую систему; высокое кровяное давление имеет тенденцию к развитию аневризм аорты из-за ослабления сосудистой среды у пациентов с MFS, а ишемия миокарда и сердечная недостаточность также могут быть вызваны повышенной потребностью миокарда в кислороде, что приводит к высокому кровяному давлению; таким образом, основной целью является предотвращение высокого кровяного давления [23]. По всем этим причинам часто планируют кесарево сечение.
По всем этим причинам часто планируют кесарево сечение.
Тип анестезии также обсуждался. Общая анестезия вызывает колебания артериального давления во время интубации; поэтому периферическая анестезия предпочтительнее из-за медленного начала и постепенного прогрессирования эпидуральной блокады. Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение.
В некоторых исследованиях регионарная анестезия успешно применялась у пациенток с MFS как во время обезболивания родов, так и во время кесарева сечения. Комбинированная спинально-эпидуральная анестезия предпочтительнее общей анестезии при кесаревом сечении у пациентов с MFS, поскольку комбинированная спинально-эпидуральная анестезия обеспечивает превосходную гемодинамическую стабильность, а адекватный послеоперационный контроль боли может быть достигнут с помощью эпидуральной анальгезии. Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии.
Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Таким образом, обследование беременных женщин с MFS требует междисциплинарного подхода при тесном сотрудничестве гинеколога, кардиолога, анестезиолога и неонатолога. Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты.Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Каталожные номера
1.Пириц Р. Э., МакКьюсик В. А. Синдром Марфана: диагностика и лечение. Медицинский журнал Новой Англии . 1979; 300(14):772–777. doi: 10.1056/nejm197
3001406. O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Италия
O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Италия

 Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
 Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.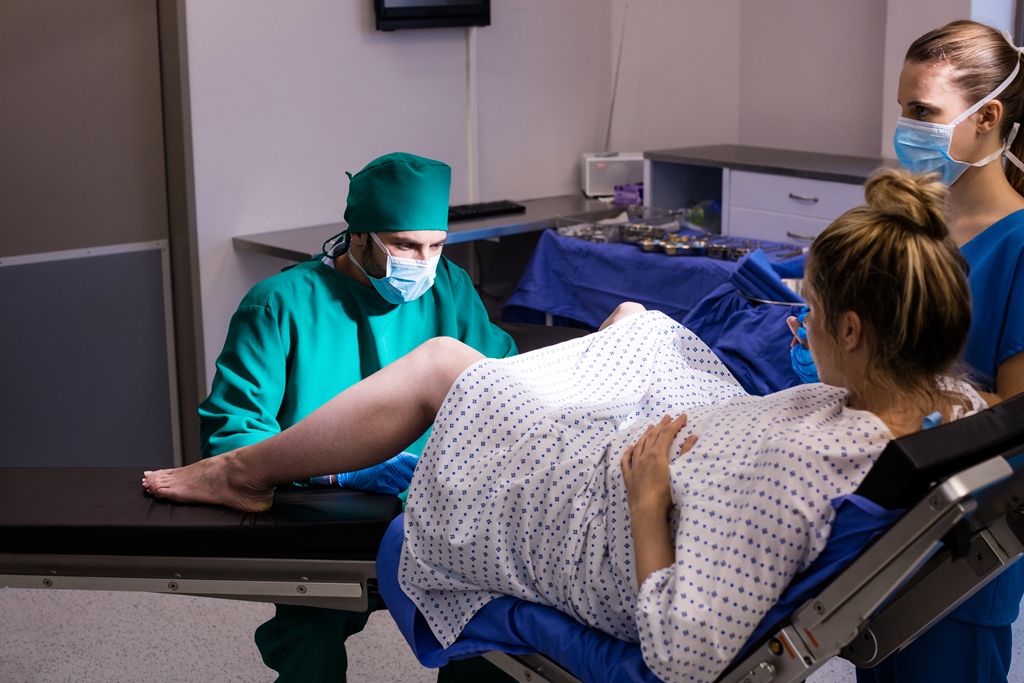
 Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства.
Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения.
К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи.
Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм. У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.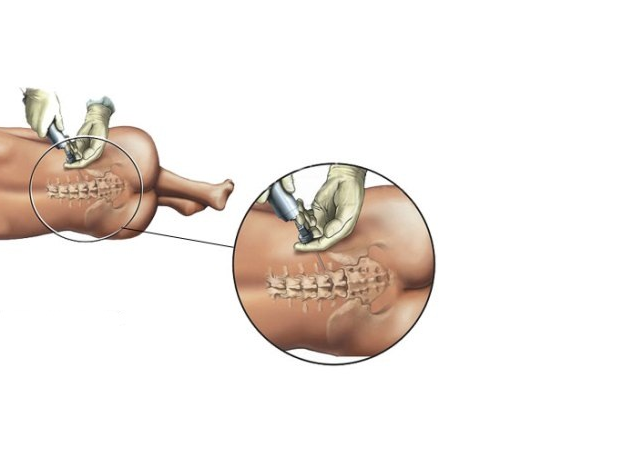 Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника.
Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом.
Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано. По всем этим причинам часто планируют кесарево сечение.
По всем этим причинам часто планируют кесарево сечение. Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии.
Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг). У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время. [PubMed] [CrossRef] [Google Scholar]2. De Paepe A., Devereux R.B., Dietz HC, Hennekam RCM, Pyeritz R.E. Пересмотренные диагностические критерии синдрома Марфана. Американский журнал медицинской генетики . 1996;62(4):417–426. doi: 10.1002/(sici)1096-8628(19960424)62:4<417::aid-ajmg15>3.0.co;2-r. [PubMed] [CrossRef] [Google Scholar]3.Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10.1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]4. Патерностер Д. М., Сантаросса К., Ветторе Н. и соавт. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]6.
[PubMed] [CrossRef] [Google Scholar]2. De Paepe A., Devereux R.B., Dietz HC, Hennekam RCM, Pyeritz R.E. Пересмотренные диагностические критерии синдрома Марфана. Американский журнал медицинской генетики . 1996;62(4):417–426. doi: 10.1002/(sici)1096-8628(19960424)62:4<417::aid-ajmg15>3.0.co;2-r. [PubMed] [CrossRef] [Google Scholar]3.Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10.1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]4. Патерностер Д. М., Сантаросса К., Ветторе Н. и соавт. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]6.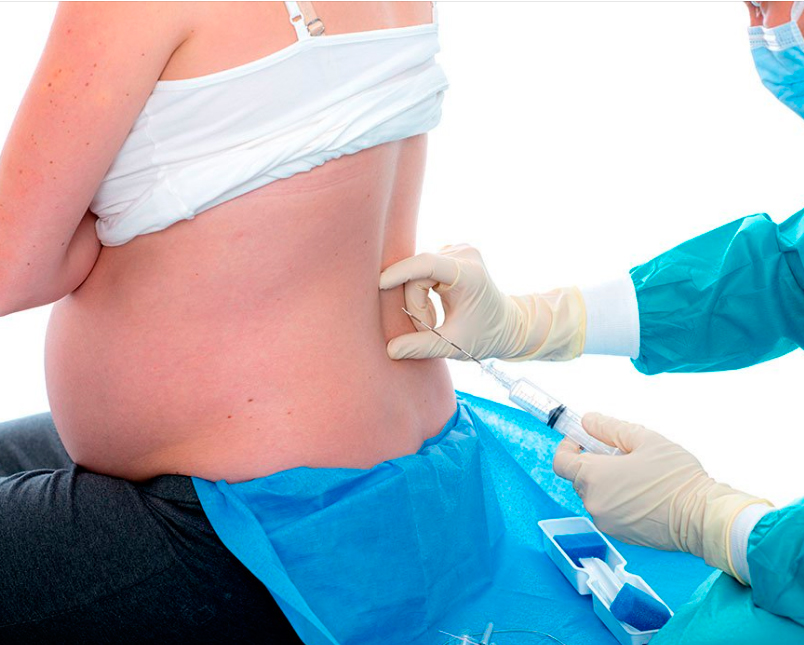 Истерлинг Т.Р., Бенедетти Т.Дж., Шумейкер Б.С. и др. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты. Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]8. Регитц-Загросек В., Лундквист С. Б., Борги К. и соавт. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) European Heart Journal . 2011; 32:3147–3197. [PubMed] [Google Scholar]9. Мейбум Л. Дж., Вос Ф. Э., Тиммерманс Дж., Бурс Г. Х., Цвиндерман А.Х., Малдер Б.Дж. М. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование.
Истерлинг Т.Р., Бенедетти Т.Дж., Шумейкер Б.С. и др. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты. Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]8. Регитц-Загросек В., Лундквист С. Б., Борги К. и соавт. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) European Heart Journal . 2011; 32:3147–3197. [PubMed] [Google Scholar]9. Мейбум Л. Дж., Вос Ф. Э., Тиммерманс Дж., Бурс Г. Х., Цвиндерман А.Х., Малдер Б.Дж. М. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование. Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar] 10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar] 11. Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed] [CrossRef] [Google Scholar] 12. Бусер Р. Т., Мордекай М. М., Брюлл С. Дж. Комбинированная спинально-эпидуральная анальгезия родов у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar] 13.Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана.
Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar] 10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar] 11. Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed] [CrossRef] [Google Scholar] 12. Бусер Р. Т., Мордекай М. М., Брюлл С. Дж. Комбинированная спинально-эпидуральная анальгезия родов у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar] 13.Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана. Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar] 14. Пьериц Р. Э., Фишман Э. К., Бернхардт Б. А., Зигельман С. С. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]15.Fattori R., Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar] 16. Ан Н.У., Спонселлер П.Д., Ан У.М., Налламшетти Л., Кушик Б.С., Зинрайх С.Дж. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar] 17.Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике.
Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar] 14. Пьериц Р. Э., Фишман Э. К., Бернхардт Б. А., Зигельман С. С. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]15.Fattori R., Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar] 16. Ан Н.У., Спонселлер П.Д., Ан У.М., Налламшетти Л., Кушик Б.С., Зинрайх С.Дж. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar] 17.Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике. Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar] 18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни. Журнал нейрохирургии: позвоночник .2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar] 19. Лундби Р., Рэнд-Хендриксен С., Халд Дж. К. и др. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ. Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar] 21.
Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar] 18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни. Журнал нейрохирургии: позвоночник .2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar] 19. Лундби Р., Рэнд-Хендриксен С., Халд Дж. К. и др. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ. Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar] 21. Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar] 22. Рахман Дж., Рахман Ф.З., Рахман В., Аль-Сулейман С.А., Рахман М.С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины .2003; 48: 723–728. [PubMed] [Google Scholar] 23. Ким Д.В., Лим Ю.Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef][Google Scholar]
Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar] 22. Рахман Дж., Рахман Ф.З., Рахман В., Аль-Сулейман С.А., Рахман М.С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины .2003; 48: 723–728. [PubMed] [Google Scholar] 23. Ким Д.В., Лим Ю.Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef][Google Scholar]24. МакКусик В.А. Синдром Марфана, МФС. Онлайн менделевское наследование у человека. OMIM, MIM № 154700, Балтимор (MD): Университет Джона Хопкинса, 2003.
25. Fettes P.D.W., Jansson J.-R., Wildsmith J.A.W. Неудачная спинальная анестезия: механизмы, лечение и профилактика. Британский журнал анестезии . 2009;102(6):739–748. doi: 10.1093/bja/aep096. [PubMed] [CrossRef] [Google Scholar] 26. Лакасси Х.Дж., Миллар С., Лейте Л.Г. и др. Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинномозговой анестезии у двух рожениц с синдромом Марфана. Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar] 27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar] 26. Лакасси Х.Дж., Миллар С., Лейте Л.Г. и др. Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинномозговой анестезии у двух рожениц с синдромом Марфана. Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar] 27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]Эпидуральная анестезия при кесаревом сечении у беременной женщины с синдромом Марфана и дуральной эктазией
Представитель акушерства Gynecol. 2017; 2017: 2126310.
, 1 , 2 , * , 3 , 3 , 4 и 4Франко Пепе
1 У.О.К. Ostetricia e ginecologia e ps, ospedale santo bambino, catania, Италия
mariagrazia stracquadanio
2 istituto di patologia ostetrica e ginecologica, Ospedale Santo Bambino, Catania, Италия
Francesco de Luca
3 U. O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
Agata Privitera
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Италия
ELISABETTA SANALITRO
4 Modulo Dipartimentale Anestesia Ostetrica, Ospedale Santo Bambino, Catania, Италия
Puccio Scarpinati
4 Modulo Dipartimentale Anestesia Ostetrica, Ospedale Santo Bambino, Catania , Италия
1 У.О.К. Ostetricia e Ginecologia e PS, Ospedale Santo Bambino, Катания, Италия
2 Istituto di Patologia Ostetrica e Ginecologica, Ospedale Santo Bambino, Катания, Италия
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Italy
4 Modulo Dipartimental Anestesia Ostetrica, Ospedale Santo Bambino, Catania, Italy
Академический редактор: Michael Geary
Поступила в редакцию 18 февраля 2017 г.; Принято 19 апреля 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Abstract
Синдром Марфана (СМФ) представляет собой генетическое заболевание соединительной ткани, характеризующееся разнообразными клиническими проявлениями и мультисистемными осложнениями. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
1. Введение
Синдром Марфана (СМФ) представляет собой аутосомно-доминантное наследственное заболевание соединительной ткани; его заболеваемость оценивается примерно в 1 : 5.000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинический и инструментальный диагноз основан на соблюдении Гентских критериев, предложенных в 1996 г. De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al.в 2010 году [3]. Некоторые проявления очевидны с детства (например, эктопия хрусталика), тогда как другие проявляются в более позднем возрасте, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Как сообщается в литературе, акушерское ведение женщин с MFS в настоящее время хорошо закодировано, с благоприятным исходом, если диаметр корня аорты менее 40 мм. Увеличение размера аорты во время беременности не является уникальным явлением у женщин с MFS, но известно, что оно происходит во время нормальной здоровой беременности и в большей степени у женщин с преэклампсией [6].
Некоторые недавние руководства рекомендуют женщинам с MFS избегать беременности или, в качестве альтернативы, пройти хирургическую замену восходящей аорты до зачатия, если размеры аорты > 4 см [7].
Литература предполагает 1% риск расслоения аорты или серьезного кардиального события у женщин с диаметром корня аорты <40 мм [8]. Риск повышается при диаметре корня аорты >40 мм, при быстром увеличении размеров аорты или в контексте расслоения в семейном анамнезе [9].
Однако наличие эктазии твердой мозговой оболочки считается основной причиной неудачи местно-регионарной анестезии во время кесарева сечения. Целью данного исследования является представление случая беременной женщины с MFS в сроке с обширной дуральной эктазией, у которой было успешное кесарево сечение с эпидуральной анестезией во время ее второй беременности.
2. История болезни
Ф. С., 35 лет, рост 180 см, вес 85 кг, пациентка с MSF с пояснично-крестцовой твердой мозговой оболочкой, перенесшая кесарево сечение на сроке 37 недель и 3 дня беременности.Она сообщает, что мать была очень высока и внезапно умерла в возрасте до 50 лет; ее дедушка по материнской линии тоже был особенно высоким, а ее брат был миопиком и тяжелым сколиозом. Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
В акушерском анамнезе: предыдущее кесарево сечение в 2004 г. без осложнений. После спинномозговой анестезии была проведена спинно-блокадная анестезия, которая была переведена в общую. В послеоперационном периоде у нее было кровотечение из-за атонии матки, лечилась окситоцином и простагландинами и выздоравливала в реанимации. Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозной дилатацией некоторых нервных корешков.Это открытие является одним из основных диагностических критериев MFS. В 2009 году у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства.
Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения.
К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи.
Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
3. Обсуждение
MFS — аутосомно-доминантное заболевание соединительной ткани, связанное с мутацией гена фибриллина, гликопротеина, который является основным компонентом внеклеточных микрофибрилл, чей ген картируется на хромосоме 15. MFS затрагивает различные органы и системы. с разной степенью тяжести: по этой причине ее диагностика в основном клинико-инструментальная, а затем молекулярная. Он основан на наблюдении Гентских критериев и пересмотренных критериев [10].
В литературе имеется большой опыт ведения беременных с РС [9–13].Беременность можно рассматривать как относящуюся к группе низкого риска при отсутствии выраженной дилатации аорты и митральной недостаточности. У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
Бета-блокаторы снижают риск дилатации аорты и сердечных осложнений, но они, по-видимому, повышают тонус и сократительную способность матки, а также могут снижать кровоток в пупочной артерии, вызывая низкий вес новорожденных. У нашей беременной они не применялись.
Эктазия твердой мозговой оболочки является одним из основных критериев диагностики MFS и присутствует более чем у 2/3 пораженных взрослых [14–16], а распространенность тяжелого (степени 2 и 3) поражения твердой мозговой оболочки выше у пациенты, несущие преждевременные мутации терминирующего кодона, по сравнению с теми, кто несет миссенс-мутации [17]. Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника.
Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом.
Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Очевидно, что для наилучшего ведения родов и родоразрешения у пациенток с MFS основной целью является снижение сердечно-сосудистого стресса, и кесарево сечение часто выполняется для предотвращения сердечно-сосудистых осложнений. Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22].Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22].
Колебания гемодинамических параметров, вторичные по отношению к боли и тревоге при родах, могут оказывать негативное влияние на сердечно-сосудистую систему; высокое кровяное давление имеет тенденцию к развитию аневризм аорты из-за ослабления сосудистой среды у пациентов с MFS, а ишемия миокарда и сердечная недостаточность также могут быть вызваны повышенной потребностью миокарда в кислороде, что приводит к высокому кровяному давлению; таким образом, основной целью является предотвращение высокого кровяного давления [23]. По всем этим причинам часто планируют кесарево сечение.
По всем этим причинам часто планируют кесарево сечение.
Тип анестезии также обсуждался. Общая анестезия вызывает колебания артериального давления во время интубации; поэтому периферическая анестезия предпочтительнее из-за медленного начала и постепенного прогрессирования эпидуральной блокады. Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение.
В некоторых исследованиях регионарная анестезия успешно применялась у пациенток с MFS как во время обезболивания родов, так и во время кесарева сечения. Комбинированная спинально-эпидуральная анестезия предпочтительнее общей анестезии при кесаревом сечении у пациентов с MFS, поскольку комбинированная спинально-эпидуральная анестезия обеспечивает превосходную гемодинамическую стабильность, а адекватный послеоперационный контроль боли может быть достигнут с помощью эпидуральной анальгезии. Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии.
Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Таким образом, обследование беременных женщин с MFS требует междисциплинарного подхода при тесном сотрудничестве гинеколога, кардиолога, анестезиолога и неонатолога. Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты.Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Каталожные номера
1.Пириц Р. Э., МакКьюсик В. А. Синдром Марфана: диагностика и лечение. Медицинский журнал Новой Англии . 1979; 300(14):772–777. doi: 10.1056/nejm197
3001406. O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
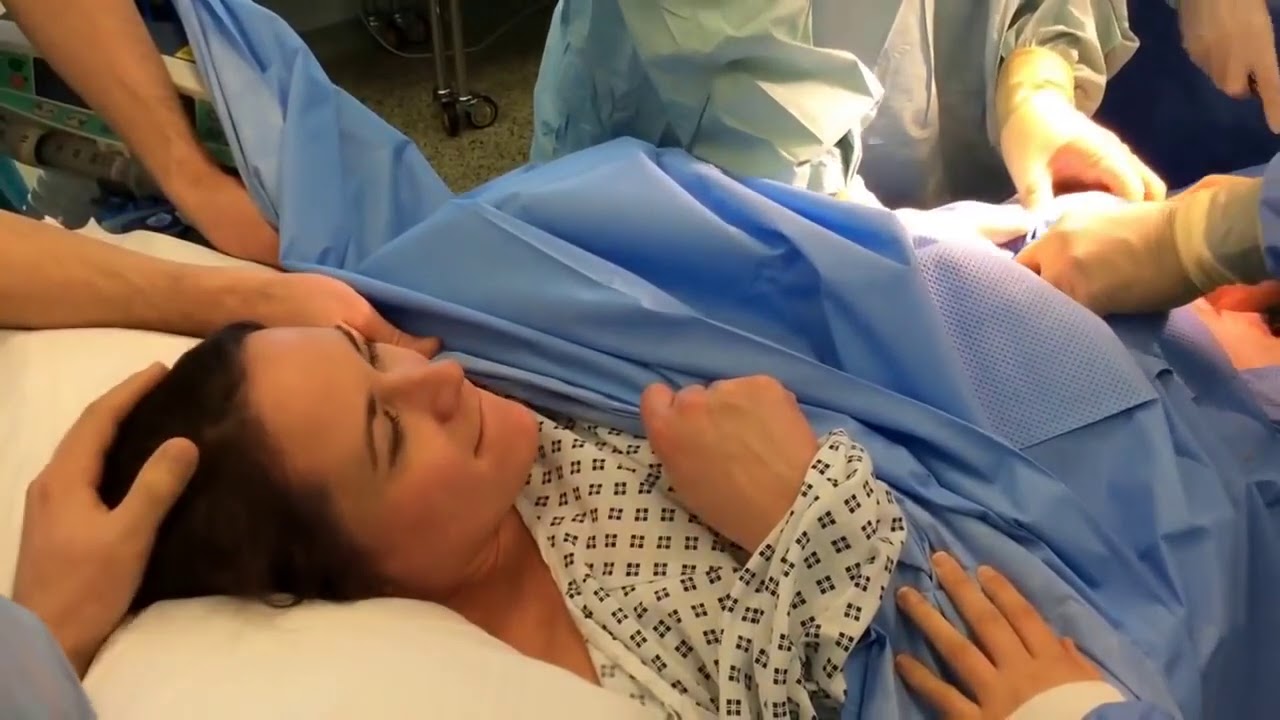
 Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
 Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
 Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства.
Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения.
К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи.
Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.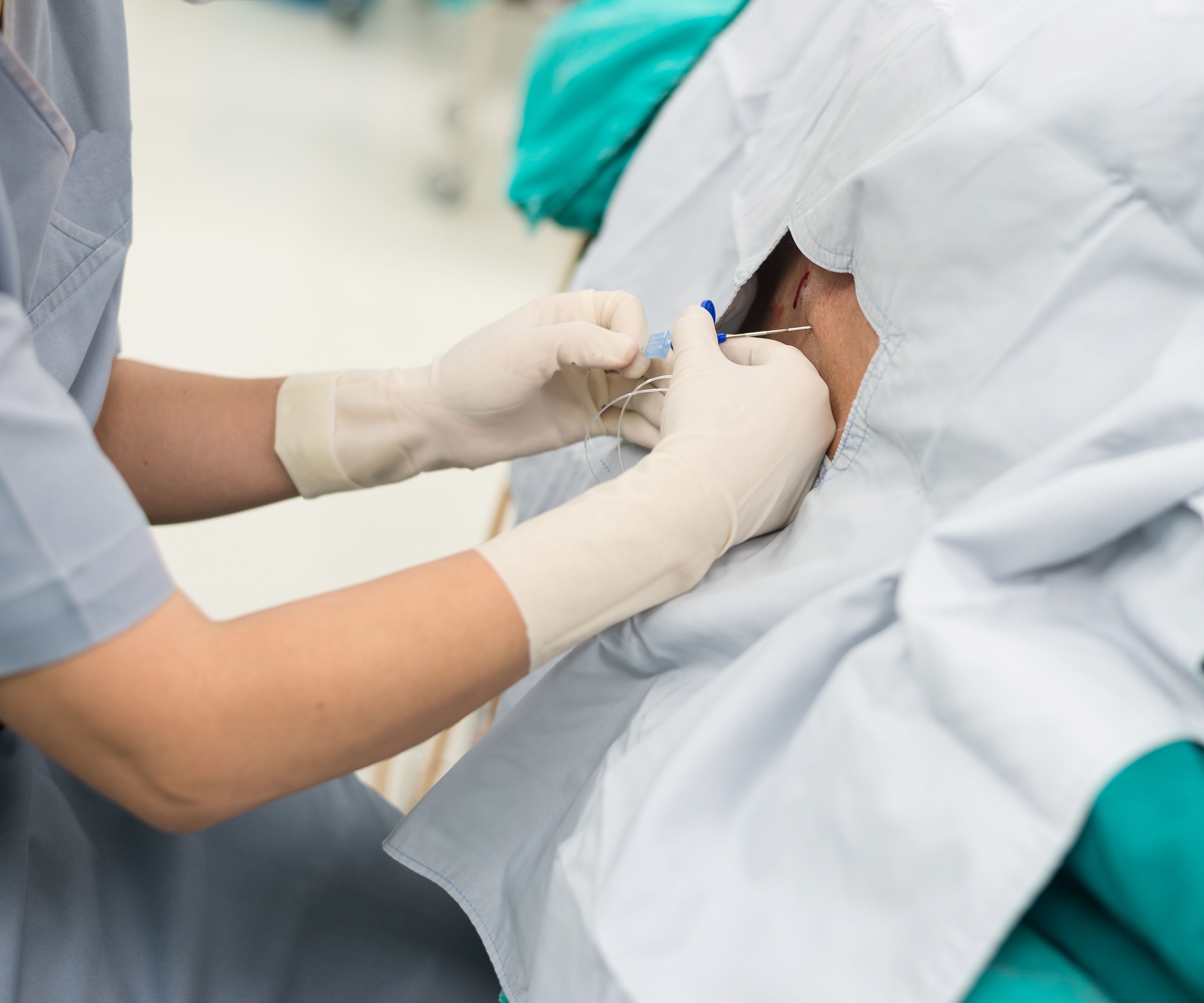 У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.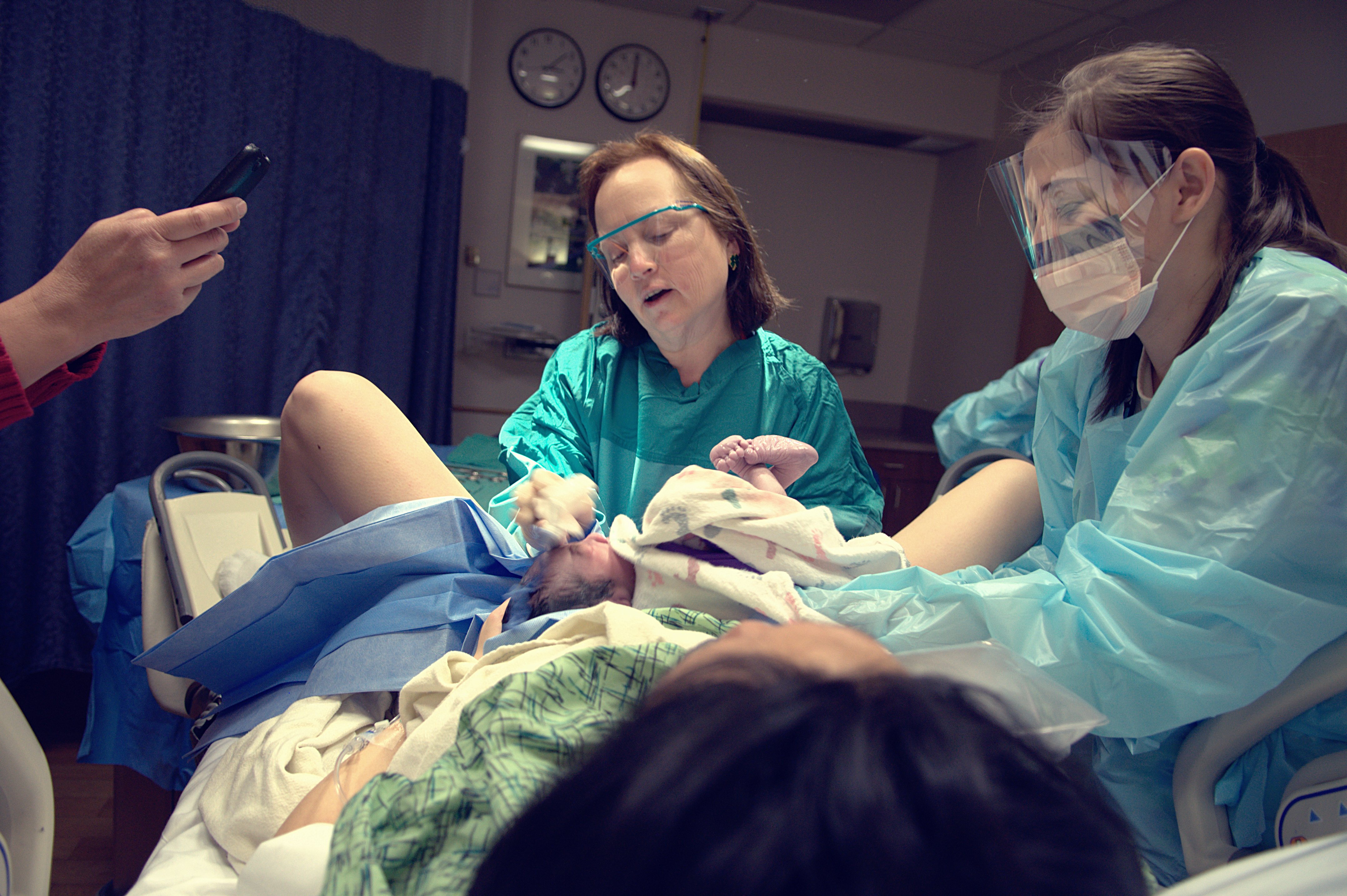 Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника.
Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом.
Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.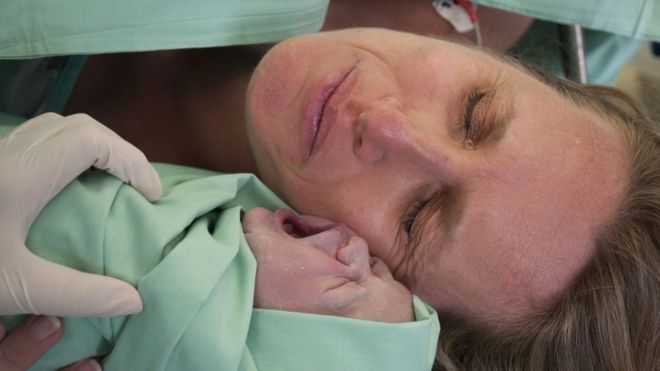 По всем этим причинам часто планируют кесарево сечение.
По всем этим причинам часто планируют кесарево сечение.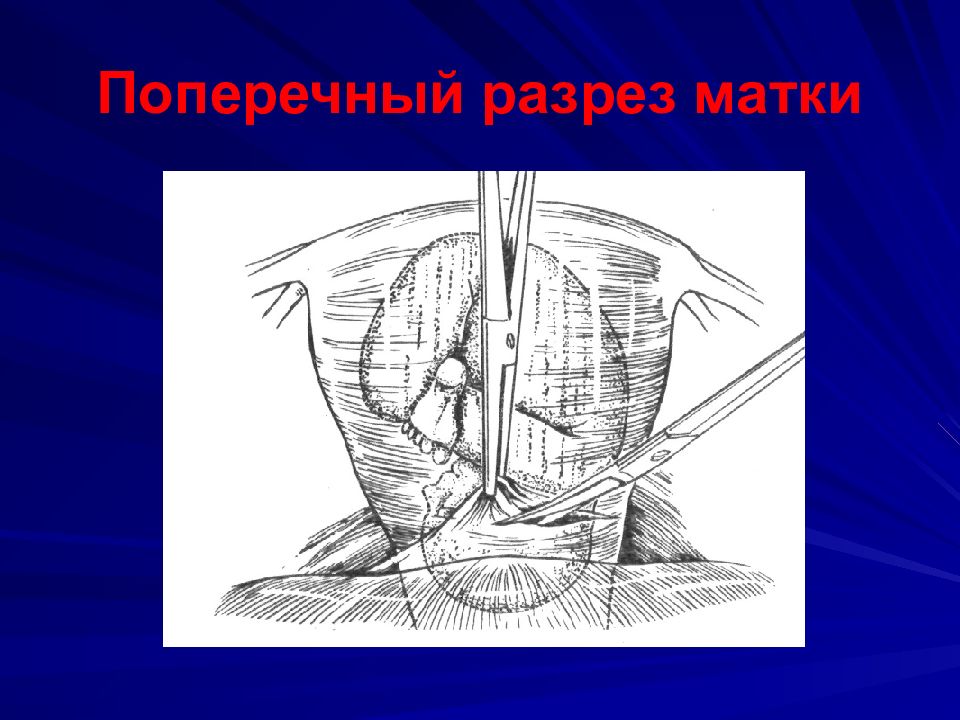 Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии.
Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг). У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время. [PubMed] [CrossRef] [Google Scholar]2. De Paepe A., Devereux R.B., Dietz HC, Hennekam RCM, Pyeritz R.E. Пересмотренные диагностические критерии синдрома Марфана. Американский журнал медицинской генетики . 1996;62(4):417–426. doi: 10.1002/(sici)1096-8628(19960424)62:4<417::aid-ajmg15>3.0.co;2-r. [PubMed] [CrossRef] [Google Scholar]3.Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10.1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]4. Патерностер Д. М., Сантаросса К., Ветторе Н. и соавт. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]6.
[PubMed] [CrossRef] [Google Scholar]2. De Paepe A., Devereux R.B., Dietz HC, Hennekam RCM, Pyeritz R.E. Пересмотренные диагностические критерии синдрома Марфана. Американский журнал медицинской генетики . 1996;62(4):417–426. doi: 10.1002/(sici)1096-8628(19960424)62:4<417::aid-ajmg15>3.0.co;2-r. [PubMed] [CrossRef] [Google Scholar]3.Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10.1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]4. Патерностер Д. М., Сантаросса К., Ветторе Н. и соавт. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]6. Истерлинг Т.Р., Бенедетти Т.Дж., Шумейкер Б.С. и др. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты. Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]8. Регитц-Загросек В., Лундквист С. Б., Борги К. и соавт. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) European Heart Journal . 2011; 32:3147–3197. [PubMed] [Google Scholar]9. Мейбум Л. Дж., Вос Ф. Э., Тиммерманс Дж., Бурс Г. Х., Цвиндерман А.Х., Малдер Б.Дж. М. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование.
Истерлинг Т.Р., Бенедетти Т.Дж., Шумейкер Б.С. и др. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты. Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]8. Регитц-Загросек В., Лундквист С. Б., Борги К. и соавт. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) European Heart Journal . 2011; 32:3147–3197. [PubMed] [Google Scholar]9. Мейбум Л. Дж., Вос Ф. Э., Тиммерманс Дж., Бурс Г. Х., Цвиндерман А.Х., Малдер Б.Дж. М. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование. Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar] 10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar] 11. Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed] [CrossRef] [Google Scholar] 12. Бусер Р. Т., Мордекай М. М., Брюлл С. Дж. Комбинированная спинально-эпидуральная анальгезия родов у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar] 13.Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана.
Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar] 10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar] 11. Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed] [CrossRef] [Google Scholar] 12. Бусер Р. Т., Мордекай М. М., Брюлл С. Дж. Комбинированная спинально-эпидуральная анальгезия родов у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar] 13.Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана. Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar] 14. Пьериц Р. Э., Фишман Э. К., Бернхардт Б. А., Зигельман С. С. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]15.Fattori R., Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar] 16. Ан Н.У., Спонселлер П.Д., Ан У.М., Налламшетти Л., Кушик Б.С., Зинрайх С.Дж. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar] 17.Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике.
Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar] 14. Пьериц Р. Э., Фишман Э. К., Бернхардт Б. А., Зигельман С. С. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]15.Fattori R., Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar] 16. Ан Н.У., Спонселлер П.Д., Ан У.М., Налламшетти Л., Кушик Б.С., Зинрайх С.Дж. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar] 17.Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике. Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar] 18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни. Журнал нейрохирургии: позвоночник .2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar] 19. Лундби Р., Рэнд-Хендриксен С., Халд Дж. К. и др. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ. Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar] 21.
Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar] 18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни. Журнал нейрохирургии: позвоночник .2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar] 19. Лундби Р., Рэнд-Хендриксен С., Халд Дж. К. и др. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ. Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar] 21. Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar] 22. Рахман Дж., Рахман Ф.З., Рахман В., Аль-Сулейман С.А., Рахман М.С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины .2003; 48: 723–728. [PubMed] [Google Scholar] 23. Ким Д.В., Лим Ю.Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef][Google Scholar]
Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar] 22. Рахман Дж., Рахман Ф.З., Рахман В., Аль-Сулейман С.А., Рахман М.С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины .2003; 48: 723–728. [PubMed] [Google Scholar] 23. Ким Д.В., Лим Ю.Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef][Google Scholar]24. МакКусик В.А. Синдром Марфана, МФС. Онлайн менделевское наследование у человека. OMIM, MIM № 154700, Балтимор (MD): Университет Джона Хопкинса, 2003.
25. Fettes P.D.W., Jansson J.-R., Wildsmith J.A.W. Неудачная спинальная анестезия: механизмы, лечение и профилактика. Британский журнал анестезии . 2009;102(6):739–748. doi: 10.1093/bja/aep096. [PubMed] [CrossRef] [Google Scholar] 26. Лакасси Х.Дж., Миллар С., Лейте Л.Г. и др. Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинномозговой анестезии у двух рожениц с синдромом Марфана. Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar] 27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar] 26. Лакасси Х.Дж., Миллар С., Лейте Л.Г. и др. Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинномозговой анестезии у двух рожениц с синдромом Марфана. Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar] 27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]Эпидуральная анестезия при кесаревом сечении у беременной женщины с синдромом Марфана и дуральной эктазией
Представитель акушерства Gynecol. 2017; 2017: 2126310.
, 1 , 2 , * , 3 , 3 , 4 и 4Франко Пепе
1 У.О.К. Ostetricia e ginecologia e ps, ospedale santo bambino, catania, Италия
mariagrazia stracquadanio
2 istituto di patologia ostetrica e ginecologica, Ospedale Santo Bambino, Catania, Италия
Francesco de Luca
3 U. O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
Agata Privitera
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Италия
ELISABETTA SANALITRO
4 Modulo Dipartimentale Anestesia Ostetrica, Ospedale Santo Bambino, Catania, Италия
Puccio Scarpinati
4 Modulo Dipartimentale Anestesia Ostetrica, Ospedale Santo Bambino, Catania , Италия
1 У.О.К. Ostetricia e Ginecologia e PS, Ospedale Santo Bambino, Катания, Италия
2 Istituto di Patologia Ostetrica e Ginecologica, Ospedale Santo Bambino, Катания, Италия
3 U.O. Cardiologia Pediatrica, Ospedale Santo Bambino, Catania, Italy
4 Modulo Dipartimental Anestesia Ostetrica, Ospedale Santo Bambino, Catania, Italy
Академический редактор: Michael Geary
Поступила в редакцию 18 февраля 2017 г.; Принято 19 апреля 2017 г.
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Abstract
Синдром Марфана (СМФ) представляет собой генетическое заболевание соединительной ткани, характеризующееся разнообразными клиническими проявлениями и мультисистемными осложнениями. Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия с успехом использовалась во время кесарева сечения, но у некоторых пациенток с MFS существует вероятность неустойчивого и неадекватного распространения интратекальных местных анестетиков в результате дуральной эктазии. В этих случаях эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика с контролируемым началом анестезии, аналгезии и симпатического блока и низким риском периоперационных осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и дуральной эктазией, которая успешно перенесла кесарево сечение с использованием эпидуральной анестезии. Предыдущая беременность этой женщины закончилась кесаревым сечением с неудачной спинальной анестезией, которая была переведена на общую анестезию в связи с неизвестной на тот момент дуральной эктазией.
1. Введение
Синдром Марфана (СМФ) представляет собой аутосомно-доминантное наследственное заболевание соединительной ткани; его заболеваемость оценивается примерно в 1 : 5.000, без различий по полу или этническому происхождению. В 90% случаев это связано с мутациями в гене FBN1, кодирующем фибриллин [1]. Клинические проявления гена могут поражать несколько органов с различной степенью тяжести, в частности, поражая сердечно-сосудистую, скелетную и глазную системы. Клинический и инструментальный диагноз основан на соблюдении Гентских критериев, предложенных в 1996 г. De Paepe et al. [2], в диапазоне от знакомства до полиорганного поражения, и они были недавно пересмотрены Loeys et al.в 2010 году [3]. Некоторые проявления очевидны с детства (например, эктопия хрусталика), тогда как другие проявляются в более позднем возрасте, например пояснично-крестцовая дуральная эктазия; основная причина заболеваемости и смертности связана с дилатацией аорты и острым расслоением аорты. Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Как сообщается в литературе, акушерское ведение женщин с MFS в настоящее время хорошо закодировано, с благоприятным исходом, если диаметр корня аорты менее 40 мм. Увеличение размера аорты во время беременности не является уникальным явлением у женщин с MFS, но известно, что оно происходит во время нормальной здоровой беременности и в большей степени у женщин с преэклампсией [6].
Некоторые недавние руководства рекомендуют женщинам с MFS избегать беременности или, в качестве альтернативы, пройти хирургическую замену восходящей аорты до зачатия, если размеры аорты > 4 см [7].
Литература предполагает 1% риск расслоения аорты или серьезного кардиального события у женщин с диаметром корня аорты <40 мм [8]. Риск повышается при диаметре корня аорты >40 мм, при быстром увеличении размеров аорты или в контексте расслоения в семейном анамнезе [9].
Однако наличие эктазии твердой мозговой оболочки считается основной причиной неудачи местно-регионарной анестезии во время кесарева сечения. Целью данного исследования является представление случая беременной женщины с MFS в сроке с обширной дуральной эктазией, у которой было успешное кесарево сечение с эпидуральной анестезией во время ее второй беременности.
2. История болезни
Ф. С., 35 лет, рост 180 см, вес 85 кг, пациентка с MSF с пояснично-крестцовой твердой мозговой оболочкой, перенесшая кесарево сечение на сроке 37 недель и 3 дня беременности.Она сообщает, что мать была очень высока и внезапно умерла в возрасте до 50 лет; ее дедушка по материнской линии тоже был особенно высоким, а ее брат был миопиком и тяжелым сколиозом. Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
В акушерском анамнезе: предыдущее кесарево сечение в 2004 г. без осложнений. После спинномозговой анестезии была проведена спинно-блокадная анестезия, которая была переведена в общую. В послеоперационном периоде у нее было кровотечение из-за атонии матки, лечилась окситоцином и простагландинами и выздоравливала в реанимации. Через пять дней пациентка была выписана в удовлетворительном состоянии, наблюдалась каждые 6 мес и получала профилактическую терапию бета-адреноблокаторами. В 2007 г. из-за болей в пояснице она выполнила МРТ пояснично-крестцового отдела, которая показала эктазию дистального отдела твердой мозговой оболочки с кистозной дилатацией некоторых нервных корешков.Это открытие является одним из основных диагностических критериев MFS. В 2009 году у нее началась вторая беременность, и она находилась под наблюдением амбулаторной акушерской клиники больницы Санто Бамбино в Катании (Сицилия). В течение первого триместра беременности пациентка была бессимптомной с хорошей сердечно-сосудистой компенсацией и не принимала никаких лекарств. Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства.
Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения.
К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи.
Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
3. Обсуждение
MFS — аутосомно-доминантное заболевание соединительной ткани, связанное с мутацией гена фибриллина, гликопротеина, который является основным компонентом внеклеточных микрофибрилл, чей ген картируется на хромосоме 15. MFS затрагивает различные органы и системы. с разной степенью тяжести: по этой причине ее диагностика в основном клинико-инструментальная, а затем молекулярная. Он основан на наблюдении Гентских критериев и пересмотренных критериев [10].
В литературе имеется большой опыт ведения беременных с РС [9–13].Беременность можно рассматривать как относящуюся к группе низкого риска при отсутствии выраженной дилатации аорты и митральной недостаточности. У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
Бета-блокаторы снижают риск дилатации аорты и сердечных осложнений, но они, по-видимому, повышают тонус и сократительную способность матки, а также могут снижать кровоток в пупочной артерии, вызывая низкий вес новорожденных. У нашей беременной они не применялись.
Эктазия твердой мозговой оболочки является одним из основных критериев диагностики MFS и присутствует более чем у 2/3 пораженных взрослых [14–16], а распространенность тяжелого (степени 2 и 3) поражения твердой мозговой оболочки выше у пациенты, несущие преждевременные мутации терминирующего кодона, по сравнению с теми, кто несет миссенс-мутации [17]. Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника.
Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом.
Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Очевидно, что для наилучшего ведения родов и родоразрешения у пациенток с MFS основной целью является снижение сердечно-сосудистого стресса, и кесарево сечение часто выполняется для предотвращения сердечно-сосудистых осложнений. Пациентки с диаметром корня аорты < 4 см во время родов имеют одинаковый исход при вагинальном родоразрешении и кесаревом сечении, но кесарево сечение предпочтительнее у пациенток с корнем аорты > 4 см, поскольку риск сердечной декомпенсации чрезвычайно высок. 22].Однако сообщалось о расслоении аорты даже при отсутствии предшествующей дилатации корня аорты [22].
Колебания гемодинамических параметров, вторичные по отношению к боли и тревоге при родах, могут оказывать негативное влияние на сердечно-сосудистую систему; высокое кровяное давление имеет тенденцию к развитию аневризм аорты из-за ослабления сосудистой среды у пациентов с MFS, а ишемия миокарда и сердечная недостаточность также могут быть вызваны повышенной потребностью миокарда в кислороде, что приводит к высокому кровяному давлению; таким образом, основной целью является предотвращение высокого кровяного давления [23]. По всем этим причинам часто планируют кесарево сечение.
По всем этим причинам часто планируют кесарево сечение.
Тип анестезии также обсуждался. Общая анестезия вызывает колебания артериального давления во время интубации; поэтому периферическая анестезия предпочтительнее из-за медленного начала и постепенного прогрессирования эпидуральной блокады. Поскольку самопроизвольные роды определяют повышение АД во время схваток, применение эпидуральной анальгезии снижает боль, АД и частоту сердечных сокращений. У нашей пациентки было выполнено кесарево сечение, так как у нее уже было кесарево сечение.
В некоторых исследованиях регионарная анестезия успешно применялась у пациенток с MFS как во время обезболивания родов, так и во время кесарева сечения. Комбинированная спинально-эпидуральная анестезия предпочтительнее общей анестезии при кесаревом сечении у пациентов с MFS, поскольку комбинированная спинально-эпидуральная анестезия обеспечивает превосходную гемодинамическую стабильность, а адекватный послеоперационный контроль боли может быть достигнут с помощью эпидуральной анальгезии. Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии.
Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Таким образом, обследование беременных женщин с MFS требует междисциплинарного подхода при тесном сотрудничестве гинеколога, кардиолога, анестезиолога и неонатолога. Беременность следует планировать после полного обследования пациентки и определения конкретных рисков. Актуальной является эхокардиографическая оценка расширения корня аорты. Во время беременности акушерское ведение существенно не отличается, но оно отягощено более высокой частотой преждевременного разрыва плодных оболочек, побочными эффектами препаратов, применяемых по показаниям для профилактики разрыва аорты, и риском расслоения аорты.Анестезиологическое обеспечение во время родов обсуждается. Регионарная анестезия успешно использовалась во время кесарева сечения, но существует значительная вероятность неустойчивого и неадекватного интратекального распространения местных анестетиков, скорее всего, в результате дуральной эктазии. У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Каталожные номера
1.Пириц Р. Э., МакКьюсик В. А. Синдром Марфана: диагностика и лечение. Медицинский журнал Новой Англии . 1979; 300(14):772–777. doi: 10.1056/nejm197
3001406.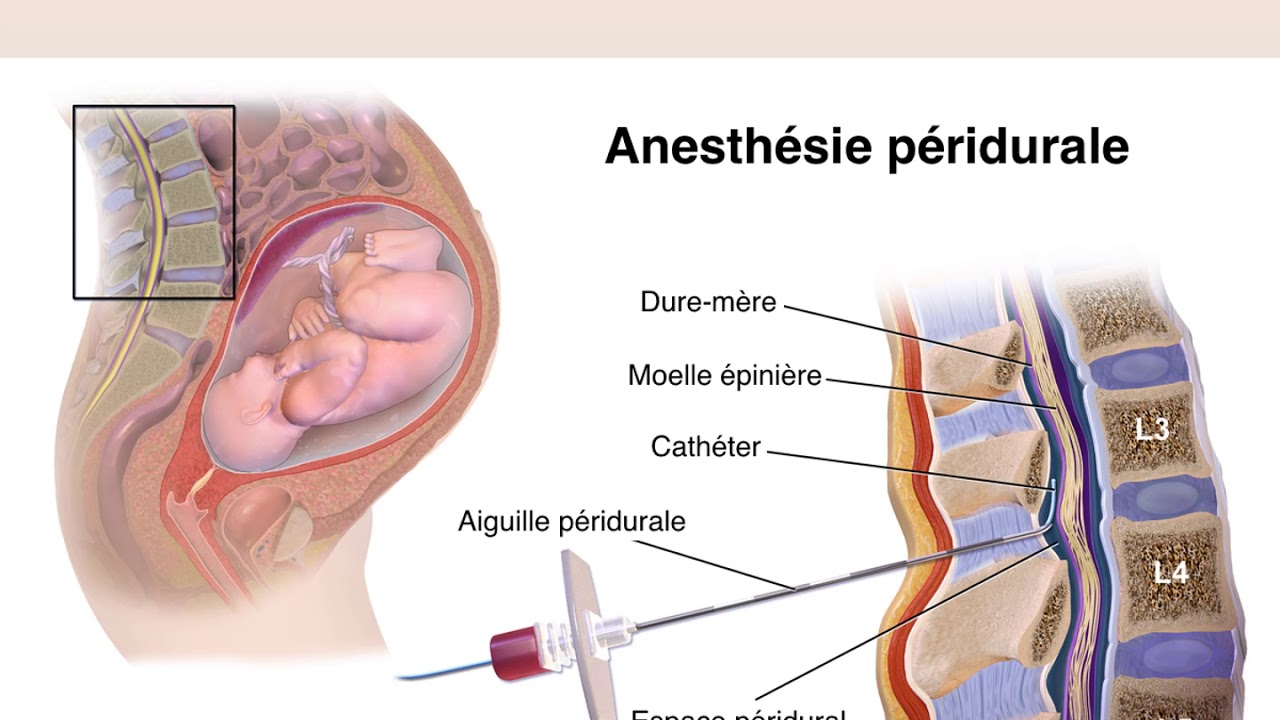 O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия
O. Cardiologia Pediatrica, Ospedale Santo Bambino, Катания, Италия

 Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
Сердечно-сосудистые проявления, такие как дилатация и расслоение аорты, являются причиной 90% смертей, связанных с MFS [4, 5]. Заболевание не связано со снижением фертильности; на самом деле это обычное дело — беременная женщина с этим синдромом.В таком случае было бы уместно провести точную клиническую оценку до беременности, в частности, эхокардиографию, для оценки размера корня аорты: диаметр более 40 мм подвергает пациентку риску его разрыва.
 Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.
Медицинский анамнез был положительным на эктопию хрусталика (диагностировали, когда ей было 6 лет), дорсальный сколиоз (лечили корсетом с 10 до 14 лет) и легкую эктазию дуги аорты. Ранее перенесла правостороннюю сафенэктомию и энуклеацию фиброаденомы правой молочной железы. Физикальное обследование показало скелетные аномалии, такие как высокое арочное небо, раскрытие рук больше высоты, килевидная деформация грудной клетки справа, плоскостопие, двусторонний вальгус и арахнодактилия.На коже груди, плеч, спины и живота были видны стрии. При обследовании сердечно-сосудистой системы с помощью стетоскопа выслушиваются металлический щелчок и систолический шум. Тоны сердца достоверные и ритмичные, с хорошей гемодинамической компенсацией, а на ЭКГ — нормальный синусовый ритм и нормальная дорожка со средним пульсом 65 ударов в минуту. Пациент был нормотензивным (АД 120/70 мм рт.ст.). Эхокардиограмма показала легкое расширение корня аорты (42 мм), нормальную функцию желудочков и легкий пролапс митрального клапана без регургитации.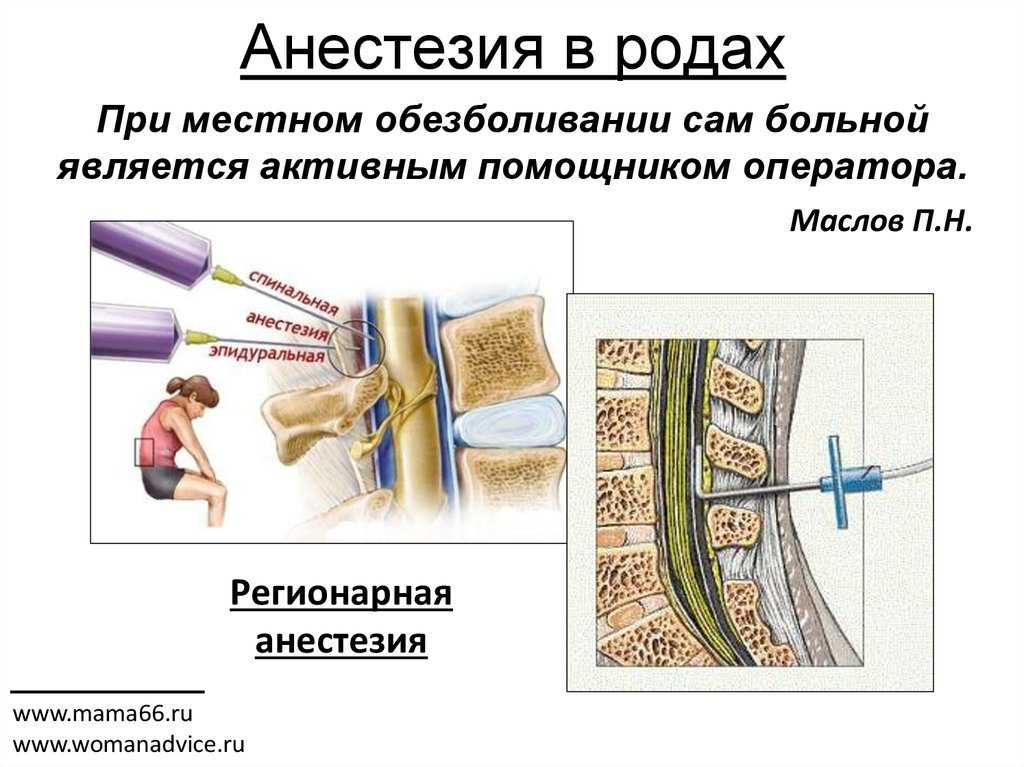
 Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства.
Ежемесячно ее посещали акушеры; она также прошла три ультразвуковых исследования (по одному на каждый триместр беременности), два кардиологических обследования (в начале и в ближайшем сроке) и две эхокардиографии матери (в 22 недели и в ближайшем сроке) для наблюдения за корнем аорты.Рост плода был регулярным. В 37 недель + 3 дня в связи с возникновением сокращений матки больная поступила в стационар для операции кесарева сечения. Учитывая предыдущий неудачный опыт проведения спинномозговой анестезии (недостаточная эффективность при использовании общей анестезии), зная о наличии эктазии дурального мешка при предоперационном обследовании пациентки, для выполнения ей второго кесарева сечения была предложена эпидуральная анестезия. Этот тип анестезии обеспечивает лучшую циркуляцию и распределение анестетика, преодолевая проблемы, связанные со спинномозговой анестезией при наличии дуральной эктазии.Препараты, вводимые эпидурально, требуют в 5-10 раз больших доз и больших объемов, чем рассчитанные для субарахноидального пространства. К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения.
К преимуществам эпидуральной блокады относятся меньшая частота и тяжесть материнской гипотензии благодаря снижению частоты симпатического блока, меньший риск головной боли из-за случайного прокола твердой мозговой оболочки и возможность точного контроля уровня и продолжительности анестезии. Пациент был проинформирован о выбранном типе регионарной анестезии и находился под наблюдением.Она находилась под постоянным неинвазивным мониторингом (ЭКГ, артериальное давление, насыщение кислородом) и получала премедикацию ранитидином 50 мг и метоклопрамидом 10 мг в физиологическом растворе. Ее уложили в сидячее положение, а затем выполнили местно-регионарную блокаду под эпидуральной анестезией из срединного доступа с размещением эпидурального катетера через иглу Туохи 17G, расположенную между L2 и L3. Ей дали лидокаин 400 мг (20 мл 2%) с 1 мэкв бикарбоната натрия и 50 мкг фентанила.Анестезиологический блок проявлялся в течение трех минут без побочных эффектов. Через 15 минут началось кесарево сечение, так как сенсорный блок был достаточно высоким (Т4) для кесарева сечения. Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи.
Систолическое артериальное давление оставалось стабильным (110–125/70 мм рт. ст.) в течение всего времени операции и послеоперационного периода. Признаков интраоперационных и послеоперационных осложнений не было, болевых симптомов пациентка не отмечала. Была проведена краткосрочная профилактика инфекции (3 г ампициллина/сульбактама) после рождения ребенка, а также 20 МЕ окситоцина.Через 30 минут после анестезиологического блока в эпидуральное пространство через катетер вводили 1 мг морфина + 75 мкг клонидина и 12 мг наропина. Через час от начала анестезиологического блока в инфузионный насос для эпидуральной анестезии была помещена непрерывная анестезия 0,1% наропином, 250 мг со скоростью 10 мл/ч. В конце операции для дальнейшего обезболивания вводят 75 мг диклофенака в/м и 0,2 мг метилэргометрина в/м. были введены. Больной находился под наблюдением в течение 2 часов, после чего был переведен в палату.Новорожденный мужского пола весил 3,250 г, он был извлечен через 30 минут с момента установки эпидурального катетера и через 1 минуту после разреза кожи. Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм.
Оценка по шкале Апгар на первой минуте была 9, а через 5 минут – 10. Эпидуральный катетер удален через 12 часов после кесарева сечения. Послеоперационное течение было обычным, выписана на четвертые сутки после кесарева сечения. Для профилактики венозных тромбоэмболий проводилась 12-дневная гепаринопрофилактика. После пятилетнего наблюдения мы можем утверждать, что пациент здоров и диаметр корня аорты всегда составляет 42 мм. У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты.
У женщин с низким поражением сердца риск расслоения аорты, эндокардита и застойной сердечной недостаточности во время беременности оценивается всего в 1%. Риск выше в третьем триместре беременности из-за увеличения гемодинамического стресса. Во время беременности и в послеродовом периоде следует часто проводить эхокардиографию, в зависимости от степени исходной дилатации корня аорты, для мониторинга сердечно-сосудистой системы и возможной прогрессирующей дилатации аорты. Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника.
Предполагается, что при синдроме Марфана твердая мозговая оболочка слабее и, как следствие, пульсация цереброспинальной жидкости в конечном итоге приводит к эктазии твердой мозговой оболочки с постепенной эрозией кости. Твердая эктазия характеризуется отеком твердой мозговой оболочки и позвоночного канала, а иногда и оболочек нервов. Хотя это может происходить по всему каналу, наиболее часто локализуется пояснично-крестцовый отдел позвоночника. Наиболее распространенными клиническими симптомами, которые могут усиливаться в положении лежа на спине, являются боль в пояснице, головная боль, астения, снижение чувствительности ниже и вокруг пораженного участка, иногда ректальная боль и/или дискомфорт в области гениталий [16, 18].Расширение твердой мозговой оболочки вариабельно; иногда поражение ограничивается очаговым расширением дуральной оболочки нервных корешков вблизи их выхода из позвоночного столба: их называют «корешковые кисты». Хроническая дилатация дурального мешка также может оказывать эрозивное действие на соседние костные структуры позвоночника. Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом.
Косвенные признаки поражения костей можно наблюдать при рентгенологическом исследовании (Rx) и при исследовании компьютерной томографии (КТ). Тем не менее, золотым стандартом для оценки дуральной эктазии является RM в отношении качества анатомических деталей и их многоплоскостности.Распространенность дуральной эктазии у пациентов с РС колеблется от 63% до 92%, вероятно, в связи с методом визуализации, используемым в различных исследованиях [19-21]. В исследовании, опубликованном в 1999 г., из 83 пациентов с МФС, обследованных с помощью МРТ, эктазия твердой мозговой оболочки была обнаружена в 92% случаев и ни у одного из пациентов контрольной группы. Однако высокая распространенность дуральной эктазии (41%) отмечается даже у пациентов с МФС без болей в спине [16]. Корреляции с наличием дилатации аорты обнаружено не было; поэтому эктазия твердой мозговой оболочки не имеет прогностического значения сердечно-сосудистого прогноза у этих пациентов.Что касается клинических проявлений, то эктазия твердой мозговой оболочки часто клинически бессимптомна или может иногда ассоциироваться с болью в пояснице или люмбоишиасом. Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано.
Однако четкой корреляции между болью в пояснице и дуральной эктазией не было продемонстрировано. По всем этим причинам часто планируют кесарево сечение.
По всем этим причинам часто планируют кесарево сечение. Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии.
Однако сообщалось о многих случаях неудач спинальной анестезии у пациентов с Марфаном, возможно, из-за дуральной эктазии [24, 25].Описано несколько случаев неправильного или неадекватного распространения интратекального местного анестетика у пациентов с этим синдромом. Лакасси и др. [26] провели непрерывную спинномозговую анестезию у двух пациентов с постепенно увеличивающейся дозой бупивакаина, но они прекратили дальнейшее введение бупивакаина после 21 мл из-за опасений потенциального неврологического повреждения. Они также сообщили о неравномерном распределении спинномозговой анестезии из-за непредсказуемого и неадекватного распространения интратекальных местных анестетиков у пациентов с MFS.Одним из важнейших факторов, влияющих на высоту блока у больных, получающих спинальную анестезию, является объем ликвора в пояснично-крестцовом пространстве, что способствует вариабельности распространения спинального блока. Ким и др. [27] сообщили об успешном периоперационном ведении пациента с MFS и дуральной эктазией по поводу кесарева сечения с использованием эпидуральной анестезии. Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг).
Хирургически адекватный уровень анестезии был достигнут через 30 мин после эпидурального введения 27 мл 2% лидокаина с адреналином (1:200) и фентанилом (100 мкг). У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время.
У этих пациенток эпидуральная анестезия может быть особенно полезной техникой во время кесарева сечения, поскольку она обеспечивает адекватное распространение и действие местного анестетика и контролируемое начало анестезии, обезболивания и симпатического блока с низким риском осложнений.Мы сообщаем об периоперационном ведении пациентки с MFS и пояснично-крестцовой эктазией твердой мозговой оболочки, перенесшей успешное кесарево сечение с использованием эпидуральной анестезии. Во время ее предыдущей беременности неудачная спинальная анестезия во время кесарева сечения была преобразована в общую анестезию из-за неизвестного наличия дуральной эктазии в то время. [PubMed] [CrossRef] [Google Scholar]2. De Paepe A., Devereux R.B., Dietz HC, Hennekam RCM, Pyeritz R.E. Пересмотренные диагностические критерии синдрома Марфана. Американский журнал медицинской генетики . 1996;62(4):417–426. doi: 10.1002/(sici)1096-8628(19960424)62:4<417::aid-ajmg15>3.0.co;2-r. [PubMed] [CrossRef] [Google Scholar]3.Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10.1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]4. Патерностер Д. М., Сантаросса К., Ветторе Н. и соавт. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]6.
[PubMed] [CrossRef] [Google Scholar]2. De Paepe A., Devereux R.B., Dietz HC, Hennekam RCM, Pyeritz R.E. Пересмотренные диагностические критерии синдрома Марфана. Американский журнал медицинской генетики . 1996;62(4):417–426. doi: 10.1002/(sici)1096-8628(19960424)62:4<417::aid-ajmg15>3.0.co;2-r. [PubMed] [CrossRef] [Google Scholar]3.Loeys B.L., Dietz H.C., Braverman A.C., et al. Пересмотренная гентская нозология синдрома Марфана. Журнал медицинской генетики . 2010;47(7):476–485. doi: 10.1136/jmg.2009.072785. [PubMed] [CrossRef] [Google Scholar]4. Патерностер Д. М., Сантаросса К., Ветторе Н. и соавт. Акушерские осложнения при беременности с синдромом Марфана. Минерва Гинекологическая . 1999; 50:441–443. [PubMed] [Google Scholar]5. Beigthon P., De Paepe A., Danks D., et al. Международная нозология наследственных заболеваний соединительной ткани, Берлин, 1986. Американский журнал медицинской генетики . 1988; 29: 581–589. [PubMed] [Google Scholar]6. Истерлинг Т.Р., Бенедетти Т.Дж., Шумейкер Б.С. и др. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты. Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]8. Регитц-Загросек В., Лундквист С. Б., Борги К. и соавт. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) European Heart Journal . 2011; 32:3147–3197. [PubMed] [Google Scholar]9. Мейбум Л. Дж., Вос Ф. Э., Тиммерманс Дж., Бурс Г. Х., Цвиндерман А.Х., Малдер Б.Дж. М. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование.
Истерлинг Т.Р., Бенедетти Т.Дж., Шумейкер Б.С. и др. Материнская гемодинамика и диаметр аорты при нормальной и гипертензивной беременности. Акушерство и гинекология . 1991; 78: 1073–1077. [PubMed] [Google Scholar]7. Hiratzka L.F., Bakris G.L., Beckman J.A., et al. Руководство ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM по диагностике и лечению пациентов с заболеванием грудной аорты. Журнал Американского колледжа кардиологов . 2010;55:e27–129. [PubMed] [Google Scholar]8. Регитц-Загросек В., Лундквист С. Б., Борги К. и соавт. Рекомендации ESC по ведению сердечно-сосудистых заболеваний во время беременности: рабочая группа по ведению сердечно-сосудистых заболеваний во время беременности Европейского общества кардиологов (ESC) European Heart Journal . 2011; 32:3147–3197. [PubMed] [Google Scholar]9. Мейбум Л. Дж., Вос Ф. Э., Тиммерманс Дж., Бурс Г. Х., Цвиндерман А.Х., Малдер Б.Дж. М. Беременность и рост корня аорты при синдроме Марфана: проспективное исследование. Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar] 10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar] 11. Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed] [CrossRef] [Google Scholar] 12. Бусер Р. Т., Мордекай М. М., Брюлл С. Дж. Комбинированная спинально-эпидуральная анальгезия родов у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar] 13.Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана.
Европейский кардиологический журнал . 2005;26(9):914–920. doi: 10.1093/eurheartj/ehi103. [PubMed] [CrossRef] [Google Scholar] 10. Лалчандани С., Вингфилд М. Беременность у женщин с синдромом Марфана. Европейский журнал акушерства, гинекологии и репродуктивной биологии . 2003;110(2):125–130. doi: 10.1016/S0301-2115(03)00151-9. [PubMed] [CrossRef] [Google Scholar] 11. Элькаям У., Остжега Э., Шотан А., Мехра А. Сердечно-сосудистые проблемы у беременных с синдромом Марфана. Анналы внутренней медицины . 1995;123(2):117–122. doi: 10.7326/0003-4819-123-2-199507150-00007. [PubMed] [CrossRef] [Google Scholar] 12. Бусер Р. Т., Мордекай М. М., Брюлл С. Дж. Комбинированная спинально-эпидуральная анальгезия родов у пациентки с синдромом Марфана. Международный журнал акушерской анестезии . 2007;16(3):274–276. doi: 10.1016/j.ijoa.2006.10.011. [PubMed] [CrossRef] [Google Scholar] 13.Липскомб К.Дж., Смит Дж.К., Кларк Б., Доннаи П., Харрис Р. Исход беременности у женщин с синдромом Марфана. Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar] 14. Пьериц Р. Э., Фишман Э. К., Бернхардт Б. А., Зигельман С. С. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]15.Fattori R., Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar] 16. Ан Н.У., Спонселлер П.Д., Ан У.М., Налламшетти Л., Кушик Б.С., Зинрайх С.Дж. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar] 17.Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике.
Международный журнал акушерства и гинекологии . 1997;104(2):201–206. doi: 10.1111/j.1471-0528.1997.tb11045.x. [PubMed] [CrossRef] [Google Scholar] 14. Пьериц Р. Э., Фишман Э. К., Бернхардт Б. А., Зигельман С. С. Эктазия твердой мозговой оболочки является общим признаком синдрома Марфана. Американский журнал генетики человека . 1988;43(5):726–732. [Бесплатная статья PMC] [PubMed] [Google Scholar]15.Fattori R., Nienaber C.A., Descovich B., et al. Значение дуральной эктазии в фенотипической оценке синдрома Марфана. Ланцет . 1999;354(9182):910–913. doi: 10.1016/s0140-6736(98)12448-0. [PubMed] [CrossRef] [Google Scholar] 16. Ан Н.У., Спонселлер П.Д., Ан У.М., Налламшетти Л., Кушик Б.С., Зинрайх С.Дж. Эктазия твердой мозговой оболочки связана с болью в спине при синдроме Марфана. Позвоночник . 2000;25(12):1562–1568. doi: 10.1097/00007632-200006150-00017. [PubMed] [CrossRef] [Google Scholar] 17.Attanasio M., Pratelli E., Porciani M.C., et al. Скрининг дуральной эктазии и мутации FBN1 у 40 пациентов с синдромом Марфана и родственными расстройствами: роль дуральной эктазии в диагностике. Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar] 18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни. Журнал нейрохирургии: позвоночник .2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar] 19. Лундби Р., Рэнд-Хендриксен С., Халд Дж. К. и др. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ. Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar] 21.
Европейский журнал медицинской генетики . 2013;56(7):356–360. doi: 10.1016/j.ejmg.2013.04.006. [PubMed] [CrossRef] [Google Scholar] 18. Санчес А. А., Иглесиас С. Д., Лопес С. Д. и соавт. Ректотекальная фистула, вторичная по отношению к переднему крестцовому менингоцеле: история болезни. Журнал нейрохирургии: позвоночник .2008;8(5):487–489. doi: 10.3171/SPI/2008/8/5/487. [PubMed] [CrossRef] [Google Scholar] 19. Лундби Р., Рэнд-Хендриксен С., Халд Дж. К. и др. Эктазия твердой мозговой оболочки при синдроме Марфана: исследование случай-контроль. Американский журнал нейрорадиологии . 2009;30(8):1534–1540. doi: 10.3174/ajnr.A1620. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Villeirs G.M., Van Tongerloo A.J., Verstraete K.L., Kunnen M.F., De Paepe A.M. Расширение позвоночного канала и дуральная эктазия при синдроме Марфана: оценка с помощью КТ. Нейрорадиология . 1999;41(11):850–854. doi: 10.1007/s002340050856. [PubMed] [CrossRef] [Google Scholar] 21. Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar] 22. Рахман Дж., Рахман Ф.З., Рахман В., Аль-Сулейман С.А., Рахман М.С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины .2003; 48: 723–728. [PubMed] [Google Scholar] 23. Ким Д.В., Лим Ю.Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef][Google Scholar]
Ho N.C., Hadley D.W., Jain P.K., Francomano C.A. Случай 47: дуральная эктазия, связанная с синдромом Марфана. Радиология . 2002;223(3):767–771. doi: 10.1148/radiol.2233000971. [PubMed] [CrossRef] [Google Scholar] 22. Рахман Дж., Рахман Ф.З., Рахман В., Аль-Сулейман С.А., Рахман М.С. Акушерско-гинекологические осложнения у женщин под общей анестезией. Журнал репродуктивной медицины .2003; 48: 723–728. [PubMed] [Google Scholar] 23. Ким Д.В., Лим Ю.Г. Случай синдрома Марфана под общей анестезией. Корейский журнал анестезиологии . 1993;26(5):1055–1058. doi: 10.4097/kjae.1993.26.5.1055. [CrossRef][Google Scholar]24. МакКусик В.А. Синдром Марфана, МФС. Онлайн менделевское наследование у человека. OMIM, MIM № 154700, Балтимор (MD): Университет Джона Хопкинса, 2003.
25. Fettes P.D.W., Jansson J.-R., Wildsmith J.A.W. Неудачная спинальная анестезия: механизмы, лечение и профилактика. Британский журнал анестезии . 2009;102(6):739–748. doi: 10.1093/bja/aep096. [PubMed] [CrossRef] [Google Scholar] 26. Лакасси Х.Дж., Миллар С., Лейте Л.Г. и др. Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинномозговой анестезии у двух рожениц с синдромом Марфана. Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar] 27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [PMC бесплатная статья] [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar] 26. Лакасси Х.Дж., Миллар С., Лейте Л.Г. и др. Эктазия твердой мозговой оболочки: вероятная причина неадекватной спинномозговой анестезии у двух рожениц с синдромом Марфана. Британский журнал анестезии . 2005;94(4):500–504. doi: 10.1093/bja/aei076. [PubMed] [CrossRef] [Google Scholar] 27. Ким Г., Ко Дж. С., Чой Д. Х. Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Марфана и дуральной эктазией. Корейский журнал анестезиологии . 2011;60(3):214–216. doi: 10.4097/kjae.2011.60.3.214. [PMC бесплатная статья] [PubMed] [CrossRef] [Google Scholar]Кесарево сечение под эпидуральной анестезией при задокументированном случае разрыва аневризмы синуса вальсальвы
J Anaesthesiol Clin Pharmacol. 2015 г., январь-март; 31(1): 119–122.
SR Divakar
1 Кафедра анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
Chandrashekhar Singh
1 Департамент Anes, Больницы, Канпур, Уттар-Прадеш, Индия
Чандра Мохан Верма
2 Отделение кардиологии, Институт кардиологии LPS, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
Чайтанья Д.
 Кулкарни
Кулкарни3 Кафедра радиологии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
1 Кафедра анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
2 Кафедра кардиологии, Институт кардиологии LPS, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия3 Кафедра радиологии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия для переписки: Dr.SR Divakar, Отделение анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур — 208 002, Уттар-Прадеш, Индия. Электронная почта: moc.liamg@38rakavidrdАвторское право: © Journal of Anaesthesiology Clinical Pharmacology
Это статья с открытым доступом, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение. на любом носителе при условии правильного цитирования оригинальной работы.
на любом носителе при условии правильного цитирования оригинальной работы.
Abstract
Разрыв аневризмы синуса Вальсальвы (RSOV), возникающий во время беременности, является редкой сердечной аномалией и может быть как врожденным, так и приобретенным. Врожденные аневризмы синуса Вальсальвы обычно связаны с другими структурными дефектами, такими как дефект межжелудочковой перегородки (50-55%), аортальная регургитация (АР) (25-35%), двустворчатый аортальный клапан (10-15%) и синдром Марфана (10%). %). RSOV во время беременности усиливает гемодинамическую нагрузку на сердечно-сосудистую систему матери и представляет собой серьезную проблему с точки зрения акушерской анестезии.Мы сообщаем о случае 35-летней зарегистрированной пациентки с RSOV с легкой формой АР, проявляющейся полностью бессимптомно на сроке 37 недель 4 дня беременности. Успешно проведено плановое кесарево сечение в нижнем сегменте под эпидуральной анестезией.
Ключевые слова: Анестезия, кесарево сечение, эпидуральная анестезия, осложнения беременности, синус Вальсальвы.Врожденный вариант встречается чаще и составляет 0,1-3,5% всех врожденных пороков сердца.[1]
Врожденная SOVA чаще встречается у мужчин с мужчинами: соотношение женщин 4: 1 и более высокая распространенность среди азиатского населения, чем западного. [2]
Аневризма синуса Вальсальвы обычно остается бессимптомной до тех пор, пока не произойдет разрыв, ведущий к катастрофическим событиям. [1,3] Размер, расположение и быстрота разрыва являются главными определяющими факторами клинической картины и прогноза разрыва аневризмы синуса Вальсальвы (RSOV).[2] Высокая степень клинического подозрения с последующей визуализацией помогает в подтверждении диагноза.
В англоязычной литературе мало обсуждается RSOV, возникающий во время беременности, и его анестезиологическое обеспечение. Во всех ранее зарегистрированных случаях либо не обсуждалось анестезиологическое обеспечение[4], либо проводились нормальные вагинальные роды[5], либо выполнялось кесарево сечение под общей анестезией[6].
Здесь мы представляем анестезиологическое обеспечение пациента с RSOV в срок, отправленный на плановое кесарево сечение в нижнем сегменте (LSCS) и перевязку маточных труб под эпидуральной анестезией.
История болезни
35-летняя повторнобеременная женщина из сельской местности поступила в акушерское отделение для планового осмотра в связи с аменореей на сроке 9 месяцев. В ее предыдущем анамнезе было два родоразрешения: сначала LSCS, выполненная под спинальной анестезией 4,5 года назад из-за отсутствия прогресса родов с беспрецедентным интраоперационным и послеоперационным течением, а второй — нормальные вагинальные роды 2 года назад дома. Послеродовой период протекал нормально, за исключением временного дискомфорта за грудиной и легкой одышки, которые развились сразу после вторых родов.Это продолжалось в течение одной недели и утихло без какого-либо лечения/консультации. В настоящей беременности у нее был ничем не примечательный дородовой период.
При общем осмотре пациент выглядит бледным и истощенным. У нее была частота пульса 108 уд/мин, скачкообразный характер. Ее артериальное давление было 116/52 мм рт.ст. на обеих руках.
У нее была частота пульса 108 уд/мин, скачкообразный характер. Ее артериальное давление было 116/52 мм рт.ст. на обеих руках.
Обследование сердечно-сосудистой системы выявило пальпируемое дрожание в левой парастернальной области и громкий непрерывный машинный шум 4/6 степени, выслушиваемый на всем протяжении прекардиальной области, лучше всего выслушиваемый в нижней левой парастернальной области.Остальное общее и системное обследование было нормальным.
Акушерское УЗИ выявило живой плод в 37 недель 4 дня в поперечном положении с нормальной частотой сердечных сокращений.
Все стандартные анализы крови были нормальными, за исключением гемоглобина 9,6 г/дл. Рентгенограмма грудной клетки и газовый анализ артериальной крови были в норме. Электрокардиография выявила синусовую тахикардию с увеличением левого желудочка. Трансторакальная двумерная эхокардиография выявила перепончатое выпячивание из правого коронарного синуса в правый желудочек с небольшой перфорацией 2. Ширина 7 мм, что дает характерный вид «ветроуловителя» с максимальным градиентом давления 80 мм рт. ст. поперек шунта []. Непрерывно-волновая допплерография и цветная визуализация потока выявили высокоскоростной однонаправленный поток из аорты в правый желудочек через поражение шунта [рисунки и ]. Систолическое давление в легочной артерии составило 24 мм рт. ст. без признаков тромбов, эмболов или вегетаций. Полости желудочков увеличены, функция левого желудочка в покое нормальная.
Ширина 7 мм, что дает характерный вид «ветроуловителя» с максимальным градиентом давления 80 мм рт. ст. поперек шунта []. Непрерывно-волновая допплерография и цветная визуализация потока выявили высокоскоростной однонаправленный поток из аорты в правый желудочек через поражение шунта [рисунки и ]. Систолическое давление в легочной артерии составило 24 мм рт. ст. без признаков тромбов, эмболов или вегетаций. Полости желудочков увеличены, функция левого желудочка в покое нормальная.
(а) Трансторакальная двумерная эхокардиография, демонстрирующая типичный «ветровой» вид аневризмы правого синуса Вальсальвы с разрывом в правый желудочек.АО-Аорта, ПЖ-Правый желудочек, ЛЖ-Левый желудочек, разрыв аневризмы синуса Вальсальвы. (b) Трансторакальная двумерная эхокардиография с визуализацией цветного потока демонстрирует однонаправленный непрерывный мозаичный поток из аорты в правый желудочек через разрыв правого синуса аневризмы Вальсальвы
Трансторакальная двумерная эхокардиография с непрерывной допплеровской визуализацией потока демонстрирует непрерывный высокоскоростной турбулентный поток через область шунта
Во время преданестезиологического осмотра были подтверждены данные общего и системного обследования. Поскольку у пациентки полностью отсутствовали симптомы дистресса плода, было запланировано хирургическое вмешательство под эпидуральной анестезией.
Поскольку у пациентки полностью отсутствовали симптомы дистресса плода, было запланировано хирургическое вмешательство под эпидуральной анестезией.
В ночь перед операцией вводили перорально ранитидин 150 мг и алпразолам 0,25 мг. Ее не давали перорально в течение 6 часов. Письменное информированное согласие было получено как от пациентки, так и от ее мужа.
В операционной пациента уложили на операционный стол на спину с клином 10-15° под правым бедром. Маска Хадсона была прикреплена с непрерывным потоком кислорода.Внутривенный доступ был получен с помощью канюли 18G после местной анестезии смесью местного анестетика Eutectic (2,5% лигнокаина + 2,5% прилокаина). Внутривенно ранитидин 50 мг, инъекции. Метоклопрамид 10 мг и антибиотикопрофилактика 2 г цефтриаксона были даны за 30 минут до индукции.
Частота пульса, неинвазивное кровяное давление, насыщение кислородом, электрокардиография и центральное венозное давление (ЦВД) (норма 5–10 см H 2 O) контролировались на протяжении всей операции и оставались в пределах нормы.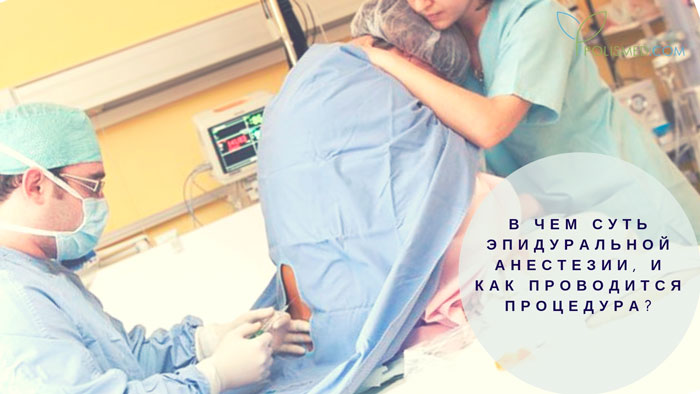
После предварительной нагрузки 600 мл раствора Рингера больная уложена в сидячее положение и установлена местная анестезия L 2 -L 3 межпозвонкового пространства с использованием 3 мл раствора 2% лигнокаина.
Эпидуральное пространство на этом уровне локализовано с помощью иглы Туохи 18G с потерей устойчивости к физиологическому раствору на глубину 4 см и эпидуральный катетер 18G введен на 5 см в эпидуральное пространство. Эпидуральный катетер был закреплен и введена тестовая доза 3 мл 2% лигнокаина с адреналином 1:200000 без признаков развития субарахноидального блока через 5 минут.Больная возвращена в исходное положение.
Раствор местного анестетика был приготовлен из 15 мл 0,5% бупивакаина, 100 мкг фентанила, 5 мл 2% лигнокаина и 0,15 мл 8,4% бикарбоната натрия.
Эту смесь местных анестетиков и опиоидов вводили через эпидуральный катетер по 5 мл с интервалом 5 минут. Через 25 минут была установлена успешная двусторонняя сенсорная блокада боли, тонкого прикосновения и температуры от T 6 до S 4 . Была выполнена LSCS, и здоровая девочка весом 2600 г была рождена с оценкой по шкале Апгар 8/10 и 9/10 через 1 и 5 мин соответственно.Выполнена двусторонняя перевязка маточных труб.
Была выполнена LSCS, и здоровая девочка весом 2600 г была рождена с оценкой по шкале Апгар 8/10 и 9/10 через 1 и 5 мин соответственно.Выполнена двусторонняя перевязка маточных труб.
Окситоцин для инъекций 10 ЕД вводили медленно внутривенно для достижения достаточного сокращения матки. Поскольку наблюдалась тенденция к снижению артериального давления, для поддержания оптимального артериального давления внутривенно вводили всего 6 мг фенилэфрина.
Во время операции пациент оставался гемодинамически стабильным с общей кровопотерей около 550 мл, которая была заменена жидкостями под контролем центрального венозного мониторинга (ЦВД), который позже был введен во время операции.
Операция длилась 60 мин. Пациент переведен в отделение реанимации и интенсивной терапии (ОРИТ) для дальнейшего наблюдения. Полное восстановление после эпидуральной анестезии произошло через 6 часов. Сенсорную дозу, 16 мл 0,125% бупивакаина и 50 мкг фентанила, вводили через эпидуральный катетер каждые восемь часов в течение первых 48 часов, а эпидуральный катетер удаляли на 3-й -й послеоперационный день с соблюдением асептики. Пациент выздоровел без осложнений в отделении интенсивной терапии и в дальнейшем наблюдался в палате в течение следующих 7 дней.Пациентка выписана в удовлетворительном состоянии с рекомендациями регулярного послеродового осмотра и кардиологической консультации.
Пациент выздоровел без осложнений в отделении интенсивной терапии и в дальнейшем наблюдался в палате в течение следующих 7 дней.Пациентка выписана в удовлетворительном состоянии с рекомендациями регулярного послеродового осмотра и кардиологической консультации.
Обсуждение
Врожденная SOVA обычно поражает правый синус, на который приходится 70-90% всех аневризм синуса, в то время как некоронарный синус и левый коронарный синус составляют 10-20% и <5% соответственно.[7]
Большинство аневризм правого коронарного синуса прорываются в правый желудочек и редко в правое предсердие, вызывая аорто-кадиальный шунт.[2] Разрыв SOVA обычно происходит в раннем взрослом возрасте (3-4 -е -е десятилетие).[8]
Разрыв SOVA соединяет системную циркуляцию высокого давления с малой циркуляцией низкого давления, что приводит к непрерывному шунтированию крови на протяжении систолы и диастолы. Объем шунта зависит от диаметра разрыва и тяжести легочного сосудистого сопротивления. Большой шунт вызывает объемную перегрузку малого круга кровообращения и левых отделов сердца. Вначале наблюдается компенсаторное расширение и гипертрофия камер сердца. Когда объем шунтируемой крови превышает компенсаторные механизмы, развивается застойная сердечная недостаточность.[3]
Большой шунт вызывает объемную перегрузку малого круга кровообращения и левых отделов сердца. Вначале наблюдается компенсаторное расширение и гипертрофия камер сердца. Когда объем шунтируемой крови превышает компенсаторные механизмы, развивается застойная сердечная недостаточность.[3]
Беременность – физиологическое состояние, связанное с изменением общего объема крови, периферического сосудистого сопротивления и сократительной способности миокарда, что способствует адаптации сердечно-сосудистой системы матери к повышенным метаболическим потребностям матери и плода. Нормальные беременные женщины хорошо адаптируются к этим физиологическим изменениям без неблагоприятных последствий, но женщины со структурными заболеваниями сердца могут столкнуться с неблагоприятными последствиями.[9]
Этот случай может быть типичным врожденным разрывом SOVA во время предыдущих вагинальных родов, вызванным гемодинамическим напряжением родов.
В данном случае была использована эпидуральная анестезия, потому что:
Начало симпатической блокады очень медленное и, таким образом, позволяет избежать реверсирования шунтирующего тока при материнской гипоксемии. [10]
[10]
Уровень анестезии можно легко титровать, изменяя объем местных анестетиков.[11]
Пациент оставался в сознании в течение всего интраоперационного периода и не сообщал о каких-либо неблагоприятных симптомах (одышке, боли в груди или сердцебиении), поэтому его можно было немедленно вызвать.[12]
Обеспечивает хорошее послеоперационное обезболивание, избегая опиоидов и их осложнений.[10,11,13]
Воздействует на факторы, повышающие системное сосудистое сопротивление (боль или хирургический стресс), что может вызвать резкое увеличение кровотока по шунту, приводящее к застою в легких и, в конечном итоге, к застойной сердечной недостаточности.
Единственным недостатком эпидуральной анестезии является то, что ее нельзя использовать в экстренных случаях, например, при тяжелом дистрессе плода, из-за задержки начала анестезии.
Эпидуральная анестезия также может использоваться у пациенток с RSOV, перенесших нормальные вагинальные роды, где она значительно снижает гемодинамическую нагрузку на сердечно-сосудистую систему при родах, но о таких случаях не сообщалось. [10]
[10]
Эпидуральная анестезия предпочтительнее спинальной анестезии, поскольку последняя вызывает быстрое падение системного сосудистого сопротивления и реверсию шунта с внезапным началом гипоксемии матери и плода.[10] Эпидуральная анестезия предпочтительнее общей анестезии, поскольку сама общая анестезия усиливает гемодинамическую нагрузку беременности и родов на сердечно-сосудистую систему у таких пациенток. Недостатки общей анестезии:
Во время интубации, аспирации и экстубации резкое повышение частоты сердечных сокращений и системное сосудистое сопротивление усиливают шунтирующий поток, что может привести к застойной сердечной недостаточности.[14]
Набухание сосудов слизистой оболочки дыхательных путей, вызванное гормонами, увеличивает вероятность кровотечения из дыхательных путей и аспирации после ларингоскопии и интубации.[15]
Повышенная вероятность аспирации желудочного содержимого, приводящая к химическому пневмониту (синдром Мендельсона).[14]
Использование опиоидов повышает частоту гипоксии, гиперкапнии и респираторного ацидоза с реверсированием шунтирующего тока, что приводит к материнской гипоксемии, а также к депрессии новорожденных в послеоперационном периоде. [11,13]
[11,13]
Заключение
Эпидуральная анестезия эффективна у пациенток с RSOV при доношенной беременности, перенесших нормальные роды через естественные родовые пути или кесарево сечение, поскольку она снижает дополнительную гемодинамическую нагрузку родов на уже скомпрометированную сердечно-сосудистую систему этих пациенток.
Подтверждение
Отделение акушерства и гинекологии, больницы LLR, Медицинский колледж GSVM, Канпур 208002.
Литература
1. Гольдберг Н., Краснов Н. Аневризмы синуса вальсальвы. Клин Кардиол. 1990; 13:831–6. [PubMed] [Google Scholar]2. Chu SH, Hung CR, How SS, Chang H, Wang SS, Tsai CH, et al. Разорвавшиеся аневризмы синуса вальсальвы у восточных больных. J Грудной сердечно-сосудистый хирург. 1990; 99: 288–98. [PubMed] [Google Scholar]3. Перлофф Дж.К. Врожденные аневризмы синусов вальсальвы. В: Perloff JK, редактор. Клиническое распознавание врожденного порока сердца. 5-е изд. Филадельфия: Saunders WB; 2003.стр. 457–70. [Google Академия]7. Кольцо ВС. Проект номенклатуры и базы данных хирургии врожденного сердца: аневризма аорты, аневризма синуса Вальсальвы и расслоение аорты. Энн Торак Серг. 2000;69:S147–63. [PubMed] [Google Scholar]8. Фридман ВФ. Врожденные пороки сердца в младенчестве и детстве. В: Браунвальд Э., редактор. Болезни сердца: Учебник сердечно-сосудистой медицины. 5-е изд. Филадельфия: В. Б. Сондерс; 1997. С. 1505–91. [Google Академия]9. Глостен Б. Анестезия в акушерстве. В: Миллер Р.Д., редактор.Черчилль-Дэвидсон «Практика анестезии». 5-е изд. Том. 2. Лондон: Арнольд; 2003. стр. 2024–68. [Google Академия] 10. Кучковский КМ. Анальгезия родов у рожениц с пороком сердца: что нужно знать акушеру? Acta Obstet Gynecol Scand. 2004; 83: 223–33. [PubMed] [Google Scholar] 11. Грасс Дж.А. Роль эпидуральной анестезии и обезболивания в послеоперационном исходе. Anesthesiol Clin Северная Америка. 2000;18:407–28. VIII. [PubMed] [Google Scholar] 12. Бисвас Р.Г., Бандйопадхьяй Б.К., Саркар М., Саркар Ю.К., Госвами А., Мукерджи П.
Кольцо ВС. Проект номенклатуры и базы данных хирургии врожденного сердца: аневризма аорты, аневризма синуса Вальсальвы и расслоение аорты. Энн Торак Серг. 2000;69:S147–63. [PubMed] [Google Scholar]8. Фридман ВФ. Врожденные пороки сердца в младенчестве и детстве. В: Браунвальд Э., редактор. Болезни сердца: Учебник сердечно-сосудистой медицины. 5-е изд. Филадельфия: В. Б. Сондерс; 1997. С. 1505–91. [Google Академия]9. Глостен Б. Анестезия в акушерстве. В: Миллер Р.Д., редактор.Черчилль-Дэвидсон «Практика анестезии». 5-е изд. Том. 2. Лондон: Арнольд; 2003. стр. 2024–68. [Google Академия] 10. Кучковский КМ. Анальгезия родов у рожениц с пороком сердца: что нужно знать акушеру? Acta Obstet Gynecol Scand. 2004; 83: 223–33. [PubMed] [Google Scholar] 11. Грасс Дж.А. Роль эпидуральной анестезии и обезболивания в послеоперационном исходе. Anesthesiol Clin Северная Америка. 2000;18:407–28. VIII. [PubMed] [Google Scholar] 12. Бисвас Р.Г., Бандйопадхьяй Б.К., Саркар М., Саркар Ю.К., Госвами А., Мукерджи П. Периоперационное ведение беременных с пороками сердца при кесаревом сечении под наркозом. (636-7). J Indian Med Assoc. 2003; 101: 632–634. [PubMed] [Google Scholar] 13. Баллантайн Дж. К., Карр Д. Б., де Ферранти С., Суарес Т., Лау Дж., Чалмерс Т. С. и др. Сравнительное влияние послеоперационной обезболивающей терапии на легочный исход: кумулятивный метаанализ рандомизированных контролируемых исследований. Анест Анальг. 1998; 86: 598–612. [PubMed] [Google Scholar] 14. Гхай Б., Мохан В., Кетарпал М., Малхотра Н.Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Эйзенменгера. Int J Obstet Анест. 2002; 11:44–7. [PubMed] [Google Scholar] 15. Боника Дж. Анатомо-физиологические изменения матери во время беременности и родов. В: Bonica JJ, McDonald JS, редакторы. Принципы и практика акушерской анальгезии. Балтимор: Уильямс и Уилкинс; 1995. С. 45–83. [Google Scholar]
Периоперационное ведение беременных с пороками сердца при кесаревом сечении под наркозом. (636-7). J Indian Med Assoc. 2003; 101: 632–634. [PubMed] [Google Scholar] 13. Баллантайн Дж. К., Карр Д. Б., де Ферранти С., Суарес Т., Лау Дж., Чалмерс Т. С. и др. Сравнительное влияние послеоперационной обезболивающей терапии на легочный исход: кумулятивный метаанализ рандомизированных контролируемых исследований. Анест Анальг. 1998; 86: 598–612. [PubMed] [Google Scholar] 14. Гхай Б., Мохан В., Кетарпал М., Малхотра Н.Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Эйзенменгера. Int J Obstet Анест. 2002; 11:44–7. [PubMed] [Google Scholar] 15. Боника Дж. Анатомо-физиологические изменения матери во время беременности и родов. В: Bonica JJ, McDonald JS, редакторы. Принципы и практика акушерской анальгезии. Балтимор: Уильямс и Уилкинс; 1995. С. 45–83. [Google Scholar]Кесарево сечение под эпидуральной анестезией при задокументированном случае разрыва аневризмы синуса вальсальвы
J Anaesthesiol Clin Pharmacol. 2015 г., январь-март; 31(1): 119–122.
2015 г., январь-март; 31(1): 119–122.
SR Divakar
1 Кафедра анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
Chandrashekhar Singh
1 Департамент Anes, Больницы, Канпур, Уттар-Прадеш, Индия
Чандра Мохан Верма
2 Отделение кардиологии, Институт кардиологии LPS, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
Чайтанья Д.Кулкарни
3 Кафедра радиологии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
1 Кафедра анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
2 Кафедра кардиологии, Институт кардиологии LPS, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия 3 Кафедра радиологии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия для переписки: Dr. SR Divakar, Отделение анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур — 208 002, Уттар-Прадеш, Индия. Электронная почта: moc.liamg@38rakavidrdАвторское право: © Journal of Anaesthesiology Clinical Pharmacology
SR Divakar, Отделение анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур — 208 002, Уттар-Прадеш, Индия. Электронная почта: moc.liamg@38rakavidrdАвторское право: © Journal of Anaesthesiology Clinical Pharmacology
Это статья с открытым доступом, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение. на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья была процитирована другими статьями в PMC.Abstract
Разрыв аневризмы синуса Вальсальвы (RSOV), возникающий во время беременности, является редкой сердечной аномалией и может быть как врожденным, так и приобретенным. Врожденные аневризмы синуса Вальсальвы обычно связаны с другими структурными дефектами, такими как дефект межжелудочковой перегородки (50-55%), аортальная регургитация (АР) (25-35%), двустворчатый аортальный клапан (10-15%) и синдром Марфана (10%). %). RSOV во время беременности усиливает гемодинамическую нагрузку на сердечно-сосудистую систему матери и представляет собой серьезную проблему с точки зрения акушерской анестезии.Мы сообщаем о случае 35-летней зарегистрированной пациентки с RSOV с легкой формой АР, проявляющейся полностью бессимптомно на сроке 37 недель 4 дня беременности. Успешно проведено плановое кесарево сечение в нижнем сегменте под эпидуральной анестезией.
%). RSOV во время беременности усиливает гемодинамическую нагрузку на сердечно-сосудистую систему матери и представляет собой серьезную проблему с точки зрения акушерской анестезии.Мы сообщаем о случае 35-летней зарегистрированной пациентки с RSOV с легкой формой АР, проявляющейся полностью бессимптомно на сроке 37 недель 4 дня беременности. Успешно проведено плановое кесарево сечение в нижнем сегменте под эпидуральной анестезией.
Ключевые слова: Анестезия, кесарево сечение, эпидуральная анестезия, осложнения беременности, синус Вальсальвы.Врожденный вариант встречается чаще и составляет 0,1-3,5% всех врожденных пороков сердца.[1]
Врожденная SOVA чаще встречается у мужчин с мужчинами: соотношение женщин 4: 1 и более высокая распространенность среди азиатского населения, чем западного. [2]
Аневризма синуса Вальсальвы обычно остается бессимптомной до тех пор, пока не произойдет разрыв, ведущий к катастрофическим событиям. [1,3] Размер, расположение и быстрота разрыва являются главными определяющими факторами клинической картины и прогноза разрыва аневризмы синуса Вальсальвы (RSOV). [2] Высокая степень клинического подозрения с последующей визуализацией помогает в подтверждении диагноза.
[2] Высокая степень клинического подозрения с последующей визуализацией помогает в подтверждении диагноза.
В англоязычной литературе мало обсуждается RSOV, возникающий во время беременности, и его анестезиологическое обеспечение. Во всех ранее зарегистрированных случаях либо не обсуждалось анестезиологическое обеспечение[4], либо проводились нормальные вагинальные роды[5], либо выполнялось кесарево сечение под общей анестезией[6].
Здесь мы представляем анестезиологическое обеспечение пациента с RSOV в срок, отправленный на плановое кесарево сечение в нижнем сегменте (LSCS) и перевязку маточных труб под эпидуральной анестезией.
История болезни
35-летняя повторнобеременная женщина из сельской местности поступила в акушерское отделение для планового осмотра в связи с аменореей на сроке 9 месяцев. В ее предыдущем анамнезе было два родоразрешения: сначала LSCS, выполненная под спинальной анестезией 4,5 года назад из-за отсутствия прогресса родов с беспрецедентным интраоперационным и послеоперационным течением, а второй — нормальные вагинальные роды 2 года назад дома. Послеродовой период протекал нормально, за исключением временного дискомфорта за грудиной и легкой одышки, которые развились сразу после вторых родов.Это продолжалось в течение одной недели и утихло без какого-либо лечения/консультации. В настоящей беременности у нее был ничем не примечательный дородовой период.
При общем осмотре пациент выглядит бледным и истощенным. У нее была частота пульса 108 уд/мин, скачкообразный характер. Ее артериальное давление было 116/52 мм рт.ст. на обеих руках.
Обследование сердечно-сосудистой системы выявило пальпируемое дрожание в левой парастернальной области и громкий непрерывный машинный шум 4/6 степени, выслушиваемый на всем протяжении прекардиальной области, лучше всего выслушиваемый в нижней левой парастернальной области.Остальное общее и системное обследование было нормальным.
Акушерское УЗИ выявило живой плод в 37 недель 4 дня в поперечном положении с нормальной частотой сердечных сокращений.
Все стандартные анализы крови были нормальными, за исключением гемоглобина 9,6 г/дл. Рентгенограмма грудной клетки и газовый анализ артериальной крови были в норме. Электрокардиография выявила синусовую тахикардию с увеличением левого желудочка. Трансторакальная двумерная эхокардиография выявила перепончатое выпячивание из правого коронарного синуса в правый желудочек с небольшой перфорацией 2.Ширина 7 мм, что дает характерный вид «ветроуловителя» с максимальным градиентом давления 80 мм рт. ст. поперек шунта []. Непрерывно-волновая допплерография и цветная визуализация потока выявили высокоскоростной однонаправленный поток из аорты в правый желудочек через поражение шунта [рисунки и ]. Систолическое давление в легочной артерии составило 24 мм рт. ст. без признаков тромбов, эмболов или вегетаций. Полости желудочков увеличены, функция левого желудочка в покое нормальная.
(а) Трансторакальная двумерная эхокардиография, демонстрирующая типичный «ветровой» вид аневризмы правого синуса Вальсальвы с разрывом в правый желудочек.АО-Аорта, ПЖ-Правый желудочек, ЛЖ-Левый желудочек, разрыв аневризмы синуса Вальсальвы. (b) Трансторакальная двумерная эхокардиография с визуализацией цветного потока демонстрирует однонаправленный непрерывный мозаичный поток из аорты в правый желудочек через разрыв правого синуса аневризмы Вальсальвы
Трансторакальная двумерная эхокардиография с непрерывной допплеровской визуализацией потока демонстрирует непрерывный высокоскоростной турбулентный поток через область шунта
Во время преданестезиологического осмотра были подтверждены данные общего и системного обследования.Поскольку у пациентки полностью отсутствовали симптомы дистресса плода, было запланировано хирургическое вмешательство под эпидуральной анестезией.
В ночь перед операцией вводили перорально ранитидин 150 мг и алпразолам 0,25 мг. Ее не давали перорально в течение 6 часов. Письменное информированное согласие было получено как от пациентки, так и от ее мужа.
В операционной пациента уложили на операционный стол на спину с клином 10-15° под правым бедром. Маска Хадсона была прикреплена с непрерывным потоком кислорода.Внутривенный доступ был получен с помощью канюли 18G после местной анестезии смесью местного анестетика Eutectic (2,5% лигнокаина + 2,5% прилокаина). Внутривенно ранитидин 50 мг, инъекции. Метоклопрамид 10 мг и антибиотикопрофилактика 2 г цефтриаксона были даны за 30 минут до индукции.
Частота пульса, неинвазивное кровяное давление, насыщение кислородом, электрокардиография и центральное венозное давление (ЦВД) (норма 5–10 см H 2 O) контролировались на протяжении всей операции и оставались в пределах нормы.
После предварительной нагрузки 600 мл раствора Рингера больная уложена в сидячее положение и установлена местная анестезия L 2 -L 3 межпозвонкового пространства с использованием 3 мл раствора 2% лигнокаина.
Эпидуральное пространство на этом уровне локализовано с помощью иглы Туохи 18G с потерей устойчивости к физиологическому раствору на глубину 4 см и эпидуральный катетер 18G введен на 5 см в эпидуральное пространство. Эпидуральный катетер был закреплен и введена тестовая доза 3 мл 2% лигнокаина с адреналином 1:200000 без признаков развития субарахноидального блока через 5 минут.Больная возвращена в исходное положение.
Раствор местного анестетика был приготовлен из 15 мл 0,5% бупивакаина, 100 мкг фентанила, 5 мл 2% лигнокаина и 0,15 мл 8,4% бикарбоната натрия.
Эту смесь местных анестетиков и опиоидов вводили через эпидуральный катетер по 5 мл с интервалом 5 минут. Через 25 минут была установлена успешная двусторонняя сенсорная блокада боли, тонкого прикосновения и температуры от T 6 до S 4 . Была выполнена LSCS, и здоровая девочка весом 2600 г была рождена с оценкой по шкале Апгар 8/10 и 9/10 через 1 и 5 мин соответственно.Выполнена двусторонняя перевязка маточных труб.
Окситоцин для инъекций 10 ЕД вводили медленно внутривенно для достижения достаточного сокращения матки. Поскольку наблюдалась тенденция к снижению артериального давления, для поддержания оптимального артериального давления внутривенно вводили всего 6 мг фенилэфрина.
Во время операции пациент оставался гемодинамически стабильным с общей кровопотерей около 550 мл, которая была заменена жидкостями под контролем центрального венозного мониторинга (ЦВД), который позже был введен во время операции.
Операция длилась 60 мин. Пациент переведен в отделение реанимации и интенсивной терапии (ОРИТ) для дальнейшего наблюдения. Полное восстановление после эпидуральной анестезии произошло через 6 часов. Сенсорную дозу, 16 мл 0,125% бупивакаина и 50 мкг фентанила, вводили через эпидуральный катетер каждые восемь часов в течение первых 48 часов, а эпидуральный катетер удаляли на 3-й -й послеоперационный день с соблюдением асептики. Пациент выздоровел без осложнений в отделении интенсивной терапии и в дальнейшем наблюдался в палате в течение следующих 7 дней.Пациентка выписана в удовлетворительном состоянии с рекомендациями регулярного послеродового осмотра и кардиологической консультации.
Обсуждение
Врожденная SOVA обычно поражает правый синус, на который приходится 70-90% всех аневризм синуса, в то время как некоронарный синус и левый коронарный синус составляют 10-20% и <5% соответственно.[7]
Большинство аневризм правого коронарного синуса прорываются в правый желудочек и редко в правое предсердие, вызывая аорто-кадиальный шунт.[2] Разрыв SOVA обычно происходит в раннем взрослом возрасте (3-4 -е -е десятилетие).[8]
Разрыв SOVA соединяет системную циркуляцию высокого давления с малой циркуляцией низкого давления, что приводит к непрерывному шунтированию крови на протяжении систолы и диастолы. Объем шунта зависит от диаметра разрыва и тяжести легочного сосудистого сопротивления. Большой шунт вызывает объемную перегрузку малого круга кровообращения и левых отделов сердца. Вначале наблюдается компенсаторное расширение и гипертрофия камер сердца. Когда объем шунтируемой крови превышает компенсаторные механизмы, развивается застойная сердечная недостаточность.[3]
Беременность – физиологическое состояние, связанное с изменением общего объема крови, периферического сосудистого сопротивления и сократительной способности миокарда, что способствует адаптации сердечно-сосудистой системы матери к повышенным метаболическим потребностям матери и плода. Нормальные беременные женщины хорошо адаптируются к этим физиологическим изменениям без неблагоприятных последствий, но женщины со структурными заболеваниями сердца могут столкнуться с неблагоприятными последствиями.[9]
Этот случай может быть типичным врожденным разрывом SOVA во время предыдущих вагинальных родов, вызванным гемодинамическим напряжением родов.
В данном случае была использована эпидуральная анестезия, потому что:
Начало симпатической блокады очень медленное и, таким образом, позволяет избежать реверсирования шунтирующего тока при материнской гипоксемии.[10]
Уровень анестезии можно легко титровать, изменяя объем местных анестетиков.[11]
Пациент оставался в сознании в течение всего интраоперационного периода и не сообщал о каких-либо неблагоприятных симптомах (одышке, боли в груди или сердцебиении), поэтому его можно было немедленно вызвать.[12]
Обеспечивает хорошее послеоперационное обезболивание, избегая опиоидов и их осложнений.[10,11,13]
Воздействует на факторы, повышающие системное сосудистое сопротивление (боль или хирургический стресс), что может вызвать резкое увеличение кровотока по шунту, приводящее к застою в легких и, в конечном итоге, к застойной сердечной недостаточности.
Единственным недостатком эпидуральной анестезии является то, что ее нельзя использовать в экстренных случаях, например, при тяжелом дистрессе плода, из-за задержки начала анестезии.
Эпидуральная анестезия также может использоваться у пациенток с RSOV, перенесших нормальные вагинальные роды, где она значительно снижает гемодинамическую нагрузку на сердечно-сосудистую систему при родах, но о таких случаях не сообщалось.[10]
Эпидуральная анестезия предпочтительнее спинальной анестезии, поскольку последняя вызывает быстрое падение системного сосудистого сопротивления и реверсию шунта с внезапным началом гипоксемии матери и плода.[10] Эпидуральная анестезия предпочтительнее общей анестезии, поскольку сама общая анестезия усиливает гемодинамическую нагрузку беременности и родов на сердечно-сосудистую систему у таких пациенток. Недостатки общей анестезии:
Во время интубации, аспирации и экстубации резкое повышение частоты сердечных сокращений и системное сосудистое сопротивление усиливают шунтирующий поток, что может привести к застойной сердечной недостаточности.[14]
Набухание сосудов слизистой оболочки дыхательных путей, вызванное гормонами, увеличивает вероятность кровотечения из дыхательных путей и аспирации после ларингоскопии и интубации.[15]
Повышенная вероятность аспирации желудочного содержимого, приводящая к химическому пневмониту (синдром Мендельсона).[14]
Использование опиоидов повышает частоту гипоксии, гиперкапнии и респираторного ацидоза с реверсированием шунтирующего тока, что приводит к материнской гипоксемии, а также к депрессии новорожденных в послеоперационном периоде.[11,13]
Заключение
Эпидуральная анестезия эффективна у пациенток с RSOV при доношенной беременности, перенесших нормальные роды через естественные родовые пути или кесарево сечение, поскольку она снижает дополнительную гемодинамическую нагрузку родов на уже скомпрометированную сердечно-сосудистую систему этих пациенток.
Подтверждение
Отделение акушерства и гинекологии, больницы LLR, Медицинский колледж GSVM, Канпур 208002.
Литература
1. Гольдберг Н., Краснов Н. Аневризмы синуса вальсальвы. Клин Кардиол. 1990; 13:831–6. [PubMed] [Google Scholar]2. Chu SH, Hung CR, How SS, Chang H, Wang SS, Tsai CH, et al. Разорвавшиеся аневризмы синуса вальсальвы у восточных больных. J Грудной сердечно-сосудистый хирург. 1990; 99: 288–98. [PubMed] [Google Scholar]3. Перлофф Дж.К. Врожденные аневризмы синусов вальсальвы. В: Perloff JK, редактор. Клиническое распознавание врожденного порока сердца. 5-е изд. Филадельфия: Saunders WB; 2003.стр. 457–70. [Google Академия]7. Кольцо ВС. Проект номенклатуры и базы данных хирургии врожденного сердца: аневризма аорты, аневризма синуса Вальсальвы и расслоение аорты. Энн Торак Серг. 2000;69:S147–63. [PubMed] [Google Scholar]8. Фридман ВФ. Врожденные пороки сердца в младенчестве и детстве. В: Браунвальд Э., редактор. Болезни сердца: Учебник сердечно-сосудистой медицины. 5-е изд. Филадельфия: В. Б. Сондерс; 1997. С. 1505–91. [Google Академия]9. Глостен Б. Анестезия в акушерстве. В: Миллер Р.Д., редактор.Черчилль-Дэвидсон «Практика анестезии». 5-е изд. Том. 2. Лондон: Арнольд; 2003. стр. 2024–68. [Google Академия] 10. Кучковский КМ. Анальгезия родов у рожениц с пороком сердца: что нужно знать акушеру? Acta Obstet Gynecol Scand. 2004; 83: 223–33. [PubMed] [Google Scholar] 11. Грасс Дж.А. Роль эпидуральной анестезии и обезболивания в послеоперационном исходе. Anesthesiol Clin Северная Америка. 2000;18:407–28. VIII. [PubMed] [Google Scholar] 12. Бисвас Р.Г., Бандйопадхьяй Б.К., Саркар М., Саркар Ю.К., Госвами А., Мукерджи П.Периоперационное ведение беременных с пороками сердца при кесаревом сечении под наркозом. (636-7). J Indian Med Assoc. 2003; 101: 632–634. [PubMed] [Google Scholar] 13. Баллантайн Дж. К., Карр Д. Б., де Ферранти С., Суарес Т., Лау Дж., Чалмерс Т. С. и др. Сравнительное влияние послеоперационной обезболивающей терапии на легочный исход: кумулятивный метаанализ рандомизированных контролируемых исследований. Анест Анальг. 1998; 86: 598–612. [PubMed] [Google Scholar] 14. Гхай Б., Мохан В., Кетарпал М., Малхотра Н.Эпидуральная анестезия при кесаревом сечении у пациентки с синдромом Эйзенменгера. Int J Obstet Анест. 2002; 11:44–7. [PubMed] [Google Scholar] 15. Боника Дж. Анатомо-физиологические изменения матери во время беременности и родов. В: Bonica JJ, McDonald JS, редакторы. Принципы и практика акушерской анальгезии. Балтимор: Уильямс и Уилкинс; 1995. С. 45–83. [Google Scholar]Кесарево сечение под эпидуральной анестезией при задокументированном случае разрыва аневризмы синуса вальсальвы
J Anaesthesiol Clin Pharmacol.2015 г., январь-март; 31(1): 119–122.
SR Divakar
1 Кафедра анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
Chandrashekhar Singh
1 Департамент Anes, Больницы, Канпур, Уттар-Прадеш, Индия
Чандра Мохан Верма
2 Отделение кардиологии, Институт кардиологии LPS, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
Чайтанья Д.Кулкарни
3 Кафедра радиологии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
1 Кафедра анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия
2 Кафедра кардиологии, Институт кардиологии LPS, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия3 Кафедра радиологии, Медицинский колледж GSVM и больницы LLR, Канпур, Уттар-Прадеш, Индия для переписки: Dr.SR Divakar, Отделение анестезиологии и интенсивной терапии, Медицинский колледж GSVM и больницы LLR, Канпур — 208 002, Уттар-Прадеш, Индия. Электронная почта: moc.liamg@38rakavidrdАвторское право: © Journal of Anaesthesiology Clinical Pharmacology
Это статья с открытым доступом, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение. на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья была процитирована другими статьями в PMC.Abstract
Разрыв аневризмы синуса Вальсальвы (RSOV), возникающий во время беременности, является редкой сердечной аномалией и может быть как врожденным, так и приобретенным. Врожденные аневризмы синуса Вальсальвы обычно связаны с другими структурными дефектами, такими как дефект межжелудочковой перегородки (50-55%), аортальная регургитация (АР) (25-35%), двустворчатый аортальный клапан (10-15%) и синдром Марфана (10%). %). RSOV во время беременности усиливает гемодинамическую нагрузку на сердечно-сосудистую систему матери и представляет собой серьезную проблему с точки зрения акушерской анестезии.Мы сообщаем о случае 35-летней зарегистрированной пациентки с RSOV с легкой формой АР, проявляющейся полностью бессимптомно на сроке 37 недель 4 дня беременности. Успешно проведено плановое кесарево сечение в нижнем сегменте под эпидуральной анестезией.
Ключевые слова: Анестезия, кесарево сечение, эпидуральная анестезия, осложнения беременности, синус Вальсальвы.Врожденный вариант встречается чаще и составляет 0,1-3,5% всех врожденных пороков сердца.[1]
Врожденная SOVA чаще встречается у мужчин с мужчинами: соотношение женщин 4: 1 и более высокая распространенность среди азиатского населения, чем западного. [2]
Аневризма синуса Вальсальвы обычно остается бессимптомной до тех пор, пока не произойдет разрыв, ведущий к катастрофическим событиям. [1,3] Размер, расположение и быстрота разрыва являются главными определяющими факторами клинической картины и прогноза разрыва аневризмы синуса Вальсальвы (RSOV).[2] Высокая степень клинического подозрения с последующей визуализацией помогает в подтверждении диагноза.
В англоязычной литературе мало обсуждается RSOV, возникающий во время беременности, и его анестезиологическое обеспечение. Во всех ранее зарегистрированных случаях либо не обсуждалось анестезиологическое обеспечение[4], либо проводились нормальные вагинальные роды[5], либо выполнялось кесарево сечение под общей анестезией[6].
Здесь мы представляем анестезиологическое обеспечение пациента с RSOV в срок, отправленный на плановое кесарево сечение в нижнем сегменте (LSCS) и перевязку маточных труб под эпидуральной анестезией.
История болезни
35-летняя повторнобеременная женщина из сельской местности поступила в акушерское отделение для планового осмотра в связи с аменореей на сроке 9 месяцев. В ее предыдущем анамнезе было два родоразрешения: сначала LSCS, выполненная под спинальной анестезией 4,5 года назад из-за отсутствия прогресса родов с беспрецедентным интраоперационным и послеоперационным течением, а второй — нормальные вагинальные роды 2 года назад дома. Послеродовой период протекал нормально, за исключением временного дискомфорта за грудиной и легкой одышки, которые развились сразу после вторых родов.Это продолжалось в течение одной недели и утихло без какого-либо лечения/консультации. В настоящей беременности у нее был ничем не примечательный дородовой период.
При общем осмотре пациент выглядит бледным и истощенным. У нее была частота пульса 108 уд/мин, скачкообразный характер. Ее артериальное давление было 116/52 мм рт.ст. на обеих руках.
Обследование сердечно-сосудистой системы выявило пальпируемое дрожание в левой парастернальной области и громкий непрерывный машинный шум 4/6 степени, выслушиваемый на всем протяжении прекардиальной области, лучше всего выслушиваемый в нижней левой парастернальной области.Остальное общее и системное обследование было нормальным.
Акушерское УЗИ выявило живой плод в 37 недель 4 дня в поперечном положении с нормальной частотой сердечных сокращений.
Все стандартные анализы крови были нормальными, за исключением гемоглобина 9,6 г/дл. Рентгенограмма грудной клетки и газовый анализ артериальной крови были в норме. Электрокардиография выявила синусовую тахикардию с увеличением левого желудочка. Трансторакальная двумерная эхокардиография выявила перепончатое выпячивание из правого коронарного синуса в правый желудочек с небольшой перфорацией 2.Ширина 7 мм, что дает характерный вид «ветроуловителя» с максимальным градиентом давления 80 мм рт. ст. поперек шунта []. Непрерывно-волновая допплерография и цветная визуализация потока выявили высокоскоростной однонаправленный поток из аорты в правый желудочек через поражение шунта [рисунки и ]. Систолическое давление в легочной артерии составило 24 мм рт. ст. без признаков тромбов, эмболов или вегетаций. Полости желудочков увеличены, функция левого желудочка в покое нормальная.
(а) Трансторакальная двумерная эхокардиография, демонстрирующая типичный «ветровой» вид аневризмы правого синуса Вальсальвы с разрывом в правый желудочек.АО-Аорта, ПЖ-Правый желудочек, ЛЖ-Левый желудочек, разрыв аневризмы синуса Вальсальвы. (b) Трансторакальная двумерная эхокардиография с визуализацией цветного потока демонстрирует однонаправленный непрерывный мозаичный поток из аорты в правый желудочек через разрыв правого синуса аневризмы Вальсальвы
Трансторакальная двумерная эхокардиография с непрерывной допплеровской визуализацией потока демонстрирует непрерывный высокоскоростной турбулентный поток через область шунта
Во время преданестезиологического осмотра были подтверждены данные общего и системного обследования.Поскольку у пациентки полностью отсутствовали симптомы дистресса плода, было запланировано хирургическое вмешательство под эпидуральной анестезией.
В ночь перед операцией вводили перорально ранитидин 150 мг и алпразолам 0,25 мг. Ее не давали перорально в течение 6 часов. Письменное информированное согласие было получено как от пациентки, так и от ее мужа.
В операционной пациента уложили на операционный стол на спину с клином 10-15° под правым бедром. Маска Хадсона была прикреплена с непрерывным потоком кислорода.Внутривенный доступ был получен с помощью канюли 18G после местной анестезии смесью местного анестетика Eutectic (2,5% лигнокаина + 2,5% прилокаина). Внутривенно ранитидин 50 мг, инъекции. Метоклопрамид 10 мг и антибиотикопрофилактика 2 г цефтриаксона были даны за 30 минут до индукции.
Частота пульса, неинвазивное кровяное давление, насыщение кислородом, электрокардиография и центральное венозное давление (ЦВД) (норма 5–10 см H 2 O) контролировались на протяжении всей операции и оставались в пределах нормы.
После предварительной нагрузки 600 мл раствора Рингера больная уложена в сидячее положение и установлена местная анестезия L 2 -L 3 межпозвонкового пространства с использованием 3 мл раствора 2% лигнокаина.
Эпидуральное пространство на этом уровне локализовано с помощью иглы Туохи 18G с потерей устойчивости к физиологическому раствору на глубину 4 см и эпидуральный катетер 18G введен на 5 см в эпидуральное пространство. Эпидуральный катетер был закреплен и введена тестовая доза 3 мл 2% лигнокаина с адреналином 1:200000 без признаков развития субарахноидального блока через 5 минут.Больная возвращена в исходное положение.
Раствор местного анестетика был приготовлен из 15 мл 0,5% бупивакаина, 100 мкг фентанила, 5 мл 2% лигнокаина и 0,15 мл 8,4% бикарбоната натрия.
Эту смесь местных анестетиков и опиоидов вводили через эпидуральный катетер по 5 мл с интервалом 5 минут. Через 25 минут была установлена успешная двусторонняя сенсорная блокада боли, тонкого прикосновения и температуры от T 6 до S 4 . Была выполнена LSCS, и здоровая девочка весом 2600 г была рождена с оценкой по шкале Апгар 8/10 и 9/10 через 1 и 5 мин соответственно.Выполнена двусторонняя перевязка маточных труб.
Окситоцин для инъекций 10 ЕД вводили медленно внутривенно для достижения достаточного сокращения матки. Поскольку наблюдалась тенденция к снижению артериального давления, для поддержания оптимального артериального давления внутривенно вводили всего 6 мг фенилэфрина.
Во время операции пациент оставался гемодинамически стабильным с общей кровопотерей около 550 мл, которая была заменена жидкостями под контролем центрального венозного мониторинга (ЦВД), который позже был введен во время операции.
Операция длилась 60 мин. Пациент переведен в отделение реанимации и интенсивной терапии (ОРИТ) для дальнейшего наблюдения. Полное восстановление после эпидуральной анестезии произошло через 6 часов. Сенсорную дозу, 16 мл 0,125% бупивакаина и 50 мкг фентанила, вводили через эпидуральный катетер каждые восемь часов в течение первых 48 часов, а эпидуральный катетер удаляли на 3-й -й послеоперационный день с соблюдением асептики. Пациент выздоровел без осложнений в отделении интенсивной терапии и в дальнейшем наблюдался в палате в течение следующих 7 дней.Пациентка выписана в удовлетворительном состоянии с рекомендациями регулярного послеродового осмотра и кардиологической консультации.
Обсуждение
Врожденная SOVA обычно поражает правый синус, на который приходится 70-90% всех аневризм синуса, в то время как некоронарный синус и левый коронарный синус составляют 10-20% и <5% соответственно.[7]
Большинство аневризм правого коронарного синуса прорываются в правый желудочек и редко в правое предсердие, вызывая аорто-кадиальный шунт.[2] Разрыв SOVA обычно происходит в раннем взрослом возрасте (3-4 -е -е десятилетие).[8]
Разрыв SOVA соединяет системную циркуляцию высокого давления с малой циркуляцией низкого давления, что приводит к непрерывному шунтированию крови на протяжении систолы и диастолы. Объем шунта зависит от диаметра разрыва и тяжести легочного сосудистого сопротивления. Большой шунт вызывает объемную перегрузку малого круга кровообращения и левых отделов сердца. Вначале наблюдается компенсаторное расширение и гипертрофия камер сердца. Когда объем шунтируемой крови превышает компенсаторные механизмы, развивается застойная сердечная недостаточность.[3]
Беременность – физиологическое состояние, связанное с изменением общего объема крови, периферического сосудистого сопротивления и сократительной способности миокарда, что способствует адаптации сердечно-сосудистой системы матери к повышенным метаболическим потребностям матери и плода. Нормальные беременные женщины хорошо адаптируются к этим физиологическим изменениям без неблагоприятных последствий, но женщины со структурными заболеваниями сердца могут столкнуться с неблагоприятными последствиями.[9]
Этот случай может быть типичным врожденным разрывом SOVA во время предыдущих вагинальных родов, вызванным гемодинамическим напряжением родов.
В данном случае была использована эпидуральная анестезия, потому что:
Начало симпатической блокады очень медленное и, таким образом, позволяет избежать реверсирования шунтирующего тока при материнской гипоксемии.[10]
Уровень анестезии можно легко титровать, изменяя объем местных анестетиков.[11]
Пациент оставался в сознании в течение всего интраоперационного периода и не сообщал о каких-либо неблагоприятных симптомах (одышке, боли в груди или сердцебиении), поэтому его можно было немедленно вызвать.[12]
Обеспечивает хорошее послеоперационное обезболивание, избегая опиоидов и их осложнений.[10,11,13]
Воздействует на факторы, повышающие системное сосудистое сопротивление (боль или хирургический стресс), что может вызвать резкое увеличение кровотока по шунту, приводящее к застою в легких и, в конечном итоге, к застойной сердечной недостаточности.
Единственным недостатком эпидуральной анестезии является то, что ее нельзя использовать в экстренных случаях, например, при тяжелом дистрессе плода, из-за задержки начала анестезии.
Эпидуральная анестезия также может использоваться у пациенток с RSOV, перенесших нормальные вагинальные роды, где она значительно снижает гемодинамическую нагрузку на сердечно-сосудистую систему при родах, но о таких случаях не сообщалось.[10]
Эпидуральная анестезия предпочтительнее спинальной анестезии, поскольку последняя вызывает быстрое падение системного сосудистого сопротивления и реверсию шунта с внезапным началом гипоксемии матери и плода.[10] Эпидуральная анестезия предпочтительнее общей анестезии, поскольку сама общая анестезия усиливает гемодинамическую нагрузку беременности и родов на сердечно-сосудистую систему у таких пациенток. Недостатки общей анестезии:
Во время интубации, аспирации и экстубации резкое повышение частоты сердечных сокращений и системное сосудистое сопротивление усиливают шунтирующий поток, что может привести к застойной сердечной недостаточности.[14]
Набухание сосудов слизистой оболочки дыхательных путей, вызванное гормонами, увеличивает вероятность кровотечения из дыхательных путей и аспирации после ларингоскопии и интубации.[15]
Повышенная вероятность аспирации желудочного содержимого, приводящая к химическому пневмониту (синдром Мендельсона).[14]
Использование опиоидов повышает частоту гипоксии, гиперкапнии и респираторного ацидоза с реверсированием шунтирующего тока, что приводит к материнской гипоксемии, а также к депрессии новорожденных в послеоперационном периоде.[11,13]
Заключение
Эпидуральная анестезия эффективна у пациенток с RSOV при доношенной беременности, перенесших нормальные роды через естественные родовые пути или кесарево сечение, поскольку она снижает дополнительную гемодинамическую нагрузку родов на уже скомпрометированную сердечно-сосудистую систему этих пациенток.
Подтверждение
Отделение акушерства и гинекологии, больницы LLR, Медицинский колледж GSVM, Канпур 208002.