симптомы, лечение и пути передачи
Симптомы вируса Коксаки
Инкубационный период этого вируса составляет от 2 до 10 дней. Первые признаки вируса Коксаки напоминают простуду или грипп: ухудшение общего самочувствия, ломота в мышцах и резкое повышение температуры до 39-40 градусов.
Читайте также: Вирус Коксаки в Украине в 2019: все, что известно о болезни
Далее на теле появляются маленькие пузырьки с жидкостью. Чаще всего их можно заметить во рту, на ладонях и ступнях ног. Также эти пузырьки могут появляться на предплечье и на половых органах. Они не чешутся, но вызывают болевые ощущения.
Из-за Коксаки на теле появляются пузырьки
Также Коксаки влияет на желудочно-кишечный тракт — у человека начинается сильная диарея (до 5-10 раз в день) и рвота.
Вирус Коксаки может дать и осложнения. Иногда он может привести к воспалению центральной нервной системы, вирусному менингиту, параличу, перикардиту (воспаление наружной оболочки сердца и околосердечной сумки), миокардиту (заболевание сердечной мышцы), а также развитию диабета I степени.
Пути заражения Коксаки
Опасность этого вируса заключается еще и в том, что вирус очень быстро распространяется. Чаще всего им заражаются дети, однако его могут подцепить и взрослые. Вирус может быть в загрязненной воде, в сточных водах, а также в человеческих экскрементах и слюне. То есть он может передаваться воздушно-капельным путем.
Лечение и профилактика
Вирус проходит в течение двух недель. Его реально вылечить и в домашних условиях. Однако, очень опасны его симптомы, в частности высокая температура и диарея, и возможные осложнения. Поэтому медики настоятельно советуют при первых симптомах обратиться к врачу.
Пока нет вакцины от вируса Коксаки, поэтому его профилактика заключается в стандартных правилах гигиены, например, тщательное мытье рук после туалета и перед едой, если вы знаете об опасности, то лучше не контактировать с загрязненной водой и инфицированными людьми.
Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера
9-10 декабря 2021 г. в Президентской библиотеке им. Б.Н. Ельцина в Санкт-Петербурге завершила свою работу II Международная научно-практическая конференция по вопросам противодействия новой коронавирусной инфекции и другим инфекционным заболеваниям. По итогам её работы была подготовлена и принята резолюция.
в Президентской библиотеке им. Б.Н. Ельцина в Санкт-Петербурге завершила свою работу II Международная научно-практическая конференция по вопросам противодействия новой коронавирусной инфекции и другим инфекционным заболеваниям. По итогам её работы была подготовлена и принята резолюция.
Организаторы конференции: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; ФБУН Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера Роспотребнадзора; ФКУЗ Российский научно-исследовательский противочумный институт «Микроб» Роспотребнадзора.
Работу конференции открыла Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека – Главный государственный санитарный врач Российской Федерации 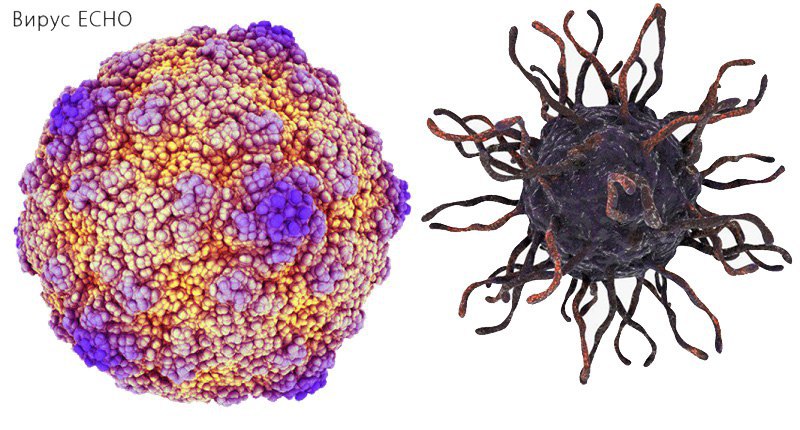 В работе конференции в очном формате принимают участие 132 ведущих российских и зарубежных учёных, представители стран СНГ, ШОС, Европейского союза, международных организаций из 11-ти стран мира (Социалистическая Республика Вьетнам, Республика Гвинея, Республика Сенегал, Федеративная Республика Германия, Республика Армения, Республика Беларусь, Киргизская Республика, Республика Казахстан, Монголия), в том числе представитель Европейского бюро ВОЗ. В заочном формате запланировано участие 179-ти учёных.
В работе конференции в очном формате принимают участие 132 ведущих российских и зарубежных учёных, представители стран СНГ, ШОС, Европейского союза, международных организаций из 11-ти стран мира (Социалистическая Республика Вьетнам, Республика Гвинея, Республика Сенегал, Федеративная Республика Германия, Республика Армения, Республика Беларусь, Киргизская Республика, Республика Казахстан, Монголия), в том числе представитель Европейского бюро ВОЗ. В заочном формате запланировано участие 179-ти учёных.
По словам А.Ю. Поповой, за время начала пандемии удалось значительно расширить понимание этой инфекции и борьбы с заболеванием. На сегодняшний день в мире зарегистрировано 267,5 млн. случаев заражения ковид, вирус мутирует. Россия находится в первой десятке по тестированию на коронавирус, а по уровню заболеваемости на 94-м месте в мире. Российская Федерация достойно справляется с вызовом, применяя опережающую (проективную) стратегию в борьбе COVID-19. В стране второй год проводится масштабная работа по исследованию популяционного иммунитета населения к новой коронавирусной инфекции.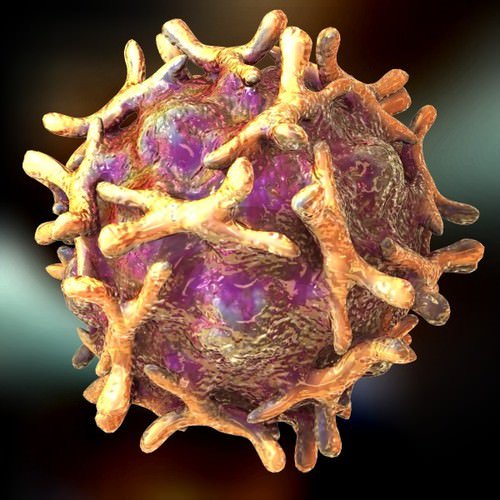
Анна Попова также зачитала приветственное обращение Председателя Правительства РФ Михаила Мишустина к участникам конференции и предоставила слово для приветствия почётным членам мероприятия – Губернатору Санкт-Петербурга 
В рамках первого планарного заседания под председательством А.Ю. Поповой и директора РосНИПЧИ «Микроб» Кутырева Владимира Викторовича «COVID-19: эпидемиология, вирусология и иммунология» прозвучали следующие доклады: «Эпидемиологические аспекты пандемии COVID-19» (Кутырев В.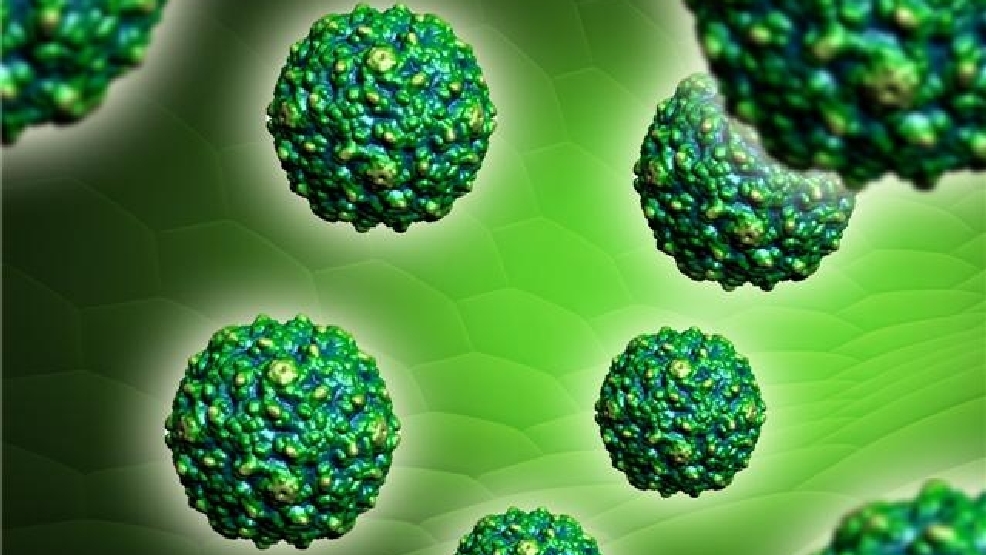 В.), «Иммунология COVID-19» (
В.), «Иммунология COVID-19» (
На первом секционном заседании «Молекулярная эпидемиология SARS-CoV-2. Изучение микробных и вирусных ассоциатов» прозвучали следующие доклады: «Геномная эпидемиология варианта «дельта» в России» ( Н. Ильина, ФНКЦ физико-химической медицины), «Антибиотикорезистентность в период пандемии COVID-19» (Р.С. Козлов, Смоленский государственный медицинский университет), «Генетическая характеристика коронавируса SARS-CoV-2, циркулирующего на территории Российской Федерации и Киргизской Республики» (
Н. Ильина, ФНКЦ физико-химической медицины), «Антибиотикорезистентность в период пандемии COVID-19» (Р.С. Козлов, Смоленский государственный медицинский университет), «Генетическая характеристика коронавируса SARS-CoV-2, циркулирующего на территории Российской Федерации и Киргизской Республики» ( В. Миронова, С.В. Балахонов, ФКУЗ «Иркутский научно-исследовательский противочумный институт»).
В. Миронова, С.В. Балахонов, ФКУЗ «Иркутский научно-исследовательский противочумный институт»).
На втором секционном заседании «Перспективы появления и развития препаратов для этиотропной терапии и клинические особенности COVID-19» презентованы доклады: «Лечение новой коронавирусной инфекции: успехи и ошибки» (С.В. Царенко, МГУ им. М.В. Ломоносова), «Перспективы этиотропного лечения COVID-19. Российские данные» (Д.Ю. Пушкарь, Московский государственный медико-стоматологический университет им. А.И. Евдокимова), «Вариант Дельта: как должны меняться терапевтические подходы с изменением вируса?» (А.В. Аверьянов, ФГБУ НИИ пульмонологии ФМБА России), «Кандидат в лекарственное средство PDSTPи его применение для профилактики и лечения инфекций, вызванных вирусом SARS-CoV-2» (В.А. Макаров, ФИЦ «Фундаментальные основы биотехнологии»), «Специфические противомикробные препараты для лечения COVID-19» (В. В. Зарубаев, НИИ эпидемиологии и микробиологии им. Пастера), «Российские стандарты использования прямой противовирусной терапии на основе таких препаратов, как Авифавир, принятые для борьбы с новой коронавирусной инфекцией еще в 2020 году берутся на вооружение и международной Биг-фармой», (К.В. Балакин, ХимРар), «Препарат природного полифенола для превентивной терапии COVID-19» (Т.С. Ведехина, ФНКЦ физико-химической медицины ФМБА России), «Платформа для быстрого реагирования на новые вызовы биобезопасности: нейтрализующие SARS-CoV-2 антитела» (С.В. Кулемзин, Институт молекулярной и клеточной биологии СО РАН).
В. Зарубаев, НИИ эпидемиологии и микробиологии им. Пастера), «Российские стандарты использования прямой противовирусной терапии на основе таких препаратов, как Авифавир, принятые для борьбы с новой коронавирусной инфекцией еще в 2020 году берутся на вооружение и международной Биг-фармой», (К.В. Балакин, ХимРар), «Препарат природного полифенола для превентивной терапии COVID-19» (Т.С. Ведехина, ФНКЦ физико-химической медицины ФМБА России), «Платформа для быстрого реагирования на новые вызовы биобезопасности: нейтрализующие SARS-CoV-2 антитела» (С.В. Кулемзин, Институт молекулярной и клеточной биологии СО РАН).
На третьем секционном заседании «Лабораторная диагностика COVID19» прозвучали доклады: «Диагностика COVID-19: проблемы и решения» (Кристина Дешермайер, Институт тропической медицины имени Бернхарда Нохта в Гамбурге, Германия (ВКС), «Лабораторная диагностика COVID-19 в Российской Федерации» (А. Н. Летюшев, В.Ю. Ананьев, Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека), «Особенности диагностики COVID-19 методами амплификации нуклеиновых кислот» (С.Б. Яцышина, ЦНИИЭ Роспотребнадзора (ВКС), «Разработка набора реагентов для выявления SARS-CoV-2 методом LAM» (В.В. Петров, ЦНИИЭ Роспотребнадзора), «Опыт разработки и внедрения портативных диагностических систем для выявления возбудителей инфекционных заболеваний методом изотермической амплификации на примере анализатора «Изаскрин-8» (К.А. Прусаков, ФНКЦ физико-химической медицины ФМБА России), «Организация массового ПЦР тестирования в крупной централизованной лаборатории» (А.Г. Комаров, ГБУЗ «Диагностический центр Департамента здравоохранения Москвы»), «Научно-практические аспекты лабораторной диагностики новой коронавирусной инфекции. Опыт работы лаборатории «Клиники АрхиМед» (В.М. Безруков, В.А. Потапов, OOO «Клиника Архимед»), «Гибкие, производительные системы для диагностики и эпидемиологи» (О.
Н. Летюшев, В.Ю. Ананьев, Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека), «Особенности диагностики COVID-19 методами амплификации нуклеиновых кислот» (С.Б. Яцышина, ЦНИИЭ Роспотребнадзора (ВКС), «Разработка набора реагентов для выявления SARS-CoV-2 методом LAM» (В.В. Петров, ЦНИИЭ Роспотребнадзора), «Опыт разработки и внедрения портативных диагностических систем для выявления возбудителей инфекционных заболеваний методом изотермической амплификации на примере анализатора «Изаскрин-8» (К.А. Прусаков, ФНКЦ физико-химической медицины ФМБА России), «Организация массового ПЦР тестирования в крупной централизованной лаборатории» (А.Г. Комаров, ГБУЗ «Диагностический центр Департамента здравоохранения Москвы»), «Научно-практические аспекты лабораторной диагностики новой коронавирусной инфекции. Опыт работы лаборатории «Клиники АрхиМед» (В.М. Безруков, В.А. Потапов, OOO «Клиника Архимед»), «Гибкие, производительные системы для диагностики и эпидемиологи» (О.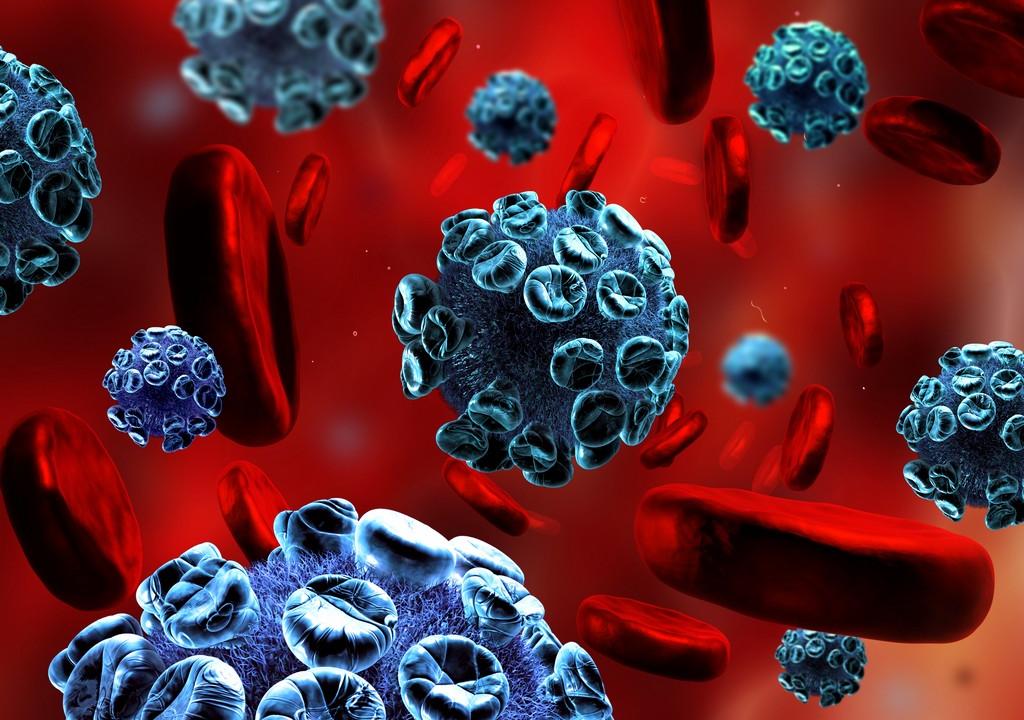 Б. Володин, ООО «Лаборатория Литех»), «Роль серологических тестов в определении статуса новой коронавирусной инфекции среди населения» (Л.У. Анварова, Управление по научным исследованиям, инновациям и подготовке научных и педагогических кадров Санэпидслужбы, Ташкент, Узбекистан), «Контроль качества ПЦР-наборов для диагностики SARS-CoV-2 в период пандемии коронавирусной инфекции на территории Узбекистана (Н.Г. Кан, Научно-исследовательский институт вирусологии, Ташкент, Узбекистан).
Б. Володин, ООО «Лаборатория Литех»), «Роль серологических тестов в определении статуса новой коронавирусной инфекции среди населения» (Л.У. Анварова, Управление по научным исследованиям, инновациям и подготовке научных и педагогических кадров Санэпидслужбы, Ташкент, Узбекистан), «Контроль качества ПЦР-наборов для диагностики SARS-CoV-2 в период пандемии коронавирусной инфекции на территории Узбекистана (Н.Г. Кан, Научно-исследовательский институт вирусологии, Ташкент, Узбекистан).
В рамках четвёртого секционного заседания «Коронавирусы: что нам ждать от них?» прозвучали доклады: «Роль рекомбинации в эволюции родов коронавирусов» (А.Н. Лукашев, Первый Московский государственный медицинский университет им. И.М. Сеченова), «Инфодемия и пандемия COVID-19» (К.А. Зыков, НИИ пульмонологии ФМБА России), «Эпидемиологическая роль домашних животных в передаче вируса SARS-CoV2» (А.В. Луницин, ФГБНУ Федеральный исследовательский центр вирусологии и микробиологии, Покров, Владимирская область), «Распространение COVID-19 в популяции животных и перспективы вакцинопрофилактики» (Т. С. Галкина, ВНИИ защиты животных Россельхознадзора, Владимир), «Моделирование процесса преодоления межвидового барьера коронавирусами на клеточном уровне in vitro» (С.Г. Юрков, ФИЦ вирусологии и микробиологии Минобрнауки РФ), «Альфа и бета-коронавирусы из летучих мышей, обитающих на территории европейской части России» (А.С. Сперанская, А.Е. Самойлов, ЦНИИ эпидемиологии Роспотребнадзора).
С. Галкина, ВНИИ защиты животных Россельхознадзора, Владимир), «Моделирование процесса преодоления межвидового барьера коронавирусами на клеточном уровне in vitro» (С.Г. Юрков, ФИЦ вирусологии и микробиологии Минобрнауки РФ), «Альфа и бета-коронавирусы из летучих мышей, обитающих на территории европейской части России» (А.С. Сперанская, А.Е. Самойлов, ЦНИИ эпидемиологии Роспотребнадзора).
На пятом секционном заседании «Иммунология СОVID-19: от особенностей иммунного ответа до коллективного иммунитета» прозвучали доклады: «Особенности гуморального ответа на инфекцию, вакцинацию и ревакцинацию при COVID-19» (С.Ю. Комбарова, Л.И. Новикова, Московский НИИЭМ им. Г.Н. Габричевского), «Клеточный иммунитет против SARS-CoV-2: мишени, динамика и протективная роль» (Г.А. Ефимов, НМИЦ гематологии МЗ РФ), «Что не так в иммунной системе пациентов с тяжелым течением COVID-19 и как это исправить?» (А.А. Круглов, НИИ физико-химической биологии им.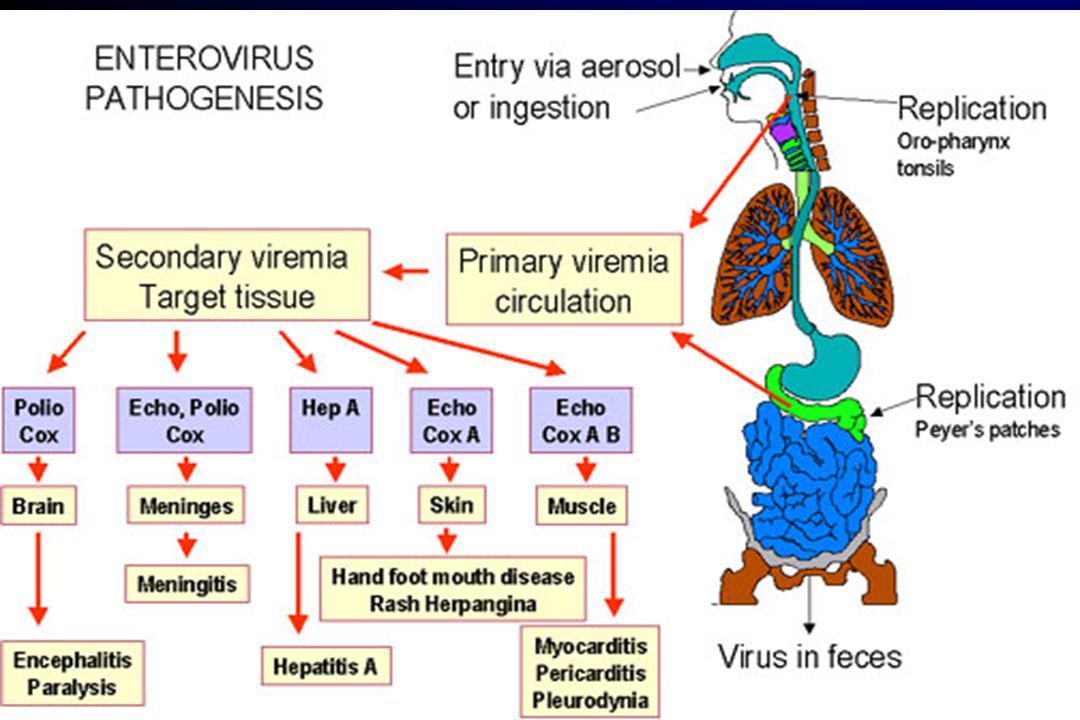 А.Н. Белозерского, МГУ им. М.В, Ломоносова), «Польза и вред антител при COVID-19» (Д.C. Матюшкина, НИИ дезинфектологии Роспотребнадзора), «Характеристика серопревалентности к SARSCoV-2 населения Республики Беларусь в период эпидемии COVID-19» (А.М. Дашкевич, Республиканский центр гигиены, эпидемиологии и общественного здоровья, Беларусь), «Результаты сероэпидемиологического исследования населения Кыргызской Республики на наличие антител к вирусу SARS-CoV2» (З.Ш. Нурматов, руководитель Республиканского научно-практического центра по контролю вирусных инфекций, Кыргызстан), «Исследование молекулярных аспектов COVID-19 в Научно-технологическом университете «Сириус» (И.В. Астраханцева, НТУ «Сириус»), «Динамика серопревалентности к SARS-CoV-2 в различных группах населения в первый период распространения новой коронавирусной инфекции» (М.В. Питерский, А.В. Семенов, ГНЦ вирусологии и биотехнологии «Вектор»).
А.Н. Белозерского, МГУ им. М.В, Ломоносова), «Польза и вред антител при COVID-19» (Д.C. Матюшкина, НИИ дезинфектологии Роспотребнадзора), «Характеристика серопревалентности к SARSCoV-2 населения Республики Беларусь в период эпидемии COVID-19» (А.М. Дашкевич, Республиканский центр гигиены, эпидемиологии и общественного здоровья, Беларусь), «Результаты сероэпидемиологического исследования населения Кыргызской Республики на наличие антител к вирусу SARS-CoV2» (З.Ш. Нурматов, руководитель Республиканского научно-практического центра по контролю вирусных инфекций, Кыргызстан), «Исследование молекулярных аспектов COVID-19 в Научно-технологическом университете «Сириус» (И.В. Астраханцева, НТУ «Сириус»), «Динамика серопревалентности к SARS-CoV-2 в различных группах населения в первый период распространения новой коронавирусной инфекции» (М.В. Питерский, А.В. Семенов, ГНЦ вирусологии и биотехнологии «Вектор»).
В зале Учёного совета 9 декабря состоялось седьмое совещание глав служб государств – членов Шанхайской организации сотрудничества, отвечающих за обеспечение санитарно-эпидемиологического благополучия.
10 декабря работа конференции началась открытием второго пленарного заседания «COVID-19: фундаментальные основы профилактики и лечения». Прозвучали доклады «Подходы к иммунотерапии COVID-19» (А.Г. Габибов, Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова, РАН), «Роль фундаментальных исследований и технологических решений в разработке вакцин против COVID-19» (А.А. Ишмухамедов, ФНЦ исследований и разработки иммунобиологических препаратов им. М.П. Чумакова), «Новые подходы в создании вакцинных препаратов к широкому спектру патогенов: феномен «тренированного иммунитета» (О.А. Свитич, НИИВС им. И.И. Мечникова), «Вакцина «Спутник V». Промежуточные итоги и перспективы» (Д.Ю. Логунов, НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи МЗ РФ), «Противодействие глобальным инфекционным угрозам вирусной этиологии» (Р.А. Максютов, ГНЦ вирусологии и биотехнологии «Вектор»), «COVID-19: проблемы вакцинации» (Дон Сяопин, Китайский центр по контролю и профилактике заболеваний, Пекин, Китай).
В рамках шестого секционного заседания «Объединяя усилия: международный опыт и международное взаимодействие по противодействию COVID-19» прозвучали следующие доклады: «Ситуация с эпидемией COVID-19 во Вьетнаме и сотрудничество Вьетнама и Российской Федерации в профилактике эпидемии» (Нгуенг Фи Лонг, Совместный Российско-Вьетнамский Тропический научно-исследовательский и технологический центр, Ханой, Вьетнам), «COVID-19 в Центральном Вьетнаме: состояние проблемы» (До Тхай Хунг, Институт Пастера в Нячанге, Вьетнам), «Стратегия борьбы с пандемией COVID-19 в Монголии» (Энхсайхан Лхагвасурэн, Министерство здравоохранения, Улан-Батор, Монголия), «Мобильная лаборатория Института Пастера в Дакаре: от создания до расследования вспышек лихорадки денге и COVID-19» (Фае Умар, Институт Пастера в Дакаре, Дакар, Сенегал), «Эволюция эпидемиологических показателей COVID-19 в Гвинейской Республике» (М.И. Буаро, С. Бумбали, С.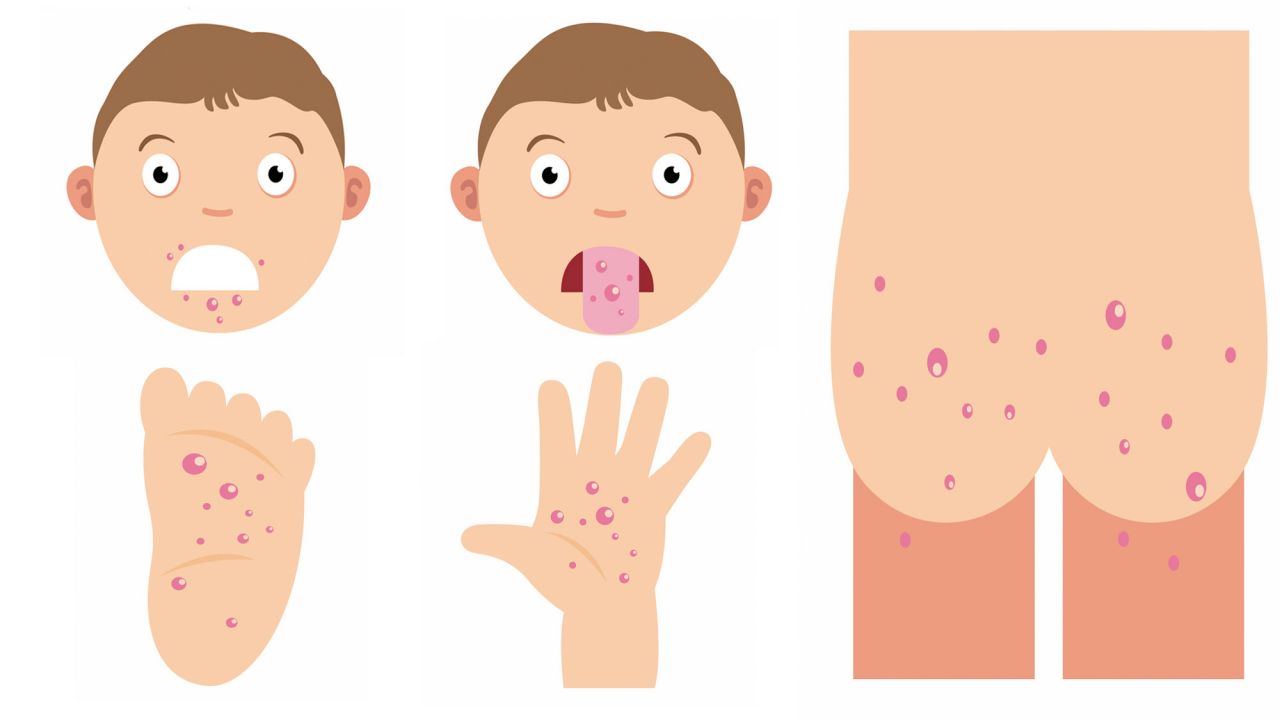 Кейта, Институт прикладной биологии Гвинеи, Киндия, Гвинейская Республика), «Эволюция пандемии новой коронавирусной инфекции в Гвинее и меры противодействия» (Н’Фали Магассуба, директор Научно-исследовательского центра вирусологии и лаборатории геморрагических лихорадок, Университет Гамаля Абдель Насера, Конакри, Гвинейская Республика), «Возможности коррекции подходов к борьбе с COVID-19: опыт международного взаимодействия в 2021 году» (Т.А. Руженцова, Д.А. Хавкина, П.В. Чухляев, Московский НИИЭМ им. Г.Н. Габричевского).
Кейта, Институт прикладной биологии Гвинеи, Киндия, Гвинейская Республика), «Эволюция пандемии новой коронавирусной инфекции в Гвинее и меры противодействия» (Н’Фали Магассуба, директор Научно-исследовательского центра вирусологии и лаборатории геморрагических лихорадок, Университет Гамаля Абдель Насера, Конакри, Гвинейская Республика), «Возможности коррекции подходов к борьбе с COVID-19: опыт международного взаимодействия в 2021 году» (Т.А. Руженцова, Д.А. Хавкина, П.В. Чухляев, Московский НИИЭМ им. Г.Н. Габричевского).
Седьмое заседание – круглый стол «Дискуссионные вопросы формирования постинфекционного и поствакцинального иммунитета к SARS-CoV-2» – включал следующие вопросы для дискуссий: закономерности формирования гуморального иммунитета; пути и критерии корректной оценки клеточного иммунитета; критерии защитного уровня постинфекционного и поствакцинального иммунитета; иммунологические механизмы формирования постковидного синдрома. Участники: академики РАН Зверев В.В., Тотолян А.А., Козлов В.А., члены-корреспонденты РАН Свитич О.А. и Симбирцев А.С., профессоры Сизякина Л.П. и Топтыгина А.П..
Участники: академики РАН Зверев В.В., Тотолян А.А., Козлов В.А., члены-корреспонденты РАН Свитич О.А. и Симбирцев А.С., профессоры Сизякина Л.П. и Топтыгина А.П..
Восьмое секционное заседание «Вакцины: настоящее и будущее. Гонка за эволюцией SARS-CoV-2?» включало в себя следующие доклады: «Пептидная вакцина Aurora-CoV: от разработки до внедрения» (И.М. Суслопаров, ГНЦ вирусологии и биотехнологии «Вектор» Роспотребнадзора), «Кандидатные вакцины против COVID-19 на основе рекомбинантных штаммов вирусов гриппа А и B» (И.Р. Иматдинов, ГНЦ вирусологии и биотехнологии «Вектор»), «Мукозальные вакцины на основе вируса гриппа А для профилактики респираторных инфекций» (М.А. Стукова, Д.А. Лиознов, НИИ гриппа им. А.А. Смородинцева), «Сравнительная эффективность и безопасность вакцин против коронавирусной инфекции» (С.М. Харит, Детский научно-клинический центр инфекционных болезней ФМБА России), «Фенотипы поствакцинального иммунитета при использовании пептидных антигенов для профилактики COVID-19 у лиц, перенесших коронавирусную инфекцию» (Л. П. Сизякина, Ростовский медицинский университет, Ростов-на-Дону).
П. Сизякина, Ростовский медицинский университет, Ростов-на-Дону).
Девятое заседание – круглый стол «Клинико-эпидемиологические особенности COVID-19» – состоял из фиксированных выступлений: «Эпидемиологические и клинико-патогенетические особенности СOVID-19: взгляд инфекциониста» (Н.Ю. Пшеничная, ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора), «Клинико-эпидемиологические параллели COVID-19 у детей» (А.В. Горелов, ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора), «COVID-19 у детей на волнах пандемии» (Ю.В. Лобзин, А.Н. Усков, С.В. Рычкова, Детский научно-клинический центр инфекционных болезней ФМБА России), «ОРВИ в период пандемии COVID-19: проблемы дифференциальной диагностики и возможности профилактики у детей» (И.В. Бабаченко, Детский научно-клинический центр инфекционных болезней ФМБА России), «Лейтрагин: новый подход к лечению цитокинового шторма при COVID-19» (В. Н. Каркищенко, И.А. Помыткин, НЦ биомедицинских технологий ФМБА России), «Функциональная ось «легкие–кишечник» и проблема long-ковида/пост-ковида. Что мы знаем о роли микробиоты человека при COVID-19?» (Д.В. Усенко, ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора).
Н. Каркищенко, И.А. Помыткин, НЦ биомедицинских технологий ФМБА России), «Функциональная ось «легкие–кишечник» и проблема long-ковида/пост-ковида. Что мы знаем о роли микробиоты человека при COVID-19?» (Д.В. Усенко, ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора).
В завершение работы учёные подвели итоги работы конференции. Принята резолюция.
Резолюция
Видео с работы конференции
Программа конференции
БД РД НО
Коксаки вирусна инфекция в детска възраст — какви са проявите при децата?
Коксаки вирусите принадлежат към групата на ентеровирусите. Те се предават по въздушно-капков път, поради което инфекцията много лесно се разпространява в затворени колективи, като ясли и детски градини.
Най-често коксаки-вирусната инфекция протича с грипоподобни симптоми и преминава без да се предприема специфично лечение. В други случаи обаче вирусите могат да засегнат кожата, храносмилателната, дихателната система, мускулите и сърцето, предизвиквайки по-сериозни заболявания. Поради тази причина клиничната картина и оплакванията при децата могат да са много разнообразни.
В други случаи обаче вирусите могат да засегнат кожата, храносмилателната, дихателната система, мускулите и сърцето, предизвиквайки по-сериозни заболявания. Поради тази причина клиничната картина и оплакванията при децата могат да са много разнообразни.
В повече от 50% от случаите заболяването протича много леко, дори без специфична клинична картина. В тези случаи инфекцията се самоограничава в рамките на около 3 дни. При други деца могат да се наблюдават симптоми, като повишена температура, главоболие, мускулни болки, обриви, болки в гърлото с автозни изменения, коремни болки, гадене, повръщане и други.
Какви проблеми могат да възникнат?
Заболявания, които се причиняват от коксаки-вирусите, са:
- Болестта ръка-крак-уста. Инкубационният период е 1-3 дни, след което детето повишава температура. Скоро в устната кухина се появяват малки мехурчета, които еволюират в язвички. Те са силно болезнени и могат да са причина за отказ от храна и вода, в резултат от което може бързо да се стигне до дехидратация.
 Могат да се наблюдават и обриви по дланите и стъпалата, съпроводени със сърбеж.
Могат да се наблюдават и обриви по дланите и стъпалата, съпроводени със сърбеж. - Конюнктивит. Наблюдава се зачервяване на окото, сълзене, оток, нарушено зрение и чувствителност към светлина. Заболяването рподължава 7-10 дни и засяга двете очи. Възстановяването е пълно, но детето може да е заразно известно време след преболедуване.
- Вирусен менингит и енцефалит. Рядко се наблюдават. Инфекцията засяга обвивките на мозъка и/или мозъчния паренхим. Това е от тежките прояви на коксаки вирусната инфекция, която може да доведе до тежки и животозастрашаващи усложнения.
- Миокардит. Това е друго тежко заболяване, което засяга сърдечния мускул. Рядко настъпва, но усложненият, които предизвиква, могат да са сериозни.
NEWS_MORE_BOX
Какво е лечението?
При неусложнено протичане на заболяването терапията е симптоматична. Антибиотици не се предписват, тъй като те не повлияват вирусните причинители.
Препоръчва се почивка на легло в първите няколко дни от заболяването. Обикновено инфекцията има благоприятен ход и се самоограничава. Могат да се назначат нестероидни противовъзпалителни средства за понижаване на температурата и облекчаване на болката. Препоръчва се даване на по-голямо количество течности, за да се избегне рискът от обезводняване на организма поради повишената температура и понижения прием на течности през устата.
Може ли да се предпази детето от разболяване?
Превенцията е трудна, тъй като вирусите са сравнително устойчиви в околната среда и лесно се предават от дете на дете. Това важи с особена сила за затворените колективи, като детски ясли и градини, училища. Най-застрашени от разболяване са децата до 5 годишна възраст.
Като основно средство за превенция срещу заболяването се препоръчва редовно миене на ръцете и ползване на дезинфектант, особено след ползване на тоалетна, след смяна на памперс, преди хранене и преди приготвяне на храната.
Повърхностите трябва редовно да се дезинфекцират особено в детските центрове. Не се препоръчва там да има плюшени или платнени играчки, тъй като те по-трудно се дезинфекцират и често стават лесно средство за разпространяване на инфекцията.
Деца, които са болни от коксаки-вирусна инфекция не трябва да посещават детски заведения до отшумяване на симптомите. Така се намалява рискът от разпространението на заразата.
вирусов Коксаки B и почки — забытая тема | Нефрология Диализная трансплантация
Аннотация
Вирусы Коксаки В типов 1–6 (CVB1–6) встречаются во всем мире и вызывают широкий спектр заболеваний, включая миокардит и асептический менингит. Хотя повреждение почек из-за CVB подозревают с 1950-х годов, эти агенты редко ищут в современной клинической нефрологической практике. Тем не менее CVB может инфицировать мезангиальные клетки.Кроме того, инфицирование этими вирусами приводит к гистологической картине, напоминающей мезангиопролиферативный гломерулонефрит и IgA-нефропатию у мышей.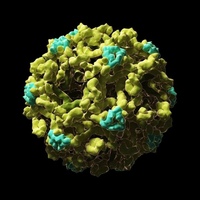 В настоящей статье мы представляем обзор этой в значительной степени игнорируемой темы, а также медленно и неуклонно увеличивающихся данных, свидетельствующих о связи между коксакивирусными инфекциями и заболеваниями почек.
В настоящей статье мы представляем обзор этой в значительной степени игнорируемой темы, а также медленно и неуклонно увеличивающихся данных, свидетельствующих о связи между коксакивирусными инфекциями и заболеваниями почек.
Биология вирусов Коксаки
В 1948 году при поиске «вирусов параполиомиелита» Далдорф и Сиклс [1] обнаружили новый вирус в стуле двух детей, живших в маленьком городке Коксаки, штат Нью-Йорк.Позже вирусы Коксаки были сгруппированы в две категории — вирусы Коксаки А (CVA, типы 1–22 и 24) и вирусы Коксаки В (CVB, типы 1–6) — в зависимости от их тропизма к тканям и течения инфекции у мышей-сосунков. Таксономически коксаки-, полио- и эховирусы образуют род энтеровирусов, который относится к семейству пикорнавирусов.
Вирусы Коксаки представляют собой небольшие («пико») частицы диаметром около 30 нм, состоящие из белкового капсида и РНК-генома [ 2 ]. Как и другие энтеровирусы, они очень устойчивы к кислоте и другим воздействиям окружающей среды. Вирусы Коксаки распространяются фекально-оральным путем и попадают в организм через желудочно-кишечный тракт. CVB реплицируются в энтероцитах и вторично попадают в кровоток, чтобы воздействовать на другие системы органов. В качестве начального этапа заражения на клеточном уровне вирус связывается со специфическими рецепторами на поверхности эукариотических клеток. Это взаимодействие приводит к высвобождению вирусной РНК в клеточную цитоплазму. Здесь вновь созданные вирусные РНК-полимеразы переводят вирусную положительную цепь (+) РНК в комплементарную минус (-) цепь РНК, которая затем служит матрицей для образования множества новых вирусных (+) молекул РНК.Вирусная РНК и капсидные белки затем собираются с образованием полноценных вирусов, которые высвобождаются из клетки-хозяина.
Вирусы Коксаки распространяются фекально-оральным путем и попадают в организм через желудочно-кишечный тракт. CVB реплицируются в энтероцитах и вторично попадают в кровоток, чтобы воздействовать на другие системы органов. В качестве начального этапа заражения на клеточном уровне вирус связывается со специфическими рецепторами на поверхности эукариотических клеток. Это взаимодействие приводит к высвобождению вирусной РНК в клеточную цитоплазму. Здесь вновь созданные вирусные РНК-полимеразы переводят вирусную положительную цепь (+) РНК в комплементарную минус (-) цепь РНК, которая затем служит матрицей для образования множества новых вирусных (+) молекул РНК.Вирусная РНК и капсидные белки затем собираются с образованием полноценных вирусов, которые высвобождаются из клетки-хозяина.
Вирусы Коксаки встречаются во всем мире. Большинство коксакивирусных инфекций проявляются как гриппоподобное лихорадочное заболевание или остаются бессимптомными [2]. Однако ЦВБ кроме того вызывают асептический менингит, острый и хронический миокардит, паралитические заболевания, рабдомиолиз, плевродинию (болезнь Борнхольма) и тяжелые септические заболевания у новорожденных.
Учитывая тот факт, что рецепторы для CVB и клеточные компоненты для репликации CVB были идентифицированы в почечной ткани [3], разумно предположить, что CVB может, по крайней мере, при определенных обстоятельствах, вызывать повреждение почек.
Вирусы Коксаки и почки
Сообщения о случаях заболевания людей
В 1958 г., через 10 лет после открытия первого вируса Коксаки, Утц и Шелоков [4] сообщили о генерализованной инфекции CVB3 у 40-летнего мужчины. В течение заболевания, которое характеризовалось двухфазной лихорадкой, ознобом, миалгией и головной болью, CVB3 неоднократно выделяли из крови, спинномозговой жидкости и мочи. Функция почек, оцениваемая по экскреции фенолсульфонфталеина, была нарушена.На 5-е сутки заболевания образцы мочи были положительными на ЦВБ, в то время как в крови вирус не определялся.
Во время эндемического асептического менингита у японских детей антиген CVB5 также был обнаружен в эксфолиированных мочевых клетках с помощью иммунофлуоресцентного окрашивания [ 5 ].
Помимо обнаружения CVB в моче, вирус был идентифицирован в почечной ткани с признаками воспалительной реакции. Burch и Colcolough [6] идентифицировали большое количество антигена CVB4 в миокардиальной и почечной ткани 45-летнего мужчины, умершего от панкардита и нефрита.Встречались интерстициальное воспаление и участки очагового хронического гломерулонефрита с повышенной клеточностью пучков клубочков, серповидным образованием и гиалинизацией клубочков. Точно так же Benyesh-Melnick и др. . [7] выделили CVB1 из ткани почки ребенка, умершего от миокардита.
Позднее Bayatpour et al опубликовали гломерулонефрит CVB4, характеризующийся вирурией, протеинурией, гематурией, лейкоцитурией, высоким кровяным давлением и повышенным содержанием азота мочевины в крови у 9-летнего мальчика.[8]. Берч и др. . обнаружили CVB4 с помощью иммунофлуоресценции в почках 19-летнего мужчины, умершего от острой дилатационной кардиомиопатии [9]. Кроме того, Aronson и Phillips [10] сообщили о шести взрослых пациентах с острой олигурической почечной недостаточностью, у которых одновременно наблюдалось значительное повышение уровня титра антител CVB5. В систематическом аутопсийном исследовании антиген CVB был обнаружен с помощью иммунофлуоресцентного окрашивания в почках 11 из 104 невыбранных пациентов [11]. Специфическая реакция вирусный антиген-антитело показала фокальную яркую внутрицитоплазматическую флуоресценцию, рассеянную в клубочках, канальцевом эпителии и интерстициальной ткани.
В систематическом аутопсийном исследовании антиген CVB был обнаружен с помощью иммунофлуоресцентного окрашивания в почках 11 из 104 невыбранных пациентов [11]. Специфическая реакция вирусный антиген-антитело показала фокальную яркую внутрицитоплазматическую флуоресценцию, рассеянную в клубочках, канальцевом эпителии и интерстициальной ткани.
В исследовании, посвященном вирусным инфекциям у реципиентов почечного трансплантата, CVB3 был выделен из двух из 20 образцов мочи [12]. К сожалению, не было предоставлено никакой информации о клиническом состоянии и функции почек пострадавших пациентов. Кроме того, были идентифицированы четыре пациента с отторжением почечного трансплантата на фоне резко нарастающих титров антител CVB4 и клинических признаков коксакивирусной инфекции и почечной недостаточности [13].
До 1976 года сообщалось об ограниченном числе случаев, связывающих CVB-инфекцию с почечной недостаточностью.В то время генетическая идентификация вирусов современными технологиями была недоступна. Анализ историй болезни пациентов не позволяет сделать однозначный вывод о том, был ли вирус CVB непосредственно ответственен за нарушение функции почек. Поэтому исследования на животных, возможно, могут быть более информативными.
Анализ историй болезни пациентов не позволяет сделать однозначный вывод о том, был ли вирус CVB непосредственно ответственен за нарушение функции почек. Поэтому исследования на животных, возможно, могут быть более информативными.
Исследования на животных
вс и др. . [ 14 ] описали согласованную последовательную картину гистологических поражений почек , индуцированных CVB1 у мышей .Через две недели после инфицирования клубочки показали повышенную клеточность с пролиферацией и набуханием эндотелиальных и мезангиальных клеток. В дальнейшем сращение капиллярных петель приводило к картине, сходной с дольковым гломерулонефритом. Более запущенные поражения показали склерозирующие изменения клубочков и частичную или полную гиалинизацию пучка клубочков. Флуоресцентная микроскопия показала отложение гамма-глобулина вдоль капилляров в виде нерегулярных скоплений. Эти наблюдения подтвердили публикации 1950-х и 1960-х годов, показывающие гистологические изменения и экскрецию CVB1 [15] и CVB5 [16] с мочой инфицированных мышей.
Kamiyama [17] разработал более хроническую модель и прививал мышам CVB4, вводимый один раз в месяц в течение 9 месяцев. Он сообщил о пролиферации мезангиальных клеток, заметных изменениях базальной мембраны клубочков, образовании полулуний, интерстициальном воспалении и равном количестве отложений IgA и IgG в клубочках.
Йошида и др. . наблюдали с помощью гибридизации in situ сильных CVB4-специфических сигналов положительной цепи (+) РНК в мезангиальных клетках [18].В их модели CVB4 ежемесячно вводили мышам в течение 5 месяцев. Интересно, что преобладающие отложения IgA в клубочках наряду с мезангиальной пролиферацией обнаруживались в течение нескольких месяцев после инфицирования (рис. 1), что свидетельствует об экспериментальной IgA-нефропатии.
Рис. 1.
Интенсивность гломерулярного IgA по иммунофлуоресценции у CVB4-инфицированных мышей. Высота столбца представляет собой среднее значение для инфицированных мышей (заштриховано) и контрольных мышей (открыто).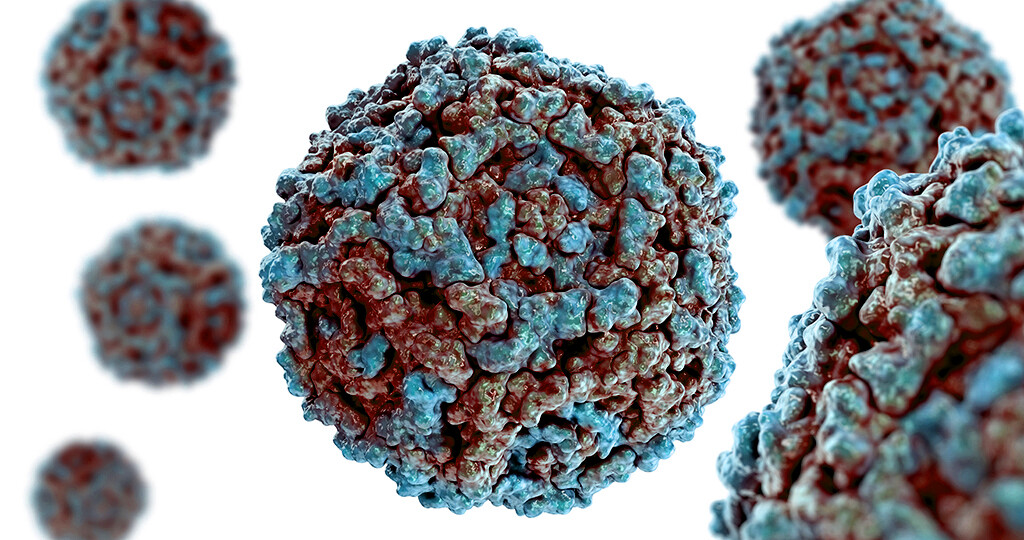 Интенсивность оценивалась по шкале, где отрицательный = 0, слабый = 0.5, легкая = 1, умеренная = 2 и выраженная = 3 (адаптировано из [18]).
Интенсивность оценивалась по шкале, где отрицательный = 0, слабый = 0.5, легкая = 1, умеренная = 2 и выраженная = 3 (адаптировано из [18]).
Рис. 1.
Интенсивность гломерулярного IgA методом иммунофлуоресценции у CVB4-инфицированных мышей. Высота столбца представляет собой среднее значение для инфицированных мышей (заштриховано) и контрольных мышей (открыто). Интенсивность оценивалась по шкале, где отрицательная = 0, легкая = 0,5, легкая = 1, умеренная = 2 и выраженная = 3 (адаптировано из [18]).
Чтобы установить, нарушается ли функция мезангиальных клеток инфекцией CVB4, Kume [19] изучал выведение коллоидного углерода мезангиальными клетками у мышей, инфицированных CVB4, и обнаружил снижение клиренса у инфицированных по сравнению с неинфицированными животными.
Гистологические изменения, наблюдаемые у мышей, подтверждаются данными, полученными у других видов. Берч и др. . [20] заразили беличьих обезьян CVB4 и наблюдали заметную пролиферацию мезангиальных и эндотелиальных клеток. Высыпания имели пятнистое распространение. Вирус удалось выделить из почечной ткани двух обезьян, вскрытых через 3 и 7 дней после инокуляции.
Высыпания имели пятнистое распространение. Вирус удалось выделить из почечной ткани двух обезьян, вскрытых через 3 и 7 дней после инокуляции.
Таким образом, в отличие от исследований на людях, исследования на мышах и обезьянах определенно указывают на патогенный потенциал, по крайней мере, после инокуляции больших количеств CVB1 и CVB4.Поражения кажутся преимущественно гломерулярными и напоминают IgA-нефропатию человека.
Исследования in vitro Кональди и др. . [ 3 ] получили первичные клеточные линии почек из непораженной части почек человека , резецированных по поводу карциномы . Полученные клеточные линии эпителиальных клеток проксимальных канальцев, гломерулярных подоцитов и гломерулярных мезангиальных клеток инокулировали эталонными штаммами CVB1-6. Мезангиальные клетки экспрессировали меньшее количество рецепторов CVB, чем эпителиальные клетки проксимальных канальцев.После заражения все клеточные линии продуцировали жизнеспособные вирусы. Цитопатический эффект наблюдался только в отношении эпителиальных клеток клубочков и эпителиальных клеток проксимальных канальцев. Напротив, мезангиальные клетки выжили и даже установили состояние персистирующей инфекции. Это хроническое носительство было наиболее выраженным для CVB1, 3 и 5, которые продуцировались в высоких и стабильных титрах в течение по меньшей мере 50 дней (фиг. 2). Фагоцитарная функция мезангиальных клеток была проверена с помощью анализа фагоцитоза с латексными шариками, покрытыми IgG, и в инфицированных клетках она была резко снижена.Кроме того, сократительная способность мезангиальных клеток была значительно снижена.
Цитопатический эффект наблюдался только в отношении эпителиальных клеток клубочков и эпителиальных клеток проксимальных канальцев. Напротив, мезангиальные клетки выжили и даже установили состояние персистирующей инфекции. Это хроническое носительство было наиболее выраженным для CVB1, 3 и 5, которые продуцировались в высоких и стабильных титрах в течение по меньшей мере 50 дней (фиг. 2). Фагоцитарная функция мезангиальных клеток была проверена с помощью анализа фагоцитоза с латексными шариками, покрытыми IgG, и в инфицированных клетках она была резко снижена.Кроме того, сократительная способность мезангиальных клеток была значительно снижена.
Рис. 2.
Вирусные титры при заражении мезангиальных клеток in vitro . CVB1, 3 и 5 вызывают хроническую и персистентную инфекцию в культуре первичных мезангиальных клеток человека. Напротив, CVB2 и 6 выводятся из клеток через 30–40 дней. CVB4 вызывает длительную инфекцию с медленно снижающимися титрами вируса (адаптировано из [3]).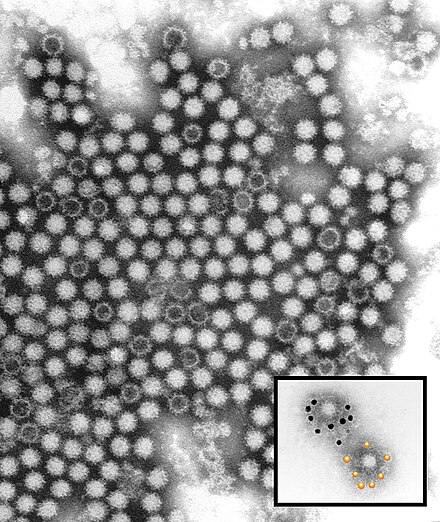
Рис. 2.
Вирусные титры при заражении мезангиальных клеток in vitro .CVB1, 3 и 5 вызывают хроническую и персистентную инфекцию в культуре первичных мезангиальных клеток человека. Напротив, CVB2 и 6 выводятся из клеток через 30–40 дней. CVB4 вызывает длительную инфекцию с медленно снижающимися титрами вируса (адаптировано из [3]).
На основании этих исследований можно предположить, что, во-первых, поражение почек, вызванное CVB, будет смешанным, гломерулярным и канальцевым, и, во-вторых, нефротоксический потенциал зависит от штамма вируса CVB, вызывающего инфекцию.
Комментарии и перспективы
Из представленных данных вполне вероятно, что CVB может инфицировать клетки почек in vivo и in vitro и при этом вызывать транзиторные или хронические заболевания почек.
CVB вызывает цитопатические эффекты в почечной ткани. Когда первичные клеточные культуры подоцитов человека и эпителиальных клеток проксимальных канальцев инфицированы CVB1-6, они проявляют цитопатические эффекты и лизис инфицированных клеток [3]. In vitro литические инфекции приводят к высвобождению высоких титров CVB и отщеплению прикрепленных клеток от пластикового материала. На этом фоне возникает соблазн предположить, что сходный механизм объясняет транзиторную вирурию и выделение вируссодержащих клеток из мочевыводящих путей при CVB-инфекции.
In vitro литические инфекции приводят к высвобождению высоких титров CVB и отщеплению прикрепленных клеток от пластикового материала. На этом фоне возникает соблазн предположить, что сходный механизм объясняет транзиторную вирурию и выделение вируссодержащих клеток из мочевыводящих путей при CVB-инфекции.
Взаимодействие между CVB и мезангиальными клетками зависит от подтипа CVB. In vitro , первичные культуры мезангиальных клеток человека инфицируются CVB1-6 [3]. CVB1, 3 и 5 вызывают персистентную и текущую инфекцию и непрерывную продукцию вируса. Интересно, что CVB1, 3 и 5, но не CVB2, 4 и 6, связываются с фактором ускорения распада (DAF/CD55), который представляет собой гликозилфосфатидилинозитол-заякоренный белок клеточной поверхности, состоящий из пяти внеклеточных коротких консенсусных повторов [21, 22].Остается установить, отражает ли дифференциальное связывание с DAF/CD55 просто совпадение или DAF играет роль в индукции состояния носительства CVB-инфицированных клеток. [3]. Кроме того, клеточная сократимость, еще одно важное свойство гломерулярной патофизиологии, заметно снижена в хронически инфицированных CVB мезангиальных клетках.В соответствии с этими данными, инокуляция CVB4 вызывает задержку мезангиального клиренса коллоидного углерода у мышей [19].
[3]. Кроме того, клеточная сократимость, еще одно важное свойство гломерулярной патофизиологии, заметно снижена в хронически инфицированных CVB мезангиальных клетках.В соответствии с этими данными, инокуляция CVB4 вызывает задержку мезангиального клиренса коллоидного углерода у мышей [19].
При введении CVB4 мышам развивается мезангиопролиферативный гломерулонефрит с гистологически вариабельной экспрессией. В некоторых исследованиях увеличение мезангиальной клеточности было обнаружено лишь временно [17, 23–25], тогда как в других эффект длился в течение многих месяцев [18, 26]. Эти различия лучше всего объясняются разными путями, частотой и количеством применяемого CVB, а также разными используемыми штаммами вирусов и мышей.Объясняют ли экспериментальные данные, по крайней мере частично, гетерогенное клиническое течение коксакивирусных инфекций, встречающихся у людей, еще предстоит выяснить. Что касается хронической инфекции клеток in vivo , вирусный антиген и вирусная положительная цепь (+) РНК были обнаружены с помощью иммунофлуоресценции и гибридизации in situ в почках мышей [3, 25]. Это указывает на репликацию CVB в этих клетках.
Это указывает на репликацию CVB в этих клетках.
Патофизиологический механизм, посредством которого индуцируется поражение почек при CVB-инфекции, неизвестен.Было высказано предположение, что острое повреждение вызывается острой и литической инфекцией клеток. Напротив, хроническое повреждение может быть вызвано хронической инфекцией клеток с последующими механизмами гломерулярного повреждения, связанными с иммунными комплексами [14, 27]. Последний механизм может объяснить интересное наблюдение CVB4-индуцированной IgA-нефропатии [18].
Тропизм к различным тканям и органам является давно известной особенностью различных штаммов CVB. В качестве примера описаны штаммы CVB3, вызывающие молниеносный миокардит у мышей, а также штаммы, которые вообще не влияют на сердце мыши [28, 29].Хотя причина этого явления детально не выяснена, по аналогии с кардиотропизмом разные штаммы CVB могут проявлять разную степень нефротропизма. Если бы это было так, многие CVB дикого типа могли бы вызывать просто временное или вообще не вызывать значительного повреждения почек. С другой стороны, более нефротропные штаммы могут вызывать острое или хроническое функциональное нарушение функции почек. В этом контексте иммуносупрессия или предшествующее повреждение почек могут быть факторами, делающими почки более уязвимыми к инфекциям, вызванным вирусами Коксаки.В соответствии с этой возможностью была описана CVB-индуцированная трансплантационная почечная недостаточность [13].
С другой стороны, более нефротропные штаммы могут вызывать острое или хроническое функциональное нарушение функции почек. В этом контексте иммуносупрессия или предшествующее повреждение почек могут быть факторами, делающими почки более уязвимыми к инфекциям, вызванным вирусами Коксаки.В соответствии с этой возможностью была описана CVB-индуцированная трансплантационная почечная недостаточность [13].
Причины большинства гломерулярных и интерстициальных типов нефрита остаются неизвестными. Учитывая сообщения о случаях заболевания человека, острые и хронические экспериментальные воспалительные заболевания почек, вызванные CVB, и наблюдения за клеточными культурами, полученными из клеток почек, разумно предположить, что CVB имеет клиническое значение для заболевания почек и должны быть исследованы соответствующим образом в будущем.
Фонд Эрики Баер-Шпихер. СНФ № 3100–61505.
Заявление о конфликте интересов . Ни один не заявил.
Каталожные номера
1 Даллдорф Г. , Сиклз, Г.М. Неидентифицированный фильтрующийся агент, выделенный из фекалий детей с параличом.
, Сиклз, Г.М. Неидентифицированный фильтрующийся агент, выделенный из фекалий детей с параличом.
Наука
1948
;108
:61
–63 2Рюкерт Р.Picornaviridae: вирусы и их репликация, In: Fields B, Knipe DM, eds.
Вирусология
, Рейвен Пресс, Нью-Йорк,1996
;609
–654 3Кональди П.Г., Бьянконе Л., Боттелли А., Де Мартино А., Камюсси Г., Тониоло А. Отличительные патогенные эффекты вирусов Коксаки группы В на клубочковых и канальцевых клетках почек человека.
Дж Вирол
1997
;71
:9180
–9187 4 Утц Дж.П., Шелоков А.И.вирусная инфекция Коксаки В; наличие вируса в крови, моче и спинномозговой жидкости.
J Am Med Assoc
1958
;168
:264
–267 5Хинума Й., Миямото Т., Мураи Й., Исида Н. Обнаружение антигена вируса Коксаки в мочевых клетках методом иммунофлуоресценции.
Ланцет
1962
;2
:179
–180 6Берч Г.Э., Колколо Х.Л.Прогрессирующий вирусный панкардит Коксаки и нефрит.
Энн Интерн Мед
1969
;71
:963
–970 7Бенеш-Мельник М., Розенберг Х.С., Уотсон Б. Вирусы в культурах клеток почек детей с врожденными пороками сердца и другими заболеваниями.
Proc Soc Exp Biol Med
1964
;117
:452
–459 8 Баятпур М. , Збитнев А., Демпстер Г., Миллер К.Р.Роль вируса Коксаки В4 в патогенезе острого гломерулонефрита.
, Збитнев А., Демпстер Г., Миллер К.Р.Роль вируса Коксаки В4 в патогенезе острого гломерулонефрита.
Can Med Assoc J
1973
;109
:873
пассим 9Берч Г., Харб Дж., Хирамото Ю. Вирусная инфекция Коксаки В4 почки человека.
Дж Урол
1974
;112
:714
–722 10Аронсон, доктор медицины, Филлипс, Калифорния.Коксакивирусная инфекция В5 при острой олигурической почечной недостаточности.
J Заразить Dis
1975
;132
:303
–306 11 Берч Г.Э., Чу К.С., Колколо Х.Л., Сохал Р.С. Иммунофлуоресцентная локализация антигена коксакивируса В в почках наблюдается при обычном вскрытии.
Am J Med
1969
;47
:36
–42 12Креч У, Юнг М, Прайс ПК, Тиль Г, Сеге Д, Ройтер Ф.Вирусные инфекции у реципиентов почечного трансплантата.
Z Immunitatsforsch Exp Клин Иммунол
1975
;148
:341
–355 13Page Y, Serrange C, Revillard JP, Traeger J, Denoyel J. Письмо: Вирусные инфекции Коксаки B при трансплантации почки.
Ноув Пресс Мед
1976
;5
:1587
–1588 14 Сунь СК, Лай Ч., Чен С.Т., Шеффер Б.Т.Эволюция хронического гломерулонефрита, индуцированного у мышей вирусами ECHO-9 и Коксаки B 1.
Дж Патол
1971
;104
:53
–57 15Дженсен ММ. Экспериментальные вирусные инфекции мочевыводящих путей мышей.
J Заразить Dis
1965
;115
:370
16Паппенгеймер А.М., Кунц Л.Дж., Ричардсон С.Экскреция вируса Коксаки (штамм Conn. № 5) с мочой инфицированных мышей.
Proc Soc Exp Biol Med
1951
;77
:405
–407 17Камияма С. Экспериментальный гломерулонефрит, вызванный вирусом Коксаки B4 у мышей – гломерулярные изменения, связанные с прерывистыми вирусными прививками.
Ниппон Джинзо Гаккай Ши
1990
;32
:939
–948 18 Йошида К. , Судзуки Дж., Судзуки С. и др. .Экспериментальная IgA-нефропатия, индуцированная вирусом Коксаки B4 у мышей.
, Судзуки Дж., Судзуки С. и др. .Экспериментальная IgA-нефропатия, индуцированная вирусом Коксаки B4 у мышей.
Am J Нефрол
1997
;17
:81
–88 19Куме К. Влияние вируса Коксаки B4 на поглощение и транспорт коллоидного углерода гломерулярным мезангием.
Ниппон Джинзо Гаккай Ши
1990
;32
:777
–789 20Берч Г.Э., Чу К.С., Сойке К.Ф.Коксакивирусный нефрит В4 у беличьей обезьяны.
Бр J Эксп Патол
1982
;63
:680
–685 21 Шафрен Д.Р., Бейтс Р.К., Агрез М.В.![]() , Херд Р.Л., Бернс Г.Ф., Барри Р.Д. Вирусы Коксаки B1, B3 и B5 используют фактор ускорения распада в качестве рецептора для прикрепления клеток.
, Херд Р.Л., Бернс Г.Ф., Барри Р.Д. Вирусы Коксаки B1, B3 и B5 используют фактор ускорения распада в качестве рецептора для прикрепления клеток.
Дж Вирол
1995
;69
:3873
–3877 22Паш А., Куппер Дж. Х., Вольде А., Кандольф Р., Селинка Х.К.Сравнительный анализ взаимодействия вирус-клетка-хозяин гемагглютинирующих и негемагглютинирующих штаммов вируса Коксаки В3.
Дж Ген Вирол
1999
;80 (Пт 12)
:3153
–3158 23Като К. Экспериментальный нефрит, вызванный Cox. Вирус В4 у мышей (авторский перевод).
Ниппон Джинзо Гаккай Ши
1980
;22
:233
–247 24 Охара Н.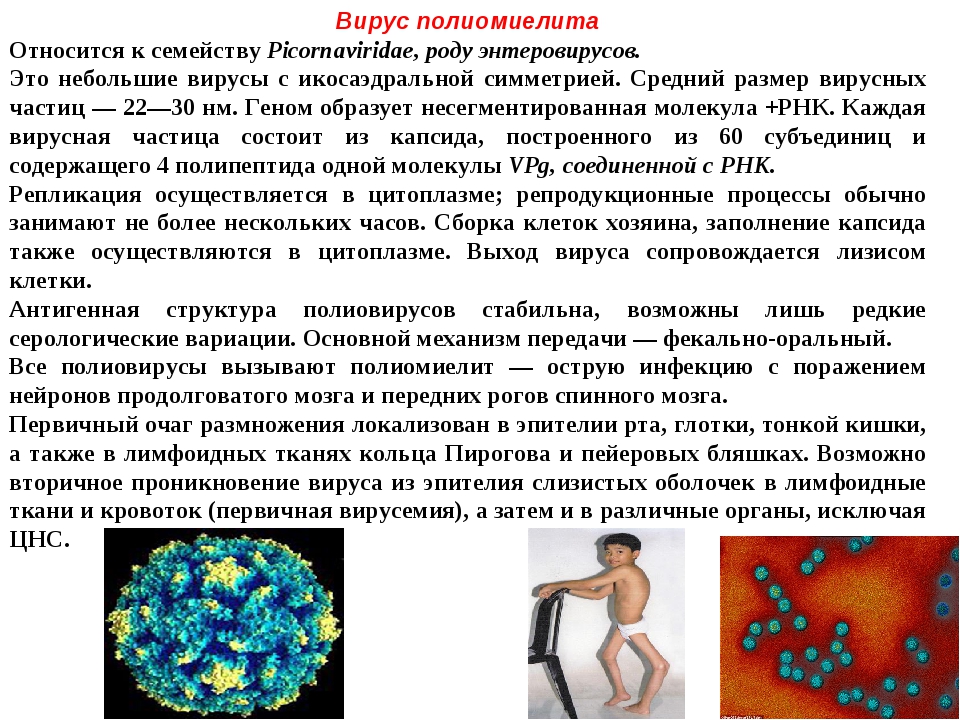 Экспериментальный нефрит, индуцированный вирусом Коксаки В4 у мышей – транзиторная мезангиальная пролиферация, связанная с острой виремией.
Экспериментальный нефрит, индуцированный вирусом Коксаки В4 у мышей – транзиторная мезангиальная пролиферация, связанная с острой виремией.
Ниппон Джинзо Гаккай Ши
1986
;28
:351
–364 25Mutoh S, Kumada K, Kume K, Suzuki J, Yokota T, Suzuki H. Обнаружение РНК вируса Коксаки B4 в почках инфицированных мышей с помощью на месте гибридизация.
Нефрон
1994
;67
:340
–345 26Исомэ М., Йошида К., Судзуки С. и др. . Экспериментальный гломерулонефрит после последовательной инокуляции пяти различных серотипов вирусов Коксаки группы В мышам.
Нефрон
1997
;77
:93
–99 27 Сан С. , Берч Г.Э., Сохал Р.С., Чу К.С.Вирусный нефрит Коксаки В4 у мышей и его аутоиммунные явления.
, Берч Г.Э., Сохал Р.С., Чу К.С.Вирусный нефрит Коксаки В4 у мышей и его аутоиммунные явления.
Proc Soc Exp Biol Med
1967
;126
:882
–885 28Селинка Х.К., Вольде А., Паш А. и др. . Сравнительный анализ двух штаммов вируса Коксаки В3: предполагаемое влияние взаимодействия вирус-рецептор на патогенез.
Дж Мед Вирол
2002
;67
:224
–233 29Селинка Х.К., Вольде А., Заутер М., Кандольф Р., Клингел К. Взаимодействия вирус-рецептор вирусов Коксаки В и их предполагаемое влияние на кардиотропизм.
Med Microbiol Immunol (Берл)
2004
;193
:127
–131 © Автор [2006]. Опубликовано Oxford University Press от имени ERA-EDTA. Все права защищены. Чтобы получить разрешение, отправьте электронное письмо по адресу: [email protected]
Опубликовано Oxford University Press от имени ERA-EDTA. Все права защищены. Чтобы получить разрешение, отправьте электронное письмо по адресу: [email protected]
Циклооксгеназа-2 индуцируется инфекцией SARS-CoV-2, но не влияет на проникновение или репликацию вируса
Выявление лекарств, которые регулируют инфекцию коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) и ее симптомы, было актуальной областью исследований во время пандемии коронавирусной болезни 2019 (COVID-19).Нестероидные противовоспалительные препараты (НПВП), которые часто используются для облегчения боли и воспаления, могут модулировать как инфекцию SARS-CoV-2, так и реакцию хозяина на вирус. НПВП ингибируют ферменты циклооксигеназу-1 (ЦОГ-1) и циклооксигеназу-2 (ЦОГ-2), которые опосредуют выработку простагландинов (ПГ). PGE 2 , один из наиболее распространенных PG, играет разнообразную биологическую роль в гомеостазе и воспалительных реакциях. Предыдущие исследования показали, что лечение НПВП или ингибирование передачи сигналов рецептора PGE 2 приводит к усилению регуляции ангиотензинпревращающего фермента 2 (ACE2), рецептора входа в клетку для SARS-CoV-2, что вызывает опасения, что НПВП могут повысить восприимчивость к инфекции. .Также было показано, что передача сигналов COX/PGE 2 регулирует репликацию многих вирусов, но пока неизвестно, играет ли она роль в репликации SARS-CoV-2. Целью этого исследования было проанализировать влияние НПВП на COVID-19 с точки зрения проникновения и репликации SARS-CoV-2. Мы обнаружили, что инфекция SARS-CoV-2 индуцирует активацию ЦОГ-2 в различных культурах клеток человека и мышиных системах. Однако подавление передачи сигналов COX-2/PGE 2 двумя обычно используемыми НПВП, ибупрофеном и мелоксикамом, не влияло на экспрессию ACE2 , проникновение вируса или репликацию вируса.Наши результаты показывают, что передача сигналов ЦОГ-2, управляемая SARS-CoV-2, вместо этого может играть роль в регуляции воспаления и повреждения легких, наблюдаемых у пациентов с COVID-19.
Предыдущие исследования показали, что лечение НПВП или ингибирование передачи сигналов рецептора PGE 2 приводит к усилению регуляции ангиотензинпревращающего фермента 2 (ACE2), рецептора входа в клетку для SARS-CoV-2, что вызывает опасения, что НПВП могут повысить восприимчивость к инфекции. .Также было показано, что передача сигналов COX/PGE 2 регулирует репликацию многих вирусов, но пока неизвестно, играет ли она роль в репликации SARS-CoV-2. Целью этого исследования было проанализировать влияние НПВП на COVID-19 с точки зрения проникновения и репликации SARS-CoV-2. Мы обнаружили, что инфекция SARS-CoV-2 индуцирует активацию ЦОГ-2 в различных культурах клеток человека и мышиных системах. Однако подавление передачи сигналов COX-2/PGE 2 двумя обычно используемыми НПВП, ибупрофеном и мелоксикамом, не влияло на экспрессию ACE2 , проникновение вируса или репликацию вируса.Наши результаты показывают, что передача сигналов ЦОГ-2, управляемая SARS-CoV-2, вместо этого может играть роль в регуляции воспаления и повреждения легких, наблюдаемых у пациентов с COVID-19.
Важность: Представители органов здравоохранения выразили обеспокоенность по поводу использования нестероидных противовоспалительных препаратов (НПВП) для лечения симптомов коронавирусной болезни 2019 года (COVID-19), вызванной тяжелым острым респираторным синдромом коронавирус 2 (SARS-CoV-2).Действие НПВП заключается в ингибировании ферментов циклооксигеназы-1 (ЦОГ-1) и циклооксигеназы-2 (ЦОГ-2). Эти ферменты имеют решающее значение для образования простагландинов, липидных молекул, играющих различные роли в поддержании гомеостаза, а также в регуляции воспалительной реакции. Хотя было показано, что сигнальные пути ЦОГ-1/ЦОГ-2 влияют на репликацию многих вирусов, их влияние на инфекцию SARS-CoV-2 остается неизвестным. Мы обнаружили, что инфекция SARS-CoV-2 индуцирует экспрессию ЦОГ-2 как в системах культур клеток человека, так и в моделях на мышах.Однако ингибирование активности ЦОГ-2 с помощью НПВП не влияло на проникновение или репликацию SARS-CoV-2. Наши результаты показывают, что передача сигналов ЦОГ-2 может вместо этого регулировать воспаление легких, наблюдаемое у пациентов с COVID-19, что является важной областью для будущих исследований.
Наши результаты показывают, что передача сигналов ЦОГ-2 может вместо этого регулировать воспаление легких, наблюдаемое у пациентов с COVID-19, что является важной областью для будущих исследований.
Диана Кокс-Фостер, доктор философии. — Кафедра энтомологии
Направления деятельности кафедры
- Экология и биология болезней
- Химическая экология
Научные интересы
Биохимия и физиология насекомых; эволюционное развитие; молекулярная биология; взаимодействия хозяин/патоген
Обучение
Структура и функции насекомых
Биология развития
Молекулярные методы в биологии
Исследовательская деятельность и интересы:
Меня интересует коэволюция насекомых с их патогенами и паразитами и роль иммунной системы насекомых в этом взаимодействии.Мы обнаружили, что клетки крови насекомых производят активные формы кислорода, когда они распознают и инкапсулируют многоклеточных захватчиков в клеточной иммунной защите. Мы внесли уникальный вклад, продемонстрировав, что АФК могут активно генерироваться in vitro после специфического заражения иммуноэлиситорами или патогенами. Мы обнаружили, что уникальный фермент оксидоредуктазы GMC, FAD-глюкозодегидрогеназа (GLD), играет несколько ролей у насекомых; этот фермент необходим как для линьки, так и для клеточного иммунного ответа у дрозофилы.GLD сохраняется у насекомых, что подтверждается гомологией генов, активностью ферментов и иммуногистохимическими реакциями. Моя рабочая гипотеза состоит в том, что линька и иммунные функции имеют общие биохимические механизмы и используют разные механизмы регуляции развития. Наши текущие исследования: (1) характеристика взаимодействия ферментов с использованием анализов переноса электронов и последующего образования свободных радикалов; (2) исследование регуляции экспрессии генов в эпидермисе и иммунной системе; (3) характеристика реакций рецептор/лиганд, участвующих в распознавании патогенов; и (4) изучение межклеточных взаимодействий и сигнальных путей, лежащих в основе этой активации.
Мы внесли уникальный вклад, продемонстрировав, что АФК могут активно генерироваться in vitro после специфического заражения иммуноэлиситорами или патогенами. Мы обнаружили, что уникальный фермент оксидоредуктазы GMC, FAD-глюкозодегидрогеназа (GLD), играет несколько ролей у насекомых; этот фермент необходим как для линьки, так и для клеточного иммунного ответа у дрозофилы.GLD сохраняется у насекомых, что подтверждается гомологией генов, активностью ферментов и иммуногистохимическими реакциями. Моя рабочая гипотеза состоит в том, что линька и иммунные функции имеют общие биохимические механизмы и используют разные механизмы регуляции развития. Наши текущие исследования: (1) характеристика взаимодействия ферментов с использованием анализов переноса электронов и последующего образования свободных радикалов; (2) исследование регуляции экспрессии генов в эпидермисе и иммунной системе; (3) характеристика реакций рецептор/лиганд, участвующих в распознавании патогенов; и (4) изучение межклеточных взаимодействий и сигнальных путей, лежащих в основе этой активации.
Мы изучаем взаимодействие энтомопатогенных нематод и их насекомых-хозяев. У нас есть доказательства, свидетельствующие о коэволюционной битве между иммунной системой насекомых и нематодами. Мы обнаружили, что степень клеточного распознавания нематод во время клеточного иммунного ответа насекомого коррелирует с восприимчивостью/резистентностью насекомого к нематодам. Мы также обнаружили, что нематоды продуцируют антиоксидантные факторы для противодействия АФК, продуцируемым клетками крови насекомых, и предположили, что это может способствовать выживанию нематод.Сообщалось об антиоксидантных факторах у некоторых паразитических нематод, поражающих млекопитающих, но это уникальное открытие для энтомопатогенных нематод. В сотрудничестве с Рэнджи Гоглером, Элизабет Коулз, Ричардом Коулзом и Кристофером Бреем мы выделяем белки поверхностной оболочки и их гены из Steinernema glaseri, которые выбивают иммунную систему личинок японского жука видоспецифическим образом. Мы планируем преобразовать этот ген в Heterorhabditis bacteriophora, энтомопатогенную нематоду, которую можно легко разводить в массовом порядке, чтобы создать более эффективное средство биологической борьбы с личинками японского жука. Мы также изучаем механизм, лежащий в основе подавления иммунной системы жуков, и определяем специфичность этого действия к хозяину. Подобные взаимодействия между насекомыми и нематодами могут лежать в основе специфичности векторов к микрофиляриям.
Мы также изучаем механизм, лежащий в основе подавления иммунной системы жуков, и определяем специфичность этого действия к хозяину. Подобные взаимодействия между насекомыми и нематодами могут лежать в основе специфичности векторов к микрофиляриям.
У медоносных пчел мы исследуем взаимодействие паразитического клеща, РНК-вирусов (вирусы пикорна и дискистронида) и других микробов. У нас есть доказательства того, что паразитические клещи подавляют иммунитет пчел и вызывают активацию вирусов.Нарушаются как клеточные иммунные ответы, так и опосредованный NF-kappaB синтез противомикробных пептидов. Инфекция или присутствие других патогенов также могут стимулировать прогрессирование вирусных заболеваний. Мы начинаем исследовать роль клещей и вирусов в разрушении колоний медоносных пчел в сотрудничестве с Ливанг Цуй и Нэнси Остигай. Наши исследования также выявили новую информацию о путях передачи пикорноподобных вирусов у пчел, устойчивости этих вирусов у пчел и иммунной системе медоносной пчелы. Мы начинаем определять, какие белки присутствуют в слюне клещей, чтобы определить, как клещи подавляют иммунные реакции. В сотрудничестве с Дугом Кавенером и Каори Иидой мы выделили гены нескольких генов, участвующих в иммунитете медоносных пчел.
Мы начинаем определять, какие белки присутствуют в слюне клещей, чтобы определить, как клещи подавляют иммунные реакции. В сотрудничестве с Дугом Кавенером и Каори Иидой мы выделили гены нескольких генов, участвующих в иммунитете медоносных пчел.
Не у всех захватчиков возникает четко выраженный иммунный ответ, как при передаче болезни насекомыми-переносчиками. Понимание механизмов, лежащих в основе коэволюции между переносчиком и болезнетворным организмом, имеет решающее значение для понимания того, как может быть нарушен цикл передачи болезни.Благодаря междисциплинарному сотрудничеству с Drs. F. Gildow (PSU) и S. Gray (Cornell), мы изучаем механизмы, лежащие в основе специфичности вируса/переносчика у тлей в добавочной слюнной железе, первичном месте, определяющем передачу различных видов лютеовирусов. В моей лаборатории мы идентифицировали несколько белков, которые связываются с лютеовирусом векторно-специфическим образом и которые также распознаются антителами, имитирующими вирус. Мы изолируем гены, кодирующие эти белки, для изучения эволюции этих взаимодействий вирус/переносчик среди различных видов тлей и вирусов.Это исследование может способствовать пониманию механизмов, лежащих в основе векторной специфичности комаров к передаче альфавирусов.
Мы изолируем гены, кодирующие эти белки, для изучения эволюции этих взаимодействий вирус/переносчик среди различных видов тлей и вирусов.Это исследование может способствовать пониманию механизмов, лежащих в основе векторной специфичности комаров к передаче альфавирусов.
Соответствующие публикации
Йергер Э., Р. А. Граццини, Д. Хеск, Д. Л. Кокс-Фостер, Р. Крейг, Р. О. Мумма. 1992. Экспресс-метод выделения чистых железистых трихом. Завод Физиол. 99:1-7.
Мумма, Р. О., Р. Крейг, Д. Л. Кокс-Фостер, Дж. Медфорд, Р. Граццини, Э. Йергер, Д. Хеск. 1992. Химия, морфология и генетика устойчивости герани к мелким вредителям.In Actas: I. Simposio Internacional Quimica de Productos Naturales y sus Aplicaciones. (Дж. А. Гарбарино и П. Фидлер, ред.) Division Quimica de Productos Naturales, Sociedad Chilena de Quimica, стр. 45–89.
Zabalgogeazcoa, I., DL Cox-Foster, FE Gildow. 1993. Родословный анализ передачи двухцепочечной РНК у сортов ячменя. Наука о растениях 91:45-53.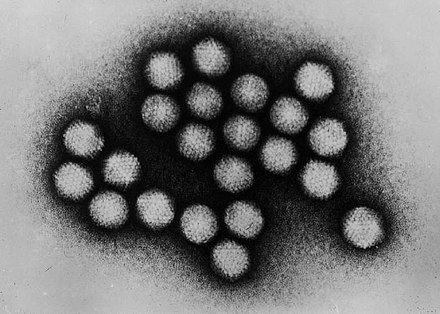
Росситер, М.К., Д.Л. Кокс-Фостер, М.А. Бриггс. 1993. Инициация материнских эффектов у Lymantria dispar: генетические и экологические компоненты образования яиц.Дж. Эвол. биол. 6:577-589.
Мумма, Р. О., Р. Крейг, Д. Л. Кокс-Фостер, Дж. Медфорд, Х. Гроссман, Р. Граццини, Д. Хеск, Д. Уолтерс, Э. Йергер. 1993. Биохимия и генетика устойчивости мелких членистоногих у пеларгоний. В материалах Третьей международной конференции по герани. (Р. Крейг и Дж. Селчау, ред.) Ball Publishing, Женева, Иллинойс. стр. 173-184.
Кокс-Фостер Д. Л., Дж. Э. Стер. 1994. Индукция и локализация FAD-глюкозодегидрогеназы (GLD) во время инкапсуляции абиотических имплантатов у личинок Manduca sexta.J. Физиология насекомых. 40(3):235-250.
Шульц Д. Дж., Р. Крейг, Д. Л. Кокс-Фостер, Р. О. Мумма, Дж. И. Медфорд. 1994. Выделение РНК из рекальцитрантной растительной ткани. Репортер по молекулярной биологии растений 12 (4): 310-316.
Граццини Р., Д. Хеск, Э. Йергер, Д. Л. Кокс-Фостер, Дж.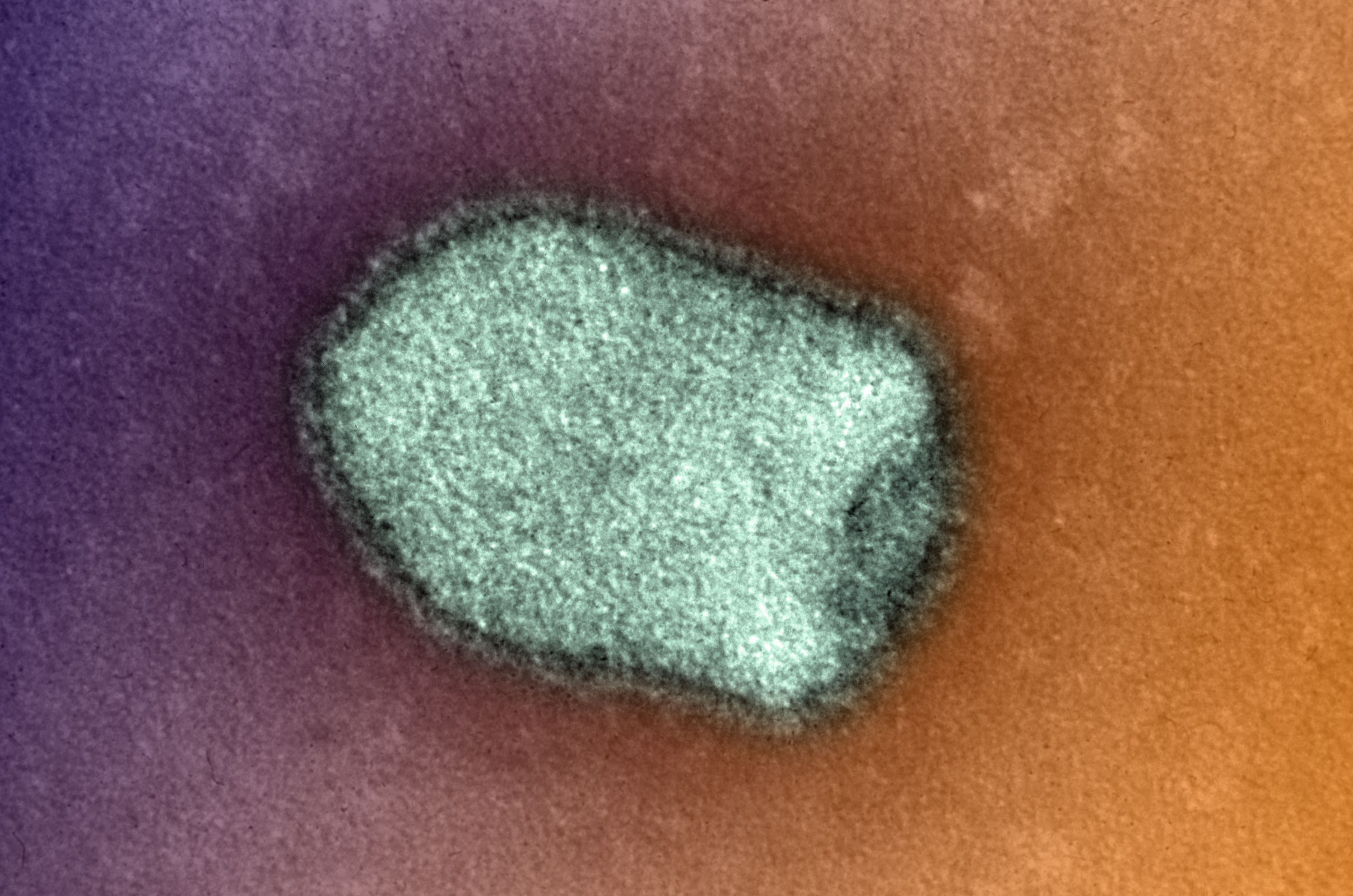 И. Медфорд, Р. Крейг, Р. О. Мумма. 1995. Видовое распределение биохимических и морфологических признаков, связанных с малой устойчивостью к вредителям у Pelargonium Xhortorum. Дж. Амер. соц. Хорт. науч. 120 (2): 336-342.
И. Медфорд, Р. Крейг, Р. О. Мумма. 1995. Видовое распределение биохимических и морфологических признаков, связанных с малой устойчивостью к вредителям у Pelargonium Xhortorum. Дж. Амер. соц. Хорт. науч. 120 (2): 336-342.
Граццини, Р., Д. Хеск, Э. Йергер, Д. Л. Кокс-Фостер, Дж. И. Медфорд, Р. Крейг, Р. О. Мумма. 1995. Распространение анакардиновых кислот, связанных с низкой устойчивостью к вредителям, среди сортов пеларгонии Xhortorum. Дж. Амер. соц. Хорт. науч. 120 (2): 343.
Шульц Д., Дж. Шанклин, Р. Крейг, Д. Л. Кокс-Фостер, Р. О. Мумма и Дж. И. Медфорд. 1996 г. Экспрессия дельта-9 14:0-ацил-переносящего гена десатуразы жирных кислот необходима для производства омега-5 анакардиновых кислот, обнаруженных в устойчивой к вредителям герани (Pelargonium xhortorum).Proc., Национальная академия наук 93 (16): 8771.
Росситер, М.С., Д.Л. Кокс-Фостер, М.М. Абу-Заид и Д. Бержерон. Нерастворимость яичного белка у Lymantria dispar по сравнению с другими лесными чешуекрылыми. Химиоэкология, (В печати).
Химиоэкология, (В печати).
Коксиеллез / Ку-лихорадка |
обновлено в ноябре 2020 г.
Руководство по коксиеллезу/ку-лихорадке у кошек впервые было опубликовано в J Feline Med Surg 2013; 15: 573-575; это обновление было подготовлено Германом Эгберинком.
Ключевые точки
Ку-лихорадка является зоонозным заболеванием, вызываемым Coxiella burnetii . Сельскохозяйственные и домашние животные являются основными резервуарами инфекции.
Заражение кошек Coxiella burnetii происходит часто, как показывают исследования серопревалентности.
Кошки заражаются при укусах клещей или при контакте с сельскохозяйственными животными, при проглатывании или вдыхании бактерий.
Болезнь у кошек обычно протекает субклинически; может произойти аборт. Coxiella burnetii был выделен из плаценты абортированных кошек, а также от кошек, у которых были нормальные роды.
После экспериментального заражения у кошек развивается лихорадка, анорексия и вялость.
Инфекция C. burnetii может быть диагностирована путем выделения возбудителя или серологическим исследованием.
Coxiella burnetii вызывает Ку-лихорадку у человека.
Кошки считаются источником инфекции для людей, в частности, в результате контакта с бактериями, выделяемыми во время аборта или родов. Ношение перчаток и маски при уходе за рожавшей или прервавшей беременность кошкой может свести к минимуму риск заражения. Рекомендуется профилактика клещей.
Бактериальные свойства
Coxiella burnetii представляет собой грамотрицательную облигатную внутриклеточную маленькую плеоморфную бактерию, относящуюся к отряду Legionellales .Этот организм имеет сложный жизненный цикл с разными морфологическими стадиями. Это может происходить как мелкоклеточный вариант, так и крупноклеточный вариант. Мелкоклеточный вариант представляет собой устойчивую спороподобную форму, способную длительное время выживать в окружающей среде, будучи устойчивой к различным средствам химической и физической инактивации (Angelakis, Raoult, 2010).
Это может происходить как мелкоклеточный вариант, так и крупноклеточный вариант. Мелкоклеточный вариант представляет собой устойчивую спороподобную форму, способную длительное время выживать в окружающей среде, будучи устойчивой к различным средствам химической и физической инактивации (Angelakis, Raoult, 2010).
Эпидемиология и патогенез
Многие виды млекопитающих, птиц и клещей могут быть инфицированы C.Бернетии . Однако наиболее распространенными резервуарами являются крупный рогатый скот, овцы и козы. Поскольку бактерия обладает тропностью к матке и молочной железе, плацента и плодные оболочки могут быть сильно контаминированы. Загрязненные аэрозоли плодных оболочек, мочи, фекалий или молока инфицированных животных считаются основным резервуаром инфекции для человека. Особенно во время родов выделяется большое количество бактерий, тем самым загрязняя окружающую среду.
Кошки также могут заразиться через укусы клещей, проглатывание зараженных трупов или после воздействия аэрозолей, и они считаются источником инфекции для людей (Kosatsky, 1984; Langley et al. , 1988; Марри и др., 1988а; 1988б; 1989). ДНК C.burnetii также была обнаружена в сыром мясе кенгуру, предназначенном для употребления в пищу домашними животными (Shapiro et al., 2020). Потенциальная роль некоторых видов сырого мяса в передаче инфекции кошкам и людям требует дальнейшего изучения. Как показали серологические исследования, контакт с кошками встречается довольно часто (Higgins and Marrie, 1990; Htwe et al., 1992; Matthewman et al., 1997; Komiya et al., 2003). В этих исследованиях результаты варьируются от 2 до 19% кошек, которые являются серопозитивными.В исследовании, проведенном в Великобритании, была продемонстрирована серопревалентность 61,5% (Meredith et al., 2014). В одном исследовании был продемонстрирован значительно более высокий уровень положительных результатов на антитела у бездомных кошек (41,7%) по сравнению с домашними кошками (14,2%) (Komiya et al., 2003). Различия в серопревалентности, обнаруженные в этих исследованиях, возможно, связаны с различиями в изучаемых популяциях, но свою роль может играть отсутствие стандартизированных серологических методов (Cicutin, 2017).
, 1988; Марри и др., 1988а; 1988б; 1989). ДНК C.burnetii также была обнаружена в сыром мясе кенгуру, предназначенном для употребления в пищу домашними животными (Shapiro et al., 2020). Потенциальная роль некоторых видов сырого мяса в передаче инфекции кошкам и людям требует дальнейшего изучения. Как показали серологические исследования, контакт с кошками встречается довольно часто (Higgins and Marrie, 1990; Htwe et al., 1992; Matthewman et al., 1997; Komiya et al., 2003). В этих исследованиях результаты варьируются от 2 до 19% кошек, которые являются серопозитивными.В исследовании, проведенном в Великобритании, была продемонстрирована серопревалентность 61,5% (Meredith et al., 2014). В одном исследовании был продемонстрирован значительно более высокий уровень положительных результатов на антитела у бездомных кошек (41,7%) по сравнению с домашними кошками (14,2%) (Komiya et al., 2003). Различия в серопревалентности, обнаруженные в этих исследованиях, возможно, связаны с различиями в изучаемых популяциях, но свою роль может играть отсутствие стандартизированных серологических методов (Cicutin, 2017). Инфекция также была продемонстрирована у свободноживущих европейских диких кошек (Candela et al., 2017).
Инфекция также была продемонстрирована у свободноживущих европейских диких кошек (Candela et al., 2017).
В исследовании распространенности ДНК C. burnetii в образцах влагалища и матки здоровых кошек из приюта или принадлежащих клиентам, 4 из 47 биопсий матки оказались положительными с помощью ПЦР (Cairns et al., 2007). В другом исследовании 2 из 26 тканей матки здоровых кошек и 1 из 11 кошек с репродуктивными аномалиями были положительными с помощью ПЦР (Fujishiro et al., 2015). Как и у сельскохозяйственных животных, C. burnetii колонизирует плаценту инфицированных кошек во время беременности в большом количестве, и его можно культивировать из матки кошек в течение 10 недель после родов (Higgins and Marrie, 1990).После экспериментального заражения C. burnetii культивировали в течение 2 месяцев из мочи инфицированных кошек (Greene, 2012).
Были опубликованы исследования, указывающие на связь между Ку-лихорадочной пневмонией у людей после контакта с плацентой и амниотической жидкостью абортированных или внешне здоровых кошек (Kosatsky, 1984; Langley et al. , 1988; Marrie et al., 1988a; Pinsky et al. , 1991; Мало и др., 2018). В исследовании случай-контроль, проведенном Maritime Canada, было выявлено несколько факторов риска развития Ку-лихорадки у людей.Самая сильная связь была с контактом с мертворожденными котятами и рожавшими кошками (Marrie et al., 1988b). Результаты большого опроса австралийских заводчиков кошек подтверждают предположение о том, что заводчики кошек входят в группу риска заражения Ку-лихорадкой (Shapiro et al., 2017). Были выявлены методы животноводства, которые могут увеличить риск заражения: кормление сырым мясом и обращение с ним, роды дома в живой среде и помощь, оказываемая во время родов (например, реанимация изо рта в рот).Во время вспышки в приюте для животных и ветеринарной клинике на юго-востоке Квинсленда наиболее вероятным источником инфекции была признана роженица (Malo et al., 2018). Вспышка Ку-лихорадки среди персонала ветеринарной больницы была связана с кесаревым сечением беременной матки.
, 1988; Marrie et al., 1988a; Pinsky et al. , 1991; Мало и др., 2018). В исследовании случай-контроль, проведенном Maritime Canada, было выявлено несколько факторов риска развития Ку-лихорадки у людей.Самая сильная связь была с контактом с мертворожденными котятами и рожавшими кошками (Marrie et al., 1988b). Результаты большого опроса австралийских заводчиков кошек подтверждают предположение о том, что заводчики кошек входят в группу риска заражения Ку-лихорадкой (Shapiro et al., 2017). Были выявлены методы животноводства, которые могут увеличить риск заражения: кормление сырым мясом и обращение с ним, роды дома в живой среде и помощь, оказываемая во время родов (например, реанимация изо рта в рот).Во время вспышки в приюте для животных и ветеринарной клинике на юго-востоке Квинсленда наиболее вероятным источником инфекции была признана роженица (Malo et al., 2018). Вспышка Ку-лихорадки среди персонала ветеринарной больницы была связана с кесаревым сечением беременной матки. Племенная матка показала сильную серопозитивность в отношении C. burnetii , а антитела, указывающие на недавнюю или перенесенную инфекцию, были продемонстрированы у 26% кошек, живущих в том же питомнике (Kopecny et al., 2013). В серологическом исследовании четырех различных субпопуляций кошек серопревалентность была самой высокой у кошек, размножающихся в питомнике (Shapiro et al., 2015). В этой популяции 9,3% кошек были серопозитивными по сравнению с 1% домашних кошек и 0% в популяциях диких и приютских кошек. Сероэпидемиологическое исследование среди ветеринаров США не показало связи контакта с кошками с серопозитивностью к C. burnetii (Whitney et al., 2009). В этом исследовании факторы риска, связанные с серопозитивностью, включали возраст старше 46 лет, регулярный контакт с прудами и лечение крупного рогатого скота, свиней и диких животных. В другом исследовании не было обнаружено связи между владением кошкой и собакой и повышенной частотой серопозитивных реакций на C.
Племенная матка показала сильную серопозитивность в отношении C. burnetii , а антитела, указывающие на недавнюю или перенесенную инфекцию, были продемонстрированы у 26% кошек, живущих в том же питомнике (Kopecny et al., 2013). В серологическом исследовании четырех различных субпопуляций кошек серопревалентность была самой высокой у кошек, размножающихся в питомнике (Shapiro et al., 2015). В этой популяции 9,3% кошек были серопозитивными по сравнению с 1% домашних кошек и 0% в популяциях диких и приютских кошек. Сероэпидемиологическое исследование среди ветеринаров США не показало связи контакта с кошками с серопозитивностью к C. burnetii (Whitney et al., 2009). В этом исследовании факторы риска, связанные с серопозитивностью, включали возраст старше 46 лет, регулярный контакт с прудами и лечение крупного рогатого скота, свиней и диких животных. В другом исследовании не было обнаружено связи между владением кошкой и собакой и повышенной частотой серопозитивных реакций на C. burnetii (Skerget et al., 2003).
burnetii (Skerget et al., 2003).
В заключение следует отметить, что рожавших кошек следует рассматривать как потенциальный источник инфекции. Однако сельскохозяйственные животные на сегодняшний день являются наиболее важным источником инфекции для человека.
Клинические признаки у кошек
У животных болезнь обычно протекает субклинически, но возможен аборт. У экспериментально инфицированных кошек отмечают лихорадку, анорексию и вялость. Клинические признаки появились через 2 дня после инокуляции и продолжались 3 дня (Greene, 2012).
Диагностика
У людей точный диагноз Ку-лихорадки основывается на серологических исследованиях и выделении микроорганизма. Диагностическим считается четырехкратное увеличение парных проб сыворотки. Организм показывает фазовые изменения в ходе инфекции. Для установления стадии инфекции можно определить антитела к антигенам фазы I и II. При острой инфекции титры антител к антигенам фазы II значительно выше, чем к антигенам фазы I. ПЦР и иммуногистохимия использовались на образцах тканей пациентов. Подобные методы могут быть использованы у кошек, но лабораторная диагностика обычно не проводится.
ПЦР и иммуногистохимия использовались на образцах тканей пациентов. Подобные методы могут быть использованы у кошек, но лабораторная диагностика обычно не проводится.
Лечение
Если диагноз был установлен у кошки с клиническими признаками, можно использовать тетрациклины, такие как пероральный доксициклин в дозе 10 мг/кг каждые 24 часа в течение 2 недель (Greene, 2012).
Профилактика
Хищничество и контакт с эктопаразитами подвергают кошку риску заражения, поэтому рекомендуется профилактика клещей (см. руководство ESCCAP 03, июнь 2018 г.; Борьба с эктопаразитами у собак и кошек; ESCCAP, 2018 г.).Вакцин для кошек нет.
Зоонозный риск
Кошки, инфицированные C. burnetii в результате контакта с инфицированными сельскохозяйственными животными или недавнего заражения клещами, могут выделять бактерии во время родов.
У человека инфекция C. burnetii часто протекает бессимптомно (60%), но могут развиваться острые и хронические формы заболевания (Angelakis and Raoult, 2010). Острое заболевание часто протекает в легкой форме с лихорадкой, головной болью, миалгией и спонтанным выздоровлением (Caron et al., 1998). Однако могут возникнуть признаки пневмонии, гепатита и аборта, а также более серьезные осложнения, особенно менингоэнцефалит, сепсис и миокардит с последующей смертью больного. Хроническое заболевание через много месяцев или лет после сообщения о заражении. Хроническая форма в основном характеризуется эндокардитом и встречается почти исключительно у пациентов с предрасполагающими условиями (Fenollar et al., 2001).
burnetii часто протекает бессимптомно (60%), но могут развиваться острые и хронические формы заболевания (Angelakis and Raoult, 2010). Острое заболевание часто протекает в легкой форме с лихорадкой, головной болью, миалгией и спонтанным выздоровлением (Caron et al., 1998). Однако могут возникнуть признаки пневмонии, гепатита и аборта, а также более серьезные осложнения, особенно менингоэнцефалит, сепсис и миокардит с последующей смертью больного. Хроническое заболевание через много месяцев или лет после сообщения о заражении. Хроническая форма в основном характеризуется эндокардитом и встречается почти исключительно у пациентов с предрасполагающими условиями (Fenollar et al., 2001).
Чтобы свести к минимуму зоонозный риск, при уходе за беременными или прерванными кошками следует надевать перчатки, защитные очки и рукава.Роды в специально отведенных для родов условиях (а не рядом с людьми или в среде проживания людей) снизят риск передачи инфекции. В Австралии была предложена вакцинация против Q-лихорадки восприимчивых лиц, имеющих профессиональный или регулярный контакт с рожавшими кошками (Malo et al. , 2018).
, 2018).
Подтверждение
ABCD Europe выражает благодарность компании Boehringer Ingelheim (основателю-спонсору ABCD) и Virbac за поддержку.
Каталожные номера
Ангелакис Э., Рауль Д. (2010): Ку-лихорадка. Vet Microbiol 140 (3-4), 297-309.
Кэрнс К., Брюэр М., Лаппин М.Р. (2007): Распространенность ДНК Coxiella burnetii в образцах влагалища и матки здоровых кошек из северо-центральной части Колорадо. J Feline Med Surg 9, 196-201.
Candela MG, Caballol A, Atance PM (2017): Широкое воздействие Coxiella burnetii на виды жвачных и кошачьих, живущих в естественной среде: зоонозы при взаимодействии человека, домашнего скота и дикой природы.Epidemiol Infect 145(3), 478–481.
Caron F, Meurice JC, Ingrand P, Bourgoin A, Masson P, Roblot P и др. (1998): Острая Ку-лихорадочная пневмония: обзор 80 госпитализированных пациентов. Сундук 114(3), 808-813.
Cicutin GL (2017): Ку-лихорадка у собак и кошек. В: João Carlos Caetano Simões et al (Eds.): Принципы и практика Ку-лихорадки, Единая парадигма здоровья. Издательство Nova Science, Нью-Йорк.
ESCCAP – Европейский научный совет по паразитам животных-компаньонов.Борьба с эктопаразитами у собак и кошек. https://www.esccap.org/page/GL3+Control+of+Ectoparasites+in+Dogs+and+Cats/27/ (июнь 2018 г.).
Fenollar F, Fournier PE, Carrieri MP, Habib G, Messana T, Raoult D (2001): Факторы риска и профилактика эндокардита Ку-лихорадки. Clin Infect Dis 33(3), 312-316.
Fujishiro MA, Scorza AV, Gookin JL, Lappin MR (2015): Оценка ассоциации между Coxiella burnetii и репродуктивными аномалиями у кошек. J Feline Med Surg 18(4), 344-347.
Greene CE (2012 г.): Францицелла и Ку-лихорадка. В: CE Greene (Ed.): Infectious Diseases of the Dog and Cat. Эльзевир Сондерс, Сент-Луис, 482–484.
Higgins D, Marrie TJ (1990): Сероэпидемиология Ку-лихорадки среди кошек в Нью-Брансуике и на острове Принца Эдуарда. Ann NY Acad Sci 590, 271-274.
Ann NY Acad Sci 590, 271-274.
Htwe KK, Amano K, Sugiyama Y, Yagami K, Minamoto N, Hashimoto A и др. (1992): Сероэпидемиология Coxiella burnetii у домашних и домашних животных в Японии.Ветеринарная рекомендация 131 (21), 490.
Komiya T, Sadamasu K, Kang MI, Tsuboshima S, Fukushi H, Hirai K (2003): Распространенность инфекции Coxiella burnetii среди кошек в различных условиях жизни. J Vet Med Sci 65(9), 1047-1048.
Копекни Л., Босвард К.Л., Шапиро А., Норрис Дж.М. (2013): Исследование инфекции Coxiella burnetii в племенном питомнике в центре вспышки Ку-лихорадки. J Feline Med Surg 15, 1037-1045.
Kosatsky T (1984): Бытовая вспышка Q-лихорадочной пневмонии, связанная с роженицей кошки.Ланцет 2 (8417-8418), 1447-1449.
Langley JM, Marrie TJ, Covert A, Waag DM, Williams JC (1988): Пневмония игроков в покер. Вспышка Ку-лихорадки в городе после контакта с рожавшей кошкой. N Engl J Med 319(6), 354-356.
Malo JA, Colbrab C, Young M, Vasant B, Jarvinen K, Viney K, Lambert SB (2018): Вспышка Ку-лихорадки, связанная с контактом с рожавшей кошкой в приюте для животных и ветеринарной клинике на юго-востоке Квинсленда. Австралийский и новозеландский журнал общественного здравоохранения 42(5), 451-455.
Marrie TJ, Durant H, Williams JC, Mintz E, Waag DM (1988b): Контакт с беременными кошками: фактор риска заражения Ку-лихорадкой в Приморской Канаде. J Infect Dis 158(1), 101-108.
Marrie TJ, Langille D, Papukna V, Yates L (1989): Truckin’ pneumonia — вспышка Ку-лихорадки на заводе по ремонту грузовиков, вероятно, из-за аэрозолей с одежды, зараженной контактом с новорожденными котятами. Эпидемиол Инфект 102(1), 119-127.
Marrie TJ, MacDonald A, Durant H, Yates L, McCormick L (1988a): Вспышка Ку-лихорадки, вероятно, из-за контакта с рожавшей кошкой.Грудь 93(1), 98-103.
Мэтьюмен Л. , Келли П., Хейтер Д., Дауни С., Рэй К., Брайсон Н. и др. (1997): Воздействие на кошек на юге Африки Coxiella burnetii, возбудителя Ку-лихорадки. Eur J Epidemiol 13(4), 477-479.
, Келли П., Хейтер Д., Дауни С., Рэй К., Брайсон Н. и др. (1997): Воздействие на кошек на юге Африки Coxiella burnetii, возбудителя Ку-лихорадки. Eur J Epidemiol 13(4), 477-479.
Meredith AL, Cleaveland SC, Denwood MJ, Brown JK, Shaw DJ (2014): Серораспространенность Coxiella burnetii (Q-Fever) у жертв и хищников в Соединенном Королевстве: Оценка инфекции у диких грызунов, лисиц и домашних кошек с использованием модифицированного ИФА.Трансграничные и возникающие болезни. DOI: 10.1111/tbed.12211.
Пинский Р.Л., Фишбейн Д.Б., Грин К.Р., Генсхаймер К.Ф. (1991): Вспышка кошачьей лихорадки Ку в Соединенных Штатах. J Infect Dis 164 (1), 202-204.
Шапиро А.Дж., Босвард К.Л., Хеллер Дж., Норрис Дж.М. (2015): Серопревалентность Coxiella burnetii у домашних и диких кошек в восточной Австралии. Vet Microbiol 177(1-2), 154-161.
Шапиро А.Дж., Норрис Дж.М., Босвард К.Л., Хеллер Дж. (2017): Ку-лихорадка (Coxiella burnetii) Знание и отношение австралийских заводчиков кошек и их практика содержания. Зоонозы Общественное здравоохранение 64(4), 252-261.
Зоонозы Общественное здравоохранение 64(4), 252-261.
Шапиро, А., Босвард, К., Мэтьюз, К., Винсент, Г., Стенос, Дж., Тадепалли, М., и Норрис, Дж. (2020). Молекулярное обнаружение coxiella burnetii в сыром мясе, предназначенном для употребления в пищу домашними животными. Зоонозы и общественное здравоохранение, 67 (4), 443–452. doi: https://doi.org/10.1111/zph.12707
Skerget M, Wenisch C, Daxboeck F, Krause R, Haberl R, Stuenzner D (2003): Владение кошкой или собакой и серопревалентность эрлихиоза, Ку-лихорадки и болезни кошачьей царапины.Emerg Infect Dis 9(10), 1337-1340.
Whitney EA, Massung RF, Candee AJ, Ailes EC, Myers LM, Patterson NE, et al (2009): Исследование сероэпидемиологических и профессиональных рисков антител к Coxiella burnetii среди ветеринаров США. Clin Infect Dis 48(5), 550-557.
S. pneumoniae pneumoniae | 29 | аденовирус | 10 | S. pneumoniae + Аденовирус | 5 |
| Кишечная палочка | 3 | Вирус гриппа А | 9 | S. pneumoniae + Риновирус | 6 |
| Легионелла пневмофила | 4 | Риновирус | 9 | S. pneumoniae + Грипп A pneumoniae + Грипп A | 4 |
| САРМ | 3 | Коронавирус | 7 | S. pneumoniae + Метапневмовирус | 2 |
| H гриппа | 2 | РСВ-А | 3 | S. pneumoniae + Грипп B pneumoniae + Грипп B | 1 |
| Corynebacterium striatum | 2 | РСВ-Б | 1 | S pneumoniae + Moraxella catarrhalis + Вирус гриппа А | 1 |
| Серратия marcescens | 1 | Вирус гриппа В | 1 | S. pneumoniae + S. aureus + Аденовирус pneumoniae + S. aureus + Аденовирус | 1 |
| Моракселла катаралис | 1 | Метапневмовирус | 1 | S pneumoniae + H influenzae + Аденовирус + Риновирус + Вирус Кокса | 1 |
| Alcaligenes xylosoxidans | 1 | Вирус гриппа А + Вирус гриппа В | 2 | S. | 1 |
| Enterobacter cloacae | 1 | Вирус гриппа А + Парагрипп 1 | 1 | S. pneumoniae + Риновирус + Вирус Кокса | 2 |
| S. pneumoniae + H. influenzae | 2 | Вирус гриппа A + RSV-A | 1 | S. pneumoniae + Риновирус + h2N1 pneumoniae + Риновирус + h2N1 | 1 |
| S. pneumoniae + S. aureus | 2 | Вирус гриппа A + h2N1 | 1 | S. pneumoniae + Аденовирус + Коронавирус | 1 |
| S. pneumoniae + P. aeruginosa | 1 | Вирус гриппа А + Коронавирус | 1 | S pneumoniae + Вирус гриппа A + Парагрипп 4 | 1 |
P. aeruginosa + Легионелла aeruginosa + Легионелла | 1 | Вирус гриппа А + Риновирус | 1 | S pneumoniae + Вирус гриппа A + RSVA | 1 |
| P aeruginosa + C полосатое тело | 1 | Вирус гриппа А + Аденовирус | 1 | S pneumoniae + Вирус гриппа А + Коронавирус | 1 |
| P aeruginosa + S marcescens + H influenzae | 1 | Вирус гриппа А + RSV + метапневмовирус | 2 | S. pneumoniae + Риновирус + Коронавирус + Энтеровирус pneumoniae + Риновирус + Коронавирус + Энтеровирус | 1 |
| E coli + Corynebacterium striatum + A baumannii | 1 | Вирус гриппа А + RSV + V.грипп В | 1 | S pneumoniae + Коронавирус + Грипп v.A + Грипп v.B + RSV | 1 |
| E coli + Achromobacter xylosoxidans | 1 | Аденовирус + RSV-A | 1 | S. pneumoniae + RSVB pneumoniae + RSVB | 2 |
| S. aureus + Enterococcus faecium | 1 | Аденовирус + Парагрипп 3 | 1 | H influenzae + Парагрипп 3 | 1 |
| S. aureus + Pasteurella multocida | 1 | Аденовирус + Риновирус | 1 | H influenzae + Аденовирус + h2N1 | 1 |
| Аденовирус + Коронавирус | 1 | H influenzae + Аденовирус + Риновирус | 1 | ||
| Аденовирус + Вирус гриппа B + RSV | 1 | H influenzae + Риновирус + RSVA | 1 | ||
| Аденовирус + Энтеровирус + Коронавирус | 1 | P aeruginosa + h2N1 | 1 | ||
| Риновирус + Вирус гриппа B | 1 | P aeruginosa + Риновирус | 1 | ||
| Риновирус + Вирус Кокса | 3 | P aeruginosa + RSVA + Коронавирус | 1 | ||
| Коронавирус + RSV-A | 2 | P aeruginosa + RSVB | 1 | ||
| Парагрипп 1 + h2N1 | 1 | E coli + Вирус гриппа B + Риновирус | 1 | ||
| Вирус Кокса + Энтеровирус | 1 | E coli + Вирус гриппа A + RSV | 1 | ||
| Moraxella catarrhalis + Коронавирус | 1 | ||||
| Corynebacterium striatum + Метапневмовирус | 1 | ||||
| Stenotrophomonas maltophilia + Аденовирус | 1 | ||||
| ВСЕГО | 59 | ВСЕГО | 66 | ВСЕГО | 46 |
Breakingviews — Кокс: Отлив вируса выявляет лучших лидеров
ЦЮРИХ (Reuters Breakingviews) — Люди мало что знают о Закари Тейлоре. 12-й президент Америки продержался у власти 16 месяцев, прежде чем умер от желудочно-кишечного расстройства после того, как съел вишни 4 июля 1850 года. Но он был первым неполитиком, занявшим Овальный кабинет или какую бы форму он ни принимал в то время. Только что зарекомендовавший себя героем в мексикано-американской войне партия вигов выдвинула Тейлора в качестве своего кандидата, и он победил на выборах — первых, которые должны состояться во вторник по всей стране — отмеченных разногласиями, которые были бы знакомы сегодня.
12-й президент Америки продержался у власти 16 месяцев, прежде чем умер от желудочно-кишечного расстройства после того, как съел вишни 4 июля 1850 года. Но он был первым неполитиком, занявшим Овальный кабинет или какую бы форму он ни принимал в то время. Только что зарекомендовавший себя героем в мексикано-американской войне партия вигов выдвинула Тейлора в качестве своего кандидата, и он победил на выборах — первых, которые должны состояться во вторник по всей стране — отмеченных разногласиями, которые были бы знакомы сегодня.
Президент США Дональд Трамп отвечает на вопросы, пока вице-президент Майк Пенс слушает во время ежедневного брифинга целевой группы по коронавирусу в Белом доме в Вашингтоне, США, 25 марта 2020 года. один из многих лидеров военного времени, вырвавшихся из водоворота американской политики и ставших главнокомандующими, несмотря на то, что ранее он мало или совсем не интересовался этой профессией. Джордж Вашингтон, возможно, был первым, но были и другие, такие как Улисс Грант и Дуайт Эйзенхауэр. Эндрю Джексон и Теодор Рузвельт уже были политиками, но их победы на полях сражений сделали их полноценными звездами. Дело в том, что новые и часто неожиданные лидеры, как правило, появляются из военного времени.
Эндрю Джексон и Теодор Рузвельт уже были политиками, но их победы на полях сражений сделали их полноценными звездами. Дело в том, что новые и часто неожиданные лидеры, как правило, появляются из военного времени.
Что подводит нас к текущей битве с коронавирусом. Лидерство снова пересматривается. Некомпетентные разоблачаются насквозь отливающей вирусом волной. Но таковы и смелые мужчины и женщины в наших сообществах, компаниях, больницах, школах, центральных банках, молитвенных домах и, да, выборных должностях, которые борются с этим экзистенциальным бедствием с состраданием, эффективностью и моральной целью.Таким образом, должностные инструкции для всех видов ролей, не в последнюю очередь президента Соединенных Штатов, переписываются в режиме реального времени.
Появляются новые впечатляющие опции, соответствующие историческим прецедентам. Американское президентство — самый очевидный пример. Всего за неделю виртуальной блокировки стала очевидной неспособность Дональда Трампа справиться с кризисом с успокаивающим апломбом. Но не потому, что его бывший соперник на пост президента, бывший вице-президент Джо Байден, взял на себя ответственность.Несомненно, кандидат от Демократической партии давал показания государственного деятеля из телесуфлера у себя дома, но он просто не имеет отношения к реагированию на кризис. Вместо этого губернаторы Нью-Йорка и Калифорнии, такие как Эндрю Куомо или Гэвин Ньюсом, воспользовались этой брешью.
Но не потому, что его бывший соперник на пост президента, бывший вице-президент Джо Байден, взял на себя ответственность.Несомненно, кандидат от Демократической партии давал показания государственного деятеля из телесуфлера у себя дома, но он просто не имеет отношения к реагированию на кризис. Вместо этого губернаторы Нью-Йорка и Калифорнии, такие как Эндрю Куомо или Гэвин Ньюсом, воспользовались этой брешью.
Та же динамика проявляется и за пределами американских политических скачек. В корпоративном контексте каждый сотрудник, бездельничающий дома, беспокоящийся о своей следующей зарплате или своих пенсионных сбережениях, анализирует сообщения всей компании на предмет любых намеков на предстоящие увольнения.Будут помнить руководителей, которые проявляют настоящую стойкость, сопротивляясь искушению преждевременно реагировать на спад, и которым удается сохранять спокойствие и продуктивность сотрудников. Но многие из них не справятся с новыми вызовами, вызванными экономическим шоком, вызванным Covid-19.
Генеральный директор, строящий империю, привыкший использовать легкие кредиты и постоянно растущие цены на акции для приобретения конкурирующих компаний и снижения их затрат, может больше не подходить. Инвесторы-активисты, склонные к резким письмам, призывающим советы директоров занимать деньги и выкупать акции, сочтут посткоронавирусную среду враждебной.Прежде всего, начальники будут нуждаться в сострадании, поскольку теперь бедные сотрудники выздоравливают от вируса или оплакивают близких, которым повезло меньше. Эксперты по реструктуризации тоже получат свой день, ссорясь с кредиторами, поставщиками и юристами за снисходительность и многое другое.
Такие больницы, как Humanitas Gavazzeni в пораженном вирусом городе Бергамо на севере Италии, уже выпускают новых руководителей. Хотя мы, возможно, еще не знаем всех их имен, мы расскажем истории врачей и медсестер, работающих круглосуточно, часто с большим личным риском для своего здоровья и здоровья своих семей.Каждый час они принимают решения о сортировке, фактически выбирая, кому жить, а кому умереть. Может ли быть большее испытание на решительность и нервы?
Может ли быть большее испытание на решительность и нервы?
Британская национальная служба здравоохранения будет иметь на выбор своих отличников, в том числе некоторых из более чем 500 000 человек, которые вызвались добровольцами в течение нескольких часов после призыва о помощи на этой неделе. В каждой больнице, борющейся с этой болезнью, появится кто-то новый. То же самое и в школах, где учителям, не привыкшим к обучению через Zoom или электронную почту, придется осваивать новые навыки.Директора, привыкшие ходить по коридорам, должны будут выглядеть по-другому. Некоторым это не удастся, а другие проявят себя, чтобы завтра стать директорами школ.
Что возвращает нас к большой работе американского президента. Кое-кто в его кабинете отодвинул Трампа на задний план. По сравнению с некоторыми из его замечаний, которые особенно беспокоили инвесторов фондового рынка, высказывания его вице-президента Майка Пенса были более успокаивающими. Прямой разговор Энтони Фаучи, главного национального эксперта по инфекционным заболеваниям, и координатора по реагированию на коронавирус Деборы Биркс сделал их пандемическими знаменитостями по обе стороны прохода.
Одно можно сказать наверняка: после недель, а то и месяцев изоляции, увольнений и сокращения собственного капитала взгляды американцев на то, какого лидера они хотят видеть у руля, не будут такими, как сегодня. Трамп уже кажется не тем человеком в неподходящее время. Байден, хотя он и может проявлять большее сочувствие, может не соответствовать новым требованиям, которые электорат потребует от следующего президента. И кто может сказать, что смертоносный выбор Covid-19 людей старше 60 лет в качестве своих основных жертв не повлияет через несколько месяцев на общие представления о мудрости назначения людей в возрасте за семьдесят на самые важные руководящие должности в обществе?
После того, как острая фаза вируса пройдет, лидерство будет переоценено на всех уровнях цивилизации — от президента и премьера до корпораций, школ, больниц и мэрий.Предыдущие представления о том, что когда-то требовалось резюме, покажутся устаревшими. С каким боссом было веселее всего выпить пива, надеюсь, он станет смехотворным стандартом.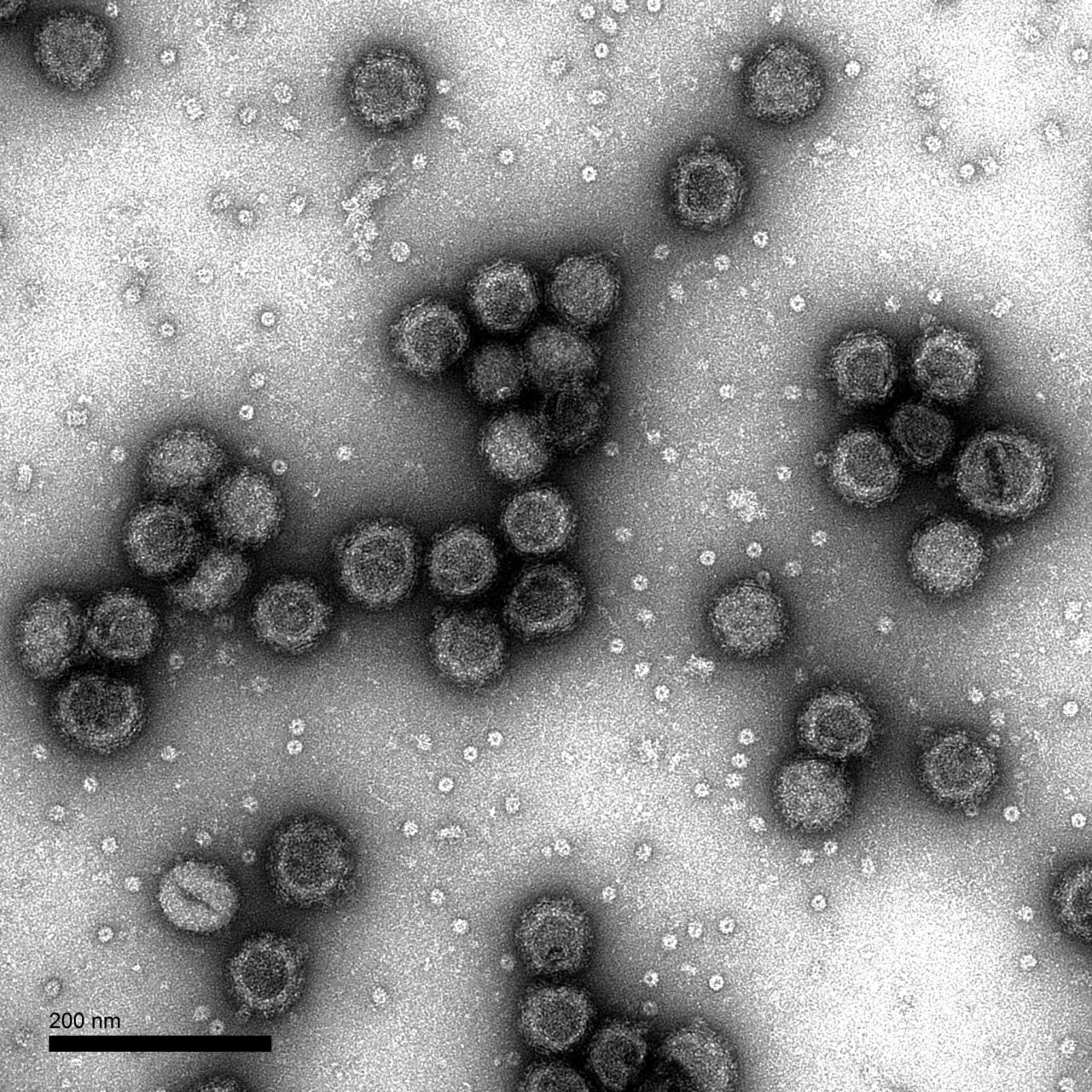 У кого было больше всего делегатов на первичных выборах штата — сам по себе съезд, от которого можно отказаться в исключительных обстоятельствах — будет запоздалой мыслью. Единственное, что будет иметь значение, это то, кто подошел к коронавирусу и победил.
У кого было больше всего делегатов на первичных выборах штата — сам по себе съезд, от которого можно отказаться в исключительных обстоятельствах — будет запоздалой мыслью. Единственное, что будет иметь значение, это то, кто подошел к коронавирусу и победил.
Breakingviews
Reuters Breakingviews — ведущий в мире источник финансовой информации, определяющей повестку дня.Как бренд Reuters для финансовых комментариев, мы анализируем новости большого бизнеса и экономики по мере того, как они появляются по всему миру каждый день. Глобальная команда из примерно 30 корреспондентов в Нью-Йорке, Лондоне, Гонконге и других крупных городах предоставляет экспертный анализ в режиме реального времени.
Подпишитесь на бесплатную пробную версию нашего полного спектра услуг на https://www.breakingviews.com/trial и следите за нами в Твиттере @Breakingviews и на www.breakingviews.com. Все высказанные мнения принадлежат авторам.
Продукты RealCycler
Бета-лактамазы типа AmpC: blaACC + blaEBC / blaCIT + blaDHA
Арт. : AMPC-U, AMPC-G, AMPC-UX, AMPC-GX
: AMPC-U, AMPC-G, AMPC-UX, AMPC-GX
blaCTX-M1 + blaCTX-M2 + blaCTX-M9
Код: BLACTX-U, BLACTX-G
Бета-лактамазы типа AmpC: blaCIT + blaDHA
Ref.: CIDH-U, CIDH-G, CIDH-UX, CIDH-GX
ß-лактамазы AmpC-типа: blaCIT + blaDHA + blaACC + blaEBC
Код: CIDHAE-U, CIDHAE-G, CIDHAE-UX, CIDHAE-GX
E. coli + blaCTX-M1 / bla CTX-M2 + blaCTX-M9
Код: CTXE-U, CTXE-G, CTXE-UX, CTXE-GX
P.aeruginosa + A. baumannii + S. aureus / blaOXA + blaVIM + blaKPC + blaCTX-M
Ref.: DRPROA-U, DRPROA-G, DRPROA-UX, DRPROA-GX
P. aeruginiaceae + Enterobacteriaceaeosa S. aureus / blaOXA + blaCTX-M + blaVIM + blaKPC / blaIMP + blaNDM + vanA-vanB + mecA-mecC
Код: ENZERO-U, ENZERO-G, ENZERO-UX, ENZERO-GX
blaIMP + blaNDM
Код: IMND-U, IMND-G, IMND-UX, IMND-GX
blaIMP + blaVIM
Арт. : IMVI-U, IMVI-G, IMVI-UX, IMVI-GX
: IMVI-U, IMVI-G, IMVI-UX, IMVI-GX
blaIMP + blaNDM / blaOXA + blaCTX-M + blaVIM + blaKPC
Код: INOCVK-U, INOCVK-G, INOCVK-UX, INOCVK-GX
blaKPC + blaNDM
Код: КПНД-У, КПНД-Г, КПНД-UX, КПНД-GX
blaIMP + blaNDM-1 + MCR-1 / blaOXA + blaCTX-M + blaVIM + blaKPC
Ref: MDRO-U, MDRO-G, MDRO-UX, MDRO-GX
blaIMP + blaNDM-1 + MCR-1 / blaOXA + blaCTX-M + blaVIM + blaKPC / S.aureus + PVL + vanA-vanB + mecA-mecC
Ref: MDRORG-U, MDRORG-G, MDRORG-UX, MDRORG-GX
blaOXA + blaVIM
Код: OXVI-U, OXVI-G, OXVI-UX, OXVI-GX
blaOXA + blaVIM + blaKPC
Код: OXVIKP-U, OXVIKP-G, OXVIKP-UX, OXVIKP-GX
blaOXA + blaVIM + blaKPC + blaNDM
Реф.: ОКСВИКПНД-У, ОКСВИКПНД-Г, ОКСВИКПНД-UX, ОКСВИКПНД-GX
Pseudomonas aeruginosa + Acinetobacter baumannii / ген mecA + Staphylococcus aureus
Арт.

 Могат да се наблюдават и обриви по дланите и стъпалата, съпроводени със сърбеж.
Могат да се наблюдават и обриви по дланите и стъпалата, съпроводени със сърбеж.