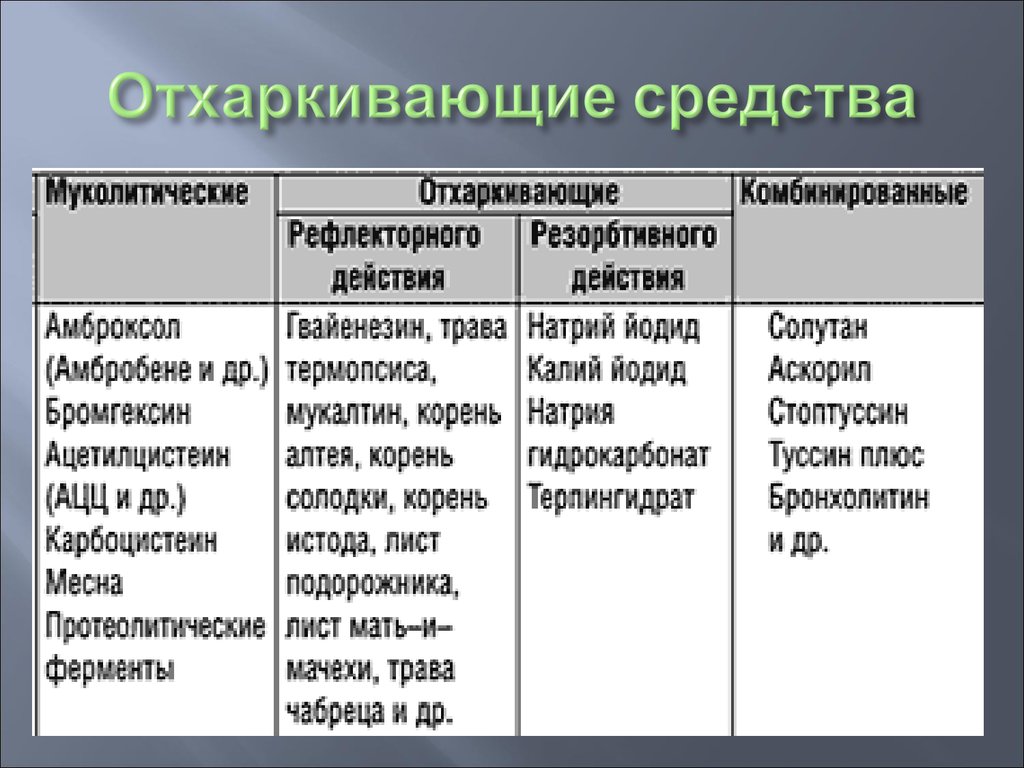
Муколитические препараты в современной клинической практике
Муколитические препараты в современной клинической практике- Главная
- Библиотека
- Издания для врачей
- Педиатрия.Consilium Medicum
- Педиатрия 2010
- Педиатрия №1 (2010)
- Муколитические препараты в современной клинической практике
- Авторы
Список литературы
1. Беседина М.В. Ацетилцистеин – новый «старый знакомый». Практика педиатра. 2007; 5: 64–6.
Беседина М.В. Ацетилцистеин – новый «старый знакомый». Практика педиатра. 2007; 5: 64–6.
3. Геппе Н.А., Снегоцкая М.Н., Никитенко А.А. Ацетилцистеин в лечении кашля у детей. Педиатрия. 2007; 2: 43–7.
4. Зайцева О.В. Муколитические препараты в терапии болезней органов дыхания у детей: современный взгляд на проблему. Педиатрия. 2007; 1: 33–8.
5. Захарова И.Н., Дмитриева Ю.А. Эффективность муколитических препаратов при кашле у детей. Педиатрия. 2009; 3: 72–8.
6. Игнатьева Е.П., Макарова О.В., Поникав В.Е. Современные отхаркивающие средства. В мире лекарств. 1998; 1: 10–3.
7. Коровина Н.А., Захарова И.Н., Заплатников А.Л., Овсянникова Е.М. Кашель у детей. Противокашлевые и отхаркивающие лекарственные средства в педиатрической практике (пособие для врачей). М.: Посад, 2000.
 Лечение кашля у детей. Практ. педиатра. 2004; 8–17.
Лечение кашля у детей. Практ. педиатра. 2004; 8–17.9. Смирнов В.Ю Муколитики в патогенетической терапии хронических бронхолегочных заболеваний. ФАРМиндекс-Практик.
Авторы
И.М.Косенко
Санкт-Петербургская государственная педиатрическая медицинская академия
Поделиться
Назад к списку
Ключевые слова
артериальная гипертензия артериальная гипертония дети лечение сахарный диабет ишемическая болезнь сердца беременность диагностика ожирение COVID-19 сердечно-сосудистые заболевания хроническая сердечная недостаточность факторы риска метаболический синдром рак молочной железы хроническая обструктивная болезнь легких профилактика хроническая болезнь почек качество жизни антигипертензивная терапия бесплодие инфаркт миокарда фибрилляция предсердий амлодипин сахарный диабет 2-го типа бронхиальная астма атеросклероз химиотерапия таргетная терапия бактериальный вагиноз витамин D нестероидные противовоспалительные препараты атопический дерматит вирус папилломы человека реабилитация сердечная недостаточность неалкогольная жировая болезнь печени прогноз эндометриоз гастроэзофагеальная рефлюксная болезнь инсульт статины комбинированные оральные контрацептивы острый коронарный синдром патогенез артериальное давление ревматоидный артрит эффективность эндотелиальная дисфункция инсулинорезистентность
Подождите секунду, мы ищем Расширенный поиск
Новости медицины фармации и здравоохранения
Новости медицины фармации и здравоохранения | Remedium.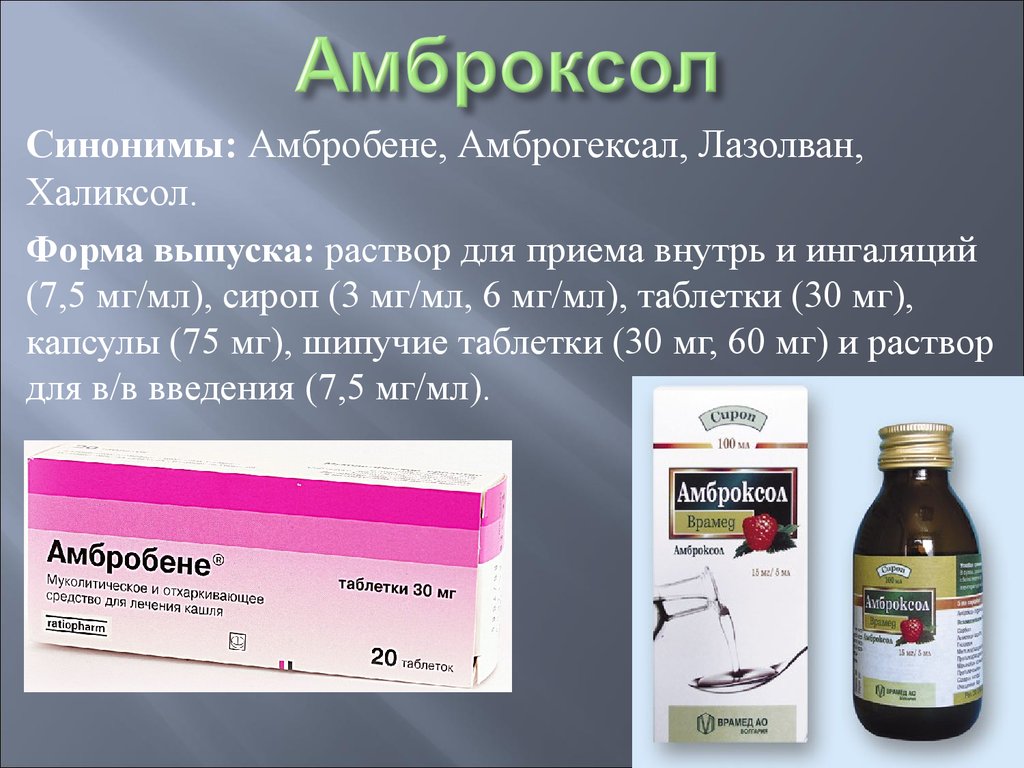 ru
ruПопулярное
- В новом законе уточнен порядок финансирования закупок препаратов для лечения орфанных заболеваний
- Форум «Новейшая генетика» подведет итоги года в области медицинской генетики, диагностики и лечения наследственных заболеваний
- В России антимикробная резистентность на законодательном уровне рассматривается как фактор биологической угрозы
- Россия и Индия обсудили перспективы сотрудничества в области медицины
Карта портала
- СМИ — Новости
- Пресс-Релизы
- Фармацевтам
- Врачам
- Акушерство и гинекология
- Аллергология
- Гепатология
- Дерматология
- Диетология
- Инфекционные заболевания
- Исследования и разработки
- Кардиология
- Неврология
- Онкология
- Оториноларингология
- Педиатрия
- Психиатрия
- Психология
- Пульмонология
- Ревматология
- Стоматология
- Терапия
- Травматология
- Урология
- Хирургия
- Эндокринология
- Специалистам здравоохранения
- Фармацевтический рынок
- Промышленность
- Фармацевтическая промышленность
- Медтехника +
- Правовая хроника
- Аналитика
- Законодательство
- Документы для аптечных учреждений
- Документы о здравоохранении
- Разные документы
- Медицинские издания
- Журналы
- Книги
- Мероприятия
- О компании
- О проекте
- Реклама
- Контакты
- Поиск
- Еnglish
| Логин: | |
| Пароль: | |
| Запомнить меня | |
| Регистрация | |
| Забыли свой пароль? | |
Подписка Онлайн
Книги Журналы
Новости
6 декабря 2022
КРЭТ продемонстрировал новую линейку обеззараживателей воздуха
Оборудование используется для предотвращения распространения болезней, передающихся воздушно-капельным путем.
Подробнее
6 декабря 2022
В России впервые развернуто производство препарата, который снижает смертность от злокачественной гипертермии
6 декабря 2022
Холдинг «Швабе» и Политех Петра Великого договорились о сотрудничестве в области замещения импорта
/upload/iblock/614/mukolit%2520kids.pdf
Врачам
6 декабря 2022
Характеристика профиля личности и приверженность к терапии как факторы прогноза компенсации сахарного диабета 1-го типа у подростков
И. Л. Никитина, А.О. Плаксина, А.С. Пирожкова, И.А. Кельмансон; Национальный…
Л. Никитина, А.О. Плаксина, А.С. Пирожкова, И.А. Кельмансон; Национальный…
Подробнее
2 декабря 2022
Топическая антибактериальная терапия перфоративных отитов в пандемию COVID-19
1 декабря 2022
Лекция: Нереспираторные осложнения COVID у детей
Фармацевтам
24 октября 2022
Открытие конкурентов рядом с аптечной организацией
Совсем рядом с нашей аптекой, стенка в стенку, открылись конкуренты. Это законно?
Подробнее
30 августа 2022
Отпуск сразу большого количества упаковок ОТС-препарата
9 августа 2022
Душно в торговом зале аптеки – улучшение условий труда в такой ситуации
Искать
Раздел не найден.
Раздел не найден.
Муколитические лекарства — StatPearls — NCBI Bookshelf
Программа непрерывного образования
Муколитики — это препараты, применяемые для лечения гиперсекреции слизи и ее последствий, таких как рецидивирующие инфекции у пациентов с ХОБЛ, муковисцидозом и бронхоэктазами. Они принадлежат к группе агентов, называемых мукоактивными агентами. В этом упражнении описываются различные варианты и их соответствующие механизмы действия, показания и противопоказания, относящиеся к членам медицинской бригады, поскольку они являются ценными средствами для лечения продуктивного кашля и связанных с ним слизисто-обструктивных респираторных заболеваний.
Цели:
Определите механизмы действия различных классов муколитических средств.
Опишите побочные эффекты муколитических средств.
Рассмотрите соответствующий мониторинг пациентов, получающих муколитические средства.

Объясните важность улучшения межпрофессиональных командных стратегий для улучшения коммуникации и координации для улучшения результатов у пациентов, страдающих обструктивными заболеваниями слизистых оболочек, которые получают муколитические препараты.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Муколитики представляют собой препараты, принадлежащие к классу мукоактивных средств. Они оказывают влияние на слизистый слой, выстилающий дыхательные пути, с целью повышения его клиренса. Слизь является первой линией защиты различных эпителиев внутри нашего тела от вредных патогенов. Его работа также влечет за собой защиту эпителия от раздражающих раздражителей, обнаруженных в желудочно-кишечном тракте. В нем находится набор белков, таких как иммуноглобулины, различные гликопротеины и даже некоторые антимикробные ферменты, такие как лизоцим. Сшивание полимерных гелеобразующих муцинов в основном определяет биофизические свойства слизи. Этот слой очень хорошо защищает от бактерий благодаря ингибированию роста бактерий и предотвращению образования биопленки. Слой слизи также работает как физический барьер против респираторных раздражителей и предотвращает потерю жидкости. Отхаркиваемая слизь называется мокротой.
Этот слой очень хорошо защищает от бактерий благодаря ингибированию роста бактерий и предотвращению образования биопленки. Слой слизи также работает как физический барьер против респираторных раздражителей и предотвращает потерю жидкости. Отхаркиваемая слизь называется мокротой.
Количество слизи в нашем организме регулируется в основном двумя механизмами: клетками, секретирующими слизь, и мукоцилиарным эскалаторным механизмом. Бокаловидные клетки слизистых оболочек и подслизистых желез дыхательной, желудочно-кишечной и репродуктивной систем отвечают за секрецию слизи, а мукоцилиарный эскалатор отвечает за выведение слизи по направлению к глотке, откуда она в конечном итоге отхаркивается. кашлевой рефлекс. Однако есть некоторые условия, при которых это правило нарушается.
При таких состояниях, как ХОБЛ и астма, хроническое раздражение дыхательных путей приводит к гиперсекреции слизи. Чрезмерное образование слизи подавляет механизмы мукоцилиарного клиренса, что приводит к накоплению этой избыточной слизи. Это приводит к образованию слизистых пробок, которые еще больше уменьшают клиренс. Дыхательные пути реагируют выделением избытка медиаторов воспаления в попытке устранить обструкцию. К сожалению, это только ухудшает состояние по мере увеличения вязкости слизи, что приводит к дальнейшему снижению клиренса, а также к возникновению воспаления и фиброза. Это состояние только ухудшается, потому что эта статическая слизь заражена бактериями, такими как Pseudomonas aeruginosa и Staphylococcus aureus. Таким образом запускается порочный круг, который неизменно заканчивается острым обострением состояния. Классические муколитики, такие как N-ацетилцистеин, показаны при таких состояниях, поскольку они снижают вязкость слизи и повышают ее текучесть, тем самым улучшая ее клиренс.[1]
Это приводит к образованию слизистых пробок, которые еще больше уменьшают клиренс. Дыхательные пути реагируют выделением избытка медиаторов воспаления в попытке устранить обструкцию. К сожалению, это только ухудшает состояние по мере увеличения вязкости слизи, что приводит к дальнейшему снижению клиренса, а также к возникновению воспаления и фиброза. Это состояние только ухудшается, потому что эта статическая слизь заражена бактериями, такими как Pseudomonas aeruginosa и Staphylococcus aureus. Таким образом запускается порочный круг, который неизменно заканчивается острым обострением состояния. Классические муколитики, такие как N-ацетилцистеин, показаны при таких состояниях, поскольку они снижают вязкость слизи и повышают ее текучесть, тем самым улучшая ее клиренс.[1]
При таких состояниях, как кистозный фиброз, секреция слизи нарушена, поэтому секрет дыхательных путей в основном включает нитевидные полимеры актина и ДНК, полученную из воспалительных клеток. Эти выделения также густые и вязкие и часто становятся мишенью для бактерий. Здесь полезен другой класс муколитиков, нацеленный на полимеры ДНК.
Эти выделения также густые и вязкие и часто становятся мишенью для бактерий. Здесь полезен другой класс муколитиков, нацеленный на полимеры ДНК.
Механизм действия
Муколитики делятся на две подгруппы:
1. Классические муколитики
2. Пептидные муколитики
Классические муколитики:
Дисульфидные связи являются строительными блоками многих сложных белков, включая слизь. N-ацетил-L-цистеин (НАЦ), прототип препарата этого класса, сохраняет восстанавливающую способность и работает по механизму обмена тиол-дисульфид. Муциновые полимеры имеют остатки цистеина по всей своей структуре. Дисульфидные связи закрепляются на этих остатках, что приводит к сшиванию полимера. Свободная тиольная группа в структуре NAC гидролизует дисульфидные связи, присоединенные к цистеиновым остаткам. Эта реакция нарушает трехмерную структуру слизи, восстанавливая связь S-S до связи S-H (сульфгидрила), что делает ее неспособной закреплять сложную структуру белка. [1] В эту подгруппу входят
[1] В эту подгруппу входят
Н — Ацетилцистеин
Наряду с вышеупомянутым муколитическим действием N-ацетилцистеин также обладает противовоспалительными и антиоксидантными свойствами. Эти агенты помогают уменьшить количество активных форм кислорода и медиаторов воспаления, которые вызывают поражение дыхательных путей.
Карбоцистеин
Карбоцистеин также увеличивает объем мокроты, вызывая, таким образом, дополнительный отхаркивающий эффект. Он очень безопасен и эффективен для астматиков, так как не раздражает дыхательные пути.[2] Он может быть показан для снижения острого ХОБЛ (острого обострения хронической обструктивной болезни легких) из-за его свойства значительно снижать бактериальную нагрузку в дыхательных путях таких пациентов.[3] Легочные инфекции вызывают до 70% всех обострений ХОБЛ.
Эрдостеин и Фудостеин
Это более новые препараты, которые представляют собой производные тиолов и обладают дополнительным антиоксидантным и противокашлевым действием. У них есть сульфгидрильная группа в их активном метаболите, называемом Met-1, который действует во время респираторного взрыва нейтрофилов. Эрдостеин также продемонстрировал значительный антибиотикопотенциирующий эффект. В отчетах также указывается, что он защищает от альфа-1-антитрипсина.
У них есть сульфгидрильная группа в их активном метаболите, называемом Met-1, который действует во время респираторного взрыва нейтрофилов. Эрдостеин также продемонстрировал значительный антибиотикопотенциирующий эффект. В отчетах также указывается, что он защищает от альфа-1-антитрипсина.
Пептидные муколитики
В отличие от классических муколитиков пептидные муколитики сохраняют защитные муцины. Пептидные муколитики воздействуют на ДНК-полимеры и звенья F-актина, которые имеют тенденцию к увеличению при гнойных выделениях. Таким образом, пептидные муколитики, предназначенные для снижения вязкости слизи за счет деполимеризации полимеров ДНК или сети F-актина, которые часто присутствуют в гнойных выделениях, очень полезны при таких состояниях, как муковисцидоз.
Дорнасе Альфа
Дорназа альфа оказывает муколитическое действие за счет деполимеризации полимеров ДНК. Он вызывает умеренное увеличение ОФВ1 (объем форсированного выдоха через 1 секунду) у пациентов с муковисцидозом. [6]
[6]
Тимозин β4
Муколитический эффект тимозина β4 обусловлен его действием на F-актин. F-актин вырабатывается в большом количестве в гнойных выделениях и повышает вязкость из-за своей нитевидной природы. Таким образом, тимозин может иметь значение для разрушения гноя в дыхательных путях посредством деполимеризации этих нитей.[7]
Введение
N-ацетилцистеин можно вводить перорально, внутривенно и местно в форме небулайзера. Хотя местное введение имело преимущество в активации механизма мукоцилиарного клиренса наряду с индукцией кашлевого рефлекса, пероральное введение обеспечивает гораздо лучшую переносимость.[8] Это обсуждается далее в разделе о побочных реакциях. Пероральная доза от 200 до 600 мг в день рекомендуется для лечения слизисто-обструктивных расстройств [9].] Безопасность для беременных женщин и детей хорошо известна.[10]
Рекомендуемая доза дорназы альфа составляет 2,5 мг, вводимая в форме небулайзера 1–2 раза в день для пациентов с муковисцидозом.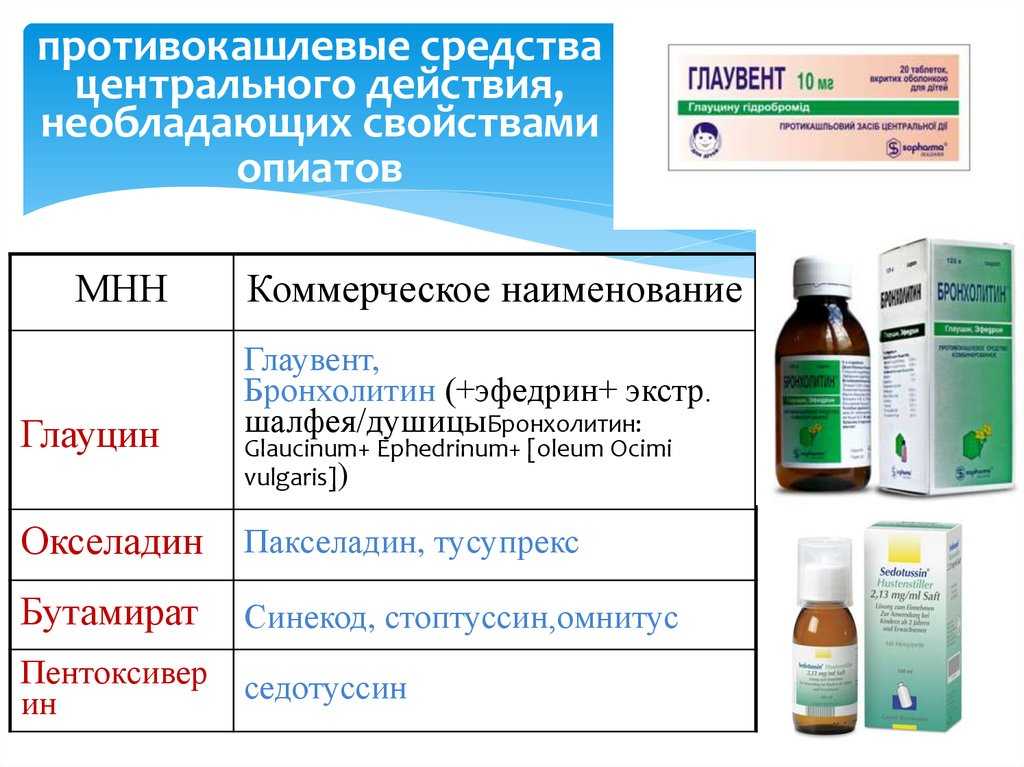 [6] Данные свидетельствуют об улучшении ФЖЕЛ и ОФВ1 уже через три дня после начала терапии. Стандартные методы лечения муковисцидоза, такие как антибиотики и физиотерапия органов грудной клетки, следует продолжать вместе с препаратом. Аналогичная доза и способ введения рекомендованы для детей всех возрастных групп и подростков. Раннее введение у младенцев и детей младшего возраста с диагнозом муковисцидоз, даже при отсутствии клинических признаков или симптомов заболевания, показало пользу [11]. Хотя данные о безопасности дорназы альфа при беременности ограничены, в моделях на животных, получавших дозы, значительно превышающие максимальную рекомендуемую дозу для человека, не сообщалось о влиянии на исход плода.
[6] Данные свидетельствуют об улучшении ФЖЕЛ и ОФВ1 уже через три дня после начала терапии. Стандартные методы лечения муковисцидоза, такие как антибиотики и физиотерапия органов грудной клетки, следует продолжать вместе с препаратом. Аналогичная доза и способ введения рекомендованы для детей всех возрастных групп и подростков. Раннее введение у младенцев и детей младшего возраста с диагнозом муковисцидоз, даже при отсутствии клинических признаков или симптомов заболевания, показало пользу [11]. Хотя данные о безопасности дорназы альфа при беременности ограничены, в моделях на животных, получавших дозы, значительно превышающие максимальную рекомендуемую дозу для человека, не сообщалось о влиянии на исход плода.
Карбоцистеин вводят перорально в дозах от 750 мг два раза в день до 4,5 г один раз в день. Имеющиеся данные свидетельствуют о том, что более высокая концентрация активных соединений была достигнута за счет ночного приема препарата.[2]
Эрдостеин вводят перорально, и дозы могут варьироваться от 600 до 900 мг. Однако дозу следует тщательно титровать у пожилых пациентов с хроническим заболеванием печени, поскольку в этих случаях сообщалось о повышении концентрации в плазме и периоде полувыведения [5].
Однако дозу следует тщательно титровать у пожилых пациентов с хроническим заболеванием печени, поскольку в этих случаях сообщалось о повышении концентрации в плазме и периоде полувыведения [5].
Побочные эффекты
Наиболее частыми побочными эффектами перорального N-ацетилцистеина являются рвота и диарея. После 16-18 дней использования N-ацетилцистеина частота рвоты и диареи увеличилась на 50% и 43,5% соответственно.[9][12] Сообщается, что повышение артериального давления, респираторный дистресс, боль в груди, лихорадка, ректальное кровотечение, головная боль, гипотония, вялость и кожная аллергия встречаются менее чем в 5% случаев. Аэрозольный N-ацетилцистеин плохо переносится из-за его раздражающего действия и очень неприятного запаха, который может вызвать рвоту. Высокая частота анафилактических реакций наблюдается у пациентов, получающих внутривенно N-ацетилцистеин.[13]
Наиболее часто сообщаемыми побочными реакциями при приеме Дорназы альфа являются ларингит, изменение голоса и сыпь по сравнению с плацебо.
 Другими менее значительными побочными эффектами были фарингит, боль в груди и конъюнктивит. Эти побочные эффекты были в основном преходящими и, как сообщалось, не были достаточно серьезными, чтобы вызвать отмену лечения или потребовать изменения дозировки. На сегодняшний день не было сообщений об анафилактической реакции на дорназу альфа. Во всех исследованиях примерно у 2–4% пациентов, получавших дорназу альфа, вырабатывались сывороточные антитела к препарату, клиническое значение которых еще предстоит выяснить.[6]
Другими менее значительными побочными эффектами были фарингит, боль в груди и конъюнктивит. Эти побочные эффекты были в основном преходящими и, как сообщалось, не были достаточно серьезными, чтобы вызвать отмену лечения или потребовать изменения дозировки. На сегодняшний день не было сообщений об анафилактической реакции на дорназу альфа. Во всех исследованиях примерно у 2–4% пациентов, получавших дорназу альфа, вырабатывались сывороточные антитела к препарату, клиническое значение которых еще предстоит выяснить.[6]При применении карбоцистеина сообщалось о легком дискомфорте в желудке, язве желудка и фиксированной лекарственной сыпи.[2]
Эпигастралгия, головная боль, эритема и тошнота были зарегистрированы у пациентов, получавших эрдостеин, последние два из которых привели к прекращению лечения.[5]
Противопоказания
Из-за склонности вызывать рвоту N-ацетилцистеин противопоказан пациентам с язвенной болезнью.
 Он также противопоказан пациентам с варикозным расширением вен пищевода и разрывами Мэллори-Вейса по тем же причинам. Его следует строго избегать у пациентов, у которых в прошлом была анафилактическая реакция на препарат.
Он также противопоказан пациентам с варикозным расширением вен пищевода и разрывами Мэллори-Вейса по тем же причинам. Его следует строго избегать у пациентов, у которых в прошлом была анафилактическая реакция на препарат.Единственным противопоказанием для дорназы альфа является известная гиперчувствительность к препарату в прошлом или гиперчувствительность пациента к клеточным продуктам яичника китайского хомяка (CHO).[14]
Карбоцистеин противопоказан пациентам с активной язвой желудка.[2]
Мониторинг
После перорального приема 400 мг N-ацетилцистеина максимальная концентрация в плазме составила 3,47 мг/л, для ее достижения потребовалось 30 минут. Объем распределения N-ацетилцистеина колеблется от 0,33 до 0,47 л/кг. Через 4 часа после внутривенного введения 50% препарата связывается с белками плазмы. N-ацетилцистеин подвергается экстенсивному метаболизму при первом прохождении в стенке кишечника и печени при пероральном введении, что приводит к биодоступности примерно от 6 до 10%. Большая часть элиминации этого препарата происходит непочечно, а почками выводится только 30% [9].]
Большая часть элиминации этого препарата происходит непочечно, а почками выводится только 30% [9].]
Исследования на животных показали минимальную системную абсорбцию после аэрозольного вдыхания дорназы альфа. Вдыхание даже очень высоких доз (10 мг три раза в день) не приводило к значительному увеличению концентрации ДНКазы в сыворотке [15]. Любая небольшая системная абсорбция считается связанной с белком и выводится из организма без значительного накопления в тканях. Это означает, что для пациентов, получающих этот препарат, необходим минимальный мониторинг или его отсутствие. После вдыхания дорназы альфа в дозе 2,5 мг в течение первых 15 минут была обнаружена средняя концентрация в мокроте 2 мкг/мл, а через 2 часа концентрация снизилась до 0,6 мкг/мл. Расчетный период полувыведения из легких в моделях животных составил около 11 часов. У приматов биодоступность была менее 2%.[17]
Карбоцистеин демонстрирует кинетику открытой модели с одним отделением после абсорбции и достигает своей максимальной концентрации в плазме через 1–1,7 часа. Препарат подвергается частичному метаболизму в печени, и до 60% препарата выводится почками в неизмененном виде.[2]
Препарат подвергается частичному метаболизму в печени, и до 60% препарата выводится почками в неизмененном виде.[2]
После перорального приема эрдостеин достигает максимальной концентрации в плазме через 1,4 часа и имеет аналогичный период полувыведения. Он содержит две заблокированные сульфгидрильные группы. Они высвобождаются только после метаболизма в печени, что придает ценное свойство не воздействовать на слизь, выстилающую желудок. О значительном накоплении препарата не сообщалось.[5]
Лекарственные взаимодействия
Пероральный N-ацетилцистеин нельзя давать с активированным углем, так как препарат массой 3 г адсорбирует 54,6% препарата, а препарат массой 6 г адсорбирует 96,2% препарата, что заметно снижает его эффективность.[9]
N-ацетилцистеин обеспечивает местную защиту уретры, мочевого пузыря, мочеточников и почек от токсических метаболитов внутривенного циклофосфамида при пероральном введении вместе с ним.[18]
Имеющиеся данные свидетельствуют о том, что N-ацетилцистеин может предотвращать доксорубицин-индуцированную кардиомиопатию на животных моделях при совместном применении.

Было показано, что дорназа альфа значительно усиливает антибиотический эффект тобрамицина и амикацина в отношении нескольких штаммов Pseudomonas aeruginosa и Staphylococcus aureus. [6]
Применение эрдостеина с амоксициллином у пациентов с острым инфекционным обострением хронического бронхита приводило к более высоким концентрациям антибиотика в мокроте, что приводило к более раннему и более выраженному улучшению клинических симптомов по сравнению с плацебо.
Сообщалось о более высокой концентрации амоксициллина в мокроте у пациентов, страдающих острым инфекционным обострением хронического бронхита, при одновременном применении с эрдостеином.[5]
Токсичность
N-ацетилцистеин имеет широкий терапевтический индекс. Однако ошибки дозирования привели к случаям токсичности. Они чаще встречаются при внутривенном введении препарата. Сообщается о случае, когда 23-летней женщине была введена десятикратная рекомендуемая нагрузочная доза. [13] Эта доза привела к тромбоцитопении, гемолизу, острой почечной недостаточности и, в конечном итоге, к смерти. Другое исследование, однако, показало, что пероральное введение N-ацетилцистеина, которое обычно используется у пациентов с слизисто-обструктивными заболеваниями, безопаснее, чем внутривенное введение, а ошибки дозирования гораздо менее вероятны [19].] Исследования показали, что пероральные дозы до 30 г/день в течение трех дней очень хорошо переносятся с незначительными побочными эффектами, такими как рвота и диарея.[12]
[13] Эта доза привела к тромбоцитопении, гемолизу, острой почечной недостаточности и, в конечном итоге, к смерти. Другое исследование, однако, показало, что пероральное введение N-ацетилцистеина, которое обычно используется у пациентов с слизисто-обструктивными заболеваниями, безопаснее, чем внутривенное введение, а ошибки дозирования гораздо менее вероятны [19].] Исследования показали, что пероральные дозы до 30 г/день в течение трех дней очень хорошо переносятся с незначительными побочными эффектами, такими как рвота и диарея.[12]
Из-за короткого периода полувыведения и плохой системной абсорбции дорназа альфа является относительно хорошо переносимым препаратом. Токсичность дорназы альфа не приводила к тому, что животные модели подвергались воздействию доз, в 180 раз превышающих максимальную рекомендуемую дозу для человека в исследованиях однократной ингаляционной дозы [14].
В моделях на животных не было обнаружено какой-либо клинически значимой токсичности эрдостеина даже после введения очень больших доз препарата. [5]
[5]
Улучшение результатов коллектива здравоохранения
По прогнозам ВОЗ, глобальная распространенность ХОБЛ составит около 250 миллионов человек, при этом ежегодно умирает около 3 миллионов человек. К сожалению, ожидается, что в ближайшие годы эта цифра возрастет, что будет означать существенное социально-экономическое воздействие. Таким образом, в то время как исследования по окончательному лечению ХОБЛ продолжаются, крайне важно отвлечь внимание на методы лечения, которые могли бы улучшить образ жизни и уменьшить количество острых обострений, пребывание в стационаре и смертность у таких пациентов. Именно в этой области муколитики демонстрируют огромный потенциал.
Требуется хорошо скоординированная межпрофессиональная команда пульмонологов, физиотерапевтов, семейных врачей (MD, DO, NPs, PA), медсестер и фармацевтов для совместной работы над лечением случая ХОБЛ. Прежде всего, пациент должен быть проинструктирован о важности изменения образа жизни. Врач должен тщательно проинструктировать пациента о пользе прописанных лекарств, правильной дозировке, ожидаемых побочных реакциях и научить их правильной процедуре использования небулайзера. Такой подход поможет добиться максимальной комплаентности пациента. Пациенты также должны быть осведомлены о важности регулярных контрольных посещений. Важную роль также играют клинические психологи, группы поддержки и центры избавления от зависимости, так как это поможет отсрочить прогрессирование заболевания у курящих пациентов. Такой межпрофессиональный подход к лечению пациентов муколитиками, где это уместно, может привести к улучшению исходов с меньшим количеством побочных эффектов. [Уровень 5]
Такой подход поможет добиться максимальной комплаентности пациента. Пациенты также должны быть осведомлены о важности регулярных контрольных посещений. Важную роль также играют клинические психологи, группы поддержки и центры избавления от зависимости, так как это поможет отсрочить прогрессирование заболевания у курящих пациентов. Такой межпрофессиональный подход к лечению пациентов муколитиками, где это уместно, может привести к улучшению исходов с меньшим количеством побочных эффектов. [Уровень 5]
За последние 30 лет в лечении муковисцидоза достигнуты большие успехи. Сегодня средний возраст выживания пациента составляет почти 40 лет. Частично это может быть связано с развитием таких методов лечения, как муколитики. Этим усилиям можно способствовать, привлекая к управлению хорошо организованную межпрофессиональную команду. Хотя муколитики, назначенные врачом, являются важной частью этого, роль медсестер, физиотерапевтов грудной клетки, диетологов и детских психиатров также важна.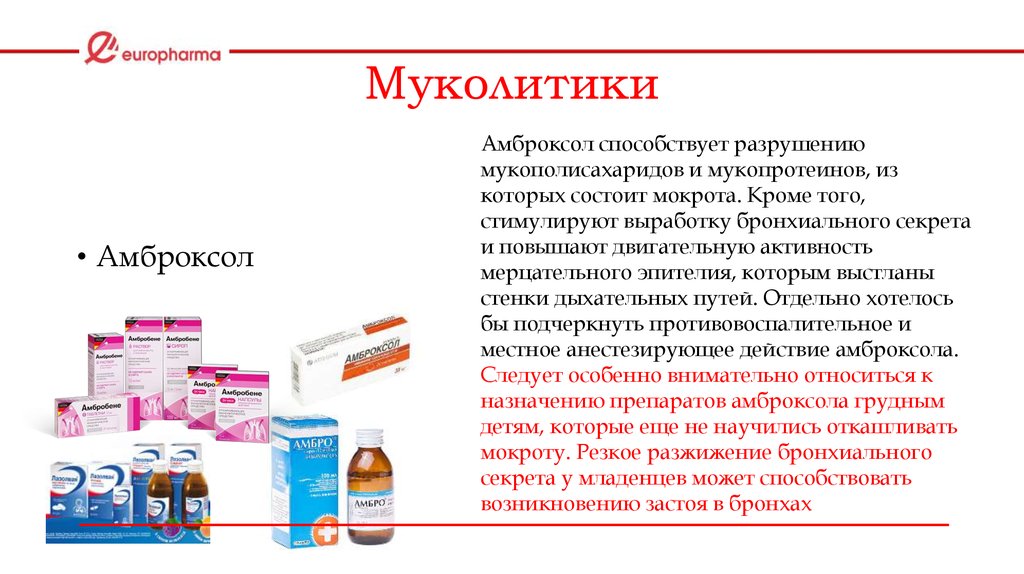 [20]
[20]
Хотя в последнее время эффективность муколитиков подвергалась сомнению, данные, представленные в крупномасштабных исследованиях, проведенных для N-ацетилцистеина [уровень 2], дорназы альфа [уровень 1], карбоцистеина [уровень 1] и эрдостеина [уровень 2 ] нельзя игнорировать.[21][22][23][24]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Садовска А.М., Вербракен Дж., Даркенн К., Де Бакер В.А. Роль N-ацетилцистеина в лечении ХОБЛ. Int J Chron Obstruct Pulmon Dis. 2006;1(4):425-34. [Статья бесплатно PMC: PMC2707813] [PubMed: 18044098]
- 2.
Hooper C, Calvert J. Роль S-карбоксиметилцистеина (карбоцистеина) в лечении хронической обструктивной болезни легких. Int J Chron Obstruct Pulmon Dis. 2008;3(4):659-69. [Бесплатная статья PMC: PMC2650606] [PubMed: 19281081]
- 3.

Sun L, Tang L, Xu Y, Wang S, Li Y, Kang J. Влияние и механизм действия карбоцистеина на бактериальную нагрузку дыхательных путей у крыс, хронически подвергающихся воздействию сигаретного дыма. Респирология. 2010 Октябрь; 15 (7): 1064-71. [PubMed: 20807377]
- 4.
Dal Negro RW. Эрдостеин: противокашлевое и противовоспалительное действие. Легкое. 2008;186 Приложение 1:S70-3. [PubMed: 18185958]
- 5.
Dechant KL, Noble S. Erdosteine. Наркотики. 1996 декабря; 52(6):875-81; обсуждение 882. [PubMed: 8957158]
- 6.
Брайсон Х.М., Соркин Э.М. Дорназа альфа. Обзор его фармакологических свойств и терапевтического потенциала при муковисцидозе. Наркотики. 1994 декабрь; 48 (6): 894-906. [PubMed: 7533697]
- 7.
Рубин Б.К. Муколитики, отхаркивающие и мукокинетические препараты. Уход за дыханием. 2007 г., июль; 52 (7): 859–65. [PubMed: 17594730]
- 8.
Ziment I.
 Ацетилцистеин: препарат с интересным прошлым и захватывающим будущим. Дыхание. 1986;50 Приложение 1:26-30. [PubMed: 3809740]
Ацетилцистеин: препарат с интересным прошлым и захватывающим будущим. Дыхание. 1986;50 Приложение 1:26-30. [PubMed: 3809740]- 9.
Holdiness MR. Клиническая фармакокинетика N-ацетилцистеина. Клин Фармакокинет. 1991 февраль; 20(2):123-34. [PubMed: 2029805]
- 10.
Kortsalioudaki C, Taylor RM, Cheeseman P, Bansal S, Mieli-Vergani G, Dhawan A. Безопасность и эффективность N-ацетилцистеина у детей с острым заболеванием печени, не вызванным ацетаминофеном отказ. Трансплант печени. 2008 Январь; 14 (1): 25-30. [PubMed: 18161828]
- 11.
Nasr SZ, Kuhns LR, Brown RW, Hurwitz ME, Sanders GM, Strouse PJ. Использование компьютерной томографии и рентгенографии грудной клетки для оценки эффективности аэрозольной рекомбинантной ДНКазы человека у пациентов с муковисцидозом в возрасте до 5 лет: предварительное исследование. Педиатр Пульмонол. 2001 г., май; 31(5):377-82. [PubMed: 11340684]
- 12.
Миллер Л.
 Ф., Румак Б.Х. Клиническая безопасность высоких пероральных доз ацетилцистеина. Семин Онкол. 1983 март; 10 (1 Приложение 1): 76-85. [В паблике: 6340205]
Ф., Румак Б.Х. Клиническая безопасность высоких пероральных доз ацетилцистеина. Семин Онкол. 1983 март; 10 (1 Приложение 1): 76-85. [В паблике: 6340205]- 13.
Махмуди Г.А., Астараки П., Мохташами А.З., Ахади М. Передозировка N-ацетилцистеина после отравления ацетаминофеном. Представитель Int Med Case J. 2015; 8:65-9. [Бесплатная статья PMC: PMC4354467] [PubMed: 25767408]
- 14.
Altaf R, Parmar M. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 15 мая 2022 г. Дорнас Альфа. [PubMed: 32310478]
- 15.
Эйткен М.Л., Берк В., Макдональд Г., Шак С., Монтгомери А.Б., Смит А. Ингаляция рекомбинантной ДНКазы человека у нормальных субъектов и пациентов с муковисцидозом. Исследование 1 фазы. ДЖАМА. 1992 8 апреля; 267 (14): 1947-51. [PubMed: 1548827]
- 16.
Молер М., Кук Дж., Льюис Д., Мур Дж., Синикропи Д., Чемпионсмит А., Феррайоло Б., Морденти Дж. Измененная фармакокинетика рекомбинантной дезоксирибонуклеазы человека у крыс из-за присутствия связывающий белок.
 Препарат Метаб Распоряжение. 1993 янв-февраль;21(1):71-5. [PubMed: 8095230]
Препарат Метаб Распоряжение. 1993 янв-февраль;21(1):71-5. [PubMed: 8095230]- 17.
Зеленый JD. Фармако-токсикологический экспертный отчет Pulmozyme rhDNase Genentech, Inc. Hum Exp Toxicol. 1994 мая; 13 Дополнение 1:S1-42. [PubMed: 8031609]
- 18.
Unverferth DV, Leier CV, Balcerzak SP, Hamlin RL. Полезность поглотителя свободных радикалов для предотвращения сердечной недостаточности, вызванной доксорубицином, у собак. Ам Джей Кардиол. 1985 г., 01 июля; 56 (1): 157–61. [PubMed: 4014022]
- 19.
Кантер МЗ. Сравнение перорального и внутривенного ацетилцистеин при лечении отравления ацетаминофеном. Am J Health Syst Pharm. 2006 01 октября; 63 (19): 1821-7. [В паблике: 169
]- 20.
Эрнст М.М., Джонсон М.С., Старк Л.Дж. Проблемы развития и психосоциальные проблемы при муковисцидозе. Детский подростковый психиатр Clin N Am. 2010 апр;19(2):263-83, viii. [Бесплатная статья PMC: PMC2874200] [PubMed: 20478499]
- 21.

Cazzola M, Calzetta L, Page C, Jardim J, Chuchalin AG, Rogliani P, Matera MG. Влияние N-ацетилцистеина на обострения хронического бронхита или ХОБЛ: метаанализ. Eur Respir Rev. 2015 Sep;24(137):451-61. [Бесплатная статья PMC: PMC9487680] [PubMed: 26324807]
- 22.
Yang C, Montgomery M. Dornase alfa для муковисцидоза. Cochrane Database Syst Rev. 2018 Sep 06;9:CD001127. [Статья бесплатно PMC: PMC6513278] [PubMed: 30187450]
- 23.
Zeng Z, Yang D, Huang X, Xiao Z. Влияние карбоцистеина на пациентов с ХОБЛ: систематический обзор и метаанализ. Int J Chron Obstruct Pulmon Dis. 2017;12:2277-2283. [Бесплатная статья PMC: PMC5546781] [PubMed: 28814855]
- 24.
Dal Negro RW, Wedzicha JA, Iversen M, Fontana G, Page C, Cicero AF, Pozzi E, Calverley PMA., RESTORE group. ВОССТАНОВИТЬ исследование. Влияние эрдостеина на частоту и продолжительность обострений ХОБЛ: исследование RESTORE. Eur Respir J. 2017 Oct;50(4) [PMC free article: PMC5678897] [PubMed: 288]
Mucolytic Medications — StatPearls — NCBI Bookshelf
Continuing Education Activity
его последствия, такие как рецидивирующие инфекции у пациентов с ХОБЛ, муковисцидозом и бронхоэктазами. Они принадлежат к группе агентов, называемых мукоактивными агентами. В этом упражнении описываются различные варианты и их соответствующие механизмы действия, показания и противопоказания, относящиеся к членам медицинской бригады, поскольку они являются ценными средствами для лечения продуктивного кашля и связанных с ним слизисто-обструктивных респираторных заболеваний.
Они принадлежат к группе агентов, называемых мукоактивными агентами. В этом упражнении описываются различные варианты и их соответствующие механизмы действия, показания и противопоказания, относящиеся к членам медицинской бригады, поскольку они являются ценными средствами для лечения продуктивного кашля и связанных с ним слизисто-обструктивных респираторных заболеваний.
Цели:
Определите механизмы действия различных классов муколитических средств.
Опишите побочные эффекты муколитических средств.
Рассмотрите соответствующий мониторинг пациентов, получающих муколитические средства.
Объясните важность улучшения межпрофессиональных командных стратегий для улучшения коммуникации и координации для улучшения результатов у пациентов, страдающих обструктивными заболеваниями слизистых оболочек, которые получают муколитические препараты.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Муколитики представляют собой препараты, принадлежащие к классу мукоактивных средств. Они оказывают влияние на слизистый слой, выстилающий дыхательные пути, с целью повышения его клиренса. Слизь является первой линией защиты различных эпителиев внутри нашего тела от вредных патогенов. Его работа также влечет за собой защиту эпителия от раздражающих раздражителей, обнаруженных в желудочно-кишечном тракте. В нем находится набор белков, таких как иммуноглобулины, различные гликопротеины и даже некоторые антимикробные ферменты, такие как лизоцим. Сшивание полимерных гелеобразующих муцинов в основном определяет биофизические свойства слизи. Этот слой очень хорошо защищает от бактерий благодаря ингибированию роста бактерий и предотвращению образования биопленки. Слой слизи также работает как физический барьер против респираторных раздражителей и предотвращает потерю жидкости. Отхаркиваемая слизь называется мокротой.
Количество слизи в нашем организме регулируется в основном двумя механизмами: клетками, секретирующими слизь, и мукоцилиарным эскалаторным механизмом. Бокаловидные клетки слизистых оболочек и подслизистых желез дыхательной, желудочно-кишечной и репродуктивной систем отвечают за секрецию слизи, а мукоцилиарный эскалатор отвечает за выведение слизи по направлению к глотке, откуда она в конечном итоге отхаркивается. кашлевой рефлекс. Однако есть некоторые условия, при которых это правило нарушается.
Бокаловидные клетки слизистых оболочек и подслизистых желез дыхательной, желудочно-кишечной и репродуктивной систем отвечают за секрецию слизи, а мукоцилиарный эскалатор отвечает за выведение слизи по направлению к глотке, откуда она в конечном итоге отхаркивается. кашлевой рефлекс. Однако есть некоторые условия, при которых это правило нарушается.
При таких состояниях, как ХОБЛ и астма, хроническое раздражение дыхательных путей приводит к гиперсекреции слизи. Чрезмерное образование слизи подавляет механизмы мукоцилиарного клиренса, что приводит к накоплению этой избыточной слизи. Это приводит к образованию слизистых пробок, которые еще больше уменьшают клиренс. Дыхательные пути реагируют выделением избытка медиаторов воспаления в попытке устранить обструкцию. К сожалению, это только ухудшает состояние по мере увеличения вязкости слизи, что приводит к дальнейшему снижению клиренса, а также к возникновению воспаления и фиброза. Это состояние только ухудшается, потому что эта статическая слизь заражена бактериями, такими как Pseudomonas aeruginosa и Staphylococcus aureus. Таким образом запускается порочный круг, который неизменно заканчивается острым обострением состояния. Классические муколитики, такие как N-ацетилцистеин, показаны при таких состояниях, поскольку они снижают вязкость слизи и повышают ее текучесть, тем самым улучшая ее клиренс.[1]
Таким образом запускается порочный круг, который неизменно заканчивается острым обострением состояния. Классические муколитики, такие как N-ацетилцистеин, показаны при таких состояниях, поскольку они снижают вязкость слизи и повышают ее текучесть, тем самым улучшая ее клиренс.[1]
При таких состояниях, как кистозный фиброз, секреция слизи нарушена, поэтому секрет дыхательных путей в основном включает нитевидные полимеры актина и ДНК, полученную из воспалительных клеток. Эти выделения также густые и вязкие и часто становятся мишенью для бактерий. Здесь полезен другой класс муколитиков, нацеленный на полимеры ДНК.
Механизм действия
Муколитики делятся на две подгруппы:
1. Классические муколитики
2. Пептидные муколитики
Классические муколитики:
Дисульфидные связи являются строительными блоками многих сложных белков, включая слизь. N-ацетил-L-цистеин (НАЦ), прототип препарата этого класса, сохраняет восстанавливающую способность и работает по механизму обмена тиол-дисульфид. Муциновые полимеры имеют остатки цистеина по всей своей структуре. Дисульфидные связи закрепляются на этих остатках, что приводит к сшиванию полимера. Свободная тиольная группа в структуре NAC гидролизует дисульфидные связи, присоединенные к цистеиновым остаткам. Эта реакция нарушает трехмерную структуру слизи, восстанавливая связь S-S до связи S-H (сульфгидрила), что делает ее неспособной закреплять сложную структуру белка.[1] В эту подгруппу входят
Муциновые полимеры имеют остатки цистеина по всей своей структуре. Дисульфидные связи закрепляются на этих остатках, что приводит к сшиванию полимера. Свободная тиольная группа в структуре NAC гидролизует дисульфидные связи, присоединенные к цистеиновым остаткам. Эта реакция нарушает трехмерную структуру слизи, восстанавливая связь S-S до связи S-H (сульфгидрила), что делает ее неспособной закреплять сложную структуру белка.[1] В эту подгруппу входят
Н — Ацетилцистеин
Наряду с вышеупомянутым муколитическим действием N-ацетилцистеин также обладает противовоспалительными и антиоксидантными свойствами. Эти агенты помогают уменьшить количество активных форм кислорода и медиаторов воспаления, которые вызывают поражение дыхательных путей.
Карбоцистеин
Карбоцистеин также увеличивает объем мокроты, вызывая, таким образом, дополнительный отхаркивающий эффект. Он очень безопасен и эффективен для астматиков, так как не раздражает дыхательные пути. [2] Он может быть показан для снижения острого ХОБЛ (острого обострения хронической обструктивной болезни легких) из-за его свойства значительно снижать бактериальную нагрузку в дыхательных путях таких пациентов.[3] Легочные инфекции вызывают до 70% всех обострений ХОБЛ.
[2] Он может быть показан для снижения острого ХОБЛ (острого обострения хронической обструктивной болезни легких) из-за его свойства значительно снижать бактериальную нагрузку в дыхательных путях таких пациентов.[3] Легочные инфекции вызывают до 70% всех обострений ХОБЛ.
Эрдостеин и Фудостеин
Это более новые препараты, которые представляют собой производные тиолов и обладают дополнительным антиоксидантным и противокашлевым действием. У них есть сульфгидрильная группа в их активном метаболите, называемом Met-1, который действует во время респираторного взрыва нейтрофилов. Эрдостеин также продемонстрировал значительный антибиотикопотенциирующий эффект. В отчетах также указывается, что он защищает от альфа-1-антитрипсина.
Пептидные муколитики
В отличие от классических муколитиков пептидные муколитики сохраняют защитные муцины. Пептидные муколитики воздействуют на ДНК-полимеры и звенья F-актина, которые имеют тенденцию к увеличению при гнойных выделениях. Таким образом, пептидные муколитики, предназначенные для снижения вязкости слизи за счет деполимеризации полимеров ДНК или сети F-актина, которые часто присутствуют в гнойных выделениях, очень полезны при таких состояниях, как муковисцидоз.
Таким образом, пептидные муколитики, предназначенные для снижения вязкости слизи за счет деполимеризации полимеров ДНК или сети F-актина, которые часто присутствуют в гнойных выделениях, очень полезны при таких состояниях, как муковисцидоз.
Дорнасе Альфа
Дорназа альфа оказывает муколитическое действие за счет деполимеризации полимеров ДНК. Он вызывает умеренное увеличение ОФВ1 (объем форсированного выдоха через 1 секунду) у пациентов с муковисцидозом.[6]
Тимозин β4
Муколитический эффект тимозина β4 обусловлен его действием на F-актин. F-актин вырабатывается в большом количестве в гнойных выделениях и повышает вязкость из-за своей нитевидной природы. Таким образом, тимозин может иметь значение для разрушения гноя в дыхательных путях посредством деполимеризации этих нитей.[7]
Введение
N-ацетилцистеин можно вводить перорально, внутривенно и местно в форме небулайзера. Хотя местное введение имело преимущество в активации механизма мукоцилиарного клиренса наряду с индукцией кашлевого рефлекса, пероральное введение обеспечивает гораздо лучшую переносимость. [8] Это обсуждается далее в разделе о побочных реакциях. Пероральная доза от 200 до 600 мг в день рекомендуется для лечения слизисто-обструктивных расстройств [9].] Безопасность для беременных женщин и детей хорошо известна.[10]
[8] Это обсуждается далее в разделе о побочных реакциях. Пероральная доза от 200 до 600 мг в день рекомендуется для лечения слизисто-обструктивных расстройств [9].] Безопасность для беременных женщин и детей хорошо известна.[10]
Рекомендуемая доза дорназы альфа составляет 2,5 мг, вводимая в форме небулайзера 1–2 раза в день для пациентов с муковисцидозом.[6] Данные свидетельствуют об улучшении ФЖЕЛ и ОФВ1 уже через три дня после начала терапии. Стандартные методы лечения муковисцидоза, такие как антибиотики и физиотерапия органов грудной клетки, следует продолжать вместе с препаратом. Аналогичная доза и способ введения рекомендованы для детей всех возрастных групп и подростков. Раннее введение у младенцев и детей младшего возраста с диагнозом муковисцидоз, даже при отсутствии клинических признаков или симптомов заболевания, показало пользу [11]. Хотя данные о безопасности дорназы альфа при беременности ограничены, в моделях на животных, получавших дозы, значительно превышающие максимальную рекомендуемую дозу для человека, не сообщалось о влиянии на исход плода.
Карбоцистеин вводят перорально в дозах от 750 мг два раза в день до 4,5 г один раз в день. Имеющиеся данные свидетельствуют о том, что более высокая концентрация активных соединений была достигнута за счет ночного приема препарата.[2]
Эрдостеин вводят перорально, и дозы могут варьироваться от 600 до 900 мг. Однако дозу следует тщательно титровать у пожилых пациентов с хроническим заболеванием печени, поскольку в этих случаях сообщалось о повышении концентрации в плазме и периоде полувыведения [5].
Побочные эффекты
Наиболее частыми побочными эффектами перорального N-ацетилцистеина являются рвота и диарея. После 16-18 дней использования N-ацетилцистеина частота рвоты и диареи увеличилась на 50% и 43,5% соответственно.[9][12] Сообщается, что повышение артериального давления, респираторный дистресс, боль в груди, лихорадка, ректальное кровотечение, головная боль, гипотония, вялость и кожная аллергия встречаются менее чем в 5% случаев. Аэрозольный N-ацетилцистеин плохо переносится из-за его раздражающего действия и очень неприятного запаха, который может вызвать рвоту.
 Высокая частота анафилактических реакций наблюдается у пациентов, получающих внутривенно N-ацетилцистеин.[13]
Высокая частота анафилактических реакций наблюдается у пациентов, получающих внутривенно N-ацетилцистеин.[13]Наиболее часто сообщаемыми побочными реакциями при приеме Дорназы альфа являются ларингит, изменение голоса и сыпь по сравнению с плацебо. Другими менее значительными побочными эффектами были фарингит, боль в груди и конъюнктивит. Эти побочные эффекты были в основном преходящими и, как сообщалось, не были достаточно серьезными, чтобы вызвать отмену лечения или потребовать изменения дозировки. На сегодняшний день не было сообщений об анафилактической реакции на дорназу альфа. Во всех исследованиях примерно у 2–4% пациентов, получавших дорназу альфа, вырабатывались сывороточные антитела к препарату, клиническое значение которых еще предстоит выяснить.[6]
При применении карбоцистеина сообщалось о легком дискомфорте в желудке, язве желудка и фиксированной лекарственной сыпи.[2]
Эпигастралгия, головная боль, эритема и тошнота были зарегистрированы у пациентов, получавших эрдостеин, последние два из которых привели к прекращению лечения.
 [5]
[5]
Противопоказания
Из-за склонности вызывать рвоту N-ацетилцистеин противопоказан пациентам с язвенной болезнью. Он также противопоказан пациентам с варикозным расширением вен пищевода и разрывами Мэллори-Вейса по тем же причинам. Его следует строго избегать у пациентов, у которых в прошлом была анафилактическая реакция на препарат.
Единственным противопоказанием для дорназы альфа является известная гиперчувствительность к препарату в прошлом или гиперчувствительность пациента к клеточным продуктам яичника китайского хомяка (CHO).[14]
Карбоцистеин противопоказан пациентам с активной язвой желудка.[2]
Мониторинг
После перорального приема 400 мг N-ацетилцистеина максимальная концентрация в плазме составила 3,47 мг/л, для ее достижения потребовалось 30 минут. Объем распределения N-ацетилцистеина колеблется от 0,33 до 0,47 л/кг. Через 4 часа после внутривенного введения 50% препарата связывается с белками плазмы. N-ацетилцистеин подвергается экстенсивному метаболизму при первом прохождении в стенке кишечника и печени при пероральном введении, что приводит к биодоступности примерно от 6 до 10%. Большая часть элиминации этого препарата происходит непочечно, а почками выводится только 30% [9].]
N-ацетилцистеин подвергается экстенсивному метаболизму при первом прохождении в стенке кишечника и печени при пероральном введении, что приводит к биодоступности примерно от 6 до 10%. Большая часть элиминации этого препарата происходит непочечно, а почками выводится только 30% [9].]
Исследования на животных показали минимальную системную абсорбцию после аэрозольного вдыхания дорназы альфа. Вдыхание даже очень высоких доз (10 мг три раза в день) не приводило к значительному увеличению концентрации ДНКазы в сыворотке [15]. Любая небольшая системная абсорбция считается связанной с белком и выводится из организма без значительного накопления в тканях. Это означает, что для пациентов, получающих этот препарат, необходим минимальный мониторинг или его отсутствие. После вдыхания дорназы альфа в дозе 2,5 мг в течение первых 15 минут была обнаружена средняя концентрация в мокроте 2 мкг/мл, а через 2 часа концентрация снизилась до 0,6 мкг/мл. Расчетный период полувыведения из легких в моделях животных составил около 11 часов. У приматов биодоступность была менее 2%.[17]
У приматов биодоступность была менее 2%.[17]
Карбоцистеин демонстрирует кинетику открытой модели с одним отделением после абсорбции и достигает своей максимальной концентрации в плазме через 1–1,7 часа. Препарат подвергается частичному метаболизму в печени, и до 60% препарата выводится почками в неизмененном виде.[2]
После перорального приема эрдостеин достигает максимальной концентрации в плазме через 1,4 часа и имеет аналогичный период полувыведения. Он содержит две заблокированные сульфгидрильные группы. Они высвобождаются только после метаболизма в печени, что придает ценное свойство не воздействовать на слизь, выстилающую желудок. О значительном накоплении препарата не сообщалось.[5]
Лекарственные взаимодействия
Пероральный N-ацетилцистеин нельзя давать с активированным углем, так как препарат массой 3 г адсорбирует 54,6% препарата, а препарат массой 6 г адсорбирует 96,2% препарата, что заметно снижает его эффективность.[9]
N-ацетилцистеин обеспечивает местную защиту уретры, мочевого пузыря, мочеточников и почек от токсических метаболитов внутривенного циклофосфамида при пероральном введении вместе с ним.
 [18]
[18]Имеющиеся данные свидетельствуют о том, что N-ацетилцистеин может предотвращать доксорубицин-индуцированную кардиомиопатию на животных моделях при совместном применении.
Было показано, что дорназа альфа значительно усиливает антибиотический эффект тобрамицина и амикацина в отношении нескольких штаммов Pseudomonas aeruginosa и Staphylococcus aureus. [6]
Применение эрдостеина с амоксициллином у пациентов с острым инфекционным обострением хронического бронхита приводило к более высоким концентрациям антибиотика в мокроте, что приводило к более раннему и более выраженному улучшению клинических симптомов по сравнению с плацебо.
Сообщалось о более высокой концентрации амоксициллина в мокроте у пациентов, страдающих острым инфекционным обострением хронического бронхита, при одновременном применении с эрдостеином.[5]
Токсичность
N-ацетилцистеин имеет широкий терапевтический индекс. Однако ошибки дозирования привели к случаям токсичности. Они чаще встречаются при внутривенном введении препарата. Сообщается о случае, когда 23-летней женщине была введена десятикратная рекомендуемая нагрузочная доза.[13] Эта доза привела к тромбоцитопении, гемолизу, острой почечной недостаточности и, в конечном итоге, к смерти. Другое исследование, однако, показало, что пероральное введение N-ацетилцистеина, которое обычно используется у пациентов с слизисто-обструктивными заболеваниями, безопаснее, чем внутривенное введение, а ошибки дозирования гораздо менее вероятны [19].] Исследования показали, что пероральные дозы до 30 г/день в течение трех дней очень хорошо переносятся с незначительными побочными эффектами, такими как рвота и диарея.[12]
Однако ошибки дозирования привели к случаям токсичности. Они чаще встречаются при внутривенном введении препарата. Сообщается о случае, когда 23-летней женщине была введена десятикратная рекомендуемая нагрузочная доза.[13] Эта доза привела к тромбоцитопении, гемолизу, острой почечной недостаточности и, в конечном итоге, к смерти. Другое исследование, однако, показало, что пероральное введение N-ацетилцистеина, которое обычно используется у пациентов с слизисто-обструктивными заболеваниями, безопаснее, чем внутривенное введение, а ошибки дозирования гораздо менее вероятны [19].] Исследования показали, что пероральные дозы до 30 г/день в течение трех дней очень хорошо переносятся с незначительными побочными эффектами, такими как рвота и диарея.[12]
Из-за короткого периода полувыведения и плохой системной абсорбции дорназа альфа является относительно хорошо переносимым препаратом. Токсичность дорназы альфа не приводила к тому, что животные модели подвергались воздействию доз, в 180 раз превышающих максимальную рекомендуемую дозу для человека в исследованиях однократной ингаляционной дозы [14].
В моделях на животных не было обнаружено какой-либо клинически значимой токсичности эрдостеина даже после введения очень больших доз препарата.[5]
Улучшение результатов коллектива здравоохранения
По прогнозам ВОЗ, глобальная распространенность ХОБЛ составит около 250 миллионов человек, при этом ежегодно умирает около 3 миллионов человек. К сожалению, ожидается, что в ближайшие годы эта цифра возрастет, что будет означать существенное социально-экономическое воздействие. Таким образом, в то время как исследования по окончательному лечению ХОБЛ продолжаются, крайне важно отвлечь внимание на методы лечения, которые могли бы улучшить образ жизни и уменьшить количество острых обострений, пребывание в стационаре и смертность у таких пациентов. Именно в этой области муколитики демонстрируют огромный потенциал.
Требуется хорошо скоординированная межпрофессиональная команда пульмонологов, физиотерапевтов, семейных врачей (MD, DO, NPs, PA), медсестер и фармацевтов для совместной работы над лечением случая ХОБЛ. Прежде всего, пациент должен быть проинструктирован о важности изменения образа жизни. Врач должен тщательно проинструктировать пациента о пользе прописанных лекарств, правильной дозировке, ожидаемых побочных реакциях и научить их правильной процедуре использования небулайзера. Такой подход поможет добиться максимальной комплаентности пациента. Пациенты также должны быть осведомлены о важности регулярных контрольных посещений. Важную роль также играют клинические психологи, группы поддержки и центры избавления от зависимости, так как это поможет отсрочить прогрессирование заболевания у курящих пациентов. Такой межпрофессиональный подход к лечению пациентов муколитиками, где это уместно, может привести к улучшению исходов с меньшим количеством побочных эффектов. [Уровень 5]
Прежде всего, пациент должен быть проинструктирован о важности изменения образа жизни. Врач должен тщательно проинструктировать пациента о пользе прописанных лекарств, правильной дозировке, ожидаемых побочных реакциях и научить их правильной процедуре использования небулайзера. Такой подход поможет добиться максимальной комплаентности пациента. Пациенты также должны быть осведомлены о важности регулярных контрольных посещений. Важную роль также играют клинические психологи, группы поддержки и центры избавления от зависимости, так как это поможет отсрочить прогрессирование заболевания у курящих пациентов. Такой межпрофессиональный подход к лечению пациентов муколитиками, где это уместно, может привести к улучшению исходов с меньшим количеством побочных эффектов. [Уровень 5]
За последние 30 лет в лечении муковисцидоза достигнуты большие успехи. Сегодня средний возраст выживания пациента составляет почти 40 лет. Частично это может быть связано с развитием таких методов лечения, как муколитики. Этим усилиям можно способствовать, привлекая к управлению хорошо организованную межпрофессиональную команду. Хотя муколитики, назначенные врачом, являются важной частью этого, роль медсестер, физиотерапевтов грудной клетки, диетологов и детских психиатров также важна.[20]
Этим усилиям можно способствовать, привлекая к управлению хорошо организованную межпрофессиональную команду. Хотя муколитики, назначенные врачом, являются важной частью этого, роль медсестер, физиотерапевтов грудной клетки, диетологов и детских психиатров также важна.[20]
Хотя в последнее время эффективность муколитиков подвергалась сомнению, данные, представленные в крупномасштабных исследованиях, проведенных для N-ацетилцистеина [уровень 2], дорназы альфа [уровень 1], карбоцистеина [уровень 1] и эрдостеина [уровень 2 ] нельзя игнорировать.[21][22][23][24]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Каталожные номера
- 1.
Садовска А.М., Вербракен Дж., Даркенн К., Де Бакер В.А. Роль N-ацетилцистеина в лечении ХОБЛ. Int J Chron Obstruct Pulmon Dis. 2006;1(4):425-34. [Статья бесплатно PMC: PMC2707813] [PubMed: 18044098]
- 2.

Hooper C, Calvert J. Роль S-карбоксиметилцистеина (карбоцистеина) в лечении хронической обструктивной болезни легких. Int J Chron Obstruct Pulmon Dis. 2008;3(4):659-69. [Бесплатная статья PMC: PMC2650606] [PubMed: 19281081]
- 3.
Sun L, Tang L, Xu Y, Wang S, Li Y, Kang J. Влияние и механизм действия карбоцистеина на бактериальную нагрузку дыхательных путей у крыс, хронически подвергающихся воздействию сигаретного дыма. Респирология. 2010 Октябрь; 15 (7): 1064-71. [PubMed: 20807377]
- 4.
Dal Negro RW. Эрдостеин: противокашлевое и противовоспалительное действие. Легкое. 2008;186 Приложение 1:S70-3. [PubMed: 18185958]
- 5.
Dechant KL, Noble S. Erdosteine. Наркотики. 1996 декабря; 52(6):875-81; обсуждение 882. [PubMed: 8957158]
- 6.
Брайсон Х.М., Соркин Э.М. Дорназа альфа. Обзор его фармакологических свойств и терапевтического потенциала при муковисцидозе. Наркотики.
 1994 декабрь; 48 (6): 894-906. [PubMed: 7533697]
1994 декабрь; 48 (6): 894-906. [PubMed: 7533697]- 7.
Рубин Б.К. Муколитики, отхаркивающие и мукокинетические препараты. Уход за дыханием. 2007 г., июль; 52 (7): 859–65. [PubMed: 17594730]
- 8.
Ziment I. Ацетилцистеин: препарат с интересным прошлым и захватывающим будущим. Дыхание. 1986;50 Приложение 1:26-30. [PubMed: 3809740]
- 9.
Holdiness MR. Клиническая фармакокинетика N-ацетилцистеина. Клин Фармакокинет. 1991 февраль; 20(2):123-34. [PubMed: 2029805]
- 10.
Kortsalioudaki C, Taylor RM, Cheeseman P, Bansal S, Mieli-Vergani G, Dhawan A. Безопасность и эффективность N-ацетилцистеина у детей с острым заболеванием печени, не вызванным ацетаминофеном отказ. Трансплант печени. 2008 Январь; 14 (1): 25-30. [PubMed: 18161828]
- 11.
Nasr SZ, Kuhns LR, Brown RW, Hurwitz ME, Sanders GM, Strouse PJ. Использование компьютерной томографии и рентгенографии грудной клетки для оценки эффективности аэрозольной рекомбинантной ДНКазы человека у пациентов с муковисцидозом в возрасте до 5 лет: предварительное исследование.
 Педиатр Пульмонол. 2001 г., май; 31(5):377-82. [PubMed: 11340684]
Педиатр Пульмонол. 2001 г., май; 31(5):377-82. [PubMed: 11340684]- 12.
Миллер Л.Ф., Румак Б.Х. Клиническая безопасность высоких пероральных доз ацетилцистеина. Семин Онкол. 1983 март; 10 (1 Приложение 1): 76-85. [В паблике: 6340205]
- 13.
Махмуди Г.А., Астараки П., Мохташами А.З., Ахади М. Передозировка N-ацетилцистеина после отравления ацетаминофеном. Представитель Int Med Case J. 2015; 8:65-9. [Бесплатная статья PMC: PMC4354467] [PubMed: 25767408]
- 14.
Altaf R, Parmar M. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 15 мая 2022 г. Дорнас Альфа. [PubMed: 32310478]
- 15.
Эйткен М.Л., Берк В., Макдональд Г., Шак С., Монтгомери А.Б., Смит А. Ингаляция рекомбинантной ДНКазы человека у нормальных субъектов и пациентов с муковисцидозом. Исследование 1 фазы. ДЖАМА. 1992 8 апреля; 267 (14): 1947-51. [PubMed: 1548827]
- 16.
Молер М.
 , Кук Дж., Льюис Д., Мур Дж., Синикропи Д., Чемпионсмит А., Феррайоло Б., Морденти Дж. Измененная фармакокинетика рекомбинантной дезоксирибонуклеазы человека у крыс из-за присутствия связывающий белок. Препарат Метаб Распоряжение. 1993 янв-февраль;21(1):71-5. [PubMed: 8095230]
, Кук Дж., Льюис Д., Мур Дж., Синикропи Д., Чемпионсмит А., Феррайоло Б., Морденти Дж. Измененная фармакокинетика рекомбинантной дезоксирибонуклеазы человека у крыс из-за присутствия связывающий белок. Препарат Метаб Распоряжение. 1993 янв-февраль;21(1):71-5. [PubMed: 8095230]- 17.
Зеленый JD. Фармако-токсикологический экспертный отчет Pulmozyme rhDNase Genentech, Inc. Hum Exp Toxicol. 1994 мая; 13 Дополнение 1:S1-42. [PubMed: 8031609]
- 18.
Unverferth DV, Leier CV, Balcerzak SP, Hamlin RL. Полезность поглотителя свободных радикалов для предотвращения сердечной недостаточности, вызванной доксорубицином, у собак. Ам Джей Кардиол. 1985 г., 01 июля; 56 (1): 157–61. [PubMed: 4014022]
- 19.
Кантер МЗ. Сравнение перорального и внутривенного ацетилцистеин при лечении отравления ацетаминофеном. Am J Health Syst Pharm. 2006 01 октября; 63 (19): 1821-7. [В паблике: 169
]- 20.
Эрнст М.



 Другими менее значительными побочными эффектами были фарингит, боль в груди и конъюнктивит. Эти побочные эффекты были в основном преходящими и, как сообщалось, не были достаточно серьезными, чтобы вызвать отмену лечения или потребовать изменения дозировки. На сегодняшний день не было сообщений об анафилактической реакции на дорназу альфа. Во всех исследованиях примерно у 2–4% пациентов, получавших дорназу альфа, вырабатывались сывороточные антитела к препарату, клиническое значение которых еще предстоит выяснить.[6]
Другими менее значительными побочными эффектами были фарингит, боль в груди и конъюнктивит. Эти побочные эффекты были в основном преходящими и, как сообщалось, не были достаточно серьезными, чтобы вызвать отмену лечения или потребовать изменения дозировки. На сегодняшний день не было сообщений об анафилактической реакции на дорназу альфа. Во всех исследованиях примерно у 2–4% пациентов, получавших дорназу альфа, вырабатывались сывороточные антитела к препарату, клиническое значение которых еще предстоит выяснить.[6] Он также противопоказан пациентам с варикозным расширением вен пищевода и разрывами Мэллори-Вейса по тем же причинам. Его следует строго избегать у пациентов, у которых в прошлом была анафилактическая реакция на препарат.
Он также противопоказан пациентам с варикозным расширением вен пищевода и разрывами Мэллори-Вейса по тем же причинам. Его следует строго избегать у пациентов, у которых в прошлом была анафилактическая реакция на препарат.

 Ацетилцистеин: препарат с интересным прошлым и захватывающим будущим. Дыхание. 1986;50 Приложение 1:26-30. [PubMed: 3809740]
Ацетилцистеин: препарат с интересным прошлым и захватывающим будущим. Дыхание. 1986;50 Приложение 1:26-30. [PubMed: 3809740]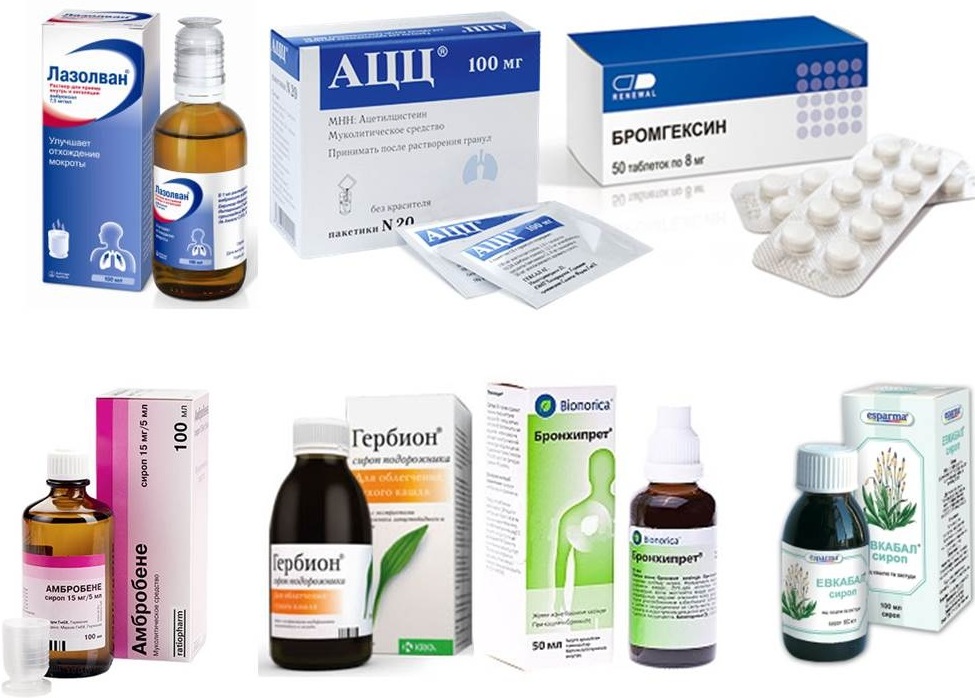 Ф., Румак Б.Х. Клиническая безопасность высоких пероральных доз ацетилцистеина. Семин Онкол. 1983 март; 10 (1 Приложение 1): 76-85. [В паблике: 6340205]
Ф., Румак Б.Х. Клиническая безопасность высоких пероральных доз ацетилцистеина. Семин Онкол. 1983 март; 10 (1 Приложение 1): 76-85. [В паблике: 6340205] Препарат Метаб Распоряжение. 1993 янв-февраль;21(1):71-5. [PubMed: 8095230]
Препарат Метаб Распоряжение. 1993 янв-февраль;21(1):71-5. [PubMed: 8095230]