Влияние нарушений реологических свойств крови матери на внутриутробное развитие плода uMEDp
В статье даны современные представления о реологических свойствах крови во время беременности, их влиянии на плацентарный кровоток, рост и развитие плода. Обозначена роль физиологической гемодилюции во втором триместре беременности. Приведены собственные данные о течении гестационного процесса и перинатальных исходах у женщин с повышенными концентрационными показателями крови. Установлено, что наиболее характерным осложнением в подобных случаях становится задержка развития плода – она выявляется в 40% случаев. Показано, что патофизиологический механизм развития данного состояния основывается на повышении вязкости крови в сосудах мелкого калибра и нарушении микроциркуляторного кровотока. Обоснована целесообразность применения терапии, направленной на улучшение реологических свойств крови. В частности беременным с повышенными показателями гемоглобина во втором триместре рекомендовано назначение препарата Курантил N.
Рис. 1. Средняя масса новорожденных в основной группе и группе сравнения
Рис. 2. Вязкость крови при низких и высоких скоростях сдвига у женщин основной группы и группы сравнения
Рис. 3. Биомикроскопия конъюнктивы глаза у беременной с гемоконцентрацией. Увеличение числа капилляров, миандрическая извитость сосудов, нарушение соотношения диаметров артериол и венул
Рис. 4. Биомикроскопия конъюнктивы глаза у беременной с гемоконцентрацией. Неравномерность диаметра и извитость сосудов, сладж-феномен
Важнейшей задачей современного акушерства являются профилактика и лечение серьезных осложнений беременности, оказывающих прямое влияние на перинатальные исходы для матери и плода. В ряду таких осложнений значимое место занимают плацентарная недостаточность и синдром задержки развития плода (СЗРП).
Частота СЗРП колеблется от 3–10% в развитых странах до 15–20% – в развивающихся. Известно, что именно СЗРП чаще всего обусловливает низкий вес ребенка при рождении. Связь между СЗРП/низким весом и мертворождаемостью/смертностью новорожденных может быть установлена в 66–69% случаев [1, 2].
Связь между СЗРП/низким весом и мертворождаемостью/смертностью новорожденных может быть установлена в 66–69% случаев [1, 2].
Причины СЗРП многочисленны. Среди них возраст матери, паритет, избыточная и низкая масса тела во время беременности, гестационная гипертензия, экстрагенитальная патология и др. При всем разнообразии факторов, ассоциированных с задержкой развития плода, патогенетические механизмы этого осложнения во многом универсальны. Большое значение в их реализации играют структурные особенности плаценты и гемодинамические характеристики женской крови, являющейся для плода единственным поставщиком энергетических и пластических ресурсов [3–5].
Известно, что физические свойства крови играют главную роль в реализации ее реологических возможностей. Для поддержания плацентарного кровотока необходима высокая текучесть в микроциркуляторном звене. Напомним, что кровь – это неньютоновская жидкость, поэтому ее вязкость – это переменная величина, которая зависит от диаметра сосуда и колеблется в пределах 1,7–22,9 мПа•с [6].
Физиологические рамки концентрационных характеристик крови у беременных до сих пор остаются предметом дискуссий. Нижняя граница нормы гемоглобина во втором триместре оценивается как 105–110 г/л [1–10]. Верхний предел не обозначен как для беременности в целом, так и для отдельных ее этапов. В то же время очевидно, что отсутствие гемодилюции, ведущей к повышенной вязкости и нарушенной микроциркуляции крови, может быть маркером грядущего неблагополучия [11–13]. Имеются данные о том, что при высоком уровне гемоглобина у женщины во время беременности риск перинатальной смертности повышается в 2,6 раза. По результатам анализа исходов 295 651 родов высокий гемоглобин назван независимым фактором риска неблагоприятных перинатальных исходов [14, 15].
В то же время очевидно, что отсутствие гемодилюции, ведущей к повышенной вязкости и нарушенной микроциркуляции крови, может быть маркером грядущего неблагополучия [11–13]. Имеются данные о том, что при высоком уровне гемоглобина у женщины во время беременности риск перинатальной смертности повышается в 2,6 раза. По результатам анализа исходов 295 651 родов высокий гемоглобин назван независимым фактором риска неблагоприятных перинатальных исходов [14, 15].
Для того чтобы определить верхнюю границу концентрационных показателей крови у женщин в средние сроки гестации, нами был оценен средний уровень показателя гемоглобина в выборке из 280 беременных, не страдающих анемией и находящихся на сроках 16–24 недели. Установлен средний показатель гемоглобина – 118,4 г/л (95% ДИ 116,7–120,0), а первое стандартное отклонение зафиксировано на отметке 126,6 г/л. Уровень гемоглобина превысил это значение у неожиданно значимого числа женщин (n = 52, 18,5%). Мы наблюдали течение беременностей этих женщин (основная группа) в сравнении с 50 случайно отобранными беременными, имеющими уровень гемоглобина 110–126,5 г/л (группа сравнения).
При сопоставлении основных анамнестических характеристик оказалось, что при одинаковом среднем возрасте женщин число первородящих в основной группе было выше (63%). В то время как в группе сравнения на долю пациенток с первыми и повторными родами пришлось 48 и 52% соответственно (p = 0,04).
Была проанализирована динамика гемоглобина на различных сроках текущей беременности. Для женщин основной группы было характерно незначительное снижение гемоглобина от первого ко второму триместру с дальнейшей стабилизацией на среднем уровне 129,3 г/л (95% ДИ 126,7–131,9). При этом у 20% пациенток были зафиксированы очень высокие показатели – 140–149 г/л. В группе сравнения наблюдалась иная динамика. Если в начале беременности значения гемоглобина были сходными с таковыми в основной группе, то к 20–21-й неделе они существенно снизились до 113,2 г/л (95% ДИ 120,2–116,1). У 22% женщин в этот период появлялись признаки анемии. Однако к родам гемоглобин вновь повысился до 118,5 г/л (95% ДИ 117,2–119,7).
Ультразвуковые маркеры начинающейся фетоплацентарной недостаточности у женщин основной группы были обнаружены уже во втором триместре, на 18–22-й неделе. На этом сроке такие симптомы, как изменение толщины и степени зрелости плаценты, имели место у 27% пациенток, а к 32–36-й неделе – уже у 37%. Признаки внутриутробного страдания плода в третьем триместре фиксировались в 27% случаев. В группе сравнения отклонения ультразвуковых характеристик плаценты обнаруживались только в третьем триместре, они редко сопровождались симптомами хронической гипоксии плода (около 4%, различия с основной группой значимы, критерий χ
Реализация плацентарной недостаточности в СЗРП (по данным ультразвукового исследования) у женщин основной группы происходила, как правило, в последнем триместре беременности, иногда до 30 недель. Задержка развития плода зафиксирована у 42% женщин с повышенным уровнем гемоглобина. В группе сравнения СЗРП наблюдался только в 4% случаев (критерий χ2 = 19,32, р = 0,00). Наличие гемоконцентрации повышало шансы развития СЗРП более чем в 16 раз (отношение шансов = 16,25 ± 0,77, 95% ДИ 3,55–74,2).
Наличие гемоконцентрации повышало шансы развития СЗРП более чем в 16 раз (отношение шансов = 16,25 ± 0,77, 95% ДИ 3,55–74,2).
В большинстве случаев антенатальный диагноз нашел свое подтверждение после рождения ребенка. Родоразрешение в обеих группах произошло на симметричных сроках. При этом масса тела детей, рожденных от женщин с гемоконцентрацией, в среднем составила 3057 г (95% ДИ 2927,9–3186,2), а в группе сравнения – 3480 г (95% ДИ 3362,1–3614,6, t = 4,79, p = 0,001) (рис. 1). Число детей с подтвержденным диагнозом СЗРП в основной группе составило 43%, что соответствовало результатам антенатальной диагностики. Гипоксия при рождении была отмечена в 52% случаев, в каждом третьем случае она была среднетяжелой или тяжелой. В 17% наблюдений возникла необходимость перевода на второй этап лечения. В группе сравнения на долю детей с низкой массой тела приходилось только 6%. Течение раннего неонатального периода, как правило, носило физиологический характер.
Предполагая, что основной причиной худших перинатальных исходов было нарушение реологических свойств крови, связанное с повышенной ее концентрацией, мы провели исследование вязкости крови в диапазоне высоких и низких скоростей сдвига.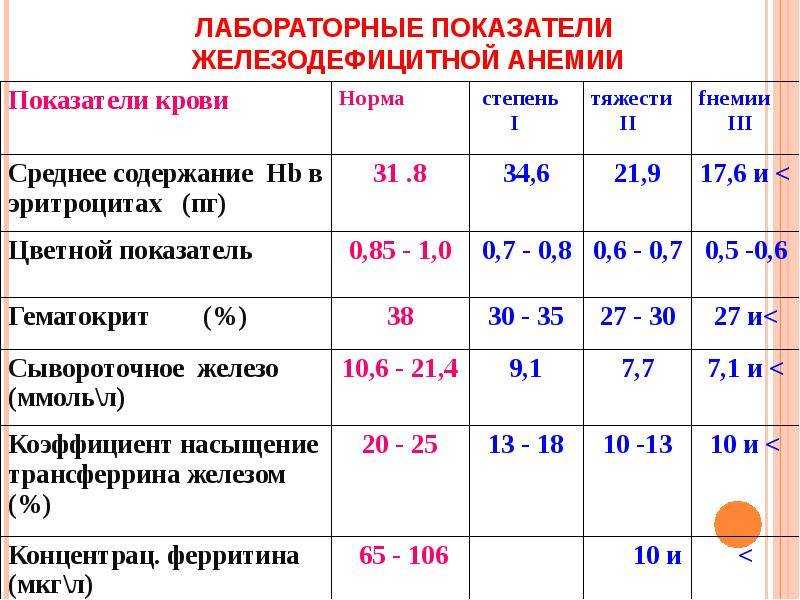 Это имитировало ситуацию в крупных и самых мелких сосудах. Использовался ротационный микровискозиметр МВР-1 «Росинка» со скоростями сдвига от 25 до 250 с-1. В основной группе вязкость цельной крови при скорости сдвига 25 с
Это имитировало ситуацию в крупных и самых мелких сосудах. Использовался ротационный микровискозиметр МВР-1 «Росинка» со скоростями сдвига от 25 до 250 с-1. В основной группе вязкость цельной крови при скорости сдвига 25 с
Визуализировать нарушения текучих свойств крови позволяет биомикроскопия сосудов конъюнктивы глазного яблока. Возможность экстраполяции локальных данных на системный кровоток доказана в экспериментальных и клинических исследованиях [16].
В нашем исследовании биомикроскопия выполнялась при помощи щелевой лампы ЩЛ-2Б. Количественная оценка состояния конъюнктивальной микроциркуляции проводилась по системе критериев Л.Т. Малой и соавт. (1977) с вычислением парциальных и общего конъюнктивального индекса в баллах. Учитывались сосудистые нарушения (изменения соотношений диаметров артериол и венул, количества функционирующих капилляров, степень мобилизации артериоло-венулярных шунтов), а также вне- и внутрисосудистая патология (кровоизлияния, периваскулярный отек, сладж-феномен и микротромбоз).
В основной группе сосудистый конъюнктивальный индекс составил 8,71 балла (95% ДИ 7,55–9,88), а в группе сравнения – 0,75 балла (95% ДИ 0,46–1,04, t = 10,64, p = 0,001). Разница в показателях микроциркуляции была обусловлена выраженными сосудистыми изменениями у беременных с гемоконцентрацией. На фоне дегенеративных повреждений сосудистой стенки, заключающихся в неравномерности калибра и извилистости, манифестировала артериальная вазоконстрикция. Увеличивалось количество артериоло-венулярных анастомозов. Это приводило к запустеванию капиллярной сети – уменьшению числа функционирующих капилляров, вследствие чего замедлялся кровоток в сосудистом конъюнктивальном бассейне (рис. 3 и 4). В основной группе также был широко представлен внутрисосудистый патологический компонент, преимущественно за счет сладж-феномена, в венулах и капиллярах. Парциальный конъюнктивальный индекс составил 1,29 балла (95% ДИ 1,08–1,5). В группе сравнения внутрисосудистых изменений не отмечалось.
Увеличивалось количество артериоло-венулярных анастомозов. Это приводило к запустеванию капиллярной сети – уменьшению числа функционирующих капилляров, вследствие чего замедлялся кровоток в сосудистом конъюнктивальном бассейне (рис. 3 и 4). В основной группе также был широко представлен внутрисосудистый патологический компонент, преимущественно за счет сладж-феномена, в венулах и капиллярах. Парциальный конъюнктивальный индекс составил 1,29 балла (95% ДИ 1,08–1,5). В группе сравнения внутрисосудистых изменений не отмечалось.
Различий во внесосудистом индексе между группами обнаружено не было. В итоге общий конъюнктивальный индекс в основной группе составил 10,14 балла (95% ДИ 8,91–11,37), а в группе сравнения – только 0,75 балла (95% ДИ 0,46–1,04, t = 11,85, p = 0,00).
Данные биомикроскопии продемонстрировали, что повышенная вязкость крови у беременных с гемоконцентрацией прямо реализуется в виде выраженного системного нарушения микроциркуляции. Вероятно, именно это приводит к падению маточно-плацентарного кровотока и создает предпосылки к формированию СЗРП.
Вероятно, именно это приводит к падению маточно-плацентарного кровотока и создает предпосылки к формированию СЗРП.
Полученные результаты подтверждают, что умеренная гемоконцентрация во втором триместре беременности является серьезной проблемой. Несмотря на достаточную распространенность ситуации, специалисты, как правило, не уделяют ей должного внимания. Между тем отсутствие врачебной настороженности и непонимание негативных последствий гемоконцентрации в период второй волны инвазии трофобласта могут привести к неблагоприятным перинатальным исходам.
В настоящее время не существует способов снизить концентрационные показатели крови у беременной. Однако можно улучшить реологические характеристики крови, повысить текучие свойства и тем самым обеспечить эффективную микрогемодинамику. С этой точки зрения следует обратить внимание на дипиридамол – хорошо изученный препарат, который давно известен врачам и широко используется в акушерской практике.
Основа фармакологического действия дипиридамола заключается в ингибировании захвата аденозина тромбоцитами, эритроцитами и клетками эндотелия. Это соотносится с увеличением локальных концентраций аденозина. Последний, влияя на А2-рецепторы тромбоцитов, способствует стимуляции аденилатциклазы и увеличению концентрации циклического 3,5-аденозинмонофосфата. Данный механизм определяет ингибирование агрегации тромбоцитов и поддерживает локальное вазодилатирующее влияние дипиридамола. Кроме того, сосудорасширяющий эффект связан и со способностью препарата потенцировать синтез эндотелиоцитами оксида азота. Ангиогенная активность определяется стимуляцией образования капилляров и коллатеральных артерий. Способность дипиридамола ингибировать активность ренина в плазме крови и снижать концентрацию альдостерона, подавляя тем самым функциональность ренин-ангиотензин-альдостероновой системы, оказывает положительное действие на пациентов с артериальной гипертензией [17]. Сегодня доказаны эффекты дипиридамола в отношении профилактики развития сосудистых осложнений, в частности преэклампсии во время беременности [18]. Прием дипиридамола или ацетилсалициловой кислоты с целью профилактики преэклампсии рекомендует Всемирная организация здравоохранения [19].
Это соотносится с увеличением локальных концентраций аденозина. Последний, влияя на А2-рецепторы тромбоцитов, способствует стимуляции аденилатциклазы и увеличению концентрации циклического 3,5-аденозинмонофосфата. Данный механизм определяет ингибирование агрегации тромбоцитов и поддерживает локальное вазодилатирующее влияние дипиридамола. Кроме того, сосудорасширяющий эффект связан и со способностью препарата потенцировать синтез эндотелиоцитами оксида азота. Ангиогенная активность определяется стимуляцией образования капилляров и коллатеральных артерий. Способность дипиридамола ингибировать активность ренина в плазме крови и снижать концентрацию альдостерона, подавляя тем самым функциональность ренин-ангиотензин-альдостероновой системы, оказывает положительное действие на пациентов с артериальной гипертензией [17]. Сегодня доказаны эффекты дипиридамола в отношении профилактики развития сосудистых осложнений, в частности преэклампсии во время беременности [18]. Прием дипиридамола или ацетилсалициловой кислоты с целью профилактики преэклампсии рекомендует Всемирная организация здравоохранения [19]. При этом ацетилсалициловая кислота в России противопоказана в первом и третьем триместрах беременности, тогда как дипиридамол разрешен к использованию в течение всего гестационного периода. Известно, что в комбинации с низкомолекулярным гепарином дипиридамол способствует снижению частоты антенатальных потерь, преждевременных родов и низкого веса плода при высоком риске плацентарной недостаточности [20]. Дипиридамол имеет минимальную трансплацентарную перфузию, что делает его применение во время всего периода беременности полностью безопасным для плода [21].
При этом ацетилсалициловая кислота в России противопоказана в первом и третьем триместрах беременности, тогда как дипиридамол разрешен к использованию в течение всего гестационного периода. Известно, что в комбинации с низкомолекулярным гепарином дипиридамол способствует снижению частоты антенатальных потерь, преждевременных родов и низкого веса плода при высоком риске плацентарной недостаточности [20]. Дипиридамол имеет минимальную трансплацентарную перфузию, что делает его применение во время всего периода беременности полностью безопасным для плода [21].
Зарегистрированные в России препараты Курантил® (Курантил® 25, Курантил® N 25, Курантил® N 75) – это пероральные формы дипиридамола. Наиболее удобной для беременных оказалась форма выпуска в виде таблеток, покрытых оболочкой, – Курантил® N 25 (дипиридамол 25 мг). В соответствии с инструкцией по применению препарат показан для профилактики плацентарной недостаточности при осложненной беременности. В акушерской практике препарат используется для улучшения плацентарного кровотока и предупреждения дистрофических изменений в плаценте, устранения гипоксии тканей плода и накопления в них гликогена. Может использоваться у беременных с высоким риском плацентарной недостаточности: внутриутробной инфекцией, гестозом, аутоиммунной патологией, экстрагенитальными заболеваниями (сахарным диабетом, метаболическим синдромом), а также заболеваниями, для которых характерно тромбообразование. Режим терапии выбирается индивидуально.
Может использоваться у беременных с высоким риском плацентарной недостаточности: внутриутробной инфекцией, гестозом, аутоиммунной патологией, экстрагенитальными заболеваниями (сахарным диабетом, метаболическим синдромом), а также заболеваниями, для которых характерно тромбообразование. Режим терапии выбирается индивидуально.
Опыт, накопленный в отечественной акушерской практике, подтверждает, что препараты Курантил® N 25 и Курантил® N 75 оказывают положительное действие на плацентарный кровоток при маточно-плацентарной и плодово-плацентарной формах дисфункции плаценты [22, 23]. Характерно, что эффекты препарата носят универсальный характер и реализуются вне зависимости от причин, вызвавших нарушение плацентарного кровотока. Это способствует снижению числа осложнений беременности и улучшению перинатальных исходов при инфекционно-воспалительных процессах, аутоиммунных заболеваниях, патологии вен малого таза и других заболеваниях [24–27].
С учетом полученных нами данных не вызывает сомнения целесообразность назначения препаратов Курантил® N 25 и Курантил® N 75 пациенткам, у которых уровень гемоглобина во втором триместре беременности превышает 126–130 г/л. Следует придерживаться терапевтической дозы препарата (75–150 мг в сутки) и продолжительности лечения сроком четыре – шесть недель с возможным повтором курса через месяц. Улучшение маточно-плацентарного кровотока за счет фармакологических эффектов препарата обеспечивает надежную профилактику СЗРП и осуществляет действенную защиту плода в условиях гемоконцентрации у матери.
Следует придерживаться терапевтической дозы препарата (75–150 мг в сутки) и продолжительности лечения сроком четыре – шесть недель с возможным повтором курса через месяц. Улучшение маточно-плацентарного кровотока за счет фармакологических эффектов препарата обеспечивает надежную профилактику СЗРП и осуществляет действенную защиту плода в условиях гемоконцентрации у матери.
Железодефицитная анемия при беременности » Медвестник
Л.Х. ХЕЙДАР, ассистент кафедры акушерства и гинекологии московского факультета Российского государственного медицинского университета, врач высшей категории, кандидат медицинских наук; Е.А. БОЯР, ассистент кафедры акушерства и гинекологии московского факультета Российского государственного медицинского университета, врач высшей категории, кандидат медицинских наук
Болезнь каждого четвертого жителя Земли
Железодефицитная анемия — это одно из наиболее распространенных заболеваний человека, поражающее около 25% населения земного шара. Железодефицитная анемия (ЖДА) характеризуется недостатком в организме железа, необходимого для построения молекулы гемоглобина, в частности, его железосодержащей части — гема.
Железодефицитная анемия (ЖДА) характеризуется недостатком в организме железа, необходимого для построения молекулы гемоглобина, в частности, его железосодержащей части — гема.
Актуальность проблемы ЖДА беременных связана с ее значительной распространенностью во время беременности (от 21 до 80%) и неблагоприятным влиянием на течение беременности, родов, послеродового периода, а также на развитие патологии плода и новорожденного.
Согласно мировой медицинской статистике распространенность анемии во время беременности в развивающихся странах колеблется от 35 до 56% в Африке, от 37 до 75% в Азии и от 37 до 52% в Латинской Америке. Предполагается, что наиболее частым этиологическим фактором данного заболевания является дефицит железа и фолиевой кислоты. Установлено, что у 20% беременных уровень гемоглобина не превышает 80 г/л, а у 2—7% пациенток данный показатель составляет не более 70 г/л.
Дефицит железа во время беременности связан с увеличением потребности организма женщины в железе. Суточная потребность во время беременности в железе увеличивается и составляет: в I триместре 0,6—0,8 мг/сут, во II-м — 2,8—3 мг/сут, в III-м — 3,5—4 мг/сут. Это связано с расходами на развитие плаценты и плода, образованием дополнительного глобулярного объема, сопровождающегося усиленным эритропоэзом, расходами на растущую матку и другими потребностями.
Суточная потребность во время беременности в железе увеличивается и составляет: в I триместре 0,6—0,8 мг/сут, во II-м — 2,8—3 мг/сут, в III-м — 3,5—4 мг/сут. Это связано с расходами на развитие плаценты и плода, образованием дополнительного глобулярного объема, сопровождающегося усиленным эритропоэзом, расходами на растущую матку и другими потребностями.
Анемия не только широко распространена в этих странах у женщин во время беременности, но также очень часто встречается в виде тяжелой формы самостоятельного заболевания. По данным ВОЗ, в индустриальных странах средний уровень распространенности данной патологии составляет 18%.
Как поставить диагноз анемии?
Основными критериями железодефицитной анемии являются: снижение уровня гемоглобина (Hb), цветового показателя, отражающего содержание Hb в эритроците. Морфологически определяется гипохромия эритроцитов, микроцитоз, анизоцитоз и пойкилоцитоз. Содержание ретикулоцитов в крови, как правило, в пределах нормы.
Существует несколько классификаций анемий, основанных на этиологических, патогенетических и гематологических признаках. В практической деятельности тяжесть клинического течения анемии принято определять по уровню гемоглобина в периферической крови, и чаще используется следующая классификация ЖДА:
В практической деятельности тяжесть клинического течения анемии принято определять по уровню гемоглобина в периферической крови, и чаще используется следующая классификация ЖДА:
- легкая степень (Hb от 90 до 109 г/л)
- умеренная (Hb от 70 до 89 г/л)
- тяжелая (Hb менее 70 г/л).
Эксперты ВОЗ анемией у беременных считают уровень Hb
Клиническая картина железодефицитной анемии зависит от степени выраженности дефицита железа. При легкой степени ЖДА клиническая симптоматика обычно отсутствует и объективными признаками являются лабораторные показатели. Клиническая симптоматика появляется, как правило, при средней тяжести анемии. По мере нарастания дефицита железа появляются слабость, головокружение, головная боль, сердцебиение, одышка, обмороки, снижение работоспособности, бессонница. Эти симптомы неспецифичны для железодефицитной анемии и могут наблюдаться при анемиях другой этиологии.
Терапия диетическая и лекарственная
Учитывая важную роль железа в патогенезе железодефицитной анемии во время беременности, необходимо соблюдение основных принципов диетотерапии. При выборе пищевого рациона следует ориентироваться не на количество железа в продукте, а на форму, которой оно представлено. Именно форма определяет процент всасывания и усвоения железа, следовательно, эффективность диетотерапии. Наиболее эффективно железо усваивается из продуктов, где оно содержится в виде гема, когда оно активно захватывается и всасывается клетками слизистой кишечника в неизмененном виде (говядина, язык говяжий, мясо кролика, индейки, курицы).
При выборе пищевого рациона следует ориентироваться не на количество железа в продукте, а на форму, которой оно представлено. Именно форма определяет процент всасывания и усвоения железа, следовательно, эффективность диетотерапии. Наиболее эффективно железо усваивается из продуктов, где оно содержится в виде гема, когда оно активно захватывается и всасывается клетками слизистой кишечника в неизмененном виде (говядина, язык говяжий, мясо кролика, индейки, курицы).
Частота встречаемости анемии беременных у женщин, больных эпилепсией, не превышает общепопуляционную, однако подобные случаи требуют тщательной коррекции с целью снижения весьма серьезных акушерских осложнений. Эпилепсия — хроническое заболевание мозга, характеризующееся повторными приступами, которые возникают в результате чрезмерной нейронной активности. Эпилепсия является одним из наиболее распространенных заболеваний нервной системы и значимой медико-социальной проблемой.
Процессы абсорбции гема в кишечнике не зависят от кислотности среды и ингибирующих пищевых веществ. В злаках, фруктах и овощах железо находится в негемовой форме и всасывание из них значительно хуже. Снижению всасывания также способствует присутствие в них оксалатов, фосфатов, танина и других ингибиторов ферроабсорбции. Необходимо отметить, что мясо, печень, рыба, аскорбиновая кислота, а также вещества, понижающие рН пищи (например, молочная кислота) увеличивают всасывание железа из овощей и фруктов при одновременном их потреблении. Полноценная и сбалансированная по основным ингредиентам диета позволяет лишь «покрыть» физиологическую потребность организма в железе, но не устранить его дефицит, и должна рассматриваться как один из вспомогательных компонентов терапии.
В злаках, фруктах и овощах железо находится в негемовой форме и всасывание из них значительно хуже. Снижению всасывания также способствует присутствие в них оксалатов, фосфатов, танина и других ингибиторов ферроабсорбции. Необходимо отметить, что мясо, печень, рыба, аскорбиновая кислота, а также вещества, понижающие рН пищи (например, молочная кислота) увеличивают всасывание железа из овощей и фруктов при одновременном их потреблении. Полноценная и сбалансированная по основным ингредиентам диета позволяет лишь «покрыть» физиологическую потребность организма в железе, но не устранить его дефицит, и должна рассматриваться как один из вспомогательных компонентов терапии.
Традиционным методом лечения железодефицитной анемии беременных является применение пероральных препаратов железа. В настоящее время пероральные ферропрепараты разделены на две основные группы: ионные – это соли двухвалентного железа (ферро-фольгамма, ферретаб, сорбифер дурулес, актиферрин, тардиферрон, тотема, ферроплекс, фенюльс и др. ) и неионные – представленные протеиновым и гидроксид-полимальтозным комплексом трехвалентного железа (мальтофер, феррум лек, ферлатум).
) и неионные – представленные протеиновым и гидроксид-полимальтозным комплексом трехвалентного железа (мальтофер, феррум лек, ферлатум).
Преимущества универсальных препаратов
В нашей практике мы предпочитаем назначать беременным пациенткам с ЖДА универсальный по своим фармакологическим эффектам и спектру клинического воздействия препарат ферро-фольгамма. В его состав входят: сульфат железа 100 мг, в т.ч. железо (Fe2+) 37 мг, цианокобаламин 10 мкг, фолиевая кислота 5 мг, аскорбиновая кислота 100 мг.
Ферро-фольгамма — мультифакторный гемопоэтик, включающий все необходимые компоненты, обеспечивающие стимуляцию структурного синтеза гемоглобина и повышающие репродукцию эритроцитов красным ростком костного мозга. Универсальность фармакологических эффектов препарата связана с его избирательно-стимулирующим действием на синтез не только железосодержащей, но и белковой частей гемоглобина.
Патогномоничными для ЖДА можно считать изменения кожи, ногтей, волос, мышечную слабость, соответствующую степени анемии, извращение вкуса.
Так, сульфат железа практически не образует в желудочно-кишечном тракте малодоступных сложных соединений и обладает высоким коэффициентом всасывания. Активные компоненты препарата ферро-фольгамма находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание, главным образом, в верхнем отделе тонкой кишки. Абсорбционный коэффициент в значительной степени усилен присутствием в препарате аскорбиновой кислоты.
Ферро-фольгамма с успехом применялась для лечения анемии при различной акушерско-гинекологической патологии: пациенткам с маточными кровотечениями различной этиологии, гестозом в сочетании с анемией, плацентарной недостаточностью и хронической гипоксией плода.
Важно также подчеркнуть, что препарат ферро-фольгамма оказывается эффективным и в случаях сочетания беременности с другими патологиями, причем достаточно опасными. В частности, мы применяли препарат для лечения анемии у беременных с эпилепсией во второй половине беременности. Препарат назначался по 1 капсуле 3 раза в день до еды. Продолжительность терапии составила 1 месяц. За время лечения побочных эффектов, таких как аллергические реакции, желудочно-кишечные расстройства, не наблюдалось, поскольку наличие специальной оболочки обеспечивает усвоение препарата из кишечника, что значительно улучшает его переносимость.
Продолжительность терапии составила 1 месяц. За время лечения побочных эффектов, таких как аллергические реакции, желудочно-кишечные расстройства, не наблюдалось, поскольку наличие специальной оболочки обеспечивает усвоение препарата из кишечника, что значительно улучшает его переносимость.
При длительном течении анемии или при отсутствии эффекта от ее лечения, несмотря на умеренное снижение гемоглобина, нарушается функция плаценты, развивается плацентарная недостаточность, которая при анемии обусловлена резким снижением уровня железа не только в материнской крови, но и в плаценте. Это приводит к нарушению активности дыхательных ферментов в синцитиотрофобласте и снижению транспорта железа к плоду. При сочетании анемии с другой патологией беременности происходит нарушение не только газообмена, но и питательной функции плаценты.
На фоне проводимой терапии через 10 дней количество эритроцитов и величина гематокрита существенно не изменились, незначительно увеличилось содержание гемоглобина. После проведенного полного курса лечения происходило значительное увеличение содержания гемоглобина по сравнению с исходными данными в среднем почти на 22%. У беременных на фоне проводимой терапии наблюдалось улучшение общего самочувствия, улучшались сон и настроение, снижалась утомляемость. Применение ферро-фольгаммы в профилактических дозах позволяет снизить развитие анемии после родов, особенно после операции кесарево сечение. Для беременных, страдающих эпилепсией, наличие в препарате фолиевой кислоты и цианокобаламина является уникальным, так как позволяет снизить риск развития дефектов нервной трубки плода у этого контингента женщин.
После проведенного полного курса лечения происходило значительное увеличение содержания гемоглобина по сравнению с исходными данными в среднем почти на 22%. У беременных на фоне проводимой терапии наблюдалось улучшение общего самочувствия, улучшались сон и настроение, снижалась утомляемость. Применение ферро-фольгаммы в профилактических дозах позволяет снизить развитие анемии после родов, особенно после операции кесарево сечение. Для беременных, страдающих эпилепсией, наличие в препарате фолиевой кислоты и цианокобаламина является уникальным, так как позволяет снизить риск развития дефектов нервной трубки плода у этого контингента женщин.
Анемия — высокий риск для матери и плода!
К группе повышенного риска развития железодефицитной анемии относятся беременные женщины с анемией в анамнезе, наличием очагов хронической инфекции, хронических заболеваний желудочно-кишечного тракта, подвергшиеся воздействию неблагоприятных химических факторов, многорожавшие, с беременностью, характеризующейся многоплодием, рвотой, повторными кровотечениями, особенно при предлежании плаценты.
Наличие ЖДА во время беременности связано со значительным риском как для матери, так и для плода. Увеличение тяжести анемии сопровождается более частым развитием у беременной тяжелых форм гестоза, пиелонефрита, кровотечений во время родов. Кроме того, повышается риск преждевременных родов, плацентарной недостаточности и внутриутробной гибели плода.
В соответствии с рекомендациями ВОЗ женщинам во время беременности должна проводиться профилактика железодефицитной анемии (в дозе 50 мг/сут), а при наличии железодефицитной анемии (Hb
Издательство Juniper | Open Access Journal
Engineering Group
Pharma Group
Medical Group
Health Care Group
General Sciences
Microbiology Group
Формат PDF (Portable Document Format) 90 имеет формат 90
HTML
База данных HTML представляет собой сборник документов
Подробнее
Электронные книги
Издатели Juniper с честью принимают написанные электронные книги
Посмотреть ещё
Juniper Publishers Vision
«Содействовать созданию, распространению и применению научных знаний на благо общества и улучшению жизни людей. Основная миссия издательства Juniper — постоянно прилагать усилия для преобразования научной информации от исследователей со всего мира, в легкодоступные данные путем публикации на нашем веб-сайте. Наше видение состоит в том, чтобы создать открытую научную платформу, где у всех есть равные возможности искать, делиться и генерировать знания, расширяя возможности исследователей и ученых в их повседневной работе».
Основная миссия издательства Juniper — постоянно прилагать усилия для преобразования научной информации от исследователей со всего мира, в легкодоступные данные путем публикации на нашем веб-сайте. Наше видение состоит в том, чтобы создать открытую научную платформу, где у всех есть равные возможности искать, делиться и генерировать знания, расширяя возможности исследователей и ученых в их повседневной работе».
Последние статьи
1 2345678910Следующая
Мини-обзор
Мини-обзор
Мини-обзор
Обзорная статья
Исследовательская статья
Мини-обзор
Мнение
Исследовательская статья
Обзорная статья
Констриктивный перикардит, вторичный по отношению к туберкулезной инфекции: обзор литературы
Мария Исабель Гомес Корал*, Астрид Каролина Барко Гильен, Джессика Мариэла Амайя Альварес, Нэнси Каролина Амайя Гомес, Кристина Мариукси Куон Йенг Эскаланте, Кэтрин Натали Эспиналь Амайя, Каролина Мишель Мехиа Аланиз, Эрика Александра Салдана, Стефани
Журнал кардиологии и сердечно-сосудистой терапии
DOI:10. 19080/JOCCT.2022.18.555976
19080/JOCCT.2022.18.555976
Исследовательская статья
Отзывы
Я очень горжусь тем, что являюсь главным редактором Журнала кардиологии и сердечно-сосудистой терапии, онлайн-журнала высокого качества, привлекательного графического формата и интересного, полезного… Подробнее
Джузеппе Гуллас
Флорентийский университет , Италия
Global Journal of Archeology & Anthropology — очень величественный журнал. И я очень, очень, очень рад, что мне дали возможность писать статьи для журнала. Я… Подробнее
Лоуренс Томас
Школа Максвелла Сиракузский университет
Мне посчастливилось участвовать в кейс-стади Juniper Online Journal, где выдающиеся исследователи поддерживают меня и поддерживают их работу. Сам журнал показал высокий уровень и качество… Подробнее
Мохаммед Низар Баттихи
Центральные лаборатории Баттихи, Иордания
Мне нравится читать International Journal of Pulmonary and Respiratory Science, так как он объединяет представителей легочных дисциплин для обсуждения новых тенденций, результатов исследований и новых. .. Подробнее
.. Подробнее
Келли Л. Колвелл
Государственный университет Янгстауна, США
Наша работа была опубликована в журнале «Достижения в области стоматологии и гигиены полости рта» в 2017 году на тему «Управление вызовами реакции на лекарственные лихеноиды полости рта». Процесс публикации нашего ма… Подробнее
Кобкан Тонгпрасом
Университет Чулалонгкорн, Таиланд
Существует множество онлайн-журналов, которые следует учитывать, когда один из авторов представляет рукопись. Достижениям в стоматологии и гигиене полости рта следует уделять первостепенное внимание из-за их профессионального уровня… Подробнее
John E Nathan
Американский совет детской стоматологии, США
Я был действительно впечатлен качеством процесса публикации и высокой заметностью моей статьи, опубликованной в OAJT.
Акопова Ольга В.
Институт физиологии им.
/61/1.png) Богомольца, Украина
Богомольца, Украина Для исследователя и ученого важно иметь возможность делиться идеями и мыслями с другими профессионалами по всему миру. Журнал хирургии с открытым доступом (OAJS) позволил мне с… Подробнее
Уильям Джеймс Кобб
Оксфордский университет, Великобритания
Журнал медицины анестезии и интенсивной терапии (JAICM) — превосходный журнал, посвященный серьезным проблемам в отделениях анестезии и интенсивной терапии. Все опубликованные рукописи не… Подробнее
Gamal Agmy
Университет Асьюта, Египет
Железодефицитная анемия при беременности и роль внутривенного введения железа
Анемия, состояние, при котором количества эритроцитов недостаточно для удовлетворения физиологических потребностей организма в транспорте кислорода, затрагивает более трети женщин репродуктивного возраста во всем мире. 1 Резолюция 65.6 Всемирной ассамблеи здравоохранения одобрила комплексный план осуществления питания матерей, детей грудного и раннего возраста.
Хотя существует много этиологий анемии, от хронических заболеваний до острой кровопотери, считается, что 50% анемий, наблюдаемых во время беременности, связаны с дефицитом железа. 2 В соответствии с рекомендациями Всемирной организации здравоохранения (ВОЗ) анемия определяется как легкая (уровень гемоглобина 10-11 г/дл), умеренная (уровень гемоглобина 8,5-10 г/дл) и тяжелая ( уровень гемоглобина < 8,5 г/дл). 2
Согласно этому определению, данные Национального обследования здоровья и питания показали, что в Соединенных Штатах у 8,8% беременных женщин в какой-то момент во время беременности развивается анемия, причем примерно у половины этой когорты уровень гемоглобина менее 10 г/дл. 3 Риск анемии увеличивается с увеличением гестационного возраста, а к третьему триместру у 30% беременных наблюдается дефицит железа. 4
Распространенность анемии является важным показателем общественного здравоохранения. Несмотря на то, что анемия в первую очередь вызвана дефицитом железа, низкая кислородная способность может быть результатом других состояний, таких как хронические заболевания, которые остаются серьезной проблемой для здоровья в США. Однако исследования, изучающие текущие показатели анемии среди всего населения США и в более конкретных подгруппах, ограничены.
Однако исследования, изучающие текущие показатели анемии среди всего населения США и в более конкретных подгруппах, ограничены.
Анемию беременных следует лечить, поскольку многочисленные исследования показали, что анемия средней и тяжелой степени связана с неблагоприятными исходами для матери и новорожденного. 5-9 Вторичный анализ данных Консорциума по безопасному труду Национального института детского здоровья и развития Юнис Кеннеди Шрайвер показал, что у женщин с дородовой анемией наблюдались повышенные показатели тяжелой материнской заболеваемости (например, смерть, переливание крови, гистерэктомия) и неблагоприятные неонатальные исходы, и эти результаты сохранялись после поправки на сопутствующие факторы. 5
Хотя данные о положительном влиянии добавок железа на материнские и младенческие исходы ограничены, Кокрановский обзор 2015 года показал, что профилактические добавки железа уменьшают материнскую анемию в срок на 70% и дефицит железа в сроке на 57%. 10 Таким образом, выявление и лечение анемии во время беременности имеют первостепенное значение и могут служить профилактической мерой для кажущихся различными причин тяжелой материнской и неонатальной заболеваемости.
10 Таким образом, выявление и лечение анемии во время беременности имеют первостепенное значение и могут служить профилактической мерой для кажущихся различными причин тяжелой материнской и неонатальной заболеваемости.
Диагностика анемии является первым важным шагом в ее лечении, при этом определения анемии ВОЗ обычно соблюдаются в клинических условиях. Однако диагностика железодефицитной анемии как во время беременности, так и вне ее менее ясна. В начале дородовой помощи у каждой пациентки собирается общий анализ крови.
Если уровень гемоглобина ниже 11 г/дл, следующим шагом является определение причины анемии. Дифференциальный диагноз широк, особенно у пациентов с хроническими заболеваниями. Однако, поскольку дефицит железа является наиболее распространенной причиной анемии во время беременности, большинство экспертов рекомендуют начинать оценку с определения уровня ферритина в сыворотке крови.
Хотя существует несколько маркеров для оценки общих запасов железа в организме, таких как общее содержание железа в сыворотке, насыщение трансферрина, рецептор трансферрина в сыворотке и общая железосвязывающая способность, уровень ферритина в сыворотке менее или равный 30 нг/мл соответствует 92. % чувствителен и 98% специфичен для диагностики дефицита железа. 11
% чувствителен и 98% специфичен для диагностики дефицита железа. 11
В большей части ранней литературы по ферритину для определения дефицита железа использовалось значение меньше или равное 12 нг/мл. Однако более новые исследования показали, что хотя этот порог ферритина имеет высокую специфичность (98%) для дефицита железа, он имеет низкую чувствительность (25%), а это означает, что многие диагнозы будут упущены. 12,13
К сожалению, лаборатории нередко используют очень низкие уровни ферритина для определения дефицита железа даже у беременных женщин. Таким образом, крайне важно, чтобы заказывающий поставщик смотрел на абсолютное значение ферритина и интерпретировал его в контексте клинической картины, а не зависел от лаборатории, чтобы отметить результат как нормальный или ненормальный.
Если уровень ферритина меньше или равен 30 нг/мл, можно поставить диагноз дефицита железа. Однако если уровень гемоглобина ниже 11 г/дл, а ферритина выше 30 нг/мл, диагноз остается неопределенным. В таких случаях другие исследования железа могут подтвердить дефицит железа (например, общее насыщение железом <20%).
В таких случаях другие исследования железа могут подтвердить дефицит железа (например, общее насыщение железом <20%).
Средний корпускулярный объем (MCV) также полезен для руководства на следующем этапе оценки. Если MCV меньше 80 фл, это согласуется с микроцитарной анемией, и дифференциальный диагноз в первую очередь включает дефицит железа и гемоглобинопатию (серповидноклеточная анемия, талассемия). Электрофорез гемоглобина и тест на α-талассемию могут быть выполнены, чтобы исключить лежащую в основе гемоглобинопатию как причину анемии.
Если гемоглобинопатии нет, а ферритин выше 30 нг/мл, также может быть рассмотрен вопрос о направлении к гематологу для выяснения причины анемии. Если MCV составляет более 90–100 мкл, подозревается макроцитарная анемия, и обследование может включать обследование на дефицит фолиевой кислоты или B12.
После выявления дефицита железа следующим шагом является лечение. Хотя небеременной женщине требуется примерно 18 мг элементарного железа в день, беременным женщинам следует принимать примерно 30 мг в день. 14,15 Повышенная потребность во время беременности обусловлена увеличением объема крови матери и эритроидной массы плода.
14,15 Повышенная потребность во время беременности обусловлена увеличением объема крови матери и эритроидной массы плода.
Для получения необходимого суточного количества железа беременным женщинам, особенно страдающим анемией, часто необходимы дополнительные добавки. Для женщин с анемией легкой и средней степени тяжести в первом или втором триместре беременности (гестация <28 недель) лечение дефицита железа первой линии представляет собой комбинацию улучшенного питания и пероральных добавок железа.
Американский колледж акушеров и гинекологов рекомендует врачам и их пациентам обсудить употребление продуктов, богатых железом, включая креветки, индейку, обогащенные злаки, бобы, чечевицу, печень, устриц и моллюсков. 15 Также стоит рассмотреть продукты, которые ухудшают усвоение железа, такие как молочные и соевые продукты, шпинат, кофе или чай. 15
В дополнение к диетическим изменениям , пациентам также следует начать пероральные добавки железа.
Общие составы, включая содержание элементарного железа и побочные эффекты, показаны в таблице 1 . 16 Существуют различные препараты железа, такие как сульфат железа, фумарат железа, глюконат железа, глицинсульфат железа и сульфат железа, покрытые мукопротеозой. Сульфат железа широко используется из-за его широкой доступности и низкой стоимости; однако систематический обзор, сравнивающий различные составы перорального железа, показал, что лучше всего переносится глицин железа, покрытый мукопротеозой. 16 Наиболее распространенная дозировка всех составов составляет 325 мг, что будет содержать от 35 до 106 мг элементарного железа на таблетку. Максимальная энтеральная абсорбция железа составляет от 20% до 30%, но в среднем типичная абсорбция железа составляет от 10% до 15%. 14 Следовательно, из 325-мг таблетки сульфата железа, содержащей 65 мг элементарного железа, будет абсорбироваться только от 6,5 до 9,75 мг железа. 17
Железо для перорального приема является препаратом первого ряда; однако его эффективность часто ограничивается плохой кишечной абсорбцией. К сожалению, увеличение дозы перорального железа не улучшает эффективность. Это было показано в рандомизированном контролируемом исследовании (РКИ), в котором сравнивали 1 и 2 капсулы сульфата железа в день (34 мг элементарного железа на капсулу) для лечения железодефицитной анемии во время беременности. После 18 недель лечения не было различий в уровнях гемоглобина и ферритина между женщинами, принимавшими 1 или 2 капсулы в день.
К сожалению, увеличение дозы перорального железа не улучшает эффективность. Это было показано в рандомизированном контролируемом исследовании (РКИ), в котором сравнивали 1 и 2 капсулы сульфата железа в день (34 мг элементарного железа на капсулу) для лечения железодефицитной анемии во время беременности. После 18 недель лечения не было различий в уровнях гемоглобина и ферритина между женщинами, принимавшими 1 или 2 капсулы в день.
Возможное объяснение заключается в том, что более высокие и более частые дозы перорального приема железа приводят к увеличению выработки гормона гепсидина, который ингибирует всасывание железа из пищи, чтобы предотвратить дальнейшее насыщение железом. 18,19 По этой причине некоторые эксперты начали рекомендовать дозирование через день (прием железа через день, а не каждый день), поскольку это, по-видимому, приводит к эквивалентному или лучшему усвоению железа с меньшим количеством побочных эффектов. 20
Пероральные добавки железа часто плохо переносятся пациентами, сопровождаясь общими побочными эффектами, такими как тошнота и запор. В таких случаях прием пероральных препаратов железа через день может быть особенно полезен для уменьшения побочных эффектов и повышения соблюдения режима лечения по сравнению с ежедневным приемом или приемом два раза в день. 18,20
В таких случаях прием пероральных препаратов железа через день может быть особенно полезен для уменьшения побочных эффектов и повышения соблюдения режима лечения по сравнению с ежедневным приемом или приемом два раза в день. 18,20
Для дальнейшего уменьшения побочных эффектов пациенты часто обращаются за пероральными препаратами железа с кишечнорастворимой оболочкой или с пролонгированным высвобождением, но они могут снижать абсорбцию в дистальном отделе двенадцатиперстной кишки и проксимальном отделе тощей кишки, что ухудшает лечение. Исторически также считалось, что пероральное железо может улучшать усвоение при приеме вместе с добавкой витамина С, но недавнее РКИ показало, что этот подход не дает преимуществ по сравнению с пероральным приемом только железа. 21
Внутривенное (в/в) введение препаратов железа, позволяющее избежать ограниченного всасывания в кишечнике пероральных препаратов, становится все более доступным вариантом для пациентов с дефицитом железа. Внутривенное введение железа может увеличить запасы железа быстрее, чем пероральное, но оно остается недостаточно используемым во время беременности из-за стоимости и восприятия риска. 22 Подобно пероральному железу, доступны многочисленные препараты железа для внутривенного введения с различными рекомендациями по дозировке и контролю ( Таблица 2 ).
Внутривенное введение железа может увеличить запасы железа быстрее, чем пероральное, но оно остается недостаточно используемым во время беременности из-за стоимости и восприятия риска. 22 Подобно пероральному железу, доступны многочисленные препараты железа для внутривенного введения с различными рекомендациями по дозировке и контролю ( Таблица 2 ).
Сахароза железа является наиболее широко доступным вариантом, особенно в условиях стационара, и имеет долгую историю применения беременными женщинами с благоприятным профилем безопасности. Основным недостатком сахарозы железа является то, что в отличие от более новых препаратов железа для внутривенного введения, для которых может потребоваться только 1 или 2 инфузии, сахароза железа представляет собой многодозовый режим, который обычно требует 4 или 5 инфузий для пополнения запасов железа, в зависимости от общего дефицита железа. У большинства беременных женщин с железодефицитной анемией от умеренной до тяжелой степени дефицит железа составляет 1000 мг или более, но расчет общего дефицита железа в организме (масса тела в кг × [целевой уровень гемоглобина — фактический уровень гемоглобина в г/дл] × 2,45) может помочь определить точную потребность.
Исторически возникали опасения по поводу безопасности внутривенного введения железа из-за потенциального риска серьезной и фатальной анафилаксии. 15,23 Риск был самым высоким при использовании декстрана железа с высокой молекулярной массой, но этот состав больше не доступен. При использовании современных составов низкомолекулярного декстрана железа риск анафилаксии ниже и оценивается в 82 случая на 100 000 человек по сравнению с 21 случаем на 100 000 человек, принимающих сахарозу железа. 23
С момента первоначального использования внутривенного железа для лечения анемии во время беременности были проведены многочисленные клинические испытания внутривенного железа у беременных женщин, сравнивающие эффективность и безопасность внутривенного железа с пероральным.
Систематический обзор и метаанализ, сравнивающий внутривенное введение железа с пероральным для лечения железодефицитной анемии у беременных, показал, что внутривенное введение железа превосходит пероральное при лечении анемии у беременных ( Рисунок 1 ). 22 Вероятность достижения целевого уровня гемоглобина у беременных женщин, получавших препараты железа внутривенно, была в 2,7 раза выше, чем у женщин, принимавших препараты железа перорально, через 4 недели лечения. 22
22 Вероятность достижения целевого уровня гемоглобина у беременных женщин, получавших препараты железа внутривенно, была в 2,7 раза выше, чем у женщин, принимавших препараты железа перорально, через 4 недели лечения. 22
Точно так же женщины в группе внутривенного введения железа достигли более высокого уровня гемоглобина через 4 недели по сравнению с женщинами в группе перорального приема железа. Кроме того, у беременных женщин, получавших препараты железа внутривенно, частота нежелательных явлений была ниже, чем у женщин, принимавших препараты железа перорально, в первую очередь из-за более низкой частоты нежелательных явлений со стороны желудочно-кишечного тракта. 22
В другом систематическом обзоре и метаанализе, посвященном преимуществам внутривенного введения железа для лечения послеродовой анемии, также был сделан вывод, что у женщин, получавших внутривенное введение железа, были более высокие концентрации гемоглобина и ферритина на 1, 2, 3, 4 и 6 неделях послеродового периода. по сравнению с женщинами, принимающими железо перорально или перорально. 24
по сравнению с женщинами, принимающими железо перорально или перорально. 24
В своей практике мы разработали клинический алгоритм диагностики и лечения железодефицитной анемии у беременных ( Рисунок 2 ). Тем не менее, мы признаем, что рекомендации могут различаться в зависимости от популяции пациентов и условий практики, а также что стоимость и доступность различных препаратов железа для внутривенного введения могут различаться в стационарных или амбулаторных условиях.
Например, анализ требований по частному страхованию, проведенный Институтом затрат на здравоохранение, показал, что в 2017 году частные планы медицинского страхования платили от 412 до 4316 долларов за посещение для внутривенного введения железа. 25 Женщинам в первом или втором триместре беременности с железодефицитной анемией мы рекомендуем консультирование по вопросам питания и пробный прием пероральных препаратов железа. Уровень гемоглобина следует повторно оценить через 4–6 недель после начала лечения. Если у пациента сохраняется железодефицитная анемия и нет реакции на пероральные препараты железа, целесообразно начать лечение внутривенным введением железа .
Если у пациента сохраняется железодефицитная анемия и нет реакции на пероральные препараты железа, целесообразно начать лечение внутривенным введением железа .
Перед лечением препаратами железа для внутривенного введения важно исключить гемоглобинопатию или дефицит фолиевой кислоты и B12, на что указывают MCV и степень анемии. Беременным женщинам с железодефицитной анемией в третьем триместре или ранее при значительных факторах риска, таких как бариатрическая хирургия в анамнезе или многоплодная беременность, следует вводить железо внутривенно для более быстрого восполнения запасов железа при подготовке к родам. Медицинские работники должны стремиться к уровню гемоглобина более 10 г/дл при родах, чтобы снизить риск послеродового кровотечения и переливания крови.
Целевой уровень гемоглобина более 11 г/дл или полное устранение анемии может быть предпочтительным у пациентов с возражением против продуктов крови или с высоким риском переливания крови, например, с нарушениями свертываемости крови, предлежанием или приращением плаценты, или несколько предшествующих кесаревых сечений.
В заключение следует отметить, что железодефицитная анемия является глобальным заболеванием, от которого беременные женщины несут значительное бремя. К счастью, железодефицитная анемия является излечимым заболеванием при правильном и систематическом лечении.
Лечение железодефицитной анемии у беременных широко распространено, но препараты железа для внутривенного введения следует рассматривать чаще, когда диетические вмешательства и пероральные добавки железа не помогли устранить анемию.
Важно отметить, что этот подход, как ожидается, снизит риск неблагоприятных исходов для матери и новорожденного, уменьшит частоту переливаний крови и улучшит общее самочувствие матери до и после родов.
Ссылки 1. Всемирная организация здравоохранения. Глобальные цели ВОЗ в области питания на 2025 г.: краткое изложение политики в отношении анемии. 20 декабря 2014 г. По состоянию на 21 июня 2021 г. https://www.who.int/publications/i/item/WHO-NMH-NHD-14. 2
2
2. Анемия. Всемирная организация здравоохранения. По состоянию на 21 июня 2021 г. http://www.who.int/topics/anaemia/en/
3. Le CH. Распространенность анемии и анемии средней и тяжелой степени среди населения США (NHANES 2003-2012). PLoS Один . 2016;11(11):e0166635. doi:10.1371/journal.pone.0166635
4. Mei Z, Cogswell ME, Looker AC, et al. Оценка статуса железа у беременных женщин в США по данным Национального обследования состояния здоровья и питания (NHANES), 1999–2006 гг. Ам Дж Клин Нутр . 2011;93(6):1312-1320. doi:10.3945/ajcn.110.007195
5. Harrison RK, Lauhon SR, Colvin ZA, McIntosh JJ. Материнская анемия и тяжелая материнская заболеваемость в когорте США. Am J Obstet Gynecol MFM . Опубликовано в сети 13 мая 2021 г. doi:10.1016/j.ajogmf.2021.100395
6. Имдад А., Бхутта З.А. Обычный прием добавок железа/фолиевой кислоты во время беременности: влияние на материнскую анемию и исходы родов. Детский эпидемиологический перинат . 2012;26(доп.1):168-177. doi:10.1111/j.1365-3016.2012.01312.x
2012;26(доп.1):168-177. doi:10.1111/j.1365-3016.2012.01312.x
7. Perez EM, Hendricks MK, Beard JL., et al. Железодефицитная анемия матери влияет на взаимодействие матери и ребенка и развитие ребенка. Дж Нутр . 2005;135(4):850-855. doi:10.1093/jn/135.4.850
8. Parks S, Hoffman MK, Goudar SS, et al. Материнская анемия и исходы для матери, плода и новорожденного в проспективном когортном исследовании в Индии и Пакистане. БЙОГ . 2019;126(6):737-743. doi:10.1111/1471-0528.15585
9. Хайдер Б.А., Олофин И., Ван М., Шпигельман Д., Эззати М., Фаузи В.В.; Группа по изучению модели воздействия на питание (анемия). Анемия, пренатальное использование железа и риск неблагоприятных исходов беременности: систематический обзор и метаанализ. БМЖ . 2013;346:f3443. doi:10.1136/bmj.f3443
10. Peña-Rosas JP, De-Regil LM, Garcia-Casal MN, Dowswell T. Ежедневный пероральный прием препаратов железа во время беременности. Кокрановская система базы данных, версия . 2015;22(7):CD004736. doi:10.1002/14651858.CD004736.pub5
2015;22(7):CD004736. doi:10.1002/14651858.CD004736.pub5
11. Ачебе М.М., Гафтер-Гвили А. Как я лечу анемию у беременных: железо, кобаламин и фолиевая кислота. Кровь. 2017;129(8):940-949. doi:10.1182/blood-2016-08-672246
12. Goodnough LT, Nemeth E, Ganz T. Обнаружение, оценка и лечение ограниченного железом эритропоэза. Кровь . 2010;116(23):4754-4761. doi:10.1182/blood-2010-05-286260
13. Ali MA, Luxton AW, Walker WH. Концентрация ферритина в сыворотке и запасы железа в костном мозге: проспективное исследование. Can Med Assoc J. 1978;118(8):945-946.
14. Центры по контролю и профилактике заболеваний. Рекомендации по профилактике и контролю дефицита железа в США. MMWR Recomm Rep. 1998;47(RR-3):1-29.
15. Американский колледж акушеров и гинекологов. Практический бюллетень ACOG №. 95: анемия во время беременности. Акушерство Гинекол . 2008;112(1):201-207. doi:10.1097/AOG.0b013e3181809c0d
16. Кансело-Идальго М. Дж., Каштелу-Бранко С., Паласиос С. и др. Переносимость различных пероральных добавок железа: систематический обзор. Curr Med Res Opin . 2013;29(4):291-303. doi:10.1185/03007995.2012.761599
Дж., Каштелу-Бранко С., Паласиос С. и др. Переносимость различных пероральных добавок железа: систематический обзор. Curr Med Res Opin . 2013;29(4):291-303. doi:10.1185/03007995.2012.761599
17. Шинар С., Скорник-Рапапорт А., Масловитц С. Добавки железа при одноплодной беременности: есть ли польза от удвоения дозы элементарного железа беременным женщинам с дефицитом железа? рандомизированное контролируемое исследование. Дж Перинатол . 2017;37(7):782-786. doi:10.1038/jp.2017.43
18. Moretti D, Goede JS, Zeder C, et al. Пероральные добавки железа повышают уровень гепсидина и снижают всасывание железа при ежедневном или двукратном приеме у молодых женщин с дефицитом железа. Кровь . 2015;126(17):1981-1989. doi:10.1182/blood-2015-05-642223
19. Ганц Т., Немет Э. Импорт железа. IV. гепсидин и регуляция метаболизма железа в организме. Am J Physiol Gastrointest Liver Physiol . 2006;290(2):G199-Г203. doi:10.1152/ajpgi.00412.2005
20. Стоффель Н.Ю., Зедер С., Бриттенхэм Г.М., Моретти Д., Циммерманн М.Б. У женщин с железодефицитной анемией абсорбция железа из добавок выше при приеме через день, чем при приеме через день. Гематологические . 2020;105(5):1232-1239. doi:10.3324/HAEMATOL.2019.220830
Стоффель Н.Ю., Зедер С., Бриттенхэм Г.М., Моретти Д., Циммерманн М.Б. У женщин с железодефицитной анемией абсорбция железа из добавок выше при приеме через день, чем при приеме через день. Гематологические . 2020;105(5):1232-1239. doi:10.3324/HAEMATOL.2019.220830
21. Li N, Zhao G, Wu W, et al. Эффективность и безопасность витамина С в качестве добавок железа у взрослых пациентов с железодефицитной анемией: рандомизированное клиническое исследование. Открытие сети JAMA . 2020;3(11):e2023644. doi:10.1001/jamanetworkopen.2020.23644
22. Говиндаппагари С., Бервик Р.М. Лечение железодефицитной анемии у беременных внутривенным и пероральным препаратами железа: систематический обзор и метаанализ. Ам Дж Перинатол . 2019;36(4):366-376. doi:10.1055/s-0038-1668555
23. Wang C, Graham DJ, Kane RC, et al. Сравнительный риск анафилактических реакций, связанных с внутривенными препаратами железа. ЯМА . 2015;314(19):2062-2068. doi:10.
