| Пиобактериофаг комплексный 📜 Инструкция по применению Пиобактериофаг комплексный 💊 Состав препарата Пиобактериофаг комплексный ✅ Применение препарата Пиобактериофаг комплексный 📅 Условия хранения Пиобактериофаг комплексный ⏳ Срок годности Пиобактериофаг комплексный Сохраните у себя Поделиться с друзьями Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности Описание лекарственного препарата Пиобактериофаг комплексный (Pyobacteriophage complex) Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2011 года, дата обновления: 2020. Владелец регистрационного удостоверения:Код ATX: V03A (Прочие разные препараты)Лекарственные формы
Форма выпуска, упаковка и состав препарата Пиобактериофаг комплексный
Консервант: хинозол 0.0001 г/мл 20 мл — флаконы (8) — пачки картонные.
Консервант: хинозол 0.0001 г/мл 100 мл — флаконы (1) — пачки картонные. Фармакологическое действиеПиобактериофаг комплексный жидкий обладает способностью специфически лизировать бактерии стафилококков, стрептококков, энтерококков, протея, клебсиелл пневмония и окситока, синегнойной и кишечной палочек. Показания препарата Пиобактериофаг комплексныйЛечение и профилактика гнойно-воспалительных и кишечных заболеваний, вызванных стафилококками, энтерококками, стрептококками, синегнойной палочкой, клебсиеллами, патогенной кишечной палочкой различных серогрупп, протеем при внутреннем, ректальном и наружном применении:
С профилактической целью препарат используют для обработки операционных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям. Важным условием эффективной фаготерапии является предварительное определение фагочувствителыюсти возбудителя. Открыть список кодов МКБ-10
Режим дозированияЛечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и через рот, 7-20 дней (по клиническим показаниям). В зависимости от характера очага инфекции бактериофаг применяют:
Рекомендуемые дозировки препарата
Применение бактериофагов не исключает использования других антибактериальных препаратов. Применение бактериофага у детей (до 6 месяцев). При сепсисе, энтероколите новорожденных, включая недоношенных детей, бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки (см. табл.). При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в клизмах) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней. При лечении омфалитов, пиодермии, инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или на пораженный участок кожи). Побочное действиеНе установлено. Противопоказания к применениюОтсутствуют. Применение при беременности и кормлении грудьюВозможно применение препарата при беременности и в период грудного вскармливания по показаниям. Применение у детейПрименение возможно согласно режиму дозирования. Применение у пожилых пациентовПрименение возможно согласно режиму дозирования. Особые указанияПеред употреблением флакон с жидким бактериофагом необходимо взбалтывать. Влияние на способность к управлению транспортными средствами и механизмами Сведения о возможном влиянии лекарственного препарата на способность управлять транспортными средствами, механизмами отсутствуют. ПередозировкаМеры по оказанию помощи при передозировке не установлены. Лекарственное взаимодействиеПрименение препарата возможно в сочетании с другими лекарственными средствами, в т.ч. с антибиотиками. Условия хранения препарата Пиобактериофаг комплексныйХранение в соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8 °С в сухом, защищенном от света и недоступном для детей месте. Замораживание не допускается. Срок годности препарата Пиобактериофаг комплексныйСрок годности — 2 года. Транспортирование в соответствии с СП 3.3.2.1248-03 при температуре от 2° до 8°С, допускается транспортирование при температуре от 9° до 25°С не более 1 месяца. Замораживание не допускается. Условия реализацииБез рецепта. Сохраните у себя Поделиться с друзьями Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности | ||
Пиобактериофаг поливалентный очищенный инструкция по применению: показания, противопоказания, побочное действие – описание Pyobacteriophage polyvalent purified р-р д/приема внутрь, местн. и наружн. прим.: фл. 20 мл 4 или 10 шт. (36440)
Перед использованием флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
Препарат должен быть прозрачным и не содержать осадка.
Внимание! При помутнении препарат не применять!
Вследствие содержания в препарате питательной среды, в которой могут развиваться бактерии из окружающей среды, вызывая помутнение препарата, необходимо при вскрытии флакона соблюдать следующие правила:
- тщательно мыть руки;
- обработать колпачок спиртсодержащим раствором; снять колпачок, не открывая пробки;
- не класть пробку внутренней поверхностью на стол или другие предметы;
- не оставлять флакон открытым;
- вскрытый флакон хранить только в холодильнике.
При использовании малых доз (2-8 капель) препарат необходимо отбирать стерильным шприцем в объеме 0.5-1 мл.
Препарат из вскрытого флакона при соблюдении условий хранения, вышеперечисленных правил и отсутствии помутнения может быть использован в течение всего срока годности.
Препарат используют для приема внутрь (через рот), в виде клизм, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа, а также в дренированные полости: абсцессов, брюшную, плевральную, мочевого пузыря, почечной лоханки.
Внутрь препарат принимают натощак за 0.5-1 час до приема пищи.
Рекомендуемые дозировки препарата
| Возраст пациента | Доза на 1 прием при различных способах введения препарата | |
| внутрь (мл) | в клизме (мл) | |
| 0-6 мес | 5 | 10 |
| 6-12 мес | 10 | 20 |
| От 1 года до 3 лет | 15 | 20-30 |
| От 3 до 8 лет | 20 | 30-40 |
| От 8 лет и старше | 20-30 | 40-50 |
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь.
В случае обработки полости гнойного очага химическими антисептиками перед применением бактериофага она должна быть промыта стерильным 0.9 % раствором натрия хлорида.
При лечении ангины, фарингита, ларингита препарат используют для полосканий полости рта и глотки 3 раза в день по 10-20 мл, курс лечения 7-10 дней.
При лечении бронхита, пневмонии препарат принимают внутрь 3 раза в день по 10-20 мл, а также применяют в виде аэрозолей и ингаляций (без подогрева и использования ультразвука), курс лечения 15-20 дней.
При лечении отита препарат используют для промывания и введения в полость среднего уха по 2-5 мл 1-3 раза в день. Курс лечения 7-15 дней.
При лечении воспаления пазух носа препарат используют для промывания полости носа, носоглотки и пазух носа в дозе 5-10 мл и введения в пазухи 2-3 мл. Процедуру повторяют ежедневно однократно в течение 7-10 дней. Кроме того, препарат вводят в полость носа в виде турунд, смоченных бактериофагом, по очереди в каждый носовой ход и оставляют в течение 0,5-1 часа. Процедуру повторяют 3 раза в день, курс лечения 7-15 дней.
При лечении стоматита и хронического пародонтита препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в парадонтальные карманы турунд, пропитанных бактериофагом, на 5-10 мин, курс лечения 7-10 дней.
При конъюнктивите и кератоконъюнктивите препарат применяют по 2-3 капли 4-5 раз в день, курс лечения 5-7 дней; при гнойной язве роговицы — по 4-5 капель в день в течение 7-10 дней, при гнойном иридоциклите — по 6-8 капель каждые 3 часа в сочетании с приемом внутрь в терапевтических дозировках в течение 7-10 дней.
При абсцессе после вскрытия и удаления гнойного содержимого препарат вводят в количестве меньшем, чем объем удаленного гноя ежедневно однократно, курс лечения 7-10 дней.
При перитоните и плеврите препарат вводят в дренированные полости — брюшную и плевральную через дренажные трубки ежедневно однократно 20-70 мл, курс лечения 10-15 дней.
При остеомиелите препарат вводят в полость раны через турунды, дренажи в количестве 10-30 мл ежедневно однократно, курс лечения 15-20 дней.
При лечении мастита, нагноений ран и ожогов, препарат применяют в виде орошения, аппликаций, повязок, введения в дренаж в дозе 5-50 мл в зависимости от очага поражения не менее 1 раз в день, курс лечения 10-15 дней.
При лечении гнойно-воспалительных гинекологических заболеваний (нагноений ран, эндометрита, вульвита, бартолинита, кольпита, сальпингоофорита) препарат используют для орошений, аппликаций, вводят в полости ран, вагины, матки по 5-20 мл один раз в день в течение 7-10 дней.
При цистите, пиелонефрите, уретрите препарат принимают внутрь в терапевтической дозе 3 раза в день за 1 час до еды в течение 10-20 дней. В том случае, если полость мочевого пузыря или почечной лоханки дренированы, препарат вводят через цистостому или нефростому 1-3 раза в день по 20-50 мл в мочевой пузырь и 5-7 мл в почечную лоханку, курс лечения 7-15 дней.
При гастроэнтероколите, панкреатите, холецистите, а также дисбактериозе кишечника бактериофаг принимают внутрь в возрастных дозировках 3 раза в день за 1 час до еды в течение 7-15 дней (по клиническим показаниям). При неукротимой рвоте препарат применяют в виде высоких клизм 2-3 раза в день по 20-40 мл. При дисбактериозе кишечника препарат может применяться с препаратами нормофлоры.
Для профилактики внутрибольничных хирургических инфекций препарат используют для обработки послеоперационных и свежеинфицированных ран в дозе 5-50 мл в зависимости от очага поражения ежедневно однократно в течение 5-7 дней.
Применение препарата у детей до 1 года (включая недоношенных детей)
При гастроэнтероколите, пневмонии и сепсисе новорожденных препарат применяют через рот 2-3 раза в сутки по 3-5 мл за 30 минут до кормления. В случаях неукротимой рвоты препарат применяют в виде высоких клизм (через газоотводную трубку или катетер) ежедневно однократно в дозе 5-10 мл. Возможно сочетание ректального (в виде высоких клизм) и перорального применения препарата. Курс лечения 7-15 дней (по клиническим показаниям). При рецидивирующем течении заболевания возможно повторное проведение курсов лечения.
При лечении омфалита, пиодермии, инфицированных ран бактериофаг применяют в виде аппликаций по 5-10 мл 2-3 раза в день (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или пораженный участок кожи) в течение 7-15 дней.
С целью профилактики возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют по эпидемическим показаниям внутрь по 3-5 мл 3 раза в день за 30 минут до кормления в течение всего срока пребывания в стационаре.
Пиобактериофаг комплексный: инструкция к препарату, отзывы
«Пиобактериофаг комплексный» – антибактериальное лекарственное средство, являющееся бактериофагом.
Медицинский препарат выпускается в виде растворов для приема внутрь, а также для местного наружного использования и представляет собой жидкость прозрачного, слегка желтого цвета, однако цвет ее варьируется от светлого до темно-желтого, иногда с выраженным зеленоватым оттенком.
Упаковано данное лекарственное средство во флаконы по 20 мл, помещенные в картонные коробки по 8 штук, а также во флаконы по 100 мл, по 1 штуке в пачке.
Состав медикамента
Активное вещество, которое входит в состав 1 мл данного раствора, – это стерильно-очищенные фильтраты фаголизатов бактерий Streptococcus, Proteus mirabilis, Enterococcus, энтеропатогенные Escherichia coli, Staphylococcus и Proteus vulgaris, Klebsiella pneumoniae, Klebsiella oxytoca и Pseudomonas aeruginosa.
В качестве дополнительных компонентов используются консерванты: 8-гидроксихинолина сульфат либо 8-гидроксихинолин сульфат моногидрат.
Фармакологические свойства лекарственного средства
«Пиобактериофаг комплексный» вызывает лизис следующих разновидностей бактерий:
- энтеропатогенных Escherichia coli;
- Staphylococcus;
- Proteus vulgaris;
- Pseudomonas aeruginosa;
- Klebsiella pneumonia;
- Streptococcus, Enterococcus;
- Proteus mirabilis;
- Klebsiella oxytoca.
Показания к применению
Согласно инструкции, «Пиобактериофаг комплексный» может применяться для профилактики и лечения разнообразных гнойных, воспалительных и кишечных заболеваний, которые вызваны воздействием таких патологических микроорганизмов, как энтерококки, стрептококки, стафилококки, синегнойная палочка, клебсиелла, протеи, кишечная палочка разных серогрупп.
Таким образом, применение лекарственного препарата показано при возникновении следующих патологических состояний:
- Возникновение энтеральных инфекций — дисбактериоза, гастроэнтероколита, холецистита.

- При заболеваниях ЛОР-органов, а также верхних дыхательных путей и легких – воспалительные процессы в среднем ухе и пазухах носа, ларингиты, фарингиты, ангина, трахеиты, бронхиты, плевриты, пневмонии.
- Разнообразные инфекции мочевыводящих путей — циститы, уретриты, пиелонефриты.
- При заражении генитальными инфекциями — сальпингоофориты, эндометриты, кольпиты.
- При возникновении генерализованных форм различных септических заболеваний — конъюнктивита, кератоконъюнктивита, иридоциклита, гнойной язвы роговицы глаза.
- При хирургических инфекциях — карбункулах, фурункулах, флегмонах, абсцессах, панарициях, гидраденитах, ожогах, нагноении ран, остеомиелитах, бурситах, маститах, парапроктитах.
- При возникновении гнойно-воспалительных заболеваний у младенцев — конъюнктивитов, омфалитов, пиодермии, гастроэнтероколитов, сепсиса и т. д.
- При некоторых других заболеваниях, которые спровоцированы вышеперечисленными патогенными микроорганизмами.

Применение медикамента для профилактики
В профилактических целях данное лекарственное средство можно применять для предупреждения возникновения разнообразных внутрибольничных инфекций, для обработки свежих послеоперационных ран. Кроме этого, применение медикаментозного препарата «Пиобактериофаг комплексный» может быть целесообразным в случаях любых поверхностных повреждений кожи у взрослых и детей в качестве сильного антисептического средства.
Противопоказания к применению
Медицинский препарат противопоказан при наличии симптомов повышенной чувствительности к основным либо вспомогательным его компонентам. В остальных случаях его применять можно.
Способ применения
Как принимать «Пиобактериофаг комплексный»?
Он используется по-разному, в зависимости от очага инфицирования — в виде закапываний, полосканий, промываний и введения смоченных в растворе тампонов при патологических процессах, протекающих в ЛОР-органах. В этом случае лекарственное средство применяется по 2–10 мл несколько раз в сутки. Тампоны, смоченные в лекарственном растворе, оставляют, как правило, на 1 час.
Тампоны, смоченные в лекарственном растворе, оставляют, как правило, на 1 час.
При закапываниях в конъюнктивальный мешок — при развитии конъюнктивитов и кератоконъюнктивитов – по 2 капли 5 раз в сутки. При образовании гнойных язв на роговице – по 5 капель, при развитии гнойных иридоциклитов – по 8 капель каждые 2 часа, сочетая при этом местное лечение медикаментом с приемом его внутрь. При применении различных орошений и примочек «Пиобактериофаг комплексный» используется в количестве до 150 мл, что зависит от размеров очагов воспаления.
При абсцессах лекарственный раствор вводится непосредственно в полость очага после очищения ее от гнойного содержимого, и осуществляется это посредством пункции в количестве, примерно равном объему удаленного гноя.
При остеомиелите медикамент используют посредством вливания в рану после необходимой хирургической обработки в объеме 10 мл. Для полоскания полости рта при развитии стоматитов и хронических пародонтитов: по 20 мл несколько раз в сутки. Также возможно введение пропитанных лекарственным раствором турунд в пародонтальные карманы.
Также возможно введение пропитанных лекарственным раствором турунд в пародонтальные карманы.
Применение «Пиобактериофага комплексного» возможно в виде клизм при развитии дисбактериоза кишечника, а также при кишечных формах патологий внутренних органов.
Для лечения и профилактики инфекций мочевыводящих путей применяются дренажи в полость почечных лоханок либо мочевого пузыря – препарат при этом вводится через нефростому либо цистостому 2 раза в день в объеме 20–50 мл.
Лечение патологических процессов, характеризующихся образованием гноя и возникновением воспаления, проводится, как правило, и местно, и перорально. Продолжительность лечебных процедур зависит от характера заболевания и его степени и составляет обычно от 7 до 20 дней.
Назначение медикамента не исключает использования других антибактериальных средств. Это подтверждает инструкция по применению к «Пиобактериофагу комплексному».
Побочные явления
До нынешнего времени случаев возникновения побочных реакций при применении лекарственного средства зарегистрировано не было.
Случаев передозировки лекарственным препаратом также не было зарегистрировано.
Особые указания
Основным условием эффективности терапии данным медикаментом является заблаговременное определение фагочувствительности возбудителей заболевания и применение «Пиобактериофага» на ранних стадиях болезни. Перед каждым применением флакон с лекарственным раствором необходимо встряхивать. Перед его вскрытием необходимо дезинфицировать руки, обрабатывать колпачок флакона спиртовыми растворами. Данные мероприятия необходимы для того, чтобы бактерии не попали внутрь флакона, поскольку это может вызвать помутнение раствора и непригодность лекарственного средства. Хранить препарат следует в холодильнике.
Отличия «Пиобактериофага» комплексного и поливалентного
В лечении инфекционно-воспалительных патологий, возбудителями которых являются патогенные микробы, применяют растворы со стерильными фаголизатами этих микроорганизмов в составе. В аптеке обычно можно найти два типа таких средств: «Пиобактериофаг» поливалентный и комплексный. Разницы между ними на первый взгляд нет, поэтому часто приобретается не тот препарат, что нужно.
Разницы между ними на первый взгляд нет, поэтому часто приобретается не тот препарат, что нужно.
Отличительные черты можно найти в инструкции, в частности при тщательном изучении их состава.
В растворе комплексного средства еще дополнительно содержится стерильный фаголизат энтерококков.
Существенная разница между действием поливалентного и комплексного «Пиобактериофага» отсутствует. Список показаний у них полностью одинаков. Хотя одно отличие все же есть — если патология вызвана энтерококками, раствор поливалентный будет неэффективен.
Что лучше купить, решать вам. Но следует учесть нюанс. Перед назначением любых лекарств с противомикробным действием нужно провести анализ, при помощи которого можно выявить возбудителей болезни и их чувствительность к препаратам.
Так что, если недуг спровоцировали энтерококки, лучше приобретать комплексный раствор.
«Пиобактериофаг комплексный»: отзывы
Для детей данное средство очень хорошо подходит. Это подтверждают многочисленные отзывы. Оно действительно эффективно, помогает быстро. Люди отмечают, что оно редко вызывает побочные реакции, только если имеется индивидуальная непереносимость.
Оно действительно эффективно, помогает быстро. Люди отмечают, что оно редко вызывает побочные реакции, только если имеется индивидуальная непереносимость.
Пиобактериофаг комплексный в Новокузнецке — инструкция по применению, описание, отзывы пациентов и врачей, аналоги
Описание препарата
Пиобактериофаг комплексный, как и его аналоги, обладает специфическим антибактериальным свойством. Выпускают медикамент в жидкой форме. В инструкции по применению пиобактериофага комплексного указано, что действие препарата направлено на гибель болезнетворных клеток, а также дальнейшее заражение прочих чувствительных микроорганизмов. Результаты исследований показали, что активный компонент не нарушает естественную микрофлору.
Бактериальные инфекции могут вызвать серьезные нарушения в организме. Как правило, рост патогенных микроорганизмов диагностируют у пациентов со сниженной защитной функцией. Бактерии могут поселиться на слизистых оболочках, кожных покровах, а также в кишечнике. Существует несколько методов определения возбудителя заболевания – окрашивание мазка, высевание биологического материала, определение наличия антител в крови, анализ патогенности микроорганизма. Для проведения исследования используют различный материал, содержащий геномную информацию ткани и выделения. Купить пиобактериофаг комплексный можно в сети аптек.
Заболевания, вызванные бактериями, лечат с помощью антибиотиков. Схему, а также продолжительность лечения назначает специалист в каждом индивидуальном случае. Бесконтрольный прием таких медикаментов, может спровоцировать развитие устойчивости к действующим компонентам. Такая реакция чаще всего появляется во время лечения пациентов от стафилококка. В отличие от антибиотиков, у бактериофагов низкая вероятность развития резистентности. Клинические испытания подтвердили эффективность лечения вирусами, избирательно поражающими бактериальные клетки.
Существует несколько методов определения возбудителя заболевания – окрашивание мазка, высевание биологического материала, определение наличия антител в крови, анализ патогенности микроорганизма. Для проведения исследования используют различный материал, содержащий геномную информацию ткани и выделения. Купить пиобактериофаг комплексный можно в сети аптек.
Заболевания, вызванные бактериями, лечат с помощью антибиотиков. Схему, а также продолжительность лечения назначает специалист в каждом индивидуальном случае. Бесконтрольный прием таких медикаментов, может спровоцировать развитие устойчивости к действующим компонентам. Такая реакция чаще всего появляется во время лечения пациентов от стафилококка. В отличие от антибиотиков, у бактериофагов низкая вероятность развития резистентности. Клинические испытания подтвердили эффективность лечения вирусами, избирательно поражающими бактериальные клетки.
Форма выпуска, состав и упаковка
Пиобактериофаг комплексный, как и его поливалентный аналог, имеет форму раствора для внутреннего и местного применения. В каждом флаконе препарата дозировкой двадцать или сто миллилитров содержится очищенная смесь разрушенных фагом клеток, содержащая вирусные частицы. В качестве консерванта производитель использует Chinosolum. Антибактериальное средство назначают при диагностировании заболеваний, спровоцированных патогенными и условно-патогенными микроорганизмами.
Препарат в жидком виде помещен в упаковки из стекла. В аптеках фаг можно купить в картонных пачках по восемь штук (20 мл каждый) или один флакон (в дозировке 100 мл).
В каждом флаконе препарата дозировкой двадцать или сто миллилитров содержится очищенная смесь разрушенных фагом клеток, содержащая вирусные частицы. В качестве консерванта производитель использует Chinosolum. Антибактериальное средство назначают при диагностировании заболеваний, спровоцированных патогенными и условно-патогенными микроорганизмами.
Препарат в жидком виде помещен в упаковки из стекла. В аптеках фаг можно купить в картонных пачках по восемь штук (20 мл каждый) или один флакон (в дозировке 100 мл).
Фармакологическое действие
МИБП-фаг растворяет клетки и их системы, в том числе болезнетворные микроорганизмы, такие как кокки, протей, кишечная и синегнойная палочка, палочка Фридлендера.
Показания
Антибактериальный препарат назначают пациентам с диагностированными заболеваниями кишечника, а также кожи, сопровождающимися воспалительным процессом в острой или хронической форме. Провоцируют развитие таких нарушений кокки, палочки (синегнойная и кишечная), протей. Чаще всего перечисленные микроорганизмы вызывают следующие нарушения:
1. Со стороны дыхательной системы – воспаление слизистой оболочки зева, глотки, гортани, трахеи, бронхов, легких, а также отек плевры.
2. Гнойное воспаление тканей с их расплавлением и образованием гнойной полости; гнойный воспалительный процесс клетчатки, соединительной ткани; болезненные, воспаленные, заполненные гноем полости в коже; острое воспаление нескольких волосяных мешочков с образованием гнойно-некротического инфильтрата; воспаление молочной железы; гнойно-некротический процесс, развивающийся в кости и костном мозге.
3. Воспаление органов мочевыводящих путей, в том числе мочевого пузыря, придатка матки, слизистой оболочки влагалища, уретры, поражение канальцевой системы почки, воспалительный процесс во внутреннем слизистом слое матки.
4. Воспаление роговицы и конъюнктивы, передний увеит, язвенный кератит.
Провоцируют развитие таких нарушений кокки, палочки (синегнойная и кишечная), протей. Чаще всего перечисленные микроорганизмы вызывают следующие нарушения:
1. Со стороны дыхательной системы – воспаление слизистой оболочки зева, глотки, гортани, трахеи, бронхов, легких, а также отек плевры.
2. Гнойное воспаление тканей с их расплавлением и образованием гнойной полости; гнойный воспалительный процесс клетчатки, соединительной ткани; болезненные, воспаленные, заполненные гноем полости в коже; острое воспаление нескольких волосяных мешочков с образованием гнойно-некротического инфильтрата; воспаление молочной железы; гнойно-некротический процесс, развивающийся в кости и костном мозге.
3. Воспаление органов мочевыводящих путей, в том числе мочевого пузыря, придатка матки, слизистой оболочки влагалища, уретры, поражение канальцевой системы почки, воспалительный процесс во внутреннем слизистом слое матки.
4. Воспаление роговицы и конъюнктивы, передний увеит, язвенный кератит. 5. Дисбаланс микрофлоры кишечника, воспаление стенок желчного пузыря, воспалительное заболевание желудка, толстого и тонкого отделов кишечника желудочно-кишечного тракта.
6. Воспаление кожи и подкожной клетчатки в области пупочной раны; гнойное поражение кожи, возникающее в результате внедрения в неё гноеродных кокков; воспаление наружной оболочки глаза.
7. В качестве профилактики инфицирования ран, в том числе послеоперационных.
Перед началом лечения производитель рекомендует в обязательном порядке провести определение чувствительности возбудителя заболевания к действию фага. В Москве пиобактериофаг комплексный можно приобрести с доставкой на дом.
5. Дисбаланс микрофлоры кишечника, воспаление стенок желчного пузыря, воспалительное заболевание желудка, толстого и тонкого отделов кишечника желудочно-кишечного тракта.
6. Воспаление кожи и подкожной клетчатки в области пупочной раны; гнойное поражение кожи, возникающее в результате внедрения в неё гноеродных кокков; воспаление наружной оболочки глаза.
7. В качестве профилактики инфицирования ран, в том числе послеоперационных.
Перед началом лечения производитель рекомендует в обязательном порядке провести определение чувствительности возбудителя заболевания к действию фага. В Москве пиобактериофаг комплексный можно приобрести с доставкой на дом.
Противопоказания
Отсутствует клинически зафиксированная информация о возможной причине отказа от медицинского лечения из-за вреда, который препарат способен причинить пациенту.
Дозировка
Терапия нарушений, сопровождающихся гнойным процессом, должна осуществляться двумя способами – перорально и местно. Продолжительность терапевтического периода зависит от анамнеза и текущего состояния пациента. Стандартно производитель рекомендует применять фаг от семи до двадцати суток в зависимости от клинических показаний:
1. Жидким раствором обрабатывают пораженные участки, количество препарата зависит от размеров очага воспаления. Также фаг вводят непосредственно в полость очага нарыва или гнойника, но только после удаления гноя из органов или тканей, вызванного воспалительным процессом. При гнойно-некротическом процессе, развивающемся в кости и костном мозге, в рану вводят в среднем пятнадцать миллилитров препарата.
2. При воспалительных процессах мочевых путей фаг следует принимать перорально. Также раствор вводят непосредственно в мочевой пузырь (по двадцать-пятьдесят миллилитров) и почечную лоханку (от пяти до семи миллилитров).
3. Для лечения гинекологических заболеваний антибактериальное средство вводят в матку или влагалище ежедневно. Оптимальная дозировка составляет от пяти до десяти миллилитров.
Продолжительность терапевтического периода зависит от анамнеза и текущего состояния пациента. Стандартно производитель рекомендует применять фаг от семи до двадцати суток в зависимости от клинических показаний:
1. Жидким раствором обрабатывают пораженные участки, количество препарата зависит от размеров очага воспаления. Также фаг вводят непосредственно в полость очага нарыва или гнойника, но только после удаления гноя из органов или тканей, вызванного воспалительным процессом. При гнойно-некротическом процессе, развивающемся в кости и костном мозге, в рану вводят в среднем пятнадцать миллилитров препарата.
2. При воспалительных процессах мочевых путей фаг следует принимать перорально. Также раствор вводят непосредственно в мочевой пузырь (по двадцать-пятьдесят миллилитров) и почечную лоханку (от пяти до семи миллилитров).
3. Для лечения гинекологических заболеваний антибактериальное средство вводят в матку или влагалище ежедневно. Оптимальная дозировка составляет от пяти до десяти миллилитров. 4. При поражениях слизистой оболочки полости рта медикамент назначают в виде полосканий. Фаг должен использоваться в дозировке от десяти до двадцати миллилитров. В течение дня процедуру необходимо провести три-четыре раза.
5. При дисбиозах и нарушениях работы внутренних органов препарат назначают в виде введения жидкости через задний проход в прямую кишку или непосредственно в толстую кишку. Можно принимать фаг также внутрь (перорально).
6. Для лечения лор-заболеваний фаг назначают в среднем по шесть миллилитров (от одного до трех раз) в течение дня. Смоченные турунды оставляют в полости рта на шестьдесят минут.
Дозировка препарата зависит не только от заболевания и способа введения, но и от возраста пациента. Допускается комбинированное лечение с использованием прочих антибактериальных средств. Если перед нанесением фага местно использовались другие антисептические средства, рану следует предварительно обработать физраствором.
Пациентам младшей возрастной категории (до шести месяцев) фаг назначают в виде клизм, реже – пероральным способом, только при отсутствии частого срыгивания.
4. При поражениях слизистой оболочки полости рта медикамент назначают в виде полосканий. Фаг должен использоваться в дозировке от десяти до двадцати миллилитров. В течение дня процедуру необходимо провести три-четыре раза.
5. При дисбиозах и нарушениях работы внутренних органов препарат назначают в виде введения жидкости через задний проход в прямую кишку или непосредственно в толстую кишку. Можно принимать фаг также внутрь (перорально).
6. Для лечения лор-заболеваний фаг назначают в среднем по шесть миллилитров (от одного до трех раз) в течение дня. Смоченные турунды оставляют в полости рта на шестьдесят минут.
Дозировка препарата зависит не только от заболевания и способа введения, но и от возраста пациента. Допускается комбинированное лечение с использованием прочих антибактериальных средств. Если перед нанесением фага местно использовались другие антисептические средства, рану следует предварительно обработать физраствором.
Пациентам младшей возрастной категории (до шести месяцев) фаг назначают в виде клизм, реже – пероральным способом, только при отсутствии частого срыгивания. Допускается смешивание жидкого раствора с грудным молоком. Срок лечения зависит от опасности заболевания.
Для использования фага в виде аппликаций, медикаментом смачивают марлевую повязку и наносят на пораженный участок кожного покрова два раза в течение дня. Средняя цена на пиобактериофаг комплексный составляет 824,00 рубля.
Допускается смешивание жидкого раствора с грудным молоком. Срок лечения зависит от опасности заболевания.
Для использования фага в виде аппликаций, медикаментом смачивают марлевую повязку и наносят на пораженный участок кожного покрова два раза в течение дня. Средняя цена на пиобактериофаг комплексный составляет 824,00 рубля.
Побочные действия
Сведения о возможных побочных эффектах пиобактериофага комплексного и соответствующие отзывы пациентов отсутствуют.
Передозировка
Мероприятия по оказанию медицинской помощи при чрезмерном использовании препарата не зафиксированы.
Лекарственное взаимодействие
Допускается одновременное использование фага с другими медикаментами, в том числе и антибактериальными.
Особые указания
Перед использованием флакон с раствором нужно взболтать. Запрещено употреблять бактериофаг при помутнении. Влияние лекарства на возможность управлять сложными механизмами и транспортными средствами не определено. Перед использованием препарата нужно обязательно обработать руки, а также колпачок антисептическим средством. Открытый флакон необходимо хранить в специальных температурных условиях – в холодильнике.
Запрещено употреблять бактериофаг при помутнении. Влияние лекарства на возможность управлять сложными механизмами и транспортными средствами не определено. Перед использованием препарата нужно обязательно обработать руки, а также колпачок антисептическим средством. Открытый флакон необходимо хранить в специальных температурных условиях – в холодильнике.
Беременность и лактация
Допускается использование фага в период вынашивания ребенка и естественного вскармливания, но только по показаниям лечащего врача.
Применение в детском возрасте
Лечение детей должно производиться строго по дозированной схеме, описанной в инструкции.
Применение в пожилом возрасте
Специальная коррекция дозировки пиобактериофага комплексного пациентам старшей возрастной группы не потребуется. Достаточно придерживаться рекомендаций, приведенных производителем.
Условия и сроки хранения
Хранить бактериофаг необходимо в сухом месте, защищенном от яркого солнечного освещения. Оптимальный температурный режим находится в пределах от двух до восьми градусов. Срок хранения пиобактериофага комплексного составляет 24 месяца с момента изготовления.
Цены на Пиобактериофаг комплексный в Москве
Выгодные цены
Сертификаты и лицензии
Выбор бактериофагов при лечении дисбактериоза
Для лечения дисбактериоза кишечника используют бактериофаги. Бактериофаги – это препараты антибактериального действия, но в отличие от антибиотиков действуют на бактерии более избирательно (стафилококковый бактериофаг убивает только стафилококки).![]() Бактериофаги не токсичны для человека и не нарушают нормальную микрофлору кишечника. Бактериофаги можно применять даже у новорожденных детей.
Бактериофаги не токсичны для человека и не нарушают нормальную микрофлору кишечника. Бактериофаги можно применять даже у новорожденных детей.
Для подбора бактериофага необходимо определение чувствительности микроорганизмов к бактериофагу. Степень чувствительности микрофлоры к бактериофагам определяют при проведении бактериологического исследования кала — анализа на дисбактериоз.
Одновременно с бактериофагами назначается комплексный иммуноглобулиновый препарат (КИП).
Схема выбора бактериофагов
| Название микроорганизма | Бактериофаг |
|---|---|
| При избыточном росте одного из условно-патогенных микроорганизмов | |
| Кишечная палочка гемолитическая Кишечная полочка с измененными свойствами |
|
| Протей (мирабилис, вульгарис) |
|
| Стафилококк |
|
| Синегнойная палочка |
|
| Стрептококк |
|
| Клебсиелла пневмонии |
|
| Энтерококки |
|
| При наличии ассоциаций условно-патогенных микроорганизмов | |
| Энтеропатогенная кишечная палочка Протей видов вульгарис и мирабилис |
|
| Энтеропатогенная кишечная палочка Протей видов вульгарис и мирабилис Стафилококк Псевдомонас аэругиноза Стрептококк |
|
| Энтеропатогенная кишечная палочка Протей видов вульгарис и мирабилис Стафилококк Псевдомонас аэругиноза Энтерококки |
|
Возрастная дозировка бактериофагов у детей
| Название препарата | Дозы |
|---|---|
| Бактериофаг коли жидкий | Препарат применяют внутрь через рот:
в клизме 1 раз в день вместо одного приема через рот жидкого бактериофага:
|
| Бактериофаг протейный жидкий | |
| Бактериофаг стрептококковый жидкий | |
| Бактериофаг псевдомонас аэругиноза (синегнойный) жидкий | |
| Бактериофаг клебсиелл пневмонии очищенный жидкий | |
| Бактериофаг стафилококковый жидкий | |
| Бактериофаг колипротейный жидкий | |
| Пиобактериофаг комбинированный жидкий | |
| Пиобактериофаг поливалентный очищенный жидкий | |
| Бактериофаг клебсиелл поливалентный очищенный жидкий | |
| Стафилофаг (бактериофаг стафилококковый, таблетки с кислотоустойчивым покрытием) |
|
| Колипротеофаг (бактериофаг колипротейный) таблетки с кислотоустойчивым покрытием | |
| Пиополифаг (пиобактериофаг комбинированный) таблетки с кислотоустойчивым покрытием |
© Copyright: kukuzya.ru
«Пиобактериофаговый комплекс»: инструкция по применению, отзывы
«Пиобактериофаговый комплекс» — антибактериальный препарат, являющийся бактериофагом.
Лекарственное средство выпускается в виде растворов для приема внутрь, а также для местного наружного применения и представляет собой прозрачную слегка желтоватую жидкость, однако цвет ее варьирует от светло- до темно-желтого, иногда с выраженным зеленоватым оттенком.
Препарат расфасован во флаконы по 20 мл, помещенные в пачки картонные по 8 штук, а также во флаконы по 100 мл по 1 штуке в пачке.
Состав лекарственного средства
Действующее вещество, входящее в состав 1 мл данного раствора, представляет собой стерильно очищенные фильтраты бактериальных фаголизатов Streptococcus, Proteus mirabilis, Enterococcus, энтеропатогенных кишечных палочек, Staphylococcus и Proteus vulgaris, Klebsiella pneumoniae, Klebsiella oxytoca и Pseudosaonas.
В качестве дополнительных компонентов используются консерванты: 8-гидроксихинолина сульфат или 8-гидроксихинолина сульфат моногидрат.
Фармакологические свойства препарата
«Пиобактериофаговый комплекс» вызывает лизис следующих видов бактерий:
- энтеропатогенная кишечная палочка;
- Стафилококк;
- Протей обыкновенный;
- синегнойная палочка;
- Клебсиеллезная пневмония;
- Стрептококки, энтерококки;
- Proteus mirabilis;
- Клебсиелла окситока.
Показания к применению
Согласно инструкции, «Пиобактериофаг комплекс» может применяться для профилактики и лечения различных гнойных, воспалительных и кишечных заболеваний, которые вызваны действием патологических микроорганизмов, таких как энтерококки, стрептококки, стафилококки, синегнойная палочка, клебсиелла, Протей, кишечная палочка различных серогрупп.
Таким образом, применение препарата показано при возникновении следующих патологических состояний:
- Возникновение кишечных инфекций — дисбактериоз, гастроэнтероколит, холецистит.

- При заболеваниях ЛОР-органов, а также верхних дыхательных путей и легких, воспалительных процессах в среднем ухе и придаточных пазухах, ларингитах, фарингитах, тонзиллитах, трахеитах, бронхитах, плевритах, пневмониях.
- Различные инфекции мочевыводящих путей — цистит, уретрит, пиелонефрит.
- При заражении половыми инфекциями — сальпингоофорит, эндометрит, кольпит.
- При генерализованных формах различных гнойно-септических заболеваний — конъюнктивитов, кератоконъюнктивитов, иридоциклитов, гнойных язв роговицы.
- При хирургических инфекциях — карбункулы, фурункулы, флегмоны, абсцессы, панариций, гидраденит, ожоги, нагноение ран, остеомиелит, бурсит, мастит, парапроктит.
- При возникновении гнойно-воспалительных заболеваний у детей раннего возраста — конъюнктивита, омфалита, пиодермии, гастроэнтероколита, сепсиса и др.
- При некоторых других заболеваниях, которые провоцируются вышеперечисленными патогенными микроорганизмами.

Применение медикаментов для профилактики
В профилактических целях данный препарат можно применять для предупреждения возникновения различных внутрибольничных инфекций, для обработки свежих послеоперационных ран.Кроме того, применение препарата «Пиобактериофаг комплекс» может быть целесообразным при любых поверхностных поражениях кожи у взрослых и детей в качестве сильного антисептика.
Противопоказания
Препарат противопоказан при наличии симптомов повышенной чувствительности к его основным или вспомогательным компонентам. В остальных случаях можно использовать.
Способ применения
Как принимать «Пиобактериофаговый комплекс»?
Применяют различными способами в зависимости от очага инфекции — в виде инстилляций, полосканий, полосканий и введения тампонов, смоченных в растворе, при патологических процессах в ЛОР-органах.В этом случае препарат применяют по 2-10 мл несколько раз в день. Тампоны, смоченные в лекарственном растворе, оставляют, как правило, на 1 час.
При закапывании в конъюнктивальный мешок — при развитии конъюнктивита и кератоконъюнктивита — по 2 капли 5 раз в сутки. При образовании гнойных язв на роговице — по 5 капель, при развитии гнойного иридоциклита — по 8 капель каждые 2 часа, сочетая местное лечение с медикаментозным и пероральным приемом. При использовании различных орошений и примочек «Пиобактериофаг комплекс» применяют в количестве до 150 мл, что зависит от размеров очагов воспаления.
При абсцессах раствор препарата вводят непосредственно в полость поражения после очищения ее от гнойного содержимого, причем делают это путем пункции в количестве, примерно равном объему удаленного гноя.
При остеомиелите препарат применяют путем вливания в рану после необходимой хирургической обработки в объеме 10 мл. Для полоскания рта при развитии стоматита и хронического пародонтита: по 20 мл несколько раз в день.Также возможно введение Турунды, пропитанной лекарственным раствором, в пародонтальные карманы.
Применение «Пиобактериофага комплекса» возможно в виде клизм при развитии дисбактериоза кишечника, а также при кишечных формах патологий внутренних органов.
Для лечения и профилактики инфекций мочевыводящих путей применяют дренирование в полость почечной лоханки или мочевого пузыря — препарат вводят через нефростому или цистостому 2 раза в сутки в объеме 20-50 мл.
Лечение патологических процессов, характеризующихся образованием гноя и возникновением воспаления, проводят, как правило, как местно, так и перорально. Продолжительность лечебных процедур зависит от характера заболевания и его степени и обычно составляет от 7 до 20 дней.
Назначение препарата не исключает применения других антибактериальных средств. Это подтверждает инструкция по применению к «Пиобактериофаговому комплексу».
Побочные эффекты
До настоящего времени случаев побочных реакций при применении препарата не зарегистрировано.
О случаях передозировки препарата не сообщалось.
специальные инструкции
Основным условием эффективности терапии данным препаратом является раннее определение фагочувствительности возбудителей и применение «Пиобактериофага» на ранних стадиях заболевания. Перед каждым применением флакон с раствором препарата необходимо встряхивать. Перед открытием нужно продезинфицировать руки, обработать крышку флакона спиртовыми растворами.Эти меры необходимы для того, чтобы во флакон не попали бактерии, так как это может вызвать помутнение раствора и непригодность препарата. Хранить препарат в холодильнике.
Отличия «Пиобактериофаг» комплексный и поливалентный
При лечении инфекционно-воспалительных патологий, возбудителями которых являются патогенные микробы, используют растворы со стерильными фаголизатами этих микроорганизмов в составе. В аптеке обычно можно найти два вида таких средств: «Пиобактериофаг» мультивалентный и комплексный.Разницы между ними на первый взгляд нет, поэтому часто приобретается не тот препарат.
Отличительные признаки можно найти в инструкции, в частности при внимательном изучении их состава.
Раствор комплексного средства еще дополнительно содержит стерильный энтерококковый фаголизат.
Существенной разницы между действием поливалентного и комплексного «Пиобактериофага» нет. Список показаний у них полностью одинаковый.Хотя есть одно отличие, если патология вызвана энтерококками, поливалентный раствор будет малоэффективен.
Что лучше купить, решать вам. Но следует учитывать нюанс. Перед назначением любого лекарства с антимикробным действием необходимо провести анализ, с помощью которого можно выявить возбудителей заболевания и их чувствительность к препаратам.
Итак, если недуг спровоцировали энтерококки, лучше приобрести комплексный раствор.
границ | Фенотипическая и генотипическая характеристика новых поливалентных бактериофагов с мощной активностью in vitro против международной коллекции генетически разнообразного Staphylococcus aureus
Введение
Staphylococcus aureus является одной из основных причин внутрибольничных и внебольничных инфекций во всем мире. Это чрезвычайно универсальный возбудитель, вызывающий широкий спектр заболеваний различной степени тяжести: от незначительных инфекций кожи и мягких тканей до опасных для жизни инвазивных инфекций (Lowy, 1998).Госпитализированные пациенты особенно подвержены инфекциям S. aureus из-за наличия ослабленной иммунной системы и инфекций области хирургического вмешательства, вызванных имплантацией постоянных медицинских устройств (Brandt et al., 1999). S. aureus обычно устойчив к пенициллину и метициллин-резистентный Инфекции, вызванные S. aureus (MRSA), устойчивые ко всем бета-лактамным антибиотикам, чаще всего лечат внутривенным введением ванкомицина, антибиотика «последнего средства» при резистентных стафилококковых инфекциях. инфекции.Однако возникла устойчивость к этому антибиотику (Центры по контролю и профилактике заболеваний, 2002 г.) и более новым агентам, таким как линезолид (Циодрас и др., 2001 г.) и даптомицин (Скист, 2006 г.), и существует большое и постоянно растущая потребность в новых антибиотиках и других терапевтических стратегиях для лечения этого патогена.
Это чрезвычайно универсальный возбудитель, вызывающий широкий спектр заболеваний различной степени тяжести: от незначительных инфекций кожи и мягких тканей до опасных для жизни инвазивных инфекций (Lowy, 1998).Госпитализированные пациенты особенно подвержены инфекциям S. aureus из-за наличия ослабленной иммунной системы и инфекций области хирургического вмешательства, вызванных имплантацией постоянных медицинских устройств (Brandt et al., 1999). S. aureus обычно устойчив к пенициллину и метициллин-резистентный Инфекции, вызванные S. aureus (MRSA), устойчивые ко всем бета-лактамным антибиотикам, чаще всего лечат внутривенным введением ванкомицина, антибиотика «последнего средства» при резистентных стафилококковых инфекциях. инфекции.Однако возникла устойчивость к этому антибиотику (Центры по контролю и профилактике заболеваний, 2002 г.) и более новым агентам, таким как линезолид (Циодрас и др., 2001 г.) и даптомицин (Скист, 2006 г.), и существует большое и постоянно растущая потребность в новых антибиотиках и других терапевтических стратегиях для лечения этого патогена.
Фаговая терапия использует естественную способность литических бактериофагов (фагов) внедряться, размножаться внутри клетки, а затем убивать хозяина. В обязательном порядке литические фаги считаются наиболее подходящими кандидатами для здоровья человека, поскольку они способны быстро убивать своего хозяина, что значительно снижает вероятность развития у бактерий устойчивости к фагам (Skurnik et al., 2007; Cui и др., 2017b). У них также отсутствуют необходимые генетические факторы для включения в геном, обнаруженные у фагов умеренного пояса. Несмотря на широкое распространение в 1930-х годах, фаговая терапия в значительной степени уступила место открытию и клинической разработке антибиотиков широкого спектра действия в западных странах. Тем не менее, фаготерапия продолжает использоваться в Институте бактериофагов, микробиологии и вирусологии им. Г. Элиавы в Тбилиси, Грузия, и в Институте иммунологии и экспериментальной терапии во Вроцлаве, Польша, которые стали крупными центрами разработки и применения бактериофагов. фаговая терапия (Summers, 2001; Kutter et al., 2010). Сообщалось о показателях успеха, превышающих 85% при лечении устойчивых к антибиотикам инфекций, вызванных патогенами, включая S. aureus , Pseudomonas aeruginosa , Klebsiella pneumoniae и Escherichia coli в Польше (O’Flaherty et al., 2009) в исследованиях с участием большого числа пациентов. На сегодняшний день было проведено три ранних клинических испытания фагов для лечения инфекций S. aureus . В 2009 г. Rhoads et al. сообщили о безопасности в исследовании фагов против венозных язв нижних конечностей (Rhoads et al., 2009) и совсем недавно McCallin et al. (2018) продемонстрировали безопасность коктейля фагов широкого спектра действия в плацебо-контролируемом исследовании, включая назальное и пероральное введение. Недавнее исследование в Австралии продемонстрировало безопасность надлежащей производственной практики — качественного трехфагового коктейля, вводимого внутривенно 13 пациентам с инвазивными инфекциями S.
фаговая терапия (Summers, 2001; Kutter et al., 2010). Сообщалось о показателях успеха, превышающих 85% при лечении устойчивых к антибиотикам инфекций, вызванных патогенами, включая S. aureus , Pseudomonas aeruginosa , Klebsiella pneumoniae и Escherichia coli в Польше (O’Flaherty et al., 2009) в исследованиях с участием большого числа пациентов. На сегодняшний день было проведено три ранних клинических испытания фагов для лечения инфекций S. aureus . В 2009 г. Rhoads et al. сообщили о безопасности в исследовании фагов против венозных язв нижних конечностей (Rhoads et al., 2009) и совсем недавно McCallin et al. (2018) продемонстрировали безопасность коктейля фагов широкого спектра действия в плацебо-контролируемом исследовании, включая назальное и пероральное введение. Недавнее исследование в Австралии продемонстрировало безопасность надлежащей производственной практики — качественного трехфагового коктейля, вводимого внутривенно 13 пациентам с инвазивными инфекциями S. aureus (Petrovic Fabijan et al., 2020). Это исследование стало важной вехой в фаговой терапии, первым регулируемым клиническим испытанием системно вводимых фагов.
aureus (Petrovic Fabijan et al., 2020). Это исследование стало важной вехой в фаговой терапии, первым регулируемым клиническим испытанием системно вводимых фагов.
Большинство сообщений в литературе о литических стафилококковых фагах показывают, что они, как правило, являются членами подсемейства Twortvirinae , которое в настоящее время включает пять родов, представляющих различные линии — Kayvirus , Sepunavirus , Silviavirus , неклассифицированный Twortvirinae . Эти фаги демонстрируют широкий круг хозяев, инфицируя большинство изолятов S. aureus и даже других видов стафилококков (Lobocka et al., 2012). Исследования этой группы фагов, а также их литических ферментов обещают будущие клинические разработки отдельно или в сочетании с антибиотиками (Berryhill et al., 2021), тем более, что сравнительный геномный анализ показывает небольшое сходство между фагами из разных линий в генном наборе или в их последовательности литических генов (O’Flaherty et al. , 2005a; Synnott et al., 2009; Lobocka et al., 2012). Таким образом, они могут представлять собой важный и разнообразный источник фагов для традиционной терапии или разработки методов лечения, основанных на новых противомикробных ферментах.
, 2005a; Synnott et al., 2009; Lobocka et al., 2012). Таким образом, они могут представлять собой важный и разнообразный источник фагов для традиционной терапии или разработки методов лечения, основанных на новых противомикробных ферментах.
Здесь мы сообщаем о выделении и характеристике 78 литических фагов с широким кругом хозяев против разнообразной коллекции S. aureus. Эти 185 изолятов включают представителей всех глобально распространенных линий MRSA и чувствительных к метициллину, включая множественные изоляты клональных комплексов (CC) 1, 5, 8, 22, 30, 45, 59 и CC80, содержащих основные линии MRSA (Chatterjee и Отто, 2013). По возможности мы выделяли и размножали фаги на модифицированном авирулентном изоляте S. carnosus (Rosenstein et al., 2009), не содержащий ни одного из генов вирулентности, связанных с профагами S. aureus , которые потенциально могут поставить под угрозу безопасное производство фагов для терапевтического применения. Мы изучили характеристики in vitro выбранных фагов в культуре планктона и биопленки и охарактеризовали геномное сходство и таксономию 22 фагов с некоторыми из самых широких диапазонов хозяев.
Материалы и методы
Бактериальные штаммы
Модифицированный штамм S. carnosus , TM300H, гибридный штамм, полученный из TM300H, экспрессирующий как нативный глицерол-фосфат (GroP), так и S.aureus рибитолфосфатного (RboP) типа тейхоевых кислот стенок использовали для выделения и размножения фага. S. carnosus является невирулентным видом стафилококка, используемым в производстве мяса, и поэтому мы считали его доброкачественным размножающимся хозяином для производства фагов. TM300H трансформировали плазмидой устойчивости к хлорамфениколу, кодирующей полирибитолфосфатные (RboP) повторяющиеся единицы тейхоевой кислоты стенки S. aureus , чтобы стимулировать адсорбцию фага (Winstel et al., 2013). Для этого потребовалось добавление в питательную среду 10 мкг/мл хлорамфеникола.Метициллин-чувствительный изолят D329 использовали в качестве альтернативного хозяина для размножения фага, если это было невозможно при использовании TM300H. Изолят S. aureus 15981 (полученный от профессора А.Т. Дженкинса, Университет Бата, Великобритания) также был включен в это исследование, поскольку он является очень сильным производителем биопленки и использовался в нескольких исследованиях вирулентности S. aureus и биопленки. регулирование, включая правила Valles et al. (2003) и Toledo-Arana et al. (2005). Все бактериальные изоляты культивировали в триптонно-соевом бульоне (TSB) или агаре (TSA) и хранили при -80°C в TSB, содержащем 25% (об./об.) глицерина.В этом исследовании использовали сто восемьдесят пять генетически разнообразных изолятов S. aureus из нашей коллекции, включая изоляты из 13 опубликованных исследований носительства и болезней человека и животных (таблица 1). Они включали 126 изолятов MRSA и 59 изолятов MSSA из 14 разных стран с 58 различными мультилокусными типами последовательностей (Enright et al., 2000). Эта коллекция содержит несколько репрезентативных изолятов всех основных линий MRSA и MSSA (Enright et al.
aureus 15981 (полученный от профессора А.Т. Дженкинса, Университет Бата, Великобритания) также был включен в это исследование, поскольку он является очень сильным производителем биопленки и использовался в нескольких исследованиях вирулентности S. aureus и биопленки. регулирование, включая правила Valles et al. (2003) и Toledo-Arana et al. (2005). Все бактериальные изоляты культивировали в триптонно-соевом бульоне (TSB) или агаре (TSA) и хранили при -80°C в TSB, содержащем 25% (об./об.) глицерина.В этом исследовании использовали сто восемьдесят пять генетически разнообразных изолятов S. aureus из нашей коллекции, включая изоляты из 13 опубликованных исследований носительства и болезней человека и животных (таблица 1). Они включали 126 изолятов MRSA и 59 изолятов MSSA из 14 разных стран с 58 различными мультилокусными типами последовательностей (Enright et al., 2000). Эта коллекция содержит несколько репрезентативных изолятов всех основных линий MRSA и MSSA (Enright et al. , 2002; Feil et al., 2003; Holden et al., 2013), в том числе связанные с внебольничными (Vandenesch et al., 2003) и домашними животными (van Belkum et al., 2008) инфекциями MRSA. В таблице 1 показаны тип последовательности MLST и клональный комплекс каждого изолята, а также ссылка на исходное исследование, в котором изолят впервые был охарактеризован с помощью MLST, а для изолятов MRSA — типирование SCC mec . Дополнительная информация об исследуемых изолятах доступна в указанном источнике и, в большинстве случаев, на веб-сайте PubMLST по адресу https://pubmlst.org/организмы/золотистый стафилококк.
, 2002; Feil et al., 2003; Holden et al., 2013), в том числе связанные с внебольничными (Vandenesch et al., 2003) и домашними животными (van Belkum et al., 2008) инфекциями MRSA. В таблице 1 показаны тип последовательности MLST и клональный комплекс каждого изолята, а также ссылка на исходное исследование, в котором изолят впервые был охарактеризован с помощью MLST, а для изолятов MRSA — типирование SCC mec . Дополнительная информация об исследуемых изолятах доступна в указанном источнике и, в большинстве случаев, на веб-сайте PubMLST по адресу https://pubmlst.org/организмы/золотистый стафилококк.
Таблица 1 Подробная информация об изолятах Staphylococcus aureus , использованных в этом исследовании.
Выделение фагов, размножение и определение круга хозяев
Образцы сточных вод были собраны из различных технологических резервуаров на очистных сооружениях Davyhulme and Eccles, Манчестер, Англия. Органические вещества удаляли из проб центрифугированием при 3000 g в течение 30 мин. Аликвоты по 10 мл супернатанта фильтровали (0.с размером пор 22 мкм) перед объединением с 10 мл TSB двойной концентрации и 100 мкл экспоненциально растущих бактериальных культур с последующей инкубацией при 37°C в орбитальном инкубаторе при 150 об/мин в течение 24 часов. Бактериальный дебрис удаляли центрифугированием (3000 г , 30 мин), а супернатанты фильтровали (0,22 мкм) и хранили при 4°C. Этот супернатант использовали для проверки присутствия литических фагов методом наложения двойного агара (Kropinski et al., 2009). Изолированные одиночные бляшки собирали в буфер SM (50 мМ Tris-HCl, 8 мМ MgSO 4 , 100 мМ NaCl и 0.01% желатина, рН 7,5) в стерильной дистиллированной воде, и проводили последовательные циклы очистки одиночных бляшек до тех пор, пока не получали очищенные бляшки. Очищенные фаговые суспензии хранили при 4°С. Штамм S. carnosus TM300H использовали для размножения фага, когда это было возможно; однако для некоторых фагов использовали метициллин-чувствительный изолят S.
Аликвоты по 10 мл супернатанта фильтровали (0.с размером пор 22 мкм) перед объединением с 10 мл TSB двойной концентрации и 100 мкл экспоненциально растущих бактериальных культур с последующей инкубацией при 37°C в орбитальном инкубаторе при 150 об/мин в течение 24 часов. Бактериальный дебрис удаляли центрифугированием (3000 г , 30 мин), а супернатанты фильтровали (0,22 мкм) и хранили при 4°C. Этот супернатант использовали для проверки присутствия литических фагов методом наложения двойного агара (Kropinski et al., 2009). Изолированные одиночные бляшки собирали в буфер SM (50 мМ Tris-HCl, 8 мМ MgSO 4 , 100 мМ NaCl и 0.01% желатина, рН 7,5) в стерильной дистиллированной воде, и проводили последовательные циклы очистки одиночных бляшек до тех пор, пока не получали очищенные бляшки. Очищенные фаговые суспензии хранили при 4°С. Штамм S. carnosus TM300H использовали для размножения фага, когда это было возможно; однако для некоторых фагов использовали метициллин-чувствительный изолят S. aureus D329 (таблица 1).
aureus D329 (таблица 1).
Диапазон хозяев фага определяли с помощью точечного теста, 100 мкл бактериальной культуры в логарифмической фазе смешивали с 10 мл мягкого агара, смесь выливали на 10 мл чашек с TSA и 10 мкл фагового лизата (~106 БОЕ/мл) наносили на чашку перед инкубацией в течение ночи при 37°С.Бактериальные штаммы классифицировались как полностью чувствительные к конкретному фагу, если при выборочном тесте обнаруживались прозрачные бляшки, промежуточно чувствительные, если бляшки демонстрировали признаки просветления, но были мутными или мутными, и устойчивые, если просветления не было. Все анализы диапазона хозяев были выполнены в трех повторностях.
В данное исследование также была включена коллекция из 32 неохарактеризованных фагов S. aureus , собранных в ходе предыдущих исследований.
In Vitro Ростовые экспериментыКинетика роста в планктонной культуре
Скорость роста каждого бактериального изолята в жидкой культуре изучали в 96-луночных плоскодонных микротитрационных планшетах путем измерения поглощения в каждой лунке по методу Alves et al. др.(2014). Вкратце, рост бактерий измеряли по поглощению (600 нм) в течение 19 ч при 37 °C при встряхивании с использованием устройства для считывания микропланшетов (FLUOstar Omega, BMG LABTECH). Считыватель планшетов предоставлял точки данных абсорбции каждые 180 с после 10-секундного перемешивания при 200 об/мин. Точки данных через каждые 30 минут использовались для анализа.
др.(2014). Вкратце, рост бактерий измеряли по поглощению (600 нм) в течение 19 ч при 37 °C при встряхивании с использованием устройства для считывания микропланшетов (FLUOstar Omega, BMG LABTECH). Считыватель планшетов предоставлял точки данных абсорбции каждые 180 с после 10-секундного перемешивания при 200 об/мин. Точки данных через каждые 30 минут использовались для анализа.
Анализы времени уничтожения
Анализы времени уничтожения были проведены для определения чувствительности планктонных бактериальных клеток к заражению фагом и для исследования частоты появления устойчивых к фагам бактериальных мутантов с использованием метода, описанного в Alves et al.(2014). Вкратце, 200 мкл ночных бактериальных культур в разведении 1:100 добавляли в лунки 96-луночного титрационного микропланшета. Разведения были сделаны с использованием TSB. После 2 часов инкубации при 37°C добавляли фаговый лизат с множественностью поражения 0,1, и микропланшеты инкубировали еще 17 часов. Опыты проводили в трехкратной повторности.
Формирование и обработка
S. aureus Биопленки Анализы биопленки проводились с использованием стандартного метода 96-луночных планшетов, как описано ранее (Alves et al., 2014). Вкратце, 200 мкл разведений 1:100 ночной бактериальной культуры, приготовленных с использованием TSB с добавлением 1% D-(+)-глюкозы (TSBg), добавляли в микротитровальные планшеты. Планшеты для микротитрования с крышками запечатывали парафильмом, заворачивали во влажное бумажное полотенце, затем помещали в герметичный пластиковый бокс для поддержания влажности. Планшеты инкубировали при 37°C в течение 48 ч без перемешивания, чтобы обеспечить образование биопленки. Через 24 часа 50 мкл отработанной среды удаляли и заменяли 50 мкл свежей TSBg. Затем планшеты инкубировали еще 24 часа при 37°C.Биопленки трижды промывали PBS перед сушкой на воздухе и окрашиванием 0,1% (мас./об.) кристаллическим фиолетовым (CV). Окрашенные биопленки промывали PBS, сушили на воздухе, затем солюбилизировали в 200 мкл 30% (об. /об.) ледяной уксусной кислоты. Массу биопленки измеряли спектрофотометрически с использованием планшет-ридера FLUOstar при поглощении 590 нм. Подсчет клеток S. aureus , извлеченных из 48-часовых биопленок, проводили путем промывания PBS для удаления неприлипших бактерий и остаточной среды. Затем биопленки ресуспендировали в 200 мкл PBS и серийно разбавляли, распределяя по 100 мкл на чашках с TSA для определения КОЕ для каждого изолята.
/об.) ледяной уксусной кислоты. Массу биопленки измеряли спектрофотометрически с использованием планшет-ридера FLUOstar при поглощении 590 нм. Подсчет клеток S. aureus , извлеченных из 48-часовых биопленок, проводили путем промывания PBS для удаления неприлипших бактерий и остаточной среды. Затем биопленки ресуспендировали в 200 мкл PBS и серийно разбавляли, распределяя по 100 мкл на чашках с TSA для определения КОЕ для каждого изолята.
48-часовые биопленки обрабатывали 200 мкл разбавленного фагового лизата с двумя различными MOI, 1,0 и 0,1. Количественную оценку биомассы биопленки и количества жизнеспособных клеток после воздействия фага в течение 6 и 24 часов проводили, как описано выше.
Секвенирование генома фага
Выделение геномной ДНК фага
Геномную ДНК фага экстрагировали методом фенол/хлороформ/изоамиловый спирт (25:24:1 [об/об]) с использованием 1,5 мл лизата (от 107 до 109 БОЕ). /мл). Лизаты центрифугировали при 10 000 g в течение 10 мин при 4°C, 1 мл супернатанта переносили в свежую микроцентрифужную пробирку и обрабатывали ДНКазой I (10 мкл 1 мг/мл ДНКазы I) и РНКазой А (4 мкл из 12. 5 мг/мл РНКазы А). В каждую пробирку добавляли 1 мл фенола (pH 10) перед встряхиванием в течение 30 с и центрифугированием при 10 000 g в течение 10 мин при 4°C. Водный слой удаляли в свежую пробирку и добавляли 1 мл фенола/хлороформа/изоамилового спирта (25:24:1), встряхивали в течение 30 с и центрифугировали при 10 000 g еще в течение 10 минут при 4°C. Затем повторяли стадию фенол/хлороформ/изоамиловый спирт, после чего ДНК осаждали двумя объемами ледяного абсолютного этанола и 1/10 объема 7.5 М ацетата аммония и хранили при -20°С в течение ночи. Образцы центрифугировали при 10 000 g в течение 20 минут при 4°C, а осадки ДНК дважды промывали 1 мл 70% этанола (об/об), затем ресуспендировали в 100 мкл воды, свободной от нуклеаз.
5 мг/мл РНКазы А). В каждую пробирку добавляли 1 мл фенола (pH 10) перед встряхиванием в течение 30 с и центрифугированием при 10 000 g в течение 10 мин при 4°C. Водный слой удаляли в свежую пробирку и добавляли 1 мл фенола/хлороформа/изоамилового спирта (25:24:1), встряхивали в течение 30 с и центрифугировали при 10 000 g еще в течение 10 минут при 4°C. Затем повторяли стадию фенол/хлороформ/изоамиловый спирт, после чего ДНК осаждали двумя объемами ледяного абсолютного этанола и 1/10 объема 7.5 М ацетата аммония и хранили при -20°С в течение ночи. Образцы центрифугировали при 10 000 g в течение 20 минут при 4°C, а осадки ДНК дважды промывали 1 мл 70% этанола (об/об), затем ресуспендировали в 100 мкл воды, свободной от нуклеаз.
Полногеномное секвенирование
Библиотеки выбранных образцов фаговой ДНК (исходная ДНК 0,2 нг/мкл) готовили с использованием набора Illumina NexteraXT для подготовки образцов ДНК в соответствии с инструкциями производителя. Секвенирование фаговой ДНК (парные концы 2 × 150 с высоким выходом) проводили с использованием платформы Illumina NextSeq500 в Манчестерском столичном университете, Великобритания.
Секвенирование фаговой ДНК (парные концы 2 × 150 с высоким выходом) проводили с использованием платформы Illumina NextSeq500 в Манчестерском столичном университете, Великобритания.
Сборка генома, аннотация и сравнение
Прочтения последовательности были собраны с использованием SPAdes v3.11 (Банкевич и др., 2012). Все сборки фагов приводили к одному большому контигу плюс ряд небольших повторов. Самые большие контиги и их покрытие оценивались и визуализировались с помощью Bandage (Wick et al., 2015), отдельные сборки геномов анализировались с помощью Artemis (Rutherford et al., 2000), а самые большие каркасы сравнивались со сходством ранее секвенированных геномов. с помощью BLASTN.На основании сходства между последовательностями наших запросов и наиболее частыми совпадениями (близкородственными геномами), идентифицированными с помощью BLASTn, сборки геномов всех родственных фагов, заражающих S. aureus , были извлечены из GenBank (https://www.ncbi.nlm.nih. gov/nuccore) и базы данных Европейского нуклеотидного архива (ENA) в апреле 2021 года для получения окончательной коллекции из 122 фаговых геномов.
Геномы были аннотированы с помощью PROKKA v1.14.6 (Seemann, 2014) с использованием пользовательской базы данных генов Caudovirales (Michniewski et al., 2019). Деревья соединения соседей были построены с использованием минимальных хеш-расстояний, реализованных в Mashtree (Katz et al., 2019). Сравнения геномов проводились с использованием минимального хеширования, реализованного в MASH (Ondov et al., 2016), а для оценки количества генов, общих для каждой геном (Пейдж и др., 2015). Филогенетические деревья были построены с использованием Archeopteryx v0.9929 (https://sites.google.com/site/cmzmasek/home/software/archaeopteryx).
Статистический анализ
Планктонные эксперименты и эксперименты с биопленками проводились как минимум в трех повторностях, и эти значения использовались для построения среднего ± стандартное отклонение.Статистический анализ проводили с использованием программного пакета GraphPad Prism Version 7.0, данные анализировали как обычный однофакторный дисперсионный анализ (ANOVA) и критерий множественных сравнений Сидака для определения значимости результатов. Результаты считались значительно отличающимися по значению p <0,05, если не указано иное.
Результаты считались значительно отличающимися по значению p <0,05, если не указано иное.
Результаты
Выделение фага
Модифицированный штамм S. carnosus TM300H и штамм S. aureus D329 использовали для выделения и размножения 46 фагов из 150 отфильтрованных проб сточных вод в течение нескольких месяцев.Все бляшки были небольшого размера, большинство из них имели диаметр <1 мм ( n = 39), а самые большие — 2 мм. 39 из 46 фагов были размножены на TM300H; однако остальные (EW20, EW29, EW30, EW41 и EW44-46) не смогли надежно заразить этот штамм и вместо этого были размножены на S. aureus D239. Фаги были названы в соответствии с недавним руководством по номенклатуре с обозначениями от vB_SauM_EW1 до vB_SauM_EW46 (Adriaenssens and Brister, 2017) и в дальнейшем обозначаются как EW1, EW2… EW46.32 фага, выделенные ранее, были размножены на модифицированном TM300H и были названы от EW47 до EW78.
Диапазон хозяев
Диапазон хозяев 78 фагов был определен с помощью точечного теста лизатов против 185 изолятов S. aureus (таблица 2) в слоях агара. Бактериальные штаммы были классифицированы как чувствительные, промежуточно чувствительные или устойчивые, в зависимости от морфологии бляшек — их примеры показаны на рисунке 1. Большинство из них демонстрировали фенотип широкого круга хозяев: 40 из наших 78 фагов были способны инфицировать более 90% изолятов в качестве определяется их чувствительностью или промежуточной чувствительностью к фагам в этом анализе (таблица 2).Пятнадцать из них были способны нарушить рост более 95% (178/185) изолятов. Фаги EW70 и EW71 имели самый широкий круг хозяев и были способны инфицировать 184 из 185 изолятов. Из 184 изолятов они могли инфицировать 96 (53%), а 101 (55%) были полностью восприимчивы, соответственно, то есть образовывали отчетливые прозрачные бляшки. Единственным фагом, который они не могли заразить, был мутант изолята MRSA252, полученный в предыдущем исследовании во время выращивания изолята в жидкой культуре с фагом К (Alves et al., 2014).
aureus (таблица 2) в слоях агара. Бактериальные штаммы были классифицированы как чувствительные, промежуточно чувствительные или устойчивые, в зависимости от морфологии бляшек — их примеры показаны на рисунке 1. Большинство из них демонстрировали фенотип широкого круга хозяев: 40 из наших 78 фагов были способны инфицировать более 90% изолятов в качестве определяется их чувствительностью или промежуточной чувствительностью к фагам в этом анализе (таблица 2).Пятнадцать из них были способны нарушить рост более 95% (178/185) изолятов. Фаги EW70 и EW71 имели самый широкий круг хозяев и были способны инфицировать 184 из 185 изолятов. Из 184 изолятов они могли инфицировать 96 (53%), а 101 (55%) были полностью восприимчивы, соответственно, то есть образовывали отчетливые прозрачные бляшки. Единственным фагом, который они не могли заразить, был мутант изолята MRSA252, полученный в предыдущем исследовании во время выращивания изолята в жидкой культуре с фагом К (Alves et al., 2014).
Рисунок 1 Анализ диапазона хозяев, показывающий влияние 16 фагов на штамм S. aureus Fin76167. Образование налета оценивали в зависимости от уровня очистки, (A) Устойчивость без нарушения газона, (B) Промежуточная чувствительность варьируется от, B1 Несколько бляшек с легким нарушением газона, B2 Существенное помутнение во всей чистой зоне, B3 Высокая степень очистки с наличием многочисленных мутантных колоний, до (C) Чувствительная с полной очисткой от бактериального газона.
aureus Fin76167. Образование налета оценивали в зависимости от уровня очистки, (A) Устойчивость без нарушения газона, (B) Промежуточная чувствительность варьируется от, B1 Несколько бляшек с легким нарушением газона, B2 Существенное помутнение во всей чистой зоне, B3 Высокая степень очистки с наличием многочисленных мутантных колоний, до (C) Чувствительная с полной очисткой от бактериального газона.
Таблица 2 Процентное покрытие фагом EW против 185 изолятов S. aureus .
Time Kill Assays в планктонной культуре
Чтобы исследовать динамику фагов и их хозяев в жидкой культуре, мы количественно оценили способность фагов снижать количество бактерий в бульонных культурах и наблюдали появление любых устойчивых к фагам мутантов. Мы выбрали десять из четырнадцати фагов, которые были способны инфицировать> 96% протестированных изолятов, для экспериментов по уничтожению времени (из таблицы 2). Это были фаги EW15, EW18, EW27, EW29, EW36, EW41, EW52, EW71, EW72 и EW74. Суспензии этих десяти фагов тестировали против TM300H, D329, MRSA252 и 15981. Эти изоляты были выбраны, поскольку они включают две использованные размножающиеся бактерии, MRSA252, представитель основной линии MRSA (CC30), и первый изолят MRSA с секвенированным геномом ( Holden et al., 2004) и хорошо изученный изолят 15981, продуцирующий обильную биопленку. Фаги вводили в растущие культуры для достижения множественности заражения (MOI), равной 0.1, и инкубировали в течение 19 ч с показаниями OD 600 , снятыми каждые 3 мин.
Это были фаги EW15, EW18, EW27, EW29, EW36, EW41, EW52, EW71, EW72 и EW74. Суспензии этих десяти фагов тестировали против TM300H, D329, MRSA252 и 15981. Эти изоляты были выбраны, поскольку они включают две использованные размножающиеся бактерии, MRSA252, представитель основной линии MRSA (CC30), и первый изолят MRSA с секвенированным геномом ( Holden et al., 2004) и хорошо изученный изолят 15981, продуцирующий обильную биопленку. Фаги вводили в растущие культуры для достижения множественности заражения (MOI), равной 0.1, и инкубировали в течение 19 ч с показаниями OD 600 , снятыми каждые 3 мин.
Как EW41, так и EW52, размноженные на D329, были единственным фагом, неэффективным против TM300H в этом анализе планктонной культуры. Остальные восемь фагов успешно снижали рост TM300H в течение 4 часов после их введения и предотвращали любой наблюдаемый рост устойчивых к фагам мутантов через 19 часов (рис. 2A). В случае с изолятом D329 фагам EW27 и EW29 первоначально потребовалось на час больше времени, чем другим фагам, прежде чем они оказали какое-либо влияние на хозяина, как показано на рисунке 2B. Однако и EW27, и EW29 эффективно снижали рост D329 через 4 и 6 часов соответственно, предотвращая при этом появление устойчивых к фагам мутантов. Что касается фага EW72, то ему не удалось истощить количество бактерий до появления устойчивых к фагу мутантов через 5 ч, хотя это повлияло на скорость роста D329 по сравнению с контролями. Интересно, что увеличение плотности бактерий по сравнению с контролем наблюдалось в D329 после добавления EW36. Отдельные фазы роста MRSA252 кажутся менее четко определенными при заражении фагом (рис. 2C), что также наблюдается у штамма 15981 (рис. 2D).Ясно, что ряд фагов не мог эффективно уменьшить численность бактерий до появления устойчивых мутантов. Среди фагов наблюдалась пониженная скорость уничтожения при воздействии на другие штаммы по сравнению с их размножающимися хозяевами, при этом количество бактерий уменьшалось гораздо более постепенно, при этом для некоторых фагов, таких как EW15, требовалось несколько часов. Интересно, что фаги EW71 и EW74 оказывали бактериостатическое действие на штамм 15981 без изменения поглощения, наблюдаемого для c.
Однако и EW27, и EW29 эффективно снижали рост D329 через 4 и 6 часов соответственно, предотвращая при этом появление устойчивых к фагам мутантов. Что касается фага EW72, то ему не удалось истощить количество бактерий до появления устойчивых к фагу мутантов через 5 ч, хотя это повлияло на скорость роста D329 по сравнению с контролями. Интересно, что увеличение плотности бактерий по сравнению с контролем наблюдалось в D329 после добавления EW36. Отдельные фазы роста MRSA252 кажутся менее четко определенными при заражении фагом (рис. 2C), что также наблюдается у штамма 15981 (рис. 2D).Ясно, что ряд фагов не мог эффективно уменьшить численность бактерий до появления устойчивых мутантов. Среди фагов наблюдалась пониженная скорость уничтожения при воздействии на другие штаммы по сравнению с их размножающимися хозяевами, при этом количество бактерий уменьшалось гораздо более постепенно, при этом для некоторых фагов, таких как EW15, требовалось несколько часов. Интересно, что фаги EW71 и EW74 оказывали бактериостатическое действие на штамм 15981 без изменения поглощения, наблюдаемого для c. 14 ч до медленного увеличения (рис. 2D).
14 ч до медленного увеличения (рис. 2D).
Рисунок 2 Кривая времени-уничтожения четырех среднеэкспоненциальных планктонных штаммов S. aureus десятью различными фагами при множественности заражения (MOI) 0,1. Показания поглощения при 600 нм снимали с помощью планшетного ридера каждые 30 минут в течение 19 часов при встряхивании при 37°C, всего было проведено три независимых эксперимента. (A) Модифицированный Изолят S. carnosus TM300H; (Б) S . aureus изолят D329, (C) S . aureus изолят MRSA252 и (D) S . aureus изолят 15981.
Как наблюдалось в D329, EW36, по-видимому, оказывал положительное влияние на рост MRSA252 по сравнению с контролем, поскольку наблюдалось значительное увеличение OD 600 со временем. Такая же тенденция наблюдалась и у EW72 при росте 15981, однако лишь немного больше, чем в контроле. Интересно, что EW52, по-видимому, оказывал кратковременное положительное влияние на скорость роста MRSA252 в течение 2 часов при первоначальном внесении в лунки, после чего следовал продолжительный период заражения, в течение которого концентрация MRSA252 на мгновение увеличивалась, прежде чем в конечном итоге уменьшилась бактериальная плотность ниже начальной концентрации через 15 ч.Для всех трех использованных изолятов S. aureus фаги, которые были способны успешно снижать оптическую плотность и предотвращать повторный рост бактерий, смогли достичь ее в течение 8 часов по сравнению с контролями. Тем не менее, был ряд фагов, включая EW15, EW27, EW29 и EW52, которые проявляли более низкую степень бактериолитической способности по отношению к своим хозяевам, и им требовалось до ~ 13 часов, чтобы оказать какое-либо ингибирующее и бактерицидное действие на бактерии. Изолят 15981 быстро развивал устойчивость к фагам EW18 и EW52.Однако фаг EW52 в конечном итоге успешно снижал плотность бактерий, тогда как фаг EW18 умеренно снижал рост 15981, но вызывал появление устойчивых мутантов.
Интересно, что EW52, по-видимому, оказывал кратковременное положительное влияние на скорость роста MRSA252 в течение 2 часов при первоначальном внесении в лунки, после чего следовал продолжительный период заражения, в течение которого концентрация MRSA252 на мгновение увеличивалась, прежде чем в конечном итоге уменьшилась бактериальная плотность ниже начальной концентрации через 15 ч.Для всех трех использованных изолятов S. aureus фаги, которые были способны успешно снижать оптическую плотность и предотвращать повторный рост бактерий, смогли достичь ее в течение 8 часов по сравнению с контролями. Тем не менее, был ряд фагов, включая EW15, EW27, EW29 и EW52, которые проявляли более низкую степень бактериолитической способности по отношению к своим хозяевам, и им требовалось до ~ 13 часов, чтобы оказать какое-либо ингибирующее и бактерицидное действие на бактерии. Изолят 15981 быстро развивал устойчивость к фагам EW18 и EW52.Однако фаг EW52 в конечном итоге успешно снижал плотность бактерий, тогда как фаг EW18 умеренно снижал рост 15981, но вызывал появление устойчивых мутантов. Штамм 15981 оказался наиболее устойчивым к уничтожению фаговой инфекции в этом анализе. Замедление роста происходило гораздо медленнее по сравнению с другими хозяевами, и в каждом эксперименте наблюдалось появление устойчивости к фагам. Фаг EW41 оказался наиболее эффективным в ингибировании роста всех трех изолятов S. aureus , быстро снижая плотность клеток в течение 2 часов после применения фага.Однако, поскольку EW41 был выделен и размножен на D329, поскольку его нельзя было размножить на TM300H, неудивительно, что в этом анализе он мало или совсем не влиял на TM300H.
Штамм 15981 оказался наиболее устойчивым к уничтожению фаговой инфекции в этом анализе. Замедление роста происходило гораздо медленнее по сравнению с другими хозяевами, и в каждом эксперименте наблюдалось появление устойчивости к фагам. Фаг EW41 оказался наиболее эффективным в ингибировании роста всех трех изолятов S. aureus , быстро снижая плотность клеток в течение 2 часов после применения фага.Однако, поскольку EW41 был выделен и размножен на D329, поскольку его нельзя было размножить на TM300H, неудивительно, что в этом анализе он мало или совсем не влиял на TM300H.
Две наиболее распространенные линии MRSA в Великобритании имеют типы последовательности MLST (ST) 22 и 36, и в настоящее время они распространены по всему миру (Holden et al., 2004; Holden et al., 2013) . Мы выбрали изоляты из этих линий, чтобы изучить их свойства образования биопленки и восприимчивость к фагам, поскольку эти генотипы являются наиболее распространенными в нашей коллекции. Мы сравнили плотность биопленки, продуцируемую 43 изолятами ST22 и 27 изолятами ST36 через 48 часов, путем измерения оптической плотности при OD 590 после окрашивания CV. Мы обнаружили значительные различия в изолятах этих генотипов (дополнительная фигура 1) с очевидной дихотомией между относительно небольшой биопленкой, продуцируемой большинством изолятов ST22, по сравнению с изолятами ST36. Это можно увидеть при визуальном осмотре окрашенных биопленок из четырех наиболее опытных изолятов, производящих биопленки, из каждого ST, при этом биопленки изолята ST36 обычно окрашены более темным цветом, чем биопленки ST22 (дополнительная фигура 2).
Мы сравнили плотность биопленки, продуцируемую 43 изолятами ST22 и 27 изолятами ST36 через 48 часов, путем измерения оптической плотности при OD 590 после окрашивания CV. Мы обнаружили значительные различия в изолятах этих генотипов (дополнительная фигура 1) с очевидной дихотомией между относительно небольшой биопленкой, продуцируемой большинством изолятов ST22, по сравнению с изолятами ST36. Это можно увидеть при визуальном осмотре окрашенных биопленок из четырех наиболее опытных изолятов, производящих биопленки, из каждого ST, при этом биопленки изолята ST36 обычно окрашены более темным цветом, чем биопленки ST22 (дополнительная фигура 2).
Мы использовали те же изоляты ST22; изоляты ARI10, WW44936, 1018.07, HO5322054809 и ST36; 07.1696.F, 06.9570.L, 07.1227.Z и 07.2880.V (подробные сведения об изолятах см. в Таблице 1), чтобы изучить взаимосвязь между биомассой биопленки и количеством жизнеспособных клеток. Мы сравнили показания OD 590 окрашенных CV 48-часовых зрелых биопленок для этих восьми изолятов и сравнили их с количеством жизнеспособных клеток. На дополнительном рисунке 3 показано, что изменение биомассы биопленки между самыми сильными и самыми слабыми биопленкообразователями не обязательно коррелирует с количеством присутствующих жизнеспособных клеток.Все изоляты имели примерно одинаковое количество клеток в своих биопленках, но для некоторых изолятов наблюдалась заметно большая вариация в показаниях OD 590 . Изоляты ST22 ARI10 и WW936 продуцировали значительно больше CV-окрашенных биопленок, чем 1018.07 и 370.07, и аналогичным образом изоляты ST36 07.1696.F и 06.9570.L давали гораздо больше CV-окрашенных биопленок, чем два других изолята этого генотипа.
На дополнительном рисунке 3 показано, что изменение биомассы биопленки между самыми сильными и самыми слабыми биопленкообразователями не обязательно коррелирует с количеством присутствующих жизнеспособных клеток.Все изоляты имели примерно одинаковое количество клеток в своих биопленках, но для некоторых изолятов наблюдалась заметно большая вариация в показаниях OD 590 . Изоляты ST22 ARI10 и WW936 продуцировали значительно больше CV-окрашенных биопленок, чем 1018.07 и 370.07, и аналогичным образом изоляты ST36 07.1696.F и 06.9570.L давали гораздо больше CV-окрашенных биопленок, чем два других изолята этого генотипа.
Штаммы ST22 продемонстрировали склонность к образованию умеренно прилипших биопленок, которые имели значительно более низкие значения OD, чем лучшие биопленкообразователи ST36, но при этом у них было постоянно более высокое количество клеток — аналогично значениям, наблюдаемым для изолятов ST36.Биопленки, продуцируемые штаммом S. aureus , были обнаружены на границе воздух-биопленка и в виде больших агрегатов на поверхности раздела твердое тело-жидкость у основания лунок титрационного микропланшета.
Влияние фагов на 48-часовые биопленки
Мы выбрали четыре фага (EW27, EW36, EW41 и EW71) для анализа уменьшения биопленки на основе; i) их широкий круг хозяев по сравнению с исследуемыми изолятами (таблица 2) и ii) быстро литические характеристики в планктонной культуре и наблюдаемое отсутствие отбора устойчивых мутантов (рисунок 2).Каждый из этих четырех фагов добавляли к 48-часовым биопленкам при MOI 0,1 или 1,0, а подсчет жизнеспособных клеток и показания OD 600 окрашенных CV биопленок проводили через 6 и 24 часа после применения фага. Показания биопленки для каждого фага и соответствующее количество жизнеспособных клеток представлены на дополнительных рисунках 4–7, а показания биопленки обобщены в таблице 3. MOI) против четырех изолятов ST22 и четырех изолятов ST36.
EW27
Количество жизнеспособных клеток, извлеченных из каждой биопленки, обработанной фагом EW27, для всех изолятов ST22 и ST36, кроме изолята 07.2496.L, было значительно снижено ( p < 0,001) после 6-часового воздействия EW27 по сравнению с необработанные элементы управления биопленкой (таблица 3 и дополнительная фигура 4). Однако после первоначального снижения КОЕ/мл через 6 ч можно наблюдать увеличение концентрации бактерий во всех изолятах ST22, обработанных фагом, через 24 ч, что позволяет предположить, что в течение этого времени возникла резистентность к фагу.Не было существенной разницы между количеством КОЕ в лунках, обработанных фагом в течение 6 и 24 часов ( p <0,05). При рассмотрении общей биомассы биопленки после воздействия фага и окрашивания CV результаты показали, что фаг EW27 был высокоэффективен в уменьшении биопленки, продуцируемой всеми штаммами ST22 и ST36. Для изолятов ST36, обработанных EW27, биомасса биопленки значительно увеличилась в изолятах 07.1696.F, 06.9570.L и BTN 2172 с использованием как MOI 1, так и 0,1 ( p <0,05), несмотря на незначительное снижение количества бактерий после 24-часовой обработки по сравнению с до 6 ч.После обработки EW27 после обеих временных точек EW27 при MOI 0,1 оказался наиболее эффективным как для уменьшения бактериальных клеток, так и для биомассы биопленки почти для всех штаммов ST22 и ST36.
Однако после первоначального снижения КОЕ/мл через 6 ч можно наблюдать увеличение концентрации бактерий во всех изолятах ST22, обработанных фагом, через 24 ч, что позволяет предположить, что в течение этого времени возникла резистентность к фагу.Не было существенной разницы между количеством КОЕ в лунках, обработанных фагом в течение 6 и 24 часов ( p <0,05). При рассмотрении общей биомассы биопленки после воздействия фага и окрашивания CV результаты показали, что фаг EW27 был высокоэффективен в уменьшении биопленки, продуцируемой всеми штаммами ST22 и ST36. Для изолятов ST36, обработанных EW27, биомасса биопленки значительно увеличилась в изолятах 07.1696.F, 06.9570.L и BTN 2172 с использованием как MOI 1, так и 0,1 ( p <0,05), несмотря на незначительное снижение количества бактерий после 24-часовой обработки по сравнению с до 6 ч.После обработки EW27 после обеих временных точек EW27 при MOI 0,1 оказался наиболее эффективным как для уменьшения бактериальных клеток, так и для биомассы биопленки почти для всех штаммов ST22 и ST36.
EW36
Фаг EW36 вызывал значительное снижение биомассы биопленки для всех исследуемых изолятов, за исключением 07.2496.L, при обоих MOI ( p <0,01), при этом MOI 0,1 оказался наиболее эффективным (таблица 3 и дополнительная фигура 5). Как для ST22, так и для ST36 не наблюдалось увеличения плотности биопленки с 6 до 24 ч, что позволяет предположить, что фаг EW36 успешно разрушал биопленки, предотвращая повторный рост.Это также подтверждается более значительным снижением количества жизнеспособных клеток, когда биопленки обрабатывались в течение 24 часов. Интересно, что популяции жизнеспособных бактерий, извлеченных из каждой биопленки, продуцируемой четырьмя изолятами ST22 и ST36, оказались выше в лунках, обработанных фагом EW36, при MOI 0,1, несмотря на более низкие показатели поглощения, чем биопленки, обработанные более высоким титром фага при MOI 0,1. MOI 1. EW36 смог снизить количество жизнеспособных клеток для изолятов ST22 и ST36 по крайней мере на один log через 6 ч и на два log через 24 ч при MOI 0. 1. Для биопленок, обработанных при множественности множественности 1, через 6 часов наблюдалось двухлогарифмическое снижение, а через 24 часа — трехлогарифмическое снижение.
1. Для биопленок, обработанных при множественности множественности 1, через 6 часов наблюдалось двухлогарифмическое снижение, а через 24 часа — трехлогарифмическое снижение.
EW41
Значительное снижение ( p < 0,01) биомассы биопленки наблюдалось для всех изолятов ST22 и ST36, протестированных с фагом EW41, за исключением изолята 370.07, где наблюдалось двухлогарифмическое снижение количества восстановленных клеток и снижение биопленки на 60-93%. биомассу наблюдали после 6-часовой обработки (таблица 3 и дополнительная фигура 6). Интересно, что фаг EW41 оказывал наименьшее влияние на снижение биомассы биопленки изолята W449 36 через 6 ч, снижая ее примерно на 22 % при MOI 1 и на 19 % при MOI 0.1; однако количество жизнеспособных клеток было относительно всех других изолятов, и в обе временные точки наблюдалось двухлогарифмическое снижение. Кроме того, биомасса биопленки и количество жизнеспособных клеток, восстановленных из биопленок, подвергнутых заражению EW41, через 24 часа дали уровни, аналогичные 6-часовому воздействию. Фаг EW41 смог дополнительно снизить уровни биопленки W449 36 примерно на 85% при воздействии в течение 24 часов. Биопленки ST36, подвергнутые заражению фагом EW41 в течение 24 часов, давали более высокие уровни биомассы биопленки и увеличение числа извлеченных клеток до одного log по сравнению с 6-часовой экспозицией, что позволяет предположить, что за это время произошел повторный рост.Во всех изолятах ST22 и ST36 как биомасса биопленки, так и извлеченные жизнеспособные клетки были постоянно ниже в лунках, зараженных EW41, при множественности заражения 0,1 по сравнению с множественностью заражения 1, хотя это не было значительным.
Фаг EW41 смог дополнительно снизить уровни биопленки W449 36 примерно на 85% при воздействии в течение 24 часов. Биопленки ST36, подвергнутые заражению фагом EW41 в течение 24 часов, давали более высокие уровни биомассы биопленки и увеличение числа извлеченных клеток до одного log по сравнению с 6-часовой экспозицией, что позволяет предположить, что за это время произошел повторный рост.Во всех изолятах ST22 и ST36 как биомасса биопленки, так и извлеченные жизнеспособные клетки были постоянно ниже в лунках, зараженных EW41, при множественности заражения 0,1 по сравнению с множественностью заражения 1, хотя это не было значительным.
EW71
Фаг EW71 оказался наиболее эффективным из четырех в снижении плотности биопленки и количества жизнеспособных клеток (таблица 3 и дополнительная фигура 7). Фаг EW71 был эффективен в снижении ( p <0,01) биомассы биопленки после 6 часов обработки, при этом значительно ограничивая повторный рост через 24 часа.Кроме того, фаг EW71 успешно снижал количество жизнеспособных клеток на величину до трех логарифмических единиц через 6 ч и продолжал снижать количество жизнеспособных клеток после 24-часовой обработки на величину до четырех логарифмических единиц по сравнению с контролем. Плотность биопленки ST22 после обработки EW71 через 6 часов колебалась от 63% до 87%, что, следовательно, предотвращало повторный рост всех четырех хозяев ST22 через 24 часа, что еще больше снижало плотность биопленки. Более значительное снижение плотности биопленки также наблюдалось, когда изоляты ST36 подвергались заражению фагом EW71, при этом значения OD 590 снижались на 59–95 % через 6 часов.Интересно, что незначительное увеличение поглощения наблюдалось во всех четырех биопленках ST36 при воздействии фага в течение 24 часов. Однако увеличение числа жизнеспособных клеток до уровня наблюдалось только для 07.1696.F и 07.2496.L, что позволяет предположить, что устойчивость к фагам и повторный рост произошли в течение двух периодов отбора проб. Было обнаружено, что фаги, применяемые к биопленкам при MOI 1, наиболее эффективны для снижения количества жизнеспособных клеток в биопленке после 6- и 24-часового воздействия; однако плотность биопленки была несколько выше при этом MOI.
Плотность биопленки ST22 после обработки EW71 через 6 часов колебалась от 63% до 87%, что, следовательно, предотвращало повторный рост всех четырех хозяев ST22 через 24 часа, что еще больше снижало плотность биопленки. Более значительное снижение плотности биопленки также наблюдалось, когда изоляты ST36 подвергались заражению фагом EW71, при этом значения OD 590 снижались на 59–95 % через 6 часов.Интересно, что незначительное увеличение поглощения наблюдалось во всех четырех биопленках ST36 при воздействии фага в течение 24 часов. Однако увеличение числа жизнеспособных клеток до уровня наблюдалось только для 07.1696.F и 07.2496.L, что позволяет предположить, что устойчивость к фагам и повторный рост произошли в течение двух периодов отбора проб. Было обнаружено, что фаги, применяемые к биопленкам при MOI 1, наиболее эффективны для снижения количества жизнеспособных клеток в биопленке после 6- и 24-часового воздействия; однако плотность биопленки была несколько выше при этом MOI. Несмотря на это, биомассы биопленки были примерно одинаковыми у большинства хозяев как при 6-, так и при 24-часовой обработке, за исключением изолята W449 36; однако эта разница не была существенной.
Несмотря на это, биомассы биопленки были примерно одинаковыми у большинства хозяев как при 6-, так и при 24-часовой обработке, за исключением изолята W449 36; однако эта разница не была существенной.
Оценка анализов фаговых биопленок
В таблице 3 и на дополнительных рисунках 4–7 показано процентное снижение биопленок изолята S. aureus ST22 и ST36 при заражении EW27, EW36, EW41 и EW71 при множественности множественности 1 и 0,1 после 6 и 24 ч. Для всех изолятов ST22 среднее снижение биомассы биопленки для MOI 1 и MOI 0.1 через 6 часов составило 59% и 71% соответственно, тогда как медиана снижения для MOI 1 и MOI 0,1 после 24-часового воздействия составила 72% и 75% соответственно. Принимая во внимание, что для изолятов ST36 среднее снижение биомассы биопленки для MOI 1 и MOI 0,1 через 6 ч составило 80% и 79% соответственно. После 24-часовой обработки среднее снижение MOI 1 и MOI 0,1 для изолятов ST36 составило 75% и 80% соответственно.
В целом, наибольшее снижение биомассы биопленки после 6- и 24-часовой обработки фагами наблюдалось с фагами EW41 и EW71 соответственно, при MOI 0. 1. Хотя значительное снижение биомассы биопленки наблюдалось при обработке обоими MOI фага, наибольшее снижение для всех изолятов ST22 и ST36 после 6- и 24-часового воздействия было достигнуто при обработке биопленок при MOI 0,1. Хотя каждый фаг был способен рассеивать биопленки всех исследуемых изолятов, полной элиминации клеток не наблюдалось ни у одного из хозяев ни в одном из MOI, поскольку клетки восстанавливались при обработке фагами в течение 6 ч и 24 ч.
1. Хотя значительное снижение биомассы биопленки наблюдалось при обработке обоими MOI фага, наибольшее снижение для всех изолятов ST22 и ST36 после 6- и 24-часового воздействия было достигнуто при обработке биопленок при MOI 0,1. Хотя каждый фаг был способен рассеивать биопленки всех исследуемых изолятов, полной элиминации клеток не наблюдалось ни у одного из хозяев ни в одном из MOI, поскольку клетки восстанавливались при обработке фагами в течение 6 ч и 24 ч.
Фагорезистентные мутанты
Морфология колоний, извлеченных из обработанных фагом биопленок, была гетерогенной, и это было наиболее заметно для изолятов, обработанных фагом EW71, как показано на рисунке 3.Было обнаружено, что устойчивые к фагам мутантные изоляты, извлеченные из каждого эксперимента с фагами, устойчивы ко всем фагам при точечном тестировании на слоях агара.
Рисунок 3 Гетерогенные фенотипы колоний, образованные устойчивыми к фагам мутантами S. aureus 07.2496.L и 07. 1696.F после воздействия EW71.
1696.F после воздействия EW71.
Геномика
Мы секвенировали геномы 22 фагов с широким кругом хозяев на основе результатов точечного тестирования (таблица 2). Все они являются Myoviruses и членами подсемейства Twortvirinae семейства Herelleviridae на основании сходства BLASTN.Для дальнейшего изучения родства и таксономии наших фагов мы сравнили их геномы со 100 общедоступными геномами Twortvirinae в Genbank (по состоянию на апрель 2021 г.) с использованием алгоритма min-hash, реализованного в MASH (Ondov et al., 2016), для создания матрицы расстояний, которые использовались для построения дендрограмм соседнего соединения, показанных на рисунке 4. Геномы 22 фагов разделены на три основные группы, обозначенные 1 3.
Рисунок 4 расстояния. (A) неукорененная дендрограмма фагов EW1-22, показывающая три основные группы и подгруппы. (B) Круговая дендрограмма, показывающая родство одних и тех же фагов по отношению к 100 Twortvirinae геномным сборкам и родам фагов, которые они представляют. Дендрограмма укоренена в середине самой длинной ветви.
Дендрограмма укоренена в середине самой длинной ветви.
Группа 1
Эта группа содержит пять фагов EW15, EW20, EW22, EW27 и EW41 (показаны красным на рис. 4). Они имеют очень высокое сходство (расстояния MASH <1%) друг с другом, за исключением фага EW41, который отличается на 1.6% (дополнительная таблица 1). Он также имеет немного меньший геном - 132 999 п.н. по сравнению с другими, размер которых составляет около 135 800 п.н. Эти фаги очень похожи на 11 стафилококковых фагов рода Silviavirus и объединяются с ними (рис. 4B). К ним относятся фаги широкого круга хозяев Romulus и Remus, предложенные в качестве идеальных фагов-кандидатов для терапии человека из-за их широкого круга хозяев и вирулентности (Vandersteegen et al., 2013).
Группа 2
Самая большая группа в этом исследовании включает 11 фагов рода Kayvirus на основании сходства геномных последовательностей, геномы которых имеют сходство >95% ( i.е. <5% расстояния MASH) друг с другом (рисунок 4 и дополнительная таблица 1). Он содержит три подгруппы A, B и C, которые отмечены зеленым цветом на рисунке 4. Группа 2A содержит фаги EW36 и EW42 длиной 139 881 и 139 874 п.н. соответственно. Группа 2B состоит из фагов EW1, EW2, EW4, которые очень похожи (>99%) друг на друга, и EW13, который отличается от них примерно на 1,8% оснований. Первые три фага имеют геномы длиной 140 906 п.н., около 4 т.п.н. короче, чем у EW13, на 145 736 п.н.Группа 2C включает фаги EW3, EW5, EW6, EW7 и EW9 с геномами от 141 953 до 143 288 п.н. Их геномы >99,5% сходства друг с другом. Фаги группы 2 сами по себе образуют отдельную кладу на дендрограмме на рисунке 4B и наиболее тесно связаны с геномами, принадлежащими фагам рода Kayvirus , которые включают вид «Staphylococcus phage MCE-2014» (Alves et al., 2014). ) и несколько неклассифицированных Kayviruses, имеющих около 90% сходства последовательностей. О фаге MCE-2014 (также известном как DRA88) впервые сообщили в исследовании, в котором он использовался в сочетании с фагом K для лечения экспериментального S.
Он содержит три подгруппы A, B и C, которые отмечены зеленым цветом на рисунке 4. Группа 2A содержит фаги EW36 и EW42 длиной 139 881 и 139 874 п.н. соответственно. Группа 2B состоит из фагов EW1, EW2, EW4, которые очень похожи (>99%) друг на друга, и EW13, который отличается от них примерно на 1,8% оснований. Первые три фага имеют геномы длиной 140 906 п.н., около 4 т.п.н. короче, чем у EW13, на 145 736 п.н.Группа 2C включает фаги EW3, EW5, EW6, EW7 и EW9 с геномами от 141 953 до 143 288 п.н. Их геномы >99,5% сходства друг с другом. Фаги группы 2 сами по себе образуют отдельную кладу на дендрограмме на рисунке 4B и наиболее тесно связаны с геномами, принадлежащими фагам рода Kayvirus , которые включают вид «Staphylococcus phage MCE-2014» (Alves et al., 2014). ) и несколько неклассифицированных Kayviruses, имеющих около 90% сходства последовательностей. О фаге MCE-2014 (также известном как DRA88) впервые сообщили в исследовании, в котором он использовался в сочетании с фагом K для лечения экспериментального S. aureus биопленки. Используемый здесь мутант фага K штамма MRSA252 был получен из этого исследования (таблица 1).
aureus биопленки. Используемый здесь мутант фага K штамма MRSA252 был получен из этого исследования (таблица 1).
Группа 3
Эта группа содержит две близкородственные подгруппы фагов, геномы которых различаются примерно на 3%. Четыре фага группы 3A в этой группе — это EW18, EW26, EW29 и EW72 с геномами от 143, 240 до 143 287 п.н., которые > 99,5% похожи друг на друга. Они наиболее тесно связаны с изолятами базы данных рода Kayvirus , которые включают виды phiPLA-Rodi, чей эталонный фаг, phiIPLA-RODI, использовался в нескольких исследованиях, в том числе с участием S.aureus (Gutierrez et al., 2015; Gonzalez et al., 2017). Геномы фагов группы 3B EW71 и EW74 имеют длину 139 939 и 139 896 п.н. соответственно, и они имеют > 99% сходства последовательностей друг с другом и с геномами трех фагов в Genbank из рода Kayvirus . К ним относится фаг K (Gill, 2014), наиболее известный из стафилококковых фагов (рис. 4B), который обычно включают в препараты стафилококковых фагов (O’Flaherty et al. , 2005b).
, 2005b).
В целом, геномы фагов Silviavirus группы 1 имеют примерно от 25% до 26% сходства последовательностей ДНК с геномами фагов Kayvirus групп 2 и 3. Группы 2 и 3 более похожи: сходство ДНК примерно 90% с использованием минимальных расстояний (дополнительная таблица 1). В дополнительной таблице 2 перечислены все аннотированные гены в изученных 122 Twortvirinae и показано их отсутствие (идентичность BLASTP> 95%). Фаги группы 1 не имели общих генов с фагами групп 2 и 3 при использовании Roary с параметрами по умолчанию.Группы 2 и 3 имеют общие 38 генов при идентичности BLASTP> 95% (18% из 202 генов в геноме EW1). Никакая известная функция не могла быть назначена 33, но основные гены включали ген терминазы, кодируемую интроном эндонуклеазу, белок, содержащий домен LysM, предполагаемый белок репарации ДНК и белок компонента вириона.
Диапазон хозяев фагов группы 1, измеряемый процентом штаммов, способных быть инфицированными (охват), варьировал от 61,62% до 97,3%.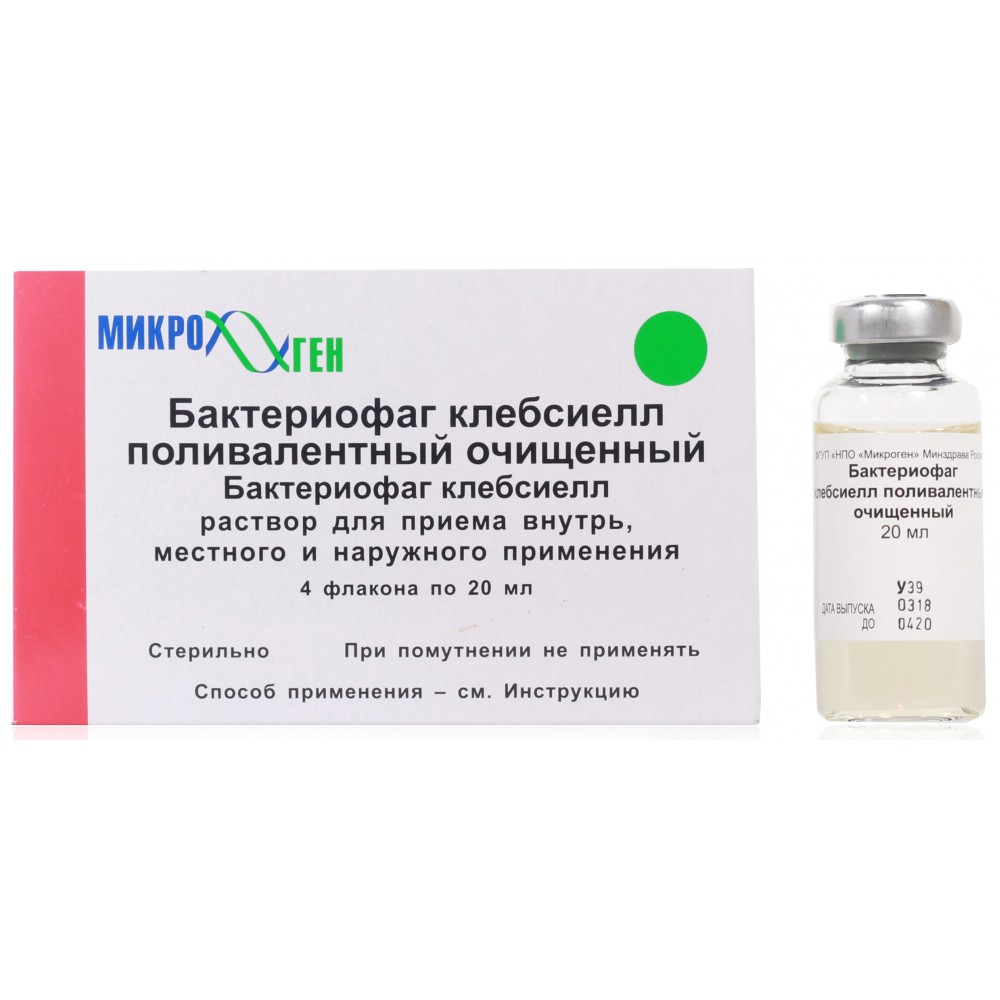 Во 2-й группе это покрытие варьировалось от 56.с 76% до 96,76% и в группе 3 с 96,22% до 99,46% (таблица 2). Таким образом, все три группы имели фаги, которые могли инфицировать подавляющее большинство, если не все 184 клинических изолята, но не мутантный штамм MRSA252 фага К.
Во 2-й группе это покрытие варьировалось от 56.с 76% до 96,76% и в группе 3 с 96,22% до 99,46% (таблица 2). Таким образом, все три группы имели фаги, которые могли инфицировать подавляющее большинство, если не все 184 клинических изолята, но не мутантный штамм MRSA252 фага К.
Обсуждение
Фаговая терапия имеет потенциал для лечения многих бактериальных заболеваний, но для большинства бактериальных патогенов ограниченный круг хозяев литических фагов означает, что эмпирическое использование требует использования смесей различных штаммов фагов с различным кругом хозяев и характеристиками вирулентности .Широкий круг хозяев, высоковирулентные фаги S. aureus относительно легко выделить, и их использование в фаговой терапии, особенно в Грузии и Польше, было связано с высокой степенью успеха. Это исследование подтверждает сообщения о чрезвычайно широком круге хозяев некоторых Myoviridae, особенно некоторых охарактеризованных здесь кейвирусов и сильвиавирусов. Два из этих Kayvirus, EW70 и EW71, смогли заразить полную панель наших 185 генетически разнообразных изолятов S. aureus в слоях агара, которые включали очень широкий спектр генотипов MRSA и MSSA.Девять других фагов могли инфицировать> 96% изолятов, и они включали три сильвиавируса, два кайвируса из другой клады из EW70 и EW71, а также четыре других, которые тесно связаны с EW70 и EW71. Широкий круг хозяев миовирусов S. aureus частично объясняется тем, что они имеют общий рецептор, который, как было обнаружено, является основой тейхоевых кислот клеточной стенки (Xia et al., 2011; Winstel et al., 2013).
aureus в слоях агара, которые включали очень широкий спектр генотипов MRSA и MSSA.Девять других фагов могли инфицировать> 96% изолятов, и они включали три сильвиавируса, два кайвируса из другой клады из EW70 и EW71, а также четыре других, которые тесно связаны с EW70 и EW71. Широкий круг хозяев миовирусов S. aureus частично объясняется тем, что они имеют общий рецептор, который, как было обнаружено, является основой тейхоевых кислот клеточной стенки (Xia et al., 2011; Winstel et al., 2013).
В наших планктонных анализах все 10 фагов были способны инфицировать по крайней мере один из четырех штаммов S.aureus тестировали, и пять из них смогли заразить и значительно снизить рост двух. Было обнаружено, что EW41 является наиболее эффективным в планктонных условиях, поскольку он сразу же снижает количество бактериальных клеток, предотвращая повторный рост всех трех изолятов S. aureus , но не оказывает влияния на модифицированный изолят S. carnosus . Поскольку он был размножен на хозяине S. aureus , штамм D239, его специфичность может быть более ограниченной по сравнению с другими фагами при заражении коагулазонегативными стафилококками.Четыре фага не влияли на рост по крайней мере одного из трех хозяев S. aureus в жидкой культуре. Однако эффективные фаги были способны предотвратить появление резистентных мутантов на протяжении всего эксперимента. Когда наблюдали устойчивые мутанты, скорость роста и, предположительно, приспособленность этих устойчивых к фагам клеток явно влияли и не восстанавливались до уровней, достигнутых неинфицированным контролем. Это говорит о том, что устойчивость к фаговой инфекции была достигнута за счет способности к росту (Middelboe, 2000; Avrani and Lindell, 2015).Возникновение спонтанной устойчивости к фагам может включать отбор субпопуляций с измененными структурами рецепторов, которые в S. aureus включают техоевую кислоту стенки (Hall et al., 2011; Xia et al., 2011; Avrani and Lindell, 2015).
Поскольку он был размножен на хозяине S. aureus , штамм D239, его специфичность может быть более ограниченной по сравнению с другими фагами при заражении коагулазонегативными стафилококками.Четыре фага не влияли на рост по крайней мере одного из трех хозяев S. aureus в жидкой культуре. Однако эффективные фаги были способны предотвратить появление резистентных мутантов на протяжении всего эксперимента. Когда наблюдали устойчивые мутанты, скорость роста и, предположительно, приспособленность этих устойчивых к фагам клеток явно влияли и не восстанавливались до уровней, достигнутых неинфицированным контролем. Это говорит о том, что устойчивость к фаговой инфекции была достигнута за счет способности к росту (Middelboe, 2000; Avrani and Lindell, 2015).Возникновение спонтанной устойчивости к фагам может включать отбор субпопуляций с измененными структурами рецепторов, которые в S. aureus включают техоевую кислоту стенки (Hall et al., 2011; Xia et al., 2011; Avrani and Lindell, 2015). Затраты на приспособление, связанные с приобретением фагорезистентности, могут вызывать различные структурные и морфологические изменения (Inal, 2003; Ormala and Jalasvuori, 2013). Один из подходов заключается в сокрытии поверхностных рецепторов, которые фаги использовали в качестве мест стыковки для адсорбции на своих хозяевах; однако эти участки часто используются для поглощения питательных веществ (Mizoguchi et al., 2003), что, возможно, ограничивало их рост и вирулентность, что может быть причиной того, что количество клеток смогло восстановиться после 24-часовой обработки по сравнению с 6-часовой, однако плотность биопленки оставалась значительно низкой.
Затраты на приспособление, связанные с приобретением фагорезистентности, могут вызывать различные структурные и морфологические изменения (Inal, 2003; Ormala and Jalasvuori, 2013). Один из подходов заключается в сокрытии поверхностных рецепторов, которые фаги использовали в качестве мест стыковки для адсорбции на своих хозяевах; однако эти участки часто используются для поглощения питательных веществ (Mizoguchi et al., 2003), что, возможно, ограничивало их рост и вирулентность, что может быть причиной того, что количество клеток смогло восстановиться после 24-часовой обработки по сравнению с 6-часовой, однако плотность биопленки оставалась значительно низкой.
При применении в низких концентрациях (MOI 0,1) фаги должны инфицировать и реплицироваться в достаточной степени, чтобы увеличить их количество, чтобы превзойти скорость репликации для бактериального хозяина. Это могло бы объяснить, почему большинство изолятов-хозяев продолжали расти в течение по крайней мере 1 часа после введения. В аналогичных исследованиях, сравнивающих инфицирование фагами при различных MOI (Abedon, 1992; Beeton et al., 2015; Cui et al., 2017a), чем больше MOI, тем эффективнее был фаг в исследовании, что, предположительно, в значительной степени связано с увеличением частоты столкновений и инфекций фагов, что приводит к более высокой плотности вирусного потомства в более короткие сроки. .
В аналогичных исследованиях, сравнивающих инфицирование фагами при различных MOI (Abedon, 1992; Beeton et al., 2015; Cui et al., 2017a), чем больше MOI, тем эффективнее был фаг в исследовании, что, предположительно, в значительной степени связано с увеличением частоты столкновений и инфекций фагов, что приводит к более высокой плотности вирусного потомства в более короткие сроки. .
Четыре фага S. aureus , использованные в исследованиях биопленок, были выбраны на основе их литического потенциала в анализах на точечных чашках и в жидкой культуре. Все четыре продемонстрировали в целом высокую эффективность в эффективном снижении биомассы биопленки и числа клеток каждого S.aureus изолируют через 6 и 24 ч. Повторный рост клеток был обнаружен после 24-часового заражения фагом по сравнению с 6-часовым заражением по крайней мере одним из хозяев, что позволяет предположить, что произошел рост устойчивых к фагам мутантов, однако это произошло за счет повторного роста биопленки. Эти наблюдения были аналогичны тем, о которых сообщалось в предыдущем исследовании биопленки S. aureus (Melo et al., 2018). Наблюдение за повторным ростом биопленки и устойчивостью к фагам по-прежнему остается серьезной проблемой и регулярно наблюдается в биопленках при воздействии одного литического фага, который способствует отбору мутантов (Drilling et al., 2014). Это требует комбинированного фагового подхода с использованием коктейлей фагов или совместного введения с антибиотиками для предотвращения появления устойчивых к фагам мутантных бактерий. В предыдущих исследованиях использовалась разрушающая способность фага сокращать структуры биопленки, продуцируемые S. aureus , и сокращать бактериальные популяции в достаточной степени, чтобы облегчить проникновение антибиотиков и искоренить инфекцию (Tkhilaishvili et al., 2018; Dickey and Perrot, 2019). . Предыдущие данные свидетельствуют о том, что фенотип устойчивости к фагам повышает чувствительность к антибиотикам, а также приводит к потере приспособленности (Leon and Bastias, 2015).
Эти наблюдения были аналогичны тем, о которых сообщалось в предыдущем исследовании биопленки S. aureus (Melo et al., 2018). Наблюдение за повторным ростом биопленки и устойчивостью к фагам по-прежнему остается серьезной проблемой и регулярно наблюдается в биопленках при воздействии одного литического фага, который способствует отбору мутантов (Drilling et al., 2014). Это требует комбинированного фагового подхода с использованием коктейлей фагов или совместного введения с антибиотиками для предотвращения появления устойчивых к фагам мутантных бактерий. В предыдущих исследованиях использовалась разрушающая способность фага сокращать структуры биопленки, продуцируемые S. aureus , и сокращать бактериальные популяции в достаточной степени, чтобы облегчить проникновение антибиотиков и искоренить инфекцию (Tkhilaishvili et al., 2018; Dickey and Perrot, 2019). . Предыдущие данные свидетельствуют о том, что фенотип устойчивости к фагам повышает чувствительность к антибиотикам, а также приводит к потере приспособленности (Leon and Bastias, 2015). Кроме того, применение коктейлей фагов, состоящих из нескольких поливалентных фагов, нацеленных на разные рецепторные белки, для предотвращения множественной устойчивости, но также увеличивает скорость уничтожения, что значительно снижает вероятность того, что хозяева приобретут устойчивость к фагу (Gu et al., 2012) . Способности против биопленок и широкий круг хозяев, продемонстрированные четырьмя изучаемыми фагами, делают их многообещающими кандидатами для возможных будущих комбинированных исследований.
Кроме того, применение коктейлей фагов, состоящих из нескольких поливалентных фагов, нацеленных на разные рецепторные белки, для предотвращения множественной устойчивости, но также увеличивает скорость уничтожения, что значительно снижает вероятность того, что хозяева приобретут устойчивость к фагу (Gu et al., 2012) . Способности против биопленок и широкий круг хозяев, продемонстрированные четырьмя изучаемыми фагами, делают их многообещающими кандидатами для возможных будущих комбинированных исследований.
Предыдущие исследования фагов/хозяев продемонстрировали, что увеличение концентрации взаимодействия фагов с бактериями (MOI), которое существенно увеличивает скорость столкновений между фагом и клетками биопленки, приводит к увеличению скорости уничтожения бактерий (Gupta and Prasad, 2011). ; Лопес и др., 2018). Кроме того, большее снижение могло быть достигнуто за счет прямого бактериального лизиса без эффекта. Однако не было существенной разницы между значениями MOI, что позволяет предположить, что повышенное соотношение фагов и бактерий не дает преимуществ в снижении биомассы биопленки, как описано ранее (Lopes et al. , 2018). В целом, снижение биомассы биопленки (OD 590 ) в целом было выше в биопленках, обработанных при MOI 0,1 (по сравнению с 1) с использованием любого из четырех фагов после 6-часовой и 24-часовой обработки.Эффективность низкого MOI демонстрирует самовоспроизводящуюся природу литических фагов для размножения в количестве, поэтому требуется только небольшая начальная доза.
, 2018). В целом, снижение биомассы биопленки (OD 590 ) в целом было выше в биопленках, обработанных при MOI 0,1 (по сравнению с 1) с использованием любого из четырех фагов после 6-часовой и 24-часовой обработки.Эффективность низкого MOI демонстрирует самовоспроизводящуюся природу литических фагов для размножения в количестве, поэтому требуется только небольшая начальная доза.
По сравнению с характерными фенотипами гладких, округлых колоний, обычно продуцируемых S. aureus , восстановление гетерогенных морфотипов, продуцируемых устойчивыми к фагам производными после воздействия фага, регулярно выявлялось в ходе этого исследования, хотя чаще всего наблюдалось в биопленках, обработанных EW71. . О подобных колониях неправильной формы сообщалось в предыдущих исследованиях, и считается, что они вызваны субпопуляцией внутри колонии, которая вернулась к чувствительному к фагам фенотипу, что впоследствии привело к гибели клеток по мере формирования колонии (Mizoguchi et al. , 2003; О’Флинн и др., 2007 г.; Кочарунчитт и др., 2009). Однако наблюдение колоний, подобных «пакману», как показано здесь, не было так хорошо задокументировано и требует дальнейшего изучения.
, 2003; О’Флинн и др., 2007 г.; Кочарунчитт и др., 2009). Однако наблюдение колоний, подобных «пакману», как показано здесь, не было так хорошо задокументировано и требует дальнейшего изучения.
Основным фактором при производстве фагов для терапии человека является возможное присутствие индуцированного профага из размножающихся бактерий-хозяев. Изоляты S. aureus обычно содержат несколько профагов в своих геномах, которые опосредуют горизонтальный перенос генов и содержат гены вирулентности, такие как токсины (Xia and Wolz, 2014).В этом исследовании мы обнаружили, что большинство фагов можно размножать на авирулентном штамме S. carnosus , который можно использовать для повышения безопасности стафилококковых фаговых терапевтических средств в будущем производстве GMP, если использовать вместо потенциально вирулентных хозяев S. aureus . .
Заявление о доступности данных
Наборы данных, представленные в этом исследовании, можно найти в онлайн-репозиториях. Названия репозитория/репозиториев и регистрационные номера можно найти ниже: https://www.ncbi.nlm.nih.gov/genbank/, GCA_011207355, GCA_011207615, GCA_011207935, GCA_011208035, GCA_011208175, GCA_011208205, GCA_011208235, GCA_011208435, GCA_011207435, GCA_011207495, GCA_011207545, GCA_011207665, GCA_011207715, GCA_011207785, GCA_011207815, GCA_011207845, GCA_011207985, MT080595, GCA_011208105, GCA_011208285 , GCA_011208355 и GCA_01120837.
Названия репозитория/репозиториев и регистрационные номера можно найти ниже: https://www.ncbi.nlm.nih.gov/genbank/, GCA_011207355, GCA_011207615, GCA_011207935, GCA_011208035, GCA_011208175, GCA_011208205, GCA_011208235, GCA_011208435, GCA_011207435, GCA_011207495, GCA_011207545, GCA_011207665, GCA_011207715, GCA_011207785, GCA_011207815, GCA_011207845, GCA_011207985, MT080595, GCA_011208105, GCA_011208285 , GCA_011208355 и GCA_01120837.
Вклад авторов
ME задумал это исследование. ME, EW, JR, GX, AM, RR и SM разработали экспериментальные процедуры. EW, ME, JR, SM и RR проводили эксперименты, анализировали и курировали данные.EW и ME собрали коллекцию фагов. ME, EW, JR, AM и GX написали рукопись. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
EW финансировался за счет аспирантов факультета естественных наук и инженерии Манчестерского столичного университета.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы выражаем признательность за экспертную поддержку в области микробиологии от технической группы 4-го этажа Манчестерского столичного университета. Мы благодарим Фила Джонса из United Utilities за его неоценимую помощь.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fcimb.2021.698909/full#supplementary-material
Дополнительный рисунок 1 | Образование биопленки (A) 43 S.золотистый ST22; и (B) 27 изолятов ST36, выращенных в микротитровальных планшетах для тканевых культур в течение 48 ч при 37°C. Плотность полученных биопленок оценивали после окрашивания кристаллическим фиолетовым, растворяли в 30% уксусной кислоте и измеряли при OD590. Каждый анализ был выполнен в трех повторностях, данные представлены как средние значения (± стандартное отклонение).
Дополнительный рисунок 2 | Изменение продукции биопленки изолятами ST22 (A) и ST36 (B) после 48 часов инкубации в TSB с добавлением 1 % D-(+)-глюкозы. Биопленки визуализировали после окрашивания 0,1% кристаллическим фиолетовым.
Биопленки визуализировали после окрашивания 0,1% кристаллическим фиолетовым.
Дополнительный рисунок 3 | Сравнение плотности биопленки восьми изолятов S. aureus , оцененных окрашиванием CV (A) и соответствующих подсчетов жизнеспособных клеток (B) .
Дополнительный рисунок 4 | Влияние фага EW27 на зрелые биопленки изолятов S. aureus ST22 (A) и ST36 (B) . Статические биопленки первоначально выращивали в микротитрационных планшетах для тканевых культур в течение 48 рук, зараженных EW36, при множественности заражения 1 и 0.1 на период 6 и 24 ч. (A) Биопленки первоначально окрашивали кристаллическим фиолетовым и измеряли оптическую плотность при поглощении 590 нм. (B) Жизнеспособные клетки извлекали из лунок, обработанных фагом, соскабливая и удаляя биопленки из лунок поверхностного планшета, и высевали в трех повторностях. Каждый анализ был выполнен в трех повторностях, данные представлены как средние значения (± стандартное отклонение).
Каждый анализ был выполнен в трех повторностях, данные представлены как средние значения (± стандартное отклонение).
Дополнительный рисунок 5 | Влияние фага EW36 на зрелые биопленки S.aureus ST22 (A) и изоляты ST36 (B). Статические биопленки первоначально выращивали в микротитрационных планшетах для тканевых культур в течение 48 ч и подвергали заражению EW36 при множественности заражения 1 и 0,1 в течение 6 и 24 ч. Верхние биопленки первоначально окрашивали кристаллическим фиолетовым и измеряли оптическую плотность при поглощении 590 нм. Нижняя часть Жизнеспособные клетки извлекали из лунок, обработанных фагом, соскабливая и удаляя биопленки с лунок поверхностного планшета, и высевали в трех экземплярах.Каждый анализ был выполнен в трех повторностях, данные представлены как средние значения (± стандартное отклонение).
Дополнительный рисунок 6 | Влияние фага EW41 на зрелые биопленки S. aureus ST22 (A) и изолятов ST36 (B) . Статические биопленки первоначально выращивали в микротитровальных планшетах для тканевых культур в течение 48 ч и подвергали заражению EW36 при множественности заражения 1 и 0,1 в течение 6 и 24 ч. Верхние биопленки первоначально окрашивали кристаллическим фиолетовым и измеряли оптическую плотность при поглощении 590 нм.Нижняя часть Жизнеспособные клетки извлекали из лунок, обработанных фагом, соскабливая и удаляя биопленки с лунок поверхностного планшета, и высевали в трех экземплярах. Каждый анализ был выполнен в трех повторностях, данные представлены как средние значения (± стандартное отклонение).
aureus ST22 (A) и изолятов ST36 (B) . Статические биопленки первоначально выращивали в микротитровальных планшетах для тканевых культур в течение 48 ч и подвергали заражению EW36 при множественности заражения 1 и 0,1 в течение 6 и 24 ч. Верхние биопленки первоначально окрашивали кристаллическим фиолетовым и измеряли оптическую плотность при поглощении 590 нм.Нижняя часть Жизнеспособные клетки извлекали из лунок, обработанных фагом, соскабливая и удаляя биопленки с лунок поверхностного планшета, и высевали в трех экземплярах. Каждый анализ был выполнен в трех повторностях, данные представлены как средние значения (± стандартное отклонение).
Дополнительный рисунок 7 | Влияние фага EW71 на зрелые биопленки S. aureus ST22 (A) и изолятов ST36 (B). Статические биопленки первоначально выращивали в микротитрационных планшетах для тканевых культур в течение 48 ч и подвергали заражению EW36 при множественности заражения 1 и 0. 1 на период 6 и 24 ч. Верхние биопленки первоначально окрашивали кристаллическим фиолетовым и измеряли оптическую плотность при поглощении 590 нм. Нижняя часть Жизнеспособные клетки извлекали из лунок, обработанных фагом, соскабливая и удаляя биопленки с лунок поверхностного планшета, и высевали в трех экземплярах. Каждый анализ был выполнен в трех повторностях, данные представлены как средние значения (± стандартное отклонение).
1 на период 6 и 24 ч. Верхние биопленки первоначально окрашивали кристаллическим фиолетовым и измеряли оптическую плотность при поглощении 590 нм. Нижняя часть Жизнеспособные клетки извлекали из лунок, обработанных фагом, соскабливая и удаляя биопленки с лунок поверхностного планшета, и высевали в трех экземплярах. Каждый анализ был выполнен в трех повторностях, данные представлены как средние значения (± стандартное отклонение).
Дополнительная таблица 1 | Минимальные хэш-расстояния исследуемых геномов фагов, выраженные в процентах.
Дополнительная таблица 2 | Наличие или отсутствие гена в 122 исследованных геномах фагов (BLASTP > 95%). Как назвать и классифицировать свой фаг: неофициальное руководство. Вирусы 9 (4), 1–9. doi: 10.3390/v70
Полный текст CrossRef | Google Scholar
Алвес Д. Р., Гаудион А., Бин Дж. Э., Перес Эстебан П., Арно Т. С., Харпер Д. Р., и другие. (2014). Совместное использование бактериофага К и нового бактериофага для снижения образования биопленки Staphylococcus Aureus. Заяв. Окружающая среда. микробиол. 80 (21), 6694–6703. doi: 10.1128/AEM.01789-14
Заяв. Окружающая среда. микробиол. 80 (21), 6694–6703. doi: 10.1128/AEM.01789-14
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Аврани С., Линделл Д. (2015). Конвергентная эволюция в направлении повышения скорости роста и снижения диапазона резистентности штаммов прохлорококков, устойчивых к фагам. Проц. Натл. акад. науч. США 112 (17), E2191–E2200.doi: 10.1073/pnas.1420347112
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Банкевич А., Нурк С., Антипов Д., Гуревич А. А., Дворкин М., Куликов А. С. и др. (2012). SPAdes: новый алгоритм сборки генома и его приложения для секвенирования отдельных клеток. Дж. Вычисл. биол. 19 (5), 455–477. doi: 10.1089/cmb.2012.0021
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Битон М. Л., Алвес Д. Р., Энрайт М. К., Дженкинс А.Т. (2015). Оценка фаготерапии против синегнойной палочки с использованием модели инфекции Galleria Mellonella. Междунар. Дж. Антимикроб. Агенты 46 (2), 196–200. doi: 10.1016/j.ijantimicag.2015.04.005
Междунар. Дж. Антимикроб. Агенты 46 (2), 196–200. doi: 10.1016/j.ijantimicag.2015.04.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Беррихилл, Б. А., Хазеби, Д. Л., МакКолл, И. К., Хьюз, Д., Левин, Б. Р. (2021). Оценка потенциальной эффективности и ограничений фага для совместной антибиотико- и фаговой терапии инфекций, вызванных золотистым стафилококком. Проц. Натл. акад. науч. США 118 (10), 1–8. doi: 10.1073/pnas.2008007118
Полный текст CrossRef | Google Scholar
Брандт К.М., Даффи М.К., Бербари Э.Ф., Ханссен А.Д., Штекельберг Дж.М., Осмон Д.Р. (1999). Инфекция протезного сустава, вызванная золотистым стафилококком, лечится удалением протеза и отсроченной реимплантационной артропластикой. Мэйо. клин. проц. 74 (6), 553–558. doi: 10.4065/74.6.553
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Центры по контролю и профилактике заболеваний (2002 г.).Staphylococcus Aureus, устойчивый к ванкомицину – США, 2002 г. MMWR Morb. Смертный. еженедельно. 51 (26), 565–567.
MMWR Morb. Смертный. еженедельно. 51 (26), 565–567.
Реферат PubMed | Google Scholar
Чаттерджи С.С., Отто М. (2013). Улучшение понимания факторов, вызывающих эпидемические волны метициллин-резистентного золотистого стафилококка. клин. Эпидемиол. 5, 205–217. doi: 10.2147/CLEP.S37071
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Цуй, З., Фэн, Т., Гу, Ф., Li, Q., Dong, K., Zhang, Y., et al. (2017а). Характеристика и полный геном вирулентного фага Myoviridae JD007, активного против различных изолятов Staphylococcus Aureus из различных больниц в Шанхае, Китай. Вирол. J. 14 (1), 26. doi: 10.1186/s12985-017-0701-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Cui, Z., Guo, X., Dong, K., Zhang, Y., Li, Q., Zhu, Y., et al. (2017б). Оценка безопасности стафилококковых фагов семейства Myoviridae на основе полных последовательностей генома. Науч. Rep. 7, 41259. doi: 10. 1038/srep41259
1038/srep41259
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дики, Дж., Перро, В. (2019). Дополнительное лечение фагами повышает эффективность низких концентраций антибиотиков против биопленок золотистого стафилококка in vitro. PLoS Один 14 (1), e0209390. doi: 10.1371/journal.pone.0209390
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дриллинг А., Моралес С., Ярделеза К., Врейгде С., Спек, П., Вормалд, П.Дж. (2014). Бактериофаг уменьшает биопленку Staphylococcus Aureus Ex Vivo изолятов от пациентов с хроническим риносинуситом. утра. Дж. Ринол. Аллергия 28 (1), 3–11. doi: 10.2500/ajra.2014.28.4001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Enright, M.C., Day, N.P., Davies, CE, Peacock, SJ, Spratt, B.G. (2000). Мультилокусное типирование последовательностей для характеристики метициллин-резистентных и метициллин-чувствительных клонов золотистого стафилококка. Дж. Клин. микробиол. 38 (3), 1008–1015. doi: 10.1128/JCM.38.3.1008-1015.2000
Дж. Клин. микробиол. 38 (3), 1008–1015. doi: 10.1128/JCM.38.3.1008-1015.2000
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Enright, M.C., Robinson, D.A., Randle, G., Feil, E.J., Grundmann, H., Spratt, B.G. (2002). Эволюционная история метициллин-резистентного золотистого стафилококка (MRS). Проц. Натл. акад. науч. США 99 (11), 7687–7692. doi: 10.1073/pnas.122108599
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фейл, Э.J., Cooper, J.E., Grundmann, H., Robinson, D.A., Enright, M.C., Berendt, T., et al. (2003). Насколько клональным является золотистый стафилококк? J. Бактериол. 185 (11), 3307–3316. doi: 10.1128/JB.185.11.3307-3316.2003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гилл, Дж. Дж. (2014). Пересмотренная последовательность генома бактериофага Staphylococcus Aureus K. Genome Announc. 2 (1), э01173–13. doi: 10.1128/genomeA.01173-13
Полный текст CrossRef | Google Scholar
Гонсалес С. , Fernandez, L., Campelo, A.B., Gutierrez, D., Martinez, B., Rodriguez, A., et al. (2017). Поведение двухвидовых биопленок Staphylococcus Aureus, обработанных бактериофагом phiIPLA-RODI, зависит от сопутствующих микроорганизмов. Заяв. Окружающая среда. микробиол. 83 (3), e02821–16. doi: 10.1128/AEM.02821-16
, Fernandez, L., Campelo, A.B., Gutierrez, D., Martinez, B., Rodriguez, A., et al. (2017). Поведение двухвидовых биопленок Staphylococcus Aureus, обработанных бактериофагом phiIPLA-RODI, зависит от сопутствующих микроорганизмов. Заяв. Окружающая среда. микробиол. 83 (3), e02821–16. doi: 10.1128/AEM.02821-16
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Gu, J., Liu, X., Li, Y., Han, W., Lei, L., Yang, Y., et al. (2012). Способ получения фагового коктейля с большим терапевтическим потенциалом. PLoS One 7 (3), e31698. doi: 10.1371/journal.pone.0031698
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гупта Р., Прасад Ю. (2011). Эффективность поливалентного бактериофага Р-27/НР в борьбе с мультирезистентным золотистым стафилококком, ассоциированным с инфекциями человека. Курс. микробиол. 62 (1), 255–260. doi: 10.1007/s00284-010-9699-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Gutierrez, D. , Vandenheuvel, D., Мартинес Б., Родригес А., Лавин Р., Гарсия П. (2015). Два фага, phiIPLA-RODI и phiIPLA-C1C, лизирующие моно- и двухвидовые стафилококковые биопленки. Заяв. Окружающая среда. микробиол. 81 (10), 3336–3348. doi: 10.1128/AEM.03560-14
, Vandenheuvel, D., Мартинес Б., Родригес А., Лавин Р., Гарсия П. (2015). Два фага, phiIPLA-RODI и phiIPLA-C1C, лизирующие моно- и двухвидовые стафилококковые биопленки. Заяв. Окружающая среда. микробиол. 81 (10), 3336–3348. doi: 10.1128/AEM.03560-14
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Холден, М. Т., Фейл, Э. Дж., Линдсей, Дж. А., Пикок, С. Дж., Дэй, Н. П., Энрайт, М. К., и др. (2004). Полные геномы двух клинических штаммов Staphylococcus Aureus: доказательства быстрой эволюции вирулентности и лекарственной устойчивости. Проц. Натл. акад. науч. США 101 (26), 9786–9791. doi: 10.1073/pnas.0402521101
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Холден М. Т., Хсу Л. Ю., Курт К., Вейнерт Л. А., Мазер А. Э., Харрис С. Р. и др. (2013). Геномный портрет возникновения, эволюции и глобального распространения пандемии метициллин-резистентного золотистого стафилококка. Рез. генома. 23 (4), 653–664. doi: 10.1101/gr.147710.112
doi: 10.1101/gr.147710.112
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Инал, Дж.М. (2003). Фаговая терапия: переоценка бактериофагов как антибиотиков. Арх. Иммунол. тер. Эксп. (Варш). 51 (4), 237–244.
Реферат PubMed | Google Scholar
Кац Л. С., Гризуолд Т., Моррисон С. С., Каравас Дж. А., Чжан С., Ден Баккер Х. и др. (2019). Mashtree: быстрое сравнение файлов последовательностей всего генома. J. Программное обеспечение с открытым исходным кодом. 4 (44), 1–6. doi: 10.21105/joss.01762
Полный текст CrossRef | Google Scholar
Кочарунчитт, К., Росс, Т., Макнил, Д.Л. (2009). Использование бактериофагов в качестве агентов биоконтроля для борьбы с сальмонеллой, связанной с проростками семян. Междунар. Дж. Пищевая микробиология. 128 (3), 453–459. doi: 10.1016/j.ijfoodmicro.2008.10.014
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кропински А.М., Маццокко А. , Уодделл Т.Е., Лингор Э., Джонсон Р.П. (2009). Подсчет бактериофагов с помощью анализа двойного агарового налета. Методы Мол. биол. 501, 69–76. дои: 10.1007/978-1-60327-164-6_7
, Уодделл Т.Е., Лингор Э., Джонсон Р.П. (2009). Подсчет бактериофагов с помощью анализа двойного агарового налета. Методы Мол. биол. 501, 69–76. дои: 10.1007/978-1-60327-164-6_7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Куттер Э., Де Вос Д., Гвасалия Г., Алавидзе З., Гогохия Л., Куль С. и др. (2010). Фаговая терапия в клинической практике: лечение инфекций человека. Курс. фарм. Биотехнолог. 11 (1), 69–86. doi: 10.2174/13807401
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лобокка М., Хейнович М. С., Домбровский К., Гоздек А., Косаковский Дж., Witkowska, M., et al. (2012). Геномика стафилококковых Twort-подобных фагов – потенциальная терапия постантибиотической эры. Доп. Вирус рез. 83, 143–216. doi: 10.1016/B978-0-12-394438-2.00005-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лопес, А., Перейра, К., Алмейда, А. (2018). Последовательное комбинированное действие фагов и антибиотиков на инактивацию Escherichia Coli. Микроорганизмы 6 (4), 1–20. doi: 10.3390/microorganisms6040125
Микроорганизмы 6 (4), 1–20. doi: 10.3390/microorganisms6040125
CrossRef Полный текст | Google Scholar
Маккаллин С., Саркер С.А., Султана С., Окслин Ф., Брюссов Х. (2018). Метагеномный анализ российских и грузинских коктейлей пиофагов и плацебо-контролируемое исследование безопасности одного фага в сравнении с фаговым коктейлем у здоровых носителей золотистого стафилококка. Окружающая среда. микробиол. 20 (9), 3278–3293. doi: 10.1111/1462-2920.14310
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мело, Л.Д.Р., Брандао, А., Актюрк, Э., Сантос, С.Б., Азередо, Дж. (2018). Характеристика нового штамма Kayvirus Staphylococcus Aureus, содержащего лизин, активный против биопленки. Вирусы 10 (4), 1–16. doi: 10.3390/v10040182
Полный текст CrossRef | Google Scholar
Михневский С., Редгвелл Т., Григоните А., Рихтман Б., Агило-Ферретьянс М., Кристи-Олеза Дж. и др. (2019). На волне геномики для изучения разнообразия и активности водных колифагов. Окружающая среда. микробиол. 21 (6), 2112–2128. doi: 10.1111/1462-2920.14590
Окружающая среда. микробиол. 21 (6), 2112–2128. doi: 10.1111/1462-2920.14590
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мидзогути, К., Морита, М., Фишер, Ч.Р., Йоичи, М., Танджи, Ю., Унно, Х. (2003). Коэволюция бактериофага PP01 и Escherichia Coli O157:H7 в непрерывной культуре. Заяв. Окружающая среда. микробиол. 69 (1), 170–176. doi: 10.1128/AEM.69.1.170-176.2003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
О’Флаэрти С., Коффи А., Мини В., Фицджеральд Г. Ф., Росс Р. П. (2005a). Рекомбинантный фаг Lysin LysK обладает широким спектром литической активности в отношении клинически значимых стафилококков, включая метициллин-резистентный золотистый стафилококк. J. Бактериол. 187 (20), 7161–7164. doi: 10.1128/JB.187.20.7161-7164.2005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
О’Флаэрти С., Росс Р. П., Коффи А. (2009). Бактериофаги и их лизины для уничтожения инфекционных бактерий. FEMS микробиол. Ред. 33 (4), 801–819. doi: 10.1111/j.1574-6976.2009.00176.x
FEMS микробиол. Ред. 33 (4), 801–819. doi: 10.1111/j.1574-6976.2009.00176.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
О’Флаэрти С., Росс Р. П., Мини В., Фитцджеральд Г.Ф., Эльбреки, М.Ф., Коффи, А. (2005b). Потенциал поливалентного антистафилококкового бактериофага К для борьбы с антибиотикорезистентными стафилококками в больницах. Заяв. Окружающая среда. микробиол. 71 (4), 1836–1842 гг. doi: 10.1128/AEM.71.4.1836-1842.2005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
О’Флинн Г., Коффи А., Фитцджеральд Г., Росс Р. П. (2007). Устойчивые к фагам мутантные колонии Salmonella Enterica демонстрируют необычный фенотип в присутствии фага Felix 01. Письмо. заявл. микробиол. 45 (6), 581–585. doi: 10.1111/j.1472-765X.2007.02242.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ондов Б.Д., Треанген Т.Дж., Мелстед П., Маллони А.Б., Бергман Н.Х., Корен С. и др. (2016). Mash: быстрая оценка расстояния до генома и метагенома с использованием MinHas. Геном Биол. 17 (1), 132. doi: 10.1186/s13059-016-0997-x
и др. (2016). Mash: быстрая оценка расстояния до генома и метагенома с использованием MinHas. Геном Биол. 17 (1), 132. doi: 10.1186/s13059-016-0997-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пейдж, А.J., Cummins, C.A., Hunt, M., Wong, V.K., Reuter, S., Holden, M.T.G., et al. (2015). Роари: Быстрый крупномасштабный анализ генома прокариот. Биоинформатика 31 (22), 3691–3693. doi: 10.1093/bioinformatics/btv421
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Петрович Фабижан А., Лин Р. С. Ю., Хо Дж., Мэддокс С., Бен Закур Н. Л., Иределл Дж. Р. и др. (2020). Безопасность терапии бактериофагами при тяжелой инфекции, вызванной золотистым стафилококком. Нац.микробиол. 5 (3), 465–472. doi: 10.1038/s41564-019-0634-z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Роудс Д. Д., Уолкотт Р. Д., Кусковски М. А., Уолкотт Б. М., Уорд Л. С., Сулаквелидзе А. (2009). Бактериофаговая терапия венозных язв нижних конечностей у людей: результаты исследования безопасности фазы I. J. Wound Care 18 (6), 237–238, 240–233. doi: 10.12968/jowc.2009.18.6.42801
Бактериофаговая терапия венозных язв нижних конечностей у людей: результаты исследования безопасности фазы I. J. Wound Care 18 (6), 237–238, 240–233. doi: 10.12968/jowc.2009.18.6.42801
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Розенштейн Р., Nerz, C., Biswas, L., Resch, A., Raddatz, G., Schuster, S.C., et al. (2009). Анализ генома мясной закваски бактерии Staphylococcus Carnosus TM300. Заяв. Окружающая среда. микробиол. 75 (3), 811–822. doi: 10.1128/AEM.01982-08
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Rutherford, K., Parkhill, J., Crook, J., Horsnell, T., Rice, P., Rajandream, M.A., et al. (2000). Артемида: Визуализация последовательности и аннотация. Биоинформатика 16 (10), 944–945.doi: 10.1093/bioinformatics/16.10.944
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Синнотт А. Дж., Куанг Ю., Куримото М., Ямамичи К., Ивано Х., Танджи Ю. (2009). Выделение из сточных вод и характеристика новых бактериофагов Staphylococcus Aureus с широким кругом хозяев и мощными литическими способностями. Заяв. Окружающая среда. микробиол. 75 (13), 4483–4490. doi: 10.1128/AEM.02641-08
(2009). Выделение из сточных вод и характеристика новых бактериофагов Staphylococcus Aureus с широким кругом хозяев и мощными литическими способностями. Заяв. Окружающая среда. микробиол. 75 (13), 4483–4490. doi: 10.1128/AEM.02641-08
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тхилаишвили Т., Ломбарди, Л., Клатт, А.Б., Трампуз, А., Ди Лука, М. (2018). Бактериофаг Sb-1 усиливает антибиотическую активность в отношении биопленки, разрушает экзополисахаридный матрикс и воздействует на персистеры золотистого стафилококка. Междунар. Дж. Антимикроб. Агенты 52 (6), 842–853. doi: 10.1016/j.ijantimicag.2018.09.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Толедо-Арана, А., Мерино, Н., Вергара-Иригарай, М., Дебарбуй, М., Пенадес, Дж. Р., Ласа, И. (2005). Staphylococcus Aureus развивает альтернативную Ica-независимую биопленку в отсутствие двухкомпонентной системы arlRS. J. Бактериол. 187 (15), 5318–5329.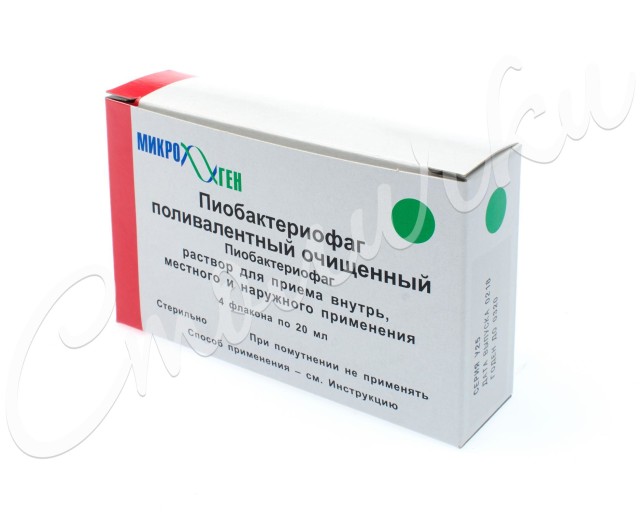 doi: 10.1128/JB.187.15.5318-5329.2005
doi: 10.1128/JB.187.15.5318-5329.2005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Циодрас С., Голд Х. С., Сакулас Г., Элиопулос Г. М., Веннерстен С., Венкатараман Л. и др. (2001). Резистентность к линезолиду клинического изолята золотистого стафилококка. Ланцет 358 (9277), 207–208. doi: 10.1016/S0140-6736(01)05410-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Валлес, Дж., Релло, Дж., Очагавиа, А., Гарначо, Дж., Алкала, Массачусетс (2003). Внебольничная инфекция кровотока у взрослых пациентов в критическом состоянии: влияние шока и неадекватной антибиотикотерапии на выживаемость. Сундук 123 (5), 1615–1624. doi: 10.1378/chest.123.5.1615
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
van Belkum, A., Melles, D.C., Peeters, J.K., van Leeuwen, W.B., van Duijkeren, E., Huijsdens, X.W., et al. (2008). Метициллин-резистентный и чувствительный золотистый стафилококк последовательности типа 398 у свиней и людей. Аварийный. Заразить. Дис. 14 (3), 479–483. doi: 10.3201/eid1403.070760
Аварийный. Заразить. Дис. 14 (3), 479–483. doi: 10.3201/eid1403.070760
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Vandenesch, F., Naimi, T., Enright, M.C., Lina, G., Nimmo, G.R., Heffernan, H., et al. (2003). Внебольничный устойчивый к метициллину золотистый стафилококк, несущий гены лейкоцидина Пантон-Валентин: появление во всем мире. Аварийный. Заразить. Дис. 9 (8), 978–984. doi: 10.3201/eid0908.030089
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вандерстееген, К., Кропински А.М., Нэш Дж.Х., Нобен Дж.П., Германс К., Лавин Р. (2013). Romulus и Remus, два фаговых изолята, представляющих отдельную кладу внутри рода Twortlikevirus, проявляют подходящие свойства для применения в фаговой терапии. Дж. Вирол. 87 (6), 3237–3247. doi: 10.1128/JVI.02763-12
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вик, Р. Р., Шульц, М. Б., Зобель, Дж., Холт, К. Э. (2015). Bandage: интерактивная визуализация геномных сборок De Novo. Биоинформатика 31 (20), 3350–3352. doi: 10.1093/bioinformatics/btv383
Э. (2015). Bandage: интерактивная визуализация геномных сборок De Novo. Биоинформатика 31 (20), 3350–3352. doi: 10.1093/bioinformatics/btv383
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Винстел В., Лян К., Санчес-Карбальо П., Стеглич М., Мунар М., Брокер Б. М. и др. (2013). Структура тейхоевой кислоты стенки регулирует горизонтальный перенос генов между основными бактериальными патогенами. Нац. коммун. 4, 2345. doi: 10.1038/ncomms3345
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ся, Г., Корриган, Р. М., Винстел, В., Гёрке, К., Грундлинг, А., Пешель, А. (2011). Настенная тейхоевая кислота-зависимая адсорбция стафилококковых сифовирусов и миовирусов. J. Бактериол. 193 (15), 4006–4009. doi: 10.1128/JB.01412-10
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Секстафаг® поливалентный пиобактериофаг
Секстафаг® поливалентный пиобактериофаг
Торговое наименованиеСекстафаг ®
Лекарственная формараствор для перорального, местного и наружного применения
Срок годности2 года
Производитель НПО «Микроген», ул. Братская, 177., Пермь, Пермский край, 614089 Россия
Братская, 177., Пермь, Пермский край, 614089 Россия
Презентация
Раствор для приема внутрь, местного и наружного применения, ампулы по 20 мл 4 или 10 ампул по 20 мл в каждой картонной пачке с листком-вкладышем.Ингредиенты
Препарат представляет собой стерильный фильтрат фаговых лизатов стафилококков, стрептококков, протея (P. vulgaris, P. mirabilis), синегнойной палочки, энтеропатогенных эшерихиаколи, клебзиеллапневмонии.Консервант — 8-гидроксихинолина сульфат моногидрат — 0,0001 г/мл (оценочное содержание). е).
Показания
Лечение и профилактика воспалительных и кишечных заболеваний, вызванных стафилококками, стрептококками, протеем, клебсиеллой, синегнойной и кишечной палочкой:- болезни уха, носа, горла, дыхательных путей и легких — воспаление придаточных пазух, среднего уха, тонзиллит , фарингит, ларингит, трахеит, бронхит, пневмония, плеврит;
- хирургические инфекции — гнойные раны, ожоги, абсцессы, флегмоны, фурункулы, карбункулы, гидрадениты, панариции, периректиты, маститы, бурситы, остеомиелиты;
- урогенитальные инфекции — уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит;
- посттравматический конъюнктивит, кератоконъюнктивит, гнойные язвы роговицы и иридоциклит;
- кишечные инфекции — гастроэнтероколит, холецистит, дисбактериоз;
- Генерализованные септические заболевания;
- гнойно-воспалительные заболевания новорожденных — омфалит, пиодермия, конъюнктивит, гастроэнтероколит, сепсис и др.

- другие заболевания, вызванные стафилококками, стрептококками (включая энтерококки), протеем, клебсиеллой пневмонии, синегнойной палочкой и кишечной палочкой.
С профилактической целью препарат применяют для лечения операционных и инфицированных ран, для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя.
Литические и геномные свойства спонтанных мутантов Kayvirus ряда хозяев доказывают их пригодность для улучшения фаговой терапии против стафилококков
Pantůček, R. et al . Поливалентный стафилококковый фаг phi 812: его мутанты в диапазоне хозяев и родственные фаги. Вирусология 246 , 241–252, https://doi. org/10.1006/viro.1998.9203 (1998).
org/10.1006/viro.1998.9203 (1998).
Артикул пабмед Google Scholar
Вандерштеген, К. и др. . Микробиологическая и молекулярная оценка бактериофага ISP для борьбы с Staphylococcus aureus . PLoS One 6 , e24418, https://doi.org/10.1371/journal.pone.0024418 (2011).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Лескинен, К. и др. . Характеристика vB_SauM-fRuSau02, Twort-подобного бактериофага, выделенного из терапевтического фагового коктейля. Вирусы 9 , 258, https://doi.org/10.3390/v90 (2017).
КАС Статья ПабМед Центральный Google Scholar
Квачадзе Л. и др. . Оценка литической активности стафилококкового бактериофага Sb-1 в отношении свежевыделенных клинических возбудителей. Microb Biotechnol 4 , 643–650, https://doi.org/10.1111/j.1751-7915.2011.00259.x (2011).
Microb Biotechnol 4 , 643–650, https://doi.org/10.1111/j.1751-7915.2011.00259.x (2011).
КАС Статья пабмед ПабМед Центральный Google Scholar
Synnott, A. J. и др. . Выделение из сточных вод и характеристика новых бактериофагов Staphylococcus aureus с широким кругом хозяев и мощными литическими способностями. Appl Environ Microbiol 75 , 4483–4490, https://doi.org/10.1128/AEM.02641-08 (2009).
КАС Статья пабмед ПабМед Центральный Google Scholar
Цуй, З. и др. . Характеристика и полный геном вирулентного Myoviridae фага JD007, активного против различных изолятов Staphylococcus aureus из различных больниц в Шанхае, Китай. Virol J 14 , 26, https://doi.org/10.1186/s12985-017-0701-0 (2017).
КАС Статья пабмед ПабМед Центральный Google Scholar

Абатанджело, В. и др. . Литические бактериофаги широкого спектра действия, убивающие Staphylococcus aureus местных полевых штаммов. PLoS One 12 , e0181671, https://doi.org/10.1371/journal.pone.0181671 (2017).
КАС Статья пабмед ПабМед Центральный Google Scholar
Rohde, C. и др. . Мнение экспертов по трем темам, связанным с фаговой терапией: устойчивость к бактериальным фагам, обучение фагам и профаги в бактериальных производственных штаммах. Вирусы 10 , 178, https://doi.org/10.3390/v10040178 (2018).
КАС Статья ПабМед Центральный Google Scholar
Пирне, Ж.-П. и др. . Требования к качеству и безопасности продуктов для устойчивой фаготерапии. Фарм Рез 32 , 2173–2179, https://doi.org/10.1007/s11095-014-1617-7 (2015).
КАС Статья пабмед ПабМед Центральный Google Scholar
Pelfrene, E., Willebrand, E., Cavaleiro Sanches, A., Sebris, Z. & Cavaleri, M. Бактериофаговая терапия: регуляторная перспектива. J Antimicrob Chemother 71 , 2071–2074, https://doi.org/10.1093/jac/dkw083 (2016).
Артикул пабмед Google Scholar
Энав, Х., Кирцнер, С., Линделл, Д., Мандель-Гутфройнд, Ю. и Бежа, О. Адаптация к субоптимальным хозяевам является движущей силой диверсификации вирусов в океане. Nat Commun 9 , 4698, https://doi.org/10.1038/s41467-018-07164-3 (2018).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Брюссов, Х. Популяционная геномика бактериофагов в Популяционная геномика: микроорганизмы (ред. Полц, М.F. & Rajora, OP) 297–334, https://doi.org/10.1007/13836_2018_16 (Springer, 2019).
Мэджилл, Д. Дж. и др. . Локализованная генетическая гетерогенность обеспечивает новый способ эволюции фагов двухцепочечной ДНК. Научный представитель 7 , 13731, https://doi.org/10.1038/s41598-017-14285-0 (2017).
Научный представитель 7 , 13731, https://doi.org/10.1038/s41598-017-14285-0 (2017).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Эссо, К. и др. . Исследование большой коллекции из 90 131 бактериофагов Pseudomonas aeruginosa 90 132, собранных из одного источника в окружающей среде в Абиджане, Кот-д’Ивуар. PLoS One 10 , e0130548, https://doi.org/10.1371/journal.pone.0130548 (2015).
КАС Статья пабмед ПабМед Центральный Google Scholar
Морено Свитт, А. И. и др. . Геномная характеристика дает новое представление о разнообразии фагов Salmonella . BMC Genomics 14 , 481, https://doi.org/10.1186/1471-2164-14-481 (2013).
КАС Статья пабмед ПабМед Центральный Google Scholar

Мейер, Дж. Р. и др. . Повторяемость и непредвиденные обстоятельства в эволюции ключевых инноваций фага Lambda. Science 335 , 428–432, https://doi.org/10.1126/science.1214449 (2012).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Паес-Эспино, Д. и др. . Иммунитет CRISPR стимулирует быструю эволюцию фагового генома у Streptococcus thermophilus . mBio 6 , e00262–15, https://doi.org/10.1128/mBio.00262-15 (2015).
КАС Статья пабмед ПабМед Центральный Google Scholar
О’Флаэрти, С. и др. . Геном стафилококкового фага К: новая линия Myoviridae , заражающая грамположительные бактерии с низким содержанием G + C. J Bacteriol 186 , 2862–2871, https://doi.org/10.1128/JB.186.9.2862-2871.2004 (2004).
КАС Статья пабмед ПабМед Центральный Google Scholar

О’Флаэрти, С. и др. . Потенциал поливалентного бактериофага К против Staphylococcus для борьбы с антибиотикорезистентными стафилококками в больницах. Appl Environ Microbiol 71 , 1836–1842, https://doi.org/10.1128/AEM.71.4.1836-1842.2005 (2005 г.).
КАС Статья пабмед ПабМед Центральный Google Scholar
Лобоцкая М. и др. . Геномика стафилококковых Твортоподобных фагов – потенциальных терапевтических средств постантибиотической эры. Adv Virus Res 83 , 143–216, https://doi.org/10.1016/B978-0-12-394438-2.00005-0 (2012).
КАС Статья пабмед Google Scholar
Stewart, C.R., Yip, T.K.S., Myles, B. & Laughlin, L. Роли генов 38, 39 и 40 в отключении биосинтеза хозяина при заражении Bacillus subtilis бактериофагом SPO1. Вирусология 392 , 271–274, https://doi. org/10.1016/j.virol.2009.06.046 (2009).
org/10.1016/j.virol.2009.06.046 (2009).
КАС Статья пабмед Google Scholar
Стюарт, Ч.Р., Дири, У.Дж., Иган, Э.С.К., Майлз, Б. и Петти, А.А. Продукт гена 56 SPO1 ингибирует деление клетки-хозяина во время инфицирования Bacillus subtilis бактериофагом SPO1. Вирусология 447 , 249–253, https://doi.org/10.1016/j.virol.2013.09.005 (2013).
КАС Статья пабмед Google Scholar
Gill, J. J. Пересмотренная последовательность генома Staphylococcus aureus бактериофага K. Genome Announc 2 , e01173–13, https://doi.org/10.1128/genomeA.01173-13 (2014).
Артикул пабмед ПабМед Центральный Google Scholar
Lavigne, R. & Vandersteegen, K. Интроны группы I в бактериофагах Staphylococcus . Future Virol 8 , 997–1005, https://doi. org/10.2217/fvl.13.84 (2013).
org/10.2217/fvl.13.84 (2013).
КАС Статья Google Scholar
Гу, Дж. и др. .Геномная характеристика литического фага Staphylococcus aureus Gh25: предоставление новых ключей к интронному сдвигу в фагах. J Gen Virol 94 , 906–915, https://doi.org/10.1099/vir.0.049197-0 (2013).
КАС Статья пабмед Google Scholar
Бенешик М. и др. . Роль Sh4b-связывающего домена в природном делеционном мутанте Kayvirus эндолизина LysF1 с широким диапазоном литической активности. Вирусные гены 54 , 130–139, https://doi.org/10.1007/s11262-017-1507-2 (2018).
КАС Статья пабмед Google Scholar
Кашпарек П., Пантучек Р., Каханкова Дж., Ружичкова В. и Дошкарж Дж. Перестройки генома у мутантов поливалентного стафилококкового бактериофага 812. Folia Microbiol 9 , 331–338, https://doi.org/10.1007/BF02932087 (2007).
Folia Microbiol 9 , 331–338, https://doi.org/10.1007/BF02932087 (2007).
Артикул Google Scholar
Росыпал С., Росыпалова А., Дошкарж Й., Пакрова Э. и Геновова С. Использование поливалентного фага 812 и его мутантов диапазона хозяев для дифференциации Staphylococcus aureus от других стафилококков. Scripta Fac Sci Nat Univ Purk Brun 16 , 317–336 (1986).
Google Scholar
Новачек, Дж. и др. . Структура и выпуск генома Twort-подобного фага Myoviridae с двухслойной базовой пластинкой. Proc Natl Acad Sci USA 113 , 9351–9356, https://doi.org/10.1073/pnas.1605883113 (2016).
КАС Статья пабмед Google Scholar
Эйер, Л. и др. . Структурный белковый анализ поливалентного стафилококкового бактериофага 812. Протеомика 7 , 64–72, https://doi. org/10.1002/pmic.200600280 (2007).
org/10.1002/pmic.200600280 (2007).
КАС Статья пабмед Google Scholar
Сибесма В., Пирней Ж.-П. & Экспертный круглый стол по принятию и повторному внедрению терапии бактериофагами. Шелковый путь к принятию и повторному внедрению терапии бактериофагами. Biotechnol J. 11 , 595–600, https://doi.org/10.1002/biot.201600023 (2016).
КАС Статья Google Scholar
Кван Т., Лю Дж., Дюбоу М., Грос П. и Пеллетье Дж. Полные геномы и протеомы 27 бактериофагов Staphylococcus aureus . Proc Natl Acad Sci USA 102 , 5174–5179, https://doi.org/10.1073/pnas.0501140102 (2005).
ОБЪЯВЛЕНИЕ КАС Статья пабмед Google Scholar
Такеучи, И. и др. . Наличие двух рецептор-связывающих белков способствует широкому кругу хозяев стафилококковых фагов типа Twort. Appl Environ Microbiol 82 , 5763–5774, https://doi.org/10.1128/AEM.01385-16 (2016).
Appl Environ Microbiol 82 , 5763–5774, https://doi.org/10.1128/AEM.01385-16 (2016).
КАС Статья пабмед ПабМед Центральный Google Scholar
Azam, AH, Hoshiga, F., Takeuchi, I., Miyanaga, K. & Tanji, Y. Анализ устойчивости к фагам в Staphylococcus aureus SA003 выявляет различные механизмы связывания близкородственного Twort-подобного фаги ɸSA012 и ɸSA039. Appl Microbiol Biotechnol 102 , 8963–8977, https://doi.org/10.1007/s00253-018-9269-x (2018).
КАС Статья пабмед Google Scholar
Чжан, X. и др. . Консервативные концы и прилегающая вариабельная область фагов Twortlikevirus Staphylococcus . Вирол Син 30 , 433–440, https://doi.org/10.1007/s12250-015-3643-y (2015).
КАС Статья пабмед Google Scholar

Cui, Z. и др. . Оценка безопасности фагов Staphylococcus семейства Myoviridae на основе полных последовательностей генома. Научный представитель 7 , 41259, https://doi.org/10.1038/srep41259 (2017).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Wilson, G.G., Young, K.K.Y., Edlin, G.J. & Konigsberg, W. Высокочастотная генерализованная трансдукция бактериофагом T4. Nature 280 , 80–82, https://doi.org/10.1038/280080a0 (1979).
ОБЪЯВЛЕНИЕ КАС Статья пабмед Google Scholar
Янг К.К., Эдлин Г.Дж. и Уилсон Г.Г. Генетический анализ бактериофага Т4, трансдуцирующего бактериофаги. J Virol 41 , 345–347 (1982).
КАС пабмед ПабМед Центральный Google Scholar

Carlton, R.M., Noordman, WH, Biswas, B., de Meester, E.D. & Loessner, MJ. Бактериофаг P100 для борьбы с Listeria monocytogenes в пищевых продуктах: секвенирование генома, биоинформатический анализ, исследование оральной токсичности и применение. Regul Toxicol Pharmacol 43 , 301–312, https://doi.org/10.1016/j.yrtph.2005.08.005 (2005).
КАС Статья пабмед Google Scholar
Двиведи, Б., Сюэ Б., Лундин Д., Эдвардс Р. А. и Брейтбарт М. Биоинформатический анализ генов рибонуклеотидредуктазы в фаговых геномах и метагеномах. BMC Evol Biol 13 , 33, https://doi.org/10.1186/1471-2148-13-33 (2013).
КАС Статья пабмед ПабМед Центральный Google Scholar
Enright, M.C., Day, N.P., Davies, C.E., Peacock, S.J. & Spratt, B.G. Многолокусное типирование последовательности для характеристики метициллин-устойчивых и метициллин-чувствительных клонов Staphylococcus aureus . J Clin Microbiol 38 , 1008–1015 (2000).
J Clin Microbiol 38 , 1008–1015 (2000).
КАС пабмед ПабМед Центральный Google Scholar
Feil, EJ, Li, B.C., Aanensen, D.M., Hanage, W.P. & Spratt, B.G. eBURST: вывод закономерностей эволюционного происхождения среди кластеров родственных бактериальных генотипов из данных мультилокусного типирования последовательности. J Bacteriol 186 , 1518–1530, https://doi.org/10.1128/JB.186.5.1518-1530.2004 (2004).
КАС Статья пабмед ПабМед Центральный Google Scholar
Milheiriço, C., Oliveira, D.C. & de Lencastre, H. Обновление стратегии мультиплексной ПЦР для присвоения типов элементов mec в Staphylococcus aureus . Antimicrob Agents Chemother 51 , 3374–3377, https://doi.org/10.1128/AAC.00275-07 (2007).
КАС Статья пабмед ПабМед Центральный Google Scholar

Пантучек, Р. и др. . Выявление типов бактериофагов и их носительства в Staphylococcus aureus . Arch Virol 149 , 1689–1703, https://doi.org/10.1007/s00705-004-0335-6 (2004).
КАС Статья пабмед Google Scholar
Штверакова Д. и др. . Быстрая идентификация интактных стафилококковых бактериофагов с помощью масс-спектрометрии с лазерной десорбцией ионизационно-времяпролетной матрицей. Вирусы 10 , 176, https://doi.org/10.3390/v10040176 (2018).
КАС Статья ПабМед Центральный Google Scholar
Моша, М., Боштик, Й., Пантучек, Р. и Дошкарж, Й. Лекарственное средство в виде лизата против Staphylococcus фага, способ его приготовления и применения. CZ201200668-A3. Заявка на патент (2012 г.).
Росыпал С. и Росыпалова А. Спонтанный мутант поливалентного фага 812, способный к росту в Staphylococcus aureus NCTC 8511, несущий профаг 53. Folia Fac Sci Nat Univ Purk Brun 11 , 37–47 (1970).
Folia Fac Sci Nat Univ Purk Brun 11 , 37–47 (1970).
Google Scholar
Sambrook, J., Fritsch, E.F. & Maniatis, T. Молекулярное клонирование: лабораторное руководство . 2-е изд. (Лаборатория Колд-Спринг-Харбор, 1989 г.).
Ботка, Т. и др. . Полный анализ генома двух новых бактериофагов, выделенных из штаммов импетиго Staphylococcus aureus . Вирусные гены 51 , 122–131, https://doi.org/10.1007/s11262-015-1223-8 (2015).
КАС Статья пабмед Google Scholar
Ботка, Т. и др. . В штаммах импетиго Staphylococcus aureus обнаружены две сильно различающиеся линии плазмид, кодирующих эксфолиативный токсин B. Int J Med Microbiol 307 , 291–296, https://doi.org/10.1016/j.ijmm.2017.05.005 (2017).
КАС Статья пабмед Google Scholar
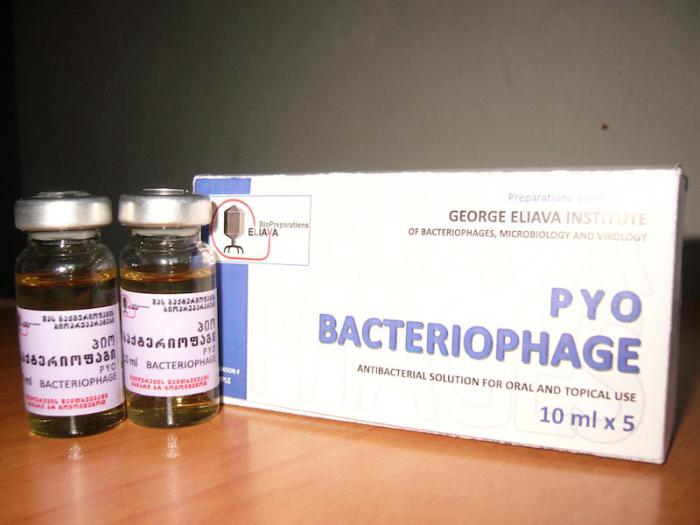
Coil, D., Jospin, G. & Darling, A.E. A5-miseq: обновленный конвейер для сборки микробных геномов из данных Illumina MiSeq. Биоинформатика 31 , 587–589, https://doi.org/10.1093/bioinformatics/btu661 (2015).
КАС Статья пабмед Google Scholar
Бреттин, Т. и др. . RASTtk: модульная и расширяемая реализация алгоритма RAST для создания пользовательских конвейеров аннотаций и аннотирования пакетов геномов. Научный представитель 5 , 8365, https://doi.org/10.1038/srep08365 (2015).
КАС Статья пабмед ПабМед Центральный Google Scholar
Lowe, T. M. & Chan, P. P. tRNAscan-SE On-line: интеграция поиска и контекста для анализа генов транспортной РНК. Nucleic Acids Res 44 , W54–W57, https://doi.org/10.1093/nar/gkw413 (2016).
КАС Статья пабмед ПабМед Центральный Google Scholar

Фрит, М. К., Сондерс, Н. Ф. В., Кобе, Б. и Бейли, Т. Л. Обнаружение мотивов последовательности с произвольными вставками и удалениями. PLoS Computational Biology 4 , e1000071, https://doi.org/10.1371/journal.pcbi.1000071 (2008).
ОБЪЯВЛЕНИЕ MathSciNet КАС Статья пабмед ПабМед Центральный Google Scholar
Соловьев В. и Саламов А. Автоматическая аннотация микробных геномов и метагеномных последовательностей в Метагеномика и ее приложения в сельском хозяйстве, биомедицине и исследованиях окружающей среды (изд. Li, RW) 61–78 (Nova Science Издательства, 2011).
Лесник, Е. А. и др. . Предсказание ро-независимых терминаторов транскрипции у Escherichia coli . Nucleic Acids Res 29 , 3583–3594, https://doi.org/10.1093/nar/29.17.3583 (2001).
КАС Статья пабмед ПабМед Центральный Google Scholar

Грант, Дж. Р. и Стотард, П. Сервер CGView: инструмент сравнительной геномики для кольцевых геномов. Nucleic Acids Res 36 , W181–W184, https://doi.org/10.1093/nar/gkn179 (2008).
КАС Статья пабмед ПабМед Центральный Google Scholar
Лю Б. и Поп М. База данных генов устойчивости к антибиотикам ARDB. Nucleic Acids Res 37 , D443–D447, https://doi.org/10.1093/nar/gkn656 (2009).
КАС Статья пабмед Google Scholar
Чен Л., Чжэн Д., Лю Б., Ян Дж. и Джин К. VFDB 2016: иерархический и уточненный набор данных для анализа больших данных — 10 лет спустя. Nucleic Acids Res 44 , D694–D697, https://doi.org/10.1093/nar/gkv1239 (2016).
КАС Статья пабмед Google Scholar
Дерипер, А. и др. . Phylogeny.fr: надежный филогенетический анализ для неспециалистов. Nucleic Acids Res 36 , W465–W469, https://doi.org/10.1093/nar/gkn180 (2008).
Nucleic Acids Res 36 , W465–W469, https://doi.org/10.1093/nar/gkn180 (2008).
КАС Статья пабмед ПабМед Центральный Google Scholar
Gu, J. и др. . Полная последовательность генома Staphylococcus aureus бактериофага Gh25. J Virol 86 , 8914–8915, https://doi.org/10.1128/JVI.01313-12 (2012).
КАС Статья пабмед ПабМед Центральный Google Scholar
Аджуэбор, Дж. и др. . Сравнение фага K Staphylococcus с близкими родственниками фага, обычно используемыми в фаговой терапии. Антибиотики (Базель). 7 , 37, https://doi.org/10.3390/antibiotics7020037 (2018).
Артикул ПабМед Центральный Google Scholar
Гутьеррес, Д. и др. . Два фага, phiIPLA-RODI и phiIPLA-C1C, лизируют моно- и двухвидовые стафилококковые биопленки. Appl Environ Microbiol 81 , 3336–3348, https://doi.org/10.1128/AEM.03560-14 (2015).
Appl Environ Microbiol 81 , 3336–3348, https://doi.org/10.1128/AEM.03560-14 (2015).
КАС Статья пабмед ПабМед Центральный Google Scholar
Такемура-Утияма, И. и др. . Геномные и филогенетические признаки Staphylococcus фагов S25-3 и S25-4 (семейство Myoviridae , род Twort-подобных вирусов). Ann Microbiol 64 , 1453–1456, https://doi.org/10.1007/s13213-013-0762-2 (2014).
КАС Статья Google Scholar
Ким, С. Г. и др. . Полная последовательность генома Staphylococcus aureus бактериофага pSa-3. Genome Announc 5 , e00182–17, https://doi.org/10.1128/genomeA.00182-17 (2017).
Артикул пабмед ПабМед Центральный Google Scholar
Кирби, А. Е. Синергическое действие гентамицина и бактериофага в популяции непрерывной культуры Staphylococcus aureus . PLoS One 7 , e51017, https://doi.org/10.1371/journal.pone.0051017 (2012 г.).
PLoS One 7 , e51017, https://doi.org/10.1371/journal.pone.0051017 (2012 г.).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Эль-Хаддад, Л. и др. . Повышение безопасности поливалентных фагов Staphylococcus aureus путем их получения на штамме Staphylococcus xylosus . PLoS One 9 , e102600, https://doi.org/10.1371/journal.pone.0102600 (2014).
ОБЪЯВЛЕНИЕ КАС Статья пабмед ПабМед Центральный Google Scholar
Варга М. и др. . Эффективный перенос плазмид устойчивости к антибиотикам путем трансдукции в клоне Staphylococcus aureus USA300, устойчивого к метициллину. FEMS Microbiol Lett 332 , 146–152, https://doi.org/10.1111/j.1574-6968.2012.02589.x (2012).
КАС Статья пабмед Google Scholar

Машланова И. и др. . Бактериофаги Staphylococcus aureus эффективно упаковывают различные бактериальные гены и мобильные генетические элементы, включая SCCmec , с различной частотой. Environ Microbiol Rep 5 , 66–73, https://doi.org/10.1111/j.1758-2229.2012.00378.x (2013 г.).
КАС Статья пабмед Google Scholar
Инфекции микробиоты, вызванные бактериофагами, могут привести к повышенной кишечной проницаемости в экспериментальной модели на грызунах | Патогены кишечника
Это исследование показало, что повышенная проницаемость кишечника может быть вызвана бактериофагами, влияющими на микробиоту. Ранее мы подтвердили функциональность и селективность коктейлей бактериофагов (неопубликованные данные).Десять дней администрации коктейля бактериофагов на Staphylococcus SPP., Streptococcus SPP., PSEUDUS SPP., pseudomonas SPP., K. pneumonia , Salmonella , Salmonella , виды не приводил к явным клиническим изменениям в желудочно-кишечном тракте или нарушениям стула у крыс. В то же время, начиная с пятого дня лечения бактериофагом, у всех животных наблюдалась потеря веса, спутанная шерсть и снижение активности, что, как считается, связано с транслокацией эндотоксинов через негерметичную слизистую оболочку.
В то же время, начиная с пятого дня лечения бактериофагом, у всех животных наблюдалась потеря веса, спутанная шерсть и снижение активности, что, как считается, связано с транслокацией эндотоксинов через негерметичную слизистую оболочку.
Мы провели тест на проницаемость лактулоза-маннитол, чтобы определить, могут ли бактериофаги вызывать заболевания микробиоты, приводящие к изменениям в организме хозяина в виде повышения проницаемости кишечника [11]. Таким образом, мы сравнили изменения экскреции маннитола и лактулозы с мочой, а также изменения соотношения лактулоза:маннит за 2 дня до и на 10-й день после ежедневного заражения коктейлем бактериофагов. Экскреция маннита была немного, но не значительно снижена после заражения бактериофагом по сравнению с ранее.В то же время у крыс наблюдалось достоверное увеличение ( P < 0,05) экскреции лактулозы после обработки бактериофагом по сравнению с до обработки. У животных наблюдалось значительно повышенное соотношение лактулоза: маннит ( P < 0,05), что, как считается, отражает повышенную проницаемость кишечника (рис. 1; дополнительный файл 1: таблица S1). Увеличение было не менее чем в 2,4 раза у всех животных. У всех животных была дырявая кишка с эталонным соотношением лактулоза/маннит >0.46 [12].
Рис. 1Нарушение целостности кишечного барьера у крыс, получавших смесь бактериофагов. a Изменения соотношения лактулоза:маннит до и после лечения коктейлем бактериофагов; b Концентрация CIC в сыворотке до и после лечения смесью бактериофагов. Данные выражены как среднее ± SE. * P < 0,05 (критерий знакового ранга Уилкоксона). Данные об изменении экскреции лактулозы и маннита после заражения бактериофагом у каждого животного представлены в дополнительном файле 1: таблица S1
.Затем мы измерили концентрацию CIC в сыворотке, чтобы определить, вызывают ли изменения, вызванные бактериофагами, системную воспалительную реакцию у крыс.Наличие ЦИК является элементом нормального иммунного ответа, а повышенный уровень ЦИК связан с различными патологическими состояниями, в том числе с интоксикацией [14]. Как показано на рис. 1, на 10-й день лечения средний уровень ЦИК был в 2,5 раза выше, чем до лечения ( P < 0,05), что свидетельствовало об эндогенной интоксикации, скорее всего, обусловленной повышенной проницаемостью кишечника и продолжающимся синдромом повышенной кишечной проницаемости. . У необработанных животных отрицательного контроля, которые содержались в тех же условиях, что и обработанные животные, не было обнаружено никаких изменений в течение периода исследования (данные не представлены).
Насколько нам известно, это первое исследование, показывающее, что экспериментальная инфекция бактериофагами может быть опасной для макроорганизмов [15, 16]. Патологический эффект проявлялся в повышении проницаемости кишечника и являлся результатом избирательного действия фагов на микробиоту без прямого воздействия на эукариотические клетки хозяина [17]. За последнее десятилетие знания об аномальной кишечной проницаемости или повышенной кишечной проницаемости и повышенной бактериальной транслокации из просвета кишечника значительно расширились.Это выявило роль бактериальной транслокации как одного из основных триггеров различных полиэтиологических заболеваний, связанных с хроническим воспалением, таких как воспалительные заболевания кишечника, болезнь Крона, болезни Альцгеймера, аутизм, диабет, новообразования толстой кишки, сердечная недостаточность, аритмии, ревматоидный артрит, и др. [2, 5–7]. Наши результаты показывают, что бактериофаги, которые ранее не считались патогенами млекопитающих или человека, могут способствовать заболеваниям микробиоты и, таким образом, косвенно вызывать патологические состояния млекопитающих, связанные с повышенной кишечной проницаемостью.Считается, что эти патологии не заразны или, по крайней мере, в настоящее время нет надежных доказательств их заразности [18, 19]. Однако, принимая во внимание их возможную связь с синдромом повышенной кишечной проницаемости, можно предположить, что причиной их возникновения и распространения могут быть фаги, происходящие из внешней среды, поскольку бактериофаги широко распространены и человек постоянно подвергается их воздействию [20]. Наконец, инфицирование микробиоты бактериофагами можно считать новой группой вирусных заболеваний млекопитающих.Должны быть проведены дополнительные исследования, в том числе с использованием стерильных крыс в качестве контроля для подтверждения влияния бактериофага на микробиоту кишечника и с использованием метагеномного анализа изменений в микробных сообществах кишечника, вызванных бактериофагами, что приводит к негерметичной кишке.
Потребуются дальнейшие исследования, чтобы разгадать болезни микробиоты и оценить лежащие в их основе механизмы и роль в различных патологиях человека.
Сравнительный анализ различных методов консервации фагов Staphylococcus, предназначенных для промышленной разработки противомикробных препаратов на основе фагов
Abstract
Бактериофаги доказали свою эффективность в качестве антимикробных агентов при лечении инфекционных заболеваний и в других областях биоконтроля, включая консервирование и дезинфекцию пищевых продуктов.Широкое использование бактериофагов требует усовершенствованных методов средне- и долгосрочного хранения, а также облегчения транспортировки. С этой целью мы определили стабильность четырех фагов Staphylococcus (phiIPLA88, phiIPLA35, phiIPLA-RODI и phiIPLA-C1C) с антимикробным потенциалом при различных температурах (20°C/25°C, 4°C, -20°C). С, -80°С, -196°С) и при лиофилизации (сублимационной сушке) с использованием нескольких стабилизирующих добавок (дисахариды, глицерин, сорбит и обезжиренное молоко). Различия между фагами наблюдались при разных температурах (20°С/25°С, 4°С и -20°С), при которых фаги были менее стабильны.При более низких температурах (-80°С и -196°С) все фаги показали хорошую жизнеспособность через 24 месяца независимо от стабилизатора. Различия между фагами наблюдались и после лиофилизации, хотя добавление обезжиренного молока приводило к получению сухого порошка со стабильным титром через 24 месяца. В качестве альтернативы для облегчения хранения и транспортировки также изучалась инкапсуляция фага. Фаг phiIPLA-RODI, инкапсулированный в альгинатные капсулы, сохранял высокую жизнеспособность при хранении при 4°С в течение 6 мес и при 20°С в течение 1 мес.Кроме того, метод распылительной сушки позволил получить сухие порошки, содержащие жизнеспособные инкапсулированные фаги (phiIPLA-RODI и phiIPLA88) как в обезжиренном молоке, так и в трегалозе в течение 12 месяцев при 4°C. Хранение фагов при 20°С было менее эффективным; на самом деле phiIPLA88 был стабилен в течение как минимум 12 месяцев в трегалозе, но не в обезжиренном молоке, в то время как phiIPLA-RODI был стабилен только в течение 6 месяцев в любом стабилизаторе. Эти результаты позволяют предположить, что инкапсулированные фаги могут быть подходящим способом доставки фагов.
Образец цитирования: González-Menéndez E, Fernández L, Gutiérrez D, Rodríguez A, Martinez B, García P (2018) Сравнительный анализ различных методов сохранения для хранения фагов Staphylococcus , направленных на промышленную разработку фагов антимикробные продукты.ПЛОС ОДИН 13(10): e0205728. https://doi.org/10.1371/journal.pone.0205728
Редактор: Krystyna Dąbrowska, Институт иммунологии и экспериментальной терапии, Польская академия наук, ПОЛЬША
Поступила в редакцию: 21 марта 2018 г.; Принято: 1 октября 2018 г.; Опубликовано: 11 октября 2018 г.
Авторское право: © 2018 González-Menéndez et al. Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и в его файлах вспомогательной информации.
Финансирование: Это исследование было поддержано грантами AGL2015-65673-R (Министерство науки и инноваций, Испания), GRUPIN14-139 (Программа науки, технологий и инноваций на 2013-2017 гг. и фонды FEDER ЕС, Principado de Asturias) , Испания). Л.Ф. является постдокторантом Marie Curie Clarin-Cofund. PG, BM и AR являются членами исследовательского сообщества «Фагебиотики», финансируемого FWO Vlaanderen (WO.016.14) и сеть бактериофагов FAGOMA II. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: «Авторы заявили об отсутствии конкурирующих интересов.
Введение
Бактериофаги являются естественными врагами бактерий. Литические бактериофаги специфически заражают бактерию-хозяина и размножаются внутри цитоплазмы, чтобы в конечном итоге лизировать клетку. Это антимикробное свойство может быть использовано в качестве альтернативы классическим антибиотикам для лечения инфекций человека, спровоцированных полирезистентными бактериями или «супербактериями» [1].Действительно, существует острая потребность в новых противомикробных препаратах, на что четко указала Генеральная Ассамблея ООН [2]. Кроме того, существуют и другие области применения бактериофагов, включая животноводство, ветеринарию и сельское хозяйство [3]. Более того, бактериофаги также были предложены в качестве новых инструментов для повышения безопасности пищевых продуктов путем контроля патогенных бактерий в пищевых продуктах [4].
Что касается применения бактериофагов при лечении и профилактике инфекционных заболеваний у животных и человека, то имеются многочисленные исследования, подтверждающие их эффективность.Например, успешные результаты были получены на мышиных моделях легких [5], раневых [6] и желудочно-кишечных инфекций [7]. Кроме того, фаги были предложены для борьбы с пищевыми патогенами путем снижения колонизации зоонозными бактериями на фермах, для удаления биопленок с промышленного оборудования и поверхностей, контактирующих с пищевыми продуктами, а также для подавления роста патогенных бактерий в пищевых продуктах [8].
Действительно, несколько фаговых продуктов для терапии человека доступны в странах Восточной Европы (препараты Pyophage и Intestiphage от Института Элиавы, Тбилиси, Грузия) и продукты для пищевых продуктов (ListShield ™ , PhageGuard Listex, EcoShield ™ и SalmoFresh ™ ) в настоящее время продаются в США и Западной Европе.
Возобновление интереса к применению бактериофагов привело к ряду in vitro исследований сохранения и доставки фагов (недавний обзор [9]). Некоторые методы сохранения, такие как лиофилизация, использовались для получения составов, подходящих для клинического применения фагов. Например, аэрозольные порошки, содержащие бактериофаги КС4-М и ФКЗ, были приготовлены для доставки в легкие и лечения инфекций Burkholderia cepacia и Pseudomonas aeruginosa [10], а лиофилизированные вкладыши, содержащие бактериофагов Staphylococcus aureus , использовались для эрадикации MRSA из MRSA [11].Более того, пероральное введение фагов требует повышенной устойчивости к суровым желудочным условиям, что было решено путем микрокапсулирования фагов в полимерных матрицах, таких как альгинат и пектин [12, 13]. Недавно было предложено микрокапсулирование для получения микрокапсул, содержащих фаги, которые после добавления в гель пропиленгликоля можно было бы использовать в качестве дезинфицирующих средств в пищевой промышленности [14]. Это исследование пришло к выводу, что восприимчивость бактериофагов к условиям хранения и обработки различается среди фагов.Следовательно, эти параметры должны быть оптимизированы для каждого фага, чтобы гарантировать срок годности продуктов на основе фага и обеспечить применение правильной дозировки.
В этом контексте нас интересуют фагов Staphylococcus и их использование в качестве противомикробных препаратов для борьбы с S . aureus и Staphylococcus epidermidis . Метициллин-устойчивый S . Штаммы aureus (MRSA) ответственны за серьезные и трудно поддающиеся лечению инфекции человека [15]. С . aureus также является одним из основных бактериальных агентов, вызывающих заболевания пищевого происхождения у людей из-за продукции энтеротоксинов [16]. Обнадеживающие результаты были получены при использовании фагов против S . aureus на животных моделях инфекций диабетической стопы [17], диабетических кожных ран [18], септицемии [19] и хронического остеомиелита [20]. Несколько исследований также продемонстрировали эффективность бактериофагов для борьбы с S . aureus развивается в некоторых пищевых продуктах, таких как сыр [21, 22] и молоко [23].Фаги также способны предотвращать или уменьшать S . образование биопленок aureus [24–26].
Несмотря на все эти исследования, на сегодняшний день в продажу поступил только один продукт на основе фага против Staphylococcus , Pyophage. Отчасти это связано с нормативными ограничениями, которые окружают маркетинг продуктов на основе фагов. Чтобы преодолеть эти нормативные препятствия, необходимы дополнительные исследования, чтобы предоставить дополнительные доказательства эффективности, безопасности и стабильности этих препаратов при хранении.Например, важно определить оптимальные условия хранения для обеспечения долговременной стабильности фага до того, как продукты на основе фага станут широко коммерциализированы.
В этом исследовании мы оценили стабильность различных бактериофагов Staphylococcus при различных условиях хранения в течение 24-месячного периода. Для этого мы использовали четыре фага, ранее выделенные в нашей лаборатории. Два из них, phiIPLA35 и phiIPLA88, были отобраны как вирулентные мутанты S . aureus умеренных фагов ФА72 и ФН5 соответственно [27, 28]. Эти бактериальные вирусы принадлежат к семейству Siphoviridae и эффективно ингибируют S . aureus рост в молочных продуктах [21, 27, 29, 23]. Совсем недавно мы выделили и охарактеризовали два фага Myoviridae , phiIPLA-RODI и phiIPLA-C1C, инфицирующих широкий спектр видов стафилококков [25]. Их высокая литическая способность против планктонных культур и биопленок делает их хорошими кандидатами для удаления Staphylococcus как в больницах, так и в пищевых учреждениях.Наши результаты будут полезны для разработки простой и эффективной методологии сохранения запасов фагов, которые впоследствии можно будет применять после крупномасштабного размножения в промышленных условиях. В частности, мы сосредоточились на оценке влияния температуры и присутствия стабилизирующего агента на стабильность фага и изучили два метода инкапсуляции, которые позволили бы транспортировать и хранить без охлаждения. Кроме того, мы оценили эффективность подготовки замороженных запасов для хранения фагов внутри инфицированных клеток.Хотя этот метод не подходит для доставки фагов в пищу или применения фаговой терапии, он может быть удобным методом сохранения исходных запасов для промышленного производства фагов.
Материалы и методы
Бактериальные штаммы и размножение бактериофагов
Staphylococcus aureus Sa9 использовали в качестве штамма-хозяина фагов phiIPLA35 и phiIPLA88 [28]. Бактериофаги phiIPLA-RODI и phiIPLA-C1C размножали на S . aureus IPLA1 и S . epidermidis F12 соответственно [25]. Все штаммы обычно культивировали в трипсиновом соевом бульоне (TSB; Шарлау, Барселона, Испания) при 37°C при встряхивании или на чашках TSB, содержащих 2% (вес/объем) бактериологического агара (TSA). Бактериофаги размножали, как описано ранее [28, 25]. Вкратце, ранние экспоненциальные культуры штаммов-хозяев Staphylococcus (OD 600 = 0,1) были инфицированы фагом при множественности заражения (MOI) 1–10.Затем инфицированные культуры инкубировали в течение 3 ч при 37°С при энергичном встряхивании. Фаговые лизаты получали центрифугированием культур и последующей фильтрацией (фильтры из ацетата целлюлозы 0,45 мкм). Частичную очистку получали после осаждения фаговых лизатов добавлением NaCl (0,5 М, конечная концентрация) и ПЭГ 8000 (10%, конечная концентрация). Образцы выдерживали в течение 18 ч при 4°С, а затем центрифугировали при 10000 об/мин, 30 мин при 4°С. Осадок, содержащий фаги, ресуспендировали в буфере SM (20 мМ Tris HCl, 10 мМ MgSO 4 , 10 мМ Ca(NO 3 ) 2 и 0.1 М NaCl, рН 7,5).
Титрфагов рассчитывали методом анализа бляшек по методу двойного слоя [30]. Аликвоты (0,1 мл) стационарных культур Staphylococcus (~10 8 КОЕ/мл) смешивали с несколькими разведениями отдельных суспензий фагов в буфере SM, а затем добавляли к 3 мл расплавленного TSB top-агара (0,7% мас./об.). ). Эту смесь выливали на чашки с ТСК и инкубировали 18 ч при 37°С. Анализы проводили в трех экземплярах, а результаты выражали в БОЕ/мл.В условиях культивирования, описанных выше, титр фаговых лизатов phiIPLA35 и phiIPLA88 колебался в пределах 10 9 -10 10 БОЕ/мл, тогда как лизаты phiIPLA-RODI и phiIPLA-C1C показывали значения 10 8 -10 9 БОЕ/мл.
Подготовка проб для низкотемпературного хранения
Лизаты фагасмешивали со стабилизаторами, получая конечную концентрацию 0,8 М трегалозы, 0,8 М сахарозы, 15 % глицерина или 11 % обезжиренного молока и конечный титр в диапазоне от 10 8 до 10 9 БОЕ/мл.Пробы до хранения при пониженной температуре брали в качестве контрольных. Флаконы для криоконсервации заполняли 1 мл вышеуказанных смесей (фаговый лизат плюс стабилизатор) и хранили при -20°С, -80°С или -196°С (жидкий азот).
Кроме того, образцы, содержащие свежезараженные клетки, были приготовлены, как описано ранее Golec et al [31], с некоторыми изменениями. Экспоненциальные культуры штаммов стафилококков-хозяев (OD 600 = 0,1), растущие в среде TSB, инфицировали соответствующим фагом при MOI = 5 и инкубировали в течение 15 мин при 20°C без встряхивания.Аликвоты зараженной культуры немедленно высевали для определения титра фага методом двойного слоя. Кроме того, образцы хранили при температуре -20°С, -80°С и -196°С в присутствии глицерина (конечная концентрация 15%).
Все образцы хранились в трех экземплярах. Через 1, 6, 12 и 24 месяца аликвоты тестировали на титр фага, как описано выше. Аликвоты фаговых лизатов в TSB без стабилизаторов также хранили в трех повторностях при 4°C и 20°C/25°C, а титр измеряли через 1, 3 и 6 месяцев.
Лиофилизация
Лизаты фагаразводили 1:1 (об./об.) в 22% обезжиренном молоке, 1,6М сахарозе или 30% сорбите и замораживали при -80°С во флаконах по 2 мл в течение 24 часов. Свежезараженные клетки, приготовленные, как указано выше, центрифугировали и суспендировали в обезжиренном молоке (конечная концентрация 11%) или сахарозе (конечная концентрация 0,8 М) и немедленно замораживали при -80°С. Образцы лиофилизировали с использованием сублимационной сушилки Alpha 1–4 (Christ, Osterode am Harz, Германия), затем флаконы запечатывали в условиях вакуума и хранили при 4°C.Титр фагов определяли методом двойного слоя после восстановления каждого флакона 2 мл стерильной воды.
Инкапсуляция в альгинат
фага частично очищали, как описано выше, а затем разбавляли в десять раз в 50 мМ HEPES pH 7,5, содержащем 2% (вес/объем) альгината натрия (FDA 21 CFR Sigma-Aldrich, США). Образцы перемешивали при 500 об/мин в течение 1 ч при 20°С. Капсулы формировали, добавляя пипеткой фаговую суспензию (3,5 мл, диаметр 1 мм, SARSTEDT, Германия) в 0.1 М раствор CaCl 2 при непрерывном перемешивании. Альгинатные капсулы выдерживали в этом растворе 30 мин при 20°С, затем четыре раза промывали водой с милли-Q и хранили при 4°С.
Микрокапсулы готовили эмульгированием. Внутреннюю фазу готовили путем добавления 2 мл фаговой суспензии к 4 мл 50 мМ HEPES, pH 7,5, и дальнейшего смешивания с альгинатом натрия до конечной концентрации 3% (масса/объем). Этот раствор перемешивали в течение 1 ч при 20°С с 3 мл 30 мМ CaCl 2 .Внешнюю фазу эмульсии готовили смешиванием 20 мл Miglyol 812 (Acofarma, Испания), содержащего 3% (вес/объем) Span 80 (Sigma-Aldrich, США) и 50 мкл ледяной уксусной кислоты; эту фазу перемешивали в течение 30 мин при 50°С. Для получения микроэмульсии внутреннюю и внешнюю фазы гомогенизировали при 20000 об/мин в течение 2 мин с использованием Heidolph SilentCrusher M (Merck KGaA, Дармштадт, Германия). 50 мкл ледяной уксусной кислоты добавляли на стадии гомогенизации для улучшения гелеобразования. Размер микрокапсул определяли методом динамического светорассеяния (DLS) на приборе Malvern Mastersizer S Long Bench (Malvern Instruments, Великобритания).
Тройные образцы инкапсулированных и микрокапсулированных фагов хранили при 4°C и 20°C/25°C, аликвоты отбирали через 1, 2 и 3 месяца. Альгинатные капсулы и микрокапсулы (1 г), содержащие фаговые частицы, растворяли в 9 мл 0,1 М цитрата натрия в течение 20 мин при встряхивании перед серийным разведением. Цитрат натрия действует путем дестабилизации структуры альгината кальция за счет обмена ионов кальция на ионы натрия [32]. Титр фага рассчитывали, как описано выше.
Распылительная сушка
Для проверки влияния высокой температуры на стабильность фагов частично очищенные фаги разводили в буфере SM, трегалозе (конечная концентрация 15%) или обезжиренном молоке (конечная концентрация 11%).Образцы инкубировали в течение 30 мин при различных температурах (40–60°С), а затем титровали по двухслойной методике. Все анализы были выполнены в трехкратной повторности.
Смеси фагов и стабилизаторов (трегалоза и обезжиренное молоко) высушивали с использованием распылительной сушилки LabPlant SD-05 (Keyson Products, Essex, England). Для этого образцы (150 мл) загружали при 40°С, расход 5 мл/мин, расход воздуха 54 м 3 /ч или 900 л/мин (температура воздуха на входе и выходе 170°С). и 120°C соответственно), а давление воздуха в компрессоре равно 0.9 бар. Высушенный порошок собирали и хранили при 4°C и 20°C/25°C. Образцы, содержащие трегалозу, хранили в эксикаторе с силикагелем.
Образцы порошка, содержащие фаги, были восстановлены стерильной водой для достижения первоначального объема и концентрации обезжиренного молока и трегалозы. Серийные разведения высевали для титрования фагов, как описано выше.
Статистический анализ
Статистический анализ проводили с использованием программного обеспечения SPSS-PC 23.0 (SPSS, Чикаго, Иллинойс, США) для установления каких-либо существенных различий в титрах фагов между стабилизирующими добавками, условиями хранения и временем.Различия в титрах фагов, выраженные как среднее значение ± стандартное отклонение трех биологических повторностей во всех анализах, определяли с помощью однофакторного дисперсионного анализа (ANOVA). Критерий Стьюдента-Ньюмена-Кеулса использовали для сравнения средних значений на уровне значимости P<0,01 или P<0,05 в зависимости от эксперимента.
Результаты
Низкотемпературное хранение улучшает сохранность
Staphylococcus фаговС целью поиска наиболее подходящих условий для хранения фагов phiIPLA35, phiIPLA88, phiIPLA-RODI и phiIPLA-C1C образцы хранились в различных условиях в течение 24 месяцев, и в течение этого времени оценивался титр.
Фаг phiIPLA88 показал хорошую стабильность при 4°C со снижением менее чем на 1 лог. соответственно (табл. 1).
Таблица 1. Стабильность фагов Staphylococcus (phiIPLA35, phiIPLA88, phiIPLA-RODI и phiIPLA-C1C), хранившихся при различных температурах в TSB без добавок и в присутствии нескольких стабилизирующих добавок.
https://дои.org/10.1371/journal.pone.0205728.t001
Примечательно, что образцы, хранившиеся при 20°C/25°C, потеряли жизнеспособность через 6 месяцев, так как титр снизился до 4,4 логарифмических единиц. Что касается стабильности фагов при различных температурах замерзания, то сифофаги phiIPLA35 и phiIPLA88 показали хорошую стабильность для всех стабилизаторов без существенных изменений титра фага через 24 месяца при -20°C (потеря жизнеспособности <0,2 логарифмической единицы). Напротив, когда эти фаги хранились в виде инфицированных клеток, наблюдалась потеря до 2,4 логарифмических единиц в титре фага через 24 месяца для фага phiIPLA88 (таблица 1).Меньшая стабильность наблюдалась у миофагов phiIPLA-RODI и phiIPLA-C1C при -20°С. Действительно, в образцах, хранившихся в течение 24 мес, при использовании в качестве стабилизаторов трегалозы или сахарозы бляшек лизиса обнаружено не было (табл. 1). Однако phiIPLA-RODI показал большую стабильность в глицерине, чем phiIPLA-C1C, сохраняя титр 10 8 БОЕ/мл (потеря жизнеспособности <0,9 логарифмической единицы) через 24 месяца при -20°C, в то время как phiIPLA-C1C показал титр около 10 4 БОЕ/мл (потеря жизнеспособности ~ 3,6 ед. log).Что касается миофагов, хранящихся внутри клеток-хозяев, образцы сохраняли титр фага около 10 3 –10 4 БОЕ/мл (потеря жизнеспособности ~ 4 единицы log) через 24 месяца (таблица 1).
Результаты, представленные в таблице 1, свидетельствуют о том, что титры фагов существенно не снижались в образцах, хранившихся при температуре -80°C через 24 месяца, независимо от используемого стабилизатора. Таким образом, снижение всегда было ниже 1 логарифмической единицы через 24 месяца как для сифофагов, так и для миофагов. Аналогичные результаты наблюдались для образцов, хранившихся в жидком азоте через 12 месяцев.Все они сохраняли высокую стабильность, за исключением phiIPLA-C1C (таблица 1), для которого снижение титра фага составляло около 1–1,4 логарифмических единиц в присутствии всех стабилизаторов.
Лиофилизация в обезжиренном молоке является альтернативой хранению фагов
В поисках альтернативы длительному хранению фаговые лизаты лиофилизировали в присутствии трех стабилизаторов (обезжиренное молоко, сахароза и сорбит), а затем хранили при 4°C в течение 24 месяцев. Результаты показали, что сорбит обладает плохой стабилизирующей активностью в отношении сифофагов с потерей фагового титра около 4.3 логарифмических единицы для фага phiIPLA35 (рис. 1А). Однако образцы, соответствующие сифофагам, хранящимся в обезжиренном молоке, сохраняли свою инфекционность с потерей титра фагов менее 1 логарифмической единицы. В случае миофагов три стабилизатора обеспечивали аналогичную защиту во время лиофилизации и хранения (рис. 1C и 1D). Примечательно, что лиофилизация вызвала высокую потерю инфекционности фага phiIPLA-C1C независимо от используемого стабилизатора со снижением на 2 логарифмических единицы через месяц после процесса лиофилизации (рис. 1D), тогда как phiIPLA-RODI показал очень хорошую стабильность во всех случаях.
Рис. 1. Стабильность фагов Staphylococcus при лиофилизации и последующем хранении.
Фаги phiIPLA35 (A), phiIPLA88 (B), phiIPLA-RODI (C) и phiIPLA-C1C (D) в различных добавках до лиофилизации (черные столбцы) и после хранения при 4°C в течение: 1 месяца (темно-серые столбцы), 6 месяцев (светло-серые столбцы) и 24 месяца (белые столбцы). Стабильность фагов выражали как титр образцов во времени. Столбцы представляют собой среднее ± стандартное отклонение титра фага, полученного из трех биологических повторностей.Различные буквы значительно различались в тесте S-N-K (P <0,01).
https://doi.org/10.1371/journal.pone.0205728.g001
В качестве дополнительного метода стабилизации фагов в процессе лиофилизации свежезараженные клетки суспендировали в обезжиренном молоке или сахарозе и далее лиофилизировали. В целом защита фагов внутри инфицированных клеток оказалась эффективной системой, позволяющей избежать пагубных последствий процесса, особенно для phiIPLA-C1C, поскольку снижение титра фага при лиофилизации было ниже, чем наблюдаемое в других образцах, т.е.е. разница в титре фага между образцами до и после лиофилизации составляла 1,0 логарифмической единицы, тогда как при использовании обезжиренного молока в качестве защиты снижение достигает 2,3 логарифмической единицы (рис. 1D). Однако более высокой защиты не наблюдалось в течение 24 месяцев хранения, за исключением phiIPLA88. В образцах, содержащих инфицированные клетки, мы не наблюдали снижения титра фага по сравнению с исходным титром через 24 месяца хранения, тогда как для образцов, хранившихся в сорбите, наблюдалось снижение на 2,3 логарифмических единицы (рис. 1Б).
Фаги Staphylococcus сохраняют свою жизнеспособность в альгинатных микрокапсулахОценивали стабильность фагов в процессах альгинатной инкапсуляции и микроинкапсуляции и последующем хранении при 4°C и 20°C. Были получены капсулы со средним размером диаметра 5 мм и микрокапсулы со средним размером диаметра 129 мкм. Титр фага, рассчитанный сразу после процесса инкапсуляции, составлял примерно 10 6 БОЕ/мл, за исключением капсул, содержащих phiIPLA-C1C (таблица 2).
Хранение альгинатных капсул, содержащих phiIPLA-RODI, при 4°C сохраняло титр фага в течение 3 месяцев и составляло 5,74±0,4 логарифмических единиц (БОЕ/мл) даже через 6 месяцев (данные не представлены). Напротив, капсулы, хранившиеся при 20°C, сохраняли стабильность phiIPLA-RODI в течение 2 месяцев со снижением на 2,5 логарифмических единицы в течение этого периода хранения (таблица 2). Остальные фаги были менее стабильны при 20°С. В целом более высокая стабильность наблюдалась при температуре охлаждения, чем при 20°C. С другой стороны, микроинкапсулирование в альгинате обеспечивает более высокую стабильность к фагам по сравнению со стандартным инкапсулированием.Таким образом, после трех месяцев хранения при температуре охлаждения наблюдалось логарифмическое снижение только примерно на 1–1,5 единицы. Напротив, жизнеспособные фаги не были обнаружены после двух месяцев при 20°C (таблица 2).
PhiIPLA88 и phiIPLA-RODI можно хранить в виде сухого порошка при 20°C
Перед определением влияния процесса распылительной сушки на жизнеспособность фага мы исследовали устойчивость фагов phiIPLA88 и phiIPLA-RODI при высоких температурах в присутствии трех добавок (буфер SM, обезжиренное молоко и трегалоза).PhiIPLA88 оказался достаточно стабильным при 50°C, и образцы даже сохраняли титр 10 5 БОЕ/мл через 30 минут при 60°C в трегалозе и буфере SM (рис. 2А). Аналогичные результаты наблюдались для phiIPLA-RODI при 40°C и 50°C, но титры снижались на 6 логарифмических единиц при 60°C в присутствии трегалозы и обезжиренного молока (рис. 2B).
Рис. 2. Защитное действие различных стабилизаторов на термическую инактивацию фагов.
Бактериофаги phiIPLA88 (A) и phiIPLA-RODI (B) инкубировали при разных температурах: 4°C (черные столбцы), 40°C (темно-серые столбцы), 50°C (светло-серые столбцы) и 60°C. (белые полосы), в течение 30 мин.Стабильность фага в этих условиях измеряли как изменение титра фага после обработки. Столбцы представляют собой среднее значение ± стандартное отклонение титра фага в трех биологических повторностях. Различные буквы значительно отличались в тесте S-N-K (P <0,05). Звездочка (*): ниже порога обнаружения бактериофага (10 2 БОЕ/мл).
https://doi.org/10.1371/journal.pone.0205728.g002
На основании этих результатов суспензии, содержащие phiIPLA88 и phiIPLA-RODI, были высушены распылением с использованием обезжиренного молока и трегалозы в качестве стабилизаторов при 40°C в качестве температуры для загрузки образцы.Полученные порошки хранили при 4°С или 20°С. Образцы титровали сразу после процесса и в течение 12 месяцев (рис. 3).
Рис. 3. Эволюция титра фага после распылительной сушки.
Фаги phiIPLA88 (A) и phiIPLA-RODI (B), до обработки (черные столбцы), сразу после обработки (темно-серые столбцы) и при хранении 1 месяц (серые столбцы), 6 месяцев (светло-серые столбцы) и 12 месяцев (белые столбики), при разных температурах и с разными стабилизирующими добавками. Столбцы представляют собой среднее значение ± стандартное отклонение титра фага в трех биологических повторностях.Различные буквы значительно отличались в тесте S-N-K (P <0,05). Звездочка (*): ниже порога обнаружения бактериофага (10 2 БОЕ/мл).
https://doi.org/10.1371/journal.pone.0205728.g003
Снижение на 1–2 логарифмических единицы наблюдалось для phiIPLA88 в трегалозе и обезжиренном молоке сразу после процесса (рис. 3A), тогда как phiIPLA-RODI показал большая потеря жизнеспособности у обоих стабилизаторов (до 4 логарифмических единиц) (рис. 3Б). Что касается хранения, то phiIPLA88 оказался более стабильным и сохранил титр 10 7 -10 8 БОЕ/мл после хранения в течение 12 месяцев при 20°С в образцах, содержащих трегалозу в качестве стабилизирующего агента, а также в образцах, хранившихся при 4°C в присутствии обезжиренного молока.Неожиданно хранение при 4°C привело к снижению титра фага phiIPLA88 в присутствии трегалозы. Наконец, несмотря на более низкую стабильность во время процесса, phiIPLA-RODI также сохранял инфекционность при 20°C в течение шести месяцев и при температуре охлаждения в течение 12 месяцев независимо от стабилизатора (рис. 3B).
Обсуждение
Ожидается, что коммерциализация продуктов на основе бактериофагов увеличится в ближайшие несколько лет в связи с внедрением фаговой терапии для преодоления глобального кризиса устойчивости к антибиотикам [33].Фактически было проведено несколько клинических испытаний с использованием бактериофагов для лечения инфекционных заболеваний у людей [34–37], и также возможно, что пищевая промышленность будет включать эти продукты в свои рутинные процедуры дезинфекции [38]. В связи с этим по-прежнему необходимо оптимизировать условия хранения фагов как для небольших запасов, предназначенных для сохранения фагов в течение длительного периода времени, так и для больших объемов очищенных фагов, готовых к доставке. Соответственно, в этом исследовании сравнивается стабильность небольших запасов четырех фагов Staphylococcus в течение 24-месячного периода с использованием трех методов консервации (низкая температура, лиофилизация и инкапсуляция).
Методы низкотемпературного сохранения широко использовались для поддержания запасов фагов в течение длительного времени [39]. Преимущество их в том, что они доступны для большинства лабораторий, хотя основным недостатком являются связанные с ними затраты на электроэнергию и их непригодность для больших объемов. Здесь мы показали четкую взаимосвязь между температурой хранения и стабильностью фага, которая была особенно очевидна для фагов, принадлежащих к семейству Myoviridae . Таким образом, стабильность фага увеличивалась по мере снижения температуры хранения.На самом деле мы наблюдали, что снижение титра фага было менее чем на 1,5 логарифмических единицы через 12 месяцев при -196°C, независимо от используемого фага и стабилизатора. Очевидно, что этот метод полезен только для сохранения небольших объемов основного запаса. Результаты, полученные при -80°С, оказались сходными, что свидетельствует о том, что фаги обоих семейств могут сохраняться при этой температуре в любом стабилизаторе для длительного хранения (не менее 2 лет).
Некоторые различия в стабильности между двумя семействами фагов были обнаружены при температуре -20°C.Предыдущие исследования показывают, что снижение титра фагов, наблюдаемое в замороженных образцах, хранящихся при -20°C, в основном связано с образованием крупных кристаллов льда [9]. Наши результаты показывают, что этот эффект был более выражен для фагов, принадлежащих к семейству Myoviridae , несмотря на присутствие стабилизаторов. В частности, phiIPLA-RODI и phiIPLA-C1C были относительно нестабильны в присутствии трегалозы и сахарозы, дисахаридов, которые обычно используются для криоконсервации микроорганизмов [40].Напротив, стоит отметить защитный эффект обезжиренного молока и глицерина при этой температуре. Действительно, глицерин показал хорошую эффективность для сохранения phiIPLA-RODI. Одно из возможных объяснений состоит в том, что криоконсервирующий эффект дисахаридов теряется при медленном замораживании [41].
Что касается приготовления основных стадий для использования в промышленном производстве фагов, то в целом хранение в инфицированных клетках не обеспечивало усиленной защиты по сравнению с голыми фагами. В целом, наши результаты предполагают меньшую эффективность этого метода для наших стафилококковых фагов, чем ранее наблюдалась для S . aureus фагов A5W и phiAGO1.3, у которых не было обнаружено снижения титра [31]. Эти различия могут быть связаны с более длительным временем хранения и более высокой температурой (-20°C), которой подвергались наши фаги по сравнению с A5W и phiAGO1.3. Кроме того, различия в конкретных условиях, используемых для получения инфицированных клеток (MOI, время адсорбции, этапы промывки после заражения), нельзя исключать как дополнительную причину более низкой жизнеспособности фага, наблюдаемой в наших фагах.
Для длительного сохранения фагов Staphylococcus мы также исследовали лиофилизацию, которая доказала свою эффективность для других бактериофагов [42, 10, 11, 43, 44]. Хотя для пробоподготовки требуется специальное оборудование, преимуществом этого метода является получение сухого порошка, который легко хранить и транспортировать. После лиофилизации образцы, содержащие фаги, хранили при 4°C, чтобы избежать нестабильности, наблюдаемой ранее для некоторых бактериофагов в порошках, содержащих трегалозу, из-за кристаллизации матрицы [45].Обезжиренное молоко обеспечивало хорошую защиту в течение 24 месяцев для всех изученных фагов, хотя заметное снижение титра фага произошло для phiIPLA-C1C в процессе лиофилизации. Исследования стабильности других фагов Myoviridae , таких как S . aureus phage ISP также подтвердил чувствительность этих фагов к процессу лиофилизации и показал, что дисахариды трегалоза и сахароза являются эффективными стабилизаторами [44]. В этом контексте Puapermpoonsiri et al.[42] установили, что стабильность лиофилизированных бактериофагов четко зависит от влажности порошка, оптимальная величина которой находится в диапазоне 4–6%.
Микроинкапсуляция бактериофагов — это технология, в основном изучаемая для защиты фагов от кислой среды желудочно-кишечного тракта, когда эти фаги используются для лечения инфекций человека или животных [46, 47]. Здесь мы оценили использование фагов, инкапсулированных в альгинат, для улучшения их стабильности в условиях хранения и транспортировки.Наши результаты показали, что микрокапсулированные фаги могут храниться при температуре 20°C в течение 2 месяцев, что облегчает транспортировку образцов. Однако при длительном хранении микрокапсулирование не приводило к улучшению жизнеспособности фага по сравнению с жизнеспособностью, полученной при использовании методов низкой температуры (включая охлаждение) и лиофилизации. Следует отметить, что методы микрокапсулирования требуют дополнительных затрат, которые следует оценивать в зависимости от конечного применения. Несмотря на это, их более высокая устойчивость к условиям окружающей среды могла бы компенсировать эти недостатки.Вариант метода микрокапсулирования с использованием микрожидкостных устройств недавно был использован для производства капсул из альгината кальция, содержащих бактериофаг UFV-AREG1, который применяется для дезинфекции поверхностей пищевых продуктов [14]. Аналогичным образом этот метод был использован для инкапсуляции Clostridium difficile бактериофага CDKM9, предназначенного для лечения заболеваний толстой кишки [48].
В поисках менее вредной стратегии для поддержания жизнеспособности фага и с учетом возможности ее адаптации к промышленным масштабам с непрерывным производством мы оценили метод распылительной сушки.Необходимость использования высоких температур для сушки фаговых суспензий предполагает обязательное использование защитных соединений во избежание денатурации фаговых белков. Для этой цели были выбраны как трегалоза, так и обезжиренное молоко, поскольку они показали способность защищать белки от денатурации [49, 50]. Наши результаты показали более высокую стабильность phiIPLA88 по сравнению со стабильностью phiIPLA-RODI в обоих стабилизаторах. Более того, снижение титра фага, наблюдаемое после процесса сушки, было аналогично описанному для миофага Staphylococcus Romulus, подвергнутого аналогичному процессу с использованием трегалозы [51].Определенно, необходима дальнейшая оптимизация процесса сушки распылением, чтобы уменьшить снижение жизнеспособности, вызванное использованием горячего воздуха для сушки фаговой суспензии. Например, использование низкотемпературной системы распылительной сушки позволяет получать ингаляционный порошок, содержащий фаги, для лечения легочных инфекций [52, 53]. В связи с этим уже сообщалось, что бактериофаги, принадлежащие к разным семействам, ведут себя по-разному при аэрозолизации [54]. Дальнейшая работа необходима для изучения других стабилизаторов, характеристики которых позволят не только длительное хранение суспензий фагов, но и их прямую доставку в таких приложениях, как фаговая терапия или биоконтроль.
Благодарности
Это исследование было поддержано грантами AGL2015-65673-R (Министерство науки и инноваций, Испания), GRUPIN14-139 (Программа науки, технологий и инноваций на 2013–2017 годы и фонды ЕС FEDER, Principado de Asturias, Испания). Л.Ф. является постдокторантом Marie Curie Clarin-Cofund. PG, BM и AR являются членами исследовательского сообщества «Фагебиотики», финансируемого FWO Vlaanderen (WO.016.14), и сети бактериофагов FAGOMA II. Мы благодарим НАНОВЭКС Биотехнологии С.Л. за помощь в работе. Мы также благодарим доктора Сусану Луке (Университет Овьедо) за консультацию по технологии распылительной сушки.
Каталожные номера
- 1. Каттер Э., Де Вос Д., Гвасалия Г., Алавидзе З., Гогохия Л., Куль С. и др. Фаготерапия в клинической практике: лечение инфекций человека. Карр Фарм Биотехнолог. 2010 г.; 11: 69–86. пмид:20214609
- 2. ООН. Пресс-релиз: Совещание высокого уровня по устойчивости к противомикробным препаратам. 2016; [цитировано 29 марта 2017 г.].URL: https://www.un.org/pga/71/2016/09/21/press-release-hl-meeting-on-antimicrobial-resistance/
- 3. Монах А.Б., Рис К.Д., Барроу П., Хагенс С., Харпер Д.Р. Применение бактериофагов: где мы сейчас? Lett Appl Microbiol. 2010 г.; 51:363–369. пмид:20796209
- 4. Гарсия П., Родригес Л., Родригес А., Мартинес Б. Биоконсервация пищевых продуктов: многообещающие стратегии с использованием бактериоцинов, бактериофагов и эндолизинов. Тенденции Food Sci Technol. 2010 г.; 21:373–382.
- 5.Уотерс Э.М., Нил Д.Р., Каман Б., Сахота Дж.С., Клоки М.Р.Дж., Уинстенли С. и другие. Фаговая терапия высокоэффективна против хронических инфекций легких с помощью Pseudomonas aeruginosa . грудная клетка. 2017; 72:666–667. пмид:28265031
- 6. Regeimbal JM, Jacobs AC, Corey BW, Henry MS, Thompson MG, Pavlicek RL, et al. Персонализированный терапевтический коктейль диких фагов окружающей среды спасает мышей от раневых инфекций Acinetobacter baumannii . Противомикробные агенты Chemother, 2016; 60, 5806–5816.пмид:27431214
- 7. Lee CY, Kim SJ, Park BC, Han JH. Влияние пищевых добавок с бактериофагами против энтеротоксигенной Escherichia coli (ETEC) K88 на клинические симптомы поросят после отъема, зараженных возбудителем ETEC. J Anim Physiol Anim Nutr (Берл). 2016; 101:88–95.
- 8. Силланкорва С.М., Оливейра Х., Азередо Дж. Бактериофаги и их роль в безопасности пищевых продуктов. Int J Food Microbiol. 2012 г.; 2012:863945.
- 9. Малик Д.Дж., Соколов И.Дж., Виннер Г.К., Манкузо Ф., Синкерруи С., Владисавлевич Г.Т. и др.Составление, стабилизация и инкапсуляция бактериофага для фаговой терапии. Adv Коллоидный интерфейс Sci. 2017; 249:100–133. пмид:28688779
- 10. Гольшахи Л., Линч К.Х., Деннис Дж.Дж., Финли В.Х. In vitro Доставка в легкие бактериофагов KS4-M и PhiKZ с использованием ингаляторов сухого порошка для лечения инфекций Burkholderia cepacia и Pseudomonas aeruginosa при муковисцидозе. J Appl Microbiol. 2011 г.; 110:106–117. пмид:20875034
- 11.Альфадель М., Пуапермпуансири Ю., Форд С.Дж., Макиннес Ф.Дж., Ван дер Валле С.Ф. Лиофилизированные вкладыши для назального введения, содержащие бактериофаги, факультативные для Staphylococcus aureus : оценка in vitro. Международный J Фарм 2011; 416: 280–287. пмид:21771648
- 12. Дини С., Ислан Г.А., Де Урраза П.Дж., Кастро Г.Р. Новые биополимерные матрицы для микрокапсулирования фагов: усиленная защита от кислотности и активности протеаз. Макромол Биоски. 2012 г.; 12:1200–1208. пмид:22847825
- 13.Колом Дж., Кано-Сарабиа М., Отеро Дж., Ариньес-Сориано Дж., Кортес П., Маспоч Д. и др. Микрокапсулирование с альгинатом/CaCO 3 : Стратегия улучшения фаготерапии. Научный представитель 2017; 25:41441.
- 14. Boggione DMG, Batalha LS, Gontijo MTP, Lopez MES, Teixeira AVNC, Santos IJB и др. Оценка микроинкапсуляции бактериофага UFV-AREG1 в микрокапсулах альгината-Ca с использованием микрофлюидных устройств. Коллоиды Surf B Биоинтерфейсы. 2017; 158:182–189. пмид:28692873
- 15.Лоуи ФД. Staphylococcus aureus инфекций. N Engl J Med. 1998 год; 339: 520–532. пмид:9709046
- 16.
Le Loir Y, Baron F, Gautier M. Staphylococcus aureus и пищевое отравление. Жене Мол Рез. 2003 г.; 2: 63–76. пмид:12
3
- 17. Чхиббер С., Каур Т., Сандип К. Совместная терапия с использованием литического бактериофага и линезолида: эффективное лечение для устранения метициллин-резистентного Staphylococcus aureus (MRSA) от инфекций диабетической стопы.ПЛОС Один. 2013; 8(2):e56022. пмид:23418497
- 18. Мендес Дж. Дж., Леандро С., Корте-Реал С., Барбос Р., Кавако-Сильв П., Мело-Кристино Дж. и др. Ранозаживляющий потенциал местной бактериофаговой терапии диабетических кожных ран. Восстановление ран. 2013; 21: 595–603. пмид:23755910
- 19. Такемура-Утияма И., Утияма Дж., Осанаи М., Моримото Н., Асагири Т., Уджихара Т. и др. Экспериментальная фаговая терапия против летальной легочной септицемии, вызванной Staphylococcus aureus у мышей.микробы заражают. 2014; 16: 512–517. пмид:24631574
- 20. Кишор С., Мишр Р.Р., Сараф С.К., Кумар М., Шривастав А.К., Натх Г. Фаговая терапия стафилококкового хронического остеомиелита на экспериментальной модели животных. Индийская J Med Res. 2016; 143:87–94. пмид:26997019
- 21. Буэно Э., Гарсия П., Мартинес Б., Родригес А. Фаговая инактивация Staphylococcus aureus в свежих и твердых сырах. Int J Food Microbiol. 2012 г.; 158:23–27. пмид:22795798
- 22.Эль Хаддад Л., Бен Абдаллах Н., Планте П.Л., Думареск Дж., Кацарава Р., Лабри С. и др. Повышение безопасности поливалентных фагов Staphylococcus aureus путем их производства на штамме Staphylococcus xylosus . ПЛОС Один. 2014; 9:e102600. пмид:25061757
- 23. Обесо Дж. М., Гарсия П., Мартинес Б., Арройо-Лопес Ф. Н., Гарридо-Фернандес А., Родригес А. Использование логистической регрессии для прогнозирования судьбы Staphylococcus aureus в пастеризованном молоке в присутствии двух литических фагов.Appl Environ Microbiol. 2010, 76:6038–6046. пмид:20656872
- 24. Алвес Д.Р., Годион А., Бин Дж.Э., Перес Эстебан П., Арнот Т.С., Харпер Д.Р. и др. Совместное использование бактериофага К и нового бактериофага для уменьшения образования биопленки Staphylococcus aureus . Appl Environ Microbiol. 2014; 80:6694–6703. пмид:25149517
- 25. Гутьеррес Д., Ванденхеувель Д., Мартинес Б., Родригес А., Лавин Р., Гарсия П. Два фага, phiIPLA-RODI и phiIPLA-C1C, лизируют моно- и двухвидовые стафилококковые биопленки.Appl Environ Microbiol. 2015 г.; 81:3336–3348. пмид:25746992
- 26. Келли Д., Маколифф О., Росс Р.П., Коффи А. Предотвращение образования биопленки Staphylococcus aureus и снижение установленной плотности биопленки с использованием комбинации фага К и модифицированных производных. Lett Appl Microbiol. 2012 г.; 54:286–291. пмид:22251270
- 27. Гарсия П., Мадера С., Мартинес Б., Родригес А. Биоконтроль Staphylococcus aureus в процессах производства творога с использованием бактериофагов.Int Dairy J. 2007; 17:7.
- 28. Гарсия П., Мартинес Б., Обесо Дж. М., Лавин Р., Лурц Р., Родригес А. Функциональный геномный анализ двух фагов Staphylococcus aureus , выделенных из молочной среды. Appl Environ Microbiol. 2009 г.; 75:7663–7673. пмид:19837832
- 29. Гарсия П., Мадера С., Мартинес Б., Родригес А., Суарес Х.Э. Распространенность бактериофагов, заражающих Staphylococcus aureus , в образцах молочных продуктов и их потенциал в качестве агентов биоконтроля.Дж. Молочная наука. 2009 г.; 92:3019–3026. пмид:19528579
- 30. Адамс МХ. Подсчет частиц бактериофагов. Бактериофаги. Лондон: Interscience Publishers, Ltd., 1959; 27–34.
- 31. Голец П., Дабровски К., Хейнович М.С., Гоздек А., Лос Дж.М., Вегжин Г. и соавт. Надежный метод хранения хвостатых фагов. J Микробиологические методы. 2011 г.; 84:486–489. пмид:21256885
- 32. Smidsrød O, Skjåk-Braek G. Альгинат в качестве матрицы для иммобилизации клеток.Тенденции биотехнологии. 1990 г.; 8(3):71–8. пмид:1366500
- 33. Нагель Т.Е., Чан Б.К., Де Вос Д., Эль-Шибины А., Кангете Э.К., Макуми А. и др. Развивающемуся миру срочно нужны фаги для борьбы с патогенными бактериями. Фронт. Микробиол.2016; 7:882. пмид:27375602
- 34. Райт А., Хокинс С.Х., Энггард Э.Е., Харпер Д.Р. Контролируемое клиническое исследование терапевтического препарата бактериофага при хроническом отите, вызванном резистентной к антибиотикам Pseudomonas aeruginosa ; предварительный отчет об эффективности.Клин Отоларингол. 2009 г.; 34:349–357. пмид:19673983
- 35. Роуз Т., Вербекен Г., Де Вос Д., Мерабишвили М., Ваничутте М., Дженнес С. и др. Экспериментальная фаготерапия ожоговой раневой инфекции: трудные первые шаги. Int J ожоговая травма. 2014; 4:66–73.
- 36. Фиш Р., Каттер Э., Уит Г., Бласдел Б., Кутателадзе М., Куль С. Лечение бактериофагами непреходящих диабетических язв на пальцах ног: серия случаев. J Уход за ранами. 2016; 25:27–33.
- 37. Саркер С.А., Султана С., Рейтелер Г., Мойн Д., Дескомб П., Чартон Ф. и др.Пероральная фаготерапия острой бактериальной диареи двумя препаратами колифага: рандомизированное исследование у детей из Бангладеш. ЭБиоМедицина. 2016; 4:124–137. пмид:26981577
- 38. Гутьеррес Д., Родригес-Рубио Л., Мартинес Б., Родригес А., Гарсия П. Бактериофаги как оружие против бактериальных биопленок в пищевой промышленности. Фронт микробиол. 2016; 7:825. пмид:27375566
- 39. Акерманн Х.В., Тремблей Д., Муано С. Долгосрочное сохранение бактериофагов. Информационный бюллетень Всемирной федерации коллекций культур.2004 г.; 38:35–40.
- 40. Хубалек З. Протективы, используемые при криоконсервации микроорганизмов. Криобиология. 2003 г.; 46:205–229. пмид:12818211
- 41. Учида Т., Такея С., Нагаяма М. и Гохара К. Замораживающие свойства растворов дисахаридов: ингибирование роста гексагональных кристаллов льда и образование кубического льда. 2012. В: Борисенко Е, ред. Кристаллизация и материаловедение современных искусственных и природных кристаллов. Лондон: Интек. 2012. стр. 203–224.
- 42. Пуапермпуансири У, Форд С.Дж., Ван дер Валле К.Ф. Стабилизация бактериофага при сушке вымораживанием. Инт Дж Фарм. 2010 г.; 389: 168–175. пмид:20105458
- 43. Дини С., Де Урраза П.Дж. Влияние буферных систем и концентрации дисахаридов на стабильность колифагов Podoviridae при лиофильной сушке и хранении. Криобиология, 2013; 66:339–342. пмид:23537872
- 44. Мерабишвили М., Верве С., Пирнай Дж. П., Де Вос Д., Вербекен Г., Маст Дж. и др.Стабильность ISP фага Staphylococcus aureus после сушки вымораживанием (лиофилизация). ПЛОС Один. 2013; 8:e68797. пмид:23844241
- 45. Vandenheuvel D, Meeus J, Lavigne R, Van den Mooter G. Нестабильность бактериофагов в высушенных распылением порошках трегалозы вызвана кристаллизацией матрицы. Инт Дж Фарм. 2014; 472 (1–2): 202–205. пмид:24950368
- 46. Ma Y, Pacan JC, Wang Q, Xu Y, Huang X, Korenevsky A, et al. Микрокапсулирование бактериофага felix O1 в хитозан-альгинатные микросферы для приема внутрь.Appl Environ Microbiol. 2008 г.; 74:4799–4805. пмид:18515488
- 47. Colom J, Cano-Sarabia M, Otero J, Cortes P, Maspoch D, Llagostera M. Инкапсулированные в липосомы бактериофаги для усиленной пероральной фаговой терапии против Salmonella spp. Appl Environ Microbiol. 2015 г.; 81:4841–4849. пмид:25956778
- 48. Виннер Г.К., Владисавлевич Г.Т., Клоки М.Р.Дж., Малик Д.Дж. Микрокапсулирование специфических бактериофагов Clostridium difficile с использованием микрожидкостных стеклянных капиллярных устройств для доставки в толстую кишку с использованием рН-триггерного высвобождения.ПЛОС Один. 2017; 12(10):e0186239. пмид:222
- 49. Лесли С.Б., Исраэл Э., Лайтхарт Б., Кроу Д.Х., Кроу Л.М. Трегалоза и сахароза защищают как мембраны, так и белки интактных бактерий во время сушки. Appl Environ Microbiol. 1995 год; 61:3592–3597. пмид:7486995
- 50. Font de Valdez G, Savoy de Giori G, Pesce de Ruiz Holgado A, Oliver G. Сравнительное исследование эффективности некоторых добавок в защите молочнокислых бактерий от сублимационной сушки. Криобиология.1983 год; 20: 560–566. пмид:6194937
- 51. Vandenheuvel D, Singh A, Vandersteegen K, Klumpp J, Lavigne R, Van den Mooter G. Возможность распылительной сушки бактериофагов в респирабельные порошки для борьбы с легочными бактериальными инфекциями. Евр Джей Фарм Биофарм. 2013; 84: 578–582. пмид: 23353012
- 52. Matinkhoo S, Lynch KH, Dennis JJ, Finlay WH, Vehring R. Высушенные распылением вдыхаемые порошки, содержащие бактериофаги, для лечения легочных инфекций. Дж. Фарм.2011 г.; 100: 5197–5205. пмид:22020816
- 53. Леунг С.С., Парумасивам Т., Гао Ф.Г., Картер Э.А., Карриги Н.Б., Веринг Р. и др. Влияние условий хранения на стабильность высушенных распылением порошков ингаляционных бактериофагов. Инт Дж Фарм. 2017; 521:141–149. пмид:28163231
- 54. Turgeon N, Toulouse MJ, Martel B, Moineau S, Duchaine C. Сравнение пяти бактериофагов в качестве моделей для изучения вирусных аэрозолей. Appl Environ Microbiol. 2014; 80:4242–4250. пмид: 24795379
Медицинские уведомления о фагоцитах, отсортированные по производителям
Еврофаг говорит:Здравствуйте,
Хороший вопрос.Не будучи врачом, здесь Эрель обратил внимание на книги и последние публикации, а также на практику лечебных центров фаговой терапии.
Мы можем иметь дело двумя способами: либо с помощью коммерческого коктейля, либо путем выращивания лабораторного фага, который поколение за поколением доставляется каждый раз в присутствии исходного бактериального штамма и будет более агрессивным по отношению к бактериям, воздействию которых он подвергается (в В этом случае необходимо обязательно противостоять каждому новому поколению фага штамма исходных бактерий – так что не дайте развиться бактериям с фагами, иначе бактерии имеют тенденцию становиться устойчивыми).
При любом подходе настоятельно рекомендуется лечить бактерии в присутствии нескольких различных типов фагов, но все они агрессивны по отношению к бактериям. Это необходимое условие для ограничения риска того, что бактерии станут устойчивыми в результате мутации.
Наконец, с умеренно агрессивными фагами бороться бесполезно. Это должны быть очень агрессивные и быстро повторяющиеся фаги, которые Эрель называл «мощными и одаренными бактериофагами большой жизненной силы», «вызывать у больного in vivo бактериофагию, достаточно активную, чтобы уничтожить в течение нескольких часов все патогенные бактерии в организме» (Эрелль из речи в 1947 г. при получении премии Дормой Малой академии наук).
Сделайте фагограмму, поэтому неплохо проверить чувствительность бактерий к препарату бактериофага. Осталось найти лабораторию для вас.
Из этого знания можно сделать следующие выводы:
– коммерческий коктейль может работать очень хорошо, если вам повезет, что это более вирулентные фаги, действующие на вас или ваши бактерии. Это опыт производителей этих отборных коктейлей, а затем собранных в большом количестве и стабильно вирулентных фагов на обычных бактериях.Многие врачи, в том числе и французские, с успехом применяли иностранные коктейли. Так что у вас есть шанс, что это сработает. Если вы можете составить фагограмму, вы также можете проверить свои шансы на успех. Скорее всего, лечение работает только в том случае, если фагограмма очень положительна. Если вы не можете сделать фагограмму, вы максимизируете свои шансы с помощью определенного коктейля вашей патологии, или лучше, если у вас есть восприимчивость, которая дает вам название бактерии, с коктейлем, специфичным для бактерии.
– если нет, если коктейль Коммерции в отношении ваших бактерий не работает, это должно быть лабораторное исследование, которое в настоящее время не проводится во Франции.лаборатория должна иметь 3 или 4 разных фага, активных на ваших бактериях, чтобы результаты были более агрессивными, а затем поместить их в стабильный коктейль, который затем можно будет вводить. До начала 1960-х и 1970-х годов этим занимались лаборатории бактериофагов, созданные Эреллем или Институтом Пастера. Врач пациента прислал свои бактерии и через десять дней получил подходящий коктейль. Сейчас во Франции этого больше не делают, потому что антибиотики явно стали дешевле.
С фагом результат никогда не гарантируется, но если мы уважаем советы Эрелла, основные из перечисленных выше, показатель успеха очень важен в соответствии с результатами, опубликованными Эреллем, врачами, которые его сменили, и зарубежными лечебными центрами, которые в настоящее время работают. операция.
Наконец, фаготерапия более эффективна, если ее проводить на ранней стадии. Микробы (бактерии, а не фаги) действительно могут нанести непоправимый ущерб органам, а их популяция велика, больше шансов, что у вас есть мутация, позволяющая им противостоять фагам и сделать лечение менее эффективным.
Риски редки или отсутствуют теоретически или. Работы доктора Поля Эрве Рича и Дубланше (из которых также извлечена часть вышеуказанной информации) дают вам и вашему врачу полную информацию о методах лечения и рисках.


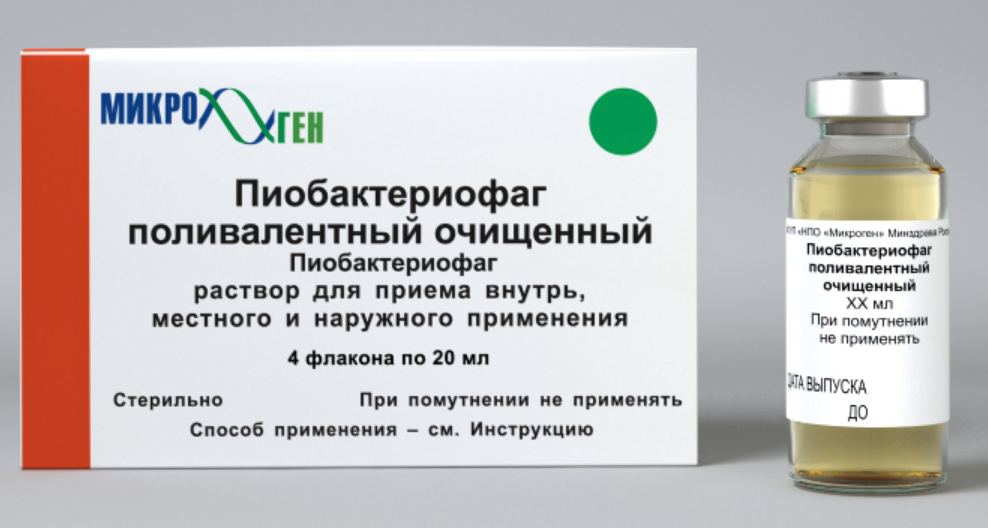

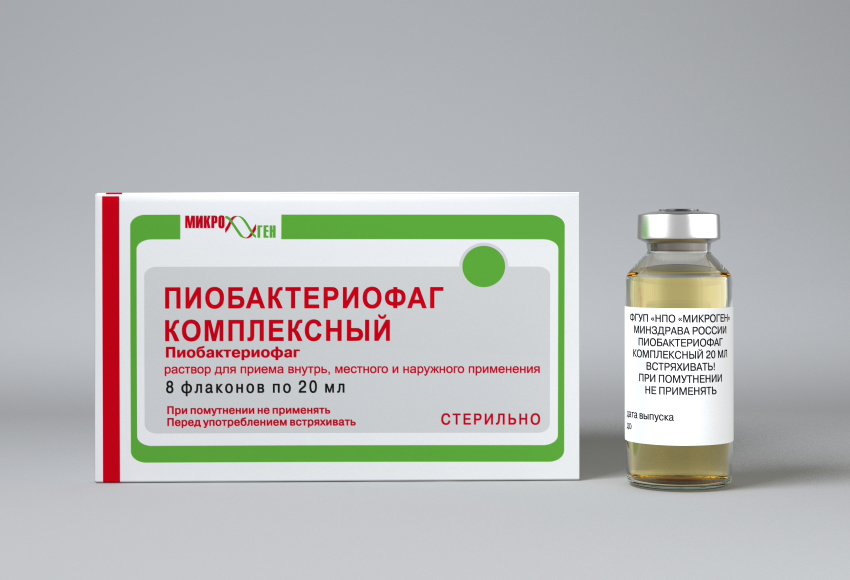 ;
; ч. вызванный внешним воздействием)
ч. вызванный внешним воздействием) 0
0 ч. эндометрит, миометрит, метрит, пиометра, абсцесс матки)
ч. эндометрит, миометрит, метрит, пиометра, абсцесс матки)
 В случае, если до применения бактериофага для лечения ран применялись химические антисептики, рана должна быть тщательно промыта стерильным 0.9% раствором натрия хлорида.
В случае, если до применения бактериофага для лечения ран применялись химические антисептики, рана должна быть тщательно промыта стерильным 0.9% раствором натрия хлорида.


 — 10 мл,
— 10 мл, ,
,

