Преждевременное созревание плаценты. Что такое Преждевременное созревание плаценты?
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Преждевременное созревание плаценты — появление эхографических признаков зрелости плацентарной ткани раньше гестационного срока, для которого такие изменения являются физиологическими. Клинически никак не проявляется, диагностируется только при плановом скрининге. При постановке диагноза используют данные УЗИ. Исследование дополняют допплерографией плацентарного кровотока, КТГ, фетометрией, фонокардиографией плода. Лечение предполагает терапию основного заболевания и назначение препаратов, улучшающих кровообращение между беременной и ребенком, — антиагрегантов, сосудорасширяющих средств, эссенциальных фосфолипидов, аминокислотных комплексов.
- Причины преждевременного созревания плаценты
- Патогенез
- Классификация
- Симптомы преждевременного созревания плаценты
- Осложнения
- Диагностика
- Лечение преждевременного созревания плаценты
- Прогноз и профилактика
- Цены на лечение
Общие сведения
В норме детское место проходит несколько этапов (стадий) развития, соответствующих особенностям роста и созревания плода на определенных сроках гестации. Физиологические изменения, происходящие в тканях плаценты, позволяют ей эффективно справляться с выполнением питательной, дыхательной, выводящей и барьерной функции. При наличии некоторых провоцирующих факторов, вызывающих перенапряжение компенсаторных процессов, детское место растет и созревает ускоренными темпами. В подобных случаях говорят о ПСП — преждевременном созревании (старении) плаценты. Актуальность своевременной диагностики расстройства обусловлена высокой вероятностью его осложнения фетоплацентарной недостаточностью, представляющей угрозу для физиологичного развития ребенка.
Преждевременное созревание плаценты
Причины преждевременного созревания плаценты
Раннее начало процессов старения плацентарной ткани провоцируется любым фактором, приводящим к усиленному функционированию системы «мать-плод». Пусковым моментом в развитии нарушения могут послужить изменения в материнском организме, неблагоприятные факторы окружающей среды, патологическое течение беременности. По мнению специалистов в сфере акушерства и гинекологии, наиболее распространенными причинами преждевременного начала процессов старения детского места являются:
- Экстрагенитальная патология. Ускоренное развитие плацентарной ткани чаще наблюдается у беременных, страдающих соматическими и эндокринными заболеваниями (болезнями почек, артериальными гипертензиями, сахарным диабетом, гипотиреозом, гипертиреозом). Это связано с повышенной нагрузкой на функционально несостоятельные органы и системы, а также изменениями микроциркуляции во время беременности.

- Хронические заболевания репродуктивных органов. К нарушению процессов плацентации, а затем и функционирования плаценты приводят структурные изменения стенки матки, возникшие после абортов, вследствие хронического эндометрита, аденомиоза, субслизистых миом. Преждевременное начало созревания возможно при дисгормональных расстройствах на фоне заболеваний яичников (оофоритов, аднекситов, склерокистозного синдрома).
- Гестозы. Характерные изменения кровообращения в стенке матки и маточно-плацентарном комплексе, возникающие при длительном течении гестозов, усиливают функциональную нагрузку на детское место. На начальных этапах компенсаторные механизмы позволяют поддерживать нормальное кровоснабжение плода. Однако в последующем срыв компенсации ускоряет рост плаценты, стимулирует ее преждевременное развитие, созревание и старение.
- Инфекционные заболевания. Значительная нагрузка на плацентарную ткань, которая выполняет защитную функцию, появляется при угрозе поражения плода инфекционными агентами.
 Провоцирующими факторами становятся возбудители специфических генитальных инфекций (простого герпеса, микоплазмоза, уреаплазмоза, хламидиоза), других инфекционных болезней (ОРВИ, краснухи, токсоплазмоза, цитомегаловирусной инфекции).
Провоцирующими факторами становятся возбудители специфических генитальных инфекций (простого герпеса, микоплазмоза, уреаплазмоза, хламидиоза), других инфекционных болезней (ОРВИ, краснухи, токсоплазмоза, цитомегаловирусной инфекции). - Изосерологическая несовместимость матери и плода. Ребенок, у которого вследствие AB0- или Rh-конфликта возникла гемолитическая болезнь, нуждается в более интенсивном поступлении питательных веществ и кислорода, что повышает нагрузку на ткань плаценты. Усиленное функционирование в сочетании с типичными дисциркуляторными нарушениями потенцирует ускоренный рост и раннее старение элементов фетоплацентарного комплекса.
Предпосылками для развития патологии также являются влияние повреждающих факторов окружающей среды (химических и вибрационных производственных вредностей, радиационных воздействий), наличие у беременной вредных привычек (курение, употребление психоактивных веществ). Нарушение чаще диагностируют у женщин с избыточной или недостаточной массой тела, низкой двигательной активностью и нерациональным питанием.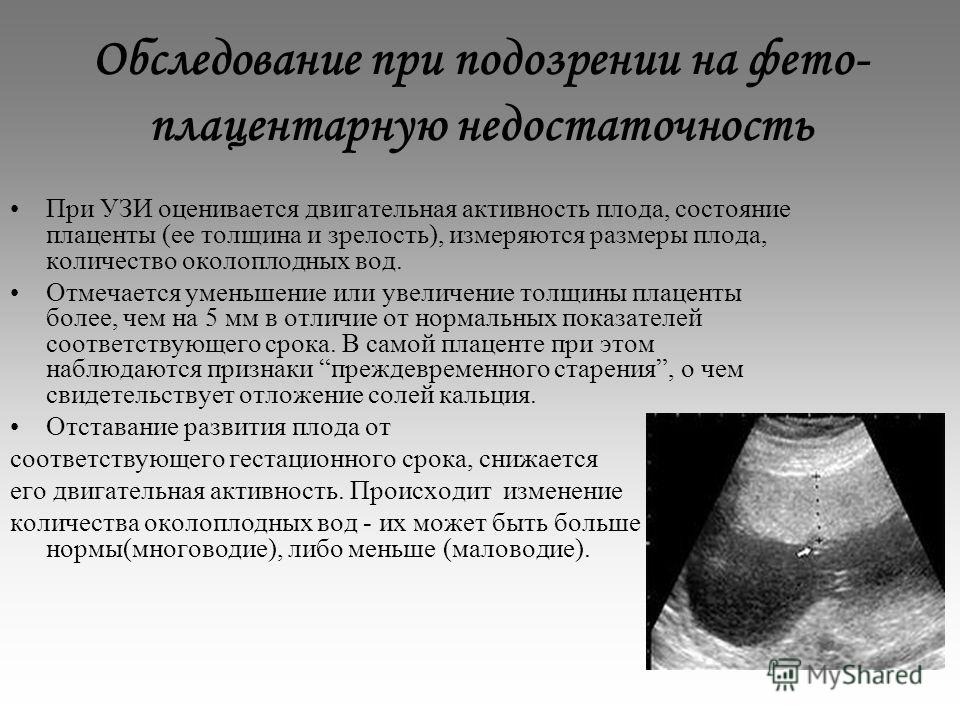
Патогенез
Преждевременное созревание плаценты является частью компенсаторных механизмов, возникающих при фетоплацентарной недостаточности и впоследствии усугубляющих ее течение. При увеличении потребностей плода в питательных веществах, угрозе его заражения инфекционными агентами, нарушениях микроциркуляции в маточно-плацентарном или фето-плацентарном комплексе формирование и рост детского места происходят более интенсивно, в результате ее ткани раньше достигают этапа, когда начинается их созревание, а потом и старение с образованием кист, кальцинатов, тромбозов, инфарктов. Как следствие, функциональные возможности плаценты уменьшаются, фетоплацентарная недостаточность нарастает.
Классификация
Систематизация стадий зрелости плаценты основана на особенностях ее физиологического развития, учитывает изменения структуры органа, характерные для определенных этапов беременности. О преждевременном созревании говорят в том случае, когда УЗИ-признаки очередной стадии зрелости определяются раньше существующего гестационного срока.
- 0 — нулевая (формирование). Длится со 2-й до 30-й недели гестации. Плацентарная ткань по мере роста ворсинчатого дерева постепенно увеличивается в массе и объеме, на УЗИ имеет гомогенную эхонегативную паренхиму без каких-либо включений.
- I — первая (рост). На 30-34-й неделях беременности в плаценте появляется небольшое количество эхогенных включений за счет коллагенизации стромы, наблюдается небольшая волнистость хориальной пластины, ткани начинают уплотняться.
- II — вторая (зрелость). К 35-39-й неделям гестационного срока усиливается волнистость хориальной мембраны, акустическая плотность повышена, в тканях определяется множество мелких эхопозитивных включений. Орган функционирует нормально.
- III — третья (старение). С 37-й недели беременности хориальная пластина становится извилистой, структура плаценты представлена округлыми плотными дольками с разрежением в центре. Обменная площадь и объем органа уменьшаются.

Созревание считается преждевременным, если признаки первой степени зрелости появляются до 27 недели гестации, второй степени — до 32 недели, третьей — до 36 недели. Подобная динамика развития свидетельствует о высокой вероятности возникновения функциональной недостаточности органа и декомпенсации адаптивных возможностей комплекса «мать-плод».
Симптомы преждевременного созревания плаценты
Изменения, происходящие при раннем старении в плацентарной ткани, клинически не определяются и могут быть обнаружены только инструментально. При отсутствии острых заболеваний, явного обострения хронических болезней или признаков осложнения беременности пациентка обычно не предъявляет каких-либо жалоб. В остальных случаях превалирует симптоматика основной патологии. При значительной плацентарной недостаточности, вызванной преждевременным созреванием тканей плаценты, возможно изменение двигательной активности плода — учащение шевелений и увеличение их интенсивности.
Осложнения
Поскольку старение детского места сопряжено со снижением его функциональных возможностей, патология обычно сопровождается появлением или усилением признаков плацентарной недостаточности. По данным наблюдений, декомпенсация нарушений в системе «плацента-плод» в 64% случаев вызвана именно преждевременным созреванием органа. Ретроспективные исследования свидетельствуют, что появление признаков ПСП на 22-26 неделях беременности практически всегда ассоциировано с выраженной задержкой развития плода и внутриутробной гипоксией в начале III триместра. В крайних случаях патология приводит к антенатальной гибели ребенка. При раннем начале дистрофических и склеротических процессов чаще наблюдаются преждевременная отслойка плаценты, досрочное излитие околоплодных вод и преждевременные роды.
Диагностика
Обнаружение при УЗИ-скрининге изменений, типичных для преждевременного созревания плаценты, является основанием для выполнения комплексной оценки состояния фетоплацентарной системы с последующим тщательным мониторингом беременности.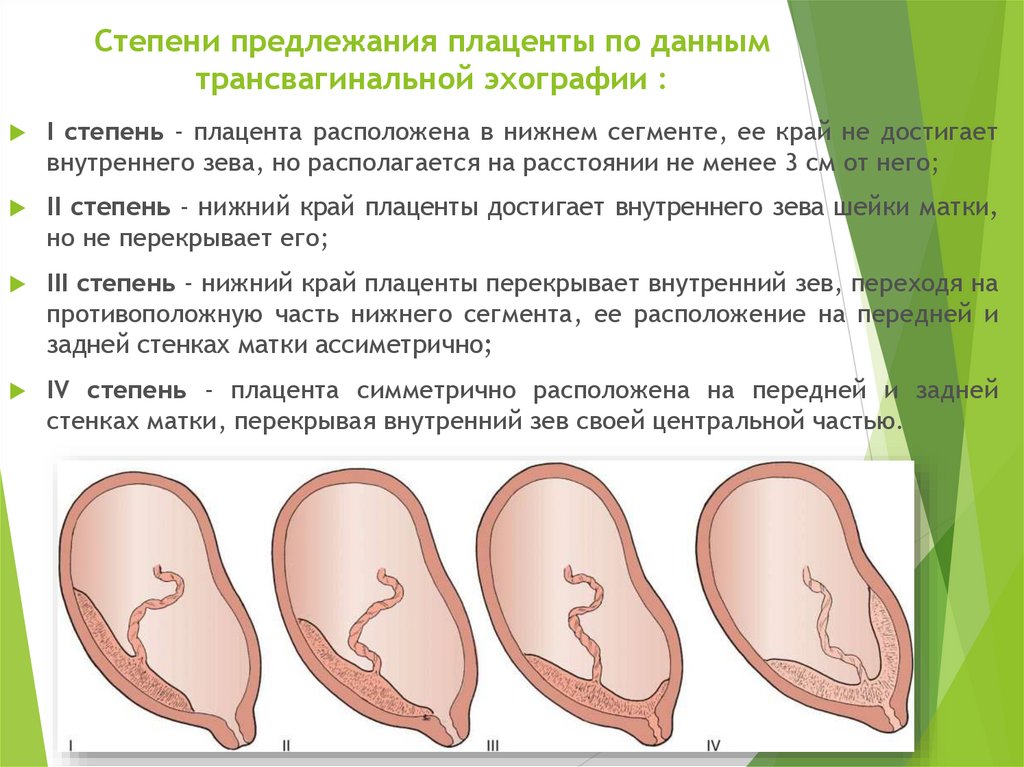 Основные мероприятия направлены на выявление структурных изменений и оценку функциональных возможностей органа. Наиболее ценными в диагностическом плане являются:
Основные мероприятия направлены на выявление структурных изменений и оценку функциональных возможностей органа. Наиболее ценными в диагностическом плане являются:
- УЗИ матки, плаценты и плода. Метод признан «золотым стандартом» диагностики, позволяет определить толщину плацентарной ткани, обнаружить характерные структурные изменения, свидетельствующие об уплотнении детского места, его структуризации на дольки, появлении кист, отложений солей, участков с нарушенным кровоснабжением.
- Допплерометрия маточно-плацентарного кровотока. Отражение ультразвука кровью, которая движется в сосудах плаценты, зависит от скорости кровотока в системе. С помощью допплерограммы легко оценивать как количественные показатели кровоснабжения, так и качественные характеристики, косвенно свидетельствующие о состоянии сосудов.
С учетом высокого риска развития фетоплацентарной недостаточности необходимо обеспечить контроль роста ребенка при помощи фетометрии, КТГ, фонокардиографии плода. Поскольку преждевременные дистрофические изменения плаценты обычно является вторичными и провоцируется другими расстройствами, важно определить основную патологию. С этой целью рекомендована лабораторная диагностика инфекционных процессов — исследование мазка, микробиологический анализ посева на питательные среды, РИФ, ИФА, ПЦР, TORCH-комплекс, консультации смежных специалистов — уролога, эндокринолога, терапевта, кардиолога, инфекциониста, дерматолога, ревматолога, иммунолога, гематолога и др. Дифференциальная диагностика проводится с инфарктами детского места, кальцинатами, его гиперплазией и новообразованиями (хориоангиомой, пузырным заносом).
Поскольку преждевременные дистрофические изменения плаценты обычно является вторичными и провоцируется другими расстройствами, важно определить основную патологию. С этой целью рекомендована лабораторная диагностика инфекционных процессов — исследование мазка, микробиологический анализ посева на питательные среды, РИФ, ИФА, ПЦР, TORCH-комплекс, консультации смежных специалистов — уролога, эндокринолога, терапевта, кардиолога, инфекциониста, дерматолога, ревматолога, иммунолога, гематолога и др. Дифференциальная диагностика проводится с инфарктами детского места, кальцинатами, его гиперплазией и новообразованиями (хориоангиомой, пузырным заносом).
Лечение преждевременного созревания плаценты
Основными врачебными задачами при ведении беременной с ПСП являются коррекция расстройств, вызвавших патологию, нормализация кровообращения в маточно-плацентарной системе, выбор оптимального способа и времени родоразрешения. Тактика ведения пациентки на дородовом этапе определяется сроком, на котором было диагностировано преждевременное старение:
- Раннее выявление ПСП.
 Обнаружение обменно-дистрофических изменений плацентарной ткани на 20-24 неделях является показанием для обследования в специализированном отделении патологии беременности. В таких случаях, начиная с 26 недели гестации, допплометрический контроль кровотока выполняется не реже 1 раза в неделю, ежедневно подсчитываются движения плода. Срочное родоразрешение при критических нарушениях тока крови в пуповине, КТГ-признаках гипоксии плода, остановке его роста, резком уменьшении объема околоплодных вод, появлении других признаков угрозы ребенку может выполняться даже на сроке 31-33 недели.
Обнаружение обменно-дистрофических изменений плацентарной ткани на 20-24 неделях является показанием для обследования в специализированном отделении патологии беременности. В таких случаях, начиная с 26 недели гестации, допплометрический контроль кровотока выполняется не реже 1 раза в неделю, ежедневно подсчитываются движения плода. Срочное родоразрешение при критических нарушениях тока крови в пуповине, КТГ-признаках гипоксии плода, остановке его роста, резком уменьшении объема околоплодных вод, появлении других признаков угрозы ребенку может выполняться даже на сроке 31-33 недели. - Выявление ПСП в III триместре. Согласно результатам исследований, при обнаружении процесса преждевременного старения плаценты на 32-34 и, тем более, 35-37 неделях гестационного срока вероятность патологического течения беременности существенно снижается. Однако для своевременного выявления осложнений необходимо обеспечить регулярное проведение УЗИ и наблюдение специалиста. Предпочтительным методом родоразрешения являются естественные роды.
 Лишь в тех случаях, когда ПСП сочетается со значительной задержкой развития плода, для профилактики острого дистресс-синдрома у ребенка показано кесарево сечение.
Лишь в тех случаях, когда ПСП сочетается со значительной задержкой развития плода, для профилактики острого дистресс-синдрома у ребенка показано кесарево сечение.
Независимо от сроков выявления преждевременного созревания ткани плаценты акушер-гинеколог или профильный специалист активно лечат основное генитальное или экстрагенитальное заболевание с использованием антибиотиков, гормонотерапии, иммуннокорректоров, сердечно-сосудистых и других медикаментозных средств. Параллельно с коррекцией ведущего расстройства назначают препараты для улучшения кровоснабжения плода — сосудорасширяющие препараты, антиагреганты, аминокислотные комплексы, эссенциальные фосфолипиды. Лекарственная терапия дополняется немедикаментозными методами — рациональной двигательной активностью, коррекцией диеты, нормализацией режима сна и отдыха.
Прогноз и профилактика
Своевременный скрининг и правильная врачебная тактика позволяют снизить риски фетоплацентарной недостаточности при старении плаценты, замедлить этот процесс и пролонгировать беременность до безопасных для рождения ребенка сроков. Первичная профилактика предполагает планирование беременности пациентками с генитальными и экстрагенитальными заболеваниями, защищенный секс для предохранения от специфических инфекций, обоснованное назначение инвазивных гинекологических процедур, отказ от курения, употребления алкоголя и наркотиков. Во время гестации для нормального развития плаценты важно позаботиться о защите от возможного заражения ОРВИ и другими инфекционными болезнями, поддержании уровня гемоглобина, достаточной двигательной активности и рациональной диете. Вторичная профилактика направлена на раннюю диагностику расстройства, включает своевременную постановку на учет в женской консультации, регулярное прохождение плановых осмотров и УЗИ.
Первичная профилактика предполагает планирование беременности пациентками с генитальными и экстрагенитальными заболеваниями, защищенный секс для предохранения от специфических инфекций, обоснованное назначение инвазивных гинекологических процедур, отказ от курения, употребления алкоголя и наркотиков. Во время гестации для нормального развития плаценты важно позаботиться о защите от возможного заражения ОРВИ и другими инфекционными болезнями, поддержании уровня гемоглобина, достаточной двигательной активности и рациональной диете. Вторичная профилактика направлена на раннюю диагностику расстройства, включает своевременную постановку на учет в женской консультации, регулярное прохождение плановых осмотров и УЗИ.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении преждевременного созревания плаценты.
Источники
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Чечнева М.А. • Мезенхимальная дисплазия плаценты
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Мезенхимальная дисплазия плаценты (МДП), или плацентарная мезенхимальная гиперплазия, — редкая аномалия стволовых ворсинок плаценты, характеризуется плацентомегалией, кистозной дилатацией и образованием везикул, сосудистыми аномалиями.
Впервые МДП описана как гиперплазия стволовых ворсин плаценты у беременных с высоким уровнем α-фетопротеина в сочетании с крупной плацентой и эхографическими признаками частичного пузырного заноса.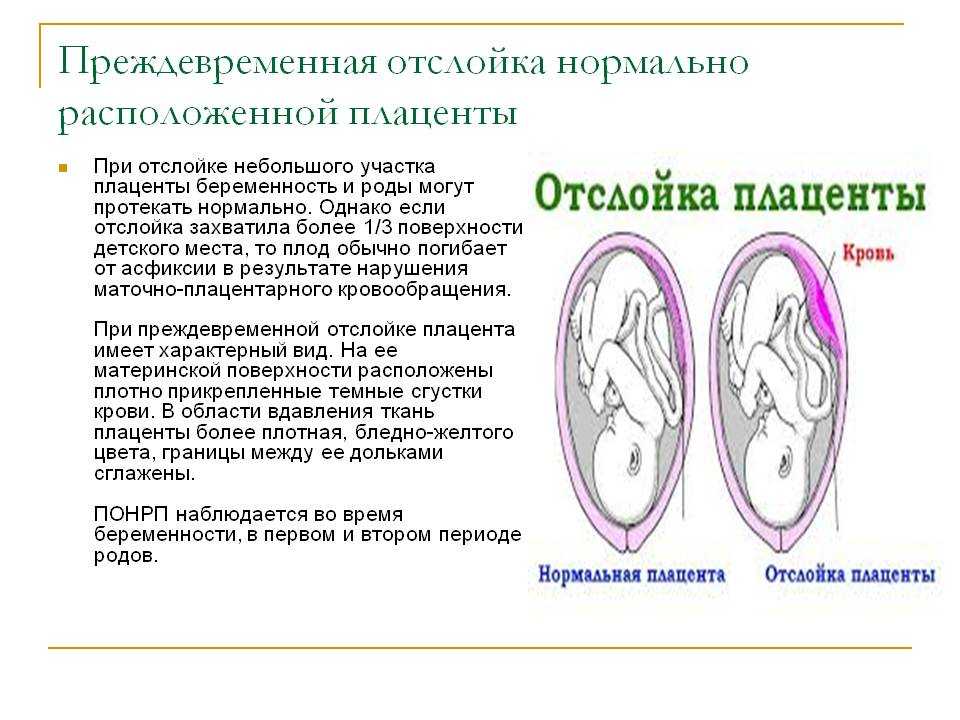 При гистологическом исследовании отсутствовали признаки пролиферации трофобласта, что исключало диагноз частичного пузырного заноса [1]. M. Arizawa и соавт. определили частоту встречаемости данной патологии — 0,02% (7 случаев среди 30 758 плацент более чем за 21 год) [3]. Кроме того, считается, что частота встречаемости МДП занижена и причина гиподиагностики в том, что морфологическая картина до сих пор остается незнакома многим патологоанатомам.
При гистологическом исследовании отсутствовали признаки пролиферации трофобласта, что исключало диагноз частичного пузырного заноса [1]. M. Arizawa и соавт. определили частоту встречаемости данной патологии — 0,02% (7 случаев среди 30 758 плацент более чем за 21 год) [3]. Кроме того, считается, что частота встречаемости МДП занижена и причина гиподиагностики в том, что морфологическая картина до сих пор остается незнакома многим патологоанатомам.
В настоящее время рассматривается несколько теорий возникновения МДП. По одной из них — это врожденный порок развития мезодермы. Эта теория основана на наблюдениях мезенхимальных стволовых гиперплазий ворсинок параллельно с пролиферативными нарушениями плаценты, такими как хорионангиома, дилатация хорионических сосудов, а также гемангиомами плода [3].
Другая, андрогенетическая, теория говорит о том, что МДП — результат эндоредупликации гаплоидного отцовского генома. В этом случае этиология МДП близка к механизму развития полного пузырного заноса. Около 75% случаев полного пузырного заноса возникают от оплодотворения безъядерной яйцеклетки гаплоидным сперматозоидом, которая впоследствии подвергается эндоредупликации, в остальных случаях происходит оплодотворение двумя сперматозоидами. При имплантации таких эмбрионов формируются кистозный отек ворсины хориона, трофобластическая гиперплазия и анэмбриония [4].
Около 75% случаев полного пузырного заноса возникают от оплодотворения безъядерной яйцеклетки гаплоидным сперматозоидом, которая впоследствии подвергается эндоредупликации, в остальных случаях происходит оплодотворение двумя сперматозоидами. При имплантации таких эмбрионов формируются кистозный отек ворсины хориона, трофобластическая гиперплазия и анэмбриония [4].
Некоторые случаи МДП обусловлены триплоидией, хотя в большинстве зарегистрированных случаев плоды имели нормальный женский кариотип 46,ХХ. На сегодняшний день из описанных в литературе случаев соотношение женского и мужского кариотипа плодов составляет 3,6: 1 [2].
Также в качестве патогенетического механизма формирования МДП рассматриваются гипоксия и гипоперфузии различной этиологии. Считается, что во время гипоксии происходит стимуляция фибробластов, что ведет к увеличению массы соединительной ткани с последующим увеличением производства сосудистого эндотелиального фактора роста (VEGFs), ведущего к ангиогенезу.
По данным ряда авторов, данная патология плаценты часто сочетается с пороками развития плода и имеет неблагоприятный исход. Клиническими проявлениями МДП могут быть задержка внутриутробного роста плода, антенатальная гибель, некоторые хромосомные аномалии, синдром Беквита-Видемана, транзиторный неонатальный сахарный диабет, отцовская однородительская дисомия 6, трисомия 13 и синдром Клайнфелтера [5-7].
Клиническими проявлениями МДП могут быть задержка внутриутробного роста плода, антенатальная гибель, некоторые хромосомные аномалии, синдром Беквита-Видемана, транзиторный неонатальный сахарный диабет, отцовская однородительская дисомия 6, трисомия 13 и синдром Клайнфелтера [5-7].
В 23% случаев МДП сочетается с синдромом Беквита-Видемана. В большинстве случаев данный синдром возникает спорадически и имеет аутосомно-доминантный тип наследования. Предполагается, что данное заболевание может возникать вследствие перестроек, вовлекающих участок короткого плеча хромосомы 11 р15. Выявление макросомии, омфалоцеле и макроглоссии в сочетании с нормальным кариотипом позволяет диагностировать синдром Беквита-Видемана. С различной частотой обнаруживаются нефромегалия, гепатомегалия, многоводие, складки мочек уха, диафрагмальная грыжа и пороки сердца [5, 6]. Гиперплазия клеток поджелудочной железы встречается в 30-50% случаев, вызывает повышение уровня инсулина и неонатальную гипогликемию, манифестирующую на 2-й или 3-й день жизни [7].
МДП не имеет специфических клинических проявлений. В большинстве случаев в начале беременности диагностируется при ультразвуковом исследовании (УЗИ) в скрининговые сроки и первично обозначается как частичный пузырный занос, в отличие от которого большинство плодов имеют нормальный кариотип, уровень β-ХГЧ на протяжении всей беременности несколько повышен или остается в пределах нормы, уровень α-фетопротеина повышен [8].
Многие случаи протекают бессимптомно и диагностируются после родов на основании морфологического исследования гиперплазированной плаценты. Макроскопически плацента с МДП представляет собой увеличенную по объему и массе плаценту с чередованием кистозных структур и нормальной паренхимы. Кистозные структуры представляют собой кистозные расширения вен стволовых ворсин. Иногда возникают тромбозы и аневризмы, расширение стволовых сосудов ворсин. Сосуды на плодовой части плаценты извиты и расширены. Гистологически для МДП характерны увеличенные отечные стволовые ворсины с расширенными сосудами и отсутствием трофобластической пролиферации. Сосуды толстостенные, с фибромускулярной гиперплазией. Терминальные ворсины, как правило, нормальные. В отличие от пузырного заноса ворсины обычно хорошо васкуляризированы и не имеют признаков пролиферации трофобласта [4, 7].
Сосуды толстостенные, с фибромускулярной гиперплазией. Терминальные ворсины, как правило, нормальные. В отличие от пузырного заноса ворсины обычно хорошо васкуляризированы и не имеют признаков пролиферации трофобласта [4, 7].
По литературным данным, ультразвуковая картина МДП похожа на частичный пузырный занос — утолщенная плацента с гипоэхогенными включениями. В других случаях описано несколько маленьких анэхогенных включений в ткани плаценты, не имеющих клинического значения. Бесспорно, что диффузный процесс требует тщательного мониторинга беременности. Выявление при УЗИ гиперплазированной кистозной плаценты вместе с фенотипически неизмененным плодом крайне маловероятно при пузырном заносе и заставляет предположить МДП. Дифференциальную диагностику необходимо проводить также с хорионангиомой и субхорионической гематомой [9,10].
Приводим 4 законченных наблюдения беременности при МДП.
Клиническое наблюдение 1
Пациентка Ш., 32 лет. Беременность повторная, в анамнезе срочные самопроизвольные роды без осложнений. Направлена в поликлинику МОНИИАГ с подозрением на частичный пузырный занос. При УЗИ в 15 нед выявлено утолщение плаценты до 32 мм, примерно 1/3 площади плаценты с измененной структурой — множественными мелкими гипо- и анэхогенными включениями размером до 3 мм (рис. 1). Маркеров хромосомных аномалий и пороков развития плода не выявлено. Уровень ХГЧ в пределах нормы. Заключение УЗИ: беременность 15 нед, частичный пузырный занос. Учитывая отсутствие аномалий развития плода, принято решение о пролонгировании беременности. Течение беременности осложнилось задержкой внутриутробного роста плода. Проводилась стандартная терапия вазоактивными препаратами. Родоразрешена при беременности 37 нед, произошли самопроизвольные роды, родилась девочка с массой тела 2800 г, ростом 46 см, что соответствует гипотрофии плода I степени, с оценкой по шкале Апгар 8-9 баллов. Кровопотеря в родах 350 мл. Послеродовый период протекал без осложнений.
Направлена в поликлинику МОНИИАГ с подозрением на частичный пузырный занос. При УЗИ в 15 нед выявлено утолщение плаценты до 32 мм, примерно 1/3 площади плаценты с измененной структурой — множественными мелкими гипо- и анэхогенными включениями размером до 3 мм (рис. 1). Маркеров хромосомных аномалий и пороков развития плода не выявлено. Уровень ХГЧ в пределах нормы. Заключение УЗИ: беременность 15 нед, частичный пузырный занос. Учитывая отсутствие аномалий развития плода, принято решение о пролонгировании беременности. Течение беременности осложнилось задержкой внутриутробного роста плода. Проводилась стандартная терапия вазоактивными препаратами. Родоразрешена при беременности 37 нед, произошли самопроизвольные роды, родилась девочка с массой тела 2800 г, ростом 46 см, что соответствует гипотрофии плода I степени, с оценкой по шкале Апгар 8-9 баллов. Кровопотеря в родах 350 мл. Послеродовый период протекал без осложнений.
Рис. 1. Пациентка Ш. Структурные изменения плаценты.
а) 15 недель беременности.
б) 37 недель беременности.
Диагностика МДП проведена при гистологическом исследовании плаценты.
Клиническое наблюдение 2
Пациентка И., 29 лет. Данная беременность вторая. В I триместре скрининговое УЗИ не проводилось. Со слов пациентки при УЗИ, проведенном в 18 нед беременности, возникли подозрения на пузырный занос, в связи с чем консультирована в Российском онкологическом научном центре им. Н.Н. Блохина. Наличие трофобластической болезни не подтверждено. Уровень β-ХГЧ в пределах нормы: 23 335 МЕ/л (10 000-35 000 МЕ/л).
В МОНИИАГ находилась под наблюдением с 20 нед гестации. Данные УЗИ: размеры плода соответствуют 20 нед беременности. Пороки развития и признаки гипотрофии плода не обнаружены. Плацента расположена по передней стенке матки, размерами 145-147 мм, толщиной до 50 мм. Структура плаценты изменена, имеется множество округлых жидкостных включений различного диаметра — от 4 до 12 мм с четкими ровными границами. В структуре плацентарной ткани множественные локусы кровотока. Архитектоника сосудов плаценты не изменена. Кровоток в миометрии сохранен, архитектоника сосудов не изменена. Плодовоплацентарный кровоток не нарушен. Заключение: ультразвуковая картина соответствует МДП (рис. 2-4).
В структуре плацентарной ткани множественные локусы кровотока. Архитектоника сосудов плаценты не изменена. Кровоток в миометрии сохранен, архитектоника сосудов не изменена. Плодовоплацентарный кровоток не нарушен. Заключение: ультразвуковая картина соответствует МДП (рис. 2-4).
Рис. 2. Пациентка И. МДП. Диффузное утолщение и множественные кистозные включения в плаценте.
Рис. 3. Сосудистое дерево при МДП. Архитектоника базальных и спиральных артерий не нарушена.
Рис. 4. Сосудистое дерево при МДП. Расширенные сосуды стволовых ворсин.
В течение II триместра выявлена сочетанная тромбофилия по гену MTGFR и фактору Leiden. Уровень гомоцистеина в пределах нормы. Маркеров АФС не выявлено.
УЗИ при сроке гестации 36-37 нед: размеры плода соответствуют 36,6 нед беременности. Признаки гипотрофии и пороки развития плода не обнаружены. Плодовоплацентарный кровоток не нарушен. Количество околоплодных вод в пределах нормы. Плацента расположена по передней стенке матки, толщиной до 78 мм, II степени зрелости. Структура плаценты гиперэхогенная, множественные жидкостные включения до 1 см в диаметре, сосуды плаценты расширены. Гормоны фетоплацентарного комплекса в пределах нормы. Уровень ХГЧ — 8 533 МЕ/л (норма 8 880-29 000 МЕ/л).
Структура плаценты гиперэхогенная, множественные жидкостные включения до 1 см в диаметре, сосуды плаценты расширены. Гормоны фетоплацентарного комплекса в пределах нормы. Уровень ХГЧ — 8 533 МЕ/л (норма 8 880-29 000 МЕ/л).
Самопроизвольные роды произошли в сроке 38 нед. Родилась живая доношенная девочка с массой тела 2710 г, ростом 47 см, что соответствует гипотрофии I степени, без видимых пороков развития, с оценкой состояния по шкале Апгар 8 и 9 баллов. Кровопотеря в родах 300 мл. Послеродовый период протекал без осложнений.
Масса плаценты 1498 г (медиана 445 г), размерами 28 х 27 см, с краевым прикреплением пуповины. Диск толщиной до 7 см, хориальная пластинка с извитыми, резко полнокровными сосудами, крупными очагами субхориального фибриноида. Материнская поверхность с нарушенной целостностью, в краевых отделах кисты с прозрачным содержимым диаметром до 1,5 см. В крае плаценты обширный очаг инфаркта (18 х 9 см), толщина плаценты в этой области не превышает 1 см. На разрезе ткань с многочисленными широкими белесоватыми прослойками, единичными кистами (рис. 5).
5).
Рис. 5. МДП, макроскопическая картина.
а) Фрагмент ткани плаценты с пузырьковидными ворсинами.
б) Крупные извитые сосуды, окруженные желеобразным материалом, кистозные полости, обилие фибриноида.
При микроскопическом исследовании плаценты определяются крупные стволовые ворсины с отечной, рыхлой стромой, местами с образованием полостей (рис. 6). Сосуды в пораженных ворсинах разного диаметра, нередко причудливо извитые. Наблюдаются разнообразные поражения сосудов: облитерационная ангиопатия, тромбоз, нередко с организацией, геморрагический эндоваскулит. Встречаются группы фиброзированных бессосудистых ворсин. Васкуляризация промежуточных и терминальных ворсин неравномерная, местами определяется ангиоматоз. Трофобластическая выстилка без признаков пролиферации. Гистологическое заключение: МДП.
Рис. 6. МДП, микроскопическая картина.
а) Резкий отек стволовых ворсин с образованием полостей. х200. Окраска гематоксилином и эозином.
б) Промежуточные и терминальные ворсины обычного вида рядом с отечной стволовой ворсиной. х100. Окраска гематоксилином и эозином.
в) Извитой, расширенный сосуд стволовой ворсины. х200. Иммуногистохимическая реакция с антителами к CD31.
г) Отечная стволовая ворсина с формированием полостей, в сохранной строме видны многочисленные сосуды разного диаметра. х100. Иммуногистохимическая реакция с антителами к CD31.
Клиническое наблюдение 3
Пациентка Ф., 26 лет. Данная беременность первая. В 12 нед при проведении генетического скрининга заподозрены патология хориона?, пузырный занос? Консультирована в медико-генетическом отделении МОНИИАГ: беременность 12 нед 4 дня, аномалия хориона?, частичный пузырный занос?, МДП? При УЗИ в 21 нед гестации: плацента перекрывает внутренний зев с множественными кистозными образованиями. Проводилось обследование на наличие генетических маркеров тромбофилии, выявлена сочетанная тромбофилия по гену MTGFR и PAI — I. Уровень ХГЧ составил 52 624 МЕ/л, α-фетопротеина — 194,0 МЕ/л.
Уровень ХГЧ составил 52 624 МЕ/л, α-фетопротеина — 194,0 МЕ/л.
С 25-26 нед гестации выявлена задержка внутриутробного роста плода I степени, асимметричного типа. Плодово-пла центарный кровоток не нарушен. Плацента «0» степени зрелости, толщиной 33 мм (больше нормы), с множественными кистозными образованиями, перекрывает внутренний зев. При исследовании уровня гормонов фетоплацентарного комплекса в 30 нед гестации плацентарный лактоген, прогестерон, кортизол и α-фетопротеин находились в пределах нормативных значений.
При УЗИ в 31 нед значение бипариетального размера соответствует 10-му перцентилю, ДГ ДЖ — 3-му перцентилю, масса плода — 10-му перцентилю, что характерно для задержки внутриутробного роста плода I степени. Плацента по передней стенке матки толщиной до 47-63 мм, III степени зрелости. Особенности строения плаценты: примерно 1/3 плаценты по левому краю со структурными изменениями: множественные жидкостные включения размером до 4-5 мм, кровоток определяется, архитектоника сосудистого дерева не изменена. Прикрепление пуповины к неизмененной части плаценты. Заключение: беременность 31 нед. Головное предлежание. Синдром задержки роста плода I степени. МДП. Умеренное многоводие (рис. 7).
Прикрепление пуповины к неизмененной части плаценты. Заключение: беременность 31 нед. Головное предлежание. Синдром задержки роста плода I степени. МДП. Умеренное многоводие (рис. 7).
Рис. 7. Пациентка Ф. МДП. Кистозные включения в структуре утолщенной плаценты.
Течение беременности осложнилось присоединением умеренной преэклампсии. Несмотря на проводимую терапию, отмечено нарастание симптомов преэклампсии, появились нарушения плодовой гемодинамики. При сроке гестации 36 нед пациентка родоразрешена путем кесарева сечения. Извлечена живая недоношенная девочка с массой тела 1950 г, ростом 44 см, что соответствовало задержке внутриутробного роста II степени, гипотрофии II степени. Оценка состояния по шкале Апгар 7 и 8 баллов. Операция протекала без технических сложностей. Кровопотеря составила 800 мл.
Масса плаценты нормальная (409 г при медиане 408 г). Диск толщиной 5-7 см, хориальная пластинка с извитыми, резко полнокровными сосудами, крупными очагами субхориального фибриноида. Материнская поверхность с ненарушенной целостностью, в краевых отделах кисты с прозрачным содержимым диаметром до 1,5 см с изменениями ворсинчатого дерева и выраженными гемореологическими изменениями — некрозом больших групп ворсин и облитерацией фибрином не менее 1/3 объема плацентарного диска. Гистологическое заключение: МДП.
Материнская поверхность с ненарушенной целостностью, в краевых отделах кисты с прозрачным содержимым диаметром до 1,5 см с изменениями ворсинчатого дерева и выраженными гемореологическими изменениями — некрозом больших групп ворсин и облитерацией фибрином не менее 1/3 объема плацентарного диска. Гистологическое заключение: МДП.
Клиническое наблюдение 4
Пациентка О., 28 лет. Направлена в поликлинику МОНИИАГ с подозрением на частичный пузырный занос. При исследовании в МОНИИАГ размеры плода соответствуют 14-15 нед беременности, маркеров хромосомных аномалий и пороков развития плода не выявлено. Плацента расположена по передней стенке матки толщиной 28 мм.
Выявлены массивные структурные изменения плаценты: множественные жидкостные включения различного диаметра — от 4 до 12 мм, округлые, анэхогенные, с ровными четкими контурами. Кровоток в миометрии выраженный, в структуре плацентарной ткани множественные локусы кровотока, сосуды крупного диаметра, сосудистое дерево, архитектоника сосудов сохранены. Плодовая гемодинамика не нарушена.
Плодовая гемодинамика не нарушена.
Заключение: беременность 13-14 нед. Структурные изменения плаценты — нельзя исключить МДП. Дифференциальная диагностика с пузырным заносом после получения анализа крови на β-ХГЧ (рис. 8, 9).
Рис. 8. Пациентка О. Структурные изменения плаценты при МДП.
Рис. 9. Пациентка О. Сосудистая архитектоника при МДП.
Повышение уровня β-ХГЧ послужило основанием для направления пациентки для консультации в центр трофобластической болезни, где она наблюдалась до 33 нед, проводилась дифференциальная диагностика между множественными хорионангиомами плаценты и дистрофическими изменениями в плаценте. Четких данных о наличии трофобластической болезни не было выявлено, несмотря на значительное повышение уровня β-ХГЧ (103 000 ед. при норме до 78 100 ед.).
УЗИ, проведенное в МОНИИАГ в 33 нед: размеры плода соответствуют 31,2 нед беременности. Предполагаемая масса 1800-1900 г. Аномалий развития не выявлено. Размеры и масса плода соответствуют 25-50-му перцентилю для данного срока, задержки внутриутробного роста не выявлено. Плацента по передней стенке матки толщиной от 40 до 52 мм, III степени зрелости. Особенности строения плаценты: в правой части плацента более эхогенная, в структуре единичные анэхогенные участки неправильной формы, кровоток обычный, сосудистая архитектоника не изменена, кровоток в спиральных артериях прослеживается, индекс резистентности (ИР) 0,36, систолодиастолическое отношение (С/Д) 1,57. Ультразвуковая картина данной части плаценты не типична для пузырного заноса, не типична для III степени зрелости, не имеет признаков хорионангиомы. На остальном протяжении плацента утолщена, структура более характерна для III степени зрелости — определяются граница котиледонов, в центре котиледона — анэхогенная зона с гиперэхогенным кольцевидным участком по периферии. Сосудистая архитектоника не изменена, кровоток в спиральных артериях прослеживается, ИР 0,31, С/Д 1,45. Заключение: беременность 33 нед. Головное предлежание. Диффузное утолщение плаценты. Структурные изменения плаценты не типичны для хорионангиомы, не позволяют дифференцировать частичный пузырный занос и мезенхимальную дисплазию.
Плацента по передней стенке матки толщиной от 40 до 52 мм, III степени зрелости. Особенности строения плаценты: в правой части плацента более эхогенная, в структуре единичные анэхогенные участки неправильной формы, кровоток обычный, сосудистая архитектоника не изменена, кровоток в спиральных артериях прослеживается, индекс резистентности (ИР) 0,36, систолодиастолическое отношение (С/Д) 1,57. Ультразвуковая картина данной части плаценты не типична для пузырного заноса, не типична для III степени зрелости, не имеет признаков хорионангиомы. На остальном протяжении плацента утолщена, структура более характерна для III степени зрелости — определяются граница котиледонов, в центре котиледона — анэхогенная зона с гиперэхогенным кольцевидным участком по периферии. Сосудистая архитектоника не изменена, кровоток в спиральных артериях прослеживается, ИР 0,31, С/Д 1,45. Заключение: беременность 33 нед. Головное предлежание. Диффузное утолщение плаценты. Структурные изменения плаценты не типичны для хорионангиомы, не позволяют дифференцировать частичный пузырный занос и мезенхимальную дисплазию.
Родоразрешена при беременности 37 нед, произошли самопроизвольные роды, протекали без осложнений. Родился живой доношенный мальчик с массой тела 2850 г, ростом 47 см, что соответствует гипотрофии плода I степени, оценка по шкале Апгар 8-9 баллов. Течение послеродового периода без осложнений.
Масса плаценты составила 714 г (более 97-го перцентиля, медиана 430 г). Макроско пическое и микроскопическое исследование подтвердило МДП.
Выводы
На основании немногочисленных наблюдений МДП можно сформулировать некоторые положения, касающиеся диагностики и течения беременности при этой редкой патологии.
- Наиболее значимым методом диагностики МДП в настоящее время можно считать лучевые методы, в частности УЗИ. Ультразвуковая картина мезенхимальной дисплазии плаценты достаточно характерна и заключается в диффузном утолщении плаценты, множественных кистозных полостях, занимающих часть плаценты или всю площадь плаценты. Кистозные полости при МДП имеют существенные отличия от частичного пузырного заноса: размеры кист позволяют дифференцировать их в виде отдельных округлых анэхогенных структур с ровными четкими контурами, гладкой внутренней поверхностью.
 Морфологическая основа кистозных включений в плацентарной ткани — резкий отек стволовых ворсин с образованием полостей. Архитектоника сосудистой сети не нарушена, топография плацентарных сосудов соответствует строению нормальной сосудистой сети плаценты. Извитые, расширенные сосуды стволовых ворсин могут четко определяться при ЦДК.
Морфологическая основа кистозных включений в плацентарной ткани — резкий отек стволовых ворсин с образованием полостей. Архитектоника сосудистой сети не нарушена, топография плацентарных сосудов соответствует строению нормальной сосудистой сети плаценты. Извитые, расширенные сосуды стволовых ворсин могут четко определяться при ЦДК. - При подозрении на частичный пузырный занос и отсутствии аномалий развития плода можно предполагать МДП, возможно пролонгирование беременности. При МДП уровень β-ХГЧ не всегда соответствует норме для данного срока гестации, а уровень α-фетопротеина не всегда имеет высокие значения, следовательно, ни уровень β-ХГЧ, ни уровень α-фетопротеина не играют решающей роли в постановке диагноза.
- Для течения беременности при МДП характерно формирование плацентарной недостаточности, задержки внутриутробного роста плода. Но не только наличие структурных изменений в плаценте определяет формирование осложнений беременности.
 Ведение беременности, определение сроков и методов родоразрешения должны проводиться по акушерским показаниям с учетом сопутствующей экстрагенитальной и акушерской патологии.
Ведение беременности, определение сроков и методов родоразрешения должны проводиться по акушерским показаниям с учетом сопутствующей экстрагенитальной и акушерской патологии. - При удовлетворительном состоянии плода и отсутствии противопоказаний со стороны матери возможно ведение родов через естественные родовые пути. Ни в одном наблюдаемом случае структурные изменения плаценты не привели к нарушению сократительной деятельности матки в родах или послеродовом периоде, кровопотеря не превысила физиологическую.
Литература
- Moscoso G., Jauniaux E., Hustin J. Placental vascular anomaly with diffuse mesenchymal stem villous hyperplasia: a new clinico-pathological entity? // Pathol Res Pract. 1991; 187 (2-3): 324-328.
- Arigita M., Illa M., Nadal A., Badenas C., Soler A., Alsina N., Borrell A. Chorionic villus sampling in the prenatal diagnosis of placental mesenchymal dysplasia // Ultrasound Obstet Gynecol.
 2010; 36: 644-646.
2010; 36: 644-646. - Arizawa M., Nakayama M. Suspected involvement of the X chromosome in placental mesenchymal dysplasia // Congenit Anom (Kyoto). 2002; 42: 309-317.
- Kaiser-Rogers К.A., McFadden D.E., Livasy C.A., Dansereau J., Jiang R., Knops J.F. Androgenetic/ biparental mosaicism causes placental mesenchymal dysplasia // J Med Genet. 2006; 43: 187-192.
- H’mida D., Gribaa M., Yacoubi T. et al. Placental mesenchymal dysplasia with Beck-Wiedemann syndrome fetus in the context of biparental and androgenic cell lines // Placenta. 2008; 29 (5): 454-460.
- Armes J., McGown I., Williams M. et al. The placenta in Beckwith-Wiedemann syndrome: genotype-phenotype associations, excessive extravillous trophoblast and placental mesenchymal dysplasia // Roy Coll Pathol Aust. 2012; 44 (6): 1-9. 7. Aviram R., Kidron D., Silverstein S. Placental mesenchymal dysplasias associated with transient neonatal diabetes mellitus and paternal UPD6 // Placenta.
 2008; 29 (7): 646-649.
2008; 29 (7): 646-649. - Nayeri U.A., West A.B., Grossetta Nardini H.K., Copel J.A., Sfakianaki A.K. Systematic review of sonographic findings of placental mesenchymal dysplasia and subsequent pregnancy outcome // Ultrasound Obstet Gynecol. 2013; 41 (Issue 4): 366-374.
- Hui Li, Lei Li, Xiao Tang, Fan Yang, Kai-Xuan Yang. Placental mesenchymal dysplasia: a case of a normal-appearing fetus with intrauterine growth restriction. Case Report // Int J Clin Exp Pathol. 2014; 7 (8): 5302-5307.
- Павлов К.А., Дубова Е.А., Щеголев А.И. Мезенхимальная дисплазия плаценты // Акушерство и гинекология. 2010. 5: 15-20.
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Взаимосвязь плацентарной степени, зрелости легких плода и неонатального исхода при нормальной и осложненной беременности
. 1984 г., 1 января; 148 (1): 54-8.
doi: 10.1016/s0002-9378(84)80032-0.
Г. М. Каззи, Т. Л. Гросс, М. Г. Розен, Н. Ю. Джаауль-Каззи
- PMID: 6691381
- DOI: 10.1016/s0002-9378(84)80032-0
Г. М. Каззи и др. Am J Obstet Gynecol. .
. 1984 г., 1 января; 148 (1): 54-8.
doi: 10. 1016/s0002-9378(84)80032-0.
1016/s0002-9378(84)80032-0.
Авторы
Г. М. Каззи, Т. Л. Гросс, М. Г. Розен, Н. Ю. Джаауль-Каззи
- PMID: 6691381
- DOI: 10.1016/s0002-9378(84)80032-0
Абстрактный
Ранее было показано, что диагностированные ультразвуком изменения зрелости плаценты от 0 до III степени коррелируют со зрелостью легких плода. В проспективном исследовании 230 доношенных и преждевременных осложненных беременностей мы сравнили взаимосвязь между сонографической классификацией плаценты, фосфолипидами амниотической жидкости и неонатальными исходами. Было обнаружено, что частота гестационного возраста менее 38 недель, отношение лецитин/сфингомиелин (L/S) менее 2,0, отрицательный фосфатидилглицерин и неонатальная болезнь гиалиновых мембран снижаются по мере повышения плацентарной степени от 0 до III. Пациентки были разделены на подгруппы в зависимости от осложнений у матери. У пациенток с плацентами III степени частота гестационного возраста менее 38 недель и отношения L/S менее 2,0 была значительно увеличена при сравнении подгруппы пациенток с хронической гипертонией по отдельности с обеими подгруппами, повторными родами кесаревым сечением и Сахарный диабет классов A, B и C (оба с p менее 0,05) Все трое детей, у которых развилась болезнь гиалиновых мембран в сочетании с плацентой III степени, были от беременностей сроком менее 38 недель, осложненных хронической гипертензией. Эти данные свидетельствуют о том, что наличие плаценты III степени зависит как от гестационного возраста, так и от осложнений беременности. Таким образом, когда планируется плановое кесарево сечение в ближайшем сроке гестации, наличие плаценты III степени является надежным предиктором зрелости легких. При преждевременных осложненных беременностях плацента III степени по УЗИ может быть связана с болезнью гиалиновых мембран.
Пациентки были разделены на подгруппы в зависимости от осложнений у матери. У пациенток с плацентами III степени частота гестационного возраста менее 38 недель и отношения L/S менее 2,0 была значительно увеличена при сравнении подгруппы пациенток с хронической гипертонией по отдельности с обеими подгруппами, повторными родами кесаревым сечением и Сахарный диабет классов A, B и C (оба с p менее 0,05) Все трое детей, у которых развилась болезнь гиалиновых мембран в сочетании с плацентой III степени, были от беременностей сроком менее 38 недель, осложненных хронической гипертензией. Эти данные свидетельствуют о том, что наличие плаценты III степени зависит как от гестационного возраста, так и от осложнений беременности. Таким образом, когда планируется плановое кесарево сечение в ближайшем сроке гестации, наличие плаценты III степени является надежным предиктором зрелости легких. При преждевременных осложненных беременностях плацента III степени по УЗИ может быть связана с болезнью гиалиновых мембран.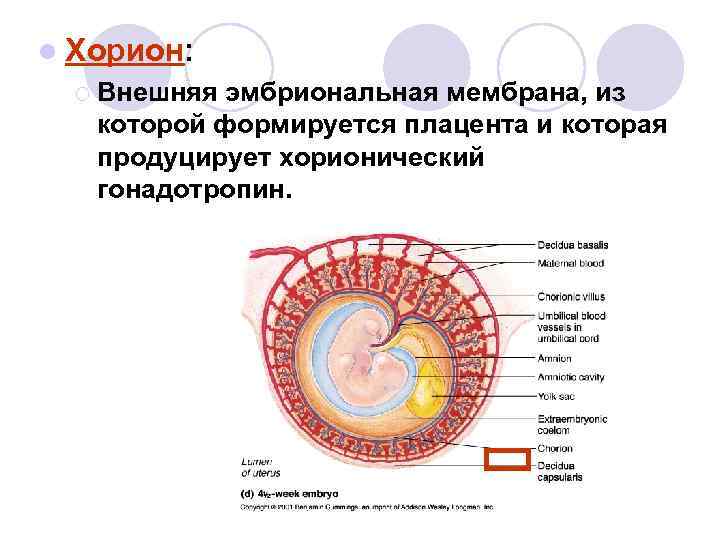
Похожие статьи
Взаимосвязь степени плаценты с легочной зрелостью плода и респираторным дистресс-синдромом.
Шах Ю.Г., Грэм Д. Шах Ю.Г. и др. Ам Дж. Перинатол. 1986 г., янв.; 3 (1): 53–55. doi: 10.1055/s-2007-999827. Ам Дж. Перинатол. 1986 год. PMID: 3510631
Корреляция ультразвуковой классификации плаценты в реальном времени с соотношением лецитин/сфингомиелин в амниотической жидкости.
Табш КМ. Табш КМ. Am J Obstet Gynecol. 1983 15 февраля; 145 (4): 504-8. doi: 10.1016/0002-9378(83)90325-3. Am J Obstet Gynecol. 1983. PMID: 6824044
Неинвазивное прогнозирование болезни гиалиновых мембран: оптимизированная классификация сонографического созревания плаценты.

Каззи Г.М., Гросс Т.Л., Сокол Р.Я., Каззи С.Н. Каззи Г.М. и др. Am J Obstet Gynecol. 1985 15 мая; 152 (2): 213-9. doi: 10.1016/s0002-9378(85)80024-7. Am J Obstet Gynecol. 1985. PMID: 3890546
Применение УЗИ в диагностике зрелости легких плода.
Голд С.Х., Платт Л.Д. Голде С.Х. и соавт. Клин Обстет Гинекол. 1984 июнь; 27 (2): 391-401. doi: 10.1097/00003081-198406000-00013. Клин Обстет Гинекол. 1984. PMID: 6378474 Обзор.
Чувствительность и специфичность соотношения L/S в зависимости от гестационного возраста.
Кризи Г.В., Саймон Н.В. Creasy GW и др. Ам Дж. Перинатол. 1984 г., июль; 1(4):302-5. doi: 10.1055/s-2007-1000026. Ам Дж. Перинатол. 1984. PMID: 6394018 Обзор.

Посмотреть все похожие статьи
Цитируется
Новый подход к обнаружению микрокальцинатов в плаценте во время беременности с использованием текстурных особенностей и алгоритма K-ближайших соседей.
Мирон М., Молдовану С., Штефэнеску Б.И., Куля М., Павел С.М., Куля-Флореску А.Л. Мирон М. и др. Дж Имиджинг. 2022 19 марта; 8 (3): 81. doi: 10.3390/jimaging8030081. Дж Имиджинг. 2022. PMID: 35324636 Бесплатная статья ЧВК.
Перинатальные исходы при преждевременной кальцификации плаценты и ассоциации с цветным допплеровским исследованием: отчет из больницы третичного уровня в Восточной Индии.
Дэш С., Дас Б., Панда С.Р., Раджгуру М., Джена П., Мишра А., Рат С.К.
 Дэш С. и др.
Клин Практ. 2021 9 ноября; 11 (4): 841-849. doi: 10.3390/clinpract11040099.
Клин Практ. 2021.
PMID: 34842626
Бесплатная статья ЧВК.
Дэш С. и др.
Клин Практ. 2021 9 ноября; 11 (4): 841-849. doi: 10.3390/clinpract11040099.
Клин Практ. 2021.
PMID: 34842626
Бесплатная статья ЧВК.Кальцификация сосудов плаценты и здоровье сердечно-сосудистой системы: пришло время определить, насколько здоровье матери и потомства высечено на камне.
Wallingford MC, Benson C, Chavkin NW, Chin MT, Frasch MG. Уоллингфорд М.С. и др. Фронт Физиол. 2018 7 августа; 9:1044. doi: 10.3389/fphys.2018.01044. Электронная коллекция 2018. Фронт Физиол. 2018. PMID: 30131710 Бесплатная статья ЧВК.
термины MeSH
вещества
Общий осмотр плаценты и его значение в оценке необъяснимой внутриутробной гибели плода
Введение
Патологическое исследование плаценты проводят по показаниям для плода, матери и плаценты (таблица 1).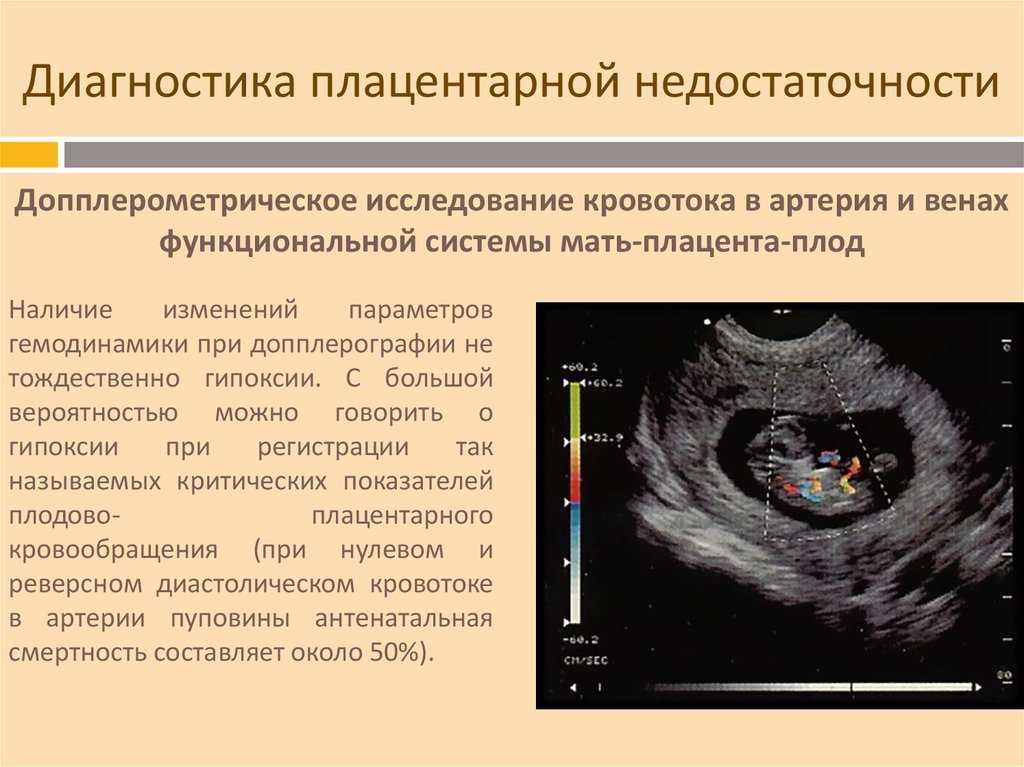 Цели заключаются в том, чтобы выявить заболевание плода или матери, дать прогноз для текущей и будущей беременности, оценить влияние материнского заболевания на течение беременности, а также по юридическим соображениям [1]. Многие поражения плаценты диагностируются исключительно при макроскопическом исследовании, и степень патологического процесса лучше всего определяется на всем образце. Тщательное макроскопическое исследование плаценты перед гистологическим исследованием улучшает микроскопическую интерпретацию. В идеале клиническая информация доступна во время общего обследования, включая продолжительность беременности, вес плода и любые проблемы, связанные с беременностью, родами или плодом/новорожденным [2].
Цели заключаются в том, чтобы выявить заболевание плода или матери, дать прогноз для текущей и будущей беременности, оценить влияние материнского заболевания на течение беременности, а также по юридическим соображениям [1]. Многие поражения плаценты диагностируются исключительно при макроскопическом исследовании, и степень патологического процесса лучше всего определяется на всем образце. Тщательное макроскопическое исследование плаценты перед гистологическим исследованием улучшает микроскопическую интерпретацию. В идеале клиническая информация доступна во время общего обследования, включая продолжительность беременности, вес плода и любые проблемы, связанные с беременностью, родами или плодом/новорожденным [2].
Полноразмерная таблица
Хранение плаценты
Некоторые специалисты рекомендуют хранить в пластиковых контейнерах в холодильнике при температуре 4 °C [3], в то время как другие рекомендуют немедленную фиксацию в формалине [4] . Полная фиксация целой плаценты занимает много дней в достаточном количестве формалина. Первичная формалиновая фиксация делает плаценты менее заразными и их легче срезать, а степень инфаркта можно лучше оценить. Однако фиксация формалином делает плаценту непригодной для бактериологического исследования и посева тканей и имеет другие недостатки, такие как проблемы с хранением, затраты и запах [2, 3].
Полная фиксация целой плаценты занимает много дней в достаточном количестве формалина. Первичная формалиновая фиксация делает плаценты менее заразными и их легче срезать, а степень инфаркта можно лучше оценить. Однако фиксация формалином делает плаценту непригодной для бактериологического исследования и посева тканей и имеет другие недостатки, такие как проблемы с хранением, затраты и запах [2, 3].
Техника сбора
Перед сбором желательна и полезна фотография. Фотографии плацентарных аномалий могут быть упомянуты позже и соотнесены с микроскопическими особенностями и клиническими аспектами. Окрашивание гематоксилином и эозином (H&E) используется для гистологического исследования. Специальные анализы, такие как анализ хромосом, анализ мРНК и микрочипов, а также стереологический анализ, требуют специальных процедур сбора и отбора проб, которые выходят за рамки этой статьи.
Поскольку плаценты сильно различаются по форме, размеру и внешнему виду, неофит должен изучить большое количество плацент, чтобы ознакомиться со спектром. Существуют различные методы извлечения плаценты [1–3], и описанный ниже метод используется автором (рис. 1). Все препараты плаценты в авторском институте фиксируют в 10 % формалине. Плаценту проверяют на целостность и последовательно исследуют пуповину, оболочки и диск. Шаблон отчета, использованный автором, прилагается (таблица 2).
Существуют различные методы извлечения плаценты [1–3], и описанный ниже метод используется автором (рис. 1). Все препараты плаценты в авторском институте фиксируют в 10 % формалине. Плаценту проверяют на целостность и последовательно исследуют пуповину, оболочки и диск. Шаблон отчета, использованный автором, прилагается (таблица 2).
Полный размер Таблица
Рис. 1Методы кассы плаценты ( A — E MEMBREN, F — J MEMBRAN, F — J , F — J , F — J . диск)
Полноразмерное изображение
Пуповина
В норме пуповина прикрепляется к плацентарному диску в центральном или почти центральном месте. Другие варианты включают эксцентрические, маргинальные, оболочечные, разветвленные и интерпозиционные тяжи. У недоношенных детей, как правило, более толстая пуповина, чем у более зрелых детей, тогда как вещество пуповины часто отсутствует, а пуповины тонкие при маточно-плацентарной недостаточности.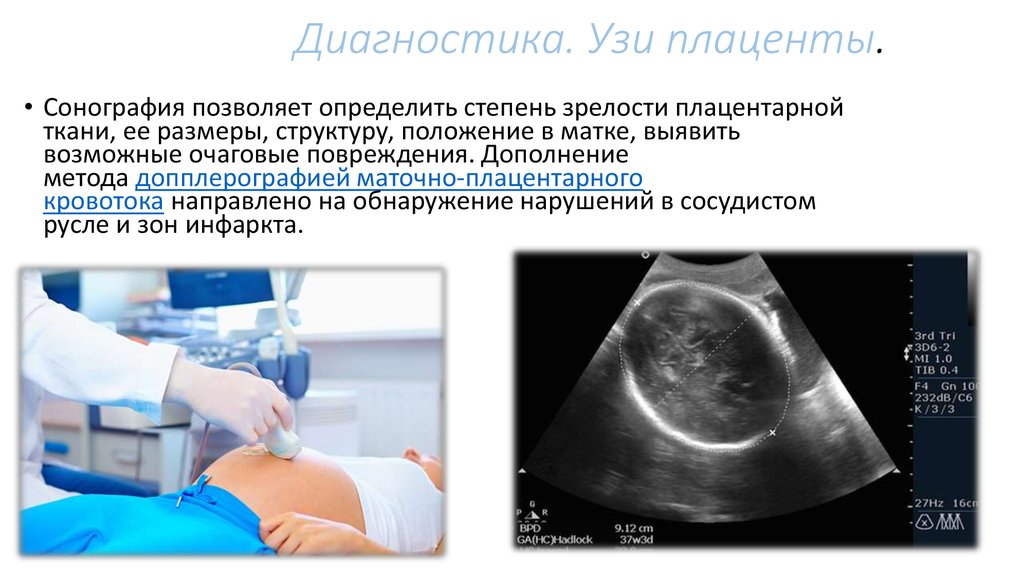 Отек пуповины может быть значительным при водянке плода. Воспаление пуповины может проявляться в виде желтого обесцвечивания или микроабсцессов при заражении Candida [2].
Отек пуповины может быть значительным при водянке плода. Воспаление пуповины может проявляться в виде желтого обесцвечивания или микроабсцессов при заражении Candida [2].
Регистрируются длина (включая оторванные сегменты) и диаметр (от наименьшего до наибольшего) пуповины. Необходимо помнить, что полный пуповина часто не направляется в патологоанатомическую лабораторию. Длинные пуповины (>75 см в срок) обычно связаны с настоящими узлами и обвитием плода. Застой и тромбоз сосудов пуповины являются полезными признаками истинной обструкции. Известно, что короткие пуповины возникают при нарушениях со сниженной подвижностью плода и статистически показывают больше проблем с неврологическим развитием [2]. Чрезмерное натяжение короткой пуповины может вызвать дистресс плода, разрыв пуповины с кровотечением и, возможно, отделение плаценты.
Проверяется скручивание кровеносных сосудов и регистрируется количество скручиваний и направление скручивания. Чаще всего против часовой стрелки (левый поворот). У пуповины со значительно большим числом витков и, возможно, без витков выше заболеваемость и смертность [5]. Необходимо также исследовать и регистрировать наличие истинных узлов, сегментарных сужений/стриктур, изъязвлений, отеков, узелков и тромбов. Стриктуры пуповины представляют собой значительное уменьшение размера пуповины и часто обнаруживаются вблизи плодного конца. Обычно наблюдается постепенное уменьшение вартонова желе по направлению к брюшной полости плода, но это приобретает угрожающее клиническое значение, если связано с чрезмерно длинными тяжами, гиперспирализацией, поверхностными венозными тромбами плаценты и фибриновыми подушками интимы [6].
У пуповины со значительно большим числом витков и, возможно, без витков выше заболеваемость и смертность [5]. Необходимо также исследовать и регистрировать наличие истинных узлов, сегментарных сужений/стриктур, изъязвлений, отеков, узелков и тромбов. Стриктуры пуповины представляют собой значительное уменьшение размера пуповины и часто обнаруживаются вблизи плодного конца. Обычно наблюдается постепенное уменьшение вартонова желе по направлению к брюшной полости плода, но это приобретает угрожающее клиническое значение, если связано с чрезмерно длинными тяжами, гиперспирализацией, поверхностными венозными тромбами плаценты и фибриновыми подушками интимы [6].
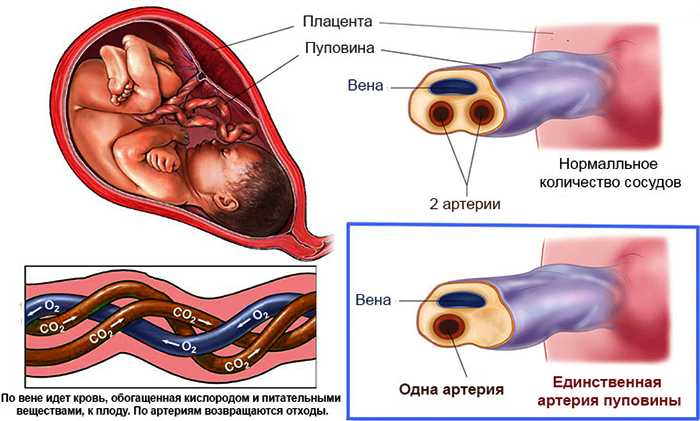
Пуповина отделяется от диска и отделяется от места прикрепления пуповины на расстоянии 5 см от места прикрепления и плодного конца. Любые узловатые или ненормально выглядящие области также берутся на пробу. В этот момент отмечают количество сосудов. Отбор проб из нескольких областей важен, потому что воспалительная реакция, тромбы и другие признаки не всегда равномерно распределяются по всей длине спинного мозга. Эмбриологические остатки редко видны макроскопически, и большинство из них исчезают, оставляя две пупочные артерии и левую пупочную вену. Отсутствие одной пупочной артерии является распространенной аномалией, встречающейся примерно в 1 % родов. Чаще встречается при многоплодной беременности и оболочечных прикреплениях пуповины. Приблизительно у 20 % младенцев с отсутствием одной артерии имеются другие серьезные врожденные аномалии, которые могут затрагивать любую систему органов. Несколько разрезов по длине пуповины должны подтвердить это открытие, потому что две пупочные артерии часто сливаются прямо над местом прикрепления [2].
Эмбриологические остатки редко видны макроскопически, и большинство из них исчезают, оставляя две пупочные артерии и левую пупочную вену. Отсутствие одной пупочной артерии является распространенной аномалией, встречающейся примерно в 1 % родов. Чаще встречается при многоплодной беременности и оболочечных прикреплениях пуповины. Приблизительно у 20 % младенцев с отсутствием одной артерии имеются другие серьезные врожденные аномалии, которые могут затрагивать любую систему органов. Несколько разрезов по длине пуповины должны подтвердить это открытие, потому что две пупочные артерии часто сливаются прямо над местом прикрепления [2].
Мембраны
Мембраны проверяются на целостность, вставку, цвет, толщину и характеристики поверхности. Мембраны обычно прикрепляются к периферическому краю ворсинчатой ткани, которая обычно является внешней границей сосудистой пластинки. В циркумвалляции имеется избыточная двойная складка мембраны с закрытыми остатками и старыми кровоизлияниями в месте прикрепления мембраны.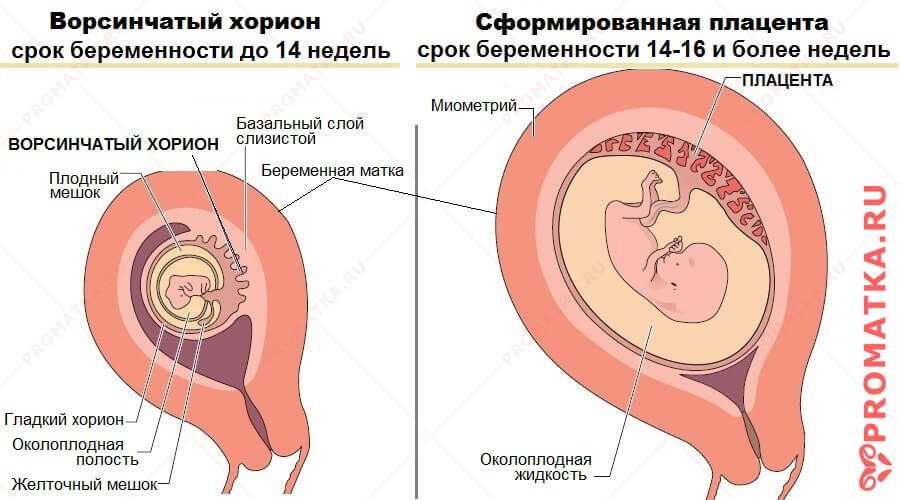 По окружности имеется небольшой гребень фибрина, где мембраны соприкасаются с расширенной поверхностью плаценты.
По окружности имеется небольшой гребень фибрина, где мембраны соприкасаются с расширенной поверхностью плаценты.
Помутнение обычно полупрозрачных плодных оболочек может наблюдаться при наличии хориоамнионита. Меконий придает зеленую окраску; однако в незрелых плацентах зеленоватое или коричневатое обесцвечивание чаще связано с продуктами распада крови (гематоидин и гемосидерин) после гемолиза [2, 3]. Оболочки визуально осматривают на наличие плоскоклеточной метаплазии, узловатых амнионов, амниотических полипов, амниотических тяжей и опухолей. Другие утолщения плодных оболочек могут свидетельствовать о сдавленных плодах и, реже, о задержке внутриматочной спирали [2].
Изолируют место разрыва оболочек, отрезают ленту от края до края диска и готовят рулон. Очень короткое расстояние от места разрыва до диска указывало бы на низколежащую плаценту и наоборот [1, 3]. Метод «jelly roll» для получения максимального количества мембран с капсульной децидуальной оболочкой был впервые описан Zeek и Assali [7]. В одной кассете на обработку подается не менее двух секций. Мембраны затем обрезаются с диска.
В одной кассете на обработку подается не менее двух секций. Мембраны затем обрезаются с диска.
Диск
Диск (фиксированный и обрезанный) взвешивается и записываются измерения в трех измерениях. Избыточное количество материнских ретроплацентарных сгустков необходимо удалить перед взвешиванием. Масса плаценты может значительно варьировать, так как на нее влияет фиксация, наличие пуповины, оболочек и рыхлых сгустков, количество оставшейся крови и неповрежденность материнской поверхности. Таблицы веса плаценты основаны на урезанном весе. Фокс и его коллеги показали, что фиксация формалином в течение 24 часов увеличивает массу плаценты на 7,67 %; следовательно, свежий вес = фиксированный вес × 0,929 [8]. Если плацента взвешивается в фиксированном состоянии, это должно быть отмечено в отчете. Гестационный возраст и вес ребенка важны для правильной оценки измеренного веса, а соотношение веса плода и плаценты можно легко рассчитать в процессе валового анализа. Соотношение увеличивается примерно с 2 на 20 неделе беременности до примерно 7–8 на сроке [9, 10].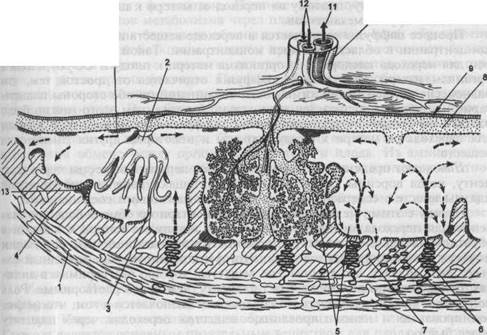 Тяжелая или светлая плацента часто указывает на аномальную беременность. Доношенные плаценты обычно весят от 400 до 600 г.
Тяжелая или светлая плацента часто указывает на аномальную беременность. Доношенные плаценты обычно весят от 400 до 600 г.
Регистрируют форму плаценты в этом соединении и ищут добавочные/сукцентуриатные доли. Как правило, плацента имеет форму от круглой до яйцевидной формы и составляет примерно 18–20 см в диаметре и 1,5–2,5 см в толщину в срок [2]. Форма оценивается путем измерения длины самой длинной оси, а затем самой длинной длины, перпендикулярной первой [11, 12]. Эллиптичность связана с программированием развития плода, а форма плаценты может отражать место имплантации и, следовательно, потенциально ее материнское кровоснабжение [3, 13].
При исследовании плодной поверхности плаценты отмечают ее цвет и ищут признаки субхориальных фибриновых бляшек, субхориального тромбоза и субамниотических гематом. Могут быть видны эктатические толстостенные сосуды плацентарной мезенхимальной дисплазии. Плодовая поверхность зрелой плаценты часто покрыта крошечными белыми возвышениями под хорионом, что придает поверхности мозаичный, неправильный рисунок. Эти выпячивания представляют собой скопления фибрина в межворсинчатом пространстве, и их количество увеличивается по мере взросления. Большие субхориальные тромбы являются аномальными и иногда связаны с задержкой роста плода [3]. Сосуды плода, находящиеся в хорионе, необходимо тщательно осмотреть на наличие тромбов, которые проявляются в виде бело-желтых полос на поверхности сосуда. Артерии поверхностны (пересекают поверхность) вен. Кисты можно увидеть на поверхности плода, а также в паренхиматозных перегородках. Они вызваны пролиферацией трофобластических Х-клеток и могут иногда становиться довольно большими и геморрагическими [2, 3].
Эти выпячивания представляют собой скопления фибрина в межворсинчатом пространстве, и их количество увеличивается по мере взросления. Большие субхориальные тромбы являются аномальными и иногда связаны с задержкой роста плода [3]. Сосуды плода, находящиеся в хорионе, необходимо тщательно осмотреть на наличие тромбов, которые проявляются в виде бело-желтых полос на поверхности сосуда. Артерии поверхностны (пересекают поверхность) вен. Кисты можно увидеть на поверхности плода, а также в паренхиматозных перегородках. Они вызваны пролиферацией трофобластических Х-клеток и могут иногда становиться довольно большими и геморрагическими [2, 3].
Оценивают целостность, цвет и текстуру материнской поверхности, констатируют наличие ретроплацентарных и краевых гематом. Когда кровотечение локализовано за плацентой, ворсинчатая ткань сдавливается сгустком крови (что отличает ее от послеродового тромба). Семядоли увеличиваются в размерах и дифференцируются по мере развития плода. Любые отсутствующие семядоли должны быть отмечены. Если в зрелой плаценте отсутствуют семядольные подразделения, это может указывать на инфильтрацию материнского дна избыточным количеством фибрина.
Если в зрелой плаценте отсутствуют семядольные подразделения, это может указывать на инфильтрацию материнского дна избыточным количеством фибрина.
Через диск делают несколько параллельных срезов с интервалом 2 см для оценки паренхимы. Цвет ворсинчатой ткани почти полностью определяется содержанием в ней крови плода. Так, застойная плацента (как при сахарном диабете матери) темная, а анемичная, отечная, обескровленная или эритробластозная плацента бледная, гораздо более рыхлая и более толстая (3–5 см) в отличие от нормальной плаценты [3]. ]. Поверхности срезов осматривают на наличие инфаркта, околоворсинчатого фибрина и гемангиом. Должны быть зарегистрированы трехмерные измерения всех поражений, а также оценка процента плаценты, вовлеченной в такой процесс, как инфаркт [1, 3]. Большинство инфарктов обычно располагаются на материнской поверхности и имеют довольно линейные очерченные края. Инфаркты кажутся более плотными, чем соседние ткани, и кажутся гранулированными из-за оставшихся спавшихся ворсинок на разных стадиях дегенерации. Со временем цвет меняется с красного на белый. При инфарктах можно увидеть кистозные изменения и геморрагические участки. Инфаркт чаще всего наблюдается у края плаценты, где кровоток обычно меньше. Межворсинчатые тромбы возникают в межворсинчатом пространстве в центральных отделах плаценты. Самые ранние тромбы представляют собой свежие красные сгустки, которые через пластинчатые тромбы превращаются в твердые белые очаги. Локализованные участки периворсинчатого отложения фибрина наблюдаются практически во всех зрелых плацентах, и небольшие количества не связаны с заболеванием плода или матери. Массивное периворсинчатое отложение фибрина (MPVFD) обычно приводит к образованию малой для гестационного возраста жесткой плаценты с твердой желто-белой утолщенной материнской поверхностью. Описаны три модели MPVFD: classic с наличием базального фибриноида по всему материнскому полу; пограничный с вовлечением 25–50 % ворсинок; трансмуральный , покрывающий ≥50 % ворсинок, и серийные срезы демонстрируют либо базальный фибрин, либо диффузные вертикально ориентированные бледные трабекулы, простирающиеся от базальной зоны в среднюю и субхориальную зоны в виде решетчатой сети [14].
Со временем цвет меняется с красного на белый. При инфарктах можно увидеть кистозные изменения и геморрагические участки. Инфаркт чаще всего наблюдается у края плаценты, где кровоток обычно меньше. Межворсинчатые тромбы возникают в межворсинчатом пространстве в центральных отделах плаценты. Самые ранние тромбы представляют собой свежие красные сгустки, которые через пластинчатые тромбы превращаются в твердые белые очаги. Локализованные участки периворсинчатого отложения фибрина наблюдаются практически во всех зрелых плацентах, и небольшие количества не связаны с заболеванием плода или матери. Массивное периворсинчатое отложение фибрина (MPVFD) обычно приводит к образованию малой для гестационного возраста жесткой плаценты с твердой желто-белой утолщенной материнской поверхностью. Описаны три модели MPVFD: classic с наличием базального фибриноида по всему материнскому полу; пограничный с вовлечением 25–50 % ворсинок; трансмуральный , покрывающий ≥50 % ворсинок, и серийные срезы демонстрируют либо базальный фибрин, либо диффузные вертикально ориентированные бледные трабекулы, простирающиеся от базальной зоны в среднюю и субхориальную зоны в виде решетчатой сети [14]. Бессосудистые ворсинки, указывающие на нарушение кровоснабжения плода, проявляются в виде бледных областей, но обычно не видны макроскопически. Хорангиомы обычно располагаются под хорионической пластинкой. Гематогенная диссеминация внутриутробной или материнской инфекции (например, листериоза) может привести к абсцессам и микроабсцессам, разбросанным по ворсинчатой ткани.
Бессосудистые ворсинки, указывающие на нарушение кровоснабжения плода, проявляются в виде бледных областей, но обычно не видны макроскопически. Хорангиомы обычно располагаются под хорионической пластинкой. Гематогенная диссеминация внутриутробной или материнской инфекции (например, листериоза) может привести к абсцессам и микроабсцессам, разбросанным по ворсинчатой ткани.
Гистологические образцы ткани ворсинок плаценты должны быть взяты из отдельных областей (разных семядолей), а не из края плаценты, где часто обнаруживаются изменения в виде снижения кровотока и отложения фибрина. Поверхность плода в ворсинчатом отделе должна включать мелкие кровеносные сосуды и не содержать существенного субхориального сгустка или фибрина. Срезы берутся из паренхимы таким образом, чтобы были включены как хорионическая, так и базальная пластинки. Если плацента слишком толстая, срез делят пополам и представляют в виде двух последовательных кассет. Нет единого мнения относительно количества секций, необходимых для адекватности [1–3, 15]. Плаценты неоднородны, и общая оценка может быть значительно искажена из-за неоптимального разделения. Само определение хорангиоза требует как минимум трех срезов, а очаговая патология может быть пропущена, если срезы сделаны неадекватно, например, ворсинки неизвестной этиологии или пограничные периворсинчатые отложения фибрина могут быть пропущены, если представлено менее пяти срезов. В дополнение к необычным участкам плаценты также должны быть получены срезы из абсолютно нормальных частей плаценты.
Плаценты неоднородны, и общая оценка может быть значительно искажена из-за неоптимального разделения. Само определение хорангиоза требует как минимум трех срезов, а очаговая патология может быть пропущена, если срезы сделаны неадекватно, например, ворсинки неизвестной этиологии или пограничные периворсинчатые отложения фибрина могут быть пропущены, если представлено менее пяти срезов. В дополнение к необычным участкам плаценты также должны быть получены срезы из абсолютно нормальных частей плаценты.
Многоплодная беременность
Суммарный вес плаценты следует сравнивать с диапазонами общего веса плаценты для близнецов (согласно неделе беременности) [1]. Площади территорий хорионической пластинки могут быть неодинаковыми, и это следует учитывать как относительные проценты от общей поверхности плаценты. Обязательна запись мембранных отношений между близнецами, тройнями и кратными плодами более высокого порядка. Для полноценного анализа необходимо, чтобы пуповины были помечены акушером швами или зажимами в порядке родов.
Наиболее важными решениями, которые необходимо принять при исследовании плацент при многоплодных родах, являются: количество оболочек, разделяющих мешки (две или четыре), и типы сосудистых анастомозов (обычно присутствуют только в монохориальных двойных плацентах). Если есть четыре отличительных листка, это дихориальная диамниотическая плацента, тогда как если только две тонкие оболочки соприкасаются, это монохориальная диамниотическая плацента. В дихориальных диамниотических плацентах обычно можно найти гребень в месте, где мембраны встречаются над плацентой. Образец этой так называемой «Т-зоны» лучше всего брать путем осторожного разреза перегородки примерно на 3 см выше линии ее прикрепления, а затем разрезания под прямым углом срезов, включающих ткань хорионической пластинки ниже, по обеим сторонам перегородки. Включение ткани хорионической пластинки в перевернутый «Т-образный срез» служит для ее стабилизации во время отбора проб и сохранения ее ориентации во время гистологической обработки. Рекомендуется представить два таких среза, чтобы убедиться, что действительный образец перегородки доступен для микроскопической интерпретации [3].
Рекомендуется представить два таких среза, чтобы убедиться, что действительный образец перегородки доступен для микроскопической интерпретации [3].
Сосудистый «экватор» представляет собой неровную поверхность границы ветвей разветвлений хорионической пластинки каждого близнеца и лежит между двумя местами прикрепления пуповины. Две половины плаценты близнецов рассекают в месте экватора сосудов, чтобы определить вес плаценты каждого близнеца. Остальная часть исследования проводится по стандартному протоколу для одноплодной плаценты.
Необъяснимая внутриутробная гибель плода (UIUFD)
UIUFD определяется как гибель плода, происходящая без каких-либо признаков патологии плода, матери или плаценты до начала родов, и классифицируется ReCoDe как «отсутствие соответствующего состояния, выявленного при рождении». классификации [16]. Плацента может предоставить чрезвычайно полезную информацию о перинатальной заболеваемости и смертности. В ретроспективном исследовании всех (n = 211) мертворождений после 24 недель беременности в период с января 2011 г.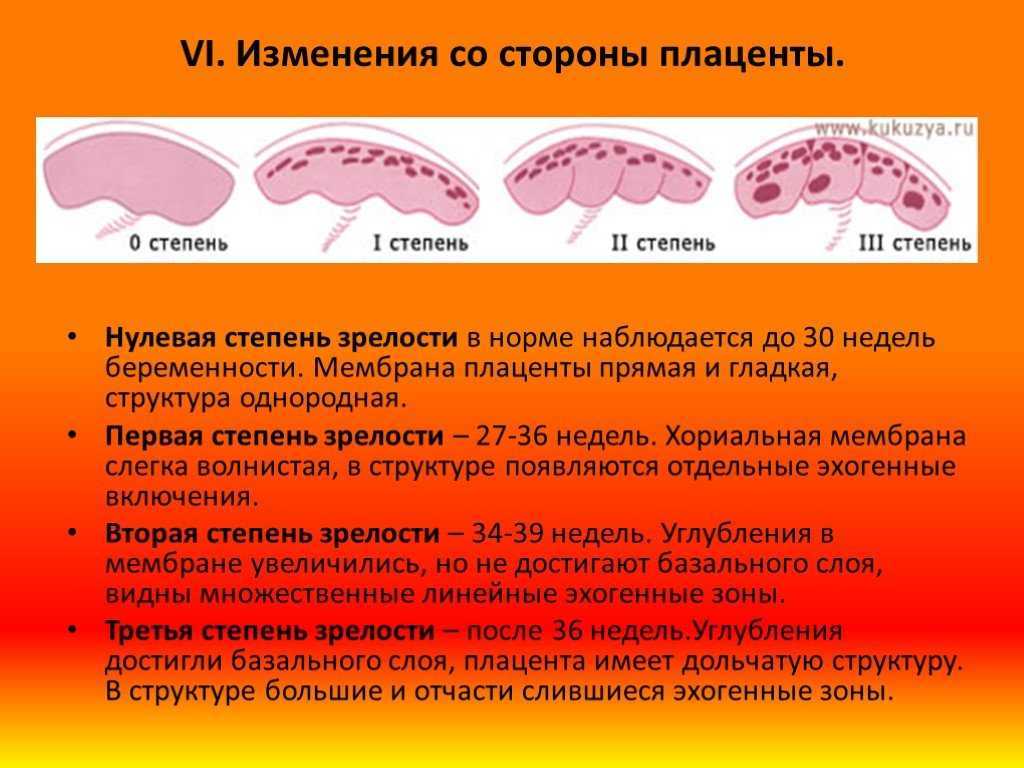 по декабрь 2012 г. в исследовательском институте автора (неопубликованные данные) было выявлено 33 случая UIUFD. Было обнаружено, что плацента является виновником, непосредственно способствовавшим смерти почти 88 % женщин с UIUFD, и выявленными поражениями были нарушения кровоснабжения плода (42,4 %), нарушения кровоснабжения матери (12,1 %), острый хориоамнионит (18,2 %). %) и различные состояния, такие как массивный околоворсинчатый фибриноид, ворсинки неизвестной этиологии и т. д. (15,2 %) [данные представлены на 60-м ежегодном собрании PPS (совместно с SPP) в Бирмингеме, Великобритания, в сентябре 2014 г.; «Необъяснимое мертворождение — виновата ли плацента?», с которым можно ознакомиться по адресу http://www.pps-spp2014.co.uk/wp-content/uploads/2014/02/ABSTRACTS-4th-joint-PPS-SPP-Meeting. -Bham-Sept-14.pdf)]. Это ясно подчеркивает роль исследования плаценты в оценке причины мертворождения и подтверждает важность методичного и тщательного исследования плаценты, как подробно описано выше.
по декабрь 2012 г. в исследовательском институте автора (неопубликованные данные) было выявлено 33 случая UIUFD. Было обнаружено, что плацента является виновником, непосредственно способствовавшим смерти почти 88 % женщин с UIUFD, и выявленными поражениями были нарушения кровоснабжения плода (42,4 %), нарушения кровоснабжения матери (12,1 %), острый хориоамнионит (18,2 %). %) и различные состояния, такие как массивный околоворсинчатый фибриноид, ворсинки неизвестной этиологии и т. д. (15,2 %) [данные представлены на 60-м ежегодном собрании PPS (совместно с SPP) в Бирмингеме, Великобритания, в сентябре 2014 г.; «Необъяснимое мертворождение — виновата ли плацента?», с которым можно ознакомиться по адресу http://www.pps-spp2014.co.uk/wp-content/uploads/2014/02/ABSTRACTS-4th-joint-PPS-SPP-Meeting. -Bham-Sept-14.pdf)]. Это ясно подчеркивает роль исследования плаценты в оценке причины мертворождения и подтверждает важность методичного и тщательного исследования плаценты, как подробно описано выше.
Ссылки
Фэй-Петерсен О.М., Хеллер Д.С., Джоши В.В. Справочник по патологии плаценты. 2-е изд. Лондон: Тейлор и Фрэнсис; 2006.
Google ученый
Каплан С. Общий осмотр плаценты. Сург Патол Клин. 2013; 6:1–26.
Артикул Google ученый
Бениршке К., Бертон Г.Дж., Берген Р.Н. Исследование плаценты. В: Бениршке К., Кауфман П., редакторы. Патология плаценты человека. 6-е изд. Берлин: Спрингер; 2012. с. 1–12.
Глава Google ученый
Варфоломей Р.А., Колвин Э.Д., Граймс В.Х., Фиш Дж.С., Лестер В.М., Галлоуэй В.Х. Критерии, по которым можно диагностировать токсикоз беременных по немеченым формалином фиксированным плацентам. Am J Obstet Gynecol. 1961; 82: 277–90.

КАС пабмед Google ученый
Мачин Г.А., Акерман Дж., Гилберт-Барнесс Э. Аномальное закручивание пуповины связано с неблагоприятными перинатальными исходами. Педиатр Дев Патол. 2000;3(5):462–71.
Артикул КАС пабмед Google ученый
Бениршке К., Бертон Г.Дж., Берген Р.Н. Анатомия и патология пуповины. В: Бениршке К., Кауфман П., редакторы. Патология плаценты человека. 6-е изд. Берлин: Спрингер; 2012. с. 309–75.
Глава Google ученый
Zeek PM, Assali NS. Сосудистые изменения в децидуальной оболочке, связанные с экламптогенным токсикозом беременных. Ам Джей Клин Патол. 1950;20:1099–109.
КАС пабмед Google ученый
Fox GE, Van Wesep R, Resau JH, Sun CC.
 Влияние иммерсионной фиксации формальдегидом на массу плаценты человека. Arch Pathol Lab Med. 1991; 115: 726–8.
Влияние иммерсионной фиксации формальдегидом на массу плаценты человека. Arch Pathol Lab Med. 1991; 115: 726–8.КАС пабмед Google ученый
Molteni RA, Stys SJ, Battaglia FC. Взаимосвязь веса плода и плаценты у человека: соотношение веса плода и плаценты в разные сроки беременности и распределение веса при рождении. J Reprod Med. 1978;21(5):327–34.
КАС пабмед Google ученый
Перри И.Дж., Биверс Д.Г., Уинкап П.Х., Барефорд Д. Предикторы соотношения массы плаценты и массы плода в многонациональном сообществе. БМЖ. 1995;310(6977):436–9.
Артикул ПабМед Центральный КАС пабмед Google ученый
Патак С., Хук Э., Хакетт Г., Мердок Э., Себире Н.Дж., Джессоп Ф. и др. Скручивание пуповины, прикрепление пуповины и форма плаценты в невыбранной когорте родов в срок: взаимосвязь с общими акушерскими исходами.
 Плацента. 2010;31:963–8.
Плацента. 2010;31:963–8.Артикул КАС пабмед Google ученый
Салафия К.М., Ямпольский М., Мисра Д.П., Шлахтер О., Хаас Д., Юкер Б. и др. Форма поверхности плаценты, функция и последствия сосудистой патологии матери и плода. Плацента. 2010; 31: 958–62.
Артикул ПабМед Центральный КАС пабмед Google ученый
Баркер Д.Дж., Торнбург К.Л., Осмонд С., Каджанти Э., Эрикссон Дж.Г. Площадь поверхности плаценты и артериальная гипертензия у потомства в более позднем возрасте. Int J Dev Biol. 2010;54:525–30.
Артикул ПабМед Центральный пабмед Google ученый
Фэй-Петерсен О.М., Эрнст Л.М. Инфаркт материнского дна и массивное периворсинчатое отложение фибрина. Сург Патол Клин. 2013;6:101–14.
Артикул Google ученый


 Провоцирующими факторами становятся возбудители специфических генитальных инфекций (простого герпеса, микоплазмоза, уреаплазмоза, хламидиоза), других инфекционных болезней (ОРВИ, краснухи, токсоплазмоза, цитомегаловирусной инфекции).
Провоцирующими факторами становятся возбудители специфических генитальных инфекций (простого герпеса, микоплазмоза, уреаплазмоза, хламидиоза), других инфекционных болезней (ОРВИ, краснухи, токсоплазмоза, цитомегаловирусной инфекции).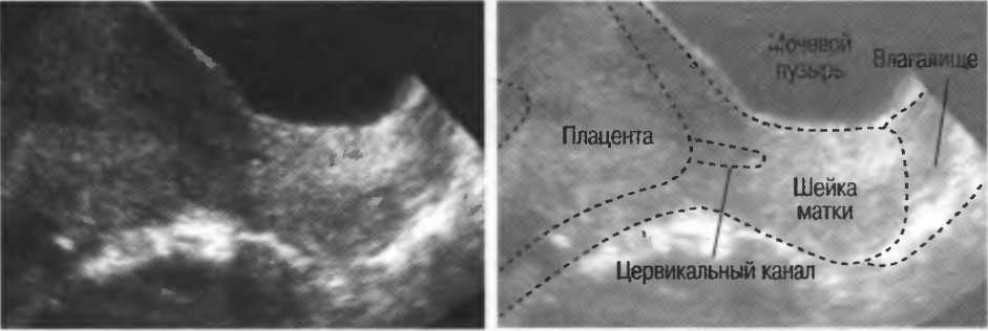
 Обнаружение обменно-дистрофических изменений плацентарной ткани на 20-24 неделях является показанием для обследования в специализированном отделении патологии беременности. В таких случаях, начиная с 26 недели гестации, допплометрический контроль кровотока выполняется не реже 1 раза в неделю, ежедневно подсчитываются движения плода. Срочное родоразрешение при критических нарушениях тока крови в пуповине, КТГ-признаках гипоксии плода, остановке его роста, резком уменьшении объема околоплодных вод, появлении других признаков угрозы ребенку может выполняться даже на сроке 31-33 недели.
Обнаружение обменно-дистрофических изменений плацентарной ткани на 20-24 неделях является показанием для обследования в специализированном отделении патологии беременности. В таких случаях, начиная с 26 недели гестации, допплометрический контроль кровотока выполняется не реже 1 раза в неделю, ежедневно подсчитываются движения плода. Срочное родоразрешение при критических нарушениях тока крови в пуповине, КТГ-признаках гипоксии плода, остановке его роста, резком уменьшении объема околоплодных вод, появлении других признаков угрозы ребенку может выполняться даже на сроке 31-33 недели. Лишь в тех случаях, когда ПСП сочетается со значительной задержкой развития плода, для профилактики острого дистресс-синдрома у ребенка показано кесарево сечение.
Лишь в тех случаях, когда ПСП сочетается со значительной задержкой развития плода, для профилактики острого дистресс-синдрома у ребенка показано кесарево сечение. Морфологическая основа кистозных включений в плацентарной ткани — резкий отек стволовых ворсин с образованием полостей. Архитектоника сосудистой сети не нарушена, топография плацентарных сосудов соответствует строению нормальной сосудистой сети плаценты. Извитые, расширенные сосуды стволовых ворсин могут четко определяться при ЦДК.
Морфологическая основа кистозных включений в плацентарной ткани — резкий отек стволовых ворсин с образованием полостей. Архитектоника сосудистой сети не нарушена, топография плацентарных сосудов соответствует строению нормальной сосудистой сети плаценты. Извитые, расширенные сосуды стволовых ворсин могут четко определяться при ЦДК. Ведение беременности, определение сроков и методов родоразрешения должны проводиться по акушерским показаниям с учетом сопутствующей экстрагенитальной и акушерской патологии.
Ведение беременности, определение сроков и методов родоразрешения должны проводиться по акушерским показаниям с учетом сопутствующей экстрагенитальной и акушерской патологии.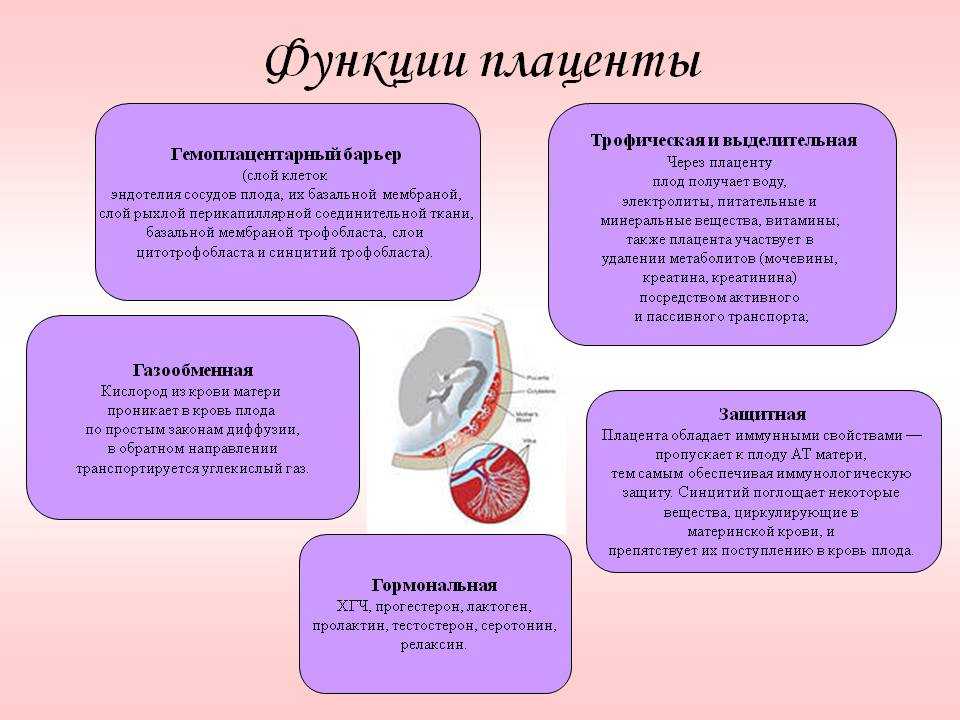 2010; 36: 644-646.
2010; 36: 644-646. 2008; 29 (7): 646-649.
2008; 29 (7): 646-649.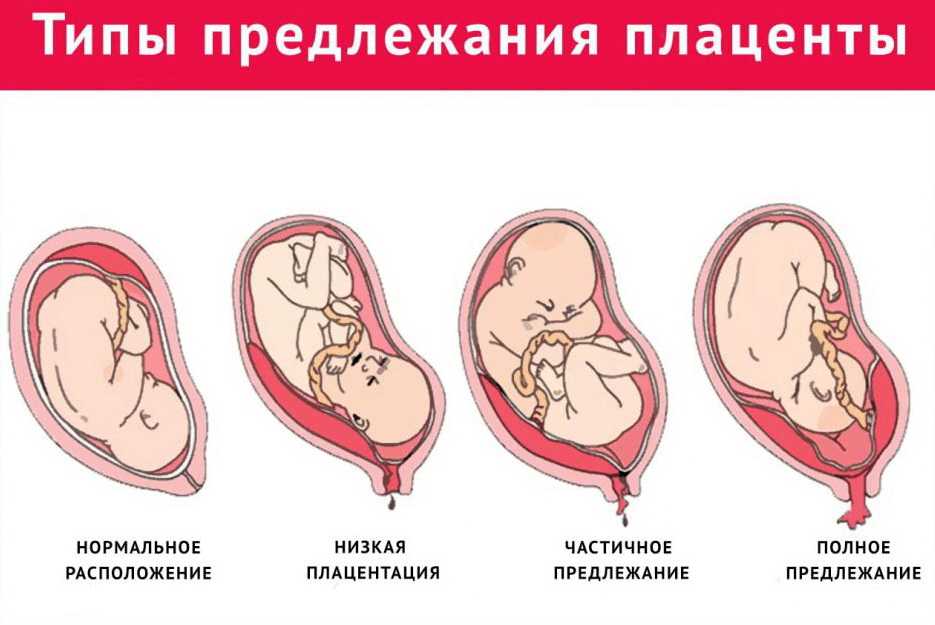

 Дэш С. и др.
Клин Практ. 2021 9 ноября; 11 (4): 841-849. doi: 10.3390/clinpract11040099.
Клин Практ. 2021.
PMID: 34842626
Бесплатная статья ЧВК.
Дэш С. и др.
Клин Практ. 2021 9 ноября; 11 (4): 841-849. doi: 10.3390/clinpract11040099.
Клин Практ. 2021.
PMID: 34842626
Бесплатная статья ЧВК.
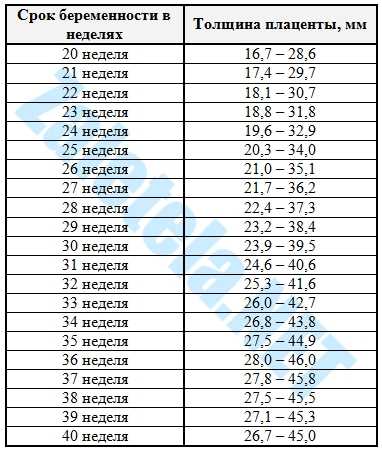 Влияние иммерсионной фиксации формальдегидом на массу плаценты человека. Arch Pathol Lab Med. 1991; 115: 726–8.
Влияние иммерсионной фиксации формальдегидом на массу плаценты человека. Arch Pathol Lab Med. 1991; 115: 726–8. Плацента. 2010;31:963–8.
Плацента. 2010;31:963–8.