Плацентарная недостаточность: диагностика, возможные осложнения и лечение: Материнство: Прочие заболевания
Плацента — уникальный орган, формирующийся у женщины во время беременности. Плацента устанавливает связь между плодом и матерью. Через нее осуществляется передача будущему ребенку питательных веществ, а также дыхательная, выделительная, защитная и гормональная функции плода.
Если плацента перестает выполнять данные функции в полной мере, начинает развиваться фетоплацентарная недостаточность. По сути, недостаточность — это нарушение кровообращения в системе мать-плацента-плод.
Если подобные нарушения незначительны, то они не окажут негативного влияния на плод, но при особенно выраженной ФПН может развиться гипоксия плода (кислородная недостаточность), что впоследствии может привести к его гибели.
По своему течению существуют 2 формы ФПН: хроническая и острая
При острой ФПН может быть обнаружена преждевременная отслойка нормально расположенной плаценты, вызванная резким нарушением маточно-плацентарного кровотока, что в ряде случаев может привести к гибели плода.
При хронической ФПН (наиболее распространенной) происходит постепенное нарушение кровообращения в плаценте.
Медики выделяют компенсированную и декомпенсированную формы хронической плацентарной недостаточности.
Несмотря на не слишком выраженное ухудшение кровоснабжения при компенсированной ФПН, плод не страдает и приспосабливается к этим изменениям, благодаря компенсаторным возможностям материнского организма.
При декомпенсированной ФПН изменения имеют более стойкий характер, что приводит к недостаточному снабжению кислородом плода, к нарушению его сердечной деятельности и задержке развития.
К факторам, способным вызвать появление ФПН во время беременности, относятся:
Симптомы заболевания
При компенсированной хронической ФПН симптомы заболевания практически отсутствуют, и беременная чувствует себя вполне нормально. О наличии у нее плацентарной недостаточности женщина может узнать, как правило, во время прохождения ультразвукового исследования.
При хронической и острой декомпенсированной ФПН симптомы более выражены. Сначала отмечаются активные движения плода, после активность резко уменьшается.
Помните о том, что, начиная с 28 недели, будущая мама в норме должна ощущать движения плода не менее десяти раз в сутки. Если плод не столь активен — это является поводом для того, чтобы немедленно наведаться к своему акушеру-гинекологу.
Кроме того, если имеется задержка развития плода, при декомпенсированной ФПН отмечается некоторое уменьшение размеров живота. Правда, самостоятельно выявить данные изменения очень сложно, поэтому обычно уменьшение выявляется гинекологом во время планового приема.
И напоследок: наиболее опасный признак развития острой ФПН — это кровянистые выделения из влагалища. Это свидетельствует о том, что произошла преждевременная отслойка нормально расположенной плаценты, и подобная ситуация требует незамедлительного обращения к акушеру-гинекологу.
Диагностика ФПН
Для диагностики ФПН в акушерской практике применяют 3 основных метода: ультразвуковое исследование (УЗИ), кардиотокографию (КТГ) и допплерометрию. При любом незначительном подозрении на плацентарную недостаточность следует провести все эти обследования в обязательном порядке!
При любом незначительном подозрении на плацентарную недостаточность следует провести все эти обследования в обязательном порядке!
При УЗИ будет оцениваться двигательная активность плода, состояние плаценты (ее зрелость и толщина), количество околоплодных вод и размеры плода.
Плацентарная недостаточность — лечение и диагностика плацентарной недостаточности при беременности в Москве
Предсказание риска задержки внутриутробного развития и/или гипоксии плода либо их своевременное выявление чрезвычайно важны для предупреждения и коррекции этих осложнений. Для оценки состояния плаценты особенно широко используется определение в крови пептидных гормонов и специфических белков беременности.
Совместно с НИИ морфологии человека РАМН мы исследуем динамику плацентарных белков у женщин с герпесвирусными инфекциями.
При подготовке к беременности в сыворотке крови с 26 дня менструального цикла до 2 дня менструации и/или во время менструации в менструальной крови определяется концентрация АМГФ (альфа-2-микроглобулин фертильности, РР14).
Во время беременности в первом триместре определяются:
- АМГФ с 6 по 11 неделю, желательно с интервалом в 2-3 недели
- ТБГ (трофобластический бета-1-гликопротеин) с первых дней обращения или беременности в динамике 2-3 раза с интервалом в 2 недели, особенно при осложненной беременности и ОАГА.
Во втором триместре определяются:
- ТБГ
- АФП (альфа-фетопротеин)
- ПАМГ (плацентарный альфа-1-микроглобулин, РР12) с 16-23 недели, особенно при подозрении на плацентарную недостаточность, гипоксию и гипотрофию плода.
В третьем триместре определяются:
АМГФ (альфа-2-микроглобулин фертильности, РР14)
АМГФ – специфический белок репродуктивной системы женщин и мужчин. У женщин АМГФ синтезируется в эпителии желез эндометрия матки в лютеиновой фазе менструального цикла и в децидуальной ткани плаценты. Синтез и секреция в эндометрии и плаценте зависят преимущественно от уровня прогестерона.
Определение содержания АМГФ в кровянистых выделениях матки после ранних самопроизвольных абортов показало, что при потере беременности концентрация АМГФ в 50-100 раз превышает уровень белка в нормальной менструальной крови. Поэтому тест на АМГФ может быть использован для дифференциальной диагностики маточных кровотечений и установления причины женского бесплодия. Резкое увеличение содержания АМГФ в сыворотке крови отмечается при тяжелом эндометриозе. При хроническом эндометрите отмечено уменьшение содержания АМГФ в эндометриальном секрете в среднем в 5 раз по сравнению с нормой.
При наступлении беременности содержание АМГФ в сыворотке быстро увеличивается, достигая максимума между 6 и 12 неделями. После 16 недель концентрация АМГФ уменьшается и выходит на плато начиная с 24 недель беременности. В первом триместре уровень АМГФ в сыворотке крови матери перестает нарастать или падает при угрозе невынашивания беременности еще до начала клинических проявлений. Так как уровень АМГФ чрезвычайно индивидуален, целесообразно его исследование в первом триместре в динамике 2-3 раза с интервалом в 2-3 недели.
ТБГ(трофобластический бета-1-гликопротеин)
ТБГ – специфический белок беременности и связанных с нею заболеваний (пузырный занос, хорионэпилиома), синтезируется клетками цито- и синцитиотрофобласта и секретируется в кровоток матери. ТБГ обнаруживается в сыворотке крови на протяжении всей беременности, начиная с самых ранних сроков.
- при угрозе прерывания беременности в 1 и 2 триместрах;
- при внутриутробной задержке роста плода;
- при анэмбрионии и мертвом плоде;
- при беременности, осложненной гестозом.
Уровень ТБГ в сыворотке крови матери резко возрастает при многоплодии, сахарном диабете, гемолитической болезни плода, перенашивании беременности.
В связи с широким диапазоном индивидуальных концентраций ТБГ, рекомендуется его исследование в динамике 2-3 раза с интервалом в 1-2 недели.
Плацентарный альфа-1-микроглобулин (ПАМГ)
ПАМГ-1 является одним из основных секреторных белков децидуальной части плаценты, идентичным по физико-химическим, иммунохимическим и биологическим свойствам плацентарному протеину 12-РР12, который, в свою очередь, оказался представителем семейства белков (низкомолекулярным IGFBP 1), специфически связывающих инсулиноподобные факторы роста — ИФР.
Повышенный уровень ПАМГ-1 является:
- дополнительным диагностическим признаком, подтверждающим
внутриутробное страдание плода, при отягощенном акушерском
анамнезе; - основанием для целенаправленного комплексного обследования
недостаточности; - прогностическим критерием высокого риска перинатальных
осложнений, связанных с внутриутробной гипоксией и внутриутробной
задержкой развития плода.
Задержка внутриутробного роста плода при повышенном уровне ПАМГ-1 может быть обусловлена нарушениями развития и созревания плаценты. Ряд исследователей рассматривают ПАМГ-1 как естественный «материнский» регулятор инвазивности трофобласта. Вероятно, что в аномально высоких концентрациях ПАМГ препятствует нормальному внедрению цитотрофобласта в спонгиозный слой эндометрия и ограничивает рост трофобласта ворсинчатого хориона.
Ряд исследователей рассматривают ПАМГ-1 как естественный «материнский» регулятор инвазивности трофобласта. Вероятно, что в аномально высоких концентрациях ПАМГ препятствует нормальному внедрению цитотрофобласта в спонгиозный слой эндометрия и ограничивает рост трофобласта ворсинчатого хориона.
Концентрация ПАМГ-1 в материнской сыворотке в норме не превышает 40 нг/мл на протяжении всей беременности. Для выявления фетоплацентарных нарушений рекомендуется исследовать сыворотку крови матери, начиная с 16-17 недели беременности до 33-35 недель беременности.
Наш медицинский центр оказывает самый широкий спектр услуг. Вы всегда можете обратится к нам по вопросам ведения беременности. Мы готовы оказать вам услуги ведения беременности после эко и ведения поздней беременности.
Комплексная терапия беременных с метаболическим синдромом и плацентарной недостаточностью
Одним из основных показаний для применения гипербарической оксигенации (ГБО) в акушерстве является плацентарная недостаточность (ПН).
Плацента играет существенную роль в регуляции уровня перекисного окисления липидов (ПОЛ) в организме плода [1, 6]. При ПН значительно снижено содержание в плаценте общих липидов, свободного холестерина, триглицеридов. Одновременно с этим усилено ПОЛ на фоне снижения активности антиоксидантной системы. Накопление токсичных продуктов ПОЛ в клетках приводит к нарушению структуры и проницаемости биологических мембран. Усиление ПОЛ и изменение активности антиоксидантной системы играет роль в патогенезе гестоза, ПН и задержки внутриутробного развития плода.
Накопление токсичных продуктов ПОЛ в клетках приводит к нарушению структуры и проницаемости биологических мембран. Усиление ПОЛ и изменение активности антиоксидантной системы играет роль в патогенезе гестоза, ПН и задержки внутриутробного развития плода.
Особую группу представляют беременные с метаболическим синдромом. Наряду с различными осложнениями беременности (гестоз, гестационный сахарный диабет и др.) [14] у данной группы пациенток отмечается ПН, проявляющаяся выраженными изменениями со стороны маточно-плацентарного, плодово-плацентарного кровотока. В этой связи изучение методов коррекции данной патологии является важной проблемой в акушерской практике [10, 11].
Цель настоящего исследования — оценка эффективности комплексного лечения ПН у беременных с метаболическим синдромом с применением ГБО.
Материал и методы
Для исследования были отобраны 148 беременных с метаболическим синдромом беременность которых осложнилась ПН. Возраст обследованных колебался от 21 года до 32 лет (средний возраст 26±1,8 года), средний индекс массы тела (ИМТ) составил 27±1,1 кг/м2. В группу контроля вошли 50 здоровых беременных с нормальной массой тела, средний ИМТ 21±1,6 кг/м2. Всем пациенткам проводили общеклиническое обследование (анамнез, оценка антропометических показателей), инструментальное (допплерометрическое исследование кровотока в маточных и спиральных артериях, в артерии пуповины и ее терминальных ветвях, аорте и средней мозговой артерии плода) и лабораторное исследование (определение содержания плацентарного лактогена — ПЛ, продуктов свободнорадикального окисления липидов: диеновые конъюгаты — ДК; малоновый диальдегид — МДА).
Возраст обследованных колебался от 21 года до 32 лет (средний возраст 26±1,8 года), средний индекс массы тела (ИМТ) составил 27±1,1 кг/м2. В группу контроля вошли 50 здоровых беременных с нормальной массой тела, средний ИМТ 21±1,6 кг/м2. Всем пациенткам проводили общеклиническое обследование (анамнез, оценка антропометических показателей), инструментальное (допплерометрическое исследование кровотока в маточных и спиральных артериях, в артерии пуповины и ее терминальных ветвях, аорте и средней мозговой артерии плода) и лабораторное исследование (определение содержания плацентарного лактогена — ПЛ, продуктов свободнорадикального окисления липидов: диеновые конъюгаты — ДК; малоновый диальдегид — МДА).
Статистическую обработку данных выполняли с использованием программы Statistica 5.0, достоверность получаемых различий оценивали по непараметрическим критериям Вилкоксона и Манна—Уитни. Достоверными считали различия при p<0,05.
Лечение ПН проводили в соответствии с рекомендациями Г. М. Савельевой (2008). В качестве традиционной терапии всем пациенткам назначали стандартные схемы β-адреномиметиков (гинипрал), вазоактивных препаратов (трентал), антигипоксантов (актовегин), гепатопротекторов (эссенциале форте) и витаминотерапии. В сроки беременности более 38 нед осуществлялась подготовка к родам, которая включала введение спазмолитиков и простагландинов.
М. Савельевой (2008). В качестве традиционной терапии всем пациенткам назначали стандартные схемы β-адреномиметиков (гинипрал), вазоактивных препаратов (трентал), антигипоксантов (актовегин), гепатопротекторов (эссенциале форте) и витаминотерапии. В сроки беременности более 38 нед осуществлялась подготовка к родам, которая включала введение спазмолитиков и простагландинов.
Лечение гестозов проводилось путем комплексной инфузионной терапии, включая магнезиальную, а также антигипертензивную и седативную терапию. В случае неэффективности лечения гестоза производилось досрочное родоразрешение. При выявлении сопутствующей соматической патологии осуществляли ее коррекцию.
В дополнение к терапии назначался курс ГБО. Оксигенотерапия проводилась в барокамере ОКА-НТ и БЛ-301 в режиме 1,3 ата на изопрессии, в течение 40 мин со скоростью циркуляции кислорода 40 л/мин. Общая продолжительность сеанса с учетом компрессии и декомпрессии — 60 мин. Курс состоял из 8—10 сеансов, 1 раз в сутки.
Перед сеансом ГБО и после него обязательно измеряли частоту дыхания, пульса, артериальное давление и частоту сердцебиения плода.
Для оценки эффективности данной терапии пациентки были разделены на две группы: 1-я группа — 78 пациенток, которые получали в комплексе с основной терапией ГБО; 2-я группа (сравнения) — 70 пациенток, не получавших ГБО.
Результаты и обсуждение
Полученные данные (табл. 1) показали, что содержание ПЛ в сыворотке крови беременных, страдающих метаболическим синдромом с ПН, снижено на 26% по сравнению с контрольной группой. После лечения концентрация ПЛ повысилась, причем в группе беременных, получавших в комплексной терапии ГБО, в большей степени, чем в группе без ГБО.
Одно из главных проявлений ПН — нарушение гормональной функции плаценты, которое опережает клинические проявления на 2—3 нед [5, 15].
Таким образом, назначение ГБО в комплексном лечении ПН приводит к улучшению показателей гормонсинтезирующей функции плаценты.
На основании полученных результатов можно сделать заключение о возможности использования динамического определения гормона для оценки состояния плода, эффективности проводимого лечения и решения вопроса о тактике ведения беременности и родоразрешения, что согласуется с данными отечественных исследований [9].
В исследовании В.Н. Серова [12] выявлена достоверная закономерность изменения уровня ПЛ в крови беременных с поздним токсикозом в зависимости от степени его тяжести.
И.С. Сидоровой и соавт. [13] также показано, что хроническая ПН сопровождается уменьшением концентрации ПЛ пропорционально степени синдрома задержки развития плода.
В настоящем исследовании установлено, что при метаболическом синдроме имеет место усиление процессов свободнорадикального окисления липидов и ГБО непосредственно влияет на этот процесс (табл. 2).
Концентрация МДА и ДК до лечения у беременных с метаболическим синдромом была достоверно повышена по сравнению с контрольной группой пациенток.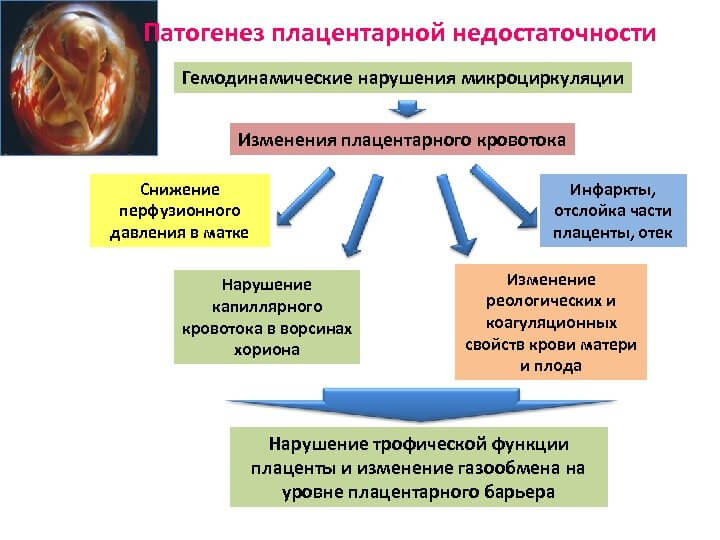 После лечения концентрация продуктов ПОЛ достоверно уменьшилась по сравнению с показателями до лечения, причем в 1-й группе пациенток в большей степени, чем в группе сравнения.
После лечения концентрация продуктов ПОЛ достоверно уменьшилась по сравнению с показателями до лечения, причем в 1-й группе пациенток в большей степени, чем в группе сравнения.
Полученные результаты согласуются с исследованием Г.Ц. Ароян [2], в котором показано, что при синдроме задержки развития плода наблюдается выраженное повышение уровня МДА, изменение концентрации свободных жирных кислот, снижение активности гормона роста.
При оценке допплерометрических показателей все беременные с метаболическим синдромом и ПН имели достоверно выраженные изменения. До лечения у этих больных систолодиастолическое отношение (СДО) и индекс резистентности (ИР) были достоверно выше по сравнению с контрольной группой. После комплексного лечения показатели СДО и ИР снизились, причем в группе беременных, получавших ГБО, в большей степени, чем в группе без ГБО (табл. 3), что согласуется с исследованиями Ю.А. Артюх [3].
Таким образом, на основании полученных результатов можно сделать вывод, что комплексная терапия беременных с метаболическим синдромом и ПН с применением метода ГБО эффективна и способствует восстановлению нарушенного кровообращения, ликвидации гипоксии плода, оказывая положительное влияние на исход беременности и родов.
запись к врачу — ДокДок СПб
Акушеры Санкт-Петербурга — отзывы
При общении с доктором мне очень многое непонятно было, и до сих пор осталось непонятным. Врач сказала о том, что у меня практически не работают яичники, но при этом она пыталась мне сделать тест на беременность. Она делала мне УЗИ, сказала, что беременности не видит. Прием длился примерно полчаса. Сначала я пришла, меня спросили, что меня беспокоит, я рассказала, доктор все записала, потом осмотрела, после чего сделала мне УЗИ и отправила на сдачу крови. Я бы обратилась повторно. Врач очень хороший, но единственное, что мне не понравилось, когда я пришла, то рассчитывала именно на консультацию гинеколога, по оплате. Врач, получается, не предупреждая меня, сразу начала говорить, что нужно сделать, сдать анализы, и только в конце она сказала, что анализы платные.
Кристина
Все прошло отлично, мне понравилось. Доктор общалась положительно, я очень восхищена этим человеком. Она очень добрый, хороший человек. Свои рекомендации доктор объясняла доступно. Прием длился, мне кажется, минут тридцать точно. На приеме меня осматривали, делали мазки и делали УЗИ, также я сдавала кровь. Я обратилась бы повторно к этому специалисту.
Олеся
Все прошло хорошо, быстро и безболезненно. Мне понравилось. Приду еще. Ирина Геронтьевна общалась очень вежливо. Мне было комфортно. Никаких грубостей не было. Доктора выбирала по отзывам. При необходимости я повторно обращусь к ней. Прием начался вовремя. Если будет нужно, к этому специалисту обращусь
Мне понравилось. Приду еще. Ирина Геронтьевна общалась очень вежливо. Мне было комфортно. Никаких грубостей не было. Доктора выбирала по отзывам. При необходимости я повторно обращусь к ней. Прием начался вовремя. Если будет нужно, к этому специалисту обращусь
Наталья
Прием понравился, грамотный, тактичный доктор. Осталась довольна качеством приема. От приема получила результаты УЗИ и пояснение врача. Обращусь повторно к данному специалисту.
Ирина
Прием прошел хорошо. Все отлично Элина Александровна по общению приятный человек. Все понятно и доступно объясняла. Во время приема провела УЗИ, назначила анализы. По итогу приема доктор помог в решении моей проблемы: дала рекомендации. Данного специалиста порекомендовала бы.
Все отлично Элина Александровна по общению приятный человек. Все понятно и доступно объясняла. Во время приема провела УЗИ, назначила анализы. По итогу приема доктор помог в решении моей проблемы: дала рекомендации. Данного специалиста порекомендовала бы.
Ольга
Очень хороший, внимательный врач, преобладает внутренне спокойствие, пояснял все как будет. На приеме был разговор, доктор успокоил, провел осмотр и консультацию, все объяснил и постоянно спрашивал, как я себя чувствую. По итогу приема провел УЗИ и анализы которые придут на почту.
Анастасия
Юрий Сахманович очень понравился. На приеме все подробно разъяснил и показал. Мне понравился по общению. Профессионал своего дела. Я хотела пойти к другому доктору. Мне посоветовала этого врача клиника. Всю информацию объяснял доступно.
На приеме все подробно разъяснил и показал. Мне понравился по общению. Профессионал своего дела. Я хотела пойти к другому доктору. Мне посоветовала этого врача клиника. Всю информацию объяснял доступно.
Фируза
Все было отлично. Единственно меня заранее не предупредили о ценах на анализа и я была немного не приятно удивлена. В остальном все было супер. Доктор мне помогла в решении моего вопроса. Повторно обращусь при необходимости.
Елена
Все было замечательно. Прием длился не долго, в целом около десяти минут. От консультации я получила ответы на все интересующие меня вопросы, врач сделала УЗИ. Мне все понравилось. Специалиста советую.
Прием длился не долго, в целом около десяти минут. От консультации я получила ответы на все интересующие меня вопросы, врач сделала УЗИ. Мне все понравилось. Специалиста советую.
Евгения
Приятная женщина. Прием прошел отлично. Доктор выслушала мои жалобы, провела осмотр и УЗИ, взяла мазки и выдала направление на необходимые анализы. Я осталась довольна.
Лола
Показать 10 отзывов из 2299Фетоплацентарная недостаточность: причины, проявления, диагностика и лечение
Фетоплацентарная недостаточность — симптомокомплекс, который развивается у беременных женщин. Как видно из названия, состояние влияет на функции плаценты и развитие плода, а также может приводить к его гибели и способствовать различным осложнениям беременности. В акушерской практике фетоплацентарная недостаточность встречается достаточно часто, поэтому большое значение отводится её раннему выявлению и своевременному устранению.
Как видно из названия, состояние влияет на функции плаценты и развитие плода, а также может приводить к его гибели и способствовать различным осложнениям беременности. В акушерской практике фетоплацентарная недостаточность встречается достаточно часто, поэтому большое значение отводится её раннему выявлению и своевременному устранению.
Причины патологии
Развитию фетоплацентарной недостаточности может способствовать много факторов. Наиболее часто выявляется связь со следующими состояниями:
- сопутствующие болезни у матери, которые могут затрагивать сердечно-сосудистую систему, почки, эндокринные железы и другие органы;
- анемия беременных;
- нарушение свертываемости крови с образованием микротромбов в сосудах плаценты;
- инфекции, передающиеся половым путем, и внегенитальные инфекционные заболевания;
- патология репродуктивных органов женщины, которая является следствием врожденных или приобретенных состояний;
- различные виды акушерской патологии (многоплодная беременность, токсикоз, резус-конфликт матери и плода и др.
 ).
).
Вероятность развития фетоплацентарной недостаточности возрастает, если у женщины в анамнезе уже была такая патология, имелись аборты, отмечаются вредные привычки, работа во вредных условиях труда или проживание в местности с неблагоприятной экологической обстановкой.
Как проявляется фетоплацентарная недостаточность?
Клинические проявления выглядят следующим образом:
- развитие внутриутробных инфекций;
- снижение выработки специфических гормонов;
- нарушение сократительной функции матки;
- венозный застой в малом тазу;
- сдвигание срока родов в большую или меньшую сторону;
- развитие много- или маловодия.
Поскольку плацента является главным источником питания и кислорода для плода, изменения её функций сказываются на его состоянии. При фетоплацентарной недостаточности отмечаются признаки гипоксии, которые проявляются повышенной активностью плода на ранних сроках беременности с последующим её снижением, вплоть до полного отсутствия движений. Также отмечаются различные виды задержки внутриутробного развития, которая может быть выражена в отставании от нормы антропометрических показателей и развития внутренних органов. Все эти симптомы, характерные для фетоплацентарной недостаточности, значительно повышают риск прерывания беременности, преждевременных родов и внутриутробной гибели плода.
Также отмечаются различные виды задержки внутриутробного развития, которая может быть выражена в отставании от нормы антропометрических показателей и развития внутренних органов. Все эти симптомы, характерные для фетоплацентарной недостаточности, значительно повышают риск прерывания беременности, преждевременных родов и внутриутробной гибели плода.
Диагностика
Для достоверного выявления фетоплацентарной недостаточности назначается комплексное обследование беременной женщины, в которое входят следующие методы:
- Ультразвуковое исследование. Назначается УЗИ плода, плаценты, определяется кровоток в плаценте посредством доплерографии.
- Определение частоты сердцебиения плода. С этой целью проводится фонокардиография и кардиотокография.
Перед составлением плана обследования врач собирает анамнез, выясняет жалобы, проводит осмотр. Это помогает выявить факторы риска, которые могут приводить к развитию фетоплацентарной недостаточности, и подобрать точные методы диагностики, которые позволят подтвердить или опровергнуть диагноз. Среди дополнительных методик — мазки из влагалища на флору, анализы крови на гормоны и др. Если во время УЗИ врач заметит признаки врожденных изменений плода, то назначается генетическое обследование. Пройти его можно в медико-генетическом центре «Геномед».
Среди дополнительных методик — мазки из влагалища на флору, анализы крови на гормоны и др. Если во время УЗИ врач заметит признаки врожденных изменений плода, то назначается генетическое обследование. Пройти его можно в медико-генетическом центре «Геномед».
Лечение фетоплацентарной недостаточности
Точные методы лечения всегда подбираются индивидуально, в зависимости от клиники и этиологии фетоплацентарной недостаточности. Они могут быть направлены на восстановление питания плода, предупреждение ранних родов, нормализацию кровообращения в плаценте, восстановление тонуса матки и её сократительной функции и др. Такое лечение обычно проводится в стационаре под наблюдением специалистов и с регулярным контролем динамики показателей. Вид родоразрешения при фетоплацентарной недостаточности также подбирается индивидуально. При купировании состояния и отсутствии осложнений возможны естественные роды. В других случаях выполняют кесарево сечение.
Международный всероссийский курс «Маленький плод.
 Допплерометрия в акушерстве: плацентарная недостаточность».
Допплерометрия в акушерстве: плацентарная недостаточность».26 октября, прошел наш долгожданный международный всероссийский курс «Маленький плод. Допплерометрия в акушерстве: плацентарная недостаточность». Автором курса является профессор Иерусалимского университета, руководитель отделения медицины плода и УЗИ в акушерстве клиники Haddas Mount Scopus при университете Иерусалима, выдающийся, всемирно известный эксперт в данной области доктор Дан Вадим Вальски.
Тема, раскрытая на курсе, настолько актуальна для сегодняшней практики, что собрала в зале огромную аудиторию врачей УЗД плода, акушеров-гинекологов Петербурга, Москвы и многих других регионов, и еще большее количество докторов со всех уголков страны подключились к online-трансляции! Ведь тема ведения, диагностики и родоразрешения маловесных и экстремально маловесных плодов ― это дилемма любой акушерской службы!
Вот один из отзывов наших коллег, побывавших на курсе:
«Курс неподражаем своей фундаментальностью. Теория. Аналитика. Практика. Менеджмент. Создалось впечатление, что собственная работа часто направлена исключительно на лечение “невроза” акушеров из-за столь мизерного риска антенатальной гибели плода в большинстве ситуаций и на рост процента недоношенности. В плацентарных проблемах есть внутренняя логика и логика прогресса заболевания. Важно думать в категориях, а не в цифрах.
Теория. Аналитика. Практика. Менеджмент. Создалось впечатление, что собственная работа часто направлена исключительно на лечение “невроза” акушеров из-за столь мизерного риска антенатальной гибели плода в большинстве ситуаций и на рост процента недоношенности. В плацентарных проблемах есть внутренняя логика и логика прогресса заболевания. Важно думать в категориях, а не в цифрах.
Самостоятельные роды ― это как поход в тренажерный зал, и идти туда нужно с определенным запасом прочности. Где точка пересечения этих парабол?!
Это лишь яркие мгновения сегодняшнего действа. Таким Дана Вальски Санкт-Петербург ещё не видел!».
А Петербург не видел профессора Вальски почти 30 лет… Поэтому для нас огромная честь и радость, что местом проведения своего цикла он выбрал нашу клинику, и особая благодарность руководителю отделения пренатальной диагностики клиники «Скандинавия» Марине Михайловне Петровой, которая сделала это возможным и скоординировала всю организацию данного цикла.
Ждем новых встреч.
Фетоплацентарная недостаточность (Фпн) — признаки, причины, симптомы, лечение и профилактика
Диагностика
После сбора анамнестических сведений и физикального осмотра пациентки ей назначаются лабораторные тестирования, оценивающие состояние матери и ребенка в динамике. В этих целях выполняются исследования уровня плацентарного лактогена, эстриола, хорионического гонадотропина, кортизола.
Установление параметров гемостаза и обмена веществ в организме роженицы учитывают с помощью анализа показателей аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы.
Оценку ПЛ-развития проводят, измеряя окружность живота и массу тела беременной, используя кардиотокографию, ультразвуковое исследование (УЗИ) и ПЛ-биометрию. УЗИ-диагностика также необходима для определения дыхательных ПЛ-движений и двигательной ПЛ-активности.
Определение статуса плацентарного кровообращения выполняют с помощью дуплексного сканирования и допплерографии, способных выявить любые гемодинамические расстройства маточно-плацентарного комплекса.
Лечение
Формирование тактики ведения лиц с ФПН-изменениями осуществляется с учетом результатов консультаций акушер-гинеколога, хирурга, гематолога, УЗИ-диагноста.
Лечебные мероприятия при данном недуге предполагают проведение этиотропной терапии по индивидуальным показаниям больной. Они должны быть направлены на ликвидацию ведущих факторов ФПН-возникновения и максимальное пролонгирование гестации.
Этиотропная медикаментозная коррекция осуществляется средствами защиты ПЦ-мембраны, повышающими клеточный уровень аденозинтрифосфорной кислоты, нормализующими маточно-плацентарную гемодинамику, противоанемическими препаратами.
Выбор способа родоразрешения зависит от эффективности ФПН-терапии и благоприятного прогноза относительно естественных родов. Для оказания экстренной помощи показано проведение кесарева сечения.
Профилактика
В основе ФПН-профилактики – раннее обнаружение и клиническое прогнозирование плацентарной дисфункции у пациенток с физиологическим и осложненным течением гестации. При выявлении таких случаев требуется рациональное ведение беременности с постоянным мониторингом состояния женщины и ПЛ-развития с помощью лабораторных и инструментальных методик.
При выявлении таких случаев требуется рациональное ведение беременности с постоянным мониторингом состояния женщины и ПЛ-развития с помощью лабораторных и инструментальных методик.
Литература и источники
Видео по теме:
Плацентарная недостаточность | Беременность Роды и ребенок
Иногда плацента не работает должным образом. Это будет означать, что ребенок не получает кислорода и питательных веществ, в которых он нуждается. Если у вас плацентарная недостаточность, ваш ребенок может плохо расти или у него могут развиться осложнения во время родов.
Заболевание может привести к проблемам как у матери, так и у ребенка. Это связано с преэклампсией и отслойкой плаценты, когда плацента отслаивается от стенки матки.
Он также может препятствовать нормальному росту ребенка в утробе матери, что известно как задержка внутриутробного развития (ЗВУР).У ребенка могут быть серьезные осложнения, в том числе нехватка кислорода во время родов, преждевременные роды, низкий уровень сахара в крови, слишком мало кальция в крови или слишком много эритроцитов, а иногда даже мертворождение.
Что вызывает плацентарную недостаточность?
Плацентарная недостаточность возникает либо из-за неправильного роста плаценты, либо из-за ее повреждения.
Иногда размер плаценты может быть недостаточным, например, если вы вынашиваете близнецов или более.Иногда она имеет неправильную форму или неправильно прилегает к стенке матки.
Ваш образ жизни также может повредить плаценту. Плацентарная недостаточность может возникнуть, если вы курите или принимаете некоторые запрещенные наркотики во время беременности. Медицинские состояния, такие как диабет, преэклампсия и нарушения свертываемости крови, также увеличивают риск.
Каковы симптомы плацентарной недостаточности?
Плацентарная недостаточность бессимптомная.Иногда это диагностируется, когда женщины понимают, что их ребенок не так много двигается. Другими признаками того, что ребенок может развиваться неправильно, является то, что ваш живот стал меньше, чем при предыдущих беременностях.
Заболевание может быть выявлено во время ваших обычных дородовых тестов, которые измеряют рост вашей матки и ребенка. Иногда это замечают во время планового УЗИ.
Как лечится плацентарная недостаточность?
Если ваш врач подозревает плацентарную недостаточность, он будет внимательно следить за ростом вашего ребенка.Вас попросят вести учет движений ребенка и сообщить вашей медицинской бригаде, если вы заметите какие-либо изменения.
Лечение будет зависеть от стадии беременности. Если вам меньше 37 недель, ваш врач может решить подождать как можно дольше и внимательно следить за ребенком. Но если вы доношены или есть признаки того, что ваш ребенок находится в состоянии стресса, они могут решить вызвать роды или родить ребенка с помощью кесарева сечения.
Плацентарная недостаточность — StatPearls — NCBI Bookshelf
Непрерывное обучение
Плацентарная недостаточность — это состояние, при котором происходит нарушение ремоделирования плацентарных сосудов, что приводит к отсутствию плацентации, что приводит к ацидозу и гипоксемии плода.Наиболее распространенные последующие последствия этого состояния для плода включают задержку внутриутробного развития, недоношенность или, к сожалению, гибель плода. Чтобы снизить риск заболеваемости и смертности плода, особенно при беременности с высоким риском, следует проводить регулярный пренатальный скрининг с помощью ультразвуковой допплерографии, чтобы увеличить шансы обнаружения и диагностики. В этом мероприятии рассматриваются патофизиология, оценка и возможные методы лечения плацентарной недостаточности, а также подчеркивается роль межпрофессиональной команды в лечении пациентов с этим заболеванием.
Цели:
Рассмотрите факторы риска, связанные с плацентарной недостаточностью.

Опишите типичные результаты ультразвуковой допплерографии, связанные с плацентарной недостаточностью.
Укажите наиболее распространенные нежелательные явления, связанные с плацентарной недостаточностью.
Введение
Плацентарная недостаточность связана с различными акушерскими расстройствами, такими как преэклампсия и задержка внутриутробного развития, оба из которых предрасполагают к преждевременным родам, основной причине перинатальной заболеваемости и смертности во всем мире.Плохая плацентарная функция чаще всего описывается термином «плацентарная недостаточность» в медицинском сообществе; однако одно исследование выявило проблему отсутствия стандартизированного определения или консенсуса в отношении патогномоничных признаков, относящихся к плацентарной недостаточности.[1]
Это создает много проблем, когда речь идет об изучении плацентарной недостаточности в литературе, но общее понимание состоит в том, что плацентарная недостаточность представляет собой процесс, при котором происходит прогрессирующее ухудшение функционирования плаценты, так что перенос кислорода и питательных веществ к плоду через плаценту нарушается. снижается, завершаясь декомпенсированной гипоксией и ацидозом.[2][3] Этот процесс приводит к гипоксемии плода, которая затем стимулирует снижение метаболических потребностей плода для сохранения уже доступных питательных веществ, что приводит к ограничению внутриутробного роста плода. С гистопатологической точки зрения плацентарная недостаточность может быть определена при наличии фиброза ворсин хориона, маточно-плацентарного тромбоза, плацентарных инфарктов, отложений фибрина или уменьшения количества и площади поверхности ворсинчатого капиллярного дерева.
снижается, завершаясь декомпенсированной гипоксией и ацидозом.[2][3] Этот процесс приводит к гипоксемии плода, которая затем стимулирует снижение метаболических потребностей плода для сохранения уже доступных питательных веществ, что приводит к ограничению внутриутробного роста плода. С гистопатологической точки зрения плацентарная недостаточность может быть определена при наличии фиброза ворсин хориона, маточно-плацентарного тромбоза, плацентарных инфарктов, отложений фибрина или уменьшения количества и площади поверхности ворсинчатого капиллярного дерева.
Следует отметить, что инфаркты плаценты могут быть нормальным явлением, так как они наблюдаются примерно в 25% нормальных доношенных беременностей; однако было показано, что учащение инфаркта плаценты связано с плацентарной недостаточностью и, следовательно, с задержкой внутриутробного развития (ЗВУР).Как МРТ, так и ультразвуковые исследования, направленные на выявление плацентарной недостаточности, продемонстрировали уменьшение площади и объема плаценты, а также увеличение толщины плаценты в дополнение к плацентам шаровидной формы на МРТ [5].
Этиология
На сегодняшний день основные причины, которые могут привести к плацентарной недостаточности, плохо изучены и все еще изучаются. Известны сопутствующие материнские факторы риска, которые включают преэклампсию или другие гипертензивные расстройства у матери, употребление матерью сигарет, употребление матерью наркотиков, включая кокаин или героин, употребление матерью алкоголя, первородство, преклонный возраст матери и наличие в анамнезе родов с ЗВУР у новорожденного.[2][6]
Исследования, анализирующие допплеровские волны в различных плацентарных сосудах матерей, которые курили сигареты во время беременности, продемонстрировали уменьшение волн скорости кровотока, что указывает на то, что воздействие никотина может привести к изменению плацентарной сосудистой сети.[6]
Любое состояние матери, которое может привести к нарушению кровообращения плода, подвергает плод риску развития плацентарной недостаточности. Кроме того, некоторые лекарства, такие как противоопухолевые, противосудорожные или антикоагулянты, могут препятствовать росту плода. Экстремальные значения индекса массы тела матери, включая недоедание матери, также связаны с развитием ЗВУР у новорожденных.[7] Исследования беременности, осложненной ЗВУР, продемонстрировали неполную трансформацию плацентарной сосудистой сети на ранних сроках беременности, которую можно обнаружить с помощью ультразвуковой допплерографии.
Экстремальные значения индекса массы тела матери, включая недоедание матери, также связаны с развитием ЗВУР у новорожденных.[7] Исследования беременности, осложненной ЗВУР, продемонстрировали неполную трансформацию плацентарной сосудистой сети на ранних сроках беременности, которую можно обнаружить с помощью ультразвуковой допплерографии.
Эпидемиология
Недоношенность является ведущей причиной перинатальной смерти, за которой следует задержка внутриутробного развития плода, осложняющая приблизительно от 4% до 6% известных беременностей.Плацентарная недостаточность является потенциальной причиной преждевременных родов, преэклампсии, ЗВУР и мертворождения, которые могут возникать в 10–15 % случаев беременности. Для плода с ЗВУР риск спонтанных преждевременных родов в три раза выше по сравнению с плодом без задержки роста, а также в пять-шесть раз выше риск развития перинатальной смерти [2]. К сожалению, примерно у 50% новорожденных ЗВУР выявляют только после родов.
Патофизиология
Хотя основная этиология плацентарной недостаточности неизвестна, существуют предполагаемые механизмы. Плацентарная недостаточность связана со снижением кровотока через пупок к плоду, что может быть вторичным по отношению к повышенному сопротивлению пуповинно-плацентарных сосудов. Это повышенное сопротивление можно визуализировать как аномальные допплеровские кривые скорости кровотока в пупочной артерии и оно может быть вторичным по отношению к аномалии прикрепления ворсинок к плацентарной мембране, нарушению перфузии между пупком и плацентой или снижению маточно-плацентарного кровотока.[2] Исследования допплерографии пупочной артерии показали, что степень повреждения плаценты напрямую связана со степенью повреждения плода во время беременности.[9]
Плацентарная недостаточность связана со снижением кровотока через пупок к плоду, что может быть вторичным по отношению к повышенному сопротивлению пуповинно-плацентарных сосудов. Это повышенное сопротивление можно визуализировать как аномальные допплеровские кривые скорости кровотока в пупочной артерии и оно может быть вторичным по отношению к аномалии прикрепления ворсинок к плацентарной мембране, нарушению перфузии между пупком и плацентой или снижению маточно-плацентарного кровотока.[2] Исследования допплерографии пупочной артерии показали, что степень повреждения плаценты напрямую связана со степенью повреждения плода во время беременности.[9]
Основная роль плаценты заключается в том, чтобы служить связующим звеном между кровообращением плода и матери. Для этого необходимо обеспечить прилегание плаценты и ремоделирование артерий матки, чтобы обеспечить доставку питательных веществ к растущему плоду. Отличительной чертой успешной плацентации является ремоделирование маточных артерий. После оплодотворения формируется бластоциста, состоящая из внутренней клеточной массы, которая в конечном итоге станет плодом, и внешней оболочки, называемой трофобластом, которая становится плодной частью плаценты.Чтобы способствовать прилипанию к плаценте, цитотрофобласт, который является внутренним слоем трофобласта, секретирует металлопротеиназы матрикса, которые разрушают блестящую оболочку, а прилипанию способствует образование якорных ворсинок и экспрессия молекул адгезии.[10] Это вторжение в маточно-плацентарные артерии позволяет ремоделировать их в расширенные, с низким сопротивлением, неэластичные сосуды, в которых отсутствует вазомоторный контроль со стороны матери, что приводит к увеличению маточно-плацентарной перфузии, что позволяет удовлетворить потребности плода.[5] Любое нарушение процесса ремоделирования может привести к увеличению сопротивления маточно-плацентарных сосудов, что приводит к гипоперфузии плаценты и ее последующим эффектам, включая активацию коагуляции, дисфункцию эндотелиальных клеток, плацентарный тромбоз и отложения фибрина, что связано с развитие IUGR.
После оплодотворения формируется бластоциста, состоящая из внутренней клеточной массы, которая в конечном итоге станет плодом, и внешней оболочки, называемой трофобластом, которая становится плодной частью плаценты.Чтобы способствовать прилипанию к плаценте, цитотрофобласт, который является внутренним слоем трофобласта, секретирует металлопротеиназы матрикса, которые разрушают блестящую оболочку, а прилипанию способствует образование якорных ворсинок и экспрессия молекул адгезии.[10] Это вторжение в маточно-плацентарные артерии позволяет ремоделировать их в расширенные, с низким сопротивлением, неэластичные сосуды, в которых отсутствует вазомоторный контроль со стороны матери, что приводит к увеличению маточно-плацентарной перфузии, что позволяет удовлетворить потребности плода.[5] Любое нарушение процесса ремоделирования может привести к увеличению сопротивления маточно-плацентарных сосудов, что приводит к гипоперфузии плаценты и ее последующим эффектам, включая активацию коагуляции, дисфункцию эндотелиальных клеток, плацентарный тромбоз и отложения фибрина, что связано с развитие IUGR. [5][3] Кроме того, если есть потеря фокальной адгезии эндоваскулярных трофобластов, можно увидеть уменьшение площади поверхности плаценты, связанное с плацентарной недостаточностью.Это уменьшение площади плацентарной поверхности, наряду с увеличением толщины плаценты, придает плаценте шаровидный вид, что постулируется как компенсаторный механизм плацентарной недостаточности.
[5][3] Кроме того, если есть потеря фокальной адгезии эндоваскулярных трофобластов, можно увидеть уменьшение площади поверхности плаценты, связанное с плацентарной недостаточностью.Это уменьшение площади плацентарной поверхности, наряду с увеличением толщины плаценты, придает плаценте шаровидный вид, что постулируется как компенсаторный механизм плацентарной недостаточности.
Внутриутробная среда представляет собой среду с низким содержанием кислорода, поэтому кровообращение плода должно быть гибким, чтобы адаптироваться к любым изменениям, происходящим с маточно-плацентарной функцией.[9] Эта гипоксическая среда стимулирует ангиогенез, в результате чего образуются сосудистые связи между материнским кровообращением и межворсинчатым пространством.Теперь, когда создана сосудистая и питательная сеть поддержки, формируется трофобласт ворсинок, который состоит из материнских микроворсинок и базального слоя плода.[10] Для поддержания плацентарной функции требуется большое количество энергии, на что указывает тот факт, что в нормальном физиологическом состоянии плацента потребляет примерно 70% глюкозы и 40% кислорода, которые в норме поступают в матку. Следовательно, для достижения оптимального роста и развития плода доставка питательных веществ в матку должна превышать потребности плаценты, чтобы оставались питательные вещества для использования плодом.[10] Таким образом, любое нарушение доставки питательных веществ в матку влияет на доставку питательных веществ к плоду.
Следовательно, для достижения оптимального роста и развития плода доставка питательных веществ в матку должна превышать потребности плаценты, чтобы оставались питательные вещества для использования плодом.[10] Таким образом, любое нарушение доставки питательных веществ в матку влияет на доставку питательных веществ к плоду.
На успешную плацентацию может негативно повлиять латерализация, когда инвазия плаценты происходит в одну сторону, а плацента имплантируется не центрально. Если плацента остается асимметричной до срока, ультразвуковая допплерография продемонстрирует стойкие насечки на неимплантированной стороне, что приведет к относительной плацентарной недостаточности. Латерализация плаценты также была связана с повышенным риском развития материнской преэклампсии и, следовательно, плацентарной недостаточности ниже по течению.[9][11]
Анамнез и медицинский осмотр
Поскольку задержка внутриутробного развития является одним из основных исходов, связанных с плацентарной недостаточностью, большинство выживших новорожденных поступают либо преждевременно, и их называют новорожденными с «экстремально низкой массой тела при рождении» (ЭНМТ), либо в зависимости от того, когда произошло нарушение кровоснабжения, они могут иметь измененные пропорции тела при рождении. При отторжении плаценты последующие эффекты, такие как ЗВУР, клинически очевидны при допплеровском исследовании примерно на 26-й неделе беременности.[9]
При отторжении плаценты последующие эффекты, такие как ЗВУР, клинически очевидны при допплеровском исследовании примерно на 26-й неделе беременности.[9]
При подозрении на ЗВУР, независимо от того, является ли он вторичным по отношению к плацентарной недостаточности или другой этиологии, плоду будет полезен частый комбинированный мониторинг с использованием как допплеровского, так и биофизического профиля. Эта комбинация методов скрининга позволяет распознать снижение производительности, наблюдаемое, когда ЗВУР связана с плацентарными проблемами. Используя допплеровское исследование, неудачную плацентацию можно визуализировать по зазубринам в маточных артериях, а также по увеличению сопротивления в пупочной артерии с прогрессированием либо до отсутствия, либо до обратного конечно-диастолического объема.Одним из первых признаков, наблюдаемых в биофизическом профиле при подозрении на патологию плода, является нереактивная запись сердечного ритма плода. Следующее будет либо плохим, либо потерей движений тела плода, дыхательных движений и тонуса. Эти признаки ухудшения допплеровского статуса и плохие биофизические профили типичны при дистрессе плода, который часто встречается при плацентарной недостаточности и может указывать на необходимость родоразрешения.
Эти признаки ухудшения допплеровского статуса и плохие биофизические профили типичны при дистрессе плода, который часто встречается при плацентарной недостаточности и может указывать на необходимость родоразрешения.
Оценка
В настоящее время отсутствуют критерии для диагностики плацентарной недостаточности, так как нет и стандартизированных методов диагностики.Частично проблема связана с большим разнообразием терминологии, используемой для описания того, что известно как «плацентарная недостаточность». и плацентарного кровообращения как в здоровом, так и в болезненном состоянии. Было обнаружено, что четыре допплеровских метода являются основными для получения полезной информации о кровообращении плода и матери, включая исследования пупочной артерии, исследования маточных артерий, исследования средней мозговой артерии и исследования венозного протока.[9] Поскольку плод продолжает созревать во время беременности к сроку, происходит множество изменений кровообращения, которые можно оценить с помощью ультразвуковой допплерографии.
До наступления беременности в маточных артериях наблюдается низкий диастолический кровоток, высокое сопротивление и эластическая тяга, отмеченная в виде ранних диастолических насечек. Успешная плацентация предполагает удаление интимной мышцы из сосудистой сети таким образом, чтобы кровеносные сосуды имели сильный диастолический кровоток, минимальное сопротивление и не обладали эластическими свойствами.При успешной плацентации ультразвуковая допплерография показывает, что ремоделирование происходит быстро, так что к 12 неделям беременности происходит потеря надрезов, а резистентность снижается к 20 неделям беременности или ранее. При отторжении плаценты зарубка сохраняется, а резистентность остается высокой, что, как было показано, коррелирует с осложнениями плода, связанными с материнской гипертонией, включая ЗВУР, преэклампсию и гибель плода [9]. Было показано, что использование маточных артерий для допплеровского скрининга для оценки надрезов и резистентности, чтобы помочь выявить эти ситуации с высоким риском, дает примерно 85% чувствительности для выявления тяжелой ЗВУР и преэклампсии.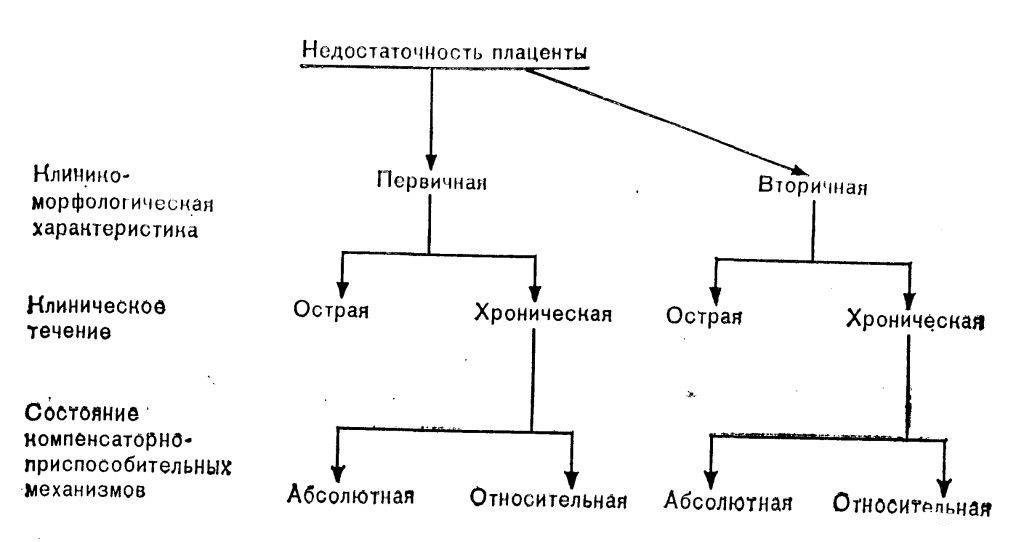
По мере увеличения сопротивления плаценты допплеровские исследования пупочной артерии могут демонстрировать либо нормальную, либо сниженную, либо отсутствующую, либо обратную конечно-диастолическую скорость.[12][8] Высокое сопротивление плаценты на ранних сроках беременности является нормальным явлением, и поэтому можно ожидать, что конечная диастолическая скорость будет отсутствовать при допплеровском исследовании до 12–14 недель беременности. Когда плацента успешно прорастает, резистентность падает, а допплеровское исследование пупочной артерии должно демонстрировать непрерывный кровоток к 14–18 неделям беременности.[9] Стойкое сопротивление пупочной артерии на протяжении всей беременности является показателем повышенного риска плацентарной недостаточности.
В то время как допплеровское исследование пупочной артерии дает важную информацию о возможном поражении плаценты, ценным дополнением является также использование допплеровского исследования средней мозговой артерии (СМА). MCA предоставляет информацию о реакциях системного кровообращения у развивающегося плода, поскольку он представляет сопротивление нижележащей микроциркуляции головного мозга.Нормальная допплерография СМА показывает высокое сопротивление на протяжении всей беременности; тем не менее, плацентарное заболевание можно идентифицировать, когда наблюдается увеличение диастолического потока наряду со снижением пульсового индекса. Таким образом, допплеровское исследование СМА может предоставить важную дополнительную информацию, когда есть подозрение на тяжелую ЗВУР, указывая на то, что может быть нарушение плода и может потребоваться вмешательство.
MCA предоставляет информацию о реакциях системного кровообращения у развивающегося плода, поскольку он представляет сопротивление нижележащей микроциркуляции головного мозга.Нормальная допплерография СМА показывает высокое сопротивление на протяжении всей беременности; тем не менее, плацентарное заболевание можно идентифицировать, когда наблюдается увеличение диастолического потока наряду со снижением пульсового индекса. Таким образом, допплеровское исследование СМА может предоставить важную дополнительную информацию, когда есть подозрение на тяжелую ЗВУР, указывая на то, что может быть нарушение плода и может потребоваться вмешательство.
Другой формой допплерографии, которая дает представление о здоровье плаценты и плода, является венозная допплерография, которая передает информацию, относящуюся к сердечным данным, когда кровообращение плода испытывает стресс.Венозная кривая, которая, как было показано, обеспечивает наилучшие клинические данные, представляет собой венозный проток. Есть много преимуществ использования венозного протока по сравнению с другими венозными волнами, которые включают его реакцию на изменения оксигенации, он является одним из основных регуляторов венозного возврата при аномальном и нормальном кровообращении плода, он не зависит от сердечной функции, он служит прямой канал для просмотра ретроградных пульсовых волн правого предсердия, и, наконец, поскольку он имеет повышенный и фокальный цветной допплеровский сигнал скорости уже с 12 недель беременности до 40 недель беременности, его очень легко визуализировать.[9] Если аномальный венозный проток или ретроградная предсердная волна визуализируются при допплерографии примерно на 12–14 неделе беременности, существует повышенный риск сердечных аномалий плода, и это также служит возможным предвестником, указывающим на тяжелую ЗВУР на основе плаценты.
Есть много преимуществ использования венозного протока по сравнению с другими венозными волнами, которые включают его реакцию на изменения оксигенации, он является одним из основных регуляторов венозного возврата при аномальном и нормальном кровообращении плода, он не зависит от сердечной функции, он служит прямой канал для просмотра ретроградных пульсовых волн правого предсердия, и, наконец, поскольку он имеет повышенный и фокальный цветной допплеровский сигнал скорости уже с 12 недель беременности до 40 недель беременности, его очень легко визуализировать.[9] Если аномальный венозный проток или ретроградная предсердная волна визуализируются при допплерографии примерно на 12–14 неделе беременности, существует повышенный риск сердечных аномалий плода, и это также служит возможным предвестником, указывающим на тяжелую ЗВУР на основе плаценты.
МРТ позволяет получить дополнительную информацию для обнаружения и диагностики плацентарной недостаточности. Пустоты потока возникают, когда наблюдается потеря сигнала МРТ в кровеносном сосуде, где кровь течет энергично. При использовании Т2-взвешенной визуализации с усилением релаксации (RARE) плацентарная недостаточность может быть обнаружена, когда между плацентой и маткой наблюдаются уменьшенные пустоты потока, поскольку это можно рассматривать как отражение снижения маточно-плацентарной перфузии. Дополнительным преимуществом МРТ является высокая контрастность мягких тканей. Таким образом, плацентарные сосудистые аномалии, в том числе кровоизлияния и инфаркты, могут быть обнаружены на МРТ плаценты, что указывает на высокий риск плацентарной недостаточности и ЗВУР ниже по течению.
При использовании Т2-взвешенной визуализации с усилением релаксации (RARE) плацентарная недостаточность может быть обнаружена, когда между плацентой и маткой наблюдаются уменьшенные пустоты потока, поскольку это можно рассматривать как отражение снижения маточно-плацентарной перфузии. Дополнительным преимуществом МРТ является высокая контрастность мягких тканей. Таким образом, плацентарные сосудистые аномалии, в том числе кровоизлияния и инфаркты, могут быть обнаружены на МРТ плаценты, что указывает на высокий риск плацентарной недостаточности и ЗВУР ниже по течению.
Лечение/управление
В настоящее время не существует известного лечения плацентарной недостаточности, кроме родоразрешения, если оно находится в жизнеспособном состоянии. Было показано, что низкие дозы аспирина и использование антиоксидантной терапии, включая витамины С и Е, способствуют улучшению плацентации в тех случаях, когда существует неопределенность в отношении успешной плацентации.[9] Исследования показали, что при подозрении на ЗВУР во время беременности перинатальная смертность снижается примерно на 38%. [12][13]
[12][13]
Женщинам из группы высокого риска, например, с хронической гипертензией, коагулопатиями или преэклампсией в анамнезе, может быть полезно проведение ультразвукового допплеровского скрининга на сроке от 12 до 14 недель беременности, потому что, если двусторонняя насечка очевидна, затем следует начать терапию низкими дозами аспирина.
Исследования in vitro показали, что гепарин может стимулировать неоангиогенез, а также улучшать плацентарную перфузию. Антикоагулянтные свойства гепарина проявляются в его способности мобилизовать фактор тканевого ингибирования в кровообращение, а также в том, что он также усиливает антитромбиновую активность.Дополнительные преимущества гепарина при рассмотрении плацентарной недостаточности и ее последующих последствий заключаются в том, что гепарин способствует пролиферации трофобластов, уменьшает воспаление за счет подавления каскада комплемента, снижает апоптоз, а также косвенно действует как фактор роста [3].
Было также показано, что гепарин активирует определенные белки, участвующие в плацентарном ангиогенезе и развитии. К ним относятся ангиопоэтин-2, отвечающий за ремоделирование сосудов ворсин хориона, лептин, отвечающий за регуляцию переноса питательных веществ, а также рецептор фактора роста эндотелия сосудов-3, тканевой ингибитор матриксной металлопротеазы-1, фактор некроза опухоли-альфа. и ангиостатин.Основываясь на его свойствах и предварительных данных, некоторые исследования показали, что гепарин может играть роль в профилактическом лечении плацентарной болезни.
К ним относятся ангиопоэтин-2, отвечающий за ремоделирование сосудов ворсин хориона, лептин, отвечающий за регуляцию переноса питательных веществ, а также рецептор фактора роста эндотелия сосудов-3, тканевой ингибитор матриксной металлопротеазы-1, фактор некроза опухоли-альфа. и ангиостатин.Основываясь на его свойствах и предварительных данных, некоторые исследования показали, что гепарин может играть роль в профилактическом лечении плацентарной болезни.
Дифференциальный диагноз
Существует множество факторов, которые могут способствовать развитию плацентарной недостаточности, и известно, что ЗВУР является серьезным последующим осложнением; однако иногда может быть трудно отличить новорожденного с малым весом для гестационного возраста (SGA) от новорожденного с IUGR. Одно из основных преимуществ допплеровских исследований, особенно пупочной артерии, заключается в том, что аномальные допплеровские исследования пупочной артерии можно использовать для дифференциации между патологической ЗВУР и новорожденным с малым весом для гестационного возраста, таким образом определяя, при какой беременности требуется высокоуровневое наблюдение. по сравнению с рутинным мониторингом.[9][14]
по сравнению с рутинным мониторингом.[9][14]
Если средний предполагаемый вес плода ниже 10-го процентиля для определенного гестационного возраста, этот плод является SGA. И наоборот, плод с ЗВУР не сможет достичь нормального роста, как правило, вследствие плацентарной недостаточности, генетического заболевания или инфекции.[14] Таким образом, новорожденный с SGA будет физически маленьким, но в целом здоровым, по сравнению с новорожденным с IUGR, который также может быть физически маленьким, но, вероятно, его здоровье будет скомпрометировано.
При рассмотрении дифференциальных диагнозов, которые способствуют плацентарной недостаточности, известны сопутствующие заболевания, включая, помимо прочего, преэклампсию, гипертензивные расстройства у матери, поскольку оба они нарушают плацентарную резистентность и маточно-плацентарный кровоток.Другие заболевания, которые следует учитывать, включают маловодие и недоедание матери или ограничение калорий.
Прогноз
Если новорожденный страдает ЗВУР вследствие плацентарной недостаточности и выживает в перинатальном периоде, он подвергается более высокому риску развития когнитивных нарушений в детстве, чем детский церебральный паралич и судорожные расстройства, по сравнению с новорожденным без задержки роста. Пациенты, страдающие плацентарной недостаточностью, часто имеют аномальные кривые скорости кровотока в пупочной артерии (DFVW), и когда в одном исследовании сравнивали DFVW младенцев, у которых была плацентарная недостаточность внутриутробно, с теми младенцами, у которых ее не было, они обнаружили, что младенцы, у которых была аномальная У DFVW также был более низкий IQ, когда им было 5 лет.Имеются также данные о том, что ЗВУР в младенчестве предрасполагает к хроническим заболеваниям во взрослом возрасте, включая повышенный риск развития ишемической болезни сердца, гипертонии и диабета.[2]
Пациенты, страдающие плацентарной недостаточностью, часто имеют аномальные кривые скорости кровотока в пупочной артерии (DFVW), и когда в одном исследовании сравнивали DFVW младенцев, у которых была плацентарная недостаточность внутриутробно, с теми младенцами, у которых ее не было, они обнаружили, что младенцы, у которых была аномальная У DFVW также был более низкий IQ, когда им было 5 лет.Имеются также данные о том, что ЗВУР в младенчестве предрасполагает к хроническим заболеваниям во взрослом возрасте, включая повышенный риск развития ишемической болезни сердца, гипертонии и диабета.[2]
Чтобы обеспечить лучший прогноз для новорожденного, приоритет должен быть сосредоточен на вмешательствах, которые позволяют максимально увеличить гестационный возраст при рождении. Подсчитано, что на каждую неделю продления беременности для плодов между 24-й и 28-й неделями выживаемость без сопутствующих осложнений увеличивается примерно на 10-15%.[3]
Осложнения
Последующие эффекты плацентарной недостаточности на развивающийся плод сложны и многофакторны; однако основными эффектами, как правило, являются плацентарная дыхательная недостаточность и гипоксемия плода, оба из которых способствуют ограничению внутриутробного развития и связанным с ним последствиям, включая недоношенность.
Самым опасным осложнением, очевидно, является полное отсутствие плаценты и, как следствие, выкидыш. Для развивающегося плода степень аномалий пупочной артерии, наблюдаемая при допплерографии, коррелирует с ацидозом, потребностью в реанимации, прессорной поддержке, дыхательной поддержке, а также полисистемной недостаточностью органов, которая имеет тенденцию возникать при гипоксемии, поскольку это вызывает перераспределение кровотока. у развивающегося плода в основные органы, такие как мозг и сердце, за счет других соответствующих органов, таких как кишечник и почки.[14] Кроме того, когда допплеровские исследования демонстрируют отсутствие или реверсию конечно-диастолического кровотока, у новорожденных увеличивается частота внутрижелудочковых кровоизлияний.[9]
При повышении резистентности плаценты во время беременности плод с уже ЗВУР подвергается дальнейшему риску гипогликемии, гипоксически-ишемической энцефалопатии, тромбоцитопении, лейкопении и анемии.[8] Кроме того, есть данные, свидетельствующие о том, что у младенцев существует риск развития когнитивного дефицита в детстве, а затем развития хронических заболеваний во взрослом возрасте.
Предупреждение и просвещение пациентов
Крайне важно, чтобы регулярный пренатальный скрининг и ультразвуковое исследование проводились во время беременности женщины, чтобы обеспечить наилучшие возможные результаты для новорожденного. Хотя окончательных профилактических мер для плацентарной недостаточности не существует, после того, как она была распознана с помощью УЗИ, МРТ, плацентарной недостаточности или любой комбинации этих методов, можно начинать такие вмешательства, как терапия гепарином, с надеждой на продление беременности с надеждой на минимизацию ацидоз и гипоксия и, как следствие, ЗВУР, недоношенность или гибель плода.Необходимо провести дальнейшие исследования вмешательств и методов лечения, и во время беременности они принесут наибольшую пользу развивающемуся плоду.
Pearls and Other Issues
Определенного лекарства от плацентарной недостаточности не существует, но последствия можно свести к минимуму, если диагностировать ее на ранней стадии, и мать получает надлежащий дородовой уход. Недавний метаанализ показал, что гепарин может стимулировать рост плода и пролонгировать беременность, если гепарин назначается пациентам с высоким подозрением на плацентарную недостаточность, но не снижает неблагоприятных исходов у новорожденных.
Недавний метаанализ показал, что гепарин может стимулировать рост плода и пролонгировать беременность, если гепарин назначается пациентам с высоким подозрением на плацентарную недостаточность, но не снижает неблагоприятных исходов у новорожденных.
Улучшение результатов медицинских бригад
На основании допплеровских исследований самые ранние признаки отслойки плаценты, скорее всего, не будут обнаружены, по крайней мере, после 12 недель беременности, что коррелирует с проспективным когортным исследованием, которое продемонстрировало скрининг плацентарной функции при беременностях с высоким риском во втором триместре по сравнению с первым триместром был лучшим предиктором неблагоприятных перинатальных исходов.[15]
При обсуждении плацентарной недостаточности предполагается участие как минимум двух групп, если не больше, для оказания помощи пациентам, поскольку одна группа будет нести ответственность за пренатальное наблюдение за матерью и плодом, а другая группа будет заниматься для новорожденного после родов. Ведение как матери, так и ребенка с задержкой внутриутробного развития требует междисциплинарной команды, состоящей из акушеров-гинекологов, неонатальных реаниматологов, медсестер акушерства и отделения интенсивной терапии, респираторных терапевтов, фармацевтов, пульмонологов, а иногда и других специальностей, включая хирургию, инфекционные заболевания или генетику.
Ведение как матери, так и ребенка с задержкой внутриутробного развития требует междисциплинарной команды, состоящей из акушеров-гинекологов, неонатальных реаниматологов, медсестер акушерства и отделения интенсивной терапии, респираторных терапевтов, фармацевтов, пульмонологов, а иногда и других специальностей, включая хирургию, инфекционные заболевания или генетику.
У новорожденных с ЗВУР часто развиваются хронические заболевания легких, вторичные по отношению к их недоношенности, и может потребоваться несколько лекарств, а также домашняя оксигенация, или у них могут развиться множественные инфекции, включая некротизирующий энтероколит или поздний сепсис, все из которых требуют координации между вышеупомянутые команды, чтобы обеспечить улучшенные результаты для пациента.Иногда, в зависимости от исхода беременности, важно привлечь комитет по этике или группу паллиативной помощи. Зачастую семьям легче организовать семейные встречи, на которых присутствует хотя бы один член от каждой специализированной группы, поскольку это улучшает общение между всеми командами и дает семьям возможность задать свои вопросы сразу всем специалистам.
Ссылки
- 1.
- Хант К., Кеннеди С.Х., Ватиш М. Определения и сообщения о плацентарной недостаточности в биомедицинских журналах: обзор литературы.Eur J Obstet Gynecol Reprod Biol. 2016 окт.; 205:146-9. [PubMed: 27591716]
- 2.
- Ганьон Р. Плацентарная недостаточность и ее последствия. Eur J Obstet Gynecol Reprod Biol. 22 сентября 2003 г .; 110 Приложение 1: S99-107. [PubMed: 12965097]
- 3.
- Mazarico E, Molinet-Coll C, Martinez-Portilla RJ, Figueras F. Терапия гепарином при плацентарной недостаточности: систематический обзор и метаанализ. Acta Obstet Gynecol Scand. 2020 фев; 99 (2): 167-174. [PubMed: 31519033]
- 4.
- Агарвал Р., Тивари А., Вадхва Н., Радхакришнан Г. Гистопатологические данные плаценты при недоношенности/доношенности и раннем/позднем начале малы для гестационного возраста: являются ли они значимыми? Индиан Дж. Патол Микробиол. 2017 г., апрель-июнь; 60(2):232-235. [PubMed: 28631641]
- 5.

- Огия Й, Нобусава Х, Сейно Н, Миягами О, Яги Н, Хирото С, Мунечика Дж, Хиросе М, Такэяма Н, Охике Н, Мацуока Р, Секидзава А, Гокан Т. МРТ-визуализация плодов для оценки плацентарной недостаточности. Magn Reson Med Sci.2016;15(2):212-9. [Статья бесплатно PMC: PMC5600058] [PubMed: 26607809]
- 6.
- Pintican D, Poienar AA, Strilciuc S, Mihu D. Влияние курения матери на васкуляризацию плаценты человека: систематический обзор. Тайвань J Obstet Gynecol. 2019 июль; 58 (4): 454-459. [PubMed: 31307732]
- 7.
- Audette MC, Kingdom JC. Скрининг задержки роста плода и плацентарной недостаточности. Semin Fetal Neonatal Med. 2018 апр; 23 (2): 119-125. [PubMed: 29221766]
- 8.
- Башат А.А., Харман К.Р., Гембрух У. Гематологические последствия плацентарной недостаточности. Arch Dis Child Fetal Neonatal Ed. 2004 Январь;89(1):F94. [Бесплатная статья PMC: PMC1721655] [PubMed: 14711871]
- 9.
- Harman CR, Baschat AA. Комплексная оценка состояния плода: какие допплеровские исследования следует провести? Curr Opin Obstet Gynecol.
 2003 г., 15 апреля (2): 147–57. [PubMed: 12634607]
2003 г., 15 апреля (2): 147–57. [PubMed: 12634607] - 10.
- Башат А.А. Реакция плода на плацентарную недостаточность: обновление.БЖОГ. 2004 г., октябрь; 111 (10): 1031-41. [PubMed: 15383103]
- 11.
- Юсуф С., Ахмад А., Кадир С., Гул С., Тали С.Х., Шахин Ф., Ахтар С., Дар Р. Использование плацентарной латеральности и допплеровских аномалий маточных артерий для прогнозирования преэклампсии. J Obstet Gynaecol Индия. 2016 окт; 66 (Приложение 1): 212-6. [Бесплатная статья PMC: PMC5016443] [PubMed: 27651606]
- 12.
- Seyam YS, Al-Mahmeid MS, Al-Tamimi HK. Допплерометрия кровотока в пупочной артерии при задержке внутриутробного развития и ее связь с перинатальным исходом.Int J Gynaecol Obstet. 2002 г., май; 77 (2): 131–137. [PubMed: 12031563]
- 13.
- Alfirevic Z, Neilson JP. Ультразвуковая допплерография при беременности с высоким риском: систематический обзор с метаанализом. Am J Obstet Gynecol. 1995 г., май; 172(5):1379-87.
 [PubMed: 7755042]
[PubMed: 7755042] - 14.
- Kalache KD, Dückelmann AM. Доплер в акушерстве: за пупочной артерией. Клин Обстет Гинекол. 2012 март; 55(1):288-95. [PubMed: 22343245]
- 15.
- Коста С.Л., Проктор Л., Додд Дж.М., Тоал М., Окун Н., Джонсон Дж.А., Уиндрим Р., Королевство Дж.К.Скрининг плацентарной недостаточности при беременности высокого риска: лучше ли раньше? Плацента. 2008 декабря; 29 (12): 1034-40. [PubMed: 18930542]
OP 52 Силденафил для лечения плацентарной недостаточности – доклинический метаанализ роста плода и артериального давления матери
Разрыв матки в норме. Elle est très red, peu supçonnée, avec des facteurs de risque mal identifies. Il y a donc souvent un retard de Prize en charge avec une morbi-mortalité fœto-maternelle plus Importante.Nous avons voulu décrire écrire la présentation clinique, la Prize en charge et le pronostic maternel et néonatal de cette complication.
Ретроспективное описательное исследование 13 матернитов, связанных с серией 10 случаев разрыва матки в связи с беременностью в третий триместр.
L’incidence était de 2,8/100 000 naissances. Хирургический прием ле-консерватора 9 cas sur 10, le pronostic maternel était bon aucun cas de décès maternel et 6 sur 7patientes ayant eu au moins une grandesse ultérieur.Le pronostic foetal était plus reservé, avec 2 morts foetales ou néonatales et 1 инвалид moteur. Парми ле пациентов, 6/6 (100 %) на eu au moins une césarienne itérative lors des Grossesses suivantes avec des foetus en bonne santé.
Серия 10 cas sur 25 ans, la morbidité et la fatalité maternelles fœtales étaient Importantes, в согласии с донами литературы. Le pronostic maternel demeurait bon. Lorsque le traitement chirurgical est conservateur, une grandesse ultérieure est envisageable et une cesarienne itérative doit être pratiquée.
Разрыв матки в здоровой матке является редким акушерским осложнением, мало заподозренным и с плохо выявленными факторами риска. Таким образом, существует частая задержка лечения и, следовательно, важная заболеваемость и смертность плода и матери.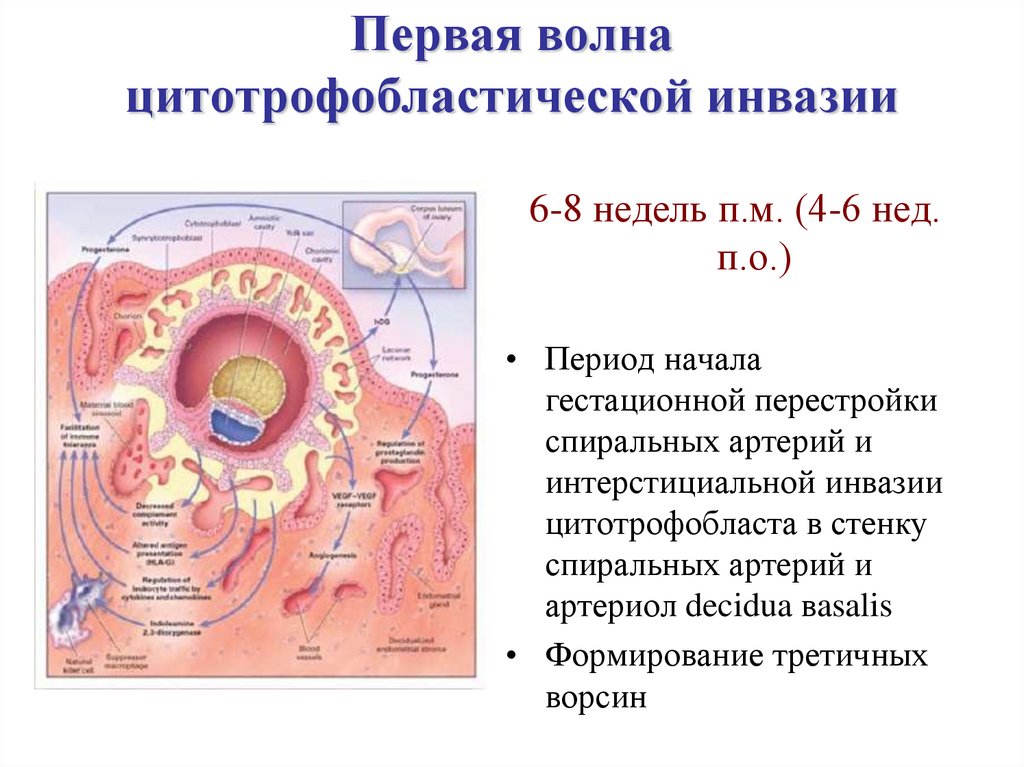 В этой статье описываются клинические признаки и симптомы, лечение, а также прогноз для матери и новорожденного при разрыве матки.
В этой статье описываются клинические признаки и симптомы, лечение, а также прогноз для матери и новорожденного при разрыве матки.
Описательное ретроспективное исследование в 13 родильных домах, сообщившее о 10 сериях случаев разрыва матки на беременной здоровой матке в третьем триместре беременности.
Заболеваемость составила 2,8/100 000 рождений. Хирургическое лечение было консервативным в 9 из 10 случаев, прогноз для матери был благоприятным, материнской смертности не было, у 6 из 7 пациенток была хотя бы одна последующая беременность. Прогноз для плода был более сдержанным, с 2 случаями гибели плода или новорожденного и 1 с моторной инвалидностью. 6/6 пациенток (100%) перенесли хотя бы одно повторное кесарево сечение при последующих беременностях здоровыми плодами.
В этой серии из 10 случаев за 25 лет заболеваемость и смертность матери и плода были значительными, что согласуется с данными литературы.Прогноз для матери оставался благоприятным. При консервативном хирургическом лечении возможна последующая беременность и необходимо повторное кесарево сечение.
Недоедание плода, плацентарная недостаточность и программирование развития β-клеток поджелудочной железы в период внутриутробного развития
Одним из основных факторов, влияющих на питание плода, является поступление питательных веществ к плоду от матери, которое напрямую зависит от роста и функции плаценты плода. Когда плацента неисправна, она не может снабжать растущий плод достаточным количеством кислорода, питательных веществ и других факторов, а без этой жизненно важной поддержки плод не может расти и развиваться в полную силу.Плацентарная недостаточность может привести к задержке внутриутробного развития (ЗВУР) — состоянию, при котором внутриутробный плод не может полностью раскрыть свой генетический потенциал для роста и размера. ЗВУР влияет примерно на 4–15% беременностей (125, 134), а недоедание матери во время беременности является фактором риска ЗВУР (13). Обширный массив данных как эпидемиологических исследований на людях, так и исследований на животных показывает, что питательные факторы плода в утробе матери обуславливают значительную предрасположенность к диабету 2 типа (СД2). В большинстве моделей IUGR замешано неправильное программирование определенных тканей, чувствительных к питательным веществам, таких как β-клетки поджелудочной железы (4, 153).Цель этого обзора — дать практическую оценку современных моделей ЗВУР с особым акцентом на возникающую роль плацентарной недостаточности и ее влияние на развитие и рост инсулин-продуцирующих β-клеток у плода.
В большинстве моделей IUGR замешано неправильное программирование определенных тканей, чувствительных к питательным веществам, таких как β-клетки поджелудочной железы (4, 153).Цель этого обзора — дать практическую оценку современных моделей ЗВУР с особым акцентом на возникающую роль плацентарной недостаточности и ее влияние на развитие и рост инсулин-продуцирующих β-клеток у плода.
Плацентарная недостаточность возникает, когда плацента не может обеспечить плод достаточным количеством питательных веществ и секретируемых факторов. На неспособность плаценты удовлетворять потребности плода может влиять ряд факторов, включая измененный кровоток матери или плода, снижение способности к транспорту питательных веществ, изменения уровня плацентарных циркулирующих гормонов и содержание экзосом, секретируемых плацентой плоду. 42, 93, 149, 172).Растущее количество данных свидетельствует о том, что ЗВУР является критическим фактором, определяющим неонатальную заболеваемость и смертность (151), а также риск хронических и метаболических заболеваний на протяжении всей жизни (6, 162). Несмотря на множество исследований, молекулярные механизмы, связывающие ЗВУР и предрасположенность к метаболическим заболеваниям, таким как ожирение и СД2 (4, 69, 92, 109, 144), остаются плохо изученными. Как отмечалось выше, в этом обзоре основное внимание будет уделено влиянию плаценты на фетальное программирование СД2 и на программирование ЗВУР при дисфункции β-клеток (21, 58).
Несмотря на множество исследований, молекулярные механизмы, связывающие ЗВУР и предрасположенность к метаболическим заболеваниям, таким как ожирение и СД2 (4, 69, 92, 109, 144), остаются плохо изученными. Как отмечалось выше, в этом обзоре основное внимание будет уделено влиянию плаценты на фетальное программирование СД2 и на программирование ЗВУР при дисфункции β-клеток (21, 58).
Мы и другие исследователи показали, что алиментарный стресс у матери, такой как низкобелковая (НБ) диета или общее ограничение калорий (ОК) во время беременности и маточно-плацентарная недостаточность, являются причинами ЗВУР и приводят к долгосрочным последствиям для массы β-клеток. и функция (4, 34, 50, 153, 155). Масса β-клеток у взрослых людей достигается в течение первого десятилетия постнатальной жизни (64), а популяция β-клеток поддерживается во взрослом возрасте за счет очень низкой скорости саморепликации существующих β-клеток (44). Во время развития β-клетки чрезвычайно чувствительны к питательной среде плода, что в конечном итоге может повлиять на конечную массу взрослого человека (156) и риск развития СД2 в более позднем возрасте (3, 156). Соответственно, ЗВУР при рождении тесно связана со снижением массы β-клеток, частично из-за снижения пролиферации и повышенного апоптоза, а также непереносимости глюкозы у взрослых потомков (3, 45, 74, 120). Поэтому правдоподобно предположить, что общая масса β-клеток, развившаяся на этих ранних стадиях, может обеспечить некоторую степень защиты от или против риска развития СД2, хотя данные о людях, напрямую подтверждающие эту концепцию, отсутствуют.
Соответственно, ЗВУР при рождении тесно связана со снижением массы β-клеток, частично из-за снижения пролиферации и повышенного апоптоза, а также непереносимости глюкозы у взрослых потомков (3, 45, 74, 120). Поэтому правдоподобно предположить, что общая масса β-клеток, развившаяся на этих ранних стадиях, может обеспечить некоторую степень защиты от или против риска развития СД2, хотя данные о людях, напрямую подтверждающие эту концепцию, отсутствуют.
К сожалению, данные о массе β-клеток человека у лиц с ЗВУР ограничены.Тем не менее, ЗВУР при рождении тесно связана с изменением чувствительности к инсулину у детей и взрослых (111), хотя важно отметить, что нарушение чувствительности к инсулину само по себе недостаточно для того, чтобы вызвать СД2. В состоянии резистентности к инсулину СД2 развивается только тогда, когда происходит значительная потеря функциональной массы β-клеток и количества секретируемого инсулина уже недостаточно для удовлетворения потребности. Таким образом, потеря массы β-клеток и дефекты секреции инсулина являются основными факторами, определяющими, разовьется ли у человека СД2 или нет (52). Поэтому мы обсудим новые роли киназы сенсора питательных веществ, механистической мишени рапамицина (mTOR) в плаценте, а также плацентарного лактогена (PL) и микроРНК, экспортируемых плацентарными экзосомами, в регуляции фетального программирования β-клеток. массы на различных животных моделях плацентарной недостаточности (рис. 1). Мы сосредоточились на mTOR, потому что эта киназа функционирует для интеграции сигналов питательных веществ и факторов роста в отдельных клетках, включая β-клетку, и в более глобальном масштабе в таких органах, как плацента, для стимулирования роста и функционирования.
Поэтому мы обсудим новые роли киназы сенсора питательных веществ, механистической мишени рапамицина (mTOR) в плаценте, а также плацентарного лактогена (PL) и микроРНК, экспортируемых плацентарными экзосомами, в регуляции фетального программирования β-клеток. массы на различных животных моделях плацентарной недостаточности (рис. 1). Мы сосредоточились на mTOR, потому что эта киназа функционирует для интеграции сигналов питательных веществ и факторов роста в отдельных клетках, включая β-клетку, и в более глобальном масштабе в таких органах, как плацента, для стимулирования роста и функционирования.
Рис. 1. Плацентарная недостаточность Программирование массы β-клеток у потомства. Задержка внутриутробного развития плода (ЗВУР) является результатом изменений субоптимальной внутриутробной среды матери, что влияет на функцию плаценты. Это включает несколько интегрированных факторов, включая, помимо прочего, снижение активности механистической мишени сигнальных путей рапамицина (mTOR), специфических гормонов, таких как уровни плацентарного лактогена, и содержание экзосом (т. е. микроРНК).Все эти факторы могут способствовать ЗВУР плода и развитию массы β-клеток поджелудочной железы у плода. BCAA, аминокислота с разветвленной цепью.
е. микроРНК).Все эти факторы могут способствовать ЗВУР плода и развитию массы β-клеток поджелудочной железы у плода. BCAA, аминокислота с разветвленной цепью.
В этом разделе мы сосредоточимся на ключевых моделях недостаточности питания плода: маточно-плацентарной недостаточности и ограничении питания матери. Мы обсудим текущие доступные данные о влиянии этих моделей на рост плаценты и развитие и функцию β-клеток поджелудочной железы и постулируем возможные механистические связи между функцией плаценты и ростом β-клеток.
Плацентарная недостаточность
Эпидемиологические исследования на животных и людях показали сильную корреляцию между малым размером тела при рождении и хроническими заболеваниями во взрослом возрасте (1). К ним относятся, помимо прочего, риск развития сердечно-сосудистых заболеваний, гипертонии, ожирения и СД2 (10). Плацентарная недостаточность возникает вторично по отношению к нарушениям инвазии трофобласта, маточно-плацентарного кровотока и усвоения питательных веществ, что способствует недостаточности питания плода и ЗВУР. ЗВУР сам по себе является результатом множественных и сложных изменений во внутриутробной среде матери, которые влияют на функцию плаценты, потенциально включая гипоксический и окислительный клеточный стресс, метаболическую дисфункцию и лишение питательных веществ, а также подавление ключевых плацентарных белков, таких как те, что участвуют в передаче сигнала mTOR. пути и ключевые регуляторы развития плаценты, поглощения питательных веществ и реакции клеток на стресс.Мы обсудим несколько исследований на животных, чтобы лучше понять механизмы, лежащие в основе влияния плацентарной недостаточности на ЗВУР и развитие массы β-клеток поджелудочной железы.
ЗВУР сам по себе является результатом множественных и сложных изменений во внутриутробной среде матери, которые влияют на функцию плаценты, потенциально включая гипоксический и окислительный клеточный стресс, метаболическую дисфункцию и лишение питательных веществ, а также подавление ключевых плацентарных белков, таких как те, что участвуют в передаче сигнала mTOR. пути и ключевые регуляторы развития плаценты, поглощения питательных веществ и реакции клеток на стресс.Мы обсудим несколько исследований на животных, чтобы лучше понять механизмы, лежащие в основе влияния плацентарной недостаточности на ЗВУР и развитие массы β-клеток поджелудочной железы.
Преэклампсия.
у человека.
Преэклампсия включает начало новой или усиленной гипертензии во время беременности, часто с протеинурией. Приблизительно 2–8% беременностей сопровождаются развитием преэклампсии (27a). Неполная плацентация и поверхностная инвазия трофобласта в децидуальную оболочку матери приводят к ишемическим состояниям плаценты (99), которые стимулируют материнские провоспалительные цитокины, антиангиогенные факторы и агонистические аутоантитела против рецептора ангиотензина II типа I, возможно, за счет активации ангиотензина II типа I. рецептор, способствующий гипертонии у матери (72, 91).Нарушение функции маточно-плацентарного интерфейса означает снижение плацентарного кровотока на 50-70% (99), а также снижение целостности плаценты из-за усиления апоптоза клеток синцитиотрофобласта (77). Эти изменения могут привести к уменьшению поступления питательных веществ и изменению транспорта многочисленных факторов через плацентарный барьер (67, 117), что приводит к повышенному риску преэклампсии при родах и предрасположенности к различным хроническим и метаболическим заболеваниям в более позднем возрасте. ЗВУР обнаруживается у 39% беременных с преэклампсией (167).Также было показано, что у детей с преэклампсией повышено артериальное давление (159), сердце меньшего размера с повышенной частотой сердечных сокращений в покое (54), повышен индекс массы тела (166) и повышена частота госпитализаций по поводу эндокринных, алиментарных и метаболических заболеваний (169). ). Насколько нам известно, о влиянии преэклампсии на массу β-клеток у новорожденных в моделях человека или животных не сообщалось.
рецептор, способствующий гипертонии у матери (72, 91).Нарушение функции маточно-плацентарного интерфейса означает снижение плацентарного кровотока на 50-70% (99), а также снижение целостности плаценты из-за усиления апоптоза клеток синцитиотрофобласта (77). Эти изменения могут привести к уменьшению поступления питательных веществ и изменению транспорта многочисленных факторов через плацентарный барьер (67, 117), что приводит к повышенному риску преэклампсии при родах и предрасположенности к различным хроническим и метаболическим заболеваниям в более позднем возрасте. ЗВУР обнаруживается у 39% беременных с преэклампсией (167).Также было показано, что у детей с преэклампсией повышено артериальное давление (159), сердце меньшего размера с повышенной частотой сердечных сокращений в покое (54), повышен индекс массы тела (166) и повышена частота госпитализаций по поводу эндокринных, алиментарных и метаболических заболеваний (169). ). Насколько нам известно, о влиянии преэклампсии на массу β-клеток у новорожденных в моделях человека или животных не сообщалось. Однако важно отметить, что ЗВУР, распространенный результат преэклампсии, обычно связан с резистентностью к инсулину у людей (70, 111).Из лонгитюдных и полногеномных ассоциативных исследований данные свидетельствуют о том, что неспособность β-клеток удовлетворить потребность в инсулине является переломным моментом для прогрессирования СД2 (3). Таким образом, будет важно оценить массу β-клеток у людей или животных в моделях новорожденных с преэклампсией.
Однако важно отметить, что ЗВУР, распространенный результат преэклампсии, обычно связан с резистентностью к инсулину у людей (70, 111).Из лонгитюдных и полногеномных ассоциативных исследований данные свидетельствуют о том, что неспособность β-клеток удовлетворить потребность в инсулине является переломным моментом для прогрессирования СД2 (3). Таким образом, будет важно оценить массу β-клеток у людей или животных в моделях новорожденных с преэклампсией.
у животных.
Модель пониженного перфузионного давления матки (RUPP) у крыс обычно используется для имитации преэклампсии у человека. Обычно используемая у крыс Sprague-Dawley, эта модель преэклампсии ограничивает приток крови к матке посредством хирургической окклюзии маточных и яичниковых артерий (обычно делается на 90 266 14-й 90 267-й день беременности на 21-й день беременности), создавая плацентарную ишемию.Маточно-плацентарный кровоток снижен на 40%, а артериальное давление матери повышено на 20–30 мм рт.ст. (33). У потомства беременных с RUPP наблюдается IUGR (5, 63), и у них наблюдается развитие непереносимости глюкозы во взрослом возрасте (74). Потеря массы β-клеток или дефект секреции инсулина могут объяснить фенотип непереносимости глюкозы, но фенотип массы и функции β-клеток у потомства плода RUPP неизвестен. В настоящее время очень мало исследований, определяющих причины повышенного риска СД2 в модели RUPP-преэклампсии.
У потомства беременных с RUPP наблюдается IUGR (5, 63), и у них наблюдается развитие непереносимости глюкозы во взрослом возрасте (74). Потеря массы β-клеток или дефект секреции инсулина могут объяснить фенотип непереносимости глюкозы, но фенотип массы и функции β-клеток у потомства плода RUPP неизвестен. В настоящее время очень мало исследований, определяющих причины повышенного риска СД2 в модели RUPP-преэклампсии.
Перевязка материнской маточной артерии.
Модель маточно-плацентарной недостаточности, включающая хирургическую перевязку артерии или артерий, снабжающих кровью плаценту, также индуцирует ЗВУР у потомства. Эти процедуры вызывают частичный инфаркт плаценты, снижая способность плаценты переносить питательные вещества и приводя к фенотипу ЗВУР у плода. Крысы Sprague-Dawley, подвергшиеся перевязке маточных артерий на день 18 21,5-дневной беременности, имели потомство IUGR, демонстрирующее снижение веса плаценты со сниженными концентрациями в плазме и соотношением аминокислот (лейцин, изолейцин и валин) и снижение уровня циркулирующего инсулина (115). Когда лигирование было выполнено на день 19, у потомства IUGR во взрослом возрасте развились ожирение, непереносимость глюкозы, резистентность к инсулину и СД2 (153). Тем не менее нормальная масса β-клеток наблюдалась между IUGR и контрольными животными в начале жизни (возраст 1 и 7 недель), что указывает на критическое временное окно программирования для воздействия на постоянную базальную массу β-клеток. Интересно, что, несмотря на нормальную массу в раннем возрасте, масса β-клеток была значительно снижена по сравнению с контрольной группой, до 50% к 15-недельному возрасту и до ~30% к 26-недельному возрасту (153).Также было выявлено возрастное снижение функции β-клеток, включающее множественные дефекты островков, от васкуляризации (78), метаболизма аминокислот и экспрессии ионных каналов до здоровья митохондрий (128, 152). Эпигенетическая регуляция экспрессии генов (например, Pdx1) была описана как один из механизмов, с помощью которого маточно-плацентарная недостаточность может привести к потере массы и функции β-клеток (119, 123).
Когда лигирование было выполнено на день 19, у потомства IUGR во взрослом возрасте развились ожирение, непереносимость глюкозы, резистентность к инсулину и СД2 (153). Тем не менее нормальная масса β-клеток наблюдалась между IUGR и контрольными животными в начале жизни (возраст 1 и 7 недель), что указывает на критическое временное окно программирования для воздействия на постоянную базальную массу β-клеток. Интересно, что, несмотря на нормальную массу в раннем возрасте, масса β-клеток была значительно снижена по сравнению с контрольной группой, до 50% к 15-недельному возрасту и до ~30% к 26-недельному возрасту (153).Также было выявлено возрастное снижение функции β-клеток, включающее множественные дефекты островков, от васкуляризации (78), метаболизма аминокислот и экспрессии ионных каналов до здоровья митохондрий (128, 152). Эпигенетическая регуляция экспрессии генов (например, Pdx1) была описана как один из механизмов, с помощью которого маточно-плацентарная недостаточность может привести к потере массы и функции β-клеток (119, 123). Интересно, что плацентарная экспрессия белков-переносчиков глюкозы у беременных крыс не изменилась при маточно-плацентарной недостаточности, индуцированной на 19-й день беременности (133).В будущем было бы интересно оценить активность переносчика питательных веществ, когда маточно-плацентарная недостаточность индуцируется в течение более длительного периода гестационного периода.
Интересно, что плацентарная экспрессия белков-переносчиков глюкозы у беременных крыс не изменилась при маточно-плацентарной недостаточности, индуцированной на 19-й день беременности (133).В будущем было бы интересно оценить активность переносчика питательных веществ, когда маточно-плацентарная недостаточность индуцируется в течение более длительного периода гестационного периода.
Материнская гипертермия у овец.
Плацентарная недостаточность вызывается у овец воздействием повышенной температуры окружающей среды, начиная с 40-дневного срока. Гипертермическая обработка приводит к повышению температуры тела (39–40°С) у беременных овцематок. Для поддержания теплового гомеостаза кровоток направляется в периферическую сосудистую систему, снижая внутриматочное и пупочное артериальное давление.Уменьшения маточно-плацентарного кровотока достаточно, чтобы снизить массу тела при рождении потомства и вызвать хроническую дисфункцию метаболических тканей (11, 141). Базальные концентрации инсулина в плазме были ниже при ЗВУР по сравнению с контролем (102), и это было связано со снижением массы β-клеток (35) и улучшением чувствительности к инсулину (96). Совсем недавно Келли и соавт. (87) предоставили некоторое представление о механизмах, лежащих в основе сниженного роста и пролиферации β-клеток и дефектной секреции инсулина в островках плодов IUGR, путем проведения объективного секвенирования РНК.В этом исследовании они сообщили, что в снижении пролиферации и нарушении регуляции метаболизма участвуют несколько генов, которые регулируют клеточный цикл, передачу сигналов фактора роста, функцию митохондрий и механизм экзоцитоза. Это исследование дополнительно выявило новую роль передачи сигналов Wnt и протеасом как др. возможных механизмов дисфункции β-клеток. Воздействие ЗВУР, вызванного гипертонией у матери, на развитие и функцию островков в этой модели подробно рассмотрено Boehmer et al. (21).
Совсем недавно Келли и соавт. (87) предоставили некоторое представление о механизмах, лежащих в основе сниженного роста и пролиферации β-клеток и дефектной секреции инсулина в островках плодов IUGR, путем проведения объективного секвенирования РНК.В этом исследовании они сообщили, что в снижении пролиферации и нарушении регуляции метаболизма участвуют несколько генов, которые регулируют клеточный цикл, передачу сигналов фактора роста, функцию митохондрий и механизм экзоцитоза. Это исследование дополнительно выявило новую роль передачи сигналов Wnt и протеасом как др. возможных механизмов дисфункции β-клеток. Воздействие ЗВУР, вызванного гипертонией у матери, на развитие и функцию островков в этой модели подробно рассмотрено Boehmer et al. (21).
Ограничение питания матери
Доступность питательных веществ и диетическое поведение матери во время беременности контролируют питательные вещества, которые воспринимаются или транспортируются плодом, и могут в значительной степени способствовать программированию плода. В основном на животных моделях изучалась роль ограничения питания матери в разные моменты времени во время или после беременности. Например, в исследованиях предпринимались попытки манипулировать рационом матери в любом месте, начиная только с последней недели беременности и заканчивая контролем рациона на протяжении всей беременности и периода лактации. Этот разнообразный подход помогает выделить любые критические «окна развития» и установить, является ли определенная фаза развития (ранний эмбриогенез, средний органогенез и позднее созревание) более чувствительной к материнской среде внутриутробно.Ниже мы обсудим влияние манипуляций с материнской диетой на человека и грызунов и их влияние на массу β-клеток поджелудочной железы.
В основном на животных моделях изучалась роль ограничения питания матери в разные моменты времени во время или после беременности. Например, в исследованиях предпринимались попытки манипулировать рационом матери в любом месте, начиная только с последней недели беременности и заканчивая контролем рациона на протяжении всей беременности и периода лактации. Этот разнообразный подход помогает выделить любые критические «окна развития» и установить, является ли определенная фаза развития (ранний эмбриогенез, средний органогенез и позднее созревание) более чувствительной к материнской среде внутриутробно.Ниже мы обсудим влияние манипуляций с материнской диетой на человека и грызунов и их влияние на массу β-клеток поджелудочной железы.
у человека.
Существует очень мало исследований на людях, в которых непосредственно изучается влияние плаценты на влияние недоедания матери на программирование плода. Одно исследование показало, что плацентарные аномалии были связаны со случаями ЗВУР, используя доступные данные, связанные с последствиями голода в Нидерландах (1944–1945). Это исследование включало долгосрочное отслеживание 94 800 когорт голодающих и 212 900 контрольных когорт. Данные, полученные в результате этого крупного когортного исследования, показали сильную корреляцию между низкой массой тела при рождении и предрасположенностью к ожирению и СД2. Женщины, которые недоедали в третьем триместре беременности и в течение первого месяца после рождения, имели детей со значительно более низким уровнем ожирения (130). Однако дети, матери которых недоедали в первой половине беременности, имели более высокий уровень ожирения (130).Воздействие голода во втором или третьем триместре беременности значительно снизило отношение площади плаценты к массе тела при рождении по сравнению с детьми, не подвергавшимися воздействию, или детьми, подвергшимися воздействию только в течение первого триместра (129). Площадь плаценты уменьшалась независимо от периода беременности (118). Более того, у взрослых потомков женщин во время голода в Нидерландах средние концентрации глюкозы были выше, особенно у лиц, подвергшихся воздействию голода в середине и на поздних сроках беременности.
Это исследование включало долгосрочное отслеживание 94 800 когорт голодающих и 212 900 контрольных когорт. Данные, полученные в результате этого крупного когортного исследования, показали сильную корреляцию между низкой массой тела при рождении и предрасположенностью к ожирению и СД2. Женщины, которые недоедали в третьем триместре беременности и в течение первого месяца после рождения, имели детей со значительно более низким уровнем ожирения (130). Однако дети, матери которых недоедали в первой половине беременности, имели более высокий уровень ожирения (130).Воздействие голода во втором или третьем триместре беременности значительно снизило отношение площади плаценты к массе тела при рождении по сравнению с детьми, не подвергавшимися воздействию, или детьми, подвергшимися воздействию только в течение первого триместра (129). Площадь плаценты уменьшалась независимо от периода беременности (118). Более того, у взрослых потомков женщин во время голода в Нидерландах средние концентрации глюкозы были выше, особенно у лиц, подвергшихся воздействию голода в середине и на поздних сроках беременности. У лиц, которые, как сообщается, родились с задержкой внутриутробного развития плода, наблюдалась непереносимость глюкозы, в основном, когда они страдали ожирением во взрослом возрасте (129). Группа перинатального воздействия также показала значительное увеличение концентрации проинсулина натощак и средней концентрации инсулина (129). Было высказано предположение, что нарушение толерантности к глюкозе, наблюдаемое в группе среднего и позднего срока беременности, могло быть связано с нарушением секреции инсулина (37). Было показано, что дети с ЗВУР имеют сниженную чувствительность к инсулину (164) и не могут компенсировать свою сниженную чувствительность к инсулину, когда во взрослом возрасте становятся тучными, что подвергает их более высокому риску развития СД2 (25).Фракция β-клеток поджелудочной железы у плодов IUGR человека была лишь немного ниже, без каких-либо различий в проценте снижения β-клеток в тканях поджелудочной железы плода (16). Однако в небольшой группе беременностей, осложненных тяжелой задержкой роста плода, сообщалось о потере количества β-клеток (161).
У лиц, которые, как сообщается, родились с задержкой внутриутробного развития плода, наблюдалась непереносимость глюкозы, в основном, когда они страдали ожирением во взрослом возрасте (129). Группа перинатального воздействия также показала значительное увеличение концентрации проинсулина натощак и средней концентрации инсулина (129). Было высказано предположение, что нарушение толерантности к глюкозе, наблюдаемое в группе среднего и позднего срока беременности, могло быть связано с нарушением секреции инсулина (37). Было показано, что дети с ЗВУР имеют сниженную чувствительность к инсулину (164) и не могут компенсировать свою сниженную чувствительность к инсулину, когда во взрослом возрасте становятся тучными, что подвергает их более высокому риску развития СД2 (25).Фракция β-клеток поджелудочной железы у плодов IUGR человека была лишь немного ниже, без каких-либо различий в проценте снижения β-клеток в тканях поджелудочной железы плода (16). Однако в небольшой группе беременностей, осложненных тяжелой задержкой роста плода, сообщалось о потере количества β-клеток (161). Следовательно, роль β-клеток поджелудочной железы нельзя не учитывать при рассмотрении дефектов чувствительности к инсулину у детей с ЗВУР.
Следовательно, роль β-клеток поджелудочной железы нельзя не учитывать при рассмотрении дефектов чувствительности к инсулину у детей с ЗВУР.
у мышей.
Двумя наиболее распространенными диетическими манипуляциями матери для индукции ЗВУР у потомства являются низкобелковая (НБ) диета и общее ограничение калорий (ОК) только во время беременности или до конца лактации.Было показано, что изокалорийное снижение концентрации белка в материнском рационе во время беременности не влияет на потребление пищи или массу тела самок (4). Однако влияние LP на массу тела потомства у мышей было различным. Алехандро и др. (3) не показали изменения массы тела при рождении, в то время как другие (31, 158) сообщили о снижении массы тела в группе потомства на 90 266 дней 1 90 267 и 90 266 7 90 267 . Важно отметить, что наблюдаемое снижение массы тела не зависело от размера помета при рождении.В некоторых исследованиях сообщалось, что у потомства IUGR наблюдался догоняющий рост (см. обзор в ссылке 84), показывая восстановление массы тела около 90 266 дней 14 90 267 (31), но Su et al. (158) сообщили о стойком снижении массы тела у потомства LP на протяжении всей взрослой жизни. Несмотря на сильное снижение потребления калорий, у мышей CR не наблюдалось различий в размере приплода и снижение массы тела при рождении только примерно на 8% (30). В модели CR (снижение потребления калорий на 50%) значительное снижение массы плаценты наблюдалось на 90 266 11-й день.5 (148) или в оба дня 16 и 19 в более тяжелом исследовании CR (80% снижение потребления калорий) (30). В последнем исследовании сниженная масса плаценты была связана с уменьшением объема соединительной зоны и плацентарной экспрессии переносчиков глюкозы, что предполагает возможные изменения в плацентарном переносе питательных веществ. В том же исследовании CR плацента подверглась морфологической и функциональной адаптации, включая долговременные эпигенетические изменения и изменение транскриптома (30, 60), для поддержания роста плода.
(158) сообщили о стойком снижении массы тела у потомства LP на протяжении всей взрослой жизни. Несмотря на сильное снижение потребления калорий, у мышей CR не наблюдалось различий в размере приплода и снижение массы тела при рождении только примерно на 8% (30). В модели CR (снижение потребления калорий на 50%) значительное снижение массы плаценты наблюдалось на 90 266 11-й день.5 (148) или в оба дня 16 и 19 в более тяжелом исследовании CR (80% снижение потребления калорий) (30). В последнем исследовании сниженная масса плаценты была связана с уменьшением объема соединительной зоны и плацентарной экспрессии переносчиков глюкозы, что предполагает возможные изменения в плацентарном переносе питательных веществ. В том же исследовании CR плацента подверглась морфологической и функциональной адаптации, включая долговременные эпигенетические изменения и изменение транскриптома (30, 60), для поддержания роста плода.
Сильная корреляция между плацентарной недостаточностью/ЗВУР и потерей массы β-клеток поджелудочной железы также существует у мышей. У потомства мышей Balb/c, получавших изокалорийную диету LP (8%), начиная с 90 266 дня эмбрионального развития 0,5 90 267 дня беременности и до рождения, не наблюдалось влияния на массу β-клеток новорожденного, но увеличивалась масса β-клеток на 90 266 день 14 90 267 (только потомство женского пола) (31). Однако у всех потомков женского пола в конечном итоге развилась непереносимость глюкозы с аналогичным уровнем массы β-клеток к дню 130 (31).Внутриутробное лечение LP-диетой также приводило к снижению способности потомства как мужского, так и женского пола восстанавливать массу β-клеток после индуцированной стрептозотоцином гибели β-клеток (31). У потомства самок C57BL/6J, получавших изокалорийный LP (9%, эмбриональный возраст дней 0,5 до рождения), наблюдалось уменьшение площади β-клеток при рождении, но нормализовалась масса во взрослом возрасте (4). Несмотря на нормализацию массы β-клеток у этих мышей, потомство группы LP продемонстрировало легкую непереносимость глюкозы и улучшенную чувствительность к инсулину (4).
У потомства мышей Balb/c, получавших изокалорийную диету LP (8%), начиная с 90 266 дня эмбрионального развития 0,5 90 267 дня беременности и до рождения, не наблюдалось влияния на массу β-клеток новорожденного, но увеличивалась масса β-клеток на 90 266 день 14 90 267 (только потомство женского пола) (31). Однако у всех потомков женского пола в конечном итоге развилась непереносимость глюкозы с аналогичным уровнем массы β-клеток к дню 130 (31).Внутриутробное лечение LP-диетой также приводило к снижению способности потомства как мужского, так и женского пола восстанавливать массу β-клеток после индуцированной стрептозотоцином гибели β-клеток (31). У потомства самок C57BL/6J, получавших изокалорийный LP (9%, эмбриональный возраст дней 0,5 до рождения), наблюдалось уменьшение площади β-клеток при рождении, но нормализовалась масса во взрослом возрасте (4). Несмотря на нормализацию массы β-клеток у этих мышей, потомство группы LP продемонстрировало легкую непереносимость глюкозы и улучшенную чувствительность к инсулину (4). У потомства самок C57BL/6J, получавших LP-диету, начиная с 90 266 дня эмбрионального развития 0,5 90 267 и до конца лактационного периода, у взрослых особей наблюдалась непереносимость глюкозы из-за снижения массы β-клеток и дефекта секреции инсулина (158). Важно отметить, что различное влияние на массу β-клеток предполагает, что напряжение и продолжительность лечения LP имеют значение и что эти параметры следует тщательно учитывать при интерпретации данных.
У потомства самок C57BL/6J, получавших LP-диету, начиная с 90 266 дня эмбрионального развития 0,5 90 267 и до конца лактационного периода, у взрослых особей наблюдалась непереносимость глюкозы из-за снижения массы β-клеток и дефекта секреции инсулина (158). Важно отметить, что различное влияние на массу β-клеток предполагает, что напряжение и продолжительность лечения LP имеют значение и что эти параметры следует тщательно учитывать при интерпретации данных.
у крыс.
Были проведены дополнительные исследования на крысах в отношении ограничений в питании матери.Диета LP от эмбриона день 2 на протяжении всей беременности увеличивала общее потребление пищи у самок, но значительно снижала прибавку в весе матери, плода и плаценты в период эмбриона день 21 (51, 79). Недоедание матери в течение первых 2 недель беременности приводило к ожирению и аномалиям адипоцитов у потомства в постнатальный период (85). Однако более короткая продолжительность диетического ограничения не повлияла на ожирение у потомства (14), особенно если лечение проводилось на ранней стадии беременности (90 266 дней 0–7 90 267), когда плацента еще не полностью развита и не функционирует. У потомства LP развилась гиперфагия, фактор риска ожирения и симптом, связанный с развитием диабета (165). Обработка LP крыс Wister на протяжении всей беременности и лактации приводила к меньшей массе тела при рождении у потомства и повышенному развитию инсулинорезистентности и диабета во взрослом возрасте (51). У крыс Sprague-Dawley не было изменений в массе плода при рождении, но сообщалось о задержке роста потомства из-за недостаточного питания (LP 9% от рождения до лактации) (157).
У потомства LP развилась гиперфагия, фактор риска ожирения и симптом, связанный с развитием диабета (165). Обработка LP крыс Wister на протяжении всей беременности и лактации приводила к меньшей массе тела при рождении у потомства и повышенному развитию инсулинорезистентности и диабета во взрослом возрасте (51). У крыс Sprague-Dawley не было изменений в массе плода при рождении, но сообщалось о задержке роста потомства из-за недостаточного питания (LP 9% от рождения до лактации) (157).
У самок крыс Wister, получавших корм LP (5%), в течение последней недели беременности наблюдались изменения веса плаценты, связанные со снижением содержания инсулина и массы β-клеток (17). Низкобелковая (8%) диета во время беременности также приводила к задержке роста плода из-за увеличения объема плаценты без компенсаторного увеличения васкуляризации плаценты (43). У самок, получавших 50%-ное ограничение корма в период с 90 266 дней беременности 10 до 90 266 20 , наблюдалось снижение массы плаценты и гипотрофия в плацентарных областях (базальная и лабиринтная зоны) (12). В совокупности эти данные свидетельствуют о том, что ограничения питания матери влияют на развитие плаценты и, таким образом, могут способствовать метаболическим фенотипам, наблюдаемым у потомства.
В совокупности эти данные свидетельствуют о том, что ограничения питания матери влияют на развитие плаценты и, таким образом, могут способствовать метаболическим фенотипам, наблюдаемым у потомства.
У самок крыс Wistar изокалорийный LP (8%) во время беременности снижал массу β-клеток из-за уменьшения пролиферации, размера островков, васкуляризации островков и содержания инсулина в поджелудочной железе и приводил к дефектам секреции инсулина островками в ответ на аргинин или лейцин ( 34). Когда потомство содержалось на диете LP даже после постнатального периода, у него был более низкий уровень инсулина натощак при нормальной циркулирующей глюкозе (34).Крысы Sprague-Dawley, получавшие LP (9%), также продемонстрировали уменьшение площади островков и подавление инсулина и соответствующих генов ( FoxO1 , Pdx1 и MafA ), отвечающих за образование и созревание островков (171). Многочисленные исследования выявили снижение экспрессии мРНК Pdx1 , что приводит к снижению пролиферации β-клеток и уменьшению размера β-клеток через дней 2 (94), 15 или 21 (45) и к эпигенетической регуляции таких генов, как Hnf4a связаны с развитием СД2 (145).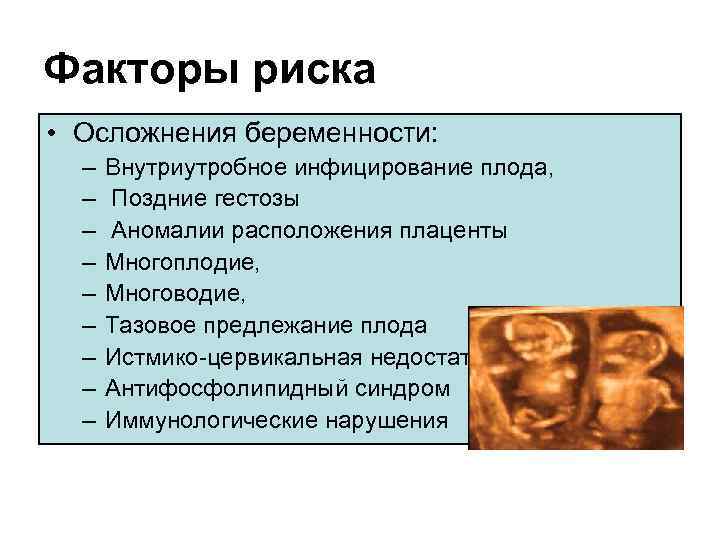 Точно так же беременные крысы, ограниченные только 50% их пищи с 90 266 дня 15 90 267 беременности, привели к потомству IUGR со значительным снижением массы β-клеток и содержания инсулина в постнатальном периоде 90 266 дней 1 и 21 (57, 106). Никаких изменений массы поджелудочной железы в постнатальный период 90 266 дней 21 90 267 не наблюдалось, что свидетельствует о специфическом влиянии на развитие β-клеток (57, 106). Когда их диетическое ограничение началось на 90 266 день 11 90 267 периода беременности, у крыс IUGR во взрослом возрасте развилась непереносимость глюкозы и резистентность к инсулину, наряду с дефектами развития поджелудочной железы (56, 170).См. в Таблице 1 избранный список исследований, посвященных влиянию питания матери во время беременности и моделей маточно-плацентарной недостаточности на массу плаценты, массу β-клеток и непереносимость глюкозы у потомства.
Точно так же беременные крысы, ограниченные только 50% их пищи с 90 266 дня 15 90 267 беременности, привели к потомству IUGR со значительным снижением массы β-клеток и содержания инсулина в постнатальном периоде 90 266 дней 1 и 21 (57, 106). Никаких изменений массы поджелудочной железы в постнатальный период 90 266 дней 21 90 267 не наблюдалось, что свидетельствует о специфическом влиянии на развитие β-клеток (57, 106). Когда их диетическое ограничение началось на 90 266 день 11 90 267 периода беременности, у крыс IUGR во взрослом возрасте развилась непереносимость глюкозы и резистентность к инсулину, наряду с дефектами развития поджелудочной железы (56, 170).См. в Таблице 1 избранный список исследований, посвященных влиянию питания матери во время беременности и моделей маточно-плацентарной недостаточности на массу плаценты, массу β-клеток и непереносимость глюкозы у потомства.
| Вес плацентар | Вес плода | β-клеточная масса или площадь | β-клеточная функция | GTT | ITT | ITT | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| мышь | ||||||||||||||||
Ограниченная диета (LP и CR на E0. 5–e19) 5–e19) | ↓ (29, 30, 148) | ↓ (30, 31) | ↔ (31) ↓ (4) | ↓ (4, 158) | , 31, 31, | ↑ (4) ↔ (158) | ↓ (149) | |||||||||
| RAT | ||||||||||||||||
| RUPP (E14.5-E19.5) | ? | ↓ (63) | ? | ? | ↓ (74) | ? | ? | |||||||||
| Перевязка маточной артерии (e19–e21) | ? | ↓ (168) | ↓ (168) | ↓ (36) | ↓ (153) | ↓ (153) | ↓ (153) | ↓ (112) | ↓ (112) | |||||||
| Ограниченная диета (LP и CR) | ↓ (51) ↔ (155) | ↓ (51, 155) ↔ (157) | ↓ (34, 45, 57, 106, 155) | ↓ (34, 46) | ↓ (34, 46) | ↓ ↓ (145) | ↓ (139) | |||||||||
| Овцы | ||||||||||||||||
| Гипертермия-индуцированная плацентарная недостаточность | ↓ (97) | ↓ (95) | ↓ (95) | ↓ (97) | ? | ↑ (96) | ↓ (140) |
У человека масса β-клеток достигается в течение первого десятилетия постнатальной жизни (64), а дифференцированный и зрелый пул β-клеток поддерживается очень низкая скорость самовоспроизведения во взрослом возрасте (44). Беременность и ожирение являются двумя физиологическими триггерами пролиферации дифференцированных β-клеток. Было показано, что микроРНК регулируют экспрессию критических генов, связанных с пролиферацией, функцией и гибелью β-клеток (4, 53, 101). Как обсуждалось выше, исследования предполагают корреляцию между потомством, вызванным маточно-плацентарной недостаточностью IUGR, и потерей массы β-клеток у потомства. Однако механистическая связь между функцией плаценты и развитием β-клеток не ясна. Потеря массы β-клеток связана со снижением скорости пролиферации β-клеток и их размера (95, 158, 160) и, в некоторых случаях, усилением апоптоза.Сообщалось об эпигенетическом маркировании критических генов, таких как Pdx1 (119) и Hnf4a (145), а также о подавлении основных белков β-клеток, таких как mTOR, PDK1 и циклин D1/2, посредством регуляции микроРНК (4, 46, 158). Вклад эпигенетических механизмов очень важен и был рассмотрен Pinney и Simmons (122, 123). Ниже мы обсудим влияние переносчиков аминокислот и PL-гормона (8), а также выскажем предположения о потенциальных эффектах микроРНК из плацентарного экзосомного груза, которые могут экспортироваться в поджелудочную железу плода, чтобы повлиять на развитие и пролиферацию β-клеток (7).
Беременность и ожирение являются двумя физиологическими триггерами пролиферации дифференцированных β-клеток. Было показано, что микроРНК регулируют экспрессию критических генов, связанных с пролиферацией, функцией и гибелью β-клеток (4, 53, 101). Как обсуждалось выше, исследования предполагают корреляцию между потомством, вызванным маточно-плацентарной недостаточностью IUGR, и потерей массы β-клеток у потомства. Однако механистическая связь между функцией плаценты и развитием β-клеток не ясна. Потеря массы β-клеток связана со снижением скорости пролиферации β-клеток и их размера (95, 158, 160) и, в некоторых случаях, усилением апоптоза.Сообщалось об эпигенетическом маркировании критических генов, таких как Pdx1 (119) и Hnf4a (145), а также о подавлении основных белков β-клеток, таких как mTOR, PDK1 и циклин D1/2, посредством регуляции микроРНК (4, 46, 158). Вклад эпигенетических механизмов очень важен и был рассмотрен Pinney и Simmons (122, 123). Ниже мы обсудим влияние переносчиков аминокислот и PL-гормона (8), а также выскажем предположения о потенциальных эффектах микроРНК из плацентарного экзосомного груза, которые могут экспортироваться в поджелудочную железу плода, чтобы повлиять на развитие и пролиферацию β-клеток (7). ).Мы уделяем особое внимание этим потенциальным механизмам, поскольку было показано, что они влияют на пролиферацию β-клеток, и их уровни изменяются в моделях, связанных с IUGR.
).Мы уделяем особое внимание этим потенциальным механизмам, поскольку было показано, что они влияют на пролиферацию β-клеток, и их уровни изменяются в моделях, связанных с IUGR.
Плацентарная транспортная система
Будучи эндокринным органом, плацента адаптируется и реагирует на любые изменения в микроокружении, модулируя транспортные системы, расположенные на синцитиотрофобластах, двухслойном эпителиальном плацентарном барьере. Эти системы включают различные переносчики аминокислот, жирных кислот и глюкозы и экспрессируются как в мембране микроворсинок (на материнской стороне), так и в базальной плазматической мембране (на стороне плода) синцитиотрофобластов.На сегодняшний день сообщается об экспрессии по крайней мере 21 гена переносчика аминокислот в плаценте человека, и они в основном классифицируются как аккумуляторы и обменники (28). Среди них тремя основными транспортными системами являются система A, система L и система β. Транспортеры системы А отвечают за поглощение заменимых аминокислот и в основном связаны с мембраной микроворсинок синцитиотрофобластов. Их активность увеличивается во время беременности (39). Питание матери LP коррелировало с подавлением транспортеров плацентарной системы А, происходящим до недоразвития плода (149), что позволяет предположить, что сниженная активность этого плацентарного белка у потомства является фактором, способствующим ЗВУР (61).Активность транспортера системы А была значительно снижена в условиях гипоксии (10–13%) у беременных мышей (149). Незаменимые аминокислоты заменяются на заменимые через транспортеры системы L, и сообщалось, что их экспрессия такая же, как и у транспортеров системы А во время беременности (116). IUGR показал снижение транспорта лейцина через плаценту из-за снижения активности транспортеров системы L (82). Их активность также была снижена в модели CR на мышах (55) и в модели на крысах с ограниченным содержанием белка (139).Транспортеры системы β регулируют поглощение таурина, и их активность снижена у потомков ЗВУР, что приводит к значительно более низким концентрациям таурина в плазме у плодов (113).
Их активность увеличивается во время беременности (39). Питание матери LP коррелировало с подавлением транспортеров плацентарной системы А, происходящим до недоразвития плода (149), что позволяет предположить, что сниженная активность этого плацентарного белка у потомства является фактором, способствующим ЗВУР (61).Активность транспортера системы А была значительно снижена в условиях гипоксии (10–13%) у беременных мышей (149). Незаменимые аминокислоты заменяются на заменимые через транспортеры системы L, и сообщалось, что их экспрессия такая же, как и у транспортеров системы А во время беременности (116). IUGR показал снижение транспорта лейцина через плаценту из-за снижения активности транспортеров системы L (82). Их активность также была снижена в модели CR на мышах (55) и в модели на крысах с ограниченным содержанием белка (139).Транспортеры системы β регулируют поглощение таурина, и их активность снижена у потомков ЗВУР, что приводит к значительно более низким концентрациям таурина в плазме у плодов (113). Было показано, что уровни аминокислот (особенно аминокислот с разветвленной цепью, таких как лейцин) значительно влияют на клетки-предшественники поджелудочной железы и, следовательно, на массу β-клеток (49, 126), в то время как добавление таурина, как было показано, нормализует пролиферацию и апоптоз в островках поджелудочной железы крыс IUGR ( 22). Добавка таурина на поздних сроках беременности также улучшала постнатальный рост потомства крыс с IUGR, но резистентность к инсулину по-прежнему развивалась позже во взрослом возрасте (76).Транспортеры жирных кислот в плацентарном барьере включают липазы, транспортные белки жирных кислот и белки, связывающие жирные кислоты. В IUGR плацентах продемонстрировано снижение экспрессии мРНК липопротеинлипазы и эндотелиальной липазы (59) со сниженной активностью липопротеинлипазы в недоношенных плацентах (103). Хотя материнское ожирение у мышей было связано с измененной экспрессией белка, связывающего жирные кислоты, в плаценте, что приводило к увеличению накопления и роста липидов у плода (41), (104), его прямое влияние на развитие и функцию β-клеток неизвестно.
Было показано, что уровни аминокислот (особенно аминокислот с разветвленной цепью, таких как лейцин) значительно влияют на клетки-предшественники поджелудочной железы и, следовательно, на массу β-клеток (49, 126), в то время как добавление таурина, как было показано, нормализует пролиферацию и апоптоз в островках поджелудочной железы крыс IUGR ( 22). Добавка таурина на поздних сроках беременности также улучшала постнатальный рост потомства крыс с IUGR, но резистентность к инсулину по-прежнему развивалась позже во взрослом возрасте (76).Транспортеры жирных кислот в плацентарном барьере включают липазы, транспортные белки жирных кислот и белки, связывающие жирные кислоты. В IUGR плацентах продемонстрировано снижение экспрессии мРНК липопротеинлипазы и эндотелиальной липазы (59) со сниженной активностью липопротеинлипазы в недоношенных плацентах (103). Хотя материнское ожирение у мышей было связано с измененной экспрессией белка, связывающего жирные кислоты, в плаценте, что приводило к увеличению накопления и роста липидов у плода (41), (104), его прямое влияние на развитие и функцию β-клеток неизвестно. В плаценте транспорту глюкозы в основном способствует GLUT1. Другие переносчики глюкозы, в том числе GLUT3, GLUT4, GLUT8, GLUT9, GLUT10 и GLUT12, также экспрессируются в плаценте (89), но их экспрессия не изменилась при ЗВУР (83). У грызунов как недоедание матери, так и диета с высоким содержанием жиров приводили к увеличению плацентарной экспрессии GLUT1 (149), что свидетельствует о способности плаценты адаптироваться к среде питания матери. Как циркулирующая глюкоза, так и доступность кислорода для растущей поджелудочной железы плода могут оказывать большое влияние на рост и развитие β-клеток (66, 73).
В плаценте транспорту глюкозы в основном способствует GLUT1. Другие переносчики глюкозы, в том числе GLUT3, GLUT4, GLUT8, GLUT9, GLUT10 и GLUT12, также экспрессируются в плаценте (89), но их экспрессия не изменилась при ЗВУР (83). У грызунов как недоедание матери, так и диета с высоким содержанием жиров приводили к увеличению плацентарной экспрессии GLUT1 (149), что свидетельствует о способности плаценты адаптироваться к среде питания матери. Как циркулирующая глюкоза, так и доступность кислорода для растущей поджелудочной железы плода могут оказывать большое влияние на рост и развитие β-клеток (66, 73).
Сигнализация mTOR и аминокислоты с разветвленной цепью
mTOR представляет собой датчик питательных веществ, который объединяет различные сигналы питания и окружающей среды, включая последующие сигналы рецепторов фактора роста, аминокислоты, уровни энергии и клеточный стресс, для стимулирования клеточного роста. Существующая в двух комплексах (mTORC1 и mTORC2), киназа mTOR является идеальным кандидатом, связывающим среду плода с ожирением и предрасположенностью к СД2. Во-первых, снижение плацентарной передачи сигналов mTOR коррелирует со снижением фетальной плацентарной функции в моделях IUGR человека и грызунов (136, 137).Многочисленные исследования с использованием образцов IUGR как животных, так и человека (диета LP, гипоксия, пассивное курение и ожирение) показывают снижение активности mTOR плаценты (81, 88, 90, 107). Во-вторых, повышенная передача сигналов плацентарного mTOR положительно коррелирует с чрезмерным ростом плода, вызванным ожирением матери у людей (42, 80, 147), что указывает на то, что активность плацентарного mTOR регулирует плацентарную функцию и транспорт питательных веществ. Несмотря на эти ассоциативные исследования, проведенные на образцах человека, существует ограниченное количество исследований, изучающих молекулярную связь между повышенным риском СД2 после ЗВУР, вызванной маточно-плацентарной недостаточностью, и, в частности, дисфункцией β-клеток.Хотя механизмы, лежащие в основе этого ответа, неясны, он может включать регуляцию mTORC1 роста и функции плаценты, например, транспорта аминокислот.
Во-первых, снижение плацентарной передачи сигналов mTOR коррелирует со снижением фетальной плацентарной функции в моделях IUGR человека и грызунов (136, 137).Многочисленные исследования с использованием образцов IUGR как животных, так и человека (диета LP, гипоксия, пассивное курение и ожирение) показывают снижение активности mTOR плаценты (81, 88, 90, 107). Во-вторых, повышенная передача сигналов плацентарного mTOR положительно коррелирует с чрезмерным ростом плода, вызванным ожирением матери у людей (42, 80, 147), что указывает на то, что активность плацентарного mTOR регулирует плацентарную функцию и транспорт питательных веществ. Несмотря на эти ассоциативные исследования, проведенные на образцах человека, существует ограниченное количество исследований, изучающих молекулярную связь между повышенным риском СД2 после ЗВУР, вызванной маточно-плацентарной недостаточностью, и, в частности, дисфункцией β-клеток.Хотя механизмы, лежащие в основе этого ответа, неясны, он может включать регуляцию mTORC1 роста и функции плаценты, например, транспорта аминокислот. Йонссон и др. (80) показали, что белок mTOR экспрессируется в транспортирующем эпителии плаценты человека и в плаценте IUGR человека, и что активность обеих транспортных систем A и L плацентарных аминокислот снижена (136). Было показано, что mTOR позитивно регулирует транспорт аминокислот системы А (137, 138) и транспортную систему лейцина как в эксплантатах ворсинок нормальных доношенных плацент (136), так и в культивируемых клетках трофобласта (137) на посттранскрипционном уровне (89).Эти данные предполагают, что mTOR регулирует плацентарный транспорт аминокислот, и обеспечивают возможное механистическое объяснение изменений в транспорте лейцина при ЗВУР (137). С другой стороны, активация плацентарной передачи сигналов mTORC1 и переносчиков аминокислот была повышена у женщин, страдающих ожирением и рожавших детей крупного для гестационного возраста возраста (80). Эти исследования показывают сильную корреляцию между передачей сигналов mTOR и массой тела при рождении, подтверждая идею о том, что mTOR функционирует как плацентарный сенсор питательных веществ.
Йонссон и др. (80) показали, что белок mTOR экспрессируется в транспортирующем эпителии плаценты человека и в плаценте IUGR человека, и что активность обеих транспортных систем A и L плацентарных аминокислот снижена (136). Было показано, что mTOR позитивно регулирует транспорт аминокислот системы А (137, 138) и транспортную систему лейцина как в эксплантатах ворсинок нормальных доношенных плацент (136), так и в культивируемых клетках трофобласта (137) на посттранскрипционном уровне (89).Эти данные предполагают, что mTOR регулирует плацентарный транспорт аминокислот, и обеспечивают возможное механистическое объяснение изменений в транспорте лейцина при ЗВУР (137). С другой стороны, активация плацентарной передачи сигналов mTORC1 и переносчиков аминокислот была повышена у женщин, страдающих ожирением и рожавших детей крупного для гестационного возраста возраста (80). Эти исследования показывают сильную корреляцию между передачей сигналов mTOR и массой тела при рождении, подтверждая идею о том, что mTOR функционирует как плацентарный сенсор питательных веществ.
mTOR идеально сочетает передачу сигналов фактора роста и доступность питательных веществ, чтобы соответствовать росту плода, регулируя транспорт питательных веществ через плаценту. Однако до сих пор не было проведено никаких причинно-следственных исследований, изучающих эти механизмы. Действительно, сниженные уровни большинства незаменимых аминокислот также связаны с IUGR плодами (26, 27) у экспериментальных самок с материнской моделью изокалорийной LP диеты у мышей (18). Нарушение плацентарного транспорта аминокислот со снижением их использования плодом наблюдалось в модели плацентарной недостаточности у овец, вызванной гипертермией (38, 140).У людей материнская концентрация аминокислот при беременности, осложненной ЗВУР, так же низка, как и у небеременных женщин (40), а повышение материнской концентрации аминокислот посредством внутривенного вливания значительно увеличивает поглощение незаменимых аминокислот плодом (135). Хотя в исследованиях на животных нет прямых доказательств связи активности mTOR плаценты плода в утробе матери с окружающей средой плода, дисфункцией β-клеток и предрасположенностью к СД2, мы предполагаем, что определенные аминокислоты, циркулирующие у плода, могут оказывать потенциальное влияние на развивающуюся поджелудочную железу. и развитие β-клеток.В поддержку этой гипотезы была обнаружена положительная корреляция между активностью mTOR и повышенным эмбриональным уровнем аминокислот с разветвленной цепью в жидкости полости бластоцисты диабетических кроликов (68). Также было продемонстрировано, что определенные аминокислоты, такие как лейцин, которые могут активировать mTOR, напрямую влияют на предшественников поджелудочной железы и развитие β-клеток in vitro (49, 126). С использованием генетических моделей мышей было показано, что mTOR и ассоциированные белки этого пути напрямую регулируют развитие, массу и функцию β-клеток (2, 20, 49, 127).Островки потомства LP также показали снижение белка и активности mTOR, частично из-за повышенной экспрессии микроРНК 199 и 7, которые нацелены на путь mTOR (4). Восстановление передачи сигналов mTOR в β-клетках в течение последней недели беременности у потомства LP (4) было достаточным для устранения дисфункции β-клеток у этих мышей. При наличии генетических моделей с временной регуляцией и новой технологии с высокой специфичностью к мишени, такой как CRISPR-Cas 9, будущие исследования могут напрямую проверить потребность плацентарного mTOR [или белка(ов) в пути] для переноса специфических аминокислот.
и развитие β-клеток.В поддержку этой гипотезы была обнаружена положительная корреляция между активностью mTOR и повышенным эмбриональным уровнем аминокислот с разветвленной цепью в жидкости полости бластоцисты диабетических кроликов (68). Также было продемонстрировано, что определенные аминокислоты, такие как лейцин, которые могут активировать mTOR, напрямую влияют на предшественников поджелудочной железы и развитие β-клеток in vitro (49, 126). С использованием генетических моделей мышей было показано, что mTOR и ассоциированные белки этого пути напрямую регулируют развитие, массу и функцию β-клеток (2, 20, 49, 127).Островки потомства LP также показали снижение белка и активности mTOR, частично из-за повышенной экспрессии микроРНК 199 и 7, которые нацелены на путь mTOR (4). Восстановление передачи сигналов mTOR в β-клетках в течение последней недели беременности у потомства LP (4) было достаточным для устранения дисфункции β-клеток у этих мышей. При наличии генетических моделей с временной регуляцией и новой технологии с высокой специфичностью к мишени, такой как CRISPR-Cas 9, будущие исследования могут напрямую проверить потребность плацентарного mTOR [или белка(ов) в пути] для переноса специфических аминокислот. кислоты от плаценты к плоду, и может ли добавление определенных аминокислот обратить вспять влияние ограничения питания матери на массу β-клеток у плода.
кислоты от плаценты к плоду, и может ли добавление определенных аминокислот обратить вспять влияние ограничения питания матери на массу β-клеток у плода.
Влияние PL на пролиферацию и развитие β-клеток
PL, гормон, секретируемый исключительно плацентой, может играть важную роль в регуляции программирования β-клеток в ответ на субоптимальную внутриутробную среду. Действительно, отмечено, что PL играет ключевую роль в адаптации материнских островков во время беременности, усиливая функцию и пролиферацию β-клеток (24). Известно, что PL стимулирует секрецию инсулина и функцию островков у грызунов и человека (23, 62, 163), независимо от гормона роста (105) и инсулинового фактора роста-I (19).Насколько нам известно, нет прямых доказательств того, что PL может регулировать развитие β-клеток у плода во время беременности. Тем не менее, есть некоторые свидетельства того, что ПЛ обнаруживается в кровотоке плода. PL был обнаружен в течение беременности, от 6 недель до 30 недель, на уровне 1 г/день в ближайшее время (150). Однако концентрация в пуповине плода сразу после рождения оказалась намного ниже (80–125 нг/мл) (86). PL также был обнаружен в этой более низкой концентрации (80–120 нг/мл) в кровотоке плода и в еще более низком уровне (55–70 нг/мл) в амниотической жидкости (71).Таким образом, в середине беременности как у человека, так и у овцы концентрация PL в плазме плода превышала концентрацию PL в пуповине в срок (62). Это предполагает прямую секрецию PL в кровоток плода. Что касается прямого влияния PL на пролиферацию β-клеток у растущего плода, неясно, достаточна ли концентрация PL, достигающая среды поджелудочной железы плода, для активации их рецепторов таким образом, который влияет на рост β-клеток.
Однако концентрация в пуповине плода сразу после рождения оказалась намного ниже (80–125 нг/мл) (86). PL также был обнаружен в этой более низкой концентрации (80–120 нг/мл) в кровотоке плода и в еще более низком уровне (55–70 нг/мл) в амниотической жидкости (71).Таким образом, в середине беременности как у человека, так и у овцы концентрация PL в плазме плода превышала концентрацию PL в пуповине в срок (62). Это предполагает прямую секрецию PL в кровоток плода. Что касается прямого влияния PL на пролиферацию β-клеток у растущего плода, неясно, достаточна ли концентрация PL, достигающая среды поджелудочной железы плода, для активации их рецепторов таким образом, который влияет на рост β-клеток.
Предполагается, что в плаценте человеческий PL (hPL) играет роль «гормона роста матери», стимулируя передачу питательных веществ от матери к плоду посредством потенцирования материнской непереносимости глюкозы, липолиза, протеолиза (65), и резистентность к инсулину (142).При тестировании беременных женщин из группы высокого риска между 24 и 36 неделями гестации концентрация hPL у них была значительно ниже при преэклампсии и выше при гестационном диабете (48). Низкий уровень hPL у матери также коррелирует с задержкой роста плода (9, 114). Однако остается неясным, может ли PL регулировать островки плода так же, как они модулируют зрелые островки матери (8). Таким образом, будущие исследования могли бы оценить последствия измененных уровней PL или экспрессии его рецептора на развитие β-клеток у потомков IUGR.
Низкий уровень hPL у матери также коррелирует с задержкой роста плода (9, 114). Однако остается неясным, может ли PL регулировать островки плода так же, как они модулируют зрелые островки матери (8). Таким образом, будущие исследования могли бы оценить последствия измененных уровней PL или экспрессии его рецептора на развитие β-клеток у потомков IUGR.
Экзосомы и микроРНК
Экзосомы представляют собой нановезикулы, происходящие из эндосом, которые переносят различные молекулы, включая микроРНК, некодирующие РНК, белки и липиды (98, 100, 131), во внеклеточную среду и передают сигналы в отдаленные ткани (например, в поджелудочную железу). ) для модуляции клеточного развития, роста и функции. Недавно было обнаружено, что плацента секретирует эти нановезикулы в кровоток матери и плода во время беременности (108). Таким образом, можно предположить, что экзосомы, экспортируемые плацентой, могут достигать поджелудочной железы плода и их содержимого (т.е., микроРНК) могут влиять на пролиферацию β-клеток. Интересно, что Baeyens et al. (8) предположили, что плацентарно-специфические экзосомы увеличивают пролиферацию β-клеток в островках человека, предполагая, что экзосомы обладают свойствами прорастания. Хотя это спекулятивно, можно предположить, что плацентарные экзосомы, экспортируемые в поджелудочную железу, могут играть активную роль в пролиферации и выживании β-клеток как в поджелудочной железе матери, так и плода в ответ на метаболические потребности и сигналы развития, соответственно, во время беременности.Было показано, что длинные некодирующие РНК динамически экспрессируются во время увеличения массы β-клеток у беременных мышей и контролируют пролиферацию β-клеток in vitro (154). Кроме того, появляется все больше доказательств того, что микроРНК играют важную роль в модуляции экспрессии генов β-клеток и, таким образом, могут модифицировать пролиферацию, функцию и гибель β-клеток (4, 53, 101). Секреция экзосом значительно увеличивается во время беременности, а осложнения, включая преэклампсию, связаны с еще большей концентрацией экзосом в материнском кровотоке (132).
Интересно, что Baeyens et al. (8) предположили, что плацентарно-специфические экзосомы увеличивают пролиферацию β-клеток в островках человека, предполагая, что экзосомы обладают свойствами прорастания. Хотя это спекулятивно, можно предположить, что плацентарные экзосомы, экспортируемые в поджелудочную железу, могут играть активную роль в пролиферации и выживании β-клеток как в поджелудочной железе матери, так и плода в ответ на метаболические потребности и сигналы развития, соответственно, во время беременности.Было показано, что длинные некодирующие РНК динамически экспрессируются во время увеличения массы β-клеток у беременных мышей и контролируют пролиферацию β-клеток in vitro (154). Кроме того, появляется все больше доказательств того, что микроРНК играют важную роль в модуляции экспрессии генов β-клеток и, таким образом, могут модифицировать пролиферацию, функцию и гибель β-клеток (4, 53, 101). Секреция экзосом значительно увеличивается во время беременности, а осложнения, включая преэклампсию, связаны с еще большей концентрацией экзосом в материнском кровотоке (132). Возможно, что значительное 50-кратное увеличение количества экзосом (108, 143, 146) во время беременности может быть направлено на развитие и рост β-клеток. Как общее, так и плацентарное экзосомы увеличиваются с гестационным возрастом и положительно коррелируют с массой плаценты (143). Однако прямая связь между секретируемыми экзосомами и их содержимым, функцией и развитием плаценты не ясна (124). Можно постулировать, что любое изменение уровня и состава груза плацентарно-специфических экзосом, например, при ЗВУР, вызванной преэклампсией (121), может модулировать пролиферацию и развитие β-клеток у растущего плода.В нескольких сообщениях предполагается, что изменение специфических микроРНК может вызывать потерю массы и функции β-клеток в различных моделях IUGR. Например, уровни микроРНК (миР199, миР7, миР375 и миР15b) были изменены у потомков IUGR по сравнению с контролем (4, 46, 158). Dumortier и Van Obberghen (47) обсудили влияние микроРНК на развитие поджелудочной железы и, более конкретно, на β-клетки.
Возможно, что значительное 50-кратное увеличение количества экзосом (108, 143, 146) во время беременности может быть направлено на развитие и рост β-клеток. Как общее, так и плацентарное экзосомы увеличиваются с гестационным возрастом и положительно коррелируют с массой плаценты (143). Однако прямая связь между секретируемыми экзосомами и их содержимым, функцией и развитием плаценты не ясна (124). Можно постулировать, что любое изменение уровня и состава груза плацентарно-специфических экзосом, например, при ЗВУР, вызванной преэклампсией (121), может модулировать пролиферацию и развитие β-клеток у растущего плода.В нескольких сообщениях предполагается, что изменение специфических микроРНК может вызывать потерю массы и функции β-клеток в различных моделях IUGR. Например, уровни микроРНК (миР199, миР7, миР375 и миР15b) были изменены у потомков IUGR по сравнению с контролем (4, 46, 158). Dumortier и Van Obberghen (47) обсудили влияние микроРНК на развитие поджелудочной железы и, более конкретно, на β-клетки. На сегодняшний день специфические для плаценты микроРНК не исследовались на предмет влияния на пролиферацию и функцию β-клеток.Таким образом, в будущем будет представлять большой научный интерес оценка того, поглощаются ли плацентарные экзосомы β-клетками, идентификация каких-либо сигнальных молекул, которые несут экзосомы, а также проверка того, нацелены ли экзосомы на пролиферацию и функцию β-клеток.
На сегодняшний день специфические для плаценты микроРНК не исследовались на предмет влияния на пролиферацию и функцию β-клеток.Таким образом, в будущем будет представлять большой научный интерес оценка того, поглощаются ли плацентарные экзосомы β-клетками, идентификация каких-либо сигнальных молекул, которые несут экзосомы, а также проверка того, нацелены ли экзосомы на пролиферацию и функцию β-клеток.
Перспективы и значение
Плацента как эндокринный орган играет важную роль в координации адекватного роста плода, синтезируя и секретируя критические факторы, влияющие на рост и физиологию плода. Несмотря на десятилетия исследований, плацента является наименее изученным органом, и опубликованные сегодня исследования особенно коррелируют друг с другом.Существует острая необходимость в разработке генетических моделей мышей, чтобы показать прямую причинно-следственную связь и влияние специфических белков в плаценте, таких как mTOR-сенсор питательных веществ, которые могут модулировать программирование плода. Впоследствии в будущих исследованиях следует оценить эффективность использования этих критических белков в качестве жизнеспособных биомаркеров для диагностики лиц, которые могут подвергаться риску развития СД2. Наконец, нам нужно лучше понять, как плацента может общаться с растущим плодом, как в контексте здоровья, так и в контексте болезни.Открытие экзосом и микроРНК как возможных механизмов того, как плацента общается с плодом, является важным направлением. Роль экзосом, полученных из плаценты, в адаптации матери к резистентности к инсулину и, в частности, их влияние на развивающуюся поджелудочную железу плода, остается неизвестной. Будущие исследования должны быть направлены на изучение экзосом плаценты при нормальной и осложненной ЗВУР беременности и оценку их влияния на пролиферацию и гибель островковых клеток человека, а также их функцию in vitro.Будущие исследования могут также оценить влияние экзосом на пролиферацию и апоптоз in vivo и индуцированных плюрипотентных стволовых клеток на дифференцировку β-клеток.
Впоследствии в будущих исследованиях следует оценить эффективность использования этих критических белков в качестве жизнеспособных биомаркеров для диагностики лиц, которые могут подвергаться риску развития СД2. Наконец, нам нужно лучше понять, как плацента может общаться с растущим плодом, как в контексте здоровья, так и в контексте болезни.Открытие экзосом и микроРНК как возможных механизмов того, как плацента общается с плодом, является важным направлением. Роль экзосом, полученных из плаценты, в адаптации матери к резистентности к инсулину и, в частности, их влияние на развивающуюся поджелудочную железу плода, остается неизвестной. Будущие исследования должны быть направлены на изучение экзосом плаценты при нормальной и осложненной ЗВУР беременности и оценку их влияния на пролиферацию и гибель островковых клеток человека, а также их функцию in vitro.Будущие исследования могут также оценить влияние экзосом на пролиферацию и апоптоз in vivo и индуцированных плюрипотентных стволовых клеток на дифференцировку β-клеток. Поскольку другие группы продемонстрировали измененные экзосомы при ЗВУР и преэклампсии (121, 108), весьма вероятно, что их карго-содержание может модулировать развитие β-клеток. Идентификация специфических микроРНК или других сигнальных молекул в экзосомах необходима, чтобы позволить нам идентифицировать их мишени генов β-клеток. Это может стать важным шагом для обнаружения механистической связи между плацентарной функцией/секретируемыми факторами и регуляцией пролиферации и выживания β-клеток, тем самым подготовив почву для идентификации молекулярных мишеней для заместительной терапии β-клетками.
Поскольку другие группы продемонстрировали измененные экзосомы при ЗВУР и преэклампсии (121, 108), весьма вероятно, что их карго-содержание может модулировать развитие β-клеток. Идентификация специфических микроРНК или других сигнальных молекул в экзосомах необходима, чтобы позволить нам идентифицировать их мишени генов β-клеток. Это может стать важным шагом для обнаружения механистической связи между плацентарной функцией/секретируемыми факторами и регуляцией пролиферации и выживания β-клеток, тем самым подготовив почву для идентификации молекулярных мишеней для заместительной терапии β-клетками.
Плацентарная недостаточность – симптомы церебрального параличаДетский церебральный паралич
Плацентарная недостаточность или неспособность материнской плацентарной функции должным образом обеспечить здоровый, нормальный уровень насыщения кислородом и питательными веществами для плода представляет серьезный риск и последствия для ребенка, если не будет получена быстрая диагностика и немедленная медицинская помощь.
Диагностика и раннее тестирование плацентарной недостаточности при беременности
Плацентарная недостаточность, которая клинически упоминается как маточно-плацентарная сосудистая недостаточность или UPVI, представляет собой известный медицинский риск для беременных женщин.Таким образом, любая программа ухода за новорожденными будет проводить тест эффективности плаценты во временных рядах в течение 12 th . 16 -я и 20 -я недель беременности. В этом смысле ранняя диагностика и раннее тестирование на плацентарную недостаточность, а также устранение препятствий для развития плода или высокого риска для здоровья матери полностью зависят от получения беременными женщинами дородовой помощи в начале первого триместра.
В частности, эти сроки беременности позволяют медицинским работникам также попытаться подготовиться к профилактической помощи в случае, если тестирование на плацентарную недостаточность в целом выявит специфические гестационные осложнения, обычно связанные с UPVI, включая задержку внутриутробного развития у младенца и наличие преэклампсии или эклампсии. в матери.Наконец, любой младенец с дистрессом плода или другими родовыми осложнениями в утробе матери должен свидетельствовать о возможности плацентарной недостаточности как причины.
в матери.Наконец, любой младенец с дистрессом плода или другими родовыми осложнениями в утробе матери должен свидетельствовать о возможности плацентарной недостаточности как причины.
Проблемы, связанные с плацентарной недостаточностью
Во-первых, относительные проблемы, связанные с плацентарной недостаточностью, будут варьироваться от пациента к пациенту, особенно в том смысле, что плацентарная недостаточность является одной из степени или вопросом относительного количества, которое плацента демонстрирует для удовлетворения потребностей в кислороде и питательных веществах. плод.В этом смысле проблемы, связанные с плацентарной недостаточностью, зависят от следующего:
- Если плацентарная недостаточность мешает гестационному росту внутриутробного ребенка, строительные блоки жизни, такие как критические аминокислоты, продукты крови, питательные вещества и кислород, не достигают плода. Недостижение целей гестационного роста тесно связано с целым рядом необратимых нарушений развития у младенцев, включая церебральный паралич, умственную отсталость и достаточно тяжелые случаи смерти плода и мертворождения
- Плацентарная недостаточность, если она оправдана другими факторами, участвующими в расчете даты родов, может вызвать преждевременные роды, которые перевешивают риски, связанные с преждевременными родами, по оценке лечащего врача
- Плацентарная недостаточность связана с низкой массой тела при рождении, длительными родами и родами с тяжелыми состояниями, что может потребовать заблаговременного родоразрешения путем кесарева сечения
- Плацентарная недостаточность, при подозрении на нее, требует постоянного наблюдения в течение оставшейся части беременности, что касается матери, то состояние до крайне тяжелого состояния будет казаться относительно бессимптомным до подтверждения диагноза с помощью УЗИ и обследования акушером
В конечном счете, плацентарная недостаточность ставит под угрозу жизнь как ребенка, так и матери. В любом случае лишения гестационных потребностей в утробе матери, младенцы подвергаются экспоненциально повышенному риску развития в дальнейшем когнитивных, связанных с развитием и медицинских осложнений, которые, как правило, носят необратимый характер.
В любом случае лишения гестационных потребностей в утробе матери, младенцы подвергаются экспоненциально повышенному риску развития в дальнейшем когнитивных, связанных с развитием и медицинских осложнений, которые, как правило, носят необратимый характер.
Объяснение плацентарной недостаточности и задержки внутриутробного развития (ЗВУР)
Задержка внутриутробного развития возникает, когда в результате гестационного развития ребенка младенец имеет недостаточную массу тела, низкий рост или недоразвитие, при этом обычные гестационные недостатки развития чаще всего проявляются в легких, для полного формирования которых требуется не менее тридцати семи недель.В случаях тяжелой или длительной плацентарной недостаточности потребности внутриутробного развития ребенка не удовлетворяются, поскольку плацента не может должным образом циркулировать между матерью и ребенком, жизненно важными сосудистыми, дыхательными, гормональными и метаболическими активами, необходимыми для здорового живорождения, из-за плацентарной недостаточности. Измененное или сниженное плацентарное функционирование, которое не может активно или пассивно транспортировать необходимые гестационные материалы от матери к плоду, приведет к развитию задержки внутриутробного развития у младенцев, если плацентарная недостаточность сохраняется или прогрессирует.
Измененное или сниженное плацентарное функционирование, которое не может активно или пассивно транспортировать необходимые гестационные материалы от матери к плоду, приведет к развитию задержки внутриутробного развития у младенцев, если плацентарная недостаточность сохраняется или прогрессирует.
Роль плацентарной недостаточности в развитии церебрального паралича
Детский церебральный паралич (ДЦП) — это прогрессивно ухудшающееся состояние в детском и раннем взрослом возрасте, при котором пациенты испытывают серьезные проблемы со здоровьем из-за сходной группы разрушительных и неизлечимых симптомов. Как правило, повреждение или недостаточность головного мозга, необходимая в предполагаемых случаях начала церебрального паралича, требует длительного или острого тяжелого кислородного голодания в мозге, вызывая более легкие, но имеющие медицинское значение осложнения, такие как повреждение головного мозга и судороги, более немедленно, чем появление церебрального паралича. однако у младенцев.На практике большинство форм церебрального паралича очень сильно коррелируют с живорождением с плацентарной недостаточностью, поскольку непроизвольная материнская депривация из-за плацентарной недостаточности препятствует нормальному гестационному развитию и росту плода. Этот дефицит кислорода, а также прерывание гестации из-за экстренных преждевременных родов, тяжелых родов или длительного дефицита питательных веществ являются предполагаемыми причинами или способствующими факторами в случаях церебрального паралича.
однако у младенцев.На практике большинство форм церебрального паралича очень сильно коррелируют с живорождением с плацентарной недостаточностью, поскольку непроизвольная материнская депривация из-за плацентарной недостаточности препятствует нормальному гестационному развитию и росту плода. Этот дефицит кислорода, а также прерывание гестации из-за экстренных преждевременных родов, тяжелых родов или длительного дефицита питательных веществ являются предполагаемыми причинами или способствующими факторами в случаях церебрального паралича.
Ресурсы:
https://www.nlm.nih.gov/medlineplus/ency/article/001485.htm
http://ebooks.cambridge.org/chapter.jsf?bid=CBO9780511933806&cid=CBO9780511933806A027
https://myhealth.alberta.ca/Health/aftercareinformation/pages/conditions.aspx?hwid=uh5193
https://www.mountsinai.on.ca/care/placenta-clinic/complications/placentalinsufficiency
Дефицит галектина-3 во время беременности увеличивает риск задержки роста плода (ЗРП) из-за плацентарной недостаточности
«>Lees, C.С. и др. 2-летние неврологические и промежуточные перинатальные исходы у новорожденных с очень недоношенной задержкой роста плода (ТРЮФЕЛЬ): рандомизированное исследование. Lancet (Лондон, англ.) 385 , 2162–2172, https://doi.org/10.1016/s0140-6736(14)62049-3 (2015).
Артикул Google Scholar
Lees, C. et al. Перинатальная заболеваемость и смертность при ранней задержке роста плода: когортные результаты исследования рандомизированного течения пуповины и плода в Европе (TRUFFLE). Акушер УЗИ. Гинекол. 42 , 400–408, https://doi.org/10.1002/uog.13190 (2013).
КАС Статья пабмед Google Scholar
Bilardo, C.M. et al. Тяжелая задержка роста плода на сроке 26–32 недели: ключевые выводы исследования TRUFFLE. Акушер УЗИ. Гинекол. 50 , 285–290, https://doi.org/10. 1002/uog.18815 (2017).
1002/uog.18815 (2017).
КАС Статья пабмед Google Scholar
Судзуки, К.Развивающийся мир DOHaD. Дж. Дев. Ориг. Здоровье Дис. 9 , 266–269, https://doi.org/10.1017/s2040174417000691 (2018).
КАС Статья пабмед Google Scholar
Burton, G.J. & Jauniaux, E. Патофизиология задержки роста плода плацентарного происхождения. утра. Дж. Обст. Гинекол. 218 , S745–s761, https://doi.org/10.1016/j.ajog.2017.11.577 (2018).
КАС Статья пабмед Google Scholar
Навате, А.& Lees, C. Задержка роста плода в раннем возрасте. Лучший. Практика. Рез. клин. Обст. Гинеколь. 38 , 24–37, https://doi.org/10.1016/j.bpobgyn.2016.08.005 (2017).
Артикул пабмед Google Scholar
Блуа, С. М. и др. Ключевая роль галектина-1 в фетоматеринской толерантности. Нац. Мед 13 , 1450–1457 (2007).
КАС Статья Google Scholar
Тан, Н.Г. и др. Эволюционное происхождение плацентарной экспрессии кластерных галектинов хромосомы 19 и их сложная дисрегуляция при преэклампсии. Плацента https://doi.org/10.1016/j.placenta.2014.07.015 (2014 г.).
Тирадо-Гонсалес, И. и др. Галектин-1 влияет на уклонение трофобласта от иммунитета и выступает в качестве прогностического фактора исхода беременности. Мол. Репродукция человека. https://doi.org/10.1093/molehr/gas043 (2013 г.).
Блуа, С.М., Конрад М.Л., Фрайтаг Н. и Барриентос Г. Галектины в ангиогенезе: последствия для беременности. J. Изд. Иммун. https://doi.org/10.1016/j.jri.2014.12.001 (2015 г.).
Yang, H., Lei, C. & Zhang, W. Экспрессия галектина-3 в эндометрии мыши и его эффект во время имплантации эмбриона. Репрод. Биомед. Интернет 24 , 116–122, https://doi.org/10.1016/j.rbmo.2011.09.003 (2012).
КАС Статья пабмед Google Scholar
Божич М.и другие. Галектин-1 и галектин-3 в трофобласте гестационного трофобластического заболевания. Плацента 25 , 797–802 (2004).
КАС Статья Google Scholar
Hu, R., Jin, H., Zhou, S., Yang, P. & Li, X. Протеомный анализ реакций, вызванных гипоксией, при синцитиализации плацентарной клеточной линии человека BeWo. Плацента 28 , 399–407, https://doi.org/10.1016/j.placenta.2006.07.005 (2007).
КАС Статья пабмед Google Scholar
Jeschke, U. et al. Экспрессия галектина-1, -3 (gal-1, gal-3) и антигена Томсена-Фриденрайха (TF) в нормальных, ЗВУР, преэклампсии и HELLP плацентах. Плацента https://doi.org/10.1016/j.placenta.2007.06.006 (2007 г.).
Деммерт, М. и др. Галектин-3 в пуповинной крови доношенных и недоношенных детей. клин. Эксп. Иммунол. 167 , 246–251, https://doi.org/10.1111/j.1365-2249.2011.04509.x (2012).
КАС Статья пабмед ПабМед Центральный Google Scholar
Amarilio, G. et al. Повышение маркеров воспаления в сыворотке пуповины у новорожденных с малым весом для гестационного возраста. Ж. Перинатол. 31 , 30–32, https://doi.org/10.1038/jp.2010.53 (2011).
КАС Статья пабмед Google Scholar
Нардоцца, Л.М. и др. Ограничение роста плода: современные знания по общей акушерству/гинекологии. Арх. Гинекол. Обст. 286 , 1–13, https://doi.org/10.1007/s00404-012-2330-6 (2012).
Арх. Гинекол. Обст. 286 , 1–13, https://doi.org/10.1007/s00404-012-2330-6 (2012).
Артикул пабмед Google Scholar
Пауэлл, К. Л. и др. Роль бета-изоформы рецептора тромбоксана А2 в патогенезе задержки внутриутробного развития. науч. Респ. https://doi.org/10.1038/srep28811 (2016 г.).
Ли, В. Х., Ли, А. Б., Филлипс, Э. Б., Робертс, Дж. К. и Вейтлауф, Х. М. Пространственно-временной паттерн экспрессии галектина-3 в мышином маточно-плацентарном комплексе: доказательства дифференциальной регуляции. биол. Воспр. 58 , 1277–1282, https://doi.org/10.1095/biolreprod58.5.1277 (1998).
КАС Статья пабмед Google Scholar
фон Вольф М., Ван Х., Габиус Х.J. & Strowitzki, T. Отпечатки пальцев галектина в эндометрии и децидуальной оболочке человека во время менструального цикла и на ранних сроках беременности. Мол. Гум. Воспр. 11 , 189–194 (2005).
Мол. Гум. Воспр. 11 , 189–194 (2005).
Артикул Google Scholar
Yang, H. et al. Антиапоптотический эффект галектина-3 в клетках эндометрия человека при регуляции эстрогена и прогестерона. биол. Воспр. 87 , 39, https://doi.org/10.1095/биолрепрод.112.099234 (2012).
КАС Статья пабмед Google Scholar
Yang, H., Lei, C. & Zhang, W. Экспрессия галектина-3 в эндометрии мыши и его эффект во время имплантации эмбриона. Репрод. биомедицина онлайн 24 , 116–122 (2012).
КАС Статья Google Scholar
Бойич-Трбоевич, Ж. и другие.Трофобласту человека требуется галектин-3 для миграции и инвазии клеток. науч. Респ. 9 , 2136, https://doi.org/10.1038/s41598-018-38374-w (2019).
КАС Статья пабмед ПабМед Центральный Google Scholar
Суонсон, А. М. и Дэвид, А. Л. Модели ограничения роста плода на животных: рекомендации по трансляционной медицине. Плацента https://doi.org/10.1016/j.placenta.2015.03.003 (2015).
Clausson, B., Cnattingius, S. & Axelsson, O. Исходы переношенных родов: роль ограничения роста плода и пороков развития. Акушерство. Гинекол. 94 , 758–762 (1999).
КАС пабмед Google Scholar
Резник Р. Задержка внутриутробного развития. Акушерство. Гинекол. 99 , 490–496 (2002).
ПабМед Google Scholar
Баркер Д.J. Последствия ограничения роста плода для взрослых. клин. Обст. Гинекол. 49 , 270–283 (2006).
Артикул Google Scholar
Yougbare, I. et al. Активированные NK-клетки вызывают дисфункцию плаценты и выкидыши при аллоиммунной тромбоцитопении плода. Нац. коммун. 8 , 224, https://doi.org/10.1038/s41467-017-00269-1 (2017).
КАС Статья пабмед ПабМед Центральный Google Scholar
Алвес, К.М. и др. Галектин-3 играет модулирующую роль в продолжительности жизни и активации мышиных нейтрофилов во время ранней инфекции Toxoplasma gondii. Иммунобиология 215 , 475–485 (2010).
КАС Статья Google Scholar
Чен Х.Ю., Лю Ф.Т. и Ян Р.Ю. Роль галектина-3 в иммунных реакциях. Архив Иммунол. и др. therapiae Experimentis 53 , 497–504 (2005).
КАС Google Scholar
Бриттоли, А., Fallarini, S., Zhang, H., Pieters, RJ & Lombardi, G. Исследования in vitro галектина-3 в естественных клетках-киллерах человека. Иммунол. лат. 194 , 4–12, https://doi.org/10.1016/j.imlet.2017.12.004 (2018).
КАС Статья пабмед Google Scholar
Crider-Pirkle, S. et al. Кубилин, партнер по связыванию галектина-3 в мышином маточно-плацентарном комплексе. J. Biol. хим. 277 , 15904–15912 (2002 г.).
КАС Статья Google Scholar
Акисон Л.К., Нитерт М.Д., Клифтон В.Л., Мориц К.М. и Симмонс Д.Г. Обзор: изменения отложения плацентарного гликогена при осложненной беременности: текущие доклинические и клинические данные. Плацента 54 , 52–58, https://doi.org/10.1016/j.placenta.2017.01.114 (2017).
КАС Статья пабмед Google Scholar
Кунель, Э.и другие. Плацентарно-специфическая сверхэкспрессия sFlt-1 изменяет дифференцировку трофобласта и экспрессию переносчика питательных веществ в модели IUGR у мышей. Дж. Сотовый. Биохим. 118 , 1316–1329, https://doi.org/10.1002/jcb.25789 (2017).
КАС Статья пабмед Google Scholar
Коан, П. М., Конрой, Н., Бертон, Г. Дж. и Фергюсон-Смит, А. С. Происхождение и характеристики клеток гликогена в развивающейся мышиной плаценте. Дев. Дин. 235 , 3280–3294, https://doi.org/10.1002/dvdy.20981 (2006).
КАС Статья пабмед Google Scholar
Констанция, М. и др. Плацентарный IGF-II является основным модулятором роста плаценты и плода. Nature 417 , 945–948, https://doi.org/10.1038/nature00819 (2002).
КАС Статья пабмед Google Scholar
Баррьентос, Г.и другие. CXCR4(+) Дендритные клетки способствуют ангиогенезу во время имплантации эмбриона у мышей. Ангиогенез , https://doi.org/10.1007/s10456-012-9325-6 (2012).
Фрайтаг, Н. и др. Вмешательство в Gal-1-опосредованный ангиогенез способствует патогенезу преэклампсии. Проц. Нац. акад. науч. США. https://doi.org/10.1073/pnas.1303707110 (2013 г.).
Фрайтаг, Н. и др. Влияние относительного содержания NK-DC на плацентацию и его связь с эпигенетическим программированием у потомства. Гибель клеток Dis . https://doi.org/10.1038/cddis.2014.353 (2014 г.).
Плакс В. и др. Функциональное фенотипирование оборота материнского альбумина в плаценте мыши с помощью динамической МРТ с контрастным усилением. Мол. Изображение биол. 13 , 481–492, https://doi.org/10.1007/s11307-010-0390-1 (2011).
Артикул Google Scholar
Пэн В., Ван Х.Ю., Мияхара Ю., Пэн Г. и Ван Р.F. Ассоциированный с опухолью галектин-3 модулирует функцию опухолереактивных Т-клеток. Рак Res. 68 , 7228–7236 (2008).
КАС Статья Google Scholar
Анализ рынка препаратов для лечения плацентарной недостаточности 2026
Плацентарная недостаточность — это осложнение беременности, при котором плацента не может обеспечить плод достаточным питанием. Плацента представляет собой очень сложный круглый орган в матке, который поддерживает жизнь и здоровье ребенка во время беременности, обеспечивая его пищей и кислородом.Плацентарная недостаточность также известна как плацентарная дисфункция. Это редкое, но серьезное осложнение беременности. Курение и хроническое высокое кровяное давление являются двумя распространенными причинами плацентарной недостаточности. Кроме того, к фетоплацентарной недостаточности могут привести снижение потребления пищи матерью, нарушение свертываемости крови, наркомания, преэклампсия и т.д. Нет материнских симптомов, связанных с дисфункцией плаценты; однако мать может заметить, если размер матки меньше по сравнению с разными сроками беременности, меньше движений ребенка и т. д.
В зависимости от класса препаратов мировой рынок препаратов для лечения плацентарной недостаточности можно разделить на антиагреганты и антикоагулянты. Сегмент антиагрегантов, вероятно, будет расширяться значительными темпами в течение прогнозируемого периода. Антитромбоцитарные средства, такие как низкомолекулярные гепарины, обычно предпочитают врачи для лечения плацентарной недостаточности, поскольку они обладают более выраженной антитромботической активностью. Ожидается, что это приведет к росту сегмента в течение прогнозируемого периода.С точки зрения канала сбыта мировой рынок препаратов для лечения плацентарной недостаточности можно разделить на больничные аптеки, медицинские магазины и другие. Сегмент больничных аптек, как ожидается, будет расширяться значительными темпами в течение прогнозируемого периода, так как во время лечения пациенты вынуждены посещать больницы для профилактического осмотра, а также им удобно покупать лекарства в больничных аптеках.
Увеличение числа курящих женщин в развитых и развивающихся странах привело к различным проблемам с плацентой во время беременности.Это один из основных факторов, стимулирующих мировой рынок лечения плацентарной недостаточности. Однако ожидается, что ограниченная осведомленность в развивающихся странах о влиянии плацентарной недостаточности на ребенка и мать во время беременности будет препятствовать развитию рынка в ближайшие несколько лет.
С точки зрения региона, мировой рынок лечения плацентарной недостаточности можно разделить на Северную Америку, Европу, Азиатско-Тихоокеанский регион, Латинскую Америку, Ближний Восток и Африку. Северная Америка доминирует на мировом рынке препаратов для лечения плацентарной недостаточности.Прогнозируется, что на этот регион будет приходиться значительная доля мирового рынка в течение прогнозируемого периода из-за повышения осведомленности о влиянии расстройства на здоровье ребенка и матери. В Европе, по данным Community Research and Development Information Services (2015), плацентарная недостаточность является одной из ведущих причин, препятствующих росту ребенка до нормального веса в Европе. В нем также говорится, что ежегодно более 11 000 детей страдают плацентарной недостаточностью в Европейском Союзе.Это один из движущих факторов рынка лечения плацентарной недостаточности в Европе. Такие факторы, как рост числа пациентов с диабетом, ожирение у беременных женщин в развивающихся странах, таких как Китай и Япония, и развитие медицинских учреждений, вероятно, будут стимулировать рынок лечения плацентарной недостаточности в Азиатско-Тихоокеанском регионе в течение прогнозируемого периода. Кроме того, прогнозируется, что прогресс в тестах и диагностике, увеличение дохода на душу населения и доступность лекарств увеличат рынок лечения плацентарной недостаточности в регионе Ближнего Востока и Африки в течение прогнозируемого периода.
Ключевыми игроками на мировом рынке препаратов для лечения плацентарной недостаточности являются Glenmark Pharmaceuticals Limited, Aralez Pharmaceuticals Inc., AstraZeneca, Biocon Limited, Bristol-Myers Squibb Company и Merck & Co., Inc. среди прочих.
Этот аналитический отчет TMR является результатом тщательного изучения и тщательной оценки различных факторов, влияющих на рост рынка. В TMR работает сплоченная команда аналитиков, стратегов и отраслевых экспертов, которые предлагают клиентам инструменты, методологии и платформы для принятия более взвешенных решений.Наша цель, идеи и действенная аналитика позволяют CXO и руководителям уверенно продвигать свои критически важные приоритеты.
Изучение различных сил, влияющих на динамику рынка, а также ключевых и связанных с ними отраслей, помогает предприятиям понять различные потребительские предложения. Наши клиенты используют эти идеи и перспективы для повышения качества обслуживания клиентов в быстро меняющейся бизнес-среде.
Все наши идеи и взгляды в целом основаны на 4 столпах или этапах: ASBC-S, которые предлагают сложную и настраиваемую структуру для успеха организации.Их сущность и роль в организационных успехах освещены ниже:
- Повестка дня для CXO: TMR посредством исследования задает тон для повесток дня, которые имеют отношение к генеральным директорам, финансовым директорам, ИТ-директорам и другим руководителям CXO компаний, работающих на рынке. Перспективы помогают нашим клиентам преодолеть разрыв между повесткой дня и планом действий. TMR стремится дать CXO рекомендации по выполнению критически важных действий с помощью различных инструментов бизнес-анализа и повышению производительности организаций.Перспективы помогут вам выбрать собственный маркетинговый комплекс, который хорошо согласуется с политикой, видением и миссией.
- Стратегические рамки: исследование предлагает, как организации устанавливают как краткосрочные, так и долгосрочные стратегические планы. Наша команда экспертов сотрудничает и общается с вами, чтобы понять это, чтобы сделать ваши организации устойчивыми и устойчивыми в трудные времена. Эти идеи помогают им определить устойчивое конкурентное преимущество для каждого бизнес-подразделения.
- Сравнительный анализ для определения целевых рынков и позиционирования бренда. Оценки в исследовании обеспечивают тщательный анализ маркетинговых каналов и комплекса маркетинга. Наши различные группы работают синергетически с вами, чтобы помочь определить ваши фактические и потенциальные прямые, косвенные и бюджетные области конкуренции. Кроме того, исследование помогает определить наиболее эффективные бюджеты для различных процессов и рекламных мероприятий. Кроме того, исследование поможет вам установить ориентиры для интеграции людей и процессов с 4P маркетинга.В конце концов, это даст вам возможность найти уникальные стратегии предложения и ниши.
- Business Composability for Sustainability (C-S): Постоянное стратегическое планирование для обеспечения устойчивости, характеризующее нашу структуру C-S в отчете, стало более актуальным, чем раньше, перед лицом сбоев, вызванных пандемиями, рецессиями, циклами подъемов и спадов, а также меняющимся геополитическим сценарием. Исследование TMR предлагает высокий уровень настройки, чтобы помочь вам достичь компонуемости бизнеса.Компонуемые предприятия все чаще привлекают внимание CXO, чтобы помочь им бороться с волатильностью рынка. Наши аналитики и отраслевые эксперты помогут вам справиться с такой неопределенностью и помогут вам стать разумным устойчивым бизнесом в целом.
Исследование представляет собой тщательный анализ региональных потребительских и технологических тенденций, включая самую последнюю отраслевую динамику. Они широко охватывают, но не ограничиваются
- Северная Америка, Южная Америка и Америка
- Азиатско-Тихоокеанский регион и Япония
- Европа
- Латинская Америка
- Ближний Восток и Африка
Исследование предлагает информацию, основанную на данных, и рекомендации по нескольким аспектам.Некоторые из наиболее примечательных вопросов:
- Каковы основные последние тенденции, которые могут повлиять на жизненный цикл продукта и рентабельность инвестиций?
- Какие нормативные тенденции формируют стратегии корпоративного, бизнес-уровня и функционального уровня?
- Какие микромаркетинговые инициативы ведущих игроков принесут инвестиции?
- Что может быть лучшей структурой и инструментами для анализа PESTLE?
- В каких регионах появятся новые возможности?
- Какие революционные технологии будут использоваться для получения новых источников дохода в ближайшем будущем?
- Какие операционные и тактические схемы используются различными игроками для завоевания лояльности клиентов?
- Какова текущая и ожидаемая интенсивность конкуренции на рынке в ближайшем будущем?
Заявление об отказе от ответственности : Это исследование рынка является постоянной работой, и мы уделяем особое внимание поддержанию высочайшего уровня точности на всех этапах.

 ).
).

 2003 г., 15 апреля (2): 147–57. [PubMed: 12634607]
2003 г., 15 апреля (2): 147–57. [PubMed: 12634607] [PubMed: 7755042]
[PubMed: 7755042]