Ученые СПбГУ: прививка от туберкулеза может снизить скорость распространения COVID-19 и облегчить его течение
Весной ученые всего мира активно обсуждали, есть ли связь между вакцинацией от туберкулеза в раннем детстве и легким течением новой коронавирусной инфекции. Однако на тот момент статистики по пациентам с COVID-19 было еще недостаточно, чтобы делать достоверные выводы. Сегодня врачи всего мира начинают находить важные закономерности, которые позволят защитить здоровье людей в будущем.
Обзор опубликован в научном журнале Juvenis scientia.
Анализ статистических данных, который провели эксперты СПбГУ, показал, что уровень заболеваемости COVID-19, течение вызванной инфекцией острой интерстициальной пневмонии и уровень смертности от нее связаны с фактом вакцинации бациллами Кальметта-Герена (БЦЖ) согласно национальному календарю прививок. Смертность оказалась ниже в тех странах, где работали ранее или продолжаются и сегодня национальные программы иммунизации вакциной, особенно если практиковались ревакцинации: в Восточной Европе, Финляндии, Китае, Японии, Корее, Средней и Южной Азии, Африке, в ряде стран, входивших в СССР.
Авторами статьи, созданной под руководством заместителя руководителя лаборатории мозаики аутоиммунитета, заведующего кафедрой патологии СПбГУ Леонида Чурилова, стали молодые
исследователи: студентка СПбГУ, лаборант-исследователь лаборатории Алина Петяева, врач-терапевт, выпускница онлайн-курса СПбГУ General Pathophysiology Яна Ивашкевич, ведущая научную работу в Университете, а также врач Любовь Козачевская.
Прививку БЦЖ в России делают один раз в жизни новорожденным — Но именно раннее и продолжительное воздействие штамма вакцины на формирующуюся иммунную систему обеспечивает адъювантный эффект — усиливает иммунный ответ организма на различные, в том числе многие инфекционные антигены.
Врач-терапевт, выпускница онлайн-курса СПбГУ General Pathophysiology Яна Ивашкевич
«Адъювант — это вещество, усиливающее иммунные ответы неспецифически. Многие адъюванты усиливают и аутоиммунные процессы. Но вакцина БЦЖ имеет нехарактерные для большинства адъювантов свойства: например, выполняет функцию иммуномодулятора, а также снижает риск некоторых аутоиммунных болезней и лимфом. COVID-19 может провоцировать аутоиммунные осложнения, поэтому столь необычные для адъюванта свойства БЦЖ могут и в этом отношении быть полезны. По данным статистики, в странах, практикующих неонатальную вакцинацию БЦЖ, отмечено общее снижение детской смертности», — рассказала Яна Ивашкевич.
Многие адъюванты усиливают и аутоиммунные процессы. Но вакцина БЦЖ имеет нехарактерные для большинства адъювантов свойства: например, выполняет функцию иммуномодулятора, а также снижает риск некоторых аутоиммунных болезней и лимфом. COVID-19 может провоцировать аутоиммунные осложнения, поэтому столь необычные для адъюванта свойства БЦЖ могут и в этом отношении быть полезны. По данным статистики, в странах, практикующих неонатальную вакцинацию БЦЖ, отмечено общее снижение детской смертности», — рассказала Яна Ивашкевич.
Ревакцинацию — повторение прививки в течение жизни — сейчас практикуют только четыре страны: Белоруссия, Казахстан, Туркменистан и Узбекистан. Важно, что эффект тренированного иммунитета достигается, если вакцина БЦЖ вводится при незрелой иммунной системе, уверены ученые. «Есть основания полагать, что у взрослых и пожилых людей, не привитых в раннем детстве, эффект от позднего введения вакцины будет существенно меньше, — объяснил Леонид Чурилов. — В то же время имеются работы исследователей из Нидерландов, где в детстве не проводят вакцинацию БЦЖ, указывающие, что ее введение взрослым не ухудшает, а, возможно, несколько облегчает течение болезни при инфицировании новым коронавирусом».
Как рассказали авторы статьи, вакцина БЦЖ активирует местный иммунный ответ на слизистых оболочках. Именно через них распространяется вызванное SARS-CoV-2 острое респираторное заболевание. По словам ученых, вакцина БЦЖ запускает тренированный иммунитет, который активирует моноциты, макрофаги и натуральные киллеры — клетки, мобилизующие неспецифические защитные силы организма. Также вырабатываемые после вакцинации БЦЖ гамма-интерферон и другие медиаторы в конечном итоге могут способствовать менее тяжелому течению заболевания.
У возбудителя новой коронавирусной инфекции и БЦЖ имеются общие пептиды, а значит, возможна индукция перекрестного иммунитета. Сейчас активно идут крупные клинические исследования вакцины БЦЖ и испытания ее использования для профилактики новой коронавирусной инфекции — например, в Нидерландах и Австралии.
Врач-терапевт, выпускница онлайн-курса СПбГУ General Pathophysiology Яна Ивашкевич
Кроме того, объясняют ученые, позицию о связи БЦЖ со снижением скорости распространения COVID-19 и менее тяжелым течением болезни подтверждают исследования международных коллективов коллег из США, Германии, Канады, Индии и Ирана.
Публикации о данном исследовании ученых СПбГУ вышли в крупнейших российских СМИ: в деловой газете «Взгляд», «Российской газете», газете «Санкт-Петербургские ведомости», газете «Петербургский дневник», в Известиях, интернет-издания Lenta.ru, на лентах информационных агентств РБК, Интерфакс и РИА Новости, а также в эфире Радио Sputnik.
Отметим, что 6 декабря в СПбГУ пройдет VI Международная академия аутоиммунитета (SPBAA 2020) — крупнейшее в России образовательное мероприятие, объединяющее ведущих ученых и клиницистов всего мира, которые занимаются проблемами аутоиммунных заболеваний. В этом году участники мероприятия встретятся в онлайн-формате и обсудят влияние на иммунитет COVID-19, аллергии, беременности и многих других факторов. Регистрация доступна на сайте мероприятия. Для российских студентов-медиков и всех обучающихся СПбГУ предусмотрено участие на безвозмездной основе.
Прививка БЦЖ: почти абсолютная защита от ковида
Что случилось
Вакцинация бациллой Кальметта — Герена (БЦЖ) обеспечила 100-процентную защиту от развития инфекции COVID-19, вызванной коронавирусом SARS-CoV-2.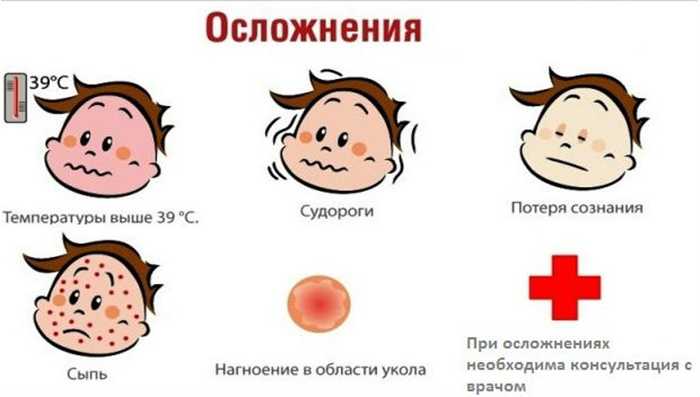
Почему это важно
По мере усугубления пандемии COVID-19 разработка вакцин вышла на первый план. Увы, антиген-специфические вакцины, на которых сосредоточено большинство клинических программ, с трудом поспевают за новыми штаммами коронавируса. Идеальная вакцина должна быть безопасной, эффективной, доступной и обеспечивающей длительную защиту от вируса с любыми мутациями.
О чём вообще речь
Вакцина БЦЖ оказывает долгосрочные положительные изменения во врожденной иммунной системе как первой линии обороны против любого патогена. «Тренированный иммунитет», задействованный и подкрепляемый ежегодной прививкой БЦЖ, держит иммунную систему в должном активированном состоянии для противостояния вирусам, бактериям и паразитам. БЦЖ надежно защищает от ковида, причем вне зависимости от каких-либо мутационных особенностей любых штаммов коронавируса, включая ныне доминирующий омикрон. Фактически БЦЖ представляет собой универсальную вакцину.
С учетом, во-первых, решительно копеечной стоимости БЦЖ, доступной любому государству, и, во-вторых, столетней истории этой противотуберкулезной вакцины, которая является одной из самых безопасных из когда-либо разработанных и которой по-прежнему вакцинируются десятки миллионов детей ежегодно, и потому сводящей на нет все претензии антипрививочников, перед нами открываются решительно новые перспективы борьбы с коронавирусной пандемией.
Что такое БЦЖ
Бацилла Кальме́тта — Гере́на (БЦЖ, BCG), впервые внедренная в медицинскую практику в 1921 году, — это вакцина, применяемая главным образом для защиты от туберкулеза. БЦЖ также обладает определенной активностью против других нетуберкулезных микобактериальных инфекций (проказы и язвы Бурули), является стандартом лечения немышечно-инвазивного рака мочевого пузыря.
БЦЖ представляет собой живой высокоаттенуированный (ослабленный) штамм микобактерии бычьего типа (Mycobacterium bovis).
Эффективность вакцины БЦЖ для предотвращения туберкулеза точно оценить затруднительно ввиду сочетания ряда факторов, таких как различия культивируемых штаммов вакцины и лабораторных условий, где она выращивается, генетические различия в популяциях прививаемых, изменения в окружающей среде, воздействия других бактериальных и паразитарных инфекций. [1] [2] [3] [4] [5] [6] [7]
Считается, что вакцина БЦЖ снижает риск заболеть туберкулезом приблизительно на 50%. [8] Другие оценки полагают, что вакцина БЦЖ уменьшает количество инфекций на 19–27% и ослабляет риск прогрессирования до активного туберкулеза на 71%. [9]
[8] Другие оценки полагают, что вакцина БЦЖ уменьшает количество инфекций на 19–27% и ослабляет риск прогрессирования до активного туберкулеза на 71%. [9]
Продолжительность защитного действия БЦЖ точно не известна. В одном исследовании было показано, что вакцинная защита ослабевает до 59% по прошествии 15 лет после иммунизации и до нуля через 20 лет. [10] В другом было продемонстрировано сохранение защитной эффективности и через 60 лет. [11]
БЦЖ остается единственной одобренной вакциной для профилактики туберкулеза, но противоречивость ее эффективности заставляет разрабатывать новые противотуберкулезные вакцины, появление которых более чем востребовано ввиду эволюции Mycobacterium tuberculosis со множественной лекарственной устойчивостью (МЛУ). Фармотрасль к созданию противотуберкулезных вакцин относится весьма прохладно, понимая отсутствие серьезных бизнес-перспектив, так как туберкулез в основном ассоциирован с небогатыми странами.
Предпосылки
Вакцина БЦЖ, будучи одной из самых безопасных когда-либо разработанных вакцин, широко применяется по всему миру, назначаясь новорожденным для профилактики туберкулеза.
С началом пандемии коронавируса SARS-CoV-2 некоторые эпидемиологические исследования выявили связь между неонатальной вакцинацией БЦЖ и снижением заболеваемости и смертности от коронавирусной инфекции COVID-19 — даже у пожилых людей спустя десятилетия после иммунизации. [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] Однако в некоторых популяциях, которые прививались по-разному и получали разные штаммы БЦЖ, подобного преимущества не наблюдалось.
Эффективность БЦЖ для защиты от ковида
Клиническое исследование NCT02081326 фазы II/III (рандомизированное, двойное слепое, плацебо-контролируемое) проверило гипотезу, полагающую, что периодическая вакцинация бациллой Кельметта — Герена (БЦЖ) оказывает благоприятное иммунологическое и метаболическое действие при сахарном диабете 1-го типа.
- Идея состояла в том, что БЦЖ стимулирует врожденную иммунную систему, которая активирует фактор некроза опухоли (TNF), запускающий процесс уничтожения аутореактивных цитотоксических T-клеток, разрушающих инсулиносекретирующие бета-клетки поджелудочной железы. Прогрессирующий аутоиммунный процесс, лежащий в основе сахарного диабета 1-го типа, смягчается, поджелудочная железа получает возможность для регенерации. БЦЖ, перезагружающая иммунную систему, вызывает масштабные изменения: посредством механизма эпигенетического перепрограммирования в в T-клетках CD4+ происходит деметилирование всех шести ключевых T-регуляторных генов (Foxp3, TNFRSF18, IL2RA, IKZF2, IKZF4, CTLA4), имеющих отношение к метаболизму глюкозы, что отражается переключением иммунной системы с высокого уровня окислительного фосфорилирования на усиленный ранний аэробный гликолиз.
 Такой системный метаболический сдвиг позволяет клеткам потреблять большое количество глюкозы регулируемым образом и безопасно снизить гипергликемию до уровня, близкого к нормальному. [1] [2] [3]
Такой системный метаболический сдвиг позволяет клеткам потреблять большое количество глюкозы регулируемым образом и безопасно снизить гипергликемию до уровня, близкого к нормальному. [1] [2] [3]
Взрослым пациентам (n=144) назначали внутрикожно плацебо или БЦЖ — две дозы с промежутком 4 недели в первый год, а затем по одной дозе ежегодно на протяжении последующих четырех лет.
Когда началась пандемия коронавирусной инфекции COVID-19, было принято решение изучить влияние вакцины БЦЖ на коронавирус SARS-CoV-2. Это и было сделано в период с начала января 2020 года по апрель 2021-го, когда все участники уже получили по три дозы БЦЖ или плацебо.
Установлено, что вакцинация БЦЖ предотвратила развитие ковида с эффективностью 92%: в группе БЦЖ ковидом заболел 1% испытуемых (n=1/96), тогда как в группе плацебо — 12,5% (n=6/48). Диагноз подтверждался наличием симптомов и антител против SARS-CoV-2.
Если говорить о предотвращении развития ковида, диагноз которого подтверждался методом ПЦР (что более точно и достоверно), защитная эффективность вакцины БЦЖ составила 100%: 0% заболевших — против 10,4% (n=5/48).
Привитые БЦЖ реже сталкивались с другими инфекциями, вызванными не SARS-CoV-2 (например, грипп, простуда, синусит, инфекции мочевого пузыря), однако для достижения статистически значимого (p=0,004) расхождения с группой плацебо потребовалось два года после первой дозы вакцины. Даже если какое-либо заболевание случалось, степень тяжести его симптомов и продолжительность инфекции были существенно легче и короче (p=0,04).
БЦЖ против коронавируса: плюсы
Клиническое испытание NCT02081326 продемонстрировало, что периодическая и относительно частая вакцинация БЦЖ защитила от ковида с высочайшей эффективностью, сравнимой с тем уровнем защиты, который предоставляли «Комирнати» (Comirnaty, тозинамеран; BNT162b2) и «Спайквакс» (Spikevax, эласомеран; mRNA-1273) — сильнейшие мРНК-вакцины авторства «Пфайзер» (Pfizer)/«Байонтек» (BioNTech) и «Модерна» (Moderna) — на заре пандемии, когда коронавирус еще не мутировал.
При оценке столь впечатляющих исходов следует принять к сведению ряд положительных особенностей этого исследования, свидетельствующих в пользу достоверности полученных результатов:
- Поскольку в США новорожденных или взрослых никогда планово не вакцинировали БЦЖ, испытание осуществило адекватную проверку влияния такой иммунизации на риск развития ковида.
 К моменту начала пандемии COVID-19 все участники, не подверженные туберкулезу и ранее не прививавшиеся БЦЖ, получили по три дозы вакцины БЦЖ или плацебо.
К моменту начала пандемии COVID-19 все участники, не подверженные туберкулезу и ранее не прививавшиеся БЦЖ, получили по три дозы вакцины БЦЖ или плацебо.
- Использовался очень мощный японский штамм БЦЖ, Tokyo 172-1, характеризующийся одним из самых высоких показателей потентности in vitro и высокой иммуногенностью. [1] [2] [3] [4] [5] Действительно, по числу заболевших или умерших от ковида в пересчете на миллион жителей Япония, как страна с обязательной вакцинацией БЦЖ, не занимает никаких лидирующих позиций, находясь лишь во второй сотне в рейтинге стран, наиболее пострадавших от пандемии.
- У приглашенных участников был сахарный диабет 1-го типа — известный фактор риска инфекционных заболеваний, включая ковид. [6] [7] Это позволяет предположить, что вакцина БЦЖ эффективна в популяциях, восприимчивых к инфекциям.
- Исследование обращалось к строгим молекулярным методам для диагностики случаев COVID-19 на основе ПЦР и/или SARS-CoV-2-направленной выработки иммуноглобулина к специфическим регионам вируса для подтверждения текущей или прошлой инфекции.

- Отсева пациентов не было, что усилило статистическую мощность.
- Исследование было проведено среди людей, прежде не болевших ковидом и не вакцинировавшихся от него. Включение серопозитивных по SARS-CoV-2 могло бы исказить степень защитного эффекта вакцины БЦЖ.
Следует отметить
В начале июля 2022 года были опубликованы результаты клинического испытания ACTIVATE II (NCT04414267) фазы IV (рандомизированного, двойного слепого, плацебо-контролируемого, многоцентрового), проверившего вакцину БЦЖ для защиты от COVID-19 среди возрастных (50 лет и старше) жителей Греции (n=190). В ходе 6-месячных наблюдений после введения одной дозы БЦЖ выяснилось, что риск ковида относительно плацебо снизился на 68%: отношение шансов (odds ratio, OR) 0,32 (95% ДИ: 0,13–0,79; p=0,014). [1]
БЦЖ против коронавируса: минусы
Единственным недостатком вакцинации БЦЖ для профилактики коронавирусной инфекции COVID-19 является весьма длительный период времени, который требуется для организации надлежащей и широкой противовирусной защиты, которая в данном случае является внецелевым эффектом этой противотуберкулезной вакцины. В отличие от стандартных антиген-специфических противоковидных вакцин, иммунитет после которых формируется в течение нескольких недель, иммунизация БЦЖ требует для этого многие месяцы — не исключено, необходимо приблизительно два года. [1] [2] [3] [4] Однако если защита против SARS-CoV-2, предоставленная первыми, в целом ограничена конкретным штаммом коронавируса и со временем ослабевает, то прививка БЦЖ работает вне зависимости от вирусных мутаций, причем на протяжении десятилетий или даже, возможно, пожизненно. [2] [3]
В отличие от стандартных антиген-специфических противоковидных вакцин, иммунитет после которых формируется в течение нескольких недель, иммунизация БЦЖ требует для этого многие месяцы — не исключено, необходимо приблизительно два года. [1] [2] [3] [4] Однако если защита против SARS-CoV-2, предоставленная первыми, в целом ограничена конкретным штаммом коронавируса и со временем ослабевает, то прививка БЦЖ работает вне зависимости от вирусных мутаций, причем на протяжении десятилетий или даже, возможно, пожизненно. [2] [3]
Медленное наступление защитного эффекта с продолжительным его сохранением обусловлено постепенной миграцией микроорганизмов в составе БЦЖ в костный мозг, где они инфицируют резидентные стволовые клетки. Процесс может ускориться при внутривенном введении БЦЖ. [2] [5] [6]
В течение двух–трех лет БЦЖ изменяет ключевые метаболические и иммунные сигнальные пути посредством метилирования генов. [6] [7] [8] Происходят также химические модификации (метилирование, ацетилирование и т. п.) гистонов в промоторах и энхансерах генов. [9] [10] Медленный перезапуск ключевых иммунных генов под действием БЦЖ почти во всех типах лимфоидных клеток, таких как T-клетки и моноциты, свидетельствует, что продолжительный иммунитет является многолинейным. Возможно, это связано с ремоделированием иммунной системы стволовыми клетками под влиянием синергичного характера микроорганизмов в составе БЦЖ.
п.) гистонов в промоторах и энхансерах генов. [9] [10] Медленный перезапуск ключевых иммунных генов под действием БЦЖ почти во всех типах лимфоидных клеток, таких как T-клетки и моноциты, свидетельствует, что продолжительный иммунитет является многолинейным. Возможно, это связано с ремоделированием иммунной системы стволовыми клетками под влиянием синергичного характера микроорганизмов в составе БЦЖ.
В целом сам по себе процесс формирования «тренированного иммунитета» весьма небыстрый. Речь идет о концепции, опровергающей, что только адаптивный иммунитет располагает памятью, и полагающей, что врожденная иммунная система обладает аналогичным свойством. «Тренированный иммунитет» реализуется путем эпигенетического перепрограммирования — устойчивых изменений в экспрессии генов и физиологии клеток, не связанных с постоянными генетическими изменениями, такими как мутации и рекомбинации, которые необходимы для адаптивного иммунитета. [11]
Слабые места
Предшествовавшие проверки БЦЖ в задаче профилактики COVID-19 себя не оправдали. Так, клиническое исследование BCG-CORONA (NCT04328441) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое), осуществленное среди голландских медработников (n=1171) не выявило какой-либо пользы от БЦЖ. [1]
Так, клиническое исследование BCG-CORONA (NCT04328441) фазы III (рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое), осуществленное среди голландских медработников (n=1171) не выявило какой-либо пользы от БЦЖ. [1]
С аналогичным провалом столкнулось клиническое исследование NCT04379336 фазы III (рандомизированное, двойное слепое, плацебо-контролируемое) среди южноафриканских медицинских работников (n=964). [2]
Открытые вопросы
Причины, по которым в ряде клинических испытаний вакцинация БЦЖ не сработала для защиты от SARS-CoV-2, многочисленны. Так, могла вмешаться латентная туберкулезная инфекция, представляющая собой континуум между иммунной памятью и активно реплицирующимися микобактериями, когда инфекция оказывает глубокое влияние на активацию и поляризацию моноцитов и на количество и активность лимфоцитов, при этом подавляя процессы «тренированного иммунитета» в костном мозге. [1] [2] [3] [4]
Неспецифические иммунные преимущества БЦЖ могут иметь клиническое значение только у очень молодых или пожилых людей ввиду сильного различия с общей популяцией в том, что касается T- и B-клеточных компартментов, пролиферативной способности, чувствительности к активации и сигналам выживания. [5] [6] [7]
[5] [6] [7]
Нельзя исключать вкладов со стороны таких факторов, как статус предшествовавшей вакцинации БЦЖ (является ли прививка первичной или фактически бустерной по прошествии многих лет), особенности штамма БЦЖ (французский, датский, японский, русские варианты БЦЖ имеют разную иммунную активность), дозовый режим (возможно, имеют значение нагрузочные две-три дозы БЦЖ, вводимые с месячным промежутком), способ применения (не исключено, внутривенная доставка БЦЖ более эффективна, чем внутрикожная).
Что дальше
Осталось дождаться результатов крупномасштабного клинического испытания BRACE (NCT04327206) фазы III (рандомизированного, двойного слепого, плацебо-контролируемого, многоцентрового) среди медицинских работников (n=6828) Австралии, Бразилии, Великобритании, Голландии и Испании. [1]
Вакцинация БЦЖ: 90 лет прошло, а еще так много нужно узнать…
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Редакция
Вакцинация БЦЖ: 90 лет спустя, а еще так много предстоит узнать…
- Ajit Lalvani,
- Saranya Sridhar
- Tuberculosis Research Fort Подразделение, Департамент респираторной медицины, Национальный институт сердца и легких, Имперский колледж Лондона, Норфолк-плейс, Лондон, W2 1PG, Великобритания; a.
 lalvani{at}imperial.ac.uk
lalvani{at}imperial.ac.uk
http://dx.doi.org/10.1136/thx.2010.140996
Статистика с сайта Altmetric.com
Запрос разрешений
вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
История вакцинации против туберкулеза изобилует случаями научных открытий и повторных открытий. В конце 19В начале 20-го века, после объявления Робертом Кохом об открытии им Mycobacterium tuberculosis в 1882 году, ученые всего мира, в том числе и сам Кох, решили изобрести вакцину против туберкулеза. В 1908 году Леон Кальметт, бактериолог, и Камиль Герен, ветеринар из Института Пастера, Лилль, начали эксперимент по разработке вакцины путем ослабления штамма Mycobacterium bovis до тех пор, пока он не потерял свою вирулентность. Тринадцать лет и 230 пассажей спустя они смогли показать, что штамм обладал защитным действием на животных моделях и больше не вызывал болезни, которая, как впоследствии было обнаружено, в первую очередь связана с потерей генов в области различия 1 (RD1) области 9Геном 0063 M bovis .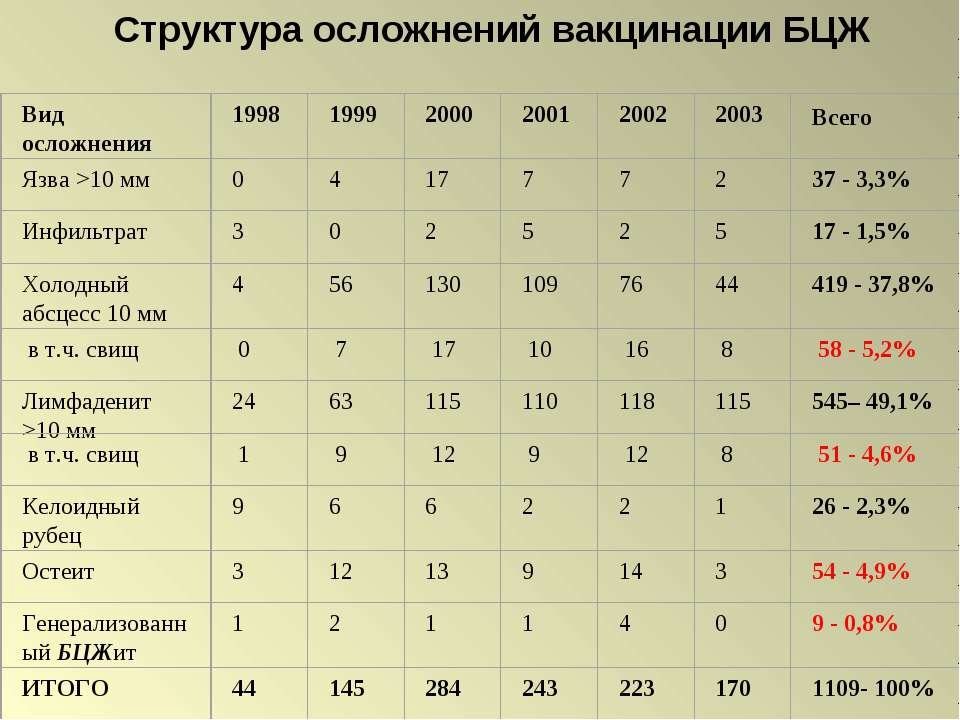 1 В том же году ребенку, контактировавшему с больным туберкулезом, была введена первая доза живой аттенуированной вакцины M bovis Bacille Calmette-Geurin (БЦЖ). Теперь, когда ввели более 3 миллиардов доз, БЦЖ является наиболее широко используемой вакциной во всем мире.
1 В том же году ребенку, контактировавшему с больным туберкулезом, была введена первая доза живой аттенуированной вакцины M bovis Bacille Calmette-Geurin (БЦЖ). Теперь, когда ввели более 3 миллиардов доз, БЦЖ является наиболее широко используемой вакциной во всем мире.
С момента своего первого применения 90 лет назад БЦЖ была рекомендована в качестве вакцины из-за ее частичного защитного действия против активного туберкулеза и смерти, хотя и с большей эффективностью против диссеминированных и менингеальных заболеваний у детей, чем против легочных заболеваний у подростков и взрослых.2 3 Это, вместе с исследованиями вскрытия, предполагает, что БЦЖ уменьшает размер очагов туберкулеза в легких, тем самым ограничивая бациллярное размножение и распространение4, и модели животных, где вакцинация БЦЖ снижает бактериальную нагрузку через 9 лет.0063 Mtuberculosis вызов, но не защищает от инфекции, привел к давней догме, согласно которой БЦЖ защищает от распространения и заболевания, но не от инфекции. Всего 5 лет назад первое сообщение5 о способности БЦЖ защищать от инфекции изменило наше представление о том, как действует БЦЖ. Вывод о том, что БЦЖ может действовать на ранней стадии пути передачи инфекции от туберкулеза к заболеванию (рис. 1), впоследствии был подтвержден исследованиями контактов взрослых и детей в сообществе в Гамбурге6 и двумя исследованиями школьных вспышек туберкулеза в Великобритании. 7 последний из которых опубликован в текущем выпуске Thorax ( см. стр. 1067 ).8 Исследуя вспышку точечного туберкулеза в детском саду, Эриксен и его коллеги обнаружили, что у детей, вакцинированных БЦЖ, вероятность заражения была значительно ниже, судя по высвобождению гамма-интерферона. -анализа (IGRA), чем у непривитых детей. Эффективность вакцины против инфекции оценивалась в 66%, но, учитывая небольшой размер исследования, доверительные интервалы достаточно широки, чтобы перекрываться со снижением ОР на 38%7 и 24%5, наблюдавшимся в предыдущих более крупных исследованиях.
Всего 5 лет назад первое сообщение5 о способности БЦЖ защищать от инфекции изменило наше представление о том, как действует БЦЖ. Вывод о том, что БЦЖ может действовать на ранней стадии пути передачи инфекции от туберкулеза к заболеванию (рис. 1), впоследствии был подтвержден исследованиями контактов взрослых и детей в сообществе в Гамбурге6 и двумя исследованиями школьных вспышек туберкулеза в Великобритании. 7 последний из которых опубликован в текущем выпуске Thorax ( см. стр. 1067 ).8 Исследуя вспышку точечного туберкулеза в детском саду, Эриксен и его коллеги обнаружили, что у детей, вакцинированных БЦЖ, вероятность заражения была значительно ниже, судя по высвобождению гамма-интерферона. -анализа (IGRA), чем у непривитых детей. Эффективность вакцины против инфекции оценивалась в 66%, но, учитывая небольшой размер исследования, доверительные интервалы достаточно широки, чтобы перекрываться со снижением ОР на 38%7 и 24%5, наблюдавшимся в предыдущих более крупных исследованиях. В совокупности эти данные убедительно свидетельствуют о том, что по крайней мере часть защитного эффекта БЦЖ связана с защитой от инфекции, что имеет существенное значение для разработки и оценки новых противотуберкулезных вакцин, а также роли БЦЖ в программах борьбы с ТБ. Действительно, Эриксен и его коллеги обсуждают вопрос о пересмотре порога вакцинации БЦЖ в регионах с разным уровнем заболеваемости туберкулезом. Тем не менее, к выводам о причинной роли БЦЖ в защите от инфекции следует относиться с осторожностью, учитывая нерандомизированный характер обсервационных исследований на сегодняшний день, хотя совокупные данные из множества эпидемиологически различных условий делают доводы в пользу причинной роли БЦЖ все более частыми. неотразимый.
В совокупности эти данные убедительно свидетельствуют о том, что по крайней мере часть защитного эффекта БЦЖ связана с защитой от инфекции, что имеет существенное значение для разработки и оценки новых противотуберкулезных вакцин, а также роли БЦЖ в программах борьбы с ТБ. Действительно, Эриксен и его коллеги обсуждают вопрос о пересмотре порога вакцинации БЦЖ в регионах с разным уровнем заболеваемости туберкулезом. Тем не менее, к выводам о причинной роли БЦЖ в защите от инфекции следует относиться с осторожностью, учитывая нерандомизированный характер обсервационных исследований на сегодняшний день, хотя совокупные данные из множества эпидемиологически различных условий делают доводы в пользу причинной роли БЦЖ все более частыми. неотразимый.
Рисунок 1
Схема защитного действия БЦЖ на различных стадиях естественного течения туберкулеза. Серые стрелки представляют эффекты БЦЖ, обнаруженные за последние 5 лет, а черные стрелки представляют исторически известные эффекты.
В этом выпуске Thorax мы также узнаем о другом до сих пор неизвестном эффекте БЦЖ, который, по-видимому, заключается в ее способности способствовать разрешению лечения у пациентов с активным заболеванием. Jeremiah и его коллеги сообщают о результатах лонгитюдного исследования 546 взрослых пациентов с обычно высоким исходным бактериальным обсеменением мокроты, проходящих лечение от туберкулеза легких в Танзании (9).0027 см. стр. 1072 )9; 5,5% результатов посева мокроты не стали отрицательными через 2 месяцев лечения, что является общепризнанным маркером риска рецидива после завершения лечения. При многофакторном анализе отсутствие рубца после введения БЦЖ было связано с весьма значимым трехкратным увеличением риска неудачной конверсии посева мокроты. Пациенты с самой высокой начальной бактериальной нагрузкой мокроты имели пятикратно повышенный риск неудачной конверсии мокроты в течение 2 месяцев, как и ожидалось, в то время как ВИЧ-статус, количество CD4 и индекс массы тела не были значимо связаны с неудачной конверсией мокроты. Эти результаты намекают на возможную роль БЦЖ в содействии клиренсу большой бациллярной нагрузки во время лечения. Учитывая, что БЦЖ не защищает от развития туберкулеза легких в условиях высокой нагрузки, ее связь с микробиологической реакцией на лечение является неожиданной и удивительной. Однако возможно, что противотуберкулезные антибиотики и иммунный ответ хозяина каким-то образом взаимодействуют, чтобы уменьшить микобактериальную нагрузку in vivo, но вклад иммунного ответа хозяина сам по себе трудно установить наряду с мощным эффектом противотуберкулезного лечения при лекарственно-чувствительных заболеваниях. болезнь. Тем не менее, значительные показатели спонтанного выздоровления больных туберкулезом в доантибиотическую эру в санаториях10 и недавние данные на животных моделях11 предполагают значительную роль реакции хозяина в микробиологическом излечении. Таким образом, по крайней мере вероятно, что иммунитет хозяина играет роль в бактериальном клиренсе мокроты, но неизвестно, как этот иммунитет позитивно и долговременно модулируется вакцинацией БЦЖ много лет назад.
Эти результаты намекают на возможную роль БЦЖ в содействии клиренсу большой бациллярной нагрузки во время лечения. Учитывая, что БЦЖ не защищает от развития туберкулеза легких в условиях высокой нагрузки, ее связь с микробиологической реакцией на лечение является неожиданной и удивительной. Однако возможно, что противотуберкулезные антибиотики и иммунный ответ хозяина каким-то образом взаимодействуют, чтобы уменьшить микобактериальную нагрузку in vivo, но вклад иммунного ответа хозяина сам по себе трудно установить наряду с мощным эффектом противотуберкулезного лечения при лекарственно-чувствительных заболеваниях. болезнь. Тем не менее, значительные показатели спонтанного выздоровления больных туберкулезом в доантибиотическую эру в санаториях10 и недавние данные на животных моделях11 предполагают значительную роль реакции хозяина в микробиологическом излечении. Таким образом, по крайней мере вероятно, что иммунитет хозяина играет роль в бактериальном клиренсе мокроты, но неизвестно, как этот иммунитет позитивно и долговременно модулируется вакцинацией БЦЖ много лет назад. Кроме того, вызывает недоумение тот факт, что предположительно иммунологически опосредованные эффекты БЦЖ на микробиологический ответ на лечение могли быть настолько сильными, когда ВИЧ-статус и количество CD4 не оказывали существенного влияния на скорость конверсии мокроты. Бумага Иеремии et al. не содержит информации о чувствительности инфекционных штаммов к антибиотикам, которая является основным фактором, определяющим время конверсии мазка мокроты и посева, но, учитывая сообщения о низкой распространенности туберкулеза с множественной лекарственной устойчивостью в Танзании,12 Выводы. К этому замечательному первому сообщению о связи вакцинации БЦЖ с выздоровлением следует относиться с осторожностью, пока дальнейшие исследования не подтвердят это наблюдение; тем не менее, результаты должны стимулировать дальнейшие исследования в том же духе, расширенные на детей, внелегочные заболевания и устойчивые к лекарствам организмы. Интересно, что этот отчет расширил данные о защитном действии БЦЖ, идентифицировав другой гораздо более поздний момент в естественном течении туберкулезной инфекции, когда БЦЖ, по-видимому, действует (рис.
Кроме того, вызывает недоумение тот факт, что предположительно иммунологически опосредованные эффекты БЦЖ на микробиологический ответ на лечение могли быть настолько сильными, когда ВИЧ-статус и количество CD4 не оказывали существенного влияния на скорость конверсии мокроты. Бумага Иеремии et al. не содержит информации о чувствительности инфекционных штаммов к антибиотикам, которая является основным фактором, определяющим время конверсии мазка мокроты и посева, но, учитывая сообщения о низкой распространенности туберкулеза с множественной лекарственной устойчивостью в Танзании,12 Выводы. К этому замечательному первому сообщению о связи вакцинации БЦЖ с выздоровлением следует относиться с осторожностью, пока дальнейшие исследования не подтвердят это наблюдение; тем не менее, результаты должны стимулировать дальнейшие исследования в том же духе, расширенные на детей, внелегочные заболевания и устойчивые к лекарствам организмы. Интересно, что этот отчет расширил данные о защитном действии БЦЖ, идентифицировав другой гораздо более поздний момент в естественном течении туберкулезной инфекции, когда БЦЖ, по-видимому, действует (рис. 1).
1).
Наряду с растущим количеством данных о том, что БЦЖ влияет на несколько отдельных моментов в естественном течении туберкулеза, все больше данных указывают на положительное влияние БЦЖ на другие заболевания, помимо туберкулеза, включая проказу13, астму14, детскую пневмонию15 и младенческую смертность от всех причин16. 17 Таким образом, несмотря на то, что мы используем БЦЖ уже почти столетие, только совсем недавно база эпидемиологических данных постепенно раскрывает плейотропные эффекты БЦЖ на туберкулез и другие серьезные заболевания. Несмотря на этот недавний прогресс в распознавании множественных эффектов БЦЖ, ее иммунологические механизмы действия, а также причины ее неспособности последовательно предотвращать туберкулез легких у взрослых остаются неясными.18 Это серьезный недостаток, учитывая исключительную важность такого понимания для разработка и оценка новых и улучшенных противотуберкулезных вакцин с большей защитной эффективностью. Более того, в клинических испытаниях находится не менее двенадцати экспериментальных вакцин-кандидатов, большинство из которых оцениваются на предмет их способности усиливать иммунный ответ, первоначально вызванный БЦЖ. Проблема в том, что мы до сих пор не знаем, какой из иммунных ответов, индуцированных БЦЖ, опосредует или коррелирует с защитой от туберкулезной инфекции или заболевания. Хотя полифункциональные CD4 и CD8 Т-клетки, специфичные для Антигены М.tuberculosis все чаще рассматриваются как потенциальные корреляты или медиаторы защитного иммунитета в испытаниях вакцин и индуцируются новыми вакцинами,19 20 БЦЖ-специфические полифункциональные Т-клетки не коррелируют с защитой от туберкулеза.21
Проблема в том, что мы до сих пор не знаем, какой из иммунных ответов, индуцированных БЦЖ, опосредует или коррелирует с защитой от туберкулезной инфекции или заболевания. Хотя полифункциональные CD4 и CD8 Т-клетки, специфичные для Антигены М.tuberculosis все чаще рассматриваются как потенциальные корреляты или медиаторы защитного иммунитета в испытаниях вакцин и индуцируются новыми вакцинами,19 20 БЦЖ-специфические полифункциональные Т-клетки не коррелируют с защитой от туберкулеза.21
Значительная трудность в интерпретация результатов обеих статей, опубликованных в этом выпуске Thorax , и, действительно, всех обсервационных исследований, изучающих защитные эффекты и основные механизмы БЦЖ, основывается на образовании рубцов как суррогатном маркере вакцинации БЦЖ. Зависимость от образования рубца при выводе о прививке осложняется высокой распространенностью (20–50%) реципиентов, неспособных сформировать рубец22–24, и влиянием метода вакцинации на развитие рубца. 16 Более того, образование рубца не коррелирует с БЦЖ-индуцированное развитие адаптивных клеточных иммунных ответов.25, 26 Эта нерешенная связь между образованием рубца и вакцинацией БЦЖ затрудняет оценку истинного защитного эффекта вакцины, независимо от рубца, в эпоху, когда рандомизированные испытания БЦЖ по сравнению с плацебо являются неэтичными. Таким образом, вопрос заключается в том, опосредована ли частичная защита от различных стадий пути от воздействия туберкулеза до болезни, вызванной вакцинацией БЦЖ, иммунными реакциями, которые не зависят от реакции, необходимой для рубцевания, или иммунными реакциями, которые также вызывают рубцевание. Третья возможность заключается в том, что рубцовая реакция на внутрикожное введение БЦЖ является суррогатным маркером людей, у которых уже есть врожденный защитный иммунитет к туберкулезу, который не индуцируется вакцинацией БЦЖ. Продольные иммуноэпидемиологические исследования с клиническими конечными точками, которые наблюдают за лицами, вакцинированными БЦЖ, у которых есть и у которых нет рубцов, необходимы, чтобы распутать иммунологические отношения между триадой вакцинации, образованием рубцов и защитой.
16 Более того, образование рубца не коррелирует с БЦЖ-индуцированное развитие адаптивных клеточных иммунных ответов.25, 26 Эта нерешенная связь между образованием рубца и вакцинацией БЦЖ затрудняет оценку истинного защитного эффекта вакцины, независимо от рубца, в эпоху, когда рандомизированные испытания БЦЖ по сравнению с плацебо являются неэтичными. Таким образом, вопрос заключается в том, опосредована ли частичная защита от различных стадий пути от воздействия туберкулеза до болезни, вызванной вакцинацией БЦЖ, иммунными реакциями, которые не зависят от реакции, необходимой для рубцевания, или иммунными реакциями, которые также вызывают рубцевание. Третья возможность заключается в том, что рубцовая реакция на внутрикожное введение БЦЖ является суррогатным маркером людей, у которых уже есть врожденный защитный иммунитет к туберкулезу, который не индуцируется вакцинацией БЦЖ. Продольные иммуноэпидемиологические исследования с клиническими конечными точками, которые наблюдают за лицами, вакцинированными БЦЖ, у которых есть и у которых нет рубцов, необходимы, чтобы распутать иммунологические отношения между триадой вакцинации, образованием рубцов и защитой. Примечательно, что крупные клинические испытания вакцины с конечной точкой, предназначенные для усиления БЦЖ новыми вакцинами, могут предоставить возможность решить этот сложный вопрос и выявить истинные корреляты защитного иммунитета, вызванные вакцинами.
Примечательно, что крупные клинические испытания вакцины с конечной точкой, предназначенные для усиления БЦЖ новыми вакцинами, могут предоставить возможность решить этот сложный вопрос и выявить истинные корреляты защитного иммунитета, вызванные вакцинами.
Подобно прекрасному вину, которое с возрастом становится только лучше, через 90 лет после первой прививки людям мы все еще изучаем различные аспекты применения БЦЖ при туберкулезе и за его пределами. По иронии судьбы, масштабы глобальной пандемии туберкулеза, сами по себе частично являющиеся результатом неспособности БЦЖ полностью защитить от туберкулеза, вынуждают нас настойчиво пытаться разгадать механизмы, ответственные за частичную эффективность БЦЖ, одновременно продвигаясь вперед с клиническими испытаниями вакцины. новые экспериментальные вакцины. Таким образом, прививка от туберкулеза, по-видимому, имеет много общего с самой жизнью, как предполагал Серен Кьеркегор:0063 Жизнь можно понять только задом наперёд, а прожить её надо вперёд ’.
Ссылки
- ↵
- Хсу Т.,
- Хингли-Уилсон С.М.,
- Чен Б.,
- и др.
34 90. Первичный механизм аттенуации бацилл Кальметта-Герена заключается в потере секреторной литической функции, необходимой для инвазии в интерстициальную ткань легких. Proc Natl Acad Sci U S A 2003;100:12420–5.
- ↵
- Trunz BB,
- Fine P,
- Краситель C
. Влияние вакцинации БЦЖ на детский туберкулезный менингит и милиарный туберкулез во всем мире: метаанализ и оценка экономической эффективности. Ланцет 2006; 367:1173–80.
- ↵
- Colditz GA,
- Brewer TF,
- Berkey CS,
- и др.
. Эффективность вакцины БЦЖ в профилактике туберкулеза. Метаанализ опубликованной литературы. JAMA 1994; 271:698–702.
- ↵
- Сазерленд I,
- Линдгрен I
.
 Защитный эффект вакцинации БЦЖ на основании патологоанатомических исследований. Бугорок 1979; 60: 225–31.
Защитный эффект вакцинации БЦЖ на основании патологоанатомических исследований. Бугорок 1979; 60: 225–31. - ↵
- Сойсал А.,
- Миллингтон К.А.,
- Бакир М.,
- и др.
. Влияние вакцинации БЦЖ на риск инфицирования микобактериями туберкулеза у детей с бытовым контактом с туберкулезом: проспективное исследование на базе местных сообществ. Ланцет 2005; 366:1443–51.
- ↵
- Diel R,
- Loddenkemper R,
- Niemann S,
- и др.
. Значение IGRA цельной крови для развития активного туберкулеза — обновление. Am J Respir Crit Care Med . Впервые опубликовано в сети: 27 августа 2010 г. doi:10.1164/rccm.201006-0974OC.
- ↵
- Эйзенхут М,
- Паранджоти С,
- Абубакар I,
- и др.
.
 Вакцинация БЦЖ снижает риск инфицирования микобактериями туберкулеза, выявляемыми с помощью анализа высвобождения гамма-интерферона. Вакцина 2009;27:6116–20.
Вакцинация БЦЖ снижает риск инфицирования микобактериями туберкулеза, выявляемыми с помощью анализа высвобождения гамма-интерферона. Вакцина 2009;27:6116–20. - ↵
- Эриксен Дж.,
- Чоу Дж.Й.,
- Меллис В.,
- и др.
. Защитный эффект вакцинации БЦЖ при вспышке питомников в 2009 г.: пора пересмотреть порог вакцинации? Thorax 2010;65:1067–71.
- ↵
- Иеремия К.,
- PrayGod G,
- Фаурхольт-Джепсен Д,
- и др.
. Статус прививки БЦЖ может предсказать конверсию мокроты у пациентов с туберкулезом легких: новый взгляд на старую вакцину? Грудная клетка 2010;65:1072–6.
- ↵
- Миллингтон К.А.,
- Гудинг С.,
- Хинкс Т.С.,
- и др.
. Специфические клеточные иммунные профили Mycobacterium tuberculosis предполагают бактериальную персистенцию спустя десятилетия после спонтанного излечения при нелеченном самоизлеченном туберкулезе.
 J Infect Dis 2010;202:10.
J Infect Dis 2010;202:10. - ↵
- Сада-Овалле I,
- Скольд М,
- Тиан Т,
- и др.
. Альфа-галактозилцерамид как терапевтическое средство при легочной микобактериальной туберкулезной инфекции. Am J Respir Crit Care Med 2010;182:841–7.
- ↵
- Chonde TM,
- Basra D,
- Mfinanga SG,
- и др.
. Национальное исследование устойчивости к противотуберкулезным препаратам в Танзании. Int J Tuberc Lung Dis 2010;14:967–72.
- ↵
- Setia MS,
- Steinmaus C,
- Ho CS,
- и др.
. Роль БЦЖ в профилактике лепры: метаанализ. Lancet Infect Dis 2006; 6:162–70.
- ↵
- Эль-Зейн М.,
- Родитель М.Э.,
- Бенедетти А.
 ,
, - и др.
. Защищает ли вакцинация БЦЖ от развития детской астмы? Систематический обзор и метаанализ эпидемиологических исследований. Int J Epidemiol 2010;39:469–86.
- ↵
- Niobey FM,
- Duchiade MP,
- Vasconcelos AG,
- и др.
. [Факторы риска смерти от пневмонии у детей в возрасте до 1 года в столичном регионе на юго-востоке Бразилии. Исследование случай-контроль]. Rev Saude Publica 1992; 26: 229–38.
- ↵
- Рот А,
- Густафсон П,
- Нхага А,
- и др.
. Шрам от вакцинации БЦЖ связан с лучшей выживаемостью детей в Гвинее-Бисау. Int J Epidemiol 2005;34:540–7.
- ↵
- Garly ML,
- Martins CL,
- Bale C,
- и др.
.
 Рубец БЦЖ и положительная туберкулиновая реакция связаны со снижением детской смертности в Западной Африке. Неспецифический положительный эффект БЦЖ? Вакцина 2003; 21:2782–90.
Рубец БЦЖ и положительная туберкулиновая реакция связаны со снижением детской смертности в Западной Африке. Неспецифический положительный эффект БЦЖ? Вакцина 2003; 21:2782–90. - ↵
- Орм IM
. Ахиллесова пята BCG. Туберкулез (Эдинб) . Впервые опубликовано в Интернете: 24 июля 2010 г. doi: 10.1016 / j.tube.2010.06.002.
- ↵
- Абель Б.,
- Тамерис М.,
- Мансур Н.,
- и др.
. Новая противотуберкулезная вакцина AERAS-402 индуцирует устойчивые и полифункциональные CD4+ и CD8+ Т-клетки у взрослых. Am J Respir Crit Care Med 2010;181:1407–17.
- ↵
- Beveridge NE,
- Price DA,
- Casazza JP,
- и др.
. Иммунизация БЦЖ и рекомбинантным MVA85A индуцирует долгоживущие полифункциональные популяции Т-лимфоцитов памяти CD4+, специфичные для Mycobacterium tuberculosis.
 Eur J Immunol 2007; 37:3089–100.
Eur J Immunol 2007; 37:3089–100. - ↵
- Кагина Б.М.,
- Абель Б.,
- Скриба Т.Дж.,
- и др.
. Специфическая частота Т-клеток и профиль экспрессии цитокинов не коррелируют с защитой от туберкулеза после вакцинации новорожденных БЦЖ. Am J Respir Crit Care Med 2010;182:1073–9.
- ↵
- Fjallbrant H,
- Ridell M,
- Larsson LO
. Рубец БЦЖ и туберкулиновая реактивность у детей и взрослых. Scand J Infect Dis 2008;40:387–92.
- ↵
- Friedland IR
. Бустерный эффект повторного туберкулинового тестирования у детей и его связь с вакцинацией БЦЖ. S Afr Med J 1990;77:387–9.
- ↵
- Фариди М.М.,
- Каур С.,
- Кришнамурти С.
 ,
, - и др.
. Тест торможения туберкулиновой конверсии и миграции лейкоцитов после вакцинации БЦЖ у новорожденных. Hum Вакцина 2009 г.;5:690–5.
- ↵
- Джейсон Дж.,
- Арчибальд Л.К.,
- Нваньянву О.К.,
- и др.
. Клинические и иммунные последствия рубцевания прививки Mycobacterium bovis БЦЖ. Infect Immun 2002;70:6188–95.
- ↵
- Рани С.Х.,
- Виджаялакшми В.,
- Сунил К.,
- и др.
. Клеточный иммунитет у детей с рубцовой недостаточностью после вакцинации БЦЖ. Indian Pediatr 1998; 35: 123–7.
View Abstract
Сноски
Связанные статьи 140186, 134767. ESAT-6/CFP-10 IFN-gamma ELISpot был коммерциализирован дочерней компанией Оксфордского университета (T-SPOT.
 TB, Oxford Immunotec Ltd, Абингдон, Великобритания), в которой Оксфордский университет и AL имеют миноритарные доли капитала и прав к роялти. У СС нет конфликта интересов.
TB, Oxford Immunotec Ltd, Абингдон, Великобритания), в которой Оксфордский университет и AL имеют миноритарные доли капитала и прав к роялти. У СС нет конфликта интересов.Происхождение и рецензирование По заказу; не рецензируемых внешними экспертами.
Статьи по ссылкам
- Туберкулез
Защитный эффект вакцинации БЦЖ при вспышке питомников в 2009 г.: пора пересмотреть порог вакцинации?
Дж Эриксен Джей И Чоу В. Меллис Б Уипп С Уолтерс Э. Абрахамсон I Абубакар
Торакс 2010; 65 1067-1071 Впервые опубликовано в сети: 28 октября 2010 г. doi: 10.1136/thx.2010.140186
- Туберкулез
Статус прививки БЦЖ может предсказать конверсию мокроты у пациентов с туберкулезом легких: новый подход к старой вакцине?
Кидола Иеремия Джордж ПрейГод Даниэль Форхольт-Джепсен Хребет Нягося Аасе Б. Андерсен Харлин М.С. Гревал Хенрик Фриис
Thorax 2010; 65 1072-1076 Впервые опубликовано в сети: 01 октября 2010 г.
 doi: 10.1136/thx.2010.134767
doi: 10.1136/thx.2010.134767 - Airwaves
Airwaves
Эндрю Буш Ян Паворд
Торакс 2010; 65 i-i Впервые опубликовано в сети: 18 ноября 2010 г. doi: 10.1136/thx.2010.154732
Прочитать полный текст или скачать PDF:
Подписаться
Войти под своим именем пользователя и паролем
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
Понимание механизмов индуцированной внутривенным введением БЦЖ защиты от туберкулеза у нечеловекообразных приматов (противотуберкулезная вакцина)
Защита младенцев от смертельной туберкулезной инфекции
Только одна вакцина (вакцина БЦЖ) защищает младенцев от туберкулеза (ТБ) — самой смертельной инфекции в мире, — но при введении под кожу младенцам эта вакцина дает противоречивые результаты.
В рамках Проекта вакцинации против туберкулеза будет определено, является ли внутривенное введение вакцины БЦЖ более последовательно эффективной для защиты младенцев от туберкулезной инфекции, чем внутрикожное введение.
Обзор
По данным Всемирной организации здравоохранения (ВОЗ) , туберкулез (ТБ) является девятой по значимости причиной смерти во всем мире и основной причиной от одного инфекционного агента, стоящего выше ВИЧ/СПИДа. Приблизительно 10,4 миллиона человек заболели туберкулезом в 2016 г., при этом число новых случаев увеличилось по сравнению с предыдущим годом. Необходимость в эффективной противотуберкулезной вакцине является острой.
Вакцина Bacillus Calmette-Guérin (BCG) является единственной вакциной, одобренной в настоящее время для использования у детей грудного возраста для профилактики туберкулеза. Однако при внутрикожном введении (введении в кожу) вакцина БЦЖ дает разные результаты. В рамках нового проекта под названием «Понимание механизмов внутривенной БЦЖ-индуцированной защиты от туберкулеза у нечеловеческих приматов (вакцина против туберкулеза)» исследователи изучают альтернативные, более эффективные методы доставки вакцины пациентам. Финансируемый за счет гранта Фонда Билла и Мелинды Гейтс для FNIH, проект вакцины против туберкулеза будет осуществляться совместно Национальным институтом аллергии и инфекционных заболеваний (NIAID) и Университетом Питтсбурга.
Финансируемый за счет гранта Фонда Билла и Мелинды Гейтс для FNIH, проект вакцины против туберкулеза будет осуществляться совместно Национальным институтом аллергии и инфекционных заболеваний (NIAID) и Университетом Питтсбурга.
Исследователи противотуберкулезной вакцины изучат влияние нового внутривенного (в/в) метода доставки вакцины БЦЖ для лечения туберкулеза. Этот метод может лучше активировать Т-клетки (лейкоциты), которые помогают вызвать важный долгосрочный иммунный ответ в легких для предотвращения туберкулеза. Исследователи будут тестировать этот метод доставки на макаках в течение девяти месяцев, а затем проанализируют результаты с помощью анализов крови, сканирования изображений и вскрытия.
Партнеры
Партнеры из государственного сектора
- Национальный институт аллергии и инфекционных заболеваний (NIAID)
Партнеры частного сектора
- Фонд Билла и Мелинды Гейтс*
Академические партнеры
- Университет Питтсбурга
*Предоставлена финансовая или неденежная поддержка этой программе.

 Такой системный метаболический сдвиг позволяет клеткам потреблять большое количество глюкозы регулируемым образом и безопасно снизить гипергликемию до уровня, близкого к нормальному. [1] [2] [3]
Такой системный метаболический сдвиг позволяет клеткам потреблять большое количество глюкозы регулируемым образом и безопасно снизить гипергликемию до уровня, близкого к нормальному. [1] [2] [3] К моменту начала пандемии COVID-19 все участники, не подверженные туберкулезу и ранее не прививавшиеся БЦЖ, получили по три дозы вакцины БЦЖ или плацебо.
К моменту начала пандемии COVID-19 все участники, не подверженные туберкулезу и ранее не прививавшиеся БЦЖ, получили по три дозы вакцины БЦЖ или плацебо.
 lalvani{at}imperial.ac.uk
lalvani{at}imperial.ac.uk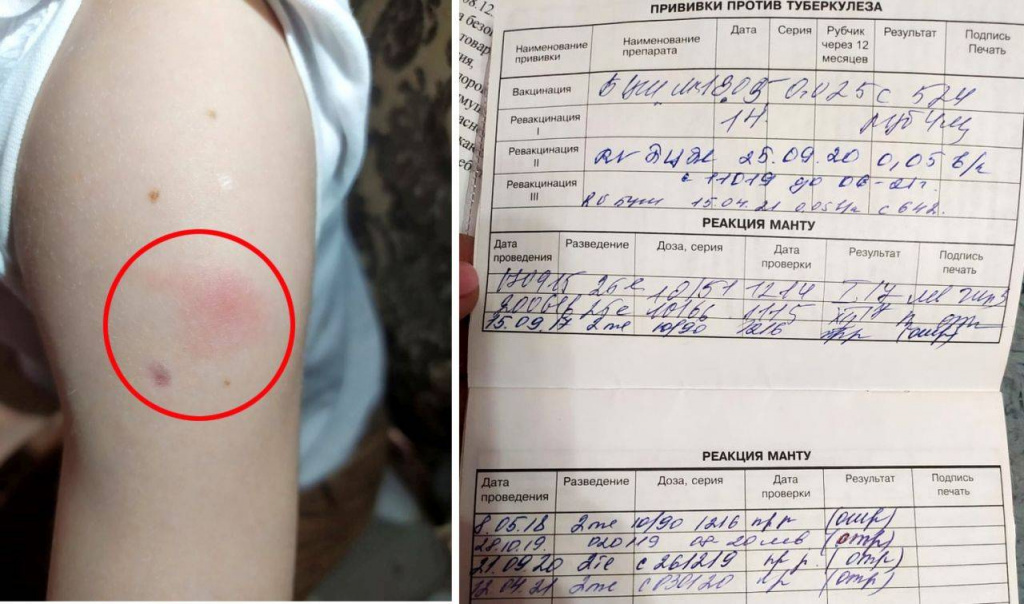 Защитный эффект вакцинации БЦЖ на основании патологоанатомических исследований. Бугорок 1979; 60: 225–31.
Защитный эффект вакцинации БЦЖ на основании патологоанатомических исследований. Бугорок 1979; 60: 225–31.  Вакцинация БЦЖ снижает риск инфицирования микобактериями туберкулеза, выявляемыми с помощью анализа высвобождения гамма-интерферона. Вакцина 2009;27:6116–20.
Вакцинация БЦЖ снижает риск инфицирования микобактериями туберкулеза, выявляемыми с помощью анализа высвобождения гамма-интерферона. Вакцина 2009;27:6116–20.  J Infect Dis 2010;202:10.
J Infect Dis 2010;202:10.  ,
, Рубец БЦЖ и положительная туберкулиновая реакция связаны со снижением детской смертности в Западной Африке. Неспецифический положительный эффект БЦЖ? Вакцина 2003; 21:2782–90.
Рубец БЦЖ и положительная туберкулиновая реакция связаны со снижением детской смертности в Западной Африке. Неспецифический положительный эффект БЦЖ? Вакцина 2003; 21:2782–90.  Eur J Immunol 2007; 37:3089–100.
Eur J Immunol 2007; 37:3089–100.  ,
, TB, Oxford Immunotec Ltd, Абингдон, Великобритания), в которой Оксфордский университет и AL имеют миноритарные доли капитала и прав к роялти. У СС нет конфликта интересов.
TB, Oxford Immunotec Ltd, Абингдон, Великобритания), в которой Оксфордский университет и AL имеют миноритарные доли капитала и прав к роялти. У СС нет конфликта интересов. doi: 10.1136/thx.2010.134767
doi: 10.1136/thx.2010.134767