Экспериментальная вакцина против цитомегаловируса вновь оплошала
Изображение: Science Photo Library/Alamy.ВАЖНОЕ, КЛИНИЧЕСКИЕ ИСПЫТАНИЯ, НОВОСТИAstellas и Vical не смогли добиться результативности среди реципиентов аллогенных трансплантатов гемопоэтических стволовых клеток.
Коротко
- Японская «Астеллас фарма» (Astellas Pharma) и «Вайкел» (Vical) сообщили о провале клинических исследований HELIOS фазы III экспериментальной вакцины ASP0113, разработанной для предотвращения развития цитомегаловирусной (ЦМВ) инфекции и сопутствующих осложнений у ЦМВ-серопозитивных реципиентов аллогенных трансплантатов гемопоэтических стволовых клеток. Не удалось зафиксировать ни продления общей выживаемости, ни снижения вирусного поражения органов. Не получилось также засвидетельствовать вторичные конечные точки, заявленные временем до первого проявления виремии и временем до начала применения антивирусной терапии.

- В сентябре 2016 года ASP0113 не смогла превзойти плацебо в задаче отражения цитомегаловируса среди пациентов, прошедших процедуру пересадки почки, полученной от ЦМВ-серопозитивного донора.
- ASP0113, ранее известная как «Трансвакс» (TransVax), — бивалентная ДНК-вакцина, содержащая плазмиды, которые кодируют ЦМВ-антигены фосфопротеин pp65 и оболочечный гликопротеин B (gB). Вакцина призвана индуцировать клеточный и гуморальный иммунные ответы. «Астеллас» лицензировала ее у «Вайкел» в июле 2011 года, оценив проект в пределах 130 млн долларов.
Подробности
Ежегодно в мире выполняется приблизительно 70 тыс. процедур аллогенной трансплантации гемопоэтических стволовых клеток. Такие пациенты переходят в группу иммунокомпрометированных, поскольку подвергаются иммуносупрессивной терапии, направленной на препятствование отторжению трансплантата. И для них в настоящее время не существует одобренной вакцины против ЦМВ, которая могла бы контролировать реактивацию вируса и снижать риск осложнений.
В ноябре 2017 года «Мерк и Ко» (Merck & Co.) получила разрешение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) на «Превимис» (Prevymis, летермовир), предназначенный для профилактики цитомегаловирусной инфекции среди взрослых ЦМВ-серопозитивных реципиентов аллогенного трансплантата гемопоэтических стволовых клеток. Летермовир представляет собой ненуклеозидный ингибитор комплекса цитомегаловирусной ДНК-терминазы (протеины UL51, UL56 и UL89), нужной для процессинга и упаковки вирусной ДНК.
На экспериментальном конвейере «Вайкел» есть еще раннестадийная «Цимвектин» (CyMVectin), предназначенная для вакцинирования женщин в целях уменьшения вероятности передачи цитомегаловируса плоду во время беременности.
Тем временем «Хелосайт» (Helocyte), прежде известная как «Диавакс байосайенсиз» (DiaVax Biosciences), намеревается во втором полугодии объявить результаты клинических испытаний фазы II двух вакцин.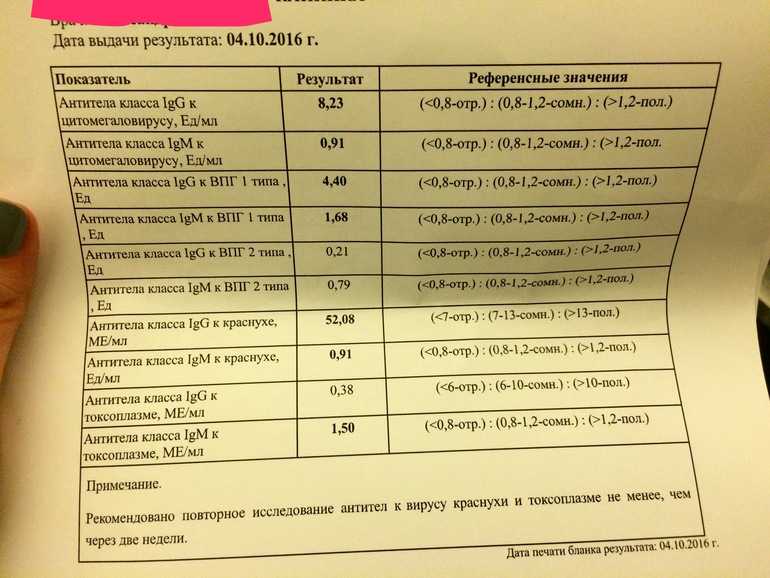
«ВиБиАй ваксинс» (VBI Vaccines) занимается профилактической ЦМВ-вакциной VBI-1501, построенной по технологии капсидных вирусоподобных частиц. «Модерна терапьютикс» (Moderna Therapeutics) запустила клинические исследования фазы I прототипной вакцины mRNA-1647, состоящей из шести мРНК, кодирующих протеины пентамерного комплекса поверхностных гликопротеинов (gH, gL, UL128, UL130 и UL131A) и еще один антиген (gB).
Как бы то ни было, любая из цитомегаловирусных вакцин способна зарабатывать миллиарды долларов ежегодно.
Важная информация
Mosmedpreparaty.ru — специализированная научно-исследовательская и справочно-информационная аналитическая служба группы компаний «Мосмедпрепараты», таргетированная на ключевые события глобальной отрасли фармации, биотехнологий, медицины и здравоохранения.
- Ничто на Mosmedpreparaty.ru не является рекламой или продвижением лекарственных препаратов, методов лечения, медицинских услуг.
- Сведения и публикации Mosmedpreparaty.ru носят исключительно научно-просветительский и ознакомительный характер.
- Медицинская информация, транслируемая Mosmedpreparaty.ru, предназначена только для специалистов в области здравоохранения и сфере обращения лекарственных средств.
- Медицинская информация, содержащаяся на Mosmedpreparaty.ru, не предназначена для использования в качестве замены консультации со специалистом в области здравоохранения.
- Ничто на Mosmedpreparaty.ru не должно истолковываться как предоставление медицинского совета или рекомендации и не может служить основанием для принятия каких-либо решений или осуществления каких-либо действий без участия специалиста в области здравоохранения.

Присутствие на веб-ресурсе Mosmedpreparaty.ru и ознакомление с его содержимым означает, что вы прочитали «Пользовательское соглашение» и приняли его условия.
Научный эксперт R&A-офиса Mosmedpreparaty.ru.
Дополнительная информация о Романе и его контактные данные доступны в разделе «Научно-исследовательский офис».
Цитомегаловирус — причины, симптомы, лечение
Адреса медицинских центров
АВЕНЮ-Александровка
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
пр. 40-летия Победы, 220. 2-й этаж.
2-й этаж.
8-938-120-44-00
АВЕНЮ-Вересаево
Новый!
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
Ростов-на-Дону
ул. Берберовская, д.2/101, ст 2
8-928-120-22-11
АВЕНЮ-Западный
Пн — Пт 7:30 — 20:00,
г. Ростов-на-Дону
ул. 2-я Краснодарская, 145 А. 2-й этаж.
8-900-122-11-03
АВЕНЮ-Комарова
Пн — Пт 7:30 — 20:00,
Сб, Вс 9:00 — 18:00
г. Ростов-на-Дону
б-р Комарова, д.11
8-928-120-67-67
АВЕНЮ-Красный Аксай
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
Ростов-на-Дону
ул. Богданова, 85 (литер 8).
8-928-111-22-11
АВЕНЮ-Левенцовка
Пн — Пт 7:30 — 20:00,
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
пр. Маршала Жукова, д.23.
8-900-120-03-11
АВЕНЮ-Нахичевань
Пн — Пт 7:30 — 20:00
Сб, 9:00 — 15:00
Воскресенье — выходной.
г. Ростов-на-Дону
ул. 1-я Майская, 5/9
8-928-120-24-24
АВЕНЮ-Стачки
Новый!
Пн — Пт 7:30 — 20:00
г. Ростов-на-Дону
пр. Стачки, 31
8-928-120-03-30
АВЕНЮ-Стройгородок
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
Ростов-на-Дону
ул. Таганрогская, 112а
8 (928) 27-000-87
АВЕНЮ-Текучёва
Пн — Пт 7:30 — 20:00
Сб, Вс 9:00 — 15:00
ул. Текучёва, 238 / Соборный 78. 2-й этаж.
Машину можно оставить на платной парковке около магазина Перекрёсток (ЖК Миллениум-1)
8-928-120-51-51
АВЕНЮ-Чкаловский
Пн — Пт 7:30 — 20:00,
Сб, Вс 9:00 — 15:00
г. Ростов-на-Дону
ул. Вятская, 45а. 2-й этаж.
8-928-77-000-75
Франшиза
COVID-2019
Записаться на приём
Выберите медицинский центр*
АВЕНЮ-Александровка
АВЕНЮ-Батайск Восточный
АВЕНЮ-Батайск Северный
АВЕНЮ-Вересаево
АВЕНЮ-Западный
АВЕНЮ-Комарова
АВЕНЮ-Красный Аксай
АВЕНЮ-Левенцовка
АВЕНЮ-Нахичевань
АВЕНЮ-Стачки
АВЕНЮ-Стройгородок
АВЕНЮ-Текучёва
АВЕНЮ-Чкаловский
Выберите специализацию*
Аллерголог-иммунолог
Аллерголог-иммунолог детский
Гастроэнтеролог
Гастроэнтеролог детский
Гинеколог
Гинеколог детский
Дерматовенеролог
Дерматовенеролог детский
Диетолог
Инфекционист
Кардиолог
Кардиолог детский
ЛОР
ЛОР детский
Маммолог
Невролог
Невролог детский
Проктолог
Сосудистый хирург
Терапевт
Травматолог-ортопед
Трихолог
УЗИ
Уролог-андролог
Хирург
Эндокринолог
Эндокринолог детский
Ваше ФИО*
Телефон*
Я подтверждаю, что обработка, проверка и хранение моих персональных данных произведены с моего согласия.
Ваша заявка принята
Наши специалисты свяжутся с Вами в ближайшее время.
Записаться на приём
Выберите медицинский центр*
АВЕНЮ-Александровка
АВЕНЮ-Батайск Восточный
АВЕНЮ-Батайск Северный
АВЕНЮ-Вересаево
АВЕНЮ-Западный
АВЕНЮ-Комарова
АВЕНЮ-Красный Аксай
АВЕНЮ-Левенцовка
АВЕНЮ-Нахичевань
АВЕНЮ-Стачки
АВЕНЮ-Стройгородок
АВЕНЮ-Текучёва
АВЕНЮ-Чкаловский
Выберите специализацию*
Инфекционист
Ваше ФИО*
Телефон*
Я подтверждаю, что обработка, проверка и хранение моих персональных данных произведены с моего согласия.
Ваша заявка принята
Наши специалисты свяжутся с Вами в ближайшее время.
Вакцины ЦМВ и клинические испытания | National CMV Foundation
В настоящее время не существует вакцины против ЦМВ для профилактики врожденного цитомегаловируса (ЦМВ). Вакцины ЦМВ все еще находятся на стадии исследований и разработок, и есть надежда и ожидания, что они будут доступны в ближайшие 5-10 лет.
Многие эксперты считают, что вакцина против ЦМВ, предотвращающая передачу ЦМВ ребенку после инфицирования матери, значительно уменьшит долгосрочную инвалидность у младенцев. Вакцина против краснухи является примером сопоставимой вакцины, вводимой в детстве для устранения передачи вируса от матери к ребенку. Вакцина против краснухи устранила синдром врожденной краснухи как причину врожденных дефектов в странах, где применяется вакцина (искоренена в США в 2015 г.), и есть аналогичные надежды на вакцину ЦМВ.
Что важно для продвижения вперед? Спрос общественного здравоохранения и финансовая поддержка со стороны населения в целом, фармацевтической промышленности и федерального правительства.
Потенциальные целевые группы населения для вакцины против ЦМВ включают женщин детородного возраста, пациентов с ослабленным иммунитетом и детей. В связи с высокой частотой врожденной передачи ЦМВ вакцины против ЦМВ, как правило, предназначены для девочек-подростков или женщин детородного возраста для предотвращения вертикальной передачи (пассаж возбудителя или возбудителя от матери к ребенку через плаценту, с грудным молоком, или через прямой контакт во время или после рождения) ЦМВ. Кроме того, пациенты с ослабленным иммунитетом, в том числе реципиенты трансплантированных органов, являются целевой группой, поскольку они подвержены риску заболевания, связанного с ЦМВ.
В будущем и для комплексной профилактики распространения ЦМВ-инфекции настоятельно рекомендуется включить ЦМВ-вакцину в план плановой вакцинации детей.
Испытания вакцины ЦМВ
Клинические испытания вакцины включают следующее:
- Испытания фазы I — стоимость менее 1 миллиона долларов
- Испытание фазы II — стоимость от 5 до 10 миллионов долларов
- Испытание фазы III — стоимость от 10 до 750 миллионов долларов
Многие глобальные фармацевтические компании, организации клинических исследований, компании, занимающиеся клиническими испытаниями, и академические исследовательские центры занимаются выпуском эффективной вакцины против ЦМВ. В частности, для врожденной вакцины против ЦМВ на сегодняшний день было проведено около 10 испытаний фазы I, 2 испытания фазы II и ни одного испытания фазы III.
В частности, для врожденной вакцины против ЦМВ на сегодняшний день было проведено около 10 испытаний фазы I, 2 испытания фазы II и ни одного испытания фазы III.
Правительственные рекомендации
В 1999 г. Национальный институт медицины (IOM) проанализировал 26 заболеваний с потенциалом для вакцинопрофилактики и ранжировал различные вакцины-кандидаты по уровням I-IV (от самого высокого к самому низкому) на основе влияния на стоимость и сохраненного года с поправкой на качество жизни (QALY). Врожденная вакцина против ЦМВ, введенная 12-летним детям, была поставлена на первое место в группе уровня I как первоочередная из-за экономии средств, а также человеческих страданий, которые можно было бы облегчить, остановив ЦМВ.
В начале 1990-х ежегодные затраты на уход за детьми, рожденными с врожденным ЦМВ, только в США оценивались в 1–2 миллиарда долларов. Поскольку дети, рожденные с врожденным ЦМВ, часто требуют длительного ухода и обширных медицинских и хирургических вмешательств, средняя стоимость лечения одного ребенка оценивается в 300 000 долларов США.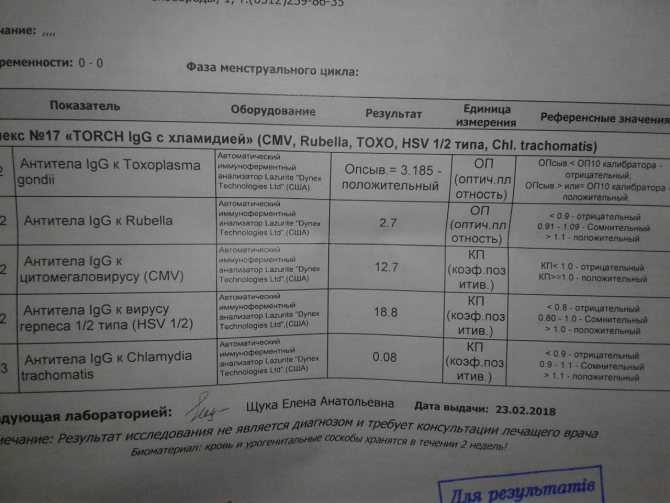
В последнее время не проводилось исследований по переоценке влияния на стоимость врожденной ЦМВ.
Примите участие в кампании, став защитником вариантов профилактики и лечения ЦМВ.
Цитомегаловирусные вакцины — PMC
Clin Infect Dis. 2013 15 декабря; 57 (Приложение 4): S196–S199.
doi: 10.1093/cid/cit587
Информация об авторе Информация об авторских правах и лицензиях Отказ от ответственности
Эффективная вакцина против цитомегаловируса (ЦМВ) может предотвратить большинство врожденных дефектов, вызванных врожденными ЦМВ-инфекциями. Вакцины-кандидаты, проходящие клиническую оценку, включают живые аттенуированные вакцины, белковые субъединицы, ДНК и вакцины с вирусным вектором. Субъединичные подходы были сосредоточены на белках CMV pp65 и IE1 как важных индукторах цитотоксических Т-клеток и гликопротеине B (gB) как важном индукторе нейтрализующих антител. Вакцина, состоящая из рекомбинантного белка gB с MF59.адъювант снижал частоту первичной инфекции на 50%. Недавние открытия, касающиеся путей проникновения ЦМВ в различные типы клеток, предполагают возможный курс на улучшение. Пентамерный комплекс из 5 субъединиц однозначно необходим для проникновения в эндотелиальные и эпителиальные клетки. Сыворотки от естественно инфицированных субъектов обладают высокоэффективной нейтрализующей активностью, специфичной для этого комплекса, тогда как вакцина gB/MF59 не может индуцировать сравнимую нейтрализующую активность. Способность вакцины индуцировать слюнные антитела, которые нейтрализуют проникновение эпителиальных клеток, может быть особенно важной для предотвращения передачи инфекции через рот, поскольку первыми инфицированными клетками являются, предположительно, эпителиальные клетки слизистой оболочки полости рта. Кроме того, последние данные свидетельствуют о том, что антитела могут ингибировать распространение ЦМВ после проникновения между эндотелиальными и эпителиальными клетками. Такая активность может способствовать ограничению репликации вируса в тканях или ухудшению распространения в плаценте и плоде.
Недавние открытия, касающиеся путей проникновения ЦМВ в различные типы клеток, предполагают возможный курс на улучшение. Пентамерный комплекс из 5 субъединиц однозначно необходим для проникновения в эндотелиальные и эпителиальные клетки. Сыворотки от естественно инфицированных субъектов обладают высокоэффективной нейтрализующей активностью, специфичной для этого комплекса, тогда как вакцина gB/MF59 не может индуцировать сравнимую нейтрализующую активность. Способность вакцины индуцировать слюнные антитела, которые нейтрализуют проникновение эпителиальных клеток, может быть особенно важной для предотвращения передачи инфекции через рот, поскольку первыми инфицированными клетками являются, предположительно, эпителиальные клетки слизистой оболочки полости рта. Кроме того, последние данные свидетельствуют о том, что антитела могут ингибировать распространение ЦМВ после проникновения между эндотелиальными и эпителиальными клетками. Такая активность может способствовать ограничению репликации вируса в тканях или ухудшению распространения в плаценте и плоде. Таким образом, включение эпитопов, полученных из пентамерного комплекса, может обеспечить повышенную эффективность за счет индукции сильнодействующих нейтрализующих/ингибирующих распространение антител, которые нацелены на репликацию вируса в широком спектре типов клеток. Вакцины-кандидаты следующего поколения, проходящие доклиническую разработку, включают пептиды, субъединицы или мультисубъединичные комплексы, представляющие части или все пентамерные комплексы. Подходы включают пептиды, рекомбинантные белки, ДНК, дефектные по репликации вирусные векторы, генетически инвалидные ЦМВ и инактивированные вирионы ЦМВ. Разнообразие разрабатываемых новых стратегий вселяет оптимизм в отношении того, что появится успешный кандидат.
Таким образом, включение эпитопов, полученных из пентамерного комплекса, может обеспечить повышенную эффективность за счет индукции сильнодействующих нейтрализующих/ингибирующих распространение антител, которые нацелены на репликацию вируса в широком спектре типов клеток. Вакцины-кандидаты следующего поколения, проходящие доклиническую разработку, включают пептиды, субъединицы или мультисубъединичные комплексы, представляющие части или все пентамерные комплексы. Подходы включают пептиды, рекомбинантные белки, ДНК, дефектные по репликации вирусные векторы, генетически инвалидные ЦМВ и инактивированные вирионы ЦМВ. Разнообразие разрабатываемых новых стратегий вселяет оптимизм в отношении того, что появится успешный кандидат.
Ключевые слова: цитомегаловирус, врожденная инфекция, вакцина
Цитомегаловирус (ЦМВ) является одним из самых крупных и сложных из известных вирусов, вызывающих заболевания человека. Геном длиной 235 т.п.н. кодирует не менее 165 белков [1], но исследования вакцины против ЦМВ были сосредоточены на ограниченном числе вирусных белков, которые доминируют в клеточных или гуморальных иммунных реакциях при естественной инфекции.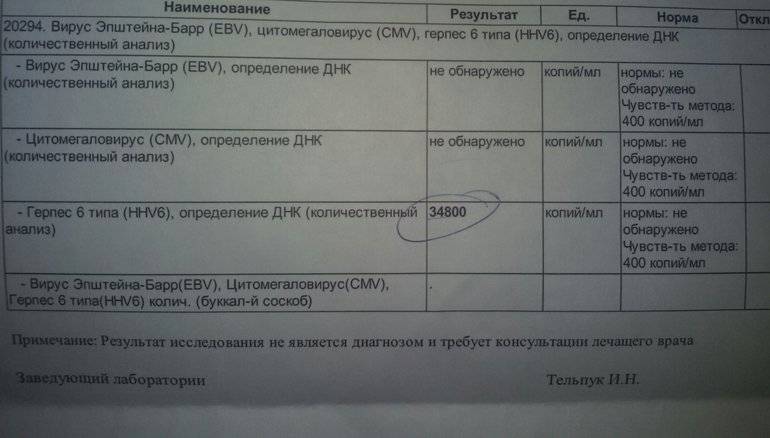 Белок pp65 является основной мишенью цитотоксического Т-клеточного ответа [2]. Рр65, расположенный в покрове между капсидом и вирусной оболочкой, является наиболее распространенным белком вирионов ЦМВ. Белок IE1 также является важной цитотоксической Т-клеточной мишенью, которая не находится в вирионе, но обильно экспрессируется в клетках после инфицирования. На поверхности вириона и в оболочке находится несколько гликопротеиновых комплексов, которые опосредуют проникновение в клетку-хозяин. Считается, что гетеродимер, состоящий из гликопротеина М и гликопротеина N, инициирует взаимодействие с клеткой-хозяином путем связывания с гепарином. Второй гетеродимер, состоящий из гликопротеина H и гликопротеина L (gH/gL), может опосредовать взаимодействие с рецептором, которое завершается инициированием конформационных изменений в гликопротеине B (gB), которые управляют слиянием вирусной оболочки с мембраной клетки-мишени [3]. Все эти комплексы являются важными мишенями для гуморального иммунитета, поскольку содержат эпитопы, связывающие определенный класс антител, известных как нейтрализующие антитела [4–7].
Белок pp65 является основной мишенью цитотоксического Т-клеточного ответа [2]. Рр65, расположенный в покрове между капсидом и вирусной оболочкой, является наиболее распространенным белком вирионов ЦМВ. Белок IE1 также является важной цитотоксической Т-клеточной мишенью, которая не находится в вирионе, но обильно экспрессируется в клетках после инфицирования. На поверхности вириона и в оболочке находится несколько гликопротеиновых комплексов, которые опосредуют проникновение в клетку-хозяин. Считается, что гетеродимер, состоящий из гликопротеина М и гликопротеина N, инициирует взаимодействие с клеткой-хозяином путем связывания с гепарином. Второй гетеродимер, состоящий из гликопротеина H и гликопротеина L (gH/gL), может опосредовать взаимодействие с рецептором, которое завершается инициированием конформационных изменений в гликопротеине B (gB), которые управляют слиянием вирусной оболочки с мембраной клетки-мишени [3]. Все эти комплексы являются важными мишенями для гуморального иммунитета, поскольку содержат эпитопы, связывающие определенный класс антител, известных как нейтрализующие антитела [4–7]. Связываясь с медиаторами проникновения вируса, нейтрализующие антитела могут блокировать проникновение в клетку и, следовательно, нейтрализовать инфекционность вируса.
Связываясь с медиаторами проникновения вируса, нейтрализующие антитела могут блокировать проникновение в клетку и, следовательно, нейтрализовать инфекционность вируса.
Живые аттенуированные вакцины обладают потенциальными преимуществами в отношении сложных вирусов, таких как ЦМВ. Экспрессируя полный или почти полный набор вирусных антигенов, они могут индуцировать как гуморальные, так и клеточные иммунные ответы, которые очень похожи на те, которые индуцируются естественной инфекцией. Тем не менее, безопасность живой вакцины ЦМВ представляет собой серьезную проблему, особенно если ее непреднамеренно вводят во время беременности. Живая вакцина Тауна состоит из изолята ЦМВ, ослабленного последовательным пассированием на культивируемых фибробластах человека. Его безопасно вводили почти 1000 добровольцам, и он вызывает как клеточные, так и гуморальные реакции. При использовании в низкой дозе вакцина Тауна не защищала от первичной материнской инфекции [8]. Однако впоследствии было показано, что более высокая доза является более иммуногенной; эффективность этой дозы не сообщалось.
В попытке улучшить иммуногенность вакцины Towne при сохранении ее профиля безопасности, области, составляющие приблизительно 25% генома Towne, были заменены соответствующими последовательностями из штамма Toledo низкого пассажа для получения 4 различных «химер Towne-Toledo». ” Четыре живые аттенуированные вакцины, каждая из которых содержала разные химеры, не вызывали связанных с вакциной побочных эффектов при введении ЦМВ-серопозитивным добровольцам, но не повышали иммунитет к ЦМВ выше ранее существовавших уровней [9].]. В настоящее время проводится фаза 1 испытаний четырех химерных вакцин на ЦМВ-серонегативных добровольцах.
Субъединичные вакцины обеспечивают мощный целенаправленный иммунный ответ на некоторые вирусные иммуногены. Простейшие субъединичные вакцины сочетают субъединичные иммуногены (например, рекомбинантные белки) с адъювантом, тогда как векторные системы доставки основаны на генетическом программировании клеток-хозяев (через поглощение «голой» ДНК или заражение дефектными по репликации вирусами) для экспрессии желаемого(ых) иммуногена(ов) в клетках-хозяевах. виво. Стратегии субъединичных вакцин были сосредоточены в первую очередь на pp65 и IE1 для индукции клеточного иммунитета и gB для индукции нейтрализующих антител. ГБ/MF59вакцина, разработанная Sanofi, сочетает рекомбинантную растворимую форму gB с MF59, масляно-водным адъювантом [10]. В фазе 1 испытаний вакцина gB/MF59 была одновременно безопасной и высокоиммуногенной [10]. Во 2-й фазе исследования он снизил частоту первичной инфекции на 50% [11]. Последующее исследование показало, что у пациентов, получивших вакцину gB/MF59 до трансплантации почки, продолжительность ЦМВ-виремии была меньше, и им требовалось меньше дней противовирусного лечения [12]. Аналогичная вакцина, состоящая из рекомбинантного белка gB с адъювантом AS01, была разработана GlaxoSmithKline. Это было безопасно и иммуногенно в испытании фазы 1.
виво. Стратегии субъединичных вакцин были сосредоточены в первую очередь на pp65 и IE1 для индукции клеточного иммунитета и gB для индукции нейтрализующих антител. ГБ/MF59вакцина, разработанная Sanofi, сочетает рекомбинантную растворимую форму gB с MF59, масляно-водным адъювантом [10]. В фазе 1 испытаний вакцина gB/MF59 была одновременно безопасной и высокоиммуногенной [10]. Во 2-й фазе исследования он снизил частоту первичной инфекции на 50% [11]. Последующее исследование показало, что у пациентов, получивших вакцину gB/MF59 до трансплантации почки, продолжительность ЦМВ-виремии была меньше, и им требовалось меньше дней противовирусного лечения [12]. Аналогичная вакцина, состоящая из рекомбинантного белка gB с адъювантом AS01, была разработана GlaxoSmithKline. Это было безопасно и иммуногенно в испытании фазы 1.
Вакцина TransVax была разработана компанией Vical для использования в качестве терапевтической вакцины у пациентов, перенесших трансплантацию. Он состоит из плазмидных ДНК, кодирующих pp65 и gB, в состав которых входит полоксамерный адъювант. Во 2-й фазе исследования TransVax снижал посттрансплантационную ЦМВ-виремию у пациентов, перенесших трансплантацию гемопоэтических клеток [13]. TransVax была лицензирована для Astellas Pharma Inc и вступила в 3-ю фазу испытаний у пациентов с трансплантацией гемопоэтических клеток. Врожденная вакцина Викала против ЦМВ, CyMVectin, находится на поздней стадии доклинической разработки. CyMVectin состоит из плазмид, экспрессирующих pp65 и gB, в состав которых входит ваксфектин, адъювант, стимулирующий устойчивые клеточные и гуморальные реакции.
Во 2-й фазе исследования TransVax снижал посттрансплантационную ЦМВ-виремию у пациентов, перенесших трансплантацию гемопоэтических клеток [13]. TransVax была лицензирована для Astellas Pharma Inc и вступила в 3-ю фазу испытаний у пациентов с трансплантацией гемопоэтических клеток. Врожденная вакцина Викала против ЦМВ, CyMVectin, находится на поздней стадии доклинической разработки. CyMVectin состоит из плазмид, экспрессирующих pp65 и gB, в состав которых входит ваксфектин, адъювант, стимулирующий устойчивые клеточные и гуморальные реакции.
AVX601 — вакцина с вектором РНК-вируса, разработанная Alphavax. Эта платформа использует дефектный по репликации вирус венесуэльского энцефалита лошадей для экспрессии gB и слитого белка pp65/IE1 [14]. Вакцина была лицензирована компанией Novartis и прошла 1-ю фазу испытаний. [4]. В этих исследованиях измерялась способность антител нейтрализовать проникновение вируса в клетки фибробластов. Более поздние исследования показали, что механизмы проникновения ЦМВ зависят от типа клеток: в то время как gB и димер gH/gL необходимы для проникновения в фибробласты, для проникновения в эндотелиальные или эпителиальные клетки требуются 3 дополнительных вирусных белка, UL128, UL130 и UL131A, которые взаимодействуют с gH. /gL с образованием пентамерного комплекса [15]. Тот факт, что пентамерный комплекс полностью незаменим для проникновения в фибробласты, свидетельствует о том, что анализы нейтрализации на основе фибробластов неспособны обнаруживать нейтрализующие антитела, нацеленные на эпитопы, уникальные для пентамерного комплекса. Для решения этой проблемы использовали фибробласты и эпителиальные клетки для измерения нейтрализующей активности ЦМВ-серопозитивных сывороток. В среднем нейтрализующая активность в отношении проникновения в эпителий была в 48 раз выше, чем в отношении проникновения в фибробласты, что свидетельствует о том, что в предыдущих анализах на основе фибробластов был пропущен большой компонент нейтрализующей активности. При измерении эпителиальных нейтрализующих титров для Towne и gB/MF59у реципиентов вакцины ни одна из вакцин не была близка к индукции нейтрализующих титров эпителиального проникновения, сравнимых с титрами, индуцированными естественной инфекцией — gB/MF59 был в 15 раз ниже, тогда как Towne был в 28 раз ниже [16].
/gL с образованием пентамерного комплекса [15]. Тот факт, что пентамерный комплекс полностью незаменим для проникновения в фибробласты, свидетельствует о том, что анализы нейтрализации на основе фибробластов неспособны обнаруживать нейтрализующие антитела, нацеленные на эпитопы, уникальные для пентамерного комплекса. Для решения этой проблемы использовали фибробласты и эпителиальные клетки для измерения нейтрализующей активности ЦМВ-серопозитивных сывороток. В среднем нейтрализующая активность в отношении проникновения в эпителий была в 48 раз выше, чем в отношении проникновения в фибробласты, что свидетельствует о том, что в предыдущих анализах на основе фибробластов был пропущен большой компонент нейтрализующей активности. При измерении эпителиальных нейтрализующих титров для Towne и gB/MF59у реципиентов вакцины ни одна из вакцин не была близка к индукции нейтрализующих титров эпителиального проникновения, сравнимых с титрами, индуцированными естественной инфекцией — gB/MF59 был в 15 раз ниже, тогда как Towne был в 28 раз ниже [16]. Последующие исследования показали, что большая часть эпителиально-специфического нейтрализующего ответа направлена против эпитопов внутри пентамерного комплекса [17].
Последующие исследования показали, что большая часть эпителиально-специфического нейтрализующего ответа направлена против эпитопов внутри пентамерного комплекса [17].
Эти данные свидетельствуют о том, что для эффективной вакцины против ЦМВ может быть необходима индукция надежной нейтрализующей активности, специфичной для эпителия/эндотелия. Поскольку большинство ЦМВ-инфекций передаются перорально, эпителиально-специфическая нейтрализующая активность в слюне может блокировать передачу вируса, предотвращая попадание инокулята в эпителиальные клетки слизистой оболочки полости рта [18]. В тех случаях, когда слюнные антитела неэффективны, сывороточные антитела могут служить для ограничения репликации ЦМВ и распространения в тканях или для нарушения распространения в плаценту и, в конечном счете, к плоду. In vitro антитела могут ингибировать распространение ЦМВ между эндотелиальными или эпителиальными клетками, но не фибробластами [19].]. Таким образом, антитела, которые ингибируют эпителиальное/эндотелиальное проникновение/распространение, могут иметь важное значение для предотвращения материнской инфекции или, в противном случае, для нарушения распространения и/или диссеминации in vivo, тем самым снижая риск передачи плоду.
Вакцины, предназначенные для генерирования нейтрализующих реакций, нацеленных как на проникновение фибробластов, так и на эпителиальные/эндотелиальные клетки, находятся на стадии доклинической разработки. Однако остается неясным, в какой степени конформационные и/или мультисубъединичные эпитопы доминируют над «нейтрализующим эпитомом» пентамерного комплекса. На то, что может быть необходимо представить полный пентамерный комплекс в его конформационно-нативном состоянии, указывает исследование моноклональных антител, выделенных от естественно инфицированных субъектов: из 17 пентамерных комплекс-специфических нейтрализующих антител все, кроме 1, распознавали мультисубъединичные эпитопы [6] . На другом конце спектра сложности вакцина субъединичной ДНК UL130 индуцирует эпителиально-специфические нейтрализующие ответы, а иммунизация двумя короткими пептидами из UL130 и UL131 индуцирует нейтрализующие титры у кроликов, которые превышают таковые для большинства серопозитивных сывороток человека [20].
В настоящее время изучаются различные подходы к вакцинам, включая простые пептиды или субъединицы; рекомбинантные мультисубъединичные комплексы, такие как gH/gL или полный пентамерный комплекс; инактивированные вирионы ЦМВ, содержащие нативный пентамерный комплекс, gB, pp65 и другие вирусные антигены; генетически инвалидный CMV, экспрессирующий нативный пентамерный комплекс, который потенциально сочетает в себе иммуногенность живой вакцины с безопасностью убитой вакцины; дефектные по репликации вирусные векторы (например, вирус оспы, аденовирус, альфавирус и другие), экспрессирующие субъединицы или мультисубъединичные комплексы; и комбинации прайм/бустер вышеперечисленного.
Несколько экспериментальных вакцин против CMV прошли клиническую оценку (таблица), и одна из них, gB/MF59, обладает некоторой защитной эффективностью. Включение эпитопов, полученных из пентамерного комплекса, может обеспечить дополнительную эффективность за счет индукции сильнодействующих нейтрализующих/препятствующих распространению антител, которые нацелены на репликацию вируса в широком спектре типов клеток. Вакцины-кандидаты следующего поколения, которые включают эпитопы пентамерного комплекса, находятся в стадии доклинической разработки. Разнообразие разрабатываемых новых стратегий вселяет оптимизм в отношении того, что появится успешный кандидат.
Вакцины-кандидаты следующего поколения, которые включают эпитопы пентамерного комплекса, находятся в стадии доклинической разработки. Разнообразие разрабатываемых новых стратегий вселяет оптимизм в отношении того, что появится успешный кандидат.
Table 1.
Experimental Cytomegalovirus Vaccines in or Approaching Clinical Evaluation
| Type | Vaccine | Developer | Components | Status |
|---|---|---|---|---|
| Live attenuated | Towne | Wistar | Целый вирус | Фаза 2 |
| Таун-Толедо 1, 2, 3, 4 | Aviron/MedImmune | Целый вирус | Phase 1 | |
| Subunit protein | gB/MF59 | Chiron/Sanofi | gB/MF59 | Phase 2 |
| GSK1492903A | GlaxoSmithKline | gB/ASO1 | Phase 1 | |
| Subunit ДНК -вектором | Transvax | Викал | ГБ, PP65 | Фаза 2 |
| Cymvectin | Vical | GB, PP65 | 0091 | |
| Субъединица Вирусная вектора | AVX601 | ALPHAVAX/NOVARTIS | ГБ/PP65-IE1 | Фаза 1 |
 Открыто в APER 9000 9000 9000.9000 9000. 9000. 9000. 9000. 9000. 9000.8 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000.. Благодарю доктора Стюарта Адлера и доктора Джованни Нигро.
Открыто в APER 9000 9000 9000.9000 9000. 9000. 9000. 9000. 9000. 9000.8 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000. 9000.. Благодарю доктора Стюарта Адлера и доктора Джованни Нигро.Финансовая поддержка. Эта работа была поддержана грантами Национального института здоровья.
Дополнение к спонсорству. Эта рукопись является частью приложения «Пренатальная терапия врожденной цитомегаловирусной инфекции», спонсируемого Ассоциацией Anticito Onlus.
Возможные конфликты интересов. Автор подтверждает отсутствие потенциального конфликта интересов.
Автор подал форму ICMJE для раскрытия потенциальных конфликтов интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
1. Долан А., Каннингем С., Гектор Р.Д. и соавт. Генетический состав цитомегаловируса человека дикого типа. Джей Ген Вирол. 2004; 85 (часть 5): 1301–12. [PubMed] [Академия Google]
и соавт. Генетический состав цитомегаловируса человека дикого типа. Джей Ген Вирол. 2004; 85 (часть 5): 1301–12. [PubMed] [Академия Google]
2. Уиллс М.Р., Кармайкл А.Дж., Майнард К. и соавт. В реакции цитотоксических Т-лимфоцитов (ЦТЛ) человека на цитомегаловирус доминирует структурный белок pp65: частота, специфичность и использование Т-клеточного рецептора pp65-специфических ЦТЛ. Дж Вирол. 1996; 70: 7569–79. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Wille PT, Wisner TW, Ryckman B, Johnson DC. Гликопротеин gB цитомегаловируса человека (HCMV) способствует проникновению вируса в транс, действуя как вирусный слитый белок, а не как рецептор-связывающий белок. МБио. 2013; 4:1–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Marshall GS, Rabalais GP, Stout GG, Waldeyer SL. Антитела к рекомбинантному гликопротеину В после естественной инфекции цитомегаловирусом человека коррелируют с нейтрализующей активностью. J заразить Dis. 1992; 165: 381–4. [PubMed] [Google Scholar]
5. Urban M, Klein M, Britt WJ, Hassfurther E, Mach M. Гликопротеин H цитомегаловируса человека является основным антигеном для нейтрализации гуморального иммунного ответа. Джей Ген Вирол. 1996; 77 (часть 7): 1537–47. [PubMed] [Академия Google]
Urban M, Klein M, Britt WJ, Hassfurther E, Mach M. Гликопротеин H цитомегаловируса человека является основным антигеном для нейтрализации гуморального иммунного ответа. Джей Ген Вирол. 1996; 77 (часть 7): 1537–47. [PubMed] [Академия Google]
6. Маканьо А., Бернаскони Н.Л., Ванцетта Ф. и соавт. Выделение человеческих моноклональных антител, которые эффективно нейтрализуют цитомегаловирусную инфекцию человека путем нацеливания на различные эпитопы в комплексе gH/gL/UL128-131A. Дж Вирол. 2010;84:1005–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Shimamura M, Mach M, Britt WJ. Цитомегаловирусная инфекция человека вызывает гликопротеин M (gM)/gN-специфический ответ нейтрализующих вирус антител. Дж Вирол. 2006; 80: 4591–600. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Адлер С.П., Старр С.Е., Плоткин С.А., и соавт. Иммунитет, индуцированный первичной цитомегаловирусной инфекцией человека, защищает от вторичной инфекции у женщин детородного возраста. J заразить Dis. 1995; 171: 26–32. Опечатка в J Infect Dis 1995; 171:1080. [PubMed] [Google Scholar]
J заразить Dis. 1995; 171: 26–32. Опечатка в J Infect Dis 1995; 171:1080. [PubMed] [Google Scholar]
9. Heineman TC, Schleiss M, Bernstein DI, et al. Фаза 1 исследования 4 живых рекомбинантных химерных вакцин Towne/Toledo цитомегаловируса человека. J заразить Dis. 2006; 193:1350–60. [PubMed] [Академия Google]
10. Frey SE, Harrison C, Pass RF, et al. Влияние дозы антигена и режимов иммунизации на гуморальный ответ на субъединичную вакцину цитомегаловирусного гликопротеина В. J заразить Dis. 1999; 180:1700–3. [PubMed] [Google Scholar]
11. Pass RF, Zhang C, Evans A, et al. Вакцинопрофилактика материнской цитомегаловирусной инфекции. N Engl J Med. 2009; 360:1191–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Griffiths PD, Stanton A, McCarrell E, et al. Вакцина цитомегаловирусного гликопротеина-В с MF59адъювант у реципиентов трансплантата: рандомизированное плацебо-контролируемое исследование фазы 2. Ланцет. 2011; 377:1256–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Kharfan-Dabaja MA, Boeckh M, Wilck MB, et al. Новая терапевтическая цитомегаловирусная ДНК-вакцина при аллогенной трансплантации гемопоэтических стволовых клеток: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2. Ланцет Infect Dis. 2012;12:290–9. [PubMed] [Google Scholar]
Kharfan-Dabaja MA, Boeckh M, Wilck MB, et al. Новая терапевтическая цитомегаловирусная ДНК-вакцина при аллогенной трансплантации гемопоэтических стволовых клеток: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2. Ланцет Infect Dis. 2012;12:290–9. [PubMed] [Google Scholar]
14. Reap EA, Morris J, Dryga SA, et al. Разработка и доклиническая оценка вакцины с частицами репликона альфавируса против цитомегаловируса. вакцина. 2007; 25:7441–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Ван Д., Шенк Т. Белковый комплекс вириона цитомегаловируса человека, необходимый для тропизма эпителиальных и эндотелиальных клеток. Proc Natl Acad Sci U S A. 2005; 102:18153–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Cui X, Meza BP, Adler SP, McVoy MA. Цитомегаловирусные вакцины не способны индуцировать проникающие в эпителий нейтрализующие антитела, сравнимые с естественной инфекцией. вакцина. 2008;26:5760–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17.


