ПОВАРЕННАЯ СОЛЬ | Энциклопедия Кругосвет
ПОВАРЕННАЯ СОЛЬ – хлорид натрия NaCl. Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 20° С и 38,1 при 80° С. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей – хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. Плотность NaCl – 2,165 г/см3, температура плавления 800,8° С, температура кипения 1465° С.
Раньше говаривали: «Соль всему голова, без соли и жито – трава»; «Один глаз на полицу (где хлеб), другой – в солоницу (солонку)», и еще: «Без хлеба не сытно, без соли не сладко»… Бурятская народная мудрость гласит: «Собираясь пить чай, клади в него щепотку соли; от нее быстрее усваивается пища, исчезнут болезни желудка».
Вряд ли мы узнаем, когда впервые наши далекие предки вкусили соль: нас отделяют от них десять-пятнадцать тысяч лет. Тогда еще не было посуды для приготовления пищи, все растительные продукты люди вымачивали в воде и подпекали на тлеющих углях, а мясо, насаженное на палки, обжаривали в пламени костра. «Поваренной солью» первобытных людей наверняка была зола, которая неизбежно попадала в пищу во время ее приготовления. Зола содержит поташ – карбонат калия K
Возможно, однажды, за неимением пресной воды, мясо либо корни и листья растений были замочены в соленой морской или озерной воде, и еда оказалась вкуснее обычной. Может быть, добытое впрок мясо, чтобы защитить его от хищных птиц и насекомых, люди спрятали в морскую воду, а потом обнаружили, что оно приобрело приятный вкус. Наблюдательные охотники первобытных племен могли заметить, что животные любят лизать солонцы – белые кристаллы каменной соли, выступающие кое-где из-под земли, и попробовали добавлять соль в пищу. Могли быть и другие случаи первого знакомства людей с этим удивительным веществом.
Чистая поваренная соль, или хлорид натрия NaCl – бесцветное негигроскопичное (не поглощающее влагу из воздуха) кристаллическое вещество, растворимое в воде и плавящееся при 801° С. В природе хлорид натрия встречается в виде минерала галита – каменной соли. Слово «галит» происходит от греческого «галос», означающего и «соль», и «море». Основная масса галита чаще всего находится на глубине 5 км под поверхностью земли. Однако давление слоя горных пород, расположенных над пластом соли, превращает ее в вязкую, пластичную массу. «Всплывая» в местах пониженного давления кроющих пород, пласт соли образует соляные «купола», выходящие в ряде мест наружу.
Природный галит редко бывает чисто белого цвета. Чаще он буроватый или желтоватый из-за примесей соединений железа. Встречаются, но очень редко, кристаллы галита голубого цвета. Это означает, что они долгое время в глубинах земли находились по соседству с породами, содержащими уран, и подверглись радиоактивному облучению.
В лаборатории тоже можно получить синие кристаллы хлорида натрия. Для этого не потребуется облучения; просто в плотно закрытом сосуде надо нагреть смесь поваренной соли NaCl и небольшого количества металлического натрия Na. Металл способен растворяться в соли. Когда атомы натрия проникают в кристалл, состоящий из катионов Na+ и анионов Cl–, они «достраивают» кристаллическую решетку, занимая подходящие места и превращаясь в катионы Na+. Освободившиеся электроны располагаются в тех местах кристалла, где полагалось бы находиться хлорид-анионам Cl–?. Такие необычные места внутри кристалла, занятые электронами вместо ионов, называют «вакансиями».
При охлаждении кристалла некоторые вакансии объединяются, это и служит причиной появления синей окраски. Кстати, при растворении в воде синего кристалла соли образуется бесцветный раствор – совсем как из обычной соли.
Греческий поэт Гомер (VIII в. до н.э.), написавший Илиаду и Одиссею, называл поваренную соль «божественной». В те времена она ценилась выше золота: ведь, как гласила пословица, «без золота прожить можно, а без соли — нельзя». Из-за месторождений каменной соли происходили военные столкновения, а иногда нехватка соли вызывала «соляные бунты».
На столах императоров, царей, королей и шахов стояли солонки из золота, и заведовал ими особо доверенный человек — солоничий. Воинам часто платили жалованье солью, а чиновники получали солевой паек. Как правило, соляные источники были собственностью властителей и коронованных особ. В Библии есть выражение «пьет соль от дворца царского», означающее человека, получающего содержание от царя.
Соль издавна была символом чистоты и дружбы. «Вы – соль земли» – говорил Христос своим ученикам, имея в виду их высокие нравственные качества. Соль употреблялась при жертвоприношениях, новорожденных детей у древних евреев посыпали солью, а в католических церквах при крещении в ротик младенца клали кристаллик соли.
В обычае арабов было при утверждении торжественных договоров подавать сосуд с солью, из которого в знак доказательства и гарантии постоянной дружбы лица, заключившие договор – «завет соли» – съедали по несколько ее крупинок. «Съесть вместе пуд соли» – у славян значит хорошо узнать друг друга и подружиться. По русскому обычаю, когда подносят гостям хлеб-соль, то тем самым желают им здоровья.
Поваренная соль – не только пищевой продукт, но издавна распространенный консервант, ее применяли при обработке кожевенного и мехового сырья. А в технике она до сих пор является исходным сырьем для получения практически всех соединений натрия, в том числе соды.
Поваренная соль входила и в состав самых древних лекарств, ей приписывали целебные свойства, очищающее и дезинфицирующее действие, причем с давних пор подмечено, что поваренная соль разных месторождений имеет разные биологические свойства: самая в этом отношении полезная – морская. В
Однако в употреблении соли надо соблюдать меру. Известно, что средний европеец ежедневно поглощает с пищей до 15 г соли, в то время как средний японец – около 40 г. Как раз японцы и держат мировое первенство по числу больных гипертонией – болезнью, одна из причин которой состоит в том, что в организме задерживается больше жидкости, чем ему необходимо. Клетки разбухают от ее излишка, сжимают кровеносные сосуды, поэтому повышается кровяное давление, от чего и сердце начинает работать с перегрузкой. Трудно становится и почкам, очищающим организм от избытка катионов натрия.
Ни одно растение не может расти на почве, покрытой солью, солончаки всегда были символом земли бесплодной и необитаемой. Когда властитель Священной Римской империи Фридрих I Барбаросса разрушил в 1155 Милан в Италии, то велел посыпать руины поверженного города солью в знак его полного уничтожения… У разных народов во все времена рассыпать соль значило накликать беду и потерять здоровье.
В древности люди использовали несколько способов добычи поваренной соли: естественное испарение морской воды в «соляных садках», где выпадал хлорид натрия NaCl – «морская» соль, вываривание воды соленых озер с получением «выварочной» соли, и выламывание «каменной» соли в подземных рудниках. Все эти способы дают соль с примесями хлорида магния MgCl
В морской воде в среднем на 1 л приходится до 30 г различных солей, на долю поваренной соли приходится 24 г. Технология получения хлорида натрия NaCl из морской и озерной воды всегда была довольно примитивной.
Например, в конце «бронзового века» – за три, три с половиной тысячи лет до нашей эры – древние солевары обливали бревна морской водой, а потом сжигали их и из золы выбирали соль. Позднее соленые воды стали выпаривать на больших противнях, а для удаления примесей добавляли кровь животных, собирая образующуюся пену. Примерно с конца 16 в. растворы соли очищали и концентрировали, пропуская через башни, заполненные соломой и ветками кустарников. Выпаривание раствора соли на воздухе производили и совсем примитивным способом, сливая рассол по стене, сложенной из связок хвороста и соломы.
Солеварение, старейшее из химических ремесел, возникло на Руси, по-видимому, в начале 7 века. Соляные промыслы принадлежали монахам, которым благоволили русские цари, с них даже не взимался налог на продаваемую соль. Выварка соли приносила монастырям огромные прибыли. Рассолы добывали не только из озер, но и из подземных соляных источников; буровые скважины, которые для этого строили, в 15 в. достигали длины 60–70 м. В скважины опускали трубы, изготовленные из цельного дерева, а упаривали рассолы в железных противнях на дровяной топке. В 1780 в России таким способом было выварено более ста тысяч тонн соли…
В настоящее время поваренную соль добывают из отложений соляных озер и на месторожденияхкаменной соли – галита.
Поваренная соль – не только важная пищевая приправа, но и химическое сырье: из нее получают гидроксид натрия, соду, хлор.
Людмила Аликберова
Урок 9. Ионы в водном растворе – HIMI4KA
В уроке 9 «Ионы в водном растворе» из курса «Химия для чайников» рассмотрим растворение соли в воде, а также электролиз растворов и расплавов солей; познакомимся с законами Фарадея для электролиза и научимся находить продукты электролиза. Базой знаний для данного урока послужит материал из урока 8 «строение солей».

Растворение соли в воде
Из прошлого урока нам известно, что соли трудно расплавить и еще сложнее довести ее до кипения, однако, полярные жидкости, такие как вода, способны растворять соли без особых усилий, поскольку неполные положительные и отрицательные заряды на атомах полярных молекул воды в какой-то мере заменяют собой положительные и отрицательные ионы в кристаллической решетке соли. Другими словами, молекулы воды помогают разрушить кристалл соли.
Из рисунка видно, что происходит с положительными и отрицательными ионами при растворении в воде кристалла поваренной соли NaCl. Каждый ион Na+ окружается молекулами воды, которые обращены к нему отрицательно заряженными атомами кислорода. То же самое происходит с ионами Cl—, которые окружаются молекулами воды, обращенными к нему своими положительно заряженными атомами водорода. Ионы из кристалла соли оказываются гидратированными, а сам процесс присоединения молекул воды к ионам получил название — гидратация. Если в результате процесса гидратации устойчивость ионов, переходящих в раствор, становится больше их устойчивости в кристаллической решетке, то происходит растворение соли в воде. Хлорид натрия является отличным примером растворимой соли. И, наоборот, если энергия гидратации слишком мала, то кристалл является более устойчивой формой и не растворяется в воде. Примером таких нерастворимых солей является сульфат бария (BaSO4) и хлорид серебра (AgCl). Когда кристалл растворяется, он не просто распадается на ионы, а разъединяется на ионы молекулами жидкости, в которой происходит растворение. Неполярные жидкости (например, бензин С8H18) НЕ способны разъединять ионы в кристаллической решетке солей.
Электролиз растворов и расплавов солей
Металлы хорошо проводят ток — это знает каждый школьник. Электропроводность в металлах вызвана перемещением электронов в них, но ионы металла остаются неподвижными. Хотя кристаллы солей не проводят ток, зато растворы и расплавы солей это умеют и практикуют, так как анионы (отрицательные ионы) и катионы (положительные ионы) могут направленно перемещаться в противоположные направления, если приложить напряжение. Подвижность ионов соли оказывается еще большей, если она подверглась процессу гидратации.
Давным-давно английский ученый Майкл Фарадей расплавил соль (нагрев ее выше 801ºС), затем погрузил в расплав два электрода (катод и анод), а после взял и пропустил электрический ток через расплавленную соль. После этих манипуляций он обратил внимание что на электродах начали протекать химические реакции: ионы натрия начали мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия
- Na+ + e— (с катода) → Na
Хлорид-ионы мигрируют в другом направлении-в сторону анода, отдают ему свои избыточные электроны и окисляются до газообразного хлора
Все это можно изобразить с помощью полной реакции, которая представляет собой разделение NaCl на составляющие его элементы:
- Na+ + Cl— → Na + ½Cl2
Весь процесс получил название электролиз, что означает «разрыв на части при помощи электричества». Для электролиза не обязательно расплавлять соль, можно также использовать обычный водный раствор соли, ведь подвижность ионов оказывается еще большей, если соль подверглась процессу гидратации. Но тогда полная реакция будет выглядеть иначе, и на катоде будет выделяться не металлический натрий, а газообразный водород:
- Na+ + Cl— + H2O → Na+ + ½Cl2 + ½H2 + OH—
Надеюсь, что вам стало интересно, почему продуктом электролиза водного раствора является не Na (как это было в расплавленной соли), а ½H2. Объясняется просто: часть молекул H2O диссоциируют на ионы H+ и OH—. Поскольку ион H+ обладает большим сродством к электрону (то есть сильнее его притягивает), нежели ион Na+, то ионы H+ первыми достигают катода, где незамедлительно восстанавливают недостающий электрон и превращаются из иона в полноценный газ H2, а ионы Na+ так и остаются в растворе.
Вот вам плюшка с продуктами электролиза водного раствора солей, может пригодится — может нет, но лучше законспектируйте:
А Фарадей тем временем не сидел без дела, а наблюдал, проводил опыты, использовал другие электролиты, увеличивал-уменьшал заряд и опять наблюдал. В конце концов он заметил взаимосвязь между количеством подаваемого электричества и количеством получаемых веществ. Установленные им закономерности называются законы Фарадея для электролиза. Сформулируем их:
- Пропускание одного и того же электрического заряда через электролитическую ячейку всегда приводит к количественно одинаковому химическому превращению в данной реакции. Масса элемента, выделяемого на электроде, пропорциональна количеству заряда, пропущенному через электролитическую ячейку.
- Для выделения на электроде 1 моля вещества, которое в процессе электрохимической реакции приобретает или теряет 1 электрон, необходимо пропустить через ячейку 96485 кулонов (Кл) электричества. Если в реакции принимает участие N электронов, для выделения моля продукта необходимо N·96485 Кл электричества.
Количество электричества, равное 96485 Кл, получило название 1 фарадей и обозначается символом F. Законы Фарадея становятся очевидными, если принять во внимание, что 1 F — это просто заряд 1 моля электронов, т.е. 6,022 1023 электронов. Множитель 6,022-1023, позволяющий переходить от индивидуальных молекул к молям вещества, одновременно позволяет перейти и от 1 электронного заряда к 1 F электрического заряда. Разумеется, в свое время Фарадей ничего не знал ни о числе Авогадро, ни о заряде электрона. Однако из проведенных экспериментов он смог сделать вывод, что заряды на ионах кратны некоторой элементарной единице заряда, так что 96485 Кл электричества соответствуют 1 молю таких единиц. Термин электрон впервые появился в 1881 г.; его ввел английский физик Дж.Стоней для обозначения элементарной единицы ионного заряда. Применять термин «электрон» к реальной отрицательно заряженной частице начали спустя еще 10 лет.
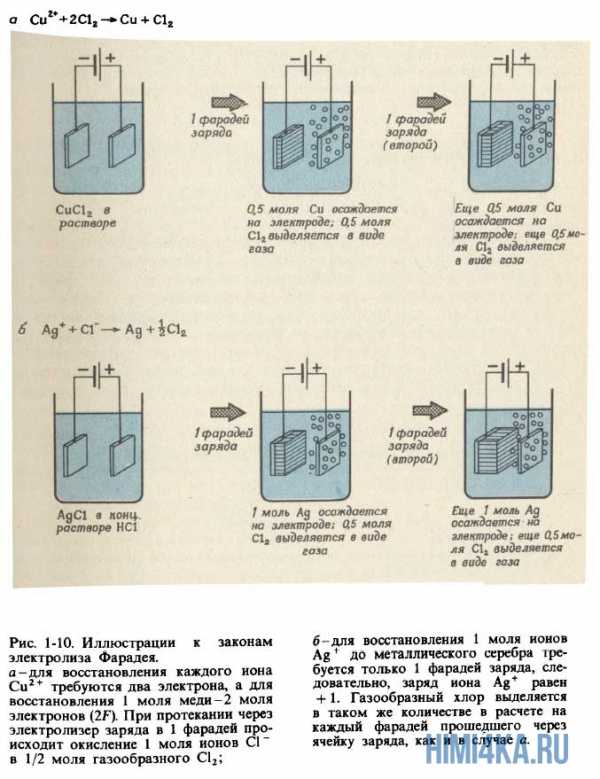
1 пример. Запишите уравнения реакций, протекающих при пропускании электрического тока через расплавленную соль NaCl. Сколько граммов натрия и хлора выделится при пропускании 1 F электричества через электролитическую ячейку?
Решение: Уравнение реакции, протекающей на катоде: Na+ + е— → Na, а уравнение 1 анодной реакции: Сl— → Cl2 + е—. Когда через расплавленную соль NaCl проходит 1 моль электронов (1 F), каждый электрон восстанавливает 1 ион натрия, в результате чего образуется 1 моль атомов натрия. Следовательно, на катоде выделяется 22,990 г Na. На аноде происходит удаление 1 моля электронов от 1 моля хлорид-ионов, после чего остается 1 моль атомов хлора, которые попарно соединяются, образуя 1/2 моля молекул Сl2. Следовательно, масса газообразного хлора, выделяющегося на аноде, должна быть равна 35,453 г (что равно атомной массе Сl, или половине молекулярной массы Сl).
Пример 2. Сколько граммов металлического магния и газообразного хлора выделяется при пропускании 1 F электричества через электролитическую ячейку с расплавленным хлоридом магния, MgCl2?
Решение: На катоде происходит реакция Mg2+ + 2е— → Mg, а на аноде — реакция 2Сl— → Сl2 + 2е—. Поскольку для восстановления каждого иона Mg2+ необходимо 2 электрона, 1 моля электронов хватит только для восстановления половины моля ионов магния, таким образом на катоде должно выделиться 12,153 г магния. (Атомная масса магния равна 24,305 г/моль.) Как и в примере 1, на аноде окислится 1 моль ионов Сl— и выделится половина моля, т.е. 35,453 г, газообразного Сl2.
Пример 3. Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы Аl3 +. Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг металла.
Решение: 1 кг алюминия содержит 1000 г / 26,98 г·моль-1 = 37,06 моля атомов. Поскольку на выделение каждого атома алюминия необходимо 3 электрона, на 37,06 моля атомов потребуется 3·37,06 = 111,2 моля электронов. Это количество электричества эквивалентно 111,2F, или 10 730 000 Кл.
Надеюсь урок 9 «Ионы в водном растворе» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к уроку 10 «Ионы в газе».
himi4ka.ru
Растворимость хлористого натрия — Справочник химика 21
Прежде всего необходимо, чтобы существовало достаточно большое различие между растворимостью вещества в данном растворителе при нагревании и на холоду. Следует отметить, что иногда это различие является незначительным, вследствие чего для достижения желаемого результата приходится испарять часть растворителя. В неорганической химии примером этого рода является растворимость хлористого натрия в воде (26,2% при 0° и 28,2% при 100°). Однако в некоторых случаях слишком большое различие в растворимости при различных температурах также не оказывается полезным фактором. Так, при применении высококипящих алифатических углеводородов или их смесей, например лигроина или керосина, обладающих, как правило, плохой растворяющей способностью при низкой температуре, в процессе перекристаллизации вместе с веществами могут выпадать в осадок и все примеси. [c.52]Возможность осуществления этого процесса основана на соотношении совместной растворимости перхлората аммония и хлористого натрия, которое позволяет разделить продукты реакции фракционированной кристаллизацией. Данные о их взаимной растворимости графически представлены на рис. 11 для трех температур. Растворимость хлористого натрия изменяется незначительно с изменением температуры, в то время как растворимость перхлората аммония при совместном присутствии зависит от температуры. Таким образом, при охлаждении насыщенного раствора в качестве примеси к перхлорату аммония осаждается лишь немного хлористого натрия. Далее при добавлении небольшого количества воДы к раствору система может быть на- [c.97]
Здесь следует помнить, что растворимость хлористого натрия в воде с повышением температуры возрастает незначительно (в 100 мл воды при 25° С растворяется 36,1 г, при 100° С—39,6 г). Поэтому нет необходимости перед очистной фильтрацией нагревать раствор до кипения, фильтровать его можно на обычной химической воронке (без обогрева). Нужно показать учащимся приемы подготовки бумажного фильтра и вкладывания его в воронку и обратить их внимание на детали работы, обеспечивающие успешную фильтрацию. Раствор в воронку следует приливать по стеклянной палочке, уровень жидкости в воронке должен быть ниже рая бумажного фильтра, носик воронки должен касаться стенки стакана или колбы — приемника фильтрата. [c.37]
Растворимость азотнокислого бария в пределах от О до 100° С увеличилась почти в семь раз, растворимость хлористого натрия увеличилась только на 10%, а растворимость углекислого лития уменьшилась примерно в два раза. [c.215]
На рис. XVI- показаны кривые растворимости водных растворов различных солей в зависимости от температуры. Как видно из рисунка, наиболее резко возрастающей положительной растворимостью обладает азотнокислый калий (линия /—/), меньше изменяется с повышением температуры растворимость хлористого калия (линия 2—2) и почти не изменяется растворимость хлористого натрия (линия 3— [c.633]
Растворимость хлористого натрия в воде при различных температурах приведена в табл. 29. [c.255]
Растворимость хлористого натрия в воде [c.255]
Так, если растворимость хлористого натрия при 20° равна 36, то это означает, что при 20° в 100 г воды может раствориться 36 г соли. [c.51]
Растворимость твердых веществ всегда ограничена. Взятое количество жидкости способно растворить только определенное количество твердого вещества. По растворимости в воде твердые вещества делятся на растворимые (хлористый натрий, сахароза и т. д.), малорастворимые (хлористый свинец, гидроокись кальция и т. д.) и практически нерастворимые (сернокислый барий, углекислый кальций и т. д.). [c.64]
Производство хлористого калия методом галургии. Выделение КС1 из сильвинита основано на том, что растворимость хлористого калия с повышением температуры значительно возрастает, тогда как растворимость хлористого натрия почти не изменяется. [c.580]
Растворимость хлористого натрия, вес. 7о [c.18]
Растворимость хлористого натрия, вес. /о [c.18]
Содержание тяжелой воды в растворителе, вес. доля Растворимость хлористого натрия, г/100 г воды [c.83]
Растворимость хлористого натрия в водном растворе серной кислоты, г/л [c.418]
Растворимость хлористого натрия, г/1000 г растворителя [c.1665]
Состав растворителя, вес. 7 Содержание хлористого водорода, г/1000 г растворителя Растворимость хлористого натрия, г/1000 г растворителя Состав растворителя, вес. 7о Содержание хлористого водорода, г/1000 г растворителя Растворимость хлористого натрия, г/1000 г растворителя [c.1666]
| Рис. 5-1. Растворимость хлористого натрия в водно-аммиачных растворах при 20, 35 и 60 С. |
www.chem21.info
Растворимость соли в воде: как происходит?
Вода – одно из главных химических соединений на нашей планете. К одному из самых интересных её свойств относится способность образовывать водные растворы. А во многих сферах науки и техники растворимость соли в воде играет немаловажную роль.
Что такое растворимость
Под растворимостью понимают способность различных веществ образовывать с жидкостями – растворителями – однородные (гомогенные) смеси. Именно объём материала, который используется для растворения и образования насыщенного раствора, обуславливает его растворимость, сопоставимую с массовой долей этого вещества или его количеством в концентрированном растворе.
По способности растворяться соли классифицируются следующим образом:
- к растворимым относятся вещества, которые можно растворить в 100 г воды больше 10 г;
- к малорастворимым принадлежат те, количество которых в растворителе не превышает 1 г;
- концентрация нерастворимых в 100 г воды меньше 0,01.
В том случае, когда полярность вещества, используемого для растворения, аналогична полярности растворителя, оно является растворимым. При разных полярностях, скорее всего, развести вещество не представляется возможным.

Как происходит растворение
Если говорить о том, растворяется ли соль в воде, то для большинства солей это справедливое утверждение. Существует специальная таблица, в соответствии с которой можно точно определить величину растворимости. Так как вода – универсальный растворитель, она хорошо смешивается с другими жидкостями, газами, кислотами и солями.
Один из самых наглядных примеров растворения твёрдого вещества в воде можно наблюдать практически каждый день на кухне, во время приготовления блюд с использованием поваренной соли. Так почему соль растворяется в воде?
Из школьного курса химии многие помнят, что молекулы воды и соли являются полярными. Это означает, что их электрические полюса противоположны, что обусловливает высокую диэлектрическую проницаемость. Молекулы воды окружают ионы другого вещества, например, как в рассматриваемом нами случае, NaCl. При этом образуется жидкость, являющаяся однородной по своей консистенции.
Влияние температуры
Существуют некоторые факторы, оказывающие влияние на растворимость солей. В первую очередь это температура растворителя. Чем она выше, тем большим является значение коэффициента диффузии частичек в жидкости, а массообмен происходит быстрее.
Хотя, например, растворимость в воде поваренной соли(NaCl) от температуры практически не зависит, поскольку коэффициент её растворимости – 35,8 при t 20° С и 38,0 при 78° С. А вот сульфат меди (CaSO4) при повышении температуры воды растворяется хуже.
К другим факторам, которые влияют на растворимость, относятся:
- Размер растворяемых частиц – при большей площади разделения фаз растворение происходит быстрее.
- Процесс перемешивания, который при интенсивном выполнении способствует более эффективному массообмену.
- Наличие примесей: одни ускоряют процесс растворения, а другие, затрудняя диффузию, снижают скорость протекания процесса.
Видео про механизм растворения соли
vseowode.ru
Поваренная соль растворимость в воде
Выполнение работы. Провести определение эквивалента карбоната натрия по известному эквиваленту диоксида углерода. Наполнить кристаллизатор 1 (рис. 29) на половину его объема насыщенным раствором поваренной соли, в котором растворимость диоксида углерода меньше, чем в воде. Тем же раствором наполнить вровень с краями мерный цилиндр 2 вместимостью 100 мл и закрыть его стеклянной пластинкой, надвигая последнюю скользящим движением. Перевернуть цилиндр вверх дном и опустить в кристаллизатор. Удалить под раствором стеклянную пластинку и закрепить цилиндр в лапке штатива так, чтобы края цилиндра были ниже уровня раствора в кристаллизаторе, следя за тем, чтобы в цилиндр не попал воздух. [c.37]Природные растворимые соли встречаются в виде солевых залежей или естественных растворов (рассолы, рапы) озер, морей и подземных источников. Основные составляющие солевых залежей или рапы соляных озер хлорид натрия, сульфат натрия, хлориды и сульфаты калия, магния и кальция, соли брома, бора, карбонаты (природная сода). Советский Союз обладает мощными месторождениями ряда природных солей. В СССР имеется более половины разведанных мировых запасов калийных солей (60%) и огромные ресурсы природного и коксового газа для получения азотнокислых и аммиачных солей (азотных удобрений). В СССР есть большое количество соляных озер, рапа которых служит источником для получения солей натрия, магния, кальция, а также соединений брома, бора и др. Основными методами эксплуатацни твердых солевых отложений являются горные разработки в копях и подземное выщелачивание. Добычу соли в копях ведут открытым или подземным способом в зависимости от глубины залегания пласта. Таким путем добывают каменную соль, сульфат натрия (тенардит), природные соли калия и магния (сильвинит, карналлит) и т. д. Подземное выщелачивание является способом добычи солей (главным образом поваренной соли) в виде рассола. Этот метод удобен, когда поваренная соль должна применяться в растворенном виде — для производства кальцинированной соды, хлора и едкого натра и т. п. Подземное выщелачивание ведут, размывая пласт водой, накачиваемой в него через буровые скважины. Естественные рассолы образуются в результате растворения пластов соли подпочвенными водами. Добыча естественных рассолов производится откачиванием через буровые скважины при помощи глубинных насосов или сжатого воздуха (эрлифт). Естественные растворы поваренной соли, используемые как сырье для содовых и хлорных заводов, донасыщают каменной солью в резервуарах-сатураторах и подвергают очистке. Иногда естественные рассолы [c.140]
В зависимости от концентрации едкого натра эта реакция протекает с различной скоростью, причем образуются легко растворимые в воде соли сульфокислот и поваренная соль [c.383]
В настоящее время наибольшее значение имеет способ получения соды методом Сольве. Метод основан на образовании сравнительно трудно растворимого в воде бикарбоната натрия, который может быть получен при взаимодействии поваренной соли с растворимым гидрокарбонатом [c.98]
Концентрация насыщенных растворов чаще всего выражается в граммах вещества на 100 г растворителя. Растворимость при данных условиях в определенном растворителе является важной характеристикой вещества и приводится в химических справочниках. Например, растворимость поваренной соли Na l при 20°С составляет 36 г на 100 г воды, нитрата натрия NaNOj при тех же условиях — 88 г на 100 г воды. Растворимость некоторых соединений приведена в табл. 4. [c.109]
Атмофильные элементы — это кислород, азот, инертные газы (от гелия до ксенона). Гидрофильные элементы образуют соединения, растворимые в воде и поэтому содержащиеся в гидросфере Земли — в морях, океанах, реках, озерах главным образом поваренную соль (т. е. элементы натрий и хлор), соли калия, магния, кальция. Таким образом, часть гидрофильных элементов являются одновременно и литофильными. Это, как правило, элементы, проявляющие в своих соединениях невысокую степень окисления -1-1, +2, реже +3. [c.236]
При увлажнении щихты только водой образовывались очень непрочные гранулы, которые легко разрушались. Известно, что при введении в шихту различных добавок (например, извести, глины) прочность гранул повышается. В наших условиях введение значительных количеств глины нежелательно, так как приводит к снижению температур деформации и плавления шихты. Испытаны различные добавки, повышающие прочность гранул. В качестве увлажняющих растворов применялись растворы соды, поваренной соли, растворимого стекла, серной, фосфорной и кремнефтористоводородной кислот и сульфитно-спиртовой барды. [c.131]
Итак, в водных и неводных растворах одних и тех же исходных соединений взаимодействуют различные вещества, дающие продукты реакции с различными свойствами. Более того, исключительное своеобразие физико-химических свойств воды обусловливает и своеобразие химических свойств растворенных в ней соединений. Куда уж больше оказывается, что реакция между Ag + и С1 в воде приводит к образованию — подумать только — нерастворимого соединения АдС1. И что уж совсем удивительно хлористый натрий, поваренная соль, в воде превосходно растворима [c.82]
При содержании в воде электролитов (солей, кислот, оснований) ее растворяющая способность по отношению к неэлектролитам изменяется иногда она увеличивается, но в большинстве случаев становится меньше. Например, при добавлении к прозрачному раствору желатины обычной поваренной соли происходит помутнение раствора за счет уменьшения растворимости белка. Это явление называют высаливанием, а противоположное ему по эффекту — всаливание м. [c.218]
М. Г. Кучеров позаботился о том, чтобы при массовых анализах аналитики имели дело со спиртовыми жидкостями с одним и тем же содержанием винного спирта. Опытным путем он установил, что при 60%-ном содержании винного спирта, благодаря значительному количеству в нем воды, создаются условия для ограниченной растворимости высших спиртов, входящих в сивушное масло. Прибавлением электролита — насыщенного при комнатной температуре раствора поваренной соли — растворимость сивушного масла могла быть значительно понижена, но при этом нельзя было не считаться с наступлением кристаллизации соли, что мешало бы проведению количественных определений сивушного масла. Снова опытным путем Кучеров показал, что кристаллизации соли никогда не наблюдается при условии смешения одного объема 60%-ного спирта с 3—3,5 объемами насыщенного при 15° С раствора поваренной соли. [c.74]
К физическим методам относится и замещение рас-, творителя в насыщенном растворе. Например, поваренная соль растворима в этиловом спирте, но нерастворима в эфире. Если небольшое количество спиртового раствора соли вылить в большой объем эфира, фактическим растворителем становится эфир (спирт и эфир смешиваются). Полученный
www.chem21.info
Натрий растворимость в воде — Справочник химика 21
Сравните качественно следующие свойства бензойной кислоты и бензоата натрия растворимость в воде, летучесть, температуры плавления, степень ионизации в водном растворе, кислотность и основность. [c.184]Гидроксид калия и гидроксид натрия растворимы в воде. Водный раствор гидроксида натрия иногда называют едкий натр, а водный раствор гидроксида калия-едкое кали. [c.109]
Аммонийные соли и соли щелочных металлов карбоновых кислот (калия, натрия) растворимы в воде, но не растворимы в неполярных растворителях большинство солей тяжелых металлов (железа, серебра, меди и т. д.) в воде не растворимы. [c.555]
Сернистые красители. Подобно кубовым, нерастворимы в воде. Их перед крашением также восстанавливают в лейкосоединения, однако, в отличие от кубовых, в качестве восстановителя применяют сульфид натрия. Растворимые в воде лейкосоединения сернистых красителей адсорбируются целлюлозными волокнами, затем при окислении воздухом в порах волокна опять образуются нерастворимые в воде сернистые красители. [c.248]
Образовавшаяся соль — резинат натрия — растворима в воде и называется канифольным мылом. Кальциевое канифольное мыло в воде нерастворимо. [c.188]
О. натрия. Группа ортофосфатов, включающая среднюю и кислые соли ортофосфорной кислоты и гидроксида натрия растворимые в воде кристаллические вещества применяются как компоненты детергентов, умягчители воды и др. [c.298]
Для хлорида натрия растворимость в воде с температурой повышается незначительно растворимость при 100° С превышает растворимость при 0° С в [c.186]
При нагревании жиров со щелочами выделяются не свободные кислоты, а их соли—мыла мыла получаются твердые, если применялся едкий натр, и жидкие, если процесс вели с едким кали. Соли калия и натрия растворимы в воде, соли других металлов нерастворимы. [c.403]
О солях натрия и калия рассказано при описании соответствующих кислот. Почти все соли калия и натрия растворимы в воде. [c.288]
Щелочное стекло содержит окись натрия, растворимую в воде. Когда имеют дело с обычными объемными образцами стекла, это вымывание незначительно и поэтому незаметно. Однако, превращаясь в стеклянную нить, стекло в тысячи раз увеличивает свою поверхность. Например, из [c.234]
Первая стадия — разложение — в распространенных схемах имеет целью перевести вольфрам в вольфрамат натрия, растворимый в воде, или в вольфрамовую кислоту, легко растворимую в растворе аммиака. При переходе в эти соединения вольфрам сразу отделяется от ряда примесей. В растворе возможна дальнейшая очистка вольфрама избирательным осаждением. Применяются и другие методы вскрытия минерала и очистка вольфрамовых соединений, основанные на использовании других свойств — летучести, адсорбции, комплексообразования. К ним относятся хлорирование, образование карбонилов, экстракция органическими растворителями, ионный обмен. Но эти методы не вышли за рамки лабораторных исследований (см. ниже). [c.579]
Атомные веса щелочных металлов лития — 7, натрия — 23, калия—39, рубидия — 85 и цезия —133 показывают, что здесь, как и в ряду галоидов, можно расположить элементы по величине атомного веса, чтобы судить об относительных свойствах сходственных соединений тел этой группы. Так, напр., двойные хлороплатиновые соли лития и натрия растворимы в воде для калия, рубидия и цезия мало растворимы, и чем выше пай металла, тем менее растворима соль, В других случаях замечается обратное чем выше пай, тем легче растворима соответственная соль. Даже в самих металлах ясно проявляется последовательность в изменении свойств, сообразно с изменением атомных весов так, литий трудно перегоняется, а натрий уже получается при посредстве перегонки калий легче перегоняется, чем натрий, а рубидий и цезий еще более летучи. [c.44]
Однако эта реакция отличается от предыдущей одна из новых солей (азотнокислый натрий) растворима в воде, а другая (хлористое серебро) практически нерастворима и выделяется из раствора в виде осадка. Такая реакция дойдет до конца, т. е. одно из веществ будет полностью израсходовано. [c.78]
Алюминаты калия и натрия растворимы в воде. Если к раствору соли алюминия прилить избыток раствора щелочи, то образующийся вначале осадок гидроокиси алюминия растворится вследствие образования растворимого алюмината (так же, как и осадок гидроокиси цинка, растворяется при добавлении щелочи). [c.282]
Опыт 87. а) Фенол образует с гидроксидом натрия растворимые в воде феноляты. При действии на них серной кислоты происходит разложение фенолята и выделение малорастворимого в воде фенола [c.279]
Метаванадат закиси железа Fe(V0a)2 получают действием соли закиси железа на раствор метаванадата калия. Легко растворяется в соляной кислоте, мало — в воде и растворах хлорида натрия. Растворимость в воде— 1,8 г в 100 мл при 100°. [c.240]
Абсолютное большинство солей натрия растворимо в воде. [c.35]
Бесцветное кристаллическое вещество т. пл. 137,5 °С. Образует эвтектическую смесь с о-толуолсульфамидом (61,15% п-изомера и 39,85% о-изомера) с т. пл. 110,4 °С. Кристаллизуется с 2 молекулами воды, т. пл. кристаллогидрата 105 °С. Растворим в спирте и водном растворе едкого натра. Растворимость в воде [c.464]
Осадок после фильтрования не промывают, так как хлориды калия и натрия растворимы в воде. Выход солей в сухом виде определяют по содержанию воды во влажном осадке и в соответствии с составом раствора определяют количество солей, находящихся в растворе, удерживаемом осадкам. По разности между весом влажного осадка и весом раствора вычисляют количество соли 3 осадке. Возможно также определить абсолютный выход солей, пользуясь промывкой осадка спиртом и последующей сушкой его. [c.307]
Основные химические свойства натрия характеризуются тем, что он во всех соединениях проявляет валентность равную + I. Подавляющее большинство солей натрия растворимо в воде. Гидрат окиси натрия является щелочью. [c.28]
Для разделения бензальдегида и толуола пользуются свойством альдегидов давать с бисульфитом натрия растворимые в воде бисульфитные соединения. [c.84]
Фториды калия и натрия растворимы в воде, поэтому реакция образовании мпл0раств0рим010 LIF можеп быть использована для обнаружения ионов Li+ в присутствии ионов Na+ и К . Из катионов I аналитической группы реакции обнаружения ионов Li
www.chem21.info
Растворимость в воде хлоридов — Справочник химика 21
Действительно, если взять любой растворимый в воде хлорид и добавить к раствору нитрат серебра АдЫОз, то всегда будет выпадать один и тот же осадок очень мало растворимого хлорида серебра. [c.188]В воде, а также в составе механических примесей, сопровождающих нефть, содержится значительное количество хлористых солей. В некоторых нефтях содержание хлоридов доходит до 4000—5000 мг/л. Растворимые в воде хлориды кальция и магния гидролизуются, т. е. в водном растворе разлагаются по уравнениям [c.15]
Аналогично, но при более высоких температурах гидролизуются соли кальция и натрия. Скорость гидролиза увеличивается с повышением температуры. При 343°С гидролизу подвергается 90% хлорида магния. Даже небольшое количество образовавшегося хлористого водорода при наличии сероводорода, который появляется при переработке сернистого сырья, резко интенсифицирует коррозионное разрушение металла печных труб. Это объясняется реакциями между железом, сероводородом и хлористым водородом. На железе образуется пленка сернистого железа, которая разрушается хлористым водородом с образованием растворимого в воде хлорида железа и сероводорода [c.147]
В основу этого метода анализа положена малая растворимость в воде хлоридов, сульфатов и гидроксидов ряда катионов. [c.133]
Подгруппа хлоридов включает одновалентные медь, серебро, золото, таллий, двухвалентный свинец, выделяемые в виде плохо растворимых в воде хлоридов. Подгруппа сульфидов основного характера включает сульфиды меди (II), кадмия (II), олова (И), висмута (III). В этой же группе могут быть выделены технеции (IV), рутений (И1), родий (III), палладий (И). [c.31]
Растворимы в воде хлориды, бромиды, нитриты, нитраты, ацетаты, сульфаты, а также иодиды железа (11) и (111), алюминия, хрома, бария, стронция, кальция, марганца, магния и хроматы алюминия и железа. [c.36]
Какие же это реакции Во-первых, это реакции солеобразования с различными кислотами, которые в зависимости от вида кислоты могут образовывать либо соли с хорошей растворимостью в воде (хлориды, ацетаты), что и используется для извлечения алкалоидов из растений, либо окрашенные [c.250]
При выпаривании насыщенного при 20 °С водного раствора хлорида натрия массой 200 г получена соль, масса которой 52,64 г. Какова растворимость в воде хлорида натрия при 20 °С [c.167]
Обладая хорошей растворимостью в воде, хлориды присутствуют во всех водах. Больше всего они содержатся в морской воде (до 3%) и придают ей горько-соленый вкус. Соленость способствует процессам коррозии. [c.317]
Серебристо-белый металл, плотность 3,76 т. пл. 710 °С т. кип. 1640 °С. Наиболее ядовиты хорошо растворимые в воде хлорид, нитрат и сульфат, а также гидроксид бария плохо растворимый в воде карбонат менее ядовит. В малых концентрациях соли бария довольно стабильны в воде, в больших (более 100 мг ) под влиянием сульфатов, содержащихся в природной воде, частично выпадают в осадок. [c.33]
Многие минералы обладают повышенной гигроскопичностью— способностью поглощать пары воды из окружающей -среды. Она определяется конституцией минерала и его удельной поверхностью (поверхностью, приходящейся на единицу объема). Наибольшую гигроскопичность имеют минералы, как Правило, хорошо растворимые в воде хлориды (галит, сильвин, 118 [c.118]
Все бораты (производные бора), кроме боратов щелочных элементов, мало растворимы в воде. Иэ солей А1, Ga, 1п и Т1 » хорощо растворимы в воде хлориды, сульфаты и нитраты, мало растворимы — фториды и ортофосфаты. Карбонаты этих же злементов малоустойчивы и при комнатной температуре разлагаются на оксид соответствующего металла и диоксид углерода, а при попытке их получения по реакции обмена в водном растворе [c.301]
Серебристо-белый металл плотность 6,45(а) т. пл. 1855 °С т. кип. 4340 °С растворимы в воде хлорид, нитрат и сульфат циркония. [c.150]
Рубидий и цезий, как и другие щелочные металлы, образуют растворимые в воде хлориды, нитраты, сульфаты, карбонаты, хроматы, оксалаты и фосфаты. По аналитическим реакциям осаждения рубидий и цезий обнаруживают весьма большое сходство с калием. [c.566]
Ко второй подгруппе принадлежат ионы u» +, d++, Bi + » и Hg- — , образующие растворимые в воде хлориды. [c.243]
Хлоргидраты многих органических оснований ведут себя аналогично хлориду аммония, т. е. их можно кратковременно нагревать до температуры испарения водной соляной кислоты (120°) без разложения. Находящийся в остатке после выпаривания растворимый в воде хлорид можно затем открыть, прибавляя к нему нитрат серебра. [c.149]
Для извлечения меди из огарков сернокислотных заводов и из медных сульфидных руд часто используют хлорирующий обжиг [5, 6]. В результате хлорирующего обжига медь из сульфидной формы переводят в растворимый в воде хлорид. [c.57]
Второй вариант этого метода анализа основан на малой растворимости в воде хлоридов, сульфатов и гидроксидов ряда катионов. По этому варианту все катионы могут быть разделены на пять аналитических групп. [c.133]
Главными реактивами, последовательно применяемыми для деления катионов на группы, являются хлористоводородная кислота, тиоацетамид при различных значениях pH среды и карбонат аммония. Классификация катионов в этом методе аналогична классификации в сероводородном методе и основана на малой растворимости в воде хлоридов, сульфидов и карбонатов. В связи с этим катионы делят на пять аналитических групп. [c.143]
В качестве катализаторов при получении галоидалкилов из спиртов применяют концентрированную серную кислоту, хлористый магний или хлористый цинк. Можно применять также хлористое железо и другие не растворимые в воде хлориды многовалентных металлов от хрома до висмута, как, например, олова или м
www.chem21.info
