Анализ кала на дисбактериоз
Главная \ 3. Пробиотики \ Дисбактериоз (дисбиоз) \ Анализы на дисбактериоз
Анализ кала на дисбактериоз
Содержание: | |
Нормы анализа кала на дисбиоз | Энтерококки |
Бифидобактерии | Стафилококки |
Лактобактерии | Клостридии |
Эшерихии (E.coli типичные) | Кандида |
Бактероиды | Анализ кала на патогенную флору |
Пептострептококки | Часто задаваемые вопросы |
Представлены обобщенные сведения о традиционном микробиологическом анализе кала культурально-зависимым способом (бакпосевом).
О новых методиках анализа кишечной микробиоты информация ниже.
Анализ кала на дисбактериоз
Данное исследование позволяет определить содержание бактерий в толстом кишечнике. В кишечнике человека содержится огромное количество бактерий, которые активно участвуют в переваривании и усвоении питательных веществ. Анализ кала на дисбактериоз назначается по большей части детям, в таких случаях, когда имеются следующие нарушения работы кишечника: диарея, запор, боли в животе, метеоризм, а также после длительного лечения антибиотиками (антибиотики помимо того, что борются с инфекциями, уничтожают и нормальные бактерии кишечника). Существую три группы бактерий кишечника – «нормальные» бактерии (бифидобактерии, лактобактерии и эшерихии) они активно участвуют в работе кишечника, условно-патогенные бактерии (энтерококки, стафилококки, клостридии, кандиды) при определенных обстоятельствах могут превратиться в патогенные бактерии и вызвать различные заболевания, и патогенные бактерии (шигелла, сальмонелла) которые при попадании в кишечник вызывают серьезные инфекционные заболевания кишечника.
В кишечнике человека содержится огромное количество бактерий, которые активно участвуют в переваривании и усвоении питательных веществ. Анализ кала на дисбактериоз назначается по большей части детям, в таких случаях, когда имеются следующие нарушения работы кишечника: диарея, запор, боли в животе, метеоризм, а также после длительного лечения антибиотиками (антибиотики помимо того, что борются с инфекциями, уничтожают и нормальные бактерии кишечника). Существую три группы бактерий кишечника – «нормальные» бактерии (бифидобактерии, лактобактерии и эшерихии) они активно участвуют в работе кишечника, условно-патогенные бактерии (энтерококки, стафилококки, клостридии, кандиды) при определенных обстоятельствах могут превратиться в патогенные бактерии и вызвать различные заболевания, и патогенные бактерии (шигелла, сальмонелла) которые при попадании в кишечник вызывают серьезные инфекционные заболевания кишечника.
(КОЕ / г фекалий)
| Дети до 1 года | Дети старшего возраста | Взрослые |
Бифидобактерии | 1010 – 1011 | 109 – 1010 | 108 – 1010 |
Лактобактерии | 106 – 107 | 107 – 108 | 106 – 108 |
Эшерихии | 106 – 107 | 107 – 108 | 106 – 108 |
Бактероиды | 107 – 10 | 107 – 108 | 107 – 108 |
Пептострептококки | 103 – 105 | 105 – 106 | 105 – 106 |
Энтерококки | 105 – 107 | 105 – 108 | 105 – 108 |
Сапрофитные стафилококки | ≤104 | ≤104 | ≤104 |
Патогенные стафилококки | — | — | — |
Клостридии | ≤103 | ≤105 | ≤105 |
Кандида | ≤103 | ≤104 | ≤104 |
Патогенные энтеробактерии | — | — | — |
Бифидобактерии
Норма бифидобактерий
Дети до 1 года | 1010 – 1011 |
Дети старшего возраста | 109 – 1010 |
Взрослые | 108 – 1010 |
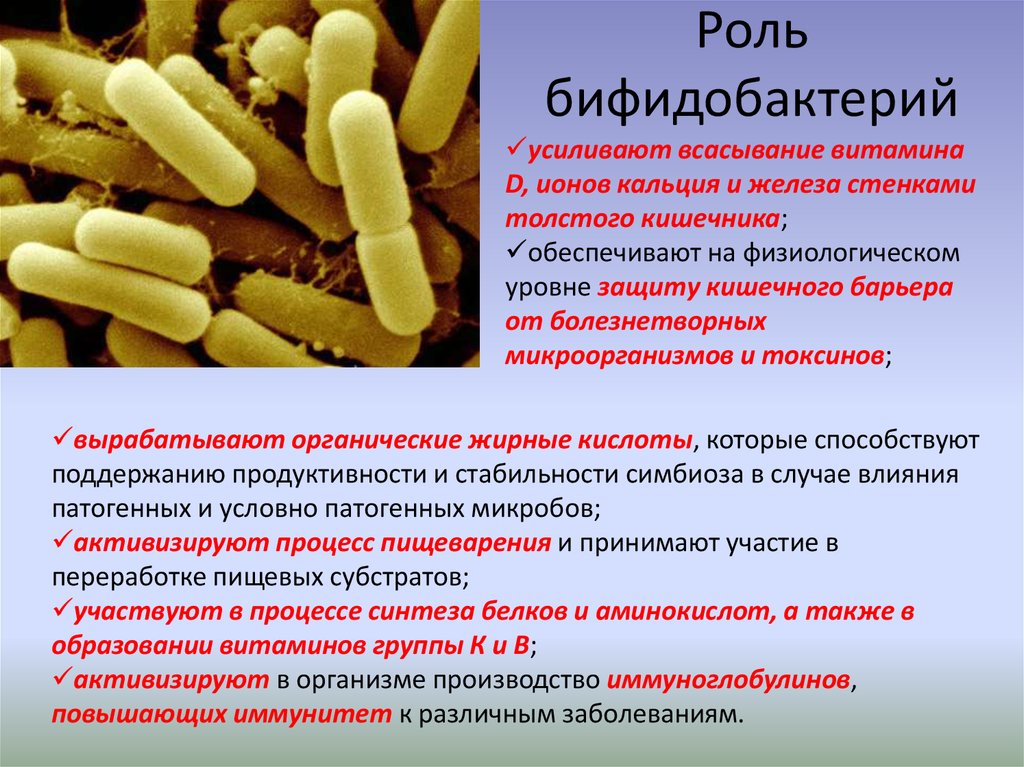
Около 95% всех бактерий в кишечнике – бифидобактерии. Бифидобактерии участвуют в производстве таких витаминов как В1, В2, В3, В5, В6, В12,К. Помогают всасыванию витамина D, при помощи специальных вырабатываемых ими веществ борются с «плохими» батериями, а также участвуют в усилении иммунитета.
Бифидобактерии участвуют в производстве таких витаминов как В1, В2, В3, В5, В6, В12,К. Помогают всасыванию витамина D, при помощи специальных вырабатываемых ими веществ борются с «плохими» батериями, а также участвуют в усилении иммунитета.
Причины снижения количества бифидобактерий
- Медикаментозное лечение (антибиотики, нестероидные противовоспалительные средства (НПВС) такие как анальгин, аспирин, слабительные средства)
- Неправильное питание (избыток жиров или белков или углеводов, голодание, неправильный режим питания, искусственное вскармливание)
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
- Ферментопатии (целиакия, лактазная недостаточность)
- Хронические заболевания ЖКТ (хронический гастрит, панкреатит, холецистит, язвенная болезнь желудка или двенадцатиперстной кишки)
- Иммунные заболевания (иммунные дефициты, аллергии)
- Смена климатических зон
- Стресс
Лактобактерии
Норма лактобактерий
Дети до 1 года | 106 – 107 |
Дети старшего возраста | 107 – 108 |
Взрослые | 106 – 108 |
Лактобактерии занимают около 4-6% от общей массы бактерий кишечника. Лактобактерии являются не менее полезными, чем бифидобактерии. Их роль в организме следующая: поддержка уровня pH в кишечнике, производство большого количества веществ (молочная кислота, уксусная кислота, перекись водорода, лактоцидин, ацидофилин), которые активно используются для уничтожения патогенных микроорганизмов, а также вырабатывают лактазу.
Лактобактерии являются не менее полезными, чем бифидобактерии. Их роль в организме следующая: поддержка уровня pH в кишечнике, производство большого количества веществ (молочная кислота, уксусная кислота, перекись водорода, лактоцидин, ацидофилин), которые активно используются для уничтожения патогенных микроорганизмов, а также вырабатывают лактазу.
Причины снижения количества лактобактерий
- Медикаментозное лечение (антибиотики, нестероидные противовоспалительные средства (НПВС) такие как анальгин, аспирин, слабительные средства)
- Неправильное питание (избыток жиров или белков или углеводов, голодание, неправильный режим питания, искусственное вскармливание)
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
- Стресс
Эшерихии (E.coli типичные)
Норма эшерихий
Дети до 1 года | 107 – 108 |
Дети старшего возраста | 107 – 108 |
Взрослые | 107 – 108 |
Эшерихии появляются в организме человека с рождения и присутствуют в нем на протяжении всей жизни.
Причины снижения количества эшерихий
- Гельминтозы
- Лечение антибиотиками
- Неправильное питание (избыток жиров или белков или углеводов, голодание, неправильный режим питания, искусственное вскармливание)
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
Бактероиды
Норма бактероидов в кале
Дети до 1 года | 107 – 108 |
Дети старшего возраста | 107 – 108 |
Взрослые | 107 – 108 |
Бактероиды участвуют в пищеварении, а именно в переработке жиров в организме.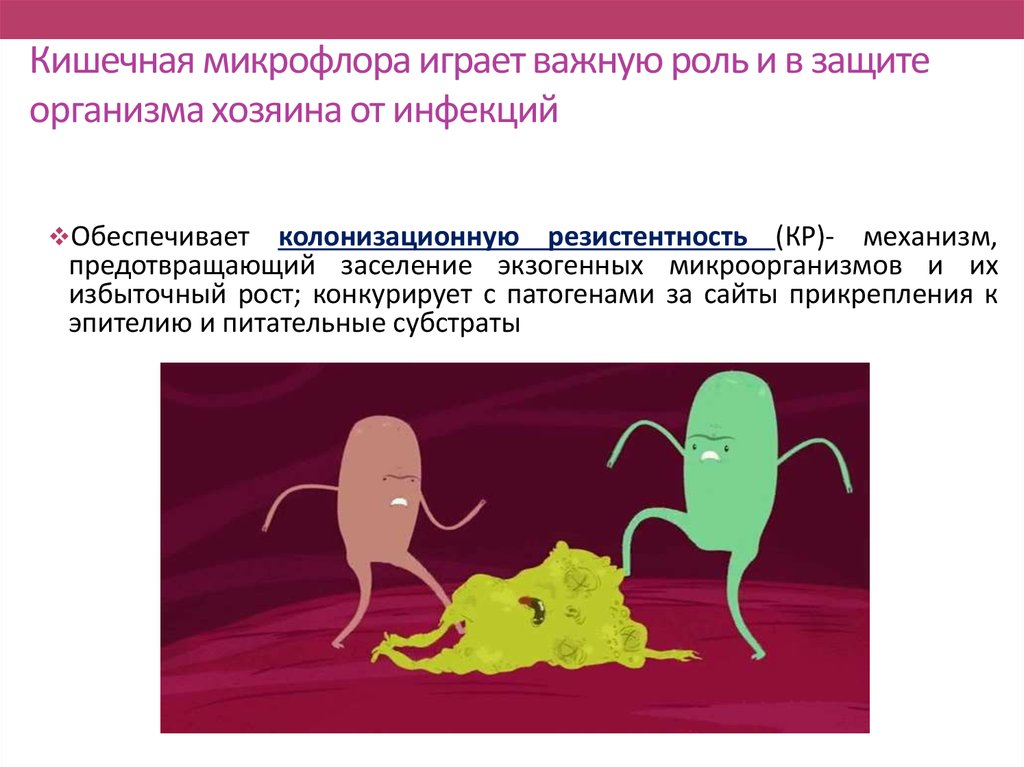 У детей до 6 месяцев в анализах кала не обнаруживаются, их можно обнаружить, начиная с возраста 8-9 месяцев.
У детей до 6 месяцев в анализах кала не обнаруживаются, их можно обнаружить, начиная с возраста 8-9 месяцев.
Причины увеличения содержания бактероидов
- Жировая диета (употребление большого количества жиров в пищу)
- Лечение антибиотиками
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
Причины снижения содержания бактероидов
- Лечение антибиотиками
- Кишечные инфекции (дизентерия, сальмонеллез, вирусные инфекции)
Пептострептококки
Нормальное количество в кале
Дети до 1 года | 103 – 105 |
Дети старшего возраста | 105 – 106 |
Взрослые | 105 – 106 |
В норме пептострептококки живут в толстом кишечнике, при увеличении их количества и попадании в любую другую область нашего организма, они вызывают воспалительные заболевания. Участвуют в переработке углеводов и молочных белков. Вырабатывают водород, который в кишечнике превращается в перекись водорода и помогает контролировать рН в кишечнике.
Участвуют в переработке углеводов и молочных белков. Вырабатывают водород, который в кишечнике превращается в перекись водорода и помогает контролировать рН в кишечнике.
Причины увеличения содержания пептострептококков
- Употребление большого количества углеводов
- Кишечные инфекции
- Хронические заболевания ЖКТ
Энтерококки
Норма энтерококков
Дети до 1 года | 105 – 107 |
Дети старшего возраста | 105 – 108 |
Взрослые | 105 – 108 |
Энтерококки участвуют в переработке углеводов, в производстве витаминов, а также играют роль в создании местного иммунитета (в кишечнике). Количество энтерококков не должно превышать количество кишечных палочек, если их количество увеличивается, они могут вызвать ряд заболеваний.
Причины увеличения содержания энтерококков
- Снижение иммунитета, иммунные заболевания
- Пищевые аллергии
- Гельминтозы
- Лечение антибиотиками (в случае резистентности энтерококков к применяемому антибиотику)
- Неправильное питание
- Снижение количества кишечной палочки (эшерихии)
Стафилококки (сапрофитные стафилококки и патогенные стафилококки)
Норма сапрофитных стафилококков
Дети до 1 года | ≤104 |
Дети старшего возраста | ≤104 |
Взрослые | ≤104 |
Норма патогенных стафилококков
Дети до 1 года | — |
Дети старшего возраста | — |
Взрослые | — |
Стафилококки делятся на патогенные и непатогенные. К патогенным относятся: золотистый, гемолитический и плазмокоагулирующий, наиболее опасен золотистый. К непатогенным стафилококкам относятся негемолитический и эпидермальный.
К патогенным относятся: золотистый, гемолитический и плазмокоагулирующий, наиболее опасен золотистый. К непатогенным стафилококкам относятся негемолитический и эпидермальный.
Стафилококк не относится к нормальной микрофлоре кишечника, он попадает в организм из внешней среды вместе с пищей. Золотистый стафилококк, попадая в ЖКТ, обычно, вызывает токсические инфекции.
Причины появления стафилококка
Стафилококк может попасть в организм человека разными путями, начиная грязными руками, вместе с продуктами питания и заканчивая внутрибольничными инфекциями.
Клостридии
Норма клостридий
Дети до 1 года | ≤103 |
Дети старшего возраста | ≤105 |
Взрослые | ≤105 |
Клостридии участвуют в переработке белков, продуктом их переработки являются такие вещества как индол и скатол, которые по сути являются ядовитыми веществами, однако в небольших количествах эти вещества стимулируют перистальтику кишечника тем самым улучшая функцию эвакуации каловых масс. Однако при увеличении количества клостридий в кишечнике вырабатывается большее количество индола и скатола, что может привести к развитию такого заболевания как гнилостная диспепсия.
Однако при увеличении количества клостридий в кишечнике вырабатывается большее количество индола и скатола, что может привести к развитию такого заболевания как гнилостная диспепсия.
Причины увеличения количества клостридий
- Большое количество белка употребляемого в пищу
Кандида
Норма кандид
Дети до 1 года | ≤103 |
Дети старшего возраста | ≤104 |
Взрослые | ≤104 |
При увеличении количества кандид в кишечнике может развиться бродильная диспепсия, а также заметное увеличение количества кандид может спровоцировать развитие различных видов кандидоза.
Причины увеличения количества кандид
- Употребление большого количества углеводов в пищу
- Лечение антибиотиками (без применения в комплексе противогрибковых препаратов)
- Использование гормональных противозачаточных средств
- Беременность
- Сахарный диабет
- Стресс
Анализ кала на патогенную флору
Анализ кала на патогенную флору является тем же самым анализом кала на дисбактериоз. В бланке с результатами анализов он занимает место – Патогенные энтеробактерии. К группе патогенных энтеробактерий относят Сальмонеллу и Шигеллу как основных возбудителей инфекционных заболеваний кишечника.
В бланке с результатами анализов он занимает место – Патогенные энтеробактерии. К группе патогенных энтеробактерий относят Сальмонеллу и Шигеллу как основных возбудителей инфекционных заболеваний кишечника.
Патогенные (болезнетворные) бактерии (pathogenic bacteria, греч. pathos — страдание и genes — порождающий, рождающийся; греч. bacterion — палочка) — бактерии, паразитирующие на других организмах и способные вызывать инфекционные заболевания человек, среди которых особое место занимают кишечные инфекции. Кишечные инфекции — целая группа заразных заболеваний, которые в первую очередь повреждают пищеварительный тракт. Заражение происходит при попадании возбудителя инфекции через рот, как правило, при употреблении зараженных пищевых продуктов и воды. Всего таких заболеваний более 30, в частности, к ним относятся: холера, брюшной тиф, ботулизм, сальмонеллез, дизентерия и т.п. Среди кишечных заболеваний самое безобидное — это пищевое отравление.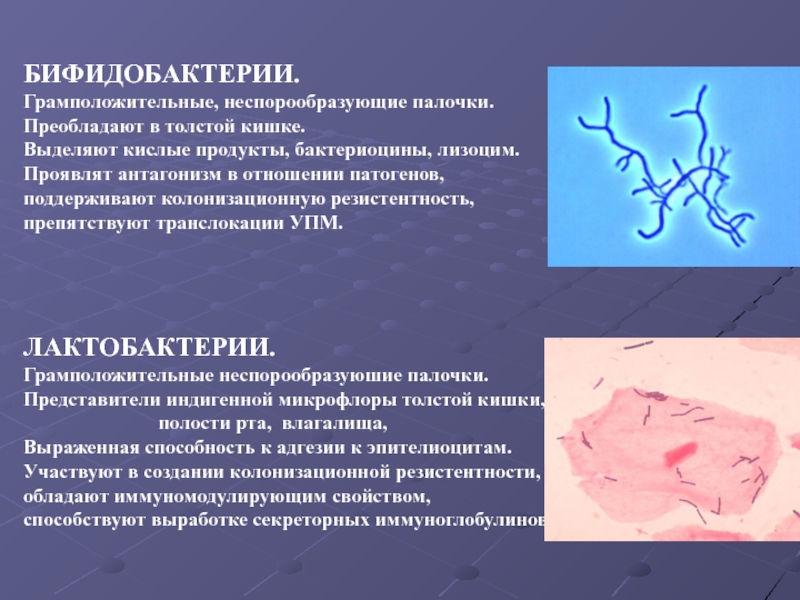 Возбудителями кишечных инфекций могут быть как сами бактерии (сальмонеллез, брюшной тиф, холера), так и их токсины (ботулизм). Некоторые бактерии могут вызывать язвенную болезнь и рак желудка, а также хронический гастрит.
Возбудителями кишечных инфекций могут быть как сами бактерии (сальмонеллез, брюшной тиф, холера), так и их токсины (ботулизм). Некоторые бактерии могут вызывать язвенную болезнь и рак желудка, а также хронический гастрит.
Сальмонелла
В норме сальмонеллы в результате анализа быть не должно!
Вызывает такое заболевание как сальмонеллез, которое проявляется сильным токсическим поражением кишечника. Основными переносчиками являются водоплавающие птицы.
Причины появления сальмонеллы
- Употребление плохо обработанного или сырого мяса
- Употребление плохо обработанных или сырых яиц
- Контакт с переносчиками
- Контакт с водой зараженной сальмонеллой
- Грязные руки
Шигелла
В норме шигеллы в результате анализа быть не должно!
Вызывает такое заболевание как дизентерия, которое также поражает кишечник и проявляется сильным токсическим поражением кишечника.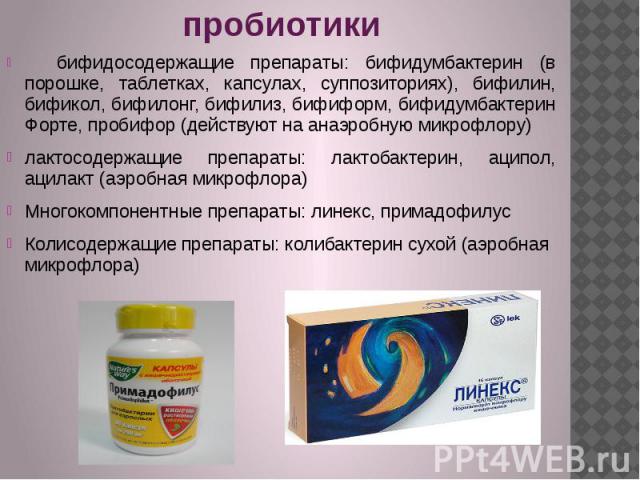 Основными путями заражения являются молочные продукты, сырые овощи, зараженная вода, люди больные дизентерией.
Основными путями заражения являются молочные продукты, сырые овощи, зараженная вода, люди больные дизентерией.
Причины появления шигеллы
- Употребление или контакт с зараженной водой
- Употребление зараженных продуктов питания
- Контакт с людьми болеющими дизентерией
- Грязные руки и контакт с зараженными поверхностями (посуда, игрушки)
Часто задаваемые вопросы
Как правильно подготовиться к анализу?
Применение некоторых медикаментов может повлиять на результат анализа кала. Поэтому их применение необходимо приостановить или прекратить в период подготовки к сдаче анализа кала после консультации с вашим врачом.
- Отменить прием препаратов (после личной консультации Вашего лечащего врача). К препаратам, которые могут повлиять на результаты анализов кала, относятся следующие:
- Противодиарейные препараты (Смекта, Неосмектин, Полифан, Имодиум, Энтерол)
- Противогельминтные препараты (Немозол, Декарис, Вермокс, Гельминтокс)
- Антибиотики — любые виды
- Лечебные и очищающие клизмы
- Слабительные препараты (Бисакодил, Экстракт сенны, Форлакс, Порталак)
- НПВП – нестероидные противовоспалительные препараты (Аспирин, Парацетамол, Ибупрофен)
- Также нельзя использовать кал который был в контакте с чистящими или дезинфицирующими средствами, которые используются для чистки унитаза, водой или мочой.

Как правильно собрать кал для анализа?
- Помочитесь перед сбором материала, для того чтобы моча не попала в кал.
- Необходимо взять чистую, сухую ёмкость, куда будет проводиться дефекация.
- Из полученного материала необходимо взять 8-10 см3 (~2 чайные ложки). Кал забирается при помощи специальной «ложки» которая встроена в крышку специального контейнера, который вам должны выдать для сбора кала.
- Кал для анализа собирается из разных участков каловых масс (сверху, с боков, изнутри)
- Материал (кал) кладется в выданный вам контейнер, и плотно закрывается.
- Необходимо подписать контейнер (Ваше имя и фамилию, дату сбора анализа)
Как хранить кал перед отправкой в лабораторию?
Материал для анализа кала на дисбактериоз и на кишечную инфекцию необходимо доставить в лабораторию в максимально короткие сроки 30-40 минут (максимум 1,5 -2 часа). Чем больше времени прошло со времени сбора материала и момента доставки материала в лабораторию, тем менее достоверны будут анализы. Проблема в том, что большая часть бактерий кишечника являются анаэробными, то есть они живут в среде без кислорода, при контакте с ним умирают. Это может повлиять на достоверность результата. Поэтому хранить хоть какое либо время свыше рекомендуемых максимальных 2 часа, категорически не рекомендуется.
Проблема в том, что большая часть бактерий кишечника являются анаэробными, то есть они живут в среде без кислорода, при контакте с ним умирают. Это может повлиять на достоверность результата. Поэтому хранить хоть какое либо время свыше рекомендуемых максимальных 2 часа, категорически не рекомендуется.
Примечание
Полный (максимально подробный и точный) микробиологический анализ кала (анализ микробиоты толстой кишки) невозможно провести культурально зависимым способом, т.к. не все бактерии можно выделить и культивировать в искусственных условиях. В общем, проблема с микробиомом состоит в том, что мы можем выращивать в лаборатории менее 5% видов микробов, остальные просто слишком привередливы. Сегодня используются более технологичные культурально-независимые методы анализа:
Обзор популярных методов анализа микробиоты
Современные анализы кишечной микробиоты проводятся культурально-независимыми способами, среди которых можно выделить два наиболее известных на сегодняшний день в России метода — метод газовой хроматографии масс-спектрометрии микробных маркеров и метагеномный анализ микробиоты с помощью секвенирования нуклеиновых кислот. Обе методики имеют свои преимущества и недостатки (стоимость, время), включая погрешности в самих результатах и ограничения в использовании, а поэтому они совершенствуются до сих пор. Но несмотря на определенные недочеты, указанные технологии при грамотном использовании все же являются мощным инструментарием на пути к достижению целей персонализированнной медицины.
Обе методики имеют свои преимущества и недостатки (стоимость, время), включая погрешности в самих результатах и ограничения в использовании, а поэтому они совершенствуются до сих пор. Но несмотря на определенные недочеты, указанные технологии при грамотном использовании все же являются мощным инструментарием на пути к достижению целей персонализированнной медицины.
Анализ ГХ-МС | Метагеномный анализ |
Информация к разделу: Дисбактериоз
См. отдельно: Типичный анализ микробиома кишечника по образцам стула (метод метагеномики)
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- БИФИКАРДИО
- ПРОБИОТИКИ С ПНЖК
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА ЖКТ
- ДИСБИОЗ КИШЕЧНИКА
- МИКРОБИОМ и ВЗК
- МИКРОБИОМ И РАК
- МИКРОБИОМ, СЕРДЦЕ И СОСУДЫ
- МИКРОБИОМ И ПЕЧЕНЬ
- МИКРОБИОМ И ПОЧКИ
- МИКРОБИОМ И ЛЕГКИЕ
- МИКРОБИОМ И ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И ЩИТОВИДНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И КОЖНЫЕ БОЛЕЗНИ
- МИКРОБИОМ И КОСТИ
- МИКРОБИОМ И ОЖИРЕНИЕ
- МИКРОБИОМ И САХАРНЫЙ ДИАБЕТ
- МИКРОБИОМ И ФУНКЦИИ МОЗГА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОБИОМ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- КОРОТКОЦЕПОЧЕЧНЫЕ ЖИРНЫЕ КИСЛОТЫ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- МИКРОБИОМ И ПРЕЦИЗИОННОЕ ПИТАНИЕ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
Бифидобактерии и лактобактерии
Бифидобактерии и лактобактерии – основные представители полезной микрофлоры организма человека.
Бифидобактерии составляют основу микрофлоры кишечника. Эти микроорганизмы
— синтезируют витамины;
— осуществляют пищеварительные функции;
— абсорбируют желчные кислоты, желчные пигменты, холестерин;
— стимулируют перистальтику, предупреждают запоры и поносы;
— предупреждают заселение болезнетворных бактерий;
— стимулируют иммунные реакции.
Лактобактерии на 90% составляют микрофлору влагалища женщины детородного возраста, являются регулировщиками микробиологической чистоты влагалища. В тонком кишечнике они активизируют лимфоидную ткань, обеспечивая механизмы врожденного иммунитета. Лактобактерии заселяют ротовую полость, носоглотку, тормозя проникновение внутрь организма болезнетворных бактерий.
При уменьшении количества лакто- и бифидобактерий снижаются защитные силы организма и падает иммунитет. У людей старшего возраста происходит физиологическое снижение бифидо- и лактофлоры, поэтому они чаще болеют, имеют проблемы со стулом и т. д.
д.
Дисбактериоз
Приблизительно оценить количество бифидо- и лактобактерий в организме можно с помощью анализа кала на дисбактериоз.
О дисбактериозе можно говорить, если у человека
Бифидобактерии снижены до 109 и ниже — ОПАСНОСТЬ!
Лактобактерии снижены до 107 и ниже — ОПАСНОСТЬ!
Типичная кишечная палочка снижена до 107 и ниже — ОПАСНОСТЬ!
При дисбактериозе легко запускаются воспалительные и хронические процессы в организме.
Пониженные бифидобактерии
Понижение количества бифидобактерий на всех слизистых может привести к
— снижению всех защитных сил организма;
— частым ОРВИ;
— авитаминозам и дисэлементозам;
— анемии;
— плохому перевариванию сложных углеводов.
Пониженные лактобактерии
Уменьшение количества лактобактерий может стать причиной
— снижения иммунных реакций на слизистых тонкого кишечника,
— дисбиозам влагалищного биотопа (вагинитам, молочнице и др. ),
),
— аллергическим реакциям,
— частым ОРВИ.
Пробиотики
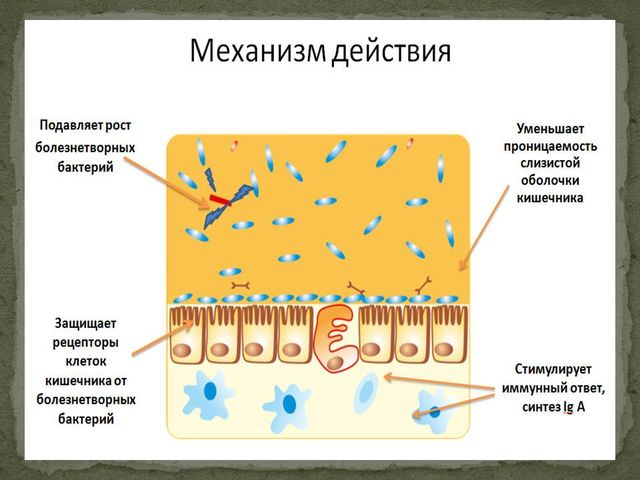
Для лечения дисбактериоза используются пробиотики – препараты, содержащие бифидо- и лактобактерии. Важно, чтобы титр бактерий, которые содержатся в препарате, был достаточно высоким. Жидкие пробиотики более эффективны, чем сухие, так как начинают действовать сразу, как только попадают в организм. К тому же, возможно не только их внутреннее, но и местное применение. Этим критериям отвечают препараты Бифидум БАГ и Трилакт компании «ВекторБиАльгам» (Новосибирск).
Бифидум БАГ — жидкий пробиотик, который содержит консорциум активных штаммов бифидобактерий видов B.bifidum (4 штамма) и B.longum (2 штамма). Титр бактерий — 1011 (на 1 мл пробиотика — более 10 млрд. живых активных клеток бифидобактерий).
Бифидум БАГ:
— способствует синтезу витаминов и усвоению микроэлементов;
— улучшает работу пищеварительной системы;
— укрепляет иммунитет;
— уменьшает рост патогенных микроорганизмов.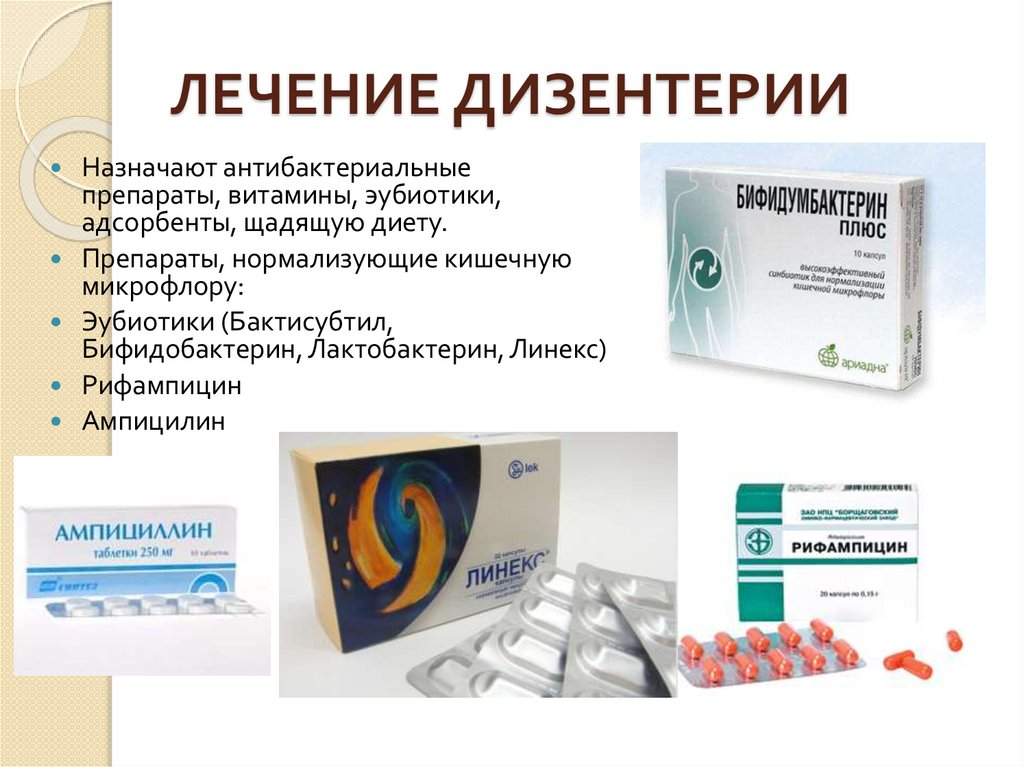
Бифидум БАГ используется для лечения дисбактериоза, сопровождает прием антибиотиков, избавляет от антибиотикоассоциированных диарей, восстанавливает нарушенную микрофлору кишечника.
Трилакт содержит лактобактерии видов L. acidophilus, L. casei и L. plantarum. Титр бактерий — 1010.
Трилакт
— подавляет рост патогенных бактерий;
— повышает иммунитет;
— снижает аллергическую настроенность организма.
Трилакт используется при лечении острых кишечных инфекций, мочеполовых инфекций, инфекций ЛОР-органов.
Наши пробиотики:
Бифидум Баг | Трилакт | Экофлор |
Посмотреть все
Кишечные лактобациллы в здравии и болезни, водителю или просто попутчику?
1. Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, Morelli L, Canani RB, Flint HJ, Salminen S, et al. Документ консенсуса экспертов: Консенсусное заявление Международной научной ассоциации пробиотиков и пребиотиков о сфере применения и надлежащем использовании термина пробиотик. Нац. Преподобный Гастроэнтерол. Гепатол. 2014; 11: 506–514. [PubMed] [Google Scholar]
Документ консенсуса экспертов: Консенсусное заявление Международной научной ассоциации пробиотиков и пребиотиков о сфере применения и надлежащем использовании термина пробиотик. Нац. Преподобный Гастроэнтерол. Гепатол. 2014; 11: 506–514. [PubMed] [Google Scholar]
2. Marco ML, Heeney D, Binda S, Cifelli CJ, Cotter PD, Foligné B, Gänzle M, Kort R, Pasin G, Pihlanto A, et al. Польза для здоровья от ферментированных продуктов: микробиота и не только. Курс. мнение Биотехнолог. 2017;44:94–102. [PubMed] [Google Scholar]
3. Floch MH, Walker WA, Sanders E, Nieuwdorp M, Kim AS, Brenner DA, Qamar AA, Miloh TA, Guarino A, Guslandi M, et al. Рекомендации по использованию пробиотиков — обновленные материалы 2015 г. и консенсусное мнение. Дж. Клин. Гастроэнтерол. 2015;49:S69–S73. [PubMed] [Google Scholar]
4. Альмонацид Д.Э., Крааль Л., Оссандон Ф.Дж., Будовская Ю.В., Карденас Дж.П., Бик Э.М., Годдард А.Д., Ричман Дж., Апте З.С. Секвенирование гена 16S рРНК и здоровые референсные диапазоны для 28 клинически значимых микробных таксонов из микробиома кишечника человека. ПЛОС Один. 2017; 12:1–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2017; 12:1–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Чу Д.М., Ма Дж., Принц А.Л., Энтони К.М., Сеферович М.Д., Аагард К.М. Созревание структуры и функции микробиома младенцев на разных участках тела и в зависимости от способа родоразрешения. Нац. Мед. 2017;23:314–323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Nistal E, Caminero A, Herran AR, Perez-Andres J, Vivas S, Ruiz De Morales JM, Saenz de Miera LE, Casqueiro J. Изучение дуоденальной бактериальной сообщества с помощью анализа гена 16S рРНК у взрослых с активной целиакией по сравнению с контрольной группой без целиакии. Дж. Заявл. микробиол. 2015;120:1691–1700. [PubMed] [Google Scholar]
7. Fan P, Liu P, Song P, Chen X, Ma X. Умеренное ограничение пищевого белка изменяет состав микробиоты кишечника и улучшает барьерную функцию подвздошной кишки на модели взрослой свиньи. науч. Отчет 2017; 7: 1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Slifierz MJ, Friendship RM, Weese JS. Продольное исследование фекальной и носовой микробиоты домашней свиньи в раннем возрасте. БМС микробиол. 2015; 15:1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Продольное исследование фекальной и носовой микробиоты домашней свиньи в раннем возрасте. БМС микробиол. 2015; 15:1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Mohan M, Chow CET, Ryan CN, Chan LS, Dufour J, Aye PP, Blanchard J, Moehs CP, Sestak K. Дисбактериоз кишечника, вызванный глютеном, сопровождается селективной активацией микроРНК с плотным соединением кишечника и бактериями. — связывающие мотивы в модели глютеновой болезни макаки-резуса. Питательные вещества. 2016; 8:1–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Li D, Chen H, Mao B, Yang Q, Zhao J, Gu Z, Zhang H, Chen YQ, Chen W. Микробная биогеография и основная микробиота желудочно-кишечный тракт крысы. науч. Отчет 2017; 7: 1–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Morikawa M, Tsujibe S, Kiyoshima-Shibata J, Watanabe Y, Kato-Nagaoka N, Shida K, Matsumoto S. Микробиота тонкой кишки избирательно поглощается фагоцитами собственной пластинки и пейеровых бляшек. ПЛОС Один. 2016; 11:1–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2016; 11:1–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12•. Росси М., Мартинес-Мартинес Д., Амаретти А., Ульрици А., Раймонди С., Мойя А. Анализ последовательностей метагеномного генома выявил субдоминантную, но постоянную популяцию лактобацилл в микробиоте кишечника человека. Окружающая среда. микробиол. 2016;8:399–406. Более 50 видов Lactobacillus неоднократно обнаруживались в количестве до 10 8 клеток/г в кале человека. Метагеномика позволила идентифицировать различия на уровне штаммов среди лактобацилл, и отдельные генотипов Lactobacillus постоянно обнаруживались в стуле в течение почти двух лет. [PubMed] [Google Scholar]
13•. Госманн С., Анахтар М.Н., Хэндли С.А., Фаркасану М., Абу-Али Г., Боуман Б.А., Падаваттан Н., Десаи С., Друа Л., Мудли А. и др. Лактобацилло-дефицитные цервиковагинальные бактериальные сообщества связаны с повышенным риском инфицирования ВИЧ среди молодых южноафриканских женщин. Иммунитет. 2017;46:29–37. Это проспективное исследование показало, что женщины с низким разнообразием вагинальных бактериальных сообществ, в которых преобладают Lactobacillus crispatus , имеют более низкий риск заражения ВИЧ и имеют меньшее количество активированных CD4 + Т-клеток слизистой оболочки по сравнению с женщинами с разнообразными генитальными бактериальными сообществами. Результаты были подтверждены меньшим количеством активированных CD4+ Т-клеток в слизистой оболочке гениталий стерильных мышей, которым интравагинально инокулировали L. crispatus , по сравнению с ВИЧ-ассоциированными бактериальными таксонами. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2017;46:29–37. Это проспективное исследование показало, что женщины с низким разнообразием вагинальных бактериальных сообществ, в которых преобладают Lactobacillus crispatus , имеют более низкий риск заражения ВИЧ и имеют меньшее количество активированных CD4 + Т-клеток слизистой оболочки по сравнению с женщинами с разнообразными генитальными бактериальными сообществами. Результаты были подтверждены меньшим количеством активированных CD4+ Т-клеток в слизистой оболочке гениталий стерильных мышей, которым интравагинально инокулировали L. crispatus , по сравнению с ВИЧ-ассоциированными бактериальными таксонами. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Duar RM, Frese SA, Fernando SC, Burkey TE, Tasseva G, Peterson DA, Blom J, Wenzel CQ, Szymanski CM, Walter J. Экспериментальное определение адаптации хозяина Lactobacillus reuteri к различным видам позвоночных. заявл. Окружающая среда. микробиол. 2017; 83:1–44. [PMC free article] [PubMed] [Google Scholar]
15. Yang L, Poles MA, Fisch GS, Ma Y, Nossa C, Phelan JA, Pei Z. Иммуносупрессия, вызванная ВИЧ, связана с колонизацией проксимального отдела кишечника экологические бактерии. СПИД. 2016;30:19–29. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Yang L, Poles MA, Fisch GS, Ma Y, Nossa C, Phelan JA, Pei Z. Иммуносупрессия, вызванная ВИЧ, связана с колонизацией проксимального отдела кишечника экологические бактерии. СПИД. 2016;30:19–29. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Вуйкович-Цвиджин И., Суэйнсон Л.А., Чу С.Н., Ортис А.М., Санти К.А., Петриелло А., Данхэм Р.М., Фадрош Д.В., Лин Д.Л., Фаруки А.А. и др. . Обилие Lactobacillus в кишечнике связано с ингибированием IDO1 и динамикой Th27 у макак, инфицированных SIV. Cell Rep. 2015; 13:1589–1597. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Хирао Л.А., Гришина И., Бурри О., Ху В.К., Сомрит М., Санкаран-Уолтерс С., Голке К.А., Фентон А.Н., Ли Дж.А., Кроуфорд Р.В. и др. . Раннее обнаружение SIV-инфекции слизистой оболочкой клетками Панета индуцирует продукцию IL-1beta и инициирует разрушение эпителия кишечника. PLoS Патог. 2014; 10:1–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Голомб Б.Л., Хирао Л.А., Дандекар С., Марко М.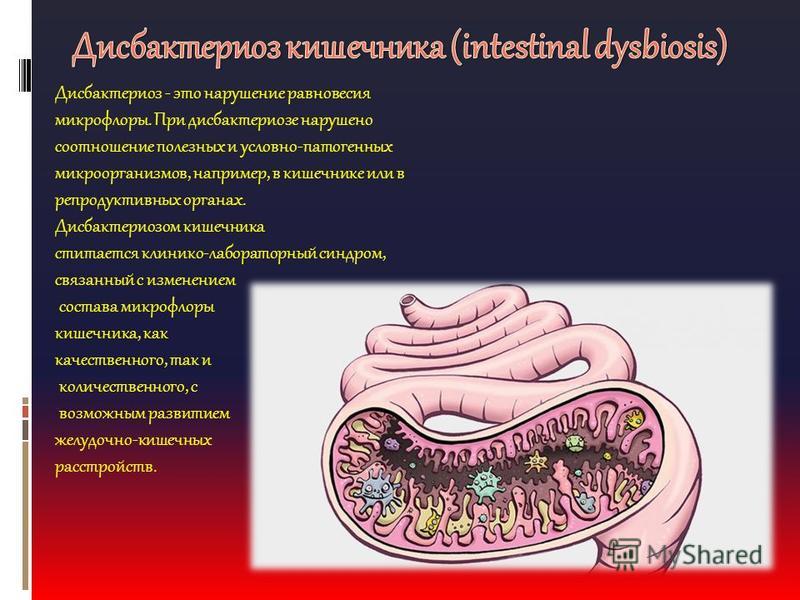 Л. Экспрессия генов Lactobacillus plantarum и комменсальная микробиота в подвздошной кишке здоровых и ранних ВИО-инфицированных макак-резусов. науч. Отчет 2016; 6: 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Л. Экспрессия генов Lactobacillus plantarum и комменсальная микробиота в подвздошной кишке здоровых и ранних ВИО-инфицированных макак-резусов. науч. Отчет 2016; 6: 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. d’Ettorre G, Rossi G, Scagnolari C, Andreotti M, Giustini N, Serafino S, Schietroma I, Scheri GC, Fard SN, Trinchieri V, et al . Пробиотические добавки способствуют снижению активации Т-клеток, увеличению частоты Th27 и восстановлению целостности кишечного эпителия и митохондриальной морфологии у ВИЧ-1-положительных пациентов, получающих АРТ. Иммунитет, Воспаление. Дис. 2017 г.: 10.1002/iid3.160. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20••. Зеланте Т., Яннитти Р.Г., Кунья С., ДеЛука А., Джованни Г., Пьерачини Г., Зекки Р., Д’Анджело С., Масси-Бенедетти С., Фалларино Ф. и др. Катаболиты триптофана из микробиоты взаимодействуют с арильными углеводородными рецепторами и уравновешивают реактивность слизистой оболочки через интерлейкин-22.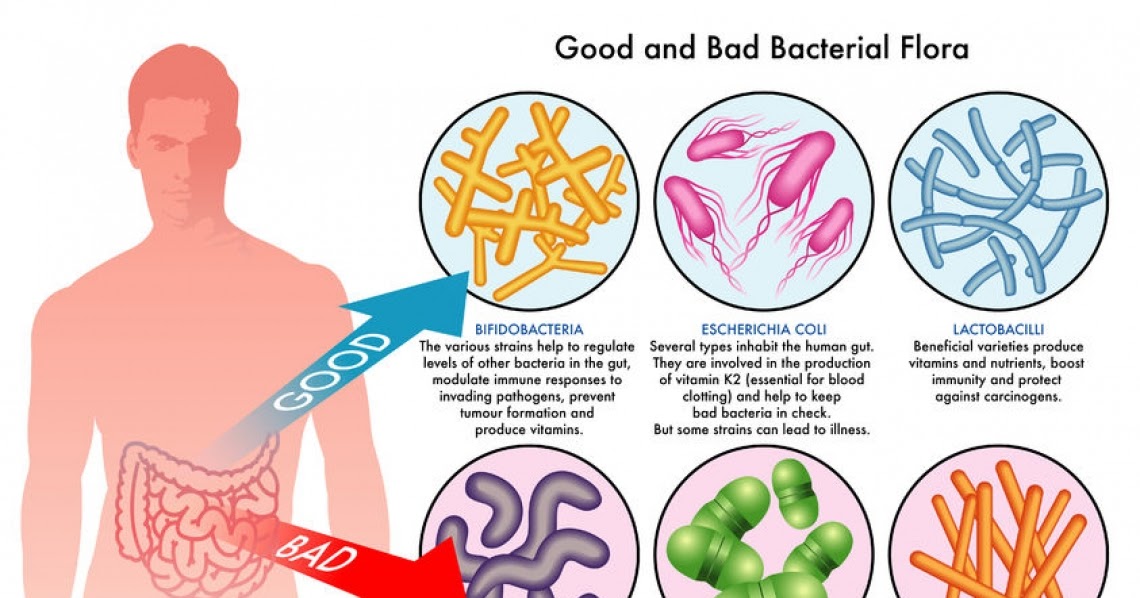 Иммунитет. 2013; 39: 372–385. В этом раннем отчете выделены кишечные и вагинальные лактобациллы из-за их мощной способности продуцировать метаболиты триптофана, которые активируют AHR-хозяин в эпителиальной ткани. Активация эпителиальных AHR индуцирует выработку множества противомикробных соединений и, как было установлено, необходима для борьбы с условно-патогенными микроорганизмами. Важно отметить, что мыши с нокаутом AHR, инфицированные Candida albicans не удалось спасти путем введения лактобацилл, метаболизирующих триптофан. [PubMed] [Google Scholar]
Иммунитет. 2013; 39: 372–385. В этом раннем отчете выделены кишечные и вагинальные лактобациллы из-за их мощной способности продуцировать метаболиты триптофана, которые активируют AHR-хозяин в эпителиальной ткани. Активация эпителиальных AHR индуцирует выработку множества противомикробных соединений и, как было установлено, необходима для борьбы с условно-патогенными микроорганизмами. Важно отметить, что мыши с нокаутом AHR, инфицированные Candida albicans не удалось спасти путем введения лактобацилл, метаболизирующих триптофан. [PubMed] [Google Scholar]
21••. Камдар К., Хакпур С., Чен Дж., Леоне В., Брулк Дж., Мангату Т., Антонопулос Д.А., Чанг Э.Б., Кан С.А., Киршнер Б.С. и соавт. Генетические и метаболические сигналы во время острой кишечной бактериальной инфекции изменяют микробиоту и приводят к прогрессированию хронического воспалительного заболевания. Клеточный микроб-хозяин. 2016;19:21–31. У мышей с нокаутом TLR1 острая кишечная инфекция Yersinia enterocolitica дестабилизирует иммунитет слизистых оболочек, вызывая рост δ- Proteobacteria и снижение уровня других таксонов, включая лактобациллы. Через два месяца после заражения наблюдались хронические иммунные реакции против комменсальной микробиоты. Добавки с L. reuteri было достаточно, чтобы вернуть иммунную систему к гомеостазу. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Через два месяца после заражения наблюдались хронические иммунные реакции против комменсальной микробиоты. Добавки с L. reuteri было достаточно, чтобы вернуть иммунную систему к гомеостазу. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. da Fonseca DM, Hand TW, Han S-J, Gerner MY, Zaretsky AG, Byrd AL, Harrison OJ, Ortiz AM, Quinones M, Trinchieri G, et al. Последствия острой инфекции, зависящие от микробиоты, нарушают тканеспецифический иммунитет. Клетка. 2017; 163:354–366. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Лю Х-Н, У Х, Чен Ю-З, Чен Ю-Дж, Шен Х-З, Лю Т-Т. Измененная молекулярная характеристика кишечной микробиоты у пациентов с синдромом раздраженного кишечника по сравнению со здоровым контролем: систематический обзор и метаанализ. Копать землю. Дис печени. 2017; 49: 331–337. [PubMed] [Google Scholar]
24. Zhuang X, Xiong L, Li L, Li M, Chen M. Изменения микробиоты кишечника у пациентов с синдромом раздраженного кишечника: систематический обзор и метаанализ. Дж. Гастроэнтерол. Гепатол. 2017;32:28–38. [PubMed] [Академия Google]
Дж. Гастроэнтерол. Гепатол. 2017;32:28–38. [PubMed] [Академия Google]
25. Ford AC, Quigley EMM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, Soffer EE, Spiegel BMR, Moayyedi P. Эффективность пребиотиков, пробиотиков и синбиотиков при синдроме раздраженного кишечника и хроническом идиопатическом запоре: систематический обзор и метаанализ. Являюсь. Дж. Гастроэнтерол. 2014;109:1547–1561. [PubMed] [Google Scholar]
26. Lewis JD, Chen EZ, Baldassano RN, Otley AR, Griffiths AM, Lee D, Bittinger K, Bailey A, Friedman ES, Hoffmann C, et al. Воспаление, антибиотики и диета как экологические стрессоры микробиома кишечника при болезни Крона у детей. Клеточный микроб-хозяин. 2015;18:489–500. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Wang W, Chen L, Zhou R, Wang X, Song L, Huang S, Wang G, Xia B. Увеличение доли Bifidobacterium и группы Lactobacillus и потеря Бутират-продуцирующие бактерии при воспалительных заболеваниях кишечника. Дж. Клин. микробиол. 2014;52:398–406. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Ganji-Arjenaki M., Rafieian-Kopaei M. Пробиотики — хороший выбор при ремиссии воспалительных заболеваний кишечника: метаанализ и систематический обзор. J Cell Physiol. 2017 г.: 10.1002/jcp.25911. [PubMed] [CrossRef] [Google Scholar]
29••. Ламас Б., Ричард М.Л., Ледук В., Фам Х.П., Мишель М.Л., Да Коста Г., Бридонно С., Джегу С., Хоффманн Т.В., Нативидад Дж.М. и др. CARD9 воздействует на колит, изменяя метаболизм триптофана в кишечной микробиоте в лиганды арилуглеводородного рецептора. Нац. Мед. 2016;22:598–605. Исследования однонуклеотидного полиморфизма (SNP) человека показывают, что аллели члена семейства 9 доменов рекрутирования каспаз (CARD9) связаны с воспалительным заболеванием кишечника и что этот аллель риска может влиять на развитие провоспалительного микробиома. С помощью CARD9мышей с нокаутом, этот отчет связывает дефицит CARD9 с измененным кишечным микробиомом со сниженной выработкой лигандов AHR. L. reuteri был идентифицирован как значительно истощенный таксон, и пополнение этого вида улучшило симптомы колита у мышей с нокаутом CARD9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
reuteri был идентифицирован как значительно истощенный таксон, и пополнение этого вида улучшило симптомы колита у мышей с нокаутом CARD9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30•. Zhang X, Zhang D, Jia H, Feng Q, Wang D, Liang D, Wu X, Li J, Tang L, Li Y и др. Микробиомы полости рта и кишечника нарушены при ревматоидном артрите и частично нормализуются после лечения. Нац. Мед. 2015;21:895–905. Это исследование на людях с использованием метагеномного секвенирования фекальной микробиоты выявило несколько видов кишечных видов Lactobacillus , которые были повышены в оральной и фекальной микробиоте пациентов с РА по сравнению со здоровыми субъектами. [PubMed] [Google Scholar]
31. Liu X, Zeng B, Zhang J, Li W, Mou F, Wang H, Zou Q, Zhong B, Wu L, Wei H, et al. Роль микробиома кишечника в модулировании прогрессирования артрита у мышей. науч. Отчет 2016; 6: 1–11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Vaghef-Mehrabany E, Alipour B, Homayouni-Rad A, Sharif S-K, Asghari-Jafarabadi M, Zavvari S. Пробиотические добавки улучшают воспалительный статус у пациентов с ревматоидным артритом. Питание. 2014; 30:430–435. [PubMed] [Google Scholar]
Пробиотические добавки улучшают воспалительный статус у пациентов с ревматоидным артритом. Питание. 2014; 30:430–435. [PubMed] [Google Scholar]
33. Zamani B, Golkar HR, Farshbar S, Emadi-Baygi M, Tajabadi-Ebrahimi M, Jafari P, Akhavan R, Taghizadeh M, Memarzadeh MR, Asemi Z. Клинический и метаболический ответ на добавление пробиотиков у пациентов с ревматоидным артритом: рандомизированное двойное слепое плацебо-контролируемое исследование. Междунар. Дж. Реум. Дис. 2016;19: 869–879. [PubMed] [Google Scholar]
34•. Алканани А.К., Хара Н., Готлиб П.А., Ир Д., Робертсон К.Э., Вагнер Б.Д., Франк Д.Н., Циприс Д. Изменения кишечной микробиоты коррелируют с предрасположенностью к диабету 1 типа. Сахарный диабет. 2015;64:3510–3520. В этом когортном исследовании генетический компонент СД1 частично контролировался путем набора пациентов с СД1 и их здоровых родственников первой степени родства. Фекальную микробиоту оценивали с помощью секвенирования 16S рРНК как фактора окружающей среды, связанного с заболеванием. Пропорции Lactobacillus были значительно снижены у пациентов с СД1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Пропорции Lactobacillus были значительно снижены у пациентов с СД1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. de Goffau MC, Fuentes S, Van Den Bogert B, Honkanen H, De Vos WM, Welling GW, Hyöty H, Harmsen HJM. Аберрантный состав кишечной микробиоты в начале диабета 1 типа у детей раннего возраста. Диабетология. 2014;57:1569–1577. [PubMed] [Google Scholar]
36. Uusitalo U, Liu X, Yang J, Hummel S, Butterworth M, Rewers M, Hagopian W, She J, Simell O, Toppari J, et al. Ассоциация раннего воздействия пробиотиков и островкового аутоиммунитета в исследовании TEDDY. JAMA Педиатр. 2016;170:20–28. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Chen J, Chia N, Kalari KR, Yao JZ, Novotna M, Soldan MMP, Luckey DH, Marietta EV, Jeraldo PR, Chen X, et al. У пациентов с рассеянным склерозом кишечная микробиота отличается от контрольной группы здоровых людей. науч. Отчет 2016; 6: 1–10. [Google Scholar]
38. Станисавлиевич С., Лукич Дж., Сокович С.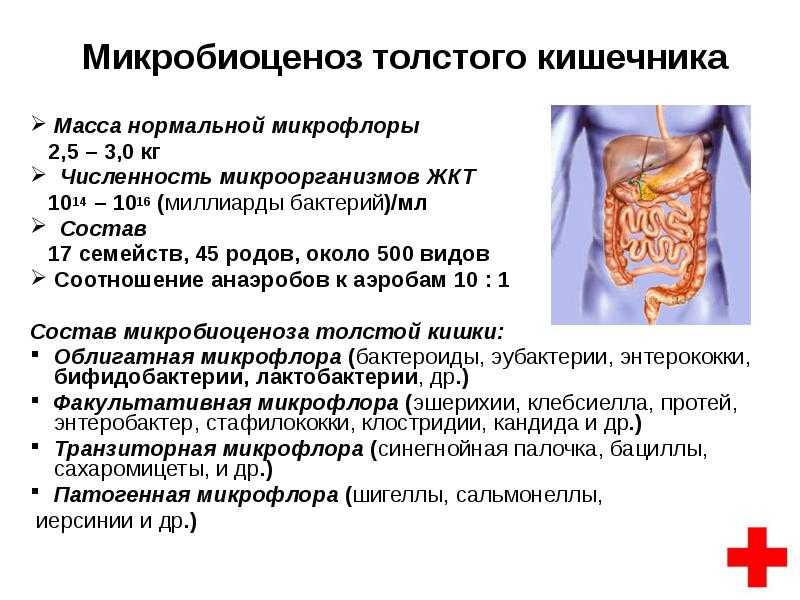 , Михайлович С., Стойкович М.М., Милькович Д., Голич Н. Корреляция состава кишечной микробиоты с устойчивостью к экспериментальному аутоиммунному энцефаломиелиту у крыс. Фронт. микробиол. 2016;7:1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Михайлович С., Стойкович М.М., Милькович Д., Голич Н. Корреляция состава кишечной микробиоты с устойчивостью к экспериментальному аутоиммунному энцефаломиелиту у крыс. Фронт. микробиол. 2016;7:1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Kouchaki E, Tamtaji OR, Salami M, Bahmani F, Daneshvar Kakhaki R, Akbari E, Tajabadi-Ebrahimi M, Jafari P, Asemi Z. Клинический и метаболический ответ на пробиотические добавки у пациентов с рассеянным склерозом: рандомизированный, двойное слепое плацебо-контролируемое исследование. клин. Нутр. 2016 г.: 10.1016/j.clnu.2016.08.015. [PubMed] [CrossRef] [Google Scholar]
40. Lim CK, Bilgin A, Lovejoy DB, Tan V, Bustamante S, Taylor BV, Bessede A, Brew BJ, Guillemin GJ. Метаболомика кинуренинового пути предсказывает и обеспечивает механистическое понимание прогрессирования рассеянного склероза. науч. Отчет 2017; 7: 1–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41•. Ротхаммер В., Масканфрони И., Бунсе Л., Такенака М. , Кенисон Дж., Мэйо Л., Чао К.С., Патель Б., Ян Р., Блейн М. и др. Интерфероны типа I и микробные метаболиты триптофана модулируют активность астроцитов и воспаление центральной нервной системы через рецептор арильных углеводородов. Нац. Мед. 2016; 22: 586–597. Это исследование на мышах причинно связывает лактобациллы с производством лигандов AHR и смягчением экспериментально индуцированного воспаления центральной нервной системы. Восстановление нарушенного антибиотиками микробиома с помощью L. reteuri , способных метаболизировать триптофан, было достаточно для улучшения маркеров заболевания. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Кенисон Дж., Мэйо Л., Чао К.С., Патель Б., Ян Р., Блейн М. и др. Интерфероны типа I и микробные метаболиты триптофана модулируют активность астроцитов и воспаление центральной нервной системы через рецептор арильных углеводородов. Нац. Мед. 2016; 22: 586–597. Это исследование на мышах причинно связывает лактобациллы с производством лигандов AHR и смягчением экспериментально индуцированного воспаления центральной нервной системы. Восстановление нарушенного антибиотиками микробиома с помощью L. reteuri , способных метаболизировать триптофан, было достаточно для улучшения маркеров заболевания. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Ignacio A, Fernandes MR, Rodrigues VAA, Groppo FC, Cardoso AL, Avila-Campos MJ, Nakano V. Корреляция между индексом массы тела и фекальной микробиотой у детей. клин. микробиол. Заразить. 2016; 22:1–8. [PubMed] [Google Scholar]
43. Riva A, Borgo F, Lassandro C, Verduci E, Morace G, Borghi E, Berry D. Детское ожирение связано с измененной микробиотой кишечника и дискордантными сдвигами в популяциях Fiirmicutes.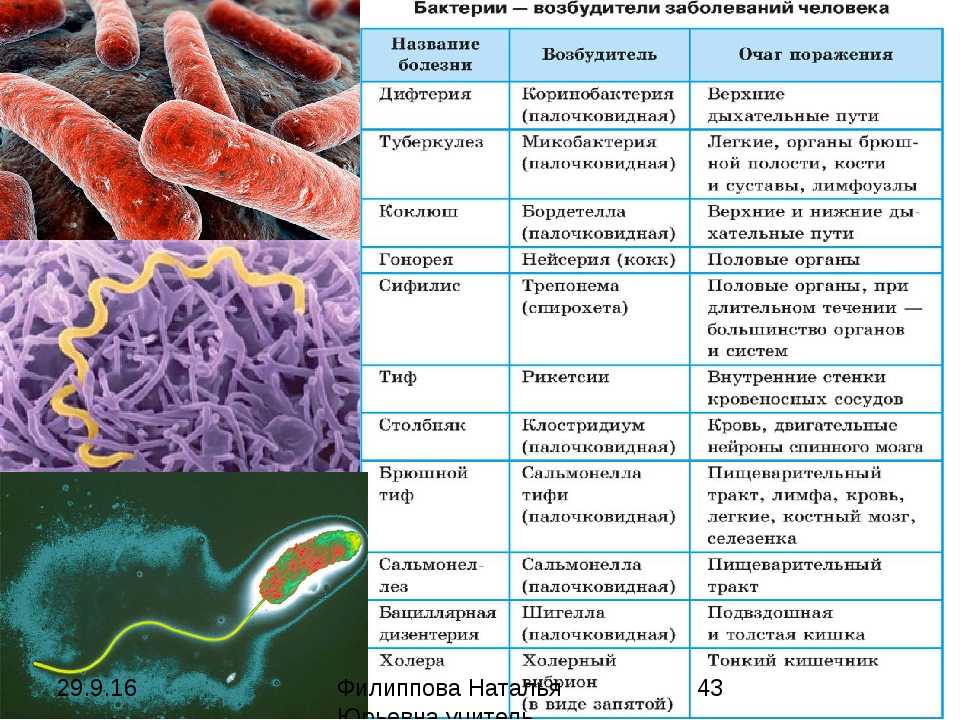 Окружающая среда. микробиол. 2017;19: 95–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Окружающая среда. микробиол. 2017;19: 95–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Hu HJ, Park SG, Jang HB, Choi MG, Park KH, Kang JH, Park SI, Lee HJ, Cho SH. Ожирение изменяет профиль микробного сообщества у корейских подростков. ПЛОС Один. 2015; 10:1–14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Teixeira TFS, Grześkowiak LM, Salminen S, Laitinen K, Bressan J, Gouveia Peluzio M, do C. Уровни Bifidobacterium и Clostridium coccoides в кале, но не липополисахарида в плазме обратно пропорционально инсулину и индексу HOMA у женщин. клин. Нутр. 2013;32:1017–1022. [PubMed] [Академия Google]
46. Karlsson FH, Tremaroli V, Nookaew I, Bergström G, Behre CJ, Fagerberg B, Nielsen J, Bäckhed F. Метагеном кишечника у европейских женщин с нормальным, нарушенным и диабетическим контролем глюкозы. Природа. 2013; 498:99–103. [PubMed] [Google Scholar]
47. Forslund K, Hildebrand F, Nielsen T, Falony G, Le Chatelier E, Sunagawa S, Prifti E, Vieira-Silva S, Gudmundsdottir V, Krogh Pedersen H, et al.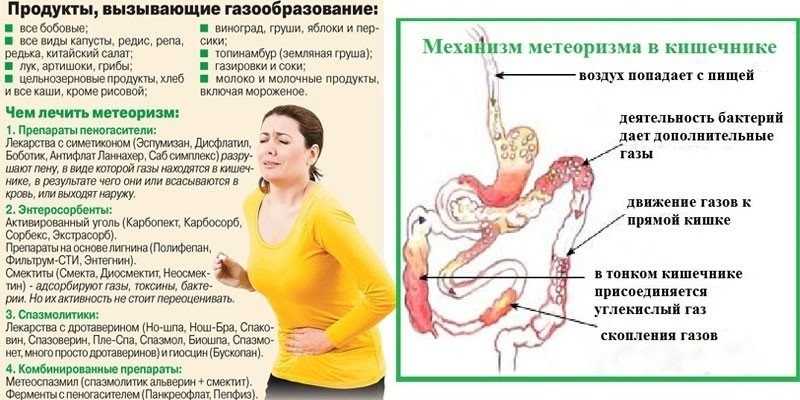 Распутывание диабета 2 типа и сигнатур лечения метформином в микробиоте кишечника человека. Природа. 2015; 528: 262–266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Распутывание диабета 2 типа и сигнатур лечения метформином в микробиоте кишечника человека. Природа. 2015; 528: 262–266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Sáez-Lara MJ, Robles-Sanchez C, Ruiz-Ojeda FJ, Plaza-Diaz J, Gil A. Влияние пробиотиков и синбиотиков на ожирение, синдром резистентности к инсулину, диабет 2 типа и неалкогольную жировую болезнь печени: Обзор клинических испытаний на людях. Междунар. Дж. Мол. науч. 2016; 17:1–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Дрисси Ф., Рауль Д., Мерхей В. Метаболическая роль лактобактерий в изменении веса у людей и животных. микроб. Патог. 2016 г.: 10.1016/j.micpath.2016.03.006. [PubMed] [CrossRef] [Академия Google]
50. Roy CILe, Štšepetova J, Sepp E, Songisepp E, Sandrine P, Mikelsaar M. Новое понимание влияния популяции Lactobacillus на метаболическое взаимодействие бактерий-хозяев. Онкотаргет. 2015;6:30545–30556. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Gonzalez FJ, Jiang C, Patterson AD. Ось кишечной микробиоты-фарнезоидного Х-рецептора модулирует метаболические заболевания. Гастроэнтерология. 2016; 151:845–859. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ось кишечной микробиоты-фарнезоидного Х-рецептора модулирует метаболические заболевания. Гастроэнтерология. 2016; 151:845–859. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Zhang L, Xie C, Nichols RG, Chan SHJ, Jiang C, Hao R, Smith PB, Cai J, Simons MN, Hatzakis E, et al. Передача сигналов рецептора Farnesoid X формирует микробиоту кишечника и контролирует метаболизм липидов в печени. mSystems. 2016; 1:1–17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Borges-Canha M, Portela-Cidade JP, Dinis-Ribeiro M, Leite-Moreira AF, Pimentel-Nunes P. Роль кишечной микробиоты в колоректальном канцерогенезе: систематический обзор. Преподобный Esp. Раскопки Энфермедадес. 2015; 107: 659–671. [PubMed] [Google Scholar]
54. Li J, Sung CYJ, Lee N, Ni Y, Pihlajamäki J, Panagiotou G, El-Nezami H. Модулируемая пробиотиками микробиота кишечника подавляет рост гепатоцеллюлярной карциномы у мышей. проц. Натл. акад. науч. 2016; 113:E1306–E1315. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Hieken TJ, Chen J, Hoskin TL, Walther-Antonio M, Johnson S, Ramaker S, Xiao J, Radisky DC, Knutson KL, Kalari KR, et al. Микробиом асептически собранной ткани молочной железы человека при доброкачественных и злокачественных заболеваниях. науч. Отчет 2016; 6: 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Hieken TJ, Chen J, Hoskin TL, Walther-Antonio M, Johnson S, Ramaker S, Xiao J, Radisky DC, Knutson KL, Kalari KR, et al. Микробиом асептически собранной ткани молочной железы человека при доброкачественных и злокачественных заболеваниях. науч. Отчет 2016; 6: 1–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Герреро-Престон Р., Годой-Виторино Ф., Джедличка А., Родригес-Иларио А., Гонсалес Х., Бонди Дж., Лоусон Ф., Фолавийо О., Михайлиди С., Дзидзич А и др. Секвенирование ампликона 16S рРНК идентифицирует микробиоту, связанную с раком ротовой полости, папилломавирусной инфекцией и хирургическим лечением. Онкотаргет. 2016;7:51320–51334. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57•. Zijlmans MAC, Korpela K, Riksen-Walraven JM, de Vos WM, de Weerth C. Материнский пренатальный стресс связан с кишечной микробиотой младенцев. Психонейроэндокринология. 2015;53:233–245. Секвенирование 16S рРНК фекальных микробиомов когорты матери и ребенка до и после рождения позволило Zijlmans и коллегам связать материнский пренатальный стресс с изменениями в микробиоме младенцев. Патобионты были обогащены у младенцев, матери которых были более подвержены стрессу. Количество клеток Lactobacillus было истощено. [PubMed] [Академия Google]
Патобионты были обогащены у младенцев, матери которых были более подвержены стрессу. Количество клеток Lactobacillus было истощено. [PubMed] [Академия Google]
58. Голубева А.В., Крэмптон С., Десбоннет Л., Эдж Д., О’Салливан О., Ломасни К.В., Жданов А.В., Криспи Ф., Молони Р.Д., Борре Ю.Е., и соавт. Изменения основных физиологических систем, вызванные пренатальным стрессом, коррелируют с составом микробиоты кишечника во взрослом возрасте. Психонейроэндокринология. 2015;60:58–74. [PubMed] [Google Scholar]
59. Leclercq S, Mian FM, Stanisz AM, Bindels LB, Cambier E, Ben-Amram H, Koren O, Forsythe P, Bienenstock J. Низкие дозы пенициллина в раннем возрасте вызывают длительные срочные изменения микробиоты кишечника мышей, цитокинов головного мозга и поведения. Нац. коммун. 2017; 8:1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60••. Баффингтон С.А., Ди Приско Г.В., Охтунг Т.А., Аджами Н.Дж., Петрозино Дж.Ф., Коста-Маттиоли М. Микробная реконституция устраняет вызванный питанием матери социальный и синаптический дефицит у потомства. Клетка. 2016; 165:1762–1775. Рацион питания матери с высоким содержанием жиров был связан с повышенным риском заболеваний у потомства; однако это первое сообщение о том, что такие диеты приводят к ухудшению психического здоровья. Интересно, что у потомства самок, получавших ВЧ-кормление, наблюдалось значительное снижение уровней кортикальных рецепторов окситоцина и колонизация этих животных L. reuteri было достаточно, чтобы исправить этот дефицит. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клетка. 2016; 165:1762–1775. Рацион питания матери с высоким содержанием жиров был связан с повышенным риском заболеваний у потомства; однако это первое сообщение о том, что такие диеты приводят к ухудшению психического здоровья. Интересно, что у потомства самок, получавших ВЧ-кормление, наблюдалось значительное снижение уровней кортикальных рецепторов окситоцина и колонизация этих животных L. reuteri было достаточно, чтобы исправить этот дефицит. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Smith CJ, Emge JR, Berzins K, Lung L, Khamishon R, Shah P, Rodrigues DM, Sousa AJ, Reardon C, Sherman PM, et al. Пробиотики нормализуют ось кишечник-мозг-микробиота у мышей с иммунодефицитом. Являюсь. Дж. Физиол. — Гастроинтест. Физиол печени. 2014; 307:G793–G802. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Emge JR, Huynh K, Miller EN, Kaur M, Reardon C, Barrett KE, Gareau MG. Модуляция оси микробиота-кишечник-мозг пробиотиками в мышиной модели воспалительного заболевания кишечника.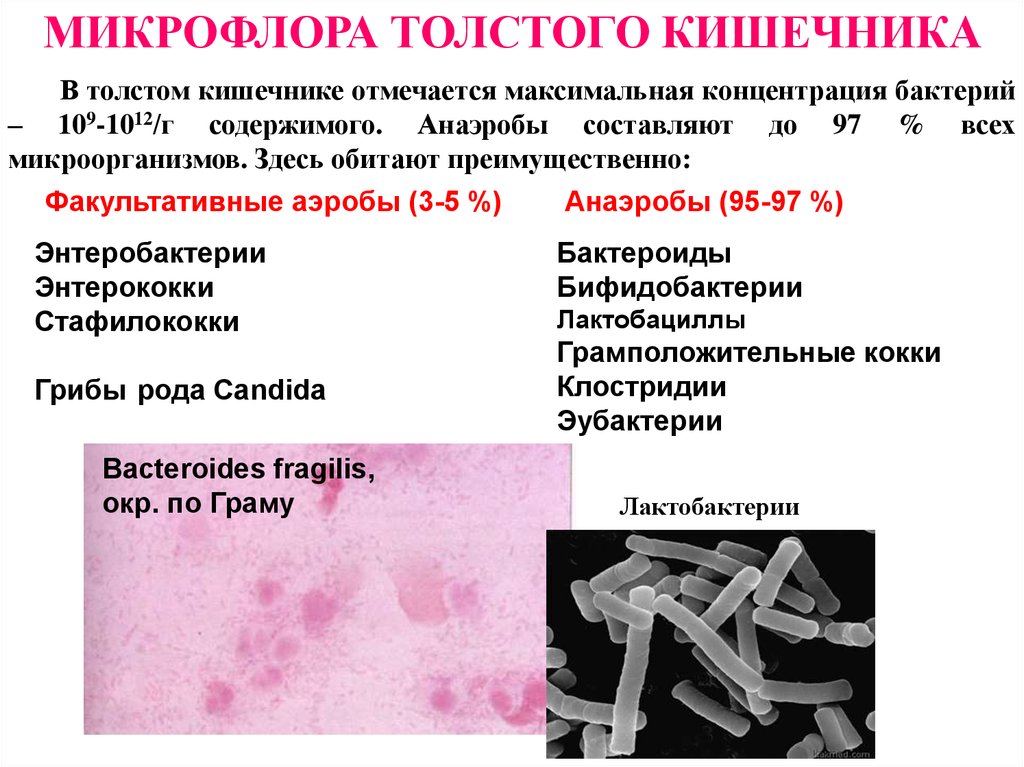 Являюсь. Дж. Физиол. — Гастроинтест. Физиол печени. 2016;310:G989–G998. [PubMed] [Google Scholar]
Являюсь. Дж. Физиол. — Гастроинтест. Физиол печени. 2016;310:G989–G998. [PubMed] [Google Scholar]
63. Хуанг Р., Ван К., Ху Дж. Влияние пробиотиков на депрессию: систематический обзор и метаанализ рандомизированных контролируемых испытаний. Питательные вещества. 2016; 8:1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Steenbergen L, Sellaro R, van Hemert S, Bosch JA, Colzato LS. Рандомизированное контролируемое исследование для проверки влияния пробиотиков разных видов на когнитивную реакцию на грустное настроение. Мозг. Поведение Иммун. 2015; 48: 258–264. [PubMed] [Академия Google]
Экологическая роль лактобактерий в желудочно-кишечном тракте: значение для фундаментальных и биомедицинских исследований
1. Ahola, A.J., H. Yli-Knuuttila, T. Suomalainen, T. Poussa, A. Ahlstrom, J.H. Meurman, and R. Korpela . 2002. Кратковременное потребление сыра, содержащего пробиотики, и его влияние на факторы риска кариеса. Арка Оральный биол. 47 : 799-804.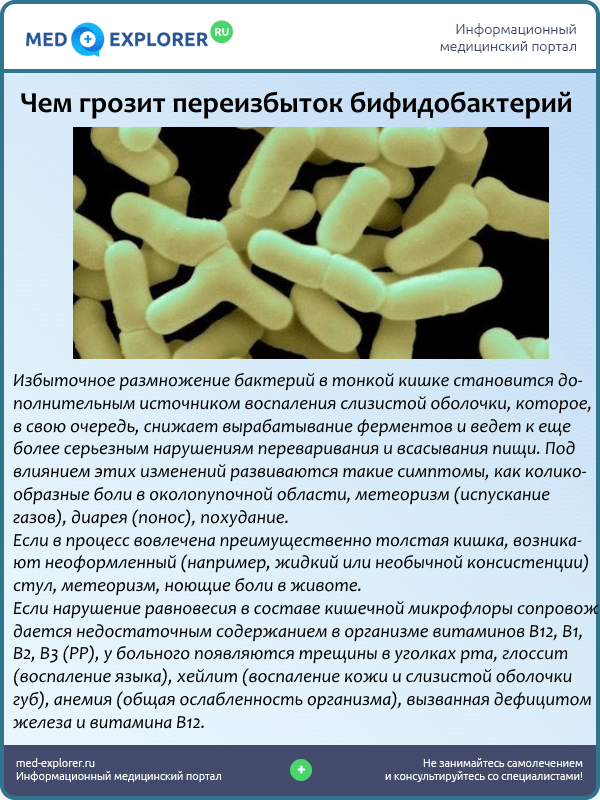 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
2. Александр, М. 1971. Микробная экология. John Wiley and Sons, Нью-Йорк, штат Нью-Йорк.
3. Альтерманн Э., В. М. Рассел, М. А. Азкарате-Перил, Р. Баррангу, Б. Л. Бак, О. Маколифф, Н. Саутер, А. Добсон, Т. Дуонг, М. Калланан, С. Лик, А. Хамрик, Р. Кано и Т. Р. Кленхаммер. 2005. Полная последовательность генома пробиотической молочнокислой бактерии Lactobacillus acidophilus NCFM. проц. Натл. акад. науч. США 102 : 3906-3912. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Бакхед Ф., Р. Э. Лей, Дж. Л. Зонненбург, Д. А. Петерсон и Дж. И. Гордон. 2005. Хозяин-бактериальный мутуализм в кишечнике человека. Наука 307 : 1915-1920. [PubMed] [Google Scholar]
5. Баррангу Р., Э. Альтерманн, Р. Хаткинс, Р. Кано и Т. Р. Клаенхаммер. 2003. Функциональный и сравнительный геномный анализ оперона, участвующего в утилизации фруктоолигосахаридов Lactobacillus acidophilus . проц. Натл. акад. науч. США 100 : 8957-8962. [Бесплатная статья PMC] [PubMed] [Google Scholar]
акад. науч. США 100 : 8957-8962. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Баррангоу Р., М. А. Азкарат-Перил, Т. Дуонг, С. Б. Коннерс, Р. М. Келли и Т. Р. Клаенхаммер. 2006. Глобальный анализ использования углеводов Lactobacillus acidophilus с использованием микрочипов кДНК. проц. Натл. акад. науч. США 103 : 3816-3821. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Берг, Р. Д. 1996. Местная микрофлора желудочно-кишечного тракта. Тенденции микробиол. 4 : 430-435. [PubMed] [Google Scholar]
8. Берг Р. Д. и Д. К. Сэвидж. 1975. Иммунные ответы специфических безпатогенных и гнотобиотических мышей на антигены аборигенных и неаборигенных микроорганизмов. Заразить. Иммун. 11 : 320-329. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Берг Р. Д. и Д. К. Сэвидж. 1972. Иммунологические реакции и местные микроорганизмы желудочно-кишечного тракта. Являюсь. Дж. Клин. Нутр. 25 : 1364-1371. [PubMed] [Google Scholar]
Клин. Нутр. 25 : 1364-1371. [PubMed] [Google Scholar]
10. Бик Э. М., П. Б. Экбург, С. Р. Гилл, К. Э. Нельсон, Э. А. Пурдом, Ф. Франсуа, Г. Перес-Перес, М. Дж. Блазер и Д. А. Релман. 2006. Молекулярный анализ бактериальной микробиоты желудка человека. проц. Натл. акад. науч. США 103 : 732-737. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Booijink, C.C., E.G. Zoetendal, M. Kleerebezem, and WM de Vos. 2007. Микробные сообщества в тонком кишечнике человека: сочетание разнообразия с метагеномикой. Будущая микробиология. 2 : 285-295. [PubMed] [Google Scholar]
12. Брукс С.П., М. Макаллистер, М. Сандоз и М.Л. Калмокофф. 2003. Независимый от культуры филогенетический анализ фекальной флоры крыс. Может. Дж. Микробиол. 49 : 589-601. [PubMed] [Google Scholar]
13. Bunte, C., C. Hertel, and W. P. Hammes. 2000. Мониторинг и выживание Lactobacillus paracasei LTH 2579 в пищевых продуктах и желудочно-кишечном тракте человека.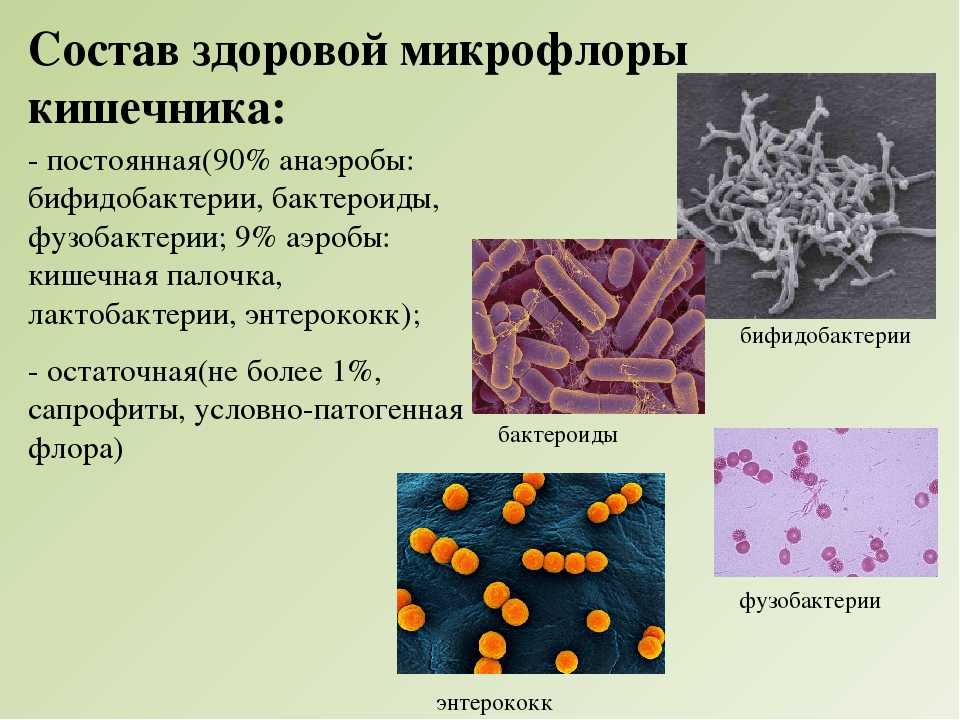 Сист. заявл. микробиол. 23 : 260-266. [PubMed] [Google Scholar]
Сист. заявл. микробиол. 23 : 260-266. [PubMed] [Google Scholar]
14. Christensen, H.R., H. Frokier, and J.J. Pestka. 2002. Лактобациллы по-разному модулируют экспрессию цитокинов и маркеров поверхности созревания в мышиных дендритных клетках. Дж. Иммунол. 168 : 171-178. [PubMed] [Google Scholar]
. Коллинз, Д. Хиггинс, Ф. Шанахан, Г. Ф. Фицджеральд, Д. ван Синдерен и П. В. О’Тул. 2006. Многорепликонная архитектура генома Lactobacillus salivarius . проц. Натл. акад. науч. США 103 : 6718-6723. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Dal Bello, F., and C. Hertel. 2006. Полость рта как естественный резервуар кишечных лактобацилл. Сист. заявл. микробиол. 29 : 69-76. [PubMed] [Google Scholar]
17. Dal Bello, F., J. Walter, WP Hammes, and C. Hertel. 2003. Усложнение видового состава молочнокислых бактерий в фекалиях человека, выявленное при альтернативных условиях инкубации.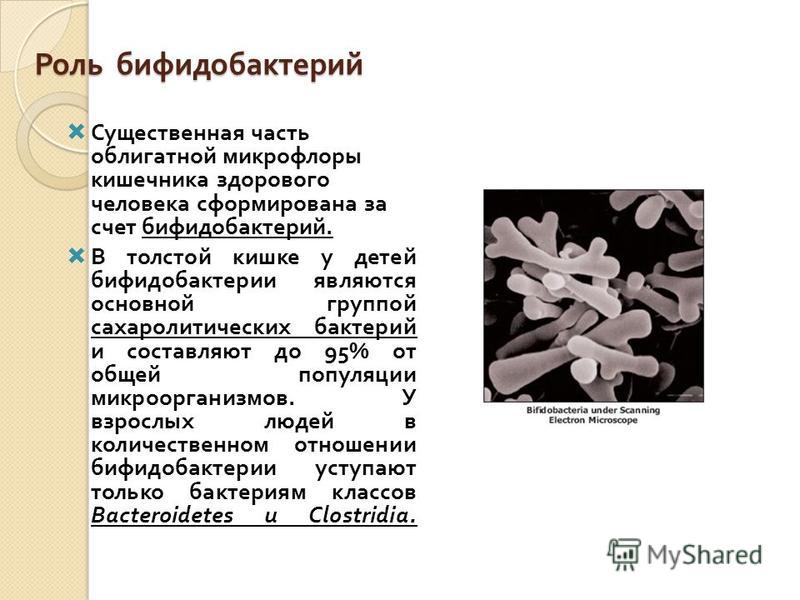 микроб. Экол. 45 : 455-463. [PubMed] [Google Scholar]
микроб. Экол. 45 : 455-463. [PubMed] [Google Scholar]
18. Дэй, Р. Л., К. Н. Лаланд и Ф. Дж. Одлинг-Сми. 2003. Переосмысление адаптации: перспектива построения ниши. Перспектива. биол. Мед. 46 : 80-95. [PubMed] [Академия Google]
19. Denou, E., R.D. Pridmore, B. Berger, J.M. Panoff, F. Arigoni, and H. Brussow. 2008. Идентификация генов, связанных с фенотипом длительного персистенции кишечника пробиотика Lactobacillus johnsonii , штамм NCC533, с использованием комбинации анализа геномики и транскриптома. Дж. Бактериол. 190 : 3161-3168. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Duchmann, R., I. Kaiser, E. Hermann, W. Mayet, K. Ewe и KH Meyer zum Buschenfelde. 1995. Толерантность к резидентной кишечной флоре существует, но нарушается при активном воспалительном заболевании кишечника (ВЗК). клин. Эксп. Иммунол. 102 : 448-455. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Данн, К., Л. Мерфи, С. Флинн, Л. О’Махони, С. О’Халлоран, М. Фини, Д. Моррисси, Г. , Thornton, G. Fitzgerald, C. Daly, B. Kiely, E. M. Quigley, GC O’Sullivan, F. Shanahan и JK Collins. 1999. Пробиотики: от мифа к реальности. Демонстрация функциональности на животных моделях заболеваний и в клинических испытаниях на людях. Антони ван Левенгук 76 : 279-292. [PubMed] [Google Scholar]
Данн, К., Л. Мерфи, С. Флинн, Л. О’Махони, С. О’Халлоран, М. Фини, Д. Моррисси, Г. , Thornton, G. Fitzgerald, C. Daly, B. Kiely, E. M. Quigley, GC O’Sullivan, F. Shanahan и JK Collins. 1999. Пробиотики: от мифа к реальности. Демонстрация функциональности на животных моделях заболеваний и в клинических испытаниях на людях. Антони ван Левенгук 76 : 279-292. [PubMed] [Google Scholar]
22. Экбург, П. Б., Э. М. Бик, К. Н. Бернштейн, Э. Пурдом, Л. Детлефсен, М. Сарджент, С. Р. Гилл, К. Э. Нельсон и Д. А. Релман. 2005. Разнообразие микробной флоры кишечника человека. Наука 308 : 1635-1638. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Finegold, S.M., HR Attebery, and VL Sutter. 1974. Влияние диеты на фекальную флору человека: сравнение японской и американской диет. Являюсь. Дж. Клин. Нутр. 27 : 1456-1469. [PubMed] [Google Scholar]
24. Finegold, S.M., VL Sutter, and GE Mathisen. 1983. Нормальная индигенная кишечная флора, с. 3-31. В Д. Дж. Хентгес (ред.), Кишечная микробиота человека в норме и при болезнях. Academic Press, Нью-Йорк, штат Нью-Йорк.
3-31. В Д. Дж. Хентгес (ред.), Кишечная микробиота человека в норме и при болезнях. Academic Press, Нью-Йорк, штат Нью-Йорк.
25. Фрэнк Д. Н. и Н. Р. Пейс. 2008. Микробиология желудочно-кишечного тракта вступает в эру метагеномики. Курс. мнение Гастроэнтерол. 24 : 4-10. [PubMed] [Google Scholar]
26. Франк, Д. Н., А. Л. Сент-Аманд, Р. А. Фельдман, Э. К. Бодекер, Н. Харпаз и Н. Р. Пейс. 2007. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. проц. Натл. акад. науч. США 104 : 13780-13785. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Фуллер Р. и Б. Э. Брукер. 1974. Лактобациллы, прикрепляющиеся к эпителию зобов птиц. Являюсь. Дж. Клин. Нутр. 27 : 1305-1312. [PubMed] [Google Scholar]
28. Гилл Х. и Дж. Прасад. 2008. Пробиотики, иммуномодуляция и польза для здоровья. Доп. Эксп. Мед. биол. 606 : 423-454. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
29. Goh, YJ, JH Lee, and RW Hutkins. 2007. Функциональный анализ оперона утилизации фруктоолигосахаридов в Lactobacillus paracasei 1195. Заявл. Окружающая среда. микробиол. 73 : 5716-5724. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Гордон, Х. А., и Л. Пести. 1971. Гнотобиотическое животное как инструмент в изучении взаимоотношений микробов-хозяев. бактериол. Ред. 35 : 390-429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Hammes, W.P., and R.F. Vogel. 1995. Род Lactobacillus , с. 19-54. В Б. Ж.-Б. Вуд и У. Х. Хольцапфель (ред.), Роды молочнокислых бактерий, том. 2. Blackie Academic and Professional, Лондон, Великобритания. [Академия Google]
32. Хардин Г. 1960. Принцип конкурентного исключения. Наука 131 : 1292-1297. [PubMed] [Google Scholar]
33. Harmsen, H.J., G.C. Raangs, T. He, J.E. Degener, and G.W. Welling. 2002. Обширный набор зондов на основе 16S рРНК для обнаружения бактерий в фекалиях человека. заявл. Окружающая среда. микробиол. 68 : 2982-2990. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2002. Обширный набор зондов на основе 16S рРНК для обнаружения бактерий в фекалиях человека. заявл. Окружающая среда. микробиол. 68 : 2982-2990. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Hayashi, H., M. Sakamoto, and Y. Benno. 2002. Фекальное микробное разнообразие у строгого вегетарианца, определенное с помощью молекулярного анализа и культивирования. микробиол. Иммунол. 46 : 819-831. [PubMed] [Google Scholar]
35. Хаяши Х., М. Сакамото и Ю. Бенно. 2002. Филогенетический анализ микробиоты кишечника человека с использованием библиотек клонов 16S рДНК и строго анаэробных методов на основе культивирования. микробиол. Иммунол. 46 : 535-548. [PubMed] [Google Scholar]
36. Хаяши Х., Р. Такахаши, Т. Ниши, М. Сакамото и Ю. Бенно. 2005. Молекулярный анализ микробиоты тощей, подвздошной, слепой и прямой кишки человека с использованием библиотек генов 16S рРНК и полиморфизма длины концевых рестрикционных фрагментов. Дж. Мед. микробиол. 54 : 1093-1101. [PubMed] [Google Scholar]
Дж. Мед. микробиол. 54 : 1093-1101. [PubMed] [Google Scholar]
37. Холд, Г. Л., С. Э. Прайд, В. Дж. Рассел, В. Дж. Фурри и Х. Дж. Флинт. 2002. Оценка микробного разнообразия в образцах толстой кишки человека с помощью анализа последовательности 16S рДНК. ФЭМС микробиол. Экол. 39 : 33-39. [PubMed] [Google Scholar]
38. Jacobsen, C.N., V. Rosenfeldt Nielsen, A.E. Hayford, PL Moller, K.F. Michaelsen, A. Paerregaard, B. Sandstrom, M. Tvede, and M. Jakobsen. 1999. Скрининг пробиотической активности сорока семи штаммов Lactobacillus spp. методами in vitro и оценкой способности пяти выбранных штаммов к колонизации человека. заявл. Окружающая среда. микробиол. 65 : 4949-4956. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Кендлер О. и Н. Вайс. 1986. Регулярные неспорообразующие грамположительные палочки, с. 1208-1234 гг. В PHA Sneath, NS Mair, ME Sharpe, and JG Holt (ed.), Bergey’s manual of systemic bacteriology, vol. 2. Уильямс и Уилкинс, Балтимор, Мэриленд. [Академия Google]
2. Уильямс и Уилкинс, Балтимор, Мэриленд. [Академия Google]
40. Кассен Р. и П. Б. Рейни. 2004. Экология и генетика микробного разнообразия. Анну. Преподобный Микробиолог. 58 : 207-231. [PubMed] [Google Scholar]
41. Кимура К., А. Л. Маккартни, М. А. МакКоннелл и Г. В. Таннок. 1997. Анализ фекальных популяций бифидо- и лактобактерий и исследование иммунологических реакций их хозяев-людей на преобладающие штаммы. заявл. Окружающая среда. микробиол. 63 : 3394-3398. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Клееребезем, М., Дж. Боекхорст, Р. ван Краненбург, Д. Моленаар, О.П. Койперс, Р. Леер, Р. Тарчини, С.А. Петерс, Х.М. Сандбринк, М.В. Фиерс, В. Стикема, Р.М. Брон, С.М. Хоффер, М.Н. Гроот, Р. Керховен, М. де Врис, Б. Урсинг, В. М. де Вос и Р. Дж. Зизен. 2003. Полная последовательность генома Lactobacillus plantarum WCFS1. проц. Натл. акад. науч. США 100 : 1990-1995. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Клок Б., М. Сванберг и Л. Г. Петерссон. 1990. Кариес зубов, мутантные стрептококки, лактобациллы и скорость секреции слюны у взрослых. Сообщество Дент. Оральный эпидемиол. 18 : 249-252. [PubMed] [Google Scholar]
Клок Б., М. Сванберг и Л. Г. Петерссон. 1990. Кариес зубов, мутантные стрептококки, лактобациллы и скорость секреции слюны у взрослых. Сообщество Дент. Оральный эпидемиол. 18 : 249-252. [PubMed] [Google Scholar]
44. Lan, P.T., H. Hayashi, M. Sakamoto, and Y. Benno. 2002. Филогенетический анализ микробиоты слепой кишки кур с использованием библиотек клонов 16S рДНК. микробиол. Иммунол. 46 : 371-382. [PubMed] [Google Scholar]
45. Lerche, M., and G. Reuter. 1961. Isolierung und Differenzierung anaerober Lactobacillaceae aus dem Darm erwachsener Menschen (Beitrag zum Lactobacillus Bifidus-Problem). Центральный бл. Бактериол. 180 : 324-356. [Google Scholar]
46. Leser, T.D., JZ Amenuvor, T.K. Jensen, R.H. Lindecrona, M. Boye, and K. Moller. 2002. Независимый от культуры анализ кишечных бактерий: новый взгляд на микробиоту желудочно-кишечного тракта свиней. заявл. Окружающая среда. микробиол. 68 : 673-690. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Ley, RE, F. Backhed, P. Turnbaugh, CA Lozupone, RD Knight и JI Gordon. 2005. Ожирение изменяет микробную экологию кишечника. проц. Натл. акад. науч. США 102 : 11070-11075. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Лей, Р. Э., Д. А. Петерсон и Дж. И. Гордон. 2006. Экологические и эволюционные силы, формирующие микробное разнообразие в кишечнике человека. Сотовый 124 : 837-848. [PubMed] [Google Scholar]
49. Лей, Р. Э., П. Дж. Тернбо, С. Кляйн и Дж. И. Гордон. 2006. Микробная экология: микробы кишечника человека, связанные с ожирением. Природа 444 : 1022-1023. [PubMed] [Google Scholar]
50. Liu, M., F. H. van Enckevort, and R. J. Siezen. 2005. Обновление генома: секвенирование генома молочнокислых бактерий находится на подъеме. Микробиология 151 : 3811-3814. [PubMed] [Google Scholar]
51. Лу, Дж., У. Идрис, Б. Хармон, К. Хофакр, Дж. Дж. Маурер и М. Д. Ли. 2003. Разнообразие и сукцессия кишечного бактериального сообщества созревающих цыплят-бройлеров. заявл. Окружающая среда. микробиол. 69 : 6816-6824. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Хармон, К. Хофакр, Дж. Дж. Маурер и М. Д. Ли. 2003. Разнообразие и сукцессия кишечного бактериального сообщества созревающих цыплят-бройлеров. заявл. Окружающая среда. микробиол. 69 : 6816-6824. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Мэдиган, М. Т., и Дж. М. Мартинко. 2006. Биология микроорганизмов, 11-е изд. Пирсон Прентис Холл, Аппер-Сэдл-Ривер, Нью-Джерси.
53. Мэдсен, К. 2006. Пробиотики и иммунный ответ. Дж. Клин. Гастроэнтерол. 40 : 232-234. [PubMed] [Google Scholar]
54. Мэдсен К.Л., Дойл Дж.С., Джуэлл Л.Д., Тавернини М.М., Федорак Р.Н. 1999. Виды Lactobacillus предотвращают колит у мышей с дефицитом гена интерлейкина 10. Гастроэнтерология 116 : 1107-1114. [PubMed] [Google Scholar]
55. Макарова К., Слесарев А., Вольф Ю., Сорокин А., Миркин Б., Кунин Е., Павлов А., Павлова Н., Карамычев В., Карамычев Н. Получин, В. Шахова, И. Григорьев, Ю. Лу, Д. Рохсар, С. Лукас, К. Хуанг, Д. М. Гудштейн, Т. Хокинс, В. Пленгвидья, Д. Велкер, Дж. Хьюз, Ю. Гох, А. Бенсон, К. Болдуин, Дж. Х. Ли, И. Диас-Мунис, Б. Дости, В. Смеянов, В. Вехтер, Р. Баработе, Г. Лорка, Э. Альтерманн, Р. Баррангоу, Б. Ганесан, Ю. Се, Х. Росторн, Д. Тамир, К. Паркер, Ф. Брейдт, Дж. Бродбент, Р. Хаткинс, Д. О’Салливан, Дж. Стил, Г. Унлу, М. Сайер, Т. Клаенхаммер, П. Ричардсон, С. Козявкин, Б. Веймер и Д. Миллс. 2006. Сравнительная геномика молочнокислых бактерий. проц. Натл. акад. науч. США 103 : 15611-15616. [Бесплатная статья PMC] [PubMed] [Google Scholar]
М. Гудштейн, Т. Хокинс, В. Пленгвидья, Д. Велкер, Дж. Хьюз, Ю. Гох, А. Бенсон, К. Болдуин, Дж. Х. Ли, И. Диас-Мунис, Б. Дости, В. Смеянов, В. Вехтер, Р. Баработе, Г. Лорка, Э. Альтерманн, Р. Баррангоу, Б. Ганесан, Ю. Се, Х. Росторн, Д. Тамир, К. Паркер, Ф. Брейдт, Дж. Бродбент, Р. Хаткинс, Д. О’Салливан, Дж. Стил, Г. Унлу, М. Сайер, Т. Клаенхаммер, П. Ричардсон, С. Козявкин, Б. Веймер и Д. Миллс. 2006. Сравнительная геномика молочнокислых бактерий. проц. Натл. акад. науч. США 103 : 15611-15616. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Марш П. и М. В. Мартин. 1999. Оральная микробиология, 4-е изд. Баттерворт-Хайнеманн, Оксфорд, Великобритания.
57. Марто, П., П. Пошар, Дж. Доре, К. Бера-Майе, А. Берналье и Г. Кортье. 2001. Сравнительное исследование групп бактерий в кишечной и фекальной микробиоте человека. заявл. Окружающая среда. микробиол. 67 : 4939-4942. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. McBurney, WT, 2003. Анализ микробиоты кишечника грызунов. Кандидат наук. Тезис. Университет Отаго, Данидин, Новая Зеландия.
McBurney, WT, 2003. Анализ микробиоты кишечника грызунов. Кандидат наук. Тезис. Университет Отаго, Данидин, Новая Зеландия.
59. Мечников Е. 1907. Продление жизни. Оптимистичные исследования. Уильям Хайнеманн, Лондон, Великобритания.
60. Микельсаар М., Р. М. Мандар и Э. Сепп. 1998. Молочнокислая микробиота в микробной экосистеме человека и ее развитие, с. 279-342. В С. Салминен и А. фон Райт (ред.), Молочнокислые бактерии: микробиология и функциональные аспекты. Марсель Деккер, Inc., Нью-Йорк, штат Нью-Йорк.
61. Mitsuoka, T. 1969. Сравнительные исследования лактобацилл из фекалий человека, свиней и кур. Центральный бл. Бактериол. 210 : 32-51. (На немецком языке.) [PubMed] [Google Scholar]
62. Mitsuoka, T. 1992. Желудочно-кишечный тракт человека, с. 69-114. В Б. Дж. Б. Вуд (ред.), Молочнокислые бактерии в норме и болезни, том. 1. Elsevier Applied Science, Лондон, Великобритания. [Google Scholar]
63. Мицуока Т. , К. Хаякава и Н. Кимура. 1975. Фекальная флора человека. III. Связь: состав лактобацилл флоры разных возрастных групп. Центральный бл. Бактериол. 232 : 499-511. (На немецком языке.) [PubMed] [Google Scholar]
, К. Хаякава и Н. Кимура. 1975. Фекальная флора человека. III. Связь: состав лактобацилл флоры разных возрастных групп. Центральный бл. Бактериол. 232 : 499-511. (На немецком языке.) [PubMed] [Google Scholar]
64. Миёси Ю., С. Окада, Т. Учимура и Э. Сато. 2006. Белок, способствующий адгезии слизи, MapA, опосредует адгезию Lactobacillus reuteri к эпителиальным клеткам кишечника человека Caco-2. Бионауч. Биотехнолог. Биохим. 70 : 1622-1628. [PubMed] [Google Scholar]
65. Морелли, Л. 2000. Селекция пробиотических лактобацилл in vitro: критическая оценка. Курс. Выпуски Интест. микробиол. 1 : 59-67. [PubMed] [Google Scholar]
66. Ouwehand, A.C., S. Salminen, and E. Isolauri. 2002. Пробиотики: обзор полезных эффектов. Антони ван Левенгук 82 : 279-289. [PubMed] [Google Scholar]
67. Пенья, Дж. А., А. Б. Роджерс, З. Ге, В. Нг, С. Ю. Ли, Дж. Г. Фокс и Дж. Версалович. 2005. Пробиотик Lactobacillus spp. уменьшить Helicobacter hepaticus -индуцированное воспалительное заболевание кишечника у мышей с дефицитом интерлейкина-10. Заразить. Иммун. 73 : 912-920. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Пробиотик Lactobacillus spp. уменьшить Helicobacter hepaticus -индуцированное воспалительное заболевание кишечника у мышей с дефицитом интерлейкина-10. Заразить. Иммун. 73 : 912-920. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Петерсон, Д. А., Н. П. Макналти, Дж. Л. Гуруге и Дж. И. Гордон. 2007. Ответ IgA на симбиотические бактерии как медиатор гомеостаза кишечника. Клеточный микроб-хозяин 2 : 328-339. [PubMed] [Google Scholar]
69. Pfeiler, E.A., and T.R. Klaenhammer. 2007. Геномика молочнокислых бактерий. Тенденции микробиол. 15 : 546-553. [PubMed] [Google Scholar]
70. Prescott, L.M., JP Harley, and D.A. Klein. 2005. Микробиология, 6-е изд. Макгроу-Хилл, Бостон, Массачусетс.
71. Придмор, Р. Д., Б. Бергер, Ф. Дезьер, Д. Виланова, К. Барретто, А. К. Питте, М. К. Цвален, М. Руве, Э. Альтерманн, Р. Баррангу, Б. Молле, А. Мерсенье, Т. Клаенхаммер, Ф. Аригон и М. А. Шелл. 2004. Последовательность генома пробиотической кишечной бактерии Lactobacillus johnsonii NCC 533. Proc. Натл. акад. науч. США 101 : 2512-2517. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2004. Последовательность генома пробиотической кишечной бактерии Lactobacillus johnsonii NCC 533. Proc. Натл. акад. науч. США 101 : 2512-2517. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Reuter, G. 2001. The Lactobacillus и Бифидобактерии Микрофлора кишечника человека: состав и последовательность. Курс. Выпуски Интест. микробиол. 2 : 43-53. [PubMed] [Google Scholar]
73. Reuter, G. 1965. Untersuchungen über die Zusammensetzung und die Beeinflussbarkeit der menschlichen Magen- und Darmflora unter besonderer Berücksichtigung der Laktobazillen. Ernährungsforschung 10 : 429-435. [Google Scholar]
74. Ринттила Т., А. Кассинен, Э. Малинен, Л. Крогиус, А. Палва. 2004. Разработка обширного набора праймеров, нацеленных на 16S рДНК, для количественного определения патогенных и местных бактерий в образцах фекалий с помощью ПЦР в реальном времени. Дж. Заявл. микробиол. 97 : 1166-1177. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
75. Роос С. и Х. Йонссон. 2002. Белок клеточной поверхности с высокой молекулярной массой из Lactobacillus reuteri 1063 прилипает к компонентам слизи. Микробиология 148 : 433-442. [PubMed] [Google Scholar]
76. Райан, К. Дж. 2004. Нормальная микробная флора. В К. Дж. Райан и К. Г. Рэй (ред.), Медицинская микробиология. Введение в инфекционные болезни, 4-е изд. Макгроу-Хилл, Нью-Йорк, штат Нью-Йорк.
77. Саарела М., Г. Могенсен, Р. Фонден, Дж. Матто и Т. Маттила-Сандхольм. 2000. Пробиотические бактерии: безопасность, функциональные и технологические свойства. Дж. Биотехнология. 84 : 197-215. [PubMed] [Google Scholar]
78. Salzman, N.H., H. de Jong, Y. Paterson, H.J. Harmsen, G.W. Welling, and N.A. Bos. 2002. Анализ 16S-библиотек микрофлоры желудочно-кишечного тракта мышей выявил большую новую группу кишечных бактерий мышей. Микробиология 148 : 3651-3660. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
79. Солнье Д. М., Д. Моленаар, В. М. де Вос, Г. Р. Гибсон и С. Колида. 2007. Идентификация пребиотического метаболизма фруктоолигосахаридов у Lactobacillus plantarum WCFS1 через микрочипы. заявл. Окружающая среда. микробиол. 73 : 1753-1765. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Savage, D.C. 1977. Микробная экология желудочно-кишечного тракта. Анну. Преподобный Микробиолог. 31 : 107-133. [PubMed] [Google Scholar]
81. Savage, D.C., R. Dubos, and RW Schaedler. 1968. Эпителий желудочно-кишечного тракта и его автохтонная бактериальная флора. Дж. Эксп. Мед. 127 : 67-76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Scanlan, P.D., F. Shanahan, C. O’Mahony, and J.R. Marchesi. 2006. Независимый от культуры анализ временных вариаций доминирующей фекальной микробиоты и целевых бактериальных подгрупп при болезни Крона. Дж. Клин. микробиол. 44 : 3980-3988. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Шелл, М. А., М. Кармиранцу, Б. Снел, Д. Виланова, Б. Бергер, Г. Песси, М. К. Цвален, Ф. Дезьер, П. Борк , М. Делли, Р. Д. Придмор и Ф. Аригон. 2002. Последовательность генома Bifidobacterium longum отражает его адаптацию к желудочно-кишечному тракту человека. проц. Натл. акад. науч. США 99 : 14422-14427. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Шиффрин, Э. Дж., Ф. Роша, Х. Линк-Амстер, Дж. М. Эшлиманн и А. Доннет-Хьюз. 1995. Иммуномодуляция клеток крови человека после приема молочнокислых бактерий. Дж. Молочная наука. 78 : 491-497. [PubMed] [Google Scholar]
85. Сигерс, Дж. Ф. 2002. Лактобациллы как векторы доставки живых вакцин: прогресс и перспективы. Тенденции биотехнологии. 20 : 508-515. [PubMed] [Google Scholar]
86. Sghir, A., G. Gramet, A. Suau, V. Rochet, P. Pochart, and J. Dore. 2000. Количественная оценка групп бактерий в фекальной флоре человека с помощью гибридизации олигонуклеотидных зондов. заявл. Окружающая среда. микробиол. 66 : 2263-2266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
заявл. Окружающая среда. микробиол. 66 : 2263-2266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Виренга, Ю. ван Койк и М. Л. Капсенберг. 2005. Селективные пробиотические бактерии индуцируют IL-10-продуцирующие регуляторные Т-клетки in vitro путем модулирования функции дендритных клеток посредством специфичной для дендритных клеток молекулы межклеточной адгезии, захватывающей 3-захватывающий нонинтегрин. Дж. Аллергия Клин. Иммунол. 115 : 1260-1267. [PubMed] [Google Scholar]
88. Spanhaak, S., R. Havenaar, and G. Schaafsma. 1998. Влияние потребления молока, ферментированного штаммом Широта Lactobacillus casei , на микрофлору кишечника и иммунные показатели человека. Евро. Дж. Клин. Нутр. 52 : 899-907. [PubMed] [Google Scholar]
89. Steidler, L. 2003. Генно-инженерные пробиотики. Лучшая практика. Рез. клин. Гастроэнтерол. 17 : 861-876. [PubMed] [Академия Google]
90. Суау, А., Р. Боннет, М. Сутрен, Дж. Дж. Годон, Г. Р. Гибсон, М. Д. Коллинз и Дж. Дор. 1999. Прямой анализ генов, кодирующих 16S рРНК из сложных сообществ, выявил множество новых молекулярных видов в кишечнике человека. заявл. Окружающая среда. микробиол. 65 : 4799-4807. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Суау, А., Р. Боннет, М. Сутрен, Дж. Дж. Годон, Г. Р. Гибсон, М. Д. Коллинз и Дж. Дор. 1999. Прямой анализ генов, кодирующих 16S рРНК из сложных сообществ, выявил множество новых молекулярных видов в кишечнике человека. заявл. Окружающая среда. микробиол. 65 : 4799-4807. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Tannock, GW 1999. Анализ кишечной микрофлоры: возрождение. Антони ван Левенгук 76 : 265-278. [PubMed] [Академия Google]
92. Tannock, G.W. 1992. Молочнокислая микробиота свиней, мышей и крыс, с. 21-48. В Б. Дж. Б. Вуд (ред.), Молочнокислые бактерии в норме и болезни, том. 1. Elsevier Applied Science, Лондон, Великобритания. [Google Scholar]
93. Tannock, G.W. 1995. Нормальная микрофлора: введение в микробы, населяющие организм человека. Чепмен и Холл, Лондон, Великобритания.
94. Tannock, G.W. 2004. Особое пристрастие к лактобактериям. заявл. Окружающая среда. микробиол. 70 : 3189-3194. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Tannock, GW, S. Ghazally, J. Walter, D. Loach, H. Brooks, G. Cook, M. Surette, C. Simmers, P. Бремер, Ф. Даль Белло и К. Хертель. 2005. На экологическое поведение Lactobacillus reuteri 100-23 влияет мутация гена luxS . заявл. Окружающая среда. микробиол. 71 : 8419-8425. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Tannock, GW, K. Munro, HJ Harmsen, GW Welling, J. Smart и P.K. Gopal. 2000. Анализ фекальной микрофлоры людей, потребляющих пробиотический продукт, содержащий Лактобактерии рамнозус DR20. заявл. Окружающая среда. микробиол. 66 : 2578-2588. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Tappenden, K.A., and A.S. Deutsch. 2007. Физиологическая значимость кишечной микробиоты: вклад в здоровье человека. Варенье. Сб. Нутр. 26 : 679S-683S. [PubMed] [Google Scholar]
98. Tsuji, N.M. 2006. Антиген-специфические CD4(+) регуляторные Т-клетки в кишечнике. Воспаление. Лекарства от аллергии Цели 5 : 191-201. [PubMed] [Google Scholar]
Воспаление. Лекарства от аллергии Цели 5 : 191-201. [PubMed] [Google Scholar]
99. van der Waaij, L.A., HJ Harmsen, M. Madjipour, FG Kroese, M. Zwiers, HM van Dullemen, NK de Boer, GW Welling и PL Jansen. 2005. Бактериальный популяционный анализ биоптатов толстой кишки и терминального отдела подвздошной кишки человека с помощью флуоресцентных зондов на основе 16S рРНК: комменсальные бактерии живут во взвешенном состоянии и не имеют прямого контакта с эпителиальными клетками. Воспаление. Кишечник Дис. 11 : 865-871. [PubMed] [Google Scholar]
100. Vanhoutte, T., G. Huys, E. De Brandt, and J. Swings. 2004. Анализ временной стабильности микробиоты в фекалиях человека с помощью денатурирующего градиентного гель-электрофореза с использованием универсальных и групповых праймеров гена 16S рРНК. ФЭМС микробиол. Экол. 48 : 437-446. [PubMed] [Google Scholar]
101. Велес, М. П., С. К. Де Кеерсмакер и Дж. Вандерлейден. 2007. Факторы адгезии Lactobacillus в желудочно-кишечном тракте человека. ФЭМС микробиол. лат. 276 : 140-148. [PubMed] [Google Scholar]
2007. Факторы адгезии Lactobacillus в желудочно-кишечном тракте человека. ФЭМС микробиол. лат. 276 : 140-148. [PubMed] [Google Scholar]
102. Walter, J., P. Chagnaud, GW Tannock, DM Loach, F. Dal Bello, HF Jenkinson, WP Hammes, and C. Hertel. 2005. Высокомолекулярный поверхностный белок (Lsp) и метионинсульфоксидредуктаза B (MsrB) вносят вклад в экологические характеристики Lactobacillus reuteri в кишечнике мышей. заявл. Окружающая среда. микробиол. 71 : 979-986. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Walter, J., NC Heng, WP Hammes, DM Loach, GW Tannock и C. Hertel. 2003. Идентификация генов Lactobacillus reuteri , специфически индуцируемых в желудочно-кишечном тракте мыши. заявл. Окружающая среда. микробиол. 69 : 2044-2051. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Walter, J., C. Hertel, GW Tannock, CM Lis, K. Munro и WP Hammes. 2001. Обнаружение Lactobacillus , Pediococcus , Leuconostoc и Weissella в фекалиях человека с использованием группоспецифичных праймеров для ПЦР и денатурирующего градиентного гель-электрофореза. заявл. Окружающая среда. микробиол. 67 : 2578-2585. [Бесплатная статья PMC] [PubMed] [Google Scholar]
заявл. Окружающая среда. микробиол. 67 : 2578-2585. [Бесплатная статья PMC] [PubMed] [Google Scholar]
105. Уолтер Дж., Д. М. Лоуч, М. Алкумбер, К. Рокель, К. Германн, М. Пфитценмайер и Г. В. Таннок. 2007. Истощение тейхоевых кислот D-аланиловым эфиром в Lactobacillus reuteri 9.0026 100-23 приводит к нарушению колонизации желудочно-кишечного тракта мыши. Окружающая среда. микробиол. 9 : 1750-1760. [PubMed] [Google Scholar]
106. Уолтер Дж., К. Шваб, Д. М. Лоуч, М. Г. Ганцле и Г. В. Таннок. 2008. Глюкозилтрансфераза A (GtfA) и инулосахараза (Inu) из Lactobacillus reuteri TMW1.106 способствуют агрегации клеток, образованию биопленки in vitro и колонизации желудочно-кишечного тракта мыши. Микробиология 154 : 72-80. [PubMed] [Академия Google]
107. Ван, М., С. Арне, Б. Джеппссон и Г. Молин. 2005. Сравнение бактериального разнообразия кишечного тракта человека путем прямого клонирования и секвенирования генов 16S рРНК. ФЭМС микробиол. Экол. 54 : 219-231. [PubMed] [Google Scholar]
ФЭМС микробиол. Экол. 54 : 219-231. [PubMed] [Google Scholar]
108. Ван, К., Г. М. Гаррити, Дж. М. Тидже и Дж. Р. Коул. 2007. Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой таксономии бактерий. заявл. Окружающая среда. микробиол. 73 : 5261-5267. [Бесплатная статья PMC] [PubMed] [Google Scholar]
109. Wang, X., S.P. Heazlewood, D.O. Krause и T.H. Florin. 2003. Молекулярная характеристика видов микробов, колонизирующих слизистую оболочку подвздошной и толстой кишки человека, с использованием анализа последовательности 16S рДНК. Дж. Заявл. микробиол. 95 : 508-520. [PubMed] [Google Scholar]
110. Xu, J., M.K. Bjursell, J. Himrod, S. Deng, L.K. Carmichael, HC Chiang, L.V. Hooper, and J.I. Gordon. 2003. Геномный взгляд на симбиоз человек- Bacteroides thetaiotaomicron . Наука 299 : 2074-2076. [PubMed] [Google Scholar]
111. Сюй Дж. и Дж.