Скрининговые обследования при беременности
Метод УЗИ используется на протяжении всей беременности. Согласно приказу Минздрава России №572н от 12 ноября 2012 г., скрининговое ультразвуковое исследование плода должно проводиться трехкратно:
с 11 по 14 недели – первый скрининг
с 18 по 21 недели — второй скрининг
с 30 по 34 недели — третий скрининг
Скрининг (от англ. screening «отбор, сортировка») — это комплексная диагностика беременных женщин. Скрининг включает анализ крови (биохимическое исследование) и УЗИ плода. Результаты скрининга помогают определить, есть ли вероятность рождения ребенка с пороками развития, существует ли угроза здоровью женщины. Если риски есть, то беременной назначается дополнительное обследование.
В клинике «Геном-Калининград» для УЗИ беременных используется оборудование класса «Эксперт» от ведущего мирового производителя Samsung.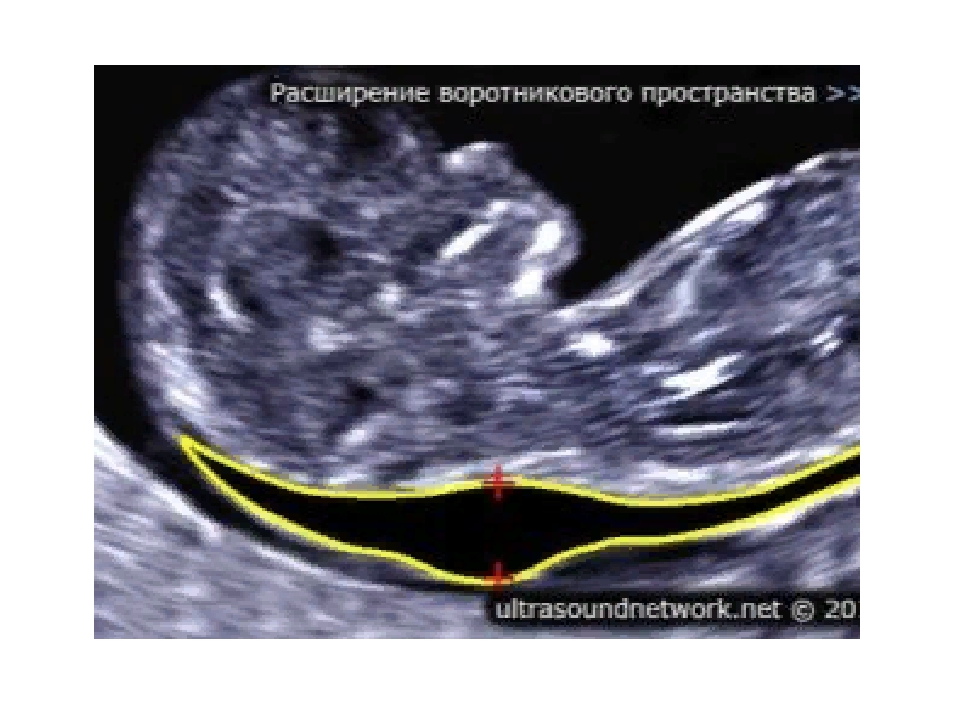
УЗИ на ранних сроках беременности
Самое первое УЗИ беременности проводится ещё до скрининговых сроков — на 6-10 неделе. При этом используется трансвагинальный датчик.
Цели исследования:
— Подтвердить факт беременности
— Определить число эмбрионов в матке и убедиться, что они нормально развиваются.
— Оценить будущую жизнеспособность плода. Это возможно по показателям сердцебиения (количество ударов в минуту должен составить 180 ± 7 ударов) и двигательной активности.
Показанием для проведения исследования является наличие болей внизу живота или кровянистых выделений из влагалища, а также отягощённый акушерский анамнез — неразвивающиеся или внематочные беременности, самопроизвольные выкидыши.
Особенности скрининга I триместра
На сроке с 11 по 14 недели УЗИ проводится, как правило, трансабдоминально и лишь в определённых случаях — трансвагинально.
1) Установить точный срок беременности. Определив размер плода, можно установить дату зачатия и родов.
2) Выявить факт неразвивающейся беременности.
3) Подтвердить или опровергнуть факт многоплодной беременности. Около 10% женщин после процедуры ЭКО получают беременность многоплодную. В этом случае важно определить, нормально ли развиваются малыши, как обстоит дело с плацентой – она одна на всех или у каждого ребёнка «своя». Это позволит выбрать правильную стратегию наблюдения беременности.
4) Определить, где располагается хорион, в каком состоянии находятся желточный мешок и оболочки эмбриона.
5) Определить длину эмбриона. Она измеряется показателем КТР (копчико-теменной размер). Таблица нормальных значений ВТП (толщина воротникового пространства), которая имеет важное значения для диагностирования генетических нарушений плода, разработана для сроков, когда КТР плода составляет минимум 45 мм, а максимум 84 мм.
Таблица нормальных значений ВТП (толщина воротникового пространства), которая имеет важное значения для диагностирования генетических нарушений плода, разработана для сроков, когда КТР плода составляет минимум 45 мм, а максимум 84 мм.
Показатель ТВП (толщина воротникового пространства), отличный от нормы, указывает на риск развития синдрома Дауна у малыша (трисомия по 21 хромосоме). Трисомия означает, что в кариотипе человека имеется дополнительная хромосома, что приводит к различным отклонениям в развитии. Расширение ТВП бывает более чем при 50 различных пороках развития плода и при внутриутробной гибели плода. Но в некоторых случаях увеличение ТВП происходит по другим причинам. Здоровье малыша при этом может быть в норме.
Для оценки риска развития хромосомных аномалий плода учитываются не только данные УЗИ, но и результаты анализа крови, возраст матери, данные анамнеза. Экспертное УЗИ в I триместре поможет исключить такие тяжелейшие генетические патологии, как синдром Дауна, синдром Эдвардса, синдром Патау, тройной набор хромосом у ребенка, патологии зачатка центральной нервной системы, пуповинная грыжа (омфалоцеле) и другие
В первом триместре на УЗИ важно также определить размер головы, ее окружность, диаметр и расстояние от лба до затылка, наличие носовой косточки у будущего ребенка, пупочных артерий, размеры верхнечелюстной кости, мочевого пузыря, сердца, местонахождение желудка, сердца и других жизненно важных органов, частоту сердцебиения плода. Экспертное УЗИ оборудование даёт возможность специалисту обнаружить даже самые незначительные отклонения от нормы, что позволяет акушеру-гинекологу своевременно принять необходимые меры по улучшению ситуации.
Экспертное УЗИ оборудование даёт возможность специалисту обнаружить даже самые незначительные отклонения от нормы, что позволяет акушеру-гинекологу своевременно принять необходимые меры по улучшению ситуации.
Подозрение на генетические патологии и выявление аномалий развития плода по результатам скрининга I триместра являются поводом для проведения неинвазивного пренатального теста или инвазивной диагностики.
Особенности скрининга II триместра
На сроке 20 — 24 недели врач детально исследует каждую часть тела плода, определяет положение плаценты, оценивает количество околоплодных вод и степень роста плода. Особое внимание уделяется оценке состояния головного мозга, лица, позвоночника, сердца, желудка, кишечника, почек и конечностей.
Особенности скрининга III триместра
На сроке с 30 по 34 недели беременности ультразвуковое исследование проводится для оценки развития плода. Специалист определяет:
— размер головки плода, живота и бедренной кости;
— вес плода;
— количество околоплодных вод;
— положение и состояние плаценты;
— состояние кровотока в плаценте, головке плода, маточных артериях с помощью цветного доплеровского картирования;
Кроме того, специалист пристально изучает движения плода.
В период третьего триместра экспертное УЗИ даст полную информацию о состояния плода, исключит наличие патологий развития и поможет определить наиболее точный срок родов. УЗИ необходимо проводить в срок и внепланово, по назначению врача, чтобы убедиться в состоянии плаценты, пуповины, определить предлежание ребенка и проч.
В скрининговые сроки врач оценивает состояние сердца плода, основных сосудов, регистрирует параметры кровотока в системе мать-плацента-плод. Для этого проводится допплерометрия, эхокардиография.
Исследование сердца плода показано в следующих случаях:
— в анамнезе женщины имеются врожденные аномалии сердца
— пациенткам с сахарным диабетом
— пациенткам, принимающим противоэпилептические препараты
— у плода толщина воротникового пространства превышает норму
— у плода обнаружены какие-либо другие пороки развития при плановых обследованиях
УЗИ беременности предполагает также измерение длины шейки матки. Метод носит название цервикометрия
Метод носит название цервикометрия
Ультразвуковое исследование в первом триместре беременности
Приходя на ультразвуковое исследование, многие беременные женщины задают вопрос, не несет ли оно какого-либо вреда для ее будущего ребенка. В этом листке вы получите ответ на этот вопрос, а также краткую информацию о том, зачем же проводится ультразвуковое исследование.
Безопасность ультразвука ранних сроках беременности подтверждена исследованиями Американского Института Ультразвука в Медицине, в ходе которых не было установлено каких-либо изменений тканей и клеток млекопитающих при облучении их ультразвуком. При использовании этого метода на протяжении более 20 лет не было получено данных о возникновении каких-либо осложнений у плода.
Ультразвуковое исследование позволяет не только установить наличие беременности, но и наблюдать за процессами роста и развития эмбриона, своевременно выявлять замершую беременность, внематочную беременность, установить причину кровянистых выделений, заподозрить наличие хромосомной патологии у плода (например, болезни Дауна).
Почему важно провести исследование с 10 по 13 неделю беременности? До 10 недели размеры эмбриона менее 3 см, и невозможно оценить анатомическое строение органов плода даже при использовании самой современной аппаратуры. После 10 недель могут быть диагностированы выраженные пороки развития плода, которые несовместимы с жизнью или приводят к тяжелой инвалидизации. Прерывание беременности на более ранних сроках является, несомненно, менее травматичным, чем прерывание беременности при обнаружении пороков развития плода во втором триместре.
С 10 по 13 неделю можно выявить ультразвуковые маркеры (признаки) хромосомной патологии плода – увеличение толщины воротникового пространства плода и отсутствие у него носовой кости.
Толщина воротникового пространства плода – это размер участка между кожей плода и мягкими тканями, окружающими шейный отдел позвоночника.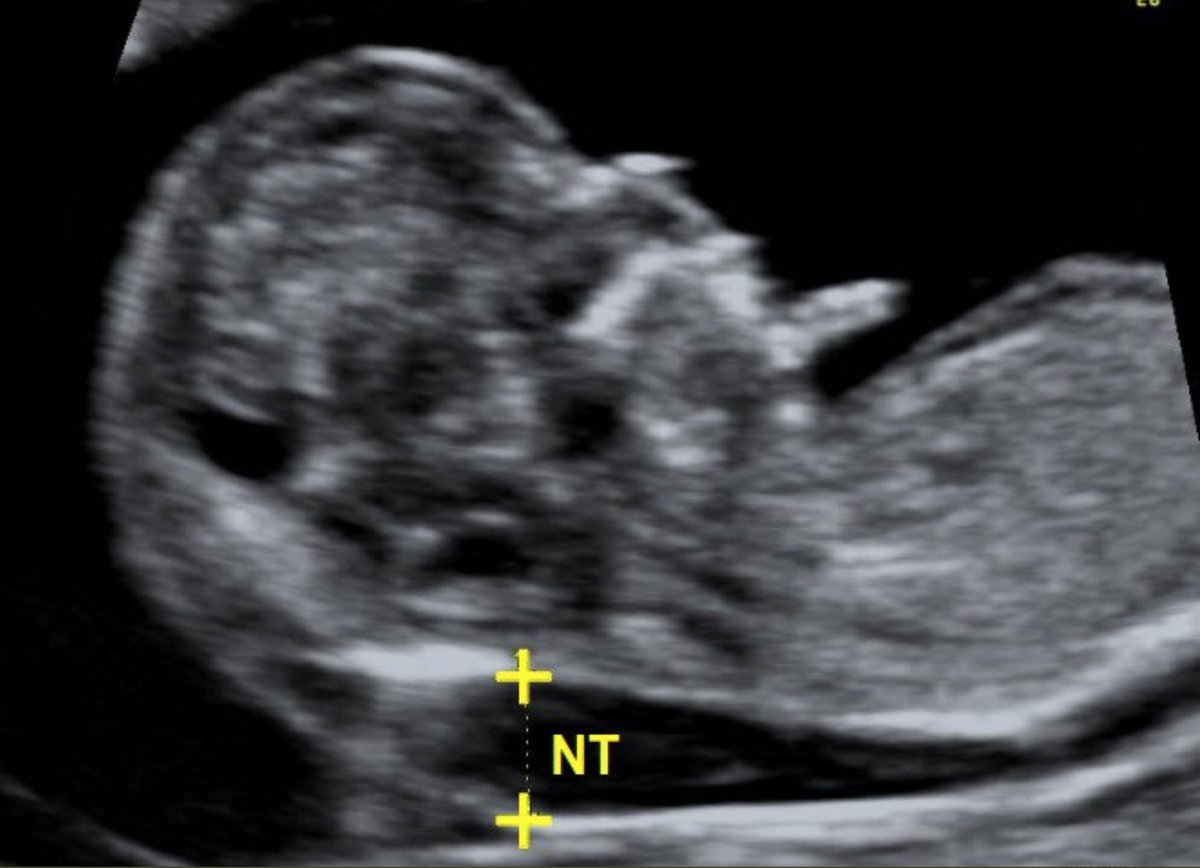 Воротниковое пространство выявляется у плодов как в норме, так и при хромосомных заболеваниях (например, болезни Дауна), но для плодов с хромосомными заболеваниями характерно увеличение толщины воротникового пространства более 2,5мм. Воротниковое пространство у всех плодов самопроизвольно исчезает после 14 недель беременности, поэтому очень важно пройти исследование с 10 по 13 неделю беременности, когда его можно измерить. Носовая кость в норме определяется при ультразвуковом исследовании с 10 недели беременности. У плодов с хромосомной патологией процессы окостенения происходят позже, поэтому отсутствие носовой кости при ультразвуковом исследовании в эти сроки может являться признаком хромосомной патологии плода.
Воротниковое пространство выявляется у плодов как в норме, так и при хромосомных заболеваниях (например, болезни Дауна), но для плодов с хромосомными заболеваниями характерно увеличение толщины воротникового пространства более 2,5мм. Воротниковое пространство у всех плодов самопроизвольно исчезает после 14 недель беременности, поэтому очень важно пройти исследование с 10 по 13 неделю беременности, когда его можно измерить. Носовая кость в норме определяется при ультразвуковом исследовании с 10 недели беременности. У плодов с хромосомной патологией процессы окостенения происходят позже, поэтому отсутствие носовой кости при ультразвуковом исследовании в эти сроки может являться признаком хромосомной патологии плода.
Комбинированное ультразвуковое исследование в сочетании с определением концентрации белков плода в крови матери в настоящее время является наиболее эффективным способом профилактики рождения ребенка с болезнью Дауна или другими хромосомными заболеваниями.
Мы надеемся, что эта информация поможет Вам лучше понять, для чего мы проводим это исследование, и почему важно провести его именно с 10 по 13 неделю беременности.
Определение толщины воротникового пространства
Ультразвуковое исследование, которое позволяет определить вероятность рождения ребенка с синдромом Дауна. Речь идет о скоплении подкожной жидкости на задней поверхности шеи плода, которое измеряют на сроке 11-13 недель. Некоторое количество жидкости присутствует в каждом случае, но у многих детей с синдромом Дауна ее количество сильно превышает норму. Точный диагноз можно поставить только на основании дополнительных исследований: биопсии хориона или амниоцентеза. Однако, их проведение чревато небольшим риском прерывания беременности.
Определение толщины воротникового пространства не дает точного представления о состоянии ребенка, но помогает определить, требуется ли назначение более глубокого диагностического теста.
Определение толщины должно проводиться на этапе от 11 до 13 недель плюс 6 дней. Раньше этого срока выполнить его будет сложно, ведь ребенок еще слишком мал, а позже излишки жидкости поглощаются его лимфатической системой. Как правило, измерения проводятся обычным способом, лишь иногда требуется сделать вагинальное УЗИ.
Для того, чтобы точно определить срок беременности, врач УЗИ, измеряет плод от макушки до копчика (это называется копчико-теменной размер КТР). Затем доктор устанавливает толщину воротникового пространства. При этом кожа выглядит на мониторе белой линией, а подкожная жидкость — черной.
На 11-й неделе беременности нормой является ширина в 1-2 мм, а на сроке 13 недель и 6 дней – 2,8 мм. Толщина воротникового пространства растет пропорционально росту ребенка. Высокий показатель не всегда указывает на наличие проблемы. У некоторых детей, не предрасположенных к синдрому Дауна, содержание подкожной жидкости иногда бывает выше нормы. Девять из десяти детей с показателем 2,5-3,5 мм рождаются абсолютно нормальными.
Чем выше показатель толщины воротникового пространства, тем выше риск развития синдрома Дауна и других хромосомных нарушений.
Вероятность рождения такого ребенка существует у каждой женщины, и с возрастом она увеличивается. Для определения степени риска учитывается возраст будущей мамы и результат теста на определение толщины воротникового пространства. Специальная программа помогает определить эту вероятность для женщины определенного возраста – ее называют фоновым показателем. Личные показатели используют для определения степени риска в каждом конкретном случае. Эта степень может быть выше или ниже фонового показателя.
Большинство женщин с высокой степенью риска рожают здоровых детей. Ребенок с синдромом Дауна появляется в одном из 150 случаев присутствия высокого риска или даже реже. В ситуации, когда риск настолько высок, что составляет 1 из 5, стоит помнить, что сохраняется шанс четыре против одного, что ребенок родится здоровым. Единственная возможность точной диагностики вероятности появления хромосомных отклонений – диагностический тест, такой как биопсия хориона или амниоцентез.
Одним из преимуществ теста на определение толщины воротникового пространства является то, что его делают на ранних сроках беременности. Поэтому биопсия ворсин хориона (БВХ) также может быть сделана в первом триместре.
У 75% детей, страдающих синдромом Дауна, отклонения были выявлены во время исследования толщины воротникового пространства.
Иногда измерения демонстрируют вероятность наличия порока у здоровых детей. Такой результат называется ложноположительным, это 5% от общего числа. Таким образом, у одной из 20 женщин ошибочно определяется высокая степень риска рождения ребенка с отклонениями. Наиболее точный результат можно получить при совмещении показателей теста на определение толщины воротникового пространства и анализа крови. Последний выявляет уровень свободного бета-ХГЧ и концентрацию протеина PAPP-A (ассоциированного с беременностью плазменного белка А). У детей с синдромом Дауна обычно наблюдается высокий уровень свободных бета-ХГЧ и низкая концентрация протеина PAPP-A. УЗИ для определения толщины воротникового пространства в сочетании с анализом крови в 90% случаев дает точный результат. Это исследование называется двойным тестом.
УЗИ для определения толщины воротникового пространства в сочетании с анализом крови в 90% случаев дает точный результат. Это исследование называется двойным тестом.
Пренатальный скрининг при беремености цена в Ростове-на-Дону
Для чего необходим скрининг I и II триместров, и почему он показан всем беременным женщинам?
У любой пары существует риск зачатия ребёнка, имеющего генетическое заболевание. В данном случае не играет никакой роли образ жизни родителей, их социальное положение, состояние здоровья. Риск есть всегда.
Скрининговые исследования предлагаются всем лицам, наблюдающимися по поводу беременности. Одно из таких обследований – УЗ-обследование генетических аномалий в I триместре беременности, прохождение которого желательно каждой беременной женщине до 14 недели гестации.
Таким образом, скрининг I триместра – комплекс пренатальных исследований, осуществляемых на 11-14 неделях гестации, целью которых является предварительная идентификация женщин с повышенным риском рождения ребенка, страдающего хромосомными болезнями.
К 11-12 неделе гестации ребенок уже достигает достаточных размеров, чтобы хорошо изучить его анатомические особенности. На этом сроке уже можно выявить серьезные нарушения развития ребенка, которые могут быть несовместимы с жизнью, либо приводить к тяжелой инвалидизации. Среди всех выявляемых генетических аномалий чаще всего встречается синдром Дауна, при котором в 21 паре не две, а три пары хромосом.
Ультразвуковые маркёры, которые повышают риск генетических заболеваний
Первое, что должно настораживать и требовать особого внимания – расширение ТВП (толщины воротникового пространства), невизуализируемые кости носа, порок сердца, связанный с дисфункцией трикуспидального клапана, а также реверсивный ток крови в венозном протоке. Ниже представлены более детальные уточнения по каждому отклонению.
Ниже представлены более детальные уточнения по каждому отклонению.
Воротниковое пространство
Воротниковое пространство определяется как участок скопления жидкости между кожей и тканями шейного отдела позвоночника. Выявляется и в норме, и при генетических заболеваниях, но во втором случае ТВП увеличивается до 2,6 мм (а может и больше). Принципиально важно пройти скрининг на 12 (+-1) неделе беременности, ибо на более поздних сроках беременности воротниковое пространство исчезает. Очень редко эта структура переходит в генерализованный, либо локальный отек, иногда несовместимый с жизнью.
Как измеряется ТВП?
Для измерения ТВП применяются два метода – трансабдоминальный (практически во всех случаях), либо трансвагинальный. Результаты этих исследований отличаться не будут.
-
Обследование проводится только в I триместр беременности, на сроке гестации от 11 до 14 недель. При этом размер ребенка для эффективного скрининга должен быть не менее 45 мм, но и не более 85 мм.
 Если на 11 неделе плод чуть меньше, это можно считать вариантом нормы, то тогда обследование переносится на 7-10 дней.
Если на 11 неделе плод чуть меньше, это можно считать вариантом нормы, то тогда обследование переносится на 7-10 дней.
-
Измерения осуществляются в переднезаднем направлении, то есть сагиттально, а головка ребенка предлежит нейтрально.
-
Область на мониторе увеличивается до головы и верхней трети туловища.
-
Область видимости должна увеличиваться так, чтобы наименьшее перемещение курсора выдавало изменение размера на одну десятую миллиметра.
-
Измеряется ТВП в наиболее широком месте, при этом требуется дифференциация эхоструктуры кожи и амниона.
-
Во время обследования толщина воротничкового пространства измеряется несколько раз, а выбирается наибольшее из полученных значений.
Порой к мнимому увеличению ТВП приводит обвивание шеи пуповиной. Тогда измеряется с обеих сторон пуповины. Дабы оценить риск, высчитывается среднее значение из полученных.
Тогда измеряется с обеих сторон пуповины. Дабы оценить риск, высчитывается среднее значение из полученных.
Схема работы
- Ультразвуковое исследование
- Взятие анализа крови на некоторые гормоны
Визуализация носовых костей
Проводится на 11-14 неделе гестации. В этот период визуализация получается в 96% случаев. Копчико-теменной размер плода должен быть не менее 45 мм и не более 84 мм.
-
Изображение на мониторе увеличивается таким образом, чтобы была полностью видна голова и верхняя треть туловища.
-
Плод должен рассматриваться в переднезадней плоскости.
-
При отсутствии каких-либо хромосомных патологий возможно отсутствие определения носовых костей в 1% случаев у женщин европеоидной расы, и в 9% случаев у женщин африканского этноса.
-
При трисомии 21 пары носовые кости не визуализируются в 65% случаев, при трисомии 13 пары – 25%, при трисомии 18 пары – у половины.

В процессе визуализации носовых костей должны распознаваться три слоя. Верхний – это кожа, посередине – кончик. Внизу визуализируется собственно носовая кость, эта линия более толстая.
Допплерометрия венозного протока и трикуспидальная регургитация
Зачастую большинство хромосомных патологий сопровождаются нарушениями и пороками развития многих систем организма. Чаще всего – сердцечно-сосудистой, что в некоторых случаях приводит к тяжелой инвалидизации.
Венозный проток
В первом триместре беременности нарушение тока крови в венозном протоке вместе с хромосомными аномалиями и сердечными патологиями может привести к невынашиванию беременности. В эти сроки гестации изменение кривых скорости тока крови диагностируют у 85% имеющих трисомию 21, а у здоровых плодов – 5%.
Трикуспидальная регургитация
Трикуспидальной регургитацией называют порок правых камер сердца, характеризующийся недостаточностью трехстворчатого клапана, что приводит к возвращению крови в предсердие из желудочка в момент систолы.
Это явление, как и реверс тока в венозном протоке уже не диагностируется к 15-16 неделе. Тем не менее, следует в 19 неделю пройти эхокардиографию, потому что в некоторых случаях вышеописанные явления могут говорить о наличии врожденного порока сердца.
Разумеется, описанное исследование не должно ограничиваться выявлением ультразвуковых маркёров, увеличивающих риск для ребенка – синдром Эдвардса, Патау и др. В 1 триместре также диагностируют синдром Дэнди-Уокера, акранию, мегацистис и многое другое.
Результаты скрининга, особенно в сочетании с анализом на фактор роста плаценты, имеют немалое значение не только для последующего диагностирования ряда хромосомных патологий, но также используются для анализа риска выкидыша, тяжелой степени гестоза, нарушения и задержки развития плода.
Рекомендации The Fetal Medicine Foundation (FMF)
Для оценки вышеперечисленных признаков врач должен обладать высокой квалификацией. Наши специалисты, осуществляющие пренатальный скрининг в Ростове-на-Дону, имеют лицензии The Fetal Medicine Foundation, международной организации, деятельность которой посвящена исследованиям в области биологии плода, пренатальной медицины.
Наши специалисты, осуществляющие пренатальный скрининг в Ростове-на-Дону, имеют лицензии The Fetal Medicine Foundation, международной организации, деятельность которой посвящена исследованиям в области биологии плода, пренатальной медицины.
Организация разрабатывает новейшее программное обеспечение, которым снабжаются сертифицированные медицинские пренатальные центры, что позволяет по результатам УЗ- и биохимического исследований анализировать риск хромосомных аномалий у плода.
В заключение
В том случае, если полученные результаты будут говорить о невысоком риске наличия хромосомных аномалий у ребенка, специалисты центра порекомендуют повторное проведение УЗ-исследования в 20 неделю беременности и в 31 неделю беременности (+- 1-2 недели).
В случае выявления повышенного риска наличия у ребенка генетических заболеваний необходимо понимать, что это лишь результат скрининга, но никак не диагноз. В такой ситуации потребуется консультация врача-генетика и последующее кариотипирование плода. Это цитогенетический метод, позволяющий проанализировать число и структуру хромосом, диагностировать нарушения в хромосомном составе. Используются инвазивные методы диагностики – хорионбиопсия, либо амниоцентез, позволяющие обнаружить врожденные хромосомные дефекты.
Это цитогенетический метод, позволяющий проанализировать число и структуру хромосом, диагностировать нарушения в хромосомном составе. Используются инвазивные методы диагностики – хорионбиопсия, либо амниоцентез, позволяющие обнаружить врожденные хромосомные дефекты.
Ни здоровый образ жизни родителей, ни отсутствие родственников с генетическими патологиями, ни высокое социальное благополучие не могут гарантировать рождение ребенка без хромосомных аномалий. Наши специалисты рекомендуют вам своевременно проходить обследования на протяжении всего срока гестации.
Наименование услуги
ЦенаУЗИ с 11 по 14 неделю (экспертное)
2400 pуб.УЗИ с 11 по 14 неделю (экспертное) при многоплодной беременности
3200 pуб.
Врачи по направлению
Почему стоит выбрать нас
- ЗНАНИЯ, ОПЫТ И КВАЛИФИКАЦИЯ
Все врачи регулярно проходят обучение в ведущих российских и зарубежных клиниках и мероприятиях
- СОБСТВЕННАЯ ЛАБОРАТОРИЯ
Выполнение анализов в максимально короткие сроки по доступным ценам.
- ТЕХНИЧЕСКАЯ ОСНАЩЕННОСТЬ
Кабинеты оснащены современным оборудованием ведущих мировых производителей
- ПЕРВОПРОХОДЦЫ И ИННОВАТОРЫ
Мы первыми внедряем многие современные технологии в Ростове-на-Дону. (5D УЗИ, эстетическая гинекология и анрология, фотодинамическая терапия, радиотермометрия, вакуумная аспирационная биопсия, Fotona4D)
Отзывы о нас на Флампе
Мы на карте
Отзывы об услуге
Скрининг I триместра
Первое УЗИ матери и ребенка проводится в период с 11 по 13 неделю. Этот срок определен Министерством Здравоохранения, как период, в
который ткани и органы плода сформировались и отчетливо различимы.
Однако интервал: 12 неделя 2 дня — 12 неделя 4 дня экспертами
признан самым информативным. В этот период можно выявить
ультразвуковые маркеры (признаки) хромосомной патологии плода –
увеличение толщины воротникового пространства плода и отсутствие у
него носовой кости при проведении УЗИ.
Этот срок определен Министерством Здравоохранения, как период, в
который ткани и органы плода сформировались и отчетливо различимы.
Однако интервал: 12 неделя 2 дня — 12 неделя 4 дня экспертами
признан самым информативным. В этот период можно выявить
ультразвуковые маркеры (признаки) хромосомной патологии плода –
увеличение толщины воротникового пространства плода и отсутствие у
него носовой кости при проведении УЗИ.
Скрининг I триместра
Скрининговое обследвование – комплекс диагностики, который состоит из УЗИ и лабораторного исследования. Основная задача такого подхода – сформировать полноценную картину о том, каким образом происходит формирование и развитие тканей, соответствие процессов норме, предупреждение патологии.
Во время первого скрининга проводят биохимический анализ крови,
который регистрирует вероятность развития пороков, обнаруживает или
исключает хромосомные заболевания, такие как: болезнь Дауна, Патау,
Эдвардса и др.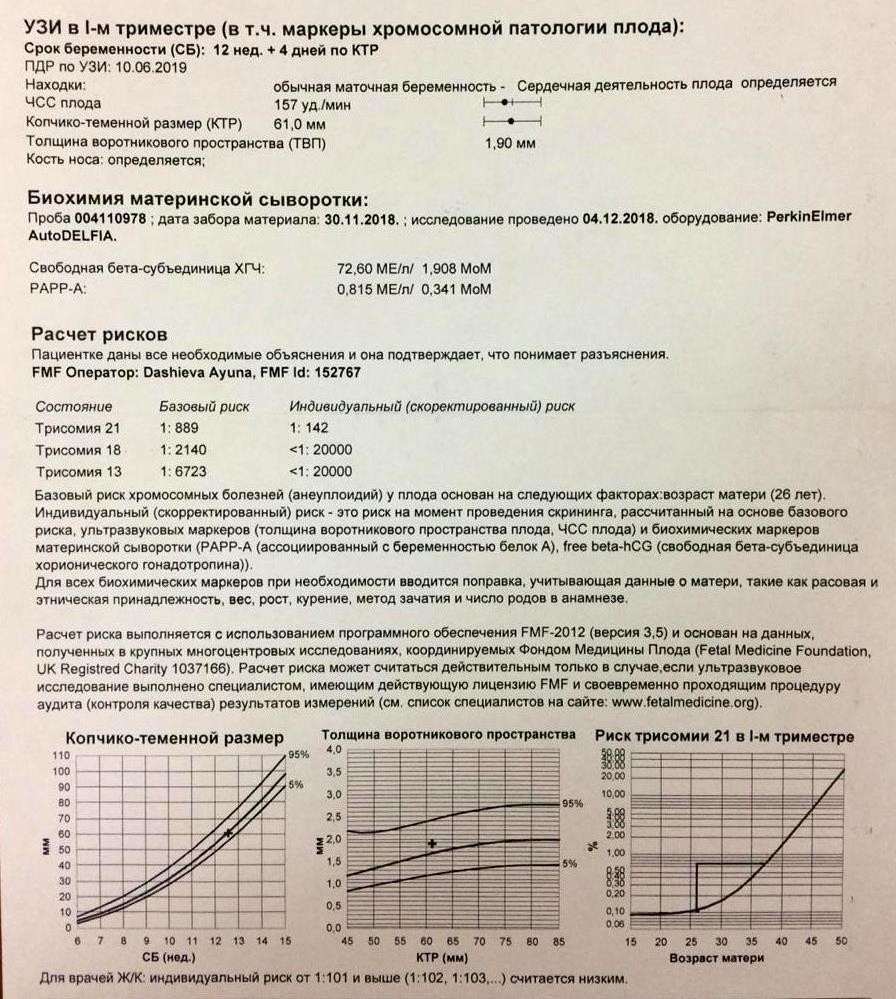
Ультразвуковое скрининговое исследование проводится на оборудовании экспертного уровня. Врач ультразвуковой диагностики детально изучает уже сформировавшиеся органы и системы к этому времени.
Виды Скрининга:
Ультразвуковое исследование производится двумя способами:
- Трансабдоминально – привычная форма УЗИ через поверхность живота. Важно помнить, что перед обследованием мочевой пузырь должен быть полон. Рекомендуется выпить 1-1,5 литра воды за час до диагностики.
- Трансвагинально – Ультразвуковое исследование специальным датчиком, который вводят во влагалище. Мочевой пузырь должен быть пуст. Является более информативным методом, который не требует подготовки, нежели трансабдоминальное УЗИ.
Безопасно ли УЗИ во время беременности.
Ультразвуковое исследование – неинвазивный метод диагностики,
который основан на отражении звуковых волн от разных тканей и
считыванием их датчиком. Ультразвук нетоксичен, нерадиоактивен.
Поэтому этот вид обследования абсолютно безопасен и проходит
безболезненно.
Ультразвук нетоксичен, нерадиоактивен.
Поэтому этот вид обследования абсолютно безопасен и проходит
безболезненно.
В нашем центре проводится УЗИ на современном высокотехнологичном оборудовании компетентными врачами ультразвуковой диагностики. По окончании обследования выдается заключение с распечатанными фотографиями ультразвукового исследования.
УЗИ 12 недель
Во время проведения УЗИ врач УЗИ-диагностики ищет маркеры хромосомной патологии плода:
- Увеличение толщины воротникового пространства плода (ТВП).
- Несформированная носовая кость.
Отсутствие этих признаков говорит о том, что малыш развивается
правильно.
А также измеряются жизненные показатели:
- KTP – показатель величины плода, который измеряется длинной от темечка до копчиковой кости.
- Размер головы плода.

- Частота сердечных сокращений.
Так как размер плода на момент УЗИ еще очень мал, поэтому так важно, чтобы диагностика проводилась на оборудовании экспертного класса, которое имеет высокое разрешение.
Забота о здоровье мамы и малыша – вопрос, который важно ставить в приоритет. Ищите того врача, которому вы доверяете и клинику, где современное оборудование. Для вашего удобства в Кудрово работает многопрофильный медицинский центр «M+clinic», где ценностью врачей является здоровье и его поддержание.
Запишитесь на консультацию по телефону:
+7 (812) 303-07-03 доб.1
+7 (921) 963-85-00 или через форму на сайте.
Расширение яремных лимфатических протоков — Вопрос генетику
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 73 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, липидолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.51% вопросов.
Оставайтесь с нами и будьте здоровы!
Вопросы про УЗИ при беременности
На вопросы отвечает Заведующая женской консультацией, врач акушер – гинеколог высшей категории Сафонова Вера Александровна
Что такое УЗИ и зачем оно нужно?
Ультразвуковое исследование плода проводится с целью диагностики отклонений в его развитии (пороки развития, совместимые и несовместимые с жизнью, аномалий пуповины, осложнения функции плаценты, отклонения в структуре и характере прикрепления плаценты). Цель УЗИ – своевременное выявление отклонений и определение тактики последующего ведения беременности. УЗИ основано на эффекте ДОППЛЕРА- отражение звука от границы раздела двух сред разной плотности .
Как часто можно делать УЗИ?
УЗИ производится три раза : в 11,2 -13,6 недель, 18-21 недели, 32-34 недели . При наличии медицинских показаний чаще.
Какие бывают виды предлежания ,чем они опасны и чем характеризуются?
Предлежащей частью может быть головка плода, ягодицы, ножки, ягодицы с одной или двумя ножками. Предлежащая часть-это часть плода, опредяющаяся над входом в малый таз. Нормальное предлежание — головное. При других предлежаниях за счет отсутствия разделения вод на передние и задние, высока опасность преждевременного излития вод, выпадения петель пуповины, преждевременных родов , внутриутробной гибели плода. При поперечном положении плода предлежащая часть отсутствует. Матка перетянута в поперечном направлении, высока опасность преждевременного прерывания беременности при сроке с 28 и более недель.
Предлежащая часть-это часть плода, опредяющаяся над входом в малый таз. Нормальное предлежание — головное. При других предлежаниях за счет отсутствия разделения вод на передние и задние, высока опасность преждевременного излития вод, выпадения петель пуповины, преждевременных родов , внутриутробной гибели плода. При поперечном положении плода предлежащая часть отсутствует. Матка перетянута в поперечном направлении, высока опасность преждевременного прерывания беременности при сроке с 28 и более недель.
Что такое бипариетальный размер головы (БПР) ? Норма и отклонения.
БПР измеряется во время УЗИ. Существуют нормативы для каждого срока беременности. Уменьшение размеров менее минимальных значений норматива может трактоваться как задержка развития плода. Увеличение более максимального значения норматива может являться следствием крупного плода или при сочетании с аномальной картиной структур мозга — порок развития . Клубникообразная или лимонообразная форма головки настораживает врача на возможную хромосомную аномалию.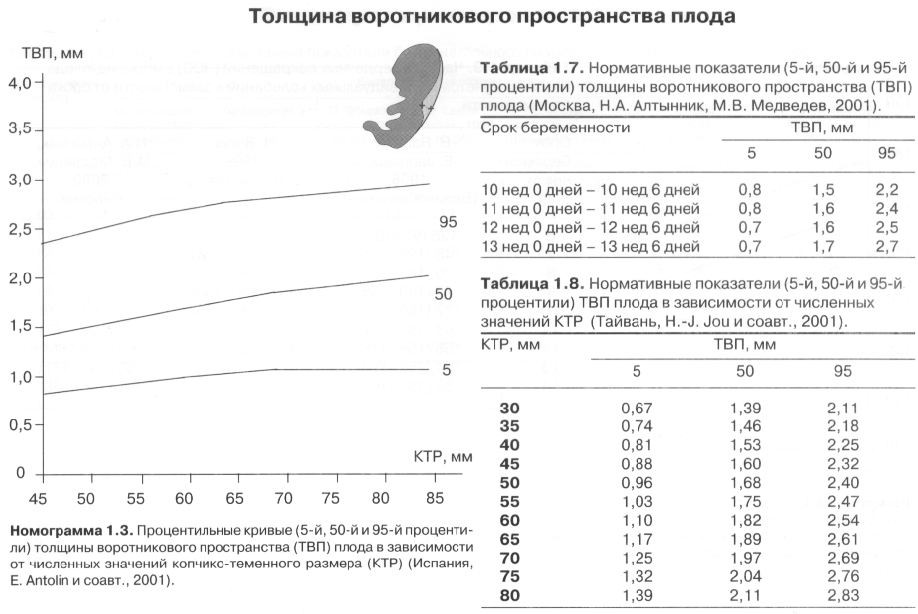 Абсолютным показанием для прерывания беременности является отсутствие костей свода черепа, отсутствие мозговой ткани головного мозга у плода.
Абсолютным показанием для прерывания беременности является отсутствие костей свода черепа, отсутствие мозговой ткани головного мозга у плода.
Окружность живота ОЖ .
Окружность живота оценивается в комплексе с другими размерами плода. Увеличение ОЖ может сочетаться с водянкой плода, гепатоспленомегалией, внутрибрюшными кистами и др.аномалиями плода.
Длинные трубчатые кости плода.
Длинные трубчатые кости плода могут иметь отклонения в развитии (укорочения, деформации, полное отсутствие). Беременная с выявленными пороками костей внутриутробного плода консультируется на предмет исключения хромосомных аномалий. Наиболее частые находки при обследовании позвоночника – спинно мозговые грыжи. Наиболее частая локализация в шейном и крестцово- копчиковых отделах. При локализации : в шейном отделе – 100% прерывание беременности ; в крестцокопчиковом отделе – при отсутствии поражения вещества мозга беременной можно продлить после консультации нейрохирургов.
Носовая косточка. Длина в норме и отклонения .
Определение длины носовой косточки имеет значение при диагностике синдрома Дауна ( укорочение после 12 нед ) симптом используется в сочетании с другими обследованиями.
Легкие .
Легкие должны иметь однородную структуру и различную степень зрелости для разного срока беременности. При выявлении отклонений вопрос о продлении беременности решается совместно с генетиком .
Строение сердца. На каких сроках можно выявить отклонения? Насколько они опасны?
Закладка сердца внутриутробного плода происходит в сроке до 5 недель беременности. Влияние всевозможных вредных факторов в эти сроки на организм беременной ( курение, алкоголь, наркотики, прием лекарственных препаратов, экология и другие) могут приводить к нарушению нормального органогенеза. После 11-12 недель производиться обследование сердца плода. Возможно выявление врожденных пороков и в ранние сроки беременности (расположение сердца за пределами грудной клетки, в правом отделе грудной клетки, аномальное смещение сердца). Существуют пороки сердца совместимые с жизнью плода после его рождения с несовместимые с жизнью, требующие прерывания беременности после решения консилиума. Среди врожденных пороков сердца встречаются такие, как дефект межпредсердной и межжелудочковой перегородок, аномальное отхождение магистральных сосудов (аорта, легочная артерия), стенозы, клапанные пороки, сочетанные комбинированные пороки .
Существуют пороки сердца совместимые с жизнью плода после его рождения с несовместимые с жизнью, требующие прерывания беременности после решения консилиума. Среди врожденных пороков сердца встречаются такие, как дефект межпредсердной и межжелудочковой перегородок, аномальное отхождение магистральных сосудов (аорта, легочная артерия), стенозы, клапанные пороки, сочетанные комбинированные пороки .
ЧСС что такое? Какие нормы?
Сердечный ритм внутриутробного плода в норме от 120-160 ударов/мин. Меньше 120 встречается при врожденных аномалиях сердца, но может быть и вариантом нормы, если при динамичном наблюдении нет прогрессирования в брадикардии до 90 ударов/мин . Учащение сердцебиения выше 160 уд/мин может наблюдаться при волнении матери, в родах, как реакция на схватку кратковременно. Длительная тахикардия может рассматриваться как угрожающий для плода симптом.
Желудок.
Определение желудка при УЗИ — важный диагностический, отсутствие эхотени может указывать на хромосомную аномалию плода или быть вариантом нормы после его сокращения. Возможно наличие аномалий ЖКТ даже при определении эхотени желудка.
Возможно наличие аномалий ЖКТ даже при определении эхотени желудка.
Печень .
При определении гиперэхогенных включений в печени плода необходимо исключить наличие внутриутробной инфекции.
Почки.
Почки не должны занимать более 1/3 объема брюшной полости плода и иметь характерную анатомическую структуру. При отклонении в развитии ( расширение чашечек, лоханок) беременность продлевается под динамичном наблюдением акушера, генетика и врача ультразвуковой диагностики ( УЗД ). При прогрессировании процесса вопрос о продлении беременности решается на комиссии . Возможно полное отсутствие почек , что требует в 100% прерывание беременности . Возможно отсутствие эхотени мочевого пузыря в зоне его анатомического расположения. Причины — расположение в другом в нехарактерном месте, нарушения развития мочеточников или как вариант нормы после его физиологического сокращения.
Кишечник. Что означает расширенный кишечник?
Существуют нормативные показатели размеров (поперечных) в разные сроки. Увеличение размеров более нормативных данному сроку беременности может свидетельствовать о врожденном пороке ануса.
Увеличение размеров более нормативных данному сроку беременности может свидетельствовать о врожденном пороке ануса.
Место впадения пуповины.
Внутриутробный плод связан с организмом матери пуповиной. Место впадения пуповины у плода оценивается врачом при УЗИ: не должно быть грыжевых образований и аномального количества сосудов пуповины ( в норме – 3 сосуда). При обнаружении 2х сосудов в пуповине необходима консультация генетика. При обнаружении грыжевых образований – тактика ведения зависит от срока, величины дефекта, состава грыжевого содержимого.
Масса плода на различных сроках беременности, норма и отклонения.
Разработаны табличные показатели массы плода для разных сроков беременности. Отклонения допускаются не более чем на 1 неделю, при большем отклонении веса вопрос решается индивидуально (конституциональный фактор, маловесный плод, недостаток питания женщины, истиная задержка развития плода от 1 до 3 степени). Задержка развития плода развивается как следствие имеющейся патологии у матери ( анемия, гипертоническая болезнь, хронический пиелонефрит, сахарный диабет, вредные привычки у матери, осложненное течение беременности- гестоз и др. )
)
Плацента. Что такое и какие есть стадии зрелости и что они означают?
Плацента прикреплена к матке якорными ворсинами, очень не плотно. Содержит большое количество сосудов. Выполняет функции : секреторную, дыхательную, обменную, гормональную, питательную и др. При нарушении функций плаценты изменяется состояние внутриутробного плода вплоть до его внутриутробной гибели ( бактериальное поражение плаценты, вирусное поражение, нарушения кровотока, нарушения характера прикрепления и плацентации). Изменения в структуре плаценты происходит в соответствии с ее ростом и созреванием, что характеризует различные степени созревания. Появления признаков преждевременного созревания данному сроку беременности свидетельствует о наличии функциональных изменений плацента.
Толщина стенок матки.
При обследовании стенок матки возможно выявление опухолевидных образований(миома). Миометрий – мышечный слой матки , состоит из 3 слоев ( внутренний , средний и наружный).
Околоплодные воды. Функция и их количество. Что бывает при отклонениях от норма количества вод.
Околоплодные воды – составная и неотъемленная часть внутриутробного существования плода. Определяется визуально на УЗИ и при акушерском обследовании беременной. Многоводие приводит к перерастяжению матки, риску преждевременного излития околоплодных вод и преждевременных родов, является маркером внутриутробного инфицирования плода, врожденных пороков развития плода или вариантом нормы в сроке 23-24 недели. При реализации инфекционного фактора возможна внутриутробная гибель плода. Маловодие возможно при хромосомных аномалиях плода, аномалиях мочевыделительной системы плода и других состояниях. Требуется консультация генетика. Изменение структуры околоплодных вод- множественные подвижные хлопьевидные включения могут быть следствием инфекции или вариантом нормы при доношенной беременности .
Каков нормальный цвет околоплодных вод?
В норме воды светломолочного или светложелтого цвета . При зеленом цвете вод (мекониальные воды) имеются признаки длительного внутриутробного страдания плода (анемия, инфекция почек, гестоз, водянка беременной, вредные привычки у женщины, угроза прерывания беременности и другие эстрагенитальные заболевания).
При зеленом цвете вод (мекониальные воды) имеются признаки длительного внутриутробного страдания плода (анемия, инфекция почек, гестоз, водянка беременной, вредные привычки у женщины, угроза прерывания беременности и другие эстрагенитальные заболевания).
Шейка матки. Норма и отклонения.
Шейка матки во время беременности имеет различный норматив по длине перво – и повторобеременных. Укорочение шейки является угрожающим симптомом для последующего вынашивания беременности . Критичным является длина шейки 25-30 мм.
Условия визуализации какие бывают и от чего зависят?
Визуализация может быть удовлетворительной и неудовлетворительной , зависят от срока беременности, положения и предлежания плода, свойств ткани самой женщины, что сказывается на отражение ультразвуковой волны.
Почему даже УЗИ не может выявить грубые пороки плода?
100 % диагностики на сегодняшнем этапе не дает ни один метод обследования, даже на машинах экспертного класса. Существующий порок может «расти и развиваться» вместе с плодом и быть обнаруженным в более поздние сроки. Пропуск пороков можно объяснить удовлетворительными условиями визуализации ( в т.ч.маловодие), сроком, положением и предлежанием плода, а также от опыта врача и оборудованием.
Существующий порок может «расти и развиваться» вместе с плодом и быть обнаруженным в более поздние сроки. Пропуск пороков можно объяснить удовлетворительными условиями визуализации ( в т.ч.маловодие), сроком, положением и предлежанием плода, а также от опыта врача и оборудованием.
Не опасно ли УЗИ для матери и плода?
За весь многолетний опыт обследования женщин на УЗИ отрицательного влияния на мать и плод не описано. Существует миф о том, что после УЗИ плод задерживается в развитии или погибает. Беременные обследуются специальными датчиками с определенной длиной ультразвуковой волны. Всегда имеются медицинские показания для обследования плода при аномальном течении беременности.
Какие ограничения есть при прохождении УЗИ. Можно ли его делать всем ?
Ограничения для прохождения УЗИ: ситуации при которых существует угроза жизни плода , а время потраченное на УЗИ откладывает мероприятие по спасению его жизни( подозрение и отслойка плаценты, острая гипоксия плода) . УЗИ дело добровольное. Если имеется религиозный мотив или другие причины отказа от обследования, оформляется информированный отказ от обследования в соответствии с «Основами законодательства РФ об охране здоровья граждан». ( ст. 31,32,33) .
УЗИ дело добровольное. Если имеется религиозный мотив или другие причины отказа от обследования, оформляется информированный отказ от обследования в соответствии с «Основами законодательства РФ об охране здоровья граждан». ( ст. 31,32,33) .
Что такое индекс амниотической жидкости?
Объем околоплодных вод, измеренных в 4 квадратах полости матки. Имеется норматив для каждого срока беременности .
Области придатков. Норма и отклонения.
Это зона проекции труб и яичников справа и слева от матки. В норме патологических образований не должно определяться. Отклонения от нормы : определение кистозных и плотных образований.
Причины :
• вариант нормы при имеющейся кисте желтого тела, поддерживающей развитие беременности и исчезающей после 16 недель.
• истинная киста яичника или опуховидное образование, требующие хирургического лечения.
Что такое 3D, 4D, 5D УЗИ ? Какие виды бывают и чем отличаются друг от друга?
Это объемное изображение условий визуализации. Обычное УЗИ — двухмерное 2D.
Обычное УЗИ — двухмерное 2D.
Что такое УЗИ доплеровское?
Допплеровское исследование – исследование кровотока в сосудах пуповины, маточных артериях, мозговых артериях плода и других сосудах с целью выявления нарушений кровообращения .
Что такое скрининг?
Скрининг- «просеивание». 100% охват каким либо методом обследования.
Критерии при определении срока беременности?
Акушеры гинекологи во всем мире пользуются следующим способом определения срока : первый день менструации , которая была в последний раз и ходила регулярно, минус 3 месяца плюс 7 дней. Можно использовать дату зачатия ( если он известен женщине). Или результаты раннего УЗИ обследования до 12 недель. Существуют сроки беременности : по началу шевеления плода, но они малодостоверны ( первобеременная — с 20 недель, повторнобеременая – с 18 недель )
Как по диаметру плодного яйца определить срок беременности?
Определяется по среднему диаметру плодного яйца, которые имеют свои нормативы для разного срока .
Что такое фетометрия?
Измерение плода.
Что такое задержка внутриутробного развития?
Отставание фетометрических показателей на 2 недели и более или при определении высоты стояния дна матки уменьшение более чем на 2 см для данного срока беременности. Всегда является следствием влияния неблагоприятных факторов на течение беременности (анемия, инфекция почек, водянка беременной, гестоз, вредные привычки у женщины , угроза прерывания беременности и другие эстрагенитальные заболевания).
Что такое синдром задержки развития плода?
Старое определение задержки внутриутробного плода. В настоящее время использование данной формулировки некорректно.
Равномерно ли развивается плод?
Для разных сроков имеются свои закономерности развития плода.
Что такое воротниковое пространство и на что влияют его размеры?
Это пространство между внутренней поверхностью кожи шейного отдела плода и мягких тканей прилежащих к позвонкам шейного отдела. Увеличение размеров больше нормативных является поводом посещения генетика, т.к. высок риск хромосомных аномалий. ТВП ( трансворотниковое пространство )– маркер возможных сердечно- сосудистых аномалий.
Увеличение размеров больше нормативных является поводом посещения генетика, т.к. высок риск хромосомных аномалий. ТВП ( трансворотниковое пространство )– маркер возможных сердечно- сосудистых аномалий.
Обвитие пуповиной. Опасно или нет. Как избавиться от него. К чему может привести?
Во время беременности обвитие пуповиной не влияет на состояние плода. Риск имеется при родоразрешении. В схватку может нарушаться кровоток, при потугах — может нарушаться частота сердцебиения плода. Применяются медикаментозное лечение, в случае его отсутствия – оперативное пособие (операция кесарева сечение или рассечение промежности). Избавиться внутриутробно нельзя. Больше 50 % родов протекают с обвитием пуповины вокруг шеи плода. В родах ведется наблюдение частоты сердечных сокращений плода. В зависимости от акушерской ситуации определяется тактика дальнейшего ведения родов.
Что такое акушерская неделя?
7 дней.
На каком сроке отчетливо можно услышать сердцебиение ?
Сердцебиение плода лоцируется с 7 недель беремен на УЗИ, допплеровским аппаратом зарегистрировать сердечные сокращения — с 10 недель, ухом акушерским фонендоскопом -с 23 недель .
С какого срока можно установить пол?
Окончательное формирование пола можно установить к исходу 24 недели.
На каком сроке при УЗИ можно разглядеть беременность?
В 2- 3 недели, если она маточная.
Какое УЗИ лучше внутренне или внешнее?
Существуют разные показания для обследования влагалищным и трансвезикальным датчиком. Возможно совмещение разных методов. Характер обследования зависит от целей и имеющейся патологии.
Помогает ли УЗИ выявить внематочную беременность?
Помогает, но не в 100 % случаях. Трудности возникают при сочетании маточной и внематочной беременности.
Может ли женщина отказаться от УЗИ совсем?
Да, имеет такое право. Но стандарт обследования беременных обязывает врача назначать УЗИ, но право выбора остается за вами . Требуется информированный отказ от обследования в соответствии с «Основами законодательства РФ об охране здоровья граждан». ( ст.31,32,33) . Ст. 33 « Отказ от медицинского вмешательства с указанием возможных последствий оформляется записью в медицинской документации и подписывается гражданином и медицинским работником)
( ст.31,32,33) . Ст. 33 « Отказ от медицинского вмешательства с указанием возможных последствий оформляется записью в медицинской документации и подписывается гражданином и медицинским работником)
Показания УЗИ для прерывания беременности. По каким показаниям и отклонениям принимается решение о прерывании беременности ? Если первое УЗИ выявило отклонения от нормы, то какова дальнейшая процедура принятия решения?
При обнаружении отклонений в развитии плода вопрос о дальнейшем продлении беременности решается с привлечением врачей смежных с специальностей ( хирург, ортопед, генетик.) Существуют медицинские показания для прерывания беременности в любом сроке в случае подтверждения порока развития, несовместимого с жизнью. Медицинские показания определяет главный генетик области комиссионно. Существуют такие отклонения от нормы, которые требуют динамичного наблюдения врачом УЗИ разных уровней (расширение лоханки почек, гиперэхогенные фокусы в полости сердца, гиперэхогеный кишечник , вентрикуломегалия, отсутствие эхотени желудка и мочевого пузыря и др . При отсутствии отрицательной динамики или неподтвержденные ранее подозрения в ходе динамичного наблюдения позволяют беременность пролонгировать дальше.
При отсутствии отрицательной динамики или неподтвержденные ранее подозрения в ходе динамичного наблюдения позволяют беременность пролонгировать дальше.
Вопросы по ведению беременности в женской консультации
Обязательно вставать на учет по беременности?
Для благополучного исхода любых родов важное значение имеет обязательное и правильное медицинское ведение беременности в женской консультации:
- своевременная постановка на диспансерный учет по беременности в женской консультации
- регулярное посещение врача акушера–гинеколога
- выполнение назначений, обследований и всех рекомендаций врачей акушеров-гинекологов, терапевта и других врачей специалистов
- выполнение режима сохранения беременности
- посещение «Школы материнства»
- постановка на учет в детскую поликлинику в 30 недель беременности
- стабильное психологическое состояние женщины на протяжении всей беременности
- своевременное обсуждение возникающих вопросов совместно с врачом и акушеркой.
 Тесный контакт «беременная — врач- акушерка — беременная» за период наблюдения повышает самоорганизацию женщины, повышает её ответственность за исход беременности.
Тесный контакт «беременная — врач- акушерка — беременная» за период наблюдения повышает самоорганизацию женщины, повышает её ответственность за исход беременности.
В какой срок надо вставать на учет по беременности?
Постановка на учет по беременности осуществляет врач женской консультации при осмотре женщины до 12 недель. При обращении в ранние сроки 5-6 недель, допускается осмотр в динамике с целью подтверждения развивающейся беременности.
На основании каких приказов, стандартов ведется ведение беременных на диспансерном учете?
Ведение беременности у женщин различной степени риска осуществляется согласно «Порядка оказания медицинской помощи по профилю «акушерство и гинекология»(за исключением использования репродуктивных технологий), утвержденному приказом № 572н Министерства здравоохранения Российской Федерации от 01 ноября 2012 г.
Существует обязательное базовое обследование, по показаниям — расширение обследования и лечения согласно уровню ЛПУ.
Как часто надо посещать женскую консультацию при беременности?
Ведение беременных осуществляется в строгом соответствии «Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования репродуктивных технологий)», утвержденному приказом Министерства здравоохранения РФ от 01.11.2012 г.
Обязательно ли посещения других врачей специалистов?
Обязательно посетить терапевта и окулиста в 1, 2, 3 триместр беременности, стоматолога в 1 и 2 триместрах беременности.
В зависимости от имеющейся патологии консультация смежных специалистов: кардиолога, нефролога, невропатолога, хирурга, психиатра, нарколога и др.
Справка о ранней постановке на учет для чего выдается?
Пособие по этой справке выплачивается по месту работы или месту учебы. Если пособие Вам не нужно, Ваше право не предоставлять документы для платы. Пособие — как поощрение женщины за раннее обращение, соблюдение режима сохранения беременности.
Обменная карта. Когда выдается обменная карта? Примут на роды, если на момент поступления у беременной не окажется обменной карты?
Обменная карта – единая форма, действующая на всей территории РФ. В ней содержатся сведения о беременной, течении её беременности, результатах дополнительных и обязательных обследований, листе нетрудоспособности, родовом сертификате. Обменная карта выдается на руки беременным в сроке 18 недель, которая должна находиться при женщине всегда, где бы она не находилась.
Иностранным гражданам экстренная помощь оказывается бесплатно, плановая медицинская — без наличия полиса обязательного медицинского страхования за счет средств гражданина.
Важно отметить, что при поступлении на роды обязательно наличие полиса обязательного медицинского страхования.
границ | Как HSC колонизируются и расширяются в фетальной нише эмбриона позвоночных: эволюционная перспектива
Введение
Гематопоэз — это высококонсервативный процесс у многих организмов, кульминацией которого является появление гемопоэтических стволовых клеток (HSC).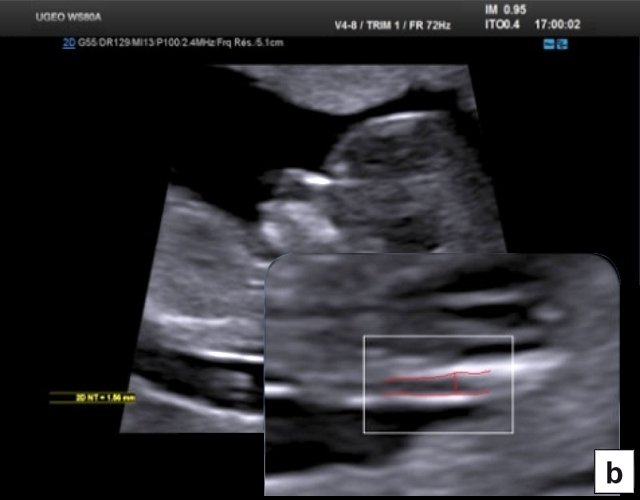 У рыбок данио и млекопитающих кроветворение начинается с появления примитивных миелоидных и эритроидных клеток (Palis et al., 2001; Bertrand et al., 2005; Palis, 2014; McGrath et al., 2015). Подобные клетки, прогемоциты, также обнаруживаются у личинок дрозофилы, которые дают начало плазматоцитам (макрофагоподобным клеткам) и кристаллическим клеткам (тромбоцитоподобным клеткам) (Lebestky et al., 2000). Примитивные миелоидные и эритроидные клетки также обнаруживаются у эмбрионов ксенопусов (Ciau-Uitz et al., 2014). После этого окончательный гематопоэз у позвоночных происходит двумя разными волнами. Первая волна характеризуется переходными эритромиелоидными предшественниками (ЭМИ), которые возникают в желточном мешке у мышей и людей (Bertrand et al., 2005; McGrath et al., 2015), заднем островке крови у рыбок данио (Bertrand et al., al., 2007) и заднебоковой вентральный островок крови у xenopus (Ciau-Uitz et al., 2014). Внешний вид EMPs в куриных эмбрионах еще предстоит определить. Вторая волна состоит из спецификации HSC из гемогенного эндотелия аорты посредством высококонсервативного процесса перехода от эндотелия к гемопоэзу (EHT).
У рыбок данио и млекопитающих кроветворение начинается с появления примитивных миелоидных и эритроидных клеток (Palis et al., 2001; Bertrand et al., 2005; Palis, 2014; McGrath et al., 2015). Подобные клетки, прогемоциты, также обнаруживаются у личинок дрозофилы, которые дают начало плазматоцитам (макрофагоподобным клеткам) и кристаллическим клеткам (тромбоцитоподобным клеткам) (Lebestky et al., 2000). Примитивные миелоидные и эритроидные клетки также обнаруживаются у эмбрионов ксенопусов (Ciau-Uitz et al., 2014). После этого окончательный гематопоэз у позвоночных происходит двумя разными волнами. Первая волна характеризуется переходными эритромиелоидными предшественниками (ЭМИ), которые возникают в желточном мешке у мышей и людей (Bertrand et al., 2005; McGrath et al., 2015), заднем островке крови у рыбок данио (Bertrand et al., al., 2007) и заднебоковой вентральный островок крови у xenopus (Ciau-Uitz et al., 2014). Внешний вид EMPs в куриных эмбрионах еще предстоит определить. Вторая волна состоит из спецификации HSC из гемогенного эндотелия аорты посредством высококонсервативного процесса перехода от эндотелия к гемопоэзу (EHT). Формирование гемогенного эндотелия требует правильного баланса внешних и внутренних факторов, чтобы инициировать экспрессию специфических факторов транскрипции, таких как runx1 и gata2 . Во время развития млекопитающих и птиц спецификация HSC происходит в области аорта-гонады-мезонефрос (AGM), где они образуют внутриаортальные кластеры (Jaffredo et al., 2000; Bollerot et al., 2005a, b; Зовейн и др., 2008; Чен и др., 2009; Boisset et al., 2010) между 9,5 и 11,5 днями эмбриона (E) у мышей, между E26 и E40 у людей и между E3-4 у кур. Во время развития рыбок данио HSCs появляются через 32-60 часов после оплодотворения (hpf) из гемогенного эндотелия в дорсальной части аорты (Bertrand et al., 2010; Kissa and Herbomel, 2010), процесс, который требует воспалительных цитокинов, продуцируемых нейтрофилами ( Espin-Palazon et al., 2014) и деградация внеклеточного матрикса (ECM) макрофагами, позволяющая HSC проникать в кровоток (Travnickova et al., 2015). HSC сначала обнаруживаются в островке вентральной крови, а затем в мезодерме дорсальной боковой пластинки у xenopus (Ciau-Uitz et al.
Формирование гемогенного эндотелия требует правильного баланса внешних и внутренних факторов, чтобы инициировать экспрессию специфических факторов транскрипции, таких как runx1 и gata2 . Во время развития млекопитающих и птиц спецификация HSC происходит в области аорта-гонады-мезонефрос (AGM), где они образуют внутриаортальные кластеры (Jaffredo et al., 2000; Bollerot et al., 2005a, b; Зовейн и др., 2008; Чен и др., 2009; Boisset et al., 2010) между 9,5 и 11,5 днями эмбриона (E) у мышей, между E26 и E40 у людей и между E3-4 у кур. Во время развития рыбок данио HSCs появляются через 32-60 часов после оплодотворения (hpf) из гемогенного эндотелия в дорсальной части аорты (Bertrand et al., 2010; Kissa and Herbomel, 2010), процесс, который требует воспалительных цитокинов, продуцируемых нейтрофилами ( Espin-Palazon et al., 2014) и деградация внеклеточного матрикса (ECM) макрофагами, позволяющая HSC проникать в кровоток (Travnickova et al., 2015). HSC сначала обнаруживаются в островке вентральной крови, а затем в мезодерме дорсальной боковой пластинки у xenopus (Ciau-Uitz et al. , 2000), а временные клетки с характеристиками HSC тесно связаны с сердечной трубкой у дрозофилы (Dey et al. , 2016).
, 2000), а временные клетки с характеристиками HSC тесно связаны с сердечной трубкой у дрозофилы (Dey et al. , 2016).
У всех этих организмов начальная спецификация эндотелиальных клеток (ECs) приводит к ограниченному количеству HSC, которые должны созревать и разрастаться. Это достигается за счет миграции через разные ниши, каждая из которых находится в разных анатомических местах, содержащих определенные микросреды.Первой нишей, которая расширяет HSCs у мышей, людей и xenopus, является фетальная печень (FL) (Ema and Nakauchi, 2000; Ciau-Uitz et al., 2014), прежде чем они мигрируют в костный мозг (BM). Напротив, HSC рыбок данио расширяются в каудальной гематопоэтической ткани (CHT) (Tamplin et al., 2015), а затем мигрируют в костный мозг (KM), а HSC курицы расширяются в парааортальных очагах (PAF) до засеивания BM ( Dunon, Imhof, 2000; Jaffredo et al., 2000; Bollerot et al., 2005a, b). Этот процесс отличается у дрозофилы, где начальная волна HSC (происходящая из мезодермы головы) возникает на ранней стадии развития личинок, за которой следует вторая волна HSC, обнаруживаемая в лимфатических узлах (Lebestky et al.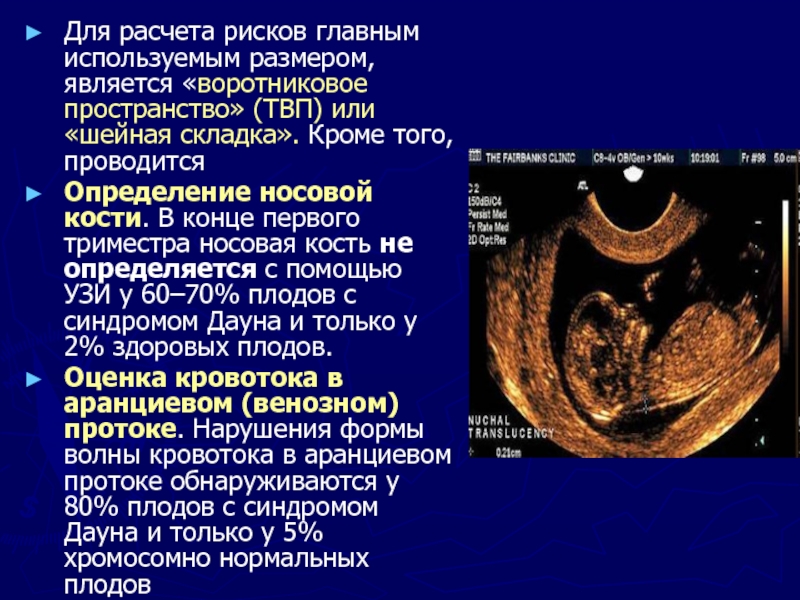 , 2000; Dey et al., 2016). Затем HSC засевают в гематопоэтические кластеры в дорсальной части брюшка взрослых дрозофил (Ghosh et al., 2015; Dey et al., 2016).
, 2000; Dey et al., 2016). Затем HSC засевают в гематопоэтические кластеры в дорсальной части брюшка взрослых дрозофил (Ghosh et al., 2015; Dey et al., 2016).
Исследования на мышах и рыбках данио показали, что HSC физически взаимодействуют с ЭК, которые способствуют их пролиферации в нише плода (Tamplin et al., 2015; Khan et al., 2016). Мы и другие показали, что это расширение зависит от экспрессии нескольких цитокинов, продуцируемых стромальными клетками и каудальными ЭК (ЦИК) (Tamplin et al., 2015; Mahony et al., 2016, 2018). Дополнительные сигналы также важны для их расширения, о чем и пойдет речь в этом обзоре. Эта эмбриональная экспансия является важным шагом в формировании пула взрослых HSC и правильном созревании HSC.
Самовосстанавливающиеся и мультипотентные свойства HSC делают эти клетки отличной мишенью для протоколов регенеративной медицины (Cavazzana-Calvo et al., 2000; Walasek et al., 2012; Aiuti et al., 2013). Многие методы лечения в настоящее время используют экспансию ex vivo аутологичных HSC человека с использованием коктейля цитокинов, но всегда с ограниченной эффективностью (Petzer et al.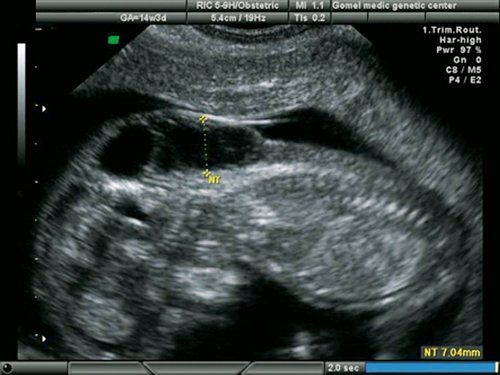 , 1996; Каваззана-Кальво и др., 2000; Schuster et al., 2012). Следовательно, для улучшения клинического лечения ряда гемопоэтических заболеваний требуется лучшее понимание различных комбинаций цитокинов, присутствующих в нише, а также дополнительных механизмов и сигнальных путей, которые обычно расширяют HSC. Здесь мы рассматриваем недавнюю литературу, которая описывает внешние сигналы, важные для самонаведения, экспансии и, наконец, высвобождения HSC из эмбриональной ниши у рыбок данио, ксенопусов, кур и млекопитающих.Анатомические участки, где происходит кроветворение у этих организмов, суммированы в таблице 1. Затем мы кратко обсудим возможные клинические последствия этих текущих знаний.
, 1996; Каваззана-Кальво и др., 2000; Schuster et al., 2012). Следовательно, для улучшения клинического лечения ряда гемопоэтических заболеваний требуется лучшее понимание различных комбинаций цитокинов, присутствующих в нише, а также дополнительных механизмов и сигнальных путей, которые обычно расширяют HSC. Здесь мы рассматриваем недавнюю литературу, которая описывает внешние сигналы, важные для самонаведения, экспансии и, наконец, высвобождения HSC из эмбриональной ниши у рыбок данио, ксенопусов, кур и млекопитающих.Анатомические участки, где происходит кроветворение у этих организмов, суммированы в таблице 1. Затем мы кратко обсудим возможные клинические последствия этих текущих знаний.
Таблица 1. Сводка анатомических участков кроветворения у указанных видов.
Возникновение HSC и возвращение в эмбриональную нишу
Млекопитающие
HSC млекопитающих продуцируются на дне эмбриональной аорты в области AGM (Zovein et al., 2008; Чен и др. , 2009; Ivanovs et al., 2011), но также в желточных и пупочных артериях (de Bruijn et al., 2000). Кроме того, исследования на людях и мышах выявили HSC в плаценте, которые возникают независимо от HSC из AGM и параллельно с ними (Gekas et al., 2005; Ottersbach and Dzierzak, 2005; Rhodes et al., 2008; Gekas et al. , 2010). Однако остается неизвестным, какой вклад HSC, происходящие из плаценты, вносят в пул взрослых стволовых клеток. Затем HSC колонизируют FL от E11 у мышей и E28 у людей, главным образом в ответ на CXCL12 (Chou and Lodish, 2010).CXCL12, высвобождаемый из ЭК, стромальных клеток и мезенхимальных предшественников, хорошо охарактеризован своей ролью в хоминге, удержании и выживании HSC в нише (Ara et al., 2003; Christensen et al., 2004; Sugiyama et al., 2006; Sawitza et al., 2009; Greenbaum et al., 2013). CXCL12 усиливает миграцию FL-HSCs в комбинации с фактором стволовых клеток (SCF) по сравнению с BM-HSCs (Christensen et al., 2004). Кроме того, мыши, лишенные CXCL12 или его рецептора (CXCR4), демонстрируют нормальный FL-гематопоэз, но аберрантную колонизацию селезенки и BM, что позволяет предположить, что специфическая и отличная сигнальная среда привлекает и поддерживает HSC (Nagasawa et al.
, 2009; Ivanovs et al., 2011), но также в желточных и пупочных артериях (de Bruijn et al., 2000). Кроме того, исследования на людях и мышах выявили HSC в плаценте, которые возникают независимо от HSC из AGM и параллельно с ними (Gekas et al., 2005; Ottersbach and Dzierzak, 2005; Rhodes et al., 2008; Gekas et al. , 2010). Однако остается неизвестным, какой вклад HSC, происходящие из плаценты, вносят в пул взрослых стволовых клеток. Затем HSC колонизируют FL от E11 у мышей и E28 у людей, главным образом в ответ на CXCL12 (Chou and Lodish, 2010).CXCL12, высвобождаемый из ЭК, стромальных клеток и мезенхимальных предшественников, хорошо охарактеризован своей ролью в хоминге, удержании и выживании HSC в нише (Ara et al., 2003; Christensen et al., 2004; Sugiyama et al., 2006; Sawitza et al., 2009; Greenbaum et al., 2013). CXCL12 усиливает миграцию FL-HSCs в комбинации с фактором стволовых клеток (SCF) по сравнению с BM-HSCs (Christensen et al., 2004). Кроме того, мыши, лишенные CXCL12 или его рецептора (CXCR4), демонстрируют нормальный FL-гематопоэз, но аберрантную колонизацию селезенки и BM, что позволяет предположить, что специфическая и отличная сигнальная среда привлекает и поддерживает HSC (Nagasawa et al.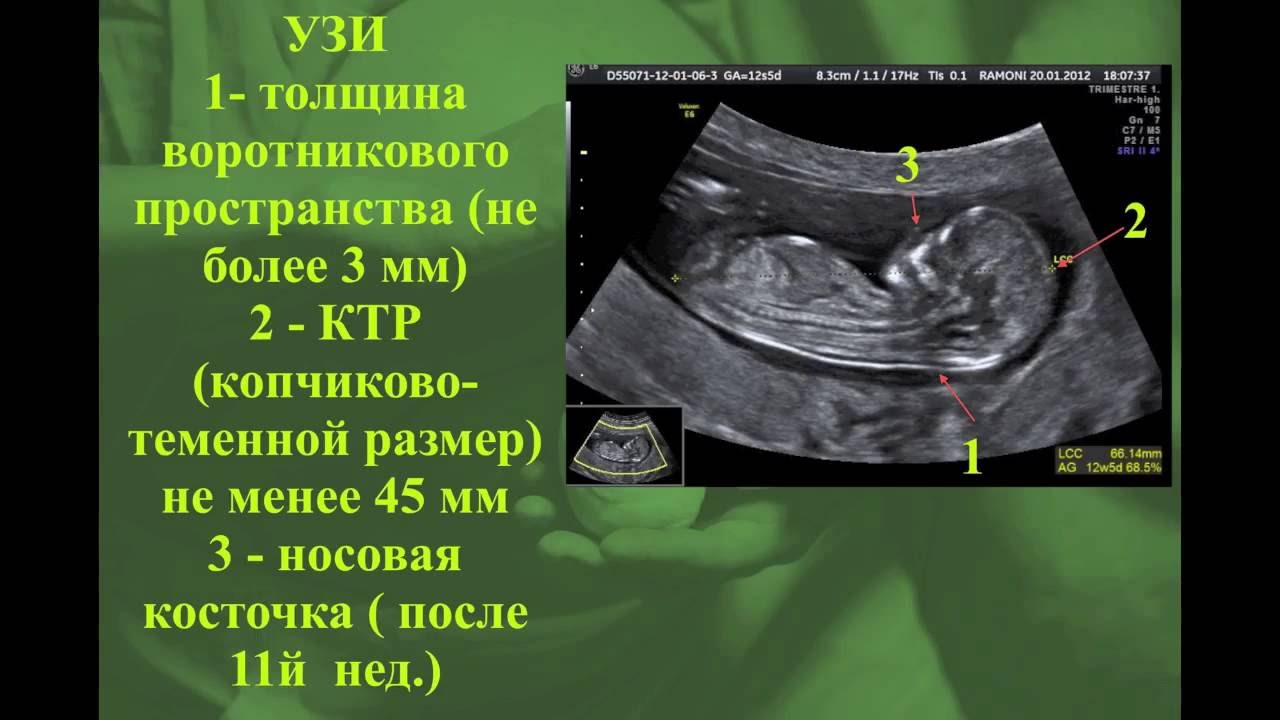 , 1996; Ara et al., 2003). В FL обнаружено, что HSC тесно связаны с EC и стромальными клетками, которые способствуют экспансии HSC (Tamplin et al., 2015; Khan et al., 2016).
, 1996; Ara et al., 2003). В FL обнаружено, что HSC тесно связаны с EC и стромальными клетками, которые способствуют экспансии HSC (Tamplin et al., 2015; Khan et al., 2016).
Помимо секреции цитокинов, прямой контакт между разными клетками внутри FL и гематопоэтическими предшественниками также важен для поддержания и увеличения HSCs (Nanno et al., 1994; Corlu et al., 1998). HSC экспрессируют ряд интегринов и рецепторов адгезии, которые имеют решающее значение для правильного переноса HSC в FL и могут опосредовать контакт с клетками.Например, VE-кадгерин (CD144), α2b-интегрин (CD41), β1-интегрин (CD29), cKIT и CXCR4 представляют собой хорошо зарекомендовавшие себя молекулы транспорта, экспрессируемые HSC, и играют ключевую роль в наведении HSC в нишу плода (Mazo et al. др., 2011).
Дальнейшие исследования продемонстрировали, что HSC пуповины обладают более высоким сродством к прикреплению к BM взрослых, чем эмбриональные HSC, что связано со специфическим сдвигом в экспрессии специфических интегринов HSC. Это указывает на то, что экспрессия интегрина необходима во время развития, чтобы обеспечивать хождение в специфические ниши (Roy and Verfaillie, 1999).Интегрины (в основном α4-интегрин) участвуют в опосредовании взаимодействия HSC с сосудистой нишей в BM (Mazo et al., 1998), и их ингибирование мобилизует HSC из FL (Kim et al., 2016). HSC, происходящие из эндотелия человека, также экспрессируют и используют фактор миелоидной адгезии, гликозилфосфатидилинозитол-заякоренный поверхностный белок (GPI-80; также известный как Vanin-2 или VNN2 ) (Prashad et al., 2015), чтобы облегчить их миграция и разрастание в фетальной нише.
Это указывает на то, что экспрессия интегрина необходима во время развития, чтобы обеспечивать хождение в специфические ниши (Roy and Verfaillie, 1999).Интегрины (в основном α4-интегрин) участвуют в опосредовании взаимодействия HSC с сосудистой нишей в BM (Mazo et al., 1998), и их ингибирование мобилизует HSC из FL (Kim et al., 2016). HSC, происходящие из эндотелия человека, также экспрессируют и используют фактор миелоидной адгезии, гликозилфосфатидилинозитол-заякоренный поверхностный белок (GPI-80; также известный как Vanin-2 или VNN2 ) (Prashad et al., 2015), чтобы облегчить их миграция и разрастание в фетальной нише.
Несколько путей ECM, клеточной адгезии и цитоскелета обогащены линией стромальных клеток, полученных из мышиных фибробластов FL AFT024 [линия клеток, которая поддерживает экспансию HSC in vitro (Nolta et al., 2002)] и внутри HSCs, делая возможным миграцию HSC и закрепление в своих нишах (Charbord and Moore, 2005).
Цыпленок
Окончательный гематопоэз цыплят инициируется на E3-4 появлением внутриаортальных кластеров HSC, происходящих из эндотелия (как наблюдается у млекопитающих) (Jaffredo et al. , 2000; Bollerot et al., 2005a, b; Yvernogeau and Robin, 2017). Затем HSC мигрируют в соседнюю мезенхиму, вентрально от аорты и располагаются в PAF, которые поддерживают развитие клеток CD45 + (Cormier, 1993; Geerts et al., 1993), таких как клетки-предшественники миелоэритроидов и незрелые предшественники тимуса (которые еще не претерпели перестройки рецепторов Т-клеток) (Lampisuo et al., 1999; Jaffredo et al., 2000; Liippo et al., 2000; Saynajakangas et al. ., 2009). Дополнительный участок эмбрионального гемопоэза включает желточный мешок, который также способствует расширению и созреванию эритроидных и миелоидных клеток (Guedes et al., 2014). Однако сигналы самонаведения к куриным PAF остаются неидентифицированными. Хотя мало известно о микроокружении, которое д. Поддерживать HSCs в куриных PAFs, дифференциальная экспрессия интегринов может играть важную роль в поддержке HSCs (Corbel, 2002).
, 2000; Bollerot et al., 2005a, b; Yvernogeau and Robin, 2017). Затем HSC мигрируют в соседнюю мезенхиму, вентрально от аорты и располагаются в PAF, которые поддерживают развитие клеток CD45 + (Cormier, 1993; Geerts et al., 1993), таких как клетки-предшественники миелоэритроидов и незрелые предшественники тимуса (которые еще не претерпели перестройки рецепторов Т-клеток) (Lampisuo et al., 1999; Jaffredo et al., 2000; Liippo et al., 2000; Saynajakangas et al. ., 2009). Дополнительный участок эмбрионального гемопоэза включает желточный мешок, который также способствует расширению и созреванию эритроидных и миелоидных клеток (Guedes et al., 2014). Однако сигналы самонаведения к куриным PAF остаются неидентифицированными. Хотя мало известно о микроокружении, которое д. Поддерживать HSCs в куриных PAFs, дифференциальная экспрессия интегринов может играть важную роль в поддержке HSCs (Corbel, 2002).
Ксенопус
Эксперименты по картированию судьбы и трансплантации показали, что bona fide HSC генерируются в дорсальной боковой пластинке (DLP), эквиваленте AGM млекопитающих (Turpen et al. , 1981; Maeno et al., 1985; Ciau-Uitz et al. al., 2000; Clements, Traver, 2013). На личиночных стадиях происходящие из DLP HSCs достигают зрелости и засевают FL, где они продуцируют эритроциты, которые заменят эмбриональные примитивные эритроциты. FL является основным местом экспансии и дифференцировки HSC во время эмбриогенеза, т.е.э., до метаморфоза (Chen, Turpen, 1995). В классических исследованиях использовались срезы почек и печени головастиков лягушки-быка для выявления кроветворной микросреды, поддерживающей развитие красных кровяных телец (Broyles et al., 1981). После метаморфоза большинство клеток крови происходит из DLP (Ciau-Uitz et al., 2014).
, 1981; Maeno et al., 1985; Ciau-Uitz et al. al., 2000; Clements, Traver, 2013). На личиночных стадиях происходящие из DLP HSCs достигают зрелости и засевают FL, где они продуцируют эритроциты, которые заменят эмбриональные примитивные эритроциты. FL является основным местом экспансии и дифференцировки HSC во время эмбриогенеза, т.е.э., до метаморфоза (Chen, Turpen, 1995). В классических исследованиях использовались срезы почек и печени головастиков лягушки-быка для выявления кроветворной микросреды, поддерживающей развитие красных кровяных телец (Broyles et al., 1981). После метаморфоза большинство клеток крови происходит из DLP (Ciau-Uitz et al., 2014).
Данио
Во время развития рыбок данио gata2b (самый ранний гемогенный маркер эндотелия) экспрессируется в ЭК в дне дорсальной аорты (Butko et al., 2015). Затем HSCs определяются через экспрессию runx1 и cmyb , и их можно наблюдать в процессе ЭГТ со дна дорсальной аорты между 32-60 часами оплодотворения (Bertrand et al.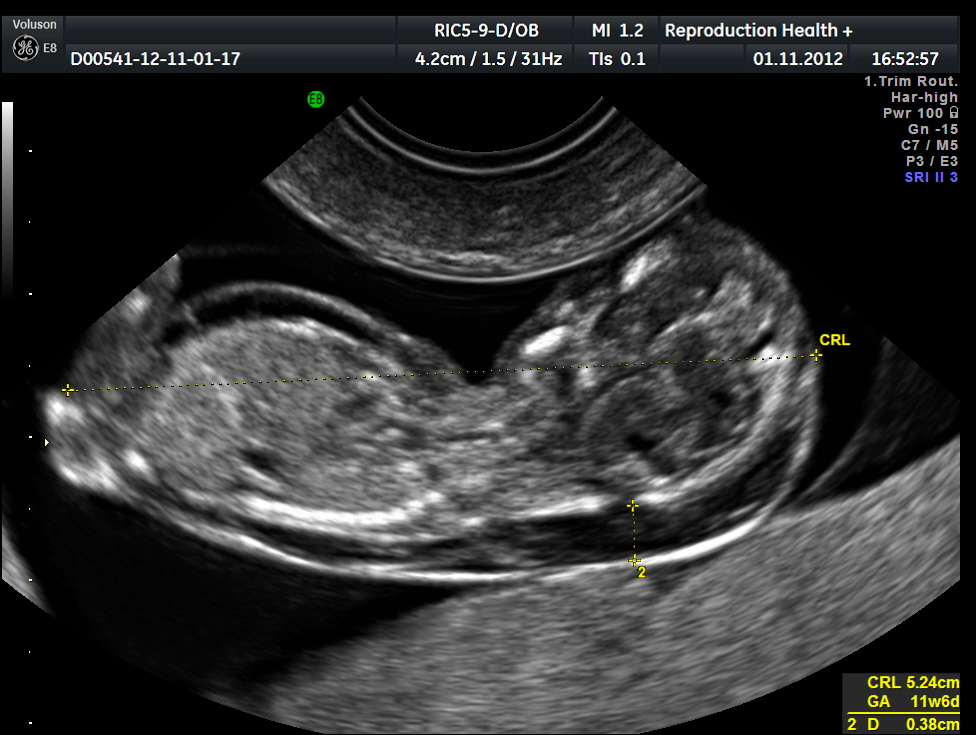 , 2010; Kissa and Herbomel, 2010; Mahony et al. др., 2018). В отличие от млекопитающих, HSC рыбок данио затем мигрируют к вене, где они входят в кровоток, чтобы мигрировать в CHT (Bertrand et al., 2010). В пределах CHT они значительно увеличиваются между 3 и 4 днями после оплодотворения (dpf) (Murayama et al., 2006; Тамплин и др., 2015; Махони и др., 2016; Стаал и др., 2016). HSCs мигрируют в эмбриональную нишу CHT в ответ на cxcl12a , экспрессируемый из стромальных клеток (Tamplin et al., 2015). Дальнейшие исследования рыбок данио идентифицировали klf6a как важный фактор транскрипции, который непосредственно регулирует экспрессию ccl25b в ЭК (Xue et al., 2015, 2017). Xue et al. (2017) продемонстрировали, что ccl25b экспрессируется в CHT на 48hpf и является важным цитокином для хемоаттракции HSC и расширения в нише CHT.Эти результаты были дополнительно подтверждены культурой ex vivo мышиных HSC в присутствии Ccl21 (мышиный ортолог ccl25b ), который усиливал экспансию HSC за счет активации его рецептора, Ccr7 (Xue et al.
, 2010; Kissa and Herbomel, 2010; Mahony et al. др., 2018). В отличие от млекопитающих, HSC рыбок данио затем мигрируют к вене, где они входят в кровоток, чтобы мигрировать в CHT (Bertrand et al., 2010). В пределах CHT они значительно увеличиваются между 3 и 4 днями после оплодотворения (dpf) (Murayama et al., 2006; Тамплин и др., 2015; Махони и др., 2016; Стаал и др., 2016). HSCs мигрируют в эмбриональную нишу CHT в ответ на cxcl12a , экспрессируемый из стромальных клеток (Tamplin et al., 2015). Дальнейшие исследования рыбок данио идентифицировали klf6a как важный фактор транскрипции, который непосредственно регулирует экспрессию ccl25b в ЭК (Xue et al., 2015, 2017). Xue et al. (2017) продемонстрировали, что ccl25b экспрессируется в CHT на 48hpf и является важным цитокином для хемоаттракции HSC и расширения в нише CHT.Эти результаты были дополнительно подтверждены культурой ex vivo мышиных HSC в присутствии Ccl21 (мышиный ортолог ccl25b ), который усиливал экспансию HSC за счет активации его рецептора, Ccr7 (Xue et al.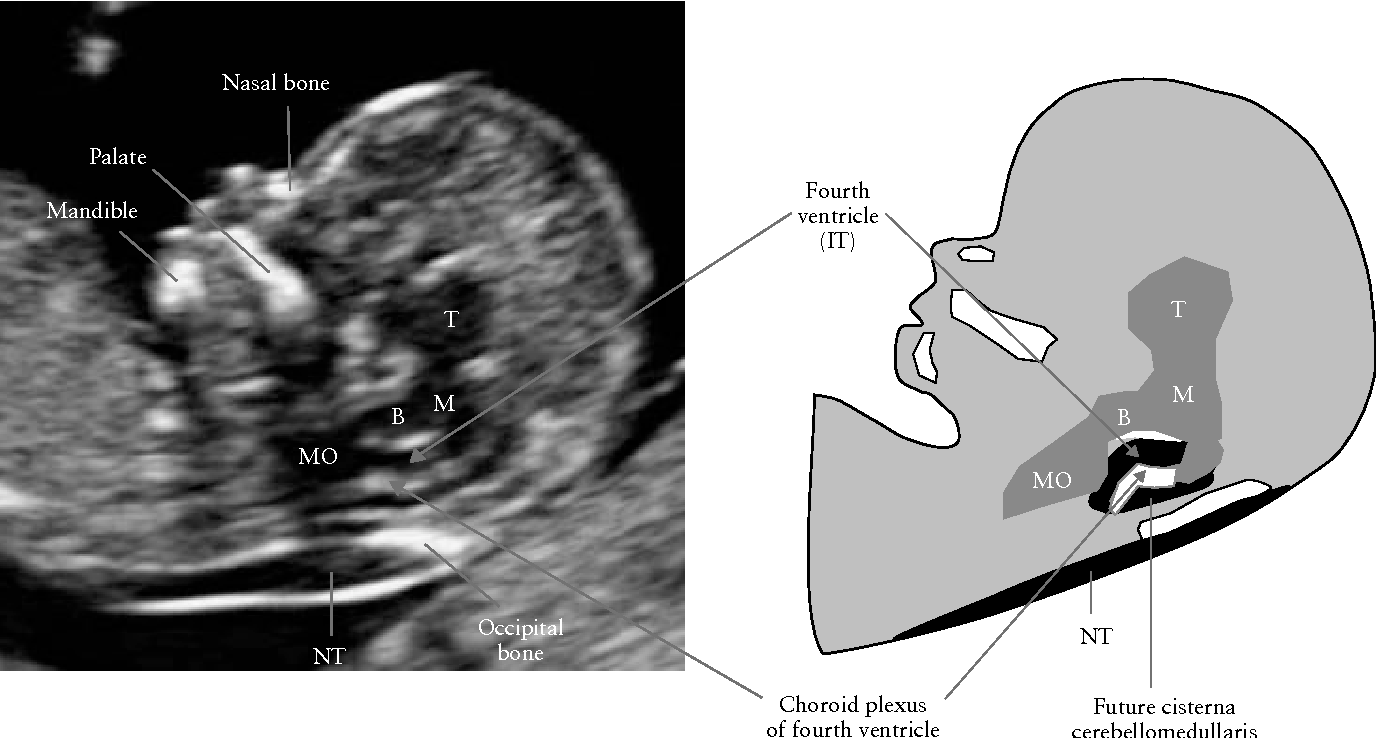 , 2017 ). По прибытии в нишу CHT макрофаги VCAM + также необходимы, чтобы направлять HSC (посредством связывания с α 4-интегрином , экспрессируемым HSC) в венозные капилляры и удерживать их в своей эмбриональной нише (Li et al., 2018).
, 2017 ). По прибытии в нишу CHT макрофаги VCAM + также необходимы, чтобы направлять HSC (посредством связывания с α 4-интегрином , экспрессируемым HSC) в венозные капилляры и удерживать их в своей эмбриональной нише (Li et al., 2018).
Неклеточные автономные медиаторы экспансии Hsc в эмбриональной нише
Пул HSC сначала подвергается расширению вскоре после выхода HSC из AGM (Taoudi et al., 2008; Rybtsov et al., 2016), прежде чем мигрировать в их фетальную нишу. Затем количество HSC значительно увеличивается примерно в 38 раз от их исходного количества, достигая пика примерно на E14 у мышей и прекращаясь примерно через 2–4 дня после рождения (Morrison et al., 1995; Ema and Nakauchi, 2000; Baumann et al., 2004; Lessard et al., 2004; Чен и др., 2009; Паюшина, 2012). Следовательно, полная характеристика различных клеток и факторов окружающей среды, которые расширяют HSCs у разных организмов, необходима для улучшения ограниченных в настоящее время регенеративных методов лечения. В дальнейшем мы опишем различные элементы микросреды, которые способствуют этому распространению по филуму позвоночных.
В дальнейшем мы опишем различные элементы микросреды, которые способствуют этому распространению по филуму позвоночных.
Стромальные клетки
В эмбрионе мыши HSC тесно связаны с перипортальными стромальными клетками Nestin + , которые экспрессируют многие факторы экспансии HSC, такие как angptl2 (Khan et al., 2016). Многие различные поддерживающие линии стромальных клеток также были получены из FL мыши, такие как AFT024, которые поддерживают HSC in vitro (Nolta et al., 2002), и клеточная линия KM3, которая поддерживает эмбриональные стволовые клетки человека (Hu et al. др., 2012). Анализ клеточной линии AFT024 выявил обогащение секретируемыми факторами, такими как инсулиноподобный фактор роста, SCF, ангиопоэтин-3, Wnts и Ephrin2a, которые поддерживают HSC (Charbord and Moore, 2005).
Подтип стромальных клеток, звездчатые клетки, представляют собой жировые накапливающие синусоидные клетки печени, которые появляются в районе E10-11 у эмбриона мыши и экспрессируют ряд цитокинов, ECM и молекул адгезии (Ramadori and Saile, 2002; Tan et al. , 2017). Звездчатые клетки являются Desmin -положительными и обнаруживаются в непосредственной близости от HSC (Kiassov et al., 1995). Эти клетки экспрессируют множество различных поддерживающих гемопоэтических цитокинов, таких как OSM , Csf1 , THPO , EPO, Igf1, SCF / KitL и Cxcl12 (Fujio et al., 1994; Kubota et al., 2007; Kubota et al., 2007; Tan et al., 2017). Звездчатые клетки также экспрессируют VCAM , фибронектин1, витронектин1 , Lamb1-1 (Laminin-b1-1) и Lamc1 (Laminin-c1) (Kubota et al., 2007; Tan et al., 2017). In vitro , звездчатые клетки печени взрослых могут поддерживать HSCs сходным образом с мезенхимальными стволовыми клетками BM (Kordes et al., 2013). Следовательно, звездчатые клетки могут играть важную роль в поддержании микросреды печени и увеличении пула HSC.
, 2017). Звездчатые клетки являются Desmin -положительными и обнаруживаются в непосредственной близости от HSC (Kiassov et al., 1995). Эти клетки экспрессируют множество различных поддерживающих гемопоэтических цитокинов, таких как OSM , Csf1 , THPO , EPO, Igf1, SCF / KitL и Cxcl12 (Fujio et al., 1994; Kubota et al., 2007; Kubota et al., 2007; Tan et al., 2017). Звездчатые клетки также экспрессируют VCAM , фибронектин1, витронектин1 , Lamb1-1 (Laminin-b1-1) и Lamc1 (Laminin-c1) (Kubota et al., 2007; Tan et al., 2017). In vitro , звездчатые клетки печени взрослых могут поддерживать HSCs сходным образом с мезенхимальными стволовыми клетками BM (Kordes et al., 2013). Следовательно, звездчатые клетки могут играть важную роль в поддержании микросреды печени и увеличении пула HSC.
Недавние исследования также были сосредоточены на стромальных клетках рыбок данио, полученных из сомитов (Murayama et al.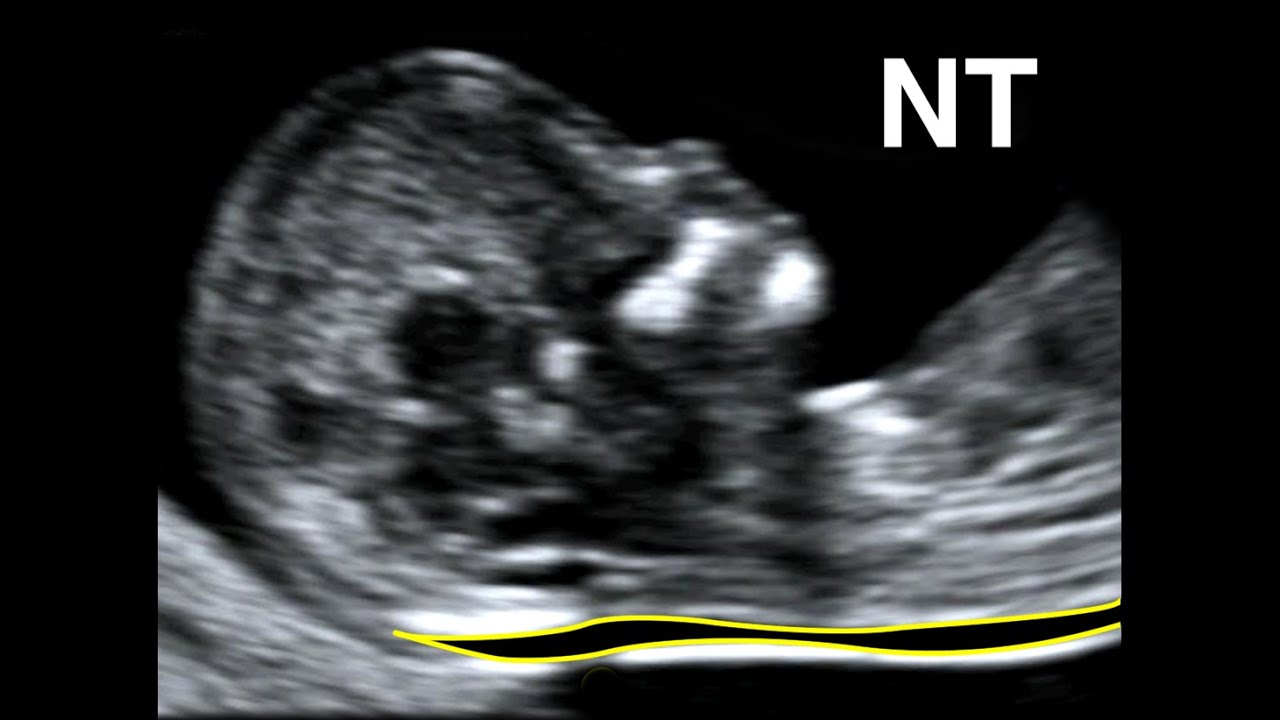 , 2015). Изолированные стромальные клетки CHT рыбок данио [каудальная гемопоэтическая эмбриональная стромальная ткань (CHEST)] из эмбрионов 3dpf экспрессируют ряд гемопоэтических цитокинов, некоторые из которых не присутствуют в изолированных клетках почек взрослых рыб (например, gcsfb , il11a , il11b и fgf21 ).Кроме того, клетки CHEST были способны увеличивать культивируемые HSC и стимулировать дифференцировку HSC in vitro (Wolf et al., 2017). Развитие этих линий стромальных клеток рыбок данио является важным шагом и представляет собой ценный инструмент для изучения гематопоэза на этой модели. Действительно, сравнивая транскриптом CHEST, ZKS (стромальные клетки почек рыбок данио) и ZEST (клетки стромального ствола эмбрионов рыбок данио), Беррун и его коллеги подчеркнули гематопоэтическую роль истмина 1 ( ism1 ), секретируемого белка, необходимого для HSC. развитие, а также эритромиелоидная дифференцировка (Berrun et al., 2018).
, 2015). Изолированные стромальные клетки CHT рыбок данио [каудальная гемопоэтическая эмбриональная стромальная ткань (CHEST)] из эмбрионов 3dpf экспрессируют ряд гемопоэтических цитокинов, некоторые из которых не присутствуют в изолированных клетках почек взрослых рыб (например, gcsfb , il11a , il11b и fgf21 ).Кроме того, клетки CHEST были способны увеличивать культивируемые HSC и стимулировать дифференцировку HSC in vitro (Wolf et al., 2017). Развитие этих линий стромальных клеток рыбок данио является важным шагом и представляет собой ценный инструмент для изучения гематопоэза на этой модели. Действительно, сравнивая транскриптом CHEST, ZKS (стромальные клетки почек рыбок данио) и ZEST (клетки стромального ствола эмбрионов рыбок данио), Беррун и его коллеги подчеркнули гематопоэтическую роль истмина 1 ( ism1 ), секретируемого белка, необходимого для HSC. развитие, а также эритромиелоидная дифференцировка (Berrun et al., 2018).
Помимо гемопоэтических цитокинов, метаболизм липидов также важен для экспансии и развития HSC во время эмбриогенеза. Это было недавно продемонстрировано посредством исследования липопротеинлипазы ( lpl ), фермента, экспрессируемого стромой и / или ЭК в CHT и необходимого для метаболизма жирных кислот. И lpl , и его кофактор аполипопротеин c2 ( apoc2 ) контролировали высвобождение незаменимой жирной кислоты (докозагексаеновой кислоты), которая была идентифицирована как новый фактор расширения HSC (Liu et al., 2018). Это исследование выявило дополнительный возможный путь, важный для улучшения экспансии HSC ex vivo .
Это было недавно продемонстрировано посредством исследования липопротеинлипазы ( lpl ), фермента, экспрессируемого стромой и / или ЭК в CHT и необходимого для метаболизма жирных кислот. И lpl , и его кофактор аполипопротеин c2 ( apoc2 ) контролировали высвобождение незаменимой жирной кислоты (докозагексаеновой кислоты), которая была идентифицирована как новый фактор расширения HSC (Liu et al., 2018). Это исследование выявило дополнительный возможный путь, важный для улучшения экспансии HSC ex vivo .
Передняя доля лимфатической железы дрозофилы состоит из медуллярной зоны (MZ), кортикальной зоны (CZ) и заднего сигнального центра (PSC). Прогемоциты расположены в MZ и дают начало зрелым гемоцитам, плазматоцитам, кристаллическим клеткам и редким ламеллоцитам в ответ на иммунный вызов (Evans et al., 2003). Затем эти клетки-потомки будут колонизировать CZ.PSC дрозофилы является важной сигнальной нишей, которая контролирует продукцию и созревание клеток крови и ассоциирована со стромальными клетками млекопитающих (Lebestky et al. , 2003). PSC является источником сигнала Hedgehog, который активирует фактор транскрипции цинкового пальца Cubitus interruptus (Ci) (гомолог белков Gli позвоночных) в клетках, расположенных в MZ, для поддержания покоя предшественников крови и тонкой настройки дифференцировки при иммунном заражении. независимо от фактора транскрипции EBF Col в крови предшественников (Mandal et al., 2007; Benmimoun et al., 2015a, b; Pennetier et al., 2012). Дальнейшие исследования подтвердили, что PSC могут взаимодействовать с соседними клетками напрямую через тонкие отростки, которые простираются в MZ (Mandal et al., 2007). Дополнительные сигналы, которые влияют на передачу сигналов PSC и поддержание HSC, включают одоранты, которые стимулируют высвобождение γ-аминомасляной кислоты из мозга, и инсулиноподобный фактор роста 2 дрозофилы адипоцитами (Yu et al., 2018).
, 2003). PSC является источником сигнала Hedgehog, который активирует фактор транскрипции цинкового пальца Cubitus interruptus (Ci) (гомолог белков Gli позвоночных) в клетках, расположенных в MZ, для поддержания покоя предшественников крови и тонкой настройки дифференцировки при иммунном заражении. независимо от фактора транскрипции EBF Col в крови предшественников (Mandal et al., 2007; Benmimoun et al., 2015a, b; Pennetier et al., 2012). Дальнейшие исследования подтвердили, что PSC могут взаимодействовать с соседними клетками напрямую через тонкие отростки, которые простираются в MZ (Mandal et al., 2007). Дополнительные сигналы, которые влияют на передачу сигналов PSC и поддержание HSC, включают одоранты, которые стимулируют высвобождение γ-аминомасляной кислоты из мозга, и инсулиноподобный фактор роста 2 дрозофилы адипоцитами (Yu et al., 2018).
Эндотелиальные клетки
HSC прибывают в нишу CHT рыбок данио и постепенно колонизируют эту ткань от 48 до 80 часов после оплодотворения (Tamplin et al. , 2015). Хотя некоторые HSC все еще присутствуют через 96 hpf, большинство из них размножились и покинули нишу CHT (Mahony et al., 2016). Чтобы разместить HSCs внутри CHT, сосудистая ниша реконструируется для улучшения посева стволовых клеток, процесса, который контролируется cxcr1 (Blaser et al., 2017). По прибытии в нишу CHT, HSCs запускают «обнимающее» поведение со стороны каудальных эндотелиальных клеток (cECs). Эти объятия позволяют ЦИК поддерживать тесную близость между HSC и стромальной клеткой, что индуцирует пролиферацию HSC (Tamplin et al., 2015). Сжатые HSC затем подвергаются клеточному делению, при котором либо обе дочерние клетки покидают нишу, одна уходит, а одна, наиболее проксимальная к стромальной клетке, остается, либо обе остаются. Поразительно, что фармакологическая стимуляция приживления ниш HSC приводит к общему увеличению количества взрослых стволовых клеток, как показано с помощью отслеживания клонов (Tamplin et al., 2015). Это указывает на вклад приживления HSC эмбриональной ниши в увеличение размера пула взрослых стволовых клеток и подчеркивает важность полного понимания цитокинов, экспрессируемых EC, которые расширяют HSC.
, 2015). Хотя некоторые HSC все еще присутствуют через 96 hpf, большинство из них размножились и покинули нишу CHT (Mahony et al., 2016). Чтобы разместить HSCs внутри CHT, сосудистая ниша реконструируется для улучшения посева стволовых клеток, процесса, который контролируется cxcr1 (Blaser et al., 2017). По прибытии в нишу CHT, HSCs запускают «обнимающее» поведение со стороны каудальных эндотелиальных клеток (cECs). Эти объятия позволяют ЦИК поддерживать тесную близость между HSC и стромальной клеткой, что индуцирует пролиферацию HSC (Tamplin et al., 2015). Сжатые HSC затем подвергаются клеточному делению, при котором либо обе дочерние клетки покидают нишу, одна уходит, а одна, наиболее проксимальная к стромальной клетке, остается, либо обе остаются. Поразительно, что фармакологическая стимуляция приживления ниш HSC приводит к общему увеличению количества взрослых стволовых клеток, как показано с помощью отслеживания клонов (Tamplin et al., 2015). Это указывает на вклад приживления HSC эмбриональной ниши в увеличение размера пула взрослых стволовых клеток и подчеркивает важность полного понимания цитокинов, экспрессируемых EC, которые расширяют HSC.
Прямые физические контакты между HSC и EC были описаны у эмбрионов мыши, аналогично CHT у рыбок данио (Tamplin et al., 2015), и могут опосредоваться E -селектином и VCAM1 (Schweitzer et al., 1996; Виттиг и др., 2010). Мышиные FL-HSC экспрессируют рецептор эндотелиального протеина C , который может связывать активированный протеин C . Это индуцирует передачу сигналов рецептора 1, активируемого протеазой, который ингибирует апоптоз и поддерживает активность самообновления (Iwasaki et al., 2010). В отличие от мышиных HSC, человеческие HSC экспрессируют рецептор эндотелиального протеина C в FL, но теряют свою экспрессию после миграции в BM (Subramaniam et al., 2018).
ЭК печени плода также поддерживают гематопоэз ex vivo и способствуют дифференцировке HSC (Ohneda and Bautch, 1997; Wittig et al., 2010). FL ECs поддерживают гематопоэз за счет экспрессии SCF / KitL, которая в норме связана с мембраной. Превращение этого цитокина в его растворимую форму происходит под контролем MMP9 , транскрипция которого регулируется Ezh3, репрессором транскрипции, экспрессируемым FL EC. Этот процесс был описан только в контексте эритропоэза (Neo et al., 2018), но может иметь отношение к экспансии HSC.
Этот процесс был описан только в контексте эритропоэза (Neo et al., 2018), но может иметь отношение к экспансии HSC.
Эти исследования подчеркивают важность ECs в расширении HSCs в CHT рыбок данио и FL у млекопитающих. Однако многие другие типы клеток поддерживают экспансию HSC во время эмбриогенеза.
Регулирование HSC их гематопоэтическим потомством
Регуляция экспансии HSC их потомством была описана в лимфатической железе дрозофилы. PDGF и связанный с VEGF фактор-1 (Pvf1) продуцируется PSC и активирует его рецептор (PVR) на дифференцированных клетках в корковой зоне.Это активирует передачу сигналов JAK / STAT и, следовательно, контролирует экспрессию и секрецию фактора роста аденозиндезаминазы-A (Adgf-A) из дифференцированных клеток. Этот фермент превращает аденозин в инозин, который способствует поддержанию предшественников, посредством внутриклеточного пути PKA (Mondal et al., 2011). Сходным образом у млекопитающих микросреда плаценты поддерживает гематопоэз посредством экспрессии PDGF-B, чтобы в целом ингибировать дифференцировку HSC (Chhabra et al.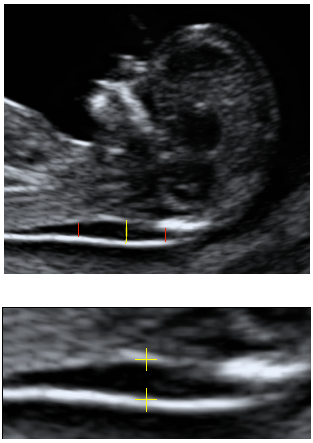 , 2012). Drosophila bip1 ( bric-à-brac, взаимодействующий белок 1 ) и Nucleoporin 98 (Nup98) — дополнительные гены, идентифицированные для контроля пролиферации предшественников в крови, которые контролируют экспрессию PVR (Mondal et al., 2014). Отрицательная обратная связь дифференцированных клеток в HSCs была подтверждена в BM взрослых мышей, но остается недокументированной в FL.
, 2012). Drosophila bip1 ( bric-à-brac, взаимодействующий белок 1 ) и Nucleoporin 98 (Nup98) — дополнительные гены, идентифицированные для контроля пролиферации предшественников в крови, которые контролируют экспрессию PVR (Mondal et al., 2014). Отрицательная обратная связь дифференцированных клеток в HSCs была подтверждена в BM взрослых мышей, но остается недокументированной в FL.
Гепатоциты млекопитающих
Гепатоциты составляют большую часть массы печени и, следовательно, также играют роль в нише HSC. Анализ образцов FL человека выявил присутствие E -селектин-положительных бипотентных гепатобластов FL, способных дифференцироваться в эпителиальные клетки печени или желчных путей (Terrace et al., 2007).Гепатобласты мышей характеризуются экспрессией белкового дельта-гомолога 1 (DLK-1) и ряда важных гемопоэтических цитокинов, таких как Epo, Thpo, Il6, SCF и Flt31 . Гепатобласты также экспрессируют высокие уровни молекул ECM, включая витронектин, фибронектин и тенасцин C, которые экспрессируются под контролем передачи сигналов TBGβ1 (Sugiyama et al.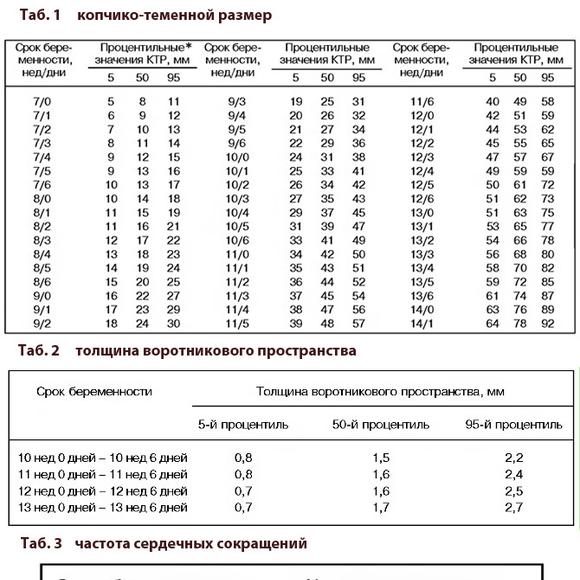 , 2013). Важность гепатоцитов в увеличении HSC была продемонстрирована совместным культивированием клеточных линий гепатоцитов с FL-клетками, что привело к значительному увеличению количества HSC (Aiuti et al., 1998). Их важность была дополнительно подчеркнута анализом Map2k4 -мутантных эмбрионов мышей, лишенных гепатобластов, у которых гемопоэз сильно пострадал после снижения экспрессии цитокинов в FL, таких как EPO и SCF . Соответственно, у этих эмбрионов наблюдалось сильное снижение количества HSC (Sugiyama et al., 2011).
, 2013). Важность гепатоцитов в увеличении HSC была продемонстрирована совместным культивированием клеточных линий гепатоцитов с FL-клетками, что привело к значительному увеличению количества HSC (Aiuti et al., 1998). Их важность была дополнительно подчеркнута анализом Map2k4 -мутантных эмбрионов мышей, лишенных гепатобластов, у которых гемопоэз сильно пострадал после снижения экспрессии цитокинов в FL, таких как EPO и SCF . Соответственно, у этих эмбрионов наблюдалось сильное снижение количества HSC (Sugiyama et al., 2011).
Другое исследование показало, что DLK1-положительные предшественники гепатоцитов (или гепатобласты) были основным источником в нише FL, поскольку они были основным источником SCF, IGF-2, Cxcl12 , а также angptl2 и angptl3 .Первоначально эти клетки были идентифицированы как Т-клетки, поскольку они были окрашены антителом к CD3 (Chou and Lodish, 2010). Ex vivo совместное культивирование этих FL гепатобластов с BM-HSCs ведет к усилению долговременной репопуляции HSC и ex vivo экспансии HSC (Zhang and Lodish, 2004; Zhang et al. , 2006). Далее было предположено, что Angptl2 может опосредовать свои эффекты через рецептор LILRB2 (Deng et al., 2014).
, 2006). Далее было предположено, что Angptl2 может опосредовать свои эффекты через рецептор LILRB2 (Deng et al., 2014).
Гипоксия и АФК
Гипоксия — важный сигнал созревания в микросреде.У дрозофилы низкий уровень кислорода ощущается Sima, ортологом индуцируемого гипоксией фактора 1-α (Hif1-α), который индуцирует дифференцировку кристаллических клеток. Умеренные уровни АФК необходимы для пролиферации ранних предшественников. Тонкая настройка уровней ROS также необходима для уравновешивания дифференцировки предшественников в MZ путем регулирования уровней E -cadherin (Gao et al., 2014). Хотя уровни ROS и гипоксия являются хорошо описанными сигналами, относящимися к нише BM взрослых, очень мало известно об их роли во время эмбриональной экспансии HSC в любых других моделях.
Факторы транскрипции, контролирующие нишу HSC
Понимание генетической сети, которая контролирует спецификацию и поддержание ниши, позволит создать или воспроизвести эти ниши in vitro . Факторы транскрипции контролируют многие аспекты ниши, от того, как ниша привлекает HSC, до их выращивания и высвобождения. Как упоминалось ранее, klf6a представляет собой фактор транскрипции, который контролирует экспрессию ccl25b в cECs из CHT рыбок данио.Следовательно, в отсутствие klf6a HSCs не могут колонизировать CHT и не расширяться (Xue et al., 2017).
Факторы транскрипции контролируют многие аспекты ниши, от того, как ниша привлекает HSC, до их выращивания и высвобождения. Как упоминалось ранее, klf6a представляет собой фактор транскрипции, который контролирует экспрессию ccl25b в cECs из CHT рыбок данио.Следовательно, в отсутствие klf6a HSCs не могут колонизировать CHT и не расширяться (Xue et al., 2017).
У рыбок данио мы также показали роль tfec , фактора транскрипции цинковых пальцев семейства mitf (Lister et al., 2011), в экспансии HSC. Tfec высоко экспрессируется в цИК CHT и контролирует экспрессию нескольких нишевых цитокинов CHT (таких как kitlgb , thpo , csf1a и csf3b ) (Mahony et al., 2016). Эти цитокины, как известно, способствуют пролиферации и выживанию HSC, что приводит к их увеличению. Следовательно, у мутантов tfec HSC не созревают, что приводит к тяжелой анемии (Mahony et al., 2016). Однако этот фенотип может быть спасен сверхэкспрессией kitlgb (Mahony et al. , 2016). Кроме того, tfec также контролирует экспрессию онкостатина М ( осм) из цИК, которые могут синергетически усиливать экспансию HSC с kitlgb (Mahony et al., 2018). Tfec , следовательно, является критическим фактором транскрипции, необходимым для надлежащей роли эмбриональной гематопоэтической ниши. Эта роль tfec , вероятно, сохранилась у млекопитающих. В самом деле, у крыс сравнение синусоидальных ЭК печени с микрососудистыми ЭК легких выявило специфическую комбинацию факторов транскрипции, которые контролировали функцию и идентичность ЭК печени (Geraud et al., 2010). Tfec был идентифицирован как специфический для печени фактор транскрипции вместе с Gata4, Lmo3 и Maf .В то время как роль Tfec , Lmo3 и Maf еще не исследована во время гематопоэза плода мыши, Gata4 , по-видимому, требуется для ЭК для функционирования в качестве ниши HSC (Geraud et al., 2017). Дальнейшие исследования показали, что Gata4 требуется для правильного созревания ЭК в эмбриональной печени и правильной колонизации HSPC, поскольку Gata4 позволяет специфицировать прерывистый эндотелий, который делает возможной колонизацию HSC.
, 2016). Кроме того, tfec также контролирует экспрессию онкостатина М ( осм) из цИК, которые могут синергетически усиливать экспансию HSC с kitlgb (Mahony et al., 2018). Tfec , следовательно, является критическим фактором транскрипции, необходимым для надлежащей роли эмбриональной гематопоэтической ниши. Эта роль tfec , вероятно, сохранилась у млекопитающих. В самом деле, у крыс сравнение синусоидальных ЭК печени с микрососудистыми ЭК легких выявило специфическую комбинацию факторов транскрипции, которые контролировали функцию и идентичность ЭК печени (Geraud et al., 2010). Tfec был идентифицирован как специфический для печени фактор транскрипции вместе с Gata4, Lmo3 и Maf .В то время как роль Tfec , Lmo3 и Maf еще не исследована во время гематопоэза плода мыши, Gata4 , по-видимому, требуется для ЭК для функционирования в качестве ниши HSC (Geraud et al., 2017). Дальнейшие исследования показали, что Gata4 требуется для правильного созревания ЭК в эмбриональной печени и правильной колонизации HSPC, поскольку Gata4 позволяет специфицировать прерывистый эндотелий, который делает возможной колонизацию HSC. Следовательно, когда Gata4 был специфически удален в синусоидальных ECs печени во время развития, сосудистая сеть FL не могла нормально развиваться и кроветворение не поддерживалось FL (Geraud et al., 2017). Делеция другого фактора транскрипции, , активирующего фактор транскрипции 4 ( ATF4 ), нарушает способность как эндотелиальных, так и стромальных клеток поддерживать развитие HSC FL. Дальнейший анализ показал, что Atf4 напрямую регулирует экспрессию Angptl3 , чтобы контролировать эффективность репопуляции HSC (Zhao et al., 2015). Следует отметить, что Atf4 также требуется на автономном уровне ячейки для правильного самообновления FL HSCs (Rieger, 2015).
Следовательно, когда Gata4 был специфически удален в синусоидальных ECs печени во время развития, сосудистая сеть FL не могла нормально развиваться и кроветворение не поддерживалось FL (Geraud et al., 2017). Делеция другого фактора транскрипции, , активирующего фактор транскрипции 4 ( ATF4 ), нарушает способность как эндотелиальных, так и стромальных клеток поддерживать развитие HSC FL. Дальнейший анализ показал, что Atf4 напрямую регулирует экспрессию Angptl3 , чтобы контролировать эффективность репопуляции HSC (Zhao et al., 2015). Следует отметить, что Atf4 также требуется на автономном уровне ячейки для правильного самообновления FL HSCs (Rieger, 2015).
Высвобождение HSC из эмбриональной ниши
Клеточные процессы, управляющие высвобождением HSC млекопитающих из эмбриональной ниши, еще предстоит полностью охарактеризовать. Однако недавнее исследование показало, что переход FL-to-BM требует правильного образования верпролин-гомологичного белкового комплекса 2 синдрома Вискотта-Олдрича (WAVE), опосредованного Hem-1 (Shao et al. , 2018). Нарушение этого комплекса приводит к потере сигнала выживания c-Abl в FL-HSC, преждевременной смерти и снижению колонизации BM, подчеркивая внутренний путь клетки, который необходим для перехода FL-to-BM.
, 2018). Нарушение этого комплекса приводит к потере сигнала выживания c-Abl в FL-HSC, преждевременной смерти и снижению колонизации BM, подчеркивая внутренний путь клетки, который необходим для перехода FL-to-BM.
Миграция HSC из FL в BM опосредуется различными цитокинами, сигналами ECM и молекулами адгезии (например, CXCL12, SCF, кадгеринами, интегринами) (Ciriza et al., 2013). Затем HSCs поддерживаются в покоящемся состоянии в BM на протяжении всей взрослой жизни с помощью множества различных сигналов и клеток (Boulais and Frenette, 2015).
Механизмы, управляющие высвобождением HSC из эмбриональной ниши, также неуловимы у рыбок данио. Однако визуализация в реальном времени выявила значительные изменения в архитектуре сосудов, которые обычно вмещают HSC. При 4 dpf количество HSC, присутствующих в CHT, уменьшается, и они больше не встраиваются в сосудистую сеть, а вместо этого обнаруживаются слабо связанными с сосудистыми клетками (Tamplin et al., 2015; Mahony et al., 2016). Дальнейшие исследования показали, что экспрессия mmp9 в макрофагах необходима для модуляции доступности HSC для cxcl12 .В самом деле, ингибирование mmp9 привело к накоплению HSCs в CHT, которое было спасено у cxcl12a -морфантов (Theodore et al., 2017). Следовательно, модуляция сосудистой структуры и ECM с помощью mmp9 является важной особенностью для контроля удержания и высвобождения HSC из эмбриональной ниши.
Дальнейшие исследования показали, что экспрессия mmp9 в макрофагах необходима для модуляции доступности HSC для cxcl12 .В самом деле, ингибирование mmp9 привело к накоплению HSCs в CHT, которое было спасено у cxcl12a -морфантов (Theodore et al., 2017). Следовательно, модуляция сосудистой структуры и ECM с помощью mmp9 является важной особенностью для контроля удержания и высвобождения HSC из эмбриональной ниши.
Эволюционно консервативные элементы
Возникновение и происхождение гемопоэтических стволовых клеток из ЭК — это высококонсервативный процесс у кур, рыбок данио, мышей и людей (Jaffredo et al., 2000; Bollerot et al., 2005a, b; Зовейн и др., 2008; Чен и др., 2009; Бертран и др., 2010; Boisset et al., 2010). Даже клетки крови дрозофилы обнаруживаются в тесной связи с сердечной трубкой (Dey et al., 2016). Более того, клеточно-автономная экспрессия факторов транскрипции (таких как runx1 и gata2 ), необходимая для достижения EHT, является высококонсервативной.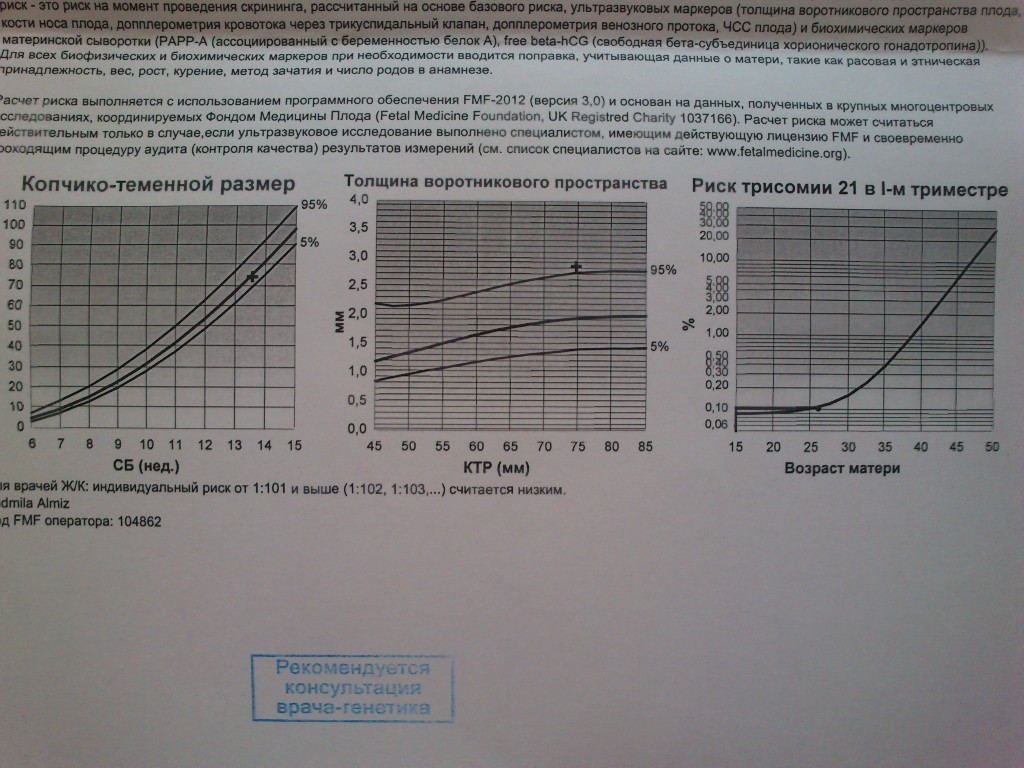 Эти знания, полученные в результате изучения различных моделей животных, позволили получить индуцибельные HSC из EC in vitro (Gomes et al., 2018).
Эти знания, полученные в результате изучения различных моделей животных, позволили получить индуцибельные HSC из EC in vitro (Gomes et al., 2018).
У видов, обсуждаемых в этом обзоре, существует несколько консервативных процессов, но также есть много различий в том, как HSCs расширяются в их фетальной нише. Понимание основных сходств и различий имеет решающее значение для полного понимания расширения HSC. Здесь мы суммируем основные консервативные элементы у дрозофилы, рыбок данио, мышей и человека, а также их эволюцию.
PSC дрозофилы состоит из стромальных клеток лимфатической железы и контролирует производство и созревание клеток крови (Lebestky et al., 2003). Эти клетки отвечают за передачу сигналов ряда внешних факторов, чтобы контролировать экспансию HSC (Рисунок 1 и Таблица 2). В ходе эволюции структура зародышевой ниши сильно изменилась. Тип позвоночных совпадает с возникновением замкнутой системы кровообращения, зависящей от сосудистой сети. У рыбок данио роль сосудистой сети становится очень важной для экспансии HSC (Tamplin et al.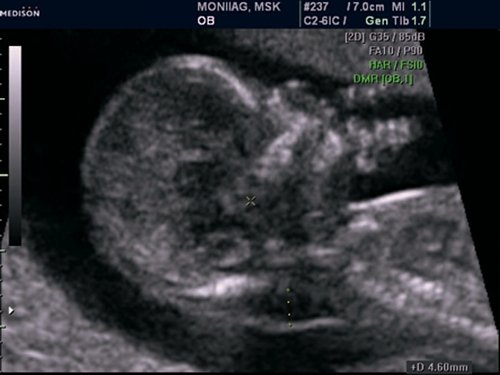 , 2015) и остается таковой у высших видов позвоночных (Table 2). У эмбрионов птиц HSC расширяются в желточном мешке, сильно васкуляризованной структуре (Guedes et al., 2014), и мышиные HSCs также тесно связаны с растущей сосудистой сетью в FL, которая поддерживает HSCs (Ohneda and Bautch, 1997; Wittig et al., 2010; Tamplin et al., 2015) (Рисунок 1 и Таблица 2).
, 2015) и остается таковой у высших видов позвоночных (Table 2). У эмбрионов птиц HSC расширяются в желточном мешке, сильно васкуляризованной структуре (Guedes et al., 2014), и мышиные HSCs также тесно связаны с растущей сосудистой сетью в FL, которая поддерживает HSCs (Ohneda and Bautch, 1997; Wittig et al., 2010; Tamplin et al., 2015) (Рисунок 1 и Таблица 2).
Рисунок 1. Краткое описание экспансии HSC позвоночных в эмбриональной нише. После своего происхождения из эндотелия аорты, HSCs возвращаются в свою эмбриональную нишу в ответ на несколько привлекательных цитокинов, таких как cxcl12 и ccl25b / Ccl21 . HSC направляются к сосудистым клеткам с помощью Mφ (макрофагов).Сосудистые клетки в эмбриональной нише затем реконструируются, чтобы приспособиться к прибывающим HSC. Затем HSC попадают в нишу плода и подвергаются делению клеток, чтобы увеличить свое первоначальное количество. Это расширение происходит в ответ на несколько цитокинов, высвобождаемых из многих различных типов клеток.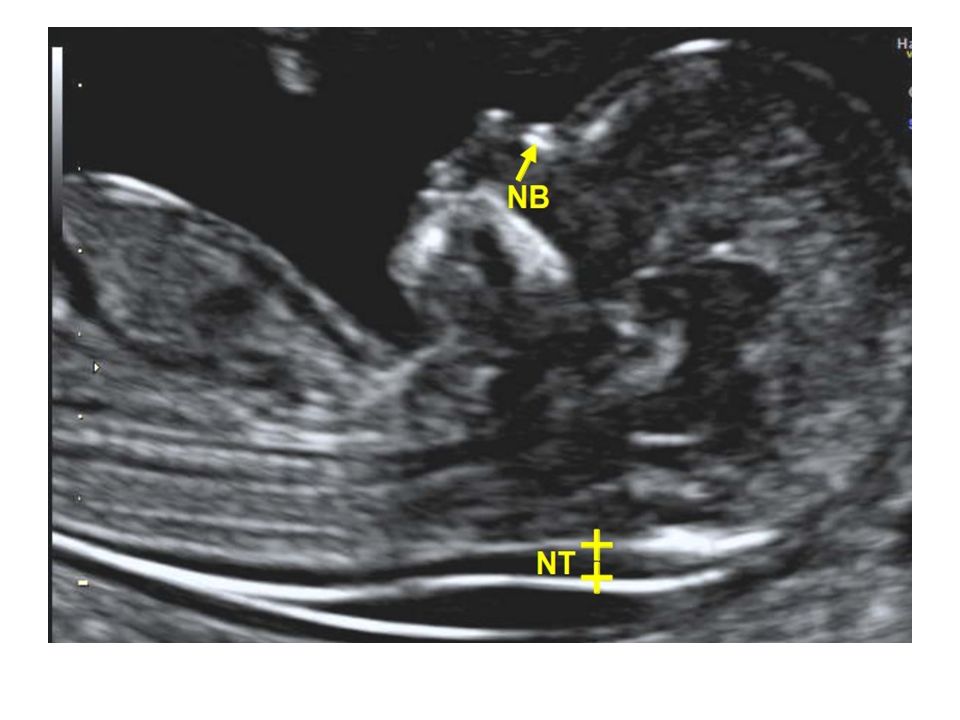 Эндотелиальные клетки высвобождают kitlg и osm под контролем tfec . Стромальные клетки выделяют cxcl12 под контролем atf4 . Гепатобласты выделяют Kit-лиганд и ангиопоэтины.После значительного расширения ЕСМ реконструируется с помощью Mmp9 , высвобождаемого из нейтрофилов, и HSCs покидают свою фетальную нишу, чтобы мигрировать в свою взрослую нишу. Здесь представлен обзор основных типов клеток, участвующих в экспансии HSC плода, а также некоторые примеры важных цитокинов / сигналов, которые они секретируют, хотя существуют и многие другие.
Эндотелиальные клетки высвобождают kitlg и osm под контролем tfec . Стромальные клетки выделяют cxcl12 под контролем atf4 . Гепатобласты выделяют Kit-лиганд и ангиопоэтины.После значительного расширения ЕСМ реконструируется с помощью Mmp9 , высвобождаемого из нейтрофилов, и HSCs покидают свою фетальную нишу, чтобы мигрировать в свою взрослую нишу. Здесь представлен обзор основных типов клеток, участвующих в экспансии HSC плода, а также некоторые примеры важных цитокинов / сигналов, которые они секретируют, хотя существуют и многие другие.
Таблица 2. Краткое изложение важных клеток и тканей, необходимых для обеспечения экспансии HSC в процессе эволюции.
От рыбок данио до млекопитающих, HSCs расширяются во все более сложной нише: тогда как CHT у костистых рыб — это временная васкуляризованная ткань (Tamplin et al., 2015), HSC будут колонизировать FL у млекопитающих, орган bona fide . С этим происходит добавление нового клеточного слоя к нише HSC, то есть гепатоцитов. Как стромы и ЭК, гепатобласты будут секретировать сходные сигналы выживания и пролиферации, такие как SCF и другие цитокины (Sugiyama et al., 2011, 2013) (Рисунок 1 и Таблица 2). Интересно отметить, что даже если структуры изменились, генетическая сеть, по-видимому, сохранилась. Одним из таких примеров является фактор транскрипции Tfec , который специфически экспрессируется в сосудистой сети CHT рыбок данио, а также в синусоидальных ЭК фетальной и взрослой печени грызунов (Geraud et al., 2010; Махони и др., 2016).
С этим происходит добавление нового клеточного слоя к нише HSC, то есть гепатоцитов. Как стромы и ЭК, гепатобласты будут секретировать сходные сигналы выживания и пролиферации, такие как SCF и другие цитокины (Sugiyama et al., 2011, 2013) (Рисунок 1 и Таблица 2). Интересно отметить, что даже если структуры изменились, генетическая сеть, по-видимому, сохранилась. Одним из таких примеров является фактор транскрипции Tfec , который специфически экспрессируется в сосудистой сети CHT рыбок данио, а также в синусоидальных ЭК фетальной и взрослой печени грызунов (Geraud et al., 2010; Махони и др., 2016).
Клиническое значение
Недавнее использование скрининговых лекарств выявило несколько многообещающих кандидатов для улучшения клинического использования HSC в регенеративной медицине. Например, StemRegenin-1 (SR1), антагонист арилуглеводородного рецептора (AHR), усиливает экспансию ex vivo клеток CD34 + и улучшает долгосрочное приживление на мышиных моделях (Boitano et al. , 2010) . Недавние клинические испытания на ранней стадии дополнительно подчеркнули эффективность этого соединения в улучшении размножения клеток CD34 + из пуповинной крови (Wagner et al., 2016). UM171, другое соединение, улучшает размножение и приживление клеток пуповинной крови человека, хотя точный механизм еще предстоит полностью охарактеризовать (Fares et al., 2014). Высокопроизводительные скрининги у рыбок данио также подчеркнули роль dmPGE2, который дает конкурентное преимущество обработанным HSC и был успешным в последующих клинических испытаниях (North et al., 2007; Cutler et al., 2013; Goessling and North, 2014). Идентификация дополнительных соединений и комбинаций цитокинов улучшит экспансию HSC для терапевтического использования.
, 2010) . Недавние клинические испытания на ранней стадии дополнительно подчеркнули эффективность этого соединения в улучшении размножения клеток CD34 + из пуповинной крови (Wagner et al., 2016). UM171, другое соединение, улучшает размножение и приживление клеток пуповинной крови человека, хотя точный механизм еще предстоит полностью охарактеризовать (Fares et al., 2014). Высокопроизводительные скрининги у рыбок данио также подчеркнули роль dmPGE2, который дает конкурентное преимущество обработанным HSC и был успешным в последующих клинических испытаниях (North et al., 2007; Cutler et al., 2013; Goessling and North, 2014). Идентификация дополнительных соединений и комбинаций цитокинов улучшит экспансию HSC для терапевтического использования.
Важность дальнейшего понимания ниши была дополнительно подчеркнута, поскольку было показано, что дисфункции ниши (например, вызванные мезенхимальными инфекциями) могут приводить к генотоксическому стрессу и могут повышать чувствительность HSC к развитию лейкемии (Zambetti et al.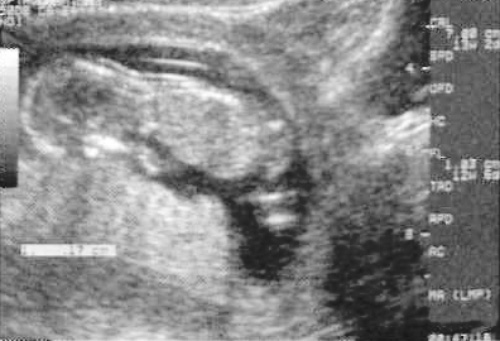 , 2016; Passaro et al. др., 2017). Остается определить, может ли аберрантная передача сигналов цитокинов в нише плода сенсибилизировать HSC к различным заболеваниям.
, 2016; Passaro et al. др., 2017). Остается определить, может ли аберрантная передача сигналов цитокинов в нише плода сенсибилизировать HSC к различным заболеваниям.
Заключение
Понимание полной генетической и молекулярной программы, которая контролирует распространение HSC в эмбриональной нише, остается важной целью для улучшения текущих протоколов регенеративной медицины.Использование многих животных моделей в филогенезе будет соответствовать этой цели, так как большинство механизмов, участвующих в контроле экспансии HSC с помощью эмбриональной ниши, по-видимому, сохраняются в процессе эволюции (Figure 1 and Table 2).
Авторские взносы
Рукопись написанаCBM. JYB отредактировал рукопись.
Финансирование
JYB поддерживается кафедрой естественных наук, финансируемой Фондом Габриэллы Джорджи-Кавальери, а также Швейцарским национальным фондом (31003_166515).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Аиути, А., Биаско, Л., Скарамуцца, С., Ферруа, Ф., Чикалезе, М. П., Барикорди, К., и др. (2013). Лентивирусная генная терапия гемопоэтическими стволовыми клетками у пациентов с синдромом Вискотта-Олдрича. Наука 341: 1233151. DOI: 10.1126 / наука.1233151
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Айути, А., Чиккини, К., Бернардини, С., Феделе, Г., Амиконе, Л., Фантони, А., и др. (1998). Гемопоэтическая поддержка и экспрессия цитокинов мышиных стабильных клеточных линий гепатоцитов (MMH). Гепатология 28, 1645–1654. DOI: 10.1002 / hep.510280626
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ара, Т., Токойода, К., Сугияма, Т., Эгава, Т., Кавабата, К.и Нагасава Т. (2003). Для долгоживущих гемопоэтических стволовых клеток необходим фактор-1, производный от стромальных клеток, для колонизации костного мозга в онтогенезе. Иммунитет 19, 257–267. DOI: 10.1016 / S1074-7613 (03) 00201-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауманн, К.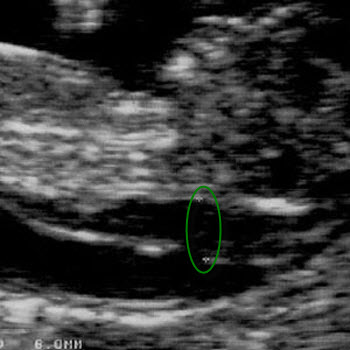 И., Бейли, А. С., Ли, В., Феркович, М. Дж., Йодер, М. К., и Флеминг, В. Х. (2004). PECAM-1 экспрессируется на гемопоэтических стволовых клетках на протяжении всего онтогенеза и определяет популяцию эритроидных предшественников. Кровь 104, 1010–1016. DOI: 10.1182 / кровь-2004-03-0989
И., Бейли, А. С., Ли, В., Феркович, М. Дж., Йодер, М. К., и Флеминг, В. Х. (2004). PECAM-1 экспрессируется на гемопоэтических стволовых клетках на протяжении всего онтогенеза и определяет популяцию эритроидных предшественников. Кровь 104, 1010–1016. DOI: 10.1182 / кровь-2004-03-0989
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенмимун Б., Хэнлин М. и Вальцер Л. (2015a). Поддержание гемопоэтических предшественников EBF / Collier: за пределами ниши. Cell Cycle 14, 3517–3518. DOI: 10.1080 / 15384101.2015.1093449
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенмимун, Б., Полеселло, К., Хэнлин, М., и Вальцер, Л. (2015b).Фактор транскрипции EBF Collier непосредственно способствует поддержанию предшественников клеток крови дрозофилы независимо от ниши. Proc. Natl. Акад. Sci. США 112, 9052–9057. DOI: 10.1073 / pnas.1423967112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беррун А.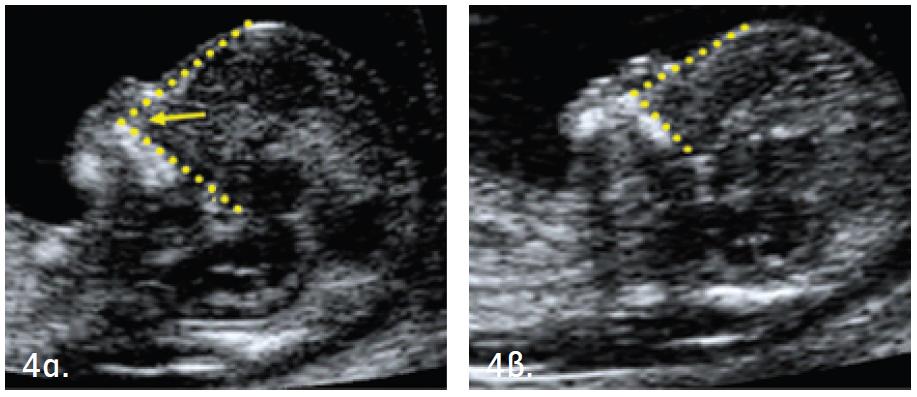 , Харрис Э. и Стахура Д. Л. (2018). Истмин 1 (ism1) необходим для нормального кроветворения у развивающихся рыбок данио. PLoS One 13: e0196872. DOI: 10.1371 / journal.pone.0196872
, Харрис Э. и Стахура Д. Л. (2018). Истмин 1 (ism1) необходим для нормального кроветворения у развивающихся рыбок данио. PLoS One 13: e0196872. DOI: 10.1371 / journal.pone.0196872
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бертран, Дж.Ю., Чи, Н. К., Сантосо, Б., Тенг, С., Стейниер, Д. Ю., и Травер, Д. (2010). Гематопоэтические стволовые клетки происходят непосредственно из эндотелия аорты во время развития. Природа 464, 108–111. DOI: 10.1038 / nature08738
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бертран, Дж. Ю., Джалил, А., Клейн, М., Юнг, С., Кумано, А., и Годин, И. (2005). Три пути к созреванию макрофагов в раннем желточном мешке мыши. Кровь 106, 3004–3011. DOI: 10.1182 / кровь-2005-02-0461
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бертран, Дж. Й., Ким, А. Д., Виолетт, Э. П., Стахура, Д. Л., Сиссон, Дж. Л. и Травер, Д. (2007). Окончательный гематопоэз инициируется через коммитированного эритромиелоидного предшественника в эмбрионе рыбок данио. Девелопмент 134, 4147–4156. DOI: 10.1242 / dev.012385
Девелопмент 134, 4147–4156. DOI: 10.1242 / dev.012385
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Блазер, Б. У., Мур, Дж. Л., Хагедорн, Э.J., Li, B., Riquelme, R., Lichtig, A., et al. (2017). CXCR1 ремоделирует сосудистую нишу, способствуя приживлению гемопоэтических стволовых клеток и клеток-предшественников. J. Exp. Med. 214, 1011–1027. DOI: 10.1084 / jem.20161616
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Буассе, Дж. К., ван Каппеллен, В., Андриё-Солер, К., Гальярт, Н., Дзержак, Э., и Робин, К. (2010). Визуализация in vivo кроветворных клеток, возникающих из эндотелия аорты мышей. Природа 464, 116–120.DOI: 10.1038 / nature08764
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бойтано, А. Е., Ван, Дж., Ромео, Р., Бушез, Л. К., Паркер, А. Е., Саттон, С. Е. и др. (2010). Антагонисты арилуглеводородных рецепторов способствуют размножению гемопоэтических стволовых клеток человека. Наука 329, 1345–1348. DOI: 10.1126 / science.11
Наука 329, 1345–1348. DOI: 10.1126 / science.11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боллерот, К., Пуже, К., и Джаффредо, Т. (2005a).Эмбриональное происхождение гемопоэтических стволовых клеток: рассказ о гемангиобластах и гемогенном эндотелии. APMIS 113, 790–803.
PubMed Аннотация | Google Scholar
Боллерот, К., Ромеро, С., Данон, Д., и Джаффредо, Т. (2005b). Основной фактор связывания в раннем птичьем эмбрионе: клонирование Cbfbeta и комбинаторные паттерны экспрессии с Runx1. Gene Expr. Узоры 6, 29–39.
PubMed Аннотация | Google Scholar
Бройлс, Р. Х., Джонсон, Г. М., Мэйплс, П. Б., и Кинделл, Г. Р. (1981). Две эритропетические микросреды и две линии личиночных эритроцитов головастиков лягушки-быка. Dev. Биол. 81, 299–314. DOI: 10.1016 / 0012-1606 (81) -1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бутко, Э., Дистел, М., Пуже, К. , Вейтс, Б., Кобаяши, И., Нг, К. и др. (2015). Gata2b является ограниченным ранним регулятором гемогенного эндотелия у эмбрионов рыбок данио. Девелопмент 142, 1050–1061.DOI: 10.1242 / dev.119180
, Вейтс, Б., Кобаяши, И., Нг, К. и др. (2015). Gata2b является ограниченным ранним регулятором гемогенного эндотелия у эмбрионов рыбок данио. Девелопмент 142, 1050–1061.DOI: 10.1242 / dev.119180
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cavazzana-Calvo, M., Hacein-Bey, S., de Saint Basile, G., Gross, F., Yvon, E., Nusbaum, P., et al. (2000). Генная терапия тяжелого комбинированного иммунодефицита человека (SCID) -X1 болезни. Наука 288, 669–672. DOI: 10.1126 / science.288.5466.669
CrossRef Полный текст | Google Scholar
Чен, М. Дж., Йокомизо, Т., Зейглер, Б. М., Дзержак, Э., и Спек, Н. А. (2009).Runx1 необходим для перехода от эндотелиальных клеток к гемопоэтическим, но не после этого. Природа 457, 887–891. DOI: 10.1038 / nature07619
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, X. Д., и Терпен, Дж. Б. (1995). Внутриэмбриональное происхождение печеночного кроветворения у Xenopus laevis . J. Immunol. 154, 2557–2567.
J. Immunol. 154, 2557–2567.
PubMed Аннотация | Google Scholar
Чхабра, А., Лехнер, А. Дж., Уэно, М., Ачарья, А., Ван Хендель, Б., Ван, Ю. и др. (2012). Трофобласты регулируют плацентарную гематопоэтическую нишу посредством передачи сигналов PDGF-B. Dev. Cell 22, 651–659. DOI: 10.1016 / j.devcel.2011.12.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чоу, С., Лодиш, Х. Ф. (2010). Печеночные предшественники печени плода являются поддерживающими стромальными клетками для гемопоэтических стволовых клеток. Proc. Natl. Акад. Sci. США 107, 7799–7804. DOI: 10.1073 / pnas.1003586107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристенсен, Дж.Л., Райт, Д. Э., Вейджерс, А. Дж., И Вайсман, И. Л. (2004). Циркуляция и хемотаксис кроветворных стволовых клеток плода. PLoS Biol. 2: E75. DOI: 10.1371 / journal.pbio.0020075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чау-Уитц, А. , Монтейро, Р., Кирмизитас, А., и Пациент, Р. (2014). Онтогенетический гематопоэз: онтогенез, генетическое программирование и сохранение. Exp. Гематол. 42, 669–683. DOI: 10.1016 / j.exphem.2014.06.001
, Монтейро, Р., Кирмизитас, А., и Пациент, Р. (2014). Онтогенетический гематопоэз: онтогенез, генетическое программирование и сохранение. Exp. Гематол. 42, 669–683. DOI: 10.1016 / j.exphem.2014.06.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чау-Уитц, А., Уолмсли М. и Пациент Р. (2000). Различное происхождение взрослой и эмбриональной крови у Xenopus. Cell 102, 787–796. DOI: 10.1016 / S0092-8674 (00) 00067-2
CrossRef Полный текст | Google Scholar
Цириза, Дж., Томпсон, Х., Петросян, Р., Манилай, Дж. О., и Гарсиа-Охеда, М. Э. (2013). Миграция гемопоэтических предшественников из печени плода в костный мозг плода: извлеченные уроки и возможные клинические применения. Exp. Гематол. 41, 411–423.DOI: 10.1016 / j.exphem.2013.01.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корбел, К. (2002). Экспрессия интегрина alphaVbeta3 в эндотелии аорты куриного эмбриона. Внутр. J. Dev. Биол. 46, 827–830.
J. Dev. Биол. 46, 827–830.
Google Scholar
Корлу А., Лами И., Ильин Г. П., Фардел О., Кнайп Б., Ле Джоссик К. и др. (1998). Активность билиарных эпителиальных клеток печени крыс, стимулирующая кроветворение: участие молекулы клеточной поверхности, белка, регулирующего печень. Exp. Гематол. 26, 382–394.
PubMed Аннотация | Google Scholar
Кормье, Ф. (1993). Плюрипотентные гемопоэтические клетки-предшественники птиц: обнаружение и обогащение из парааортальной области раннего эмбриона. J. Cell Sci. 105 (Pt 3), 661–666.
PubMed Аннотация | Google Scholar
Катлер К., Мултани П., Роббинс Д., Ким, Х. Т., Ле, Т., Хоггатт, Дж. И др. (2013). Трансплантация гемопоэтических стволовых клеток пуповинной крови с модулированной простагландином. Кровь 122, 3074–3081. DOI: 10.1182 / кровь-2013-05-503177
PubMed Аннотация | CrossRef Полный текст | Google Scholar
де Брюйн, М. Ф., Спек, Н. А., Петерс, М. К., и Дзержак, Э. (2000). Окончательные гемопоэтические стволовые клетки сначала развиваются в основных артериальных областях эмбриона мыши. EMBO J. 19, 2465–2474. DOI: 10.1093 / emboj / 19.11.2465
К., и Дзержак, Э. (2000). Окончательные гемопоэтические стволовые клетки сначала развиваются в основных артериальных областях эмбриона мыши. EMBO J. 19, 2465–2474. DOI: 10.1093 / emboj / 19.11.2465
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэн, М., Лу, З., Чжэн, Дж., Ван, X., Chen, X., Hirayasu, K., et al. (2014). Мотив в LILRB2, критический для связывания и активации Angptl2. Кровь 124, 924–935. DOI: 10.1182 / кровь-2014-01-549162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дей, Н.С., Рамеш, П., Чу, М., Мандал, С., и Мандал, Л. (2016). Dpp-зависимые гемопоэтические стволовые клетки дают Hh-зависимые предшественники крови в личиночных лимфатических железах дрозофилы. Элиф 5: e18295. DOI: 10.7554 / eLife.18295
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эма Х. и Накаучи Х. (2000). Экспансия гемопоэтических стволовых клеток в развивающейся печени эмбриона мыши. Кровь 95, 2284–2288.
Кровь 95, 2284–2288.
Google Scholar
Эспин-Палазон, Р., Стахура, Д. Л., Кэмпбелл, К. А., Гарсия-Морено, Д., Дель Сид, Н., Ким, А. Д. и др. (2014). Передача провоспалительных сигналов регулирует появление гемопоэтических стволовых клеток. Ячейка 159, 1070–1085.DOI: 10.1016 / j.cell.2014.10.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эванс, К. Дж., Хартенштейн, В., Банерджи, У. (2003). Толще крови: законсервированные механизмы кроветворения у дрозофилы и позвоночных. Dev. Cell 5, 673–690. DOI: 10.1016 / S1534-5807 (03) 00335-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fares, I., Chagraoui, J., Gareau, Y., Gingras, S., Ruel, R., Mayotte, N., et al. (2014).Расширение пуповинной крови. Производные пиримидоиндола являются агонистами самообновления гемопоэтических стволовых клеток человека. Наука 345, 1509–1512. DOI: 10.1126 / science.1256337
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фуджио К. , Эвартс Р. П., Ху З., Марсден Э. Р. и Торгейрссон С. С. (1994). Экспрессия фактора стволовых клеток и его рецептора c-kit во время регенерации печени из предполагаемых стволовых клеток у взрослых крыс. Lab. Вкладывать деньги. 70, 511–516.
, Эвартс Р. П., Ху З., Марсден Э. Р. и Торгейрссон С. С. (1994). Экспрессия фактора стволовых клеток и его рецептора c-kit во время регенерации печени из предполагаемых стволовых клеток у взрослых крыс. Lab. Вкладывать деньги. 70, 511–516.
PubMed Аннотация | Google Scholar
Гао, Х., Ву, X, Саймон, Л., и Фоссет, Н. (2014). Антиоксиданты поддерживают уровни E-кадгерина, чтобы ограничить дифференцировку прогемоцитов дрозофилы. PLoS One 9: e107768. DOI: 10.1371 / journal.pone.0107768
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гекас К., Дитерлен-Ливр Ф., Оркин С. Х. и Миккола Х. К. (2005). Плацента — это ниша для гемопоэтических стволовых клеток. Dev. Cell 8, 365–375.DOI: 10.1016 / j.devcel.2004.12.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гекас К., Родос К. Э., Ван Гендель Б., Чабра А., Уэно М. и Миккола Х. К. (2010). Развитие гемопоэтических стволовых клеток в плаценте. Внутр. J. Dev. Биол. 54, 1089–1098. DOI: 10.1387 / ijdb.103070cg
Внутр. J. Dev. Биол. 54, 1089–1098. DOI: 10.1387 / ijdb.103070cg
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Geraud, C., Koch, P. S., Zierow, J., Klapproth, K., Busch, K., Olsavszky, V., et al.(2017). GATA4-зависимая органоспецифическая дифференцировка эндотелия контролирует развитие печени и эмбриональный гематопоэз. J. Clin. Вкладывать деньги. 127, 1099–1114. DOI: 10.1172 / JCI
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Geraud, C., Schledzewski, K., Demory, A., Klein, D., Kaus, M., Peyre, F., et al. (2010). Синусоидальный эндотелий печени: программа дифференцировки, зависящая от микросреды у крыс, включая новый соединительный белок-1, связанный с эндотелиальной дифференцировкой печени. Гепатология 52, 313–326. DOI: 10.1002 / hep.23618
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гош С., Сингх А., Мандал С. и Мандал Л. (2015). Активные гемопоэтические центры у взрослых дрозофилы генерируют гемоциты и вносят свой вклад в иммунный ответ. Dev. Cell 33, 478–488. DOI: 10.1016 / j.devcel.2015.03.014
Dev. Cell 33, 478–488. DOI: 10.1016 / j.devcel.2015.03.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гомес, А.М., Курочкин, И., Чанг, Б., Даниэль, М., Лоу, К., Сатия, Н., и др. (2018). Индукция кооперативного фактора транскрипции опосредует гемогенное репрограммирование. Cell Rep. 25, 2821–2835.e7. DOI: 10.1016 / j.celrep.2018.11.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гринбаум, А., Хсу, Ю. М., Дэй, Р. Б., Шютпельц, Л. Г., Кристофер, М. Дж., Боргердинг, Дж. Н. и др. (2013). CXCL12 у ранних мезенхимальных предшественников необходим для поддержания гемопоэтических стволовых клеток. Природа 495, 227–230.DOI: 10.1038 / природа11926
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуэдес, П. Т., де Оливейра, Б. К., Мансо, П. П., Капуто, Л. Ф., Котта-Перейра, Г., и Пелажо-Мачадо, М. (2014). Гистологические анализы демонстрируют временный вклад желточного мешка, печени и костного мозга в кроветворение во время развития цыплят. PLoS One 9: e. DOI: 10.1371 / journal.pone.00
PLoS One 9: e. DOI: 10.1371 / journal.pone.00
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ху, Дж., Hu, S., Ma, Q., Wang, X., Zhou, Z., Zhang, W., et al. (2012). Бессмертные стромальные клетки эмбриональной печени мыши поддерживают рост и поддержание эмбриональных стволовых клеток человека. Онкол. Реп. 28, 1385–1391. DOI: 10.3892 / or.2012.1909
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иванов, А., Рыбцов, С., Велч, Л., Андерсон, Р. А., Тернер, М. Л., Медвинский, А. (2011). Высокоэффективные гемопоэтические стволовые клетки человека сначала появляются во внутриэмбриональной области аорта-гонад-мезонефрос. J. Exp. Med. 208, 2417–2427. DOI: 10.1084 / jem.20111688
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ивасаки, Х., Араи, Ф., Кубота, Ю., Даль, М., и Суда, Т. (2010). Гемопоэтические стволовые клетки, экспрессирующие рецептор эндотелиального протеина С, находятся в перисинусоидальной нише в печени плода. Кровь 116, 544–553. DOI: 10.1182 / кровь-2009-08-240903
Кровь 116, 544–553. DOI: 10.1182 / кровь-2009-08-240903
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джаффредо, Т., Готье, Р., Бражуль, В., и Дитерлен-Ливр, Ф. (2000). Отслеживание потомства гемангиобласта аорты у птичьего эмбриона. Dev. Биол. 224, 204–214. DOI: 10.1006 / dbio.2000.9799
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, Дж. А., Мендельсон, А., Кунисаки, Ю., Бирбрайр, А., Коу, Ю., Арнал-Эстап, А., и др. (2016). Ниши гемопоэтических стволовых клеток печени плода связаны с воротными сосудами. Наука 351, 176–180. DOI: 10.1126 / наука.aad0084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Киасов, А. П., Ван Эйкен, П., ван Пелт, Дж. Ф., Депла, Э., Февери, Дж., Десмет, В. Дж. И др. (1995). Десмин, экспрессирующие негематопоэтические клетки печени во время развития печени крыс: иммуногистохимическое и морфометрическое исследование. Дифференциация 59, 253–258. DOI: 10.1046 / j.1432-0436.1995.5940253.x
DOI: 10.1046 / j.1432-0436.1995.5940253.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, А.Г., Вреченак, Дж.Д., Белиг, М. М., Айссенберг, Л., Реттиг, М. П., Райли, Дж. С. и др. (2016). Усиление аллогенного приживления в утробе у мышей после мобилизации HSC плода путем ингибирования альфа4бета1 / 7. Кровь 128, 2457–2461. DOI: 10.1182 / кровь-2016-06-723981
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кордес, К., Савица, И., Гоце, С., и Хауссинджер, Д. (2013). Звездчатые клетки печени поддерживают кроветворение и являются резидентными мезенхимальными стволовыми клетками печени. Ячейка.Physiol. Биохим. 31, 290–304. DOI: 10.1159 / 000343368
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кубота, Х., Яо, Х. Л. и Рид, Л. М. (2007). Идентификация и характеристика клеток, хранящих витамин А, в печени плода: значение для функциональной важности звездчатых клеток печени в развитии печени и кроветворении. стволовые клетки 25, 2339–2349. DOI: 10.1634 / стволовые клетки.2006-0316
стволовые клетки 25, 2339–2349. DOI: 10.1634 / стволовые клетки.2006-0316
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ламписуо, М., Липпо, Дж., Вайнио, О., МакНэгни, К. М., Кульмала, Дж., И Лассила, О. (1999). Характеристика претимических предшественников внутри куриного эмбриона. Внутр. Иммунол. 11, 63–69. DOI: 10.1093 / intimm / 11.1.63
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лебестки Т., Чанг Т., Хартенштейн В. и Банерджи У. (2000). Спецификация гемопоэтического клона дрозофилы с помощью консервативных факторов транскрипции. Наука 288, 146–149. DOI: 10.1126 / наука.288.5463.146
CrossRef Полный текст | Google Scholar
Li, D., Xue, W., Li, M., Dong, M., Wang, J., Wang, X., et al. (2018). Макрофаги VCAM-1 (+) направляют самонаведение HSPC в сосудистую нишу. Природа 564, 119–124. DOI: 10.1038 / s41586-018-0709-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лийппо, Дж.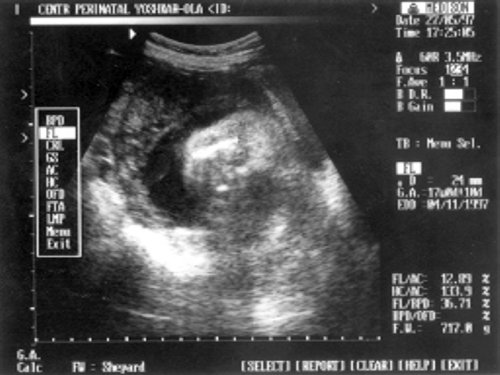 , Коскела, К., и Лассила, О. (2000). Претимические предшественники из парааортальной мезодермы птиц экспрессируют GATA-3 и отдельные изоформы chTcf, но все еще лишены гамма-перестройки Т-клеточного рецептора. Сканд. J. Immunol. 52, 502–509. DOI: 10.1046 / j.1365-3083.2000.00807.x
, Коскела, К., и Лассила, О. (2000). Претимические предшественники из парааортальной мезодермы птиц экспрессируют GATA-3 и отдельные изоформы chTcf, но все еще лишены гамма-перестройки Т-клеточного рецептора. Сканд. J. Immunol. 52, 502–509. DOI: 10.1046 / j.1365-3083.2000.00807.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Листер, Дж. А., Лейн, Б. М., Нгуен, А., и Ланни, К. (2011). Эмбриональная экспрессия генов семейства MiT рыбок данио tfe3b, tfeb и tfec. Dev. Дин. 240, 2529–2538. DOI: 10.1002 / dvdy.22743
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, К., Хан, Т., Стахура, Д. Л., Ван, Х., Вайсман, Б.Л., Ким, Дж. И др. (2018). Липопротеинлипаза регулирует поддержание гемопоэтических стволовых клеток-предшественников за счет поступления ДГК. Нац. Commun. 9: 1310. DOI: 10.1038 / s41467-018-03775-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маэно М., Точинай С.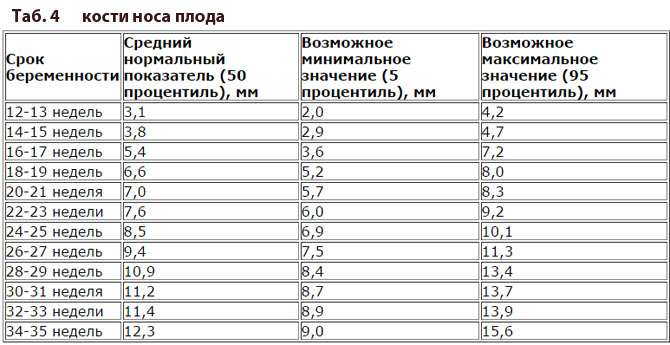 и Катагири К. (1985). Дифференциальное участие вентральной и дорсолатеральной мезодерм в кроветворении Xenopus, что выявлено у диплоидно-триплоидных или межвидовых химер. Dev. Биол. 110, 503–508.DOI: 10.1016 / 0012-1606 (85) -3
и Катагири К. (1985). Дифференциальное участие вентральной и дорсолатеральной мезодерм в кроветворении Xenopus, что выявлено у диплоидно-триплоидных или межвидовых химер. Dev. Биол. 110, 503–508.DOI: 10.1016 / 0012-1606 (85) -3
CrossRef Полный текст | Google Scholar
Махони К. Б., Фиш Р. Дж., Паш К. и Бертран Дж. Ю. (2016). tfec контролирует сосудистую нишу кроветворных стволовых клеток во время эмбриогенеза рыбок данио. Кровь 128, 1336–1345. DOI: 10.1182 / кровь-2016-04-710137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махони, К. Б., Паше, К., Бертран, Дж. Ю. (2018). Онкостатин М и набор-лиганд контролируют судьбу гемопоэтических стволовых клеток во время эмбриогенеза рыбок данио. Stem Cell Rep. 10, 1920–1934. DOI: 10.1016 / j.stemcr.2018.04.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мандал, Л., Мартинес-Агосто, Дж. А., Эванс, К. Дж., Хартенштейн, В., и Банерджи, У.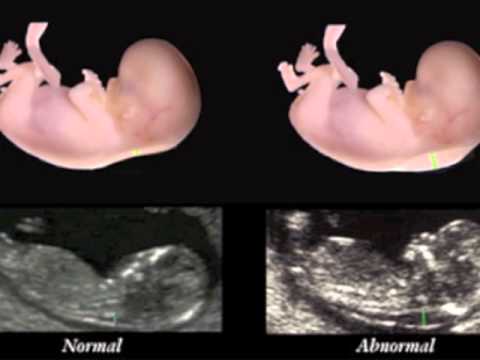 (2007). Ниша, зависящая от Hedgehog и Antennapedia, поддерживает гематопоэтических предшественников Drosophila. Природа 446, 320–324. DOI: 10.1038 / nature05585
(2007). Ниша, зависящая от Hedgehog и Antennapedia, поддерживает гематопоэтических предшественников Drosophila. Природа 446, 320–324. DOI: 10.1038 / nature05585
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мазо, И. Б., Гутьеррес-Рамос, Дж. К., Френетт, П. С., Хайнс, Р. О., Вагнер, Д. Д., и фон Андриан, У. Х. (1998). Прокатывание гемопоэтических клеток-предшественников в микрососудах костного мозга: параллельные вклады эндотелиальных селектинов и молекулы адгезии сосудистых клеток 1. J. Exp. Med. 188, 465–474. DOI: 10.1084 / jem.188.3.465
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакГрат, К. Э., Фрейм, Дж. М., Феган, К. Х., Боуэн, Дж. Р., Конвей, С. Дж., Катерман, С. С. и др.(2015). Определенные источники гематопоэтических предшественников возникают перед HSCs и обеспечивают функциональные клетки крови в эмбрионе млекопитающих. Cell Rep 11, 1892–1904. DOI: 10.1016 / j.celrep.2015.05.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мондал, Б. К., Мукерджи, Т., Мандал, Л., Эванс, К. Дж., Синенко, С. А., Мартинес-Агосто, Дж. А. и др. (2011). Взаимодействие между дифференцирующимися сигналами клеток и ниш в поддержании гематопоэтических предшественников. Cell 147, 1589–1600. DOI: 10.1016 / j.cell.2011.11.041
К., Мукерджи, Т., Мандал, Л., Эванс, К. Дж., Синенко, С. А., Мартинес-Агосто, Дж. А. и др. (2011). Взаимодействие между дифференцирующимися сигналами клеток и ниш в поддержании гематопоэтических предшественников. Cell 147, 1589–1600. DOI: 10.1016 / j.cell.2011.11.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мондал, Б. К., Шим, Дж., Эванс, К. Дж., И Банерджи, У. (2014). Регуляторы экспрессии Pvr в равновесном контроле сигналов и поддержании предшественников крови дрозофилы. Элиф 3: e03626. DOI: 10.7554 / eLife.03626
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моррисон, С. Дж., Хеммати, Х. Д., Вандич, А.М., и Вайсман И. Л. (1995). Очистка и характеристика гемопоэтических стволовых клеток печени плода. Proc. Natl. Акад. Sci. США 92, 10302–10306. DOI: 10.1073 / pnas.92.22.10302
CrossRef Полный текст | Google Scholar
Мураяма, Э., Кисса, К., Сапата, А., Морделет, Э., Бриолат, В. , Лин, Х. Ф. и др. (2006). Отслеживание миграции гемопоэтических предшественников в последующие кроветворные органы во время развития рыбок данио. Иммунитет 25, 963–975.DOI: 10.1016 / j.immuni.2006.10.015
, Лин, Х. Ф. и др. (2006). Отслеживание миграции гемопоэтических предшественников в последующие кроветворные органы во время развития рыбок данио. Иммунитет 25, 963–975.DOI: 10.1016 / j.immuni.2006.10.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мураяма, Э., Саррис, М., Редд, М., Ле Гуядер, Д., Вивье, К., Хорсли, В. и др. (2015). Дефицит NACA показывает решающую роль производных сомитов стромальных клеток в формировании гематопоэтических ниш. Нац. Commun. 6: 8375. DOI: 10.1038 / ncomms9375
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нагасава, Т., Хирота, С., Татибана, К., Такакура, Н., Нисикава, С., Китамура, Ю. и др. (1996). Дефекты В-клеточного лимфопоэза и миелопоэза костного мозга у мышей, лишенных хемокина CXC PBSF / SDF-1. Природа 382, 635–638. DOI: 10.1038 / 382635a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нанно, М., Хата, М., Дои, Х., Сатоми, С.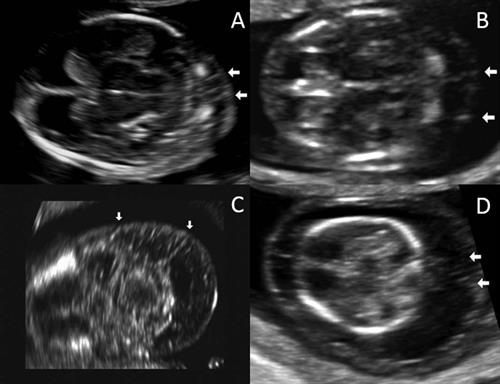 , Яги, Х., Саката, Т. и др. (1994). Стимуляция кроветворения in vitro клоном гепатоцитов эмбриона мыши посредством межклеточного контакта. J. Cell.Physiol. 160, 445–454. DOI: 10.1002 / jcp.1041600307
, Яги, Х., Саката, Т. и др. (1994). Стимуляция кроветворения in vitro клоном гепатоцитов эмбриона мыши посредством межклеточного контакта. J. Cell.Physiol. 160, 445–454. DOI: 10.1002 / jcp.1041600307
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нео, В. Х., Бут, К. А. Г., Аззони, Э., Чи, Л., Дельгадо-Ольгин, П., де Бруин, М., и др. (2018). Клеточно-внешнее кроветворное влияние инактивации Ezh3 в эндотелиальных клетках печени плода. Кровь 131, 2223–2234. DOI: 10.1182 / кровь-2017-10-811455
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нолта, Дж. А., Тиманн, Ф.Т., Аракава-Хойт, Дж., Дао, М. А., Барски, Л. В., Мур, К. А. и др. (2002). Линия стромальных клеток AFT024 поддерживает долгосрочное поддержание ex vivo приживления мультипотентных гематопоэтических предшественников человека. Лейкемия 16, 352–361. DOI: 10.1038 / sj.leu.2402371
PubMed Аннотация | CrossRef Полный текст | Google Scholar
North, T.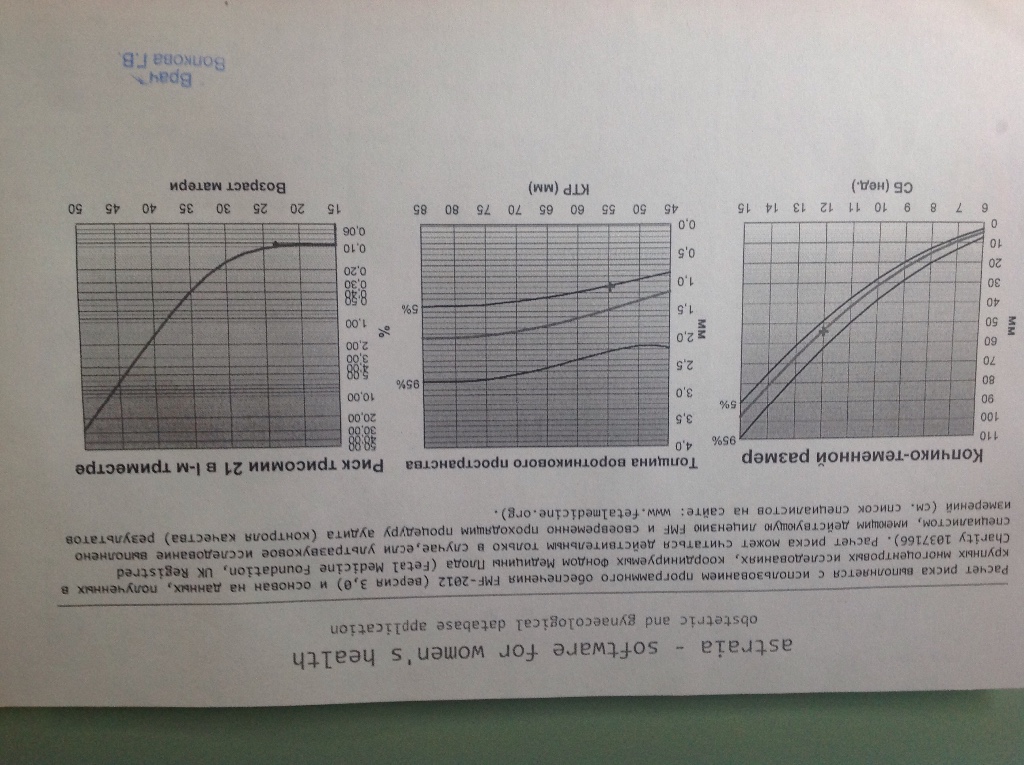 E., Goessling, W., Walkley, C. R., Lengerke, C., Kopani, K. R., Lord, A. M., et al. (2007). Простагландин E2 регулирует гомеостаз гемопоэтических стволовых клеток позвоночных. Природа 447, 1007–1011. DOI: 10.1038 / nature05883
E., Goessling, W., Walkley, C. R., Lengerke, C., Kopani, K. R., Lord, A. M., et al. (2007). Простагландин E2 регулирует гомеостаз гемопоэтических стволовых клеток позвоночных. Природа 447, 1007–1011. DOI: 10.1038 / nature05883
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Охнеда, О., и Бауч, В. Л. (1997). Эндотелиальные клетки мыши поддерживают эритропоэз и миелопоэз печени плода посредством различных взаимодействий. руб. J. Haematol. 98, 798–808. DOI: 10.1046 / j.1365-2141.1997.3163133.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оттерсбах К., Дзержак Э. (2005). Плацента мыши содержит гемопоэтические стволовые клетки в области лабиринта сосудов. Dev. Cell 8, 377–387. DOI: 10.1016 / j.devcel.2005.02.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Палис, Дж., Чан, Р. Дж., Кониски, А., Патель, Р., Старр, М., и Йодер, М. К. (2001). Пространственное и временное появление гемопоэтических предшественников с высоким пролиферативным потенциалом во время эмбриогенеза мышей.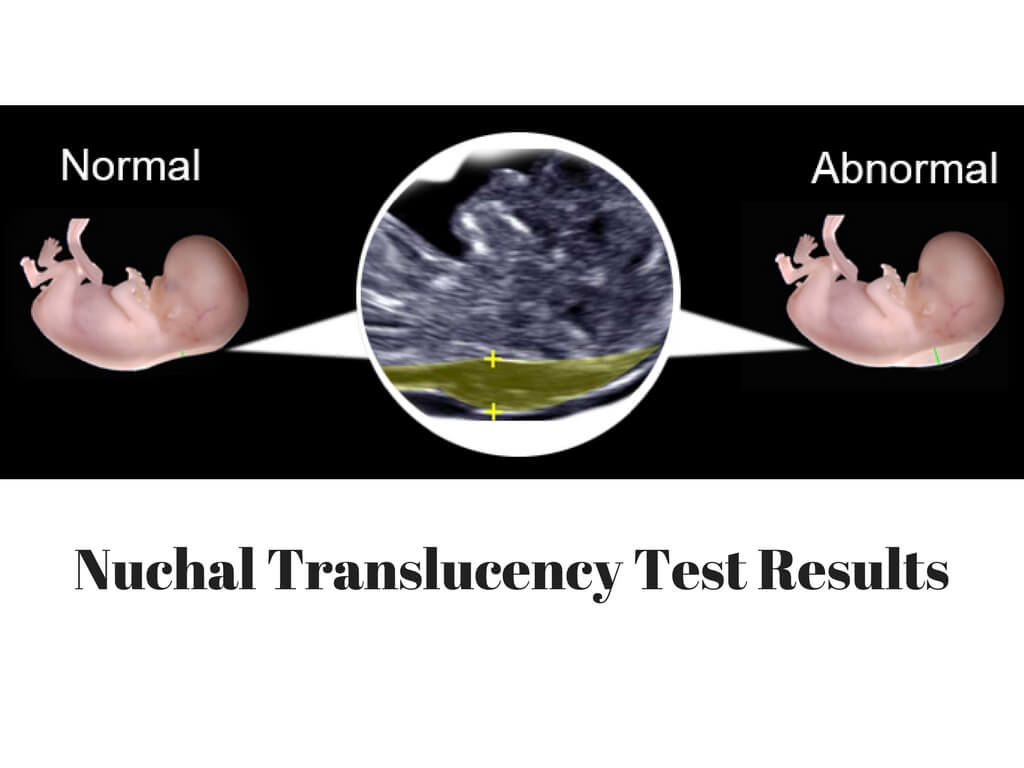 Proc. Natl. Акад. Sci. США 98, 4528–4533. DOI: 10.1073 / pnas.071002398
Proc. Natl. Акад. Sci. США 98, 4528–4533. DOI: 10.1073 / pnas.071002398
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пассаро, Д., Ди Туллио, А., Абарратеги, А., Руо-Пьер, К., Фостер, К., Ариза-Макнотон, Л. и др. (2017). Повышенная проницаемость сосудов в микросреде костного мозга способствует прогрессированию заболевания и лекарственному ответу при остром миелоидном лейкозе. Cancer Cell 32, 324–341.e6. DOI: 10.1016 / j.ccell.2017.08.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паюшина О.В. (2012). Кроветворное микроокружение в печени плода: роль различных популяций клеток. ISRN Cell Biol. 2012: 979480. DOI: 10.5402 / 2012/979480
CrossRef Полный текст | Google Scholar
Pennetier, D., Oyallon, J., Morin-Poulard, I., Dejean, S., Vincent, A., and Crozatier, M. (2012). Контроль размера гематопоэтической ниши Drosophila с помощью передачи сигналов костных морфогенетических белков обнаруживает параллели с млекопитающими. Proc. Natl. Акад. Sci. США 109, 3389–3394. DOI: 10.1073 / pnas.1109407109
Proc. Natl. Акад. Sci. США 109, 3389–3394. DOI: 10.1073 / pnas.1109407109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петцер, А.Л., Зандстра, П. У., Пирет, Дж. М., и Ивс, К. Дж. (1996). Дифференциальные эффекты цитокинов на примитивные (CD34 + CD38-) человеческие гемопоэтические клетки: новые ответы на Flt3-лиганд и тромбопоэтин. J. Exp. Med. 183, 2551–2558. DOI: 10.1084 / jem.183.6.2551
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Prashad, S. L., Calvanese, V., Yao, C. Y., Kaiser, J., Wang, Y., Sasidharan, R., et al. (2015). GPI-80 определяет способность к самообновлению гемопоэтических стволовых клеток в процессе развития человека. Cell Stem Cell 16, 80–87. DOI: 10.1016 / j.stem.2014.10.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамадори Г. и Саиле Б. (2002). Мезенхимальные клетки в печени — один или два типа клеток? Печень 22, 283–294.
Google Scholar
Родос, К. Э., Гекас, К., Ван, Ю., Люкс, К. Т., Фрэнсис, К. С., Чан, Д. Н. и др. (2008). Возникновение гемопоэтических стволовых клеток инициируется в сосудистой сети плаценты при отсутствии кровообращения. Cell Stem Cell 2, 252–263. DOI: 10.1016 / j.stem.2008.01.001
Э., Гекас, К., Ван, Ю., Люкс, К. Т., Фрэнсис, К. С., Чан, Д. Н. и др. (2008). Возникновение гемопоэтических стволовых клеток инициируется в сосудистой сети плаценты при отсутствии кровообращения. Cell Stem Cell 2, 252–263. DOI: 10.1016 / j.stem.2008.01.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рой В. и Верфейли К. М. (1999). Экспрессия и функция молекул клеточной адгезии на фетальной печени, пуповинной крови и гематопоэтических предшественниках костного мозга: значение для анатомической локализации и специфической регуляции гемопоэза на стадии развития. Exp. Гематол. 27, 302–312. DOI: 10.1016 / S0301-472X (98) 00031-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рыбцов, С., Иванов, А., Чжао, С., Медвинский, А. (2016). Скрытая экспансия незрелых предшественников лежит в основе резкого всплеска активности взрослых HSC в печени плода. Девелопмент 143, 1284–1289. DOI: 10.1242 / dev.131193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Saynajakangas, R. , Uchida, T., and Vainio, O. (2009). Дифференциальная экспрессия генов в клетках CD45 на стадии парааортальных очагов кроветворения цыплят. Сканд. J. Immunol. 70, 288–294.DOI: 10.1111 / j.1365-3083.2009.02304.x
, Uchida, T., and Vainio, O. (2009). Дифференциальная экспрессия генов в клетках CD45 на стадии парааортальных очагов кроветворения цыплят. Сканд. J. Immunol. 70, 288–294.DOI: 10.1111 / j.1365-3083.2009.02304.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шустер, Дж. А., Ступников, М. Р., Ма, Г., Ляо, В., Лай, Р., Ма, Ю. и др. (2012). Расширение гемопоэтических стволовых клеток для трансплантации: современные перспективы. Exp. Гематол. Онкол. 1:12. DOI: 10.1186 / 2162-3619-1-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Швейцер, К. М., Драгер, А. М., ван дер Валк, П., Тийсен, С.Ф., Зевенберген А., Тейсмейер А. П. и др. (1996). Конститутивная экспрессия Е-селектина и молекулы-1 адгезии сосудистых клеток на эндотелиальных клетках кроветворных тканей. г. J. Pathol. 148, 165–175.
Google Scholar
Shao, L., Chang, J., Feng, W., Wang, X., Williamson, E.A., Li, Y., et al. (2018). Каркас Wave2 Hem-1 необходим для перехода кроветворения из печени плода в костный мозг. Нац Коммуна 9, 2377. DOI: 10.1038 / s41467-018-04716-5
Каркас Wave2 Hem-1 необходим для перехода кроветворения из печени плода в костный мозг. Нац Коммуна 9, 2377. DOI: 10.1038 / s41467-018-04716-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стааль, Ф.Дж., Спанек, Х. П., и Фиббе, У. Э. (2016). Визуализация переноса гемопоэтических стволовых клеток человека in vivo с использованием модели ксенотрансплантата рыбок данио. Stem Cells Dev. 25, 360–365. DOI: 10.1089 / scd.2015.0195
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Субраманиам, А., Сафаи Талхонче, М., Магнуссон, М., и Ларссон, Дж. (2018). Экспрессия рецептора эндотелиального протеина С (EPCR) маркирует гемопоэтические стволовые клетки печени плода человека. Haematologica 104, e47 – e50.DOI: 10.3324 / haematol.2018.198515
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сугияма Д., Кулькео К. и Мидзуочи К. (2013). TGF-бета-1 активирует продукцию внеклеточного матрикса в гепатобластах мыши. мех. Dev. 130, 195–206. DOI: 10.1016 / j.mod.2012.09.003
мех. Dev. 130, 195–206. DOI: 10.1016 / j.mod.2012.09.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сугияма Д., Кулькео К., Мидзуочи К., Хорио Ю. и Окаяма С. (2011). Гепатобласты составляют нишу для эритропоэза печени плода за счет продукции цитокинов. Biochem. Биофиз. Res. Commun. 410, 301–306. DOI: 10.1016 / j.bbrc.2011.05.137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сугияма Т., Кохара Х., Нода М. и Нагасава Т. (2006). Поддержание пула гемопоэтических стволовых клеток с помощью передачи сигналов хемокинов CXCL12-CXCR4 в нишах стромальных клеток костного мозга. Иммунитет 25, 977–988. DOI: 10.1016 / j.immuni.2006.10.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тамплин, О.Дж., Дюран, Э. М., Карр, Л. А., Чайлдс, С. Дж., Хагедорн, Э. Дж., Ли, П. и др. (2015). Прибытие гемопоэтических стволовых клеток запускает динамическое ремоделирование периваскулярной ниши. Ячейка 160, 241–252. DOI: 10.1016 / j.cell.2014.12.032
Ячейка 160, 241–252. DOI: 10.1016 / j.cell.2014.12.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тан, К. С., Кулькио, К., Наканиши, Ю., и Сугияма, Д. (2017). Экспрессия цитокинов и мРНК внеклеточного матрикса в звездчатых клетках печени плода. Genes Cells 22, 836–844.DOI: 10.1111 / gtc.12517
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тауди С., Гонно К., Мур К., Шеридан Дж. М., Блэкберн К. С., Тейлор Е. и др. (2008). Обширная генерация гемопоэтических стволовых клеток в области AGM посредством созревания VE-кадгерин + CD45 + пре-дефинитивных HSC. Стволовая клетка 3, 99–108. DOI: 10.1016 / j.stem.2008.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Террас, Дж. Д., Карри, И.С., Хей, Д. К., Массон, Н. М., Андерсон, Р. А., Форбс, С. Дж. И др. (2007). Характеристика клеток-предшественников и их расположение в развивающейся печени человека. Stem Cells Dev. 16, 771–778. DOI: 10.1089 / scd.2007.0016
16, 771–778. DOI: 10.1089 / scd.2007.0016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Теодор, Л. Н., Хагедорн, Э. Дж., Кортес, М., Нацухара, К., Лю, С. Ю., Перлин, Дж. Р. и др. (2017). Определенные роли матриксных металлопротеиназ 2 и 9 в возникновении, миграции и колонизации ниш эмбриональных гемопоэтических стволовых клеток. Stem Cell Rep. 8, 1226–1241. DOI: 10.1016 / j.stemcr.2017.03.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Травникова, Дж., Тран Чау, В., Жюльен, Э., Матеос-Лангерак, Дж., Гонсалес, К., Лелиевр, Э. и др. (2015). Примитивные макрофаги контролируют мобилизацию HSPC и окончательный гематопоэз. Нац. Commun. 6: 6227. DOI: 10.1038 / ncomms7227
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Терпен, Дж.Б., Кнудсон, К. М., и Хёфен, П. С. (1981). Ранний онтогенез гемопоэтических клеток изучали путем трансплантации цитогенетически меченого тканевого зачатка: локализация предполагаемого компартмента стволовых клеток. Dev. Биол. 85, 99–112. DOI: 10.1016 / 0012-1606 (81) -6
Dev. Биол. 85, 99–112. DOI: 10.1016 / 0012-1606 (81) -6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wagner, JE Jr, Brunstein, C.G., Boitano, A.E., DeFor, T.E., McKenna, D., Sumstad, D., et al. (2016). Фаза I / II испытания гемопоэтических стволовых клеток пуповинной крови, увеличенных стемрегенином-1, поддерживает тестирование в качестве автономного трансплантата. Cell Stem Cell 18, 144–155. DOI: 10.1016 / j.stem.2015.10.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валасек, М.А., ван Ос, Р., и де Хаан, Г. (2012). Экспансия гемопоэтических стволовых клеток: проблемы и возможности. Ann. Акад. Sci. 1266, 138–150. DOI: 10.1111 / j.1749-6632.2012.06549.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виттиг, О., Паез-Кортез, Дж., И Кардье, Дж. Э. (2010).Синусоидальные эндотелиальные клетки печени способствуют В-лимфопоэзу из примитивных гемопоэтических клеток.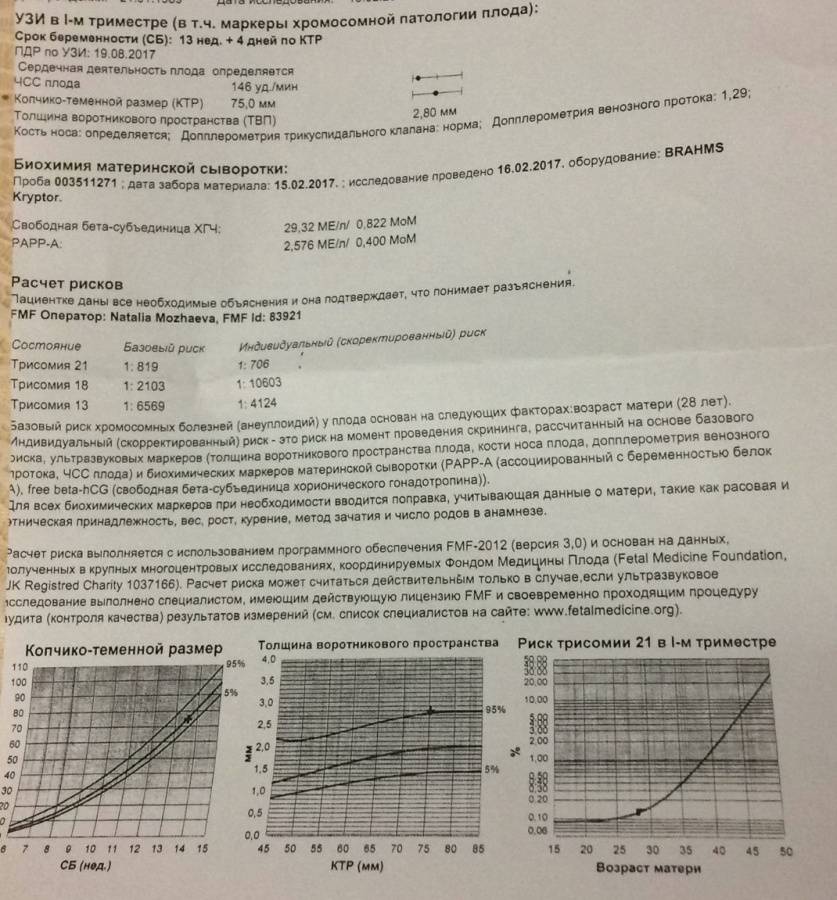 Stem Cells Dev. 19, 341–350. DOI: 10.1089 / scd.2009.0300
Stem Cells Dev. 19, 341–350. DOI: 10.1089 / scd.2009.0300
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вольф, А., Аджо, Дж., Кэмпбелл, К., Райт, Ф., Маркес, Г., Травер, Д. и др. (2017). Клетки каудальной гемопоэтической эмбриональной стромальной ткани (CHEST) рыбок данио поддерживают кроветворение. Sci. Реп. 7: 44644. DOI: 10.1038 / srep44644
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюэ, Ю., Гао, С., и Лю, Ф. (2015). Полногеномный анализ семейства Klf рыбок данио идентифицирует два гена, важных для созревания эритроидов. Dev. Биол. 403, 115–127. DOI: 10.1016 / j.ydbio.2015.05.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюэ, Ю., Львов, Дж., Чжан, К., Ван, Л., Ма, Д., и Лю, Ф. (2017). Сосудистая ниша регулирует ложение и размножение гемопоэтических стволовых клеток и клеток-предшественников посредством klf6a-ccl25b. Dev. Ячейка 42: e344. DOI: 10.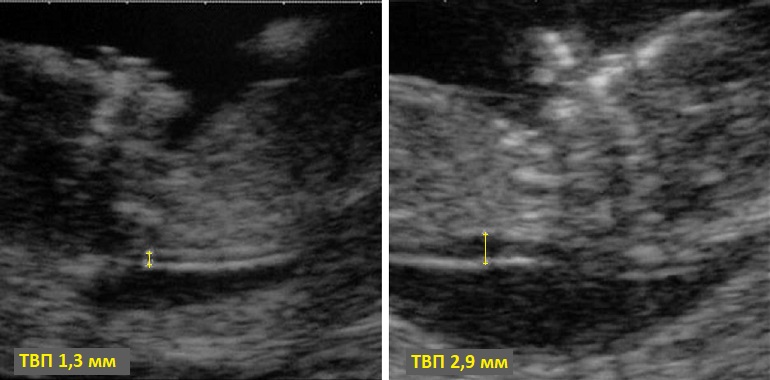 1016 / j.devcel.2017.07.012
1016 / j.devcel.2017.07.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Замбетти, Н. А., Пинг, З., Чен, С., Кенсвил, К. Дж. Г., Милона, М. А., Сандерс, М. А., и др. (2016). Мезенхимальное воспаление вызывает генотоксический стресс в гемопоэтических стволовых клетках и предсказывает развитие болезни при предлейкемии человека. Стволовая клетка 19, 613–627. DOI: 10.1016 / j.stem.2016.08.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, К.К., Каба, М., Ге, Г., Се, К., Тонг, В., Хуг, К. и др. (2006). Ангиопоэтин-подобные белки стимулируют рост гемопоэтических стволовых клеток ex vivo. Нац. Med. 12, 240–245. DOI: 10,1038 / нм1342
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, C.C., и Lodish, H.F. (2004). Инсулиноподобный фактор роста 2, экспрессируемый в новой популяции клеток печени плода, является фактором роста гемопоэтических стволовых клеток. Кровь 103, 2513–2521.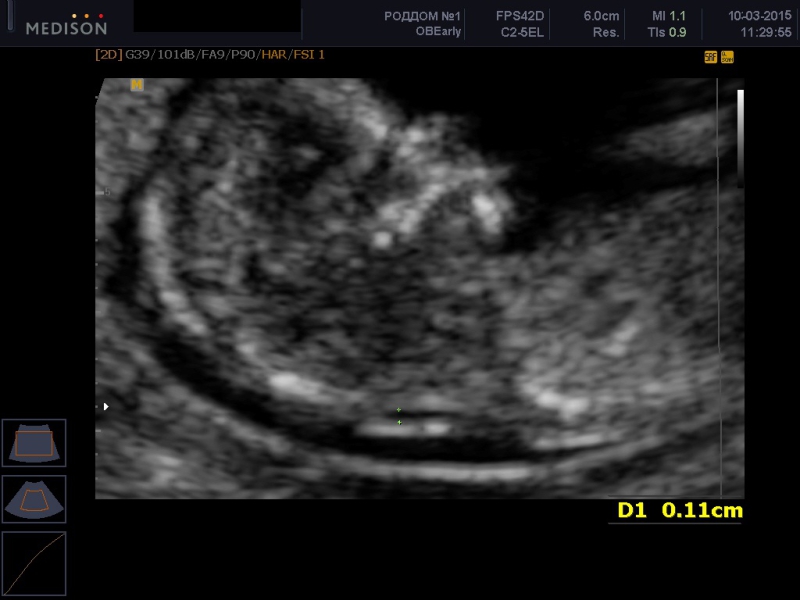 DOI: 10.1182 / кровь-2003-08-2955
DOI: 10.1182 / кровь-2003-08-2955
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhao, Y., Zhou, J., Liu, D., Dong, F., Cheng, H., Wang, W., et al. (2015). ATF4 играет ключевую роль в развитии функциональных гемопоэтических стволовых клеток в печени плода мыши. Кровь 126, 2383–2391. DOI: 10.1182 / кровь-2015-03-633354
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зовейн, А. К., Хофманн, Дж. Дж., Линч, М., Френч, В. Дж., Турло, К.А., Янг Ю. и др. (2008). Отслеживание судьбы показывает эндотелиальное происхождение гемопоэтических стволовых клеток. Стволовые клетки клеток 3, 625–636. DOI: 10.1016 / j.stem.2008.09.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Расширение кроветворных стволовых клеток печени плода in vitro
Barcena, A., Muench, M.O., Kapidzic, M. & Fisher, S.J. Новая роль плаценты человека как места кроветворения на протяжении всей беременности. Репродукция. Sci. 16 (2), 178–187 (2009).
Репродукция. Sci. 16 (2), 178–187 (2009).
Артикул Google Scholar
Böiers, C., Carrelha, J. & Lutteropp, M. Лимфомиелоидный вклад иммунного ограниченного предшественника, возникающего до образования дефинитивных гемопоэтических стволовых клеток. Cell Stem Cell 13 (5), 535–548 (2013).
Артикул Google Scholar
Lacaud, A. & Kouskoff, V. Гемангиобласт, гемогенный эндотелий и примитивный гематопоэз в сравнении с дефинитивным. Exp. Гематол. 49 , 19–24 (2017).
Артикул Google Scholar
Бхаттачарья, Н. и Пал, С. Использование ткани плода человека в бионических устройствах и устройствах из биоматериалов. Тенденции. Биоматер. Артиф. Органы. 18 , 93–100 (2005).
Google Scholar
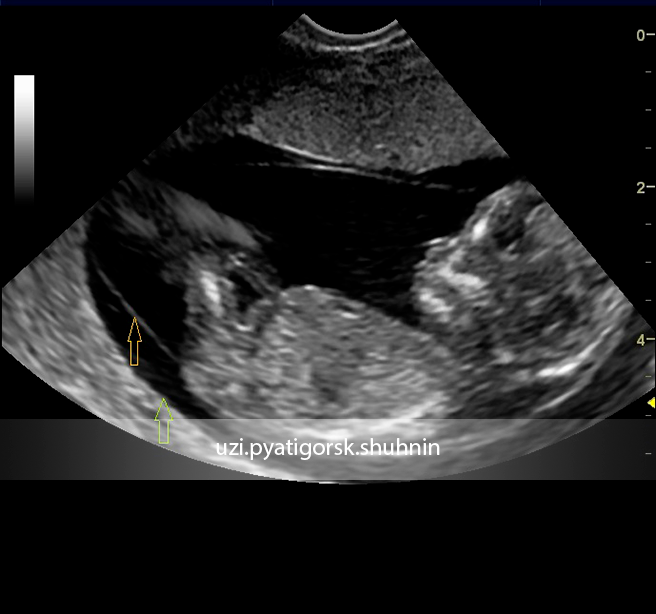
Кучма М.Д. и др. Сравнительный анализ кроветворных клеток-предшественников из плаценты, пуповинной крови и печени плода на основе их иммунофенотипа. BioMed. Res. Интер. 2015 , 1–16 (2015).
Артикул Google Scholar
Raju, G. M. K. et al. Колониестимулирующая активность, секретируемая клетками печени плода человека по сравнению с нормальным костным мозгом взрослого человека: роль в приживлении трансплантата после трансплантации. Кровь 88 (1), 258 (1996).
Google Scholar
Ребел, В. И., Миллер, К. Л., Ивс, К. Дж. И Лансдорп, П. М. Потенциал репопуляции гемопоэтических стволовых клеток фетальной печени у мышей превышает таковой у их взрослых клеток костного мозга из печени. Кровь 87 , 3500–3507 (1996).
CAS Статья Google Scholar
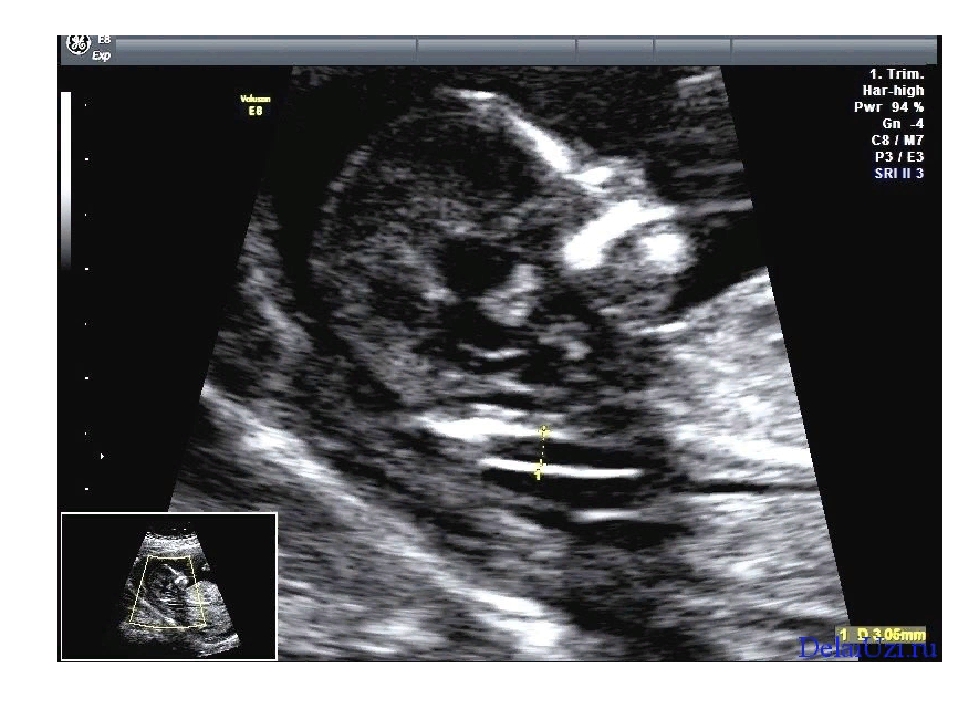
Мур, А.К., Эма, Х. и Лемишка, Р.И. «In vitro» поддержание высокоочищенных трансплантируемых гемопоэтических стволовых клеток. Кровь 89 , 4337–4340 (1997).
CAS Статья Google Scholar
Holyoake, T. L., Nicolini, F. E. и Eaves, C.J. Функциональные различия между трансплантируемыми человеческими гемопоэтическими стволовыми клетками из печени плода, пуповинной крови и взрослого костного мозга. Exp. Гематол. 27 , 1418–1427 (1999).
CAS Статья Google Scholar
Mehra, N.K., Taneja, V., Sharma, S. & Kochupillai, V. Статус HLA после трансплантации фетальной печени при апластической анемии и остром миелоидном лейкозе. Тимус 10 , 131–136 (1987).
CAS PubMed Google Scholar
Kochupillai, V. et al. Инфузия печени плода при апластической анемии. Тимус 10 (1-2), 95-102 (1987).
Тимус 10 (1-2), 95-102 (1987).
CAS PubMed Google Scholar
Arjmand, B. et al. Совместная трансплантация фетальных мезенхимальных и гемопоэтических стволовых клеток человека на модели мышей с диабетом 1 типа. Фронт. Эндокринол. 10 , 761 (2019).
Артикул Google Scholar
Mohamed, A. A. et al. Ex vivo Экспансия стволовых клеток: определение оптимальных условий с использованием различных цитокинов. Lab. Гематол. 12 , 86–93 (2006).
CAS Статья Google Scholar
Piacibello, W. et al. Обширная амплификация и самообновление примитивных гемопоэтических стволовых клеток человека из пуповинной крови. Кровь 89 , 2644–2653 (1997).
CAS Статья Google Scholar
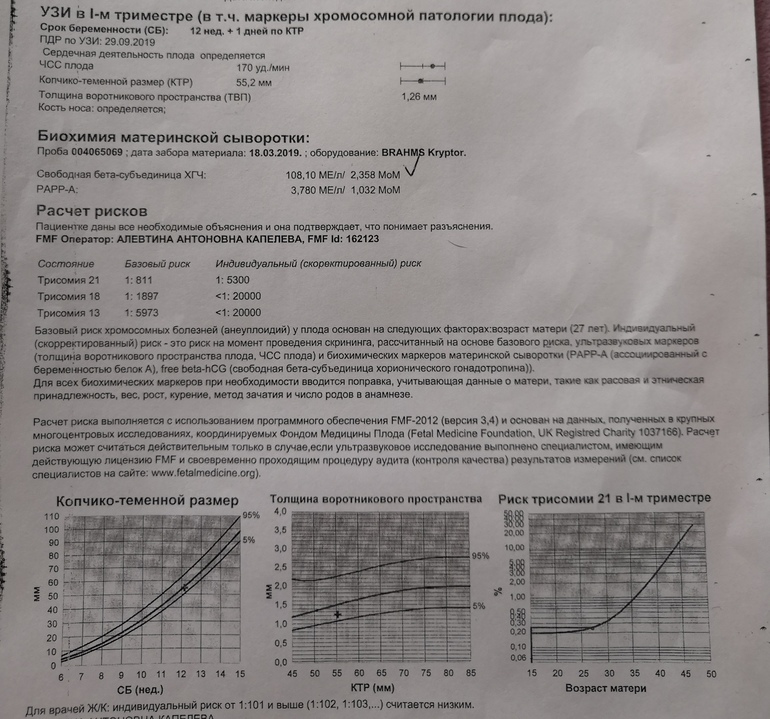
Defelice, L. et al. Flt3L индуцирует ex-vivo амплификацию предшественников пуповинной крови и ранних стволовых клеток в краткосрочных культурах. руб. J. Haematol. 106 , 133–141 (1999).
CAS Статья Google Scholar
Su, R.J. et al. Фактор роста, полученный из тромбоцитов, способствует экспансии ex vivo клеток CD34 + из пуповинной крови человека и усиливает клетки, инициирующие долгосрочное культивирование, репопулирующие клетки, не страдающие ожирением, диабетические / тяжелые комбинированные иммунодефицитные, и образование адгезивных клеток. руб.J. Haematol. 117 , 735–746 (2002).
CAS Статья Google Scholar
Rappold, I. et al. Передача сигналов Gp130 синергетична с FL и TPO для длительного распространения предшественников пуповинной крови. Лейкоз 13 (12), 2036–2048 (1999).
CAS Статья Google Scholar
Lazzari, L. et al. Долгосрочное увеличение и поддержание гемопоэтических стволовых клеток пуповинной крови с использованием тромбопоэтина, Flt3-лиганда, интерлейкина (IL) -6 и IL-11 в системе культивирования без сыворотки и стромы. руб. J. Haematol. 112 , 397–404 (2001).
CAS Статья Google Scholar
Fietz, T. et al. Культивирование пуповинной крови человека: сравнение мононуклеарных и отобранных клеток CD34 + . Кость. Костный мозг. Транспланта. 11 , 1109–1115 (1999).
Артикул Google Scholar
Каушанский К., и др. Тромбопоэтин увеличивает количество клеток-предшественников эритроидов, увеличивает производство эритроцитов и ускоряет восстановление эритроидов после миелосупрессивной терапии. J. Clin. Вкладывать деньги. 3 , 1683–1687 (1995).
J. Clin. Вкладывать деньги. 3 , 1683–1687 (1995).
Артикул Google Scholar
Kawada, H. et al. Rapid ex vivo экспансия гемопоэтических предшественников пуповины человека с использованием новой системы культивирования. Exp. Гематол. 27 , 904–915 (1999).
CAS Статья Google Scholar
Yao, C. L. et al. Характеристика бессывороточных ex vivo -расширенных гемопоэтических стволовых клеток, полученных из CD133 (+) клеток пуповинной крови человека. Стебель. Ячейки. Dev. 15 , 70–78 (2006).
CAS Статья Google Scholar
Chivu, M. et al. Сравнение различных протоколов распространения гемопоэтических стволовых клеток пуповинной крови. J. Cell. Мол. Med. 8 , 223–231 (2004).
CAS Статья Google Scholar
Роллини, П.Долгосрочное распространение ex vivo трансплантируемых гемопоэтических стволовых клеток печени плода человека. Кровь 103 , 1166–1170 (2004).
CAS Статья Google Scholar
Соважо Г., Исков Н. и Хамфрис Р. К. In vitro и in vivo экспансия гемопоэтических стволовых клеток. Онкоген 23 , 7223–7232 (2004).
CAS Статья Google Scholar
Nicolini, F. E., Cashman, J. D., Hogge, D. E., Humphries, R. K. & Eaves, C. J. Мыши NOD / SCID, сконструированные для экспрессии человеческого IL-3, GM-CSF и фактора Steel, постоянно мобилизуют привитые человеческие предшественники и препятствуют регенерации человеческих стволовых клеток. Лейкемия 18 , 341–347 (2004).
CAS Статья Google Scholar

Mc Niece, I. K., Langley, K. E. & Zsebo, K. M. Рекомбинантный фактор стволовых клеток человека действует синергично с GM-CSF, G-CSF, IL-3 и Epo, чтобы стимулировать человеческие клетки-предшественники миелоидной и эритроидной линий. Exp Hematol. 19 , 226–238 (1991).
CAS Google Scholar
Sui, X. et al. Эритропоэтин-независимая продукция эритроцитов: сигналы через gp130 и c-kit значительно способствуют эритропоэзу из человеческих клеток CD34 + . J Exp Med. 183 , 837 (1996).
CAS Статья Google Scholar
Мацунага, Т., Като, Т., Миядзаки, Х. и Огава, М. Тромбопоэтин способствует выживанию гемопоэтических клеток мышей, длительно восстанавливающихся: сравнение с эффектами лиганда FLT3 / FLK-2 и интерлейкина-6. Кровь 92 , 452–461 (1998).
CAS Статья Google Scholar
Кале, В. П. и Лайм, Л. С. Стимуляция костного мозга взрослого человека факторами, секретируемыми кроветворными клетками печени плода: «in vitro» оценка с использованием полутвердой системы клонального анализа. Стебель. Ячейки. 17 , 107–116 (1999).
CAS Статья Google Scholar
Fox, N., Priestley, G., Papayannopoulou, T. & Kaushansky, K. Тромбопоэтин увеличивает количество гемопоэтических стволовых клеток после трансплантации. J. Clin. Вкладывать деньги. 110 , 389–394 (2002).
CAS Статья Google Scholar
Шустер, Дж.A. et al. Расширение гемопоэтических стволовых клеток для трансплантации: современные перспективы. Exp. Гематол. Онкол. 1 , 12 (2012).
Артикул Google Scholar
Jing, L. et al. Экспансия кроветворных стволовых клеток in vitro путем ингибирования передачи сигналов GSK3 и p38.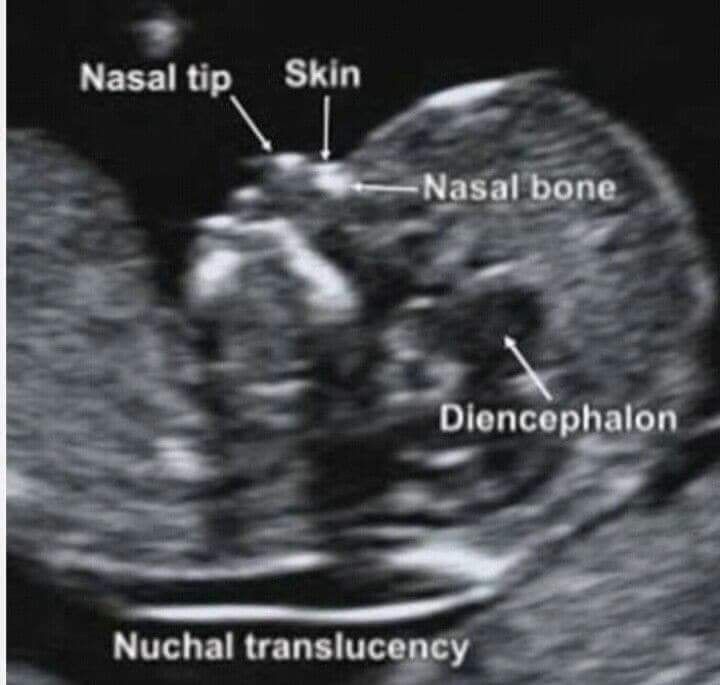 Стебель. Ячейки. Развивать. 28 (22), 1–12 (2019).
Стебель. Ячейки. Развивать. 28 (22), 1–12 (2019).
Google Scholar
Идентификация единиц экспансии HSC / MPP в печени плода с помощью одноклеточной пространственно-временной транскриптомики
Yamamoto, R. et al. Клональный анализ обнаруживает самообновляющиеся предшественники с ограниченным клонированием, полученные непосредственно из гемопоэтических стволовых клеток. Cell 154 , 1112–1126 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Уилкинсон, А. С., Игараши, К. Дж. И Накаучи, Х. Самообновление гемопоэтических стволовых клеток in vivo и ex vivo. Нац. Преподобный Жене. 21 , 541–554 (2020).
CAS PubMed Статья Google Scholar
Calvanese, V. et al. MLLT3 управляет самообновлением и приживлением гемопоэтических стволовых клеток человека.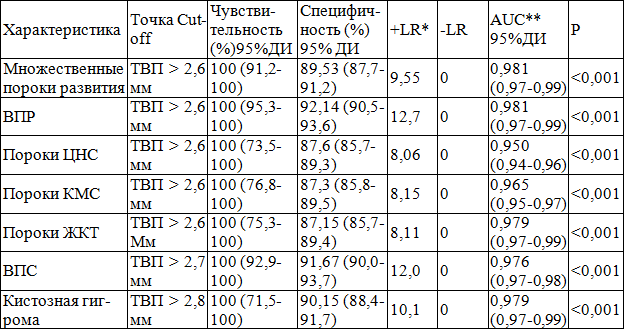 Nature 576 , 281–286 (2019).
Nature 576 , 281–286 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Wilkinson, A.C. et al. Долгосрочная экспансия гематопоэтических стволовых клеток ex vivo позволяет проводить безусловную трансплантацию. Nature 571 , 117–121 (2019).
CAS PubMed PubMed Central Статья Google Scholar
МакГрат К. Э., Фрейм Дж. М. и Палис Дж. Ранний гемопоэз и развитие макрофагов. Семин. Иммунол. 27 , 379–387 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Hoeffel, G. & Ginhoux, F. Онтогенез тканерезидентных макрофагов. Фронт. Иммунол. 6 , 486 (2015).
PubMed PubMed Central Статья CAS Google Scholar
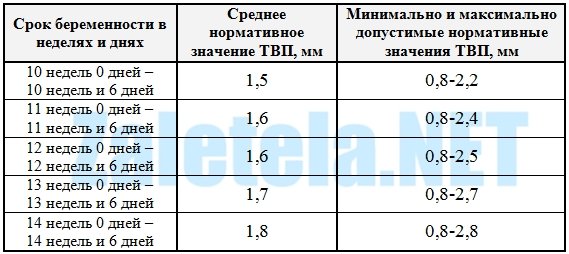
Эма, Х. и Накаучи, Х. Экспансия гемопоэтических стволовых клеток в развивающейся печени эмбриона мыши. Кровь 95 , 2284–2288 (2000).
CAS PubMed Статья PubMed Central Google Scholar
Миккола, Х.К.А. и Оркин, С.Х. Путь развития гемопоэтических стволовых клеток. Развитие 133 , 3733–3744 (2006).
CAS PubMed Статья PubMed Central Google Scholar
Рыбцов, С., Иванов, А., Чжао, С. Л., Медвинский, А. Скрытая экспансия незрелых предшественников лежит в основе острого всплеска активности взрослых HSC в печени плода. Девелопмент 143 , 1284–1289 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Lee, Y., Leslie, J., Yang, Y. & Ding, L. Звездчатые и эндотелиальные клетки печени поддерживают гемопоэтические стволовые клетки в развивающейся печени. J. Exp. Med. 218 , e20200882 (2021).
J. Exp. Med. 218 , e20200882 (2021).
CAS PubMed Статья PubMed Central Google Scholar
Суэйн А., Иноуэ Т., Тан К. С., Наканиши Ю. и Сугияма Д. Внутренняя и внешняя регуляция гемопоэза млекопитающих в печени плода. Histol. Histopathol. 29 , 1077–1082 (2014).
PubMed PubMed Central Google Scholar
Schmelzer, E. Печеночные предшественники фетальной печени: взаимодействие с гемопоэтическими стволовыми клетками. Дифференциация 106 , 9–14 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Khan, J. A. et al. Ниши гемопоэтических стволовых клеток печени плода связаны с воротными сосудами. Наука 351 , 176–180 (2016).
CAS PubMed Статья PubMed Central Google Scholar
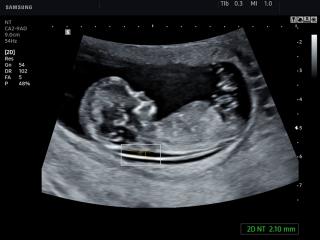
Han, X. et al. Составление атласа клеток мыши от Microwell-Seq. Ячейка 172 , 1091–1107.e17 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Popescu, D. M. et al. Расшифровка гемопоэза печени плода человека. Nature 574 , 365–371 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Ståhl, P. L. et al.Визуализация и анализ экспрессии генов в срезах тканей с помощью пространственной транскриптомики. Наука 353 , 78–82 (2016).
Артикул CAS Google Scholar
McKinney-Freeman, S. et al. Транскрипционный ландшафт онтогенеза гемопоэтических стволовых клеток. Cell Stem Cell 11 , 701–714 (2012).
CAS PubMed PubMed Central Статья Google Scholar

Gao, S. & Liu, F. Печень плода: идеальная ниша для размножения гемопоэтических стволовых клеток. Sci. China Life Sci. 61 , 885–892 (2018).
PubMed Статья PubMed Central Google Scholar
Becht, E. et al. Снижение размерности для визуализации данных с одной ячейкой с использованием UMAP. Нац. Biotechnol. 37 , 38–44 (2019).
CAS Статья Google Scholar
Zhang, Y. et al. Mds1-Evi1, содержащий PR-домен, имеет решающее значение для долговременной функции гемопоэтических стволовых клеток. Кровь 118 , 3853–3861 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Yokomizo, T. et al. Hlf отмечает путь развития гемопоэтических стволовых клеток, но не эритромиелоидных предшественников. J. Exp. Med. 216 , 1599–1614 (2019).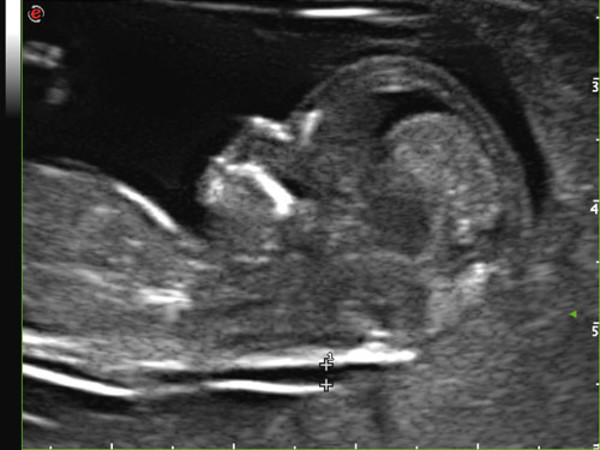
CAS PubMed PubMed Central Статья Google Scholar
Huang, K. L. et al. Обычный гаплотип снижает экспрессию PU.1 в миелоидных клетках и задерживает начало болезни Альцгеймера. Нац. Neurosci. 20 , 1052–1061 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Tober, J. et al.Созревание гемопоэтических стволовых клеток из предгематопоэтических стволовых клеток сопровождается повышающей регуляцией PD-L1. J. Exp. Med. 215 , 645–659 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Hamey, F. K. & Gottgens, B. Машинное обучение предсказывает предполагаемые гемопоэтические стволовые клетки в больших наборах данных транскриптомики отдельных клеток. Exp. Гематол. 78 , 11–20 (2019).
CAS PubMed PubMed Central Статья Google Scholar
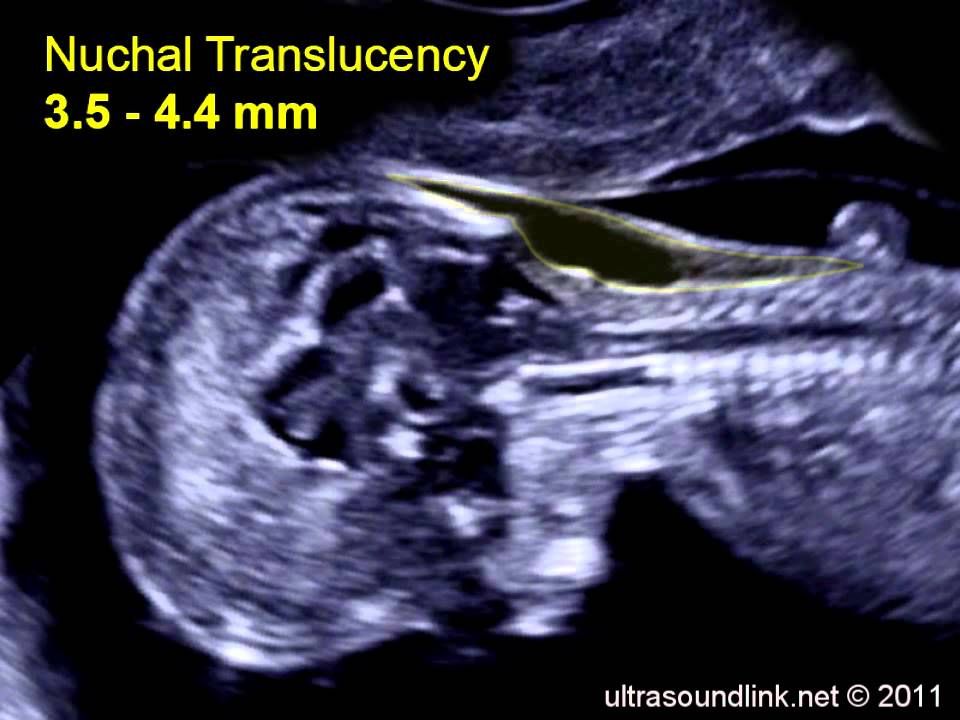
Moon, K. R. et al. Визуализация структуры и переходов в биологических данных высокой размерности. Нац. Biotechnol. 37 , 1482–1492 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Джордан, К. Т., МакКерн, Дж. П. и Лемишка, И.R. Клеточные и онтогенетические свойства фетальных гемопоэтических стволовых клеток. Cell 61 , 953–963 (1990).
CAS PubMed Статья PubMed Central Google Scholar
Rebel, V. I. et al. Сравнение долговременных репопуляций гемопоэтических стволовых клеток в печени плода и костном мозге взрослых мышей. Exp. Гематол. 24 , 638–648 (1996).
CAS PubMed PubMed Central Google Scholar
Harrison, D. E., Zhong, R. K., Jordan, C. T., Lemischka, I. R. & Astle, C. M. По сравнению с костным мозгом взрослого плода репопуляция печени плода в долгосрочной перспективе почти в пять раз эффективнее, чем в краткосрочной. Exp. Гематол. 25 , 293–297 (1997).
Exp. Гематол. 25 , 293–297 (1997).
CAS PubMed PubMed Central Google Scholar
Zeigler, FC, Bennett, B., Jordan, CT, Bauer, K. & Matthews, W. Клеточная и молекулярная характеристика роли тирозинкиназы рецептора Flk-2 Flt-3 в гематопоэтических стволовых клетках. клетки. Кровь 84 , A415 – A415 (1994).
Артикул Google Scholar
Ким, И., Хе, С. Х., Йилмаз, О. Х., Киль, М. Дж. И Моррисон, С. Дж. Повышенная очистка гемопоэтических стволовых клеток фетальной печени с использованием рецепторов семейства SLAM. Кровь 108 , 737–744 (2006).
CAS PubMed PubMed Central Статья Google Scholar
Тояма, Х., Араи, Ф., Хосокава, К., Икусима, Ю. М. и Суда, Т. N-кадгерин + HSC в печени плода проявляют более высокую активность по долгосрочному восстановлению костного мозга, чем N-кадгерин-HSC. Biochem. Биофиз. Res. Commun. 428 , 354–359 (2012).
Biochem. Биофиз. Res. Commun. 428 , 354–359 (2012).
CAS PubMed Статья Google Scholar
Iwasaki, H., Arai, F., Kubota, Y., Dahl, M. & Suda, T. Гематопоэтические стволовые клетки, экспрессирующие рецептор эндотелиального протеина C, находятся в перисинусоидной нише в печени плода. Кровь 116 , 544–553 (2010).
CAS PubMed Статья Google Scholar
Vento-Tormo, R. et al. Одноклеточная реконструкция раннего взаимодействия матери и плода у людей. Природа 563 , 347–353 (2018).
CAS PubMed Статья Google Scholar
Ефремова, М., Венто-Тормо, М., Тейхманн, С. А. и Венто-Тормо, Р. CellPhoneDB: определение межклеточной коммуникации на основе комбинированной экспрессии многосубъединичных комплексов лиганд-рецептор. Нац.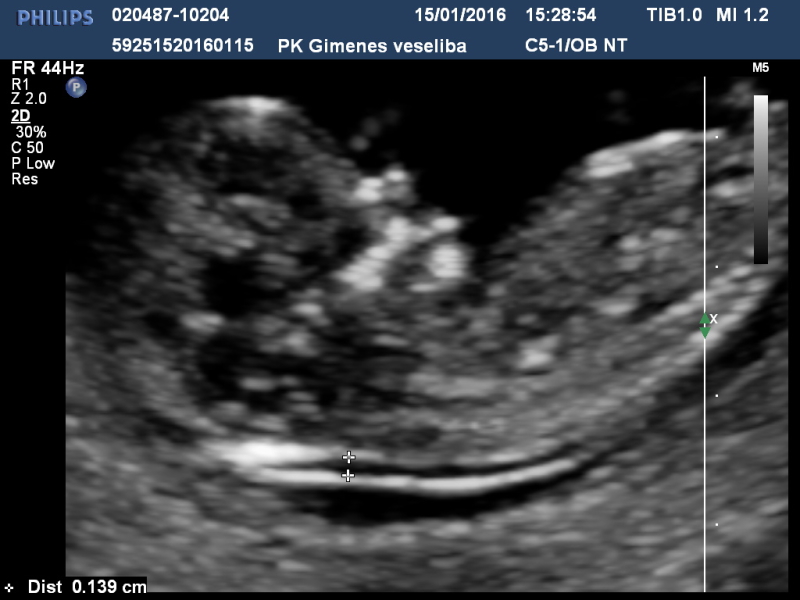 Protoc. 15 , 1484–1506 (2020).
Protoc. 15 , 1484–1506 (2020).
CAS PubMed Статья Google Scholar
Li, D. et al. Макрофаги VCAM-1 (+) направляют самонаведение HSPC в сосудистую нишу. Природа 564 , 119–124 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Mariani, S.A. et al. Провоспалительные макрофаги, ассоциированные с аортой, участвуют в эмбриональном развитии гемопоэтических стволовых клеток. Иммунитет 50 , 1439–1452.e5 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Вайдья А. и Кейл В. П. Передача сигналов TGF-бета и ее роль в регуляции гемопоэтических стволовых клеток. Syst. Synth. Биол. 9 , 1–10 (2015).
PubMed PubMed Central Статья Google Scholar

Ikushima, Y. M. et al. Усиленная передача сигналов Angpt1 / Tie2 влияет на способность к дифференцировке и длительной репопуляции гемопоэтических стволовых клеток. Biochem. Биофиз. Res. Commun. 430 , 20–25 (2013).
CAS PubMed Статья Google Scholar
Чжан, К.C. & Lodish, H. F. Инсулиноподобный фактор роста 2, экспрессируемый в новой популяции клеток печени плода, является фактором роста гемопоэтических стволовых клеток. Кровь 103 , 2513–2521 (2004).
CAS PubMed Статья Google Scholar
Wong, J. C. et al. Связанный с глюкокортикоидами и диетой путь переключает активность клеток-предшественников адипоцитов in vivo. Sci. Сигнал. 9 , ra103 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Caselli, A. et al. IGF-1-опосредованное расширение остеобластической ниши усиливает долговременное приживление гемопоэтических стволовых клеток после трансплантации костного мозга мыши. Стволовые клетки 31 , 2193–1204 (2013).
et al. IGF-1-опосредованное расширение остеобластической ниши усиливает долговременное приживление гемопоэтических стволовых клеток после трансплантации костного мозга мыши. Стволовые клетки 31 , 2193–1204 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Gealekman, O. et al. Усиление ангиогенеза при ожирении и в ответ на активаторы PPARgamma за счет продукции адипоцитами VEGF и ANGPTL4. г. J. Physiol. Эндокринол. Метаб. 295 , E1056 – E1064 (2008).
CAS PubMed PubMed Central Статья Google Scholar
Imai, A. et al. Адреномедуллин подавляет вызванную фактором роста эндотелия сосудов повышенную проницаемость сосудов и воспаление при ретинопатии. г. J. Pathol. 187 , 999–1015 (2017).
CAS PubMed Статья PubMed Central Google Scholar
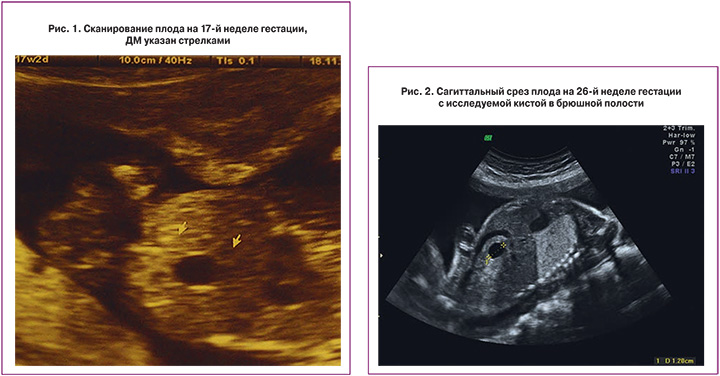
Broxmeyer, H. E., Capitano, M., Campbell, T. B., Hangoc, G. & Cooper, S. Модуляция кроветворных хемокиновых эффектов in vitro и in vivo с помощью DPP-4 / CD26. Stem Cells Dev. 25 , 575–585 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Маседо, Д. Б. и Кайзер, У. Б. DLK1, передача сигналов notch и время полового созревания. Семин. Репрод. Med. 37 , 174–181 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Fawkner-Corbett, D. et al. Пространственно-временной анализ развития кишечника человека при одноклеточном разрешении. Ячейка 184 , 810–26 e823 (2021).
CAS PubMed PubMed Central Статья Google Scholar
Asp, M. et al. Пространственно-временная экспрессия генов в масштабе всего органа и клеточный атлас развивающегося сердца человека, клетки. Ячейка 179 , 1647–60 e1619 (2019).
Ячейка 179 , 1647–60 e1619 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Chen, A, et al. Большое поле зрения с пространственно разрешенной транскриптомикой при наноразмерном разрешении. bioRxiv https://doi.org/10.1101/2021.01.17.427004 (2021 г.).
Ren, X. et al. Реконструкция пространственной организации клетки из данных секвенирования одноклеточной РНК на основе лиганд-рецепторной самосборки. Cell Res. 30 , 763–778 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Tamplin, O.J. et al. Прибытие гемопоэтических стволовых клеток запускает динамическое ремоделирование периваскулярной ниши. Ячейка 160 , 241–252 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Варол К., Милднер А. и Юнг С. Макрофаги: развитие и специализация тканей. Annu. Rev. Immunol. 33 , 643–675 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Yahara, Y. et al. Эритромиелоидные предшественники дают рост популяции остеокластов, которые способствуют гомеостазу и восстановлению кости. Нац. Cell Biol. 22 , 49–59 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Hoeffel, G. et al. Фетальные моноциты, происходящие из эритромиелоидных предшественников C-Myb (+), дают начало взрослым тканевым макрофагам. Иммунитет 42 , 665–678 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Mass, E. et al. Спецификация тканевых макрофагов в процессе органогенеза. Наука 353 , aaf4238 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Xue, Y. et al. Сосудистая ниша регулирует ложение и размножение гемопоэтических стволовых клеток и клеток-предшественников посредством klf6a-ccl25b. Dev. Ячейка 42 , 349–362 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Gomez Perdiguero, E. et al. Резидентные в тканях макрофаги происходят из эритромиелоидных предшественников, происходящих из желточного мешка. Природа 518 , 547–551 (2015).
PubMed Статья CAS PubMed Central Google Scholar
Ozgur, E. et al. Распределение EphB4 и EphrinB2 в нормальной и злокачественной ткани мочеполовой системы. Урол. Онкол. 29 , 78–84 (2011).
PubMed Статья CAS PubMed Central Google Scholar
Allard, J. B. & Duan, C. IGF-связывающие белки: почему они существуют и почему их так много? Фронт. Эндокринол. (Лозанна) 9 , 117 (2018).
Артикул Google Scholar
Bach, L.A. IGF-связывающие белки. J. Mol. Эндокринол. 61 , T11 – T28 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Доулатов, С., Нотта, Ф., Лауренти, Э. и Дик, Дж. Э. Гематопоэз: взгляд человека. Cell Stem Cell 10 , 120–136 (2012).
CAS PubMed Статья PubMed Central Google Scholar
Милявский М. и др. Характерная реакция на повреждение ДНК в гемопоэтических стволовых клетках человека показывает независимую от апоптоза роль p53 в самообновлении. Cell Stem Cell 7 , 186–197 (2010).
CAS PubMed Статья PubMed Central Google Scholar

Mohrin, M. et al. Покой гемопоэтических стволовых клеток способствует подверженной ошибкам репарации ДНК и мутагенезу. Cell Stem Cell 7 , 174–185 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Zhou, F. et al. Отслеживание образования гемопоэтических стволовых клеток при разрешении одной клетки. Природа 533 , 487–492 (2016).
CAS PubMed Статья PubMed Central Google Scholar
Chou, S. & Lodish, H. F. Печеночные предшественники печени плода являются поддерживающими стромальными клетками для гемопоэтических стволовых клеток. Proc. Natl. Акад. Sci. США 107 , 7799–7804 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Zhang, C.C. et al. Ангиопоэтин-подобные белки стимулируют рост гемопоэтических стволовых клеток ex vivo.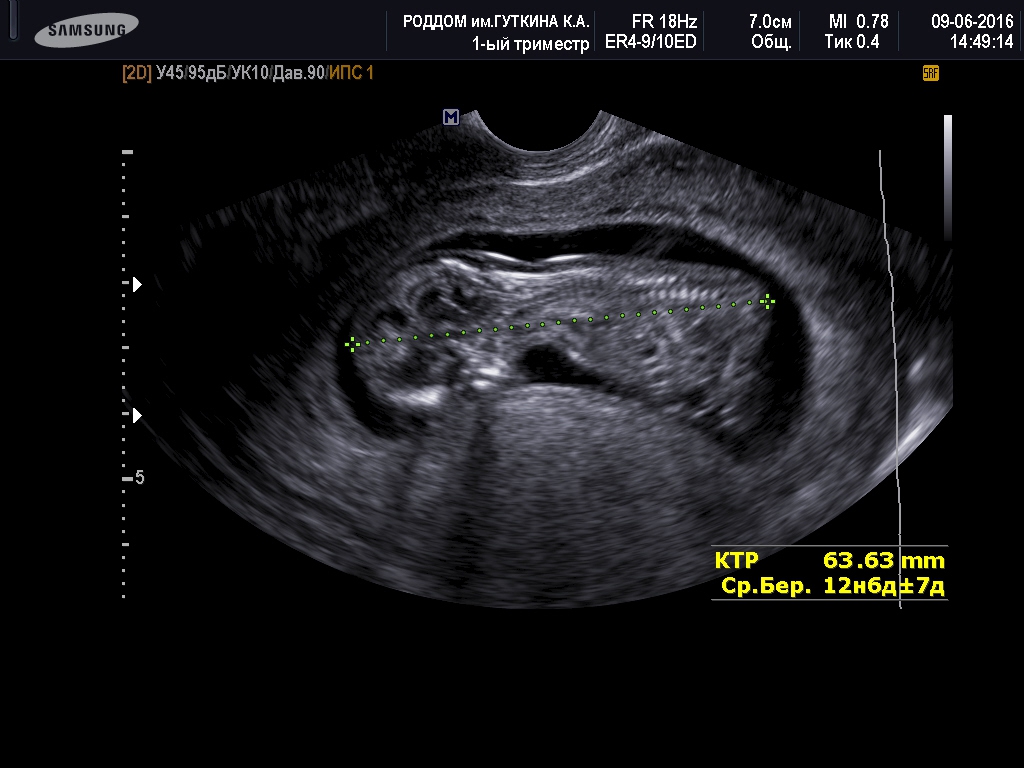 Нац. Med. 12 , 240–245 (2006).
Нац. Med. 12 , 240–245 (2006).
PubMed PubMed Central Статья CAS Google Scholar
Liu, C. et al. Макрофаги опосредуют восстановление разрыва сосудов головного мозга посредством прямой физической адгезии и механической тяги. Иммунитет 44 , 1162–1176 (2016).
CAS PubMed Статья PubMed Central Google Scholar
Lim, H.Y. et al. Макрофаги, экспрессирующие гиалуронановый рецептор LYVE-1, поддерживают артериальный тонус за счет опосредованной гиалуроновой кислотой регуляции коллагена гладкомышечных клеток. Иммунитет 49 , 326–341 e327 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Liang, Q., Su, L., Zhang, D. & Jiao, J. CD93 негативно регулирует астрогенез в ответ на MMRN2 через репрессор транскрипции ZFP503 в развивающемся головном мозге. Proc. Natl. Акад. Sci. США 117 , 9413–9422 (2020).
Proc. Natl. Акад. Sci. США 117 , 9413–9422 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Wang, X. et al. Сравнительный анализ дифференцировки клеточных клонов во время гепатогенеза у людей и мышей на уровне одноклеточного транскриптома. Cell Res. 30 , 1109–1126 (2020).
PubMed PubMed Central Статья CAS Google Scholar
Ding, N. et al. Глобальный анализ транскриптома для идентификации взаимодействий между кодирующими и некодирующими РНК во время дифференцировки эритроидов человека. Фронт. Med. 10 , 297–310 (2016).
PubMed Статья Google Scholar
Ren, Y, et al. Динамическая интерактивная сеть длинных некодирующих РНК и доступность хроматина облегчают дифференцировку эритроидов. bioRxiv https://doi.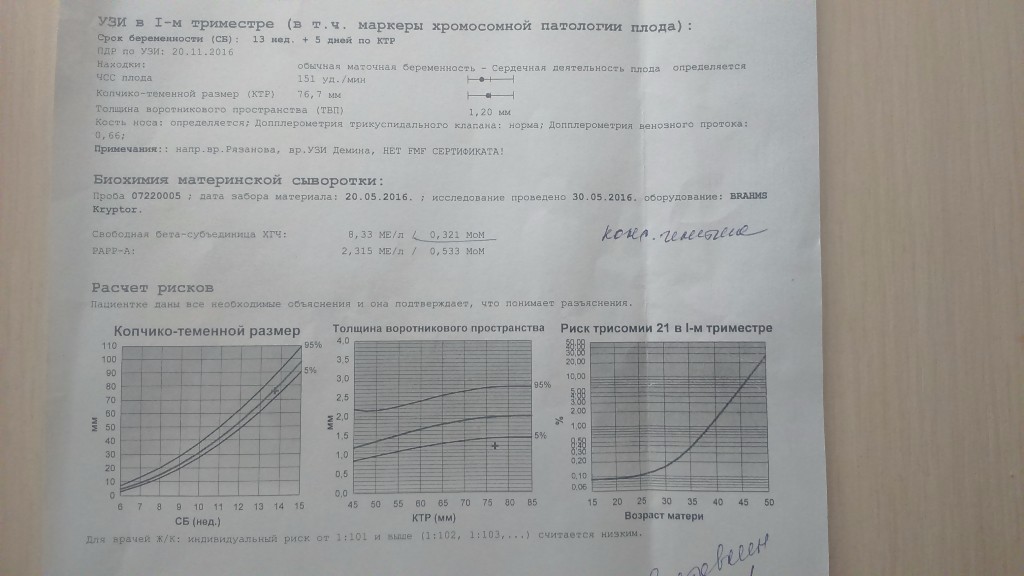 org/10.1101/2021.03.02.433076 (2021 г.).
org/10.1101/2021.03.02.433076 (2021 г.).
Lv, J., Wang, L., Gao, Y., Ding, Y. Q. & Liu, F. 5-гидрокситриптамин, синтезируемый в аорта-гонад-мезонефросе, регулирует выживание гемопоэтических стволовых клеток и клеток-предшественников. J. Exp. Med. 214 , 529–545 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Oberlin, E. et al. Экспрессия VE-кадгерина позволяет идентифицировать новый класс гемопоэтических стволовых клеток в эмбриональной печени человека. Кровь 116 , 4444–4455 (2010).
CAS PubMed Статья Google Scholar
Chen, Y., Haviernik, P., Bunting, K. D. и Yang, Y. C. Cited2 требуется для нормального кроветворения в печени плода мыши. Кровь 110 , 2889–2898 (2007).
CAS PubMed PubMed Central Статья Google Scholar
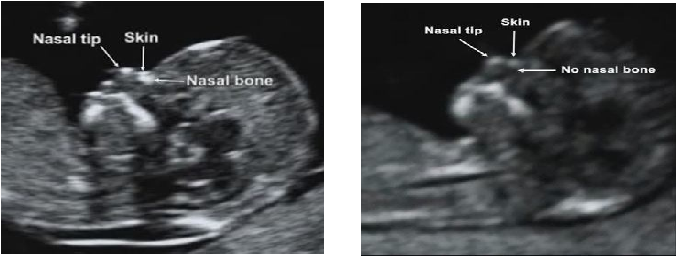
Lancini, C., Gargiulo, G., van den Berk, PC & Citterio, E. Количественный анализ путем секвенирования следующего поколения гематопоэтических стволовых клеток и клеток-предшественников (LSK) и транскриптомов B-клеток селезенки из диких type и Usp3-нокаутные мыши. Краткий обзор данных 6 , 556–561 (2016).
PubMed PubMed Central Статья Google Scholar
Zhao, Y. et al. ATF4 играет ключевую роль в развитии функциональных гемопоэтических стволовых клеток в печени плода мыши. Кровь 126 , 2383–2391 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Yu, G., Wang, L.G., Han, Y. & He, Q. Y. clusterProfiler: пакет R для сравнения биологических тем среди генных кластеров. OMICS 16 , 284–287 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Лизат тромбоцитов человека для замены фетальной бычьей сыворотки в расширении hMSC для трансляционных приложений: систематический обзор | Журнал трансляционной медицины
Роби П. «Мезенхимальные стволовые клетки»: факт или вымысел, и значение их терапевтического использования. F1000Res. 2017; 6: F1000.
PubMed PubMed Central Google Scholar
Shih DT, Burnouf T. Приготовление, критерии качества и свойства добавок лизата тромбоцитов крови человека для размножения стволовых клеток ex vivo. N Biotechnol. 2015; 32: 199–211.
CAS PubMed Google Scholar
Lensch M, Muise A, White L, Badowski M, Harris D. Сравнение синтетических сред, разработанных для размножения мезенхимальных стромальных клеток, полученных из жировой ткани. Биомедицина. 2018; 6: 54.
PubMed Central Google Scholar
Sotiropoulou PA, Perez SA, Salagianni M, Baxevanis CN, Papamichail M. Состав среды для культивирования клеток и исследование трансляционных стволовых клеток, полученных из костного мозга взрослых. Стволовые клетки. 2006; 24: 1409–10.
Стволовые клетки. 2006; 24: 1409–10.
PubMed Google Scholar
Perez-Ilzarbe M, Diez-Campelo M, Aranda P, Tabera S, Lopez T, del Canizo C, Merino J, Moreno C, Andreu EJ, Prosper F, Perez-Simon JA. Сравнение условий размножения ex vivo культивирования мезенхимальных стволовых клеток для клеточной терапии человека.Переливание. 2009; 49: 1901–10.
CAS PubMed Google Scholar
Hemeda H, Giebel B, Wagner W. Оценка лизата тромбоцитов человека по сравнению с фетальной бычьей сывороткой для культивирования мезенхимальных стромальных клеток. Цитотерапия. 2014; 16: 170–80.
CAS PubMed Google Scholar
Сельваджи Т.А., Уокер Р.Э., Флейшер Т.А. Выработка антител к фетальной телячьей сыворотке с артусоподобными реакциями у инфицированных вирусом иммунодефицита человека пациентов, получавших инфузии сингенных лимфоцитов. Кровь. 1997; 89: 776–9.
Кровь. 1997; 89: 776–9.
CAS PubMed Google Scholar
Макенсен А., Драгер Р., Шлезер М., Мертельсманн Р., Линдеманн А. Присутствие антител IgE к альбумину бычьей сыворотки у пациента, у которого развивается анафилаксия после вакцинации дендритными клетками человека с импульсными пептидами. Cancer Immunol Immunother. 2000; 49: 152–6.
CAS PubMed Google Scholar
Crespo-Diaz R, Behfar A, Butler GW, Padley DJ, Sarr MG, Bartunek J, Dietz AB, Terzic A. Лизат тромбоцитов, состоящий из протеома естественной репарации, поддерживает пролиферацию мезенхимальных стволовых клеток и хромосомную стабильность. Пересадка клеток. 2011; 20: 797–811.
PubMed Google Scholar
Витценедер К., Линденмайр А., Габриэль С., Хёллер К., Тайсс Д., Редл Х., Хеннербихлер С. Полученные от человека альтернативы фетальной телячьей сыворотке в культуре клеток.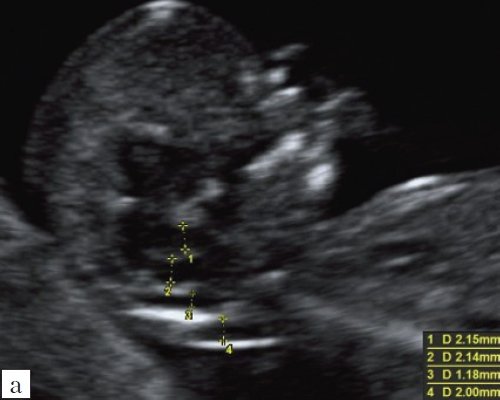 Transfus Med Hemother. 2013; 40: 417–23.
Transfus Med Hemother. 2013; 40: 417–23.
PubMed PubMed Central Google Scholar
Dessels C, Potgieter M, Pepper MS. Делаем переход: альтернативы фетальной бычьей сыворотке для увеличения стромальных клеток, полученных из жировой ткани. Front Cell Dev Biol. 2016; 4: 115.
PubMed PubMed Central Google Scholar
Cimino M, Gonçalves RM, Barrias CC, Martins MCL.Ксено-свободные стратегии для безопасной экспансии мезенхимальных стволовых / стромальных клеток человека: добавки и покрытия. Stem Cells Int. 2017; 2017: 6597815.
CAS PubMed PubMed Central Google Scholar
Бибак К., Хеккер А., Коджаомер А., Ланнерт Х., Шальмозер К., Странк Д., Клютер Х. Человеческие альтернативы фетальной бычьей сыворотке для размножения мезенхимальных стромальных клеток из костного мозга. Стволовые клетки. 2009; 27: 2331–41.
Стволовые клетки. 2009; 27: 2331–41.
CAS PubMed Google Scholar
Фогель Дж. П., Салай К., Гейгер Ф., Крамер М., Рихтер В., Кастен П. Плазма, обогащенная тромбоцитами, улучшает рост мезенхимальных стволовых клеток человека и сохраняет способность к дифференцировке и образованию костной ткани in vivo в кальций-фосфатной керамике. Тромбоциты. 2006; 17: 462–9.
CAS PubMed Google Scholar
Abdelrazik H, Spaggiari GM, Chiossone L, Moretta L. Мезенхимальные стволовые клетки, размноженные в лизате тромбоцитов человека, проявляют пониженную ингибирующую способность в отношении пролиферации и функции Т- и NK-клеток.Eur J Immunol. 2011; 41: 3281–90.
CAS PubMed Google Scholar
Mohammadi S, Nikbakht M, Malek Mohammadi A, Zahed Panah M, Ostadali MR, Nasiri H, Ghavamzadeh A. Лизат тромбоцитов человека как не содержащая ксено альтернатива фетальной бычьей сыворотке для in vitro расширения стромальной мезенхимы человека клетки. Int J Hematol Oncol Stem Cell Res. 2016; 10: 161–71.
Лизат тромбоцитов человека как не содержащая ксено альтернатива фетальной бычьей сыворотке для in vitro расширения стромальной мезенхимы человека клетки. Int J Hematol Oncol Stem Cell Res. 2016; 10: 161–71.
PubMed PubMed Central Google Scholar
Mangum LH, Natesan S, Stone R, Wrice NL, Larson DA, Florell KF, Christy BA, Herzig MC, Cap AP, Christy RJ. Источник ткани и условия роста клеток влияют на фенотипические изменения стволовых клеток, полученных из жировой ткани. Stem Cells Int. 2017; 2017: 7108458.
PubMed PubMed Central Google Scholar
Schallmoser K, Bartmann C, Rohde E, Bork S, Guelly C, Obenauf AC, Reinisch A, Horn P, Ho AD, Strunk D, Wagner W. Изменения экспрессии генов, связанных с репликативным старением, в мезенхимальных стромальных клетках похожи в разных условиях культивирования.Haematologica. 2010; 95: 867–74.
CAS PubMed PubMed Central Google Scholar

Дусет С., Эрноу И., Чжан И, Лленсе-младший, Бегот Л., Холи Икс, Латайлад Дж. Лизаты тромбоцитов способствуют размножению мезенхимальных стволовых клеток: безопасный заменитель животной сыворотки в применениях клеточной терапии. J. Cell Physiol. 2005; 205: 228–36.
CAS PubMed Google Scholar
Bernardi M, Agostini F, Chieregato K, Amati E, Durante C, Rassu M, Ruggeri M, Sella S, Lombardi E, Mazzucato M, Astori G. Способ производства влияет на эффективность производных тромбоцитов для увеличения мезенхимальных стромальных клеток in vitro . J Transl Med. 2017; 15:90.
PubMed PubMed Central Google Scholar
Хорн П., Бокерманн Г., Холева Д., Борк С., Валенда Т., Кох С., Дрешер В., Хутшенройтер Г., Зенке М., Хо А.Д., Вагнер В.Влияние отдельных лизатов тромбоцитов на выделение и рост мезенхимальных стромальных клеток человека. Цитотерапия. 2010; 12: 888–98.
CAS PubMed Google Scholar
Блэр П., Флауменхафт Р. Альфа-гранулы тромбоцитов: основные биологические и клинические корреляты. Blood Rev.2009; 23: 177–89.
CAS PubMed PubMed Central Google Scholar
Schallmoser K, Bartmann C, Rohde E, Reinisch A, Kashofer K, Stadelmeyer E, Drexler C, Lanzer G, Linkesch W., Strunk D.Лизат тромбоцитов человека может заменить фетальную бычью сыворотку для увеличения функциональных мезенхимальных стромальных клеток в клиническом масштабе. Переливание. 2007; 47: 1436–46.
CAS PubMed Google Scholar
Schallmoser K, Strunk D. Создание пула лизата тромбоцитов человека и эффективное использование в культуре клеток. Методы Мол биол. 2013; 946: 349–62.
CAS PubMed Google Scholar
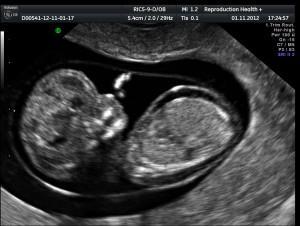
Schallmoser K, Strunk D. Приготовление объединенного лизата тромбоцитов человека (pHPL) в качестве эффективной добавки для бессывороточных культур стволовых клеток человека. J Vis Exp. 2009. https://doi.org/10.3791/1523.
Артикул PubMed PubMed Central Google Scholar
Rauch C, Feifel E, Amann EM, Spotl HP, Schennach H, Pfaller W., Gstraunthaler G. Альтернативы использованию фетальной бычьей сыворотки: лизаты тромбоцитов человека в качестве заменителя сыворотки в средах для культивирования клеток.АЛЬТЕКС. 2011; 28: 305–16.
PubMed Google Scholar
Burnouf T, Strunk D, Koh MB, Schallmoser K. Лизат тромбоцитов человека: замена фетальной телячьей сыворотки в качестве золотого стандарта для размножения человеческих клеток? Биоматериалы. 2016; 76: 371–87.
CAS PubMed Google Scholar
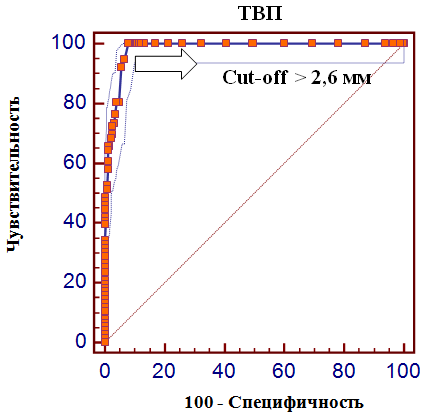
Эрикссон Л., Хогман С.Ф. Тромбоциты концентрируются в дополнительном растворе, приготовленном из объединенных лейкоцитов.1. Исследования in vitro. Vox Sang. 1990; 59: 140–5.
CAS PubMed Google Scholar
McCullough J. Обзор переливания тромбоцитов. Semin Hematol. 2010; 47: 235–42.
PubMed Google Scholar
Schallmoser K, Henschler R, Gabriel C, Koh MBC, Burnouf T. Требования к производству и качеству лизата тромбоцитов человека: заявление рабочей группы по клеточной терапии Международного общества переливания крови.Trends Biotechnol. 2019; 38 (1): 13–23.
PubMed Google Scholar
Mojica-Henshaw MP, Jacobson P, Morris J, Kelley L., Pierce J, Boyer M, Reems JA. Лизат тромбоцитов, превращенный в сыворотку, может заменить фетальную бычью сыворотку в культурах мезенхимальных стромальных клеток человека. Цитотерапия. 2013; 15: 1458–68.
Цитотерапия. 2013; 15: 1458–68.
CAS PubMed Google Scholar
Kinzebach S, Dietz L, Klüter H, Thierse HJ, Bieback K.Функциональный и дифференциальный протеомный анализ для выявления факторов, происходящих от тромбоцитов, влияющих на экспансию мезенхимальных стромальных клеток ex vivo. BMC Cell Biol. 2013; 14: 48.
CAS PubMed PubMed Central Google Scholar
Bernardi M, Albiero E, Alghisi A, Chieregato K, Lievore C, Madeo D, Rodeghiero F, Astori G. Производство лизата тромбоцитов человека с использованием ультразвука для увеличения ex vivo мезенхимальных веществ, полученных из костного мозга человека стромальные клетки.Цитотерапия. 2013; 15: 920–9.
CAS PubMed Google Scholar
Luttenberger T, Schmid-Kotsas A, Menke A, Siech M, Beger H, Adler G, Grunert A, Bachem MG. Факторы роста, полученные из тромбоцитов, стимулируют пролиферацию и синтез внеклеточного матрикса звездчатых клеток поджелудочной железы: влияние на патогенез фиброза поджелудочной железы. Lab Invest. 2000; 80: 47–55.
Факторы роста, полученные из тромбоцитов, стимулируют пролиферацию и синтез внеклеточного матрикса звездчатых клеток поджелудочной железы: влияние на патогенез фиброза поджелудочной железы. Lab Invest. 2000; 80: 47–55.
CAS PubMed Google Scholar
Пирс Дж., Бенедетти Е., Преслар А., Якобсон П., Джин П., Стрончек Д. Ф., Ремс Дж. А. Сравнительный анализ препаратов лизата тромбоцитов человека в промышленных масштабах. Переливание. 2017; 57: 2858–69.
CAS PubMed PubMed Central Google Scholar
Moher D, Liberati A, Tetzlaff J, Altman DG, Group P. Предпочтительные элементы отчетности для систематических обзоров и метаанализов: заявление PRISMA. Open Med. 2009; 3: e123–30.
Google Scholar
Barro L, Su YT, Nebie O, Wu YW, Huang YH, Koh MB, Knutson F, Burnouf T. Лизат человеческих тромбоцитов с двойной вирусной инактивированностью (Intercept-растворитель / детергент) для размножения мезенхимальных стромальных клеток человека in vitro . Переливание. 2019; 59: 2061–73.
Переливание. 2019; 59: 2061–73.
CAS PubMed Google Scholar
Dessels C, Durandt C, Pepper MS. Сравнение альтернатив лизату тромбоцитов человека с использованием просроченных и свежевыделенных концентратов тромбоцитов для увеличения стромальных клеток, полученных из жировой ткани.Тромбоциты. 2019; 30: 356–67.
CAS PubMed Google Scholar
Бечеруччи В., Пиччини Л., Казамассима С., Бисин С., Гори В., Джентиле Ф, Чеккантини Р., Де Риенцо Е., Бинди Б., Паван П. и др. Лизат тромбоцитов человека в увеличении мезенхимальных стромальных клеток в соответствии с протоколом степени GMP: опыт фабрики клеток. Stem Cell Res Ther. 2018; 9: 124.
CAS PubMed PubMed Central Google Scholar
Chen MS, Wang TJ, Lin HC, Burnouf T. Четыре типа лизата тромбоцитов человека, включая один, вирусно инактивированный растворителем-детергентом, можно использовать для размножения мезенхимальных стромальных клеток Wharton jelly. N Biotechnol. 2019; 49: 151–60.
N Biotechnol. 2019; 49: 151–60.
CAS PubMed Google Scholar
Kandoi S, Patra B, Vidyasekar P, Sivanesan D, Vijayalakshmi S, Rajagopal K, Verma RS. Оценка лизата тромбоцитов как заменителя FBS в методах эксплантационного и ферментативного выделения МСК пуповины человека.Научный отчет 2018; 8: 12439.
PubMed PubMed Central Google Scholar
Phetfong J, Tawonsawatruk T, Seenprachawong K, Srisarin A, Isarankura-Na-Ayudhya C., Supokawej A. Повторное использование продуктов крови в качестве альтернативной добавки для оптимизации мезенхимальных стволовых клеток клинического уровня культура. Bone Joint Res. 2017; 6: 414–22.
CAS PubMed PubMed Central Google Scholar
Фернандес-Реболло Э, Ментруп Б., Эберт Р., Францен Дж., Абагнале Г., Зибен Т., Островска А., Хоффманн П. , Ру П.Ф., Рат Б. и др. Сравнение лизата тромбоцитов человека и фетальной телячьей сыворотки: эти добавки не подходят для различных мезенхимальных стромальных клеток. Научный отчет 2017; 7: 5132.
, Ру П.Ф., Рат Б. и др. Сравнение лизата тромбоцитов человека и фетальной телячьей сыворотки: эти добавки не подходят для различных мезенхимальных стромальных клеток. Научный отчет 2017; 7: 5132.
PubMed PubMed Central Google Scholar
Маттиссен С., Ни Дхубгаилл С., Ван Гервен В., Закария Н. Культивирование мезенхимальных стволовых клеток из стромы роговицы без использования ксено.Инвестируйте Ophthalmol Vis Sci. 2017; 58: 2659–65.
PubMed Google Scholar
Viau S, Chabrand L, Eap S, Lorant J, Rouger K, Goudaliez F, Sumian C, Delorme B. Уменьшение количества патогенов с помощью коротковолнового УФ-излучения без добавок сохраняет оптимальную эффективность лизата тромбоцитов человека для размножения мезенхимальных стволовых клеток костного мозга человека. PLoS ONE. 2017; 12: e0181406.
PubMed PubMed Central Google Scholar
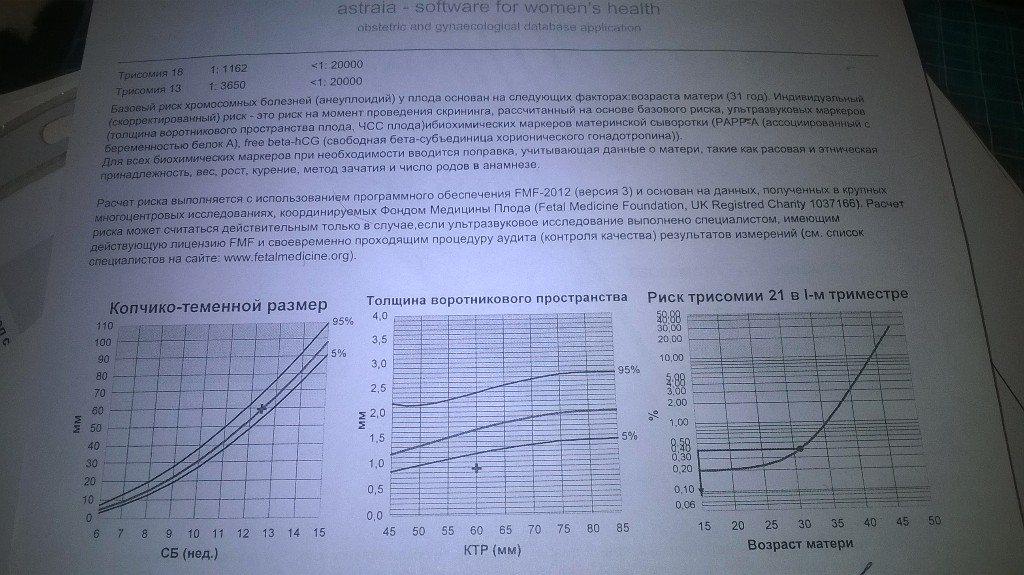
Riis S, Nielsen FM, Pennisi CP, Zachar V, Fink T. Сравнительный анализ сред и добавок по инициированию и размножению стволовых клеток, полученных из жировой ткани. Stem Cells Transl Med. 2016; 5: 314–24.
PubMed PubMed Central Google Scholar
Эскобар С.Х., Чапарро О. Экстракция, культивирование и криоконсервация мезенхимальных стволовых клеток, полученных из жировой ткани человека. Stem Cells Transl Med. 2016; 5: 358–65.
PubMed PubMed Central Google Scholar
Heathman TR, Stolzing A, Fabian C, Rafiq QA, Coopman K, Nienow AW, Kara B, Hewitt CJ. Масштабируемость и перенос процесса продукции мезенхимальных стромальных клеток из монослоя в культуру микроносителя с использованием лизата тромбоцитов человека. Цитотерапия. 2016; 18: 523–35.
CAS PubMed Google Scholar

Ширзад Н., Бордбар С., Гударзи А., Мохаммад М., Хосравани П., Сайяхпур Ф., Багхабан Эсламинеджад М., Эбрахими М. Лизат тромбоцитов пуповинной крови в качестве заменителя сыворотки при расширении мезенхимальных стволовых клеток человека.Cell J. 2017; 19: 403–14.
PubMed PubMed Central Google Scholar
Juhl M, Tratwal J, Follin B, Søndergaard RH, Kirchhoff M, Ekblond A, Kastrup J, Haack-Sørensen M. Сравнение лизатов человеческих тромбоцитов клинической степени для культивирования мезенхимальных стромальных клеток из костного мозга и жировой ткани ткань. Сканд Дж. Клин Лаб Инвест. 2016; 76: 93–104.
CAS PubMed Google Scholar
Muraglia A, Todeschi MR, Papait A, Poggi A, Spanò R, Strada P, Cancedda R, Mastrogiacomo M. Комбинированные производные тромбоцитов и плазмы усиливают пролиферацию стволовых клеток / клеток-предшественников, сохраняя их потенциал дифференцировки. Цитотерапия. 2015; 17: 1793–806.
Цитотерапия. 2015; 17: 1793–806.
CAS PubMed Google Scholar
Wagner ER, Bravo D, Dadsetan M, Riester SM, Chase S, Westendorf JJ, Dietz AB, van Wijnen AJ, Yaszemski MJ, Kakar S. Конструирование ткани связок с использованием нового пористого каркаса ткани фумарата поликапролактона и жировой ткани -производные мезенхимальные стволовые клетки, выращенные в лизате тромбоцитов.Tissue Eng Часть A. 2015; 21: 2703–13.
CAS PubMed PubMed Central Google Scholar
Риордан Н.Х., Мадригал М., Рено Дж., Де Купейро К., Хименес Н., Руис С., Санчес Н., Ичим Т.Э., Сильва Ф., Патель А.Н. Масштабируемое эффективное размножение мезенхимальных стволовых клеток в среде без ксено с использованием коммерчески доступных реагентов. J Transl Med. 2015; 13: 232.
PubMed PubMed Central Google Scholar

Кинзебах С., Бибак К. Экспансия мезенхимальных стволовых / стромальных клеток в условиях культивирования без ксеногенов. Adv Biochem Eng Biotechnol. 2013; 129: 33–57.
PubMed Google Scholar
Шанский Ю.Д., Сергеева Н.С., Свиридова И.К., Киракозов М.С., Кирсанова В.А., Ахмедова С.А., Антохин А.И., Чиссов В.И. Лизат тромбоцитов человека как многообещающая добавка, стимулирующая рост, для культивирования стволовых клеток и других типов клеток. Bull Exp Biol Med.2013; 156: 146–51.
CAS PubMed Google Scholar
Griffiths S, Baraniak PR, Copland IB, Nerem RM, McDevitt TC. Лизат тромбоцитов человека стимулирует рост и омоложение высококассетных и стареющих мультипотентных мезенхимальных стромальных клеток человека in vitro. Цитотерапия. 2013; 15: 1469–83.
CAS PubMed Google Scholar

Ben Azouna N, Jenhani F, Regaya Z, Berraeis L., Ben Othman T, Ducrocq E, Domenech J.Фенотипические и функциональные характеристики мезенхимальных стволовых клеток костного мозга: сравнение культур с использованием различных сред с добавлением лизата тромбоцитов человека или фетальной бычьей сыворотки. Stem Cell Res Ther. 2012; 3: 6.
CAS PubMed Google Scholar
Gottipamula S, Sharma A, Krishnamurthy S, Majumdar AS, Seetharam RN. Лизат тромбоцитов человека является альтернативой фетальной бычьей сыворотке для крупномасштабного размножения мезенхимальных стромальных клеток костного мозга.Biotechnol Lett. 2012; 34: 1367–74.
CAS PubMed Google Scholar
Naaijkens BA, Niessen HW, Prins HJ, Krijnen PA, Kokhuis TJ, de Jong N, van Hinsbergh VW, Kamp O, Helder MN, Musters RJ, et al. Лизат тромбоцитов человека в качестве заменителя фетальной бычьей сыворотки улучшает культуру стромальных клеток, полученных из жировой ткани человека, для будущего восстановления сердца.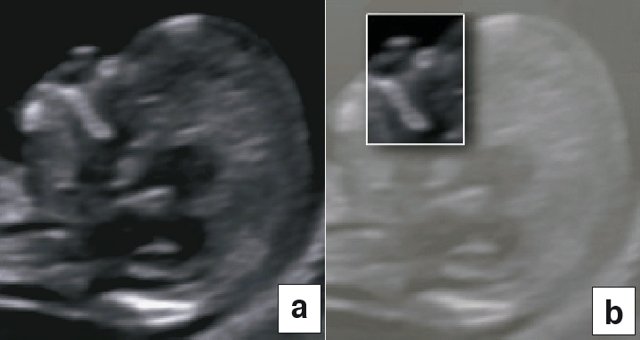 Cell Tissue Res. 2012; 348: 119–30.
Cell Tissue Res. 2012; 348: 119–30.
CAS PubMed PubMed Central Google Scholar
Говиндасами В., Рональд В.С., Абдулла А.Н., Ганесан Натан К.Р., Азиз З.А., Абдулла М., Заин Р.Б., Касим Н.Х., Муса С., Бонде Р.Р. Лизат тромбоцитов человека позволяет увеличивать количество стромальных клеток пульпы зуба для клинического применения. Цитотерапия. 2011; 13: 1221–33.
CAS PubMed Google Scholar
Бланде И.С., Бассанезе В., Лавини-Рамос К., Фэй К.С., Калил Дж., Миякава А.А., Шеттерт ИТ, Кригер Дж. Э.. Размножение мезенхимальных стволовых клеток жировой ткани в бессывороточной среде животных с добавлением аутологичного лизата тромбоцитов человека.Переливание. 2009; 49: 2680–5.
PubMed Google Scholar
Prins HJ, Rozemuller H, Vonk-Griffioen S, Verweij VG, Dhert WJ, Slaper-Cortenbach IC, Martens AC.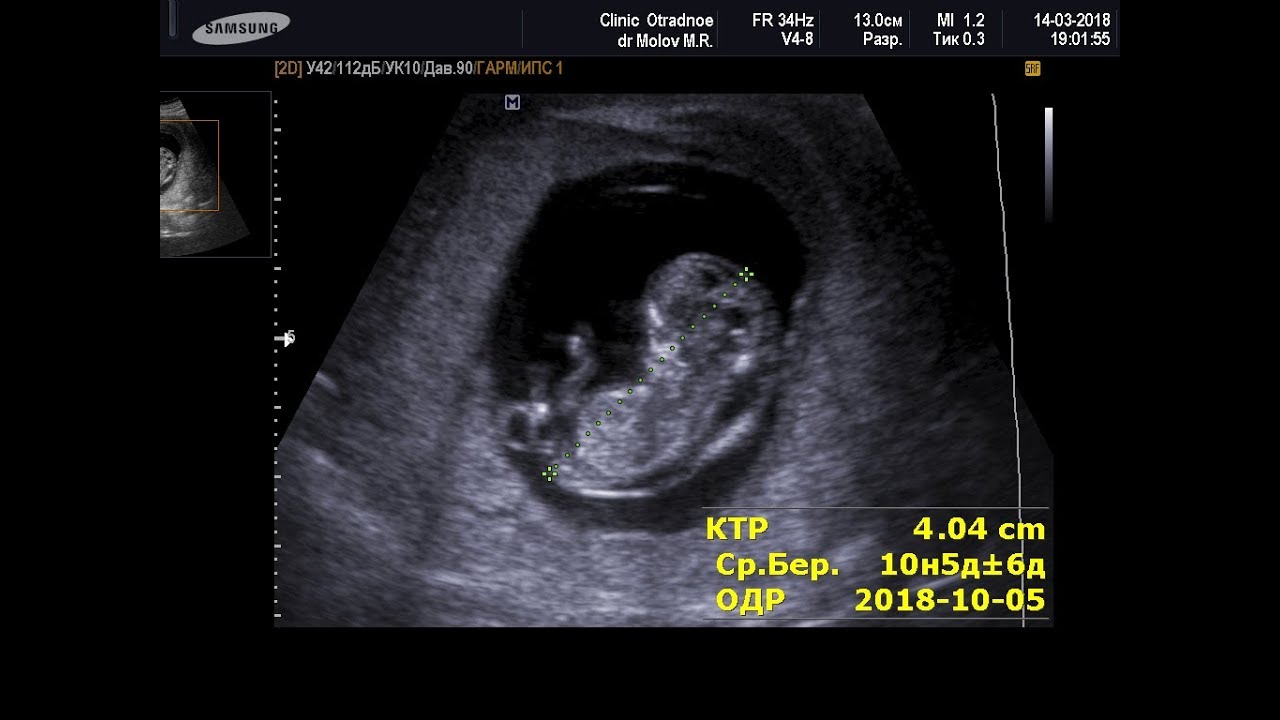 Костеобразовательная способность мезенхимальных стромальных клеток при культивировании в присутствии лизата тромбоцитов человека в качестве заменителя фетальной бычьей сыворотки. Tissue Eng Часть A. 2009; 15: 3741–51.
Костеобразовательная способность мезенхимальных стромальных клеток при культивировании в присутствии лизата тромбоцитов человека в качестве заменителя фетальной бычьей сыворотки. Tissue Eng Часть A. 2009; 15: 3741–51.
CAS PubMed Google Scholar
Zaky SH, Ottonello A, Strada P, Cancedda R, Mastrogiacomo M. Лизат тромбоцитов способствует увеличению in vitro стромальных клеток костного мозга человека для инженерии костей и хрящей. J Tissue Eng Regen Med. 2008; 2: 472–81.
CAS PubMed Google Scholar
Capelli C, Domenghini M, Borleri G, Bellavita P, Poma R, Carobbio A, Micò C, Rambaldi A, Golay J, Introna M. Лизат тромбоцитов человека обеспечивает размножение и производство мезенхимальных стромальных клеток клинической степени из небольшие образцы аспиратов костного мозга или смывов фильтров костного мозга.Пересадка костного мозга. 2007; 40: 785–91.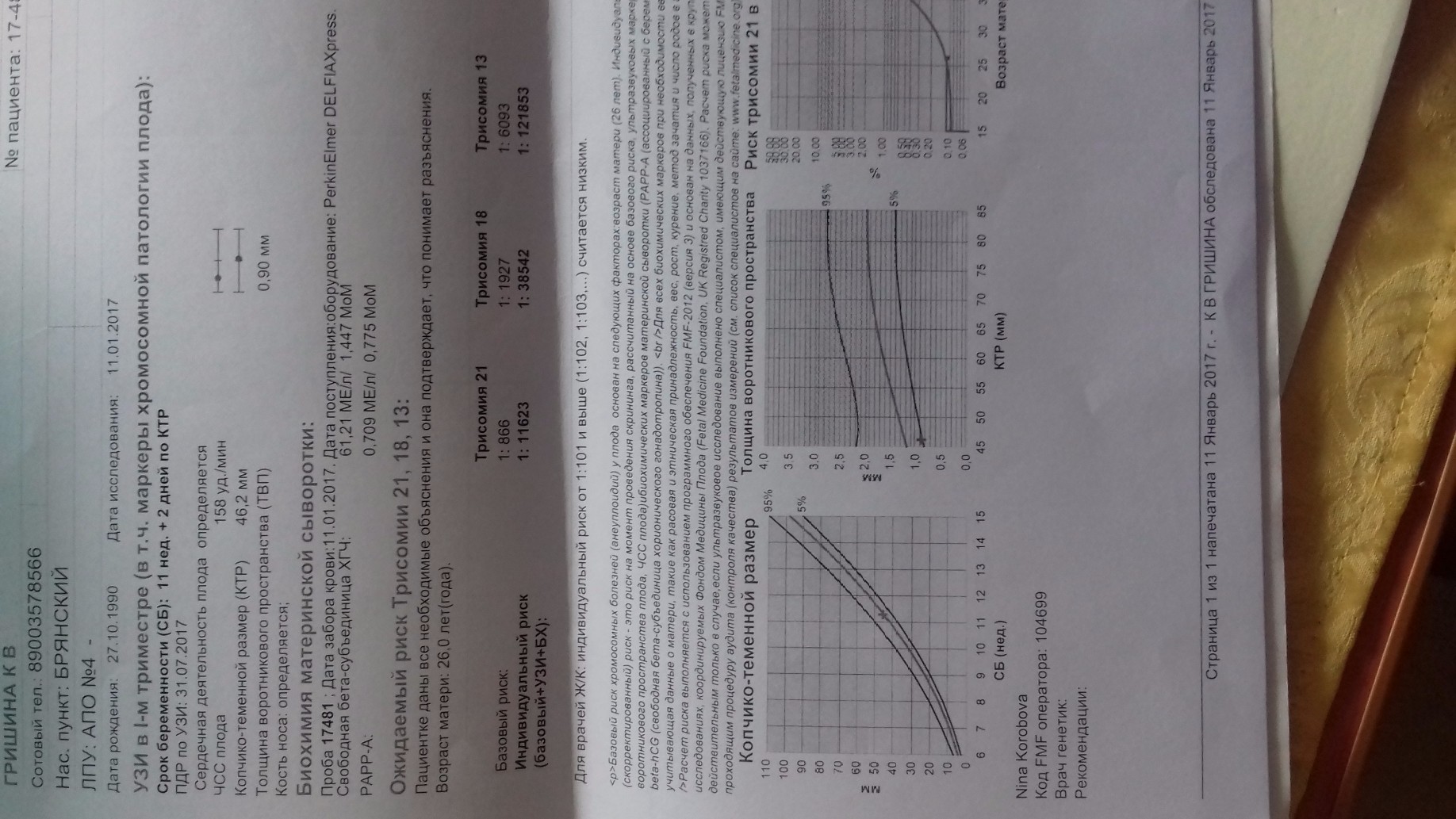
CAS PubMed Google Scholar
Reinisch A, Bartmann C, Rohde E, Schallmoser K, Bjelic-Radisic V, Lanzer G, Linkesch W., Strunk D. Гуманизированная система для размножения мультипотентных мезенхимальных стромальных клеток, полученных из пуповинной крови, для клинического применения. Regen Med. 2007; 2: 371–82.
PubMed Google Scholar
Фекете Н., Гаделорге М., Фюрст Д., Маурер К., Даузенд Дж., Флери-Каппельессо С., Майлендер В., Лотфи Р., Игнатиус А., Сенсебе Л. и др.Лизат тромбоцитов из объединенных концентратов тромбоцитов, полученных из цельной крови, и концентратов тромбоцитов, полученных из афереза, для выделения и размножения мезенхимальных стромальных клеток костного мозга человека: процесс производства, содержание и идентификация активных компонентов. Цитотерапия. 2012; 14: 540–54.
CAS PubMed PubMed Central Google Scholar
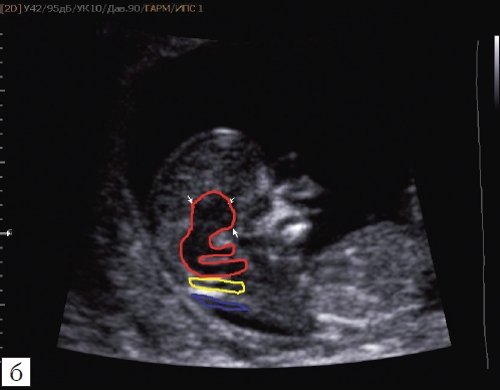
Astori G, Amati E, Bambi F, Bernardi M, Chieregato K, Schäfer R, Sella S, Rodeghiero F.Лизат тромбоцитов как заменитель животной сыворотки для увеличения ex vivo мезенхимальных стволовых / стромальных клеток: настоящее и будущее. Stem Cell Res Ther. 2016; 7: 93.
PubMed PubMed Central Google Scholar
Shichinohe H, Kuroda S, Sugiyama T., Ito M, Kawabori M, Nishio M, Takeda Y, Koike T., Houkin K. Биологические особенности стромальных клеток костного мозга человека (hBMSC), культивируемых без белков животных Средняя безопасность и эффективность клинического использования нейротрансплантации.Перевод Stroke Res. 2011; 2: 307–15.
CAS PubMed Google Scholar
Рен Дж., Уорд Д., Чен С., Тран К., Джин П., Сабатино М., Роби П. Г., Стрончек Д. Ф. Сравнение стромальных клеток костного мозга человека, культивируемых в факторах роста тромбоцитов человека, и фетальной бычьей сыворотке. J Transl Med. 2018; 16:65.
J Transl Med. 2018; 16:65.
CAS PubMed PubMed Central Google Scholar
Shih DT, Chen JC, Chen WY, Kuo YP, Su CY, Burnouf T.Экспансия мезенхимальных стромальных предшественников жировой ткани в бессывороточной среде с добавлением инактивированного вирусами аллогенного лизата тромбоцитов человека. Переливание. 2011; 51: 770–8.
PubMed Google Scholar
Castiglia S, Mareschi K, Labanca L, Lucania G, Leone M, Sanavio F, Castello L, Rustichelli D, Signorino E, Gunetti M, et al. Инактивированный лизат тромбоцитов человека с псораленом: новая перспектива производства мезенхимальных стромальных клеток в условиях надлежащей производственной практики.Цитотерапия. 2014. 16: 750–63.
CAS PubMed PubMed Central Google Scholar
Иудикон П, Фиораванти Д., Бонанно Дж., Мицели М. , Лаворино С., Тотта П., Фрати Л., Нути М., Пирелли Л. Не содержащий патогенов лизат тромбоцитов с низким содержанием плазмы и распространение мезенхимальных стволовых клеток человека. J Transl Med. 2014; 12:28.
, Лаворино С., Тотта П., Фрати Л., Нути М., Пирелли Л. Не содержащий патогенов лизат тромбоцитов с низким содержанием плазмы и распространение мезенхимальных стволовых клеток человека. J Transl Med. 2014; 12:28.
PubMed PubMed Central Google Scholar
Бибак К., Фернандес-Муньос Б., Пати С., Шефер Р. Пробелы в знаниях о лизате тромбоцитов человека как дополнении клеточной культуры для клеточной терапии: совместная публикация AABB и Международного общества клеточной терапии. Цитотерапия. 2019; 21 (9): 987.
Google Scholar
Усиленная экспансия ex vivo взрослых мезенхимальных стволовых клеток с помощью мезенхимальных стволовых клеток плода ECM
https://doi.org/10.1016/j.biomaterials.2014.01.081Получить права и контентAbstract
Крупномасштабное распространение высокофункциональных Мезенхимальные стволовые клетки взрослого человека (aMSC) остаются технологически сложной задачей, поскольку aMSC теряют способность к самообновлению и мультипотентность во время традиционного длительного культивирования, а их качество / количество снижается с возрастом донора и заболеванием.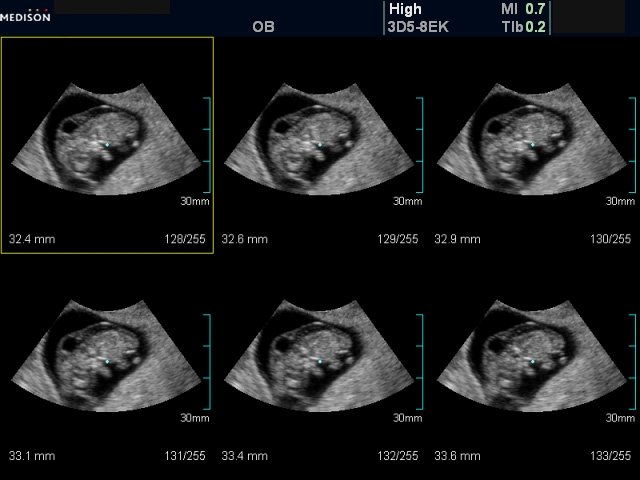 Выявление условий культивирования, обеспечивающих длительное расширение и омоложение, окажет огромное влияние на регенеративную медицину. Было показано, что происходящий из aMSC децеллюляризованный внеклеточный матрикс (ЕСМ) обеспечивает такое микроокружение, которое способствует самообновлению и «стволовости» МСК. Поскольку предыдущие исследования продемонстрировали превосходную пролиферацию и остеогенный потенциал МСК плода человека (fMSC), мы предполагаем, что их ECM может способствовать распространению клинически значимых aMSC. Мы продемонстрировали, что aMSC были более пролиферативными (∼1.6 ×) на ECM, полученном из fMSC, чем на ECM, полученных из aMSC, и традиционных изделиях для культивирования тканей (TCPS). Эти aMSC были меньше и более однородны по размеру (медиана ± межквартильный диапазон: 15,5 ± 4,1 мкм против 17,2 ± 5,0 мкм и 15,5 ± 4,1 мкм для aMSC ECM и TCPS соответственно), демонстрировали необходимые сигнатуры биомаркеров и окрашивались положительно на остеогенные, адипогенные и хондрогенные выражения; признаки того, что они сохраняли мультипотентность во время культивирования.
Выявление условий культивирования, обеспечивающих длительное расширение и омоложение, окажет огромное влияние на регенеративную медицину. Было показано, что происходящий из aMSC децеллюляризованный внеклеточный матрикс (ЕСМ) обеспечивает такое микроокружение, которое способствует самообновлению и «стволовости» МСК. Поскольку предыдущие исследования продемонстрировали превосходную пролиферацию и остеогенный потенциал МСК плода человека (fMSC), мы предполагаем, что их ECM может способствовать распространению клинически значимых aMSC. Мы продемонстрировали, что aMSC были более пролиферативными (∼1.6 ×) на ECM, полученном из fMSC, чем на ECM, полученных из aMSC, и традиционных изделиях для культивирования тканей (TCPS). Эти aMSC были меньше и более однородны по размеру (медиана ± межквартильный диапазон: 15,5 ± 4,1 мкм против 17,2 ± 5,0 мкм и 15,5 ± 4,1 мкм для aMSC ECM и TCPS соответственно), демонстрировали необходимые сигнатуры биомаркеров и окрашивались положительно на остеогенные, адипогенные и хондрогенные выражения; признаки того, что они сохраняли мультипотентность во время культивирования. Кроме того, fMSC ECM улучшил пролиферацию (∼2.2 ×), размер (19,6 ± 11,9 мкм против 30,2 ± 14,5 мкм) и потенциал дифференцировки в aMSC с поздним пассированием по сравнению с TCPS. В заключение, мы установили fMSC ECM как многообещающую платформу для культивирования клеток для ex vivo экспансии aMSC.
Кроме того, fMSC ECM улучшил пролиферацию (∼2.2 ×), размер (19,6 ± 11,9 мкм против 30,2 ± 14,5 мкм) и потенциал дифференцировки в aMSC с поздним пассированием по сравнению с TCPS. В заключение, мы установили fMSC ECM как многообещающую платформу для культивирования клеток для ex vivo экспансии aMSC.
Ключевые слова
Костный мозг
Биоактивность
Биомиметический материал
Клеточная пролиферация
ЕСМ (внеклеточный матрикс)
Мезенхимальные стволовые клетки
Рекомендуемые статьи Цитирующие статьи (0)
Авторские права © Авторские права © Авторские праваОпубликовано Elsevier Ltd.Рекомендуемые статьи
Цитирование статей
ATF4, новый игрок в расширении фетальных HSC | Кровь
В этом выпуске Blood Чжао и др. Определили базовую область — фактор транскрипции лейциновой молнии, активирующий фактор транскрипции 4 (ATF4), в качестве ключевой молекулы для внутренней и внешней регуляции обширного распространения гематопоэтической функции печени плода (FL). стволовые клетки (HSC) (см. рисунок). 1
стволовые клетки (HSC) (см. рисунок). 1
HSC совершают увлекательное путешествие во время эмбрионального развития от первого появления до конечного пункта назначения. Первые дефинитивные HSCs возникают из гемогенных эндотелиальных клеток в области AGM и в плаценте на ст. E10.5 развития мышей. 2,3 Они мигрируют в FL, а также в селезенку на E11.5 и начинают массово обновляться, тем самым увеличивая свою численность в> 100 раз в течение 4–5 дней.Эта волна экспансии HSC обеспечивает пожизненный пул стволовых клеток для взрослой жизни. С E15.5 и вскоре после рождения HSC оседают в костном мозге, где они в основном пребывают в состоянии покоя во время гемопоэза взрослых. У мышей наблюдается заметный сдвиг в их молекулярной программе и функциональном поведении через 3-4 недели после рождения. FL HSC быстро делятся (1 деление каждые 12-14 часов), в то время как взрослые HSC находятся в глубоком спящем состоянии и редко делятся (1 деление каждые 145 дней). 4
4
Молекулярное профилирование FL долгоживущих репопулирующих HSCs (LT-HSCs) во время этой фазы массивной экспансии может дать ключ к разгадке того, как мы можем манипулировать взрослыми HSCs, чтобы перезапустить их самообновляющуюся экспансию для регенеративной медицины.У взрослых HSC, как только они «пробуждаются» от состояния покоя и входят в клеточный цикл, они должны быстро вернуться в свое состояние покоя, чтобы предотвратить истощение и долговременную недостаточность органов. Более того, расширенный репликативный стресс в HSC взрослых несет опасность повреждения ДНК, которое может произойти, когда эти клетки принудительно вступают в клеточный цикл. 5 Что делает HSC плода настолько особенными, чтобы способствовать обширным самообновляющимся делениям, не страдая от истощения, индукции дифференцировки или геномной нестабильности? Это важные вопросы, ответ на которые может показать нам, как обеспечить расширение HSC для медицинских нужд.
Исследование Zhao et al. Представляет важного нового игрока во внутренней и внешней регуляции самообновления и экспансии FL HSC. ATF4 представляет собой фактор транскрипции основной области лейциновой молнии, принадлежащий к семейству ATF, которое состоит из 7 членов у мышей и людей. Более 10 лет назад сообщалось, что фенотип гомозиготного нокаута ATF4 у мышей приводит к перинатальной летальности с тяжелой анемией и низким гематокритом. 6 Авторы здесь пересмотрели последствия делеции ATF4 на биологию HSCs в очень деталях, исследуя внутренне и внешне контролируемые решения клеточной судьбы в отсутствие ATF4 (see figure). Они продемонстрировали, что FL мышей ATF4 — / — между E12.5 и E15.5 имеют сильно сниженное количество функциональных и фенотипических LT-HSC. Важно, что не было явной проблемы в появлении определенных HSCs в области AGM на E11.5 в отсутствие ATF4, и почти такое же количество LT-HSCs осело на FL на E11.5. Эти результаты предполагают, что FL HSC у мышей ATF4 — / — обладают пониженной способностью к самообновлению и расширению.
Zhao et al. Затем продолжили функциональную количественную оценку количества LT-HSC, репопулирующих клетки крови на разных стадиях развития. Трансплантация целых эквивалентов FL и ограниченных разведений фетальных клеток (анализ конкурентных единиц репопуляции) подтвердила сильно сниженное количество функциональных LT-HSCs в FL.Только серийная трансплантация равного количества проспективно изолированных LT-HSC из эмбрионов ATF4 — / — и ATF4 + / + E14.5 реципиентам WT позволила авторам выявить внутренний дефект способности к самообновлению в ATF4. — / — HSC. Когда кто-то обсуждает термин «самообновление стволовых клеток», в HSCs д. Принимать решения о судьбе многих различных клеток: выживание и деление д. Облегчаться в отсутствие дифференцировки. Zhao et al. Исключили повышенную гибель клеток или изменения в развитии клеточного цикла в HSC, лишенных ATF4, в качестве альтернативного объяснения их уменьшенного количества.
Помимо внутреннего дефекта самообновления, вызванного отсутствием ATF4 в HSCs, авт. Также выяснили важный вклад среды FL клеток в этот фенотип. Они элегантно показали, что ATF4 регулирует экспрессию и секрецию ангиопоэтин-подобного 3 (Angptl3) в эндотелиальных и стромальных клетках, который играет ключевую роль в поддержании стволовости в LT-HSCs. 7,8 LT-HSC от мышей-доноров WT быстро теряли свою способность к восстановлению в сокультурах с клетками стромы из ATF4 — / — FL, которые затем можно было восстановить путем добавления экзогенного Angptl3.
Zhao et al. Представляют здесь новую молекулу ATF4, которая необходима для достаточной экспансии LT-HSC во время развития. Однако его интеграция в комплексную регуляцию с другими известными факторами гемопоэза FL требует будущих исследований. Более того, разделение бивалентного вклада внешних и внутренних функций, управляемых ATF4 во время этой важной фазы для установления пожизненного гематопоэза, требует исследования временного условного нокаута ATF4 в различных гематопоэтических и негематопоэтических клонах.Условная система также позволит оценить участие ATF4 в устойчивом состоянии и стрессовом гематопоэзе у взрослых.
В последнее время было идентифицировано много отдельных молекул, которые являются ключевыми для самообновления FL HSC, 9,10 некоторые из них также важны для взрослых HSC. Однако сейчас стоит задача понять их точное взаимодействие и найти молекулярные паттерны и узлы, которые можно использовать для регенеративных подходов.Тем не менее, нам необходимо знать многие, если не все компоненты молекулярной сети, которая управляет самообновлением HSC, не только на уровне транскрипции, но и функционально подтверждено, как успешно проведено в этом исследовании, чтобы иметь возможность формировать систему в соответствии с нашими потребностями. .
Раскрытие информации о конфликте интересов: автор заявляет об отсутствии конкурирующих финансовых интересов.
смертей от плода, 2014-2019 расширенный Запрос
Примечание: Любое использование этих данных подразумевает согласие соблюдать условия ограничений на использование данных.
Смерть плода относится к спонтанной внутриутробной смерти плода на любом сроке беременности. Смерть плода на более поздних сроках беременности (например, на 20 неделе беременности или более, или на 28 неделе или более) также иногда называют мертворождением. В Соединенных Штатах, Законы штата требуют сообщать о внутриутробных смертях, и Федеральный закон предписывает сбор и публикацию данных о гибели плода на национальном уровне. В большинстве штатов сообщается о гибели плода на сроке 20 недель беременности и более и / или при доставке 350 граммов.Однако несколько штатов сообщают о гибели плода на всех сроках беременности.
Данные о гибели плода ежегодно публикуются Национальным центром статистики здравоохранения. в отчетах и в виде файлов данных с индивидуальными записями.
Этот сбор данных позволяет определить количество смертей плода на сроке беременности 20 и более недель. происходящие на территории США для жителей США в 2014-2019 гг. Информация взята из форм отчета о гибели плода, как Редакция 1989 г.S. Стандартный отчет о гибели плода (неотредактированный) и Редакция 2003 г. Стандартного отчета США о гибели плода (пересмотренная). Данные доступны по месту жительства: регион, район, штат проживания матери; время: год, месяц и день недели смерти; характеристики родителей, включая расу и этническую принадлежность матери, возраст матери, прибавку в весе матери и возраст отца; характеристики плода, включая гестационный возраст, пол, вес при рождении, множественность, живую и общую дату рождения, место доставки, способ доставки, использование щипцов или вакуума, тазовое предлежание, фельдшер; факторы риска для матери, включая диабет, хроническую гипертензию, гипертензию, связанную с беременностью, и эклампию; врожденные аномалии плода, включая анэнцефалию, Spina Bifida / менингоцеле, омфалоцеле / гастрошизис, расщелина губы / неба и синдром Дауна.
Ограничения на использование данных:
Закон о государственной службе здравоохранения (42 U.S.C. 242m (d)) предусматривает, что данные, собранные Национальный центр статистики здравоохранения (NCHS) может использоваться только в тех целях, для которых они были получены; любые попытки установить личность любых зарегистрированных случаев или использовать информацию для любых целей, кроме чем для статистической отчетности и анализа здравоохранения, является нарушением закона.Поэтому пользователи будут:
- Используйте эти данные только для статистической отчетности и анализа здравоохранения.
- Что касается региональной географии, не представляйте и не публикуйте данные о количестве умерших 9 или менее (в цифрах, графиках, картах, таблицах и т. Д.).
- Не пытайтесь узнать личность какого-либо лица или учреждения, включенного в эти данные.
- Не раскрывать или иным образом использовать личность любого человека или учреждения, обнаруженных случайно. и сообщать сотруднику NCHS по конфиденциальности о любом таком открытии.
Сотрудник по конфиденциальности
Национальный центр статистики здравоохранения
3311 Toledo Road
Хяттсвилл, Мэриленд 20782
Телефон 888-642-4159
Электронная почта: [email protected]
Санкции за нарушение правил:
Исследователи, нарушившие условия ограничений на использование данных, потеряют доступ к WONDER. и их спонсоры и учреждения будут уведомлены.Исследователи, которых подозревают в Нарушение правил может быть запрещено использовать WONDER, пока расследование не будет завершено. Умышленное предоставление ложных сведений по любому вопросу, входящему в юрисдикцию какого-либо отдела или Агентство федерального правительства нарушает 18 USC 1001 и наказывается штрафом в размере до 10 000 долларов.




 Тесный контакт «беременная — врач- акушерка — беременная» за период наблюдения повышает самоорганизацию женщины, повышает её ответственность за исход беременности.
Тесный контакт «беременная — врач- акушерка — беременная» за период наблюдения повышает самоорганизацию женщины, повышает её ответственность за исход беременности.