PH метры для мочи на ecounit.ru
Каждый желает иметь крепкое здоровье и всегда себя хорошо чувствовать. Впрочем, времени на посещение врачей и прохождения необходимых тестов и анализов обычно не хватает, да и стоят они недешево. Для тех, кто ищет возможность эффективно и экономно контролировать свое здоровье, отличным решением являются РНph-метры для мочи.
Что нужно знать о кислотности мочи
- Для установления уровня кислотности мочи используются ph-метры. Они позволяют установить вероятность образования камней: в щелочной среде – фосфатных, в кислой – уратных, в нейтрально-кислой – оксалатных.
- Оптимально проверять уровень ph через два часа после приема пищи либо за час до него. Контроль должен проводиться несколько раз в день дважды в неделю.
- Физические нагрузки влияют на ph мочи.
- Повышенная кислотность желудочного сока характеризуется увеличением ph мочи, но на этот параметр не влияет пониженная кислотность.
- РН метры мочи позволяют точно и оперативно отслеживать реакцию организма на прием лекарственных препаратов, изменение питания и т.

- Динамика изменений ph может служить подтверждением правильности выбранного лечения.
Изменение РН мочи может свидетельствовать о заболеваниях и о состоянии организма в целом, поэтому диагностика с использованием ph метра является важной процедурой.
Работа с большинством портативных моделей ph метров для мочи строится следующим образом:
- Снимается защитный колпачок с корпуса;
- Включается прибор;
- Электрод погружается до рифленой метки в исследуемую среду;
- В течение пяти-шести секунд моча перемешивается;
- После стабилизации выполняется считывание показаний;
- Если изначально использовался сухой электрод, нужно подождать немного дольше для термокомпенсации;
- После выполнения измерений электрод промывается дистиллированной водой;
- Прибор выключается;
- Надевается защитный колпачок.
Реакция мочи (pH мочи)
Органические кислоты и кислые соли неорганических кислот, содержащиеся в моче, диссоциируют в водной среде, выделяя известное количество свободных ионов водорода (H+). Концентрация (активность) свободных ионов водорода представляет истинную реакцию мочи – активную кислотность (pH).
Концентрация (активность) свободных ионов водорода представляет истинную реакцию мочи – активную кислотность (pH).
Реакцию мочи следует определять сразу после доставки ее в лабораторию, так как при стоянии мочи выделяется углекислота и реакция смещается в щелочную сторону.
Для клинического анализа мочи реакцию можно определять каким-либо из указанных способов (недопустимо, как нередко делают на практике, судить о реакции мочи по осадку).
Методы определения реакции мочи
Ориентировочный способ определения реакции мочи при помощи синей и красной лакмусовой бумаги.
Степень кислотности определить этим методом нельзя. При определении реакции пользуются одновременно двумя видами лакмусовой бумаги, погружая в мочу две полоски. При исследовании возможны следующие результаты:
- синяя бумажка краснеет, красная – не изменяется – реакция кислая;
- красная синеет, синяя не изменяется – реакция щелочная;
- обе бумажки не изменяют цвета – реакция нейтральная;
- обе бумажки меняют цвет – реакция амфотерная.

Более точным является определение реакции мочи с помощью жидких индикаторов.
Способ Магаршака
Ход определения: В пробирку вносят 1 – 2 мл мочи и добавляют по 1 капле индикатора. Встряхивают и определяют реакцию (pH) мочи по таблице:
| Цвет | pH |
|---|---|
| Интенсивно-фиолетовый | 6,2 |
| Фиолетовый | 6,4 |
| Светло-фиолетовый | 6,6 |
| Серо-фиолетовый | 6,8 |
| Темно-серый | 7,0 |
| Серый | 7,2 |
| Серо-зеленый | 7,4 |
| Светло-зеленый | 7,6 |
| Зеленый | 7,8 |
Унифицированный метод определения реакции мочи с индикатором бромтимоловым синим

Ход определения: К 2 – 3 мл мочи добавляют по 1 – 2 капли раствора индикатора. Граница переходных тонов индикатора лежит в пределах pH от 6,0 до 7,6; этот диапазон обеспечивает определение кислой и щелочной реакции. Желтый цвет соответствует кислой реакции, бурый – слабокислой, травянистый – нейтральной, буровато-зеленый – слабощелочной, зеленый и синий – щелочной.
Практическое выполнение этой реакции очень просто и при большом количестве исследований значительно экономит время, однако дает только ориентировочное представление о кислой или щелочной реакции, отличить мочу с нормальной кислотностью от патологически кислой не представляется возможным.
Определение реакции мочи с помощью индикаторных полосок
Этот метод достаточно широко вошел в практику, и выполним в любых условиях. Определение реакции мочи производят, используя монофункциональные или полифункциональные индикаторные полоски. Большинство полосок рассчитано на определение реакции мочи в диапазоне от 5 до 9 и основано на двойном индикаторном методе, суть которого заключается в использовании в качестве реагентов индикаторной зоны для pH двух красителей — бромтимолового синего и метилового красного.
Нормальные значения реакции мочи
Реакция мочи у взрослого человека при смешанной пище слабокислая или нейтральная (pH в пределах 5,0 – 7,0, в среднем – 6,0). В зависимости от характера пищи реакция мочи может колебаться от 4,5 до 8,0 – кислая реакция мочи (pH<5,0) наблюдается при перегрузке мясной пищей, а щелочная (pH>6) – при овощной диете. Наименее кислая реакция мочи наблюдается при употреблении растительной пищи, в период желудочного пищеварения. В ночное время, когда желудочная секреция минимальна, экскреция ионов водорода почками бывает максимальной и реакция мочи снижается до 5,0 и ниже.
У новорожденных реакция мочи кислая (pH 5,4 – 5,9), у недоношенных еще более кислая (pH 4,8 – 5,4), что обусловлено необходимостью компенсировать имеющийся ацидотический сдвиг, возникающий во время родов. Спустя 2 – 4 дня после рождения ребенка величина pH мочи быстро увеличивается и достигает при грудном вскармливании 6,9 – 7,8, а при искусственном 5,4 – 6,9.
Клиническое значение определения реакции мочи
Щелочность мочи увеличивается при рвоте и поносе, особенно при высокой кислотности желудочного сока, ощелачивающей терапии, хронической инфекции мочевыводящих путей, при циститах и пиелитах, гематурии, при рассасывании экссудатов и транссудатов, при употреблении минеральных вод, а также при гипервентиляции легких (например, в случае перегревания). При воспалительных заболеваниях мочевого пузыря реакция мочи щелочная (кроме циститов, вызванных кишечной палочкой или микобактерией туберкулеза).
Кислотность увеличивается при сахарном диабете, туберкулезе почек и мочевого пузыря, почечной недостаточности, при лихорадочных состояниях, голодании, почечно-каменной болезни, гипокалиемии и гипохлоремии, вливании большого количества изотонического раствора натрия хлорида, у детей при экссудативном диатезе.
Изменение реакции мочи соответствует изменениям pH крови – при ацидозах моча имеет кислую реакцию, при алкалозах – щелочную. Однако иногда наблюдается расхождение этих показателей. При хронических поражениях канальцевого аппарата почек в крови отмечается картина гиперхлоремического ацидоза, а реакция мочи щелочная, что связано с нарушением синтеза кислоты и аммиака в связи с поражением канальцев.
При гипокалиемическом алкалозе наблюдается ацидурия. Недостаток калия увеличивает секрецию ионов водорода канальцами. В данной ситуации это физиологический ответ почечных канальцев, направленный на поддержание ионного равновесия между клетками и межтканевой жидкостью. Таким образом, определение реакции мочи может иметь значение при дифференциальной диагностике алкалоза и ацидоза разной этиологии.
Стойкий сдвиг реакции мочи в сторону кислой или щелочной реакции является неблагоприятным патогенетическим фактором. Реакцию мочи следует учитывать при проведении химического, микроскопического и бактериологического исследования мочи и при назначении больному диуретиков и антибактериальных средств.
Литература:
- Справочник по клиническим лабораторным методам исследования под ред. Е. А. Кост. Москва «Медицина» 1975 г.
- Справочник «Лабораторные методы исследования в клинике» под ред. проф. В. В. Меньшикова. Москва, «Медицина», 1987 г.
- Л. В. Козловская, А. Ю. Николаев. Учебное пособие по клиническим лабораторным методам исследования. Москва, Медицина, 1985 г.
- Руководство к практическим занятиям по клинической лабораторной диагностике. Под ред. проф. М. А. Базарновой, проф. В. Т. Морозовой. Киев, «Вища школа», 1988 г.
pH метр мочи — AQUA-LAB
Зачастую рН метры используются не только для определения кислотности воды и пищевой продукции. Они широко применимы и в современной медицинской диагностике – для исследования различных жидкостей человеческого организма и организма животных: слюны, крови, мочи и т. д. Для этих целей производители разрабатывают специализированные измерители, и одним из таких является рН метр мочи.
Ранее для установления кислотно-щелочных показателей мочи использовались бумажные индикаторы, однако, несмотря на простоту и дешевизну метода индикации, специалисты не могли быть полностью уверены в достоверности полученных таким способом результатов. На помощь медикам и ветеринарам пришёл современный рН метр мочи, демонстрирующий качество и высокую точность измерений как в лабораторных, так и в полевых условиях.
Зачем измерять рН мочи?
Кислотно-щелочные показатели мочи как животного, так и человек, меняется в зависимости от состояния организма и может указывать на определённые патологии. Не случайно определение кислотности мочи является неизменным и незаменимым инструментом диагностики широкого спектра заболеваний. Например, излишне кислая моча указывает на повышенную кислотность желудка. Также изменение баланса рН может говорить о дегидратации, ацидозе, инфекциях мочевыводящих путей, туберкулезе почек, хронической почечной недостаточности, лихорадочных состояниях и т. д.
д.
Если рН мочи человека находится в промежутке 6-6,4 утром и 6,4-7 вечером, это значит, что организм находится в норме. Более оптимальным является лёгкий сдвиг в кислую сторону, примерно 6,4-6,5 единиц рН. Остальные значения уже указывают на определённые отклонения. Что влияет на кислотность мочи?
Помимо диагностики болезненных состояний, рН метр для мочи может также определить изменение кислотности, вызванную другими факторами – например, применением лекарственных средств и препаратов, изменением привычного питания ввиду диеты и т. п., тяжёлой физической работы и др.
Модели рН метров мочи, как правило, бывают портативными и снабжены встроенным измерительным щупом, который для проведения анализа следует погружать в исследуемый образец. Результаты можно увидеть на электронном табло прибора спустя 20-30 секунд после того, как анализируемая жидкость успокоится после её перемешивания рН метром.
ph в моче — 25 рекомендаций на Babyblog.ru
🔝Если Вы реально заботитесь о качестве своей жизни, то скорее всего задумываетесь о том, какую воду Вы пьете!
Все знают, что организм состоит на 75% из воды и без нее невозможна жизнь… Если человек на 3 дня останется без воды — он умрет…
⠀
❓Почему мы так заботимся о количестве выпитой воды, но не заботимся о ее качестве?
⠀
🚸Небольшой экскурс в предысторию о воде и тех жидкостях, которые прямо сейчас помогают нам читать этот текст.
⠀
У нас в организме всего 3 типа жидкости имеют кислотный уровень PH: это слезы, желудочный сок и моча. Все остальные жидкости имеют слабощелочной показатель…
⠀
💧Вода из под крана, бутилированная вода, которую мы покупаем имеет нейтральный уровень PH. Что это может значить для нас?
⠀
То что вода не пригодна для нашего организма и для того, чтобы подпустить эту воду к клеткам и сделать биодоступной, чтобы клетки могли использовать эту воду для химических и обменных процессов организму необходимо ее сначала привести к слабощелочному уровню PH. Как это делает наш организм, Вы думаете? С помощью собственных ресурсов.
😲Например кальций из костей… Почему после того, как вы выпиваете 1 или 2 стакана воды, то скорее всего в течение 30 минут побежите в туалет?
⠀
Потому что вода проходит практически порожником и не усваивается в клетках. Организм взял сколько смог, переработал столько сколько было сил и остальное отдал обратно в рамках экономии энергии и собственных ресурсов…
⠀
💁🏻♀️Биодоступная вода усваивается организмом полностью и работает как увлажняющий крем изнутри. Без необходимого количества жидкости в клетках вы
Без необходимого количества жидкости в клетках вы
⠀
🙅🏻♀️не сбросите лишний вес
🙅🏻♀️не нормализуете работу ЖКТ
🙅🏻♀️не усвоите витамины в полном объеме
⠀
💎Устройство PH Balance которое вы видите на фото выше — это уникальная разработка Российских ученых из Новосибирска, в состав которого входит фильр из 5 природных камней.
⠀
💎Циалит (использовался при ликвидации последствий Чернобльской АЭС(очищает воду от радиации, тяжелых металлов, нормализует уровень PH, насыщает воду микроэлементами)
💎Шунгит- структурирует поверхностное натяжение воды, чтобы она могла добраться до самых тоненьких капелярчиков вашего тела и насыщает ее отрицательным зарядом, чтобы ваши клетки не тратили свой заряд прежде чем усвоить молекулу воды
💎Кремень влияет на энергообмен
💎Магний — который необходим нам каждый день, чтобы быть бодрыми и спокойными каждый день
💎Серебро — очищает воду от вредоносных бактерий и паразитов.
⠀
🧘🏻Данное устройство — это ваш стимул соблюдать ежедневный водный баланс и залог того, что вы проживете еще долгую и здоровую жизнь!
⠀
🥇Стоимость данного устройства в разы ниже, чем аналоги.
🏆Сама бутылка сделала из тритана — этот материал широко используется в медицинской промышленности и изготовлении детских бутылочек, является абсолютно безвредным и не выделят никаких токсинов даже при нагревании.
⠀
Данное устройство для ощелачивания воды — это залог вашего здоровья и здоровья ваших близких! 👨👩👧👦
🧬 Как понять результаты анализа мочи?
Рассказываем, что можно выяснить о своем здоровье, получив на руки бланк с результатами исследования.
Расшифровывать общий анализ мочи лучше вместе с врачом. Дело в том, что показатели этого анализа при разных заболеваниях могут быть довольно похожи. Чтобы поставить точный диагноз, нужно учитывать жалобы пациента и обращать внимание на внешние признаки конкретной болезни. Без доктора эта задача невыполнима.
«Оценивать разные показатели мочи нужно в комплексе. Редко бывает, чтобы изменен был только один показатель, обычно меняется сразу несколько, — уролог 1-го Даниловского многопрофильного медицинского центра Риназ Камалетдинов.
— А чтобы разобраться, что конкретно происходит с пациентом, необходимо учесть жалобы пациента, его симптомы и применить дополнительные методы диагностики. Ведь мы лечим не анализ, а пациента».
Кроме того, бывают ситуации, когда результаты анализов отклоняются от нормы не из за болезни, а из за физических нагрузок, изменений в меню или приема некоторых лекарств. Например, после нескольких часов в тренажерном зале может увеличиться количество лейкоцитов в крови, съеденная накануне свекла способна окрасить мочу в розовый, а противовоспалительный препарат индометацин — в сине-зеленый цвет. Поэтому, получив «нестандартный» анализ мочи, нужно обсудить его результаты с лечащим врачом: чтобы убедиться, что проблема существует, врач назначит повторный анализ мочи, или направит на какой-нибудь другой тест.
Тем не менее, кое-что можно понять и самостоятельно. Главное, не делать из этого далеко идущих выводов и не бежать в аптеку, не побеседовав перед этим со специалистом. В бланках из разных лабораторий результаты анализа мочи могут быть представлены немного по разному, однако практически везде они будут сгруппированы по внешнему виду мочи, ее химическим свойствам и результатам исследования под микроскопом.
В бланках из разных лабораторий результаты анализа мочи могут быть представлены немного по разному, однако практически везде они будут сгруппированы по внешнему виду мочи, ее химическим свойствам и результатам исследования под микроскопом.
Внешний вид
Цвет. В норме цвет мочи — желтый: от соломенно-желтого до темно-янтарного. Оттенок зависит от концентрации урохрома — красящего пигмента в составе мочи. В концентрированной моче, которая копилась в мочевом пузыре всю ночь, урохрома больше, так что моча будет скорее янтарной. А если человек недавно выпил воды, то цвет будет скорее соломенным.
При этом моча может быть окрашена чуть ли не во все цвета радуги. Причем необычный оттенок может как быть вариантом нормы, так и говорить о болезни. Причем инфекции мочевыводящих путей могут давать разные оттенки мочи — цвет зависит от конкретного вида болезнетворных микроорганизмов.
«Порой у пациента моча окрашивается в красный цвет, — рассказывает кандидат медицинских наук, диетолог и нефролог GMS Cliniс Светлана Артемова.
Без анализа невозможно понять, по какой причине это происходит. Это может быть связано, например, с употреблением в пищу свеклы, с лечением сульфаниламидами, или с рабдомиолизом — состоянием, при котором происходит разрушение мышечной ткани».
Причины, по которым моча может изменить цвет
| Цвет | Естественные причины | Заболевания |
|---|---|---|
| Красный | Питание: мочу окрашивает свекла, ежевика, ревень Лекарства: например, хлорпромазин или пропофол |
Инфекция мочевыводящих путей Рабдомиолиз (состояние, при котором разрушается мышечная ткань) Травма мочевыводящих путей (например. связанная с выходом камней из почек) Порфирия (наследственное нарушение пигментного обмена) |
| Оранжевый | Питание: мочу окрашивает морковь, добавки с витамином С Лекарства: например, рифампицин или феназопиридин |
— |
| Зеленый | Питание: мочу окрашивает спаржа и добавки с витаминами группы В Лекарства: например, пропофол или амитриптилин |
Инфекция мочевыводящих путей |
| Синий | Лекарства: например, индометацин или амитриптилин | Синдром синих подгузников у младенцев (болезнь, связанная с нарушением всасывания аминокислоты триптофана) |
| Фиолетовый | — | Синдром пурпурного мочевого мешка (инфекция мочевыводящих путей и пациентов с мочевым катетером) |
| Черный | Питание: мочу окрашивают некоторые виды бобов Лекарства: например, леводопа или метронидазол |
Синдром Жильбера (наследственная болезнь печени) Болезни желчевыводящих путей |
| Белый | Лекарства: например, пропофол | Хилурия (болезнь, при которой расширяются лимфатические сосуды почек, и в моче появляется лимфа — жидкая часть крови) Воспалительные заболевания мочевыводящих путей, при которых в моче появляется гной (то есть большое количество лейкоцитов) Мочекаменная болезнь, при которой в моче появляются кристаллы фосфата |
Прозрачность. В норме моча должна быть прозрачной. Причину помутнения определяют в ходе химического и микроскопического анализов. Как правило, это не норма: дело может быть, например, в бактериях, солях, слизи или в большом количестве лейкоцитов.
В норме моча должна быть прозрачной. Причину помутнения определяют в ходе химического и микроскопического анализов. Как правило, это не норма: дело может быть, например, в бактериях, солях, слизи или в большом количестве лейкоцитов.
Удельный вес. Этот показатель отражает концентрацию веществ, растворенных в моче. У здоровых людей в течение дня он колеблется 1,008−1,025 г/л. Если удельный вес снижается, это может говорить и о том, что человек просто выпил много воды, и о проблемах с концентрирующей способностью почек — такое может случиться, например, при диабете I типа или тяжелом воспалении почек. Если в моче появляется глюкоза, ее удельный вес тоже снижается. А если в моче появляется белок (такое случается при воспалении в мочевыделительной системе) или кетокислоты (такое бывает при диабете I типа), удельный вес, наоборот, увеличивается. Чтобы разобраться, нужно учесть результаты химического анализа мочи.
«Низкий удельный вес мочи говорит о том, что у пациента страдает концентрационная функция почек.
Возможно, речь идет о хронической почечной недостаточности, — говорит Камалетдинов. — Но в то же время этот показатель нередко снижается у пациентов, достигших солидного возраста».
рН. В норме моча у большинства людей слабо кислая: рН в пределах 5,5–7,0. На рН может повлиять диета. Если человек ест много кислых ягод и белковых продуктов, рН мочи снижается, то есть она станет кислой. А если предпочитает цитрусовые и низкоуглеводную диету, то рН, наоборот, увеличится, и моча станет щелочной.
рН сам по себе — не очень информативный показатель. Как правило, на него обращают внимание при подозрении на камни в почках: если моча кислая, есть шанс, что дело, например, в мочевой кислоте, а если щелочная — в оксалате или фосфате кальция. Это важно для постановки диагноза:от камней разного происхождения человека тоже нужно избавлять по разному.
Химические свойства
Белок. В норме его в моче быть не должно, или там очень мало — меньше 0,002 г/л. Иногда у здоровых людей он все-таки появляется — например, если они поели мяса, или испытали накануне серьезную физическую нагрузку или эмоциональный стресс — но если человек перестает есть мясо, отдыхает и успокаивается, выделение белка прекращается. Если он продолжает выделяться вместе с мочой (это устанавливают, повторяя анализ снова и снова), дело может быть в воспалении почек или мочевыводящих путей.
Иногда у здоровых людей он все-таки появляется — например, если они поели мяса, или испытали накануне серьезную физическую нагрузку или эмоциональный стресс — но если человек перестает есть мясо, отдыхает и успокаивается, выделение белка прекращается. Если он продолжает выделяться вместе с мочой (это устанавливают, повторяя анализ снова и снова), дело может быть в воспалении почек или мочевыводящих путей.
Глюкоза. У здоровых небеременных людей глюкозы в моче быть не должно. Как мы уже писали, «сахар» попадает в мочу при нарушениях обмена глюкозы — например, при диабете II типа.
Кетоновые тела. Эти вещества накапливаются в организме, если телу не хватает углеводов, и для получения энергии оно вынуждено разрушать запасы жира. Поскольку питаться ими для нас не нормально, кетоновых тел в моче здоровых небеременных людей быть не должно. Как правило, кетоновые тела появляются в моче у голодающих людей или из за тяжелых физических нагрузок, но чаще всего — на фоне неконтролируемого диабета 1 типа.
Билирубин. У здоровых небеременных людей билирубина в моче быть не должно. Как мы уже писали, билирубин попадает в мочу, если печень не справляется с его утилизацией. Такое бывает при гепатитах и при нарушении оттока желчи — это может случиться, если желчевыводящие пути, например, перекроет желчный камень.
Уробилиноген. Это бесцветный продукт «обезвреживания» вредного билирубина печенью и кишечными бактериями. До 10 мг/л уробилиногена выводится вместе с мочой. Если уровень этого вещества высокий, велика вероятность, что у человека проблемы с печенью — от вирусного гепатита до печеночной недостаточности. Но не исключено, что дело в ускоренном распаде гемоглобина — такое бывает, например, при гемолитической анемии и некоторых других заболеваниях.
Нитриты. Вместе с мочой организм избавляется от соединений азота — нитратов, так что они всегда в ней есть у здоровых людей. Но если в мочевыводящих путях поселяются болезнетворные бактерии — например, кишечные палочки, энтеробактерии или клебсиеллы — в моче появляются нитриты. Дело в том, что эти бактерии питаются нитратами и превращают их в нитриты, так что присутствие этих веществ в моче всегда недобрый знак. При этом отсутствие нитритов не означает отсутствие инфекции. Некоторые стафилококки и стрептококки к нитратам равнодушны, так что их приходится выявлять, просматривая мочу под микроскопом.
Дело в том, что эти бактерии питаются нитратами и превращают их в нитриты, так что присутствие этих веществ в моче всегда недобрый знак. При этом отсутствие нитритов не означает отсутствие инфекции. Некоторые стафилококки и стрептококки к нитратам равнодушны, так что их приходится выявлять, просматривая мочу под микроскопом.
Результаты микроскопического исследования
Плоский эпителий. Эпителиальными называют клетки, которые выстилают поверхности нашего тела изнутри и снаружи. Плоский эпителий выстилает наружную поверхность уретры. Если в анализе мочи эпителиальных клеток больше 15-20, значит, анализ взяли неправильно.
«Большое количество слущенных клеток эпителия может говорить и о травме, и о продолжающемся воспалительном процессе, и о например, отторжении трансплантата, — говорит Камалетдинов».
Однако, если в женской моче эпителиальные клетки лежат пластами, врач может заподозрить плоскоклеточный рак. Но только заподозрить — чтобы подтвердить диагноз, потребуется проконсультироваться с врачом и сдать несколько других анализов.
Но только заподозрить — чтобы подтвердить диагноз, потребуется проконсультироваться с врачом и сдать несколько других анализов.
Переходный эпителий. Выстилает стенки почечных лоханок, мочевого пузыря, мочеточников и протоков предстательной железы. В норме их быть не должно. Если в общем анализе мочи появляется много этих клеток, врач может заподозрить мочекаменную болезнь, воспаление или новообразования мочевыводящих путей.
Почечный эпителий. Выстилает почки изнутри. В норме его быть не должно, эти клетки появляются только при болезнях почек. Каких именно — сказать может только врач.
Лейкоциты. В норме этих клеток быть не должно. Если под микроскопом видно больше пяти клеток (или больше 2000 в мл мочи), врач вправе заподозрить воспалительный процесс в мочевыводящих путях, который может быть связан с бактериями или, например, с гломерулонефритом. Что именно воспалилось и чс чем это связано, можно будет сказать только после консультации с лечащим врачом.
Эритроциты. В норме этих клеток быть не должно, однако иногда красные кровяные клетки попадают в мочу случайно — так что врач вправе назначить повторное исследование. Если эритроциты из мочи не исчезнут, дело может быть в повреждении почек или мочевого пузыря, которое могут вызвать десятки причин — от ушиба и мочекаменной болезни до хронической почечной недостаточности. Чтобы уточнить анализ, нужно проконсультироваться с врачом.
Цилиндры. Как мы уже говорили, цилиндры — это белковые «отпечатки» почечных канальцев. У здоровых людей они либо вовсе не встречаются, либо встречаются в крайне небольшом количестве. Если цилиндров много — что-то не так с почками — дело может быть в воспалении, отравлении или каких-то иных причинах.
Соли. В норме солей в моче быть не должно, или встречаются единичные кристаллики. Как правило, они появляются, если у человека есть склонность к мочекаменной болезни, или при инфекции почек. Если в моче обнаружились аморфные фосфаты или ураты, кристаллы мочевой кислоты, оксалаты, трипельфосфаты, нужно проконсультироваться с врачом.
Бактерии. В норме моча стерильна — то есть никаких микроорганизмов в ней быть не должно (или не более 2×103 на мл). Если количество бактерий увеличивается до 105 на мл, дело может быть в воспалении мочевыделительных органов.
Дрожжевые грибы. В норме дрожжей в моче быть не должно — они появляются только если в моче есть глюкоза, и при антибактериальной терапии. А еще они иногда заводятся в банке, если мочу хранили слишком долго.
- Разбираться с результатами нужно вместе с врачом. Поставить диагноз по одному только общему анализу мочи нельзя, нужно учитывать и другие данные о здоровье.
- Одни и те же изменения в анализе мочи могут говорить и о варианте нормы, и о серьезном заболевании. Это еще один повод проконсультироваться с врачом.
- Если собрать мочу неправильно, результаты анализа мочи могут быть искаженными. Тогда тест надежнее пересдать.
pH мочи (реакция, кислотность).
 Норма рН.
Норма рН.Одной из важнейших функций почек является поддержание кислотно-основного равновесия в организме. Вещества, которые выводят почки с мочой, имеют те или иные кислотно-основные свойства. Если в моче превалируют вещества, проявляющие кислотные свойства, моча — кислая (pH < 7), если в моче больше веществ, проявляющих основные (щелочные) свойства, моча — щелочная (рН > 7), если же этих веществ поровну – моча имеет нейтральную кислотность (pH = 7).
Норма рН мочи
В норме кислотность мочи находится в пределах 5-7, однако отдельные колебания могут быть в пределах 4,5-8. Если реакция мочи постоянно является кислой (рН < 5) или щелочной (pH > 6), и при этом отсутствуют возможные причины, обосновывающие такие цифры реакции мочи, необходим диагностический поиск. Определение рН мочи входит в клинический анализ мочи.
От чего зависит реакция мочи?
- обмен веществ
- характер питания
- воспалительных заболеваний мочевыводящих путей
- патологические процессы, сопровождающиеся ацидозом (закисление крови), или алкалозом (защелачивание крови).

- кислотность желудка
- функциональная активность канальцев почек
В каких случаях реакция мочи смещается в сторону закисления?
- употребление пищи богатой белками и кислотами
- воспалительные заболевания мочевыделительной системы, вызванные кишечной палочкой (цистит, пиелонефрит) или микобактерией туберкулеза (туберкулез почки).
- повышенное образование кислот в организме:
- кетоацидоз (длительное голодание, сахарный диабет, злоупотребление алкоголем)
- молочнокислый ацидоз (физические нагрузки, шоковые состояния, сепсис)
- повышенное поступление кислот в организм:
- назначение хлорида аммония
- назначение гидрохлорида аргинина
- прием хлорида кальция
- применение некоторых лекарственных средств (аскорбиновая кислота, кортикотропин, метионин)
- потеря бикарбоната (буферная система крови) через желудочно-кишечный тракт:
- диарея
- фистула поджелудочной железы
- уретеросигмоидостомия
- гипокалиемия
- проксимальный почечный тубулярный ацидоз (цистиноз, СКВ, множественная миелома, отравление тяжёлыми металлами, болезнь Уилсона и нефротический синдром)
- первичный и вторичный гиперальдостеронизм
В каких случаях реакция мочи смещается в сторону защелачивания?
- употребление большого количества растительной и молочной пищи
- инфекции мочевыводящих путей (пиелонефрит, цистит), за исключением случаев, когда инфекционный процесс вызван кишечной палочкой или микобактерией туберкулеза.
 Некоторые бактерии способны разлагать азотсодержащие вещества в моче до аммиака, который проявляет щелочные свойства.
Некоторые бактерии способны разлагать азотсодержащие вещества в моче до аммиака, который проявляет щелочные свойства. - рвота (потеря хлора и воды)
- при высокой кислотности желудка
- хроническая почечная недостаточность
- Применение некоторых лекарственных средств (адреналин, никотинамид, бикарбонаты)
- Употребление большого количества щелочной минеральной воды
- дистальный почечный тубулярный ацидоз
- гиперкалиемия
- гипоальдостеронизм
- гиперфункция паращитовидной железы
Таким образом, реакция мочи является достаточно важным показателем, который в совокупности с другими показателями позволяет установить правильный диагноз. Кроме того следует помнить, что смещение рН мочи в ту или иную сторону способствует выпадению в осадок различных солей: при рН ниже 5,5 чаще образуются уратные камни, при pH от 5,5 до 6,0 – оксалатные конкременты, при pH выше 7,0 — фосфатные камни. Это следует учитывать при мочекаменной болезни.
рН-метрия мочи — цены от 50 руб. в Москве, 62 адреса
pH-метрия мочи – лабораторное исследование, направленное на определение количества ионов водорода в урине, оценку ее кислотности. В условиях лабораторий этот тест выполняется как самостоятельно, так и в рамках общего анализа мочи. Показатель pH мочи позволяет оценить общее состояние организма, выявить нарушения кислотно-щелочного баланса при различных заболеваниях и патологических состояниях. Частым показанием для определения кислотности мочи считается мочекаменная болезнь, по уровню pH можно судить о составе конкрементов. Биоматериалом для исследования является средняя порция утренней мочи. Тест проводится методом индикаторов (бромтимолового синего, метилового красного), а также с помощью ионометра. У здорового взрослого человека pH мочи с утра составляет 5-7 единиц. Сроки выполнения анализа не превышают 1 суток.
Кислотность мочи – лабораторный показатель, который отражает активность ионов водорода в данной биологической жидкости, то есть, соотношение в ней водородных и гидроксильных ионов. Если преобладают соединения с кислотными свойствами, показатель pH меньше 7. Когда в моче больше щелочных соединений – pH больше 7. При одинаковом количестве веществ со щелочными и кислотными свойствами моча обладает нейтральной кислотностью, равной 7. Сдвиг показателя pH в ту или иную сторону свидетельствует о нарушениях в обменных процессах, причиной которых могут стать патологии печени, легких, системные заболевания, острые состояния, такие как лихорадка и гипоксия. Часто кислотность мочи изменяется при болезнях почек, инфекциях мочеполовой системы, из-за особенностей питания и питьевого режима.
Если преобладают соединения с кислотными свойствами, показатель pH меньше 7. Когда в моче больше щелочных соединений – pH больше 7. При одинаковом количестве веществ со щелочными и кислотными свойствами моча обладает нейтральной кислотностью, равной 7. Сдвиг показателя pH в ту или иную сторону свидетельствует о нарушениях в обменных процессах, причиной которых могут стать патологии печени, легких, системные заболевания, острые состояния, такие как лихорадка и гипоксия. Часто кислотность мочи изменяется при болезнях почек, инфекциях мочеполовой системы, из-за особенностей питания и питьевого режима.
В медицинской практике pH мочи чаще всего определяется в рамках общего анализа. В зависимости от клинической картины заболевания, возраста, особенностей питания и образа жизни конкретного пациента результаты этого теста предоставляют врачу различную информацию. На основе них специалист определяет особенности течения заболевания, принимает решение о целесообразности назначения дальнейших диагностических процедур, корректирует тактику лечения, разрабатывает рекомендации по составлению рациона, изменению режима физической активности и т. д. Сбор мочи для исследования необходимо производить с утра. Анализу подвергается средняя порция. В лабораториях для определения кислотности мочи используется метод индикаторов либо электронный ионометр (селективные электроды). Результаты находят применение в общетерапевтической практике, нефрологии, урологии.
д. Сбор мочи для исследования необходимо производить с утра. Анализу подвергается средняя порция. В лабораториях для определения кислотности мочи используется метод индикаторов либо электронный ионометр (селективные электроды). Результаты находят применение в общетерапевтической практике, нефрологии, урологии.
Показания
pH-метрия мочи в рамках общего анализа выполняется при профилактических обследованиях – при ежегодном медицинском осмотре на производстве, в учебных заведениях, при поступлении на военную службу, мониторинге состояния беременных и новорожденных и т. д. Результаты теста позволяют на ранней стадии выявить патологии почек и эндокринной системы, метаболические нарушения. Целенаправленно исследование pH мочи осуществляется при мочекаменной болезни. Полученные данные используются для оценки вероятности образования конкрементов и определения их состава: при кислотности мочи менее 5,5 образуются уратные камни, при показателях от 5,5 до 6 – оксалатные, при показателях от 7 до 7,8 – фосфатные.
Определение pH мочи показано при метаболическом ацидозе – нарушении кислотно-основного состояния с понижением концентрации бикарбоната в крови и повышением уровня ионов водорода. Исследование назначается пациентам с заболеваниями почек и мочевого пузыря, с сахарным диабетом, находящимся в шоковом состоянии. Также определение кислотности мочи необходимо при подозрении на метаболический алкалоз – состояние, при котором в организме накапливаются щелочные соединения, в крови преобладают гидроксильные ионы. Изменения такого типа обнаруживаются у пациентов с нарушениями водно-электролитного баланса – после гемодиализа, операций, интоксикаций и т. д. Кроме того, pH-метрия мочи показана при респираторных алкалозах и ацидозах – нарушениях кислотности в результате недостатка или избытка углекислого газа в крови.
Ограничением pH-метрии мочи, как и большинства рутинных тестов, является низкая специфичность. Отклонение результатов от нормы определяется при широком круге заболеваний, результаты указывают лишь на преобладание в моче ионов водорода или гидроксильных групп. Для установления причины нарушения нужно учитывать другие показатели общего анализа мочи, данные клинического исследования. Преимуществом теста на pH мочи является доступность и простота выполнения. Это особенно важно при масштабных профилактических обследованиях и в процессе мониторинга состояния пациентов.
Для установления причины нарушения нужно учитывать другие показатели общего анализа мочи, данные клинического исследования. Преимуществом теста на pH мочи является доступность и простота выполнения. Это особенно важно при масштабных профилактических обследованиях и в процессе мониторинга состояния пациентов.
Подготовка к анализу и забор материала
Для определения pH мочи используется средняя порция биоматериала, собранная с утра. За 2 дня до анализа следует отменить прием диуретиков, за 1 день – исключить из рациона блюда с большим содержанием жира и соли, продукты, изменяющие цвет мочи, а также отказаться от тяжелых физических нагрузок. Мочу нужно собрать сразу после пробуждения в стерильную емкость с крышкой. Первая и последняя порции отправляются в унитаз, средняя используется для анализа. Перед процедурой сбора необходимо провести тщательный туалет наружных половых органов.
В лаборатории pH мочи определяется методом индикаторов.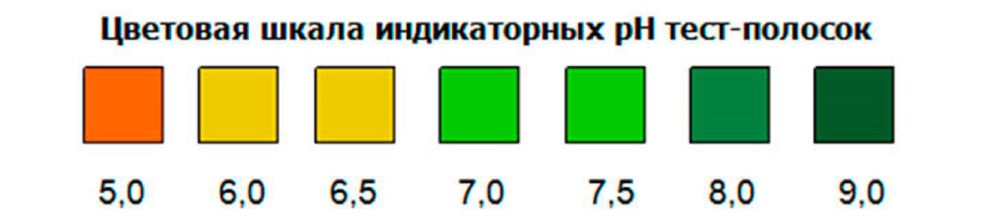 Отдельно подготавливается раствор бромтимолового синего и метилового красного. Затем их сливают вместе и тщательно смешивают. Чтобы установить концентрацию ионов водорода в моче, в нее добавляется индикатор, смесь взбалтывается. По итоговой окраске образца путем ее сравнения со стандартной шкалой определяется уровень pH мочи. Результаты анализа подготавливаются в течение 1 дня.
Отдельно подготавливается раствор бромтимолового синего и метилового красного. Затем их сливают вместе и тщательно смешивают. Чтобы установить концентрацию ионов водорода в моче, в нее добавляется индикатор, смесь взбалтывается. По итоговой окраске образца путем ее сравнения со стандартной шкалой определяется уровень pH мочи. Результаты анализа подготавливаются в течение 1 дня.
Нормальные значения
В норме pH мочи взрослого человека находится в коридоре от 5 до 7 единиц. Отклонения на 0,5-1 часто рассматриваются как физиологические и не требующие лечения. Самые низкие значения определяются ночью и ранним утром, до еды, а самые высокие – вечером, после приема пищи. При этом молочно-овощной рацион повышает щелочность мочи, а рацион с преобладанием мяса, рыбы, хлебобулочных изделий – кислотность. У новорожденных детей, рожденных в срок, норма pH мочи составляет от 5,4 до 5,9 единиц, у недоношенных – от 4,8 до 5,4. Через несколько дней после рождения кислотность мочи у ребенка повышается и до 6-12 месяцев зависит от типа питания: при грудном вскармливании она составляет от 6,9 до 7,8 единиц, при искусственном – от 5,4 до 6,9 единиц.
Повышение уровня pH
Причиной повышения уровня pH мочи может стать алкалоз, развившийся в результате метаболических или респираторных нарушений. Щелочная реакция мочи возникает после рвоты и диареи, введения бикарбоната натрия, при нарушениях водно-электролитного баланса, в том числе наследственных, при гипервентиляции легких. К другим причинам повышения уровня pH мочи относится большинство инфекций мочевого тракта, гематурия, опухоли мочевыделительной системы, рассасывание воспалительных инфильтратов.
Снижение уровня pH
Причиной снижения уровня pH мочи может быть метаболический или респираторный ацидоз. Повышение кислотности внутренней среды организма происходит при недостаточной вентиляции легких, вдыхании воздуха с большим содержанием углекислого газа, накоплении в тканях кислотных соединений (например, при диабете – кетоацидоз). К другим причинам снижения уровня pH мочи относятся острая и хроническая почечная недостаточность, гломерулонефрит, туберкулез почек, мочекаменная болезнь, лихорадка.
Лечение отклонений от нормы
pH-метрия мочи является рутинным методом исследования. ее результаты позволяют выявить состояния алкалоза и ацидоза, нарушения в работе мочевыделительной системы, а при мочекаменной болезни установить риск образования конкрементов и их состав. Если по результатам анализа определяется повышенная или пониженная кислотность мочи, то для выяснения причины и назначения лечения нужно обратиться к врачу – терапевту, нефрологу, урологу. Физиологические отклонения pH мочи от нормы можно скорректировать самостоятельно. Для этого необходимо придерживаться сбалансированного рациона, употреблять достаточное количество жидкости, подбирать физическую нагрузку, соответствующую уровню подготовленности организма.
Влияние pH мочи и уровня мочевой кислоты в моче на развитие контрастной нефропатии — Полный текст — Исследование почек и артериального давления 2020, Vol. 45, № 1
Аннотация
Справочная информация: Гиперурикемия может вызвать острое повреждение почек, активируя воспалительные, прооксидантные и сосудосуживающие пути. Кроме того, рентгеноконтрастное вещество вызывает острую урикозурию, потенциально приводящую к образованию кристаллов.Поэтому мы стремились исследовать влияние кислотности мочи и уровня мочевой кислоты в моче на развитие контраст-индуцированной нефропатии (КИН) у пациентов, подвергающихся плановой коронарографии. Методы: Мы зарегистрировали 175 пациентов, которым была выполнена плановая коронарография. CIN определяли как повышение уровня креатинина в сыворотке крови >25% по сравнению с исходным значением через 48–72 ч после применения контраста. Перед коронарной ангиографией и через 48-72 часа измеряли уровень мочевой кислоты в сыворотке крови, мочевины, креатинина, бикарбоната и отношение мочевой кислоты к креатинину в сыворотке крови (UACR). Результаты: Из 175 включенных субъектов у 29 (16,6%) развилась ЦИН. Те, у кого развился CIN, имели более высокую распространенность диабета, более высокий UACR (0,60 против 0,44, p = 0,014), более высокий объем контраста и более низкий уровень натрия в сыворотке.
Кроме того, рентгеноконтрастное вещество вызывает острую урикозурию, потенциально приводящую к образованию кристаллов.Поэтому мы стремились исследовать влияние кислотности мочи и уровня мочевой кислоты в моче на развитие контраст-индуцированной нефропатии (КИН) у пациентов, подвергающихся плановой коронарографии. Методы: Мы зарегистрировали 175 пациентов, которым была выполнена плановая коронарография. CIN определяли как повышение уровня креатинина в сыворотке крови >25% по сравнению с исходным значением через 48–72 ч после применения контраста. Перед коронарной ангиографией и через 48-72 часа измеряли уровень мочевой кислоты в сыворотке крови, мочевины, креатинина, бикарбоната и отношение мочевой кислоты к креатинину в сыворотке крови (UACR). Результаты: Из 175 включенных субъектов у 29 (16,6%) развилась ЦИН. Те, у кого развился CIN, имели более высокую распространенность диабета, более высокий UACR (0,60 против 0,44, p = 0,014), более высокий объем контраста и более низкий уровень натрия в сыворотке. При однофакторном анализе модели логистической регрессии установлено, что риск КИН связан с сахарным диабетом ( p = 0,0016, ОШ = 3,8 [95% ДИ: 1,7–8,7]), UACR мочи ( p = 0,0027, ОШ = 9,6 [95% ДИ: 2,2–42,2]), натрий в сыворотке ( p = 0.0079, ОШ = 0,8 [95% ДИ: 0,77–0,96]) и объем контрастного вещества ( p = 0,0385, ОШ = 1,8 [95% ДИ: 1,03–3,09]). В модели множественной логистической регрессии с пошаговым методом отбора диабет ( p = 0,0120, ОШ = 3,2 [95% ДИ: 1,3–8,1]) и UACR ( p = 0,0163, ОШ = 6,9 [95% ДИ: 1,4–33,4]) были окончательно идентифицированы 2 фактора риска. Выводы: Мы продемонстрировали, что более высокий показатель UACR в моче связан с развитием CIN у пациентов, перенесших плановую коронарографию.
При однофакторном анализе модели логистической регрессии установлено, что риск КИН связан с сахарным диабетом ( p = 0,0016, ОШ = 3,8 [95% ДИ: 1,7–8,7]), UACR мочи ( p = 0,0027, ОШ = 9,6 [95% ДИ: 2,2–42,2]), натрий в сыворотке ( p = 0.0079, ОШ = 0,8 [95% ДИ: 0,77–0,96]) и объем контрастного вещества ( p = 0,0385, ОШ = 1,8 [95% ДИ: 1,03–3,09]). В модели множественной логистической регрессии с пошаговым методом отбора диабет ( p = 0,0120, ОШ = 3,2 [95% ДИ: 1,3–8,1]) и UACR ( p = 0,0163, ОШ = 6,9 [95% ДИ: 1,4–33,4]) были окончательно идентифицированы 2 фактора риска. Выводы: Мы продемонстрировали, что более высокий показатель UACR в моче связан с развитием CIN у пациентов, перенесших плановую коронарографию.
© 2019 Автор(ы) Опубликовано S. Karger AG, Basel
Введение
Контраст-индуцированная нефропатия (КИН) исторически была частой причиной острого повреждения почек (ОПП) у госпитализированных пациентов после операции и артериальной гипотензии [1, 2] со значительно повышенным риском смертности в краткосрочной и долгосрочной перспективе. сопровождение [3]. Ранние исследования связывали контрастную нефропатию с использованием контрастных веществ с высокой осмоляльностью, а исследования биопсии документировали канальцевое поражение, напоминающее осмотический нефроз [4].Действительно, экспериментальные исследования также выявили повышенную осмолярную нагрузку рентгеноконтрастного вещества как средство индукции альдозоредуктазно-фруктокиназного пути в проксимальных канальцах, что приводит к окислительному стрессу и повреждению канальцев [5]. Использование контрастных веществ с низкой осмолярностью (которая все еще высока по сравнению с осмоляльностью сыворотки) привело к более низкой частоте ОПП, и это было дополнительно снижено с помощью протоколов, которые включают минимизацию объема вводимого контраста и обеспечение гидратации.Как следствие, частота CIN низкая [6] и, вероятно, завышена [7]. Кроме того, многие клинические исследования показали, что несколько новых почечных биомаркеров, таких как липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), цистатин С и антитромбин III, могут предсказывать CIN раньше, чем креатинин сыворотки [8-10].
сопровождение [3]. Ранние исследования связывали контрастную нефропатию с использованием контрастных веществ с высокой осмоляльностью, а исследования биопсии документировали канальцевое поражение, напоминающее осмотический нефроз [4].Действительно, экспериментальные исследования также выявили повышенную осмолярную нагрузку рентгеноконтрастного вещества как средство индукции альдозоредуктазно-фруктокиназного пути в проксимальных канальцах, что приводит к окислительному стрессу и повреждению канальцев [5]. Использование контрастных веществ с низкой осмолярностью (которая все еще высока по сравнению с осмоляльностью сыворотки) привело к более низкой частоте ОПП, и это было дополнительно снижено с помощью протоколов, которые включают минимизацию объема вводимого контраста и обеспечение гидратации.Как следствие, частота CIN низкая [6] и, вероятно, завышена [7]. Кроме того, многие клинические исследования показали, что несколько новых почечных биомаркеров, таких как липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), цистатин С и антитромбин III, могут предсказывать CIN раньше, чем креатинин сыворотки [8-10].
Тем не менее, наша группа продолжает наблюдать случаи ОПП после введения рентгеноконтрастных препаратов, и мы и другие показали, что повреждение можно предсказать по наличию гиперурикемии [1, 11].Гиперурикемия активирует воспалительные, прооксидантные и вазоконстрикторные пути и участвует как в остром, так и в хроническом повреждении почек [12-16]. Кроме того, радиоконтраст также может вызывать острую урикозурию [17, 18], потенциально приводящую к образованию кристаллов, особенно если моча кислая [19]. Сосредоточившись на этом последнем наблюдении, мы решили проверить гипотезу о том, могут ли кислотность мочи, уровень мочевой кислоты в моче, уровень бикарбоната в сыворотке и уровень мочевой кислоты в сыворотке быть факторами риска развития КИН у пациентов, подвергающихся плановой коронарографии.
Материалы и методы
Пациенты и дизайн исследования
Комитет по этике Медицинской школы Университета Коча одобрил протокол исследования. Мы зарегистрировали 175 пациентов, которые были госпитализированы в отделение кардиологии университетской больницы Коч для плановой коронарной ангиографии в период с января 2018 г. по декабрь 2018 г. Были собраны проспективные данные о клинических, демографических и лабораторных данных пациентов. Пациенты старше 18 лет с предполагаемой скоростью клубочковой фильтрации (рСКФ) от 30 до 90 мл/мин/л.73 м 2 (в соответствии с формулой CKD-EPI) были включены в это исследование. Перед включением в исследование у всех субъектов было получено письменное информированное согласие. Исключались пациенты, отвечающие следующим критериям: возраст старше 80 лет, диализные больные, 5-я стадия хронической болезни почек, рСКФ >90 мл/мин/1,73 м 2 , 4-я стадия сердечной недостаточности, кардиогенный шок, связанный с инфарктом миокарда, наличие в анамнезе подагра, продолжающееся лечение аллопуринолом, продолжающееся лечение гломерулонефрита или диагноз рака.
по декабрь 2018 г. Были собраны проспективные данные о клинических, демографических и лабораторных данных пациентов. Пациенты старше 18 лет с предполагаемой скоростью клубочковой фильтрации (рСКФ) от 30 до 90 мл/мин/л.73 м 2 (в соответствии с формулой CKD-EPI) были включены в это исследование. Перед включением в исследование у всех субъектов было получено письменное информированное согласие. Исключались пациенты, отвечающие следующим критериям: возраст старше 80 лет, диализные больные, 5-я стадия хронической болезни почек, рСКФ >90 мл/мин/1,73 м 2 , 4-я стадия сердечной недостаточности, кардиогенный шок, связанный с инфарктом миокарда, наличие в анамнезе подагра, продолжающееся лечение аллопуринолом, продолжающееся лечение гломерулонефрита или диагноз рака.
CIN определяли как увеличение >25% уровня креатинина в сыворотке по сравнению с исходным значением через 48–72 ч после применения контраста. Пациенты были разделены на 2 группы на основании изменения показателей сывороточного креатинина через 48–72 ч после применения контраста. Пациенты с повышением уровня креатинина в сыворотке на ≥25% были отнесены к категории CIN, в то время как пациенты с отсутствием изменений или увеличением значений креатинина сыворотки <25% были включены в контрольную группу. Мы также разделили субъектов на группу контроля, субклинического ОПП или CIN на основе более чувствительного биомаркера ОПП, NGAL.
Пациенты с повышением уровня креатинина в сыворотке на ≥25% были отнесены к категории CIN, в то время как пациенты с отсутствием изменений или увеличением значений креатинина сыворотки <25% были включены в контрольную группу. Мы также разделили субъектов на группу контроля, субклинического ОПП или CIN на основе более чувствительного биомаркера ОПП, NGAL.
Количество контраста и лекарства, используемые пациентами, были зарегистрированы вместе с демографическими характеристиками и всеми другими клиническими данными пациентов, участвовавших в этом проекте. Чтобы помочь предотвратить развитие CIN, использование нефротоксичных препаратов, таких как нестероидные противовоспалительные препараты, метформин, ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина и диуретики, было прекращено, и пациентам была назначена гидратация в соответствии с опубликованными рекомендациями. [2]. Кроме того, всем пациентам вводили N-ацетилцистеин (>1200 мг/день), начиная с 2-х дней до коронарографии и продолжая до 2-х дней после ангиографии.
Биохимические анализы
Перед коронарографией у всех пациентов брали 10 мл крови и 10 мл мочи. Образец крови использовался для измерения уровней мочевой кислоты, мочевины, креатинина, натрия (Na), калия (K) и бикарбоната, в то время как мочевая кислота и креатинин в выборочной моче измерялись, и использовалось отношение мочевой кислоты к креатинину (UACR). чтобы получить результат, аналогичный результату 24-часового измерения мочевой кислоты в образце мочи. Для проведения дополнительных анализов на NGAL у пациентов снова брали 10 мл крови и 10 мл мочи, центрифугировали и хранили при –80°С.Для изучения функции почек у пациентов и определения развития КИН через 48–72 ч после коронароангиографии брали образцы крови и мочи объемом 10 мл и сохраняли при –80°С для повторного проведения тех же анализов. Тесты проводились одновременно, чтобы избежать какой-либо систематической ошибки из-за различий в методологии и калибровке (рис. 1). Уровни мочевой кислоты анализировали с помощью Cobas 6000 (Roche Modular System) с использованием ферментативного/колориметрического метода.
Рис. 1.
Блок-схема дизайна исследования.
NGAL Анализ методом ИФА
Для измерения NGAL образцы крови пациентов собирали в сухие пробирки и немедленно центрифугировали (3500 г ) в течение 10 мин при +4°C. Сыворотки разделяли на аликвоты и сразу же замораживали при –80°С. Уровни NGAL в сыворотке определяли с помощью конкурентного ELISA с использованием коммерческих наборов (Thermo Fisher, Invitrogen, BMS2202). Внутри- и интеркоэффициенты вариации составили 4 и 5,8% соответственно.
Статистические методы
Были рассчитаны средние значения и стандартные отклонения для непрерывных переменных, а также количество и проценты для категориальных переменных.Медианы и межквартильные диапазоны использовались для контрастного объема и NGAL, поскольку они не имеют нормального распределения. Диагноз CIN ставили, если уровень креатинина в сыворотке повышался на 25% по сравнению с исходным уровнем в течение 48 ч после применения контраста. Числовые переменные представлены в виде средних значений (стандартных отклонений) и номинальных значений в процентах. Все переменные были подвергнуты тестированию Колмогорова-Смирнова, чтобы определить, имеют ли они нормальное распределение. Была исследована связь CIN с представляющими интерес исходными переменными: (1) тест χ 2 и тест t использовались для сравнения CIN и не-CIN; (2) модель одномерной логистической регрессии использовалась для изучения отдельных исходных переменных; и (3) множественная регрессия с пошаговыми методами использовалась для скрининга высокопотенциальных факторов риска.При пошаговом отборе для включения переменной в модель требовался уровень значимости 0,3, а для того, чтобы переменная оставалась в модели, требовался уровень значимости 0,35. Кроме того, поскольку более высокий уровень NGAL считался важным и ранним биомаркером ОПП, мы определили 3 группы риска на основе терцилей изменения NGAL от исходного уровня до 48 ч после использования контраста (т. е. группы с изменением ≤66,3 нг/мл). мл [группа 1], ≥79 нг/мл [группа 3] и от <79 до >66,3 нг/мл [группа 2]) и исследовали его связь с CIN и другими исходными переменными с использованием теста и анализа χ 2 дисперсии (ANOVA) в групповых сравнениях.
Все переменные были подвергнуты тестированию Колмогорова-Смирнова, чтобы определить, имеют ли они нормальное распределение. Была исследована связь CIN с представляющими интерес исходными переменными: (1) тест χ 2 и тест t использовались для сравнения CIN и не-CIN; (2) модель одномерной логистической регрессии использовалась для изучения отдельных исходных переменных; и (3) множественная регрессия с пошаговыми методами использовалась для скрининга высокопотенциальных факторов риска.При пошаговом отборе для включения переменной в модель требовался уровень значимости 0,3, а для того, чтобы переменная оставалась в модели, требовался уровень значимости 0,35. Кроме того, поскольку более высокий уровень NGAL считался важным и ранним биомаркером ОПП, мы определили 3 группы риска на основе терцилей изменения NGAL от исходного уровня до 48 ч после использования контраста (т. е. группы с изменением ≤66,3 нг/мл). мл [группа 1], ≥79 нг/мл [группа 3] и от <79 до >66,3 нг/мл [группа 2]) и исследовали его связь с CIN и другими исходными переменными с использованием теста и анализа χ 2 дисперсии (ANOVA) в групповых сравнениях. Для сравнения использовали натуральные логарифмические значения контрастного объема и NGAL. Для вывода использовали двусторонний уровень значимости 0,05. Все анализы проводились с использованием SAS 9.4 (Институт SAS, Кэри, Северная Каролина, США).
Для сравнения использовали натуральные логарифмические значения контрастного объема и NGAL. Для вывода использовали двусторонний уровень значимости 0,05. Все анализы проводились с использованием SAS 9.4 (Институт SAS, Кэри, Северная Каролина, США).
Результаты
Средний возраст пациентов составил 67,6 ± 11,2 года, 65,7% мужчин. Курильщики составили 41,7% больных. Доля больных сахарным диабетом и артериальной гипертензией составила 35,4 и 70,9% соответственно. Из 175 субъектов, включенных в окончательный анализ, 29 (16.у 6%) развилась CIN, определяемая как повышение уровня креатинина сыворотки на 25% от исходного уровня до 48 часов после использования контраста. В таблице 1 показаны базовые переменные в сравнении между двумя группами. Те, у кого развился CIN, имели более высокую распространенность диабета (62,1 против 30,1%, p = 0,001), более низкий уровень натрия в сыворотке (139 против 141 ммоль/л, p = 0,022), более высокий UACR (0,60 против 0,44). , p = 0,014), более высокий объем контрастного вещества (230 против 125 мл, p = 0,036) и более высокий, но незначимый уровень NGAL в сыворотке крови на исходном уровне (386 против 0,036). 275 нг/мл, p = 0,053).
275 нг/мл, p = 0,053).
Таблица 1.
Исходные характеристики и сравнение между 2 группами CIN
Используя однофакторный анализ модели логистической регрессии (таблица 2), риск развития CIN наблюдался при диабете ( p = 0,0016, отношение шансов [OR] = 3,8 [95% ДИ: 1,7–8,7]), натрий в сыворотке ( p = 0,0079, ОШ = 0,86 [95% ДИ: 0,77–0,96]), UACR ( p = 0,0027, ОШ = 9,6 [95% ДИ: 2,2–42,2]), и объем контраста ( p = 0.0385, ОШ = 1,8 [95% ДИ: 1,03–3,09]). Используя модель множественной логистической регрессии с пошаговым методом отбора, диабет ( p = 0,0120, ОШ = 3,2 [95% ДИ: 1,3–8,1]) и UACR ( p = 0,0163, ОШ = 6,9 [95% ДИ: 1,4–33,4]) были окончательно идентифицированы 2 фактора риска.
Таблица 2.
Результаты моделей одномерной и множественной логистической регрессии
Значения NGAL в моче (как более чувствительный маркер ОПП) от исходного уровня до 48 часов можно найти в таблицах 3 и 4.Как показано в таблицах 3 и 4, возраст, уровень гемоглобина, уровень креатинина, скорость клубочковой фильтрации, уровень натрия в сыворотке, бикарбонат сыворотки, мочевая кислота в сыворотке и UACR мочи значительно различались между разными тертилями NGAL мочи. Пациенты с более высоким терцилем NGAL имели более высокий исходный уровень мочевой кислоты в сыворотке и UACR мочи по сравнению с двумя другими группами.
Пациенты с более высоким терцилем NGAL имели более высокий исходный уровень мочевой кислоты в сыворотке и UACR мочи по сравнению с двумя другими группами.
Таблица 3.
Исходные характеристики и сравнение между тремя группами изменения NGAL
Таблица 4.
Парные сравнения с методом Тьюки после ANOVA, как показано в таблице 3
Обсуждение
В этом исследовании мы исследовали роль уровней мочевой кислоты в моче, pH мочи, бикарбоната сыворотки и уровней мочевой кислоты в сыворотке в развитии CIN у пациентов, перенесших коронарографию. Мы обнаружили, что сахарный диабет, высокие дозы контрастного вещества и высокие уровни UACR в моче были независимыми факторами риска развития CIN, в то время как уровни бикарбоната в сыворотке, мочевая кислота в сыворотке и pH мочи не были значительными факторами риска.
Считается, что CIN встречается реже [7]. Тем не менее, в нашем исследовании у 16,6% пациентов (29 из 175) развилась КИН, и подобные частоты (10–20%) были отмечены другими [20, 21]. CIN может привести к необратимому повреждению почек, даже если почечная функция изначально возвращается к норме, а риск смерти значительно возрастает у пациентов с высоким риском [21]. Действительно, КИН увеличивает риск краткосрочной и долгосрочной смертности в 2–4 раза, особенно у пациентов с высоким риском [22]. Поэтому выявление факторов риска КИН важно с точки зрения снижения связанных с этим осложнений.
CIN может привести к необратимому повреждению почек, даже если почечная функция изначально возвращается к норме, а риск смерти значительно возрастает у пациентов с высоким риском [21]. Действительно, КИН увеличивает риск краткосрочной и долгосрочной смертности в 2–4 раза, особенно у пациентов с высоким риском [22]. Поэтому выявление факторов риска КИН важно с точки зрения снижения связанных с этим осложнений.
Известные факторы риска КИН включают пожилой возраст, хроническую почечную недостаточность, сахарный диабет, прогрессирующие сердечно-сосудистые заболевания, гипотензию, анемию и высокие дозы контрастного вещества [23]. Совсем недавно гиперурикемия также была определена как фактор риска [1]. Мы выявили высокие уровни NGAL у пациентов с CIN. В предыдущем метаанализе Tong et al. [24] сообщили, что повышенные уровни NGAL в сыворотке и моче, по-видимому, являются полезными биомаркерами для раннего прогнозирования CIN. Кроме того, высокие уровни UACR в моче были определены как независимый фактор риска развития CIN. Выявление высокого исходного уровня UACR в моче в качестве независимого фактора риска является новым и может иметь отношение к способности рентгеноконтрастного препарата резко повышать уровень мочевой кислоты в моче, что может привести к образованию кристаллов в моче и повреждению канальцев. Следует отметить, что диабет, как известно, также вызывает урикозурию [25] и обычно определяется как фактор риска КИН, в том числе в этом исследовании. Эти данные свидетельствуют о том, что исходный уровень UACR в моче предшествует и предсказывает острые изменения функции почек, а также согласуется с урикозурией как потенциальным механизмом повреждения почек.
Выявление высокого исходного уровня UACR в моче в качестве независимого фактора риска является новым и может иметь отношение к способности рентгеноконтрастного препарата резко повышать уровень мочевой кислоты в моче, что может привести к образованию кристаллов в моче и повреждению канальцев. Следует отметить, что диабет, как известно, также вызывает урикозурию [25] и обычно определяется как фактор риска КИН, в том числе в этом исследовании. Эти данные свидетельствуют о том, что исходный уровень UACR в моче предшествует и предсказывает острые изменения функции почек, а также согласуется с урикозурией как потенциальным механизмом повреждения почек.
Известно, что кислотность мочи повышает токсичность мочевой кислоты и других токсинов за счет увеличения хелатирования мочевой кислоты в моче в канальцах и мозговом веществе почек [19]. Повреждение CIN происходит по сходному механизму в канальцах и мозговом веществе; однако взаимосвязь между pH мочи и риском CIN еще не изучалась. Хотя рН мочи пациентов, у которых развился CIN, был ниже, чем в контрольной группе в нашем исследовании, разница не была статистически значимой. Эта информация подтверждает роль кислотности мочи в влиянии на риск ОПП при КИН, но существует необходимость в более крупном проспективном исследовании для определения рН мочи как фактора риска.
Эта информация подтверждает роль кислотности мочи в влиянии на риск ОПП при КИН, но существует необходимость в более крупном проспективном исследовании для определения рН мочи как фактора риска.
Недавно сообщалось, что высокий уровень мочевой кислоты в сыворотке крови является независимым предиктором CIN в некоторых исследованиях [11, 26-28]. Менди и др. [1] оценили сывороточную мочевую кислоту как потенциальный фактор риска CIN у 450 пациентов, перенесших чрескожное коронарное вмешательство, и обнаружили, что уровень мочевой кислоты в сыворотке >5.4 мг/дл как предиктор развития CIN (чувствительность 70%, специфичность 67%). В другом исследовании Barbieri et al. [28] обнаружили, что повышенный уровень мочевой кислоты в сыворотке (>7 мг/дл) был связан с развитием КИН у пациентов, перенесших коронарную ангиографию или чрескожное коронарное вмешательство (скорректированное ОШ = 1,42 [95% ДИ: 1,04–1,93], p = 026). И наоборот, в других исследованиях не удалось продемонстрировать взаимосвязь между мочевой кислотой и CIN [29, 30]. В текущем исследовании пациенты с ОПП, как правило, имели более высокие исходные уровни мочевой кислоты в сыворотке и более низкие уровни бикарбоната в сыворотке и рН мочи; однако они статистически не отличались от субъектов, у которых не развилось ОПП.
В текущем исследовании пациенты с ОПП, как правило, имели более высокие исходные уровни мочевой кислоты в сыворотке и более низкие уровни бикарбоната в сыворотке и рН мочи; однако они статистически не отличались от субъектов, у которых не развилось ОПП.
С терапевтической точки зрения 2 профилактических исследования показали, что аллопуринол может предотвращать контрастную нефропатию [31, 32], а недавний анализ показал, что он является наиболее эффективным из всех опробованных на сегодняшний день препаратов [33]. Напротив, Iranirad et al. [34] не смогли показать какого-либо дополнительного преимущества аллопуринола по сравнению с гидратацией в отношении развития КИН у пациентов с высоким риском. Аналогичным образом, другое исследование, сравнивающее N-ацетилцистеин с аллопуринолом, также не обнаружило существенной разницы в эффективности этих препаратов для предотвращения КИН [35].
Тем не менее, несмотря на непрекращающиеся споры об эффективности фармакологического снижения уровня мочевой кислоты в плазме, повышенный уровень мочевой кислоты в моче может предрасполагать к образованию кристаллов уратов, что приводит к повреждению канальцев, связанному с воспалением, особенно в кислой моче [36, 37]. Повышение уровня мочевой кислоты в моче также может вызывать повреждение канальцев посредством эпителиально-мезенхимальной трансформации [38], дисфункции эндотелия, окислительного стресса и повышения уровня С-реактивного белка [39-42].Таким образом, эти механизмы могут частично объяснить, почему более высокие уровни UACR в моче присутствовали у пациентов, у которых развилась CIN в нашем исследовании. На рисунке 2 показана потенциальная роль уровня мочевой кислоты и кислотности мочи в патогенезе CIN.
Повышение уровня мочевой кислоты в моче также может вызывать повреждение канальцев посредством эпителиально-мезенхимальной трансформации [38], дисфункции эндотелия, окислительного стресса и повышения уровня С-реактивного белка [39-42].Таким образом, эти механизмы могут частично объяснить, почему более высокие уровни UACR в моче присутствовали у пациентов, у которых развилась CIN в нашем исследовании. На рисунке 2 показана потенциальная роль уровня мочевой кислоты и кислотности мочи в патогенезе CIN.
Рис. 2.
Предполагаемые механизмы влияния мочевой кислоты на развитие контраст-индуцированной нефропатии (КИН).
С точки зрения ограничений, выбранные пациенты были из одного центра, что, следовательно, может ограничивать возможности обобщения.Размер выборки также был относительно небольшим, и мы не наблюдали пациентов в течение длительного времени. Наконец, в текущем исследовании не изучалась связь между более высоким UACR мочи и краткосрочной и долгосрочной прогностической ценностью, такой как новое сердечно-сосудистое событие, смертность и госпитализация.
Таким образом, более высокий показатель UACR в моче связан с развитием CIN у пациентов, перенесших плановую коронарографию. Требуются дальнейшие исследования для выяснения основных механизмов, а также рандомизированные контролируемые испытания с большим размером выборки, чтобы определить, может ли снижение уровня мочевой кислоты в сыворотке и исходного уровня UACR в моче уменьшить развитие CIN.
Благодарности
М.К. выражает признательность за использование услуг и возможностей Исследовательского центра трансляционной медицины Университета Коч (KUTTAM), финансируемого Президентом Турции, Президентом по стратегии и бюджету. Ответственность за содержание несут исключительно авторы, и оно не обязательно отражает официальную точку зрения Управления по стратегии и бюджету.
Заявление об этике
Комитет по этике Медицинской школы Университета Коча одобрил протокол исследования.Перед включением в исследование у всех субъектов было получено письменное информированное согласие.
Заявление о раскрытии информации
Все авторы заявляют об отсутствии конфликта интересов.
Источники финансирования
Это исследование не финансировалось каким-либо грантом.
Вклад авторов
Концепция: Г.А., М.К.; Руководство: Г.А., М.К.; Материалы: Г.А., В.К.; Данные: Г.А., Н.Е., С.Ю., В.К.; Анализ: Г.А., З.И., М.Л.Г., Д.З.И.К., С.И.; Написание: Г.А., М.К., Д.С., Б.А.
Критическая редакция: G.A., MK, B.A., A.A.S., MLG, DS, RJJ, AC
Ссылки
- Менди М.А., Афсар Б., Оксуз Ф., Турак О., Яйла С., Озджан Ф. и другие. Мочевая кислота является полезным инструментом для прогнозирования контраст-индуцированной нефропатии. Ангиология. 2017 авг; 68 (7): 627–32.
- Ингибиторы АПФ в группе исследователей диабетической нефропатии.
 Должны ли все пациенты с сахарным диабетом 1 типа и микроальбуминурией получать ингибиторы ангиотензинпревращающего фермента? Метаанализ индивидуальных данных пациентов. Энн Интерн Мед. 2001 март; 134 (5): 370–9.
Должны ли все пациенты с сахарным диабетом 1 типа и микроальбуминурией получать ингибиторы ангиотензинпревращающего фермента? Метаанализ индивидуальных данных пациентов. Энн Интерн Мед. 2001 март; 134 (5): 370–9. - Маккалоу П.А., Берман А.Д.Чрескожные коронарные вмешательства у почечных пациентов с высоким риском: стратегии защиты почек и сосудов. Кардиол клин. 23 августа 2005 г. (3): 299–310.
- Moreau JF, Droz D, Sabto J, Jungers P, Kleinknecht D, Hinglais N, et al. Осмотический нефроз, индуцированный водорастворимыми трийодсодержащими контрастными веществами у человека.Ретроспективное исследование 47 случаев.
 Радиология. 1975 г., май; 115 (2): 329–36.
Радиология. 1975 г., май; 115 (2): 329–36. - Андрес-Эрнандо А., Ли Н., Сичерчи С., Инаба С., Чен В., Ронкал-Хименес С. и др. Защитная роль блокады фруктокиназы в патогенезе острого повреждения почек у мышей. Нац коммун. 2017 Февраль;8(1):14181.
- Weisbord SD, Gallagher M, Jneid H, Garcia S, Cass A, Thwin SS и др.; СОХРАНИТЬ пробную группу. Результаты после ангиографии с бикарбонатом натрия и ацетилцистеином. N Engl J Med. 2018 г., февраль; 378 (7): 603–14.
- Вильгельм-Лин Э.
 , Монтес-Рат М.Е., Чертоу Г.Оценка риска рентгеноконтрастной нефропатии. J Am Soc Нефрол. 2017 фев; 28 (2): 653–9.
, Монтес-Рат М.Е., Чертоу Г.Оценка риска рентгеноконтрастной нефропатии. J Am Soc Нефрол. 2017 фев; 28 (2): 653–9. - Бахожевска-Гаевска Х., Малышко Дж., Ситневская Э., Малышко Дж. С., Понятовский Б., Павляк К. и соавт. NGAL (липокалин, ассоциированный с нейтрофильной желатиназой) и цистатин С: являются ли они хорошими предикторами контрастной нефропатии после чрескожных коронарных вмешательств у пациентов со стабильной стенокардией и нормальным уровнем креатинина в сыворотке крови? Int J Кардиол.2008 г., июль; 127 (2): 290–1.
- Ву Р., Конг Ю., Инь Дж., Лян Р., Лу З., Ван Н. и др. Антитромбин III является новым предиктором контраст-индуцированной нефропатии после коронарной ангиографии.
 Почечный пресс крови Res. 2018;43(1):170–80.
Почечный пресс крови Res. 2018;43(1):170–80. - Лу З., Ченг Д., Инь Дж., Ву Р., Чжан Г., Чжао К. и др.Антитромбин III защищает от контраст-индуцированной нефропатии. ЭБиоМедицина. 2017 март; 17: 101–7.
- Канбай М., Солак Ю., Афсар Б., Нистор И., Аслан Г., Чаглаян О.Х. и др. Мочевая кислота в сыворотке крови и риск острого повреждения почек после введения контраста. Ангиология. 2017 г., февраль; 68 (2): 132–44.
- Канбай М.
 , Сегал М., Афсар Б., Канг Д.Х., Родригес-Итурбе Б., Джонсон Р.Дж.Роль мочевой кислоты в патогенезе сердечно-сосудистых заболеваний человека. Сердце. 2013 г., июнь; 99 (11): 759–66.
, Сегал М., Афсар Б., Канг Д.Х., Родригес-Итурбе Б., Джонсон Р.Дж.Роль мочевой кислоты в патогенезе сердечно-сосудистых заболеваний человека. Сердце. 2013 г., июнь; 99 (11): 759–66. - Канбай М., Афсар Б., Сириополь Д., Унал Х.У., Караман М., Саглам М. и др. Актуальность мочевой кислоты и асимметричного диметиларгинина для моделирования прогнозирования сердечно-сосудистого риска у пациентов с хронической болезнью почек.Инт Урол Нефрол. 2016 июль; 48 (7): 1129–36.
- Канбай А., Инону Х., Солак Ю., Эрден А., Услу Э., Юксел С.А. и др. Мочевая кислота как потенциальный медиатор сердечно-сосудистой заболеваемости при синдроме обструктивного апноэ сна.
 Европейский J Стажер Мед. 2014 июнь; 25 (5): 471–476.
Европейский J Стажер Мед. 2014 июнь; 25 (5): 471–476. - Канбай М., Афсар Б., Чович А.Мочевая кислота как кардиометаболический фактор риска: быть или не быть. Внести нефрол. 2011; 171: 62–7.
- Канбай М., Икижек М., Солак Ю., Селкоки Ю., Уйсал С., Армутку Ф. и другие. Уровни мочевой кислоты и пентраксина-3 независимо связаны с риском ишемической болезни сердца у пациентов со 2-й и 3-й стадиями заболевания почек.Am J Нефрол. 2011;33(4):325–31.
- Келли ВН.
 Урикозурия и рентгеноконтрастные вещества. N Engl J Med. 1971 г., апрель; 284 (17): 975–976.
Урикозурия и рентгеноконтрастные вещества. N Engl J Med. 1971 г., апрель; 284 (17): 975–976. - Постлетуэйт А.Э., Келли В.Н.Урикозурический эффект рентгеноконтрастных веществ. Исследование четырех широко используемых препаратов на человеке. Энн Интерн Мед. 1971 г., июнь; 74 (6): 845–52.
- Прейтнер Ф., Лаверьер-Лосс А., Метреф С., Да Коста А., Морет С., Ротман С. и др. Индуцированная уратами острая почечная недостаточность и хроническое воспаление у мышей с нокаутом Glut9, специфичных для печени.Am J Physiol Renal Physiol. 2013 г., сен; 305 (5): F786–95.
- Newhouse JH, Kho D, Rao QA, Starren J.
 Частота изменений креатинина в сыворотке крови в отсутствие йодсодержащего контрастного вещества: последствия для исследований контрастной нефротоксичности. AJR Am J Рентгенол. 2008 г., август; 191 (2): 376–82.
Частота изменений креатинина в сыворотке крови в отсутствие йодсодержащего контрастного вещества: последствия для исследований контрастной нефротоксичности. AJR Am J Рентгенол. 2008 г., август; 191 (2): 376–82. - Соломон Р.Дж., Мехран Р., Натараджан М.К., Дусет С., Католи Р.Е., Станилоэ К.С. и др. Контраст-индуцированная нефропатия и отдаленные нежелательные явления: причина и следствие? Clin J Am Soc Нефрол. 2009 г., июль; 4 (7): 1162–9.
- Фаджиони М., Мехран Р.Предотвращение индуцированной контрастом почечной недостаточности: Руководство. Интерв Кардиол (Лондон). 2016 окт; 11 (2): 98–104.
- Мехран Р.
 , Аймонг Э.Д., Никольский Э., Ласич З., Якову И., Фахи М. и др. Простая оценка риска для прогнозирования контраст-индуцированной нефропатии после чрескожного коронарного вмешательства: разработка и начальная валидация.J Am Coll Кардиол. 2004 г., октябрь; 44 (7): 1393–9.
, Аймонг Э.Д., Никольский Э., Ласич З., Якову И., Фахи М. и др. Простая оценка риска для прогнозирования контраст-индуцированной нефропатии после чрескожного коронарного вмешательства: разработка и начальная валидация.J Am Coll Кардиол. 2004 г., октябрь; 44 (7): 1393–9. - Тонг Дж., Ли Х., Чжан Х., Луо З., Хуан И., Хуан Дж. и др. Липокалин, связанный с нейтрофильной желатиназой, в прогнозировании контраст-индуцированной нефропатии: системный обзор и метаанализ. J Cardiovasc Pharmacol. 2015 г., сен; 66 (3): 239–45.
- Литвин Ю., Шкртич М., Ян Г.К., Ип П.М., Перкинс Б.А., Черней Д.З. Опосредованная глюкозурией экскреция мочевой кислоты с мочой у пациентов с неосложненным сахарным диабетом 1 типа.
 Am J Physiol Renal Physiol. 2015 г., январь; 308 (2): F77–83.
Am J Physiol Renal Physiol. 2015 г., январь; 308 (2): F77–83. - Хан К., Канбай М., Ланаспа М.А., Джонсон Р.Дж., Эджаз А.А.Мочевая кислота в сыворотке и острая почечная недостаточность: мини-обзор. J Adv Res. 2017 сен; 8 (5): 529–36.
- Саритемур М., Туркели М., Калкан К., Танбога И.Х., Аксакал Э. Связь мочевой кислоты и контраст-индуцированной нефропатии у пациентов, перенесших первичное чрескожное коронарное вмешательство в отделении неотложной помощи.Am J Emerg Med. 2014 фев; 32 (2): 119–23.
- Барбьери Л.
 , Вердоя М., Шаффер А., Кассетти Э., Марино П., Сурьяпраната Х. и др.; Новарская группа по изучению атеросклероза (NAS). Уровни мочевой кислоты и риск контраст-индуцированной нефропатии у пациентов, перенесших коронарографию или ЧКВ.Nutr Metab Cardiovasc Dis. 2015 февраль; 25 (2): 181–186.
, Вердоя М., Шаффер А., Кассетти Э., Марино П., Сурьяпраната Х. и др.; Новарская группа по изучению атеросклероза (NAS). Уровни мочевой кислоты и риск контраст-индуцированной нефропатии у пациентов, перенесших коронарографию или ЧКВ.Nutr Metab Cardiovasc Dis. 2015 февраль; 25 (2): 181–186. - Карабулут А., Шахин И., Илькер Авджи И., Окуян Э., Доган З., Узунлар Б. и др. Влияние уровня щелочной фосфатазы сыворотки крови на патофизиологический механизм контраст-индуцированной нефропатии. Кардиол Пол. 2014;72(10):977–82.
- Ковальчик Дж., Француз П., Свобода Р., Ленарчик Р., Средняява Б., Голда А.
 и др.Прогностическое значение гиперурикемии у больных с различными видами почечной дисфункции и острым инфарктом миокарда, перенесших чрескожное коронарное вмешательство. Клиническая практика Нефрона. 2010;116(2):c114–22.
и др.Прогностическое значение гиперурикемии у больных с различными видами почечной дисфункции и острым инфарктом миокарда, перенесших чрескожное коронарное вмешательство. Клиническая практика Нефрона. 2010;116(2):c114–22. - Эрол Т., Текин А., Катирчибаши М.Т., Сезгин Н., Билги М., Текин Г. и др.Эффективность предварительного лечения аллопуринолом для профилактики контраст-индуцированной нефропатии: рандомизированное контролируемое исследование. Int J Кардиол. 2013 г., август; 167 (4): 1396–9.
- Кумар А., Бхавани Г., Кумари Н., Мурти К.С., Лалвани В., Раджу К.Н. Сравнительное исследование почечных защитных эффектов аллопуринола и N-ацетилцистеина при контраст-индуцированной нефропатии у пациентов, перенесших катетеризацию сердца.
 J Clin Diagn Res. 2014 г., декабрь; 8 (12): HC03–07.
J Clin Diagn Res. 2014 г., декабрь; 8 (12): HC03–07. - Ахмед К., Маквей Т., Чернявичуте Р., Мохамед С., Тубассам М., Карим М. и др. Эффективность контраст-ассоциированных методов профилактики острого повреждения почек; систематический обзор и сетевой метаанализ. БМК Нефрол. 2018 ноябрь;19(1):323.
- Иранирад Л., Садеги М.С., Багери А., Дустали К., Норузи С., Хеджази С.Ф. и др. Профилактическая терапия аллопуринолом и предотвращение контраст-индуцированной нефропатии у пациентов с высоким риском, подвергающихся коронарной ангиографии: проспективное рандомизированное контролируемое исследование. АРЬЯ Атеросклера.2017 сен; 13 (5): 230–5.
- Садинени Р.
 , Картик К.Р., Сварналата Г., Дас У., Тадури Г. N-ацетилцистеин по сравнению с аллопуринолом в профилактике контрастной нефропатии у пациентов с хроническим заболеванием почек: рандомизированное контролируемое исследование. Индийский Дж. Нефрол. 2017 март-апрель; 27 (2): 93–8.
, Картик К.Р., Сварналата Г., Дас У., Тадури Г. N-ацетилцистеин по сравнению с аллопуринолом в профилактике контрастной нефропатии у пациентов с хроническим заболеванием почек: рандомизированное контролируемое исследование. Индийский Дж. Нефрол. 2017 март-апрель; 27 (2): 93–8. - Эджаз А.А., Алквадан К.Ф., Дасс Б., Шимада М., Канбай М., Джонсон Р.Дж. Влияние мочевой кислоты в сыворотке на расчетную СКФ у пациентов, перенесших кардиохирургию: экспериментальное исследование. Am J Нефрол. 2015;42(6):402–9.
- Шеперс М.С., ван Баллегойен Э.С., Бангма Ч., Верколен С.Ф.Кристаллы вызывают острую некротическую гибель клеток проксимальных канальцев почек, но не клеток собирательных канальцев.
 почки инт. 2005 г., октябрь; 68 (4): 1543–53.
почки инт. 2005 г., октябрь; 68 (4): 1543–53. - Ryu ES, Kim MJ, Shin HS, Jang YH, Choi HS, Jo I и др. Индуцированный мочевой кислотой фенотипический переход клеток почечных канальцев как новый механизм хронического заболевания почек.Am J Physiol Renal Physiol. 2013 март; 304 (5): F471–80.
- Айкас Ф., Солак Ю., Эрден А., Булут К., Доган С., Сарли Б. и др. Сохранение сердечно-сосудистых факторов риска у женщин с преэклампсией в анамнезе: долгосрочное последующее исследование. J Исследовательская Мед. 2015 г., апрель; 63 (4): 641–5.
- Канбай М.
 , Худдам Б., Азак А., Солак Ю., Кадиоглу Г.К., Кирбас И. и др.Рандомизированное исследование аллопуринола на функцию эндотелия и расчетную скорость клубочковой фильтрации у пациентов с бессимптомной гиперурикемией и нормальной функцией почек. Clin J Am Soc Нефрол. 2011 авг; 6 (8): 1887–94.
, Худдам Б., Азак А., Солак Ю., Кадиоглу Г.К., Кирбас И. и др.Рандомизированное исследование аллопуринола на функцию эндотелия и расчетную скорость клубочковой фильтрации у пациентов с бессимптомной гиперурикемией и нормальной функцией почек. Clin J Am Soc Нефрол. 2011 авг; 6 (8): 1887–94. - Канбай М., Сириополь Д., Нистор И., Эльджиоглу О.К., Телчи О., Такир М. и др.Влияние аллопуринола на эндотелиальную дисфункцию: метаанализ. Am J Нефрол. 2014;39(4):348–56.
- Канбай М., Йылмаз М.И., Сонмез А., Солак Ю., Саглам М., Чакир Э. и др. Уровень мочевой кислоты в сыворотке крови является независимым предиктором сердечно-сосудистых событий при далеко зашедшей нефропатии.
 Am J Нефрол. 2012;36(4):324–31.
Am J Нефрол. 2012;36(4):324–31.
Автор Контакты
Gamze Aslan, MD
Отделение кардиологии
Университетская больница Коч
TR–34010 Zeytinburnu, Стамбул (Турция)
Электронная почта [email protected]
Информация о статье / публикации
Предварительный просмотр первой страницы
Получено: 04 сентября 2019 г.
Принято: 01 ноября 2019 г.
Опубликовано онлайн: 20 декабря 2019 г.
Дата выпуска выпуска: январь 2020 г.
Количество печатных страниц: 11
Количество фигурок: 2
Количество столов: 4
ISSN: 1420-4096 (печать)
eISSN: 1423-0143 (онлайн)
Для получения дополнительной информации: https://www. karger.com/KBR
karger.com/KBR
Лицензия открытого доступа / Дозировка препарата / Отказ от ответственности
Эта статья находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененного материала требует письменного разрешения. Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством. Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам.Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством. Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам.Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
Какова роль мониторинга рН и выделения мочи в оценке синдрома лизиса опухоли (СЛО)?
Автор
Алан К. Икеда, доктор медицины Временный медицинский директор, директор отделения онкологии Детского специализированного центра Лас-Вегаса
Алан К. Икеда, доктор медицины, является членом следующих медицинских обществ: Американская академия педиатрии, Американское общество трансплантации крови и костного мозга. , Американское общество детской гематологии/онкологии
Икеда, доктор медицины, является членом следующих медицинских обществ: Американская академия педиатрии, Американское общество трансплантации крови и костного мозга. , Американское общество детской гематологии/онкологии
Раскрытие информации: Я владею акциями различных фармацевтических компаний.Это зависит от конкретной недели для: нескольких и варьируется.
Соавтор (ы)
Девапиран Джайшанкар, MBBS Профессор медицины, заведующий отделением онкологии-гематологии, директор программы стипендий по онкологии, Медицинский колледж Джеймса Х. Квиллена, Государственный университет Восточного Теннесси
Девапиран Джайшанкар, MBBS является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Американское общество клинической онкологии, Американское общество гематологии
Раскрытие информации: Нечего раскрывать.
Главный редактор
Вафик С. Эль-Дейри, доктор медицинских наук, доктор медицинских наук Роуз Данлэп, профессор медицины, заведующая отделением гематологии и онкологии, Медицинский центр штата Пенсильвания, Херши
Эль-Дейри, доктор медицинских наук, доктор медицинских наук Роуз Данлэп, профессор медицины, заведующая отделением гематологии и онкологии, Медицинский центр штата Пенсильвания, Херши
Вафик С. Эль-Дейри, доктор медицинских наук, доктор медицинских наук, является членом следующих медицинских обществ. : Американская ассоциация исследований рака, Американское общество клинических исследований, Американское общество генной и клеточной терапии
Раскрытие информации: Ничего не раскрывается.
Дополнительные участники
Коямангалат Кришнан, доктор медицинских наук, FRCP, FACP Кафедра передового опыта в области медицины, профессор медицины, Медицинский колледж Джеймса Х. Квиллена в Университете штата Восточный Теннесси
Коямангалат Кришнан, доктор медицинских наук, FRCP, FACP является членом следующих медицинские общества: Альфа Омега Альфа, Американский колледж врачей – Американское общество внутренних болезней, Американское общество гематологии, Королевский медицинский колледж
Раскрытие информации: Нечего раскрывать.
Благодарности
Steven K Bergstrom, MD Отделение педиатрии, Отделение гематологии-онкологии, Медицинский центр Kaiser Permanente в Окленде
Стивен К. Бергстром, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американского общества клинической онкологии, Американского общества гематологии, Американского общества детской гематологии/онкологии, Группы детской онкологии и Международного общества экспериментальной гематологии
.Раскрытие информации: Нечего раскрывать.
Max J Coppes, MD, PhD, MBA Старший вице-президент, Центр рака и заболеваний крови, Детский национальный медицинский центр; Профессор медицины, онкологии и педиатрии Медицинской школы Джорджтаунского университета; Клинический профессор педиатрии, Школа медицины и медицинских наук Университета Джорджа Вашингтона
webmd.com»> Макс Дж. Коппс, доктор медицинских наук, магистр делового администрирования, является членом следующих медицинских обществ: Американской ассоциации исследований рака, Американского общества детской гематологии/онкологии и Общества педиатрических исследований.Раскрытие информации: Нечего раскрывать.
Stephan A Grupp, MD, PhD Директор программы биологии стволовых клеток, отделение педиатрии, отделение онкологии, Детская больница Филадельфии; Адъюнкт-профессор педиатрии Медицинской школы Пенсильванского университета
Stephan A Grupp, MD, PhD, является членом следующих медицинских обществ: Американская ассоциация исследований рака, Американское общество трансплантации крови и костного мозга, Американское общество гематологии, Американское общество детской гематологии/онкологии и Общество педиатрических исследований
webmd.com»> Раскрытие информации: Нечего раскрывать.Алан К. Икеда, доктор медицины Доцент кафедры педиатрии, отделение гематологии и онкологии, Медицинская школа Дэвида Геффена в Калифорнийском университете в Лос-Анджелесе; Заместитель директора отделения педиатрической трансплантации крови и костного мозга, Детская больница Mattel
Алан К. Икеда, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американского общества трансплантации крови и костного мозга и Американского общества детской гематологии/онкологии
.Раскрытие информации: гонорар автора справочника Medscape
Koyamangalath Krishnan, MD, FRCP, FACP Dishner Endowed Chair of Excellence in Medicine, Professor of Medicine, James H Quillen College of Medicine at East Tennessee State University
webmd.com»> Koyamangalath Krishnan, MD, FRCP, FACP является членом следующих медицинских обществ: Alpha Omega Alpha, American College of Physicians-American Society of Internal Medicine, American Society of Hematology и Royal College of Physicians.Раскрытие информации: Нечего раскрывать.
Kathleen M Sakamoto, MD, PhD Профессор и заведующий отделением гематологии-онкологии, заместитель председателя по исследованиям Детской больницы Mattel в Калифорнийском университете в Лос-Анджелесе; Со-ассоциированный директор программ области передачи сигналов, Комплексный онкологический центр Йонссона, Калифорнийский институт наносистем и Институт молекулярной биологии, Калифорнийский университет, Лос-Анджелес, Медицинская школа Дэвида Геффена
Kathleen M Sakamoto, MD, PhD, является членом следующих медицинских обществ: Американское общество гематологии, Американское общество детской гематологии/онкологии, Международное общество экспериментальной гематологии, Общество педиатрических исследований и Западное общество педиатрических исследований
webmd.com»> Раскрытие информации: Нечего раскрывать.Амит П. Сарнаик, MD Штатный врач, отделение педиатрии, Государственный университет Уэйна и Детская больница Мичигана
Амит П. Сарнаик, доктор медицины, является членом следующих медицинских обществ: Американская академия педиатрии
Раскрытие информации: Нечего раскрывать.
Филип Шульман, MD Заведующий отделением медицинской онкологии медицинского отделения Мемориального онкологического центра Слоуна-Кеттеринга; Клинический профессор медицинского факультета Медицинской школы Нью-Йоркского университета
Филип Шульман, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации исследований рака, Американского колледжа врачей, Американского общества гематологов и Медицинского общества штата Нью-Йорк
.
Раскрытие информации: Нечего раскрывать.
Франсиско Талавера, PharmD, PhD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Заработная плата Medscape
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Нечего раскрывать.
Влияние фосфатной добавки на рН мочи у пациентов с нейрогенным мочевым пузырем, получающих прерывистую катетеризацию
В исследование были включены семь молодых взрослых с нейрогенным мочевым пузырем, которые жили дома, имели нормальное УЗИ почек и выполняли CIC четыре раза в день. Критерии исключения включали беременность, заболевания почек или печени в анамнезе, гиперкальциемию, гиперфосфатемию, мочекаменную болезнь или недавнее хирургическое вмешательство. Применение антацидов, антигипертензивных средств, диуретиков, кортикостероидов, препаратов кальция, фосфора и/или витамина D также исключало возможность включения в исследование. Пациенты с травмой спинного мозга включались через 2 года и более после травмы. Все пациенты продолжали получать медицинскую помощь у своего лечащего врача; ни одна терапия не была отменена или изменена. Посевы мочи, полученные для исследования, не повлияли на тактику ухода за пациентом, так как результаты хранились в картотеке технолога-исследователя и не были доступны ни детскому терапевту, ни исследователю.Протокол был одобрен Комитетом по исследованию человека Университета Вирджинии.
Критерии исключения включали беременность, заболевания почек или печени в анамнезе, гиперкальциемию, гиперфосфатемию, мочекаменную болезнь или недавнее хирургическое вмешательство. Применение антацидов, антигипертензивных средств, диуретиков, кортикостероидов, препаратов кальция, фосфора и/или витамина D также исключало возможность включения в исследование. Пациенты с травмой спинного мозга включались через 2 года и более после травмы. Все пациенты продолжали получать медицинскую помощь у своего лечащего врача; ни одна терапия не была отменена или изменена. Посевы мочи, полученные для исследования, не повлияли на тактику ухода за пациентом, так как результаты хранились в картотеке технолога-исследователя и не были доступны ни детскому терапевту, ни исследователю.Протокол был одобрен Комитетом по исследованию человека Университета Вирджинии.
Каждый пациент наблюдался в течение 4 недель: 1 неделя до приема добавок, 2 недели приема добавок и 1 неделя после приема добавок. Пациенты были проинструктированы о приготовлении добавки и измерении рН мочи до начала исследования.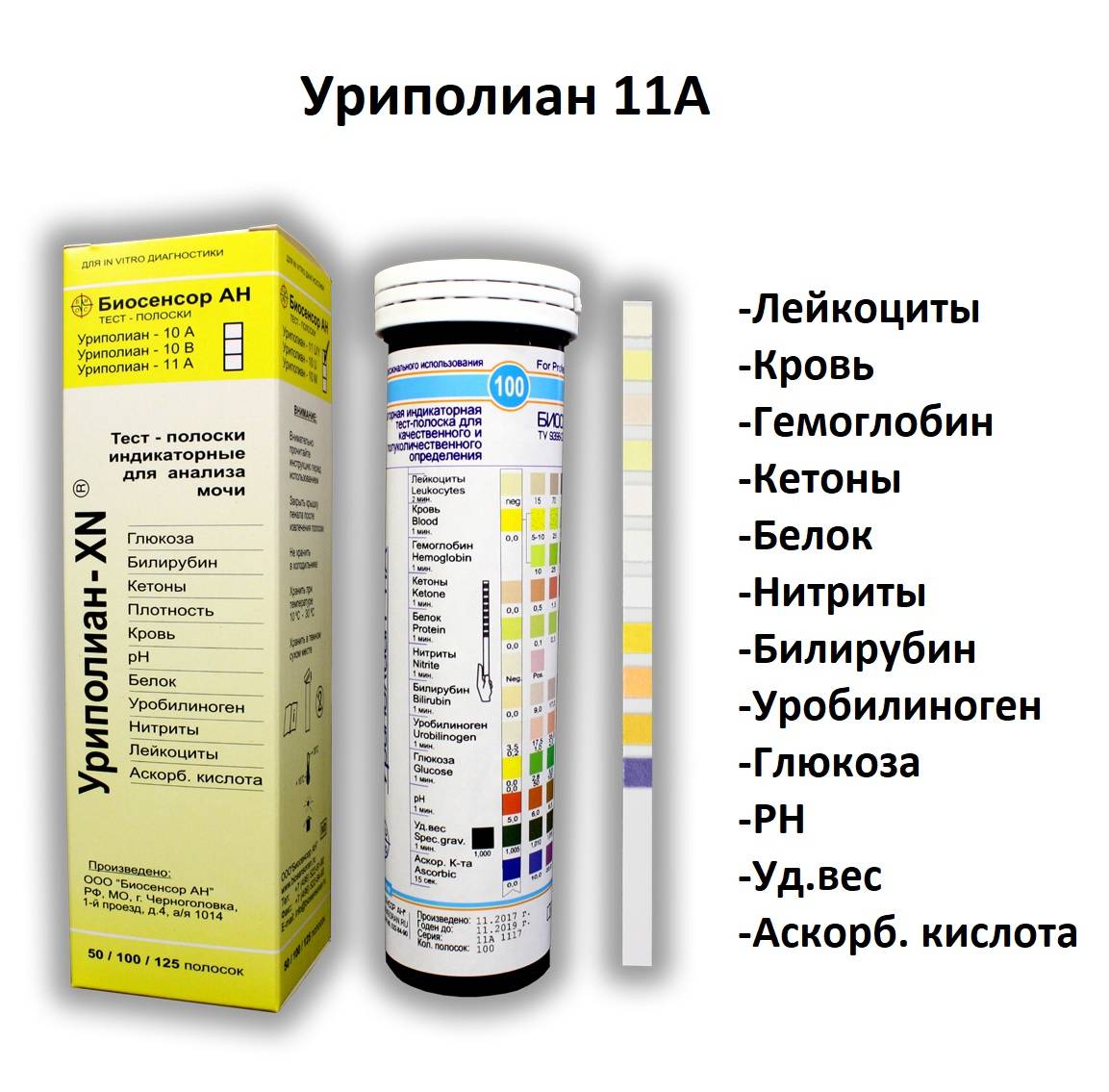 В течение первой недели пациент регистрировал рН мочи три раза в день: первая утренняя проба мочи, дневная проба и вечерняя проба. Для этого собирали мочу после катетеризации для мочеиспускания.Индикаторную полоску рН (colorpHast®, EM Science, Гиббстаун, Нью-Джерси, США) погружали в мочу, затем через 1 мин считывали показания в соответствии с цветом полоски. Затем регистрировали рН, обозначенный цветом. На второй и третьей неделе больной продолжал регистрировать рН мочи трижды в сутки. Кроме того, пациент пил фосфорную добавку (Neutra-phos®, Alza Pharmaceuticals, Маунтин-Вью, Калифорния, США) три раза в день (утром, днем и вечером). Фосфорная добавка представляла собой порошкообразный концентрат, поставляемый в пакетах.Каждый пакет содержал 240 мг фосфора, 164 мг натрия и 278 мг калия. Для приема внутрь пакет открывали и порошок смешивали с 3 унциями воды; затем смесь сразу же принимали внутрь. На четвертой неделе больной не принимал фосфорную добавку, но продолжал регистрировать рН мочи три раза в день.
В течение первой недели пациент регистрировал рН мочи три раза в день: первая утренняя проба мочи, дневная проба и вечерняя проба. Для этого собирали мочу после катетеризации для мочеиспускания.Индикаторную полоску рН (colorpHast®, EM Science, Гиббстаун, Нью-Джерси, США) погружали в мочу, затем через 1 мин считывали показания в соответствии с цветом полоски. Затем регистрировали рН, обозначенный цветом. На второй и третьей неделе больной продолжал регистрировать рН мочи трижды в сутки. Кроме того, пациент пил фосфорную добавку (Neutra-phos®, Alza Pharmaceuticals, Маунтин-Вью, Калифорния, США) три раза в день (утром, днем и вечером). Фосфорная добавка представляла собой порошкообразный концентрат, поставляемый в пакетах.Каждый пакет содержал 240 мг фосфора, 164 мг натрия и 278 мг калия. Для приема внутрь пакет открывали и порошок смешивали с 3 унциями воды; затем смесь сразу же принимали внутрь. На четвертой неделе больной не принимал фосфорную добавку, но продолжал регистрировать рН мочи три раза в день. Во время исследования каждого пациента посещали два раза в неделю на дому. При каждом посещении проверяли подсчет пакетов и запись рН мочи для оценки соблюдения режима лечения. Кроме того, образец мочи из мочевого пузыря, собранный для посева во время обычного CIC в день визита, немедленно охлаждали и помещали на планшеты в течение 10 часов.Положительный посев мочи (бактериурия) определялся как ⩾10 4 колониеобразующих единиц возбудителя на миллилитр мочи, как описано ранее. 1
Во время исследования каждого пациента посещали два раза в неделю на дому. При каждом посещении проверяли подсчет пакетов и запись рН мочи для оценки соблюдения режима лечения. Кроме того, образец мочи из мочевого пузыря, собранный для посева во время обычного CIC в день визита, немедленно охлаждали и помещали на планшеты в течение 10 часов.Положительный посев мочи (бактериурия) определялся как ⩾10 4 колониеобразующих единиц возбудителя на миллилитр мочи, как описано ранее. 1
Механистическое моделирование PBPK влияния pH мочи на почечную и системную диспозицию метамфетамина и амфетамина
Abstract
Влияние рН мочи на почечную экскрецию и системную диспозицию наблюдалось для многих лекарств и метаболитов. При изменении pH мочи канальцевая ионизация, пассивная реабсорбция, почечный клиренс и системное воздействие лекарств и метаболитов могут резко измениться, вызывая клинически значимые опасения.Удивительно, но влияние pH мочи на утилизацию лекарств на людях обычно не изучается, а регулирующие органы не разработали руководства по этому вопросу и не требуют от промышленности проведения соответствующих испытаний на людях. В этом исследовании мы предположили, что моделирование фармакокинетики на физиологической основе (PBPK) может быть использовано в качестве экономически эффективного метода для изучения потенциального влияния pH мочи на распределение лекарств и метаболитов. Наша ранее разработанная и проверенная механистическая модель почек была интегрирована с моделью PBPK всего тела для имитации почечного клиренса и площади под кривой зависимости концентрации в плазме от времени (AUC) при различных состояниях pH мочи с использованием метамфетамина и амфетамина в качестве модельных соединений.Мы впервые разработали и проверили модели наркотиков для метамфетамина и амфетамина в условиях нормального pH мочи [абсолютная средняя кратная ошибка (AAFE) <1,25 на уровне исследования]. Затем были смоделированы кислотные и щелочные сценарии мочи. Результаты нашего моделирования показывают, что профили почечной экскреции и концентрации в плазме для метамфетамина и амфетамина могут быть воспроизведены при различном рН мочи (AAFE <2 на индивидуальном уровне).
В этом исследовании мы предположили, что моделирование фармакокинетики на физиологической основе (PBPK) может быть использовано в качестве экономически эффективного метода для изучения потенциального влияния pH мочи на распределение лекарств и метаболитов. Наша ранее разработанная и проверенная механистическая модель почек была интегрирована с моделью PBPK всего тела для имитации почечного клиренса и площади под кривой зависимости концентрации в плазме от времени (AUC) при различных состояниях pH мочи с использованием метамфетамина и амфетамина в качестве модельных соединений.Мы впервые разработали и проверили модели наркотиков для метамфетамина и амфетамина в условиях нормального pH мочи [абсолютная средняя кратная ошибка (AAFE) <1,25 на уровне исследования]. Затем были смоделированы кислотные и щелочные сценарии мочи. Результаты нашего моделирования показывают, что профили почечной экскреции и концентрации в плазме для метамфетамина и амфетамина могут быть воспроизведены при различном рН мочи (AAFE <2 на индивидуальном уровне). Модель метамфетамина-амфетамина исходного метаболита PBPK всего тела также успешно имитировала профили зависимости концентрации амфетамина в плазме от времени (AAFE < 1.25 на уровне исследования) и соотношения концентраций амфетамина/метамфетамина в моче (AAFE <2 на индивидуальном уровне) после приема метамфетамина. Это демонстрирует, что наша механистическая модель PBPK может предсказывать влияние pH мочи на системное и мочевое распределение лекарств и метаболитов.
Модель метамфетамина-амфетамина исходного метаболита PBPK всего тела также успешно имитировала профили зависимости концентрации амфетамина в плазме от времени (AAFE < 1.25 на уровне исследования) и соотношения концентраций амфетамина/метамфетамина в моче (AAFE <2 на индивидуальном уровне) после приема метамфетамина. Это демонстрирует, что наша механистическая модель PBPK может предсказывать влияние pH мочи на системное и мочевое распределение лекарств и метаболитов.
ЗАЯВЛЕНИЕ О ЗНАЧИМОСТИ Наше исследование показывает, что объединение механистической почечной модели с физиологически обоснованной фармакокинетической моделью всего организма может прогнозировать величину изменения почечной экскреции и площади под кривой зависимости концентрации в плазме от времени (AUC) лекарств и метаболитов при изменении pH мочи. изменен.Это обеспечивает экономичный метод оценки вероятности изменения почечной и системной диспозиции из-за изменения рН мочи. Это важно, потому что многие лекарства и заболевания могут изменять рН мочи, что приводит к количественным и клинически значимым изменениям в распределении лекарств и метаболитов, что может потребовать корректировки терапии.
Введение
Влияние рН мочи на почечный клиренс слабых кислот и оснований было обнаружено более полувека назад в исследованиях салициловой кислоты (Macpherson et al., 1955) и метамфетамин (Beckett and Rowland, 1965c). Считается, что механизм этого явления заключается в измененном статусе ионизации слабых кислот и оснований с изменением pH фильтрата почечных канальцев и последующими изменениями пассивной реабсорбции неионизированных лекарств в почках (Milne et al., 1958; Tucker, 1981). Изменения в почечной пассивной реабсорбции могут иметь сильное влияние на почечный клиренс. Например, при снижении pH мочи со щелочного (pH ≈ 7,5–8,5) до кислого (pH ≈ 4,5–5,5) количество препарата, выделяемого в неизмененном виде с мочой для слабых оснований, таких как петидин, метамфетамин и мексилетин, увеличивалось до в 21 раз (Chan, 1979), в 48 раз (Beckett and Rowland, 1965c) и в 87 раз (Kiddie et al., 1974), соответственно, тогда как почечный клиренс слабых кислот, таких как хлорпропамид (Neuvonen and Kärkkäinen, 1983) и салициловая кислота (Macpherson et al. , 1955), снижался на 99% и 97% соответственно. Кроме того, после приема имипрамина, метамфетамина и амитриптилина их соответствующие метаболиты, дезипрамин, амфетамин и нортриптилин, показали увеличение в 5 раз (Gram et al., 1971), в 11 раз (Beckett and Rowland, 1965b). и 93-кратное (Kärkkäinen and Neuvonen, 1986) увеличение экскреции с мочой, соответственно, при кислой реакции мочи по сравнению с щелочной.Эти данные демонстрируют ярко выраженное и широкое значение влияния pH мочи как на лекарства, так и на их метаболиты.
, 1955), снижался на 99% и 97% соответственно. Кроме того, после приема имипрамина, метамфетамина и амитриптилина их соответствующие метаболиты, дезипрамин, амфетамин и нортриптилин, показали увеличение в 5 раз (Gram et al., 1971), в 11 раз (Beckett and Rowland, 1965b). и 93-кратное (Kärkkäinen and Neuvonen, 1986) увеличение экскреции с мочой, соответственно, при кислой реакции мочи по сравнению с щелочной.Эти данные демонстрируют ярко выраженное и широкое значение влияния pH мочи как на лекарства, так и на их метаболиты.
В целом примерно 31% продаваемых лекарств выводятся через почки в неизмененном виде (Varma et al., 2009), а 70% продаваемых лекарств представляют собой либо моноосновные слабые кислоты, либо моноосновные слабые основания (Manallack, 2007), которые могут иметь различные состояния ионизации в просвете канальцев. Кроме того, средний показатель LogP запатентованных соединений в 18 фармацевтических компаниях варьировался от 3.от 5 до 4,5 (Leeson and St-Gallay, 2011), что свидетельствует о том, что большинство лекарств обладают внутренней липофильностью от умеренной до высокой и, следовательно, трансцеллюлярной проницаемостью. В совокупности эти данные свидетельствуют о том, что многие препараты потенциально подвержены значительному почечному клиренсу и эффективной почечной пассивной реабсорбции, которая может быть изменена из-за изменений рН мочи. Таким образом, изменчивость почечного клиренса в зависимости от pH мочи может быть неожиданно распространенной. Действительно, было показано, что более дюжины лекарственных препаратов имеют почечную экскрецию, зависящую от рН мочи (Macpherson et al., 1955; Беккет и Роуленд, 1965a,c; Герхардт и др., 1969; Шарпстоун, 1969; Sjöqvist и др., 1969; Грам и др., 1971; Кидди и др., 1974; Чан, 1979; Neuvonen and Kärkkainen, 1983; Мухиддин и др., 1984; Беновиц и Джейкоб, 1985; Аоки и Ситар, 1988 г .; Фройденталер и др., 1998). Если почечная экскреция является важным путем элиминации интересующего лекарственного средства, изменение pH мочи также будет влиять на системное распределение лекарственного средства. Например, для слабых оснований мемантина и флекаинида площадь под кривой зависимости концентрации в плазме от времени (AUC 0-inf ) увеличилась на 5.
В совокупности эти данные свидетельствуют о том, что многие препараты потенциально подвержены значительному почечному клиренсу и эффективной почечной пассивной реабсорбции, которая может быть изменена из-за изменений рН мочи. Таким образом, изменчивость почечного клиренса в зависимости от pH мочи может быть неожиданно распространенной. Действительно, было показано, что более дюжины лекарственных препаратов имеют почечную экскрецию, зависящую от рН мочи (Macpherson et al., 1955; Беккет и Роуленд, 1965a,c; Герхардт и др., 1969; Шарпстоун, 1969; Sjöqvist и др., 1969; Грам и др., 1971; Кидди и др., 1974; Чан, 1979; Neuvonen and Kärkkainen, 1983; Мухиддин и др., 1984; Беновиц и Джейкоб, 1985; Аоки и Ситар, 1988 г .; Фройденталер и др., 1998). Если почечная экскреция является важным путем элиминации интересующего лекарственного средства, изменение pH мочи также будет влиять на системное распределение лекарственного средства. Например, для слабых оснований мемантина и флекаинида площадь под кривой зависимости концентрации в плазме от времени (AUC 0-inf ) увеличилась на 5. в 3 раза (Freudenthaler et al., 1998) и в 3,6 раза (Muhiddin et al., 1984) соответственно, тогда как для слабых кислот хиноксацина и хлорпропамида AUC 0-inf в плазме снижалась на 67% (Barbhaiya et al. ., 1982) и 81% (Neuvonen and Kärkkäinen, 1983) соответственно при щелочном состоянии мочи по сравнению с кислым состоянием мочи. Это показывает, что величина влияния pH мочи на AUC плазмы может быть столь же значительной, как и взаимодействие между лекарствами в результате совместного введения с сильным ингибитором или индуктором (т.д., AUC увеличилась в 5 раз или уменьшилась на 80%).
в 3 раза (Freudenthaler et al., 1998) и в 3,6 раза (Muhiddin et al., 1984) соответственно, тогда как для слабых кислот хиноксацина и хлорпропамида AUC 0-inf в плазме снижалась на 67% (Barbhaiya et al. ., 1982) и 81% (Neuvonen and Kärkkäinen, 1983) соответственно при щелочном состоянии мочи по сравнению с кислым состоянием мочи. Это показывает, что величина влияния pH мочи на AUC плазмы может быть столь же значительной, как и взаимодействие между лекарствами в результате совместного введения с сильным ингибитором или индуктором (т.д., AUC увеличилась в 5 раз или уменьшилась на 80%).
Учитывая количество известных лекарственных препаратов, на которые влияет рН мочи, и существенную величину наблюдаемого влияния рН мочи на диспозицию наркотиков и метаболитов, поразительно, что влияние рН мочи на диспозицию наркотиков и метаболитов в почках и системных организмах обычно не исследуется на наличие слабых кислот и основаны на клинических исследованиях, и регулирующие органы не разработали руководств по оценке безопасности лекарств при различных pH мочи. Напротив, характеристика взаимодействий между лекарственными средствами, воздействия пищевых продуктов и влияния болезней на утилизацию лекарств требуется регулирующими органами как неотъемлемые компоненты процесса утверждения лекарств, и эти взаимодействия и эффекты были широко исследованы на людях и смоделированы с помощью моделей (Shebley). и другие., 2018) для поддержки принятия регулирующих решений.
Напротив, характеристика взаимодействий между лекарственными средствами, воздействия пищевых продуктов и влияния болезней на утилизацию лекарств требуется регулирующими органами как неотъемлемые компоненты процесса утверждения лекарств, и эти взаимодействия и эффекты были широко исследованы на людях и смоделированы с помощью моделей (Shebley). и другие., 2018) для поддержки принятия регулирующих решений.
В этом исследовании мы выдвинули гипотезу о том, что методы моделирования могут быть использованы для понимания и прогнозирования влияния рН мочи на распределение наркотиков и метаболитов. Чтобы проверить эту гипотезу, недавно разработанная и проверенная динамическая физиологически обоснованная механистическая модель почек (Huang and Isoherranen, 2018) была интегрирована в модель родительского метаболита на физиологической основе фармакокинетики всего тела (PBPK) (Huang and Isoherranen, 2020) для имитации мочи. pH-зависимое системное распределение исходного метаболита и экскреция с мочой с использованием метамфетамина и амфетамина в качестве модельных соединений.
Материалы и методы
Разработка структурной модели исходно-метаболитного PBPK всего тела с механистической моделью почки и местом отбора проб периферической вены руки.
104-компонентная модель родительского метаболита (52 отсека для каждого) PBPK всего тела была разработана с использованием MATLAB и платформы Simulink (R2018a; MathWorks, Natick, MA) путем слияния нашей ранее опубликованной механистической модели почки (Huang and Isoherranen, 2018). ) с моделью PBPK всего тела исходного метаболита (Huang and Isoherranen, 2020), как показано на рис.1. Эта модель содержит 10 физиологически важных компартментов тканей/органов, смоделированных как органы с ограниченной скоростью перфузии, два компартмента кровообращения (т. е. центральный венозный компартмент и центральный артериальный компартмент), место взятия пробы периферической вены руки, как описано ранее (Huang and Isoherranen, 2020), двухкамерная модель печени с ограниченной скоростью проницаемости и 35-камерная механистическая модель почки (Huang and Isoherranen, 2018). Механистическая модель почки была включена для замены обычного почечного компартмента с ограниченной скоростью перфузии и для регистрации несвязанной фильтрации, активной секреции и канальцевого фильтрата/pH мочи пассивной реабсорбции.Механистическую модель почки объединили с моделью PBPK, соединив центральный артериальный отдел с клубочком для создания почечного притока и соединив сосудистый отдел последнего подсегмента собирательного протока с центральным венозным отделом для создания почечного оттока. Файл модели и сценарий кода предоставляются в качестве дополнительных материалов.
Механистическая модель почки была включена для замены обычного почечного компартмента с ограниченной скоростью перфузии и для регистрации несвязанной фильтрации, активной секреции и канальцевого фильтрата/pH мочи пассивной реабсорбции.Механистическую модель почки объединили с моделью PBPK, соединив центральный артериальный отдел с клубочком для создания почечного притока и соединив сосудистый отдел последнего подсегмента собирательного протока с центральным венозным отделом для создания почечного оттока. Файл модели и сценарий кода предоставляются в качестве дополнительных материалов.
Структура разработанной механистической интегрированной в почки модели родительского метаболита PBPK всего тела. Схематическое представление физиологически обоснованной фармакокинетической модели исходного метаболита с включенной механистической моделью почек и местом отбора проб периферической вены руки.Почечная артерия, соединяющая центральную артерию со входом в механистическую модель почки, показана красными пунктирными линиями. Почечная вена, которая соединяет выход механистической модели почки с центральным венозным компартментом, показана синими пунктирными линиями. Опосредованная транспортером активная секреция или активная реабсорбция показаны черными пунктирными стрелками. Двунаправленная пассивная диффузия, зависящая от рН, показана двойными стрелками. Места забора периферических вен рук показаны оранжевым цветом, а анастомозы предплечья показаны пурпурным цветом.Внутривенная и пероральная дозировка показаны зеленым цветом. СКФ — скорость клубочковой фильтрации; i — количество подсегментов, на которые делится каждый сегмент; М, метаболит; П, родитель; Q почки , почечный кровоток; Q моча , поток образования мочи.
Почечная вена, которая соединяет выход механистической модели почки с центральным венозным компартментом, показана синими пунктирными линиями. Опосредованная транспортером активная секреция или активная реабсорбция показаны черными пунктирными стрелками. Двунаправленная пассивная диффузия, зависящая от рН, показана двойными стрелками. Места забора периферических вен рук показаны оранжевым цветом, а анастомозы предплечья показаны пурпурным цветом.Внутривенная и пероральная дозировка показаны зеленым цветом. СКФ — скорость клубочковой фильтрации; i — количество подсегментов, на которые делится каждый сегмент; М, метаболит; П, родитель; Q почки , почечный кровоток; Q моча , поток образования мочи.
Физико-химические параметры метамфетамина и амфетамина.
В этом исследовании обсуждаются только правовращающие изомеры метамфетамина и амфетамина [то есть S(+)-метамфетамин и S(+)-амфетамин] из-за их большей психоактивной активности по сравнению с l -изомерами. Молекулярная масса, pK a и значения LogP метамфетамина (Meth) и амфетамина (Amph) были получены с сайта www.drugbank.ca. Несвязанные фракции плазмы (f u, p ) метамфетамина и амфетамина определяли в объединенной плазме человека с помощью ультрацентрифугирования, как описано ранее (Shirasaka et al., 2013). Вкратце, в объединенную человеческую плазму добавляли метамфетамин и амфетамин до конечной концентрации 0,2 мкМ. Три аликвоты по 200 мкл центрифугировали в 435 000 г в течение 90 минут при 37°С, а еще три аликвоты по 200 мкл инкубировали при 37°С в течение 90 минут.Супернатант (50 мкл) после ультрацентрифугирования и инкубированные образцы (50 мкл) затем гасили 250 мкл смеси 3:1 (об/об) ацетонитрил:метанол, содержащей 100 нМ метамфетамина-d 11 и амфетамина-d 11 в качестве внутренних стандартов и проанализированы с помощью ЖХ-МС/МС, как описано ранее (Wagner et al., 2017). Эксперименты проводились трижды в два отдельных дня. Несвязанную плазменную фракцию за каждый день рассчитывали как отношение средней свободной концентрации (C u ) в супернатанте (после ультрацентрифугирования) к средней общей концентрации (C) в плазме (после инкубации).
Молекулярная масса, pK a и значения LogP метамфетамина (Meth) и амфетамина (Amph) были получены с сайта www.drugbank.ca. Несвязанные фракции плазмы (f u, p ) метамфетамина и амфетамина определяли в объединенной плазме человека с помощью ультрацентрифугирования, как описано ранее (Shirasaka et al., 2013). Вкратце, в объединенную человеческую плазму добавляли метамфетамин и амфетамин до конечной концентрации 0,2 мкМ. Три аликвоты по 200 мкл центрифугировали в 435 000 г в течение 90 минут при 37°С, а еще три аликвоты по 200 мкл инкубировали при 37°С в течение 90 минут.Супернатант (50 мкл) после ультрацентрифугирования и инкубированные образцы (50 мкл) затем гасили 250 мкл смеси 3:1 (об/об) ацетонитрил:метанол, содержащей 100 нМ метамфетамина-d 11 и амфетамина-d 11 в качестве внутренних стандартов и проанализированы с помощью ЖХ-МС/МС, как описано ранее (Wagner et al., 2017). Эксперименты проводились трижды в два отдельных дня. Несвязанную плазменную фракцию за каждый день рассчитывали как отношение средней свободной концентрации (C u ) в супернатанте (после ультрацентрифугирования) к средней общей концентрации (C) в плазме (после инкубации). Среднее значение двух экспериментов использовалось как окончательное f u,p .
Среднее значение двух экспериментов использовалось как окончательное f u,p .
Соотношение метамфетамина и амфетамина в крови и плазме определяли экспериментально, как описано ранее (Sager et al., 2016). Метамфетамин и амфетамин добавляли в 3 мл свежей крови человека до конечной концентрации 0,2 мкМ. Отбирали три аликвоты по 700 мкл и инкубировали в течение 2 часов при 37°С для уравновешивания разделения крови. Образцы крови (60 мкл) собирали после инкубации для измерения концентрации в крови, оставшиеся образцы центрифугировали в 1000 g в течение 10 минут для отделения плазмы, и образец плазмы (60 мкл) собирали для измерения концентрации в плазме.Затем образцы крови и плазмы (60 мкл) гасили 120 мкл метанола, содержащего 100 нМ метамфетамина-d 11 и амфетамина-d 11 в качестве внутренних стандартов, и анализировали с помощью ЖХ-МС/МС, как описано ранее (Wagner et al. др., 2017). Эксперименты проводились трижды в два отдельных дня, и отношение крови к плазме рассчитывали как отношение концентрации в образце крови к концентрации в образце плазмы. Среднее значение двух экспериментов использовали в качестве окончательного отношения крови к плазме.
Среднее значение двух экспериментов использовали в качестве окончательного отношения крови к плазме.
Клеточная проницаемость метамфетамина и амфетамина измерялась с использованием клеток почки собак Madin-Darby (MDCK) (Американская коллекция типовых культур CCL-34, пассажи 10–15). Клетки культивировали в модифицированной по Дульбекко среде Игла с добавлением 10 % FBS, 4,5 г/л глюкозы и 1 % пенициллина/стрептомицина при 37°C с 5 % CO 2 во влажной атмосфере. Клетки высевали с плотностью примерно 6,5 × 10 4 клеток/см 2 на 24-луночные планшеты Transwell с 0.Вставки с размером пор 4 мкм. Через 96 часов после посева клетки использовали для анализа проницаемости. Для предварительной инкубации апикальную и базолатеральную камеры сначала дважды промывали теплым сбалансированным солевым раствором Хенкса (HBSS) с pH 7,2, а затем проводили акклиматизацию к HBSS в течение 15 минут. Целостность мембран подтверждали измерениями трансэпителиального электрического сопротивления, а монослои со значениями ниже 200 Ом × см 2 исключали из исследования. Транспортный анализ начинали путем замены буфера либо на апикальной, либо на базолатеральной стороне тестовыми растворами (200 мкл апикальной и 800 мкл базолатеральной донорских камер), содержащими 1 мкМ метамфетамина или амфетамина в HBSS (pH 7.2). Образцы 100 мкл среды из приемной камеры отбирали через 0, 20, 40, 60, 90 и 120 минут для анализа методом ЖХ-МС/МС с использованием ранее опубликованного метода (Wagner et al., 2017). Очевидную проницаемость (P , приложение ) метамфетамина и амфетамина через клеточные монослои рассчитывали, используя уравнение. 1:(1), где A — площадь поверхности мембраны (см 2 ) вставного фильтра, C 0 — начальная концентрация соединения в донорной камере (микромоляры) и dQ/dt (микромоль в секунду). ) представляет собой наклон линии линейной регрессии измеренного количества наркотика в приемной камере (Q) в зависимости от времени (t) и представляет собой количество метамфетамина или амфетамина, которое пересекает монослой в единицу времени.
Транспортный анализ начинали путем замены буфера либо на апикальной, либо на базолатеральной стороне тестовыми растворами (200 мкл апикальной и 800 мкл базолатеральной донорских камер), содержащими 1 мкМ метамфетамина или амфетамина в HBSS (pH 7.2). Образцы 100 мкл среды из приемной камеры отбирали через 0, 20, 40, 60, 90 и 120 минут для анализа методом ЖХ-МС/МС с использованием ранее опубликованного метода (Wagner et al., 2017). Очевидную проницаемость (P , приложение ) метамфетамина и амфетамина через клеточные монослои рассчитывали, используя уравнение. 1:(1), где A — площадь поверхности мембраны (см 2 ) вставного фильтра, C 0 — начальная концентрация соединения в донорной камере (микромоляры) и dQ/dt (микромоль в секунду). ) представляет собой наклон линии линейной регрессии измеренного количества наркотика в приемной камере (Q) в зависимости от времени (t) и представляет собой количество метамфетамина или амфетамина, которое пересекает монослой в единицу времени. Эксперименты проводились как для апикально-базолатерального, так и для базолатерально-апикального направлений в двух повторах в три отдельных дня. В качестве конечной кажущейся проницаемости использовали среднее значение P app , измеренное в обоих направлениях в трех экспериментах. Подробные результаты показаны на дополнительных рисунках. 1 и 2.
Эксперименты проводились как для апикально-базолатерального, так и для базолатерально-апикального направлений в двух повторах в три отдельных дня. В качестве конечной кажущейся проницаемости использовали среднее значение P app , измеренное в обоих направлениях в трех экспериментах. Подробные результаты показаны на дополнительных рисунках. 1 и 2.
Разработка модели PBPK для метамфетамина и амфетамина.
Общий рабочий процесс для разработки и проверки модели показан на рис. 2. Для разработки модели лекарственного средства клинические фармакокинетические данные метамфетамина и амфетамина у людей были собраны из базы данных Национального центра биотехнологической информации (http://www. .ncbi.nlm.nih.gov/pubmed) по состоянию на 1 января 2019 г. Ключевые слова для поиска: «метамфетамин ИЛИ амфетамин И фармакокинетика». Один внутривенный (Li et al., 2010) и два набора данных перорально (Rowland, 1969; CDER, 2001) использовались в качестве обучающих наборов для разработки моделей метамфетамина и амфетамина соответственно. Семь (шесть внутривенных и один пероральный) и два (оба пероральных) набора данных опубликованы в шести исследованиях (Perez-Reyes et al., 1991; Cook et al., 1993; Mendelson et al., 1995, 2006; CDER, 2002; Harris et al., 2003) использовались в качестве тестовых наборов для проверки разработанных моделей PBPK для метамфетамина и амфетамина соответственно.Подробная информация об исследуемых популяциях и дизайнах исследований для всех использованных наборов данных обобщена в дополнительной таблице 1. Кривые зависимости концентрации в плазме от времени и профили экскреции с мочой из этих исследований были оцифрованы с использованием WebPlotDigitizer (версия 4.2, https://automeris.io/). WebPlotDigitizer).
Семь (шесть внутривенных и один пероральный) и два (оба пероральных) набора данных опубликованы в шести исследованиях (Perez-Reyes et al., 1991; Cook et al., 1993; Mendelson et al., 1995, 2006; CDER, 2002; Harris et al., 2003) использовались в качестве тестовых наборов для проверки разработанных моделей PBPK для метамфетамина и амфетамина соответственно.Подробная информация об исследуемых популяциях и дизайнах исследований для всех использованных наборов данных обобщена в дополнительной таблице 1. Кривые зависимости концентрации в плазме от времени и профили экскреции с мочой из этих исследований были оцифрованы с использованием WebPlotDigitizer (версия 4.2, https://automeris.io/). WebPlotDigitizer).
Общий рабочий процесс для разработки и проверки модели метамфетамина и амфетамина PBPK исходного метаболита всего тела для моделирования рН-зависимого системного распределения мочи и экскреции с мочой.AAFE, абсолютная средняя кратная ошибка; B/P, отношение крови к плазме; CL iv , общий клиренс тела, измеренный после внутривенного введения дозы; CL po , общий клиренс из организма, измеренный после перорального приема; CL r , почечный клиренс; M/P, отношение метаболита к исходному веществу; P и приложение , экспериментально определенная кажущаяся клеточная проницаемость; ПЭТ, позитронно-эмиссионная томография.
При пероральном всасывании как метамфетамина, так и амфетамина предполагалось, что соединения в просвете желудочно-кишечного тракта полностью растворяются и равномерно распределяются внутри отсека просвета сразу после перорального приема.Предполагалось, что всасывание лекарственного средства из просвета в кишечную кровь регулируется одной константой скорости всасывания, которая была установлена достаточно высокой, чтобы общее всасывание ограничивалось кишечным кровотоком. Это было основано на высокой растворимости в воде [928 и 1740 мг/л (www.drugbank.ca)] и высокой проницаемости метамфетамина и амфетамина. Метаболизм метамфетамина и амфетамина в кишечнике считался незначительным, поскольку оба препарата имеют низкие коэффициенты экстракции в печени, главным образом опосредованные CYP2D6, а экспрессия CYP2D6 в кишечнике невысока (Paine et al., 2006). Таким образом, фракция, всосавшаяся (F a ) и фракция, ускользнувшая из кишечника (F g ), были приняты равными 1.
Для физиологической модели системные параметры, включая физический объем и кровоток для каждого органа/ткани были взяты из литературы (Brown et al., 1997). Коэффициенты распределения ткани и плазмы (K p ) для мозга, желудочно-кишечного тракта, сердца, почек, печени, легких, поджелудочной железы и селезенки для метамфетамина были рассчитаны на основе опубликованного исследования позитронно-эмиссионной томографии человека (Volkow et al., 2010), в то время как значения K p для жировой ткани, костей, мышц и кожи были оптимизированы, поскольку K p = 3 на основе наблюдаемого объема распределения метамфетамина в равновесном состоянии (V ss ) 4,02 л/кг. (Харрис и др., 2003). Из-за структурного сходства между метамфетамином и амфетамином для амфетамина были установлены специфические для внутренних органов значения K p (т. е. K p для головного мозга, желудочно-кишечного тракта, сердца, почек, печени, легких, поджелудочной железы и селезенки).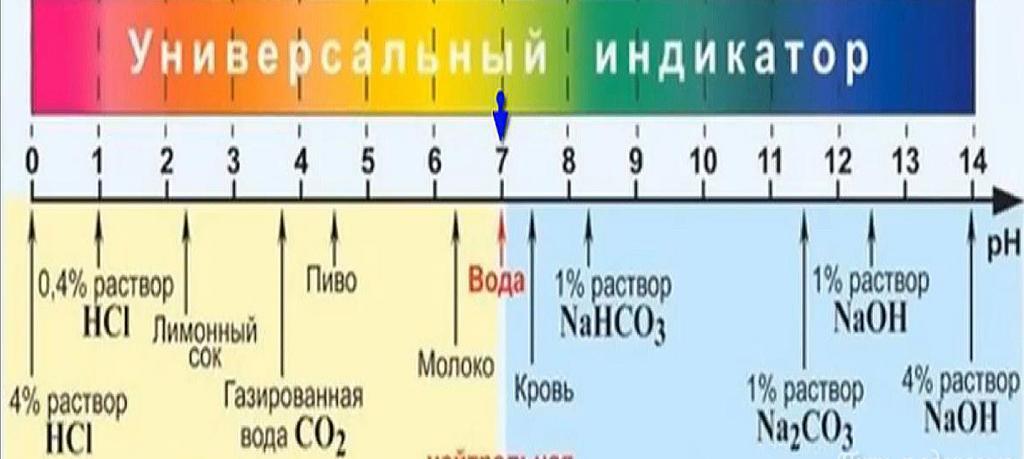 то же, что метамфетамин.Основываясь на более высокой полярности амфетамина по сравнению с метамфетамином, тканеспецифические значения K p для жировой ткани, костей, мышц и кожи были установлены равными 2 для амфетамина, в результате чего прогнозируемый V ss составил 3,14 л/кг. по сравнению с наблюдаемым кажущимся V ss в диапазоне от 3,2 до 5,6 л/кг после перорального приема (Randall, 2004).
то же, что метамфетамин.Основываясь на более высокой полярности амфетамина по сравнению с метамфетамином, тканеспецифические значения K p для жировой ткани, костей, мышц и кожи были установлены равными 2 для амфетамина, в результате чего прогнозируемый V ss составил 3,14 л/кг. по сравнению с наблюдаемым кажущимся V ss в диапазоне от 3,2 до 5,6 л/кг после перорального приема (Randall, 2004).
Печеночный клиренс метамфетамина и амфетамина был смоделирован на основе данных in vivo человека. Метамфетамин имеет наблюдаемый системный клиренс 18.0 л/ч (Li et al., 2010) и наблюдаемый почечный клиренс 8,09 л/ч (Li et al., 2010) после внутривенного введения. Наблюдаемый пероральный клиренс амфетамина составляет 15,8 л/ч (CDER, 2001), а наблюдаемый почечный клиренс — 7,14 л/ч (Rowland, 1969). В результате печеночный клиренс метамфетамина и амфетамина был рассчитан как 9,91 и 7,41 л/ч соответственно, исходя из предположения, что F a и F g равны 1 для амфетамина.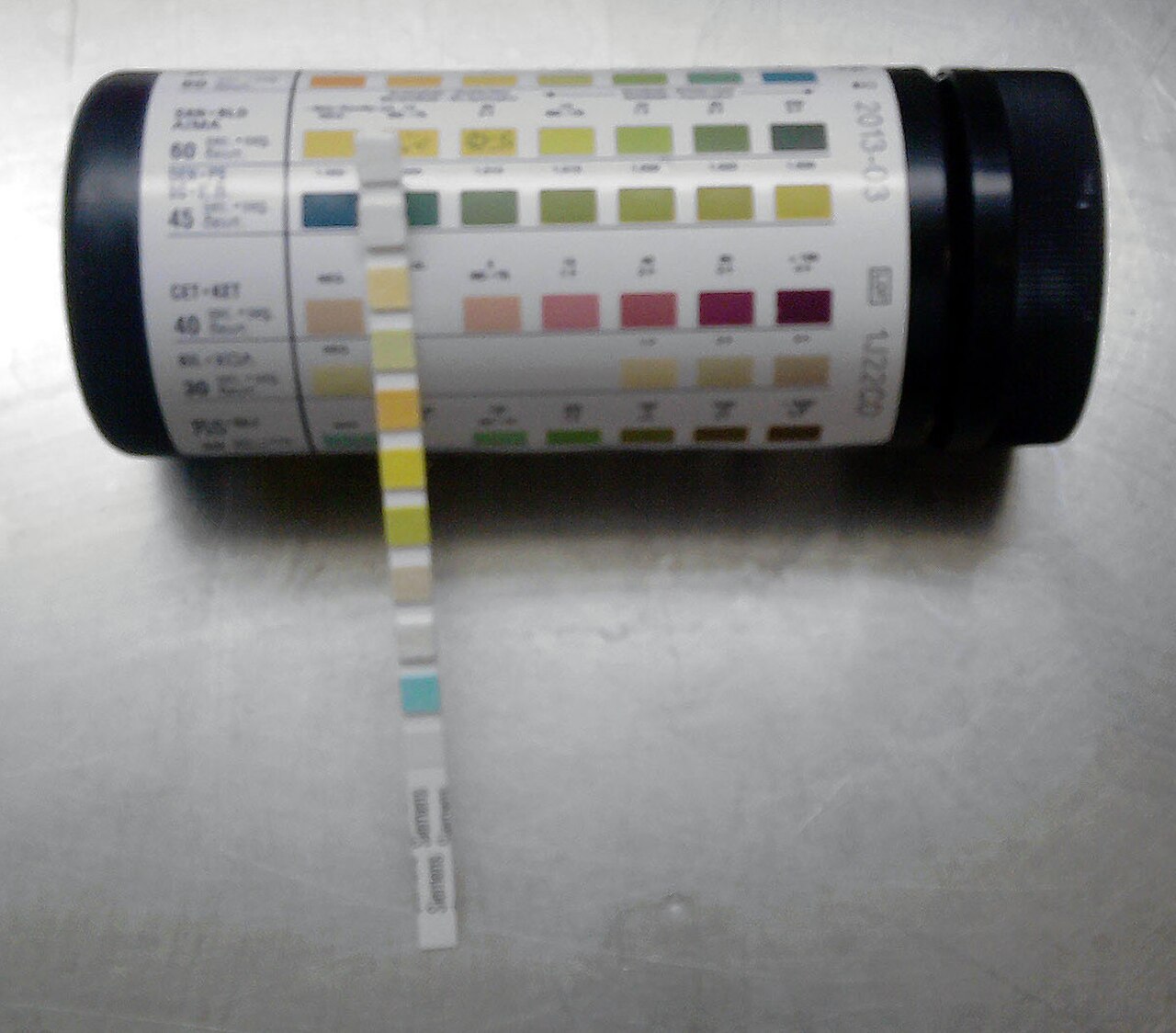 Внутренний метаболический клиренс метамфетамина и амфетамина был рассчитан обратно как 14.4 и 9,87 л/ч, соответственно, на основании измеренной несвязанной фракции плазмы, отношения крови к плазме и модели печеночного клиренса при хорошем перемешивании (Wilkinson and Shand, 1975).
Внутренний метаболический клиренс метамфетамина и амфетамина был рассчитан обратно как 14.4 и 9,87 л/ч, соответственно, на основании измеренной несвязанной фракции плазмы, отношения крови к плазме и модели печеночного клиренса при хорошем перемешивании (Wilkinson and Shand, 1975).
Модель механистической почки использовалась для моделирования почечного клиренса метамфетамина и амфетамина. Экспериментально определенные человеческие f u,p и проницаемость в клетках MDCK использовались в качестве входных данных модели для моделирования процессов несвязанной фильтрации и пассивной реабсорбции, как описано ранее (Huang and Isoherranen, 2018).Без учета активной секреции механистическая почечная модель предсказывала значения почечного клиренса 2,9 и 3,2 л/ч для метамфетамина и амфетамина соответственно, что было значительно ниже наблюдаемых значений [8,09 л/ч для метамфетамина (Li et al., 2010) и 7,14 л/ч для амфетамина (Rowland, 1969)]. Поэтому к механистической почечной модели был добавлен компонент активной секреции для имитации почечного клиренса метамфетамина и амфетамина на основе предыдущей характеристики метамфетамина и амфетамина как переносчиков органических катионов 2 и субстратов для экструзии множественных лекарств и токсинов (Wagner et al. , 2017). Из-за низкой достоверности количественного определения и экспрессии почечных транспортеров in vitro и in vivo клиренс активной секреции метамфетамина и амфетамина был оптимизирован по отношению к наблюдаемому почечному клиренсу [т.е. 8,09 л/ч для метамфетамина (Li et al. al., 2010) и 7,14 л/ч для амфетамина (Rowland, 1969)], предполагая одинаковую апикальную и базолатеральную секрецию и равномерное распределение активной секреции среди трех подсегментов проксимальных канальцев в модели.Все подробные физико-химические и фармакокинетические параметры, использованные в моделях, перечислены в таблице 1. место отбора проб
, 2017). Из-за низкой достоверности количественного определения и экспрессии почечных транспортеров in vitro и in vivo клиренс активной секреции метамфетамина и амфетамина был оптимизирован по отношению к наблюдаемому почечному клиренсу [т.е. 8,09 л/ч для метамфетамина (Li et al. al., 2010) и 7,14 л/ч для амфетамина (Rowland, 1969)], предполагая одинаковую апикальную и базолатеральную секрецию и равномерное распределение активной секреции среди трех подсегментов проксимальных канальцев в модели.Все подробные физико-химические и фармакокинетические параметры, использованные в моделях, перечислены в таблице 1. место отбора проб
Проверка моделей метамфетамина и амфетамина PBPK.
Все симуляции были выполнены с использованием MATLAB и платформы Simulink (R2018a; MathWorks) с тем же путем введения и тем же режимом дозирования, что и в соответствующих клинических исследованиях (дополнительная таблица 1), предполагая репрезентативную популяцию со средней физиологией. Градиент pH фильтрата почечных канальцев для репрезентативной популяции показан в дополнительной таблице 2 со значением pH мочи 6,5 в неконтролируемых (т.е. нормальных) условиях. Общий рабочий процесс разработки и проверки модели был адаптирован из предыдущих исследований (Huang et al., 2017; Cheong et al., 2019) и схематически показан на рис. 2. Для проверки модели метамфетамина были смоделированы профили зависимости концентрации метамфетамина в плазме от времени. после внутривенного и перорального введения и сравнивали с наблюдаемыми данными семи наборов тестов (шесть внутривенных и одно пероральное введение), опубликованными в пяти исследованиях (Perez-Reyes et al., 1991; Кук и др., 1993; Мендельсон и др., 1995, 2006; Харрис и др., 2003). Эти исследования не использовались при разработке моделей. Для проверки модели амфетамина профили зависимости концентрации амфетамина в плазме от времени были смоделированы после перорального приема и сопоставлены с наблюдаемыми данными из двух наборов тестовых данных (CDER, 2002), которые не использовались при разработке модели.
Градиент pH фильтрата почечных канальцев для репрезентативной популяции показан в дополнительной таблице 2 со значением pH мочи 6,5 в неконтролируемых (т.е. нормальных) условиях. Общий рабочий процесс разработки и проверки модели был адаптирован из предыдущих исследований (Huang et al., 2017; Cheong et al., 2019) и схематически показан на рис. 2. Для проверки модели метамфетамина были смоделированы профили зависимости концентрации метамфетамина в плазме от времени. после внутривенного и перорального введения и сравнивали с наблюдаемыми данными семи наборов тестов (шесть внутривенных и одно пероральное введение), опубликованными в пяти исследованиях (Perez-Reyes et al., 1991; Кук и др., 1993; Мендельсон и др., 1995, 2006; Харрис и др., 2003). Эти исследования не использовались при разработке моделей. Для проверки модели амфетамина профили зависимости концентрации амфетамина в плазме от времени были смоделированы после перорального приема и сопоставлены с наблюдаемыми данными из двух наборов тестовых данных (CDER, 2002), которые не использовались при разработке модели. Все смоделированные концентрации в плазме были отобраны из места отбора проб периферической вены руки, которое было разработано и проверено ранее (Huang and Isoherranen, 2020), чтобы соответствовать месту отбора проб в наблюдаемых фармакокинетических исследованиях.Чтобы оценить производительность модели, абсолютная средняя кратная ошибка (AAFE) была рассчитана в соответствии с уравнением. 2. Кроме того, AUC была рассчитана методом трапеций и сравнена с наблюдаемой AUC. Соотношение между смоделированной и наблюдаемой AUC было рассчитано для оценки кратной разницы между ними. Расчетное значение AAFE должно быть в пределах 1,25, а отношение AUC должно быть в пределах 0,8–1,25 (критерий приемлемости модели), чтобы моделирование считалось успешным.(2)
Все смоделированные концентрации в плазме были отобраны из места отбора проб периферической вены руки, которое было разработано и проверено ранее (Huang and Isoherranen, 2020), чтобы соответствовать месту отбора проб в наблюдаемых фармакокинетических исследованиях.Чтобы оценить производительность модели, абсолютная средняя кратная ошибка (AAFE) была рассчитана в соответствии с уравнением. 2. Кроме того, AUC была рассчитана методом трапеций и сравнена с наблюдаемой AUC. Соотношение между смоделированной и наблюдаемой AUC было рассчитано для оценки кратной разницы между ними. Расчетное значение AAFE должно быть в пределах 1,25, а отношение AUC должно быть в пределах 0,8–1,25 (критерий приемлемости модели), чтобы моделирование считалось успешным.(2)
Моделирование и проверка влияния рН мочи на почечную экскрецию и системную Утилизация метамфетамина и амфетамина.
Чтобы оценить, может ли проверенная модель PBPK всего тела быть применена для прогнозирования влияния pH мочи на профиль концентрации в плазме в зависимости от времени и экскреции метамфетамина и амфетамина с мочой, распределение метамфетамина было смоделировано при двух различных условиях pH мочи, в отличие от значения по умолчанию. неконтролируемый рН мочи (т. е. рН мочи = 6,5). Для кислого рН мочи рН канальцевого фильтрата устанавливали на ступенчатое снижение с 7,2 в первом субсегменте проксимальных канальцев до 5.0 в последнем подсегменте собирательной трубочки. Для щелочного рН мочи рН канальцевого фильтрата устанавливали ступенчатым образом с 7,4 в первом субсегменте проксимальных канальцев до 8,0 в последнем субсегменте собирательных трубочек. Подробные настройки градиента pH почечного канальцевого фильтрата, использованные в моделировании, показаны в дополнительной таблице 2.
неконтролируемый рН мочи (т. е. рН мочи = 6,5). Для кислого рН мочи рН канальцевого фильтрата устанавливали на ступенчатое снижение с 7,2 в первом субсегменте проксимальных канальцев до 5.0 в последнем подсегменте собирательной трубочки. Для щелочного рН мочи рН канальцевого фильтрата устанавливали ступенчатым образом с 7,4 в первом субсегменте проксимальных канальцев до 8,0 в последнем субсегменте собирательных трубочек. Подробные настройки градиента pH почечного канальцевого фильтрата, использованные в моделировании, показаны в дополнительной таблице 2.
Количество наркотика, выделяемого с мочой в зависимости от времени, и зависимость концентрации метамфетамина в плазме от времени моделировались при каждом из трех условий pH мочи после перорального приема. дозировка 11 мг метамфетаминового основания.Смоделированные профили времени экскреции с мочой сравнивали с наблюдаемыми данными трех наборов тестов, соответствующих трем условиям pH мочи (Beckett and Rowland, 1965c). Из-за ограниченного числа субъектов в наблюдаемых данных ( n = 1) в качестве критерия приемлемости использовался двукратный критерий приемлемости AAFE, когда представитель смоделированной популяции сравнивался с индивидуальными наблюдаемыми данными. Двукратный критерий был выбран с учетом сообщаемой межиндивидуальной вариабельности (коэффициент дисперсии: 56%) почечного клиренса метамфетамина (Kim et al., 2004). Двукратный диапазон является консервативным критерием при условии, что почечный клиренс соответствует логарифмически нормальному распределению, при котором 95% людей имеют почечный клиренс в пределах 2,53–19,5 л/ч, что дает 2,77-кратную разницу между верхним/нижним пределом и среднее геометрическое. Результаты моделирования влияния pH мочи на экскрецию метамфетамина с мочой также сравнивались с результатами другого клинического исследования (Beckett and Rowland, 1965b) в качестве второго набора проверок. Поскольку данные наблюдаемой концентрации метамфетамина в плазме во времени не были доступны в условиях основного и кислого pH мочи, смоделированные и наблюдаемые концентрации в плазме не сравнивались.
Двукратный критерий был выбран с учетом сообщаемой межиндивидуальной вариабельности (коэффициент дисперсии: 56%) почечного клиренса метамфетамина (Kim et al., 2004). Двукратный диапазон является консервативным критерием при условии, что почечный клиренс соответствует логарифмически нормальному распределению, при котором 95% людей имеют почечный клиренс в пределах 2,53–19,5 л/ч, что дает 2,77-кратную разницу между верхним/нижним пределом и среднее геометрическое. Результаты моделирования влияния pH мочи на экскрецию метамфетамина с мочой также сравнивались с результатами другого клинического исследования (Beckett and Rowland, 1965b) в качестве второго набора проверок. Поскольку данные наблюдаемой концентрации метамфетамина в плазме во времени не были доступны в условиях основного и кислого pH мочи, смоделированные и наблюдаемые концентрации в плазме не сравнивались.
Экскреция с мочой и зависимость концентрации в плазме от времени для амфетамина были смоделированы аналогичным образом при неконтролируемых, кислых и щелочных условиях мочи после перорального приема 11 мг основания амфетамина. Процент дозы амфетамина, выведенной с мочой, рассчитывали путем деления кумулятивного количества, выведенного с мочой, на дозу. Количество, выделяемое с мочой, учитывалось в течение 48 часов для неконтролируемого pH мочи и 16 часов для кислого и щелочного pH мочи, как описано в наблюдаемом исследовании, и сравнивалось с наблюдаемыми данными из соответствующих наборов тестовых данных (Beckett and Rowland, 1965a).Влияние изменения рН мочи на экскрецию амфетамина с мочой оценивали на основе процентного изменения экскреции с мочой (количество экскретируемого амфетамина) при кислой или щелочной реакции мочи по сравнению с экскрецией с мочой, когда рН мочи не контролировался (моделированный рН мочи = 6,5). ). Рассчитывали отношение прогнозируемого к наблюдаемому процентному изменению экскреции с мочой при изменении рН мочи. Двойной критерий приемлемости, аналогичный тому, который использовался для исследований лекарственного взаимодействия (Sager et al., 2015), применяли к этому соотношению, чтобы определить, было ли моделирование успешным.
Процент дозы амфетамина, выведенной с мочой, рассчитывали путем деления кумулятивного количества, выведенного с мочой, на дозу. Количество, выделяемое с мочой, учитывалось в течение 48 часов для неконтролируемого pH мочи и 16 часов для кислого и щелочного pH мочи, как описано в наблюдаемом исследовании, и сравнивалось с наблюдаемыми данными из соответствующих наборов тестовых данных (Beckett and Rowland, 1965a).Влияние изменения рН мочи на экскрецию амфетамина с мочой оценивали на основе процентного изменения экскреции с мочой (количество экскретируемого амфетамина) при кислой или щелочной реакции мочи по сравнению с экскрецией с мочой, когда рН мочи не контролировался (моделированный рН мочи = 6,5). ). Рассчитывали отношение прогнозируемого к наблюдаемому процентному изменению экскреции с мочой при изменении рН мочи. Двойной критерий приемлемости, аналогичный тому, который использовался для исследований лекарственного взаимодействия (Sager et al., 2015), применяли к этому соотношению, чтобы определить, было ли моделирование успешным. Кроме того, смоделированный профиль зависимости концентрации амфетамина в плазме от времени при неконтролируемых и кислых условиях мочи сравнивали с наблюдаемыми данными из четырех тестовых наборов данных (Beckett et al., 1969). Из-за ограниченного числа субъектов в наблюдаемых данных ( n = 2) при сравнении средних результатов смоделированной популяции с индивидуальными наблюдаемыми данными использовался двукратный критерий приемлемости AAFE.
Кроме того, смоделированный профиль зависимости концентрации амфетамина в плазме от времени при неконтролируемых и кислых условиях мочи сравнивали с наблюдаемыми данными из четырех тестовых наборов данных (Beckett et al., 1969). Из-за ограниченного числа субъектов в наблюдаемых данных ( n = 2) при сравнении средних результатов смоделированной популяции с индивидуальными наблюдаемыми данными использовался двукратный критерий приемлемости AAFE.
Верификация метамфетамин-амфетаминовой модели исходного метаболита.
Модель исходного метаболита метамфетамина-амфетамина была создана на основе моделей отдельных соединений с использованием ранее разработанной модели PBPK (Huang and Isoherranen, 2020). Было смоделировано, что образование амфетамина из метамфетамина происходит в печеночном компартменте. Печеночный клиренс амфетамина из метамфетамина был рассчитан как 3,29 л/ч с использованием данных клинического исследования, сообщающего об отношении AUC амфетамина к метамфетамину (отношение = 0. 208) после внутривенного введения метамфетамина (Newton et al., 2005) и наблюдали пероральный клиренс амфетамина 15,8 л/ч (CDER, 2001) на основе предыдущего метода (Lane and Levy, 1980).
208) после внутривенного введения метамфетамина (Newton et al., 2005) и наблюдали пероральный клиренс амфетамина 15,8 л/ч (CDER, 2001) на основе предыдущего метода (Lane and Levy, 1980).
Для проверки кинетической модели исходного метаболита метамфетамин-амфетамин были смоделированы профили зависимости концентрации амфетамина в плазме от времени в качестве метаболита метамфетамина после внутривенного введения метамфетамина и сопоставлены с наблюдаемыми данными четырех наборов тестов (Cook et al., 1993; Харрис и др., 2003; Мендельсон и др., 2006). Чтобы оценить модель, к AAFE был применен 1,25-кратный критерий приемлемости, чтобы определить, было ли моделирование успешным. Все симуляции проводились с тем же способом введения и той же дозировкой, что и в соответствующих исследованиях (дополнительная таблица 1), и все смоделированные концентрации в плазме были отобраны из места отбора проб периферической вены руки.
Чтобы проверить, может ли проверенная модель исходного метаболита отражать кинетику метамфетамина-амфетамина в моче при различных условиях pH мочи, результаты моделирования сравнивали с наблюдаемым соотношением концентраций мочи (Oyler et al. , 2002) и данные об экскреции (Kim et al., 2004). Во-первых, концентрация метамфетамина и амфетамина в моче моделировалась при неконтролируемом рН мочи (рН мочи = 6,5) после четырех последовательных пероральных доз 10 или 20 мг метамфетамина. Отношение концентрации метаболитов в моче к исходной концентрации рассчитывали как отношение концентрации амфетамина к концентрации метамфетамина в моче, и это отношение сравнивали с наблюдаемыми данными (Oyler et al., 2002). Поскольку наблюдаемые данные были зарегистрированы только у одного субъекта после доз 10 или 20 мг, для определения того, было ли моделирование успешным, использовался двукратный критерий приемлемости для рассчитанного AAFE.Для экстраполяции мы также смоделировали отношение концентрации метаболитов в моче к исходной концентрации в кислых и щелочных условиях мочи. Поскольку данные о наблюдаемом соотношении метаболита в моче/родительском компоненте не были доступны в условиях кислого и щелочного pH мочи, для этих двух условий не проводилось сравнения между смоделированной и наблюдаемой концентрациями в моче.
, 2002) и данные об экскреции (Kim et al., 2004). Во-первых, концентрация метамфетамина и амфетамина в моче моделировалась при неконтролируемом рН мочи (рН мочи = 6,5) после четырех последовательных пероральных доз 10 или 20 мг метамфетамина. Отношение концентрации метаболитов в моче к исходной концентрации рассчитывали как отношение концентрации амфетамина к концентрации метамфетамина в моче, и это отношение сравнивали с наблюдаемыми данными (Oyler et al., 2002). Поскольку наблюдаемые данные были зарегистрированы только у одного субъекта после доз 10 или 20 мг, для определения того, было ли моделирование успешным, использовался двукратный критерий приемлемости для рассчитанного AAFE.Для экстраполяции мы также смоделировали отношение концентрации метаболитов в моче к исходной концентрации в кислых и щелочных условиях мочи. Поскольку данные о наблюдаемом соотношении метаболита в моче/родительском компоненте не были доступны в условиях кислого и щелочного pH мочи, для этих двух условий не проводилось сравнения между смоделированной и наблюдаемой концентрациями в моче. Во-вторых, количество метамфетамина и амфетамина, выделяемых с мочой, моделировали при неконтролируемом рН мочи (рН мочи = 6,5) после четырех последовательных доз метамфетамина по 10 мг.Процент дозы метамфетамина, выведенной с мочой в виде метамфетамина или амфетамина, рассчитывали путем деления кумулятивного количества метамфетамина и амфетамина, выведенного с мочой за 16 дней, на дозу метамфетамина. Соотношение метаболита с мочой/выделения исходного вещества рассчитывали путем деления экскреции амфетамина с мочой на экскрецию метамфетамина с мочой. Смоделированный процент экскреции метамфетамина и амфетамина с мочой и соотношение метаболит/родитель сравнивались с наблюдаемыми данными у 13 человек (Kim et al., 2004).
Во-вторых, количество метамфетамина и амфетамина, выделяемых с мочой, моделировали при неконтролируемом рН мочи (рН мочи = 6,5) после четырех последовательных доз метамфетамина по 10 мг.Процент дозы метамфетамина, выведенной с мочой в виде метамфетамина или амфетамина, рассчитывали путем деления кумулятивного количества метамфетамина и амфетамина, выведенного с мочой за 16 дней, на дозу метамфетамина. Соотношение метаболита с мочой/выделения исходного вещества рассчитывали путем деления экскреции амфетамина с мочой на экскрецию метамфетамина с мочой. Смоделированный процент экскреции метамфетамина и амфетамина с мочой и соотношение метаболит/родитель сравнивались с наблюдаемыми данными у 13 человек (Kim et al., 2004).
Результаты
Разработка и проверка моделей наркотиков метамфетамина и амфетамина.
Несвязанная фракция плазмы человека, отношение крови к плазме и клеточная проницаемость MDCK были экспериментально определены для метамфетамина и амфетамина и использованы в модели PBPK. Значение f u,p составляло 0,77 (±0,03) для метамфетамина и 0,82 (±0,09) для амфетамина. Отношение крови к плазме составляло 1,04 (± 0,07) для метамфетамина и 1,04 (± 0,06) для амфетамина, что свидетельствует о некотором распределении в эритроцитах.Клеточная проницаемость MDCK составляла 29,1 × 10 -6 (± 5,75) см / с для метамфетамина и 26,9 × 10 -6 (± 4,42) см / с для амфетамина (дополнительные рисунки 1 и 2), что указывает на высокую проницаемость для обоих соединений.
Значение f u,p составляло 0,77 (±0,03) для метамфетамина и 0,82 (±0,09) для амфетамина. Отношение крови к плазме составляло 1,04 (± 0,07) для метамфетамина и 1,04 (± 0,06) для амфетамина, что свидетельствует о некотором распределении в эритроцитах.Клеточная проницаемость MDCK составляла 29,1 × 10 -6 (± 5,75) см / с для метамфетамина и 26,9 × 10 -6 (± 4,42) см / с для амфетамина (дополнительные рисунки 1 и 2), что указывает на высокую проницаемость для обоих соединений.
Модели наркотиков метамфетамина (рис. 3) и амфетамина (рис. 4) были независимо проверены с использованием наблюдаемых данных концентрации в плазме в зависимости от времени из семи тестовых наборов метамфетамина (шесть внутривенных доз и одна пероральная доза) (Perez-Reyes et al. , 1991; Кук и др., 1993; Мендельсон и др., 1995, 2006; Harris et al., 2003) и два тестовых набора для перорального дозирования амфетамина (CDER, 2002) соответственно. Значения AAFE для данных концентрации метамфетамина (рис. 3) и амфетамина (рис. 4) в плазме от времени в тестовых наборах варьировались от 1,04 до 1,19, а прогнозируемые/наблюдаемые отношения AUC варьировались от 0,87 до 1,11 (дополнительная рис. 3; Дополнительная таблица 1). Соотношение между прогнозируемыми и наблюдаемыми концентрациями для смоделированных исследований также показано на дополнительном рис.3. Обе оценочные метрики соответствовали строгому критерию приемлемости модели, демонстрируя успешную проверку модели и высокую достоверность входных параметров модели как для метамфетамина, так и для амфетамина.
3) и амфетамина (рис. 4) в плазме от времени в тестовых наборах варьировались от 1,04 до 1,19, а прогнозируемые/наблюдаемые отношения AUC варьировались от 0,87 до 1,11 (дополнительная рис. 3; Дополнительная таблица 1). Соотношение между прогнозируемыми и наблюдаемыми концентрациями для смоделированных исследований также показано на дополнительном рис.3. Обе оценочные метрики соответствовали строгому критерию приемлемости модели, демонстрируя успешную проверку модели и высокую достоверность входных параметров модели как для метамфетамина, так и для амфетамина.
Моделирование зависимости концентрации метамфетамина (метамфетамина) в плазме от времени после внутривенного введения. Смоделированные концентрации в плазме (показаны красным цветом) сравнивались с наблюдаемыми данными (показаны синим цветом) из шести различных наборов тестов. Рассчитанное значение AAFE для каждого набора данных показано на каждой панели.Наблюдаемые данные по метамфетамину взяты из (A) (Cook et al. , 1993), (B) (Mendelson et al., 1995), (C) (Harris et al., 2003), (D) (Harris et al. ., 2003), (E) (Мендельсон и др., 2006) и (F) (Мендельсон и др., 2006).
, 1993), (B) (Mendelson et al., 1995), (C) (Harris et al., 2003), (D) (Harris et al. ., 2003), (E) (Мендельсон и др., 2006) и (F) (Мендельсон и др., 2006).
Моделирование профилей зависимости концентрации метамфетамина (Meth) и амфетамина (Amph) в плазме от времени после перорального приема. Смоделированные концентрации в плазме (красные линии) сравнивали с наблюдаемыми данными (синие кружки) из трех разных наборов тестов. Рассчитанное значение AAFE для каждого набора данных показано на каждой панели.Наблюдаемые данные для метамфетамина (А) получены от Perez-Reyes et al. (1991), а данные наблюдений для амфетамина (B и C) взяты из CDER (2002).
Моделирование и проверка влияния pH мочи на почечную экскрецию и системное распределение метамфетамина и амфетамина.
После успешной проверки системной модели метамфетамина экскреция метамфетамина с мочой была смоделирована как функция времени при различных условиях рН мочи. Цель этих симуляций состояла в том, чтобы проверить, можно ли смоделировать влияние pH мочи на экскрецию метамфетамина с использованием модели PBPK всего тела в сочетании с механистической моделью почек. Наше моделирование показывает, что экскреция метамфетамина с мочой, когда моча кислая (рис. 5А, красная пунктирная кривая), значительно превышает экскрецию, когда моча является щелочной (рис. 5А, синяя пунктирная кривая), и что смоделированный профиль экскреции метамфетамина с мочой при щелочной или кислой моче согласуется. с данными наблюдений у людей (Beckett and Rowland, 1965c). Смоделированная экскреция метамфетамина при рН мочи 6,5 (рис. 5А, черная сплошная кривая) находится между кислыми и щелочными условиями мочи (рис.5А красный и синий). рН мочи 6,5 был выбран для представления предполагаемого рН мочи у людей, когда рН мочи не контролируется. Рассчитанные значения AAFE соответствовали двукратному критерию приемлемости модели при всех трех условиях рН мочи (рис. 5А). Влияние pH мочи на экскрецию с мочой также было смоделировано и сравнено со вторым наблюдаемым исследованием, показанным на дополнительной рис. 4. Процентная доза, выделяемая с мочой в виде метамфетамина, была успешно зафиксирована при всех трех условиях pH мочи, при этом все расчетные значения AAFE соответствуют 2-кратный критерий приемлемости модели (дополнительный рис.
Наше моделирование показывает, что экскреция метамфетамина с мочой, когда моча кислая (рис. 5А, красная пунктирная кривая), значительно превышает экскрецию, когда моча является щелочной (рис. 5А, синяя пунктирная кривая), и что смоделированный профиль экскреции метамфетамина с мочой при щелочной или кислой моче согласуется. с данными наблюдений у людей (Beckett and Rowland, 1965c). Смоделированная экскреция метамфетамина при рН мочи 6,5 (рис. 5А, черная сплошная кривая) находится между кислыми и щелочными условиями мочи (рис.5А красный и синий). рН мочи 6,5 был выбран для представления предполагаемого рН мочи у людей, когда рН мочи не контролируется. Рассчитанные значения AAFE соответствовали двукратному критерию приемлемости модели при всех трех условиях рН мочи (рис. 5А). Влияние pH мочи на экскрецию с мочой также было смоделировано и сравнено со вторым наблюдаемым исследованием, показанным на дополнительной рис. 4. Процентная доза, выделяемая с мочой в виде метамфетамина, была успешно зафиксирована при всех трех условиях pH мочи, при этом все расчетные значения AAFE соответствуют 2-кратный критерий приемлемости модели (дополнительный рис. 4).
4).
Моделирование влияния pH мочи на экскрецию метамфетамина (метамфетамина) с мочой и зависимость концентрации в плазме от времени. Профили экскреции метамфетамина с мочой (A) и профили зависимости концентрации в плазме от времени (B) были смоделированы после перорального приема метамфетамина в дозе 11 мг в условиях кислого pH мочи (красные пунктирные кривые), в условиях неконтролируемого pH мочи (черные сплошные кривые) и в условиях щелочного pH мочи. (синие пунктирные кривые). Моделирование экскреции метамфетамина с мочой в зависимости от времени сравнивали с наблюдаемыми данными ( N = 1) при трех различных условиях pH мочи (Beckett and Rowland, 1965c), показанных красными квадратами (кислая моча), черными кружками (неконтролируемый pH мочи). и синие треугольники (щелочная моча).Рассчитанные значения AAFE для всех трех состояний мочи показаны на вставках.
Влияние рН мочи на системное распределение метамфетамина также было смоделировано (рис. 5А) для изучения влияния изменений рН мочи на экспозицию метамфетамина и период полураспада. Рассчитанные значения метамфетамина в плазме AUC 0-inf при щелочных, неконтролируемых и кислых условиях мочи составили 970, 542 и 284 мкг × ч/л, соответственно, после перорального приема 11 мг метамфетаминового основания, что иллюстрирует сильное влияние рН мочи при системном воздействии метамфетамина.Смоделированные концентрации метамфетамина в плазме были самыми высокими, когда моча была щелочной, за ней следовал неконтролируемый рН мочи (рН мочи = 6,5), а концентрации метамфетамина в плазме были самыми низкими, когда моча была кислой (рис. 5В).
Рассчитанные значения метамфетамина в плазме AUC 0-inf при щелочных, неконтролируемых и кислых условиях мочи составили 970, 542 и 284 мкг × ч/л, соответственно, после перорального приема 11 мг метамфетаминового основания, что иллюстрирует сильное влияние рН мочи при системном воздействии метамфетамина.Смоделированные концентрации метамфетамина в плазме были самыми высокими, когда моча была щелочной, за ней следовал неконтролируемый рН мочи (рН мочи = 6,5), а концентрации метамфетамина в плазме были самыми низкими, когда моча была кислой (рис. 5В).
Подобно метамфетамину, рН мочи также играет важную роль в экскреции амфетамина с мочой (Beckett and Rowland, 1965a). Чтобы резюмировать влияние pH мочи на почечную диспозицию амфетамина, была смоделирована экскреция амфетамина с мочой при трех различных условиях pH мочи (рис.6А). По сравнению с неконтролируемым состоянием pH мочи (pH мочи = 6,5), было предсказано, что щелочное состояние мочи приведет к снижению экскреции амфетамина с мочой на 97%, тогда как наблюдаемое снижение составило 91%, что привело к прогнозируемому отношению к наблюдаемому в 1,07 раза. соответствие критерию приемлемости в 2 раза. С другой стороны, было предсказано, что подкисление мочи приведет к увеличению экскреции амфетамина с мочой на 48% по сравнению с неконтролируемым состоянием pH мочи, тогда как наблюдаемое увеличение составило 75%, что привело к соотношению прогнозируемое/наблюдаемое, равное 0.64-кратное соответствие критерию приемлемости 2-кратного.
соответствие критерию приемлемости в 2 раза. С другой стороны, было предсказано, что подкисление мочи приведет к увеличению экскреции амфетамина с мочой на 48% по сравнению с неконтролируемым состоянием pH мочи, тогда как наблюдаемое увеличение составило 75%, что привело к соотношению прогнозируемое/наблюдаемое, равное 0.64-кратное соответствие критерию приемлемости 2-кратного.
Моделирование влияния pH мочи на экскрецию с мочой и зависимость концентрации амфетамина (Amph) от времени. Экскреция амфетамина с мочой в течение 48 часов (неконтролируемый рН мочи показан черным цветом), 16 часов (щелочной рН мочи показан синим цветом) и 16 часов (кислый рН мочи показан красным цветом) моделировалась после перорального приема 11 мг амфетамина (А). Наблюдаемые индивидуальные данные экскреции амфетамина показаны кружками (Векетт и Роуланд, 1965а).Среднее смоделированное количество (в процентах от дозы) амфетамина, выделяемого с мочой при каждом значении pH мочи, показано треугольниками с двукратными планками ошибок. Смоделированные (кривые) профили зависимости концентрации амфетамина в плазме от времени (B и C) показаны в сравнении с наблюдаемыми [открытыми символами, (Beckett et al., 1969)] данными у двух отдельных субъектов при неконтролируемом рН мочи (черные символы и сплошная кривая). ), кислый рН мочи (красные символы и пунктирная кривая) и щелочной рН мочи (синяя пунктирная кривая) после перорального приема 11 мг амфетамина.Показаны рассчитанные значения AAFE для каждого отдельного субъекта. AAFE и представляет собой расчетную AAFE, сравнивающую смоделированные и наблюдаемые концентрации амфетамина в плазме при неконтролируемом рН мочи. AAFE acid представляет собой рассчитанное AAFE, сравнивающее смоделированные и наблюдаемые концентрации амфетамина в плазме при кислом рН мочи.
Смоделированные (кривые) профили зависимости концентрации амфетамина в плазме от времени (B и C) показаны в сравнении с наблюдаемыми [открытыми символами, (Beckett et al., 1969)] данными у двух отдельных субъектов при неконтролируемом рН мочи (черные символы и сплошная кривая). ), кислый рН мочи (красные символы и пунктирная кривая) и щелочной рН мочи (синяя пунктирная кривая) после перорального приема 11 мг амфетамина.Показаны рассчитанные значения AAFE для каждого отдельного субъекта. AAFE и представляет собой расчетную AAFE, сравнивающую смоделированные и наблюдаемые концентрации амфетамина в плазме при неконтролируемом рН мочи. AAFE acid представляет собой рассчитанное AAFE, сравнивающее смоделированные и наблюдаемые концентрации амфетамина в плазме при кислом рН мочи.
Также было смоделировано влияние pH мочи на системное распределение амфетамина (рис. 6, B и C) и сопоставлено с наблюдаемыми данными (Beckett et al., 1969). Значения AAFE для моделирования кислого и неконтролируемого pH мочи соответствовали двойному критерию приемлемости модели (рис. 6, B и C). Двойной критерий был использован из-за небольшого размера выборки в наблюдаемых исследованиях ( n = 2). К сожалению, клинические данные о влиянии щелочного рН мочи на системную диспозицию амфетамина были недоступны, и, следовательно, проверка этого состояния не проводилась. Основываясь на моделировании с использованием проверенной модели амфетамина, значения AUC 0-inf амфетамина в плазме при щелочных, неконтролируемых и кислых условиях мочи составили 1325, 692 и 361 мкг × ч/л соответственно после перорального приема дозы 11 мг основания амфетамина, демонстрируя резкое влияние pH мочи на системное воздействие амфетамина.
Моделирование и проверка кинетики метамфетамина-амфетамина-родителя-метаболита в плазме и моче.
После успешной проверки моделей метамфетамина (рис. 3) и амфетамина (рис. 4) была установлена связь «родитель-метаболит», что позволило смоделировать утилизацию амфетамина как метаболита метамфетамина. Для проверки модели исходного метаболита метамфетамин-амфетамин были смоделированы профили зависимости концентрации амфетамина в плазме от времени в виде метаболита после внутривенного введения дозы метамфетамина и сопоставлены с наблюдаемыми данными.Как показано на рис. 7, все значения AAFE находились в пределах 1,25-кратного критерия приемлемости, что указывает на то, что связь исходного метаболита между метамфетамином и амфетамином была успешно установлена и подтверждена.
Рис. 7.Моделирование зависимости концентрации амфетамина (Amph) в плазме от времени в качестве метаболита после внутривенного введения метамфетамина (Meth). Были смоделированы профили зависимости концентрации амфетамина в плазме от времени (показаны красными кривыми) в качестве метаболита метамфетамина после внутривенного введения дозы метамфетамина и сопоставлены с наблюдаемыми данными (показаны синими кружками) из четырех тестовых наборов.Все рассчитанные значения AAFE находились в пределах 1,25-кратного диапазона. Наблюдаемые данные по амфетамину взяты из (A) (Cook et al., 1993), (B) (Harris et al., 2003), (C) (Mendelson et al., 2006) и (D) (Mendelson et al., 2006). др., 2006).
Для оценки применимости проверенной модели исходного метаболита для регистрации кинетики метамфетамина-амфетамина в моче было смоделировано отношение концентрации метаболитов в моче к исходной концентрации при неконтролируемом рН мочи (рН мочи = 6,5) и проведено сравнение с наблюдаемыми данными (Oyler et al. др., 2002) у одного субъекта после четырех последовательных доз 10 или 20 мг метамфетамина (рис. 8). Значения AAFE для этих симуляций находились в пределах двукратного критерия приемлемости, который использовался из-за небольшого размера выборки ( n = 1). Соотношение концентрации метаболитов в моче и исходной концентрации также было смоделировано в кислых и щелочных условиях мочи, чтобы изучить влияние изменения рН мочи на этот показатель. Результаты моделирования показывают, что на соотношение концентрации метаболитов в моче и концентрации исходного вещества может влиять рН мочи.В частности, щелочная среда мочи приводила к более высокому соотношению Amph/Meth в моче. Кроме того, процент дозы, выделяемой с мочой в виде метамфетамина и амфетамина, также моделировался при неконтролируемом рН мочи (рН мочи = 6,5) и сравнивался с наблюдаемыми данными (рис. 9). Наблюдаемая средняя процентная доза, выделяемая с мочой в виде метамфетамина и амфетамина, составляла 41,3% и 9,8% соответственно, тогда как прогнозируемые значения составляли 40,6% и 8,2% соответственно. Наблюдаемое соотношение амфетамин/метамфетамин в моче было равно 0.26, тогда как прогнозируемое отношение было 0,20. Все прогнозируемые/наблюдаемые значения находились в пределах 2-кратного критерия приемлемости. Вместе эти данные свидетельствуют об успешном применении модели для моделирования кинетики системных и мочевых исходных метаболитов.
Рис. 8.Моделирование зависимости концентрации метаболита в моче от концентрации исходного вещества (амфетамин/метамфетамин) во времени после многократного перорального приема метамфетамина (метамфетамина). Соотношение амфетамин/метамфетамин (Amph/Meth) в моче моделировали при кислом рН мочи (красные кривые), при неконтролируемом рН мочи (черная кривая) и при щелочном рН мочи (синяя кривая) после четырех последовательных пероральных доз метамфетамина и сравнивали с наблюдаемым соотношением мочи (черные кружки) из двух наборов тестов (Oyler et al., 2002) с дозой 10 мг (A) и дозой 20 мг (B) в условиях неконтролируемого pH мочи. Рассчитанные значения AAFE, сравнивающие моделирование и наблюдение в условиях неконтролируемого pH мочи, показаны на вставках.
Рис. 9.Моделирование количества метамфетамина (Meth) и его метаболита амфетамина (Amph), выделяемого с мочой (в процентах от дозы метамфетамина) после многократного перорального приема метамфетамина. (A) показывает смоделированную долю (в красном квадрате с 2-кратными погрешностями) дозы метамфетамина, выделяемой с мочой в виде метамфетамина и амфетамина (выраженной в процентах от дозы метамфетамина) после четырех пероральных доз 10 мг метамфетамина и при условии, что рН мочи составляет 6.5 для имитации неконтролируемого pH мочи. Смоделированное отношение экскреции Amph/Meth с мочой (в красном квадрате с 2-кратными погрешностями) на основе данных, представленных в (A), показано в (B). Наблюдаемые данные (Kim et al., 2004) для отдельных субъектов показаны синими кружками, а наблюдаемые средние значения показаны синими треугольниками.
Обсуждение
Влияние рН мочи на почечную экскрецию лекарств наблюдалось для множества лекарств у людей (Макферсон и др., 1955; Векетт и Роуланд, 1965а, с; Герхардт и др., 1969; Шарпстоун, 1969; Sjöqvist и др., 1969; Грам и др., 1971; Кидди и др., 1974; Чан, 1979; Мухиддин и др., 1984; Беновиц и Джейкоб, 1985; Аоки и Ситар, 1988 г .; Фройденталер и др., 1998). Кроме того, сообщалось, что множество лекарств и болезненных состояний вызывают изменения pH мочи (Cook et al., 2007). Например, было показано, что ацетазоламид, показанный при глаукоме и отеках, повышает рН мочи у людей с 5,5 до 7,6 (Moviat et al., 2006). Напротив, было показано, что холестирамин, показанный при гиперхолестеринемии, вызывает метаболический ацидоз и, следовательно, может снижать рН мочи до 4.8 (Ивз и Корман, 1984). Кроме того, закисление мочи наблюдается при диабете, ожирении и хронической болезни почек (Maalouf et al., 2004, 2010; Nakanishi et al., 2012), а ощелачивание мочи наблюдается при рвоте и инфекциях мочевыводящих путей (Yi et al., 2012; Лай и др., 2019). Таким образом, потенциальное влияние сопутствующих заболеваний и сопутствующих заболеваний на рН мочи и, следовательно, почечный клиренс лекарств может быть обычным и глубоким. Тем не менее, общее влияние измененного pH мочи на концентрацию лекарственного средства в моче, профили экскреции, системное воздействие и последующие клинические последствия было недооценено.В этом исследовании мы предположили, что моделирование in silico можно использовать для понимания и прогнозирования влияния измененного рН мочи на почечную и системную диспозицию лекарств и метаболитов. Цель этого исследования состояла в том, чтобы интегрировать проверенную механистическую модель почек (Huang and Isoherranen, 2018) с моделью исходного метаболита PBPK всего тела (Huang and Isoherranen, 2020), чтобы изучить применимость окончательной модели для прогнозирования эффекта варьирование рН мочи в зависимости от почечного клиренса и системного воздействия для оценки потенциальных клинических последствий с использованием метамфетамина и амфетамина в качестве модельных соединений.
В настоящее время влияние pH мочи на почечный клиренс и системную диспозицию редко рассматривают при использовании методов in silico для имитации диспозиции лекарств и метаболитов. Для исследований, специально изучающих экскрецию с мочой в зависимости от времени, профили экскреции с мочой в основном моделировались с использованием простой кинетики мочи первого порядка (Heredia Ortiz et al., 2014; Phillips et al., 2014; Adachi et al., 2015; Marchand et al., 2015; Yang et al., 2015) регулируется фиксированным наблюдаемым значением, таким как константа скорости элиминации.Хотя эти модели могли успешно воспроизвести наблюдаемые данные, их нельзя экстраполировать на непроверенные или измененные сценарии из-за их немеханистической природы при моделировании кинетики мочи. Напротив, механистическое моделирование можно использовать для экстраполяции распределения наркотиков из известных условий на неизученные сценарии, такие как неизученные группы населения и неизученное совместное введение наркотиков (Wagner et al., 2015; Huang et al., 2017; Zhang et al., 2017; Hanke). et al., 2018) и, вероятно, неизученные условия рН мочи.
Недавно модель MechKiM, встроенная в платформу Simcyp, использовалась для прогнозирования влияния почечного клиренса и рН мочи на почечный клиренс (Matsuzaki et al., 2019). В этом исследовании семь соединений использовались в качестве тестового набора для проверки производительности модели, а моделирование проводилось при условии одинакового рН фильтрата почечных канальцев во всех почечных сегментах. Общие результаты моделирования в условиях неконтролируемого рН мочи показали значения AAFE в диапазоне от 2,87 (при условии, что рН однородного канальцевого фильтрата = 6.2) до 3,62 (при условии рН однородного трубчатого фильтрата = 7,4). Для сравнения, наша механистическая модель почки, в которой предполагается наличие канальцевого градиента pH в различных сегментах канальцев, показала превосходную эффективность для набора из 35 ненейтральных испытуемых соединений со значениями AAFE 1,83, 1,82 и 1,46 для слабых оснований, слабых кислот и цвиттер-ионов. соответственно (Huang and Isoherranen, 2018). Эта лучшая производительность может быть связана с нашей стратегией использования ступенчатого градиента pH почечного канальцевого фильтрата для учета естественного непрерывного процесса подкисления канальцевого фильтрата, хотя другие различия, такие как учет микроворсинок и большее число (11 против7) трубчатых отсеков в нашей модели также может способствовать повышению производительности. Кроме того, предыдущее исследование (Matsuzaki et al., 2019) показало относительно нечувствительную реакцию моделируемого почечного клиренса на изменения рН мочи. Например, моделируемый ими почечный клиренс амфетамина не изменялся при рН мочи от 5 до 8, что не согласуется с наблюдаемыми резкими изменениями (Векетт и Роуланд, 1965а; Векетт и др., 1969). И наоборот, наша модель точно воспроизводит почечную экскрецию метамфетамина и амфетамина в кислой среде (pH мочи = 5.0), неконтролируемые (pH мочи = 6,5) и щелочные (pH мочи = 8,0) условия мочи (рис. 6), и ранее было показано, что они фиксируют изменение почечного клиренса салициловой кислоты и мемантина в зависимости от pH мочи (Huang и Изохерранен, 2018). Мы подтвердили важность ступенчатого градиента путем прямого сравнения экскреции метамфетамина с мочой с использованием наших ступенчатых градиентов pH и ранее опубликованного (Matsuzaki et al., 2019) постоянного значения pH. Подход с постоянным значением pH не смог воспроизвести наблюдаемые данные при неконтролируемом (AAFE = 2.2 или 6,5) и щелочное состояние мочи (AAFE = 13,6) (дополнительная рис. 5), тогда как ступенчатый градиент pH успешно (AAFE <2) имитировал экскрецию метамфетамина с мочой (дополнительная рис. 4). Вместе эти результаты подтверждают, что наша модель и стратегия PBPK могут успешно фиксировать математическую взаимосвязь между pH мочи и соответствующей кажущейся проницаемостью, пассивной реабсорбцией и почечным клиренсом. Для дальнейшей проверки полной модели требуется дополнительное исследование с использованием дополнительных наборов данных.
Изменение pH мочи также может влиять на системное воздействие лекарств и их метаболитов, если почечный клиренс является важным путем выведения. Например, AUC амфетамина в плазме снижалась примерно на 50 % при кислом рН мочи по сравнению с неконтролируемым рН мочи (Beckett et al., 1969), а поскольку известно, что рН мочи влияет на почечный клиренс многих лекарств, такие эффекты на препарат AUC может быть общим. Представленный здесь рабочий процесс моделирования и симуляции предлагает реальный подход к прогнозированию того, будет ли воздействие лекарственного средства чувствительным к изменениям рН мочи.Для этого важно построить как механистическую модель почек, чувствительную к pH мочи, так и модель PBPK всего тела, которая фиксирует всасывание, распределение и другие пути выведения лекарств, такие как печеночный метаболизм и экскреция с желчью. В этом исследовании мы сначала проверили модель PBPK всего тела для метамфетамина (рис. 3) и амфетамина (рис. 4), а затем проверили влияние рН мочи на почечную экскрецию (рис. 5А и 6А), чтобы в конечном итоге смоделировать рН мочи. влияние на AUC метамфетамина в плазме (рис.5Б) и амфетамин (рис. 6, Б и В). Основываясь на моделировании, мы также предсказали, что подщелачивание мочи может увеличить AUC метамфетамина и амфетамина в плазме примерно на 100 % по сравнению с неконтролируемым рН мочи из-за повышенной пассивной реабсорбции и снижения почечного клиренса (рис. 5 и 6). В совокупности мы показываем рабочий процесс моделирования, который может служить надежным и экономичным методом для оценки того, как изменяется AUC лекарственного средства при изменении pH мочи из-за комедикации или болезненных состояний.
Влияние рН мочи также влияет на интерпретацию данных о концентрации мочи. В настоящее время концентрации лекарств и метаболитов в моче широко используются для понимания фармакокинетики лекарств, для фенотипирования некоторых метаболизирующих ферментов у людей (Wedlund et al., 1984; Chládek et al., 2000; Vogl et al., 2015). а также для тестирования и скрининга на употребление запрещенных наркотиков (Fabbri et al., 2003; Moeller et al., 2017). Как показано на рис. 5 и 6 изменения pH мочи будут изменять почечную экскрецию и, следовательно, зависимость концентрации мочи от времени.Кроме того, моделирование на рис. 8 предполагает, что соотношение метаболит/родитель в моче также может зависеть от изменений рН мочи. В настоящее время образцы мочи, собранные в один момент времени, часто служат непосредственным показателем для интерпретации данных без количественного учета искажающего влияния различных рН мочи на распределение мочи. Таким образом, анализ концентрации наркотиков в собранных образцах мочи может привести к неправильному толкованию и принятию субоптимальных решений. Описанный здесь подход к моделированию и симуляции вместе с измерением значений рН мочи может помочь в интерпретации данных об экскреции с мочой и помочь свести к минимуму ложноотрицательные и ложноположительные показания.
В заключение, это исследование показывает, что ранее разработанная и проверенная механистическая модель почек вместе с моделью исходного метаболита PBPK всего тела может точно предсказать влияние pH мочи на почечный клиренс метамфетамина и амфетамина, профиль зависимости концентрации в плазме от времени и системный и кинетика исходного метаболита в моче. Эти результаты свидетельствуют о том, что механистические модели PBPK могут в целом применяться для прогнозирования потенциального влияния сопутствующих заболеваний и сопутствующих заболеваний на почечную и системную диспозицию исходного метаболита из-за изменения рН мочи.Рабочий процесс моделирования и подход, установленный здесь, вероятно, будут полезны при оценке чувствительности расположения новых соединений к изменениям pH мочи, особенно для слабых кислот и оснований, которые обладают значительной проницаемостью.
Благодарности
Авторы хотели бы поблагодарить доктора Дэвида Дж. Вагнера за его квалифицированную помощь в предварительных экспериментах по проницаемости.
Авторские взносы
Принимал участие в разработке исследования: Huang, Czuba, Isoherranen.
Проведенные эксперименты: Хуанг, Чуба.
Проведенный анализ данных: Хуанг, Чуба, Изохерранен.
Написал или участвовал в написании рукописи: Huang, Czuba, Isoherranen.
Footnotes
- Получено 5 января 2020 г.
- Принято 18 марта 2020 г.
Эта работа была поддержана грантом Национального института здравоохранения P01 DA032507. В.Х. поддержал Уоррен Г.Стипендия Магнусона и стипендия Уильяма Э. Брэдли Вашингтонского университета, Сиэтл, Вашингтон.
https://doi.org/10.1124/jpet.120.264994.
↵Дополнительные материалы к этой статье доступны на сайте jpet.aspetjournals.org.
Собещения
9072- Copyright © 2020 Американское общество для фармакологии и Experimental Therapeutics
рН мочи — Са мочевого пузыря ncer WebCafé
Чтобы ознакомиться с выводами медсестры WebCafe Sharon McMullen о рН мочи применительно к пациентам с раком мочевого пузыря, нажмите здесь.
pH : логарифмическая шкала, используемая для определения кислотности или щелочности водного раствора. (Википедия)
рН является мерой кислотности и щелочности. По шкале от 1 до 10 7 представляет нейтральность, более низкие числа указывают на повышение кислотности, а более высокие значения — на щелочность. Каждая единица изменения соответствует десятикратному изменению кислотности или щелочности. pH мочи может варьироваться от крайне нездорового минимума 4,5 до максимума 8,5. Высокое значение pH может указывать на чрезмерную буферизацию организма, чтобы компенсировать слишком кислую физиологическую систему.
Соляная кислота в желудке необходима для пищеварения, а высокий уровень кислоты в организме фактически препятствует правильному производству желудочной кислоты. Когда рН тела слишком кислый, реакция организма состоит в том, чтобы компенсировать это выделением менее кислой жидкости, что приводит к нехватке надлежащей желудочной кислоты.
Баланс — это ключ. Слишком щелочная среда так же нежелательна, как и слишком кислая (хотя и легче переносимая). В организме со сбалансированным рН моча утром (после голодания) слегка кислая, с диапазоном рН 6.5–7,0, обычно становится более щелочной, pH = 7,5–8,0, к вечеру, когда организм переваривает пищу и выделяет электролиты.
Нездоровый pH- ниже 6,0
Нормальный pH- от 6,5 до 8,0
Нездоровый pH- выше 8,5
Хотя исследование 1993 года, сравнивающее людей с раком мочевого пузыря с пациентами с доброкачественной гиперплазией предстательной железы, показало, что у людей с раком мочевого пузыря была более высокая концентрация рН мочи (или высокая щелочность), нет никаких доказательств того, что стремление к показателю рН ниже нормального уровня является сдерживающим фактором. 2
Имеются данные о том, что кислая моча оказывает негативное влияние на уровни аддуктов ДНК уротелиальных клеток у людей, подвергшихся воздействию бензидина и ароматических аминов, полученных из сигаретного дыма. У людей с рН мочи ниже 6 уровень аддукта ДНК был в 10 раз выше, чем у субъектов с рН мочи 7 или выше. В исследовании сообщается, что pH мочи, на который влияет диета, может быть важным фактором восприимчивости к раку мочевого пузыря, вызванному табаком среди населения в целом, 1 , но необходимы дальнейшие исследования, прежде чем можно будет сделать определенные выводы.
Пациентам с цистэктомией говорят, что предпочтительнее иметь слегка кислую мочу (которая сбалансирована), так как это препятствует росту бактерий. Если стома имеет беловатый цвет, увеличение потребления кислых продуктов может снизить рН.
Баланс pH мочи контролируется диетой, и его лучше всего поддерживать оптимальным, зная, какие агенты являются кислыми, а какие оставляют после пищеварения щелочную золу.
Щелочные продукты :
Фрукты, овощи, травы, ростки и просо (особенно сырые овощи)
Хотя цитрусовые являются кислыми в процессе пищеварения, они оставляют щелочную золу.
Очень щелочные продукты Включает:
- Бананы
- Инжир
- Минеральная вода
- Апельсиновый сок
- Картофель
- Шпинат
- Арбуз
- Томатный сок
- Зелень репы
- Зелень одуванчика
Непищевые вещества, которые могут сделать мочу щелочной
- Антибиотики
- Большинство минеральных добавок, особенно кальция, калия, железа и магния.
- Антациды
- Жесткая вода
Кислотные продукты; крахмал, белок, спирт и сахар. Табак, аспирин и большинство лекарств являются кислотообразующими.
- Кукуруза
- Мясо
- Фасоль
- Рыба
- Домашняя птица
- Зерно
- Спаржа
- Уксус
- Кофе
Очень кислые продукты и добавки включают
- Дистиллированная вода
- Фильтрованная вода
- Яйца
- Печень и прочие субпродукты
- Соус
- Бульон из костей или других частей животных
- Вино
- Йогурт
- Пахта, включая блины и печенье на пахте
- Сметана
- Прочие ферментированные продукты
- Большинство добавок витамина В
- Молибденовые добавки
- Добавки соляной кислоты
- Пищеварительные ферменты
- Цельнозерновые продукты, такие как цельная пшеница или овсянка
Непищевые вещества, повышающие кислотность мочи
Пробиотики – это добавки, содержащие «полезные бактерии».Пробиотики часто используются после приема антибиотиков и могут помочь в некоторых случаях инфекции мочевого пузыря
Мягкая вода – Мягкая вода – это вода с низким содержанием минералов. Этот тип воды имеет тенденцию быть более кислой.
Многие пациенты с раком мочевого пузыря контролируют уровень pH с помощью тест-полосок с нитразином; они недорогие и их можно найти в магазинах здоровой пищи, а также в магазинах товаров для аквариумов, бассейнов и спа, а также в Wal Mart. Однако результаты теста могут варьироваться в зависимости от времени суток и потребляемой пищи.Прежде чем вносить какие-либо серьезные изменения в диету, было бы разумно спросить своего врача, повлияет ли это каким-либо образом на ваше лечение.
Спасибо банде и особенно Тому Мюллеру и Шэрон за помощь.
Каталожные номера
1. Кислый рН мочи связан с повышенным уровнем свободного бензидина и N-ацетилбензидина в моче и аддуктов ДНК уротелиальных клеток у подвергшихся воздействию рабочих. Ротман Н; Таласка Г; Хейс РБ; Бхатнагар ВК; Белл Д.А.; Лакшми В.М.; Кашьяп СК; Досемечи М; Кашьяп Р; Сюй Ф.Ф.; Джагер М; Хирвонен А; Парих DJ; Дэвис ББ; Зенсер Т.В. Отделение профессиональной эпидемиологии, Национальный институт рака, Бетесда, Мэриленд 20892, США.Эпидемиологические биомаркеры рака Предыдущая 1997 г., декабрь 6(12):1039-42 PMID: 9419400 UI: 98080670
2. Простатспецифический антиген в сыворотке внебольничной популяции здоровых мужчин: установление возрастных референтных диапазонов. Oesterling JE, Jacobsen SJ, Chute CG и др. JAMA. 1993; 270:860-864. PMID: 7688054 Пользовательский интерфейс: 93341065
создано 01.07.1999
последнее изменение 05.03.2019
Анализ мочи: 24-часовой анализ на наличие камней в почках (для родителей)
Что это такое
Суточный анализ мочи иногда является частью обследования ребенка с камнем в почках.Этот тест измеряет, сколько мочи (мочи) производит ребенок в день, кислотность (pH) мочи и количество определенных веществ в ней, таких как кальций, натрий, мочевая кислота, оксалат, цитрат и креатинин.
Почему это делается
Камни в почках образуются, когда определенные соли или минералы накапливаются в моче и образуют кристаллы. Кристаллы слипаются и увеличиваются, в конечном итоге образуя твердую массу, называемую камнем.
Суточный анализ мочи может показать, обнаружены ли в моче определенные вещества в высоких концентрациях, которые могут вызывать образование камней в почках.pH мочи также важен, так как некоторые кристаллы с большей вероятностью образуются в слишком кислой моче (низкий pH), а другие – в недостаточно кислой моче (высокий pH).
Информация, полученная в результате этого теста, в сочетании с другими тестами, такими как анализы крови и радиологические исследования, может помочь определить причину и местонахождение камней, а также лечение, которое может помочь предотвратить образование новых камней в почках. После начала лечения еще один 24-часовой сбор мочи может помочь определить, работает ли лечение.
Подготовка
Этот тест обычно проводится после того, как ребенок уже излечился от камней в почках, чувствует себя хорошо, нормально ест и не лечится от инфекции мочевыводящих путей (ИМП). Вашему ребенку может потребоваться временно прекратить прием определенных лекарств, которые могут повлиять на результаты анализов. Обязательно проконсультируйтесь с врачом о всех лекарствах, которые принимает ваш ребенок.
Процедура
Ваш врач даст вам контейнер для сбора мочи вашего ребенка в течение 24 часов.Утром после пробуждения ребенка попросят помочиться в унитаз, чтобы начать исследование с пустым мочевым пузырем. Вы должны отметить точное время, когда это делается — это начало сбора мочи вашего ребенка.
В течение дня вся моча вашего ребенка должна собираться в контейнер. На следующее утро следует также собрать первую дневную мочу, зафиксировав время суток. В течение периода тестирования должна быть собрана вся моча, даже если это небольшое количество.
Если ваш ребенок не приучен к горшку и не может мочиться в чашку, вместо этого можно использовать пакеты для сбора мочи с клейкой лентой на одном конце для сбора образцов. Область гениталий вашего ребенка нужно будет очистить, а затем мешок помещается вокруг мочевого отверстия и закрепляется прикрепленной лентой. Поверх сумки можно положить подгузник. Мешок нужно будет часто менять, чтобы собрать всю мочу, и каждый мешок нужно будет опорожнять в специальный контейнер.
Другим вариантом является использование катетера (узкая мягкая трубка), который можно ввести в мочевой пузырь и оставить там на 24 часа для получения мочи.
Контейнер следует закрыть крышкой и хранить в холодильнике или прохладном месте в течение периода сбора. Когда вся моча будет собрана, доставьте контейнер в лабораторию, рекомендованную врачом. Важно следовать всем инструкциям по правильному сбору, хранению и транспортировке образца мочи.
Лаборант измерит объем и уровень кислотности мочи, а также количество определенных веществ в моче и сообщит об этих результатах вашему врачу.
Чего ожидать
Поскольку тест предполагает нормальное мочеиспускание, не должно быть никакого дискомфорта, пока ваш ребенок может предоставить образец мочи. Перед сдачей каждой пробы мочи важно очищать область вокруг отверстия для мочеиспускания.
Получение результатов
Результаты суточного анализа мочи будут доступны в течение нескольких дней. Если тест показывает аномальные результаты, могут потребоваться дополнительные тесты. Поговорите со своим врачом о значении конкретных результатов теста.
Риски
24-часовой анализ мочи не связан с какими-либо рисками. У младенцев иногда может возникать раздражение кожи из-за клейкой ленты на мешке для сбора. Если требуется катетеризация образца, это может вызвать временный дискомфорт, и вы можете обсудить любые вопросы, связанные с этой процедурой, со своим врачом.
Помощь вашему ребенку
Суточный анализ мочи безболезненный. Объяснение простыми словами, как будет проводиться тест и почему он проводится, может помочь уменьшить любой страх.Убедитесь, что ваш ребенок понимает, что в образце не должно быть посторонних предметов, таких как туалетная бумага или волосы.
Если у вас есть вопросы
Если у вас есть вопросы о суточном анализе мочи, обратитесь к своему врачу.
Типы анализов мочи: pH, кетоны, белки и клетки — видео и стенограмма урока
Интерпретация pH мочи
Одно значение, которое можно измерить в моче, известно как pH мочи. pH является мерой кислотности или щелочности вещества.Если рН низкий, то это кислая среда. Если рН высокий, то он щелочной или щелочной.
Чтобы запомнить, что есть что, я дам вам небольшую хитрость, которая сработала для меня. Если вы выросли на мультфильмах, вы, вероятно, видели комичные, где мультяшные грабители обливали кислотой крышу банковского хранилища и ждали, пока кислота проест себе путь вниз в хранилище, чтобы грабители могли спуститься туда, чтобы украсть все деньги. . Если вы помните, что кислота любит проникать внутрь вещей, то вы помните, что кислые вещества опускаются по шкале pH.То есть их значения pH ниже, чем у основных веществ.
Нормальный рН мочи составляет примерно 4,6–8, в среднем 6. рН мочи может повышаться, то есть она становится более щелочной, из-за:
- Инфекции мочевыводящих путей
- Почечная недостаточность
- Введение некоторых лекарств, таких как бикарбонат натрия
- Вегетарианские диеты
С другой стороны, причины пониженного или кислого pH мочи включают:
- Метаболический или респираторный ацидоз
- Диабетический кетоацидоз, осложнение сахарного диабета
- Диарея
- Голод
- Диеты с высоким содержанием белка
Интерпретация содержания кетонов в моче
Помимо pH мочи, другим важным значением в анализе мочи, тесте, измеряющем уровни различных веществ в моче, является кетонов .Кетоны или кетоновые тела — это молекулы, вырабатываемые организмом при расщеплении жира для использования в качестве источника энергии.
Если вы счастливы и здоровы и получаете достаточно питательных веществ, то ваше тело расщепляет углеводы как источник топлива. Но в условиях, когда вы не получаете достаточно углеводов, когда вы их израсходовали или когда они не могут быть использованы в качестве источника энергии (как в случае сахарного диабета), тогда организм начинает расщеплять жировые запасы. чтобы обеспечить вас энергией, в результате чего вместо этого в качестве источника энергии используются кетоновые тела.
В качестве знакомого примера той же сделки: если у вас есть гибридный автомобиль, то вы знаете, что автомобиль может работать от батареи только определенное время. Если вы не заряжаете автомобиль, разрядился аккумулятор или он вышел из строя, то гибридный автомобиль переключается на другой источник энергии — бензин. Кетоны, по сути, являются резервным источником топлива во время большой нужды или болезни.
В норме в моче не должно быть кетонов. Если в моче обнаруживаются кетоны, называемые кетонурией, они могут указывать на:
- Экстремальные физические нагрузки, как в случае ультрамарафонцев, истощающие обычные источники энергии
- Голодание, приводящее к недостаточному потреблению углеводов
- Неконтролируемый диабет или диабетический кетоацидоз
- Алкогольный кетоацидоз в результате злоупотребления алкоголем
- Беременность
- Рвота
Интерпретация белка в моче
Другой компонент, который можно проверить в моче, – это белок.Обычно тест, называемый тест-полосками для мочи, используется в качестве рутинного сканирования на наличие белка в моче. Это тест, в котором есть все эти красивые цветные квадраты на полоске бумаги. Я уверен, что вы видели это раньше. Типичный анализ мочи с помощью тест-полоски не обнаруживает нормального количества белка в моче, обычно менее 150 мг/день. Пенистая моча часто указывает на аномальное количество белка в моче, называемое протеинурией , которое обнаруживается с помощью тест-полоски для мочи.
Но проблема с тестом мочи в том, что у него есть несколько недостатков.Обычно он измеряет только один тип белка, называемый альбумином, и гораздо менее чувствителен к глобулинам и белкам Бенс-Джонса. Кроме того, индикаторы тест-полосок иногда могут быть обмануты различными уровнями концентрации мочи и, следовательно, могут давать ложные результаты. Поэтому более точный тест на протеинурию известен как «тест на сульфосалициловую кислоту». Оба этих теста дают результаты с рядом знаков плюс, указывающих на постоянно увеличивающуюся концентрацию белков в моче. Поскольку тест на сульфосалициловую кислоту более точен, в этом уроке мы сосредоточимся на интерпретации его результатов:
- Отрицательный результат или 0 указывает на отсутствие протеинурии
- След указывает на легкую протеинурию около 20 мг/дл
- 1+ (или просто +) означает 50 мг/дл
- 2+ (++) означает 200 мг/дл
- 3+ (+++) означает, что протеинурия находится на уровне 500 мг/дл
- 4+ (++++) говорит нам о том, что протеинурия равна или превышает 1000 мг/дл
Сама по себе протеинурия может быть результатом многих различных проблем, в том числе;
- Заболевания сердца, такие как застойная сердечная недостаточность
- Гломерулонефрит, состояние, при котором почечный клубочек, структура, фильтрующая кровь, становится более пористым и пропускает белки с мочой
- Почечная тубулоинтерстициальная болезнь, при которой почки не могут реабсорбировать достаточное количество белка, отфильтрованного клубочками
- Рак, такой как множественная миелома, который вырабатывает большое количество белков до такой степени, что даже нормально функционирующие почки не могут реабсорбировать их в достаточном количестве, прежде чем они достигнут мочевого пузыря
- Почечный амилоидоз, состояние, при котором нерастворимые белки откладываются в почках
- Сахарный диабет
Как правило, чем выше степень протеинурии, тем больше вероятность того, что болезнь поразит клубочки.
Клетки и цилиндры в моче
Образец мочи также можно исследовать под микроскопом на наличие клеток и цилиндров. В норме в поле большого увеличения под микроскопом должно быть не более 2 эритроцитов. Превышение этого уровня может означать аномальное количество эритроцитов в моче, что мы называем гематурией . Это может быть результатом многих причин, которые можно запомнить по мнемоническому TICS:
- «Т» для «опухолей», «т» оксинов, таких как НПВП, или « т» травма в результате почечной пробойник
- «I» для «инфекций, таких как инфекция мочевыводящих путей или воспаление, вызывающее что-то вроде гломерулонефрита»
- C для сопутствующих заболеваний или конкрементов, которые относятся к камням в почках, мочеточниках, мочевом пузыре или уретре
- S для операции на мочевыводящих путях или серповидно-клеточной анемии или других аномалий, связанных с кровью, таких как гемофилия или тромбоцитопения (оба из которых могут вызвать кровотечение)
При гематурии и наличии значительного количества эритроцитов моча становится светло-розовой, красной или цвета колы.
Как и в случае с эритроцитами, у нормального здорового человека должно быть не более 5 лейкоцитов в поле зрения при большом увеличении. Если больше, то следует заподозрить инфекционный или воспалительный процесс. Инфекции обычно вызывают гной в моче, называемый пиурией . Гной представляет собой скопление мертвых лейкоцитов и бактерий, последние из которых никогда не должны быть обнаружены в нормальных образцах мочи.
На прощание: в пробе мочи также могут быть обнаружены цилиндры.Слепки представляют собой наборы белков и клеток. Существует множество различных типов литья. Эритроцитарные цилиндры указывают на гломерулярное заболевание, тогда как лейкоциты могут указывать на почечную инфекцию, также известную как пиелонефрит.
Резюме урока
В качестве повторения помните, что анализ мочи может смотреть на рН мочи, который является мерой кислотности или щелочности вещества, а также на кетонов . Кетоны или кетоновые тела — это молекулы, вырабатываемые организмом при расщеплении жира для использования в качестве источника энергии.



 — А чтобы разобраться, что конкретно происходит с пациентом, необходимо учесть жалобы пациента, его симптомы и применить дополнительные методы диагностики. Ведь мы лечим не анализ, а пациента».
— А чтобы разобраться, что конкретно происходит с пациентом, необходимо учесть жалобы пациента, его симптомы и применить дополнительные методы диагностики. Ведь мы лечим не анализ, а пациента».
 Без анализа невозможно понять, по какой причине это происходит. Это может быть связано, например, с употреблением в пищу свеклы, с лечением сульфаниламидами, или с рабдомиолизом — состоянием, при котором происходит разрушение мышечной ткани».
Без анализа невозможно понять, по какой причине это происходит. Это может быть связано, например, с употреблением в пищу свеклы, с лечением сульфаниламидами, или с рабдомиолизом — состоянием, при котором происходит разрушение мышечной ткани».
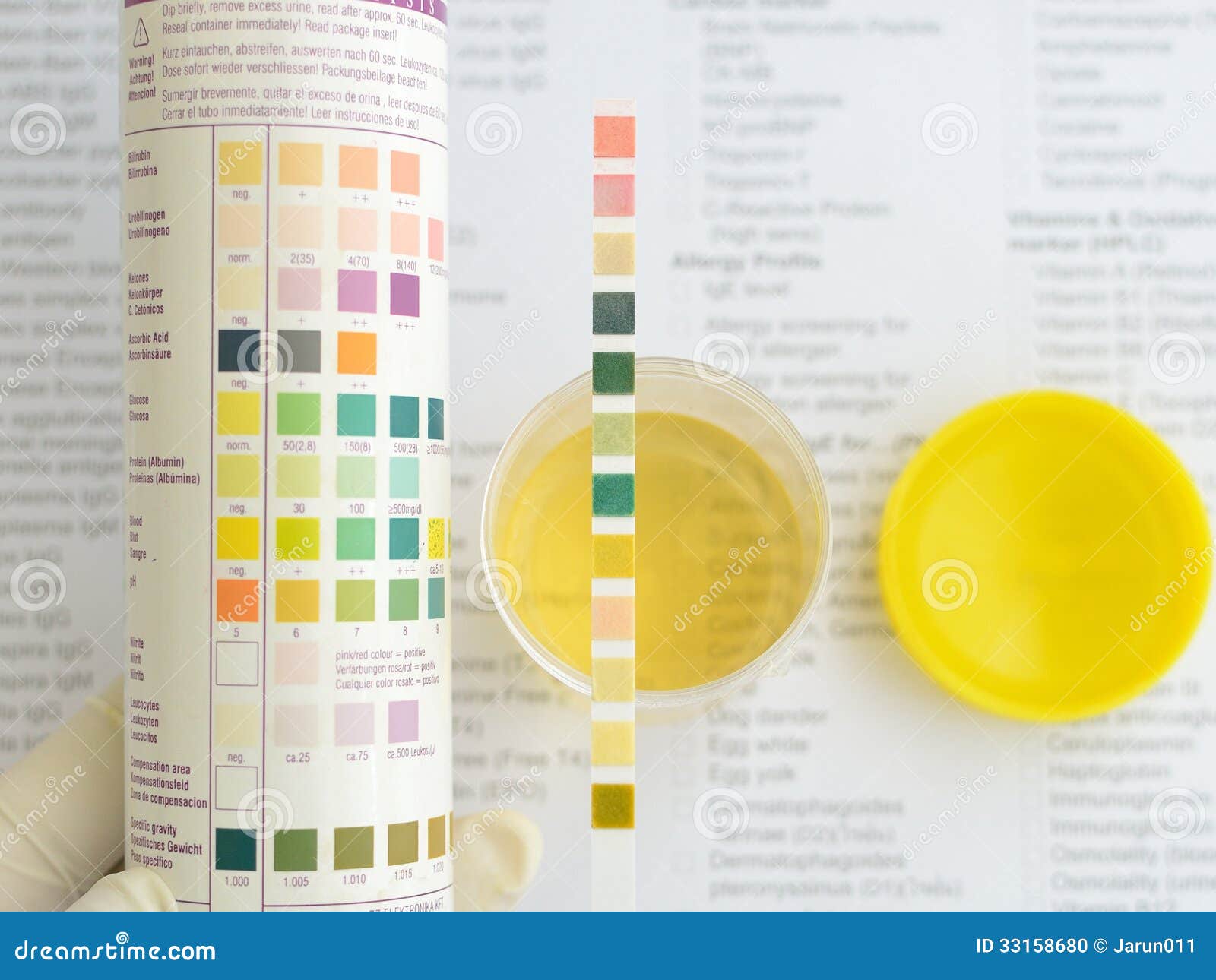 Возможно, речь идет о хронической почечной недостаточности, — говорит Камалетдинов. — Но в то же время этот показатель нередко снижается у пациентов, достигших солидного возраста».
Возможно, речь идет о хронической почечной недостаточности, — говорит Камалетдинов. — Но в то же время этот показатель нередко снижается у пациентов, достигших солидного возраста».

 Некоторые бактерии способны разлагать азотсодержащие вещества в моче до аммиака, который проявляет щелочные свойства.
Некоторые бактерии способны разлагать азотсодержащие вещества в моче до аммиака, который проявляет щелочные свойства. Должны ли все пациенты с сахарным диабетом 1 типа и микроальбуминурией получать ингибиторы ангиотензинпревращающего фермента? Метаанализ индивидуальных данных пациентов. Энн Интерн Мед. 2001 март; 134 (5): 370–9.
Должны ли все пациенты с сахарным диабетом 1 типа и микроальбуминурией получать ингибиторы ангиотензинпревращающего фермента? Метаанализ индивидуальных данных пациентов. Энн Интерн Мед. 2001 март; 134 (5): 370–9.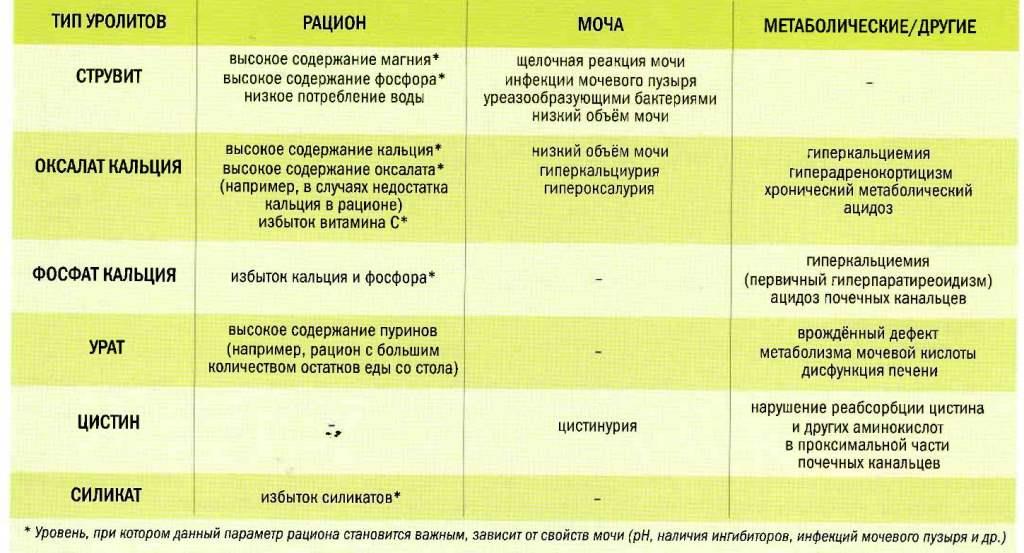 Радиология. 1975 г., май; 115 (2): 329–36.
Радиология. 1975 г., май; 115 (2): 329–36. , Монтес-Рат М.Е., Чертоу Г.Оценка риска рентгеноконтрастной нефропатии. J Am Soc Нефрол. 2017 фев; 28 (2): 653–9.
, Монтес-Рат М.Е., Чертоу Г.Оценка риска рентгеноконтрастной нефропатии. J Am Soc Нефрол. 2017 фев; 28 (2): 653–9. Почечный пресс крови Res. 2018;43(1):170–80.
Почечный пресс крови Res. 2018;43(1):170–80. , Сегал М., Афсар Б., Канг Д.Х., Родригес-Итурбе Б., Джонсон Р.Дж.Роль мочевой кислоты в патогенезе сердечно-сосудистых заболеваний человека. Сердце. 2013 г., июнь; 99 (11): 759–66.
, Сегал М., Афсар Б., Канг Д.Х., Родригес-Итурбе Б., Джонсон Р.Дж.Роль мочевой кислоты в патогенезе сердечно-сосудистых заболеваний человека. Сердце. 2013 г., июнь; 99 (11): 759–66. Европейский J Стажер Мед. 2014 июнь; 25 (5): 471–476.
Европейский J Стажер Мед. 2014 июнь; 25 (5): 471–476. Урикозурия и рентгеноконтрастные вещества. N Engl J Med. 1971 г., апрель; 284 (17): 975–976.
Урикозурия и рентгеноконтрастные вещества. N Engl J Med. 1971 г., апрель; 284 (17): 975–976. Частота изменений креатинина в сыворотке крови в отсутствие йодсодержащего контрастного вещества: последствия для исследований контрастной нефротоксичности. AJR Am J Рентгенол. 2008 г., август; 191 (2): 376–82.
Частота изменений креатинина в сыворотке крови в отсутствие йодсодержащего контрастного вещества: последствия для исследований контрастной нефротоксичности. AJR Am J Рентгенол. 2008 г., август; 191 (2): 376–82. , Аймонг Э.Д., Никольский Э., Ласич З., Якову И., Фахи М. и др. Простая оценка риска для прогнозирования контраст-индуцированной нефропатии после чрескожного коронарного вмешательства: разработка и начальная валидация.J Am Coll Кардиол. 2004 г., октябрь; 44 (7): 1393–9.
, Аймонг Э.Д., Никольский Э., Ласич З., Якову И., Фахи М. и др. Простая оценка риска для прогнозирования контраст-индуцированной нефропатии после чрескожного коронарного вмешательства: разработка и начальная валидация.J Am Coll Кардиол. 2004 г., октябрь; 44 (7): 1393–9. Am J Physiol Renal Physiol. 2015 г., январь; 308 (2): F77–83.
Am J Physiol Renal Physiol. 2015 г., январь; 308 (2): F77–83. , Вердоя М., Шаффер А., Кассетти Э., Марино П., Сурьяпраната Х. и др.; Новарская группа по изучению атеросклероза (NAS). Уровни мочевой кислоты и риск контраст-индуцированной нефропатии у пациентов, перенесших коронарографию или ЧКВ.Nutr Metab Cardiovasc Dis. 2015 февраль; 25 (2): 181–186.
, Вердоя М., Шаффер А., Кассетти Э., Марино П., Сурьяпраната Х. и др.; Новарская группа по изучению атеросклероза (NAS). Уровни мочевой кислоты и риск контраст-индуцированной нефропатии у пациентов, перенесших коронарографию или ЧКВ.Nutr Metab Cardiovasc Dis. 2015 февраль; 25 (2): 181–186. и др.Прогностическое значение гиперурикемии у больных с различными видами почечной дисфункции и острым инфарктом миокарда, перенесших чрескожное коронарное вмешательство. Клиническая практика Нефрона. 2010;116(2):c114–22.
и др.Прогностическое значение гиперурикемии у больных с различными видами почечной дисфункции и острым инфарктом миокарда, перенесших чрескожное коронарное вмешательство. Клиническая практика Нефрона. 2010;116(2):c114–22. J Clin Diagn Res. 2014 г., декабрь; 8 (12): HC03–07.
J Clin Diagn Res. 2014 г., декабрь; 8 (12): HC03–07. , Картик К.Р., Сварналата Г., Дас У., Тадури Г. N-ацетилцистеин по сравнению с аллопуринолом в профилактике контрастной нефропатии у пациентов с хроническим заболеванием почек: рандомизированное контролируемое исследование. Индийский Дж. Нефрол. 2017 март-апрель; 27 (2): 93–8.
, Картик К.Р., Сварналата Г., Дас У., Тадури Г. N-ацетилцистеин по сравнению с аллопуринолом в профилактике контрастной нефропатии у пациентов с хроническим заболеванием почек: рандомизированное контролируемое исследование. Индийский Дж. Нефрол. 2017 март-апрель; 27 (2): 93–8. почки инт. 2005 г., октябрь; 68 (4): 1543–53.
почки инт. 2005 г., октябрь; 68 (4): 1543–53. , Худдам Б., Азак А., Солак Ю., Кадиоглу Г.К., Кирбас И. и др.Рандомизированное исследование аллопуринола на функцию эндотелия и расчетную скорость клубочковой фильтрации у пациентов с бессимптомной гиперурикемией и нормальной функцией почек. Clin J Am Soc Нефрол. 2011 авг; 6 (8): 1887–94.
, Худдам Б., Азак А., Солак Ю., Кадиоглу Г.К., Кирбас И. и др.Рандомизированное исследование аллопуринола на функцию эндотелия и расчетную скорость клубочковой фильтрации у пациентов с бессимптомной гиперурикемией и нормальной функцией почек. Clin J Am Soc Нефрол. 2011 авг; 6 (8): 1887–94. Am J Нефрол. 2012;36(4):324–31.
Am J Нефрол. 2012;36(4):324–31.