| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
dpva.ru
Водный раствор — хлористый натрий
Водный раствор — хлористый натрий
Cтраница 1
Водный раствор хлористого натрия, содержащий небольшое количество примесей, течет к электролитической ячейке через подвергающуюся коррозии трубу из сплава железа, а затем через коррозионно-стойкую трубу из органического пластика. Ток утечки, от ячейки через раствор в трубе, составляющий 0 57 А, вызвал нежелательную коррозию трубы из сплава железа. Инертный в коррозионном отношении металлический электрод, потенциал которого больше, чем у железа, помещали в пластиковой трубе и соединяли с землей. [1]
Электролиз водных растворов хлористого натрия дает возможность получать хлор, водород и едкий натр. [2]
Помимо водных растворов хлористого натрия, хлористого магния и хлористого кальция в качестве эвтектиков применяют и другие растворы. [3]
Если в водный раствор хлористого натрия погрузить сильнокислотный катионит в натриевой форме, то окажется, что концентрация хлористого натрия внутри зерен катионита будет значительно ниже, чем во внешнем растворе. Это произойдет потому, что концентрация подвижных ионов натрия в катиони-те высока и ионы натрия из внешнего раствора не могут в значительной степени проникнуть внутрь зерна. Концентрация ионов хлора в зерне в начальный период погружения равна нулю, поэтому ионы хлора будут стремиться проникнуть внутрь зерна, но вследствие закона электронейтральности это может быть достигнуто только в том случае, если с анионом внешнего раствора в зерно будут проникать катионы натрия. [4]
Рассолы — водные растворы хлористого натрия Nad и хлористого кальция СаСЬ применяют для температур охлаждаемой среды, близких к нулю или ниже его. [5]
При электролизе водных растворов хлористого натрия или хлористого калия на твердом катоде ( угольном или металлическом) всегда выделяется водород. [6]
При электролизе водных растворов хлористого натрия
При электролизе водных растворов хлористого натрия на твердых катодах протекает выделение водорода. [8]
Промышленный электролиз водных растворов хлористого натрия осуществляют в ваннах с твердым ( железо) или с жидким ( ртуть) катодом. В обоих случаях анодом служит графит. [10]
Получается электролизом водного раствора хлористого натрия, также взаимодействием раствора соды с известковым молоком или прокаливанием смеси кальцинированной соды с окисью железа и дальнейшим разложением феррита натрия водой и упариванием раствора едкого натра. [11]
Получается электролизом водного раствора хлористого натрия, также взаимодействием раствора соды с известковым молоком или прокаливанием окиси железа с содой и дальнейшим разложением феррита натрия водой. [12]
При электролизе водных растворов хлористого натрия только часть его превращается в едкий натр. [13]
При электролизе водного раствора хлористого натрия в случае, когда электроды электролизера не разделены диафрагмой, в результате вторичной реакции образуется гипохлорит натрия — На аноде вследствие частичной разрядки ОН-ионов помимо хлора выделяется также небольшое количество кислорода. [14]
При электрохимическом разложении водных растворов хлористого натрия в ваннах с твердым катодом необходимо отделять анодный продукт электролиза-хлор от катодного продукта — едкого натра. [15]
Страницы: 1 2 3 4
Определение хлорида натрия в водном растворе
Исторический обзор возникновения интереса к неводным растворителям, а следовательно, и к выяснению роли растворителя в природе растворов, дан в известных монографиях Вальдена 121 иЮ. И. Соловьева [3]. Еще в середине XVI в. Бойль заинтересовался способностью спирта растворять хлориды железа и меди. Позднее ряд химиков отмечает и использует растворяющую способность спирта. В 1796 г. русский химик Ловиц использует спирт для отделения хлоридов кальция и стронция от нерастворимого хлорида бария, как будто положив начало применению неводных растворителей в аналитических целях. В первой половине XIX в. подобные наблюдения и их практическое применение встречаются чаще, причем химики устанавливают случаи химического взаимодействия растворителя с растворенным веществом, показывая, что и в органических жидкостях могут образовываться сольваты (Грэхем, Дюма, Либих, Кульман). Основным свойством, которое при этом изучалось, была растворимость. В 80-х годах XIX в. Рауль, исследуя в целях определения молекулярных весов понижение температур замерзания и повышение температур кипения нри растворении, отмечает принципиальное сходство между водой и неводными средами. Но систематическое физико-химическое изучение неводных растворов наряду с водными начинается только в самом конце столетия, когда Каррара осуществляет измерение электропроводности растворов триэтилсульфония в ацетоне, метиловом, этиловом и бензиловом спиртах, а также ионизации различных кислот, оснований и солей в метиловом спирте. В этот же период М. С. Вревский проводит измерения теплоемкостей растворов хлорида кобальта в смесях воды и этилового спирта [4], а также давлений и состава паров над растворами десяти электролитов в смесях воды и метилового спирта [5]. Им впервые четко установлено явление высаливания спирта и определено как .. . следствие неравномерного взаимодействия соли с частицами растворителя . Несколько раньше на самый факт повышения общего давления пара при растворении хлорида натрия в смесях этанола и воды, на первый взгляд противоречащий закону Рауля, обратил внимание И. А. Каблуков [6]. Пожалуй, эти работы можно считать первыми, в которых подход к смешанным растворителям, к избирательной сольватации и к специфике гидратационной способности воды близок современному пониманию этих вопросов. Мы возвратимся к этому сопоставлению в гл. X.Полученный в результате реакции хлорид оттитровывают нитратом серебра. В ряде случаев содержание хлора определяют сплавлением с металлическим натрием, при этом хлор переходит в хлорид натрия. Остаток после сплавления растворяют в воде, подкисляют азотной кислотой и титруют раствором нитрата серебра. Для определения хлора пользуются методами мокрого сжигания органического вещества серной кислотой в присутствии нитрата калия или сжигания в атмосфере кислорода в присутствии платинового катализатора. Продукты разложения поглощают водным раствором едкого кали. Ион хлора в продуктах разложения определяют по Фольгарду. [c.213]
С хлоридом железа (III) фенол дает фиолетовое окрашивание. Для определения фенола служит также реакция Либермана. Для этого фенол обрабатывают концентрированной серной кислотой и добавляют несколько капель водного раствора нитрита натрия. При разбавлении раствор приобретает красное окрашивание, при добавлении едкого натра окраска переходит в голубую. Эта цветная реакция объясняется образованием индофенола (т. пл. 160 °С), натриевая соль которого имеет синюю окраску [c.327]
Предложен метод быстрого определения свободного формальдегида в водных растворах фенолоформальдегидных полимеров, состоящий в нейтрализации исследуемого раствора спиртовым раствором гидроксида натрия и определении формальдегида по реакции с хлоридом гидроксиламина. [c.216]
Чтобы количественно оценивать влияние давления на ионное равновесие, следует располагать значениями парциальных ионных объемов (на моль диссоциированного вещества). К сожалению, мы не умеем в настоящее время определять абсолютные значения парциальных ионных объемов в различных средах. Поэтому поступают так же, как при определении абсолютных потенциалов в электрохимических системах. Принимают, что парциальный объем иона водорода 1 + в водном растворе при 25 °С и 0,1013 МПа равен нулю. Тогда можно вычислить относительные по отношению к Рн+ парциальные объемы других ионов по значениям парциальных молярных объемов электролитов в бесконечно разбавленных водных растворах. Измерения следует проводить в тех же условиях, где Кн+ равен нулю, т. е. при 25°С и 0,1013 МПа. Так, например, определив значение парциального молярного объема нацело диссоциированной соляной кислоты (бесконечно разбавленный раствор), находят парциальный ионный объем хлора Ус1 — Затем, зная значение Ус1-, можно аналогичным путем исследовать водный раствор хлорида натрия и получить и т. д. [c.114]
В отличие от рассмотренных выше элементов определение общего содержания ртути методом ААС основано на измерении поглощения света ее парами, которые вьщеляются потоком воздуха из водного раствора после восстановления ионов до атомного состояния, при длине волны 253,7 нм в газовой кювете при комнатной температуре ( метод холодн()го пара ). В качестве восстановителей применяют хлорид олова, станнит натрия, аскорбиновую кислоту и др. [3,8]. Предел обнаружения состав.гтя-ет 0,2 мкг/л, диапазон измеряемых концентраций 0,2 — 10 мкг/л [И] Для устранения мешающего влияния органических веществ, поглощаюшцх свет при данной длине волны, к пробе добавляют кислый раствор перманганата или бихромата калия. [c.249]
Количественное определение производят титрованием водного раствора препарата, нагретого до 30—40° 0,1 н. раствором соляной кислоты в присутствии натрия хлорида и индикатора метилового оранжевого [c.91]
В некоторых случаях вместо ртути можно применять другие запирающие жидкости, например насыщенный раствор хлорида или сульфата натрия в воде. Добавление электролитов в раствор понижает растворимость газов, поэтому насыщенный раствор сульфата натрия в серной кислоте обладает определенными преимуществами перед водными растворами указанных солей. Для приготовления запирающей жидкости смешивают раствор 200 г безводного сульфата натрия в 800 мл воды с 40 мл концентрированной серной кислоты и полученную смесь кипятят с обратным холодильником. Давление пара над этим раствором при [c.39]
Лабораторная работа № 40 ОПРЕДЕЛЕНИЕ ХЛОРИДА НАТРИЯ В ВОДНОМ РАСТВОРЕ [c.212]
Для получения суспензий применяли диатомит с размером частиц в основном менее 10 мкм, карбонат кальция
www.chem21.info
Хлорид натрия — Знаешь как
( Натрий хлор , поваренная соль , каменная соль ) NaCl . Получают из природных источников , соляные озёра , в лабораторных условиях путём взаимодействия натрия с хлором при температуре ( 100 — 150°С ) :
2Na + 2Cl = 2NaCl
Реакцией натрия с соляной кислотой :
2Na + 2HCl = 2NaCl + h3↑
Реакцией гидроксида натрия с соляной кислотой :
NaOH + HCl = NaCl + h3O
Реакцией на соли более слабых кислот :
Na2CO3 + 2HCl = 2NaCl + CO2 + h3O
Взаимодействием гидроксида натрия с хлоридом аммония причём в ходе нагревания выделяется газообразный аммиак , подобные реакции используют ( как качественную реакцию для проверки на нахождения аммиака в солях ) :
NaOH + Nh5Cl = NaCl + Nh4↑ + h3O
Обменная реакция между солью щелочью с образованием новой соли и нерастворимого гидроксида :
FeCl3 + 3NaOH = Fe( OH )3↓ + 3NaCl
Применение . Хлорид натрия неотъемлемая часть жизнедеятельности всех живых организмов , он участвует в обмене веществ в организмах , а в растениях как минеральная соль без которой они погибают , у животных и людей нехватка хлорида натрия приводит к нарушению работы всего организма , так как в основном его свойства используются для выведения из организма через пот вредных веществ .
В производстве неорганических удобрений , получении натрия , хлора , водорода , в химической промышленности , для получения гидроксида натрия и всех его соединений . Большое количество используется в производстве мыла .
Действием на хлорид натрия более сильных кислот получают соляную кислоту и гидросульфат натрия , для выделения её из раствора нагревают ( 50 °С ):
NaCl + h3SO4 =NaHSO4 + HCl↑
Кипячение приводит к полному образованию сульфата натрия и соляной кислоты :
2NaCl + h3SO4 = Na2SO4 + 2HCl↑
В лабораторных условиях при взаимодействии хлорида натрия , серной кислоты и оксида свинца получают газообразный хлор ( который в свою очередь можно использовать как окислитель для получения золота и платины , метод Миллера ) :
2NaCl + 4h3SO4 + PbO2 = Cl2↑ + Pb( HSO4 )2 + 2NaHSO4 + 2h3O
Аналогично ведёт себя оксид марганца :
2NaCl + 2h3SO4 + MnO2 = Cl2↑ + MnSO4 + Na2SO4 + 2h3O
Реакцию с перманганатом калия , хлоридом натрия и концентрированной серной кислотой проводят только добавлением серной кислоты в хлорид натрия , а затем перманганат калия . Если поменять вещества местами то произойдёт мгновенное выделение оксида марганца которое приведёт к воспламенению и взрыву , поэтому подобную реакцию проводят крайне редко :
10NaCl + 8h3SO4 + 2KMnO4 = 5Cl2↑ + 2MnSO4 + 5Na2SO4 + K2SO4 + 8h3O
Реакция хлорида натрия с солями серебра приводит к осаждению солей серебра из их растворов в качестве белого творожистого осадка ( качественная реакция на ионы серебра ) :
NaCl + AgNO3 = NaNO3 + AgCl↓
NaCl + AgNO2 =NaNO3 + AgCl↓
В водных растворах при пропускании газообразного аммиака и оксида углерода образуются две новых соли хлорид аммония и гидрокарбонат натрия :
NaCl + h3O + Nh4 + CO2 = NaHCO3 + Nh5Cl
При нагревании до температуры ( 300°С ) хлорида натрия и хлорида алюминия образуется соединение тетрахлоралюминат натрия :
NaCl + AlCl3 = NaAlCl4
Вы читаете, статья на тему хлорид натрия
znaesh-kak.com
Электролиз водного раствора хлорида натрия — Студопедия.Нет
Электролиз водного раствора хлорида натрияв промышленности используют для получения хлора, водорода и гидроксида натрия.
В настоящее время в промышленности используют два способа электролиза — диафрагменный и ртутный. Основной процесс в том и другом способах — электролиз насыщенного раствора поваренной соли. В обоих методах анодные процессы подобны; их основной продукт — газообразный хлор. Катодные же процессы различны.
При диафрагменном способе применяют стальной катод, к которому подают раствор хлорида натрия. Часть хлорида натрия превращается в гидроксид натрия, и выделяется водород. Хлорид натрия отделяют от гидроксида натрия при упаривании раствора. При этом из-за снижения растворимости он выпадает в осадок. Товарный продукт — раствор гидроксида натрия концентрацией 42-50 %(мас.) содержит 2-4 %(мас.) хлорида натрия.
В ртутном электролизе катод из ртути. Ионы натрия, разряжаясь на нем, образуют натриевую амальгаму. В отдельном аппарате – разлагателе — амальгама натрия разлагается водой, образуя водород и раствор гидроксида натрия. В разлагателе сразу может быть получен раствор гидроксида натрия с товарной концентрацией 42-50 %(мас), не содержащий примесей хлорида натрия.
Раствор поваренной соли (рассол) перед электролизом подвергается очистке. Рассол очищают от солей кальция и магния. Очистка производится осаждением примесей строго дозированными осадительными реактивами: суспензией соды и известковым молоком.
Осаждение примесей происходит по реакциям:
Mg2++ Са(ОН)2 = Са2+ + Mg(OH)2↓
Са2+ + Na2CО3 = 2 Na+ + CaCО3↓
Помимо химической очистки рассол освобождают от механических примесей отстаиванием и фильтрованием.
Диафрагменное производство (рис. 9.1) включает следующие стадии:
1) приготовление и очистка рассола. На этой стадии растворяют твердую поваренную соль и очищают рассол от ионов кальция и магния. Подготовленный рассол направляют на электролиз;
2) электролиз;
3) выпаривание электролитических щелоков. На этой стадии слабые растворы едкого натра и хлорида натрия, полученные при электролизе, упаривают до товарной концентрации по гидроксиду натрия. Выпадающую при этом соль отделяют от раствора, растворяют в воде и передают на стадию приготовления рассола, где этот рассол присоединяется к рассолу, приготовленному из свежей соли;
4) вывод сульфатов. На эту стадию поступает хлорид натрия, полученный на последней ступени выпаривания электролитических щелоков и содержащий повышенное количество сульфатов. Из соли выделяют сульфат натрия в виде товарной продукции. Очищенный раствор соли передают на стадию приготовления рассола;
5) охлаждение и сушка хлора;
6) охлаждение и сушка водорода.
Реакции, протекающие в диафрагменном электролизере, зависят от материалов и конструкций электролизеров, концентрации рассола, рН среды, плотности тока, температуры и содержания кислородсодержащих ионов.
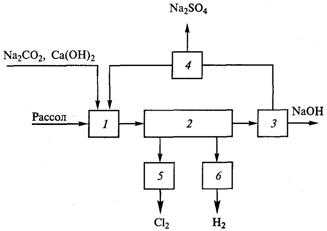 Рис. 9.1. Структурная схема диафрагменного метода:
Рис. 9.1. Структурная схема диафрагменного метода:
1- приготовление и очистка рассола; 2 — электролиз; 3 — выпаривание электролитических щелоков; 4 — вывод сульфидов: 5 — охлаждение, осушка и компрессирование хлора; 6 — охлаждение, осушка и компрессирование водорода.
В промышленных электролизерах анод выполняется из графита, катод — из железа.
На железном катоде основной процесс — выделение водорода:
2 Н+ + 2ē = Н2
2 Н2О + 2ē = Н2 + 2 OH—
Разряд ионов натрия невозможен, так как равновесный потенциал разряда иона натрия на железном катоде в нейтральном насыщенном растворе хлорида натрия значительно выше (-2,71 В), чем у водорода (-0,415 В).
Основная реакция на графитовом аноде:
2 Сl— + 2ē = С12
Кроме этой реакции на аноде протекают побочные реакции:
2 OH— — 2ē = 0,5 О2 + Н2O Н2O — 2ē = 0,5 О2 + 2 Н+
Равновесный электродный потенциал разряда гидроксид-ионов в нейтральном насыщенном растворе хлорида натрия равен +0,82 В, а ионов хлора +1,32 В. Следовательно, на аноде с малым перенапряжением должен бы в первую очередь выделяться кислород.
Как известно из теоретической электрохимии, параллельные электродные реакции проходят с такими частными плотностями тока, которые дают одинаковый потенциал электрода. Поэтому можно записать:
φа = φ (С12) + ψ(С12) = φ (О2) + ψ (О2) (9.12)
где: φа — потенциал анода, В; φ (С12), φ (О2) — равновесные потенциалы выделения хлора и кислорода определяются по формуле Нернста и зависят от концентрации (активности) ионов хлора или гидроксида, а также от температуры; ψ (С12), ψ (О2) — перенапряжение хлора и кислорода; величина перенапряжения увеличивается с ростом плотности тока.
Перенапряжение для выделения хлора снижается с повышением температуры в большей мере, чем у кислорода. При повышении плотности тока процесс на аноде также сдвигается в сторону выделения хлора. Как видно из рис. 9.2, с повышением плотности тока потенциал выделения хлора возрастает в меньшей мере, чем у кислорода. На аноде могут разряжаться гипохлорит-ионы. В результате выделяется кислород:
3 СlO— + 3 Н2O — 6ē = ClO3— + 1,5 О2 + 2 Сl— + 3 Н2
Наличие гипохлоритных ионов вызвано частичным гидролизом хлора.
При диафрагменном электролизе вместе с хлором всегда выделяется кислород. Нормальный уровень выделения кислорода определяется установленным технологическим режимом (материалом анодов, плотностью тока, температурой, составом рассола и др.). Важнейшее условие при этом — нормальная кислотность анолита (раствор находящегося в анодном пространстве).

Рис. 9.2. Анодные поляризационные кривые на графите при 250 °С в 22.6 % (мас.) растворе хлорида натрия:
1- выделение хлора; 2 — выделение кислорода.
Наличие в электролите гипохлорит- и гипохлорат-ионов может вызвать протекание побочных реакций на катоде:
СlO3— + 3 Н2 = 3 Н2O + Сl— СlO— + Н2 = Н2O + Сl—
Повышение щелочности анолита увеличивает интенсивность выделения кислорода на аноде. Поэтому процесс электролиза в диафрагменных электролизерах строят таким образом, чтобы в максимальной степени снизить электролитический перенос иона гидроксида к аноду. Это удается достигнуть за счет применения фильтрующей диафрагмы.
Фильтрующую диафрагму выполняют в виде пористой перегородки, разделяющей катодное и анодное пространства. Она препятствует смешиванию продуктов электролиза. Через нее непрерывно проходит поток анолита из анодного пространства к катоду.
Протекаемость диафрагмы и степень превращения (ориентировочно) контролируют по концентрации гидроксида натрия в католите (электролите, находящемся в катодном пространстве). Практически у современных промышленных электролизеров предельному значению степени превращения соответствует концентрация гидроксида натрия в католите 140-150 г/л. Когда концентрация щелочи превышает его значение, ход электролиза отклоняется от нормы.
Данные, показывающие зависимость выхода по току от концентрации щелочи, приведены на рис. 9.3. Наблюдается снижение выхода по току при работе с католитом, имеющим концентрацию щелочи выше 150 г/л.
Рис. 9.3. Зависимость выхода по току от концентрации гидроксида натрия в католите
Повышенные температуры электролиза и конденсации хлорида натрия в электролите понижают растворимость хлора, что сокращает вероятность протекания побочных реакций, а следовательно, увеличивает выход потоку. Кроме того, повышение температуры увеличивает электропроводность электролита, благодаря чему снижается напряжение на ванне. Таким образом, уменьшается расход электроэнергии, поэтому электролиз растворов хлорида натрия проводят при температурах 70 — 80 °С.
Промышленные электролизеры с фильтрующей перегородкой широко применяются в промышленности.
Схема современного диафрагменного электролизера представлена на рис. 9.4. Корпус электролизера 7 разделен на две полости: анодное 4и катодное 5 пространства. В анодном пространстве размещены аноды из графита. Анодное и катодное пространства разделены диафрагмой, основанием для крепления которой служит катод 3. Диафрагма покрывает катод со стороны, обращенной к аноду. В анодное пространство подают рассол — насыщенный раствор поваренной соли.
Уровень анолита выше верхней границы диафрагмы. В газовом пространстве над уровнем анолита собирается хлор, образовавшийся на аноде. Отсюда хлор отводится в коллектор. Анолит вследствие разности уровней жидкости в анодном и катодном пространствах протекает сквозь диафрагму.
На катоде восстанавливается водород, а анолит, перетекающий к катоду, меняет состав и обогащается гидроксид-ионами. Католит содержит поваренную соль, гидроксид натрия и небольшую примесь хлората натрия. Он отводится из катодного пространства через сливную трубку 9; ее устройство позволяет регулировать уровень раствора в электролизере. В газовом пространстве над уровнем католита собирается водород, направляемый затем в коллектор.
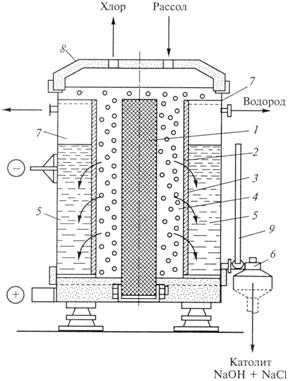 Католит, вышедший из электролизера, иначе называемый электролитическим щелоком, содержит гидроксид натрия 110-120 г/л и хлорид натрия 170-180 г/л.
Католит, вышедший из электролизера, иначе называемый электролитическим щелоком, содержит гидроксид натрия 110-120 г/л и хлорид натрия 170-180 г/л.
Рис. 9.4. Схема диафрагменного электролизер:
1- анод; 2 — диафрагма; 3 — катод; 4 — анодное пространство; 5 – катодное пространство; 6 — капельница; 7- корпус электролизера; 8 — крышка; 9 -сливная трубка для католита
Отношение концентрации гидроксида натрия к концентрации хлорида натрия в католите определяется важным показателем технологического режима — степенью превращения (Х) хлорида натрия приэлектролизе. Так называют отношение числа молей хлорида натрия, превратившихся в гидроксид натрия, к числу молей хлорида натрия, поступивших на электролиз.
Степень превращения вычисляют по формуле:
Х= 1,46 · CNaOH / [CNaCl + l,46 CNaOH] (9.13)
Процессы, протекающие в электролизерах, и их технические показатели во многом зависят от функционирования диафрагмы. Чтобы диафрагма могла выполнять свои функции, она должна удовлетворять следующим требованиям:
— быть достаточно плотной и прочной, чтобы обеспечивать полное разделение газовых продуктов и исключать смещение анолита и католита;
— иметь низкое электрическое сопротивление, чтобы избежать потери напряжения в диафрагме;
— обладать достаточно низким гидравлическим сопротивлением;
— быть химически стойкой к кислотам и щелочам, чтобы диафрагма работала продолжительный срок;
— иметь близкие свойства и однородность на всех участках.
Лучший материал для диафрагмы — хризолитовый асбест.
Основное требование к материалу анода — наибольшее перенапряжение выделению кислорода, чем хлора.
Еще не найден материал, абсолютно стойкий к процессам совместного электрохимического выделения хлора и кислорода. На практике стремятся к тому, чтобы применяемые материалы разрушались с относительно небольшой скоростью.
Предпочтение отдается материалам с низким удельным электросопротивлением, так как чем ниже сопротивление, тем ниже падение напряжения в аноде и тем равномернее распределение по нему плотности тока. Практически можно использовать платину, графит и магнетит. Лучшая по всем показателям (кроме стоимости) — платина. В промышленности аноды изготавливают исключительно из искусственного графита.
Ртутный метод электролиза водного раствора хлорида натрия содержит те же стадии, что и диафрагменный, за исключением выпаривания (рис. 9.5). Приготовление и очистка рассола в этом производстве имеют особенности и по технологической схеме отличаются от соответствующей стадии диафрагменного производства. Это связано с особыми требованиями к анолиту, возвращаемому на электролиз.
Анолит после электролиза содержит 260-270 г/л хлорида натрия, около 0,6 г/л растворенного хлора, около 5 мг/л кальция, магния, тяжелых металлов, примеси графитовой пыли.
Рис. 9.5. Структурная схема электролиза водного раствора хлорида натрия с ртутным катодом:
1- подготовка и очистка рассола; 2- электролиз: 3 — дехлорирование и очистка анолита; 4 — охлаждение, сушка и компрессирование хлора: 5 — охлаждение, сушка и компрессирование водорода.
Для удаления хлора из анолита последовательно применяют подкисление, вакуумирование, отдувку воздухом, разрушение остатков хлора восстановителями. Подкисляют анолит соляной кислотой. Вакуумирование проводят при давлении 400-450 мм.рт.ст.
Реакции, протекающие на аноде в электролизерах с ртутным катодом, аналогичны реакциям, рассмотренным для диафрагменных электролизеров.
Катодный процесс в электролизерах с ртутным катодом коренным образом отличается от такового в диафрагменном электролизере, в котором на стальном катоде разряжаются ионы водорода.
В ртутных электролизерах выделение водорода на катоде является побочным и вредным процессом. Его развитие сдерживается счет того, что на ртутном катоде или на катоде из амальгамы натрия водород выделяется с большим перенапряжением.
Характерная поляризационная кривая этого процесса приведена на рис. 9.6. На рисунке видно, что интенсивное выделение водорода наступает при потенциалах катода, более отрицательных, нежели – 1.9 В. Однако при меньшем отрицательном потенциале на ртутном катоде возникает другая электродная реакция — образование ртутной амальгамы натрия, на которую и затрачивается основная часть тока.
Металлический натрий в момент выделения реагирует с ртутью, образуя интерметаллическое соединение NaHgn (растворенное в ртути амальгама натрия). При этом работа, необходимая для восстановления иона натрия, снижается на величину энергии, выделяемой при образовании амальгамы. Потенциал образования амальгамы натрия φк = -1.80 В.
Изменение потенциала выделения веществ в электрохимическом процессе за счет возникновения вторичной реакции на электроде называется деполяризацией. За счет деполяризации возможно выделение натрия на ртутном катоде в виде амальгамы по реакции:
Na+ + n Hg + ē = NaHgn
Этот процесс проходит практически без перенапряжения.
Основная побочная реакция на катоде:
2 H+ + 2e— = H2
Рис. 9.6. Поляризационная кривая
выделения водорода на ртути
На катоде проходят и другие побочные процессы. Амальгама натрия реагирует с хлором, растворенным в анолите, по уравнениям:
NaHgn + Сl2 = Na++ CI— + nHg Hg + Cl2 = Hg2++ 2 Cl—
Под действием воды амальгама разлагается, выделяя щелочь:
NaHgn + 2 Н2O = Н2 + Na+ + 2 ОН— + nHg
Реакция в разлагателе состоит из двух сопряженных реакций:
2 Н2O + е— = Н2 + 2 ОН— NaHgn – е— = Na+ + n Hg
Электролитический процесс в электролизере с ртутным катодом проходит в две стадии. На первой стадии, подвергая электролизу водный раствор хлорида натрия, получают хлор и крепкую амальгаму натрия. Амальгама, полученная после электролиза, содержит 0.3-0.5 % натрия. На второй стадии амальгаму обрабатывают очищенной водой. Часть амальгамы разлагается с образованием гидроксида натрия и водорода. Слабую амальгаму ртутным насосом повторно подают на электролиз.
Проведение процесса в две стадии позволяет получить в электролизерах с ртутным катодом раствор гидроксида натрия с очень малыми примесями хлорида натрия.
Схема электролизера с ртутным катодом представлена на рис. 9.7. Он состоит из трех основных частей: электролитической ванны 9, разлагателя 12 и ртутного насоса 10.
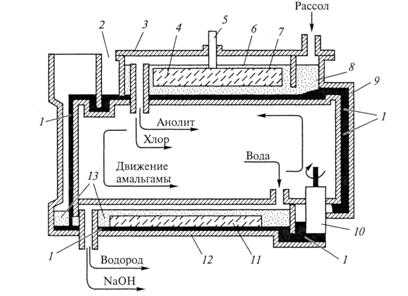
Рис. 9.7. Схема электролизера с ртутным катодом:
1 — амальгама; 2 — выходной карман электролизера; 3 — крышка электролизера; 4 — анод; 5 — анодный токопровод и его уплотнение; 6 — анолит; 7 — пространство для сбора хлора; 8 — входной карман электролизера; 9 — электролитическая ванна; 10 — ртутный насос; 11 — насадка разлагателя; 12 — разлагатель; 13- раствор гидроксида натрия.
В электролитическую ванну 9непрерывно поступают насыщенный раствор хлорида натрия и слабая амальгама. Из электролизера отводятся хлор совместно с водяными парами и крепкая амальгама Отдельно от амальгамы отводят обедненный в результате электролиза раствор хлорида натрия с растворенным в нем хлором.
В разлагатель 12непрерывно подают крепкую амальгаму и очищенную воду. Отводятся водород с водяными парами, раствор гидроксида натрия в воде и слабая амальгама.
Ртутные электролизеры рассчитаны на работу с высокой плотностью тока (5000-10 000 А/м2). С повышением плотности улучшается выход потоку. Кроме того, снижается (при одной и той же токовой нагрузке) расчетная поверхность катода, следовательно, уменьшается необходимое количество ртути.
В настоящее время распространены горизонтальные электролизеры. Они представляют собой наклонный желоб прямоугольного сечения, по дну которого самотеком течет амальгама. Желоб покрыт крышкой 3, на которой укреплены графитовые плоские анодные плиты 4. Расстояние между электродами 3-5 мм. Плиты располагают так тесно, чтобы площадь рабочей поверхности анодов приближалась к площади поверхности катода. Каждая анодная плита имеет токоподвод, выведенный через крышку электролизера. В месте прохода токоподвода через крышку имеется уплотнение 5, препятствующее выходу хлора в атмосферу.
В процессе электролиза графит разрушается. В результате увеличивается межэлектродное расстояние и растет напряжение электролиза. Поэтому в современных конструкциях аноды снабжают устройством, позволяющим регулировать межэлектродное расстояние.
Для этого применяют устройства двух различных типов. Первый тип рассчитан на опускание каждого анода в отдельности, второй — на опускание одновременно целой группы анодов.
Поверх слоя амальгамы в электолизере в том же направлении движется анолит 6.
Над слоем анолита образуется газовое пространство 7. В нем собирается выделившийся хлор. Хлор и анолит отводятся из электролизера либо совместно, либо раздельно.
Вторая стадия электрохимического процесса проходит в разлагателе. Горизонтальные разлагатели имеют вид стального, герметично закрытого желоба, устанавливаемого с уклоном. На дне разлагателя укладывают графитовые плиты 12. Поток амальгамы самотеком движется по его дну. Противотоком к амальгаме движется раствор едкого натра и отводится вместе с водородом в конце разлагателя.
КОНТРОЛЬНЫЕ ВОПРОСЫ К ТЕМЕ 9.2
9-1. Какие существуют промышленные способы электролиза водного раствора хлорида натрия?
9-2. Назовите основные стадии диафрагменного способа электролиза.
9-3. Какая реакция протекает на катоде при диафрагменном способе электролиза? Какие побочные реакции могут протекать на катоде при диафрагменном способе электролиза?
9-4. Какое основное вещество выделяется на аноде при диафрагменном способе электролиза? Какое побочное вещество выделяется на аноде при диафрагменном способе электролиза?
9-5. В чем заключаются особенности электролиза водного раствора хлорида натрия с ртутным катодом? Какова роль диафрагмы в диафрагменном электролизере?
ЗАДАЧИ К ТЕМЕ 9.2
9-1. Вытекающий из диафрагменного хлорного электролизера щелок содержит 130 кг/м3 щелочи. Ванна работает с нагрузкой 25 кА, выходом по току для CI2 и NaOH 96 %, а для водорода 98 %. Рассчитайте: а) суточную производительность ванны по хлору и водороду (по массе и объему) и по щелочи; б) объем щелока, вытекающего за 1 ч из ванны. Условия нормальные.
9-2. Сколько часов должен работать электролизер БГК-17-25 для получения хлора объемом 800 м3, если выход по току составляет 96 %, сила тока 30 кА? Условия нормальные.
9-3. Рассчитайте теоретическое значение (В) напряжения разложения при электролизе водного раствора хлорида натрия. Концентрация анолита 270 кг/м3, католита 120 кг/м3.
9-4. Рассчитайте коэффициент использования энергии для электролизера, снабженного железным катодом, где теоретическое напряжение разложения 2.16 В, а практическое 3.55 В при электролизе водного раствора хлорида натрия. Выход по току 93 %.
9-5. Определите выход по току для электролизера БГК-17-50, где в течение суток при силе тока 40 кА было получено 9821 м3 электролитического щелока, содержащего 140 кг/м3 едкого натра.
9-6. В диафрагменном способе получения едкого натра процесс электролиза заканчивают, когда массовая доля едкого натра в растворе достигает 10 %. Рассчитайте, какая массовая доля хлорида натрия подверглась электролизу, если первоначальная концентрация рассола была 310 кг/м3, а плотность 1.197 т/м3.
9-7. Определите степень превращения для католита, содержащего 120 кг/м3 едкого натра, если первоначальное содержание хлорида натрия составило 293 кг/м3. Потерями в производстве пренебречь.
9-8. Определите дополнительный расход электроэнергии на получение водорода массой 1 т, вызываемый перенапряжением выделения газа h = 0.2 В.
9-9. Вычислите расход энергии на получение хлора массой 1 т в электролизере БГК-17-50, если сила тока на зажимах 25 кА, напряжение 3.6 В, выход по току 96 %.
9-10. Определите выход по току для электролизера фирмы «Хукер», в котором получается 225 м3/ч католита, содержащего 135 кг/м3 едкого натра. Электролизер работает с нагрузкой 40 кА.
9-11. Определите недельную потребность предприятия в железнодорожных цистернах грузоподъемностью 50 т для перевозки жидкого хлора, если на предприятии действуют 3 серии электролизеров БГК-17-50, по 68 штук в каждой серии. Нагрузка электролизера 50 кА, выход по току 96 %.
9-12. Рассчитайте теоретический расход электроэнергии для получения едкого натра массой 1 т и хлора массой 1 т в диафрагменном электролизере, если теоретическое напряжение разложения раствора хлорида натрия равно 2.2 В.
9-13. Вычислите расход энергии на производство 1 т едкого натра в электролизере с ртутным катодом типа «Сольве» V-200, если напряжение на электродах составляет 4.56 В, выход по току 96 %, сила тока 190 кА.
9-14. В цехе электролиза имеется 66 ванн с ртутными катодами. От источника постоянного тока на них подается напряжение 250 В при силе тока 30 кА. Определите производительность такого цеха в сутки по щелоку с концентрацией едкого натра 140 кг/м3 и хлору при выходе по току 96 %; напряжение на каждой ванне и расход энергии на 1 т хлора и 1 т едкого натра (в отдельности).
9-15. По днищу ртутного электролизера, имеющего длину 10 м, ширину 1,5 м, протекает ртуть слоем 5 мм. При входе в электролизер массовая доля натрия в ртути равна 0.01 %, а на выходе 0.2 %. Выход по току 95 %. Катодная плотность тока 5000 А/м2. Определите массу 40 %-ного раствора едкого натра, которую можно получить с 1 м2 ртутного катода, и линейную скорость течения ртути. Изменением плотности ртути при образовании амальгамы пренебречь.
9-16. Определите выход по энергии для ртутного, электролизера Р-101, если здесь: потенциал анода -1.42 В; потенциал катода 1.84 В; напряжение на ванне 3.55 В; выход по току 93.7 %.
9-17. Рассчитайте объемную скорость циркуляции ртути в хлорном электролизере, если в поступающей ртути массовая доля натрия равна 0.015 %, а в выходящей из электролизера 0.21 %. Выход по току натрия равен 97 %, нагрузка электролизера 25 кА.
9-18. В горизонтальном разлагателе, куда поступает в час 23 т амальгамы натрия, выделился водород объемом 56 м3. Определите массовую долю натрия в амальгаме (при н. у.).
9-19. Проектная годовая мощность одного из предприятий по производству соляной кислоты составляет 80 тыс. т продукта с массовой долей хлороводорода 34 %. Обеспечит ли это предприятие хлором и водородом цех с 84 ваннами типа Р-ЗО, работающий по графику предприятия? Выход по току 96 %, нагрузка одного электролизера 30 кА. Выход кислоты составляет 95 % от теоретического.
9-20. Диафрагменный хлорный электролизер имеет следующие показатели работы: выход по току хлора 95 %; выход по току водорода 99 %; нагрузка 20 кА. Какую массу соляной кислоты с массовой долей хлороводорода 35 % можно получить из всего произведенного хлора за 30 дней работы электролизера? Какой объем водорода в м3 должен произвести электролизер для получения этой массы кислоты, если объемная доля водорода на 5 % больше против стехиометрии?
studopedia.net
Растворители хлорида натрия — Справочник химика 21
Раствор должен содержать не менее двух компонентов, один из которых является р астворителем, а другой— растворенным веществом. Растворитель—это компонент раствора, находящийся в том же агрегатном состоянии, что и раствор. Например, при взаимодействии хлорида натрия (твердое вещество) и воды (жидкость) образуется жидкий раствор. В этом случае вода — растворитель, хлорид натрия — растворенное ве-/» щество. Часто растворы образуются веществами, нахо- [c.68]Как известно, молекула хлорида натрия состоит из двух, а молекула хлорида бария — из трех атомов, и Аррениус пришел к мысли, что при растворении в растворителях, подобных воде, определенная часть молекул распадается на отдельные атомы. Более того, поскольку эти распавшиеся молекулы проводят электрический ток (в то время как молекулы, подобные молекуле сахара, не распадаются и не проводят электрический ток), Аррениус предположил, что молекулы распадаются (или диссоциируют) не на обычные атомы, а на атомы, несущие электрический заряд. [c.119]
I Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом. Другим примером гомогенной системы может служить раствор нескольких веществ в одном растворителе, например раствор хлорида натрия, сульфата магння, азота и кислорода в воде. В каждом из этих двух случаев система состоит только из одной фазы из газовой фазы в первом примере и из водного раствора во втором [c.171]
Эффективность и полнота извлечения могут быть повышены также путем уменьшения растворимости целевого продукта в водном слое. Один из таких приемов, называемый высаливанием, заключается в насыщении исходного раствора нейтральной неорганической солью, например хлоридом натрия, В некоторых случаях высаливание позволяет в несколько раз сократить расход растворителя, что уменьшает трудоемкость как самого извлечения, так и последующего выделения продукта. При экстрагировании хорошо растворимых в воде соединений высаливание является необходимой мерой. [c.124]
Хлориды. Неорганические хлориды, наиболее вероятным нз которых является хлорид натрия, накапливаются в слое катализатора так же, как описано выше для натрия. Достигаемая при этом концентрация недостаточно высока, чтобы заметно влиять на активность катализатора гидрообработки. Из попадающих 3 сырье органических хлоридов (вероятнее всего, из используемых в производстве масел хлорированных растворителей) может образоваться хлорид водорода, вызывающий угро-,зу коррозии и засорения оборудования, например в результате образования частиц хлорида аммония при реакции с аммиаком в ходе последующей переработки продукта. После ряда очень неприятных происшествий на нефтеперерабатывающих предприятиях за содержанием хлоридов в сырье следят весьма тщательно. [c.118]
Выщелачивание хлорида калия из сильвинита производится нагретым до 105—115°С оборотным раствором (щелоком) в шнековом растворителе 2. Выделившийся хлорид калия кристаллизуется в вакуум-кристаллизаторе 5, в котором вакуум создается с помощью пароструйных эжекторов, отсасывающих паровоздушную смесь. На пути к центрифуге 6 к пульпе добавляются солянокислые соли аминов для уменьшения слеживаемости хлорида калия. Степень извлечения хлорида калия составляет 0,90—0,95 дол. ед. Галургический метод позволяет комплексно перерабатывать полиметаллические руды, извлекая из них все полезные компоненты, в том числе хлориды магния, бромиды и пищевой хлорид натрия. [c.258]
Некоторые вещества, например полимеры, можно исследовать в виде тонких пленок, которые помещают на пути луча. Иногда пленки можно получить непосредственно на пластинке из хлорида натрия испарением растворителя, расплавлением вещества или его напылением в вакууме. Даже непрозрачная для видимого света пленка может пропускать ИК-излучение в достаточной степени, чтобы записать ее спектр. Однако для количественных измерений в пленках трудно контролировать толщину образца, а также потери на рассеяние света. В спектрах пленок часто наблюдаются интерференционные полосы, которые могут налагаться на полосы исследуемого вещества. При образовании пленки молекулы могут ориентироваться определенным образом, поэтому при частичной поляризации ИК-излучения в приборе (особенно с дифракционной решеткой) может наблюдаться зависимость спектра от положения образца в луче. [c.209]
Далее нами было исследовано распределение НСЮ между органической и водной фазой путем изучения равновесия в системе МЭК-насыщенный хлоридом натрия водный раствор НСЮ при однократной экстракции. При этом использовали исходные растворы НСЮ с концентрацией от 0.4 до 1.0 моль/л, соотношение объемов растворителя и водного раствора изменялось от 1 1 до 1 4. Результаты по распределению НСЮ четырех серий опытов для различных исходных концентраций сведены в табл. 2.12. При данных условиях в экстракционной системе связь между равновесными концентрациями в водной (Свод ) и органической (С рг ) фазах можно приближенно описать уравнением Шилова [63] [c.62]
Этот метод непосредственно применим для определения низких концентраций (мг/л) хлорорганических соединений в жидких нефтепродуктах с температурами кипения не выше 400 °С. Нефтепродукты, в которых концентрация хлора более, чем 100 мг/л, могут быть разбавлены подходящим растворителем, не содержащим хлора. Неорганические хлориды, которые нацело разлагаются при температурах, меньших, чем температура в печи, также определяются этим методом (например, хлориды аммония, трехвалентного железа, палладия). Более устойчивые хлориды не могут быть определены этим методом (например, хлориды натрия, калия). Сера и фтор не мешают определению, бромиды и иодиды определяются количественно. [c.42]
Процесс растворения веществ обусловлен взаимодействием частиц растворенного вещества с молекулами растворителя. Механизм растворения твердых тел в жидкости состоит в основном из трех стадий. В качестве примера рассмотрим растворение кристалла хлорида натрия, который состоит из электростатически связанных ионов натрия и хлора. Как известно, между ионами N3+ и С1 имеет место ионная связь, между молекулами воды действуют силы Ван-дер-Ваальса и водородная связь, а между ионами на- [c.84]
Растворимость твердых веществ в жидкостях зависит от роды растворяемого вещества и растворителя, от температуры и может изменяться в очень широких пределах. Так,- в — 1ф воды при комнатной температуре растворяется 222 г нитрата серебра, 88 г нитрата натрия, 36 г хлорида натрия и тоЛько 0,00015 г хлорида серебра.
www.chem21.info
Хлорид — натрий — Большая Энциклопедия Нефти и Газа, статья, страница 1
Хлорид — натрий
Cтраница 1
Хлорид натрия, выделяясь из водного раствора, образует бесцветные кристаллы кубической формы. А почему поваренная соль бывает розовой. При каких условиях кристаллический хлорид натрия приобретает синий цвет. [1]
Хлорид натрия, выводимый по линии 33, может найти различные применения. Обычно его используют для регенерации химических агентов на стадии отбеливания. [2]
Хлорид натрия и бромид калия в виде порошков реагируют с трифторидом хлора при слабом нагревании. [3]
Хлорид натрия сверху поступает в муфель, туда же через дозатор подается серная кислота. Газообразный хлористый водород с температурой порядка 400 С через отверстия в боковой стенке удаляется из реакционной камеры. [5]
Хлорид натрия необходимо добавлять небольшими порциями ( по 0 15 — 0 2 г), потому что одновременно с образованием хлористого хромила протекает реакция восстановления шестивалентного хрома до трехвалентного. [6]
Хлорид натрия представляет собой соль, содержащую равные количества анионов и катионов. [7]
Хлорид натрия, поваренная соль, хлористый натрий, галит, NaCl — природный минерал. Различают каменную, самосадочную, садочную и выварочную соль. Каменную соль добывают открытым или шахтным способом; самосадочную — получают в летний период при естественном испарении воды из рапы озер или лиманов; садочную ( бассейную) — извлекают из морской воды, упаривая ее в специальных садочных бассейнах; выварочную соль получают выпариванием естественных рассолов на солевых заводах. Применяется поваренная соль в химической, текстильной, кожевенной, целлюлозно-бумажной и других отраслях промышленности, а также в холодильной технике, в качестве приправы к пище и консервирующего продукты питания средства. [8]
Хлориды натрия, калия, как и большинство солей с общим ионом, взаимно понижают растворимость. [9]
Хлорид натрия вызывает появление черных пятен на консервных банках, покрытых оловом. [10]
Хлорид натрия через загрузочную трубу из дозатора непрерывно поступает в муфель. Туда же по трубе из дозатора поступает серная кислота на распределитель кислоты гусек, который укреплен на головке вала и вращается вместе с ним. Гусек имеет форму чайника, через носик которого кислота сливается на хлорид натрия в муфеле. [11]
Хлорид натрия ( 240 г) растворяют в 900 мл воды. [12]
Хлорид натрия растворяется в воде только потому, что значительная затрата энергии, которая необходима для разделения связанных в кристаллической решетке ионов, компенсируется за счет присоединения молекул воды к этим ионам, следовательно, в результате химического процес-с а. Таким образом, количество энергии, выделяющейся при растворении, представляет собой разность между двумя очень большими составляющими — энергией решетки и энергией гидратации, так что количественное предсказание соотношений, характеризующих растворимость, возможно лишь в ограниченной степени. Силы, действующие при растворении, крайне различны по своему характеру и величине; поэтому границы между химическим или физическим процессами, сопровождающими растворение, можно провести лишь условно. [13]
Хлорид натрия через загрузочную трубу из дозатора непрерывно поступает в муфель. Туда же по трубе подается кислота; перемешивание и передвижение реагентов осуществляются мешалкой с четырьмя плечами, расположенными крестообразно. Продукт реакции г-хлористый водород — с температурой около 400 С через Прямоугольное отверстие на боковой стенке муфеля направляется на абсорбцию водой. С через круглое отверстие в поду муфеля покидает печь и поступает в размольно-холодилыный барабан. [14]
Хлорид натрия ( бытовое название — поваренная соль, пищевая соль) лучше растворяется в горячей воде. Если добавлять хлорид натрия в горячую воду до тех пор, пока не будет достигнуто насыщение раствора, и охладить затем раствор, то по мере понижения температуры соль начинает выпадать из водного раствора. Поскольку пищевая соль в твердом состоянии кристаллична, то говорят, что NaCl выкристаллизовывается из раствора. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
