Тест для определения беременности МАМАTEST (10 мМЕ/мл) 2 тест-полоски в уп — Планета Здоровья
Описание товара
Тест-полоски для определения беременности MAMATEST® обнаруживают присутствие в моче беременной женщины особого гормона – хорионического гонадотропина человека (ХГЧ). Вскоре после оплодотворения яйцеклетки развивающаяся плацента начинает вырабатывать этот специфический гормон. На 6-8 день после зачатия концентрация ХГЧ в крови достигает 25 мМЕ/мл; в моче концентрация ХГЧ достигает уровня, на котором можно его диагностировать, на день-два позже, то есть на 7-10 день беременности. На тест-полоску нанесены реагенты, которые при взаимодействии с мочой, содержащей ХГЧ, дают окрашивание, и в тест-зоне появляется четкая цветная полоса. Данную тест-систему рекомендуется использовать утром, так как именно в утренней порции мочи концентрация ХГЧ наиболее высока.
Если результат теста кажется сомнительным, рекомендуем проведение двух тестирований с интервалом в 2 дня. На протяжении первых недель беременности концентрация ХГЧ в моче удваивается каждые 48 часов, и результат с каждым днем становится более явным и четким.
Содержимое упаковки
Две тест-полоски, каждая в индивидуальной упаковке, содержащей пакет с абсорбентом; инструкция по использованию.
Способ применения
Тестирование производить при комнатной температуре. Собрать утреннюю порцию мочи в чистую сухую посуду. Вскрыть индивидуальную упаковку, достать тест-полоску, держа ее за конец, промаркированный буквами HCG. Тест-полоску погрузить в емкость с мочой, держа вертикально, до уровня метки «MAX» на 3 секунды.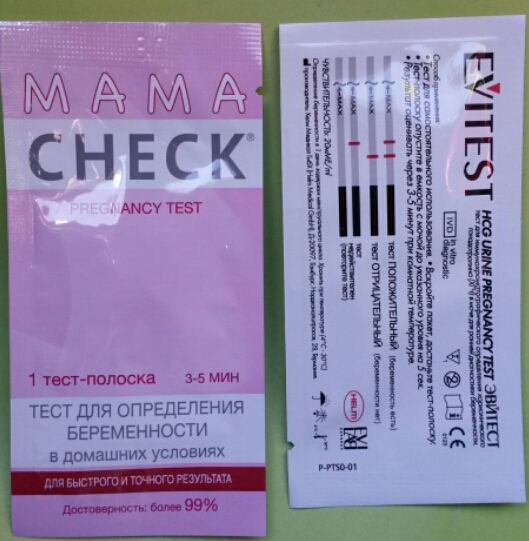 Затем положить тест-полоску на сухую горизонтальную поверхность. Через 3-5 минут оценить результат. Пакет с абсорбентом выбросить.
Затем положить тест-полоску на сухую горизонтальную поверхность. Через 3-5 минут оценить результат. Пакет с абсорбентом выбросить.
Оценка результата
С – контрольная зона, Т – тест-зона Вариант 1: Одна полоска в контрольной зоне, одна полоска в тест-зоне: результат положительный (с наибольшей вероятностью Вы беременны). Вариант 2: Одна полоска в контрольной зоне, тест-зона пуста: результат отрицательный (с наибольшей вероятностью Вы не беременны). Вариант 3: Контрольная зона и тест-зона пусты, либо появилась одна полоска в тест-зоне: результат неверен, тест проведен неправильно. Повторите тестирование. Если результат теста кажется сомнительным, проведите второе тестирование через 2 дня.
Меры предосторожности
Не оценивать результаты теста по прошествии 6 минут.
Не использовать тест-полоски с истекшим сроком годности.
Не использовать тест-полоски с нарушенной индивидуальной упаковкой.
Тест-полоски предназначены только для одноразового использования.
Не принимать вовнутрь составные части тест-полосок и абсорбирующее вещество.
Условия хранения
Тест-полоски хранить в индивидуальной упаковке при температуре от 4 до 30°С, не подвергать воздействию прямых солнечных лучей и влаги.
Купить Тест для определения беременности МАМАTEST (10 мМЕ/мл) 2 тест-полоски в уп
Цена на Тест для определения беременности МАМАTEST (10 мМЕ/мл) 2 тест-полоски в уп
Инструкция по применению для Тест для определения беременности МАМАTEST (10 мМЕ/мл) 2 тест-полоски в уп
20 штук Тест-полоска на беременность с мочой, 10 мМЕ/мл — Tallinn
10 €
€ 10.00
В продаже
Предложить цену
- Добавлено 21.11.2022 20:00
- Состояние Новое
Tallinn
20 штук, срок годности 2025
Сообщить
Спасибо за помощь!
Такие обращения делают okidoki лучше.
Похожие объявления
Маски медицинские 500 штук
35 €
Анализатор мочи roche Urilux S
190 € Возможен торг
Med.
 maskid 0,10 EUR/tk Медицинские маски 0,10EUR/шт
maskid 0,10 EUR/tk Медицинские маски 0,10EUR/шт5 €
Защитные маски для лица, 3-хслойные, 50 штук в упаковке
8 €
Тест на овуляцию 20 штук
14 € Возможен торг
Чашки с мочой для тестов на беременность или овуляцию
2 € Возможен торг
Аммиака раствор 10% 100мл
7 € Возможен торг
Маски медицинские- 1 маска 10 центов .

0.10 €
Маски медицинские 50 штук
4 €
Хирургические иглы советских времен по 10 штук в упаковке.
2 € Возможен торг
Маски 50 штук четырехслойные (черные)
10 € Возможен торг
Экспресс-тест мочи на функцию печени (10 параметров) 2 шт.
11.20 €
Номер объявления: 11676847
Bicillin® LA, 1,2 мм, 21 г, шприц, 2 мл, 10 шприцев/лоток
Производитель: монарх
2369,61 долларов США
Код изделия: 000559
Производственная часть №: 60793-0701-10
- Без возврата:
- —Без возврата
- Контролируется:
- —Да
- Охлажденный:
- — Охлаждаемый
- Перевозки:
- — UPS Next Day Air (35 долларов США за коробку)
Этот продукт должен быть доставлен в течение ночи.

Наш отдел доставки упакует ваши заказы в минимально возможное количество коробок. При выборе способов доставки на следующий день или 2-го дня авиаперевозкой окончательная стоимость доставки будет рассчитана после упаковки вашего заказа и выставления счета. Размер коробки и место назначения не влияют на расчет стоимости доставки. Количество коробок определяется размером, весом и количеством заказанной продукции. Для получения дополнительной информации или вопросов, пожалуйста, свяжитесь с нами.
Спецификации продуктов
| Название бренда | Бициллин® ЛА |
| Требуется медицинская лицензия | Да |
| Учебный класс | Ркс |
| Контейнер | Шприц |
| Форма | СДВ |
| Общее имя | Пенициллин G Бензатин |
| без консервантов | Да |
| Беречь от света и/или замерзания | Да |
| Охладить | Да |
| Путь введения | ИМ |
| Размер | 2 мл |
| Температура хранилища | от 2º до 8ºC (от 36º до 46ºF) |
| Сила | 1,2 мм |
| Терапевтический класс | Антибиотик |
| Тимеросал Бесплатно | ДА |
| Единица измерения | Лоток |
Спецификации продуктов
| Название бренда | Бициллин® ЛА |
| Требуется медицинская лицензия | Да |
| Учебный класс | Ркс |
| Контейнер | Шприц |
| Форма | СДВ |
| Общее имя | Пенициллин G Бензатин |
| без консервантов | Да |
| Беречь от света и/или замерзания | Да |
| Охладить | Да |
| Путь введения | ИМ |
| Размер | 2 мл |
| Температура хранилища | от 2º до 8ºC (от 36º до 46ºF) |
| Сила | 1,2 мм |
| Терапевтический класс | Антибиотик |
| Тимеросал Бесплатно | ДА |
| Единица измерения | Лоток |
Иммуногенность четырехвалентной вакцины против вируса папилломы человека при совместном введении с противостолбнячной дифтерийно-бесклеточной коклюшной вакциной и четырехвалентной менингококковой конъюгированной вакциной у здоровых подростков: результаты рандомизированного, слепого, контролируемого исследования
Abstract
Введение
Вакцины против вируса папилломы человека (ВПЧ), столбняка, дифтерии, коклюша (Tdap) и Neisseria meningitidis широко рекомендуются для подростков. Фаза 4 слепого наблюдательного исследования была проведена для изучения влияния одновременного введения четырехвалентной вакцины против ВПЧ (ВПЧ4) и Tdap с четырехвалентной менингококковой конъюгированной вакциной CRM 197 (MenACWY-CRM) с точки зрения иммуногенности против различных вакцинные антигены и общий профиль безопасности. Предыдущие результаты показали, что одновременное введение трех вакцин не влияло на иммуногенность Tdap и MenACWY или безопасность. В этой статье представлены недавно опубликованные результаты иммуногенности ВПЧ.
Фаза 4 слепого наблюдательного исследования была проведена для изучения влияния одновременного введения четырехвалентной вакцины против ВПЧ (ВПЧ4) и Tdap с четырехвалентной менингококковой конъюгированной вакциной CRM 197 (MenACWY-CRM) с точки зрения иммуногенности против различных вакцинные антигены и общий профиль безопасности. Предыдущие результаты показали, что одновременное введение трех вакцин не влияло на иммуногенность Tdap и MenACWY или безопасность. В этой статье представлены недавно опубликованные результаты иммуногенности ВПЧ.
Методы
Здоровые подростки в возрасте 11–18 лет (801) были рандомизированы для получения либо HPV4 + Tdap + MenACWY, либо HPV4 + Tdap + плацебо и двух дополнительных доз HPV4 через 2 и 6 месяцев после первой дозы. Реакции антител на типы ВПЧ (ВПЧ-6, -11, -16 и -18) оценивали на исходном уровне и через 1 месяц после полной вакцинации.
Результаты
После третьей дозы HPV4 было продемонстрировано не меньшее количество иммунных ответов на HPV4 + Tdap + MenACWY по сравнению с HPV4 + Tdap + Плацебо; нижние пределы двустороннего 95% ДИ межгрупповых различий в показателях сероконверсии составляли > − 5% (граница не меньшей эффективности) по отношению к каждому протестированному типу ВПЧ. Показатели сероконверсии варьировали от 98,0% (ВПЧ-6) до 99,7% (ВПЧ-11 и ВПЧ-18) в группе HPV4 + Tdap + MenACWY и от 99,0% (ВПЧ-11 и ВПЧ-16) до 99,7% (ВПЧ-6). и HPV-18) в группе HPV4 + Tdap + плацебо.
Показатели сероконверсии варьировали от 98,0% (ВПЧ-6) до 99,7% (ВПЧ-11 и ВПЧ-18) в группе HPV4 + Tdap + MenACWY и от 99,0% (ВПЧ-11 и ВПЧ-16) до 99,7% (ВПЧ-6). и HPV-18) в группе HPV4 + Tdap + плацебо.
Заключение
В целом, эти данные подтверждают одновременное применение HPV4, Tdap и MenACWY-CRM у подростков.
Финансирование
Novartis Vaccines and Diagnostics Inc., в настоящее время часть группы компаний GSK.
Регистрация проб
Идентификатор ClinicalTrials.gov, NCT01424644.
Введение
При рассмотрении текущих эпидемиологических данных и методов иммунизации вакцины против вируса папилломы человека (ВПЧ), менингококковой и столбнячной дифтерийно-бесклеточной коклюшной (Tdap) вакцины относятся к числу вакцин, обычно рекомендуемых для введения в подростковом возрасте [1, 2]. Когда это возможно, применяется одновременное введение различных вакцин, обычно в разные места инъекций, чтобы попытаться максимизировать возможности для улучшения соблюдения календаря вакцинации и защиты населения, если нет иммунологического вмешательства между совместно вводимыми вакцинами.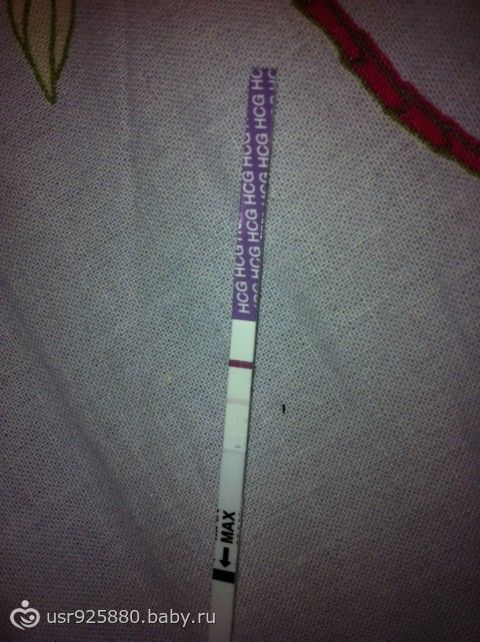
Клиническое исследование фазы 4 было проведено в США и Италии для демонстрации не меньшей эффективности иммунных реакций вакцины Tdap ( Boostrix , GSK) и четырехвалентной вакцины против ВПЧ (HPV4; Gardasil , Merck & Co. , Inc.) при одновременном введении с четырехвалентной менингококковой конъюгированной вакциной CRM 197 (MenACWY-CRM; Menveo , GSK) или плацебо у здоровых подростков в возрасте 11–18 лет. Поскольку результаты иммуногенности, относящиеся к эталонным антигенам Tdap и MenACWY-CRM, и данные по безопасности были доступны, они были ранее опубликованы [3]. В этой статье представлены последние доступные анализы, относящиеся к оценке иммуногенности ВПЧ4, когда вакцина вводилась одновременно с Tdap и MenACWY-CRM или плацебо.
Methods
Это многоцентровое, рандомизированное, слепое, контролируемое исследование фазы 4 (NCT01424644), проведенное в 20 центрах США и Италии в период с сентября 2011 г. по декабрь 2012 г., в котором участвовали здоровые подростки в возрасте 11–18 лет. были рандомизированы в соотношении 1:1 для одновременного получения по одной дозе HPV4, Tdap и MenACWY-CRM (группа HPV4 + Tdap + MenACWY) или по одной дозе HPV4, Tdap и плацебо (группа HPV4 + Tdap + Placebo). Все участники получили две дополнительные дозы ВПЧ4, введенные через 2 и 6 месяцев после первой дозы. Более подробная информация о дизайне исследования, рандомизации, ослеплении, вмешательствах и расчетах размера выборки была опубликована ранее [3].
были рандомизированы в соотношении 1:1 для одновременного получения по одной дозе HPV4, Tdap и MenACWY-CRM (группа HPV4 + Tdap + MenACWY) или по одной дозе HPV4, Tdap и плацебо (группа HPV4 + Tdap + Placebo). Все участники получили две дополнительные дозы ВПЧ4, введенные через 2 и 6 месяцев после первой дозы. Более подробная информация о дизайне исследования, рандомизации, ослеплении, вмешательствах и расчетах размера выборки была опубликована ранее [3].
Приемлемые участники исследования включали тех, кто дал свое письменное согласие/согласие и получил детские прививки против дифтерии, столбняка и коклюша в соответствии с местным законодательством, но еще не получил ни одной подростковой дозы вакцин против дифтерии, столбняка или коклюша. Приемлемые лица женского пола должны были иметь отрицательный тест мочи на беременность и, если они были сексуально активны, быть готовыми принять соответствующие меры контроля над рождаемостью в течение периода исследования. Основными критериями исключения были: наличие в анамнезе анафилаксии/серьезных реакций на любой компонент исследуемых вакцин; предшествующее заболевание (подтвержденное или подозреваемое), вызванное Н. meningitidis ; получение любых исследуемых или лицензированных вакцин, содержащих менингококковые антигены, или предшествующая вакцинация против ВПЧ; История любого серьезного острого, хронического или прогрессирующего заболевания или нарушения иммунной системы. Более подробный список критериев включения и исключения опубликован в другом месте [3].
meningitidis ; получение любых исследуемых или лицензированных вакцин, содержащих менингококковые антигены, или предшествующая вакцинация против ВПЧ; История любого серьезного острого, хронического или прогрессирующего заболевания или нарушения иммунной системы. Более подробный список критериев включения и исключения опубликован в другом месте [3].
Исследование проводилось в соответствии с Хельсинкской декларацией и рекомендациями по надлежащей клинической практике. До регистрации в соответствующих независимых комитетах по этике было получено одобрение протокола исследования и документов, связанных с протоколом. Информированное согласие было получено от всех отдельных участников, включенных в исследование, или для лиц моложе 18 лет от их родителей или законных опекунов.
Здесь мы описываем результаты второй основной цели исследования, связанной с иммуногенностью ВПЧ4, которая заключалась в том, чтобы продемонстрировать не меньшую эффективность иммунных ответов, индуцированных ВПЧ4 при одновременном применении с Tdap и MenACWY-CRM, по сравнению с реакциями, вызванными ВПЧ4. при совместном применении с Tdap и плацебо через 1 месяц после третьей дозы HPV4. Не меньшей эффективности было продемонстрировано, если нижние пределы двусторонних 95% доверительных интервалов (ДИ) различий между группами (группа HPV4 + Tdap + MenACWY минус HPV4 + Tdap + группа плацебо) в показателях сероконверсии (SC) были > – 5% для каждого из типов ВПЧ 6 (ВПЧ-6), ВПЧ-11, ВПЧ-16 и ВПЧ-18.
при совместном применении с Tdap и плацебо через 1 месяц после третьей дозы HPV4. Не меньшей эффективности было продемонстрировано, если нижние пределы двусторонних 95% доверительных интервалов (ДИ) различий между группами (группа HPV4 + Tdap + MenACWY минус HPV4 + Tdap + группа плацебо) в показателях сероконверсии (SC) были > – 5% для каждого из типов ВПЧ 6 (ВПЧ-6), ВПЧ-11, ВПЧ-16 и ВПЧ-18.
Иммунный ответ на вакцинацию против ВПЧ4 оценивали с использованием образцов крови, собранных на исходном уровне, до первой дозы ВПЧ4 и через 1 месяц после третьей дозы ВПЧ4. Уровни сывороточных антител против четырех типов ВПЧ измеряли с помощью проверенного конкурентного иммуноанализа Luminex, который использовался для оценки иммунных ответов на ВПЧ4 в ходе его программы клинических исследований [4, 5].
Показатели SC были рассчитаны через 1 месяц после третьей дозы ВПЧ4 для каждой исследовательской группы и типа ВПЧ как процент участников с титрами антител, превышающими или равными пороговому значению для конкретного типа ВПЧ, и серонегативными на исходном уровне (т. е. имели титры антител ниже порогового значения). Предварительно установленное пороговое значение составляло 16 мМЕ/мл для ВПЧ-11, 20 мМЕ/мл для ВПЧ-6 и ВПЧ-16 и 24 мМЕ/мл для ВПЧ-18. Ассоциированный двусторонний 95% ДИ для частоты SC в каждой группе были рассчитаны с использованием метода Клоппера-Пирсона [6], а ДИ для межгрупповых различий в частоте SC были рассчитаны с использованием метода Miettinen-Nurminen [7].
е. имели титры антител ниже порогового значения). Предварительно установленное пороговое значение составляло 16 мМЕ/мл для ВПЧ-11, 20 мМЕ/мл для ВПЧ-6 и ВПЧ-16 и 24 мМЕ/мл для ВПЧ-18. Ассоциированный двусторонний 95% ДИ для частоты SC в каждой группе были рассчитаны с использованием метода Клоппера-Пирсона [6], а ДИ для межгрупповых различий в частоте SC были рассчитаны с использованием метода Miettinen-Nurminen [7].
Средние геометрические титры антител (GMT) и отношения средних геометрических (GMR; уровни антител после вакцинации по сравнению с исходным уровнем) также рассчитывались по исследовательской группе путем возведения в степень (по основанию 10 ) соответствующих средних наименьших квадратов журнала 10 -трансформированные титры. Ассоциированный 95% CI были получены с использованием дисперсионного анализа (ANOVA) с исследовательской группой и центром в модели.
Основной популяцией для анализа иммуногенности была группа ВПЧ по протоколу (ВПЧ-ПП), которая включала всех участников без существенных отклонений от протокола, которые правильно получили все дозы вакцины и для которых имелись поддающиеся оценке образцы сыворотки по крайней мере для одного типа ВПЧ в как на исходном уровне, так и через 1 месяц после третьей дозы, при этом инъекция вакцины и забор крови происходили в окнах, требуемых протоколом.
При допущении 10% отсева в исследование планировалось включить около 800 человек (по 400 на вакцинированную группу), чтобы получить размер выборки из 360 поддающихся оценке участников в каждой группе. Вероятность демонстрации не меньшей эффективности для каждого типа ВПЧ составила ≥ 99,8 % с использованием предела не меньшей эффективности, равного – 5%. Более подробная информация о расчете размера выборки и общей мощности исследования была опубликована ранее [3].
Результаты
Из 801 участника, включенного в это исследование (247 в Италии и 554 в США), 634 были включены в набор HPV-PP: 309в группе HPV4 + Tdap + MenACWY и 325 в группе HPV4 + Tdap + плацебо. Основными причинами исключения были введение запрещенной вакцинации и несоблюдение графика вакцинации или забора крови. Демографические характеристики участников группы HPV-PP в целом были сбалансированы между исследуемыми группами. Средний возраст участников составил 11,9 (± 1,6) года, 38% из них были женщинами (таблица 1).
Полный размер таблицы
Через месяц после введения третьей дозы ВПЧ4 частота подкожного склероза варьировала от 98,0% (ВПЧ-6) до 99,7% (ВПЧ-11 и ВПЧ-18) в группе HPV4 + Tdap + MenACWY и от 99,0% ( HPV-11 и HPV-16) и 99,7% (HPV-6 и HPV-18) в группе HPV4 + Tdap + плацебо (рис. 1a). Различия между показателями SC в группе HPV4 + Tdap + MenACWY и группе HPV4 + Tdap + плацебо составили – 1,0% (95% ДИ – 3,5% до 0,3%) для ВПЧ-6, 0,3% (95% ДИ – 1,2% до 1,9 %) для ВПЧ-11, 1,0 % (95 % ДИ от −1,2 до 2,6 %) для ВПЧ-16 и 0,0 % (95% ДИ от -1,5% до 1,4%) для ВПЧ-18, при этом нижний предел 95% ДИ составляет > − 5% для каждого тестируемого типа ВПЧ (рис. 1b). Таким образом, было показано, что иммунный ответ на ВПЧ4, вводимый одновременно с Tdap и MenACWY-CRM, не уступает ответам на ВПЧ4 при совместном введении с Tdap и плацебо.
Рис.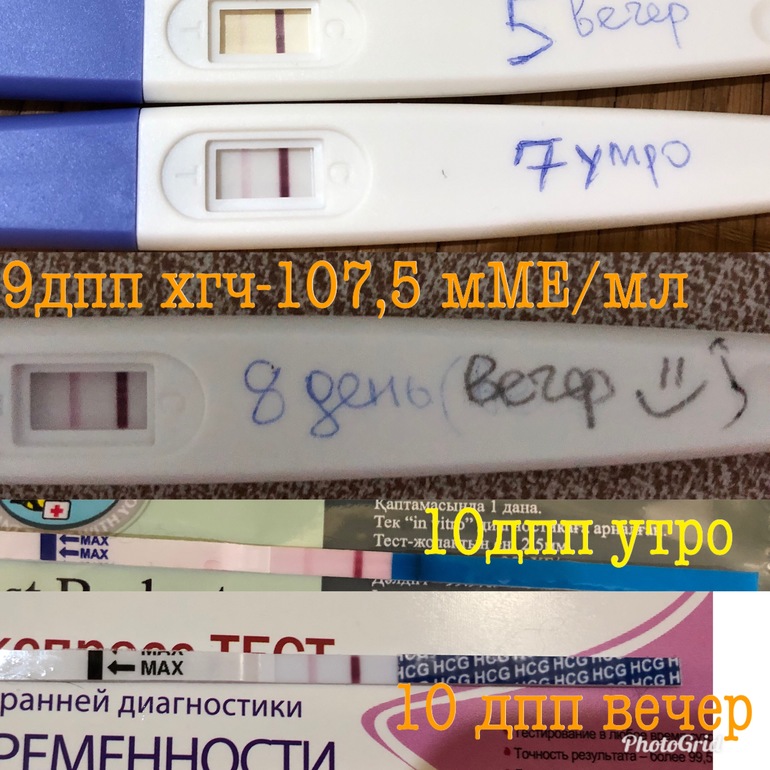 1
1 Резюме иммунных ответов на типы ВПЧ: уровни сероконверсии ( a ) и межгрупповая разница в показателях сероконверсии ( b ), средние геометрические титры ( c ) и отношения средних геометрических ( d ). HPV human papillomavirus, HPV4 quadrivalent HPV vaccine, Tdap tetanus-diphtheria-acellular pertussis vaccine, MenACWY quadrivalent meningococcal conjugate vaccine, mMU milliMerck units, M7 month 7 (1 month post-third HPV4 доза). Столбики погрешностей представляют 95% доверительные интервалы
Полноразмерное изображение
Исходно GMT были одинаковыми между двумя группами для каждого типа ВПЧ. Через один месяц после третьей дозы ВПЧ4 в обеих группах наблюдался сильный ответ антител для всех типов ВПЧ (рис. 1c). Среднее время по Гринвичу варьировалось от 1012,60 (ВПЧ-6) до 629.3,21 (ВПЧ-16) в группе HPV4 + Tdap + MenACWY и между 1084,13 (HVP-6) и 7221,71 (ВПЧ-16). GMT были сопоставимы между группами с перекрывающимися 95% ДИ при анализе по типу ВПЧ (рис. 1c).
1c).
Через месяц после третьей дозы ВПЧ4 СГМ варьировал от 173,85 (ВПЧ-6) до 1111,67 (ВПЧ-16) в группе, получавшей ВПЧ4 + Tdap + MenACWY, и от 191,15 (ВПЧ-6) до 1277,5 (ВПЧ-16) в группе группа HPV4 + Tdap + плацебо (рис. 1d). В целом GMT и GMR были выше в отношении ВПЧ-16 и ниже в отношении ВПЧ-6, независимо от исследуемой группы.
Обсуждение
Анализы иммуногенности вакцины против ВПЧ4, введенной одновременно с Tdap и MenACWY-CRM или плацебо, подтвердили ранее опубликованные данные, подтверждающие совместное введение трех вакцин без влияния на иммуногенность каждого вакцинного антигена [8]. ] или безопасности [3, 8]. В целом средний возраст населения, включенного в это исследование, составлял 11,9 лет, что соответствовало возрастному диапазону, обычно рекомендуемому для плановой вакцинации против ВПЧ (11–12 лет) [1, 2].
Когда ВПЧ4 вводили совместно с Tdap и MenACWY-CRM, частота SC для всех протестированных типов ВПЧ составляла ≥ 98% и не уступала показателям, наблюдаемым при назначении плацебо вместо MenACWY-CRM. Поствакцинальные GMT и соотношения были сопоставимы между исследуемыми группами при анализе по типу ВПЧ, при этом более высокие титры наблюдались против ВПЧ-16 и более низкие против ВПЧ-6. В том же исследовании, как сообщалось ранее [3], через 1 месяц после вакцинации 95 % и 99 % участников в группе MenACWY-CRM имели уровни серопротекторных антител ≥ 1,0 МЕ/мл) против дифтерийного и столбнячного анатоксинов соответственно. по сравнению с 82% и 98% среди получателей плацебо. Отношения средних геометрических концентраций антител против коклюшных антигенов, коклюшного токсина, филаментозного гемагглютинина и пертактина для группы MenACWY-CRM по сравнению с плацебо составили 1,01, 0,84 и 0,82 соответственно. В целом, были соблюдены критерии не меньшей эффективности для иммунологических ответов против всех антигенов Tdap. Кроме того, введение однократной дозы MenACWY-CRM вызывало устойчивый ответ антител против четырех серогрупп менингококков с 77%, 84%, 95% и 86% участников демонстрируют титры бактерицидных антител в сыворотке человеческого комплемента ≥ 8 против серогрупп A, C, W и Y соответственно [3].
Поствакцинальные GMT и соотношения были сопоставимы между исследуемыми группами при анализе по типу ВПЧ, при этом более высокие титры наблюдались против ВПЧ-16 и более низкие против ВПЧ-6. В том же исследовании, как сообщалось ранее [3], через 1 месяц после вакцинации 95 % и 99 % участников в группе MenACWY-CRM имели уровни серопротекторных антител ≥ 1,0 МЕ/мл) против дифтерийного и столбнячного анатоксинов соответственно. по сравнению с 82% и 98% среди получателей плацебо. Отношения средних геометрических концентраций антител против коклюшных антигенов, коклюшного токсина, филаментозного гемагглютинина и пертактина для группы MenACWY-CRM по сравнению с плацебо составили 1,01, 0,84 и 0,82 соответственно. В целом, были соблюдены критерии не меньшей эффективности для иммунологических ответов против всех антигенов Tdap. Кроме того, введение однократной дозы MenACWY-CRM вызывало устойчивый ответ антител против четырех серогрупп менингококков с 77%, 84%, 95% и 86% участников демонстрируют титры бактерицидных антител в сыворотке человеческого комплемента ≥ 8 против серогрупп A, C, W и Y соответственно [3].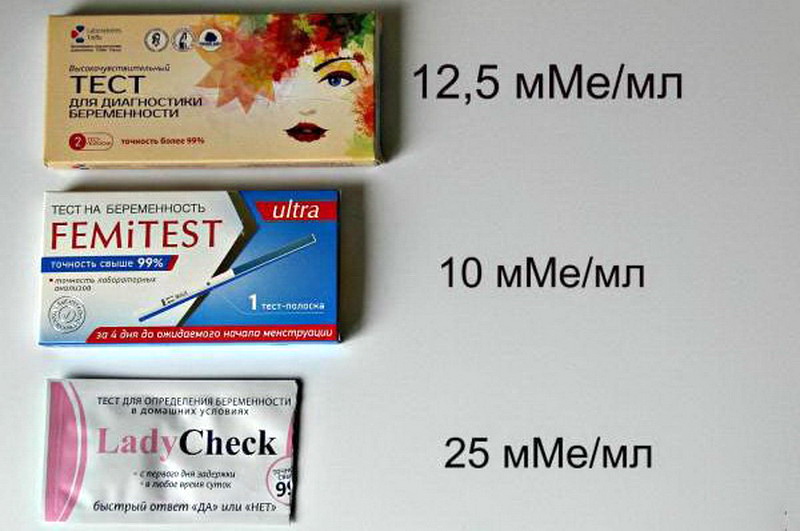
В предыдущих исследованиях оценивали совместное введение другой четырехвалентной менингококковой конъюгированной вакцины с вакцинами против ВПЧ и Tdap. Исследование подростков в возрасте 10–17 лет показало не худший иммунный ответ на ВПЧ4 при введении четырехвалентной конъюгированной вакцины против дифтерийного анатоксина ( Menactra , Sanofi Pasteur Inc., Франция) и вакцины Tdap ().0271 Adacel, Sanofi Pasteur Inc., Франция) вводили одновременно с первой дозой ВПЧ4 или через 1 месяц [9]. Другое испытание с использованием того же графика вакцинации показало аналогичные результаты у подростков в возрасте 11–15 лет с невалентной вакциной против ВПЧ ( Гардасил — 9 , Merck & Co., Inc., США) вместо ВПЧ4 [10].
В другом исследовании оценивали HPV4, Tdap и MenACWY-CRM, но сравнивали одновременное введение трех вакцин [8]. Реакции на ВПЧ4 были устойчивыми и сопоставимыми между схемами вакцинации [8], что свидетельствует о том, что одновременное введение трех вакцин не влияет на индивидуальные иммунные реакции на типы ВПЧ, что согласуется с наблюдениями в текущем исследовании.
При сравнении данных по безопасности участников, подвергшихся воздействию вакцины против ВПЧ4, которым одновременно вводили Tdap и MenACWY-CRM, с данными, зарегистрированными у участников, подвергшихся воздействию ВПЧ4, Tdap и плацебо, одинаковый процент участников текущего исследования сообщил о каких-либо нежелательных явлениях [51% по сравнению с 50% соответственно, причем наиболее частыми были боль в месте инъекции (7% против 6%) и фарингит (6% против 5%) [3]. Аналогичная частота наблюдалась в двух группах в отношении нежелательных явлений, сопровождавшихся медицинским вмешательством (20% и 24% соответственно, ни одно из которых не было расценено как связанное с исследуемыми вакцинами) и новых случаев хронического заболевания (6% и 7% соответственно) с наиболее часто сообщаемыми хроническими состояниями являются сезонная аллергия и незначительные дерматологические состояния, такие как акне и атопический дерматит, что соответствует ожидаемым закономерностям для этой возрастной группы. В целом семь участников (четыре в группе HPV + Tdap + MenACWY и трое в группе HPV + Tdap + плацебо) сообщили о девяти серьезных нежелательных явлениях в течение всего периода исследования; ни один из них не считался связанным с исследуемыми вакцинами [3].
В целом семь участников (четыре в группе HPV + Tdap + MenACWY и трое в группе HPV + Tdap + плацебо) сообщили о девяти серьезных нежелательных явлениях в течение всего периода исследования; ни один из них не считался связанным с исследуемыми вакцинами [3].
Потенциальные ограничения исследования включали отсутствие группы HPV4 + MenACWY + плацебо и тот факт, что результаты были в основном получены у лиц в возрасте 11–12 лет (это возраст, обычно рекомендуемый для вакцинации против ВПЧ), а не у лиц старшего возраста. подростки.
Заключение
Результаты иммуногенности для типов ВПЧ вместе с ранее оцененными иммунными ответами на менингококковый, столбнячный, дифтерийный и коклюшный антигены и данными по безопасности еще больше подтверждают целесообразность одновременного применения HPV4, Tdap и MenACWY-CRM у подростков.
Ссылки
Центры по контролю и профилактике заболеваний. Рекомендуемый график иммунизации для детей и подростков в возрасте 18 лет и младше, США.
 https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf. По состоянию на 11 апреля 2019 г.
https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf. По состоянию на 11 апреля 2019 г.Европейский центр профилактики и контроля заболеваний. Планировщик вакцин. https://vaccine-schedule.ecdc.europa.eu. По состоянию на 11 апреля 2019 г.
Гаспарини Р., Джонстон В., Конверсано М., Гарскадден А., Александерян Д. Иммуногенность и безопасность комбинированной вакцины против столбняка, редуцированной дифтерии, бесклеточной коклюшной вакцины при совместном введении с четырехвалентной менингококковой конъюгированной вакциной и вакциной против вируса папилломы человека в здоровые подростки. J Вакцины Вакцина. 2014;5(3):231.
Google Scholar
Диас Д., Ван Дорен Дж., Шлоттманн С., Келли С., Пухальски Д., Руиз В. и др. Оптимизация и проверка мультиплексного анализа люминекс для количественного определения антител к нейтрализующим эпитопам вирусов папилломы человека 6, 11, 16 и 18.
 Clin Diagn Lab Immunol. 2005;12(8):959–69.
Clin Diagn Lab Immunol. 2005;12(8):959–69.Центральный пабмед КАС пабмед Google Scholar
Opalka D, Lachman CE, MacMullen SA, Jansen KU, Smith JF, Chirmule N, et al. Одновременное количественное определение антител к нейтрализующим эпитопам на вирусоподобных частицах для вирусов папилломы человека типов 6, 11, 16 и 18 с помощью мультиплексного люминесцентного анализа. Клин Диагн Лаб Иммунол. 2003;10(1):108–15.
Центральный пабмед КАС пабмед Google Scholar
Клоппер С., Пирсон С. Использование доверительных или доверительных пределов показано на примере бинома. Биометрика. 1934; 26 (4): 404–13.
Артикул Google Scholar
Миеттинен О., Нурминен М. Сравнительный анализ двух ставок. Стат мед. 1985;4(2):213–26.
Артикул КАС пабмед Google Scholar
«>Reisinger KS, Block SL, Collins-Ogle M, Marchant C, Catlett M, Radley D, et al. Безопасность, переносимость и иммуногенность Gardasil вводят одновременно с Menactra и Adacel . Педиатрия. 2010;125(6):1142–51.
Артикул пабмед Google Scholar
Шиллинг А., Парра М.М., Гутьеррес М., Рестрепо Дж., Укрос С., Эррера Т. и др. Совместное введение 9-валентной вакцины против вируса папилломы человека с менингококковой вакциной и вакциной Tdap. Педиатрия.
 2015;136(3):e563–72.
2015;136(3):e563–72.Артикул пабмед Google Scholar
Аргедас А., Солей С., Лоайса С., Ринкон Г., Гевара С., Перес А. и др. Безопасность и иммуногенность одной дозы MenACWY-CRM, исследуемой четырехвалентной менингококковой гликоконъюгированной вакцины, при введении подросткам одновременно или последовательно с вакцинами Tdap и HPV. вакцина. 2010;28(18):3171–9.
Артикул КАС пабмед Google Scholar
Скачать ссылки
Благодарности
Авторы благодарят участников и исследователей исследования.
Финансирование
Это исследование спонсировалось компанией Novartis Vaccines and Diagnostics Inc., в настоящее время входящей в группу компаний GSK. GlaxoSmithKline Biologicals SA взяла на себя все расходы, связанные с разработкой и публикацией рукописи. Все авторы имели полный доступ ко всем данным в этом исследовании и несут полную ответственность за целостность данных и точность анализа данных.
Медицинское написание, редакционная и другая помощь
Авторы благодарят Дэвида Александеряна (ранее Novartis Pharma), Ноэми Джильоли (Novartis Pharma), Уильяма Джонстона (Birmingham Pediatrics, Бирмингем, Алабама, США), Эллен Ипма (GSK), Жаклин Mobius (GSK) и Susanne Pittl (GSK) за их вклад в проведение исследования. Авторы также хотели бы поблагодарить платформу Modis за редакторскую помощь и координацию рукописи, Петронелу Петрар (Modis c/o GSK) за предоставление медицинских услуг и Полин Де Бердт (Modis c/o GSK) за управление публикациями. Эта помощь финансировалась GlaxoSmithKline Biologicals SA.
Эта помощь финансировалась GlaxoSmithKline Biologicals SA.
Авторство
Все названные авторы соответствуют критериям Международного комитета редакторов медицинских журналов (ICMJE) для авторства этой статьи, несут ответственность за целостность работы в целом и дали свое согласие на публикацию этой версии. Все авторы внесли равный вклад в исследование.
Раскрытие информации
Ян Мяо является сотрудником группы компаний GSK. Тембиле Мзоло — сотрудник группы компаний GSK. Микеле Пеллегрини является сотрудником группы компаний GSK и владеет акциями группы компаний GSK.
Соблюдение этических норм
Все процедуры, проведенные в исследованиях с участием людей, соответствовали этическим стандартам институционального и/или национального исследовательского комитета, а также Хельсинкской декларации 1964 г. и ее более поздним поправкам или сопоставимым этическим стандартам. Утверждение протокола исследования и документов, связанных с протоколом, было получено до зачисления от следующих институциональных наблюдательных советов/комитетов по этике: Schulman Associates Institutional Review Board Inc. , Цинциннати, Огайо, США; Независимый комитет по этике A.S.L. ди Таранто, Таранто, Италия; Независимый комитет по этике IRCCS Azienda Ospedaliera Universitaria San Martino, Генуя, Италия; Независимый комитет по этике Azienda Ospedaliero-Universitaria Maggiore della Carità di Novara, Новара, Италия. Информированное согласие было получено от всех отдельных участников, включенных в исследование, или для лиц моложе 18 лет от их родителей или законных опекунов.
, Цинциннати, Огайо, США; Независимый комитет по этике A.S.L. ди Таранто, Таранто, Италия; Независимый комитет по этике IRCCS Azienda Ospedaliera Universitaria San Martino, Генуя, Италия; Независимый комитет по этике Azienda Ospedaliero-Universitaria Maggiore della Carità di Novara, Новара, Италия. Информированное согласие было получено от всех отдельных участников, включенных в исследование, или для лиц моложе 18 лет от их родителей или законных опекунов.
Доступность данных
Продукт, изучаемый в данном клиническом исследовании, вместе с правами на полученные данные и результаты были переданы компании Novartis компании GSK. Для интервенционных исследований, в которых оцениваются лекарства GSK, анонимные данные на уровне пациентов предоставляются независимым исследователям для рассмотрения независимой комиссией на сайте http://www.clinicalstudydatarequest.com в течение 6 месяцев после публикации. Чтобы защитить конфиденциальность пациентов и лиц, участвующих в наших исследованиях, GSK не раскрывает данные пациентов публично. Данные на уровне пациентов для этого исследования будут доступны на http://www.clinicalstudydatarequest.com по запросу, с учетом любых ранее существовавших прав и обязательств и/или согласий, требуемых в соответствии с соответствующими соглашениями, регулирующими или связанными с этими исследованиями. Menveo и Boostrix являются товарными знаками, принадлежащими группе компаний GSK. Gardasil и Gardasil — 9 являются товарными знаками, принадлежащими Merck & Co., Inc. Menactra и Adacel являются товарными знаками, принадлежащими Sanofi Pasteur Inc. Международной лицензии Creative Commons Attribution-NonCommercial 4.0 (http://creativecommons.org/licenses/by-nc/4.0/), которая разрешает любое некоммерческое использование, распространение и воспроизведение на любом носителе, при условии, что вы укажете соответствующие права на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения.
Данные на уровне пациентов для этого исследования будут доступны на http://www.clinicalstudydatarequest.com по запросу, с учетом любых ранее существовавших прав и обязательств и/или согласий, требуемых в соответствии с соответствующими соглашениями, регулирующими или связанными с этими исследованиями. Menveo и Boostrix являются товарными знаками, принадлежащими группе компаний GSK. Gardasil и Gardasil — 9 являются товарными знаками, принадлежащими Merck & Co., Inc. Menactra и Adacel являются товарными знаками, принадлежащими Sanofi Pasteur Inc. Международной лицензии Creative Commons Attribution-NonCommercial 4.0 (http://creativecommons.org/licenses/by-nc/4.0/), которая разрешает любое некоммерческое использование, распространение и воспроизведение на любом носителе, при условии, что вы укажете соответствующие права на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения.
Author information
Authors and Affiliations
GSK, Amsterdam, The Netherlands
Yan Miao & Thembile Mzolo
GSK, Siena, Italy
Michele Pellegrini
Authors
- Yan Miao
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Thembile Mzolo
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Michele Pellegrini
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Микеле Пеллегрини.
Дополнительная информация
Расширенные цифровые функции
Чтобы просмотреть расширенные цифровые функции для этой статьи, перейдите по ссылке https://doi.

 maskid 0,10 EUR/tk Медицинские маски 0,10EUR/шт
maskid 0,10 EUR/tk Медицинские маски 0,10EUR/шт

 https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf. По состоянию на 11 апреля 2019 г.
https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf. По состоянию на 11 апреля 2019 г. Clin Diagn Lab Immunol. 2005;12(8):959–69.
Clin Diagn Lab Immunol. 2005;12(8):959–69. 2015;136(3):e563–72.
2015;136(3):e563–72.