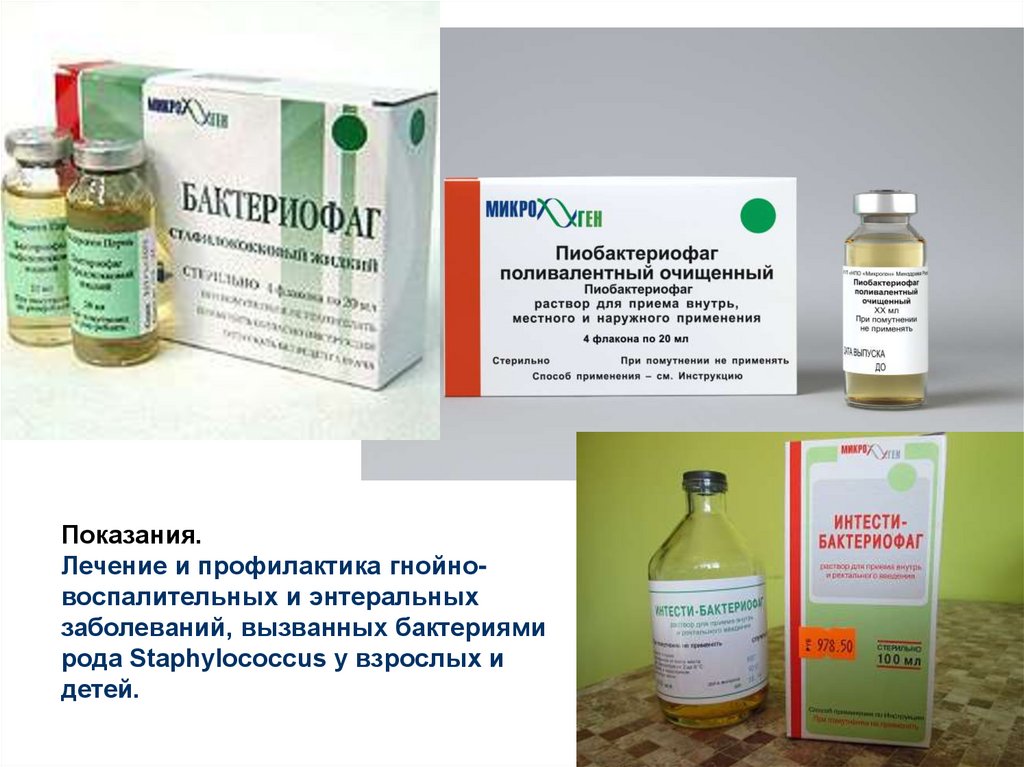
раствор для приема внутрь, местного и наружного применения — Энциклопедия лекарств РЛС
0.002 ‰
Аналоги
Заказ в аптеках
Заказать
препарат
Все формы выпуска, дозировки, регистрационные удостоверения, производители лекарства, характеристики препарата
Описание препарата Пиобактериофаг комплексный (раствор для приема внутрь, местного и наружного применения) основано на официальной инструкции, утверждено компанией-производителем в 2008 году
Дата согласования: 22.09.2008
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Инструкция
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
Пиобактериофаг (Pyobacteriofag)
ATX
V03A Другие лечебные средства
Фармакологическая группа
Вакцины, сыворотки, фаги и анатоксины
Нозологическая классификация (МКБ-10)
Список кодов МКБ-10
- A09 Диарея и гастроэнтерит предположительно инфекционного происхождения (дизентерия, диарея бактериальная)
- A41.

- A49.9 Бактериальная инфекция неуточненная
- h26.0 Язва роговицы
- h26.
 2 Кератоконъюнктивит
2 Кератоконъюнктивит - h30 Иридоциклит
- H66 Гнойный и неуточненный средний отит
- J01 Острый синусит
- J02 Острый фарингит
- J03 Острый тонзиллит [ангина]
- J04.
 0 Острый ларингит
0 Острый ларингит - J04.1 Острый трахеит
- J18 Пневмония без уточнения возбудителя
- J32 Хронический синусит
- J40 Бронхит, не уточненный как острый или хронический
- K63.
 8.0* Дисбактериоз
8.0* Дисбактериоз - K81 Холецистит
- L08.0 Пиодермия
- N12 Тубулоинтерстициальный нефрит, не уточненный как острый или хронический
- N30 Цистит
- N34 Уретрит и уретральный синдром
- N70 Сальпингит и оофорит
- N71 Воспалительные болезни матки, кроме шейки матки
- N76 Другие воспалительные болезни влагалища и вульвы
- P38 Омфалит новорожденного с небольшим кровотечением или без него
- P39.
 1 Конъюнктивит и дакриоцистит у новорожденного
1 Конъюнктивит и дакриоцистит у новорожденного - R09.1 Плеврит
- T14.1 Открытая рана неуточненной области тела
- Z100* КЛАСС XXII Хирургическая практика
Инструкция
Описание
Смесь фаголизатов стафилококковых, стрептококковых, коли, протейных и
псевдомонас аэругиноза бактерий. Консервант — хинозол (0,01 мг/мл).
Консервант — хинозол (0,01 мг/мл).
Фармакологическое действие
Пиобактериофаг комплексный обладает способностью специфически лизировать бактерии стафилококков, стрептококков (в том числе энтерококков), протея, синегнойной и кишечной палочек.
Показания к применению
Заболевания уха, горла, носа, дыхательных путей и легких — воспаления пазух
носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония,
плеврит; — хирургические инфекции — нагноения ран, ожоги, абсцесс, флегмона,
фурункулы, карбункулы, гидраденит, панариции, парапроктит, мастит, бурсит,
остеомиелит; — урогенитальные инфекции — уретрит, цистит, пиелонефрит, кольпит,
эндометрит, сальпингоофорит; — энтеральные инфекции — гастроэнтероколит,
холецистит, дисбактериоз; — генерализованные септические заболевания; —
гнойно-воспалительные заболевания новорожденных — омфалит, пиодермия,
конъюнктивит, гастроэнтероколит, сепсис и др. ; — другие заболевания, вызванные
бактериями стафилококков, стрептококков (в том числе энтерококков), протея,
синегнойной и кишечной палочек. С профилактической целью препарат используют для обработки
послеоперационных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по
эпидемическим показаниям. Важным условием эффективной фаготерапии является предварительное
определение
фагочувствительности возбудителя.
; — другие заболевания, вызванные
бактериями стафилококков, стрептококков (в том числе энтерококков), протея,
синегнойной и кишечной палочек. С профилактической целью препарат используют для обработки
послеоперационных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по
эпидемическим показаниям. Важным условием эффективной фаготерапии является предварительное
определение
фагочувствительности возбудителя.
Особые указания
Применение бактериофага не исключает использования других антибактериальных препаратов.
Условия и сроки хранения
В сухом защищенном от света месте при температуре 2-10 °C.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C.
Замораживание не допускается. В соответствии с СП 3.3.2.1248-03. Допускается транспортирование при температуре 9–25 °C не более 1 мес.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Заказ в аптеках
Выбор региона: Алтайский крайАмурская областьАрхангельская областьАстраханская областьБайконурБелгородская областьБрянская областьВладимирская областьВолгоградская областьВологодская областьВоронежская областьЕврейская автономная областьЗабайкальский крайИвановская областьИркутская областьКабардино-Балкарская РеспубликаКалининградская областьКалужская областьКамчатский крайКарачаево-Черкесская РеспубликаКемеровская областьКировская областьКостромская областьКраснодарский крайКрасноярский крайКурганская областьКурская областьЛенинградская областьЛипецкая областьМагаданская областьМоскваМосковская областьМурманская областьНенецкий автономный округНижегородская областьНовгородская областьНовосибирская областьОмская областьОренбургская областьОрловская областьПензенская областьПермский крайПриморский крайПсковская областьРеспублика АдыгеяРеспублика АлтайРеспублика БашкортостанРеспублика БурятияРеспублика ДагестанРеспублика ИнгушетияРеспублика КалмыкияРеспублика КарелияРеспублика КомиРеспублика КрымРеспублика Марий ЭлРеспублика МордовияРеспублика Саха (Якутия)Республика Северная Осетия — АланияРеспублика ТатарстанРеспублика ТываРеспублика ХакасияРостовская областьРязанская областьСамарская областьСанкт-ПетербургСаратовская областьСахалинская областьСвердловская областьСевастопольСмоленская областьСтавропольский крайТамбовская областьТверская областьТомская областьТульская областьТюменская областьУдмуртская РеспубликаУльяновская областьХабаровский крайХанты-Мансийский автономный округЧелябинская областьЧеченская РеспубликаЧувашская РеспубликаЧукотский автономный округЯмало-Ненецкий автономный округЯрославская область
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.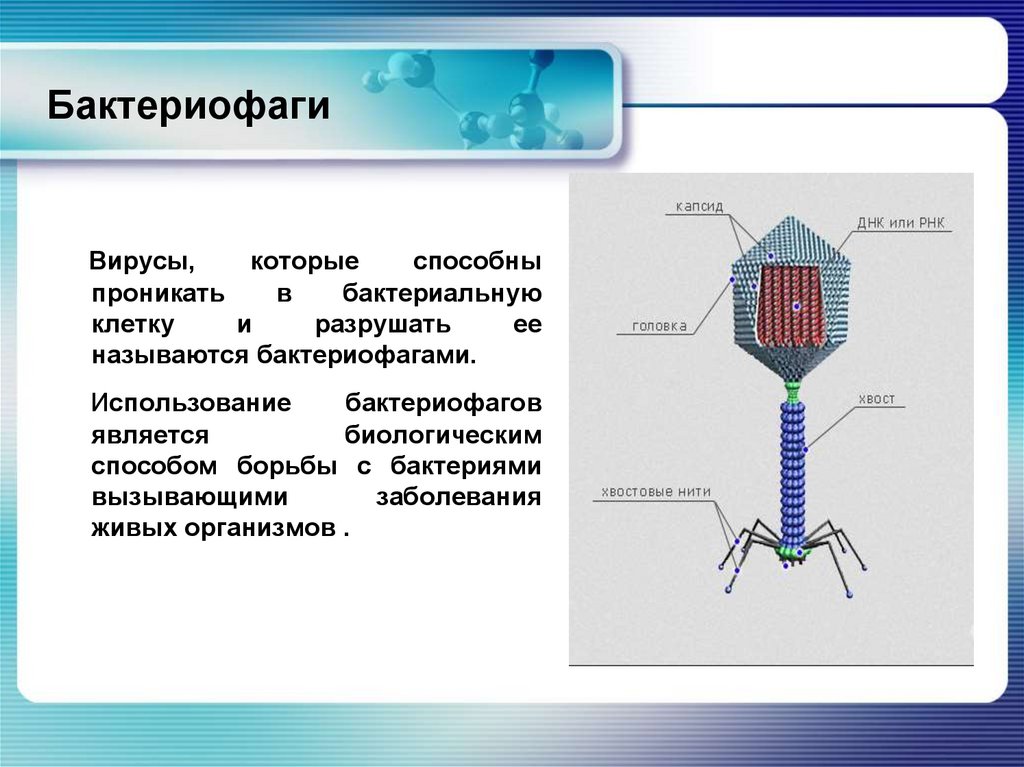
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Отзывы
Медсовет для врачей | Remedium.ru
29.12.2022
Оперировать нельзя выжидать. Правила хирургической пунктуации
Д.С. Зубков; Ассоциация травматологов-ортопедов Москвы
Врач-хирург поликлиники направил пациента в стационар для проведения неотложного оперативного вмешательства, пациент вернулся к вечеру и написал жалобу главному врачу: врач приемного отделения сообщил ему, что никаких показаний к операции нет и…
Подробнее
28. 12.2022
12.2022
Хронический и острый периодонтит: виды, лечение
Периодонтит – заболевание периодонта. Периодонт в переводе «окружающий (пери) зуб (одонт)». Часто также в том же значении применяется термин пародонт. Он включает все компоненты, удерживающие зуб в челюстной кости: десну, кость, фиксирующие волокна и фиксирующую структуру на …
Подробнее
27.12.2022
Остеоартрит суставов кистей. Обзор клинических рекомендаций
Ю.С. Филатова, М.В. Ильин; Ярославский государственный медицинский университет
В статье рассматривается распространенность остеоартрита суставов кистей. Освещаются современные аспекты патогенеза и лидирующая роль воспаления в нем. В статье оцениваются факторы риска развития остеоартрита. ..
..
Подробнее
26.12.2022
Отбеливание зубов
Существует множество систем и продуктов для отбеливания зубов, в том числе отбеливающие зубные пасты, безрецептурные гели, ополаскиватели, полоски, капы и продукты для отбеливания, которые можно получить по рекомендации стоматолога. Отбеливание зубов идеально подходит для людей со здоровыми нереставрированными…
Подробнее
23.12.2022
Риски развития саркопении после бариатрических операций у пациентов с сахарным диабетом 2-го типа
А.Г. Хитарьян1,2, А.А. Абовян2*, А.В. Межунц1,2, А. А. Орехов1,2, Д.А. Мельников1,2, А.В. Саркисян2, С.А. Адизов1, А.А. Рогут1, Г.Д. Зиглер2, М.Ж.К. Амегнину2; Клиническая больница «РЖД-Медицина», 2 Ростовский государственный медицинский университет
А. Орехов1,2, Д.А. Мельников1,2, А.В. Саркисян2, С.А. Адизов1, А.А. Рогут1, Г.Д. Зиглер2, М.Ж.К. Амегнину2; Клиническая больница «РЖД-Медицина», 2 Ростовский государственный медицинский университет
Введение. Несмотря…
Подробнее
21.12.2022
Постковидный синдром: в фокусе психоневрологические нарушения
А.В. Васильева1,2; 1 НМИЦ ПН им. В.М. Бехтерева, 2 СЗГМУ им. И.И. Мечникова
Пандемия новой коронавирусной инфекции с 2020 г. охватила весь мир, миллионы людей переболели COVID-19, что определяет актуальность изучения состояния здоровья пациентов после окончания острого периода инфекции. Имеющиеся данные…
Имеющиеся данные…
Подробнее
14.12.2022
Тетрациклиновые зубы
Тетрациклины были разработаны в 1948 году как антибиотики широкого спектра действия, которые можно использовать для лечения распространенных инфекций у детей и взрослых. Одним из побочных эффектов этой группы веществ является их встраивание в ткани с образованием кальцинатов. Первое упоминание об…
Подробнее
09.12.2022
Онлайн-спецпроект «Вместе – против ОРВИ!»
Уважаемые коллеги! В холодное время года традиционно увеличивается заболеваемость респираторными инфекциями, поэтому нагрузка на врачей также возрастает. Чтобы помочь вам в разгар эпидемиологического сезона, мы подготовили онлайн-проект для медицинских специалистов «Вместе – против ОРВИ!». Его цель…
Его цель…
Подробнее
06.12.2022
Характеристика профиля личности и приверженность к терапии как факторы прогноза компенсации сахарного диабета 1-го типа у подростков
И.Л. Никитина, А.О. Плаксина, А.С. Пирожкова, И.А. Кельмансон; Национальный медицинский исследовательский центр имени В.А. Алмазова
Введение. Сахарный диабет 1-го типа (СД1) у детей и подростков занимает ведущее место в структуре хронических заболеваний детского возраста. Несмотря…
Подробнее
02.12.2022
Топическая антибактериальная терапия перфоративных отитов в пандемию COVID-19
С. В. Рязанцев1, К.А. Балацкая1, И.В. Ткачук2, А.Е. Голованов2, П.В. Киреев2; 1Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи, 2 Военно-медицинская академия имени С.М. Кирова
В. Рязанцев1, К.А. Балацкая1, И.В. Ткачук2, А.Е. Голованов2, П.В. Киреев2; 1Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи, 2 Военно-медицинская академия имени С.М. Кирова
Развивающаяся резистентность микроорганизмов к воздействию…
Подробнее
Загрузить еще
Комбинированное использование бактериофага К и нового бактериофага для уменьшения образования биопленки Staphylococcus aureus
1. Lowy FD. 1998. Инфекции золотистого стафилококка. Н. англ. Дж. Мед. 339: 520–532. 10.1056/NEJM199808203390806. [PubMed] [CrossRef] [Google Scholar]
2. Фостер Т. Дж.
2005.
Уклонение от иммунитета стафилококками. Нац. Преподобный Микробиолог.
3: 948–958. 10.1038/nrmicro1289. [PubMed] [CrossRef] [Google Scholar]
Дж.
2005.
Уклонение от иммунитета стафилококками. Нац. Преподобный Микробиолог.
3: 948–958. 10.1038/nrmicro1289. [PubMed] [CrossRef] [Google Scholar]
3. Plata K, Rosato AE, Wegrzyn G. 2009. Золотистый стафилококк как инфекционный агент: обзор биохимии и молекулярной генетики его патогенности. Акта Биохим. пол. 56:597–612. [PubMed] [Google Scholar]
4. Chang S, Sievert DM, Hageman JC, Boulton ML, Tenover FC, Downes FP, Shah S, Rudrik JT, Pupp GR, Brown WJ, Cardo D, Fridkin SK. 2003. Инфицирование устойчивым к ванкомицину Staphylococcus aureus, содержащим ген устойчивости vanA. Н. англ. Дж. Мед. 348: 1342–1347. 10.1056/NEJMoa025025. [PubMed] [CrossRef] [Google Scholar]
5. Murray CK, Holmes RL, Ellis MW, Mende K, Wolf SE, McDougal LK, Guymon CH, Hospenthal DR. 2009. Двадцатипятилетняя эпидемиология изолятов инвазивного метициллин-резистентного золотистого стафилококка (MRSA), обнаруженных в ожоговом центре. Бернс 35:1112–1117. 10.1016/Дж.Бернс.2009.02.013. [PubMed] [CrossRef] [Google Scholar]
6. Keen EF, Robinson BJ, Hospenthal DR, Aldous WK, Wolf SE, Chung KK, Murray CK.
2010.
Преобладание мультирезистентных организмов, обнаруженных в военном ожоговом центре. Бернс
36:819–825. 10.1016/j.burns.2009.10.013. [PubMed] [CrossRef] [Google Scholar]
Keen EF, Robinson BJ, Hospenthal DR, Aldous WK, Wolf SE, Chung KK, Murray CK.
2010.
Преобладание мультирезистентных организмов, обнаруженных в военном ожоговом центре. Бернс
36:819–825. 10.1016/j.burns.2009.10.013. [PubMed] [CrossRef] [Google Scholar]
7. Erol S, Altoparlak U, Akcay MN, Celebi F, Parlak M. 2004. Изменения микробной флоры и колонизации ран у обожженных. Бернс 30:357–361. 10.1016/j.burns.2003.12.013. [PubMed] [CrossRef] [Академия Google]
8. Персиваль С.Л., Хилл К.Е., Уильямс Д.В., Хупер С.Дж., Томас Д.В., Костертон Дж.В. 2012. Обзор научных данных о биопленках в ранах. Восстановление ран. 20:647–657. 10.1111/j.1524-475X.2012.00836.x. [PubMed] [CrossRef] [Google Scholar]
9. Høiby N, Bjarnsholt T, Givskov M, Molin S, Ciofu O. 2010. Антибиотикорезистентность бактериальных биопленок. Междунар. Дж. Антимикроб. Агенты 35:322–332. 10.1016/j.ijantimicag.2009.12.011. [PubMed] [CrossRef] [Google Scholar]
10. De Beer D, Stoodley P, Lewandowski Z.
1997. Измерение локальных коэффициентов диффузии в биопленках методами микроинъекции и конфокальной микроскопии. Биотехнолог. биоинж.
53:151–158. 10.1002/(SICI)1097-0290(19970120)53:2<151::AID-BIT4>3.0.CO;2-N. [PubMed] [CrossRef] [Google Scholar]
Измерение локальных коэффициентов диффузии в биопленках методами микроинъекции и конфокальной микроскопии. Биотехнолог. биоинж.
53:151–158. 10.1002/(SICI)1097-0290(19970120)53:2<151::AID-BIT4>3.0.CO;2-N. [PubMed] [CrossRef] [Google Scholar]
11. Lam J, Chan R, Lam K, Costerton JW. 1980. Образование мукоидных микроколоний Pseudomonas aeruginosa в инфицированных легких при муковисцидозе. Заразить. Иммун. 28: 546–556. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Джеймс Г.А., Своггер Э., Уолкотт Р., Пульчини Э.Д., Секор П., Сестрич Дж., Костертон Дж.В., Стюарт П.С. 2008. Биопленки в хронических ранах. Восстановление ран. 16:37–44. 10.1111/j.1524-475X.2007.00321.x. [PubMed] [CrossRef] [Академия Google]
13. Davies CE, Hill KE, Wilson MJ, Stephens P, Hill CM, Harding KG, Thomas DW.
2004.
Использование ПЦР 16S рибосомной ДНК и денатурирующего градиентного гель-электрофореза для анализа микрофлоры заживающих и незаживающих хронических венозных язв голени. Дж. Клин. микробиол.
42:3549–3557. 10.1128/JCM.42.8.3549-3557.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
микробиол.
42:3549–3557. 10.1128/JCM.42.8.3549-3557.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Донлан Р.М. 2008. Биопленки на центральных венозных катетерах: возможна ли эрадикация? Курс. Верхняя. микробиол. Иммунол. 322: 133–161. [PubMed] [Академия Google]
15. Даруиш Р.О. 2004. Лечение инфекций, связанных с хирургическими имплантатами. Н. англ. Дж. Мед. 350: 1422–1429. 10.1056/NEJMra035415. [PubMed] [CrossRef] [Google Scholar]
16. Sen CK, Gordillo GM, Roy S, Kirsner R, Lambert L, Hunt TK, Gottrup F, Gurtner GC, Longaker MT. 2010. Кожные раны человека: серьезная и быстрорастущая угроза общественному здравоохранению и экономике. Восстановление ран. 17: 763–771. 10.1111/j.1524-475X.2009.00543.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Ляпику А., Торрес А.
2013.
Новые препараты для лечения метициллин-резистентного золотистого стафилококка. Мнение эксперта. Эмердж. Наркотики
18: 291–305. 10.1517/14728214. 2013.813480. [PubMed] [CrossRef] [Google Scholar]
2013.813480. [PubMed] [CrossRef] [Google Scholar]
18. Kurlenda J, Grinholc M. 2012. Альтернативная терапия заболеваний, вызванных золотистым стафилококком. Акта Биохим. пол. 59:171–184. [PubMed] [Google Scholar]
19. Берроуз Б., Харпер Д.Р., Андерсон Дж., МакКонвилл М., Энрайт М.С. 2011. Терапия бактериофагами: потенциальное использование в борьбе с устойчивыми к антибиотикам патогенами. Эксперт преподобный Anti Infect. тер. 9: 775–785. 10.1586/ери.11.90. [PubMed] [CrossRef] [Google Scholar]
20. Young I, Wang I, Roof WD. 2000. Фаги уйдут: стратегии лизиса клеток-хозяев. Тенденции микробиол. 8:120–128. 10.1016/S0966-842X(00)01705-4. [PubMed] [CrossRef] [Google Scholar]
21. Kraushaar B, Thanh MD, Hammerl JA, Reetz J, Fetsch A, Hertwig S.
2013.
Выделение и характеристика фагов с литической активностью в отношении метициллинрезистентных штаммов Staphylococcus aureus, принадлежащих к клональному комплексу 398. Арх. Вирол.
158:2341–2350. 10.1007/s00705-013-1707-6. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
22. Capparelli R, Parlato M, Borriello G, Salvatore P, Iannelli D. 2007. Экспериментальная фаготерапия против золотистого стафилококка у мышей. Антимикроб. Агенты Чемотер. 51:2765–2773. 10.1128/ААС.01513-06. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Gupta R, Prasad Y. 2011. Эффективность поливалентного бактериофага Р-27/НР для борьбы с полирезистентным золотистым стафилококком, ассоциированным с инфекциями человека. Курс. микробиол. 62: 255–260. 10.1007/s00284-010-9699-х. [PubMed] [CrossRef] [Google Scholar]
24. Abedon ST. 2011. Бактериофаги и биопленки: экология, фаготерапия, бляшки. Издательство Nova Science, Hauppauge, NY. [Google Scholar]
25. Гурский А., Мендзыбродский Р., Борисовский Дж., Вебер-Дабровска Б., Лобокка М., Фортуна В., Леткевич С., Зимецкий М., Филби Г. 2009. Бактериофаговая терапия для лечения инфекций. Курс. мнение расследование Наркотики 10: 766–774. [PubMed] [Google Scholar]
26. Скурник М., Паюнен М., Кильюнен С.
2007.
Биотехнологические проблемы фаготерапии. Биотехнолог. лат.
29: 995–1003. 10.1007/s10529-007-9346-1. [PubMed] [CrossRef] [Google Scholar]
Скурник М., Паюнен М., Кильюнен С.
2007.
Биотехнологические проблемы фаготерапии. Биотехнолог. лат.
29: 995–1003. 10.1007/s10529-007-9346-1. [PubMed] [CrossRef] [Google Scholar]
27. O’Flaherty S, Ross RP, Meaney W, Fitzgerald GF, Elbreki MF, Coffey A. 2005. Потенциал поливалентного антистафилококкового бактериофага К для борьбы с антибиотикорезистентными стафилококками в больницах. заявл. Окружающая среда. микробиол. 71: 1836–1842. 10.1128/АЭМ.71.4.1836-1842.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Kelly D, McAuliffe O, Ross RP, Coffey A. 2012. Профилактика образования биопленки Staphylococcus aureus и снижение установленной плотности биопленки с помощью комбинации фага К и модифицированных производных. лат. заявл. микробиол. 54: 286–291. 10.1111/j.1472-765X.2012.03205.x. [PubMed] [CrossRef] [Google Scholar]
29. O’Flaherty S, Coffey A, Edwards R, Meaney W, Fitzgerald GF, Ross RP.
2004.
Геном стафилококкового фага К: новой линии Myoviridae, заражающей грамположительные бактерии с низким содержанием G+C. Дж. Бактериол.
186: 2862–2871. 10.1128/JB.186.9.2862-2871.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Бактериол.
186: 2862–2871. 10.1128/JB.186.9.2862-2871.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Xia G, Corrigan RM, Winstel V, Goerke C, Gründling A, Peschel A. 2011. Пристеночная тейхоевая кислота-зависимая адсорбция стафилококковых сифовирусов и миовирусов. Дж. Бактериол. 193:4006–4009. 10.1128/JB.01412-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Enright MC, Day NP, Davies CE, Peacock SJ, Spratt BG. 2000. Мультилокусное типирование последовательности для характеристики метициллин-резистентных и метициллин-чувствительных клонов Staphylococcus aureus. Дж. Клин. микробиол. 38:1008–1015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Tucker RG. 1961. Роль ионов магния в росте анти-R фага Salmonella. J. Gen. Microbiol. 26:313–323. 10.1099/00221287-26-2-313. [PubMed] [CrossRef] [Google Scholar]
33. Адамс М. 1959. Бактериофаги. Interscience Publishers, Нью-Йорк, штат Нью-Йорк. [Google Scholar]
34. Азиз Р.К., Бартельс Д., Бест А.А., ДеДжонг М., Диз Т., Эдвардс Р.А., Формсма К., Гердес С., Гласс Э.М., Кубал М., Мейер Ф., Олсен Г.Дж., Олсон Р., Остерман А.Л., Овербик Р.А., Макнил Л.К., Паарманн Д., Пачиан Т., Паррелло Б., Пуш Г.Д., Райх К., Стивенс Р., Вассиева О., Вонстейн В., Вилке А., Загнитко О.
2008.
Сервер RAST: быстрые аннотации с использованием технологии подсистем. Геномика BMC
9:75. 10.1186/1471-2164-9-75. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Азиз Р.К., Бартельс Д., Бест А.А., ДеДжонг М., Диз Т., Эдвардс Р.А., Формсма К., Гердес С., Гласс Э.М., Кубал М., Мейер Ф., Олсен Г.Дж., Олсон Р., Остерман А.Л., Овербик Р.А., Макнил Л.К., Паарманн Д., Пачиан Т., Паррелло Б., Пуш Г.Д., Райх К., Стивенс Р., Вассиева О., Вонстейн В., Вилке А., Загнитко О.
2008.
Сервер RAST: быстрые аннотации с использованием технологии подсистем. Геномика BMC
9:75. 10.1186/1471-2164-9-75. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Нирмал Кумар Г.П., Сундарраджан С., Пол В.Д., Нандини С., Сараванан Р.С., Харихаран С., Шрирам Б., Падманабхан С. 2012. Использование хозяина, свободного от профагов, для достижения гомогенной популяции бактериофагов: новые результаты. Вирус Рез. 169: 182–187. 10.1016/j.virusres.2012.07.026. [PubMed] [CrossRef] [Google Scholar]
36. Паюнен М., Кильюнен С., Скурник М.
2000.
Бактериофаг ϕYeO3-12, специфичный для Yersinia enterocolitica серотипа О:3, родственен колифагам Т3 и Т7. Дж. Бактериол. 182: 5114–5120. 10.1128/JB.182.18.5114-5120.2000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
182: 5114–5120. 10.1128/JB.182.18.5114-5120.2000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Буланже П. 2009. Очистка бактериофагов и анализ SDS-PAGE структурных белков фага от частиц-призраков. Методы Мол. биол. 502: 227–238. 10.1007/978-1-60327-565-1_13. [PubMed] [CrossRef] [Google Scholar]
38. Пикард DJJ. 2009. Получение лизатов бактериофагов и чистой ДНК. Методы Мол. биол. 502:3–9. 10.1007/978-1-60327-565-1_1. [PubMed] [CrossRef] [Google Scholar]
39. Sambrook J, Russell DW. 2001. Молекулярное клонирование: лабораторное руководство, 3-е изд., тома с 1 по 3. CSH Press, Колд-Спринг-Харбор, Нью-Йорк. [Академия Google]
40. Кот В., Вогенсен Ф.К., Соренсен С.Дж., Хансен Л.Х. 2014. DPS — экспресс-метод секвенирования генома ДНК-содержащих бактериофагов непосредственно из одной бляшки. Дж. Вирол. Методы 196: 152–156. 10.1016/j.jviromet.2013.10.040. [PubMed] [CrossRef] [Google Scholar]
41. Серка Н., Оливейра Р., Азередо Дж.
2007. Восприимчивость планктонных клеток и биопленок Staphylococcus epidermidis к литическому действию стафилококкового бактериофага K. Lett. заявл. микробиол.
45:313–317. 10.1111/j.1472-765X.2007.02190.х. [PubMed] [CrossRef] [Google Scholar]
Восприимчивость планктонных клеток и биопленок Staphylococcus epidermidis к литическому действию стафилококкового бактериофага K. Lett. заявл. микробиол.
45:313–317. 10.1111/j.1472-765X.2007.02190.х. [PubMed] [CrossRef] [Google Scholar]
42. Abramson JH. 2011. Обновление WINPEPI: компьютерные программы для эпидемиологов и их обучающий потенциал. Эпидемиол. Перспектива. иннов. 8:1. 10.1186/1742-5573-8-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Силланкорва С., Нойбауэр П., Азередо Дж. 2008. Выделение и характеристика Т7-подобного литического фага Pseudomonas fluorescens. БМС Биотехнология. 8:80. 10.1186/1472-6750-8-80. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Аккерманн Х-В. 2011. Таксономия бактериофагов. микробиол. Ауст. 32:90–94. [Google Scholar]
45. Риз П.Дж., Фрай Б.А.
1981.
Морфология стафилококкового бактериофага К и метаболизм ДНК инфицированного Staphylococcus aureus. Дж. Генерал Вирол.
53:293–307.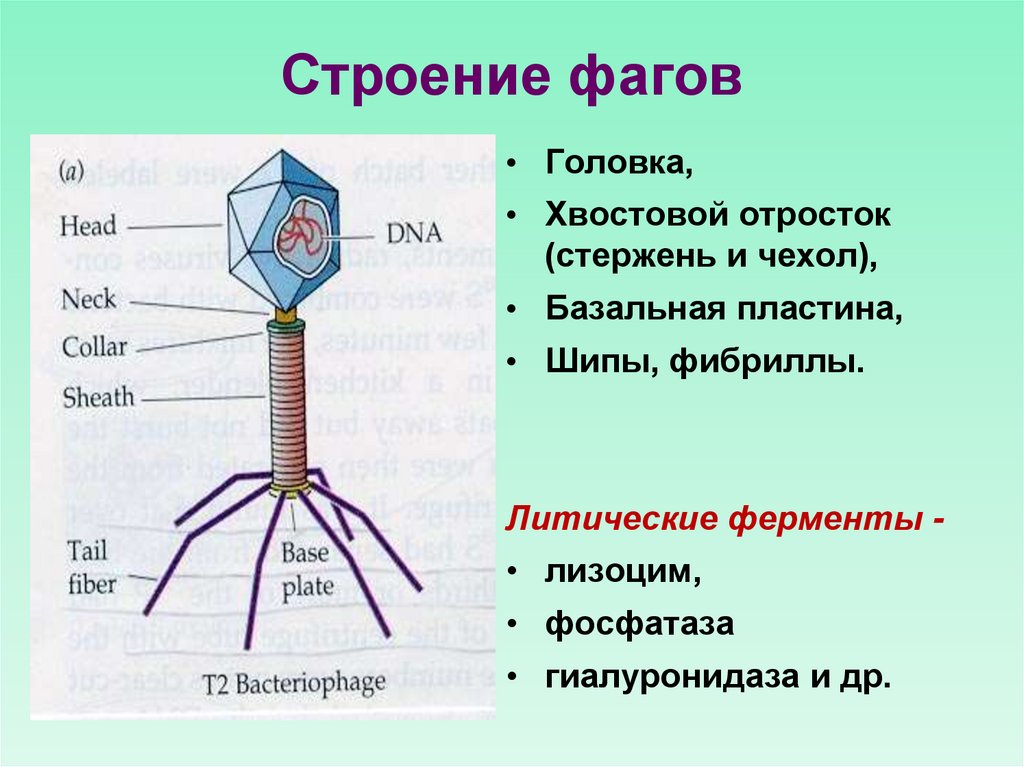 10.1099/0022-1317-53-2-293. [PubMed] [CrossRef] [Google Scholar]
10.1099/0022-1317-53-2-293. [PubMed] [CrossRef] [Google Scholar]
46. Streisinger G, Emrich J, Stahl MM. 1967. Хромосомная структура фага t4, iii. Терминальное резервирование и определение длины. проц. Натл. акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 57:292–295. 10.1073/пнас.57.2.292. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Kwan T, Liu J, DuBow M, Gros P, Pelletier J. 2005. Полные геномы и протеомы 27 бактериофагов Staphylococcus aureus. проц. Натл. акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 102: 5174–5179. 10.1073/пнас.0501140102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Cui Z, Song Z, Wang Y, Zeng L, Shen W, Wang Z, Li Q, He P, Qin J, Guo X. 2012. Полная последовательность генома фага Staphylococcus aureus широкого круга хозяев JD007. Дж. Вирол. 86:13880–13881. 10.1128/ОВИ.02728-12. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Gu J, Liu X, Lu R, Li Y, Song J, Lei L, Sun C, Feng X, Du C, Yu H, Yang Y, Han W. 2012.
Полная последовательность генома бактериофага Staphylococcus aureus Gh25. Дж. Вирол.
86:8914–8915. 10.1128/ОВИ.01313-12. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2012.
Полная последовательность генома бактериофага Staphylococcus aureus Gh25. Дж. Вирол.
86:8914–8915. 10.1128/ОВИ.01313-12. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Deghorain M, Van Melderen L. 2012. Семейство стафилококковых фагов: обзор. Вирусы 4:3316–3335. 10.3390/v4123316. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Лобоцка М., Хейнович Домбровски М.С., Гоздек К., Косаковский А., Витковска Дж., Улатовска М.И., Вебер-Домбровска Б., Квятек М., Парасион С., Гавор Й, Косовска Х, Гловацка А. 2012. Геномика стафилококковых Twort-подобных фагов — потенциальных терапевтических средств постантибиотической эры. Доп. Вирус Рез. 83:143–216. 10.1016/В978-0-12-394438-2.00005-0. [PubMed] [CrossRef] [Google Scholar]
52. Се С-Э, Ло Х-Х, Чен С-Т, Ли М-С, Ценг Ю-Х.
2011.
Широкий круг хозяев и сильная литическая активность лизирующего фага Staphylococcus aureus Stau2. заявл. Окружающая среда. микробиол.
77: 756–761. 10.1128/АЭМ. 01848-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
01848-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Kwiatek M, Parasion S, Mizak L, Gryko R, Bartoszcze M, Kocik J. 2012. Характеристика бактериофага, выделенного от коровы, больной маститом, литического в отношении штаммов Staphylococcus aureus. Арка Вирол. 157: 225–234. 10.1007/s00705-011-1160-3. [PubMed] [CrossRef] [Академия Google]
54. Hejkal TW, Wellings FM, Lewis AL, LaRock PA. 1981. Распространение вирусов, связанных с частицами в сточных водах. заявл. Окружающая среда. микробиол. 41:628–634. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Narang HK, Codd AA. 1981. Частота встречаемости вируса в рутинных образцах фекалий от пациентов с острым небактериальным гастроэнтеритом. Дж. Клин. микробиол. 13:982–988. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Langlet J, Gaboriaud F, Gantzer C.
2007.
Влияние рН на количество единиц, образующих бляшки, и агрегацию бактериофага MS2. Дж. Заявл. микробиол.
103: 1632–1638. 10.1111/j.1365-2672.2007.03396.х. [PubMed] [CrossRef] [Google Scholar]
10.1111/j.1365-2672.2007.03396.х. [PubMed] [CrossRef] [Google Scholar]
57. Земб О., Манефилд М., Томас Ф., Жаке С. 2013. Адсорбция фагов бактериями в свете электростатики: тематическое исследование с использованием E. coli, T2 и проточной цитометрии. Дж. Вирол. Методы 189: 283–289. 10.1016/j.jviromet.2013.02.007. [PubMed] [CrossRef] [Google Scholar]
58. Esteban PP, Alves DR, Enright MC, Bean JE, Gaudion A, Jenkins ATA, Young AER, Arnot TC. 2014. Усиление антимикробных свойств бактериофага-К путем стабилизации с помощью наноэмульсий масло-в-воде. Биотехнолог. прог. 30:932–944. 10.1002/бтпр.1898. [PubMed] [CrossRef] [Google Scholar]
59. Hatfull GF. 2008. Геномика бактериофагов. Курс. мнение микробиол. 11: 447–453. 10.1016/j.mib.2008.09.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Lima-Mendez G, Toussaint A, Leplae R.
2011.
Модульный взгляд на геномное пространство бактериофагов: идентификация модулей маркеров хозяина и образа жизни. Рез. микробиол.
162: 737–746. 10.1016/j.resmic.2011.06.006. [PubMed] [CrossRef] [Академия Google]
Рез. микробиол.
162: 737–746. 10.1016/j.resmic.2011.06.006. [PubMed] [CrossRef] [Академия Google]
61. Танджи Ю., Шимада Т., Фукудоми Х., Миянага К., Накаи Ю., Унно Х. 2005. Терапевтическое использование фагового коктейля для борьбы с Escherichia coli O157:H7 в желудочно-кишечном тракте мышей. Дж. Биоци. биоинж. 100: 280–287. 10.1263/jbb.100.280. [PubMed] [CrossRef] [Google Scholar]
62. Gu J, Liu X, Li Y, Han W, Lei L, Yang Y, Zhao H, Gao Y, Song J, Lu R, Sun C, Feng X. 2012. Метод создания фагового коктейля с большим терапевтическим потенциалом. PLoS один 7:e31698. 10.1371/journal.pone.0031698. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Ryan EM, Alkawareek MY, Donnelly RF, Gilmore BF. 2012. Синергические комбинации фаг-антибиотик для контроля биопленок Escherichia coli in vitro. ФЭМС Иммунол. Мед. микробиол. 65:395–398. 10.1111/j.1574-695X.2012.00977.x. [PubMed] [CrossRef] [Google Scholar]
64. Comeau AM, Tétart F, Trojet SN, Prère MF, Krisch HM. 2007.
Синергия фагов и антибиотиков (PAS): бета-лактамные и хинолоновые антибиотики стимулируют рост вирулентных фагов. PLoS один
2:e799. 10.1371/journal.pone.0000799. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2007.
Синергия фагов и антибиотиков (PAS): бета-лактамные и хинолоновые антибиотики стимулируют рост вирулентных фагов. PLoS один
2:e799. 10.1371/journal.pone.0000799. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Kirby AE. 2012. Синергическое действие гентамицина и бактериофага в непрерывной культуре популяции золотистого стафилококка. PLoS один 7:e51017. 10.1371/журнал.поне.0051017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Henein A. 2013. Каковы ограничения более широкого терапевтического использования фагов? Бактериофаг 3:e24872. 10.4161/бакт.24872. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Бактериофаги — StatPearls — Книжная полка NCBI
Лаура М. Касман; Ла Донна Портер.
Информация об авторе
Последнее обновление: 26 сентября 2022 г.
Введение
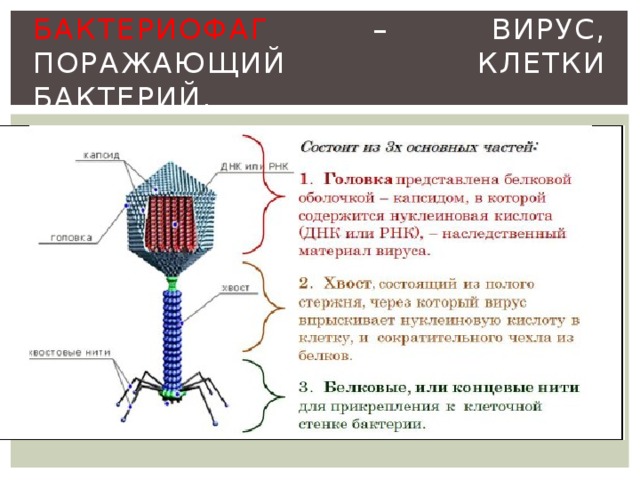
Бактериофаги, также известные как фаги, представляют собой вирусы, которые инфицируют и размножаются только в бактериальных клетках. Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Они повсеместно распространены в окружающей среде и признаны наиболее распространенными биологическими агентами на Земле. Они чрезвычайно разнообразны по размеру, морфологии и геномной организации [1][2][3]. Однако все они состоят из генома нуклеиновой кислоты, заключенного в оболочку кодируемых фагом капсидных белков, которые защищают генетический материал и обеспечивают его доставку в следующую клетку-хозяина. Электронная микроскопия позволила детально визуализировать сотни типов фагов, некоторые из которых имеют «головы», «ноги» и «хвосты». Несмотря на такой внешний вид, фаги неподвижны и зависят от броуновского движения, чтобы достичь своих целей.
Как и все вирусы, бактериофаги очень видоспецифичны в отношении своих хозяев и обычно заражают только один вид бактерий или даже определенные штаммы внутри вида. Как только бактериофаг прикрепляется к восприимчивому хозяину, он следует одной из двух стратегий репликации: литической или лизогенной. Во время цикла литической репликации фаг прикрепляется к восприимчивой бактерии-хозяину, вводит свой геном в цитоплазму клетки-хозяина и использует рибосомы хозяина для производства своих белков. Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Ресурсы клетки-хозяина быстро преобразуются в вирусные геномы и капсидные белки, которые собираются в несколько копий исходного фага. Когда клетка-хозяин умирает, она активно или пассивно лизируется, высвобождая новый бактериофаг для заражения другой клетки-хозяина. В цикле лизогенной репликации фаг также прикрепляется к восприимчивой бактерии-хозяину и вводит свой геном в цитоплазму клетки-хозяина. Однако вместо этого фаговый геном интегрируется в хромосому бактериальной клетки или сохраняется как эписомальный элемент, где в обоих случаях он реплицируется и передается дочерним бактериальным клеткам, не убивая их. Интегрированные фаговые геномы называются профагами, а содержащие их бактерии — лизогенами. Профаги могут вернуться к литическому циклу репликации и убить своего хозяина, чаще всего в ответ на изменение условий окружающей среды [4].
Функция
Хотя бактериофаги не могут инфицировать и размножаться в клетках человека, они являются важной частью микробиома человека и важным посредником генетического обмена между патогенными и непатогенными бактериями [5][6]. Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
Перенос генов от одного бактериального штамма к другому с помощью бактериофага называется трансдукцией и может происходить генерализованным или специфическим образом.
При «генерализованной» трансдукции случайные фрагменты бактериальной геномной ДНК упаковываются внутри фаговых капсидов вместо фаговой геномной ДНК по мере распада клетки-хозяина в результате литической репликации. Если фаг, несущий эту бактериальную ДНК, вводит ее в здоровую клетку-хозяина, она может интегрироваться в хромосому этой бактерии, изменяя ее геном и геном ее дочерних клеток.
При «специализированной» трансдукции считается, что лизогенные фаги, которые были амплифицированы в популяции бактерий, вырезают некоторую бактериальную ДНК вместе со своим геномом при запуске цикла литической репликации. Поскольку лизогены имеют один и тот же сайт интеграции, все фаги-потомки передают один и тот же бактериальный ген своим новым хозяевам.
Помимо генетического обмена, бактериофаги могут изменять микробные популяции, потому что они охотятся на определенные виды бактерий, оставляя другие невредимыми. На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли.
На протяжении более 100 лет исследователи пытались использовать это свойство в качестве средства для лечения патогенных бактериальных инфекций у людей и животных. Хотя дикие фаги, вероятно, оказывают временное воздействие на популяции диких бактерий [7], существует множество препятствий для клинического использования литических бактериофагов в качестве антимикробной терапии (фаговая терапия) у людей. Во-первых, штаммы диких бактерий очень разнообразны, и многие из них устойчивы к одному или нескольким фагам. Известно много механизмов резистентности, например, CRISPR-Cas9.система, разработанная в настоящее время как инструмент для генетических манипуляций в лаборатории, возникла как бактериальный защитный механизм против заражения бактериофагами [8]. Кроме того, фаги гораздо более иммуногенны, чем противомикробные препараты, и быстро выводятся из крови ретикулярной эндотелиальной системой. Их большой размер по сравнению с противомикробными препаратами, вероятно, ограничит их использование местным применением, если будут найдены эффективные фаговые коктейли. Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Некоторые исследователи предположили, что использование фаговых ферментов, которые могут проникать через стенки бактериальных клеток, может быть более простой стратегией [9].]. На сегодняшний день не проводилось рандомизированных, контролируемых, двойных слепых испытаний, показывающих эффективность какой-либо стратегии на людях.
Клиническое значение
Фаги имеют клиническое значение по нескольким причинам. Во-первых, многие высокопатогенные бактериальные токсины кодируются геномами бактериофагов, так что бактерия-хозяин является патогенной только тогда, когда лизогенизируется кодирующим токсин фагом. Примерами являются холерный токсин в Vibrio cholerae [10], дифтерийный токсин в Corynebacterium diphtheriae 9.0168 [11]. Без токсинов, кодируемых фагами, эти виды бактерий либо намного менее патогенны, либо вообще не патогенны. Почему фаги кодируют эти токсины, неизвестно. В то время как холерный токсин, возможно, помогает как фагу, так и его хозяину добраться до следующей жертвы, вызывая обильную водянистую диарею, паралич, вызванный ботулиническим токсином, по-видимому, имеет противоположный эффект.
Во-вторых, бактериофаги являются векторами для горизонтального переноса генов, включая гены устойчивости к противомикробным препаратам [5]. Они также были разработаны для введения генов в определенные штаммы для клинического эффекта, хотя это использование в настоящее время находится на стадии тестирования [15].
Третий клинически значимый аспект бактериофагов заключается в том, что их обнаружение можно использовать в качестве биомаркера присутствия их хозяина в сложной пробе окружающей среды. Это чаще всего используется в качестве заменителя фекального загрязнения источников воды. Если фаг присутствует, то, скорее всего, присутствует и хозяин. В качестве альтернативы фаги были сконструированы для производства обнаруживаемой молекулы, такой как люцифераза, когда они заражают своего хозяина в качестве средства обнаружения бактерий в смешанном образце окружающей среды [16].
Хотя бактериофаги в основном вытеснены более новыми технологиями, они также имеют клиническое значение благодаря своей способности различать штаммы одного и того же вида бактерий. Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Большинство изученных видов бактерий имеют несколько патогенных бактериофагов, так же как люди как вид восприимчивы к нескольким вирусам. Различные штаммы внутри вида устойчивы к одним фагам, а не к другим. При систематическом заражении каждого штамма стандартной панелью фагов для этого вида каждый штамм можно идентифицировать по характеру восприимчивости и устойчивости к каждому типу фага. Фаговое типирование Staphylococcus aureus , например, использовал стандартизированную панель бактериофагов, совместно используемую во всем мире, для дифференциации штаммов S. aureus . До разработки молекулярных методов для этой цели, таких как мультилокусное типирование последовательностей и гель-электрофорез в пульсирующем поле, фаговое типирование было стандартным критерием для отслеживания штаммов в эпидемиологических целях [17].
Наконец, бактериофаги были первым открытым типом вирусов и стали частью многих фундаментальных открытий молекулярной биологии. Например, доказательства того, что ДНК является молекулой, передающей генетическую информацию, основные механизмы регуляции генов и генетический код, и это лишь некоторые из них, были обнаружены с помощью бактериофагов.
Улучшение результатов работы команды здравоохранения
Устойчивость к антибиотикам и инфекционный контроль
Бактериофаги являются движущей силой эволюции бактерий в микробиоме человека (уровень доказательности II). Профаг можно заставить переключиться на литический цикл репликации с помощью стресса клетки-хозяина, включая противомикробные препараты. Следовательно, можно ожидать, что лечение антибиотиками, особенно направленное на микробную флору кишечника, также изменит вирусный (фаговый) микробиом. Бактериофаги не так легко инактивируются, как вегетативные бактериальные клетки, но они уязвимы для УФ-инактивации, автоклавирования и стандартных процедур дезинфекции в больницах.
Заболевание, опосредованное бактериальными токсинами
Для всех членов бригады, ухаживающих за пациентом с заболеванием, вызываемым токсинами, такими как холера или шигелла, важно, чтобы процедуры дезинфекции выбирались с учетом их способности инактивировать как вирусы, так и бактерии. Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Хотя бактериофаги не заражают клетки человека напрямую, они могут опосредовать перенос генов вирулентности от патогенных к непатогенным бактериальным штаммам.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Симмондс П., Айевсакун П. Классификация вирусов – где провести черту? Арх Вирол. 2018 авг; 163(8):2037-2046. [Бесплатная статья PMC: PMC6096723] [PubMed: 30039318]
- 2.
Hatfull GF, Hendrix RW. Бактериофаги и их геномы. Карр Опин Вирол. 2011 окт;1(4):298-303. [Бесплатная статья PMC: PMC3199584] [PubMed: 22034588]
- 3.
Doore SM, Fane BA. Микровирусы: разнообразие, сборка и экспериментальная эволюция. Вирусология. 2016 Апрель; 491: 45-55. [PubMed: 26874016]
- 4.
Переключатель Ptashne M. Lambda: уроки замены модуля.
 Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]- 5.
Бойд Э.Ф. Кодируемые бактериофагами бактериальные факторы вирулентности и взаимодействия фаг-остров патогенности. Adv вирус Res. 2012;82:91-118. [PubMed: 22420852]
- 6.
Watson BNJ, Staals RHJ, Fineran PC. CRISPR-Cas-опосредованная устойчивость к фагам усиливает горизонтальный перенос генов путем трансдукции. мБио. 13 февраля 2018 г., 9(1) [бесплатная статья PMC: PMC5821089] [PubMed: 29440578]
- 7.
Де Сорди Л., Лоуренсо М., Дебарбье Л. Битва внутри: Взаимодействие бактериофагов и бактерий в желудочно-кишечном тракте тракт. Клеточный микроб-хозяин. 2019 13 февраля; 25 (2): 210-218. [В паблике: 30763535]
- 8.
Кристин Дж.Р., Беккерт М.В. Происхождение и применение CRISPR-опосредованного редактирования генома. Эйнштейн Дж. Биол. Мед. 2016;31(1-2):2-5. [Статья бесплатно PMC: PMC5319590] [PubMed: 28232776]
- 9.

Maciejewska B, Olszak T, Drulis-Kawa Z. Применение бактериофагов по сравнению с фаговыми ферментами для борьбы и лечения бактериальных инфекций: амбициозный и реалистичный применение? Приложение Microbiol Biotechnol. 2018 март; 102(6):2563-2581. [Бесплатная статья PMC: PMC5847195] [PubMed: 29442169]
- 10.
Pham TD, Nguyen TH, Iwashita H, Takemura T, Morita K, Yamashiro T. Сравнительный анализ области профага CTX штаммов Vibrio cholerae седьмой пандемической волны 1, выделенных в Азии . Микробиол Иммунол. 2018 Октябрь; 62 (10): 635-650. [Бесплатная статья PMC: PMC6220881] [PubMed: 30211956]
- 11.
Холмс РК. Биология и молекулярная эпидемиология дифтерийного токсина и гена tox. J заразить Dis. 2000 г., февраль; 181 Приложение 1: S156-67. [В паблике: 10657208]
- 12.
Fortier LC. Вклад бактериофагов в биологию и вирулентность патогенных клостридий. Adv Appl Microbiol. 2017;101:169-200. [PubMed: 29050666]
- 13.



 2 Кератоконъюнктивит
2 Кератоконъюнктивит 0 Острый ларингит
0 Острый ларингит 8.0* Дисбактериоз
8.0* Дисбактериоз 1 Конъюнктивит и дакриоцистит у новорожденного
1 Конъюнктивит и дакриоцистит у новорожденного Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]
Карр Биол. 20 июня 2006 г .; 16 (12): R459-62. [PubMed: 16782001]