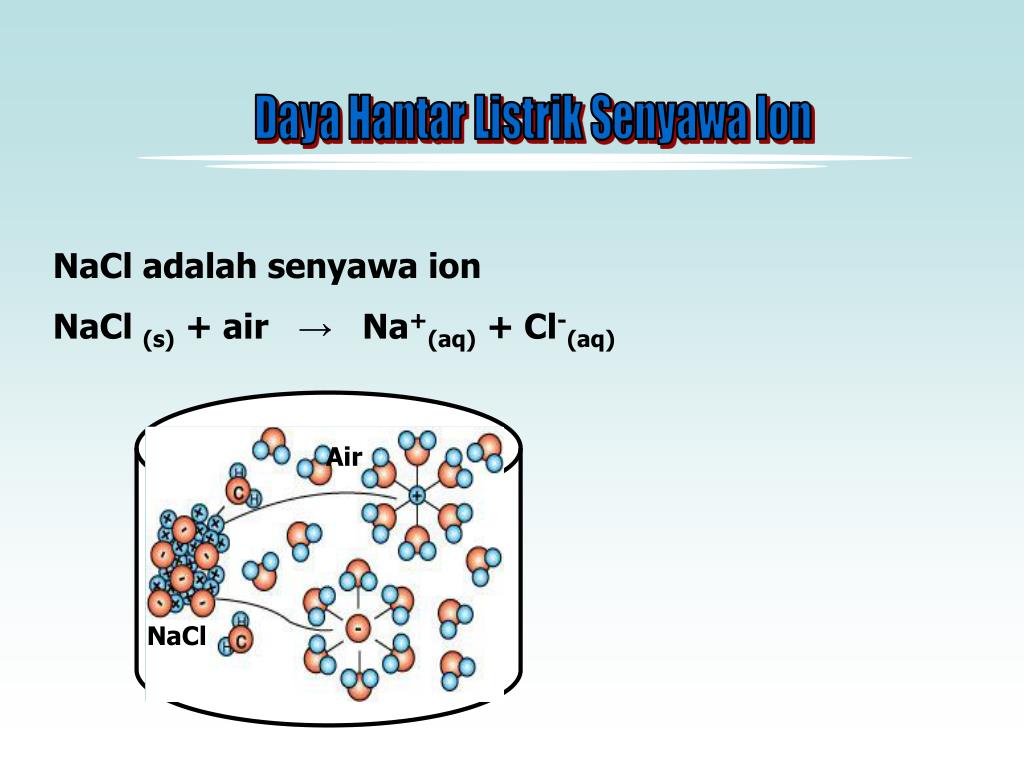
Натрий хлорид хч: описание и применение хлорида натрия
Натрий хлористый хч (NaCl) – это соль натрия и соляной (хлороводородной) кислоты. При комнатной температуре и давлении вещество существует в виде относительно крупных кубических кристаллов. Они обладают характерным соленым вкусом, но не имеют ни цвета, ни запаха.
Способы получения
В природе имеются огромные запасы этого вещества: оно встречается как в растворенном виде (в воде морей, озер, подземных источников), так и в виде твердого минерала — галита. Последний состоит из NaCl более чем на 90%.
В промышленных масштабах натрий хлористый хч производится путем выпаривания различных растворов – либо морской воды, либо рассола, полученного из соляных источников и озер. После выпаривания вещество очищают до «химически чистого» (с минимумом примесей) состояния.
Оптимальные условия для добычи NaCl из морской воды:
• жаркий сухой климат;
• большая площадь низменностей, затопляемых во время прилива, либо просто лежащих ниже уровня моря, но не орошаемых речной водой;
• плотная спрессованная почва, не впитывающая воду;
• отсутствие дождей;
• хорошая транспортная доступность этих территорий.
Учитывая широкую распространенность этого вещества в природе, нет необходимости дополнительно получать его какими-либо лабораторными или промышленными методами. Но оно является основным или побочным продуктом многих реакций. Например, между:
• металлическим натрием и газообразным хлором или разбавленной соляной кислотой;
• разбавленной соляной кислотой и гидроксидом или пероксидом Na;
• концентрированным гидроксидом натрия и концентрированным раствором хлорида аммония при повышенной температуре;
• растворами сульфата натрия и хлорида бария.
Свойства
Натрий хлорид хч растворяется в воде, а также во многих органических растворителях. Реактив не гигроскопичен, однако, если соль загрязнена примесями щелочноземельных металлов, то она склонна к отсыреванию при длительном хранении. Чем выше концентрация этой соли в водном растворе, тем ниже температура его замерзания.
Где применяется NaCl
В сотнях отраслей. Приведем некоторые:
1. В пищевой промышленности
В пищевой промышленности
Наличие NaCl в рационе человека и животных необходимо для их жизнедеятельности. Эта соль обеспечивает полноту усвоения полезных веществ из пищи и участвует во многих метаболических процессах. В качестве пищевой добавки, приправы и консерванта выпускается под названием «поваренная соль».
2. В водоподготовке
NaCl широко применяется для регенерации ионообменников в составе промышленных фильтров.
3. В медицине
Соляной, еще его называют физиологическим, раствор является основой для многих лекарственных средств. Также он применяется как базовый заместитель объема крови при сильных кровотечениях, как средство экстренной гидратации и восстановления баланса жидкости и солей.
4. В химической промышленности
NaCl является важнейшим сырьем для производства многих химических реагентов, таких как газообразный хлор, металлический натрий, хлороводородная кислота, сульфат и хлорат натрия.
Правила использования
Работать с твердой солью и ее растворами следует аккуратно, избегая попадания в глаза и на незащищенную кожу.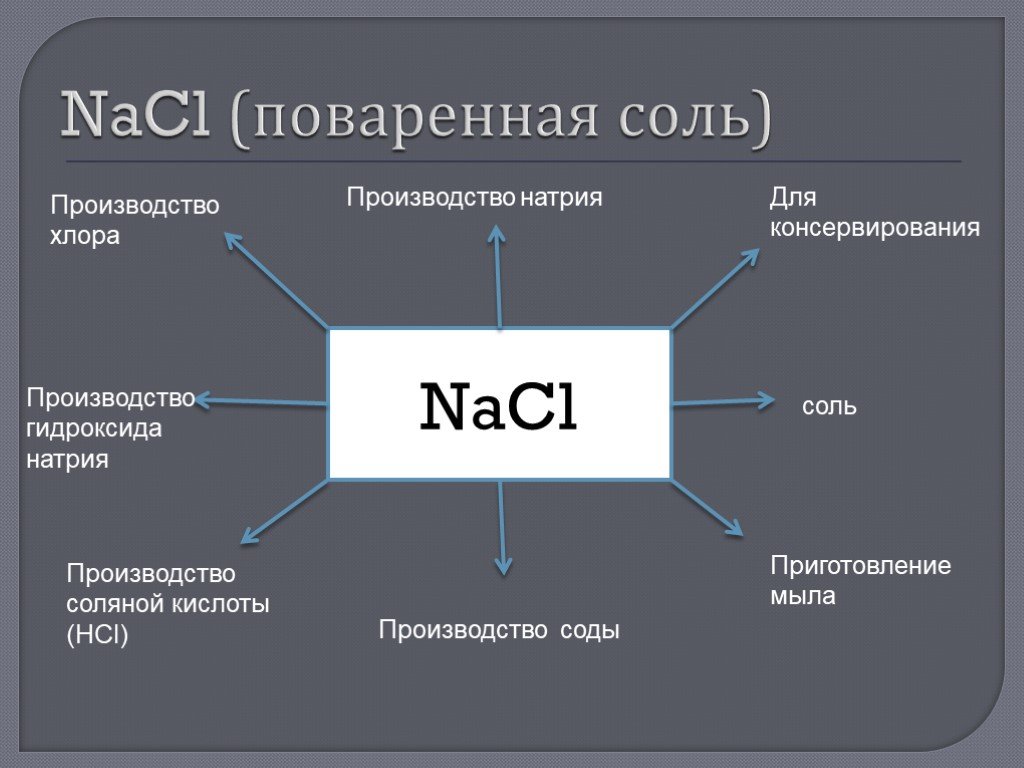
Натрий хлорид хч не токсичен, однако его передозировка может вызвать солевое отравление, опасное для здоровья и даже жизни. Кроме того, попадание раствора на поврежденные кожные покровы ухудшает заживление ран и сопровождается болью и дискомфортом. Попадание соли в глаза также вызывает раздражение и боль.
Хранят реактив на сухих складах или в плотно закрытой таре, в непромокаемых мешках на открытых площадках – бетонированных или асфальтированных.
Ph.Eur. Европейская Фармакопея Входит в состав препаратов: список Фармакологическое действиеИоны натрия и хлора являются важнейшими неорганическими компонентами внеклеточной жидкости, поддерживающими соответствующее осмотическое давление плазмы крови и внеклеточной жидкости. ФармакокинетикаИоны натрия проникают через плацентарный барьер и в грудное молоко. Выводится почками (ионы калия — в дистальных канальцах в обмен на ионы натрия или водорода), небольшое количество выводится с потом. Показания активного вещества НАТРИЯ ХЛОРИДИзотонический раствор: дегидратация различного генеза. Для поддержания объема плазмы крови во время и после операций. В качестве растворителя для различных препаратов. Гипертонический раствор: нарушения водно-электролитного обмена — дефицит ионов натрия и хлора; гипоосмолярная дегидратация различного генеза (вследствие длительной рвоты, диареи, ожогов; при желудочной фистуле, легочном кровотечении, кишечном кровотечении). Открыть список кодов МКБ-10
Режим дозированияИндивидуальный, в зависимости от показаний, клинической ситуации, схемы терапии и применяемой лекарственной формы. Изотонический раствор натрия хлорида вводят в/в, п/к и в клизмах, а также используют для промывания ран, глаз, слизистой носовой полости. В зависимости от клинической ситуации в/в вводят до 3 л/сут. Гипертонический раствор натрия хлорида вводят в/в. Разовая доза для в/в струйного введения может составлять 10-30 мл. При состояниях, требующих немедленного восполнения ионов натрия и хлора, вводят в/в капельно в дозе 100 мл. Побочное действиеВозможно: тошнота, рвота, диарея, спазмы желудка, жажда, слезотечение, потливость, лихорадка, тахикардия, артериальная гипертензия, нарушение функции почек, отеки, одышка, головная боль, головокружение, беспокойство, слабость, подергивание и гипертонус мышц. При наружном и местном применении побочные реакции к настоящему времени не установлены. Противопоказания к применениюПовышенная чувствительность к натрия хлориду; гипернатриемия, состояния гипергидратации, угроза отека легких, мозга. Применение при беременности и кормлении грудьюПри беременности и в период грудного вскармливания возможно применение по показаниям в тех случаях, когда предполагаемая польза для матери превышает потенциальный риск для плода или младенца. Применение при нарушениях функции почекС осторожностью применяют большие объемы натрия хлорида у пациентов с нарушением выделительной функции почек. Применение у детейВозможно применение у детей по показаниям в рекомендуемых соответственно возрасту дозах и лекарственных формах. Особые указанияС осторожностью применяют большие объемы натрия хлорида у пациентов с нарушением выделительной функции почек, при гипокалиемии. Введение больших количеств раствора может привести к хлоридному ацидозу, гипергидратации, увеличению выведения калия из организма. Гипертонический раствор не применяют п/к и в/м. При длительном применении необходим контроль концентрации электролитов в плазме и суточного диуреза. Температура инфузионного раствора должна составлять 38°С. Лекарственное взаимодействиеНПВС, андрогены, эстрогены, анаболические гормоны, кортикотропин, минералокортикоиды, вазодилататоры, ганглиоблокаторы приводят к усилению задержки Na+. |
Хлорид натрия — свойства, использование, происхождение и получение
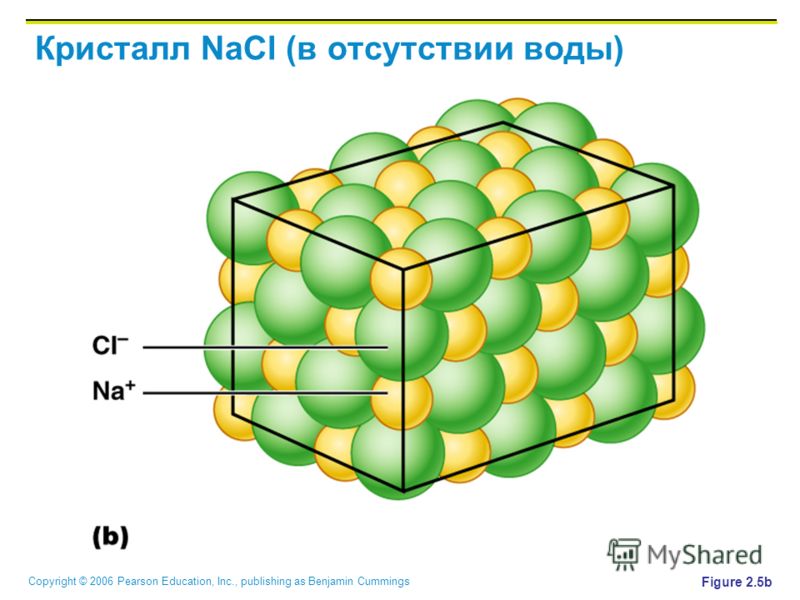
Хлорид натрия широко известен как соль, которая представляет собой ионное соединение, имеющее химическую формулу (NaCl), представляющую собой соотношение ионов хлорида и натрия 1:1. Хлорид натрия — это соль, которая в наибольшей степени отвечает за соленость морской воды и внеклеточной жидкости различных многоклеточных организмов. Он обычно используется в качестве приправы и пищевого консерванта в пищевой форме поваренной соли.
Определенные огромные количества NaCl используются во многих промышленных процессах и являются основным источником соединений натрия и хлора, которые используются в качестве сырья для дальнейших химических синтезов. Вторым основным применением хлорида натрия является борьба с обледенением дорог в минусовую погоду.
Около 1-5% морской воды состоит из хлорида натрия.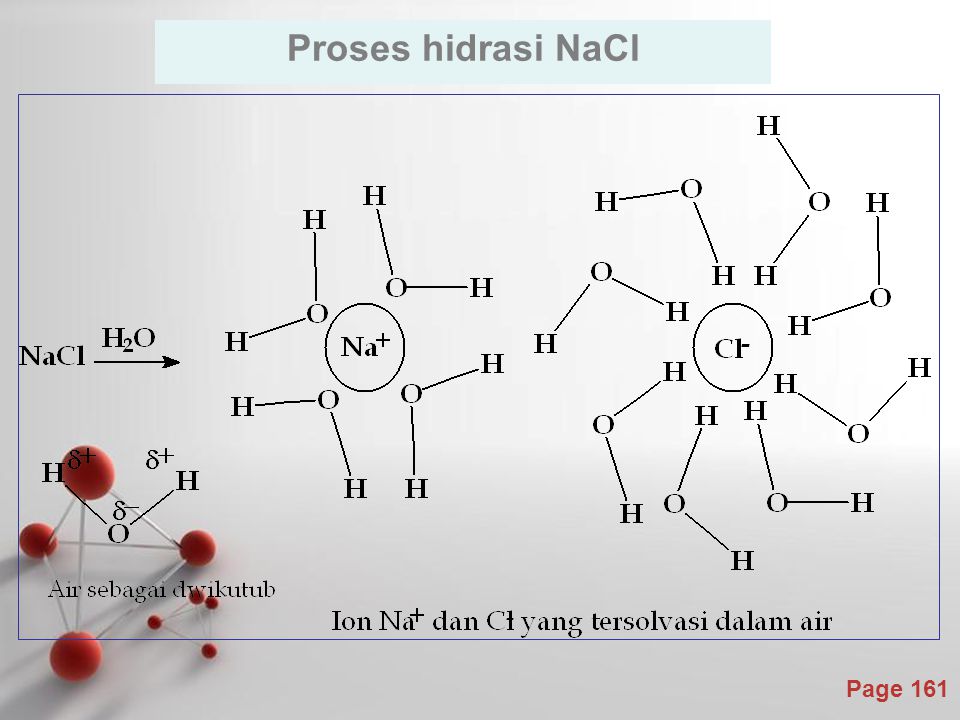 Это твердое кристаллическое вещество белого цвета. Его называют солевым раствором в водной форме.
Это твердое кристаллическое вещество белого цвета. Его называют солевым раствором в водной форме.
Молекулярная масса NaCl составляет 58,44 г/моль.
Это водорастворимое соединение с катионом натрия и анионом хлорида. Она широко известна как поваренная соль и используется в основном в пищевой промышленности для консервации и ароматизации. Значение pH NaCl равно 7.
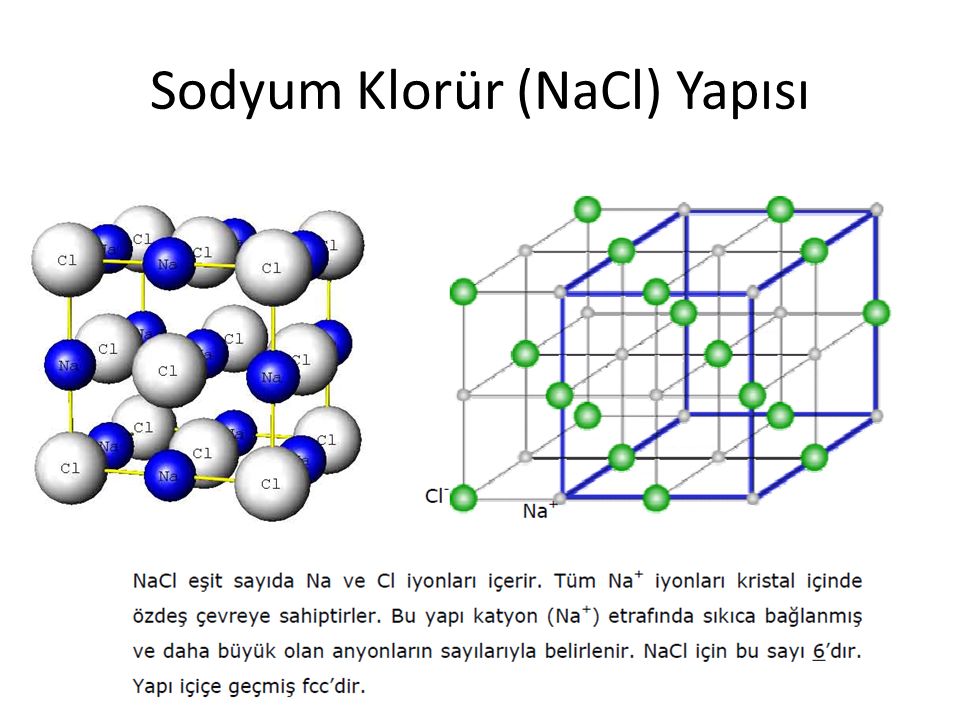
Структура NaCl
Структура NaCl может быть представлена следующим образом:
(Изображение будет загружено в ближайшее время)
Свойства хлорида натрия
Физические свойства хлорида натрия
Хлорид натрия, белое кристаллическое твердое вещество, имеет плотность 2,165 г/мл, температура плавления 801 ° C, а температура кипения составляет около 1413 ° C. Он также доступен в виде водных растворов с различной концентрацией, известных как солевые растворы.
Химические свойства NaCl
Хлорид натрия является легко растворимым соединением в воде и других полярных растворителях и представляет собой стабильное твердое вещество.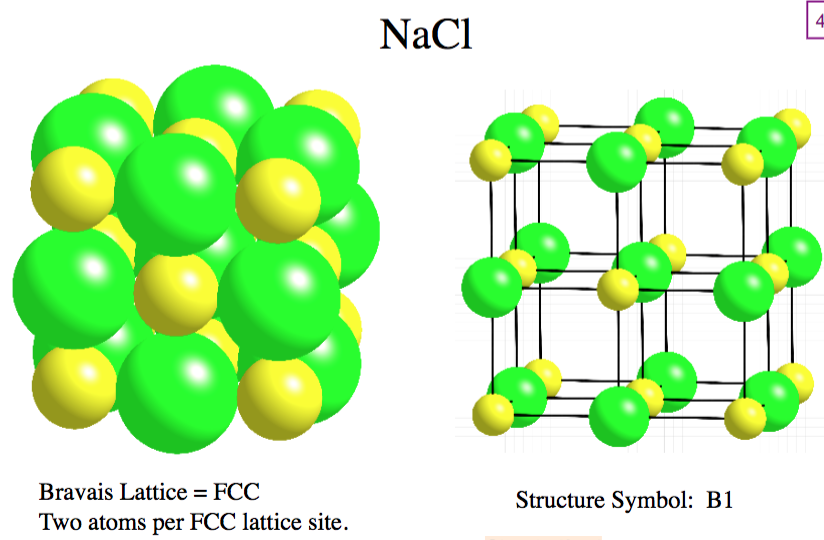 Он разлагается только при высоких температурах с образованием токсичных паров двуокиси натрия (Na2O) и соляной кислоты (HCl).
Он разлагается только при высоких температурах с образованием токсичных паров двуокиси натрия (Na2O) и соляной кислоты (HCl).
Использование хлорида натрия
Из множества применений NaCl некоторые из них перечислены ниже.
Хлорид натрия хорошо известен как поваренная соль и широко используется в пищевой промышленности для ароматизации и консервации.
Кроме того, он используется для производства различных основных химических веществ, включая гидроксид натрия, пищевую соду, карбонат натрия, соляную кислоту и многое другое.
Он также применяется в текстильной, нефтеперерабатывающей, целлюлозно-бумажной промышленности, производстве антипиренов, дорожном строительстве и резиновой промышленности.
В производстве кальцинированной соды используется для производства карбоната натрия с помощью процесса Solvay.

Другим важным применением хлорида натрия является удаление льда с дорог и тротуаров в снежных и холодных регионах. Эти солевые растворы также используются в различных медицинских целях.
Соединение также используется в чистящих средствах, таких как шампунь, зубная паста и даже в средствах для смягчения воды.
Транспорт и абсорбция питательных веществ
И натрий, и хлорид играют важную роль в нашем тонком кишечнике. Натрий помогает вашему организму усваивать сахар, воду, хлорид и аминокислоты (которые являются строительными блоками белка).
Когда хлорид находится в форме соляной кислоты (водород и хлорид), он действует как компонент желудочного сока. Он помогает нашему организму переваривать и усваивать питательные вещества.
Поддержание энергии покоя
Натрий и калий — это электролиты в жидкости внутри и снаружи клеток нашего тела.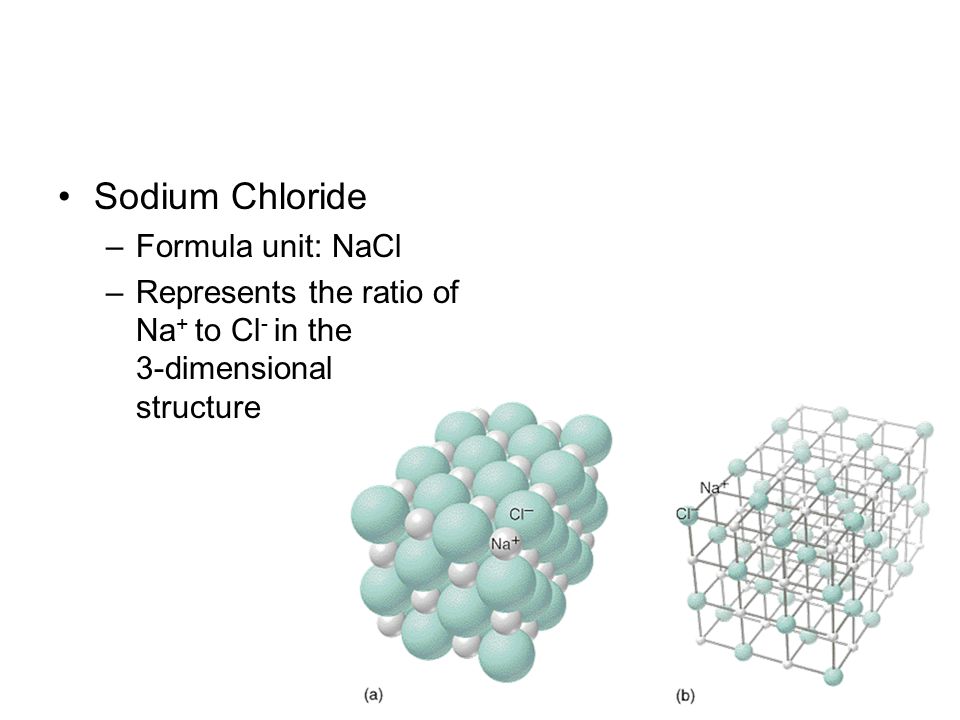 Баланс между этими двумя частицами влияет на то, как клетки поддерживают энергию тела.
Баланс между этими двумя частицами влияет на то, как клетки поддерживают энергию тела.
Кроме того, это то, как нервы посылают сигналы в мозг, как сокращаются мышцы и как работает сердце.
Поддержание водного баланса и артериального давления
Мозг, почки и надпочечники совместно регулируют количество натрия в организме человека. Химические сигналы стимулируют почки удерживать воду, чтобы она могла избавиться от лишней воды с мочой или повторно всосаться в кровоток.
Когда в нашем кровотоке слишком много натрия, мозг дает сигнал почкам выпустить больше воды в кровоток. Это приводит к увеличению объема крови и артериального давления. Уменьшение потребления натрия может привести к тому, что меньше воды будет всасываться в кровоток. В результате снижается артериальное давление.
Наличие хлорида натрия
Обычно большинство химических соединений, состоящих из хлора или натрия, получают из солей. Широко распространен в природе. Соль является важным компонентом растворенных в морской воде веществ.
Широко распространен в природе. Соль является важным компонентом растворенных в морской воде веществ.
Чистая соль может быть получена из минералов галита. Хлорид натрия образуется при разработке месторождений, а соляной раствор собирается путем перекачки воды в месторождения. Поэтому соли растворяются, а раствор откачивается.
Выпаривание морской воды является одним из основных методов извлечения соли и чаще всего применяется в таких странах, как Индия. Обычно полученные кристаллы состоят из примесей типа сульфата натрия, сульфата кальция и так далее. Чистые кристаллы получают путем растворения солей в небольшом количестве воды и фильтрации раствора.
Получение хлорида натрия
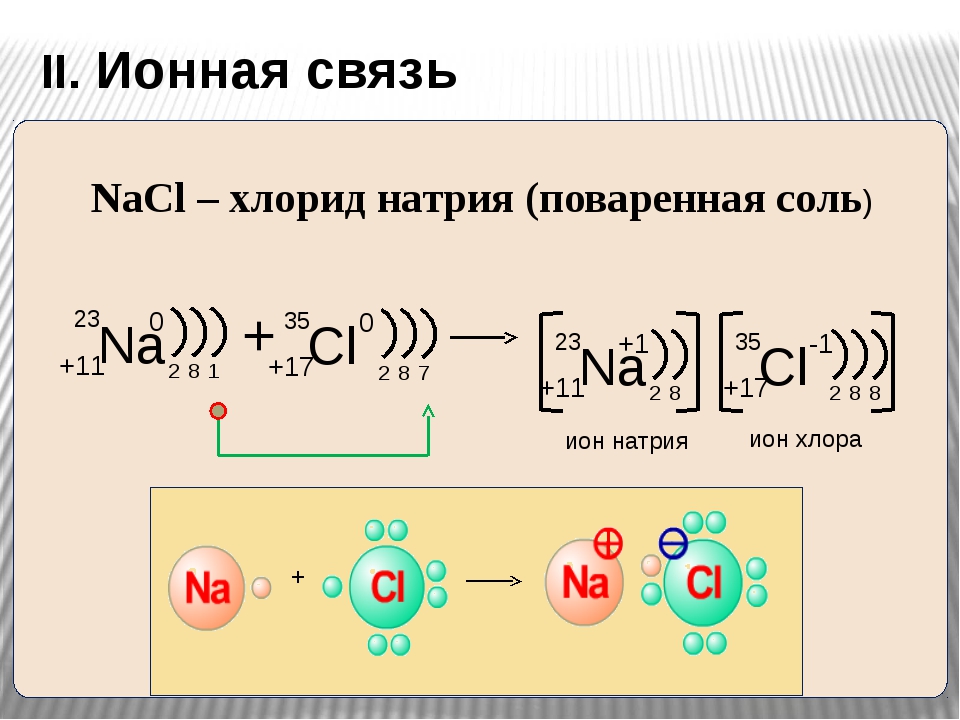
Однако натрий и хлор реагируют вместе, образуя вещество, знакомое почти всем по всему миру: хлорид натрия, поваренную соль или поваренную соль.
2Na(т) + Cl2(г) → 2NaCl(т)
5.1: Сахар и соль — Химия LibreTexts
- Сохранить как PDF
- Идентификатор страницы
- 47472
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \(\ce{NaCl}\), представляющее соотношение ионов натрия и хлорида 1:1.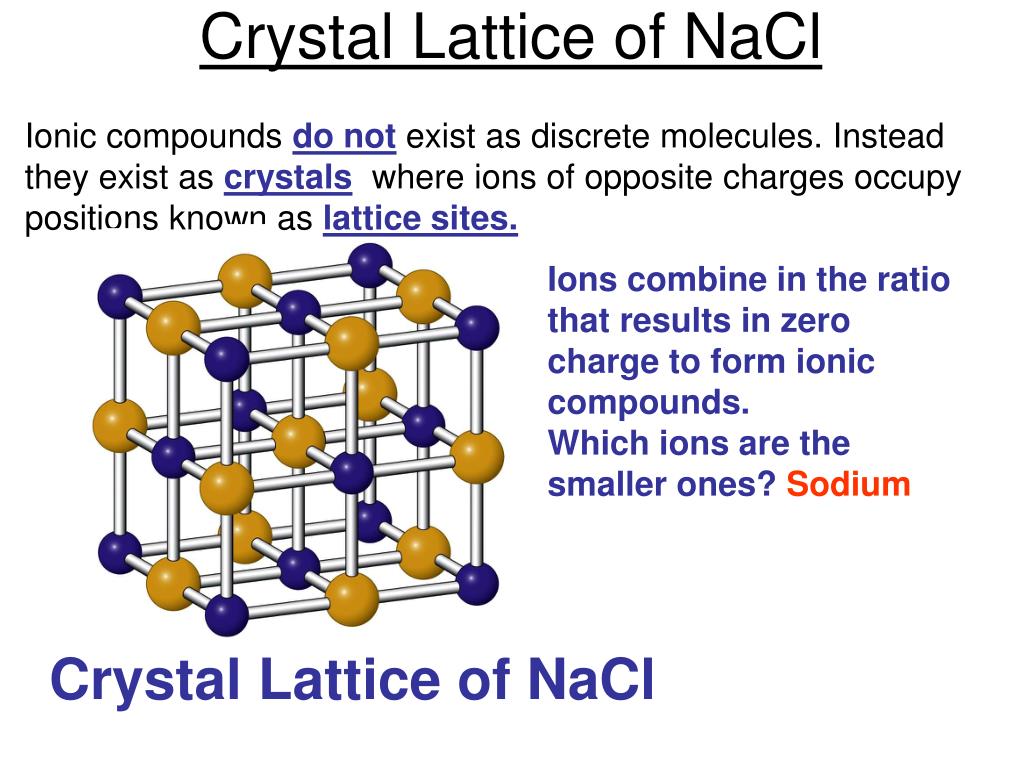 Он широко используется в качестве приправы и консерванта пищевых продуктов. Соль можно получить, соединив вместе два очень реакционноспособных элемента: металлический натрий (\(\ce{Na (s)}\) и газообразный хлор (\(\ce{Cl2 (g)}\).0003
Он широко используется в качестве приправы и консерванта пищевых продуктов. Соль можно получить, соединив вместе два очень реакционноспособных элемента: металлический натрий (\(\ce{Na (s)}\) и газообразный хлор (\(\ce{Cl2 (g)}\).0003
Элемент натрия (рис. \(\PageIndex{1a}\)) является очень активным металлом; при возможности он будет реагировать с потом на ваших руках и образовывать гидроксид натрия, который является очень едким веществом. Элемент хлор (рис. \(\PageIndex{1b}\)) представляет собой бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитой природы. Однако соедините эти два опасных вещества, и они вступят в реакцию, образуя ионное соединение хлорида натрия (рис. \(\PageIndex{1c}\)), известное просто как соль. 9{−}}\) ионы необходимы для правильного функционирования нервов и дыхания. Оба этих иона поставляются солью. Вкус соли — один из основных вкусов; соль, вероятно, самый древний известный ароматизатор и один из немногих камней, которые мы едим.
Видео \(\PageIndex{1}\):
Другим соединением является сахар, который является общим названием сладких растворимых углеводов, многие из которых используются в пищевых продуктах. Сахар имеет химическую формулу \(\ce{C12h32O11}\) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют различные виды сахара, полученные из разных источников.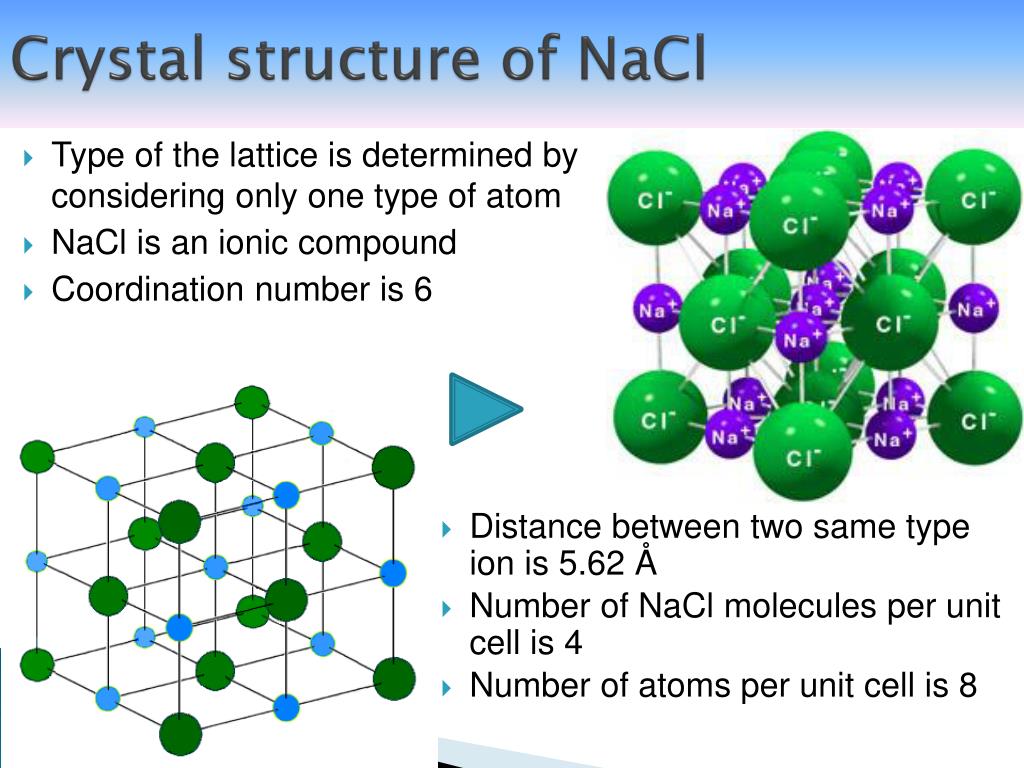 Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ref{eq1}). Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ref{eq2} и продемонстрировано в видео \(\PageIndex{2}\).
Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ref{eq1}). Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ref{eq2} и продемонстрировано в видео \(\PageIndex{2}\).
\[\ce{C12h32O11 (т) + теплота → 12C (т) + 11h3O (г)} \label{eq2} \]
Видео \(\PageIndex{2}\): Научный эксперимент на кухне показывает, что происходит с молекулами сахара при нагревании. Эксперимент не подвел!
Как и соль, сахар имеет совершенно иные свойства (как физические, так и химические), чем составляющие его элементы. Это различие в свойствах составляющих элементов и соединений является центральной чертой химических реакций.
- Википедия
5. 1: Sugar and Salt распространяется по лицензии CK-12, автором, ремиксом и/или куратором выступили Мариса Альвиар-Агнью и Генри Агнью.
1: Sugar and Salt распространяется по лицензии CK-12, автором, ремиксом и/или куратором выступили Мариса Альвиар-Агнью и Генри Агнью.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- нет на странице
- Теги
- автор @ Генри Агнью
- автор@Мариса Альвиар-Агнью
- источник@https://www.


 Изотонический раствор восполняет дефицит жидкости в организме при дегидратации. Гипертонический раствор натрия хлорида при в/в введении обеспечивает коррекцию осмотического давления внеклеточной жидкости и плазмы крови. При местном применении в офтальмологии натрия хлорид оказывает противоотечное действие.
Изотонический раствор восполняет дефицит жидкости в организме при дегидратации. Гипертонический раствор натрия хлорида при в/в введении обеспечивает коррекцию осмотического давления внеклеточной жидкости и плазмы крови. При местном применении в офтальмологии натрия хлорид оказывает противоотечное действие.