Криопротокол ЭКО — цена, схема, подробно по дням
Главная
/ ЭКО в центре репродукции «Линия жизни»
/ ЭКО без стимуляции
/ Криопротокол ЭКО
Криопротокол — перенос размороженных эмбрионов, которые получены в результате ЭКО и заморожены для использования в одном из следующих циклов. Использование размороженных эмбрионов не снижает вероятности беременности – наоборот, повышает шансы на имплантацию при наличии показаний. Есть плюсы для протекания беременности
все услуги
Стоимость
Первичная видеоконсультация врача-репродуктолога
4 000 ₽
Услуги по программе криопротокол ЭКО
Криопротокол (перенос размороженного эмбриона)
Разморозка криоконсервированных эмбрионов
Перенос лучшего эмбриона в полость матки
Пребывание в дневном стационаре
Цена:
62 000 ₽
Стоимость
Первичная видеоконсультация врача-репродуктолога
4 000 ₽
Что такое «криопротокол»?
Криопротокол – отсроченный перенос эмбрионов, которые получены в результате ЭКО и заморожены для использования в одном из следующих циклов. Термины «криоперенос» и «криоцикл» из этой же области. Первоначально сфера применения таких протоколов ограничивалась случаями, когда пациенты замораживали свои эмбрионы в ходе ЭКО для наступления беременности в отдаленном будущем. Сейчас криопереносы часто проводят по медицинским показаниям.
Термины «криоперенос» и «криоцикл» из этой же области. Первоначально сфера применения таких протоколов ограничивалась случаями, когда пациенты замораживали свои эмбрионы в ходе ЭКО для наступления беременности в отдаленном будущем. Сейчас криопереносы часто проводят по медицинским показаниям.
Рекомендации перед криптопротоколом
Этот вид протокола возможен только после обычного ЭКО (за исключением переноса донорских эмбрионов). Если криопротокол назначается по медицинским показаниям, то предваряющая его программа завершается на этапе получения эмбрионов. Эмбрионы замораживаются методом витрификацииМетод сверхбыстрого замораживая биоматериала. – только он может обеспечить бережную заморозку и размораживание.
Подробнее про витрификацию читайте в разделе про наш криобанкСпециальное помещение и оборудование, где хранятся половые клетки и эмбрионы..
Когда начинается криопротокол, эмбрионы размораживаются и переносятся будущей маме. Нужна ли какая-то подготовка к криопереносу? Обследование – такое же, как перед свежим циклом ЭКО. Если эмбрионы получены недавно, то большинство анализов обычно еще действительны, надо пересдать только просроченные. Кроме того, лечащий врач-репродуктолог может сделать индивидуальные назначения.
Если эмбрионы получены недавно, то большинство анализов обычно еще действительны, надо пересдать только просроченные. Кроме того, лечащий врач-репродуктолог может сделать индивидуальные назначения.
Подготовка к переносу эмбрионов
Что перед протоколом может сделать сама пациентка для увеличения шансов на успех? По-особенному готовится к процедуре криопереноса не нужно. Достаточно выполнить несколько простых правил:
- строго следовать предписаниям своего доктора;
- избегать больших нагрузок, но не отказываться от физической активности;
- остерегаться респираторных инфекций, переохлаждений, других неблагоприятных внешних факторов;
- за несколько дней до процедуры отказаться от половой жизни.
Как проходит криопротокол
Через какое время после свежего цикла, в котором эмбрионы получены и заморожены, проводится криоперенос? Решение принимается врачом в зависимости от состояния репродуктивной системы пациентки и ее общего здоровья.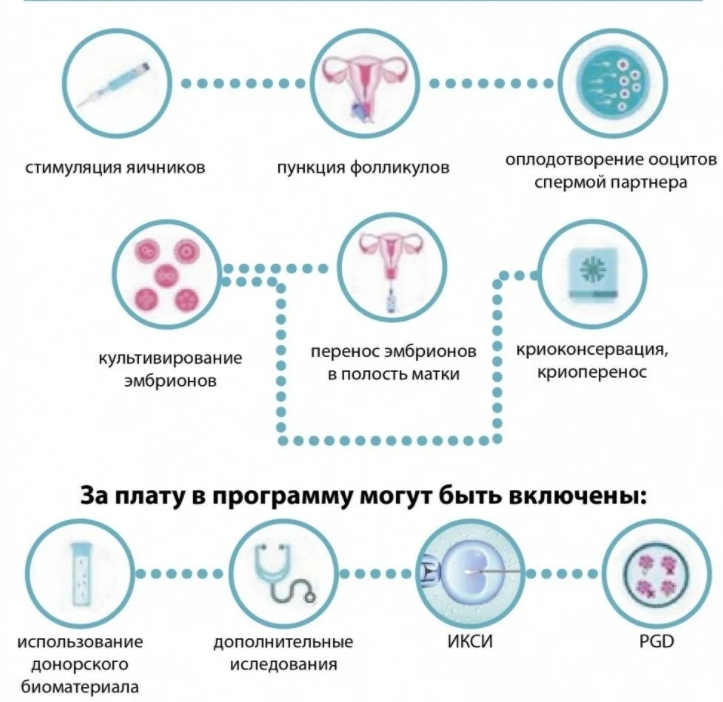 В среднем перерыв составляет два цикла.
В среднем перерыв составляет два цикла.
Если речь идет об эмбрионах, когда-то витрифицированных на будущее, то длительность перерыва зависит только от супругов. Когда они решают, что пришло время для беременности, тогда и возвращаются в нашу клинику.
Есть два основных варианта проведения криопротокола: перенос может быть осуществлен в естественном цикле (ЕЦ) или на заместительной гормональной терапии (ЗГТ). Оптимальный вариант подбирает лечащий врач-репродуктолог.
Естественный криоцикл
Криоперенос в ЕЦ проводится в условиях, близких к физиологическим. Гормоны назначаются по минимуму – только чтобы поддержать лютеиновую фазу и тем самым повысить шансы на беременность. С этой целью до переноса витрифицированных эмбрионов и после него будущая мама принимает препараты прогестерона. Гормональные препараты, готовят организм женщины к беременности..
С самого начала цикла врач по УЗИ следит, как созревает яйцеклетка и растет эндометрий. Когда овуляция подтверждается, специалист назначает перенос витрифицированных эмбрионов.
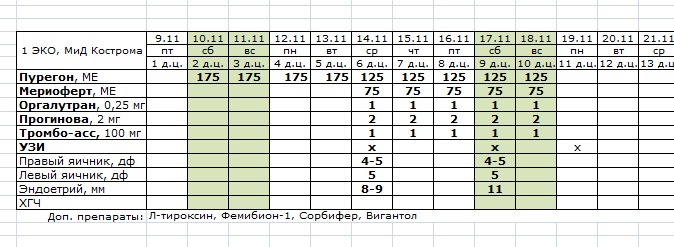
Для выбора криопереноса в ЕЦ есть несколько условий. Это возраст младше 35 лет, регулярность менструального цикла и отсутствие проблем с овуляцией. Вот схема протокола ЭКО в естественном цикле
Криоперенос за ЗГТ
Предполагает управление менструальным циклом будущей мамы, для этого используются гормональные средства. Данный вид криопротокола показан женщинам позднего репродуктивного возраста, пациенткам с нерегулярным циклом, сниженным фолликулярным резервомУменьшение количества яйцеклеток в яичниках, вместе с этим снижается и их качество, отсутствием овуляции.
Схема криопротокола на ЗГТ
С начала цикла используются эстрогенные препараты. Они вызывают рост эндометрия, который контролируется по УЗИ. Когда слизистая оболочка матки достигает нужных параметров, эстрогены заменяются на препараты прогестерона (чтобы поддержать лютеиновую фазу), и назначается процедура переноса.
Иногда врачам не удается добиться нормального роста эндометрия в ЕЦ или на ЗГТ. Тогда в протокол включаются небольшие дозы медикаментов для стимуляции яичников.
Тогда в протокол включаются небольшие дозы медикаментов для стимуляции яичников.
Сама процедура переноса, независимо от схемы криопротокола, проходит так же, как в классической программе ЭКО
Как проходит перенос размороженных эмбрионов?
Если вы решаете воспользоваться хранящимися в криобанке эмбрионами, то первым шагом должна стать запись на консультацию репродуктолога. Врач проводит осмотр пациентки, анализирует информацию о предыдущих программах ВРТ, назначает обследование в необходимом объеме, выбирает оптимальную схему криопереноса. Как правило, процедура назначается на очередной менструальный цикл.
Схема криопереноса
Существует два варианта программы. Первый – криоперенос в естественном цикле (ЕЦ) – проводится по приведенной ниже схеме.
- С помощью УЗ-мониторингаНаблюдение с помощью трансвагинальногоУЗИ. репродуктолог устанавливает факт овуляции, на основе этой информации назначает дату процедуры и необходимую медикаментозную поддержку второй фазы цикла.

- Перед переносом эмбриолог размораживает и культивирует эмбрионы, оценивает их качество, проводит вспомогательный хетчинг, если он показан.
- Репродуктолог помещает один, максимум два эмбриона в полость матки пациентки. Эмбриоперенос – безболезненная процедура, которая проводится без наркоза и занимает около 5 минут. Помещенный в специальный тонкий катетер эмбрион переносят в полость матки под контролем УЗ.
- Через 14 дней пациентка приходит в клинику для проведения теста ХГЧ.
Реже назначается криоперенос на фоне заместительной гормональной терапии (ЗГТ). Он предусматривает применение гормональных препаратов с целью подготовки эндометрия. На фоне применения препаратов репродуктолог отслеживает с помощью УЗИ толщину эндометрия. Когда она достигает нужных показателей, назначается дата криопереноса и медикаментозная поддержка второй фазы цикла. Дальше программа идет так же, как перенос в ЕЦ.
Результативность криопротоколов
Часто пациентки беспокоятся, что шансы на беременность с витрифицированными эмбрионами ниже, чем в свежем цикле. Оснований для тревоги нет. Целый ряд исследований, проведенных в последнее десятилетие, показал: результативность переносов в криоциклах не ниже, а почти в два раза выше, чем в свежих.
Оснований для тревоги нет. Целый ряд исследований, проведенных в последнее десятилетие, показал: результативность переносов в криоциклах не ниже, а почти в два раза выше, чем в свежих.
Дополнительные преимущества:
- меньшая нагрузка на организм будущей мамы,
- меньшая стоимость ЭКО криопротоколов.
Беременность, наступившая в результате криопереноса, связана с меньшим риском преждевременных родов и кровотечений. Детки, появившиеся на свет после криопротоколов, ничем не отличаются от других малышей.
Почему при всех этих преимуществах криопротоколов они назначаются не всем пациенткам? Если удается получить нормальное количество клеток, эндометрийВнутренняя слизистая оболочка матки хорошо подготовлен, у будущей мамы нет отягощенного анамнеза, то прогноз хороший и без криопротокола. К тому же, пациенты скорее встретятся со своим малышом.
Но при наличии показаний криопротокол – оптимальный способ обойти имеющиеся препятствия и повысить шансы на имплантацию, благополучную беременность и рождение ребенка. Репродуктологи центра «Линии жизни» знают, когда необходим перенос в криоцикле и имеют огромный опыт его проведения.
Репродуктологи центра «Линии жизни» знают, когда необходим перенос в криоцикле и имеют огромный опыт его проведения.
Факторы успеха криопереносов в Центре репродукции «Линия жизни»
- У специалистов «Линии жизни» большой практический опыт проведения криопротоколов. Они регулярно совершенствуют навыки на международных профильных конференциях и семинарах, обмениваются наработками с зарубежными коллегами.
- Заморозка и размораживание хрупких репродуктивных клеток – рутинная практика для наших эмбриологов. Центр располагает собственным современным криохранилищем.
- Диагностическая база «Линии жизни» находится на уровне лучших европейских репродуктивных клиник. Наши репродуктологи не пропускают ситуаций, в которых криопротокол обеспечит большую вероятность наступления беременности и рождения малыша.

Записывайтесь на прием к нашим докторам по телефону, отправляйте заявку через специальную форму на этой странице или пишите в онлайн-чат.
Также Вам может подойти процедура
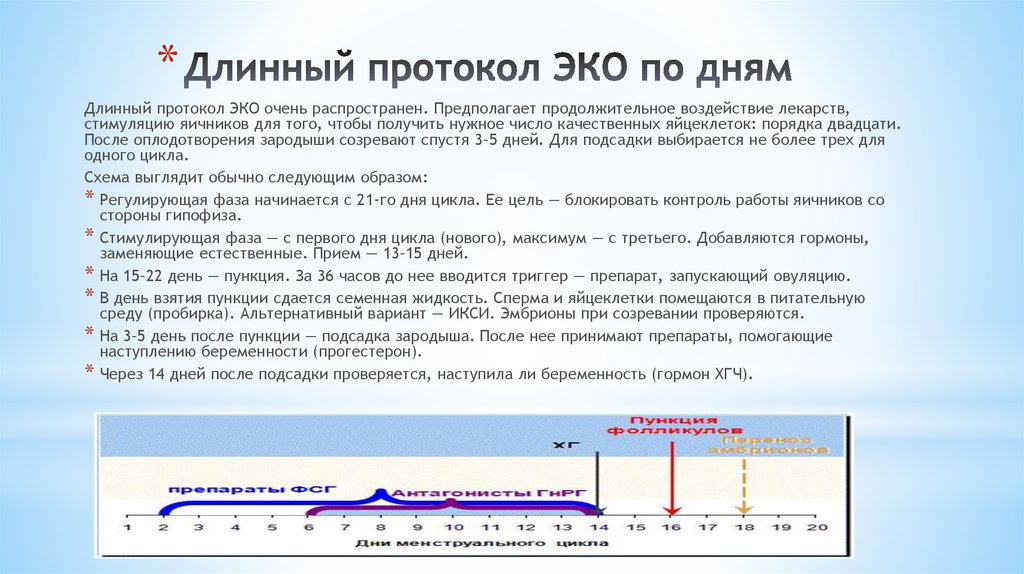
Длинный протокол ЭКО
Эта схема стимуляции длится дольше короткой и предполагает более мощную гормональную нагрузку. Начинается с блокирования производства собственных гормонов, чтобы полностью контролировать рост фолликулов. Назначается, когда короткий протокол заведомо не поможет достичь беременности
Короткий протокол ЭКО
Предполагает применение гормональных препаратов в течение 12-14 дней, чтобы получить достаточно зрелых яйцеклеток для оплодотворения и культивирования эмбрионов. Плюсы – щадящая гормональная нагрузка, малая длительность курса, низкая по сравнению с длинным протоколом стоимость
Программа показана, когда в стандартном протоколе ЭКО невозможно получить достаточное количество ооцитов. Включает 2 короткие стимуляции и 2 пункции подряд в одном цикле. Позволяет развить фолликулы, которые не достигли нужных размеров при первой стимуляции, и получить дополнительные качественные яйцеклетки
Включает 2 короткие стимуляции и 2 пункции подряд в одном цикле. Позволяет развить фолликулы, которые не достигли нужных размеров при первой стимуляции, и получить дополнительные качественные яйцеклетки
все сотрудники
Помогут стать мамой и папой
Ильина Анна Александровна
медицинский директор, врач-репродуктолог, врач-акушер-гинеколог
Колода Юлия Алексеевна
кандидат медицинских наук
врач-репродуктолог, врач-акушер-гинеколог
Мокрова Анастасия Сергеевна
Потапов Михаил Евгеньевич
кандидат медицинских наук
врач-репродуктолог, врач-акушер-гинеколог
Сингх Лариса Николаевна
врач-репродуктолог, врач-акушер-гинеколог
Шахова Марина Александровна
все сотрудники
Хотим выразить огромную благодарность замечательному доктору-Ильиной Анне Александровне!!! Ее золотые руки и проделанная работа со мной, стали результатом благодаря которому 21. 11.2022 года на свет появился наш сыночек-богатырь весом 4310грамм. Анна Александровна, спасибо за Ваш труд, за Ваш профессионализм, за Вашу самоотверженность! Здоровья Вам и Вашей семье!
11.2022 года на свет появился наш сыночек-богатырь весом 4310грамм. Анна Александровна, спасибо за Ваш труд, за Ваш профессионализм, за Вашу самоотверженность! Здоровья Вам и Вашей семье!
29 ноября 2022
Специалист
Ильина Анна Александровна
Хочу поблагодарить Калинину Наталью Геннадьевну за моего сына, родился 7.08.2022! Два года пробовала с помощью ЭКО забеременеть в другой клинике, не получалось. Сменила клинику, нашла врача по душе, получилось с первого раза! Наталья Геннадьевна не только профессионал в своей работе, но и очень приятная в общении, по энергетике, что тоже очень важно при планировании беременности, моральное состояние. Ещё раз большое спасибо за такое счастье!
27 ноября 2022
Специалист
Калинина Наталья Геннадьевна
Пытались, ждали и надеялись, что свершится чудо. Живём в Самаре, делали раза 4 ЭКО, 10 переносов, 2 переноса суррогатной матери в нашем городе — все безуспешно. Когда местные врачи решили, что шансов забеременеть и родить у нас нет, совершенно случайно мы узнали от друзей о Диане Малхазовне Обидняк. Первая же встреча перевернула всё в душе, сердце, голове! И мы решились попытать счастье в последн…
Первая же встреча перевернула всё в душе, сердце, голове! И мы решились попытать счастье в последн…
25 ноября 2022
25 ноября 2022
Специалист
Обидняк Диана Малхазовна
Научная деятельность
Экспертный уровень квалификации сотрудников: в штате клиники доктора и кандидаты наук с большим опытом работы, авторскими методиками и статьями в престижных медицинских изданиях, в том числе англоязычных. Наши врачи регулярно повышают квалификацию и участвуют в международных конгрессах ESHRE по репродукции человека.
все статьи
Как сдать сперму на хранение и зачем это делать?
Цель криоконсервации — чтобы в будущем у мужчины оставалась возможность стать отцом, невзирая на обстоятельства.
все статьи
все видео
Гарантии в экстракорпоральном оплодотворении: да или нет?
«Почему вы не даете гарантий успеха ЭКО?» — один из частых вопросов, которые нам задают. Отвечает один из самых опытных и именитых репродуктологов нашего центра Михаил Евгеньевич Потапов.
Отвечает один из самых опытных и именитых репродуктологов нашего центра Михаил Евгеньевич Потапов.
все видео
Записаться на прием
Имя *
Телефон *
Сообщение
Нажимая на кнопку, Вы даете согласие на обработку своих персональных данных. Данный сайт защищен reCaptcha, к которой применяются Политика конфиденциальности и Условия обслуживания Google.
Крио-консервация: криопротокол и как происходит крио ЭКО
Процедура ЭКО предполагает образование нескольких эмбрионов, из которых для переноса в матку выбирается один. Один из ответов на вопрос о том, что делать с неиспользованными эмбрионами, — криоконсервация. Это метод замораживания биологических материалов в жидком азоте при температуре -196 °С. Такая обработка холодом дает возможность сохранять их так долго, как потребуется. Сегодня известно, что речь идет минимум о десятилетиях.
Такая обработка холодом дает возможность сохранять их так долго, как потребуется. Сегодня известно, что речь идет минимум о десятилетиях.
Витрификация, от латинского vitrum — «стекло» (быстрая заморозка как превращение в «стекло»), — метод быстрой криоконсервации, позволяющий сохранить больше биологического материала. Качество эмбриона и последующий успех ЭКО с его использованием не зависит от выбора метода заморозки, в этом криоконсервация и витрификация одинаковы.
Размороженный эмбрион (сперматозоид, яйцеклетка) полностью восстанавливает свои свойства. Доказано, что использование замороженного материала никаким образом не сказывается на здоровье будущего малыша.
Криоконсервация и разморозка эмбрионовЭмбрионы возрастом 5–6 дней, или бластоцисты, помещаются в сосуд Дьюара, который представляет собой большой термос, наполненный жидким азотом. Предварительно с помощью специальных растворов из эмбрионов удаляется вода, поскольку при заморозке она образует кристаллы, которые повреждают ткани. Бластоцисты замораживаются на специальном носителе, криотопе. Криотопы маркируют идентификационными данными так, чтобы перепутать их было невозможно.
Бластоцисты замораживаются на специальном носителе, криотопе. Криотопы маркируют идентификационными данными так, чтобы перепутать их было невозможно.
Если эмбрионов несколько, то перед размораживанием их качество оценивают по классификации Гарднера и выбирают для переноса самые качественные. Весь процесс разморозки занимает 10 минут. Эмбрион помещают в теплый (37 °С) раствор криопротектора. Раствор несколько раз меняют, постепенно уменьшая концентрацию криопротектора, чтобы избежать осмотического шока. В последнем растворе криопротектора нет. Размороженный эмбрион помещается в среду для культивирования и отправляется в инкубатор. При необходимости выполняется вспомогательный хетчинг. Эта процедура помогает эмбриону выйти из яйцеклетки и повышает вероятность его успешной имплантации. В течение одного-двух часов после размораживания эмбрион переносят в полость матки.
Когда применяется криоконсервацияКриоконсервацией может воспользоваться любой человек, желающий сохранить свой генетический материал на будущее.
Криоконсервация спермы необходима, если:
- В день пункции яичников (изъятия яйцеклеток) мужчина не может сдать сперму.
- Плохие показатели спермограммы. В этом случае криоконсервация позволяет несколькими порциями получить нужное количество спермы.
- Имеется онкологическое заболевание, требующее химио- и лучевой терапии, поскольку такое лечение негативно влияет на репродуктивную функцию.
- Имеется заболевание, ухудшающее репродуктивные способности мужчины.
Показания к криоконсервации яйцеклеток:
- Для сохранения яйцеклеток с целью проведения ЭКО в будущем.
- Сохранение яйцеклеток с целью донорства.
- Онкологическое заболевание, требующее химио- и лучевой терапии, поскольку такое лечение негативно влияет на репродуктивную функцию женщины.
Криоконсервация яйцеклеток показана:
- Для проведения повторных попыток ЭКО в случае неудачи или если пара желает в будущем обзавестись еще детьми.

- При синдроме гиперстимуляции яичников. В этом случае шанс на успешное наступление беременности в этом цикле крайне невелик, а здоровье женщины находится под угрозой. Поэтому эмбрионы замораживают и сохраняют, а женщине дают возможность восстановиться и позже завершить ЭКО.
- Когда эндометрий оказался не готов к переносу эмбриона.
- Когда требуется NGS (Next Generation Sequencing) — генетическая диагностика эмбриона.
Криоцикл, или криопротокол, — это протокол ЭКО с использованием эмбрионов, подвергавшихся криоконсервации, а затем размороженных. Он отличается от обычного цикла ЭКО тем, что пропускаются сложные этапы стимуляции и пункции яичников. Это повышает шансы на успешность попытки.
Этапы крио-ЭКОКриоцикл состоит из двух основных этапов: подготовки эндометрия и криоэмбриотрансфера, то есть перенос размороженного эмбриона в полость матки.
Подготовка эндометрия
Есть три вида подготовки эндометрия:
- Перенос эмбриона в естественном цикле.
- Артифицированный криоцикл на фоне заместительной гормональной терапии (ГЗТ), когда при помощи гормональных препаратов, имитирующих пролиферативную фазу, наращивается эндометрий. Когда достигается необходимая степень его зрелости, выполняют криоэмбриотрансфер.
- ГЗТ на фоне десенситизации гипофиза. В этом случае гормональные препараты «отключают» гипофиз, а менструальный цикл полностью имитируется экзогенными, то есть вводимыми извне гормонами.
Эффективность крио-ЭКО при всех трех видах подготовки одинакова, их выбор зависит от особенностей организма женщины.
Криоэмбриотрансфер
Перенос эмбриона в криоцикле ничем не отличается от обычного ЭКО. С помощью тонкого катетера врач через шейку вводит эмбрион в матку. Это безболезненная процедура, которая занимает от полутора до трех часов, причем собственно перенос длится не более минуты, а остальное время женщина находится под наблюдением врача.
Крио-ЭКО — более щадящий метод по сравнению с обычным ЭКО. Гормональная стимуляция яичников необходима, однако она снижает шансы на успешную беременность в этом же цикле. Криоконсервация сохраняет яйцеклетки или эмбрионы, пока женщина восстанавливается. Криоэмбриотрансфер выполняют, когда ее организм будет полностью готов к беременности. Таким образом, в криоцикле шансы на успех выше.
Еще одно преимущество — экономическая выгода, так как криопротокол имеет меньшую стоимость.
Протоколы получения иммортализованных клеточных линий коричневых и белых преадипоцитов человека
Methods Mol Biol. Авторская рукопись; доступно в PMC 2018 27 марта.
Опубликовано в окончательной редакции как:
Methods Mol Biol. 2017; 1566: 77–85.
doi: 10.1007/978-1-4939-6820-6_8
PMCID: PMC5870121
NIHMSID: NIHMS951638
PMID: 28244042
Информация об авторских правах и отказе от ответственности. 0003
0003
Коричневые и белые преадипоциты человека представляют собой уникальную клеточную модель для изучения адипогенеза и термогенеза человека. Здесь мы опишем подробные процедуры для выделения человека коричневого и белого predipocytes от глубокого и поверхностного жира шеи. Чтобы выращивать эти клетки in vitro в течение длительного периода времени, их следует иммортализировать в соответствии с обсуждаемой здесь процедурой. Мы также предоставляем протокол для расширения, криоконсервации и адипогенной дифференцировки клеток.
Ключевые слова: Бурая и белая жировая ткань, Стромально-васкулярная фракция (СВФ), Преадипоциты, шейный жир, Иммортализация, Дифференцировка расстройства, такие как диабет 2 типа, сердечно-сосудистые заболевания и некоторые виды рака. Бурая и белая жировая ткань представляют собой два функционально различных типа жира, присутствующих у млекопитающих. В то время как основная роль белой жировой ткани (WAT) заключается в хранении избыточных калорий, бурая жировая ткань (BAT) специализируется на рассеивании энергии и термогенезе за счет активности разобщающего белка 1 (UCP1). BAT может быть активирован холодовой стимуляцией как у людей, так и у грызунов. Активируемые холодом НЖТ у людей потребляют больше глюкозы на массу ткани, чем любая другая ткань (1). Учитывая способность BAT использовать топливо и преобразовывать химическую энергию питательных веществ в тепло, увеличение активности или количества бурого жира человека представляет собой многообещающую стратегию борьбы с ожирением.
BAT может быть активирован холодовой стимуляцией как у людей, так и у грызунов. Активируемые холодом НЖТ у людей потребляют больше глюкозы на массу ткани, чем любая другая ткань (1). Учитывая способность BAT использовать топливо и преобразовывать химическую энергию питательных веществ в тепло, увеличение активности или количества бурого жира человека представляет собой многообещающую стратегию борьбы с ожирением.
Недавнее повторное открытие функциональной БЖТ у взрослых людей было сделано с помощью позитронно-эмиссионной томографии/компьютерной томографии с 18F-фтордезоксиглюкозой (ПЭТ/КТ с 18F-ФДГ) в виде билатерально-симметричных пятен поглощения радиоактивно меченой глюкозы в области шеи и надключичной области ( 2). Позже сообщалось, что UCP1-экспрессирующие адипоциты существуют у взрослых людей вокруг шеи, надключичных областей и областей спинного мозга (3-5). Что наиболее важно, было показано, что количество бурой жировой ткани обратно коррелирует с индексом массы тела и процентным содержанием жира в организме, тогда как у людей положительно коррелирует со скоростью метаболизма в состоянии покоя.
Исследование жировой ткани, собранной из различных депо на шее человека, показало, что поверхностный и более глубокий жир имеют классические гистологические, ультраструктурные и генные признаки белой и бурой жировой ткани грызунов соответственно. Важно отметить, что более глубокий жир шеи человека экспрессировал более высокие уровни UCP1 по сравнению с более поверхностными депо шеи (6). Для проведения комплексных исследований молекулярных и клеточных аспектов адипогенеза и термогенеза человека in vitro , мы установили пары иммортализованных коричневых и белых преадипоцитов человека из биоптатов жира шеи человека. Процедуры генерации, роста и дифференцировки этих клеток подробно описаны ниже.
2.1. Equipment
Laminar flow hood
Humidified CO2 incubator
Water bath
Centrifuge
pH meter
Chemical balance
Stirrer
Cell Culture vessels
Serological pipettes
Aspiration pipettes
Inverted microscope
«Mr.
 Frosty» freezing container
Frosty» freezing containerLiquid Nitrogen tank
Hemocytometer или автоматический счетчик клеток
Фильтр для клеток 100 мкм
Парафильм
Стерильные инструменты для диссекции
2.2. Реагенты
Раствор для переваривания: 2 мг/мл коллагеназы-I в 3,55 BSA в PBS. Растворите 20 мг коллагеназы-I в 10 мл буфера PBS. К раствору добавляют БСА до конечной концентрации 3,5%. Фильтр с использованием блока фильтров 0,22 мкм. Подготовьте примерно 10 мл на образец.
Среда для выращивания: 10% FBS в DMEM/высокое содержание глюкозы. Добавьте 100 мл эмбриональной бычьей сыворотки (FBS) к 890 мл DMEM/High Glucose. Добавьте 10 мл пенициллин-стрептомицина. pH до 7,4, используя HCl или NaOH и стерильный фильтр. Для приготовления питательной среды с гентамицином добавьте исходный раствор 1000× в питательную среду и профильтруйте стерильно.
Среда для замораживания: 50 % FBS и 10 % DMSO в DMEM/с высоким содержанием глюкозы.
 Добавьте 25 мл FBS к 20 мл DMEM/High Glucose. Добавьте 5 мл ДМСО. Стерильный фильтр.
Добавьте 25 мл FBS к 20 мл DMEM/High Glucose. Добавьте 5 мл ДМСО. Стерильный фильтр.Среда для дифференциации и индукции: Подготовьте запасы реагентов для среды для дифференциации и индукции следующим образом: Биотин: растворите 0,08 г в 10 мл 0,1 н. NaOH до получения 30 мМ раствора. Инсулин: растворяют инсулин в концентрации 10 мг/мл в 0,01 М HCl. Пантотенат: раствор 8,5 мМ раствора в H3O (500× маточный). Дексаметазон: растворить 0,002 г в 1 мл EtOH (2 мг/мл, 5 мМ). Изобутилметилксантин (IBMX): сделайте запас 50 мМ в 0,1 М КОН. 3,3′,5-трийод-L-тиронин (Т 3 ): добавьте 1,0 мл 1,0 N NaOH к 1 мг, осторожно перемешайте, чтобы порошок растворился, и добавьте 152,6 мл стерильной среды (10 мкМ). Индометацин: 447,25 мг индометацина растворяют в 10 мл этанола (0,125 М). Нагреть до 75°С. Аликвотные исходные растворы и хранить их при температуре -20°C. Избегайте многократных циклов замораживания/оттаивания. Среда для дифференциации: добавьте 1 мл FBS к 48,5 мл DMEM/High Glucose.
 Добавьте 500 мкл пенициллина-стрептомицина, 15 мкл человеческого инсулина (0,5 мкМ) и 10 мкл Т3 (2 нМ). pH до 7,4, используя HCl или NaOH и стерильный фильтр. Индукционная среда: добавьте 1 мл FBS к 48,5 мл DMEM/High Glucose. Добавьте 500 мкл пенициллина-стрептомицина, 50 мкл биотина (33 мкМ), 15 мкл человеческого инсулина (0,5 мкМ), 100 мкл пантотената (17 мкМ), 1 мкл дексаметазона (0,1 мкМ), 10 мкл Т3 (2 нМ), 500 мкл IBMX. (500 мкМ) и 12,5 мкл индометацина (30 мкМ). pH до 7,4, используя HCl или NaOH и стерильный фильтр.
Добавьте 500 мкл пенициллина-стрептомицина, 15 мкл человеческого инсулина (0,5 мкМ) и 10 мкл Т3 (2 нМ). pH до 7,4, используя HCl или NaOH и стерильный фильтр. Индукционная среда: добавьте 1 мл FBS к 48,5 мл DMEM/High Glucose. Добавьте 500 мкл пенициллина-стрептомицина, 50 мкл биотина (33 мкМ), 15 мкл человеческого инсулина (0,5 мкМ), 100 мкл пантотената (17 мкМ), 1 мкл дексаметазона (0,1 мкМ), 10 мкл Т3 (2 нМ), 500 мкл IBMX. (500 мкМ) и 12,5 мкл индометацина (30 мкМ). pH до 7,4, используя HCl или NaOH и стерильный фильтр.Трипсин-ЭДТА (0,25%)
Реагент ДНК-гигро или PBATE-Htert-neo РЕТРОВИРАЛЬНЫЙ ПЛОМИДС (Addgene-Htert-Hygro или PBATE-Htert-neo-ретровиральные плазмы (Addgene-htert-hygro или pbate-htert-neo-ретровирус . Выделение предшественников бурого и белого жира из жира шеи человека
Все этапы следует проводить в ламинарном боксе.
Удалите образец жира из пробирки для сбора и перенесите на кусок парафильма.
Добавьте небольшое количество раствора для пищеварения на ткань, чтобы избежать высыхания.

Измельчите ткань в растворе до получения мелкой консистенции.
Перенесите в пробирку на 50 мл, содержащую 10 мл раствора для пищеварения, и закройте пробирку парафильмом. Для выделения клеток-предшественников ВАТ человека (клетки hBAT-SVF) необходимо объединить ткани, собранные из жира глубокой шеи (оболочка сонной артерии, длинная мышца шеи и превертебральные депо). Для выделения клеток-предшественников WAT человека (клетки hWAT-SVF) объединяли ткани, собранные из поверхностного жира шеи (подкожные и субплатизмальные депо).
Тщательно встряхните каждую пробирку и поместите пробирки в водяную баню для встряхивания при 70 об/мин и 37 °C. Убедитесь, что водяная баня достаточно наполнена, чтобы ткань была погружена в нее.
Тщательно встряхивайте пробирки каждые 10 минут. Пробирки должны оставаться в ванне до тех пор, пока не растворятся все комки, но не настолько долго, чтобы появился слой прозрачного жира (до 45 минут – более длительные расщепления, как правило, приводят к большему количеству клеток, но чрезмерное расщепление может снизить выход клеток).

Когда переваривание завершено, добавьте 3 мл FBS для остановки коллагеназы и тщательно пипетируйте.
Пропустить через фильтр 100 мкм в свежую пробирку на 50 мл (снова промыть пробирку 10 мл питательной среды, затем профильтровать).
Отцентрифугируйте пробирки при 300 g в течение 10 минут.
Аккуратно аспирируйте большую часть супернатанта и ресуспендируйте осадок в 10 мл питательной среды.
Центрифугировать при 300 g в течение 10 минут.
Осторожно отсасывайте большую часть супернатанта, оставляя только осадок.
Ресуспендируйте осадок в 10 мл питательной среды с гентамицином.
Центрифугировать при 300 g в течение 10 минут.
Аккуратно отсасывайте большую часть надосадочной жидкости и снова повторите промывку/отжим.
Аккуратно отсосите большую часть надосадочной жидкости.
Ресуспендируйте осадок в 1 мл питательной среды с гентамицином.

Посев клеток в питательную среду в одну лунку 12-луночного планшета. Добавьте 1 мл питательной среды, чтобы снова промыть пробирку, затем перенесите в ту же лунку.
На следующий день тщательно промойте клетки только один раз питательной средой с гентамицином (некоторые клетки могут свободно прикрепляться к планшету, следите за тем, чтобы не отсоединить их во время промывки).
Через 48 часов повторите промывку.
Удалите гентамицин из питательной среды через 72 часа.
3.2. Получение иммортализованных предшественников бурого и белого жира человека
Получение ретровируса с использованием амфотропной клеточной линии Phoenix (Phoenix-A):
В этом протоколе ретровирусная плазмида (pBate-hTert-hygro или pBate-hTert-neo) используется для доставки обратной транскриптазы теломеразы человека (hTERT) в первичные клетки hBAT и hWAT-SVF. Для получения ретровируса с высоким титром для инфекции можно использовать бесхелперную клеточную линию Amphotropic Phoenix (Phoenix-A).
 Линии пакующих клеток Phoenix Ampho и Eco представляют собой линии-продуценты ретровирусов второго поколения для получения амфотропных и экотропных ретровирусов без хелперов. Клеточная линия Phoenix-A может использоваться для доставки генов в делящиеся клетки большинства видов млекопитающих, включая человека (см. примечание 4.1) (7,8).
Линии пакующих клеток Phoenix Ampho и Eco представляют собой линии-продуценты ретровирусов второго поколения для получения амфотропных и экотропных ретровирусов без хелперов. Клеточная линия Phoenix-A может использоваться для доставки генов в делящиеся клетки большинства видов млекопитающих, включая человека (см. примечание 4.1) (7,8).
День 0: Подготовка клеток-продуцентов ретровируса Phoenix-A для трансфекции
1
За 18–24 часа до трансфекции засейте клетки Phoenix-A в количестве 4–5 миллионов клеток на 10-сантиметровую чашку в питательной среде.
2
После посева клеток перенесите планшеты в инкубатор. Не тревожьте клетки в течение нескольких часов, чтобы обеспечить их прикрепление.
День 1: Трансфекция
3
За час до трансфекции смените среду клеток Phoenix-A и добавьте 6 мл свежей ростовой среды в каждую 10-см чашку. Будьте осторожны, чтобы не отделить клетки.
4
Для каждой 10-сантиметровой чашки разведите 5 мкг ДНК в 250 мкл бессывороточной среды DMEM с высоким содержанием глюкозы.
 Аккуратно пипетируйте вверх и вниз или быстро перемешайте.
Аккуратно пипетируйте вверх и вниз или быстро перемешайте.5
Для каждой 10-сантиметровой чашки разведите 15 мкл реагента PolyJet™ в 250 мкл бессывороточной среды DMEM с высоким содержанием глюкозы. Пипетировать вверх и вниз 3-4 раза, чтобы перемешать.
6
Немедленно добавьте разведенный раствор реагента PolyJet™ к разведенной ДНК. Пипетировать вверх и вниз 3–4 раза или быстро перемешать на вортексе. Дайте смеси постоять 10–15 минут при комнатной температуре, чтобы образовались комплексы ДНК/реагент.
7
Добавьте по каплям 500 мкл смеси ДНК/реагента в планшет и гомогенизируйте смесь, слегка вращая планшет.
8
Через 6–12 часов после заражения удалите среду, содержащую смесь ДНК/реагент, и добавьте к клеткам свежую среду для роста. 94 клетки в одной лунке 12-луночного планшета. Для достижения максимальной эффективности инфекции клетки должны быть примерно на 60–80% слиты. Не забудьте включить одну контрольную лунку для выбора препарата.

День 3: Сбор ретровирусных частиц и заражение первичных клеток hBAT-SVF и hWAT-SVF
10
Соберите супернатант клеток Phoenix-A, содержащий частицы ретровируса.
11
Профильтровать через фильтр 0,45 мкм для удаления клеток из суспензии.
12
Вирус можно использовать в свежем виде для заражения клеток-мишеней. В качестве альтернативы разделите вирус на аликвоты и немедленно заморозьте при температуре -80°C для последующего заражения. Избегайте замораживания и оттаивания вируса, так как это снижает титр вируса (см. примечание 4.2).
13
Для инфицирования клеток hBAT-SVF и hWAT-SVF разбавьте вирус pBate-hTert-hygro в питательной среде в соотношении 1:1. Добавьте полибрен до конечной концентрации 4 мкг/мл. Добавьте смесь в клетки.
14
Повторяйте шаг 4 каждый день, пока клетки растут, пока клетки не достигнут почти 90% слияния (обычно 3 раза).

15
После того, как клетки достигнут конфлюэнтности около 90%, разделите клетки в каждой лунке на две лунки.
16
На следующий день начните выбор препарата с помощью соответствующего маркера выбора. При использовании гигромицина начните с 100 мкг/мл гигромицина в питательной среде. Для выбора неомицина начните с 500 мкг/мл G418 (генетицин). Оптимальная концентрация антибиотика может различаться у разных субъектов и должна определяться для каждой клеточной линии (см. примечание 4.3).
17
Внимательно следите за реакцией клеток на селективный препарат. Большое количество контрольных клеток должно погибнуть в течение 2–3 дней. Если наблюдается небольшая гибель клеток или ее отсутствие, увеличьте концентрацию препарата. Для обеспечения эффективного отбора меняйте среду, содержащую лекарство, через день.
18
Когда все контрольные клетки (без инфекции) погибнут, остановите отбор и добавьте питательную среду, содержащую низкую концентрацию антибиотика (50 мкг/мл гигромицина или 200 мкг/мл G418) еще на одну неделю.

19
Удалите антибиотик и дайте клеткам расти без антибиотика в течение нескольких дней. Иммортализованные преадипоциты человека начнут пролиферировать, и почти через неделю появятся скопления клеток.
20
Когда они станут конфлюэнтными на 80–90%, разделите клетки или заморозьте их в соответствии с протоколом замораживания, описанным ниже.
3.3. Поддержание и размножение иммортализованных преадипоцитов человека
Выращивайте клетки в питательной среде при 37°C во влажном инкубаторе с 5% CO2.
Когда клетки достигают 80–90% слияния, разделите их 1:2 или 1:3 (см. примечания 4.4 и 4.6).
Для пересева, аспирации питательной среды. Промойте один раз PBS (без кальция и магния). Для чашки диаметром 10 см добавьте 1 мл 0,25% (w/v) предварительно нагретого трипсина и верните в инкубатор на 2–3 минуты. Наблюдайте за клетками под инвертированным микроскопом. Когда клетки начинают округляться и отделяться от планшета, нейтрализуйте трипсин, добавляя в чашку 10 мл питательной среды, и осторожно собирайте клетки пипеткой.
 Поместите клетки в новые чашки и инкубируйте в инкубаторе и дайте им прилипнуть.
Поместите клетки в новые чашки и инкубируйте в инкубаторе и дайте им прилипнуть.Замените питательную среду на следующий день, чтобы удалить неприлипшие клетки.
3.4. Криоконсервация первичных и иммортализованных преадипоцитов человека
Приготовьте среду для замораживания, как описано выше.
Аккуратно отделите клетки от сосуда для культуры ткани, следуя процедуре, описанной выше для пересева.
После добавления питательной среды и сбора клеток пипеткой перенесите клеточный раствор в пробирку на 15 мл и отцентрифугируйте при 300 g в течение 4 минут.
Аккуратно извлеките пробирку из центрифуги, аспирируйте большую часть супернатанта, не нарушая клеточный осадок, и ресуспендируйте осадок в 1 мл среды для замораживания на флакон для замораживания. Чтобы обеспечить максимальное восстановление замороженных клеток, каждую конфлюэнтную 10-сантиметровую чашку следует замораживать в двух флаконах.

Поместите флаконы в контейнер для замораживания «Mr. Frosty», содержащий 100% изопропиловый спирт, при температуре -80 °C на 24 часа.
Перенести флаконы с жидкостью N 2 Резервуар для бессрочного хранения.
3.5. Дифференциация иммортализованных белых и коричневых преадипоцитов человека
Посев 40 000–50 000 клеток на лунку в 24-луночном планшете.
Дайте клеткам расти в питательной среде до полного слияния (обычно 3–4 дня для большинства клеточных линий, до 6 дней) (см. примечание 4.5).
Как только клетки достигнут слияния, отберите питательную среду и добавьте к клеткам свежеприготовленную индукционную среду.
Добавляйте свежую индукционную среду каждые три дня в течение 12 дней.
Соберите дифференцированные адипоциты для дальнейшего анализа (анализ экспрессии генов, окрашивание масляным красным О и т. д.)
Для некоторых линий в индукционную среду следует добавить розиглитазон (1 мкМ) для усиления дифференцировки.

В качестве альтернативы, чтобы вызвать повышенную экспрессию UCP1 , митохондриальную активность и использование топлива в зрелых адипоцитах, клетки можно предварительно обработать BMP7 в среде для дифференцировки перед адипогенной дифференцировкой, как описано ниже (9–11).
Добавьте 3,3 нМ BMP7 или аналогичный объем носителя в среду для дифференцировки.
Как только клетки достигнут слияния, отберите среду для роста и добавьте к клеткам среду для дифференцировки, содержащую BMP7 или носитель.
Обработайте клетки BMP7 в среде для дифференцировки в течение шести дней. Добавляйте свежую среду для дифференциации каждые три дня.
На 7-й день начните добавлять в клетки среду для индукции.
Среду для индукции меняйте каждые три дня в течение 12 дней.
4.1. Работа с клетками Phoenix
Никогда не допускайте слияния клеток Phoenix-A, так как это снижает эффективность их трансфекции.
 Для максимально здорового состояния культуры пассируйте клетки, когда они конфлюэнтны на 70–80% в соотношении 1:4 или 1:5.
Для максимально здорового состояния культуры пассируйте клетки, когда они конфлюэнтны на 70–80% в соотношении 1:4 или 1:5.4.2. Концентрация вируса
Для увеличения титра препаратов ретровируса супернатант можно сконцентрировать с использованием имеющихся в продаже наборов для концентрации ретровируса или других собственных методов. По возможности старайтесь использовать свежий вирус, так как титр снижается с каждым циклом замораживания-оттаивания.
4.3. Выбор препарата
Клетки, полученные от разных людей, могут различаться по своей реакции на неомицин или гигромицин. Попробуйте разные концентрации для каждой клеточной линии. Внимательно следите за инфицированными и неинфицированными контрольными клетками, пока они находятся под отбором лекарств.
4.4. Поддержание иммортализованных белых и коричневых преадипоцитов человека
Чтобы обеспечить оптимальные условия роста, никогда не наносите слишком тонкий слой клеток. Некоторые клеточные линии имеют тенденцию расти очень медленно, когда их конфлюэнтность ниже 20–30%.
 Разделение 80–90% сливающаяся культура в соотношении от 1:2 до 1:3 обычно обеспечивает хорошее исходное слияние.
Разделение 80–90% сливающаяся культура в соотношении от 1:2 до 1:3 обычно обеспечивает хорошее исходное слияние.4.5. Дифференцировка иммортализованных белых и коричневых преадипоцитов человека
Никогда не начинайте добавлять индукционную среду к клеткам, пока они не станут полностью конфлюэнтными. Субконфлюэнтные преадипоциты не дифференцируются эффективно. Оптимальное начальное количество клеток может незначительно различаться между клеточными линиями, и его следует определять для каждой отдельной клеточной линии.
4.6. Микоплазменная контаминация
Регулярно проверяйте клетки на наличие микоплазмы. Придерживайтесь правил асептики, чтобы предотвратить заражение. Обработайте зараженные клетки реагентом против микоплазмы, таким как Plasmocin™ (InvivoGen, Сан-Диего, Калифорния), в соответствии с инструкциями производителя.
Эта работа была частично поддержана грантами NIH R01 DK077097 и R01 DK102898 (для Y.-H.T.) и P30 DK036836 (для Исследовательского центра диабета Джослина).

1. Орава Дж., Нуутила П., Лиделл М.Е., Ойконен В., Нопонен Т., Вильянен Т., Шейнин М., Тайттонен М., Ниеми Т., Энербак С., Виртанен К.А. Различные метаболические реакции бурой жировой ткани человека на активацию холодом и инсулином. Клеточный метаб. 2011;14(2):272–279.. doi: 10.1016/j.cmet.2011.06.012. [PubMed] [CrossRef] [Google Scholar]
2. Nedergaard J, Bengtsson T, Cannon B. Неожиданные доказательства активной бурой жировой ткани у взрослых людей. Am J Physiol Endocrinol Metab. 2007; 293(2):E444–452. doi: 10.1152/ajpendo.00691.2006. [PubMed] [CrossRef] [Google Scholar]
3. Cypess AM, Lehman S, Williams G, Tal I, Rodman D, Goldfine AB, Kuo FC, Palmer EL, Tseng YH, Doria A, Kolodny GM, Kahn CR. Выявление и значение бурой жировой ткани у взрослых людей. N Engl J Med. 2009 г.;360(15):1509–1517. doi: 10.1056/NEJMoa0810780. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Ван Маркен Лихтенбелт В.Д., Ванхоммериг Дж.В., Смолдерс Н.М., Дроссартс Дж.
 М., Кемеринк Г.Дж., Буви Н.Д., Шраувен П., Теуле Г.Дж. Холодовая активация бурой жировой ткани у здоровых мужчин. N Engl J Med. 2009;360(15):1500–1508. doi: 10.1056/NEJMoa0808718. [PubMed] [CrossRef] [Google Scholar]
М., Кемеринк Г.Дж., Буви Н.Д., Шраувен П., Теуле Г.Дж. Холодовая активация бурой жировой ткани у здоровых мужчин. N Engl J Med. 2009;360(15):1500–1508. doi: 10.1056/NEJMoa0808718. [PubMed] [CrossRef] [Google Scholar]5. Виртанен К.А., Лиделл М.Е., Орава Дж., Хеглинд М., Вестергрен Р., Ниеми Т., Тайттонен М., Лайне Дж., Сависто Н.Дж., Энербак С., Нуутила П. Функциональный бурый жир ткани у здоровых взрослых. N Engl J Med. 2009 г.;360(15):1518–1525. doi: 10.1056/NEJMoa0808949. [PubMed] [CrossRef] [Google Scholar]
6. Cypess AM, White AP, Vernochet C, Schulz TJ, Xue R, Sass CA, Huang TL, Roberts-Toler C, Weiner LS, Sze C, Chacko AT, Deschamps Л.Н., Гердер Л.М., Тручан Н., Глазго А.Л., Холман А.Р., Гаврила А., Хассельгрен П.О., Мори М.А., Молла М., Ценг Ю.Х. Анатомическая локализация, профилирование экспрессии генов и функциональная характеристика бурого жира шеи взрослого человека. Нат Мед. 2013;19(5):635–639. doi: 10.1038/nm.3112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7.
 Pear WS, Nolan GP, Scott ML, Baltimore D. Получение бесхелперных ретровирусов с высоким титром путем транзиторной трансфекции. Proc Natl Acad Sci U S A. 1993;90(18):8392–8396. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Pear WS, Nolan GP, Scott ML, Baltimore D. Получение бесхелперных ретровирусов с высоким титром путем транзиторной трансфекции. Proc Natl Acad Sci U S A. 1993;90(18):8392–8396. [Бесплатная статья PMC] [PubMed] [Google Scholar]8. Swift S, Lorens J, Achacoso P, Nolan GP. Быстрое производство ретровирусов для эффективной доставки генов в клетки млекопитающих с использованием систем на основе клеток 293T. Карр Проток Иммунол. 2001;10(10):17С. doi: 10.1002/0471142735.im1017cs31. [PubMed] [CrossRef] [Академия Google]
9. Шульц Т.Дж., Хуанг Т.Л., Тран Т.Т., Чжан Х., Таунсенд К.Л., Шадрах Д.Л., Черлетти М., Макдугалл Л.Е., Гиоргадзе Н., Чкония Т., Шриер Д., Фалб Д., Киркланд Д.Л., Вейджерс А.Дж., Ценг Ю.Х. Идентификация индуцируемых предшественников бурых адипоцитов, находящихся в скелетных мышцах и белом жире. Proc Natl Acad Sci U S A. 2011;108(1):143–148. doi: 10.1073/pnas.1010929108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Tseng YH, Kokkotou E, Schulz TJ, Huang TL, Winnay JN, Taniguchi CM, Tran TT, Suzuki R, Espinoza DO, Yamamoto Y, Ahrens М.
 Дж., Дадли А.Т., Норрис А.В., Кулкарни Р.Н., Кан Ч.Р. Новая роль костного морфогенетического белка 7 в буром адипогенезе и расходе энергии. Природа. 2008;454(7207):1000–1004. doi: 10.1038/nature07221. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж., Дадли А.Т., Норрис А.В., Кулкарни Р.Н., Кан Ч.Р. Новая роль костного морфогенетического белка 7 в буром адипогенезе и расходе энергии. Природа. 2008;454(7207):1000–1004. doi: 10.1038/nature07221. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]11. Сюэ Р., Лайнс М.Д., Дрейфус Дж.М., Шамси Ф., Шульц Т.Дж., Чжан Х., Хуан Т.Л., Таунсенд К.Л., Ли И., Такахаши Х., Вайнер Л.С., Уайт А.П., Лайнс М.С., Рубин Л.Л., Гудиер Л.Дж., Сайпес А.М., Ценг Ю.Х. Клональный анализ и профилирование генов определяют генетические биомаркеры термогенного потенциала коричневых и белых преадипоцитов человека. Нат Мед. 2015;21(7):760–768. doi: 10.1038/nm.3881. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Nalgene® 5100-0050 Контейнер для замораживания Mr. Frosty для криопробирок объемом 4,5–5,0 мл, поликарбонат
Замораживание клеток в пробирках объемом от 4,5 до 5 мл с использованием Nalgene 5100-0050 Mr. Frosty trade; Контейнер для заморозки. Этот контейнер для криогенной заморозки недорогой, многоразовый и удобный для замораживания биологических образцов с рекомендуемой контролируемой скоростью охлаждения -1°C/минуту.
 Изопропиловый спирт необходим для достижения рекомендуемой скорости охлаждения. Простая в использовании система разработана для достижения скорости охлаждения, близкой к оптимальной для сохранения клеток. Без контакта со спиртом: без впитывания, без снятия этикетки и без ущерба для ручной печати тубы.
Изопропиловый спирт необходим для достижения рекомендуемой скорости охлаждения. Простая в использовании система разработана для достижения скорости охлаждения, близкой к оптимальной для сохранения клеток. Без контакта со спиртом: без впитывания, без снятия этикетки и без ущерба для ручной печати тубы.Экономит драгоценное место в морозильной камере во время процесса охлаждения. Завинчивающаяся верхняя крышка удерживает образцы внутри в случае случайного опрокидывания контейнера. Устраняет ненадежные самодельные контейнеры для пены.
Размеры продукта (Ш x В): 112 мм x 151 мм
Совместимость пробирок: 4,5–5,0 млТребуется: 100% изопропиловый спирт и механический морозильник.
Продукт содержит: Контейнер из поликарбоната, крышка из полиэтилена высокой плотности, держатель трубки, пенопластовая вставка.
ИНСТРУКЦИИ:
1. Снимите держатель трубки из полиэтилена высокой плотности и пенопластовую вставку из поликарбонатного блока. Выбросьте пенопластовую вставку.
Выбросьте пенопластовую вставку.
2. Добавьте 100% изопропиловый спирт до линии наполнения контейнера Mr. Frosty. Не перелей.
3. Осторожно установите на место держатель трубки.
4. Поместите пробирки с образцом в отверстия держателя пробирок.
5. Поместите устройство на дно механической морозильной камеры от -70°C до -80°C. Оставьте в покое не менее чем на 4 часа.
6. Извлеките замороженные пробирки из устройства и поместите в морозильную камеру для длительного хранения (например, при -130°C или ниже).
ПРИМЕЧАНИЕ. Не храните полную банку на боку. Хранить при комнатной температуре, когда не используется. Заменяйте спирт
при каждом пятом использовании. Очистите с помощью неабразивного нещелочного моющего средства, такого как моющее средство Thermo Scientific Nalgene
L-900 (кат. № 900-4000). .Сделано в Мексике.
Часто задаваемые вопросы (FAQ)
Какая температура должна быть в моем контейнере для замораживания клеток Mr.
 Frosty с регулируемой скоростью, когда я начинаю замораживать клетки?
Frosty с регулируемой скоростью, когда я начинаю замораживать клетки?Для достижения максимальной скорости охлаждения вся система должна иметь комнатную температуру непосредственно перед замораживанием.
Должен ли я сохранить или выбросить вкладыш из пеноматериала в моем контейнере для замораживания клеток с регулируемой скоростью Mr. Frosty?
Вставка из белого пеноматериала служит только для облегчения чтения печатных инструкций на банке. Его наличие или отсутствие не повлияет на скорость охлаждения, поэтому от него можно отказаться.
Почему рекомендуется менять изопропанол в моем контейнере для замораживания ячеек с регулируемой скоростью Mr. Frosty после каждых 5 использований?
Система Mr. Frosty зависит от удельной теплоемкости спирта, чтобы обеспечить оптимальную скорость охлаждения 1 градус Цельсия в минуту. После нескольких циклов охлаждения и нагревания произошло достаточное количество конденсации пара, чтобы большая часть спирта в резервуаре была заменена водой, что влияет на теплоемкость собранного устройства, что может повлиять на скорость охлаждения.





 Frosty» freezing container
Frosty» freezing container Добавьте 25 мл FBS к 20 мл DMEM/High Glucose. Добавьте 5 мл ДМСО. Стерильный фильтр.
Добавьте 25 мл FBS к 20 мл DMEM/High Glucose. Добавьте 5 мл ДМСО. Стерильный фильтр. Добавьте 500 мкл пенициллина-стрептомицина, 15 мкл человеческого инсулина (0,5 мкМ) и 10 мкл Т3 (2 нМ). pH до 7,4, используя HCl или NaOH и стерильный фильтр. Индукционная среда: добавьте 1 мл FBS к 48,5 мл DMEM/High Glucose. Добавьте 500 мкл пенициллина-стрептомицина, 50 мкл биотина (33 мкМ), 15 мкл человеческого инсулина (0,5 мкМ), 100 мкл пантотената (17 мкМ), 1 мкл дексаметазона (0,1 мкМ), 10 мкл Т3 (2 нМ), 500 мкл IBMX. (500 мкМ) и 12,5 мкл индометацина (30 мкМ). pH до 7,4, используя HCl или NaOH и стерильный фильтр.
Добавьте 500 мкл пенициллина-стрептомицина, 15 мкл человеческого инсулина (0,5 мкМ) и 10 мкл Т3 (2 нМ). pH до 7,4, используя HCl или NaOH и стерильный фильтр. Индукционная среда: добавьте 1 мл FBS к 48,5 мл DMEM/High Glucose. Добавьте 500 мкл пенициллина-стрептомицина, 50 мкл биотина (33 мкМ), 15 мкл человеческого инсулина (0,5 мкМ), 100 мкл пантотената (17 мкМ), 1 мкл дексаметазона (0,1 мкМ), 10 мкл Т3 (2 нМ), 500 мкл IBMX. (500 мкМ) и 12,5 мкл индометацина (30 мкМ). pH до 7,4, используя HCl или NaOH и стерильный фильтр.


 Линии пакующих клеток Phoenix Ampho и Eco представляют собой линии-продуценты ретровирусов второго поколения для получения амфотропных и экотропных ретровирусов без хелперов. Клеточная линия Phoenix-A может использоваться для доставки генов в делящиеся клетки большинства видов млекопитающих, включая человека (см. примечание 4.1) (7,8).
Линии пакующих клеток Phoenix Ampho и Eco представляют собой линии-продуценты ретровирусов второго поколения для получения амфотропных и экотропных ретровирусов без хелперов. Клеточная линия Phoenix-A может использоваться для доставки генов в делящиеся клетки большинства видов млекопитающих, включая человека (см. примечание 4.1) (7,8). Аккуратно пипетируйте вверх и вниз или быстро перемешайте.
Аккуратно пипетируйте вверх и вниз или быстро перемешайте.


 Поместите клетки в новые чашки и инкубируйте в инкубаторе и дайте им прилипнуть.
Поместите клетки в новые чашки и инкубируйте в инкубаторе и дайте им прилипнуть.

 Для максимально здорового состояния культуры пассируйте клетки, когда они конфлюэнтны на 70–80% в соотношении 1:4 или 1:5.
Для максимально здорового состояния культуры пассируйте клетки, когда они конфлюэнтны на 70–80% в соотношении 1:4 или 1:5. Разделение 80–90% сливающаяся культура в соотношении от 1:2 до 1:3 обычно обеспечивает хорошее исходное слияние.
Разделение 80–90% сливающаяся культура в соотношении от 1:2 до 1:3 обычно обеспечивает хорошее исходное слияние.
 М., Кемеринк Г.Дж., Буви Н.Д., Шраувен П., Теуле Г.Дж. Холодовая активация бурой жировой ткани у здоровых мужчин. N Engl J Med. 2009;360(15):1500–1508. doi: 10.1056/NEJMoa0808718. [PubMed] [CrossRef] [Google Scholar]
М., Кемеринк Г.Дж., Буви Н.Д., Шраувен П., Теуле Г.Дж. Холодовая активация бурой жировой ткани у здоровых мужчин. N Engl J Med. 2009;360(15):1500–1508. doi: 10.1056/NEJMoa0808718. [PubMed] [CrossRef] [Google Scholar]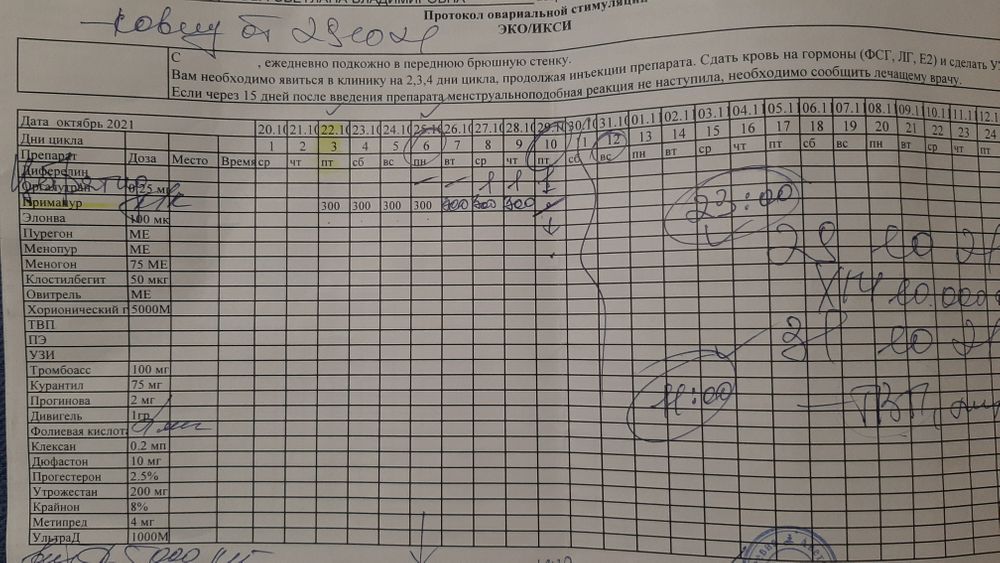 Pear WS, Nolan GP, Scott ML, Baltimore D. Получение бесхелперных ретровирусов с высоким титром путем транзиторной трансфекции. Proc Natl Acad Sci U S A. 1993;90(18):8392–8396. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Pear WS, Nolan GP, Scott ML, Baltimore D. Получение бесхелперных ретровирусов с высоким титром путем транзиторной трансфекции. Proc Natl Acad Sci U S A. 1993;90(18):8392–8396. [Бесплатная статья PMC] [PubMed] [Google Scholar] Дж., Дадли А.Т., Норрис А.В., Кулкарни Р.Н., Кан Ч.Р. Новая роль костного морфогенетического белка 7 в буром адипогенезе и расходе энергии. Природа. 2008;454(7207):1000–1004. doi: 10.1038/nature07221. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж., Дадли А.Т., Норрис А.В., Кулкарни Р.Н., Кан Ч.Р. Новая роль костного морфогенетического белка 7 в буром адипогенезе и расходе энергии. Природа. 2008;454(7207):1000–1004. doi: 10.1038/nature07221. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Изопропиловый спирт необходим для достижения рекомендуемой скорости охлаждения. Простая в использовании система разработана для достижения скорости охлаждения, близкой к оптимальной для сохранения клеток. Без контакта со спиртом: без впитывания, без снятия этикетки и без ущерба для ручной печати тубы.
Изопропиловый спирт необходим для достижения рекомендуемой скорости охлаждения. Простая в использовании система разработана для достижения скорости охлаждения, близкой к оптимальной для сохранения клеток. Без контакта со спиртом: без впитывания, без снятия этикетки и без ущерба для ручной печати тубы. Выбросьте пенопластовую вставку.
Выбросьте пенопластовую вставку.  Frosty с регулируемой скоростью, когда я начинаю замораживать клетки?
Frosty с регулируемой скоростью, когда я начинаю замораживать клетки?