Диагностика вируса Коксаки в Ростове-на-Дону в Euroexpert Clinic
Диагностика вируса Коксаки в Ростове-на-Дону в Euroexpert ClinicРазмер:
A
A
A
Цвет: CCC
Изображения Вкл.Выкл.
Обычная версия сайта
Ростов-на-Дону, Малиновского д.76Б/87А
Пн-Пт 8:00-20:00,Сб 8:00-18:00, Вс 09:00-14:00
Оставить отзыв
Заказать звонок
echo «»;ЛД12.42.001
Антитела к вирусу Коксаки (Coxsackievirus), IgM
728 руб
90%
Положительных отзывов
4,5/5
Рейтинг на ProDoctorov
Отлично
Хочу выразить огромную благодарность психиатру «Евроэксперт клиники» г. Ростов-на-Дону Санникову А. Н. за доброе и чуткое отношение к пациентам. Я сама из далёкой Якутии, попав на приём к Александру Николаевичу, ощутила на себе, как важно знать и чувствовать, что тебя ведёт такой профессионал как он.

Сайт Prodoctorov
Отлично
Обследуемся с мужем в этом медицинском центре уже больше года. Нам всё нравится. Удобное расположение центра, легко доехать и быстро найти. Помещения чистые и уютные. Медицинское оборудование — на высшем уровне. Очень приятные цены, я специально мониторила по медицинским центрам и сравнивала. А также еще и приятные скидки! Персоналу большая благодарность! Очень грамотные специалисты! Большое спасибо Черкашину Андрею Андреевичу, Ланкиной Марии Сергеевне за лечение! Благодарим также милую улыбчивую медсестру Шевандину Наталью Николаевну! И особая благодарность самой очаровательной Елене на ресепшене, она всегда для пациентов подберёт удобное время посещения, позвонит и предупредит всегда вовремя, очень внимательная и отзывчивая.

Сайт Prodoctorov
Отлично
Хочу поделиться мнением о клинике «Евроэксперт»! Пришли с мужем к неврологу по вопросу сильнейшей боли в шее. После консультации дали направление на МРТ, которую мне сделали через 30 минут у их партнёров, отправив бесплатно на такси, да ещё и со скидкой. Вернулись к врачу, чтобы подтвердить диагноз и получить лечение. В ожидании повторного приёма боль усилилась до такой степени, что я не могла ни стоять, ни сидеть. Чему была крайне приятно удивлена, так это тому, что администратор вынесла мне подушку, уложила и 25 раз спросила, удобно ли мне. Вот уж, правда, не ожидала, что есть такое человеческое отношение и желание помочь другому, когда ему плохо! Хочу сказать спасибо врачу А. А. Черкашину и администратору Елене!
Сайт Prodoctorov
Отлично
После посещения поликлиник пришёл сюда, и скажу прямо.
 .. Все отлично, врачи у которых был, кардиолог и невролог, и могу сказать уверенно, что знают свою профессию, чтобы много не писать, скажу так… Если будут проблемы со здоровьем, то приду только сюда, и вам советую, а администратору отдельное спасибо за добрый и тёплый приём.
.. Все отлично, врачи у которых был, кардиолог и невролог, и могу сказать уверенно, что знают свою профессию, чтобы много не писать, скажу так… Если будут проблемы со здоровьем, то приду только сюда, и вам советую, а администратору отдельное спасибо за добрый и тёплый приём.Сайт Prodoctorov
Отлично
По рекомендации знакомых посетили «Евроэксперт клиник» и не пожалели. Чисто, уютно, оборудование новейшее, чего не скажешь о поликлиниках. Обслуживание отличное. Врач УЗИ Самохина Людмила Юрьевна настолько дотошно все осмотрела, расписала, рассказала, что понятно даже дилетанту. Спасибо Вам огромное, Людмила Юрьевна. Побольше бы таких специалистов.
Сайт Prodoctorov
Отлично
Приветливый персонал, грамотный администратор Елена, всегда подскажет, проконсультирует, квалифицированные врачи. Оборудование всё новое, возможность сдачи анализов и прохождение процедур в одном месте, удобное расположение.

Сайт Prodoctorov
Этот сайт использует cookie. для хранения данных. Продолжая использовать сайт, Вы даете согласие на работу с этими файлами
Антител к вирусу коксаки (Coxsackievirus) IgG. Серология по низкой цене в Москве — Лаборатория ИАКИ
Быстрый переход:
··· выберите раздел ···— Аллергологические исследования—— По крови——— Панели аллергенов———— Пыльца трав и злаковых———— Пыльца сорной травы———— Пыльца деревьев———— Пищевые (IgE специфические)———— Пищевые (IgG специфические)———— Бытовые аллергены———— Грибковые и бактериальные аллергены———— Аллергены животных и птиц———— Строительные аллергены———— Аллергены косметических средств———— Аллергены чистяще-моющих средств———— Красители и консерванты пищевых косметических средств———— Профессиональные аллергены———— Металлы ———— Лекарственные панели (IgE специфические)———— Лекарственные панели (IgG специфические)———— Панели расширенные——— Миксты (смеси аллергенов)———— Пыльца трав и злаковых———— Пыльца сорной травы———— Пыльца деревьев———— Бытовые аллергены———— Грибковые и бактериальные аллергены———— Аллергены животных и птиц———— Пищевые———— Cкрининговые исходные тесты——— Единичные аллергены———— Насекомые, яды———— Аллергия на птиц———— Другие аллергены———— Лекарственные препараты——— Общие панели—— По слюне——— Единичные аллергены——— Миксты (смеси аллергенов)——— Панели аллергенов——— Панели расширенные—— Из носа——— Единичные аллергены———— Аллергия на птиц———— Другие аллергены——— Миксты (смеси аллергенов)———— Бытовые———— Деревья———— Животные———— Злаковые———— Скрининговые———— Сорные——— Панели аллергенов———— Бактериальные аллергены———— Бытовые аллергены и домашние животные———— Грибковые———— Деревья, злаковые, сорные травы——— Панели деревья——— Панели расширенные— Другие диагностические исследования—— Диагностические комплексы—— Биохимические исследования——— Обмен белков——— Обмен пигментов——— Обмен углеводов——— Обмен липопротеинов——— Электролиты——— Обмен железа——— Ферменты——— Специфические белки——— Цитокины——— Витамины——— Коагулогические исследования—— Гормональные исследования——— Гормоны щитовидной железы——— Диагностика заболеваний щитовидной железы——— Половые гормоны——— Надпочечники——— Поджелудочная железа——— Желудок——— Гормон роста——— Костный метаболизм——— Биогенные амины——— Ревматология——— Диагностика тромбозов——— Антигенные маркеры опухолевого роста——— Исследование мочи——— Исследование кала—— Серология——— Сифилис——— Бактериальные инфекции——— Острые кишечные инфекции——— Вирусные инфекции——— Маркеры вирусных гепатитов——— ВИЧ-инфекция——— Протозойные инфекции——— Гельминтозы—— Бактериологические исследования——— Посев на инфекции——— Посев крови——— Грибковые инфекции ——— Исследование на дисбактериоз——— Посев на флору с определением чувствительности к антибиотикам—— Иммунология—— Общеклинические исследования——— Гематологические исследования——— ИЗОСЕРОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ——— Исследование (мокрота, кожа, волосы, отделямое из носа)——— Исследование каловых масс——— Исследование мочи——— Микроскопические исследования отделяемого мочеполовых органов—— Диагностика методом ПЦР——— Бактериальные инфекции——— Бактериальные инфекции — кровь——— Вирусные инфекции——— Грибковые инфекции——— Протозойные инфекции——— Протозойные инфекции — кровь——— Диагностические профили
Заказать (0)
- Диагностические комплексы
- Биохимические исследования
- Обмен белков
- Обмен пигментов
- Обмен углеводов
- Обмен липопротеинов
- Электролиты
- Обмен железа
- Ферменты
- Специфические белки
- Цитокины
- Витамины
- Коагулогические исследования
- Гормональные исследования
- Гормоны щитовидной железы
- Диагностика заболеваний щитовидной железы
- Половые гормоны
- Надпочечники
- Поджелудочная железа
- Желудок
- Гормон роста
- Костный метаболизм
- Биогенные амины
- Ревматология
- Диагностика тромбозов
- Антигенные маркеры опухолевого роста
- Исследование мочи
- Исследование кала
- Серология
- Сифилис
- Бактериальные инфекции
- Острые кишечные инфекции
- Вирусные инфекции
- Маркеры вирусных гепатитов
- ВИЧ-инфекция
- Протозойные инфекции
- Гельминтозы
- Бактериологические исследования
- Посев на инфекции
- Посев крови
- Грибковые инфекции
- Исследование на дисбактериоз
- Посев на флору с определением чувствительности к антибиотикам
- Иммунология
- Общеклинические исследования
- Гематологические исследования
- ИЗОСЕРОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
- Исследование (мокрота, кожа, волосы, отделямое из носа)
- Исследование каловых масс
- Исследование мочи
- Микроскопические исследования отделяемого мочеполовых органов
- Диагностика методом ПЦР
- Бактериальные инфекции
- Бактериальные инфекции — кровь
- Вирусные инфекции
- Грибковые инфекции
- Протозойные инфекции
- Протозойные инфекции — кровь
- Диагностические профили
()
1400 p
Описание Показания Подготовка
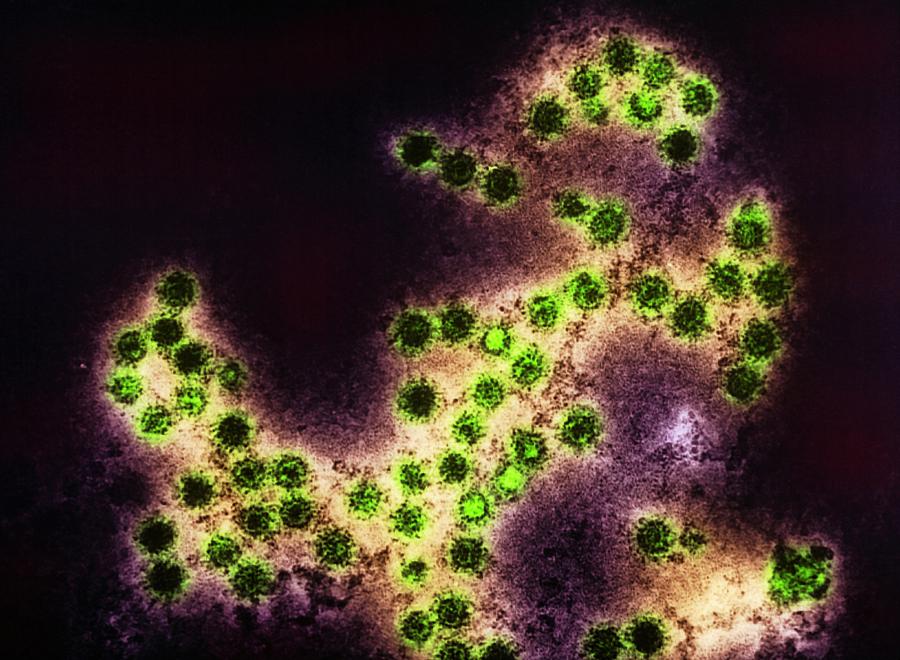
Вирус Коксаки А и B относятся к, так называемым, энтеровирусам. Эти вирусы передаются воздушно-капельным и фекально-оральным путями. Человек заражается через контакт с грязью или выделениями больного. Энтеровирусные инфекции в умеренном климате происходят в основном летом и касаются, в основном, детей в возрасте до первого года жизни. Инфекции у взрослых и старших детей могут иметь тяжелую форму. Однако, у большинства людей вирус Коксаки дает мягкие симптомы, например, боль в горле, ринит и жар. У взрослых этот вирус обычно проявляется воспалением горла, миндалин и простудой.
Эти вирусы передаются воздушно-капельным и фекально-оральным путями. Человек заражается через контакт с грязью или выделениями больного. Энтеровирусные инфекции в умеренном климате происходят в основном летом и касаются, в основном, детей в возрасте до первого года жизни. Инфекции у взрослых и старших детей могут иметь тяжелую форму. Однако, у большинства людей вирус Коксаки дает мягкие симптомы, например, боль в горле, ринит и жар. У взрослых этот вирус обычно проявляется воспалением горла, миндалин и простудой.
В соответствии с Федеральным законом ФЗ № 323 «Об основах защиты здоровья граждан в Российской Федерации» интерпретация результатов исследований, установление диагноза, назначение лечения, должны производиться врачом соответствующей специализации.
Диагностика коксаки вирусной инфекции
Специальная подготовка не требуется.
Забор крови для исследования производят не ранее чем через 2 часа после приема пищи.
Перед исследованием (за 1 час) желательно исключить факторы, влияющие на результаты лабораторного исследования: физическое и эмоциональное напряжение, курение.
Рекомендуется за 1-2 дня до предполагаемого исследования не употреблять жирную пищу и алкоголь.
При приеме лекарственных препаратов следует проконсультироваться с врачом по поводу целесообразности проведения исследования на фоне приема препаратов или возможности отмены приема препарата. Длительность отмены препарата определена периодом выведения препарата из крови (в среднем, рекомендуют выждать 4-5 периодов полувыведения препарата, указанного в аннотации).
Если отменить прием лекарств нельзя, необходимо проинформировать об этом лабораторию.
Детей до 5 лет перед забором крови обязательно поить кипяченой водой (порциями, до 150-200 ml, на протяжении 30 минут)
Вернуться к списку анализов
Общая подготовка к исследованию
Забор крови для исследования производят не ранее чем через 2 часа после приема пищи. Перед исследованием (за 1 час) желательно исключить факторы, влияющие на результаты: физическое и эмоциональное напряжение, курение. Рекомендуется также за 1-2 дня до предполагаемого исследования не употреблять жирную пищу и алкоголь.
Перед исследованием (за 1 час) желательно исключить факторы, влияющие на результаты: физическое и эмоциональное напряжение, курение. Рекомендуется также за 1-2 дня до предполагаемого исследования не употреблять жирную пищу и алкоголь.
Если вы принимаете лекарства, обязательно предупредите об этом лечащего врача.
Отправить заказ
Заказ актуален в течение 3 дней. Если у Вас возникли вопросы, просим оставить их в комментарии! Дополнительную информацию Вы можете уточнить по телефону +7 (495) 695-5-695.
добавить e-mail и комментарийДиагностика коксакивирусной инфекции группы А с помощью полимеразной цепной реакции
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Неотложная педиатрия
Диагностика коксакивирусной инфекции группы А с помощью полимеразной цепной реакции
- M Hosoya1,
- H Ishiko2,
- Y Shimada2,
- K Honzumi1,
- S Suzuki3,
- K Kato3,
- H Suzuki1
- 1 Department of Pediatrics, Fukushima Medical Университетская школа медицины, Фукусима 960-1295, Япония
- 2 Лаборатория инфекционных заболеваний, Mitsubishi Kagaku Bio-Clinical Laboratories, Inc.
 , Токио 174-8555, Япония
, Токио 174-8555, Япония - 3 Фукусимский институт общественного здравоохранения и наук об окружающей среде, Фукусима 960-8560, Япония
- Адрес для связи:
Доктор М. Хосоя, кафедра педиатрии, Медицинский университет Фукусима, Химикакар 1 960-1295, Япония;
mhosoya{at}fmu.ac.jp
Abstract
Цели: Изучить взаимосвязь между энтеровирусной инфекцией, особенно вирусом Коксаки группы А, и острым лихорадочным заболеванием в течение двух лет с использованием культуры тканей и полимеразной цепной реакции (ПЦР). ).
Методы: Мазки из горла были взяты у 246 детей с июня по август 1997 и 1998 гг. Геномы энтеровирусов были обнаружены в 54 из 178 образцов, из которых вирус не был выделен. Из 41 энтеровирусного генотипа, идентифицированного с помощью анализа последовательности продуктов ПЦР, 38 были вирусами Коксаки группы А, которые обычно трудно выделить с помощью культуры ткани.
Заключение: Результаты показывают, что обнаружение и идентификация вируса на основе ПЦР полезны при диагностике вирусной инфекции Коксаки группы А.
- coxsackievirus group A
- herpangina
- polymerase chain reaction
- phylogenetic
http://dx.doi.org/10.1136/adc.87.4.316
Statistics from Altmetric.com
Request Permissions
Если вы хотите повторно использовать часть или всю эту статью, воспользуйтесь приведенной ниже ссылкой, которая приведет вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
- вирус Коксаки группа А
- герпангина
- полимеразная цепная реакция
- филогенетический
Энтеровирусы человека включают полиовирусы, эховирусы, вирусы Коксаки групп А и В и энтеровирусы (типы 68–71). Эти подгруппы изначально отличались друг от друга их различными эффектами в культуре тканей и инокуляции животных. Полиовирусы, эховирусы и вирусы Коксаки группы В легко изолировать с помощью культуры тканей, но, как правило, вирусы Коксаки группы А трудно выделить. Поэтому вместо этого используется инокуляция мышей-сосунов. 1 Вирусологические исследования, проведенные в начале 1950-х годов с использованием этого метода, четко показали, что несколько вирусов Коксаки группы А были причиной эпидемической герпангины, 2, 3 , но полный спектр клинических проявлений инфекции вируса Коксаки группы А остается неопределенным. Диагностические исследования с использованием прививки мышам-сосункам в настоящее время проводятся редко. Недавно были разработаны методы полимеразной цепной реакции (ПЦР) для обнаружения большинства серотипов энтеровирусов. 4– 6 Филогенетический анализ последовательностей генома энтеровирусов позволяет классифицировать генотипы энтеровирусов. 7, 8 Ранее мы сообщали об энтеровирусах, связанных с фебрильными судорогами в летние месяцы, с помощью ПЦР и последующего филогенетического анализа амплифицированных последовательностей генома.
Полиовирусы, эховирусы и вирусы Коксаки группы В легко изолировать с помощью культуры тканей, но, как правило, вирусы Коксаки группы А трудно выделить. Поэтому вместо этого используется инокуляция мышей-сосунов. 1 Вирусологические исследования, проведенные в начале 1950-х годов с использованием этого метода, четко показали, что несколько вирусов Коксаки группы А были причиной эпидемической герпангины, 2, 3 , но полный спектр клинических проявлений инфекции вируса Коксаки группы А остается неопределенным. Диагностические исследования с использованием прививки мышам-сосункам в настоящее время проводятся редко. Недавно были разработаны методы полимеразной цепной реакции (ПЦР) для обнаружения большинства серотипов энтеровирусов. 4– 6 Филогенетический анализ последовательностей генома энтеровирусов позволяет классифицировать генотипы энтеровирусов. 7, 8 Ранее мы сообщали об энтеровирусах, связанных с фебрильными судорогами в летние месяцы, с помощью ПЦР и последующего филогенетического анализа амплифицированных последовательностей генома. 9 В настоящем исследовании мы исследовали связь энтеровирусов, особенно вирусов Коксаки группы А, с более широким спектром острых лихорадочных заболеваний, включая герпетическую ангину, фебрильные судороги и фарингит/тонзиллит в летние месяцы, используя культуру тканей и ПЦР.
9 В настоящем исследовании мы исследовали связь энтеровирусов, особенно вирусов Коксаки группы А, с более широким спектром острых лихорадочных заболеваний, включая герпетическую ангину, фебрильные судороги и фарингит/тонзиллит в летние месяцы, используя культуру тканей и ПЦР.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы
В период с июня по август 1997 г. и 1998 г. в префектуре Фукусима, Япония, были взяты мазки из зева для эпиднадзора за вирусами у 246 детей с температурой тела более 38,5 °C и клиническими признаками фарингеальной и/или тонзиллярная инфекция. Образцы собирали в транспортную среду, содержащую 2 мл минимальной эссенциальной среды Игла с желатином (5 мг/л), пенициллином (400 ЕД/л), стрептомицином (400 мкг/л) и амфотерицином В (1,25 мкг/л), разделенных на на две части и хранят при -70°С до анализа. Одну часть использовали для выделения вируса с помощью клеточной культуры, а другую — для обнаружения вируса с помощью ПЦР.
Двадцати четырем детям (в возрасте 0,25–6,50 лет, средний возраст 2,21) был поставлен клинический диагноз герпетической ангины на основании внезапного начала лихорадки и характерных везикулярных и/или изъязвленных поражений слизистой оболочки ротоглотки. Двадцати одному ребенку (в возрасте 0,67–4,50 года, средний возраст 1,97) был поставлен клинический диагноз фебрильных судорог, если они соответствовали следующим пяти критериям: возраст от 6 месяцев до 5 лет; лихорадка >38°С; продолжительность приступа <15 минут; отсутствие инфекции ЦНС, определяемой с использованием стандартных методов, таких как бактериальная культура и выделение вируса; отсутствие стойких неврологических нарушений после приступа. Подробности о 21 пациенте сообщались ранее. 9 У остальных 201 обследованного ребенка (в возрасте 0,16–15,9 лет, средний возраст 3,87 года) не было ни характерной энантемы в полости рта, ни неврологических проявлений. Им поставили диагноз фарингит/тонзиллит. Из этих 201 больных у восьми был конъюнктивит, у пяти — экзантематозные проявления, у одного — стоматит, у одного — паротит, у одного — шейный лимфаденит.
Двадцати одному ребенку (в возрасте 0,67–4,50 года, средний возраст 1,97) был поставлен клинический диагноз фебрильных судорог, если они соответствовали следующим пяти критериям: возраст от 6 месяцев до 5 лет; лихорадка >38°С; продолжительность приступа <15 минут; отсутствие инфекции ЦНС, определяемой с использованием стандартных методов, таких как бактериальная культура и выделение вируса; отсутствие стойких неврологических нарушений после приступа. Подробности о 21 пациенте сообщались ранее. 9 У остальных 201 обследованного ребенка (в возрасте 0,16–15,9 лет, средний возраст 3,87 года) не было ни характерной энантемы в полости рта, ни неврологических проявлений. Им поставили диагноз фарингит/тонзиллит. Из этих 201 больных у восьми был конъюнктивит, у пяти — экзантематозные проявления, у одного — стоматит, у одного — паротит, у одного — шейный лимфаденит.
Выделение вируса
Для выделения вируса использовали клетки Hep-2, Vero, RD-18S (линия клеток рабдомиомы человека), HMV-II (линия клеток злокачественной меланомы человека) и MDCK. Сливающиеся клеточные культуры высевали в лунки микропланшета и инокулировали 100 мкл поддерживающей среды и 50 мкл образцов мазка из зева. Культуры клеток инкубировали при 34°С в 5% СО 2 и наблюдали в течение семи дней за цитопатическим эффектом. Затем однократно проводили слепой пассаж, если не наблюдалось цитопатического эффекта. Изоляты вируса идентифицировали с помощью тестов на нейтрализацию с использованием сыворотки от Denka Seiken Co. Ltd (Токио, Япония), как первоначально сообщалось Шмидтом и его коллегами. 10
Сливающиеся клеточные культуры высевали в лунки микропланшета и инокулировали 100 мкл поддерживающей среды и 50 мкл образцов мазка из зева. Культуры клеток инкубировали при 34°С в 5% СО 2 и наблюдали в течение семи дней за цитопатическим эффектом. Затем однократно проводили слепой пассаж, если не наблюдалось цитопатического эффекта. Изоляты вируса идентифицировали с помощью тестов на нейтрализацию с использованием сыворотки от Denka Seiken Co. Ltd (Токио, Япония), как первоначально сообщалось Шмидтом и его коллегами. 10
ПЦР для выявления генома энтеровируса
Образцы мазка из горла, отрицательные на наличие вирусов при культуральном исследовании, были проверены на наличие генома энтеровируса при помощи ПЦР. Один метод вложенной ПЦР (ПЦР-FMU) был описан ранее. 6 Вкратце, РНК экстрагировали из 250 мкл каждого образца с использованием Isogen-LS (NipponGene, Токио, Япония) (набор с кислотным тиоцианатом гуанидиния). Нуклеиновую кислоту осаждали центрифугированием, однократно промывали 70%-ным этанолом, сушили и растворяли в 10 мкл стерильной воды. Синтез кДНК проводили с использованием 2,5 ед. обратной транскриптазы вируса мышиного лейкоза Молони (Toyobo, Осака, Япония) из 3 мкл ресуспендированной РНК. Аликвоту 10 мкл продукта кДНК использовали в качестве матрицы для амплификации с использованием ДНК-полимеразы Taq (Perkin-Elmer, Norwalk, CT). Праймеры нацелены на 5′-некодированную область последовательности коксакивируса B1, 11 , как сообщили Золл и его коллеги. 5 F1 (5′-CAAGCACTTCTGTTTCCCCGG), комплементарную геномной смысловой РНК в положениях 160–180, и R1 (5′-ATTGTCACCATAAGCAGCCA), антисмысловая РНК 580–599, использовали для первого раунда амплификации; F2 (5′-TCCTCCGGCCCC TGAATGCG) смысловые положения 445–464 и R1 использовали для второго раунда амплификации. Продукты помещали в 2% агарозные гели бромистого этидия и фотографировали в ультрафиолетовом свете. Ожидалось, что положительная реакция ПЦР будет давать полосу из 155 пар оснований (п.н.). ПЦР с использованием этих общих праймеров позволяет обнаружить 60 из 66 различных серотипов энтеровирусов; не наблюдалось продукта амплификации вирусов Коксаки типов A11, A17 и A24 и эховирусов типов 16, 22 и 23.
Синтез кДНК проводили с использованием 2,5 ед. обратной транскриптазы вируса мышиного лейкоза Молони (Toyobo, Осака, Япония) из 3 мкл ресуспендированной РНК. Аликвоту 10 мкл продукта кДНК использовали в качестве матрицы для амплификации с использованием ДНК-полимеразы Taq (Perkin-Elmer, Norwalk, CT). Праймеры нацелены на 5′-некодированную область последовательности коксакивируса B1, 11 , как сообщили Золл и его коллеги. 5 F1 (5′-CAAGCACTTCTGTTTCCCCGG), комплементарную геномной смысловой РНК в положениях 160–180, и R1 (5′-ATTGTCACCATAAGCAGCCA), антисмысловая РНК 580–599, использовали для первого раунда амплификации; F2 (5′-TCCTCCGGCCCC TGAATGCG) смысловые положения 445–464 и R1 использовали для второго раунда амплификации. Продукты помещали в 2% агарозные гели бромистого этидия и фотографировали в ультрафиолетовом свете. Ожидалось, что положительная реакция ПЦР будет давать полосу из 155 пар оснований (п.н.). ПЦР с использованием этих общих праймеров позволяет обнаружить 60 из 66 различных серотипов энтеровирусов; не наблюдалось продукта амплификации вирусов Коксаки типов A11, A17 и A24 и эховирусов типов 16, 22 и 23.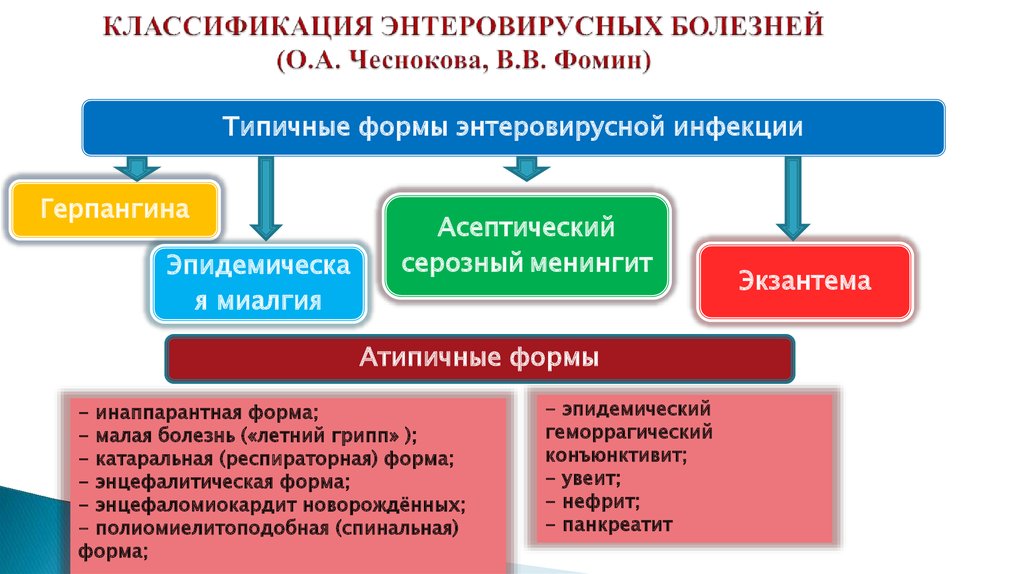 5 Чувствительность PCR-FMU, рассчитанная по экстракциям серийных разведений титрированного эховируса типа 7, соответствовала 10 -3 TCID 50 /мл. 6 Отрицательные контроли были включены для каждого этапа анализа.
5 Чувствительность PCR-FMU, рассчитанная по экстракциям серийных разведений титрированного эховируса типа 7, соответствовала 10 -3 TCID 50 /мл. 6 Отрицательные контроли были включены для каждого этапа анализа.
ПЦР для типирования энтеровирусов
Образцы, положительные с помощью ПЦР-FMU, были проверены на наличие последовательностей генома энтеровирусов с использованием ПЦР-MBCL в биоклинической лаборатории Mitsubishi Kagaku (MBCL). Праймеры были установлены в 5′-некодируемой области и области VP2: OL68-1 (5′-GGTAAYTTCCACCACCANCC) 7 , комплементарная геномной смысловой РНК в положениях 1178–1197, и MD91 (5′-CCTCCGGCCCCTGAATGCGGCTAAT) 4 антисмысловая РНК в положениях 444–468 аттенуированного штамма полиовируса Sabin 1, 12 , использовали для первого раунда амплификации; OL68-1 и EVP4 (5′-CTACTTTGGGTGTCCGTGTT) 4 антисмысловая РНК в положении 541–560 использовали для второго раунда амплификации. ПЦР-MBCL амплифицирует продукт размером примерно 650 п.н., включая часть 5′-некодирующей области, полную область VP4 и 5′-конец области VP2. Этот метод выявил все 64 протестированных штамма прототипа энтеровируса. 13 Чувствительность ПЦР-МККЛ соответствовала приблизительно 10 -1 -10 -2 TCID 50 /мл. 9
ПЦР-MBCL амплифицирует продукт размером примерно 650 п.н., включая часть 5′-некодирующей области, полную область VP4 и 5′-конец области VP2. Этот метод выявил все 64 протестированных штамма прототипа энтеровируса. 13 Чувствительность ПЦР-МККЛ соответствовала приблизительно 10 -1 -10 -2 TCID 50 /мл. 9
Продукты ПЦР выделяли из геля, очищали и секвенировали на автоматическом ДНК-секвенаторе с использованием флуоресцентного дидезокси-терминатора цепи. База данных MBCL для полной области VP4 всех 64 энтеровирусов человека была создана на основе данных секвенирования нуклеотидов области VP4 49 прототипов штаммов энтеровирусов и 15 ранее опубликованных последовательностей энтеровирусов, полученных из GenBank. 13 Последовательности VP4 из каждого продукта ПЦР были филогенетически проанализированы вместе с последовательностями прототипов в базе данных MBCL с использованием программы SINCA (Fujitsu Limited, Токио, Япония). Генетические расстояния были оценены с использованием двухпараметрического метода Кимуры, а неукорененные филогенетические деревья были построены с использованием метода объединения соседей. Статистическая значимость филогений с использованием объединения соседей оценивалась с помощью бутстрап-анализа с 1000 передискретизациями наборов данных.
Генетические расстояния были оценены с использованием двухпараметрического метода Кимуры, а неукорененные филогенетические деревья были построены с использованием метода объединения соседей. Статистическая значимость филогений с использованием объединения соседей оценивалась с помощью бутстрап-анализа с 1000 передискретизациями наборов данных.
Диагностика энтеровирусной инфекции
Диагноз энтеровирусной инфекции был поставлен, когда энтеровирус был обнаружен в образцах мазка из зева с помощью клеточной культуры и/или ПЦР. Обнаружение энтеровируса в любой локализации, за исключением нижних отделов кишечника, обычно считается причинно-следственной связью с конкретным заболеванием.
РЕЗУЛЬТАТЫ
Выделение вируса
Вирус Коксаки А16 и вирус простого герпеса типа 1 были выделены из одного из 24 образцов мазков из зева, взятых у пациентов с клинически диагностированной герпетической ангиной (см. таблицу 1). Вирус не был выделен из 21 образца, взятого у пациентов с фебрильными судорогами.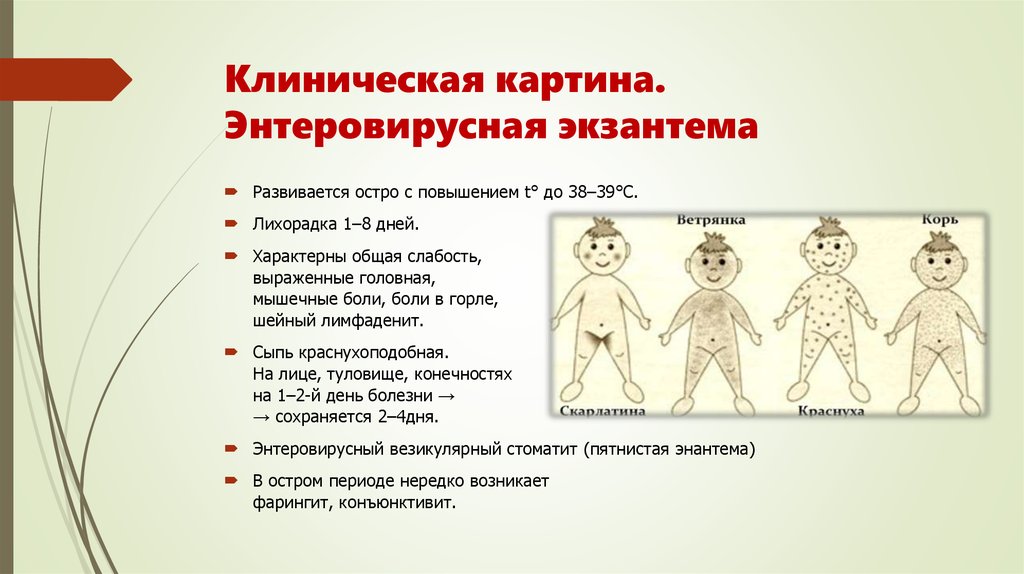 От 66 (32,8%) из 201 больного с другими лихорадочными заболеваниями в летние месяцы выделено 66 вирусов (32 энтеровируса, 31 аденовирус, 2 вируса парагриппа и 1 вирус простого герпеса).
От 66 (32,8%) из 201 больного с другими лихорадочными заболеваниями в летние месяцы выделено 66 вирусов (32 энтеровируса, 31 аденовирус, 2 вируса парагриппа и 1 вирус простого герпеса).
Таблица 1
Обнаружение и идентификация вирусов в мазке из зева с использованием клеточной культуры
Скрининг на наличие энтеровируса с помощью ПЦР Культуры тканей идентифицировали с помощью ПЦР-ФМУ в 17/22 образцах, взятых у больных герпангиной, 11/21 образцах, взятых у больных с фебрильными судорогами, и 26/135 образцах, взятых у больных фарингитом/тонзиллитом в летние месяцы (см. табл. 2). . Геном энтеровируса был обнаружен в образцах от одного пациента с фарингитом/тонзиллитом, ассоциированным с экзантемой, и одного пациента со стоматитом.
Таблица 2
Обнаружение и идентификация вирусов из мазков из зева с помощью полимеразной цепной реакции
Идентификация энтеровирусов с помощью филогенетического анализа
Таблица 2). Положительные результаты получены в 14/17 пробах от больных герпетической ангиной, во всех 11 пробах от больных с фебрильными судорогами и в 16/26 пробах от больных фарингитом/тонзиллитом. Так, наличие энтеровирусного генома было подтверждено у 41 (75,9%) из 54 испытанных образцов. Филогенетический анализ с использованием области, кодирующей белок VP4 (207 п.н.), 64 штаммов-прототипов энтеровирусов из базы данных MBCL дал четыре основных кластера. Анализ последовательностей продуктов ПЦР позволил идентифицировать генотипы энтеровирусов. Генотипы всех 14 энтеровирусов, выявленных в образцах больных герпетической ангиной, 8/11 энтеровирусов, выявленных в образцах больных с фебрильными судорогами, и всех 16 энтеровирусов, выявленных в образцах больных фарингитом/тонзиллитом, входили в А-кластер энтеровирусов (Коксаки-группа А). -подобный генотип).
Положительные результаты получены в 14/17 пробах от больных герпетической ангиной, во всех 11 пробах от больных с фебрильными судорогами и в 16/26 пробах от больных фарингитом/тонзиллитом. Так, наличие энтеровирусного генома было подтверждено у 41 (75,9%) из 54 испытанных образцов. Филогенетический анализ с использованием области, кодирующей белок VP4 (207 п.н.), 64 штаммов-прототипов энтеровирусов из базы данных MBCL дал четыре основных кластера. Анализ последовательностей продуктов ПЦР позволил идентифицировать генотипы энтеровирусов. Генотипы всех 14 энтеровирусов, выявленных в образцах больных герпетической ангиной, 8/11 энтеровирусов, выявленных в образцах больных с фебрильными судорогами, и всех 16 энтеровирусов, выявленных в образцах больных фарингитом/тонзиллитом, входили в А-кластер энтеровирусов (Коксаки-группа А). -подобный генотип).
Энтеровирусы, принадлежащие к коксакивирусу А5-подобного генотипа, которые были идентифицированы в образцах пациентов с герпетической ангиной, фебрильными судорогами и фарингитом/тонзиллитом в течение двух лет, сформировали два отчетливых кластера (рис. 1). Кластеры связаны с годом, когда были взяты образцы, а не с типом заболевания. Аналогичные кластеры были и у других генотипов.
1). Кластеры связаны с годом, когда были взяты образцы, а не с типом заболевания. Аналогичные кластеры были и у других генотипов.
Рисунок 1
Филогенетическое дерево 64 прототипов энтеровирусов и 38 энтеровирусов, выявленных у больных с лихорадкой в течение двух лет. Филогенетическое дерево было построено на основе нуклеотидных последовательностей кодирующей области белка VP4. Шестьдесят четыре прототипа штаммов энтеровирусов были разделены на четыре генетических кластера (A, B, C и D). Все 14 энтеровирусов, выявленных у больных герпетической ангиной (Her), 8/11 энтеровирусов, выявленных у больных с фебрильными судорогами (ФС), и все 16 энтеровирусов, выявленных у больных фарингитом/тонзиллитом (ФТ), входили в кластер А энтеровирусов (группа вирусов Коксаки). А-подобный генотип). Генотипы вируса Коксаки группы А, обнаруженные при герпетической ангине, фебрильных судорогах и фарингите/тонзиллите за два лета, были четко сгруппированы в зависимости от года, когда были взяты образцы (19). 97 или 1998), а не от типа болезни.
97 или 1998), а не от типа болезни.
При сравнении исходных характеристик (возраст, степень лихорадки или количество дней после начала заболевания, когда были взяты образцы) среди всех пациентов с коксакивирусной инфекцией группы А, пациентов с герпангиной (2,34 (1,45) года) и фебрильными судорогами (1,94 (1,05) ) лет) были моложе, чем больные фарингитом/тонзиллитом (4,39 (3,38) года). Среди лиц с фарингитом/тонзиллитом существенных различий в исходных характеристиках не было, в то время как выделялись группы, инфицированные вирусами Коксаки группы А, другими энтеровирусами или аденовирусами.
ОБСУЖДЕНИЕ
В целом, вирусы Коксаки группы А (за исключением некоторых серотипов, таких как А9, А10 и А16) редко выделяют с помощью стандартных методов культивирования тканей. В настоящем исследовании только один (А16) из 33 выделенных энтеровирусов был вирусом Коксаки группы А. Недавно разработанные методы ПЦР очень чувствительны для обнаружения большинства геномов энтеровирусов в различных образцах. 4– 6 Также сообщалось о методе ПЦР для специфического обнаружения вирусов Коксаки группы А, 14 , но не смог определить серотип (генотип) энтеровируса. Филогенетический анализ последовательностей энтеровирусного генома VP-1 позволил классифицировать энтеровирусные генотипы. 8 Исследования выравнивания секвенированных энтеровирусов выявили высококонсервативные последовательности в 5′-некодирующей области и области VP2. Когда праймеры были установлены в этих консервативных областях, методы ПЦР могли обнаружить большинство серотипов энтеровирусов. 5, 7 Последующий филогенетический анализ полных последовательностей VP4 между 5′-некодирующей областью и областью VP2 позволил нам идентифицировать генотипы энтеровирусов. 9, 13 Поскольку для идентификации вируса не требуется выделение вируса, ожидается, что комбинация обнаружения вируса на основе ПЦР и идентификации вируса на основе филогенетического анализа будет полезна для обнаружения и идентификации вирусов Коксаки группы А.
4– 6 Также сообщалось о методе ПЦР для специфического обнаружения вирусов Коксаки группы А, 14 , но не смог определить серотип (генотип) энтеровируса. Филогенетический анализ последовательностей энтеровирусного генома VP-1 позволил классифицировать энтеровирусные генотипы. 8 Исследования выравнивания секвенированных энтеровирусов выявили высококонсервативные последовательности в 5′-некодирующей области и области VP2. Когда праймеры были установлены в этих консервативных областях, методы ПЦР могли обнаружить большинство серотипов энтеровирусов. 5, 7 Последующий филогенетический анализ полных последовательностей VP4 между 5′-некодирующей областью и областью VP2 позволил нам идентифицировать генотипы энтеровирусов. 9, 13 Поскольку для идентификации вируса не требуется выделение вируса, ожидается, что комбинация обнаружения вируса на основе ПЦР и идентификации вируса на основе филогенетического анализа будет полезна для обнаружения и идентификации вирусов Коксаки группы А. Тридцать восемь (92,7%) из 41 энтеровируса, идентифицированного этими методами из образцов, в которых вирус не был выделен культурой ткани, были вирусами Коксаки группы А при генотипировании.
Тридцать восемь (92,7%) из 41 энтеровируса, идентифицированного этими методами из образцов, в которых вирус не был выделен культурой ткани, были вирусами Коксаки группы А при генотипировании.
Вирусы Коксаки группы А считаются основными возбудителями герпетической ангины. ПЦР-ФМУ выявил энтеровирусы у 17 из 22 пациентов с культурально-негативной герпангиной, из которых у 14 (82,4 %) энтеровирусный геном был обнаружен с помощью ПЦР-МВКЛ. Это указывает на то, что эти два метода имеют разную чувствительность. Все 15 энтеровирусов, идентифицированных с помощью клеточной культуры и ПЦР-MBCL, были вирусами Коксаки группы А. Наши результаты подтверждают, что энтеровирусы, и особенно вирусы Коксаки группы А, являются важными возбудителями лихорадочных заболеваний, связанных с фебрильными судорогами в летний период. Возбудители острого фарингита/тонзиллита выявлены у 92 (45,8%) из 201 больного. Распространенными патогенами были энтеровирусы (58/92), за которыми следовали аденовирусы (35/92). Из 48 энтеровирусов, идентифицированных как с помощью клеточной культуры, так и с помощью ПЦР-МВКЛ, 16 (33,3 %) были вирусами Коксаки группы А. Не было выявлено существенных различий в исходных характеристиках (возраст, степень лихорадки и клинические признаки) групп, инфицированных вирусами Коксаки группы А, другими энтеровирусами или аденовирусами.
Из 48 энтеровирусов, идентифицированных как с помощью клеточной культуры, так и с помощью ПЦР-МВКЛ, 16 (33,3 %) были вирусами Коксаки группы А. Не было выявлено существенных различий в исходных характеристиках (возраст, степень лихорадки и клинические признаки) групп, инфицированных вирусами Коксаки группы А, другими энтеровирусами или аденовирусами.
Кластеризация по годам, показанная филогенетическим анализом изолятов вируса Коксаки группы А, а не по типу заболевания, указывает на то, что вирусы, преобладающие каждый год, вызывают различные лихорадочные заболевания в летнее время, включая герпетическую ангину, фебрильные судороги и фарингит/тонзиллит.
В заключение, ПЦР и последующий филогенетический анализ амплифицированных последовательностей очень полезны для обнаружения и идентификации энтеровирусов и, таким образом, для диагностики вирусов Коксаки группы А. Методы также будут полезны для изучения молекулярной эпидемиологии энтеровирусных инфекций.
ССЫЛКИ
- ↵
Вишневый JD .
 Энтеровирусы: коксакивирусы, эховирусы и полиовирусы. В: Фейгин Р.Д., Черри Д.Д., ред. Учебник детских инфекционных болезней , 4-е изд. Филадельфия, Пенсильвания: WB Saunders Company, 1998:1787–839.
Энтеровирусы: коксакивирусы, эховирусы и полиовирусы. В: Фейгин Р.Д., Черри Д.Д., ред. Учебник детских инфекционных болезней , 4-е изд. Филадельфия, Пенсильвания: WB Saunders Company, 1998:1787–839. - ↵
Huebner RJ , Cole RM, Beeman EA, и др. . Герпангина: этиологические исследования конкретного инфекционного заболевания. JAMA1951;145:628–33.
- ↵
Kravis LP , Hummeler K, Sigel MM, и др. . Герпангина: клинические и лабораторные аспекты вспышки, вызванной вирусами Коксаки группы А. Педиатрия1953;11:113–19.
- ↵
Ротбарт HA . Ферментативная амплификация РНК энтеровирусов. J Clin Microbiol, 1990; 28:438–42.
- ↵
Zoll GJ , Melchers WJG, Kopecka H, и др. . Общая полимеразная цепная реакция, опосредованная праймерами, для обнаружения энтеровирусов: применение для рутинной диагностики и персистирующих инфекций.
 J Clin Microbiol, 1992; 30:160–5.
J Clin Microbiol, 1992; 30:160–5. - ↵
Hosoya M , Honzumi K, Suzuki H. Обнаружение энтеровируса с помощью полимеразной цепной реакции и культуры в спинномозговой жидкости детей с транзиторными неврологическими осложнениями, связанными с острым лихорадочным заболеванием. J Infect Dis1997;175:700–3.
- ↵
Олив DM , Аль-Муфти С., Аль-Мулла В., и др. . Обнаружение и дифференциация пикорнавирусов в клинических образцах после геномной амплификации. J Gen Virol1990;71:2141–7.
- ↵
Оберсте М.С. , Махер К., Килпатрик Д.Р., и др. . Молекулярная эволюция энтеровирусов человека: корреляция серотипа с последовательностью VP1 и применение к классификации пикорнавирусов. J Virol1999;73:1941–8.
- ↵
Хосоя М.
 , Сато М., Хонзуми К., и др. . Ассоциация неполиомиелитной энтеровирусной инфекции в центральной нервной системе детей с фебрильными судорогами. Pediatrics2001;107:E12.
, Сато М., Хонзуми К., и др. . Ассоциация неполиомиелитной энтеровирусной инфекции в центральной нервной системе детей с фебрильными судорогами. Pediatrics2001;107:E12. - ↵
Schmidt NJ , Melnick JL, Wennwe HA, и др. . Оценка пулов иммунных лошадиных сывороток к энтеровирусам для идентификации полевых штаммов вируса. Bull WHO 1971;45:317–30.
- ↵
Iizuka N , Kuge S, Nomoto A. Полная последовательность нуклеотидов генома вируса Коксаки B1.Virology1987;156:64–73.
- ↵
Номото А , Омата Т, Тойода Х, и др. . Полная нуклеотидная последовательность генома аттенуированного штамма полиовируса Sabin 1.Proc Natl Acad Sci U S A1982;79:5793–7.
- ↵
Ишико Х. , Симада Ю., Йонаха М.
 , и др. . Молекулярная диагностика энтеровирусов человека с помощью филогенетической классификации с использованием последовательности VP4. J Заразить Dis . Под давлением.
, и др. . Молекулярная диагностика энтеровирусов человека с помощью филогенетической классификации с использованием последовательности VP4. J Заразить Dis . Под давлением. - ↵
Gjoen KV , Bruu A-L. Специфическое обнаружение вирусов Коксаки А с помощью полимеразной цепной реакции. Clin Diagn Virol1997;8:183–8.
Читать полный текст или скачать PDF:
Подписаться
Войти под своим именем пользователя и паролем
Для личных счетов ИЛИ управляющих корпоративными счетами
Имя пользователя *
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
Антитела к вирусу Коксаки В | Справочник тестов ARUP Laboratories
Антитела к вирусу Коксаки B
0060055
Скопировано!
Рекомендации по заказу
Рекомендации, когда заказывать или не заказывать тест. Может включать связанные или предпочтительные тесты.
Может включать связанные или предпочтительные тесты.
ПЦР-тестирование предпочтительно для диагностики острой инфекции. Обнаружение нейтрализующих антител к вирусу Коксаки В.
Мнемоника
Уникальный идентификатор теста.
COX B
Методология
Процесс(ы), использованный(ые) для проведения теста.
Полуколичественная нейтрализация сыворотки
Выполнено
Дни недели, в которые проводится тест.
Пн-Пт
Сообщено
Ожидаемое время обработки результата, начиная с момента получения образца ARUP.
6–12 дней
Статус утверждения Департамента здравоохранения Нью-Йорка
Указывает на то, что тест одобрен Департаментом здравоохранения штата Нью-Йорк.
Этот тест одобрен Департаментом здравоохранения Нью-Йорка.
Требуемый образец
Подготовка пациента
Сбор
Пробирка для сепарации сыворотки (SST) или обычная красная.
Подготовка образцов
Отделить от клеток как можно скорее или в течение 2 часов после сбора. Перенесите 1 мл сыворотки в стандартную транспортную пробирку ARUP. (Минимум: 0,3 мл) Параллельное тестирование является предпочтительным, и образцы выздоравливающих должны быть получены в течение 30 дней после получения образцов острого заболевания.
Температура хранения/транспортировки
Охлажденный.
Неприемлемые условия
ЦСЖ или плазма. Загрязненные, гемолизированные или сильно липемические образцы.
Стабильность
Окружающая среда: 48 часов; В холодильнике: 2 недели; Замороженный: 1 год (избегайте повторяющихся циклов замораживания/оттаивания)
Референтный интервал
Нормальный диапазон/ожидаемое значение(я) для конкретного болезненного состояния. Может также включать аномальные диапазоны.
Коксаки B1: менее 1:10
Коксаки B2: менее 1:10
Коксаки B3: менее 1:10
Коксаки B4: Меньше 1:10
Коксаки B5: Меньше 1:10
Коксаки B6: Меньше 1:10
Интерпретационные данные
Исходная информация для теста. Может включать информацию о заболевании, объяснение результатов пациента, рекомендации, подробности тестирования, сопутствующие заболевания, объяснение возможных результатов пациента.
Может включать информацию о заболевании, объяснение результатов пациента, рекомендации, подробности тестирования, сопутствующие заболевания, объяснение возможных результатов пациента.
Единичные положительные титры антител, превышающие или равные 1:80, могут указывать на перенесенную или текущую инфекцию. Сероконверсия или увеличение титров между сыворотками острых и выздоравливающих как минимум в четыре раза считается убедительным доказательством текущей или недавно перенесенной инфекции.
Категория соответствия
Стандарт
Примечание
Дополнительная информация, относящаяся к тесту.
История горячей линии
Просмотр истории горячей линии
Дата изменения
Имя теста.
Другое Изменение интерфейса
Новый тест
Неактивный
Н/Д
Коды CPT
Коды текущей процедурной терминологии Американской медицинской ассоциации (CPT), опубликованные в Справочнике лабораторных тестов ARUP, предоставляются только в информационных целях. Коды отражают нашу интерпретацию требований к кодированию CPT, основанную на рекомендациях AMA, публикуемых ежегодно. Коды
Коды отражают нашу интерпретацию требований к кодированию CPT, основанную на рекомендациях AMA, публикуемых ежегодно. Коды
CPT предоставляются только в качестве руководства для помощи клиентам в выставлении счетов. ARUP настоятельно рекомендует клиентам подтверждать коды CPT у своего административного подрядчика Medicare, поскольку требования могут различаться. 9Кодирование 0008 CPT является исключительной ответственностью стороны, выставляющей счет. ARUP Laboratories не несет ответственности за ошибки в выставлении счетов из-за использования опубликованных кодов CPT.
86658 x6
Вы клиент ARUP? Нажмите здесь, чтобы узнать цену.
Компоненты
Компоненты теста
| Код теста компонента* | Название схемы компонентов | ЧАСТЬ |
|---|---|---|
| 0065111 | Антитела к вирусу Коксаки B типа 1 | 5103-7 |
| 0065112 | Антитела к вирусу Коксаки B типа 2 | 5105-2 |
| 0065113 | Антитела к вирусу Коксаки B, тип 3 | 5107-8 |
| 0065123 | Антитела к вирусу Коксаки B, тип 5 | 5111-0 |
| 0065124 | Антитела к вирусу Коксаки B, тип 6 | 5113-6 |
| 0065130 | Антитела к вирусу Коксаки B, тип 4 | 5109-4 |
* Коды тестов компонентов нельзя использовать для заказа тестов.

 .. Все отлично, врачи у которых был, кардиолог и невролог, и могу сказать уверенно, что знают свою профессию, чтобы много не писать, скажу так… Если будут проблемы со здоровьем, то приду только сюда, и вам советую, а администратору отдельное спасибо за добрый и тёплый приём.
.. Все отлично, врачи у которых был, кардиолог и невролог, и могу сказать уверенно, что знают свою профессию, чтобы много не писать, скажу так… Если будут проблемы со здоровьем, то приду только сюда, и вам советую, а администратору отдельное спасибо за добрый и тёплый приём.
 , Токио 174-8555, Япония
, Токио 174-8555, Япония