Дисбактериоз кишечника: симптомы, лечение, причины, профилактика
Оглавление:
Общие сведения
В норме в желудочно-кишечном тракте проживает масса бактерий, которые выполняют самые разнообразные полезные функции: расщепляют растительную клетчатку, синтезируют витамины группы В, сдерживают размножение патогенных микроорганизмов и др. При дисбактериозе происходит изменение качественного и количественного состава микрофлоры кишечника — популяция полезных бифидо- и лактобактерий существенно уменьшается, а количество патогенных микроорганизмов растет.
Причины дисбактериоза кишечника
- длительный бесконтрольный прием антибиотиков;
- перенесенная острая кишечная инфекция;
- несбалансированное питание;
- хронические заболевания желудочно-кишечного тракта;
- злоупотребление алкоголем;
- тяжелые иммунодефициты (при лейкозе, СПИДе, лечении злокачественных опухолей лучевой и химиотерапией).

Симптомы дисбактериоза кишечника
Симптомы и проявления обычно связаны с заболеванием или состоянием, которое вызвало дисбактериоз, и являются неспецифичными:
Что можете сделать Вы
Лечение дисбактериоза – это длительный процесс. Поэтому ваша основная задача скрупулезно соблюдать назначения врача.
Лечение
Что может сделать врач
Диагностикой и лечением дисбактериоза, как правило, занимается терапевт. Для постановки диагноза требуется наличие определенной клинической картины, а также результаты следующих анализов: копрограмма (общий анализ кала) и микробиологический посев кала. Но для назначения грамотного лечения необходимо не только установить наличие дисбактериоза, но и выявить его причину. В каждом конкретном случае могут потребоваться разный набор дополнительных исследований.
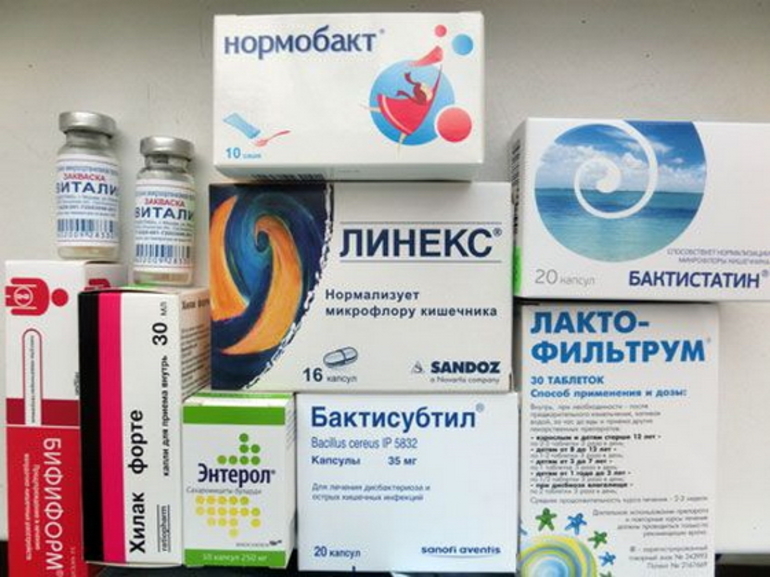
Лекарственные препараты, используемые при дисбактериозе, разделяют на пробиотики и пребиотики.
Пробиотики содержат в себе живые микроорганизмы — молочнокислые бактерии, чаще бифидо- или лактобактерии, которые относятся к нормальным обитателям кишечника здорового человека. Пребиотики – это вещества, создающие среду для роста полезных бактерий. В большинстве случаев для лечения дисбактериоза бывает достаточно вновь заселить кишечник здоровой микрофлорой. А она сама победит патогенные микроорганизмы. Иногда все же для борьбы с патогенной флорой приходится использовать антибиотики. Лечение проводится не менее 4-6 недель с последующим контролем эффективности терапии.
Профилактика
Немаловажное значение для профилактики дисбактериоза имеет рациональный режим питания и сбалансированный состав пищи. При назначении антибиотиков параллельно рекомендуется применять препараты, поддерживающие рост и развитие нормальной микрофлоры. Будущим мамам следует знать, что вскармливание грудным молоком защищает малышей от дисбактериоза с самого рождения.
Как победить состояние дисбактериоза у детей?
Дисбактериоз в последнее время — весьма распространённое состояние у детей, особенно у грудничков.
— Вадим Леонидович, дисбактериоз некоторые врачи считают болезнью. Каково Ваше мнение по этому поводу?
— Дисбактериоз – это состояние, которое может развиваться при различных заболеваниях или неблагоприятных окружающих условиях человека. Приведу простой пример: вы сидите на лекции или в кино, в зале душно нарастает количество углекислого газа в воздухе. В этой ситуации постепенно начинает развиваться состояние дисбактериоза. На работе отругал начальник, человек получил новую порцию стресса, усилилась моторика кишечника, положено начало к развитию состояния дисбактериоза. На нормальную кишечную флору, и не только кишечную, но и на флору всех полостных органов влияет: неправильное питание, плохая экология, изменение климата, различные ионизирующие излучения, которые окружают человека в повседневной жизни, воспалительные заболевания, прием лекарственных средств. Но это не болезнь – это изменение флоры (состояние временное) в зависимости от внешних условий воздействия.
— Дисбактериоз может быть только в кишечнике или этому подвержены все слизистые оболочки организма?
— Нарушенная кишечная флора будет отрицательно действовать на слизистую всех полостных органов в которых она имеется (полость рта, пищевод, желудок, кишечник, влагалище и др.). Здесь появляется цепочка взаимосвязей: болезнь слизистой кишки влияет на состояние микрофлоры, нарушенная микрофлора – на слизистую.
— По каким признакам родители могут определить, что у ребенка имеется состояние дисбактериоза?
— Родителям стоит задуматься, если у ребенка снижается аппетит, ребенок бледный с синюшными кругами под глазами и под носом. Если у ребенка периодически отмечается подташнивание, бурчание и боли в животе, меняется стул, в кале присутствует зелень или кусочки непереваренной пищи. Ребенок плохо прибавляет в весе, срыгивает, начинает часто болеть простудными заболеваниями. Возможно, вечером, а именно в семь часов, отмечается субфебрильная температура — 37,1-37,2.
 При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.
При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.— При изменении кишечной микрофлоры ребенка в худшую сторону происходит снижение иммунитета. Когда у ребенка появляются частые простудные заболевания, это тоже говорит о том, что органы пищеварения не позволяют иметь 100%-ный иммунитет. Ведь у человека иммунитет на 98% зависит от состояния микрофлоры толстой кишки. И когда она нарушается, иммунитет падает, а, значит, появляются частые простуды.
— То есть, если у родителей часто болеет ребенок, они должны задуматься о посещении гастроэнтеролога?
— Как один из моментов. Мы знаем, что многие болезни: кожи, зубов, слизистых, вплоть до бронхиальной астмы, – это порой осложнение болезней органов пищеварения. Когда мне задают подобные вопросы, я сразу вспоминаю один случай: выходит конферансье на сцену и говорит: «У меня сегодня что-то болит голова».
 Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.
Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.— Как врач определяет наличие у ребенка состояния дисбактериоза?
— Когда ребенок сдает анализ, все эти факторы обследуются досконально?
— Нет, конечно.

— Тогда получается нельзя с точностью определить у ребенка наличие дисбактериоза?
— Без учета данных факторов нельзя. Поэтому многие родители, когда обращаются к нам за помощью, часто удивляются, почему мы спрашиваем все тонкости и подробности питания, которые в принципе никто никогда не спрашивает. Поэтому мы положительно отличаемся и в плане лечения, и в плане диагностики, и в плане результата. И поэтому к нам всегда огромная очередь.
— Какие методы лечения состояния дисбактериоза существуют и надо ли его вообще лечить?
— Лечить обязательно надо! Начинать лечение необходимо с основного заболевания, приведшего к этому состоянию или с той причины, которая привела к нему. Естественно, первично назначаются лекарственные препараты, которые воздействуют непосредственно на устранение основной причины. Предположим, у ребенка имеется гастрит, проводится его лечение и плюс назначаются препараты улучшающие микрофлору кишечника ребенка. Если ребенок находится в помещениях, где имеются различные домашние «приборы-излучатели» (телевизор, компьютер, микроволновая печь, радиотелефон, и другие, то, соответственно, их необходимо использовать, как можно реже.
 Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.— Врач сможет точно определить, отчего именно развился дисбактериоз?
— Чаще всего, мы видим причину.
— Существует ли профилактика дисбактериоза?
— В первую очередь необходимо следить за состоянием здоровья ребенка. Обязательно нужно придерживаться принципов здорового питания. В ежедневном рационе ребенка должна содержаться растительная клетчатка (овощи, фрукты, зерновые каши), которая способствует восстановлению кишечной микрофлоры. Естественно, набор должен быть полный: микроэлементы, витамины, ферменты. В рационе должна преобладать растительная пища, обязательно ребенку необходимо употреблять кисломолочные продукты и белки, в виде яиц, мяса, курицы, рыбы.
 Это будет способствовать восстановлению нормальной кишечной флоры.
Это будет способствовать восстановлению нормальной кишечной флоры.— Можно вести здоровый образ жизни, но ведь от стрессов и излучений уберечься гораздо сложнее. Какой выход в этом случае?
— Единственный – избавиться от источника негатива. Если, допустим, у вас стресс на работе, то нужно заменить место работы. И это абсолютно серьезно, ведь мы живем один раз. Быть в постоянном стрессе и лечиться от болезней – это не лучшее решение проблемы. Это просто бессмысленно. Не зря считают японцы, что место работы надо менять один раз в пять лет. И на каждом предприятии у них имеется комната разгрузки, в которой стоят муляжи начальников. Если начальник тебя обидел, заходишь в эту комнату и имеющейся там палкой лупишь по данному муляжу. Начальника, чей муляж разрушается быстрее остальных, увольняют с предприятия. Это и есть профилактика болезней у сотрудников и борьба за более высокую производительность на предприятии.
— Получается, что также не рационально жить в Челябинской области, где экология не самая лучшая?
— Безусловно, проживать у Средиземного моря или в горах Грузии гораздо полезнее, чем в Челябинской области.
 Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.— А какова роль наследственности в развитии болезней ЖКТ?
— Безусловно, большую роль в здоровье ребенка играет здоровье его родителей. Они передают ему предрасположенность к заболеваниям органов пищеварения. Если мама нездорова, то качество ее грудного молока будет низким, что является следующим фактором не в пользу ребенка.
— Во время грудного вскармливания мама должна соблюдать особый режим питания или диету?
— Питание должно быть полноценным и разнообразным.
 При наличии заболеваний ЖКТ у матери с профилактической целью могут быть назначены лекарства, улучшающие ее состояние. На это мама сама должна обратить внимание врача-гинеколога, потому что ее состояние здоровья на момент рождения ребенка играет большую роль в формировании здоровья малыша. В частности, насколько полноценным будет состав его микрофлоры кишечника. Ведь заселение нормальных микробов в кишечник ребенка происходит в утробе матери, начиная 26-28 недели.
При наличии заболеваний ЖКТ у матери с профилактической целью могут быть назначены лекарства, улучшающие ее состояние. На это мама сама должна обратить внимание врача-гинеколога, потому что ее состояние здоровья на момент рождения ребенка играет большую роль в формировании здоровья малыша. В частности, насколько полноценным будет состав его микрофлоры кишечника. Ведь заселение нормальных микробов в кишечник ребенка происходит в утробе матери, начиная 26-28 недели.— Какие продукты детям не рекомендуется употреблять в пищу?
— Существует пять основных вредных продуктов – это газированные напитки, майонез, кетчуп, чипсы и жевательная резинка. Это все продукты генной инженерии. Например, длительное использование жевательной резинки приводит к слабоумию (наличие в ней фенолов). Более того, она покрыта вредным вкусообразующим веществом. А частое ее использование ведет к нарушению пищевого рефлекса. И в следующий раз при глотании пищи желудок не будет готов к ее перевариванию.
— А какие продукты лучше не давать до трех лет?
— Все продукты до трех лет должны быть натуральными, не консервированными! Использовать их можно в сыром или вареном виде. Жареное и копченое, маринованное, шоколадное, естественно, нельзя. Хотя в последнее время надо уже говорить и о вредных привычках у детей раннего возраста, когда малышам матери начинают давать по чайной ложке водки на ночь, чтобы они лучше спали. А для аппетита детям стали давать пиво. Это встречается достаточно часто в последнее время. К нам поступают дети раннего возраста с циррозом печени, потому что мама, вскармливая ребенка грудью, употребляла алкогольные напитки и курила.
— Как вы относитесь к употреблению молока в питании детей?
— Учитывая тот факт, что идеально здоровых детей нет, употребление молока многим из них может быть не на пользу. Молоко может способствовать излишнему росту микрофлоры, а порой, организм ребенка не способен его переварить (лактазная недостаточность).
 Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.
Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.— Если ребенок вынужден принимать антибиотики, что нужно делать в профилактических целях, чтобы не развился дисбактериоз?
— Лучше всего прием антибиотиков сочетать с отваром трав, например, тысячелистника, подорожника, ромашки или душицы. Они на 80% снижают отрицательное воздействие антибиотиков на слизистую кишечника и его микрофлору.
— Как часто встречаются заболевания органов пищеварения?
— Заболевания желудочно-кишечного тракта у детей находятся на втором месте после респираторных инфекций. И это если учесть, что ребенок болеет ОРВИ 2-3 раза за год, а диагноз заболевания ЖКТ ставится однократно.
— Вы лечите детей только с области или из Челябинска тоже?
— ЧОДКБ обслуживает жителей Челябинской области вне зависимости от ее территорий, то есть сюда входит и Челябинск. Но учитывая тот факт, что в Челябинске имеются в достаточном количестве гастроэнтерологические койки и специалисты, диагностика тоже на высоком уровне, мы стараемся брать из Челябинска только самые тяжелые и сложные случаи.
 И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.
И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.— Каким образом дети попадают к вам?
— Они приезжают по направлению врачей из территорий области на консультативный прием в детскую областную поликлинику к специалисту-гастроэнтерологу. Осмотрев ребенка, и проведя необходимые исследования, врач решает необходимость его госпитализации или лечения в амбулаторных условиях. Вторым вариантом прибытия пациента в областную детскую поликлинику или на госпитализацию в отделение является осмотр врача-гастроэнтеролога «выездной поликлиники». Это когда наши специалисты консультируют детей по месту их проживания.
Ольга Мельчакова, информационное агентство «Уралпресс»
Дисбактериоз кишечника / Статьи
Под дисбактериозом кишечника зачастую подразумевают заболевание, но по словам работников медицинской сферы, точнее вести речь о синдроме, когда нарушается количественный и качественный состава микрофлоры. В здоровом кишечнике превалирую полезные бактерии – в случае дисбактериоза они гибнут, и на их место приходят микроорганизмы патогенного характера.
В здоровом кишечнике превалирую полезные бактерии – в случае дисбактериоза они гибнут, и на их место приходят микроорганизмы патогенного характера.
В чем здесь заключается опасность?
- Нарушается обмен веществ.
- Ухудшается синтез витаминов
- Ухудшается выработка микро – и макроэлементов.
Этот синдром ведет к появлению авитаминоза хронического характера, к развитию неспособности организма противостоять заболеваниям. Из-за недостатка витамина B «падает» зрение, образуется конъюнктивит и прочие глазные заболевания. Дефицит витамина A провоцирует дерматит и сухость кожи. Проблемы с витамином D – хрупкие кости и даже остеопороз. Вообще проблем со здоровьем из-за дисбактериоза существует масса.
Причины возникновения и способы борьбы с недугом
Стрессы – пусковые факторы для развития дисбактериоза, а также прием пищи и воды, несвойственных человеку (например, в заграничных поездках), а также инфекции, прием антибиотиков.
Кроме того, важно смотреть и на повседневную деятельность человека – дисбактериоз могут «заработать» лица, которые злоупотребляют чипсами, газировкой, шоколадом, консервированными продуктами.
По этой причине в период лечения сильнодействующими лекарствами или в отпуске нужно сберечь микрофлору и пить препараты натурального происхождения, в которых есть полезные бактерии для всего кишечника. «Линекс», например, способствует восстановлению бактериального баланса в организме. В качестве профилактики и дополнительных мер нужна организация правильного питания- есть больше кисломолочных продуктов, фрукты, овощи, каши. Топинамбур богат олигосахаридами, что стимулирует рост полезных кишечных бактерий.
Расстройство пищеварения – это первый тревожный маячок, показывающий на дисбактериоз. Вздутие живота, диарея, кишечный дискомфорт должны насторожить! Здесь настоятельно применять средства для снятия симптомов «Имодиум», «Лопедиум» и «Смекта», но лишь для облегчения на время. Симптомы довольно быстро возвращаются.
Изменения веса в обе стороны — резкий набор или похудение – тоже говорят о проблеме. Также должны вызвать закономерное беспокойство высыпания на коже.
Все причисленное в сочетании с ослабленным иммунитетом – просто-таки призыв обратиться к специалисту и сдать анализы на возможный дисбактериоз кишечника.
Если диагноз подтвердится, терапевт или гастроэнтеролог назначает курс лечения, т.е. ряд процедур, в ходе которых восстанавливается состав микрофлоры кишечника.
причины, признаки, диагностика, лечение — Медцентр «Надежда»
Дисбактериоз, лечение которого является необходимостью, характеризуется состоянием, которое видоизменяет состав микроорганизмов, находящихся в кишечнике. Это, как правило, способствует нарушению работы желудочно – кишечного тракта.
Дисбактериоз кишечника: симптомы
Как и любое заболевание, дисбактериоз кишечника имеет предпосылки появления. Дисбактериоз у взрослых имеет следующие причины:
- чрезмерный прием антибиотиков;
- наличие кишечных инфекций;
- наличие заболеваний органов пищеварения, к примеру, гастрит, язва и прочее;
- неправильное питание;
- пониженный иммунитет.
Дисбактериоз у детей также имеет ряд существенных причин, к ним можно отнести:
- позднее начало кормления грудью;
- кормление смесями;
- неправильное питание;
- нарушенная моторика кишечника;
- хронические болезни желудка;
- пищевые аллергические реакции;
- попадание инфекции.

Дисбактериоз кишечника у взрослых и детей имеет одинаковые симптомы. Недуг характеризуется появлением вредных грибков и бактерий. Они в кратчайшие сроки разрушают микрофлору. Таким образом, пациент получает нарушение пищеварения. В случае игнорирования лечения дисбактериоза у взрослых, симптомы будут ухудшаться. Начнут появляться сильные болевые ощущения, а также нарушение усвоения витаминов и полезных веществ, что приведет к резкому понижению веса.
Дисбактериоз кишечника: лечение
Прежде всего, лечение недуга предполагает обращение к врачу, а именно гастроэнтерологу. Он сможет провести диагностику и на ее основе назначить необходимый курс лечения.
Лечение дисбактериоза у взрослых предполагает следующие процедуры:
- Строгая диета. В рацион необходимо включить кисломолочные продукты, которые обогатят организм бифидобактериями.
- Прием антибиотиков, который поможет избавиться от бактерий наносящих вред организму.
- Специализированные медикаменты, которые помогут нормализировать микрофлору кишечника, к примеру, бификол, хиллак, линекс.

Лечение дисбактериоза кишечника у взрослых, как правило, восстанавливает микрофлору кишечника по истечении двух месяцев. Но стоит помнить о том, что микрофлора очень чувствительна к различным воздействиям. Для уменьшения рисков повторного заболевания необходимо уделить должное внимание вашему здоровью.
Дисбактериоз: нужен баланс!
13 января 2021
В кишечнике обитает огромное количество бактерий. “Полезные” микроорганизмы участвуют в важнейших процессах пищеварения, усвоения питательных веществ, поддержания иммунитета и др.
Болезнетворных бактерий значительно меньше, однако они только и ждут, когда смогут “захватить” организм.
При нарушении здоровой микрофлоры кишечника баланс между “полезными” и болезнетворными микроорганизмами смещается в сторону уменьшения первых и увеличения вторых. В этом случае говорят о дисбактериозе. Как сохранить идеальный баланс микрофлоры?
В этом случае говорят о дисбактериозе. Как сохранить идеальный баланс микрофлоры?
Причины дисбактериоза
К факторам, влияющим на микрофлору кишечника, относятся:
- Несбалансированный рацион питания, пристрастие к фаст-фуду, бесконтрольные диеты.
- Прием некоторых лекарственных препаратов, например антибиотиков или гормональных средств. Такие препараты необходимо принимать только по назначению врача.
- Эндокринные заболевания, хронические болезни органов пищеварения, нарушение моторики кишечника, а также кишечные инфекции.
- Вредные привычки: курение, злоупотребление алкоголем.
- Сильный стресс, резкая смена образа жизни, снижение иммунитета.
Признаки нарушения баланса
О том, что микрофлора кишечника нарушена свидетельствуют такие симптомы:
- регулярные запоры;
- диарея;
- тошнота, чувство тяжести в желудке, рвота;
- сильная изжога;
- отрыжка, неприятный привкус во рту;
- несвежее дыхание;
- вздутие живота, колики.

Также о дисбактериозе свидетельствуют менее явные признаки. Среди них понижение давления, возникновение аллергических реакций на пищевые продукты, кожные высыпания, головная боль, быстрая утомляемость, слабость, раздражительность. На фоне дисбактериоза снижается иммунитет, учащаются простудные заболевания, также может развиться анемия.
Как восстановить микрофлору кишечника?
При подозрении на дисбактериоз необходимо обратиться за медицинской помощью. Врач проведет обследование и назначит лечение. Для устранения проблемы следует выявить причину дисбактериоза. Может потребоваться отмена каких-либо препаратов, корректировка питания или более тщательное обследование внутренних органов.
В рамках медикаментозного лечения врач может назначить такие препараты:
- Пребиотики – пищевые ингредиенты, нужные для создания благоприятной среды для размножения здоровой микрофлоры.
- Пробиотики – полезные бактерии, которые искусственно подселяют для восстановления нормальной микрофлоры кишечника.

- Ферменты – вещества, стимулирующие пищеварительные процессы, они нужны для помощи ослабленной пищеварительной системе.
- Антибиотики – назначаются в особых случаях для подавления болезнетворных бактерий.
При нарушениях микрофлоры кишечника рекомендуется сбалансированная диета без “тяжелой” пищи. Нужно исключить жареное, жирное, острое, кислое, соленое, копченое. Отказаться от крепких бульонов, мучного, сладкого, крепкого кофе, чая. Также под запретом курение и алкоголь.
Будьте здоровы!
Синдром дисбактериоза кишечника — AptekaOnline
Дисбактериоз не является самостоятельным заболеванием, этот синдром указывает на развитие ряда болезней желудочно-кишечного тракта.
Кишечник является частью пищеварительной системы человека и отвечает за всасывание расщепленных питательных веществ и удаление излишков с каловыми массами. Нормальная работа кишечника напрямую связана с микрофлорой, живущей на его стенках. Многочисленные микроорганизмы в кишечнике участвуют в синтезе аминокислот, витаминов, усвоении микроэлементов, а также блокируют рост и размножение патогенных бактерий, вызывающих различные нарушения в работе кишечника. В ряде случаев здоровый баланс микрофлоры может быть нарушен и вредные микроорганизмы начинают быстро размножаться. Именно такие состояния называют дисбактериозом кишечника.
Многочисленные микроорганизмы в кишечнике участвуют в синтезе аминокислот, витаминов, усвоении микроэлементов, а также блокируют рост и размножение патогенных бактерий, вызывающих различные нарушения в работе кишечника. В ряде случаев здоровый баланс микрофлоры может быть нарушен и вредные микроорганизмы начинают быстро размножаться. Именно такие состояния называют дисбактериозом кишечника.
Развитие дисбактериоза
Считать дисбактериоз самостоятельным заболеванием ошибочно, ведь он развивается при появлении соответствующих условий, связанных с нарушением нормальной работы организма. Аллергия, склонность к ОРЗ и ОРВИ, несбалансированный рацион, кишечные инфекции, нарушения функций ЖКТ, стресс, изменения микрофлоры, связанные с возрастом, химическая и лучевая терапия, длительное лечение гормональными и антибактериальными препаратами (в частности, антибиотиками) — вот далеко не полный список причин, вызывающих дисбактериоз у пациентов.
Поэтому лечение дисбактериоза в первую очередь должно быть направлено на устранение причин, которыми он был вызван. В отдельных случаях устранить причину невозможно, например, для онкобольных отмена курса лечения вызовет гораздо более критичные последствия, чем нарушение микрофлоры кишечника. Для таких пациентов подбирается специальный рацион и медикаментозные препараты, которые позволяют ограничить количество патогенных микроорганизмов, что позволяет поддерживать удовлетворительную работу собственной микрофлоры и нормальное пищеварение.
В отдельных случаях устранить причину невозможно, например, для онкобольных отмена курса лечения вызовет гораздо более критичные последствия, чем нарушение микрофлоры кишечника. Для таких пациентов подбирается специальный рацион и медикаментозные препараты, которые позволяют ограничить количество патогенных микроорганизмов, что позволяет поддерживать удовлетворительную работу собственной микрофлоры и нормальное пищеварение.
Пациентам, у которых симптомы дисбактериоза проявились из-за неправильного питания, сильного стресса или временной антибиотикотерапии, для восстановления микрофлоры потребуется значительно меньше усилий и времени. Регулировка питания, снижение эмоциональных нагрузок, окончание курса антибиотиков — все это в большинстве случаев создает благоприятные условия для нормализации работы кишечника. Небольшой курс лечения дисбактериоза кишечника специализированными препаратами позволяет полностью восстановить функции органа пищеварения.
Симптомы дисбактериоза
Первыми признаками дисбактериоза являются появление тошноты и рвоты, металлического привкуса во рту, снижение аппетита или полное его отсутствие, нарушения стула (диарея, запор), вздутие живота, чувство незаконченного опорожнения кишечника, эпизодические боли в животе. Кроме того, картина может быть дополнена сопутствующими симптомами: слабостью, головными болями, нарушениями сна, высокой утомляемостью, в отдельных случаях на кожных покровах и слизистых оболочках могут появляться зудящие высыпания.
Кроме того, картина может быть дополнена сопутствующими симптомами: слабостью, головными болями, нарушениями сна, высокой утомляемостью, в отдельных случаях на кожных покровах и слизистых оболочках могут появляться зудящие высыпания.
Симптомы дисбактериоза кишечника у всех пациентов индивидуальны. Какие именно признаки проявятся у отдельно взятого человека, зависит не только от причины дисбактериоза, но и от степени тяжести заболевания в каждом конкретном случае и возраста каждого пациента. Так, дисбактериоз у новорожденных укладывается в норму до определенного возраста — пока кишечник будет нормально заселен микрофлорой. По степени тяжести официальная медицина дисбактериоз у детей и взрослых разделяет на латентный, средний и тяжелый, а также на стафилококковую, протейную и ассоциированную формы.
Диагностика дисбактериоза
При появлении первых симптомов необходимо проконсультироваться у гастроэнтеролога и пройти необходимые обследования. Основными анализами на дисбактериоз являются микробиологическое (проверка кала на изменения биоценоза в кишечнике) и копрологическое (проверка характера нарушения переваривания и всасывания в кишечнике) исследования. Только после этих процедур врач может подтвердить наличие заболевания и определить, как лечить дисбактериоз с учетом индивидуальных особенностей, степени и вида у конкретного пациента.
Основными анализами на дисбактериоз являются микробиологическое (проверка кала на изменения биоценоза в кишечнике) и копрологическое (проверка характера нарушения переваривания и всасывания в кишечнике) исследования. Только после этих процедур врач может подтвердить наличие заболевания и определить, как лечить дисбактериоз с учетом индивидуальных особенностей, степени и вида у конкретного пациента.
Лечение дисбактериоза
Дисбактериоз является клинико-лабораторным синдромом, сильно зависящим от других заболеваний, возраста пациента, типа возбудителя и множества других факторов, поэтому его лечение необходимо начинать с выявления основных причин, вызвавших нарушения, и их устранения.
Параллельно с лечением основного заболевания, лечению дисбактериоза уделяется не меньшее внимание. Игнорирование проблемы дисбактериоза может негативно сказаться на общем течении заболеваний и стать причиной серьезных нарушений работы ЖКТ и других органов и систем.
Целью лечения непосредственно дисбактериоза является восстановление нормальной флоры кишечника. Для этого пациенту назначаются препараты, содержащие штаммы бифидобактерий, например линекс, лактофильтрум, хилак форте, а также специальная диета, направленная на поддержку заселения кишечника микрофлорой. Так, пациентам рекомендуется делать акцент в питании на кисломолочных продуктах, содержащих необходимые для восстановления микрофлоры организмы, либо применять препараты, в составе которых есть молочнокислые бактерии, такие как бифиформ, а для детей аципол. Кроме того, на время лечения ограничивают употребление алкоголя и курение, как небезопасные для флоры кишечника факторы. Назначение медикаментозной терапии (к примеру энтерофурила, де-нола) в каждом случае дисбактериоза индивидуально в зависимости от степени тяжести, возраста, экологических условий и других многочисленных факторов. Лечение дисбактериоза всегда является комплексным, решающим не только проблему дефицита полезной микрофлоры, но и исключающим условия для повторения недуга.
Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап — начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии. Количество бифидобактерий в кишечнике ребенка, находящегося на грудном вскармливании, быстро нарастает в первые недели его жизни. В течение первого года жизни меняется видовой состав кишечной микрофлоры, что связано с различными периодами в жизни ребенка: периодом грудного вскармливания до введения прикорма, после введения прикорма, после появления в рационе твердой пищи, после прекращения грудного вскармливания. Беременность мамы, микрофлора родовых путей, течение родов, рождение раньше срока, наличие и продолжительность грудного вскармливания, раннее введение прикорма, частые простудные заболевания определяют становление этого процесса.
Беременность мамы, микрофлора родовых путей, течение родов, рождение раньше срока, наличие и продолжительность грудного вскармливания, раннее введение прикорма, частые простудные заболевания определяют становление этого процесса.
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника. Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника. Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора — Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- Корниенко Е.А., Мазанкова Л.Н., Горелов А.В. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины. Лечащий врач 2015.
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
PP-BIB-RUS-0082
Лечение туберкулеза антибиотиками вызывает глубокий дисбактериоз микробиома, который сохраняется долгое время после завершения терапии
Разрешение на исследование
Все добровольцы дали письменное информированное согласие на участие в этом исследовании. Все протоколы и формы согласия были одобрены экспертными советами GHESKIO и Weill Cornell Medicine. Все методы и процедуры выполнялись в соответствии с соответствующими институциональными руководствами и правилами.
Все протоколы и формы согласия были одобрены экспертными советами GHESKIO и Weill Cornell Medicine. Все методы и процедуры выполнялись в соответствии с соответствующими институциональными руководствами и правилами.
Набор пациентов и защита субъектов-людей
Субъекты были включены в исследование с помощью Tri-Intuitional Tuberculosis Research Unit (TBRU) совместно с центрами GHESKIO в Порт-о-Пренс, Гаити, где все участники предоставили письменное информированное согласие.Все протоколы TBRU и формы согласия для образцов, собранных в GHESKIO, были одобрены Институциональными наблюдательными советами GHESKIO и Weill Cornell Medicine (см. Одобрение исследования). Специализированная полевая клиническая группа в центрах GHESKIO в Порт-о-Пренс, Гаити, набрала добровольцев-исследователей в рамках финансируемого NIH U19 исследовательского подразделения по туберкулезу (AI111143). Инфекционный статус пациента Mtb определяется с помощью количественного анализа высвобождения IFNγ (IGRA), а активное заболевание ТБ определяется с использованием стандартных клинических оценок. Все пациенты с активным туберкулезом легких проходят периодическое последующее наблюдение во время лечения, а любой, кто имел контакт с больным активным туберкулезом, проходит шестимесячное наблюдение и повторно проверяется на статус IGRA. Все образцы пациентов были деидентифицированы на месте с помощью системы штрих-кода, прежде чем они были отправлены в Нью-Йорк для анализа. ДНК человека была очищена от данных метагеномного секвенирования перед анализом и публикацией в соответствии с удалением всех биометрических идентификаторов в соответствии с Законом о переносимости и подотчетности медицинского страхования 30 .Все клинические метаданные собирались на месте и управлялись через систему управления данными REDCap 31 .
Все пациенты с активным туберкулезом легких проходят периодическое последующее наблюдение во время лечения, а любой, кто имел контакт с больным активным туберкулезом, проходит шестимесячное наблюдение и повторно проверяется на статус IGRA. Все образцы пациентов были деидентифицированы на месте с помощью системы штрих-кода, прежде чем они были отправлены в Нью-Йорк для анализа. ДНК человека была очищена от данных метагеномного секвенирования перед анализом и публикацией в соответствии с удалением всех биометрических идентификаторов в соответствии с Законом о переносимости и подотчетности медицинского страхования 30 .Все клинические метаданные собирались на месте и управлялись через систему управления данными REDCap 31 .
Клинические характеристики исследовательских групп из исследования TBRU
Мы набрали четыре группы лиц, используя дизайн перекрестного исследования. Чтобы охарактеризовать кишечный микробиом людей из населения Гаити, мы набрали две группы контрольных людей: 50 без инфекции Mtb (IGRA-) и 25 латентно инфицированных Mtb (LTBI), что определялось положительным результатом теста на интерферон. Анализ гамма-выделения (IGRA).Чтобы определить влияние антимикобактериального лечения HRZE на кишечный микробиом, мы набрали 19 добровольцев, которые в настоящее время проходят лечение HRZE от лекарственно-чувствительного туберкулеза. 3 из этих пролеченных лиц находились на противотуберкулезной терапии дольше стандартных 6 месяцев по усмотрению врача (см. Таблицу 1). Кроме того, чтобы определить продолжительность нарушения микробиома при лечении HRZE, мы набрали 19 ранее леченных пациентов, которые были излечены от активного туберкулеза. Клинические характеристики групп приведены в таблице 1.Чтобы надлежащим образом контролировать возраст, мы разделили нашу группу ЛТБИ на две отдельные контрольные подгруппы, обозначенные как ЛТБИ (лечебный контроль) и ЛТБИ (вылеченный контроль), поскольку состав микробиома может значительно меняться с возрастом 32 . Учитывая возрастной диапазон леченных и вылеченных пациентов, мы использовали контрольную группу в возрасте до 33 лет для контрольной группы лечения и контрольную группу в возрасте до 30 лет для вылеченной контрольной группы.
Анализ гамма-выделения (IGRA).Чтобы определить влияние антимикобактериального лечения HRZE на кишечный микробиом, мы набрали 19 добровольцев, которые в настоящее время проходят лечение HRZE от лекарственно-чувствительного туберкулеза. 3 из этих пролеченных лиц находились на противотуберкулезной терапии дольше стандартных 6 месяцев по усмотрению врача (см. Таблицу 1). Кроме того, чтобы определить продолжительность нарушения микробиома при лечении HRZE, мы набрали 19 ранее леченных пациентов, которые были излечены от активного туберкулеза. Клинические характеристики групп приведены в таблице 1.Чтобы надлежащим образом контролировать возраст, мы разделили нашу группу ЛТБИ на две отдельные контрольные подгруппы, обозначенные как ЛТБИ (лечебный контроль) и ЛТБИ (вылеченный контроль), поскольку состав микробиома может значительно меняться с возрастом 32 . Учитывая возрастной диапазон леченных и вылеченных пациентов, мы использовали контрольную группу в возрасте до 33 лет для контрольной группы лечения и контрольную группу в возрасте до 30 лет для вылеченной контрольной группы. Все субъекты ВИЧ-отрицательны. Однако другие клинические переменные, такие как история диабета, были недоступны.
Все субъекты ВИЧ-отрицательны. Однако другие клинические переменные, такие как история диабета, были недоступны.
Экстракция ДНК из стула
Образцы стула были собраны и хранились менее 24 часов при 4°C, разделены на аликвоты (~2 мл каждая), заморожены при -80°C и отправлены в Нью-Йорк. ≈500 мг стула из замороженных образцов суспендировали в 500 мкл экстракционного буфера (200 мМ Трис-HCl, pH = 8,0; 200 мМ NaCl; 20 мМ ЭДТА), 210 мкл 20% SDS, 500 мкл фенола/хлороформа/ изоамиловый спирт (25:24:1) и 500 мкл гранул циркония/диоксида кремния диаметром 0,1 мм (BioSpec Products). Образцы лизировали посредством механического разрушения бисерной мешалкой (BioSpec Products) в течение двух минут с последующими двумя экстракциями смесью фенол/хлороформ/изоамиловый спирт (25:24:1).ДНК осаждали этанолом и ацетатом натрия при температуре -80 °C в течение 1 часа, повторно суспендировали в 200 мкл воды, не содержащей нуклеаз, и дополнительно очищали с помощью набора QIAamp DNA Mini Kit (Qiagen) в соответствии с протоколами производителя, включая удаление белка. обработкой протеиназой К. ДНК элюировали 200 мкл воды без нуклеаз и сортировали при -20°С.
обработкой протеиназой К. ДНК элюировали 200 мкл воды без нуклеаз и сортировали при -20°С.
16S секвенирование рДНК
Праймеры, использованные для амплификации рДНК: 563 F (59-nnnnnnnn-NNNNNNNNNNNN-AYTGGGYDTAAAGN G-39) и 926 R (59-nnnnnnnn-NNNNNNNNNNNN-CCGTCAATTYH9TT AGT-39TR AGT-39)Каждая реакция содержала 50 нг очищенной ДНК, 0,2 мМ dNTP, 1,5 мкМ MgCl 2 , 1,25 ед. Platinum TaqDNA полимеразы, 2,5 мкл 10 х ПЦР-буфера и 0,2 мкМ каждого праймера. Уникальный штрих-код Голея из 12 оснований (Ns) предшествовал праймерам для идентификации образцов после объединения ампликонов. Перед штрих-кодом добавляли от одного до восьми дополнительных нуклеотидов, чтобы компенсировать секвенирование праймеров. Условия циклирования были следующими: 94 °C в течение 3 мин, затем 27 циклов 94°C в течение 50 с, 51°C в течение 30 с и 72°C в течение 1 мин, где финальная стадия удлинения проводилась при 72°C. в течение 5 мин.Репликаты ПЦР объединяли и затем очищали с использованием набора для очистки ПЦР Qiaquick (Qiagen) и набора для очистки ПЦР Qiagen MinElute. Продукты ПЦР определяли количественно и объединяли в эквимолярных количествах перед лигированием штрих-кодов и адаптеров Illumina с использованием процедуры подготовки образцов Illumina TruSeq. Готовая библиотека была секвенирована на платформе Illumina Miseq в соответствии с протоколом, рекомендованным Illumina.
Продукты ПЦР определяли количественно и объединяли в эквимолярных количествах перед лигированием штрих-кодов и адаптеров Illumina с использованием процедуры подготовки образцов Illumina TruSeq. Готовая библиотека была секвенирована на платформе Illumina Miseq в соответствии с протоколом, рекомендованным Illumina.
Биоинформатический анализ 16S
Для секвенирования 16S MiSeq считывания парных концов объединяли, демультиплексировали, фильтровали по качеству с использованием максимальной ожидаемой ошибки (Emax = 1) и дереплицировали.Последовательности были сгруппированы в операционные таксономические единицы (OTU) с 97% сходством на основе расстояния с использованием UPARSE 33 . Потенциально химерные последовательности были удалены с использованием как методов de novo, так и методов на основе ссылок (где для последнего использовалась база данных Gold) 34 . Таксономические присвоения были сделаны с использованием BLASTN 35 по базе данных NCBI refseq_rna с пользовательскими скриптами 36 .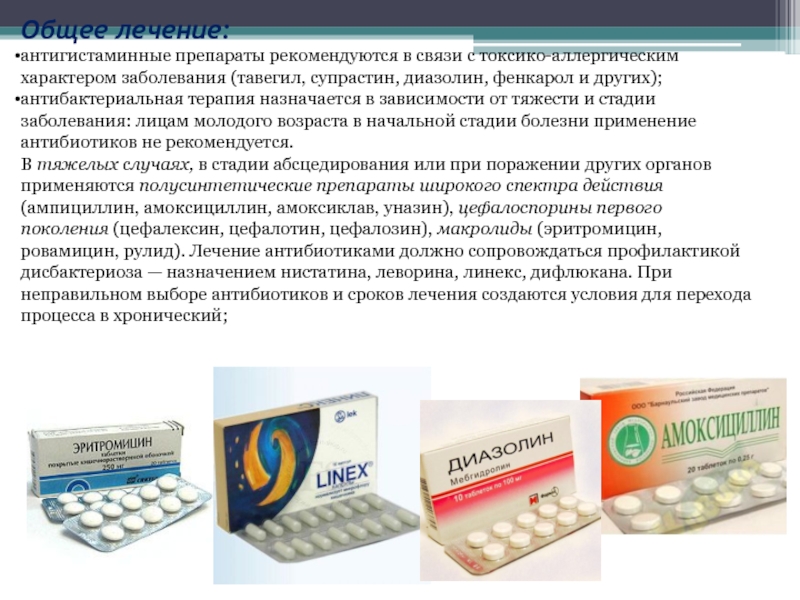 Наш подход позволяет идентифицировать 30 основных таксонов, связанных с конкретной OTU, поэтому таксономическая номенклатура, которую мы используем для 16S, является универсальной.Эти данные о вызовах OTU доступны в дополнительных таблицах 2 и 3: в дополнительной таблице 2 приведены результаты OTU BLASTN для LTBI (контроль лечения) и когорты лечения, а в дополнительной таблице 3 приведены результаты OTU BLASTN для LTBI (вылеченный контроль) и вылеченные когорты. Файл матрицы биологических наблюдений (biom) 37 , файл таксономии, файл эталонной последовательности и файл дерева были созданы с использованием команд QIIME. Эти файлы были импортированы в R 38 и объединены с файлом метаданных в один объект Phyloseq 39 .Phyloseq использовался для всего последующего анализа таксономических данных 16S, а графики были построены с помощью пакета ggplot2 40 .
Наш подход позволяет идентифицировать 30 основных таксонов, связанных с конкретной OTU, поэтому таксономическая номенклатура, которую мы используем для 16S, является универсальной.Эти данные о вызовах OTU доступны в дополнительных таблицах 2 и 3: в дополнительной таблице 2 приведены результаты OTU BLASTN для LTBI (контроль лечения) и когорты лечения, а в дополнительной таблице 3 приведены результаты OTU BLASTN для LTBI (вылеченный контроль) и вылеченные когорты. Файл матрицы биологических наблюдений (biom) 37 , файл таксономии, файл эталонной последовательности и файл дерева были созданы с использованием команд QIIME. Эти файлы были импортированы в R 38 и объединены с файлом метаданных в один объект Phyloseq 39 .Phyloseq использовался для всего последующего анализа таксономических данных 16S, а графики были построены с помощью пакета ggplot2 40 .
Метагеномное секвенирование методом дробовика
От 150 до 200 нг ДНК, выделенной из стула (см. выше), подвергали акустическому сдвигу. Библиотеки для секвенирования Hiseq готовили с использованием набора KAPA Hyper Prep Kit (Roche). ПЦР-амплификацию библиотек проводили в течение 6 циклов. Образцы анализировали на Hiseq 4000 в парном конце 125/125 парных парных парных оснований с использованием набора TruSeq SBS Kit v3 (Illumina).Среднее количество пар чтения на образец составляло около 11 миллионов.
выше), подвергали акустическому сдвигу. Библиотеки для секвенирования Hiseq готовили с использованием набора KAPA Hyper Prep Kit (Roche). ПЦР-амплификацию библиотек проводили в течение 6 циклов. Образцы анализировали на Hiseq 4000 в парном конце 125/125 парных парных парных оснований с использованием набора TruSeq SBS Kit v3 (Illumina).Среднее количество пар чтения на образец составляло около 11 миллионов.
Биоинформатический анализ Shotgun
Для анализа метагеномных прочтений Shotgun последовательности были сначала обрезаны и удалены от хозяина с использованием Trimmomatic 41 и Bowtie2 42 . Затем деконтаминированные считывания хозяина были профилированы по обилию микробных видов с использованием Metaphlan2 43 , а также по обилию гена Uniref и ортологов KEGG, а также по функциональным путям (пути Metacyc, пути KEGG и модули KEGG) с использованием конвейера программного обеспечения HUMAnN2 22 и внутренние письменные сценарии (предоставляются по запросу). Затем нормализованные таксономические, генные и метаболические пути использовались для последующего статистического анализа в R. Все образцы кишечного микробиома были секвенированы с использованием секвенирования 16S рДНК, однако только подмножество контролей было секвенировано с использованием метагеномики. Из-за ограничений размера выборки для сравнения секвенирования метагеномной ДНК мы объединили как Mtb неинфицированных, так и лиц с ЛТБИ в здоровую контрольную группу, которую использовали в качестве компаратора для метагеномного анализа.
Затем нормализованные таксономические, генные и метаболические пути использовались для последующего статистического анализа в R. Все образцы кишечного микробиома были секвенированы с использованием секвенирования 16S рДНК, однако только подмножество контролей было секвенировано с использованием метагеномики. Из-за ограничений размера выборки для сравнения секвенирования метагеномной ДНК мы объединили как Mtb неинфицированных, так и лиц с ЛТБИ в здоровую контрольную группу, которую использовали в качестве компаратора для метагеномного анализа.
Статистический анализ
Способность обнаруживать дифференциально распространенные OTU между группами людей имеет решающее значение для сравнения между группами, и существуют различные методы, которые были проверены для такого рода анализа.Для секвенирования 16S рДНК мы использовали инструменты, доступные в пакете Phyloseq, для обработки данных и метаданных для последующего анализа. Необработанные подсчеты с таксономией и метаданными были переданы в пакет DESeq2 для дифференциального анализа численности с использованием предположения об отрицательном биномиальном распределении с нулевой инфляцией 19 . Этот метод предполагает, что для многих OTU дисперсия численности (т. е. количества прочтений) между образцами или группами превышает среднее количество прочтений (часто равно нулю). Когда это так, метод DESeq можно использовать для преобразования данных, чтобы можно было более точно сравнивать различия между выборками или между группами.Гомоскедастические данные об изобилии использовались для создания тепловых карт на рис. 3c и d путем применения преобразования, стабилизирующего дисперсию, из подобранных средних дисперсии для преобразования данных подсчета. Мы дополнительно использовали удобный для микробиома линейный дискриминантный анализ, инструмент размера эффекта (LEfSe) 20 для выявления статистически значимых различий между клиническими группами. В этом методе сначала используется непараметрический критерий сумм-рангов Крускала-Уоллиса (КВ) между различными группами людей (т., здоровые [состоит из Mtb неинфицированных и ЛТБИ], получающих лечение HRZE или вылеченных), с последующим линейным дискриминантным анализом для оценки размера эффекта (т.
Этот метод предполагает, что для многих OTU дисперсия численности (т. е. количества прочтений) между образцами или группами превышает среднее количество прочтений (часто равно нулю). Когда это так, метод DESeq можно использовать для преобразования данных, чтобы можно было более точно сравнивать различия между выборками или между группами.Гомоскедастические данные об изобилии использовались для создания тепловых карт на рис. 3c и d путем применения преобразования, стабилизирующего дисперсию, из подобранных средних дисперсии для преобразования данных подсчета. Мы дополнительно использовали удобный для микробиома линейный дискриминантный анализ, инструмент размера эффекта (LEfSe) 20 для выявления статистически значимых различий между клиническими группами. В этом методе сначала используется непараметрический критерий сумм-рангов Крускала-Уоллиса (КВ) между различными группами людей (т., здоровые [состоит из Mtb неинфицированных и ЛТБИ], получающих лечение HRZE или вылеченных), с последующим линейным дискриминантным анализом для оценки размера эффекта (т. , или путь между группами). Мы попытались использовать как методы DESeq2, так и LEfSe, и попытались подчеркнуть, где есть совпадение. Все рисунки в статье, относящиеся к анализу последовательности 16S, построены с использованием нормализованного и преобразованного содержания из пакета DESeq2.Для статистического анализа результатов чтения метагеномики дробовика данные были импортированы в R и преобразованы в объекты Phyloseq с помощью пользовательских сценариев. Пользовательский код, реализующий непараметрические тесты (ранг со знаком Уилкоксона) с коррекцией FDR (метод Бенджамини и Хохберга), а также LEfSe 20 , использовался для проверки дифференциальной численности таксонов и функциональных путей. Для сравнений LTBI-Treatment и LTBI-Cured порог p-значения сохранялся на уровне 0,05 как для исходного критерия Крускелла-Уоллиса, так и для последующих ранговых критериев Уилкоксона для соответствующих по полу подклассов.Мы дополнительно использовали тесты Permanova и Betadisper с использованием функции adonis в пакете Vegan в R.
, или путь между группами). Мы попытались использовать как методы DESeq2, так и LEfSe, и попытались подчеркнуть, где есть совпадение. Все рисунки в статье, относящиеся к анализу последовательности 16S, построены с использованием нормализованного и преобразованного содержания из пакета DESeq2.Для статистического анализа результатов чтения метагеномики дробовика данные были импортированы в R и преобразованы в объекты Phyloseq с помощью пользовательских сценариев. Пользовательский код, реализующий непараметрические тесты (ранг со знаком Уилкоксона) с коррекцией FDR (метод Бенджамини и Хохберга), а также LEfSe 20 , использовался для проверки дифференциальной численности таксонов и функциональных путей. Для сравнений LTBI-Treatment и LTBI-Cured порог p-значения сохранялся на уровне 0,05 как для исходного критерия Крускелла-Уоллиса, так и для последующих ранговых критериев Уилкоксона для соответствующих по полу подклассов.Мы дополнительно использовали тесты Permanova и Betadisper с использованием функции adonis в пакете Vegan в R. Adonis разбивает матрицу расстояний данных подсчета OTU и проводит анализ дисперсии между группами выборок. Betadisper также поддерживает этот вывод, определяя, одинаково ли распределяется дисперсия между двумя группами. Все графики типа «ящик с усами» были сгенерированы с помощью функции ggplot2 40 geom_boxplot, которая показывает первый и третий квартили набора данных и медиану данных в поле, усы показывают 1.5-кратное значение межквартильного диапазона шарнира коробки, а выбросы показаны точками. Все остальные графики были сделаны с помощью Prism 7.
Adonis разбивает матрицу расстояний данных подсчета OTU и проводит анализ дисперсии между группами выборок. Betadisper также поддерживает этот вывод, определяя, одинаково ли распределяется дисперсия между двумя группами. Все графики типа «ящик с усами» были сгенерированы с помощью функции ggplot2 40 geom_boxplot, которая показывает первый и третий квартили набора данных и медиану данных в поле, усы показывают 1.5-кратное значение межквартильного диапазона шарнира коробки, а выбросы показаны точками. Все остальные графики были сделаны с помощью Prism 7.
Доступность данных
Все данные секвенирования и компьютерный код, а также метаданные, подтверждающие результаты этого исследования, можно получить у соответствующих авторов по запросу.
Дисбактериоз — обзор | ScienceDirect Topics
36.5.2 Дисбактериоз
Дисбактериоз часто определяют как «дисбаланс» в микробном сообществе кишечника, связанный с заболеванием.Этот дисбаланс может быть связан с увеличением или потерей членов сообщества или изменениями в относительной численности микробов. Эта теория в первую очередь фокусируется на изменениях в таксономическом составе микробного сообщества и функциях, связанных с отдельными членами или подмножествами членов в сообществе. 126 Характеристика дисбактериоза традиционно основывалась на таксономических каталогах кишечных микробов, генерируемых у разных людей в отдельные моменты времени, с использованием секвенирования 16S или 18S рРНК. 127 Более поздние попытки каталогизировать не микробные виды, а скорее микробные гены в кишечнике с использованием метагеномики дробовика. 128,129 Таксономическая характеристика или генетический состав сообщества затем используется для вывода о его функциях на основе данных в литературе, полученных в результате исследований с использованием эталонных микробных штаммов. Обычно эти модельные микробы изучаются как отдельные организмы и часто in vitro, чтобы получить эти функциональные данные.
Эта теория в первую очередь фокусируется на изменениях в таксономическом составе микробного сообщества и функциях, связанных с отдельными членами или подмножествами членов в сообществе. 126 Характеристика дисбактериоза традиционно основывалась на таксономических каталогах кишечных микробов, генерируемых у разных людей в отдельные моменты времени, с использованием секвенирования 16S или 18S рРНК. 127 Более поздние попытки каталогизировать не микробные виды, а скорее микробные гены в кишечнике с использованием метагеномики дробовика. 128,129 Таксономическая характеристика или генетический состав сообщества затем используется для вывода о его функциях на основе данных в литературе, полученных в результате исследований с использованием эталонных микробных штаммов. Обычно эти модельные микробы изучаются как отдельные организмы и часто in vitro, чтобы получить эти функциональные данные.
Огромное количество исследований выявило существенные различия в таксономическом составе микробных сообществ кишечника между пациентами с ВЗК и здоровыми людьми из контрольной группы. 130 Эти различия были выявлены в бактериальном, грибковом и вирусном компонентах сообщества. 131,132 Однако специфические микробные таксономические различия широко варьируются в зависимости от исследований, и окончательная структура сообщества, связанная с заболеванием, не была идентифицирована. Это может быть связано с большими различиями в составе микробного сообщества кишечника у людей и/или техническими различиями между исследованиями. Поэтому, как определить дисбактериоз и диагностировать «дисбиотическое сообщество», до сих пор неясно.Также неясно, является ли дисбактериоз причиной, следствием или одновременно причиной и следствием заболевания, поскольку воспаление само по себе может привести к изменениям в составе микробного сообщества в кишечнике. 133
130 Эти различия были выявлены в бактериальном, грибковом и вирусном компонентах сообщества. 131,132 Однако специфические микробные таксономические различия широко варьируются в зависимости от исследований, и окончательная структура сообщества, связанная с заболеванием, не была идентифицирована. Это может быть связано с большими различиями в составе микробного сообщества кишечника у людей и/или техническими различиями между исследованиями. Поэтому, как определить дисбактериоз и диагностировать «дисбиотическое сообщество», до сих пор неясно.Также неясно, является ли дисбактериоз причиной, следствием или одновременно причиной и следствием заболевания, поскольку воспаление само по себе может привести к изменениям в составе микробного сообщества в кишечнике. 133
Дисбактериоз может вызывать или способствовать развитию ВЗК различными способами. Это может привести к появлению одного или нескольких микробов с функциями, вредными для хозяина, или к потере одного или нескольких микробов с полезными для хозяина функциями. Поскольку многие микробы в кишечном сообществе имеют важные функциональные отношения друг с другом, изменения в небольшом количестве микробов и/или их функций могут иметь широкое влияние на сообщество.Конкретные функции, которые могут представлять интерес, включают изменения в доступности ниш или характеристик, влияющих на принятие или устойчивость к колонизации, изменения в микробных продуктах или физических характеристиках, которые изменяют взаимодействие между бактериями или с хозяином, и изменения в сообществе, которые активируют механизмы вирулентности в организме. иначе комменсальные микробы. Наиболее последовательной характеристикой микробных сообществ от больных пациентов является потеря таксономического разнообразия. 134 Однако снова неясно, является ли потеря биоразнообразия в кишечнике причиной или следствием заболевания.В настоящее время также неясно, как такая потеря разнообразия сама по себе может привести к заболеванию, тем более что гнотобиотические животные, колонизированные одним или небольшим количеством микробов, не проявляют болезни, связанной с колонизацией только ограниченным сообществом.
Поскольку многие микробы в кишечном сообществе имеют важные функциональные отношения друг с другом, изменения в небольшом количестве микробов и/или их функций могут иметь широкое влияние на сообщество.Конкретные функции, которые могут представлять интерес, включают изменения в доступности ниш или характеристик, влияющих на принятие или устойчивость к колонизации, изменения в микробных продуктах или физических характеристиках, которые изменяют взаимодействие между бактериями или с хозяином, и изменения в сообществе, которые активируют механизмы вирулентности в организме. иначе комменсальные микробы. Наиболее последовательной характеристикой микробных сообществ от больных пациентов является потеря таксономического разнообразия. 134 Однако снова неясно, является ли потеря биоразнообразия в кишечнике причиной или следствием заболевания.В настоящее время также неясно, как такая потеря разнообразия сама по себе может привести к заболеванию, тем более что гнотобиотические животные, колонизированные одним или небольшим количеством микробов, не проявляют болезни, связанной с колонизацией только ограниченным сообществом. Это говорит о том, что специфические микробы в сообществе и их функции имеют первостепенное значение.
Это говорит о том, что специфические микробы в сообществе и их функции имеют первостепенное значение.
Состав и поведение микробного сообщества чрезвычайно чувствительны к окружающей среде. 9 Окружающая среда кишечного микробного сообщества состоит как из компонентов организма хозяина, так и из проглоченных веществ.Каждый из этих факторов может оказывать глубокое влияние на состав и поведение микробного сообщества кишечника. Компоненты, происходящие от хозяина, определяются генетикой хозяина и, возможно, влиянием диеты или других проглоченных веществ непосредственно на хозяина. Наиболее характерными детерминантами состава и поведения микробного сообщества хозяина являются системы противомикробной защиты хозяина. Когда эти системы разрушаются генетическим нокаутом отдельных компонентов у модельных животных, возникает дисбактериоз. 135 Проглатываемое содержимое просвета кишечника в основном поступает из пищи. Вклад диеты в микробный дисбиоз представляет особый интерес для многих исследователей, поскольку ВЗК распространяется одновременно с распространением западного образа жизни по всему миру, а западная диета сильно отличается от традиционных диет в невестернизированных обществах. 136 Диетические компоненты состоят из макронутриентов, таких как жиры и сахара, микронутриентов, таких как витамины и минералы, и непищевых компонентов, таких как пищевые эмульгаторы.Западная диета, как правило, сильно обработана и содержит большое количество насыщенных жиров и простых сахаров. Было показано, что этот тип диеты способствует выработке метаболитов, вредных для тканей хозяина. 137 И наоборот, диеты с низким содержанием субстратов, необходимых микробам для производства метаболитов, укрепляющих здоровье в тканях хозяина, также могут способствовать возникновению заболеваний. Например, неперевариваемые пищевые волокна используются микробами для производства короткоцепочечных жирных кислот, а пищевой триптофан используется для производства лигандов рецепторов арильных углеводородов, оба из которых способствуют здоровью кишечника. 95,138 Наконец, пищевые эмульгаторы часто добавляют в обработанные пищевые продукты для улучшения их текстуры или стабильности.
136 Диетические компоненты состоят из макронутриентов, таких как жиры и сахара, микронутриентов, таких как витамины и минералы, и непищевых компонентов, таких как пищевые эмульгаторы.Западная диета, как правило, сильно обработана и содержит большое количество насыщенных жиров и простых сахаров. Было показано, что этот тип диеты способствует выработке метаболитов, вредных для тканей хозяина. 137 И наоборот, диеты с низким содержанием субстратов, необходимых микробам для производства метаболитов, укрепляющих здоровье в тканях хозяина, также могут способствовать возникновению заболеваний. Например, неперевариваемые пищевые волокна используются микробами для производства короткоцепочечных жирных кислот, а пищевой триптофан используется для производства лигандов рецепторов арильных углеводородов, оба из которых способствуют здоровью кишечника. 95,138 Наконец, пищевые эмульгаторы часто добавляют в обработанные пищевые продукты для улучшения их текстуры или стабильности. In vitro эти соединения активируют производство фимбр в E. coli , что приводит к прикреплению и повреждению тканей этими обычно комменсальными бактериями. 139 In vivo было показано, что потребление диетических эмульгаторов вызывает дисбактериоз и обострение колита у мышей IL-10 -/- . 140 Другие виды экологического стресса, такие как введение антибиотиков, также могут привести к изменениям в микробном сообществе путем прямого уничтожения микробов или горизонтального переноса генов. 141,142 Экологический стресс также может определять, ведут ли бактериофаги лизогенный или литический образ жизни. 143 Индуцированный фагом лизис не только убивает бактерии, но также потенциально приводит к инфицированию новых мишеней для бактерий с изменением поведения этих бактерий.
In vitro эти соединения активируют производство фимбр в E. coli , что приводит к прикреплению и повреждению тканей этими обычно комменсальными бактериями. 139 In vivo было показано, что потребление диетических эмульгаторов вызывает дисбактериоз и обострение колита у мышей IL-10 -/- . 140 Другие виды экологического стресса, такие как введение антибиотиков, также могут привести к изменениям в микробном сообществе путем прямого уничтожения микробов или горизонтального переноса генов. 141,142 Экологический стресс также может определять, ведут ли бактериофаги лизогенный или литический образ жизни. 143 Индуцированный фагом лизис не только убивает бактерии, но также потенциально приводит к инфицированию новых мишеней для бактерий с изменением поведения этих бактерий.
Открытым вопросом в области дисбактериоза является важность того, когда происходят дисбиотические изменения в микробном сообществе. Кесарево сечение приводит к изменениям в процессах ранней колонизации, а раннее введение антибиотиков может значительно нарушить развивающиеся сообщества. 144 Оба эти фактора связаны с рядом иммуноопосредованных заболеваний в более позднем возрасте, но точных доказательств причинно-следственной связи или понимания механизмов все еще нет. 145 Кроме того, у многих пациентов ВЗК развивается без событий в раннем возрасте, которые, как ожидается, могут вызвать дисбактериоз. Таким образом, дополнительные неизвестные события могут способствовать раннему, давнему дисбиозу во время диагностики ВЗК, или более острые дисбиотические события также могут способствовать ВЗК. Ожидается, что тип дисбиотического явления также будет ключевым фактором того, как дисбактериоз способствует развитию ВЗК.Будут ли это широкие изменения в сообществе или небольшие, кардинальные изменения в конкретных микробах, еще предстоит определить. Эта неопределенность, по крайней мере частично, связана с техническими проблемами, которые могут переоценивать актуальность очень распространенных микробов и недооценивать функциональное значение менее многочисленных членов сообщества.
144 Оба эти фактора связаны с рядом иммуноопосредованных заболеваний в более позднем возрасте, но точных доказательств причинно-следственной связи или понимания механизмов все еще нет. 145 Кроме того, у многих пациентов ВЗК развивается без событий в раннем возрасте, которые, как ожидается, могут вызвать дисбактериоз. Таким образом, дополнительные неизвестные события могут способствовать раннему, давнему дисбиозу во время диагностики ВЗК, или более острые дисбиотические события также могут способствовать ВЗК. Ожидается, что тип дисбиотического явления также будет ключевым фактором того, как дисбактериоз способствует развитию ВЗК.Будут ли это широкие изменения в сообществе или небольшие, кардинальные изменения в конкретных микробах, еще предстоит определить. Эта неопределенность, по крайней мере частично, связана с техническими проблемами, которые могут переоценивать актуальность очень распространенных микробов и недооценивать функциональное значение менее многочисленных членов сообщества. Технические ограничения доступных в настоящее время методов и данных также, вероятно, переоценивают важность известных микробов с установленными функциональными данными по сравнению с неизвестными микробами, которые могут быть столь же важны для заболевания.Наконец, до сих пор неизвестно, как дисбиоз вызывает ВЗК или способствует ему. Имеются некоторые свидетельства того, что специфические дисбиотические микробные сообщества могут вызывать заболевания у нормальных хозяев. 146 Однако есть гораздо более убедительные доказательства того, что дисбиоз работает в сочетании с дополнительными факторами, такими как основная генетическая предрасположенность или повреждение кишечника, вызывая заболевание. Например, перенос микробных сообществ от пациентов с ВЗК стерильным мышам, по-видимому, не вызывает спонтанного колита. 69,70,146 Тем не менее, он, по-видимому, способствует заболеванию на предрасположенных к заболеванию мышах, таких как IL-10 -/- мышей или мышей с химической индукцией колита.
Технические ограничения доступных в настоящее время методов и данных также, вероятно, переоценивают важность известных микробов с установленными функциональными данными по сравнению с неизвестными микробами, которые могут быть столь же важны для заболевания.Наконец, до сих пор неизвестно, как дисбиоз вызывает ВЗК или способствует ему. Имеются некоторые свидетельства того, что специфические дисбиотические микробные сообщества могут вызывать заболевания у нормальных хозяев. 146 Однако есть гораздо более убедительные доказательства того, что дисбиоз работает в сочетании с дополнительными факторами, такими как основная генетическая предрасположенность или повреждение кишечника, вызывая заболевание. Например, перенос микробных сообществ от пациентов с ВЗК стерильным мышам, по-видимому, не вызывает спонтанного колита. 69,70,146 Тем не менее, он, по-видимому, способствует заболеванию на предрасположенных к заболеванию мышах, таких как IL-10 -/- мышей или мышей с химической индукцией колита. 69,70,146 Кроме того, дисбактериоз, связанный с диетой западного типа, по-видимому, допускает колонизацию микроорганизмами, ассоциированными с ВЗК. Безмикробные мыши, колонизированные микробами от мышей, которых кормили пищей с высоким содержанием жиров и сахаров, имеют повышенную восприимчивость к колонизации AIEC. 147 Таким образом, дисбактериоз может по-разному влиять на разных носителей в зависимости от характера дисбиотического сообщества и лежащей в основе генетической предрасположенности к заболеванию у хозяина.Независимо от того, возникает ли дисбиоз первым и вызывает болезнь, или является следствием болезни, однажды возникнув, он почти наверняка способствует сохранению болезни.
69,70,146 Кроме того, дисбактериоз, связанный с диетой западного типа, по-видимому, допускает колонизацию микроорганизмами, ассоциированными с ВЗК. Безмикробные мыши, колонизированные микробами от мышей, которых кормили пищей с высоким содержанием жиров и сахаров, имеют повышенную восприимчивость к колонизации AIEC. 147 Таким образом, дисбактериоз может по-разному влиять на разных носителей в зависимости от характера дисбиотического сообщества и лежащей в основе генетической предрасположенности к заболеванию у хозяина.Независимо от того, возникает ли дисбиоз первым и вызывает болезнь, или является следствием болезни, однажды возникнув, он почти наверняка способствует сохранению болезни.
Взаимодействие лекарственных средств с кишечным микробиомом
Ингибиторы протонной помпы
ИПП являются одними из наиболее часто используемых лекарственных средств во всем мире и используются для лечения кислотозависимых заболеваний, таких как пептические язвы, гастроэзофагеальный рефлюкс и диспепсия, а также для профилактики -стероидные противовоспалительные препараты, индуцированные гастродуоденопатией и кровотечениями. Поскольку ИПП очень эффективны и имеют очень благоприятный профиль безопасности, их использование очень быстро увеличилось за последние несколько десятилетий. В Нидерландах два миллиона человек (~ 12% населения) в настоящее время используют либо пантопразол, либо омепразол по рецепту, и аналогичные проценты использования были зарегистрированы в других странах, таких как Великобритания.20 21 Общая стоимость ИПП в Великобритании составляет оценивается более чем в 100 миллионов фунтов стерлингов в год.22 Более того, поскольку ИПП доступны без рецепта в Нидерландах и во многих других странах, общее число пользователей ИПП будет намного выше, чем оценка, основанная только на рецептах. .В последние годы большое внимание уделяется профилю безопасности и потенциальным побочным эффектам хронического использования ИПП. Несмотря на то, что относительный риск нежелательных реакций на лекарственные препараты (НЛР) низок, большое число пользователей ИПП во всем мире означает, что абсолютное число пациентов с НЛР может оставаться высоким.
Поскольку ИПП очень эффективны и имеют очень благоприятный профиль безопасности, их использование очень быстро увеличилось за последние несколько десятилетий. В Нидерландах два миллиона человек (~ 12% населения) в настоящее время используют либо пантопразол, либо омепразол по рецепту, и аналогичные проценты использования были зарегистрированы в других странах, таких как Великобритания.20 21 Общая стоимость ИПП в Великобритании составляет оценивается более чем в 100 миллионов фунтов стерлингов в год.22 Более того, поскольку ИПП доступны без рецепта в Нидерландах и во многих других странах, общее число пользователей ИПП будет намного выше, чем оценка, основанная только на рецептах. .В последние годы большое внимание уделяется профилю безопасности и потенциальным побочным эффектам хронического использования ИПП. Несмотря на то, что относительный риск нежелательных реакций на лекарственные препараты (НЛР) низок, большое число пользователей ИПП во всем мире означает, что абсолютное число пациентов с НЛР может оставаться высоким. Несмотря на наличие четких основанных на доказательствах показаний к использованию ИПП, было высказано предположение, что до 70% назначений ИПП могут быть ненужными, при использовании ИПП в качестве профилактики стрессовых язв у пациентов, которые не соответствуют назначению, основанному на доказательствах. критерии вносят в это большой вклад.Другим важным фактором здесь является то, что после начала приема ИПП практически не происходит переоценки исходного показания, по которому они были назначены, а последующие попытки прекратить их прием приводят к ненужному хроническому использованию [23, 24].
Несмотря на наличие четких основанных на доказательствах показаний к использованию ИПП, было высказано предположение, что до 70% назначений ИПП могут быть ненужными, при использовании ИПП в качестве профилактики стрессовых язв у пациентов, которые не соответствуют назначению, основанному на доказательствах. критерии вносят в это большой вклад.Другим важным фактором здесь является то, что после начала приема ИПП практически не происходит переоценки исходного показания, по которому они были назначены, а последующие попытки прекратить их прием приводят к ненужному хроническому использованию [23, 24].
Крупное популяционное исследование, проведенное в Нидерландах, показало, что ИПП были препаратами, наиболее связанными с уменьшением разнообразия и таксономическими изменениями в микробиоме кишечника. с синдромом раздраженного кишечника воспроизвели эти изменения во всех трех когортах и показали, что относительная численность до 20% бактериальных таксонов была изменена (уменьшена или увеличена) у пользователей ИПП по сравнению с теми, кто их не принимал. 25 Аналогичные результаты, показывающие меньшее микробное разнообразие и меньшее количество кишечных комменсалов, были получены в исследовании, анализирующем данные 16-секундного анализа образцов фекалий от 1827 близнецов. 26 Кроме того, небольшое перекрестное исследование на 12 здоровых добровольцах показало значительные изменения в таксономии после стартовые ИЦП.11
25 Аналогичные результаты, показывающие меньшее микробное разнообразие и меньшее количество кишечных комменсалов, были получены в исследовании, анализирующем данные 16-секундного анализа образцов фекалий от 1827 близнецов. 26 Кроме того, небольшое перекрестное исследование на 12 здоровых добровольцах показало значительные изменения в таксономии после стартовые ИЦП.11
В целом, таксономические изменения в образцах фекалий потребителей ИПП показывают снижение численности симбиотических бактерий кишечника и увеличение количества бактерий ротовой полости. Эти изменения включают увеличение в семействах Enterobacteriaceae, Enterococcaceae и Lactobacillaceae и уменьшение в Ruminococcaceae и Bifidobacteriaceae, в то время как сдвиг в сторону типичных бактерий ротовой полости отражается в увеличении видов Rothia dentocariosa и Rothia mucilaginosa , рода Actinomyces и семейство Micrococcaceae.25 Более того, похоже, что наблюдаемые изменения являются классовым эффектом ИПП, поскольку омепразол, эзомепразол и пантопразол показали аналогичные изменения. Более высокая доза также, по-видимому, связана с более значительными микробными изменениями.19
Более высокая доза также, по-видимому, связана с более значительными микробными изменениями.19
В недавнем исследовании, в котором использовались данные о метагеномных последовательностях, позволяющие проводить как таксономию с высоким разрешением, так и прогнозировать пути, было изучено влияние 41 широко используемого лекарства на микробиом кишечника, и снова было обнаружено, что на ИПП приходится наибольшее количество ассоциаций.19 После поправки на влияние одновременного приема других препаратов ИПП были достоверно связаны с 24 таксонами и 133 путями. Прогнозируемые функциональные изменения включали усиление биосинтеза жирных кислот и липидов, ферментацию метаболизма никотинамидадениндинуклеотида (НАД), биосинтез L-аргинина и деградацию пуриндезоксирибонуклеозидов. Эти изменения в путях можно объяснить наблюдаемыми изменениями численности конкретных таксонов. Например, биосинтез L-аргинина был более распространенным в микробиоме пользователей ИПП.Хотя предполагается, что несколько таксонов бактерий, в том числе видов Bifidobacterium и видов Ruminococcus , вносят свой вклад в эти пути, статистический анализ показал, что только изменения в Streptococcus mutans способствовали прогнозируемым изменениям путей из-за использования ИПП. Кислотность желудочного сока, вызванная ИПП, считается ответственной за наблюдаемые микробные изменения, поскольку она позволяет бактериям полости рта колонизировать микробиом кишечника, что приводит к изменениям в таксономическом гомеостазе (рис. 1).Это подтверждается наблюдением «орализации» кишечного микробиома у пользователей ИПП.25 Однако исследование in vitro, оценивающее прямое влияние широко используемых лекарств, включая ИПП, на кишечных комменсалов, показало заметные изменения в скорости роста бактерий, что подразумевает существует также прямой эффект, который потенциально опосредован связыванием ИПП с бактериальными Н+/К+АТФ-азами.27
Кислотность желудочного сока, вызванная ИПП, считается ответственной за наблюдаемые микробные изменения, поскольку она позволяет бактериям полости рта колонизировать микробиом кишечника, что приводит к изменениям в таксономическом гомеостазе (рис. 1).Это подтверждается наблюдением «орализации» кишечного микробиома у пользователей ИПП.25 Однако исследование in vitro, оценивающее прямое влияние широко используемых лекарств, включая ИПП, на кишечных комменсалов, показало заметные изменения в скорости роста бактерий, что подразумевает существует также прямой эффект, который потенциально опосредован связыванием ИПП с бактериальными Н+/К+АТФ-азами.27
Важно признать, что изменения в микробиоме, вызванные ИПП, на самом деле могут способствовать клинически важным заболеваниям.Например, в предыдущих исследованиях были определены изменения в микробиоме кишечника, которые приводят к снижению устойчивости к колонизации кишечных инфекций, включая Clostridium difficile , Campylobacter и Salmonella , которые аналогичны тем, которые в настоящее время наблюдаются у пользователей ИПП. 28 29 У пользователей ИПП ОШ составляет от 1,5 до 1,8 для C. difficile и от 2,0 до 4,0 для других патогенных бактерий.30 Как известно, инфекции C. difficile развиваются в измененной микробной среде кишечника после назначении антибиотиков,31 потенциально это также может быть верно в условиях использования ИПП.Кроме того, назначение и отмена ИПП влияет на клиническое течение декомпенсированного цирроза печени, возможно, за счет изменений в микробиоте кишечника [32]. ожирение в более позднем возрасте.33
28 29 У пользователей ИПП ОШ составляет от 1,5 до 1,8 для C. difficile и от 2,0 до 4,0 для других патогенных бактерий.30 Как известно, инфекции C. difficile развиваются в измененной микробной среде кишечника после назначении антибиотиков,31 потенциально это также может быть верно в условиях использования ИПП.Кроме того, назначение и отмена ИПП влияет на клиническое течение декомпенсированного цирроза печени, возможно, за счет изменений в микробиоте кишечника [32]. ожирение в более позднем возрасте.33
Хотя профили эффективности и безопасности ИПП по-прежнему очень благоприятны, когда они назначаются по показаниям, основанным на доказательствах, медицинскому сообществу следует начать переосмысливать их широкое и хроническое использование и их безрецептурную доступность.Мы подошли к моменту, когда нам необходимо тщательно оценить долгосрочные последствия вызванных ИПП изменений в микробиоме до одной пятой части населения западного общества, сдвиг, который произошел за относительно короткий период время в истории человечества и специально изучить последствия изменения развивающегося микробиома кишечника в раннем возрасте и его влияние на здоровье и болезни в более позднем возрасте.
Метформин
Метформин представляет собой пероральный препарат, снижающий уровень глюкозы в крови, используемый при лечении диабета 2 типа (СД2).Хотя точный механизм его действия сложен и до конца не изучен, метформин действительно ингибирует глюконеогенез в печени, и исследования все чаще показывают, что некоторые из его полезных эффектов опосредованы кишечной микробиотой. показаниях или симптомах, метформин (почти) используется исключительно при диабете, что затрудняет отделение влияния препарата на микробиом от изменений в микробиоме кишечника, связанных с основным заболеванием.Тем не менее, это было сделано в ходе важного исследования, которое показало, что ранее наблюдаемые изменения в микробиоме кишечника, которые, как считалось, были вызваны лежащим в основе СД2, на самом деле были вызваны использованием метформина.12
В дополнительном интервенционном исследовании на здоровых добровольцах применение метформина привело к изменению более чем 80 видов по сравнению с контрольной группой, получавшей плацебо. Примечательно, что лечение метформином значительно увеличивает численность Escherichia coli и снижает численность Intestinibacter , что согласуется с результатами перекрестных когорт, в которых сравнивали пациентов, не получавших лечения, с пациентами, получавшими метформин, с СД2.12 36 Впоследствии авторы трансплантировали образцы фекалий от доноров, получавших метформин или плацебо, стерильным мышам и наблюдали более низкие уровни глюкозы в крови у мышей, получавших образцы фекалий от добровольцев, получавших метформин, что указывает на прямое влияние микробиома кишечника. на уровень глюкозы в крови. Считается, что этот эффект опосредован действием метформина на бактерии, продуцирующие короткоцепочечные жирные кислоты (бутират), и обилием Akkermansia muciniphila , а также общими биологическими путями и генами, закодированными в различных метформин-пораженных бактериях, например , металлопротеины или переносчики металлов.Кроме того, клинически хорошо известно, что до одной трети пациентов, принимающих метформин, сообщают о побочных эффектах со стороны желудочно-кишечного тракта, таких как диарея, вздутие живота и тошнота, а также об идентифицированных метформин-индуцированных изменениях, включая увеличение факторов вирулентности и генов газового метаболизма (в основном полученных из увеличение E.
Примечательно, что лечение метформином значительно увеличивает численность Escherichia coli и снижает численность Intestinibacter , что согласуется с результатами перекрестных когорт, в которых сравнивали пациентов, не получавших лечения, с пациентами, получавшими метформин, с СД2.12 36 Впоследствии авторы трансплантировали образцы фекалий от доноров, получавших метформин или плацебо, стерильным мышам и наблюдали более низкие уровни глюкозы в крови у мышей, получавших образцы фекалий от добровольцев, получавших метформин, что указывает на прямое влияние микробиома кишечника. на уровень глюкозы в крови. Считается, что этот эффект опосредован действием метформина на бактерии, продуцирующие короткоцепочечные жирные кислоты (бутират), и обилием Akkermansia muciniphila , а также общими биологическими путями и генами, закодированными в различных метформин-пораженных бактериях, например , металлопротеины или переносчики металлов.Кроме того, клинически хорошо известно, что до одной трети пациентов, принимающих метформин, сообщают о побочных эффектах со стороны желудочно-кишечного тракта, таких как диарея, вздутие живота и тошнота, а также об идентифицированных метформин-индуцированных изменениях, включая увеличение факторов вирулентности и генов газового метаболизма (в основном полученных из увеличение E. coli видов), может способствовать этим побочным эффектам.12 36
coli видов), может способствовать этим побочным эффектам.12 36
Переплетение взаимосвязей между метформином и кишечным микробиомом показывает, как широко используемое лекарство может изменить кишечный микробиом, и объясняет часть терапевтической функции лекарства, а также некоторые его побочные эффекты.В нем также подчеркивается необходимость строгого контроля таких вмешивающихся факторов, как употребление наркотиков (включая метформин, антибиотики, ИПП и другие препараты) при проведении исследований микробиома, посвященных конкретным заболеваниям или состояниям.
Другие широко используемые неантибиотические препараты
Крупные популяционные исследования микробиома с использованием перекрестных данных когорт из Великобритании, Нидерландов и Бельгии оценили сотни факторов, включая употребление наркотиков. В дополнение к ИПП и метформину эти исследования показали, что другие часто используемые препараты, включая слабительные, статины, антидепрессанты и опиоиды, могут объяснить некоторую изменчивость состава кишечного микробиома. 15 18 37
15 18 37
При рассмотрении микробных изменений, вызванных использованием слабительных средств, следует учитывать тот факт, что время кишечного транзита, консистенция стула и количество бактерий (например, микробная нагрузка на образец) влияют на характеристики микробиома.38, 39 Например, увеличение численности из видов Bacteroides наблюдаются у лиц, принимающих слабительные средства, а также в образцах стула с низкой консистенцией. Однако в независимом исследовании мышей, подвергшихся воздействию полиэтиленгликоля (ПЭГ), было обнаружено аналогичное увеличение Bacteroides .В этом исследовании индукция легкой осмотической диареи путем введения ПЭГ вызывала долговременные изменения в микробиоме кишечника, временное нарушение слизистого барьера и последующие врожденные и адаптивные иммунные реакции.40 После введения ПЭГ семейство S24-7 (в пределах порядок Bacteroidales) исчез и был полностью заменен отростком семейства Bacteroideaceae. Этот эффект был постоянным, если семейство S24-7 не было заменено. Другие таксоны, такие как Verrucomicrobia и Gammaproteobacteria, показали временные изменения, но в конечном итоге вернулись к исходным уровням.Немногочисленные данные о пациентах, принимающих препараты кишечника, также показали краткосрочные преходящие изменения в показателях разнообразия микробиома, но подробные исследования отсутствуют. долгосрочное воздействие на состав микробиома кишечника, которое не зависит от консистенции стула и количества бактерий в образце.
Другие таксоны, такие как Verrucomicrobia и Gammaproteobacteria, показали временные изменения, но в конечном итоге вернулись к исходным уровням.Немногочисленные данные о пациентах, принимающих препараты кишечника, также показали краткосрочные преходящие изменения в показателях разнообразия микробиома, но подробные исследования отсутствуют. долгосрочное воздействие на состав микробиома кишечника, которое не зависит от консистенции стула и количества бактерий в образце.
Продольное профилирование выявляет стойкий дисбиоз кишечника, вызванный традиционной противотуберкулезной терапией | Микробиом
ВОЗ. Глобальный отчет по туберкулезу. 2016-е изд. Женева: ВОЗ; 2016.
Google Scholar
Бреннан П.Дж., Янг Д.Б. Изониазид. Туберкулез (Эдинб) . 2008;88(2):112–116.
Бреннан П.Дж., Янг Д.Б. Пиразинамид. Туберкулез (Эдинб) . 2008;88(2):141–144.
Бреннан П. Дж., Янг Д.Б. Рифампин. Туберкулез (Эдинб) . 2008;88(2):151–154.
Дж., Янг Д.Б. Рифампин. Туберкулез (Эдинб) . 2008;88(2):151–154.
Бреннан П.Дж., Янг Д.Б. Этамбутол. Туберкулез (Эдинб) . 2008;88(2):102–105.
Янг В.Б., Шмидт Т.М. Антибиотикоассоциированная диарея, сопровождающаяся масштабными изменениями состава фекальной микробиоты. Дж. Клин Микробиол. 2004;42(3):1203–6.
Артикул пабмед ПабМед Центральный Google Scholar
Гиппони М., Шутто С., Аккорнеро Л., Бонасси С., Расо С., Виньоло С., Кафьеро Ф.Оценка изменений кишечной бактериальной флоры у пациентов, получающих длительное пероральное лечение бакампициллином или амоксициллином: рандомизированное исследование. Химиотерапия. 1985;4(3):214–7.
КАС пабмед Google Scholar
Brismar B, Edlund C, Malmborg AS, Nord CE. Концентрации ципрофлоксацина и влияние на микрофлору толстой кишки у пациентов, перенесших колоректальные операции.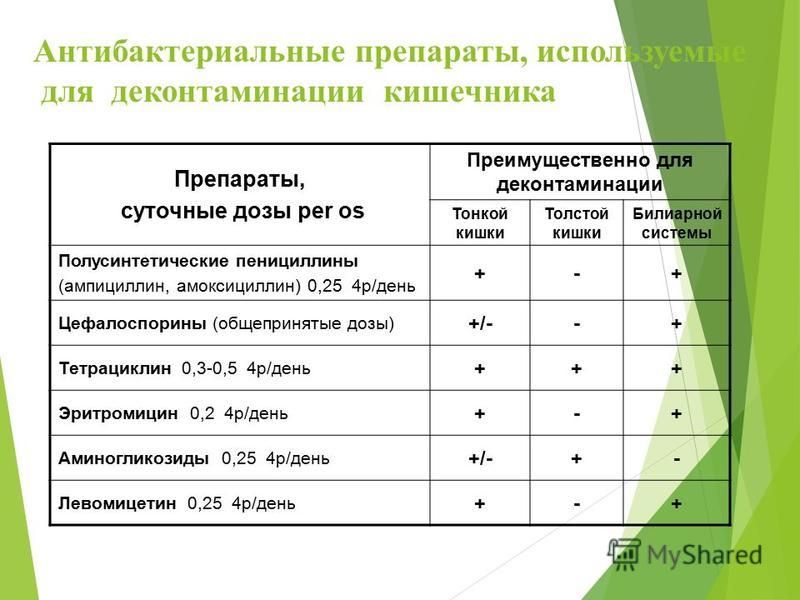 Противомикробные агенты Chemother. 1990;34(3):481–3.
Противомикробные агенты Chemother. 1990;34(3):481–3.
КАС Статья пабмед ПабМед Центральный Google Scholar
Brismar B, Edlund C, Nord CE. Сравнительное влияние кларитромицина и эритромицина на нормальную микрофлору кишечника. Scand J Infect Dis. 1991;23(5):635–42.
КАС Статья пабмед Google Scholar
Гринвуд С., Морроу А.Л., Лагомарчино А.Дж., Алтай М., Тафт Д.Х., Ю З., Ньюбург Д.С., Уорд Д.В., Шиблер К.Р. Раннее эмпирическое применение антибиотиков у недоношенных детей связано с более низким бактериальным разнообразием и более высоким относительным обилием энтеробактерий.J Педиатр. 2014;165(1):23–9.
Артикул пабмед ПабМед Центральный Google Scholar
Вризе А., Аут К., Фуэнтес С., Йонкер Л., Реулинг И., Кутте Р.С., ван Нуд Э., Холлеман Ф., Кнаапен М. , Ромейн Дж.А. и др. Влияние перорального ванкомицина на микробиоту кишечника, метаболизм желчных кислот и чувствительность к инсулину. J Гепатол. 2014;60(4):824–31.
, Ромейн Дж.А. и др. Влияние перорального ванкомицина на микробиоту кишечника, метаболизм желчных кислот и чувствительность к инсулину. J Гепатол. 2014;60(4):824–31.
КАС Статья пабмед Google Scholar
Кини К.М., Юрист-Дутч С., Арриета М.С., Финлей Б.Б. Влияние антибиотиков на микробиоту человека и последующее заболевание. Анну Рев Микробиол. 2014;68:217–35.
КАС Статья пабмед Google Scholar
Лэнгдон А., Крук Н., Дантас Г. Влияние антибиотиков на микробиом на протяжении всего развития и альтернативные подходы к терапевтической модуляции. Геном Мед. 2016;8(1):39.
Артикул пабмед ПабМед Центральный Google Scholar
Лихтман Дж.С., Феррейра Дж.А., Нг К.М., Смитс С.А., Зонненбург Дж.Л., Элиас Дж.Е. Взаимодействия хозяин-микробиота в патогенезе антибиотикоассоциированных заболеваний. Cell Rep. 2016;14(5):1049–61.
Cell Rep. 2016;14(5):1049–61.
КАС Статья пабмед ПабМед Центральный Google Scholar
Nord CE, Bergan T, Thorsteinsson SB. Влияние тикарциллина/клавуланата на микрофлору кишечника. J Антимикробная химиотерапия. 1989; 24 (Приложение B): 221–6.
КАС Статья пабмед Google Scholar
Детлефсен Л., Релман Д.А. Неполное восстановление и индивидуальная реакция микробиоты дистального отдела кишечника человека на повторное воздействие антибиотиков. Proc Natl Acad Sci U S A. 2011;108 Suppl 1:4554–61.
КАС Статья пабмед Google Scholar
Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж.К. Долгосрочные последствия воздействия антибиотиков на кишечную микробиоту человека. Микробиология. 2010; 156 (часть 11): 3216–23.
КАС Статья пабмед Google Scholar

Walker AW, Ince J, Duncan SH, Webster LM, Holtrop G, Ze X, Brown D, Stares MD, Scott P, Bergerat A, et al. Доминирующие и чувствительные к диете группы бактерий в микробиоте толстой кишки человека. ISME J. 2011;5(2):220–30.
КАС Статья пабмед Google Scholar
Дункан С.Х., Беленгер А., Холтроп Г., Джонстон А.М., Флинт Х.Дж., Лобли Г.Э. Уменьшение потребления углеводов людьми с ожирением приводит к снижению концентрации бутирата и бактерий, продуцирующих бутират, в фекалиях.Appl Environ Microbiol. 2007;73(4):1073–1078.
КАС Статья пабмед Google Scholar
Brinkworth GD, Noakes M, Clifton PM, Bird AR. Сравнительное влияние диет с очень низким содержанием углеводов, высоким содержанием жиров и высоким содержанием углеводов и низким содержанием жиров для снижения веса на привычки кишечника и фекальные короткоцепочечные жирные кислоты и бактериальные популяции. Бр Дж Нутр. 2009;101(10):1493–502.
Бр Дж Нутр. 2009;101(10):1493–502.
КАС Статья пабмед Google Scholar
Флинт Х.Дж., Скотт К.П., Луис П., Дункан С.Х. Роль микробиоты кишечника в питании и здоровье. Нат Рев Гастроэнтерол Гепатол. 2012;9(10):577–89.
КАС Статья пабмед Google Scholar
Тернбо П.Дж., Лей Р.Е., Маховальд М.А., Магрини В., Мардис Э.Р., Гордон Д.И. Связанный с ожирением кишечный микробиом с повышенной способностью собирать энергию. Природа. 2006; 444(7122):1027–31.
Артикул пабмед Google Scholar
Cox LM, Yamanishi S, Sohn J, Alexeyenko AV, Leung JM, Cho I, Kim SG, Li H, Gao Z, Mahana D, et al. Изменение кишечной микробиоты во время критического окна развития имеет длительные метаболические последствия. Клетка. 2014;158(4):705–21.
КАС Статья пабмед ПабМед Центральный Google Scholar
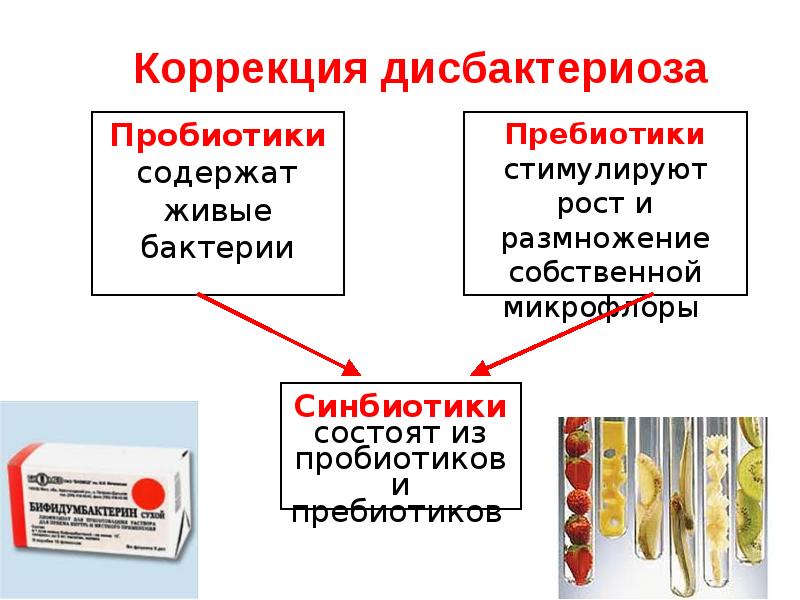
Мазманян С.К., Лю С.Х., Цианабос А.О., Каспер Д.Л. Иммуномодулирующая молекула симбиотических бактерий управляет созреванием иммунной системы хозяина.Клетка. 2005;122(1):107–18.
КАС Статья пабмед Google Scholar
Olszak T, An D, Zeissig S, Vera MP, Richter J, Franke A, Glickman JN, Siebert R, Baron RM, Kasper DL, et al. Воздействие микробов в раннем возрасте оказывает стойкое влияние на функцию Т-клеток естественных киллеров. Наука. 2012;336(6080):489–93.
КАС Статья пабмед ПабМед Центральный Google Scholar
Иванов И.И., Фрутос Рде Л., Манел Н., Йошинага К., Рифкин Д.Б., Сартор Р.Б., Финлей Б.Б., Литтман Д.Р. Специфическая микробиота управляет дифференцировкой Т-хелперов, продуцирующих ИЛ-17, в слизистой оболочке тонкой кишки. Клеточный микроб-хозяин. 2008;4(4):337–49.
КАС Статья пабмед ПабМед Центральный Google Scholar
Макферсон А.Дж., Харрис Н.Л. Взаимодействие между комменсальными кишечными бактериями и иммунной системой.Нат Рев Иммунол. 2004;4(6):478–85.
КАС Статья пабмед Google Scholar
Белкаид Ю., Хэнд Т.В. Роль микробиоты в иммунитете и воспалении. Клетка. 2014;157(1):121–41.
КАС Статья пабмед ПабМед Центральный Google Scholar
Hill DA, Hoffmann C, Abt MC, Du Y, Kobuley D, Kirn TJ, Bushman FD, Artis D. Метагеномный анализ выявил вызванные антибиотиками временные и пространственные изменения кишечной микробиоты с сопутствующими изменениями гомеостаза иммунных клеток. .Иммунол слизистых оболочек. 2010;3(2):148–58.
КАС Статья пабмед Google Scholar
Бекаттини С., Таур Ю., Памер Э.Г. Индуцированные антибиотиками изменения кишечной микробиоты и заболевания. Тренды Мол Мед. 2016;22(6):458–78.
КАС Статья пабмед ПабМед Центральный Google Scholar
Лей Р.Э., Тернбо П.Дж., Кляйн С., Гордон Дж.И. Микробная экология: кишечные микробы человека, связанные с ожирением.Природа. 2006; 444(7122):1022–3.
КАС Статья пабмед Google Scholar
Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, Liang S, Zhang W, Guan Y, Shen D, et al. Метагеномное ассоциативное исследование микробиоты кишечника при диабете 2 типа. Природа. 2012;490(7418):55–60.
КАС Статья пабмед Google Scholar
Manichanh C, Borruel N, Casellas F, Guarner F.Микробиота кишечника при ВЗК. Нат Рев Гастроэнтерол Гепатол. 2012;9(10):599–608.
КАС Статья пабмед Google Scholar
Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, Codelli JA, Chow J, Reisman SE, Petrosino JF, et al. Микробиота модулирует поведенческие и физиологические отклонения, связанные с нарушениями развития нервной системы. Клетка. 2013;155(7):1451–63.
КАС Статья пабмед ПабМед Центральный Google Scholar
Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, Challis C, Schretter CE, Rocha S, Gradinaru V, et al. Микробиота кишечника регулирует моторный дефицит и нейровоспаление в модели болезни Паркинсона. Клетка. 2016;167(6):1469–80. е1412.
КАС Статья пабмед Google Scholar
Камада Н., Сео С.У., Чен Г.Ю., Нуньес Г. Роль микробиоты кишечника в иммунитете и воспалительных заболеваниях. Нат Рев Иммунол.2013;13(5):321–35.
КАС Статья пабмед Google Scholar
Льюис Б.Б., Баффи К.Г., Картер Р.А., Лейнер И., Туссен Н.К., Миллер Л.С., Гобурн А., Линг Л., Памер Э.Г. Потеря опосредованной микробиотой резистентности к инфекции Clostridium difficile при пероральном приеме ванкомицина по сравнению с метронидазолом. J заразить Dis. 2015;212(10):1656–65.
Артикул пабмед ПабМед Центральный Google Scholar
Ubeda C, Taur Y, Jenq RR, Equinda MJ, Son T, Samstein M, Viale A, Socci ND, van den Brink MR, Kamboj M, et al. Доминирование устойчивых к ванкомицину энтерококков в кишечной микробиоте обеспечивается лечением антибиотиками у мышей и предшествует инвазии в кровоток у людей. Джей Клин Инвест. 2010;120(12):4332–41.
КАС Статья пабмед ПабМед Центральный Google Scholar
Иванов И.И., Атараши К., Манел Н., Броди Э.Л., Шима Т., Караоз У., Вей Д., Гольдфарб К.С., Санти К.А., Линч С.В., и другие.Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Клетка. 2009;139(3):485–98.
КАС Статья пабмед ПабМед Центральный Google Scholar
Russell SL, Gold MJ, Hartmann M, Willing BP, Thorson L, Wlodarska M, Gill N, Blanchet MR, Mohn WW, McNagny KM, et al. Изменения в микробиоте, вызванные приемом антибиотиков в раннем возрасте, повышают восприимчивость к аллергической астме. EMBO Rep. 2012;13(5):440–7.
КАС Статья пабмед ПабМед Центральный Google Scholar
Чо И., Яманиши С., Кокс Л., Мете Б.А., Завадил Дж., Ли К., Гао З., Махана Д., Раджу К., Тейтлер И. и др. Антибиотики в раннем возрасте изменяют микробиом толстой кишки мышей и ожирение. Природа. 2012;488(7413):621–6.
КАС Статья пабмед ПабМед Центральный Google Scholar
Козырский А.Л., Эрнст П., Беккер А.Б. Повышенный риск детской астмы из-за использования антибиотиков в раннем возрасте. Грудь. 2007;131(6):1753–1759.
Артикул пабмед Google Scholar
Риснес К.Р., Беланже К., Мурк В., Бракен М.Б. Воздействие антибиотиков в возрасте 6 месяцев и астма и аллергия в возрасте 6 лет: результаты исследования когорты из 1401 ребенка в США. Am J Эпидемиол. 2011;173(3):310–8.
Артикул пабмед Google Scholar
Корпела К., Салонен А., Вирта Л.Дж., Кекконен Р.А., Форслунд К., Борк П., де Вос В.М. Кишечный микробиом связан с пожизненным использованием антибиотиков финскими детьми дошкольного возраста. Нац коммун. 2016;7:10410.
КАС Статья пабмед ПабМед Центральный Google Scholar
Zitvogel L, Galluzzi L, Viaud S, Vetizou M, Daillere R, Merad M, Kroemer G. Рак и микробиота кишечника: неожиданная связь. Sci Transl Med. 2015;7(271):271пс271.
Артикул Google Scholar
Иида Н., Дзуцев А., Стюарт К.А., Смит Л., Буладу Н., Вайнгартен Р.А., Молина Д.А., Сальседо Р., Бэк Т., Крамер С. и соавт.Комменсальные бактерии контролируют реакцию рака на терапию, модулируя микроокружение опухоли. Наука. 2013;342(6161):967–70.
КАС Статья пабмед Google Scholar
Vetizou M, Pitt JM, Daillere R, Lepage P, Waldschmitt N, Flament C, Rusakiewicz S, Routy B, Roberti MP, Duong CP, et al. Противораковая иммунотерапия блокадой CTLA-4 зависит от микробиоты кишечника. Наука. 2015;350(6264):1079–84.
КАС Статья пабмед ПабМед Центральный Google Scholar
Daillere R, Vetizou M, Waldschmitt N, Yamazaki T, Isnard C, Poirier-Colame V, Duong CP, Flament C, Lepage P, Roberti MP, et al. Enterococcus hirae и Barnesiella intestinihominis способствуют терапевтическим иммуномодулирующим эффектам, вызванным циклофосфамидом. Иммунитет. 2016;45(4):931–43.
КАС Статья пабмед Google Scholar
Секиров И., Там Н.М., Джогова М., Робертсон М.Л., Ли И., Лупп С., Финлей Б.Б. Вызванные антибиотиками нарушения кишечной микробиоты изменяют восприимчивость хозяина к кишечной инфекции.Заразить иммун. 2008;76(10):4726–36.
КАС Статья пабмед ПабМед Центральный Google Scholar
Buffie CG, Jarchum I, Equinda M, Lipuma L, Gobourne A, Viale A, Ubeda C, Xavier J, Pamer EG. Глубокие изменения кишечной микробиоты после однократного приема клиндамицина приводят к устойчивой восприимчивости к колиту, вызванному Clostridium difficile. Заразить иммун. 2012;80(1):62–73.
КАС Статья пабмед ПабМед Центральный Google Scholar
Хан Н., Видьярти А., Надим С., Неги С., Наир Г., Агревала Дж. Н. Изменение микробиоты кишечника провоцирует восприимчивость к туберкулезу. Фронт Иммунол. 2016;7:529.
ПабМед ПабМед Центральный Google Scholar
Dubourg G, Lagier JC, Armougom F, Robert C, Hamad I, Brouqui P, Raoult D. Микробиота кишечника пациента с резистентным туберкулезом более полно изучена культуромикой, чем метагеномикой. Eur J Clin Microbiol Infect Dis.2013;32(5):637–45.
КАС Статья пабмед Google Scholar
Ахиджо Б.А., Майга М.К., Ихмс Э.А., Майга М., Ордонез А.А., Чунг Л.С., Бек С., Андраде Б.Б., Джейн С., Бишай В.Р. Антифиброзный препарат пирфенидон способствует образованию полостей в легких и лекарственной устойчивости у мышиной модели хронического туберкулеза. Взгляд JCI. 2016;1(14):e86017.
Артикул пабмед ПабМед Центральный Google Scholar
Winglee K, Eloe-Fadrosh E, Gupta S, Guo H, Fraser C, Bishai W. Аэрозольная инфекция Mycobacterium tuberculosis вызывает быструю потерю разнообразия микробиоты кишечника. ПЛОС Один. 2014;9(5):e97048.
Артикул пабмед ПабМед Центральный Google Scholar
McDonald D, Price MN, Goodrich J, Nawrocki EP, DeSantis TZ, Probst A, Andersen GL, Knight R, Hugenholtz P. Улучшенная таксономия Greengenes с явными рангами для экологического и эволюционного анализа бактерий и архей.ISME J. 2012;6(3):610–8.
КАС Статья пабмед Google Scholar
Langille MG, Zaneveld J, Caporaso JG, McDonald D, Knights D, Reyes JA, Clemente JC, Burkepile DE, Vega Thurber RL, Knight R, et al. Прогностическое функциональное профилирование микробных сообществ с использованием последовательностей маркерных генов 16S рРНК. Нац биотехнолог. 2013;31(9):814–21.
КАС Статья пабмед ПабМед Центральный Google Scholar
Sonnenburg JL, Backhed F. Взаимодействие диеты и микробиоты как модераторов метаболизма человека. Природа. 2016;535(7610):56–64.
КАС Статья пабмед Google Scholar
Рейквам Д.Х., Ерофеев А., Сандвик А., Грчич В., Янсен Ф.Л., Гаустад П., Маккой К.Д., Макферсон А.Дж., Меза-Зепеда Л.А., Йохансен Ф.Е. Истощение кишечной микробиоты мышей: влияние на слизистую оболочку кишечника и экспрессию эпителиальных генов. ПЛОС Один. 2011;6(3):e17996.
КАС Статья пабмед ПабМед Центральный Google Scholar
Scorpio A, Zhang Y. Мутации в pncA, гене, кодирующем пиразинамидазу/никотинамидазу, вызывают устойчивость туберкулезной палочки к противотуберкулезному препарату пиразинамиду. Нат Мед. 1996;2(6):662–7.
КАС Статья пабмед Google Scholar
Гроссе Дж., Трюффо-Перно С., Лакруа С., Джи Б.Антагонизм между изониазидом и комбинацией пиразинамид-рифампин против туберкулезной инфекции у мышей. Противомикробные агенты Chemother. 1992;36(3):548–51.
КАС Статья пабмед ПабМед Центральный Google Scholar
Ahmad Z, Fraig MM, Pinn ML, Tyagi S, Nuermberger EL, Grosset JH, Karakousis PC. Эффективность химиотерапии туберкулеза коррелирует с устойчивостью к микобактериям туберкулеза в моделях на животных.J Антимикробная химиотерапия. 2011;66(7):1560–6.
КАС Статья пабмед ПабМед Центральный Google Scholar
Атараши К., Таноуэ Т., Осима К., Суда В., Нагано Ю., Нисикава Х., Фукуда С., Сайто Т., Нарушима С., Хасэ К. и др. Индукция Treg рационально подобранной смесью штаммов Clostridia из микробиоты человека. Природа. 2013; 500(7461):232–6.
КАС Статья пабмед Google Scholar
Тернбо П.Дж., Бакхед Ф., Фултон Л., Гордон Дж.И. Ожирение, вызванное диетой, связано с заметными, но обратимыми изменениями в микробиоме дистального отдела кишечника мышей. Клеточный микроб-хозяин. 2008;3(4):213–23.
КАС Статья пабмед ПабМед Центральный Google Scholar
Palm NW, de Zoete MR, Cullen TW, Barry NA, Stefanowski J, Hao L, Degnan PH, Hu J, Peter I, Zhang W, et al. Покрытие иммуноглобулином А выявляет колитогенные бактерии при воспалительных заболеваниях кишечника.Клетка. 2014;158(5):1000–10.
КАС Статья пабмед ПабМед Центральный Google Scholar
Zhang C, Zhang M, Wang S, Han R, Cao Y, Hua W, Mao Y, Zhang X, Pang X, Wei C, et al. Взаимодействия между кишечной микробиотой, генетикой хозяина и диетой, имеющие отношение к развитию метаболических синдромов у мышей. ISME J. 2010;4(2):232–41.
КАС Статья пабмед Google Scholar
Каакуш НЕТ. Взгляд на роль erysipelotrichaceae в организме человека. Front Cell Infect Microbiol. 2015;5:84.
Артикул пабмед ПабМед Центральный Google Scholar
Убеда С., Буччи В., Кабальеро С., Джукович А., Туссен Н.С., Эквинда М., Липума Л., Линг Л., Гобурн А., № Д. и др. Кишечная микробиота, содержащая виды Barnesiella, излечивает устойчивые к ванкомицину колонии Enterococcus faecium. Заразить иммун.2013;81(3):965–73.
КАС Статья пабмед ПабМед Центральный Google Scholar
Livanos AE, Greiner TU, Vangay P, Pathmasiri W, Stewart D, McRitchie S, Li H, Chung J, Sohn J, Kim S, et al. Опосредованное антибиотиками нарушение микробиома кишечника ускоряет развитие диабета 1 типа у мышей. Нат микробиол. 2016;1(11):16140.
КАС Статья пабмед Google Scholar
Диксон РП, Хаффнейгл ГБ. Микробиом легких: новые принципы респираторной бактериологии в норме и при патологии. PLoS Патог. 2015;11(7):e1004923.
Артикул пабмед ПабМед Центральный Google Scholar
Wu J, Liu W, He L, Huang F, Chen J, Cui P, Shen Y, Zhao J, Wang W, Zhang Y, et al. Микробиота мокроты, ассоциированная с впервые выявленным, рецидивирующим и неэффективным туберкулезом. ПЛОС Один. 2013;8(12):e83445.
Артикул пабмед ПабМед Центральный Google Scholar
Клиндворт А., Прюссе Э., Швир Т., Пепли Дж., Кваст С., Хорн М., Глокнер ФО. Оценка общих праймеров для ПЦР гена рибосомной РНК 16S для классических исследований и исследований разнообразия на основе секвенирования следующего поколения. Нуклеиновые Кислоты Res. 2013;41(1):e1.
КАС Статья пабмед Google Scholar
Эдгар РЦ. Поиск и кластеризация на несколько порядков быстрее, чем BLAST. Биоинформатика. 2010;26(19):2460–1.
КАС Статья пабмед Google Scholar
Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pena AG, Goodrich JK, Gordon JI, et al. QIIME позволяет анализировать данные секвенирования с высокой пропускной способностью. Нат Методы. 2010;7(5):335–6.
КАС Статья пабмед ПабМед Центральный Google Scholar
Haas BJ, Gevers D, Earl AM, Feldgarden M, Ward DV, Giannoukos G, Ciulla D, Tabbaa D, Highlander SK, Sodergren E, et al.Формирование и обнаружение химерной последовательности 16S рРНК в ампликонах Сэнгера и 454-пиросеквенированных ПЦР. Геном Res. 2011;21(3):494–504.
КАС Статья пабмед ПабМед Центральный Google Scholar
Lozupone C, Knight R. UniFrac: новый филогенетический метод сравнения микробных сообществ. Appl Environ Microbiol. 2005;71(12):8228–35.
КАС Статья пабмед ПабМед Центральный Google Scholar
Lozupone CA, Hamady M, Kelley ST, Knight R. Количественные и качественные меры бета-разнообразия приводят к различному пониманию факторов, которые структурируют микробные сообщества. Appl Environ Microbiol. 2007;73(5):1576–85.
КАС Статья пабмед ПабМед Центральный Google Scholar
Vazquez-Baeza Y, Pirrung M, Gonzalez A, Knight R. EMPeror: инструмент для визуализации данных о микробном сообществе с высокой пропускной способностью. Гигасайнс.2013;2(1):16.
Артикул пабмед ПабМед Центральный Google Scholar
Segata N, Izard J, Waldron L, Gevers D, Miropolsky L, Garrett WS, Huttenhower C. Открытие и объяснение метагеномных биомаркеров. Геном биол. 2011;12(6):R60.
Артикул пабмед ПабМед Центральный Google Scholar
Факты о дисбиозе кишечника и способах его лечения
Вы делите свое тело с триллионами микроскопических организмов.Когда они не ладят, это называется «дисбиозом», и это имеет косвенные последствия для вашего здоровья.
Дисбактериоз — это современная проблема, возникшая, когда ученые обнаружили поразительное разнообразие микробов, живущих на теле человека и в нем. В большинстве своем эти одноклеточные организмы безвредны (некоторые даже хороши) и живут в симбиозе с вами, хозяином.
Но микробы — чувствительные маленькие существа, и их гармоничные сообщества легко вывести из равновесия.Это позволяет менее дружелюбным насекомым брать на себя управление и делать то, что им больше всего подходит, а это не всегда то, что нужно вашему организму. Это упрощенное определение дисбактериоза .
В этой статье вы познакомитесь с причинами дисбактериоза и его симптомами, тестированием и лечением. Вы обнаружите, что дисбактериоз — это удивительно распространенная проблема, и почему исследователи до сих пор не могут понять, что первично: дисбактериоз или болезнь.
☝️ ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ ☝Эта статья предназначена только для информационных целей.Он не предназначен для составления или замены профессиональной медицинской консультации, диагностики или лечения.
Содержание
Что такое дисбактериоз?
Дисбактериоз определяется как негативные изменения в микробных сообществах вашего тела, которые связаны с проблемами со здоровьем и болезнями. Различают два основных вида дисбактериоза: бактериальный и грибковый. Однако дисбактериоз не является заболеванием.
Дисбактериоз — это универсальный термин, потому что не существует «идеального» микробиома.Каждый человек уникален, а это значит, что каждый микробиом тоже уникален. Однако исследователи выявили некоторые общие признаки дисбактериоза, связанные с количеством одних микробов по отношению к другим:
- чрезмерный рост некоторых бактерий или дрожжей
- отсутствие или недостаток полезных бактерий
- низкое разнообразие видов в микробиоме
Грибковый дисбактериоз
В организме также обитают небольшие количества дрожжевых грибков, которые по большей части безвредны.Тем не менее, разрастание грибка является частой причиной ушных инфекций, микоза, молочницы и вагинальных инфекций, многие из которых вызываются дрожжевым грибком Candida и плесенью Aspergillus.
☝️ СОВЕТ ☝️ Значение дисбактериоза происходит от древнегреческого: дис- (плохой или плохой) и биозис (образ жизни).
Что такое дисбактериоз кишечника?
Самая известная микробная экосистема — кишечный микробиом. Расположенный в толстой кишке, он содержит триллионы бактериальных клеток, которые работают с кишечником, чтобы поддерживать его здоровье.Там также есть некоторые дрожжи, грибы и археи.
В здоровом и сбалансированном микробиоме достаточно нужных бактерий для производства важных питательных веществ, поддерживающих здоровье слизистой оболочки кишечника и защищающих от вторжений, которые могут вызвать дисбактериоз, захватив экосистему.
Разнообразие является ключевым показателем для измерения дисбактериоза микробиома кишечника. В здоровом микробиоме присутствует более 1000 различных видов бактерий. Они сдерживают чужеродные бактерии и потенциально инфекционные микробы, поэтому они не могут размножаться и вызывать у вас заболевание.
Что вызывает дисбактериоз кишечника?
Иллюстрация, вдохновленная обзором о дисбактериозе 2016 года, проведенным ДеГруттолой А.К. и другие.В вашей повседневной жизни существует множество факторов, которые могут влиять на дисбиоз толстой кишки и здоровье микробиома, самым большим из которых являются антибиотики. Даже всего один курс антибиотиков может вызвать дисбактериоз, который длится месяцами. Многократный прием антибиотиков может даже навсегда нарушить микробиом кишечника.
Другие факторы, связанные с дисбактериозом кишечника, включают диету и образ жизни.Вечеринки каждую ночь и жизнь на фаст-фуде и сладких напитках не принесут пользы вашему кишечнику, но употребление большого количества цельных продуктов, фруктов и овощей и регулярные физические упражнения принесут пользу.
Практически невозможно определить, является ли дисбактериоз частью проблемы или просто следствием болезни. Исследователи полагают, что это, вероятно, порочный круг, в котором микробиом кишечника и организм создают условия для болезни.
Действительно, болезнь (и даже прием лекарств) может повлиять на микробиом, вызывая дисбактериоз, который затем подпитывает болезнь.Точно так же считается, что дисбиоз может вызвать проблемы с обменом веществ в организме, которые впоследствии повышают восприимчивость человека к болезням.
Симптомы дисбактериоза
Симптомы дисбиоза кишечника очень расплывчаты и совпадают со многими распространенными проблемами со здоровьем, включая синдром раздраженного кишечника, воспалительное заболевание кишечника и глютеновую болезнь. Исследования также показывают, что дисбактериоз является фактором риска развития этих состояний.
Общие симптомы дисбактериоза кишечника:
- метеоризм
- вздутие живота
- боль в животе
- диарея
- запор
Только помните, что если у вас есть симптомы дисбактериоза кишечника, вам всегда следует обратиться к врачу для проведения диагностического обследования, чтобы убедиться, что у вас нет серьезных проблем со здоровьем.
Тесты на дисбактериоз
Дисбактериоз — это слово, используемое для описания функционального состояния, это не диагноз, потому что он не считается состоянием здоровья.
Если вы хотите проверить наличие дисбактериоза кишечника, вы можете пройти тест на микробиом кишечника, например, тест Atlas Microbiome Test. Их специально не называют тестами на дисбактериоз кишечника, потому что они анализируют многие особенности микробиоты кишечника, а не только дисбактериоз.
Вы можете прямо сейчас заказать онлайн-тест Atlas Microbiome Test, и набор для сбора будет доставлен к вашей двери.Все, что вам нужно сделать, это собрать небольшой образец стула и вернуть его. Ваш образец анализируется в лаборатории, чтобы определить бактерии в вашем кишечнике и то, как они влияют на ваше здоровье.
| Отчет | Чему вы научитесь |
|---|---|
| Разнообразие микробиома | Узнайте, насколько разнообразен микробиом вашего кишечника и является ли дисбактериоз проблемой. |
| Полезные бактерии | Узнайте о полезных бактериях в кишечнике и достаточно ли их для защиты от дисбактериоза. |
| Уровни бутирата | Узнайте, производят ли ваши бактерии достаточное количество бутирата для поддержания здоровья кишечника. |
| Метаболизм пищевых волокон | Узнайте, насколько хорошо кишечные микробы расщепляют различные пищевые волокна. |
| Защита от болезней | Узнайте, как кишечные микробы защищают вас от 5 заболеваний, связанных с дисбактериозом. |
| Синтез витаминов | Узнайте, производят ли ваши микробы достаточное количество витаминов группы В и К, чтобы накормить население. | Диета при дисбактериозе | Каждую неделю открывайте персонализированные списки продуктов, чтобы восстановить микробиом кишечника и бороться с дисбактериозом. |
Несмотря на то, что универсального определения дисбиоза не существует, существует достаточно данных, чтобы понять, как выглядит сбалансированный микробиом. Вот почему тесты кишечного микробиома — хороший вариант, если вас беспокоит дисбактериоз.
Тест разнообразия на дисбактериоз
Тесты микробиома— это лучший способ проверить разнообразие микробиома — основного показателя здоровья, — который показывает, довольны ли и сбалансированы ваши кишечные бактерии, или есть ли переизбыток одних бактерий и недостаток других.
Если в кишечнике недостаточно полезных и пробиотических бактерий, вы более подвержены дисбактериозу. Вот почему тест Atlas Microbiome Test также проверяет обилие пробиотических бактерий, таких как Lactobacillus и Bifidobacteria , а также других полезных бактерий в кишечнике.
Питательный тест на дисбактериоз
Тесты, такие как тест Atlas Microbiome Test, могут оценить уровень бутирата (критической короткоцепочечной жирной кислоты), вырабатываемого вашими бактериями для поддержания здоровья вашего кишечника.Кишечные микробы также вырабатывают витамины, которые питают другие бактерии, и здесь вы также можете увидеть, как поживает ваш микробиом.
Статус защиты от болезней
Дисбактериоз часто наблюдается при серьезных заболеваниях, и наш тест микробиома может оценить, насколько ваш кишечный микробиом похож или отличается от пяти распространенных заболеваний:
- Болезнь Крона
- Язвенный колит
- Ожирение
- Болезнь сердца
- Диабет II типа
Лечение дисбактериоза кишечника
Лечение дисбактериоза должно быть адаптировано для каждого человека с использованием результатов теста микробиома кишечника.Протокол лечения дисбактериоза кишечника может включать в себя сочетание диетических изменений, пробиотических добавок и модификаций образа жизни для создания оптимальных условий для размножения полезных бактерий.
Получайте еженедельные персональные рекомендации по питанию для борьбы с дисбактериозомНе существует лекарства, которое могло бы лечить симптомы дисбактериоза кишечника, и лечение обычно разрабатывается в каждом конкретном случае. При легком дисбалансе микробиома, выявленном с помощью теста Atlas Microbiome Test, ваши еженедельные рекомендации по питанию представляют собой диету для лечения дисбактериоза.
Питая свой микробиом пребиотическими продуктами, вы питаете полезные бактерии в кишечнике, чтобы они могли процветать и восстанавливать баланс в экосистеме. Пребиотики — это просто красивое название для растительной пищи, потому что хорошие кишечные бактерии питаются пищевыми волокнами и растительными питательными веществами.
Дневник питания Atlas Biomed для здоровья микробиомаЭта персонализированная диета при дисбактериозе является естественным лечением дисбактериоза, которое не требует каких-либо добавок или лекарств. Все, что вам нужно сделать, это следовать еженедельным рекомендациям по питанию и записывать свои успехи в приложении Atlas Health.
Это приложение имеет встроенную функцию подсчета очков, позволяющую оценивать ваши блюда на основе того, насколько они благоприятны для микробиома, чтобы помочь вам придерживаться диеты при дисбактериозе кишечника. Кроме того, вы можете получить бесплатную консультацию диетолога и попросить совета у профессионала.
Отслеживайте состояние своего микробиома с течением времени с помощью нашей опции тестовой подписки. С помощью нашей функции подписки вы даже можете отслеживать, насколько эффективна ваша диета для лечения дисбактериоза кишечника. Проходите тест Atlas Microbiome Test каждые три месяца, чтобы увидеть, как ваш микробиом меняется и реагирует на улучшения в вашем выборе продуктов питания.
Другие виды дисбактериоза
Дисбактериоз поражает не только толстую кишку. Он может поразить любую часть тела, которая имеет свою особую экосистему микробов, потому что бактерии повсюду от вашего рта до мочевыводящих путей.
Дисбактериоз кожи
Только на вашей коже есть несколько нишевых микробиомов, которые зависят от местной среды. Например, микробам, которым нравится жирная кожа вашего носа, скорее всего, не так нравятся ваши потные подмышки.
Действительно, некоторые исследования показали, что перхоть и себорейный дерматит (зудящая сыпь с шелушащимися чешуйками) связаны с грибковым и бактериальным дисбиозом. Атопический дерматит, более известный как экзема, также связан с дисбактериозом микробиома кожи.
Дисбактериоз полости рта
Дисбактериоз полости рта — еще одна распространенная проблема, которая может иметь серьезные последствия. Гингивит и периодонтит (две стадии заболевания десен) связаны с дисбиозом полости рта, вызванным бактерией Porphyromonas gingivalis .
Чрезмерный рост P. gingivalis означает, что эти микробы могут попасть вместе со слюной в пищеварительный тракт, где они могут активировать иммунную систему, вызывая хроническое воспаление и дисбактериоз микробиома кишечника.
Избыточный бактериальный рост в тонкой кишке (СИБР)
Ваш кишечник состоит из двух частей. Тонкий кишечник извлекает большую часть энергии и питательных веществ из пищи, а толстый кишечник поглощает воду, электролиты и некоторые другие питательные вещества и избавляется от отходов.
СИБР — это тип дисбактериоза, при котором избыточный рост бактерий приводит к избыточному производству метана или водорода. Эти газы воздействуют на клетки слизистой оболочки кишечника, вызывая вздутие живота, боли в животе, газообразование, диарею и иногда запоры.
Кандидозный дисбактериоз
Candida — это, как правило, безвредные дрожжи, которые иногда выходят из-под контроля и захватывают местный микробиом с неприятными побочными эффектами. Разрастание Candida является формой дисбактериоза, известной как кандидоз.
Дрожжевые грибки Candida могут вызывать молочницу полости рта — грибковый дисбиоз полости рта — с неприятными симптомами, такими как болезненность, белые или желтые пятна, которые кровоточат при соскабливании, неприятный привкус во рту, сухость и трещины по бокам рта.
Другой распространенный тип грибкового дисбактериоза Candida поражает только женщин: дрожжевые инфекции. В вагинальном микробиоме преобладают бактерии Lactobacillus , которые поддерживают кислую среду для сдерживания патогенов. Когда эта экосистема нарушается (например, антибиотиками), дрожжевые грибки кандиды могут взять верх и вызвать вагинальную инфекцию.
☝️ ФАКТ ☝️ Анализы микробиома не могут показать, есть ли у вас грибковое разрастание, дисбактериоз кожи или паразитарная инфекция.
Программа микробиома — Центр индивидуализированной медицины
Программа микробиома
Изобретение микроскопа давно позволило ученым понять, как бактерии могут вызывать и передавать инфекции в организме человека. Теперь, используя геномное секвенирование, исследователи обнаруживают, что сообщества бактерий внутри и на теле каждого человека, известные под общим названием человеческий микробиом, делают для людей гораздо больше, чем мы могли себе представить.
Количество бактерий человеческого микробиома и их генетического материала намного превышает количество человеческих клеток и генов, и эта популяция бактерий играет важную роль в поддержании здоровья. При его нарушении могут возникнуть серьезные проблемы со здоровьем.
Например, рассмотрим, что может произойти, когда люди подвергаются воздействию антибиотиков. У некоторых людей антибиотики могут вызвать дисбаланс нормальных бактериальных сообществ и привести к чрезмерному росту Clostridium difficile и сильному воспалению в кишечнике.Восстановление нормального микробиома путем прямой трансплантации микробиома может восстановить здоровье.
В рамках программы «Микробиом» исследователи изучают гораздо больше вопросов о взаимосвязи между микробиомом, здоровьем и болезнями, в том числе:
- Что микробиом может рассказать о здоровье?
- Могут ли микробные сообщества в толстой кишке быть причиной симптомов раздраженного кишечника?
- Как кишечные микробы влияют на другие части тела, такие как суставы, печень и иммунная система?
- Могут ли кишечные микробные метаболиты быть причиной того, что диета влияет на развитие рака толстой кишки?
- Могут ли методы геномного секвенирования помочь исследователям идентифицировать организмы, вызывающие вагиноз и проблемы с репродуктивным здоровьем?
- Может ли дисбаланс в микробиоме привести к аутоиммунным заболеваниям?
- Как ученые и клиницисты используют свои знания о микробиоме в новых диагностических и прогностических подходах?
Проекты
Чувствительность к глютенуИзменение состава кишечной микрофлоры связано с расстройствами желудочно-кишечного тракта, включая чувствительность к глютену и риск появления симптомов, подобных синдрому раздраженного кишечника (СРК).
Это исследование характеризует кишечную микрофлору пациентов с глютеновой болезнью и подгруппы пациентов с IBS для выявления и разработки новых методов лечения, а также профилактических вмешательств для лиц с высоким риском развития чувствительности к глютену и IBS -подобных симптомы.
Clostridium difficile инфекцияИнфекция Clostridium difficile является основной причиной внутрибольничной диареи в США. Несмотря на успехи в лечении, инфекция Clostridium difficile по-прежнему связана с неблагоприятными исходами: некоторым пациентам требуется срочная операция по поводу опасных для жизни инфекций, а у других наблюдаются рецидивы и хронические симптомы инвалидности.
В рамках этого проекта исследуется микробный состав фекалий в толстой кишке с целью разработки инструментов, позволяющих прогнозировать ответ на лечение и риск рецидива.
Ревматоидный артритУстойчивые изменения нормального кишечного микробиома в сочетании с нарушенным барьером слизистой оболочки кишечника могут оказывать продолжительное влияние на системный иммунный ответ. Это может быть предшественником хронических воспалительных и аутоиммунных заболеваний, таких как ревматоидный артрит.
Характеристика состава кишечной микрофлоры больных ревматоидным артритом и здоровых членов их семей позволяет определить конкретные микробные виды или экологические свойства, такие как биоразнообразие, которые могут быть причиной микробного дисбаланса (дисбактериоза) у пациентов.
Это поможет улучшить прогностические и диагностические протоколы для лиц с высоким риском развития ревматоидного артрита и может привести к новым стратегиям лечения.
Рак толстой кишкиИзвестно, что диетические факторы влияют на риск развития рака толстой кишки, но точный способ, которым диетические факторы вызывают повреждение клеток и ДНК, не установлен. Без информации об этих лежащих в основе механизмах доступны только эмпирические подходы к коррекции диетических эффектов, и, к сожалению, такие профилактические стратегии не увенчались успехом.
Этот проект предполагает, что диета людей и возникающие в результате сообщества кишечного микробиома создают метаболиты, которые могут повредить клетки кишечника и привести к повреждению ДНК, что приводит к развитию рака. Исследователи тестируют два метаболических пути с токсическим потенциалом, включая сульфатредуцирующие бактерии и метаногены.
Бактериальный вагинозБактериальный вагиноз — это состояние, которое может иметь важные последствия для репродуктивного здоровья на многих уровнях. Все больше данных свидетельствует о том, что это может быть результатом критических изменений в местном микробиоме.
В этом исследовании исследователи используют современные методы геномного секвенирования для оценки роли микробных сообществ и отдельных микробных вкладов в заболевание, с планами разработать новые диагностические и терапевтические подходы на основе этой новой информации.
Устройства для оказания медицинской помощиРанняя диагностика заболевания и долгосрочный терапевтический мониторинг могут привести к своевременной корректировке интервенционных стратегий для каждого пациента. Этот проект направлен на разработку устройства для оказания медицинской помощи для быстрого выявления бактериальных инфекционных заболеваний для быстрого своевременного лечения, а также портативной микрожидкостной платформы для мониторинга иммунно-опосредованного ответа на терапию.
Цель состоит в том, чтобы развернуть эти платформы в отделениях интенсивной терапии, операционных и дома, чтобы помочь медицинским работникам в принятии решений в индивидуальной медицине.
Прогноз риска ракаЭтот проект направлен на разработку и проверку набора инструментов для вывода причинно-следственных связей, искусственного интеллекта и машинного обучения для улучшенного прогнозирования рисков с использованием мультиомных данных. Инструменты прогнозирования риска для целенаправленной идентификации конкретных генотипов и фенотипов будущих злокачественных новообразований дополнят индивидуализированное клиническое управление в профилактике и лечении рака.
Эти мультиомные алгоритмы прогнозирования риска предоставят персонализированные оценки риска рака для принятия клинических решений на основе генетических, эпигенетических, микробиомных, протеомных, метаболических и транскриптомных данных о факторах риска.
Руководители программ
Индивидуальная медицина — История Дайанны
Трансплантация микробиома избавляет пациента от резистентной к антибиотикам кишечной инфекции.
Анимация программы «Микробиом»
Программа «Микробиом» исследует генетический код микроорганизмов в организме с использованием новейших методов анализа микробиома человека для выявления, предотвращения и диагностики инфекций и других заболеваний.
.
Многие распространенные лекарства могут изменить ваш микробиом повышают риск устойчивости к антибиотикам, показывает новое голландское исследование.
Микробиом кишечника включает не менее 1000 видов бактерий и зависит от ряда различных факторов, включая прием лекарств.Исследования показывают, что изменения в микробиоме кишечника связаны с ожирением, диабетом, заболеваниями печени, раком и нейродегенеративными заболеваниями.
«Мы уже знаем, что на эффективность и токсичность некоторых лекарств влияет бактериальный состав желудочно-кишечного тракта и что кишечная микробиота связана с многочисленными состояниями здоровья; поэтому крайне важно понять, каковы последствия Использование лекарств в микробиоме кишечника», — сказал ведущий исследователь Арнау Вич Вила из Медицинского центра Университета Гронингена.
В этом исследовании исследователи изучили 41 категорию часто используемых препаратов и оценили 1883 образца фекалий людей, которые принимали и не принимали лекарства, включая пациентов с синдромом раздраженного кишечника (СРК) и воспалительным заболеванием кишечника (ВЗК).
Восемнадцать категорий препаратов оказывали значительное влияние на микробиом кишечника, а восемь повышали риск устойчивости к противомикробным препаратам.
Категории с наибольшим воздействием на микробиом:
В микробиоме кишечника у пользователей ИПП был более высокий уровень бактерий верхних отделов желудочно-кишечного тракта и повышенное производство жирных кислот, а у пользователей метформина был более высокий уровень потенциально вредных E.бактерии coli .
По словам исследователей, семь других категорий лекарств были связаны со значительными изменениями в бактериальных популяциях в кишечнике.
Например, использование антидепрессантов СИОЗС людьми с СРК было связано с повышенным уровнем потенциально вредных бактерий вида Eubacterium ramulus .