Проба Манту, Россия в медицинском центре «Академия здоровья»
Стоимость услуги380р 480р
МЫ ОСУЩЕСТВЛЯЕМ ПОСТВАКЦИНАЛЬНОЕ СОПРОВОЖДЕНИЕ: ЕСЛИ ВЫ СВЯЗЫВАЕТЕ НЕДОМОГАНИЕ С ПРОВЕДЕННОЙ У НАС ПРИВИВКОЙ, ВЫ ВСЕГДА МОЖЕТЕ НАМ ПОЗВОНИТЬ ИЛИ ОБРАТИТЬСЯ В МЕДИЦИНСКИЙ ЦЕНТР НА ПРИЕМ К ВРАЧУ БЕСПЛАТНО!
Манту, проба Манту, тест на реакцию Манту
Тест для определения специфической чувствительности организма к возбудителю туберкулеза.
Проба Манту ребенку, где сделать в Петербурге?
Туберкулиновая проба или как еще называют данную процедуру, проба Манту, реакция Манту, является диагностическим исследованием.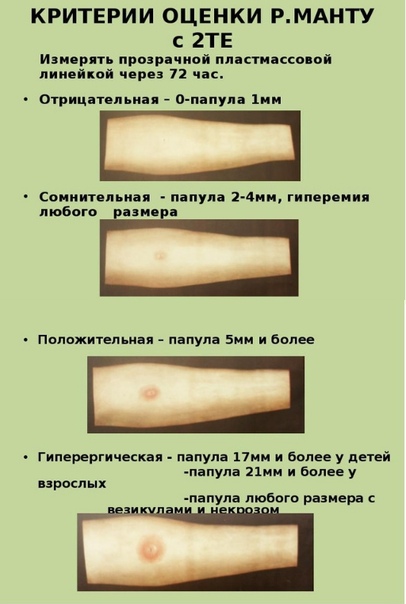

Туберкулиновая проба (реакция Манту) – клиника «Семейный доктор».
Реакция Манту (туберкулиновая проба, которую еще ошибочно называют «прививка Манту») является на сегодня самым проверенным и достоверным способом ранней диагностики туберкулеза. Поэтому ее делают ежегодно всем детям старше года. Часто ее проводят организованно – в садиках и школах. Родители предварительно должны дать свое письменное согласие на процедуру.
После того как в предплечье малыша вводят туберкулин, на месте пробы в течение двух-трех дней образуется папула (ее еще называют «пуговкой»), величина которой свидетельствуют о реакции иммунитета на возбудителей туберкулеза. Размер «пуговки» врач обычно измеряет на третий день после инъекции. В норме диаметр папулы не должен превышать 5 миллиметров.
Чем больше воспаление, тем выше вероятность того, что иммунная система ребенка уже знакома с инфекцией. А это значит, что потребуются дополнительные исследования, чтобы подтвердить или опровергнуть диагноз.
Но паниковать не стоит, «пуговка», превышающая по размеру норму, не всегда указывает на туберкулез. Возможна аллергическая реакция или индивидуальная повышенная чувствительность к туберкулину, которая часто бывает наследственной. Кроме того, ребенок мог не оправиться от простуды или предыдущей вакцинации.
Чтобы результаты пробы были достоверными, важно также после инъекции внимательно следить за малышом: ни он сам, ни одежда не должны натирать место укола. Ни в коем случае нельзя мазать его различными кремами, тем более йодом или зеленкой, заклеивать пластырем, купать ребенка или проводить еще какие-то манипуляции.
Ни в коем случае нельзя мазать его различными кремами, тем более йодом или зеленкой, заклеивать пластырем, купать ребенка или проводить еще какие-то манипуляции.
Сделать реакцию Манту вы можете в нашей клинике. У нас тщательно соблюдаются условия транспортировки, хранения и введения препаратов, а все процедуры проводятся в комфортной для детей и родителей обстановке.
Подробную информацию получите в контакт-центре по телефону или в регистратуре клиники.
Порядок проведения вакцинации детей. Право на отказ от туберкулинодиагностики. Разъясняет аппарат прокуратуры Свердловской области
19.03.2018г.
Старший прокурор отдела по надзору за исполнением законов о несовершеннолетних прокуратуры области Н.А. Новокрещенова
В соответствии с Конституцией Российской Федерации в ст.ст. 41, 42 каждый имеет право на охрану здоровья, на благоприятную окружающую среду. При этом согласно ч.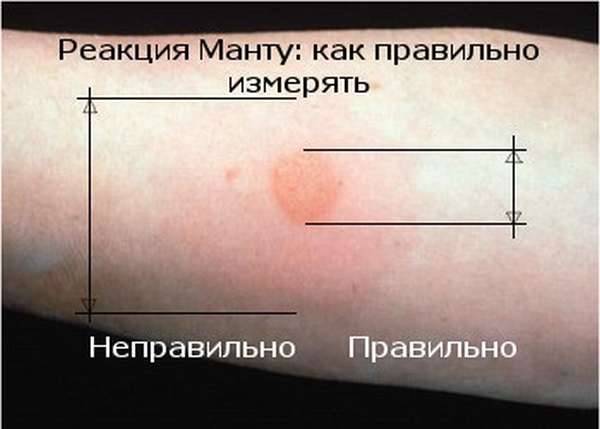
Санитарно-эпидемиологическое благополучие населения является одним из основных условий реализации конституционных прав граждан на охрану здоровья и благоприятную окружающую среду.
Федеральными законами от 17.09.1998 № 157-ФЗ «Об иммунопрофилактике инфекционных болезней», от 18.06.2001 № 77-ФЗ «О предупреждении распространения туберкулеза в Российской Федерации» установлены правовые основы государственной политики в области иммунопрофилактики инфекционных болезней, предупреждения распространения туберкулеза, осуществляемые в целях охраны здоровья и обеспечения санитарно-эпидемиологического благополучия населения.
В связи с этим статей 9 закона предусмотрен национальный календарь профилактических прививок, предусматривающий проведение детям профилактических прививок против 13 инфекционных заболеваний, в том числе туберкулеза, сроки их проведения.
Прививки проводятся в медицинских организациях, имеющих лицензию на право осуществления медицинской деятельности, в том числе по вакцинации, специально обученными медицинскими работниками.
В соответствии со статьями 5, 11 Федерального закона «Об иммунопрофилактике инфекционных болезней» профилактические прививки проводятся с письменного информированного добровольного согласия одного из родителей либо иного законного представителя несовершеннолетнего в возрасте до 15 лет на медицинское вмешательство гражданина, при отсутствии медицинских противопоказаний.
При осуществлении иммунопрофилактики родители имеют право на получение от медиков полной и объективной информации о необходимости прививок, возможных поствакцинальных осложнениях, на отказ от профилактических прививок, последствиях отказа.
В силу п. 2 ст. 5 указанного закона отсутствие профилактических прививок влечет временный отказ в приеме граждан в образовательные организации и оздоровительные учреждения в случае возникновения массовых инфекционных заболеваний или при угрозе возникновения эпидемий.
Федеральным законом от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» полномочия по введению (отмене) ограничительных мероприятий (карантина) возложены на главных государственных санитарных врачей и их заместителей.
В других случаях отсутствие профилактических прививок не влечет ограничение прав детей на получение образования и посещение образовательного учреждения.
В соответствии со ст. 7 Федерального закона от 18.06.2001 № 77-ФЗ «О предупреждении распространения туберкулеза в Российской Федерации» противотуберкулезная помощь несовершеннолетним в возрасте до 15 лет оказывается с согласия родителя или иного законного представителя.
Статьей ст. 39 Федерального закона от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» установлено, что на территории Российской Федерации действуют санитарные правила, утвержденные федеральным органом исполнительной власти, осуществляющим федеральный государственный санитарно-эпидемиологический надзор. Соблюдение санитарных правил является обязательным для физических и юридических лиц.
Соблюдение санитарных правил является обязательным для физических и юридических лиц.
В соответствии с п.п. 5.1, 5.2, абзацем вторым п. 5.7 СП 3.1.2.3114-13 «Профилактика туберкулеза», утвержденных постановлением Главного государственного санитарного врача РФ от 22.10.2013 № 60, проба Манту проводится:
— 1 раз в год независимо от результата предыдущих проб — вакцинированным против туберкулеза детям с 12-месячного возраста и до достижения 18 лет;
— 2 раза в год — детям, не вакцинированным против туберкулеза по медицинским противопоказаниям, а также по причине отказа родителей от иммунизации ребенка, до получения ребенком прививки против туберкулеза.
Дети, туберкулинодиагностика которым не проводилась, допускаются в детскую организацию при наличии заключения врача-фтизиатра об отсутствии заболевания.
Законность данной нормы подтверждена решением Верховного суда Российской Федерации от 17.02.2015, в соответствии с которым названное требование направлено на предупреждение возникновения, распространения туберкулеза, а также соблюдение прав других граждан на охрану здоровья и благоприятную окружающую среду.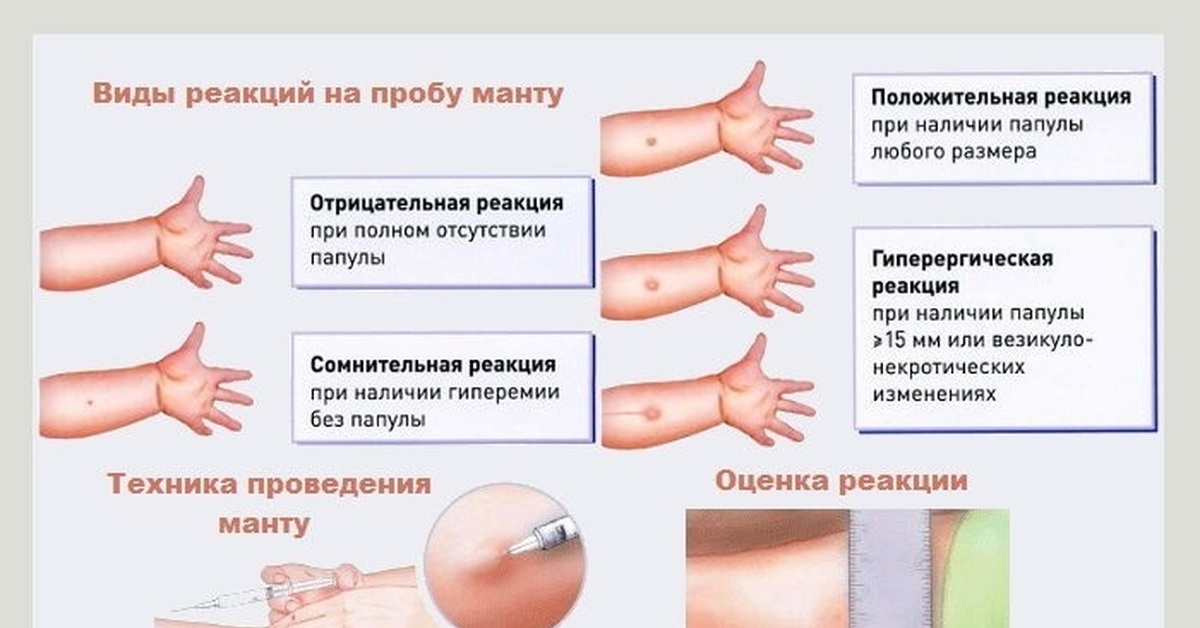 Положение абзаца второго п. 5.7 не противоречит нормам законодательства, так как не регулирует отношения, связанные с оказанием противотуберкулезной помощи несовершеннолетнему в возрасте до 15 лет, а также не предусматривает медицинского вмешательства без информированного добровольного согласия гражданина или его законного представителя.
Положение абзаца второго п. 5.7 не противоречит нормам законодательства, так как не регулирует отношения, связанные с оказанием противотуберкулезной помощи несовершеннолетнему в возрасте до 15 лет, а также не предусматривает медицинского вмешательства без информированного добровольного согласия гражданина или его законного представителя.
Также указанное положение не устанавливает и ограничений прав на образование, гарантированных Федеральным законом от 29.12.2012 № 273-ФЗ «Об образовании в Российской Федерации».
Сложившаяся судебная практика в Свердловской области и других субъектах Российской Федерации также признает законным не допуск детей в образовательные организации без заключений (справок) от врача-фтизиатра об отсутствии заболевания.
Министерством здравоохранения Российской Федерации в письме от 07.04.2017 «О направлении клинических рекомендаций «Выявление и диагностика туберкулеза у детей, поступающих и обучающихся в образовательных организациях» разъяснено, что отсутствие обследования на туберкулезную инфекцию предполагает зачисление ребенка в образовательную организацию с последующим выбором форм и методов образовательного процесса, исключающих посещение необследованным ребенком здорового детского коллектива.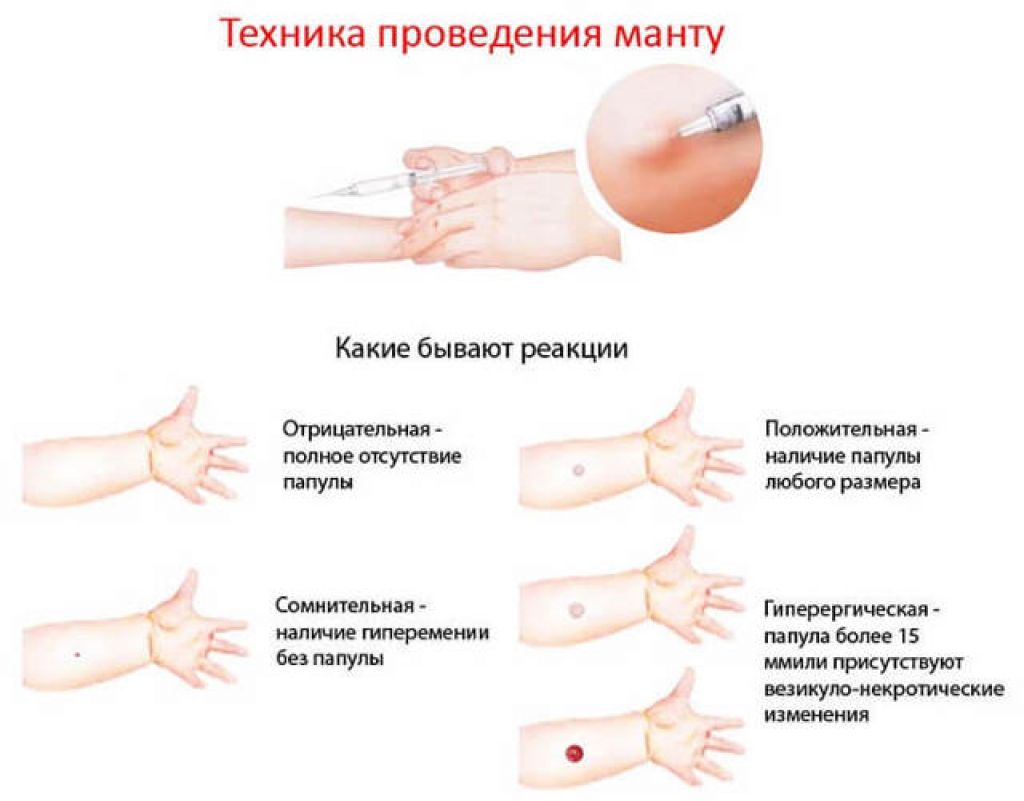 При отказе от иммунодиагностики (любого иного метода, позволяющего исключить заболевание туберкулезом) врач-фтизиатр определяет возможность выдачи справки или медицинского заключения об отсутствии активной формы туберкулеза.
При отказе от иммунодиагностики (любого иного метода, позволяющего исключить заболевание туберкулезом) врач-фтизиатр определяет возможность выдачи справки или медицинского заключения об отсутствии активной формы туберкулеза.
Федеральным законом Российской Федерации от 29.12.2012 № 273-ФЗ «Об образовании в Российской Федерации» (ст.ст. 17, 28) с целью обеспечения права ребенка на образование предусмотрены различные формы получения образования и обучения как в организациях, осуществляющих образовательную деятельность, так и в форме семейного образования и самообразования.
границ | Профилактическая аллергеноспецифическая вакцинация от аллергии: миссия осуществима?
Фон
Со времени классического эксперимента, в котором Эдвард Дженнер впервые вакцинировал коровью оспу для защиты от инфекций натуральной оспы в 1796 году, многое было достигнуто не только в области вакцинации против инфекционных заболеваний (1–3), но и против рака (4). С введением вакцин было отмечено резкое снижение количества эпизодов инфекционных заболеваний, близкое к 100% или почти 100%, что свидетельствует о том, насколько эффективной может быть вакцинация (4).Вакцинация против инфекционных заболеваний ежегодно спасает миллионы жизней, полностью изменила условия жизни и в конечном итоге внесла важный вклад в увеличение продолжительности жизни (3). Что касается инфекционных заболеваний и рака, цель вакцинации состоит в том, чтобы вызвать сильный адаптивный иммунитет на уровне антител и Т-клеток против патогенов и опухолевых антигенов для защиты вакцинированного субъекта. Таким образом, каждый мог бы предположить, что вакцинация полезна только тогда, когда необходимо создать сильный иммунный ответ у кого-то, у кого отсутствует иммунитет, или, по крайней мере, для усиления иммунного ответа.Соответственно, практически не существует доступных стратегий вакцинации от болезней, которые характеризуются гипериммунитетом, таких как аутоиммунные заболевания.
С введением вакцин было отмечено резкое снижение количества эпизодов инфекционных заболеваний, близкое к 100% или почти 100%, что свидетельствует о том, насколько эффективной может быть вакцинация (4).Вакцинация против инфекционных заболеваний ежегодно спасает миллионы жизней, полностью изменила условия жизни и в конечном итоге внесла важный вклад в увеличение продолжительности жизни (3). Что касается инфекционных заболеваний и рака, цель вакцинации состоит в том, чтобы вызвать сильный адаптивный иммунитет на уровне антител и Т-клеток против патогенов и опухолевых антигенов для защиты вакцинированного субъекта. Таким образом, каждый мог бы предположить, что вакцинация полезна только тогда, когда необходимо создать сильный иммунный ответ у кого-то, у кого отсутствует иммунитет, или, по крайней мере, для усиления иммунного ответа.Соответственно, практически не существует доступных стратегий вакцинации от болезней, которые характеризуются гипериммунитетом, таких как аутоиммунные заболевания.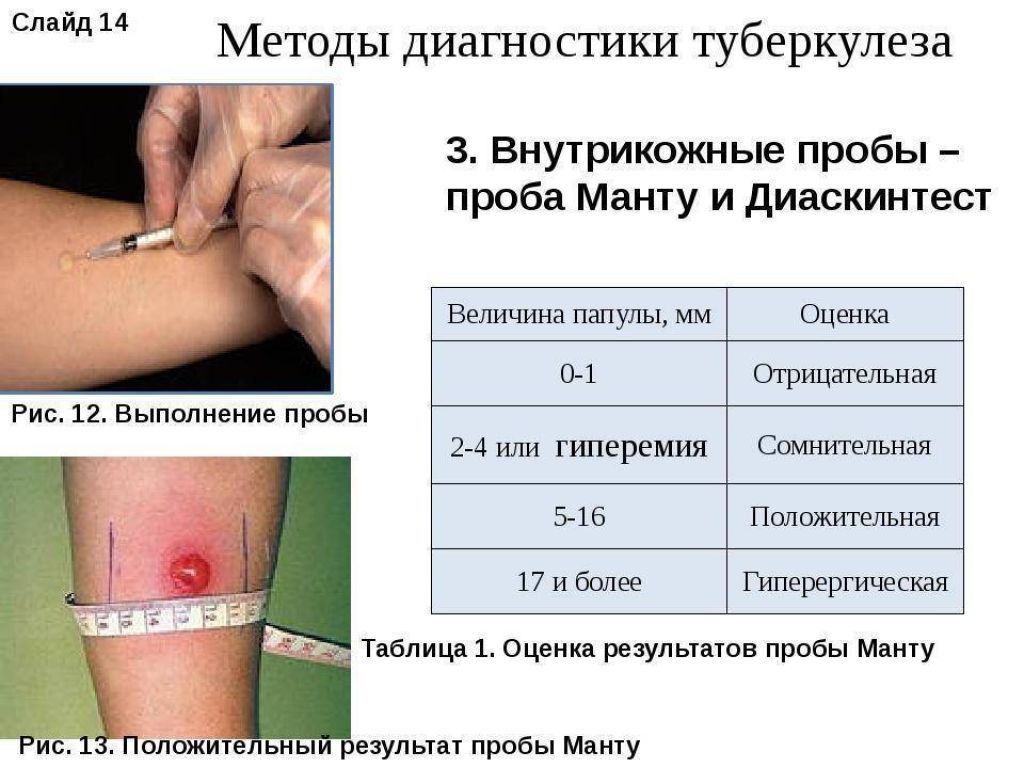 Основное исключение — аллерген-специфическая иммунотерапия (АИТ) при IgE-ассоциированных аллергиях (5). AIT основан на введении болезнетворных аллергенов для индукции «противодействия иммунному ответу», состоящего из аллергенспецифических антител IgG, которые блокируют связывание IgE с аллергенами, и изменений клеточного иммунного ответа, в частности, снижения уровня аллергена. -специфические ответы Th3 (6).
Основное исключение — аллерген-специфическая иммунотерапия (АИТ) при IgE-ассоциированных аллергиях (5). AIT основан на введении болезнетворных аллергенов для индукции «противодействия иммунному ответу», состоящего из аллергенспецифических антител IgG, которые блокируют связывание IgE с аллергенами, и изменений клеточного иммунного ответа, в частности, снижения уровня аллергена. -специфические ответы Th3 (6).
Аллергический иммунный ответ
В отличие от людей, не страдающих аллергией, у которых наблюдается нормальный ответ IgG при контакте с антигенами окружающей среды, пациенты с аллергией вырабатывают антитела IgE против аллергенов (7, 8). Разрабатываются ли у человека аллерген-специфические антитела IgE или нет, зависит от большого количества факторов хозяина и окружающей среды, включая генетические факторы, предрасполагающие к выработке IgE, а также воздействие аллергена и факторы адъюванта, и это лишь некоторые из них (9). Антитела IgE относятся к наименее распространенному классу иммуноглобулинов у человека (10). Однако IgE может связываться с рецептором высокого сродства к IgE (FcεRI) на тучных клетках и базофилах и с рецептором низкого сродства к IgE (CD23) на B-клетках и антигенпрезентирующих клетках. При распознавании аллергенов связанным с клеткой IgE эффекторные клетки активируются с высвобождением медиаторов воспаления, протеаз и цитокинов. Таким образом, активация воспалительных клеток иммунными комплексами IgE-аллерген приводит к аллергическому воспалению и различным аллергическим симптомам, таким как аллергический риноконъюнктивит, астма, воспаление кожи, пищевая аллергия и опасный для жизни анафилактический шок.Термин аллергия был введен венским педиатром Клеменсом фон Пирке для описания преувеличенных иммунных ответов против per se безвредных антигенов (11). IgE-ассоциированная аллергия, также называемая аллергией немедленного типа, является наиболее распространенным и важным иммунологически опосредованным заболеванием гиперчувствительности, которым страдает примерно 30% населения (12).
Однако IgE может связываться с рецептором высокого сродства к IgE (FcεRI) на тучных клетках и базофилах и с рецептором низкого сродства к IgE (CD23) на B-клетках и антигенпрезентирующих клетках. При распознавании аллергенов связанным с клеткой IgE эффекторные клетки активируются с высвобождением медиаторов воспаления, протеаз и цитокинов. Таким образом, активация воспалительных клеток иммунными комплексами IgE-аллерген приводит к аллергическому воспалению и различным аллергическим симптомам, таким как аллергический риноконъюнктивит, астма, воспаление кожи, пищевая аллергия и опасный для жизни анафилактический шок.Термин аллергия был введен венским педиатром Клеменсом фон Пирке для описания преувеличенных иммунных ответов против per se безвредных антигенов (11). IgE-ассоциированная аллергия, также называемая аллергией немедленного типа, является наиболее распространенным и важным иммунологически опосредованным заболеванием гиперчувствительности, которым страдает примерно 30% населения (12).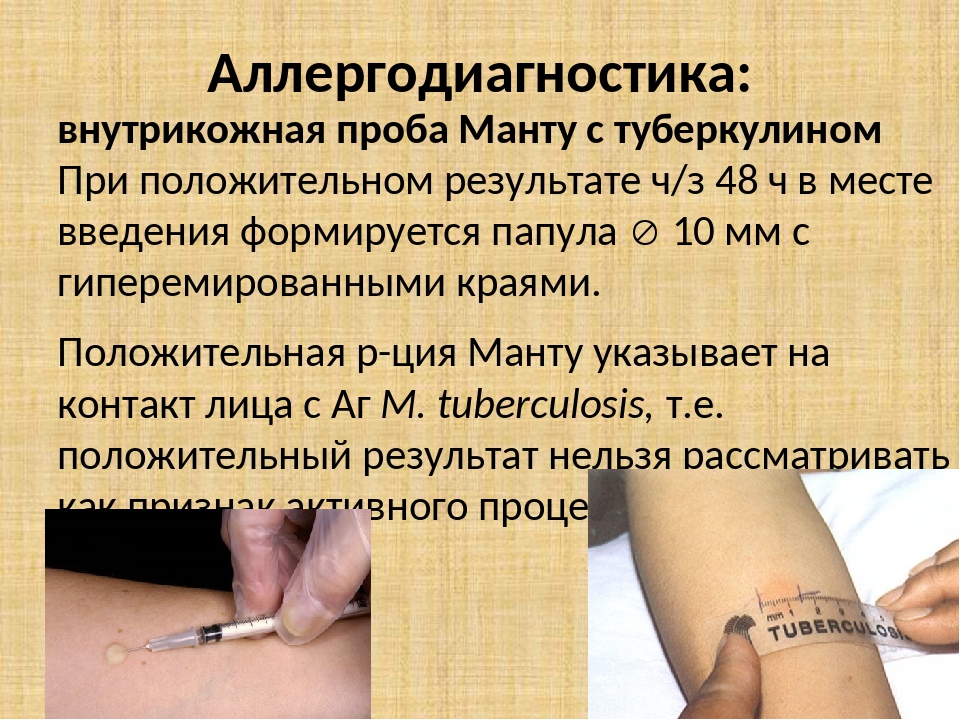
Первым шагом в развитии аллергии является аллергическая сенсибилизация, которая характеризуется выработкой антител IgE против аллергенов вскоре после рождения (13).Развитие сенсибилизации IgE в раннем детстве недавно было подробно изучено в популяционных когортах с использованием микромассивных молекул аллергенов (14, 15). Эти исследования проанализировали в когортах новорожденных развитие сенсибилизации IgE к большому количеству молекул респираторных и пищевых аллергенов с помощью технологии микромассивов в течение первых двух десятилетий жизни (16–23). Согласно этим исследованиям, кажется, что существует временное окно в раннем возрасте, в течение которого может возникнуть аллергическая сенсибилизация (24), тогда как взрослые пациенты с аллергией больше не меняют свои профили реактивности IgE (25).В нескольких исследованиях было замечено, что процент сенсибилизированных детей увеличивается в течение первых лет жизни, но неясно, связано ли это с развитием «новой сенсибилизации» в течение первых лет или со способностью к выявлять аллерген-специфические антитела IgE в сыворотке и плазме в этот период.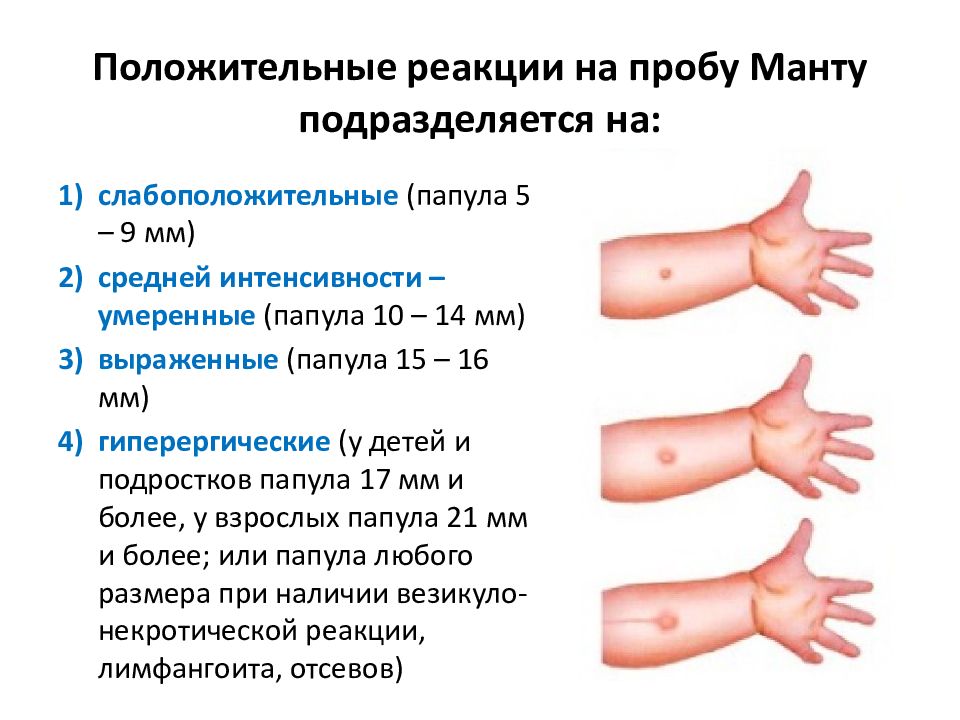
Недавнее исследование показало, что уровни сенсибилизации IgE были ниже у детей от матерей, передающих более высокие уровни аллерген-специфических антител IgG через пуповинную кровь своим детям, чем у детей, матери которых передавали более низкие уровни специфических антител IgG (Рисунок 1) (26). .В последнем исследовании аллерген-специфические антитела IgG материнского происхождения можно было проследить у детей до 6 месяцев жизни. Предполагая, что эти антитела IgG обладают защитным действием, можно предположить, что первые несколько месяцев жизни являются наиболее критическим периодом для аллергической сенсибилизации. Это предположение также подтверждается другими исследованиями, в которых сообщается, что дети, родившиеся незадолго до сезона пыльцы, становились более чувствительными к аллергенам пыльцы, чем дети, рожденные непосредственно после прекращения сезона пыльцы (27).Фактически, определение раннего временного окна, в течение которого происходит аллергическая сенсибилизация, имеет большое значение при рассмотрении стратегий профилактической аллерген-специфической вакцинации.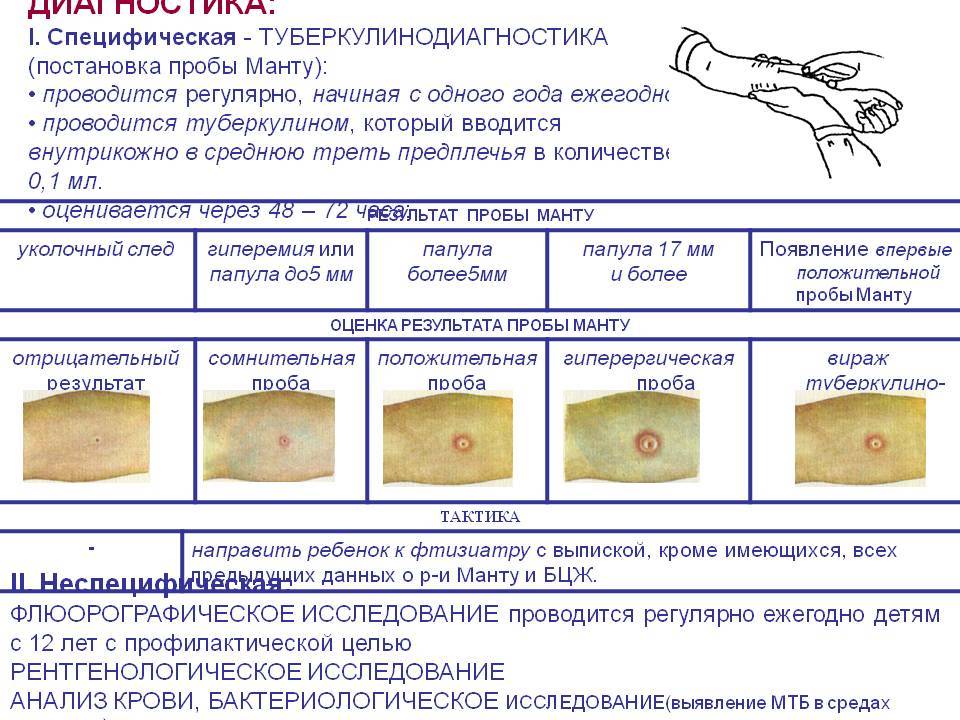
Рисунок 1 . Передача высоких уровней материнских аллергенспецифических антител IgG может защитить потомство от сенсибилизации и развития аллергенспецифических антител IgE (A) , тогда как низкие уровни материнских аллергенспецифических IgG могут предрасполагать к аллергической сенсибилизации потомства (В) .
Еще один важный урок, извлеченный из когортных исследований при рождении, состоит в том, что может потребоваться повторный контакт с аллергеном для повышения выработки аллерген-специфических IgE до определенных уровней, чтобы клинически бессимптомная сенсибилизация IgE могла развиваться в направлении аллергических симптомов. Это показано на рисунке 1, указывая на то, что выработка антител IgE в раннем возрасте без симптомов (т. Е. Бессимптомная сенсибилизация) может предшествовать развитию аллергических симптомов. В этом контексте следует упомянуть два когортных исследования новорожденных.Westman et al. отметили, что к 4 годам жизни 12,5% шведских детей имели антитела IgE к основному аллергену пыльцы березы Bet v 1, но только 2,5% имели аллергические симптомы.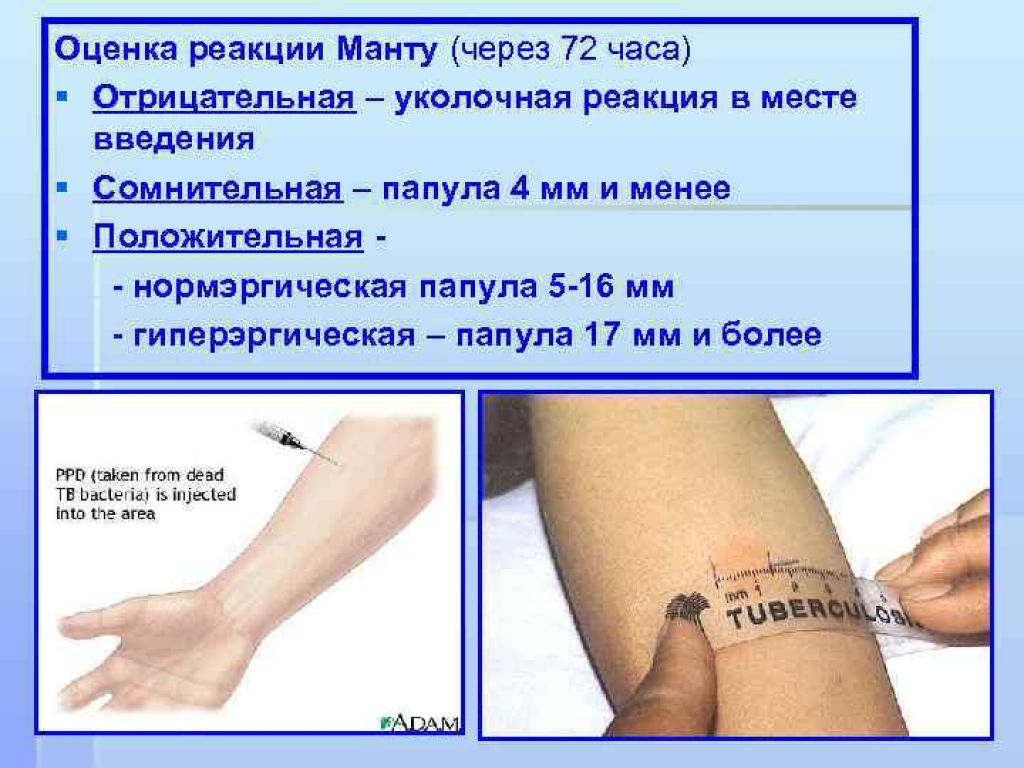 Ситуация значительно изменилась, когда детям исполнилось 16 лет. Затем 25,4% имели антитела IgE, специфичные к Bet v 1, и у большинства (т.е. 17,8%) наблюдались симптомы аллергии на пыльцу березы (17). В исследовании когорты новорожденных, изучающем развитие аллергии на пыльцу трав, Westman et al. были аналогичные результаты. В 4-летнем возрасте у подавляющего большинства детей с антителами IgE к аллергенам пыльцы травы симптомы еще не проявлялись, тогда как в 16 лет почти у 50% IgE-положительных детей появились симптомы (23).Кроме того, обычным явлением является прогрессирование легких симптомов в сторону тяжелых симптомов в более позднем детстве, например, прогрессирование ринита в сторону астмы, и было обнаружено, что прогрессирование клинически бессознательной сенсибилизации IgE к аллергическим симптомам можно предсказать в более раннем возрасте на основе уровней IgE к молекулам аллергена. (17, 21).
Ситуация значительно изменилась, когда детям исполнилось 16 лет. Затем 25,4% имели антитела IgE, специфичные к Bet v 1, и у большинства (т.е. 17,8%) наблюдались симптомы аллергии на пыльцу березы (17). В исследовании когорты новорожденных, изучающем развитие аллергии на пыльцу трав, Westman et al. были аналогичные результаты. В 4-летнем возрасте у подавляющего большинства детей с антителами IgE к аллергенам пыльцы травы симптомы еще не проявлялись, тогда как в 16 лет почти у 50% IgE-положительных детей появились симптомы (23).Кроме того, обычным явлением является прогрессирование легких симптомов в сторону тяжелых симптомов в более позднем детстве, например, прогрессирование ринита в сторону астмы, и было обнаружено, что прогрессирование клинически бессознательной сенсибилизации IgE к аллергическим симптомам можно предсказать в более раннем возрасте на основе уровней IgE к молекулам аллергена. (17, 21).
Особенности AIT
Первое исследование AIT было проведено Леонардом Нун в 1911 году и продемонстрировало, что иммунизация экстрактом аллергена пыльцы трав улучшала симптомы аллергии на пыльцу трав (28). В своей классической статье Нун поддерживает идею проведения активной вакцинации для лечения аллергии, ссылаясь на более раннюю работу Данбара, который в 1903 году показал, что можно уменьшить симптомы аллергии с помощью антисывороток против пыльцевых аллергенов и, таким образом, показал, что пассивная вакцинация иммунизация является возможным методом лечения аллергии (29). Мы суммировали развитие AIT от прошлого до присутствия в недавней обзорной статье, в которой освещаются важные шаги (30). Они включают демонстрацию того, что индукция аллерген-специфических антител IgG в ходе AIT блокирует связывание IgE с аллергенами и, таким образом, все последующие эффекты иммунных комплексов аллерген-IgE на активацию воспалительных иммунных клеток.Важность индукции аллерген-специфичных IgG-блокирующих антител была продемонстрирована уже очень рано, показывая, что пассивный перенос IgG от пациентов, леченных AIT, может подавлять аллергическое воспаление кожи (31), вплоть до недавнего элегантного исследования, показывающего, что пассивное введение аллергена -специфические рекомбинантные антитела IgG 4 эффективны для лечения аллергии на кошек (32).
В своей классической статье Нун поддерживает идею проведения активной вакцинации для лечения аллергии, ссылаясь на более раннюю работу Данбара, который в 1903 году показал, что можно уменьшить симптомы аллергии с помощью антисывороток против пыльцевых аллергенов и, таким образом, показал, что пассивная вакцинация иммунизация является возможным методом лечения аллергии (29). Мы суммировали развитие AIT от прошлого до присутствия в недавней обзорной статье, в которой освещаются важные шаги (30). Они включают демонстрацию того, что индукция аллерген-специфических антител IgG в ходе AIT блокирует связывание IgE с аллергенами и, таким образом, все последующие эффекты иммунных комплексов аллерген-IgE на активацию воспалительных иммунных клеток.Важность индукции аллерген-специфичных IgG-блокирующих антител была продемонстрирована уже очень рано, показывая, что пассивный перенос IgG от пациентов, леченных AIT, может подавлять аллергическое воспаление кожи (31), вплоть до недавнего элегантного исследования, показывающего, что пассивное введение аллергена -специфические рекомбинантные антитела IgG 4 эффективны для лечения аллергии на кошек (32).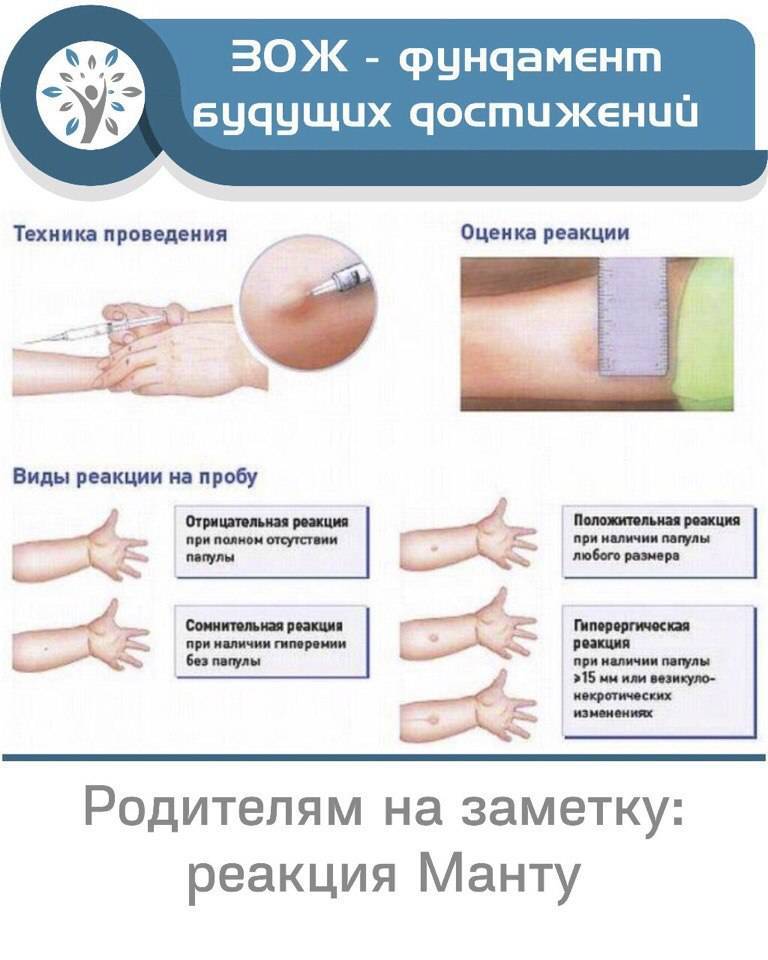 Те формы АИТ, которые устойчиво индуцируют аллерген-специфические IgG, как показано в клинических исследованиях, наиболее часто используются и считаются эффективным лечением, в частности подкожный АИТ на основе адсорбированных аллергенов или производных аллергенов.Индукция аллерген-специфических IgG считается основным механизмом AIT (5, 33), и поэтому AIT можно рассматривать как форму терапевтической вакцинации. Основная причина, по которой АИТ не полностью разработана для лечения аллергии, заключается в том, что нынешняя АИТ по-прежнему основана на натуральных экстрактах аллергенов, которые часто бывают низкого качества (34). Соответственно, AIT на основе экстракта аллергена часто бывает только частично эффективным (35, 36) и может вызывать побочные эффекты у пациентов с аллергией, поскольку введение аллергена субъекту с аллергией может вызывать аллергические реакции немедленной и поздней фазы (37, 38).Кроме того, необходимы обременительные схемы лечения, чтобы избежать побочных эффектов, которые сильно ухудшают приверженность пациента (39).
Те формы АИТ, которые устойчиво индуцируют аллерген-специфические IgG, как показано в клинических исследованиях, наиболее часто используются и считаются эффективным лечением, в частности подкожный АИТ на основе адсорбированных аллергенов или производных аллергенов.Индукция аллерген-специфических IgG считается основным механизмом AIT (5, 33), и поэтому AIT можно рассматривать как форму терапевтической вакцинации. Основная причина, по которой АИТ не полностью разработана для лечения аллергии, заключается в том, что нынешняя АИТ по-прежнему основана на натуральных экстрактах аллергенов, которые часто бывают низкого качества (34). Соответственно, AIT на основе экстракта аллергена часто бывает только частично эффективным (35, 36) и может вызывать побочные эффекты у пациентов с аллергией, поскольку введение аллергена субъекту с аллергией может вызывать аллергические реакции немедленной и поздней фазы (37, 38).Кроме того, необходимы обременительные схемы лечения, чтобы избежать побочных эффектов, которые сильно ухудшают приверженность пациента (39). Поэтому были разработаны молекулярные формы АИТ (40, 41). Молекулярные формы AIT основаны на точном знании болезнетворных аллергенов, многие из которых были детально охарактеризованы молекулярным клонированием за последние 30 лет (42).
Поэтому были разработаны молекулярные формы АИТ (40, 41). Молекулярные формы AIT основаны на точном знании болезнетворных аллергенов, многие из которых были детально охарактеризованы молекулярным клонированием за последние 30 лет (42).
Молекулярные формы AIT
В этом разделе мы обсудим различные молекулярные формы AIT, которые могут быть использованы в клинических испытаниях для профилактической вакцинации против аллергенов (рис. 2).Обратите внимание, что мы ограничили молекулярные формы АИТ, рассматриваемые для профилактической вакцинации, теми, которые уже были протестированы в клинических испытаниях у пациентов с аллергией и для которых изучены иммунные ответы, полученные у людей после вакцинации (9, 41).
Рисунок 2 . Вакцины от молекулярной аллергии, которые могут быть использованы для профилактической вакцинации, и их особенности. Показано влияние на ответы IgE, IgG и Т-клеток при введении. Слева направо: свернутые рекомбинантные аллергены дикого типа содержат аллерген-специфические эпитопы IgE, IgG и Т-клеток и могут усиливать эти ответы при иммунизации. Рекомбинантные гипоаллергены проявляют пониженную реактивность IgE, но после вакцинации могут вызывать аллерген-специфические IgE, IgG и Т-клеточные ответы. Пептиды, содержащие эпитоп Т-клеток, лишены реактивности IgE и IgG и, соответственно, нацелены на Т-клетки, не вызывая ответов IgE или IgG. Могут быть получены вирусоподобные наночастицы, содержащие защищенные аллергены, не обладающие реактивностью IgE, но могут вызывать ответы IgG и Т-клеток. Вакцины-носители пептидов на основе В-клеточных эпитопов лишены аллерген-специфических IgE и Т-клеточной реактивности и вызывают аллерген-специфические ответы IgG без усиления аллерген-специфических IgE и Т-клеточных ответов.
Рекомбинантные гипоаллергены проявляют пониженную реактивность IgE, но после вакцинации могут вызывать аллерген-специфические IgE, IgG и Т-клеточные ответы. Пептиды, содержащие эпитоп Т-клеток, лишены реактивности IgE и IgG и, соответственно, нацелены на Т-клетки, не вызывая ответов IgE или IgG. Могут быть получены вирусоподобные наночастицы, содержащие защищенные аллергены, не обладающие реактивностью IgE, но могут вызывать ответы IgG и Т-клеток. Вакцины-носители пептидов на основе В-клеточных эпитопов лишены аллерген-специфических IgE и Т-клеточной реактивности и вызывают аллерген-специфические ответы IgG без усиления аллерген-специфических IgE и Т-клеточных ответов.
Свернутые рекомбинантные аллергены дикого типа
Сложенные рекомбинантные аллергены дикого типа, которые имитируют все свойства природных аллергенов, производятся более 30 лет в соответствии с последовательностями ДНК аллергенов. Рекомбинантные аллергены дикого типа содержат эпитопы IgE и Т-клеток соответствующих природных аллергенов. Из испытаний подкожной инъекции AIT (SCIT), проведенных со смесью рекомбинантных аллергенов пыльцы травы и с рекомбинантным основным аллергеном пыльцы березы Bet v 1, известно, что вакцинация индуцирует аллерген-специфические антитела IgG, которые ингибируют связывание IgE с аллергеном (43, 44). .Однако иммунизация рекомбинантными аллергенами дикого типа также вызывает аллерген-специфические ответы антител IgE, оставляя опасения, что они могут усиливать аллергенспецифические ответы IgE, если они используются для вторичной профилактической вакцинации, или что они могут даже вызывать сенсибилизацию IgE, если они используются для первичная профилактическая вакцинация еще не сенсибилизированных субъектов. Это беспокойство может быть смягчено тем фактом, что исследования, показывающие, что АИТ может уменьшить прогрессирование аллергического ринита в астму у детей, были проведены SCIT с использованием естественных аллергенов (45).Результаты испытаний с использованием сублингвальной иммунотерапии (SLIT) с экстрактами природных аллергенов для предотвращения прогрессирования клинически бессознательной сенсибилизации IgE к аллергическим симптомам неубедительны (46, 47).
Из испытаний подкожной инъекции AIT (SCIT), проведенных со смесью рекомбинантных аллергенов пыльцы травы и с рекомбинантным основным аллергеном пыльцы березы Bet v 1, известно, что вакцинация индуцирует аллерген-специфические антитела IgG, которые ингибируют связывание IgE с аллергеном (43, 44). .Однако иммунизация рекомбинантными аллергенами дикого типа также вызывает аллерген-специфические ответы антител IgE, оставляя опасения, что они могут усиливать аллергенспецифические ответы IgE, если они используются для вторичной профилактической вакцинации, или что они могут даже вызывать сенсибилизацию IgE, если они используются для первичная профилактическая вакцинация еще не сенсибилизированных субъектов. Это беспокойство может быть смягчено тем фактом, что исследования, показывающие, что АИТ может уменьшить прогрессирование аллергического ринита в астму у детей, были проведены SCIT с использованием естественных аллергенов (45).Результаты испытаний с использованием сублингвальной иммунотерапии (SLIT) с экстрактами природных аллергенов для предотвращения прогрессирования клинически бессознательной сенсибилизации IgE к аллергическим симптомам неубедительны (46, 47).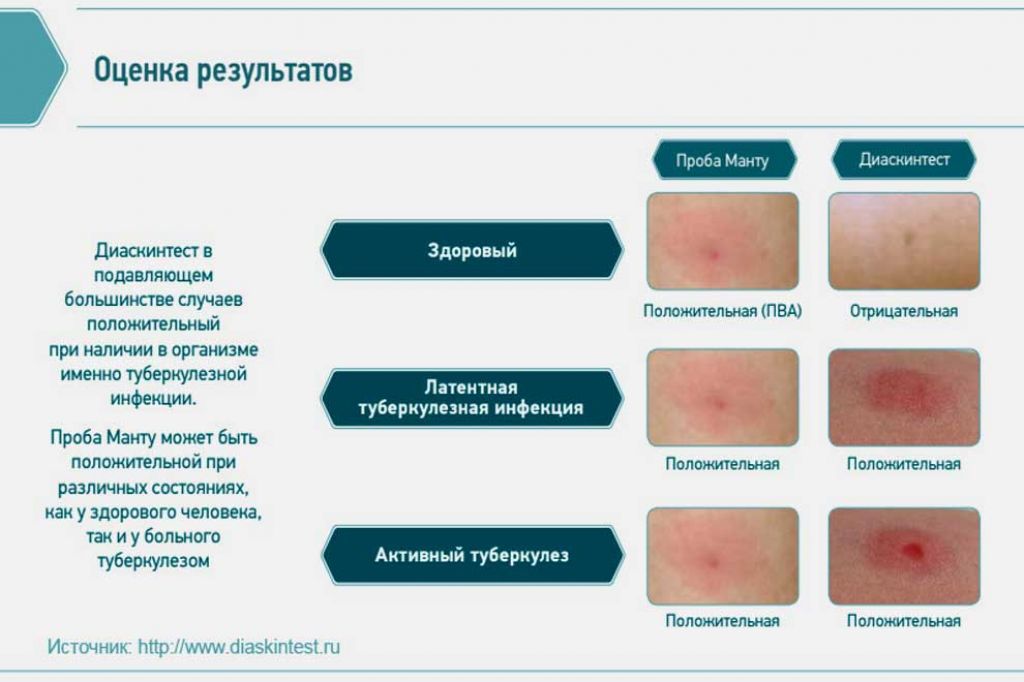 Причиной этого могло быть то, что подходы SLIT довольно неэффективны в индукции аллергенспецифических ответов IgG по сравнению с SCIT (48). Соответственно, SCIT со свернутыми рекомбинантными аллергенами дикого типа, в принципе, может рассматриваться для профилактической вакцинации, но могут быть предпочтительны другие молекулярные формы AIT с пониженным риском аллергической сенсибилизации.
Причиной этого могло быть то, что подходы SLIT довольно неэффективны в индукции аллергенспецифических ответов IgG по сравнению с SCIT (48). Соответственно, SCIT со свернутыми рекомбинантными аллергенами дикого типа, в принципе, может рассматриваться для профилактической вакцинации, но могут быть предпочтительны другие молекулярные формы AIT с пониженным риском аллергической сенсибилизации.
Рекомбинантные и синтетические гипоаллергены
Рекомбинантные и синтетические гипоаллергены представляют собой гипоаллергенные производные аллергенов с пониженной реактивностью IgE, но сохраненными эпитопами Т-клеток (49). Гипоаллергены отличаются от соответствующих аллергенов дикого типа модификациями их структуры, снижающими их реактивность IgE по сравнению с аллергенами дикого типа. Таким образом, они обладают пониженной способностью вызывать IgE-опосредованное аллергическое воспаление. Однако первичная последовательность гипоаллергенов практически не изменяется по сравнению с аллергенами дикого типа, так что последовательные Т-клеточные эпитопы сохраняются и могут индуцировать аллерген-специфическую активацию Т-клеток. Уже в первом клиническом исследовании, которое было проведено с рекомбинантными гипоаллергенными производными аллергена основного аллергена пыльцы березы Bet v 1, было показано, что вакцинация такими производными индуцирует аллерген-специфические блокирующие IgG антитела (50). Однако иммунизация гипоаллергенами может также стимулировать аллерген-специфические ответы IgE и из-за сохранения аллерген-специфических Т-клеточных эпитопов может вызывать поздние фазовые Т-клеточные побочные эффекты у пациентов с аллергией (51).
Уже в первом клиническом исследовании, которое было проведено с рекомбинантными гипоаллергенными производными аллергена основного аллергена пыльцы березы Bet v 1, было показано, что вакцинация такими производными индуцирует аллерген-специфические блокирующие IgG антитела (50). Однако иммунизация гипоаллергенами может также стимулировать аллерген-специфические ответы IgE и из-за сохранения аллерген-специфических Т-клеточных эпитопов может вызывать поздние фазовые Т-клеточные побочные эффекты у пациентов с аллергией (51).
Рекомбинантные гипоаллергенные фрагменты Bet v 1 были недавно оценены в двойном слепом плацебо-контролируемом клиническом исследовании, проведенном на неаллергических субъектах в течение 2 лет (52). Было обнаружено, что вакцинация рекомбинантными фрагментами Bet v 1 индуцировала непрерывно растущие ответы IgG, которые могли предотвратить связывание IgE пациентов с аллергией с Bet v 1. Таким образом, эта вакцина вызывала защитный ответ IgG. Хотя индукция аллерген-специфических ответов IgE была отмечена у субъектов, получавших рекомбинантные фрагменты Bet v 1, аллергической сенсибилизации не происходило, поскольку кожные пробы, проведенные с Bet v 1, оставались отрицательными, что может быть связано с гораздо более высокой индукцией блокирующего IgG по сравнению с IgE. .Соответственно, рекомбинантные гипоаллергенные производные аллергена могут рассматриваться для профилактической вакцинации, и есть доказательства того, что вакцинация неаллергических субъектов является безопасной. Тем не менее остается опасение, что гипоаллергены также могут вызывать аллерген-специфические ответы IgE и, следовательно, аллергическую сенсибилизацию, и что они могут усиливать аллерген-специфические Т-клеточные ответы из-за того, что аллерген-специфические Т-клеточные эпитопы сохраняются в этих производных.
.Соответственно, рекомбинантные гипоаллергенные производные аллергена могут рассматриваться для профилактической вакцинации, и есть доказательства того, что вакцинация неаллергических субъектов является безопасной. Тем не менее остается опасение, что гипоаллергены также могут вызывать аллерген-специфические ответы IgE и, следовательно, аллергическую сенсибилизацию, и что они могут усиливать аллерген-специфические Т-клеточные ответы из-за того, что аллерген-специфические Т-клеточные эпитопы сохраняются в этих производных.
Пептиды, содержащие эпитоп Т-клеток
Аллергенные пептиды, содержащие Т-клеточные эпитопы, представляют собой относительно короткие синтетические пептиды длиной ~ 12–20 аминокислот, содержащие Т-клеточные эпитопы без какой-либо реактивности IgE (53).Из испытаний AIT, проведенных с такими пептидами, известно, что в зависимости от применяемой дозы и режима они могут вызывать активацию Т-клеток и, в конечном итоге, толерантность к Т-клеткам (54, 55). Из-за того, что эти пептиды очень короткие, они не индуцируют аллерген-специфические IgG-блокирующие антитела и, следовательно, не могут быть использованы для профилактической вакцинации.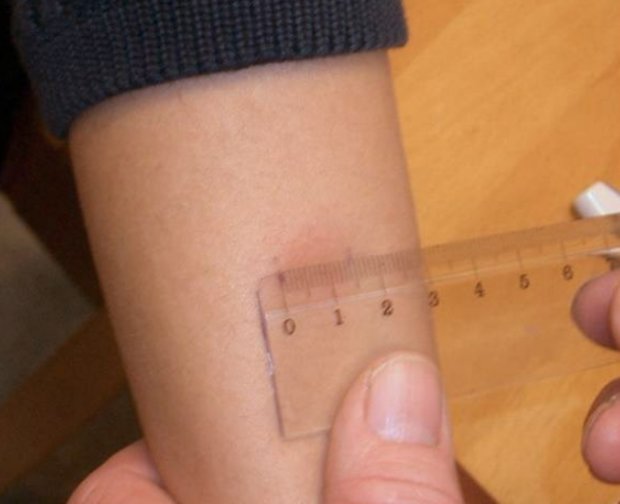 Однако их можно использовать для аллерген-специфической первичной профилактики путем индукции толерантности Т-клеток (56). Можно предположить, что такие пептиды можно вводить путем инъекции или даже применять пероральным путем для индукции глубокой толерантности адаптивной иммунной системы, но это нельзя рассматривать как профилактическую вакцинацию, которая должна индуцировать защитные аллерген-специфические антитела IgG.Проблемы для подходов с использованием пептидов, содержащих Т-клеточные эпитопы, для индукции первичной толерантности состоят в объединении смесей пептидов, включающих все релевантные аллергены и разнообразие MHC субъектов, подлежащих лечению, а также в разработке протоколов для введения, обеспечивающих надежную и устойчивую индукцию толерантности.
Однако их можно использовать для аллерген-специфической первичной профилактики путем индукции толерантности Т-клеток (56). Можно предположить, что такие пептиды можно вводить путем инъекции или даже применять пероральным путем для индукции глубокой толерантности адаптивной иммунной системы, но это нельзя рассматривать как профилактическую вакцинацию, которая должна индуцировать защитные аллерген-специфические антитела IgG.Проблемы для подходов с использованием пептидов, содержащих Т-клеточные эпитопы, для индукции первичной толерантности состоят в объединении смесей пептидов, включающих все релевантные аллергены и разнообразие MHC субъектов, подлежащих лечению, а также в разработке протоколов для введения, обеспечивающих надежную и устойчивую индукцию толерантности.
Вирусоподобные наночастицы (VNP), содержащие защищенные аллергены
В первом типе подходов к вирусоподобным частицам молекулы аллергенов были связаны химически (57-59), а также с помощью специфических линкерных систем с вирусоподобными частицами, продуцируемыми рекомбинантной экспрессией (60).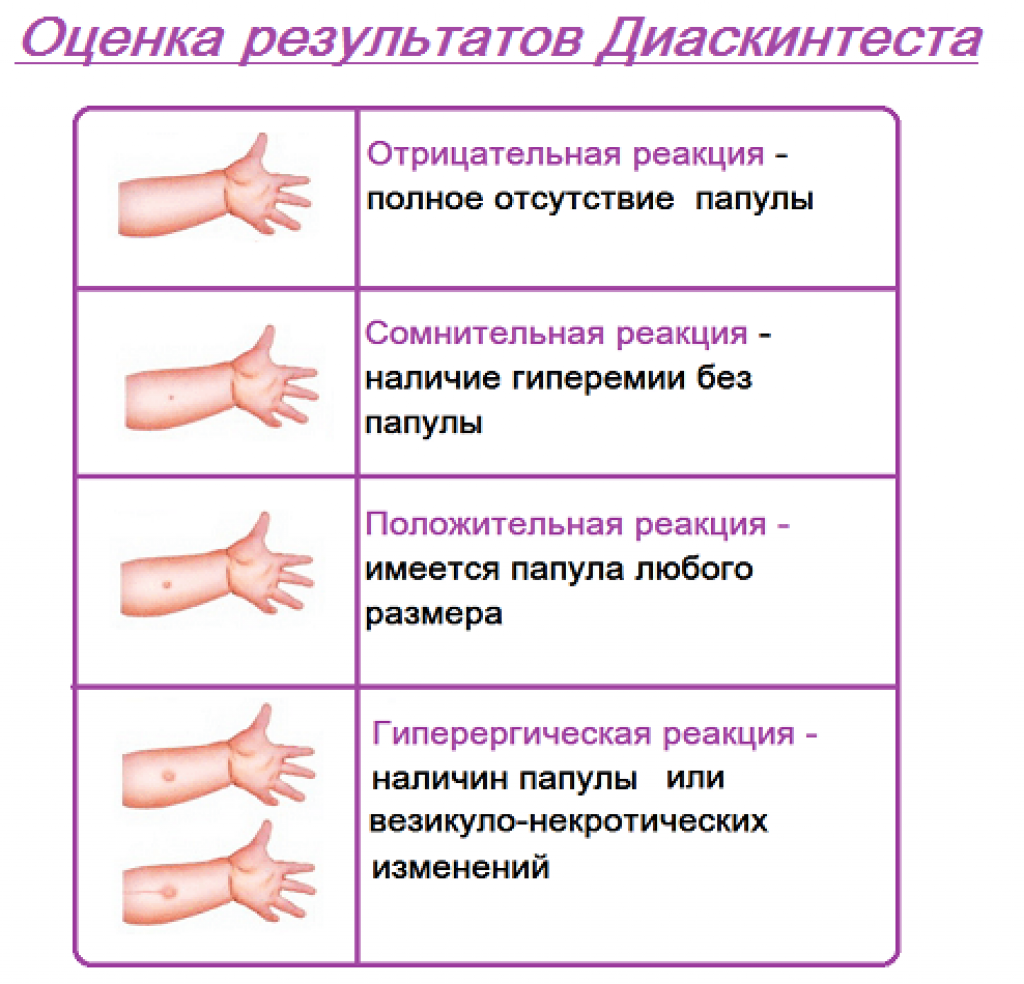 В результате этой процедуры были получены вакцины со сниженной аллергенной активностью и способностью вызывать аллерген-специфические ответы IgG. Вакцина, состоящая из пептида, полученного из основного аллергена клещей домашней пыли Der p 1, связанного с вирусоподобными частицами, даже была подвергнута клиническим испытаниям на неаллергических субъектах, и было обнаружено, что она вызывает аллерген-специфические ответы IgG (61). Однако аллергены, связанные с вирусоподобными частицами, проявляются в виде случайных конъюгатов и могут даже встречаться в виде крупных олигомеров. Таким образом, их было трудно производить в контролируемых условиях, необходимых для клинического использования и разработки лекарств.Недавно было сообщено об альтернативном подходе к созданию вирусоподобных наночастиц (VNP). В VNP кДНК, кодирующая аллерген, сливается с ДНК, кодирующей вирус (белок Matrix, p15MA) (62), или с гликозилфосфатидилинозитовой акцепторной последовательностью (63), которая экспрессируется внутри или вне VNP соответственно (64).
В результате этой процедуры были получены вакцины со сниженной аллергенной активностью и способностью вызывать аллерген-специфические ответы IgG. Вакцина, состоящая из пептида, полученного из основного аллергена клещей домашней пыли Der p 1, связанного с вирусоподобными частицами, даже была подвергнута клиническим испытаниям на неаллергических субъектах, и было обнаружено, что она вызывает аллерген-специфические ответы IgG (61). Однако аллергены, связанные с вирусоподобными частицами, проявляются в виде случайных конъюгатов и могут даже встречаться в виде крупных олигомеров. Таким образом, их было трудно производить в контролируемых условиях, необходимых для клинического использования и разработки лекарств.Недавно было сообщено об альтернативном подходе к созданию вирусоподобных наночастиц (VNP). В VNP кДНК, кодирующая аллерген, сливается с ДНК, кодирующей вирус (белок Matrix, p15MA) (62), или с гликозилфосфатидилинозитовой акцепторной последовательностью (63), которая экспрессируется внутри или вне VNP соответственно (64). ). В модели аллергии на пыльцу полыни на мышах (65) такие частицы были успешно использованы для профилактической вакцинации (66), но до сих пор нет опыта применения VNP в клинических исследованиях AIT у пациентов, и поэтому этот подход требует дальнейшего развития.
). В модели аллергии на пыльцу полыни на мышах (65) такие частицы были успешно использованы для профилактической вакцинации (66), но до сих пор нет опыта применения VNP в клинических исследованиях AIT у пациентов, и поэтому этот подход требует дальнейшего развития.
Пептидные вакцины, содержащие эпитоп В-клеток, связанных с носителем,
Пептиды, содержащие связанные с носителем В-клеточные эпитопы, являются дальнейшим усовершенствованием рекомбинантных гипоаллергенов (38, 67, 68). Чтобы уменьшить побочные эффекты из-за активации аллерген-специфических Т-клеток, аллерген-специфические Т-клеточные эпитопы были уменьшены в максимально возможной степени и заменены белками-носителями, которые происходят не от аллергенов, а от вирусов. Белки, производные от вируса, были выбраны из риновируса и, наконец, из вируса гепатита B (HBV) с целью получения не только помощи Т-лимфоцитов, но и, в конечном итоге, индукции полезного противовирусного иммунитета (69, 70).В наиболее совершенных в настоящее время вакцинах-кандидатах в качестве белка-носителя используется полученный из HBV белок PreS, с которым сливаются неаллергенные пептиды, полученные из участков связывания IgE аллергенов (71–74). Таким образом, вакцины, содержащие связанный с носителем В-клеточный эпитоп, могут направлять блокирующие антитела IgG на сайты связывания IgE аллергенов. Вакцины-кандидаты могут производиться с постоянным качеством, удовлетворяющим стандартам GMP, необходимым для современного производства вакцин, поскольку они могут быть экспрессированы в виде рекомбинантных слитых белков в Escherichia coli в больших количествах очень экономичным способом.Пептидные вакцины, содержащие В-клеточные эпитопы, связанные с носителем, были разработаны для нескольких важных источников аллергенов, включая пыльцу деревьев, трав, сорняков, кошек, клещей домашней пыли и многих других (68). Эти молекулы были охарактеризованы в отношении их структурных и иммунологических характеристик in vitro и in vivo на животных моделях в отношении их способности индуцировать ответы антител IgG, которые могут блокировать связывание IgE пациента с аллергией с естественными аллергенами (75). Таким образом, кажется, что технология применима ко всем известным источникам аллергенов.
Таким образом, вакцины, содержащие связанный с носителем В-клеточный эпитоп, могут направлять блокирующие антитела IgG на сайты связывания IgE аллергенов. Вакцины-кандидаты могут производиться с постоянным качеством, удовлетворяющим стандартам GMP, необходимым для современного производства вакцин, поскольку они могут быть экспрессированы в виде рекомбинантных слитых белков в Escherichia coli в больших количествах очень экономичным способом.Пептидные вакцины, содержащие В-клеточные эпитопы, связанные с носителем, были разработаны для нескольких важных источников аллергенов, включая пыльцу деревьев, трав, сорняков, кошек, клещей домашней пыли и многих других (68). Эти молекулы были охарактеризованы в отношении их структурных и иммунологических характеристик in vitro и in vivo на животных моделях в отношении их способности индуцировать ответы антител IgG, которые могут блокировать связывание IgE пациента с аллергией с естественными аллергенами (75). Таким образом, кажется, что технология применима ко всем известным источникам аллергенов. Пептидная вакцина, содержащая связанный с носителем В-клеточный эпитоп, предназначенная для лечения аллергии на пыльцу трав, названная BM32, была охарактеризована наилучшим образом (73), и несколько клинических испытаний были проведены или продолжаются с BM32 (76–78). В таблице 1 представлен обзор клинических исследований BM32 или его компонентов. В частности, в таблице показаны номера клинических испытаний со ссылкой на официальную базу данных клинических испытаний, дизайн исследований и основные выводы, сделанные в этих исследованиях, а также ссылки на документы, описывающие клинические результаты.
Пептидная вакцина, содержащая связанный с носителем В-клеточный эпитоп, предназначенная для лечения аллергии на пыльцу трав, названная BM32, была охарактеризована наилучшим образом (73), и несколько клинических испытаний были проведены или продолжаются с BM32 (76–78). В таблице 1 представлен обзор клинических исследований BM32 или его компонентов. В частности, в таблице показаны номера клинических испытаний со ссылкой на официальную базу данных клинических испытаний, дизайн исследований и основные выводы, сделанные в этих исследованиях, а также ссылки на документы, описывающие клинические результаты.
Таблица 1 . Клинические испытания вакцин-носителей пептидов на основе рекомбинантных В-клеточных эпитопов.
Начиная с оценки безопасности BM32 с помощью кожных проб (76) и в последующих исследованиях AIT (77, 78), было подтверждено, что BM32 из-за отмены реактивности IgE не вызывает аллергических реакций немедленного типа, и их было всего несколько.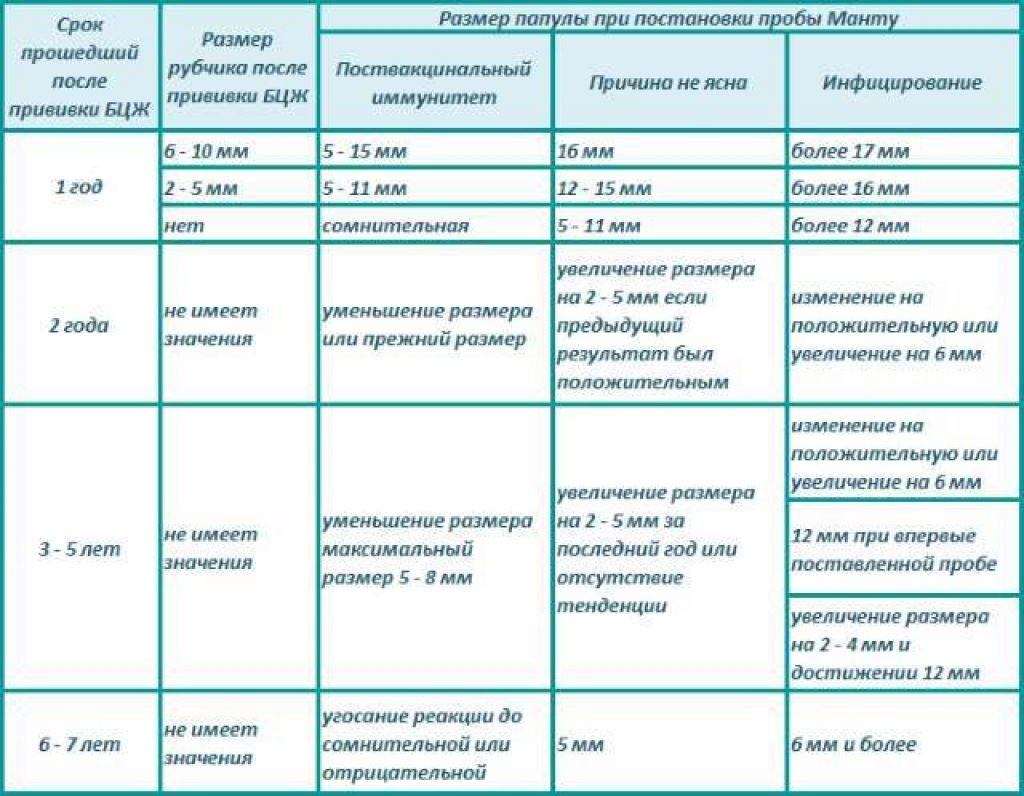 и умеренные реакции поздней фазы из-за уменьшения эпитопов Т-клеток, полученных из аллергенов. BM32 индуцировал высокие уровни аллерген-специфических антител IgG, которые ингибировали связывание IgE с аллергенами пыльцы трав и активацию базофилов, вызванную аллергеном пыльцы травы, аллергическое воспаление немедленного типа и активацию Т-клеток, индуцированную аллергеном.Следует отметить, что гораздо меньшее количество инъекций BM32 было одинаково эффективным по сравнению с множественными инъекциями вакцин на основе экстрактов аллергенов (79). Пациенты переносили высокие дозы BM32, так что нескольких (т.е. 3-5) предсезонных инъекций в первый год лечения было достаточно для создания сильного блокирующего ответа антител IgG и снижения симптомов, вызванных аллергеном пыльцы трав, на> 25. % по сравнению с плацебо (78). Важно отметить, что аллерген-специфический блокирующий ответ IgG может быть повышен до исходного уровня только одной бустерной инъекцией (78).Аллерген-специфический IgG, индуцированный у вакцинированных пациентов, не только уменьшал симптомы аллергии на пыльцу трав, но также предотвращал повышение выработки аллерген-специфического IgE при воздействии аллергена пыльцы травы в течение сезона пыльцы, что привело к снижению уровней аллерген-специфических IgE в организме.
и умеренные реакции поздней фазы из-за уменьшения эпитопов Т-клеток, полученных из аллергенов. BM32 индуцировал высокие уровни аллерген-специфических антител IgG, которые ингибировали связывание IgE с аллергенами пыльцы трав и активацию базофилов, вызванную аллергеном пыльцы травы, аллергическое воспаление немедленного типа и активацию Т-клеток, индуцированную аллергеном.Следует отметить, что гораздо меньшее количество инъекций BM32 было одинаково эффективным по сравнению с множественными инъекциями вакцин на основе экстрактов аллергенов (79). Пациенты переносили высокие дозы BM32, так что нескольких (т.е. 3-5) предсезонных инъекций в первый год лечения было достаточно для создания сильного блокирующего ответа антител IgG и снижения симптомов, вызванных аллергеном пыльцы трав, на> 25. % по сравнению с плацебо (78). Важно отметить, что аллерген-специфический блокирующий ответ IgG может быть повышен до исходного уровня только одной бустерной инъекцией (78).Аллерген-специфический IgG, индуцированный у вакцинированных пациентов, не только уменьшал симптомы аллергии на пыльцу трав, но также предотвращал повышение выработки аллерген-специфического IgE при воздействии аллергена пыльцы травы в течение сезона пыльцы, что привело к снижению уровней аллерген-специфических IgE в организме. пролеченные пациенты (78).
пролеченные пациенты (78).
Три более важных наблюдения были сделаны в клинических испытаниях с BM32: во-первых, BM32 индуцировал аллерген-специфический IgG и, в частности, постоянно растущий аллерген-специфический IgG. 4 ответ без повышения аллерген-специфического IgE, как это наблюдается для всех других AIT. вакцины (80).Во-вторых, BM32 не стимулировал Т-клеточные и воспалительные цитокиновые ответы, специфичные для аллергенов пыльцы трав, и, таким образом, по-видимому, не оказывает праймирующего действия на аллерген-специфические Т-клеточные ответы (80). В-третьих, было обнаружено, что BM32 индуцирует также антитела IgG против HBV, которые блокируют инфицирование in vitro культивируемых клеток печени, и, таким образом, кажется, что BM32 также защищает от инфекции HBV (81). По этой причине в настоящее время проводится еще одно клиническое исследование, в ходе которого выясняется, может ли BM325, компонент BM32, вызывать защитный иммунный ответ на ВГВ у субъектов, которые не были вакцинированы против ВГВ, и у субъектов, которые принадлежат к 10–20% не ответивших. к используемым в настоящее время вакцинам против HBV на основе S-белка (Таблица 1; ClinicalTrials.gov: NCT03625934). Кроме того, это исследование также исследует, вызывает ли BM325 терапевтический иммунный ответ против HBV у пациентов с хроническими инфекциями HBV. Это исследование интересно тем, что в нем участвовали субъекты, не страдающие аллергией на пыльцу трав, и, таким образом, можно будет изучить, безопасен ли BM325 для людей, не страдающих аллергией, и не вызывает ли аллергическую сенсибилизацию. В настоящее время BM32 был оценен в нескольких исследованиях фазы II, и была установлена оптимальная доза и протокол вакцинации, так что вакцина готова к испытаниям фазы III, которые могут предоставить данные, необходимые для регистрации вакцины в Европе.
к используемым в настоящее время вакцинам против HBV на основе S-белка (Таблица 1; ClinicalTrials.gov: NCT03625934). Кроме того, это исследование также исследует, вызывает ли BM325 терапевтический иммунный ответ против HBV у пациентов с хроническими инфекциями HBV. Это исследование интересно тем, что в нем участвовали субъекты, не страдающие аллергией на пыльцу трав, и, таким образом, можно будет изучить, безопасен ли BM325 для людей, не страдающих аллергией, и не вызывает ли аллергическую сенсибилизацию. В настоящее время BM32 был оценен в нескольких исследованиях фазы II, и была установлена оптимальная доза и протокол вакцинации, так что вакцина готова к испытаниям фазы III, которые могут предоставить данные, необходимые для регистрации вакцины в Европе.
В связи с обнадеживающими результатами, полученными для BM32 в клинических исследованиях, и некоторыми уникальными особенностями, которые идентифицируют эту вакцину как отличного кандидата для профилактической вакцинации, мы рассматриваем вакцины BM32 и пептидные вакцины, содержащие В-клеточные эпитопы, связанные с носителем, как подходящие кандидаты для профилактической вакцинации против аллергия. Далее мы кратко резюмируем и обсуждаем эти характеристики в свете потенциального использования для профилактической вакцинации против аллергенов.
Далее мы кратко резюмируем и обсуждаем эти характеристики в свете потенциального использования для профилактической вакцинации против аллергенов.
Уникальные особенности вакцин-носителей пептидов на основе рекомбинантных В-клеточных эпитопов, предрасполагающие их к профилактической вакцинации против аллергенов
Вакцина-носитель пептида на основе рекомбинантных В-клеточных эпитопов для лечения АИТ аллергии на пыльцу трав, BM32, прошла обширную оценку в клинических исследованиях (таблица 1).В исследованиях AIT пациенты переносили высокие дозы BM32 без серьезных аллергических реакций немедленной или поздней фазы. Небольшие дозы (например, 3-5 подкожных инъекций) вызывали аллерген-специфические ответы антител IgG, направленные на эпитопы IgE природных аллергенов. Таким образом, BM32 может фокусировать блокирующие ответы IgG против эпитопов на естественных аллергенах, участвующих в аллергической сенсибилизации. Из-за замены аллерген-специфичных Т-клеточных эпитопов на носитель-специфические Т-клеточные эпитопы, BM32 показал сильно сниженную или отсутствующую стимуляцию аллерген-специфических Т-клеточных ответов (80), и поэтому можно ожидать, что после профилактической вакцинации в раннем возрасте вакцина не будет стимулировать Т-клетки к аллергической сенсибилизации, но индуцирует аллерген-специфические IgG. В отличие от всех других вакцин против AIT на основе экстрактов аллергенов, BM32 не усиливает аллерген-специфические ответы IgE, и можно предположить, что вакцина не будет усиливать аллергенспецифические ответы IgE при использовании для вторичной профилактической вакцинации, чтобы предотвратить переход клинически бессознательной сенсибилизации к аллергические симптомы. Более того, вполне вероятно, что вакцина не будет вызывать аллергической сенсибилизации при использовании для первичной профилактической вакцинации неаллергических субъектов. Всего несколько вакцинаций BM32 потребовалось, чтобы вызвать сильный аллерген-специфический блокирующий ответ IgG, который можно было усилить одной инъекцией.Таким образом, должна быть возможность вызвать у матерей или детей в раннем возрасте после рождения устойчивый базовый блокирующий ответ IgG, который можно усилить однократными инъекциями, когда это необходимо. Было показано, что благодаря использованию белка PreS, происходящего от HBV, в качестве белка-носителя в BM32, последний также индуцировал защитный иммунный ответ против инфекций HBV.
В отличие от всех других вакцин против AIT на основе экстрактов аллергенов, BM32 не усиливает аллерген-специфические ответы IgE, и можно предположить, что вакцина не будет усиливать аллергенспецифические ответы IgE при использовании для вторичной профилактической вакцинации, чтобы предотвратить переход клинически бессознательной сенсибилизации к аллергические симптомы. Более того, вполне вероятно, что вакцина не будет вызывать аллергической сенсибилизации при использовании для первичной профилактической вакцинации неаллергических субъектов. Всего несколько вакцинаций BM32 потребовалось, чтобы вызвать сильный аллерген-специфический блокирующий ответ IgG, который можно было усилить одной инъекцией.Таким образом, должна быть возможность вызвать у матерей или детей в раннем возрасте после рождения устойчивый базовый блокирующий ответ IgG, который можно усилить однократными инъекциями, когда это необходимо. Было показано, что благодаря использованию белка PreS, происходящего от HBV, в качестве белка-носителя в BM32, последний также индуцировал защитный иммунный ответ против инфекций HBV. Таким образом, вакцина может быть полезна не только для профилактической вакцинации против аллергии, но и для вакцинации против HBV.
Таким образом, вакцина может быть полезна не только для профилактической вакцинации против аллергии, но и для вакцинации против HBV.
Рекомбинантные пептидные вакцины-носители на основе В-клеточных эпитопов для вторичной и первичной профилактической вакцинации от аллергии
Здесь мы рассматриваем три возможных сценария профилактической вакцинации против аллергии (Рисунки 3, 4), которые предотвращают прогрессирование клинически бессознательной сенсибилизации IgE к симптомам аллергии или даже аллергической сенсибилизации.Вместе эти стратегии могут позволить искоренить возникновение тяжелых форм аллергии у населения. Предпосылки для этих подходов заключаются в том, что наиболее важные молекулы аллергенов (т.е. наиболее часто распознаваемые аллергены с высокой аллергенной активностью) могут быть определены для данной популяции, которую предполагается вакцинировать, и что вакцины-носители пептидов на основе рекомбинантных В-клеточных эпитопов могут быть сформулированы для этих молекул аллергенов.
Рисунок 3 .Вторичная профилактика. Профилактическая вакцинация для предотвращения перехода от клинически бессознательной сенсибилизации IgE к развитию аллергических симптомов. Детей с аллерген-специфической реактивностью IgE вакцинируют, чтобы индуцировать и поддерживать выработку блокирующих аллерген-специфических антител IgG для предотвращения развития аллергических симптомов.
Рисунок 4 . Первичная профилактическая вакцинация от аллергии. (A) Пренатальная вакцинация матерей должна вызывать основное производство аллерген-специфичных блокирующих антител IgG, которые затем увеличиваются с помощью бустерной инъекции, вводимой в третьем триместре, для передачи высоких уровней защитных аллерген-специфических IgG ребенку. предотвратить послеродовую аллергическую сенсибилизацию. (B) Ранняя послеродовая профилактическая вакцинация. Детям проводится ранняя послеродовая вакцинация от аллергии для создания и поддержания защитного аллерген-специфического ответа IgG для предотвращения аллергической сенсибилизации.
Анализ профилей сенсибилизации IgE в отношении комплексных панелей микромассивных молекул аллергенов в популяционных когортах рождения показал, что несколько важных молекул аллергенов могут быть определены для составления таких профилактических вакцин (22).Для этого необходимо будет только определить профили молекулярной сенсибилизации IgE для разных популяций и стран мира с уже существующей технологией молекулярной диагностики (14, 82). Для многих важных молекул респираторных аллергенов вакцины-носители пептидов на основе рекомбинантных В-клеточных эпитопов уже были доклинически охарактеризованы, и кажется, что технология широко применима ко всем типам аллергенов, включая также пищевые аллергены и аллергены яда (68). Тем не менее, в этой статье мы сосредоточили внимание на ингаляционной аллергии по нескольким причинам: во-первых, ингаляционная аллергия более чем в 10 раз более распространена, чем пищевая аллергия, и поэтому будет очень трудно проводить профилактические исследования AIT, потому что очень большое количество испытуемых будут Это необходимо для визуализации эффективности профилактического вмешательства, специфичного для аллергена.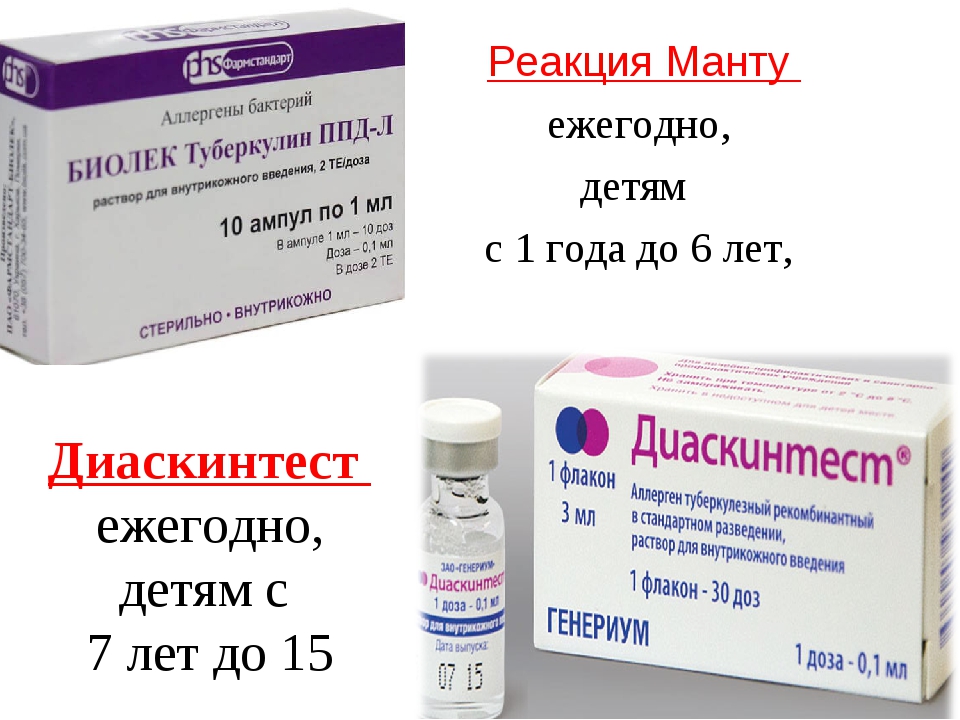 Во-вторых, большая часть прогресса в отношении стратегий молекулярной иммунотерапии была достигнута в области ингаляционной аллергии, тогда как для пищевой аллергии доступно относительно небольшое количество молекул-кандидатов. В-третьих, пищевые аллергены класса 1 часто содержат последовательные эпитопы IgE, и технически может быть труднее создать несенсибилизирующие производные аллергена для профилактики. Однако стратегия, описанная в нашей перспективной статье, будет полностью применима и при пищевой аллергии.
Во-вторых, большая часть прогресса в отношении стратегий молекулярной иммунотерапии была достигнута в области ингаляционной аллергии, тогда как для пищевой аллергии доступно относительно небольшое количество молекул-кандидатов. В-третьих, пищевые аллергены класса 1 часто содержат последовательные эпитопы IgE, и технически может быть труднее создать несенсибилизирующие производные аллергена для профилактики. Однако стратегия, описанная в нашей перспективной статье, будет полностью применима и при пищевой аллергии.
Поскольку было показано, что лежащие в основе механизмы действия различных вакцин-носителей пептидов на основе рекомбинантных В-клеточных эпитопов идентичны (т.е.например, индукция аллерген-специфических блокирующих ответов IgG), будет легко сформулировать отдельные компоненты по отдельности, а затем смешать их, принимая во внимание профили распознавания IgE различных популяций. Технология, применяемая в настоящее время для BM32, основана на адсорбции четырех отдельных компонентов на гидроксиде алюминия с последующим смешением четырех адсорбатов (73). Соответственно, с помощью этой технологии такие смеси могут быть составлены также для других компонентов из неродственных источников аллергенов.Кроме того, должна быть возможность комбинировать пептиды из разных молекул аллергенов в единые слитые белки, что должно позволить уменьшить количество компонентов, необходимых для вакцины против аллергии, которые защищают от нескольких различных источников аллергенов.
Соответственно, с помощью этой технологии такие смеси могут быть составлены также для других компонентов из неродственных источников аллергенов.Кроме того, должна быть возможность комбинировать пептиды из разных молекул аллергенов в единые слитые белки, что должно позволить уменьшить количество компонентов, необходимых для вакцины против аллергии, которые защищают от нескольких различных источников аллергенов.
Однако для многих стран уже можно определить несколько важных источников аллергенов для профилактической вакцинации против аллергии. Например, пыльца березы и аллергия на кошек преобладают в Скандинавии и России (17, 20, 83). Профилактическая вакцина против аллергии на пыльцу березы потребует только одного компонента аллергена, т.е.е., основной аллерген пыльцы березы, Bet v 1, и вакцина для кошек будут основаны в первую очередь на главном аллергене кошек, Fel d 1. Аллергия на клещей домашней пыли является наиболее серьезной аллергией, поражающей более 20% населения в Азия, Австралия и многие другие части мира (84, 85). Для клещей домашней пыли был определен коктейль только из 6 важных молекул аллергенов, включая Der p 1, Der p 2, Der p 5, Der p 7, Der p 21 и Der p 23 (86, 87). В Средней и Южной Европе и Америке преобладает аллергия на пыльцу трав (88), и с ней можно справиться с помощью BM32.В Средиземноморском регионе распространены пыльца оливок и некоторые сорняки, такие как Parietaria , требующие гипосенсибилизации Ole e 1 и Par j 1, а также Par j 2 (89, 90) соответственно. В Восточной Европе и некоторых частях США преобладает амброзия, а пыльца полыни важна в Центральной Азии (91, 92).
Для клещей домашней пыли был определен коктейль только из 6 важных молекул аллергенов, включая Der p 1, Der p 2, Der p 5, Der p 7, Der p 21 и Der p 23 (86, 87). В Средней и Южной Европе и Америке преобладает аллергия на пыльцу трав (88), и с ней можно справиться с помощью BM32.В Средиземноморском регионе распространены пыльца оливок и некоторые сорняки, такие как Parietaria , требующие гипосенсибилизации Ole e 1 и Par j 1, а также Par j 2 (89, 90) соответственно. В Восточной Европе и некоторых частях США преобладает амброзия, а пыльца полыни важна в Центральной Азии (91, 92).
С доступной технологией вакцин-носителей пептидов на основе рекомбинантных В-клеточных эпитопов становится возможным немедленно изучить концепции профилактической вакцинации против основного источника аллергена в некоторых из этих стран / континентов в подтверждение принципиальных клинических испытаний.Однако для каждой из вакцин-носителей пептидов на основе В-клеточных эпитопов необходимо собрать опыт терапевтических испытаний AIT в качестве начального шага, прежде чем можно будет рассматривать профилактическую вакцинацию (рисунок 5, таблица 2). Ниже мы обсудим три различных подхода к профилактической вакцинации от аллергии (Вставка 1: Вторичная профилактика, первичная профилактика).
Ниже мы обсудим три различных подхода к профилактической вакцинации от аллергии (Вставка 1: Вторичная профилактика, первичная профилактика).
Рисунок 5 . Возможный путь к профилактической вакцинации молекулярными вакцинами против аллергии. Показаны систематические шаги к первичной профилактической вакцинации против аллергии.Вакцины от молекулярной аллергии, которые доказали свою безопасность и индуцируют аллерген-специфические ответы IgG без усиления ответов IgE, могут быть дополнительно оценены на этапе 1, который включает вакцинацию неаллергических субъектов, чтобы продемонстрировать, что вакцина безопасна и не вызывает аллергической сенсибилизации. На этапе 2 эти вакцины будут оцениваться на предмет их способности предотвращать переход клинически бессознательной сенсибилизации к аллергическим симптомам путем вторичной профилактики. Кроме того, можно изучить, может ли пренатальная вакцинация матерей предотвратить развитие аллергической сенсибилизации у детей путем блокирования антител IgG, передаваемых от матери ребенку. В качестве шага 3 можно рассматривать раннюю постнатальную вакцинацию для предотвращения развития аллергической сенсибилизации у детей.
В качестве шага 3 можно рассматривать раннюю постнатальную вакцинацию для предотвращения развития аллергической сенсибилизации у детей.
Таблица 2 . Возможный путь к профилактической вакцинации молекулярными вакцинами против аллергии.
Вторичная профилактика: предотвращение прогрессирования немой IgE-сенсибилизации к симптомам
Данные, полученные путем продольного тестирования детей в популяционных когортах рождения с микромассивом молекул аллергенов, показали, что в возрасте 4–6 лет у большинства детей наблюдается только клинически бессимптомная сенсибилизация IgE к респираторным аллергенам, которая в более позднем возрасте прогрессирует до симптомы аллергии (17, 23).Уровни IgE, связанные с клинически бессимптомной сенсибилизацией IgE, обычно низкие, и кажется, что можно определить пороговые уровни IgE для безмолвной сенсибилизации и симптоматической аллергии (83). Кроме того, эти исследования продемонстрировали, что образцы и уровни аллерген-специфической реактивности IgE, измеренные в раннем возрасте (т. Е. В возрасте 4–6 лет), полезны для прогнозирования прогрессирования симптомов аллергии (17, 22). Соответственно, эти когортные исследования при рождении показали, что можно выявить детей с клинически скрытой сенсибилизацией в раннем возрасте, которые имеют повышенный риск развития аллергии в более позднем возрасте.Таким образом, можно идентифицировать детей, чтобы предотвратить прогрессирование «молчащей» сенсибилизации IgE к аллергическим симптомам с помощью вторичной профилактической аллерген-специфической вакцинации (рис. 3). На практике можно представить, что таких детей идентифицируют с помощью серологических тестов, выявляющих ответы IgE на комплексную панель микромассивных молекул аллергенов, и вакцинируют этих детей вакцинами-носителями пептидов на основе В-клеточных эпитопов против соответствующих аллергенов. Доказательством принципиальных клинических исследований могут быть двойные слепые плацебо-контролируемые исследования, в которых одна группа детей получает активную вакцинацию, а контрольная группа лечится плацебо.
Е. В возрасте 4–6 лет), полезны для прогнозирования прогрессирования симптомов аллергии (17, 22). Соответственно, эти когортные исследования при рождении показали, что можно выявить детей с клинически скрытой сенсибилизацией в раннем возрасте, которые имеют повышенный риск развития аллергии в более позднем возрасте.Таким образом, можно идентифицировать детей, чтобы предотвратить прогрессирование «молчащей» сенсибилизации IgE к аллергическим симптомам с помощью вторичной профилактической аллерген-специфической вакцинации (рис. 3). На практике можно представить, что таких детей идентифицируют с помощью серологических тестов, выявляющих ответы IgE на комплексную панель микромассивных молекул аллергенов, и вакцинируют этих детей вакцинами-носителями пептидов на основе В-клеточных эпитопов против соответствующих аллергенов. Доказательством принципиальных клинических исследований могут быть двойные слепые плацебо-контролируемые исследования, в которых одна группа детей получает активную вакцинацию, а контрольная группа лечится плацебо.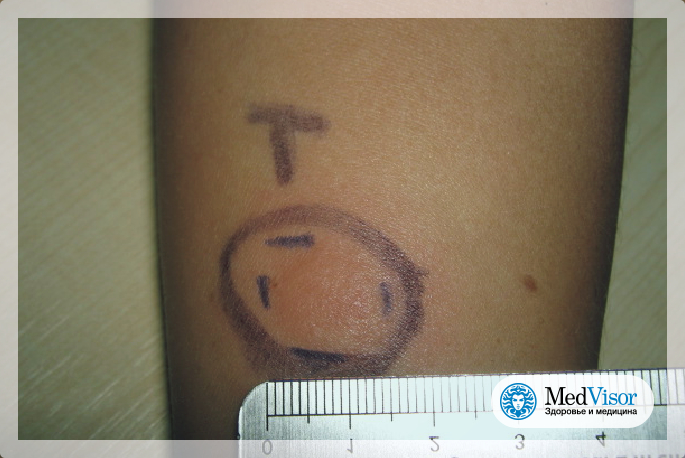 Принимая во внимание знания о том, что для достижения долгосрочных клинических преимуществ при АИТ после прекращения лечения требуется лечение> 3 лет (93), можно предположить, что исследования прототипа будут включать 3 года лечения и период последующего наблюдения еще 2 раза. годы. Уже во время лечения и в период последующего наблюдения следует регистрировать появление аллергических симптомов в двух группах в качестве клинической конечной точки, безопасности и измерять индукцию аллерген-специфичных блокирующих антител IgG и сенсибилизацию IgE в качестве иммунологических суррогатных маркеров (таблица 2).Преимущество вакцин-носителей пептидов на основе В-клеточных эпитопов состоит в том, что для создания и поддержания реакции блокирующих антител IgG необходимо лишь несколько вакцинаций. Кроме того, для вакцины против аллергии на пыльцу травы BM32 было показано, что индуцированный вакцинацией IgG снижает усиление аллерген-специфических антител IgE во время сезонов пыльцы (78). Таким образом, можно надеяться, что это также произойдет в исследовании вторичной профилактики и что уровни аллерген-специфического IgE будут оставаться ниже порогового уровня для симптомов, тогда как аллерген-специфический IgG повышен у вакцинированных детей (рис.
Принимая во внимание знания о том, что для достижения долгосрочных клинических преимуществ при АИТ после прекращения лечения требуется лечение> 3 лет (93), можно предположить, что исследования прототипа будут включать 3 года лечения и период последующего наблюдения еще 2 раза. годы. Уже во время лечения и в период последующего наблюдения следует регистрировать появление аллергических симптомов в двух группах в качестве клинической конечной точки, безопасности и измерять индукцию аллерген-специфичных блокирующих антител IgG и сенсибилизацию IgE в качестве иммунологических суррогатных маркеров (таблица 2).Преимущество вакцин-носителей пептидов на основе В-клеточных эпитопов состоит в том, что для создания и поддержания реакции блокирующих антител IgG необходимо лишь несколько вакцинаций. Кроме того, для вакцины против аллергии на пыльцу травы BM32 было показано, что индуцированный вакцинацией IgG снижает усиление аллерген-специфических антител IgE во время сезонов пыльцы (78). Таким образом, можно надеяться, что это также произойдет в исследовании вторичной профилактики и что уровни аллерген-специфического IgE будут оставаться ниже порогового уровня для симптомов, тогда как аллерген-специфический IgG повышен у вакцинированных детей (рис. 3).
3).
Однако необходимо иметь в виду, что подход вторичной профилактики потребует непрерывного лечения в течение жизни, потому что сенсибилизация IgE уже произошла в целевой популяции и при снижении уровня защитных антител IgG могут появиться аллергенспецифические IgE и связанные с ними симптомы.
Первичная профилактика пренатальной вакцинацией против аллергенов матери
Несколько линий доказательств предполагают, что первичная профилактическая аллерген-специфическая вакцинация против аллергии может быть достигнута путем вакцинации матери.Прежде всего, в нескольких экспериментальных исследованиях на животных было продемонстрировано, что иммунизация матери может подавлять аллергическую сенсибилизацию потомства (94–97). Во-вторых, было показано, что защитный эффект в основном опосредуется переносом аллерген-специфических антител IgG в моделях пассивной иммунизации (98–101). В-третьих, клинический опыт свидетельствует о том, что АИТ беременных женщин может защитить детей от аллерген-специфической сенсибилизации IgE (102), и было обнаружено, что антитела IgG 1 и IgG 4 , индуцированные у беременных женщин с помощью АИТ, передаются в ребенок и может быть обнаружен в пуповинной крови (103). Наконец, недавнее исследование показало, что высокие уровни естественных материнских аллерген-специфических антител IgG могут защитить от аллергической сенсибилизации у детей, когда они наблюдались до возраста 5 лет в когортном исследовании новорожденных (26).
Наконец, недавнее исследование показало, что высокие уровни естественных материнских аллерген-специфических антител IgG могут защитить от аллергической сенсибилизации у детей, когда они наблюдались до возраста 5 лет в когортном исследовании новорожденных (26).
Концепция вакцинации матерей на самом деле довольно хорошо принята в области инфекционных болезней. Вакцинация матерей считается безопасной и эффективной, в частности, против гриппа (104, 105), стрептококка группы B (106), коклюша (107) и некоторых других инфекционных заболеваний (108–110).
Практически можно было бы рассмотреть вакцинацию матери вакцинами-носителями пептидов на основе рекомбинантных В-клеточных эпитопов, если было продемонстрировано, что вакцина не вызывает аллергической сенсибилизации и безопасна для неаллергических субъектов, но индуцирует высокие уровни аллерген-специфичных IgG-блокирующих антител ( Рисунки 4А, 5, Таблица 2). В настоящее время не существует надежного маркера, который позволил бы безопасно предсказать, разовьется ли у детей от определенных родителей аллергическая сенсибилизация к определенной молекуле аллергена. Следовательно, для подтверждения принципиальных исследований, изучающих возможность первичной профилактики аллергии путем вакцинации матери, не потребуется предварительного отбора участвующих матерей. Такие исследования следует проводить на популяциях, в которых очень часто встречается сенсибилизация к определенным аллергенам, и должны быть доступны подходящие вакцины для этих молекул. Например, профилактические исследования аллергии на пыльцу травы можно проводить с BM32 в Средней Европе, вакцинацию против аллергии на пыльцу березы можно проводить с гипоаллергенным вариантом Bet v 1 в России и Скандинавии, а профилактическую вакцинацию против аллергии на клещей домашней пыли в большей части Азии. .Такие доказательства принципиальных исследований могут включать женщин, желающих иметь детей, путем проведения им курса базовых вакцинаций для выработки аллерген-специфических ответов IgG, а после того, как они забеременеют, аллерген-специфические IgG могут быть усилены с помощью одной бустерной инъекции.
Следовательно, для подтверждения принципиальных исследований, изучающих возможность первичной профилактики аллергии путем вакцинации матери, не потребуется предварительного отбора участвующих матерей. Такие исследования следует проводить на популяциях, в которых очень часто встречается сенсибилизация к определенным аллергенам, и должны быть доступны подходящие вакцины для этих молекул. Например, профилактические исследования аллергии на пыльцу травы можно проводить с BM32 в Средней Европе, вакцинацию против аллергии на пыльцу березы можно проводить с гипоаллергенным вариантом Bet v 1 в России и Скандинавии, а профилактическую вакцинацию против аллергии на клещей домашней пыли в большей части Азии. .Такие доказательства принципиальных исследований могут включать женщин, желающих иметь детей, путем проведения им курса базовых вакцинаций для выработки аллерген-специфических ответов IgG, а после того, как они забеременеют, аллерген-специфические IgG могут быть усилены с помощью одной бустерной инъекции.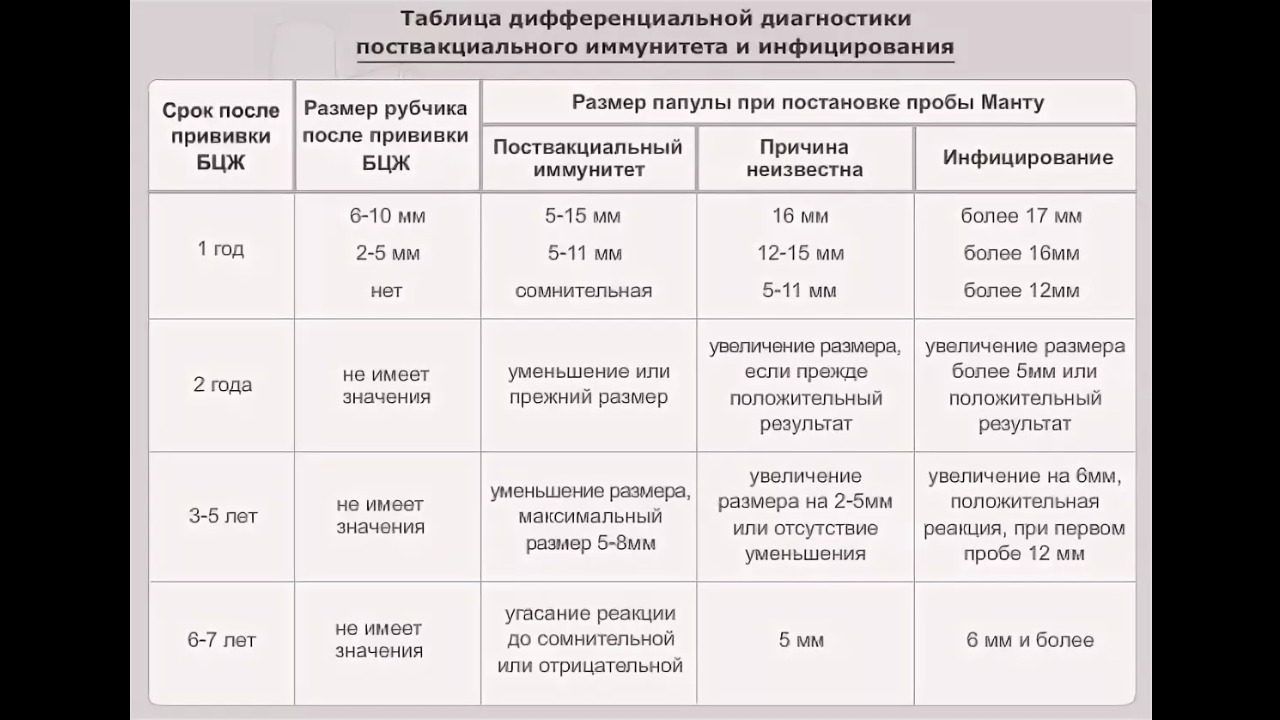 дан в третьем триместре. Такое доказательство принципа исследования может быть проведено как двойное слепое плацебо-контролируемое исследование с участием группы матерей, получающих активную вакцинацию, и группы матерей, получающих плацебо.Возникновение IgE-сенсибилизации и аллергических симптомов у детей, находящихся под наблюдением в течение первых нескольких лет (например, 3-5 лет), будет важными конечными точками исследования (таблица 2). Передача аллерген-специфических IgG от матери к ребенку и развитие у ребенка собственных аллерген-специфических реакций антител может быть измерена путем анализа образцов капиллярной крови с использованием микромассивов аллергенов, как недавно сообщалось (26).
дан в третьем триместре. Такое доказательство принципа исследования может быть проведено как двойное слепое плацебо-контролируемое исследование с участием группы матерей, получающих активную вакцинацию, и группы матерей, получающих плацебо.Возникновение IgE-сенсибилизации и аллергических симптомов у детей, находящихся под наблюдением в течение первых нескольких лет (например, 3-5 лет), будет важными конечными точками исследования (таблица 2). Передача аллерген-специфических IgG от матери к ребенку и развитие у ребенка собственных аллерген-специфических реакций антител может быть измерена путем анализа образцов капиллярной крови с использованием микромассивов аллергенов, как недавно сообщалось (26).
Основная надежда и ожидание, связанное с вакцинацией матерей, заключается в том, что она может предотвратить аллергическую сенсибилизацию ребенка, не требуя дополнительной вакцинации детей.Однако это должно быть подтверждено клиническими исследованиями.
Первичная профилактика с помощью ранней послеродовой аллерген-специфической вакцинации
Чтобы добиться первичной профилактики аллергии путем ранней послеродовой вакцинации, иммунизацию необходимо проводить до того, как произойдет аллергическая сенсибилизация. В противном случае такой подход можно было бы квалифицировать только как вторичный превентивный подход (вставка 1). Таким образом, детей необходимо вакцинировать вскоре после рождения, чтобы выработать блокирующий аллерген-специфический ответ IgG и предотвратить аллергическую сенсибилизацию.В случае профилактических вакцин против инфекционных заболеваний цель состоит в том, чтобы установить особую память В-клеток, которая активируется при инфицировании и будет защищать в идеале на протяжении всей жизни. Что касается аллергии, цель состоит в том, чтобы предотвратить аллергическую сенсибилизацию, которая, согласно когортным исследованиям при рождении, происходит только в раннем детстве, тогда как контакт аллергена в более позднем возрасте не вызывает аллергической сенсибилизации. Поэтому не представляется важным генерировать память В-клеток, которая может быть активирована при контакте с аллергеном в более позднем возрасте, но поддерживать высокий уровень защитных аллерген-специфических антител в раннем возрасте, когда возникает аллергическая сенсибилизация.
В противном случае такой подход можно было бы квалифицировать только как вторичный превентивный подход (вставка 1). Таким образом, детей необходимо вакцинировать вскоре после рождения, чтобы выработать блокирующий аллерген-специфический ответ IgG и предотвратить аллергическую сенсибилизацию.В случае профилактических вакцин против инфекционных заболеваний цель состоит в том, чтобы установить особую память В-клеток, которая активируется при инфицировании и будет защищать в идеале на протяжении всей жизни. Что касается аллергии, цель состоит в том, чтобы предотвратить аллергическую сенсибилизацию, которая, согласно когортным исследованиям при рождении, происходит только в раннем детстве, тогда как контакт аллергена в более позднем возрасте не вызывает аллергической сенсибилизации. Поэтому не представляется важным генерировать память В-клеток, которая может быть активирована при контакте с аллергеном в более позднем возрасте, но поддерживать высокий уровень защитных аллерген-специфических антител в раннем возрасте, когда возникает аллергическая сенсибилизация.
Вставка 1. Определения, относящиеся к подходам к вакцинации против аллергии.
Терапевтическая вакцинация: аллерген-специфическая иммунотерапия (АИТ)
SCIT: Подкожная аллергенспецифическая иммунотерапия
SLIT: Сублингвальная аллергенспецифическая иммунотерапия
Вторичная профилактика: предотвращение прогрессирования легких симптомов в тяжелое заболевание
Вторичная профилактика: предотвращение прогрессирования клинически бессознательной сенсибилизации к симптомам
Первичная профилактика: предотвращение сенсибилизации IgE
Рекомбинантная пептидная вакцина от аллергии: рекомбинантная вакцина от аллергии, состоящая из молекулы-носителя, не являющейся производной аллергена, и неаллергенных пептидов, полученных из участков связывания IgE аллергена.
Хотя существуют доказательства генетической предрасположенности к сенсибилизации к определенным молекулам аллергена в зависимости от фона HLA (9, 65), в настоящее время нет окончательных маркеров, которые позволили бы безопасно определить детей, которые подвержены риску сенсибилизации к определенным аллергенам. аллерген. Соответственно, не будет возможности отбирать детей для исследования принципа первичной профилактической вакцинации. Тем не менее, исследование необходимо будет проводить в группах населения, в которых широко распространены определенные аллергии, как это было описано для вакцинации матерей.В таком доказательном исследовании дети будут получать вскоре после рождения курс вакцинации вакцинами-носителями пептидов на основе В-клеточных эпитопов, предназначенными для аллергенов, которые широко распространены в популяции, для создания ответа антител, блокирующих аллерген-специфический IgG ( Рисунок 4B). Этот ответ IgG должен поддерживаться бустерными инъекциями в течение ~ 3 лет, что является предпочтительным временем для исследований AIT для создания устойчивых ответов IgG. Исследование должно включать группу плацебо, получающую только адъювант, и поэтому должно быть спланировано как двойное слепое плацебо-контролируемое исследование (таблица 2).В течение 3 лет вакцинации и в течение периода наблюдения от ~ 2 до 3 лет после этого дети будут находиться под наблюдением для изучения развития сенсибилизации IgE и аллергических симптомов, а также для мониторинга аллерген-специфических реакций антител IgG в дополнение к тщательной оценке безопасности ( Таблица 2).
аллерген. Соответственно, не будет возможности отбирать детей для исследования принципа первичной профилактической вакцинации. Тем не менее, исследование необходимо будет проводить в группах населения, в которых широко распространены определенные аллергии, как это было описано для вакцинации матерей.В таком доказательном исследовании дети будут получать вскоре после рождения курс вакцинации вакцинами-носителями пептидов на основе В-клеточных эпитопов, предназначенными для аллергенов, которые широко распространены в популяции, для создания ответа антител, блокирующих аллерген-специфический IgG ( Рисунок 4B). Этот ответ IgG должен поддерживаться бустерными инъекциями в течение ~ 3 лет, что является предпочтительным временем для исследований AIT для создания устойчивых ответов IgG. Исследование должно включать группу плацебо, получающую только адъювант, и поэтому должно быть спланировано как двойное слепое плацебо-контролируемое исследование (таблица 2).В течение 3 лет вакцинации и в течение периода наблюдения от ~ 2 до 3 лет после этого дети будут находиться под наблюдением для изучения развития сенсибилизации IgE и аллергических симптомов, а также для мониторинга аллерген-специфических реакций антител IgG в дополнение к тщательной оценке безопасности ( Таблица 2). В идеале исследование показало бы, что первичная профилактическая вакцинация детей безопасна, индуцирует аллерген-специфический IgG-блокирующий ответ антител и, в частности, предотвращает аллергическую сенсибилизацию.
В идеале исследование показало бы, что первичная профилактическая вакцинация детей безопасна, индуцирует аллерген-специфический IgG-блокирующий ответ антител и, в частности, предотвращает аллергическую сенсибилизацию.
Возможный путь к профилактической вакцинации против аллергенов
На рисунке 5 мы предлагаем возможный путь к профилактической вакцинации молекулярными вакцинами против аллергии, который включает различные шаги для обеспечения безопасности и демонстрации осуществимости.Мы утверждаем, что молекулярные вакцины против аллергии, которые рассматриваются для профилактической вакцинации, должны первоначально оцениваться в терапевтических исследованиях АИТ у пациентов с аллергией (рис. 5, этап 0). Такие исследования предоставят информацию относительно безопасности этих вакцин для пациентов с аллергией, и можно будет оценить, индуцируют ли вакцины желаемые аллерген-специфические блокирующие ответы IgG с низким или нулевым усилением аллергенспецифических ответов IgE. Кроме того, можно определить, действительно ли аллерген-специфические антитела IgG блокируют связывание IgE пациентов с аллергией с аллергенами и обеспечивают положительный клинический эффект.
Кроме того, можно определить, действительно ли аллерген-специфические антитела IgG блокируют связывание IgE пациентов с аллергией с аллергенами и обеспечивают положительный клинический эффект.
На следующем или параллельном этапе терапевтического АИТ вакцины следует оценить в клинических исследованиях на неаллергических взрослых субъектах, чтобы выяснить, безопасна ли вакцина и для неаллергических пациентов. В частности, необходимо изучить, вызывает ли вакцина какую-либо соответствующую аллергическую сенсибилизацию, как это было сделано в недавно опубликованном исследовании (52) (рис. 5, шаг 1, таблица 2). Аллерген-специфические антитела IgG будут проверяться на их способность блокировать связывание IgE пациентов с аллергией с аллергеном, а кинетика их индукции, их уровни и продолжительность их сохранения будут проанализированы для облегчения планирования профилактических исследований.
После этапов 0 и 1 должны быть доступны данные для планирования вторичных профилактических исследований, которые, как предполагается, должны изучить, может ли вакцинация предотвратить прогрессирование клинически бессознательной сенсибилизации IgE к аллергическим симптомам и / или прогрессирование легких симптомов, таких как ринит, в тяжелые. например, астма. Эти исследования извлекут большую пользу из опыта, накопленного в терапевтических исследованиях AIT, поскольку они представляют собой логическое продолжение терапевтических исследований. Фактически, вполне вероятно, что вторичная профилактика будет намного более безопасной и эффективной, чем терапевтическая АИТ, поскольку эти подходы предотвратят возникновение тяжелых аллергических симптомов.Таким образом, следует учитывать, что будет намного труднее лечить субъектов, страдающих аллергией, с уже существующими тяжелыми аллергическими симптомами, чем пациентов без симптомов или с легкими симптомами, поскольку побочные эффекты могут быть гораздо реже, если они вообще возникают, в последней группе субъектов. Данные исследований, анализирующих вакцинацию субъектов, не страдающих аллергией, будут информировать о способности вакцин к сенсибилизации IgE и, следовательно, предоставят важную информацию для вторичных профилактических подходов, поскольку любое усиление ответов IgE у субъектов с чувствительностью к IgE без клинических симптомов или у субъектов с легкой аллергией будет быть непреднамеренным.
например, астма. Эти исследования извлекут большую пользу из опыта, накопленного в терапевтических исследованиях AIT, поскольку они представляют собой логическое продолжение терапевтических исследований. Фактически, вполне вероятно, что вторичная профилактика будет намного более безопасной и эффективной, чем терапевтическая АИТ, поскольку эти подходы предотвратят возникновение тяжелых аллергических симптомов.Таким образом, следует учитывать, что будет намного труднее лечить субъектов, страдающих аллергией, с уже существующими тяжелыми аллергическими симптомами, чем пациентов без симптомов или с легкими симптомами, поскольку побочные эффекты могут быть гораздо реже, если они вообще возникают, в последней группе субъектов. Данные исследований, анализирующих вакцинацию субъектов, не страдающих аллергией, будут информировать о способности вакцин к сенсибилизации IgE и, следовательно, предоставят важную информацию для вторичных профилактических подходов, поскольку любое усиление ответов IgE у субъектов с чувствительностью к IgE без клинических симптомов или у субъектов с легкой аллергией будет быть непреднамеренным.
Кроме того, шаги 0 и 1 будут важными предпосылками для первичной вакцинации матери, поскольку вакцинация матери будет проводиться в конечном итоге у матерей, страдающих аллергией или несенсибилизированных. Что касается вакцинации матерей с аллергией, важно, чтобы безопасность вакцины для пациентов с аллергией была продемонстрирована в исследованиях AIT, тогда как для вакцинации матерей, не страдающих аллергией, важно знать, что вакцина не вызывает соответствующей аллергической сенсибилизации.
Поскольку ранняя постнатальная аллерген-специфическая вакцинация несенсибилизированных детей включает очень маленьких детей и требует опыта работы с предполагаемой вакциной в отношении безопасности и отсутствия сенсибилизирующей способности, мы предлагаем рассматривать ее как последний шаг (т. Е. Шаг 3) после терапевтических исследований AIT ( шаг 0), вакцинация взрослых, не страдающих аллергией (шаг 1), вторичная профилактическая вакцинация детей (шаг 2) или вакцинация матери (шаг 2) (рисунок 5, таблица 2). В идеале первичная профилактическая вакцинация от аллергии может быть уже достигнута путем вакцинации матери, что снизит потребность в ранней послеродовой профилактической вакцинации детей.
В идеале первичная профилактическая вакцинация от аллергии может быть уже достигнута путем вакцинации матери, что снизит потребность в ранней послеродовой профилактической вакцинации детей.
Указанный путь к профилактической вакцинации (рис. 5, таблица 2) можно ускорить за счет использования современных молекулярных противоаллергических вакцин, если они будут протестированы на несколько важных аллергенов параллельно. Кроме того, будет полезно использовать вакцины, которые напоминают полезные свойства вакцин-носителей пептидов на основе В-клеточных эпитопов и создают защитные аллерген-специфические ответы антител IgG. Подобный механизм действия вакцин может фактически сократить количество необходимых клинических испытаний.
Важными следующими шагами будет следовать пути, описанному в таблице 2, с доступными вакцинами-носителями пептидов на основе В-клеточных эпитопов, такими как BM32, и исследовать в рамках доказательных исследований, действительно ли предложенная концепция профилактической вакцинации осуществима.
Заключение
Профилактические вакцины доступны от инфекционных заболеваний, но еще не от IgE-ассоциированной аллергии, наиболее распространенного иммунно-опосредованного заболевания гиперчувствительности. Аллерген-специфическая иммунотерапия (АИТ) — это эффективное и модифицирующее заболевание лечение аллергии.Он представляет собой терапевтическую вакцинацию, которая индуцирует аллерген-специфические антитела IgG, блокирующие распознавание IgE аллергенов и последующее аллергическое воспаление, вызванное иммунными комплексами IgE-аллерген. AIT — это экономичный и единственный способ лечения болезни с долгосрочным эффектом даже после отмены, но в настоящее время только 10% пациентов с аллергией получают лечение AIT. Широкое применение и дальнейшее развитие АИТ ограничивается низким качеством экстрактов природных аллергенов. С молекулярной характеристикой болезнетворных аллергенов были разработаны новые формы молекулярных АИТ, из которых вакцины-носители пептидов на основе В-клеточных эпитопов были оценены в нескольких клинических испытаниях, и было обнаружено, что они проявляют несколько характеристик, которые делают их возможными кандидатами для профилактических целей. вакцинация от аллергии.Мы предлагаем поэтапную оценку этих новых молекулярных вакцин против аллергии в клинических испытаниях для разработки вакцин для вторичной и первичной вакцинации против аллергии. Вторичная профилактическая вакцинация против аллергии может предотвратить развитие тяжелых аллергических симптомов у пациентов с аллергией и, таким образом, может считаться более безопасной и эффективной, чем терапевтическая вакцинация пациентов, уже страдающих тяжелыми аллергическими симптомами. Первичная профилактика аллергической сенсибилизации может быть достигнута путем вакцинации матери, вызывающей блокирование аллерген-специфических антител IgG, которые передаются через плаценту и могут предотвратить аллергическую сенсибилизацию у потомства.В качестве альтернативы можно рассмотреть возможность первичной профилактической вакцинации еще не сенсибилизированных детей в ранние сроки после рождения. Профилактическая вакцинация против аллергии с использованием современных молекулярных вакцин против аллергии может быть возможной миссией, которая обещает искоренить аллергические заболевания, аналогичные тем, которые были достигнуты в отношении инфекционных заболеваний.
вакцинация от аллергии.Мы предлагаем поэтапную оценку этих новых молекулярных вакцин против аллергии в клинических испытаниях для разработки вакцин для вторичной и первичной вакцинации против аллергии. Вторичная профилактическая вакцинация против аллергии может предотвратить развитие тяжелых аллергических симптомов у пациентов с аллергией и, таким образом, может считаться более безопасной и эффективной, чем терапевтическая вакцинация пациентов, уже страдающих тяжелыми аллергическими симптомами. Первичная профилактика аллергической сенсибилизации может быть достигнута путем вакцинации матери, вызывающей блокирование аллерген-специфических антител IgG, которые передаются через плаценту и могут предотвратить аллергическую сенсибилизацию у потомства.В качестве альтернативы можно рассмотреть возможность первичной профилактической вакцинации еще не сенсибилизированных детей в ранние сроки после рождения. Профилактическая вакцинация против аллергии с использованием современных молекулярных вакцин против аллергии может быть возможной миссией, которая обещает искоренить аллергические заболевания, аналогичные тем, которые были достигнуты в отношении инфекционных заболеваний.
Авторские взносы
RV и IT написали рукопись и разработали рисунки и таблицы. BK, RC, MC, MH, AKars, KR, AKara, MK и WP критически прочитали и отредактировали рукопись.Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Работа поддержана грантами F4605, F4609 и DK-IAI, DK-W1248 Австрийского научного фонда (FWF), Научным фондом Нижней Австрии, Russian Academic Excellence Project 5-100 и Мегагрант Правительства РФ (грант № 14.W03.31.0024). Кроме того, признано финансирование со стороны проекта Стокгольмского ALF, Шведского фонда исследований астмы и аллергии, Шведского фонда сердца и легких, Фонда рака и аллергии и Шведского исследовательского совета.
Конфликт интересов
RV получил исследовательские гранты от HVD Life Science, Вена, Австрия, и Viravaxx, Вена, Австрия, и выступает в качестве консультанта для этих компаний. MH является консультантом компании Biomay AG, Вена, Австрия. WP владеет акциями Biomay AG и получает гонорары от Novartis, Pfizer и Roche.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Рецензент AL заявил редактору о прошлом соавторстве с одним из авторов MH.
Благодарности
Авторы выражают признательность членам научных групп и групп клинических разработок, которые перенесли BM32 и его компоненты на клиническую оценку. Многолетняя поддержка Австрийского научного фонда (FWF), Biomay AG, Вена, Австрия, Ассоциации христианских доплеровских исследований, Австрия, Венского медицинского университета, Австрия, а недавно и Института иммунологии NRC ФМБА России, Москва , Россия, и Первый Московский Государственный Медицинский Университет им. И.М. Сеченова, Москва, Россия.
Сокращения
Ab, антитело; АИТ — аллергенспецифическая иммунотерапия; APC, антигенпрезентирующая клетка; GMP, Надлежащая производственная практика; ВГВ, вирус гепатита В; Ig, иммуноглобулин; ИЛ, интерлейкин; SCIT, подкожная иммунотерапия; SLIT, сублингвальная иммунотерапия; ВНП, вирусоподобные наночастицы.
Список литературы
6. Экл-Дорна Дж., Вильясала-Мерино С., Линхарт Б., Караулов А.В., Жернов Ю., Хаитов М. и др. Аллерген-специфические антитела регулируют вторичный аллерген-специфический иммунный ответ. Фронт Иммунол . (2019) 9: 3131. DOI: 10.3389 / fimmu.2018.03131
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Хофмайер С., Хатцлер Л., Рорбах А., Панетта В., Хакиме Д., Бауэр С. П. и др. «Стандартные» по сравнению с «преатопическими» реакциями IgG на молекулы белка группы 10 пищевого и воздушного происхождения, связанные с патогенезом, у сенсибилизированных березами и не страдающих атопией детей. J Allergy Clin Immunol . (2015) 135: 1367–74.e8. DOI: 10.1016 / j.jaci.2014.09.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Siroux V, Lupinek C, Resch Y, Curin M, Just J, Keil T и др. Специфические IgE и IgG, измеренные аллерген-чипом MeDALL, зависят от аллергена и пути воздействия: исследование EGEA. J Allergy Clin Immunol . (2017) 139: 643–54.e6. DOI: 10.1016 / j.jaci.2016.05.023
J Allergy Clin Immunol . (2017) 139: 643–54.e6. DOI: 10.1016 / j.jaci.2016.05.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Валента Р., Караулов А., Нидербергер В., Гаттингер П., Ван Хаге М., Фликер С. и др. Молекулярные аспекты аллергенов и аллергии. Adv. Иммунол. 138: 195–256. DOI: 10.1016 / bs.ai.2018.03.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Экл-Дорна Дж., Вильясала-Мерино С., Кэмпион Н. Дж., Бязрова М., Филатов А., Кудлай Д. и др. Отслеживание IgE-продуцирующих клеток у пациентов с аллергией. Ячейки . (2019) 8: 994. DOI: 10.3390 / Cell80
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Münchener medizinische wochenschrift / 24 июля 1906: аллергия, Клеменс против Пирке, Вена. MMW Munch Med Wochenschr . (1978) 120: 474.
Google Scholar
12. Анто Дж. М., Буске Дж., Акдис М., Оффрей С., Кейл Т., Момас И. и др. Механизмы развития аллергии (MeDALL): знакомство с новыми концепциями фенотипов аллергии. J Allergy Clin Immunol . (2017) 139: 388–99. DOI: 10.1016 / j.jaci.2016.12.940
Механизмы развития аллергии (MeDALL): знакомство с новыми концепциями фенотипов аллергии. J Allergy Clin Immunol . (2017) 139: 388–99. DOI: 10.1016 / j.jaci.2016.12.940
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Кулиг М., Бергманн Р., Клеттке У., Ван В., Таке У., Ван У.Естественное течение сенсибилизации к пищевым и ингаляционным аллергенам в течение первых 6 лет жизни. J Allergy Clin Immunol . (1999) 103: 1173–9. DOI: 10.1016 / S0091-6749 (99) 70195-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Люпинек К., Воллманн Э., Баар А., Банерджи С., Брайтенедер Х., Брокер Б.М. и др. Достижения в технологии аллерген-микрочипов для диагностики и мониторинга аллергии: аллерген-чип MeDALL. Методы . (2014) 66: 106–19.DOI: 10.1016 / j.ymeth.2013.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Bousquet J, Gern JE, Martinez FD, Anto JM, Johnson CC, Holt PG, et al. Когорты рождения больных астмой и аллергическими заболеваниями: отчет о совместном семинаре NIAID / NHLBI / MeDALL. J Allergy Clin Immunol . (2014) 133: 1535–46. DOI: 10.1016 / j.jaci.2014.01.018
Когорты рождения больных астмой и аллергическими заболеваниями: отчет о совместном семинаре NIAID / NHLBI / MeDALL. J Allergy Clin Immunol . (2014) 133: 1535–46. DOI: 10.1016 / j.jaci.2014.01.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Хацлер Л., Панетта В., Лау С., Вагнер П., Бергманн Р. Л., Илли С. и др.Молекулярное распространение и прогностическая ценность доклинического ответа IgE на phleum pratense у детей с сенной лихорадкой. J Allergy Clin Immunol . (2012) 130: 894–901.e5. DOI: 10.1016 / j.jaci.2012.05.053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Вестман М., Люпинек С., Буске Дж., Андерссон Н., Пар С., Баар А. и др. Реактивность IgE в раннем детстве к белкам класса 10, связанным с патогенезом, позволяет прогнозировать аллергический ринит в подростковом возрасте. J Allergy Clin Immunol .(2015) 135: 1199–206.e11. DOI: 10.1016 / j.jaci.2014.10.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Кустович А., Зоннтаг Х.-Дж., Бьюкен И.Е., Белгрейв Д., Симпсон А., Проспери MCF. Пути эволюции IgE-ответов на аллергены травы и клещей в детстве. J Allergy Clin Immunol . (2015) 136: 1645–52.e8. DOI: 10.1016 / j.jaci.2015.03.041
Кустович А., Зоннтаг Х.-Дж., Бьюкен И.Е., Белгрейв Д., Симпсон А., Проспери MCF. Пути эволюции IgE-ответов на аллергены травы и клещей в детстве. J Allergy Clin Immunol . (2015) 136: 1645–52.e8. DOI: 10.1016 / j.jaci.2015.03.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Posa D, Perna S, Resch Y, Lupinek C, Panetta V, Hofmaier S, et al.Эволюция и прогностическая ценность ответов IgE в отношении комплексной панели аллергенов клещей домашней пыли в течение первых двух десятилетий жизни. J Allergy Clin Immunol . (2017) 139: 541–9.e8. DOI: 10.1016 / j.jaci.2016.08.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Асарной А., Хамстен К., Ваден К., Люпинек С., Андерссон Н., Кулл И. и др. Сенсибилизация к молекулам аллергенов кошек и собак в детстве и прогнозирование симптомов аллергии кошек и собак в подростковом возрасте: исследование BAMSE / MeDALL. J Allergy Clin Immunol . (2016) 137: 813–21.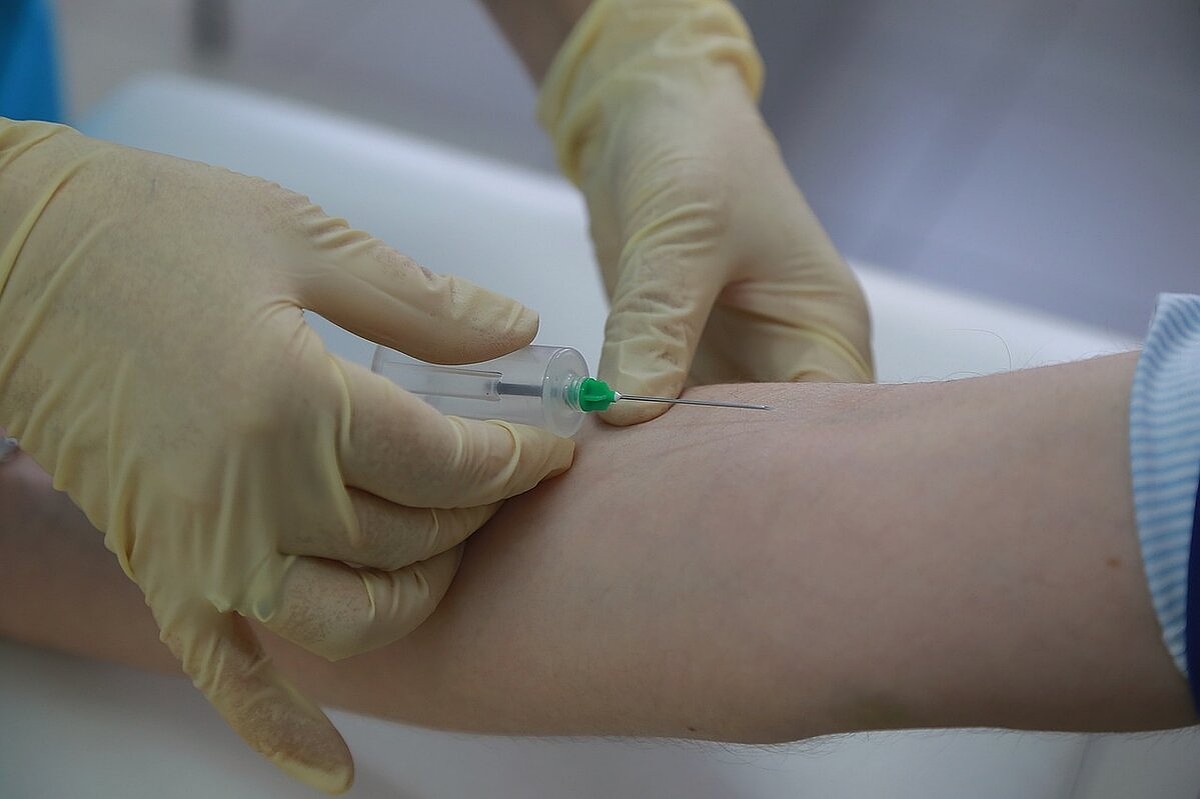 e7. DOI: 10.1016 / j.jaci.2015.09.052
e7. DOI: 10.1016 / j.jaci.2015.09.052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Асарной А., Хамстен С., Люпинек С., Мелен Э., Андерссон Н., Анто Дж. М. и др. Прогнозирование аллергии на арахис в подростковом возрасте с помощью сигнатур IgE, специфичных к запасным белкам в раннем детстве: популяционная когорта новорожденных BAMSE. J Allergy Clin Immunol . (2017) 140: 587–90.e7. DOI: 10.1016 / j.jaci.2016.12.973
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22.Викман М., Люпинек С., Андерссон Н., Белгрейв Д., Асарной А., Бенет М. и др. Обнаружение реактивности IgE к небольшому количеству молекул аллергена в раннем детстве позволяет прогнозировать респираторную аллергию в подростковом возрасте. ЕБиоМед . (2017) 26: 91–9. DOI: 10.1016 / j.ebiom.2017.11.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Вестман М., Оберг К., Апостолович Д., Люпинек С., Гаттингер П. , Миттерманн И., Андерссон Н. и др. Сенсибилизация к молекулам аллергенов пыльцы трав в когорте рождения — Phl p 4 как ранний индикатор аллергии на пыльцу трав. J Allergy Clin Immunol . (2020) 145: 1174–81.e6. DOI: 10.1016 / j.jaci.2020.01.006
, Миттерманн И., Андерссон Н. и др. Сенсибилизация к молекулам аллергенов пыльцы трав в когорте рождения — Phl p 4 как ранний индикатор аллергии на пыльцу трав. J Allergy Clin Immunol . (2020) 145: 1174–81.e6. DOI: 10.1016 / j.jaci.2020.01.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Вестман М., Асарной А., Хамстен С., Викман М., ван Хаге М. Окна возможностей для индукции толерантности к аллергии путем изучения эволюции аллергической сенсибилизации в когортах рождения. Семин Иммунол . (2017) 30: 61–6. DOI: 10.1016 / j.smim.2017.07.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25.Lupinek C, Marth K, Niederberger V, Valenta R. Анализ профилей реактивности сывороточного IgE с микрочипами аллергенов указывает на отсутствие сенсибилизации de novo IgE у взрослых. J Allergy Clin Immunol . (2012) 130: 1418–20.e4. DOI: 10.1016 / j.jaci.2012.06.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.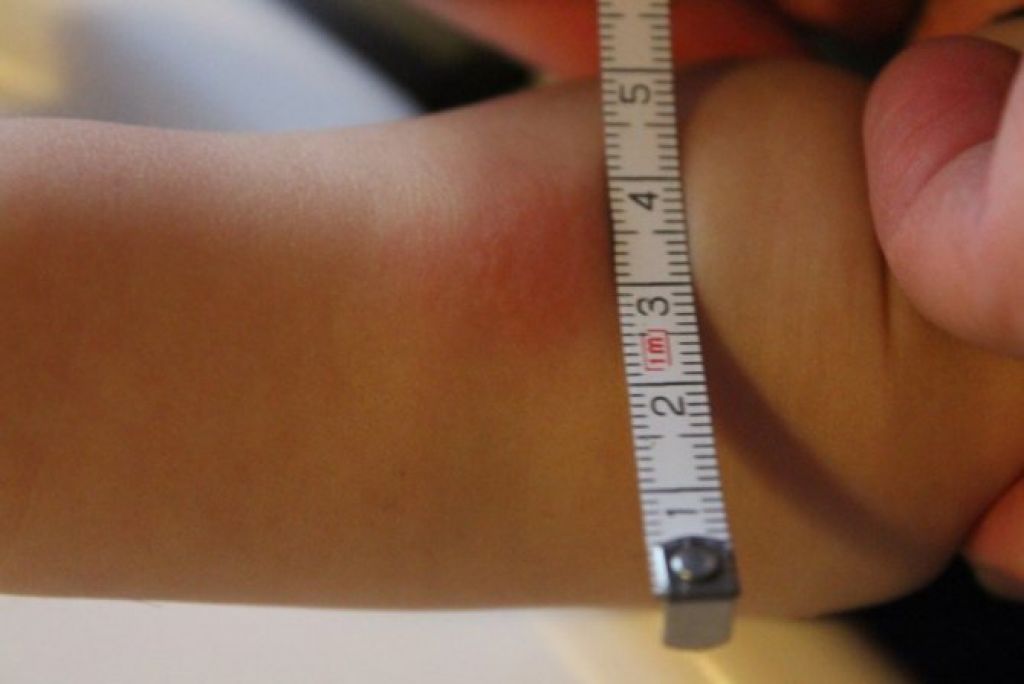 Люпинек С., Хохваллнер Х., Йоханссон С., Ми А., Риглер Е., Шейниус А. и др. Материнский аллерген-специфический IgG может защитить ребенка от аллергической сенсибилизации. J Allergy Clin Immunol . (2019) 144: 536–48. DOI: 10.1016 / j.jaci.2018.11.051
Люпинек С., Хохваллнер Х., Йоханссон С., Ми А., Риглер Е., Шейниус А. и др. Материнский аллерген-специфический IgG может защитить ребенка от аллергической сенсибилизации. J Allergy Clin Immunol . (2019) 144: 536–48. DOI: 10.1016 / j.jaci.2018.11.051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Данбар WP. Weiterer beitrag zur ursache und spezifischen heilung des heufiebers. DMW Dtsch Med Wochenschr . (1903) 29: 149–52. DOI: 10.1055 / с-0028-1138323
CrossRef Полный текст | Google Scholar
30. Дорофеева Ю., Шиловский И., Тулаева И., Фокке-Тейкл М., Фликер С., Кудлай Д. и др. Прошлое, наличие и будущее иммунотерапевтических вакцин против аллергенов. Аллергия . (2020) 1–19. DOI: 10.1111 / all.14300
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Кук Р.А., Барнард Дж. Х., Хебальд С., Стулл А. Серологические доказательства иммунитета с сопутствующей сенсибилизацией при типе аллергии у человека (сенная лихорадка). J Exp Med . (1935) 62: 733–50. DOI: 10.1084 / jem.62.6.733
J Exp Med . (1935) 62: 733–50. DOI: 10.1084 / jem.62.6.733
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Оренго Дж. М., Радин А. Р., Камат В., Бадите А., Бен Л. Х., Беннет Б. Л. и др.Лечение аллергии на кошек с помощью моноклональных антител IgG, которые связывают аллерген и предотвращают взаимодействие IgE. Нац Коммуна . (2018) 9: 1421. DOI: 10.1038 / s41467-018-03636-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Shamji MH, Durham SR. Механизмы аллергенной иммунотерапии вдыхаемых аллергенов и прогностических биомаркеров. J Allergy Clin Immunol . (2017) 140: 1485–98. DOI: 10.1016 / j.jaci.2017.10.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34.Валентина Р., Караулов А., Нидербергер В., Жернов Ю., Елисютина О., Кампана Р. и др. Экстракты аллергенов для in vivo Диагностика и лечение аллергии: есть ли будущее? J Allergy Clin Immunol Pract . (2018) 6: 1845–55.e2. DOI: 10.1016 / j.jaip.2018.08.032
(2018) 6: 1845–55.e2. DOI: 10.1016 / j.jaip.2018.08.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Mothes N, Heinzkill M, Drachenberg KJ, Sperr WR, Krauth MT, Majlesi Y, et al. Аллерген-специфическая иммунотерапия вакциной с адъювантом монофосфориллипид а: снижение сезонно усиленного производства иммуноглобулина Е и ингибирование высвобождения базофильного гистамина с помощью блокирующих антител, индуцированных терапией. Clin Exp Allergy . (2003) 33: 1198–208. DOI: 10.1046 / j.1365-2222.2003.01699.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Чен К. В., Зиглмайер П., Зиглмайер Р., Лемелл П., Хорак Ф., Буну С. П. и др. Отбор пациентов с аллергией на клещей домашней пыли с помощью молекулярной диагностики может повысить эффективность специфической иммунотерапии. J Allergy Clin Immunol . (2019) 143: 1248–52.e12. DOI: 10.1016 / j.jaci.2018.10.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Winther L, Arnved J, Malling H-J, Nolte H, Mosbech H. Побочные эффекты аллерген-специфической иммунотерапии: проспективное многоцентровое исследование. Clin Exp Allergy . (2006) 36: 254–60. DOI: 10.1111 / j.1365-2222.2006.02340.x
Winther L, Arnved J, Malling H-J, Nolte H, Mosbech H. Побочные эффекты аллерген-специфической иммунотерапии: проспективное многоцентровое исследование. Clin Exp Allergy . (2006) 36: 254–60. DOI: 10.1111 / j.1365-2222.2006.02340.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Фокке М., Свобода И., Март К., Валента Р. Развитие аллерген-специфической иммунотерапии: от экстрактов аллергенов до вакцин против аллергии в обход аллерген-специфического иммуноглобулина Е и реактивности Т-клеток. Clin Exp Allergy . (2010) 40: 385–97. DOI: 10.1111 / j.1365-2222.2009.03443.x
CrossRef Полный текст | Google Scholar
39. Киль М.А., Рёдер Э., Герт ван Вейк Р., Аль М.Дж., Хоп В.С.Дж., Руттен-ван Мёлькен МПМХ. Реальная приверженность и настойчивость среди пользователей подкожной и сублингвальной иммунотерапии аллергенами. J Allergy Clin Immunol . (2013) 132: 353–60.e2. DOI: 10.1016 / j.jaci.2013.03.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Курин М., Хаитов М., Караулов А., Намазова-Баранова Л., Кампана Р., Гариб В. и др. Следующее поколение аллерген-специфической иммунотерапии: молекулярные подходы. Curr Allergy Asthma Rep . (2018) 18:39. DOI: 10.1007 / s11882-018-0790-x
Курин М., Хаитов М., Караулов А., Намазова-Баранова Л., Кампана Р., Гариб В. и др. Следующее поколение аллерген-специфической иммунотерапии: молекулярные подходы. Curr Allergy Asthma Rep . (2018) 18:39. DOI: 10.1007 / s11882-018-0790-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Жернов Ю., Курин М., Хаитов М., Караулов А., Валента Р. Рекомбинантные аллергены для иммунотерапии: современное состояние. Curr Opin Allergy Clin Immunol . (2019) 19: 402–414.DOI: 10.1097 / ACI.0000000000000536
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Валента Р., Феррейра Ф., Фокке-Тейкл М., Линхарт Б., Нидербергер В., Свобода И. и др. От генов аллергенов до вакцин против аллергии. Анну Рев Иммунол . (2010) 28: 211–41. DOI: 10.1146 / аннурев-иммунол-030409-101218
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Jutel M, Jaeger L, Suck R, Meyer H, Fiebig H, Cromwell O. Аллерген-специфическая иммунотерапия с рекомбинантными аллергенами пыльцы трав.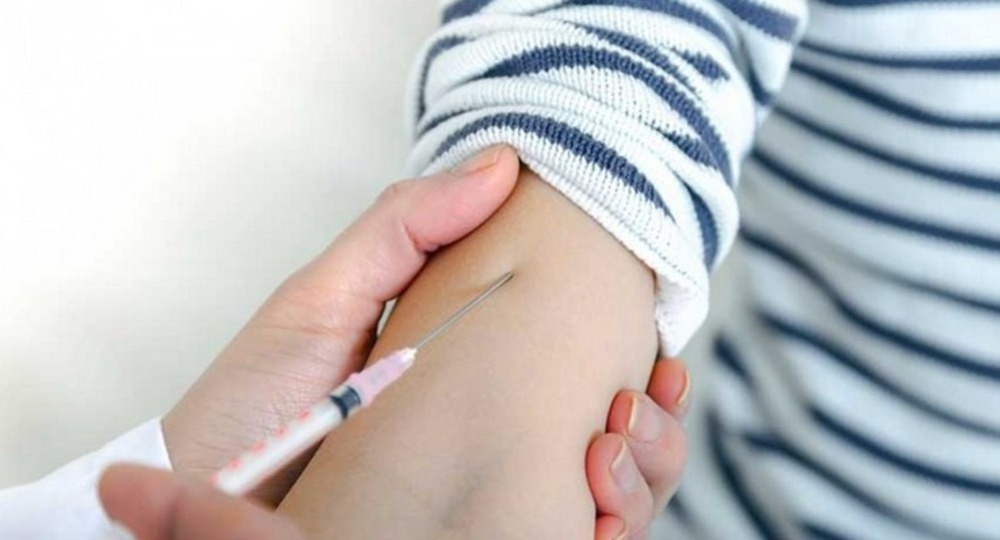 J Allergy Clin Immunol . (2005) 116: 608–13. DOI: 10.1016 / j.jaci.2005.06.004
J Allergy Clin Immunol . (2005) 116: 608–13. DOI: 10.1016 / j.jaci.2005.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Паули Г., Ларсен Т.Х., Рак С., Хорак Ф., Пасторелло Э., Валента Р. и др. Эффективность вакцины рекомбинантной пыльцы березы для лечения аллергического риноконъюнктивита березы. J Allergy Clin Immunol . (2008) 122: 951–60. DOI: 10.1016 / j.jaci.2008.09.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Мёллер С., Дреборг С., Фердуси Х.А., Халкен С., Хёст А., Якобсен Л. и др. Иммунотерапия пыльцой снижает развитие астмы у детей с сезонным риноконъюнктивитом (исследование PAT). J Allergy Clin Immunol . (2002) 109: 251–6. DOI: 10.1067 / mai.2002.121317
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Холт П.Г., Слай П.Д., Сэмпсон Х.А., Робинсон П., Ло Р., Ловенштейн Х. и др. Профилактическое использование сублингвальной иммунотерапии аллергенами у детей из группы высокого риска: пилотное исследование. J Allergy Clin Immunol . (2013) 132: 991–3.e1. DOI: 10.1016 / j.jaci.2013.04.049
J Allergy Clin Immunol . (2013) 132: 991–3.e1. DOI: 10.1016 / j.jaci.2013.04.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Сепфалузи З., Баннерт С., Ронсери Л., Майер Э., Хасслер М., Виссманн Э. и др. Профилактическая сублингвальная иммунотерапия у детей дошкольного возраста: первые доказательства безопасности и протолерогенных эффектов. Педиатр Аллергии Иммунол . (2014) 25: 788–95. DOI: 10.1111 / pai.12310
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48.Durham SR, Yang WH, Pedersen MR, Johansen N, Rak S. Сублингвальная иммунотерапия с использованием таблеток аллергена травы один раз в день: рандомизированное контролируемое исследование сезонного аллергического риноконъюнктивита. J Allergy Clin Immunol . (2006) 117: 802–9. DOI: 10.1016 / j.jaci.2005.12.1358
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Линхарт Б., Валента Р. Механизмы, лежащие в основе вакцинации против аллергии рекомбинантными гипоаллергенными производными аллергена. Вакцина .(2012) 30: 4328–35. DOI: 10.1016 / j.vaccine.2011.11.011
Вакцина .(2012) 30: 4328–35. DOI: 10.1016 / j.vaccine.2011.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Нидербергер В., Хорак Ф., Вртала С., Шпицауэр С., Краут М.-Т, Валент П. и др. Вакцинация генетически модифицированными аллергенами предотвращает прогрессирование аллергического заболевания. Proc Natl Acad Sci USA . (2004) 101: 14677–82. DOI: 10.1073 / pnas.0404735101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Кампана Р., Мориц К., Март К., Нойбауэр А., Хубер Н., Хеннинг Р. и др.Частое возникновение поздних реакций, опосредованных Т-клетками, выявленных при тестировании на атопические пластыри с гипоаллергенными фрагментами rBet v 1. J Allergy Clin Immunol . (2016) 137: 601–9.e8. DOI: 10.1016 / j.jaci.2015.08.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Кампана Р., Март К., Зиглмайер П., Вебер М., Лупинек С., Жернов Ю. и др. Вакцинация неаллергенных лиц рекомбинантными гипоаллергенными фрагментами аллергена пыльцы березы Bet v 1: безопасность, эффекты и механизмы. J Allergy Clin Immunol . (2019) 143: 1258–61. DOI: 10.1016 / j.jaci.2018.11.011
J Allergy Clin Immunol . (2019) 143: 1258–61. DOI: 10.1016 / j.jaci.2018.11.011
CrossRef Полный текст | Google Scholar
54. Haselden BM, Barry Kay A, Larché M. Иммуноглобулин E — независимый главный комплекс гистосовместимости — ограниченный Т-клеточным пептидным эпитопом — индуцированные поздние астматические реакции. J Exp Med . (1999) 189: 1885–94. DOI: 10.1084 / jem.189.12.1885
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Кэмпбелл Д.Д., Бакленд К.Ф., Макмиллан С.Дж., Кирли Дж., Олдфилд В.Л.Г., Стерн Л.Дж. и др.Пептидная иммунотерапия при аллергической астме генерирует IL-10-зависимую иммунологическую толерантность, связанную с супрессией связанных эпитопов. J Exp Med . (2009) 206: 1535–47. DOI: 10.1084 / jem.20082901
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Кампана Р., Хуанг Х. Дж., Фрейдл Р., Линхарт Б., Вртала С., Векерле Т. и др. Подходы на основе рекомбинантных аллергенов и пептидов для профилактики аллергии путем пероральной переносимости.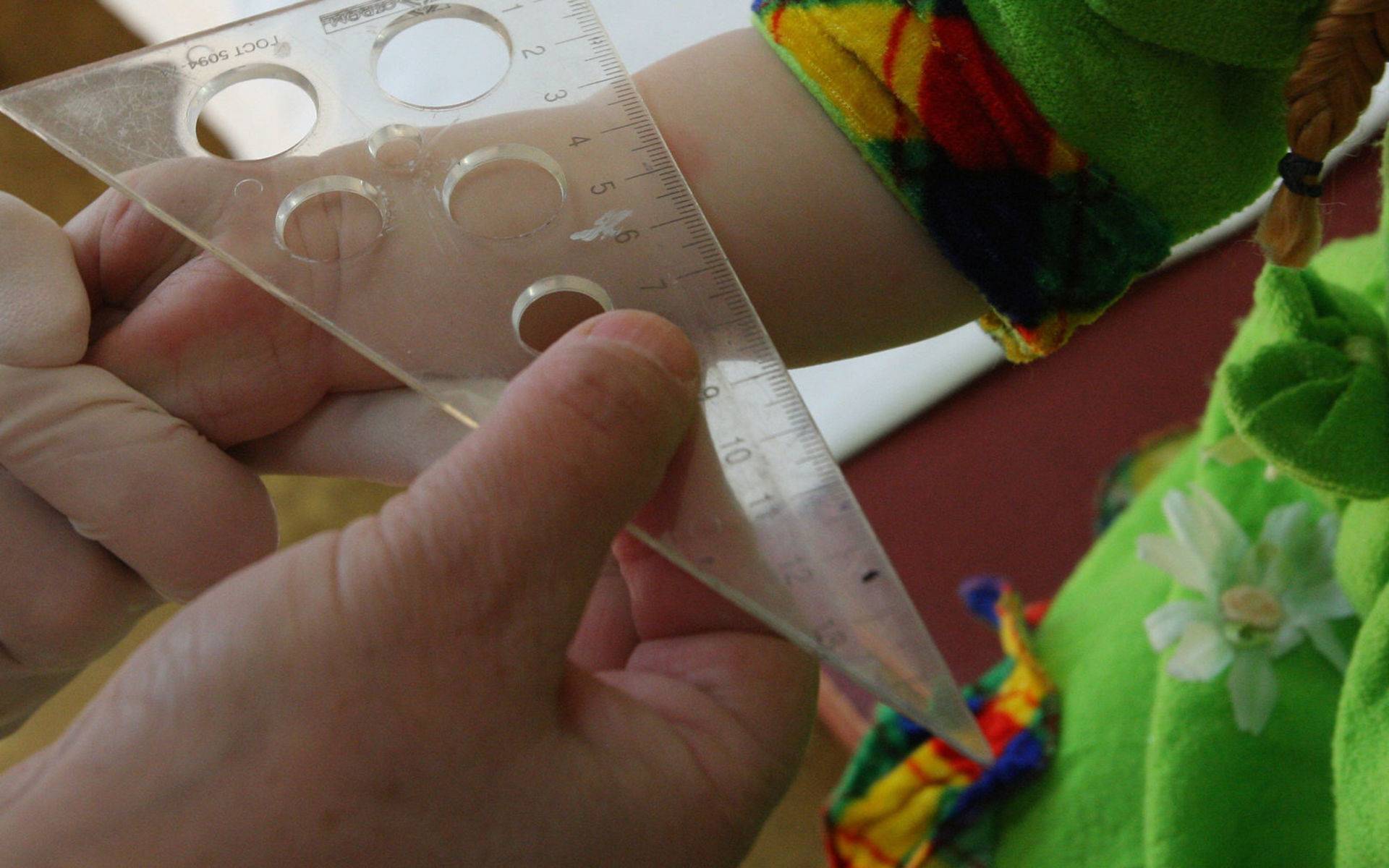 Семин Иммунол . (2017) 30: 67–80.DOI: 10.1016 / j.smim.2017.08.017
Семин Иммунол . (2017) 30: 67–80.DOI: 10.1016 / j.smim.2017.08.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Schmitz N, Dietmeier K, Bauer M, Maudrich M, Utzinger S, Muntwiler S, et al. Отображение Fel d1 на вирусоподобных частицах предотвращает реактогенность, несмотря на значительно повышенную иммуногенность: новый метод лечения аллергии на кошек. J Exp Med . (2009) 206: 1941–55. DOI: 10.1084 / jem.200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Сторни Ф., Зелтинс А., Балке И., Хит М.Д., Крамер М.Ф., Скиннер М.А. и др.Вакцина против аллергии на арахис на основе искусственно созданных вирусоподобных частиц, содержащих отдельные основные аллергены арахиса. J Allergy Clin Immunol . (2019) 145: 1240–53.e3. DOI: 10.1016 / j.jaci.2019.12.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Engeroff P, Caviezel F, Storni F, Thoms F, Vogel M, Bachmann MF. Аллергены, отображаемые на вирусоподобных частицах, обладают высокой иммуногенностью, но не могут активировать тучные клетки человека. Аллергия . (2018) 73: 341–9.DOI: 10.1111 / all.13268
Аллергены, отображаемые на вирусоподобных частицах, обладают высокой иммуногенностью, но не могут активировать тучные клетки человека. Аллергия . (2018) 73: 341–9.DOI: 10.1111 / all.13268
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Сунгрунг Т., Монгкорнтаньатип К., Пипим Т., Джиттамстапорн С., Питакполрат П., Кеваматавонг Т. и др. Вирусоподобные частицы, отображающие основной аллерген HDM Der p 2, для профилактической иммунотерапии аллергеном. Аллергия . (2020) 75: 1232–6. DOI: 10.1111 / all.14096
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Kündig TM, Senti G, Schnetzler G, Wolf C, Prinz Vavricka BM, Fulurija A, et al.Пептид Der p 1 на вирусоподобных частицах безопасен и обладает высокой иммуногенностью для здоровых взрослых. J Allergy Clin Immunol . (2006) 117: 1470–6. DOI: 10.1016 / j.jaci.2006.01.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62.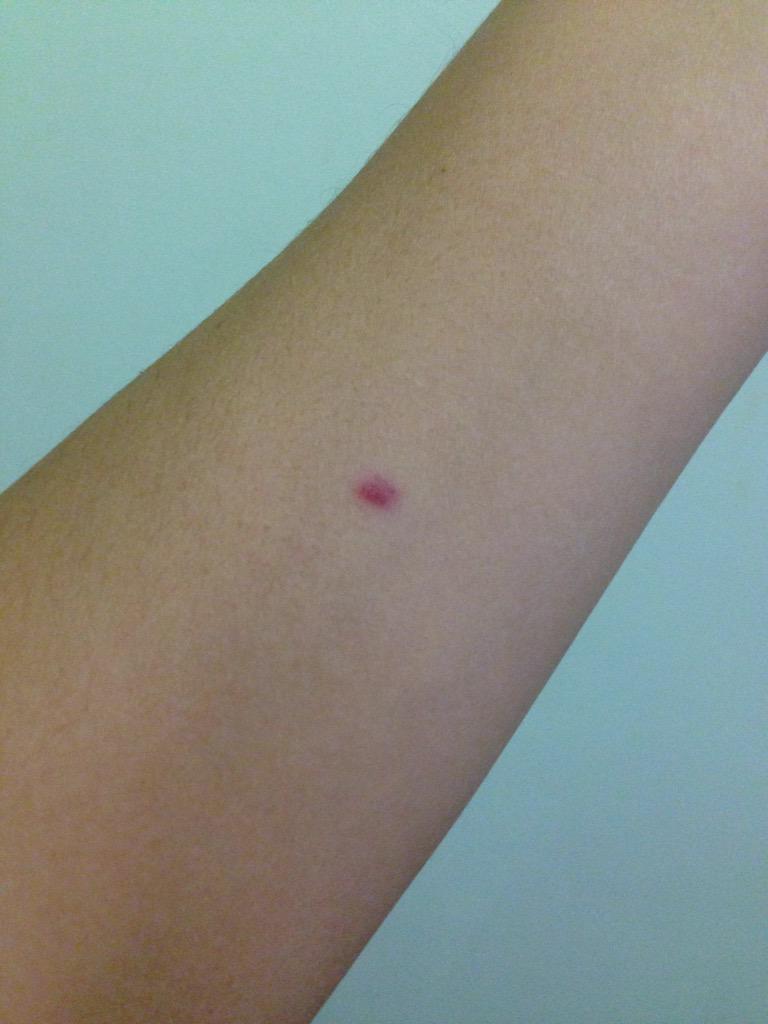 Kueng HJ, Manta C., Haiderer D, Leb VM, Schmetterer KG, Neunkirchner A, et al. Флуоросомы: удобный новый реагент для обнаружения и блокирования поливалентных и сложных взаимодействий рецептор-лиганд. FASEB J . (2010) 24: 1572–82. DOI: 10.1096 / fj.09-137281
Kueng HJ, Manta C., Haiderer D, Leb VM, Schmetterer KG, Neunkirchner A, et al. Флуоросомы: удобный новый реагент для обнаружения и блокирования поливалентных и сложных взаимодействий рецептор-лиганд. FASEB J . (2010) 24: 1572–82. DOI: 10.1096 / fj.09-137281
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Дердак С.В., Куенг Х.Дж., Леб В.М., Нойнкирхнер А., Шметтерер К.Г., Билек Э. и др. Прямая стимуляция Т-лимфоцитов иммуносомами: вирусоподобные частицы, украшенные Т-клеточным рецептором / лигандами CD3 плюс костимулирующие молекулы. Proc Natl Acad Sci USA . (2006) 103: 13144–9. DOI: 10.1073 / pnas.0602283103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64.Кратцер Б., Хофер С., Забель М., Пикл В.Ф. Все мелочи: как вирусоподобные частицы и липосомы модулируют аллергические иммунные реакции. евро J Immunol . (2020) 50: 17–32. DOI: 10.1002 / eji.201847810
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Нойнкирхнер А., Крацер Б., Кёлер С., Смоле Ю., Магер Л. Ф., Шметтерер К. Г. и др. Генетическое ограничение презентации антигена вызывает аллергическую сенсибилизацию и заболевание у гуманизированных мышей. EBioMedicine .(2018) 31: 66–78. DOI: 10.1016 / j.ebiom.2018.04.001
Нойнкирхнер А., Крацер Б., Кёлер С., Смоле Ю., Магер Л. Ф., Шметтерер К. Г. и др. Генетическое ограничение презентации антигена вызывает аллергическую сенсибилизацию и заболевание у гуманизированных мышей. EBioMedicine .(2018) 31: 66–78. DOI: 10.1016 / j.ebiom.2018.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Крацер Б., Келер С., Хофер С., Смоле Ю., Трапин Д., Итурри Дж. И др. Предотвращение аллергии с помощью вирусоподобных наночастиц (VNP), доставляющих экранированные версии основных аллергенов в гуманизированной модели мышиной аллергии. Аллергия . (2019) 74: 246–60. DOI: 10.1111 / all.13573
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Valenta R, Campana R, Focke-Tejkl M, Niederberger V.Разработка вакцины для аллерген-специфической иммунотерапии на основе рекомбинантных аллергенов и синтетических пептидов аллергенов: уроки прошлого и новые механизмы действия на будущее. J Allergy Clin Immunol . (2016) 137: 351–7. DOI: 10.1016 / j.jaci.2015.12.1299
(2016) 137: 351–7. DOI: 10.1016 / j.jaci.2015.12.1299
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Эдлмайр Дж., Несподзиана К., Линхарт Б., Фокке-Тейкл М., Вестритшниг К., Шайблхофер С. и др. Комбинированная вакцина против аллергии и риновирусных инфекций на основе поверхностного белка VP1, производного от риновируса, и неаллергенного пептида основного аллергена пыльцы тимофеевки Phl p 1. Дж Иммунол . (2009) 182: 6298–306. DOI: 10.4049 / jimmunol.0713622
CrossRef Полный текст | Google Scholar
70. Эдлмайр Дж., Несподзиана К., Фокке-Тейкл М., Линхарт Б., Валента Р. Аллерген-специфическая иммунотерапия: к комбинированным вакцинам от аллергических и инфекционных заболеваний, Curr Topics Microbiol Immunol. (2011) 352: 121–140. DOI: 10.1007 / 82_2011_130
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Банерджи С., Вебер М., Блатт К., Свобода И., Фокке-Тейкл М., Валент П. и др.Превращение der p 23, нового основного аллергена клещей домашней пыли, в гипоаллергенную вакцину. Дж Иммунол . (2014) 192: 4867–75. DOI: 10.4049 / jimmunol.1400064
Дж Иммунол . (2014) 192: 4867–75. DOI: 10.4049 / jimmunol.1400064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Март К., Брейер И., Фокке-Тейкл М., Блатт К., Шамджи М.Х., Лайхади Дж. И др. Неаллергенная вакцина против аллергии на пыльцу березы, состоящая из пептидов гепатита PreS – Fused Bet v 1, фокусирует блокировку igg по отношению к эпитопам ige и сдвигает иммунные ответы на толерогенный фенотип и фенотип Th2. Дж Иммунол . (2013) 190: 3068–78. DOI: 10.4049 / jimmunol.1202441
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Фокке-Тейкл М., Вебер М., Ниесподзиана К., Нойбауэр А., Хубер Х., Хеннинг Р. и др. Разработка и характеристика рекомбинантной гипоаллергенной пептидной вакцины против аллергии на пыльцу трав. J Allergy Clin Immunol . (2015) 135: 1207–17.e11. DOI: 10.1016 / j.jaci.2014.09.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74.Niespodziana K, Focke-Tejkl M, Linhart B, Civaj V, Blatt K, Valent P и др. Гипоаллергенная вакцина для кошек на основе пептидов, полученных из Fel d 1, слитых с PreS гепатита B. J Allergy Clin Immunol . (2011) 127: 1562–70.e6. DOI: 10.1016 / j.jaci.2011.02.004
Гипоаллергенная вакцина для кошек на основе пептидов, полученных из Fel d 1, слитых с PreS гепатита B. J Allergy Clin Immunol . (2011) 127: 1562–70.e6. DOI: 10.1016 / j.jaci.2011.02.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Вебер М., Нисподзиана К., Линхарт Б., Нойбауэр А., Хубер Н., Хеннинг Р. и др. Сравнение иммуногенности ВМ32, рекомбинантной гипоаллергенной вакцины против аллергии на пыльцу травы на основе B-клеточного эпитопа, с вакцинами на основе экстракта аллергена. J Allergy Clin Immunol . (2017) 140: 1433–6.e6. DOI: 10.1016 / j.jaci.2017.03.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Нидербергер В., Март К., Экл-Дорна Дж., Фокке-Тейкл М., Вебер М., Хеммер В. и др. Оценка кожных тестов новой вакцины на основе пептидного носителя, BM32, у пациентов с аллергией на пыльцу трав. J Allergy Clin Immunol . (2015) 136: 1101–3.e8. DOI: 10.1016 / j.jaci.2015.03.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Зигльмайер П., Фокке-Тейкл М., Шмутц Р., Лемелл П., Зигльмайер Р., Вебер М. и др. Механизмы, безопасность и эффективность вакцины на основе В-клеточного эпитопа для иммунотерапии аллергии на пыльцу трав. EBioMedicine . (2016) 11: 43–57. DOI: 10.1016 / j.ebiom.2016.08.022
Зигльмайер П., Фокке-Тейкл М., Шмутц Р., Лемелл П., Зигльмайер Р., Вебер М. и др. Механизмы, безопасность и эффективность вакцины на основе В-клеточного эпитопа для иммунотерапии аллергии на пыльцу трав. EBioMedicine . (2016) 11: 43–57. DOI: 10.1016 / j.ebiom.2016.08.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Нидербергер В., Нойбауэр А., Геваерт П., Зидарн М., Ворм М., Аберер В. и др. Безопасность и эффективность иммунотерапии вакциной BM32 на основе рекомбинантного В-клеточного эпитопа на основе пыльцы трав. J Allergy Clin Immunol . (2018) 142: 497–509.e9. DOI: 10.1016 / j.jaci.2017.09.052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Раубер М.М., Мёбс С., Кампана Р., Хеннинг Р., Шульце-Дасбек М., Грин Б. и др. Иммунотерапия аллергенов вакциной BM32 на основе гипоаллергенных В-клеточных эпитопов модифицирует IL10 и IL5-секретирующие Т-клетки. Аллергия . (2019) 75: 450–3. DOI: 10.1111 / all. 13996
13996
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80.Экл-Дорна Дж., Вебер М., Станек В., Линхарт Б., Ристл Р., Уолтл Е. Е. и др. Двухлетний курс лечения рекомбинантной вакциной против аллергии на пыльцу трав BM32 вызывает постоянно увеличивающийся аллерген-специфический ответ IgG4. EBioMedicine . (2019) 50: 421–32. DOI: 10.1016 / j.ebiom.2019.11.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Корнелиус К., Шеневейс К., Георги Ф., Вебер М., Нидербергер В., Зиглмайер П. и др. Иммунотерапия вакциной против аллергии на пыльцу трав BM32 на основе PreS индуцирует ответ антител, защищающий от инфекции гепатита B. EBioMedicine . (2016) 11: 58–67. DOI: 10.1016 / j.ebiom.2016.07.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, et al. Руководство пользователя по молекулярной аллергологии EAACI. Педиатр Аллергии Иммунол . (2016) 27: 1-250. DOI: 10.1111 / pai.12563
Педиатр Аллергии Иммунол . (2016) 27: 1-250. DOI: 10.1111 / pai.12563
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Елисютина О., Феденко Е., Кампана Р., Литовкина А., Ильина Н., Кудлай Д. и др.Bet v 1-специфические уровни IgE и реактивность PR10 позволяют отличить молчащую сенсибилизацию от фенотипа аллергии на березу. Аллергия . (2019) 74: 2525–8. DOI: 10.1111 / all.13931
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Чен З-Г, Ли И-Т, Ван В. Х., Тан К., Сен Чжэн Р., Ян Л. Ф. и др. Распространение и детерминанты dermatophagoides клещей, сенсибилизирующих аллергический ринит и аллергическую астму в Китае. Int Arch Allergy Immunol .(2019) 180: 17–27. DOI: 10.1159 / 000499409
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Хуанг Х. Дж., Реш-Марат Ю., Родригес-Домингес А., Чен К. В., Кисс Р., Зиглмайер П. и др. Недооценка специфических IgE к клещам домашней пыли с помощью ImmunoCAP на основе экстракта по сравнению с молекулярными иммунными CAP.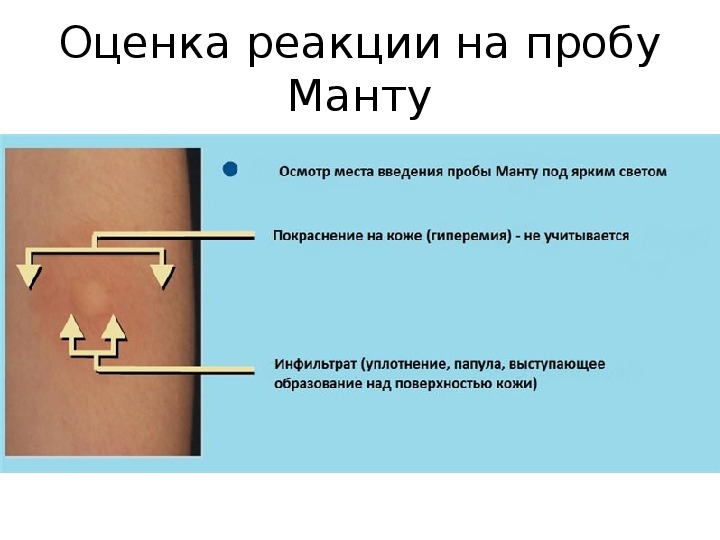 J Allergy Clin Immunol . (2018) 142: 1656–59.e9. DOI: 10.1016 / j.jaci.2018.07.010
J Allergy Clin Immunol . (2018) 142: 1656–59.e9. DOI: 10.1016 / j.jaci.2018.07.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87.Хуанг Х., Курин М., Банерджи С., Чен К., Гарматюк Т., Реш-Марат Ю. и др. Гипоаллергенная смесь пептидов, содержащая Т-клеточные эпитопы клинически значимых аллергенов клещей домашней пыли. Аллергия . (2019) 74: 2461–78. DOI: 10.1111 / all.13956
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Гангл К., Нидербергер В., Валента Р. Множественные смеси трав в отличие от отдельных трав для иммунотерапии аллергенами при аллергическом рините. Clin Exp Allergy .(2013) 43: 1202–16. DOI: 10.1111 / CEA.12128
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Вильяльба М., Родригес Р., Батанеро Э. Спектр аллергенов пыльцы оливок. От структур до диагностики и лечения. Методы . (2014) 66: 44–54. DOI: 10.1016 / j.ymeth.2013.07.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90.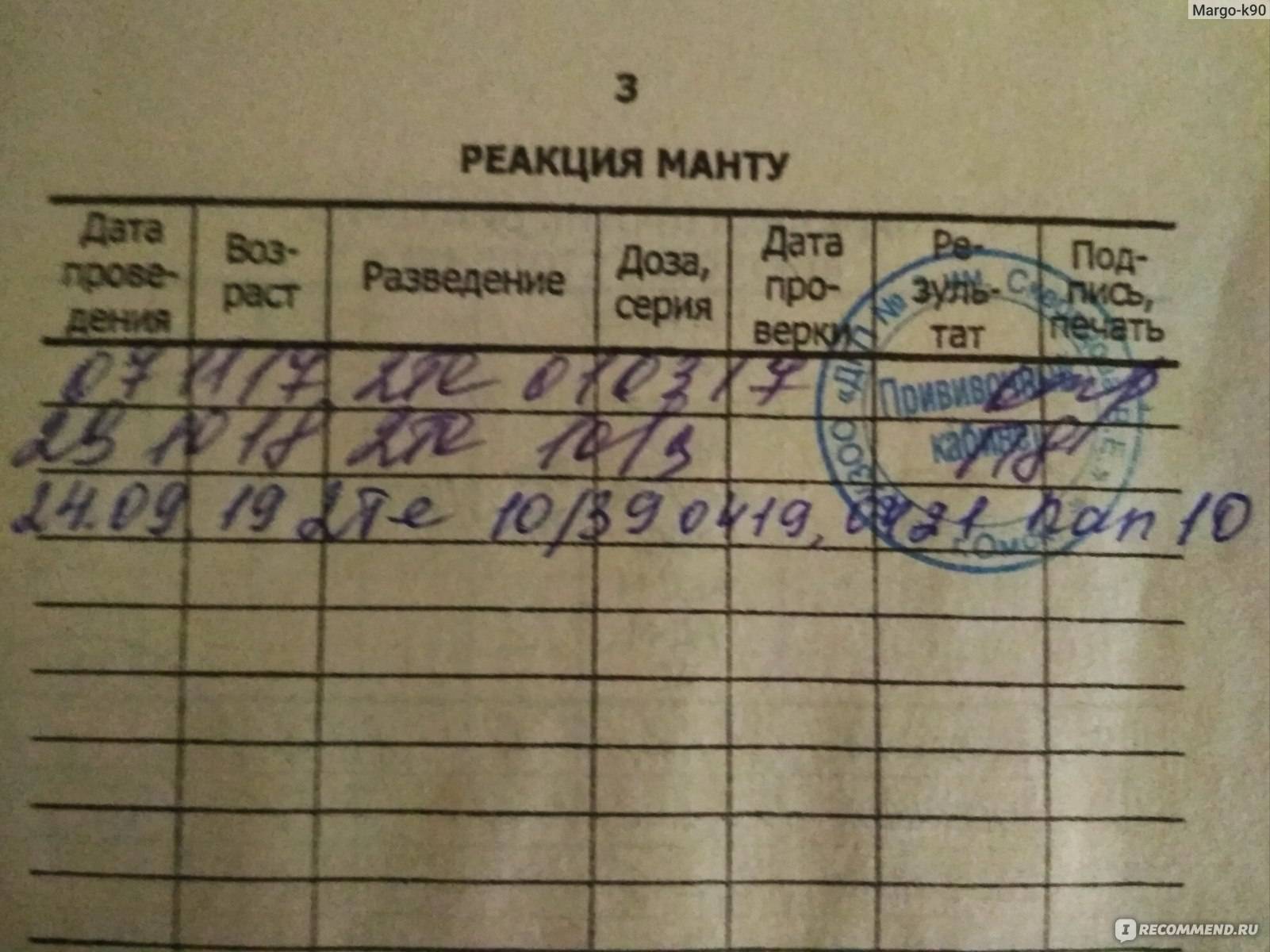 Дорофеева Ю., Коломбо П., Бланка М., Мари А., Ханферян Р., Валента Р. и др. Экспрессия и характеристика рекомбинантных Par j 1 и Par j 2, сходных с аллергенными эпитопами пыльцы Parietaria judaica . Научный сотрудник . (2019) 9: 15043. DOI: 10.1038 / s41598-019-50854-1
Дорофеева Ю., Коломбо П., Бланка М., Мари А., Ханферян Р., Валента Р. и др. Экспрессия и характеристика рекомбинантных Par j 1 и Par j 2, сходных с аллергенными эпитопами пыльцы Parietaria judaica . Научный сотрудник . (2019) 9: 15043. DOI: 10.1038 / s41598-019-50854-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Wang XY, Ma TT, Wang XY, Zhuang Y, Wang XD, Ning HY и др. Распространенность аллергического ринита, вызванного пыльцой, с высоким содержанием пыльцы на пастбищах Северного Китая. Аллергия . (2018) 73: 1232–43. DOI: 10.1111 / all.13388
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Ма Т, Ван Х, Чжуан И, Ши Х, Нин Х, Лан Т и др.Факторы распространенности и риска аллергического ринита у взрослых и детей, проживающих в различных пастбищных регионах Внутренней Монголии. Аллергия . (2020) 75: 234–9. DOI: 10.1111 / all.13941
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Виктор Дж. Р., Фусаро А. Э., Дуарте А. Дж. Да С., Сато Миннесота. Иммунизация матери против пылевого клеща до зачатия подавляет реакцию гиперчувствительности I типа у потомства. J Allergy Clin Immunol . (2003) 111: 269–77. DOI: 10.1067 / mai.2003.39
Виктор Дж. Р., Фусаро А. Э., Дуарте А. Дж. Да С., Сато Миннесота. Иммунизация матери против пылевого клеща до зачатия подавляет реакцию гиперчувствительности I типа у потомства. J Allergy Clin Immunol . (2003) 111: 269–77. DOI: 10.1067 / mai.2003.39
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Утхофф Х., Спеннер А., Рекелькамм В., Аренс Б., Вёльк Г., Хаклер Р. и др. Критическая роль иммунизации до зачатия для защитного и непатологического специфического иммунитета у новорожденных мышей. Дж Иммунол . (2003) 171: 3485–92. DOI: 10.4049 / jimmunol.171.7.3485
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Бертон О. Т., Тамайо Дж. М., Стрэнкс А. Дж., Колеоглоу К. Дж., Этген ХК.Передача сигналов аллерген-специфических антител IgG через FcγRIIb способствует пищевой толерантности. J Allergy Clin Immunol . (2018) 141: 189–201.e3. DOI: 10.1016 / j.jaci.2017.03.045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99.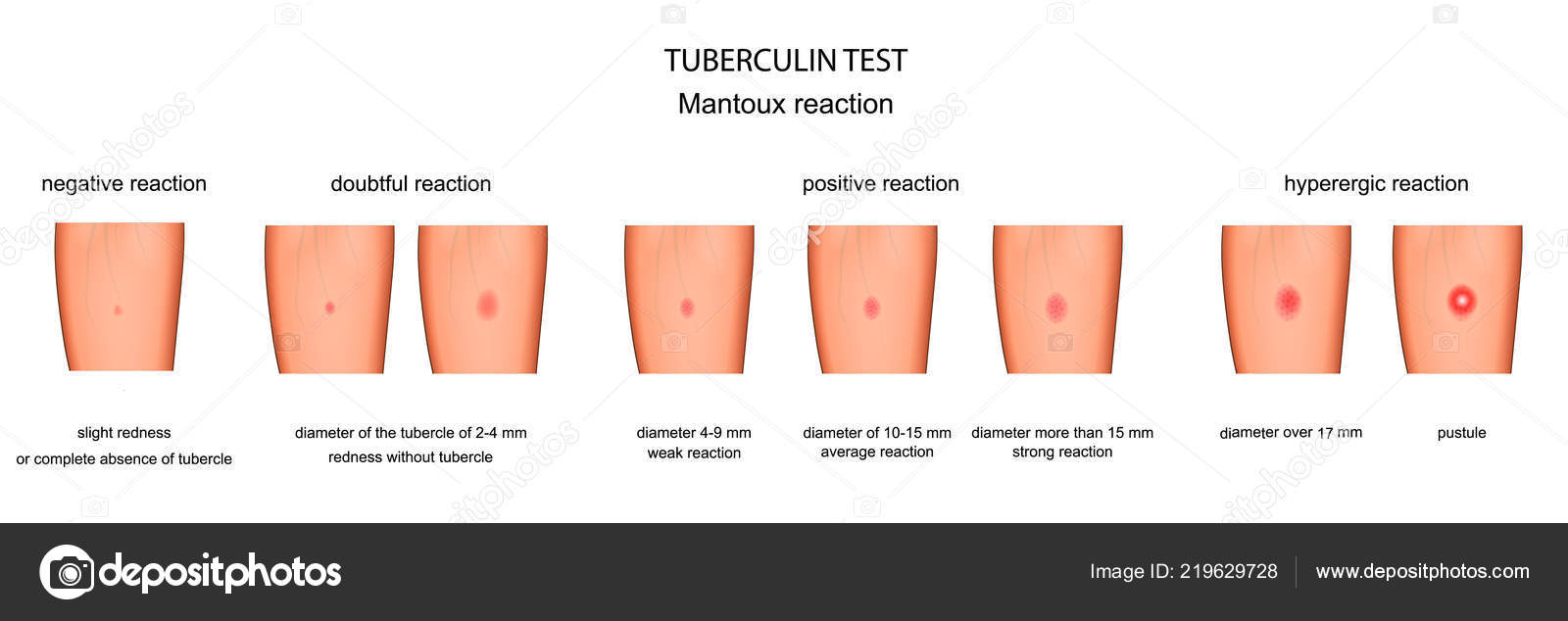 Фрейдл Р., Гстёттнер А., Бараньи Ю., Свобода И., Штольц Ф., Фокке-Тейкл М. и др. Блокирующие антитела, индуцированные иммунизацией гипоаллергенным мутантом парвальбумина, уменьшают аллергические симптомы на мышиной модели аллергии на рыбу. J Allergy Clin Immunol .(2017) 139: 1897–905.e1. DOI: 10.1016 / j.jaci.2016.10.018
Фрейдл Р., Гстёттнер А., Бараньи Ю., Свобода И., Штольц Ф., Фокке-Тейкл М. и др. Блокирующие антитела, индуцированные иммунизацией гипоаллергенным мутантом парвальбумина, уменьшают аллергические симптомы на мышиной модели аллергии на рыбу. J Allergy Clin Immunol .(2017) 139: 1897–905.e1. DOI: 10.1016 / j.jaci.2016.10.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Linhart B, Narayanan M, Focke-Tejkl M, Wrba F, Vrtala S, Valenta R. Профилактическая и терапевтическая вакцинация связанными с носителем пептидами Bet v 1, у которых отсутствуют аллерген-специфические Т-клеточные эпитопы, снижает Bet v 1-специфические Т-клетки ответы через блокирующие антитела в мышиной модели аллергии на пыльцу березы. Clin Exp Allergy . (2014) 44: 278–87. DOI: 10.1111 / cea.12216
CrossRef Полный текст | Google Scholar
101. Фликер С., Линхарт Б., Вайлд С., Видерманн Ю., Валента Р. Пассивная иммунизация аллерген-специфическими антителами IgG для лечения и профилактики аллергии. Иммунобиология . (2013) 218: 884–91. DOI: 10.1016 / j.imbio.2012.10.008
Иммунобиология . (2013) 218: 884–91. DOI: 10.1016 / j.imbio.2012.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Гловский М.М., Гекьер Л., Рейзек Э. Влияние материнской иммунотерапии на немедленную реактивность кожных проб, специфические IgG и IgE-антитела ржи I и общий IgE у детей. Энн Аллергия . (1991) 67: 21–4.
PubMed Аннотация | Google Scholar
103. Flicker S, Marth K, Kofler H, Valenta R. Плацентарный перенос аллерген-специфических IgG, но не IgE от матери, леченной специфической иммунотерапией. J Allergy Clin Immunol . (2009) 124: 1358–360.e1. DOI: 10.1016 / j.jaci.2009.09.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Бучи П., Бадур С., Кассианос Г., Прейсс С., Там Дж. С.. Вакцинация беременных от гриппа должна стать приоритетом для всех стран: комментарий экспертов. Int J Заразить Дис . (2020) 92: 1–12. DOI: 10.1016 / j.ijid.2019.12.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Джарвис Дж. Р., Дори Р. Б., Уоррикер ФДМ, Алван Н. А., Джонс К. Э.. Эффективность вакцинации против гриппа во время беременности по отношению к результатам для здоровья ребенка: систематический обзор и метаанализ. Вакцина . (2020) 38: 1601–13. DOI: 10.1016 / j.vaccine.2019.12.056
Джарвис Дж. Р., Дори Р. Б., Уоррикер ФДМ, Алван Н. А., Джонс К. Э.. Эффективность вакцинации против гриппа во время беременности по отношению к результатам для здоровья ребенка: систематический обзор и метаанализ. Вакцина . (2020) 38: 1601–13. DOI: 10.1016 / j.vaccine.2019.12.056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106.Сил А.С., Бейкер С.Дж., Беркли Дж.А., Мадхи С.А., Орди Дж., Саха С.К. и др. Вакцины для иммунизации матерей против стрептококковой болезни группы B: перспективы ВОЗ в отношении установления и определения случаев. Вакцина . (2019) 37: 4877–85. DOI: 10.1016 / j.vaccine.2019.07.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Псаррис А., Синдос М., Даскалакис Дж., Чондроджианни М.Э., Панайоту С., Антсаклис П. и др. Прививки во время беременности: как, когда и зачем. евро J Obstet Gynecol Reprod Biol . (2019) 240: 29–35. DOI: 10.1016 / j.ejogrb.2019.06.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Кочхар С., Эдвардс К.М., Роперо Альварес А.М., Моро П.Л., Ортис-младший. Внедрение новых вакцин для иммунизации беременных — программные, нормативные, безопасность и этические соображения. Вакцина . (2019) 37: 3267–77. DOI: 10.1016 / j.vaccine.2019.04.075
Кочхар С., Эдвардс К.М., Роперо Альварес А.М., Моро П.Л., Ортис-младший. Внедрение новых вакцин для иммунизации беременных — программные, нормативные, безопасность и этические соображения. Вакцина . (2019) 37: 3267–77. DOI: 10.1016 / j.vaccine.2019.04.075
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110.Maertens K, Orije MRP, Van Damme P, Leuridan E. Вакцинация во время беременности: текущие и возможные будущие рекомендации. Eur J Педиатр . (2020) 179: 235–42. DOI: 10.1007 / s00431-019-03563-w
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Готовность населения Греции получить вакцину от COVID-19 | Глобальные исследования и политика в области здравоохранения
В борьбе с новым коронавирусом, который убил более полумиллиона человек и нанес ущерб экономике по всему миру, многие компании и академические учреждения работают над разработкой вакцины.Эффективность предстоящей вакцины зависит от охвата населения, поскольку в случае низкого уровня вакцинации коллективный иммунитет не разовьется, а наиболее уязвимые группы населения не будут защищены. Таким образом, важно заранее понять намерение населения пройти вакцинацию от COVID-19, чтобы у должностных лиц общественного здравоохранения было время для разработки и реализации целевых мероприятий, направленных на повышение осведомленности населения о важности вакцинации.В конце концов, нерешительность означает, что умы можно склонить к принятию, если им предоставить правильную информацию.
Таким образом, важно заранее понять намерение населения пройти вакцинацию от COVID-19, чтобы у должностных лиц общественного здравоохранения было время для разработки и реализации целевых мероприятий, направленных на повышение осведомленности населения о важности вакцинации.В конце концов, нерешительность означает, что умы можно склонить к принятию, если им предоставить правильную информацию.
В этом контексте цель этого общенационального перекрестного исследования, проведенного в Греции, заключалась в оценке готовности взрослого населения в целом получить вакцину от COVID-19, когда она будет доступна, а также факторов, которые могут повлиять на их готовность. . Насколько нам известно, это первое исследование, проведенное в Греции, и ожидается, что его результаты окажут большое влияние на решения, принимаемые должностными лицами общественного здравоохранения.
Наши результаты показали, что более двух из пяти человек не желали или не были уверены в вакцинации от COVID-19, и только 57,7% заявили, что они будут вакцинированы. Процент людей, желающих пройти вакцинацию, недостаточно велик для достижения коллективного иммунитета либо посредством вакцинации, либо путем предшествующей передачи инфекции, исходя из оценок основного числа репродуктивных органов (R 0 ) [23, 24]. Сравнение степени готовности нашего исследования с аналогичными исследованиями, проведенными в Великобритании (76.9%) [13] или других европейских стран (от 62 до 80%) [12], похоже, что греки более нерешительно относятся к вакцине COVID-19 по сравнению с другими европейскими группами населения. Аналогичная вариабельность в странах наблюдалась в 2009 г. в отношении принятия вакцины против пандемического гриппа h2N1 с этим показателем в диапазоне от 8 до 67%, а греки сообщали о более низких показателях принятия (от 9,1 до 22,9% в зависимости от недели, на которой проводился опрос) по сравнению с другим европейским популяциям [25]. Если показатели готовности и как таковые показатели вакцинации останутся низкими, пандемия продолжит оказывать негативное воздействие на здоровье населения и экономику страны.
Процент людей, желающих пройти вакцинацию, недостаточно велик для достижения коллективного иммунитета либо посредством вакцинации, либо путем предшествующей передачи инфекции, исходя из оценок основного числа репродуктивных органов (R 0 ) [23, 24]. Сравнение степени готовности нашего исследования с аналогичными исследованиями, проведенными в Великобритании (76.9%) [13] или других европейских стран (от 62 до 80%) [12], похоже, что греки более нерешительно относятся к вакцине COVID-19 по сравнению с другими европейскими группами населения. Аналогичная вариабельность в странах наблюдалась в 2009 г. в отношении принятия вакцины против пандемического гриппа h2N1 с этим показателем в диапазоне от 8 до 67%, а греки сообщали о более низких показателях принятия (от 9,1 до 22,9% в зависимости от недели, на которой проводился опрос) по сравнению с другим европейским популяциям [25]. Если показатели готовности и как таковые показатели вакцинации останутся низкими, пандемия продолжит оказывать негативное воздействие на здоровье населения и экономику страны. В этом контексте существует острая необходимость в разработке и проведении просветительской кампании представителями общественного здравоохранения Греции, направленной на повышение показателей принятия вакцины против COVID-19 населением Греции в целом.
В этом контексте существует острая необходимость в разработке и проведении просветительской кампании представителями общественного здравоохранения Греции, направленной на повышение показателей принятия вакцины против COVID-19 населением Греции в целом.
Неуверенность в отношении вакцины — это многогранная и сложная проблема, коренящаяся в нескольких ценностях: в частности, в свободе, восприятии риска и недоверии. Нерешительность населения в отношении вакцины COVID-19 может быть объяснена опасениями по поводу безопасности и эффективности вакцины или убеждением в том, что люди не подвержены риску заболевания, — причины, представленные греками для оправдания своей нерешительности по поводу вакцины против гриппа h2N1 [ 17].Имеющиеся данные о предыдущей пандемии h2N1 показывают, что фактическое намерение вакцинации может быть другим, если вакцина доступна [26]. Примечательно, что в 2009 году лишь небольшой процент примерно 3% всего греческого населения в конечном итоге получил вакцинацию к концу декабря 2009 года (через 4 месяца после выпуска), что является одним из самых низких показателей в Европейском союзе [27]. . К счастью, исследования показали, что уровень охвата вакцинацией со временем увеличивался [28].
. К счастью, исследования показали, что уровень охвата вакцинацией со временем увеличивался [28].
Движущие силы нерешительности в отношении вакцины во многом полагаются как на системы убеждений, так и на личный опыт.Наши результаты показывают, что именно социально-демографические категории и история болезни влияют на готовность вакцинироваться от COVID-19 или нет. Было обнаружено, что люди в возрасте старше 65 лет или люди, которые принадлежали или имели члена семьи, принадлежащего к уязвимой группе, были статистически значимо более склонны к вакцинации COVID-19. Наши результаты не согласуются с выводами аналогичных исследований, проведенных в Великобритании [13] и во Франции [29]. В исследовании, проведенном в Великобритании, на готовность не повлиял повышенный риск COVID-19, в то время как во Франции люди старше 75 лет неохотно проходили вакцинацию.Наше исследование выявило людей с более низким уровнем образования как тех, у кого больше шансов получить вакцинацию от COVID-19, в то время как исследования в Великобритании [13] и Австралии [19] продемонстрировали обратное. Вышеупомянутые результаты показывают, что молодые люди, люди, не принадлежащие к уязвимым группам или не имеющие уязвимых членов семьи, а также лица с высшим образованием могут быть целевой группой в образовательных кампаниях по безопасности и эффективности вакцин, поскольку они в настоящее время не решаются пройти вакцинацию.
Вышеупомянутые результаты показывают, что молодые люди, люди, не принадлежащие к уязвимым группам или не имеющие уязвимых членов семьи, а также лица с высшим образованием могут быть целевой группой в образовательных кампаниях по безопасности и эффективности вакцин, поскольку они в настоящее время не решаются пройти вакцинацию.
Более того, респонденты, которые не были вакцинированы от сезонного гриппа, и те, кто полагал, что коронавирус был создан человеком в лаборатории, значительно чаще были отрицательными в отношении вакцинации от COVID-19. Это было ранее описано Neumann-Bohme et all [12], которые определили опасения по поводу побочных эффектов и безопасности вакцины, общий отказ от вакцин и убеждения в теориях заговора как причины нежелания вакцинировать. Ранее также было показано, что люди с большей вероятностью откажутся от новых вакцин, чем от знакомых [30].Крайне важно, чтобы вышеуказанные причины принимались во внимание в стратегиях местных органов здравоохранения и прямо рассматривались в кампаниях по информированию общественности.
Кампании по информированию общественности, адаптированные к конкретным потребностям сообщества, оказались наиболее эффективными в повышении показателей вакцинации от других вспышек [31]. Наше исследование показало, что среди граждан Греции более осведомленные респонденты о путях передачи вируса и мерах профилактики были с большей вероятностью вакцинированы.Что касается источника информации, респонденты, проинформированные через социальные сети, Интернет или другие источники, были менее склонны к вакцинации, что указывает на то, что социальные сети могут быть источником ложной информации. Новые данные свидетельствуют о том, что исправление дезинформации в социальных сетях может быть эффективным для изменения взглядов на здоровье [32].
У этого исследования есть как сильные стороны, так и ограничения. Сила этого исследования заключается в его дизайне. В предыдущих исследованиях KAP сбор данных проводился с использованием онлайн-опросников, которые сами сообщили, недостатком которых является ограничение участия уязвимых групп, таких как неграмотные и сельские жители, без доступа к Интернету и онлайновым информационным ресурсам здравоохранения. В нашем опросе использовалась смешанная методология сбора данных (CATI и CAWI), обеспечивающая случайную выборку с большей обобщаемостью с точки зрения возраста, пола и места проживания. Следует отметить, что, согласно международной библиографии, это первое исследование KAP, проведенное в Европе, способствовавшее определению знаний, представлений и практик населения в целом европейской страны с другой культурой и образом жизни, сравнивая со страной с другого континента.Более того, это первое исследование на национальной репрезентативной выборке городского / сельского населения, которое продемонстрировало готовность населения получить вакцину от COVID-19, если она станет доступной.
В нашем опросе использовалась смешанная методология сбора данных (CATI и CAWI), обеспечивающая случайную выборку с большей обобщаемостью с точки зрения возраста, пола и места проживания. Следует отметить, что, согласно международной библиографии, это первое исследование KAP, проведенное в Европе, способствовавшее определению знаний, представлений и практик населения в целом европейской страны с другой культурой и образом жизни, сравнивая со страной с другого континента.Более того, это первое исследование на национальной репрезентативной выборке городского / сельского населения, которое продемонстрировало готовность населения получить вакцину от COVID-19, если она станет доступной.
Наше исследование также имеет ограничения. Это было перекрестное исследование, поэтому оно отражает картину реакции сообщества на момент исследования. Настоящее намерение вакцинации против COVID-19 может быть другим, если вакцина будет доступна. Во-вторых, поскольку в этом исследовании использовались данные самооценки, участники могли ответить на вопросы, основываясь на том, что, по их мнению, от них ожидали (предвзятость в сообщении) [33]. Кроме того, учитывая, что основная цель настоящего исследования заключалась в оценке KAP населения в целом против COVID-19, мы не собирали данные о причинах принятия вакцины, нерешительности и нежелании делать вакцину.
Кроме того, учитывая, что основная цель настоящего исследования заключалась в оценке KAP населения в целом против COVID-19, мы не собирали данные о причинах принятия вакцины, нерешительности и нежелании делать вакцину.
Определение случая и рекомендации по сбору, анализу и представлению данных о безопасности иммунизации
Реферат
Это случай, сделанный в рамках сотрудничества Брайтона. Определение термина «усиленное заболевание, связанное с вакциной», которое будет использоваться для оценки побочных эффектов после иммунизации .Определение случая было разработано группой экспертов, созванной Коалицией за инновации в обеспечении готовности к эпидемиям (CEPI) в контексте активной разработки вакцин против SARS-CoV-2 и других новых патогенов. После исчерпывающего обзора литературы и консультаций с экспертами был использован формат определения случая Брайтонского сотрудничества для выработки согласованного определения и определенных уровней уверенности. Перед отправкой документ прошел рецензирование Брайтонской сетью сотрудничества и выбранными экспертами-рецензентами.
Ключевые слова: Неблагоприятное событие, иммунизация, рекомендации, определение случая, вакцина, усиленное заболевание, респираторное, системное заболевание
1. Преамбула
Усиленные болезни, связанные с вакцинацией (VAED), представляют собой модифицированные презентации клинических инфекций, поражающих людей, подвергшихся воздействию патоген дикого типа после предварительной вакцинации от того же патогена [1]. Заболевание, связанное с вакцинацией, усиленное респираторное заболевание (VAERD) относится к заболеванию с преимущественным поражением нижних дыхательных путей.Классическими примерами VAED являются атипичная корь и усиленный респираторно-синцитиальный вирус (RSV), возникающие после введения инактивированной вакцины против этих патогенов. В этой ситуации было документально подтверждено тяжелое заболевание, возникшее в результате инфекции у людей, у которых появились незащищающие иммунные ответы против соответствующих вирусов дикого типа [2], [3], [4], [5], [6]. Учитывая, что эти усиленные ответы вызваны неудачными попытками контролировать заражающий вирус, VAED обычно проявляется симптомами, связанными с органом-мишенью возбудителя инфекции.Следовательно, чтобы распознать усиление заболевания, связанного с вакциной, необходимо иметь четкое представление о клинической картине и обычном течении естественного заболевания.
Усиление заболевания независимо от прайминга вакцины также описано для патогенов, вызывающих последовательные инфекции с различными перекрестно-реактивными, но не перекрестно-защитными серотипами, включая денге и пандемический грипп [7], [8], [9], [10], [11], [12].
В конце 2019 г. в Ухане, Китай, возникло новое тяжелое респираторное заболевание [13].Возбудитель, тяжелый острый респираторный синдром, коронавирус-2 (SARS-CoV-2), был быстро идентифицирован и определен как тесно связанный с коронавирусами SARS и ближневосточного респираторного синдрома (MERS), которые вызвали географически локализованные вспышки в 2002 году. –2004 г. и с 2012 г. соответственно. SARS-CoV-2 перерос в глобальную пандемию со значительными последствиями из-за его высокой инфекционности и передаваемости, а также его способности вызывать как тяжелые респираторные заболевания, так и системные заболевания с фатальными последствиями для уязвимых групп населения.Естественная история коронавирусного инфекционного заболевания, вызванного SARS-CoV-2 (COVID-19), еще предстоит полностью описать. Однако уровень летальности составляет от 0,5% до почти 20% в зависимости от возраста и других факторов риска, а также понимание того, что SARS-CoV-2 в настоящее время является хорошо адаптированным патогеном человека, который будет продолжать вызывать заболевание среди уязвимых групп населения, делает разработку эффективной вакцины глобальным приоритетом.
Вероятность того, что вакцинация против SARS-CoV-2 будет связана с усилением заболевания, представляет собой теоретическую проблему, учитывая аналогичные наблюдения с другими респираторными вирусами в целом и на животных моделях высокопатогенных коронавирусов в частности [14].Важно отметить, что VAED не наблюдался после вакцинации людей против SARS или MERS, хотя количество людей, получивших эти экспериментальные вакцины, остается очень небольшим. В настоящее время патогенез, реакции хозяина и иммунитет к SARS-CoV-2 все еще изучаются и полностью не изучены. Инфекция SARS-CoV-2 связана со спектром заболеваний, которые варьируются от бессимптомной инфекции до тяжелого заболевания легких с острым респираторным дистресс-синдромом (ARDS) и фатальным полиорганным заболеванием с воспалительной, сердечно-сосудистой, гематологической и коагуляционной дисрегуляцией [15], [16] ], [17].Также описаны постинфекционные, возможно, иммуноопосредованные системные заболевания, особенно мультисистемный воспалительный синдром у детей (MIS-C) и взрослых (MIS-A) с неясным патогенезом в настоящее время [18], [19], [20 ], [21].
Учитывая широкий спектр заболеваний, связанных с SARS-CoV-2, клиническая оценка как системного VAED, так и легочного VAERD будет сложной задачей во время предварительной оценки вакцин-кандидатов и после проведения широкомасштабной вакцинации против COVID-19. .Широкий спектр естественных проявлений болезни в разных популяциях и возрастных группах делает очень трудным, если не невозможным, определить, насколько серьезной была бы инфекция COVID-19 при отсутствии вакцинации в конкретном случае. Тот, у кого без предварительной вакцинации могло быть полное бессимптомное течение, но у которого развиваются легкие респираторные симптомы в связи с предыдущей вакцинацией, можно логически рассматривать как случай VAERD. Однако этот конец спектра возможного VAERD будет иметь очень небольшое клиническое значение для этого человека.Однако на уровне популяции даже небольшой сдвиг в спектре болезней в сторону большей степени тяжести может иметь серьезные клинические и социальные последствия. Кроме того, учитывая, что тяжелое заболевание легче обнаружить и охарактеризовать, обсуждаемые здесь определения случаев сосредоточены на более тяжелых проявлениях VAED / VAERD.
Не существует общепринятого определения VAED или VAERD. Часто используемые родственные термины включают «усиленное заболевание, опосредованное вакциной (VMED)», «усиленное респираторное заболевание (ERD)», «усиление инфекции, вызванное вакциной», «усиление заболевания», «усиление иммунитета» и «усиление, зависимое от антител. (ADE) ».Это потенциально сбивает с толку, поскольку механизмы усиления заболевания, вероятно, различаются, а сопоставимость данных по испытаниям или системам эпиднадзора может быть проблематичной, если системы не используют согласованное определение случая и не собирают сопоставимые данные. Однако оценка этого потенциального нежелательного явления после иммунизации особенно важна для SARS-CoV-2, учитывая острую глобальную потребность в безопасных и эффективных вакцинах. Хотя это определение случая было разработано для выявления потенциальных случаев VAED / VAERD в контексте разработки вакцины против SARS-CoV-2, оно не является исключительным для вакцин COVID-19 и может применяться при оценке возможных VAED / VAERD после любая вакцина.
1.1. Методы разработки определения случая
Рабочая группа Брайтонского сотрудничества VAED была сформирована в марте 2020 года и включала членов, обладающих опытом в фундаментальных науках, вирусологии, моделях животных, иммунологии, вакцинологии, безопасности вакцин, клинической помощи, клинических исследованиях, общественном здравоохранении. , нормативные науки и этика.
Чтобы помочь принять решение по определению случая и руководящим принципам, с помощью PubMed была проведена серия поисков литературы. Условия поиска и результаты поиска подробно описаны в [99], [100], [101], [102], [103], [104], [105], [106], [107], [ 108], [109], [110], [111], [112], [113], [114], [115], [116], [117], [118], [119], [120] , [121], [122], [123], [124], [125], [126], [127], [128].
Чтобы заполнить текущее состояние знаний и пробелы в знаниях для оценки VAED в контексте оценки вакцин против SARS-CoV-2, в марте была созвана консенсусная конференция экспертов, включая авторов этого определения случая. 12–13, 2020. Темы обсуждения и выводы встречи опубликованы [22]. Группа экспертов на этом консенсусном совещании пришла к выводу, что демонстрация некоторого усиления болезни с любой вакциной-кандидатом после вирусного заражения на животных моделях не обязательно должна представлять собой сигнал «нет» для принятия решения о переходе к ранним испытаниям в клинической разработке вакцины. COVID-19 вакцина.Однако потребуется постоянный мониторинг этого риска во время клинических испытаний в контексте эпидемии. Каждый наблюдаемый эффект должен обсуждаться разработчиками вакцины с соответствующими регулирующими органами, которые в конечном итоге определяют фактические требования для клинических исследований.
Рабочая группа определила, что описание известных патофизиологических путей, ведущих к VAED / VAERD, необходимо для выделения различных потенциальных механизмов заболевания, поскольку установленное клиническое, лабораторное или гистопатологическое определение VAED или VAERD не доступно.Определение случая фокусируется на выявлении возможных и вероятных случаев VAED / VAERD после любой вакцинации на основе клинических проявлений и частоты клинических исходов, вызывающих озабоченность, и предоставляет предлагаемые инструменты клинической и лабораторной оценки. Однако при описании вариантов оценки возможных случаев при планировании клинических испытаний или надзора за безопасностью конкретного биомаркера или гистопатологического исследования VAED не существует, и, следовательно, определение случая не является предписывающим в отношении конкретных тестов, которые необходимо выполнить, а также того, когда и кто должен проводить или интерпретировать такое тестирование.Более того, при текущем уровне знаний оценка «золотого стандарта» для диагностики окончательного случая VAED / VAERD может быть специфичной для патогена и вакцины и не может быть определена до тех пор, пока не появятся дополнительные клинические и исследовательские данные после консультации с экспертами.
1.2. Определение патофизиологических путей, ведущих к VAED / VAERD
Предыдущий опыт конкретных болезней, усиленных вакциной, служит примером того, как различные патофизиологические механизмы могут приводить к VAED или VAERD.Механизмы описаны ниже.
1.2.1. Усиленное заболевание, опосредованное иммунным комплексом (RSV, корь, пандемический грипп)
Вскоре после успешной инактивации полиовирусов формальдегидом и успеха этой вакцины для борьбы с эпидемическим полиомиелитом, другие детские патогены стали мишенью для разработки вакцины с использованием аналогичных методов. В середине 1960-х годов инактивированная формалином вакцина против RSV вводилась младенцам и детям младшего возраста в четырех исследованиях в Соединенных Штатах [23], [24], [25], [26].Впоследствии дети подвергались воздействию вируса дикого типа в сообществе, а те иммунизированные дети, которые были серонегативны по RSV до вакцинации, испытали усиленную и атипичную картину заболевания RSV с лихорадкой, хрипом и бронхопневмонией. Этих детей чаще госпитализировали, и двое детей, вакцинированных в младенчестве, умерли в результате инфекции RSV [23]. Напротив, усиление респираторного заболевания (ERD) не наблюдалось у младенцев, которые были серопозитивными в отношении вируса во время введения инактивированной формалином вакцины против RSV [23].
Потенциальная причина усиленного заболевания, связанного с вакциной, инактивированной формалином, заключалась в том, что генерировался непротективный ответ антител с низким сродством к защитному антигену слияния RSV (F) [27], [28], [29]. Этот малоавидный, незащищающий ответ, вызываемый инактивированными формалином вакцинами, был связан с недостаточной активацией Toll-подобного рецептора (TLR) во время иммунизации [27], [28], [29], [30], [ 31]. Последующая инфекция RSV приводит к образованию иммунных комплексов и активации комплемента с повреждением легких, обострению бронхопневмонии с Th3-смещенным Т-клеточным ответом CD4 (характерный фенотип заболевания) [32], [33], [34], [35] , [36] и обильное выделение слизи [37], [38].Другим потенциальным фактором, способствующим возникновению незащищающих ответов антител, вызванных инактивированной формалином вакциной, могло быть введение RSV F в его конформации после слияния, которая менее стабильна и приводит к антителам с более низкой нейтрализующей способностью, чем конформация до слияния [ 30].
Интересно, что созревание аффинности во время более раннего контакта с RSV объясняет, почему у детей, которые были серопозитивными на вирус до прививки, никогда не развивался ERD. Предшествующее приобретение антител с высокой авидностью против RSV дикого типа, вероятно, вытеснило клоны В-клеток с низким сродством, вызванные вакциной против RSV, инактивированной формалином, таким образом, устраняя В-клетки, не обеспечивающие защиту с низким сродством.Эта же парадигма объясняет, почему ни один из детей не испытал ERD дважды. После усиления заболевания RSV после заражения диким типом новые антитела с высоким сродством к вирусу у этих людей вызвали здоровый ответ на последующие повторные инфекции.
Инактивированная формалином вакцина против вируса кори была лицензирована в США в 1963 году одновременно с первой живой аттенуированной противокоревой вакциной [39], [40]. Хотя большинство людей изначально были защищены вакциной, инактивированной формалином, антитела с относительно низкой авидностью, вызванные этой вакциной, не смогли защитить при более низких титрах и привели к тяжелой форме болезни, известной как атипичная корь, у иммунизированных лиц, подвергшихся воздействию дикого типа. вирус [41].У детей с атипичной корью наблюдалась высокая температура, петехиальная сыпь на конечностях и двухбазилярная пневмония [42]. В этом случае антитела с низкой авидностью, вызванные вакциной, не смогли нейтрализовать вирус, который связывается с высокоаффинным рецептором CD150 у лиц, подвергшихся воздействию, и способствовали опосредованному иммунным комплексом заболеванию в местах инфицирования вирусом кори, в основном на коже и легких [43]. ], [44], [45], [46]. Важно отметить, что атипичная корь возникла через много лет после воздействия вакцины, инактивированной формалином.
После наблюдения за первыми случаями атипичной кори реципиенты инактивированной формалином вакцины, еще не контактировавшие с корью дикого типа, были привиты лицензированной живой аттенуированной вакциной с целью выработки защитных антител для предотвращения дальнейших атипичных случаев. У этих людей в месте подкожной инъекции образовался эритематозный узелок, гистопатологически характеризуемый иммунными комплексами, специфичными для вируса кори [47], [48]. Некоторым не удалось вызвать корректирующий иммунный ответ после вакцинации живой аттенуированной вакциной, предположительно из-за нейтрализации вируса вакцинного штамма уже существующими антителами.Однако в большинстве случаев живая аттенуированная вакцина успешно индуцировала высокоаффинный ответ IgG, который мог превзойти потенциально патогенные антитела и обеспечить долгосрочную защиту.
1.2.2. Клеточный иммунитет при усиленных респираторных заболеваниях и атипичной кори.
Атипичная корь и ERD также характеризуются Th3-поляризацией их иммунного ответа. Хотя мыши не являются идеальной моделью небольших животных для инфицирования RSV или вирусом кори, ранняя оценка патогенеза ERD, проведенная Graham et al., показали повышенную продукцию интерлейкина 4 (IL-4) в легких пораженных мышей BALB / c [35]. Последующее истощение CD4 + Т-лимфоциты и совместное истощение IL-4 и IL-10 улучшили патологию легких с ERD, предполагая, что заболевание было вызвано, по крайней мере частично, усиленным ответом Th3 [29], [36]. Эти результаты были расширены сообщениями о высоких уровнях IL-5 и IL-13, увеличенном количестве эозинофилов и CD4 + . Т-лимфоциты у мышей с ERD [32], [33]. В последние годы критическая роль смещения Th3 была описана для усиленных компонентов заболевания, включая гиперреактивность дыхательных путей и гиперсекрецию слизи [32], [33].Инактивация RSV формальдегидом также может вносить вклад в поляризацию Th3 во время ERD за счет образования карбонильных групп на вирусных антигенах [48].
Кроме того, другие популяции Т-лимфоцитов могли вносить вклад в патогенез ERD и его фенотип. Заметное подавление Т-регуляторных клеток (T-reg) могло усилить предубеждение Th3 у реципиентов вакцины против RSV, инактивированной формалином; [49] отсутствие RSV-специфического ответа цитотоксических Т-лимфоцитов после иммунизации было допустимо для репликации вируса в легких и способствовало смещению Th3 в анамнестических CD4 + Ответ Т-лимфоцитов при инфекции дикого типа; [50], [51] и эозинофилы, хотя, вероятно, не являются критическим фактором в патогенезе заболевания [52], могут быть полезным биомаркером нежелательных реакций в моделях болезни на животных.
1.2.3. Усиленное заболевание, опосредованное антителами (денге)
Вирусы денге (DENV) принадлежат к роду Flavivirus с четырьмя серологически и генетически различными серотипами, которые различаются по аминокислотной идентичности на 30–35%. Симптомы инфекций денге варьируются от бессимптомных примерно у двух третей до легких гриппоподобных симптомов и лихорадки денге. Синдром геморрагической лихорадки денге / шока денге является наиболее тяжелой формой болезни денге и характеризуется протеканием сосудов, геморрагическими проявлениями, тромбоцитопенией и гипотензивным шоком.У людей, впервые инфицированных DENV, развиваются В-клетки памяти и долгоживущие плазматические клетки, вырабатывающие антитела, которые могут быть перекрестно-реактивными или специфичными для серотипа инфекции. Вторичные инфекции DENV вызывают перекрестно нейтрализующие антитела и защитный иммунитет. Однако праймирование одним серотипом DENV может иногда повышать риск тяжелой денге при вторичной инфекции другим серотипом DENV. Считается, что механизм увеличения тяжести заболевания связан с антителозависимым усилением (ADE) [53], [54].Было высказано предположение, что низкие уровни антител или ненейтрализующих антител, индуцированные предыдущей инфекцией DENV, связываются с новым серотипом DENV и облегчают проникновение вируса в клетки, несущие рецептор Fcγ (FcγR), что приводит к более высокой виремии и иммунной активации. Убедительное доказательство этого механизма ADE после естественного инфицирования получено из когортного исследования детей, проведенного в Никарагуа, где у детей с уровни ранее существовавших DENV-антител составляли 1: 21–1: 80 по сравнению с DENV-наивными или с высокими (> 1: 1280) титрами антител [55].
Есть опасения, что вакцины от денге могут вызывать подобные побочные эффекты. Если вакцина продуцирует антитела с плохой нейтрализующей активностью, которые связывают гетеротипические вирионы без достижения нейтрализации, опсонизированная вирусная частица может иметь повышенную способность инфицировать клетки, несущие Fcγ-R (т.е. облегченное проникновение). Если вакцина не индуцирует достаточного количества нейтрализующих антител против одного или нескольких серотипов, VAED может развиться при воздействии этих серотипов. В клиническом испытании фазы 3 дети, получившие вакцину (Dengvaxia ™: Sanofi Pasteur), имели повышенный риск госпитализации из-за лихорадки денге по сравнению с группой плацебо через 3 года после вакцинации [9], [56].Хотя механизм ADE не доказан, считается, что предшествующее воздействие денге (положительный серостатус) играет решающую роль, и те, кто не инфицированы денге, по-видимому, имеют более высокий риск тяжелого заболевания после вакцинации при последующем заражении другим серотипом денге. вирус [57]. Тем не менее, данные по ADE противоречивы, так как большинство доказательств анекдотичны или основаны на моделях на животных.
В in vitro, и животных моделях наблюдался пиковый титр усиления (т.е. определенная концентрация антител, которая наиболее эффективно усиливает инфекцию DENV).Напротив, более высокие концентрации антител эффективно нейтрализуют вирионы, тогда как более низкие концентрации могут усиливать инфекцию. Однако нейтрализующие анализы варьируются от лаборатории к лаборатории, и стандартизация таких биологических анализов в лабораториях может быть сложной задачей. ADE также постулируется для других арбовирусов, включая вирус Зика и вирус японского энцефалита [58], [59], [60].
1.2.4. Активация цитокинов / шторм и усиление болезни (SARS, MERS, SARS-CoV-2)
Обильная активация цитокинов считается важным компонентом тяжелого заболевания, вызванного SARS-CoV, MERS-CoV или SARS-CoV-2.Точный механизм этого иммунопатологического ответа все еще остается неясным, поскольку продукция активного цитокина / хемокина может быть подходящей реакцией на неконтролируемую репликацию вируса, в отличие от действительно чрезмерной реакции. В любом случае длительные цитокиновые ответы у пациентов с SARS, характеризующиеся экспрессией в основном INF-гамма [61], [62], коррелируют с худшими исходами. У этих пациентов обычно наблюдалась лимфопения, которая, вероятно, отражала эффекты повышенных уровней цитокинов и эндогенных кортикостероидов.В одном исследовании пролонгированные уровни интерферона I типа (INF) и других цитокинов наблюдались у пациентов с SARS, у которых были плохие результаты, в то время как эти уровни, как правило, были ниже у пациентов с лучшими клиническими ответами, что совпадало с развитием защитных ответов антител [63] . Однако в других исследованиях ответы антител были выше у пациентов с худшими результатами, что повышает вероятность того, что ответ антител действительно способствовал более тяжелому заболеванию. Макрофаги считаются важным источником провоспалительных цитокинов, но эти клетки не инфицированы SARS-CoV продуктивно [64], [65].И макрофаги, и дендритные клетки инфицированы SARS-CoV абортивно. Хотя клетки не поддерживают продуктивную инфекцию, при остром респираторном дистресс-синдроме (ARDS) было показано, что они продуцируют провоспалительные цитокины, такие как TNF, IL-1beta, IL-6, IL-8, CCL2 и CCL7 [66], [66], [66] [ 67], [68]. Дополнительное понимание роли чрезмерной активации цитокинов при SARS получено из исследований на мышах. У мышей, инфицированных адаптированным к мышам SARS-CoV, развивается летальная пневмония, характеризующаяся быстрой репликацией вируса и пиковыми титрами вируса в течение 16–24 часов.Однако 100% мышей выживают, если передача сигналов IFN типа I блокируется либо генетической делецией, либо обработкой антителом, блокирующим передачу сигналов INF [69].
Подобные механизмы, по-видимому, встречаются у пациентов с MERS, хотя известно меньше, потому что с момента первого выявления MERS в 2012 году было зарегистрировано всего около 2500 случаев. Как и при SARS, у пациентов с MERS обычно (с задержкой) повышенные уровни провоспалительных цитокинов. такие как IL-1beta, IL-6 и IL-8 [70]. MERS-CoV, в отличие от SARS-CoV, активно подавляет индукцию раннего ответа IFN-I, что способствует усиленной репликации вируса [71].Также в отличие от SARS-CoV, MERS-CoV чувствителен к терапии IFN-I [71]. Было показано, что MERS-CoV продуктивно заражает макрофаги и дендритные клетки с задержкой индукции IFN-I и других цитокинов [72]. Таким образом, как SARS-CoV, так и MERS-CoV индуцируют экспрессию провоспалительных молекул, хотя их способность к репликации в миелоидных клетках существенно различается.
Хотя SARS-CoV-2 присутствует в популяциях людей всего несколько месяцев, несколько исследований показали, что чрезмерная активация цитокинов способствует патогенезу.Молекулы, такие как IL-1, IL-6, TNF, IL-8, активируются у пациентов с более тяжелым заболеванием, что повышает вероятность того, что некоторые из них могут способствовать плохим результатам [73]. Антитела, блокирующие ИЛ, клинически используются как в контролируемых, так и в неконтролируемых клинических испытаниях.
ADE был убедительно продемонстрирован только при коронавирусных инфекциях у кошек, которые ранее были серопозитивными в результате инфекции или вакцинации и иммунизированы векторами, экспрессирующими S-белок, с последующей контрольной заражением вирусом инфекционного перитонита кошек [73].Однако VAERD произошел после иммунизации вакцинами, инактивированными SARS, или альфавирусными векторами, экспрессирующими белок нуклеокапсида. Во многих случаях воспалительные инфильтраты проявляют фенотип Th3, а не Th2, и характеризуются повышенным количеством эозинофилов [74], [75], [76], [77]. В другом исследовании макак иммунизировали вирусом осповакцины, экспрессирующим белок SARS, или пассивно иммунизировали плазмой макак, иммунизированных тем же вектором. Затем они были заражены SARS-CoV.В то время как животные оставались бессимптомными, природа воспалительных инфильтратов изменилась, в первую очередь с макрофагов M2- на M1-тип, с повышенной экспрессией провоспалительных цитокинов. Следует отметить, что это изменение иммунного ответа не привело к изменению клинической картины заболевания [78].
1.2.5. Индуцированное вакциной усиление заражения
Первое крупное плацебо-контролируемое испытание (испытание STEP) вакцины-кандидата Ad5-HIV было прекращено досрочно, когда запланированный промежуточный анализ продемонстрировал значительно более высокий уровень ВИЧ-инфекции у вакцинированных мужчин, которые были вакцинированы Ad5. серопозитивные на исходном уровне vs.плацебо (5,1% против 2,2% в год) и / или были необрезанными (5,2% против 1,4% в год) [79]. Более длительный последующий анализ (после раскрытия слепых данных) подтвердил первоначальные данные об увеличении инфицирования ВИЧ у вакцинированных по сравнению с группой плацебо [80]. Хотя разница в частоте инфицирования ВИЧ была относительно небольшой, она была статистически значимой (отношение рисков 1,40 (95% ДИ, 1,03–1,92; p = 0,03)). При расширенном анализе данных 49 из 914 мужчин-реципиентов вакцины стали ВИЧ-инфицированными (ежегодная заболеваемость 4.6%, 95% доверительный интервал от 3,4 до 6,1), и 33 из 922 мужчин, получавших плацебо, стали ВИЧ-инфицированными (годовая частота 3,1%, 95% доверительный интервал от 2,1 до 4,3). Возможные объяснения этой повышенной восприимчивости к ВИЧ-инфекции у вакцинированных включают отсутствие антигена ВИЧ-Env в вакцине с возможностью того, что иммунный ответ ВИЧ, индуцированный вакциной, потенциально индуцирует прикрепление ВИЧ к клеточной поверхности, но не убивает или нейтрализует вирус, тем самым обеспечивая проникновение вируса в клетку. Хотя причина очевидной повышенной восприимчивости к заражению ВИЧ, вызванной вакциной, так и не была полностью объяснена, вывод о том, что вакцина увеличила заражение ВИЧ, остается твердым.Клинические данные у тех вакцинированных, которые были инфицированы, также наводили на мысль об усилении болезни или, по крайней мере, сокращении времени от заражения до начала проявлений болезни.
Хотя никакая другая вакцина не была однозначно связана с усилением инфицирования, вполне вероятно, что это не является уникальным исходом для ВИЧ-инфекции. Принято считать, что обострение заболевания, связанное с инактивированной вакциной против кори или вакциной против RSV, имело место, но об увеличении инфицирования широко не сообщалось ни для инактивированной формалином RSV, ни для инактивированной противокоревой вакцины.Однако это могло не быть замечено из-за высокого уровня инфицирования корью или RSV в исследуемых популяциях в то время. Кроме того, четыре испытания вакцины против RSV, инактивированной формалином, не были плацебо-контролируемыми [23], [24], [25], [26]. Использовали контрольную вакцину (кандидатную вакцину против парагриппа 3 — PIV3) или исторические контроли. Тем не менее, в двух испытаниях вакцины против RSV [23] частота атак, особенно у детей младше 12 месяцев, была выше, чем в контрольной группе PIV3.В одном исследовании у 23 из 31 (74%) новорожденного, вакцинированного RSV, позже развилась инфекция RSV по сравнению с 21 из 40 (53%) инфекций RSV у детей, получавших PIV3 (нескорректированный хи-квадрат 5,1505; p-значение 0,023) [23 ]. Во втором исследовании у 13 из 43 (30%) новорожденных, вакцинированных RSV, позже развилась инфекция RSV, по сравнению с 5 из 46 (11%) RSV-инфекций у детей, получавших PIV3 (нескорректированный хи-квадрат 5,1645; p-значение 0,023) [24 ].
В случае инактивированной противокоревой вакцины, инактивированная противокоревая вакцина оценивалась в испытаниях, в которых сравнивали инактивированную вакцину плюс по крайней мере одну дозу живой противокоревой вакцины с контрольной группой только с живой противокоревой вакциной [81].Таким образом, хотя клиническое усиление кори было отмечено в группе инактивированной противокоревой вакцины, количество случаев прорыва кори было слишком маленьким, чтобы выявить разницу в заболеваемости.
Таким образом, хотя возникновение повышенного инфицирования ВИЧ, вызванного вакциной-кандидатом Ad5-HIV, стало общепризнанным как следствие иммунизации этой конкретной вакциной, усиленное приобретение инфекции не воспринималось как имевшее место с другими вакцинами.Хотя разница в количестве ВИЧ-инфекций была относительно небольшой в испытании STEP, знаменатели были большими, и вывод о том, что вакцина Ad5-HIV вызвала усиление заражения, в настоящее время является общепринятым. Для инактивированной вакцины против RSV испытания были относительно небольшими, но частота прорывных инфекций RSV была намного выше, что также привело к статистически значимому увеличению показателей инфицирования в группах вакцины RSV. Это очевидное усиление заражения могло быть упущено из виду, потому что тяжесть усиленного заболевания, возникающего у вакцинированных, затмевала более высокий риск инфицирования RSV, связанный с вакциной, и потому что фоновые уровни инфицирования RSV были высокими у реципиентов контрольных вакцин как RSV, так и PIV3.
1.3. Как существующие модели на животных влияют на оценку VAED у людей?
Хотя животные модели были разработаны для большинства респираторных вирусов, они редко воспроизводят полный спектр соответствующего заболевания человека. Таким образом, оценка риска VAED на животных моделях несовершенна и ограничена. Тем не менее, модели на животных по-прежнему могут предоставить полезную информацию о потенциальных патогенных механизмах и выявить маркеры потенциальных рисков, которые можно рассмотреть для включения в клинические испытания.
Некоторые уроки могут быть сохранены из предыдущего опыта VAED. Сегодня доклинические исследования вакцины против RSV, которые указывают на индукцию слабых нейтрализующих и сильных ненейтрализующих ответов с Th3-типами Т-клеточных ответов, предполагающих риск VAED, могут привести к изменениям в стратегиях разработки вакцины. Во-первых, выбор антигена (ов) имеет решающее значение для обеспечения соответствующего баланса продукции нейтрализующих и ненейтрализующих антител. Во-вторых, некоторые кандидатные субъединичные вакцины RSV теперь содержат адъюванты, управляющие Th2, которые уменьшают выраженный Th3-ответ и эозинофильную реакцию после контакта с диким вирусом.В-третьих, предпочтение может быть отдано вакцинам против RSV, которые могут вызывать длительные и сильно нейтрализующие ответы антител и созревание аффинности, чтобы избежать постепенного снижения уровней антител.
При планировании фазы 1/2 клинических испытаний новых вакцин-кандидатов против острых респираторных инфекций полезно проанализировать маркеры врожденного и приобретенного иммунитета, и наблюдения, сделанные на моделях животных, могут быть информативными. Что касается врожденного иммунитета, подробная оценка фенотипических маркеров моноцитов и NK-клеток, а также различных циркулирующих цитокинов (например,г. IFN-alpha, IL-10) в первые 24 часа после иммунизации, как было показано, коррелирует с долгосрочными характеристиками последующих ответов антител [82]. Также необходимо контролировать Т-клеточные ответы, включая анализ цитокинового профиля Т-клеточных ответов CD4 и CD8 с множественными маркерами Th2 и Th3. Отсутствие маркеров Th3, таких как IL-4, IL-5 или IL-13, при наличии устойчивых ответов IFN-гамма может указывать на более низкий риск некоторых форм VAED. Модели на животных определили паттерны ответа антител, которые связаны с низким риском VAED, включая высокое соотношение нейтрализации и нейтрализации.антигенсвязывающие антитела, антитела к антирецепторному связывающему домену (RBD) с высокой аффинностью (наномолярный диапазон) и кинетика антител, демонстрирующая устойчивые ответы IgG с течением времени. Можно также рассмотреть пассивный перенос сыворотки (содержащей различные уровни антител) от иммунизированных участников испытания фазы 1 в подходящие модели животных до вирусного заражения, чтобы оценить риск обострения заболевания после инфицирования.
1.4. Пробелы в знаниях в текущем понимании потенциального VAED в контексте SARS-CoV-2
1.4.1. Механизмы
Различные пути могут привести к VAED. SARS-CoV-2 — это новый патоген, не имеющий специфического иммунитета в популяциях всех возрастов, и он имеет значительную степень вариабельности в своих клинических проявлениях. Кроме того, до сих пор не выяснены механизмы его патогенеза. Следовательно, трудно понять, как аберрантные иммунные ответы могут изменить процесс, который еще недостаточно изучен и который сам по себе представляет значительный спектр клинических проявлений.Однако VAED всегда включает в себя реакцию памяти, вызванную вакцинацией, и, как показывает опыт, который до сих пор лучше всего охарактеризован, нацелен на те же органы, что и инфекции дикого типа. Поэтому наличие клинических данных и образцов от пациентов с инфекциями дикого типа (не вакцинированных) имеет решающее значение для проведения любых оценок и решений относительно наличия усиления болезни при анализе вакцины-кандидата.
1.4.2. Модели на животных
Есть несколько важных деталей, которые следует учитывать при тестировании вакцин-кандидатов на предмет риска VAED на животных моделях, независимо от выбранных видов: [1] потребность в группе контроля инфекции дикого типа с отрицательным результатом является первостепенной.Вакцина может казаться безопасной в отсутствие базового контроля инфекции дикого типа, особенно когда положительный контроль VAED представляет преувеличенный фенотип; [2] важность методической очистки всех контрольных посевов и проблем от клеточного мусора, что может повысить реактогенность в моделях на животных и смещения наблюдений; [3] признавая безотлагательность продолжающейся пандемии, может быть важно подождать значительный период времени между иммунизацией и заражением, поскольку раннее заражение может помешать исследователям увидеть эффекты, которые станут очевидными позже.Для этой цели наиболее информативным может быть испытание после того, как титры антител упадут до низких — возможно, незащищенных — уровней; [4] тщательно отбирали воспроизводимые модели VAED в качестве положительного контроля при оценке. Некоторые животные модели могут не воспроизводить одни и те же проявления, и отрицательный тест в отсутствие надлежащих положительных контролей может быть обманчивым; и [5] отдавать предпочтение моделям с клиническими проявлениями болезни над моделями, демонстрирующими только патологические изменения. В противном случае результаты могут быть искажены из-за подчеркивания патологических различий с неопределенной клинической значимостью.
1.4.3. Платформы вакцин
Многие вакцины проходят оценку для SARS-CoV-2 и других новых патогенов [83]. К ним относятся хорошо зарекомендовавшие себя вакцинные конструкции, используемые в существующих лицензированных вакцинах (белковые субъединицы, инактивированные, вирусоподобные частицы и реплицирующиеся вакцины с вирусным вектором), а также новые технологии (вакцины на основе нуклеиновой кислоты, ДНК или мРНК), которые позволяют быстро разрабатывать вакцины. вакцины-кандидаты [84]. Некоторые вакцины могут быть более подходящими для определенных групп населения, таких как пожилые люди, дети и беременные женщины, по сравнению со здоровыми взрослыми.Безопасность, иммуногенность и эффективность вакцин против SARS-CoV-2 должны быть тщательно оценены до их использования среди населения в целом, особенно с учетом опасений по поводу усиления заболевания и глобальной потребности в эффективных вакцинах для борьбы с пандемией COVID-19.
1.4.4. Адъюванты
Адъюванты использовались в вакцинах и вводились миллиардам людей. Основываясь на этом опыте и в контексте разработки вакцины против других пандемических вирусов, вызывающих острые респираторные вирусные инфекции, адъюванты могут помочь: [1] повысить уровень и устойчивость защитного гуморального ответа и расширить его эпитоп-зависимую специфичность [2] вызвать искаженный ответ в сторону более функциональных иммунных ответов, включая клеточный ответ, и [3] выработка антиген-сберегающих подходов, способных доставлять больше доз вакцины в контексте продолжающейся пандемии.
Адъюванты обладают способностью усиливать иммунные ответы за счет активации врожденного иммунитета, обусловливая уровень и качество антител и Т-клеточные ответы, специфичные к вакцинному антигену [85]. Было показано, что в дополнение к антителам наиболее эффективные адъюванты, такие как эмульсии или адъюванты, содержащие сапонины и лиганды Toll-подобных рецепторов, вызывают устойчивые и продолжительные полифункциональные CD4 + Т-клеточные ответы с преобладанием IL-2, IFN-g и TNF-ответ, но очень мало Th3-ассоциированных цитокинов [86], [87].Т-клеточные ответы CD8 также обычно не усиливаются адъювантными рекомбинантными вакцинами.
Таким образом, в контексте усиления заболевания использование соответствующих адъювантов в субъединичных вакцинах может быть возможным путем управления потенциальным риском VAED, в особенности тех, которые вызывают более сильный врожденный ответ. Однако как ранее существовавший иммунитет, так и тип антигена влияют на влияние адъюванта на иммунный ответ, и поэтому каждая комбинация антиген / адъювант требует специальной оценки.Профиль безопасности адъювантных вакцин также будет зависеть от механизма действия адъюванта. На ранних этапах клинических испытаний вакцин-кандидатов будет важно оценить влияние адъюванта не только на величину, но, что более важно, на качество иммунного ответа, такого как функциональность антител и профилирование Т-клеток. В этом отношении было показано, что нечеловеческие приматы, а не мыши, лучше всего отражают поведение адъювантов, наблюдаемых у людей, и, следовательно, представляют собой хорошую прогностическую модель для выбора рецептуры [88].
1.5. Диагностика и дифференциальная диагностика VAED / VAERD
Для диагностики VAED не существует одного или комбинации конкретных подтверждающих тестов. Поскольку клинические проявления VAED лежат в спектре естественного заболевания, которое чаще и / или тяжело встречается у вакцинированных лиц, также трудно отделить неэффективность вакцины (также называемую прорывной болезнью) от VAED у вакцинированных лиц. Все случаи неэффективности вакцины должны быть исследованы на VAED.Неудача вакцины определяется как возникновение конкретного заболевания, которое можно предотвратить с помощью вакцины, у человека, который надлежащим образом и полностью вакцинирован, с учетом инкубационного периода и нормальной задержки для получения защиты в результате иммунизации [89]. Оценка дисфункции одного или нескольких органов, атипичных иммунных и воспалительных реакций, идентификация и количественная оценка вирусов, а также гистопатология могут помочь в диагностике и классификации степени и серьезности заболевания, возникающего после вакцинации.Однако окончательное установление случая VAED / VAERD может оказаться невозможным, а установление возникновения VAED / VAERD может быть возможным только в контексте крупных рандомизированных контролируемых клинических исследований или во время постлицензионного наблюдения за безопасностью.
1,6. Оценка тяжести заболевания и классификация
Классификация или стандартизированный метод оценки тяжести заболевания для VAED / VAERD недоступны. В случае инфекции денге, когда возникновение опосредованного антителами усиления заболевания при повторном заражении является хорошо описанным феноменом, существующая клиническая классификация характеризует более тяжелые проявления заболевания.Точно так же существующие клинические характеристики заболевания и оценки тяжести заболевания могут использоваться для выявления и классификации случаев тяжелого или усиленного заболевания, возникающего после вакцинации.
Заявление о конкурирующих интересах
Авторы заявляют о следующих финансовых интересах / личных отношениях, которые могут рассматриваться как потенциальные конкурирующие интересы: Ф.М. Муньос — консультант Коалиции за инновации в обеспечении готовности к эпидемиям (CEPI) по разработке определений случаев сотрудничества Брайтона. для проекта «Платформа безопасности для экстренных вакцинаций» (SPEAC).
Дж. Крамер является членом Коалиции за инновации в обеспечении готовности к эпидемиям (CEPI).
К. Деккер — консультант Коалиции за инновации в обеспечении готовности к эпидемиям (CEPI) через проект Брайтонского сотрудничества по проекту платформы безопасности для экстренных вакцин (SPEAC) и консультант Medicago Inc.
М. Дадли — консультант Коалиции за инновации в обеспечении готовности к эпидемиям (CEPI) через Brighton Collaboration, за проект «Платформа безопасности для экстренных вакцинаций» (SPEAC).
Б. Грэм является автором заявлений на патент, находящихся на рассмотрении, связанных с вакцинами против коронавируса и моноклональными антителами.
М. Гурвит — консультант Коалиции за инновации в обеспечении готовности к эпидемиям (CEPI) через проект Брайтонского сотрудничества по проекту платформы безопасности для вакцинации в чрезвычайных ситуациях (SPEAC); и главный врач компании Verndari, Inc., которая разрабатывает вакцины от гриппа и Covid-19.
С. Перлман является членом рабочей группы ACIP по вакцинам против COVID-19.
Ф. Полак — исследователь вакцины Pfizer против COVID-19.
Б. Уорд — главный врач компании Medicago Inc., занимающейся разработкой вакцин против гриппа и Covid-19.
PH Lambert — консультант Коалиции за инновации в обеспечении готовности к эпидемиям (CEPI) по разработке определений случаев в формате Брайтонского сотрудничества и по обучению членов DSMB. Он также является членом нескольких DSMB по вакцинам.
Следующие авторы не раскрывают информацию о конфликте интересов: J.Спергель, Б. Лоу, Э. Ван Бракель, А. Дидьерлаурент.
Вакцины для путешествий и рекомендации для Мальдив
Мальдивы — это островное государство в Южной Азии, расположенное в Индийском океане. Он состоит из цепочки из 26 атоллов и является одной из самых географически удаленных стран.
Страна известна своими великолепными пляжами с голубой водой и белым песком. Есть даже пляжи, заполненные биолюминесцентными водорослями, которые светятся ночью, освещая воду.Есть различные острова и курорты на любой бюджет и любой вид деятельности.
Путешественники могут просто позагорать на пляже или заняться дайвингом и сноркелингом, чтобы увидеть коралловые рифы. Это потрясающий отдых для тех, кто любит пляж и знакомство с подводным миром.
Нужны ли мне вакцины для Мальдив?
Да, некоторые вакцины рекомендуются или требуются на Мальдивах. CDC и ВОЗ рекомендуют следующие вакцинации для Мальдив: гепатит A , гепатит B , брюшной тиф , желтая лихорадка , бешенство , менингит , полиомиелит , корь, эпидемический паротит и краснуха (MMR ) , Tdap (столбняк, дифтерия и коклюш) , ветряная оспа , опоясывающий лишай , пневмония и грипп .
Вакцинация от COVID-19 рекомендуется для поездок во все регионы, как зарубежные, так и внутренние. Обратитесь в местную клинику Passport Health, если в вашем районе предлагается вакцинация.
См. Пункты ниже, чтобы узнать больше о некоторых из этих ключевых прививок:
- COVID-19 —
Воздушно-капельный и прямой контакт —
Рекомендуется для всех невакцинированных лиц, отвечающих требованиям для вакцинации - Гепатит А —
Еда и вода —
Рекомендуется для большинства путешественников - Гепатит B —
Кровь и биологические жидкости —
Доступен ускоренный график - Брюшной тиф —
Еда и вода —
Прививка длится 2 года.Срок действия пероральной вакцины 5 лет, необходимо уметь глотать таблетки. Пероральные дозы необходимо хранить в холодильнике. - Желтая лихорадка —
Комар —
Требуется, если вы путешествуете из страны с риском передачи желтой лихорадки. - Бешенство —
Слюна инфицированных животных —
Вакцина рекомендуется для тех, кто путешествует на длительный срок, и тех, кто может контактировать с животными. - Полиомиелит —
Еда и вода —
Требуется, если вы прибываете из региона с передачей полиомиелита.Может потребоваться для паломников хаджа и умры. Считается обычной вакцинацией для большинства путешествий. Рекомендуется однократный бустер для взрослых. - Корь Свинка Краснуха (MMR) —
Различные переносчики —
Выдается всем, кто не вакцинирован и / или родился после 1957 года. Рекомендуется однократная ревакцинация для взрослых. - TDAP (столбняк, дифтерия и коклюш) –
Раны и переносимые по воздуху –
Требуется только одна ревакцинация от коклюша для взрослых. - Ветряная оспа —
Прямой контакт и воздушно-капельным путем —
Выдается лицам, не прошедшим вакцинацию и не болевшим ветряной оспой. - Опоясывающий лишай —
Прямой контакт —
Вакцину можно делать, если у вас был опоясывающий лишай. - Пневмония —
Воздушно-капельная —
Две вакцины вводятся отдельно. Все люди старше 65 лет или с ослабленным иммунитетом должны получать оба препарата. - Грипп —
Воздушный —
Компоненты вакцины меняются ежегодно. - Менингит —
Воздушный и прямой контакт —
Выдается всем, кто не вакцинирован или находится в группе повышенного риска, особенно студентам.
Дополнительные сведения см. В таблицах ниже:
Рекомендуемые туристические прививки для Мальдив | ||
| ВАКЦИНА | КАК РАСПРОСТРАНЯЕТСЯ ЗАБОЛЕВАНИЕ | ПОДРОБНЕЕ |
|---|---|---|
| COVID-19 | Бортовой и прямой контакт | Рекомендуется для всех непривитых лиц, отвечающих требованиям для вакцинации |
| Гепатит А | Еда и вода | Рекомендовано для большинства путешественников |
| Гепатит В | Кровь и жидкости организма | Доступен ускоренный график |
| Брюшной тиф | Еда и вода | Продолжительность выстрела 2 года.Срок действия пероральной вакцины 5 лет, необходимо уметь глотать таблетки. Пероральные дозы необходимо хранить в холодильнике. |
| Желтая лихорадка | Комаров | Требуется, если вы путешествуете из страны с риском передачи желтой лихорадки. |
| Бешенство | Слюна инфицированных животных | Вакцина рекомендуется для тех, кто путешествует на длительный срок и может контактировать с животными. |
| Полиомиелит | Еда и вода | Обязательно, если вы прибываете из региона, где передается полиомиелит. Может потребоваться для паломников хаджа и умры. Считается обычной вакцинацией для большинства путешествий. Рекомендуется однократный бустер для взрослых. |
Регулярные прививки для Мальдив | ||
| ВАКЦИНА | КАК РАСПРОСТРАНЯЕТСЯ ЗАБОЛЕВАНИЕ | ПОДРОБНЕЕ |
|---|---|---|
| Корь Свинка краснуха (MMR) | Различные векторы | Выдается всем непривитым и / или родившимся после 1957 года.Рекомендуется одноразовый бустер для взрослых. |
| TDAP (столбняк, дифтерия и коклюш) | Ранения и полет в воздухе | Требуется только одна ревакцинация для взрослых от коклюша. |
| Ветряная оспа | Прямой контакт и бортовой | Выдается непривитым и не болеющим ветряной оспой. |
| Опоясывающий лишай | Прямой контакт | Вакцину можно сделать, если у вас был опоясывающий лишай. |
| Пневмония | В воздухе | Две вакцины вводятся отдельно. Все люди старше 65 лет или с ослабленным иммунитетом должны получать оба препарата. |
| Грипп | В воздухе | Компоненты вакцины меняются ежегодно. |
| Менингит | Бортовой и прямой контакт | Выдается всем, кто не прошел вакцинацию или находится в группе повышенного риска, особенно студентам. |
Источники: CDC, ВОЗ и ISTM
Чикунгунья и денге присутствуют на Мальдивах. Обязательно возьмите с собой и используйте репелленты от комаров и сетку.
Посетите нашу страницу о вакцинах, чтобы узнать больше. Путешествуйте безопасно с Passport Health и назначьте встречу сегодня, позвонив или забронируйте онлайн прямо сейчас.
Нужна ли мне виза на Мальдивы?
Посетители Мальдив должны иметь паспорт со сроком действия не менее шести месяцев для въезда в страну.Виза выдается бесплатно по прибытии в страну и действительна в течение 30 дней.
Требования для въезда на Мальдивы | ||
| Нужен ли мне… | Для моей поездки на Мальдивы? | |
|---|---|---|
| Паспорт | ||
| Туристическая виза | ||
| Деловая виза | ||
| Прививки | ||
Источники: посольство Мальдивских островов и США.S. Государственный департамент
Для получения дополнительной информации свяжитесь со специалистом по паспортам здоровья, паспортам и визам, позвонив по телефону 1-844-366-8472 или заполнив нашу онлайн-форму.
Какой климат на Мальдивах?
Мальдивы имеют тропический климат. Здесь жарко круглый год, с апреля по сентябрь на него влияют муссоны. Температура стабильная, обычно держится на уровне 80-х. Дожди бывают короткие, сильные в течение всего года. С января по март более сухие.
Насколько безопасны Мальдивы?
Существует угроза терроризма и жестоких нападений на граждан США на Мальдивах. Посетители должны проявлять осторожность, особенно ночью, и избегать больших скоплений людей. Уровень преступности на Мальдивах умеренный, а насилие со стороны группировок растет. Путешественникам следует соблюдать меры предосторожности при посещении крупных городов или в ночное время. Путешествуйте группами и следите за своим окружением.
Подводный тур по Мальдивам
Избегайте неловкой остановки
Путешественники могут отправиться в удивительный подводный поход, чтобы увидеть великолепную дикую природу Индийского океана.Трансферное судно может забрать вас из Мале или из аэропорта и доставить к месту подводного плавания. Отсюда вы сядете на подводную лодку и отправитесь в 45-минутное путешествие на 100 футов ниже уровня моря. Вы можете увидеть коралловые рифы, скатов манты, акул и разноцветных рыбок на удобной подводной лодке с кондиционером.
Что взять с собой на Мальдивы?
Обязательно привезите на Мальдивы следующие предметы:
- Купальник — Мальдивы известны своими пляжами, поэтому возьмите с собой пару купальников, чтобы насладиться теплой водой.
- Umbrella — На Мальдивах часто идут дожди. Возьмите с собой зонт, чтобы не высохнуть, если вы попадете под ливень.
- Солнцезащитный крем — Отдых на пляже — обычное времяпрепровождение на Мальдивах. Обязательно вспенитесь солнцезащитным кремом, чтобы предотвратить ожоги.
Посольство США на Мальдивах
Во время путешествия очень полезно узнать, где именно находится посольство или консульство США. Запишите адрес на тот случай, если у вас возникнут проблемы с законом, вы потеряете паспорт или хотите сообщить о преступлении.Обязательно имейте при себе копию паспорта на случай, если вы потеряете оригинал.
Хотя на Мальдивах нет консульства или посольства, услуги предоставляются через:
Виртуальная миссия США на Мальдивах
210 Galle Road
Colombo 03
Шри-Ланка
Телефон: +94 (11) 249-8500
Готовы начать следующее путешествие? Позвоните нам по телефону или забронируйте онлайн сейчас!
Отзывы клиентов
Паспорт здоровья — туристические вакцины для Мальдив
Общий рейтинг: 5 звезд — 4 отзыва
❮❯
★★★★★
«Отличное обслуживание»«Приходил и уходил за 45 минут во время моей поездки на Мальдивы, очень дружелюбный, услужливый и дал хорошие рекомендации.Никогда не чувствовал давления, заставляющего покупать то, что мне не нужно. Не могу придумать, что бы я изменил, кроме более гибкого графика работы! »
★★★★★
«УДИВИТЕЛЬНЫЕ дамы!»«Я посетила место на мосту Холкомб за прививками для путешествий, так как собираюсь навестить свою семью на Мальдивах. Дамы в офисе, где приятно и с которыми можно иметь дело. Со мной хорошо обращались, и они ответили на все мои вопросы относительно моей поездки и того, что мне было нужно (даже указания, как туда добраться).Я НАСТОЯТЕЛЬНО рекомендую это место всем, кто нуждается в вакцинации! »
★★★★★
«Приятно удивлен»«Я никогда не слышал о Passport Health еще 2 дня назад. Я позвонила своему семейному врачу и спросила, нужны ли мне прививки для поездки на Мальдивы. Он рекомендовал Паспорт здоровья. Я позвонил и смог записаться на следующий день. Я пришел и получил буклет с указанием пунктов назначения, в которые я собирался, и прививок, рекомендованных Центром контроля заболеваний.Я очень доволен полученным обслуживанием ».
★★★★★
«Потрясающие впечатления»«Было приятно работать с профессионалами, имеющими большой опыт в области путешествий. Обожаю буклет о поездке на Мальдивы! »
На этой странице:
Нужны ли мне вакцины для Мальдив?
Нужна ли мне виза на Мальдивы?
Какой климат на Мальдивах?
Насколько безопасны Мальдивы?
Тур на подводной лодке на Мальдивах
Что взять с собой на Мальдивы?
U.S. Посольство на Мальдивах
Новые средства защиты для крупнейшей в мире популяции гигантских скатов
Гигантские скаты манты привлекли внимание всего мира в апреле прошлого года, когда рыбак на севере Перу случайно поймал бегемота весом 2 000 фунтов (900 кг).
Случайное зацепление этого большого ската (гигантские океанические скаты-манты могут весить до двух тонн) высветило глобальные угрозы, с которыми сталкиваются скаты, и привлекло внимание Перу, в водах которого обитают многие из гигантов.
31 декабря 2015 года Перу сделало важный шаг в направлении помощи гигантским скатам мантов, приняв резолюцию, которая не только запрещает лов мантов, но также требует, чтобы рыбаки немедленно выпускали всех мантов, пойманных случайно в качестве «прилова», обратно в океан.
Скаты-манты нередко запутываются в сетях или леске. Но лучи также намеренно нацелены на их мясные и жаберные пластины, которые фильтруют планктон во время плавания. Жаберные пластины считаются кулинарным деликатесом в Китае, где они также используются в традиционной медицине для уменьшения токсинов, улучшения кровообращения, лечения рака, увеличения количества грудного молока, а также для лечения ветряной оспы и других заболеваний.Нет никаких научных доказательств того, что зелья манты эффективны в любом из этих случаев.
По данным WildAid, неправительственной организации, которая стремится остановить незаконную торговлю дикими животными, торговля жаберными пластинами манты составляет 30 миллионов долларов в год, 99 процентов из которых приходится на одну китайскую провинцию: Гуанчжоу. Спрос резко вырос в последние годы, отчасти в качестве альтернативы акульим плавникам.
В недавнем отчете New York Times отмечалось, что чрезмерный вылов рыбы нанес серьезный ущерб многим популяциям мантов в мире.Мало что известно об общей численности, но Красный список Международного союза охраны природы, который предоставляет данные о численности и статусе сохранности видов, обнаружил, что некоторые региональные популяции сократились на 80 процентов за последние 75 лет.
Манты размножаются чрезвычайно медленно, рождая по одному щенку каждые два-пять лет, поэтому даже ограниченная рыбная ловля оказывает значительное влияние. Перу является домом для самой большой известной в мире популяции гигантских скатов манты.
Продавец в магазине держит жабры ската манты. Жабры используются в традиционной медицине и считаются кулинарным деликатесом, как и мясо скатов манты.
Фотография Пола Хилтона, Barcroft Media / Getty ImagesПожалуйста, соблюдайте авторские права. Несанкционированное использование запрещено.
Благодаря новым правилам, Перу присоединяется к 12 другим странам с различной степенью защиты скатов манта. Перу — зеркало соседнего Эквадора, что важно для населения региона, поскольку манты мигрируют между водами двух стран.
Правила не распространяются на скатов мобула, аналогичный вид, которому также грозит серьезное сокращение, но, как говорит Питер Найтс, исполнительный директор WildAid, «это большое дело. Поскольку Индонезия, а теперь и Перу, взяли на себя обязательства по защите этого вида, два крупнейших промысла манты в мире закрыты. Мы надеемся, что другие страны, где мантам угрожает местное рыболовство, в частности Индия и Шри-Ланка, последуют нашему примеру ».
Читайте больше историй о преступлениях против дикой природы и их эксплуатации на Wildlife Watch .Присылайте советы, отзывы и идеи для историй по адресу [email protected] .
Скаты манты и человеческие младенцы — последние жертвы традиционной китайской медицины — Quartz
(Предупреждение: этот пост содержит графическое изображение.)
Традиционная китайская медицина несет ответственность за угрозу популяциям носорогов, панголинов и других животных. курносые обезьяны. Добавьте к этому списку еще одно животное: скатов.
Лучи подобны 40-летним девственницам рыбного мира.Их репродуктивная медлительность — часть того, почему они не могут заменить убитых. Однако более важным фактором является рост спроса в Китае на жабры, которые ценятся как традиционное средство. Цены на их жабры подскочили на 168% с 2010 года, говорится в новом отчете организации WildAid (pdf).
Плохо для лучей, но плохо и для людей. Жабры лучей могут содержать мышьяк, кадмий и другие смертоносные металлы, но торговцы традиционной китайской медициной продвигают их специально для кормящих грудью молодых матерей.Между тем, забой скатов угрожает годовым доходам в размере 140 миллионов долларов от дайв-туров, ориентированных на скаты, — большей части этого дохода в бедных прибрежных странах Африки и Азии, которым нужны доходы от туризма.
WildAid
Золотая жила в их жабрах
Манты и подвижные скаты питаются, фильтруя пищу через хрящевые сита внутри своих жабр. Тушеные в виде тонизирующего супа (ссылка на китайском), ценимого в южной традиционной китайской медицине, эти «жаберные пластины» или «жаберные тычинки» вырезаны из туш манты, серповидных дьявольских лучей или спиннохвостых мобул (убийство для жабр). других мобулидов встречаются реже).
Рыбаки могут положить в карман от 40 до 500 долларов за жаберные пластины одного ската манты. Остальные его части имеют небольшую коммерческую ценность, хотя рыбаки иногда могут заработать дополнительные несколько долларов, продавая мясо для использования в поддельных гребешках и кормах для животных, а также кожу для изготовления обуви и кошельков.
Sascha Kellershon
Мало что еще ценно, кроме их жабр.Эликсиры для здоровья и средства для кормления: быстро развивающийся рынок
Торговцы в южном городе Гуанчжоу, где происходит большая часть торговли, говорят, что теперь они продают вдвое больше, чем в 2010 году, по данным WildAid, который опросил более 1100 человек. вендоров в 2010 и 2013 гг.По оценкам WildAid, отрасль оценивается в 30 миллионов долларов по сравнению с 11 миллионами долларов в 2010 году (pdf, стр. 3).
Почему всплеск? Несмотря на отсутствие в официальных руководствах по традиционной медицине, жаберные пластины продаются в качестве детоксифицирующих агентов и усилителей иммунной системы, а также для лечения ветряной оспы у детей. Однако совсем недавно продавцы начали рекомендовать это средство в качестве вспомогательного средства для кормления грудью молодых матерей. (Грудное вскармливание, которого в Китае десятилетиями избегали, сейчас набирает популярность, отчасти благодаря поддержке правительства.)
Жаберные пластины становятся мейнстримом
Затем , как они продаются. В последний раз, когда WildAid проводило расследование, жаберные пластины продавались в основном потребителям в обычных магазинах, таких как этот:
WildAid / Hilton
Предполагаемый объем убитых сухих жабр мобулидов для рынков Гуанчжоу в 2013 году составляет примерно 147000 особей. .С тех пор лекарство получило широкое распространение в средствах массовой информации, включая специальный выпуск популярного телешоу с демонстрацией кулинарии и обсуждением пользы жабр для здоровья фармацевтом из местной больницы, сообщает WildAid.(Это несмотря на то, что официальные руководства не признают его лечебный эффект.) Они также стали более широко доступны в Интернете:
Скриншот Taobao.com
Самый дорогой листинг здесь — 2650 юаней за килограмм (190 долларов за фунт). ).Содержит мышьяк, ртуть и другие смертоносные тяжелые металлы
Быстрое расширение рынка вызывает особую тревогу, учитывая то, что независимая лаборатория обнаружила в токсикологических испытаниях жаберных пластин: все образцы пластин жабр манты и мобулы, взятые с рынков Гуанчжоу, содержат мышьяк, кадмий, ртуть и свинец.
WildAid
Неудивительно, что 99% из 1000 респондентов опроса жителей Гуанчжоу, проведенного WildAid, не знали о тяжелых металлах, присутствующих в жаберных пластинах.Даже в небольших количествах ртуть угрожает развитию детей в утробе матери и в раннем детстве; Уровни мышьяка и кадмия, обнаруженные лабораторией в образцах, могут вызывать рак и нарушать функцию почек. Онлайн-опрос потребителей Гуанчжоу, проведенный WildAid, показал тревожные результаты. Отнюдь не роскошное чудо-лекарство — как, скажем, части панголина — крупнейшими потребителями жаберных пластин являются работающие женщины, пытающиеся сохранить здоровье своих семей.
Reuters / Tan Shung Si
Турист, ныряющий с аквалангом, фотографирует ската манта в заливе Ханифару на Мальдивах.500 долларов сейчас… или 1 миллион долларов позже?
Лоскутное одеяло законов по всему миру защищает манту и, в гораздо меньшей степени, скатов мобула (хотя у ученых нет данных о популяциях двух видов мобул, которые обычно убивают из-за торговли жаберными пластинами). Однако рыболовные суда в Шри-Ланке, Индии, Мозамбике и Перу, среди других мест, по-прежнему активно нацелены на скатов, чтобы извлечь выгоду из спроса со стороны Китая.
WildAid предлагает другой способ расчета стоимости скатов: для гидов то же самое животное, которое рыбаки могут продать за 40 и 500 долларов, принесет доход от дайв-туризма в размере 1 миллиона долларов за всю свою жизнь, заявляет организация по охране природы. Это противоречие между мгновенным удовольствием рыбака и долгосрочным бизнесом гида обременяет бедные прибрежные экономики.
Например, в бухте Иньямбане в Мозамбике, одном из крупнейших мест для дайвинга в мире, количество скатов манта сократилось на 87% всего за десятилетие, говорят ученые.Еще в 2004 году дайв-туристы встречали в среднем 6,8 ската за погружение; к 2011 году этот показатель снизился до 0,6 (pdf, стр. 34).
Некоторые страны усиливают защиту. Правительство Индонезии работает над законодательством по созданию крупнейшего на планете заповедника скатов манта. А на прошлой неделе Мальдивы сделали еще более смелый шаг. Островное государство, сильно зависящее от туризма и имеющее самую большую популяцию мантов в мире, запретило отлов или причинение вреда любым из 18 видов скатов в своих водах. «Лучи стали настолько редкими, что мы опасаемся его исчезновения, когда он приносит большую прибыль в сфере туризма», — сказал Ибрагим Наим, глава агентства по охране окружающей среды Мальдив.
Кальций влияет на конкурентоспособность кислоточувствительных и кислотоустойчивых штаммов Bradyrhizobium japonicum в клубеньке и фиксации азота двумя сортами сои в кислой почве | Интернет-исследования в области здравоохранения и окружающей среды (HERO)
Заголовок
Кальций влияет на конкурентоспособность кислотоочувствительных и кислотоустойчивых штаммов Bradyrhizobium japonicum в клубеньке и фиксации азота двумя сортами сои в кислой почве.
Авторы)
Индрасумунар, А; Menzies, NW; Дарт, ПиДжей
Журнал
Биология и биохимия почвы
ISSN: 0038-0717
EISSN: 1879-3428
Абстрактный
В эксперименте в теплице изучалась роль кальция и pH в конкурентоспособности кислотоочувствительных и кислотоустойчивых штаммов Bradyrhizobium japonicum с аналогичной эффективностью N-2-фиксации в клубеньках двух сои (Glycine max L.Merr), выбранные по устойчивости к алюминию (PI416937) или марганцу (Manta). Известкование дает кальций (Ca), а также увеличивает pH почвы. Таким образом, трудно разделить влияние Ca и pH почвы. Мы исследовали влияние Ca как такового, сравнивая реакцию на добавку гипса и извести на конкурентоспособность кислотоустойчивых и кислоточувствительных штаммов в клубеньковой сои в кислой почве. Кислотную почву обрабатывали либо CaSO4, либо CaCO3 и инкубировали в течение 2 недель перед посевом семян сои.Два кислотоочувствительных и два кислотоустойчивых штамма B. japonicum смешивали друг с другом (один кислотоустойчивый плюс один кислотоустойчивый) и инокулировали семена сои из расчета 10 (6) КОЕ семян (-1). PH почвы, измененный добавлением извести, оказал большее влияние на клубенько, чем добавление кальция в форме гипса. На реакцию влияли сорт и штамм сложным образом с заметным взаимодействием между штаммом и сортом. Один кислотоустойчивый штамм образует большинство клубеньков с обоими сортами в неизмененной почве с pH 4.36 в конкуренции с одним чувствительным к кислоте штаммом. Тот же кислотоустойчивый штамм не был конкурентоспособным со вторым кислотоочувствительным штаммом с Manta, но был с PI416937. Второй кислотоустойчивый штамм не мог конкурировать ни с одним из чувствительных к кислоте штаммов в почвах без поправок и обработанных гипсом. Он был конкурентоспособен только с PI416937 в известкованной почве, что довольно неожиданный результат. Инокуляция этой почвы без местных клубеньковых штаммов сои, увеличенная масса побегов,% поглощения N, N. Фиксация N-2 была значительно усилена инокуляцией и добавлением извести и, в меньшей степени, добавлением гипса для Manta.Этот эксперимент показывает, что добавление Ca как такового в виде гипса к кислой почве мало влияет на симбиотические характеристики, но изменение pH путем известкования имеет большое влияние, так как сорт сои и штамм B. japonicum влияют на конкурентоспособность штаммов в кислой почве и что кислотостойкость не обязательно увеличивает конкурентоспособность штамма.
