Урология » Есть ли скрининг для мочеполового туберкулеза?
- Архив журнала /
- 2017 /
- №6
Есть ли скрининг для мочеполового туберкулеза?
С.Ю. Шевченко, Е.В. Кульчавеня
1 ФГБУ «Новосибирский НИИ туберкулеза» Минздрава России, Новосибирск, Россия; 2 ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия
Введение. Большая часть больных мочеполовым туберкулезом выявляется слишком поздно. Одна из причин этого – отсутствие простого дешевого надежного скрининга.
Цель исследования: изучить возможность применения аллергена туберкулезного рекомбинантного (диаскинтест) в качестве скрининга в отношении фтизиоурологических больных.
Материалы и методы. Проведено простое проспективное открытое когортное сравнительное исследование, в которое включили 197 пациентов, поступивших для дифференциальной диагностики в Новосибирский НИИ туберкулеза в 2014–2016 гг. У 72 обследованных был подтвержден урогенитальный туберкулез, у 125 – отвергнут в пользу хронических неспецифических инфекций.
У 72 обследованных был подтвержден урогенитальный туберкулез, у 125 – отвергнут в пользу хронических неспецифических инфекций.
Заключение. Диаскинтест может быть использован в скрининге мочеполового туберкулеза, однако положительный его результат не может служить основанием для установления диагноза, а только служит поводом для углубленного фтизиоурологического обследования с использованием дополнительных провокационных проб, в частности пробы Коха, которая показала высокую диагностическую ценность.
Ключевые слова: мочеполовой туберкулез, туберкулин, диаскинтест, дифференциальная диагностика, диагностика, скрининг, инфекции мочевыводящих путей
Введение. Отчеты ВОЗ демонстрируют неизменный рост заболеваемости туберкулезом, смертности и коморбидности с инфекцией вируса иммунодефицита человека (ВИЧ) [1]. В 2015 г. в мире туберкулезом заболели 10,4 млн человек, умерли от него 1,8 млн, из них 0,4 млн были ВИЧ-инфицированными [1]. Эпидемическая ситуация по туберкулезу в целом тщательно анализируется в регионах и экспертами ВОЗ, однако эпидемиологические показатели по внелегочному, в частности мочеполовому, туберкулезу (МПТ) остаются алогично парадоксальными [2–12], что объясняется как сложностью диагностики и нехваткой специалистов, так и разночтением основных понятий и классификаций [3, 9, 11]. Неоптимальная эмпирическая терапия, проводимая больным циститом и/или пиелонефритом, делает невозможным патоморфологическую верификацию МПТ, а также резко снижает эффективность бактериологических методов выделения возбудителя туберкулеза [13–25].
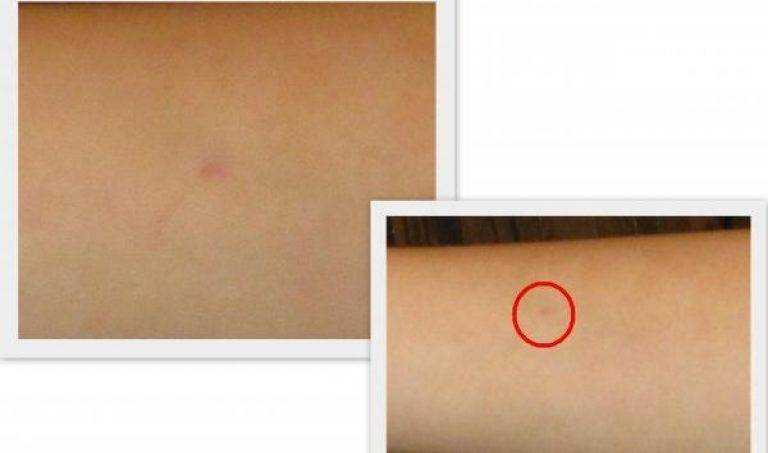
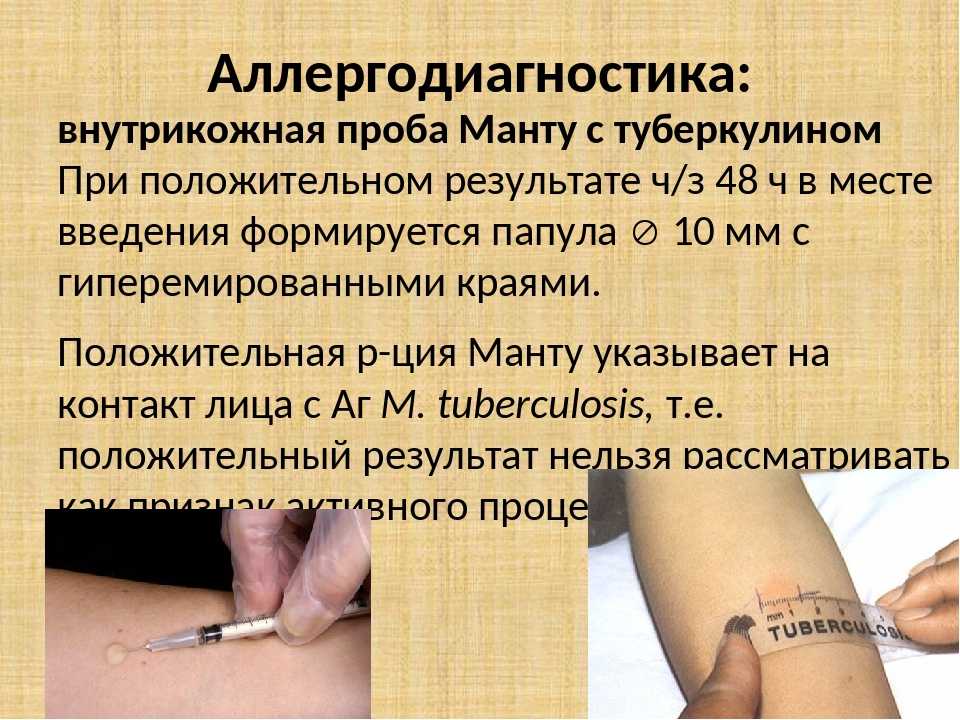
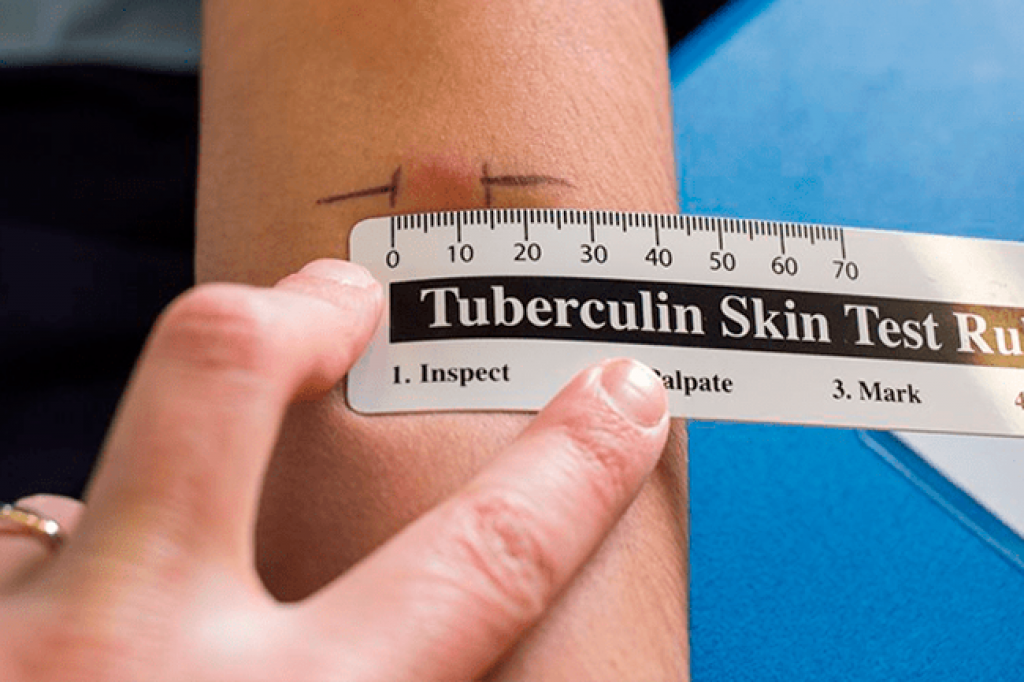
Туберкулиновые пробы – внутрикожная с 2 ТЕ (проба Манту) и подкожная провокационная с 20–50–100 ТЕ (проба Коха) – долгое время считались базовыми в диагностике туберкулеза любых локализаций. Появление в 2011 г. отечественной разработки – аллерген туберкулезный рекомбинантный – диаскинтеста (ДСТ) позволило дифференцировать поствакцинную и инфекционную аллергию у детей; ДСТ показал хорошие результаты как скрининговый метод при туберкулезе органов дыхания и широко используется во фтизиатрии и фтизиопедиатрии [26–29].
После расшифровки в 1998 г. генома M. tuberculosis появилась возможность использовать отдельные специфичные для этой бактерии белки для диагностики туберкулеза. Interferon-gamma release assay (IGRA)-тесты (QuantiFERON-TBGold, TB.SPOT.test) – современные методы выявления латентной туберкулезной инфекции, положительные результаты которых ассоциированы с процессом активного размножения M. tuberculosis. TB.SPOT.test основан на количественной оценке сенсибилизированных Т-лимфоцитов в ответ на стимуляцию пептидными антигенами, которые присутствуют в нуклеотидной последовательности M.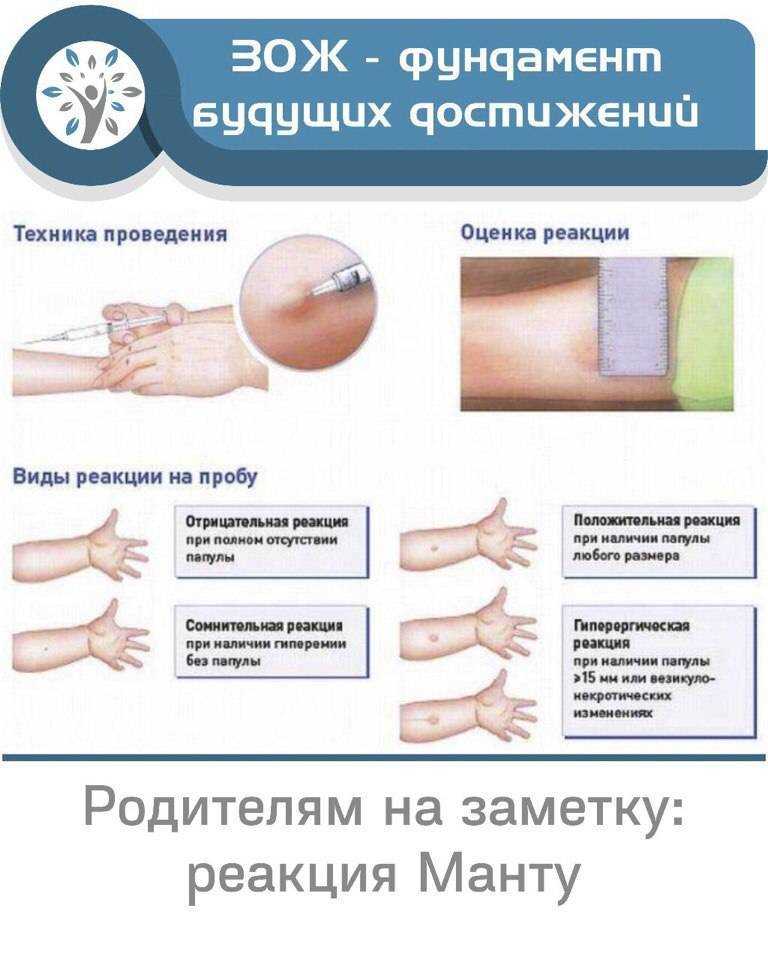
Мы поставили цель изучить возможность применения ДСТ в качестве скрининга у фтизиоурологических больных.
Материалы и методы. В исследование были включены 197 пациентов, поступивших с целью дифференциальной диагностики в отделение внелегочных форм туберкулеза Новосибирского научно-исследовательского института туберкулеза в 2014–2016 гг.
Все больные были госпитализированы по направлению противотуберкулезных диспансеров. В отделении пациентам проводили комплексное фтизиоурологическое обследование, на основании которого МПТ подтверждали либо исключали. Диагностическую кожную пробу с аллергеном туберкулезным рекомбинантным выполняли на догоспитальном этапе.
В отделении пациентам проводили комплексное фтизиоурологическое обследование, на основании которого МПТ подтверждали либо исключали. Диагностическую кожную пробу с аллергеном туберкулезным рекомбинантным выполняли на догоспитальном этапе.
Среди обследованных были 102 (51,8%) женщины и 95 (48,2%) мужчин. Средний возраст пациентов составил 46,7±1,3 года.
По результатам проведенного обследования больные были распределены в две группы:
- 1-я группа – больные активным МПТ – 72 (36,6%) человека;
- 2-я группа – больные хроническими заболеваниями органов мочеполовой системы, госпитализированные в отделение с подозрением на МПТ, у которых после комплексного фтизиоурологического обследования диагноз был исключен – 125 (63,4%) человек.
В большинстве (48; 66,7%) случаев диагноз активного МПТ был установлен на основании совокупности данных анамнеза, клинико-рентгенологических и лабораторных исследований. Бактериологически МПТ был верифицирован у 20 (27,8%) пациентов.
В 4 (5,5%) случаях диагноз подтвержден результатами патоморфологического исследования.
Все статистические расчеты выполнены в программе Statistica 8. Для сопоставления соотношений между положительными и отрицательными реакциями пробы Коха и ДСТ использовали критерий χ2; различия считали статистически значимыми при p<0,05.
Результаты. Среди 72 больных активным МПТ были 39 (54,2%) женщин и 33 (45,8%) мужчины. У 59 (81,9%) обследованных заболевание было выявлено впервые, обострение диагностировано в 9 (12,5%) наблюдениях, рецидив МПТ был зарегистрирован у 4 (5,6%) пациентов.
Согласно классификации МПТ, у 35 (48,6%) больных выявлен туберкулез мочевой системы, у 21 (29,2%) – туберкулез половых органов. У мужчин генитальный туберкулез регистрировали чаще, чем у женщин, – в 13 (61,9%) и 8 (38,1%) наблюдениях соответственно. Генерализованный МПТ (одновременное поражение органов мочевой и половой систем) установлен у 16 (22,2%) обследованных.
Тест с аллергеном туберкулезным рекомбинантным в 1-й группе был выполнен 58 (80,5%) пациентам. У 37 (63,8%) человек результат был положительным, у 21 (36,2%) – отрицательным.
У 37 (63,8%) человек результат был положительным, у 21 (36,2%) – отрицательным.
Подкожная провокационная проба Коха была проведена 51 (70,8%) пациенту с активным МПТ. В 41 (80,4%) наблюдении зарегистрирована положительная реакция на подкожное введение 50 ТЕ туберкулина, в 7 (13,7%) – сомнительная и только в 3 (5,9%) – отрицательная.
Таким образом, чувствительность ДСТ у больных активным МПТ составила 63,8%. Результат чувствительности подкожной провокационной туберкулиновой пробы оказался выше – 80,4%, на уровне отчетливой тенденции (χ2=3,67; p=0,055).
По техническим причинам не удалось всем больным активным МПТ выполнить одновременно ДСТ и пробу Коха; такое совокупное обследование проведено 38 пациентам. Положительный результат ДСТ был зарегистрирован у 25 человек, пробы Коха – у 31. Соответственно, чувствительность диагностических тестов у этих пациентов практически коррелировала с результатами группы активного МПТ в целом и составила 65,8% у ДСТ и 81,6% у пробы Коха (χ2=2,44; p=0,118).
Среди пациентов 2-й группы были 69 (55,2%) женщин и 56 (44,8%) мужчин. В этой группе преимущественно были диагностированы неспецифические инфекционно-воспалительные заболевания органов мочеполовой системы – 105 (84%) пациентов. Из них каждому третьему больному был установлен диагноз «пиелонефрит» – 38 (36,2%) человек.
Диаскинтест во 2-й группе был выполнен в 72 (57,6%) случаях, из них в 45 (62,5%) результат оказался ложноположительным, что свидетельствует о низкой специфичности ДСТ в отношении МПТ у взрослых.
Подкожная провокационная туберкулиновая проба проведена 106 пациентам данной группы. В 97 (91,5 %) случаях результат расценен как отрицательный, в 9 (8,5%) – как сомнительный.
Соответственно, специфичность пробы Коха составила 91,5%, что свидетельствует о высокой диагностической ценности данного метода по сравнению с ДСТ – 37,5% (χ2=88,67; p<0,0001).
Так же как и в 1-й группе, дополнительно проанализированы результаты провокационных тестов у пациентов, которым при дифференциально-диагностическом обследовании выполнили обе пробы. Такое совокупное обследование проведено 63 больным. У 24 из них результат ДСТ был отрицательным, у 39 – положительным.
Такое совокупное обследование проведено 63 больным. У 24 из них результат ДСТ был отрицательным, у 39 – положительным.
Проба Коха вновь продемонстрировала большую специфичность: отрицательный результат был зарегистрирован у 58 больных, положительный – лишь у 5.
Специфичность внутрикожной пробы с туберкулезным рекомбинантным аллергеном составила 38,1%; специфичность пробы Коха оказалась в 2,5 раза выше – 92,1% (χ2=40,37; p<0,0001).
Обсуждение. Сопоставление чувствительности ДСТ и подкожной провокационной туберкулиновой пробы Коха у взрослых больных активным МПТ выявило большую информативность традиционного метода диагностики: чувствительность пробы Коха составила 80,4%, ДСТ – 63,8%.
Специфичность пробы Коха составила 91,5%, что позволяет по-прежнему считать подкожную провокационную туберкулиновую пробу важной в дифференциальной диагностике МПТ и неспецифических урогенитальных инфекций.
Высокий процент положительных результатов ДСТ у больных хроническими инфекционно-воспалительными заболеваниями мочеполовой системы обусловил низкую специфичность теста – 37,5%. Известно, что аллерген туберкулезный рекомбинантный в стандартном разведении продуцируется генетически модифицированной культурой E. coli BL21(DE3)/pCFP-ESAT. Поскольку E. coli играет ведущую роль в развитии инфекций мочевыводящих путей, можно предположить, что положительные результаты обусловлены перекрестным иммунологическим ответом организма на антигены E. coli, которые могут присутствовать в составе ДСТ; эта гипотеза требует дальнейшего изучения.
Известно, что аллерген туберкулезный рекомбинантный в стандартном разведении продуцируется генетически модифицированной культурой E. coli BL21(DE3)/pCFP-ESAT. Поскольку E. coli играет ведущую роль в развитии инфекций мочевыводящих путей, можно предположить, что положительные результаты обусловлены перекрестным иммунологическим ответом организма на антигены E. coli, которые могут присутствовать в составе ДСТ; эта гипотеза требует дальнейшего изучения.
Статистически значимых отличий в результатах определения информативности диагностических тестов при одновременном их выполнении у одного пациента или в целом в когорте не выявлено.
Заключение. Диаскинтест может быть использован в скрининге мочеполового туберкулеза, однако положительный его результат не может служить основанием для установления диагноза, а только служит поводом для углубленного фтизиоурологического обследования с использованием дополнительных провокационных проб, в частности пробы Коха, которая показала высокую диагностическую ценность.
Литература
1. Global tuberculosis report 2016. WHO/HTM/TB/2016.13. World Health Organization Geneva 2016: http://www.who.int/tb/publications/global_report/en/ 2. Zachoval R., Nencka P., Vasakova M., Kopecka E., Borovička V., Wallenfels J., Cermak P. The incidence of subclinical forms of urogenital tuberculosis in patients with pulmonary tuberculosis. J Infect Public Health. 2017;S1876-0341(17)30179-X. Doi: 10.1016/j.jiph.2017.07.005. 3. Figueiredo A.A., Lucon A.M., Srougi M. Urogenital Tuberculosis. Microbiol Spectr. 2017;5(1). Doi: 10.1128/microbiolspec.TNMI7-0015-2016. 4. Kulchavenya E.V., Krasnov V.A., Mordyk A.V. Almanac of extrapulmonary tuberculosis. Novosibirsk: Sibprint. 2015;247 p. Russian (Кульчавеня Е.В., Краснов В.А., Мордык А.В. Альманах внелегочного туберкулеза. Новосибирск: Сибпринт. 2015;247 с.). 5. Adzic-Vukicevic T., Barac A., Ilic A.D., Jankovic R., Hadzi-Djokic J., Pesut D. First reported case of fulminant TB with progression of infection from lungs to the genitourinary region. 6. Kulchavenya E.V., Koveshnikova E.Yu., Zhukova I.I. Clinical and epidemiological features of modern tuberculous spondylitis. Tuberkulez i bolezni legkikh. 2013;1:41–45. Russian (Кульчавеня Е.В., Ковешникова Е.Ю., Жукова И.И. Клинико-эпидемиологические особенности современного туберкулезного спондилита. Туберкулез и болезни легких. 2013;1:41–45). 7. Viville C. Urogenital tuberculosis in 1974. J Chir (Paris).1975;109(5–6):661–676. 8. Kulchavenya E. Extrapulmonary Tuberculosis: are statistical reports accurate? Therapeutic Advances in Infectious Disease. 2014;2(2):61–70. Doi: 10.1177/2049936114528173. 9. Ketata W., Rekik W.K., Ayadi H., Kammoun S. Extrapulmonary tuberculosis. Rev Pneumol Clin. 2015;71(2–3):83–92. Doi: 10.1016/j.pneumo.2014.04.001. 10. Zuban’ O.N., Volkov A.A., Sushchii E.A., Murav’ev A.N. Genitourinary tuberculosis in modern epidemiological conditions. TubInform. 11. Nechaeva O.B., Skachkov V.V. The epidemiological situation of extrapulmonary tuberculosis in the Russian Federation. Tuberkulez i bolezni legkikh. 2013;8:3–9. Russian (Нечаева О.Б., Скачков В.В. Эпидемическая ситуация по внелегочному туберкулезу в Российской Федерации. Туберкулез и болезни легких. 2013;8:3–9). 12. Yagafarova R.K., Avzalov M.R., Vasil’ev Yu.A., Yunichev V.F. Features of the clinical course and treatment of urogenital tuberculosis. Tuberkulez i bolezni legkikh. 2015;7:164–65. Russian (Ягафарова Р.К., Авзалов М.Р., Васильев Ю.А., Юничев В.Ф. Особенности клинического течения и лечения мочеполового туберкулеза. Туберкулез и болезни легких. 2015;7:164–165). 13. Gaudiano C., Tadolini M., Busato F., Vanino E., Pucci S., Corcioni B., Golfieri R. Multidetector CT urography in urogenital tuberculosis: use of reformatted images for the assessment of the radiological findings. 14. Biswas A., Meghjee S.P. Haematuria and loin pain, could this be tuberculosis? BMJ Case Rep. 2015;7:pii: bcr2014205810. Doi: 10.1136/bcr-2014-205810. 15. Sutariya H.C., Panchal T.N., Pandya V.K., Patel K.N. Disseminated tuberculosis involving allograft in a renal transplant recipient. Journal of global infectious diseases. 2016;8(1):55–56. Doi: 10.4103/0974-777X.176151. 16. Lima N.A., Vasconcelos C.C., Filgueira P.H., Kretzmann M., Sindeaux T.A., Feitosa Neto B., Silva Junior G.B., Daher E.F. Review of genitourinary tuberculosis with focus on end-stage renal disease. Revista do Instituto de Medicina Tropical de São Paulo. 2012;54(1):57–60. 17. Mazza-Stalder J., Nicod L., Janssens J.P. Extrapulmonary tuberculosis. Revue des maladies respiratoires. 2012;29(4):566–578. 18. Minecan N., Andrei A., Segal A., Herovanu L. Diagnosis of bacteriologically unconfirmed urogenital tuberculosis. 19. Al’khovik O.I., Kulchavenya E.V., Cherednichenko A.G. Some factors of human natural resistance to tuberculosis infection. Tuberkulez i bolezni legkikh. 2014;5:22–24. Russian (Альховик О.И., Кульчавеня Е.В., Чередниченко А.Г. Некоторые факторы естественной устойчивости человека к туберкулезной инфекции. Туберкулез и болезни легких. 2014;5:22–24). 20. Fillion A., Koutlidis N., Froissart A., Fantin B. Investigation and management of genito-urinary tuberculosis. La Revue de medecine interne/fondee… par la Societe nationale francaise de medecine interne. 2014;35(12):808–814. 21. Kulchavenya E.V., Breusov A.A. Efficiency of uro-vaccom in recurrent infectious and inflammatory diseases of the genitourinary system. Urologiia. 2011;4:7–11. Russian (Кульчавеня Е.В., Бреусов А.А. Эффективность уро-ваксома при рецидивирующих инфекционно-воспалительных заболеваниях мочеполовой системы. Урология. 2011;4:7–11). 22. Kulchavenya E. 23. Hwang H.P., Lee H.B., Kang K.P., Kim W., Park S.K., Lee S. Transition of overlooked sterile pyuria. Nephrology. 2013;18(11):744–745. 24. Bacci M.R., Namura J.J., Lera A.T. Complicated urinary infection and extrapulmonary tuberculosis. BMJ case reports. 2012;2012:bcr2012007553. 25. Patil S.В., Desai A.S., Biradar A.N., Kundargi V.S. Extensive nephroureteric calcification presenting with renal failure: A rare case report. Urology annals. 2015;7(3):375–77. Doi: 10.4103/0974-7796.157958. 26. Koretskaya N.M. Diaskintest is a new method for diagnosing tuberculosis infection. Sibiriskoe meditsinskoe obozrenie. 2013;2(80):94–97. Russian (Корецкая Н.М. Диаскинтест – новый метод диагностики туберкулезной инфекции. Сибириское медицинское обозрение. 2013;2(80):94–97). 27. Alekseev A.P., Fatykhova R.Kh. The experience of using a diaskintest in the Republic of Tatarstan. Tuberkulez i bolezni legkikh. 2014;10:61–64. Russian (Алексеев А.П., Фатыхова Р.Х. Опыт применения диаскинтеста в республике Татарстан. Туберкулез и болезни легких. 2014;10:61–64). 28. Moiseeva N.N., Odinets V.S. Experience in the application of a skin test with a diaskintest in a mass examination for tuberculosis. Tuberkulez i bolezni legkikh. 2015;7:92–93. Russian (Моисеева Н.Н., Одинец В.С. Опыт применения кожной пробы с диаскинтестом при массовом обследовании на туберкулез. Туберкулез и болезни легких. 2015;7:92–93). 29. Eismont N.V. Experience of using the allergen of tuberculosis recombinant for diagnosis of tuberculosis in patients with HIV infection. Tuberkulez i bolezni legkikh. 2015;10:54–56. Russian (Эйсмонт Н.В. Опыт использования аллергена туберкулезного рекомбинантного для диагностики туберкулеза у больных ВИЧ-инфекцией. Туберкулез и болезни легких. 30. Tamašauskienė L., Hansted E., Vitkauskienė A., Miliauskas S., Naudžiūnas A., Šitkauskienė B. Use of interferon-gamma release assay and tuberculin skin test in diagnosing tuberculosis in Lithuanian adults: A comparative analysis. Medicina (Kaunas). 2017;53(3):159–65. Doi: 10.1016/j.medici.2017.05.003. 31. Wu U.I., Chuang Y.C., Sheng W.H., Sun H.Y., Jhong Y.T., Wang J.Y., Chang S.C., Wang J.T., Chen Y.C. Use of QuantiFERON-TB Gold In-tube assay in screening for neutralizing anti-interferon-γ autoantibodies in patients with disseminated nontuberculous mycobacterial infection. Clin Microbiol Infect. 2017;8:S1198-743X(17)30356-7. Doi: 10.1016/j.cmi.2017.06.029. 32. Andrews J.R., Nemes E., Tameris M., Landry B.S., Mahomed H., McClain J.B., Fletcher H.A., Hanekom W.A., Wood R., McShane H., Scriba T.J., Hatherill M. Serial QuantiFERON testing and tuberculosis disease risk among young children: an observational cohort study. Lancet Respir Med. 2017;5(4):282–90. Rev Inst Med Trop Sao Paulo. 2017;59:e20. Doi: 10.1590/S1678-9946201759020.
Rev Inst Med Trop Sao Paulo. 2017;59:e20. Doi: 10.1590/S1678-9946201759020. 2017;1(1):9–12. Russian (Зубань О.Н., Волков А.А., Сущий Е.А., Муравьев А.Н. Мочеполовой туберкулез в современных эпидемиологических условиях. ТубИнформ. 2017;1(1):9–12).
2017;1(1):9–12. Russian (Зубань О.Н., Волков А.А., Сущий Е.А., Муравьев А.Н. Мочеполовой туберкулез в современных эпидемиологических условиях. ТубИнформ. 2017;1(1):9–12). A pictorial essay. Abdom Radiol (NY). 2017. Doi: 10.1007/s00261-017-1129-0.
A pictorial essay. Abdom Radiol (NY). 2017. Doi: 10.1007/s00261-017-1129-0. Rev Med ChirSoc Med Nat Iasi.1980;84(2):241–244.
Rev Med ChirSoc Med Nat Iasi.1980;84(2):241–244. V., Brizhatyuk E.V. Tuberculosis of the bladder: diagnosis and treatment. Urologiia. 2006;3:61–65. Russian (Кульчавеня Е.В., Брижатюк Е.В. Туберкулез мочевого пузыря: диагностика и лечение. Урология. 2006;3:61–65).
V., Brizhatyuk E.V. Tuberculosis of the bladder: diagnosis and treatment. Urologiia. 2006;3:61–65. Russian (Кульчавеня Е.В., Брижатюк Е.В. Туберкулез мочевого пузыря: диагностика и лечение. Урология. 2006;3:61–65).
 2015;10:54–56).
2015;10:54–56). Doi: 10.1016/S2213-2600(17)30060-7.
Doi: 10.1016/S2213-2600(17)30060-7.
Об авторах / Для корреспонденции
А в т о р д л я с в я з и : С. Ю. Шевченко – младший научный сотрудник ФГБУ ННИИТ Минздрава России,
Новосибирск, Россия; e-mail: [email protected]
Похожие статьи
- Доброкачественная гиперплазия предстательной железы у первичного пациента
- Диагностика урогенитального туберкулеза
- Эректильная дисфункция: современное состояние проблемы
- Факторы прогноза развития нарушений мочеиспускания при гиперплазии предстательной железы у мужчин пожилого возраста
- Современная фармакотерапия неосложненных инфекций нижних мочевыводящих путей: место антибактериальных препаратов и препаратов растительного происхождения
ЭФФЕКТИВНОСТЬ КОЖНОГО ТЕСТА С АЛЛЕРГЕНОМ ТУБЕРКУЛЕЗНЫМ РЕКОМБИНАНТНЫМ ПРИ ВЫЯВЛЕНИИ ТУБЕРКУЛЕЗА У ДЕТЕЙ И ПОДРОСТКОВ МОСКВЫ В 2013 Г. | Слогоцкая
1. Lein A., von Reyn C., Ravn P. et al. Cellular immune responses to ESAT-6 discriminate between patients with pulmonary disease due to Mycobacterium avium complex and those with pulmonary disease due to Mycobacterium tuberculosis. Clin Diagn Lab Immunol. 1999; 6: 606–609.
Clin Diagn Lab Immunol. 1999; 6: 606–609.
2. Mahairas G., Sabo P., Hickey M. et al. Molecular analysis of genetic differences between Mycobacterium bovis BCG and virulent M. bovis. J Bacteriol. 1996; 178: 1274–1282.
3. Andersen P., Doherty T., Pai M., Weldingh K. The prognosis of latent tuberculosis: can disease be predicted? Trends Mol Med. 2007; 13 (5): 175–182.
4. Ewer K., Deeks J., Alvarez L. et al. Comparison of T-cell-based assay with tuberculin skin test for diagnosis of Mycobacterium tuberculosis infection in a school tuberculosis outbreak. Lancet. 2003; 361: 1168–1173.
5. Arend S., Thijsen S., Leyten E. et al. Comparison of two interferongamma assays and tuberculin skin test for tracing tuberculosis contacts. Am J Respir Crit Care Med. 2007; 175 (6): 618–627.
6. Menzies D., Pai M., Comstock G. Meta-analysis: new tests for the diagnosis of latent tuberculosis infection: areas of uncertainty and recommendations for research. Ann Intern Med. 2007; 146: 340–354.
7. Mack U., Migliori G., Sester M. et al. LTBI: latent tuberculosis infection or lasting immune responses to Mycobacterium tuberculosis? A TBNET consensus statement. Eur Respir J. 2009; 33: 956–973.
8. Pai M., Zwerling A., Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med. 2008; 149 (3): 177–184.
9. Andersen P., Andersen A., Sorensen A., Nagai S. Recall of longlived immunity to Mycobacterium tuberculosis infection in mice. J Immunol. 1995; 154 (7): 3359–72.
10. Vordermeier H., Chambers M., Cockle P. et al. Correlation of ESAT-6-specific gamma interferon production with pathology in cattle following Mycobacterium bovis BCG vaccination against experimental bovine tuberculosis. Infect Immun. 2002; 70: 3026–3032.
11. Dietrich J., Aagaard C., Leah R. et al. Exchanging ESAT6 with ТВ 10.4 in an Ag85B fusion molecule-based tuberculosis subunit vaccine: efficient protection and ESAT6-based sensitive monitoring of vaccine efficacy. J Immunol. 2005; 174: 6332–6339.
J Immunol. 2005; 174: 6332–6339.
12. Bakir M., Millington K., Soysal A. et al. Prognostic value of a T-cell-based, interferon- biomarker in children with tuberculosis contact. Ann Intern Med. 2008; 149: 777–787.
13. Diel R., Loddenkemper R., Meywald-Walter K. et al. Predictive value of a whole blood IFN-gamma assay for the development of active tuberculosis disease after recent infection with Mycobacterium tuberculosis. Am J Respir Crit Care Med. 2008; 177 (10): 1164–1170.
14. Doherty T., Demissie A., Olobo J. et al. Immune responses to the Mycobacterium tuberculosis-specific antigen ESAT-6 signal subclinical infection among contacts of tuberculosis patients. J Clin Microbiol. 2002; 40 (2): 704–706.
15. Lienhardt C., Fielding K., Hane A. et al. Evaluation of the Prognostic Value of IFN- Release Assay and Tuberculin Skin Test in Household Contacts of Infectious Tuberculosis Cases in Senegal. PLoS ONE. 2010; 5 (5): e10508. Doi: 10.1371/journal. pone.0010508.
16. Mazurek G., Weis S., Moonan P. et al. Prospective comparison of the tuberculin skin test and two whole-blood interferon-gamma release assays in persons with suspected tuberculosis. Clin Infect Dis. 2007; 45: 837–845.
Mazurek G., Weis S., Moonan P. et al. Prospective comparison of the tuberculin skin test and two whole-blood interferon-gamma release assays in persons with suspected tuberculosis. Clin Infect Dis. 2007; 45: 837–845.
17. Diel R., Nienhaus A., Schaberg T. Cost-effectiveness of isoniazid chemoprevention in close contacts. Eur Respir J. 2005; 26: 465–473.
18. Dosanjh D., Hinks T., Innes J. et al. Improved diagnostic evaluation of suspected tuberculosis. Ann Intern Med. 2008; 148: 325–336.
19. Goletti D., Stefania C., Butera O. et al. Accuracy of immunodiagnostic tests for active tuberculosis using single and combined results: a multicenter TBNET Study. PLoS ONE. 2008; 3: e3417.
20. Brandli O., Desgrandchamps D., Gabathuler U. et al. Manual of Tuberculosis. Bern, Swiss Lung League. 2007. URL: www.lung.ch
21. National Institute for Health and Clinical Excellence. Tuberculosis: Clinical Diagnosis and Management of Tuberculosis, and Measures for its Prevention and Control. London, National Institute for Health and Clinical Excellence. 2006. URL: www.nice.org.uk.
London, National Institute for Health and Clinical Excellence. 2006. URL: www.nice.org.uk.
22. The National Collaborating Centre for Chronic Conditions. Tuberculosis. Clinical Diagnosis and Management of Tuberculosis, and Measures for its Prevention and Control. London, Royal College of Physicians. 2006.
23. Борисов С. Е., Лукина Г. В., Слогоцкая Л. В., Кочетков Я. А., Гунтупова Л. Д., Куликовская Н. В. Скрининг и мониторинг туберкулезной инфекции у ревматологических больных, получающих генно-инженерные биологические препараты. Туберкулез и болезни легких. 2011; 6: 42–50.
24. Mazurek G., Jereb J., Lobue P. et al. Guidelines for using the Quanti FERON-TB Gold test for detecting Mycobacterium tuberculosis infection, United States. MMWR Recomm Rep. 2005; 54: 49–55.
25. Киселев В. И., Барановский П. М., Пупышев С. А. и др. Новый кожный тест для диагностики туберкулеза на основе рекомбинантного белка ESAT-CFP. Молекулярная медицина. 2008; 4: 4–6.
26. Lalvani A. , Millington K. A. T cell-based diagnosis of childhood tuberculosis infection. Curr Opin Infect Dis. 2007; 20: 264–271.
, Millington K. A. T cell-based diagnosis of childhood tuberculosis infection. Curr Opin Infect Dis. 2007; 20: 264–271.
27. Lalvani A. Diagnosing tuberculosis infection in the 21st century: new tools to tackle an old enemy. Chest. 2007; 131: 1898–1906.
28. Mori T., Sakatani M., Yamagishi F. et al. Specific detection of tuberculosis infection: an interferon-c-based assay using new antigens. Am J Respir Crit Care Med. 2004; 170: 59–64.
29. Pai M., Kalantri S., Dheda K. New tools and emerging technologies for the diagnosis of tuberculosis: part I. Latent tuberculosis. Expert Rev Mol Diagn. 2006; 6: 413–422.
30. Richeldi L., Ewer K., Losi M. et al. Early diagnosis of subclinical multidrug-resistant tuberculosis. Ann Intern Med. 2004; 140: 709–713.
31. Слогоцкая Л. В., Сенчихина О. Ю., Богородская Е. М. Чувствительность теста с аллергеном туберкулезным рекомбинантным, содержащим белок ESAT6-CFP10, у впервые выявленных больных туберкулезом детей и подростков в г. Москве. Туберкулез и социально значимые заболевания. 2013; 1: 37–44.
Москве. Туберкулез и социально значимые заболевания. 2013; 1: 37–44.
ПРОЦЕДУРЫ СБОРА ОБРАЗЦОВ НА ТБ – Служба здравоохранения и социального обеспечения штата Делавэр
Mycobacterium tuberculosis , микроорганизм, вызывающий туберкулез (ТБ), является основной проблемой общественного здравоохранения в Соединенных Штатах. Однако с увеличением количества бездомных, инъекционных наркотиков и появлением ВИЧ-инфицированных пациентов во многих районах страны произошел значительный рост заболеваемости как туберкулезом, так и нетуберкулезными микобактериями (НТМ).
Лаборатория общественного здравоохранения DE обслуживает штат Делавэр в качестве справочного центра для выявления и/или тестирования чувствительности M. туберкулез и другие микобактериальные изоляты. Быстрые методы, рекомендованные Центром по контролю и профилактике заболеваний (CDC) для сокращения времени обработки диагноза ТБ, а также специализированные методы идентификации, необходимые для нетуберкулезных видов микобактерий, могут оказаться неосуществимыми в местных лабораториях.
ПРЕДЛАГАЕМЫЕ ИСПЫТАНИЯ
- Мазок на кислотоустойчивые бактерии (КУБ)
- Культура для AFB
- Идентификация КУМ
- Тестирование на чувствительность к противомикробным препаратам
- Специальные запросы и обращение с обращениями
СБОР ОБРАЗЦОВ, ОБРАБОТКА И ОТПРАВКА
- Получите расходные материалы, запросив отдельные компоненты со склада этой лаборатории. Материалы можно получить, обратившись в лаборатории или отправки заказов по факсу или по электронной почте [email protected].
- Заполните форму заявки на тестирование, включая информацию о пациенте, или запрос на заказ онлайн. через нашу систему управления лабораторной информацией (LIMS). Образцы и формы должны быть размещены в специально отведенном месте на каждом участке. чтобы курьер лаборатории забрал.

- Получите образец, следуя указаниям, перечисленным ниже.
- Пометьте каждый контейнер уникальным идентификатором пациента, именем и датой сбора, чтобы они соответствовали форме заявки. Убедитесь, что крышка плотно прилегает к контейнеру и упакована в отдельный пакет.
- Поместите образец и форму заявки, если это необходимо, в мешок для биологических отходов для транспортировки в лабораторию. Убедитесь, что образец запечатан внутри двойного мешка, а форма вставляется во внешний карман, отделенный от самого образца. Доставка в лабораторию курьерской службой. ДЕЛАТЬ НЕ почта.
МОКОТА (ОТХЛАДКИВАНИЕ)
Должны быть представлены три утренних образца, полученных в разные дни. Объема от 5 до 10 мл достаточно, и нет преимущество в сборе большего объема. Образец должен содержать недавно отделившийся материал из бронхиального дерева с минимальным содержание слюны.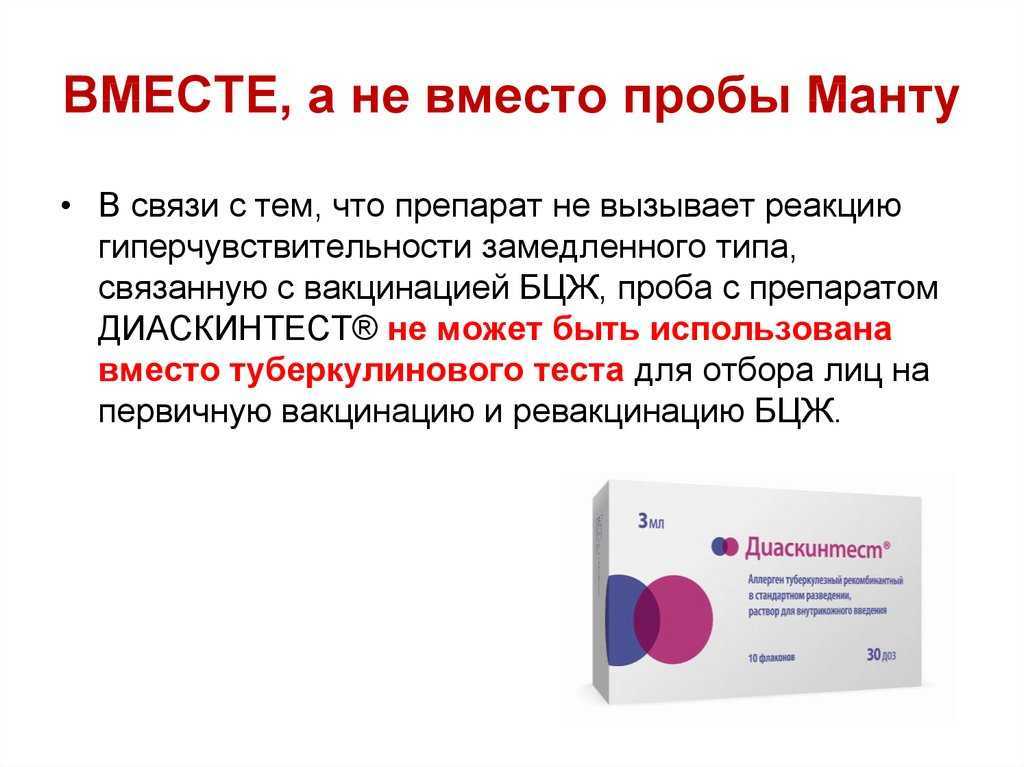
Мокрота (индуцированная)
Если у пациента возникают трудности с получением образца мокроты, следует рассмотреть вопрос об индукции. Образование мокроты может быть вызвано вдыхание теплого аэрозоля стерильного 5-10% натрия хлорида в воде, производимого небулайзером.
Образец должен иметь четкую пометку «ИНДУЦИОНИРОВАНО» в бланке запроса, поскольку распыленная мокрота имеет водянистую консистенцию и может быть принимают за слюну.
ПРОМЫВАНИЕ ЖЕЛУДКА
Эта процедура может быть использована, когда образование мокроты не удается. Эта техника требует профессионального внимания и должна покушение в больнице. Промывание желудка проводят рано утром перед едой и не ранее, чем через 8 часов после приема пищи. съеденные или принятые пероральные препараты. Требуется объем образца 5-10 мл, который необходимо нейтрализовать 100 мг карбоната натрия.
МОЧА
Следует собрать ранний утренний образец в среднем течении. Отправьте весь образец. Может потребоваться несколько образцов в течение нескольких дней, чтобы получить положительный образец. Из-за загрязнения и порчи образцы мочи за 24 часа неприемлемы. Сохранить образец в холодильнике до транспортировки.
Отправьте весь образец. Может потребоваться несколько образцов в течение нескольких дней, чтобы получить положительный образец. Из-за загрязнения и порчи образцы мочи за 24 часа неприемлемы. Сохранить образец в холодильнике до транспортировки.
КРОВЬ
Образцы должны быть собраны в изоляторные пробирки, которые можно получить в инвентарной комнате этой лаборатории по запросу. Проверяйте срок годности до рисование крови. Храните пробирки при комнатной температуре. Транспортировать в день сбора.
ЖИДКОСТИ
Жидкости организма (спинномозговая, плевральная, перикардиальная, синовиальная, асцитическая, кровь, гной и костный мозг) должны быть собраны в асептических условиях и отправлены в стерильные контейнеры. Хранить в холодильнике до транспортировки.
САЛФЕТКА
Любая ткань для культивирования должна быть собрана асептически в стерильный контейнер без фиксаторов или консервантов. Если образец может высушите, добавьте стерильный физиологический раствор, чтобы сохранить влажность. Не помещайте образец ткани для посева в формалин. Хранить в холодильнике до транспортировки.
Если образец может высушите, добавьте стерильный физиологический раствор, чтобы сохранить влажность. Не помещайте образец ткани для посева в формалин. Хранить в холодильнике до транспортировки.
ИЗОЛЯТЫ ИЛИ КУЛЬТУРЫ ДЛЯ ИДЕНТИФИКАЦИИ И/ИЛИ ЧУВСТВИТЕЛЬНОСТИ
Изоляты должны быть представлены в виде чистых, свежих субкультур на средах Middlebrook 7h20 или Lowenstein-Jensen, когда это возможно, но допустимы и жидкие запатентованные бульоны 7H9 (т. е. флаконы MGIT или BacT/Alert MP). Включите предварительную идентификацию в форму заявки на тестирование. Если направление в CDC вероятно или специально запрошено, к образцу должна быть приложена заполненная прочерковая форма CDC.
ИСПЫТАНИЯ
В этой лаборатории используется система Bactec MGIT 960 TB для обнаружения КУМ в образцах и проведения тестов на чувствительность.
Прямая идентификация из прямых образцов (например, легочных), а также выращенных культур (бульон или выращенные изоляты) выполняется с помощью лабораторного теста (LDT) с использованием полимеразной цепной реакции в реальном времени (qPCR).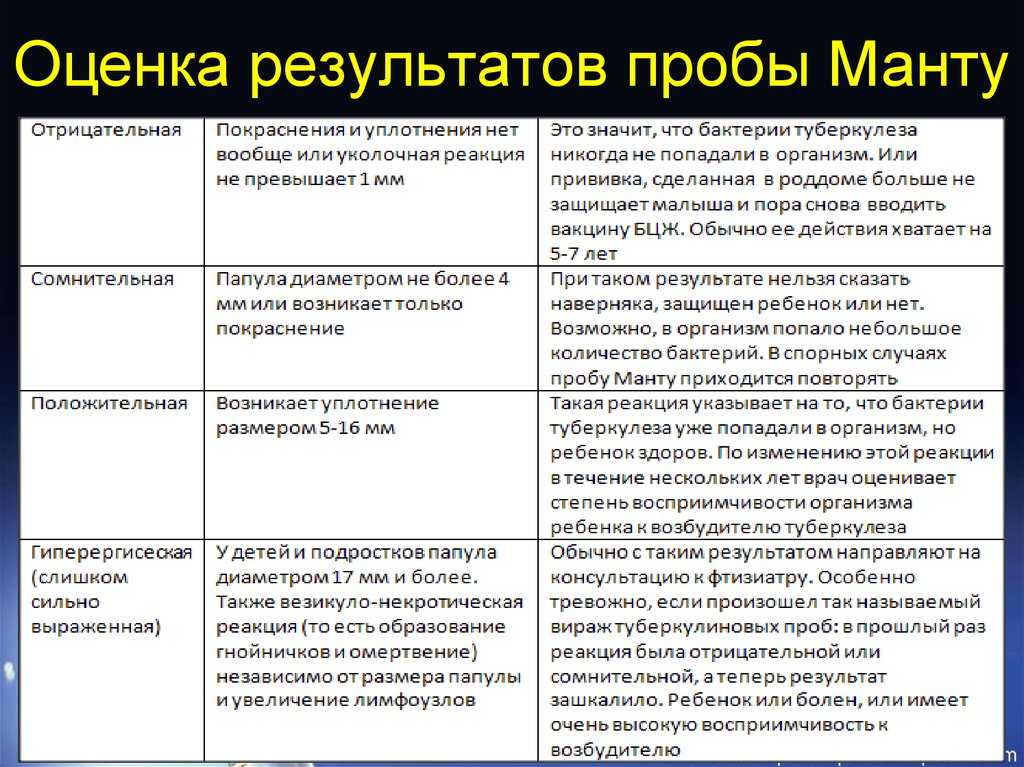
Обычные восприимчивости относятся только к Комплекс M.tuberculosis (Mtbc).
Первичный тест на лекарственную чувствительность (ТЛЧ): изониазид, рифампин, этамбутол, пиразинамид проводится в DPHL (при необходимости). Вторичные панели лекарств или быстрое первичное ТЛЧ направляются в Лабораторию микробных заболеваний штата Калифорния (MDL) или CDC, когда это оправдано или запрошено.
Тесты, требующие дополнительных специализированных методов, могут быть направлены в CDC или CA MDL.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
В соответствии с рекомендациями CDC по снижению распространения M. tuberculosis, эта лаборатория предоставляет следующие результаты КУМ:
- Быстрое флуоресцентное кислотное окрашивание исходного образца: 24–72 часа с момента поступления в лабораторию.
- Идентификация М.tuberculosis из культуры: как можно скорее, но в течение 14–21 дня с момента получения образца.

- Результаты определения чувствительности к M.tuberculosis : Как можно скорее, но в течение 15-30 дней с момента получения образца.
ПРИМЕЧАНИЕ. Все положительные результаты будут засчитаны в день обнаружения.
ОТКАЗ
Образцы будут отклонены, если они:
- Без маркировки. Все образцы ДОЛЖНЫ иметь уникальный идентификатор пациента.
- Дата сбора не указана
- Недостаточное количество — Образец не получен, образец отсутствует в контейнере или образец недостаточен для проведения испытаний.
- Мокрота, содержащая
- Моча с
- Поврежден — Образец протекал или сломался при транспортировке.
- Too Old — образцы старше 3 дней являются ненадежными образцами для тестирования.
- Загрязненный — изоляты или субкультуры будут отклонены, если не удастся выделить тестовый организм.

Вернуться к странице «Выполненные тесты»
Вернуться на страницу Лаборатории общественного здравоохранения штата Делавэр
Обратите внимание: некоторые из файлов, доступных на этой странице, представлены в формате Adobe PDF, для которого требуется Adobe Acrobat Reader. Бесплатную копию Adobe Acrobat Reader можно загрузить непосредственно с сайта Adobe. Если вы используете вспомогательную технологию, которая не позволяет читать Adobe PDF, просмотрите соответствующую текстовую версию (если она доступна) или посетите страницу специальных возможностей Adobe.
Туберкулез
Ежегодно около 1,8 миллиона человек умирают от туберкулеза (ТБ), который является излечимым заболеванием. Несмотря на то, что не существует простых решений проблем, связанных с туберкулезом, в развивающихся странах, BD Global Health использует стратегическое сочетание ресурсов и технологий, направленных на оказание положительного и устойчивого воздействия.
Экспресс-культура и тестирование на лекарственную чувствительность как никогда важны перед лицом распространения туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ) и даже туберкулеза с широкой лекарственной устойчивостью (ШЛУ-ТБ). Метод жидкостной культуры BD TB, система BD MGIT™, предоставляет результаты диагностики намного быстрее, чем традиционные методы посева, получение результата может занять от 40 до 50 дней.
Чтобы сделать высококачественную диагностику туберкулеза доступной, особенно для ВИЧ-позитивных пациентов, компания BD заключила соглашение с Фондом инновационной новой диагностики (FIND) о предоставлении доступа по ценам в условиях высокой потребности в условиях ограниченных ресурсов. В рамках этого сотрудничества были созданы демонстрационные центры в Африке, Восточной Европе, Бразилии и Азии для внедрения передовых технологий культивирования на уровне районных больниц.
В 2014 г. компания BD начала сотрудничество с Агентством США по международному развитию (USAID) в Индонезии, чтобы поддержать создание и тем самым укрепить национальные референс-лабораторные системы Индонезии в рамках постоянных усилий по предотвращению и контролю вспышек инфекционных заболеваний во всем мире. Партнерство, созданное по образцу программы BD-PEPFAR Labs for Life, поддержало Национальную программу борьбы с туберкулезом Индонезии (NTP) с целью улучшения и расширения лабораторных услуг гарантированного качества. В частности, сотрудничество делало упор на раннее выявление и подтверждение случаев ТБ, а также на услуги по мониторингу и лечению. Партнерство завершилось в декабре 2016 г. со следующими результатами:
Партнерство, созданное по образцу программы BD-PEPFAR Labs for Life, поддержало Национальную программу борьбы с туберкулезом Индонезии (NTP) с целью улучшения и расширения лабораторных услуг гарантированного качества. В частности, сотрудничество делало упор на раннее выявление и подтверждение случаев ТБ, а также на услуги по мониторингу и лечению. Партнерство завершилось в декабре 2016 г. со следующими результатами:
- Надлежащая лабораторная практика для посева на ТБ и определения лекарственной чувствительности (ТЛЧ) была внедрена в 10 учреждениях по всей стране, и было проведено обучение по ее внедрению.
- Компания BD помогла установить критерии, подход, обучение и группы мониторинга для расширения и мониторинга безопасной рабочей практики (SWP) и обеспечения качества для фтизиатрических лабораторий.
- Пятьдесят технических специалистов в 10 лабораториях прошли обучение по работе с жидкими культурами и ТЛЧ.
- Была создана эквивалентная национальная программа мониторинга.