ДЮФАСТОН ТАБЛ П/П/О 10 МГ №20
Состав и форма выпуска
Активное вещество:дидрогестерон — 10 мг
Вспомогательные вещества: лактозы моногидрат; гипромеллоза; крахмал кукурузный; кремния диоксид коллоидный; магния стеарат
Оболочка: Opadry белый Y-1–7000 (гипромеллоза, полиэтиленгликоль 400, титана диоксид (E171)
в блистере 20 шт.; в коробке картонной 1 блистер.
Описание лекарственной формы
Круглые, двояковыпуклые таблетки белого цвета, со скошенными краями, покрытые оболочкой, с гравировкой «S» над знаком «6» на одной стороне таблетки, с риской и знаком «155» с обеих сторон от риски — на другой.
Фармакологическое действие
Фармакологическое действие — гестагенное.
Фармакодинамика
Дюфастон® (дидрогестерон) — это прогестаген, активный при приеме внутрь. Дидрогестерон по своей молекулярной структуре, химическим и фармакологическим свойствам весьма близок к природному прогестерону. В связи с тем, что дидрогестерон не является производным тестостерона, он не обладает побочными эффектами, характерными для большинства синтетических прогестагенов, т.н. «андрогенных» прогестагенов. Дидрогестерон не обладает эстрогенной, андрогенной, анаболической, глюкокортикоидной и термогенной активностью. Выступая в роли прогестагенного компонента заместительной гормональной терапии (ЗГТ) в менопаузе, дидрогестерон способствует сохранению благоприятного действия эстрогенов на липидный профиль крови. Однако, в отличие от эстрогенов, которые обычно отрицательно влияют на систему свертывания крови, дидрогестерон не оказывает влияния на показатели коагуляции. Не влияет отрицательно на метаболизм углеводов и функцию печени. Дидрогестерон при пероральном применении селективно воздействует на эндометрий, тем самым предотвращая повышенный риск развития гиперплазии эндометрия и/или карциногенеза в условиях избытка эстрогенов. Он показан во всех случаях эндогенной недостаточности прогестерона.
В связи с тем, что дидрогестерон не является производным тестостерона, он не обладает побочными эффектами, характерными для большинства синтетических прогестагенов, т.н. «андрогенных» прогестагенов. Дидрогестерон не обладает эстрогенной, андрогенной, анаболической, глюкокортикоидной и термогенной активностью. Выступая в роли прогестагенного компонента заместительной гормональной терапии (ЗГТ) в менопаузе, дидрогестерон способствует сохранению благоприятного действия эстрогенов на липидный профиль крови. Однако, в отличие от эстрогенов, которые обычно отрицательно влияют на систему свертывания крови, дидрогестерон не оказывает влияния на показатели коагуляции. Не влияет отрицательно на метаболизм углеводов и функцию печени. Дидрогестерон при пероральном применении селективно воздействует на эндометрий, тем самым предотвращая повышенный риск развития гиперплазии эндометрия и/или карциногенеза в условиях избытка эстрогенов. Он показан во всех случаях эндогенной недостаточности прогестерона. Препарат не имеет контрацептивного действия. При лечении дидрогестероном терапевтический эффект достигается без подавления овуляции или нарушения менструальной функции. Дидрогестерон делает возможным зачатие и сохранение беременности во время лечения.
Препарат не имеет контрацептивного действия. При лечении дидрогестероном терапевтический эффект достигается без подавления овуляции или нарушения менструальной функции. Дидрогестерон делает возможным зачатие и сохранение беременности во время лечения.
Фармакокинетика
После приема внутрь дидрогестерон быстро всасывается изЖКТ,Cmax в плазме крови достигается через 2 ч. Связывание с белками плазмы составляет 97%. Метаболизм в печени происходит путем гидроксилирования кетоновых групп 20-го углеродного атома. Наряду с этим наблюдалось также гидроксилирование метильных групп 21-го углеродного атома и в весьма незначительном объеме — 16-α углеродного атома. С мочой выводится от 56 до 79%; через 24 ч выводится примерно 85%, через 72 ч процесс выведения практически заканчивается. Сведений о задержке или усилении действия дидрогестерона при ограниченной функции почек на сегодняшний день не поступало. Метаболиты обнаруживаются в моче преимущественно в виде конъюгатов глюкуроновой кислоты. Присутствия в моче неизмененного вещества не обнаружено.
Присутствия в моче неизмененного вещества не обнаружено.
Показания препарата Дюфастон®
Прогестероновая недостаточность: эндометриоз; бесплодие, обусловленное лютеиновой недостаточностью; привычный и угрожающий выкидыш на фоне установленного дефицита прогестерона, предменструальный синдром, дисменорея, нерегулярные менструации, вторичная аменорея (в сочетании с терапией эстрогенами), дисфункциональные маточные кровотечения.
ЗГТ: для нейтрализации пролиферативного действия эстрогенов на эндометрий в рамках ЗГТ у женщин с расстройствами, обусловленными естественной или хирургической менопаузой при интактной матке.
Противопоказания
Гиперчувствительность к дидрогестерону или другим компонентам препарата.
С осторожностью — кожный зуд во время предшествовавшей беременности.
В настоящее время нет данных об отрицательном действии дидрогестерона у пациентов с хронической почечной недостаточностью.
Применение при беременности и кормлении грудью
Препарат может применяться во время беременности (см.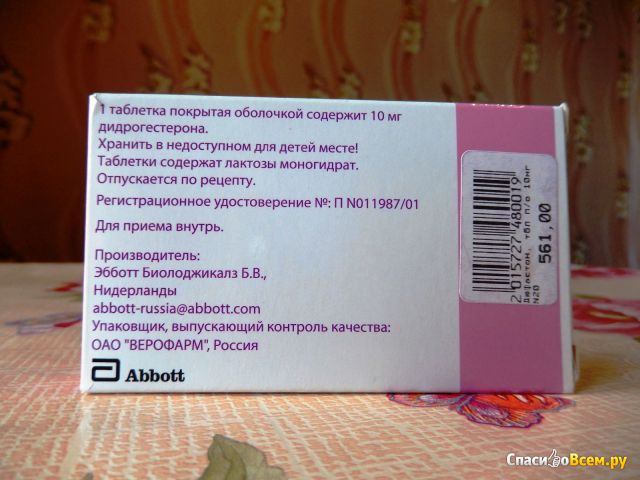 поле «Показания»). Дидрогестерон выделяется с материнским молоком, поэтому грудное вскармливание во время приема препарата не рекомендуется.
поле «Показания»). Дидрогестерон выделяется с материнским молоком, поэтому грудное вскармливание во время приема препарата не рекомендуется.
Побочные действия
Со стороны системы кроветворения: в единичных случаях — гемолитическая анемия.
Со стороны иммунной системы: в очень редких случаях — реакции гиперчувствительности.
Со стороныЦНС:головная боль/мигрень.
Со стороны гепатобилиарной системы: редко — незначительные нарушения функции печени, иногда сопровождающиеся слабостью или недомоганием, желтухой и болью в области живота.
Со стороны репродуктивной системы: в редких случаях возможно возникновение прорывных кровотечений, которые можно предотвратить увеличением дозы препарата; повышенная чувствительность молочных желез.
Со стороны кожи и подкожной клетчатки: редко — кожная сыпь, зуд, крапивница; очень редко — отек Квинке.
Общие расстройства: очень редко — периферические отеки.
Взаимодействие
Индукторы микросомальных ферментов печени (фенобарбитал, рифампицин) могут ускорять метаболизм дидрогестерона и снижать эффект.
Способ применения и дозы
Внутрь. Эндометриоз: по 10 мг 2–3 раза в день с 5 по 25 день цикла или непрерывно.
Бесплодие (обусловленное лютеиновой недостаточностью): 10 мг/день с 14 по 25 день цикла, курс проводят непрерывно в течение 6 следующих друг за другом циклов и более;рекомендуется продолжить лечение в первые месяцы беременности (как при привычном аборте).
Угрожающий аборт: 40 мг однократно, затем — по 10 мг каждые 8 ч до исчезновения симптомов.
Привычный аборт: 10 мг 2 раза в день до 20нед беременности, с последующим постепенным уменьшением дозы.
Предменструальный синдром: по 10 мг 2 раза в день с 11 по 25 день цикла.
Дисменорея: по 10 мг 2 раза в день с 5 по 25 день цикла.
Нерегулярные менструации: по 10 мг 2 раза в день с 11 по 25 день цикла.
Аменорея: эстрогены — 1 раз в день с 1 по 25 день, Дюфастон® — по 10 мг 2 раза в день с 11 по 25 день цикла.
Дисфункциональные маточные кровотечения: для остановки кровотечения — по 10 мг 2 раза в день в течение 5–7 дней; для профилактики кровотечения — по 10 мг 2 раза в день с 11 по 25 день цикла.
ЗГТ в сочетании с эстрогенами: при непрерывной схеме приема эстрогенов — по 10 мг Дюфастона® 1 раз в день в течение 14 дней в рамках 28-дневного цикла. При циклической схеме приема эстрогенов: Дюфастон® — 10 мг 1 раз в день в течение последних 12–14 дней приема эстрогенов. Если биопсия илиУЗИ свидетельствуют о недостаточной реакции на прогестагенный препарат, суточную дозу дидрогестерона необходимо увеличить до 20 мг.
Передозировка
Сообщений о симптомах передозировки не зарегистрировано. При случайном приеме в дозе, значительно выше терапевтической, рекомендуется промывание желудка.
Лечение: симптоматическое. Специфического антидота не существует.
Особые указания
У некоторых пациенток могут наблюдаться прорывные кровотечения, которые предотвращают путем увеличения дозы препарата. В случае назначения дидрогестерона в комбинации с эстрогенами (например, для ЗГТ) следует внимательно ознакомиться с противопоказаниями и предупреждениями, связанными с применением эстрогенов. Перед началом применения комбинации дидрогестерона и эстрогена (для ЗГТ) должен быть собран полный анамнез. Во время лечения рекомендуется периодически проводить контроль индивидуальной переносимости ЗГТ. Пациентка должна быть информирована, о каких изменениях в молочных железах ей следует сообщать врачу или медсестре. Исследования, включающие маммографию, следует проводить в соответствии с общепринятым скринингом пациентов. У женщин, получающих ЗГТ, точная оценка риска и пользы оценивается со временем. Иногда в течение первых месяцев лечения возможно возникновение прорывных кровотечений. Если прорывные кровотечения возникают после некоторого периода приема препарата или продолжаются после курса лечения, следует изучить причину, сделать биопсию эндометрия с целью исключения злокачественных изменений в эндометрии.
В случае назначения дидрогестерона в комбинации с эстрогенами (например, для ЗГТ) следует внимательно ознакомиться с противопоказаниями и предупреждениями, связанными с применением эстрогенов. Перед началом применения комбинации дидрогестерона и эстрогена (для ЗГТ) должен быть собран полный анамнез. Во время лечения рекомендуется периодически проводить контроль индивидуальной переносимости ЗГТ. Пациентка должна быть информирована, о каких изменениях в молочных железах ей следует сообщать врачу или медсестре. Исследования, включающие маммографию, следует проводить в соответствии с общепринятым скринингом пациентов. У женщин, получающих ЗГТ, точная оценка риска и пользы оценивается со временем. Иногда в течение первых месяцев лечения возможно возникновение прорывных кровотечений. Если прорывные кровотечения возникают после некоторого периода приема препарата или продолжаются после курса лечения, следует изучить причину, сделать биопсию эндометрия с целью исключения злокачественных изменений в эндометрии.
Состояния, при которых необходимо наблюдение: пациентов следует тщательно обследовать при наличии в анамнезе прогестеронзависимой опухоли (например менингиомы), а также в случае ее прогрессирования во время беременности или в течение предшествовавшей гормональной терапии.
Другие состояния: пациентам с генетически обусловленной непереносимостью галактозы, недостаточностью лактазы или синдромом мальабсорбции не следует принимать данный препарат.
Препарат не влияет на способность к управлению автомобилем и другими механизмами.
Производитель
Солвей Фармасьютикалз Б.В., Нидерланды.
Условия хранения препарата Дюфастон®
В сухом месте, при температуре не выше 30 °C, в оригинальной упаковке.
Хранить в недоступном для детей месте.
Срок годности препарата Дюфастон®
5 лет.
Не применять по истечении срока годности, указанного на упаковке.
ДЮФАСТОН таблетки цена в Ташкенте. Инструкция к применению, состав и отзывы на Med24
ДЮФАСТОН таблетки цена в Ташкенте. Инструкция к применению, состав и отзывы на Med24
Инструкция к применению, состав и отзывы на Med24Эбботт Биолоджикалз Б.В./Верофарм АО (Нидерланды/Россия) и другие
Цены в аптеках
Инструкция
Показания к применению
Состояния, характеризующиеся дефицитом прогестерона:
-Эндометриоз;
-Бесплодие, обусловленное недостаточностью лютеиновой фазы;
-Угрожающий аборт;
-Привычный выкидыш;
-Предменструальный синдром;
-Дисменорея;
-Нерегулярные менструации;
-Вторичная аменорея;
-Дисфункциональные маточные кровотечения.
Заместительная гормональная терапия (ЗГТ):
Для нейтрализации пролиферативного действия эстрогенов на эндометрий в рамках ЗГТ у женщин с расстройствами, обусловленными естественной или хирургической менопаузой при интактной матке.
Противопоказания
-Повышенная чувствительность к дидрогестерону или другим компонентам препарата.
-Диагностированные или подозреваемые прогестагензависимые новообразования (например, менингиома).
-Кровотечения из влагалища неясной этиологии.
-Нарушения функции печени, обусловленные острыми или хроническими заболеваниями печени в настоящее время или в анамнезе (до нормализации показателей функциональных проб печени).
-Злокачественные опухоли печени в настоящее время или в анамнезе.
-Непереносимость галактозы, недостаточность лактазы, синдром мальабсорбции глюкозы-галактозы.
-Период грудного вскармливания.
-Порфирия, в настоящее время или в анамнезе.
-Возраст до 18 лет, в связи с отсутствием данных по эффективности и безопасности у девочек-подростков младше 18 лет.
При комбинации с эстрогенами
При применению по показанию заместительная гормональная терапия (ЗГТ):
-Нелеченная гиперплазия эндометрия.
-Артериальные и венозные тромбозы, тромбоэмболии в настоящее время или в анамнезе (в том числе тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, тромбофлебит, цереброваскулярные нарушения по геморрагическому и ишемическому типу).
-Выявленная предрасположенность к венозному или артериальному тромбозу (резистентность к активированному протеину С, гипергомоцистеинемия, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт).
С осторожностью
-депрессия, в настоящее время или в анамнезе;
-состояния, ранее появившиеся или обострившиеся во время предшествующей беременности или предыдущего приема половых гормонов, такие как: холестатическая желтуха, герпес во время беременности, тяжелый кожный зуд, отосклероз.
При применении дидрогестерона в комбинации с эстрогенами необходимо соблюдать осторожность при наличии факторов риска развития тромбоэмболических состояний, таких как стенокардия, длительная иммобилизация, тяжелые формы ожирения (индекс массы тела более 30 кг/м ), пожилой возраст, обширные хирургические вмешательства, системная красная волчанка, рак, у пациенток, получающих антикоагулянтную терапию; с эндометриозом, миомой матки; наличием гиперплазии эндометрия в анамнезе; аденомой печени; сахарным диабетом с наличием или без сосудистых осложнений; артериальной гипертензией; бронхиальной астмой; эпилепсией; мигренью или тяжелой головной болью
в анамнезе; желчекаменной болезнью; хронической почечной недостаточностью; при наличии в анамнезе факторов риска развития эстрогензависимых опухолей (например, родственниц 1-ой линии родства с раком молочной железы).
Применение во время беременности и в период грудного вскармливания
Беременность
Более 10 миллионов беременных женщин принимали дидрогестерон. К настоящему времени отсутствуют данные об отрицательном влиянии дидрогестерона при его использовании во время беременности.
Препарат может применяться во время беременности (см. раздел «Показания к применению»).
Имеются отдельные сообщения о возможной связи риска развития гипоспадии с применением некоторых прогестагенов. Однако, множество различных факторов, влияющих на беременность, не позволяют сделать однозначный вывод о влиянии прогестагенов на риск возникновения гипоспадии. Результаты клинических исследований, в которых ограниченное число женщин получали дидрогестерон на ранних сроках беременности, не подтвердили увеличения риска гипоспадии. В настоящее время иные эпидемиологические данные отсутствуют.
Период грудного вскармливания
Отсутствуют данные относительно выделения дидрогестерона с грудным молоком. При применении других прогестагенов установлено, что прогестагены и их метаболиты выделяются с грудным молоком в небольших количествах. Наличие риска для ребенка не изучено. В связи с этим, грудное вскармливание во время приема препарата Дюфастон® не рекомендуется.
При применении других прогестагенов установлено, что прогестагены и их метаболиты выделяются с грудным молоком в небольших количествах. Наличие риска для ребенка не изучено. В связи с этим, грудное вскармливание во время приема препарата Дюфастон® не рекомендуется.
Состав
В 1 таблетке покрытой оболочкой содержится:
Активное вещество: дидрогестерон — 10 мг.
Вспомогательные вещества: лактозы моногидрат — 111,1 мг, гипромеллоза — 2,8 мг, крахмал кукурузный — 14,0 мг, кремния диоксид коллоидный — 1,4 мг, магния стеарат -0,7 мг.
Оболочка: опадри белый Y-1-7000 [гипромеллоза, полиэтиленгликоль 400, титана диоксид (Е171)] -4,0 мг.
Основные сведения
Аналоги ДЮФАСТОН таблетки
КОМАСТОН таблетки
Combitic Global Caplet Pvt. Ltd. (Индия)
Активные вещества
Дидрогестерон
ДЮФАСТОМИГ таблетки
Sharq Darmon, OOO (Узбекистан)
Фото упаковок ДЮФАСТОН таблетки
ДЮФАСТОН 0,01 таблетки N20
ДЮФАСТОН 0,01 таблетки N28
Алфавитный указатель препаратов
- А
- Б
- В
- Г
- Д
- Е
- Ё
- З
- И
- Й
- К
- Л
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Э
- Ю
- Я
- A-Z
- 0-9
Информация, представленная на сайте, не может быть использована для
постановки диагноза, назначения лечения и не заменяет прием врача.
© 2019-2023 med24.uz. Все права защищены.
Гормоны при беременности — PMC
1. Csapo AL, Pulkkinen MO, Wiest WG. Эффекты лютеэктомии и заместительной терапии прогестероном у пациенток на ранних сроках беременности. Am J Obstet Gynecol. 1973; 115:759. [PubMed] [Google Scholar]
2. Schneider MA, Davies MC, Honor JW. Сроки плацентарной компетентности при беременности после донорства ооцитов. Фертил Стерил. 1993; 59:1059. [PubMed] [Google Scholar]
3. Ротшильд И. Роль прогестерона в инициировании и поддержании беременности. В: Бардин К.В., Милгром Э., Мове-Джарвис П., редакторы. Прогестерон и прогестины. Нью-Йорк: Рейвен Пресс; 1983. с. 219. [Google Scholar]
4. Drake PM, Gunn MD, Charo IF, Tsou CL, Zhou Y, Huang L, et al. Плацентарные цитотрофобласты человека привлекают моноциты и CD56 (яркие) естественные клетки-киллеры посредством действия воспалительного белка моноцитов 1альфа. J Эксперт Мед. 2001; 193:1199–212. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Эксперт Мед. 2001; 193:1199–212. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Вахаби Х.А., Файед А.А., Эсмаил С.А., Аль Зейдан Р.А. Прогестоген для лечения угрожающего выкидыша. Кокрановская система базы данных, ред. 2011; 12: CD005943. [PubMed] [Академия Google]
6. Эль-Зибде М.Ю., Юсеф Л.Т. Поддержка дидрогестерона при угрозе выкидыша. Зрелые. 2009; 65 (Приложение 1): S43–6. [PubMed] [Google Scholar]
7. Резникофф-Этиевант М.Ф., Зиттоун Дж., Вайлет С., Пернет П., Мильез Дж. Низкий уровень витамина В12 как фактор риска очень раннего рецидивирующего аборта. Eur J Obstet Gynecol Reprod Biol. 2002; 104: 156–9. [PubMed] [Google Scholar]
8. Clifford K, Rai R, Regan L. Исход будущей беременности при необъяснимом повторяющемся выкидыше в первом триместре. Хум Репрод. 1997;12:387-9. [PubMed] [Google Scholar]
9. Вальх Катарина Т., Хубер Йоханнес С. Прогестерон при невынашивании беременности. Best Pract Res Clin Obstetr Gynaecol. 2008; 22: 375–89. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
10. Proctor A, Hurst Bradley S, Marshbrn Paul B, Matthews Michelle L. Влияние дополнительного прогестерона на ранних сроках беременности на исход беременности после оплодотворения in vitro . Фертил Стерил. 2006;85:1550–2. [PubMed] [Google Scholar]
11. Daya S, Gunby J. Поддержка лютеиновой фазы в циклах вспомогательной репродукции. Cochrane Database Syst Rev. 2004;3:CD004830. [PubMed] [Академия Google]
12. van der Linden M, Buckingham K, Farquhar C, Kremer JA, Metwally M. Поддержка лютеиновой фазы для циклов вспомогательной репродукции. Кокрановская система базы данных, ред. 2011; 10:CD009154. [PubMed] [Google Scholar]
13. Meis PJ, Klebanoff M, Thom E, Dombrowski MP, Sibai B, Moawad AH, et al. Профилактика повторных преждевременных родов с помощью 17 альфа-гидроксипрогестерона капроата. New Engl J Med. 2003; 348: 2379–85. [PubMed] [Google Scholar]
14. Как ХИ, Сибай БМ. Прогестерон для профилактики преждевременных родов: показания, когда начинать, эффективность и безопасность. Ther Clin Risk Manag. 2009 г.;5:55–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ther Clin Risk Manag. 2009 г.;5:55–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Von Eye Corleta H, Capp E, Ferreira MB. Фармакокинетика вагинальных суппозиториев с натуральным прогестероном. Гинеколь Обстет Инвест. 2004; 58:105–8. [PubMed] [Google Scholar]
16. Di Renzo GC, Mattei A, Gojnic M, Gerli S. Прогестерон и беременность. Curr Opin Obstet Gynecol. 2005; 17: 598–600. [PubMed] [Google Scholar]
17. Борна С., Сахаб Н. Прогестерон для поддерживающей токолитической терапии после угрожающих преждевременных родов: рандомизированное контрольное исследование. Aust N Z J Obstet Gynaecol. 2008; 48:58–63. [PubMed] [Академия Google]
18. Hudić I, Szekeres-Bartho J, Fatušić Z, Stray-Pedersen B, Dizdarević-Hudić L, Latifagić A. Добавление дидрогестерона у женщин с угрозой преждевременных родов – влияние на профиль цитокинов, гормональный профиль и прогестерон – индуцированная блокада фактор. J Reprod Immunol. 2011;92:103–7. [PubMed] [Google Scholar]
19. Арикан И., Барут А., Харма М., Харма И.М. Влияние прогестерона как токолитика и поддерживающей терапии при преждевременных родах. Гинеколь Обстет Инвест. 2011;72:269–73. [PubMed] [Google Scholar]
Арикан И., Барут А., Харма М., Харма И.М. Влияние прогестерона как токолитика и поддерживающей терапии при преждевременных родах. Гинеколь Обстет Инвест. 2011;72:269–73. [PubMed] [Google Scholar]
20. Tonguc E, Var T, Ozyer S, Citil A, Dogan M. Добавка эстрадиола во время лютеиновой фазы in vitro циклов оплодотворения: проспективное рандомизированное исследование. Eur J Obstet Gynecol Reprod Biol. 2011; 154:172–6. [PubMed] [Google Scholar]
21. Dittrich R, Beckmann MW, Oppelt PG, Hoffmann I, Lotz L, Kuwert T, et al. Рецепторы гормонов щитовидной железы и репродукция. J Reprod Immunol. 2011;90:58–66. [PubMed] [Google Scholar]
22. Krassas GE, Poppe K, Glinoer D. Функция щитовидной железы и репродуктивное здоровье человека. Endocr Rev. 2010; 31:702–55. [PubMed] [Академия Google]
23. Язбек С.Ф., Салливан С.Д. Заболевания щитовидной железы во время беременности. Мед Клин Норт Ам. 2012;96:235–56. [PubMed] [Google Scholar]
24. Vissenberg R, van den Boogaard E, van Wely M, van der Post JA, Fliers E, Bisschop PH, et al. Лечение заболеваний щитовидной железы до зачатия и на ранних сроках беременности: систематический обзор. Обновление воспроизведения гула. 2012;18:360–73. [PubMed] [Google Scholar]
Лечение заболеваний щитовидной железы до зачатия и на ранних сроках беременности: систематический обзор. Обновление воспроизведения гула. 2012;18:360–73. [PubMed] [Google Scholar]
25. Рид С.М., Миддлтон П., Коссич М.С., Кроутер К.А. Вмешательства при клиническом и субклиническом гипотиреозе у беременных. Cochrane Database Syst Rev. 2010;(7):CD007752. [PubMed] [Академия Google]
Сравнение перорального дидрогестерона с вагинальным суппозиторием прогестерона для поддержки лютеиновой фазы при экстракорпоральном оплодотворении (ЭКО): рандомизированное клиническое исследование
Iran J Reprod Med. 2013 ноябрь; 11(11): 913–918.
Сагар Салехпур, доктор медицины, Марьям Тамими, доктор медицины, и Насрин Сахархиз, доктор медицины
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
Исходная информация: Поддержка лютеиновой фазы является обязательной при вспомогательных репродуктивных технологиях (ВРТ) для оптимизации результатов, поэтому лютеиновая фаза поддерживается прогестероном, добавлением эстрадиола к прогестерону, ХГЧ или агонистами гонадотропин-рилизинг-гормона (ГнРГ).
Цель: Сравнить пероральный дидрогестрон с вагинальным прогестероном для поддержки лютеиновой фазы при ЭКО.
Материалы и методы: Мы провели это проспективное рандомизированное исследование в отделении третичной помощи при бесплодии в больнице Талегани, Тегеран, Иран. В общей сложности 80 женщин с мужским бесплодием в анамнезе, подвергшихся контролируемой стимуляции яичников для лечения ЭКО (свежий цикл), были случайным образом разделены на две группы (группа А или группа перорального дидрогестерона и группа В или группа вагинального прогестерона). Критериями включения были использование аналогов ГнРГ с понижающей регуляцией и возраст менее 40 лет с регулярными менструальными циклами. Все женщины были в эутиреоидном состоянии и с нормопролактинемией. Группа А (n=40) получала 10 мг дидрогестерона четыре раза в день (40 мг в день), а группа B (n=40) получала 400 мг вагинального суппозитория прогестерона (циклогест) дважды в день (800 мг в день).
Результаты: Частота клинической беременности в группе циклогестов была выше, чем в группе дидрогестерона, но разница была незначительной (p = 0,52), кроме того, частота выкидышей в двух группах была одинаковой. Разница между двумя группами в отношении антрального фолликула, числа эмбрионов, продолжительность лютеиновой фазы, толщина эндометрия, количество ооцитов и метафаза-II не были значимыми (p>0,05).
Заключение: Результаты показали, что пероральный дидрогестерон столь же эффективен, как и вагинальный прогестерон, для поддержки лютеиновой фазы у женщин, перенесших ЭКО.
Ключевые слова: Экстракорпоральное оплодотворение , Поддержка лютеиновой фазы , Дидрогестерон , Вагинальный прогестерон
случаи, перенесшие ЭКО, продемонстрировали значительное снижение частоты наступления беременности без поддержки лютеиновой фазы (LPS) (1–3). В отсутствие поддержки лютеиновой фазы площадь под кривой для прогестерона субоптимальна и сопровождается преждевременным лютеолизом, короткой лютеиновой фазой и ранним кровотечением (4, 5). Прогестерон необходим для имплантации и раннего развития оплодотворенной яйцеклетки. В ответ на прогестерон железы становятся извитыми и секреторными, увеличивается стромальная васкуляризация, что делает эндометрий как морфологически, так и функционально хорошо подготовленным к имплантации (6).
Прогестерон необходим для имплантации и раннего развития оплодотворенной яйцеклетки. В ответ на прогестерон железы становятся извитыми и секреторными, увеличивается стромальная васкуляризация, что делает эндометрий как морфологически, так и функционально хорошо подготовленным к имплантации (6).
При вспомогательных репродуктивных технологиях (ВРТ) добавление прогестерона в лютеиновую фазу является обычной практикой, и несколько сообщений сходятся в том, что поддержка лютеиновой фазы улучшает результаты ЭКО (7-9). Парентеральное введение прогестерона, вагинально или внутримышечно, не подвергает соединение значительным метаболическим последствиям перорального введения. Прогестерон, вводимый перорально, подвергается пресистемному препеченочному и печеночному метаболизму. Эта метаболическая активность приводит к деградации прогестерона до его восстановленных метаболитов 5α и 5β (10). Дидрогестерон представляет собой оптический изомер прогестерона, в котором метильная группа в атоме углерода 10 расположена в положении α вместо положения β в природном прогестероне (11).
Эти изменения в составе делают дидрогестерон более стабильным и эффективным при пероральном приеме, и доказано, что дидрогестерон обеспечивает превосходное соблюдение пациентом режима лечения, низкий уровень местных побочных эффектов и частоту сохраняющихся беременностей 31% после ЭКО (12). Пероральное введение является самым простым способом введения и, как правило, наиболее приемлемым путем для пациента. Вагинальное введение приводит к более высоким концентрациям в матке, но часто вызывает дискомфорт при наличии вагинального кровотечения или может быть вымыто при сильном кровотечении.
Дидрогестерон имеет хороший профиль безопасности и переносимости. Он структурно и фармакологически подобен природному прогестерону, имеет хорошую биодоступность при пероральном приеме и мало побочных эффектов. Дидрогестерон не оказывает андрогенного действия на плод и не угнетает образование прогестерона в плаценте. По-видимому, лекарство не оказало побочного действия на мать. Только Пелинеску-Ончул сообщил о сонливости. Gelle и Schaeffer сообщили о тошноте и рвоте, но только у одного пациента и Chang сообщили о тошноте и рвоте у двух пациентов. Однако тошнота и рвота могут быть вызваны самой ранней беременностью, а не лекарствами (13).
Gelle и Schaeffer сообщили о тошноте и рвоте, но только у одного пациента и Chang сообщили о тошноте и рвоте у двух пациентов. Однако тошнота и рвота могут быть вызваны самой ранней беременностью, а не лекарствами (13).
Дидрогестерон, по-видимому, связан с более высокой массой тела при рождении, более высокой 1-минутной оценкой по шкале Апгар и более низкой частотой задержки роста. Однако эти различия не были существенными. Казалось, что врожденных дефектов очень мало. Во многих работах конкретно не сообщалось об отсутствии врожденных аномалий (13). Другие исследователи сообщили о потенциальной связи между приемом матери дидрогестерона во время беременности и врожденными дефектами. Типы дефектов были очень разнообразны, без каких-либо признаков закономерности аномалий. Данные не свидетельствуют о врожденных пороках развития, связанных с применением дидрогестерона (14).
Тем не менее, имеется ограниченное количество сообщений об использовании дидрогестерона в циклах ВРТ для лютеиновой добавки, и эти исследования подготовили противоречивую информацию о пути введения прогестерона. Patki и соавт. указали, что частота наступления беременности значительно выше при применении дидрогестерона, чем при применении микронизированного вагинального прогестерона и плацебо (15). Напротив, Levine et al. сравнили фармакокинетику перорального микронизированного препарата прогестерона с фармакокинетикой вагинального геля прогестерона и показали, что вагинальный гель был связан с более высокой максимальной концентрацией прогестерона в сыворотке. Они пришли к выводу, что вагинальное введение прогестерона приводит к большей биодоступности с меньшей относительной вариабельностью, чем пероральный прогестерон (16).
Patki и соавт. указали, что частота наступления беременности значительно выше при применении дидрогестерона, чем при применении микронизированного вагинального прогестерона и плацебо (15). Напротив, Levine et al. сравнили фармакокинетику перорального микронизированного препарата прогестерона с фармакокинетикой вагинального геля прогестерона и показали, что вагинальный гель был связан с более высокой максимальной концентрацией прогестерона в сыворотке. Они пришли к выводу, что вагинальное введение прогестерона приводит к большей биодоступности с меньшей относительной вариабельностью, чем пероральный прогестерон (16).
Целью данного исследования было сравнение перорального дидрогестрона с натуральным вагинальным прогестероном для поддержки лютеиновой фазы при ЭКО.
Мы проводили это проспективное рандомизированное одностороннее слепое исследование в отделении третичной помощи при бесплодии с мая по декабрь 2012 года в больнице Талегани, Тегеран, Иран. Исследование было одобрено этическим комитетом Университета медицинских наук им. Шахида Бехешти. Протокол исследования был разъяснен для всех пациентов, и было дано информированное письменное согласие. Всего в это исследование было включено 80 женщин с мужским бесплодием в анамнезе, которым проводилась контролируемая стимуляция яичников для лечения ЭКО (свежий цикл). Критериями включения были использование аналогов ГнРГ с понижающей регуляцией и возраст менее 40 лет с регулярными менструальными циклами. Все женщины были в эутиреоидном состоянии и с нормопролактинемией.
Исследование было одобрено этическим комитетом Университета медицинских наук им. Шахида Бехешти. Протокол исследования был разъяснен для всех пациентов, и было дано информированное письменное согласие. Всего в это исследование было включено 80 женщин с мужским бесплодием в анамнезе, которым проводилась контролируемая стимуляция яичников для лечения ЭКО (свежий цикл). Критериями включения были использование аналогов ГнРГ с понижающей регуляцией и возраст менее 40 лет с регулярными менструальными циклами. Все женщины были в эутиреоидном состоянии и с нормопролактинемией.
Женщины с трубным фактором, идиопатическим бесплодием, бесплодием, связанным с эндометриозом, и овуляторными нарушениями, кроме того, женщины с исходным уровнем ФСГ >12 МЕ и аденомиозом, поликистозом яичников, эндометриозом, миомой и хронической гепаторенальной болезнью были исключены. Всем женщинам ежедневно вводили подкожно (п/к) 500 мкг агониста ГнРГ (Бусерелин Супрефакт; Авентисфарма; Германия), а затем рекомбинантный ФСГ 150–300 МЕ (Гонал-Ф; Сероно; Обонн, Швейцария) или высокоочищенный ФСГ. Фостимон; IBSA; Лугано).
Фостимон; IBSA; Лугано).
Развитие фолликулов яичников контролировали с помощью трансвагинального УЗИ и вводили 10000 МЕ хорионического гонадотропина человека (Хориомон; ИБСА; Лугано) внутримышечно, когда по крайней мере два или более ведущих фолликула достигали 18 мм в диаметре. Ооциты извлекали трансвагинально под ультразвуковым контролем через 34-36 часов после инъекции ХГЧ. После сбора яйцеклеток был проведен процесс ИКСИ. В среднем через 48-72 часа после осеменения переносили три эмбриона. Поддержка лютеиновой фазы начиналась в день забора ооцитов.
Пациентки случайным образом были разделены на две группы (группа А или группа перорального дидрогестерона и группа В или группа вагинального циклогест). для рандомизации; пронумерованные запечатанные конверты были подготовлены и предоставлены координатором исследования в соответствии с таблицами случайных чисел. Группа А (n=40) получала 10 мг дидрогестерона четыре раза в день (Дюфастон; Эббот; Стамбул), а группа В (n=40) получала 400 мг прогестерона вагинально дважды в день (Циклогест; Актавис; Барнстейпл; Великобритания). Уровень β-ХГЧ в сыворотке измеряли через 12 дней после ЭТ.
Уровень β-ХГЧ в сыворотке измеряли через 12 дней после ЭТ.
Поддержка лютеиновой фазы продолжалась до 12 недель беременности. Исход в двух группах оценивали с точки зрения клинической беременности и частоты выкидышей. Клиническая беременность определялась, когда УЗИ, проведенное через 6 недель после ЭТ, выявило наличие жизнеспособного плода. Выкидыш – это потеря плода до 20 й недели беременности. Наличие хотя бы одного жизнеспособного плода на сроке 12 нед гестации расценивали как продолжающуюся беременность.
Статистический анализ
Данные проанализированы с использованием SPSS версии 20. Категориальные данные представлены в виде чисел (%), а непрерывные данные — в виде среднего значения ± стандартное отклонение. Мы использовали квадрат Чай (X 2 ) или точный критерий Фишера для сравнения категориальных переменных и критерий Стьюдента t для сравнения непрерывных переменных в двух группах. (p≤0,05 значимо)
82 пациента, которые соответствовали критериям включения, были случайным образом разделены на две группы. Некоторые пациенты отозвали согласие на участие в исследовании (схема участия пациентов), поэтому для анализа; в каждой группе было по 40 пациентов, которые продолжали участие. Различий между группами по среднему возрасту, индексу массы тела и уровню ФСГ не выявлено. Эти демографические данные, включая средний возраст, ИМТ и ФСГ женщин в двух группах, приведены на рис. Разница между двумя группами в отношении возраста, ИМТ и ФСГ была незначительной (р>0,05) [р возраста: 0,13, ИМТ: 0,98, ФСГ: 0,83].
Некоторые пациенты отозвали согласие на участие в исследовании (схема участия пациентов), поэтому для анализа; в каждой группе было по 40 пациентов, которые продолжали участие. Различий между группами по среднему возрасту, индексу массы тела и уровню ФСГ не выявлено. Эти демографические данные, включая средний возраст, ИМТ и ФСГ женщин в двух группах, приведены на рис. Разница между двумя группами в отношении возраста, ИМТ и ФСГ была незначительной (р>0,05) [р возраста: 0,13, ИМТ: 0,98, ФСГ: 0,83].
Таблица I
Базовые характеристики пациентов
| Группы | Дидрогестерон (N=40) | Циклогест (N=40) | p-значение |
|---|---|---|---|
| Mean age, years (SD) | 29. 4 ± 5.26 4 ± 5.26 | 31.84 ± 6.10 | 0.13 |
| Mean BMI, kg/m 2 (SD) | 24.20 ± 3.04 | 24.24 ± 3.89 | 0.98 |
| FSH day 3 (IU/L) | 6.85 ± 2.43 | 7.00 ± 2.42 | 0.83 |
Open in a separate window
BMI: Body Mass Индекс
Между тем, антральный фолликул, количество эмбрионов, продолжительность лютеиновой фазы, толщина эндометрия в день ЕТ, количество ооцитов и метафаза-II были одинаковыми между двумя группами (). Разница между двумя группами в отношении (циклогест-дюфастон) была незначительной (p>0,05) [значение P антрального фолликула: 0,349, Количество эмбрионов: 0,48, Продолжительность лютеиновой фазы: 0,44, Толщина эндометрия: 0,21, Количество ооцитов: 0,59, Метафаза-II: 0,83]. Исходя из этого, частота наступления клинической беременности в группе циклогестов была выше, чем в группе дидрогестерона, но разница была недостоверной (р=0,52), кроме того, частота невынашивания беременности в двух группах была одинаковой [р=0,95] (). Однако кровотечение и другие осложнения, такие как тошнота и боль в эпигастрии, в группе дидрогестрона были больше, чем в группе циклогестса, и разница между двумя группами была достоверной (p=0,03 и p=0,009).соответственно) ().
Исходя из этого, частота наступления клинической беременности в группе циклогестов была выше, чем в группе дидрогестерона, но разница была недостоверной (р=0,52), кроме того, частота невынашивания беременности в двух группах была одинаковой [р=0,95] (). Однако кровотечение и другие осложнения, такие как тошнота и боль в эпигастрии, в группе дидрогестрона были больше, чем в группе циклогестса, и разница между двумя группами была достоверной (p=0,03 и p=0,009).соответственно) ().
Таблица II
Характеристики, клинические исходы и побочные эффекты препаратов в двух группах
| Группы | Дидрогестрон (N=40) | Циклогест (N=40) | p-значение | |
|---|---|---|---|---|
| Антральный фолликул | 0,349 | |||
| >7 | 38 (95%) 6 7 7 92 18 65 %) 90 (18)0162 | |||
| <7 | 2 (5%) | 6 (15%) | ||
| Продолжительность фазы лютеил (день) | 0,44 | |||
| 0,44 | ||||
| 0,44 | ||||
| 0,44 | ||||
| 0,44 | ||||
0. (69)% (69)% | ||||
| <11 | 15 (37.5%) | 10 (25.0%) | ||
| Endometrial thickness | 9.08 ± 1.99 | 8.52 ± 1.15 | 0.21 | |
| Oocyte number | 8,44 ± 4,37 | 9.20 ± 5.47 | 0.59 | |
| Metaphase-II | 6.37 ± 3.34 | 6.60 ± 4.13 | 0. 83 83 | |
| Embryo number | 0.63 ± 0.30 | 0.70 ± 0.31 | 0.48 | |
| Клинические исходы | ||||
| Беременная | 10 (25%) | 13 (32,5%) | 0,52 | |
| 0,52 | ||||
| 0,52 | ||||
| 8 0,52 | .01670.95 | |||
| Side effects | ||||
| Bleeding | 19 (48%) | 8 (20%) | 0. 03 03 | |
| Nausea | 10 (25%) | 0 | 0,009 | |
| Epigastric Pain | 6 (15%) | 0 | 0,008 | |
Open Open opender
.
Хи-квадрат (X 2 ) тест, независимый t тест
Гормональная поддержка лютеиновой фазы при вспомогательных репродуктивных технологиях (ВРТ) исторически была важной проблемой среди исследователей (17, 18). В последнее время добавление прогестерона (P) улучшило результаты во время АРТ и стало предпочтительным методом лечения (17-19). Что касается пути введения прогестерона, внутримышечный и трансвагинальный пути являются двумя общепринятыми методами введения прогестерона (20). Однако очень мало исследований сравнивали преимущества перорального дидрогестрона с вагинальным прогестероном для поддержки лютеина в циклах ВРТ.
Что касается пути введения прогестерона, внутримышечный и трансвагинальный пути являются двумя общепринятыми методами введения прогестерона (20). Однако очень мало исследований сравнивали преимущества перорального дидрогестрона с вагинальным прогестероном для поддержки лютеина в циклах ВРТ.
Дидрогестрон представляет собой ретропрогестерон с хорошей пероральной биодоступностью, содержащий биологически активный метаболит прогестерона, который оказывает антиэстрогенное действие на эндометрий, вызывая секреторную трансформацию (20-23). Vaisbuch и соавт. сравнили клиническую практику применения добавок лютеиновой фазы (LPS) в стимулированных циклах ЭКО в 35 странах, что составляет в общей сложности 51 155 циклов ЭКО в год. Только вагинальный прогестерон использовался для ЛПС в 64% циклов и еще в 16% циклов в комбинации с в/м введением. (15%) или пероральный прогестерон (1%). Являясь единственным агентом, i.m. прогестерон использовался в 13% циклов, пероральный прогестерон – еще в 2%, а хорионический гонадотропин человека (ХГЧ) по-прежнему использовался в 5% циклов (21).
В этом рандомизированном клиническом исследовании мы сравнили клиническую эффективность перорального дидрогестрона с вагинальным прогестероном (циклогест) в отношении ЛПС в стимулированных циклах ЭКО у 80 женщин. Что касается демографических данных, таких как возраст, ИМТ и ФСГ на 3-й день, две группы были правильно подобраны, и разница между ними была незначительной (p>0,05). Наши результаты показали, что частота клинической беременности в группе циклогестов была выше, чем в группе дидрогестрона (32,5% против 25%), но разница не была значимой (p = 0,52), кроме того, частота выкидышей в двух группах была одинаковой.
В соответствии с нашими результатами исследование ЛПС у женщин, перенесших ЭКО, проведенное Chakravarty et al , не выявило существенных различий в частоте наступления беременности, частоты выкидышей или частоты жизнеспособных родов между женщинами, получающими пероральный дидрогестрон и микронизированный прогестерон вагинально (22). Более того, результаты другого рандомизированного клинического исследования Ganesh et al подтвердили наши результаты. Они сравнили пероральный дидрогестрон с гелем прогестерона и микронизированным прогестероном для поддержки лютеиновой фазы и не выявили существенных различий между тремя группами женщин в отношении общей частоты беременностей и выкидышей (23). Кроме того, другие исследователи сообщили о результатах, сопоставимых с результатами нашего исследования, и указали на аналогичную эффективность дидрогестрона и натурального микронизированного прогестерона у женщин, подвергающихся ЭКО-ЭТ (24-26).
Они сравнили пероральный дидрогестрон с гелем прогестерона и микронизированным прогестероном для поддержки лютеиновой фазы и не выявили существенных различий между тремя группами женщин в отношении общей частоты беременностей и выкидышей (23). Кроме того, другие исследователи сообщили о результатах, сопоставимых с результатами нашего исследования, и указали на аналогичную эффективность дидрогестрона и натурального микронизированного прогестерона у женщин, подвергающихся ЭКО-ЭТ (24-26).
В настоящем исследовании разница между двумя группами в отношении толщины эндометрия и уровня ФСГ была незначительной, и наоборот, Fatemi и соавт. в своем исследовании сравнивали дидрогестрон и натуральный микронизированный прогестерон у пациенток с преждевременной недостаточностью яичников и указали значительную разницу в отношении развития эндометрия. железы, уровень прогестерона в сыворотке, уровень ЛГ и уровень ФСГ (27). Мы определили, что пероральный дидрогестрон столь же эффективен, как и циклогест для ЛПС у женщин, подвергающихся ЭКО, однако кровотечение и другие осложнения, такие как тошнота и боль в эпигастрии, в группе дидрогестрона были больше, чем в группе циклогестрона, и разница между двумя группами была значительной.
Результаты некоторых исследований, которые были рассмотрены в этой статье, выявили многочисленные потенциальные преимущества дидрогестрона, которые доказали, что этот препарат можно рассматривать в качестве альтернативы вагинальному прогестерону для ЛПС. В соответствии с этими данными мы не показали существенной разницы в отношении антрального фолликула, количества эмбрионов, продолжительности лютеиновой фазы, толщины эндометрия, количества ооцитов и фолликулов метафазы-II между двумя группами (p>0,05). Кроме того, Ganesh и соавт. предполагают, что дидрогестрон является подходящим средством для ЛПС при ЭКО, кроме того, можно избежать побочных эффектов, таких как выделения и раздражение влагалища (23). Основным ограничением нашего исследования был относительно небольшой размер выборки. Рекомендуются дальнейшие исследования с более длительным наблюдением и более крупными сериями для подтверждения результатов, представленных здесь.
В целом мы подтвердили результаты предыдущих отчетов и показали, что пероральный дидрогестрон столь же эффективен, как и вагинальный прогестерон, для поддержки лютеиновой фазы у женщин, подвергающихся ЭКО.
Мы хотели бы поблагодарить доктора Мойен Ансар (доцент кафедры биохимии Университета медицинских наук Гилана), доктора Алирезу Юсефзад и медперсонал, административный и секретарь клиники ЭКО в нашей больнице, особенно мисс Масумех Яздан Ашури за их вклад в ведение нашей истории болезни, без которой этот проект был бы невозможен.
Авторы не имеют отношений с компаниями, которые могут иметь финансовую заинтересованность в информации, содержащейся в рукописи.
1. Fauser BC, Devroey P. Репродуктивная биология и ЭКО: стимуляция яичников и последствия лютеиновой фазы. Тенденции Эндокринол Метаб. 2003; 14: 236–242. [PubMed] [Google Scholar]
2. Devroey P, Bourgain C, Macklon NS, Fauser BC. Репродуктивная биология и ЭКО: стимуляция яичников и рецептивность эндометрия. Тенденции Эндокринол Метаб. 2004; 15:84–890. [PubMed] [Google Scholar]
3. Beckers NGM, Macklon NS, Eijkemans MJC. Сравнение характеристик лютеиновой фазы без добавок после введения рекомбинантного (r) ХГЧ, рЛГ или агониста ГнРГ для созревания ооцитов при ЭКО. Хум Репрод. 2002;17:55. [Google Scholar]
Хум Репрод. 2002;17:55. [Google Scholar]
4. Penarrubia J, Balasch J, Fábregues F, Creus M, Casamitjana R, Ballescá JL, et al. Поддержка лютеиновой фазы хорионическим гонадотропином человека преодолевает недостаточность лютеиновой фазы после индуцированной агонистом гонадотропин-рилизинг-гормона овуляции в циклах, стимулированных гонадотропинами. Хум Репрод. 1998;13:3315–3318. [PubMed] [Google Scholar]
5. Albano C, Grimbizis G, Smitz J, Riethmüller-Winzen H, Reissmann T, Van Steirteghem A, et al. Лютеиновая фаза циклов без добавок после суперовуляции яичников с человеческим менопаузальным гонадотропином и антагонистом гонадотропин-рилизинг-гормона Цетрореликс. Фертил Стерил. 1998; 70: 357–359. [PubMed] [Google Scholar]
6. Оттосон У.Б., Йоханссон Б.Г., фон Шульц Б. Субфракции холестерина липопротеинов высокой плотности во время заместительной терапии эстрогенами: сравнение прогестагенов и природного прогестерона. Am J Obstet Gynecol. 1985;151:746–750. [PubMed] [Google Scholar]
7. Pritts E, Atwood A. Поддержка лютеиновой фазы при лечении бесплодия: метаанализ рандомизированных исследований. Хум Репрод. 2002; 7: 2287–2299. [PubMed] [Google Scholar]
Pritts E, Atwood A. Поддержка лютеиновой фазы при лечении бесплодия: метаанализ рандомизированных исследований. Хум Репрод. 2002; 7: 2287–2299. [PubMed] [Google Scholar]
8. Daya S, Gunby J. Поддержка лютеиновой фазы в циклах вспомогательной репродукции. Кокрановская система базы данных, ред. 2004: CD004830. [PubMed] [Google Scholar]
9. Носарка С., Крюгер Т., Зиберт И., Грове Д. Поддержка лютеиновой фазы при экстракорпоральном оплодотворении: метаанализ рандомизированных исследований. Гинеколь Обстет Инвест. 2005;60:67. [PubMed] [Академия Google]
10. Пензиас А.С. Поддержка лютеиновой фазы. Фертил Стерил. 2002; 77: 318–323. [PubMed] [Google Scholar]
11. Daya S, Gunby J. Поддержка лютеиновой фазы в циклах вспомогательной репродукции. Кокрановская система базы данных, ред. 2004: CD004830. [PubMed] [Google Scholar]
12. Абу-Муса А., Ханнун А., Халил А., Масаад З., Карам К. Подготовка искусственного эндометрия для донорства ооцитов с использованием синтетических эстрогена и прогестагена.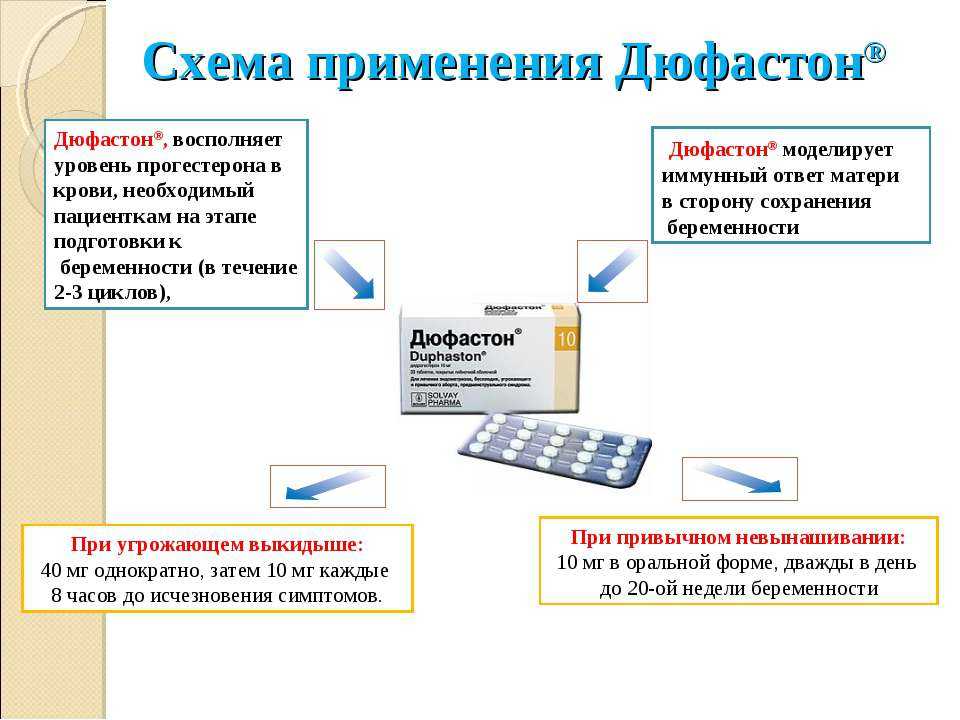 Clin Exp Obstet Gynecol. 1998; 25:83–85. [PubMed] [Академия Google]
Clin Exp Obstet Gynecol. 1998; 25:83–85. [PubMed] [Академия Google]
13. Howard C. Систематический обзор дидрогестерона для лечения угрожающего выкидыша. Гинекол Эндокринол. 2012; 28: 983–990. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Queisser-Luft A. Использование дидрогестерона во время беременности: обзор врожденных дефектов, о которых сообщалось с 1977 года. Early Hum Dev. 2009; 85: 375–377. [PubMed] [Google Scholar]
15. Patki A, Pawar VC. Модулирование исхода фертильности при вспомогательных репродуктивных технологиях с использованием дидрогестерона. Гинекол Эндокринол. 2007; 23:68–72. [PubMed] [Академия Google]
16. Levine H, Watson N. Сравнение фармакокинетики кринона 8%, вводимого вагинально, и прометрия, вводимого перорально, у женщин в постменопаузе. Фертил Стерил. 2000; 73: 516–521. [PubMed] [Google Scholar]
17. Zarutskie PW, Kuzan FB, Dixon L, Soules MR. Эндокринные изменения в позднем фолликулярном и постовуляторном интервалах как детерминанты частоты наступления беременности при экстракорпоральном оплодотворении. Фертил Стерил. 1987; 47: 137–143. [PubMed] [Google Scholar]
Фертил Стерил. 1987; 47: 137–143. [PubMed] [Google Scholar]
18. Практический комитет Американского общества репродуктивной медицины. Добавление прогестерона во время лютеиновой фазы и на ранних сроках беременности при лечении бесплодия: образовательный бюллетень. Фертил Стерил. 2008;89: 789–792. [PubMed] [Google Scholar]
19. Хубайтер З., Муашер С. Добавление лютеина в экстракорпоральное оплодотворение: больше вопросов, чем ответов. Фертил Стерил. 2008; 894: 749–758. [PubMed] [Google Scholar]
20. Chang SP. Сравнение Crinone 8% интравагинального геля и внутримышечного прогестерона для поддержки лютеина при экстракорпоральном оплодотворении. J Chin Med Assoc. 2008; 71: 381–385. [PubMed] [Google Scholar]
21. Vaisbuch E, Leong M, Shoham Z. Прогестероновая поддержка при ЭКО: применяется ли доказательная медицина в клинической практике? Всемирный веб-опрос. Репрод Биомед Онлайн. 2012;25:139–145. [PubMed] [Google Scholar]
22. Чакраварти Б.Н., Ширази Х. Х., Дам П., Госвами С.К., Чаттерджи Р., Гош С. Пероральный дидрогестерон в сравнении с интравагинальным микронизированным прогестероном в качестве поддержки лютеиновой фазы в циклах вспомогательных репродуктивных технологий (ВРТ): результаты исследования рандомизированное исследование. J Стероиды Biochem Mol Biol. 2005; 97: 416–420. [PubMed] [Google Scholar]
Х., Дам П., Госвами С.К., Чаттерджи Р., Гош С. Пероральный дидрогестерон в сравнении с интравагинальным микронизированным прогестероном в качестве поддержки лютеиновой фазы в циклах вспомогательных репродуктивных технологий (ВРТ): результаты исследования рандомизированное исследование. J Стероиды Biochem Mol Biol. 2005; 97: 416–420. [PubMed] [Google Scholar]
23. Ганеш А., Чакраворти Н., Мукерджи Р., Госвами С., Чаудхури К., Чакраварти Б. Сравнение перорального дидрогестрона с гелем прогестерона и микронизированным прогестероном для поддержки желтой железы у 1373 женщин, подвергающихся экстракорпоральному оплодотворению: рандомизированное клиническое исследование. Фертил Стерил. 2011;95:1961. [PubMed] [Google Scholar]
24. Inizi STA, Asaad M, et al. Поддержка лютеиновой фазы при экстракорпоральном оплодотворении. Ближний Восток Fertil Soc J . 2006; 11:64–69. [Google Scholar]
25. Norman TR, Morse CA, Dennerstein L. Сравнительная биодоступность перорально и вагинально вводимого прогестерона.
