применение препарата, отзывы врачей и пациенток, лечение в Москве
Обновлено: 29 Января 2020
Юлия Викторовна Чернышева — акушер-гинеколог | Врач акушер-гинеколог
0 64846
Содержание статьи
- Дюфастон при полипе в матке
- Дюфастон: отзывы женщин после 45 лет
- Дюфастон и миома: отзывы врачей
- Лечение эндометриоза Дюфастоном: отзывы
- Является ли Дюфастон противозачаточным средством
- Дюфастон при миоме во время беременности
Дюфастон (содержит дидрогестерон) применяется для лечения заболеваний половой сферы женщины. Дидрогестерон – это гормон-гестаген, синтетический аналог гормона прогестерона, синтетический аналог схож по действию с женским гормоном прогестероном. Гормональную терапию назначают, когда в организме женщины снижена выработка прогестерона, развиваются дисфункциональные расстройства и заболевания.
Эндогенный прогестерон показан для лечения следующих патологий половой сферы:

- Дисменорея.
- Привычный или угрожающий аборт.
- Нерегулярный менструальный цикл.
- Эндометриоз.
- Дисфункциональное кровотечение.
- Лютеиновая недостаточность и связанное с нарушением бесплодие.
Назначить препарат может только врач. Узнать больше о дидрогестероне, о способе применения можно из инструкции препарата или поможет консультация по e-mail , во время которой можно задать вопросы врачу-консультанту.
Дюфастон при полипе в матке
Полипы матки встречаются одинаково часто у пожилых дам, женщин среднего возраста и молодых девушек. Причины появления патологии и причины перерождения полипа в злокачественное новообразование до конца не выяснены, основной причиной считают нарушение гормонального баланса, когда снижается выработка прогестерона и возрастает секреция эстрогена. Также как миомы полипы развиваются некоторое время бессимптомно, обнаруживаются случайно.
Дюфастон при полипе эндометрия могут назначать в комплексе с другими препаратами, также назначают Дюфастон после удаления полипа эндометрия, если есть противопоказания к хирургическому вмешательству, для профилактики рецидива заболевания, молодым девушкам, нерожавшим женщинам. Терапия гормональными препаратами проводится в определенные дни менструального цикла, длительность лечения составляет несколько месяцев. Дидрогестерон не назначают пациенткам с высокой чувствительностью к компонентам, имеющим в анамнезе синдром Ротора, заболевание Дабина-Джонсона. Побочное действие препарата проявляется повышенным оволосением.
Дюфастон: отзывы женщин после 45 лет
Дюфастон при правильно подобранной дозировке не подавляет выработку собственных гормонов, не подавляет овуляцию, помогает секреторной трансформации эндометрия.
Дюфастон и миома: отзывы врачей
Можно ли принимать Дюфастон при миоме матки решает врач, гормональную терапию принимают строго по показаниям врача. Одной из причин развития миомы считают дисбаланс женских половых гормонов. Способствуют развитию миомы, эндометриоза и других патологий женской половой сферы заболевания щитовидной железы, стресс и другие факторы. Эффективен ли Дюфастон при миоме матки? Отзывы врачей говорят о высокой эффективности препарата, который помогает остановить рост опухолеподобного образования, уменьшить размер узлообразования. Гормональная терапия также назначается перед проведением органосохраняющих методов лечения.
Эффективен ли Дюфастон при миоме матки? Отзывы врачей говорят о высокой эффективности препарата, который помогает остановить рост опухолеподобного образования, уменьшить размер узлообразования. Гормональная терапия также назначается перед проведением органосохраняющих методов лечения.
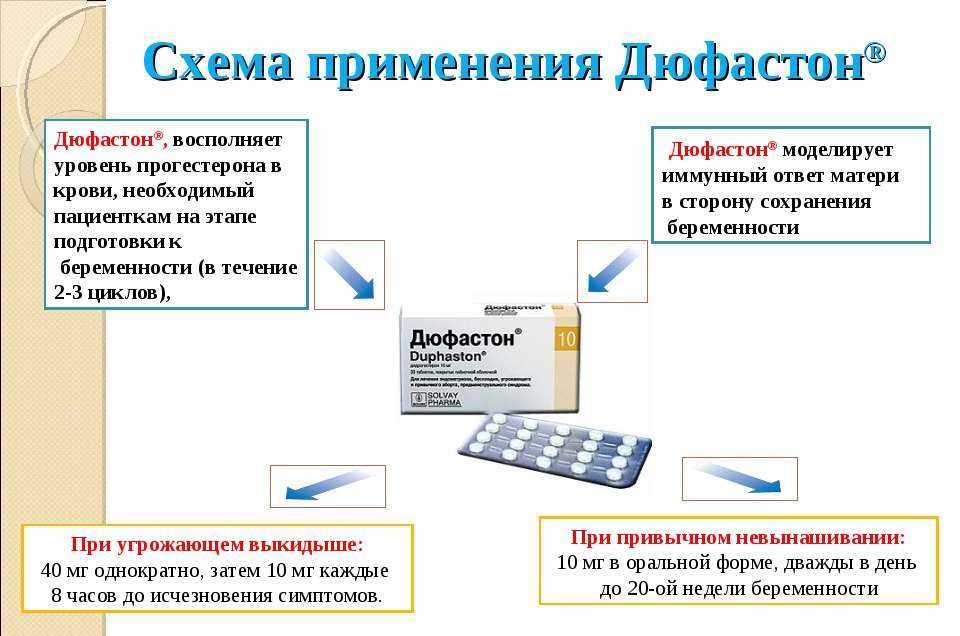
Доказана эффективность Дюфастона при миоме, отзывы женщин говорят об улучшении состояния, прекращении межменструальных выделений, кровотечений во время менструации, восстановлении менструального цикла, уменьшении узлов матки. Назначают Дюфастон при миоме матки, угрозе выкидыша, эндометриозе, женщинам, у которых были неоднократные случаи невынашивания беременности. В зависимости от патологии подбирается дозировка и длительность терапии. Самые большие дозы лекарственного средства назначают при угрозе выкидыша. Лечение курсами проводится при миоматозных узлах и заболевании эндометрия. Длительный прием препарата происходит при невынашивании беременности – дидрогестерон способствует прикреплению эмбриона в слизистом слое, снижает риск сокращения матки.
Дидрогестерон – это гормональный препарат, применение которого должно проходить под контролем врача и строго по назначению. Для диагностики патологий половой сферы следует обратиться в клиники лечения миомы. Опытные врачи-диагносты быстро и эффективно проведут обследование, врач-гинеколог назначит лечение. Экспертный совет клиники даст рекомендации по методу лечения, исходя из индивидуальных показателей здоровья и результатов диагностических исследований.
Лечение эндометриоза Дюфастоном: отзывы
Со стороны врачей и пациенток в большинстве случаев положительные о Дюфастоне отзывы. При эндометриозе и миоме отзывы врачей указывают на эффективное влияние дидрогестерона на рецепторы эндометрия и угнетение роста узлообразования. Эндометриоз и миома развиваются, когда в организме женщины нарушен баланс гормонов – падает уровень прогестерона, повышается уровень эстрогенов. В результате происходит патологическое разрастание слизистой оболочки, нарушается менструальный цикл, формируются миоматозные узлы. Есть ряд показаний и противопоказаний на лечение Дюфастоном. Отзывы при миоме и эндометриозе на форумах клиники указывают на ряд побочных проявлений:
Есть ряд показаний и противопоказаний на лечение Дюфастоном. Отзывы при миоме и эндометриозе на форумах клиники указывают на ряд побочных проявлений:
- Наиболее часто беспокоит головная боль, может развиться мигрень.
- Появляются отеки.
- Развиваются межменструальные кровотечения.
- Болит живот.
- Нарушается функциональность печени.
- Увеличивается размер миоматозного узла.
- Развивается лекарственная желтуха.
Развитие побочного эффекта приводит к замене препарата на другое лекарственное средство, врач может предложить эмболизацию маточных артерий. С помощью ЭМА за одну процедуру проводится лечение нескольких миоматозных узлов. Процедура безболезненная, бескровная, выполняется в течение 10-30 минут, не требует проведения наркоза. ЭМА проводится через прокол бедренной артерии с помощью катетера. Врач заводит катетер в маточные артерии и выпускает эмболы в кровеносные сосуды узлообразования.
Является ли Дюфастон противозачаточным средством
Дидрогестерон применяют для сохранения беременности. Синтетический аналог прогестерона влияет на трансформацию эндометрия, подготовку матки к беременности, способствует накоплению жира в организме, снижает риск сокращений матки, участвует в подготовке молочных желез к грудному вскармливанию. Недостаток гормона вызывает выкидыши, является причиной неготовности эндометрия к прикреплению плодного яйца. Дидрогестерон не применяется как противозачаточное средство.
Дюфастон при миоме во время беременности
Синтетический аналог прогестерона назначают беременным с миомами.
Бесплатная онлайн консультация
Список литературы:
- Сидорова И.С. Миома матки (современные аспекты этиологии, патогенеза, классификации и профилактики). В кн.: Миома матки. Под ред. И.С. Сидоровой. М: МИА 2003; 5—66.
- Андроутопулос Г., Декавалас Г. Последние достижения в лечении миомы матки. Перевод с англ. Н. Д. Фирсовой (2018).
- Савицкий Г. А., Иванова Р. Д., Свечникова Ф. А. Роль локальной гипергормонемии в патогенезе темпа прироста массы опухолевых узлов при миоме матки //Акушерство и гинекология. – 1983. – Т. 4. – С. 13-16.
- Кулаков В.И., Адамян JI.B. Современные технологии в диагностике и лечении гинекологических заболеваний. // Современные технологии в диагностике и лечении гинекологических заболеваний.
 — М., 2004. — 3-19 с.
— М., 2004. — 3-19 с.
Комментарии
Ваше имя Пожалуйста, введите Ваше имя
E-mail Пожалуйста, введите E-mail
Символы на картинке Пожалуйста, введите код
Текст комментария Пожалуйста, введите текст комментария
Ведущие специалисты
Все специалисты
Дмитрий Михайлович Лубнин — гинеколог
Гинеколог, кандидат медицинских наук
Записаться на прием
Лиана Назимовна Аминова — акушер-гинеколог, онколог
Акушер-гинеколог, онколог, кандидат медицинских наук
Записаться на прием
Юлия Викторовна Чернышева — акушер-гинеколог
Врач акушер-гинеколог
Записаться на прием
Борис Юрьевич Бобров — эндоваскулярный хирург
Эндоваскулярный хирург, кандидат медицинских наук, самый большой персональный опыт ЭМА в России
Записаться на прием
Дюфастон при полипе в матке
Заболевание полип матки встречается довольно часто, причем сегодня подобный диагноз может быть поставлен и женщине, имеющей детей, и 20-летней девушке.

Как правило, лечение патологии сводится к хирургическому вмешательству, но в некоторых случаях, в зависимости от вида полипа, применяется и медикаментозная терапия. Одним из препаратов, которые доктора назначают для лечения полипов, является Дюфастон.
Стоит оговориться, что самостоятельное лечение полипов исключено, так как пациентка не сможет отследить динамику развития процесса, кроме этого, возможно ухудшение состояния. Иными словами, дюфастон — не панацея от маточных полипов, это всего лишь одно из средств, применяемых как пробная альтернатива хирургическим методам.
Почему сложно лечить полипы
К сожалению, причины возникновения данного заболевания неоднозначны, ученые до сих пор не могут выявить всю природу развития процесса, а также причины, побуждающие его перетекать из доброкачественной формы в злокачественную. Основным толчком к образованию полипов принято считать гормональный дисбаланс, приводящий к чрезмерному количеству эстрогенов или недостатку прогестерона. Недостаточная изученность процесса не позволяет разработать комплекс стандартных мер, применимых ко всем вариантам и стадиям болезни.
Недостаточная изученность процесса не позволяет разработать комплекс стандартных мер, применимых ко всем вариантам и стадиям болезни.
Зачастую полипы в матке обнаруживают случайно, при УЗ-исследовании полости матки, так как начальная стадия процесса не имеет симптомов. Предположить наличие патологии женщины могут, лишь когда полипы имеют крупные размеры или их несколько, т.е. когда процесс принимает глобальные масштабы. Этот факт также осложняет терапию, так как любая болезнь легко излечивается лишь на начальных этапах.
Когда назначают Дюфастон
Этот гормональный препарат прописывается доктором при полипе матки, если новообразование является следствием нехватки прогестерона в женском организме, установленным лабораторным методом. Как правило, полипы, появившиеся в этом случае, имеют железистую или железисто-фиброзную структуру. Дюфастон может быть назначен в качестве профилактики образования новых полипов после их удаления или в качестве альтернативы к операции (если девушка не рожала или при наличии противопоказаний к вмешательству).
Дюфастон — не единственное средство, подходящее в вышеуказанных случаях. Чтобы нормализовать гормональные процессы, применяются разные методы, эффективность которых применительно к каждому случаю устанавливает лечащий гинеколог. Доктор может предложить следующие варианты:
- Пподбор орального контрацептива;
- Установку гормонального средства внутри матки;
- Назначение гестагенов (к ним относится и Дюфастон).
Медикаментозная терапия назначается только в определенные дни месячного цикла. Как правило, это вторая менструальная фаза. Лечение длится не менее 3 месяцев. Все зависит от возраста женщины и наличия других заболеваний.
Когда нельзя применять Дюфастон
Прежде чем установить диагноз и назначить лечение, доктор проводит тщательные исследования. Согласно анализам Дюфастон не может быть рекомендован тем пациенткам, которые:
- Имеют синдром Ротора;
- Страдают заболеванием Дабина – Джонсона;
- Обладают гиперчувствительностью к какому-либо компоненту препарата.

Побочных действий этого препарата на сегодняшний день не обнаружено.
Преимущества Дюфастона
Данное средство является искусственным гормональным препаратом, аналогом прогестерона. Его состав очень близок к структуре природного женского гормона. В отличие от других подобных препаратов, которые производятся аналогично структуре мужских гормонов, Дюфастон не имеет таких побочных эффектов, как появление вторичных половых мужских признаков (повышенное оволосение).
Применяют эти таблетки путем проглатывания, максимальная концентрация в крови достигается через два часа. Эти медикаменты комбинируются практически со всеми лекарственными препаратами.
Что надо знать о Дюфастоне
В особых случаях могут назначаться препараты прогестерона и эстрогена одновременно. Эта комбинация несет небольшой риск, который врач обязан предусмотреть. Перед тем как назначать обе группы препаратов одновременно, следует тщательно провести исследования и хорошо изучить анамнез, через определенное время обследование проводится повторно. Такие предостережения обусловлены тем, что побочным действием подобного лечения могут быть изменения в молочных железах.
Такие предостережения обусловлены тем, что побочным действием подобного лечения могут быть изменения в молочных железах.
Помимо терапии полипа в матке, Дюфастон назначают для нормализации менструального цикла и поддержания беременности. Сегодня это очень распространенная практика среди гинекологов. Эффективность таких медикаментов зависит от индивидуальных особенностей женского организма.
Следует подчеркнуть, что Дюфастон хоть и эффективное лекарство, но все же является гормональным препаратом. Поэтому назначение к применению должно быть рекомендовано только гинекологом после тщательного обследования. Доверяйте лечение только профессионалам!
Записаться на прием гинеколога
Сравнение влияния дюфастона и цетротида на качество ооцитов и эмбрионов у женщин, перенесших ИКСИ: перекрестное исследование
Int J Reprod Biomed. 2020 ноябрь; 18(11): 975–982.
Опубликовано в Интернете 22 ноября 2020 г. doi: 10.18502/ijrm.v13i11.7965
Нилуфар Мотареф, доктор медицины, Шейда Джухари, доктор медицины, Афсанех Мохаммадзаде, доктор медицины, Сомайех Каземнежад, доктор медицины Садхтедади, ЭШтедхэдиаф, Б. Мадхес. Бакалавр наук и Аболфазл Гуджани, магистр наук.
Мадхес. Бакалавр наук и Аболфазл Гуджани, магистр наук.
Информация об авторе Примечания к статье Информация об авторских правах и лицензиях Отказ от ответственности
Исходная информация
Преждевременный всплеск лютеинизирующего гормона (ЛГ) является одной из причин отмены цикла вспомогательных репродуктивных технологий, и необходимо найти новые подходы с улучшенным профилем эффективности и безопасности.
Цель
Сравнить влияние дюфастона и цетротида на предотвращение преждевременного выброса ЛГ и характеристики извлеченных фолликулов и эмбрионов у женщин, перенесших интрацитоплазматическую инъекцию сперматозоидов.
Материалы и методы
В это ретроспективное поперечное исследование были включены 200 пациенток, которым вводили рекомбинантный фолликулостимулирующий гормон с третьего дня менструального цикла. При достижении диаметра фолликула более 13-14 мм в контрольной группе назначали цетротид, а в основной — дюфастон внутрь с 3-го дня цикла. Полученные ооциты оплодотворяли in vitro внутрицитоплазматической спермой. Между двумя группами сравнивали уровень гормонов на третий день менструации и характеристики фолликулов, ооцитов и эмбрионов.
Полученные ооциты оплодотворяли in vitro внутрицитоплазматической спермой. Между двумя группами сравнивали уровень гормонов на третий день менструации и характеристики фолликулов, ооцитов и эмбрионов.
Результаты
Дюфастон успешно подавляет преждевременный выброс ЛГ. Достоверной разницы в уровне фолликулостимулирующего гормона, эстрадиола и ЛГ между основной и контрольной группами не было (p > 0,05). Однако результаты также показали, что Дюфастон вызывает большее извлечение ооцитов по сравнению с Цетротидом (p = 0,04). Хотя количество фолликулов выше 14 мм, зрелых ооцитов и общее количество жизнеспособных эмбрионов в основной группе было несколько выше, оно не достигало достоверной разницы по сравнению с контрольной группой (р > 0,05).
Заключение
Дюфастон можно использовать в качестве подходящего лекарства вместо антагонистов гонадотропин-рилизинг-гормона у женщин, подвергающихся контролируемой гиперстимуляции яичников. Назначение дюфастона не только предотвращает преждевременный всплеск ЛГ, но и увеличивает количество извлеченных ооцитов.
Ключевые слова: Дюфастон, Цетрореликс, Дидрогестерон, КОГ, антагонист ГнРГ.
Около 8-12% пар репродуктивного возраста во всем мире страдают бесплодием (1). За последнее десятилетие вспомогательные репродуктивные технологии (ВРТ) привлекли значительное внимание к решению проблемы бесплодия (2). Интересно, что преждевременный всплеск лютеинизирующего гормона (ЛГ) является одной из основных причин отмены цикла ВРТ. В случаях ЭКО ранний всплеск ЛГ может поставить под угрозу возобновление ооцитов (3). В последние годы было проведено несколько исследований по снижению частоты раннего выброса ЛГ с помощью агонистов и антагонистов гонадотропин-рилизинг-гормона (ГнРГ) (4).
Адъювантная терапия агонистами ГнРГ может предотвратить преждевременный всплеск ЛГ. Однако это может снизить реакцию на стимуляцию. Следовательно, для достижения подходящего развития фолликулов необходимы более высокие дозы препарата и длительный период лечения (5). Фактически, необходимость повторных измерений сывороточного ЛГ, более высокая стоимость лекарств, риск синдрома гиперстимуляции яичников из-за использования более высоких доз препаратов являются основными недостатками протоколов агонистов ГнРГ (6). Следовательно, необходимо найти новые подходы с улучшенной эффективностью, профилем безопасности и удобством для пользователя.
Следовательно, необходимо найти новые подходы с улучшенной эффективностью, профилем безопасности и удобством для пользователя.
Первоначальные исследования показывают, что стероидные продукты, такие как оральные контрацептивы и синтетический прогестерон, могут быть недорогим и эффективным методом предотвращения секреции ЛГ и фолликулостимулирующего гормона (ФСГ) (7). Кроме того, известно, что природный и синтетический прогестерон подавляют пульсирующую секрецию ГнРГ и ЛГ (8). Эти эффекты позволяют предположить, что прогестерон можно использовать в качестве альтернативы аналогу ГнРГ для подавления преждевременного всплеска ЛГ при контролируемой гиперстимуляции яичников (КГЯ). Одной из синтетических форм прогестерона является дюфастон (дидрогестерон), молекулярная структура и фармакологические эффекты которого тесно связаны с эндогенным прогестероном (9).). Клиническая эффективность Дюфастона в режиме прогестерон-примированной стимуляции яичников (PPOS) была оценена Эфтехаром и его коллегами (10), которые показали, что Дюфастон в качестве адъюванта ФСГ во время стимуляции яичников не приводил к подобному извлечению зрелых ооцитов.
Настоящее исследование было проведено для сравнения эффективности Дюфастона и Цетротида у женщин с нормальной овуляцией, перенесших КГГ, с точки зрения гормонального профиля, количества извлеченных ооцитов и качества эмбриона.
Условия исследования, пациенты, стимуляция яичников и забор ооцитов
Это ретроспективное поперечное исследование было проведено в Тегеранской клинике бесплодия им. Авиценны и включено. Женщины, проходившие схемы ИКСИ для лечения бесплодия в период с сентября 2017 г. по декабрь 2018 г. У пациенток определяли уровни ФСГ и эстрадиола в сыворотке на третий день менструации, после чего они были разделены на группы наблюдения и контроля.
Бесплодные женщины в возрасте 20–40 лет, имеющие число антральных фолликулов не менее 4 на третий день менструального цикла, уровень ФСГ < 12 МЕ/л, отсутствие аномалий матки и гидросальпинкса, перенесшие ЭКО первый или второй раз, считались подходит для исследования. Принимая во внимание, что критерии исключения из исследования включали: признаки недостаточности яичников (отсутствие количества антральных фолликулов при ультразвуковой оценке на третий день менструации), эндометриоз 3 или 4 степени, все противопоказания для стимуляции яичников и системные заболевания, такие как почечная недостаточность. .
.
В общей сложности 200 пациентов были оценены на соответствие требованиям (в каждой группе 100 пациентов). Обеим группам с третьего дня менструального цикла вводили 150–225 МЕ рекомбинантного ФСГ (рФСГ-Гонал-ф, Merck Serono, Германия). Фолликулы контролировали с помощью трансвагинальной сонографии через 5–6 дней после стимуляции гонадотропином. При достижении диаметра фолликула более 13–14 мм в контрольной группе назначали цетротид (0,25 мг/сут; Merck Serono, Германия), в основной — дюфастон (20 мг/сут; Abbott Healthcare, Америка). перорально с третьего дня цикла до триггерного дня. С момента, когда три доминантных фолликула достигли > 17 мм, для окончательного созревания ооцитов и овуляции назначали 10 000 МЕ ХГЧ (Pooyesh Daroo, Иран). Извлечение ооцитов проводили через 34–36 часов после триггера, а извлеченные ооциты оплодотворяли in vitro с помощью ИКСИ.
Измерение гормонов
Уровень ЛГ, ФСГ, эстрадиола и прогестерона в сыворотке крови определяли хемилюминесцентным методом на третий день менструации. Отсутствие овуляции до дня пункции расценивали как отсутствие преждевременного выброса ЛГ.
Отсутствие овуляции до дня пункции расценивали как отсутствие преждевременного выброса ЛГ.
Исход
Количество фолликулов выше 14 мм, количество извлеченных ооцитов, стадия их созревания (зародышевые везикулы, MI и MII), жизнеспособные эмбрионы и их класс (A, AB, B и C) оценивались как первичные результат и сравнение между двумя группами. В этой оценке эмбрион оценивали в соответствии с критериями Cummins на третий день оплодотворения по количеству, регулярности бластомеров и степени фрагментации эмбриона. Также были собраны демографические и клинические характеристики, такие как возраст, рост, продолжительность бесплодия и количество ЭКО.
Этические соображения
Это исследование было одобрено этическим комитетом Клиники лечения бесплодия им. Авиценны (IR.ACECR.avicenna.REC.1397.004). Исследователи гарантировали, что информация участников оставалась анонимной и конфиденциальной в течение всего периода исследования и соответствовала принципам Хельсинкской декларации и Комитета по этике Клиники лечения бесплодия им. Авиценны. Все участники дали информированное согласие после консультирования по поводу лечения бесплодия и обычных процедур ЭКО.
Авиценны. Все участники дали информированное согласие после консультирования по поводу лечения бесплодия и обычных процедур ЭКО.
Статистический анализ
Данные представлены как среднее ± стандартное отклонение. Независимый тест t был применен для анализа различий в результатах лечения между двумя исследуемыми группами. Все анализы проводились с использованием Статистического пакета для социальных наук, версия 16.0, SPSS Inc, Чикаго, Иллинойс, США (SPSS). Значение P < 5% считалось статистически значимым.
Характеристики пациентов
В это исследование были включены 200 пациентов, которые были распределены либо в основную группу (Дюфастон), либо в контрольную группу (Цетротид). Средний возраст контрольной группы составил 33 ± 4,1 года, а основной группы — 32 ± 4,5 года, и между ними не было существенных различий (р = 0,26). Средний ИМТ в основной и контрольной группах составил 24,61 ± 3,32 и 24,49.± 3,85 соответственно, что не показывает существенных изменений между двумя группами (p = 0,37). Кроме того, анализ данных также показал, что не было существенных различий между группами в отношении продолжительности бесплодия (3,87 ± 3,85 против 3,18 ± 3,31 года, p = 0,18). Среднее количество ЭКО в основной и контрольной группах составило 1,29 ± 0,45 и 1,62 ± 0,48 соответственно, что показало отсутствие существенных различий между ними (p = 0,21).
Кроме того, анализ данных также показал, что не было существенных различий между группами в отношении продолжительности бесплодия (3,87 ± 3,85 против 3,18 ± 3,31 года, p = 0,18). Среднее количество ЭКО в основной и контрольной группах составило 1,29 ± 0,45 и 1,62 ± 0,48 соответственно, что показало отсутствие существенных различий между ними (p = 0,21).
Стимуляция яичников, фолликулов, ооцитов и эмбрионов 9 степени0011
Средняя продолжительность стимуляции и дозы рФСГ и ХГЧ были одинаковыми в двух группах. В таблице I сравнивается количество фолликулов выше 14 мм, извлеченных ооцитов, зрелых (MII) и незрелых ооцитов (GV и MI), жизнеспособных эмбрионов и их степени (A, AB, B и C) между двумя группами. Значения для незрелых ооцитов (МИ), эмбрионального класса AB и количества извлеченных ооцитов значительно различались между группами, принимавшими дюфастон (случай) и цетротид (контроль). Кроме того, количество фолликулов выше 14 мм, зрелых ооцитов (MII), общее количество жизнеспособных эмбрионов, степени эмбрионов B и C в основной группе было несколько выше, но не достигало существенной разницы по сравнению с контрольной группой. Количество ооцитов и эмбрионов ВГ класса А в контрольной группе было больше, чем в основной группе, однако эти различия не были статистически значимыми.
Количество ооцитов и эмбрионов ВГ класса А в контрольной группе было больше, чем в основной группе, однако эти различия не были статистически значимыми.
Гормональный профиль
В таблице II представлены сывороточные концентрации ФСГ, эстрадиола и ЛГ на третий день менструации. Как видно, на третий день менструального цикла достоверных различий в уровне ФСГ, эстрадиола и ЛГ между основной и контрольной группами не было. Ни в случае, ни в контрольной группе не было овуляции ооцитов до дня пункции. Таким образом, можно утверждать, что Дюфастон предотвращает преждевременный всплеск ЛГ.
Таблица 1
Характеристики стимуляции и эмбриона в группе случая и контрольной группе
| Характеристика | Футляр (Дюфастон) | Контроль (Цетротид) | P-значение* |
| Фолликулы более 14 мм | 9,6 ± 0,56 | 8,76 ± 0,51 | 0,25 |
| Полученные ооциты | 13,35 ± 0,85 | 11,61 ± 0,76 | 0,04 |
| Незрелый ооцит (MI) | 1,11 ± 0,15 | 0,51 ± 0,10 | < 0,001 |
| Зрелый ооцит (MII) | 11,01 ± 0,56 | 9,88 ± 0,63 | 0,20 |
| Незрелый ооцит (GV) | 0,7 ± 0,18 | 0,9 ± 0,22 | 0,51 |
| Жизнеспособные эмбрионы | 8,25 ± 0,56 | 7,34 ± 0,49 | 0,29 |
| Эмбрионы А | 4,45 ± 0,37 | 4,89 ± 0,43 | 0,46 |
| Эмбрионы AB | 2,08 ± 0,22 | 1,58 ± 0,18 | 0,01 |
| Эмбрионы B | 0,77 ± 0,16 | 0,61 ± 0,11 | 0,43 |
| Эмбрионы C | 0,40 ± 0,92 | 0,28 ± 0,06 | 0,31 |
Данные представлены как среднее ± стандартное отклонение. *Независимый t тест *Независимый t тест | |||
Открыть в отдельном окне
Таблица 2
Уровень гормонов в обеих группах на 3-й день менструации
| Группа | ФСГ | Эстрадиол | левый |
| <утверждение> | 6,73 ± 0,20 | 46,26 ± 1,93 | 6,12 ± 0,48 |
| Управление | 7,25 ± 0,22 | 45,94 ± 2,68 | 6,16 ± 0,66 |
| P-значение* | 0,11 | 0,90 | 0,95 |
Данные представлены как среднее ± SE. *Независимый тест t ФСГ: фолликулостимулирующий гормон; ЛГ: Лютеинизирующий гормон *Независимый тест t ФСГ: фолликулостимулирующий гормон; ЛГ: Лютеинизирующий гормон | |||
Открыть в отдельном окне
Это ретроспективное кросс-секционное исследование показало, что в случаях ЭКО/ИКСИ пероральное назначение Дюфастона может быть успешно использовано в качестве альтернативы антагонисту ГнРГ у пациенток, подвергающихся контролируемой стимуляции яичников. Наши результаты подтвердили, что пероральное введение Дюфастона является эффективным методом получения компетентных ооцитов и блокирования преждевременных всплесков ЛГ. Дюфастон является аналогом прогестерона с некоторыми, но не со всеми эффектами прогестерона, и он безопасен без андрогенных эффектов даже в высоких дозах (11). Структурное сравнение прогестерона и Дюфастона показывает, что Дюфастон содержит дополнительную двойную связь между 6- и 7-углеродными атомами. Кроме того, 10-углерод Дюфастона содержит метильную группу в α-положении, тогда как метильная группа 10-углерода прогестерона находится в β-положении (12, 13). Эти различия в структуре повышают стабильность и биодоступность Дюфастона, что улучшает его абсорбцию и эффективность (14). Это исследование показало, что Дюфастон лучше стимулирует овуляцию и вызывает большее извлечение яйцеклеток по сравнению с Цетротидом. Кроме того, в группе пациентов, которым вводили Дюфастон, количество фолликулов выше 14 мм, зрелых ооцитов (MII) и общее количество жизнеспособных эмбрионов было выше, чем в контрольной группе; однако эти различия не были значительными. Эти результаты показали, что Дюфастон эффективен при контролируемой стимуляции яичников без каких-либо осложнений. Эти результаты согласуются с предыдущими исследованиями (15, 16).
Эти различия в структуре повышают стабильность и биодоступность Дюфастона, что улучшает его абсорбцию и эффективность (14). Это исследование показало, что Дюфастон лучше стимулирует овуляцию и вызывает большее извлечение яйцеклеток по сравнению с Цетротидом. Кроме того, в группе пациентов, которым вводили Дюфастон, количество фолликулов выше 14 мм, зрелых ооцитов (MII) и общее количество жизнеспособных эмбрионов было выше, чем в контрольной группе; однако эти различия не были значительными. Эти результаты показали, что Дюфастон эффективен при контролируемой стимуляции яичников без каких-либо осложнений. Эти результаты согласуются с предыдущими исследованиями (15, 16).
Что касается уровня прогестерона и качества ооцитов/фолликулов, Zavareh и коллеги (17) сообщили, что повышение концентрации прогестерона в крови может ингибировать развитие фолликулов и ооцитов, что приводит к снижению потенциала фертильности. Наше открытие показало, что Дюфастон в использованной дозе в этом исследовании не только не оказывал неблагоприятного воздействия на развитие фолликулов и ооцитов, но также вызывал большее извлечение ооцитов по сравнению с антагонистами ГнРГ. Эти результаты согласуются с исследованием Hamdi и коллег (18), которые показали, что медроксипрогестерон (форма прогестерона) не оказывает неблагоприятного воздействия на развитие ооцитов или фолликулов. Следует отметить, что необходимы дальнейшие исследования для оценки влияния более высоких доз Дюфастона или других конгенеров прогестерона на развитие фолликулов. Исследование также показало, что во время КГГ у пациентов не наблюдалось преждевременного выброса ЛГ, и, по-видимому, Дюфастон оказывал соответствующее влияние на контроль преждевременного выброса ЛГ. Кроме того, согласно этому исследованию, Чжу и его коллеги (9) не сообщили о преждевременном всплеске ЛГ у пациентов, принимавших Дюфастон при КГЯ. «Корреляция между прогестероном и всплеском ЛГ не совсем ясна. Во время КГЯ одновременно с резким повышением уровня эстрадиола растут несколько фолликулов, а скоординированные роли эстрогена и прогестерона могут быть более мощными для подавления уровня ЛГ» (3). активация, передача и выброс ГнРГ (8, 19).
Эти результаты согласуются с исследованием Hamdi и коллег (18), которые показали, что медроксипрогестерон (форма прогестерона) не оказывает неблагоприятного воздействия на развитие ооцитов или фолликулов. Следует отметить, что необходимы дальнейшие исследования для оценки влияния более высоких доз Дюфастона или других конгенеров прогестерона на развитие фолликулов. Исследование также показало, что во время КГГ у пациентов не наблюдалось преждевременного выброса ЛГ, и, по-видимому, Дюфастон оказывал соответствующее влияние на контроль преждевременного выброса ЛГ. Кроме того, согласно этому исследованию, Чжу и его коллеги (9) не сообщили о преждевременном всплеске ЛГ у пациентов, принимавших Дюфастон при КГЯ. «Корреляция между прогестероном и всплеском ЛГ не совсем ясна. Во время КГЯ одновременно с резким повышением уровня эстрадиола растут несколько фолликулов, а скоординированные роли эстрогена и прогестерона могут быть более мощными для подавления уровня ЛГ» (3). активация, передача и выброс ГнРГ (8, 19). Прогестерон предотвращает преждевременный выброс ЛГ, блокируя систему индукции выброса ГнРГ (3). В соответствии с этим было показано, что введение прогестина во время нормальной фолликулярной фазы приводит к снижению уровни ЛГ в плазме (20).Исследования показывают, что индуцированный эстрадиолом сигнал, генерирующий всплеск ЛГ, может быть заблокирован прогестероном на ранних стадиях (сразу после удаления эстрадиола) передачи сигнала (8, 9)., 21). Следовательно, роль прогестерона в выбросе ЛГ зависит от времени его введения (17). Результаты показали, что для предотвращения преждевременного выброса ЛГ в случаях ЭКО дюфастон можно использовать в качестве подходящего препарата вместо цетротида у пациенток, перенесших контролируемую стимуляцию яичников, поскольку он не вызывает осложнений по сравнению с цетротидом, а также более эффективен. Дюфастон может быть хорошим вариантом в клинической практике, поскольку пероральный прием более удобен для пациента, чем инъекционная форма.
Прогестерон предотвращает преждевременный выброс ЛГ, блокируя систему индукции выброса ГнРГ (3). В соответствии с этим было показано, что введение прогестина во время нормальной фолликулярной фазы приводит к снижению уровни ЛГ в плазме (20).Исследования показывают, что индуцированный эстрадиолом сигнал, генерирующий всплеск ЛГ, может быть заблокирован прогестероном на ранних стадиях (сразу после удаления эстрадиола) передачи сигнала (8, 9)., 21). Следовательно, роль прогестерона в выбросе ЛГ зависит от времени его введения (17). Результаты показали, что для предотвращения преждевременного выброса ЛГ в случаях ЭКО дюфастон можно использовать в качестве подходящего препарата вместо цетротида у пациенток, перенесших контролируемую стимуляцию яичников, поскольку он не вызывает осложнений по сравнению с цетротидом, а также более эффективен. Дюфастон может быть хорошим вариантом в клинической практике, поскольку пероральный прием более удобен для пациента, чем инъекционная форма.
Выбор любого из них должен основываться главным образом на доступности, стоимости и побочных эффектах. Отсутствие исходов беременности и новорожденных являются ограничениями этого исследования. Таким образом, необходимы дополнительные исследования, чтобы получить больше доказательств эффективности протокола Дюфастона и осветить его влияние на беременность и детей, рожденных по этому новому режиму.
Отсутствие исходов беременности и новорожденных являются ограничениями этого исследования. Таким образом, необходимы дополнительные исследования, чтобы получить больше доказательств эффективности протокола Дюфастона и осветить его влияние на беременность и детей, рожденных по этому новому режиму.
Дюфастон можно использовать как подходящее лекарство в качестве альтернативы антагонистам ГнРГ. Назначение дюфастона не только предотвращает преждевременный всплеск ЛГ, но и увеличивает количество извлекаемых фолликулов и их качество. Пероральное введение Дюфастона обеспечивает легкий доступ и лучший контроль над уровнями ЛГ по сравнению с антагонистами ГнРГ. После дополнительных исследований оптимальной дозы и долгосрочной безопасности Дюфастона его можно было бы использовать в качестве нового режима контролируемой стимуляции яичников в циклах замораживания-оттаивания.
Авторы заявляют, что у них нет конкурирующих интересов.
Авторы благодарят Клинику лечения бесплодия им. Авиценны за поддержку этого исследования.
Авиценны за поддержку этого исследования.
1. Borghtb MV, Wyns C. Фертильность и бесплодие: определение и эпидемиология. Клин Биохим 2018; 62: 2–10. [PubMed]
2. Hajipour H, Nejabati HR, Latifi Z, Hamdi K, Bahrami-asl Z, Fattahi A, et al. Иммунотерапия лимфоцитами для сохранения беременности: механизмы и проблемы. Am J Reprod Immunol 2018; 80: е12853. [PubMed]
3. Kuang Y, Chen Q, Fu Y, Wang Y, Hong Q, Lyu Q, et al. Медроксипрогестерона ацетат является эффективной пероральной альтернативой для предотвращения преждевременных всплесков лютеинизирующего гормона у женщин, подвергающихся контролируемой гиперстимуляции яичников для экстракорпорального оплодотворения. Fertil Steril 2015; 104: 62–70. е3. [PubMed]
4. Zhu X, Zhang X, Fu Y. Утрожестан как эффективная пероральная альтернатива для предотвращения преждевременных всплесков лютеинизирующего гормона у женщин, подвергающихся контролируемой гиперстимуляции яичников для экстракорпорального оплодотворения. Медицина 2015; 94: е909. [Бесплатная статья PMC] [PubMed]
Медицина 2015; 94: е909. [Бесплатная статья PMC] [PubMed]
5. Venetis CA, Kolibianakis EM, Papanikolaou E, Bontis J, Devroey P, Tarlatzis BC. Связано ли повышение уровня прогестерона в день введения хорионического гонадотропина с вероятностью беременности при экстракорпоральном оплодотворении? Систематический обзор и метаанализ. Hum Reprod Update 2007; 13: 343–355. [PubMed]
6. Bosch E, Valencia I, Escudero E, Crespo J, Simon C, Remohí J, et al. Преждевременная лютеинизация во время циклов антагонистов гонадотропин-рилизинг-гормона и ее связь с результатами экстракорпорального оплодотворения. Fertil Steril 2003; 80: 1444–1449. [PubMed]
7. Cédrin-Durnerin I, Bständig B, Parneix I, Bied-Damon V, Avril C, Decanter C, et al. Влияние оральных контрацептивов, синтетического прогестагена или предварительного лечения натуральными эстрогенами на гормональный профиль и когорту антральных фолликулов до применения антагонистов ГнРГ. Hum Reprod 2007; 22: 109–116. [PubMed]
[PubMed]
8. Richter TA, Robinson JE, Evans NP. Прогестерон блокирует стимулированный эстрадиолом всплеск лютеинизирующего гормона, нарушая активацию в ответ на стимулирующий сигнал эстрадиола у овец. Биол Репрод 2002; 67: 119–125. [PubMed]
9. Zhu X, Ye H, Fu Y. Дюфастон и протокол менопаузального гонадотропина человека у женщин с нормальной овуляцией, подвергающихся контролируемой гиперстимуляции яичников во время экстракорпорального оплодотворения/интрацитоплазматической инъекции сперматозоидов в сочетании с криоконсервацией эмбрионов. Fertil Steril 2017; 108: 505–512. [PubMed]
10. Эфтехар М., Хосейни М., Саид Л. Прогестерон-примированная стимуляция яичников при синдроме поликистозных яичников: РКИ. Int J Reprod BioMed 2019; 17: 671–676. [Бесплатная статья PMC] [PubMed]
11. Сахархиз Н., Заманиян М., Салехпур С., Задехмодаррес С., Хосейни С., Чераги Л. и соавт. Сравнительное исследование дидрогестерона и микронизированного прогестерона для поддержки лютеиновой фазы во время циклов экстракорпорального оплодотворения (ЭКО). Гинекол Эндокринол 2016; 32: 213–217. [PubMed]
Гинекол Эндокринол 2016; 32: 213–217. [PubMed]
12. Фитцпатрик Л.А., Гуд А. Микронизированный прогестерон: клинические показания и сравнение с современными методами лечения. Fertil Steril 1999; 72: 389–397. [PubMed]
13. Ганеш А., Чакраворти Н., Мукерджи Р., Госвами С., Чаудхури К., Чакраварти Б. Сравнение перорального дидрогестрона с гелем прогестерона и микронизированным прогестероном для поддержки лютеиновой кислоты у 1373 женщин, подвергающихся экстракорпоральному оплодотворению: рандомизированное клиническое исследование. . Fertil Steril 2011; 95: 1961–1965. [PubMed]
14. Schindler AE, Campagnoli C, Druckmann R, Huber J, Pasqualini JR, Schweppe KW, et al. Классификация и фармакология прогестинов. Maturitas 2003; 46 (Прил.): S7–S16. [PubMed]
15. Като О., Кавасаки Н., Бодри Д., Курода Т., Кавачия С., Като К. и соавт. Неонатальные исходы и врожденные дефекты у 6623 одноплодных женщин, рожденных после минимальной стимуляции яичников и переноса витрифицированных эмбрионов по сравнению со свежими одиночными эмбрионами. Eur J Obstet Gynecol Reprod Biol 2012; 161: 46–50. [PubMed]
Eur J Obstet Gynecol Reprod Biol 2012; 161: 46–50. [PubMed]
16. Yu S, Long H, Chang HY, Liu Y, Gao H, Zhu J и соавт. Новое применение дидрогестерона как части протокола стимуляции яичников прогестином для ЭКО: рандомизированное контролируемое исследование, включающее 516 первых циклов ЭКО/ИКСИ. Hum Reprod 2018; 33: 229–237. [PubMed]
17. Zavareh S, Saberivand A, Salehnia M. Влияние прогестерона на созревание in vitro и способность к развитию ооцитов зародышевых пузырьков мыши. Int J Fertil Steril 2009; 3: 21–28.
18. Хамди К., Фарзади Л., Гасемзаде А., Навали Н., Аташхои С., Пиа Х. и др. Сравнение медроксипрогестерона ацетата с цетротидом для предотвращения преждевременных всплесков лютеинизирующего гормона у женщин, подвергающихся экстракорпоральному оплодотворению. Int J Women’s Heal Reprod Sci 2018; 6: 187–191.
19. Рихтер Т.А., Робинсон Дж.Е., Лозано Дж.М., Эванс Н.П. Прогестерон может блокировать преовуляторный всплеск гонадотропин-рилизинг-гормона/лютеинизирующего гормона у овец за счет прямого ингибирующего действия на чувствительные к эстрадиолу клетки гипоталамуса. J Нейроэндокринол 2005; 17: 161–169. [PubMed]
J Нейроэндокринол 2005; 17: 161–169. [PubMed]
20. Soules MR, Steiner RA, Clifton DK, Cohen NL, Aksel S, Bremner WJ. Прогестероновая модуляция пульсирующей секреции лютеинизирующего гормона у здоровых женщин. J Clin Endocrinol Metab 1984; 58: 378–383. [PubMed]
21. Harris TG, Dye S, Robinson JE, Skinner DC, Evans NP. Прогестерон может блокировать передачу индуцированного эстрадиолом сигнала для образования всплеска лютеинизирующего гормона в течение определенного периода времени сразу после активации системы выработки гонадотропин-рилизинг-гормона. Эндокринология 1999; 140: 827–834. [PubMed]
Применение номограммы для прогнозирования риска субхориальной гематомы на ранних сроках беременности при экстракорпоральном оплодотворении – переносе эмбрионов/переносе замороженных эмбрионов
1.
Мазо Г., Д’Оттавио Г., Сета Ф.Д., Сарторе А., Мандруззато Г. Внутриматочная гематома в первом триместре и исход беременности. Акушерство Gynecol (2005) 105 (2): 339–44. 10.1097/01.АОГ.0000152000.71369.бд
[PubMed] [CrossRef] [Google Scholar]
10.1097/01.АОГ.0000152000.71369.бд
[PubMed] [CrossRef] [Google Scholar]
2. Ükür YE, Gksu G, Kse O, Amaz G, Zmen B, Atabekolu CS и др. Влияние субхориальной гематомы на исход беременности у пациенток с угрозой аборта. J Turkish German Gynecol Assoc (2014) 15(4):239. 10.5152/jtgga.2014.14170 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Baxi LV, Pearlstone MM. Субхориальные гематомы и наличие аутоантител. Am J Obstet Gynecol (1991) 165 (5 Pt 1): 1423–4. 10.1016/0002-9378(91)-3 [PubMed] [CrossRef] [Google Scholar]
4. Chen CP, Hsu CY, Su YN, Wang TY, Chern SR, Su JW и др. Плацентарная мезенхимальная дисплазия, связанная с дородовым кровотечением, субхориальной гематомой и ограничением внутриутробного развития. Тайваньский J Obstetrics Gynecol (2013) 52 (1): 154–6. 10.1016/j.tjog.2013.01.023 [PubMed] [CrossRef] [Академия Google]
5.
Yamada T, Atsuki Y, Wakasaya A, Kobayashi M, Hirano Y, Ohwada M. Характеристики пациентов с субхориальными гематомами во втором триместре. J Obstetrics Gynaecol Res (2012) 38(1):180–4. 10.1111/ж.1447-0756.2011.01665.х
[PubMed] [CrossRef] [Google Scholar]
J Obstetrics Gynaecol Res (2012) 38(1):180–4. 10.1111/ж.1447-0756.2011.01665.х
[PubMed] [CrossRef] [Google Scholar]
6. Pearlstone M, Baxi L. Субхориальная гематома: обзор. Обзор акушерства и гинекологии (1993) 48(2):65–8. 10.1097/00006254-199302000-00001 [PubMed] [CrossRef] [Google Scholar]
7. Асато К., Мекару К., Хешики С., Сугияма Х., Киндзё Т., Масамото Х. и др. Субхориальная гематома чаще возникает при беременности в результате экстракорпорального оплодотворения. Eur J Obstetrics Gynecol Reprod Biol (2014) 181:41–4. 10.1016/j.ejogrb.2014.07.014 [PubMed] [CrossRef] [Академия Google]
8. Jemma J, Jon H, Johns J, Hyett J, Jauniaux E. Акушерский исход после угрозы выкидыша с гематомой и без нее на УЗИ. Акушерство Gynecol (2003) 102(3):483–7. 10.1016/С0029-7844(03)00580-5 [PubMed] [CrossRef] [Google Scholar]
9.
Странделл А., Линдхард А., Вальденстрем У., Торберн Дж. Результаты гидросальпинкса и ЭКО: совокупные результаты после сальпингэктомии в рандомизированном контролируемом исследовании. Hum Reproduct (2001) 16 (11): 2403–10. 10.1093/humrep/16.11.2403
[PubMed] [CrossRef] [Академия Google]
Hum Reproduct (2001) 16 (11): 2403–10. 10.1093/humrep/16.11.2403
[PubMed] [CrossRef] [Академия Google]
10. Толчер К.М., Холберт М.Р., Уивер А.Л., МакГри М.Е., Олсон Дж.Е., Эль-Нашар С.А. и др.. Прогнозирование кесарева сечения после индукции родов среди нерожавших женщин в срок. Акушерство Гинекол (2015) 126 (5): 1059. 10.1097/АОГ.0000000000001083 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Марсель В. Прогностические модели с конкурирующими рисками: методы и применение для прогнозирования коронарного риска. Эпидемиол (Кембридж Массачусетс) (2009) 4 (20): 555–61. 10.1097/ЕДЭ.0b013e3181a39056 [PubMed] [CrossRef] [Google Scholar]
12. Дэвисон А.С., Хинкли Д.В. Методы начальной загрузки и их применение. Технометрика (1997) 94 (445): 216–7. 10.1017/CBO9780511802843 [CrossRef] [Google Scholar]
13.
Крамер АА, Циммерман ЮЭ. Оценка калибровки контрольных показателей смертности в интенсивной терапии: пересмотр теста Хосмера-Лемешоу. Crit Care Med (2007) 35 (9): 2052–2056. 10.1097/01.СКМ.0000275267.64078.Б0
[PubMed] [CrossRef] [Google Scholar]
10.1097/01.СКМ.0000275267.64078.Б0
[PubMed] [CrossRef] [Google Scholar]
14. Викерс А.Дж., Кронин А.М., Элькин Э.Б., Гонен М. Расширения анализа кривых решений, новый метод оценки диагностических тестов, моделей прогнозирования и молекулярных маркеров. Принятие решений BMC Med Inf (2008) 8(1):1–17. 10.1186/1472-6947-8-53 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Zhou J, Min W, Wang B, Hou X, Wang J, Chen H и др.. Влияние субхориальной гематомы в первом триместре на исходы беременности у пациенток, перенесших лечение ЭКО/ИКСИ. J Mother-Fetal Med (2016) 30 (4): 406–10. 10.1080/14767058.2016.1174682 [PubMed] [CrossRef] [Google Scholar]
16.
Махешвари А., Панди С., Шетти А., Гамильтон М., Бхаттачарья С. Акушерские и перинатальные исходы при одноплодной беременности в результате переноса замороженных размороженных эмбрионов по сравнению со свежими, полученными в результате лечения экстракорпорального оплодотворения: систематический обзор и метаанализ. Фертил Стерил (2012) 98(2):368. 10.1016/j.fertnstert.2012.05.019
[PubMed] [CrossRef] [Google Scholar]
Фертил Стерил (2012) 98(2):368. 10.1016/j.fertnstert.2012.05.019
[PubMed] [CrossRef] [Google Scholar]
17. Антонина С. Акушерские исходы у одноплодных после экстракорпорального оплодотворения криоконсервированными/размороженными эмбрионами. Hum Reprod (Оксфорд, Англия) (2012) 5 (27): 1343–50. 10.1093/humrep/des036 [PubMed] [CrossRef] [Google Scholar]
18. Роке М., Латтес К., Серра С., Сола И., Гебер С., Каррерас Р. и др. Перенос свежих эмбрионов по сравнению с переносом замороженных эмбрионов в циклах экстракорпорального оплодотворения: систематический обзор и метаанализ. Фертил Стерил (2013) 99(1):156–62. 10.1016/j.fertnstert.2012.09.003 [PubMed] [CrossRef] [Google Scholar]
19.
Симон С., Веласко Дж.Дж.Г., Вальбуэна Д., Пейнадо Дж.А., Пеллисер А. Повышение восприимчивости матки за счет снижения уровня эстрадиола в предимплантационном периоде у пациентов с высокой реакцией с использованием режима понижения фолликулостимулирующего гормона. Fertil Steril (1998) 70(2):234. 10.1016/S0015-0282(98)00140-Х
[PubMed] [CrossRef] [Google Scholar]
10.1016/S0015-0282(98)00140-Х
[PubMed] [CrossRef] [Google Scholar]
20. Kalra SK, Ratcliffe SJ, Milman L, Gracia CR, Coutifaris C, Barnhart KT. Перинатальная заболеваемость после экстракорпорального оплодотворения ниже при переносе замороженных эмбрионов. Фертил Стерил (2011) 95 (2): 548–53. 10.1016/j.fertnstert.2010.05.049 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Healy DL, Breheny S, Halliday J, Jaques A, Rushford D, Garrett C, et al. Распространенность и факторы риска акушерского кровотечения у 6730 одноплодных родов после вспомогательных репродуктивных технологий в штате Виктория, Австралия. Hum Reprod (2009) 25 (1): 265–74. 10.1093/хумреп/dep376 [PubMed] [CrossRef] [Google Scholar]
22. Рейх Дж., Блейкмор Дж. К., Грифо Дж. А. Сравнение субхорионической гематомы в циклах переноса одного эуплоидного замороженного эмбриона с медикаментозным или естественным путем. Фертил Стерил (2020) 114 (3): 595–600. 10.1016/j.fertnstert.2020.04.040 [PubMed] [CrossRef] [Google Scholar]
23. Гейтер К.Д., Шмиттер М., Гейтер М.Д., Нишлаг Э., Шнайдер Х.П.Г. Проспективная оценка внешнего вида эндометрия при ультразвуковом исследовании в когорте из 1186 женщин с бесплодием. Фертил Стерил (2000) 73 (1): 106–13. 10.1016/С0015-0282(99)00484-7
[PubMed] [CrossRef] [Google Scholar]
Гейтер К.Д., Шмиттер М., Гейтер М.Д., Нишлаг Э., Шнайдер Х.П.Г. Проспективная оценка внешнего вида эндометрия при ультразвуковом исследовании в когорте из 1186 женщин с бесплодием. Фертил Стерил (2000) 73 (1): 106–13. 10.1016/С0015-0282(99)00484-7
[PubMed] [CrossRef] [Google Scholar]
24. Dietterich C, Check JH, Choe JK, Nazari A, Lurie D. Увеличение толщины эндометрия в день инъекции хорионического гонадотропина человека не оказывает неблагоприятного влияния на беременность или частоту имплантации после экстракорпорального оплодотворения и переноса эмбрионов. Фертил Стерил (2002) 77 (4): 781–6. 10.1016/С0015-0282(01)03276-9[PubMed] [CrossRef] [Google Scholar]
25. Мейер В.Р., Кастельбаум А.Дж., Сомкути С., Сагоскин А.В., Дойл М., Харрис Дж.Е. и др.. Гидросальпингс отрицательно влияет на маркеры рецептивности эндометрия. Hum Reprod (1997) 12 (7): 1393–8. 10.1093/гумреп/12.7.1393 [PubMed] [CrossRef] [Google Scholar]
26.
Лу Л., Сюй Б.Ф., Чен К.Дж., Сунь ХХ. Влияние гидросальпинкса на пиноподы, фактор ингибирования лейкемии, экспрессию интегрина β3 и MUC1 в периимплантационном эндометрии. Eur J Obstetrics Gynecol Reprod Biol (2010) 151(2):171–5. 10.1016/j.ejogrb.2010.04.024
[PubMed] [CrossRef] [Академия Google]
Eur J Obstetrics Gynecol Reprod Biol (2010) 151(2):171–5. 10.1016/j.ejogrb.2010.04.024
[PubMed] [CrossRef] [Академия Google]
27. Блейк Д.А., Проктор М., Джонсон Н., Олив Д. Стадия дробления по сравнению с переносом эмбрионов на стадии бластоцисты при вспомогательном зачатии. Систематическая редакция Кокрановской базы данных (2005 г.) 7 (4): CD002118. 10.1002/14651858.CD002118.pub2 [PubMed] [CrossRef] [Google Scholar]
28. Lopes IMRS, Maganhin CC, Oliveira-Filho RM, Simões RS, Simões MJ, Iwata MC и др.. Гистоморфометрический анализ и маркеры рецептивности эндометрия Эмбриональная имплантация у женщин с синдромом поликистозных яичников во время лечения прогестероном. Научная репродукция (2014) 21 (7): 930–8. 10.1177/1933719113519169 [PubMed] [CrossRef] [Google Scholar]
29.
Лати Р.Б., Хесс А.П., Тулак С., Наяк Н.Р., Конти М., Джудиче Л.С. Дозозависимая регуляция инсулином белка-1, связывающего инсулиноподобный фактор роста, в стромальных клетках эндометрия человека опосредуется различными сигнальными путями. J Clin Endocrinol Metab (2005) 90(3):1599–606. 10.1210/jc.2004-1676
[PubMed] [CrossRef] [Google Scholar]
J Clin Endocrinol Metab (2005) 90(3):1599–606. 10.1210/jc.2004-1676
[PubMed] [CrossRef] [Google Scholar]
30. Какмак Х., Тейлор Х.С. Отказ имплантации: молекулярные механизмы и клиническое лечение. Обновление Hum Reprod (2011) 17 (2): 242–53. 10.1093/humupd/dmq037 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Wu M, Yin Y, Zhao M, Hu L, Chen Q. Низкая экспрессия фактора ингибирования лейкемии в эндометрии: возможно, имеет отношение к необъяснимому бесплодию с множественными неудачами имплантации. Цитокин (2013) 62(2):334–9. 10.1016/j.cyto.2013.03.002 [PubMed] [CrossRef] [Google Scholar]
32. Рейх Дж., Блейкмор Дж. К., Грифо Дж. А. Сравнение субхорионической гематомы в циклах переноса одного эуплоидного замороженного эмбриона с медикаментозным или естественным путем. Фертил Стерил (2020) 114 (3). 10.1016/j.fertnstert.2020.04.040 [PubMed] [CrossRef] [Академия Google]
33.
Палатник А, Гробман В.А. Взаимосвязь между субхориальной гематомой первого триместра, длиной шейки матки и преждевременными родами. Am J Obstetrics Gynecol (2015) 403: e1–.e4. 10.1016/j.ajog.2015.05.019
[PubMed] [CrossRef] [Google Scholar]
Am J Obstetrics Gynecol (2015) 403: e1–.e4. 10.1016/j.ajog.2015.05.019
[PubMed] [CrossRef] [Google Scholar]
34. Jauniaux E, Van Oppenraaij RH, Burton GJ. Акушерские исходы после ранних плацентарных осложнений. Curr Opin Obstet Gynecol (2010) 22(6):452–7. 10.1097/GCO.0b013e3283404e44 [PubMed] [CrossRef] [Google Scholar]
35. Туули М.Г., Норман С.М., Одибо А.О., Маконес Г.А., Кэхилл А.Г. Перинатальные исходы у женщин с субхориальной гематомой: систематический обзор и метаанализ. Акушерство Gynecol (2011) 117(5):1205–12. 10.1097/AOG.0b013e31821568de [PubMed] [CrossRef] [Google Scholar]
36. Яновичгрелевская А., Серошевский П. [Прогностическое значение субхориальной гематомы для течения беременности]. Ginekol Polska (2013) 84 (11): 944–9. 10.17772/gp/1664 [PubMed] [CrossRef] [Google Scholar]
37.
Надь С., Буш М., Стоун Дж., Лапински Р.Х., Гардо С. Клиническое значение субхориальных и ретроплацентарных гематом, обнаруженных в первом триместре беременности.



 — М., 2004. — 3-19 с.
— М., 2004. — 3-19 с.