Исследование уровня хорионического гонадотропина в крови (ХГЧ автомат.)
АНМО «Ставропольский краевой клинический консультативно-диагностический центр»:
355017, г. Ставрополь, ул. Ленина 304(8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное подразделение «Диагностический центр на Западном обходе»:
355029 г. Ставрополь, ул. Западный обход, 64(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-68-89 (факс)
Посмотреть подробнееКлиника семейного врача:
355017 г. Ставрополь, пр. К. Маркса, 110 (за ЦУМом)(8652) 951-951, (8652) 31-51-51 (контактный телефон)
(8652) 31-50-60 (регистратура)
Посмотреть подробнее Невинномысск, ул. Низяева 1
Невинномысск, ул. Низяева 1 (86554) 95-777, 8-962-400-57-10 (регистратура)
Посмотреть подробнееОбособленное структурное подразделение в г. Черкесске :
369000, г. Черкесск, ул. Умара Алиева 318(8782) 26-48-02, +7-988-700-81-06 (контактные телефоны)
Посмотреть подробнееОбособленное структурное подразделение в г. Элисте :
358000, г. Элиста, ул. Республиканская, 478(989) 735-42-07 (контактные телефоны)
Посмотреть подробнееЗАО «Краевой клинический диагностический центр»:
355017 г. Ставрополь, ул. Ленина 304(8652) 951-951, (8652) 35-61-49 (факс)
(8652) 951-951, (8652) 31-51-51 (справочная служба)
Посмотреть подробнееОбособленное структурное подразделение на ул. Савченко, 38 корп. 9:
Савченко, 38 корп. 9:
8 (8652) 316-847 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение на ул. Чехова, 77 :
355000, г. Ставрополь, ул. Чехова, 778(8652) 951-943 (контактный телефон)
Посмотреть подробнееОбособленное структурное подразделение в г. Михайловске:
358000, г. Михайловск, ул. Ленина, 201 (в новом жилом районе «Акварель»).8(988) 099-15-55 (контактный телефон)
Посмотреть подробнееАнализ ХГЧ при беременности — цены, исследования во время беременности в Москве
 Это специфичный гормон, который продуцируется хорионом после прикрепления к маточной стенке плодного яйца. Именно на выявление гонадотропина направлены все экспресс-тесты определения беременности, то есть появление пресловутых «двух полосок» является подтверждением того, что зачатие произошло и хорион вовсю синтезирует гормон гонадотропин.
Это специфичный гормон, который продуцируется хорионом после прикрепления к маточной стенке плодного яйца. Именно на выявление гонадотропина направлены все экспресс-тесты определения беременности, то есть появление пресловутых «двух полосок» является подтверждением того, что зачатие произошло и хорион вовсю синтезирует гормон гонадотропин.Основные функции хорионического гонадотропина
Наличие в анализе крови ХГЧ подтверждает наступившую беременность. В процессе развития плода концентрация хорионического гонадотропина изменяется, что имеет чрезвычайно важную значимость в диагностике протекания беременности. Показатели ХГЧ, не отвечающие норме, говорят о патологическом протекании беременности – эктопической беременности, нарушении функции плаценты и т. д.
ХГЧ выполняет важную функцию в развитии беременности не только в качестве теста на ее нормальное или патологическое протекание. Именно этот гормон предупреждает исчезновение желтого тела беременности и контролирует в яичниках синтез гормонов, нужных для нормального развития и протекания беременности – эстрадиола, прогестерона и эстриола.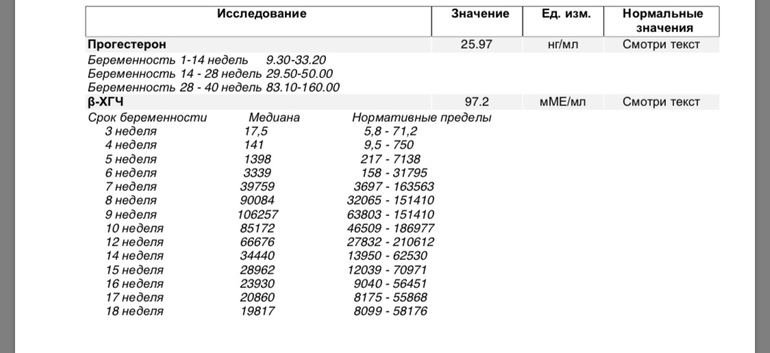
Гонадотропин человека подавляет агрессивную реакцию материнской иммунной системы против клеток зародыша, участвует в половом дифференцировании плодов мужского пола, активизирует половые железы и надпочечники плода.
Почему анализ на ХГЧ нужно делать неоднократно
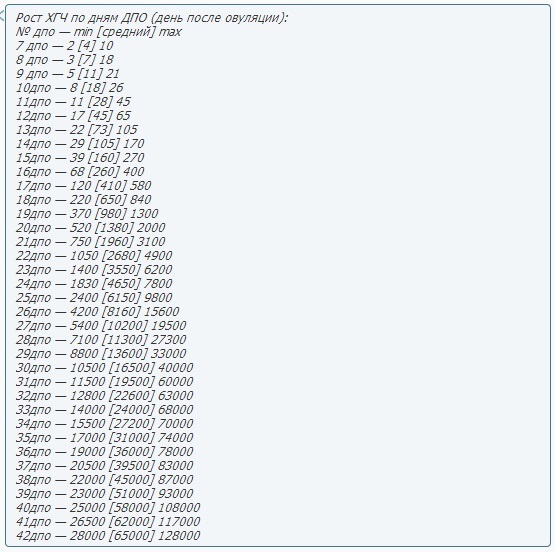
Рост ХГЧ при беременности демонстрирует определенную закономерность, что позволяет наблюдать динамику беременности, развития плода и вовремя выявлять патологии. Стремительнее всего концентрация ХГЧ повышается в первом триместре. При нормально развивающейся беременности пик содержания ХГЧ в крови отмечается на 10-12 неделе, после чего наступает фаза снижения темпов его выработки.
Любое отклонение показателей ХГЧ крови от нормы говорит о проблемах и осложнениях беременности. Если тест на ХГЧ показывает повышенную концентрацию данного гормона, это может быть признаком таких проблем, как:
- токсикоз;
- хромосомные аномалии развития плода;
- гестоз;
- перенашивание беременности.

Также концентрация ХГЧ может увеличиваться на фоне приема гестогенов или если будущая мама страдает сахарным диабетом. Следует знать, что слишком высокий уровень ХГЧ в крови регистрируется и при нормальной, многоплодной беременности – концентрация гормона растет пропорционально числу эмбрионов.
Если тест показал пониженный уровень ХГЧ крови, это может указывать на следующие патологии:
- внематочную, замершую беременность;
- пустое плодное яйцо;
- угрозу выкидыша;
- задержку развития плода;
- нарушение плацентарных функций.
Сделать анализ крови на ХГЧ в Москве можно в любом медицинском центре, однако нужно помнить, что сроки исследования в медучреждениях и лабораторные нормы могут отличаться. Если вам нужно сделать анализ крови на ХГЧ и быстро получить результат, обращайтесь в Клинику Современной Медицины.
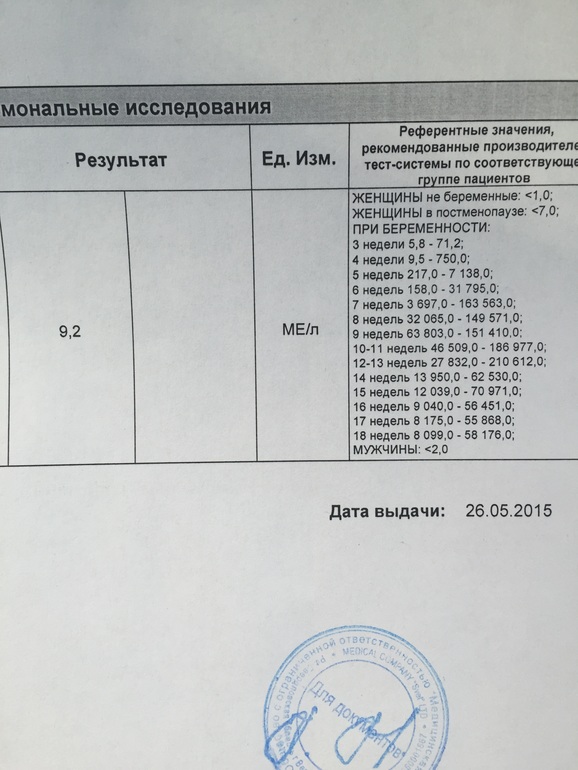
Показатели ХГЧ по неделям
Концентрация ХГЧ в крови достигает максимума примерно к 7-8 неделе беременности; затем уровень остается стабильным, начиная немного снижаться по мере развития плаценты и срока беременности.
Благодаря современной лаборатории и применению новейших калибраторов и реагентов наша клиника обладает возможностью выполнять все лабораторные тесты в кратчайший срок. Цена анализа на ХГЧ доступна каждой пациентке без исключения.
Анализ на ХГЧ как маркер патологий плода
В период вынашивания малыша женщине анализ крови на ХГЧ делают несколько раз – в первом триместре для определения уровня гонадотропина и уточнения сроков беременности и в диапазоне 14-18 недель для выявления возможных дефектов развития плода. Проводится специфичный «тройной» тест на определение ХГЧ, эстрола (ЕЗ) и альфафетопротеина (АФП).
Следует понимать, что высокая концентрация ХГЧ отнюдь не является точным показателем наличия хромосомных отклонений у плода. Но это серьезный повод провести дополнительные тесты.
Но это серьезный повод провести дополнительные тесты.
Как сдать анализ крови на ХГЧ правильно
Чтобы тест на ХГЧ был максимально достоверным, анализ нужно сдать правильно. Кровь на ХГЧ берется из вены обязательно натощак. За день до забора анализа рекомендовано исключить физнагрузки для большей достоверности теста. Обязательно предупредите лаборанта, если принимаете гормональные препараты, поскольку они сказываются на результате.
Расшифровку анализа должен проводить только врач. Лишь специалист может сделать правильный вывод о протекании беременности и определить, нужно ли проведение дополнительных исследований.
Наш медицинский центр оказывает самый широкий спектр услуг. Вы всегда можете обратится к нам по вопросам ведения беременности. Мы готовы оказать вам услуги индивидуального ведения беременности и ктг кардиотокографии плода.
Самопроизвольный выкидыш и замершая беременность
За последние 10 лет количество самопроизвольных выкидышей стремительно растет.
Самопроизвольный выкидыш – это прерывание беременности до достижения плодом жизнеспособного срока (до 22-х недель беременности и массе плода 500гр.).
Большая часть выкидышей (около 80%) происходит до 12 недель беременности. Причем, на ранних сроках до 8 недель беременности, причиной выкидыша являются хромосомные нарушения в 50% случаев. Получается, что природа отсеивает неполноценный продукт зачатия. И эти причины сложно предотвратить, особенно при наличии наследственных заболеваний. К счастью случайные поломки бывают значительно чаще, чем генетически обусловленные. Поэтому последующие беременности обычно заканчиваются благополучно.
Какие это причины?
— хронические заболевания: воспалительные заболевания матки и придатков, синдром поликистозных яичников, миома матки, эндометриоз, пороки развития половых органов.
— инфекции: токсоплазмоз, листериоз, туберкулез половых органов, половые инфекции –хламидии, микоплазмы, уреаплазмы, сифилис.
— антифосфолипидный синдром.
— эндокринные заболевания: диабет, болезни щитовидной железы.
— нарушение обмена веществ в организме: ожирение, дефицит фолиевой кислоты, дефицит железа, витамина Д.
— мужской фактор.
Конечно, эти причины выявляются и устраняются до момента планируемого зачатия.
Существуют вредные факторы, которые могут повлиять на развитие плода на ранних этапах беременности и привести к выкидышу:
— употребление алкоголя.
— использование кофеина (4-5 чашек кофе в день).
— курение (более 10 сигарет в день).
— употребление наркотиков.
— прием медикаментов с тератогенным действием (например: аспирин, найз и другие из этой группы препаратов; противогрибковые средства; антидепрессанты; некоторые антибиотики и ряд других препаратов).
— токсины и профессиональные вредности: ионизирующее излучение, пестициды, вдыхание анестезиологических газов.
Какие признаки возможной потери беременности?
Это жалобы на боли внизу живота и пояснице, кровянистые выделения из половых путей. Необходимо обратиться к врачу для исключения внематочной беременности и проведения дополнительного обследования (теста ХГЧ, анализа крови на прогестерон, УЗИ).
На ранних сроках беременности при сомнительных данных УЗИ или подозрении на неразвивающуюся (замершую) беременность выбирается выжидательная тактика с повторением осмотра гинеколога, УЗИ, тестов через 7-10 дней. Если
диагноз поставлен и факт маточной беременности подтвержден, при угрожающем выкидыше проводится сохраняющая терапия в условиях амбулаторного дневного стационара. Начавшийся выкидыш требует госпитализации в гинекологическое отделение. В случае неразвивающейся беременности проводится прерывание беременности.
В соответствии с клиническим протоколом лечения, утвержденным МЗ РФ от 07.06.2016г. предпочтение отдается медикаментозной терапии, направленной на прерывание беременности аналогами простагландинов (мизопростол) с предварительным использованием или без использования антипрогестина (мифепристона).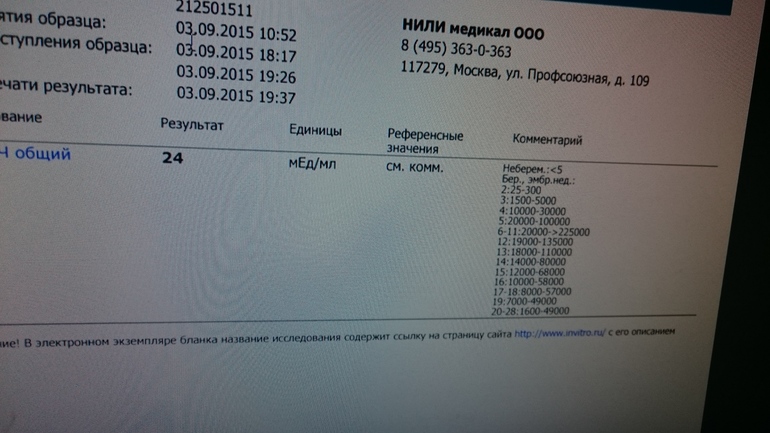 В случае необходимости хирургического лечения (при неполном выкидыше при инфицированном выкидыше) рекомендуется использовать аспирационный кюретаж (с электрическим источником вакуума или мануальный вакуум-аспиратор). Что имеет существенное преимущество перед выскабливанием полости матки поскольку менее травматичен и может быть выполнен в амбулаторных условиях.
В случае необходимости хирургического лечения (при неполном выкидыше при инфицированном выкидыше) рекомендуется использовать аспирационный кюретаж (с электрическим источником вакуума или мануальный вакуум-аспиратор). Что имеет существенное преимущество перед выскабливанием полости матки поскольку менее травматичен и может быть выполнен в амбулаторных условиях.
Все женщины, у которых произошел самопроизвольный выкидыш, нуждаются в лечении, направленном на профилактику осложнений и предотвращение повторных выкидышей. Почему необходима реабилитационная терапия?
Согласно решению XVIII Всемирного конгресса акушеров-гинекологов диагноз хронического эндометрита следует ставить абсолютно всем женщинам, перенесшим неразвивающуюся беременность. Два из трех выкидышей по мнению профессора В.Е. Радзинского обусловлены именно этим заболеванием. При исследовании материала из полости матки были выделены инфекционные возбудители: уреаплазмы, микоплазмы, стрептококки, стафилококки, кишечная палочка, вирусы (герпес, ВПЧ). Поэтому очень важно лечение провести сразу после прерывания беременности.
Поэтому очень важно лечение провести сразу после прерывания беременности.
Если время упущено, необходимо провести дополнительную диагностику: пайпель-биопсию эндометрия с гистологическим исследованием и исследованием на инфекции, в том числе на туберкулез. Затем с учетом полученных результатов проводится симптоматическая противовоспалительная терапия (иммуномодуляторы, антибактериальные препараты, физиолечение, гинекологический массаж, грязелечение). Параллельно назначается обследование на выявление других причин выкидыша (мужского фактора, хронических заболеваний матери, половых инфекций, антифосфолипидного синдрома).
В медицинском центре «Мифра-Мед» на уровне современных требований медицины созданы все возможности полного адекватного обследования: все виды анализов, УЗИ, гистероскопия, аспирационная биопсия, консультации узких специалистов (эндокринолога, терапевта, невролога, уролога). Наши врачи-гинекологи высшей категории Мелько О.Н., Новицкая Е.Л., Тихонова Т.Н. и врач-уролог высшей категории Канаев С. А. имеют достаточный опыт в реабилитации и подготовке супружеских пар к следующей беременности с благополучным исходом. Лечение проводится в дневном стационаре с применением лекарственных препаратов, физиолечения, гинекологического массажа, массажа простаты.
А. имеют достаточный опыт в реабилитации и подготовке супружеских пар к следующей беременности с благополучным исходом. Лечение проводится в дневном стационаре с применением лекарственных препаратов, физиолечения, гинекологического массажа, массажа простаты.
МЫ ОБЯЗАТЕЛЬНО ВАМ ПОМОЖЕМ!
ул. Яковлева, 16 ул. Кирова 47 Б
тел. 244-744 тел. 46-43-57
Анализ бета — ХГЧ свободный (бета-субъединица хорионического гонадотропина человека) – сдать по цене 660 руб. в Москве
Хорионический гонадотропин человека (ХГЧ) — гормон, который синтезируется в организме женщины во время беременности. Его продуцируют клетки оболочек развивающегося плода, а позже — плацента. В норме этот гормон не присутствует в крови у женщин, которые не беременны, и мужчин. Его обнаружение возможно при развитии ХГЧ-продуцирующих опухолей.
Химическая структура гормона объединяет две субъединицы – альфа и бета. Первая идентична у ХГЧ и ряда гормонов гипофиза. Вторая имеет уникальное строение. Именно она используется для оценки уровня гормона.
Именно она используется для оценки уровня гормона.
ХГЧ играет важную роль в производстве прогестерона и эстрогенов – основных гормонов, поддерживающих беременность. Он стимулирует активность желтого тела у беременных до тех пор, пока плацента не будет готова вырабатывать достаточное количество прогестерона (в течение первых 10 – 12 недель).
Когда развитие плаценты завершено, ХГЧ воздействует на клетки Лейдига, отвечающие за выработку тестостерона, который необходим для того чтобы у плода мужского пола началось формирование половых органов по мужскому типу.
По уровню ХГЧ наступление беременности может быть установлено уже на 6 — 14 день после зачатия.
Отклонения от нормы уровня ХГЧ могут указывать на то, что беременность протекает с патологиями, или на наличие хромосомных аномалий.
Материал для анализа
Сыворотка крови.
Методика исследования
Иммуноферментный анализ.
Единицы измерения
МЕ/мл (международная единица на миллилитр).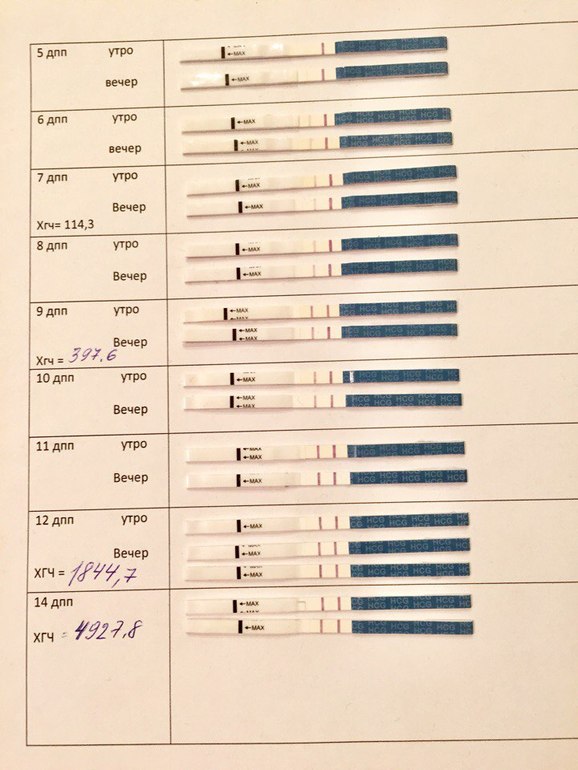
Информация на странице не предназначена для самодиагностики и самолечения.
Проконсультируйтесь с лечащим врачом.
Когда сдавать анализ?
Для определения беременности на ранних сроках тест выполняется на 3 – 5 день задержки. Если результат сомнителен, тест повторяется дважды с промежутком 2-3 дня.
Для контроля хирургического лечения внематочной беременности анализ выполняют через 1 — 2 дня после лапароскопической операции.
Сдать кровь для оценки риска патологии беременности, раннего выявления хромосомных аномалий эмбриона или диагностики опухолей можно в любое удобное время.
С какой целью назначается исследование?
Женщинам:
- диагностировать беременность;
- выявить внематочную беременность;
- оценить полноту выполнения искусственного аборта;
- определить угрозу выкидыша,
- подтвердить или опровергнуть подозрение на замершую беременность;
- диагностировать хорионэпителиому или пузырный занос;
- провести пренатальную диагностику пороков развития плода.

Мужчинам:
- диагностировать опухоль яичка.
Какие состояния вызывают повышение уровня бета-ХГЧ?
Беременные женщины:
- ранний токсикоз, гестоз;
- пороки развития плода;
- сахарный диабет матери;
- пузырный занос.
Небеременные женщины:
- хорионкарцинома;
- рак груди.
Мужчины:
[Значение сывороточного бета-хорионического гонадотропина человека на 9 и 11 день после переноса эмбриона для прогнозирования исходов беременности]
Цель: Изучить значение сывороточного бета-хорионического гонадотропина человека (β-ХГЧ) на 9 (d9) и 11 (d11) дни после переноса свежих эмбрионов (ET) и переноса замороженных-размороженных эмбрионов (FET) в прогнозировании исходов беременности.
Методы: Всего было проанализировано 227 свежих циклов ET и FET, проведенных в Центре репродуктивной медицины Народной больницы Цинюань в период с декабря 2012 г. по февраль 2014 г.Были проанализированы данные уровней β-ХГЧ в сыворотке на d9 и d11 после свежих циклов ET и FET и исходы беременности, и была построена кривая ROC для определения оптимального порогового уровня уровня β-ХГЧ в сыворотке для прогнозирования исходов беременности.
по февраль 2014 г.Были проанализированы данные уровней β-ХГЧ в сыворотке на d9 и d11 после свежих циклов ET и FET и исходы беременности, и была построена кривая ROC для определения оптимального порогового уровня уровня β-ХГЧ в сыворотке для прогнозирования исходов беременности.
Результаты: По исходам беременности циклы были разделены на группу без беременности (группа A), группу биохимической беременности (группа B) и группу клинической беременности (группа C).Значительные различия были обнаружены между средними уровнями β-ХГЧ в сыворотке, измеренными на d9 и d11 во всех 3 группах (P <0,01). Циклы в группе C были далее разделены на 5 подгрупп с одноплодной беременностью (C1), беременностью двойней (C2), ранним абортом (C3), внематочной беременностью (C4) или внутриутробной беременностью, осложненной группой внематочной беременности (C5), и всеми остальными. в 5 подгруппах были выявлены значительные различия в измерениях β-ХГЧ между d9 и d11 (P <0,01). На день 9 после ET и FET оптимальный пороговый уровень сывороточного β-ХГЧ составил 49.05 МЕ / л для прогнозирования клинической беременности и 105,15 МЕ / л для прогнозирования беременности двойней; два соответствующих пороговых уровня сывороточного β-ХГЧ на d11 составляли 51,2 МЕ / л и 241,75 МЕ / л соответственно.
в 5 подгруппах были выявлены значительные различия в измерениях β-ХГЧ между d9 и d11 (P <0,01). На день 9 после ET и FET оптимальный пороговый уровень сывороточного β-ХГЧ составил 49.05 МЕ / л для прогнозирования клинической беременности и 105,15 МЕ / л для прогнозирования беременности двойней; два соответствующих пороговых уровня сывороточного β-ХГЧ на d11 составляли 51,2 МЕ / л и 241,75 МЕ / л соответственно.
Вывод: Абсолютный уровень β-ХГЧ в сыворотке на d9 и d11 после свежих ET и FET позволяет точно диагностировать беременность и помогает в прогнозировании исходов беременности.
Возможность живорождения у пациентов с низким уровнем β-ХГЧ в сыворотке через 14 дней после переноса бластоцисты | Journal of Ovarian Research
В настоящем исследовании изучали исходы беременности у пациенток, у которых уровень β-ХГЧ в сыворотке крови был <300 мМЕ / мл через 14 дней после переноса бластоцисты.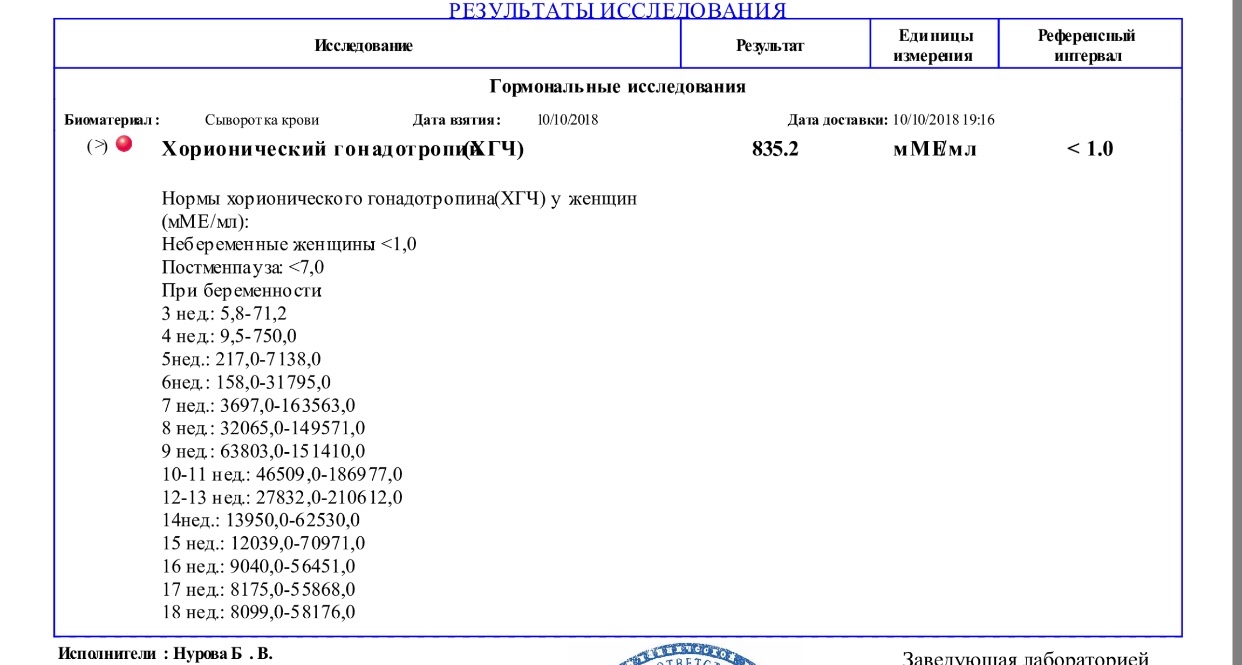 Наше исследование показало, что исходы беременности у пациенток с исходно низким уровнем β-ХГЧ в сыворотке крови были плохими — только 18,6% живорождений. Около 50% (47,4%) пациенток имели ранний выкидыш, а частота внематочной беременности составила 9.6%. В наше исследование были включены пациенты с исходно низким уровнем β-ХГЧ в сыворотке, а не все беременные женщины, поскольку было проведено много подобных исследований. Пациенты с низким уровнем β-ХГЧ часто очень обеспокоены исходом своей беременности. Кроме того, от них часто требуется сдавать тесты на уровень β-ХГЧ в сыворотке крови, чтобы отслеживать прогресс зачатия, что увеличивает количество посещений и, таким образом, вызывает у них как психологический, так и экономический стресс.
Наше исследование показало, что исходы беременности у пациенток с исходно низким уровнем β-ХГЧ в сыворотке крови были плохими — только 18,6% живорождений. Около 50% (47,4%) пациенток имели ранний выкидыш, а частота внематочной беременности составила 9.6%. В наше исследование были включены пациенты с исходно низким уровнем β-ХГЧ в сыворотке, а не все беременные женщины, поскольку было проведено много подобных исследований. Пациенты с низким уровнем β-ХГЧ часто очень обеспокоены исходом своей беременности. Кроме того, от них часто требуется сдавать тесты на уровень β-ХГЧ в сыворотке крови, чтобы отслеживать прогресс зачатия, что увеличивает количество посещений и, таким образом, вызывает у них как психологический, так и экономический стресс.
По этим причинам очень важно составить индивидуальный план последующего наблюдения в соответствии с различными интервалами сывороточного β-ХГЧ.Для пациенток с исходно низким уровнем β-ХГЧ наиболее важным фактором является определение клинической беременности. Наше исследование показало, что исходное значение β-ХГЧ> 58,8 мМЕ / мл предсказывало 85,8% клинических беременностей, в то время как неспособность достичь этого значения приводила к 73,3% биохимической потери беременности. Среди пациенток с клинической беременностью около 60% имели ранний выкидыш и 12,4% — внематочную беременность (данные не представлены). Следовательно, для пациентов с исходным β-ХГЧ> 58.8 мМЕ / мл, хотя рекомендуется продолжать поддержку лютеиновой фазы, через неделю следует провести дополнительный анализ сывороточного β-ХГЧ и ультразвуковое исследование, чтобы исключить внематочную беременность. Если исходный уровень β-ХГЧ в сыворотке крови <58,8 мМЕ / мл, рекомендуется прекратить поддержку лютеиновой фазы и провести измерение уровня β-ХГЧ в сыворотке крови и провести ультразвуковое исследование через неделю, поскольку в этой группе пациентов не было живорождений.
Наше исследование показало, что исходное значение β-ХГЧ> 58,8 мМЕ / мл предсказывало 85,8% клинических беременностей, в то время как неспособность достичь этого значения приводила к 73,3% биохимической потери беременности. Среди пациенток с клинической беременностью около 60% имели ранний выкидыш и 12,4% — внематочную беременность (данные не представлены). Следовательно, для пациентов с исходным β-ХГЧ> 58.8 мМЕ / мл, хотя рекомендуется продолжать поддержку лютеиновой фазы, через неделю следует провести дополнительный анализ сывороточного β-ХГЧ и ультразвуковое исследование, чтобы исключить внематочную беременность. Если исходный уровень β-ХГЧ в сыворотке крови <58,8 мМЕ / мл, рекомендуется прекратить поддержку лютеиновой фазы и провести измерение уровня β-ХГЧ в сыворотке крови и провести ультразвуковое исследование через неделю, поскольку в этой группе пациентов не было живорождений.
В нашем исследовании мы рассчитали кратное увеличение β-ХГЧ за 48 часов в соответствии со вторым тестом и обнаружили, что значение 1. 9 было оптимальным порогом для отличия живорожденных от неживых. Вероятность живорождения составляла 63,6% при кратном увеличении> 1,9 по сравнению с минимальной вероятностью живорождения (7,7%) у пациентов с кратным увеличением <1,9. Пациентам с пониженным уровнем β-ХГЧ в сыворотке крови следует назначить еще один тест на β-ХГЧ через 7–10 дней, поскольку может произойти аномальное зачатие, такое как внематочная беременность, как и в случае внематочной беременности в нашем настоящем исследовании. Шамонки и др.подтвердили, что снижение уровня β-ХГЧ в сыворотке почти всегда приводило к неудачному рождению живого ребенка, хотя они сообщили о 3 случаях живорождения со сниженным уровнем β-ХГЧ в сыворотке крови в когорте из 6021 пациента [10].
9 было оптимальным порогом для отличия живорожденных от неживых. Вероятность живорождения составляла 63,6% при кратном увеличении> 1,9 по сравнению с минимальной вероятностью живорождения (7,7%) у пациентов с кратным увеличением <1,9. Пациентам с пониженным уровнем β-ХГЧ в сыворотке крови следует назначить еще один тест на β-ХГЧ через 7–10 дней, поскольку может произойти аномальное зачатие, такое как внематочная беременность, как и в случае внематочной беременности в нашем настоящем исследовании. Шамонки и др.подтвердили, что снижение уровня β-ХГЧ в сыворотке почти всегда приводило к неудачному рождению живого ребенка, хотя они сообщили о 3 случаях живорождения со сниженным уровнем β-ХГЧ в сыворотке крови в когорте из 6021 пациента [10].
В нескольких ранее опубликованных исследованиях изучали прогноз исходов беременности по уровням β-ХГЧ в сыворотке крови в течение различных дней после переноса витрифицированной-нагретой бластоцисты. Oron et al. Продемонстрировали, что для β-ХГЧ, который был измерен через 11 дней после переноса одной бластоцисты, оптимальное пороговое значение для прогнозирования клинической беременности составляло 137 МЕ / л с PPV 85% и NPV 75% [6 ].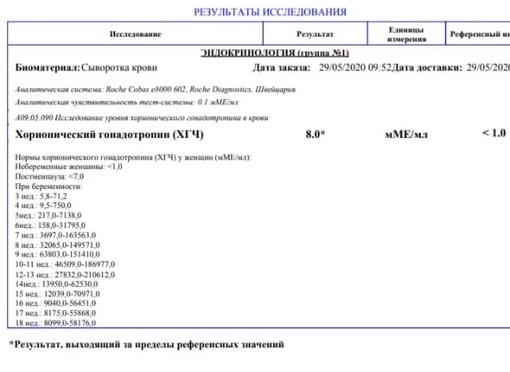 Исследование Xiong et al. Определило, что оптимальные пороговые значения составляли 152,2 МЕ / л и 211,9 МЕ / л соответственно для прогнозирования клинической беременности и живорождений у пациентов, у которых были тесты на β-ХГЧ через 11 дней после переноса витрифицированной-нагретой бластоцисты [7]. Zhao et al. Обнаружили, что единичное значение β-ХГЧ 399,5 МЕ / л на 12-й день после переноса бластоцисты было надежным для прогнозирования клинической беременности с PPV 93,47% и NPV 67,61%. Единичное значение β-ХГЧ> 410,8 МЕ / л указывает на то, что 76,62% живорождений и значение ниже этого порога привели к 80.72% неживых рождений [8]. Пороговые значения для прогнозирования клинической беременности и живорождений в этих исследованиях были выше, чем в нашем исследовании, что можно объяснить тем фактом, что в наше исследование были включены только пациенты с низким уровнем β-ХГЧ.
Исследование Xiong et al. Определило, что оптимальные пороговые значения составляли 152,2 МЕ / л и 211,9 МЕ / л соответственно для прогнозирования клинической беременности и живорождений у пациентов, у которых были тесты на β-ХГЧ через 11 дней после переноса витрифицированной-нагретой бластоцисты [7]. Zhao et al. Обнаружили, что единичное значение β-ХГЧ 399,5 МЕ / л на 12-й день после переноса бластоцисты было надежным для прогнозирования клинической беременности с PPV 93,47% и NPV 67,61%. Единичное значение β-ХГЧ> 410,8 МЕ / л указывает на то, что 76,62% живорождений и значение ниже этого порога привели к 80.72% неживых рождений [8]. Пороговые значения для прогнозирования клинической беременности и живорождений в этих исследованиях были выше, чем в нашем исследовании, что можно объяснить тем фактом, что в наше исследование были включены только пациенты с низким уровнем β-ХГЧ.
Stone et al. Исследовали связь между временем удвоения сывороточного β-ХГЧ (β-t2) и продолжающейся беременностью у беременных после вспомогательных репродуктивных технологий (ВРТ). Они показали, что β-t2 на 12-й день после переноса эмбриона составлял около 1.6 дней и пороговое значение 2,2 дня имели оптимальную PPV 87% и NPV 42% [11]. Sung et al. Рассчитали кратное увеличение между 12-м и 14-м днём после овуляции в циклах замораживания-размораживания, но разницы между живорождениями и ранним невынашиванием беременности не обнаружено (3,1 ± 0,9 раза по сравнению с 3,0 ± 1,0 раза; P> 0,05). Тем не менее, они продемонстрировали, что 2,37- и 2,6-кратные значения соответственно предсказывают 89,8% клинических беременностей и 72,7% живорождений [1].
Они показали, что β-t2 на 12-й день после переноса эмбриона составлял около 1.6 дней и пороговое значение 2,2 дня имели оптимальную PPV 87% и NPV 42% [11]. Sung et al. Рассчитали кратное увеличение между 12-м и 14-м днём после овуляции в циклах замораживания-размораживания, но разницы между живорождениями и ранним невынашиванием беременности не обнаружено (3,1 ± 0,9 раза по сравнению с 3,0 ± 1,0 раза; P> 0,05). Тем не менее, они продемонстрировали, что 2,37- и 2,6-кратные значения соответственно предсказывают 89,8% клинических беременностей и 72,7% живорождений [1].
В нашем настоящем исследовании оптимальный порог кратного увеличения для клинической беременности был равен 1.4 с AUC 0,899, чувствительностью 90,3%, специфичностью 77,8% и PPV 97,4%. Значение при прогнозировании живорождений составило 1,9 с AUC 0,803, чувствительностью 88,5%, PPV 97,4% и NPV 92,3%. Кратное увеличение клинических беременностей и живорождений в нашем исследовании было ниже, чем в исследовании Суна. Возможные причины следующие: во-первых, уровни β-ХГЧ в сыворотке в нашем исследовании были измерены через 14 дней после переноса бластоцисты, что было как минимум на два дня позже, чем в исследовании Сунга.Исследование Stone et al. Показало, что время удвоения сывороточного β-ХГЧ (β-t2) увеличилось с 1,6 дня на 12-й день до времени удвоения через 3 дня на 24-й день после переноса эмбриона [11], что позволяет предположить, что β -ХГЧ удваивается быстрее на ранних сроках беременности. Во-вторых, исследуемая популяция в нашем исследовании включала пациентов с низким уровнем β-ХГЧ в сыворотке крови, у которых перенесенные эмбрионы могут быть менее эффективными, чем у пациентов с нормальным уровнем β-ХГЧ.
Возможные причины следующие: во-первых, уровни β-ХГЧ в сыворотке в нашем исследовании были измерены через 14 дней после переноса бластоцисты, что было как минимум на два дня позже, чем в исследовании Сунга.Исследование Stone et al. Показало, что время удвоения сывороточного β-ХГЧ (β-t2) увеличилось с 1,6 дня на 12-й день до времени удвоения через 3 дня на 24-й день после переноса эмбриона [11], что позволяет предположить, что β -ХГЧ удваивается быстрее на ранних сроках беременности. Во-вторых, исследуемая популяция в нашем исследовании включала пациентов с низким уровнем β-ХГЧ в сыворотке крови, у которых перенесенные эмбрионы могут быть менее эффективными, чем у пациентов с нормальным уровнем β-ХГЧ.
В нашем предыдущем исследовании изучалась вероятность живорождений с сывороточными уровнями β-ХГЧ <100 мМЕ / мл через 14 дней после переноса эмбрионов на третий день, что показало, что коэффициент живорождений составлял всего 4 человека.3%. Также в нашем настоящем исследовании коэффициент живорождения составлял 4,5%, когда уровень β-ХГЧ в сыворотке был <100 мМЕ / мл через 14 дней после переноса бластоцисты (таблица 2), что сопоставимо с данными наблюдений, обнаруженных для эмбриона 3 дня. перевод [12].
перевод [12].
Настоящее исследование обладает следующими преимуществами. Во-первых, мы проанализировали только пациентов с низким уровнем β-ХГЧ в сыворотке, а не обследовали всех беременных, что будет полезно для разработки соответствующих рекомендаций по дальнейшему наблюдению для этой группы пациентов.Во-вторых, все включенные пациенты адоптивно получали только витрифицированные нагретые бластоцисты и имели уровни β-ХГЧ в сыворотке, которые были измерены точно в тот же день после переноса эмбриона, что может повысить точность уровней β-ХГЧ в сыворотке. Однако текущее исследование имело два недостатка. Сначала исследуемые пациенты прошли тест на β-ХГЧ через 14 дней после переноса эмбриона. Более того, время проведения теста на ХГЧ в каждом центре сильно варьировалось. Таким образом, наши результаты могут быть применимы только для прогнозирования пациентов, у которых был тест на ХГЧ в сыворотке крови через 14 дней после переноса бластоцисты.Прогноз для пациентов, у которых был тест на ХГЧ, отличный от 14 дней, следует рассчитывать в соответствии со временем удвоения ХГЧ, равным 48 часам, что ограничивает его более широкое применение. Во-вторых, количество успешно перенесенных эмбрионов варьировало от одного до двух. Это может вызвать синдром исчезающих близнецов, который может повлиять на исходный уровень β-ХГЧ в сыворотке.
Во-вторых, количество успешно перенесенных эмбрионов варьировало от одного до двух. Это может вызвать синдром исчезающих близнецов, который может повлиять на исходный уровень β-ХГЧ в сыворотке.
Сообщалось, что частота синдрома исчезающих близнецов достигает 10% после АРТ [13], что может повлиять на исходный уровень β-ХГЧ в сыворотке крови матери.В настоящем исследовании частота двойных беременностей составила всего 5,1% (16/312) с исходным уровнем β-ХГЧ в сыворотке <300 мМЕ / мл. И, наконец, при беременности двойней не наблюдалось синдрома исчезающих близнецов, за исключением 14 полных выкидышей.
Что означает мой уровень ХГЧ?
Итак, вы находитесь в процессе ЭКО, и теперь вы ждали долгие 10–16 дней своего первого теста на беременность. Ваш уровень ХГЧ снова становится положительным. Поздравляю!
Затем начинается паника.У меня слишком маленький номер? Это слишком высоко? Означает ли это, что у меня близнецы? Тройняшки? В InVia Fertility пациенты часто просят нас интерпретировать их уровень ХГЧ по результатам первого положительного теста — и, по правде говоря, в большинстве случаев это невозможно.
Что измеряет уровень ХГЧ?
ХГЧ (хорионический гонадотропин человека) — это «гормон беременности». Он обнаруживается вскоре после имплантации и обычно удваивается каждые 72 часа. Он достигает своего пика к 8-11 неделям беременности и стабилизируется.Уровень ХГЧ ниже 5 считается отрицательным. От 5 до 25 считается низким положительным значением и может предупредить врача об аномальной беременности (например, химической или внематочной). Считается, что беременность старше 25 лет.
При этом один уровень ХГЧ не дает много информации. Необходимо повторить измерения уровня сыворотки (крови), чтобы увидеть, повышается или понижается уровень соответственно. Как только уровень ХГЧ достигнет примерно 1000, трансвагинальное УЗИ сможет обнаружить гестационный мешок в матке.После этого серийное ультразвуковое исследование предоставит вашему специалисту по фертильности самую важную информацию.
Диапазон уровней ХГЧ и их значение
В таблице ниже представлены средние уровни ХГЧ, а также их диапазон. Как видите, диапазон существенно различается:
Как видите, диапазон существенно различается:
Диапазон для одиночных детей составляет 5 — 397, а для близнецов — 48 — 683. Как вы можете видеть, существует большое совпадение между первым уровнем ХГЧ у одиночек и близнецов. Это означает, что даже если у вас первый уровень ХГЧ 397, это может быть одноплодная беременность.Также, если первый уровень ХГЧ равен 48; это могла быть двойная беременность. Таким образом, один уровень ХГЧ не может отличить одноплодную беременность от многоплодной. Конечно, если первый уровень ХГЧ, скажем, 1200 мМЕ / мл; это больше всего похоже на многоплодную беременность, но вы не можете быть уверены, пока не сделаете УЗИ пару недель спустя.
Аналогичное наблюдение можно сделать и в отношении выкидыша. Здесь диапазон первого уровня ХГЧ составляет от 5 до 268. Таким образом, даже у пациентов с (превосходным) первым уровнем ХГЧ 268 мМЕ / мл может произойти выкидыш.
Наконец, на ваш уровень ХГЧ может повлиять перенос эмбриона на 5-й или 3-й день.
Чистая прибыль
Итак, подведем итог: когда первый тест на ХГЧ дает положительный результат, это отличная новость — вы преодолели огромное препятствие, и это нормально — наслаждаться моментом! Вы действительно беременны! Однако может быть разумным помнить, что последующие уровни ХГЧ должны показывать соответствующее повышение, а последующие ультразвуковые исследования должны показывать соответствующий рост, прежде чем можно будет подтвердить, что это продолжающаяся беременность.
Уровни ХГЧ, указанные выше, являются ориентировочными. Из правил всегда есть исключения. Вот почему, даже если уровень ХГЧ низкий, важно продолжать прием лекарств и продолжать наблюдение за пациентами .
Чтобы работать с квалифицированным, сертифицированным специалистом по лечению бесплодия, запишитесь на прием в одну из четырех клиник репродуктивного здоровья InVia в Чикаго.
Сокращения
- CI
- доверительный интервал
- ХГЧ
- Хорионический гонадотропин человека
- ICSI
- внутрицитоплазматическая инъекция спермы
- ЭКО
- экстракорпоральное оплодотворение
Ключевое сообщение
Концентрация ХГЧ в сыворотке крови на очень ранних сроках беременности снижается с возрастом матери.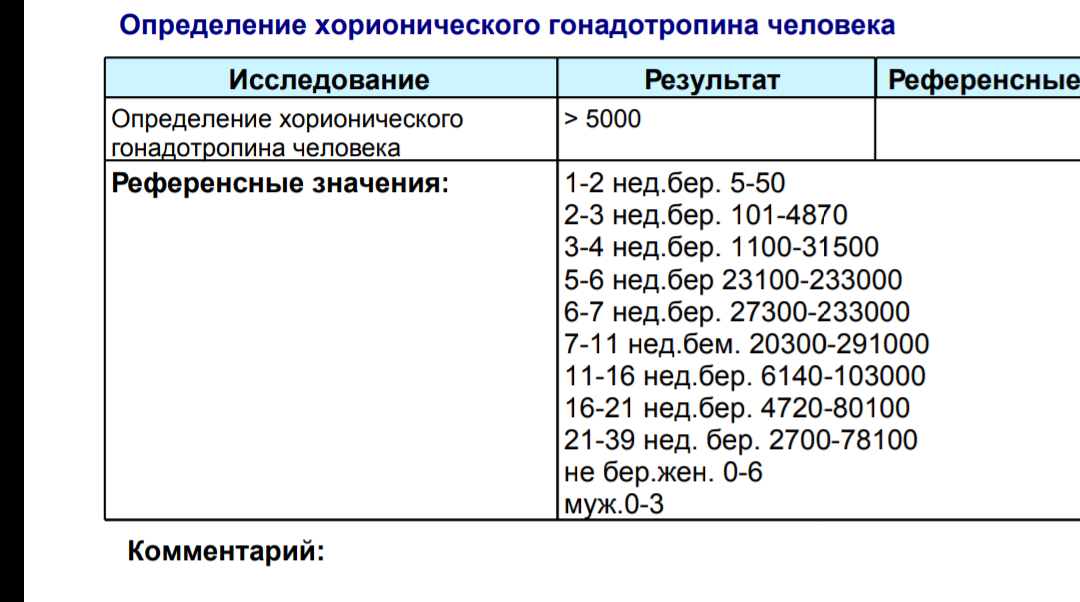
Введение
Откладывание деторождения на поздний репродуктивный период становится все более распространенным явлением. Беременность матерей более старшего возраста имеет повышенный риск неблагоприятных исходов беременности, таких как выкидыш 1, преэклампсия 2 и гибель плода 3. Однако причины увеличения рисков остаются недостаточно изученными.
Во время беременности хорионический гонадотропин человека (ХГЧ) вырабатывается клетками трофобласта в плаценте.ХГЧ способствует поддержанию желтого тела на ранних сроках беременности, которое производит и секретирует прогестерон. ХГЧ также известен как ангиогенный фактор и стимулирует развитие матки и плаценты 4-6. Концентрации ХГЧ в сыворотке крови матери на ранних сроках беременности сильно различаются между индивидуумами. 7. Знание основных механизмов таких изменений может улучшить наше понимание роли ХГЧ при беременности.
У пожилых женщин повышен риск неблагоприятного исхода беременности. Низкие концентрации ХГЧ связаны с повышенным риском выкидыша 8, 9 и преэклампсии 10. Однако неизвестно, имеют ли пожилые женщины более низкие концентрации ХГЧ в сыворотке крови на ранних сроках беременности по сравнению с более молодыми женщинами. Мы изучили связь возраста матери с концентрацией ХГЧ у 4472 беременностей, зачатых в результате экстракорпорального оплодотворения (ЭКО) в норвежской университетской больнице.
Низкие концентрации ХГЧ связаны с повышенным риском выкидыша 8, 9 и преэклампсии 10. Однако неизвестно, имеют ли пожилые женщины более низкие концентрации ХГЧ в сыворотке крови на ранних сроках беременности по сравнению с более молодыми женщинами. Мы изучили связь возраста матери с концентрацией ХГЧ у 4472 беременностей, зачатых в результате экстракорпорального оплодотворения (ЭКО) в норвежской университетской больнице.
Материалы и методы
В этом поперечном исследовании в исследуемую популяцию вошли беременные после ЭКО в университетской больнице Осло, Рикшоспиталет, Осло, Норвегия, в период с февраля 1996 года по февраль 2013 года.Мы включили все беременности, жизнеспособность которых была подтверждена ультразвуковым исследованием на 8 неделе гестации (через 6 недель после переноса эмбриона). Мы включили все беременности после переноса свежих эмбрионов из ЭКО с или без внутрицитоплазматической инъекции сперматозоидов (ИКСИ) или после переноса замороженных / размороженных эмбрионов ( n = 5326).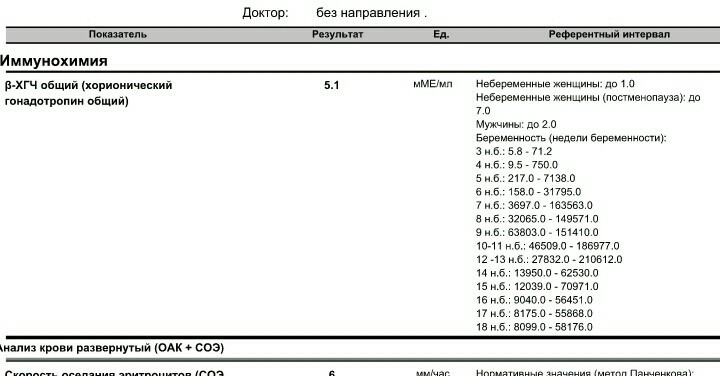 Все ооциты, использованные для лечения, были аутологичными, и все эмбрионы были перенесены на 2-3 день после извлечения яйцеклеток на стадии от двух до восьми клеток.У 4552 женщин сывороточные концентрации ХГЧ были измерены утром на 12-й день после переноса эмбриона (замороженный / размороженный) или на 16-й день после индукции овуляции экзогенным ХГЧ (свежие эмбрионы) (Рис. был переведен. Поскольку три эмбриона были перенесены тщательно отобранным женщинам с повторной неудачей лечения или очень плохим качеством эмбрионов, мы решили исключить эти беременности. Мы также исключили три беременности с выпадающими значениями концентрации ХГЧ (≥1000 МЕ / л) 7, 8, 12.Таким образом, всего можно было включить 4472 беременности.
Все ооциты, использованные для лечения, были аутологичными, и все эмбрионы были перенесены на 2-3 день после извлечения яйцеклеток на стадии от двух до восьми клеток.У 4552 женщин сывороточные концентрации ХГЧ были измерены утром на 12-й день после переноса эмбриона (замороженный / размороженный) или на 16-й день после индукции овуляции экзогенным ХГЧ (свежие эмбрионы) (Рис. был переведен. Поскольку три эмбриона были перенесены тщательно отобранным женщинам с повторной неудачей лечения или очень плохим качеством эмбрионов, мы решили исключить эти беременности. Мы также исключили три беременности с выпадающими значениями концентрации ХГЧ (≥1000 МЕ / л) 7, 8, 12.Таким образом, всего можно было включить 4472 беременности.
Блок-схема включенных участников исследования. ХГЧ, хорионический гонадотропин человека; ЭКО, экстракорпоральное оплодотворение.
Хорионический гонадотропин человека был определен количественно в отделении биохимии университетской больницы Осло, Рикшоспиталет.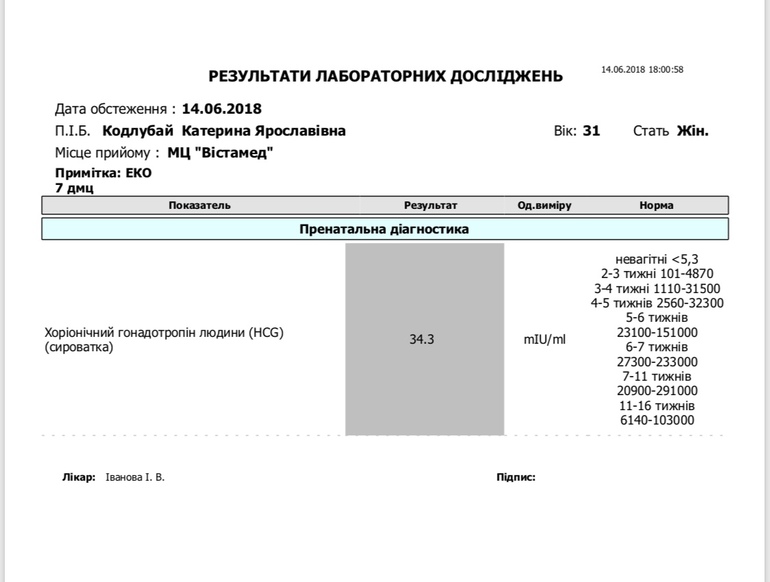 Был использован метод электрохемилюминесцентного иммуноанализа (Elecsys; Roche, Базель, Швейцария), и интактные цепи ХГЧ и свободные цепи ХГЧ были измерены с пределом обнаружения 0.5 мМЕ / мл. Контроль качества в больнице показал низкую вариацию внутри серии (коэффициент вариации <4%) и низкую вариацию во времени (коэффициент вариации <5%) 7. Это согласуется с соответствующими цифрами, приведенными производителем. Возраст матери на момент зачатия был разделен на следующие категории: ≤25, 26–27, 28–29, 30–31, 32–33, 34–35, 36–37, 38–39 и ≥40 лет. В качестве потенциальных мешающих факторов мы включили индекс массы тела до беременности (как непрерывную переменную) 7, метод ЭКО (кодируется: ЭКО без ИКСИ, ЭКО с ИКСИ или перенос замороженных / размороженных эмбрионов) 13, количество перенесенных эмбрионов (кодируется : 1 или 2) 14 и год (период) переноса эмбриона (кодируется: февраль 1996–2001, 2002–2007 или 2008 – февраль 2013).
Был использован метод электрохемилюминесцентного иммуноанализа (Elecsys; Roche, Базель, Швейцария), и интактные цепи ХГЧ и свободные цепи ХГЧ были измерены с пределом обнаружения 0.5 мМЕ / мл. Контроль качества в больнице показал низкую вариацию внутри серии (коэффициент вариации <4%) и низкую вариацию во времени (коэффициент вариации <5%) 7. Это согласуется с соответствующими цифрами, приведенными производителем. Возраст матери на момент зачатия был разделен на следующие категории: ≤25, 26–27, 28–29, 30–31, 32–33, 34–35, 36–37, 38–39 и ≥40 лет. В качестве потенциальных мешающих факторов мы включили индекс массы тела до беременности (как непрерывную переменную) 7, метод ЭКО (кодируется: ЭКО без ИКСИ, ЭКО с ИКСИ или перенос замороженных / размороженных эмбрионов) 13, количество перенесенных эмбрионов (кодируется : 1 или 2) 14 и год (период) переноса эмбриона (кодируется: февраль 1996–2001, 2002–2007 или 2008 – февраль 2013).
Статистический анализ
Концентрации ХГЧ не имели нормального распределения (рис.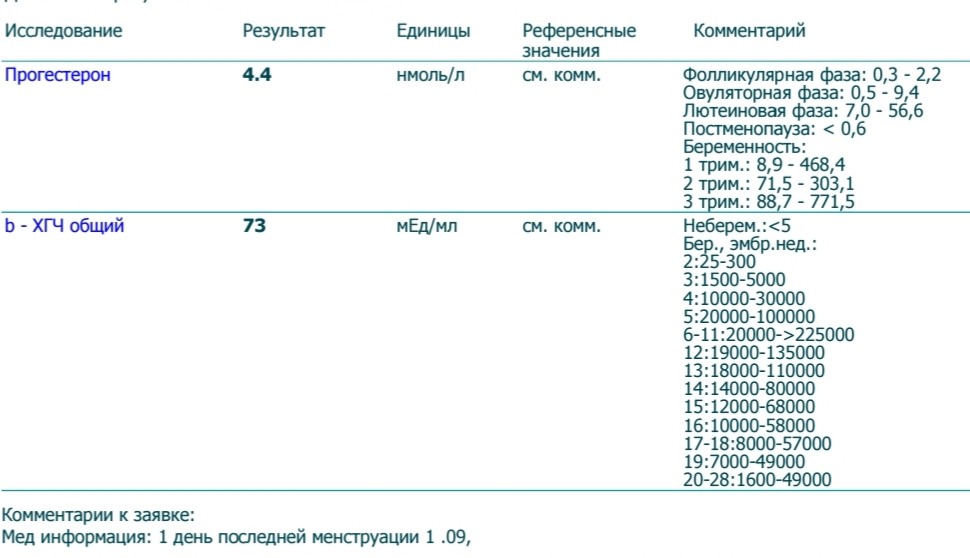 2). Поэтому мы рассчитали медианы и средние геометрические концентрации ХГЧ в каждой категории возраста матери.
2). Поэтому мы рассчитали медианы и средние геометрические концентрации ХГЧ в каждой категории возраста матери.
Распределение концентраций хорионического гонадотропина человека (ХГЧ) на 12-й день после переноса эмбриона / 16-й день после индукции овуляции у 4472 беременных после оплодотворения in vitro.
Тенденции средних геометрических концентраций ХГЧ в возрастных группах матери были протестированы с помощью взвешенного линейного регрессионного анализа. Концентрации ХГЧ были преобразованы в логарифмическом масштабе, и связь возраста матери как непрерывной переменной (лет) с концентрациями ХГЧ (преобразованная в логарифмическую шкалу) изучалась путем применения одномерного и многовариантного анализа линейной регрессии. В многопараметрическом анализе мы внесли поправки на факторы, которые были связаны как с концентрацией ХГЧ, так и с возрастом матери.
Программное обеспечение Predictive Analytics (PASW, ранее Статистический пакет для социальных наук, SPSS Inc.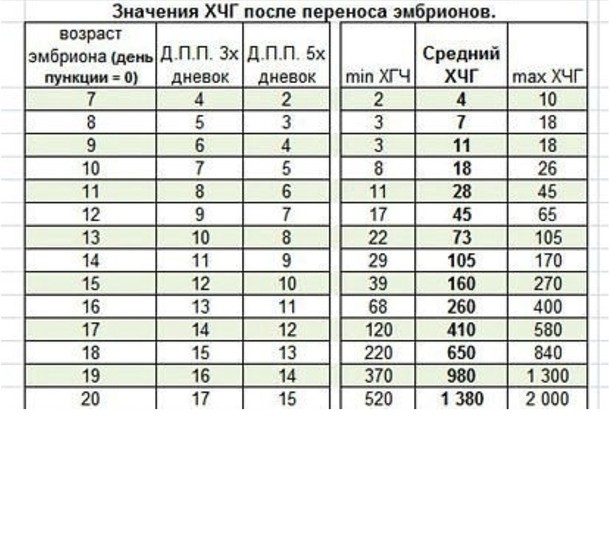 , Чикаго, Иллинойс, США) версии 21 использовалось для статистического анализа. Сотрудник по защите данных Университетской больницы Осло, Rikshospitalet, одобрил использование клинических данных для этого исследования (лицензия № 08/3438).
, Чикаго, Иллинойс, США) версии 21 использовалось для статистического анализа. Сотрудник по защите данных Университетской больницы Осло, Rikshospitalet, одобрил использование клинических данных для этого исследования (лицензия № 08/3438).
Результаты
Средний возраст матери по исследуемой выборке в целом составил 33,2 года. Средняя сывороточная концентрация ХГЧ составляла 118 МЕ / л (межквартильный диапазон 98 МЕ / л), а средняя геометрическая концентрация составляла 114 МЕ / л [95% доверительный интервал (ДИ) 112–116 МЕ / л] (Таблица 1).
Таблица 1. Возраст матери (в годах) в соответствии с медианным и средним геометрическим значением концентрации хорионического гонадотропина человека в сыворотке крови матери (МЕ / л) на 12-й день после переноса эмбриона / 16-й день после индукции овуляции у 4472 беременностей после экстракорпорального оплодотворения.| Материнский возраст | n | Медиана | IQR | Среднее геометрическое | 95% ДИ |
|---|---|---|---|---|---|
| ≤25 | 129 | 124 | 98 | 121 | 108–137 |
| 26–27 | 248 | 113 | 100 | 117 | 109–126 |
| 28–29 | 497 | 126 | 91 | 121 | 115–127 |
| 30–31 | 777 | 116 | 95 | 112 | 107–117 |
| 32–33 | 875 | 121 | 105 | 117 | 112–122 |
| 34–35 | 869 | 116 | 95 | 110 | 106–115 |
| 36–37 | 638 | 112 | 97 | 111 | 106–117 |
| 38–39 | 363 | 117 | 93 | 110 | 103–119 |
| ≥40 | 76 | 121 | 132 | 111 | 94–131 |
| Итого | 4472 | 118 | 98 | 114 | 112–116 |
- IQR, межквартильный размах; ДИ, доверительный интервал.

Медиана концентрации ХГЧ составила 121 МЕ / л (межквартильный диапазон 132 МЕ / л) среди женщин ≥40 лет и 124 МЕ / л (межквартильный диапазон 98 МЕ / л) у женщин в возрасте 25 лет и младше (Таблица 1) . Соответствующие цифры для средних геометрических концентраций составили 111 МЕ / л (95% ДИ 94–131 МЕ / л) среди самых старых женщин и 121 МЕ / л (95% ДИ 108–137 МЕ / л) у женщин в возрасте до 25 лет. . Наблюдалась значимая отрицательная тенденция средних геометрических концентраций ХГЧ с увеличением возраста матери ( p = 0.024, тест на наличие тренда с помощью взвешенной линейной регрессии) (рисунок 3). В дополнительных анализах мы также изучали женщин, перенесших только один эмбрион. В этой подвыборке также была обнаружена тенденция к снижению концентрации ХГЧ с увеличением возраста матери. Однако статистическая значимость не могла быть достигнута из-за отсутствия статистической мощности ( p = 0,074, тест на тенденцию с помощью взвешенной линейной регрессии) (данные не показаны).
Возраст матери (в группах) в соответствии со средними геометрическими концентрациями хорионического гонадотропина человека (ХГЧ) на 12-й день после переноса эмбриона / 16-й день после индукции овуляции у 4472 беременностей после экстракорпорального оплодотворения.
Средний возраст матери различается в зависимости от метода ЭКО, количества перенесенных эмбрионов и года (периода) переноса эмбрионов (Таблица 2). Средний индекс массы тела матери не отличался по возрастным группам матери ( p = 0,257, ANOVA).
Таблица 2. Средний возраст матери (в годах) в категориях вмешивающихся факторов среди 4472 беременностей после экстракорпорального оплодотворения.| Смешивающие факторы | n | Средний возраст матери | p -значение |
|---|---|---|---|
| ЭКО без ИКСИ | 2402 | 33. 29 29 | 0,052a |
| ЭКО с ИКСИ | 1711 | 33,04 | |
| Перенос замороженных / размороженных эмбрионов | 359 | 33,40 | |
| Перенесен один эмбрион | 1473 | 32.70 | <0,001b |
| Перенесено двух эмбрионов | 2999 | 33,45 | |
| 1996–2001 | 1166 | 32,63 | <0. 001a 001a |
| 2002–2007 | 1519 | 33,23 | |
| 2008–2013 | 1787 | 33,55 |
- ИКСИ, внутрицитоплазматическая инъекция сперматозоидов; ЭКО, экстракорпоральное оплодотворение.
При линейном регрессионном анализе, используя возраст матери в качестве непрерывной переменной (годы), мы оценили грубую отрицательную связь возраста матери с логарифмически преобразованными концентрациями ХГЧ: коэффициент регрессии -0,006, стандартная ошибка (SE) 0,003, p = 0,015.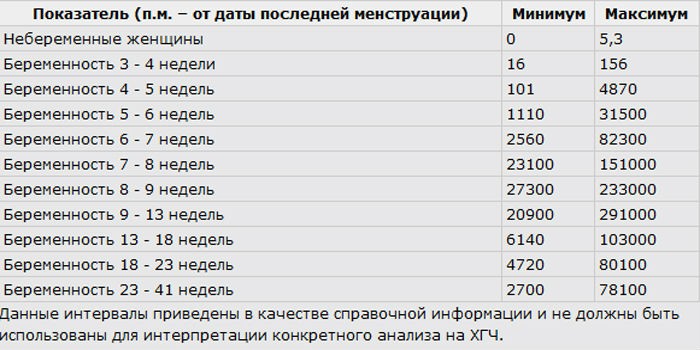 После корректировки количества перенесенных эмбрионов, метода ЭКО и года (периода) переноса эмбрионов коэффициент регрессии составил -0.011 (SE 0,003, p < 0,001).
После корректировки количества перенесенных эмбрионов, метода ЭКО и года (периода) переноса эмбрионов коэффициент регрессии составил -0.011 (SE 0,003, p < 0,001).
Обсуждение
В этом исследовании 4472 беременностей, зачатых с помощью ЭКО, сывороточные концентрации ХГЧ на очень ранних сроках беременности снижались с возрастом матери.
У нашего исследования есть некоторые ограничения. Во-первых, концентрации ХГЧ при беременностях, зачатых с помощью ЭКО, могут отличаться от спонтанно зачатых беременностей 15, 16. Однако у нас мало оснований полагать, что снижение концентрации ХГЧ с возрастом матери не действует за пределами беременностей с ЭКО.Экзогенно введенный ХГЧ, введенный для индукции овуляции при ЭКО, не обнаруживается в материнской сыворотке через 16 дней после инъекции, и поэтому это не может повлиять на наши результаты 17, если только клиренс такого ХГЧ не различается у женщин разных возрастных групп. Нам не известны исследования, указывающие на то, что это может быть так.
Нам не известны исследования, указывающие на то, что это может быть так.
Наши результаты также остались значительными после поправки на количество перенесенных эмбрионов, метод ЭКО и год (период) переноса эмбрионов. Однако вмешивающиеся факторы, возможно, еще недостаточно контролировались.Сообщается, что при беременности плодом женского пола концентрации ХГЧ выше, чем при беременности плодом мужского пола 18. Нет известной связи между полом плода и возрастом матери 19 лет, таким образом, отсутствие корректировки пола плода вряд ли смущает. наши результаты. Сообщалось о снижении концентрации ХГЧ с увеличением беременности и деторождения при одноплодной беременности на 15–20 неделях гестации 20. У нас не было информации о предыдущих беременностях в наших данных, поэтому корректировки на эти потенциально мешающие факторы не могли быть выполнены.Однако неизвестно, связаны ли концентрации ХГЧ на очень ранних сроках беременности с беременностью или паритетом.
Хромосомные аномалии чаще встречаются у потомков пожилых женщин, а сывороточные концентрации ХГЧ в первом триместре повышаются при беременностях с синдромом Дауна 21 потомством.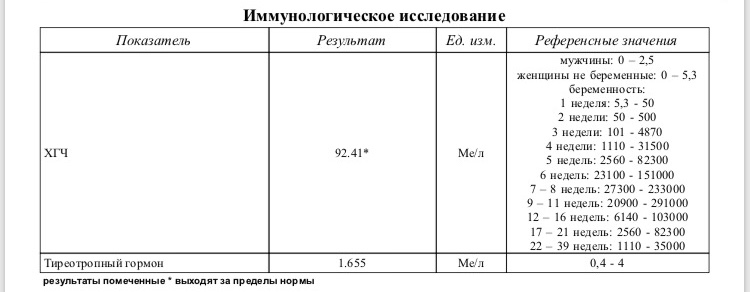 С другой стороны, сывороточные концентрации ХГЧ снижаются при беременностях с трисомией 13 и 18 22 , 23.
С другой стороны, сывороточные концентрации ХГЧ снижаются при беременностях с трисомией 13 и 18 22 , 23.
Низкие концентрации ХГЧ могут быть следствием продолжающегося выкидыша, причем выкидыш чаще встречается у пожилых женщин.Мы включили только женщин, у которых была продолжающаяся беременность через 4 недели после взятия пробы сыворотки. Таким образом, продолжающийся выкидыш или биохимическая беременность не могут объяснить наши выводы о низких концентрациях ХГЧ у пожилых женщин.
Насколько нам известно, исследований связи возраста матери с концентрацией ХГЧ в первом триместре беременности не проводилось. В небольшом исследовании 419 одноплодных беременностей во втором триместре не было выявлено значимой связи между возрастом матери и концентрацией ХГЧ в сыворотке 24.Другое исследование, включавшее 20 009 беременностей во втором триместре, показало более высокие концентрации ХГЧ в сыворотке у женщин моложе 20 лет, но никаких тенденций не было выявлено у женщин старше 25 лет 20 лет.
Причины более низких концентраций ХГЧ в сыворотке крови у женщин старшего возраста неизвестны, и мы можем только предполагать возможные объяснения. При беременности со спонтанным зачатием временной интервал от овуляции до имплантации в эндометрий может значительно варьироваться 25.Однако в нашем исследовании беременностей при ЭКО время овуляции (соответствующее извлечению ооцитов) и переноса эмбриона известно. Таким образом, вариация в интервале от переноса эмбриона до имплантации, вероятно, довольно мала. Одним из объяснений более низких концентраций ХГЧ у пожилых женщин может быть то, что этот интервал увеличивается с возрастом матери. Однако нам не известны какие-либо исследования, посвященные такой ассоциации.
Также вероятно, что качество эмбриона или имплантация эмбриона неоптимальны у пожилых женщин.Таким образом, функция трофобласта или пролиферация клеток трофобласта может быть нарушена или задержана, и, таким образом, синтезируется меньше ХГЧ. Концентрации ХГЧ были связаны с неблагоприятными исходами беременности 8-10. Таким образом, низкие концентрации ХГЧ у пожилых женщин в нашем исследовании могут свидетельствовать о том, что нарушение или задержка развития плаценты на ранних сроках беременности может способствовать более высокому риску неблагоприятного исхода беременности у пожилых женщин.
Концентрации ХГЧ были связаны с неблагоприятными исходами беременности 8-10. Таким образом, низкие концентрации ХГЧ у пожилых женщин в нашем исследовании могут свидетельствовать о том, что нарушение или задержка развития плаценты на ранних сроках беременности может способствовать более высокому риску неблагоприятного исхода беременности у пожилых женщин.
Было высказано предположение, что для успешной беременности у пожилых женщин необходимы значительно более высокие концентрации ХГЧ 9.Известно, что ХГЧ сам по себе обладает ангиогенными свойствами 4-6. ХГЧ также играет роль в модулировании действия адипокинов и других ангиогенных факторов 26 и может активировать другие ангиогенные факторы роста и тем самым способствовать поддержанию беременности 26. Такая гипотеза подтверждается более крупными плацентами, наблюдаемыми у пожилых женщин 27, и рост плаценты во многом зависит от ангиогенеза.
Мы обнаружили, что высокий возраст матери связан с низкой концентрацией ХГЧ в сыворотке крови.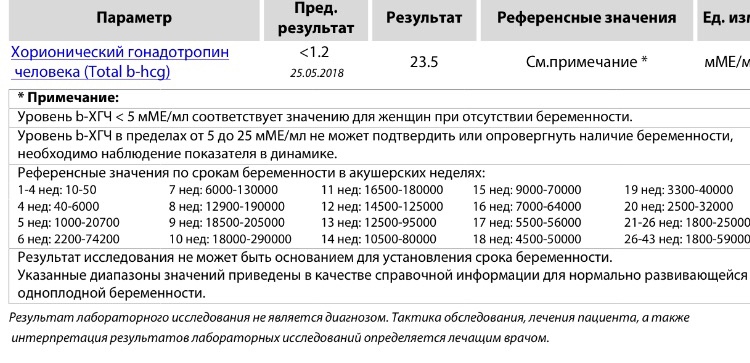 Определение факторов, влияющих на концентрацию ХГЧ, важно для понимания гормональной регуляции на ранних сроках беременности.
Определение факторов, влияющих на концентрацию ХГЧ, важно для понимания гормональной регуляции на ранних сроках беременности.
Финансирование
Мы получили финансирование от Юго-Восточного регионального управления здравоохранения Норвегии для этого исследования.
Список литературы
- 1Hansen JP. Пожилой возраст матери и исход беременности: обзор литературы. Наблюдение за акушерством и гинекологом . 1986; 41: 726–42.
- 2Jacobsson B, Ladfors L, Milsom I. Пожилой возраст матери и неблагоприятный перинатальный исход. Акушерский гинекол . 2004; 104: 727–33.
- 3Huang L, Sauve R, Birkett N, Fergusson D, van Walraven C.
 Материнский возраст и риск мертворождения: систематический обзор. CMAJ .2008; 178: 165–72.
Материнский возраст и риск мертворождения: систематический обзор. CMAJ .2008; 178: 165–72. - 4Zygmunt M, Herr F, Keller-Schoenwetter S, Kunzi-Rapp K, Munstedt K, Rao CV, et al. Характеристика хорионического гонадотропина человека как нового ангиогенного фактора. Дж Клин Эндокринол Метаб . 2002; 87: 5290–6.
- 5Zygmunt M, Herr F, Munstedt K, Lang U, Liang OD. Ангиогенез и васкулогенез при беременности. евро J Obstet Gynecol Reprod Biol . 2003; 110 (Дополнение 1): S10–8.
- 6Tsampalas M, Gridelet V, Berndt S, Foidart JM, Geenen V, Perrier d’Hauterive S. Хорионический гонадотропин человека: гормон с иммунологическими и ангиогенными свойствами.
 Дж Репрод Иммунол . 2010; 85: 93–8.
Дж Репрод Иммунол . 2010; 85: 93–8. - 7Eskild A, Fedorcsak P, Morkrid L, Tanbo TG.Индекс массы тела матери и сывороточные концентрации хорионического гонадотропина человека на очень ранних сроках беременности. Фертил Стерил . 2012; 98: 905–10.
- 8Bjercke S, Tanbo T, Dale PO, Morkrid L, Abyholm T. Концентрации хорионического гонадотропина человека на ранних сроках беременности после экстракорпорального оплодотворения. Репродукция Человека . 1999; 14: 1642–6.
- 9Homan G, Brown S, Moran J, Homan S, Kerin J.Хорионический гонадотропин человека как прогностический фактор при беременности с использованием вспомогательных репродуктивных технологий.
 Фертил Стерил . 2000; 73: 270–4.
Фертил Стерил . 2000; 73: 270–4. - 10Åsvold BO, Eskild A, Vatten LJ. Хорионический гонадотропин человека, ангиогенные факторы и риск преэклампсии: вложенное исследование случай-контроль. Acta Obstet Gynecol Scand . 2014; 2014: 454–62.
- 11Opoien HK, Fedorcsak P, Omland AK, Abyholm T., Bjercke S, Ertzeid G, et al.Экстракорпоральное оплодотворение — успешное лечение бесплодия, связанного с эндометриозом. Фертил Стерил . 2012; 97: 912–8.
- 12Ertzeid G, Tanbo T., Dale PO, Storeng R, Morkrid L, Abyholm T. Уровни хорионического гонадотропина человека при успешной имплантации после методов вспомогательной репродукции.
 Гинекол Эндокринол . 2000; 14: 258–63.
Гинекол Эндокринол . 2000; 14: 258–63. - 13Хуи П.В., Тан М.Х., Лам Й.Х., Нг Э.Х., Йунг В.С., Хо ПК.Уровни ХГЧ и альфа-фетопротеина в сыворотке крови у беременных, зачатых после ЭКО или ИКСИ свежими и замороженными-размороженными эмбрионами. Репродукция Человека . 2003; 18: 572–5.
- 14Рэти Р., Виртанен А., Коскинен П., Анттила Л., Форсстрём Дж., Лайтинен П. и др. Уровни свободного бета-ХГЧ и альфа-фетопротеина при ЭКО, ИКСИ и беременностях с переносом замороженных эмбрионов при скрининге сыворотки матери на синдром Дауна в середине триместра. Репродукция Человека . 2002; 17: 481–4.
- 15Frishman GN, Canick JA, Hogan JW, Hackett RJ, Kellner LH, Saller DN Jr.
 Тройной скрининг сыворотки при экстракорпоральном оплодотворении и естественных беременностях. Акушерский гинекол . 1997; 90: 98–101.
Тройной скрининг сыворотки при экстракорпоральном оплодотворении и естественных беременностях. Акушерский гинекол . 1997; 90: 98–101. - 16Wald NJ, White N, Morris JK, Huttly WJ, Canick JA. Сывороточные маркеры синдрома Дауна у женщин, перенесших экстракорпоральное оплодотворение: значение для антенатального скрининга. Br J Obstet Gynaecol . 1999; 106: 1304–6.
- 17Damewood MD, Shen W, Zacur HA, Schlaff WD, Rock JA, Wallach EE. Исчезновение экзогенно вводимого хорионического гонадотропина человека. Фертил Стерил . 1989; 52: 398–400.
- 18Ярон Y, Lehavi O, Orr-Urtreger A, Gull I, Lessing JB, Amit A, et al. Уровень ХГЧ в сыворотке крови матери выше при наличии плода женского пола уже на 3 неделе после оплодотворения.
 Репродукция Человека . 2002; 17: 485–9.
Репродукция Человека . 2002; 17: 485–9. - 19Ренесс Дж, Ваттен Л., Эскилд А. Соотношение полов человека: влияние возраста матери. Репродукция Человека . 2012; 27: 283–7.
- 20Mooney RA, Arvan DA, Saller DN Jr, French CA, Peterson CJ. Снижение уровня ХГЧ в сыворотке крови матери при увеличении беременности и деторождения. Акушерский гинекол .1995; 86: 900–5.
- 21Krantz DA, Larsen JW, Buchanan PD, Macri JN. Скрининг на синдром Дауна в первом триместре: свободный бета-хорионический гонадотропин человека и связанный с беременностью белок плазмы A. Am J Obstet Gynecol . 1996; 174: 612–6.
- 22Tul N, Spencer K, Noble P, Chan C, Nicolaides K.
 Скрининг на трисомию 18 по затылочной прозрачности плода и сыворотке матери без бета-ХГЧ и PAPP-A на 10–14 неделе беременности. Пренат Диагностика . 1999; 19: 1035–42.
Скрининг на трисомию 18 по затылочной прозрачности плода и сыворотке матери без бета-ХГЧ и PAPP-A на 10–14 неделе беременности. Пренат Диагностика . 1999; 19: 1035–42. - 23Spencer K, Ong C, Skentou H, Liao AW, Nicolaides KH. Скрининг на наличие трисомии 13 по прозрачности затылочной кости плода и отсутствию бета-ХГЧ и PAPP-A в сыворотке крови матери на 10–14 неделях гестации. Пренат Диагностика . 2000; 20: 411–6.
- 24Hsu JJ, Hsieh TT, Soong YK. Влияние возраста и веса матери на уровень альфа-фетопротеина в сыворотке крови во втором триместре, общий и свободный бета-уровни хорионического гонадотропина человека. Чангенг И Сюэ За Чжи . 1997; 20: 181–6.
- 25Wilcox AJ, Baird DD, Weinberg CR.
 Время имплантации зачатка и потери беременности. N Engl J Med . 1999; 340: 1796–9.
Время имплантации зачатка и потери беременности. N Engl J Med . 1999; 340: 1796–9. - 26Полеч А, Федорчак П., Эскильд А, Танбо Т.Г. Взаимодействие хорионического гонадотропина человека (ХГЧ) с основным фактором роста фибробластов и адипокинами на ангиогенез in vitro. Плацента . 2014; 35: 249–53.
- 27Haavaldsen C, Samuelsen SO, Eskild A. Связь материнского возраста с массой плаценты: популяционное исследование 536 954 беременностей. Br J Obstet Gynaecol . 2011; 118: 1470–6.
маркеров опухоли сыворотки — Американский семейный врач
1. Chan DW,
Беверидж Р.А.,
Мусс Х,
Фриче HA,
Хортобадь Г,
Терио Р,
и другие. Использование радиоиммуноанализа Truquant BR для раннего выявления рецидива рака груди у пациентов со стадией II и стадии III. Дж. Клин Онкол .
1997; 15: 2322–8 ….
Использование радиоиммуноанализа Truquant BR для раннего выявления рецидива рака груди у пациентов со стадией II и стадии III. Дж. Клин Онкол .
1997; 15: 2322–8 ….
2. Гион М., Миона Р, Леон А.Е., Диттади Р. Сравнение диагностической точности CA27.29 и CA15.3 при первичном раке молочной железы. Clin Chem . 1999; 45: 630–7.
3. Флетчер Р.Х. Карциноэмбриональный антиген. Энн Интерн Мед.1996. 104: 66–73.
4. Клинические рекомендации по применению онкомаркеров при раке молочной железы и колоректальном раке. Принято 17 мая 1996 г. Американским обществом клинической онкологии. Дж. Клин Онкол . 1996; 14: 2843–77.
5. Стейнберг В. Клиническая применимость антигена, ассоциированного с опухолью CA 19-9. Ам Дж. Гастроэнтерол . 1990; 85: 350–5.
6. Johnson PJ.
Роль сывороточного альфа-фетопротеина в диагностике и лечении гепатоцеллюлярной карциномы. Клин Печень Дис .
2001; 5: 145–59.
Клин Печень Дис .
2001; 5: 145–59.
7. Фаулер Дж. Э. Младший, Платов Г.Е., Куброк CA, Stutzman RE. Коммерческий радиоиммуноанализ на бета-субъединицу хорионического гонадотропина человека: ложноположительные определения из-за повышенного уровня лютеинизирующего гормона в сыворотке. Рак . 1982; 49: 136–9.
8. Босл Дж. Дж., Баджорин Д. Ф., Шейнфельд Дж., Моцер Р. Дж., Чаганти Р. С.. Рак яичка. В: ДеВита В.Т., Хеллман С., Розенберг С.А. и др., Ред. Рак, принципы и практика онкологии.6-е изд. Филадельфия: Липпинкотт, Уильямс и Уилкинс, 2001: 1491–518.
9. Туксен МК, Soletormos G, Домберновский П. Онкомаркеры в ведении пациентов с раком яичников. Лечение рака Ред. . 1995; 21: 215–45.
10. Gallup DG, Талледо Э. Лечение придаточного образования в 1990-е гг. Саут Мед Дж. . 1997; 90: 972–81.
11. Chen DX,
Шварц PE,
Ли XG,
Ян З. Оценка уровней CA 125 для дифференциации злокачественных и доброкачественных опухолей у пациентов с новообразованиями в тазу. Акушерский гинекол .
1988; 72: 23–7.
Оценка уровней CA 125 для дифференциации злокачественных и доброкачественных опухолей у пациентов с новообразованиями в тазу. Акушерский гинекол .
1988; 72: 23–7.
12. Политика передового опыта в отношении простатоспецифического антигена (ПСА). Американская урологическая ассоциация (AUA). Онкология [Хантингт] . 2000; 14: 267–72 277–8 280 пасс.
13. Четген МБ, Oesterling JE. Влияние простатита, задержки мочи, эякуляции и передвижения на концентрацию специфического антигена простаты в сыворотке крови. Урол Клин Норт Ам . 1997; 24: 283–91.
14. Catalona WJ,
Ричи JP,
Ахманн ФР,
Хадсон Массачусетс,
Скардино ПФ,
Флэниган RC,
и другие.
Сравнение пальцевого ректального исследования и сывороточного специфического антигена простаты для раннего выявления рака простаты: результаты многоцентрового клинического исследования с участием 6630 мужчин. Дж Урол .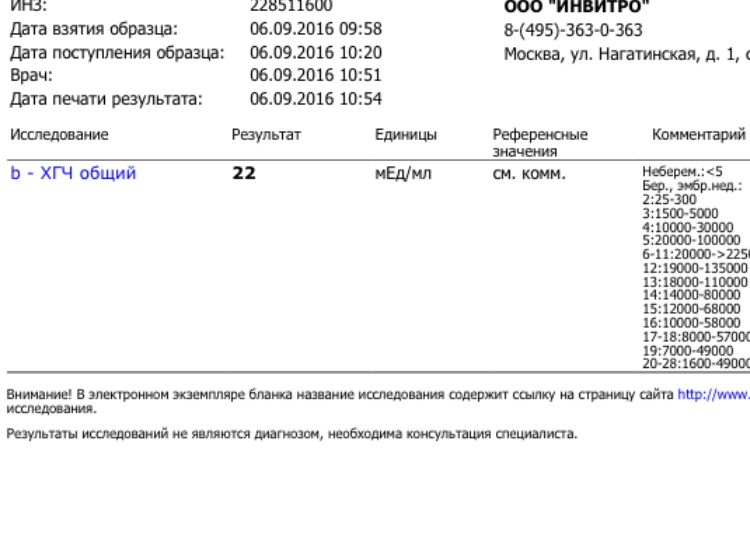 1994; 151: 1283–90.
1994; 151: 1283–90.
15. Баллеста А.М., Молина Р, Филелла Х, Джо Дж, Хименес Н.Карциноэмбриональный антиген в стадировании и последующем наблюдении за пациентами с солидными опухолями. Биол опухолей . 1995; 16: 32–41.
16. Баст Р.С. Младший, Равдин П., Хейс Д.Ф., Бейтс С, Fritsche H Jr, Джессап Дж. М., и другие. Обновление 2000 г. рекомендаций по использованию онкомаркеров при раке молочной железы и колоректального рака: руководящие принципы клинической практики Американского общества клинической онкологии. Дж. Клин Онкол . 2001; 19: 1865–78.
17. Bruinvels DJ, Стиггельбаут А.М., Киевит Дж, ван Хаувелинген ХК, Хаббема Дж. Д., ван де Вельде CJ. Наблюдение за больными колоректальным раком. Метаанализ. Энн Сург . 1994; 219: 174–82.
18. Ким Х.Дж.,
Ким MH,
Мён SJ,
Лим БК,
Парк ET,
Ю К. С.,
и другие.
Новая стратегия применения CA19-9 для дифференциации рака поджелудочной железы: анализ с использованием кривой рабочих характеристик приемника. Ам Дж. Гастроэнтерол .
1999; 94: 1941–6.
С.,
и другие.
Новая стратегия применения CA19-9 для дифференциации рака поджелудочной железы: анализ с использованием кривой рабочих характеристик приемника. Ам Дж. Гастроэнтерол .
1999; 94: 1941–6.
19. Тан З.Ы., Yu YQ, Чжоу XD, Ян БХ, Ма ZC, Лин З.Ы. Субклиническая гепатоцеллюлярная карцинома: анализ 391 пациента. J Surg Oncol Suppl . 1993; 3: 55–8.
20. Юэн М.Ф., Ченг СС, Лаудер И.Дж., Лам СК, Ooi CG, Lai CL. Раннее обнаружение гепатоцеллюлярной карциномы увеличивает шансы на излечение: опыт Гонконга. Гепатология . 2000; 31: 330–5.
21. Международная консенсусная классификация зародышевых клеток: основанная на прогностических факторах система определения стадии метастатического рака зародышевых клеток. Международная совместная группа по раку зародышевых клеток. Дж. Клин Онкол .
1997; 15: 594–603.
22. Мазумдар М, Баджорин Д.Ф., Бачик Дж., Хиггинс Дж., Motzer RJ, Bosl GJ. Прогнозирование результатов химиотерапии у пациентов с опухолями половых клеток: значение скорости снижения хорионического гонадотропина и альфа-фетопротеина человека во время терапии. Дж. Клин Онкол . 2001; 19: 2534–41.
23. Einhorn LH. Лечение рака яичек: новая улучшенная модель. Дж. Клин Онкол . 1990; 8: 1777–81.
24. Заболевания и аномалии плаценты. В: Cunningham FG, et al., Eds. Акушерство Уильямса. 21-е изд. Нью-Йорк: Макгроу-Хилл, 2001: 835–47.
25. Джейкобс И.Дж., Коньки SJ, Макдональд Н, Менон У, Розенталь А.Н., Дэвис А.П., и другие.Скрининг на рак яичников: пилотное рандомизированное контролируемое исследование. Ланцет . 1999; 353: 1207–10.
26. Заявление конференции по развитию консенсуса национальных институтов здравоохранения. Рак яичников: обследование, лечение и наблюдение. Гинеколь Онкол .
1994; 553 ч. 2: S4–14.
Рак яичников: обследование, лечение и наблюдение. Гинеколь Онкол .
1994; 553 ч. 2: S4–14.
27. Малкасян Г.Д. мл., Knapp RC, Лавин П.Т., Журавски В.Р. Младший, Подрац KC, Стэнхоуп CR, и другие. Предоперационная оценка уровней СА 125 в сыворотке у пациенток в пременопаузе и постменопаузе с массами малого таза: различение доброкачественных и злокачественных заболеваний. Am J Obstet Gynecol . 1988. 159: 341–6.
28. Bridgewater JA, Нельстроп А.Е., Растин Г.Дж., Гор МЕНЯ, Макгуайр В.П., Хоскинс WJ. Сравнение стандартных критериев ответа и критерия ответа CA-125 у пациентов с эпителиальным раком яичников, получавших платину или паклитаксел. Дж. Клин Онкол . 1999; 17: 501–8.
29. Crawford ED,
Шютц MJ,
Клежан С,
Драго Дж,
Резник М.И.,
Чодак Г.В.,
и другие. Влияние пальцевого ректального исследования на уровни простатоспецифического антигена. ЯМА .
1992; 267: 2227–8.
Влияние пальцевого ректального исследования на уровни простатоспецифического антигена. ЯМА .
1992; 267: 2227–8.
30. Угадай HA, Гормли Г.Дж., Стоунер Э, Oesterling JE. Влияние финастерида на простатоспецифический антиген: обзор имеющихся данных. Дж Урол . 1996; 155: 3–9.
31. Картер HB, Пирсон Дж. Д., Меттер Э.Дж., Брант LJ, Чан DW, Андрес Р, и другие. Продольная оценка уровней простат-специфического антигена у мужчин с заболеванием простаты и без него. ЯМА . 1992; 267: 2215–20.
32. Catalona WJ,
Партин А.В.,
Славин К.М.,
Бравер МК,
Флэниган RC,
Патель А,
и другие.
Использование процентного содержания свободного простатоспецифического антигена для улучшения дифференциации рака простаты от доброкачественного заболевания предстательной железы: проспективное многоцентровое клиническое испытание. ЯМА .
1998. 279: 1542–7.
ЯМА .
1998. 279: 1542–7.
33. Партин А.В., Каттан МВт, Субонг EN, Уолш ПК, Войно К.Дж., Эстерлинг Дж. Э., и другие.Комбинация простатоспецифического антигена, клинической стадии и шкалы Глисона для прогнозирования патологической стадии локализованного рака простаты. Мультиинституциональное обновление. ЯМА . 1997; 277: 1445–51.
34. Catalona WJ, Смит Д.С., Рэтлифф Т.Л., Basler JW. Выявление рака предстательной железы, ограниченного органом, повышается благодаря скринингу на основе простатспецифического антигена. ЯМА . 1993; 270: 948–54.
35. Харрис Р., Lohr KN.Скрининг на рак простаты: обновленные данные для Целевой группы США по профилактическим услугам. Энн Интерн Мед. 2002; 137: 917–29.
36. Albertsen PC.
Роль скрининга ПСА в раннем выявлении рака простаты. Обновления PPO .
2001; 15: 1–16.
37. Burack RC, Вуд DP младший Скрининг на рак простаты. Задача содействия принятию обоснованных решений при отсутствии окончательных доказательств эффективности. Мед Клин Норт Ам . 1999; 83: 1423–42, vi.
38. Эстерлинг Дж. Э., Мартин СК, Бергстраль Э.Дж., Лоу ФК. Использование простатоспецифического антигена для определения стадии у пациентов с впервые диагностированным раком простаты. ЯМА . 1993; 269: 57–60.
39. Милликен Р, Логотетис С. Обновление рекомендаций NCCN по лечению рака простаты. Онкология [Хантингт] . 1997. 11 (11A): 180–93.
40.Фунт CR, Партин А.В., Эйзенбергер М.А., Чан DW, Пирсон Дж. Д., Уолш ПК. Естественный анамнез прогрессирования после повышения уровня ПСА после радикальной простатэктомии. ЯМА . 1999; 281: 1591–7.
41. Greco FA, Hainsworth JD. Рак неизвестной первичной локализации. В: DeVita VT Jr, Hellman S, Rosenberg SA, et al., Eds. Рак, принципы и практика онкологии. 6-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс, 2001: 2537–60.
В: DeVita VT Jr, Hellman S, Rosenberg SA, et al., Eds. Рак, принципы и практика онкологии. 6-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс, 2001: 2537–60.
История болезни: Первый семейный синдром ХГЧ у а…
Введение
Семейный синдром ХГЧ — редкая, но доброкачественная причина повышения уровня ХГЧ в сыворотке / моче. На сегодняшний день в мировой литературе описано менее 20 семей 1–3 . Пациенты поступают с необъяснимым иным образом повышением уровня ХГЧ в сыворотке / моче, и диагноз устанавливается путем исключения других причин повышенного ХГЧ и тестирования членов семьи. Наблюдается аутосомно-доминантный тип наследования, хотя молекулярный механизм не определен.Мы представляем здесь случай семейного синдрома ХГЧ, диагностированного в Гонконге, который, по нашему мнению, является первой семьей, о которой сообщили в Китае.
Описание клинического случая
38-летняя китаянка, ветеринарный хирург, была направлена для исследования стойкого необъяснимого повышения уровня бета-хорионического гонадотропина человека (ХГЧ) в сыворотке крови, впервые выявленного при положительном тесте на беременность в моче для исследования брюшной полости. боль в августе 2020 года. Помимо меноррагии и железодефицитной анемии в анамнезе, у пациентки в прошлом было ничем не примечательное состояние здоровья.Она не принимала никаких лекарств или добавок и никогда не была сексуально активной. Семейный анамнез ничем не примечателен. Анализы крови показали стабильное повышение общего бета-ХГЧ в диапазоне 93–112 МЕ / л по результатам анализа Roche Elecsys HCG + β в течение последующих пяти месяцев. Трансабдоминальное ультразвуковое исследование таза не показало внутриматочного мешка, а также аномалий в матке и яичниках. Гормоны гипофиза, включая сывороточный тиреотропный гормон (ТТГ), лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ) и уровни пролактина были нормальными.Биохимические данные пациента приведены в таблице 1.
боль в августе 2020 года. Помимо меноррагии и железодефицитной анемии в анамнезе, у пациентки в прошлом было ничем не примечательное состояние здоровья.Она не принимала никаких лекарств или добавок и никогда не была сексуально активной. Семейный анамнез ничем не примечателен. Анализы крови показали стабильное повышение общего бета-ХГЧ в диапазоне 93–112 МЕ / л по результатам анализа Roche Elecsys HCG + β в течение последующих пяти месяцев. Трансабдоминальное ультразвуковое исследование таза не показало внутриматочного мешка, а также аномалий в матке и яичниках. Гормоны гипофиза, включая сывороточный тиреотропный гормон (ТТГ), лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ) и уровни пролактина были нормальными.Биохимические данные пациента приведены в таблице 1.
Таблица 1. Краткие биохимические результаты пациента.
 5 мкг / л
5 мкг / лОвуляция 14,0 — 95,6
Лютеин 7,7 — 58,5
Овуляция 4,7 — 21,5
Лютеин 1,7 — 7,7
 8 мкг / л
8 мкг / л Из-за противоречивых клинических и биохимических результатов, аналитическое вмешательство в анализ ХГЧ было заподозрено, и была проведена серия исследований интерференции. выполнено (таблица 2).Исследование серийных разведений проводили с помощью анализа Roche Elecsys HCG + β с разбавителем производителя в разведениях 1: 4 и 1: 9, которые показали линейное восстановление. Удовлетворительное восстановление уровня ХГЧ в сыворотке наблюдалось в анализе Roche после обработки гетерофильной блокирующей пробиркой (Scantibodies Laboratory, Inc.). Исследование осаждения полиэтиленгликоля (ПЭГ) проводили путем смешивания 200 мкл образца пациента с 200 мкл 25% (мас. / Об.) ПЭГ 6000 (Sigma Aldrich). Затем образец инкубировали при комнатной температуре в течение 10 минут и центрифугировали при 9500 × g в течение 10 минут.Уровни ХГЧ определяли с помощью анализа Roche Elecsys HCG + β в супернатанте. Выздоровление было удовлетворительным по сравнению с результатом ХГЧ в необработанном образце сыворотки. Аликвоты сыворотки были отправлены в три местные лаборатории для анализа с использованием различных аналитических платформ (Abbott Architect, Beckman DxI и Siemens Immulite 2000), все подтвердили повышение бета-ХГЧ, но в разной степени, с самым высоким результатом ХГЧ, полученным с помощью Siemens Immulite 2000 ( Таблица 1).
выполнено (таблица 2).Исследование серийных разведений проводили с помощью анализа Roche Elecsys HCG + β с разбавителем производителя в разведениях 1: 4 и 1: 9, которые показали линейное восстановление. Удовлетворительное восстановление уровня ХГЧ в сыворотке наблюдалось в анализе Roche после обработки гетерофильной блокирующей пробиркой (Scantibodies Laboratory, Inc.). Исследование осаждения полиэтиленгликоля (ПЭГ) проводили путем смешивания 200 мкл образца пациента с 200 мкл 25% (мас. / Об.) ПЭГ 6000 (Sigma Aldrich). Затем образец инкубировали при комнатной температуре в течение 10 минут и центрифугировали при 9500 × g в течение 10 минут.Уровни ХГЧ определяли с помощью анализа Roche Elecsys HCG + β в супернатанте. Выздоровление было удовлетворительным по сравнению с результатом ХГЧ в необработанном образце сыворотки. Аликвоты сыворотки были отправлены в три местные лаборатории для анализа с использованием различных аналитических платформ (Abbott Architect, Beckman DxI и Siemens Immulite 2000), все подтвердили повышение бета-ХГЧ, но в разной степени, с самым высоким результатом ХГЧ, полученным с помощью Siemens Immulite 2000 ( Таблица 1). Общий бета-ХГЧ в моче определяли с помощью анализа Roche Elecsys HCG + β и измеряли 168 МЕ / л.
Общий бета-ХГЧ в моче определяли с помощью анализа Roche Elecsys HCG + β и измеряли 168 МЕ / л.
Таблица 2. Результаты интерференционных исследований, проведенных на образце сыворотки пациента.
| Восстановление разведения | ХГЧ в чистом образце: 112 МЕ / л ХГЧ при разведении x5: 106 МЕ / л (Извлечение: 95%) ХГЧ при разведении x10: 103 МЕ / л (Извлечение: 92% ) |
| Гетерофильная блокирующая пробирка | ХГЧ в чистом образце: 112 МЕ / л ХГЧ обработка в пробирке после блокирования: 107 МЕ / л (Извлечение: 96%) |
| Осаждение ПЭГ | ХГЧ в чистом образце: 105 МЕ / л ХГЧ в супернатанте после обработки ПЭГ 1: 1: 100 МЕ / л (выход: 95%) |
Для поиска лежащих в основе опухолей были проверены опухолевые маркеры, включая карциноэмбриональный антиген, раковый антиген 125 и альфа-фетопротеин, но не были повышены. Гипергликозилированный ХГЧ (ХГЧ-Н) не определялся (<0,5 мкг / л) с помощью анализа Nichols Advantage hCG-H (Nichols Institute Diagnostics, Сан-Клементе, Калифорния). Позитронно-эмиссионная томография всего тела, компьютерная томография, магнитно-резонансная томография гипофиза, брюшной полости и таза не выявили. Эзофагогастродуоденоскопия отрицательна.
Гипергликозилированный ХГЧ (ХГЧ-Н) не определялся (<0,5 мкг / л) с помощью анализа Nichols Advantage hCG-H (Nichols Institute Diagnostics, Сан-Клементе, Калифорния). Позитронно-эмиссионная томография всего тела, компьютерная томография, магнитно-резонансная томография гипофиза, брюшной полости и таза не выявили. Эзофагогастродуоденоскопия отрицательна.
Поскольку биохимические и радиологические исследования не могли объяснить стойкое повышение уровня ХГЧ, у этого бессимптомного пациента был рассмотрен семейный синдром ХГЧ.Тест на ХГЧ в крови был проведен у одного брата или сестры, который также никогда не был сексуально активен, и его уровень был повышен (37 МЕ / л). Других членов семьи для тестирования не было. Таким образом, был установлен диагноз семейного синдрома ХГЧ. Насколько нам известно, это первый случай семейного синдрома ХГЧ, зарегистрированный на китайском языке.
Обсуждение
Хорионический гонадотропин человека — это гетеродимерный гликопротеиновый гормон, продуцируемый синцитиотрофобластом плаценты во время беременности 4 . Он состоит из общей альфа-субъединицы, общей для ЛГ, ФСГ и ТТГ, и уникальной бета-субъединицы, которая, как было показано, кодируется по крайней мере семью генами 4,5 . В кровообращении ХГЧ существует в различных формах, возникающих в результате посттрансляционного гликозилирования и его деградации в печени и почках 4 . Помимо беременности, повышенные уровни могут наблюдаться при гестационных трофобластических заболеваниях и ряде опухолей, включая опухоли зародышевых клеток, немелкоклеточный рак легкого 6 , а также плоскоклеточный рак области головы и шеи 7,8 , в котором другие формы ХГЧ, такие как свободная бета-субъединица или гипергликозилированная форма, могут преобладать 4 .У женщин в постменопаузе или пациентов с гонадной недостаточностью сульфатированный ХГЧ, секретируемый гипофизом, является частой причиной умеренно повышенного ХГЧ. Иногда повышенный уровень ХГЧ может возникать в результате экзогенного применения у спортсменов, принимающих допинг, или в качестве пищевой добавки.
Он состоит из общей альфа-субъединицы, общей для ЛГ, ФСГ и ТТГ, и уникальной бета-субъединицы, которая, как было показано, кодируется по крайней мере семью генами 4,5 . В кровообращении ХГЧ существует в различных формах, возникающих в результате посттрансляционного гликозилирования и его деградации в печени и почках 4 . Помимо беременности, повышенные уровни могут наблюдаться при гестационных трофобластических заболеваниях и ряде опухолей, включая опухоли зародышевых клеток, немелкоклеточный рак легкого 6 , а также плоскоклеточный рак области головы и шеи 7,8 , в котором другие формы ХГЧ, такие как свободная бета-субъединица или гипергликозилированная форма, могут преобладать 4 .У женщин в постменопаузе или пациентов с гонадной недостаточностью сульфатированный ХГЧ, секретируемый гипофизом, является частой причиной умеренно повышенного ХГЧ. Иногда повышенный уровень ХГЧ может возникать в результате экзогенного применения у спортсменов, принимающих допинг, или в качестве пищевой добавки. У пациента, у которого наблюдается необъяснимое повышение уровня ХГЧ, противоречащее клиническим данным, аналитические помехи, такие как интерференция гетерофильных антител, являются важными причинами, которые следует исключить. По данным справочной службы США по ХГЧ, среди 424 случаев положительного ХГЧ без истории гестационной трофобластической болезни или злокачественных новообразований и исключенной беременности, наиболее частыми причинами были трофобластная болезнь в состоянии покоя (32%), аналитическое вмешательство (25%) и гипофиз. ХГЧ (23%), затем другие злокачественные новообразования (15%) и экзогенное потребление (1%) 1 .
У пациента, у которого наблюдается необъяснимое повышение уровня ХГЧ, противоречащее клиническим данным, аналитические помехи, такие как интерференция гетерофильных антител, являются важными причинами, которые следует исключить. По данным справочной службы США по ХГЧ, среди 424 случаев положительного ХГЧ без истории гестационной трофобластической болезни или злокачественных новообразований и исключенной беременности, наиболее частыми причинами были трофобластная болезнь в состоянии покоя (32%), аналитическое вмешательство (25%) и гипофиз. ХГЧ (23%), затем другие злокачественные новообразования (15%) и экзогенное потребление (1%) 1 .
Однако вышеуказанные различия были маловероятными для нашего пациента на основании обширных отрицательных биохимических и радиологических исследований. Внутриутробная и внематочная беременность была маловероятной при отрицательных результатах визуализации тазовых органов. Активная гестационная трофобластическая болезнь и скрытые злокачественные новообразования были менее вероятны при отрицательных результатах обширной визуализации всего тела и неопределяемом гипергликозилированном ХГЧ. Нормальный уровень ЛГ и ФСГ исключил наличие ХГЧ гипофиза. Аналитические помехи были менее вероятными, хотя и не полностью исключены нормальным восстановлением при серийном разведении, обработкой пробиркой, блокирующей гетерофильные антитела, и преципитацией PEG.Обнаружение ХГЧ в моче является дополнительным доказательством подлинного увеличения эндогенных уровней ХГЧ. Отрицательные результаты обследования и стойкое повышение уровня ХГЧ привели к подозрению на семейный синдром ХГЧ, что впоследствии было подтверждено тестированием уровня ХГЧ у бессимптомного члена семьи.
Нормальный уровень ЛГ и ФСГ исключил наличие ХГЧ гипофиза. Аналитические помехи были менее вероятными, хотя и не полностью исключены нормальным восстановлением при серийном разведении, обработкой пробиркой, блокирующей гетерофильные антитела, и преципитацией PEG.Обнаружение ХГЧ в моче является дополнительным доказательством подлинного увеличения эндогенных уровней ХГЧ. Отрицательные результаты обследования и стойкое повышение уровня ХГЧ привели к подозрению на семейный синдром ХГЧ, что впоследствии было подтверждено тестированием уровня ХГЧ у бессимптомного члена семьи.
Семейный синдром ХГЧ — редкая, но доброкачественная причина повышенного ХГЧ. Уровень ХГЧ в сыворотке из описанных в литературе случаев варьировался от <1,0 - 216 МЕ / л, и уровни показали колебания со временем при серийном тестировании 2 .Профилирование антител, проведенное Коулом, продемонстрировало преобладание свободной β-субъединицы и β-субъединицы без С-концевого пептида у пораженных пациентов 1 .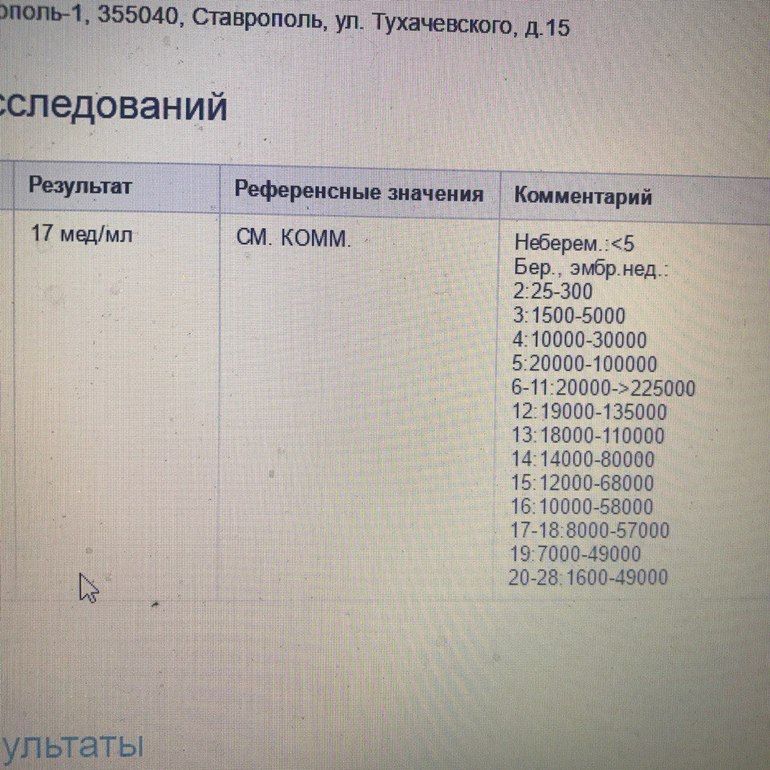 Обе формы биологически неактивны, что объясняет неизменную фертильность у этих пациентов. Присутствие этих необычных вариантов ХГЧ может объяснить разницу в результатах ХГЧ на разных аналитических платформах. Исследования, сравнивающие реактивность доступных международных стандартов и международных эталонных препаратов с сэндвич-иммуноанализами на основных анализаторах, показали существенно разную степень восстановления различных вариантов ХГЧ 9–11 .Например, анализ общего β-ХГЧ Siemens Immulite 2000, который показал эквимолярное обнаружение отсутствующего С-концевого пептида β-субъединицы и расщепленного ХГЧβ, неизменно давал наивысший результат по ХГЧ среди четырех платформ, протестированных у нашего пациента. Несоответствующие результаты различных платформ иммуноанализа могут оказать дополнительную поддержку в диагностике семейного синдрома ХГЧ, поскольку прямые измерения различных подтипов ХГЧ не всегда доступны в рутинной клинической практике. Знание реактивности анализа по отношению к различным вариантам может помочь в интерпретации противоречивых результатов.
Обе формы биологически неактивны, что объясняет неизменную фертильность у этих пациентов. Присутствие этих необычных вариантов ХГЧ может объяснить разницу в результатах ХГЧ на разных аналитических платформах. Исследования, сравнивающие реактивность доступных международных стандартов и международных эталонных препаратов с сэндвич-иммуноанализами на основных анализаторах, показали существенно разную степень восстановления различных вариантов ХГЧ 9–11 .Например, анализ общего β-ХГЧ Siemens Immulite 2000, который показал эквимолярное обнаружение отсутствующего С-концевого пептида β-субъединицы и расщепленного ХГЧβ, неизменно давал наивысший результат по ХГЧ среди четырех платформ, протестированных у нашего пациента. Несоответствующие результаты различных платформ иммуноанализа могут оказать дополнительную поддержку в диагностике семейного синдрома ХГЧ, поскольку прямые измерения различных подтипов ХГЧ не всегда доступны в рутинной клинической практике. Знание реактивности анализа по отношению к различным вариантам может помочь в интерпретации противоречивых результатов.
Отсутствуют надежные маркеры или диагностические тесты, специфичные для семейного синдрома ХГЧ. Диагностика основана на тщательном исключении общих причин и обследовании членов семьи, первое часто включает выполнение ряда дорогостоящих диагностических изображений. Следует отметить, что отсутствие ответа на пробную терапию метотрексатом было предложено в качестве одного из диагностических критериев семейного синдрома ХГЧ у пациенток репродуктивного возраста для исключения внематочной беременности 1 , которая, однако, не лишена риска.Дальнейшие исследования основных молекулярных механизмов и структурной характеристики вариантов могут выявить более эффективные способы установления диагноза и могут позволить выявить одновременное физиологическое или патологическое повышение уровня ХГЧ у диагностированных пациентов.
В заключение сообщаем о первом случае семейного синдрома ХГЧ в китайской семье. Учитывая редкость этого заболевания и отсутствие легко доступных биохимических маркеров, семейный синдром ХГЧ остается диагнозом путем исключения. Знания и осведомленность об этом расстройстве среди клиницистов важны, чтобы избежать чрезмерных исследований и ненужного лечения, а также чтобы успокоить пострадавших пациентов и членов их семей.
Знания и осведомленность об этом расстройстве среди клиницистов важны, чтобы избежать чрезмерных исследований и ненужного лечения, а также чтобы успокоить пострадавших пациентов и членов их семей.
Доступность данных
Все данные, лежащие в основе результатов, доступны как часть статьи, и никаких дополнительных исходных данных не требуется.
Согласие
От пациента было получено письменное информированное согласие на публикацию клинических и лабораторных данных.
Лабораторные исследования, исследования изображений, гистологические результаты
Schorge JO, Goldstein DP, Bernstein MR, Berkowitz RS.Последние достижения в области гестационной трофобластической болезни. J Reprod Med . 2000 Сентябрь 45 (9): 692-700. [Медлайн].
Ито Ю., Маэхара К., Канеки Э. и др. Новая бессмысленная мутация в гене NLRP7, связанная с рецидивирующим пузырным заносом. Гинекол Обстет Инвест . 2015 26 ноября. [Medline].
Гинекол Обстет Инвест . 2015 26 ноября. [Medline].
Вольф Н.Г., Лаге Дж. М.. Генетический анализ гестационной трофобластической болезни: обзор. Семин Онкол . 1995 г., 22 (2): 113-20.[Медлайн].
Slim R, Mehio A. Генетика пузырного заноса: новый свет на древнюю болезнь. Clin Genet . 2007 января 71 (1): 25-34. [Медлайн].
Фишер Р.А., Ходжес Мэриленд. Геномный импринтинг при гестационной трофобластической болезни — обзор. Плацента . 24 апреля 2003 г., приложение A: S111-8. [Медлайн].
Аль-Хуссаини Т.К., Абд эль-Аал Д.М., Ван ден Вейвер И.Б. Рецидивирующая потеря беременности из-за привычной семейной и несемейной молярной беременности. Int J Gynaecol Obstet . 2003 ноябрь 83 (2): 179-86. [Медлайн].
Hodges MD, Rees HC, Seckl MJ, et al. Генетическое уточнение и физическое картирование двуродительского полного локуса пузырного заноса на хромосоме 19q13.4. Дж. Мед Генет . 2003 г., 40 (8): e95. [Медлайн].
Лоулер С.Д., Фишер Р.А., Дент Дж.Проспективное генетическое исследование полных и частичных пузырно-заносных родинок. Am J Obstet Gynecol . 1991 Май. 164 (5, Пет. 1): 1270-7. [Медлайн].
Дево С., Цянь Дж. Х., Чебаро В. и др. Мутации NLRP7 у женщин с диплоидными андрогенетическими и триплоидными родинками: предлагаемый механизм образования родинок. Хум Мол Генет . 2009 г. 1. 18 (5): 888-97. [Медлайн].
Уотсон Э.Дж., Эрнандес Э., Миядзава К. Частичные пузырно-заносные родинки: обзор. Obstet Gynecol Surv . 1987 Сентябрь 42 (9): 540-4. [Медлайн].
Атраш HK, Hogue CJ, Grimes DA. Эпидемиология пузырного заноса на ранних сроках беременности. Am J Obstet Gynecol . 1986 апр. 154 (4): 906-9. [Медлайн].
Граймс Д.А. Эпидемиология гестационной трофобластической болезни. Am J Obstet Gynecol . 1984 октября 1. 150 (3): 309-18. [Медлайн].
Джефферс, доктор медицины, О’Дуайер П., Карран Б., лидер М., Гиллан Дж. Частичный пузырный занавес: частое, но не диагностируемое заболевание. Трехлетний ретроспективный клинико-патологический и проточно-цитометрический анализ ДНК. Int J Gynecol Pathol . 1993, 12 октября (4): 315-23. [Медлайн].
Трехлетний ретроспективный клинико-патологический и проточно-цитометрический анализ ДНК. Int J Gynecol Pathol . 1993, 12 октября (4): 315-23. [Медлайн].
Палмер Младший. Успехи эпидемиологии гестационной трофобластической болезни. J Reprod Med .1994 г., 39 (3): 155-62. [Медлайн].
Melamed A, Gockley AA, Joseph NT, Sun SY, Clapp MA, Goldstein DP, et al. Влияние расы / этнической принадлежности на риск полной или частичной молярной беременности после поправки на возраст. Гинеколь Онкол . 2016 Октябрь 143 (1): 73-76. [Медлайн].
Bandy LC, Clarke-Pearson DL, Hammond CB. Злокачественный потенциал гестационной трофобластической болезни в крайнем возрасте репродуктивной жизни. Акушерский гинекол .1984 Сентябрь 64 (3): 395-9. [Медлайн].
Hurteau JA. Гестационная трофобластическая болезнь: лечение пузырного заноса. Clin Obstet Gynecol . 2003 Сентябрь 46 (3): 557-69. [Медлайн].
Варгас Р., Барройльет Л.М., Эсселен К. и др. Последующие исходы беременности после полной и частичной молярной беременности, повторной молярной беременности и гестационной трофобластической неоплазии: обновленная информация Центра трофобластических болезней Новой Англии. J Reprod Med . 2014 май-июнь. 59 (5-6): 188-94. [Медлайн].
Gadducci A, Cosio S, Fanucchi A, et al. Прогноз пациентов с гестационной трофобластической неоплазией и акушерские исходы у тех, кто зачат после химиотерапии. Anticancer Res . 2016 июл.36 (7): 3477-82. [Медлайн].
Anticancer Res . 2016 июл.36 (7): 3477-82. [Медлайн].
Joneborg U, Eloranta S, Johansson AL, Marions L, Weibull CE, Lambe M. Эхинококковый родинок и последующий исход беременности: популяционное когортное исследование. Am J Obstet Gynecol . 2014 Декабрь 211 (6): 681.e1-7. [Медлайн].
Lurain JR, Brewer JI, Torok EE, Halpern B. Естественная история пузырного заноса после первичной эвакуации. Am J Obstet Gynecol . 1 марта 1983 г. 145 (5): 591-5. [Медлайн].
Гото С., Ямада А., Ишизука Т., Томода Ю. Развитие постмолярной трофобластической болезни после частичной молярной беременности. Гинеколь Онкол . 1993 Февраль 48 (2): 165-70. [Медлайн].
Cheung AN, Khoo US, Lai CY, et al. Метастатическая трофобластическая болезнь после первоначального диагноза частичного пузырного заноса: генотипирование и анализ гибридизации хромосом in situ. Рак . 2004 г., 1. 100 (7): 1411-7. [Медлайн].
Рак . 2004 г., 1. 100 (7): 1411-7. [Медлайн].
Menczer J, Girtler O, Zajdel L, Glezerman M. Метастатическая трофобластическая болезнь после частичного пузырного заноса: отчет о болезни и обзор литературы. Гинеколь Онкол . 1999 Август.74 (2): 304-7. [Медлайн].
Twiggs LB, Morrow CP, Schlaerth JB. Острые легочные осложнения молярной беременности. Am J Obstet Gynecol . 1979, 15 сентября. 135 (2): 189-94. [Медлайн].
Себире, штат Нью-Джерси, Фишер Р.А., Фоскетт М. и др. Риск повторного пузырно-заносного моляра и последующего исхода беременности после полной или частичной пузырно-заносной молярной беременности. BJOG . 2003 января 110 (1): 22-6. [Медлайн].
Mangili G, Garavaglia E, Cavoretto P, Gentile C, Scarfone G, Rabaiotti E.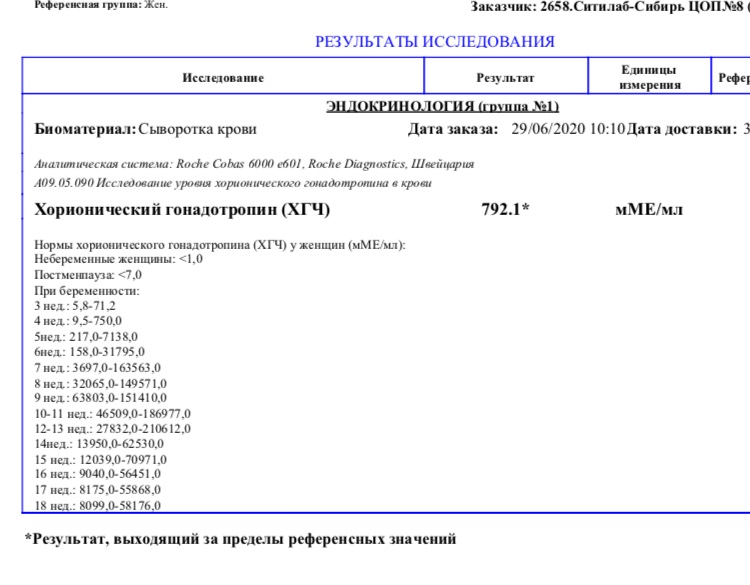 Клиническая картина пузырного заноса в северной Италии: изменилось ли оно за последние 20 лет ?. Am J Obstet Gynecol . 2008 Март 198 (3): 302.e1-4. [Медлайн].
Клиническая картина пузырного заноса в северной Италии: изменилось ли оно за последние 20 лет ?. Am J Obstet Gynecol . 2008 Март 198 (3): 302.e1-4. [Медлайн].
Сото-Райт V, Бернштейн М., Гольдштейн Д.П., Берковиц Р.С. Изменяющаяся клиническая картина полной молярной беременности. Акушерский гинекол . 1995 ноябрь 86 (5): 775-9. [Медлайн].
Sun SY, Melamed A, Goldstein DP, et al. Изменение представления полной пузырно-пузырчатой родинки в Центре трофобластических заболеваний Новой Англии за последние три десятилетия: влияет ли ранняя диагностика на риск гестационной трофобластической неоплазии? Гинеколь Онкол . 2015 июл.138 (1): 46-9. [Медлайн].
Amir SM, Osathanondh R, Berkowitz RS, Goldstein DP. Хорионический гонадотропин человека и функция щитовидной железы у пациентов с пузырным заносом.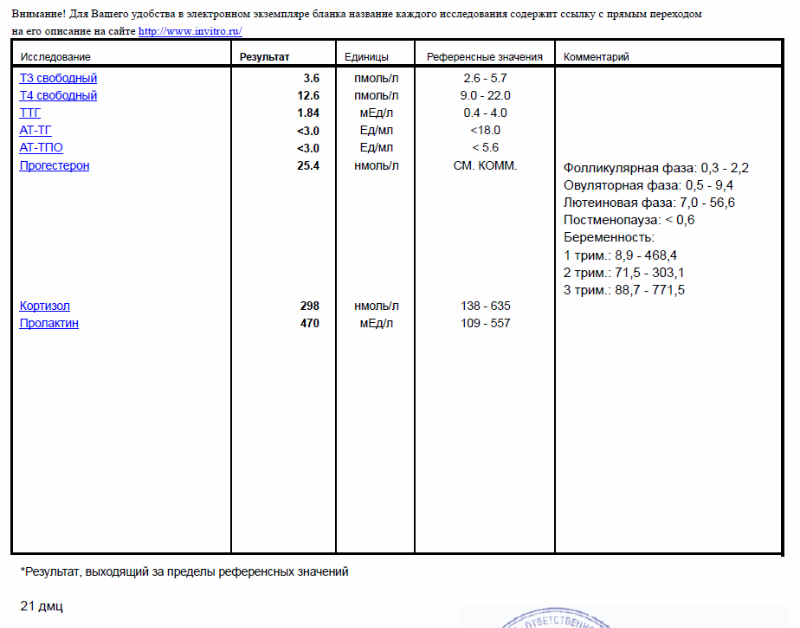 Am J Obstet Gynecol . 1984 15 ноября. 150 (6): 723-8. [Медлайн].
Am J Obstet Gynecol . 1984 15 ноября. 150 (6): 723-8. [Медлайн].
Sun SY, Melamed A, Joseph NT, et al. Клиническая картина полного пузырного заноса и частичного пузырного заноса в региональном центре трофобластической болезни в США за последние 2 десятилетия. Int J Gynecol Cancer . 2015 19 ноября [Medline].
Берковиц Р.С., Гольдштейн Д.П., Бернштейн MR. Естественное течение частичной молярной беременности. Акушерский гинекол . 1985 ноябрь 66 (5): 677-81. [Медлайн].
Фишман Д.А., Падилья Л.А., Кех П., Коэн Л., Фредериксен М., Лурайн-младший. Ведение двойных беременностей, состоящих из полной пузырно-заносной родинки и нормального плода. Акушерский гинекол . 1998 апр. 91 (4): 546-50. [Медлайн].
Стеллер MA, Genest DR, Bernstein MR, Lage JM, Goldstein DP, Berkowitz RS. Естественное течение беременности двойней с полной пузырно-заносной родинкой и сосуществующим плодом. Акушерский гинекол . 1994, январь, 83 (1): 35-42. [Медлайн].
Естественное течение беременности двойней с полной пузырно-заносной родинкой и сосуществующим плодом. Акушерский гинекол . 1994, январь, 83 (1): 35-42. [Медлайн].
Флорио П., Севери Ф.М., Кобеллис Л. и др. Сывороточный активин А и ингибин А. Новые клинические маркеры пузырного заноса. Рак . 2002 15 мая. 94 (10): 2618-22. [Медлайн].
Fulop V, Mok SC, Berkowitz RS.Молекулярная биология гестационной трофобластической неоплазии: обзор. J Reprod Med . 2004 июн. 49 (6): 415-22. [Медлайн].
Fukunaga M. Иммуногистохимическая характеристика экспрессии p57 (KIP2) в ранних пузырно-заносных молях. Хум Патол . 2002 декабрь 33 (12): 1188-92. [Медлайн].
Genest DR, Dorfman DM, Castrillon DH. Плоидность и импринтинг у пузырно-заносных родинок.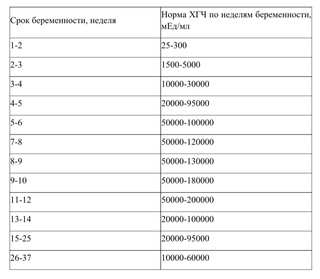 Дополнительное использование проточной цитометрии и иммуногистохимии импринтированного генного продукта p57KIP2 для помощи в классификации моляров. J Reprod Med . 2002 Май. 47 (5): 342-6. [Медлайн].
Дополнительное использование проточной цитометрии и иммуногистохимии импринтированного генного продукта p57KIP2 для помощи в классификации моляров. J Reprod Med . 2002 Май. 47 (5): 342-6. [Медлайн].
Thaker HM, Берлин A, Tycko B и др. Иммуногистохимия продукта импринтированного гена IPL / PHLDA2 для облегчения дифференциальной диагностики полной пузырно-пузырчатой формы. J Reprod Med . 2004 августа 49 (8): 630-6. [Медлайн].
Беначи А., Гарритсен Х.С., Ховард С.М., Беннет П., Фиск Н.М. Отсутствие экспрессии RhD клетками трофобласта человека. Am J Obstet Gynecol .1998 Февраль 178 (2): 294-9. [Медлайн].
Ngan HYS, Seckl MJ, Berkowitz RS, Xiang Y, Golfier F, Sekharan PK и др. Обновленная информация о диагностике и лечении гестационной трофобластической болезни. Int J Gynaecol Obstet .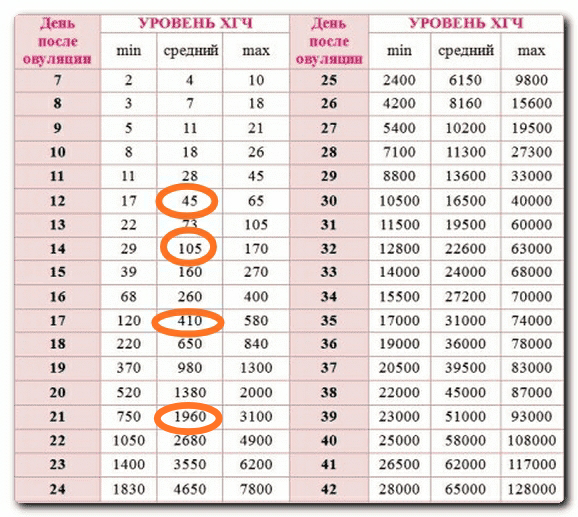 2018 Октябрь 143 Дополнение 2: 79-85. [Медлайн].
2018 Октябрь 143 Дополнение 2: 79-85. [Медлайн].
Эдди Г.Л., Шлэрт Дж. Б., Налик Р. Х., Гаддис О-младший, Накамура Р. М., Морроу С. П.. Постмолярная трофобластическая болезнь у женщин, использующих гормональные контрацептивы с эстрогеном и без него. Акушерский гинекол . 1983 декабрь 62 (6): 736-40. [Медлайн].
Агарвал Р., Теох С., Шорт Д. и др. Химиотерапия и концентрация хорионического гонадотропина человека через 6 месяцев после опорожнения матки при молярной беременности: ретроспективное когортное исследование. Ланцет . 2012 14 января. 379 (9811): 130-5. [Медлайн].
Sebire NJ, Foskett M, Short D, et al. Сокращение продолжительности эпиднадзора за хорионическим гонадотропином человека после полного или частичного пузырного заноса: доказательства для пересмотренного протокола регионального отделения трофобластической болезни Великобритании.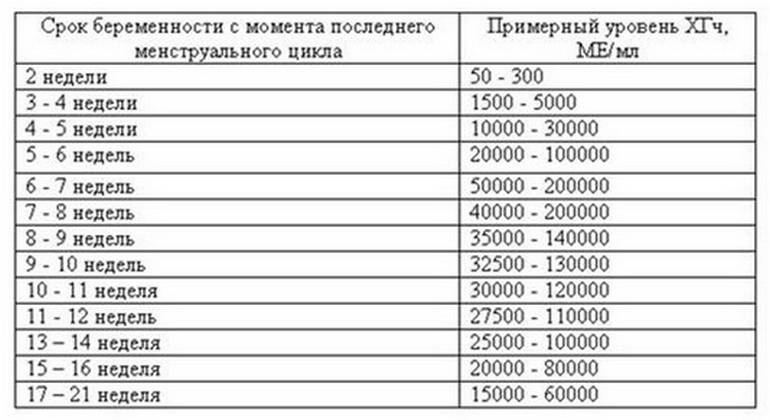 BJOG . 2007 июн. 114 (6): 760-2. [Медлайн].
BJOG . 2007 июн. 114 (6): 760-2. [Медлайн].
Batorfi J, Vegh G, Szepesi J, et al. Как долго следует наблюдать за пациентками после молярной беременности? Анализ данных наблюдения за ХГЧ в сыворотке крови. Eur J Obstet Gynecol Reprod Biol . 2004 15 января. 112 (1): 95-7. [Медлайн].
Feltmate CM, Batorfi J, Fulop V и др. Наблюдение за хорионическим гонадотропином у пациентов с молярной беременностью: время для переоценки. Акушерский гинекол .2003 апр. 101 (4): 732-6. [Медлайн].
Койл С., Шорт Д., Джексон Л., Себайр, штат Нью-Джерси, Каур Б., Харви Р. и др. Какова оптимальная продолжительность наблюдения за хорионическим гонадотропином человека после эвакуации молярной беременности? Ретроспективный анализ более 20 000 последовательных пациентов. Гинеколь Онкол . 2018 Февраль 148 (2): 254-257. [Медлайн].
[Медлайн].
Горовиц Н.С., Берковиц Р.С., Элиас К.М. Рассмотрение изменений в рекомендованном мониторинге хорионического гонадотропина человека после удаления моляров. Акушерский гинекол . 2020 января. 135 (1): 9-11. [Медлайн].
Гарнер Э.И., Липсон Э., Бернштейн М.Р., Гольдштейн Д.П., Берковиц Р.С. Опыт последующей беременности у пациенток с молярной беременностью и гестационной трофобластической опухолью. J Reprod Med . 2002 Май. 47 (5): 380-6. [Медлайн].
Amezcua CA, Bahador A, Naidu YM, Felix JC. Экспрессия обратной транскриптазы теломеразы человека, каталитической субъединицы теломеразы, связана с развитием стойкого заболевания в полных пузырях пузырного заноса. Am J Obstet Gynecol . 2001 июн. 184 (7): 1441-6. [Медлайн].
Ван Кью, Фу Дж, Ху Л, Фанг Ф, Се Л, Чен Х и др. Профилактическая химиотерапия пузырно-пузырчатого пузыря с целью профилактики трофобластической неоплазии беременных. Кокрановская база данных Syst Rev . 2017 11 сентября: CD007289. [Медлайн].
Zhao P, Chen Q, Lu W. Сравнение различных терапевтических стратегий для полного пузырного заноса у женщин в возрасте от 40 лет: ретроспективное когортное исследование. BMC Рак . 2017 9 ноября. 17 (1): 733. [Медлайн].




 Материнский возраст и риск мертворождения: систематический обзор. CMAJ .2008; 178: 165–72.
Материнский возраст и риск мертворождения: систематический обзор. CMAJ .2008; 178: 165–72.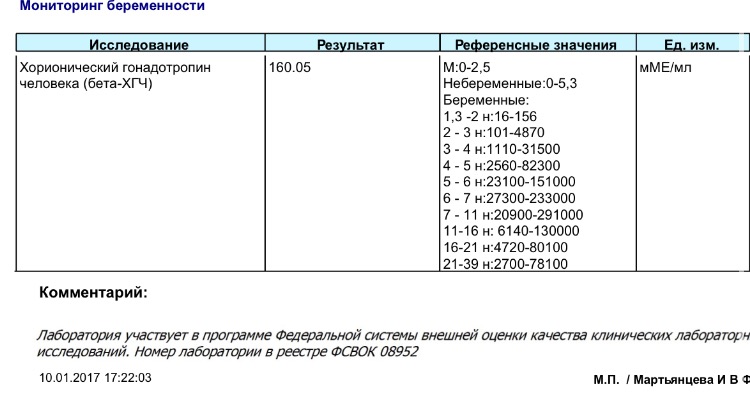 Дж Репрод Иммунол . 2010; 85: 93–8.
Дж Репрод Иммунол . 2010; 85: 93–8.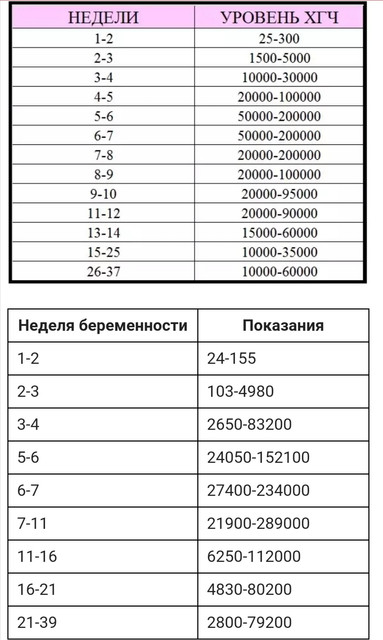 Фертил Стерил . 2000; 73: 270–4.
Фертил Стерил . 2000; 73: 270–4. Гинекол Эндокринол . 2000; 14: 258–63.
Гинекол Эндокринол . 2000; 14: 258–63. Тройной скрининг сыворотки при экстракорпоральном оплодотворении и естественных беременностях. Акушерский гинекол . 1997; 90: 98–101.
Тройной скрининг сыворотки при экстракорпоральном оплодотворении и естественных беременностях. Акушерский гинекол . 1997; 90: 98–101. Репродукция Человека . 2002; 17: 485–9.
Репродукция Человека . 2002; 17: 485–9. Скрининг на трисомию 18 по затылочной прозрачности плода и сыворотке матери без бета-ХГЧ и PAPP-A на 10–14 неделе беременности. Пренат Диагностика . 1999; 19: 1035–42.
Скрининг на трисомию 18 по затылочной прозрачности плода и сыворотке матери без бета-ХГЧ и PAPP-A на 10–14 неделе беременности. Пренат Диагностика . 1999; 19: 1035–42. Время имплантации зачатка и потери беременности. N Engl J Med . 1999; 340: 1796–9.
Время имплантации зачатка и потери беременности. N Engl J Med . 1999; 340: 1796–9.