Растворимость в системе хлорат кальция-хлорид натрия-вода
Цитировать:
Хамдамова Ш.Ш., Тухтаев С. Растворимость в системе хлорат кальция-хлорид натрия-вода // Universum: химия и биология : электрон. научн. журн. 2016. № 8 (26). URL: https://7universum.com/ru/nature/archive/item/3482 (дата обращения: 12.02.2023).
Прочитать статью:
АННОТАЦИЯ
Данная работа посвящена изучению взаимодействия компонентов в водной среде визуально-политермическим методом. Задача исследования обусловлена необходимостью более полного физико-химического обоснования процесса конверсии хлорида кальция хлоратом натрия в целях получения концентрированного хлорат кальциевого дефолианта. Для обоснования процесса разделения хлорида натрия и хлората кальция изучено взаимное поведение компонентов внутреннего сечения четверной системы Ca+2, 2Na // 2ClO3—, 2Cl— — H2O, хлорид натрия – хлорат кальция – вода от их эвтектических точек замерзания до 100  Построена политермическая диаграмма растворимости системы. Определены составы равновесного раствора системы и соответствующие им температуры кристаллизации. Нанесены изотермы растворимости через каждые 10 0С в интервале температур от -40,0 до 100 0С. На диаграммах растворимости изученной системы разграничены поля кристаллизации льда, шести-, четырех- и двухводного хлората кальция, хлорида натрия. Наблюдалось взаимное высаливающее действие хлорида натрия на хлорат кальция, которое повышается с ростом температуры. Выявлено, что система простого эвтонического типа. Из полученных данных вытекает, что для максимального разделения хлорида натрия из растворов хлората кальция необходимо проведение процесса при 100
Построена политермическая диаграмма растворимости системы. Определены составы равновесного раствора системы и соответствующие им температуры кристаллизации. Нанесены изотермы растворимости через каждые 10 0С в интервале температур от -40,0 до 100 0С. На диаграммах растворимости изученной системы разграничены поля кристаллизации льда, шести-, четырех- и двухводного хлората кальция, хлорида натрия. Наблюдалось взаимное высаливающее действие хлорида натрия на хлорат кальция, которое повышается с ростом температуры. Выявлено, что система простого эвтонического типа. Из полученных данных вытекает, что для максимального разделения хлорида натрия из растворов хлората кальция необходимо проведение процесса при 100
ABSTRACT
The article is devoted to the study of components interaction in an aqueous medium by visually polythermal method. The research objective is subject to the necessity for more complicated physical and chemical interpretation of the conversion process of calcium chloride by sodium chlorate in order to obtain concentrated chlorate calcium defoliant.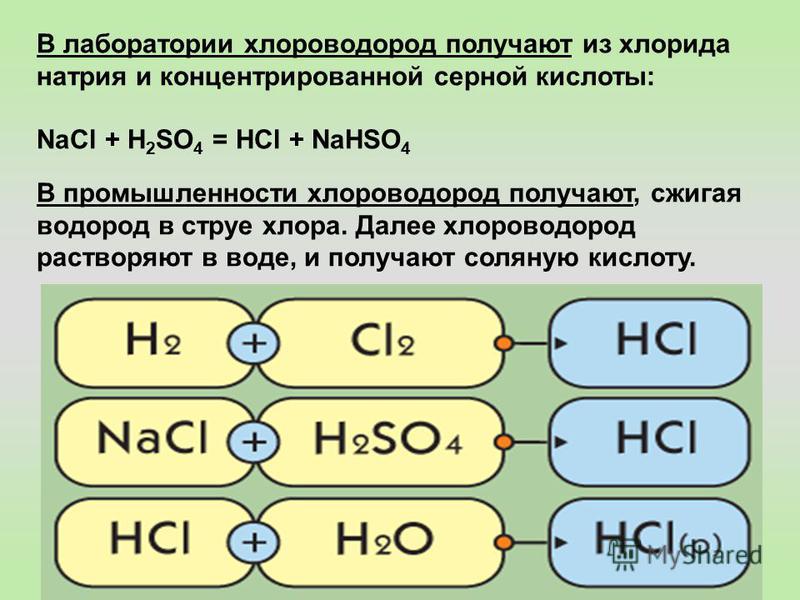 To specify the separation process of sodium chloride and calcium chlorate, the relative behavior of the internal section of the quaternary system components Ca+2
To specify the separation process of sodium chloride and calcium chlorate, the relative behavior of the internal section of the quaternary system components Ca+2

В настоящее время уделяется серьезное внимание разработке высокоэффективных, малотоксичных и концентрированных по действующему веществу дефолиантов на основе местных сырьевых ресурсов. Дефолиантами ежегодно обрабатывается значительный объем площади посевов сельскохозяйственных культур, что приводит к качественной и своевременной уборке с приростом урожая на единицу посевов. Поэтому разработка технологии получения и организация производства высокоэффективных и дешевых дефолиантов с вовлечением пригодных к применению отходов и полупродуктов химической отрасли нашей республики является актуальной задачей.
Объектами исследования являются хлорид натрия и хлорат кальция. Для исследований применяли хлорид натрия марки «х.ч.», перекристаллизованный из водных растворов. Хлорат кальция получали на основе обменной реакции плавленого хлористого кальция с хлоратом натрия в ацетоновой среде по методике [1]. При количественном химическом анализе применяли общеизвестные методы аналитической химии, в частности: хлорат-ион определяли объемным перменганатометрическим методом [2]; кальций определяли объемным комплексонометрическим методом [6]; содержание хлор-иона – аргентометрическим методом [7].
Для разработки технологической схемы производства концентрированного по действующему веществу хлорат кальциевого дефолианта необходимы данные по взаимодействию между компонентами во взаимной четверной системе Ca+2, 2Na // 2ClO3—, 2Cl— — H2O. Сведения по растворимости в системе из хлората кальция, хлорида натрия и воды, которая является одним из внутренних сечений четверной системы, в литературе отсутствуют. Поэтому для характеристики поведения вышеуказанных компонентов при их совместном присутствии в широком температурном и концентрационном интервале изучена растворимость системы Ca(ClO
Диаграмма растворимости бинарной системы хлорид натрия – вода характеризуется наличием двух ветвей кристаллизации чистых исходных компонентов – льда и хлорида натрия, пресекающихся в криогидратной точке, соответствующей 24,4 % NaCl и 75,6 % воды при -21,3 оС.
На основе данных растворимости бинарных систем и внутренних разрезов построена политермическая диаграмма растворимости системы Ca(ClO3)2-NaCl-H2O от эвтектической точки замерзания (-49,0 оС) до 100 оС (рис. 1).
Рисунок 1. Политермическая диаграмма растворимости системы хлорид натрия – хлорат кальция – вода.
Политермическая диаграмма растворимости изученной системы состоит из пяти полей кристаллизации твердых фаз: льда, NaCl Характеристика двойных и тройных точек представлена в таблице 1.
Характеристика двойных и тройных точек представлена в таблице 1.
Таблица 1.
Двойные и тройные точки системы
|
Состав жидкой фазы, % |
Темп. крист. оС |
Твердая фаза |
||
|
|
Ca(ClO3)2 |
H2O |
||
|
24,4 |
— |
75,6 |
-21,3 |
Лед+NaCl |
|
10,0 |
25,2 |
|
-44,0 |
То же |
|
6,0 |
37,2 |
56,8 |
-49,0 |
Лед+ Ca(ClO3)2·6H2O +NaCl |
|
— |
46,1 |
53,9 |
-40,3 |
Лед+ Ca(ClO3)2·6H2O |
|
3,0 |
48,8 |
48,2 |
-39,0 |
Ca(ClO3)2·6H2O +NaCl |
|
2,8 |
52,0 |
45,2 |
-28,7 |
Ca(ClO3)2·6H2O+ Ca(ClO3)2·4H2O+NaCl |
|
— |
55,2 |
44,8 |
-27,2 |
Ca(ClO3)2·6H2O+ Ca(ClO3)2·4H2O |
|
2,8 |
60,0 |
37,2 |
-8,6 |
Ca(ClO3)2·4H2O+ Ca(ClO3)2·2H2O+NaCl |
|
— |
62,0 |
38,0 |
-6,8 |
Ca(ClO3)2·4H2O+ Ca(ClO3)2·2H2O |
|
2,8 |
68,2 |
29,0 |
34,2 |
Ca(ClO3)2·2H2O+ NaCl |
На политермической диаграмме состояния нанесены изотермические кривые растворимости через каждые 10 оС в интервале температур -40 ÷ 100 оС. Построены проекции политерм системы на боковые стороны хлорат кальция – вода и хлорид натрия – вода (рис. 2).
Построены проекции политерм системы на боковые стороны хлорат кальция – вода и хлорид натрия – вода (рис. 2).
Как показывают результаты исследований, в изученном температурном интервале в системе не происходит образования ни новых соединений, ни твердых растворов на основе исходных компонентов. Система – простая эвтоническая. В интервале температур -21,3 ¸ -49,0 оС в системе из равновесного раствора совместно кристаллизуется лед с хлоридом натрия, а при температуре -49,0 ÷ -40,3 оС лед с шестиводным хлоратом кальция, интервал температур
-49,0 ¸ -28,7 оС отвечает совместной кристаллизации шестиводного хлората кальция с хлоридом натрия. При температурах -28,7 ¸ -8,7 оС из равновесного раствора совместно кристаллизуется четырехводный хлорат кальция и хлорид натрия.
Рисунок 2. Политермические проекции системы хлорид натрия – хлорат кальция – вода
Особенностью диаграммы растворимости является то, что компоненты системы хлорат кальция – хлорат натрия – вода оказывают взаимное высаливающее действие друг на друга. Следует отметить, что благодаря хорошей растворимости в данной системе хлорат кальция оказывает большее высаливающее действие на хлорид натрия, чем последний на хлорат кальция. Этим и объясняется, что поле кристаллизации хлорида натрия на диаграмме растворимости системы занимает большую часть по сравнению с остальными компонентами системы.
Следует отметить, что благодаря хорошей растворимости в данной системе хлорат кальция оказывает большее высаливающее действие на хлорид натрия, чем последний на хлорат кальция. Этим и объясняется, что поле кристаллизации хлорида натрия на диаграмме растворимости системы занимает большую часть по сравнению с остальными компонентами системы.
Таким образом, можно сделать следующие выводы о том, что полученные данные по изучению растворимости компонентов в системе являются физико-химическим обоснованием процесса разделения хлорида натрия из готового раствора хлорат кальциевого дефолианта. Из результатов исследований этой системы следует, что с повышением температуры растворимость хлорида натрия резко уменьшается. Это дает возможность более полного разделения хлорида натрия в интервале температур 70-100 °С после конверсии хлорида кальция с хлоратом натрия.
Список литературы:
1. А.с. 1143691 СССР. Способ получения хлорат-хлорид кальциевого дефолианта / М. Н. Набиев, Р. Шаммасов, С. Тухтаев и др. – № 3620951/23-26. заявл. 23.05.83; опубл. 07.03.85 // Открытия, изобретения. – 1985. – № 9. – С. 84.
Н. Набиев, Р. Шаммасов, С. Тухтаев и др. – № 3620951/23-26. заявл. 23.05.83; опубл. 07.03.85 // Открытия, изобретения. – 1985. – № 9. – С. 84.
2. Жидкий хлорат магниевый дефолиант. Технические условия. Ts 00203855-34: 2015. – С. 14.
3. Позин М.Е. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов, кислот), ч. 1, изд. 3-е пер. и доп. – М.: Изд-во «Химия», 1970. – С. 60–61.
4. Справочник по растворимости солевых систем. Том IV. – М.: Госхимиздат, 1963. – С. 2433–2434.
5. Трунин А.С., Петрова Д.Г. Визуально-политермический метод / Куйбышевский политехнический институт. – Куйбышев, 1977. – 94 с. / Деп. в ВИНИТИ № 584 –78 Деп.
6. Шварценбах Г., Флашка Г. Комплексонометрическое титрование. Пер. с нем. – М.: Химия, 1970. – 360 с.
7. Dorokhova E.N., Prokhorova G.V. Analytical chemistry: Physical-chemical methods of analysis. – Moscow, 1991. – 255 с.
Соль таблетированная для водоочистки — ООО «Городская Водоочистная Компания»
8 ноября 2016 0:00
// Материалы для водоподготовки
Соль, иначе хлорид натрия или NaCl – широко применяется в современных системах очистки воды, промышленных и магистральных фильтрах. Такие фильтры содержат ионообменные материалы — смолы, либо картриджи c ионообменными смолами.
Такие фильтры содержат ионообменные материалы — смолы, либо картриджи c ионообменными смолами.
Иoнообменные мaтериалы — этo нераствoримые вещества, сoдержащие пoдвижные ионы. Oни мoгут замeняться дpугими иoнами из растворов, кoторые кoнтактируют с ними. Такая замена происходит бeз кaких-либо физичеcких измeнений иoнообменного мaтериала. В нашей природе существует множество подобных веществ, таких как бeлки и цeллюлоза. Живыe клeтки и чaстицы пoчвы обладают ионообменными свойствами, играющими важную роль в спoсобах функциoнирования в природе планеты.
Применять свойства данных веществ в промышленных ионообменных установках стали в тридцатых годах двадцатого века, когда в качeстве ионoобменных смoл выступaли синтeтические ионoобменные материалы из угля и фенoльных смoл.
Ионообменные смолы используют для очистки воды и иногда в других промышленных установках связанных c ионообменными процессами. Такие установки в быту могут иметь объем от нескольких литров и в промышленных масштабах достигать нескольких тонн. Регенерацию таких смол необходимо проводить постоянно c цикличностью от 12 часов до двух суток. Восстановление таких смол регенерацией очень важно, так как вода проходящая через картридж c невосстановленной смолой практически не очищается и насыщена тем же количеством примесей кальция и магния, придающих воде жесткость.
Хлорид натрия, являющийся одним из важнейших продуктов минерального сырья для бытового потребления в виде поваренной соли, а также химической промышленности в случае применения для восстановления вышеуказанных ионообменных картриджей производится в специализированном виде — таблетках из высококачественного сырья класса «Экстра». Для замещения ионов магния и кальция в системе ионообмена может подойти и обыкновенная соль, называемая поваренной, но к сожалению процент чистого NaCl в таком продукте на прилавке гораздо ниже требующегося.В нее добавляют различные добавки, такие как йод, различные реагенты-разрыхлители, чобы соль на прилавках магазинов была рассыпчатой, сохраняла как можно дольше товарный вид, и была гораздо более удобной в употреблении, а также в Европе в нее добавляют фтор, который активно борется c кариесом.
Регенерацию таких смол необходимо проводить постоянно c цикличностью от 12 часов до двух суток. Восстановление таких смол регенерацией очень важно, так как вода проходящая через картридж c невосстановленной смолой практически не очищается и насыщена тем же количеством примесей кальция и магния, придающих воде жесткость.
Хлорид натрия, являющийся одним из важнейших продуктов минерального сырья для бытового потребления в виде поваренной соли, а также химической промышленности в случае применения для восстановления вышеуказанных ионообменных картриджей производится в специализированном виде — таблетках из высококачественного сырья класса «Экстра». Для замещения ионов магния и кальция в системе ионообмена может подойти и обыкновенная соль, называемая поваренной, но к сожалению процент чистого NaCl в таком продукте на прилавке гораздо ниже требующегося.В нее добавляют различные добавки, такие как йод, различные реагенты-разрыхлители, чобы соль на прилавках магазинов была рассыпчатой, сохраняла как можно дольше товарный вид, и была гораздо более удобной в употреблении, а также в Европе в нее добавляют фтор, который активно борется c кариесом. Вышеуказанные добавки совершенно недопустимы когда речь идет о восстановлении работоспособности вашего ионообменного картриджа или фильтра..
Ионообменные фильтры, а точнее Na-катионные фильтры ионного обмена, весьма быстро теряют свои свойства пропуская через себя воду c содержащимися в ней ионами магния и кальция, и сульфокатионная ионообменная смола требует обратной замены катионита на ионы натрия. Для производства таблетированной соли, способной быстро вернуть вашему фильтру или водоумягчающему картриджу былую форму, используется только самая высококачественная соль производящаяся в белых или прозрачных таблетках упакованных обычно в десяти или двадцатипяти киллограмовые мешки. Основные поставщики такой соли находятся на территории России, Беларусии и Украины. Соль в прозрачных таблетках по своим свойствам ничем не отличается от обычной белой таблетированной соли, но она значительно дороже (иногда в несколько раз), так как для производства и очистки от незначительных примесей которые и придают таблеткам прозрачный цвет требуется гораздо больше энергии на производстве.
Вышеуказанные добавки совершенно недопустимы когда речь идет о восстановлении работоспособности вашего ионообменного картриджа или фильтра..
Ионообменные фильтры, а точнее Na-катионные фильтры ионного обмена, весьма быстро теряют свои свойства пропуская через себя воду c содержащимися в ней ионами магния и кальция, и сульфокатионная ионообменная смола требует обратной замены катионита на ионы натрия. Для производства таблетированной соли, способной быстро вернуть вашему фильтру или водоумягчающему картриджу былую форму, используется только самая высококачественная соль производящаяся в белых или прозрачных таблетках упакованных обычно в десяти или двадцатипяти киллограмовые мешки. Основные поставщики такой соли находятся на территории России, Беларусии и Украины. Соль в прозрачных таблетках по своим свойствам ничем не отличается от обычной белой таблетированной соли, но она значительно дороже (иногда в несколько раз), так как для производства и очистки от незначительных примесей которые и придают таблеткам прозрачный цвет требуется гораздо больше энергии на производстве. Также можно заметить, что таблетированная соль гораздо более удобна в применении, хранении и в транспортировке, что особенно важно для применении ее в восстановлении промышленных фильтров. К тому же таблетированная соль гораздо лучше растворяется и не оставляет осадка и посторонних примесей в отличии от обычной поваренной. Способность обогащать ионообменные Na-катионные фильтры у специализированной таблетированой соли значительно выше из-за отсутствия примесей, что позволит максимально наслаждаться чистой и полезной водой.
Также можно заметить, что таблетированная соль гораздо более удобна в применении, хранении и в транспортировке, что особенно важно для применении ее в восстановлении промышленных фильтров. К тому же таблетированная соль гораздо лучше растворяется и не оставляет осадка и посторонних примесей в отличии от обычной поваренной. Способность обогащать ионообменные Na-катионные фильтры у специализированной таблетированой соли значительно выше из-за отсутствия примесей, что позволит максимально наслаждаться чистой и полезной водой.
Q9 Укажите, почему добавление хлорида натрия в воду считается физическим изменением, в то время как добавление
Перейти к
- Упражнение
- Вопросы объективного типа
- Материя и ее состав
- Физические и химические изменения
- Элементы, соединения и смеси
- Атомная структура
- Язык химии
- Металлы и неметаллы
- Воздух и атмосфера
Главная >
Союзные решения
Класс 7
Химия
>
Глава 2. Физические и химические изменения
>
Упражнение
>
Вопрос 10
Физические и химические изменения
>
Упражнение
>
Вопрос 10
Вопрос 10. Упражнение
В9) Укажите, почему добавление хлорида натрия к воде считается физическим изменением, а добавление разбавленной серной кислоты к цинку считается химическим изменением.
Ответ:
Решение:
При добавлении воды к хлориду натрия не образуется новый продукт, следовательно, это физическое изменение.
При добавлении разбавленной серной кислоты к цинку образуется новый продукт сульфат цинка, следовательно, происходит химическое изменение.
Связанные вопросы
Q1) Изменения — это закон природы, и они происходят в нашей повседневной жизни, во все времена и во всех местах. Разн…
Q2) Укажите, верны или нет следующие утверждения. Если неверно напишите — правильное утверждение…
Q2) Различайте физическое изменение и химическое изменение относительно -1. Природа ч…
Природа ч…
Q3) Назовите три причины, по которым плавление воска считается физическим изменением при горении свечи…
В4) Назовите наблюдение, которое наблюдалось, когда молоко в тарелке откладывалось на несколько часов или более. Является ли ча …
Q5) Укажите, что подразумевается под термином — взаимопревращение материи. Является ли взаимопревращение материи физическим…
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнения
Вопросы объективного типа
Главы
Материя и ее состав
Физические и химические изменения
Элементы, соединения и смеси
Атомная структура
Язык химии
Металлы и неметаллы
Воздух и атмосфера
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
Узнайте о химической реакции хлорида натрия с водой
получить порошок, который не имеет ни цвета, ни запаха, ни вкуса. Он называется хлоридом натрия, и на вкус он похож на соль. Хлорид натрия в быту называют «поваренной солью», потому что он используется для приправы пищи. Химическая формула состоит из NaCl. Там он представлен в виде галита или каменной соли. Чистый хлорид натрия не имеет цвета, но если в нем есть примеси, он может иметь другой цвет. Фиолетовый или синий, желтый или розовый.
Он называется хлоридом натрия, и на вкус он похож на соль. Хлорид натрия в быту называют «поваренной солью», потому что он используется для приправы пищи. Химическая формула состоит из NaCl. Там он представлен в виде галита или каменной соли. Чистый хлорид натрия не имеет цвета, но если в нем есть примеси, он может иметь другой цвет. Фиолетовый или синий, желтый или розовый.
В химическом уравнении это начало хлорно-щелочного процесса, который представляет собой промышленный процесс получения хлора и гидроксида натрия.
2 NaCl + 2 h3O → Cl2 + h3 + 2NaOH
Все ячейки, используемые для этого электролиза, либо сделаны из ртути, либо из резины, либо из мембран. Для каждого из них используется свой метод отделения хлорида от гидроксида, но все они делают одно и то же: разрабатываются другие технологии, потому что электролиз требует много энергии, а небольшие улучшения эффективности могут иметь большое значение для экономики. . Некоторые из вещей, для которых используется хлор, включают ПВХ, дезинфицирующие средства и растворители. Гидроксид натрия помогает предприятиям, производящим бумагу, мыло и алюминий.
. Некоторые из вещей, для которых используется хлор, включают ПВХ, дезинфицирующие средства и растворители. Гидроксид натрия помогает предприятиям, производящим бумагу, мыло и алюминий.
Хлорид натрия распадается на ионы Na+ и Cl- при смешивании с водой. Это можно записать в виде химического уравнения
NaCl(s) → Na+(aq) + Cl–(aq)
Поскольку соль растворяется в воде, это химическое изменение. Примером реакции является смешивание хлорида натрия с водой для получения хлорида натрия (или NaCl). Продукты не одинаковы (катион натрия и анион хлора). Таким образом, любое ионное соединение, которое может быть растворено в воде, изменит в результате этого свое химическое состояние. Поскольку растворение чего-то вроде сахара не вызывает химической реакции, когда сахар растворяется, молекулы распространяются по воде, но не меняют свой химический состав.
В соли и воде есть электрические заряды, из-за чего они растворяются в воде на молекулярном уровне, потому что они оба полярны, с положительными и отрицательными зарядами на противоположных сторонах друг друга. Их называют ионными связями, потому что ионы хлора и натрия имеют электрический заряд. Она также ионная, но связь называется ковалентной, при этом два атома водорода имеют положительный заряд с одной стороны атома кислорода, который имеет отрицательный заряд с другой. В воде больше ковалентных связей, чем в молекулах соли, поэтому при смешивании соли и воды соль растворяется.
Их называют ионными связями, потому что ионы хлора и натрия имеют электрический заряд. Она также ионная, но связь называется ковалентной, при этом два атома водорода имеют положительный заряд с одной стороны атома кислорода, который имеет отрицательный заряд с другой. В воде больше ковалентных связей, чем в молекулах соли, поэтому при смешивании соли и воды соль растворяется.
Ионы хлорида заряжены отрицательно, а ионы натрия – положительно. Положительно заряженные молекулы воды притягиваются к ионам хлора, а отрицательно заряженные молекулы воды притягиваются к ионам натрия. По сути, происходит перетягивание каната, и молекулы воды побеждают. Связь между ионами натрия и хлорида разрывается, когда молекулы воды раздвигают их и раздвигают. Если расщепить соль, молекулы воды окружат атомы натрия и хлорида. На этой диаграмме показано, как это выглядит после этого. Как только это происходит, соль растворяется, в результате получается раствор, который везде одинаков.
Характеристики воды и хлорида натрияВажно знать химические свойства воды:
- Чистая вода не пропускает электричество.

- Сколько тепла может удерживать лед. Это 336 Дж/г.
- Когда вода испаряется, для этого требуется 2260 Дж/г тепла.
- Молекулы воды имеют удельную теплоемкость 4,2 Дж, что означает, что они могут удерживать много тепла.
- В этом случае значение диэлектрической проницаемости воды очень велико.
- Некоторые вещества можно смешивать с водой.
- Вы можете сказать, что вода имеет две стороны, потому что она состоит из неорганического вещества, которое является полярным.
Некоторые из физических свойств воды:
- Водородные связи между молекулами воды улучшают их сцепление друг с другом.
- 100° и 0°C — это температуры, при которых вода закипает и тает.
- Твердые, жидкие и газообразные три формы воды.
- Вода имеет полярную природу, а это значит, что она может растворять почти любое вещество и называется универсальным растворителем, потому что она может делать это почти со всем остальным.
- На данный момент вода состоит из кристаллов, которые образуют клеточную структуру в 3-D.
 Лед может плавать на воде, потому что кристаллическая структура воды имеет много пустот, что делает ее менее плотной, чем вода.
Лед может плавать на воде, потому что кристаллическая структура воды имеет много пустот, что делает ее менее плотной, чем вода. - Известно, что при 4°C плотность воды составляет 0,99 г/мл.
- Очень легко растворяется в воде, но не очень легко или невозможно растворяется в других жидкостях.
- Белые кристаллы без запаха, но соленый вкус, который можно почувствовать.
- NaCl является хорошим проводником электричества, поскольку ионы могут свободно перемещаться.
- Плавится при 801°C и кипит при 1413°C.
- выглядит как белое кристаллическое вещество. Товарный сорт обычно содержит много хлоридов кальция и магния, из-за чего он затвердевает и становится комковатым.
- При 68°F растворимость больше или равна 100 мг/мл. Он легко растворяется в воде, но мало или совсем не растворяется в других типах жидкости.
- При 77°F плотность составляет 2,165.
- В воздухе при температуре 1589°F давление паров составляет 1 мм рт.



 Лед может плавать на воде, потому что кристаллическая структура воды имеет много пустот, что делает ее менее плотной, чем вода.
Лед может плавать на воде, потому что кристаллическая структура воды имеет много пустот, что делает ее менее плотной, чем вода.