Реакция Манту: норма и отклонения у детей
Со школьных лет мы помним уколы, которые нам делали в поликлинике или на месте, в классе, и мы ради этого откладывали в сторону все учебные дела. Через некоторое время медработники вызывали нас на осмотр, осматривали место введения туберкулина (как оказалось позже), прикладывали линейку и что-то записывали в свои журналы. Время прошло, мы выросли, у нас появились свои дети, и мы столкнулись снова с этими же «уколами», но уже в отношении наших малышей. Что изменилось? Только наше отношение? Наше представление и знания об этой процедуре? Давайте рассмотрим более детально вопрос теста на туберкулез, так называемой пробы Манту, ведь речь уже идет не о нас, а о наших малышах.
Содержание
Суть пробы Манту
Процедура проведения туберкулиновой пробы
Возможные результаты теста
Чтобы тест дат правильный результат
Побочные действия туберкулиновой пробы
В каких случаях пробу Манту нельзя делать?
Суть пробы Манту
Проба Манту, или так называемая туберкулиновая проба, представляет собой тест на выдерживание организмом палочки Коха в случае заражения, а также на наличие/отсутствие ее в организме в данный момент. Это стало возможным благодаря открытию туберкулиновой палочки немецким врачом – Робертом Кохом. Он и изготовил в 1890 году препарат туберкулин (вытяжку из погибших бацилл Коха) для диагностики заболевания, а применяться он стал в 1907 году в Пирке, а в России – только с 1965. Сам же современный метод диагностики был усовершенствован французским врачом – Шарлем Манту.
Это стало возможным благодаря открытию туберкулиновой палочки немецким врачом – Робертом Кохом. Он и изготовил в 1890 году препарат туберкулин (вытяжку из погибших бацилл Коха) для диагностики заболевания, а применяться он стал в 1907 году в Пирке, а в России – только с 1965. Сам же современный метод диагностики был усовершенствован французским врачом – Шарлем Манту.
Итак, проба Манту ― это не прививка от туберкулеза, а способ диагностики иммунитета человека к туберкулезу, профилактика своевременного выявления данного заболевания.
Процедура проведения туберкулиновой пробы
Когда малышу исполняется год, ему в обязательном порядке делают пробу Манту: вводят туберкулин в небольшой дозе под кожу в области внутренней стороны руки между запястьем и локтем. И через 72 часа наблюдают за реакцией: лимфоциты, отвечающие за противодействие организма к данному заболеванию, собственно, те из них, которые уже имели дело с палочкой Коха, как бы набрасываются на чужеродные бактерии (они собираются вокруг места введения препарата), образовывая уплотнение вокруг места инъекции. Чем больше уплотнение, тем большее количество лимфоцитов, борющихся с туберкулиновой палочкой в прошлом или в настоящем времени, существует в организме, что является показателем наличия заболевания ― «положительная реакция». В таком случае ребенка отправляют на дополнительное обследование. Для постановки предварительного диагноза уплотнение измеряют линейкой, и его диаметр позволяет говорить о наличии/отсутствии заболевания.
Чем больше уплотнение, тем большее количество лимфоцитов, борющихся с туберкулиновой палочкой в прошлом или в настоящем времени, существует в организме, что является показателем наличия заболевания ― «положительная реакция». В таком случае ребенка отправляют на дополнительное обследование. Для постановки предварительного диагноза уплотнение измеряют линейкой, и его диаметр позволяет говорить о наличии/отсутствии заболевания.
Каждому ребенку, вне зависимости от предыдущих реакций на введение туберкулина, данный тест делается ежегодно – 1 раз на протяжении 14 лет. Когда ребенку исполняется 14, этот метод диагностики заменяют прохождением обследования с помощью флюорографии.
От туберкулинового теста можно отказаться (просто написать заявление об отказе от него в поликлинике, где наблюдается ваш малыш). Это дело добровольное, вот только есть ли у вас уверенность в том, что ребенок нигде и никогда не встречал и не встретит в общественных местах людей, болеющих туберкулезом или являющихся его носителями? Туберкулез – наиболее распространенное (передается воздушно-капельным путем и бытовым) и опасное (не излечивается) заболевание.
Просмотрите данное видео, если вы еще раздумываете
Есть платные анализы крови на определение наличия/отсутствия данного заболевания у ребенка (иммуноглобулин AMg к туберкулезу), как вариант при вашем нежелании специально инфицировать ребенка данными бактериями, пусть даже в малых дозах и нежизнедеятельными. Они проводятся в частных клиниках и стоят денег, но здоровье крохи приоритетней.
Если же вы все же делаете пробу Манту ребенку, то стоит знать, какие результаты может выдать этот тест.
Возможные результаты теста
Результаты теста не являются точным доказательством заболевания туберкулеза, они могут показать ложный ответ, обусловленный некоторыми особенностями организма (при аллергии, недавно перенесенных инфекционных заболеваниях, неправильном питании, чувствительности кожи, наличии глистов у ребенка и т. п.) или неправильным проведением самого теста, истечением срока годности препарата. Но знать, какие же бывают показатели, стоит.
п.) или неправильным проведением самого теста, истечением срока годности препарата. Но знать, какие же бывают показатели, стоит.
Итак, реакции:
Отрицательная: ей свойственно полное отсутствие покраснения, уплотнения вокруг места введения туберкулина или оно очень незначительно (до 1 мм). Это может быть признаками: а) отсутствия заболевания; б) слабого иммунитета ребенка, при котором просто нет реакции, а заболевание есть; в) заражение есть, но ему менее 10 недель.
Сомнительная реакция: она есть, а уплотнение на руке находится в пределах 1-4 мм. Это говорит о нормальном иммунитете и отсутствии заболевания.
Положительная реакция наблюдается, если уплотнение превысило в диаметре 5 мм, но не перешло границы 16 мм. Этот показатель свидетельствует, что в организме ребенка уже был опыт борьбы с туберкулезом и имеется иммунитет к нему, а вот есть ли само заболевание, покажут дальнейшие обследования в динамике результатов.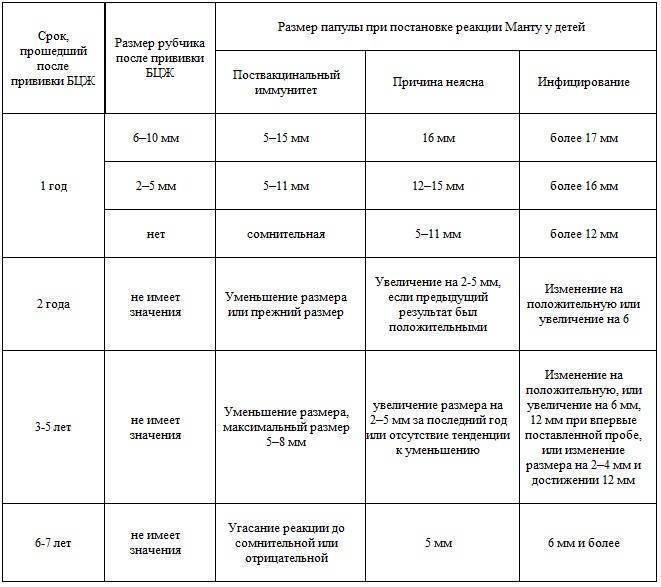
Гиперергическая реакция указывает на наличие туберкулеза. При ней размер уплотнения превышает 17 мм у детей и 21 мм у взрослых, оно явно красное, может иметь вид водянки или гнойника.
Ложноположительная реакция может иметь признаки гиперергической, но поводом к ней будут не болезнь, а неправильный уход за местом введения препарата.
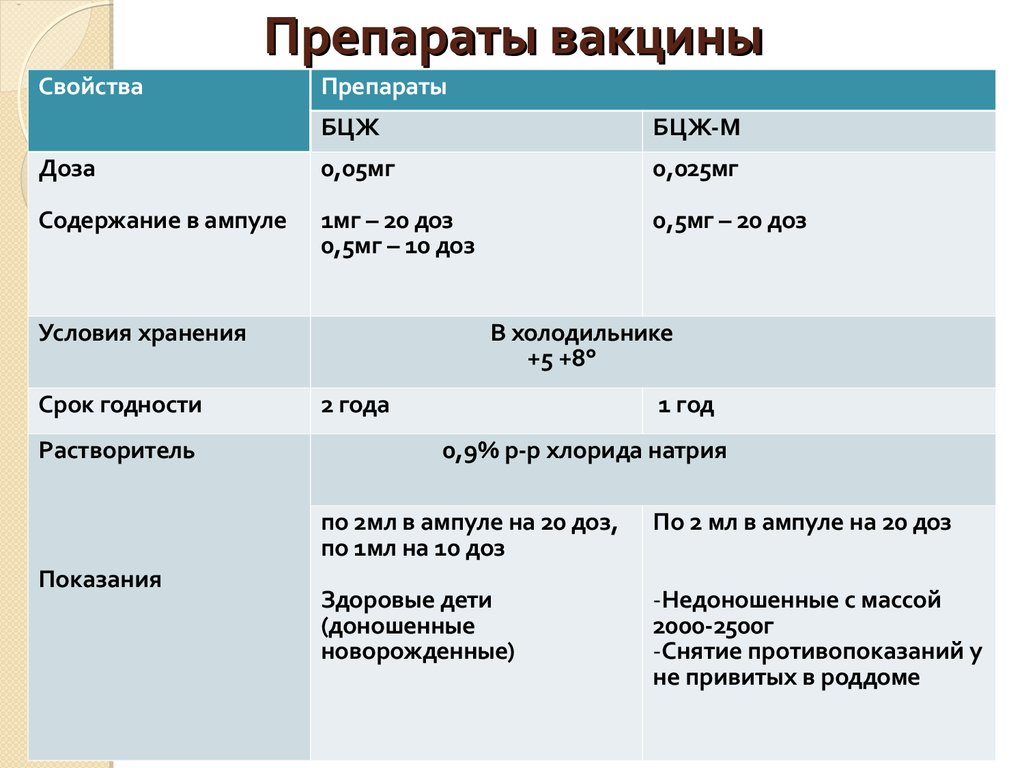
В случае присутствия положительной, гиперергической или ложноположительной реакций ребенка в сопровождении родителей направляют на дальнейшее обследование в противотуберкулезный диспансер. Хотя, если ребенку в роддоме делали прививку БЦЖ, то реакция будет в любом случае.
Кроме всего, наблюдают еще и динамику роста уплотнения при пробе Манту из года в год. Если она имеет свойство нарастать или резко увеличиваться на 6 мм, то это повод обратиться к фтизиатру (специалисту, который определяет наличие/отсутствие туберкулеза у ребенка и направляет на дальнейшее обследование, назначает лечение).
Стоит посетить данного врача и в том случае, когда вы с ребенком недавно посетили места повышенного риска (где в воздухе витает данная инъекция), людей с туберкулезом.
Чтобы избежать ложноположительного результата теста, необходимо соблюдать некоторые правила по уходу за местом укола.
Чтобы тест дал правильный результат
Правила по уходу:
- избегайте контакта воды с местом введения препарата в первый день после пробы Манту;
- следите за тем, чтобы ребенок не расчесывал место укола;
- при возникновении покраснения, уплотнения, водянистого образования обрабатывать их нельзя.
Несоблюдение этих правил может дать ложноположительный результат, что запутает врачей и напугает родителей. Ребенка придется вести на дополнительные анализы в то место, куда лучше не попадать ― противотуберкулезный диспансер, где этой болезни предостаточно.
Побочные действия туберкулиновой пробы
Как и любой медицинский препарат, туберкулиновый тест имеет свои побочные действия. После него у ребенка могут наблюдаться:
- аллергическая сыпь;
- повышение температуры тела;
- общая вялость;
- отсутствие аппетита;
- тошнота, рвота;
- головокружение.

При наличии данных симптомов стоит вызвать врача и следовать его предписаниям. Кроме этого, сами же родители должны обеспечить малышу условия комфорта и спокойствия, уделить внимание, а не отмахиваться: «Само пройдет», «Что с ним сидеть? Уже взрослый». Даже 13-летнему ребенку нужны ваше внимание и забота. Тогда выздоровление приходит быстрее, а само заболевание протекает легче.
В каких случаях пробу Манту нельзя делать?
Но существует ряд условий, при которых проведение данного диагностического мероприятия противопоказано. К ним относят такие:
- При кожных заболеваниях проба Манту не делается, так как даст ложноположительный результат.
- При аллергии разного рода.
- При острых соматических и хронических инфекционных заболеваниях. Туберкулиновый тест проводится спустя месяц после полного выздоровления.
- При эпилепсии.
- На момент вакцинации от чего-либо.
- В момент заболевания простудными недугами.
С момента прекращения действия карантина в двух последних случаях пробу Манту уже можно делать.
В заключение стоит добавить, что обезопасить своего ребенка ― задача каждого родителя. С этой целью необходимо своевременное обследование (неважно, каким способом: с помощью пробы Манту или анализа иммуноглобулина), знание родителями круга общения своих детей и мест, куда они ходят.
Вот что говорит по поводу данной процедуры Е. О. Комаровский:
Была ли эта информация полезной?
ДаНет
почему нельзя мочить, оценка результата
— Iliya Plisko
Туберкулиновая проба или проба Манту – обязательная процедура. И каждый помнит, как врачи запрещали мочить ее, но не каждый понимал, почему. На самом деле, все не так страшно, как кажется.
На самом деле, все не так страшно, как кажется.
Зачем делать пробу Манту
Проба Манту необходима для выявления пациентов с высоким риском заражения туберкулезом. С ее помощью определяют тех, кому необходимо провести повторно БЦЖ, а также находят инфицированных больных.
Вакцинация проводится ежегодно, начиная с годовалого возраста, независимо от предыдущих результатов. После введение вещества оценивается результат пробы. В эти 72 часа нельзя мочить, чесать, тереть место инъекции.
Почему нельзя мочить, чесать пробу Манту?
Контроль реакции осуществляется спустя трое суток. До этого момента не стоит притрагиваться к месту пробы Манту, тем более нельзя ее намыливать, тереть мочалкой. Мыться в течение трех дней можно, но осторожно. Нет ничего страшного, если попадут капли воды на место инъекции: ее аккуратно удаляют полотенцем, легкими промокательными движениями. А вот размачивать, посещать сауны и бани, бассейны, запрещается. Запрещено греть, чесать, наносить йодную сетку на пробу Манту. Все это способствует усилению реакции и, как результат, оценка пробы будет положительно-ошибочной. Чтобы этого не допустить, врачи запрещают мочить место инъекции.
Все это способствует усилению реакции и, как результат, оценка пробы будет положительно-ошибочной. Чтобы этого не допустить, врачи запрещают мочить место инъекции.
В остальных случаях, проба Манту может дать положительный результат только при инфицировании туберкулезом, при усилении иммунного ответа. Такое происходит при инфицировании, соматических патологиях, аллергии.
Оценка результатов прививки Манту
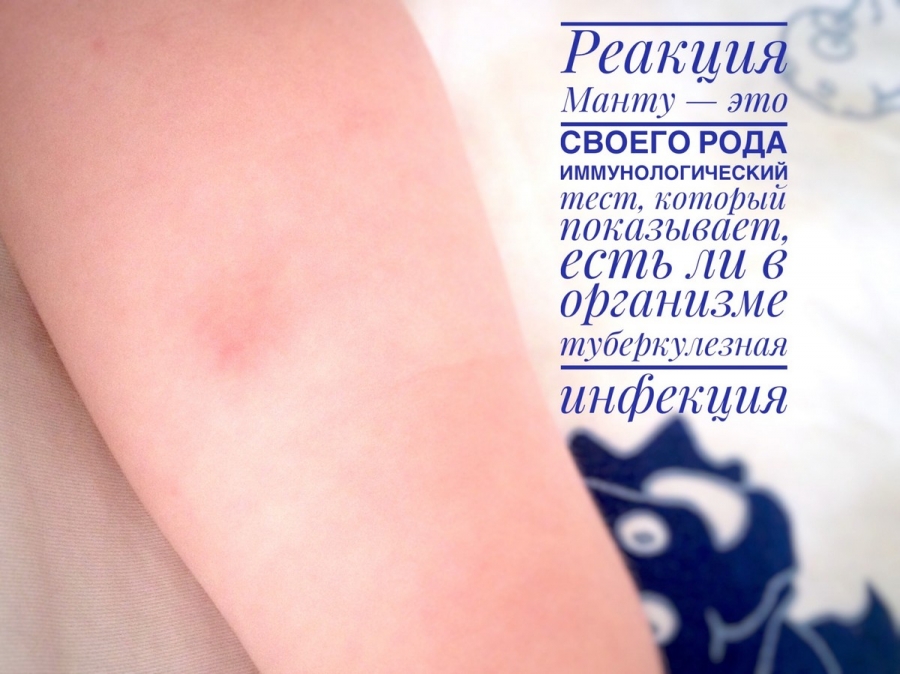
Через 72 часа, проводится оценка результата пробы Манту. Оценивается не размер гиперемированного участка, а папула – уплотненный бугорок, образовавшийся после введения туберкулина.
Отрицательный результат бывает при отсутствии папулы или при ее размере не больше 1 мм. Эта реакция говорит о том, что туберкулезная палочка никогда не попадала в организм. Также это может говорить о том, что пора повторно проводить вакцинацию БЦЖ.
Если папула от 1 до 4 мм, то говорят о сомнительной реакции. Возможно в организм попало небольшое количество бактерий и организм с ними борется.
При реакции свыше 5 мм, но менее 16 мм, говорят о положительном результате. Эта реакция показывает наличие туберкулезной палочки в организме, но организм ребенка здоров. По тому, как изменяется реакция на протяжении нескольких лет, врач оценивает восприимчивость к патогенным микроорганизмам.
Если папула больше 17 мм, то это гиперемическая реакция. Проба Манту с такими результатами требует незамедлительной консультации с фтизиатром.
Если папула крупная, сильная гиперемия над зоной инъекции, необходимо проконсультироваться с педиатром. Это можно сделать в режиме онлайн на нашем сайте.
Обсудить любые вопросы, касающиеся реакции Манту и не только, вы можете с нашими педиатрами.
Читайте такжеRelated Topics
Скрининг на туберкулез у португальских медицинских работников с использованием туберкулиновой кожной пробы и анализа высвобождения интерферона-γ Placido, A. Nienhaus
European Respiratory Journal 2009 34: 1423-1428; DOI: 10.1183/036. 00053809
00053809
- Статья
- Цифры и данные
- Информация и показатели
Резюме
0002 Были исследованы распространенность латентной туберкулезной (ТБ) инфекции (ЛТИ) и заболеваемость активным туберкулезом среди медицинских работников (МР) в португальской больнице.В этом перекрестном исследовании приняли участие 4735 работников больниц, прошедших скрининг в период с мая 2005 г. по сентябрь 2008 г. Туберкулиновая кожная проба (ТКП) и анализ высвобождения гамма-интерферона (IGRA) одновременно использовались у 1219 медработников (25,7%). Рентгенограммы были сделаны у медработников с симптомами или у медработников с положительным тестом. Тесты повторялись ежегодно или два раза в год в зависимости от оценки риска.
IGRA был положительным у 32,6%, а ТКП у 74,2% медработников. Годы, проведенные в здравоохранении, были фактором риска для положительного IGRA, но не для положительного TST. Повторная вакцинация бациллой Кальметта-Герена повышала вероятность несоответствия TST+/IGRA- (35,4% против 54,4% соответственно). У лиц, трижды протестированных с ТКП за период исследования (n = 59), средний диаметр ТКП увеличился с 5–7 до 10 мм. В течение 3 лет у 31 медработника был диагностирован активный ТБ (годовой уровень заболеваемости 191 из 100 000 человек). В восьми медработниках с активным ТБ во время постановки диагноза были проведены ТКП и IGRA, и каждый тест был положительным.
У лиц, трижды протестированных с ТКП за период исследования (n = 59), средний диаметр ТКП увеличился с 5–7 до 10 мм. В течение 3 лет у 31 медработника был диагностирован активный ТБ (годовой уровень заболеваемости 191 из 100 000 человек). В восьми медработниках с активным ТБ во время постановки диагноза были проведены ТКП и IGRA, и каждый тест был положительным.
Бремя ТБ среди медработников в Португалии высокое. С помощью IGRA количество рентгенограмм, необходимых для исключения активного ТБ, можно было сократить примерно наполовину, не пропуская ни одного случая активного ТБ. Поэтому IGRA следует внедрить в программы скрининга на ТБ.
- Медицинские работники
- Анализ высвобождения гамма-интерферона
- Португалия
- туберкулиновая кожная проба
- туберкулез
Скрининг медицинских работников (МР) на латентную туберкулезную инфекцию (ЛТБИ) и активный туберкулез (ТБ) является основополагающим в программах инфекционного контроля в больницах 1. В Португалии проводится скрининг медицинских работников на ТБ только в контексте отслеживания контактов через департамент общественного здравоохранения, в то время как профессиональная медицина отсутствует в большинстве португальских больниц. С 2005 года больница S. João в Северной Португалии (Порту) создает отдел гигиены труда для персонала больницы, который регулярно проверяет медработников на туберкулез, в зависимости от оценки риска в соответствии с рекомендациями Центров по контролю и профилактике заболеваний. 1.
В Португалии проводится скрининг медицинских работников на ТБ только в контексте отслеживания контактов через департамент общественного здравоохранения, в то время как профессиональная медицина отсутствует в большинстве португальских больниц. С 2005 года больница S. João в Северной Португалии (Порту) создает отдел гигиены труда для персонала больницы, который регулярно проверяет медработников на туберкулез, в зависимости от оценки риска в соответствии с рекомендациями Центров по контролю и профилактике заболеваний. 1.
Около века туберкулиновая кожная проба (ТКП) использовалась для выявления ЛТБИ. Однако ТКП имеет известные ограничения, в том числе перекрестную реактивность с инфекциями, вызванными бациллой Кальметта-Герена (БЦЖ) и нетуберкулезными микобактериями (НТМ). )-γ, высвобождаемый сенсибилизированными Т-клетками после стимуляции антигенами Mycobacterium tuberculosis . Эти тесты более специфичны, чем ТКП, поскольку в них используются антигены, не общие ни для одного из вакцинных штаммов БЦЖ, ни для более распространенных видов НТМ (9). 0024 напр. Mycobacterium avium ) 3. Помимо более высокой специфичности и, по крайней мере, такой же чувствительности, что и ТКП, анализы высвобождения интерферона-γ (IGRA) лучше коррелируют с суррогатными показателями воздействия M. tuberculosis 4–6 и имеют более высокая прогностическая ценность для прогрессирования ЛТИ в активный ТБ при тесном контакте в условиях низкой заболеваемости 7.
0024 напр. Mycobacterium avium ) 3. Помимо более высокой специфичности и, по крайней мере, такой же чувствительности, что и ТКП, анализы высвобождения интерферона-γ (IGRA) лучше коррелируют с суррогатными показателями воздействия M. tuberculosis 4–6 и имеют более высокая прогностическая ценность для прогрессирования ЛТИ в активный ТБ при тесном контакте в условиях низкой заболеваемости 7.
До сих пор было опубликовано лишь несколько систематических исследований ЛТИ у медработников с использованием IGRA 8–14. Поэтому мы изучили распространенность ЛТБИ и активного ТБ среди португальских медработников и сравнили показатели IGRA и TST.
МАТЕРИАЛЫ И МЕТОДЫ
Места исследования и объекты исследования
Популяция этого поперечного исследования включает всех работников больницы S. João, которые участвовали в скрининге на ТБ с мая 2005 года по сентябрь 2008 года. относятся к группе высокого риска, работники, регулярно контактирующие с пациентами в других отделениях, относятся к группе среднего риска, а работники, не имеющие постоянного контакта с пациентами или не контактирующие с биологическим материалом, относятся к группе низкого риска 1. При поступлении на работу все рабочие осматриваются. Ежегодно проводится оценка медработников, считающихся подверженными высокому риску. Все остальные оцениваются раз в два года или после известного контакта с пациентами с активным ТБ.
При поступлении на работу все рабочие осматриваются. Ежегодно проводится оценка медработников, считающихся подверженными высокому риску. Все остальные оцениваются раз в два года или после известного контакта с пациентами с активным ТБ.
Изначально скрининг выполнялся только с помощью TST. С января 2007 года TST и IGRA проводятся одновременно. ТКП выполняли, когда диаметр предыдущей ТКП был <15 мм или когда не был известен предыдущий результат ТКП. Рентгенограмма грудной клетки выполнялась при ТКП ≥10 мм или у медработников с симптомами ТБ.
Вакцинация БЦЖ оценивалась по индивидуальному журналу прививок или по рубцам. Согласно национальному плану вакцинации, вакцинация БЦЖ для новорожденных является обязательной в Португалии и до января 2000 г. повторялась, если TST была <5 мм 15 . Таким образом, каждый медработник был вакцинирован по крайней мере один раз.
ТКП выполнял обученный персонал в соответствии со стандартными процедурами. Вкратце, 0,1 мл (2 TU) очищенного производного белка (RT23; Statens Serum Institute, Копенгаген, Дания) вводили внутрикожно в ладонную сторону предплечья, и через 72–96 часов определяли поперечный диаметр уплотнения. Диаметр ≥10 мм считался положительным.
Диаметр ≥10 мм считался положительным.
Перед применением ТКП было проведено интервью и взята кровь для IGRA. В качестве IGRA был проведен анализ QuantiFERON-TB® Gold In-Tube (Cellestis Limited, Карнеги, Австралия) в соответствии с протоколом производителя. Наблюдатели не были осведомлены о результатах TST и наоборот .
Статистический анализ
Критерии хи-квадрат использовались для категорийных данных. Скорректированное ОШ и 95% ДИ были рассчитаны для предполагаемых прогностических переменных с использованием условной логистической регрессии. Построение модели было выполнено в обратном порядке с использованием критериев случайности для выбора переменных 16.
Все лица дали свое информированное согласие до их включения в исследование.
РЕЗУЛЬТАТЫ
Исследуемая популяция включала 4735 медработников. У 213 медработников (4,5%) были доступны только результаты IGRA, поскольку ТКП была противопоказана, в ней было отказано, или вторая встреча для измерения ТКП была пропущена (рис. 1⇓). Характеристики тех 1219Медработники (25,7%), протестированные одновременно с TST и IGRA, приведены в таблице 1⇓.
1⇓). Характеристики тех 1219Медработники (25,7%), протестированные одновременно с TST и IGRA, приведены в таблице 1⇓.
Рис. 1—
Исследуемая популяция. IGRA: анализ высвобождения интерферона-γ; ТКП: туберкулиновая кожная проба; ТБ: туберкулез.
Таблица 1—
Исследуемая популяция для сравнения анализа высвобождения интерферона-γ с туберкулиновой кожной пробой
TST был положительным у 74,2%, а IGRA у 32,6% медработников. Вероятность положительного IGRA увеличивалась с диаметром уплотнения TST (таблица 2⇓), с возрастом и с количеством лет, проведенных в качестве медработника (таблица 3⇓). ОШ для TST ≥10 мм у медработников с тремя или более дополнительными прививками БЦЖ после рождения составил 2,0 (9).5% ДИ 1,29–3,02). Переменная «годы с момента последней вакцинации» не влияла на результаты ТКП. Положительный IGRA был менее вероятен, если с момента последней вакцинации прошло всего ≤10 лет (ОШ 0,2; 95% ДИ 0,09–0,52). Никакой связи с профессией или оценкой риска не наблюдалось ни в одном тесте.
Никакой связи с профессией или оценкой риска не наблюдалось ни в одном тесте.
Таблица 2—
Диаметр туберкулиновой кожной пробы (TST) по результатам анализа высвобождения интерферона-γ (IGRA) IGRA), а соответствующие скорректированные ОШ и 95% ДИ для различных предполагаемых факторов риска
TST+/IGRA- несоответствие увеличивалось с увеличением количества прививок БЦЖ (таблица 4⇓). Несоответствие TST+/IGRA- составляло 40,5%, когда последняя вакцинация была сделана >15 лет назад, и 56,3%, когда прошло 1–10 лет. Дискордантность ТКП+/IGRA- у медицинских сестер была выше, чем у представителей других профессий (таблица 4⇓), и у них ТКП чаще повторялась за период исследования (30,5%), чем, например, у врачей (14,7%). Оценка риска обратно коррелировала с положительными согласованными результатами (низкий риск 38,7%, высокий риск 26,7%). Возраст > 60 лет был связан с повышенным несоответствием TST-/IGRA+ (таблица 4⇓).
Таблица 4—
Конкордантные и дискордантные результаты туберкулиновой кожной пробы (ТКП) ≥10 мм и теста высвобождения интерферона-γ (IGRA) в зависимости от предполагаемых факторов риска
В подгруппе из 59 медработников, у которых ТКП повторяли трижды в течение периода исследования (время между тестами: 12 месяцев) медиана диаметра уплотнения увеличилась с 5 мм через 7 мм до 10 мм (рис. 2⇓).
2⇓).
Рис. 2—
Коробчатая диаграмма диаметра уплотнения в мм у 59 медицинских работников с тремя туберкулиновыми кожными пробами в 2006, 2007 и 2008 гг.
Активный туберкулез был диагностирован у 31 медработника (рис. 1⇑) на основании положительных результатов ПЦР (n = 2) или культурально-подтвержденного положительного мазка (n = 29). Предполагая динамическую когорту, в которой каждый медработник присутствовал в течение 41 месяцев (с мая 2005 г. по сентябрь 2008 г.), годовой уровень заболеваемости составил 191,6 на 100 000 человек. У восьми медработников с активным ТБ ТКП и IGRA были выполнены одновременно во время постановки диагноза, и оба теста были положительными.
У 16 (51,6%) из 31 медработников с активным туберкулезом (рис. 1⇑) диагностика была инициирована отделом гигиены труда. У 13 пациентов были типичные симптомы туберкулеза, а троим диагноз был поставлен на основании положительных результатов ТКП и IGRA с последующим подозрительным рентгенографическим исследованием.
ОБСУЖДЕНИЕ
Это крупнейшее исследование по изучению эффективности ТКП и IGRA при скрининге медработников, которое позволило проанализировать факторы риска несоответствия результатов двух тестов. Годовой уровень заболеваемости активным ТБ среди португальских медработников (191,6 на 100 000 человек) был примерно в шесть раз выше, чем среди населения в целом в Португалии (32 на 100 000 человек) в 2006 г. 17 , а распространенность ЛТИ широко варьировала в зависимости от используется тест. Таким образом, доля медработников, нуждающихся в рентгенографии, могла бы быть снижена с 74,2% с положительной ТКП до 32,6%, если бы только IGRA-положительные медработники проходили рентгенографию для исключения активного ТБ.
До сих пор мало что известно о влиянии повторной вакцинации БЦЖ на вероятность результатов TST+/IGRA-, противоречивых 18, 19. Повторная вакцинация БЦЖ увеличивала вероятность положительных результатов TST, не подтвержденных IGRA. Недавняя вакцинация БЦЖ или повторная вакцинация БЦЖ снижали вероятность отрицательного результата IGRA. Скорее всего, это связано с тем, что медработников с отрицательным результатом ТКП ревакцинируют, вызывая положительный результат ТКП без изменения IGRA.
Скорее всего, это связано с тем, что медработников с отрицательным результатом ТКП ревакцинируют, вызывая положительный результат ТКП без изменения IGRA.
Увеличение диаметра ТКП в малой подгруппе (n = 59), протестированный три раза в течение периода исследования, скорее всего, указывает на бустерный эффект серийного тестирования 20, как и более высокая частота результатов TST + / QFT- у медсестер, у которых также чаще всего повторяется TST. Влияние серийного тестирования с TST на IGRA еще предстоит выяснить. Предварительные результаты показывают, что на IGRA не оказывает существенного влияния введение ТКП за 3 дня до IGRA 21.
Работа в сфере здравоохранения является хорошо известным фактором риска ТБ 22–24. По нашим данным, вероятность положительного IGRA (таблица 3⇑) увеличивалась с годами, проведенными в здравоохранении, в то время как ТКП такой связи не выявил. Удивительно, но ни оценка риска 1, ни профессия не были связаны с TST или IGRA. В двух европейских дактилоскопических исследованиях 25, 26 большинство случаев активного ТБ, связанного с работой, произошло, когда риск заражения не подозревался и профилактические меры не принимались. Ротация персонала — еще одно объяснение отсутствия этой связи. Кроме того, наш дизайн поперечного сечения может ослабить ожидаемую ассоциацию.
Ротация персонала — еще одно объяснение отсутствия этой связи. Кроме того, наш дизайн поперечного сечения может ослабить ожидаемую ассоциацию.
Скрининг медработников на ЛТБИ с ТКП в нашей популяции имел недостатки. Уровень положительной ТКП был высоким, и на него повлияла повторная вакцинация БЦЖ, что не позволяло различать медработников с риском заболевания или прогрессирования в активную форму ТБ. Таким образом, наши данные подтверждают заключение тайваньского исследования медработников27 о том, что ТКП бесполезна при исследовании контактов среди медработников, вакцинированных БЦЖ. В подгруппе, проходившей ТКП и IGRA одновременно, все восемь медработников с диагнозом активного ТБ дали положительный результат в обоих тестах. Ограничение рентгенограмм симптомными или IGRA-положительными медработниками уменьшило бы количество рентгенограмм более чем наполовину (TST 74,2% против IGRA 32,6%) без снижения числа случаев активного туберкулеза, выявленных в нашей популяции.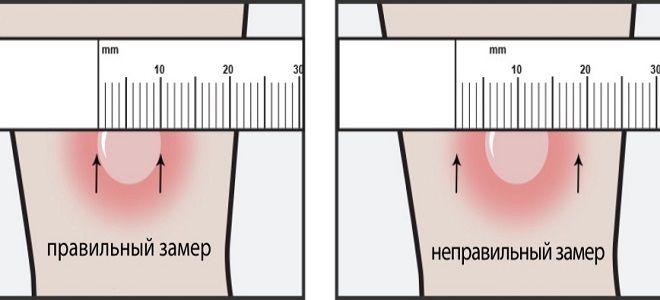
Заявление о заинтересованности
Не объявлено.
- Принята 1 апреля 2009 г.
- Принята 28 мая 2009 г.
Список литературы
- ↵
Дженсен П.А., Ламберт Л.А., Ядемарко М.Ф., и др. . Руководство по предотвращению передачи Mycobacterium tuberculosis в медицинских учреждениях, 2005 г. ММВР 2005; 54: 1–141
- ↵
Menzies D. О чем говорит туберкулиновая реактивность после прививки Bacille Calmette-Guerin? Clin Infect Dis 31 2000: Доп. 3, С71–С74.
- ↵
Андерсен П., Мунк М.Е., Поллок Дж.М., и др.
- ↵
Нахид П.
 , Пай М., Хоупвелл П.С. Успехи в диагностике и лечении туберкулеза. Proc Am Thorac Soc 2006; 3: 103–110.
, Пай М., Хоупвелл П.С. Успехи в диагностике и лечении туберкулеза. Proc Am Thorac Soc 2006; 3: 103–110. Пай М., Райли Л.В., Колфорд Дж.М. Анализы интерферона-γ в иммунодиагностике туберкулеза: систематический обзор. Lancet Infect Dis 2004;4:761–776.
- ↵
Menzies D, Pai M, Comstock G. Метаанализ: новые тесты для диагностики латентной туберкулезной инфекции: области неопределенности и рекомендации для исследований. Ann Intern Med 2007; 146: 340–352.
- ↵
Диль Р., Лодденкемпер Р., Мейвальд-Вальтер К., и др. Прогностическое значение анализа IFN-γ в цельной крови для развития активного туберкулеза. Am J Respir Crit Care Med 2008; 177: 1164–1170.
- ↵
Харада Н., Накадзима Ю., Хигучи К., и др. Скрининг на туберкулезную инфекцию с использованием интерферона-γ цельной крови и теста Манту среди японских медицинских работников.

Соберг Б., Андерсен А.Б., Ларсен Х.К., и др. Выявление низкой распространенности латентного туберкулеза среди медицинских работников в Дании, обнаруженного с помощью теста цельной крови на M. tuberculosis INF-γ. Scand J Infect Dis 2007; 39: 554–559.
Кобаши Ю., Обасе Ю., Фукуда М., и др. Использование QuantiFERON TB-2G, метода диагностики латентной туберкулезной инфекции, при контактном обследовании медицинских работников. Стажер-медик 2007; 46: 1543–1549..
Мирцхулава В., Кемпкер Р., Шилдс К.Л., и др. Распространенность и факторы риска латентной туберкулезной инфекции среди медицинских работников в Грузии. Int J Tuberc Lung Dis 2008; 12: 513–519.
Ниенхаус А, Шаблон А, Сиано Б, и др.
 Оценка высвобождения гамма-интерферона у медицинских работников. Int Arch Occup Environ Health 2008; 81: 295–300.
Оценка высвобождения гамма-интерферона у медицинских работников. Int Arch Occup Environ Health 2008; 81: 295–300. Шаблон А., Бекманн Г., Харлинг М., и др. Распространенность латентной туберкулезной инфекции среди медицинских работников легочного стационара. J Occup Med Toxicol 2009; 4:1
- ↵
Винтон П., Михршахи С., Джонсон П., и др. Сравнение теста QuantiFERON-TB Gold In-Tube и кожного туберкулинового теста для выявления латентных Mycobacterium tuberculosis среди медицинского персонала и связь между положительными результатами тестов и известными факторами риска инфекции. Infect Control Hosp Epidemiol. 2009;30:215–221.
- ↵
Национальный план вакцинации: Programa Nacional de Vacinação. Direcção-Geral da Saúde — Ministério da Saúde www.dgsaude.pt/upload/membro.id/ficheiros/i007442.pdf Последнее обращение: 1 мая 2009 г.

- ↵
Хосмер Д., Лемешоу С. Прикладная логистическая регрессия. Нью-Йорк, John Wiley & Sons, 2000 г.
- ↵
Доклад ВОЗ, 2008 г. Глобальная борьба с туберкулезом: эпиднадзор, планирование, финансирование. ВОЗ/HTM/ТБ/2008.393
- ↵
Фархат М., Гринуэй, Пай М., и др. Ложноположительные туберкулиновые кожные пробы: каков абсолютный эффект БЦЖ и нетуберкулезных микобактерий? Int J Tuberc Lung Dis 2006; 10:1192–1204.
- ↵
Ниенхаус А., Шаблон А., Диль Р. Анализ высвобождения интерферона-γ для диагностики латентной туберкулезной инфекции – анализ противоречивых результатов по сравнению с туберкулиновой кожной пробой. ПЛОС ОДИН 2008;3:e2665
- ↵
Menzies D. Интерпретация повторных туберкулиновых проб. Бустирование, конверсия и реверсия. Am J Respir Crit Care Med 1999; 159:15–21.

- ↵
Leyten EMS, Prins C, Bossink AWJ,
- ↵
Мензис Д., Джоши Р., Пай М. Риск заражения туберкулезом и заболевания, связанные с работой в медицинских учреждениях. Int J Tuberc Lung Dis 2007; 11: 593–605.
Seidler A, Nienhaus A, Diel R. Обзор эпидемиологических исследований профессионального риска туберкулеза в районах с низкой заболеваемостью. Дыхание 2005; 72: 431–446.
- ↵
Салейро С., Сантос АР, Видал О., и др.
- ↵
Диль Р.
 , Зайдлер А., Ниенхаус А., и др. Профессиональный риск передачи туберкулеза в зоне низкой заболеваемости. Respir Res 2005; 6: 35–45.
, Зайдлер А., Ниенхаус А., и др. Профессиональный риск передачи туберкулеза в зоне низкой заболеваемости. Respir Res 2005; 6: 35–45. - ↵
Де Врис Г., Себек М.М., Ламбрегтс-ван Везенбек С.С. Медицинские работники, заразившиеся туберкулезом во время работы. Eur Respir J 2006; 28: 1216–1221.
- ↵
Lee S S-J, Liu Y-C, Huang T-S,
ПредыдущийСледующий
Наверх
долларов США Туберкулез
Ошибка:
Javascript отключен в этом браузере. Для этой страницы требуется Javascript. Измените настройки вашего браузера, чтобы разрешить выполнение Javascript. Подробные инструкции см. в документации вашего браузера.
Подробные инструкции см. в документации вашего браузера.
Часто задаваемые вопросы и ресурсы Министерства сельского хозяйства США о коронавирусе (COVID-19). УЗНАТЬ БОЛЬШЕ
- Здоровье животных /
- Ветеринарная аккредитация /
- Справочное руководство NVAP /
- Контроль и искоренение
Ветеринарная аккредитация
- Вопросы, комментарии или технические проблемы?
- Предисловие
- Введение
- Содержание
- Контроль и искоренение
- бруцеллез
- Болезнь Джона
- Псевдобешенство (PRV)
- Туберкулез
- Трансмиссивные губчатые энцефалопатии
- Скрепи
- Губчатая энцефалопатия крупного рогатого скота (ГЭКРС)
- Хроническая изнуряющая болезнь (ХИБ)
- Птица
- Лошадь
- Водное животное
- Управление чрезвычайными ситуациями в области охраны здоровья животных
- Очистка и дезинфекция
- Надзор за болезнями
- Лабораторные материалы
- Движение животных
- Идентификация животных
- Соответствие и правила
- Приложение
Последнее изменение: 13 июня 2022 г.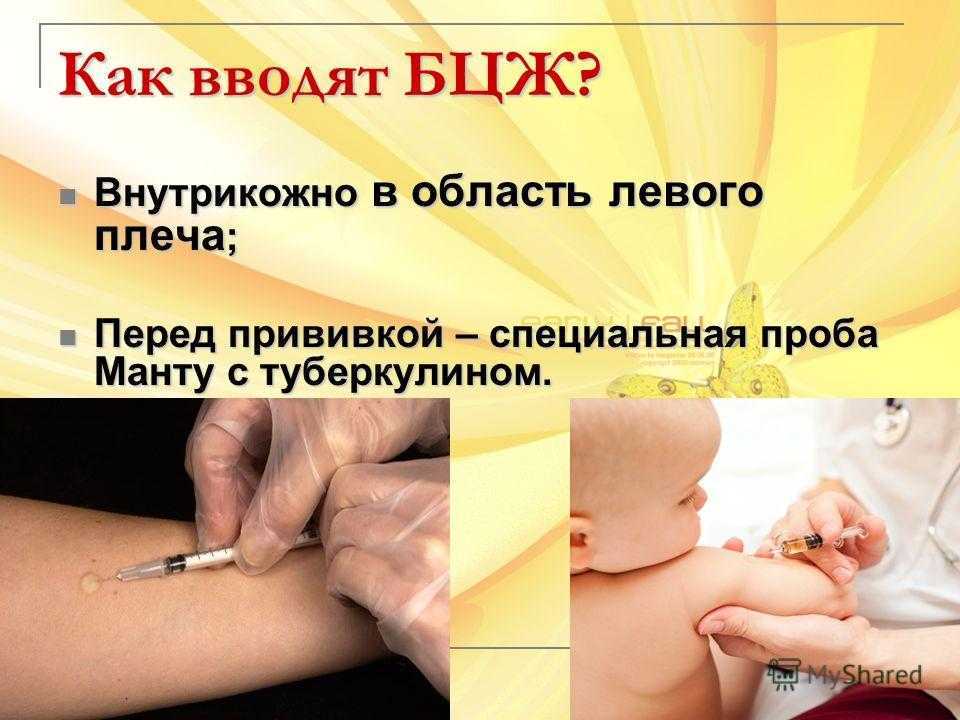
Печать
Туберкулез крупного рогатого скота (ТБ) — заразная, инфекционная, инфекционная болезнь животных и человека, вызываемая My cobacterium bovis . Обычно это хроническое изнурительное заболевание, но иногда оно может принимать острое, быстро прогрессирующее течение. Туберкулез является широко распространенным зоонозом глобального масштаба и поражает почти все виды позвоночных. Болезнь распространяется при прямом контакте, вдыхании капель, выделяемых из инфицированных легких, и при употреблении зараженного корма или молока. Все аккредитованные ветеринары должны немедленно сообщать о каждом подозрительном или диагностированном случае туберкулёза крупного рогатого скота как заместителю окружного директора, так и должностному лицу штата по охране здоровья животных.
Тестирование
Диагностика ТБ у живых животных зависит от использования эффективной методики тестирования с внутрикожной инъекцией туберкулина, полученной через вашего государственного ветеринарного врача или районного отделения APHIS-VS. Производится несколько разновидностей туберкулина. Однако для официального тестирования используйте только туберкулин, очищенный из бычьего белка (PPD bovis), лицензированный Министерством сельского хозяйства США. Требования к туберкулиновым тестам для разных видов животных см. в таблице 1.
Производится несколько разновидностей туберкулина. Однако для официального тестирования используйте только туберкулин, очищенный из бычьего белка (PPD bovis), лицензированный Министерством сельского хозяйства США. Требования к туберкулиновым тестам для разных видов животных см. в таблице 1.
Таблица 1 – Информация о туберкулиновых тестах для различных животных виды
Виды | Доза и тип | Сайт | Визуальное считывание теста и пропальпировать |
Крупный рогатый скот и зубры | 0,1 мл PPD bovis | Хвостовая складка | 72 ч +/- 6 ч |
Лошади | Ненадежно |
|
|
Овцы и козы | 0,1 мл PPD крупный рогатый скот | Хвостовая складка | 72 ч |
Свинья | 0,1 мл PPD крупный рогатый скот | Основание уха или Половые губы | 48 ч |
Птица | 0,05 мл птичий | Плетень | 48 ч |
Экзотика Bovidae | 0,1 мл PPD крупный рогатый скот | Средний шейный отдел | 72 ч |
Олени, лоси и прочие Оленьи | 0,1 мл PPD крупный рогатый скот | Средний шейный отдел | 72 ч |
Верблюдовые | 0,1 мл PPD крупный рогатый скот | Подмышечная область | 72 ч |
N Примечание: Тестирование на туберкулез и интерпретация результатов тестов для многих экзотических видов (например, некоторых животных зоопарка) еще не разработаны или не являются надежными. Для перемещения этих животных между штатами свяжитесь с государственным чиновником по ветеринарии в государстве назначения для получения информации о требованиях к тестированию на туберкулез (если таковые имеются) для этих видов.
Для перемещения этих животных между штатами свяжитесь с государственным чиновником по ветеринарии в государстве назначения для получения информации о требованиях к тестированию на туберкулез (если таковые имеются) для этих видов.
Поскольку туберкулиновая проба основана на иммунном ответе, тестируемое животное не должно одновременно получать другие лекарства, прививки или противогельминтные препараты. Эти агенты могут временно воздействовать на иммунную систему и влиять на результат туберкулиновой пробы. Это также означает, что больным животным нельзя делать инъекции, даже если они не лечатся и не лечатся каким-либо образом. Кроме того, кровотечение из хвоста не рекомендуется для других диагностических процедур (например, бруцеллеза, болезни Джона) во время инъекции туберкулиновой пробы у крупного рогатого скота или бизона, поскольку кровотечение из хвоста может помешать интерпретации теста.
Ветеринары несут юридическую ответственность за надлежащее проведение и оценку результатов туберкулиновых проб. Поэтому проведите тест самостоятельно; не делегируйте ответственность техническому специалисту. Для тестирования на ТБ у видов, отличных от крупного рогатого скота или бизонов (например, cervidae), обратитесь к официальному представителю ветеринарной службы штата или в районное отделение APHIS-VS для получения дополнительных указаний.
Поэтому проведите тест самостоятельно; не делегируйте ответственность техническому специалисту. Для тестирования на ТБ у видов, отличных от крупного рогатого скота или бизонов (например, cervidae), обратитесь к официальному представителю ветеринарной службы штата или в районное отделение APHIS-VS для получения дополнительных указаний.
Инструкции по тестированию
Этап 1: Формы —
- Заполните форму VS 6–22, Протокол теста на туберкулез. (См. в Приложении D пример формы VS 6-22 «Протокол обследования на туберкулез» и инструкции по ее заполнению)
- Идентифицируйте животное в форме по его официальной идентификации, как указано в разделе «Текущая идентификация животных».
- Весь проверенный крупный рогатый скот и бизоны должны быть индивидуально идентифицированы официальными ушными бирками. Такая идентификация должна быть полностью зафиксирована в протоколе испытаний во время инъекции и должна быть подтверждена во время наблюдения.

- Дополнительная идентификация (например, браслетные бирки, неофициальные металлические ушные бирки, номера шейных цепочек, бирки, бренды, номера рожков и имена) также должна быть записана в протоколе испытаний в качестве дополнительной информации, но никогда не должна использоваться в качестве единственной. метод идентификации.
- Если крупный рогатый скот и бизоны помечены более чем одной официальной ушной биркой, все номера ушных бирок должны быть записаны целиком.
- Порода, пол и приблизительный возраст в годах каждого подопытного животного должны быть полностью записаны в протоколе испытаний. Сокращения, такие как C=Calf или A=Adult, использовать нельзя.
- Владелец должен быть проинформирован о количестве животных, которым была сделана инъекция, и ему рекомендуется не пускать их в помещение до завершения теста.
Этап 2: Расходные материалы —
- Туберкулин. Используйте одобренный USDA-Veterinary Services туберкулин PPD Bovis (см.
 таблицу 1). Проверьте срок годности, чтобы убедиться, что туберкулин все еще действителен.
таблицу 1). Проверьте срок годности, чтобы убедиться, что туберкулин все еще действителен. - Шприц. Используйте одноразовый пластиковый туберкулиновый шприц объемом 1,0 мл.
- Игла. Используйте иглу 26-го размера и длиной 3/8 дюйма; больший калибр и более длинная или более короткая игла могут привести к утечке туберкулина из места инъекции. Для каждого животного необходимо использовать новую иглу.
Этап 3: Инъекция туберкулина — Весь испытуемый крупный рогатый скот и бизоны должны быть достаточно обездвижены, чтобы обеспечить возможность осторожного введения инъекций туберкулина, правильного прочтения идентификации животных, а также внимательного наблюдения и пальпации мест инъекций. Ни одно испытание не должно применяться или наблюдаться без удовлетворительного закрепления животного. Носовые щипцы больше не используются регулирующим персоналом APHIS.
- Крупному рогатому скоту и бизонам инъекции следует делать примерно на 2–3 дюйма дистальнее основания хвоста.
 Положите хвостовую складку на указательный палец, обнажая область вне линии роста волос на голой коже рядом с центром хвостовой складки.
Положите хвостовую складку на указательный палец, обнажая область вне линии роста волос на голой коже рядом с центром хвостовой складки. - Отметьте шрамы, дефекты и аномалии кожи в этой области в форме VS 6–22, чтобы их нельзя было спутать с возможными реакциями на тест во время чтения.
- Используйте хвостовую складку по обеим сторонам хвоста; однако обратите внимание, с какой стороны вы ввели инъекцию.
- Очистите область инъекции, но не используйте спирт, так как он может вызвать раздражение кожи.
- Возьмитесь за хвостовую складку между большим, указательным и средним пальцами, чтобы стабилизировать ее.
- Осторожно ввести иглу на всю длину между поверхностными слоями кожи; слегка извлеките его и внесите 0,1 мл туберкулина.
- На коже на конце иглы должен появиться небольшой пузырь.
N примечание: важно установить последовательную технику инъекции (т. е. всем животным следует вводить инъекцию с одной и той же стороны хвоста) — особенно при тестировании большого количества животных, если нет каких-либо физических аномалий на место инъекции.
Шаг 4. Чтение результатов теста —
- Результаты теста необходимо прочитать через 66–78 часов после инъекции (оптимально 72 часа). Ветеринар, который сделал инъекцию, должен быть тем ветеринаром, который зачитывает результат теста. Исключения должны быть одобрены в письменной форме Министерством сельского хозяйства США, Ветеринарной службой, помощником окружного директора. Ветеринар должен определить результаты теста путем наблюдения и пальпации места инъекции.
- Проверьте идентификацию удерживаемого животного и приподнимите хвост, чтобы слегка натянуть хвостовую складку.
- Внимательно осмотрите место инъекции и тщательно пропальпируйте его, чтобы обнаружить отклонения от нормы. Любой отек, чувствительность или увеличение толщины кожи считается положительной реакцией на туберкулин. Размер ответов может варьироваться и не свидетельствует об инфекционном статусе. Реакции могут быть маленькими, жесткими, размером с горошину, диффузными реакциями, ограниченными реакциями или большими реакциями.
 Если есть сомнения относительно того, произошла ли реакция , пропальпируйте противоположную сторону хвоста, чтобы определить, есть ли отклонения от нормы. Любое наблюдаемое изменение должно быть зарегистрировано.
Если есть сомнения относительно того, произошла ли реакция , пропальпируйте противоположную сторону хвоста, чтобы определить, есть ли отклонения от нормы. Любое наблюдаемое изменение должно быть зарегистрировано. - Пробное наблюдение без пальпации недопустимо.
Шаг 5: Запись в Результаты проверки —
- Используйте форму VS 6–22.
- Введите «N» (отрицательно), если вы не наблюдаете никаких изменений в ткани в месте инъекции.
- Введите «S» (подозрение), если вы наблюдаете или пальпируете любое увеличение толщины, размера или чувствительности каудальной складки в месте инъекции, как описано выше.
Реакции и интерпретация результатов испытаний
Если животное подвергается воздействию антигенов, присутствующих при туберкулезе крупного рогатого скота, инъекция туберкулина приводит к отсроченной реакции гиперчувствительности, проявляющейся отеком и уплотнением в месте инъекции. Положительный ответ обычно начинается в течение 8–12 часов и достигает пика примерно через 72 часа после инъекции.
Положительный ответ обычно начинается в течение 8–12 часов и достигает пика примерно через 72 часа после инъекции.
Если тест дает какой-либо ответ, немедленно сообщите об этом в районный отдел APHIS-VS и должностным лицам штата по охране здоровья животных. Тест на каудальную складку используется в качестве предполагаемой диагностической процедуры, и животные, классифицированные как подозрительные, должны быть дополнительно оценены с помощью сравнительного теста на шейку матки (СС), теста на гамма-интерферон или отправлены непосредственно на убой при наличии разрешения.
Только федеральные или государственные ветеринары, прошедшие специальную подготовку, могут проводить последующее тестирование. Последующее тестирование CCT должно быть выполнено в течение 10 дней после первоначальной инъекции в каудальную складку у крупного рогатого скота и бизонов, или владелец стада должен подождать 60 дней (90 дней для cervidae) после инъекции CFT, прежде чем можно будет выполнить последующую CCT. управляться. Если тест на гамма-интерферон используется в качестве последующего теста, кровь должна быть взята в течение 30 дней после даты инъекции CFT. Примечание. Тест на гамма-интерферон не одобрен для использования на бизонах или цервидах, содержащихся в неволе. Если тест CCT или гамма-интерферон показывает, что животное является реактивным, все дальнейшие тесты стада проводятся федеральными или государственными регулирующими ветеринарами.
управляться. Если тест на гамма-интерферон используется в качестве последующего теста, кровь должна быть взята в течение 30 дней после даты инъекции CFT. Примечание. Тест на гамма-интерферон не одобрен для использования на бизонах или цервидах, содержащихся в неволе. Если тест CCT или гамма-интерферон показывает, что животное является реактивным, все дальнейшие тесты стада проводятся федеральными или государственными регулирующими ветеринарами.
Ожидается, что аккредитованные ветеринары и уполномоченные ветеринары будут соответствовать показателям ответа хвостовой складки, как указано в Единых методах и правилах ликвидации туберкулеза крупного рогатого скота 2005 г., Приложение C. Неправильные методы инъекции или наблюдения, неправильное обращение с туберкулином и другие события могут привести к неточностям в тесте. и истинный статус болезни может быть упущен. Дополнительную информацию см. в Единых методах и правилах ликвидации туберкулёза крупного рогатого скота.

 , Пай М., Хоупвелл П.С. Успехи в диагностике и лечении туберкулеза. Proc Am Thorac Soc 2006; 3: 103–110.
, Пай М., Хоупвелл П.С. Успехи в диагностике и лечении туберкулеза. Proc Am Thorac Soc 2006; 3: 103–110. 
 Оценка высвобождения гамма-интерферона у медицинских работников. Int Arch Occup Environ Health 2008; 81: 295–300.
Оценка высвобождения гамма-интерферона у медицинских работников. Int Arch Occup Environ Health 2008; 81: 295–300. 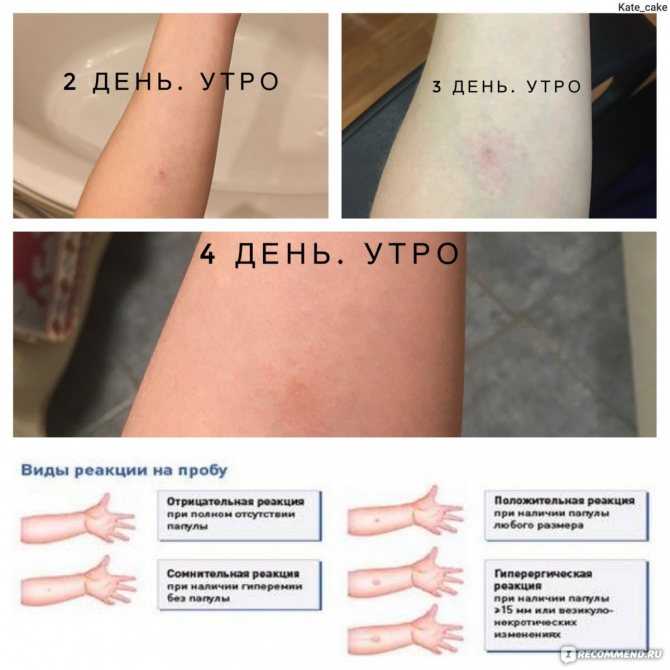

 , Зайдлер А., Ниенхаус А., и др. Профессиональный риск передачи туберкулеза в зоне низкой заболеваемости. Respir Res 2005; 6: 35–45.
, Зайдлер А., Ниенхаус А., и др. Профессиональный риск передачи туберкулеза в зоне низкой заболеваемости. Respir Res 2005; 6: 35–45.