ВЫБОР МЕТОДА ОБЕЗБОЛИВАНИЯ ПРИ ВРАСТАНИИ ПЛАЦЕНТЫ – ЗА И ПРОТИВ | Паличев
ВЫБОР МЕТОДА ОБЕЗБОЛИВАНИЯ ПРИ ВРАСТАНИИ ПЛАЦЕНТЫ – ЗА И ПРОТИВПаличев В.Н., Самоделкин В.С., Шибельгут Н.М., Елгина С.И., Мозес В.Г., Рудаева Е.В.
Кемеровская областная клиническая больница им. С.В. Беляева, Кемеровский государственный медицинский университет, г. Кемерово, Россия
ВЫБОР МЕТОДА ОБЕЗБОЛИВАНИЯ ПРИ ВРАСТАНИИ ПЛАЦЕНТЫ – ЗА И ПРОТИВ
Врастание
плаценты является одной из двух ведущие причин кровотечения в родах и после
родов, и наиболее частым показанием для гистерэктомии. Частота врастания
плаценты растет параллельно с увеличением частоты кесарева сечения. Выбор
операции кесарево сечение и планируемая гистерэктомия – это традиционный подход
к лечению врастания плаценты. Лечение врастания требует координации
между анестезиологами, акушерами, радиологами, работниками банка крови и
специализированными хирургическими бригадами.
В представленной статье описан опыт работы докторов анестезиологического отделения Областного перинатального центра Кемеровской областной клинической больницы им. С.В. Беляева. Применение предлагаемого метода региональной анестезии при родоразрешении женщин с вращением плаценты может помочь избежать материнских осложнений, которые возможны при общей анестезии, таких как сложные и неудачные интубации, легочные аспирации, интраоперационные пробуждения, развитие хронической боли и повышенная материнская заболеваемость. При сравнении женщин с разными видами анестезии было отмечено более редкое использование гемотрансфузии, снижение объема кровопотери на фоне применения региональной анестезии. Кроме того, способность поддерживать интраоперационное давление крови во время региональной анестезии была успешной в большинстве кесаревых сечений при предлежании, даже в условиях кровотечения.
Ключевые слова: врастание плаценты; акушерские кровотечения; кровопотеря; обезболивание
Palichev V.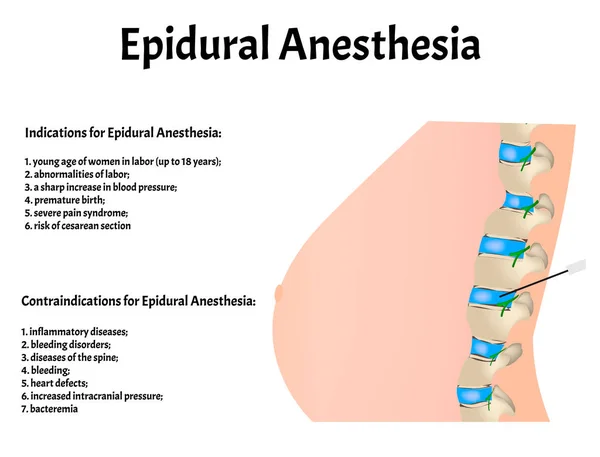 N, Samodelkin V.S., Shibelgut N.M., Еlgina S.I., Mozes V.G., Rudaeva E.V.
N, Samodelkin V.S., Shibelgut N.M., Еlgina S.I., Mozes V.G., Rudaeva E.V.
S.V. Belyaev Kemerovo Regional Сlinical Hospital, Kemerovo State Medical University, Kemerovo, Russia
THE CHOICE OF THE METHOD OF ANESTHESIA FOR PLACENTAL INGROWTH-PROS AND CONS
Placenta
accreta is one of the two leading causes of bleeding in childbirth and
postpartum, and the most common indication for hysterectomy. The frequency of
placental ingrowth increases in parallel with the increase in the frequency of
caesarean section. The choice of caesarean section and planned hysterectomy is
a traditional approach to the treatment of placental ingrowth. Treatment of
ingrowth requires coordination between anesthesiologists, obstetricians, radiologists,
blood Bank workers and specialized surgical teams.
 V. Belyaeva. The use of the proposed method of regional anesthesia
in the delivery of women with placental rotation can help to avoid maternal
complications that are possible with General anesthesia, such as complex and
unsuccessful intubations, pulmonary aspiration, intraoperative awakening, the
development of chronic pain and increased maternal morbidity. When comparing
women with different types of anesthesia, there was a more rare use of blood
transfusion, a decrease in blood loss against the background of regional
anesthesia. In addition, the ability to maintain intraoperative blood pressure
during regional anesthesia has been successful in most caesarean sections under
presentation, even under bleeding conditions.
V. Belyaeva. The use of the proposed method of regional anesthesia
in the delivery of women with placental rotation can help to avoid maternal
complications that are possible with General anesthesia, such as complex and
unsuccessful intubations, pulmonary aspiration, intraoperative awakening, the
development of chronic pain and increased maternal morbidity. When comparing
women with different types of anesthesia, there was a more rare use of blood
transfusion, a decrease in blood loss against the background of regional
anesthesia. In addition, the ability to maintain intraoperative blood pressure
during regional anesthesia has been successful in most caesarean sections under
presentation, even under bleeding conditions.Key words: placental growth; obstetric bleeding; blood loss; anesthesia
Корреспонденцию адресовать:
ЕЛГИНА Светлана
Ивановна
650029, г.
Тел: 8 (3842) 73-48-56
E-mail: [email protected]
Сведения об авторах:
ПАЛИЧЕВ Василий
Николаевич
зав. отделением анестезиологии
и реанимации № 1, ГАУЗ КО КОКБ им. С.В. Беляева, г. Кемерово,
Россия
E-mail: [email protected]
САМОДЕЛКИН Виталий Сергеевич
врач, отделение анестезиологии и реанимации
№ 1, ГАУЗ
КО КОКБ им. С.В. Беляева, г. Кемерово, Россия
E-mail: [email protected]
ШИБЕЛЬГУТ Нона
Марковна
канд. мед. наук, начальник медицинской службы акушерства, ГАУЗ КО КОКБ
им. С.В. Беляева, г. Кемерово, Россия
ЕЛГИНА Светлана Ивановна
доктор мед.
наук, доцент, профессор кафедры акушерства и гинекологии им. Г.А. Ушаковой,
ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия
Кемерово, Россия
E-mail: [email protected]
МОЗЕС Вадим Гельевич
доктор мед. наук,
профессор, доцент кафедры акушерства и гинекологии им. Г.А. Ушаковой,
ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия
E-mail: [email protected]
РУДАЕВА Елена Владимирова
канд. мед.
наук, доцент, доцент кафедры акушерства и гинекологии им. Г.А. Ушаковой,
ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия
E-mail: [email protected]
Information about authors:
PALICHEV Vasily Nikolaevich
head of the department of
anesthesiology and resuscitation N 1, S.V. Belyaev Kemerovo Regional Сlinical Hospital, Kemerovo, Russia
E-mail: [email protected]
SAMODELKIN Vitaly Sergeevich
doctor, department of
anesthesiology and intensive care N 1, S.V. Belyaev Kemerovo Regional Сlinical Hospital, Kemerovo, Russia
 [email protected]
[email protected]SHIBELGUT Nona Markovna
candidate of medical
sciences, head of the obstetrics medical service, S.V. Belyaev Kemerovo
Regional Сlinical Hospital, Kemerovo, Russia
E-mail: [email protected]
ELGINA Svetlana Ivanovna
doctor of medical sciences, docent, professor
of the department of obstetrics and gynecology named after G.A. Ushakova,
Kemerovo State Medical University, Kemerovo, Russia
E-mail: [email protected]
MOZES Vadim Gelievich
doctor of medical sciences, docent, professor of
the department of obstetrics and gynecology named after G.A. Ushakova,
Kemerovo State Medical University, Kemerovo, Russia
E-mail: [email protected]
RUDAEVA Elena Vladimirova
candidate of medical sciences, docent, department
of obstetrics and gynecology named after G.A. Ushakova, Kemerovo State
Medical University, Kemerovo, Russia
E-mail: rudaevae@mail. ru
ru
Врастание
плаценты является одной из двух ведущих причин кровотечения в родах и после
родов, и наиболее частым показанием для гистерэктомии [1]. Чем глубже врастание
плаценты, тем серьезнее последствия. Материнская смертность при врастании может
достигать 7 %, а плодовая смертность – 9 % [2].
Частота врастания плаценты растет параллельно с увеличением частоты кесарева сечения.
Большинство женщин с врастанием плаценты не имеют никаких симптомов во время беременности. Идентификация известных факторов риска необходима для ранней диагностики данной патологии [4]. Предшествующее кесарево сечение в анамнезе является основным фактором риска, особенно если есть предлежание плаценты [5]. Чем больше количество предшествующих операций кесарева сечения, тем выше риск развития врастания плацента.

Выбор операции кесарево сечение и планируемая гистерэктомия – это традиционный подход к лечению врастания плаценты [6]. Лечение врастания требует координации между анестезиологами, акушерами, радиологами, работниками банка крови и специализированными хирургическими бригадами. Тщательное планирование операции уменьшает потерю крови, потребность в переливании крови и, в конечном итоге, снижает заболеваемость и смертность во время и после операции [7]. По всем этим причинам и во избежание родов в экстренном порядке, выбором является кесарево сечение до начала родов, обычно, когда достигнут благоприятный гестационный возраст – 34 недели [8].
 Использование стратегии интенсивного контроля повреждений для
правильной трансфузии может улучшить заболеваемость и смертность. В последнее время некоторые авторы предполагают,
что региональная анестезия может быть приемлемой альтернативой для здоровых
пациентов с минимальной степенью инвазии плаценты [9, 10]. Пациенты, выбранные
для консервативного лечения, также выигрывают, если отказаться от общей
анестезии. Для таких пациентов эпидуральная или комбинированная
спинально-эпидуральная анестезия была бы предпочтительнее. Другие авторы
высказались за сочетание региональной и общей анестезии [11, 12]. При этом, рождение
ребенка может выполняться под региональной анестезией, которая позволила бы
матери быть в сознании в течение этого критического времени, после чего следует
переход к общей анестезии для проведения гистерэктомии. По сравнению с общей
анестезией, региональная анестезия при кесаревом сечении связана с 17-кратным
снижением осложнений, включая неудачную эндотрахеальную интубацию, аспирацию содержимым желудка, гипоксию [13].
Использование стратегии интенсивного контроля повреждений для
правильной трансфузии может улучшить заболеваемость и смертность. В последнее время некоторые авторы предполагают,
что региональная анестезия может быть приемлемой альтернативой для здоровых
пациентов с минимальной степенью инвазии плаценты [9, 10]. Пациенты, выбранные
для консервативного лечения, также выигрывают, если отказаться от общей
анестезии. Для таких пациентов эпидуральная или комбинированная
спинально-эпидуральная анестезия была бы предпочтительнее. Другие авторы
высказались за сочетание региональной и общей анестезии [11, 12]. При этом, рождение
ребенка может выполняться под региональной анестезией, которая позволила бы
матери быть в сознании в течение этого критического времени, после чего следует
переход к общей анестезии для проведения гистерэктомии. По сравнению с общей
анестезией, региональная анестезия при кесаревом сечении связана с 17-кратным
снижением осложнений, включая неудачную эндотрахеальную интубацию, аспирацию содержимым желудка, гипоксию [13]. Региональная
анестезия также дает обоим родителям возможность присутствовать во время
рождения их ребенка.
Региональная
анестезия также дает обоим родителям возможность присутствовать во время
рождения их ребенка.Нейроаксиальная анестезия при кесаревом сечении теперь считается стандартом практики в развитых странах. Однако гипотензия вследствие симпатэктомии и неспособность быстро титровать на снижение уровень анестезии после установления нейроаксиального блока делают спинальную и эпидуральную анестезию менее благоприятными для выбора в случаях, когда, вероятно, возможна гемодинамическая неустойчивость. Аномалии коагуляции, которые часто следуют за кровотечением и переливанием крови, существенно увеличивают риск развития спинальной или эпидуральной гематомы, особенно при манипулировании катетером [14]. Из-за значительного риска массивного кровотечения, осложненного глубокой гипотензией и коагулопатией, и высокой вероятности гистерэктомии во время кесарева сечения, общая анестезия обычно рассматривается как анестезия выбора для пациентов с врастанием плаценты.

По данным A. Ioscovich et al. (2015), в клиниках Израиля при предлежании плаценты наиболее широко используются регионарные методики анестезии. Спинальная анестезия при данной патологии без подозрения на врастание используется более чем в 65,4 % случаев. При предлежании плаценты с низким подозрением на врастание в стенку матки общая анестезия применяется в 69,2 % случаев, а при высоком подозрении на врастание – в 96,2 % случаев. На основании полученных результатов авторы делают вывод, что в 2/3 случаев при предлежании плаценты используют спинальную анестезию.
В последнее время некоторые авторы предложили, что региональная анестезия может быть приемлемой альтернативой для здоровых пациентов с минимальной степенью инвазии плаценты [15]. Пациенты, выбранные для консервативного лечения, также выигрывают, если отказаться от общей анестезии. Для таких пациентов эпидуральная или комбинированная спинальная эпидуральная анестезия была бы предпочтительнее.

В ситуации с высоким риском конверсия региональной на общую анестезию приветствуется, даже если она не была первоначально запланирована во время гистерэктомии при кесаревом сечении, необходимы из-за неадекватных интраоперационных условий и/или дискомфорта у пациентки.
Несмотря на многолетней опыт проведения анестезии у беременных, до сих пор отсутствуют четкие рекомендации, какую анестезию – общую или регионарную – лучше использовать, и в каких конкретных ситуациях. Особенно остро эта проблема стоит при проведении ургентных хирургических вмешательств, сопровождающихся массивной кровопотерей. Несмотря на то, что большинство анестезиологов во время экстренных операций широко используют общую анестезию, сторонники применения регионарной анестезии утверждают, что она более безопасна, легче переносится пациентками, отмечается более гладкое течение послеоперационного периода и раннее восстановление двигательной активности родильницы.
 Поэтому вопрос в каждом конкретном случае должен решаться
индивидуально.
Поэтому вопрос в каждом конкретном случае должен решаться
индивидуально.МАТЕРИАЛЫ И МЕТОДЫ
48 беременных женщин
с врастанием плаценты, госпитализированные в отделение патологии беременности Областного
перинатального центра (ГАУЗ КО КОКБ им. С.В. Беляева.
Ультразвуковое
исследование матки, плода и плаценты проводилось на аппаратах MinduayDC-55 CW.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Средний возраст женщин составил 33 года. На
каждую пациентку приходилось 4 беременности и 2,5 родов. Все женщины имели в анамнезе
кесарево
сечение.
Врастание плаценты диагностировано по ультразвуковому исследованию у 14 женщин
(29,2 %), полное предлежание плаценты с врастанием – у 9 (18,8 %), полное предлежание плаценты без врастания – у 19
(39,6 %), неполное предлежание плаценты с врастанием – у 5 (10,4 %), без
врастания – у 15 (31,3 %). Отслойка плаценты диагностирована у 17 пациенток
(35,4 %) с предлежанием и врастанием, в связи с этим данные женщины прооперированы в
экстренном порядке, остальные (31 или 64,6 %) в плановом. В 8 случаях (16,7 %)
объем операции расширен до гистерэктомия. В остальных 34 случаях (70,8 %)
– кесарево сечение без расширения объема операции. У 6 женщин (12,5 %)
выполнена метропластика.
В 8 случаях (16,7 %)
объем операции расширен до гистерэктомия. В остальных 34 случаях (70,8 %)
– кесарево сечение без расширения объема операции. У 6 женщин (12,5 %)
выполнена метропластика.
Структура видов используемых анестезий была следующей.
Общая анестезия (ОА) проведена у 17 женщин (35,4 %), которая
применялась при полном предлежании с врастанием плаценты – в 1 случае,
или без врастания плаценты – в 5, в краевом предлежании – в 11. ОА преимущественно
выполнялась в экстренном порядке в связи с отслойкой плаценты, и у двух женщин
в плановом порядке из-за их отказа от проводниковой анестезии.
Комбинированная спинномозговая анестезия (КСМА)
проведена у 4 женщин (8,3 %), при полном предлежании с врастанием – в
1 случае, при неполном предлежании с врастанием – в 3, исключительно в плановом порядке.
Спинномозговая анестезия (СМА) выполнена у 23 женщин (47,9 %). В плановом порядке у 12 женщин,
при полном предлежании с врастанием – в 3 случаях, при краевом – в 2, при полном предлежании без
врастания –
в 3, при краевом – в 4. В экстренном порядке СМА
выполнена у 11 женщин, при полном предлежании без врастания – в 5 случаях,
при краевом – в 6.
В экстренном порядке СМА
выполнена у 11 женщин, при полном предлежании без врастания – в 5 случаях,
при краевом – в 6.
При проведении плановой СМА у 4 женщин (8,3 %)
потребовалась конверсия на общую анестезию. Переход со СМА на ОА связан
с длительностью, привлечением смежных специалистов урологов, сосудистых
хирургов, расширением объема оперативного вмешательства.
Ситуация при
первичном выполнении РА для перехода на ОА обговаривалась с
пациентками заранее. Были получены их предварительные согласия. Это позволяло
анестезиологу быть готовым к конверсии, и делало данную конверсию безопасной
в условиях полной готовности, как персонала, так и необходимого оборудования и
медикаментов. Данная категория пациенток прогнозировалась на предмет трудных
дыхательных путей, составлялся план по решению данной проблемы. Случаев трудной
интубации не было.
При плановом осмотре пациентки с высоким риском
массивного кровотечения при патологии плацентации анестезиолог обсуждал вопросы
по использованию препаратов крови с трансфузиологом, резервируя одногруппную
свежезамороженную фильтрованную карантинизированную плазму не менее четырёх
доз, одногруппную фенотипированную эритроцитарную массу не менее одного литра,
а также не менее десяти доз криопреципитата, тромбоконцентрата или тромбомассы,
предусматривалось в обязательном порядке использование кровесберегающих
технологий. Трансфузиолог звонил на станцию переливания крови, чтобы запросить
препараты крови и информировать о возможности массивного переливания.
Количество и тип запрашиваемых препаратов зависел от прогнозируемой степени
кровотечения, учитывая исходное состояние пациентки (то есть наличие тяжелой
анемии или тромбоцитопении) и ожидаемые ограничения при лечении (редкая группа
крови или сложное совпадение из-за наличия антител).
Трансфузиолог звонил на станцию переливания крови, чтобы запросить
препараты крови и информировать о возможности массивного переливания.
Количество и тип запрашиваемых препаратов зависел от прогнозируемой степени
кровотечения, учитывая исходное состояние пациентки (то есть наличие тяжелой
анемии или тромбоцитопении) и ожидаемые ограничения при лечении (редкая группа
крови или сложное совпадение из-за наличия антител).
В экстренных случаях, когда диагноз «врастание плаценты»
ставился интраоперационно, два анестезиолога
выполняли функцию трансфузиолога для экстренного получения препаратов крови
(эритромассы, криопреципитата), при необходимости осуществлялся вызов бригады
для приготовления тромбомассы). Для экстренной коррекции системы гемостаза при
клинической картине гипокоагуляции, либо подтвержденной тестом Ли Уайта, в
стационаре имеется запас изолированных факторов свертывания крови (Протромплекс 600,
рекомбинантный Фактор VIIa).
Определение объема кровопотери проводилось
гравиметрическим способом и по объему реинфузии. Объем кровопотери варьировал от максимальной 4500 мл
при полном предлежании в сочетании с врастанием, до минимальной – 600 мл
при полном предлежании без врастания. Средний объем кровопотери при плановом
родоразрешении при патологии плацентации без врастания составил 1300 мл, при
экстренном – 1500 мл. При плановом родоразрешении с врастанием плаценты – 1500 мл,
при экстренном – 1850 мл.
Для коррекции гиповолемии были применены кровесберегающие технологии аппаратом CellSaver 5+. Аппаратная реинфузия аутокрови применялась в 35 случаях (72,9 %), при 14 (29,2 %) плановых
операциях и 21 экстренной (43,8 %). Максимальный объем реинфузии
составил 2250 мл при полном предлежании с врастанием плаценты и гистерэктомией,
объеме кровопотери 4,5 литра. В остальных случаях реинфузия составила от 600 мл
до 1500 мл. Возврат аутоэритроцитов осуществлялся через лейкофильтр.
Гемотрансфузия проводилась в 12 случаях (25,0 %).
Повторное использование свежезамороженной плазмы проведено у 4 пациенток (8,3 %).
Во время операции
всем женщинам проводился мониторинг – неинвазивный контроль артериального
давления, частоты сердечных сокращений, электрокардиограммы, оксигенации,
диуреза, лабораторных показателей.
Коррекция
гипотонии вследствие неустойчивой гемодинамики проводилась с применением двух
составляющих компонентов, сочетанного использования вазопрессоров в различных
комбинациях (дофамина, мезатона, норадреналина), а также темпом и объемом
инфузии. Как правило, использовалась рестриктивная тактика возмещения объема
кровопотери.
Все
пациентки в послеоперационном периоде наблюдались в отделении реанимации, где проводились
продленная ИВЛ, контроль клинико-лабораторных показателей систем гомеостаза и
гемостаза, что позволяло избежать материнских осложнений в раннем и позднем послеоперационных
периодах.
Продленная
ИВЛ проводилась четырем пациенткам в течение 4-6 часов. Длительность
нахождения в палате интенсивной терапии составила от 2 до 6 суток.
ЗАКЛЮЧЕНИЕ
Применение предлагаемого метода
региональной анестезии при родоразрешении женщин с врастанием плаценты может
помочь избежать материнских осложнений, которые возможны при общей анестезии,
таких как сложные и неудачные интубации, легочная аспирация, интраоперационное
пробуждение, развитие хронической боли и повышенная материнская заболеваемость.
При сравнении групп с регионарной анестезией и общей было отмечено более редкое
использование гемотрансфузии, снижение объема кровопотери. Кроме того,
способность поддерживать интраоперационное давление крови во время региональной
анестезии было успешным в большинстве случав кесарева сечения при предлежании,
даже в условиях кровотечения.
Учитывая
успешное применение региональной анестезии у пациенток с патологией
плацентации, наши данные свидетельствуют о том, что элективное использование первичной
общей анестезии или преобразованной региональной в общую может оказаться
ненужным у большинства пациенток, перенесших обычное кесарево сечение с
предлежанием плаценты и подозрением на врастание. Однако для тех женщин, кто
желает избежать преобразования интраоперационной региональной анестезии на
общую, для пациенток с высоким хирургическим риском и ожиданием тяжелых
неонатальных исходов, при подтверждении врастания, лучше ограничиться первичной
общей анестезией. Проблема с трудными дыхательными путями может быть сведена к
минимуму при условии наличия достаточных ресурсов в случае необходимости
интраоперационной интубации. И, наоборот, в условиях ограниченных возможностей,
где необходимо защитить дыхательные пути матери, нужно тщательно подходить к выбору
вида анестезии, в первую очередь у пациенток с ожидаемым расширением
хирургического вмешательства или трудными дыхательными путями.
Однако для тех женщин, кто
желает избежать преобразования интраоперационной региональной анестезии на
общую, для пациенток с высоким хирургическим риском и ожиданием тяжелых
неонатальных исходов, при подтверждении врастания, лучше ограничиться первичной
общей анестезией. Проблема с трудными дыхательными путями может быть сведена к
минимуму при условии наличия достаточных ресурсов в случае необходимости
интраоперационной интубации. И, наоборот, в условиях ограниченных возможностей,
где необходимо защитить дыхательные пути матери, нужно тщательно подходить к выбору
вида анестезии, в первую очередь у пациенток с ожидаемым расширением
хирургического вмешательства или трудными дыхательными путями.
Мы признаем, что наши результаты не
могут быть обобщенными для стационаров другого уровня, и мы не можем сравнивать
их с результатами других центров, которые
избирательно проводят преобразование региональной анестезии в общую. Однако
круглосуточная работа нашего центра позволяет оказывать высококвалифицированную
помощь при патологии плацентации, имея в арсенале все необходимое.
Информация о финансировании и конфликте интересов
Исследование
не имело спонсорской поддержки.
Авторы
декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с
публикацией настоящей статьи.
ЛИТЕРАТУРА / REFERENCES:
1. Barinov SV, Medyannikova IV, tirskaya YuI,
Shamina IV, Shavkun IA. Placenta increment in the area of uterine scar after myomectomy:
a combined approach for operative delivery. Russian Bulletin of obstetrician-gynecologist. 2018; 2: 88-91. Russian (Баринов С.В., Медянникова
И.В., Тирская Ю.И., Шамина И.В., Шавкун И.А. Приращение плаценты в области рубца на матке после миомэктомии:
комбинированный подход при оперативном родоразрешении //Российский
вестник акушера-гинеколога. 2018. № 2. С. 88-91)
2. Riveros-Perez
E, Wood C. Retrospective analysis of obstetric and anesthetic
management of patients with placenta accreta spectrum disorders. Int
J Gynaecol Obstet. 2018; 140(3):
370-374
Retrospective analysis of obstetric and anesthetic
management of patients with placenta accreta spectrum disorders. Int
J Gynaecol Obstet. 2018; 140(3):
370-374
3. Khasanov
AA. Diagnostics, prophylaxis and organ-preserving methods of delivery of
pregnant women with placenta ingrowth. Kazan
Medical Journal. 2016; 4: 477-485. Russian (Хасанов А. А. Диагностика,
профилактика и органосохраняющие методы родоразрешения беременных с врастанием
плаценты //Казанский медицинский журнал. 2016. № 4. С. 477-485)
4. Zmora I,
Bas-Lando M, Armon S, Farkash R, Ioscovich A, Samueloff A, Grisaru-Granovsky S.
Risk factors, early and late postpartum complications of
retained placenta: A case control study. Eur J Obstet
Gynecol Reprod Biol. 2019;
236: 160-165
5. Alouini
S, Megier P, Fauconnier A, Huchon C, Fievet A, Ramos A, et al. Diagnosis and management of placenta previa and low
placental implantation. J Matern Fetal Neonatal Med. 2019; 27: 1-6
J Matern Fetal Neonatal Med. 2019; 27: 1-6
6. Taylor
NJ, Russell R. Anaesthesia for abnormally invasive placenta: a
single-institution case series. Int J Obstet
Anesth. 2017; 30: 10-15
7. Einerson
BD, Branch DW. Surgical Management of Placenta Accreta Spectrum. Clin
Obstet Gynecol. 2018; 61(4):
774-782
8. Saha PK,
Bagga R, Kalra JK, Arora A, Singla R, Suri V, et al. An alternate surgical approach to reduce hemorrhage and
complications during cesarean hysterectomy for adherent placenta. Eur
J Obstet Gynecol Reprod Biol. 2018;
228: 215-220
9. Chu Q, Shen D, He L, Wang H, Zhao X, Chen Z, et al. Anesthetic
management of cesarean section in cases of placenta accreta, with versus
without abdominal aortic balloon occlusion: study protocol for a randomized
controlled trial. Trials. 2017; 18(1): 240
10. Orbach-Zinger
S, Weiniger CF, Aviram A, Balla A, Fein S, Eidelman LA, Ioscovich A. Anesthesia management of complete versus incomplete placenta
previa: a retrospective cohort study. J Matern Fetal
Neonatal Med. 2018; 31(9):
1171-1176
Anesthesia management of complete versus incomplete placenta
previa: a retrospective cohort study. J Matern Fetal
Neonatal Med. 2018; 31(9):
1171-1176
11. Bamber JH,
Sobers S. The Need to Consider the Women’s Perspective: Neuraxial Anesthesia
and Cesarean Delivery for Morbidly Adherent Placenta. Anesth
Analg. 2019; 128(4): e56-e57
12. Taheripanah
R, Shoman A, Karimzadeh MA, Zamaniyan M, Malih N. Efficacy of oxytocin versus carbetocin in prevention of
postpartum hemorrhage after cesarean section under general anesthesia: a
prospective randomized clinical trial. J Matern Fetal
Neonatal Med. 2018; 31(21):
2807-2812
13. Markley
JC, Farber MK, Perlman NC, Carusi DA. Neuraxial Anesthesia During Cesarean Delivery for Placenta
Previa With Suspected Morbidly Adherent Placenta: A Retrospective Analysis. Anesth
Analg. 2018; 127(4): 930-938
14. Edwards
HM, Svare JA, Wikkelsø AJ, Lauenborg J, Langhoff-Roos J. The increasing role of a retained placenta in postpartum
blood loss: a cohort study. Arch Gynecol Obstet. 2019; 299(3): 733-740
The increasing role of a retained placenta in postpartum
blood loss: a cohort study. Arch Gynecol Obstet. 2019; 299(3): 733-740
15. Shamshirsaz
AA, Fox KA, Erfani H, Belfort MA. The Role of Centers of Excellence With Multidisciplinary
Teams in the Management of Abnormal Invasive Placenta. Clin
Obstet Gynecol. 2018; 61(4):
841-850
Статистика просмотров
Загрузка метрик …
Ссылки
- На текущий момент ссылки отсутствуют.
Медицинский центр «Консультант» — Группа анестезиологии-реанимации
Это самый технически сложный и вместе с тем самый безопасный вид анестезиологического пособия как для пациента, так и для врача-анестезиолога. Данный вид наркоза может использоваться при любом типе операций, как малых, так и больших, длительных и очень длительных. Полное название эндотрахеальной анестезии звучит так — «многокомпонентная сбалансированная комбинированная анестезия в условиях искусственной вентиляции легких» с использованием внутривенных и газообразных анестетиков. Существует 5 основных составляющих данной анестезии.
Существует 5 основных составляющих данной анестезии.
Аналгезия, или обезболивание
Пациент, идущий на оперативное вмешательство, не должен чувствовать боли. Препараты, обеспечивающие это условие вводятся через периферический катетер, установленный в вену.
Седация, или комфортный сон
Пациент, идущий на операцию, не должен испытывать дискомфорт во время ее проведения (звуки инструмента в операционной, разговоры хирурга с ассистентами и медперсоналом и т.д.). Препараты, обеспечивающие это условие, также вводятся через периферический катетер, установленный в вену.
ИВЛ, или искусственная вентиляция легких
Операция, проводимая по различным причинам, расценивается нашим организмом, как травма, пусть и наносимая с самой благородной целью, но травма. Поэтому проведение операции требует для организма колоссальных энергоресурсов и энергозатрат. Это первая и самая важная причина применения ИВЛ, проводя которую врач-анестезиолог в значительной мере экономит собственные энергоресурсы пациента, которые понадобятся ему для скорейшего заживления раны и выздоровления. Второй, не менее важной причиной, является угнетающее действие препаратов для обезболивания и седации на дыхательный центр центральной нервной системы. С увеличением длительности и объема операции, увеличивается и их дозировка. Пациент как бы «забывает» дышать, точнее он дышит, но недостаточно для обеспечения кислородом организма в условиях травмы. Вот почему функция дыхания пациента замещается или протезируется. Происходит это только на момент операции и незаметно для пациента. После того как пациент обезболен и глубоко спит, в трахею устанавливается одноразовая стерильная интубационная трубка или в ротоглотку- ларингеальная маска. Следует отметить, что как это произойдет, впрочем, как и извлечение этой трубки из трахеи или маски, пациент не будет чувствовать, знать и тем более помнить. Здесь очень важно, чтобы анестезиолог, проводящий операцию, имел достаточный опыт. Следует добавить, что аппарат, который обеспечивает ИВЛ, должен быть очень качественным, так как он будет выдавать пациенту свою особую определенную газовую смесь.
Второй, не менее важной причиной, является угнетающее действие препаратов для обезболивания и седации на дыхательный центр центральной нервной системы. С увеличением длительности и объема операции, увеличивается и их дозировка. Пациент как бы «забывает» дышать, точнее он дышит, но недостаточно для обеспечения кислородом организма в условиях травмы. Вот почему функция дыхания пациента замещается или протезируется. Происходит это только на момент операции и незаметно для пациента. После того как пациент обезболен и глубоко спит, в трахею устанавливается одноразовая стерильная интубационная трубка или в ротоглотку- ларингеальная маска. Следует отметить, что как это произойдет, впрочем, как и извлечение этой трубки из трахеи или маски, пациент не будет чувствовать, знать и тем более помнить. Здесь очень важно, чтобы анестезиолог, проводящий операцию, имел достаточный опыт. Следует добавить, что аппарат, который обеспечивает ИВЛ, должен быть очень качественным, так как он будет выдавать пациенту свою особую определенную газовую смесь. Аппараты ИВЛ в клинике новые, прошедшие необходимые тесты и калибруются перед каждой операцией. Врач-анестезиолог определяет и видит в режиме реального времени сколько по объему пациент вдохнул, сколько выдохнул (с погрешностью до миллилитра), какой газовый состав у вдыхаемого и выдыхаемого воздуха. В любой момент пропорции газовой смеси анестезиолог может изменить, исходя из этапов операции или потребности организма пациента в ту или иную единицу времени.
Аппараты ИВЛ в клинике новые, прошедшие необходимые тесты и калибруются перед каждой операцией. Врач-анестезиолог определяет и видит в режиме реального времени сколько по объему пациент вдохнул, сколько выдохнул (с погрешностью до миллилитра), какой газовый состав у вдыхаемого и выдыхаемого воздуха. В любой момент пропорции газовой смеси анестезиолог может изменить, исходя из этапов операции или потребности организма пациента в ту или иную единицу времени.
Миорелаксация, или расслабление мышц
Необходима по нескольким причинам: нейтрализовать двигательную активность пациента во время сна — пациент спит, и ему во время наркоза снятся сны, не кошмары, а вполне нормальные сны (кто-то плавает в море, кто-то играет в хоккей, кто-то работает). Все это сопровождается движениями, которые могут помешать оперирующему хирургу или попросту расстерилизовать его. Для того, чтобы выполнить ряд операций, особенно это операции на брюшной полости, необходимо, чтобы оперируемый орган также был в покое, это обеспечивает расслабление мускулатуры тела.
Поддержание гомеостаза
Поддержание гомеостаза, или внутренней среды организма, пациента на нормальном уровне — это ряд мероприятий, направленных на помощь организму перенести стресс, травму, операцию. Сюда входит внутривенное введение различных групп лекарственных препаратов: антибиотики, противоаллергические препараты, противорвотные препараты, противовоспалительные, противоотечные, препараты снижающие кровотечение из раны после операции и много других, которые вводятся исключительно по показаниям.
На операционном столе пациент засыпает в течение 20-30 секунд. Засыпает спокойно, без «провалов», галлюцинаций и кошмаров. Просыпается также легко, полное восстановление сознания наступает в течение 15-30 минут после окончания операции.
После операции
Пробуждение после данного типа анестезии спокойное и быстрое, как правило, в течение 15-30 минут сознание восстанавливается полностью, то есть пациент отдает себе отчет, где и по какой причине он находится, что с ним произошло. За пациентом в течение раннего послеоперационного периода постоянно наблюдают медицинская сестра и врач анестезиолог-реаниматолог.
За пациентом в течение раннего послеоперационного периода постоянно наблюдают медицинская сестра и врач анестезиолог-реаниматолог.
Отличительные особенности проведения общей анестезии в клинике:
- Выполнение общей анестезии опытными врачами-анестезиологами, которые информированы о каждом этапе операции и понимают, где и когда стоит быть особенно осторожными.
- Тотальный контроль в режиме реального времени за жизненными функциями организма во время операции. В условиях анестезии обеспечивается мониторинг, включающий в себя контроль АД в динамике, контроль ЧСС в динамике, ЭКГ, контроль за дыхательной функцией организма (степень насыщения крови кислородом и частота дыхания), контроль за температурой тела во время оперативного вмешательства. Такой контроль с постоянным присутствием врача позволяет исключить такие неблагоприятные моменты для пациента как раннее или запоздалое пробуждение, так как малейшее изменение в состоянии пациента будет фиксироваться аппаратурой, а врач моментально предпримет действия для коррекции ситуации.

Тип анестезии, используемой во время кесарева сечения, связан с преходящим тахипноэ новорожденных
На этой странице
РезюмеВведениеРезультатыОбсуждениеСсылкиАвторское правоСтатьи по теме
Цель . Продемонстрировать, чаще ли преходящее тахипноэ новорожденных (ТТН) встречается у женщин, подвергающихся общей или комбинированной эпидурально-спинальной (КЭС) анестезии во время операции кесарева сечения. Методы . Это исследование было проведено ретроспективно. Всего с января 2008 г. по декабрь 2011 г. в нашей клинике было выполнено 1447 кесаревых сечений (КС). Общая анестезия выполнена в 1078 (74,5%) случаях кесарева сечения. Анестезия КЭС была выполнена в 369 случаях.случаев (25,5%). Международная классификация болезней, код Десятого пересмотра P22.1, использовалась для выявления младенцев с ТТН. Стратифицированный многофакторный анализ был проведен в подгруппах для оценки модификации эффекта факторами, которые, как известно, влияют на частоту ТТН: возраст матери, систолическое-диастолическое артериальное давление матери, частота сердечных сокращений, оценка по шкале Апгар на 1-й и 5-й минутах, пол, временной интервал от спинальной блокады. до разреза кожи и интервал времени от разреза кожи до пережатия пуповины. Результаты . Установлено, что частота диагностики ТТН выше у рожениц, перенесших кесарево сечение с сочетанной эпидурально-спинальной анестезией, однако статистических различий не выявлено.
(отношение шансов = 1,471 и 95% ДИ: 0,92–2,35). Выводы . Было обнаружено, что частота ТТН связана с C/S, но не зависит от типа анестезии. Однако для того, чтобы сделать такие выводы, необходимы исследования с более широким спектром пациентов и меньшей количественной разницей между группами.
до разреза кожи и интервал времени от разреза кожи до пережатия пуповины. Результаты . Установлено, что частота диагностики ТТН выше у рожениц, перенесших кесарево сечение с сочетанной эпидурально-спинальной анестезией, однако статистических различий не выявлено.
(отношение шансов = 1,471 и 95% ДИ: 0,92–2,35). Выводы . Было обнаружено, что частота ТТН связана с C/S, но не зависит от типа анестезии. Однако для того, чтобы сделать такие выводы, необходимы исследования с более широким спектром пациентов и меньшей количественной разницей между группами.
1. Введение
TTN является наиболее частой причиной респираторного дистресса у новорожденных [1]. Это определяется как респираторный дистресс, который, как считается, возникает из-за задержки всасывания жидкости из легких плода; он появляется в течение первых шести часов после родов и проходит спонтанно при поддерживающей терапии в течение нескольких дней. Патофизиология транзиторного тахипноэ новорожденных (ТТН) до конца не выяснена. Потенциальные факторы включают отсутствие воздействия повышенного эффекта катехоламинов и других гормонов при родах, которые начинаются до начала родов, и недостаточную активность амилорид-чувствительных эпителиальных натриевых каналов (ENaCs) [2-7]. Сообщалось о других потенциальных факторах риска, таких как отрицательный уровень фосфатидилглицерина в амниотической жидкости, оценка по шкале Апгар < 7, мужской пол и неспособность эвакуировать легочную жидкость плода из-за недостаточного давления в грудной клетке, связанного с родоразрешением путем кесарева сечения (КС) [8]. ].
Потенциальные факторы включают отсутствие воздействия повышенного эффекта катехоламинов и других гормонов при родах, которые начинаются до начала родов, и недостаточную активность амилорид-чувствительных эпителиальных натриевых каналов (ENaCs) [2-7]. Сообщалось о других потенциальных факторах риска, таких как отрицательный уровень фосфатидилглицерина в амниотической жидкости, оценка по шкале Апгар < 7, мужской пол и неспособность эвакуировать легочную жидкость плода из-за недостаточного давления в грудной клетке, связанного с родоразрешением путем кесарева сечения (КС) [8]. ].
Кесарево сечение происходит от латинского глагола «caedere», означающего «резать». Впервые он был использован в 700 г. до н.э. в римскую эпоху для извлечения ребенка из чрева матери, умершей во время родов на поздних сроках беременности. А первое кесарево сечение на живом пациенте было выполнено в 1610 году. Хотя безопасность и оптимальные условия для одного человека являются первоочередными задачами при обычном хирургическом вмешательстве, безопасность матери, плода и новорожденного также должна быть обеспечена. в К/С. И это добавляет новое измерение анестезии при КС. При анестезии при кесаревом сечении используются методы общей и регионарной анестезии.
в К/С. И это добавляет новое измерение анестезии при КС. При анестезии при кесаревом сечении используются методы общей и регионарной анестезии.
Уже общеизвестно, что частота ТТН увеличивается при кесаревом сечении, но имеется лишь ограниченное количество исследований, посвященных влиянию общей или комбинированной эпидурально-спинальной анестезии (CES), используемой при плановых кесаревых сечениях, на заболеваемость ТТН. Цель исследования состояла в том, чтобы определить, связан ли тип анестезии, используемой во время кесарева сечения, с ТТН.
2. Материалы и методы
В период с января 2008 г. по декабрь 2011 г. в научно-исследовательском и учебном госпитале Сема Университета Фатих было проведено 1447 К/С9.0003
Международная классификация болезней, код Десятого пересмотра P22.1, использовалась для выявления младенцев с TTN. Критерии включения: частота дыхания выше 60 в минуту в течение 6 часов после родов, тахипноэ продолжительностью не менее 12 часов, повышенная аэрация на рентгенограмме грудной клетки, уплощение ребер, скопление жидкости в фиссурах и реберно-диафрагмальном углу, застой сосудов и исключение либо известных респираторных (аспирация мекония, респираторный дистресс-синдром, пневмонит и врожденные пороки сердца), либо нереспираторных заболеваний (гипокальциемия, персистирующая гипогликемия и полицитемия). Случаи кесарева сечения, поступившие в отделение интенсивной терапии новорожденных с диагнозом ТТН, были разделены на две группы в зависимости от техники анестезии. Первую группу составили пациенты, получившие общую анестезию, а вторую группу — пациенты, получившие анестезию CES.
Случаи кесарева сечения, поступившие в отделение интенсивной терапии новорожденных с диагнозом ТТН, были разделены на две группы в зависимости от техники анестезии. Первую группу составили пациенты, получившие общую анестезию, а вторую группу — пациенты, получившие анестезию CES.
Неэффективные случаи, многоплодная беременность, преждевременная беременность и новорожденные с аномалиями развития плода и задержкой роста плода были исключены из исследования. Из исследования также исключались беременные женщины с сахарным диабетом, гипертоническими заболеваниями, бронхиальной астмой, которые могли повлиять на кислотно-щелочной баланс.
Триста шестьдесят рожениц, перенесших плановое кесарево сечение под анестезией CES и включенных в это ретроспективное исследование, получили одинаковую анестезию и хирургическую помощь. За два часа до выполнения методики анестезии КЭС всем роженицам через венозный катетер в течение одного часа вводили 1000 мл изотонического раствора. Всем женщинам проводилась профилактика аспирации внутривенным введением ранитидина 50 мг и метоклопрамида 10 мг за полчаса до операции. Рутинный мониторинг включал частоту сердечных сокращений, ЭКГ, среднее артериальное давление (САД) и периферическое насыщение кислородом. Анестезию КЭС проводили в положении сидя по общим правилам асептики и антисептики. Промежутки L3-L4 или L4-L5 идентифицировали относительно гребня подвздошной кости. Спинальная анестезия проводилась спинальной иглой 25G с использованием гипербарического бупивакаина 10 мг + фентанила 10 мг в положении сидя из срединного доступа. Гипотонию, которая определялась снижением САД более чем на 20% по сравнению с исходным уровнем, лечили внутривенным болюсным введением 10 мг эфедрина.
Рутинный мониторинг включал частоту сердечных сокращений, ЭКГ, среднее артериальное давление (САД) и периферическое насыщение кислородом. Анестезию КЭС проводили в положении сидя по общим правилам асептики и антисептики. Промежутки L3-L4 или L4-L5 идентифицировали относительно гребня подвздошной кости. Спинальная анестезия проводилась спинальной иглой 25G с использованием гипербарического бупивакаина 10 мг + фентанила 10 мг в положении сидя из срединного доступа. Гипотонию, которая определялась снижением САД более чем на 20% по сравнению с исходным уровнем, лечили внутривенным болюсным введением 10 мг эфедрина.
Под общей анестезией вводили пропофол в дозе 2 мг/кг. После интубации пациента ингаляционно вводили смесь 50% NO 2 и 50% O 2 .
2.1. Статистический анализ
Статистическая система NCSS (Number Cruncher Statistical System), 2007 г., и PASS (Power Analysis and Sample Size), 2008 г. (Юта, США), статистическое программное обеспечение, использовались для анализа результатов этого исследования для статистического анализа. При анализе данных исследования в дополнение к описательным статистическим методам (среднее, стандартное отклонение, медиана, частота и отношение) в нормально распределенных параметрах использовали -критерий Стьюдента, а в ненормально распределенных параметрах — критерий Манна-Уитни для сравнения. количественные данные между двумя группами. А для сравнения качественных данных использовались критерий хи-квадрат Пирсона и скорректированный критерий хи-квадрата Йейтса (коррекция непрерывности Йейтса). Результаты оценивались в доверительном интервале 95% и на уровне значимости .
При анализе данных исследования в дополнение к описательным статистическим методам (среднее, стандартное отклонение, медиана, частота и отношение) в нормально распределенных параметрах использовали -критерий Стьюдента, а в ненормально распределенных параметрах — критерий Манна-Уитни для сравнения. количественные данные между двумя группами. А для сравнения качественных данных использовались критерий хи-квадрат Пирсона и скорректированный критерий хи-квадрата Йейтса (коррекция непрерывности Йейтса). Результаты оценивались в доверительном интервале 95% и на уровне значимости .
3. Результаты
Общая анестезия выполнена в 1078 (74,5%) случаях кесарева сечения (1-я группа), КЭС-анестезия — в 369 случаях (25,5%) (2-я группа). Всего обследовано 85 (5,87%) доношенных детей, получавших лечение в отделении интенсивной терапии новорожденных по поводу ТТН. Возраст матерей в 85 случаях, наблюдаемых в ОИТН по поводу ТТН, варьировал от 20 до 44 лет, а средний возраст составил 32,25 ± 4,39 года в группе 1 и 32,18 ± 5,27 года в группе 2; в 1-й группе 73,7% мужчин и 26,3% женщин, а во 2-й группе 67,9% были мужчинами и 32,1% женщинами; средняя продолжительность госпитализации в ОИТН составила 4,04 ± 2,74 дня в 1-й группе и 3,57 ± 2,51 дня во 2-й группе без статистически значимых различий между обеими группами. Среднее систолическое и диастолическое артериальное давление составило 115,13±18,76,3±7,9 мм рт.ст. в 1-й группе и 104,09±12,68,4±8,7 мм рт.ст. во 2-й группе; средняя частота пульса составила 78,3 ± 5,1 имп/мин в 1-й группе и 76,2 ± 7,1 имп/мин во 2-й группе без статистически значимых различий между обеими группами (табл. 1).
Среднее систолическое и диастолическое артериальное давление составило 115,13±18,76,3±7,9 мм рт.ст. в 1-й группе и 104,09±12,68,4±8,7 мм рт.ст. во 2-й группе; средняя частота пульса составила 78,3 ± 5,1 имп/мин в 1-й группе и 76,2 ± 7,1 имп/мин во 2-й группе без статистически значимых различий между обеими группами (табл. 1).
Часовое постнатальное значение рН газов крови составило 7,3 ± 0,02 в 1-й группе и 7,3 ± 0,04 во 2-й группе; значение PCO 2 составило 49,0 ± 4,3 в 1-й группе и 47,8 ± 3,7 во 2-й группе; значение РО 2 составило 56,4 ± 2,0 в 1-й группе и 57,0 ± 3,6 во 2-й группе; Оценка по шкале Апгар на 1-й минуте составила 6,1 ± 1,0 для группы 1 и 6,5 ± 0,9 для группы 2; Оценка по шкале Апгар через 5 минут составила 8,3 ± 0,7 для группы 1 и 8,5 ± 0,8 для группы 2 без статистически значимых различий между обеими группами. Все процедуры спинальной анестезии во всех случаях выполнялись одним и тем же анестезиологом. Средний временной интервал от спинальной блокады до кожного разреза составил 8,2 ± 2,93 минуты. Около 80% родов путем кесарева сечения были выполнены одним и тем же гинекологом. Среднее время от разреза кожи до пережатия пуповины составило 2,69 ± 1,8 мин в 1-й группе и 2,48 ± 1,3 мин во 2-й группе. Статистически значимых различий между обеими группами обнаружено не было () (табл. 1).
Около 80% родов путем кесарева сечения были выполнены одним и тем же гинекологом. Среднее время от разреза кожи до пережатия пуповины составило 2,69 ± 1,8 мин в 1-й группе и 2,48 ± 1,3 мин во 2-й группе. Статистически значимых различий между обеими группами обнаружено не было () (табл. 1).
Общая анестезия выполнена в 57 (5,3%), а КСЭ анестезия выполнена в 28 (7,6%) случаях ТТН (табл. 2). Хотя этот показатель был выше у пациентов с анестезией CSE, поскольку число случаев составило 3,9.раз больше в тех случаях, кто имел общую анестезию, не было обнаружено статистических различий между показателями заболеваемости ТТН по типу применяемой анестезии ().
В группе, получавшей спинномозговую анестезию, в 6 % случаев отмечалась тошнота, в 5 % — рвота, в 4 % — седативный эффект, в 53 % — дрожь, в 7,6 % — ТТН.
4. Обсуждение
Ни один анестетик или метод не является идеальным для рожениц. Нормальные самопроизвольные вагинальные роды (NSVD) всегда должны быть основным выбором, поскольку они более физиологичны. Однако в особых случаях, когда NSVD может быть неприменим, выбор анестезии зависит от причины вмешательства, степени его неотложности, потребности пациентки, акушерских требований и опыта анестезиолога. Анестезиолог должен выбрать наиболее безопасный и комфортный для матери метод, обеспечивающий наименее угнетающие условия работы для новорожденного и оптимальные условия труда для проведения операции. При анестезии при кесаревом сечении используются методы общей и регионарной анестезии.
Однако в особых случаях, когда NSVD может быть неприменим, выбор анестезии зависит от причины вмешательства, степени его неотложности, потребности пациентки, акушерских требований и опыта анестезиолога. Анестезиолог должен выбрать наиболее безопасный и комфортный для матери метод, обеспечивающий наименее угнетающие условия работы для новорожденного и оптимальные условия труда для проведения операции. При анестезии при кесаревом сечении используются методы общей и регионарной анестезии.
Общая анестезия дает преимущества в ситуациях, когда существует гонка со временем, включая дистресс плода, выпадение пуповины, предлежание плаценты или выход руки ребенка первым из-за быстрой индукции, а также в ситуациях, когда регионарная анестезия противопоказана, включая коагулопатию, инфекции , и кровотечения, а также когда больной, не имеющий других противопоказаний, не одобряет регионарные методы. Его также можно считать полезным из-за более низкого риска гипотензии, лучшего поддержания стабильности сердечно-сосудистой системы и лучшего контроля дыхательных путей и вентиляции. А рисками общей анестезии являются легочная аспирация желудочного содержимого и трудности с интубацией [2–4].
А рисками общей анестезии являются легочная аспирация желудочного содержимого и трудности с интубацией [2–4].
Регионарная анестезия описывается как удаление нервной проводимости и болевых ощущений в определенных областях тела без потери сознания. Резкое обезболивание было впервые получено с помощью эпидурального и интратекального введения опиоидов в 1979 году. В последние годы предпочтение отдается регионарной анестезии из-за ее преимуществ, включая потребность пациента, пациент в сознании, отсутствие риска аспирации, отсутствие угнетения дыхания у новорожденных и отсутствие атонии матки. . Его побочные эффекты у матери включают нейротоксичность, гипотонию, тошноту, рвоту, угнетение дыхания, задержку мочи, замедленное опорожнение желудка, постдуральную головную боль, полную блокаду позвоночника, синдром передней спинномозговой артерии, боли в спине и животе и гипотермию. А побочные эффекты у плода развиваются в зависимости от системной абсорбции эпидуральных опиоидов или их побочного действия на мать [5].
CES-анестезия может уменьшить некоторые недостатки спинальной и эпидуральной анестезии, сохранив при этом ее преимущества. Анестезия CES гарантирует, что период анестезии, обеспечиваемой эпидуральной анестезией, может быть продлен за счет быстрого начала, эффективности и минимального токсического эффекта, вызванного спинальной блокадой. Анестезия CES вызывает минимальный блок, потому что метод анестезии позволяет титрование препарата. Было продемонстрировано, что он более надежен, поскольку обеспечивает селективную сенсорную блокаду.
Наиболее важной причиной дистресса плода при обоих методах анестезии является уменьшение количества O 2 , доступного для плода в результате уменьшения маточно-плацентарного кровотока. Материнские, плацентарные и эмбриональные факторы играют роль в таком снижении. Действие анестезирующих препаратов бывает прямым или через изменения в организме матери [6].
Когда интервал между индукцией и родами превышает 10 минут при общей анестезии, ткани плода насыщают NO 2 . В результате у новорожденных в первые минуты может возникнуть легкая депрессия, а при недостаточной оксигенации — диффузная гипоксия. Около 80% родов путем кесарева сечения были выполнены одним и тем же гинекологом в нашей больнице. И это привело к стандартизированным интервалам индукции-доставки. Этот интервал оказался равным в среднем трем минутам для обеих групп.
В результате у новорожденных в первые минуты может возникнуть легкая депрессия, а при недостаточной оксигенации — диффузная гипоксия. Около 80% родов путем кесарева сечения были выполнены одним и тем же гинекологом в нашей больнице. И это привело к стандартизированным интервалам индукции-доставки. Этот интервал оказался равным в среднем трем минутам для обеих групп.
Бупивакаин широко используется во время родов, так как он обладает длительным эффектом, более избирательно действует на сенсорные нервные волокна, чем на двигательные, и имеет более низкое соотношение крови плода и матери [7]. При непрерывной эпидуральной инфузии эпидуральные опиоиды редко вызывают угнетение дыхания. Нет существенных различий между оценкой по шкале Апгар и сенсорно-поведенческой оценкой и оценкой детей матерей, не принимавших лекарств. Как правило, это временное явление, которое может быть связано с гипотонией. В нашей больнице 1000 мл физиологического раствора вводили в течение одного часа до операции всем пациентам, получившим анестезию CES, чтобы убедиться в отсутствии гипотонии у матери. Использование 10 мг бупивакаина + 10 мг фентанила применялось во всех случаях в нашей больнице во время анестезии CES. Выполнение всех процедур спинальной анестезии одним и тем же анестезиологом обеспечивало стандартизированный средний интервал времени от спинальной блокады до разреза кожи. Это связано с тем, что в некоторых исследованиях в литературе сообщалось, что сокращение временного интервала от спинальной блокады до начала операции может быть одной из важных мер по снижению частоты ТТН после планового кесарева сечения под спинальной анестезией [9].].
Использование 10 мг бупивакаина + 10 мг фентанила применялось во всех случаях в нашей больнице во время анестезии CES. Выполнение всех процедур спинальной анестезии одним и тем же анестезиологом обеспечивало стандартизированный средний интервал времени от спинальной блокады до разреза кожи. Это связано с тем, что в некоторых исследованиях в литературе сообщалось, что сокращение временного интервала от спинальной блокады до начала операции может быть одной из важных мер по снижению частоты ТТН после планового кесарева сечения под спинальной анестезией [9].].
Уже общеизвестно, что операции кесарева сечения являются важным фактором риска в этиологии ТТН. В нашем исследовании мы планировали изучить взаимосвязь между типом анестезии во время операции и TTN независимо от кесарева сечения. Хотя наше исследование выявило более высокие показатели в случаях, которым проводилась анестезия CES, поскольку число случаев было в 3,9 раза больше в тех случаях, когда применялась общая анестезия, не было обнаружено статистических различий между показателями заболеваемости ТТН в зависимости от типа используемой анестезии. В заключение, было обнаружено, что частота ТТН связана с C/S, но не зависит от типа анестезии. Однако необходимы исследования с более широким спектром пациентов и меньшей количественной разницей между группами, чтобы можно было подтвердить этот вывод.
В заключение, было обнаружено, что частота ТТН связана с C/S, но не зависит от типа анестезии. Однако необходимы исследования с более широким спектром пациентов и меньшей количественной разницей между группами, чтобы можно было подтвердить этот вывод.
Ссылки
B. Kasap, N. Duman, E. Özer, M. Tatli, A. Kumral и H. Özkan, «Транзиторное тахипноэ новорожденных: прогностический фактор для длительного тахипноэ», Pediatrics International , том. 50, нет. 1, стр. 81–84, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Б. Робертс и М. А. Ширли, «Снижение риска кислотной аспирации во время кесарева сечения», Анестезия и обезболивание , том. 53, нет. 6, стр. 859–868, 1974.
Просмотр по адресу:
Google Scholar
К. А. Гертен, Д. В. Кунрод, Р. К. Бэй и Л.
 Р. Чамблисс, «Кесарево сечение и респираторный дистресс-синдром: роды имеют значение?» Американский журнал акушерства и гинекологии , том. 193, нет. 3, стр. 1061–1064, 2005.
Р. Чамблисс, «Кесарево сечение и респираторный дистресс-синдром: роды имеют значение?» Американский журнал акушерства и гинекологии , том. 193, нет. 3, стр. 1061–1064, 2005.Посмотреть по адресу:
Сайт издателя | Google Scholar
Л. К. Гилстроп, Ф. Г. Каррингом и П. Дж. Вав Дорстен, «Кесарево сечение», в Operative Obstetrics , стр. 257–273, Appleton and Lange, 2nd edition, 2002. эпидуральной анестезии при плановом и экстренном кесаревом сечении: отчет о 531 случае», European Journal of Obstetrics Gynecology and Reproductive Biology , vol. 23, нет. 5–6, стр. 369–377, 1986.
Посмотреть по адресу:
Google Scholar
G. Petropoulos, C. Siristatidis, E. Salamalekis и G. Creatsas, «Спинальная и эпидуральная анестезия по сравнению с общей анестезией для планового кесарева сечения в срок: влияние на кислотно-щелочной статус матери и новорожденного», Journal Материнско-фетальной и неонатальной медицины , том.
 13, нет. 4, pp. 260–266, 2003.
13, нет. 4, pp. 260–266, 2003.Посмотреть по адресу:
Google Scholar
H. Finegold, G. Mandell и S. Ramanathan, «Сравнение ропивакаина 0,1%-фентанил и бупивакаин% фентанил 0,125 инфузии для эпидуральной анестезии родов» Канадский журнал анестезии , том. 47, нет. 8, pp. 740–745, 2000.
Просмотр по адресу:
Google Scholar
Т. Л. Гросс, Р. Дж. Сокол и М. С. Квонг, «Транзиторное тахипноэ новорожденных: связь с преждевременными родами и значительной неонатальной заболеваемостью». Американский журнал акушерства и гинекологии , том. 146, нет. 3, pp. 236–241, 1983.
Просмотр по адресу:
Google Scholar
Г. Беррин, Т. Айка, А. Нур, Ф. Фатьма и М. Х. Ибрагим, «Ретроспективный анализ транзиторного тахипноэ новорожденный: связано ли это со спинномозговой анестезией после кесарева сечения?» Gaziantep Tıp Derg , vol.
 18, нет. 2, стр. 77–80, 2012 г.
18, нет. 2, стр. 77–80, 2012 г.Посмотреть по адресу:
Google Scholar
Copyright
Copyright © 2013 Esengül Keleş et al. Эта статья находится в открытом доступе и распространяется в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Анестезия при кесаревом сечении – Ассоциация акушерской анестезии
Варианты анестезии при кесаревом сечении в госпитале Mercy Hospital St. Louis
В целом, для кесарева сечения (КС) доступны два типа анестезии: регионарная анестезия (онемение тела от груди вниз) или общая анестезия (отход ко сну). . Общая анестезия обычно используется только в том случае, если этого требует состояние здоровья матери или в случае неотложной помощи, когда нет времени на выполнение блокады.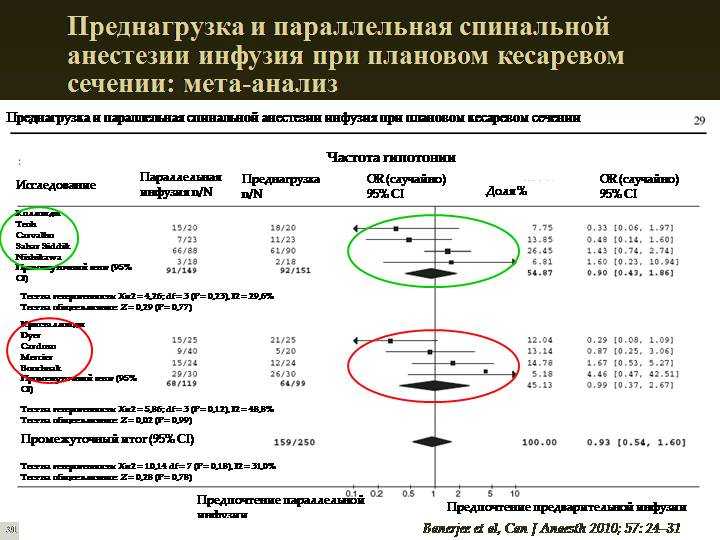 Во всех случаях член бригады анестезиологов находится с вами с самого начала анестезии, на протяжении всей операции, пока вас не доставят в послеоперационную палату, где медсестра продолжит ваше лечение.
Во всех случаях член бригады анестезиологов находится с вами с самого начала анестезии, на протяжении всей операции, пока вас не доставят в послеоперационную палату, где медсестра продолжит ваше лечение.
Факты о регионарной анестезии
Регионарная анестезия включает введение лекарственных препаратов в различные области, окружающие спинной мозг, для обезболивания и контроля боли. Это можно сделать с помощью эпидуральной, спинальной или комбинированной спинально-эпидуральной (КСЭ). Эти процедуры немного отличаются по тому, как они выполняются и как быстро вы немеете, но они очень похожи. Во всех случаях ваша спина будет очищена дезинфицирующим средством, чтобы снизить риск заражения, ваша кожа и более глубокие ткани будут обезболены инъекцией обезболивающего лекарства, и будет определено подходящее место. Если проводится эпидуральная анестезия или КСЭ, будет установлен эпидуральный катетер. Если делают спинальную анестезию, лекарство вводят, и в спине ничего не остается. Конечным результатом любой из этих техник является блок, из-за которого вы немеете от груди до кончиков пальцев ног и не можете двигать ногами в течение 9 секунд.0 минут или дольше. Ваш блок будет проверен, чтобы убедиться, что он адекватен до начала операции. Вы можете ожидать, что во время операции вы почувствуете некоторое тянущее и тянущее усилие, но вы не должны чувствовать боль. Если у вас есть боль, анестезиолог может дать дополнительные лекарства или даже общую анестезию, если это необходимо. В область позвоночника будут введены лекарства для облегчения боли в течение первого или двух дней после операции.
Конечным результатом любой из этих техник является блок, из-за которого вы немеете от груди до кончиков пальцев ног и не можете двигать ногами в течение 9 секунд.0 минут или дольше. Ваш блок будет проверен, чтобы убедиться, что он адекватен до начала операции. Вы можете ожидать, что во время операции вы почувствуете некоторое тянущее и тянущее усилие, но вы не должны чувствовать боль. Если у вас есть боль, анестезиолог может дать дополнительные лекарства или даже общую анестезию, если это необходимо. В область позвоночника будут введены лекарства для облегчения боли в течение первого или двух дней после операции.
Льготы:
- Вы бодрствуете в связи с рождением ребенка, и ваш помощник может быть с вами все это время.
- Практически никакие лекарства не идут вашему ребенку.
- Обычно считается более безопасным, чем общая анестезия.
Риски
- Могут возникнуть побочные эффекты, такие как озноб, зуд, падение артериального давления, тошнота/рвота и ощущение затрудненного дыхания из-за онемения грудной клетки.

- Примерно в 1 из 100 случаев (1%) после процедуры может возникнуть сильная головная боль, для лечения которой может потребоваться процедура. Это называется спинальной головной болью.
- Временное повреждение нерва, которое длится от нескольких дней до нескольких недель и может вызвать боль, онемение или слабость в этой области, происходит примерно в 1–2 случаях на 10 000.
- Чрезмерно высокий блок, высокий позвоночник, случается 1 из 15 000 раз и может вызвать потерю сознания, крайне низкое кровяное давление, затрудненное дыхание и потребовать немедленных родов.
- Очень редко (примерно в 1 случае из 100 000) блокада может вызвать необратимое повреждение нерва, судороги из-за токсичности лекарств, инфекции или кровотечения.
- Остановка сердца и острая аллергическая реакция (анафилаксия) происходят с частотой 1 случай на 500 000.
Факты об общей анестезии
Общая анестезия требуется в некоторых случаях, когда хирургическое вмешательство является неотложным или когда состояние здоровья матери делает опасным проведение регионарной анестезии. Для общей анестезии вам дают кислород, чтобы вы могли дышать через маску, пока хирурги готовятся вас оперировать. Непосредственно перед началом операции вам введут лекарство через внутривенный катетер (IV), чтобы вы потеряли сознание, и вставят дыхательную трубку. Вы будете оставаться без сознания на протяжении всей операции и проснетесь в конце, когда дыхательная трубка будет удалена. Ваша боль будет контролироваться внутривенными обезболивающими препаратами. Если ваше состояние стабильно, вашему партнеру обычно разрешают войти в операционную (обычно после родов), чтобы увидеть ребенка, сфотографироваться и т. д.
Для общей анестезии вам дают кислород, чтобы вы могли дышать через маску, пока хирурги готовятся вас оперировать. Непосредственно перед началом операции вам введут лекарство через внутривенный катетер (IV), чтобы вы потеряли сознание, и вставят дыхательную трубку. Вы будете оставаться без сознания на протяжении всей операции и проснетесь в конце, когда дыхательная трубка будет удалена. Ваша боль будет контролироваться внутривенными обезболивающими препаратами. Если ваше состояние стабильно, вашему партнеру обычно разрешают войти в операционную (обычно после родов), чтобы увидеть ребенка, сфотографироваться и т. д.
Преимущества:
На самом деле у общей анестезии нет никаких преимуществ перед регионарной анестезией, за исключением того, что она может быть быстрее в экстренных случаях, а некоторые медицинские условия могут сделать региональную анестезию небезопасной для матери.
Риски
- Ваш партнер не может быть с вами и младенцем все время.
- Ты не будешь помнить рождения своего ребенка.



 Р. Чамблисс, «Кесарево сечение и респираторный дистресс-синдром: роды имеют значение?» Американский журнал акушерства и гинекологии , том. 193, нет. 3, стр. 1061–1064, 2005.
Р. Чамблисс, «Кесарево сечение и респираторный дистресс-синдром: роды имеют значение?» Американский журнал акушерства и гинекологии , том. 193, нет. 3, стр. 1061–1064, 2005. 13, нет. 4, pp. 260–266, 2003.
13, нет. 4, pp. 260–266, 2003. 18, нет. 2, стр. 77–80, 2012 г.
18, нет. 2, стр. 77–80, 2012 г.
