Летняя болезнь — энтеровирусная инфекция
14.06.2021Лето — пора отпусков и отдыха, когда мы балуем себя и своих детей свежими овощами и фруктами, стремимся выехать на природу, к озёрам и рекам. Вот только радость от общения с природой может омрачить… энтеровирусная инфекция, риски заболеть которой возрастают в тёплые месяцы года. Что это за болезнь и как от неё защититься?
Энтеровирусная инфекция – инфекционное заболевание, вызываемое определённым видом кишечных вирусов. Энтеровирусы (ЭВИ) имеют много разновидностей и характеризуются многообразием клинической картины вызываемых ими заболеваний. Они могут поражать слизистые оболочки, мышцы, центральную нервную систему. Основными возбудителями являются вирусы Коксаки А, Коксаки В, ECHO, энтеровирусы 68-71 типов.
Специалисты напоминают, что источником энтеровирусной инфекции является больной человек или носитель инфекции без клинических проявлений.
Инфекция передается через воду и пищу, контактно-бытовым, воздушно-капельным путями. Факторами передачи могут быть недостаточно обработанные овощи, фрукты, зелень, игрушки, грязные руки, сырая вода и приготовленный из нее лед, а также другие объекты внешней среды, загрязненные энтеровирусами.
Важно знать, что энтеровирусы устойчивы во внешней среде: хорошо переносят низкие температуры (в условиях холодильника они сохраняются в течение нескольких недель), в водопроводной воде выживают до 18 дней, могут сохраняться на предметах обихода, продуктах питания (молоко, фрукты, овощи). Этиловый спирт (70% и более высокой концентрации) убивает энтеровирусы при экспозиции не менее 3-х часов. Энтеровирусы погибают под воздействием ультрафиолетового облучения, при высушивании и кипячении.
ЭВИ характеризуется разнообразием клинических форм и симптомов болезни (температура 39-40 С, головная и мышечная боль, сыпь, тошнота, рвота, герпетическая ангина, жидкий стул, конъюнктивит и др. ).
).
В большинстве случаев заболевание проходит без осложнений, но возможны и тяжелые формы проявления болезни. Наиболее опасен серозный менингит, который сопровождается сильными головными болями, лихорадкой, рвотой.
ЭВИ отличается высокой контагиозностью с быстрым распространением заболевания. При отсутствии ранней изоляции больных в течение 2-3 недель может переболеть до 60 – 80% детского коллектива, поэтому в детских коллективах (школах, летних лагерях, детских садах и др.) особенно важно проведение профилактических мероприятий.
Запомните несколько простых правил личной гигиены, соблюдая которые вы значительно уменьшаете шансы встретиться с энтеровирусом:
-
Для питья используйте только кипяченую или бутилированную воду;
Мойте руки с мылом перед каждым приемом пищи и после каждого посещения туалета;
-
Обеспечьте индивидуальный набор посуды для каждого члена семьи, особенно для детей;
-
Перед употреблением овощей и фруктов (в том числе бананов, арбузов, дынь) их необходимо тщательно мыть с применением щетки и последующим ополаскиванием кипятком;
-
Употребляйте в пищу доброкачественные продукты, не приобретайте продукты питания у частных лиц, в неустановленных для торговли местах;
-
Купайтесь только в официально разрешенных местах, при купании старайтесь не заглатывать воду;
-
Чаще проветривайте комнаты, влажную уборку проводите с применением дезинфицирующих средств.

Если вам не удалось уберечься от заболевания, и у вас появились клинические проявления инфекционного заболевания (повышение температуры тела, головная боль, рвота и другое) – не занимайтесь самолечением, а обратитесь за квалифицированной медицинской помощью.
Просмотров: 323Энтеровирусная инфекция
Основные возбудители:
- Коксаки A (24 серотипа),
- Коксаки B (6 серотипов),
- ECHO (34 серотипа)
- неклассифицированные энтеровирусы человека 68 — 71 типов.
Энтеровирус – это опасно?
Большинство энтеровирусных инфекций протекают легко. Но некоторые штаммы могут вызывать более тяжелые заболевания, особенно у маленьких детей.
Как происходит заражение?
Источник инфекции – человек (больной или носитель).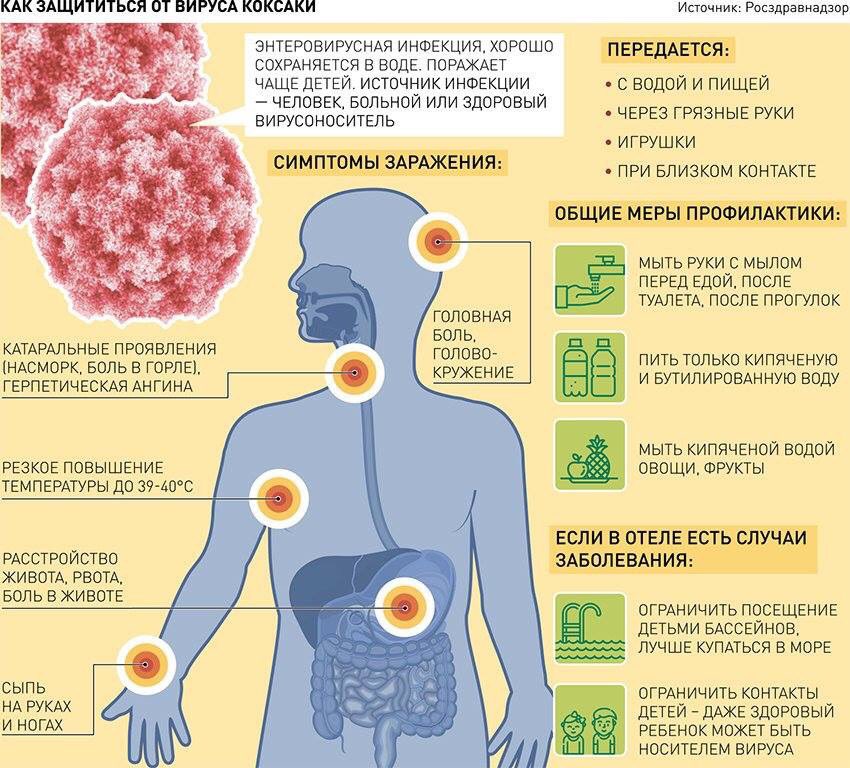 Заражение происходит воздушно-капельным путем, через пыль, а также водным, пищевым и контактно-бытовым путями. Вода открытых водоемов, загрязненная сточными водами, как в качестве источников питьевого водоснабжения, так и используемая в качестве зон для купания населения -наиболее опасна в плане передачи инфекции. Инкубационный период длится 1-10 дней.
Заражение происходит воздушно-капельным путем, через пыль, а также водным, пищевым и контактно-бытовым путями. Вода открытых водоемов, загрязненная сточными водами, как в качестве источников питьевого водоснабжения, так и используемая в качестве зон для купания населения -наиболее опасна в плане передачи инфекции. Инкубационный период длится 1-10 дней.
Кто может заразиться?
Энтеровирусами может заразиться любой Чаще всего заражаются и заболевают дети, младенцы и подростки, т.к они еще не обладают иммунитетом (защитой) от предыдущих воздействий этих вирусов.
Имеет ли заболевание сезонность?
Вспышки энтеровирусной инфекции преимущественно возникают в летне-осенний период, но отдельные случаи встречаются в течение всего года.
Как протекает инфекция?
Энтеровирусная инфекция характеризуется разнообразием клинических проявлений и множественными поражениями органов и систем: серозный менингит, геморрагический конъюнктивит, синдром острого вялого паралича, заболевания с респираторным синдромом и другие.
Один и тот же серотип энтеровируса способен вызывать развитие нескольких клинических синдромов и, наоборот, различные серотипы энтеровирусов могут вызвать сходные клинические проявления болезни. Наибольшую опасность представляют тяжелые формы инфекции с поражением нервной системы.
Как защититься?
Соблюдение правил личной гигиены имеет жизненно важное значение для предотвращения распространения энтеровирусных инфекций.
Правила гигиены:
- мытье рук с мылом
- тщательное мытье овощей и фруктов перед употреблением
- приобретение продуктов питания только в санкционированных местах
- термическая обработка продуктов
- купание только в разрешенных местах
- соблюдение гигиены во время купания (не заглатывать воду)
- недопущение контактов с инфицированными людьми, особенно с сыпью
- пить только бутилированную воду
При подозрении на инфекционное заболевание – немедленно обратитесь к врачу.
Совещание с фельдшерами ФАПов и медицинскими сестрами ДДУ на тему: «Энтеровирусная инфекция»
В связи с учащением случаев энтеровирусной инфекции на территории Ульяновской области 27.10.2016 проведено совещание с фельдшерами ФАПов и медицинскими сестрами ДДУ на тему: «Энтеровирусная инфекция».
Ключевыми вопросами стали:
- эпидемиологическая характеристика возбудителя ЭВИ
- основные клинические формы с демонстрацией фотографий
- диагностика и лечение легких форм ЭВИ
- тактика фельдшера при подозрении на ЭВИ
- основные нормативные документы по профилактике ЭВИ
- работа в очаге ЭВИ
Информация для населения Майнского района.
Энтеровирусные инфекции – это группа заболеваний, в основе причин которых лежит несколько разновидностей вирусов, характеризующихся множеством клинических проявлений.
Энтеровирусной инфекцией ребенок может болеть несколько раз за свою жизнь. Так же эта особенность не позволяет разработать вакцину, чтобы защитить наших детей от данного заболевания. Заболевание имеет сезонность: вспышки заболевания чаще всего наблюдаются в летне-осенний период.
Причины заражения энтеровирусной инфекцией.
Заражение происходит несколькими путями. Вирусы в окружающую среду могут попадать от больного ребенка или от ребенка, который является вирусоносителем. У вирусоносителей нет никаких проявлений заболеваний, однако вирусы находятся в кишечнике и выделяются в окружающую среду с калом. Такое состояние может наблюдаться у переболевших детей после клинического выздоровления либо у детей, у которых вирус попал в организм, но не смог вызвать заболевание из-за сильного иммунитета ребенка. Вирусоносительство может сохраняться на протяжении 5 месяцев.
Как передается энтеровирусная инфекция.
Механизм передачи может быть воздушно-капельный (при чихании и кашле с капельками слюны от больного ребенка к здоровому) и фекально-оральный при не соблюдении правил личной гигиены. Чаще всего заражение происходит через воду, при употреблении сырой (не кипяченой) воды. Так же возможно заражение детей через игрушки, если дети их берут в рот. Болеют чаще всего дети в возрасте от 3 до 10 лет.
Чаще всего заражение происходит через воду, при употреблении сырой (не кипяченой) воды. Так же возможно заражение детей через игрушки, если дети их берут в рот. Болеют чаще всего дети в возрасте от 3 до 10 лет.
Симптомы энтеровирусной инфекции.
- Повышение температуры тела до 38-39º С. Температура чаще всего держится 3-5 дней, после чего снижается до нормальных цифр. Очень часто температура имеет волнообразное течение: 2-3 дня держится температура, после чего снижается и 2-3 дня находится на нормальных цифрах, затем снова поднимается на 1-2 дня и вновь нормализуется уже окончательно.
- При повышении температуры ребенок ощущает слабость, сонливость, может наблюдаться головная боль, тошнота, рвота.
- При поражении слизистой оболочки полости рта развивается герпетическая ангина. Она проявляется повышением температуры тела, общей интоксикацией (слабость, головная боль, сонливость) и наличием везикулярной сыпи в виде пузырьков, заполненных жидкостью, на слизистой ротоглотки и миндалинах.
 Пузырьки эти лопаются, на их месте образуются язвочки, заполненные белым налетом. После выздоровления на месте язвочек не остается никаких следов.
Пузырьки эти лопаются, на их месте образуются язвочки, заполненные белым налетом. После выздоровления на месте язвочек не остается никаких следов. - При поражении глаз развивается конъюнктивит. Он может быть одно- и двусторонним. Проявляется в виде светобоязни, слезотечения, покраснения и припухлости глаз. Возможно наличие кровоизлияний в конъюнктиву глаза.
- При поражении кишечника- кишечная энтеровирусная инфекция. Стул обычной окраски (желтый или коричневый), жидкий(водянистый), без патологических (слизь, кровь) примесей. Появление жидкого стула может быть как на фоне повышение температуры, так, и изолировано (без повышения температуры тела).
- При поражении кожи возможно появление экзантемы – гиперемия (красное окрашивание) кожи, чаще всего на кистях, стопах, вокруг рта
- При поражении нервной системы могут развиваться энцефалиты, менингиты. У ребенка наблюдается: сильная головная боль, тошнота, рвота, повышение температуры тела, судороги, парезы и параличи, потеря сознания.

Диагностика энтеровирусной инфекции.
Для постановки точного диагноза берутся смывы из носа, зева или из ануса ребенка, в зависимости от симптомов заболевания. Смывы высеваются на клеточные культуры, и после инкубации на протяжении 4 дней проводят полимеразную цепную реакцию (ПЦР). Так как это занимает довольно длительное время, диагноз ставят на основании клинических проявлений (симптомов), а ПЦР служит только для подтверждения диагноза и не влияет на проводимое лечение.
Профилактика энтеровирусной инфекции.
Для профилактики необходимо соблюдение правил личной гигиены: мыть руки после посещения туалета, прогулки на улице, пить только кипяченую воду или воду из заводской бутылки, недопустимо использование для питья ребенка воды из открытого источника (река, озеро).
Специфической вакцины против энтеровирусной инфекции не существует, так как в окружающей среде присутствует большое количество серотипов этих вирусов.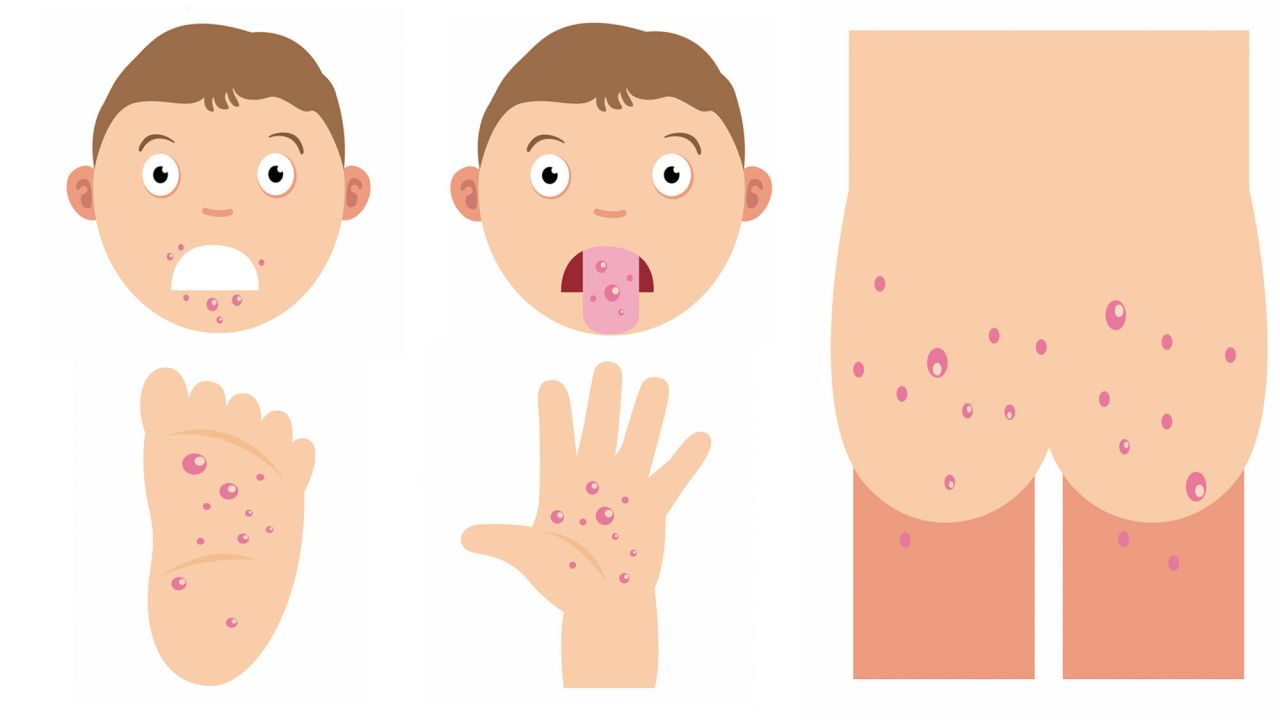 Однако в Европе часто используют вакцины, содержащие наиболее часто встречающиеся энтеровирусные инфекции (Коксаки А-9, В-1, ЕСНО-6). Использование таких вакцин снижает риск заболеваемости у детей энтеровирусными инфекциями.
Однако в Европе часто используют вакцины, содержащие наиболее часто встречающиеся энтеровирусные инфекции (Коксаки А-9, В-1, ЕСНО-6). Использование таких вакцин снижает риск заболеваемости у детей энтеровирусными инфекциями.
При первых признаках заболевания у ребенка – незамедлительно обращайтесь к врачу!!!
Врач педиатр Багдалова Галия Марсовна
Энтеровирусные инфекции особенно опасны для детей
В пресс-центре Издательского дома «Комсомольская правда-Самара» состоялась пресс-конференция «Как самарцам пережить сезон энтеровирусных инфекций».
В разговоре приняли участие главный внештатный специалист министерства здравоохранения Самарской области по инфекционным болезням у детей Сергей Михайлович Китайчик и заместитель начальника отдела эпиднадзора Управления Роспотребнадзора по Самарской области Елена Михайловна Меркулова.
Как сообщила Е.М. Меркулова, в этом году складывается сложная ситуация по энтеровирусным инфекциям. Эпидемиологи знают, что после так называемой «эпидемической ямы», которая пришлась на 2015 год, когда было зарегистрировано всего 7 случаев энтеровирусной инфекции, неминуемо наступит подъем заболеваемости. Так и случилось. В 2013 году на территории Самарской области был зафиксирован подъем заболеваемости энтеровирусными инфекциями. Тогда было зарегистрировано 207 случаев, причем, речь идет о лабораторно подтвержденных случаях заболевания. Хотя на деле заразившихся и переболевших гораздо больше. Заболевание может протекать бессимптомно или в легкой форме, и люди не обращаются к врачу за консультацией.
Наибольшую опасность представляют энтеровирусные инфекции для детей. В основном болеют дети от 7 до 14 лет. На сегодняшний день по предварительным диагнозам зарегистрировано 183 случая энтеровирусных инфекций. 70% из них – серозный менингит. Это наиболее распространенная инфекция, вызываемая энтеровирусами. Среди инфекционных поражений ЦНС частота заболевания менингитом составляет до 80%. Вспышки этого заболевания отмечаются в летне-осенний период.
Среди инфекционных поражений ЦНС частота заболевания менингитом составляет до 80%. Вспышки этого заболевания отмечаются в летне-осенний период.
Главный совет, который дают специалисты родителям заболевших детей – обратитесь в лечебное учреждение к участковому педиатру. При необходимости врач направит ребенка в инфекционную больницу. А вот самолечением заниматься опасно.
Количество возбудителей, которые вызывают энтеровирусные инфекции, насчитывает более 80 серотипов. В текущем году превалирующий возбудитель – вирус Коксаки. Основной путь заражения – фекально-оральный, реже — воздушно-капельный. Заразность энтеровирусных инфекций велика – до 70% лиц из окружения больного с большой вероятностью могут подхватить вирус.
С.М. Китайчик рассказал, как распознать энтеровирусную инфекцию. Инфекция имеет более 10 клинических форм. Чаще всего наблюдаются катар верхних дыхательных путей, сильные боли в горле, высыпания на нёбе, высокая температура, сыпь, интоксикация, боли в суставах. Эти клинические симптомы должны насторожить родителей и заставить их обратиться за медицинской помощью в поликлинику.
Эти клинические симптомы должны насторожить родителей и заставить их обратиться за медицинской помощью в поликлинику.
С диагнозом «менингит» и с подозрением на серозный менингит сейчас в инфекционной больнице находятся более 110 детей школьного возраста. Заражение чаще всего происходит при купании, употреблении зараженной воды, продуктов питания.
«Как не заболеть энтеровирусной инфекцией и, в частности, серозным менингитом? Профилактических прививок от этих заболеваний не существует, — пояснил Китайчик. – Главное, что убережет от заражения вас и ваших детей – это правила личной гигиены. Мыть руки перед едой и после посещения туалета обязательно! Необходимо строго следить за детьми в бассейнах и открытых водоемах. Нельзя позволять ребенку нырять, заглатывать воду при купании. Кстати, недопустимо пить воду из необорудованных для этого источников, даже если это родник. Если в семье есть заболевший, надо изолировать его от окружающих. При этом надо сразу обращаться в медицинское учреждение. Ибо под маской одного инфекционного заболевания может скрываться более грозное, чреватое осложнениями. А самостоятельное использование большого количества жаропонижающих средств может привести к тяжелым поражениям печени и почек и даже изменить состав крови, вызвать тяжелые лейкемические реакции».
Ибо под маской одного инфекционного заболевания может скрываться более грозное, чреватое осложнениями. А самостоятельное использование большого количества жаропонижающих средств может привести к тяжелым поражениям печени и почек и даже изменить состав крови, вызвать тяжелые лейкемические реакции».
Серозный менингит начитается остро, с резкого повышения температуры, немотивированной и не приносящей облегчения рвоты, сильной головной боли. Эти симптомы – повод для срочного обращения к врачу. Только врач может определить и поставить диагноз «серозный менингит». Если же упустить время, может наступить мозговая кома, которая резко сокращает шансы на выздоровление ребенка. Лечение серозного менингита возможно только в условиях стационара.
Осложнения при серозном менингите, как при любой вирусной инфекции, могут привести к поражению сердца, суставов, желудочно-кишечного тракта, снижению зрения, слуха, интеллекта. Но раннее выявление серозного менингита и своевременное лечение позволят избежать непредсказуемого результата.
Пресс-служба министерства здравоохранения
Как не заразиться вирусом Коксаки на отдыхе
Коксаки – энтеровирус, передающийся водным, контактно-бытовым и воздушно-капельным путями. Энтеровирусы хорошо переносят низкие температуры и сохраняются в воде. Источником инфекции является человек, вирус весьма эффективно распространяется при попадании небольшой дозы с водой, пищей, через грязные игрушки, руки.
Признаки заболевания
Инкубационный период после заражения составляет от 2 до 10 дней. Болеют Коксаки чаще всего дети от 4 до 6 лет. Основные симптомы при развитии заболевания — высокая температура, понос и рвота, а также пузырьки и язвочки на слизистой рта и коже. При первых признаках ухудшения самочувствия следует обращаться за медицинской помощью. Большинство людей после заражения полностью восстанавливают здоровье. Обычно вирус развивается умеренно, и многие пациенты выздоравливают в течение 7-10 дней.
Профилактика
Ни прививок, ни лекарств конкретно от этого вируса нет. В целях профилактики заболеваний вирусом Коксаки и другими энтеровирусными инфекциями Роспотребнадзор рекомендует туристам соблюдать правила личной гигиены, тщательно мыть руки с мылом перед едой, после посещения туалета, а также после возвращения с прогулок. Кроме того, эксперты ведомства советуют пить только бутилированную или кипяченую воду, тщательно мыть фрукты, ягоды, овощи и соблюдать температурные условия хранения пищи. Есть лучше только продукты с известными сроками хранения.
В случае если на отдыхе сложилась неблагополучная эпидемиологическая обстановка, стоит ограничить допуск детей в бассейны и детские клубы отеля.
В то же время, по данным страховых компаний, вероятность заразиться вирусом Коксаки в Турции невысока. Доля обратившихся к страховщикам российских туристов, у которых был диагностирован вирус, составляет не более 0,01% от общего количества всех прибывших на отдых в страну россиян. Сообщения о единичных случаях заражения вирусом появляются в соцсетях каждое лето, причем происходят они далеко только в Турции, но и во многих других жарких странах.
Сообщения о единичных случаях заражения вирусом появляются в соцсетях каждое лето, причем происходят они далеко только в Турции, но и во многих других жарких странах.
Анализ на энтеровирус
Энтеровирусные инфекции – большая группа острых инфекционных заболеваний, характеризующихся лихорадкой и полиморфизмом клинических симптомов, обусловленных поражением ЦНС, сердечно-сосудистой системы, ЖКТ, мышечной системы, легких, печени, почек и др. органов.
Возбудителями заболевания являются энтеровирусы Коксаки А, В и ЭКХО. Это РНК-содержащие вирусы, малых размеров (18–30 нм), длительно сохраняются во внешней среде и пищевых продуктах, чувствительны к нагреванию свыше 56°С, хлорсодержащим дезинфицирующим растворам, ультрафиолетовому облучению. Размножаются на культуре тканей, обладают цитопатогенным действием.
Источник инфекции – больной человек или вирусоноситель.
Выделение энтеровирусов с фекалиями происходит с первого дня болезни и на протяжении двух недель, из носоглотки – в течение первой недели болезни. Длительность вирусоносительства после перенесенной инфекции от 5 до 15 мес.
Длительность вирусоносительства после перенесенной инфекции от 5 до 15 мес.
Механизмы передачи инфекции – фекально-оральный, воздушно-капельный, трансплацентарный.
Восприимчивость к энтеровирусным инфекциям всеобщая и высокая, но чаще болеют дети в возрасте от 3 до 10 лет. Инфекция высококонтагиозная, может протекать как спорадически, так и в виде групповых вспышек в детских коллективах; сезонность – весенне-летне-осенняя. Иммунитет нестойкий, типоспецифический.
Входные ворота инфекции – слизистые оболочки верхних дыхательных путей или пищеварительного тракта, где вирус размножается, накапливается и вызывает местную воспалительную реакцию, что проявляется симптомами герпетической ангины, ОРЗ, фарингита или кишечной дисфункцией. В результате последующей вирусемии вирусы гематогенно разносятся по всему организму и оседают в различных органах и тканях.
Тропность энтеровирусов к нервной ткани, мышцам, эпителиальным клеткам обусловливает многообразие клинических форм инфекции. При проникновении вируса в ЦНС возможно ее поражение с развитием асептического менингита, менингоэнцефалита или паралитических полиомиелитоподобных форм.
При проникновении вируса в ЦНС возможно ее поражение с развитием асептического менингита, менингоэнцефалита или паралитических полиомиелитоподобных форм.
Вирусы ЭКХО обычно не диссеминируют из мест первичного проникновения, лишь иногда гематогенно заносятся в другие органы.
Клинические проявления энтеровирусных инфекций
Инкубационный период длится от 2-х до 7 дней. Начало заболевания острое, внезапное, бурное, температура быстро повышается до 39°–40° С, нередко с ознобом. Больных беспокоят сильная головная боль, головокружение, расстройство сна. Характерен внешний вид больного – яркие щеки и губы, гиперемия конъюнктив, инъекция сосудов склер, бледный носогубный треугольник. Часто отмечаются боли в животе, тошнота, могут быть рвота, диарея или запоры. Течение большинства форм доброкачественное, длительностью 3–7 дней, но склонное к рецидивам и волнообразному течению.
Выделяют несколько клинических форм энтеровирусной инфекции, которые могут быть либо единственным проявлением болезни либо комбинироваться с другими формами.
1. Герпетическая ангина. В первые сутки заболевания появляются красные папулы, которые располагаются на умеренно гиперемированной слизистой небных дужек, язычка, мягком и твердом нёбе, быстро превращаются в везикулы размером 1–2 мм, числом от 3–5 до 15–18, не сливающиеся между собой. Через 1–2 дня пузырьки вскрываются с образованием эрозий либо бесследно рассасываются к 3–6 дню болезни. Боль при глотании отсутствует или незначительная, иногда появляется слюнотечение. Увеличение шейных и подчелюстных лимфоузлов небольшое, но пальпация их болезненна.
2. Эпидемическая миалгия (болезнь Борнхольма, «чертова пляска», плевродиния). Характеризуется острыми болями с локализацией в мышцах передней брюшной стенки живота, нижней части грудной клетки, спине, конечностях. Боли носят приступообразный характер, продолжительностью от 30–40 секунд до 15–20 минут, повторяются на протяжении нескольких дней, могут носить рецидивирующий характер, но уже с меньшей интенсивностью и продолжительностью.
Менингеальный синдром сохраняется от 2–3 дней до 7-10 дней, санация ликвора происходит на 2-й — 3-й неделе. Возможны остаточные явления в виде астенического и гипертензионного синдромов.
Из других неврологических симптомов при менингите энтеровирусной этиологии могут быть расстройства сознания, повышение сухожильных рефлексов, отсутствие брюшных рефлексов, нистагм, клонус стоп, кратковременные глазодвигательные расcтройства.
4. Паралитические формы энтеровирусной инфекции отличаются полиморфизмом: могут развиться спинальная, бульбоспинальная, понтинная, полирадикулоневрическая формы. Чаще других встречается спинальная форма, которая характеризуется развитием острых вялых параличей одной или обеих ног, реже – рук с выраженным болевым синдромом мышечного характера. Течение этих форм легкое, не оставляет стойких парезов и параличей.
5. Энтеровирусная лихорадка (малая болезнь, 3-х дневная лихорадка). Это наиболее частая форма энтеровирусной инфекции, но трудно диагностируемая при спорадической заболеваемости. Характеризуется кратковременной лихорадкой без выраженных симптомов локальных поражений. Протекает с умереными общеинфекционными симптомами, самочувствие нарушено мало, токсикоза нет, температура сохраняется 2–4 дня. Клинически может быть диагносцирована при наличии вспышки в коллективе, когда встречаются и другие формы энтеровирусной инфекции.
Характеризуется кратковременной лихорадкой без выраженных симптомов локальных поражений. Протекает с умереными общеинфекционными симптомами, самочувствие нарушено мало, токсикоза нет, температура сохраняется 2–4 дня. Клинически может быть диагносцирована при наличии вспышки в коллективе, когда встречаются и другие формы энтеровирусной инфекции.
6. Энтеровирусная экзантема («бостонская лихорадка»). Характеризуется появлением с 1-го – 2 дня болезни на лице, туловище, конечностях высыпаний розового цвета, пятнисто- или пятнисто-папулезного характера, иногда могут быть геморрагические элементы. Сыпь держится 1–2 дня, реже – дольше и исчезает бесследно.
7. Кишечная (гастроэнтеритическая) форма. Протекает с водянистой диареей до 5–10 раз в сутки, болями в животе, метеоризмом, нечастой рвотой. Симптомы интоксикации умеренные. У детей до 2-х летнего возраста кишечный синдром часто сочетается с катаральными явлениями со стороны носоглотки. Продолжительность болезни у детей раннего возраста в течение 1–2-х недель, у детей старшего возраста 1–3 дня.
8. Респираторная (катаральная) форма проявляется слабо выраженными катаральными явлениями в виде заложенности носа, ринита, сухого редкого кашля. При осмотре выявляется гиперемия слизистой ротоглотки, мягкого нёба и задней стенки глотки. Могут отмечаться легкие диспепсические расстройства. Выздоровление наступает через 1–1,5 недели.
9. Миокардит, энцефаломиокардит новорожденных, гепатит, поражение почек, глаз (увеит) – эти формы энтеровирусной инфекции у детей встречаются редко. Клиническая диагностика их возможна только при наличии манифестных форм энтеровирусной инфекции или эпидемических вспышек заболевания. Чаще они диагносцируются при проведении вирусологических и серологических исследований.
МБДОУ с.Калинка, Хабаровский район, Хабаровский край
Энтеровирусная инфекция у детей — одно из самых распространенных заболеваний. Энтеровирусы занимают второе место в списке причин ОРВИ. Удивительно, но, несмотря на то, что эту инфекцию подхватывали практически все дети, многие родители до сих пор не знают, что такое энтеровирусная инфекция.
Удивительно, но, несмотря на то, что эту инфекцию подхватывали практически все дети, многие родители до сих пор не знают, что такое энтеровирусная инфекция.
Энтеровирусная инфекция — острые заболевания желудочно-кишечного тракта, которые вызываются энтеровирусами. На данный момент известно более 60 видов возбудителей энтеровирусной инфекции. В зависимости от серотипа (группы микроорганизмов одного вида, которые объединяются общей антигенной структурой и определяются серологическими методами диагностики) их подразделяют на 4 группы. Наиболее часто энтеровирусная инфекция вызывается вирусами Коксаки и полиомиелита.
Опасность энтеровирусной инфекции заключается в том, что ее возбудители очень устойчивы: они могут долгое время сохраняться во влажной почве и воде, попадая затем в организм человека через водопровод или зараженные продукты питания.
Мы собрали 10 фактов об энтеровирусной инфекции у детей, которые должна знать каждая мама, чтобы вовремя помочь своему ребенку.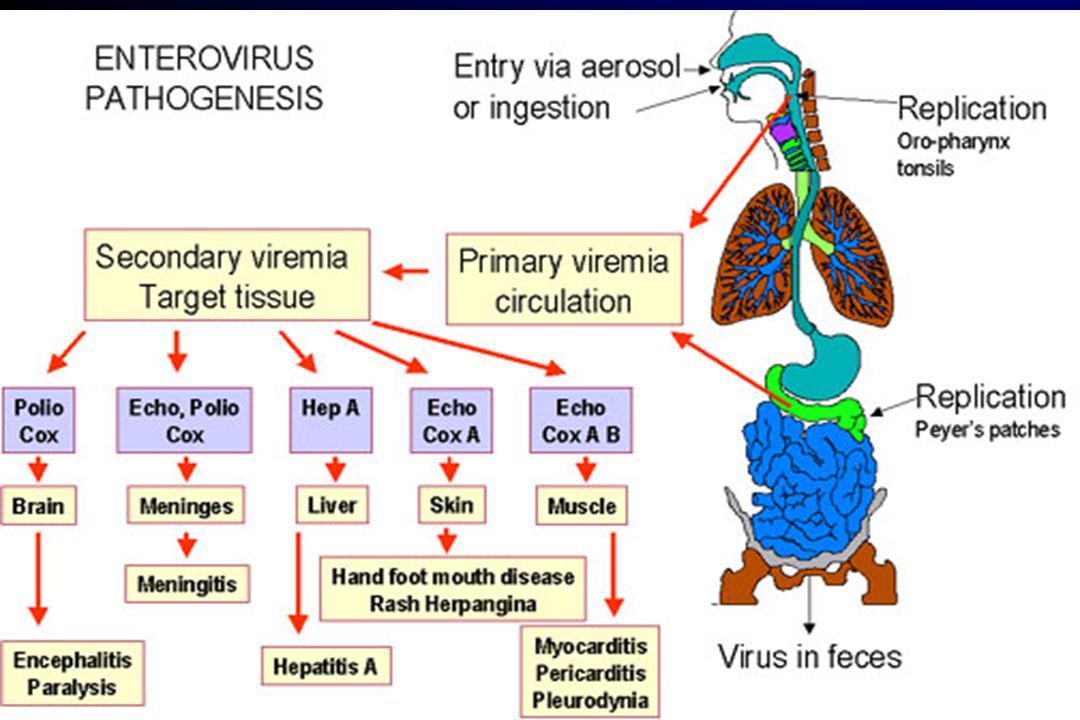
1. Энтеровирусная инфекция передается через рот, воздушно-капельным путем, через зараженную воду и пищу, а также контактно-бытовым путем.
2. Энтеровирусы могут размножаться практически во всех органах и тканях организма, что объясняет разнообразие симптомов. Самые распространенные симптомы энтеровирусной инфекции у детей: лихорадка, головная боль, боли в брюшной области, тошнота, рвота, диарея, повышение температуры тела, появление сыпи на руках и ногах, отеки конечностей, язвы в ротовой полости. Энтеровирусная инфекция у детей может протекать бессимптомно или же отмечаться только повышением температуры.
3. Опасность энтеровирусной инфекции заключается в том, что она способна распространяться в различных органах и сохраняться в организме человека в течение многих лет, что может привести к продолжительной болезни после первичного инфицирования.
4. Энтеровирусы довольно устойчивы. Они остаются жизнеспособными при комнатной температуре в течение нескольких дней и могут выжить в кислой среде желудка.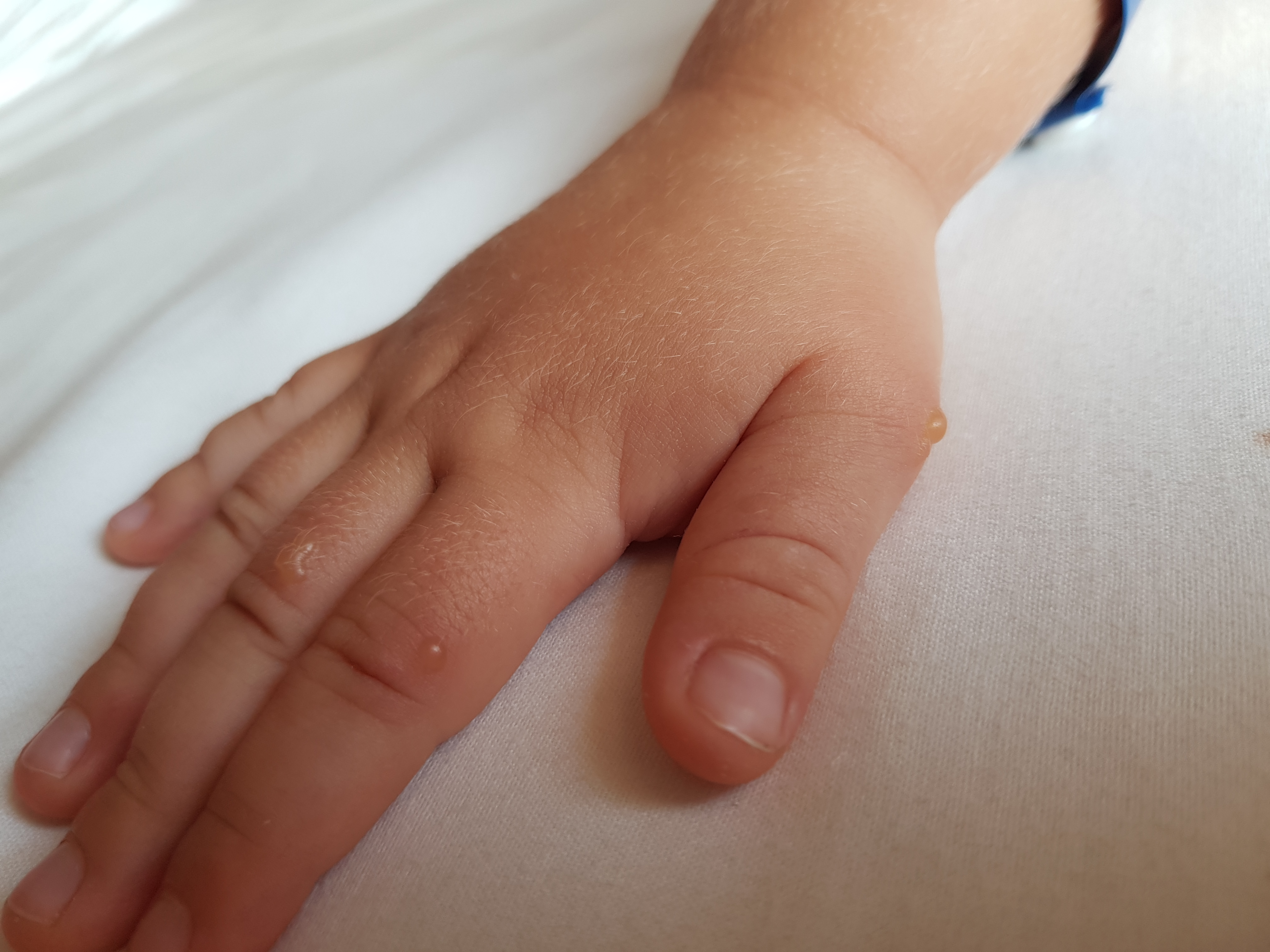
5. Энтеровирус чувствителен к: формалину, хлору, высоким температурам и ультрафиолетовому облучению.
6. Как правило, энтеровирусная инфекция у детей протекает легко и не приводит к серьезным осложнениям. Однако запущенные формы энтеровирусной инфекции поражают различные органы и системы, провоцируя развитие тяжелых заболеваний, в некоторых случаях могут заканчиваться летальным исходом
7. Самые тяжелые формы энтеровирусной инфекции – менингит и энцефалит, которые начинаются остро с повышения температуры до 39— 40 °С, сильной головной боли, многократной рвоты, не связанной с приемом пищи; также возможны боль в животе, бред, судороги, появление сыпи. Напомним, что не так давно в Украине была зафиксирована вспышка вирусного менингита.
8. Нужны ли ребенку антибиотики при лечении энтеровируса может определить только врач. Однако по словам доктора Комаровского, в инструкции ВОЗ написано, что антибиотики могут использоваться при кишечных инфекциях только в трех случаях: если понос у ребенка не проходит в течение 2 недель и обнаружены лямблии, если в кале обнаружена кровь, если это холера.
9. Лечение энтеровирусной инфекции у детей заключается в том, чтобы не допустить обезвоживания организма. Для этого ребенка необходимо отпаивать средством для пероральной регидратации (к примеру, Регидроном). Такой раствор можно приготовить и самостоятельно: в 1 л воды добавить 2 ст. ложки сахара и 1 ч. ложку соли. Давать по столовой ложке раствора каждые 5-10 минут. Никаких специфических противовирусных лекарств для энтеровирусной инфекции не существует. При высокой температуре дается жаропонижающее, назначенное врачом, в тяжелых случаях проводится госпитализация.
10. Эффективность вакцинации от энтеровирусной инфекции доказана на примере полиомиелита. Однако создать вакцину, способную выработать иммунитет ко всем энтеровирусам пока не удалось, что связано с огромным разнообразием вирусов и их способностью видоизменяться. Однако работы над разработкой ведутся, и первые вакцины уже проходят клинические исследования.
Энтеровирусные инфекции | ДермНет NZ
Автор: Ванесса Нган, штатный сотрудник, 2008 г. Обновлено доктором Джаннет Гомес, аспирантом клинической дерматологии, Университет королевы Марии, Лондон, Соединенное Королевство; Главный редактор: д-р Аманда Окли, дерматолог, Гамильтон, Новая Зеландия, декабрь 2016 г.
Обновлено доктором Джаннет Гомес, аспирантом клинической дерматологии, Университет королевы Марии, Лондон, Соединенное Королевство; Главный редактор: д-р Аманда Окли, дерматолог, Гамильтон, Новая Зеландия, декабрь 2016 г.
Что такое энтеровирусные инфекции?
Энтеровирусные инфекции охватывают широкий спектр заболеваний, вызываемых энтеровирусами (ЭВ). Они являются членами семейства Picornaviridae; небольшие, икосаэдрические, одноцепочечные вирусы с положительной смысловой РНК.
Наиболее известным из энтеровирусов является полиовирус (ПВ), но в основном он ликвидирован. Другие энтеровирусы представляют собой вирусы Коксаки А и В (CVA и CVB) и эховирусы (ECHO: энтеропатогенный орфан человека).
Как классифицируются энтеровирусы?
Энтеровирусы подразделяются на пять групп в зависимости от их молекулярных свойств.
- Полиовирус: PV1–PV3
- Человеческий EV A (HEV-A): CVA2–CVA9, CVA10, CVA12, CVA14, CVA16 и EV71
- Человеческий EV B (HEV-B): CVA9, CVB1–CVB6, E1–E7, E9, E11–E21, E24–E27, E29–E33, EV69
- Человеческий EV C (HEV-C): CVA1, CVA11, CVA13, CVA15, CVA17–CVA22, CVA2
- EV D человека (HEV-D): EV68, EV70, EV73–EV75, EV77–EV78
Энтеровирусы являются причиной многих заболеваний, включая простуду. Некоторые из вирусов Коксаки, эховирусов и EV71 вызывают экзантемы (кожная сыпь или кожная сыпь как симптом более общего заболевания) или энантемы (сыпь на слизистых оболочках). Кожные проявления могут быть тяжелыми и в некоторых случаях атипичными.
Некоторые из вирусов Коксаки, эховирусов и EV71 вызывают экзантемы (кожная сыпь или кожная сыпь как симптом более общего заболевания) или энантемы (сыпь на слизистых оболочках). Кожные проявления могут быть тяжелыми и в некоторых случаях атипичными.
Кто болеет энтеровирусными инфекциями?
Энтеровирусные инфекции широко распространены, и, по оценкам, ежегодно ими страдает более одного миллиарда человек во всем мире. В Соединенных Штатах от 30 000 до 50 000 госпитализаций ежегодно связаны с энтеровирусными инфекциями.К группе риска относятся:
- Младенцы и дети
- Новорожденные заражаются от матерей
- Пациенты с ослабленным иммунитетом
- Люди из низших социально-экономических групп.
Как распространяются энтеровирусные инфекции?
Энтеровирусные инфекции очень заразны. Энтеровирусы передаются от человека к человеку:
- Орально-орально; например, вирусы переносятся воздушно-капельным путем и передаются при кашле и чихании
- Орально-фекальная передача
- Прямой контакт с жидкостью из поражений кожи
- От матери к ребенку в перинатальном периоде.

Инкубационный период энтеровирусов обычно составляет 2–5 дней. Как только кто-то заражается, энтеровирусы имплантируются и размножаются в пищеварительном тракте.
Если инфекция остается локализованной, симптомы обычно отсутствуют. Однако, если вирус попадает в лимфатическую систему, может развиться общее недомогание. Если вирус распространяется в кровоток, возникают более серьезные симптомы.
Какие энтеровирусные инфекции вызывают кожные симптомы?
Многие энтеровирусы вызывают заболевания с кожными реакциями или реакциями слизистых оболочек.
Герпангина
- Герпангина вызывается Коксаки группы А, Коксаки В, энтеровирусом 71 и эховирусом.
- Поражения развиваются на слизистых оболочках, чаще всего на передних миндалинах, язычке и мягком небе рта.
- Поражения характеризуются крошечными серо-белыми папуловезикулами диаметром около 1–2 мм.
- Они проходят самостоятельно и проходят в течение 5–10 дней.
- Общие симптомы включают высокую температуру, головную боль, боль в горле, затрудненное глотание, рвоту и боль в животе.

Болезнь рук, ящур
- Болезнь рук, ящур (энтеровирусный стоматит) вызывается вирусом Коксаки A16 и энтеровирусом 71.
- Поражения полости рта развиваются в любом месте полости рта, но чаще всего появляются на твердом небе, языке, щеках и деснах.
- Поражения в полости рта начинаются с эритематозных пятен и папул (плоских воспаленных красных пятен) диаметром 2–8 мм и прогрессируют до образования тонкостенных пузырьков (волдырей), которые лопаются и образуют болезненные язвы, окруженные красным ореолом.Они заживают без лечения в течение 5–10 дней.
- Кожные поражения появляются одновременно с поражениями полости рта или вскоре после них. На руках и ногах может быть от нескольких до более 100 поражений.
- Поражения кожи начинаются с появления эритематозных пятен или папул, которые быстро превращаются в маленькие серые везикулы, окруженные красным ореолом. Эти поражения проходят спонтанно в течение 7-10 дней без образования рубцов.

Бостонская экзантема
- Бостонская экзантема вызывается эховирусом 16.
- После непродолжительной лихорадки внезапно появляются розовые пятна и папулы на лице и туловище, реже на конечностях.
- Небольшие язвы также могут быть обнаружены на мягком небе и миндалинах.
Эруптивный псевдоангиоматоз
- Эруптивный псевдоангиоматоз вызывается эховирусами 25 и 32, Коксаки В, вирусом Эпштейна-Барр и ЦМВ.
- На лице, туловище и конечностях развивается до десяти поражений вишнево-красного цвета.
- Псевдоангиомы имеют диаметр 2–4 мм и напоминают вишневые ангиомы.
- Они проходят спонтанно в течение десяти дней.
Другие кожные проявления иногда наблюдаются при энтеровирусных инфекциях и включают:
См. изображения энтеровирусов.
Каковы осложнения энтеровирусных инфекций?
Менее 1% энтеровирусных инфекций приводят к тяжелым симптомам заболевания. Иногда энтеровирусы могут вызывать осложнения со стороны сердца и нервной системы, такие как миокардит, асептический менингит, менингоэнцефалит и паралич.
Как диагностируются энтеровирусные инфекции?
Диагноз энтеровирусных инфекций в первую очередь основывается на клинических данных.
- ПЦР-тесты на энтеровирусы помогают подтвердить патогены.
- Серологическое тестирование и посев вируса проводятся в редких случаях.
Что такое лечение энтеровирусных инфекций?
Лечение ограничивается поддерживающей терапией.
- Мытье рук (особенно после смены подгузника) и личная гигиена
- Дезинфекция поверхностей и предметов
- Избегание тесного контакта
- Гидратация с большим количеством жидкости
- Жаропонижающие средства, такие как парацетамол при лихорадке
- Жидкости для полоскания рта, содержащие местные анестетики (лидокаин 2%) и антигистаминные препараты (например, гидрохлорид дифенгидрамина) для облегчения боли во рту
Внутривенный иммуноглобулин использовался для лечения энтеровирусной инфекции у младенцев с симптомами.
Противовирусный препарат плеконарил оказался эффективным средством лечения некоторых тяжелых энтеровирусных инфекций. Плеконарил недоступен в Новой Зеландии (декабрь 2016 г.).
Каков исход энтеровирусных инфекций?
Большинство энтеровирусных инфекций излечиваются спонтанно в течение 7–10 дней. Кожные поражения заживают без рубцов.
Ссылки
- Mathes EF, Oza V, Frieden IJ, et al.Экзема Коксаки и необычные кожные проявления при вспышке энтеровируса. Педиатрия. 2013;132(1):e149–57. doi<:10.1542/пед.2012-3175. ПабМед Центральный
- Ван, Ши-Мин и Чинг-Чуан Лю. Энтеровирус 71: эпидемиология, патогенез и лечение. Экспертный обзор противоинфекционной терапии 7.6 (2009): 735–42. Журнал
- Pons-Saort M, Parker EPK, Grassly NC. Эпидемиология неполиомиелитных энтеровирусов: последние достижения и нерешенные вопросы. Curr Opin Infect Dis. 2015 окт.28(5):479–87. ПабМед
- Hopper SM, Babl FE, McCarthy M, Tancharoen C, Lee KJ, Oakley E.
 Двойное слепое рандомизированное плацебо-контролируемое исследование местного 2% вязкого лидокаина для улучшения перорального приема у детей с болезненными инфекционными заболеваниями полости рта. БМС Педиатр. 2011 21 ноя. 11:106. ПабМед Центральный
Двойное слепое рандомизированное плацебо-контролируемое исследование местного 2% вязкого лидокаина для улучшения перорального приема у детей с болезненными инфекционными заболеваниями полости рта. БМС Педиатр. 2011 21 ноя. 11:106. ПабМед Центральный - Hawkes MT, Vaudry W. Неполиомиелитная энтеровирусная инфекция у новорожденных и детей раннего возраста. Педиатрия и здоровье детей. 2005;10(7):383–8. ПабМед Центральный
На DermNet NZ
Другие веб-сайты
Книги о кожных заболеваниях
Информационный бюллетень об энтеровирусах
Энтеровирусы — это группа вирусов, вызывающих ряд инфекционных заболеваний, обычно протекающих в легкой форме.Однако, если они поражают центральную нервную систему, они могут вызвать серьезное заболевание. Двумя наиболее распространенными из них являются эховирус и вирус Коксаки, но есть и другие. Энтеровирусы также вызывают полиомиелит и болезнь рук, ящура (HFMD).
Подавляющее большинство людей, инфицированных энтеровирусами, — более 90% — либо не имеют симптомов, либо имеют неспецифические симптомы, такие как внезапная лихорадка. Энтеровирусы могут вызывать широкий спектр симптомов, но чаще всего это лихорадка, легкие респираторные симптомы, гриппоподобное заболевание с лихорадкой и мышечными болями, лихорадка с сыпью и желудочно-кишечные симптомы.
ОсложненияБольшинство заболеваний, вызванных энтеровирусами, протекают в легкой форме, но у некоторых пациентов могут развиваться более тяжелые заболевания, включая заболевания головного мозга и сердца, пневмонию и гепатит. Кроме того, вирусы могут распространяться на другие органы, такие как селезенка, печень, костный мозг, кожа и сердце.
Способы заражения энтеровирусами Энтеровирусы чаще всего распространяются либо при контакте с выделениями, такими как слюна, мокрота или слизь, инфицированного человека, либо с его фекалиями.
Энтеровирусы являются наиболее распространенными вирусами в мире. У любого человека может развиться симптоматическое заболевание, вызванное энтеровирусами, но чаще всего заражаются дети, особенно в возрасте до 10 лет. Люди с наибольшей вероятностью развития более тяжелого заболевания — это люди с сопутствующими заболеваниями, беременные женщины, новорожденные или недоношенные дети, а также люди, страдающие холодовым стрессом или недоеданием.
ДиагностикаЭнтеровирусы обычно диагностируются клинически врачом, оценивающим симптомы пациента, чтобы определить, есть ли у него один из этих вирусов.Однако лабораторные анализы некоторых образцов, взятых у пациентов, могут помочь обнаружить энтеровирусы в более тяжелых случаях.
Лечение Большинство пациентов с энтеровирусной инфекцией выздоравливают без осложнений. Лечение обычно поддерживающее, направленное на облегчение симптомов и обеспечение обезвоживания людей. Людям с более серьезными инфекциями потребуется более интенсивная поддержка. Антибиотики назначают только при подозрении на вторичную бактериальную инфекцию наряду с энтеровирусом.
Людям с более серьезными инфекциями потребуется более интенсивная поддержка. Антибиотики назначают только при подозрении на вторичную бактериальную инфекцию наряду с энтеровирусом.
В настоящее время нет вакцин против энтеровирусов, кроме полиомиелита.Надлежащие правила гигиены, такие как частое мытье рук, необходимы для снижения риска заражения.
Примечание. Информация, содержащаяся в этом информационном бюллетене, предназначена для общего ознакомления и не должна использоваться в качестве замены индивидуального опыта и суждений медицинских работников.
Энтеровирус | Межгорное здравоохранение
Профиль зародыша
Также известен как: Вирус Коксаки; рука-нога-рот, герпангина
Тип микроба: Вирус
Сезон: Лето, осень
Энтеровирус включает несколько групп вирусов, поражающих в основном детей младшего возраста. Вспышки энтеровируса распространены в детских садах, школах и лагерях. Болезни рук, ног и рта – одна из
вирусы в группе Коксаки – особенно частый гость в групповых настройках. Обычно это сопровождается такими симптомами, как лихорадка, головная боль, язвы (в горле и во рту) и сыпь (на руках, ногах,
и область подгузника).
Вспышки энтеровируса распространены в детских садах, школах и лагерях. Болезни рук, ног и рта – одна из
вирусы в группе Коксаки – особенно частый гость в групповых настройках. Обычно это сопровождается такими симптомами, как лихорадка, головная боль, язвы (в горле и во рту) и сыпь (на руках, ногах,
и область подгузника).
Сезонность
В штате Юта энтеровирусы наиболее активны летом и ранней осенью (с июня по октябрь).
Признаки и симптомы
Симптомы энтеровирусной инфекции сильно различаются и зависят от конкретного вируса.У детей чаще всего наблюдаются лихорадка и гриппоподобные симптомы (боли и озноб), язвы во рту, боль в животе, сыпь и головные боли. Большинство случаев проходят без проблем, но у некоторых детей (особенно младенцев) возникают серьезные проблемы.
Период заражения
Симптомы энтеровирусной инфекции обычно развиваются между 3 и 6 днями, за исключением острого геморрагического конъюнктивита, при котором инкубационный период составляет от 24 до 72 часов.
Как это распространяется
Поскольку энтеровирусы в основном распространяются орально-фекальным путем, маленькие дети, чья гигиена после горшка обычно НЕ идеальна, являются наиболее эффективными переносчиками.Другие источники Передача включает зараженную пищу и воду, кашель и чихание, даже поверхности и предметы, к которым прикасался кто-то с вирусом.
Диагностика и лечение
Хотя лабораторный тест может выявить энтеровирус, в большинстве случаев диагноз ставится на основании симптомов.
Лечение энтеровируса означает купирование симптомов до тех пор, пока инфекция не исчезнет. (На эту группу вирусов не существует общепринятого лечения.)
Что я могу сделать сегодня?
1) Практикуйте профилактику и остановите распространение:
- Часто и хорошо мойте руки, и пусть дети делают то же самое.
- Уделяйте особое внимание мытью рук после посещения туалета и перед едой.
- Регулярно протирайте столы, игрушки и другие предметы и поверхности.

- Прикрывайтесь при чихании и кашле.
- Используйте салфетку один раз, затем выбросьте ее и вымойте руки.
2) Позвоните своему детскому врачу, если заметите:
- Скованность или боль в шее.
- Боль в груди.
- Очень низкое энергопотребление.
- Признаки обезвоживания (сухость во рту и глазах, мало мочи, упадок сил), которые могут возникнуть, если язвы во рту затрудняют глотание.
- Быстрое дыхание (более 40 раз в минуту) или очень затрудненное дыхание (втягивания или использование мышц живота при дыхании).
- Лихорадка выше 100,2°F у младенца в возрасте 3 месяцев или младше. Лихорадка, продолжающаяся более 3 дней.
- Любые тяжелые симптомы или симптомы, длящиеся более 7 дней.
Отказ от ответственности: Содержание этого веб-сайта не предназначено для замены профессиональной медицинской консультации, диагностики или лечения.
границ | Энтеровирусы и энцефалиты
Введение
Энтеровирусы принадлежат к семейству Picornaviridae, очень разнообразной группе небольших безоболочечных вирусов икосаэдрической формы с геномами из одной положительной цепи РНК. На основании разнообразия последовательностей они были разделены на 15 видов: энтеровирусы от A до L и риновирусы от A до C. Энтеровирусы человека, содержащие четыре вида энтеровирусов (от A до D) и три вида риновирусов (от A до C), заражают миллионы людей во всем мире каждую год.Хотя инфекции часто протекают бессимптомно, энтеровирусы человека могут вызывать различные симптомы, включая лихорадку, головную боль, респираторные заболевания, боль в горле и, иногда, рвоту и диарею. Важно отметить, что некоторые представители энтеровирусов человека являются нейротропными патогенами с широким спектром клинических нарушений, начиная от асептического менингита и заканчивая более тяжелым энцефалитом. В Соединенных Штатах было показано, что энтеровирусы являются наиболее распространенной этиологией менингита/энцефалита (Hasbun et al. , 2017; Балада-Лласат и др., 2019). Около 58% инфицированных младенцев и детей и 52% инфицированных взрослых с диагнозом менингит/энцефалит вызваны энтеровирусом. Кроме того, возраст тесно связан с клиническими проявлениями тяжелых инфекций, включая поражение ЦНС, миокардит и сепсисоподобное заболевание, наиболее часто встречающееся у новорожденных и детей грудного возраста. Наиболее известным нейротропным энтеровирусом является полиовирус (ПВ), который принадлежит к виду энтеровируса С и, как полагают, почти ликвидирован путем вакцинации из обращения в человеческом населении.Также известно, что неполиомиелитные энтеровирусы инфицируют ЦНС и являются причиной большинства недавних энтеровирусных инфекций с неврологическими расстройствами. Среди неполиомиелитных энтеровирусов виды Enterovirus A, такие как энтеровирус 71 (EV-A71), вирус Коксаки A6 (CV-A6) и CV-A16 (Goto et al., 2009; Xu et al., 2012; Huang Y. et al., 2015; Holmes et al., 2016; B’Krong et al., 2018; Suresh et al., 2018), вид Enterovirus B, подобный CV-B1 (Sun et al.
, 2017; Балада-Лласат и др., 2019). Около 58% инфицированных младенцев и детей и 52% инфицированных взрослых с диагнозом менингит/энцефалит вызваны энтеровирусом. Кроме того, возраст тесно связан с клиническими проявлениями тяжелых инфекций, включая поражение ЦНС, миокардит и сепсисоподобное заболевание, наиболее часто встречающееся у новорожденных и детей грудного возраста. Наиболее известным нейротропным энтеровирусом является полиовирус (ПВ), который принадлежит к виду энтеровируса С и, как полагают, почти ликвидирован путем вакцинации из обращения в человеческом населении.Также известно, что неполиомиелитные энтеровирусы инфицируют ЦНС и являются причиной большинства недавних энтеровирусных инфекций с неврологическими расстройствами. Среди неполиомиелитных энтеровирусов виды Enterovirus A, такие как энтеровирус 71 (EV-A71), вирус Коксаки A6 (CV-A6) и CV-A16 (Goto et al., 2009; Xu et al., 2012; Huang Y. et al., 2015; Holmes et al., 2016; B’Krong et al., 2018; Suresh et al., 2018), вид Enterovirus B, подобный CV-B1 (Sun et al. , 2019), CV-B3 (Fan and Liu, 2019), CV-B5 (Mao et al., 2018), CV-A9, Echovirus 6 (E-6), E-7, E-11 и E-13 (Holmes et al., 2016; Chen et al., 2017; B’Krong et al., 2018; Suresh et al., 2018; Chen et al., 2019; Ramalho et al., 2019; Sun et al., 2019), вид Enterovirus C, подобный CV-A24 (Tapparel et al., 2013; B’Krong et al., 2018; Suresh et al., 2018), и виды Enterovirus D, подобные EV-D68 (Tapparel et al., 2013; Messacar et al., 2018), поражают ЦНС и вызывают различные неврологические осложнения. такие как энцефалит, менингит и острый вялый паралич (ОВП) (Tapparel et al., 2013) (подробнее см. табл. 1).
, 2019), CV-B3 (Fan and Liu, 2019), CV-B5 (Mao et al., 2018), CV-A9, Echovirus 6 (E-6), E-7, E-11 и E-13 (Holmes et al., 2016; Chen et al., 2017; B’Krong et al., 2018; Suresh et al., 2018; Chen et al., 2019; Ramalho et al., 2019; Sun et al., 2019), вид Enterovirus C, подобный CV-A24 (Tapparel et al., 2013; B’Krong et al., 2018; Suresh et al., 2018), и виды Enterovirus D, подобные EV-D68 (Tapparel et al., 2013; Messacar et al., 2018), поражают ЦНС и вызывают различные неврологические осложнения. такие как энцефалит, менингит и острый вялый паралич (ОВП) (Tapparel et al., 2013) (подробнее см. табл. 1).
Таблица 1. Неврологические симптомы неполиомиелитных энтеровирусов, поражающих ЦНС.
Жизненный цикл энтеровируса
Геном энтеровируса содержит примерно 7,5 т.п.н. с одной открытой рамкой считывания, окруженной 5′- и 3′-нетранслируемыми областями (UTR), и заключен в капсид. В то время как 5′-конец ковалентно связан с вирусным белком, связанным с геномом (VPg), необходимым для репликации, полиаденилированный 3′-конец важен не только для синтеза РНК с отрицательной цепью, но также для трансляции и стабильности РНК (Zoll et al. , 2009; Кемпф и Бартон, 2015). Жизненный цикл энтеровирусов начинается со связывания с одним или несколькими специфическими рецепторами на поверхности клетки. Клеточные рецепторы энтеровирусов весьма разнообразны. Например, рецептор клеточной поверхности для PV представляет собой кластер дифференцировки 155 (CD155), тогда как EV-A71 имеет девять рецепторов клеточной поверхности, включая член класса 2 рецептора B человека (hSCARB2), гликопротеиновый лиганд 1 P-селектина человека (hPSGL1), аннексин II (Anx2), гепарансульфат, сиалилированный гликан, специфичный для дендритных клеток ICAM3-захватывающий неинтегрин, виментин, нуклеолин и триптофанил-тРНК-синтетаза человека (hWARS) (Baggen et al., 2018; Юнг и др., 2018). Связывание с рецептором позволяет вирусам проникать в клетки-хозяева посредством рецептор-опосредованного эндоцитоза. Существует несколько эндоцитарных путей, которые могут опосредовать проникновение частиц энтеровируса, связанных с рецептором, на плазматическую мембрану, включая макропиноцитоз, клатрин-зависимый эндоцитоз и клатрин-независимое поглощение, такое как кавеолозависимый и некавеолозависимый эндоцитоз (Marjomaki et al.
, 2009; Кемпф и Бартон, 2015). Жизненный цикл энтеровирусов начинается со связывания с одним или несколькими специфическими рецепторами на поверхности клетки. Клеточные рецепторы энтеровирусов весьма разнообразны. Например, рецептор клеточной поверхности для PV представляет собой кластер дифференцировки 155 (CD155), тогда как EV-A71 имеет девять рецепторов клеточной поверхности, включая член класса 2 рецептора B человека (hSCARB2), гликопротеиновый лиганд 1 P-селектина человека (hPSGL1), аннексин II (Anx2), гепарансульфат, сиалилированный гликан, специфичный для дендритных клеток ICAM3-захватывающий неинтегрин, виментин, нуклеолин и триптофанил-тРНК-синтетаза человека (hWARS) (Baggen et al., 2018; Юнг и др., 2018). Связывание с рецептором позволяет вирусам проникать в клетки-хозяева посредством рецептор-опосредованного эндоцитоза. Существует несколько эндоцитарных путей, которые могут опосредовать проникновение частиц энтеровируса, связанных с рецептором, на плазматическую мембрану, включая макропиноцитоз, клатрин-зависимый эндоцитоз и клатрин-независимое поглощение, такое как кавеолозависимый и некавеолозависимый эндоцитоз (Marjomaki et al. , 2015). Конкретные эндоцитарные пути, которые вирус использует для проникновения в клетки, зависят от вида и серотипа вируса, типа клетки-хозяина и местного микроокружения (например, рН и температуры).Например, EV-A71 проникает в клетки рабдомиосаркомы (RD) через клатрин-зависимый путь, тогда как путь, опосредованный кавеолами, используется для проникновения в клетки Jurkat. EV-A71 проявляет разные эндоцитарные пути в разных клетках-хозяевах, частично из-за разнообразия поверхностных рецепторов EV-A71 (Yamayoshi et al., 2014). При проникновении в клетки-хозяева вирус, сняв оболочку, высвобождает свой геном вирусной РНК в цитоплазму, и трансляция инициируется с внутренней последовательности рибосомы в 5′-UTR, которая называется внутренним сайтом входа в рибосому (IRES).IRES представляет собой цис- действующий элемент РНК, который образует вторичные и третичные структуры, чтобы обеспечить независимую от кэпа инициацию трансляции (Shih et al., 2011; Lee et al., 2017). Трансляция вирусной РНК дает один полипротеин, который протеолитически обрабатывается вирусными протеазами с образованием четырех капсидных белков (VP4, VP2, VP3 и VP1), необходимых для упаковки вириона, и семи неструктурных белков (2A-2B-2C и 3A).
, 2015). Конкретные эндоцитарные пути, которые вирус использует для проникновения в клетки, зависят от вида и серотипа вируса, типа клетки-хозяина и местного микроокружения (например, рН и температуры).Например, EV-A71 проникает в клетки рабдомиосаркомы (RD) через клатрин-зависимый путь, тогда как путь, опосредованный кавеолами, используется для проникновения в клетки Jurkat. EV-A71 проявляет разные эндоцитарные пути в разных клетках-хозяевах, частично из-за разнообразия поверхностных рецепторов EV-A71 (Yamayoshi et al., 2014). При проникновении в клетки-хозяева вирус, сняв оболочку, высвобождает свой геном вирусной РНК в цитоплазму, и трансляция инициируется с внутренней последовательности рибосомы в 5′-UTR, которая называется внутренним сайтом входа в рибосому (IRES).IRES представляет собой цис- действующий элемент РНК, который образует вторичные и третичные структуры, чтобы обеспечить независимую от кэпа инициацию трансляции (Shih et al., 2011; Lee et al., 2017). Трансляция вирусной РНК дает один полипротеин, который протеолитически обрабатывается вирусными протеазами с образованием четырех капсидных белков (VP4, VP2, VP3 и VP1), необходимых для упаковки вириона, и семи неструктурных белков (2A-2B-2C и 3A). -3B-3C-3D pol ), а также некоторые стабильные предшественники, которые участвуют в репликации вируса и разрушают клеточную иммунную систему хозяина.Репликация вирусной РНК катализируется вирусно-кодируемой РНК-зависимой РНК-полимеразой, 3D pol , которая использует Vpg в качестве белкового праймера для инициации процесса репликации. Синтез вирусной РНК происходит при индуцированном вирусом ремоделировании внутриклеточных мембран, образующих органеллы репликации, и приводит к образованию двухцепочечной РНК, которая, в свою очередь, транскрибируется в положительную одноцепочечную РНК (Hsu et al., 2010; van дер Шаар и др., 2016). Вновь синтезированная РНК может либо служить матрицей для трансляции и репликации, либо упаковываться в новые инфекционные вирионы.
-3B-3C-3D pol ), а также некоторые стабильные предшественники, которые участвуют в репликации вируса и разрушают клеточную иммунную систему хозяина.Репликация вирусной РНК катализируется вирусно-кодируемой РНК-зависимой РНК-полимеразой, 3D pol , которая использует Vpg в качестве белкового праймера для инициации процесса репликации. Синтез вирусной РНК происходит при индуцированном вирусом ремоделировании внутриклеточных мембран, образующих органеллы репликации, и приводит к образованию двухцепочечной РНК, которая, в свою очередь, транскрибируется в положительную одноцепочечную РНК (Hsu et al., 2010; van дер Шаар и др., 2016). Вновь синтезированная РНК может либо служить матрицей для трансляции и репликации, либо упаковываться в новые инфекционные вирионы.
Вторжение ЦНС
Энтеровирусы заражают человека преимущественно фекально-оральным путем и размножаются в желудочно-кишечном тракте, за исключением некоторых энтеровирусов, например, риновируса и EV-D68, которые могут вызывать респираторную инфекцию и распространяться через дыхательные пути.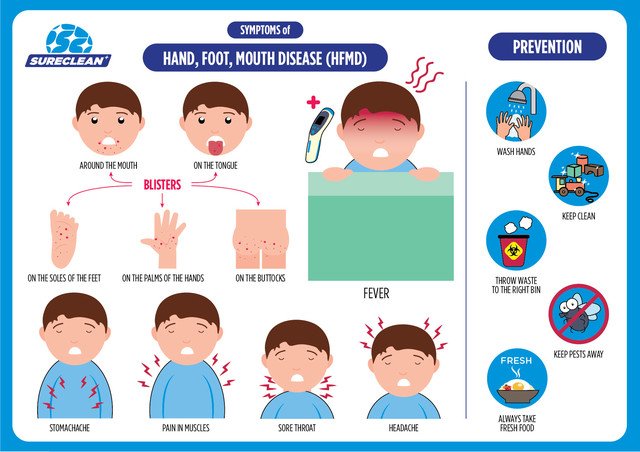 После первоначального заражения в первой зоне воздействия энтеровирусы могут получить доступ к ЦНС несколькими путями, которые не исключают друг друга (рис. 1; Rhoades et al., 2011; Huang and Shih, 2015).Во-первых, большинство нейротропных вирусов, включая энтеровирусы, распространяются через кровоток и достигают ЦНС. Распространение вирусных частиц из крови в ЦНС обычно ограничивается гематоэнцефалическим барьером (ГЭБ), который представляет собой высокоселективный полупроницаемый барьер между кровеносными сосудами и клетками головного мозга. Однако целостность ГЭБ может быть нарушена прямой инфекцией эндотелиальных клеток микрососудов головного мозга (ВМЭК), которые составляют ГЭБ, или цитокинами, которые продуцируются локально в ЦНС во время вирусных инфекций.Например, было показано, что PV проникает в ЦНС посредством передачи BBB (Yang et al., 1997). Недавние данные дополнительно продемонстрировали, что трансферриновый рецептор 1 мыши отвечает за прикрепление PV к клеточной поверхности BMECs, обеспечивая инвазию в ЦНС через BBB (Mizutani et al.
После первоначального заражения в первой зоне воздействия энтеровирусы могут получить доступ к ЦНС несколькими путями, которые не исключают друг друга (рис. 1; Rhoades et al., 2011; Huang and Shih, 2015).Во-первых, большинство нейротропных вирусов, включая энтеровирусы, распространяются через кровоток и достигают ЦНС. Распространение вирусных частиц из крови в ЦНС обычно ограничивается гематоэнцефалическим барьером (ГЭБ), который представляет собой высокоселективный полупроницаемый барьер между кровеносными сосудами и клетками головного мозга. Однако целостность ГЭБ может быть нарушена прямой инфекцией эндотелиальных клеток микрососудов головного мозга (ВМЭК), которые составляют ГЭБ, или цитокинами, которые продуцируются локально в ЦНС во время вирусных инфекций.Например, было показано, что PV проникает в ЦНС посредством передачи BBB (Yang et al., 1997). Недавние данные дополнительно продемонстрировали, что трансферриновый рецептор 1 мыши отвечает за прикрепление PV к клеточной поверхности BMECs, обеспечивая инвазию в ЦНС через BBB (Mizutani et al. , 2016). Во-вторых, энтеровирусы могут проникать в ЦНС через периферические циркулирующие иммунные клетки, которые несут внутриклеточные вирусы (Tabor-Godwin et al., 2010). Это известно как маршрут троянского коня. Несмотря на то, что головной мозг считается участком иммунитета, в нем имеется активная система иммунного надзора, которая включает рекрутирование неспецифических лейкоцитов, таких как фагоциты и лимфоциты, в мозговые оболочки и спинномозговую жидкость (ЦСЖ) (Forrester et al., 2018). Действительно, было показано, что спинномозговая жидкость содержит транспортирующую популяцию мононуклеарных клеток, состоящую из Т-клеток (~90%), В-клеток (~5%), моноцитов (~5%) и дендритных клеток (<1%). (Рансохофф и Энгельхардт, 2012). Как только эти лейкоциты инфицированы, они могут действовать как переносчики вирусов в ЦНС. Например, было показано, что инфицированные CV-B3 миелоидные клетки преодолевают гемато-СМЖ барьер в сосудистом сплетении (Tabor-Godwin et al., 2010). При попадании в ЦНС вирус, вероятно, высвобождается из миелоидных клеток и впоследствии инфицирует нейроны и/или глию головного мозга.
, 2016). Во-вторых, энтеровирусы могут проникать в ЦНС через периферические циркулирующие иммунные клетки, которые несут внутриклеточные вирусы (Tabor-Godwin et al., 2010). Это известно как маршрут троянского коня. Несмотря на то, что головной мозг считается участком иммунитета, в нем имеется активная система иммунного надзора, которая включает рекрутирование неспецифических лейкоцитов, таких как фагоциты и лимфоциты, в мозговые оболочки и спинномозговую жидкость (ЦСЖ) (Forrester et al., 2018). Действительно, было показано, что спинномозговая жидкость содержит транспортирующую популяцию мононуклеарных клеток, состоящую из Т-клеток (~90%), В-клеток (~5%), моноцитов (~5%) и дендритных клеток (<1%). (Рансохофф и Энгельхардт, 2012). Как только эти лейкоциты инфицированы, они могут действовать как переносчики вирусов в ЦНС. Например, было показано, что инфицированные CV-B3 миелоидные клетки преодолевают гемато-СМЖ барьер в сосудистом сплетении (Tabor-Godwin et al., 2010). При попадании в ЦНС вирус, вероятно, высвобождается из миелоидных клеток и впоследствии инфицирует нейроны и/или глию головного мозга. Имеются также данные о том, что EV-A71 может инфицировать лейкоциты путем связывания с hPSGL1, мембранным белком сиаломуцина, преимущественно экспрессируемым на лейкоцитах (Nishimura et al., 2009). Неясно, могут ли инфицированные EV-A71 лейкоциты приносить вирусы в ЦНС. В-третьих, некоторые энтеровирусы могут проникать в ЦНС через периферические нервы посредством ретроградного аксонального транспорта и транссинаптического распространения (Gromeier and Wimmer, 1998; Chen et al., 2007; Ong et al., 2008). Аксональный транспорт является важным клеточным процессом в нейронах, необходимым для перемещения синаптических пузырьков, липидов, белков и органелл, включая митохондрии, лизосомы, аутофагосомы и эндосомы, в тело клетки и из него.Хорошо известно, что некоторые нейротропные вирусы могут захватывать ретроградный аксональный транспорт и проникать в ЦНС. Например, исследования показали, что внутримышечно инокулированный PV поглощается эндоцитозом в нервно-мышечных соединениях (Ohka et al.
Имеются также данные о том, что EV-A71 может инфицировать лейкоциты путем связывания с hPSGL1, мембранным белком сиаломуцина, преимущественно экспрессируемым на лейкоцитах (Nishimura et al., 2009). Неясно, могут ли инфицированные EV-A71 лейкоциты приносить вирусы в ЦНС. В-третьих, некоторые энтеровирусы могут проникать в ЦНС через периферические нервы посредством ретроградного аксонального транспорта и транссинаптического распространения (Gromeier and Wimmer, 1998; Chen et al., 2007; Ong et al., 2008). Аксональный транспорт является важным клеточным процессом в нейронах, необходимым для перемещения синаптических пузырьков, липидов, белков и органелл, включая митохондрии, лизосомы, аутофагосомы и эндосомы, в тело клетки и из него.Хорошо известно, что некоторые нейротропные вирусы могут захватывать ретроградный аксональный транспорт и проникать в ЦНС. Например, исследования показали, что внутримышечно инокулированный PV поглощается эндоцитозом в нервно-мышечных соединениях (Ohka et al. , 2004). Эндоцитированные вирусные частицы в конце аксона перемещаются в ретроградном направлении к телу клетки посредством динеин-опосредованного везикулярного транспорта без инициации снятия оболочки (Ohka et al., 2009). Событие снятия оболочки происходит по прибытии в тело клетки двигательного нейрона.EV-A71 и EV-D68 также могут проникать и инфицировать ЦНС путем ретроградного аксонального транспорта через периферические спинномозговые двигательные нервы (Chen et al., 2007; Ong et al., 2008; Hixon et al., 2019). Интересно, что недавний отчет продемонстрировал, что EV-A71 может напрямую инфицировать ствол мозга через черепные нервы, предполагая, что вирус может использовать не только двигательные компоненты спинномозговых нервов, но и черепные нервы для проникновения в ЦНС (Tan et al., 2014). .
, 2004). Эндоцитированные вирусные частицы в конце аксона перемещаются в ретроградном направлении к телу клетки посредством динеин-опосредованного везикулярного транспорта без инициации снятия оболочки (Ohka et al., 2009). Событие снятия оболочки происходит по прибытии в тело клетки двигательного нейрона.EV-A71 и EV-D68 также могут проникать и инфицировать ЦНС путем ретроградного аксонального транспорта через периферические спинномозговые двигательные нервы (Chen et al., 2007; Ong et al., 2008; Hixon et al., 2019). Интересно, что недавний отчет продемонстрировал, что EV-A71 может напрямую инфицировать ствол мозга через черепные нервы, предполагая, что вирус может использовать не только двигательные компоненты спинномозговых нервов, но и черепные нервы для проникновения в ЦНС (Tan et al., 2014). .
Рисунок 1. Пути проникновения энтеровирусов в ЦНС.Энтеровирусы могут проникать в ЦНС тремя путями. Во-первых, они заражают BMEC, компрометируя и пересекая ГЭБ, чтобы напрямую попасть в ЦНС. Второй путь известен как путь троянского коня, при котором лейкоциты, инфицированные энтеровирусом, действуют как носители и пересекают мозговые барьеры, доставляя вирус в ЦНС. В-третьих, энтеровирусы способны перехватывать ретроградный аксональный транспорт и проникать в ЦНС из мышц в двигательные нейроны спинного мозга.
Второй путь известен как путь троянского коня, при котором лейкоциты, инфицированные энтеровирусом, действуют как носители и пересекают мозговые барьеры, доставляя вирус в ЦНС. В-третьих, энтеровирусы способны перехватывать ретроградный аксональный транспорт и проникать в ЦНС из мышц в двигательные нейроны спинного мозга.
Тропизм
Каждый энтеровирус имеет особый тропизм, определяемый комбинацией факторов хозяина и вируса (рис. 2; Lin and Shih, 2014).Хотя нейротропные энтеровирусы могут проникать в ЦНС и вызывать неврологические расстройства, диссеминация вируса в ЦНС, по-видимому, происходит спорадически, и неясно, как энтеровирус воздействует на определенные области и типы клеток в головном и спинном мозге. Более ранние исследования полиовируса показали, что тропизм вируса определяется клеточным рецептором для проникновения вируса (Holland, 1961). Однако рецептор PV CD155 обнаруживается в тканях, не являющихся очагами инфекции PV (Mendelsohn et al., 1989; Фрайштадт и др. , 1990; Koike et al., 1990), указывая на то, что клеточный рецептор необходим для восприимчивости к инфекции PV, но не является единственной детерминантой вирусного тропизма. Последующие исследования показали, что тканеспецифическая активность IRES в отношении вирусных РНК также играет важную роль в определении тропизма вируса (Gromeier et al., 1996; Yanagiya et al., 2003). Например, химерный PV, несущий IRES вируса гепатита С, хорошо реплицируется в печени, но не в мозге мышиной модели полиомиелита, тогда как контрольный полиовирус хорошо реплицируется как в печени, так и в головном мозге (Yanagiya et al., 2003). Имеются также данные о том, что врожденная иммунная противовирусная активность, такая как реакция интерферона (IFN), имеет решающее значение для тропизма вируса (Wessely et al., 2001; Ida-Hosonuma et al., 2005). У трансгенных мышей, содержащих человеческий CD155, PV реплицируется и вызывает тяжелые поражения в головном и спинном мозге, тогда как в других тканях серьезных патологических изменений не наблюдается.
, 1990; Koike et al., 1990), указывая на то, что клеточный рецептор необходим для восприимчивости к инфекции PV, но не является единственной детерминантой вирусного тропизма. Последующие исследования показали, что тканеспецифическая активность IRES в отношении вирусных РНК также играет важную роль в определении тропизма вируса (Gromeier et al., 1996; Yanagiya et al., 2003). Например, химерный PV, несущий IRES вируса гепатита С, хорошо реплицируется в печени, но не в мозге мышиной модели полиомиелита, тогда как контрольный полиовирус хорошо реплицируется как в печени, так и в головном мозге (Yanagiya et al., 2003). Имеются также данные о том, что врожденная иммунная противовирусная активность, такая как реакция интерферона (IFN), имеет решающее значение для тропизма вируса (Wessely et al., 2001; Ida-Hosonuma et al., 2005). У трансгенных мышей, содержащих человеческий CD155, PV реплицируется и вызывает тяжелые поражения в головном и спинном мозге, тогда как в других тканях серьезных патологических изменений не наблюдается. Однако у трансгенных мышей CD155, лишенных альфа/бета-ИФН, тяжелые поражения обнаруживаются в печени, селезенке и поджелудочной железе в дополнение к ЦНС, что позволяет предположить, что система альфа/бета-ИФН является важной детерминантой дифференциальной чувствительности тканей к ПВ.Полиовирус проникает в ЦНС, что приводит к развитию паралитического заболевания примерно у 1% инфицированных вирусом людей (Melnick, 1996). Поэтому было высказано предположение, что в 99% инфицированных случаев ответ IFN ограничивает репликацию PV в экстраневральных тканях, чтобы предотвратить инвазию в ЦНС (Racaniello, 2006). В ЦНС PV поражает и реплицируется в основном в двигательных нейронах передних рогов спинного мозга, что приводит к полиомиелиту (Nagata et al., 2004; Arita et al., 2006). В наиболее тяжелых случаях ИП поражает нейроны ствола головного мозга, вызывая бульбарный полиомиелит.В дополнение к нейронам ЦНС содержит три основных типа ненейрональных клеток, называемых глиальными клетками, включая астроциты, олигодендроциты и микроглию.
Однако у трансгенных мышей CD155, лишенных альфа/бета-ИФН, тяжелые поражения обнаруживаются в печени, селезенке и поджелудочной железе в дополнение к ЦНС, что позволяет предположить, что система альфа/бета-ИФН является важной детерминантой дифференциальной чувствительности тканей к ПВ.Полиовирус проникает в ЦНС, что приводит к развитию паралитического заболевания примерно у 1% инфицированных вирусом людей (Melnick, 1996). Поэтому было высказано предположение, что в 99% инфицированных случаев ответ IFN ограничивает репликацию PV в экстраневральных тканях, чтобы предотвратить инвазию в ЦНС (Racaniello, 2006). В ЦНС PV поражает и реплицируется в основном в двигательных нейронах передних рогов спинного мозга, что приводит к полиомиелиту (Nagata et al., 2004; Arita et al., 2006). В наиболее тяжелых случаях ИП поражает нейроны ствола головного мозга, вызывая бульбарный полиомиелит.В дополнение к нейронам ЦНС содержит три основных типа ненейрональных клеток, называемых глиальными клетками, включая астроциты, олигодендроциты и микроглию. Эти глиальные клетки играют решающую роль в поддержании гомеостаза, формировании миелина и обеспечении поддержки и защиты нейронов. Интересно, что астроциты и олигодендроциты также восприимчивы к инфекции PV в первичной культуре мышей, полученной из коры головного мозга новорожденных трансгенных мышей CD155 (Couderc et al., 2002). Неизвестно, являются ли эти глиальные клетки мишенями для инфекции PV в головном мозге человека.
Эти глиальные клетки играют решающую роль в поддержании гомеостаза, формировании миелина и обеспечении поддержки и защиты нейронов. Интересно, что астроциты и олигодендроциты также восприимчивы к инфекции PV в первичной культуре мышей, полученной из коры головного мозга новорожденных трансгенных мышей CD155 (Couderc et al., 2002). Неизвестно, являются ли эти глиальные клетки мишенями для инфекции PV в головном мозге человека.
Рисунок 2. Области ЦНС, пораженные энтеровирусами, вызывающими энцефалит, менингит и ОВП. ЦНС состоит из головного мозга, промежуточного мозга, мозжечка, ствола головного мозга и спинного мозга. После энтеровирусной инфекции ЦНС воспаление может возникать в различных анатомических областях, таких как головной мозг (энцефалит), мозговые оболочки (менингит) и спинной мозг (миелит), или одновременно в нескольких областях (менингоэнцефалит, энцефаломиелит).
Хотя EV-A71 также проникает в ЦНС, инфицированные области весьма отличаются от полиовируса. Стволовой энцефалит является наиболее частым неврологическим проявлением инфекции EV-A71. Последовательно, вирусные поражения в основном наблюдаются в стволе головного мозга и локализуются преимущественно в вентральной, медиальной и каудальной областях продолговатого мозга (Kao et al., 2004). Несколько поражений также обнаруживаются в коре, мозжечке и спинном мозге. В тяжелых случаях инфекции EV-A71 основные гистопатологические изменения в ЦНС характеризуются воспалительным поражением, которое избирательно приводит к нейрогенному отеку легких и сердечной недостаточности.В соответствии с основными местами поражения ЦНС при инфекции EV-A71, нейроны продолговатого мозга вовлечены в возникновение нейрогенного отека легких (Davison et al., 2012). Кроме того, несколько результатов вскрытия показали, что EV-A71 может инфицировать нейроны и вызывать дегенерацию нейронов, что активирует воспалительные реакции в области поражения и вызывает энцефалит (Yan et al., 2000; Khong et al., 2012; Yao et al.
Стволовой энцефалит является наиболее частым неврологическим проявлением инфекции EV-A71. Последовательно, вирусные поражения в основном наблюдаются в стволе головного мозга и локализуются преимущественно в вентральной, медиальной и каудальной областях продолговатого мозга (Kao et al., 2004). Несколько поражений также обнаруживаются в коре, мозжечке и спинном мозге. В тяжелых случаях инфекции EV-A71 основные гистопатологические изменения в ЦНС характеризуются воспалительным поражением, которое избирательно приводит к нейрогенному отеку легких и сердечной недостаточности.В соответствии с основными местами поражения ЦНС при инфекции EV-A71, нейроны продолговатого мозга вовлечены в возникновение нейрогенного отека легких (Davison et al., 2012). Кроме того, несколько результатов вскрытия показали, что EV-A71 может инфицировать нейроны и вызывать дегенерацию нейронов, что активирует воспалительные реакции в области поражения и вызывает энцефалит (Yan et al., 2000; Khong et al., 2012; Yao et al. ., 2012). Действительно, исследования показали, что нейроны восприимчивы к инфекции EV-A71 (Huang et al., 2014; Фэн и др., 2016). Интересно, что хотя нейроны могут быть инфицированы EV-A71, нейральные клетки-предшественники и астроциты, по-видимому, являются основными мишенями для инфекции EV-A71 в ЦНС (Huang et al., 2014; Feng et al., 2016). Оба этих типа клеток сходны в том, что они способны к митозу, что может иметь решающее значение для репликации вируса (Yu et al., 2015). Нейральные клетки-предшественники представляют собой клетки-предшественники ЦНС, которые дают начало многим, если не всем, типам нейронов и глиальных клеток и важны для многих функций мозга, включая обучение, память и познание.Таким образом, потеря нейральных клеток-предшественников из-за инфекции EV-A71 может вызывать долговременные аномалии ЦНС. Это подтверждается долгосрочным последующим исследованием, показывающим, что у большого количества детей после инфекции EV-A71 с тяжелым поражением ЦНС и сердечно-легочной недостаточностью наблюдается задержка развития нервной системы и снижение когнитивной функции (Chang et al.
., 2012). Действительно, исследования показали, что нейроны восприимчивы к инфекции EV-A71 (Huang et al., 2014; Фэн и др., 2016). Интересно, что хотя нейроны могут быть инфицированы EV-A71, нейральные клетки-предшественники и астроциты, по-видимому, являются основными мишенями для инфекции EV-A71 в ЦНС (Huang et al., 2014; Feng et al., 2016). Оба этих типа клеток сходны в том, что они способны к митозу, что может иметь решающее значение для репликации вируса (Yu et al., 2015). Нейральные клетки-предшественники представляют собой клетки-предшественники ЦНС, которые дают начало многим, если не всем, типам нейронов и глиальных клеток и важны для многих функций мозга, включая обучение, память и познание.Таким образом, потеря нейральных клеток-предшественников из-за инфекции EV-A71 может вызывать долговременные аномалии ЦНС. Это подтверждается долгосрочным последующим исследованием, показывающим, что у большого количества детей после инфекции EV-A71 с тяжелым поражением ЦНС и сердечно-легочной недостаточностью наблюдается задержка развития нервной системы и снижение когнитивной функции (Chang et al. , 2007). Астроциты также выполняют множество функций в головном мозге, таких как участие в формировании гематоэнцефалического барьера, поддержание внеклеточного ионного и химического гомеостаза и участие в реакции на повреждение.Поскольку астроциты митотичны и локализованы в гораздо более широкой области мозга, чем нейральные клетки-предшественники, преимущественная инфекция астроцитов над нейронами может создать резервуар для вирусной пролиферации и позволить вирусному потомству быстро распространиться в ЦНС и вызвать массивные воспалительные реакции. Было бы интересно понять, как EV-A71 отдают предпочтение нейральным клеткам-предшественникам и астроцитам.
, 2007). Астроциты также выполняют множество функций в головном мозге, таких как участие в формировании гематоэнцефалического барьера, поддержание внеклеточного ионного и химического гомеостаза и участие в реакции на повреждение.Поскольку астроциты митотичны и локализованы в гораздо более широкой области мозга, чем нейральные клетки-предшественники, преимущественная инфекция астроцитов над нейронами может создать резервуар для вирусной пролиферации и позволить вирусному потомству быстро распространиться в ЦНС и вызвать массивные воспалительные реакции. Было бы интересно понять, как EV-A71 отдают предпочтение нейральным клеткам-предшественникам и астроцитам.
Подобно EV-A71, вирус Коксаки также инфицирует нейронные клетки-предшественники в дополнение к нейронам (Feuer et al., 2005). Исследования показали, что CV-B3 может инфицировать пролиферирующие нейральные клетки-предшественники, расположенные в неонатальной субвентрикулярной зоне и гиппокампе. Интересно, что CV-B3 преимущественно реплицируется и индуцирует цитопатические эффекты в недифференцированных нейральных клетках-предшественниках (Tsueng et al.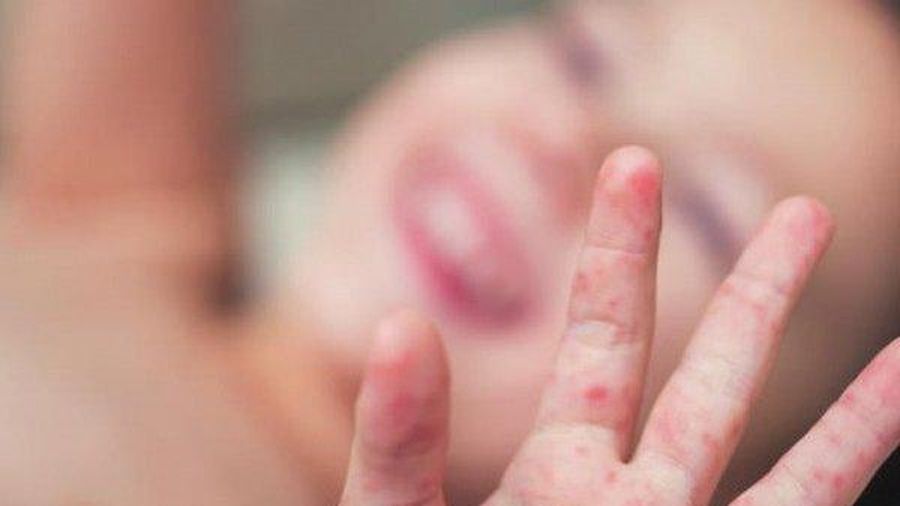 , 2011). Опосредованная CV-B3 потеря нейральных клеток-предшественников приводит к быстрому снижению нейрогенеза и может в конечном итоге вызывать дефекты развития и дисфункцию ЦНС (Ruller et al., 2012). Однако детерминанты тропизма CV-B3 в ЦНС остаются неясными.CV-B3 связывается с клетками-мишенями посредством двух основных рецепторов: фактора ускорения распада (DAF) (Bergelson et al., 1995) и рецептора вируса Коксаки и аденовируса (CAR) (Bergelson, 2009), который, как было обнаружено, сильно экспрессируется в развивающийся мозг (Xu and Crowell, 1996). Имеются данные о том, что незрелые нейроны экспрессируют относительно высокие уровни CAR по сравнению с их полностью дифференцированными аналогами (Ahn et al., 2008), предполагая, что уровень вирусного рецептора является одним из критических факторов, определяющих преимущественную репликацию вируса в недифференцированных нейральных клетках-предшественниках.Кроме того, CAR существует в виде нескольких изоформ, и было высказано предположение, что специфическая изоформа CAR, которая экспрессируется на высоких уровнях в бета-клетках поджелудочной железы человека, склонна к заражению вирусом Коксаки (Ifie et al.
, 2011). Опосредованная CV-B3 потеря нейральных клеток-предшественников приводит к быстрому снижению нейрогенеза и может в конечном итоге вызывать дефекты развития и дисфункцию ЦНС (Ruller et al., 2012). Однако детерминанты тропизма CV-B3 в ЦНС остаются неясными.CV-B3 связывается с клетками-мишенями посредством двух основных рецепторов: фактора ускорения распада (DAF) (Bergelson et al., 1995) и рецептора вируса Коксаки и аденовируса (CAR) (Bergelson, 2009), который, как было обнаружено, сильно экспрессируется в развивающийся мозг (Xu and Crowell, 1996). Имеются данные о том, что незрелые нейроны экспрессируют относительно высокие уровни CAR по сравнению с их полностью дифференцированными аналогами (Ahn et al., 2008), предполагая, что уровень вирусного рецептора является одним из критических факторов, определяющих преимущественную репликацию вируса в недифференцированных нейральных клетках-предшественниках.Кроме того, CAR существует в виде нескольких изоформ, и было высказано предположение, что специфическая изоформа CAR, которая экспрессируется на высоких уровнях в бета-клетках поджелудочной железы человека, склонна к заражению вирусом Коксаки (Ifie et al. , 2018). Неизвестно, играет ли эта специфическая изоформа CAR роль в инфицировании вирусом Коксаки ЦНС.
, 2018). Неизвестно, играет ли эта специфическая изоформа CAR роль в инфицировании вирусом Коксаки ЦНС.
Стойкая инфекция
Хотя энтеровирусы считались цитолитическими вирусами, а заболевания, вызванные инфекцией энтеровирусами, обычно недолговечны, несколько исследований показали, что некоторые энтеровирусы могут быть связаны с пожизненными расстройствами, включая постполиомиелитный синдром (Muir et al., 1995; Julien et al., 1999), шизофрения (Rantakallio et al., 1997; Suvisaari et al., 2003; Khandaker et al., 2012), боковой амиотрофический склероз (Woodall et al., 1994; Berger et al., 2000; Giraud et al., 2001), диабет 1 типа (Richardson and Morgan, 2018) и хроническая вирусная кардиомиопатия (Chapman and Kim, 2008). Причина этих пожизненных расстройств, связанных с энтеровирусами, до сих пор не ясна, но было высказано предположение, что персистирующая инфекция энтеровируса может возникать на основании присутствия РНК и белка энтеровируса в пораженных тканях на стадиях заболевания после острой инфекции (Chapman and Kim).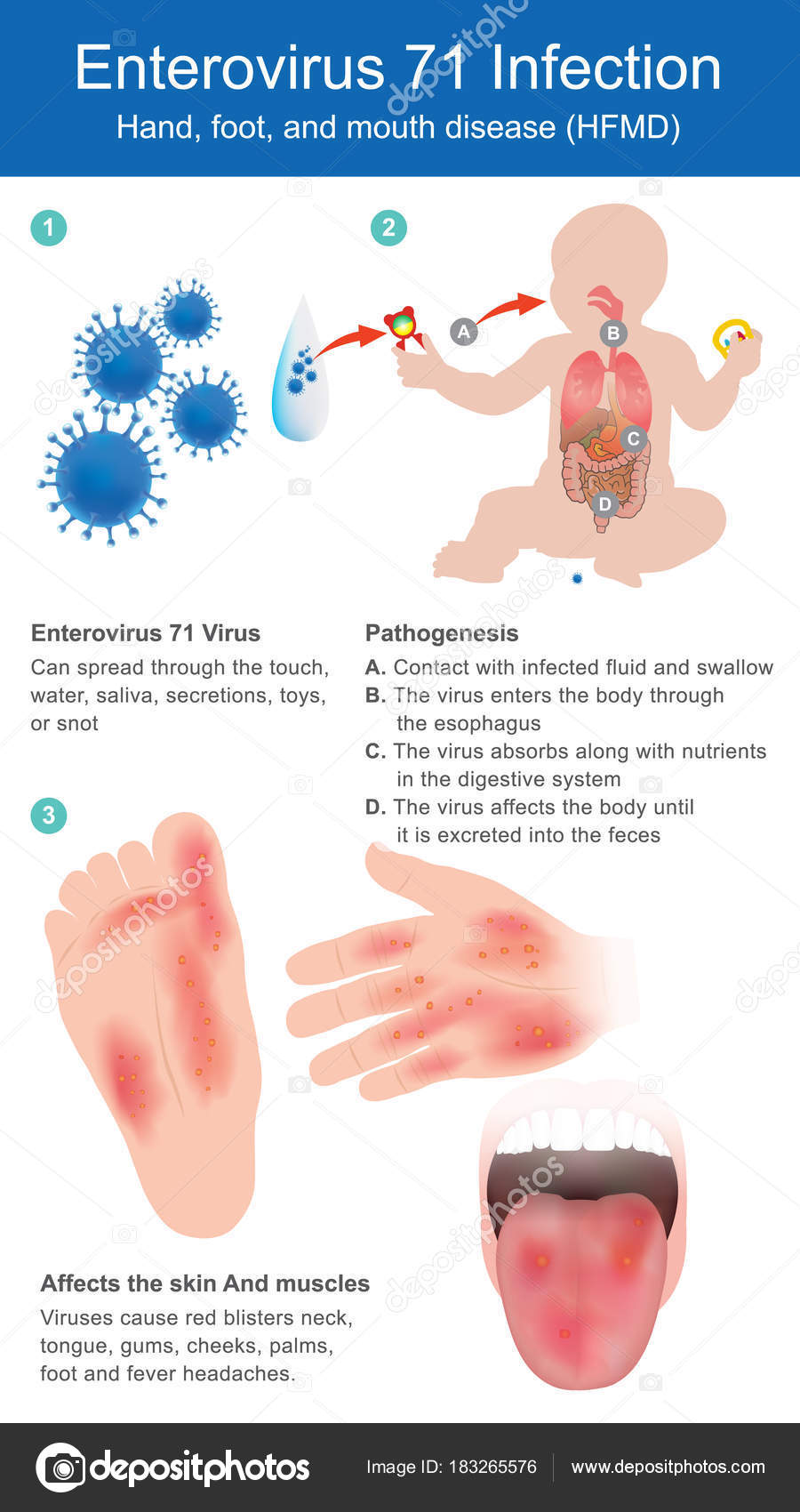 , 2008).Соответственно, распространение энтеровирусов в тканях не всегда сопровождается гибелью клеток (Bird et al., 2014). Наблюдались две основные группы персистирующих инфекций in vitro (Pinkert et al., 2011). Одна группа, называемая стационарной инфекцией, характеризуется инфекцией всех клеток, в то время как другая группа, называемая инфекцией в состоянии носительства, характеризуется цитолитическим инфицированием небольшой части клеток, что избавляет большинство клеток в культуре от заражения. цитолиз.Имеются данные о том, что энтеровирусы устанавливают инфекцию в состоянии носительства in vitro (Heim et al., 1992; Heim et al., 1995; Pinkert et al., 2011). Считается, что инфекция в состоянии носительства индуцируется отбором вирусных мутантов, которые менее цитопатичны и могут включать коэволюцию как клеток, так и вирусов. Например, после инфицирования CV-B3 экспрессия CAR рецептора CV-B3 подавляется или устраняется в субпопуляции клеток (Pinkert et al., 2011), что, как известно, связано со снижением CV- Инфекция B3 и лизис клеток (Werk et al.
, 2008).Соответственно, распространение энтеровирусов в тканях не всегда сопровождается гибелью клеток (Bird et al., 2014). Наблюдались две основные группы персистирующих инфекций in vitro (Pinkert et al., 2011). Одна группа, называемая стационарной инфекцией, характеризуется инфекцией всех клеток, в то время как другая группа, называемая инфекцией в состоянии носительства, характеризуется цитолитическим инфицированием небольшой части клеток, что избавляет большинство клеток в культуре от заражения. цитолиз.Имеются данные о том, что энтеровирусы устанавливают инфекцию в состоянии носительства in vitro (Heim et al., 1992; Heim et al., 1995; Pinkert et al., 2011). Считается, что инфекция в состоянии носительства индуцируется отбором вирусных мутантов, которые менее цитопатичны и могут включать коэволюцию как клеток, так и вирусов. Например, после инфицирования CV-B3 экспрессия CAR рецептора CV-B3 подавляется или устраняется в субпопуляции клеток (Pinkert et al., 2011), что, как известно, связано со снижением CV- Инфекция B3 и лизис клеток (Werk et al. , 2005; Фехнер и др., 2007). В результате эти эволюционировавшие клетки защищены от вирусной инфекции и клеточного лизиса и становятся доминирующими в культуре уже через несколько пассажей. Тем временем вирус также адаптируется к персистированию, приобретая независимый от CAR механизм проникновения (Pinkert et al., 2011). Таким образом, во время развития персистирующей инфекции вирусы и клетки эволюционировали таким образом, что устойчивость клеток к репликации вируса уравновешивается. В дополнение к модели коэволюции сообщалось о других изменениях вирусного генома, вызывающих персистентную инфекцию, в высококонсервативной 5′-UTR, которая имеет решающее значение для репликации вируса.Например, мутанты CV-B с делециями на 5′-конце вирусного генома персистируют в тканях хозяина, и РНК этих вариантов можно стабильно выявлять в ткани сердца мышей, экспериментально инокулированных CV-B3 дикого типа, и в человеческих случаях myocarditis (Kim et al., 2005; Chapman et al., 2008; Kim et al., 2008), предполагая, что репликация вируса важна для персистирующей инфекции in vivo .
, 2005; Фехнер и др., 2007). В результате эти эволюционировавшие клетки защищены от вирусной инфекции и клеточного лизиса и становятся доминирующими в культуре уже через несколько пассажей. Тем временем вирус также адаптируется к персистированию, приобретая независимый от CAR механизм проникновения (Pinkert et al., 2011). Таким образом, во время развития персистирующей инфекции вирусы и клетки эволюционировали таким образом, что устойчивость клеток к репликации вируса уравновешивается. В дополнение к модели коэволюции сообщалось о других изменениях вирусного генома, вызывающих персистентную инфекцию, в высококонсервативной 5′-UTR, которая имеет решающее значение для репликации вируса.Например, мутанты CV-B с делециями на 5′-конце вирусного генома персистируют в тканях хозяина, и РНК этих вариантов можно стабильно выявлять в ткани сердца мышей, экспериментально инокулированных CV-B3 дикого типа, и в человеческих случаях myocarditis (Kim et al., 2005; Chapman et al., 2008; Kim et al., 2008), предполагая, что репликация вируса важна для персистирующей инфекции in vivo . Тем не менее, было также высказано предположение, что персистенция РНК CV-B1 в скелетных мышцах или РНК CV-B3 в ЦНС не связана с генетическими изменениями, которые приводят к дефектным по репликации формам, а происходит главным образом за счет образования стабильных и атипичных двойных клеток. -комплекс РНК (Tam and Messner, 1999; Feuer et al., 2009). Интересно, что помимо снижения CAR, другие клеточные факторы также играют важную роль в персистирующей инфекции CV-B3. В частности, на репликацию CV-B3 влияет статус клеточного цикла, что позволяет предположить, что персистенция CV-B3 может зависеть от инфицирования покоящихся клеток, в которых репликация вируса снижена или подавлена (Feuer et al., 2002; Feuer et al. , 2004). Следовательно, различия между этими механизмами, вероятно, связаны с различными моделями взаимодействия вирус-хозяин, и могут существовать ткане- или клеточно-специфические механизмы для возникновения персистирующей инфекции.
Тем не менее, было также высказано предположение, что персистенция РНК CV-B1 в скелетных мышцах или РНК CV-B3 в ЦНС не связана с генетическими изменениями, которые приводят к дефектным по репликации формам, а происходит главным образом за счет образования стабильных и атипичных двойных клеток. -комплекс РНК (Tam and Messner, 1999; Feuer et al., 2009). Интересно, что помимо снижения CAR, другие клеточные факторы также играют важную роль в персистирующей инфекции CV-B3. В частности, на репликацию CV-B3 влияет статус клеточного цикла, что позволяет предположить, что персистенция CV-B3 может зависеть от инфицирования покоящихся клеток, в которых репликация вируса снижена или подавлена (Feuer et al., 2002; Feuer et al. , 2004). Следовательно, различия между этими механизмами, вероятно, связаны с различными моделями взаимодействия вирус-хозяин, и могут существовать ткане- или клеточно-специфические механизмы для возникновения персистирующей инфекции.
Ранняя вирусная инфекция ЦНС может вызвать тяжелую физическую и умственную инвалидность и, в некоторых случаях, привести к неожиданным неврологическим расстройствам спустя годы после острой инфекции. Например, примерно у 30 процентов жертв полиомиелита появляются новые симптомы (постполиомиелитный синдром) примерно через 50 лет после первичной инфекции. Некоторые исследования показали, что постполиомиелитный синдром коррелирует с присутствием вирусной РНК в ЦНС, предполагая, что PV может персистировать и вызывать долговременное повреждение ЦНС (Muir et al., 1995). В соответствии с этими выводами было показано, что штаммы полиовируса не являются полностью литическими в клеточных линиях нейробластомы (Colbere-Garapin et al., 1989). После инфекции PV в культивируемых клетках наблюдаются массивные цитопатические эффекты, но некоторые клетки выживают после инфекции без дальнейших наблюдаемых цитопатических эффектов, несмотря на непрерывную продукцию вируса. Во время персистирующей инфекции мутанты PV постоянно отбираются, и многие из идентифицированных мутаций происходят в положениях, которые, как известно, участвуют в связывании рецепторов PV, что позволяет предположить, что взаимодействие вируса с его рецептором имеет решающее значение для возникновения персистирующих инфекций (Colbere).
Например, примерно у 30 процентов жертв полиомиелита появляются новые симптомы (постполиомиелитный синдром) примерно через 50 лет после первичной инфекции. Некоторые исследования показали, что постполиомиелитный синдром коррелирует с присутствием вирусной РНК в ЦНС, предполагая, что PV может персистировать и вызывать долговременное повреждение ЦНС (Muir et al., 1995). В соответствии с этими выводами было показано, что штаммы полиовируса не являются полностью литическими в клеточных линиях нейробластомы (Colbere-Garapin et al., 1989). После инфекции PV в культивируемых клетках наблюдаются массивные цитопатические эффекты, но некоторые клетки выживают после инфекции без дальнейших наблюдаемых цитопатических эффектов, несмотря на непрерывную продукцию вируса. Во время персистирующей инфекции мутанты PV постоянно отбираются, и многие из идентифицированных мутаций происходят в положениях, которые, как известно, участвуют в связывании рецепторов PV, что позволяет предположить, что взаимодействие вируса с его рецептором имеет решающее значение для возникновения персистирующих инфекций (Colbere). -Гарапин и др., 1998). Хотя единого механизма возникновения персистирующей инфекции не существует, считается, что вирус должен уклоняться от противовирусного иммунного ответа хозяина. Поскольку энтеровирусы имеют высокую частоту мутаций из-за отсутствия способности корректировать РНК-полимеразы, они могут генерировать множество мутантов, не только влияющих на связывание с рецептором и репликацию вируса, но и на уклонение от иммунной системы. ЦНС относительно недоступна для иммунного надзора по сравнению с другими тканями, что делает ее особенно уязвимой для персистирующей инфекции.Используя визуализацию in vivo , недавнее исследование продемонстрировало, что инфекция EV-A71 мышей AG129, у которых дефицит рецепторов интерферона альфа/бета и гамма, показывает быстрое распространение и долгосрочное персистирование вируса в мозгу выживших животных. (Кейн и Осорио, 2017). Интересно, что высокие вирусные нагрузки сохраняются в головном мозге даже через 6 недель после заражения, тогда как вирусные нагрузки в других тканях, включая сердце, легкие, печень, селезенку и кишечник, постепенно снижаются до более низкого уровня.
-Гарапин и др., 1998). Хотя единого механизма возникновения персистирующей инфекции не существует, считается, что вирус должен уклоняться от противовирусного иммунного ответа хозяина. Поскольку энтеровирусы имеют высокую частоту мутаций из-за отсутствия способности корректировать РНК-полимеразы, они могут генерировать множество мутантов, не только влияющих на связывание с рецептором и репликацию вируса, но и на уклонение от иммунной системы. ЦНС относительно недоступна для иммунного надзора по сравнению с другими тканями, что делает ее особенно уязвимой для персистирующей инфекции.Используя визуализацию in vivo , недавнее исследование продемонстрировало, что инфекция EV-A71 мышей AG129, у которых дефицит рецепторов интерферона альфа/бета и гамма, показывает быстрое распространение и долгосрочное персистирование вируса в мозгу выживших животных. (Кейн и Осорио, 2017). Интересно, что высокие вирусные нагрузки сохраняются в головном мозге даже через 6 недель после заражения, тогда как вирусные нагрузки в других тканях, включая сердце, легкие, печень, селезенку и кишечник, постепенно снижаются до более низкого уровня.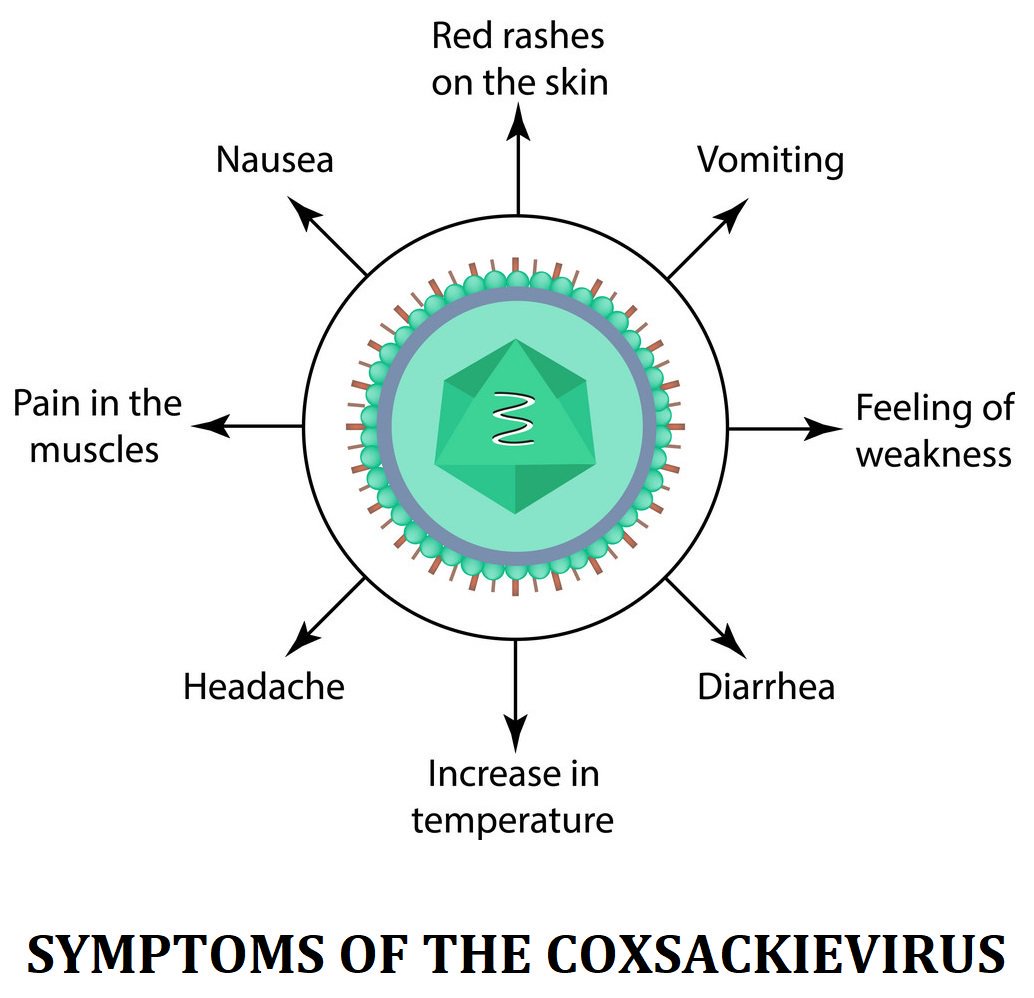 В соответствии с этими выводами, исследований in vitro показали, что, в отличие от клеток RD или клеточных линий нейробластомы, гибридная клеточная линия, подобная двигательным нейронам (NSC-34), инфицированная EV-A71, не проявляет цитопатического эффекта, а вирусные частицы принять нелитический путь выхода через аутофагию (Too et al., 2016). Кроме того, есть доказательства того, что РНК EV-A71 присутствует в стуле через несколько недель после первоначального заражения (Han et al., 2010). Взятые вместе, все эти данные свидетельствуют о том, что подобно PV и CV-B3, EV-A71 также может вызывать персистентную инфекцию в ЦНС, но долгосрочное влияние инфекции EV-A71 на ЦНС остается неясным.
В соответствии с этими выводами, исследований in vitro показали, что, в отличие от клеток RD или клеточных линий нейробластомы, гибридная клеточная линия, подобная двигательным нейронам (NSC-34), инфицированная EV-A71, не проявляет цитопатического эффекта, а вирусные частицы принять нелитический путь выхода через аутофагию (Too et al., 2016). Кроме того, есть доказательства того, что РНК EV-A71 присутствует в стуле через несколько недель после первоначального заражения (Han et al., 2010). Взятые вместе, все эти данные свидетельствуют о том, что подобно PV и CV-B3, EV-A71 также может вызывать персистентную инфекцию в ЦНС, но долгосрочное влияние инфекции EV-A71 на ЦНС остается неясным.
Нейровирулентность
Некоторые энтеровирусы могут вызывать заболевания нервной системы. Наиболее изученным нейровирулентным энтеровирусом является PV. Чтобы искоренить глобальный полиомиелит, были предприняты большие усилия для разработки вакцин против полиомиелита, включая инактивированную PV, вводимую путем инъекций, и аттенуированную PV, вводимую перорально. Хотя оба типа вакцин против полиомиелита эффективны, оральные вакцины против полиомиелита лучше не только в применении, но и в обеспечении более длительного иммунитета. Аттенуированный PV был разработан на основе наблюдения, что вирус больше не вызывает заболевания после многих пассажей в разных животных и клеточных культурах, но реплицируется в достаточной степени, чтобы индуцировать защитный иммунитет.Генетический анализ аттенуированного PV показал, что точечная мутация в пределах IRES вакцинных штаммов является критическим фактором, определяющим фенотип аттенуации (Evans et al., 1985; Kawamura et al., 1989; Ren et al., 1991). Например, мутация C472U в IRES полиовируса типа 3 вызывает дефект трансляции, что приводит к снижению репликации в ЦНС и ослаблению нейровирулентности (La Monica and Racaniello, 1989; Gutierrez et al., 1997; Ohka and Nomoto, 2001). ). Последующие исследования показали, что мутация C472U снижает эффективность связывания белка, связывающего полипиримидиновый тракт (PTB), с IRES, что необходимо для инициации трансляции (Guest et al.
Хотя оба типа вакцин против полиомиелита эффективны, оральные вакцины против полиомиелита лучше не только в применении, но и в обеспечении более длительного иммунитета. Аттенуированный PV был разработан на основе наблюдения, что вирус больше не вызывает заболевания после многих пассажей в разных животных и клеточных культурах, но реплицируется в достаточной степени, чтобы индуцировать защитный иммунитет.Генетический анализ аттенуированного PV показал, что точечная мутация в пределах IRES вакцинных штаммов является критическим фактором, определяющим фенотип аттенуации (Evans et al., 1985; Kawamura et al., 1989; Ren et al., 1991). Например, мутация C472U в IRES полиовируса типа 3 вызывает дефект трансляции, что приводит к снижению репликации в ЦНС и ослаблению нейровирулентности (La Monica and Racaniello, 1989; Gutierrez et al., 1997; Ohka and Nomoto, 2001). ). Последующие исследования показали, что мутация C472U снижает эффективность связывания белка, связывающего полипиримидиновый тракт (PTB), с IRES, что необходимо для инициации трансляции (Guest et al. , 2004). Анализ последовательности также выявил дополнительные мутации в области капсида вакцинных штаммов. Эти мутации капсида, вероятно, нарушают связывание вирусных частиц с клетками-хозяевами и снижают стабильность капсида, что может способствовать и стабилизировать фенотип аттенуации. Тем не менее, PV в значительной степени адаптируется, и аттенуированные вирусы могут повышать свою вирулентность за счет мутации и/или рекомбинации (Jorba et al., 2008; Minor, 2009). Таким образом, хотя это и необычно, иммунизация аттенуированными вакцинными штаммами может вызывать вакциноассоциированный паралитический полиомиелит, что может быть связано с реверсией мутаций в вирусном геноме, которые придают аттенуированный фенотип, и/или приобретением новых мутаций с повышенной вирулентностью (Kew и другие., 2005; Фамуларе и др., 2016). Более того, эти полиовирусы вакцинного происхождения (ПВВП) вызывали вспышки полиомиелита в районах с низким уровнем плановой иммунизации (Burki, 2019). Используя подход, сочетающий филогенетический анализ данных о последовательности во время вспышек ПВВП и экспериментальный эволюционный подход в клеточной культуре, недавнее исследование предоставило модель, описывающую этапы эволюции, достаточные для того, чтобы вакцинный штамм потерял свою аттенуацию и стал вирулентным (Stern et al.
, 2004). Анализ последовательности также выявил дополнительные мутации в области капсида вакцинных штаммов. Эти мутации капсида, вероятно, нарушают связывание вирусных частиц с клетками-хозяевами и снижают стабильность капсида, что может способствовать и стабилизировать фенотип аттенуации. Тем не менее, PV в значительной степени адаптируется, и аттенуированные вирусы могут повышать свою вирулентность за счет мутации и/или рекомбинации (Jorba et al., 2008; Minor, 2009). Таким образом, хотя это и необычно, иммунизация аттенуированными вакцинными штаммами может вызывать вакциноассоциированный паралитический полиомиелит, что может быть связано с реверсией мутаций в вирусном геноме, которые придают аттенуированный фенотип, и/или приобретением новых мутаций с повышенной вирулентностью (Kew и другие., 2005; Фамуларе и др., 2016). Более того, эти полиовирусы вакцинного происхождения (ПВВП) вызывали вспышки полиомиелита в районах с низким уровнем плановой иммунизации (Burki, 2019). Используя подход, сочетающий филогенетический анализ данных о последовательности во время вспышек ПВВП и экспериментальный эволюционный подход в клеточной культуре, недавнее исследование предоставило модель, описывающую этапы эволюции, достаточные для того, чтобы вакцинный штамм потерял свою аттенуацию и стал вирулентным (Stern et al. , 2017). На первом этапе критические мутации для фенотипа аттенуации возвращаются для увеличения репликации вируса.За этим следуют события рекомбинации с совместно циркулирующими штаммами энтеровируса, чаще всего штаммом вируса Коксаки, но в некоторых случаях циркулирующим штаммом PV для оптимизации репликации вируса в кишечнике человека. На последнем этапе вирус продолжает медленно возвращаться к последовательностям, которые сохраняются в PV дикого типа, чтобы повысить приспособленность вируса. Эта информация обеспечивает мощную основу для разработки более безопасных вакцинных штаммов и прогнозирования вирулентности вирусов.
, 2017). На первом этапе критические мутации для фенотипа аттенуации возвращаются для увеличения репликации вируса.За этим следуют события рекомбинации с совместно циркулирующими штаммами энтеровируса, чаще всего штаммом вируса Коксаки, но в некоторых случаях циркулирующим штаммом PV для оптимизации репликации вируса в кишечнике человека. На последнем этапе вирус продолжает медленно возвращаться к последовательностям, которые сохраняются в PV дикого типа, чтобы повысить приспособленность вируса. Эта информация обеспечивает мощную основу для разработки более безопасных вакцинных штаммов и прогнозирования вирулентности вирусов.
EV-A71 стал серьезной угрозой для здоровья населения в Азиатско-Тихоокеанском регионе.EV-A71 вызывает болезнь рук, ящура (HFMD) и герпетическую ангину, а иногда и тяжелые неврологические расстройства. В отличие от PV, при котором точковая мутация в IRES может ослабить нейровирулентность, связь между нейровирулентностью EV-A71 и последовательностями вирусного генома остается в значительной степени неизвестной. Пока есть лишь несколько сообщений, показывающих, что нейровирулентность может быть ослаблена мутациями в вирусном геноме EV-A71. Например, исследования показали, что определенные генетические манипуляции с геномом EV-A71, основанные на чувствительных к температуре детерминантах вакцинного штамма полиовируса, приводят к ослаблению нейровирулентности у обезьян (Arita et al., 2005). Созданный мутантный штамм EV-A71 содержит четыре мутации в консервативных областях генома энтеровируса, в том числе одну в 5′-UTR, две в гене 3D-полимеразы и одну в 3′-UTR, и все они необходимы для существенной аттенуации. Арита и др., 2008). Подобно PV, капсидные белки также играют важную роль в вирулентности EV-A71. Например, аминокислотный остаток 145 EV-A71 VP1, который влияет на использование рецептора для прикрепления вирусных частиц к клеточной поверхности (Nishimura et al., 2013; Tan et al., 2017), было показано, что он обеспечивает адаптацию мышей заменой G145E (Arita et al., 2008; Chua et al., 2008) и влияет на вирулентность у мышей (Chua et al.
Пока есть лишь несколько сообщений, показывающих, что нейровирулентность может быть ослаблена мутациями в вирусном геноме EV-A71. Например, исследования показали, что определенные генетические манипуляции с геномом EV-A71, основанные на чувствительных к температуре детерминантах вакцинного штамма полиовируса, приводят к ослаблению нейровирулентности у обезьян (Arita et al., 2005). Созданный мутантный штамм EV-A71 содержит четыре мутации в консервативных областях генома энтеровируса, в том числе одну в 5′-UTR, две в гене 3D-полимеразы и одну в 3′-UTR, и все они необходимы для существенной аттенуации. Арита и др., 2008). Подобно PV, капсидные белки также играют важную роль в вирулентности EV-A71. Например, аминокислотный остаток 145 EV-A71 VP1, который влияет на использование рецептора для прикрепления вирусных частиц к клеточной поверхности (Nishimura et al., 2013; Tan et al., 2017), было показано, что он обеспечивает адаптацию мышей заменой G145E (Arita et al., 2008; Chua et al., 2008) и влияет на вирулентность у мышей (Chua et al. , 2008; Zaini and Макминн, 2012). В соответствии с более ранними результатами недавнее исследование также продемонстрировало, что VP1-145 является ключевым фактором, определяющим нейровирулентность EV-A71 у обезьян (Fujii et al., 2018). Кроме того, было установлено, что изменения нуклеотидов в 5′-UTR и замены аминокислот в белке 2A или 3C играют важную роль в определении вирулентности EV-A71 (Li et al., 2011; Йех и др., 2011; Ли и др., 2017). Неизвестно, ослабляют ли они нейровирулентность EV-A71. Тем не менее ожидается, что все эти результаты будут способствовать не только нашему пониманию EV-A71, но и разработке живой аттенуированной вакцины EV-A71 в будущем.
, 2008; Zaini and Макминн, 2012). В соответствии с более ранними результатами недавнее исследование также продемонстрировало, что VP1-145 является ключевым фактором, определяющим нейровирулентность EV-A71 у обезьян (Fujii et al., 2018). Кроме того, было установлено, что изменения нуклеотидов в 5′-UTR и замены аминокислот в белке 2A или 3C играют важную роль в определении вирулентности EV-A71 (Li et al., 2011; Йех и др., 2011; Ли и др., 2017). Неизвестно, ослабляют ли они нейровирулентность EV-A71. Тем не менее ожидается, что все эти результаты будут способствовать не только нашему пониманию EV-A71, но и разработке живой аттенуированной вакцины EV-A71 в будущем.
EV-D68 — еще один неполиомиелитный энтеровирус, ассоциированный с полиоподобным неврологическим расстройством, известным как острый вялый миелит (ОВМ), с такими симптомами, как дисневрия и мышечная слабость, хотя наиболее частым клиническим симптомом инфекции EV-D68 является респираторная болезни (Holm-Hansen et al., 2016; Мессакар и др. , 2018). EV-D68 совершенно уникален среди энтеровирусов, поскольку он обладает некоторыми характерными чертами респираторных энтеровирусов (риновирус AC), включая оптимальную температуру роста 33°C, обеспечивающую лучшую репликацию в носовой полости и неспособность выживать в желудке из-за чувствительности к кислоте, но генетически более тесно связаны с кишечными энтеровирусами на основе филогенетического анализа. EV-D68 стал новым патогеном после вспышки в 2014 году в США.Исследования показали, что шесть мутаций, в том числе M291T, V341A, T860N, D297N, S1108G и R2005K, связаны с нейровирулентностью штаммов EV-D68, вызвавших вспышку ОВМ в 2014 г. (Greninger et al., 2015). Интересно, что в другом исследовании были выявлены 3 нуклеотидные переменные, C1817T, C3277A и A4020G, в штаммах вспышки 2014 г., которые значительно отличаются от ранее идентифицированных штаммов EV-D68 (Huang W. et al., 2015). Среди этих трех переменных C3277A вызывает аминокислотную замену T860N в сайте расщепления протеазой 2A между VP1 и 2A, тогда как A4020G приводит к аминокислотной замене S1108G в сайте расщепления протеазой 3C между 2B и 2C, предполагая, что мутация этих двух сайтов может изменить эффективность расщепления и увеличение скорости репликации и передачи.
, 2018). EV-D68 совершенно уникален среди энтеровирусов, поскольку он обладает некоторыми характерными чертами респираторных энтеровирусов (риновирус AC), включая оптимальную температуру роста 33°C, обеспечивающую лучшую репликацию в носовой полости и неспособность выживать в желудке из-за чувствительности к кислоте, но генетически более тесно связаны с кишечными энтеровирусами на основе филогенетического анализа. EV-D68 стал новым патогеном после вспышки в 2014 году в США.Исследования показали, что шесть мутаций, в том числе M291T, V341A, T860N, D297N, S1108G и R2005K, связаны с нейровирулентностью штаммов EV-D68, вызвавших вспышку ОВМ в 2014 г. (Greninger et al., 2015). Интересно, что в другом исследовании были выявлены 3 нуклеотидные переменные, C1817T, C3277A и A4020G, в штаммах вспышки 2014 г., которые значительно отличаются от ранее идентифицированных штаммов EV-D68 (Huang W. et al., 2015). Среди этих трех переменных C3277A вызывает аминокислотную замену T860N в сайте расщепления протеазой 2A между VP1 и 2A, тогда как A4020G приводит к аминокислотной замене S1108G в сайте расщепления протеазой 3C между 2B и 2C, предполагая, что мутация этих двух сайтов может изменить эффективность расщепления и увеличение скорости репликации и передачи. Однако, используя мышиную модель паралитического миелита, вызванного EV-D68, недавнее исследование показало, что штаммы EV-D68 вспышки 2014 г., выделенные от пациентов без AFM, также могут вызывать паралич у новорожденных мышей (Hixon et al., 2017). Таким образом, для установления детерминант нейровирулентности EV-D68 потребуются дальнейшие сравнительные анализы с использованием инфекционных клонов, содержащих различные комбинации ранее идентифицированных мутаций.
Однако, используя мышиную модель паралитического миелита, вызванного EV-D68, недавнее исследование показало, что штаммы EV-D68 вспышки 2014 г., выделенные от пациентов без AFM, также могут вызывать паралич у новорожденных мышей (Hixon et al., 2017). Таким образом, для установления детерминант нейровирулентности EV-D68 потребуются дальнейшие сравнительные анализы с использованием инфекционных клонов, содержащих различные комбинации ранее идентифицированных мутаций.
Иммунные реакции в ЦНС
Примерно у 3% людей, инфицированных энтеровирусом, развивается энцефалит, в то время как у большинства людей никогда не проявляются признаки инфекции ЦНС (Koskiniemi et al., 1991). Поскольку энцефалит встречается только у небольшого процента инфицированных людей, считается, что взаимодействия хозяина и патогена и иммунные реакции в периферических участках предотвращают проникновение вирусов в ЦНС и вызывают инфекцию в ней. У пациентов с энтеровирусным энцефалитом могут проявляться симптомы различной степени тяжести от легких когнитивных нарушений и потери памяти до необратимого поражения ЦНС и смерти. Симптомы в основном вызваны вызванными вирусом воспалительными реакциями в головном мозге. Воспаление — это защитный иммунный ответ организма на инфекцию, но считалось, что мозг обладает иммунными привилегиями на основании двух преобладающих убеждений.Во-первых, ГЭБ предотвращает проникновение циркулирующих иммунных клеток и антител в головной мозг. Во-вторых, отсутствует лимфодренаж, предупреждающий иммунную систему о присутствии антигенов ЦНС. Однако эти два убеждения были поставлены под сомнение в связи с обнаружением небольшого количества лейкоцитов в спинномозговой жидкости и недавно идентифицированными лимфатическими сосудами, которые обеспечивают выход лейкоцитов (Engelhardt et al., 2017). В дополнение к ГЭБ были описаны две другие структуры мозгового барьера: (1) гемато-ликворный барьер для сосудистого сплетения, расположенного в желудочках головного мозга, и (2) гемато-ликворный барьер для паутинной оболочки мозга, который находится на поверхности головного мозга.Важно отметить, что пространства ЦСЖ в этих двух мозговых барьерах не обладают такими же иммунными привилегиями, как паренхима ЦНС, и содержат различные иммунные клетки для мониторинга ЦСЖ на наличие иммунных сигналов в ответ на вирусные патогены.
Симптомы в основном вызваны вызванными вирусом воспалительными реакциями в головном мозге. Воспаление — это защитный иммунный ответ организма на инфекцию, но считалось, что мозг обладает иммунными привилегиями на основании двух преобладающих убеждений.Во-первых, ГЭБ предотвращает проникновение циркулирующих иммунных клеток и антител в головной мозг. Во-вторых, отсутствует лимфодренаж, предупреждающий иммунную систему о присутствии антигенов ЦНС. Однако эти два убеждения были поставлены под сомнение в связи с обнаружением небольшого количества лейкоцитов в спинномозговой жидкости и недавно идентифицированными лимфатическими сосудами, которые обеспечивают выход лейкоцитов (Engelhardt et al., 2017). В дополнение к ГЭБ были описаны две другие структуры мозгового барьера: (1) гемато-ликворный барьер для сосудистого сплетения, расположенного в желудочках головного мозга, и (2) гемато-ликворный барьер для паутинной оболочки мозга, который находится на поверхности головного мозга.Важно отметить, что пространства ЦСЖ в этих двух мозговых барьерах не обладают такими же иммунными привилегиями, как паренхима ЦНС, и содержат различные иммунные клетки для мониторинга ЦСЖ на наличие иммунных сигналов в ответ на вирусные патогены. Следовательно, иммунная привилегия мозга не является абсолютной, а скорее относительной по отношению к другим органам.
Следовательно, иммунная привилегия мозга не является абсолютной, а скорее относительной по отношению к другим органам.
Сообщается, что энтеровирусный энцефалит чаще возникает у детей младшего возраста. Хотя точная причина остается неизвестной, было высказано предположение, что в наблюдаемом эффекте может быть задействована ослабленная или незрелая иммунная система.Исследования показали, что экспрессия CD40-лиганда на активированных Т-клетках и продукция интерлейкина 4 (IL-4) значительно ниже у детей, инфицированных EV-A71, с менингоэнцефалитом, чем у детей без него (Yang et al., 2001). CD40-лиганд играет ключевую роль в ко-стимуляции и регуляции иммунных ответов. Он связывается с рецептором CD40 на антигенпрезентирующих клетках, включая В-клетки и макрофаги, для облегчения межклеточной коммуникации и модуляции адаптивного иммунитета. Интерлейкин-4 (ИЛ-4) также является ключевым регулятором адаптивного иммунитета.Это цитокин, который выполняет множество функций, включая стимуляцию пролиферации активированных В-клеток и Т-клеток и дифференцировку наивных хелперных Т-клеток и В-клеток в клетки Th3 и плазматические клетки соответственно. Таким образом, снижение CD40-лиганда и IL-4 может свидетельствовать о нарушении адаптивного иммунитета. Кроме того, в том же исследовании были отмечены различия в полиморфизме цитотоксического Т-лимфоцитарного антигена-4 (CTLA-4) у детей с менингоэнцефалитом и без него (Yang et al., 2001). CTLA-4 представляет собой поверхностный рецептор Т-клеток, функция которого заключается в подавлении активности Т-клеток, и было показано, что полиморфизм CTLA-4 связан с некоторыми аутоиммунными заболеваниями (Marron et al., 1997). Интересно, что в недавнем исследовании сообщалось о корреляции между генотипом человеческого лейкоцитарного антигена (HLA) и инфекционностью энтеровируса у детей раннего возраста (Sioofy-Khojine et al., 2018). Постоянно имеются доказательства того, что генетические различия между людьми могут влиять на иммунный ответ на инфекцию (Kim-Hellmuth et al., 2017). В совокупности эти результаты позволяют предположить, что генетические факторы могут обусловливать предрасположенность к неврологическим осложнениям после энтеровирусной инфекции.
Таким образом, снижение CD40-лиганда и IL-4 может свидетельствовать о нарушении адаптивного иммунитета. Кроме того, в том же исследовании были отмечены различия в полиморфизме цитотоксического Т-лимфоцитарного антигена-4 (CTLA-4) у детей с менингоэнцефалитом и без него (Yang et al., 2001). CTLA-4 представляет собой поверхностный рецептор Т-клеток, функция которого заключается в подавлении активности Т-клеток, и было показано, что полиморфизм CTLA-4 связан с некоторыми аутоиммунными заболеваниями (Marron et al., 1997). Интересно, что в недавнем исследовании сообщалось о корреляции между генотипом человеческого лейкоцитарного антигена (HLA) и инфекционностью энтеровируса у детей раннего возраста (Sioofy-Khojine et al., 2018). Постоянно имеются доказательства того, что генетические различия между людьми могут влиять на иммунный ответ на инфекцию (Kim-Hellmuth et al., 2017). В совокупности эти результаты позволяют предположить, что генетические факторы могут обусловливать предрасположенность к неврологическим осложнениям после энтеровирусной инфекции.
Хотя генетическая предрасположенность может объяснить, почему энтеровирусный энцефалит возникает только у некоторых детей, но не у других, она не может объяснить, почему дети младшего возраста, инфицированные энтеровирусами, подвержены более высокому риску развития энцефалита. Было высказано предположение, что незрелость ГЭБ в раннем развитии может частично объяснять возрастные различия в вирусной нейроинвазии (Saunders et al., 2014). Развитие ГЭБ представляет собой многоэтапный процесс, который начинается с роста новых сосудов в эмбриональную нейроэктодерму из ранее существовавших сосудов (Blanchette and Daneman, 2015). За этим следует экспрессия белков плотных контактов и переносчиков питательных веществ в BMEC, которые выстилают кровеносные сосуды в головном мозге. ГЭБ становится зрелым, когда формирующиеся сосуды вступают в тесный контакт с перицитами и астроцитами, которые обеспечивают структурную и функциональную поддержку ГЭБ. Кроме того, другие типы клеток, присутствующие в ГЭБ, включая нейроны, микроглию и периваскулярные макрофаги, также вносят вклад в свойства ГЭБ (Banerjee and Bhat, 2007). Интересно, что было показано, что ГЭБ способен ограничивать проникновение белков и малых молекул во время эмбриогенеза до образования постнатальных астроцитов и покрытия сосудов (Daneman et al., 2010; Saunders et al., 2014), что позволяет предположить, что ГЭБ является функционально зрелым даже без астроцитов в раннем развитии. Хотя астроциты не требуются для начального формирования ГЭБ, имеются убедительные доказательства того, что астроциты играют важную роль в регуляции функции ГЭБ во время постнатального развития (Haseloff et al., 2005). Например, астроциты секретируют трофические факторы, которые приводят к более плотным контактам между BMEC (Dehouck et al., 1990; Rubin et al., 1991). Помимо своей роли в регуляции ГЭБ, астроциты получают сигналы от соседних нейронов и реагируют на них высвобождением нейроактивных веществ для модуляции силы синапсов в ЦНС (Santello et al., 2019). Более того, есть доказательства того, что астроциты передают сигналы от нейронов в сосудистую сеть, что приводит к расширению артериол и увеличению местного кровотока (Anderson and Nedergaard, 2003; Zonta et al.
Интересно, что было показано, что ГЭБ способен ограничивать проникновение белков и малых молекул во время эмбриогенеза до образования постнатальных астроцитов и покрытия сосудов (Daneman et al., 2010; Saunders et al., 2014), что позволяет предположить, что ГЭБ является функционально зрелым даже без астроцитов в раннем развитии. Хотя астроциты не требуются для начального формирования ГЭБ, имеются убедительные доказательства того, что астроциты играют важную роль в регуляции функции ГЭБ во время постнатального развития (Haseloff et al., 2005). Например, астроциты секретируют трофические факторы, которые приводят к более плотным контактам между BMEC (Dehouck et al., 1990; Rubin et al., 1991). Помимо своей роли в регуляции ГЭБ, астроциты получают сигналы от соседних нейронов и реагируют на них высвобождением нейроактивных веществ для модуляции силы синапсов в ЦНС (Santello et al., 2019). Более того, есть доказательства того, что астроциты передают сигналы от нейронов в сосудистую сеть, что приводит к расширению артериол и увеличению местного кровотока (Anderson and Nedergaard, 2003; Zonta et al. , 2003). Таким образом, астроциты связывают активность нейронов с функциональными свойствами ГЭБ. Учитывая, что астроциты имеют решающее значение для структурной поддержки и поддержания ГЭБ, развивающийся мозг, содержащий незрелые астроциты, может иметь более высокую проницаемость ГЭБ по сравнению со взрослым мозгом и, вероятно, более уязвим для вирусной нейроинвазии.
, 2003). Таким образом, астроциты связывают активность нейронов с функциональными свойствами ГЭБ. Учитывая, что астроциты имеют решающее значение для структурной поддержки и поддержания ГЭБ, развивающийся мозг, содержащий незрелые астроциты, может иметь более высокую проницаемость ГЭБ по сравнению со взрослым мозгом и, вероятно, более уязвим для вирусной нейроинвазии.
Иммунная система ЦНС также может быть связана с возрастными различиями в развитии энтеровирусного энцефалита. Микроглия, основные резидентные иммунные клетки головного мозга, играют ключевую роль в регуляции сигнальных путей при воспалении ЦНС (Rivest, 2009).Хотя микроглия фенотипически и эволюционно отличается от периферических макрофагов, они используют фагоцитарные и цитотоксические механизмы для уничтожения чужеродных патогенов и действуют как антигенпрезентирующие клетки для инициации опосредованных Т-клетками адаптивных иммунных ответов, подобных макрофагам. Кроме того, было показано, что микроглия индуцирует рекрутирование моноцитов в головной мозг во время вирусной инфекции (Fekete et al. , 2018). Однако неясно, полностью ли функциональна микроглия во время раннего развития.Микроглия в раннем постнатальном мозге имеет другую морфологию по сравнению со взрослым мозгом (Cuadros and Navascues, 1998). Они в значительной степени не разветвлены и принимают амебоидную форму во время раннего развития и постепенно дифференцируются в зрелую/разветвленную микроглию по мере созревания мозга. Соответственно разные наборы генов экспрессируются в микроглии на разных фазах развития (Bennett et al., 2016; Matcovitch-Natan et al., 2016). Амебоидная морфология, наблюдаемая в развивающейся микроглии, аналогична активированной фагоцитарной микроглии из мозга взрослого человека, что позволяет предположить, что микроглия находится в постоянно «активированном» состоянии в развивающемся мозге (Lenz and Nelson, 2018).Интересно, что было показано, что активированная микроглия продуцирует воспалительные цитокины, такие как TNFα и IL-1β (Nishioku et al., 2010; Yang et al., 2015), которые увеличивают проницаемость ГЭБ и подавляют белки плотных контактов между BMEC (Gu et al.
, 2018). Однако неясно, полностью ли функциональна микроглия во время раннего развития.Микроглия в раннем постнатальном мозге имеет другую морфологию по сравнению со взрослым мозгом (Cuadros and Navascues, 1998). Они в значительной степени не разветвлены и принимают амебоидную форму во время раннего развития и постепенно дифференцируются в зрелую/разветвленную микроглию по мере созревания мозга. Соответственно разные наборы генов экспрессируются в микроглии на разных фазах развития (Bennett et al., 2016; Matcovitch-Natan et al., 2016). Амебоидная морфология, наблюдаемая в развивающейся микроглии, аналогична активированной фагоцитарной микроглии из мозга взрослого человека, что позволяет предположить, что микроглия находится в постоянно «активированном» состоянии в развивающемся мозге (Lenz and Nelson, 2018).Интересно, что было показано, что активированная микроглия продуцирует воспалительные цитокины, такие как TNFα и IL-1β (Nishioku et al., 2010; Yang et al., 2015), которые увеличивают проницаемость ГЭБ и подавляют белки плотных контактов между BMEC (Gu et al. и др., 2015; Альмутаири и др., 2016). В совокупности эти результаты позволяют предположить, что развитие микроглии может увеличить проницаемость ГЭБ за счет высвобождения воспалительных цитокинов. Любопытно, что другое исследование показало, что профили экспрессии генов различаются между активированной микроглией из головного мозга взрослого человека и микроглией из контрольного неонатального мозга (Wlodarczyk et al., 2017). Таким образом, развивающаяся микроглия отличается от «активированной» микроглии взрослых, хотя обе они демонстрируют удивительное сходство в морфологии. Тем не менее, это может служить логичным объяснением того, почему дети младшего возраста, инфицированные энтеровирусами, подвергаются более высокому риску развития энцефалита.
и др., 2015; Альмутаири и др., 2016). В совокупности эти результаты позволяют предположить, что развитие микроглии может увеличить проницаемость ГЭБ за счет высвобождения воспалительных цитокинов. Любопытно, что другое исследование показало, что профили экспрессии генов различаются между активированной микроглией из головного мозга взрослого человека и микроглией из контрольного неонатального мозга (Wlodarczyk et al., 2017). Таким образом, развивающаяся микроглия отличается от «активированной» микроглии взрослых, хотя обе они демонстрируют удивительное сходство в морфологии. Тем не менее, это может служить логичным объяснением того, почему дети младшего возраста, инфицированные энтеровирусами, подвергаются более высокому риску развития энцефалита.
Заключение
Энтеровирусная инфекция является серьезной проблемой общественного здравоохранения, учитывая увеличение вспышек серьезных неврологических осложнений. Хотя был достигнут значительный прогресс в изучении сложного взаимодействия между энтеровирусами и инфицированной клеткой в культуральной чашке, более сложное взаимодействие между вирусом и хозяином in vivo в значительной степени неизвестно, и как энтеровирусы получают доступ и распространяются в хорошо защищенной ЦНС. остается исследовать.Например, общим признаком энтеровирусного энцефалита является поражение ствола мозга (Wasserstrom et al., 1992; Huang et al., 1999; Shen et al., 1999; Lum et al., 2002; Brecht et al., 2010; Fan and Liu, 2019), но в некоторых исследованиях при неонатальном энтеровирусном энцефалите были выявлены поражения белого вещества головного мозга без вовлечения ствола (Verboon-Maciolek et al., 2006; Hirata et al., 2011; Wu et al., 2014; Correia et al. ., 2016), предполагая, что возраст и созревание головного мозга могут играть важную роль в патогенезе энтеровирусного энцефалита.В текущем обзоре мы предполагаем наличие причинно-следственной связи между развитием нейроиммунной системы и энтеровирусной нейроинвазией и предположили, что возрастная разница в развитии энтеровирусного энцефалита может быть связана с развитием нейроиммунной системы, такой как созревание астроцитов. и/или микроглии. Будущая работа должна включать дальнейшую характеристику сложных взаимодействий между хозяином и энтеровирусами с использованием соответствующих моделей животных и роли астроцитов и микроглии в развитии в регуляции проницаемости ГЭБ.
остается исследовать.Например, общим признаком энтеровирусного энцефалита является поражение ствола мозга (Wasserstrom et al., 1992; Huang et al., 1999; Shen et al., 1999; Lum et al., 2002; Brecht et al., 2010; Fan and Liu, 2019), но в некоторых исследованиях при неонатальном энтеровирусном энцефалите были выявлены поражения белого вещества головного мозга без вовлечения ствола (Verboon-Maciolek et al., 2006; Hirata et al., 2011; Wu et al., 2014; Correia et al. ., 2016), предполагая, что возраст и созревание головного мозга могут играть важную роль в патогенезе энтеровирусного энцефалита.В текущем обзоре мы предполагаем наличие причинно-следственной связи между развитием нейроиммунной системы и энтеровирусной нейроинвазией и предположили, что возрастная разница в развитии энтеровирусного энцефалита может быть связана с развитием нейроиммунной системы, такой как созревание астроцитов. и/или микроглии. Будущая работа должна включать дальнейшую характеристику сложных взаимодействий между хозяином и энтеровирусами с использованием соответствующих моделей животных и роли астроцитов и микроглии в развитии в регуляции проницаемости ГЭБ. Нам также необходимо лучше понять регуляцию иммунных реакций в ЦНС, вызванных энтеровирусами.
Нам также необходимо лучше понять регуляцию иммунных реакций в ЦНС, вызванных энтеровирусами.
Вклад авторов
Все авторы участвовали в написании и обсуждении этой обзорной статьи и одобрили окончательный вариант рукописи. H-CL сделал рисунок и таблицу.
Финансирование
Эта работа выполнена при финансовой поддержке Исследовательского центра новых вирусных инфекций из программы Исследовательского центра избранных областей в рамках проекта Higher Education Sprout Министерства образования (MOE) Тайваня, Министерства науки и технологий (MOST) , Тайвань (MOST 108-3017-F-182-001) и Мемориальный госпиталь Чан Гун (CORPD1J0061).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
Ан Дж., Джи Ю., Сео И., Юн С.Ю., Ким Д., Ким Ю.К. и др. (2008). Первичные нейроны становятся менее восприимчивыми к вирусу Коксаки B5 после созревания: корреляция со сниженным уровнем экспрессии CAR на клеточной поверхности. Дж.Мед. Вирол. 80, 434–440. doi: 10.1002/jmv.21100
Дж.Мед. Вирол. 80, 434–440. doi: 10.1002/jmv.21100
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Almutairi, M.M., Gong, C., Xu, Y.G., Chang, Y., and Shi, H. (2016). Факторы, контролирующие проницаемость гематоэнцефалического барьера. Сотовый. Мол. Жизнь наук. 73, 57–77. doi: 10.1007/s00018-015-2050-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Андерсон, К.М., и Недергаард, М. (2003). Опосредованный астроцитами контроль микроциркуляции головного мозга. Trends Neurosci. 26, 340–344; автореф. 344–345.
Реферат PubMed | Академия Google
Арита М., Ами Ю., Вакита Т. и Симидзу Х. (2008). Совместный эффект детерминант аттенуации, полученных из штамма полиовируса sabin 1, необходим для аттенуации энтеровируса 71 в модели инфекции мышей NOD/SCID. Дж. Вирол. 82, 1787–1797 гг. doi: 10.1128/jvi.01798-07
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Арита, М. , Нагата Н., Сата Т., Миямура Т. и Симидзу Х. (2006). Количественный анализ паралича, подобного полиомиелиту, у мышей, индуцированного репликоном полиовируса. Дж. Генерал Вирол. 87, 3317–3327. doi: 10.1099/vir.0.82172-0
, Нагата Н., Сата Т., Миямура Т. и Симидзу Х. (2006). Количественный анализ паралича, подобного полиомиелиту, у мышей, индуцированного репликоном полиовируса. Дж. Генерал Вирол. 87, 3317–3327. doi: 10.1099/vir.0.82172-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Арита М., Симидзу Х., Нагата Н., Ами Ю., Судзаки Ю., Сата Т. и др. (2005). Чувствительные к температуре мутанты энтеровируса 71 проявляют аттенуацию у яванских макаков. Дж. Генерал Вирол. 86, 1391–1401. doi: 10.1099/vir.0.80784-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Baggen, J., Thibaut, H.J., Strating, J., и Van Kuppeveld, FJM (2018). Жизненный цикл неполиомиелитных энтеровирусов и способы борьбы с ним. Нац. Преподобный Микробиолог. 16, 368–381. doi: 10.1038/s41579-018-0005-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Балада-Лласат, Дж. М., Розенталь, Н., Хасбун, Р. , Циммер, Л., Боззетт, С., Дафф С. и соавт. (2019). Стоимость лечения менингита и энцефалита у младенцев и детей в США. Диагн. микробиол. Заразить. Дис. 93, 349–354. doi: 10.1016/j.diagmicrobio.2018.10.012
, Циммер, Л., Боззетт, С., Дафф С. и соавт. (2019). Стоимость лечения менингита и энцефалита у младенцев и детей в США. Диагн. микробиол. Заразить. Дис. 93, 349–354. doi: 10.1016/j.diagmicrobio.2018.10.012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Bennett, M.L., Bennett, F.C., Liddelow, S.A., Ajami, B., Zamanian, J.L., Fernhoff, N.B., et al. (2016). Новые инструменты для изучения микроглии в ЦНС мыши и человека. Проц. Натл. акад. науч.США 113, E1738–E1746. doi: 10.1073/pnas.1525528113
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бергельсон, Дж. М., Моханти, Дж. Г., Кроуэлл, Р. Л., Сент-Джон, Н. Ф., Люблин, Д. М., и Финберг, Р. В. (1995). Вирус Коксаки В3, адаптированный к росту в клетках RD, связывается с фактором, ускоряющим распад (CD55). Дж. Вирол. 69, 1903–1906 гг. doi: 10.1128/jvi.69.3.1903-1906.1995
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бергер, М. М., Копп Н., Витал К., Редл Б., Аймард М. и Лина Б. (2000). Обнаружение и клеточная локализация последовательностей РНК энтеровирусов в спинном мозге пациентов с БАС. Неврология 54, 20–25.
М., Копп Н., Витал К., Редл Б., Аймард М. и Лина Б. (2000). Обнаружение и клеточная локализация последовательностей РНК энтеровирусов в спинном мозге пациентов с БАС. Неврология 54, 20–25.
Академия Google
Берд, С.В., Мейнард, Н.Д., Коверт, М.В., и Киркегор, К. (2014). Нелитическое распространение вируса усиливается компонентами аутофагии. Проц. Натл. акад. науч. США 111, 13081–13086. doi: 10.1073/pnas.1401437111
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Б’Кронг, Н., Minh, N.N.Q., Qui, P.T., Chau, T.T.H., Nghia, H.D.T., Do, L.A.H., et al. (2018). Серотипы энтеровирусов у пациентов с инфекциями центральной нервной системы и респираторными заболеваниями во Вьетнаме, 1997-2010 гг. Вирол. Дж. 15:69. doi: 10.1186/s12985-018-0980-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Брехт, М., Джиоти, Р., Макгуайр, В., и Чаухан, М. (2010). Случай неонатального стволового энцефалита Коксаки В. J. Педиатр. Детское здоровье 46, 699–701.
J. Педиатр. Детское здоровье 46, 699–701.
Академия Google
Бурки, Т. (2019). Случаи полиовируса вакцинного происхождения превышают дикие типы. Ланцет Заражение. Дис. 19:140. doi: 10.1016/s1473-3099(19)30012-x
Полнотекстовая перекрестная ссылка | Академия Google
Кейн, Э. А., и Осорио, Дж. Э. (2017). Визуализация in vivo с помощью биолюминесцентного энтеровируса 71 позволяет визуализировать тропность тканей и распространение вируса в режиме реального времени. Дж. Вирол. 91:e01759-16. doi: 10.1128/ОВИ.01759-16
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чанг, Л.Y., Huang, L.M., Gau, S.S., Wu, Y.Y., Hsia, S.H., Fan, T.Y., et al. (2007). Нейроразвитие и когнитивные функции у детей после заражения энтеровирусом 71. Н. англ. Дж. Мед. 356, 1226–1234. дои: 10.1056/nejmoa065954
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чепмен, Н. М., и Ким, К.С. (2008). Персистирующая коксакивирусная инфекция: персистенция энтеровируса при хроническом миокардите и дилатационной кардиомиопатии. Курс. Вверх. микробиол. Иммунол. 323, 275–292. дои: 10.1007/978-3-540-75546-3_13
М., и Ким, К.С. (2008). Персистирующая коксакивирусная инфекция: персистенция энтеровируса при хроническом миокардите и дилатационной кардиомиопатии. Курс. Вверх. микробиол. Иммунол. 323, 275–292. дои: 10.1007/978-3-540-75546-3_13
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чепмен Н.М., Ким К.С., Дрешер К.М., Ока К. и Трейси С. (2008). 5′-концевые делеции в геноме штамма коксакивируса В2 естественным образом встречались в сердце человека. Вирусология 375, 480–491. doi: 10.1016/j.virol.2008.02.030
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чен, К. С., Яо, Ю. К., Линь, С.C., Lee, Y.P., Wang, Y.F., Wang, J.R., et al. (2007). Ретроградный аксональный транспорт: основной путь передачи энтеровируса 71 у мышей. Дж. Вирол. 81, 8996–9003. doi: 10.1128/jvi.00236-07
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чен, X., Цзи, Т., Го, Дж., Ван, В.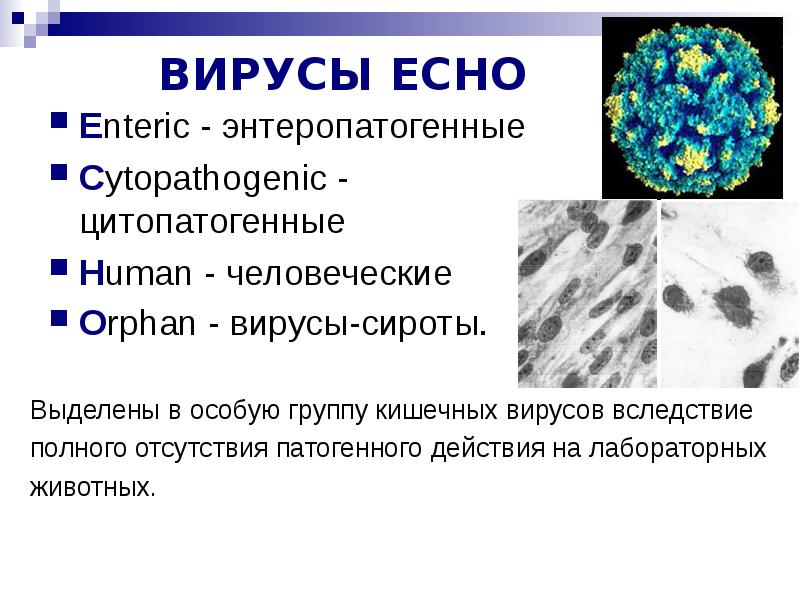 , Сюй, В., и Се, З. (2019). Молекулярная эпидемиология эховируса 18, циркулировавшего в материковом Китае с 2015 по 2016 год. Вирол. Грех. 34, 50–58. doi: 10.1007/s12250-018-0080-8
, Сюй, В., и Се, З. (2019). Молекулярная эпидемиология эховируса 18, циркулировавшего в материковом Китае с 2015 по 2016 год. Вирол. Грех. 34, 50–58. doi: 10.1007/s12250-018-0080-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чен, X., Ли Дж., Го Дж., Сюй В., Сунь С. и Се З. (2017). Вспышка эховирусного энцефалита/менингита 18 среди детей в провинции Хэбэй, Китай, 2015 г. Emerg. микробы заражают. 6:e54.
Академия Google
Чуа, Б.Х., Пхуэктес, П., Сандерс, С.А., Николлс, П.К., и Макминн, П.К. (2008). Молекулярная основа адаптации мышей к человеческому энтеровирусу 71. J. Gen. Virol. 89, 1622–1632. doi: 10.1099/vir.0.83676-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кольбер-Гарапин, Ф., Christodoulou, C., Crainic, R., and Pelletier, I. (1989). Персистирующая полиовирусная инфекция клеток нейробластомы человека. Проц. Натл. акад. науч. США 86, 7590–7594. doi: 10.1073/pnas.86.19.7590
doi: 10.1073/pnas.86.19.7590
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кольбер-Гарапен Ф., Дункан Г., Павио Н., Пеллетье И. и Пети И. (1998). Подход к пониманию механизмов персистенции полиовируса в инфицированных клетках нейрального или ненейрального происхождения. клин.Диагн. Вирол. 9, 107–113. doi: 10.1016/s0928-0197(98)00009-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Коррейя, Дж., Алвес, Дж. Э., Феррейра, П., Феррейра, М., Пирес, П., и Гарридо, К. (2016). Энтеровирусный менингоэнцефалит 71 с обширным поражением белого вещества. Педиатр. Заразить. Дис. Дж. 35, 1277–1278. doi: 10.1097/inf.0000000000001292
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кудерк, Т., Гивель-Бенхассин, Ф., Калаора В., Госселин А.С. и Блондель Б. (2002). Мышиная модель ex vivo для изучения апоптоза, вызванного полиовирусом, в нервных клетках. Дж. Генерал Вирол. 83, 1925–1930 гг. дои: 10.1099/0022-1317-83-8-1925
83, 1925–1930 гг. дои: 10.1099/0022-1317-83-8-1925
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Данеман Р., Чжоу Л., Кебеде А. А. и Баррес Б. А. (2010). Перициты необходимы для целостности гематоэнцефалического барьера во время эмбриогенеза. Природа 468, 562–566. doi: 10.1038/nature09513
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дэвисон, Д.Л., Терек М. и Чавла Л.С. (2012). Нейрогенный отек легких. Крит. Уход 16:212.
Академия Google
Dehouck, M.P., Meresse, S., Delorme, P., Fruchart, J.C., и Cecchelli, R. (1990). Более простой, воспроизводимый и массовый метод изучения гематоэнцефалического барьера in vitro. Дж. Нейрохим. 54, 1798–1801 гг. doi: 10.1111/j.1471-4159.1990.tb01236.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эванс, Д.M., Dunn, G., Minor, P.D., Schild, G.C., Cann, A.J., Stanway, G., et al. (1985). Повышенная нейровирулентность связана с изменением одного нуклеотида в некодирующей области генома полиовакцины Сэбина 3 типа. Природа 314, 548–550. дои: 10.1038/314548a0
(1985). Повышенная нейровирулентность связана с изменением одного нуклеотида в некодирующей области генома полиовакцины Сэбина 3 типа. Природа 314, 548–550. дои: 10.1038/314548a0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Famulare, M., Chang, S., Iber, J., Zhao, K., Adeniji, J.A., Bukbuk, D., et al. (2016). Реверсия вакцины Сэбина в полевых условиях: всесторонний анализ изолятов сэбин-подобного полиовируса в Нигерии. Дж. Вирол. 90, 317–331. doi: 10.1128/ОВИ.01532-15
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Fechner, H., Pinkert, S., Wang, X., Sipo, I., Suckau, L., Kurreck, J., et al. (2007). Коксакивирус В3 и аденовирусные инфекции сердечных клеток эффективно ингибируются вектор-опосредованной РНК-интерференцией, направленной на их общий рецептор. Джин Тер. 14, 960–971. doi: 10.1038/sj.gt.3302948
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фекете, Р. , Cserep, C., Lenart, N., Toth, K., Orsolits, B., Martinecz, B., et al. (2018). Микроглия контролирует распространение нейротропной вирусной инфекции с помощью передачи сигналов P2Y12 и рекрутирует моноциты с помощью независимых от P2Y12 механизмов. Акта Нейропатол. 136, 461–482. doi: 10.1007/s00401-018-1885-0
, Cserep, C., Lenart, N., Toth, K., Orsolits, B., Martinecz, B., et al. (2018). Микроглия контролирует распространение нейротропной вирусной инфекции с помощью передачи сигналов P2Y12 и рекрутирует моноциты с помощью независимых от P2Y12 механизмов. Акта Нейропатол. 136, 461–482. doi: 10.1007/s00401-018-1885-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фэн М., Го С., Фань С., Цзэн X., Чжан Ю., Ляо Ю. и др. (2016). Преимущественная инфекция астроцитов энтеровирусом 71 играет ключевую роль в вирусном нейрогенном патогенезе. Перед. Клетка. Заразить. микробиол. 6:192. doi: 10.3389/fcimb.2016.00192
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Feuer, R., Mena, I., Pagarigan, R., Slifka, M.K., and Whitton, J.L. (2002). Статус клеточного цикла влияет на репликацию, персистенцию и реактивацию вируса Коксаки in vitro. Дж. Вирол. 76, 4430–4440. doi: 10.1128/jvi.76.9.4430-4440.2002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фойер, Р.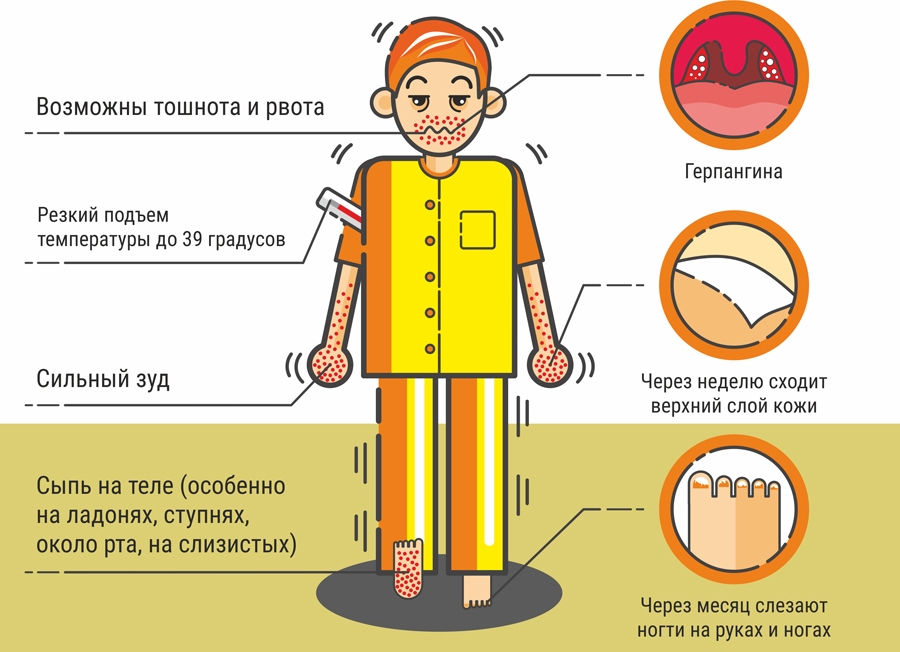 , Мена, И., Пагариган, Р.Р., Хассет, Д.Е., и Уиттон, Дж.Л. (2004). Репликация вируса Коксаки и клеточный цикл: потенциальный регуляторный механизм персистенции/латентности вируса. Мед. микробиол. Иммунол. 193, 83–90. doi: 10.1007/s00430-003-0192-z
, Мена, И., Пагариган, Р.Р., Хассет, Д.Е., и Уиттон, Дж.Л. (2004). Репликация вируса Коксаки и клеточный цикл: потенциальный регуляторный механизм персистенции/латентности вируса. Мед. микробиол. Иммунол. 193, 83–90. doi: 10.1007/s00430-003-0192-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Feuer, R., Pagarigan, R.R., Harkins, S., Liu, F., Hunziker, I.P., и Whitton, J.L. (2005). Вирус Коксаки нацелен на пролиферирующие клетки-предшественники нейронов в ЦНС новорожденных. J. Neurosci. 25, 2434–2444. doi: 10.1523/jneurosci.4517-04.2005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Feuer, R., Ruller, C.M., An, N., Tabor-Godwin, J.M., Rhoades, R.E., Maciejewski, S., et al. (2009). Вирусная персистенция и хроническая иммунопатология в центральной нервной системе взрослых после заражения вирусом Коксаки в неонатальном периоде. Дж. Вирол. 83, 9356–9369. doi: 10.1128/ОВИ.02382-07
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фрайштадт, М.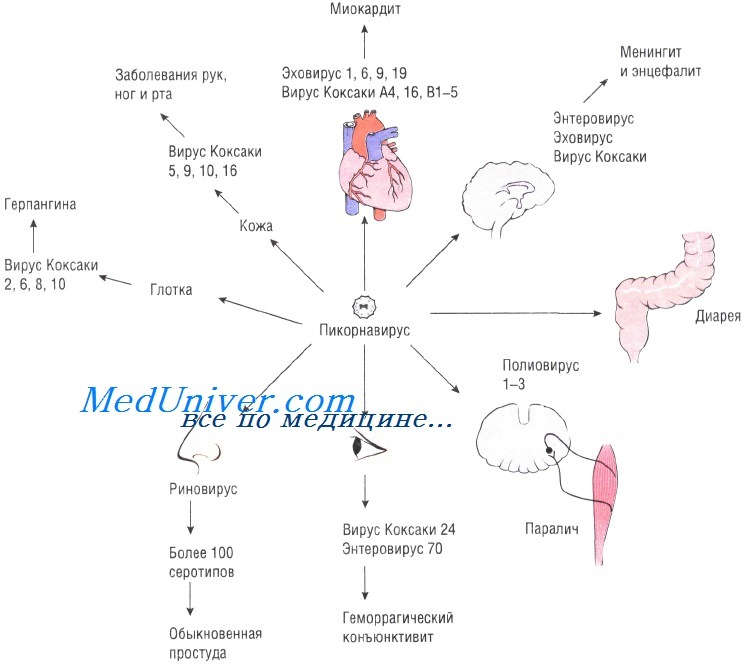 С., Каплан Г. и Раканиелло В. Р. (1990). Гетерогенная экспрессия белков, связанных с рецептором полиовируса, в клетках и тканях человека. Мол. Клеточная биол. 10, 5700–5706. doi: 10.1128/mcb.10.11.5700
С., Каплан Г. и Раканиелло В. Р. (1990). Гетерогенная экспрессия белков, связанных с рецептором полиовируса, в клетках и тканях человека. Мол. Клеточная биол. 10, 5700–5706. doi: 10.1128/mcb.10.11.5700
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Fujii, K., Sudaka, Y., Takashino, A., Kobayashi, K., Kataoka, C., Suzuki, T., et al. (2018). Аминокислотный остаток 145 энтеровируса 71 VP1 является ключевым остатком для его прикрепления к рецептору и устойчивости к нейтрализующим антителам во время инфекции яванских макаков. Дж. Вирол. 92:e00682-18. doi: 10.1128/ОВИ.00682-18
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Жиро П., Болье Ф., Оно С., Симидзу Н., Шазо Г. и Лина Б. (2001). Обнаружение энтеровирусных последовательностей из замороженных образцов спинного мозга японских пациентов с БАС. Неврология 56, 1777–1778. doi: 10.1212/wnl.56.12.1777
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гото К. , Санефудзи М., Кусухара К., Nishimura, Y., Shimizu, H., Kira, R., et al. (2009). Ромбенцефалит и вирус Коксаки А16. Аварийный. Заразить. Дис. 15, 1689–1691. дои: 10.3201/eid1510.0
, Санефудзи М., Кусухара К., Nishimura, Y., Shimizu, H., Kira, R., et al. (2009). Ромбенцефалит и вирус Коксаки А16. Аварийный. Заразить. Дис. 15, 1689–1691. дои: 10.3201/eid1510.0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Greninger, A.L., Naccache, S.N., Messacar, K., Clayton, A., Yu, G., Somasekar, S., et al. (2015). Новая вспышка штамма энтеровируса D68, связанная со случаями острого вялого миелита в США (2012–2014 гг.): ретроспективное когортное исследование. Ланцет Заражение.Дис. 15, 671–682. дои: 10.1016/S1473-3099(15)70093-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Громейер М., Александр Л. и Виммер Э. (1996). Внутренняя замена сайта входа рибосомы устраняет нейровирулентность межродовых рекомбинантов полиовируса. Проц. Натл. акад. науч. США 93, 2370–2375. doi: 10.1073/pnas.93.6.2370
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гу, Х. , Вэй, З.З., Эспинера, А., Lee, J.H., Ji, X., Wei, L., et al. (2015). Фармакологически индуцированная гипотермия ослабляет черепно-мозговую травму у новорожденных крыс. Экспл. Нейрол. 267, 135–142. doi: 10.1016/j.expneurol.2015.02.029
, Вэй, З.З., Эспинера, А., Lee, J.H., Ji, X., Wei, L., et al. (2015). Фармакологически индуцированная гипотермия ослабляет черепно-мозговую травму у новорожденных крыс. Экспл. Нейрол. 267, 135–142. doi: 10.1016/j.expneurol.2015.02.029
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гест С., Пилипенко Э., Шарма К., Чумаков К. и Роос Р. П. (2004). Молекулярные механизмы аттенуации штамма Sabin полиовируса типа 3. J. Virol. 78, 11097–11107. дои: 10.1128/jvi.78.20.11097-11107.2004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гутьеррес А.Л., Денова-Окампо М., Раканьелло В.Р. и Дель Анхель Р.М. (1997). Аттенуирующие мутации в 5′-нетранслируемой области полиовируса изменяют его взаимодействие с белком, связывающим полипиримидиновый тракт. Дж. Вирол. 71, 3826–3833. doi: 10.1128/jvi.71.5.3826-3833.1997
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хан, Дж. , Ма, X.J., Wan, J.F., Liu, Y.H., Han, Y.L., Chen, C., et al. (2010). Длительное сохранение специфических для EV71 нуклеотидов в образцах дыхательных путей и фекалий пациентов с болезнью рук-ног-рота после выздоровления. BMC Заражение. Дис. 10:178. дои: 10.1186/1471-2334-10-178
, Ма, X.J., Wan, J.F., Liu, Y.H., Han, Y.L., Chen, C., et al. (2010). Длительное сохранение специфических для EV71 нуклеотидов в образцах дыхательных путей и фекалий пациентов с болезнью рук-ног-рота после выздоровления. BMC Заражение. Дис. 10:178. дои: 10.1186/1471-2334-10-178
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хасбун Р., Розенталь Н., Балада-Лласат Дж. М., Чанг Дж., Дафф С., Боззетт С. и др. (2017). Эпидемиология менингита и энцефалита в США, 2011-2014 гг. клин. Заразить. Дис. 65, 359–363. doi: 10.1093/cid/cix319
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Haseloff, R.F., Blasig, I.E., Bauer, H.C., and Bauer, H. (2005). В поисках астроцитарного фактора (факторов), модулирующего функции гематоэнцефалического барьера в эндотелиальных клетках капилляров головного мозга in vitro. Сотовый. Мол. Нейробиол. 25, 25–39. doi: 10.1007/s10571-004-1375-x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хайм, А. , Brehm, C., Stille-Siegener, M., Muller, G., Hake, S., Kandolf, R., et al. (1995). Культивируемые миокардиальные фибробласты человека педиатрического происхождения: природный человеческий интерферон-альфа более эффективен, чем рекомбинантный интерферон-альфа 2а, в репликации вируса Коксаки В3 в состоянии носительства. Дж. Мол. Клетка. Кардиол. 27, 2199–2208. doi: 10.1016/s0022-2828(95)
, Brehm, C., Stille-Siegener, M., Muller, G., Hake, S., Kandolf, R., et al. (1995). Культивируемые миокардиальные фибробласты человека педиатрического происхождения: природный человеческий интерферон-альфа более эффективен, чем рекомбинантный интерферон-альфа 2а, в репликации вируса Коксаки В3 в состоянии носительства. Дж. Мол. Клетка. Кардиол. 27, 2199–2208. doi: 10.1016/s0022-2828(95)
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хейм А., Кану А., Киршнер П., Саймон Т., Молл Г., Hofschneider, P.H., et al. (1992). Синергическое взаимодействие интерферона-бета и интерферона-гамма в инфицированных вирусом Коксаки В3 культурах фибробластов миокарда человека. Дж. Заразить. Дис. 166, 958–965. doi: 10.1093/infdis/166.5.985
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хирата О., Исикава Н., Мидзогути Ю., Накамура К. и Кобаяши М. (2011). Случай неонатального менингоэнцефалита Коксаки B2, при котором серийные данные магнитно-резонансной томографии показывают развитие поражений. Нейропедиатрия 42, 156–158. doi: 10.1055/s-0031-1285876
Нейропедиатрия 42, 156–158. doi: 10.1055/s-0031-1285876
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хиксон, А. М., Кларк, П., и Тайлер, К. Л. (2019). Современные циркулирующие штаммы энтеровируса D68 инфицируют и подвергаются ретроградному аксональному транспорту в двигательных нейронах спинного мозга независимо от сиаловой кислоты. Дж. Вирол. 93:e00578-19. doi: 10.1128/ОВИ.00578-19
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хиксон, А.M., Yu, G., Leser, J.S., Yagi, S., Clarke, P., Chiu, C.Y., et al. (2017). Мышиная модель паралитического миелита, вызванного энтеровирусом D68. PLoS Pathog. 13:e1006199. doi: 10.1371/journal.ppat.1006199
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Голландия, JJ (1961). Сродство к рецепторам как основные детерминанты тканевого тропизма энтеровирусов у человека. Вирусология 15, 312–326. дои: 10.1016/0042-6822(61)
дои: 10.1016/0042-6822(61)
Полнотекстовая перекрестная ссылка | Академия Google
Холмс, К.W., Koo, S.S., Osman, H., Wilson, S., Xerry, J., Gallimore, C.I., et al. (2016). Преобладание энтеровируса B и эховируса 30 как причины вирусного менингита у населения Великобритании. Дж. Клин. Вирол. 81, 90–93. doi: 10.1016/j.jcv.2016.06.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Холм-Хансен, К.С., Мидгли, С.Е., и Фишер, Т.К. (2016). Глобальное появление энтеровируса D68: систематический обзор. Ланцет Заражение. Дис. 16, е64–е75.doi: 10.1016/S1473-3099(15)00543-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хсу, Н.Ю., Ильницкая, О., Белов, Г., Сантиана, М., Чен, Ю.Х., Такворян, П.М., и соавт. (2010). Вирусная реорганизация секреторного пути генерирует отдельные органеллы для репликации РНК. Сотовый 141, 799–811. doi: 10.1016/j.cell.2010.03.050
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хуан, С. С., Лю, С.С., Чанг, Ю.С., Chen, C.Y., Wang, S.T., и Yeh, T.F. (1999). Неврологические осложнения у детей с энтеровирусной инфекцией 71. Н. англ. Дж. Мед. 341, 936–942. doi: 10.1056/nejm1993411302
С., Лю, С.С., Чанг, Ю.С., Chen, C.Y., Wang, S.T., и Yeh, T.F. (1999). Неврологические осложнения у детей с энтеровирусной инфекцией 71. Н. англ. Дж. Мед. 341, 936–942. doi: 10.1056/nejm1993411302
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Huang, H.I., Lin, J.Y., Chen, H.H., Yeh, S.B., Kuo, R.L., Weng, K.F., et al. (2014). Энтеровирус 71 инфицирует нервные клетки-предшественники головного мозга. Вирусология 468–470, 592–600. doi: 10.1016/j.virol.2014.09.017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хуанг В., Ван Г., Чжугэ Дж., Нолан С. М., Димитрова Н. и Фэллон Дж. Т. (2015). Анализ последовательности всего генома показывает, что изоляты энтеровируса D68 во время вспышки в США в 2014 году в основном принадлежат к новой кладе. Науч. Реп. 5:15223. дои: 10.1038/srep15223
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хуан Ю. , Чжоу Ю., Лу Х., Ян Х., Фэн К., Дай, Ю. и др. (2015). Характеристика тяжелой болезни рук, ящура и рта в Шэньчжэне, Китай, 2009–2013 гг. J. Med. Вирол. 87, 1471–1479. doi: 10.1002/jmv.24200
, Чжоу Ю., Лу Х., Ян Х., Фэн К., Дай, Ю. и др. (2015). Характеристика тяжелой болезни рук, ящура и рта в Шэньчжэне, Китай, 2009–2013 гг. J. Med. Вирол. 87, 1471–1479. doi: 10.1002/jmv.24200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ида-Хосонума М., Ивасаки Т., Йошикава Т., Нагата Н., Сато Ю., Сата Т. и др. (2005). Реакция альфа/бета-интерферона контролирует тропизм тканей и патогенность полиовируса. Дж. Вирол. 79, 4460–4469. doi: 10.1128/jvi.79.7.4460-4469.2005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ифи, Э., Рассел, М.А., Даял, С., Лите, П., Себастьяни, Г., Ниги, Л., и соавт. (2018). Неожиданное субклеточное распределение специфической изоформы рецептора Коксаки и аденовируса, CAR-SIV, в бета-клетках поджелудочной железы человека. Диабетология 61, 2344–2355. doi: 10.1007/s00125-018-4704-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Джорба, Дж. , Кампаньоли, Р., Де, Л., и Кью, О. (2008). Калибровка нескольких молекулярных часов полиовируса, охватывающих расширенный эволюционный диапазон. Дж. Вирол. 82, 4429–4440. doi: 10.1128/ОВИ.02354-07
, Кампаньоли, Р., Де, Л., и Кью, О. (2008). Калибровка нескольких молекулярных часов полиовируса, охватывающих расширенный эволюционный диапазон. Дж. Вирол. 82, 4429–4440. doi: 10.1128/ОВИ.02354-07
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Жюльен Дж., Лепарк-Гоффар И., Лина Б., Фукс Ф., Форей С., Янатова И. и др. (1999). Постполиосиндром: в патогенезе участвует персистенция полиовируса. Дж. Нейрол. 246, 472–476. дои: 10.1007/s004150050386
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Као, С.Дж., Ян, Ф.Л., Хсу, Ю.Х., и Чен, Х.И. (2004). Механизм молниеносного отека легких, вызванного энтеровирусом 71. Клин. Заразить. Дис. 38, 1784–1788 гг. дои: 10.1086/421021
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кавамура Н., Кохара М., Абэ С., Комацу Т., Таго К., Арита М. и др. (1989). Детерминанты в 5′-некодирующей области РНК полиовируса Сэбина 1, влияющие на фенотип аттенуации. Дж. Вирол. 63, 1302–1309. doi: 10.1128/jvi.63.3.1302-1309.1989
Дж. Вирол. 63, 1302–1309. doi: 10.1128/jvi.63.3.1302-1309.1989
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кемпф, Б. Дж., и Бартон, Д. Дж. (2015). Полиаденилирование РНК пикорнавируса с помощью 3D(pol), вирусной РНК-зависимой РНК-полимеразы. Вирус Рез. 206, 3–11. doi: 10.1016/j.virusres.2014.12.030
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кью, О. М., Саттер, Р. В., Де Гурвиль, Э. М., Даудл, В. Р.и Палланш, Массачусетс (2005). Полиовирусы вакцинного происхождения и конечная стратегия глобальной ликвидации полиомиелита. год. Преподобный Микробиолог. 59, 587–635. doi: 10.1146/annurev.micro.58.030603.123625
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хандакер, Г. М., Зимброн, Дж., Далман, К., Льюис, Г., и Джонс, П. Б. (2012). Детская инфекция и взрослая шизофрения: метаанализ популяционных исследований. Шизофр. Рез. 139, 161–168. doi: 10.1016/j.schres.2012.05.023
doi: 10.1016/j.schres.2012.05.023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Khong, W.X., Yan, B., Yeo, H., Tan, E.L., Lee, J.J., Ng, J.K., et al. (2012). Штамм энтеровируса 71 (EV71), не адаптированный к мышам, проявляет нейротропизм, вызывая неврологические проявления в новой мышиной модели инфекции EV71. Дж. Вирол. 86, 2121–2131. doi: 10.1128/ОВИ.06103-11
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ким, К.С., Чепмен, Н.М., и Трейси, С. (2008). Репликация вируса Коксаки B3 в первичных клеточных культурах приводит к новым делециям вирусного генома. Дж. Вирол. 82, 2033–2037 гг. doi: 10.1128/jvi.01774-07
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ким К.С., Трейси С., Тапприч В., Бейли Дж., Ли С.К., Ким К. и др. (2005). 5’-концевые делеции встречаются у вируса Коксаки B3 во время репликации в сердце мышей и в культурах сердечных миоцитов и коррелируют с капсидированием вирусной РНК с отрицательной цепью. Дж. Вирол. 79, 7024–7041. doi: 10.1128/jvi.79.11.7024-7041.2005
Дж. Вирол. 79, 7024–7041. doi: 10.1128/jvi.79.11.7024-7041.2005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Kim-Hellmuth, S., Bechheim, M., Putz, B., Mohammadi, P., Nedelec, Y., Giangreco, N., et al. (2017). Генетические регуляторные эффекты, модифицированные иммунной активацией, способствуют ассоциации аутоиммунных заболеваний. Нац. коммун. 8:266. doi: 10.1038/s41467-017-00366-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Койке, С., Horie, H., Ise, I., Okitsu, A., Yoshida, M., Iizuka, N., et al. (1990). Белок рецептора полиовируса продуцируется как в мембраносвязанной, так и в секретируемой формах. EMBO J. 9, 3217–3224. doi: 10.1002/j.1460-2075.1990.tb07520.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Коскиниеми М., Раутонен Дж., Лехтокоски-Лехтиниеми Э. и Вахери А. (1991). Эпидемиология энцефалита у детей: обзор за 20 лет. Энн. Нейрол. 29, 492–497. дои: 10.1002/аналог.4102
Энн. Нейрол. 29, 492–497. дои: 10.1002/аналог.4102
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ла Моника, Н., и Раканиелло, В. Р. (1989). Различия в репликации аттенуированного и нейровирулентного полиовирусов в клеточной линии нейробластомы человека SH-SY5Y. Дж. Вирол. 63, 2357–2360. doi: 10.1128/jvi.63.5.2357-2360.1989
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ленц, К.М., и Нельсон, Л.Х. (2018). Микроглия и не только: врожденные иммунные клетки как регуляторы развития мозга и поведенческих функций. Перед. Иммунол. 9:698. doi: 10.3389/fimmu.2018.00698
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли Б., Юэ Ю., Чжан Ю., Юань З., Ли П., Сонг Н. и др. (2017). Новая детерминанта вирулентности энтеровируса 71 (EV71): 69-й остаток протеазы 3C модулирует патогенность. Перед. Клетка. Заразить. микробиол. 7:26. doi: 10. 3389/fcimb.2017.00026
3389/fcimb.2017.00026
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Люм, Л.C., Chua, K.B., Mcminn, P.C., Goh, A.Y., Muridan, R., Sarji, S.A., et al. (2002). Энцефаломиелит, ассоциированный с эховирусом 7. Дж. Клин. Вирол. 23, 153–160. doi: 10.1016/s1386-6532(01)00214-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Mao, Q., Hao, X., Hu, Y., Du, R., Lang, S., Bian, L., et al. (2018). Модель неонатальной мышиной инфекции центральной нервной системы, вызванной вирусом Коксаки B5. Аварийный. микробы заражают. 7:185. дои: 10.1038/с41426-018-0186-у
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мао, К., Ван, Ю., Бянь, Л., Сюй, М. и Лян, З. (2016). Лицензирование вакцины EV-A71: первый шаг к мультивалентной вакцине против энтеровируса для борьбы с HFMD и другими тяжелыми заболеваниями. Аварийный. микробы заражают. 5:e75. doi: 10.1038/emi. 2016.73
2016.73
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Маррон, М. П., Раффель, Л. Дж., Гаршон, Х. Дж., Джейкоб, К. О., Серрано-Риос, М., Martinez Larrad, M.T., et al. (1997). Инсулинозависимый сахарный диабет (ИЗСД) связан с полиморфизмом CTLA4 во многих этнических группах. Гул. Мол. Жене. 6, 1275–1282. doi: 10.1093/hmg/6.8.1275
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Маткович-Натан О., Винтер Д. Р., Гилади А., Варгас Агилар С., Спинрад А., Саррацин С. и др. (2016). Развитие микроглии следует поэтапной программе регулирования гомеостаза мозга. Наука 353:aad8670.doi: 10.1126/science.aad8670
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мендельсон, С.Л., Виммер, Э., и Раканьелло, В.Р. (1989). Клеточный рецептор полиовируса: молекулярное клонирование, последовательность нуклеотидов и экспрессия нового члена суперсемейства иммуноглобулинов. Сотовый 56, 855–865. дои: 10.1016/0092-8674(89)-9
Сотовый 56, 855–865. дои: 10.1016/0092-8674(89)-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мессакар К., Астуриас Э. Дж., Хиксон А.M., Van Leer-Buter, C., Niesters, H.G.M., Tyler, K.L., et al. (2018). Энтеровирус D68 и острый вялый миелит — оценка доказательств причинно-следственной связи. Ланцет Заражение. Дис. 18, е239–е247. дои: 10.1016/S1473-3099(18)30094-X
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Мизутани, Т., Исидзака, А., и Нихей, К. (2016). Рецептор трансферрина 1 способствует проникновению полиовируса в эндотелиальные клетки капилляров головного мозга мыши. J. Biol. хим. 291, 2829–2836.doi: 10.1074/jbc.M115.6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Muir, P., Nicholson, F., Sharief, M.K., Thompson, E.J., Cairns, N.J., Lantos, P., et al. (1995). Доказательства персистирующей энтеровирусной инфекции центральной нервной системы у больных паралитическим полиомиелитом в анамнезе. Энн. Н. Я. акад. науч. 753, 219–232. doi: 10.1111/j.1749-6632.1995.tb27548.x
Энн. Н. Я. акад. науч. 753, 219–232. doi: 10.1111/j.1749-6632.1995.tb27548.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нагата, Н., Ивасаки Т., Ами Ю., Сато Ю., Хатано И., Харашима А. и др. (2004). Модель полиомиелита через инфекцию слизистых оболочек у трансгенных мышей, несущих рецептор человеческого полиовируса, TgPVR21. Вирусология 321, 87–100. doi: 10.1016/j.virol.2003.12.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нисимура Ю., Ли Х., Хафенштайн С., Катаока С., Вакита Т., Бергельсон Дж. М. и соавт. (2013). Связывание энтеровируса 71 с PSGL-1 на лейкоцитах: VP1-145 действует как молекулярный переключатель, контролирующий взаимодействие с рецептором. PLoS Pathog. 9:e1003511. doi: 10.1371/journal.ppat.1003511
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нисимура Ю., Симодзима М., Тано Ю., Миямура Т., Вакита Т. и Симидзу Х.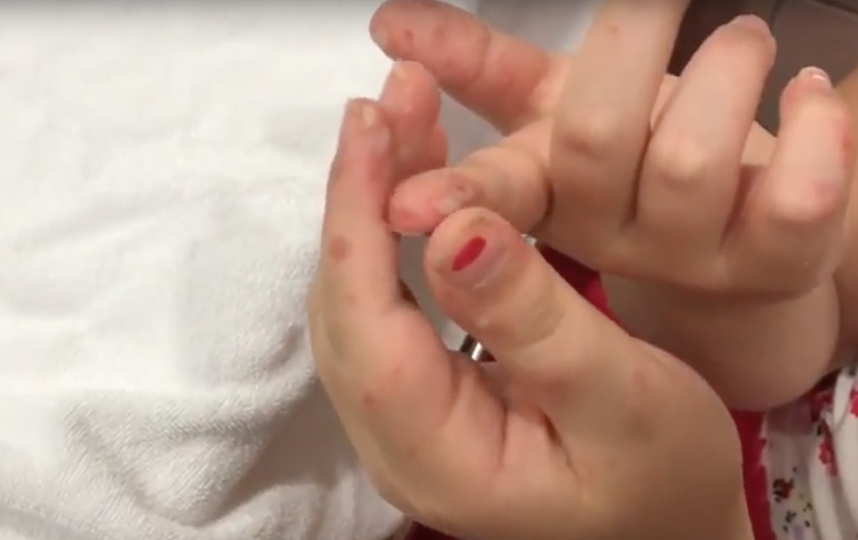 (2009). Лиганд-1 гликопротеина P-селектина человека является функциональным рецептором для энтеровируса 71. Nat. Мед. 15, 794–797. doi: 10.1038/nm.1961
(2009). Лиганд-1 гликопротеина P-селектина человека является функциональным рецептором для энтеровируса 71. Nat. Мед. 15, 794–797. doi: 10.1038/nm.1961
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нисиоку Т., Мацумото Дж., Dohgu, S., Sumi, N., Miyao, K., Takata, F., et al. (2010). Фактор некроза опухоли-альфа опосредует дисфункцию гематоэнцефалического барьера, вызванную активированной микроглией в эндотелиальных клетках микрососудов головного мозга мышей. J. Pharmacol. науч. 112, 251–254. doi: 10.1254/jphs.09292sc
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ока С., Мацуда Н., Тохяма К., Ода Т., Морикава М., Куге С. и др. (2004). Рецепторный (CD155)-зависимый эндоцитоз полиовируса и ретроградный аксональный транспорт эндосомы. Дж. Вирол. 78, 7186–7198. doi: 10.1128/jvi.78.13.7186-7198.2004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ока С. и Номото А. (2001). Молекулярные основы нейровирулентности полиовируса. Дев. биол. 105, 51–58.
и Номото А. (2001). Молекулярные основы нейровирулентности полиовируса. Дев. биол. 105, 51–58.
Академия Google
Ока, С., Сакаи, М., Бонерт, С., Игараси, Х., Дейнхардт, К., Скьяво, Г., и соавт. (2009). Рецептор-зависимый и -независимый аксональный ретроградный транспорт полиовируса в двигательных нейронах. Дж. Вирол. 83, 4995–5004. doi: 10.1128/ОВИ.02225-08
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Онг, К.С., Бадманатан, М., Деви, С., Леонг, К.Л., Кардоза, М.Дж., и Вонг, К.Т. (2008). Патологическая характеристика мышиной модели энцефаломиелита человека, вызванного энтеровирусом 71. Дж. Невропатол. Эксп. Нейрол. 67, 532–542. doi: 10.1097/NEN.0b013e31817713e7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пинкерт, С., Клингел, К., Линдиг, В., Дорнер, А., Зейххардт, Х., Спиллер, О.Б., и соавт. (2011). Коэволюция вирус-хозяин в устойчиво инфицированной вирусом Коксаки В3 клеточной линии кардиомиоцитов. Дж. Вирол. 85, 13409–13419. doi: 10.1128/ОВИ.00621-11
Дж. Вирол. 85, 13409–13419. doi: 10.1128/ОВИ.00621-11
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ramalho, E., Sousa, I. Jr., Burlandy, F., Costa, E., Dias, A., Serrano, R., et al. (2019). Идентификация и филогенетическая характеристика энтеровирусов человека, выделенных из случаев асептического менингита в Бразилии, 2013-2017 гг. Вирусы 11:E690. дои: 10.3390/v11080690
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ransohoff, R.M., and Engelhardt, B. (2012). Анатомо-клеточные основы иммунного надзора в центральной нервной системе. Нац. Преподобный Иммунол. 12, 623–635. doi: 10.1038/nri3265
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рантакаллио, П., Джонс, П., Моринг, Дж., и фон Вендт, Л. (1997). Связь между инфекциями центральной нервной системы в детстве и шизофренией во взрослом возрасте и другими психозами: 28-летнее наблюдение.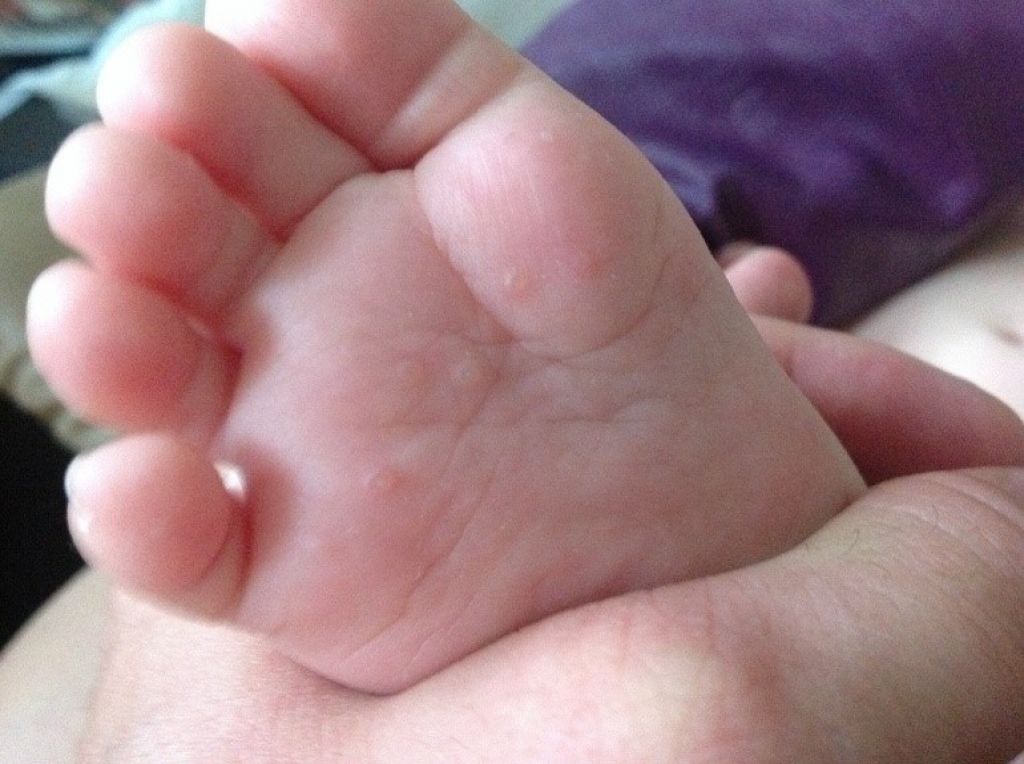 Междунар. Дж. Эпидемиол. 26, 837–843. doi: 10.1093/ije/26.4.837
Междунар. Дж. Эпидемиол. 26, 837–843. doi: 10.1093/ije/26.4.837
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рен, Р. Б., Мосс, Э. Г., и Раканьелло, В. Р. (1991). Идентификация двух детерминант, которые ослабляют вакцинородственный полиовирус 2 типа. Дж. Вирол. 65, 1377–1382. doi: 10.1128/jvi.65.3.1377-1382.1991
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Роудс, Р. Э., Табор-Годвин, Дж. М., Цуэнг, Г.и Фойер, Р. (2011). Энтеровирусные инфекции центральной нервной системы. Вирусология 411, 288–305. doi: 10.1016/j.virol.2010.12.014
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ричардсон, С.Дж., и Морган, Н.Г. (2018). Энтеровирусные инфекции в патогенезе диабета 1 типа: новые идеи для терапевтического вмешательства. Курс. мнение Фармакол. 43, 11–19. doi: 10.1016/j.coph.2018.07.006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рубин, Л. L., Hall, D.E., Porter, S., Barbu, K., Cannon, C., Horner, H.C., et al. (1991). Модель клеточной культуры гематоэнцефалического барьера. J. Cell Biol. 115, 1725–1735 гг.
L., Hall, D.E., Porter, S., Barbu, K., Cannon, C., Horner, H.C., et al. (1991). Модель клеточной культуры гематоэнцефалического барьера. J. Cell Biol. 115, 1725–1735 гг.
Реферат PubMed | Академия Google
Ruller, C.M., Tabor-Godwin, J.M., Van Deren, D.A. Jr., Robinson, S.M., Maciejewski, S., Gluhm, S., et al. (2012). Истощение нервных стволовых клеток и дефекты развития ЦНС после энтеровирусной инфекции. утра. Дж. Патол. 180, 1107–1120. doi: 10.1016/j.ajpath.2011.11.016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сантелло, М., Тони, Н., и Вольтерра, А. (2019). Функция астроцитов от обработки информации до познания и когнитивных нарушений. Нац. Неврологи. 22, 154–166. doi: 10.1038/s41593-018-0325-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сондерс, Н. Р., Дрейфус, Дж. Дж., Дзигилевска, К. М., Йоханссон, П. А., Хабгуд, М. Д., Моллгард, К., и соавт.(2014). Достоинства и недостатки исследований проницаемости гематоэнцефалического барьера: прогулка по 100-летней истории. Перед. Неврологи. 8:404. doi: 10.3389/fnins.2014.00404
Достоинства и недостатки исследований проницаемости гематоэнцефалического барьера: прогулка по 100-летней истории. Перед. Неврологи. 8:404. doi: 10.3389/fnins.2014.00404
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Shen, W.C., Chiu, H.H., Chow, K.C., and Tsai, C.H. (1999). Результаты МРТ энтеровирусного энцефалоемелита: вспышка на Тайване. АДЖНР Ам. Дж. Нейрорадиол. 20, 1889–1895 гг.
Реферат PubMed | Академия Google
Шиофи-Ходжине А.B., Oikarinen, S., Honkanen, H., Huhtala, H., Lehtonen, J.P., Briese, T., et al. (2018). Молекулярная эпидемиология энтеровирусов у детей раннего возраста с повышенным риском развития диабета 1 типа. PLoS One 13:e0201959. doi: 10.1371/journal.pone.0201959
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Стерн, А., Йех, М.Т., Зингер, Т., Смит, М., Райт, К., Линг, Г., и др. (2017). Эволюционный путь к вирулентности РНК-вируса. Моб. 169, 35–46.е19. doi: 10.1016/j.cell.2017.03.013
Моб. 169, 35–46.е19. doi: 10.1016/j.cell.2017.03.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сунь Ю., Мяо З., Ян Дж., Гонг Л., Чен Ю., Чен Ю. и др. (2019). Серомолекулярная эпидемиология энтеровирус-ассоциированного энцефалита в провинции Чжэцзян, Китай, с 2014 по 2017 год. Int. Дж. Заразить. Дис. 79, 58–64. doi: 10.1016/j.ijid.2018.11.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сувисаари Дж., Мотемпс Н., Хаукка Дж., Хови, Т., и Лоннквист, Дж. (2003). Вирусные инфекции центральной нервной системы у детей и шизофрения у взрослых. утра. Журнал психиатрии 160, 1183–1185. doi: 10.1176/appi.ajp.160.6.1183
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Tabor-Godwin, J.M., Ruller, C.M., Bagalso, N., An, N., Pagarigan, R.R., Harkins, S., et al. (2010). Новая популяция миелоидных клеток, реагирующих на инфекцию вирусом Коксаки, способствует распространению вируса в ЦНС новорожденных. J. Neurosci. 30, 8676–8691. doi: 10.1523/JNEUROSCI.1860-10.2010
J. Neurosci. 30, 8676–8691. doi: 10.1523/JNEUROSCI.1860-10.2010
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Там, П.Е., и Месснер, Р.П. (1999). Молекулярные механизмы персистенции вируса Коксаки при хронической воспалительной миопатии: вирусная РНК персистирует за счет образования двухцепочечного комплекса без связанных геномных мутаций или эволюции. Дж. Вирол. 73, 10113–10121. doi: 10.1128/jvi.73.12.10113-10121.1999
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тан, К.В., Сэм, И. К., Ли, В. С., Вонг, Х. В., и Чан, Ю. Ф. (2017). Остатки VP1 вокруг пятикратной оси энтеровируса A71 опосредуют взаимодействие гепарансульфата. Вирусология 501, 79–87. doi: 10.1016/j.virol.2016.11.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тан, С. Х., Онг, К. С., и Вонг, К. Т. (2014). Энтеровирус 71 может напрямую инфицировать ствол мозга через черепные нервы, и инфекция может быть ослаблена пассивной иммунизацией. Дж. Невропатол.Эксп. Нейрол. 73, 999–1008. doi: 10.1097/NEN.0000000000000122
Дж. Невропатол.Эксп. Нейрол. 73, 999–1008. doi: 10.1097/NEN.0000000000000122
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Таппарел, К., Зигрист, Ф., Петти, Т.Дж., и Кайзер, Л. (2013). Разнообразие пикорнавирусов и энтеровирусов с сопутствующими заболеваниями человека. Заразить. Жене. Эвол. 14, 282–293. doi: 10.1016/j.meegid.2012.10.016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ту, И. Х., Йео, Х., Сешнс, О. М., Ян, Б., Либау, Э.A., Howe, J.L., et al. (2016). Инфицирование энтеровирусом 71 клеток NSC-34, подобных двигательным нейронам, происходит нелитически. Науч. Респ. 6:36983. дои: 10.1038/srep36983
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тсуенг, Г., Табор-Годвин, Дж. М., Гопал, А., Руллер, К. М., Делайн, С., Ан, Н., и др. (2011). Вирус Коксаки преимущественно реплицируется и вызывает цитопатические эффекты в недифференцированных нейральных клетках-предшественниках. Дж. Вирол. 85, 5718–5732.doi: 10.1128/ОВИ.02261-10
Дж. Вирол. 85, 5718–5732.doi: 10.1128/ОВИ.02261-10
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван дер Шаар, Х.М., Доробанту, К.М., Албулеску, Л., Стратинг, Дж., и Ван Куппевельд, Ф.Дж.М. (2016). Привлечение жира (al): пикорнавирусы узурпируют перенос липидов в местах контакта с мембраной для создания органелл репликации. Тенденции микробиол. 24, 535–546. doi: 10.1016/j.tim.2016.02.017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вербун-Мациолек, М.A., Groenendaal, F., Cowan, F., Govaert, P., Van Loon, A.M., and De Vries, L.S. (2006). Поражение белого вещества при неонатальном энтеровирусном менингоэнцефалите. Неврология 66, 1267–1269. doi: 10.1212/01.wnl.0000208429.69676.23
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вассерстром, Р., Мамурян, А.С., Макгэри, К.Т., и Миллер, Г. (1992). Бульбарный полиомиелит: результаты МРТ с патологической корреляцией. АДЖНР Ам. Дж. Нейрорадиол. 13, 371–373.
АДЖНР Ам. Дж. Нейрорадиол. 13, 371–373.
Академия Google
Werk, D., Schubert, S., Lindig, V., Grunert, H.P., Zeichhardt, H., Erdmann, V.A., et al. (2005). Разработка эффективной стратегии РНК-интерференции против РНК-вируса с плюс-цепью: подавление вируса Коксаки B3 и родственного ему рецептора вируса коксаки-аденовируса. биол. хим. 386, 857–863.
Реферат PubMed | Академия Google
Вессели, Р., Клингел, К., Ноултон, К.У., и Кандольф, Р. (2001). Кардиоселективная инфекция вирусом Коксаки B3 требует интактной передачи сигналов интерферона типа I: последствия для смертности и ранней репликации вируса. Тираж 103, 756–761. doi: 10.1161/01.cir.103.5.756
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Влодарчик А., Холтман И.Р., Крюгер М., Йогев Н., Бруттгер Дж., Хорооши Р. и соавт. (2017). Новое подмножество микроглии играет ключевую роль в миелиногенезе в развивающемся мозге. EMBO J. 36, 3292–3308. doi: 10.15252/embj.201696056
36, 3292–3308. doi: 10.15252/embj.201696056
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вудалл, Си Джей, Riding, M.H., Graham, D.I., and Clements, G.B. (1994). Последовательности, специфичные для энтеровирусов, обнаруженных в спинном мозге пациентов с заболеванием двигательных нейронов. BMJ 308, 1541–1543. doi: 10.1136/bmj.308.6943.1541
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ву, Т., Фан, К.П., Ван, В.Ю., и Юань, Т.М. (2014). Энтеровирусные инфекции связаны с поражением белого вещества головного мозга у новорожденных. J. Педиатр. Детское здоровье 50, 817–822. дои: 10.1111/jpc.12656
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сюй, Р., и Кроуэлл, Р.Л. (1996). Экспрессия и распределение рецепторов коксакивируса B3 во время внутриутробного развития мышей Balb/c и их клеток головного мозга в культуре. Вирус Рез. 46, 157–170. doi: 10.1016/s0168-1702(96)01398-6
doi: 10.1016/s0168-1702(96)01398-6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xu, W., Liu, C.F., Yan, L., Li, J.J., Wang, L.J., Qi, Y., et al.(2012). Распределение энтеровирусов у госпитализированных детей с кисту, ящуром и взаимосвязь между возбудителями и осложнениями со стороны нервной системы. Вирол. Дж. 9:8. дои: 10.1186/1743-422X-9-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ян, Дж. Дж., Ван, Дж. Р., Лю, К. С., Ян, Х. Б., и Су, И. Дж. (2000). Вспышка энтеровирусной инфекции 71 на Тайване в 1998 г.: всестороннее патологическое, вирусологическое и молекулярное исследование случая фульминантного энцефалита. Дж. Клин. Вирол. 17, 13–22. doi: 10.1016/s1386-6532(00)00067-6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Янагия А., Ока С., Хашида Н., Окамура М., Тая С., Камошита Н. и др. (2003). Тканеспецифическая репликационная способность химерного полиовируса, который несет внутренний сайт посадки рибосомы вируса гепатита С в новой мышиной модели, трансгенной по рецептору полиовируса человека. Дж. Вирол. 77, 10479–10487. doi: 10.1128/jvi.77.19.10479-10487.2003
Дж. Вирол. 77, 10479–10487. doi: 10.1128/jvi.77.19.10479-10487.2003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Yang, K.D., Yang, M.Y., Li, C.C., Lin, S.F., Chong, M.C., Wang, C.L., et al. (2001). Измененные клеточные, но не гуморальные реакции у детей с осложненными инфекциями, вызванными энтеровирусом 71, на Тайване. Дж. Заразить. Дис. 183, 850–856. дои: 10.1086/319255
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ян, В. К., Терасаки, Т., Широки, К., Ока, С., Аоки Дж., Танабэ С. и др. (1997). Эффективная доставка циркулирующего полиовируса в центральную нервную систему независимо от рецептора полиовируса. Вирусология 229, 421–428. doi: 10.1006/viro.1997.8450
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ян, Ю., Салаяндиа, В.М., Томпсон, Дж.Ф., Ян, Л.Ю., Эстрада, Э.Ю., и Ян, Ю. (2015). Ослабление острого инсульта в мозге крыс миноциклином способствует ремоделированию гематоэнцефалического барьера и альтернативной активации микроглии/макрофагов во время выздоровления. Дж. Нейровоспаление 12:26. doi: 10.1186/s12974-015-0245-4
Дж. Нейровоспаление 12:26. doi: 10.1186/s12974-015-0245-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Yao, P.P., Qian, L., Xia, Y., Xu, F., Yang, Z.N., Xie, R.H., et al. (2012). Неврологические расстройства, вызванные энтеровирусом 71 у молодых песчанок, Meriones unguiculatus : разработка и применение модели неврологического заболевания. PLoS One 7:e51996. doi: 10.1371/journal.pone.0051996
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йе, М.T., Wang, S.W., Yu, C.K., Lin, K.H., Lei, H.Y., Su, I.J., et al. (2011). Один нуклеотид в стволовой петле II 5′-нетранслируемой области способствует вирулентности энтеровируса 71 у мышей. PLoS One 6:e27082. doi: 10.1371/journal.pone.0027082
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Yeung, M.L., Jia, L., Yip, C.C.Y., Chan, J.F.W., Teng, J.L.L., Chan, K.H., et al. (2018). Триптофанил-тРНК-синтетаза человека представляет собой фактор входа, индуцируемый гамма-интерфероном, для энтеровируса . Дж. Клин. Вкладывать деньги. 128, 5163–5177. дои: 10.1172/JCI99411
Дж. Клин. Вкладывать деньги. 128, 5163–5177. дои: 10.1172/JCI99411
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ю. Дж., Чжан Л., Рен П., Чжун Т., Ли З., Ван З. и др. (2015). Энтеровирус 71 опосредует остановку клеточного цикла в S-фазе посредством неструктурного белка 3D. Клеточный цикл 14, 425–436. дои: 10.4161/15384101.2014.980631
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Зайни, З., и МакМинн, П. (2012).Единственная мутация в капсидном белке VP1 (Q145E) штамма геногруппы C4 человеческого энтеровируса 71 приводит к мышино-вирулентному фенотипу. Дж. Генерал Вирол. 93, 1935–1940 гг. doi: 10.1099/vir.0.043893-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zoll, J., Heus, H.A., Van Kuppeveld, F.J., and Melchers, W.J. (2009). Структурно-функциональные отношения 3′-UTR энтеровируса. Вирус Рез. 139, 209–216. doi: 10.1016/j. virusres.2008.07.014
virusres.2008.07.014
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Зонта, М., Angulo, M.C., Gobbo, S., Rosengarten, B., Hossmann, K.A., Pozzan, T., et al. (2003). Передача сигналов между нейронами и астроцитами занимает центральное место в динамическом контроле микроциркуляции головного мозга. Нац. Неврологи. 6, 43–50. дои: 10.1038/nn980
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
| Введение | Обновления пикорнавируса | Энтеровирусная номенклатура | Профиль энтеровируса | Вирус Коксаки В |
| Энтеровирус 71 | прогресс в искоренении полиомиелита | Полезные веб-ссылки | Карты патогенов | ссылки |
Трансмиссионный электронный микроскоп отрицательно окрашенный приготовление Коксаки Б.
Вирусы Коксаки В относятся к роду энтеровирусов (ссылка) и
являются наиболее частым возбудителем миокардита и дилатационной кардиомиопатии. составляет 50% случаев заражения. Миокардит – редкое заболевание,
встречается только у 1% населения США. Миокардит преимущественно
поражает мужчин среднего возраста со средним возрастом дебюта заболевания
около 42 лет. Инкубационный период большинства вирусов Коксаки
инфекции составляет от двух до десяти дней и появление сердечных симптомов
обычно происходит через две недели после вирусной инфекции.Коксаки Б
вирусы, как и большинство энтеровирусов, передаются фекально-оральным и через
прямой контакт со слизистыми выделениями.
составляет 50% случаев заражения. Миокардит – редкое заболевание,
встречается только у 1% населения США. Миокардит преимущественно
поражает мужчин среднего возраста со средним возрастом дебюта заболевания
около 42 лет. Инкубационный период большинства вирусов Коксаки
инфекции составляет от двух до десяти дней и появление сердечных симптомов
обычно происходит через две недели после вирусной инфекции.Коксаки Б
вирусы, как и большинство энтеровирусов, передаются фекально-оральным и через
прямой контакт со слизистыми выделениями.
Симптомология и результат:
Инфекция Коксаки В характеризуется лихорадкой, утомляемостью, недомоганием и боли в груди. Заражение сердца вирусом Коксаки В может привести к миокардит. Вирусный миокардит – воспалительное заболевание сердца что может привести к сердечной недостаточности. Хотя заболевание обычно не причиной смерти, в 20% случаев возникает рецидив и постоянный сердечный приступ. обычно возникает повреждение.
Патогенез:
Вирус Коксаки В первоначально реплицируется в кишечнике и селезенке и
в конечном итоге распространяется на орган-мишень, сердце. Однажды в сердце,
репликация вируса вызывает повреждение клеток сердца и вызывает
миграции лейкоцитов в ткани сердца. Белая кровь
клетки впоследствии активируют аутоиммунный процесс, при котором белая кровь
клетки убивают инфицированные вирусом клетки сердца и нормальные клетки сердца, которые
не заражен.Этот аутоиммунный процесс сохраняется долгое время после проникновения вирусных частиц.
больше не обнаруживаются. Разрушение и повреждение клеток сердца
приводит к миокардиту и сердечной недостаточности.
Однажды в сердце,
репликация вируса вызывает повреждение клеток сердца и вызывает
миграции лейкоцитов в ткани сердца. Белая кровь
клетки впоследствии активируют аутоиммунный процесс, при котором белая кровь
клетки убивают инфицированные вирусом клетки сердца и нормальные клетки сердца, которые
не заражен.Этот аутоиммунный процесс сохраняется долгое время после проникновения вирусных частиц.
больше не обнаруживаются. Разрушение и повреждение клеток сердца
приводит к миокардиту и сердечной недостаточности.
Профилактика и управление:
Хотя заражение вирусом Коксаки невозможно предотвратить, его можно контролируемый с помощью санитарных мероприятий. В качестве вируса, передающегося фекально-орально, распространение вирус можно ограничить улучшением санитарии и тщательным мытьем Руки.
Миокардит можно лечить, уменьшая воспаление с помощью анальгетиков и
таким образом ограничивая количество повреждения сердца, которое происходит.Потому что миокардит
ухудшает работу сердца, деятельность следует ограничивать и
следует избегать чрезмерного потребления соли с пищей. Кислород также может быть
назначают для снижения нагрузки на сердце и при сердечной недостаточности,
можно делать пересадку сердца.
Кислород также может быть
назначают для снижения нагрузки на сердце и при сердечной недостаточности,
можно делать пересадку сердца.
Вирусная нагрузка в крови коррелирует с тяжестью заболевания неонатальной инфекции вирусом Коксаки В3: ранняя диагностика и прогнозирование тяжести заболевания возможны при тяжелой неонатальной энтеровирусной инфекции | Клинические инфекционные болезни
Аннотация
Мы провели исследование во время вспышки коксакивирусной инфекции B3 в 2005 году и обнаружили, что вирусная РНК может быть обнаружена в образцах крови пациентов вскоре после начала лихорадки, а уровень вирусной РНК положительно коррелирует с тяжестью заболевания.Своевременная диагностика возможна при тяжелом течении неонатальной энтеровирусной инфекции.
Проявления энтеровирусной инфекции у новорожденных варьируют от скрытой инфекции до тяжелой болезни и даже смерти. Серотип вируса, способ передачи и наличие пассивно приобретенных серотип-специфических материнских антител коррелируют с тяжестью и исходом перинатально приобретенной энтеровирусной инфекции [1, 2]. Лечение неонатальной энтеровирусной инфекции в первую очередь поддерживающее. Внутривенное (в/в) IgG рекомендуется для лечения неонатальной энтеровирусной инфекции, но его преимущества все еще обсуждаются [3–5].Противовирусный препарат плеконарил является потенциальным средством лечения энтеровирусной инфекции у новорожденных и детей грудного возраста, но опыт его применения все еще ограничен [6, 7].
Лечение неонатальной энтеровирусной инфекции в первую очередь поддерживающее. Внутривенное (в/в) IgG рекомендуется для лечения неонатальной энтеровирусной инфекции, но его преимущества все еще обсуждаются [3–5].Противовирусный препарат плеконарил является потенциальным средством лечения энтеровирусной инфекции у новорожденных и детей грудного возраста, но опыт его применения все еще ограничен [6, 7].
Виремия играет важную роль в патофизиологии энтеровирусной инфекции. Изучение роли виремии в клинических проявлениях энтеровирусной инфекции осуществить традиционным методом выделения вируса непросто. Из-за преходящего характера виремии и большого количества крови, необходимого для выделения вируса, использование виремии для диагностики энтеровирусной инфекции ограничено.Развитие молекулярных методов сделало обнаружение вирусной РНК в крови или спинномозговой жидкости практичным. Использование ОТ-ПЦР в течение первых нескольких дней болезни дает потенциальные преимущества для ранней диагностики, своевременного лечения и экономии средств у младенцев с легкой энтеровирусной инфекцией [3, 8]. Тем не менее корреляция между тяжестью заболевания и вирусной нагрузкой в крови с помощью ОТ-ПЦР в реальном времени у новорожденных с энтеровирусной инфекцией не оценивалась. В период с мая по август 2005 г. на Тайване произошла вспышка инфекции вирусом Коксаки B3 (CVB3), что дало возможность провести это исследование для оценки корреляции между тяжестью заболевания и вирусной нагрузкой с помощью современных молекулярных методов.
Тем не менее корреляция между тяжестью заболевания и вирусной нагрузкой в крови с помощью ОТ-ПЦР в реальном времени у новорожденных с энтеровирусной инфекцией не оценивалась. В период с мая по август 2005 г. на Тайване произошла вспышка инфекции вирусом Коксаки B3 (CVB3), что дало возможность провести это исследование для оценки корреляции между тяжестью заболевания и вирусной нагрузкой с помощью современных молекулярных методов.
Пациенты и методы .Всего 97 новорожденных и детей с культурально подтвержденной инфекцией CVB3 лечились в детской больнице Чан Гун (Тайвань) в течение мая–августа 2005 г. Всего было отмечено 24 неонатальных из них 11 были в возрасте <7 дней. Среди всех новорожденных 11 (10 из которых были в возрасте <7 дней) были классифицированы как имеющие тяжелую инфекцию. Тяжелая инфекция определялась как наличие гепатита (уровни аспартатаминотрансферазы и аланинаминотрансферазы в сыворотке более чем в 3 раза превышали верхнюю границу нормы для данного возраста) и коагулопатии (количество тромбоцитов <100 000 тромбоцитов/мкл, плюс патологический коагуляционный профиль) [1]. , 9].С другой стороны, оставшиеся 13 новорожденных (только 1 из которых был в возрасте <7 дней) были классифицированы как имеющие легкую инфекцию, которая включала неспецифическую лихорадку или вирусный менингит.
В течение периода исследования все родители пациентов, поступивших в центр ухода за новорожденными (где проходят лечение дети в возрасте до 3 месяцев), контактировали, если энтеровирусная инфекция была подтверждена посевом или высоко подозревалась (например, при наличии семейный анамнез энтеровирусной инфекции или если было отмечено заболевание матери во время родов).Всего в исследование было включено 10 пациентов, в том числе 6 новорожденных и 4 ребенка в возрасте 1–2 мес, поскольку имелось письменное согласие. Образцы крови (1,5 мл в пробирке с ЭДТА), полученные для измерения других параметров во время госпитализации и амбулаторного наблюдения, также использовались для измерения вирусной нагрузки. Последующие мазки из зева и прямой кишки для выделения и идентификации вируса брали при каждом посещении поликлиники до исчезновения энтеровируса. Лечение каждого пациента назначалось самостоятельно лечащими врачами-неонатологами.
Выделение энтеровируса и идентификацию CVB3 проводили с использованием стандартных процедур для респираторных и кишечных патогенов. Протокол ОТ-ПЦР в реальном времени был изменен по сравнению с протоколом, используемым Watkins-Riedel et al. [10]. Вкратце, вирусную РНК экстрагировали из образцов цельной крови с использованием мини-набора вирусной РНК QIAamp (Qiagen). Использовали набор для одностадийной ОТ-ПЦР (Qiagen), а положение праймера представляло собой консервативную область 5′-некодирующей области энтеровируса. Последовательности праймера и флуоресцентного зонда представляли собой (1) прямой праймер, 5′-CCCCTGAATGCGGCTAATCC-3′; (2) обратный праймер, 5′-CAATTGTCAGGATAAGCAGCC-3′; и (3) последовательность зонда, 5′-FAM-CACGGACACCCAAAGTAGTCGGTTCC-TAMRA.ОТ-ПЦР в реальном времени проводили с использованием Bio-Rad iCycler (Bio-Rad). Условия термоциклирования включали 30 мин при 48°С для обратной транскрипции и 10 мин при 95°С для активации Taq-полимеразы, за которыми следовали 40 циклов по 15 с при 95°С и 1 мин при 58°С. Размер амплифицированного продукта ПЦР составлял 157 п.н. Для количественного определения энтеровирусной РНК кДНК стандарта CVB3 клонировали с помощью системы Escherichia coli и проводили параллельно с образцами для ОТ-ПЦР в реальном времени. Предел обнаружения CVB3 составил 20 копий/мкл с помощью ОТ-ПЦР в реальном времени.
Критерии Манна-Уитни (критерии суммы рангов Вилкоксона) использовались для проверки разницы в вирусной нагрузке между тяжелыми и легкими энтеровирусными инфекциями. Оценку Каплана-Мейера (логарифмический ранговый критерий) использовали для проверки разницы в персистенции виремии между тяжелыми и легкими инфекциями.
Результаты .Демографические данные, лабораторные данные, уровень вирусной РНК в крови и методы лечения 10 пациентов показаны в таблице 1. Среди 6 новорожденных, включенных в это исследование, 5 имели тяжелое заболевание (пациенты 1 –5), и у 1 было легкое заболевание (пациент 6).Остальные 4 ребенка (пациенты 7–10) были в возрасте 1–2 месяцев, и у всех было легкое заболевание. Лихорадка отмечена у всех 10 больных, всем больным при поступлении в стационар проводилась эмпирическая антибактериальная терапия. Всем 5 пациентам с тяжелым течением заболевания (пациенты 1–5) были проведены переливания компонентов крови, включая тромбоциты, эритроцитарную массу, свежезамороженную плазму и внутривенные инфузии IgG. Пациенты с легким течением заболевания (пациенты 6–10) получали только поддерживающую терапию. Все 10 пациентов были выписаны в стабильном состоянии, осложнений при контрольном осмотре через 6 мес не отмечено.
Таблица 1
Демографические данные, клинические проявления и использование внутривенного (в/в) IgG для исследуемых пациентов.
Таблица 1
Демографические данные, клинические проявления и использование внутривенного (в/в) IgG для исследуемых пациентов.
Поскольку продолжительность периода между началом заболевания и госпитализацией была разной, сроки забора крови для определения вирусной РНК в каждом случае были непостоянными (таблица 1). Тем не менее мы отметили, что виремия выявлялась вскоре после начала заболевания.У всех пациентов наибольшая вирусная РНК-нагрузка определялась в первом образце крови, затем вирусная РНК-нагрузка постепенно снижалась. Для пациентов в возрасте <7 дней (пациенты 1–4, все с тяжелым заболеванием) самая высокая обнаруженная вирусная РНК-нагрузка составляла >20 000 копий/мкл. Для пациентов в возрасте 1–2 месяцев (пациенты 7–10 лет, все с легкой формой заболевания) самая высокая обнаруженная вирусная нагрузка составляла <2000 копий/мкл. Самая высокая вирусная нагрузка РНК у пациентов с тяжелым заболеванием (пациенты 1-5) была значительно выше, чем у пациентов с легким заболеванием (пациенты 6-10) ( P = .009 по критерию Манна-Уитни). У двух пациентов (пациенты 3 и 4) были образцы крови для определения вирусной нагрузки до и после внутривенного введения IgG. Нагрузка вирусной РНК в крови быстро снижалась после внутривенного введения IgG в обоих случаях. Мы также отметили, что более высокая нагрузка вирусной РНК соответствовала более высокому пиковому уровню аспартатаминотрансферазы в сыворотке у этих 10 детей (таблица 1). Продолжительность обнаруживаемой вирусной РНК в образцах крови была значительно больше у пациентов с тяжелым заболеванием ( P = .0331, с помощью логарифмического рангового теста, анализа Каплана-Мейера). У пациентов 2 и 4 вирусная РНК оставалась определяемой в крови через 2 мес после начала заболевания.
Продолжительность выделения вируса со стулом и глоткой составляла <4 недель у 7 пациентов, которые регулярно посещали амбулаторное наблюдение, и не было отмечено существенной разницы между пациентами с тяжелым и легким течением заболевания.
Обсуждение Насколько нам известно, это первое исследование, посвященное изучению корреляции вирусной нагрузки в крови с тяжестью заболевания при неонатальной энтеровирусной инфекции.Сильная связь была отмечена между более высокой вирусной нагрузкой, более молодым возрастом и большей тяжестью заболевания; этот вывод совместим с выводом, предложенным Dagan et al. [11]. Связь более высокой вирусной нагрузки и более молодого возраста может быть результатом либо пути передачи (перинатальная передача), либо незрелости неонатальной иммунной системы, и возможно, что более высокая вирусная нагрузка ответственна за более тяжелую болезнь у таких пациентов. Тем не менее, эта гипотеза требует дальнейшего уточнения из-за отсутствия контрольных субъектов (пациентов в возрасте <7 дней с легкой формой заболевания).На основании данных исследования нельзя было разделить более высокую вирусную нагрузку, более молодой возраст и большую тяжесть заболевания.
Мы считаем, что данные показывают, что РНК-нагрузка крови может использоваться в качестве инструмента для ранней диагностики и прогнозирования тяжести заболевания, в дополнение к возрасту на момент начала, серотипу вируса и способу передачи (имела ли место вертикальная передача). Необходимы дальнейшие исследования, чтобы определить четкий пороговый уровень нагрузки вирусной РНК в крови для прогнозирования тяжелого заболевания. Кроме того, продолжительность определяемой вирусной РНК в крови была значительно выше у пациентов с тяжелым течением заболевания, несмотря на прекращение выделения вируса из прямой кишки (как отмечено у пациентов 2 и 4).Поскольку эти пациенты были клинически здоровы, сохранение вирусной РНК-нагрузки через 2 месяца после начала заболевания может свидетельствовать о наличии в крови свободных нуклеиновых кислот, а не инфекционных частиц. Разница в сохранении вирусной нагрузки у пациентов с тяжелой и легкой формой инфекции требует дальнейшего уточнения с использованием стандартизированных и более частых контрольных проб.
В/в IgG содержат различный уровень антител к нескольким типам энтеровирусов, причем более быстрое прекращение виремии и виурии наблюдается у пациентов, получающих в/в IgG, содержащих высокий титр к собственным вирусным изолятам [5, 12].Мы обнаружили быстрое снижение нагрузки вирусной РНК в крови после внутривенного введения IgG у 2 новорожденных, получивших его (пациенты 3 и 4). Возможно, внутривенное введение IgG может быть полезным для снижения вирусной нагрузки в крови, но для выяснения этого вопроса необходимы дополнительные исследования из-за отсутствия стандартизации внутривенного введения IgG и графика определения вирусной нагрузки в этом исследовании.
Наше исследование выявило возможность использования вирусной нагрузки в крови, определяемой с помощью ОТ-ПЦР в реальном времени, для ранней диагностики и прогнозирования тяжести заболевания при неонатальной энтеровирусной инфекции — гораздо раньше, чем по результатам выделения вируса.Более ранняя диагностика приводит к более быстрому и окончательному лечению новорожденных с тяжелой энтеровирусной инфекцией, особенно во время вспышки энтеровирусной инфекции.
Благодарности
Финансовая поддержка Мемориальная больница Чанг Гун (CMRPG3201S).
Возможный конфликт интересов .Все авторы: конфликтов нет.
Ссылки
1, , , и др.Неонатальные энтеровирусные инфекции: акцент на факторах риска тяжелых и смертельных инфекций
22
(стр.889
—94
)2.Перинатальные эховирусы и инфекции Коксаки группы В
,Clin Perinatol
,1988
, vol.15
(стр.233
—46
)3.Представление, диагностика и лечение энтеровирусных инфекций у новорожденных
6
(стр.1
—10
)4, , , , , .Перинатальная эховирусная инфекция: риск передачи во время вспышки в сообществе
305
(стр.368
—71
)5, , , , .Неонатальная энтеровирусная инфекция: вирусология, серология и эффекты внутривенного иммуноглобулина
,Clin Infect Dis
,1995
, том.20
(стр.1201
—6
)6, , , , .Вирусная инфекция Коксаки В новорожденных — излечимое заболевание?
,Eur J Pediatr
,2004
, vol.163
(стр.223
—8
)7, , , и др.Совместная противовирусная исследовательская группа Национального института аллергии и инфекционных заболеваний
Двойное слепое плацебо-контролируемое исследование плеконарила у младенцев с энтеровирусным менингитом
22
(стр.335
—40
)8.Энтеровирусные инфекции: диагностика и лечение
,Semin Pediatr Infect Dis
,2002
, vol.13
(стр.40
—7
)9.Прогноз для новорожденных с энтеровирусным гепатитом и коагулопатией
,Pediatr Infect Dis J
,2001
, vol.20
(стр.758
—63
)10, , , .Экспресс-диагностика энтеровирусных инфекций методом ПЦР в реальном времени на LightCycler с использованием формата TaqMan
,Diagn Microbiol Infect Dis
,2002
, том.42
(стр.99
—105
)11, , , , .Виремия у госпитализированных детей с энтеровирусными инфекциями
,J Pediatr
,1985
, vol.106
(стр.397
—401
)12, , , .Нейтрализующие антитела к неполиомиелитным энтеровирусам в иммуноглобулине иммунной сыворотки человека
,Pediatr Infect Dis
,1983
, vol.2
(стр.454
—6
)© 2007 г. Американского общества инфекционистов
Диагностика инфекции вируса Коксаки группы А с помощью полимеразной цепной реакции
Энтеровирусы человека включают полиовирусы, эховирусы, вирусы Коксаки группы А и В и энтеровирусы (типы 68–71).Эти подгруппы изначально отличались друг от друга их различными эффектами в культуре тканей и инокуляции животных. Полиовирусы, эховирусы и вирусы Коксаки группы В легко изолировать с помощью культуры тканей, но, как правило, вирусы Коксаки группы А трудно выделить. Поэтому вместо этого используется инокуляция мышей-сосунов. 1 Вирусологические исследования, проведенные в начале 1950-х годов с использованием этой методики, четко показали, что несколько вирусов Коксаки группы А были причиной эпидемической герпангины, 2, 3 , но полный спектр клинических проявлений инфекции вируса Коксаки группы А остается неопределенным.Диагностические исследования с использованием прививки мышам-сосункам в настоящее время проводятся редко. Недавно были разработаны методы полимеразной цепной реакции (ПЦР) для обнаружения большинства серотипов энтеровирусов. 4– 6 Филогенетический анализ последовательностей генома энтеровирусов позволяет классифицировать генотипы энтеровирусов. 7, 8 Ранее мы сообщали об энтеровирусах, связанных с фебрильными судорогами в летние месяцы, с помощью ПЦР и последующего филогенетического анализа амплифицированных последовательностей генома. 9 В настоящем исследовании мы исследовали связь энтеровирусов, особенно вирусов Коксаки группы А, с более широким спектром острых лихорадочных заболеваний, включая герпетическую ангину, фебрильные судороги и фарингит/тонзиллит в летние месяцы, используя культуру тканей и ПЦР.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы
В период с июня по август 1997 и 1998 годов в префектуре Фукусима, Япония, были взяты мазки из горла для наблюдения за вирусами у 246 детей с температурой тела выше 38.5°C и клинические признаки инфекции глотки и/или миндалин. Образцы собирали в транспортную среду, содержащую 2 мл минимальной эссенциальной среды Игла с желатином (5 мг/л), пенициллином (400 ЕД/л), стрептомицином (400 мкг/л) и амфотерицином В (1,25 мкг/л), разделенных на на две части и хранят при -70°С до анализа. Одну часть использовали для выделения вируса с помощью клеточной культуры, а другую — для обнаружения вируса с помощью ПЦР.
Двадцати четырем детям (в возрасте 0,25–6,50 лет, средний возраст 2,21) был поставлен клинический диагноз герпетической ангины на основании внезапного начала лихорадки и характерных везикулярных и/или изъязвленных поражений слизистой оболочки ротоглотки.Двадцати одному ребенку (в возрасте 0,67–4,50 года, средний возраст 1,97) был поставлен клинический диагноз фебрильных судорог, если они соответствовали следующим пяти критериям: возраст от 6 месяцев до 5 лет; лихорадка >38°С; продолжительность приступа <15 минут; отсутствие инфекции ЦНС, определяемой с использованием стандартных методов, таких как бактериальная культура и выделение вируса; отсутствие стойких неврологических нарушений после приступа. Подробности о 21 пациенте сообщались ранее. 9 Остальные 201 обучаемый ребенок (в возрасте 0.16–15,9 лет, в среднем 3,87 года) не имели ни характерной энантемы в полости рта, ни неврологических проявлений. Им поставили диагноз фарингит/тонзиллит. Из этих 201 больных у восьми был конъюнктивит, у пяти — экзантематозные проявления, у одного — стоматит, у одного — паротит, у одного — шейный лимфаденит.
Выделение вируса
Для выделения вируса использовали клеткиHep-2, Vero, RD-18S (линия клеток рабдомиомы человека), HMV-II (линия клеток злокачественной меланомы человека) и MDCK.Сливающиеся клеточные культуры высевали в лунки микропланшета и инокулировали 100 мкл поддерживающей среды и 50 мкл образцов мазка из зева. Культуры клеток инкубировали при 34°C в 5% CO 2 и наблюдали в течение семи дней на цитопатический эффект. Затем однократно проводили слепой пассаж, если не наблюдалось цитопатического эффекта. Изоляты вируса идентифицировали с помощью тестов на нейтрализацию с использованием сыворотки от Denka Seiken Co. Ltd (Токио, Япония), как первоначально сообщалось Шмидтом и его коллегами. 10
ПЦР для выявления генома энтеровируса
Образцы мазка из горла, отрицательные на наличие вирусов в результате посева, были проверены на наличие генома энтеровируса с помощью ПЦР.Один метод вложенной ПЦР (ПЦР-FMU) был описан ранее. 6 Вкратце, РНК экстрагировали из 250 мкл каждого образца с использованием Isogen-LS (NipponGene, Токио, Япония) (набор с кислотным тиоцианатом гуанидиния). Нуклеиновую кислоту осаждали центрифугированием, однократно промывали 70%-ным этанолом, сушили и растворяли в 10 мкл стерильной воды. Синтез кДНК проводили с использованием 2,5 ед. обратной транскриптазы вируса мышиного лейкоза Молони (Toyobo, Осака, Япония) из 3 мкл ресуспендированной РНК. Аликвоту 10 мкл продукта кДНК использовали в качестве матрицы для амплификации с использованием ДНК-полимеразы Taq (Perkin-Elmer, Norwalk, CT).Праймеры предназначались для 5′-некодируемой области последовательности коксакивируса B1, 11 , как сообщалось Zoll et al. 5 F1 (5′-CAAGCACTTCTGTTTCCCCGG), комплементарный геномной смысловой РНК в положениях 160–180, и R1 (5′-ATTGTCACCATAAGCAGCCA), антисмысловая РНК 580–599, использовали для первого раунда амплификации; F2 (5′-TCCTCCGGCCCC TGAATGCG) смысловые положения 445–464 и R1 использовали для второго раунда амплификации. Продукты помещали в 2% агарозные гели бромистого этидия и фотографировали в ультрафиолетовом свете.Ожидалось, что положительная реакция ПЦР будет давать полосу из 155 пар оснований (п.н.). ПЦР с использованием этих общих праймеров позволяет обнаружить 60 из 66 различных серотипов энтеровирусов; для вирусов Коксаки типов A11, A17 и A24 и эховирусов типов 16, 22 и 23 не наблюдалось продукта амплификации. 5 −3 TCID 50 /мл. 6 Отрицательные контроли были включены для каждого этапа анализа.
ПЦР для типирования энтеровируса
Образцы, положительные с помощью PCR-FMU, были протестированы на наличие последовательностей энтеровирусного генома с использованием PCR-MBCL в биоклинической лаборатории Mitsubishi Kagaku (MBCL). Праймеры были установлены в 5′-некодируемой области и области VP2: OL68-1 (5′-GGTAAYTTCCACCACCANCC) 7 , комплементарные геномной смысловой РНК в положениях 1178–1197, и MD91 (5′-CCTCCGGCCCCTGAATGCGGCTAAT) 4 антисмысловая РНК 444–468 аттенуированного штамма полиовируса Sabin 1, 12 , использовалась для первого раунда амплификации; OL68-1 и EVP4 (5′-CTACTTTGGGTGTCCGTGTT) 4 антисмысловая РНК в положении 541–560 использовали для второго раунда амплификации.ПЦР-MBCL амплифицирует продукт размером примерно 650 п.н., включая часть 5′-некодирующей области, полную область VP4 и 5′-конец области VP2. Этот метод выявил все 64 протестированных штамма прототипа энтеровируса. 13 Чувствительность ПЦР-МККЛ соответствовала примерно 10 -1 -10 -2 TCID 50 /мл. 9
Продукты ПЦР выделяли из геля, очищали и секвенировали на автоматическом ДНК-секвенаторе с использованием флуоресцентного дидезокси-терминатора цепи.База данных MBCL для полной области VP4 всех 64 энтеровирусов человека была создана на основе данных секвенирования нуклеотидов области VP4 49 прототипов штаммов энтеровирусов и 15 ранее опубликованных последовательностей энтеровирусов, полученных из GenBank. 13 Последовательности VP4 из каждого продукта ПЦР были филогенетически проанализированы вместе с последовательностями прототипов в базе данных MBCL с использованием программы SINCA (Fujitsu Limited, Токио, Япония). Генетические расстояния были оценены с использованием двухпараметрического метода Кимуры, а неукорененные филогенетические деревья были построены с использованием метода объединения соседей.Статистическая значимость филогений с использованием объединения соседей оценивалась с помощью бутстрап-анализа с 1000 передискретизациями наборов данных.
Диагностика энтеровирусной инфекции
Диагноз энтеровирусной инфекции был поставлен, когда энтеровирус был обнаружен в образцах мазка из зева с помощью клеточной культуры и/или ПЦР. Обнаружение энтеровируса в любой локализации, за исключением нижних отделов кишечника, обычно считается причинно-следственной связью с конкретным заболеванием.
РЕЗУЛЬТАТЫ
Вирусная изоляция
вируса Коксаки A16 и вируса простого герпеса типа 1 были выделены из одного из 24 образцов мазков из зева, взятых у пациентов с клинически диагностированной герпетической ангиной (см. таблицу 1). Вирус не был выделен из 21 образца, взятого у пациентов с фебрильными судорогами. Из 66 (32.8%) из 201 больного с другими лихорадочными заболеваниями в летние месяцы.
Стол 1Обнаружение и идентификация вирусов в мазке из зева с использованием клеточной культуры
Скрининг на наличие энтеровируса с помощью ПЦР
Наличие последовательности энтеровирусного генома в образцах мазков из зева, из которых вирус не был выделен культурами тканей, было идентифицировано с помощью PCR-FMU в 17/22 образцах, взятых у пациентов с герпетической ангиной, 11/21 образцах, взятых у пациентов с фебрильными судорогами, и 26/135 проб, взятых у больных фарингитом/тонзиллитом в летние месяцы (см. табл. 2).Геном энтеровируса был обнаружен в образцах от одного пациента с фарингитом/тонзиллитом, ассоциированным с экзантемой, и одного пациента со стоматитом.
Стол 2Обнаружение и идентификация вирусов в мазках из зева с помощью полимеразной цепной реакции
Идентификация энтеровируса с помощью филогенетического анализа
Пятьдесят четыре исходных образца, которые дали положительные результаты с помощью PCR-FMU, были повторно исследованы с помощью PCR-MBCL (см. таблицу 2).Положительные результаты получены в 14/17 пробах от больных герпетической ангиной, во всех 11 пробах от больных с фебрильными судорогами и в 16/26 пробах от больных фарингитом/тонзиллитом. Таким образом, наличие энтеровирусного генома подтверждено у 41 (75,9%) из 54 исследованных образцов. Филогенетический анализ с использованием области, кодирующей белок VP4 (207 п.н.), 64 штаммов-прототипов энтеровирусов из базы данных MBCL дал четыре основных кластера. Анализ последовательностей продуктов ПЦР позволил идентифицировать генотипы энтеровирусов.Генотипы всех 14 энтеровирусов, выявленных в образцах больных герпетической ангиной, 8/11 энтеровирусов, выявленных в образцах больных с фебрильными судорогами, и всех 16 энтеровирусов, выявленных в образцах больных фарингитом/тонзиллитом, входили в А-кластер энтеровирусов (Коксаки-группа А). -подобный генотип).
Энтеровирусы, принадлежащие к коксакивирусу А5-подобного генотипа, которые были идентифицированы в образцах пациентов с герпетической ангиной, фебрильными судорогами и фарингитом/тонзиллитом в течение двух лет, сформировали два отчетливых кластера (рис. 1).Кластеры связаны с годом, когда были взяты образцы, а не с типом заболевания. Аналогичные кластеры были и у других генотипов.
Рисунок 1Филогенетическое дерево 64 прототипов энтеровирусов и 38 энтеровирусов, выявленных у больных с лихорадкой в течение двух лет. Филогенетическое дерево было построено на основе нуклеотидных последовательностей кодирующей области белка VP4. Шестьдесят четыре прототипа штаммов энтеровирусов были разделены на четыре генетических кластера (A, B, C и D).Все 14 энтеровирусов, выявленных у больных герпетической ангиной (Her), 8/11 энтеровирусов, выявленных у больных с фебрильными судорогами (ФС), и все 16 энтеровирусов, выявленных у больных фарингитом/тонзиллитом (ФТ), входили в кластер А энтеровирусов (группа вирусов Коксаки). А-подобный генотип). Коксаки-подобные генотипы вирусов группы А, выявленные при герпетической ангине, фебрильных судорогах и фарингите/тонзиллите за два лета, были четко сгруппированы в зависимости от года взятия образцов (1997 или 1998), а не от типа заболевания.
При сравнении исходных характеристик (возраст, степень лихорадки или количество дней после начала заболевания, когда были взяты образцы) среди всех пациентов с коксакивирусной инфекцией группы А, пациентов с герпетической ангиной (2,34 (1,45) года) и фебрильными судорогами (1,94 (1,05) лет) были моложе, чем больные фарингитом/тонзиллитом (4,39 (3,38) года). Среди лиц с фарингитом/тонзиллитом не было существенных различий в исходных характеристиках, в то время как выделялись группы, инфицированные вирусами Коксаки группы А, другими энтеровирусами или аденовирусами.
ОБСУЖДЕНИЕ
В целом, вирусы Коксаки группы А (за исключением некоторых серотипов, таких как А9, А10 и А16) редко выделяют с помощью стандартных методов культивирования тканей. В настоящем исследовании только один (А16) из 33 выделенных энтеровирусов был вирусом Коксаки группы А. Недавно разработанные методы ПЦР очень чувствительны для обнаружения большинства геномов энтеровирусов в различных образцах. 4– 6 Также сообщалось о методе ПЦР для специфического обнаружения вирусов Коксаки группы А, 14 , но не удалось идентифицировать серотип (генотип) энтеровируса.Филогенетический анализ последовательностей энтеровирусного генома VP-1 позволил классифицировать энтеровирусные генотипы. 8 Исследования выравнивания секвенированных энтеровирусов выявили высококонсервативные последовательности в 5′-некодирующей области и области VP2. Когда праймеры были установлены в этих консервативных областях, методы ПЦР могли обнаружить большинство серотипов энтеровирусов. 5, 7 Последующий филогенетический анализ полных последовательностей VP4 между 5′-некодирующей областью и областью VP2 позволил нам идентифицировать генотипы энтеровирусов. 9, 13 Поскольку для идентификации вируса не требуется выделения вируса, ожидается, что комбинация обнаружения вируса на основе ПЦР и идентификации вируса на основе филогенетического анализа будет полезна для обнаружения и идентификации вирусов Коксаки группы А. Тридцать восемь (92,7%) из 41 энтеровируса, идентифицированного этими методами из образцов, в которых вирус не был выделен культурой ткани, были вирусами Коксаки группы А при генотипировании.
Вирусы Коксаки группы А считаются основными возбудителями герпетической ангины.ПЦР-ФМУ выявил энтеровирусы у 17 из 22 пациентов с культурально-негативной герпангиной, из которых у 14 (82,4 %) энтеровирусный геном был обнаружен с помощью ПЦР-МВКЛ. Это указывает на то, что эти два метода имеют разную чувствительность. Все 15 энтеровирусов, идентифицированных с помощью клеточной культуры и ПЦР-MBCL, были вирусами Коксаки группы А. Наши результаты подтверждают, что энтеровирусы, и особенно вирусы Коксаки группы А, являются важными возбудителями лихорадочных заболеваний, связанных с фебрильными судорогами в летний период. Возбудители острого фарингита/тонзиллита были выявлены у 92 (45.8%) из 201 пациента. Распространенными патогенами были энтеровирусы (58/92), за которыми следовали аденовирусы (35/92). Из 48 энтеровирусов, идентифицированных как с помощью клеточной культуры, так и с помощью ПЦР-МВКЛ, 16 (33,3 %) были вирусами Коксаки группы А. Не было выявлено существенных различий в исходных характеристиках (возраст, степень лихорадки и клинические признаки) групп, инфицированных в разной степени вирусами Коксаки группы А, другими энтеровирусами или аденовирусами.
Кластеризация по годам, показанная филогенетическим анализом изолятов вируса Коксаки группы А, а не по типу заболевания, указывает на то, что вирусы, преобладающие каждый год, вызывают различные лихорадочные заболевания в летнее время, включая герпангину, фебрильные судороги и фарингит/тонзиллит.
В заключение, ПЦР и последующий филогенетический анализ амплифицированных последовательностей очень полезны для обнаружения и идентификации энтеровирусов и, таким образом, для диагностики инфекций, вызываемых вирусами Коксаки группы А. Методы также будут полезны для изучения молекулярной эпидемиологии энтеровирусных инфекций.
ССЫЛКИ
- ↵
Вишневый JD . Энтеровирусы: коксакивирусы, эховирусы и полиовирусы. В: Фейгин Р.Д., Черри Д.Д., ред. Учебник детских инфекционных болезней , 4-е изд. Филадельфия, Пенсильвания: WB Saunders Company, 1998:1787–839.
- ↵
Huebner RJ , Cole RM, Beeman EA, и др. . Герпангина: этиологические исследования конкретного инфекционного заболевания. JAMA1951;145:628–33.
- ↵
Kravis LP , Hummeler K, Sigel MM, и др. . Герпангина: клинические и лабораторные аспекты вспышки, вызванной вирусами Коксаки группы А.Педиатрия 1953; 11: 113–19.
- ↵
Ротбарт HA . Ферментативная амплификация РНК энтеровирусов. J Clin Microbiol, 1990; 28:438–42.
- ↵
Zoll GJ , Melchers WJG, Kopecka H, и др. . Общая полимеразная цепная реакция, опосредованная праймерами, для обнаружения энтеровирусов: применение для рутинной диагностики и персистирующих инфекций. J Clin Microbiol, 1992; 30:160–5.
- ↵
Hosoya M , Honzumi K, Suzuki H. Обнаружение энтеровируса с помощью полимеразной цепной реакции и культуры в спинномозговой жидкости детей с транзиторными неврологическими осложнениями, связанными с острым лихорадочным заболеванием. J Infect Dis1997;175:700–3.
- ↵
Олив DM , Аль-Муфти С., Аль-Мулла В., и др. . Обнаружение и дифференциация пикорнавирусов в клинических образцах после геномной амплификации.J Gen Virol1990;71:2141–7.
- ↵
Оберсте М.С. , Махер К., Килпатрик Д.Р., и др. . Молекулярная эволюция энтеровирусов человека: корреляция серотипа с последовательностью VP1 и применение к классификации пикорнавирусов. J Virol1999;73:1941–8.
- ↵
Хосоя М. , Сато М., Хонзуми К., и др. . Ассоциация неполиомиелитной энтеровирусной инфекции в центральной нервной системе детей с фебрильными судорогами.Педиатрия2001;107:E12.
- ↵
Schmidt NJ , Melnick JL, Wennwe HA, и др. . Оценка пулов иммунных лошадиных сывороток к энтеровирусам для идентификации полевых штаммов вируса. Bull WHO 1971;45:317–30.
- ↵
Iizuka N , Kuge S, Nomoto A. Полная последовательность нуклеотидов генома вируса Коксаки B1.Virology1987;156:64–73.
- ↵
Номото А , Омата Т, Тойода Х, и др. .Полная нуклеотидная последовательность генома аттенуированного штамма полиовируса Sabin 1.Proc Natl Acad Sci U S A1982;79:5793–7.


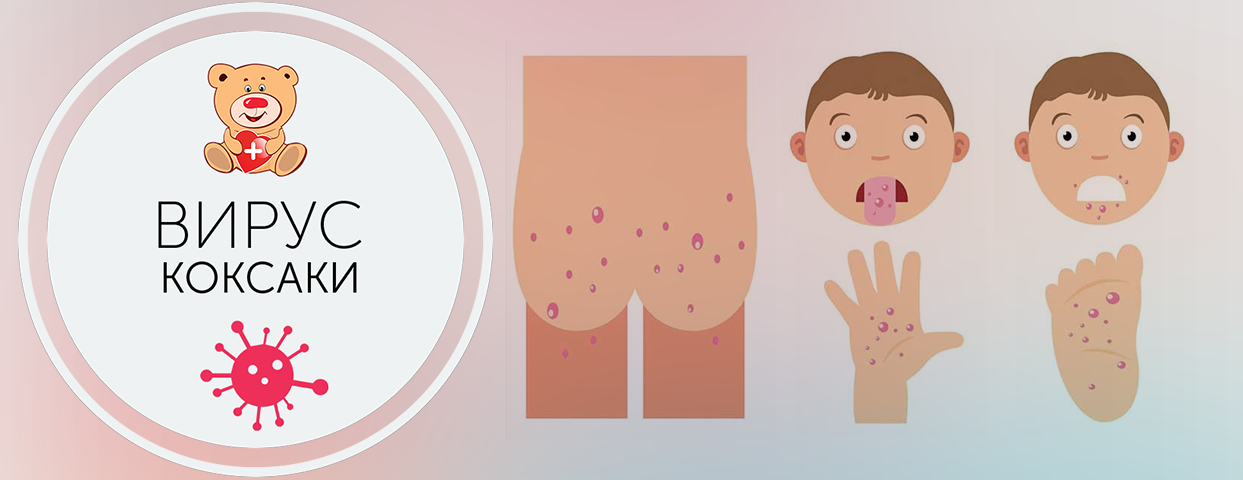 Пузырьки эти лопаются, на их месте образуются язвочки, заполненные белым налетом. После выздоровления на месте язвочек не остается никаких следов.
Пузырьки эти лопаются, на их месте образуются язвочки, заполненные белым налетом. После выздоровления на месте язвочек не остается никаких следов.


 Двойное слепое рандомизированное плацебо-контролируемое исследование местного 2% вязкого лидокаина для улучшения перорального приема у детей с болезненными инфекционными заболеваниями полости рта. БМС Педиатр. 2011 21 ноя. 11:106. ПабМед Центральный
Двойное слепое рандомизированное плацебо-контролируемое исследование местного 2% вязкого лидокаина для улучшения перорального приема у детей с болезненными инфекционными заболеваниями полости рта. БМС Педиатр. 2011 21 ноя. 11:106. ПабМед Центральный