как выбрать лучший препарат — эффективные средства от дисбактериоза кишечника
Проблемы со стулом, неприятное чувство в животе может быть связано не только с отравлением пищей. У взрослых и детей за этими симптомами часто скрывается дисбактериоз. Врачи не считают его заболеванием, это состояние часто сопровождает другие патологии или является их следствием. Но устранять нарушение микрофлоры нужно как можно раньше.
Что такое дисбактериоз
Ребенок появляется на свет стерильным, в его организме в норме нет бактерий. Кишечник, кожа заселяются постепенно, начиная с первого прикладывания младенца к груди. Чем старше становится ребенок и более разнообразна его пища, тем больше различных бактерий попадают в кишечник и формируют его микрофлору. У взрослых людей состав микроорганизмов стабилизируется, но становится разнообразным. Его можно сравнить с отпечатком пальцев, несмотря на сходство, он не повторяется ни у одного человека.
Среди кишечных бактерий насчитывается сотни видов хороших микроорганизмов, но в норме встречаются и плохие, рост которых организм может сдерживать.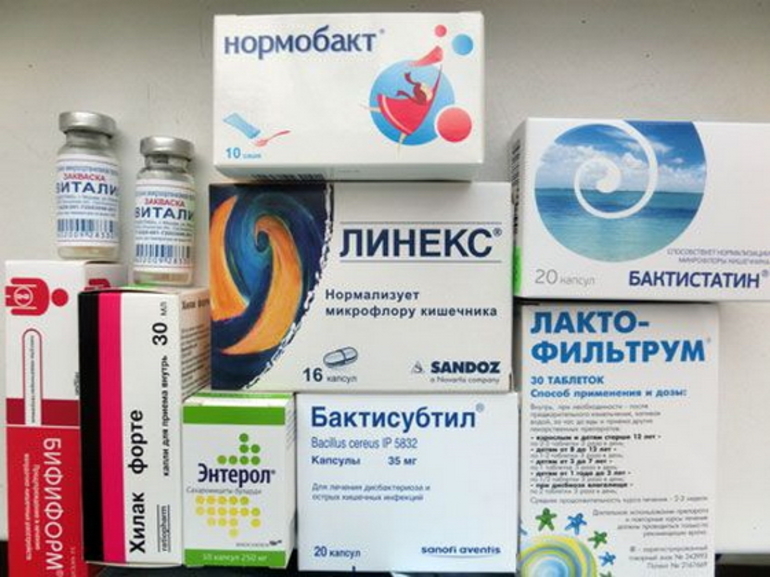
- доминирующие – присутствуют у всех здоровых людей, к ним относятся эубактеры, бактероиды, бифидобактерии, лактобактерии;
- непостоянные виды – встречаются не у всех или при определенных условиях, это стрептококки, кишечная палочка, протей, цитобактер;
- транзиторные виды – иногда попадают в кишечник, но долго там не задерживаются, это такие типы, как дрожжевые грибы, клостридии, синегнойная палочка.
Хорошими микроорганизмами являются доминирующие бактерии, их должно быть большинство. Благодаря присутствию нормальной микрофлоры переваривается пища. Бактерии помогают ферментировать некоторые неперевариваемые продукты, участвуют в всасывании витаминов, аминокислот, сахаров. Сами они тоже синтезируют витамины группы В, К, жирные кислоты. Поэтому при дисбактериозе появляются признаки гиповитаминоза.
Хорошие бактерии выполняют роль живого щита. Они формируют защитный слой на кишечной стенке, которые не позволяет прикрепиться патогенным микроорганизмам и ограничивает их в питательных веществах. Иммунная функция заключается в тренировке клеток иммунитета и регуляции его ответа на проникновение чужеродных микроорганизмов или белков.
Иммунная функция заключается в тренировке клеток иммунитета и регуляции его ответа на проникновение чужеродных микроорганизмов или белков.
Но при изменении соотношения бактерий, увеличении количества транзиторных видов, появлении дрожжевых грибков, развивается дисбактериоз. Его нельзя назвать заболеванием, но самочувствие у человека нарушается. При дисбактериозе в кишечнике нет патогенных микроорганизмов (сальмонелл, холерного вибриона, иерсиний, патогенных эшерихий, а также вирусов). Изменения состава происходят за счет дисбаланса нормальной флоры и увеличения концентрации условно-патогенных бактерий, появления грибков.
Причины
Микрофлора кишечника у взрослых находится в состоянии динамического равновесия. В нем присутствуют определенные бактерии, которые составляют большинство, и около 3 % микроорганизмов, которые меняют свой состав. В норме колебания происходят под влиянием продуктов питания и пищевых привычек. На микрофлору влияет преобладание в рационе сладкого и жирного или преимущественно растительная пища.
Исследования показывают, что жирная еда угнетает бифидобактерии и энтерококки, но в этих условиях размножаются бактероиды. Преимущественно углеводная диета стимулирует размножение бифидобактерий и общего количество микроорганизмов. Но таки перемены носят временный характер и не ведут к появлению симптомов дисбактериоза. Они сами исчезают после изменения питания.
Дисбактериоз кишечника у взрослых появляется в результате других заболеваний. Основными причинами нарушения микрофлоры являются:
- длительное лечение антибиотиками;
- патологии вышележащих отделов пищеварительного тракта;
- продолжительные монодиеты и постоянное неправильное питание;
- кишечные инфекции.
Антибиотики широкого спектра действия действуют неселективно. Они угнетают рост или вызывают гибель всех микроорганизмов. Чем дольше курс лечения, тем выше вероятность, что после него разовьется дисбактериоз. Особенно опасны тетрациклиновые антибиотики. Они значительно угнетают размножение кишечной микрофлоры, что приводит к гиповитаминозу В, К, увеличению риска кровотечений.
Гастрит, холецистит, панкреатит, гепатит или дискинезия желчных путей могут привести к развитию дисбактериоза. Опасны цирроз печени, опухолевые процессы в желудке или язва. Эти патологии сопровождаются нарушением переваривания пищи, выработки ферментов. Поэтому в кишечник пища поступает недостаточно обработанной и не может служить питательной средой для бактерий. Часть из них гибнет, а на их место приходит словно-патогенная флора.
Разгрузочный день, когда рацион строится на употреблении одного продукта питания, не наносит вреда организму. Но монодиета, которая длится несколько недель или становится образом жизни, может привести к дисбактериозу. Опасно постоянное употребление еды, содержащей простые углеводы, животные жиры. Это сладкое, мучное, блюда из фаст-фуда. Такой рацион угнетает размножение нормальной флоры, в кишечнике активируются процессы брожения, появляется большое количество дрожжевых грибков.
Двойной вред кишечнику наносят пищевые инфекции. Они повреждают слизистую оболочку, а лечение антибиотиками убивает полезные бактерии. Поэтому восстановление после болезни проходит особенно тяжело.
Поэтому восстановление после болезни проходит особенно тяжело.
Негативно на состояние кишечника влияет курение. Оно создает условия для размножения дрожжевых грибков, поэтому курильщики часто мучаются неприятными симптомами.
Симптомы дисбактериоза
Нет строгих симптомов, которые с большой вероятностью указывают на дисбактериоз. Проявления патологии часто не соответствуют степени тяжести нарушений. Самый частый признак – нарушение пищеварения по типу кишечной диспепсии. Она проявляется следующими симптомами:
- урчание в животе;
- метеоризм, усиленное газообразование;
- вздутие живота;
- нарушения стула;
- появление в кале патологических примесей.
Усиление газообразования на начальном этапе происходит после нарушения питания. Если в определенный день в рационе присутствовало молоко, бобовые, большое количество мучного и сладкого, симптомы проявляются ярко.
Нарушения стула изменчивы. Чаще всего дисбактериоз проявляется диареей. Она может сопровождаться спазмами и болью в животе. Иногда неоформленный стул появляется всего раз в сутки, поэтому не попадает под критерий диареи.
Она может сопровождаться спазмами и болью в животе. Иногда неоформленный стул появляется всего раз в сутки, поэтому не попадает под критерий диареи.
Понос может сменяться запором. Такой процесс наблюдается у людей, которые ограничивают количество клетчатки и пищевых волокон в рационе. Это лишает бактерии необходимых питательных веществ, не позволяет удерживать в просвете кишечника воду. Слизистые патологические примеси в каловых массах, боль в животе появляются при запущенных формах дисбактериоза.
Нарушение состава микрофлоры приводит к дефициту витаминов. Если он не компенсируется при помощи питания или приема поливитаминных препаратов, появляются симптомы гиповитаминоза:
- ухудшается состояние волос, ногтей;
- на коже появляются высыпания;
- проявляются аллергические реакции или пищевая непереносимость;
- повышается утомляемость, снижается работоспособность;
- нарушается сон.
Кишечные микроорганизмы синтезируют витамин К, который участвует в свертывании крови. При гиповитаминозе учащается появление синяков, гематом под кожей от небольшого механического воздействия. При язве желудка, небольших травмах увеличивается риск продолжительного кровотечения.
При гиповитаминозе учащается появление синяков, гематом под кожей от небольшого механического воздействия. При язве желудка, небольших травмах увеличивается риск продолжительного кровотечения.
В тяжелых случаях дисбактериоз, который сопровождается диареей, приводит к обезвоживанию. У многих пациентов снижается масса тела.
Какое нужно обследование
Симптомы дисбактериоза неспецифические. За одинаковыми признаками могут маскироваться патология органов пищеварения или гиповитаминоз. Поэтому дисбактериоз считается клинико-лабораторным синдромом.
Диагностика начинается с копрологического исследования, которое позволяет оценить пищеварительную функцию, состояние ферментных систем, перистальтику и скорость продвижения пищевого комка.
Но изменение состава кала еще не говорит о дисбактериозе. Необходимо подтвердить изменение состава бактерий в просвете кишечника. В Москве во многих клиниках применяют методы газожидкостной и ионной хроматографии. Они позволяют определить состав микрофлоры по полученным метаболитам.
Часто используют бактериологическое исследование. Для этого смывы со слизистой оболочки кишечника, фекалии или соскоб высевают на специальные питательные среды. Этот способ позволяет получить колонии бактерий и с высокой точностью определить их тип. Также используют специальный анализ кала на дисбактериоз. Но обязательное условие – биологический материал должен попасть в лабораторию не позже, чем через час после его получения от пациента. Кал необходимо поддерживать в теплом виде, чтобы не вызвать гибель бактерий. Метод не оправдывает себя тем, что дает представление только о состоянии флоры толстого кишечника.
Золотой стандарт диагностики дисбактериоза – интестиноскопия. Это эндоскопический метод, во время которого в полость тонкой кишки через рот и желудок или прямую и толстую кишку вводят гибкий зонд с видеокамерой. Он необходим для осмотра слизистой кишечника и получения аспирата его содержимого. Полученную жидкость также засевают на питательную среду. Недостаток метода – необходимость общей анестезии, специальных бактериологических сред и долгое ожидание результата. Иногда для диагностики дисбактериоза применяют дыхательный тест с меченным Н2.
Иногда для диагностики дисбактериоза применяют дыхательный тест с меченным Н2.
Препараты и их действие
Самый эффективный способ восстановить микрофлору и избавиться от дисбактериоза – использовать препараты из группы пробиотиков. Производители предлагают лекарственные средства в разных формах:
- капсулы;
- таблетки;
- порошок;
- капли;
- раствор.
Лекарственную форму подбирает врач в зависимости от возраста пациента. Детям и пожилым людям, которым тяжело глотать таблетки, назначают раствор или порошок для его приготовления. В возрасте 0-3 лет ребенку легче дать капли с пробиотиком. Всем остальным рекомендованы средства в виде капсул или таблеток.
Препараты от дисбактериоза – это лекарства, которые можно приобрести без рецепта врача. Но самолечением заниматься не рекомендуется, только специалист может подсказать, какой тип лучше принимать.
В составе пробиотиков обычно 1-2 типа бактерий, которые хорошо восстанавливают слизистую. Обычно это лакто- и бифидобактерии. Они являются нормальными обитателями кишечника, которые помогают улучшить микробный баланс. Механизм действия этой терапевтической группы связан с подавлением роста патогенной флоры. Молочнокислые бактерии конкурируют за рецепторы на эпителии слизистой оболочки, питательные вещества. Они выделяют молочную кислоту, цитокины, которые оказывают угнетающее действие на патогены.
Обычно это лакто- и бифидобактерии. Они являются нормальными обитателями кишечника, которые помогают улучшить микробный баланс. Механизм действия этой терапевтической группы связан с подавлением роста патогенной флоры. Молочнокислые бактерии конкурируют за рецепторы на эпителии слизистой оболочки, питательные вещества. Они выделяют молочную кислоту, цитокины, которые оказывают угнетающее действие на патогены.
Эффективно вылечить дисбактериоз помогают препараты из группы пребиотиков. Это лекарства, которые относятся к группе пищевых волокон: инулин и лактулоза, а также препараты на их основе.
Они не расщепляются пищеварительными ферментами и попадают в неизменном виде в толстый кишечник, где становятся питательным субстратом для лакто- и бифидобактерий. Поэтому микробы хорошо размножаются, увеличивают объем бактериальной массы, восстанавливают стенку кишечника. Чтобы лечение было максимально эффективное, рекомендуется пить одновременно пребиотики и пробиотики.
Лечение дисбактериоза не противопоказано при сопутствующих патологиях пищеварительного тракта. Пробиотики не наносят вреда пациентам с язвой желудка, заболеваниями печени или желчного пузыря. А в некоторых случаях они ускорят восстановление.
Пробиотики не наносят вреда пациентам с язвой желудка, заболеваниями печени или желчного пузыря. А в некоторых случаях они ускорят восстановление.
В запущенных случаях дисбактериоза кишечника и когда симптомы диспепсии слишком мучительны, могут помочь лекарства из группы ферментов. Их должен подбирать врач, в зависимости от типа нарушения пищеварения. Эти средства необходимо пить ежедневно до еды
Сколько времени придется лечить дисбактериоз, сказать тяжело. В некоторых случаях это может растянуться на несколько недель, а при запущенном состоянии – несколько месяцев.
Профилактика дисбактериоза
Даже если использовать эффективные препараты и избавиться от дисбактериоза, нельзя точно сказать, не придется ли его лечить еще раз. Поэтому врачи рекомендуют соблюдать меры профилактики.
Самый эффективный – постоянно придерживаться диеты. Она подбирается в зависимости от типа диспепсии. Универсальное средство профилактики – употреблять продукты, которые содержат естественные пробиотики. К ним относятся крупяные каши, кисломолочные продукты с закваской из бифидобактерий, некоторые сорта хлеба. Если постоянно ощущается брожение в кишечнике, на время терапии нужно исключить из рациона углеводы, молоко, горох и сою. Не рекомендуют употреблять продукты, богатые эфирными маслами. У ним относятся лук, чеснок, редька, редис.
К ним относятся крупяные каши, кисломолочные продукты с закваской из бифидобактерий, некоторые сорта хлеба. Если постоянно ощущается брожение в кишечнике, на время терапии нужно исключить из рациона углеводы, молоко, горох и сою. Не рекомендуют употреблять продукты, богатые эфирными маслами. У ним относятся лук, чеснок, редька, редис.
Хорошо пить не менее 1,5 л чистой воды в сутки. Действенный способ стабилизировать состав микрофлоры – принимать растительные соки. В этом помогают морковный, тыквенный, картофельный. Помогают многие растительные продукты: ягоды черники, земляники, абрикосы, клюква. Врач может назначить отвары лекарственных растений. Лечить дисбактериоз при преобладании грибковой флоры можно растворимым цикорием. В некоторых случаях эффективны эвкалипт, календула, соя, зверобой.
В список полезных веществ при дисбактериозе входит инулин. Он ускоряет рост и размножение бифидобактерий, чем помогает увеличить объем полезных микробов в кишечнике. Инулин помогает восстановить слизистую за счет увеличения выработки слизи, изменения степени рН и создания благоприятной среды для бактерий.
К мерам профилактики дисбактериоза относится использование пробиотиков заранее у пациентов, которым необходимо пройти курс лечения антибиотиками или химиотерапию. Это позволяет поддержать нормальный состав микрофлоры и избежать неприятных симптомов после окончания терапии.
Токарева Людмила Георгиевна, врач-терапевт медицинских кабинетов 36,6
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ, ПЕРЕД ПРИМЕНЕНИЕМ НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ
симптомы и лечение, профилактика дисбактериоза
Лекарство от дисбактериоза должно быть направлено не только на снятие симптомов, но и благоприятно устранять патологическую микрофлору, которая вызывает это кишечное заболевание. Что такое дисбактериоз, и какие препараты эффективно справятся с ним?
Дисбактериоз. Симптомы
Когда состав микрофлоры кишечника по каким-либо патогенным причинам меняется, то наступает дисбактериоз – нарушение работы желудка и пищеварительной системы, в связи с появлением патогенной микрофлоры.
Здоровый кишечник богат полезными бактериями – бифидобактериями, лактобактериями, бактероидами. Данные микроорганизмы помогают в работе желудка, и имеет защитную функцию. При попадании нежелательных бактерий – стрептококков, протея, грибков рода кандида или стафилококков, происходит дисбаланс здоровой и патогенной микрофлоры.
В процессе борьбы этих двух групп за выживание, человек и ощущает на себе проявление дисбактериоза. Правильное лекарство от дисбактериоза восстанавливает работу кишечника, и человек вновь чувствует себя здоровым.
Но что это за симптомы? Во-первых, это – вздутие живота, болезненные ощущение в области кишечника, поносы, продолжительные запоры и неустойчивый стул (чередование проноса и запора). Также заболевание может проявляться в виде общей слабости и снижении работоспособности, постоянной усталости, снижении аппетита.
Причинами дисбактериоза могут быть следующие факторы:
- Нерациональное употребление антибиотиков;
- Кишечные инфекции;
- Болезни пищеварительных органов, такие как: гастрит, язвы, панкреатит;
- Перенесенные операции на органах пищеварения;
- Неправильное питание, недостаток природных витаминов в пище;
- Снижение иммунитета.

В случае возникновения заболевания после антибиотиков применяют лекарство от дисбактериоза, которые нормализируют микрофлору, уравновешивают баланс бифидобактерий.
Нарушение работы на фоне неправильного питания устраняется путем составления диеты, анализом образа жизни и его коррекции.
Лечение дисбактериоза
Лечение дисбактериоза проводится препаратами двух групп: пробиотики и пребиотики.
Пробиотики – лекарство от дисбактериоза, наиболее эффективные преператы, так как имеют высокую концентрацию бактерий, которые угнетают рост патогенных микроорганизмов. Эта группа представлена следующими препаратами: Бифидумбактерин форте (для ректального применения), порошок Пробифор, Флорин Форте в виде порошка и другие.
Пребиотики – механизм действия основан на процессе расщепления фруктозно-галактозного дисахарида на органические кислоты, что подавляет активность патогенной микрофлоры кишечника. Представители: Дюфалак, сироп Нормазе, Порталак, Ромфалак и другие.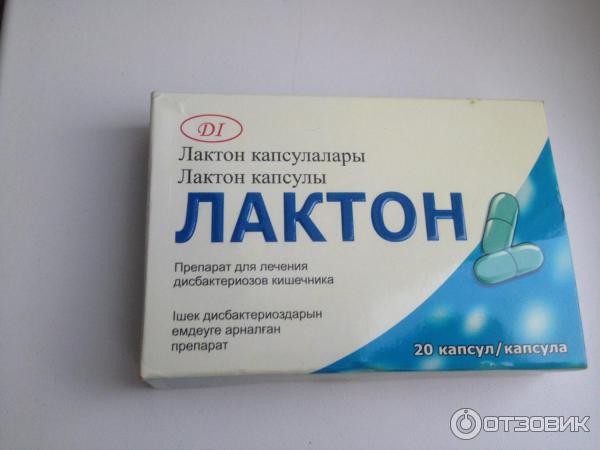
Профилактика дисбактериоза
Для профилактики заболевания рекомендуется больше времени проводить на воздухе, употреблять свежие продукты, особенно в осенне-зимний период. Лучшее лекарство от дисбактериоза это правильно соблюденная диета и хорошее настроение. Стрессы могут провоцировать кишечные заболевания, и осознание этого факта позволяет эффективно справиться с заболеванием или вовсе его избежать.
Регулярные консультации у гастроэнтеролога — это верный способ всегда быть осведомленным о состоянии своего здоровья. Также, соблюдая правила питания и приема лекарств мы можем избежать появления дисбактериоза в нашей жизни.
Дисбактериоз — миф российской медицины
Тем не менее, как дань дремучим совковым традициям, «дисбактериоз» продолжает слетать с языка многих практикующих врачей, особенно педиатров. По-прежнему стандарты медосмотров малышей включают тестирование кала на «дисбактериоз». При этом давно известно, что искать корреляцию между составом флоры в кале и реальным ее соотношением в криптах кишечника — все равно, что гадать на кофейной гуще. Во-первых, основу кишечной флоры составляют бактероиды, которые не растут на питательных средах. Во-вторых, соотношение бактерий на выходе имеет очень мало общего с тем, что живет в кишке. В-третьих, все то время, пока вы собираете и несете ваши бесценные фекалии в лабораторию, жизнь в них не прекращается, и уже через несколько часов вся флора и фауна кала радикально видоизменяется. А потому все заключения о «преобладании патогенной флоры над нормальной» в таком анализе попросту смехотворны.
Во-первых, основу кишечной флоры составляют бактероиды, которые не растут на питательных средах. Во-вторых, соотношение бактерий на выходе имеет очень мало общего с тем, что живет в кишке. В-третьих, все то время, пока вы собираете и несете ваши бесценные фекалии в лабораторию, жизнь в них не прекращается, и уже через несколько часов вся флора и фауна кала радикально видоизменяется. А потому все заключения о «преобладании патогенной флоры над нормальной» в таком анализе попросту смехотворны.
В общем, всем нам надо понимать, что такого самостоятельного заболевания, как дисбактериоз, в природе нет.
Существуют лишь ряд временных состояний организма (те же вирусные диареи или длительная антибиотикотерапия), которые могут привести к временному же дисбалансу нормальной флоры. При этом дисбаланс этот, как правило, не качественный, а количественный. В пример могу привести чрезмерный рост бактерии Clostridium difficile с развитием псевдомембранозного колита на фоне длительной терапии антибиотками.
Чаще же всего дискомфорт в животе обусловлен не мифическими заболеваниями, а совершенно реальным бунтом организма против всякой колы и прочей мак-дряни. Если вашего ребенка в животе не прекращается “шум и гам”, в первую очередь посмотрите, что он у вас ест.
У взрослых под «дисбактериозом» нередко скрываются синдром раздраженного кишечника, синдром избыточного бактериального роста в тонкой кишке, лактазная недостаточность, а также другие невыявленные состояния, при которых нарушается баланс кишечной флоры. Эти расстройства надо лечить, воздействуя на причину такого дисбаланса, а не сам дисбаланс, который является лишь следствием.
На теме дисбактериоза активно паразитируют различные производители кисломолочных продуктов питания, пробиотиков (препаратов с живыми бактериальными культурами) и пребиотиков (веществ, не перевариваемых человеком, но являющихся пищей для ряда бактерий).
Как я уже объяснил в колонке о кишечной флоре, бактерии пробиотиков могут становиться лишь транзитными колонистами, тогда как цель всех лечебных мероприятий заключается в восстановлении баланса СОБСТВЕННОЙ микрофлоры.
В ряду многочисленных препаратов для коррекции дисбактериоза хочу выделить особо абсурдный класс лекарств — бактериофаги. Бактериофаги — это такие вирусы, которые поражают бактерий. Когда-то ученые предложили использовать их против стафилококков, кишечных палочек и других возбудителей диарей. Однако исследования показали, что бактериофаги полностью разрушаются в желудке, и от таких препаратов во всем мире давно уже отказались. Точнее, во всем мире, кроме России — у нас эти псевдолекарства популярны и по сей день, и особенно хорошо неэффективные препараты лечат несуществующие дисбактериозы.
Если ваш врач уверенно заявляет, что ваша микрофлора разбалансирована, и вы вовсю уже «страдаете дисбактериозом», не паникуйте! Попытайтесь отыскать грамотного специалиста, который не станет жонглировать несуществующими диагнозами и назначать фуфломицины, а займется общепринятой диагностикой, которая позволит отличить инфекционную или органическую патологию кишечного тракта от физиологических и психосоматических расстройств. И не спешите разоряться в аптеках! Лучше сэкономьте деньги на полноценное питание себе и вашим детям, «подкормите» микрофлору естественным образом — здоровой пищей. Растительные волокна овощей, фруктов и зерновых — лучшая поддержка для
И не спешите разоряться в аптеках! Лучше сэкономьте деньги на полноценное питание себе и вашим детям, «подкормите» микрофлору естественным образом — здоровой пищей. Растительные волокна овощей, фруктов и зерновых — лучшая поддержка для
Препараты зеленой аптеки от дисбактериоза
Содержание
Около 70 % населения мира имеют дисбактериоз — нарушение баланса микрофлоры кишечника, которое приводит к сбою его деятельности.
В норме основу кишечного биоценоза человека составляют «полезные» бактерии, которые защищают организм от инфекций и помогают пищеварению. Дефицит таких бактерий и чрезмерный рост патогенных микроорганизмов вызывают дисбактериоз.
Дисбактериоз не возникает как самостоятельное заболевание, а является следствием болезней ЖКТ, стрессов, инфекций, приема антибиотиков или неправильного питания.
Для восстановления сбалансированной микробиологической среды кишечника пациентам назначают специальную диету, антисептические средства, пробиотики и витамины. Медикаментозное лечение обычно сочетают с фитопрепаратами.
Медикаментозное лечение обычно сочетают с фитопрепаратами.
Благодаря мощным противовоспалительным и спазмолитическим свойствам травяные сборы в виде чаев, настоев, отваров подавляют гнилостные процессы в кишечнике, снимают воспаление слизистой и устраняют симптомы дисбактериоза:
- метеоризм,
- запор или диарею,
- урчание и боли в животе,
- неприятный привкус во рту,
- тошноту, снижение аппетита.
Подобранные специалистом растительные средства позволяют уменьшить медикаментозную нагрузку на больного, ведь останавливают развитие патогенной микрофлоры в кишечнике, создают условия для размножения «дружественных» бактерий и не раздражают желудок. А минимальный перечень противопоказаний и польза для иммунитета позволяют применять лекарственные травы даже детям от шести месяцев.
Лекарственные растения для восстановления микрофлоры кишечника
Иммунитет человека во многом зависит от здоровья ЖКТ. Проявления дисбактериоза — вздутие, колики, нерегулярный стул — истощают организм и могут свидетельствовать о серьезных заболеваниях пищеварительной системы.
Проявления дисбактериоза — вздутие, колики, нерегулярный стул — истощают организм и могут свидетельствовать о серьезных заболеваниях пищеварительной системы.
Народная медицина предлагает немало лекарственных растений, которые борются с патогенной микрофлорой кишечника, уменьшают газообразование и помогают восстановить комфортное пищеварение. К ним относятся:
- фенхель,
- тмин,
- аир,
- полынь горькая,
- ромашка,
- тысячелистник,
- анис,
- мята,
- укроп и др.
Высокая эффективность трав в борьбе с дисбактериозом объясняется наличием в их составе эфирных масел, фитонцидов, флавоноидов, горьких и дубильных веществ, которые обеспечивают антибактериальный, ветрогонный эффект, снимают спазмы и улучшают моторику кишечника.
О полезных лекарственных растениях и сборах от дисбактериоза рассказываем далее.
Тысячелистник
Растение содержит сесквитерпены, флавоноиды, горькие, дубильные вещества, благодаря которым:
- обладает мощным антисептическим, противогрибковым и бактерицидным действием;
- нормализует моторику ЖКТ и уменьшает проявления метеоризма;
- блокирует спастические боли в кишечнике;
- активизирует выделение желудочного сока и усиливает аппетит;
- увеличивает желчеотделение.

Чтобы приготовить целебный настой от дисбактериоза, 1 ст. л. травы тысячелистника смешайте с 1 ч. л. травы полыни горькой, залейте 300 мл кипятка и настаивайте в течение 20 минут. Принимайте по 1 ст. л. 2–3 раза в день за 15 минут до еды.
Как заварить настой из тысячелистника и ромашки против дисбактериоза, читайте в нашем материале.
Крапива
Богатая на витамины, органические кислоты и гликозиды крапива — эффективное растительное средство от дисбактериоза, поскольку:
- нормализует липидный обмен и кислотность желудка;
- оказывает противовоспалительное и регенеративное действие — заживляет ранки на слизистой органов пищеварения;
- активизирует выделение желчи;
- укрепляет иммунную систему.
Листья крапивы применяют при запорах, геморрое, диарее, заболеваниях печени.
Для стимуляции обмена веществ в ЖКТ и смягчения стула готовят отвар из крапивы и крушины.Для этого 2 ч. л. листьев крапивы смешивают с 1 ч. л. коры крушины, заливают 500 мл кипятка и держат на слабом огне 10 минут. Отвар настаивают в течение 20 минут и принимают по 100 мл три раза в день до еды.
Аир
Благодаря полезным биологически активным веществам — эфирным маслам и горькому гликозиду акорину — настои из корневища аира:
- устраняют гнилостные процессы в кишечнике;
- уменьшают газообразование;
- усиливают рефлекторное выделение желудочного сока;
- возбуждают окончания вкусовых рецепторов и повышают аппетит;
- снимают спазмы кишечника;
- усиливают желчную функцию печени.
Для облегчения симптомов дисбактериоза 1 ст. л. корневищ растения поместите в эмалированную посуду, залейте стаканом кипятка и, накрыв крышкой, держите на водяной бане 15 минут. Дайте остыть.Принимайте настой три раза в день по ¼ стакана за 15 минут до еды.

Аир часто входит в состав желудочных сборов, ведь корневища растения — один из самых эффективных фитопрепаратов против метеоризма.
Какие травяные настои и отвары от дисбактериоза можно пить детям?
Дисбактериоз — один из самых распространенных диагнозов у детей до года. Среди причин развития патогенной микрофлоры у новорожденных:
- физиологическая незрелость моторной функции кишечника;
- позднее прикладывание к груди;
- искусственное вскармливание;
- раннее введение прикорма, употребление аллергенов;
- прием лекарств.
Симптомы дисбактериоза у грудных детей:
- боль в животе (ребенок может надрывно плакать, поджимать, напрягать ножки)
- частые срыгивания, отрыжка;
- частый стул: зеленого цвета, с непереваренными остатками пищи и резким кислым запахом;
- повышенное газообразование;
- белый налет на языке;
- неприятный запах изо рта;
- снижение аппетита, плохой набор веса;
- высыпания на коже;
- вялость, плохой сон.

Проявления дисбактериоза можно спутать с симптомами инфекционного заболевания или отравления, поэтому сначала рекомендуют выяснить и устранить первопричину расстройства пищеварения у малыша.
Содержание микрофлоры детского организма в нормальном состоянии является чрезвычайно важной задачей. Это способствует качественному перевариванию пищи, синтезу необходимых витаминов и формированию иммунной системы.
К наиболее эффективным лекарственным растениям от дисбактериоза у детей относятся:
- Тмин. Самое популярное средство от повышенного газообразования. Тминную водичку рекомендуют даже малышам. Плоды тмина имеют сильное бактерицидное, обезболивающее и ветрогонное эффект, нормализуют работу всего ЖКТ.
- Фенхель. Эффективное и безопасное природное средство при коликах у детей. Улучшает моторику кишечника, способствует быстрому и безболезненному выведению газов. Обладает секретолитическим, спазмолитическим, ветрогонным, противомикробным действием.

- Ромашка. Растительное средство мягкого действия, которое эффективно снимает воспаление и спазмы кишечника, уменьшает вздутие, устраняет отрыжку. Цветы ромашки имеют противомикробный эффект, благодаря чему подавляют развитие патогенной флоры ЖКТ.
- Укроп. Регулирует моторную деятельность кишечника, избавляет от метеоризма и спазмов. Повышает секрецию желудочных желез, улучшает аппетит.
Под наблюдением врача настои на основе этих растений можно применять даже детям от шести месяцев.
Если дисбактериоз сопровождают вздутие и метеоризм, облегчить страдания малыша может легкий массаж животика по часовой стрелке, использование газоотводной трубки или выкладывание на живот.
Если ребенок на грудном вскармливании, хотим напомнить, что натуральный фиточай «Лактафитол» от компании «Лектравы» — средство, которое не только повышает лактацию у мамы, но и из-за обогащения грудного молока полезными веществами налаживает работу ЖКТ малыша.
Это возможно благодаря карвону в плодах тмина и аниса, которые входят в состав препарата. Получая эти вещества вместе с грудным молоком, малыш чувствует облегчение при спазмах и коликах.
Дисбактериоз у беременных: можно ли лечиться травами?
Беременность может стать серьезным испытанием для организма будущей мамы.
Уже в первые дни после зачатия тело активно меняется, в нем вырабатываются различные гормоны, важные для сохранения и полноценного развития плода. В некоторых случаях этот процесс существенно снижает иммунитет, вследствие чего может развиться дисбактериоз.
Поскольку бактериальная флора мамы — фундамент для формирования микрофлоры малыша, лечение следует начать уже при первых симптомах недомогания.
Лекарственные растения для лечения дисбактериоза у беременных должны назначаться с особой осторожностью: только врачом и только тогда, когда польза для матери превышает потенциальный риск для плода.
Чтобы облегчить проявления метеоризма, спастической боли в животе и нормализовать стул, будущим мамам рекомендуют чаи, настои, отвары из ромашки и мяты перечной. Эти растения обладают стойким противомикробным действием, поддерживают иммунитет и являются эффективным успокаивающим средством.
Для приготовления полезного травяного настоя смешайте 1 ч. л. цветков ромашки с 1 ч. л. листья мяты перечной. Залейте 250 мл кипятка и дайте настояться в течение 15 минут. Беременным женщинам такой настой рекомендуется принимать раз в трое суток.
Здоровье органов пищеварения — гарантия отличного самочувствия и крепкого иммунитета! Поэтому прислушивайтесь к собственному телу и не откладывайте визит к врачу, когда неприятные ощущения в желудке мешают вашему комфорту.
Текущий рейтинг: 4.17 из 5. Количество голосов: 257
ABC-медицина
Колит является воспалением слизистой оболочки толстой кишки. Хроническая разновидность колита представляет собой не только воспалительные, но также строфические и дистрофические изменения толстой кишки, сопровождающиеся секреторными и моторными нарушениями. Данное заболевание является одним из наиболее распространенных в мире. Оно часто сочетается с воспалительными поражениями желудка и тонкой кишки (энтероколит).
Хроническая разновидность колита представляет собой не только воспалительные, но также строфические и дистрофические изменения толстой кишки, сопровождающиеся секреторными и моторными нарушениями. Данное заболевание является одним из наиболее распространенных в мире. Оно часто сочетается с воспалительными поражениями желудка и тонкой кишки (энтероколит).
Причины
Инфекционные. Как правило, они вызываются возбудителями различных кишечных инфекций, чаще всего сальмонеллами и шигеллами. Также провоцируют развитие колита инфекционные заболевания (микобактерии туберкулеза и др.), условно-патогенная и сапрофитная флора кишечника человека, вызванная дисбактериозом.
Алиментарные. Они возникают из-за грубых и длительных нарушений режима питания и диеты. Нередко на фоне ахилических гастритов, панкреатитов и хронических энтеритов развиваются сопутствующие гастриты, их причиной является систематическое раздражение слизистой оболочки толстой кишки из-за неполного переваривания пищи.
Токсические. Они возникают по причине длительных интоксикаций соединениями свинца, ртути, мышьяка, фосфора и др. Токсические колиты эндогенного характера могут возникнуть из-за раздражения стенки кишки теми продуктами, которые она выводит, например при уремии, подагре.
Лекарственные. Их причиной, как правило, является длительный бесконтрольный прием слабительных средств, имеющих в своем составе антрогликоэиды (препараты крушины, корня ревеня, листа сенны, плода жостера и др.). Также негативно влияют антибиотики и некоторые другие лекарства.
Аллергические. Наблюдаются при пищевой аллергии, а также непереносимости ряда химических и лекарственных веществ, высокой индивидуальной чувствительности человека к некоторым разновидностям бактериальной флоры кишечника и продуктам распада микроорганизмов.
Симптомы
Существует ряд основных симптомов, сопровождающих хронический колит кишечника:
- урчание в животе;
- тенезмы – ложные позывы к дефекации, заканчивающиеся выделением лишь слизи;
- ноющая боль в животе, которая возникает после обильной еды;
- запоры, периодически сменяющиеся диареей;
- метеоризм при запорах, сопровождающийся ощущением тяжести, вздутием живота, психоэмоциональным и физическим дискомфортом у пациента;
- диспепсия (тошнота, отрыжка, горечь во рту).

Среди общих симптомов можно выделить нарушение сна, повышенную раздражительность, слабость и потерю веса.
Диагностика
Копрологическое исследование
В кале присутствует большое количество слизи, микроскопическое исследование позволяет выявить эритроциты и лейкоциты. Бактериологическое исследование кала дает возможность обнаружить нарушения в толстой кишке – условно-патогенную микрофлору, изменения нормальной микрофлоры (дисбактериоз).
Рентгенологическое исследование
Рентгенологическое исследование (ирригография) необходимо, чтобы локализовать процесс, зафиксировать изменения рельефа слизистой оболочки, дискинезию, отличить колит от других заболеваний.
Ректороманоскопия и колоноскопия
В ходе данных исследований выявляются катаральные (гиперемированная стенка кишки, отечность, слизистый налет) и атрофические (бледность, истонченность) изменения слизистой оболочки толстой кишки.
Лечение
Диета. Больным хроническим колитом строго показано соблюдение диеты. Во время обострения назначается № 4а, она включает в себя блюда из мяса и рыбы, приготовленные на пару, паровые омлеты, черствый белый хлеб, обезжиренные слабые рыбные и мясные бульоны, каши на воде, кисели, яйца всмятку, желе и отвары из черемухи, черники, айвы, груши, шиповника, чай.
Медикаментозное лечение. Если преобладает диарейный синдром, назначаются вяжущие, адсорбирующие препараты. В случаях, когда хроническому колиту сопутствует дисбактериоз, лечение проводится с помощью антибактериальных препаратов. Устранение усиленного газообразования осуществляется активированным углем.
Чтобы записаться в клинику «ABC-Медицина» для лечения хронического колита, позвоните по телефону +7 (495) 223-38-83.
Что такое дисбактериоз, в чем причины, какие симптомы и как лечить?
В этой статье поговорим о дисбактериозе: что это, какие симптомы и причины, как сдать анализ и чем можно лечить.

Ваше тело — не только ваше. Внутри него и на его поверхностях живут триллионы микроорганизмов — на коже, слизистых оболочках, в половых органах, желудочно-кишечном тракте. Вместе они образуют то, что называется микробиомом. Когда эти микроорганизмы перестают правильно взаимодействовать друг с другом, развивается дисбактериоз.
Термин «дисбиоз» или «дисбактериоз» появился относительно недавно, когда ученые обнаружили, сколько разных микроорганизмов живут в нашем теле. По большей части эти соседи безвредны, а некоторые даже полезны.
Однако микробиом человека крайне чувствителен к изменениям среды. Иногда это приводит к изменению состава микробного сообщества, это вызывает дисбаланс и неприятные симптомы.
Внимание☝ Ни эта, ни другие статьи о здоровье не могут заменить консультацию врача.
Содержание
Дисбактериоз: что это?
Начнем с того, что дисбактериоз — это неблагоприятные изменения в микробных сообществах организма человека. Выделяют два основных типа такого дисбаланса: бактериальный и грибковый. Однако важно понимать, что сам по себе дисбактериоз заболеванием не является. Это довольно распространенная проблема: дисбактериоз встречается у взрослых и детей, даже грудничков. Но исследователи до сих пор не уверены в том, что первично: сам дисбактериоз или заболевания, которые с ним связаны.
Выделяют два основных типа такого дисбаланса: бактериальный и грибковый. Однако важно понимать, что сам по себе дисбактериоз заболеванием не является. Это довольно распространенная проблема: дисбактериоз встречается у взрослых и детей, даже грудничков. Но исследователи до сих пор не уверены в том, что первично: сам дисбактериоз или заболевания, которые с ним связаны.
Микроорганизмы живут в нашем теле повсюду: на коже и на слизистых оболочках внутри. Чаще всего это безвредные бактерии, некоторые грибы, вирусы и археи. В норме все это сообщество находится в гармонии, но изменения в организме хозяина могут вызвать дисбаланс — это и называется дисбактериозом.
Дисбактериоз — обобщенный термин, потому что не существует «идеального» микробиома. Каждый человек уникален, и каждый микробиом тоже. В целом исследователи определяют дисбактериоз по отношению одних микроорганизмов к другим. Вот основные общие признаки:
- чрезмерный рост некоторых бактерий или грибов,
- отсутствие или недостаток полезных бактерий,
- низкое разнообразие отдельных видов микроорганизмов в микробиоте.

Грибковый дисбактериоз рассматривают отдельно. Он возникает, когда безвредные грибы тела человека начинают расти интенсивнее, чем в норме. Такой грибковый рост — частая причина инфекций уха, микоза стоп, молочницы и вагинальных инфекций, многие из которых вызываются грибами рода Candida и Aspergillus.
Интересный факт☝Значение слова «дисбактериоз» («dysbiosis») происходит от древнегреческого: dys (плохой или нездоровый) и biosis (образ жизни).
Дисбактериоз кишечника
Самая известная микробная экосистема — это микробиота кишечника. Она состоит из более триллиона бактерий, грибов и архей которые поддерживают нормальное функционирование органа.
В здоровой и сбалансированной микробиоте содержится достаточное количество полезных бактерий. Они производят важные питательные вещества, которые поддерживают слизистую оболочку кишечника и защищают организм от патогенных микроорганизмов.
Разнообразие — это ключевой показатель для диагностики дисбактериоза кишечного микробиома. В здоровом микробиоме присутствует более 1000 различных видов бактерий. Они контролируют рост и размножение чужеродных бактерий и потенциально патогенных микроорганизмов.
В здоровом микробиоме присутствует более 1000 различных видов бактерий. Они контролируют рост и размножение чужеродных бактерий и потенциально патогенных микроорганизмов.
Дисбактериоз кишечника: причины
Разнообразие микробиоты снижается при дисбактериозе. Источник: Arianna K. DeGruttola, et al.Повлиять на здоровье кишечной микробиоты может много факторов, но главный из них — прием антибиотиков. Даже один курс антибиотиков может вызвать дисбактериоз, который будет длится месяцами. Многократный прием антибиотиков способен навсегда нарушить микробиом кишечника.
На развитие дисбактериоза также влияет диета и образ жизни. Алкоголь, фаст-фуд и сладкие напитки в больших количествах не принесут пользы вашему кишечнику, а вот употребление большого количества фруктов и овощей и регулярные физические упражнения — наоборот, принесут пользу.
Дисбактериоз кишечника часто встречается вместе с другими заболеваниями. Например, ожирение, сердечно-сосудистые заболевания, болезни Крона и язвенный колит. Понять, вызывает ли дисбактериоз болезни или появляется как симптом, непросто.
Понять, вызывает ли дисбактериоз болезни или появляется как симптом, непросто.
Симптомы дисбактериоза
Симптомы дисбактериоза кишечника очень неспецифичны и совпадают со многими распространенными проблемами со здоровьем, например синдромом раздраженного кишечника, воспалительным заболеванием кишечника и целиакией. Исследования показывают, что и сам по себе дисбактериоз является фактором риска развития этих состояний.
Среди распространенных симптомов дисбактериоза кишечника выделяют:
- метеоризм,
- вздутие живота,
- боль в животе,
- понос,
- запор.
Если у вас есть такие симптомы, лучше всего обратиться к врачу.
Диагностика и лечение дисбактериоза
Дисбактериоз — это не диагноз, а скорее характеристика состояния организма. Чтобы проверить, все ли хорошо у вас с балансом бактерий, можно сдать кал для специального теста. Такие тесты анализируют множество особенностей кишечной микробиоты. Они определяют, какие виды бактерий живут в вашем организме и в каком соотношении.
Они определяют, какие виды бактерий живут в вашем организме и в каком соотношении.
Как выявить дисбактериоз кишечника
Основных показателей баланса бактерий кишечника 3:
— разнообразие микроорганизмов
— оценка питательных веществ, которые производят бактерии
— оценка уровня защиты от заболеваний.
Вот как эти показатели работают:
Разнообразие микроорганизмов — это один из основных индикаторов здоровья толстого кишечника. Нарушение баланса микрофлоры ведет к развитию дисбактериоза. Тест микробиоты проверяет сколько и каких пробиотических бактерий у вас есть, например, лактобацилл (Lactobacillus) и бифидобактерий (Bifidobacteria).
Еще при дисбактериозе микробиота кишечника не производит достаточно питательных веществ и витаминов, в особенности короткоцепочечных жирных кислот. Эти вещества помогают поддерживать слизистую оболочку кишечника в норме и бороться с вредными бактериями.
Наконец, состав и соотношение бактерий кишечника помогает оценить, насколько вы защищены от заболеваний. Например, болезни Крона, язвенного колита, ожирения, болезней сердца и сахарного диабета II типа.
Например, болезни Крона, язвенного колита, ожирения, болезней сердца и сахарного диабета II типа.
Как лечить дисбактериоз кишечника
Прежде чем приступать к лечению, не помешает убедиться, что дисбактериоз действительно есть, а неприятные симптомы не вызваны пищевым отравлением или инфекцией. Для этого можно сходить к врачу и сдать анализы.
Проблемой дисбактериоза должен заниматься врач. Обычно методы лечения включают новую диету, пробиотические добавки и рекомендации по образу жизни. Одного универсального лекарства от дисбактериоза нет, какой бы убедительной не была реклама разных препаратов.
Следить за питанием полезно, даже если симптомы дисбактериоза вас не беспокоят. Рацион, богатый клетчаткой, поможет сделать вашу микробиоту разнообразнее и предотвратит вздутие и другие проблемы пищеварения.
Другие виды дисбактериоза
Дисбактериоз может затронуть не только толстую кишку, но и любую другую часть организма — от ротовой полости до мочевыводящих путей.
Дисбактериоз кожи
На коже живут сразу несколько нишевых микробиомов, а их состав зависит от окружающей среды. Например, микроорганизмы, которые обитают на коже лица, не встречаются в области подмышечных впадин, и наоборот. Некоторые исследования показали, что перхоть и себорейный дерматит связаны с грибковым и бактериальным дисбактериозом. Атопический дерматит, более известный как экзема, также связан с дисбактериозом микробиома кожи.
Дисбактериоз ротовой полости
Дисбактериоз полости рта — еще одна распространенная проблема. Он может приводить, например, к гингивиту и пародонтиту. А чрезмерный рост бактерии Porphyromonas gingivalis может приводить к хроническому воспалению и дисбактериозу кишечника. Это происходит, потому что избыток бактерий попадает в пищеварительный тракт со слюной.
Синдром избыточного бактериального роста в тонкой кишке (СИБР)
Кишечник человека состоит из двух частей. В тонкой кишке происходит синтез большей части питательных веществ из пищи. А толстая кишка адсорбирует воду, электролиты и некоторые другие питательные вещества, а также выводит продукты жизнедеятельности организма.
А толстая кишка адсорбирует воду, электролиты и некоторые другие питательные вещества, а также выводит продукты жизнедеятельности организма.
Когда мы говорим о дисбактериозе кишечника, мы имеем в виду именно толстую кишку. Но и тонкая кишка может быть подвержена дисбиозу. Микробиом тонкого кишечника отличается от микробиома толстой кишки. В весовом эквиваленте в нем меньше содержание и разнообразие бактерий.
Самая распространенная форма дисбактериоза тонкого кишечника — синдром избыточного бактериального роста (СИБР). При СИБР рост количества бактерий в тонком кишечнике приводит к избыточной выработке метана или водорода. Эти газы влияют на клетки слизистой оболочки кишечника, вызывая вздутие живота, боли, газообразование, диарею и иногда запор.
Кандидозный дисбактериоз
Кандида — это, как правило, условно-патогенные грибы, рост которых иногда выходит из-под контроля. Если это случается, грибы «захватывают» местный микробиом и провоцируют развитие неприятных симптомов. Грибы Candida могут вызывать молочницу — грибковый дисбактериоз ротовой полости. Его симптомы: болезненность полости рта, кровоточащие белых или желтые пятна, неприятный привкус во рту, сухость и трещины по бокам рта.
Грибы Candida могут вызывать молочницу — грибковый дисбактериоз ротовой полости. Его симптомы: болезненность полости рта, кровоточащие белых или желтые пятна, неприятный привкус во рту, сухость и трещины по бокам рта.
Еще эти грибы вызывают кандидоз влагалища. Он тоже часто называется молочницей. К симптомам дисбактериоза влагалища относятся сухость и жжение, обильные творожистые выделения, зуд. Они возникают, когда состав микробиоты влагалища меняется: чаще всего становится меньше бактерий Lactobacillus. Они поддерживают кислотность среды и защищают от патогенов. Когда эта экосистема нарушена, например, антибиотиками, кандида может вызвать вагинальную инфекцию.
Факт☝️ Тесты микробиоты не способны обнаружить избыточный грибковый рост, дисбактериоз кожи или влагалища, а также паразитарные инфекции. Для этого нужно сдать отдельные анализы.
На заметку
- Мы делим наше тело с триллионами микроорганизмов. На них влияет еда, напитки, лекарства, уровень активности.
 Иногда баланс микробиоты нарушается и развивается дисбактериоз.
Иногда баланс микробиоты нарушается и развивается дисбактериоз. - Дисбактериоз часто развивается в кишечнике. Но на теле есть много других мест, где живут бактерии, так что дисбактериоз может развиваться, например, на коже, во влагалище или в ротовой полости.
- Среди распространенных симптомов дисбактериоза кишечника выделяют метеоризм, вздутие живота, боль в животе, понос, запор.
- Если у вас есть этим симптомы, лучше всего обратиться к врачу и сдать анализ кала. Это поможет проверить, не вызваны ли симптомы инфекцией или отравлением и подобрать схему лечения.
- Обычно лечение дисбактериоза включает новую диету, пищевые добавки и изменения в образе жизни. Это помогает восстановить разнообразие и баланс видов бактерий.
- Следить за балансом микробиоты полезно, чтобы поддерживать иммунитет и нормальное пищеварение. Тест микробиоты Атлас поможет проверить, все ли в порядке с бактериями кишечника, и подобрать полезный рацион.
Внимание☝ Эта статья носит исключительно образовательный и информационный характер и не может быть использована для диагностики или лечения, а также в качестве замены профессиональных рекомендаций.
- Arianna K. DeGruttola, et al., “Current understanding of dysbiosis in disease in human and animal models”, 2016
- L. Clifford McDonald, “Effects of Short- and Long-course Antibiotics on the Lower Intestinal Microbiome as they Relate to Traveler’s Diarrhea”, 2018
- Kirsi Laitinen, Kati Mokkala, “Overall Dietary Quality Relates to Gut Microbiota Diversity and Abundance”, 2019
- Vincenzo Monda, et al., “Exercise Modifies the Gut Microbiota with Positive Health Effects”, 2017
- Lorenza Putignani et al., “Gut Microbiota Dysbiosis as Risk and Premorbid Factors of IBD and IBS Along the Childhood-Adulthood Transition”, 2016
- Anamaria Girbovan et al., “Dysbiosis a risk factor for celiac disease”, 2017
- Renan C Soares et al., “Dysbiotic Bacterial and Fungal Communities Not Restricted to Clinically Affected Skin Sites in Dandruff”, 2016
- Luciana Campos Paulino, “New perspectives on dandruff and seborrheic dermatitis: lessons we learned from bacterial and fungal skin microbiota”, 2017
Микрофлора кишечника Medical On Group Новосибирск
То, что в кишечнике есть микрофлора — знает каждый. Работает она как отдельный орган и состоит из полезных и патогенных микроорганизмов. Они присутствуют в определённом соотношении друг с другом. Но когда количество одних бактерий снижается, а других возрастает, тогда и возникает дисбиоз – нарушение микрофлоры кишечника.
Работает она как отдельный орган и состоит из полезных и патогенных микроорганизмов. Они присутствуют в определённом соотношении друг с другом. Но когда количество одних бактерий снижается, а других возрастает, тогда и возникает дисбиоз – нарушение микрофлоры кишечника.Как это может проявляться?
— Изменение характера стула(запоры или поносы, возможно их чередование).
— Вздутие, урчание в животе, примесь слизи в кале.
— Боли по ходу кишечника.
— Снижение иммунитета. Именно от работы кишечника часто зависит состояние иммунитета всего организма.
— Аллергические реакции.
— Проблемы с кожей.
— Кандидоз слизистых.
— Нарушение веса.
В настоящее время уже известно, что в кишечнике есть определённые виды бактерий, которые способствуют накоплению жировых отложений. Если человек в питании отдаёт предпочтение сладкой пище — это однозначно говорит о том, что есть нарушение флоры в кишечнике. Именно «плохие» бактерии из кишечника информируют наш головной мозг, что нужно съесть «что-нибудь сладенькое».
Что негативно влияет на микрофлору кишечника?
— Стресс;
— Приём лекарственных препаратов, подавляющих жизнедеятельность микрофлоры: антибиотики, гормональные препараты, включая контрацептивы, цитостатики, постоянный приём лекарств, снижающих выработку кислоты в желудке, нестероидные противовоспалительные средства;
— Несбалансированное питание: отсутствие в рационе овощей, зелени, фруктов, пищевых волокон, соблюдение в течение длительного времени монодиет, употребление большого количества простых углеводов;
— Инфекционные заболевания кишечника;
— Алкоголь;
— Курение;
— Резкая смена климата;
— Заболевания желудочно-кишечного тракта (гастрит, панкреатит, нарушение моторики кишечника, застой желчи, хеликобактерная инфекция).
Диагностика
При подозрении на дисбактериоз кишечника врач назначает сдать копрограмму — это анализ кала, который покажет насколько хорошо переваривается пища, есть ли воспаление в кишечнике, имеются ли нарушения в работе желудочно-кишечного тракта.
Если же складывается впечатление о присутствии опасной микрофлоры в кишечнике, тогда назначают посев кала.
В последнее время акцент в диагностике делается на рост именно патогенной флоры, а не на общее изменение микрофлоры в целом. И называется это состояние СИБР-синдром избыточного бактериального роста. Для его диагностики применяют водородный дыхательный тест с лактулозой, а также секвенирование генов 16S и ПЦР-диагностика.
Методы коррекции флоры кишечника:
1. Кишечные антисептики — проявляют высокую антимикробную активность но при этом действуют только в просвете кишки, не проникая в системный кровоток и через естественные тканевые барьеры.
2. Пробиотики — это живые микроорганизмы, которые при поступлении в организм в достаточном количество оказывают положительный эффект на микрофлору кишечника. Обязательно нужно обратить внимание на условия хранения препарата, так как большинство пробиотиков необходимо хранить в холодильнике. Очень важно обратить внимание сколько миллиардов бактерий содержится в одной капсуле, минимальным количеством является 1 млрд. И предпочтение лучше отдать препаратам в кишечно-растворимой капсуле, чтобы при прохождении бактерий через кислую среду желудка, они не были разрушены.
И предпочтение лучше отдать препаратам в кишечно-растворимой капсуле, чтобы при прохождении бактерий через кислую среду желудка, они не были разрушены.
3. Пребиотики — это питательная среда для пробиотиков, содержащая невсасывающиеся вещества, которые стимулируют необходимый рост или активность кишечной флоры. К ним относятся:
— лактулоза, которая угнетает рост патогенной микрофлоры, стимулирует перистальтику кишечника, тем самым оказывая мягкий слабительный эффект и помогает избавиться от токсинов в кишечнике у пациентов с заболеваниями печени.
— инулин — осуществляет питание для колоноцита (каждой клетки кишечника), входит в профилактику развития рака кишечника, повышает усвоение кальция в толстой кишке, что служит профилактикой остеопороза.
— растворимая клетчатка — пектины, семя подорожника, водоросль гуара, хитозан.
Для выполнения своей работы пребиотики нуждаются в дополнительном количестве воды.
4. Синбиотики — препараты, полученные в результате рациональной комбинации пробиотиков и пребиотиков.
При нарушениях флоры кишечника, возникших после длительного приёма антибактериальных препаратов и сопровождающихся развитием клостридиальной инфекции, эффективным методом также является фекальная трансплантация микробиоты.
Дисбаланс кишечника, ВЗК и др.
В вашем кишечнике есть триллионы микроорганизмов, которые составляют микробиом вашего кишечника. Ваш желудочно-кишечный тракт является домом для многих бактерий, грибков и вирусов. Однако это неплохо. Все эти микроорганизмы поддерживают здоровье кишечника. Когда они выходят из равновесия, возникает дисбактериоз.
Как возникает дисбактериоз?
Когда здоровье вашего кишечника нарушается и возникает дисбактериоз, у вас больше шансов заболеть желудком и другими заболеваниями.Эти условия включают:
Ваш кишечник более уязвим для болезней и других состояний здоровья, когда он находится в дисбактериозе. Изменения в микробиоме вашего кишечника, также называемом вашей кишечной флорой, могут произойти из-за того, что различные организмы в вашем кишечнике находятся на неправильном уровне. Другая причина в том, что флора имеет другие функции или их производство изменилось.
Другая причина в том, что флора имеет другие функции или их производство изменилось.
Когда ваш кишечный микробиом теряет разнообразие бактерий, это может увеличить риск развития хронического заболевания.Повышенный риск также может быть связан с вашим возрастом. Когда вы становитесь старше, ваш кишечный микробиом может быть плохо связан с желудочно-кишечным трактом и иммунной системой.
Важность здоровья кишечника
Здоровый кишечник играет важную роль в защите желудочно-кишечного тракта. Чтобы иметь здоровый микробиом, у вас должны быть защитные и вредоносные бактерии. Этот баланс поддерживает правильную работу желудочно-кишечного тракта. Правильное количество бактерий в вашей флоре помогает регулировать бактерии.
Если это не синхронизировано, у вас могут возникнуть проблемы с желудком, которые могут привести к другим заболеваниям.
Типы дисбактериоза
Различают три типа дисбактериоза. В большинстве случаев у вас могут быть все три вида дисбактериоза. Это не редкость. Эти типы дисбактериоза включают:
В большинстве случаев у вас могут быть все три вида дисбактериоза. Это не редкость. Эти типы дисбактериоза включают:
Тип 1. Эта форма дисбактериоза возникает, когда вы теряете полезные бактерии из кишечника.
Тип 2. Когда в желудке слишком много вредных бактерий, возникает этот тип дисбактериоза.
Тип 3. Дисбактериоз также может возникнуть, когда вы теряете общее разнообразие кишечного микробиома.Это означает, что вы теряете как хорошие, так и плохие бактерии в желудке.
Ваш врач сможет помочь вам восстановить здоровье кишечника.
Влияние дисбактериоза на здоровье
Когда ваше тело находится в дисбактериозе, ваше здоровье может ухудшиться. От легких эффектов, таких как судороги, диарея и запор, до более серьезных хронических состояний, микробиом вашего кишечника влияет на то, как вы преодолеваете проблемы. Симптомы дисбиоза включают в себя:
- хроническая усталость
- проблемы с пищеварением
- проблемы с мочеиспусканием
- , проблемы с мочеиспусканием
- кислотный рефлюкс или изжога
- вагинальные или ректальные инфекции или зубы
- непереносимость пищевых продуктов, газ и вздутие живота
- воспаление и болитные суставы
- прыщей , кожная сыпь и псориаз
- СДВГ или проблемы с концентрацией внимания
- Тревога или депрессия
Если эти симптомы наблюдаются более нескольких дней, следует обратиться к врачу. Чем дольше ваш кишечник находится в дисбиозе, тем больше у вас может быть проблем с хроническими заболеваниями. Ваш врач должен посетить вас, если у вас также недавно был СРК, гастроэнтерит или пищевое отравление, и вы испытываете эти проблемы.
Чем дольше ваш кишечник находится в дисбиозе, тем больше у вас может быть проблем с хроническими заболеваниями. Ваш врач должен посетить вас, если у вас также недавно был СРК, гастроэнтерит или пищевое отравление, и вы испытываете эти проблемы.
Заболевания, связанные с дисбактериозом
Дисбактериоз может вызывать ряд хронических заболеваний и состояний. Эти состояния включают, но не ограничиваются:
Если вы считаете, что испытываете какое-либо из этих состояний, вам следует немедленно обратиться к врачу для лечения основного заболевания.Может быть трудно диагностировать дисбактериоз как основную причину некоторых из этих состояний, особенно таких состояний, как аутизм. Ваш врач поможет вам с правильными следующими шагами для вас или вашего ребенка.
Общие сведения о ВЗК и дисбактериозе
ВЗК — это кишечное заболевание, вызывающее воспаление желудочно-кишечного тракта. Это распространенное заболевание, от которого страдают миллионы людей в США. Исследования показали, что дисбактериоз связан с ВЗК. Исследования показывают, что когда ваш кишечный микробиом выходит из равновесия, у вас больше шансов иметь проблемы с желудком.
Исследования показали, что дисбактериоз связан с ВЗК. Исследования показывают, что когда ваш кишечный микробиом выходит из равновесия, у вас больше шансов иметь проблемы с желудком.
Когда ваш кишечный микробиом поражен ВЗК или другими желудочно-кишечными заболеваниями, может быть трудно восстановить правильный баланс в желудочно-кишечном тракте. Вот почему вам понадобится врач, чтобы назначить правильные антибиотики или лечение пробиотиками. Лечение будет зависеть от того, какой тип дисбактериоза у вас есть, и если вы испытываете несколько типов.
Если у вас проблемы с желудком или вы испытываете вышеуказанные симптомы, вам следует обратиться к врачу. Они смогут помочь вам диагностировать основную причину вашего состояния, которое обычно может привести к дисбактериозу.
Что такое дисбактериоз кишечника? Причины, симптомы и лечение от корня
Хронические проблемы с пищеварением, такие как вздутие живота, боль, запор или диарея, могут сигнализировать о множестве разных вещей, но в основе проблемы часто лежит дисбактериоз кишечника. Если вы хотите разобраться в своих проблемах со здоровьем пищеварения, прочтите все, что вам нужно знать о дисбалансе здоровья кишечника и о том, почему это так распространено.
Если вы хотите разобраться в своих проблемах со здоровьем пищеварения, прочтите все, что вам нужно знать о дисбалансе здоровья кишечника и о том, почему это так распространено.
Что такое дисбактериоз кишечника?
«В вашем кишечнике обитает более 100 триллионов бактерий — и это МНОГО», — говорит Сара Стейнберг, доктор медицинских наук, врач Parsley Health в Нью-Йорке.Вместе бактерии и другие микробы в вашем кишечнике составляют микробиом кишечника, и за последние годы мы многое узнали о том, как работает этот микробиом и как он влияет на аспекты нашего здоровья, включая не только наше пищеварение, но и нашу иммунную систему. , воспалительная реакция и даже психическое здоровье. «За последние 10 лет область науки о микробиоме действительно взорвалась», — объясняет доктор Стейнберг.
«Дисбиоз» — это термин, используемый для описания дезадаптации или дисбаланса внутри организма, а «дисбактериоз кишечника» возникает при дисбалансе количества и разнообразия кишечной микрофлоры. Это может по-разному повлиять на ваше здоровье; на самом деле, как написали авторы исследования 2018 года: «Исследования на животных моделях и людях показали, что стойкий дисбаланс микробного сообщества кишечника, называемый дисбиозом, связан с воспалительными заболеваниями кишечника (ВЗК), синдромом раздраженного кишечника (СРК), диабетом , ожирение, рак, сердечно-сосудистые заболевания и расстройства центральной нервной системы».
Это может по-разному повлиять на ваше здоровье; на самом деле, как написали авторы исследования 2018 года: «Исследования на животных моделях и людях показали, что стойкий дисбаланс микробного сообщества кишечника, называемый дисбиозом, связан с воспалительными заболеваниями кишечника (ВЗК), синдромом раздраженного кишечника (СРК), диабетом , ожирение, рак, сердечно-сосудистые заболевания и расстройства центральной нервной системы».
Как видите, здоровье кишечника играет важную роль в нашем долговременном здоровье и способности противостоять болезням.
Что вызывает дисбактериоз кишечника?
Как Др.Стейнберг объясняет: «Каждый день мы узнаем что-то новое о факторах, которые способствуют дисбалансу бактерий в кишечнике». По ее словам, некоторые из основных факторов, провоцирующих дисбактериоз кишечника:
1. Лекарства
К ним относятся антибиотики, препараты, снижающие кислотность, отпускаемые без рецепта обезболивающие, стероиды и оральные противозачаточные таблетки. Все эти лекарства «вызывают незаметное повреждение кишечной флоры, что может привести к дисбактериозу», — объясняет доктор Стейнберг.Метаанализ нескольких препаратов, проведенный в 2020 году в Nature Communications , показал, что 18 часто используемых категорий лекарств сильно влияют на состав микробиома кишечника, причем наибольший эффект оказывают ингибиторы протонной помпы (ИПП), слабительные средства и антибиотики. Каждое лекарство имеет немного отличающийся эффект, вызывая такие вещи, как увеличение популяции определенных вредных бактерий и увеличение производства жирных кислот. Эти типы изменений связаны с несколькими состояниями здоровья.
Все эти лекарства «вызывают незаметное повреждение кишечной флоры, что может привести к дисбактериозу», — объясняет доктор Стейнберг.Метаанализ нескольких препаратов, проведенный в 2020 году в Nature Communications , показал, что 18 часто используемых категорий лекарств сильно влияют на состав микробиома кишечника, причем наибольший эффект оказывают ингибиторы протонной помпы (ИПП), слабительные средства и антибиотики. Каждое лекарство имеет немного отличающийся эффект, вызывая такие вещи, как увеличение популяции определенных вредных бактерий и увеличение производства жирных кислот. Эти типы изменений связаны с несколькими состояниями здоровья.
2. Диета
Согласно д-руСтейнберг, «американская диета, как правило, содержит больше плохих жиров и меньше овощей, что может негативно повлиять на нашу кишечную флору». Почему? Потому что овощи содержат много грубых кормов и клетчатки, которые способствуют росту хороших бактерий. Стандартная американская диета также содержит много углеводов, которые могут позволить плохим бактериям разрастись и вытеснить хорошие. Это может, к сожалению, вызвать у вас тягу к большему количеству сахара, заставить вас есть больше сахара и, возможно, даже развить проблемы с уровнем сахара в крови, такие как преддиабет или диабет.
Стандартная американская диета также содержит много углеводов, которые могут позволить плохим бактериям разрастись и вытеснить хорошие. Это может, к сожалению, вызвать у вас тягу к большему количеству сахара, заставить вас есть больше сахара и, возможно, даже развить проблемы с уровнем сахара в крови, такие как преддиабет или диабет.
3. Стресс
Если вам нужна еще одна причина, по которой стресс является самой токсичной вещью в вашей жизни, мы узнаем все больше и больше о том, как стресс негативно влияет на микробиом кишечника. Исследование на животных, опубликованное в журнале «Мозг, поведение и иммунитет » в 2011 году, показало, что социальные стрессоры приводят к менее разнообразным бактериальным сообществам в кишечнике и увеличению количества потенциально вредных бактерий. Авторы исследования 2018 года также написали, что «все чаще признается, что стресс модулирует структуру и активность сообщества кишечной микробиоты и может быть одним из причинных факторов дисбактериоза.
К сожалению, использование лекарств, диета с большим количеством обработанных пищевых продуктов и стрессовый образ жизни чрезвычайно распространены для большинства людей, а это означает, что многие из нас подвержены более высокому риску развития дисбаланса микробиома кишечника и борьбы с его последствиями. могу иметь.
Симптомы дисбактериоза кишечника
Некоторые из признаков того, что нездоровый уровень стресса, лекарства и неправильное питание повлияли на микробиом кишечника, очевидны; другие, не так много. «Для большинства людей симптомы дисбактериоза очень очевидны и включают в себя такие вещи, как диарея, запор, вздутие живота, отрыжка и боль в животе», — говорит доктор.Стейнберг. Но это не единственные симптомы, на которые стоит обратить внимание. По словам Стейнберга, дисбаланс микробиома также может быть фактором, способствующим возникновению более сложных проблем, таких как тяга к сладкому и тяга к углеводам. Есть также люди с дисбактериозом, у которых вообще не проявляются пищеварительные симптомы. «Вместо этого дисбактериоз может быть основной причиной таких проблем, как сыпь, розацеа и рецидивирующая крапивница», — объясняет она.
Есть также люди с дисбактериозом, у которых вообще не проявляются пищеварительные симптомы. «Вместо этого дисбактериоз может быть основной причиной таких проблем, как сыпь, розацеа и рецидивирующая крапивница», — объясняет она.
Если не лечить дисбиоз, он может способствовать развитию различных заболеваний, включая тревогу и депрессию, волчанку, рассеянный склероз, повышенную кишечную проницаемость и диабет — и это лишь некоторые из них.Так что, хотя дисбактериоз не вызывает паники, это то, с чем вам следует бороться. «Если его не лечить, он может стать основной причиной множества различных заболеваний», — говорит доктор Стейнберг. И многие из этих заболеваний также требуют приема лекарств и вызывают стресс, что усугубляет дисбактериоз. «Это становится вопросом несбалансированной кишечной флоры, распространяющей факторы риска, которые ее вызвали», — продолжает она. Вот почему важно своевременно лечить дисбактериоз кишечника и поддерживать здоровье кишечника.
Лечение дисбактериоза кишечника
Parsley Health придерживается целостного, индивидуального подхода к лечению дисбактериоза.Как правило, это означает создание плана лечения, адаптированного к конкретному пациенту на основе его симптомов и образа жизни. Но, по словам доктора Стейнберга, когда дело доходит до дисбактериоза, многие из этих планов лечения имеют следующие общие черты:
1. Снижение уровня сахара и углеводов
огромный медиатор дисбактериоза», — говорит доктор Штейнберг. Другими словами, количество потребляемого вами сахара оказывает огромное негативное влияние на кишечную флору.Хорошая новость заключается в том, что при смещении кишечной флоры к более здоровому балансу ваша тяга к сахару уменьшится, потому что ваш кишечник начнет отдавать предпочтение более здоровым бактериям, чем нездоровым, питающимся сахаром.
2. Увеличение потребления клетчатки
Клетчатка — еще одна важная часть головоломки о здоровом кишечнике. Это потому, что клетчатка является источником пребиотиков, которые, по сути, являются пищей, которую любят есть здоровые кишечные бактерии. По словам доктора Стейнберга, когда речь идет о потреблении клетчатки, цель состоит в разнообразии.«Мы часто застреваем в колее с точки зрения того, что мы едим. Когда мы приближаемся к исцелению кишечника, мы хотим создать разнообразную экосистему», — говорит она. Она рекомендует есть разнообразные овощи, которые обеспечивают все виды грубых кормов. «Порошок инулина также является отличной пребиотической добавкой, которую можно добавить в свой распорядок дня, чтобы накормить полезные кишечные бактерии», — продолжает она.
Это потому, что клетчатка является источником пребиотиков, которые, по сути, являются пищей, которую любят есть здоровые кишечные бактерии. По словам доктора Стейнберга, когда речь идет о потреблении клетчатки, цель состоит в разнообразии.«Мы часто застреваем в колее с точки зрения того, что мы едим. Когда мы приближаемся к исцелению кишечника, мы хотим создать разнообразную экосистему», — говорит она. Она рекомендует есть разнообразные овощи, которые обеспечивают все виды грубых кормов. «Порошок инулина также является отличной пребиотической добавкой, которую можно добавить в свой распорядок дня, чтобы накормить полезные кишечные бактерии», — продолжает она.
3. Серьезное отношение к снятию стресса
Если вы хотите вылечить дисбактериоз в кишечнике, критически важно взять стресс под контроль.«Я большой сторонник медитации и практикую йогу более 25 лет, — говорит доктор Стейнберг. Тем не менее, любое упражнение на осознанность поможет. «Каждый человек должен найти свою собственную точку доступа», — продолжает она. «Некоторым людям нужно изнурять себя потными занятиями йогой; другие любят делать упражнения на равновесие». Ключ в том, чтобы выйти из своей головы и войти в свое тело. «Все эти упражнения переносят всю активность вашего мозга из лобной доли (часть мозга, которая регулирует принятие решений, суждения и память) в мозжечок (часть мозга, которая регулирует движение мышц)», — говорит Др.Стейнберг.
«Каждый человек должен найти свою собственную точку доступа», — продолжает она. «Некоторым людям нужно изнурять себя потными занятиями йогой; другие любят делать упражнения на равновесие». Ключ в том, чтобы выйти из своей головы и войти в свое тело. «Все эти упражнения переносят всю активность вашего мозга из лобной доли (часть мозга, которая регулирует принятие решений, суждения и память) в мозжечок (часть мозга, которая регулирует движение мышц)», — говорит Др.Стейнберг.
4. Улучшение качества сна
И последнее, но не менее важное: сон является важной частью лечения дисбактериоза кишечника. Сначала это может показаться странным. Какое отношение сон имеет к бактериям в кишечнике? Что ж, исследования показывают, что сон и кишечные бактерии на самом деле неразрывно связаны. Например, авторы исследования 2019 года пришли к выводу, что общее разнообразие микробиома положительно коррелирует с повышением эффективности сна и общего времени сна и отрицательно коррелирует с пробуждением после начала сна. Это означает, что разнообразный микробиом был связан с большим количеством сна, лучшим сном и меньшим количеством пробуждений посреди ночи (ура!). Чтобы улучшить свой сон без лекарств, доктор Стейнберг рекомендует первым делом с утра выходить на солнечный свет и на свежий воздух. «Я твердо верю в то, что солнечный свет может сбросить циркадный ритм», — говорит она.
Это означает, что разнообразный микробиом был связан с большим количеством сна, лучшим сном и меньшим количеством пробуждений посреди ночи (ура!). Чтобы улучшить свой сон без лекарств, доктор Стейнберг рекомендует первым делом с утра выходить на солнечный свет и на свежий воздух. «Я твердо верю в то, что солнечный свет может сбросить циркадный ритм», — говорит она.
В конце концов, здоровый кишечник действительно является секретом отличного общего состояния здоровья. Хорошей новостью является то, что даже если вы в настоящее время имеете дело с дисбактериозом кишечника, внесение нескольких целенаправленных изменений в образ жизни может помочь вам вернуть кишечник и остальную часть тела в нужное русло.
Дисбиоз кишечника новорожденных | Журнал перинатологии
Домингес-Белло М.Г., Годой-Виторино Ф., Найт Р., Блазер М.Дж. Роль микробиома в развитии человека. Кишка. 2019;68:1108–14.
КАС пабмед ПабМед Центральный Google Scholar
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352: 539–44.
КАС пабмед ПабМед Центральный Google Scholar
Айрес Дж.С.Совместное поведение микробной толерантности при мутуализме микробиоты-хозяина. Клетка. 2016; 165:1323–31.
КАС пабмед ПабМед Центральный Google Scholar
Санчес К.К., Чен Г.Ю., Шибер А.П., Редфорд С.Е., Шохирев М.Н., Леблан М. и др. Совместная метаболическая адаптация у хозяина может способствовать бессимптомной инфекции и выбирать ослабленную вирулентность кишечного патогена. Клетка. 2018;175:146–58.e15.
КАС пабмед ПабМед Центральный Google Scholar
Сорбара М.Т., Памер Э.Г.Межбактериальные механизмы колонизационной резистентности и стратегии их преодоления патогенами. Иммунол слизистых оболочек. 2019; 12:1–9.
Иммунол слизистых оболочек. 2019; 12:1–9.
КАС пабмед ПабМед Центральный Google Scholar
Koh A, Bäckhed F. От ассоциации к причинно-следственной связи: роль кишечной микробиоты и ее функциональных продуктов в метаболизме хозяина. Мол Ячейка. 2020; 78: 584–96.
КАС пабмед ПабМед Центральный Google Scholar
Геверс Д., Кугатасан С., Денсон Л.А., Васкес-Баеза Ю., Ван Треурен В., Рен Б. и др.Нелеченный микробиом при впервые возникшей болезни Крона. Клетка. Хост-микроб. 2014;15:382–92.
КАС пабмед ПабМед Центральный Google Scholar
Клингберг Э., Магнуссон М.К., Стрид Х., Демингер А., Шталь А., Сундин Дж. и др. Отличительный состав кишечной микробиоты у пациентов с анкилозирующим спондилитом связан с повышенным уровнем фекального кальпротектина. Артрит Res Ther. 2019;21:248.
Артрит Res Ther. 2019;21:248.
КАС пабмед ПабМед Центральный Google Scholar
Falony G, Joossens M, Vieira-Silva S, Wang J, Darzi Y, Faust K, et al.Анализ вариаций микробиома кишечника на популяционном уровне. Наука. 2016; 352:560–4.
КАС пабмед ПабМед Центральный Google Scholar
Яцуненко Т.Р.Ф., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М., Магрис М. и др. Микробиом кишечника человека в зависимости от возраста и географии. Природа 2012; 486: 222–7.
КАС пабмед ПабМед Центральный Google Scholar
Биттингер К., Чжао С., Ли И., Форд Э., Фридман Э.С., Ни Дж. и др.Бактериальная колонизация перепрограммирует метаболом кишечника новорожденного. Нат микробиол. 2020;5:838–47.
КАС пабмед ПабМед Центральный Google Scholar
Вангай П., Уорд Т., Гербер Дж. С., Найтс Д. Антибиотики, детский дисбиоз и болезни. Клетка. Хост-микроб. 2015; 17: 553–64.
КАС пабмед ПабМед Центральный Google Scholar
Дешмукх Х.С., Лю Ю., Менкити О.Р., Мэй Дж., Дай Н., О’Лири К.Э. и др.Микробиота регулирует гомеостаз нейтрофилов и устойчивость хозяина к сепсису Escherichia coli K1 у новорожденных мышей. Нат Мед. 2014;20:524–30.
КАС пабмед ПабМед Центральный Google Scholar
Рукс М.Г., Гаррет В.С. Кишка. микробиота, метаболиты и иммунитет хозяина. Нат Рев Иммунол. 2016;16:341–52.
КАС пабмед ПабМед Центральный Google Scholar
Olszak T, An D, Zeissig S, Vera MP, Richter J, Franke A, et al.Воздействие микробов в раннем возрасте оказывает стойкое влияние на функцию Т-клеток естественных киллеров. Наука. 2012; 336: 489–93.
Наука. 2012; 336: 489–93.
КАС пабмед ПабМед Центральный Google Scholar
Кокс Л.М., Яманиши С., Сон Дж., Алексеенко А.В., Леунг Дж.М., Чо И. и др. Изменение кишечной микробиоты во время критического окна развития имеет длительные метаболические последствия. Клетка. 2014; 158:705–21.
КАС пабмед ПабМед Центральный Google Scholar
Кимура И., Миямото Дж., Оуэ-Китано Р., Ватанабэ К., Ямада Т., Онуки М. и др.Микробиота кишечника матери во время беременности влияет на метаболический фенотип потомства у мышей. Наука. 2020;367:eaaw8429.
КАС пабмед ПабМед Центральный Google Scholar
Гордон Х.А., Пести Л. Гнотобиотическое животное как инструмент в изучении взаимоотношений микробов-хозяев. бактериол. 1971; 35: 390–429.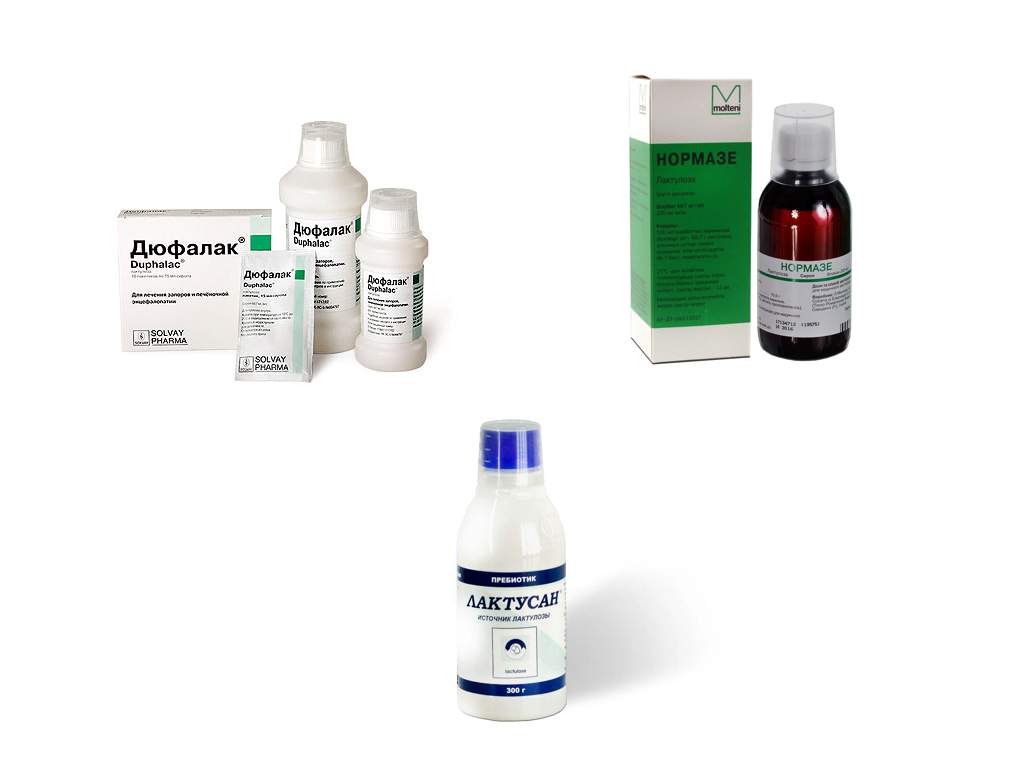
КАС пабмед ПабМед Центральный Google Scholar
Лучински П., Маквей Нойфельд К.А., Ориах К.С., Кларк Г., Динан Т.Г., Крайан Дж.Ф.Выращивание в пузыре: использование стерильных животных для оценки влияния кишечной микробиоты на мозг и поведение. Int J Neuropsychopharmacol. 2016;19:pyw020.
ПабМед ПабМед Центральный Google Scholar
Уилкс М. Бактерии и раннее развитие человека. Ранний Хам Дев. 2007; 83: 165–70.
ПабМед ПабМед Центральный Google Scholar
Gehrig JL, Venkatesh S, Chang HW, Hibberd MC, Kung VL, Cheng J, et al.Влияние пищевых продуктов, направленных на микробиоту, у гнотобиотических животных и недоедающих детей. Наука. 2019;365:eaau4732.
ПабМед ПабМед Центральный Google Scholar
Тернбо П.Дж., Лей Р.Е., Маховальд М.А., Магрини В., Мардис Э.Р., Гордон Д.И. Связанный с ожирением кишечный микробиом с повышенной способностью собирать энергию. Природа. 2006; 444:1027–31.
ПабМед ПабМед Центральный Google Scholar
Safari Z, Джерард П.Связь между кишечным микробиомом и неалкогольной жировой болезнью печени (НАЖБП). Клетка. Мол жизни Sci. 2019;76:1541–58.
КАС пабмед ПабМед Центральный Google Scholar
Jiang C, Li G, Huang P, Liu Z, Zhao B. Микробиота кишечника и болезнь Альцгеймера. Дж. Альцгеймера Дис. 2017; 58:1–15.
ПабМед ПабМед Центральный Google Scholar
Lee YP, Chiu CC, Lin TJ, Hung SW, Huang WC, Chiu CF, et al.Моноколонизация безмикробных мышей Bacteroides fragilis улучшает колоректальный рак, вызванный азоксиметаном/декстрансульфатом натрия. Иммунофармакол Иммунотоксикол. 2019;41:207–13.
Иммунофармакол Иммунотоксикол. 2019;41:207–13.
КАС пабмед ПабМед Центральный Google Scholar
Tissier H. Recherches sur la Flore кишечная де Nourrissons. C R Mem Soc Biol. 1899;51:943.
Google Scholar
Логан WR.Кишечная флора младенцев и детей раннего возраста. Джей Патол. 1913; 18: 527–51.
Google Scholar
Гарридо Д., Бариле Д., Миллс Д.А. Молекулярная основа обогащения бифидобактериями желудочно-кишечного тракта младенцев. Ад Нутр. 2012;3:415С–21С.
КАС пабмед ПабМед Центральный Google Scholar
Ruiz-Moyano S, Totten SM, Garrido DA, Smilowitz JT, German JB, Lebrilla CB и др.Различия в потреблении олигосахаридов грудного молока штаммами Bifidobacterium breve, связанными с кишечником младенцев. Appl Environ Microbiol. 2013;79:6040–9.
Appl Environ Microbiol. 2013;79:6040–9.
КАС пабмед ПабМед Центральный Google Scholar
Живкович А.М., Герман Д.Б., Лебрилла К.Б., Миллс Д.А. Гликобиом грудного молока и его влияние на микробиоту желудочно-кишечного тракта младенцев. Proc Natl Acad Sci USA. 2011; 108 (Приложение 1): 4653–8.
КАС Google Scholar
Хенрик Б.М., Хаттон А.А., Палумбо М.С., Касабури Г., Митчелл Р.Д., Андервуд М.А. и др.Повышенный рН кала указывает на глубокие изменения в микробиоме кишечника младенцев, находящихся на грудном вскармливании, из-за сокращения бифидобактерий за последнее столетие. мсфера. 2018;3:e00041–18.
ПабМед ПабМед Центральный Google Scholar
Литвак Ю., Биндлосс М.Х., Цолис Р.М., Баумлер А.Дж. Экспансия дисбиотических протеобактерий: микробный признак эпителиальной дисфункции. Curr Opin Microbiol. 2017; 39:1–6.
Curr Opin Microbiol. 2017; 39:1–6.
КАС Google Scholar
Милани С., Дюранти С., Боттачини Ф., Кейси Э., Туррони Ф., Махони Дж. и др.Первые микробные колонизаторы кишечника человека: состав, активность и последствия для здоровья кишечной микробиоты младенцев. Microbiol Mol Biol Rev. 2017;81:e00036–17.
ПабМед ПабМед Центральный Google Scholar
La Rosa PS, Warner BB, Zhou Y, Weinstock GM, Sodergren E, Hall-Moore CM, et al. Паттерн прогрессирования бактериальных популяций в кишечнике недоношенных детей. Proc Natl Acad Sci USA. 2014; 111:12522–7.
Google Scholar
Korpela K, Blakstad EW, Moltu SJ, Strommen K, Nakstad B, Ronnestad AE, et al.Развитие кишечной микробиоты и гестационный возраст у недоношенных новорожденных. Научный доклад 2018; 8: 2453.
ПабМед ПабМед Центральный Google Scholar
Ватанен Т., Плихта Д.Р., Сомани Дж., Мунк П.С., Артур Т.Д., Холл А.Б. и др. Геномная изменчивость и специфичная для штамма функциональная адаптация в микробиоме кишечника человека в раннем возрасте. Нат микробиол. 2019;4:470–9.
КАС Google Scholar
Раман А.С., Гериг Дж.Л., Венкатеш С., Чанг Х.В., Хибберд М.С., Субраманиан С. и др.Разреженная ковариантная единица, описывающая здоровое и нарушенное развитие кишечной микробиоты человека. Наука. 2019;365:eaau4735.
ПабМед ПабМед Центральный Google Scholar
Younge NE, Newgard CB, Cotten CM, Goldberg RN, Muehlbauer MJ, Bain JR, et al. Нарушение созревания микробиоты и метаболома у глубоконедоношенных детей с постнатальной задержкой роста. Научный доклад 2019; 9:8167.
Научный доклад 2019; 9:8167.
ПабМед ПабМед Центральный Google Scholar
Liu J, Li Y, Feng Y, Pan L, Xie Z, Yan Z и др.Паттерн прогрессирования кишечной микробиоты, связанный с некротизирующим энтероколитом и поздним сепсисом у недоношенных детей: проспективное исследование в отделении интенсивной терапии новорожденных в Китае. Пир Дж. 2019;7:e7310.
ПабМед ПабМед Центральный Google Scholar
Галаццо Г., ван Бест Н., Бервоетс Л., Дапаах И.О., Савелкул П.Х., Хорнеф М.В. и др. Развитие микробиоты и связь со способом рождения, диетой и атопическими расстройствами в продольном анализе образцов стула, собранных с младенчества до раннего детства.Гастроэнтерология. 2020; 158: 1584–96.
КАС Google Scholar
Madan JC, Hoen AG, Lundgren SN, Farzan SF, Cottingham KL, Morrison HG, et al./imgs/2016/12/05/01/812450/9ea11b30d56f8defbf30e17b53d06df8a75e93fb.jpg) Связь кесарева сечения и докорма молочной смесью с кишечным микробиомом 6-недельных детей. JAMA Педиатр. 2016;170:212–9.
Связь кесарева сечения и докорма молочной смесью с кишечным микробиомом 6-недельных детей. JAMA Педиатр. 2016;170:212–9.
ПабМед ПабМед Центральный Google Scholar
Stewart CJ, Ajami NJ, O’Brien JL, Hutchinson DS, Smith DP, Wong MC, et al.Временное развитие микробиома кишечника в раннем детстве по данным исследования TEDDY. Природа. 2018; 562: 583–8.
КАС пабмед ПабМед Центральный Google Scholar
Комбеллик Дж.Л., Шин Х., Шин Д., Кай Ю., Хаган Х., Лачер С. и др. Различия фекальной микробиоты новорожденных, родившихся дома и в роддоме. Научный доклад 2018; 8: 15660.
ПабМед ПабМед Центральный Google Scholar
Savage JH, Lee-Sarwar KA, Sordillo JE, Lange NE, Zhou Y, O’Connor GT, et al.Диета во время беременности и грудного возраста и кишечный микробиом младенцев. J Педиатр. 2018;203:47–54.e4.
J Педиатр. 2018;203:47–54.e4.
ПабМед ПабМед Центральный Google Scholar
Лундгрен С.Н., Мадан Дж.К., Эмонд Дж.А., Моррисон Х.Г., Кристенсен Б.С., Карагас М.Р. и др. Питание матери во время беременности связано с микробиомом стула младенца в зависимости от способа родоразрешения. Микробиом. 2018;6:109.
ПабМед ПабМед Центральный Google Scholar
Williams JE, Carrothers JM, Lackey KA, Beatty NF, Brooker SL, Peterson HK, et al.Между молочным, оральным и фекальным микробиомами в диадах мать-младенец в течение первых шести месяцев после родов существуют сильные многомерные отношения. Дж Нутр. 2019; 149: 902–14.
ПабМед ПабМед Центральный Google Scholar
Азад М.Б., Конья Т., Персо Р.Р., Гуттман Д.С., Чари Р.С., Филд С.Дж. и др. Влияние материнских интранатальных антибиотиков, способа родов и грудного вскармливания на микробиоту кишечника в течение первого года жизни: проспективное когортное исследование.Int J Obstet Gynaecol. 2016; 123:983–93.
и др. Влияние материнских интранатальных антибиотиков, способа родов и грудного вскармливания на микробиоту кишечника в течение первого года жизни: проспективное когортное исследование.Int J Obstet Gynaecol. 2016; 123:983–93.
КАС Google Scholar
Coker MO, Hoen AG, Dade E, Lundgren S, Li Z, Wong AD, et al. Конкретный класс интранатальных антибиотиков связан с созреванием микробиоты кишечника младенцев: проспективное когортное исследование. Int J Obstet Gynaecol. 2020; 127: 217–27.
КАС Google Scholar
Eck A, Rutten N, Singendonk MMJ, Rijkers GT, Savelkoul PHM, Meijssen CB и др.Развитие микробиоты новорожденных и действие антибиотиков в раннем возрасте определяются двумя различными типами поселенцев. ПЛОС ОДИН. 2020;15:e0228133.
КАС пабмед ПабМед Центральный Google Scholar
Гупта Р.В., Л. Тран, Дж. Норори, М.Дж. Феррис, А.М. Эрен, С.М. Тейлор и др. Блокаторы рецепторов гистамина-2 изменяют фекальную микробиоту у недоношенных детей. J Pediatr Gastroenterol Nutr. 2013; 56: 397–400.
КАС Google Scholar
Леви Э.И., Хоанг Д.М., Ванденплас Ю.Влияние ингибиторов протонной помпы на микробиом у детей раннего возраста. Акта Педиатр. 2020;109:1531–8.
КАС Google Scholar
Vich Vila A, Collij V, Sanna S, Sinha T, Imhann F, Bourgonje AR, et al. Влияние часто используемых лекарств на состав и метаболическую функцию кишечной микробиоты. Нац коммун. 2020;11:362.
КАС пабмед ПабМед Центральный Google Scholar
Джексон М.А., Верди С., Максан М.Е., Шин С.М., Цирер Дж., Бойер Р.С.Э. и др.Связь кишечной микробиоты с распространенными заболеваниями и отпускаемыми по рецепту лекарствами в популяционной когорте. Нац коммун. 2018;9:2655.
Нац коммун. 2018;9:2655.
ПабМед ПабМед Центральный Google Scholar
Iszatt N, Janssen S, Lenters V, Dahl C, Stigum H, Knight R, et al. Экологические токсиканты в грудном молоке норвежских матерей и состав и метаболиты кишечных бактерий у их младенцев в возрасте 1 месяца. Микробиом 2019; 7:34.
ПабМед ПабМед Центральный Google Scholar
Лауэ Х.Е., Мороиши Ю., Джексон Б.П., Палыс Т.Дж., Мадан Д.К., Карагас М.Р.Смеси питательных веществ и токсичных элементов и микробиом кишечника в раннем послеродовом периоде в продольной когорте новорожденных в США. Окружающая среда Интерн. 2020;138:105613.
КАС Google Scholar
McLean C, Jun S, Kozyrskyj A. Влияние курения матери на микробиоту кишечника младенца и его связь с избыточным весом ребенка: предварительный обзор. Мир J Педиатр. 2019;15:341–9.
Мир J Педиатр. 2019;15:341–9.
Google Scholar
Tun HM, Konya T, Takaro TK, Brook JR, Chari R, Field CJ, et al.Воздействие домашних пушистых питомцев влияет на микробиоту кишечника младенцев в возрасте 3-4 месяцев при различных сценариях родов. Микробиом. 2017;5:40.
ПабМед ПабМед Центральный Google Scholar
Д’Агата А.Л., Ву Дж., Веландаве М.К.В., Дутра С.В.О., Кейн Б., Гроер М.В. Влияние стресса в отделении интенсивной терапии в раннем возрасте на развивающийся микробиом кишечника. Дев Психобиолог. 2019;61:650–60.
ПабМед ПабМед Центральный Google Scholar
Хо ТТБ, Гроер М.В., Кейн Б., Йи А.Л., Торрес Б.А., Гилберт Дж.А. и др.Дихотомическое развитие микробиома кишечника у недоношенных детей. Микробиом. 2018;6:157.
ПабМед ПабМед Центральный Google Scholar
Парра-Льорка А., Гормаз М., Алькантара С., Сернада М., Нуньес-Рамиро А., Венто М. и др. Микробиом кишечника недоношенных в зависимости от типа вскармливания: значение донорского грудного молока. Фронт микробиол. 2018;9:1376.
ПабМед ПабМед Центральный Google Scholar
Тафт Д.Х., Салинеро Л.К., Вонгбхавит К., Каланетра К.М., Масарве С., Ю.А. и др.Бактериальная колонизация и гены устойчивости к противомикробным препаратам в зондах для энтерального питания новорожденных. FEMS Microbiol Ecol. 2019;95:физ039.
КАС пабмед ПабМед Центральный Google Scholar
Ногацка А., Салазар Н., Суарес М., Милани С., Арболея С., Солис Г. и др. Влияние интранатальной антимикробной профилактики на кишечную микробиоту и распространенность генов устойчивости к антибиотикам у доношенных новорожденных, родившихся естественным путем. Микробиом. 2017;5:93.
Микробиом. 2017;5:93.
ПабМед ПабМед Центральный Google Scholar
Гаспаррини А.Дж., Крофтс Т.С., Гибсон М.К., Тарр П.И., Уорнер Б.Б., Дантас Г. Нарушение антибиотиками кишечного микробиома и резистома недоношенных детей. Кишечные микробы. 2016;7:443–9.
КАС пабмед ПабМед Центральный Google Scholar
Гибсон М.К., Ван Б., Ахмади С., Бернхэм К.А., Тарр П.И., Уорнер Б.Б. и др.Динамика развития микробиоты кишечника недоношенных детей и антибиотикорезистом. Нат микробиол. 2016;1:16024.
КАС пабмед ПабМед Центральный Google Scholar
Rutayisire E, Huang K, Liu Y, Tao F. Способ родоразрешения влияет на разнообразие и характер колонизации микробиоты кишечника в течение первого года жизни младенцев: систематический обзор. БМК Гастроэнтерол. 2016;16:86.
БМК Гастроэнтерол. 2016;16:86.
ПабМед ПабМед Центральный Google Scholar
Dahl C, Stigum H, Valeur J, Iszatt N, Lenters V, Peddada S, et al.Недоношенные дети имеют различные микробиомы, которые не объясняются способом родоразрешения, продолжительностью грудного вскармливания или воздействием антибиотиков. Int J Эпидемиол. 2018;47:1658–69.
ПабМед ПабМед Центральный Google Scholar
Тун М.Х., Тун Х.М., Махони Дж.Дж., Конья Т.Б., Гуттман Д.С., Беккер А.Б. и другие. Постнатальное воздействие бытовых дезинфицирующих средств, микробиота кишечника младенцев и последующий риск избыточного веса у детей. Can Med Assoc J. 2018;190:E1097–e107.
Google Scholar
Шоу К.А., Берта М., Хофмеклер Т., Чопра П., Ватанен Т., Сриватса А. и др. Дисбактериоз, воспаление и ответ на лечение: лонгитюдное исследование педиатрических субъектов с недавно диагностированным воспалительным заболеванием кишечника. Геном Мед. 2016;8:75.
Геном Мед. 2016;8:75.
ПабМед ПабМед Центральный Google Scholar
Xia GH, You C, Gao XX, Zeng XL, Zhu JJ, Xu KY и др.Индекс дисбиоза инсульта (SDI) в микробиоме кишечника связан с повреждением головного мозга и прогнозом инсульта. Фронт Нейрол. 2019;10:397.
ПабМед ПабМед Центральный Google Scholar
Guo Y, Zhang Y, Gerhard M, Gao JJ, Mejias-Luque R, Zhang L, et al. Влияние Helicobacter pylori на микробиоту желудочно-кишечного тракта: популяционное исследование в Линцю, районе высокого риска рака желудка. Кишка. 2019. https://doi.org/10.1136/gutjnl-2019-319696.
Casen C, Vebo HC, Sekelja M, Hegge FT, Karlsson MK, Ciemniejewska E, et al. Отклонения в микробиоте кишечника человека: новый диагностический тест для определения дисбактериоза у пациентов с СРК или ВЗК. Пищевая фармакотерапия. 2015;42:71–83.
Пищевая фармакотерапия. 2015;42:71–83.
КАС Google Scholar
Mandl T, Marsal J, Olsson P, Ohlsson B, Andreasson K. Тяжелый дисбактериоз кишечника преобладает при первичном синдроме Шегрена и связан с активностью системного заболевания.Артрит Res Ther. 2017;19:237.
ПабМед ПабМед Центральный Google Scholar
Ватанен Т., Костич А.Д., д’Эннезель Э., Силжандер Х., Францоза Э.А., Яссур М. и др. Изменение иммуногенности ЛПС микробиома способствует аутоиммунитету у людей. Клетка. 2016; 165:842–53.
КАС пабмед ПабМед Центральный Google Scholar
Ватанен Т., Францоса Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др.Микробиом кишечника человека при диабете 1 типа с ранним началом из исследования TEDDY. Природа. 2018; 562: 589–94.
КАС пабмед ПабМед Центральный Google Scholar
Chua HH, Chou HC, Tung YL, Chiang BL, Liao CC, Liu HH и др. Дисбиоз кишечника с обилием ruminococcus gnavus ассоциирован с аллергическими заболеваниями у детей раннего возраста. Гастроэнтерология. 2018; 154:154–67.
ПабМед ПабМед Центральный Google Scholar
Lee MJ, Kang MJ, Lee SY, Lee E, Kim K, Won S и др.Нарушения генов кишечного микробиома у детей раннего возраста с атопическим дерматитом в зависимости от типа вскармливания. J Аллергия Клин Иммунол. 2018; 141:1310–9.
КАС пабмед ПабМед Центральный Google Scholar
Lamont RF, Moller Luef B, Stener Jorgensen J. Детские воспалительные и метаболические заболевания после воздействия антибиотиков во время беременности, антенатально, интранатально и неонатально. F1000рез. 2020;9:144.
F1000рез. 2020;9:144.
Google Scholar
Дохауэр Карпа К., Пол И.М., Леки Дж.А., Шунг С., Каркачи-Салли Н., Врана К.Е. и др.Ретроспективный обзор карт для выявления перинатальных факторов, связанных с пищевой аллергией. Нутр Дж. 2012;11:87.
ПабМед ПабМед Центральный Google Scholar
Мец Т.Д., МакКинни Дж., Оллсхаус А.А., Книрим С.Д., Кэри Д.К., Хейборн К.Д. Воздействие стрептококковой антибиотикопрофилактики группы B и индекс массы тела в раннем детстве в когорте вагинальных рождений. J Matern Fetal Neonatal Med. 2020;33:3318–3323.
ПабМед ПабМед Центральный Google Scholar
Воль Д.Л., Карри В.Дж., Могер Д., Миллер Дж., Тайри К.Интранатальные антибиотики и детский атопический дерматит. J Am Board Fam Med. 2015;28:82–9.
ПабМед ПабМед Центральный Google Scholar
Памми М., Коуп Дж., Тарр П.И., Уорнер Б.Б., Морроу А.Л., Май В. и др. Дисбактериоз кишечника у недоношенных детей, предшествующий некротизирующему энтероколиту: систематический обзор и метаанализ. Микробиом. 2017;5:31.
ПабМед ПабМед Центральный Google Scholar
Olm MR, Bhattacharya N, Crits-Christoph A, Firek BA, Baker R, Song YS, et al.Некротизирующему энтероколиту предшествует повышенная репликация кишечных бактерий, клебсиеллы и бактерии, кодирующие фимбрии. Научная реклама 2019;5:eaax5727.
КАС пабмед ПабМед Центральный Google Scholar
Esmaeilizand R, Shah PS, Seshia M, Yee W, Yoon EW, Dow K. Воздействие антибиотиков и развитие некротизирующего энтероколита у очень недоношенных новорожденных. Педиатр Здоровье ребенка. 2018;23:e56–e61.
ПабМед ПабМед Центральный Google Scholar
Эсайассен Э., Фьялстад Дж.В., Ювет Л.К., ван ден Анкер Дж.Н., Клингенберг К.Воздействие антибиотиков на новорожденных и ранние неблагоприятные исходы: систематический обзор и метаанализ. J Антимикроб. Чемотер. 2017; 72: 1858–70.
КАС пабмед ПабМед Центральный Google Scholar
Guillet R, Stoll BJ, Cotten CM, Gantz M, McDonald S, Poole WK, et al. Ассоциация терапии блокаторами Н3 и более высокой частотой некротизирующего энтероколита у новорожденных с очень низкой массой тела при рождении. Педиатрия. 2006; 117:e137–42.
ПабМед Google Scholar
Хьюитт К.М., Маннино, Флорида, Гонсалес А., Чейз Дж.Х., Капорасо Дж.Г., Найт Р. и др.Бактериальное разнообразие в двух отделениях интенсивной терапии новорожденных (ОИТН). ПЛОС ОДИН. 2013;8:e54703.
КАС пабмед ПабМед Центральный Google Scholar
Бокулич Н.А., Миллс Д.А., Андервуд М.А. Поверхностные микробы в отделении интенсивной терапии новорожденных: изменения при обычной уборке и с течением времени. Дж. Клин Микробиол. 2013;51:2617–24.
ПабМед ПабМед Центральный Google Scholar
Брукс Б., Олм М.Р., Фирек Б.А., Бейкер Р., Геллер-МакГрат Д., Реймер С.Р. и др.Развивающийся кишечный микробиом недоношенных детей является основным фактором, формирующим микробиом отделений интенсивной терапии новорожденных. Микробиом. 2018;6:112.
ПабМед ПабМед Центральный Google Scholar
Stewart CJ, Embleton ND, Marrs ECL, Smith DP, Fofanova T, Nelson A, et al. Продольное развитие кишечного микробиома и метаболома у недоношенных новорожденных с поздним началом сепсиса и здоровых контролей. Микробиом. 2017;5:75.
ПабМед ПабМед Центральный Google Scholar
Singer JR, Blosser EG, Zindl CL, Silberger DJ, Conlan S, Laufer VA, et al. Профилактика дисбиоза кишечного микробиома новорожденных мышей защищает от позднего сепсиса. Нат Мед. 2019;25:1772–82.
КАС пабмед ПабМед Центральный Google Scholar
Маси А.С., Стюарт С.Дж. Роль кишечного микробиома недоношенных при сепсисе и некротическом энтероколите.Ранний Хам Дев. 2019;138:104854.
ПабМед ПабМед Центральный Google Scholar
Hemmi MH, Wolke D, Schneider S. Связь между проблемами плача, сна и/или кормления в младенчестве и долгосрочными поведенческими результатами в детстве: метаанализ. Арч Дис Чайлд. 2011;96:622–9.
ПабМед ПабМед Центральный Google Scholar
Loughman A, Quinn T, Nation ML, Reichelt A, Moore RJ, Van TTH и др.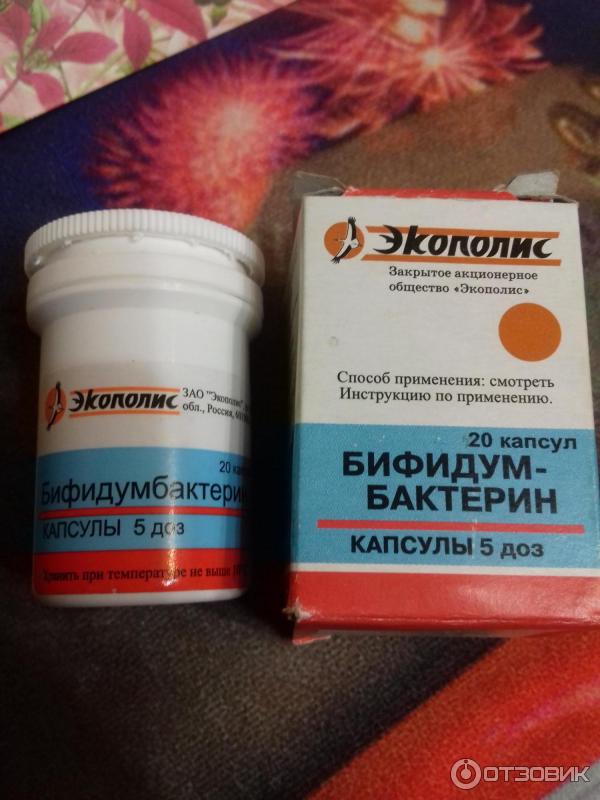 Младенческая микробиота при коликах: прогностические ассоциации с проблемным плачем и последующим поведением ребенка. J Dev Orig Health Dis. 2020: 1–11. https://doi.org/10.1017/S2040174420000227.
Младенческая микробиота при коликах: прогностические ассоциации с проблемным плачем и последующим поведением ребенка. J Dev Orig Health Dis. 2020: 1–11. https://doi.org/10.1017/S2040174420000227.
Хаттенхауэр С., Костич А.Д., Ксавье Р.Дж. Воспалительные заболевания кишечника как модель трансляции микробиома. Иммунитет. 2014;40:843–54.
КАС пабмед ПабМед Центральный Google Scholar
Майер Э.А., Тиллиш К., Гупта А.Ось кишечник/мозг и микробиота. Дж. Клин Инвестиг. 2015; 125:926–38.
ПабМед ПабМед Центральный Google Scholar
Honda K, Littman DR. Микробиота в адаптивном иммунном гомеостазе и заболеваниях. Природа. 2016; 535:75–84.
КАС пабмед ПабМед Центральный Google Scholar
Шредер Б. О., Бекхед Ф. Сигналы микробиоты кишечника к отдаленным органам в физиологии и заболеваниях.Нат Мед. 2016;22:1079–89.
О., Бекхед Ф. Сигналы микробиоты кишечника к отдаленным органам в физиологии и заболеваниях.Нат Мед. 2016;22:1079–89.
КАС пабмед ПабМед Центральный Google Scholar
Леви М., Колодзейчик А.А., Таисс К.А., Элинав Э. Дисбактериоз и иммунная система. Нат Рев Иммунол. 2017;17:219–32.
КАС пабмед ПабМед Центральный Google Scholar
Марувада П., Леоне В., Каплан Л.М., Чанг Э.Б. Микробиом человека и ожирение: выход за рамки ассоциаций.Клетка. Хост-микроб. 2017;22:589–99.
КАС пабмед ПабМед Центральный Google Scholar
Бах И.Ф. Гигиеническая гипотеза в аутоиммунитете: роль патогенов и комменсалов. Нат Рев Иммунол. 2018;18:105–20.
КАС пабмед ПабМед Центральный Google Scholar
Браун Дж.М., Хазен С.Л. Микробная модуляция сердечно-сосудистых заболеваний. Нат преп.2018;16:171–81.
КАС Google Scholar
Tilg H, Zmora N, Adolph TE, Elinav E. Кишечная микробиота, подпитывающая метаболическое воспаление. Нат Рев Иммунол. 2020;20:40–54.
КАС пабмед ПабМед Центральный Google Scholar
Якоб С., Якоб Д.Г. Инфекционные угрозы, кишечный барьер и его троянский конь: дисбактериоз. Фронт микробиол. 2019;10:1676.
ПабМед ПабМед Центральный Google Scholar
Fouhse JM, Yang K, More-Bayona J, Gao Y, Goruk S, Plastow G, et al. Неонатальное воздействие амоксициллина изменяет долговременный иммунный ответ, несмотря на временное воздействие на микробиоту кишечника у поросят. Фронт Иммунол. 2019;10:2059.
КАС пабмед ПабМед Центральный Google Scholar
Бомонт М., Паес С., Муссар Э., Кнудсен С., Кокил Л., Аймар П. и др.Метаболиты кишечной микробиоты способствуют созреванию кишечного барьера при переходе от грудного вскармливания к отъему. Кишечные микробы. 2020; 11: 1268–86.
ПабМед ПабМед Центральный Google Scholar
Suh SH, Choe K, Hong SP, Jeong SH, Mäkinen T, Kim KS, et al. Микробиота кишечника регулирует целостность молочной железы, индуцируя VEGF-C в макрофагах кишечных ворсинок. EMBO Rep. 2019; 20:e46927.
ПабМед ПабМед Центральный Google Scholar
Кулкарни Д.Х., Макдональд К.Г., Кнуп К.А., Густафссон Дж.К., Козловски К.М., Хунстад Д.А. и др.Пассажи антигена, связанные с бокаловидными клетками, ингибируются во время инфекции Salmonella typhimurium, чтобы предотвратить распространение патогена и ограничить реакцию на пищевые антигены. Иммунол слизистых оболочек. 2018;11:1103–13.
2018;11:1103–13.
КАС пабмед ПабМед Центральный Google Scholar
Abo H, Chassaing B, Harusato A, Quiros M, Brazil JC, Ngo VL, et al. Регулятор дифференцировки эритроидов-1, индуцируемый микробиотой в раннем возрасте, стимулирует пролиферацию и регенерацию стволовых клеток кишечника.Нац коммун. 2020;11:513.
КАС пабмед ПабМед Центральный Google Scholar
Fung TC, Vuong HE, Luna CDG, Pronovost GN, Александрова AA, Riley NG, et al. Воздействие серотонина и флуоксетина на кишечник модулирует бактериальную колонизацию в кишечнике. Нат микробиол. 2019;4:2064–73.
ПабМед ПабМед Центральный Google Scholar
Canfora EE, Meex RCR, Venema K, Blaak EE.Метаболиты микроорганизмов кишечника при ожирении, НАЖБП и СД2. Обзоры природы. Эндокринология. 2019;15:261–73.
Эндокринология. 2019;15:261–73.
КАС пабмед ПабМед Центральный Google Scholar
Лау В.Л., Вазири Н.Д. Жирные кислоты с короткой цепью микробов кишечника и риск диабета. Нат Рев Нефрол. 2019;15:389–90.
ПабМед ПабМед Центральный Google Scholar
Санна С., ван Зуйдам Н.Р., Махаджан А., Курильщиков А., Вич Вила А., Воса У. и др.Причинно-следственные связи между кишечным микробиомом, короткоцепочечными жирными кислотами и метаболическими заболеваниями. Нат Жене. 2019;51:600–5.
КАС пабмед ПабМед Центральный Google Scholar
Де Ваддер Ф., Ковачева-Датчари П., Гонсалвес Д., Винера Дж., Зитун С., Дюшам А. и другие. Метаболиты, генерируемые микробиотой, способствуют метаболическим преимуществам через нервные цепи кишечника и головного мозга. Клетка. 2014; 156:84–96.
Клетка. 2014; 156:84–96.
ПабМед ПабМед Центральный Google Scholar
Далиле Б., Ван Ауденхове Л., Вервлит Б., Вербеке К.Роль короткоцепочечных жирных кислот в коммуникации микробиота-кишечник-мозг. Нат Рев Гастроэнтерол Гепатол. 2019;16:461–78.
ПабМед ПабМед Центральный Google Scholar
Parada Venegas D, De la Fuente MK, Landskron G, Gonzalez MJ, Quera R, Dijkstra G, et al. Опосредованная короткоцепочечными жирными кислотами (SCFAs) эпителиальная и иммунная регуляция кишечника и ее значение для воспалительных заболеваний кишечника. Фронт Иммунол. 2019;10:277.
ПабМед ПабМед Центральный Google Scholar
Frese SA, Hutton AA, Contreras LN, Shaw CA, Palumbo MC, Casaburi G, et al.Стойкость добавок Bifidobacterium longum subsp. infantis EVC001 у младенцев, находящихся на грудном вскармливании. мсфера. 2017;2:e00501–17.
infantis EVC001 у младенцев, находящихся на грудном вскармливании. мсфера. 2017;2:e00501–17.
ПабМед ПабМед Центральный Google Scholar
Чжэн Н., Гао Ю., Чжу В., Мэн Д., Уокер В. А. Короткоцепочечные жирные кислоты, продуцируемые при взаимодействии колонизирующих кишечных комменсальных бактерий со сцеженным грудным молоком, оказывают противовоспалительное действие на незрелые энтероциты человека. ПЛОС ОДИН. 2020;15:e0229283.
КАС пабмед ПабМед Центральный Google Scholar
Waligora-Dupriet AJ, Dugay A, Auzeil N, Nicolis I, Rabot S, Huerre MR, et al. Короткоцепочечные жирные кислоты и полиамины в патогенезе некротического энтероколита: аспекты кинетики у гнотобиотических перепелов. Анаэроб. 2009; 15:138–44.
КАС пабмед ПабМед Центральный Google Scholar
Рой С.К., Менг К., Садовиц Б.Д., Коллиш-Сингул М., Йепури Н., Саталин Дж. и др.Энтеральное введение смеси, ферментированной бактериями, у новорожденных поросят: высокоточная модель некротизирующего энтероколита (НЭК). ПЛОС ОДИН. 2018;13:e0201172.
ПабМед ПабМед Центральный Google Scholar
Менг Д., Соммелла Э., Сальвиати Э., Кампилья П., Гангули К., Джебали К. и др. Индол-3-молочная кислота, метаболит триптофана, секретируемый Bifidobacterium longum подвида infantis, оказывает противовоспалительное действие в незрелом кишечнике.Педиатр рез. 2020 г. https://doi.org/10.1038/s41390-019-0740-x.
Мухопадхьяй С., Уэйд К.С., Пуополо К.М. Препараты для профилактики и лечения сепсиса у новорожденных. Клин Перинатол. 2019;46:327–47.
ПабМед ПабМед Центральный Google Scholar
Кабальеро-Флорес Г., Сакамото К., Зенг М.Ю., Ван Ю., Хаким Дж., Матус-Акунья В. и др. Иммунизация матери обеспечивает защиту потомства от прикрепляющегося и исчезающего патогена за счет доставки IgG в грудное молоко.Клетка. Хост-микроб. 2019;25:313–23.e4.
КАС пабмед ПабМед Центральный Google Scholar
Мухопадхьяй С., Сенгупта С., Пуополо К.М. Проблемы и возможности рационального использования антибиотиков у недоношенных детей. Арч Дис Чайлд. 2019;104:F327–f32.
Google Scholar
Шульман Дж., Диманд Р.Дж., Ли Х.К., Дуэнас Г.В., Беннетт М.В., Гулд Дж.Б. Применение антибиотиков в отделении интенсивной терапии новорожденных.Педиатрия. 2015; 135:826–33.
ПабМед ПабМед Центральный Google Scholar
Schulman J, Profit J, Lee HC, Duenas G, Bennett MV, Parucha J, et al. Варианты применения антибиотиков у новорожденных. Педиатрия. 2018;142:e20180115.
Варианты применения антибиотиков у новорожденных. Педиатрия. 2018;142:e20180115.
ПабМед ПабМед Центральный Google Scholar
Chi C, Buys N, Li C, Sun J, Yin C. Влияние пребиотиков на сепсис, некротизирующий энтероколит, смертность, непереносимость питания, время до полного энтерального питания, продолжительность пребывания в больнице и частоту стула у недоношенных детей : метаанализ.Eur J Clin Nutr. 2019; 73: 657–70.
КАС пабмед ПабМед Центральный Google Scholar
Sun J, Marwah G, Westgarth M, Buys N, Ellwood D, Gray PH. Влияние пробиотиков на некротизирующий энтероколит, сепсис, внутрижелудочковое кровоизлияние, смертность, продолжительность пребывания в больнице и увеличение массы тела у глубоко недоношенных детей: метаанализ. Ад Нутр. 2017; 8: 749–63.
ПабМед ПабМед Центральный Google Scholar
Дешпанде Г., Джейп Г., Рао С., Патоле С.Преимущества пробиотиков у недоношенных новорожденных в странах с низким и средним уровнем дохода: систематический обзор рандомизированных контролируемых исследований. Открытый БМЖ. 2017;7:e017638.
ПабМед ПабМед Центральный Google Scholar
Дермиши Э., Ван Ю., Ян С., Хун В., Цю Г., Гонг Х. и др. «Золотой век» пробиотиков: систематический обзор и метаанализ рандомизированных и обсервационных исследований у недоношенных детей. Неонатология. 2017; 112:9–23.
КАС пабмед ПабМед Центральный Google Scholar
Olsen R, Greisen G, Schroder M, Brok J. Профилактические пробиотики для недоношенных детей: систематический обзор и метаанализ обсервационных исследований. Неонатология. 2016;109:105–12.
ПабМед ПабМед Центральный Google Scholar
Kuang L, Jiang Y. Влияние пробиотических добавок на беременных женщин: метаанализ рандомизированных контролируемых исследований.Бр Дж Нутр. 2020; 123: 870–80.
КАС Google Scholar
Skonieczna-Zydecka K, Janda K, Kaczmarczyk M, Marlicz W, Loniewski I, Loniewska B. Влияние пробиотиков на симптомы, микробиоту кишечника и воспалительные маркеры при младенческих коликах: систематический обзор, метаанализ и метаанализ регресс рандомизированных контролируемых исследований. Дж. Клин Мед. 2020;9:999.
КАС Google Scholar
ТЭЦ ван ден Аккер, ван Гудовер Дж. Б., Шамир Р., Домеллоф М., Эмблетон Н. Д., Хойсак И. и др.Пробиотики и недоношенные дети: документ с изложением позиции комитета по гепатологии и питанию Европейского общества детской гастроэнтерологии и рабочей группы Европейского общества детской гастроэнтерологии по гепатологии и питанию по пробиотикам и пребиотикам. J Pediatr Gastroenterol Nutr. 2020; 70: 664–80.
J Pediatr Gastroenterol Nutr. 2020; 70: 664–80.
Google Scholar
ван ден Аккер ТЭЦ, ван Гудовер Дж.Б., Шаевска Х., Эмблтон Н.Д., Хойсак И., Рейд Д. и др.Пробиотики для недоношенных детей: систематический обзор штаммов и сетевой метаанализ. J Pediatr Gastroenterol Nutr. 2018;67:103–22.
Google Scholar
Su GL, Ko CW, Bercik P, Falck-Ytter Y, Sultan S, Weizman AV, et al. Клинические рекомендации AGA по роли пробиотиков в лечении желудочно-кишечных расстройств. Гастроэнтерология. 2020 г. https://doi.org/10.1053/j.gastro.2020.05.059.
Lewis ZT, Shani G, Masarweh CF, Popovic M, Frese SA, Sela DA, et al.Проверка идентичности видов и подвидов бифидобактерий в коммерческих пробиотических продуктах. Педиатр рез. 2016;79:445–52.
КАС Google Scholar
Чианг М.С., Чен К.Л., Фэн И., Чен К.С., Лиен Р., Чиу Ч. Lactobacillus rhamnosus сепсис, связанный с терапией пробиотиками у крайне недоношенных детей: патогенез и обзор для клиницистов. J Microbiol Immunol Infect. 2020. https://doi.org/10.1016/j.jmii.2020.03.029
Пелл Л.Г., Луте М.Г., Рот Д.Е., Шерман П.М. Аргументы против рутинного приема пробиотиков для профилактики НЭК. Курр Опин Педиатрия. 2019;31:195–201.
Google Scholar
Ассоциированный с кишечником цГМФ опосредует колит и дисбиоз в мышиной модели активирующей мутации в GUCY2C | Журнал экспериментальной медицины
Активирующие мутации в рецепторе гуанилилциклазы С (GC-C), мишени желудочно-кишечных пептидных гормонов гуанилина и урогуанилина, и бактериальных термостабильных энтеротоксинов вызывают раннюю диарею и хроническое воспалительное заболевание кишечника (ВЗК).GC-C регулирует секрецию ионов и жидкости в кишечнике посредством продукции цГМФ и активации цГМФ-зависимой протеинкиназы II. Мы характеризуем новую модель мыши, содержащую активирующую мутацию в Gucy2c , эквивалентную мутации, наблюдаемой в пораженной норвежской семье. Мыши-мутанты продемонстрировали повышенный уровень цГМФ в кишечнике и повышенное содержание воды и натрия в фекалиях. Базальный и линаклотид-опосредованный тонкокишечный транзит был выше у мутантных мышей, и они были более восприимчивы к индуцированному DSS колиту.Анализы фекального микробиома и экспрессии генов в ткани толстой кишки выявили дисбиоз, активацию генов, стимулируемых интерфероном, и неправильную регуляцию генов, связанных с ВЗК у человека и моделями колита у животных. Таким образом, эта новая мышиная модель обеспечивает молекулярное понимание множественных ролей цГМФ кишечных эпителиальных клеток, которые приводят к дисбактериозу и индукции воспаления в кишечнике.
Мы характеризуем новую модель мыши, содержащую активирующую мутацию в Gucy2c , эквивалентную мутации, наблюдаемой в пораженной норвежской семье. Мыши-мутанты продемонстрировали повышенный уровень цГМФ в кишечнике и повышенное содержание воды и натрия в фекалиях. Базальный и линаклотид-опосредованный тонкокишечный транзит был выше у мутантных мышей, и они были более восприимчивы к индуцированному DSS колиту.Анализы фекального микробиома и экспрессии генов в ткани толстой кишки выявили дисбиоз, активацию генов, стимулируемых интерфероном, и неправильную регуляцию генов, связанных с ВЗК у человека и моделями колита у животных. Таким образом, эта новая мышиная модель обеспечивает молекулярное понимание множественных ролей цГМФ кишечных эпителиальных клеток, которые приводят к дисбактериозу и индукции воспаления в кишечнике.
Описаны моногенные дефекты кишечного эпителия, способствующие воспалительному заболеванию кишечника (ВЗК) у детей, которые не поддаются современным схемам лечения (Leung and Muise, 2018; Nambu and Muise, 2021). Среди генов, связанных с очень ранним началом ВЗК, есть мутации в гене рецептора гуанилатциклазы С ( GUCY2C ; Bose et al., 2020; Crowley et al., 2020). Рецептор, кодируемый этим геном, гуанилатциклаза C (GC-C), является мишенью для желудочно-кишечных гормонов гуанилина (кодируется GUCA2A ) и урогуанилина (кодируется GUCA2B ; Arshad and Visweswariah, 2012; Basu et al. , 2010). GC-C преимущественно экспрессируется вдоль желудочно-кишечного тракта, где он регулирует транспорт жидкости и ионов через эпителий кишечника (Waldman and Camilleri, 2018).Связывание лиганда с GC-C приводит к повышению уровня 3’5′-циклического гуанозинмонофосфата (цГМФ) в клетках кишечника и активации цГМФ-зависимой протеинкиназы II (PKGII; Lohmann et al., 1997). PKGII фосфорилирует регулятор трансмембранной проводимости при муковисцидозе (CFTR) и натрий-водородный обменник, NHE3 (Chen et al., 2015; Golin-Bisello et al., 2005). Фосфорилирование CFTR увеличивает секрецию ионов хлорида и бикарбоната, в то время как фосфорилирование NHE3 ингибирует поглощение натрия эпителиальными клетками кишечника (IEC; Chen et al.
Среди генов, связанных с очень ранним началом ВЗК, есть мутации в гене рецептора гуанилатциклазы С ( GUCY2C ; Bose et al., 2020; Crowley et al., 2020). Рецептор, кодируемый этим геном, гуанилатциклаза C (GC-C), является мишенью для желудочно-кишечных гормонов гуанилина (кодируется GUCA2A ) и урогуанилина (кодируется GUCA2B ; Arshad and Visweswariah, 2012; Basu et al. , 2010). GC-C преимущественно экспрессируется вдоль желудочно-кишечного тракта, где он регулирует транспорт жидкости и ионов через эпителий кишечника (Waldman and Camilleri, 2018).Связывание лиганда с GC-C приводит к повышению уровня 3’5′-циклического гуанозинмонофосфата (цГМФ) в клетках кишечника и активации цГМФ-зависимой протеинкиназы II (PKGII; Lohmann et al., 1997). PKGII фосфорилирует регулятор трансмембранной проводимости при муковисцидозе (CFTR) и натрий-водородный обменник, NHE3 (Chen et al., 2015; Golin-Bisello et al., 2005). Фосфорилирование CFTR увеличивает секрецию ионов хлорида и бикарбоната, в то время как фосфорилирование NHE3 ингибирует поглощение натрия эпителиальными клетками кишечника (IEC; Chen et al. , 2015). Последующий осмотический дисбаланс в IEC вызывает отток воды из клетки, необходимой для гидратации слизи и прохождения пищевого комка по кишечнику (Arshad and Visweswariah, 2013).
, 2015). Последующий осмотический дисбаланс в IEC вызывает отток воды из клетки, необходимой для гидратации слизи и прохождения пищевого комка по кишечнику (Arshad and Visweswariah, 2013).
Семейный GUCY2C Синдром диареи (FGDS) был впервые описан в норвежской семье, где более 30 человек сообщили о диарее различной степени тяжести, начиная с младенческого возраста (Fiskerstrand et al., 2012). Аутосомно-доминантная мутация, картированная в GUCY2C , привела к замене Ser840 на изолейцин, присутствующий в домене гуанилатциклазы.Мутация привела к гиперактивации GC-C, вследствие чего мутантный рецептор вызывал более высокие уровни цГМФ при стимуляции лигандами. Эти повышенные уровни цГМФ, по-видимому, чрезмерно активировали передачу сигналов ниже по течению, что приводило к увеличению секреции жидкости и ионов и диарее (Fiskerstrand et al., 2012). Впоследствии мы охарактеризовали еще четыре активирующие мутации у неродственных детей в Европе, у которых также была тяжелая и изнуряющая диарея, обнаруживаемая внутриутробно как сильно вздутый живот у плода (Müller et al. , 2016). Мутации (Lys507Glu, Leu775Pro, Arg792Ser и Asn850Asp) присутствовали в различных доменах рецептора, включая домен гомологии киназы, линкерную область и каталитический домен (Bose et al., 2020; Mishra et al., 2018). ). Пациенты, страдающие ФГДС, и дети с мутациями de novo в GUCY2C , помимо диареи, имеют симптомы, подобные болезни Крона (БК), и колит (Fiskerstrand et al., 2012; Müller et al., 2016).
, 2016). Мутации (Lys507Glu, Leu775Pro, Arg792Ser и Asn850Asp) присутствовали в различных доменах рецептора, включая домен гомологии киназы, линкерную область и каталитический домен (Bose et al., 2020; Mishra et al., 2018). ). Пациенты, страдающие ФГДС, и дети с мутациями de novo в GUCY2C , помимо диареи, имеют симптомы, подобные болезни Крона (БК), и колит (Fiskerstrand et al., 2012; Müller et al., 2016).
GC-C является мишенью для бактериальных термостабильных энтеротоксинов (СТ), продуцируемых энтеротоксигенной Escherichia coli , одной из основных причин водянистой диареи в развивающихся странах (Schulz et al., 1990). Одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов препараты линаклотид и плеканатид, которые используются для лечения запоров, содержат богатую цистеином основную последовательность ST или урогуанилина, соответственно, и активируют GC-C, чтобы индуцировать выработку цГМФ (Shah et al. , 2018) . Тем не менее, нет доступных лекарств для облегчения диареи, опосредованной GC-C, хотя молекулы, которые могут ингибировать белки ниже по течению от GC-C, кажутся многообещающими (Bijvelds et al., 2018).
, 2018) . Тем не менее, нет доступных лекарств для облегчения диареи, опосредованной GC-C, хотя молекулы, которые могут ингибировать белки ниже по течению от GC-C, кажутся многообещающими (Bijvelds et al., 2018).
Мышей с нокаутом GC-C изучали в течение нескольких лет (Schulz et al., 1997). Хотя у них нет явных признаков запора, отчеты показывают, что они демонстрируют неврологические симптомы (Brierley, 2012; Mann et al., 2019), а подавление опосредованной урогуанилином передачи сигналов GC-C у мышей приводит к ожирению (Valentino et al., 2011). Мы продемонстрировали, что мыши GC-C -/- более восприимчивы к пероральной инфекции Salmonella enterica enterica serovar Typhimurium (Majumdar et al., 2018). Сообщалось об инактивирующих мутациях в GUCY2C , у младенцев с мекониевой непроходимостью кишечника при рождении.Эти дети были результатом кровного родства с мутациями, присутствующими в гомозиготном состоянии (Romi et al. , 2012; Smith et al., 2015; Woods et al., 2019).
, 2012; Smith et al., 2015; Woods et al., 2019).
Отсутствие моделей диарейных заболеваний, опосредованных гиперактивным GC-C, для исследования связи между GC-C, цГМФ и воспалением кишечника побудило нас разработать мутантную мышь с мутацией в Gucy2c , эквивалентной мутации S840I, обнаруженной в норвежская семья.Здесь мы подтверждаем эту модель с точки зрения увеличения частоты прохождения водянистых фекалий, регуляции активности Cftr и Nhe3 in vivo и повышенной восприимчивости этих мышей к колиту. Анализ фекального микробиома у мутантных мышей и глобальной экспрессии генов толстой кишки предоставил основное объяснение воспаления, наблюдаемого у пациентов с активирующими мутациями GC-C. Следовательно, эта мутантная мышь служит доклинической моделью секреторной диареи, опосредованной GUCY2C , связанной с ВЗК, и более распространенного инфекционного диарейного заболевания, вызванного активацией GC-C.
Уровни транскриптов Gucy2c и урогуанилина ( Guca2b ) были одинаковыми в подвздошной кишке и толстой кишке мышей дикого типа и мышей S839I, в то время как уровни гуанилина ( Guca2a ) были значительно ниже у мышей S839I (рис. 2А). Кишечник является основным местом синтеза гуанилина и урогуанилина; следовательно, уровни пропептидов в сыворотке отражают уровни, продуцируемые в кишечнике.Однако мы не наблюдали значительного снижения уровня пропептидного гормона в сыворотке мышей S839I (рис. S3). Вестерн-блоттинг показал, что экспрессия GC-C была сходной у мышей дикого типа и мышей S839I (рис. 2В), как и связывание ST с мембранами, полученными из эпителиальных клеток (рис. 2С).
Было высказано предположение, что присутствие GC-C с гиперактивирующими мутациями в кишечнике пациентов приводит к повышению внутриэпителиального клеточного цГМФ в ответ на гуанилин и/или урогуанилин (Fiskerstrand et al. , 2012; Мюллер и др., 2016). Как показано на рис. 2D, стационарные уровни цГМФ в эпителиальных клетках были примерно в 5-10 раз выше у мышей S839I. Таким образом, мутантный мышиный GC-C действительно вызывал больший ответ с точки зрения продукции цГМФ в ответ на эндогенные лиганды.
, 2012; Мюллер и др., 2016). Как показано на рис. 2D, стационарные уровни цГМФ в эпителиальных клетках были примерно в 5-10 раз выше у мышей S839I. Таким образом, мутантный мышиный GC-C действительно вызывал больший ответ с точки зрения продукции цГМФ в ответ на эндогенные лиганды.
У пациентов с ФГДС продемонстрировано замедление времени прохождения через кишечник из-за регургитации содержимого кишечника в тонкую кишку (von Volkmann et al., 2017, 2016). Мы оценили кишечный транзит у мышей дикого типа и мышей S839I, но не обнаружили никаких изменений у мышей S839I (рис. 2E).
У пациентов с активирующими мутациями в GUCY2C отмечается многократный водянистый стул (Fiskerstrand et al., 2012). Мы отслеживали количество фекальных гранул, переданных мышами за 10 минут, и заметили, что мыши S839I передали большее количество фекальных гранул (рис. 2F). Содержание воды в фекалиях, производимых мышами S839I, было выше (рис.2 Г). Эти фенотипы отражают симптомы диареи, наблюдаемые при FGDS, что позволяет предположить, что мышей S839I можно использовать для понимания процессов, которые регулируют частые эпизоды опорожнения кишечника, наблюдаемые у пациентов с FGDS.
2F). Содержание воды в фекалиях, производимых мышами S839I, было выше (рис.2 Г). Эти фенотипы отражают симптомы диареи, наблюдаемые при FGDS, что позволяет предположить, что мышей S839I можно использовать для понимания процессов, которые регулируют частые эпизоды опорожнения кишечника, наблюдаемые у пациентов с FGDS.
Повышенные уровни цГМФ в IEC стимулируют повышенную секрецию хлоридов и бикарбонатов посредством CFTR после фосфорилирования цГМФ-зависимой протеинкиназой G II (рис. 3А; Golin-Bisello et al., 2005; Лин и др., 1992). Кроме того, ингибирующее фосфорилирование натрий-водородного обменника NHE3 (SLC9A3) приводит к уменьшению импорта ионов натрия в клетки и последующему увеличению содержания натрия в просвете и фекалиях (Chen et al., 2015). Уровни транскрипта PrkgII были снижены в толстой кишке мышей S839I, как и уровень белка (рис. S3B), что позволяет предположить, что некоторые эффекты цГМФ в толстой кишке могут быть независимыми от PKGII. В то время как транскрипты Cftr были сходными как у мышей дикого типа, так и у мышей S839I, уровни Nhe3 были ниже как в подвздошной, так и в толстой кишке у мышей S839I (фиг.3 Б).
В то время как транскрипты Cftr были сходными как у мышей дикого типа, так и у мышей S839I, уровни Nhe3 были ниже как в подвздошной, так и в толстой кишке у мышей S839I (фиг.3 Б).
Мы измерили скорость транзита по тонкому кишечнику у мышей дикого типа и мышей S839I. Опорожнение желудка (GE) было слегка усилено у мышей дикого типа после лечения ингибитором Cftr, но незначительно, хотя сообщается, что GE усиливается у пациентов с CFTR (Collins et al., 1997). Никаких изменений в GE не наблюдалось у мышей S839I (рис. 3C, верхняя панель) ни в присутствии, ни в отсутствие ингибитора Cftr. Однако степень миграции красителя в тонком кишечнике, измеренная по геометрическому центру (ГЦ), была значительно выше у мышей S839I (рис.3С, нижняя панель), обработанная только носителем. При введении ингибитора Cftr наблюдалось увеличение GC у мышей дикого типа (рис. 3C, нижняя панель), что согласуется с парадоксальным наблюдением о том, что у пациентов с муковисцидозом увеличивается транзит через верхние отделы тонкой кишки (Hedsund et al. , 2012). Важно отметить, что резкое снижение GC наблюдалось у мышей S839I, получавших ингибитор Cftr (рис. 3C, нижняя панель), демонстрируя, что увеличение скорости базального транзита у мышей S839I было почти исключительно связано с активацией CFTR.
, 2012). Важно отметить, что резкое снижение GC наблюдалось у мышей S839I, получавших ингибитор Cftr (рис. 3C, нижняя панель), демонстрируя, что увеличение скорости базального транзита у мышей S839I было почти исключительно связано с активацией CFTR.
Затем мы вводили линаклотид для более мощной активации GC-C (Bryant et al., 2010). GE был выше у мышей S839I (рис. 3D, верхняя панель), когда мышам вводили через зонд только буфер, в отличие от того, что наблюдалось у мышей, получавших через зонд носитель, используемый для растворения ингибитора Cftr (рис. 3C, верхняя панель) . Сообщалось об экспрессии GC-C и урогуанилина в желудке млекопитающих, хотя и на низких уровнях (Date et al., 1999; London et al., 1997), а повышенный уровень ГЭ может быть следствием гиперактивности ГК-Х в желудке. При лечении линаклотидом GC увеличивался как у мышей дикого типа, так и у мышей S839I (рис. 3D, нижняя панель). Однако транзит был значительно выше у мышей S839I. Следовательно, опосредованная лигандом активация гиперактивного GC-C вызывает более быструю миграцию вниз по тонкому кишечнику.
Следовательно, опосредованная лигандом активация гиперактивного GC-C вызывает более быструю миграцию вниз по тонкому кишечнику.
Мы наблюдали снижение транскрипции Nhe3 как в подвздошной, так и в толстой кишке мышей S839I по сравнению с мышами дикого типа (рис.3 Б). Мы отслеживали экспрессию Nhe3 и наблюдали значительное снижение экспрессии белка как в подвздошной, так и в толстой кишке мышей S839I (рис. 3E). Повышенный отток бикарбоната из клетки из-за повышенных уровней цГМФ и активности Cftr, наряду со сниженной экспрессией Nhe3, должен повышать уровень натрия и рН просвета кишечника. В соответствии с этим pH просвета в подвздошной кишке мышей S839I был выше, чем у мышей дикого типа (фиг. 3F). Однако значительное увеличение просветного натрия наблюдалось только в толстой кишке (рис.3G) и коррелировало с более высоким содержанием натрия в кале (рис. 3H). Это говорит о том, что Nhe3 может не вносить основной вклад в импорт натрия в тонкой кишке. Однако подавление Nhe3 в сочетании с ингибированием его активности из-за повышенных уровней цГМФ в толстой кишке проявляется в усиленном выделении натрия с фекалиями, как это наблюдается у детей с гиперактивирующими мутациями в GC-C, которые демонстрируют врожденную натриевую секреторную диарею (Müller и др., 2016).
Однако подавление Nhe3 в сочетании с ингибированием его активности из-за повышенных уровней цГМФ в толстой кишке проявляется в усиленном выделении натрия с фекалиями, как это наблюдается у детей с гиперактивирующими мутациями в GC-C, которые демонстрируют врожденную натриевую секреторную диарею (Müller и др., 2016).
Мы оценили степень, в которой Nhe3 ингибируется повышенными уровнями цГМФ в кишечнике у мышей S839I при введении тенапанора, специфического ингибитора Nhe3.В то время как GE снова был выше у мышей S839I, которым вводили только носитель (рис. 3I, верхняя панель), дальнейшего увеличения не наблюдалось как у мышей дикого типа, так и у мышей S839I после введения тенапанора. Однако, в соответствии с более ранними исследованиями (McHugh et al., 2018), введение ингибитора мышам дикого типа увеличивало GC (рис. 3 I, нижняя панель). У мышей S839I уже повышенный базальный транзит дополнительно усиливался при лечении тенапанором (рис. 3I). Мы связываем это повышенное увеличение транзита по тонкому кишечнику с преобладающими более низкими уровнями Nhe3, присутствующими у мышей S839I, и эффективным ингибированием тенапанором.
3I). Мы связываем это повышенное увеличение транзита по тонкому кишечнику с преобладающими более низкими уровнями Nhe3, присутствующими у мышей S839I, и эффективным ингибированием тенапанором.
Пациенты, несущие активирующие мутации в GUCY2C , имеют различные степени воспаления в кишечнике (например, эзофагит, синдром раздраженного кишечника [СРК], БК и язвенный колит [ЯК]; Fiskerstrand et al., 2012; Müller et al. , 2016). Введение DSS мышам вызывает гибель эпителиальных клеток и нарушает барьерную функцию (Wirtz et al., 2017). Мы вводили DSS мышам и наблюдали за потерей веса и повреждением толстой кишки.Мыши S839I были более восприимчивы к DSS, о чем свидетельствует большая потеря веса (рис. 4А, левая панель) и более высокий индекс активности заболевания (рис. 4А, правая панель). Укорочение толстой кишки наблюдалось как у мышей дикого типа, так и у мышей S839I после лечения DSS (рис. 4В).
4В).
Уровни транскриптов GC-C и гуанилина снижены в биоптатах, взятых у людей, страдающих ЯК и БК (Brenna et al., 2015; Lan et al., 2016). После индукции колита с помощью DSS уровни транскриптов Gucy2c и Guca2a были снижены как у мышей дикого типа, так и у мышей S839I (фиг.4 С).
Гистологическая оценка толстой кишки у мышей дикого типа и мышей S839I не выявила различий в архитектуре толстой кишки или изменений в глубине крипт, что указывает на то, что обновление IEC было сходным у мышей S839I (рис. S3C). После лечения DSS у мышей S839I наблюдалась большая степень абсцессов крипт и разрушения слизистой оболочки толстой кишки (рис. 4D). Одновременно с большим повреждением слизистой оболочки фекальный липокалин, чувствительный маркер воспаления в кишечнике (Chassaing et al., 2012), был повышен у мышей S839I (рис. 4Е). В совокупности наши результаты показывают, что мыши S839I, несущие активирующую мутацию в Gucy2c , обнаруживают роль цГМФ в регуляции функции кишечника и повышенной восприимчивости толстой кишки к повреждению в модели колита. Примечательно, что мыши с нокаутом GC-C устойчивы к DSS-индуцированному колиту (Steinbrecher et al., 2011).
4Е). В совокупности наши результаты показывают, что мыши S839I, несущие активирующую мутацию в Gucy2c , обнаруживают роль цГМФ в регуляции функции кишечника и повышенной восприимчивости толстой кишки к повреждению в модели колита. Примечательно, что мыши с нокаутом GC-C устойчивы к DSS-индуцированному колиту (Steinbrecher et al., 2011).
Чтобы изучить глобальные изменения, наблюдаемые в кишечнике из-за присутствия гиперактивного GC-C, мы использовали беспристрастные подходы, охарактеризовав фекальный микробиом и транскриптом в ткани толстой кишки.
Изменение pH и концентрации ионов натрия в просвете кишечника может привести к дисбактериозу, который может предрасполагать к колиту. Поэтому мы провели секвенирование ампликона гена 16S рибосомной РНК (рРНК) образцов фекалий, собранных у мышей дикого типа и мышей S839I. Неограниченная ординация с помощью анализа основных компонентов с показателями несходства Брея-Кертиса показала четкое разделение между двумя наборами мышей (анализ сходства, значение P = 0.001; Рис. 5 А). Наблюдалась воспроизводимая тенденция к снижению альфа-разнообразия (P <0,1) в фекальном микробиоме мышей S839I (рис. 5B), а графики относительной численности продемонстрировали различия на уровне типов и родов (рис. 5C).
Неограниченная ординация с помощью анализа основных компонентов с показателями несходства Брея-Кертиса показала четкое разделение между двумя наборами мышей (анализ сходства, значение P = 0.001; Рис. 5 А). Наблюдалась воспроизводимая тенденция к снижению альфа-разнообразия (P <0,1) в фекальном микробиоме мышей S839I (рис. 5B), а графики относительной численности продемонстрировали различия на уровне типов и родов (рис. 5C).
Повышенное количество потенциальных условно-патогенных микроорганизмов ( Anaeroplasma , Desulfovibrio , Mucispirillum и Paraprevotella ) наблюдалось у S839I (рис.5 Д). Представители рода Paraprevotella связаны с БК толстой кишки и продуцируют янтарную кислоту, повышенные уровни которой, как сообщается, связаны с дисбактериозом микробиома и воспалением кишечника у пациентов с ВЗК и животных моделей хронического колита (Macias-Ceja et al., 2019; Уолтерс и др., 2014). Род Mucispirillum также значительно выше у мышей S839I (рис. 5D). Сообщалось, что воздействие на мышей Nod2 −/− Cybb −/− C57BL/6 грамотрицательного патобионта грызунов, Mucispirillum schaedleri, , вызывает развитие CD-подобного колит (Caruso et al., 2019). Desulfovibrio был значительно обогащен у мышей S839I, как видно из микробиома слизистой оболочки толстой кишки и фекального микробиома пациентов с ЯК и БК (Rowan et al., 2010).
Уровни защитных бактерий, таких как Colidextribacter , Dorea (продуценты короткоцепочечных жирных кислот), Dubosiella и Lactobacillus (обладающие противовоспалительными свойствами), были значительно снижены у мышей S839I (рис.5 Д). Colidextribacter и Dorea относятся к Clostridiales кластера IV и Clostridium кластера XIVa в типе Firmicutes, соответственно. Известно, что эти таксоны продуцируют жирные кислоты с короткой цепью, и, как сообщается, их меньше в образцах биопсии подвздошной кишки и фекалиях, выделенных от пациентов с БК (Nagao-Kitamoto and Kamada, 2017). Штаммы Lactobacillus восстанавливают комменсалы и гомеостаз кишечника при кишечных расстройствах (Blaser, 2014).Следовательно, более низкая распространенность этих родов у мышей S839I предполагает, что эти животные могут быть более восприимчивы к индуцированному окружающей средой колиту и воспалению в кишечнике, как сообщалось у пациентов с FGDS (Fiskerstrand et al., 2012).
Анализ предсказанных функциональных последствий различий в количестве таксонов между мышами (Narayan et al., 2020) показал значительные различия в 28 путях KEGG (таблица S3).Те, которые связаны с иммунитетом хозяина, были обогащены у мышей S839I и включали передачу сигналов NOD-подобного рецептора, процессинг и презентацию антигена, передачу сигналов IL17 и дифференцировку клеток Th27 (рис. 5 F). Пути KEGG для бактериального хемотаксиса и сборки жгутиков, связанные с подвижностью клеток в микробиоме, были значительно выше у мышей S839I (таблица S3). Пути, которые были снижены, были связаны с деградацией полициклических ароматических углеводородов, что позволяет предположить, что мыши S839I могут иметь более высокие уровни этих генотоксичных соединений в кишечнике, что может предрасполагать их к канцерогенезу; напротив, пути, связанные с химическим канцерогенезом, были уменьшены (рис.5 Ф).
Таким образом, значительные различия в микробиоме мышей S839I напоминают изменения, наблюдаемые у пациентов с ВЗК и ФГДС (Tronstad et al., 2017), и более свежие данные, касающиеся фекальной микробиоты, наблюдаемые у пациентов с микроскопическим колитом (Hertz et al., 2021). . Следовательно, лежащие в основе нарушения функции эпителия толстой кишки и/или дисбаланс секреции жидкости и ионов из-за активирующей мутации Gucy2c оказывают сильное влияние на кишечную флору.
Мы сравнили глобальные изменения экспрессии генов в толстой кишке мышей дикого типа и мышей S839I с помощью анализа секвенирования РНК, предположив, что характер экспрессии генов может объяснить восприимчивость к воспалению, наблюдаемому у пациентов. Мы идентифицировали несколько дифференциально регулируемых генов, большинство из которых подавляется (рис. 6А). Дифференциально экспрессируемые транскрипты с скорректированной частотой ложных открытий (FDR) <0.05 и log 2 кратное изменение (FC) менее -2 и >1,5 дали 645 генов с пониженной регуляцией и 101 ген с повышенной регуляцией (рис. 6А). Анализ путей изобретательности (IPA) выявил канонические пути, которые нарушены у мышей S839I. Поразительно, но наблюдались повышенные уровни большого количества генов, регулируемых передачей сигналов IFN (Barrat et al., 2019), называемых IFN-стимулированными генами (ISG), включая Ifit1 , Ifit3 , Ifitm3 , Tap1 , Irf7 , Isg15 , Ido1 и Socs1 (рис.6 Б). Мы подтвердили уровни экспрессии этих генов с помощью RTqPCR и обнаружили, что экспериментально наблюдаемое увеличение уровней транскриптов согласуется с наблюдаемым в анализе РНК-seq (рис. 6C).
Затем мы искали доказательства измененной регуляции генов IFN типа I, типа II и типа III, которые могли бы управлять экспрессией ISG. Члены семейств IFN1 и IFNIII не были обнаружены в РНК-seq, а транскрипты также не были идентифицированы с помощью RTPCR (данные не показаны).Однако Ifng можно было обнаружить с помощью RTPCR (фиг. 6C), и уровни были выше у мышей S839I.
Многие из ISG являются мишенями STAT1, включая Socs1 , который является негативным регулятором передачи сигналов цитокинов. Stat1 повышал уровень экспрессии у мышей S839I, как и Socs1 , что дополнительно подтверждало результаты, полученные при анализе секвенирования РНК (фиг. 6C). Затем мы искали экспрессию Stat1 и его фосфорилированных форм с помощью Вестерн-блоттинга с использованием экстрактов, приготовленных из цельной ткани толстой кишки.Значительное увеличение общих уровней Stat1, наряду с фосфорилированным Stat1 (по Ser727 и Tyr701), наблюдалось у мышей S839I. Также наблюдалось увеличение общего Stat1, возможно, поскольку Stat1 самостоятельно регулирует собственную транскрипцию (Fig. 6D). Значительное увеличение общего STAT1, возможно, также может быть следствием прямой индукции транскрипции в ответ на повышенные уровни цГМФ. Кроме того, уровни белков Isg15 (рис. 6E), Tap1 (рис. 6F) и Ido1 (рис. 6G), которые все регулируются Stat1 и чьи транскрипты были повышены у мышей S839I (рис.6 С), были увеличены. Примечательно, что повышенная активность STAT1 связана с тяжестью заболевания у пациентов с ВЗК (Cordes et al., 2020; Schreiber et al., 2002).
Учитывая увеличение общего Stat1, наблюдаемое у мышей S839I, возможно, что фракция может оставаться нефосфорилированной. Ранее сообщалось об индукции ISG, опосредованной нефосфорилированным STAT1, как части трехчастного транскрипционного комплекса STAT1, STAT2 и IRF9, в клеточных линиях толстой кишки (Wang et al., 2017). Действительно, анализ секвенирования РНК показал, что Stat2 и Irf9 также повышали уровень экспрессии у мышей S839I. Предполагается, что экспрессия ISG с помощью нефосфорилированного STAT1 является первичным механизмом для преодоления микробной инфекции (Cheon et al., 2013).
Повышенная экспрессия ISG у мышей S839I может быть причиной исходной патологии и последующей предрасположенности к тяжелому колиту, о котором мы сообщаем здесь (рис.4). Поэтому мы использовали функцию Analysis Match в IPA, чтобы сравнить измененную экспрессию генов, наблюдаемую у мышей S839I, с таковой у мышей после лечения DSS. Значительное количество генов продемонстрировало одинаковую тенденцию регуляции у мышей S839I и мышей, получавших DSS (рис. 7), что указывает на то, что признаки воспаления после лечения DSS, по-видимому, уже изменились у мышей S839I. IPA предсказывает z-показатель активации или ингибирования экспрессии генов, контролируемых вышестоящими регуляторами. Здесь снова общие вышестоящие регуляторы с сопоставимыми z-показателями активации были обнаружены у мышей S839I и у мышей с колитом, индуцированным DSS (рис.7).
Наконец, вышестоящие регуляторы в нашем наборе данных показали прогнозируемые z-показатели, аналогичные наблюдаемым в биопсиях толстой кишки пациентов с колитом (Zhao et al., 2015; рис. 7), подтверждая, что эти мыши S839I действительно могут служить доклинической моделью для изучения воспаление кишечника у людей, опосредованное гиперактивными мутациями GUCY2C (Crowley et al., 2020).
Здесь мы описываем новую доклиническую модель для понимания основных биологических механизмов, наблюдаемых у пациентов с редкими мутациями в GUCY2C .Наши результаты показывают, что гиперактивация GC-C приводит к потере общего гомеостаза, дисбалансу ионов жидкости, дисбактериозу кишечной микробиоты и предрасположенности к колитам. Поскольку появляется все больше свидетельств того, что межорганная коммуникация является основой общего фенотипа, наблюдаемого в организмах, а пациенты с FGDS имеют активирующую мутацию во всех тканях, где экспрессируется GC-C, мы решили разработать модель нокина всего тела.
Повышенный уровень цГМФ в МЭК у мышей S839I (фиг.2D) приводит к увеличению транзита через тонкий кишечник за счет активации Cftr (рис. 3, C и D). Ингибирование Nhe3 тенапанором также приводило к усилению транзита (Fig. 3I). Значительное снижение уровня транскрипта, а также уровня белка Nhe3 наблюдалось у мышей S839I (рис. 3, B и E). Поскольку более низкая экспрессия Nhe3 должна снижать поглощение Na + эпителиальными клетками, наблюдалось увеличение просвета натрия в толстой кишке и фекалиях, но не в подвздошной кишке (Fig. 3, G и H). Nhe3 -/- у мышей наблюдалась диарея с нарушением всасывания жидкости, повышенным содержанием ионов натрия в просвете кишечника и защелачиванием просвета кишечника (Schulteis et al., 1998; Xue et al., 2020), как мы видим здесь (рис. 3 F). Хотя сообщалось, что Nhe3 регулирует уровни натрия в тканях подвздошной кишки мышей (Murtazina et al., 2011), более поздние наблюдения показывают, что Nhe3 играет скромную роль в потоках натрия в дистальном отделе подвздошной кишки (Stephens et al., 2021). Следовательно, могут существовать дополнительные механизмы, с помощью которых поддерживается уровень натрия в подвздошной кишке.
Инактивирующие мутации в NHE3 приводят к врожденной натриевой диарее из-за мальабсорбции натрия (Janecke et al., 2015). Измененное и дефектное всасывание Na + считается одним из наиболее важных факторов диареи у пациентов с ВЗК (Seidler et al., 2006). Снижение экспрессии или активности NHE3 было зарегистрировано в биоптатах слизистой оболочки пациентов с ВЗК (Siddique et al., 2009; Yeruva et al., 2010). Сходным образом, мыши Il10 -/- , у которых развивается спонтанный колит, обнаруживают сниженную активность Nhe3 в энтероцитах (Larmonier et al., 2011; Sellon et al., 1998). Следовательно, снижение активности NHE3 в кишечнике пациентов с гиперактивными мутациями GUCY2C может способствовать возникновению симптомов, подобных болезни Крона, и колита.Недавно мы предположили, что нарушение транспорта натрия в кишечнике и его влияние на микробиом могут служить основным восходящим медиатором нижестоящей патофизиологии (Prasad and Visweswariah, 2021).
Снижение уровня транскриптов и экспрессии белка Nhe3 у мышей S839I предполагает роль цГМФ (и, возможно, PKGII) в снижении транскрипции Nhe3 . Транскрипция Nhe3 позитивно регулируется факторами транскрипции Sp1/Egr-1 (Malakooti et al., 2006). Паратгормон-индуцированное ингибирование транскрипции Nhe3 в клетках проксимальных канальцев почек опоссума было опосредовано усиленным связыванием Egr-1 с основным промотором Nhe3 и активацией активности JAK-STAT3 (Neri et al., 2015). Недавнее исследование показало, что активация p38 в клетках Caco2 толстой кишки человека коррелирует со снижением транскрипции Nhe3 (Enns et al., 2020). Ранее мы показали, что PKGII активирует p38, что, в свою очередь, приводит к усилению рекрутирования Sp1 на промотор p21, что приводит к усилению транскрипции p21 (Basu et al., 2014). Что еще предстоит изучить с учетом наших результатов, описанных здесь, так это то, является ли ингибирование транскрипции Nhe3 результатом перекрестных помех между цГМФ, PKGII, p38, Sp1/Egr-1 и STAT1 в IEC.
Активация CFTR, приводящая к увеличению оттока хлоридов, является основной причиной диареи при кишечных инфекциях, вызывая повышенную секрецию хлоридов и бикарбонатов в просвет кишечника.У мышей с гиперактивацией Cftr обнаруживаются признаки диареи и ощелачивания просвета кишечника из-за повышенной секреции бикарбоната (Gelfond et al., 2017). Здесь мы показываем, что у мышей S839I также наблюдается защелачивание просвета тонкой кишки (рис. 3 F). Повышенный транзит в тонком кишечнике мышей S839I (рис. 3C) из-за активации Cftr и ингибирования Nhe3 предполагает, что CFTR может быть нацелен на пациентов с FGDS. Инактивирующие мутации в CFTR приводят к мекониевой непроходимости кишечника у новорожденных (Sathe and Houwen, 2017) и кишечной непроходимости у взрослых из-за снижения перистальтики кишечника и гидратации.Это имитирует то, что наблюдается у пациентов с инактивирующими мутациями в GUCY2C (Bose et al., 2020; Romi et al., 2012; Smith et al., 2015; Woods et al., 2019), что указывает на решающую роль Cftr. после передачи сигналов GC-C.
Упациентов с ФГДС наблюдалось удлинение времени транзита по кишечнику и нарушение моторики тонкой кишки (von Volkmann et al., 2017). В литературе имеются противоречивые результаты по скорости кишечного транзита у пациентов с СРК-З (СРК с запором) и СРК-Д (СРК с диареей) (Ringel-Kulka et al., 2015; Roland et al., 2015), предполагая сложную регуляцию перистальтики кишечника энтеральной нервной системой.
У мышейS839I наблюдалась более высокая частота испражнений и содержание воды в фекалиях, что свидетельствует о симптомах, подобных диарее (рис. 2, F и G). Однако тяжелой водянистой диареи, отмеченной жидким стулом в подстилке клетки, а также влажными и обесцвеченными аногенитальными областями, у мышей S839I не наблюдалось. Это может быть частично связано с генетическим фоном мышей.Например, у мышей C57BL/6N при заражении мышиным патогеном Citrobacter rodentium развивается только умеренная диарея (Bhinder et al., 2013), тогда как у мышей FVB/N наблюдается тяжелая диарея и смертность (Borenshtein et al., 2008).
На нагрузку и разнообразие комменсального микробиома большое влияние оказывает транспорт эпителиальных ионов в кишечнике (De Lisle, 2007; Gurney et al., 2017; Keely et al., 2012). Потеря GC-C у мышей приводит к дисбактериозу кишечной микробиоты с более низким содержанием Lactobacillus (Majumdar et al., 2018). Известно, что комменсал Lactobacillus играет защитную роль против воспалительных заболеваний, влияя на функционирование Т-регуляторных клеток (Т-регуляторных клеток). Повышенное количество Proteobacteria с сопутствующим снижением Lactobacillus обнаруживается у пациентов с ВЗК (Sartor, 2008). У пациентов с ФГДС наблюдалось повышенное количество Enterobacteriaceae (γ Proteobacteria), что связано с воспалением кишечника и симптомами, сходными с болезнью Крона (Tronstad et al., 2017). В физиологических условиях эпителий толстой кишки подвергается β-окислению и истощает кислород в просвете, что приводит к анаэробной среде.Однако во время воспаления эпителиальные клетки толстой кишки теряют способность к β-окислению, что приводит к увеличению кислорода в просвете, дисбактериозу микробиома и цветению протеобактерий (Hughes et al., 2017). Это увеличение Proteobacteria и уменьшение Lactobacillus также наблюдается у нокаутных мышей Nhe3 -/- (Larmonier et al., 2013). Таким образом, микробный дисбиоз, наблюдаемый у мышей S839I, напоминает таковой у пациентов с ВЗК и мышиными моделями колита (рис. 5).
Положительная роль передачи сигналов GC-C во время ВЗК подтверждается наблюдением, что у пациентов с ВЗК наблюдается значительное снижение уровней транскриптов GUCA2A , GUCA2B и GUCY2C , и потеря этих белков связана с тяжести заболевания у пациентов (Brenna et al., 2015; Лан и др., 2016). Мы наблюдали аналогичные изменения у наших мышей после лечения DSS (рис. 4 C). Однако, как это ни парадоксально, у пациентов с мутацией p.S840I в GC-C проявляются признаки БК, СРК и обструкции подвздошной кишки из-за воспаления (Fiskerstrand et al., 2012). Возможно, снижение экспрессии GC-C и лиганда после лечения DSS является компенсаторным механизмом, который может противодействовать повышению уровня цГМФ, наблюдаемому у мышей S839I. Кроме того, пути, не регулируемые непосредственно цГМФ, также могут неправильно регулироваться у этих мышей, что, в свою очередь, может иметь обратную связь с регуляцией GC-C и его лигандов.Поскольку мыши, лишенные Nhe3 , проявляют предрасположенность к колиту, индуцированному DSS (Kiela et al., 2009), поток электролитов и дисбаланс в кишечнике в сочетании с изменениями в микробиоме могут быть отдаленными факторами повышенной восприимчивости к химически индуцированному колиту. колит (Prasad and Visweswariah, 2021).
RNA-seq показал, что несколько генов, связанных с воспалением кишечника и колитом, неправильно регулируются у мышей S839I.Действительно, паттерн экспрессии генов подобен наблюдаемому в толстой кишке мышей, получавших DSS (Fig. 7), и, что важно, у пациентов с ВЗК (Lamas et al., 2016; Zhao et al., 2015). Почти все гены, экспрессия которых подтверждена в биоптатах пациентов с активным ЯК (Zhao et al., 2015), аналогичным образом активируются у мышей S839I. К ним относятся STAT1 , IRF1 , IRF9 , IFIT2 , IFIT3 , IFITM2 , OAS2
8 1 и OAS28 1.Здесь мы показываем, что у мышей S839I наблюдается значительное увеличение уровней общего и фосфорилированного Stat1 (рис. 6, C и D), что может способствовать увеличению экспрессии ISG. Из-за значительного увеличения общего Stat1 у мышей S839I в ткани может быть значительная фракция нефосфорилированного Stat1, которая также может способствовать экспрессии ISG. Эта неканоническая передача сигналов STAT через нефосфорилированные STAT или монофосфорилированные STAT Ser727 была описана ранее при вирусной инфекции (Cheon et al., 2013). Например, фосфорилированные STAT дефосфорилируются после попадания в ядро, но экспрессия генов-мишеней продолжается (Bandyopadhyay et al., 2008; Cheon and Stark, 2009). Следовательно, конститутивная экспрессия гиперактивного S839I в кишечнике этих мышей приводит к хроническому состоянию активации STAT1. Поэтому мы предполагаем, что GC-C через цГМФ модулирует содержание и активность STAT1 в эпителии кишечника, что приводит к базальному воспалительному сигналу, наблюдаемому у мышей S839I, который усиливается в присутствии агента, вызывающего колит.С этим согласуется тот факт, что воспаление было уменьшено у мышей Stat1 −/− после лечения DSS (Bandyopadhyay et al., 2008) и у мышей Ido1 − / ( Ido1 активируется у мышей S839I; рис. 6, C и G) показывает снижение тяжести колита, индуцированного DSS (Shon et al., 2015).Таким образом, мы разработали модель FGDS на мышах и идентифицировали GC-C как ключевой регулятор кишечного гомеостаза и здорового функционирования кишечника.Наши результаты показывают множество последствий гиперактивации GC-C в эпителии кишечника, включая диарею, дисбиоз кишечной микробиоты и восприимчивость к воспалению кишечника. Эта модель мыши открывает возможности для изучения роли цГМФ в кишечнике и помогает в идентификации различных мишеней для ингибирования гиперактивной передачи сигналов GC-C с использованием культур органоидов ex vivo. Важно отметить, что эта мутантная мышь может служить моделью ST-опосредованной диареи, вызванной энтеротоксигенной инфекцией E. coli , которая является причиной смертности и заболеваемости детей в развивающихся странах.
МышиGucy2c S839I/S839I (S839I) были созданы с помощью рекомбинации FLP-FRT компанией Taconic Denmark (рис. S1 A). Вкратце, мутацию p.S839I вводили в экзон 22, а пуромициновую кассету, фланкированную сайтами FRT, вводили в интрон 21. Векторы-мишени создавали с использованием клонов ВАС из библиотеки ВАС C57BL/6J RPCIB-731 и трансфицировали в Taconic Линия клеток Artemis C57BL/6N Tac ES (эмбриональных стволовых клеток).Гомологичные рекомбинантные клоны отбирали с использованием положительной (PuroR) и отрицательной (тимидинкиназа) селекции. После получения клонов суперовулировавших самок BALB/c скрещивали с самцами BALB/c. Бластоцисты были выделены из матки через 3,5 дня после полового акта. В бластоцисты микроинъецировали ЭС клетки C57BL/6NTac с мутацией p.S839I в Gucy2c . После выздоровления восемь инъецированных бластоцист переносили в каждый рог матки через 2,5 дня после полового акта у ложнобеременных самок NMRI.Химеризм измеряли по вкладу окраски ES-клеток в хозяина BALB/c (черный/белый). Химерных мышей скрещивали с самками C57BL/6N Tac. Партнеры по спариванию C57BL/6N Tac были мутантными по наличию гена рекомбиназы (Flp-Deleter). Зародышевую передачу точечной мутации идентифицировали по наличию черного потомства C57BL/6N Tac.
Были получены две племенные пары гомозиготных мышей, которые подверглись обратному скрещиванию с мышами дикого типа C57BL/6N Tac в течение 10 поколений.Все процедуры проводились в соответствии с Правилами контроля и надзора 1998 г. Закона о Министерстве окружающей среды и лесного хозяйства (правительство Индии) и Комитета по этике животных Индийского института науки (одобрение CAF/Ethics/547/2017). Все животные были выращены и содержались в одном виварии. Мышей содержали в помещении с чистым воздухом в нескольких клетках и разделяли по полу и генотипу. Температуру поддерживали на уровне 22 ± 2°C, влажность поддерживали на уровне 55% ± 10%, а для мышей поддерживали 12-часовой цикл свет/темнота.Мыши имели свободный доступ к лабораторному корму и воде. Чау-чау был закуплен у Altromin International и содержал около 24% белка, 6% масла и 3% пищевых волокон. Мышей обоих полов использовали для экспериментов, если не указано иное.
Геномную ДНК для генотипирования выделяли методом HotShot (Truett et al., 2000). Вкратце, отрезок хвоста длиной 2 мм инкубировали в 75 мкл буфера для лизиса (25 мМ NaOH и 0,2 мМ ЭДТА) при 95°C в течение 1 часа.Затем пробирку охлаждали до комнатной температуры и добавляли 75 мкл нейтрализующего буфера (40 мМ Tris HCl, pH 5,5). После центрифугирования при 3000 rcf в течение 5 мин отбирали аликвоту супернатанта для ПЦР. ПЦР с использованием 2 мкл супернатанта проводили с наборами праймеров Gucy2c_27 (5′-TGAACAGTACCCAGGAGATTAGG-3′) и Gucy2c_28 (5′-AACAGTTGCAGA). ATCCTTGAGG-3′), как показано на рис. S1 B. Аллель Gucy2c S839I/S839I давал продукт длиной 371 п.н., в то время как аллель Gucy2c WT/WT давал Продукт длиной 302 п.н. (рис.С1).
Для всех экспериментов мы использовали Помощник по проектированию экспериментов (RRID: SCR_017019; https://eda.nc3rs.org.uk) для расчета количества животных, необходимых для экспериментов. Помощник по планированию экспериментов учитывает 3R (замена, уточнение и сокращение) при анализе и оценке количества животных, необходимых для эксперимента.
Мышей забивали CO 2 асфиксией, и 5 см толстой кишки и 10 см терминального отдела подвздошной кишки собирали, промывали охлажденным льдом HBSS, разрезали в продольном направлении, погружали в диссоциирующий буфер IEC, содержащий 10 мМ Hepes, 1 мМ ЭДТА, 71.5 мМ β-меркаптоэтанола и 500 мкМ 3-изобутил-1-метилксантина (IBMX) для ингибирования фосфодиэстераз и хранят на льду. Ткани инкубировали при 37°С, 100 об/мин в течение 45 мин и встряхивали в течение 30 с, после чего осторожно удаляли кусочки ткани. Пробирки центрифугировали при 3000 об/мин в течение 10 мин при 4°С. Осадок, содержащий IEC, дважды промывали ледяным PBS и, наконец, ресуспендировали в буфере для гомогенизации, содержащем 50 мМ Hepes, pH 7,5, 100 мМ NaCl, 5 мМ EDTA, 1 мМ дитиотреитола, 5 мкг/мл ингибитора трипсина соевых бобов (SBTI). , 5 мкг/мл лейпептина, 5 мкг/мл апротинина, 2 мМ PMSF, 10 мМ ортованадата натрия, 1 мМ пирофосфата натрия, 20 мМ фторида натрия и 500 мкМ IBMX.Клетки лизировали ультразвуком при 60 циклах, амплитуда 60%, 10 импульсов (каждый импульс, 5 с; IKA Labortechnik). Суспензию центрифугировали при 12000 g в течение 60 мин. Осадок, содержащий мембранную фракцию, ресуспендировали в буфере, содержащем 50 мМ Hepes, pH 7,5, 20% глицерина, 5 мкг/мл SBTI, 5 мкг/мл лейпептина, 5 мкг/мл апротинина, 2 мМ PMSF и 1 мМ ортованадата натрия. и оценивали концентрацию белка. Мембранные препараты использовали для анализа связывания 125 I-меченого ST Y72F , как описано ранее (Saha et al., 2009) и вестерн-блоттинг.
Для оценки цГМФ изолированные и интактные клетки, полученные из ~5 см толстой кишки или 10 см терминального отдела подвздошной кишки, ресуспендировали в PBS, и аликвоту суспензии клеток брали для оценки белка с помощью анализа Брэдфорда (Bradford, 1976). ). Клетки собирали центрифугированием, ресуспендировали в 0,1 N HCl и нагревали при 95°C в течение 5 мин. Затем смесь центрифугировали при 17000 rcf в течение 10 мин при 4°C.Собирали надосадочную жидкость и определяли уровни цГМФ с использованием набора ELISA для цГМФ (Cayman Chemicals). Уровни циклического GMP нормализовали по количеству белка, взятого для ELISA cGMP.
8-недельных самцов мышей дикого типа или мышей S839I умерщвляли путем асфиксии CO 2 , а 3 см дистального отдела толстой кишки собирали и мгновенно замораживали в жидком азоте. Замороженную ткань измельчали в порошок в жидком азоте с помощью ступки и пестика.Измельченную ткань переносили в буфер для гомогенизации, содержащий 50 мМ Hepes, pH 7,5, 100 мМ NaCl, 5 мМ ЭДТА, 1 мМ дитиотреитола, 5 мкг/мл SBTI, 5 мкг/мл лейпептина, 5 мкг/мл апротинина, 2 мМ фенилметилсульфонилфторида. , 10 мМ ортованадата натрия, 1 мМ пирофосфата натрия и 20 мМ фторида натрия. Экстракт затем подвергали обработке ультразвуком при 60 циклах, амплитуде 60% (каждый импульс, 5 с; IKA Labortechnik) с последующим центрифугированием при 12000 g в течение 60 мин. Осадок, содержащий мембранную фракцию, ресуспендировали в буфере, содержащем 50 мМ Hepes, pH 7.5, 20% глицерина, 5 мкг/мл SBTI, 5 мкг/мл лейпептина, 5 мкг/мл апротинина, 2 мМ фенилметилсульфонилфторида и 1 мМ ортованадата натрия. Собирали супернатант, содержащий цитозоль. Концентрацию белка в мембранной и цитозольной фракциях оценивали с помощью модифицированного теста Бредфорда (Bradford, 1976). Для вестерн-блоттинга использовали как мембранную, так и цитозольную фракции, в зависимости от клеточной локализации тестируемого антигена.
Мембранные или цитозольные белки из клеток HEK293E, IEC мыши или экстракты тканей толстой кишки разделяли на полиакриламидных гелях (SDS-PAGE) и переносили на поливинилиденфторидную мембрану Immun-Blot (Bio-Rad) в буфере для переноса (25 мМ Tris base, 192). мМ глицин и 20% метанол, рН 8.3) при −160 В и 200 мА в течение 120 мин. Поливинилиденфторидные мембраны промывали в 10 мМ Tris-Cl, pH 7,2, 100 мМ NaCl и 0,1% Tween 20 (TBS-T) и блокировали в течение 1 ч при комнатной температуре с использованием 5% блокирующего раствора (GE Healthcare), приготовленного в TBS. -Т. Мембрану инкубировали с указанными антителами в течение ночи (12–14 ч) при 4°С с последующим трехкратным промыванием TBS-T. Затем мембрану инкубировали с антимышиным IgG (в разведении 1:6000) или антикроличьим IgG (в разведении 1:30000), конъюгированным с пероксидазой хрена, в течение 1 ч при комнатной температуре с последующими тремя промываниями TBS-T.Иммунореактивные полосы визуализировали с помощью хемилюминесценции, обнаруженной с использованием реагента Immobilon (Millipore) на системе визуализации Chemidoc XRS+ (Bio-Rad). Использовали антитела против виллина и Na + /K + аденозинтрифосфатазы в разведении 1:5000. Антитела анти-pSTAT1 Ser 727, анти-pSTAT1 Tyr701, анти-STAT1, анти-TAP1, анти-ISG15 и анти-β-актин использовали в разведении 1:1000. Антитело анти-Ido1 использовали в разведении 1:4000. Антитело анти-NHE3 использовали в разведении 1:2000.Антитело против PKGII использовали в разведении 1:2000. Источники всех коммерческих антител показаны в Таблице S2.
Моноклональное антителоGCC:4B11 было получено против домена гомологии киназы человеческого GC-C и доступно в лаборатории. Супернатант от культивируемых клеток использовали для вестерн-блоттинга в разведении 1:100.
Частоту стула определяли, как описано ранее (De Palma et al., 2015). Использовались 4-недельные мыши, и эксперимент проводился между 8:00 и 9:00 утра. Мышей помещали в свежие автоклавированные клетки без какого-либо подстилочного материала, и количество гранул, прошедших через первые 10 минут, регистрировали как частота дефекации. Опыты проводили трижды в течение года на независимых пометах.
Для определения общего времени прохождения кишечника мышам, не находившимся натощак (в возрасте 7–8 недель), вводили через зонд 200 мкл неабсорбируемого маркерного красителя (6% мас./об. карминового красного в стерилизованных фильтром 0.5% метилцеллюлоза). Мыши содержались индивидуально в чистых клетках без подстилки с доступом к пище и воде. Мышей проверяли на выход с 15-минутными интервалами. Время, необходимое для прохождения первой фекальной гранулы с карминовым красным, регистрировали как общее время прохождения по кишечнику. Опыты проводили трижды в течение года на независимых пометах.
Скорость транзита по тонкому кишечнику и GE оценивали с использованием параметров GC и GE, как описано ранее (Sobczak et al.2014) с некоторыми изменениями. Вкратце, мышей в возрасте 8–12 недель не кормили в течение ночи со свободным доступом к воде. В день эксперимента мышей взвешивали и через рот вводили через зонд 200 мкл стерилизованной на фильтре смеси маркерных красителей (50 мг/100 мл фенолового красного в 0,5% метилцеллюлозе). Через 30 мин после введения маркерного красителя мышей умерщвляли, отделяли желудочно-кишечный тракт и выдерживали в охлажденном состоянии для уменьшения дальнейшей перистальтики, а вскрытие проводили как можно быстрее. Для ГХ-анализа тонкую кишку измеряли и делили на 10 равных частей.Сегменты кишечника переносили в пробирку, содержащую 1 мл дистиллированной воды, и гомогенизировали таким образом, чтобы содержимое кишечника попало в воду. Пробирки осторожно встряхивали и центрифугировали при 3000 g в течение 5 мин. После этого 250 мкл супернатанта переносили в другую свежую пробирку, содержащую 250 мкл 1 н. NaOH, и оставляли для развития окраски. Интенсивность окраски измеряли калориметрически при 560 нм с использованием спектрофотометра (Tecan Infinite M200 Pro; Tecan, Швейцария).GC тонкой кишки рассчитывали по следующей формуле:GC = Σ [(% А на сегмент × число сегментов)/100],
, где GC находится в диапазоне от 1 (минимальная подвижность) до 10 (максимальная подвижность).Для определения ГЭ мышей тщательно вскрывали желудок, его содержимое переносили в пробирку с 2 мл дистиллированной воды, осторожно встряхивали смесь с последующим центрифугированием при 3000 g в течение 5 мин.500 мкл супернатанта переносили в другую пробирку, содержащую 500 мкл 1 н. NaOH, для достижения максимальной интенсивности окраски. Интенсивность окраски (200 мкл) измеряли при 560 нм с помощью спектрофотометра. Процент красителя, который присутствовал в тонком кишечнике, от общего количества красителя, присутствующего в желудке и тонком кишечнике, был отражением ГЭ.
Чтобы протестировать опосредованное линаклотидом увеличение скорости транзита тонкой кишки, анализы GC и GE были выполнены с использованием протокола, описанного ранее (Bryant et al.2010) с некоторыми изменениями. Мышей не кормили в течение ночи с неограниченным доступом к воде. Мышей взвешивали и перорально вводили 100 мкг/кг массы тела линаклотида (Cayman Chemicals), приготовленного в 25 мМ Tris-HCl, pH 7,5. Мышей помещали в их клетки на 10 минут, а затем умерщвляли и проводили анализы GC и GE.
Для определения влияния Cftr(inh)-172 (Sigma-Aldrich) на скорость транзита по тонкой кишке мышам, голодавшим в течение ночи, перорально вводили через зонд 200 мкг Cftr(inh)-172, приготовленного в 10% масс./об. D-α- Токоферол полиэтиленгликоль 1000 сукцинат (TPGS).Контрольные мыши получали только носитель (Thiagarajah et al., 2004). Мышей возвращали в их клетки на 3 часа, после чего проводили анализы GC и GE.
Чтобы определить влияние тенапанора (ингибитор NHE3; MedChem Express) на моторику тонкой кишки, мышей не кормили в течение ночи и перорально вводили через зонд тенапанор в дозе 1 мг/кг (McHugh et al., 2018), приготовленный в 10% TPGS. Контрольные мыши получали только носитель.Мышей возвращали в их клетки на 2 часа, после чего проводили анализы GC и GE.
Экстракцию ДНК из экскрементов мышей дикого типа ( n = 11; 8 самок и 3 самца) и мышей S839I ( n = 10; 7 самок и 3 самца) проводили с использованием набора Fast DNA SPIN для почвы. (MP Biomedicals) в соответствии с протоколом производителя, с четырьмя периодами биений по 40 с.Концентрацию ДНК нормализовали до 10 нг/мкл путем разбавления раствором для элюирования ДНК (MP Biomedicals) до конечного объема 20 мкл. Образцы ДНК были отправлены в Clevergene Biocorp Pvt Ltd для ПЦР-амплификации областей V3-V4 генов 16S рРНК и секвенирования парных концов (2 × 300 п.н.) на платформе Illumina MiSeq. Гипервариабельные области V3-V4 генов 16S рРНК амплифицировали с использованием праймеров 341F (5′-CCTACGGGNGGCWGCAG-3′) и 805R (5′-GACTACHVGGGTATCTAATCC-3′) (Klindworth et al., 2013).
Необработанные чтения парных концов были получены в формате fastq с платформы Illumina MiSeq.Таблицы таксономической численности были сгенерированы из файлов fastq с использованием конвейера dada2 (v1.14.0) для чтения парных концов (Callahan et al., 2016) в R (v3.6.1). Вкратце, графики показателей качества прочтений последовательностей были проверены для определения точек снижения качества прочтений на основе того, какие из прямых и обратных прочтений были усечены на 270 и 230 позициях соответственно. Последовательности праймеров удаляли путем обрезки 22 п.н. с левого конца необработанных прочтений. Химерные последовательности удаляли с помощью функции удаления Chimera Denovo с методом логического вывода объединенных выборок.Таксономия была назначена вариантам последовательностей ампликонов без химер (ASV) с использованием базы данных Silva (v138, загружено из McLaren, 2020). Данные были отфильтрованы для удаления ASV, отнесенных к митохондриям, хлоропластам или другим небактериальным царствам, и ASV с общей частотой менее двух (синглетонов) с использованием пакета phyloseq R (McMurdie and Holmes, 2013; v1.30.0). Показатели бета-разнообразия были визуализированы с использованием графика анализа основных координат, основанного на несходстве Брея-Кертиса, с использованием пакета микробиома R (Lahti et al., 2017; v1.8.0). Относительная численность на таксономическом уровне типов и родов была основана на количестве ASV, нормализованном в процентах (100 * [×/сумма(×)]). Значимость различий между индексом разнообразия Шеннона была определена с использованием критерия суммы рангов Уилкоксона (P <0,05) в пакете микробиома R, в то время как значительная разница в относительной численности таксонов между мышами дикого типа и S839I была проверена с использованием критерия Крускала-Уоллиса в статистическом пакете STAMP. программное обеспечение (Паркс и др., 2014).
Прогнозирование функционального состава микробиома кишечника на основе набора данных подсчета ASV гена 16S рРНК и репрезентативной последовательности каждого ASV было выполнено с использованием инструмента Piphillin (Narayan et al., 2020). Вкратце, этот инструмент предсказывает функциональные атрибуты микробных сообществ посредством прямого сопоставления ближайших соседей между ампликонами гена 16S рРНК и геномами из эталонных баз данных. Прогноз был выполнен при отсечении ID 97% с использованием справочных баз данных KEGG (выпуск от мая 2020 г.) и BioCyc22.5. Выходные данные Piphillin анализировали с помощью статистического программного обеспечения STAMP с использованием непараметрического теста Крускала-Уоллиса с апостериорным тестом Тьюки-Крамера (Parks et al., 2014).
Эта статья посвящается памяти Др.Торунна Фискерстранда, чей энтузиазм по поводу разработки этой модели мыши был мотивационным.
Мы благодарим д-ра Halvor Sommerfelt за его интерес и поддержку этой работы и д-ра Avinash R. Shenoy за внимательное прочтение статьи и критические предложения. Мы признательны за помощь доктору Харини Рамани и Яшике Бопанне в экспериментах на мышах.
Подтверждена поддержка Департамента биотехнологии Министерства науки и технологий Индии (BT/PR15216/COE/34/02/2017), а также Партнерской программы DBT-IISc, фаза II (BT/PR27952/INF/ 22/212/2018/21.01.2019). С. С. Висвесвариа является национальным научным сотрудником JC Bose (SB/S2/JCB-18/2013) и научным сотрудником Margdarshi при поддержке Wellcome Trust DBT India Alliance (IA/M/16/502606). Финансовая поддержка со стороны Helse Vest Norway, Центра международного здравоохранения, Департамента глобального здравоохранения и первичной медико-санитарной помощи Бергенского университета, Норвегия, и Инициативы PATH по энтеральным вакцинам (https://www.path.org) признается поколению модели мыши. SS Visweswariah также выражает признательность Королевскому обществу Великобритании за поддержку совместного гранта для профессоров-исследователей (IC60080) и финансирование гранта Билла и Мелинды Гейтс на исследование грандиозных задач с идентификатором гранта OPP1106646.
Вклад авторов: В. Мишра, А. Бозе, С. Киран, С. Банерджи, И.А. Шах, П. Чаукимат, М.М. Реши и С. Шринивас провели эксперименты и проанализировали данные; А. Барман поддерживал и помогал в экспериментах на животных; В. Мишра, А. Боуз, С. Киран и С. Банерджи написали первоначальные наброски рукописи; и С. С. Висвесвария задумали исследование, разработали анализ и завершили рукопись.
Дисбактериоз, дисфункция кишечного барьера и воспаление при деменции: пилотное исследование | BMC Geriatrics
Деменция.Информационный бюллетень ВОЗ 2016 г.
Google Scholar
Колер К.А., Маес М., Слепченко А., Берк М., Солми М., Ланктот К.Л., Карвалью А.Ф. Ось кишечник-мозг, включая микробиом, дырявую кишку и бактериальную транслокацию: механизмы и патофизиологическая роль при болезни Альцгеймера. Курр Фарм Дез. 2016;22(40):6152–66.
КАС пабмед Google Scholar
Erny D, Hrabe de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, Keren-Shaul H, Mahlakoiv T, Jakobshagen K, Buch T, et al.Микробиота хозяина постоянно контролирует созревание и функцию микроглии в ЦНС. Нат Нейроски. 2015;18(7):965–77.
КАС пабмед ПабМед Центральный Google Scholar
О’Тул П.В., Джеффри И.Б. Микробиота кишечника и старение. Наука. 2015;350(6265):1214–5.
КАС пабмед Google Scholar
Xu Z, Knight R. Влияние диеты на разнообразие микробиома кишечника человека.Бр Дж Нутр. 2015;113(Прил.):S1–5.
КАС пабмед Google Scholar
Haran JP, Bucci V, Dutta P, Ward D, McCormick B. Стабильность микробиома пожилых людей в доме престарелых и связь с возрастом, слабостью, питанием и физическим местоположением. J Med Microbiol. 2018;67(1):40–51.
КАС пабмед Google Scholar
Zhang L, Wang Y, Xiayu X, Shi C, Chen W, Song N, Fu X, Zhou R, Xu YF, Huang L и другие.Измененная микробиота кишечника в мышиной модели болезни Альцгеймера. Дж. Альцгеймера Дис. 2017;60(4):1241–57.
КАС пабмед Google Scholar
Harach T, Marungruang N, Duthilleul N, Cheatham V, Mc Coy KD, Frisoni G, Neher JJ, Fak F, Jucker M, Lasser T, et al. Уменьшение патологии Abeta-амилоида у трансгенных мышей APPPS1 в отсутствие кишечной микробиоты. Научный доклад 2017; 7: 41802.
КАС пабмед ПабМед Центральный Google Scholar
Vogt NM, Kerby RL, Dill-McFarland KA, Harding SJ, Merluzzi AP, Johnson SC, Carlsson CM, Asthana S, Zetterberg H, Blennow K, et al.Изменения микробиома кишечника при болезни Альцгеймера. Научный доклад 2017; 7 (1): 13537.
ПабМед ПабМед Центральный Google Scholar
Саджи Н., Ниида С., Муротани К., Хисада Т., Цудуки Т., Сугимото Т., Кимура А., Тоба К., Сакураи Т. Анализ взаимосвязи между микробиомом кишечника и деменцией: поперечное исследование, проведенное в Японии . Научный доклад 2019; 9 (1): 1008.
ПабМед ПабМед Центральный Google Scholar
Haran JP, Bhattarai SK, Foley SE, Dutta P, Ward DV, Bucci V, McCormick BA.Микробиом болезни Альцгеймера связан с нарушением регуляции противовоспалительного пути P-гликопротеина. мБио. 2019;10(3):e00632–19.
КАС пабмед ПабМед Центральный Google Scholar
Auer SR, Hofler M, Linsmayer E, Berankova A, Prieschl D, Ratajczak P, Steffl M, Holmerova I. Поперечное исследование распространенности деменции, поведенческих симптомов, подвижности, боли и других параметров здоровья в домах престарелых в Австрии и Чехии: результаты проекта DEMDATA.БМС Гериатр. 2018;18(1):178.
ПабМед ПабМед Центральный Google Scholar
Sanders CL, Wengreen HJ, Schwartz S, Behrens SJ, Corcoran C, Lyketsos CG, Tschanz JT, Cache County I. Пищевой статус связан с тяжелой деменцией и смертностью: исследование прогрессирования деменции в округе Кэш. Альцгеймер Dis Assoc Disord. 2018;32(4):298-304. https://doi.org/10.1097/WAD.0000000000000274. PMID: 30188355; PMCID: PMC6345543.
Vandewoude MFJ, van Wijngaarden JP, De Maesschalck L, Luiking YC, Van Gossum A.Распространенность и бремя недоедания среди бельгийских пожилых людей, проживающих в обществе или проживающих в домах престарелых: результаты исследования NutriAction II. Старение Clin Exp Res. 2019;31(2):175-83. https://doi.org/10.1007/s40520-018-0957-2.
Maier L, Pruteanu M, Kuhn M, Zeller G, Telzerow A, Anderson EE, Brochado AR, Fernandez KC, Dose H, Mori H, et al. Обширное влияние неантибиотических препаратов на кишечные бактерии человека. Природа. 2018; 555 (7698): 623–8.
КАС пабмед ПабМед Центральный Google Scholar
Wastesson JW, Cedazo Minguez A, Fastbom J, Maioli S, Johnell K.Состав полипрагмазии: исследование на основе регистров шведов в возрасте 75 лет и старше. ПЛОС Один. 2018;13(3):e0194892.
ПабМед ПабМед Центральный Google Scholar
Жернакова А., Курильщиков А., Бондер М.Дж., Тигчелаар Э.Ф., Ширмер М., Ватанен Т., Муягич З., Вила А.В., Фалони Г., Виейра-Силва С. и другие. Популяционный метагеномный анализ выявляет маркеры состава и разнообразия кишечного микробиома. Наука. 2016;352(6285):565–9.
КАС пабмед ПабМед Центральный Google Scholar
Rubenstein LZ, Harker JO, Salva A, Guigoz Y, Vellas B. Скрининг недостаточного питания в гериатрической практике: разработка краткой мини-оценки питания (MNA-SF). J Gerontol A Biol Sci Med Sci. 2001;56(6):M366–72.
КАС пабмед Google Scholar
Фолштейн М.Ф., Фолштейн SE, МакХью Пр.«Мини-психическое состояние». Практический метод оценки когнитивного состояния пациентов для клинициста. J Psychiatr Res. 1975; 12(3):189–98.
КАС пабмед Google Scholar
Шульман К.И. Рисование часов: идеальный ли это когнитивный скрининг-тест? Int J Geriatr Psychiatry. 2000;15(6):548–61.
КАС пабмед Google Scholar
S3-Leitlinie Demenzen.2016. Deutsche Gesellschaft für Neurologie, Hrsg. Leitlinien für Diagnostik und Therapie in der Neurologie.
Google Scholar
Климиук И., Билгилиер С., Штадльманн А., Таннесбергер Дж., Кастнер М.Т., Хогенауэр С., Пускок А., Биовски-Фротц С., Шрутка-Колбл С., Таллингер Г.Г., и другие. Микробиом желудка человека обусловлен инфицированием Helicobacter pylori. Фронт микробиол. 2017;8:2508.
ПабМед ПабМед Центральный Google Scholar
Horvath A, Leber B, Schmerboeck B, Tawdrous M, Zettel G, Hartl A, Madl T, Stryeck S, Fuchs D, Lemesch S, et al.Рандомизированное клиническое исследование: влияние мультивидового пробиотика по сравнению с плацебо на функцию врожденного иммунитета, бактериальную транслокацию и проницаемость кишечника у пациентов с циррозом печени. Алимент Фармакол Тер. 2016;44(9):926–35.
КАС пабмед ПабМед Центральный Google Scholar
Hall M, Beiko RG. Анализ гена 16S рРНК с помощью QIIME2. Методы Mol Biol (Клифтон, Нью-Джерси). 2018; 1849: 113–29.
КАС Google Scholar
Каллахан Б.Дж., Макмерди П.Дж., Розен М.Дж., Хан А.В., Джонсон А.Дж., Холмс С.П.DADA2: вывод образца с высоким разрешением на основе данных ампликона Illumina. Нат Методы. 2016;13(7):581–3.
КАС пабмед ПабМед Центральный Google Scholar
Координаторы NR. Ресурсы базы данных Национального центра биотехнологической информации. Нуклеиновые Кислоты Res. 2016;44(Д1):Д7–19.
Google Scholar
Закржевски М., Проетти С., Эллис Дж. Дж., Хасан С., Брион М. Дж., Бергер Б., Краузе Л.Calypso: удобный веб-сервер для анализа и визуализации взаимодействия микробиома и окружающей среды. Биоинформатика. 2017;33(5):782–3.
КАС пабмед Google Scholar
Мандал С., Ван Треурен В., Уайт Р.А., Эггесбо М., Найт Р., Педдада С.Д. Анализ состава микробиомов: новый метод изучения микробного состава. Microb Ecol Health Дис. 2015;26:27663.
ПабМед Google Scholar
Сегата Н., Изард Дж., Уолдрон Л., Геверс Д., Миропольски Л., Гарретт В.С., Хаттенхауэр К.Открытие и объяснение метагеномных биомаркеров. Геном биол. 2011;12(6):R60.
ПабМед ПабМед Центральный Google Scholar
Команда RC. R: язык и среда для статистических вычислений. Вена: R Foundation for Statistical Computing; 2019.
Google Scholar
Лиам А., Винер М. Классификация и регрессия с помощью randomForest. Р Новости. 2002;2(3):18–22.
Google Scholar
Кассамбара А. ggcorplot: Визуализация матрицы корреляции с использованием ‘ggplot2; 2019.
Google Scholar
van Buren S, Groothuis-Oudshoorn K. Мыши: многомерное вменение с помощью цепных уравнений в R. J Stat Softw. 2011;45(3):1–67.
Google Scholar
Ревель В.psych: Процедуры личностных и психологических исследований. Эвастон: Северо-Западный университет; 2018.
Google Scholar
Альфонс А. Надежные методы обработки многомерных данных; 2019.
Google Scholar
Rundel C, Cetinkaya-Rundel M, Clyde M, Banks D. statsr: сопутствующий пакет статистики; 2018.
Google Scholar
Наказава М.fmsb: Функции для книги медицинской статистики с некоторыми демографическими данными; 2018.
Google Scholar
Ticinesi A, Tana C, Nouvenne A, Prati B, Lauretani F, Meschi T. Микробиота кишечника, когнитивная слабость и деменция у пожилых людей: систематический обзор. Clin Interv Старение. 2018;13:1497–511.
КАС пабмед ПабМед Центральный Google Scholar
Араос Р., Андреатос Н., Угалде Дж., Митчелл С., Милонакис Э., Д’Агата Е.М.С.Фекальный микробиом обитателей домов престарелых с развитой деменцией и Clostridium difficile. Dig Dis Sci. 2018;63(6):1525–31.
ПабМед ПабМед Центральный Google Scholar
Клаэссон М.Дж., Кьюсак С., О’Салливан О., Грин-Диниз Р., де Вирд Х., Фланнери Э., Маркези Дж.Р., Фалуш Д., Динан Т., Фитцджеральд Г. и др. Состав, изменчивость и временная стабильность кишечной микробиоты пожилых людей. Proc Natl Acad Sci U S A.2011; 108 (Приложение 1): 4586–91.
КАС пабмед Google Scholar
Allali I, Arnold JW, Roach J, Cadenas MB, Butz N, Hassan HM, Koci M, Ballou A, Mendoza M, Ali R, et al. Сравнение платформ секвенирования и конвейеров биоинформатики для композиционного анализа микробиома кишечника. БМС микробиол. 2017;17(1):194.
ПабМед ПабМед Центральный Google Scholar
Гупта В.К., Пол С., Датта С.География, этническая принадлежность или специфические для средств к существованию вариации в составе и разнообразии микробиома человека. Фронт микробиол. 2017;8:1162.
ПабМед ПабМед Центральный Google Scholar
Барсенилла А., Прайд С.Э., Мартин Дж.С., Дункан С.Х., Стюарт С.С., Хендерсон С., Флинт Х.Дж. Филогенетические взаимоотношения бактерий, продуцирующих бутират, из кишечника человека. Appl Environ Microbiol. 2000;66(4):1654–61.
КАС пабмед ПабМед Центральный Google Scholar
Cattaneo A, Cattane N, Galluzzi S, Provasi S, Lopizzo N, Festari C, Ferrari C, Guerra UP, Paghera B, Muscio C и др.Ассоциация амилоидоза головного мозга с таксонами провоспалительных кишечных бактерий и маркерами периферического воспаления у пожилых людей с когнитивными нарушениями. Нейробиол Старение. 2017;49:60–8.
КАС пабмед Google Scholar
Михан С.Дж., Бейко Р.Г. Филогеномный взгляд на экологическую специализацию Lachnospiraceae, семейства бактерий, связанных с желудочно-кишечным трактом. Геном Биол Эвол. 2014;6(3):703–13.
КАС пабмед ПабМед Центральный Google Scholar
Ferreira-Halder CV, Faria AVS, Andrade SS.Действие и функция Faecalibacterium prausnitzii в норме и при патологии. Best Pract Res Clin Gastroenterol. 2017;31(6):643–8.
КАС пабмед Google Scholar
Li J, Wu T, Li N, Wang X, Chen G, Lyu X. Экстракт антоцианов черники способствует барьерной функции кишечника и ингибирует активность пищеварительных ферментов, регулируя микробиоту кишечника у стареющих крыс. Функция питания 2019;10(1):333–43.
КАС пабмед Google Scholar
Леблхубер Ф., Штайнер К., Шютц Б., Фукс Д., Гостнер Дж.М.Применение пробиотиков у пациентов с деменцией при болезни Альцгеймера — исследовательское интервенционное исследование. Curr Alzheimer Res. 2018;15(12):1106–13.
КАС пабмед ПабМед Центральный Google Scholar
Finegold SM, Song Y, Liu C, Hecht DW, Summanen P, Kononen E, Allen SD. Clostridium clostridioforme: смесь трех клинически важных видов. Eur J Clin Microbiol Infect Dis. 2005;24(5):319–24.
КАС пабмед Google Scholar
Матиясич Б.Б., Обермайер Т., Липоглавсек Л., Грабнар И., Августин Г., Рогель И.Связь типа питания с фекальной микробиотой у вегетарианцев и всеядных в Словении. Евр Дж Нутр. 2014;53(4):1051–64.
КАС пабмед Google Scholar
Zhu Q, Huang L, Zhu J, Lu J, Qin H. Анализ микробиоты кишечника у долгоживущих пожилых людей и их родственников: постепенное изменение с возрастом. Механическое старение Dev. 2018; 178:1–8.
ПабМед Google Scholar
Мечников Э.продление жизни; оптимистичные исследования. Нью-Йорк: Сын Г. П. Патнэма; 1908 г. https://openlibrary.org/books/OL14036242M/The_prolongation_of_life.
Ченг Л.Х., Лю Ю.В., Ву К.С., Ван С., Цай Ю.К. Психобиотики в психическом здоровье, нейродегенеративных расстройствах и нарушениях развития нервной системы. J Анал с едой и наркотиками. 2019;27(3):632–48.
КАС пабмед Google Scholar
Сингх П., Чанг Х.Дж., Ли И.А., Д’Суза Р., Ким Х.Дж., Хонг С.Т.Выяснение антигипераммонемического механизма Lactobacillus amylovorus JBD401 с помощью сравнительного геномного анализа. Геномика BMC. 2018;19(1):292.
ПабМед ПабМед Центральный Google Scholar
Leblhuber F, Geisler S, Steiner K, Fuchs D, Schutz B. Повышенный уровень кальпротектина в кале у пациентов с деменцией Альцгеймера указывает на дырявую кишку. J Neural Transm. 2015;122(9):1319–22.
КАС пабмед Google Scholar
Лебер Б., Триполт Н.Дж., Блаттл Д., Эдер М., Вашер Т.С., Пибер Т.Р., Штаубер Р., Соурий Х., Эттл К., Штадльбауэр В.Влияние пробиотических добавок на проницаемость кишечника у пациентов с метаболическим синдромом: открытое рандомизированное пилотное исследование. Eur J Clin Nutr. 2012;66(10):1110–5.
КАС пабмед Google Scholar
Linsalata M, Riezzo G, D’Attoma B, Clemente C, Orlando A, Russo F. Неинвазивные биомаркеры барьерной функции кишечника определяют два подтипа пациентов, страдающих от диареи с преобладанием СРК: исследование случай-контроль.БМК Гастроэнтерол. 2018;18(1):167.
КАС пабмед ПабМед Центральный Google Scholar
Райнер Ф., Хорват А., Сандал Т.Д., Лебер Б., Шмербок Б., Блесл А., Гросель-Стреле А., Штаубер Р.Е., Фикерт П., Стиглер П. и др. Растворимый CD163 и растворимый маннозный рецептор предсказывают выживаемость и декомпенсацию у пациентов с циррозом печени и коррелируют с проницаемостью кишечника и бактериальной транслокацией. Алимент Фармакол Тер. 2018;47(5):657–64.
КАС пабмед Google Scholar
Руан П., Гонг З.Дж., Чжан К.Р. Изменения D(-)-лактата, диаминоксидазы и эндотоксина в плазме крови у больных циррозом печени. Гепатобилиарная система поджелудочной железы Dis Int. 2004;3(1):58–61.
КАС пабмед Google Scholar
Li H, Qiu P, Wang J, Niu C, Pan S. Влияние соединения Ginkgo biloba на проницаемость кишечника у крыс с алкогольным повреждением печени.Функция питания 2015;6(2):470–8.
КАС пабмед Google Scholar
Махер Р.Л., Хэнлон Дж., Хаджар Э.Р. Клинические последствия полипрагмазии у пожилых. Экспертное заключение Drug Safe. 2014;13(1):57–65.
ПабМед Google Scholar
Паттерсон С.М., Хьюз С., Керс Н., Кардуэлл С.Р., Брэдли М.С. Мероприятия по улучшению надлежащего использования полипрагмазии у пожилых людей.Кокрановская система базы данных, ред. 2012; 5:CD008165.
Google Scholar
Horvath A, Rainer F, Bashir M, Leber B, Schmerboeck B, Klymiuk I, Groselj-Strele A, Durdevic M, Freedberg DE, Abrams JA, et al. Биомаркеры перорального приема во время длительной терапии ингибиторами протонной помпы предсказывают выживаемость при циррозе печени. Научный доклад 2019; 9 (1): 12000.
ПабМед ПабМед Центральный Google Scholar
Штадльбауэр В., Комарова И., Климиук И., Дурдевич М., Райзингер А., Блесл А., Райнер Ф., Хорват А.Тяжесть заболевания и применение ингибиторов протонной помпы наиболее сильно влияют на состав фекального микробиома при циррозе печени. Печень инт. 2020;40(4):866–77. https://doi.org/10.1111/liv.14382. Epub 2020, 24 января. PMID: 31943691; PMCID: PMC7187411.
Cohen M. Ингибиторы протонной помпы могут вызывать повышение уровня кальпротектина в фекалиях. Br J Gen Pract. 2016;66(648):350.
ПабМед ПабМед Центральный Google Scholar
Лундгрен Д., Эклоф В., Палмквист Р., Халтдин Дж., Карлинг П.Использование ингибиторов протонной помпы связано с повышенным уровнем кальпротектина в фекалиях. Поперечное исследование субъектов, направленных на колоноскопию. Scand J Гастроэнтерол. 2019;54(2):152-7. https://doi.org/10.1080/00365521.2019.1566493. Epub 2019 Jan 24. PMID: 30676120.
Poullis A, Foster R, Mendall MA, Shreeve D, Wiener K. Ингибиторы протонной помпы связаны с повышением уровня фекального кальпротектина и могут влиять на специфичность. Eur J Гастроэнтерол Гепатол. 2003;15(5):573–4, ответ автора 574.
ПабМед Google Scholar
Хаге ФГ. С-реактивный белок и артериальная гипертензия. Дж. Гум Гипертенс. 2014;28(7):410–5.
КАС пабмед Google Scholar
Волкерт Д., Чурдакис М., Факсен-Ирвинг Г., Фрувальд Т., Ланди Ф., Суоминен М.Х., Вандевуде М., Вирт Р., Шнайдер С.М. Рекомендации ESPEN по питанию при деменции. Клин Нутр. 2015;34(6):1052–73.
ПабМед Google Scholar
Миллион М, Диалло А, Рауль Д.Микробиота кишечника и недостаточность питания. Микроб Патог. 2017;106:127–38.
ПабМед Google Scholar
Злоупотребление психоактивными веществами и микробиом
Злоупотребление психоактивными веществами, также известное как злоупотребление наркотиками, относится к чрезмерному употреблению веществ, которые наносят вред себе, обществу или обоим. Некоторые из широко используемых веществ злоупотребления включают: опиоиды, кокаин, диэтиламид лизергиновой кислоты (ЛСД), марихуану и алкоголь. Злоупотребление психоактивными веществами может привести к зависимости, вызывая серьезные негативные последствия для мозга и тела.В желудочно-кишечном тракте (ЖКТ) обитает сложный набор микроорганизмов, называемых кишечной микробиотой, которые играют решающую роль в регуляции гомеостаза в организме и заболеваниях. Широкое использование технологии секвенирования нового поколения позволило обнаружить, как дисбиоз, вызванный факторами окружающей среды, может влиять на развитие и тяжесть многих клинических расстройств. Такие исследования также привели к обнаружению оси кишечник-мозг, двунаправленного пути связи между центральной нервной системой и желудочно-кишечной системой, в которой кишечная микробиота играет решающую роль.Микробиота кишечника может регулировать функции мозга посредством микробных метаболитов, в том числе короткоцепочечных жирных кислот, которые могут преодолевать гематоэнцефалический барьер. Кроме того, мозг может регулировать микробиоту кишечника через нервные, эндокринные и цитокиновые пути. Как злоупотребление психоактивными веществами вписывается в сложную взаимосвязь между кишечной микробиотой и мозгом? Это захватывающая область исследований, которая привлекает большое внимание. Уже было показано, что некоторые вещества, которыми злоупотребляют, такие как алкоголь, вызывают дисбактериоз, который может влиять на алкогольное заболевание печени из-за повышенной кишечной проницаемости.Такие результаты также открывают захватывающую возможность использования пробиотиков, лечения дисбактериоза или трансплантации фекальной микробиоты в качестве терапевтического метода для устранения негативных последствий злоупотребления психоактивными веществами.
Этот специальный выпуск посвящен тому, как расстройство, связанное с употреблением психоактивных веществ, может изменить микробиоту кишечника и повлиять на функции центральной нервной системы и других систем органов. Также целью исследования является изучение того, как стабилизация микробиоты кишечника может предотвратить негативные последствия злоупотребления психоактивными веществами.
Редакция приветствует оригинальные исследовательские статьи, обзоры, а также другие типы статей, принятые журналом.
Мы принимаем как исследовательские, так и обзорные статьи.
Интересующие темы включают, но не ограничиваются:
• Влияние злоупотребления психоактивными веществами на микробиом кишечника
• Роль дисбиоза кишечника в патогенезе расстройств, связанных с употреблением психоактивных веществ
• Ось кишечник-мозг в связи со злоупотреблением психоактивными веществами
• Взаимодействие между наркомания и микробиота
• Использование пробиотиков, пребиотиков, трансплантация фекальной микробиоты (ТФМ) и т.п. для профилактики или лечения расстройств, связанных со злоупотреблением психоактивными веществами
• Заболевания кишечного барьера, микробиоты и печени или других органов
• Взаимодействие между нервной системой, иммунной системой и кишечником микробиота
• Взаимодействие между злоупотреблением психоактивными веществами, повышенной восприимчивостью к инфекциям и микробиотой
• Роль дисбактериоза кишечника в поведенческой реакции на злоупотребление психоактивными веществами
• Ось кишечник-печень-микробиом и злоупотребление психоактивными веществами
• Терапевтические вмешательства для облегчения нарушений оси кишечник-мозг
Срок подачи рукописи продлен: 1 апреля 2022 г.>
Ключевые слова : злоупотребление психоактивными веществами, микробиом, микробиота, ось кишечник-мозг, злоупотребление наркотиками, наркомания, злоупотребление алкоголем
Злоупотребление психоактивными веществами, также известное как злоупотребление наркотиками, относится к чрезмерному употреблению веществ, которые наносят вред себе, обществу или обоим.Некоторые из широко используемых веществ злоупотребления включают: опиоиды, кокаин, диэтиламид лизергиновой кислоты (ЛСД), марихуану и алкоголь. Злоупотребление психоактивными веществами может привести к зависимости, вызывая серьезные негативные последствия для мозга и тела. В желудочно-кишечном тракте (ЖКТ) обитает сложный набор микроорганизмов, называемых кишечной микробиотой, которые играют решающую роль в регуляции гомеостаза в организме и заболеваниях. Широкое использование технологии секвенирования нового поколения позволило обнаружить, как дисбиоз, вызванный факторами окружающей среды, может влиять на развитие и тяжесть многих клинических расстройств.Такие исследования также привели к обнаружению оси кишечник-мозг, двунаправленного пути связи между центральной нервной системой и желудочно-кишечной системой, в которой кишечная микробиота играет решающую роль. Микробиота кишечника может регулировать функции мозга посредством микробных метаболитов, в том числе короткоцепочечных жирных кислот, которые могут преодолевать гематоэнцефалический барьер. Кроме того, мозг может регулировать микробиоту кишечника через нервные, эндокринные и цитокиновые пути. Как злоупотребление психоактивными веществами вписывается в сложную взаимосвязь между кишечной микробиотой и мозгом? Это захватывающая область исследований, которая привлекает большое внимание.Уже было показано, что некоторые вещества, которыми злоупотребляют, такие как алкоголь, вызывают дисбактериоз, который может влиять на алкогольное заболевание печени из-за повышенной кишечной проницаемости. Такие результаты также открывают захватывающую возможность использования пробиотиков, лечения дисбактериоза или трансплантации фекальной микробиоты в качестве терапевтического метода для устранения негативных последствий злоупотребления психоактивными веществами.
Этот специальный выпуск посвящен тому, как расстройство, связанное с употреблением психоактивных веществ, может изменить микробиоту кишечника и повлиять на функции центральной нервной системы и других систем органов.Также целью исследования является изучение того, как стабилизация микробиоты кишечника может предотвратить негативные последствия злоупотребления психоактивными веществами.
Редакция приветствует оригинальные исследовательские статьи, обзоры, а также другие типы статей, принятые журналом.
Мы принимаем как исследовательские, так и обзорные статьи.
Интересующие темы включают, но не ограничиваются:
• Влияние злоупотребления психоактивными веществами на микробиом кишечника
• Роль дисбиоза кишечника в патогенезе расстройств, связанных с употреблением психоактивных веществ
• Ось кишечник-мозг в связи со злоупотреблением психоактивными веществами
• Взаимодействие между наркомания и микробиота
• Использование пробиотиков, пребиотиков, трансплантация фекальной микробиоты (ТФМ) и т.п. для профилактики или лечения расстройств, связанных со злоупотреблением психоактивными веществами
• Заболевания кишечного барьера, микробиоты и печени или других органов
• Взаимодействие между нервной системой, иммунной системой и кишечником микробиота
• Взаимодействие между злоупотреблением психоактивными веществами, повышенной восприимчивостью к инфекциям и микробиотой
• Роль дисбиоза кишечника в поведенческой реакции на злоупотребление психоактивными веществами
• Ось кишечник-печень-микробиом и злоупотребление психоактивными веществами
• Терапевтические вмешательства для облегчения нарушений оси кишечник-мозг
Срок подачи рукописи продлен: 1 апреля 2022 г.>
Ключевые слова : злоупотребление психоактивными веществами, микробиом, микробиота, ось кишечник-мозг, злоупотребление наркотиками, наркомания, злоупотребление алкоголем
Прочтите о дисбактериозе и узнайте больше о здоровье кишечника.
Что такое дисбактериоз и каковы симптомы?
Проще говоря, слово «дисбиоз» — это термин, обозначающий дисбаланс микробиома кишечника. Мы все осознаем важность хорошего здоровья кишечника, но как узнать, когда что-то выходит из равновесия, и если да, то что с этим делать? Читайте дальше, чтобы узнать все, что вам нужно знать о дисбактериозе кишечника и о том, как пробиотики могут помочь.
В этой статье мы рассмотрим:
Как выглядит здоровый микробиом кишечника?
Короткий ответ: мы еще не уверены, так как нет двух одинаковых микробиомов.Существует огромная степень разнообразия от одного человека к другому, даже при отсутствии какого-либо очевидного плохого состояния здоровья или болезни. На самом деле считается, что наш микробиом так же уникален для нас, как и наши отпечатки пальцев, что затрудняет классификацию микробиома как «здорового» или нет. Зачастую они просто разные.
В пищеварительном тракте человека живут триллионы бактерий и других микробов. Эти популяции микробов можно разделить на три типа: «хорошие парни» (также известные как пробиотики), которые приносят пользу своему хозяину, «плохие парни» (патогены), которые могут быть вредными в больших количествах, и «комменсалы». , которые являются доброкачественными, не принося ни пользы, ни вреда своему хозяину.Собирательное название этих колоний — кишечный микробиом, и здоровье микробиома играет удивительно большую роль в нашем общем здоровье и благополучии. Узнайте больше о микробиоме в информативной статье доктора Кейт.
Наличие смеси всех трех типов микробов в кишечнике является нормальным явлением, и даже те из них, у которых нет явных признаков плохого состояния здоровья, все равно могут быть носителями патогенов. Патогены могут также включать вирусы, паразиты и дрожжевые грибки, такие как Candida albicans .Медицинские работники могут узнать больше о чрезмерном росте Candida на сайте специалистов.
Однако, пока существует достаточно полезных микробов, чтобы контролировать популяции патогенов, они не представляют для нас большой проблемы. Проблемы возникают, когда в составе микробиома кишечника происходит сдвиг в сторону большей доли патогенных микробов по сравнению с пробиотическими. Такая ситуация называется «дисбиозом».
Ученые определили многие черты, которые, по их мнению, могут быть общими для здорового микробиома.К ним относятся:
1. Типы бактерий, встречающихся в здоровом кишечнике
1Два исследования 2,3 показали, что в здоровом кишечном микробиоме (по оценке секвенирования бактериального гена) неизменно доминируют бактерии двух типов (классов бактерий): Bacteroidetes и Firmicutes. Тем не менее, эти типы огромны, поэтому остается множество различных комбинаций бактерий (принадлежащих к этим двум группам), которые можно считать «здоровым» микробиомом.(Подробнее о фирмикутах и их влиянии на наш метаболизм)
2. Количество различных микробных «семейств», населяющих кишечник
2Широко признано, что чем больше разнообразие пробиотических микробов в кишечнике, тем лучше. У них есть некоторые общие характеристики, такие как подавление патогенов, но все пробиотики выполняют немного разные функции. Следовательно, наличие большого разнообразия бактериальных «семейств» означает, что мы можем извлечь выгоду из более широкого спектра преимуществ.
3. Стабильные популяции микробов
Общепризнано, что микробиом здорового кишечника относительно стабилен. Снижение воздействия факторов, которые могут нарушить хрупкий баланс микрофлоры кишечника, таких как антибиотики 18 , необходимо для поддержания этой стабильной среды.
Что вызывает дисбактериоз?
Большое количество сахара может оказывать пагубное влияние на микробиоту кишечника.Все, что изменяет здоровье микробиома таким образом, что он становится менее способным поддерживать наше здоровье, является фактором дисбактериоза.Многие внешние воздействия и факторы образа жизни оказывают пагубное влияние на микробиом кишечника, в том числе:
1. Антибиотики
Хорошо известно, что курс антибиотиков снижает количество полезных бактерий, живущих в кишечнике, и в то же время снижает количество патогенов, против которых принимаются лекарства. В то время как некоторые виды дружественных бактерий в некоторой степени восстанавливаются после прекращения лечения антибиотиками, другие виды могут быть потеряны навсегда. Исчезновение дружественных бактерий ослабляет будущую способность сообщества исключать патогены 9 и предотвращать инфекции.
2. Некоторые лекарства
Известно, что некоторые лекарства вызывают дисбактериоз, повреждая нежную оболочку кишечника и влияя на микробиом кишечника. К таким лекарствам относятся: НПВП, противозачаточные таблетки, ЗГТ и стероидные препараты
.3. Диета с высоким содержанием сахара
Исследования показали, что диета с высоким содержанием сахара оказывает пагубное влияние на микробиоту кишечника, преимущественно питая дрожжи и патогенные виды бактерий, а не полезные штаммы бактерий 10 .Кроме того, в исследовании 2020 года обсуждалось возможное негативное влияние «новых» или новых типов сахаров, таких как химически полученные подсластители и сахарные спирты, на кишечную флору. Исследование 11 подытожило, что патогены обладают большей способностью использовать и адаптироваться к этим новым сахарам, чем дружественные виды бактерий. Это может привести к дальнейшему распространению «плохих» штаммов бактерий в кишечнике, поскольку мы ищем менее калорийные, но часто искусственные альтернативы натуральным сахарам.
4.Диеты с низким содержанием клетчатки
Клетчатка является предпочтительным источником пищи для многих различных штаммов пробиотических бактерий, живущих в кишечнике. Наши все более бедные клетчаткой диеты бросают вызов здоровью микробиома, и одно исследование показало, что это имеет «длительные» негативные последствия 12 .
5. Гормоны
Наша микробиота кишечника чувствительна к колебаниям уровня гормонов, включая половые гормоны, гормоны щитовидной железы и гормоны надпочечников. Это одна из причин, по которой женщины страдают от таких симптомов, связанных с кишечником, как запор перед менструацией или во время беременности.
6. Стресс
Стресс увеличивает уровень гормонов надпочечников, циркулирующих в крови, и по этой причине известно, что длительный стресс оказывает пагубное влияние на различные аспекты здоровья кишечника. Исследования показывают, что стресс и воздействие гормонов стресса могут сделать наш кишечник «протекающим» или более проницаемым, чем он должен быть. Стресс также изменяет иммунную активность в кишечнике и вызывает изменения в бактериальной популяции, которая там живет 13 .
7. Возраст
Хотя это и не является фактором образа жизни, наш возраст также может влиять на микробиом.По мере развития микробиома у младенцев раннего возраста мы наблюдаем значительные изменения. Затем он начинает стабилизироваться, прежде чем снова значительно измениться во время беременности, менопаузы и в пожилом возрасте. Узнайте больше о микробиоме в детские годы.
8. Заграничные поездки
Во время путешествий мы часто контактируем с микробами, отличными от тех, к которым мы привыкли, как в местной еде, так и в воде. Существует несколько патогенов, которые, как было установлено, связаны с диареей путешественников (ДТ), в том числе: E coli, виды Shigella, виды Campylobacter и норовирус 14 .
Однако не только патогены, встречающиеся в зарубежных странах, могут привести к дисбактериозу во время путешествий. Когда мы спим, также может быть фактором. Врачи из Института Вейцмана в Израиле провели увлекательное исследование, которое показало, что деятельность наших кишечных бактерий следует четкой циркадной схеме. Результаты исследования показали, что, когда «хозяин» спал, микробиом отличался от того, когда хозяин бодрствовал. Это может объяснить, почему поездки за границу и, как следствие, изменение времени сна и приема пищи могут сильно повлиять на микробиом и вызвать симптомы пищеварения 15 .
Каковы симптомы дисбактериоза?
При нарушении баланса микробиома кишечника могут возникнуть симптомы дисбактериоза. Эти симптомы могут ощущаться главным образом в желудочно-кишечном тракте как расстройство пищеварения, но также могут иметь место побочные эффекты в других частях тела, таких как, например, иммунная система и органы выделения.
Пробиотики производят полезные метаболиты, такие как витамин К и жирные кислоты с короткой цепью, которые могут использоваться организмом, в то время как патогены производят токсины.Когда у нас в кишечнике большое количество нежелательных микробов, органы выведения (печень, почки, кожа) должны работать усерднее, чтобы расщепить, а затем вывести их токсины. На коже часто можно увидеть признаки плохой детоксикации с появлением кожных заболеваний, таких как экзема, акне, псориаз.
Эмоциональное здоровье также может пострадать из-за воздействия дисбактериоза. «Психобиотика» — это область науки, специально изучающая влияние микробиома кишечника на наше настроение и психическое здоровье.Многие исследования показывают четкую связь между здоровьем кишечника и эмоциональным здоровьем, и теперь известно, что микробиом играет важную роль в нашей способности синтезировать определенные гормоны и нейротрансмиттеры. Узнайте больше об оси кишечник-мозг и пробиотиках.
Совсем недавно была обнаружена связь между дисбиозом кишечника и некоторыми метаболическими состояниями, в том числе: диабетом 2 типа, метаболическим синдромом и даже ожирением 18 . Считается, что воспаление, вызванное несбалансированной микробиотой, играет причинную роль в метаболической «дисрегуляции».В случае ожирения было замечено, что определенные типы бактерий позволяют получать больший «урожай» энергии из продуктов, которые мы едим, а также изменяют уровни доступных короткоцепочечных жирных кислот в кишечнике. Узнайте больше о кишечных бактериях и ожирении здесь.
Симптомы, связанные с кишечником, включают:
- Вздутие живота
- Избыточное газообразование/метеоризм
- Боль в животе
- Диарея
- Запор
- Воспалительные заболевания кишечника 16
- Синдром раздраженного кишечника 17
- Кислотный рефлюкс/ГЭРБ
- Галитоз
- Пищевая непереносимость/чувствительность
Другие симптомы, включая:
- Плохое настроение/беспокойство
- Проблемы со сном
- Боль в суставах
- «Затуманенное» мышление / плохая концентрация
- Кожные жалобы
- Тяга к сладкому
- Аллергии 16
- Метаболический синдром 16
- Ожирение 18
- Усталость
Как бороться с дисбактериозом?
Итак, как же побороть дисбактериоз и излечиться от множества возможных симптомов, которые могут возникнуть в результате этого? Вы будете рады услышать, что решение относительно простое.Нам просто нужно лелеять и кормить наши дружественные бактерии.
Симптомы дисбактериоза могут включать запор.Лечение дисбактериоза кишечника часто требует двоякого подхода, поскольку нам необходимо работать над искоренением патогенного разрастания, одновременно поощряя размножение здоровых пробиотических микробов.
Давайте сначала посмотрим, как уничтожить «плохих парней»:
Анализ стула
Может быть полезно узнать, какие патогены присутствуют в вашем кишечнике и сколько их.Ваш терапевт может организовать это для вас, или, если вы предпочитаете более целостный подход к своему благополучию, вы можете поработать с диетологом или травником, который также может организовать для вас набор для домашнего теста. Узнайте больше о тестировании стула.
Антимикробные препараты
В зависимости от ваших индивидуальных предпочтений, эффективный антимикробный протокол может включать либо антибиотики, назначенные вашим лечащим врачом, либо пищевые/растительные средства, назначенные квалифицированным врачом-натуралистом. Существует множество пищевых добавок с превосходными антимикробными свойствами, в том числе: аллицин (содержится в чесноке), цитрицид (содержится в экстракте семян грейпфрута), орегано, коллоидное серебро, берберин (из виноградных косточек), экстракт листьев оливы,
.Диета
Исключите из рациона определенные продукты, которые, как известно, предпочтительно питают патогенные виды бактерий и дрожжей, такие как сахар 11 , подсластители 11 и рафинированные углеводы.
Пробиотики
Пробиотические дрожжи; Saccharomyces boulardii является одним из лучших пробиотиков при дисбактериозе , и продемонстрировал его противомикробное действие во многих клинических испытаниях. Он работает несколькими способами, включая предотвращение прилипания патогенов к стенке кишечника, а также связывание их токсинов.
Вот как кормить и воспитывать «хороших парней»:
Ферментированные продукты
Такие продукты, как живой йогурт, кимчи, чайный гриб, квашеная капуста, яблочный уксус и кефир, уже сотни лет являются частью традиционных диет.Они содержат встречающиеся в природе пробиотические бактерии, которые поддерживают микробиом.
Пребиотики
Включите в свой ежедневный рацион различные источники пребиотической клетчатки, включая широкий ассортимент свежих фруктов и овощей, бобовых и цельнозерновых продуктов.
Пробиотики
Принимайте хорошо изученную высококачественную пробиотическую добавку каждый день. Различные штаммы пробиотических бактерий производят кислоты и другие побочные продукты, которые улучшают кишечную среду и способствуют дальнейшему росту здоровых видов бактерий.Таким образом, мы можем «наклонить чашу весов» в пользу полезных организмов и более здоровой микробиоты.
Несколько пробиотических штаммов, в том числе штамм Lactobacillus acidophilus NCFM ®, были изучены и показаны в клинических испытаниях 19 для восстановления и стабилизации микробиоты кишечника после антибиотикотерапии.
Вы всегда должны выбирать пробиотическую добавку, которая имеет клинические исследования для ваших основных симптомов. Таким образом, если вздутие живота является вашим конкретным симптомом дисбактериоза, лучшие пробиотики от дисбактериоза в вашем случае будут содержать штаммы, которые хорошо изучены в отношении вздутия живота.
Для тех немногих счастливчиков, которые не проявляют никаких признаков расстройства кишечника, ежедневный прием высококачественного пробиотика по-прежнему имеет большую пользу, поскольку помогает предотвратить любые проблемы в будущем.
Резюме
В этом блоге было освещено многое, поэтому вот краткое изложение основных моментов:
- Мы полагаемся на здоровье микробиома кишечника, чтобы оставаться здоровыми.
- Микробиом всегда содержит патогены, но они обычно контролируются дружественными штаммами бактерий
- Когда происходит сдвиг в сторону более высоких уровней патогенов и пропорционально меньшего количества пробиотических бактерий, это называется дисбактериозом
- Причины кишечного дисбактериоза включают антибиотики, лекарства, стресс, путешествия и неправильное питание
- Симптомы дисбактериоза включают симптомы со стороны кишечника, такие как вздутие живота и запоры, а также симптомы со стороны всего тела, такие как плохая концентрация внимания, низкий иммунитет и даже метаболический синдром.
- Коррекция дисбактериоза может быть достигнута путем эрадикации патогенов из кишечника либо антибиотиками, противомикробными травами/питательными веществами, либо пробиотиком Saccharomyces boulardii . В сочетании с пополнением уровня полезных бактерий за счет улучшенной диеты и пробиотических добавок.
Медицинские работники могут прочитать больше о Saccharomyces boulardii и Lactobacillus acidophilus NCFM ® в базе данных пробиотиков).
Каталожные номера
- Шафкат А. и др.(2014 май). Обзор Функциональная и филогенетическая сборка микробных сообществ в микробиоме человека. Тенденции микробиол. 22(5):261-6.
- Консорциум проектов микробиома человека (13 июня 2012 г.). Структура, функции и разнообразие микробиома здорового человека. Дж. Природа. 486 (7402): 207-14.
- Цинь Дж. и др. (4 марта 2010 г.). Каталог микробных генов кишечника человека, созданный с помощью метагеномного секвенирования. Дж. Природа. 464 (7285): 59-65.
- Turnbaugh PJ, et al. (22 января 2009 г.). Основной микробиом кишечника у тучных и худых близнецов.Дж. Природа. 457 (7228): 480-4.
- Turnbaugh PJ, et al. (1 сентября 2009 г.). Обзор основного микробиома кишечника, энергетического баланса и ожирения. Дж. Физиол. 587 (часть 17): 4153-8.
- Сюй, Зи и др. (2014 Dec.) Что важнее для классификации микробных сообществ: кто там или что они могут делать? ISME J. 8 (12): 2357-9.
- Абубакер С. и др. (2012). Метаболическая реконструкция для метагеномных данных и ее применение к микробиому человека. PLoS Comput Biol. 2; 8(6):e1002358.
- Де Филиппо С. и др.(17 августа 2010 г.). Влияние диеты на формирование микробиоты кишечника, выявленное сравнительным исследованием детей из Европы и сельских районов Африки. Proc Natl Acad Sci U S A. 107(33):14691-6.
- Детлефсен Л. и др. (2011). Неполное восстановление и индивидуальная реакция микробиоты дистального отдела кишечника человека на повторное воздействие антибиотиков. Proc Natl Acad Sci U S A. 108 Suppl 1 (): 4554-61.
- Sonnenburg ED, et al. (2016). Вызванное диетой вымирание кишечной микробиоты на протяжении поколений.Дж Природа. 529:212–5.
- Ди Риенци, С.К. и др. (2020 май). Адаптация микробиоты кишечника к современным пищевым сахарам и подсластителям. J. Достижения в области питания. Том 11, выпуск 3. Страницы 616–629.
- Sonnenburg ED, et al. (2014). Голодание нашего микробного «я»: пагубные последствия диеты с дефицитом доступных для микробиоты углеводов. Дж. Метаболизм клеток. 20: 779–86.
- Karl JP, Hatch AM, Arcidiacono SM, et al. Влияние психологических, экологических и физических стрессоров на микробиоту кишечника.Фронт микробиол. 2018;9:2013. doi: 10.3389/fmicb.2018.02013.
- Юманс, BP. и другие. (2015) Характеристика микробиома кишечника человека во время диареи путешественников. Дж. Микробы кишечника; 6:110–9
- Тайсс, Калифорния, и др. (2014 г., октябрь). Трансцарский контроль суточных колебаний микробиоты способствует метаболическому гомеостазу. Дж. Селл. 3;159(3):514-29. doi: 10.1016/j.cell.2014.09.048. Epub 2014 16 окт.
- Кардинг, С. и др. (2015). Дисбактериоз микробиоты кишечника при заболеваниях. Microb Ecol Health Дис.; 26: 10.3402/mehd.v26.26191.
- Мурзин А. и др. (2010) «Влияние Saccharomyces boulardii на инфицированные Candida albicans линии клеток кишечника человека Caco-2 и Intestin 407». Письма по микробиологии FEMS 310 (1) 17-23.
- Fassarella M, Blaak EE, Penders J, et al. 2021. Стабильность и устойчивость кишечного микробиома: выяснение реакции на возмущения для регулирования здоровья кишечника. Дж. Гут. 70:595-605
- Engelbrektson, A.L.et al., (2009). «Пробиотики для минимизации нарушения фекальной микробиоты у здоровых людей, проходящих курс антибиотикотерапии».Журнал медицинской микробиологии, 58:663-670.
Статья обновлена: 25 октября 2021 г. Первоначально опубликовано: 02 августа 2021 г.
.


 Для этого 2 ч. л. листьев крапивы смешивают с 1 ч. л. коры крушины, заливают 500 мл кипятка и держат на слабом огне 10 минут. Отвар настаивают в течение 20 минут и принимают по 100 мл три раза в день до еды.
Для этого 2 ч. л. листьев крапивы смешивают с 1 ч. л. коры крушины, заливают 500 мл кипятка и держат на слабом огне 10 минут. Отвар настаивают в течение 20 минут и принимают по 100 мл три раза в день до еды.





 Иногда баланс микробиоты нарушается и развивается дисбактериоз.
Иногда баланс микробиоты нарушается и развивается дисбактериоз.