Хлорид натрия — Chemwatch
Что такое хлорид натрия?
Вы, наверное, знаете его лучше всего как «Соль»!Хлорид натрия, также известный как галит (химическая формула: NaCl), представляет собой химическое вещество, которое мы все чаще знаем как соль. Он выглядит как белый кристаллический порошок, полностью растворимый в воде.
Это один из самых богатых минералов на Земле, который является важным питательным веществом для людей, животных и растений.
Для чего используется хлорид натрия?
Хлорид натрия находит широкое применение как в быту, так и в коммерческих целях.
В домашних условиях его, конечно же, используют для приправы, но также и для консервирования.
С медицинской точки зрения хлорид натрия объединяется с водой для создания солевого раствора, который можно использовать различными способами, включая: капельница для облегчения обезвоживания и местное очищение ран, и это лишь некоторые из них.
Хлорид натрия также используется в качестве компонента при производстве ряда продуктов, в том числе; пластик, бумага, резина, стекло, хлор, полиэстер, отбеливатель, моющие средства и красители.
Опасности хлорида натрия
Хлорид натрия обычно считается безопасным химическим веществом в обращении, но при неправильном обращении со всеми химическими веществами (даже с солью) всегда существует опасность причинения вреда.
Пути воздействия хлорида натрия включают: глаза, кожа, вдыхание и проглатывание.
Воздействие хлорида натрия на глаза может вызвать серьезное раздражение глаз и временное повреждение глаз. Повторное воздействие может вызвать воспаление и покраснение, а также временное ухудшение зрения.
Хлорид натрия может вызывать легкое раздражение кожи при контакте с кожей. При длительном воздействии на кожу она может покраснеть и опухнуть, что может привести к образованию пузырей, шелушению и утолщению кожи.
Вдыхание хлорида натрия может вызвать раздражение дыхательной системы. Пары хлорида натрия могут вызывать сонливость, головокружение, снижение внимания, потерю рефлексов / координации и головокружение. Если у человека имеется нарушение кровообращения и нервной системы или повреждение почек, важно, чтобы он прошел надлежащую проверку перед обращением, чтобы гарантировать, что его состояние не ухудшится из-за воздействия.
Если у человека имеется нарушение кровообращения и нервной системы или повреждение почек, важно, чтобы он прошел надлежащую проверку перед обращением, чтобы гарантировать, что его состояние не ухудшится из-за воздействия.
Очевидно, что хлорид натрия предназначен для употребления в пищу человеком, однако употребление очень больших количеств может вызвать рвоту, диарею и сильное чувство слабости.
Безопасность хлорида натрия
Если хлорид натрия попал в глаза, немедленно промойте глаза чистой проточной водой, не забывая промывать под веками. Снятие контактных линз должно производиться только квалифицированным специалистом. Если боль не проходит, обратитесь за медицинской помощью.
В случае контакта с кожей снимите всю загрязненную одежду, обувь и аксессуары и промойте пораженный участок большим количеством воды с мылом. Перед повторным ношением загрязненную одежду следует выстирать. Если симптомы не исчезнут, обратитесь за медицинской помощью.
При вдыхании переместите человека из зараженной зоны к ближайшему источнику свежего воздуха и следите за его дыханием.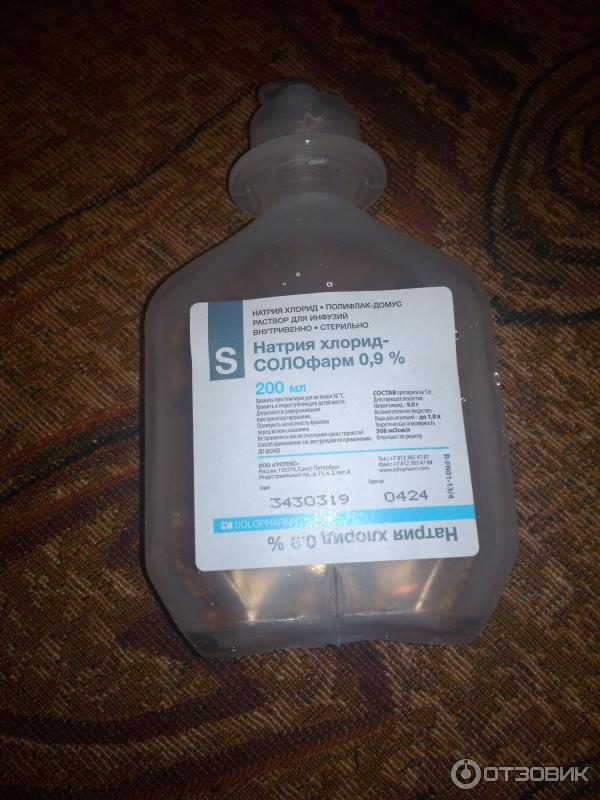 Если им трудно дышать, дайте им кислород. Если они не дышат, а вы квалифицированы, выполните сердечно-легочную реанимацию. Немедленно обратитесь за медицинской помощью.
Если им трудно дышать, дайте им кислород. Если они не дышат, а вы квалифицированы, выполните сердечно-легочную реанимацию. Немедленно обратитесь за медицинской помощью.
Если вы проглотили большое количество хлорида натрия, не вызывайте рвоту. В случае рвоты наклоните пациента вперед или положите его на левый бок, чтобы дыхательные пути оставались открытыми, чтобы предотвратить аспирацию. Обратитесь за медицинской помощью.
Безопасное обращение с хлоридом натрия
Фонтаны для экстренной промывки глаз должны быть доступны в непосредственной близости от потенциального воздействия химического вещества, и всегда должна быть соответствующая вентиляция (при необходимости установить вытяжку).
СИЗ в том числе; При работе с хлоридом натрия рекомендуется использовать защитные очки с боковыми щитками, респираторы для защиты от пыли, химические очки, защитные перчатки, фартук из ПВХ и спецодежду.
Chemwatch имеет самую большую коллекцию паспортов безопасности (SDS) в мире. Для бесплатно копию паспорта безопасности хлорида натрия, созданного Chemwatch, нажмите кнопку ниже.
Для бесплатно копию паспорта безопасности хлорида натрия, созданного Chemwatch, нажмите кнопку ниже.
Скачать SDS
Плазмозаменяющие растворы Натрия хлорид (физраствор) — «Изотонический раствор натрия хлорида — необходимый компонент для ингаляций, + как еще использую его я. »
Доброго времени суток мои дорогие!
Тема здоровья прочно засела в моей голове, поскольку сезон простуд и гриппа в самом разгаре. Так недавно мой сынишка переболел бронхитом, из-за чего нам пришлось познакомиться со многими новыми для нас средствами, одним из них был Натрия хлорид.
Итак Натрия хлорид, Sordium chloride, физраствор — это все один препарат, выглядит он как обычная вода, на вкус немного солоноватая. Продается раствор в банках объемом 200 мл и 400 мл. а также в ампулах по 5 мл и 10 мл. У меня бутылка объемом 200 мл., изготовленная из пластика, но я видела и стеклянные. Цена смешная за 200 мл. — 7 грн.
Состав, срок годности, изготовитель — все указано на единственной наклейке, а название написано даже дважды так как бутылка используется и вверх дном.
С боку бутылки для удобства есть шкала с мерными делениями, в двух направлениях — снизу в верх и сверху в низ.
На дне бутылки также имеется специальное кольцо, за него крепят бутылку к штативу когда делают капельницы.
Применяют данное вещество для:
Изотонический раствор натрия хлорида применяют для растворения лекарственных препаратов, а также при больших потерях внеклеточной жидкости или недостаточном ее поступлении (токсическая дисперсия, холера, диаррея, неукротимая рвота, обширные ожоги с сильной экссудацией и др.), явлениях гипохлоремии и гипонатриемии с обезвоживанием, кишечной непроходимости, интоксикациях, для промывания ран, глаз, слизистой оболочки носа, для регионарной перфузии совместно с фибринолизином, гепарином, противоопухолевыми и другими лекарственными средствами.
как видим спектр применения очень большой, но препарат также имеет противопоказания
Изотонический раствор натрия хлорида не следует вводить при нарушениях водно-натриевого баланса, связанных с гипернатриемией, при внеклеточной гипергидратации, внутриклеточной дегидратации, циркуляторных нарушениях, угрожающих отеком мозга и легких, при лечении массивными дозами кортикостероидов.Большие объемы изотонического раствора натрия хлорида следует применять с осторожностью у больных с нарушенной выделительной функцией почек.
Наш опыт использования Натрия хлорид:
Поскольку у нас начался бронхит, то врач прописала частые ингаляции, для проведения которых мы специально купили ингалятор — небулайзер. Действующие вещества (нам прописывали Лазолван и Вентолин) необходимо разбавлять физраствором (дозировку прописывает врач).
Тот же врач нам посоветовала на замену дорогущим каплям «Аквамарис», на которых в сезон простуд можно разориться, закапывать малышу носик тем же физраствором. Я для удобства перелила немного в пустую бутылочку от капель и наполняю ее по мере использования. Промываю носик малышу физраствором несколько раз в день и при сильной заложенности носа и при жиденьких сопельках, иногда использую физраствор утром когда слышу, что у малыша после сна пересохло в носике.
Теперь данный препарат всегда у меня в аптечке.
Спасибо за внимание и мирного неба Вам над головой!
Хлорид натрия | Encyclopedia.com
Gale
Просмотры Обновлено Jun 27 2018
Свойства
Бонд
Местоположение и обработка
Mining
vapator как поваренная соль, каменная соль, морская соль и минерал галит, представляет собой ионное соединение, состоящее из кристаллов кубической формы, состоящих из элементов натрия и хлора. Он отвечает за соленость мирового океана. Эта соль имеет важное значение с древних времен и имеет широкий и разнообразный спектр применения. Одним из его самых больших применений является использование в качестве ингредиента соли, которую люди используют при еде и приготовлении пищи. Он может быть получен химическим путем и получен путем добычи и выпаривания морской воды и рассолов.
Он отвечает за соленость мирового океана. Эта соль имеет важное значение с древних времен и имеет широкий и разнообразный спектр применения. Одним из его самых больших применений является использование в качестве ингредиента соли, которую люди используют при еде и приготовлении пищи. Он может быть получен химическим путем и получен путем добычи и выпаривания морской воды и рассолов.
Хлорид натрия бесцветен в чистом виде. Он несколько гигроскопичен или поглощает воду из атмосферы. Соль легко растворяется в воде. Его растворение в воде является эндотермическим, что означает, что он отбирает у воды некоторое количество тепловой энергии. Хлорид натрия плавится при 1474°F (801°C), кипит при 2670°F (1465°C), имеет плотность 2,16 г/см 3 (при 25°C) и проводит электричество в растворенном виде или в растворе. расплавленное состояние.
Ионное соединение, такое как хлорид натрия, удерживается ионной связью. Этот тип связи образуется, когда противоположно заряженные ионы притягиваются. Это притяжение похоже на притяжение двух противоположных полюсов магнита. Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд.
Это притяжение похоже на притяжение двух противоположных полюсов магнита. Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд.
Натрий (химический символ Na) является щелочным металлом и имеет тенденцию терять электрон с образованием положительного иона натрия (Na + ). Хлор (химический символ Cl) является неметаллом и имеет тенденцию приобретать электрон с образованием отрицательного иона хлорида (Cl —).
Противоположно заряженные ионы Na + и Cl — притягиваются, образуя ионную связь. Таким образом, многие ионы натрия и хлорида удерживаются вместе, в результате чего получается соль с характерной кристаллической формой. Трехмерное расположение или кристаллическая решетка ионов в хлориде натрия такова, что каждый Na + окружен шестью анионами (Cl — ), а каждый Cls окружен шестью катионами (Na + ). Таким образом, ионное соединение имеет баланс противоположно заряженных ионов, а суммарные положительные и отрицательные заряды равны.
Таким образом, ионное соединение имеет баланс противоположно заряженных ионов, а суммарные положительные и отрицательные заряды равны.
Хлорид натрия, в изобилии встречающийся в природе, встречается в морской воде, других соленых водах или рассолах, а также в отложениях сухой каменной соли. Его можно получить путем добычи и выпаривания воды из рассолов и морской воды. Эта соль также может быть получена химическим путем путем взаимодействия соляной кислоты (химическая формула HCl) с гидроксидом натрия (химическая формула NaOH) с образованием хлорида натрия и воды. К странам-лидерам по производству соли относятся США, Китай, Мексика и Канада.
Два способа извлечения соли из земли: камерно-столбовая добыча и добыча раствором. При камерно-столбовом методе шахты погружаются в землю, и горняки используют такие методы, как бурение и взрывные работы, для разрушения каменной соли. Соль удаляется таким образом, что остаются пустые помещения, поддерживаемые соляными столбами.
При добыче раствором вода добавляется в соляные отложения для образования рассола. Рассол представляет собой раствор хлорида натрия и воды, который может содержать или не содержать другие соли. В одном из методов в земле бурят скважину и помещают в нее две трубы (меньшая труба, помещенная внутрь большей). Пресная вода подается по внутренней трубе к соли. Растворенная соль образует рассол, который по внешней трубе перекачивается на поверхность, а затем удаляется.
Рассол представляет собой раствор хлорида натрия и воды, который может содержать или не содержать другие соли. В одном из методов в земле бурят скважину и помещают в нее две трубы (меньшая труба, помещенная внутрь большей). Пресная вода подается по внутренней трубе к соли. Растворенная соль образует рассол, который по внешней трубе перекачивается на поверхность, а затем удаляется.
Обычный способ производства соли из рассола – выпаривание воды с помощью вакуумных ванн. В этом методе рассол кипятят и перемешивают в огромных резервуарах, называемых вакуумными ваннами. Образуются высококачественные кубики соли, которые оседают на дно посуды. Затем кубики собирают, сушат и обрабатывают.
Солнечное выпаривание морской воды для получения соли — старый метод, который широко используется и сегодня. Он использует солнце как источник энергии. Этот метод эффективен в местах, где есть обильные источники соленой воды, земля для испарительных прудов и жаркий сухой климат для увеличения испарения. Морская вода проходит через ряд испарительных бассейнов. Минералы, содержащиеся в морской воде, осаждаются или выпадают из раствора с разной скоростью. Большинство из них выпадают в осадок раньше хлорида натрия и поэтому остаются, когда морская вода перемещается из одного испарительного пруда в другой.
Морская вода проходит через ряд испарительных бассейнов. Минералы, содержащиеся в морской воде, осаждаются или выпадают из раствора с разной скоростью. Большинство из них выпадают в осадок раньше хлорида натрия и поэтому остаются, когда морская вода перемещается из одного испарительного пруда в другой.
С древних времен большое значение имела соль хлорида натрия. Он использовался по-разному, включая приправу и консервирование пищи, и даже как форму денег. Эта соль улучшает вкус пищевых продуктов, таких как хлеб и сыры, и является важным консервантом мяса, молочных продуктов, маргарина и других продуктов, поскольку замедляет рост микроорганизмов. Соль способствует естественному развитию цвета ветчины и хот-догов, а также повышает нежность колбасных изделий, таких как ветчина, заставляя их поглощать воду. В виде йодированной соли является переносчиком йода. (Йод необходим для синтеза гормонов щитовидной железы, влияющих на рост, развитие и скорость метаболизма).
Химическая промышленность использует большое количество соли хлорида натрия для производства других химикатов. Хлор и гидроксид натрия получают электролизом из рассола.
Хлор и гидроксид натрия получают электролизом из рассола.
КЛЮЧЕВЫЕ ТЕРМИНЫ
Рассол — Раствор хлорида натрия и воды, который может содержать или не содержать другие соли.
Ион — Атом или молекула, которые приобрели электрический заряд либо за счет потери электронов (положительно заряженный ион), либо за счет приобретения электронов (отрицательно заряженный ион).
Ионная связь — Силы притяжения между положительными и отрицательными ионами, возникающие при переносе электронов от одного атома к другому.
Ионное соединение — Соединение, состоящее из положительных ионов (обычно ионов металлов) и отрицательных ионов (ионов неметаллов), удерживаемых вместе за счет электростатического притяжения.
Солнечное испарение — Метод испарения воды, использующий солнце в качестве источника энергии.
Хлорсодержащие продукты используются в очистителях металлов, отбеливателях для бумаги, пластмассах и при очистке воды.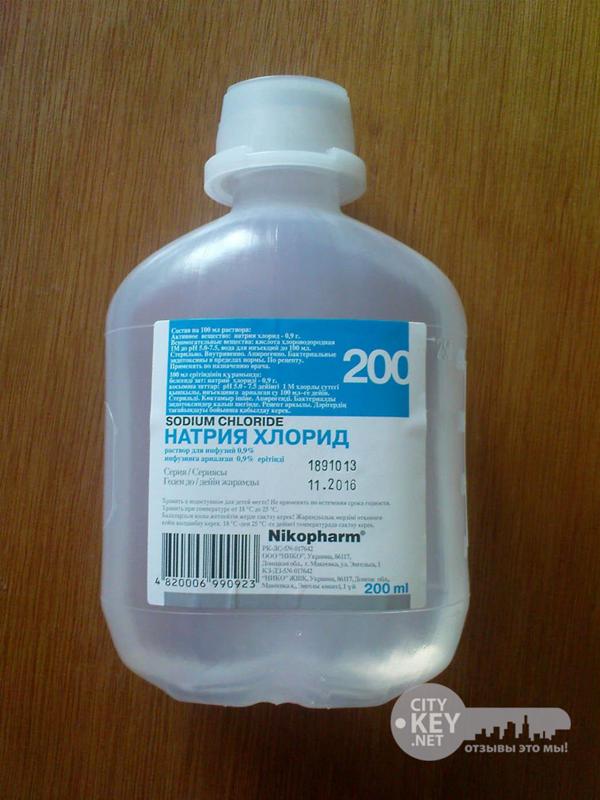 Химическая кальцинированная сода, содержащая натрий, используется для производства стекла, мыла, бумаги и смягчителей воды. Химические вещества, полученные в результате реакций с хлоридом натрия, используются в керамической глазури, металлургии, обработке шкур и фотографии.
Химическая кальцинированная сода, содержащая натрий, используется для производства стекла, мыла, бумаги и смягчителей воды. Химические вещества, полученные в результате реакций с хлоридом натрия, используются в керамической глазури, металлургии, обработке шкур и фотографии.
Хлорид натрия имеет широкий спектр применения. Он распространяется по дорогам, чтобы растопить лед, понизив температуру плавления льда. Соль играет важную роль в регуляции жидкостей организма. Используется в лекарствах и кормах для скота. Кроме того, соляные пещеры используются для хранения химических веществ, таких как нефть и природный газ.
См. также Консервирование пищевых продуктов; Соленая вода.
КНИГИ
Эмсли, Джон. Строительные блоки природы: Путеводитель по элементам от А до Я . Оксфорд, Великобритания: Oxford University Press, 2003.
Курлански, Марк. Соль: всемирная история . Нью-Йорк: Penguin Books, 2003.
Лиде, Дэвид Р., изд. CRC Handbook of Chemistry and Physics Boca Raton, FL: CRC Press, 2005.
Myers, R. Thomas, Keith B. Oldham, and Salvatore Tocci. Холт Химия Визуализация Материи . Остин, Техас: Холт, Райнхарт и Уинстон, 2000.
Секерский, Славомир. Краткая химия элементов . Чичестер, Великобритания: Horwood Publishing, 2002.
Снайдер, К.Х. Необыкновенная химия обычных вещей . 4-е изд. Нью-Йорк: Джон Уайли и сыновья, 2002.
Дана М. Барри
Энциклопедия Гейла Науки
GALE
Просмотры Обновлен июнь 110007
Обзор
СОДИЕМ. -ид) представляет собой бесцветный или белый порошок или кристаллическое твердое вещество без запаха и с характерным соленым вкусом. Он слегка гигроскопичен, что означает, что он имеет тенденцию поглощать влагу из воздуха и становиться влажным.
ОСНОВНЫЕ ФАКТЫ
ДРУГИЕ НАЗВАНИЯ:
Соль; столовая соль; поваренная соль; Rock Salt
Формула:
NACL
Элементы:
натрия, хлор
Соединение тип:
Бинарная соль (неорганический)
Состояние:
Молькулярный вес:
9 444444444444444444444444444444444444444444444444444444444444444. 44444444444444444444444444444444444444444444. ТОЧКА ПЛАВЛЕНИЯ:
44444444444444444444444444444444444444444444. ТОЧКА ПЛАВЛЕНИЯ:800,7 °C (1473 °F)
0002 Растворим в воде и глицерине; очень мало растворим в этиловом и метиловом спирте
Соль, вероятно, является одним из наиболее известных и широко используемых химических соединений. Люди использовали соль в качестве консерванта и для придания вкуса продуктам с незапамятных времен. Одно из самых ранних упоминаний о хлориде натрия относится к 2700 г. до н.э. в китайской книге Peng Tzao Kan Mu , возможно, первой когда-либо написанной книге по фармакологии. Доступ к соляным ресурсам часто был спорным вопросом среди народов, что приводило к битвам и войнам за право собственности. Иногда считалось, что он настолько ценен, что использовался как форма денег. Сегодня хлорид натрия имеет множество применений помимо использования в качестве пищевой добавки.
КАК ЭТО ПРОИЗВОДИТСЯ
Хлорид натрия встречается в природе в виде минерала галита и в большом количестве содержится в океанах, где его средняя концентрация составляет около 2,6 процента в морской воде. Существует несколько способов добычи соли, некоторые из которых восходят к древним временам. Самый ранний из известных способов производства также и самый простой: испарение морской воды солнцем. В этом методе морская вода собирается в больших неглубоких прудах и испаряется. Соли, растворенные в воде, кристаллизуются на дне прудов, и их можно соскрести, а присутствующие отдельные соединения, в том числе хлорид натрия, отделить друг от друга.
Существует несколько способов добычи соли, некоторые из которых восходят к древним временам. Самый ранний из известных способов производства также и самый простой: испарение морской воды солнцем. В этом методе морская вода собирается в больших неглубоких прудах и испаряется. Соли, растворенные в воде, кристаллизуются на дне прудов, и их можно соскрести, а присутствующие отдельные соединения, в том числе хлорид натрия, отделить друг от друга.
Этот метод лучше всего работает в жарких и засушливых частях мира. В более прохладных и влажных регионах морскую воду необходимо собирать в большие емкости, которые можно искусственно нагревать. Во многих случаях морская вода нагревается при пониженном давлении, что позволяет ей кипеть при более низкой температуре и экономить затраты на отопление. Опять же, при выкипании воды образуются кристаллы хлорида натрия (и других растворенных солей).
Возможно, самым важным источником хлорида натрия являются соляные шахты, большие подземные запасы хлорида натрия, оставшиеся после того, как древние моря высохли и были погребены под скоплением камней и почвы. Соляные шахты находятся во многих частях мира, особенно в России, Германии, Великобритании, Индии, Франции, Мексике, Канаде и США. Эти шахты часто простираются на многие километры и простираются на сотни метров в глубину. Одна из самых известных соляных шахт в США находится под городом Детройт. Он содержит более 80 километров (50 миль) подземных дорог, построенных для удаления блоков хлорида натрия, некоторые из которых имеют ширину четырехполосных шоссе. Шахта в Детройте прекратила производство в 1983, когда более низкие цены на соль и, как следствие, более низкие прибыли уже не могли поддерживать затраты на добычу. Шахта в Детройте была вновь открыта в 1988 году, но только для добычи дорожной соли.
Соляные шахты находятся во многих частях мира, особенно в России, Германии, Великобритании, Индии, Франции, Мексике, Канаде и США. Эти шахты часто простираются на многие километры и простираются на сотни метров в глубину. Одна из самых известных соляных шахт в США находится под городом Детройт. Он содержит более 80 километров (50 миль) подземных дорог, построенных для удаления блоков хлорида натрия, некоторые из которых имеют ширину четырехполосных шоссе. Шахта в Детройте прекратила производство в 1983, когда более низкие цены на соль и, как следствие, более низкие прибыли уже не могли поддерживать затраты на добычу. Шахта в Детройте была вновь открыта в 1988 году, но только для добычи дорожной соли.
Два метода добычи используются для удаления хлорида натрия из подземных источников. При камерно-столбовом способе в месторождение закапывают стволы. Затем с помощью буровзрывных работ откалываются куски хлорида натрия, которые удаляются для переработки. По мере продвижения добычи большие столбы соли остаются стоять, чтобы поддерживать пустые камеры. Отсюда и название: комнатно-столбовая. Второй метод удаления солей – добыча раствором. В земле бурят скважину и заливают водой, чтобы создать насыщенный раствор хлорида натрия, рассол раствор. Затем рассол выкачивается на поверхность и обрабатывается.
Отсюда и название: комнатно-столбовая. Второй метод удаления солей – добыча раствором. В земле бурят скважину и заливают водой, чтобы создать насыщенный раствор хлорида натрия, рассол раствор. Затем рассол выкачивается на поверхность и обрабатывается.
ОБЫЧНОЕ ПРИМЕНЕНИЕ И ПОТЕНЦИАЛЬНАЯ ОПАСНОСТЬ
Вероятно, наиболее известным применением хлорида натрия является пищевая добавка. По оценкам Института соли, люди потребляют в среднем 16 тонн соли за свою жизнь. Соль уже давно используется в пищевых продуктах для улучшения вкуса, а также в качестве консерванта. Соленые продукты хранятся дольше, чем несоленые, потому что соль подавляет рост микроорганизмов, вызывающих гниение.
Тем не менее, наиболее важным применением хлорида натрия на сегодняшний день является использование его в качестве сырья для производства других соединений. В 2004 году 65 процентов всего потребляемого в США хлорида натрия было использовано для производства гидроксида натрия, карбоната натрия, хлористого водорода, металлического натрия, газообразного хлора и других химических продуктов. Следующим наиболее важным применением хлорида натрия являются кондиционеры для воды. Соединение используется в таких устройствах, потому что натрий в хлориде натрия заменяет кальций и магний в «жесткой» воде (воде, в которой трудно пениться). Умягчая воду хлоридом натрия, можно очищать одежду и другие материалы. более эффективно при меньших затратах. Институт соли утверждает, что хлорид натрия имеет более 14 000 различных применений. Некоторые из наиболее важных из них включают:
Следующим наиболее важным применением хлорида натрия являются кондиционеры для воды. Соединение используется в таких устройствах, потому что натрий в хлориде натрия заменяет кальций и магний в «жесткой» воде (воде, в которой трудно пениться). Умягчая воду хлоридом натрия, можно очищать одежду и другие материалы. более эффективно при меньших затратах. Институт соли утверждает, что хлорид натрия имеет более 14 000 различных применений. Некоторые из наиболее важных из них включают:
- В качестве кормовой добавки для скота, птицы и других домашних животных, чтобы они получали натрий и хлор, необходимые им для поддержания здоровья и нормального роста;
- В качестве средства против обледенения дорог и автомагистралей;
- При производстве глазурей для керамических изделий;
- Для обработки шкур животных;
- При крашении и набивке тканей;
- При производстве мыла;
- Как гербицид, химическое вещество, используемое для уничтожения сорняков; и
- В качестве огнетушителя для определенных типов пожаров (например, возгорания жира).

Интересные факты
- Соль была ключевым ингредиентом раствора, который древние египтяне использовали при изготовлении мумий.
- Выражение «не стоит своей соли» произошло от древнегреческой работорговли, когда люди покупались и продавались за меру соли.
- Английское слово зарплата происходит от латинского термина salarium argentums , который относится к специальной солевой пайке, которую давали римским солдатам.
- Соль часто подвергалась высоким налогам; очень высокий налог на соль во Франции в середине восемнадцатого века способствовал подъему французской революции.
- Соляные шахты, которые больше не используются, иногда используются для хранения природного газа и нефти.
Учитывая его широкое распространение, хлорид натрия, очевидно, безопасен для большинства людей при нормальных условиях. Как и в случае с любым химическим соединением, потребление большого избытка хлорида натрия может быть вредным. Одна из проблем со здоровьем, вызывающая наибольшую озабоченность, связана с высоким кровяным давлением. Ученые выяснили, что употребление большого количества натрия может способствовать гипертонии (высокому кровяному давлению), что, в свою очередь, связано с повышенным риском сердечных приступов и инсульта. Американская кардиологическая ассоциация рекомендует здоровым взрослым американцам потреблять не более 2300 миллиграммов натрия в день. Это количество эквивалентно примерно чайной ложке соли. Для лиц с повышенным риском, людей с высоким кровяным давлением, чернокожих, а также людей среднего и пожилого возраста в рекомендациях Министерства сельского хозяйства США от 2005 года рекомендуется не более 1500 миллиграммов натрия в день. Проблема с потреблением хлорида натрия заключается в том, что большинство людей понятия не имеют, сколько соли они съедают каждый день. Конечно, они могут отслеживать количество соли, которую добавляют в пищу, которую готовят дома. Но в большинство готовых пищевых продуктов также добавляют хлорид натрия.
Одна из проблем со здоровьем, вызывающая наибольшую озабоченность, связана с высоким кровяным давлением. Ученые выяснили, что употребление большого количества натрия может способствовать гипертонии (высокому кровяному давлению), что, в свою очередь, связано с повышенным риском сердечных приступов и инсульта. Американская кардиологическая ассоциация рекомендует здоровым взрослым американцам потреблять не более 2300 миллиграммов натрия в день. Это количество эквивалентно примерно чайной ложке соли. Для лиц с повышенным риском, людей с высоким кровяным давлением, чернокожих, а также людей среднего и пожилого возраста в рекомендациях Министерства сельского хозяйства США от 2005 года рекомендуется не более 1500 миллиграммов натрия в день. Проблема с потреблением хлорида натрия заключается в том, что большинство людей понятия не имеют, сколько соли они съедают каждый день. Конечно, они могут отслеживать количество соли, которую добавляют в пищу, которую готовят дома. Но в большинство готовых пищевых продуктов также добавляют хлорид натрия. В некоторых случаях общее количество соли, потребляемой среднестатистическим американцем из обработанных пищевых продуктов, может быть значительным, легко превышая рекомендуемое среднесуточное значение, рекомендованное Американской кардиологической ассоциацией. Таким образом, люди могут потреблять опасно высокие уровни натрия, не подозревая об этом факте.
В некоторых случаях общее количество соли, потребляемой среднестатистическим американцем из обработанных пищевых продуктов, может быть значительным, легко превышая рекомендуемое среднесуточное значение, рекомендованное Американской кардиологической ассоциацией. Таким образом, люди могут потреблять опасно высокие уровни натрия, не подозревая об этом факте.
Полезные слова
- ФАРМАКОЛОГИЯ
- Изучение соединений, используемых в качестве лекарств.
ДЛЯ ДОПОЛНИТЕЛЬНОЙ ИНФОРМАЦИИ
«История соли». Институт соли. http://www.saltinstitute.org/38.html (по состоянию на 8 ноября 2005 г.).
Курланский Марк. Соль: всемирная история . Нью-Йорк: Уокер, 2002.
«Соль». История для детей. http://www.historyforkids.org/learn/food/salt.htm (по состоянию на 8 ноября 2005 г.).
«Хлорид натрия». Дж. Т. Бейкер. http://www.jtbaker.com/msds/englishhtml/S3338.htm (по состоянию на 8 ноября 2005 г.).
«Что вы всегда хотели знать о соли». Институт соли. http://www.saltinstitute.org/4.html (по состоянию на 8 ноября 2005 г.).
Институт соли. http://www.saltinstitute.org/4.html (по состоянию на 8 ноября 2005 г.).
См. также Хлор; Гидроксид натрия
Химические соединения
Гейл
просмотров обновлено 18 мая 2018 г.
Натрий хлорид (химическая формула NaCl), известный как таблица 9Соль 0066 , каменная соль, морская соль и минерал галит, представляет собой ионное соединение, состоящее из кристаллов кубической формы, состоящих из элементов натрия и хлора . Эта соль имеет важное значение с древних времен и имеет широкий и разнообразный спектр применения. Его можно получить химическим путем, добывая и выпаривая воду из морской воды и рассолов.
Свойства
Хлорид натрия в чистом виде бесцветен. Он несколько гигроскопичен или поглощает воду из атмосферы. Соль легко растворяется в воде. Его растворение в воде равно 9.0066 эндотермический , что означает, что он забирает у воды около тепловой энергии . Хлорид натрия плавится при 1474°F (801°C) и проводит электричества в растворенном или расплавленном состоянии.
Хлорид натрия плавится при 1474°F (801°C) и проводит электричества в растворенном или расплавленном состоянии.
Связи
Ионное соединение, такое как хлорид натрия, удерживается ионной связью. Этот тип связи образуется, когда противоположно заряженные ионы притягиваются. Это притяжение похоже на притяжение двух противоположных полюсов магнита. Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Это называется катион , если существует положительный заряд, и анион , если существует отрицательный заряд.
Натрий (химический символ Na) представляет собой щелочной металл и имеет тенденцию терять электрон с образованием положительного иона натрия (Na+). Хлор (химический символ Cl) представляет собой неметалл и имеет тенденцию приобретать электрон с образованием отрицательного иона хлорида (Cl-).
Противоположно заряженные ионы Na+ и Cl- притягиваются, образуя ионную связь. Таким образом, многие ионы натрия и хлора удерживаются вместе, в результате чего получается соль с характерным кристалл формы . Трехмерное расположение или кристаллическая решетка ионов в хлориде натрия такова, что каждый Na+ окружен шестью анионами (Cl-), а каждый Cl- окружен шестью катионами (Na+). Таким образом, ионное соединение имеет баланс противоположно заряженных ионов, а суммарные положительные и отрицательные заряды равны.
Таким образом, многие ионы натрия и хлора удерживаются вместе, в результате чего получается соль с характерным кристалл формы . Трехмерное расположение или кристаллическая решетка ионов в хлориде натрия такова, что каждый Na+ окружен шестью анионами (Cl-), а каждый Cl- окружен шестью катионами (Na+). Таким образом, ионное соединение имеет баланс противоположно заряженных ионов, а суммарные положительные и отрицательные заряды равны.
Размещение и переработка
Хлорид натрия, в изобилии встречающийся в природе, встречается в морской воде, других соленых водах или рассолах, а также в отложениях сухой каменной соли. Его можно получить путем добычи и выпаривания воды из рассолов и морской воды. Эта соль также может быть получена химическим путем путем взаимодействия соляной кислоты (химическая формула HCl) с гидроксид натрия (химическая формула NaOH) с образованием хлорида натрия и воды. К странам-лидерам по производству соли относятся США, Китай, Мексика и Канада.
Добыча полезных ископаемых
Два способа извлечения соли из земли: камерная и столбовая добыча и добыча раствором . При камерно-столбовом методе шахты погружаются в землю, и горняки используют такие методы, как бурение и взрывные работы, для разрушения каменной соли. Соль удаляется таким образом, что остаются пустые помещения, поддерживаемые соляными столбами.
При добыче раствором вода добавляется в месторождение соли для образования рассола. Рассол представляет собой раствор хлорида натрия и воды, который может содержать или не содержать другие соли. В одном из методов в земле бурят скважину и помещают в нее две трубы (меньшая труба, помещенная внутрь большей). Пресная вода подается по внутренней трубе к соли. Растворенная соль образует рассол, который по внешней трубе перекачивается на поверхность, а затем удаляется.
Испарение
Обычный способ производства соли из рассола – выпаривание воды с помощью вакуумных ванн. В этом методе рассол кипятят и перемешивают в огромных резервуарах, называемых вакуумными ваннами. Образуются высококачественные кубики соли, которые оседают на дно посуды. Затем кубики собирают, сушат и обрабатывают.
В этом методе рассол кипятят и перемешивают в огромных резервуарах, называемых вакуумными ваннами. Образуются высококачественные кубики соли, которые оседают на дно посуды. Затем кубики собирают, сушат и обрабатывают.
Солнечная Выпаривание морской воды для получения соли — старый метод, который широко используется и сегодня. Он использует Sun в качестве источника энергии. Этот метод эффективен в местах, где есть обильные источники соленой воды, земля для испарительных прудов и жаркий сухой климат для увеличения испарения. Морская вода проходит через ряд испарительных бассейнов. Минералы , содержащиеся в морской воде, осаждаются или выпадают из раствора с разной скоростью. Большинство из них выпадают в осадок раньше хлорида натрия и поэтому остаются, когда морская вода перемещается из одного испарительного пруда в другой.
Применение
С древних времен большое значение имела соль хлорида натрия. Он использовался по-разному, включая приправу и консервирование пищи, и даже как форму денег. Эта соль улучшает вкус пищевых продуктов, таких как хлеб и сыр, и является важным консервантом мяса, молочных продуктов, маргарина и других продуктов, поскольку замедляет рост микроорганизмы . Соль способствует естественному развитию цвета цвета в ветчине и хот-догах, а также повышает нежность колбасных изделий, таких как ветчина, заставляя их поглощать воду. В виде йодированной соли является переносчиком йода. (Йод необходим для синтеза наших гормонов щитовидной железы , которые влияют на рост, развитие и скорость метаболизма).
Эта соль улучшает вкус пищевых продуктов, таких как хлеб и сыр, и является важным консервантом мяса, молочных продуктов, маргарина и других продуктов, поскольку замедляет рост микроорганизмы . Соль способствует естественному развитию цвета цвета в ветчине и хот-догах, а также повышает нежность колбасных изделий, таких как ветчина, заставляя их поглощать воду. В виде йодированной соли является переносчиком йода. (Йод необходим для синтеза наших гормонов щитовидной железы , которые влияют на рост, развитие и скорость метаболизма).
Химическая промышленность использует большое количество соли хлорида натрия для производства других химикатов. Хлор и гидроксид натрия получают электролизом из рассола. Продукты хлора используются в очистителях металлов, отбеливатель бумаги , пластик и очистка воды . Химическая кальцинированная сода, содержащая натрий, используется для производства стекла , мыла, бумаги и средств для смягчения воды. Химикаты, полученные в результате реакций с хлоридом натрия, используются в керамической глазури, металлургии , обработке шкур и фотографии .
Химикаты, полученные в результате реакций с хлоридом натрия, используются в керамической глазури, металлургии , обработке шкур и фотографии .
Хлорид натрия имеет широкий и разнообразный спектр применения. Он распространяется по дорогам, чтобы растопить лед , понизив температуру плавления льда. Соль играет важную роль в регуляции жидкостей организма. Используется в медицине и домашний скот корм. Кроме того, соляные пещеры используются для хранения химических веществ, таких как нефть и природный газ .
См. также консервирование пищевых продуктов; Соленая вода.
Ресурсы
книги
Эмсли, Джон. Справочник потребителей по хорошим химическим веществам. Нью-Йорк: WH Freeman & Spektrum, 1994.
Хазен, Роберт и Трефил, Джеймс. Наука имеет значение. Нью-Йорк: Doubleday, 1991.
Lide, DR, изд. CRC Справочник по химии и физике. Бока-Ратон: CRC Press, 2001.
Снайдер, К. Х. Необычайная химия обычных вещей. 4-е изд. Нью-Йорк: Джон Вили и сыновья, 2002.
Х. Необычайная химия обычных вещей. 4-е изд. Нью-Йорк: Джон Вили и сыновья, 2002.
Точчи, Сальваторе и Виланд, Клаудия. Химия, визуализирующая материю. Нью-Йорк: Холт, Райнхарт и Уинстон.
Дана М. Барри
КЛЮЧЕВЫЕ ТЕРМИНЫ
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
- Рассол
— Раствор хлорида натрия и воды, который может содержать или не содержать другие соли.
- Ион
— Атом или молекула, которые приобрели электрический заряд в результате потери электронов (положительно заряженный ион) или приобретения электронов (отрицательно заряженный ион).
- Ионная связь
— Силы притяжения между положительными и отрицательными ионами, возникающие при переносе электронов от одного атома к другому.
- Ионное соединение
— Соединение, состоящее из положительных ионов (обычно ионов металлов) и отрицательных ионов (ионов неметаллов), удерживаемых вместе за счет электростатического притяжения.

- Солнечное испарение
— Метод испарения воды, использующий солнце в качестве источника энергии.
Научная энциклопедия Гейла
Оксфорд
просмотров обновлено 27 июня 2018
хлорид натрия ( NaCl ) Поваренная соль. Это основной минеральный компонент морской воды, составляющий 80% ее растворенного вещества. Хлорид натрия также является основным электролитом живых клеток, и потеря слишком большого количества соли в результате испарения с кожи или в результате болезни опасна. Он используется в качестве приправы, для лечения и сохранения пищевых продуктов, а также в химической промышленности.
Всемирная энциклопедия
Оксфорд
просмотра обновлено 14 мая 2018
 поваренная соль: соль натрия, которая является важным компонентом организма и используется для восполнения потерянных жидкостей и электролитов. См. также пероральную регидратационную терапию, физиологический раствор. Формула: NaCl.
поваренная соль: соль натрия, которая является важным компонентом организма и используется для восполнения потерянных жидкостей и электролитов. См. также пероральную регидратационную терапию, физиологический раствор. Формула: NaCl.
Словарь по сестринскому делу
Оксфорд
просмотров обновлено 29 мая 2018 г.
хлорид натрия Поваренная соль, самая распространенная форма потребления натрия. См. также «бессолевые» диеты.
A Dictionary of Food and Nutrition DAVID A. BENDER
oxford
просмотров обновлено 23 мая 2018 г. . Хлорид натрия играет ключевую роль в биологических системах в поддержании электролитного баланса. Он используется в качестве пищевого консерванта (см. консервирование пищевых продуктов).
Биологический словарь
Оксфорд
просмотров обновлено 21 мая 2018
хлорид натрия •
н. бесцветное кристаллическое соединение NaCl, встречающееся в природе в морской воде и галите; поваренная соль.
бесцветное кристаллическое соединение NaCl, встречающееся в природе в морской воде и галите; поваренная соль.
Оксфордский карманный словарь современного английского языка
Реакция хлорида натрия
[Депозитные фотографии]Хлорид натрия или натриевая соль соляной кислоты представляет собой порошок или кристаллы бесцветного вещества без запаха, с соленым вкусом. В быту хлорид натрия известен как поваренная соль. Химическая формула NaCl. В природе встречается в виде галита, т. е. каменной соли. Чистый хлорид натрия бесцветен, но если он содержит примеси, то может приобретать другие цвета. Например, он может быть фиолетовым или синим, желтым или розовым.
Физические свойства хлорида натрия
Умеренно растворим в воде, и температура, при которой протекает реакция, практически не играет роли. При температуре 21 °С коэффициент растворимости в 100 г воды составляет 35,9, при 100 °С — 38,1. Ионы хлора образуют кубическую решетку, причем ионы натрия находятся вверху. Температура плавления 800,8°С. Поваренная соль начинает кипеть при температуре 1465 °C.
Ионы хлора образуют кубическую решетку, причем ионы натрия находятся вверху. Температура плавления 800,8°С. Поваренная соль начинает кипеть при температуре 1465 °C.
Химические свойства натриевой соли соляной кислоты
NaCl – соль, образовавшаяся в результате взаимодействия щелочи и кислоты. Хлорид натрия является сильным электролитом. Ионы очень сильно притягиваются друг к другу, и притяжение между ними может быть нарушено только полярными растворителями. В H₂O кристаллическая решетка легко распадается. Освобождаются анионы и катионы связи (Na⁺, Cl⁻). Это объясняет хорошую электропроводность хлорида натрия.
[Депозитные фотографии]Качественные реакции на катионы натрия
Качественная реакция на определение катиона натрия Na⁺
Возьмите проволоку и сделайте на ее конце петлю. Насыпьте на петлю немного соли и поднесите к огню.
Другая реакция для катиона натрия
Ацетат цинка диоксурана(VI) образует желтый кристаллический осадок. Химическая реакция:
NaCl + Zn(UO₂)₃(CH₃COO)₈ + CH₃COOH + 9H₂O ↔ NaZn(UO₂)₃(CH₃COO)₉ · 9H₂O↓ + HCl
Reaction of potassium hexahydroxoantimonate(V)
A white sediment forms, растворим в щелочах:
NaCl + K[Sb(OH)₆] ↔ Na[Sb(OH)₆]↓ + KCl
В кислой среде реагент распадается с образованием белого аморфного осадка метасурьмяная кислота HSbO₃:
K[Sb(OH)₆] + HCl ↔ KCl + H3SbO₄ + 2H₂O
H3SbO₄ ↔ HSbO3↓ + H2O
Качественная реакция на присутствие аниона, т.е. Cl⁻
Это можно наблюдать в качественной реакции на ионы хлорида. При взаимодействии с нитратом серебра образуется осадок хлорида серебра белого цвета. Химическая формула:
AgNO₃ + NaCl = AgCl + NaNO₃
Молекула хлорида серебра [Викимедиа] Хлороводород из соли вытесняется более сильными кислотами, чем соляная кислота. Химическая реакция:
Химическая реакция:
2NaCl + H₂SO4 = Na₂SO₄ + 2HCl
Количественное определение хлорида натрия капель раствора хромата калия и титруют раствором азотнокислого серебра до появления оранжево-желтой окраски :
NaCl + AgNO₃ → AgCl↓ + NaNO₃
хлорид натрия [Викимедиа]Другой метод реакции хлорида натрия и определения количества соли. Смешать раствор хлорида натрия в колбе для титрования, добавить 4 капли разведенной азотной кислоты (1:4), 4 капли насыщенного спиртового раствора дифенилкарбазона. Начните титрование 0,01 М раствором перхлората ртути до появления розовато-фиолетового окрашивания.
Нажмите здесь, чтобы увидеть больше экспериментов с хлоридом натрия.
Местонахождение поваренной соли
На Земле имеется достаточное количество хлорида натрия. Его можно найти:
- В воде морей, океанов и озер.
 Мировой океан содержит 120 миллиардов тонн хлорида натрия. Из 1000 тонн морской воды можно получить 1,3 тонны хлорида натрия.
Мировой океан содержит 120 миллиардов тонн хлорида натрия. Из 1000 тонн морской воды можно получить 1,3 тонны хлорида натрия. - Месторождений этого минерала много в разных странах, самое большое месторождение находится в Великобритании.
- На берегу соленых озер.
- В солончаках
- На стенах кратеров вулканов.
Использование и польза соли для человека
Кухонная соль используется для засолки овощей, рыбы и мяса. Он используется в качестве антисептика.
[Депозитные фотографии] Роль хлорида натрия также важна в медицине; используется для изотонического раствора. 9г соли разводят в 1 л воды. Именно такая концентрация раствора хлорида содержится в организме человека: в жидкости и тканях. Растворы с более высокой концентрацией используются в качестве противомикробных средств, а также для предотвращения гниения и брожения.




 Мировой океан содержит 120 миллиардов тонн хлорида натрия. Из 1000 тонн морской воды можно получить 1,3 тонны хлорида натрия.
Мировой океан содержит 120 миллиардов тонн хлорида натрия. Из 1000 тонн морской воды можно получить 1,3 тонны хлорида натрия.