состав препарата, назначение и способы применения
В статье рассмотрим раствор для инъекций хлорид натрия.
Данный препарат широко применяется в медицинской практике как плазмозамещающее, регидратирующее средство. Так, раствор натрия хлорида (NaCl), или физраствор, в большинстве случаев используют для приготовления капельниц, которые просто незаменимы при рвоте, отравлении и других синдромах, сопровождающихся нарушением водно-солевого баланса.
Это кристаллы, имеющие белый оттенок и соленый вкус. По сути, раствор натрия хлорида — это вода для инъекций? В области медицины раствор вещества, в зависимости от того, какую концентрацию он имеет, именуют физиологическим (0,9%) или гипертоническим (10%).
Состав
В литре изотонического раствора натрия хлорида для инъекций 0,9 % содержится 9 грамм активного вещества и дистиллированная вода до 1 литра.
В литре гипертонического раствора содержится 100 грамм натрия хлорида и дистиллированная вода до 1 литра. Раствор в данном случае имеет концентрацию 10 %, то есть он более концентрированный, нежели физиологический.
Раствор в данном случае имеет концентрацию 10 %, то есть он более концентрированный, нежели физиологический.
Фармакологическая форма
Физиологический раствор выпускается в нескольких вариациях:
- Для инфузий, наружного применения, клизм, разведения медикаментозных средств. Выпускается расфасованным во флаконы, имеющие объем 100, 200, 400 мл.
- Для разведения медикаментов, которые затем будут вводиться путем подкожной, внутримышечной инъекции. Фасуется в стеклянные ампулы, имеющие объем 5, 10, 20 мл.
- Таблетки, предназначенные для перорального использования. В каждой такой таблетке находится 0,9 мг хлорида натрия. Перед использованием таблетку растворяют с использованием кипяченой теплой воды в объеме 100 мл.
Гипертонический раствор
Гипертонический раствор также выпускается в нескольких вариациях:
- Для обработки полости носа. Имеет форму спрея, фасуется, как правило, во флаконы объемом 10 мл.
- Для наружного использования или внутривенно.
 Фасуется раствор натрия хлорида для инъекций 10 % во флаконы по 200, 400 мл.
Фасуется раствор натрия хлорида для инъекций 10 % во флаконы по 200, 400 мл.
Фармакологическое воздействие
В организме натрия хлорид ответственен за поддержание давления во внеклеточной жидкости и плазме на постоянном уровне. Как правило, организм получает достаточное количество вещества совместно с едой.
В некоторых случаях могут развиваться разнообразные патологические состояния, к примеру сильные ожоги, рвота, диарея. Для них характерны большие потери солей и жидкости. В результате возникает недостаток хлорных и натриевых ионов. Такая ситуация провоцирует сгущение крови, судороги, спазмы гладкомышечных структур, нарушения функциональности нервной системы, а также системы кровообращения.
Своевременное введение в организм изотонического раствора натрия хлорида для инъекций позволяет быстро восполнить дефицит жидкости и восстановить баланс воды и солей.
Помимо этого, для средства характерно дезинтоксикационное, плазмозамещающее свойства, в связи с чем раствор может применяться для инфузии при малых кровопотерях.
Свойства гипертонического раствора
Если говорить о гипертоническом растворе, то его внутривенное введение позволяет быстро восполнить недостаток хлорных и натриевых ионов, усилить диурез. То есть гипертонический раствор может выступать средством скорой помощи при возникновении обезвоживания. Нередко гипертонический раствор требуется детям – у них обезвоживание развивается стремительно, может провоцировать серьезные осложнения, вплоть до наступления летального исхода.
При внутривенном введении раствора натрия хлорида для инъекций быстро экскретируется из кровеносного русла. Спустя час в крови остается менее половины введенной дозы раствора. Такое свойство делает вещество малоэффективным при значительных кровопотерях.
Период полуэлиминации раствора составляет около часа, затем вода, хлорные, натриевые ионы экскретируются при участии почек, вызывая повышенное отделение мочи.
В каких случаях назначается натрий хлорид для инъекций?
Показания к использованию
Как уже было сказано, в медицине натрия хлорид используется довольно широко.
Физиологический раствор:
- Способствует восстановлению водно-солевого баланса в случае обезвоживания, спровоцированного любыми причинами.
- Внутривенное введение хлорида натрия позволяет поддерживать необходимый баланс кровяной плазмы во время оперативного вмешательства, после него.
- Средство может применяться с целью дезинтоксикации при кишечных инфекциях, дизентерии, пищевом отравлении.
- Физиологический раствор обладает плазмозамещающими свойствами, поэтому его нередко используют, чтобы поддержать объем плазмы при сильных кровопотерях, диабетической коме, ожогах, диарее.
- Раствор может применяться в качестве средства промывания глаз при раздражении роговицы, спровоцированном аллергией или воспалением.
- Также рекомендовано использование физраствора для промывания полости носа при острых патологиях респираторного характера, после удаления полипов, аденоидов, с целью профилактики развития гайморита, при ринофарингите, насморке аллергического происхождения.

- В совокупности с другими медикаментами либо без них раствор может использоваться с целью ингаляции дыхательных путей.
- Благодаря своей нейтральной среде физиологический раствор – идеальное средство растворения других препаратов с целью их последующей инъекции или инфузии.
- Для смачивания марлевых повязок, бинтов, обработки раневых поверхностей.
Показания для применения
- В первую очередь, гипертонический раствор применяют с целью устранения острого недостатка в организме хлорных и натриевых ионов.
- Введение гипертонического раствора способствует быстрому восстановлению водно-солевого равновесия, нарушенного вследствие диареи, сильной рвоты, ожогов, кишечного, легочного, желудочного кровотечения.
- Гипертонический раствор является средством скорой помощи при интоксикации нитратами серебра.
- Может применяться как средство промывания полости носа при гайморите.
- Обработка раневых поверхностей.
- Устранение запоров путем введения в качестве клизмы.

- Также может являться вспомогательным средством быстрого увеличения объема отделяемой мочи.
Противопоказания к использованию
Запрещается использование физиологического раствора натрия хлорида для инъекций в следующих случаях:
- Изменения, нарушения функциональности почек.
- Применение кортикостероидных препаратов.
- Лишняя жидкость во внеклеточных пространствах.
- Внутриклеточное обезвоживание.
- Острые формы сердечной недостаточности.
- Отек легких.
- Отек мозга.
- Нарушения циркуляции жидкости, провоцирующие отек мозга, легких.
- Недостаточность калия.
- Повышенный уровень содержания хлорных и натриевых ионов в организме.
Гипертонический раствор абсолютно запрещено вводить подкожно и внутримышечно. Результатом такого применения может стать некроз тканей. В остальном гипертонический раствор не следует использовать в тех же случаях, что и физиологический.
Негативные воздействия
На фоне использования натрия хлорида для инъекций могут развиваться определенные побочные реакции.
Внутривенное введение может вызывать возникновение местных реакций – гиперемию, жжение. Использование в течение длительного времени может спровоцировать появление симптомов интоксикации.
Кроме того, может возникать следующая негативная симптоматика:
- Дефицит калия в крови.
- Повышенная кислотность.
- Отечность.
- Нарушения цикла менструаций.
- Анемия.
- Дерматиты.
- Повышение АД, учащение пульса.
- Сильная жажда, слезотечение, беспокойство, потливость, слабость, головная боль, головокружение.
- Желудочные спазмы, рвота, диарея, приступы тошноты.
- Симптомы интоксикации (при длительном использовании).
Использование раствора
Физиологический раствор натрия хлорида для инъекций 0,9 % следует вводить пациенту подкожно, внутривенно, капельно внутривенно. Обычно используется последний способ введения.
Перед применением следует прогревать раствор до температуры человеческого тела. Объем препарата рассчитывают, опираясь на состояние пациента и количество жидкости, которой он потерял. Кроме того, должны быть учтены возраст и масса тела.
Объем препарата рассчитывают, опираясь на состояние пациента и количество жидкости, которой он потерял. Кроме того, должны быть учтены возраст и масса тела.
Среднесуточная доза раствора – 0,5 литра. Данное количество способно полностью покрыть суточную потребность человеческого организма в веществах. В случае сильной интоксикации, чрезмерной обезвоженности допускается увеличение дозы до 3 литров.
Вводить вещество следует со скоростью 540 мл/ч. Если имеется острая необходимость, скорость может быть увеличена до 70 кап./мин.
При терапии детей дозировку рассчитывают, принимая во внимание массу тела, возраст. Как правило, она составляет 20-100 мл. Длительное использование средства предполагает периодический контроль состояния мочи и крови.
С целью приготовления других лекарственных средств раствор используют в объеме 50-250 мл в качестве вспомогательного компонента (для капельницы).
Как вводить средство
Вводить гипертонический раствор можно только внутривенно, струйно. Скорость введения при этом должна быть очень медленной, используемый объем – 10-30 мл.
Скорость введения при этом должна быть очень медленной, используемый объем – 10-30 мл.
С целью немедленного восполнения хлорных и натриевых ионов показано капельное введение гипертонического раствора в количестве 100 мл.
Клизмы на основе гипертонического раствора натрия хлорида для инъекций (5 мл) можно использовать с целью устранения запоров. Также они эффективны при эрозивных поражениях и воспалениях толстой кишки, гипертонической болезни, почечном, сердечном отеке, внутричерепном давлении.
Компрессы на основе гипертонического раствора применяются при фурункулах, абсцессах, гнойных ранах.
Оба вида раствора натрия хлорида могут использоваться с целью обработки полости носа, очистки ее от гноя, слизи. Для таких целей средство специально выпускается в форме спрея, однако можно закапывать средство в нос, используя обычную пипетку. Показано инстиллировать 2 капли средства в каждый носовой ход.
С целью терапии патологий верхних отделов системы дыхания и заболеваний простудного характера могут использоваться ингаляции на основе физиологического раствора. Раствор сам по себе отлично облегчает процесс отхождения мокроты. При необходимости в него можно добавить лекарственные средства («Геделикс», «Амброксол», «Лазолван»). Чтобы облегчить симптоматику бронхиальной астмы, в физраствор могут быть добавлены медикаменты-бронхолитики, к примеру «Беродуал».
Раствор сам по себе отлично облегчает процесс отхождения мокроты. При необходимости в него можно добавить лекарственные средства («Геделикс», «Амброксол», «Лазолван»). Чтобы облегчить симптоматику бронхиальной астмы, в физраствор могут быть добавлены медикаменты-бронхолитики, к примеру «Беродуал».
Мы рассмотрели описание раствора натрия хлорида для инъекций 10 % и 0,9 %.
Энцелад, Европа, Ганимед… Какую жизнь мы найдем в океанах других миров?
- Мико Таталович
- BBC Future
Автор фото, Getty Images
Ученые строят планы по исследованию спутников Юпитера и Сатурна, надеясь узнать, что происходит там, глубоко под ледяной поверхностью. Но с какими формами жизни мы можем столкнуться, если доберемся туда?
Недавние научные открытия привели астробиологов к мысли, что спутники планет нашей Солнечной системы наиболее подходят для поисков внеземной жизни. В течение следующего десятилетия планируются несколько космических экспедиций к этим спутникам, чтобы попытаться найти там признаки жизни.
В течение следующего десятилетия планируются несколько космических экспедиций к этим спутникам, чтобы попытаться найти там признаки жизни.
В отличие от самих планет Солнечной системы, на некоторых их спутниках есть жидкая вода. Например, на спутнике Юпитера Европе, как полагают, такой воды больше, чем во всех океанах Земли, вместе взятых.
Эта вода — и жизнь, если она там существует, — защищена от космической радиации и попадания астероидов толстым, в несколько километров, слоем льда.
Обнаружение фонтанов воды над поверхностью Энцелада (спутника Сатурна) и Европы может говорить о том, что подо льдом у них — более теплый океан, который согревается не Солнцем, а внутренним теплом радиоактивного распада в их недрах или приливным тепловыделением.
Уже существуют свидетельства того, что на нескольких спутниках есть водные океаны — на Европе, Энцеладе, Каллисто и Ганимеде. Согласно опубликованному в июне этого года исследованию, возраст океана на Энцеладе — примерно миллиард лет. По другим оценкам — много миллиардов лет. Вполне достаточно для того, чтобы там зародилась жизнь.
По другим оценкам — много миллиардов лет. Вполне достаточно для того, чтобы там зародилась жизнь.
Эти океаны, как полагают, — соленые, они содержат хлорид натрия, поваренную соль, как и океаны Земли, что дает основания рассчитывать на формы жизни, напоминающие земные.
Кроме того, вероятно взаимодействие жидкой воды с мантией океанского дна — а это ключевое условие, как считают ученые, приведшее к рождению жизни на Земле.
Миссия НАСА «Кассини», например, обнаружила в водных фонтанах Энцелада молекулы, по которым можно предположить наличие на дне океана гидротермальных отверстий.
Автор фото, Getty Images
Подпись к фото,Наши представления о жизни в океанах иных планет формируются нашим знанием о жизни на дне земных океанов
Такие отверстия есть на дне океанов Земли, где магма взаимодействует с соленой водой, согревает ее и рождает субстрат, помогающий создать сложный химический состав, необходимый для возникновения жизни — по крайней мере, так, считают ученые, это случилось на Земле.
Солнечный свет не достигает больших глубин — точно так же, как и в океанах спутников Сатурна и Юпитера. Но это не означает, что там нет жизни. И действительно, на Земле места, где магма прорывается сквозь океанское дно, изобилуют различными формами жизни.
Примерно 20 лет назад в документальном фильме Би-би-си «Естественная история инопланетянина» (Natural History of an Alien) прозвучало предположение, что вокруг гидротермальных отверстий на дне Европы могут сложиться целые экосистемы.
Коллектив ученых заявил, что бактерии лягут в основу пищевой цепочки — они будут использовать для питания хемосинтез (источником энергии для синтеза органических веществ из CO2 служат реакции окисления неорганических соединений. — Прим. переводчика), и формировать слои [органических] отложений на океанском дне.
Другие живые организмы, например, похожие на рыб травоядные, будут питаться бактериями из этих отложений.
Они могут жить на определенных территориях, защищая свои «пастбища» от конкурентов. На них могут охотиться хищники, похожие на земных акул по скорости и способности обнаруживать добычу с помощью эхолокации.
На них могут охотиться хищники, похожие на земных акул по скорости и способности обнаруживать добычу с помощью эхолокации.
Впрочем, такая картина намного более сложна, чем то, что ученые рассчитывают обнаружить на спутниках планет Солнечной системы.
Даже на Земле на протяжении почти 90% ее истории жизнь существовала только в виде микробов, подчеркивает Эндрю Нолл, профессор геофизики и планетологии Гарвардского университета.
Так что если в космосе и есть жизнь, высока вероятность того, что это микроорганизмы, говорит Нолл, и в таких местах, как Европа или Энцелад, эта жизнь будет полагаться исключительно на хемосинтез, который в состоянии обеспечить условия только для малого количества биомассы.
Автор фото, Getty Images
Подпись к фото,Фонтаны воды на поверхности Энцелада, спутника Сатурна
Но существование такой экосистемы возможно, настаивает Димитар Сасселов, профессор астрономии и директор Гарвардского центра «Инициатива «Происхождение жизни», поддерживающего междисциплинарные исследования возможности существования жизни во Вселенной.
«Размышлять об этом — большое удовольствие, — говорит Сасселов. — Чутье мне подсказывает, что там есть где разгуляться эволюции, и мы можем обнаружить нечто маленькое, но хищное, скорее всего — многоклеточный организм».
Еще один спутник, который планируется посетить, представляет собой загадку совершенно другого рода.
Спутник Сатурна Титан в Солнечной системе — единственный, кроме Земли, на поверхности которого есть стабильные бассейны жидкости.
Но облака, дождь и моря на Титане состоят не из воды, а из жидких метана и этана, компонентов земного природного газа. Любая вода, которая там существует, замерзает, образуя горы и скалы: температура на поверхности Титана — минус 180 градусов по Цельсию.
Это означает, что хотя пейзажи и выглядят знакомо для землян, реальные условия абсолютно чужды, враждебны земной жизни. Если и есть там жизнь, то она полагается на метан, а не на воду, и поэтому может выглядеть на взгляд землян необычно — жизнь, какой мы ее не знаем. В полном смысле чужая.
В полном смысле чужая.
То, что жизнь на Титане существует, звучит правдоподобно, но она — совершенно другая, иной биохимии, говорит Сасселов, чья цель в перспективе — установить, существует ли такая биохимия и можно ли ее воспроизвести в лабораторных условиях.
Автор фото, Getty Images
Подпись к фото,Формы жизни на дне земных океанов, возможно, подскажут нам, что именно мы можем найти на дне инопланетных океанов
Жизнь на Земле зависит от обеспечивающих целостность клетки клеточных мембран, основа которых — фосфолипиды. «Головка» фосфолипидов гидрофильна, а «хвосты» гидрофобны, что позволяет при нахождении в водной среде образовывать двойной слой фосфолипидных молекул. Понятно, что у жизни на основе метана будет другой способ формировать клетки.
Коллектив ученых Корнеллского университета под руководством инженера-химика Полетт Клэнси в 2015 году продемонстрировал, что маленькие молекулы, состоящие из азота, углерода и водорода, могут создавать клетки, способные выжить в условиях Титана.
Затем исследователи НАСА подтвердили наличие в атмосфере Титана винилцианида, органического соединения, которое может создавать клеточные мембраны.
Так что (по крайней мере в теории) такие клетки могли бы существовать в условиях Титана и создать в его метановых океанах жизнь, совершенно не похожую на земную.
«В определенном смысле та жизнь, которую мы видим на Земле, — дело случая», — говорит Тереза Фишер, астробиолог из государственного университета Аризоны (США). Существует невероятное количество потенциальных вариантов жизни, которые мы можем встретить в других мирах, считает она.
«Если предположить, что эти существа разовьются во что-то такое же социальное, умное и умеющее общаться, как земные китообразные или слоны, такое же сообразительное, как земные шимпанзе или орангутаны, то я не вижу причин, почему бы им в конце концов не эволюционировать дальше и не продвинуться к обладанию технологиями и культурой», — добавляет Сара Блэффер Херди, почетный профессор антропологии Калифорнийского университета в Дэвисе.
Лорен Саллан, палеонтолог Пенсильванского университета, напротив, считает, что внеземная жизнь — это многообразные микроорганизмы. Что же касается многоклеточных инопланетян, говорит она, то тут всё не так просто.
«Мы могли бы заключить, что они делают то же, что и мы, поскольку всё в жизни крутится вокруг потребления энергии или потребления чего-то, что снабжает нас энергией, — объясняет она. — Но вот способы, к которым для этого прибегают жители другой планеты, могут оказаться непредсказуемыми».
Автор фото, Getty Images
Подпись к фото,Если жизнь и существует в океанах таких спутников, как Европа, то она, скорее всего, — на уровне микроорганизмов
«Мы и в самом деле не знаем, каковы рамки того, что мы называем жизнью», — говорит Дэвид Шарбонно, профессор астрономии Гарвардского университета. Поэтому, по его словам, нам и надо отправлять больше космических зондов к спутникам планет Солнечной системы.
Хорошая новость состоит в том, что уже существуют планы как раз на этот счет.
НАСА объявило летом 2019-го, что миссия Dragonfly («Стрекоза») отправится к Титану в 2026 году, чтобы прибыть туда в 2034-м. Титан будет обследован с помощью летательного аппарата типа дрона на предмет признаков жизни.
Кроме того, НАСА исследует возможность отправки на Титан автономной субмарины, с помощью которой надеется исследовать море Кракена — крупнейшее углеводородное море, находящееся в северном полушарии. Шириной оно примерно в 1000 км, глубина достигает, по некоторым оценкам, 300 метров — по размерам оно похоже на Великие озера в Северной Америке.
Это может стать первой возможностью исследовать море на другой планете.
Миссия пока в стадии разработки концепции, у ученых есть еще пара десятилетий на то, чтобы понять, как вообще построить подобный подводный аппарат.
Что интригует еще больше в отношении Титана — так это то, что там под поверхностью льда может быть настоящий водный океан. Это означает, что, кроме экзотических, метановых форм жизни, есть шанс найти там и жизнь, похожую на океаническую земную.
Еще один подобный многослойный мир — это Ганимед, спутник Юпитера.
Некоторые ученые считают, что у этого небесного тела — несколько слоев океана, разделенных разными типами льда, сформированного на разной глубине и под разным давлением. Если это действительно так, то в каждом из этих слоев может быть разная жизнь, адаптировавшаяся к конкретным условиям своего слоя.
В 2022 году на Ганимед должна отправиться межпланетная станция JUICE Европейского космического агентства. Два других спутника Юпитера — Каллисто и Европа — тоже будут исследованы на наличие жизни.
Тем временем автоматическая межпланетная станция НАСА Europa Clipper, как планируется, должна выйти на орбиту Юпитера и несколько раз облететь вокруг Европы, чтобы понять, есть ли там условия для возникновения жизни. Старт миссии запланирован на 2023 год.
Автор фото, Getty Images
Подпись к фото,Спутники Сатурна — место заледенелое, но под толстой поверхностью льда есть вода в жидком состоянии
Есть и планы частной компании, поддерживаемой НАСА, отправить миссию к Энцеладу. Если в этом году ей будет дан зеленый свет, миссия стартует в 2025-м.
Если в этом году ей будет дан зеленый свет, миссия стартует в 2025-м.
Но чтобы точно узнать, какого рода жизнь существует в этих инопланетных океанах, нам надо отправить туда подводный аппарат.
Сделать это крайне трудно, поскольку придется бурить несколько километров льда — и это только для того, чтобы добраться до океана. НАСА финансирует ряд концептуальных исследований того, как это сделать.
Одна из таких концепций была представлена в 2018 году во время заседания Американского геофизического союза в Вашингтоне учеными из университета Иллинойса (Чикаго) и представителями НАСА.
Предлагается отправить на поверхность Европы так называемого туннельного робота с ядерным реактором, который мог бы бурить лед, одновременно собирая образцы льда и воды и посылая информацию на поверхность по оптоволоконному кабелю.
Однако если формы жизни окажутся по-настоящему неземными, нам, видимо, будет трудно распознать их. Кроме того, возможно, жизни там просто нет. Никакой. Во всяком случае, пока.
Никакой. Во всяком случае, пока.
В отдаленном будущем, лет этак миллиардов через пять, когда у нашего Солнца закончится водородное топливо и оно начнет расширяться, превращаясь в красного гиганта (конечный этап эволюции звезды) перед тем, как погибнуть, оно растопит льды на спутниках, о которых мы сейчас рассказывали, и превратит их в гораздо более похожие на нынешнюю Землю небесные тела.
Там будет и вода на поверхности, и куда более умеренный климат, что, возможно, даст толчок развитию жизни. Или хотя бы откроет возможность людям бежать на эти планеты с Земли, которую погибающее Солнце превратит в выжженный шар.
В этом отдаленном будущем, если мы хотим уцелеть как человечество, нам всем придется стать эмигрантами.
Остается надеяться, что новые миры, уже пригодные для жизни, примут нас, поскольку наш собственный мир к тому времени станет слишком жарким для жизни в нем.
Прочитать оригинал этой статьи на английском языке можно на сайте BBC Future.![]()
Бронхоскопия
Бронхоскопия – это современное диагностическое исследование слизистых оболочек трахеи и бронхов с помощью специального оптического прибора – бронхоскопа. Это единственный метод, позволяющий непосредственно оценить внутреннюю поверхность бронхов, изучить их конфигурацию, рельеф слизистой оболочки и её сосудистый рисунок, а при обнаружении патологически измененного участка слизистой — произвести биопсию для последующего морфологического анализа. Бронхоскопия является также важнейшим и эффективным способом лечения больных с хроническими воспалительными и гнойными заболеваниями легких.
Ларингоскопия – это метод визуального исследования гортани. Специалистом осматриваются передняя и задняя части гортани, складки преддверия и истинные голосовые складки. Исследование чаще всего выполняется ЛОР-врачом при помощи гортанного зеркала (непрямая ларингоскопия) либо ригидного ларингоскопа (прямая ларингоскопия).
Показания для проведения плановой бронхоскопии:
- Подозрение на опухоль трахеи и бронхов
- Кровохарканье
- Подозрение на наличие инородного тела в просвете дыхательных путей
- Ожоги нижних дыхательных путей
- Пневмония с затяжным течением, рецидивирующие пневмонии
- Деструктивная/аспирационная пневмония, абсцесс легкого
- Хронические заболевания бронхов и легких невыясненной причины
- Признаки диссеминированных патологических процессов на рентгене (мелких очагов, кист, полостей)
- Длительная одышка (при исключении бронхиальной астмы и сердечной недостаточности)
- Немотивированный кашель, продолжающийся свыше 1 месяца
Противопоказания к проведению исследования:
В настоящее время врачи снижают количество противопоказаний к бронхоскопии. Но при некоторых патологиях обследование может принести больше вреда, чем пользы.
Но при некоторых патологиях обследование может принести больше вреда, чем пользы.
- Обострение хронической обструктивной болезни легких (ХОБЛ) и бронхиальной астмы (проведение процедуры в этот момент может усилить спазм бронхов и усугубить состояние больного).
- Инфаркт миокарда и инсульт, перенесенные менее 4 недель назад (стресс и спазм сосудов и некоторая нехватка кислорода во время процедуры могут вызвать повторный случай нарушения кровообращения).
- Неконтролируемая аритмия
- Выраженные нарушения свертываемости крови (тромбоцитопения менее 20000)
- Аневризма аорты
- Психические заболевания, такие как шизофрения и эпилепсия (стресс и снижение концентрации кислорода в крови могут спровоцировать приступ судорог)
Подготовка к исследованию
- Исследование проводят строго натощак, полностью исключается прием пищи за 8-10 часов и жидкости за 4–6 часов до начала процедуры.
 Вечером накануне исследования (до 18:00) — лёгкий ужин. В день исследования от курения следует воздержаться.
Вечером накануне исследования (до 18:00) — лёгкий ужин. В день исследования от курения следует воздержаться. - Отменить пероральные антикоагулянты (препараты для разжижения крови) накануне исследования, пауза п/к введения гепарина за 4-6 часов до процедуры.
- На обследование при себе необходимо иметь амбулаторную карту, результаты КТ грудной клетки или описание рентгенограммы легких, полотенце (так как после процедуры возможно непродолжительное кровохарканье). Если Вы страдаете бронхиальной астмой, то не забудьте ингалятор.
- Во время предварительной беседы сообщите врачу об аллергии на медикаменты (особенно если есть аллергия на обезболивающие препараты) и имеющихся у Вас хронических заболеваниях (бронхиальная астма, сердечная недостаточность).
Как осуществляется исследование:
 С целью местной анестезии непосредственно перед исследованием проводится обработка носовой и ротовой полости 10% Лидокаин-спреем. Он вызывает онемение неба, чувство комка в горле, легкую заложенность носа. Анестезия помогает подавить кашлевой и рвотный рефлекс. В процессе исследования анестетиком поэтапно орошается слизистая гортани, голосовых связок, трахеи и бронхов. Вопреки тревожным ожиданиям большинства пациентов, во время бронхоскопии они совершенно не чувствуют боли.
С целью местной анестезии непосредственно перед исследованием проводится обработка носовой и ротовой полости 10% Лидокаин-спреем. Он вызывает онемение неба, чувство комка в горле, легкую заложенность носа. Анестезия помогает подавить кашлевой и рвотный рефлекс. В процессе исследования анестетиком поэтапно орошается слизистая гортани, голосовых связок, трахеи и бронхов. Вопреки тревожным ожиданиям большинства пациентов, во время бронхоскопии они совершенно не чувствуют боли.Трубка бронхоскопа имеет очень маленький диаметр, поэтому дыханию обследуемого она не мешает. Во время продвижения трубки по дыхательным путям в них может ощущаться легкое давление, но выраженного дискомфорта Вы при этом не испытываете. Чтобы снизить рвотный рефлекс в момент введения бронхоскопа, рекомендуем Вам дышать поверхностно и как можно чаще.
После процедуры чувство онемения остается на протяжении получаса. Не рекомендуется курить и принимать пищу на протяжении 2-х часов после завершения процедуры.
Процедура бронхоскопии, выполненная на современном цифровом оборудовании, сопровождается фиксацией полученного материала в виде фото– или видеозаписи, что позволяет проследить изменения состояния слизистой органов в динамике.
О результатах исследования Вам сообщит врач–эндоскопист сразу же после обследования, результаты цитологического исследования будут готовы через 3-4 дня, морфологическое заключение будет готово через 8–12 дней
Дополнительные диагностические и лечебные манипуляции во время бронхоскопии:
- Биопсия слизистой оболочки/новообразования
Важной составной частью диагностической бронхоскопии и ларингоскопии является биопсия. Она выполняется для морфологической верификации процесса и определения его распространенности по бронхиальному дереву. Взятие материала для цитологического и гистологического исследований выполняется несколькими способами, каждый из которых имеет свои показания. Наиболее часто биопсию производят с помошью биопсийных щипцов либо щетки-скарификатора (браш-биопсия).
- Смыв со стенок бронхов
Материал для бактериологического и цитологического исследований (с целью обнаружения атипичных клеток при периферическом раке легкого, патогенной флоры при пневмониях и бронхитах, а также выявления микобактерии туберкулеза) получают со стенок и просвета бронхов. Если содержимое бронхов скудное, то в начале через канал эндоскопа в просвет бронхов вводят небольшой объем (20-40 мл) изотонического раствора натрия хлорида, а затем аспирируют раствор, смешанный с бронхиальным содержимым, в одноразовый стерильный контейнер.
- Бронхоальвеолярный лаваж
Бронхоальвеолярный лаваж представляет собой дополнительное исследование для установления характера легочного заболевания, при котором в просвет бронхов мелкого калибра вводится значительный объем изотонического раствора хлорида натрия (порядка 120-240 мл).
Неясные изменения могут быть инфекционной, неинфекционной, злокачественной этиологии. Даже в тех случаях, когда лаваж не является диагностическим, по результатам его можно предположить диагноз, и тогда внимание врача будет сфокусировано на нужных дальнейших исследованиях. Например, даже в нормальной лаважной жидкости высока вероятность обнаружения различных нарушений. В дальнейшем бронхоальвеолярный лаваж потенциально используется в установлении степени активности заболевания, для определения прогноза и необходимой терапии.
- Санация трахеобронхиального дерева
Санация трахеобронхиального дерева — это лечебная мера, позволяющая устранить скопление слизи на пораженных бронхах. Основными задачами санационной бронхоскопии являются воздействие на характер секрета слизистых желез, улучшение дренажной функции бронхов за счет удаления секрета, проведение противовоспалительной терапии. Однократные курсы лечебной санационной бронхоскопии эффективны при пневмонии, нагноившейся кисте легкого, абсцессе легкого, а при хронической обструктивной болезни легких, хроническом обструктивном бронхите, бронхоэктазах, муковисцидозе необходимо многократное курсовое лечение.
Какие могут быть осложнения?
Как правило, данное исследование хорошо переносится пациентами, но иногда возникают потеря или охриплость голоса, боль в горле, а в случае биопсии может наблюдаться кровохарканье. Эти явления носят временный характер. Вас должны насторожить длительное кровохарканье, интенсивная неослабевающая боль в груди, появление отёка на лице и вокруг шеи, тошнота и рвота, а также повышение температуры тела и озноб. При появлении указанных симптомов немедленно обратитесь к врачу.
При появлении указанных симптомов немедленно обратитесь к врачу.
Прохождение процедур бронхоскопии и ларингоскопии в нашем центре возможно только после предварительной записи в регистрационном журнале (см. раздел Контакты), при наличии на руках результатов КТ грудной клетки или описания рентгенограммы легких.
Бронхоскопия и ларингоскопия выполняются ИСКЛЮЧИТЕЛЬНО под местной анестезией.
На амбулаторном этапе процедура выполняется на платной основе. Оплатить исследование можно в регистратуре поликлиники центра на 1-м этаже.
Направление от других специалистов для прохождения исследования не требуется.
химия из нашей жизни / Хабр
Химия, изучаемая в школе, мне больше напоминала математику: вычисление валентности, массовой доли вещества, бесконечное составление формул химических реакций, и т.д. и т.п. Нет, эти знания полезны, но согласитесь, если ваша профессия не связана с химией, использовать их вы не будете, и они вскоре вовсе забудутся. Физику я любил потому, что явления, изученные на ней можно проследить и увидеть в реальной жизни: мы каждый день сталкиваемся со светом, звуком, агрегатными состояниями веществ, электричеством и тепловыми явлениями.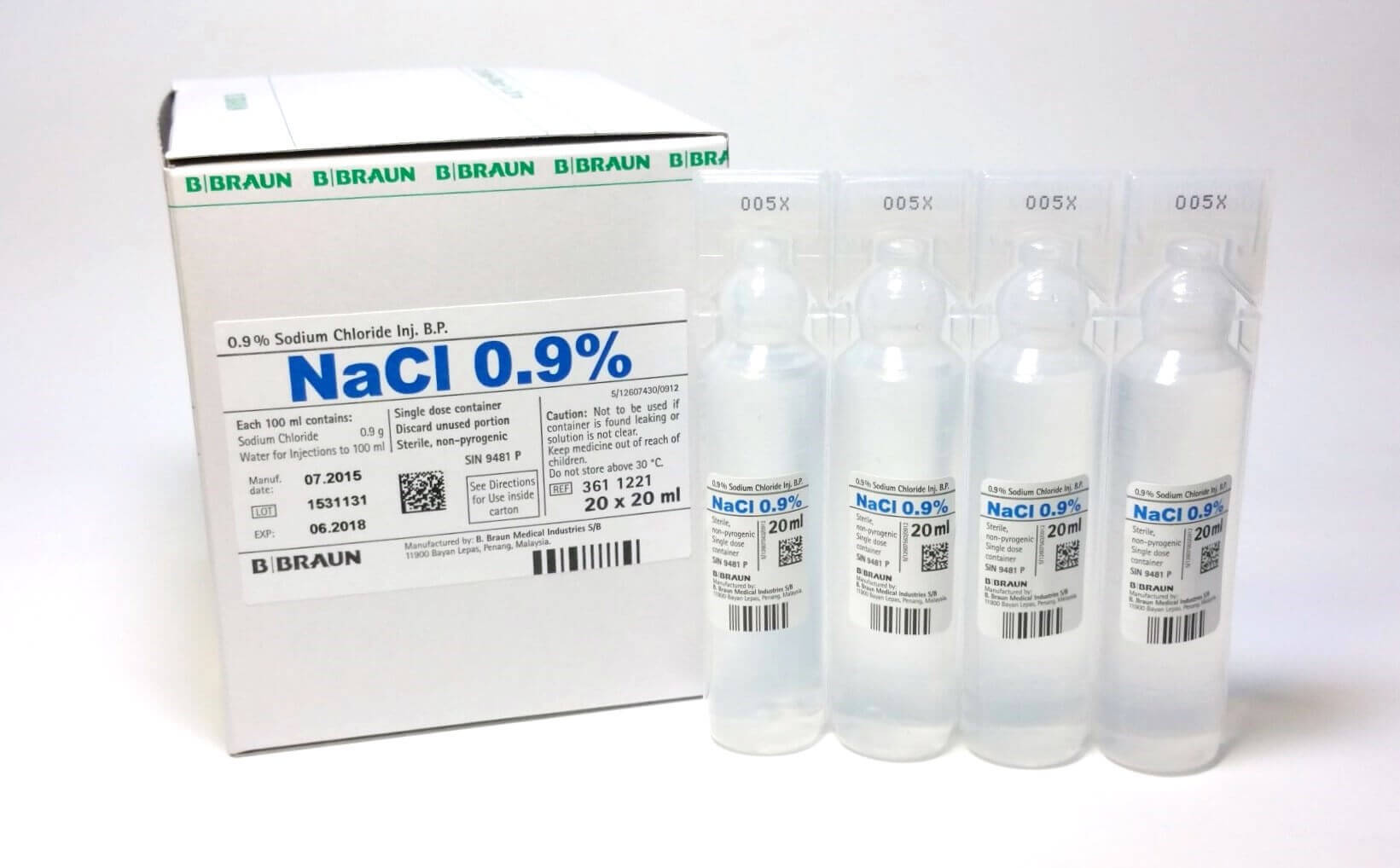 Чем химия хуже? Ведь она тоже окружает нас ежедневно и постоянно используется в быту. Поэтому сегодня мы с точки зрения химии будем разбирать вещества, используемые всеми людьми, изучим их свойства и происхождение, поехали!
Чем химия хуже? Ведь она тоже окружает нас ежедневно и постоянно используется в быту. Поэтому сегодня мы с точки зрения химии будем разбирать вещества, используемые всеми людьми, изучим их свойства и происхождение, поехали!
В статье: соль поваренная, сода пищевая, кислота лимонная, а также спирт этиловый и его действие на организм.
Соль
У всех людей есть химическая лаборатория, и имя ей кухня. Зайдем сюда. Здесь много интересных веществ, но первое, сразу бросающееся в глаза — конечно же поваренная соль, или говоря научным языком хлорид натрия (хим. формула NaCl) Разберем вещества, из которых она состоит:
Свой путь NaCl начинает с газа хлороводорода (HCl). Это очень токсичное вещество, вызывающее воспаление носоглотки и дыхательных путей, отек легких при попадании внутрь, ожоги на коже. 19 грамм хлороводорода убьёт среднестатистического человека. Однако HCl хорошо растворим в воде (500 объемов на 1 объем воды), в результате растворения получается соляная кислота (хим. формула та же). Не имеет цвета, прозрачна. Переходит в твердое состояние уже при -30°, кипит при 48°. Вещество все еще токсичное, вызывающее ожоги при попадании на кожу. Не смотря на это, содержится в желудке человека в концентрации 0,05%. HCl в желудке необходима для работы фермента пепсина, переваривающего белки, в свою очередь, для того чтобы соляная кислота не разъедала стенки желудка, в желудочном соке растворены гидрокарбонаты (соли угольной кислоты). HCl активное вещество — реагирует со всеми металлами, стоящими в ряду активности после водорода. Продукты реакции мы все прекрасно знаем — соли, получившие названия хлоридов.
формула та же). Не имеет цвета, прозрачна. Переходит в твердое состояние уже при -30°, кипит при 48°. Вещество все еще токсичное, вызывающее ожоги при попадании на кожу. Не смотря на это, содержится в желудке человека в концентрации 0,05%. HCl в желудке необходима для работы фермента пепсина, переваривающего белки, в свою очередь, для того чтобы соляная кислота не разъедала стенки желудка, в желудочном соке растворены гидрокарбонаты (соли угольной кислоты). HCl активное вещество — реагирует со всеми металлами, стоящими в ряду активности после водорода. Продукты реакции мы все прекрасно знаем — соли, получившие названия хлоридов.
Прежде чем рассмотреть сам хлорид натрия, познакомимся с еще одним элементом, его составляющим — натрием (Na). Натрий — светлосеребристый метал, отличающийся сильной пластичностью и мягкостью. В природе в чистом виде не существует, но содержится в соединениях некоторых минералов (как пример полевой шпат), и конечно же в хлориде натрия, в большом количестве растворенном в водах морей и океанов. Натрий легко окисляется до оксида натрия на воздухе, поэтому для хранения помещается в керосин. В организме человека содержится в межклеточной жидкости, совместно с калием используется для образования мышечных сокрашений, и некоторых других функций.
Натрий легко окисляется до оксида натрия на воздухе, поэтому для хранения помещается в керосин. В организме человека содержится в межклеточной жидкости, совместно с калием используется для образования мышечных сокрашений, и некоторых других функций.
Давайте же теперь рассмотрим продукт реакции соляной кислоты и натрия — хлорид натрия.
NaCl представляет из себя твердое вещество, образующее прозрачные кристаллы. C° плавления — 800°, кипения — 1465°, плотность — 2,165 г/см куб. Как уже было упомянуто, в огромных количествах растворен в морской воде. Кроме того, составляет минерал галит, содержащийся в осадочных горных породах, по берегам соленых озер, а также на стенках кратеров вулканов. Галит входит в состав каменной соли — горной породы, впрочем на 90% состоящей из него. Вещество прозрачно, или имеет белый цвет, но часто окрашено глинами и оксидами железа. Помимо хлорида натрия содержит соли калия, кальция и магния. Хлорид натрия конечно же содержится и в морской соли, образующейся при выпаривании морской воды. Состоявляет однако только 77% от вещества, и помимо NaCl, в соли содержится хлорид магния MgCl2 и сульфат магния MgSO4, а также другие вещества. Каменная и морская соль, использующиеся в быту, носят название поваренной соли. Концентрация хлорида натрия в ней достигает от 97 до практически 100%, поэтому поваренная соль почти полностью чистое вещество — NaCl. Суточная доза соли, необходимая человеку в умеренном климате — в среднем 5 грамм, однако в более жарких условиях возрастает в несколько раз. Среднестатистический человек в день употребляет 13 грамм соли, поэтому у нас, живущих в достаточно прохладном климате, недостаток данного вещества в организме редкость. NaCl необходима для водного обмена, поддержания концентрации соляной кислоты в желудке, для формирования костной и мышечной ткани.
Состоявляет однако только 77% от вещества, и помимо NaCl, в соли содержится хлорид магния MgCl2 и сульфат магния MgSO4, а также другие вещества. Каменная и морская соль, использующиеся в быту, носят название поваренной соли. Концентрация хлорида натрия в ней достигает от 97 до практически 100%, поэтому поваренная соль почти полностью чистое вещество — NaCl. Суточная доза соли, необходимая человеку в умеренном климате — в среднем 5 грамм, однако в более жарких условиях возрастает в несколько раз. Среднестатистический человек в день употребляет 13 грамм соли, поэтому у нас, живущих в достаточно прохладном климате, недостаток данного вещества в организме редкость. NaCl необходима для водного обмена, поддержания концентрации соляной кислоты в желудке, для формирования костной и мышечной ткани.
Сода
Нет человека, не видевшего эту упаковкуЧто еще интересного есть на нашей кухне? Очевидно — сода. Это кстати тоже соль натрия, но только не хлорид, а гидрокарбонат, или кислая соль угольной кислоты (NaHCO3). Напомню, что кислые соли это вещества, в которых атомы водорода заменились на атомы метала в ходе хим. реакции лишь частично. Так, мы можем заметить наличие одного атома водорода в формуле соды.
Напомню, что кислые соли это вещества, в которых атомы водорода заменились на атомы метала в ходе хим. реакции лишь частично. Так, мы можем заметить наличие одного атома водорода в формуле соды.
Перед рассмотрением самого вещества, давайте ознакомимся с одним из его компонентов — угольной кислотой. Данная кислота образуется при растворении углекислого газа в воде. Формула — h3CO3. Достаточно неустойчивое соединение, однако образуемые кислотой соли вполне устойчивы. Выглядит как бесцветная жидкость, не отличающаяся от воды. В повседневной жизни встречается как газированная вода. Концентрация углекислого газа в газировке составляет от 0,2 до 0,4%. Теперь о самой соде. Гидрокарбонат натрия, повсеместно используемый в кулинарии представляет из себя кристаллический порошок белого цвета. Плотность — 2,165 г/см куб. В природе встречается как минерал нахколит в содовых озёрах. Одно из содовых озер — Селитряное расположилось в Забайкальском крае, недалеко от Читы. Бессточно, в озеро впадает лишь одна пересыхающая речка. Глубина 6,5 метра. Имеет очень большую минерализацию, главным образом представленную карбонатом, гидрокарбонатом и хлоридом натрия. До середины 20 века использовалось для добычи вышеупомянутых веществ, а сейчас является памятником природы. Сода реагрует со многими кислотами, в ходе реакции образуется соответствующая натриевая соль (например при реакции с соляной кислотой — знакомый нам хлорид натрия), а также угольная кислота, распадающаяся на угл. газ и воду.
Глубина 6,5 метра. Имеет очень большую минерализацию, главным образом представленную карбонатом, гидрокарбонатом и хлоридом натрия. До середины 20 века использовалось для добычи вышеупомянутых веществ, а сейчас является памятником природы. Сода реагрует со многими кислотами, в ходе реакции образуется соответствующая натриевая соль (например при реакции с соляной кислотой — знакомый нам хлорид натрия), а также угольная кислота, распадающаяся на угл. газ и воду.
Лимонная кислота
Заглянем в холодильник. Что здесь есть интересного? Ну, например лимоны, а точнее их кислота — лимонная. Как и положено всем органическим соединениям, имеет вот такой «скромный» набор атомов в молекуле: C6H8O7. Может показаться, что лимонная кислота это жидкость, однако на самом деле это твердое вещество, в чистом виде представляющее кристаллы белого цвета.
Лимонная кислота — кристаллический порошокПлавится она лишь при температуре 153°. Поэтому в лимонах заключен раствор этой кислоты, ее растворимость очень высока: 133 грамма на 100 грамм воды! Как и любая другая кислота, лимонная образует соли — цитраты. Цитраты натрия, калия и кальция, образующие белые и прозрачные кристаллы, используются, как и сама лимонная кислота, в качестве пищевых добавок в промышленной кулинарии.
Цитраты натрия, калия и кальция, образующие белые и прозрачные кристаллы, используются, как и сама лимонная кислота, в качестве пищевых добавок в промышленной кулинарии.
Этиловый спирт
Выйдем с кухни и достанем аптечку. Конечно, это еще целая химическая лаборатория с большим количеством интересных веществ, но нам интересно именно вещество под названием этиловый спирт (C2H5OH).
Бесцветная жидкость, с плотностью 0,78 т.е. чуть легче воды, плавится уже при -114° (поэтому с внутренним употреблением даже в самые сильные морозы где нибудь на Таймыре суровым полярником, проблем не возникает), закипает при 78°. Спирт горюч, продукты реакции горения — углекислый газ и вода. Конечно, часто находит употребление как растворитель и антисептик, но не менее широко известен как незаменимый компонент горячительных напитков, и именно из за него происходит процесс опьянения, давайте рассмотрим почему:
Этиловый спирт или этанол всасывается в кровь в желудке и кишечнике. Он разрушительно действует на оболочки клеток эритроцитов, в результате они склеиваются, образуя тромбы, в том числе и в головном мозге, из за чего начинается легкое кислородное голодание. Помимо этого, этанол действует на нейроны в мозгу, заставляя вырабатывать дофамин, делающий человека веселым и активным. При увеличении дозы спиртного в мозге активируется гаммо-аминомасляная кислота, обладающая успокаивающим действием. Самые слабые могут уже заснуть на этой стадии. Последующее, и уже явно не желательное добавление дозы этанола просто «взрывает» нейроны, делая поведение человека или агрессивным, или удрученным, склонным к странным идеям и мыслям. К слову, количество принятого не всегда совпадает с количеством попавшего в кровь — еда, одновременно употребляемая со спиртным, препятствует его всасыванию в кровь, поэтому с виду благородное и безобидное шампанское в красивой упаковке без закуски в сравнительно небольшой дозе опьянит даже бывалого и крепкого мужчину на казалось бы культурном корпоративе, а гораздо большее количество водки, скажем с жирной курочкой (жир очень сильно препятствует всасыванию этанола в кровь, обволакивая стенки кишечника), может произвести совсем небольшой эффект.
Помимо этого, этанол действует на нейроны в мозгу, заставляя вырабатывать дофамин, делающий человека веселым и активным. При увеличении дозы спиртного в мозге активируется гаммо-аминомасляная кислота, обладающая успокаивающим действием. Самые слабые могут уже заснуть на этой стадии. Последующее, и уже явно не желательное добавление дозы этанола просто «взрывает» нейроны, делая поведение человека или агрессивным, или удрученным, склонным к странным идеям и мыслям. К слову, количество принятого не всегда совпадает с количеством попавшего в кровь — еда, одновременно употребляемая со спиртным, препятствует его всасыванию в кровь, поэтому с виду благородное и безобидное шампанское в красивой упаковке без закуски в сравнительно небольшой дозе опьянит даже бывалого и крепкого мужчину на казалось бы культурном корпоративе, а гораздо большее количество водки, скажем с жирной курочкой (жир очень сильно препятствует всасыванию этанола в кровь, обволакивая стенки кишечника), может произвести совсем небольшой эффект. Поэтому мужики после работы спокойно посидели до вечера, попили водки и поели курицы, придя домой во вполне разумительном состоянии, а на корпоративе все начали буянить и попали в СИЗО (просто юмор, автор не склоняет к употреблению ни того, ни другого).
Поэтому мужики после работы спокойно посидели до вечера, попили водки и поели курицы, придя домой во вполне разумительном состоянии, а на корпоративе все начали буянить и попали в СИЗО (просто юмор, автор не склоняет к употреблению ни того, ни другого).
Смесь Nestle Nestogen 1 700г с 0месяцев
Cмесь Nestogen 1 специально разработана для обеспечения сбалансированного здорового питания и комфортного пищеварения малыша. Смесь с пребиотиками Prebio и уникальными лактобактериями L.reuteri способствует улучшению моторики кишечника, формированию регулярного мягкого стула, здоровой микрофлоры и уменьшению колик.
- Предназначена для кормления здоровых детей с рождения в случаях, когда грудное вскармливание невозможно
- Содержит сбалансированный комплекс витаминов и минеральных веществ для гармоничного роста и развития
В течение первых месяцев жизни малыша его пищеварительной системе необходимо адаптироваться к новым условиям. Это естественный процесс развития, который может приводить к расстройствам пищеварения, таким как колики или запоры, а также вызывать чрезмерный плач. Смесь Nestogen 1 содержит уникальные лактобактерии L.reuteri и пребиотики для комфортного пищеварения и регулярного мягкого стула.
Смесь Nestogen 1 содержит уникальные лактобактерии L.reuteri и пребиотики для комфортного пищеварения и регулярного мягкого стула.
Состав: обезжиренное молоко, мальтодекстрин, деминерализованная молочная сыворотка, лактоза, смесь растительных масел (низкоэруковое рапсовое, подсолнечное, подсолнечное высокоолеиновое, кокосовое), молочный жир, пребиотики (галактоолигосахариды (ГОС) и фруктоолигосахариды (ФОС)), цитрат кальция, эмульгатор (соевый лецитин), цитрат калия, фосфат калия, хлорид магния, витамины (L-аскорбат натрия, аскорбилпальмитат (С), DL-альфа-токоферола ацетат (Е), никотинамид (РР), D-пантотенат кальция (В5), ретинола ацетат (А), тиамина мононитрат (В1), пиридоксин гидрохлорид (В6), рибофлавин (В2), D3 холекальциферол (Д), фитоменадион (К), фолиевая кислота (В9), цианкобаламин (В12), D-биотин (В7)), цитрат натрия, хлорид натрия, хлорид кальция, хлорид калия, культура лактобактерий L.reuteri1 (не менее 8,9х105 КОЕ/г), таурин, сульфат железа, инозит, сульфат цинка, L-карнитин, сульфат меди, сульфат марганца, йодид калия, селенат натрия. Упаковано в модифицированной атмосфере с азотом.
Упаковано в модифицированной атмосфере с азотом.
Важное примечание:
- Для питания детей раннего возраста предпочтительнее грудное вскармливание. Идеальной пищей для грудного ребенка является молоко матери. Грудное вскармливание должно продолжаться как можно дольше. Перед тем как принять решение об искусственном вскармливании с использованием детской смеси, обратитесь за советом к медицинскому работнику.
- Продукт следует готовить непосредственно перед каждым кормлением. Точно следуйте инструкции. Оставшийся после кормления продукт не подлежит хранению и последующему использованию. Во время кормления необходимо поддерживать ребенка, чтобы он не поперхнулся.
Натрия хлорид использование в быту. Практическая химия. Общая характеристика поваренной соли
Хлорид натрия применяют в следующих отраслях:
- В пищевой промышленности и кулинарии
- В медицине
- В коммунальном хозяйстве
- При регенерация Nа-катионитовых фильтров
- В химической промышленности
- В пищевой промышленности и кулинарии:
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97%. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль , пищевая, столовая, а также каменная, морская, и по составу добавок- йодированная, фторированная.
Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль , пищевая, столовая, а также каменная, морская, и по составу добавок- йодированная, фторированная.
Виды соли и ее основные месторождения
Он используется в горнодобывающей промышленности, производстве стали, нефтепереработке и химическом синтезе, а также в производстве удобрений, детергентов и пластмасс. Неудивительно, что его прозвали «королем химических веществ». Сегодня более 70 миллионов женщин во всем мире используют этот оральный контрацептив.
Углекислый газ является вторым наиболее важным парниковым газом, улавливающим тепло в нашей атмосфере и повышающим глобальную температуру за счет парникового эффекта. Выбросы продолжают расти, поэтому, если не произойдет резкого поворота, ожидайте повышения уровня моря, экстремальных погодных явлений и массовых вымираний, связанных с быстро прогревающимся глобусом.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
Массовая доля хлористого натрия в сортах,%:
- экстра- не менее 99,5;
- высший- 98,2;
- первый- 97,5;
- второй- 97,0.
Цвет экстра и высшего сортов- белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки.
Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
Сегодня вы, скорее всего, получите более 100 химических веществ, прежде чем садиться за миску с зерном и чашечкой кофе. Если бы ваш ответ был сумасшедшим ученым в лаборатории с пузырящимися стаканами, тогда это может быть сообщение в блоге для вас. Химические вещества не так далеки от повседневной жизни, как могут подумать некоторые. Фактически, многие из них находятся на расстоянии досягаемости оружия и, вероятно, играют неотъемлемую часть вашей повседневной жизни. По определению химическое вещество не то, что можно было бы воспринимать.
Химические вещества представляют собой продукт по химии. Говоря по опыту, химия может произвести некоторые довольно изящные вещи. Некоторые могли бы сказать, что эти изящные вещи необходимы. Теперь его время, чтобы выкопать в 5 химических веществ, используемых в повседневной жизни. Большинство примеров будут включать элементы, которые состоят из комбинированных форм химических веществ или регентов.
В кулинарии хлорид натрия потребляют как важнейшую приправу.
Хлорид натрия имеет слабые антисептические свойства- (10-15)% содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
- В медицине:
Изотонический раствор хлорида натрия в воде (0,9%) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов.
РН для обеих концентраций составляет 6. Растворы не содержат бактериостата, антимикробного агента или добавленного буфера, и каждый из них предназначен только в виде однократной инъекции. Когда требуется меньшая доза, неиспользованная часть должна быть отброшена.
Когда требуется меньшая доза, неиспользованная часть должна быть отброшена.
Решениями являются парентеральные жидкости и пополнения электролита. Гибкий пластиковый контейнер изготовлен из специально разработанного поливинилхлорида. Вода может проникать изнутри контейнера в обертку, но не в количествах, достаточных для значительного влияния на раствор. Решения, контактирующие с пластиковым контейнером, могут выщелачивать определенные химические компоненты из пластмассы в очень малых количествах; однако биологические испытания способствовали сохранности пластмассовых контейнеров.
Гипертонические растворы (10% р-р) используют как вспомогательный диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно).
В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием.
Более высокие температуры приводят к большим потерям. Маловероятно, что эти незначительные потери приведут к клинически значимым изменениям в течение срока действия. При внутривенном введении эти растворы обеспечивают источник воды и электролитов. Растворы, которые обеспечивают изотоническую концентрацию хлорида натрия, пригодны для парентерального обслуживания или замены требований к воде и электролиту.
Изотонические концентрации хлорида натрия подходят для парентерального замещения хлоридных потерь, которые превышают или равны потере натрия. Хлорид натрия в воде диссоциирует с образованием ионов натрия и хлорида. Натрий является основным катионом внеклеточной жидкости и играет большую роль в терапии флюидных и электролитных нарушений. Хлорид играет важную роль в буферизации, когда обмен кислорода и углекислого газа происходит в эритроцитах. Распределение и выделение натрия и хлорида в основном находятся под контролем почки, которая поддерживает баланс между потреблением и выходом.
- В коммунальном хозяйстве. Техническая соль:
Зимой хлорид натрия, смешанный с другими солями, песком или глиной- так называемая техническая соль- применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Средние нормальные взрослые ежедневные требования варьируются от двух до трех литров. Водный баланс поддерживается различными механизмами регулирования. Распределение воды зависит прежде всего от концентрации электролитов в кузове и натрия играет важную роль в поддержании физиологического равновесия.
Внутривенные растворы, содержащие хлорид натрия, указаны для парентерального пополнения жидкости и хлорида натрия, как того требует клиническое состояние пациента. Растворы, содержащие ионы натрия, следует использовать с большой осторожностью, если вообще у пациентов с застойной сердечной недостаточностью, тяжелой почечной недостаточностью и в клинических состояниях, в которых существует отек с удержанием натрия.
- Регенерация Nа-катионитовых фильтров:
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Чрезмерное введение растворов без калия может привести к значительной гипокалиемии. У пациентов с уменьшенной почечной функцией введение растворов, содержащих ионы натрия, может привести к удержанию натрия. Риск состояний разбавления обратно пропорционален концентрации электролитов в парентеральных растворах. Риск перегрузки растворенного вещества, вызывающий перегруженные состояния с периферическим и легочным отеком, прямо пропорционален концентрациим таких растворов в электролитах.
Не используйте пластиковые контейнеры в последовательных соединениях. Такое использование может привести к воздушной эмболии из-за остаточного воздуха, выводимого из первичного контейнера, до того, как будет завершено введение жидкости из вторичного контейнера.
Регенерацию Nа-катионитовых фильтров осуществляют 6-8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
- Химическая промышленность:
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков.
Использование вентилируемого внутривенного введения с вентиляционным отверстием в открытом положении может привести к воздушной эмболии. Вентиляционные внутривенные наборы с вентиляцией в открытом положении не должны использоваться с гибкими пластиковыми контейнерами.
Клиническая оценка и периодические лабораторные определения необходимы для мониторинга изменений баланса жидкости, концентраций электролита и кислотно-щелочного баланса при длительной парентеральной терапии или при условии, что состояние пациента гарантирует такую оценку.
Кроме того применяют в химической, нефтехимической промышленности, котельных для химической очистки воды теплосетей открытого и закрытого типа, для приготовления буровых растворов и других целей
Хлористый натрий, галит, хлорид натрия — все это названия одного и того же вещества — всем привычной поваренной соли. ее обширна: от медицины до химической и пищевой промышленности.
Следует проявлять осторожность при введении парентеральных жидкостей, особенно тех, которые содержат ионы натрия для пациентов, получающих кортикостероиды или кортикотропин. Беременность: тератогенные эффекты. Не известно, может ли инъекция хлорида натрия вызвать вред плода при введении беременной женщине или может повлиять на способность к размножению.
Следует проявлять осторожность при назначении этого препарата во время родов и родов. Кормящие матери: Неизвестно, изъят ли этот препарат в материнском молоке. Детская использования: Безопасность и эффективность у детей не установлены. Другой зарегистрированный клинический опыт не выявил различий в ответах между пожилыми и более молодыми пациентами. В целом, выбор дозы для пожилого пациента должен быть осторожным, как правило, начиная с нижнего предела диапазона дозирования, отражающим большую частоту снижения функции печени, почек или сердца, а также сопутствующей болезни или лекарственной терапии.
Другой зарегистрированный клинический опыт не выявил различий в ответах между пожилыми и более молодыми пациентами. В целом, выбор дозы для пожилого пациента должен быть осторожным, как правило, начиная с нижнего предела диапазона дозирования, отражающим большую частоту снижения функции печени, почек или сердца, а также сопутствующей болезни или лекарственной терапии.
Соль в кулинарии
Настоящая поваренная соль, в отличие от искусственной йодированной, содержит большое количество полезных микроэлементов и не имеет срока годности. Именно ее нужно использовать для приготовления домашних заготовок.
Пожалуй, пока еще самый необычный способ использования соли в кулинарии — применение ее в качестве посуды. Пласты гималайской соли заменяют на кухнях разделочные доски, тарелки и даже сковородки. Сейчас многие рестораны устанавливают вместо традиционных варочных поверхностей соляные пластины.
Известно, что этот препарат существенно выводится из почек, и риск токсических реакций на этот препарат может быть выше у пациентов с нарушенной функцией почек. Поскольку у пожилых пациентов более высокая вероятность почечной функции, следует соблюдать осторожность при выборе дозы, и может быть полезно контролировать функцию почек.
Поскольку у пожилых пациентов более высокая вероятность почечной функции, следует соблюдать осторожность при выборе дозы, и может быть полезно контролировать функцию почек.
Не администрируйте, если решение не ясно, а контейнер не поврежден. Реакции, которые могут возникать из-за раствора или метода введения, включают лихорадочный ответ, инфекцию в месте инъекции, венозный тромбоз или флебит, простирающийся от места инъекции, экстравазации и гиперволемии.
Хлористый натрий в медицине
Сама по себе соль является хорошим народным средством как для профилактики простудных заболеваний, так и для лечения уже запущенной болезни.
Раствор хлористого натрия (физраствор) широко известен в медицинской практике. Он применяется для растворения различных лекарственных препаратов. В качестве самостоятельного средства хлористый натрий используется для борьбы с обезвоживанием. Также он служит для обработки повреждений кожи.
Влияние соли на металл
Если возникает неблагоприятная реакция, прекратите вливание, оцените пациента, примите соответствующие терапевтические контрмеры и сохраните оставшуюся часть жидкости для обследования, если это будет сочтено необходимым. В случае перегибности или переливания растворенных веществ, переоценить пациента и ввести соответствующие корректирующие меры.
В случае перегибности или переливания растворенных веществ, переоценить пациента и ввести соответствующие корректирующие меры.
Доза зависит от возраста, веса и клинического состояния пациента. Парентеральные лекарственные препараты следует проверять визуально для твердых частиц и обесцвечивания перед введением, когда разрешается раствор и контейнер. Эти инструкции для использования должны быть доступны для лиц, которые выполняют шаги восстановления.
Очень популярна галотерапия — посещение соляных пещер. Это целое направление лечения и профилактики заболеваний дыхательных путей и кожи у детей и взрослых. Во время пребывания пациента в специально оборудованном помещении воздух наполняется галоаэрозолями (аэрозолями хлорида натрия), которые и являются основным действующим веществом.
Оберните обертку в углу и удалите контейнер для раствора. Может наблюдаться некоторая непрозрачность пластика из-за поглощения влаги во время процесса стерилизации. Это нормально и не влияет на качество решения или безопасность. Прозрачность постепенно уменьшится.
Прозрачность постепенно уменьшится.
Собирать флакон и гибкий контейнер для разбавителя. Чтобы снять крышку порта флакона, возьмитесь за язычок на вытяжном кольце, потяните вверх, чтобы сломать три стяжки, затем оттяните назад, чтобы снять крышку. Вверните флакон в порт флакона, пока он не пойдет дальше. Повторно проверьте флакон, чтобы убедиться, что он плотный, пытаясь повернуть его дальше в направлении сборки.
Использование соли в коммунальном хозяйстве
В зимний период для борьбы с гололедом на дорогах применяется так называемый натрий хлористый технический, смешанный с песком или мелким щебнем. Благодаря соли, снег плавится при отрицательной температуре, а песок обеспечивает сцепление подошв обуви и колес автомобилей с дорогой.
Сожмите нижнюю часть контейнера разбавителя осторожно, чтобы надуть часть контейнера, окружающего конец флакона с лекарственным средством. С другой стороны, выталкивают флакон с лекарством в контейнер, телескопируя стенки контейнера. Возьмите внутреннюю крышку флакона через стенки контейнера. Вытяните внутренний колпачок из флакона с лекарством. Убедитесь, что резиновая пробка вытащена, что позволяет смешивать препарат и разбавитель. Тщательно перемешайте содержимое контейнера и используйте его в указанное время.
Возьмите внутреннюю крышку флакона через стенки контейнера. Вытяните внутренний колпачок из флакона с лекарством. Убедитесь, что резиновая пробка вытащена, что позволяет смешивать препарат и разбавитель. Тщательно перемешайте содержимое контейнера и используйте его в указанное время.
Посмотрите на нижнюю часть флакона, чтобы убедиться, что стопор удален, и произошло полное перемешивание. Если резиновая пробка не удаляется из флакона, а лекарство не отдается при первой попытке, внутренний колпачок можно вернуть обратно в резиновую пробку, не удаляя флакон с лекарством из контейнера-разбавителя.
Несмотря на то, что соль сильно портит обувь, особенно кожаную, и является причиной коррозии автомобильных кузовов, она до сих пор не вытеснена другими реагентами за счет своей низкой стоимости. С недавних пор в стали добавлять — результат тот же, но получаемый состав меньше вредит окружающей среде.
Хлористый натрий в качестве противогололедного средства используется не только в России. Все «прелести» ее применения испытывают на себе жители Украины, Беларуси, Китая, США. В Швеции используется смесь соли с гранитной крошкой.
Все «прелести» ее применения испытывают на себе жители Украины, Беларуси, Китая, США. В Швеции используется смесь соли с гранитной крошкой.
Поваренная соль в жизни человека
Подготовка к администрации. Подтвердите активацию и добавку содержимого флакона. Проверьте герметичность, сжимая контейнер. Если обнаружены утечки, отбросить единицу, поскольку стерильность может быть нарушена. Закройте зажим управления потоком набора администрирования. Снимите крышку с выпускного отверстия внизу контейнера. Вставьте пирсинг-штифт администрирования, установленный в порт с крутящим движением, пока штифт не будет плотно вставлен. Поднимите свободный конец петли подвески на дно флакона, сломав две стяжки.
Прочие способы применения хлористого натрия
Соль входит в состав специальных растворов, которые используют на финальном этапе серебрения металлов (покрытия недрагоценных металлов вроде латуни или меди тонким слоем серебра). Этот прием используется при создании бижутерии, столовых приборов, а также для производства электрических разъемов.
Применение соли в быту
Согните петлю наружу, чтобы зафиксировать ее в вертикальном положении, затем приостановите контейнер с вешалки. Сожмите и отпустите капельную камеру, чтобы установить надлежащий уровень жидкости в камере. Открытый зажим контроля потока и чистый воздух из набора. Прикрепите комплект к венепункции. Если устройство не является постоянным, попробуйте и сделайте венопункт. Регулируйте скорость подачи с помощью зажима для контроля потока.
Обертка представляет собой барьер для влаги. Не удаляйте устройства из обертки до готовности к использованию. Немедленно используйте устройства, когда открыт пакет. После снятия обертки проверьте герметичность, нажав. контейнер. Не удаляйте устройство из обертки до готовности к использованию. Немедленно используйте устройство, когда открыт пакет.
В холодильной технике водный раствор хлористого натрия является одним из самых распространенных теплоносителей.
Очень популярны, в особенности среди сторонников здорового образа жизни, соляные лампы, плафоны которых выточены из галита. Будучи включенными, они работают как ионизаторы воздуха. Для оформления интерьера используются не только лампы или подсвечники из соли. Сейчас растет спрос на галитовые кирпичи и плитку в качестве стройматериала для облицовки стен, в том числе и в жилых помещениях.
Будучи включенными, они работают как ионизаторы воздуха. Для оформления интерьера используются не только лампы или подсвечники из соли. Сейчас растет спрос на галитовые кирпичи и плитку в качестве стройматериала для облицовки стен, в том числе и в жилых помещениях.
В тульском роддоме скончался новорожденный малыш: родители требуют наказать виновных — Новости Тулы и области. Криминал
В тульском роддоме произошла трагедия: умер ребёнок, которому было всего 4 дня. По просьбе родителей, мы не публикуем их имена. Мальчик появился на свет 24 января, в 19.05; вес — 3,5 кг, рост — 53 см. О возможных болях молодую маму акушер-гинеколог предупреждал ещё на 38 неделе беременности.
По словам женщины, 17 января у неё начались боли, похожие на схватки. Ночью супруг повёз тулячку в роддом. В родовой со схватками она пролежала до 8 утра. Ей внутривенно вводили «но-шпу» и натрия хлорид 9%. Четыре разных медика проверяли ее на раскрытие, но оно дальше не шло. Затем женщина перестала ощущать схватки и к 12 часам дня ее отправили домой.
— Спустя неделю отошли воды — они были зеленоватые, еле зелёные, — рассказала женщина. — После осмотра врач сказала, что «сама я рожать никак не буду». Позже я попросилась в туалет и заметила, что воды стали ещё зеленее и как будто ярче, но я не придала этому значения. Мне поставили капельницу с хлоридом натрия и вкололи «но-шпу», чтобы облегчить боль. Спустя два часа пришёл врач с акушеркой Аней (имя изменено. — Прим. ред.). Медики сказали: «Молодая, родит». Возможно, именно это решение и стало началом конца.
После того, как меня зашили, ко мне положили малыша. Где-то спустя час после его рождения подошла акушерка, которая сказала, что ребёнок «хрюкает» и выругалась на Аню: «Ты что, не слышишь? Чем вы тут занимаетесь тогда?». Она взяла малыша, перевернула его, из его носа и рта вышли остатки зелёных вод.
Утром врачи сообщили молодой матери, что у ребенка плохие анализы, поэтому его необходимо дополнительно обследовать. А на следующий день ей сказали, что малыша перевезут в реанимацию: у него подозрение на пневмонию. В реанимации он пробыл два дня, а 28 января скончался. Согласно официальному заключению, причиной смерти стала «неуточненная инфекция, специфичная для перинатального периода». Родители ребёнка хотят наказать всех, кто виновен в его гибели. Они обратились в следственные органы.
А на следующий день ей сказали, что малыша перевезут в реанимацию: у него подозрение на пневмонию. В реанимации он пробыл два дня, а 28 января скончался. Согласно официальному заключению, причиной смерти стала «неуточненная инфекция, специфичная для перинатального периода». Родители ребёнка хотят наказать всех, кто виновен в его гибели. Они обратились в следственные органы.
В областном Минздраве прокомментировали случившееся:
«Каждый случай младенческой смертности в регионе тщательно разбирается в медучреждении и в рамках ведомственного контроля на уровне Министерства здравоохранения с привлечением областных врачей-специалистов: акушера-гинеколога, неонатолога и педиатра. По данному факту будет проведено объективное расследование и дано заключение о причинах смерти и качестве оказания медицинской помощи в учреждении».
Хлорид натрия | Encyclopedia.com
Свойства
Связи
Местонахождение и обработка
Добыча полезных ископаемых
Испарение
Использование
Ресурсы
Ресурсы
Натриевая соль, каменная поваренная соль, поваренная соль,
галит представляет собой ионное соединение, состоящее из кристаллов кубической формы, состоящих из элементов натрия и хлора. Он отвечает за соленость мирового океана. Эта соль имеет важное значение с древних времен и имеет широкий и разнообразный спектр применения.Одним из его самых больших применений является использование в качестве ингредиента соли, которую люди используют при еде и приготовлении пищи. Он может быть получен химическим путем и получен путем добычи и выпаривания морской воды и рассолов.
Он отвечает за соленость мирового океана. Эта соль имеет важное значение с древних времен и имеет широкий и разнообразный спектр применения.Одним из его самых больших применений является использование в качестве ингредиента соли, которую люди используют при еде и приготовлении пищи. Он может быть получен химическим путем и получен путем добычи и выпаривания морской воды и рассолов.
Хлорид натрия в чистом виде бесцветен. Он несколько гигроскопичен или поглощает воду из атмосферы. Соль легко растворяется в воде. Его растворение в воде является эндотермическим, что означает, что он отбирает у воды некоторое количество тепловой энергии. Хлорид натрия плавится при 1474°F (801°C), кипит при 2670°F (1465°C), имеет плотность 2.16 г/см 3 (при 25°C), проводит электричество в растворенном или расплавленном состоянии.
Ионное соединение, такое как хлорид натрия, удерживается ионной связью. Этот тип связи образуется, когда противоположно заряженные ионы притягиваются. Это притяжение похоже на притяжение двух противоположных полюсов магнита. Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд.
Ион или заряженный атом образуется, когда атом приобретает или теряет один или несколько электронов. Он называется катионом, если существует положительный заряд, и анионом, если существует отрицательный заряд.
Натрий (химический символ Na) является щелочным металлом и имеет тенденцию терять электрон с образованием положительного иона натрия (Na + ).Хлор (химический символ Cl) является неметаллом и имеет тенденцию приобретать электрон с образованием отрицательного иона хлорида (Cl —).
Противоположные ионы Na + и Cl — притягиваются, образуя ионную связь. Таким образом, многие ионы натрия и хлорида удерживаются вместе, в результате чего получается соль с характерной кристаллической формой. Трехмерное расположение или кристаллическая решетка ионов в хлориде натрия такова, что каждый Na + окружен шестью анионами (Cl — ), а каждый Cls окружен шестью катионами (Na + ).Таким образом, ионное соединение имеет баланс противоположно заряженных ионов, а суммарные положительные и отрицательные заряды равны.
Хлорид натрия, в изобилии встречающийся в природе, встречается в морской воде, других соленых водах или рассолах, а также в отложениях сухой каменной соли. Его можно получить путем добычи и выпаривания воды из рассолов и морской воды. Эта соль также может быть получена химическим путем путем взаимодействия соляной кислоты (химическая формула HCl) с гидроксидом натрия (химическая формула NaOH) с образованием хлорида натрия и воды.К странам-лидерам по производству соли относятся США, Китай, Мексика и Канада.
Два способа извлечения соли из земли: камерно-столбовая добыча и добыча раствором. При камерно-столбовом методе шахты погружаются в землю, и горняки используют такие методы, как бурение и взрывные работы, для разрушения каменной соли. Соль удаляется таким образом, что остаются пустые помещения, поддерживаемые соляными столбами.
При добыче раствором вода добавляется в соляные отложения для образования рассола.Рассол представляет собой раствор хлорида натрия и воды, который может содержать или не содержать другие соли. В одном из методов в земле бурят скважину и помещают в нее две трубы (меньшая труба, помещенная внутрь большей). Пресная вода подается по внутренней трубе к соли. Растворенная соль образует рассол, который по внешней трубе перекачивается на поверхность, а затем удаляется.
В одном из методов в земле бурят скважину и помещают в нее две трубы (меньшая труба, помещенная внутрь большей). Пресная вода подается по внутренней трубе к соли. Растворенная соль образует рассол, который по внешней трубе перекачивается на поверхность, а затем удаляется.
Обычный способ производства соли из рассола – выпаривание воды с помощью вакуумных ванн. В этом методе рассол кипятят и перемешивают в огромных резервуарах, называемых вакуумными ваннами.Образуются высококачественные кубики соли, которые оседают на дно посуды. Затем кубики собирают, сушат и обрабатывают.
Солнечное выпаривание морской воды для получения соли — старый метод, который широко используется и сегодня. Он использует солнце как источник энергии. Этот метод эффективен в местах, где есть обильные источники соленой воды, земля для испарительных прудов и жаркий сухой климат для увеличения испарения. Морская вода проходит через ряд испарительных бассейнов. Минералы, содержащиеся в морской воде, осаждаются или выпадают из раствора с разной скоростью. Большинство из них выпадают в осадок раньше хлорида натрия и поэтому остаются, когда морская вода перемещается из одного испарительного пруда в другой.
Большинство из них выпадают в осадок раньше хлорида натрия и поэтому остаются, когда морская вода перемещается из одного испарительного пруда в другой.
С древних времен большое значение имела соль хлорид натрия. Он использовался по-разному, включая приправу и консервирование пищи, и даже как форму денег. Эта соль улучшает вкус пищевых продуктов, таких как хлеб и сыры, и является важным консервантом мяса, молочных продуктов, маргарина и других продуктов, поскольку замедляет рост микроорганизмов.Соль способствует естественному развитию цвета ветчины и хот-догов, а также повышает нежность колбасных изделий, таких как ветчина, заставляя их поглощать воду. В виде йодированной соли является переносчиком йода. (Йод необходим для синтеза гормонов щитовидной железы, влияющих на рост, развитие и скорость метаболизма).
Химическая промышленность использует большое количество соли хлорида натрия для производства других химикатов. Хлор и гидроксид натрия получают электролизом из рассола.
КЛЮЧЕВЫЕ ТЕРМИНЫ
Рассол — Раствор хлорида натрия и воды, который может содержать или не содержать другие соли.
Ион — Атом или молекула, которые приобрели электрический заряд либо отдавая электроны (положительно заряженный ион), либо приобретая электроны (отрицательно заряженный ион).
Ионная связь — Силы притяжения между положительными и отрицательными ионами, возникающие при переносе электронов от одного атома к другому.
Ионное соединение — Соединение, состоящее из положительных ионов (обычно ионов металлов) и отрицательных ионов (ионов неметаллов), удерживаемых вместе за счет электростатического притяжения.
Солнечное испарение — Метод испарения воды, использующий солнце в качестве источника энергии.
Хлорсодержащие продукты используются в очистителях металлов, отбеливателях для бумаги, пластмассах и при очистке воды. Химическая кальцинированная сода, содержащая натрий, используется для производства стекла, мыла, бумаги и смягчителей воды. Химические вещества, полученные в результате реакций с хлоридом натрия, используются в керамической глазури, металлургии, обработке шкур и фотографии.
Химические вещества, полученные в результате реакций с хлоридом натрия, используются в керамической глазури, металлургии, обработке шкур и фотографии.
Хлорид натрия имеет широкий и разнообразный спектр применения.Он распространяется по дорогам, чтобы растопить лед, понизив температуру плавления льда. Соль играет важную роль в регуляции жидкостей организма. Используется в лекарствах и кормах для скота. Кроме того, соляные пещеры используются для хранения химических веществ, таких как нефть и природный газ.
См. также Консервирование пищевых продуктов; Соленая вода.
КНИГИ
Эмсли, Джон. Строительные блоки природы: Путеводитель по элементам от А до Я . Оксфорд, Великобритания: Издательство Оксфордского университета, 2003.
Курланский Марк. Соль: всемирная история . Нью-Йорк: Penguin Books, 2003.
Лиде, Дэвид Р., изд. CRC Handbook of Chemistry and Physics Boca Raton, FL: CRC Press, 2005.
Myers, R. Thomas, Keith B. Oldham, and Salvatore Tocci. Холт Химия Визуализация Материи . Остин, Техас: Холт, Райнхарт и Уинстон, 2000.
Thomas, Keith B. Oldham, and Salvatore Tocci. Холт Химия Визуализация Материи . Остин, Техас: Холт, Райнхарт и Уинстон, 2000.
Секерский, Славомир. Краткая химия элементов . Чичестер, Великобритания: Horwood Publishing, 2002.
Снайдер, К.Х. Необыкновенная химия обычных вещей . 4-е изд. Нью-Йорк: John Wiley and Sons, 2002.
Дана М. Барри
Хлорид натрия | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Название продукта: хлорид натрия
Номер продукта: Все применимые коды продуктов American Elements, например. НА-КЛ-02 , НА-КЛ-03 , НА-КЛ-04 , NA-CL-05
Номер CAS: 7647-14-5
Соответствующие установленные области применения вещества: Научные исследования и разработки
Сведения о поставщике:
American Elements
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-424-9300
Международный: +1 703-527-3887
РАЗДЕЛ 2.
 ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
ИДЕНТИФИКАЦИЯ ОПАСНОСТИНе классифицируется как опасный в соответствии с директивами ЕС.
РАЗДЕЛ 3. СОСТАВ/ИНФОРМАЦИЯ О КОМПОНЕНТАХ
НАЗВАНИЕ КОМПОНЕНТА CAS № % КЛАСС РИСК ДЛЯ ЗДОРОВЬЯ № ООН
Натрия хлорид 7647-14-5 100% N.Р. Н. Р. Нет —
РАЗДЕЛ 4. МЕРЫ ПЕРВОЙ ПОМОЩИ
ОБЩИЕ СВЕДЕНИЯ: Обратитесь к врачу за конкретным советом.
ГЛАЗА: Тщательно промойте водой, если неприятные ощущения сохраняются, обратитесь за медицинской помощью.
КОЖА: Тщательно смыть водой с мылом.
ПРИ ВДЫХАНИИ: Удалить из зоны воздействия, дать отдых и согреться. В тяжелых случаях обратиться за медицинской помощью.
ПРОГЛАТЫВАНИЕ: Тщательно промыть рот водой. Вызвать рвоту, если в сознании. Получите медицинскую помощь.
РАЗДЕЛ 5.МЕРЫ ПОЖАРОТУШЕНИЯ
ТЕМПЕРАТУРА ВСПЫШКИ: Не воспламеняется. Неприменимо
ТЕМПЕРАТУРА САМОВОСПЛАМЕНЕНИЯ: Неприменимо
СРЕДСТВА ТУШЕНИЯ: Неприменимо
НЕОБЫЧНАЯ ПОЖАРНАЯ ОПАСНОСТЬ: При пожаре могут выделяться токсичные пары.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
ОЧИСТКА ЗАГРЯЗНЕНИЯ: Носите подходящую защитную одежду и оборудование, указанные в разделе Воздействие / Индивидуальная защита. Смешать с песком, осторожно перелить в контейнер
и организовать вывоз с помощью компании по утилизации.Тщательно промойте место разлива водой с моющим средством. В случае крупных разливов жидкости должны быть задержаны песком или землей
, а жидкости и твердые вещества должны быть перенесены в спасательные контейнеры. С любыми остатками следует обращаться как с небольшими разливами.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ИСПОЛЬЗОВАНИИ: Особых мер предосторожности нет.
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ ХРАНЕНИИ: Хранить при комнатной температуре (рекомендуется 15–25°C). Хранить хорошо закрытым и защищенным от влаги.
РАЗДЕЛ 8.КОНТРОЛЬ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Требуются защитные перчатки из поливинилового спирта (ПВА). Рекомендуется использовать лабораторный халат. Защитные очки или защитные очки с боковыми щитками необходимы, если
Рекомендуется использовать лабораторный халат. Защитные очки или защитные очки с боковыми щитками необходимы, если
существует вероятность образования сколов или пыли. При превышении порогового значения необходимо надевать респираторы. Обеспечьте адекватную общую механическую вентиляцию и
местную вытяжную вентиляцию. При работе с большим количеством этого материала обязательно надевайте соответствующее защитное снаряжение, как описано.Средства для промывания глаз должны быть легко доступны.
Тщательно вымойте после работы. Не принимать внутрь. Избегайте вдыхания пыли при ее образовании. Для лиц с чувствительными существующими заболеваниями следует обратиться за медицинской консультацией
, прежде чем приступить к работе, связанной с воздействием этого материала.
ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ OES, не установлено (длительное воздействие, 8-часовое средневзвешенное значение)
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
ВНЕШНИЙ ВИД: Прозрачные прозрачные кристаллы
pH В ВОДНОМ РАСТВОРЕ: данные отсутствуют °C
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ: 800°C
ТЕМПЕРАТУРА ВСПЫШКИ: Неприменимо
ВОСПЛАМЕНЯЕМОСТЬ: Неприменимо
ВЗРЫВООПАСНЫЕ СВОЙСТВА: Неприменимо
УДЕЛЬНЫЙ ВЕС: 2. 17
17
ДАВЛЕНИЕ ПАРА: Не применимо
РАСТВОРИМОСТЬ В ВОДЕ: Хорошо растворим (35,7 г/100 г воды при 0°C)
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
СТАБИЛЬНОСТЬ: Стабилен при нормальных условиях хранения или использования.
ОПАСНОЕ РАЗЛОЖЕНИЕ: Нет данных.
НЕОБХОДИМЫЕ МАТЕРИАЛЫ: Сильные кислоты
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
ТОКСИЧНАЯ ДОЗА — LD50 3000 мг/кг перорально, крыса.
КАНЦЕРОГЕННОСТЬ Нет признаков канцерогенных свойств.
МУТАГЕННОСТЬ/ТЕРАТОГЕННОСТЬ Нет признаков мутагенного действия.
ТОКСИКОЛОГИЧЕСКИЕ РЕЗУЛЬТАТЫ Оценка токсикологических данных отсутствует.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Опасности для окружающей среды не ожидается при условии, что с материалом обращаются и утилизируют с должным вниманием и осторожностью.
РАЗДЕЛ 13. УТИЛИЗАЦИЯ
МЕТОДЫ УТИЛИЗАЦИИ: Неопасные и нерегулируемые твердые отходы. Обратитесь за консультацией в местный орган по утилизации отходов или обратитесь в компанию по утилизации химических веществ
.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
КЛАССИФИКАЦИЯ: Не классифицируется как опасный в соответствии с директивами ЕС № EC:231-598-3 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Н/Д
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства.Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. на обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2021 АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ. ПРЕДОСТАВЛЯЕТСЯ ЛИЦЕНЗИЯ НА ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННОГО БУМАЖНОГО КОПИЯ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Демонстрации — Натрий + хлор
Демонстрации — Натрий + хлорНатрий + хлор:
Передай соль, пожалуйста
Натрий — металл серебристого цвета, достаточно мягкий для резки нож. Это чрезвычайно реакционноспособный металл, и в природе он всегда присутствует в ионные соединения, а не в чистом металлическом виде. Чистый металлический натрий реагирует бурно (а иногда и взрывоопасно) с водой, образуя гидроксид натрия, газообразный водород и тепло:
2Na(тв) + 2H 2 O(ж) ——> 2NaOH(водн.) + H 2 (г)
Хлор — ядовитый желто-зеленый газ с очень резким запах и использовался в газовой войне во время Первой мировой войны.
Натрий и хлор реагируют друг с другом, однако с образованием вещества это знакомо почти всем в мире: хлорид натрия , или поваренная соль:
2Na(тв) + Cl 2 (г) ——> 2NaCl(т)
Легко понять, почему эта реакция протекает так легко, если посмотреть на нее. на атомном уровне: натрий имеет один электрон на самом внешнем уровне (валентность)
оболочке, в то время как хлор имеет семь электронов в своей валентной оболочке.Когда
атом натрия передает электрон атому хлора, образуя катион натрия
(Na + ) и хлорид-анион (Cl — ), оба иона имеют полную
валентные оболочки и энергетически более стабильны.
на атомном уровне: натрий имеет один электрон на самом внешнем уровне (валентность)
оболочке, в то время как хлор имеет семь электронов в своей валентной оболочке.Когда
атом натрия передает электрон атому хлора, образуя катион натрия
(Na + ) и хлорид-анион (Cl — ), оба иона имеют полную
валентные оболочки и энергетически более стабильны.
Реакция чрезвычайно экзотермична, дает ярко-желтый свет и большое количество тепловой энергии.
В следующих демонстрациях 2,5-литровая бутыль заполняется хлором.
газ. Покрытие из песка на дне бутылки поглощает часть
тепловая энергия, выделяющаяся в ходе реакции, и предотвращает ее разрушение.А
в колбу помещают небольшой кусочек свеженарезанного металлического натрия, а затем
добавляется небольшое количество воды, которая вступает в реакцию с натрием и вызывает его
стать горячим. Затем горячий натрий вступает в реакцию с хлором, образуя
ярко-желтый свет, большое количество тепловой энергии и пары хлорида натрия,
который оседает на стенках бутылки.
В первом ролике натрий вспыхивает практически сразу после реагирует с водой и быстро «выгорает».(Не моргай, иначе вы его пропустите.) Во втором случае воду добавляют дважды, чтобы получить один короткая вспышка, за которой следует более длинная. (Эту реакцию можно провести и с расплавленным натрием, но я никогда не был смелым достаточно попробовать.)
Видеоклип 1: НАСТОЯЩИЙ, 679 КБ
Видеоклип 2: НАСТОЯЩИЙ, 1,74 МБ
!!! Опасности !!!
Не подвергайте металлический натрий воздействию воды! Реакция натрия и воды производит газообразный водород и тепло, что является хорошей комбинацией , а не ! натрий должны храниться под минеральным маслом или каким-либо другим высокомолекулярным углеводород.
Газообразный хлор токсичен и сильно раздражает глаза и слизистые. мембраны.
мембраны.
Эта реакция выделяет большое количество тепловой энергии; убедитесь, что колба не имеет в нем трещин.
Процедуры
Бассам З. Шахашири, Химическая промышленность Демонстрации: Пособие для учителей химии, том 1. Мэдисон: Издательство Висконсинского университета, 1983, с.61-63.
Ли Р. Саммерлин, Кристи Л. Боргфорд и Джули Б. Или, 90 083 Химические демонстрации: A Справочник для учителей, Том 2, 2-е изд. Вашингтон, округ Колумбия: Американское химическое общество, 1988, с. 56-57.
Каталожные номера
Джон Эмсли, Элементы, 3-е изд. Оксфорд, Clarendon Press, 1998, с. 56-57, 194-195.
Дэвид Л. Хейзерман, Изучение химических элементов и их Соединения. Нью-Йорк: TAB Books, 1992, с. 43-48, 70-74.
Марта Виндхольц (ред.), The Merck Index, 10-е изд. Рэуэй: Merck & Co., Inc., 1983.
Рэуэй: Merck & Co., Inc., 1983.
ионных структур
Как расположены ионы в хлориде натрия
Хлорид натрия считается типичным ионным соединением.Подобные соединения состоят из гигантской (бесконечно повторяющейся) решетки ионов. Таким образом, хлорид натрия (и любое другое ионное соединение) описывается как имеющий гигантскую ионную структуру.
Вам должно быть ясно, что гигант в данном контексте не означает просто очень большой. Это означает, что вы не можете точно сказать, сколько существует ионов.
Могут быть миллиарды ионов натрия и ионов хлора, упакованных вместе, или триллионы, или что-то еще — это просто зависит от размера кристалла.Это отличается, скажем, от молекулы воды, которая всегда содержит ровно 2 атома водорода и один атом кислорода — никогда больше и никогда меньше.
Небольшой образец решетки хлорида натрия выглядит следующим образом:
Если вы внимательно посмотрите на схему, то увидите, что ионы натрия и ионы хлора чередуются друг с другом в каждом из трех измерений.
Эту диаграмму достаточно легко нарисовать с помощью компьютера, но чрезвычайно сложно убедительно нарисовать вручную.Обычно мы рисуем «взорванную» версию, которая выглядит так:
.На самом деле касаются друг друга только те ионы, которые соединены линиями. Ион натрия в центре соприкасается с 6 ионами хлора. Случайно мы могли бы с тем же успехом расположить диаграмму вокруг иона хлорида, который, конечно же, был бы затронут 6 ионами натрия. Хлорид натрия описан как 6:6-координированный.
Вы должны помнить, что эта диаграмма представляет собой лишь крошечную часть всего кристалла хлорида натрия.Картина повторяется таким образом для бесчисленных ионов.
Как нарисовать эту структуру
Нарисовать идеальный квадрат:
Теперь нарисуйте такой же квадрат позади этого и немного сместите его. Возможно, вам придется немного потренироваться, чтобы правильно расположить два квадрата. Если вы ошибетесь, все ионы перепутаются друг с другом на вашей окончательной диаграмме.
Если вы ошибетесь, все ионы перепутаются друг с другом на вашей окончательной диаграмме.
Превратите это в идеальный куб, соединив квадраты вместе:
Теперь самое сложное! Разделите этот большой куб на 8 маленьких кубов, соединив среднюю точку каждого ребра с средней точкой ребра напротив него.Чтобы завершить процесс, вам также нужно будет соединить среднюю точку каждой грани (легко найти, когда вы соедините края) с средней точкой противоположной грани.
Теперь все, что вам нужно сделать, это вставить ионы. Используйте разные цвета или разные размеры для двух разных ионов, и не забудьте ключ. Неважно, окажетесь ли вы в центре куба ионом натрия или ионом хлорида — важно лишь то, что они чередуются во всех трех измерениях.
Вы должны быть в состоянии нарисовать совершенно адекватный набросок этого от руки менее чем за две минуты — менее одной минуты, если вы не слишком привередливы!
Почему хлорид натрия имеет соотношение 6:6?
Чем сильнее притяжение между положительными и отрицательными ионами, тем больше энергии высвобождается. Чем больше энергии высвобождается, тем более энергетически стабильной становится структура.
Чем больше энергии высвобождается, тем более энергетически стабильной становится структура.
Это означает, что для достижения максимальной стабильности необходимо максимальное количество аттракционов. Так почему же каждый ион окружает себя 6 ионами противоположного заряда?
Это максимальное количество ионов хлора, которое можно уместить вокруг центрального иона натрия до того, как ионы хлора начнут касаться друг друга. Если они начнут соприкасаться, вы создадите отталкивание в кристалле, что сделает его менее устойчивым.
Формула хлорида натрия — Использование, свойства, структура и формула хлорида натрия
Формула и структура: Химическая формула хлорида натрия — NaCl, а его молярная масса — 58,44 г/моль. Это ионное соединение, состоящее из катиона натрия (Na + ) и аниона хлорида (Cl —). Твердый NaCl имеет кристаллическую структуру, в которой каждый ион Na + окружен шестью ионами хлорида в октаэдрической геометрии.
Проявление: Хлорид натрия присутствует в морской и океанской воде, что придает им соленость.Около 1-5% морской воды состоит из хлорида натрия. Он также встречается в виде минерального галита или каменной соли.
Приготовление: Соль производится в больших масштабах путем выпаривания морской воды или соленой воды (рассола) из соленых озер и соляных колодцев. Поскольку морская вода содержит несколько других солей (кальция, магния и других элементов), процесс испарения осуществляется осторожно, так что разные соли выпадают в осадок в разное время в зависимости от их растворимости. Еще один важный метод добычи — добыча запасов каменной соли.
Физические свойства: Хлорид натрия представляет собой белое кристаллическое твердое вещество с плотностью 2,16 г/мл и температурой плавления 801 °C. Он также доступен в виде водных растворов различной концентрации, называемых солевыми растворами.
Химические свойства: Хлорид натрия хорошо растворим в воде и других полярных растворителях. Это стабильное твердое вещество. Он разлагается только при высоких температурах с образованием токсичных паров соляной кислоты (HCl) и двуокиси натрия (Na 2 O).
Это стабильное твердое вещество. Он разлагается только при высоких температурах с образованием токсичных паров соляной кислоты (HCl) и двуокиси натрия (Na 2 O).
Использование: Хлорид натрия наиболее известен как поваренная соль и широко используется в пищевой промышленности для ароматизации и консервирования.Он также используется в производстве многих важных химических веществ, включая гидроксид натрия, карбонат натрия, пищевую соду, соляную кислоту и т. д. Он также применяется на нефтеперерабатывающих заводах, в текстильной, целлюлозно-бумажной промышленности, огнезащитных составах, резиновой промышленности и в дорожных сооружениях. Еще одним важным применением является устранение обледенения дорог и тротуаров в холодных и снежных регионах. Солевые растворы также используются во многих медицинских целях.
Влияние на здоровье/угроза безопасности: При низких концентрациях хлорид натрия нетоксичен и неопасен и является важным источником электролитов для организма. Высокое потребление соли в течение длительного времени может вызвать дисбаланс электролитов в организме. Проглатывание высоких концентраций может вызвать рвоту, тошноту, диарею и обезвоживание. Он также может раздражать глаза и вызывать повреждение глаз при высоких концентрациях.
Высокое потребление соли в течение длительного времени может вызвать дисбаланс электролитов в организме. Проглатывание высоких концентраций может вызвать рвоту, тошноту, диарею и обезвоживание. Он также может раздражать глаза и вызывать повреждение глаз при высоких концентрациях.
Хлорид натрия — Энциклопедия Нового Света
| Хлорид натрия | |
|---|---|
| Общие | |
| Систематическое название | Хлорид натрия |
| Другие названия | поваренная соль, галит, поваренная соль |
| Молекулярная формула | NaCl |
| Молярная масса | 58.442 г/моль |
| Внешний вид | белый и кристаллический |
| CAS-номер | [7647-14-5] |
| Недвижимость | |
| Плотность и фаза | 2,16 г/см³, твердый |
| Растворимость в воде | 35,9 г/100 мл (25 °C) |
| Температура плавления | 801 °С (1074 К) |
| Точка кипения | 1465 °С (1738 К) |
| Структура | |
| Координация геометрия | Октаэдрический |
| Кристаллическая структура | Гранецентрированный куб |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности |
| Основные опасности | Раздражает и может жалить |
| NFPA 704 | 0 0 0
|
| Температура вспышки | негорючий |
| Заявление R/S | R: нет S: нет |
| Номер РТЭКС | ВЗ4725000 |
| Дополнительные данные | |
| Структура и свойства | n , ε r и т. |
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газообразное |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Прочие анионы | NaF, NaBr, NaI |
| Прочие катионы | LiCl, KCl, RbCl, CsCl, MgCl 2 , CaCl 2 |
| Родственные соли | Ацетат натрия |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) | |
Хлорид натрия , также известный как поваренная соль или поваренная соль , представляет собой химическое соединение с формулой NaCl.Его минеральная форма называется галит . Он хорошо растворим в воде и является солью, наиболее ответственной за соленость океана и внеклеточной жидкости многих многоклеточных организмов.
Являясь основным ингредиентом пищевой соли, она долгое время использовалась в качестве пищевой приправы и консерванта. В своем последнем качестве он уменьшал зависимость человека от сезонной доступности пищи и позволял путешествовать на большие расстояния. Таким образом, он послужил основой для распространения цивилизации.
В настоящее время доступен достаточно недорого и в больших количествах. Исторически, однако, его было трудно достать, и он был очень ценным предметом торговли. До 1900-х годов он был одним из главных двигателей национальной экономики и войн. Он контролировался правительствами и облагался налогами еще в двадцатом веке, в 90 678 году до н. э. в Китае.
Курганы соли в Салар-де-Уюни, БоливияИстория
Сохраняющая способность соли была основой цивилизации.Это устранило зависимость от сезонной доступности продуктов питания и позволило путешествовать на большие расстояния. К Средним векам караваны, состоящие из сорока тысяч верблюдов, пересекали четыреста миль по Сахаре с солью, иногда обменивая ее на рабов.
Во время своих акций протеста в Индии Ганди возглавил знаменитый марш соли, чтобы бросить вызов британской монополии на соль.
Религиозные ссылки
В Библии (версия короля Иакова) есть 35 ссылок (стихов) на соль, наиболее известной из которых, вероятно, является история жены Лота, которая превратилась в соляной столб, когда не послушалась ангелов и оглянулась на нечестивый город. Содома (Бытие 19:26).В Нагорной проповеди Иисус также называл своих последователей «солью земли». Апостол Павел также призывал христиан «всегда беседы ваши быть полны благодати, приправлены солью» (Колоссянам 4:6), чтобы, когда другие спрашивают об их вере, ответ христианина рождал «жажду» узнать больше о Христе.
В родной японской религии синто соль используется для ритуального очищения мест и людей, например, в борьбе сумо.
Возникновение
Исторически существовало два основных источника поваренной соли: морская вода и каменная соль.Каменная соль встречается в обширных слоях осадочных минералов-эвапоритов, образовавшихся в результате высыхания закрытых озер, пляжей и морей. Соляные пласты могут иметь толщину до 350 метров (метров) и подстилать обширные территории.
Соляные пласты могут иметь толщину до 350 метров (метров) и подстилать обширные территории.
В Соединенных Штатах и Канаде обширные подземные пласты простираются от бассейна Аппалачей на западе Нью-Йорка через некоторые районы Онтарио и под большей частью бассейна Мичигана. Другие месторождения находятся в Огайо, Канзасе, Нью-Мексико, Новой Шотландии и Саскачеване. В Соединенном Королевстве подземные пласты находятся в Чешире и вокруг Дройтвича.
Производство
Современная шахта каменной соли недалеко от горы Моррис, Нью-Йорк В настоящее время сольпроизводится одним из двух основных способов:
- Испарение морской воды или рассола (соленой воды) из других источников, таких как соляные скважины и соленые озера; [1]
- Добыча каменной соли, называемой галитом. Это включает добычу раствором, при которой вода используется для растворения соли, а рассол, который достигает поверхности, испаряется для извлечения соли.
Солнечное испарение морской воды
В правильном климате (где отношение испарения к количеству осадков достаточно велико) можно использовать солнечное испарение морской воды для производства соли. Рассол испаряется в соединенных прудах до тех пор, пока раствор не будет достаточно сконцентрирован в последнем пруду, чтобы соль кристаллизовалась на дне пруда.
Рассол испаряется в соединенных прудах до тех пор, пока раствор не будет достаточно сконцентрирован в последнем пруду, чтобы соль кристаллизовалась на дне пруда.
Производство в открытых емкостях из рассола
Одним из традиционных методов производства соли в более умеренном климате является использование открытых емкостей. [2] В открытых соляных печах рассол нагревается в больших неглубоких открытых лотках. Самые ранние образцы относятся к доисторическим временам, и сковороды были сделаны из керамики, известной как брикет или свинец.Более поздние образцы были сделаны из железа. Это изменение совпало с переходом от дров к углю для нагрева рассола. [3] Рассол будет закачиваться в кастрюли и концентрироваться за счет тепла горящего внизу огня. По мере образования кристаллов соли их выгребают и добавляют больше рассола.
Производство закрытых емкостей под вакуумом
Соляные заводы с открытыми чашами были фактически заменены системой закрытых чашек, где соляной раствор испаряется под частичным вакуумом. [4]
[4]
Соляные шахты
Во второй половине девятнадцатого века стало возможным добывать соль, что дешевле, чем выпаривание морской воды или извлечение соли из рассола. Следовательно, цена на соль стала более разумной. Однако извлечение соли из рассола по-прежнему широко используется: например, вакуумная соль, производимая British Salt в Миддлвиче, занимает 57 процентов рынка Великобритании. [5] для соли, используемой в кулинарии.
Характеристики
Кристаллическая структура
Кристаллическая структура хлорида натрия.Каждый атом имеет шесть ближайших соседей с октаэдрической геометрией.Хлорид натрия образует кристаллы кубической симметрии. В них более крупные ионы хлорида, показанные на диаграмме в виде зеленых сфер, расположены кубической плотной упаковкой, а более мелкие ионы натрия, показанные в виде голубых сфер, заполняют октаэдрические промежутки между ними. Ионы удерживаются вместе ионными связями.
Ион каждого типа окружен шестью ионами другого типа. Эта же основная структура встречается во многих других минералах и известна как структура галита.Это расположение известно как кубическая плотноупакованная кристаллическая система (ccp).
Эта же основная структура встречается во многих других минералах и известна как структура галита.Это расположение известно как кубическая плотноупакованная кристаллическая система (ccp).
Растворимость
| Растворимость NaCl в различных растворителях (граммы NaCl на 100 грамм растворителя при 25 °C) | |
|---|---|
| Н 2 О | 36 |
| Аммиак жидкий | 3,02 |
| Метанол | 1,4 |
| Муравьиная кислота | 5.2 |
| Сульфолан | 0.005 |
| Ацетонитрил | 0,0003 |
| Ацетон | 0,000042 |
| Формамид | 9,4 |
| Диметилформамид | 0,04 |
| Ссылка: Дж. Берджесс, Ионы металлов в растворе (Эллис Хорвуд, Нью-Йорк, 1978), ISBN 0853120277 | |
Использование
Хотя большинству людей знакомо множество применений соли в кулинарии, они могут не знать, что соль используется во множестве применений, от производства целлюлозы и бумаги до закрепления красителей в текстиле и ткани, до производства мыла и моющих средств. В большей части Канады и на севере Соединенных Штатов большое количество каменной соли используется для очистки автомагистралей ото льда зимой, хотя «дорожная соль» теряет способность плавиться при температурах ниже -15 °C до -20 °C (5 °C). F до -4 ° F).
В большей части Канады и на севере Соединенных Штатов большое количество каменной соли используется для очистки автомагистралей ото льда зимой, хотя «дорожная соль» теряет способность плавиться при температурах ниже -15 °C до -20 °C (5 °C). F до -4 ° F).
Синтетика использует
Соль также является сырьем для производства хлора, который сам по себе необходим для производства многих современных материалов, включая ПВХ и пестициды.
В промышленности элементарный хлор обычно получают электролизом хлорида натрия, растворенного в воде.Наряду с хлором этот хлорно-щелочной процесс дает газообразный водород и гидроксид натрия в соответствии с химическим уравнением:
- 2NaCl + 2H 2 O → Cl 2 + H 2 + 2NaOH
Металлический натрий промышленно производится путем электролиза жидкого хлорида натрия. Это делается в аппарате, называемом ячейкой Дауна, в котором хлорид натрия смешивают с хлоридом кальция, чтобы понизить температуру плавления ниже 700°C. Поскольку кальций более электроположителен, чем натрий, на катоде не будет образовываться кальций.Этот метод менее дорог, чем более ранний метод электролиза гидроксида натрия.
Поскольку кальций более электроположителен, чем натрий, на катоде не будет образовываться кальций.Этот метод менее дорог, чем более ранний метод электролиза гидроксида натрия.
Усилитель вкуса
Соль обычно используется в качестве усилителя вкуса пищевых продуктов и считается одним из основных вкусовых добавок. К сожалению, его часто употребляют в больших количествах, чем требуется. Это приводит к повышенному уровню артериального давления (гипертонии) у некоторых, что, в свою очередь, связано с повышенным риском сердечного приступа и инсульта. Чрезмерное потребление соли также может обезвоживать организм человека.
Биологическое использование
Многие микроорганизмы не могут жить в слишком соленой среде: вода вытягивается из их клеток путем осмоса. По этой причине соль используется для сохранения некоторых продуктов, таких как копченый бекон или рыба, а также может использоваться для отделения пиявок, которые прикрепились к корму. Его также использовали для дезинфекции ран (хотя он вызывает сильную боль). В средние века соль втирали в бытовые поверхности в качестве очищающего средства.
В средние века соль втирали в бытовые поверхности в качестве очищающего средства.
Дорожная соль
Защита от обледенения
Когда-то в истории соль была дефицитным товаром, но промышленное производство сделало ее изобилием.Около 51 процента производимой в мире соли в настоящее время используется для удаления льда с дорог в морозные погодные условия. Соль можно засыпать в бункеры для песка и разбрасывать зимними служебными автомобилями. Этот подход работает, потому что соль и вода образуют эвтектическую смесь. В контролируемых лабораторных условиях раствор хлорида натрия в воде может снизить температуру замерзания воды до -21 ° C (-6 ° F). Однако на практике хлорид натрия может растопить лед примерно до -9 ° C (15 ° F).
Добавки
Соль, продаваемая сегодня для потребления, обычно не является чистым хлоридом натрия.В 1911 году в соль впервые добавили карбонат магния, чтобы сделать ее более свободной. В 1924 году впервые были добавлены следовые количества йода — в форме йодида натрия, йодида калия или йодата калия, что привело к созданию йодированной соли для снижения заболеваемости простым зобом.
Соль для антиобледенения в Великобритании обычно содержит гексацианоферрат натрия (II) в количестве менее 100 частей на миллион в качестве противослеживающего агента. В последние годы эта добавка также используется в поваренной соли.
Обычные химикаты
Химикаты, используемые в солях против обледенения, в основном представляют собой хлорид натрия (NaCl) или хлорид кальция (CaCl 2 ).Оба похожи и эффективны при борьбе с обледенением дорог. Когда эти химические вещества производятся, их добывают/производят, измельчают до мелких гранул, а затем обрабатывают средством против слеживания. Добавление соли снижает температуру замерзания воды, что позволяет жидкости оставаться стабильной при более низких температурах и позволяет льду таять.
Также использовались альтернативные химикаты против обледенения. Производятся химические вещества, такие как ацетат кальция и магния. Эти химические вещества оказывают незначительное негативное химическое воздействие на окружающую среду, обычно связанное с NaCl и CaCl 2 .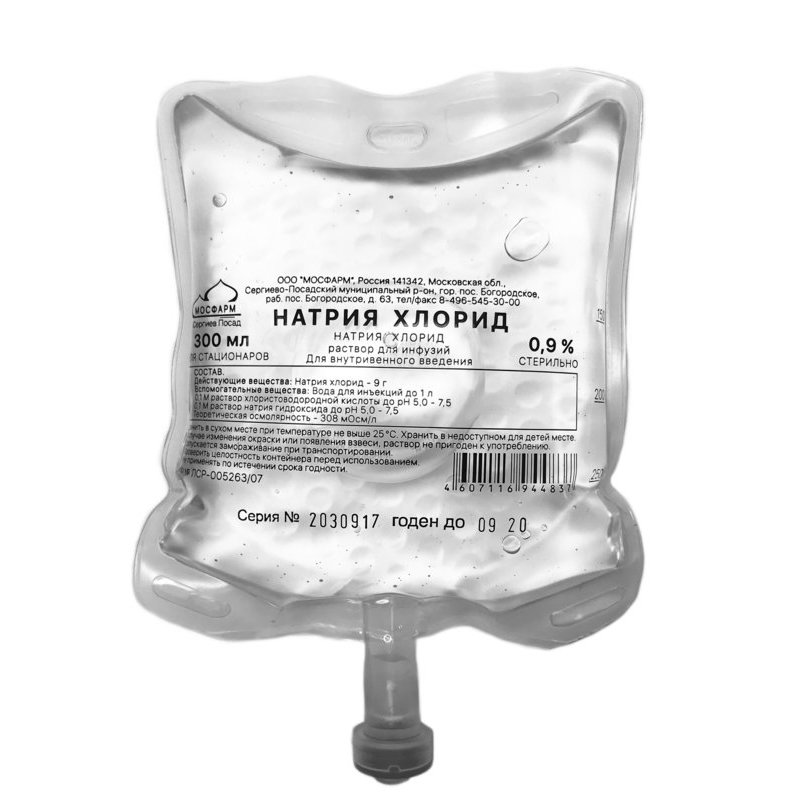
См. также
Примечания
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Курланский Марк. 2003. Соль: всемирная история . Нью-Йорк: Пингвин. ISBN 0142001619
- Мультхауф, Роберт П. 1996. Дар Нептуна: история поваренной соли . Исследования Джона Хопкинса по истории технологий. Балтимор, Мэриленд: Издательство Университета Джона Хопкинса. ISBN 0801854695
Внешние ссылки
Все ссылки получены 16 ноября 2019 г.
Кредиты
New World Encyclopedia автора и редактора переписали и дополнили статью Wikipedia в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Weird Science: соль необходима для жизни
Поваренная соль, хлорид натрия (NaCl), представляет собой встречающийся в природе минерал, необходимый для жизни животных.Соль — одна из наиболее широко используемых и старейших форм пищевой приправы (рис. 2.2). Соленость является одним из пяти основных человеческих вкусов в дополнение к сладости, кислоте, горечи и умами (пикантный мясной вкус, такой как вкус вареных грибов, сыра или соевого соуса). При растворении соли в растворе или на пище она распадается на составляющие ее ионы: натрий и хлорид (Na + и Cl — соответственно). Соленый вкус в первую очередь исходит от ионов натрия.
Соленый вкус в первую очередь исходит от ионов натрия.
Соль играет решающую роль в поддержании здоровья человека.Это основной источник ионов натрия и хлора в рационе человека. Натрий необходим для работы нервов и мышц и участвует в регуляции жидкости в организме. Натрий также играет роль в контроле организмом артериального давления и объема. Хотя натрий необходим, люди, которые потребляют слишком много натрия, могут иметь гипертонию или высокое кровяное давление, состояние, которое может привести к серьезным заболеваниям, таким как болезни сердца, болезни почек и инсульт.
Ионы хлорида служат важными электролитами, регулируя pH и давление крови.Электролиты представляют собой соединения, часто соли, которые диссоциируют на свои ионные компоненты в таких растворителях, как вода. Хлорид также является важным компонентом в производстве желудочной кислоты (HCl). Люди выделяют соль при потоотделении и должны восполнять эти потерянные ионы натрия и хлора с пищей.
Всем животным для выживания требуется немного соли. Люди потребляют продукты, которые естественным образом содержат соль (например, мясо и морепродукты), или добавляют соль в качестве приправы. Однако в рационе некоторых наземных животных недостаточно соли.Эти животные должны искать дополнительные источники соли. Сельскохозяйственным животным, таким как лошади и крупный рогатый скот, необходим доступ к соляным блокам (SF рис. 2.3 A). Известно, что дикие млекопитающие и птицы скапливаются на природных месторождениях полезных ископаемых, известных как солонцы, где они могут потреблять необходимые им для выживания минералы натрия и хлора (рис. 2.3 B).
.


 Фасуется раствор натрия хлорида для инъекций 10 % во флаконы по 200, 400 мл.
Фасуется раствор натрия хлорида для инъекций 10 % во флаконы по 200, 400 мл.

 Вечером накануне исследования (до 18:00) — лёгкий ужин. В день исследования от курения следует воздержаться.
Вечером накануне исследования (до 18:00) — лёгкий ужин. В день исследования от курения следует воздержаться.