Медсовет для врачей | Remedium.ru
02.12.2022
Топическая антибактериальная терапия перфоративных отитов в пандемию COVID-19
С.В. Рязанцев1, К.А. Балацкая1, И.В. Ткачук2, А.Е. Голованов2, П.В. Киреев2; 1Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи, 2 Военно-медицинская академия имени С.М. Кирова
Развивающаяся резистентность микроорганизмов к воздействию…
Подробнее
01.12.2022
Лекция: Нереспираторные осложнения COVID у детей
Представляем вашему вниманию лекцию для врачей-педиатров «Нереспираторные осложнения COVID у детей»
Подробнее
01. 12.2022
12.2022
Факторы риска развития асфиксии при рождении
Т.Е. Таранушенко1,2, Н.А. Паршин1,2, А.А. Ваганов1,2, Т.В. Овчинникова2; 1 КрасГМУ им. проф. В.Ф. Войно-Ясенецкого, 2 КККЦОМД
Введение. Внутриутробная гипоксия и асфиксия при родах являются ведущими причинами младенческой смертности в структуре отдельных состояний, возникающих в перинатальном периоде….
Подробнее
29.11.2022
Алгоритмы диагностики и лечения хронического тонзиллита
Т.Ю. Владимирова1, Н.Ю. Леньшина2; 1 СамГМУ, 2 ООО «Призвание» (Самара)
Введение. Особенности течения хронического тонзиллита могут варьировать с учетом возраста пациента, его коморбидного статуса и тяжести заболевания. Одним из характерных проявлений заболевания являются местные признаки хронического…
Одним из характерных проявлений заболевания являются местные признаки хронического…
Подробнее
28.11.2022
Обеспеченность витамином D и уровень провоспалительных цитокинов у новорожденных от матерей с эндокринными заболеваниями
Н.Е. Верисокина1,2, Л.Я. Климов1, И.Н. Захарова3, А.Л. Заплатников3, В.В. Зубков4, А.А. Момотова1, В.А. Курьянинова1,5, Р.А. Атанесян
 ..
..Подробнее
24.11.2022
Лекция: Траектория кашля
Представляем вашему вниманию лекцию для врачей-педиатров и оториноларингологов «Траектория кашля»
Подробнее
24.11.2022
Местное лечение острого риносинусита в эпоху COVID-19
А.А. Кривопалов, С.В. Рязанцев, В.В. Туриева, А.Е. Голованов; Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи
Введение. Острый риносинусит занимает от 40 до 60 % заболеваемости в структуре лор-патологии. Возбудитель COVID-19 аналогично другим…
Подробнее
 11.2022
11.2022
Эффективность дорназы альфа в составе базисной терапии у детей с муковисцидозом в период пандемии COVID-19
О.И. Симонова1,2, Ю.В. Горинова1, А.С. Чернявская1,2; 1 НМИЦ здоровья детей, 2 Первый МГМУ им. И.М. Сеченова
В статье авторы представили обзор результатов международных клинических исследований и последние публикации, а также собственный опыт по использованию ферментного муколитика – дорназы альфа …
Подробнее
22.11.2022
Воспаление дёсен: симптомы, причины, лечение
Заболевания дёсен, в основном гингивит и пародонтит, являются часто встречающимися стоматологическими состояниями, поражающими опорные структуры зубов, включая десну, цемент, периодонтальную связку и альвеолярную кость. В тяжёлых и запущенных случаях заболевания дёсен могут стать причиной выпадения…
В тяжёлых и запущенных случаях заболевания дёсен могут стать причиной выпадения…
Подробнее
21.11.2022
Оценка воздействия специального звукового сигнала на функциональное состояние органа слуха (экспериментальное исследование)
В.В. Дворянчиков1, М.С. Кузнецов2, С.М. Логаткин3, А.Е. Голованов2; 1 СПб НИИ ЛОР, 2 ВМА им. С.М. Кирова, 3 ГНИИИ ВМ
Введение. Внедрение специальных акустических средств в систему обеспечения безопасности делает актуальным проведение медико-биологических исследований по оценке влияния их воздействия…
Подробнее
Загрузить еще
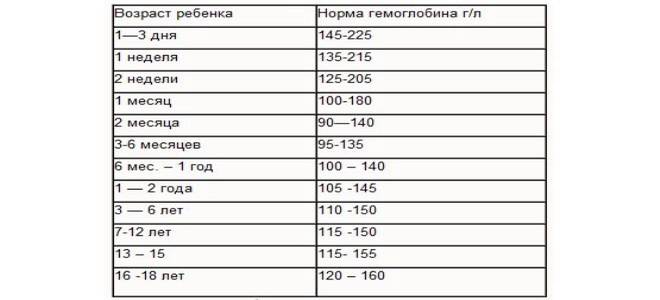
Железодефицитные анемии у детей до 6 лет
Анемии у детей — явление очень частое, к ним приводят различные факторы. Но 90% всех видов детских анемий — железодефицитная, характеризующаяся снижением гемоглобина. Этот тип анемии по данным ВОЗ наблюдается в России практически у 50% детей младшего возраста, и у 20% — старшего. Очень часто встречается так называемый «латентный» дефицит железа, который может быть выявлен исключительно по результатам анализов, поскольку другими симптомами практически не проявляется.
Но 90% всех видов детских анемий — железодефицитная, характеризующаяся снижением гемоглобина. Этот тип анемии по данным ВОЗ наблюдается в России практически у 50% детей младшего возраста, и у 20% — старшего. Очень часто встречается так называемый «латентный» дефицит железа, который может быть выявлен исключительно по результатам анализов, поскольку другими симптомами практически не проявляется.
Контроль уровня гемоглобина у детей очень важен, поэтому именно на этот показатель исследований крови часто чуть ли не в первую очередь обращают внимание врачи и родители. Изменение уровня гемоглобина дает возможность своевременно определить нарушения в организме ребенка, в работе внутренних органов.
Низкий гемоглобин приводит к недостатку кислорода в крови, что может спровоцировать отставание как в физическом, так и в умственном развитии, увеличивает шансы подвергнуться инфекции.
Показатели гемоглобина в любом возрасте контролируются при плановых анализах крови, и при контрольных, назначенных врачом при определенных симптомах и заболеваниях.
Нормы уровень гемоглобина определены следующие:
- новорожденные — 145–220 г/л
- 1 месяц — 110–200 г/л
- 1–2 месяца — 110–180 г/л
- 2–6 месяцев — 115–140 г/л
- 6 месяцев — 2 года — 115–135 г/л
- 2 — 6 лет — 115–135 г/л
Различают три степени железодефицитной анемии у детей:
- легкая — 110-91г\л
- средняя — 90-71г\л
- тяжелая — <70г\л
Если показатели гемоглобина или эритроцитов отклоняются от нормы, нужно обязательно найти причину этой проблемы. Чаще всего приводят к развитию железодефицитной анемии у маленьких детей следующие факторы:
- дефицит железа в пище из-за несбалансированного питания или позднего введения прикорма
- дефицит железа у мамы во время беременности, курение матери во время беременности, сахарный диабет у матери или некоторые патологии беременности
- дефицит животной пищи, например, вегетарианство, вскармливание неадаптированными молочными смесями или коровьим, козьим молоком
- высокий темп роста и развития детей, особенно после 6 месяцев, а так же у недоношенных и детей с высокой массой тела
- аутоиммунные заболевания
- гиподинамия
- хронические микрокровопотери, например, из кишечника
- глистные инвазии
- кишечные инфекции, воспалительные изменения кишечника,
- продолжительный прием антибиотиков или некоторых других препаратов
Есть симптомы, при которых родители должны «забить тревогу» и заподозрить у ребенка железодефицитную анемию. Это:
Это:
- побледнение кожных покровов
- бескровные губы и трещинки в уголках
- ломкость ногтей и волос
- сухость кожи
- снижение аппетита
- повышенная утомляемость
- снижение мышечного тонуса
- субфебрильная температура без клинической причины (до 37—37,5°С)
При проявлении этих симптомов обязательно нужно сделать общий анализ крови, и показать и ребенка, и результаты анализов педиатру. Он назначит дополнительные исследования, и лечение, при необходимости. Вообще, детям с риском возникновения железодефицитной анемии требуется назначение дополнительно препаратов железа. Если анемия в легкой степени, то прием препарата назначают сначала на 3 месяца, при средней степени — на 4,5 месяца, при тяжелой — на 6 месяцев.
Для поддержания нормального уровня гемоглобина в питание ребенка нужно включать продукты, богатые железом. В питание ребенка нужно включать печень, мясо кролика, говядины, говяжий язык, скумбрию, курицу. Из растительной пищи очень рекомендуются морская капуста, горох, шпинат, гречка, курага, инжир. И уже только после этих продуктов, богатых железом, по количеству его содержания, идут фрукты и овощи, в том числе яблоки и гранаты, которые принято рекомендовать для повышения гемоглобина в первую очередь. Уже доказано, что именно в пище животного происхождения содержится железо, которое усваивается организмом ребенка гораздо лучше.
Из растительной пищи очень рекомендуются морская капуста, горох, шпинат, гречка, курага, инжир. И уже только после этих продуктов, богатых железом, по количеству его содержания, идут фрукты и овощи, в том числе яблоки и гранаты, которые принято рекомендовать для повышения гемоглобина в первую очередь. Уже доказано, что именно в пище животного происхождения содержится железо, которое усваивается организмом ребенка гораздо лучше.
Родители должны понимать, что такие продукты, как какао, чай, кофе, орехи могут задерживать усваиваемость железа, поэтому их нужно исключить из рациона ребенка с железодефицитной анемией.
Прием препаратов железа и специальную диету рекомендуется сочетать с приемом витаминов С и группы В и фолиевой кислоты.
Есть еще один фактор, который способствует снижению гемоглобина. Это малоподвижный образ жизни ребенка. Чтобы нормализовать уровень гемоглобина, ребенок должен много двигаться, часто гулять. Детям с диагностированной железодефицитной анемией рекомендованы ежедневные прогулки два раза в день по два часа.
Снижению уровня гемоглобина способствует и гиподинамия. Анемичному ребенку надо как можно больше, пока он не устанет, двигаться и играть на свежем воздухе. Врачи рекомендуют таким детям две двухчасовые прогулки в день.
Железодефицитную анемию внимательные родители могут предотвратить с помощью профилактических мер. Это:
- своевременное введение прикорма
- использование адаптированных смесей
- сбалансированное питание в любом возрасте
- прием дополнительных препаратов железа по рекомендации педиатра
- исключить коровье молоко из рациона детей до года
- строго своевременно делать плановые анализы крови
- обеспечить ребенку подвижный образ жизни
- включать в питание продукты, содержащие железо, в разумных дозах
- исключить возможность для ребенка вегетарианской или веганской диеты
Будьте внимательны к состоянию здоровья, режиму питания и образу жизни ребенка, и вы сможете либо совсем избежать железодефицитной анемии, или справиться с ней вовремя и по возможности быстро.
Уровень гемоглобина при рождении влияет на исходы у недоношенных детей
Об этом блоге
Исследование, недавно опубликованное в BMC Medicine , показывает, что низкий уровень гемоглобина при рождении связан с повышенным риском смертности у недоношенных детей. В этом гостевом блоге авторы Джаянта Банерджи и Нарендра Аладангади обсуждают результаты.
Джаянта Банерджи и Нарендра Аладангади
Wikimedia Commons
Краткосрочные исходы, такие как кровоизлияние в мозг, зависимость от кислорода, продолжительность пребывания в больнице и смертность недоношенных детей, зависят от широкого круга факторов. К ним относятся гестационный возраст, масса тела при рождении, пол, антенатальные факторы и состояние младенца при рождении и в течение первых нескольких часов жизни.
Введение антенатальных стероидов, использование сурфактанта, лучший контроль температуры и влажности — все это способствовало улучшению выживаемости этих детей.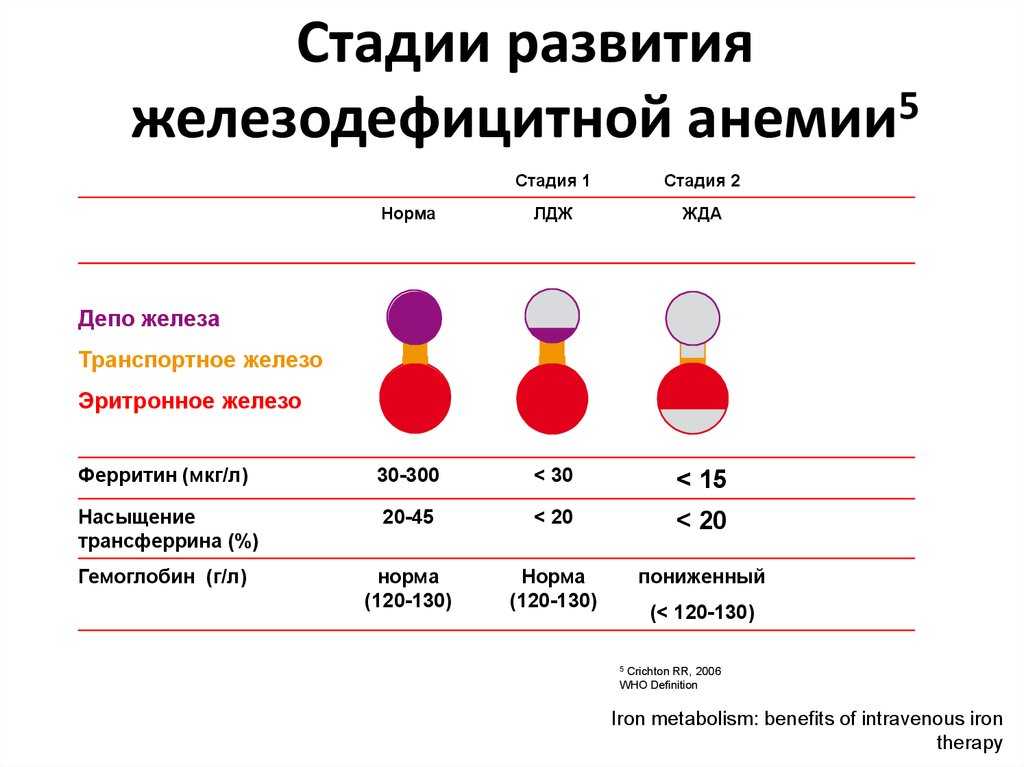 С другой стороны, плохо контролируемая артериальная гипертензия у матери во время беременности, перинатальная инфекция и дистресс плода, как известно, являются факторами риска неблагоприятных исходов.
С другой стороны, плохо контролируемая артериальная гипертензия у матери во время беременности, перинатальная инфекция и дистресс плода, как известно, являются факторами риска неблагоприятных исходов.
Нормальный уровень гемоглобина при рождении у недоношенных детей колеблется в пределах 15–20 г/дл. Эти уровни и объем крови у младенца можно улучшить, отложив пережатие пуповины на 30–120 секунд при родах. Хотя увеличение объема крови отмечается вскоре после родов, повышенный гемоглобин становится очевидным через несколько минут или часов после рождения.
Предоставление недоношенному ребенку дополнительной плацентарной крови путем отсрочки пережатия пуповины, по-видимому, связано с лучшей стабильностью состояния кровообращения и снижением риска респираторного дистресс-синдрома, кровоизлияния в мозг, некротизирующего энтероколита и потребности в переливании крови. Однако это не привело к улучшению выживаемости недоношенных детей, и поэтому это было целью нашего исследования.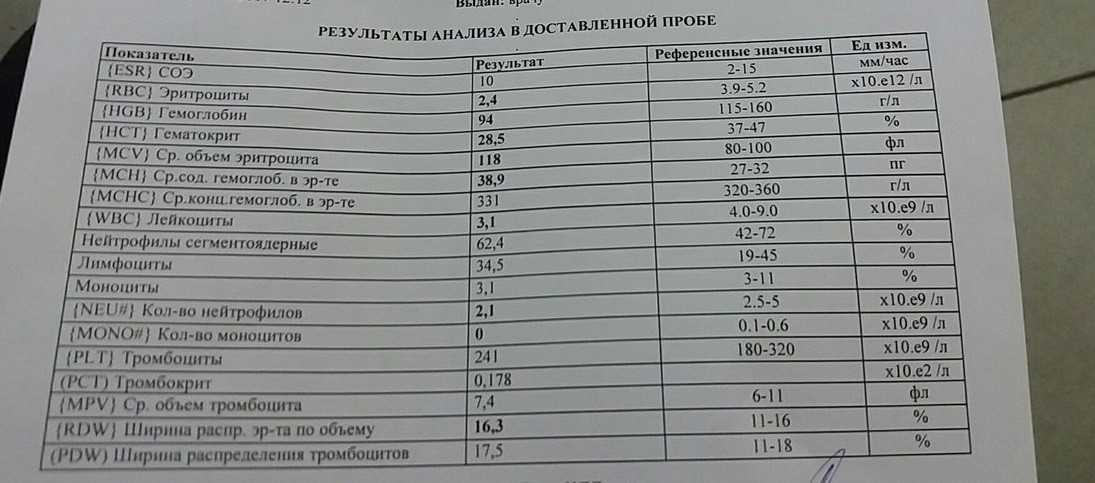
Изучали взаимосвязь между уровнем гемоглобина при рождении и ближайшими исходами, а также смертностью недоношенных детей. В исследование были включены дети, родившиеся в возрасте ≤ 32 недель в университетской больнице Хомертон в Лондоне. В исследовании приняли участие около 900 младенцев со средним гестационным возрастом 28,3 недели и массой тела при рождении 1140 г (около 2,5 фунта).
Низкий уровень гемоглобина при рождении был связан с худшими исходами.
Низкий уровень гемоглобина при рождении был связан с худшими исходами, такими как кровоизлияние в мозг, некротизирующий энтероколит, зависимость от кислорода на 36 неделе (возраст после зачатия), ретинопатия недоношенных и смерть до выписки из неонатального отделения.
После поправки на тяжесть недоношенности и массу тела при рождении низкий гемоглобин по-прежнему был связан с повышенной смертностью. Риск смертности увеличивался в четыре раза, если уровень гемоглобина при рождении составлял 18 г/дл.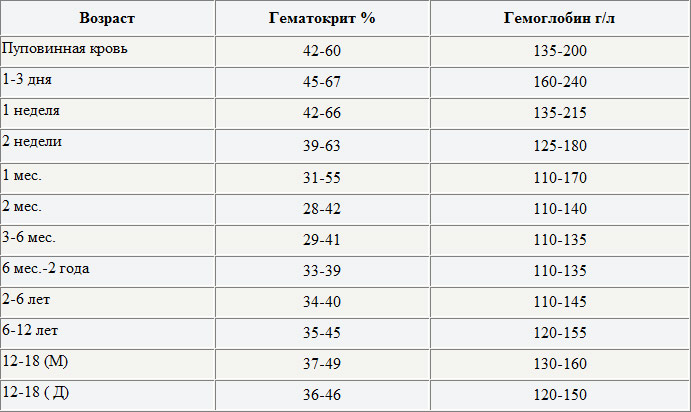 Низкие уровни также были связаны с риском переливания крови, но не были связаны с продолжительностью пребывания в больнице или количеством дней в интенсивной терапии.
Низкие уровни также были связаны с риском переливания крови, но не были связаны с продолжительностью пребывания в больнице или количеством дней в интенсивной терапии.
Таким образом, наше исследование показало, что низкий уровень гемоглобина при рождении связан со смертностью и необходимостью переливания крови у детей, рожденных в сроке менее 32 недель гестационного возраста. Отсрочка пережатия пуповины при родах может быть использована для улучшения объема крови и уровня гемоглобина у младенцев, что может улучшить общую выживаемость младенцев в исследуемой группе.
Связь между уровнем гемоглобина при рождении и долгосрочными исходами развития нервной системы все еще нуждается в дальнейших исследованиях. Тем временем измерение уровня гемоглобина при рождении может быть включено в показатели прогнозирования смертности, такие как индекс клинического риска для младенцев (CRIB) и показатель неонатальной острой физиологии (SNAP), чтобы еще больше повысить чувствительность прогнозирования.
Темы:
МедицинаТеги:
уход за новорожденнымипреждевременные родыПоделиться этим постом
< ПРЕДЫДУЩАЯ СТАТЬЯОдин день из жизни уролога
30 марта 2015 г.
СЛЕДУЮЩАЯ СТАТЬЯ >
Использование местных данных для улучшения здоровья в Замбии
02 апр 2015
Просмотреть последние сообщения на домашней странице On Medicine
Уровни неонатального гемоглобина у недоношенных детей связаны с ранним неврологическим функционированием — Полный текст — Неонатология 2021, Том. 118, № 5
История вопроса: Анемия новорожденных может нарушать транспорт кислорода к мозгу. Влияние анемии и церебральной оксигенации на неврологическое функционирование в раннем неонатальном периоде в значительной степени неизвестно. Цель: Это исследование было направлено на определение связи между начальными уровнями гемоглобина (Hb) и ранним неврологическим функционированием у недоношенных детей путем оценки их общих движений (GM). Методы: Проведен ретроспективный анализ проспективно собранных данных о недоношенных новорожденных, рожденных до 32 недель гестации. Мы исключили младенцев с внутрижелудочковым кровоизлиянием > II степени. На 8-й день мы оценили GM младенцев как в целом как нормальные/ненормальные, так и подробно, используя общую оценку оптимальности движений (GMOS). Мы измерили насыщение тканей головного мозга кислородом (r c SO 2 ) в 1-й день с использованием спектроскопии в ближней инфракрасной области. Результатов: Мы включили 65 новорожденных (средний гестационный возраст 29,9 недели [межквартильный интервал 28,2–31,0]; средний вес при рождении 1180 г [межквартильный интервал 930–1400]). Медиана Hb в 1-й день составила 10,3 ммоль/л (диапазон 4,2–13,7).
Цель: Это исследование было направлено на определение связи между начальными уровнями гемоглобина (Hb) и ранним неврологическим функционированием у недоношенных детей путем оценки их общих движений (GM). Методы: Проведен ретроспективный анализ проспективно собранных данных о недоношенных новорожденных, рожденных до 32 недель гестации. Мы исключили младенцев с внутрижелудочковым кровоизлиянием > II степени. На 8-й день мы оценили GM младенцев как в целом как нормальные/ненормальные, так и подробно, используя общую оценку оптимальности движений (GMOS). Мы измерили насыщение тканей головного мозга кислородом (r c SO 2 ) в 1-й день с использованием спектроскопии в ближней инфракрасной области. Результатов: Мы включили 65 новорожденных (средний гестационный возраст 29,9 недели [межквартильный интервал 28,2–31,0]; средний вес при рождении 1180 г [межквартильный интервал 930–1400]). Медиана Hb в 1-й день составила 10,3 ммоль/л (диапазон 4,2–13,7).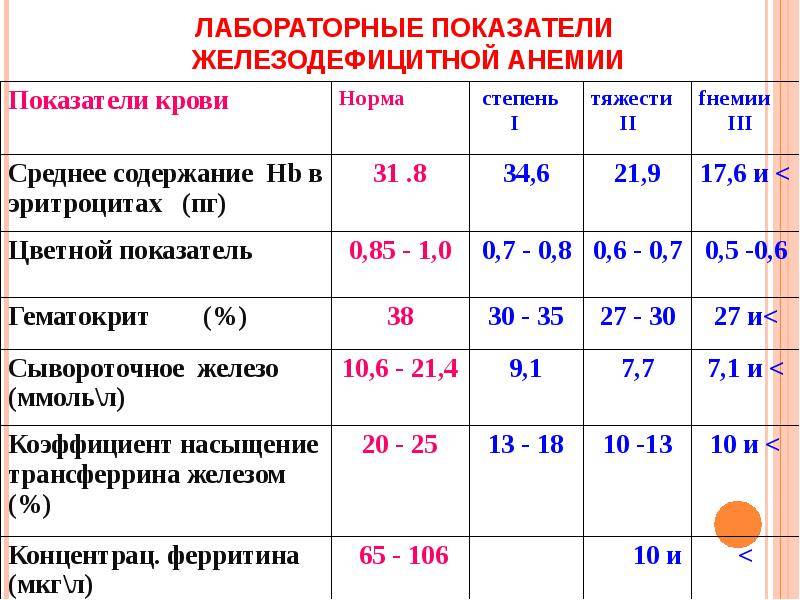 Более низкий Hb в 1-й день был связан с более высоким риском аномальных GM (OR = 2,3, 95% ДИ: 1,3–4,1) и более низким уровнем GMOS ( B = 0,9, 95% ДИ: 0,2–1,7). Гемоглобин сильно коррелировал с r c SO 2 (rho = 0,62, p < 0,01). Младенцы с более низкими значениями r c SO 2 имели тенденцию к более высокому риску аномальных GM ( р = 0,06). После поправки на вмешивающиеся факторы Hb в 1-й день объяснил 44% дисперсии нормальных/аномальных GM, а r c SO 2 объяснил 17%. Что касается объясненной дисперсии ГМО, то она составила 25% и 16% соответственно. Выводы: У недоношенных детей низкий уровень гемоглобина в 1-й день связан с нарушением неврологического функционирования на 8-й день, что частично объясняется низкой церебральной оксигенацией.
Более низкий Hb в 1-й день был связан с более высоким риском аномальных GM (OR = 2,3, 95% ДИ: 1,3–4,1) и более низким уровнем GMOS ( B = 0,9, 95% ДИ: 0,2–1,7). Гемоглобин сильно коррелировал с r c SO 2 (rho = 0,62, p < 0,01). Младенцы с более низкими значениями r c SO 2 имели тенденцию к более высокому риску аномальных GM ( р = 0,06). После поправки на вмешивающиеся факторы Hb в 1-й день объяснил 44% дисперсии нормальных/аномальных GM, а r c SO 2 объяснил 17%. Что касается объясненной дисперсии ГМО, то она составила 25% и 16% соответственно. Выводы: У недоношенных детей низкий уровень гемоглобина в 1-й день связан с нарушением неврологического функционирования на 8-й день, что частично объясняется низкой церебральной оксигенацией.
Введение
Неонатальная анемия часто встречается у недоношенных детей. Анемия может вызвать гипоксию тканей, что может привести к повреждению клеток.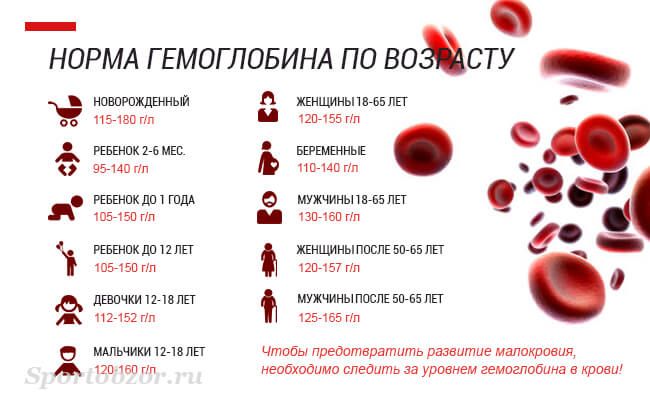 Переливание эритроцитов (эритроцитов) направлено на быстрое улучшение транспорта кислорода к жизненно важным органам. До 60% недоношенных детей, рожденных до 32 недель гестационного возраста (ГВ), получают переливание эритроцитарной массы по поводу анемии, в основном в результате ятрогенной потери крови при флеботомии и при необходимости искусственной вентиляции легких для улучшения доставки кислорода [1]. Анемия и переливание эритроцитарной массы тесно связаны в первые дни после рождения [2] и связаны со смертностью и краткосрочной заболеваемостью, такой как гемодинамически значимый открытый артериальный проток (ОАП) и внутрижелудочковое кровоизлияние (ВЖК) [2, 3].
Переливание эритроцитов (эритроцитов) направлено на быстрое улучшение транспорта кислорода к жизненно важным органам. До 60% недоношенных детей, рожденных до 32 недель гестационного возраста (ГВ), получают переливание эритроцитарной массы по поводу анемии, в основном в результате ятрогенной потери крови при флеботомии и при необходимости искусственной вентиляции легких для улучшения доставки кислорода [1]. Анемия и переливание эритроцитарной массы тесно связаны в первые дни после рождения [2] и связаны со смертностью и краткосрочной заболеваемостью, такой как гемодинамически значимый открытый артериальный проток (ОАП) и внутрижелудочковое кровоизлияние (ВЖК) [2, 3].
Тяжелая неонатальная анемия приводит к снижению транспорта кислорода и снижению оксигенации в головном мозге [4]. Это связано с неблагоприятным влиянием на созревание центральной нервной системы и последующее развитие нервной системы [5]. И наоборот, переливание эритроцитов увеличивает оксигенацию тканей головного мозга, что может улучшить неврологическое состояние младенцев [6]. Однако переливания могут также вызывать окислительный стресс и последующее повреждение нейронов. Были опубликованы противоречивые результаты по отдаленным результатам у детей, получавших лечение в соответствии с либеральными или ограничительными рекомендациями по переливанию эритроцитарной массы во время пребывания новорожденных в отделении интенсивной терапии (ОИТН) [7, 8]. Ранняя неврологическая оценка может выявить основные патофизиологические механизмы.
Однако переливания могут также вызывать окислительный стресс и последующее повреждение нейронов. Были опубликованы противоречивые результаты по отдаленным результатам у детей, получавших лечение в соответствии с либеральными или ограничительными рекомендациями по переливанию эритроцитарной массы во время пребывания новорожденных в отделении интенсивной терапии (ОИТН) [7, 8]. Ранняя неврологическая оценка может выявить основные патофизиологические механизмы.
Влияние анемии и церебральной оксигенации на функционирование нервной системы в раннем неонатальном периоде практически неизвестно. Широко применяемым методом мониторинга насыщения тканей головного мозга кислородом (r c SO 2 ) у новорожденных является спектроскопия в ближней инфракрасной области спектра (БИКС). Меры церебральной оксигенации также могут служить прогностическим инструментом для прогнозирования исходов у недоношенных детей [6, 9]. Надежным и достоверным инструментом для определения неврологического функционирования у детей раннего возраста является метод Прехтля общей оценки движений (GMA) [10, 11].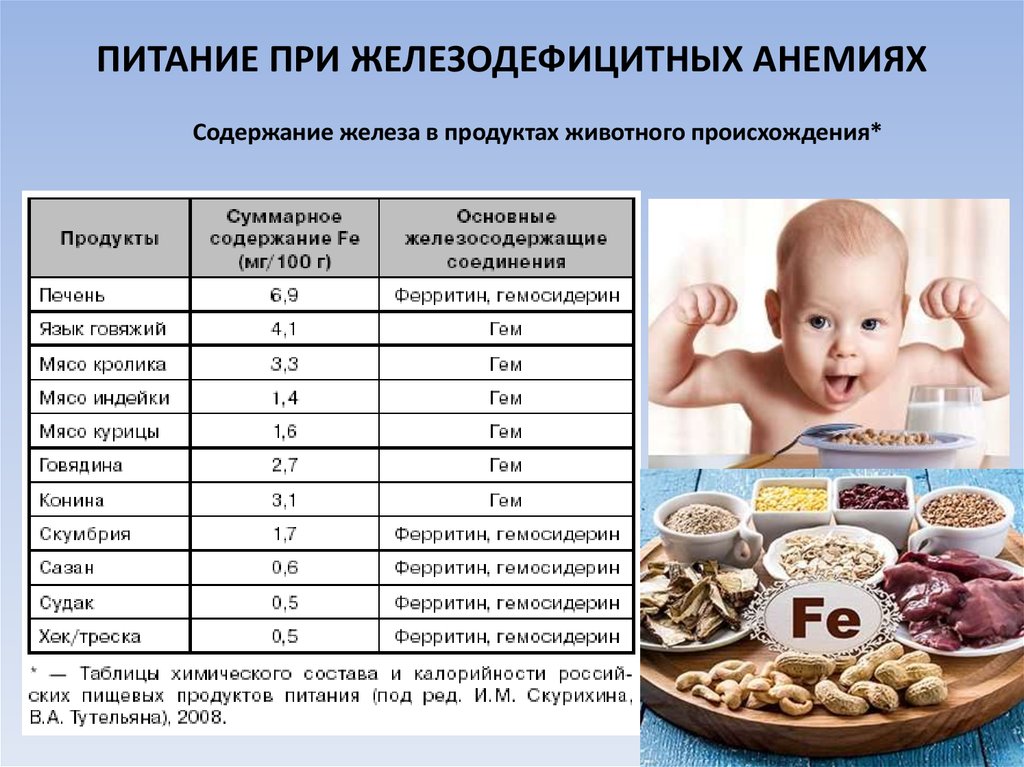 Качество общих движений (GM) в сочетании с подробными аспектами этих движений, отраженными в общей шкале оптимальности движений (GMOS), имеет важное диагностическое значение у недоношенных детей [12, 13] с прогностической ценностью от средней до хорошей после первая постнатальная неделя [14].
Качество общих движений (GM) в сочетании с подробными аспектами этих движений, отраженными в общей шкале оптимальности движений (GMOS), имеет важное диагностическое значение у недоношенных детей [12, 13] с прогностической ценностью от средней до хорошей после первая постнатальная неделя [14].
Целью нашего исследования было определение связи между исходным уровнем гемоглобина (Hb) и GMA на 8-й день после рождения у недоношенных детей, родившихся до 32 недель гестации. Мы предполагаем, что низкий уровень гемоглобина и сопутствующая ему низкая церебральная оксигенация независимо связаны с ухудшением неврологического функционирования.
Методы
Дизайн исследования и участники
Мы провели ретроспективный анализ проспективно собранных данных о врожденных и недоношенных новорожденных, поступивших в отделение интенсивной терапии Университетского медицинского центра Гронингена (UMCG) в период с мая 2006 г. по апрель 2018 г. ранее опубликованного проспективного обсервационного исследования [6, 15] или недавнего неопубликованного обсервационного пилотного исследования о возможности добавления раннего GMA в стандартное отделение интенсивной терапии новорожденных у всех недоношенных детей с гестационным возрастом ≤30 недель. Критериями включения двух предыдущих исследований были гестационный возраст <32 недель в одном из них [6] и ограничение роста плода, определяемое как окружность живота плода или расчетная масса плода <10-го процентиля или снижение роста плода ≥30 процентилей в другом [15]. Оба исследования были одобрены Наблюдательным советом по медицинской этике UMCG.
Критериями включения двух предыдущих исследований были гестационный возраст <32 недель в одном из них [6] и ограничение роста плода, определяемое как окружность живота плода или расчетная масса плода <10-го процентиля или снижение роста плода ≥30 процентилей в другом [15]. Оба исследования были одобрены Наблюдательным советом по медицинской этике UMCG.
Младенцы имели право на участие в текущем исследовании, если они соответствовали следующим критериям: ГВ ≤32 недель и видеозапись ГМ на 8-й день после рождения. Мы исключили младенцев с хромосомными аномалиями или если у них был диагностирован ВЖК > II степени по классификации Папиле, чтобы предотвратить включение случаев, когда аномальные СЖ были результатом тяжелого ВЖК. Пороги трансфузии соответствовали голландскому протоколу трансфузии при анемии (онлайн-приложение, таблица 1; см. www.karger.com/doi/10.1159)./000518655 для всех онлайн-приложений. материал).
Видеозаписи и оценки оптимальности движений
Нашим основным результатом было качество GM, включая подробную оценку, на 8-й день. Это было получено из 45-минутной видеозаписи в соответствии с Einspieler и Prechtl [11]. Поскольку с конца первой недели GMA надежен даже при умеренном прогностическом значении [14], мы оценили неврологическое состояние на 8-й день, близкое к интересующему фактору риска, то есть Hb в 1-й день. лежала на спине, в одном подгузнике. Записи во время плача, суеты, икоты или сосания пустышки исключались из анализа [11]. Все записи оценивались в автономном режиме двумя исследователями (WSK и AFB). Сначала мы разделили GM на нормальные, с плохим репертуаром, судорожно-синхронизированные или хаотичные GM [11]. Впоследствии мы забили их детальные характеристики с помощью ГМОС. Первая часть GMOS относится к общим категориям GM. Вторая часть посвящена подробной оценке шеи и туловища, а также верхних и нижних конечностей по отдельности. GMOS получается путем сложения оценок по 3 категориям плюс оценка общего качества. 42 балла указывают на наилучшую возможную производительность, а 5 — на самую низкую [12].
Это было получено из 45-минутной видеозаписи в соответствии с Einspieler и Prechtl [11]. Поскольку с конца первой недели GMA надежен даже при умеренном прогностическом значении [14], мы оценили неврологическое состояние на 8-й день, близкое к интересующему фактору риска, то есть Hb в 1-й день. лежала на спине, в одном подгузнике. Записи во время плача, суеты, икоты или сосания пустышки исключались из анализа [11]. Все записи оценивались в автономном режиме двумя исследователями (WSK и AFB). Сначала мы разделили GM на нормальные, с плохим репертуаром, судорожно-синхронизированные или хаотичные GM [11]. Впоследствии мы забили их детальные характеристики с помощью ГМОС. Первая часть GMOS относится к общим категориям GM. Вторая часть посвящена подробной оценке шеи и туловища, а также верхних и нижних конечностей по отдельности. GMOS получается путем сложения оценок по 3 категориям плюс оценка общего качества. 42 балла указывают на наилучшую возможную производительность, а 5 — на самую низкую [12]. В случае отсутствия или только очень коротких ГМ (<3 с) младенец классифицировался как гипокинетический, и ГМО не проводили.
В случае отсутствия или только очень коротких ГМ (<3 с) младенец классифицировался как гипокинетический, и ГМО не проводили.
Клинические переменные
Гемоглобин на 1-й день был получен из медицинских карт младенцев. Из этих записей мы также собрали другие клинические данные, включая гестационный возраст, массу тела при рождении (МТ), гемоглобин на 8-й день, проведенные переливания эритроцитов, оценку по шкале Апгар, тяжесть заболевания, оцененную в соответствии со шкалой неонатальной острой физиологии и перинатального расширения II (SNAPPE- II) [16], наличие КПК и ИВЛ.
Мы измерили r c SO 2 с помощью NIRS, неинвазивной процедуры, и использовали оксиметр INVOS 5100 c в сочетании с неонатальными датчиками (Medtronic, Дублин, Ирландия). Датчик помещали либо на левую, либо на правую сторону лба младенцев. Мы рассчитали среднее значение r c SO 2 2-часовой записи в первый день, в которой было задокументировано правильное положение датчика. Для анализа мы использовали среднее значение r c SO 2 , полученное для каждого отдельного ребенка.
Для анализа мы использовали среднее значение r c SO 2 , полученное для каждого отдельного ребенка.
Статистический анализ
Мы использовали SPSS версии 23.0 (IBM Corp., Армонк, штат Нью-Йорк, США) для статистического анализа. Характеристики пациентов описывались как средний межквартильный размах (IQR) или числовой ( n ) процент. С помощью корреляционного теста Пирсона рассчитывали коэффициент корреляции между уровнем гемоглобина у детей раннего возраста в 1-е и 9-е сутки жизни.0075 с СО 2 . Затем мы рассчитали отношение шансов и 95% доверительные интервалы для аномальных GM. Мы также провели линейный регрессионный анализ, чтобы проверить, являются ли Hb в 1-й день, Hb во время видеозаписи на 8-й день и церебральная оксигенация предикторами ГМО. Потенциальными искажающими факторами, которые мы рассматривали, были год рождения младенцев, гестационный возраст, баллы по шкале Апгар, тяжесть заболевания и то, родились ли они маленькими для гестационного возраста (SGA). Эти факторы, которые были однозначно связаны либо с аномальными GM, либо с GMOS в p < 0,20, были включены в модели множественной регрессии с учетом потенциального влияния мультиколлинеарности. Статистическую значимость определяли как p < 0,05.
Эти факторы, которые были однозначно связаны либо с аномальными GM, либо с GMOS в p < 0,20, были включены в модели множественной регрессии с учетом потенциального влияния мультиколлинеарности. Статистическую значимость определяли как p < 0,05.
Поскольку в нашей когорте было фиксированное количество младенцев, мы не решались провести анализ мощности. Тем не менее, мы подсчитали, сколько младенцев нам потребовалось для этого исследования, чтобы сделать осмысленный вывод. Что касается связи между ГМОС и гемоглобином в 1-й день, мы сочли релевантным коэффициент корреляции 0,4. При мощности 0,8 и альфа 0,05 нам нужно было включить 43 младенца или 61 младенца, если бы мы включили в анализ 2 ковариаты.
Результаты
Участники и видеозаписи
Мы включили 65 детей со средним возрастом 29,9 недель (МКИ 28,2–31,1) и средней массой тела 1180 г (МКИ 930–1403). Из них 46 родились в период с 2006 по 2007 год, 16 — с 2012 по 2014 год и 3 — с 2018 года.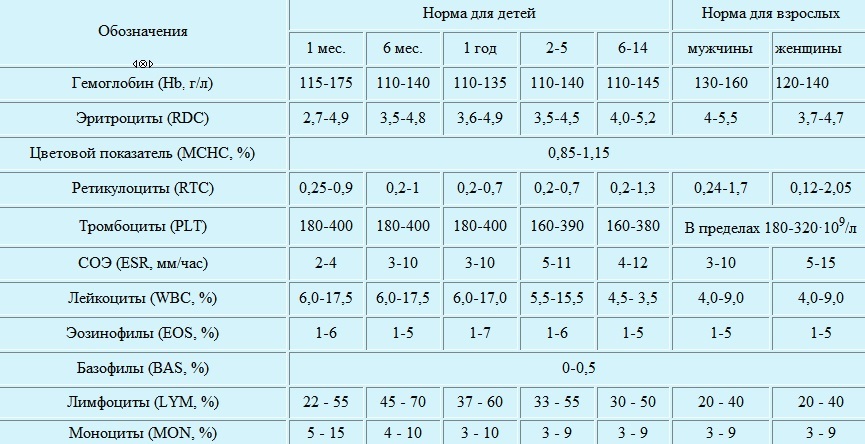 Медиана Hb в 1-й день составила 10,3 ммоль/л (диапазон 4,2–13,7). Медиана r c SO 2 в 1-й день составила 80% (МКИ 73–84). Двадцать новорожденных (31%) получили переливание эритроцитарной массы до 8-х суток. Гемоглобин на 8-е сутки колебался от 6,1 до 12,5 ммоль/л. Базовые характеристики представлены в таблице 1.
Медиана Hb в 1-й день составила 10,3 ммоль/л (диапазон 4,2–13,7). Медиана r c SO 2 в 1-й день составила 80% (МКИ 73–84). Двадцать новорожденных (31%) получили переливание эритроцитарной массы до 8-х суток. Гемоглобин на 8-е сутки колебался от 6,1 до 12,5 ммоль/л. Базовые характеристики представлены в таблице 1.
Таблица 1.
Характеристики пациентов
В таблице 2 представлена классификация качества ГМ и ГМО. Семь младенцев были классифицированы как гипокинетические из-за сепсиса. ГМО оценивали у 58 (89%) новорожденных. Из них 11 младенцев (19%) имели нормальные GM, а 47 (81%) — плохой репертуар GM. Медиана ГМО составила 27 (IQR 23–33).
Таблица 2.
Качество общих движений и показатель оптимальности
Связь между гемоглобином, оксигенацией головного мозга и качеством ГМ
Низкий уровень гемоглобина как в 1-й, так и в 8-й день был связан с более высоким риском аномальных GM на 8-й день (таблица 3). Гемоглобин в 1-й день сильно коррелировал со средним значением r c SO 2 в 1-й день (рис. 1). Низкий уровень r c SO 2 , как правило, был связан с более высоким риском аномальных GM (таблица 3). Более высокий GA был связан с более низким риском аномальных GM. Ни год рождения, ни оценка по шкале Апгар, ни SNAPPE-II, ни SGA не были значимо связаны с аномальными GM.
1). Низкий уровень r c SO 2 , как правило, был связан с более высоким риском аномальных GM (таблица 3). Более высокий GA был связан с более низким риском аномальных GM. Ни год рождения, ни оценка по шкале Апгар, ни SNAPPE-II, ни SGA не были значимо связаны с аномальными GM.
Таблица 3.
Отношения шансов для факторов риска в отношении аномальных GM на 8-й день с использованием однофакторного и множественного регрессионного анализа
Рис. 1.
Связь между уровнем гемоглобина и насыщением тканей головного мозга кислородом в 1-й день. r c SO 2 , насыщение тканей головного мозга кислородом.
Поскольку Hb сильно коррелировал с r c SO 2 , мы ввели Hb и r c SO 2 в отдельные регрессионные модели, чтобы избежать мультиколлинеарности. После поправки на тяжесть заболевания только Hb на 1-й день оставался значимо связанным с аномальными GM на 8-й день, при этом модель 1 объясняла 44% дисперсии (таблица 3). Связь оставалась значимой, когда анализировались только 45 детей, которым не делали переливание эритроцитов до 8-го дня.0075 c SO 2 просто не удалось достичь значимости ( p = 0,06), при этом модель 2 объясняет 17% дисперсии.
Связь оставалась значимой, когда анализировались только 45 детей, которым не делали переливание эритроцитов до 8-го дня.0075 c SO 2 просто не удалось достичь значимости ( p = 0,06), при этом модель 2 объясняет 17% дисперсии.
Взаимосвязь между гемоглобином, оксигенацией головного мозга и ГМО
Низкий уровень гемоглобина в 1-й день был связан с более низким уровнем ГМО в 8-й день (таблица 4). Ассоциация исчезла, когда были проанализированы только младенцы, которым не делали переливание крови в течение первой недели. r c SO 2 не был значимо связан с ГМО ( p = 0,19). Более низкий GA и более высокие баллы SNAPPE-II были связаны с более низким уровнем ГМО на 8-й день, в то время как год рождения, баллы по шкале Апгар и SGA не были связаны.
Таблица 4.
Связь между факторами риска и ГМО на 8-й день с использованием однофакторного и множественного регрессионного анализа ГМО. После проверки одномерных бета-коэффициентов в многомерные модели были введены баллы SNAPPE-II, а не GA. И Hb в 1-й день, и тяжесть заболевания оставались связанными с ГМО на 8-й день, при этом модель 1 объясняла 25% дисперсии, тогда как r c SO 2 нет, а модель 2 объясняет 16% дисперсии.
И Hb в 1-й день, и тяжесть заболевания оставались связанными с ГМО на 8-й день, при этом модель 1 объясняла 25% дисперсии, тогда как r c SO 2 нет, а модель 2 объясняет 16% дисперсии.
Обсуждение
Мы продемонстрировали, что у недоношенных детей низкий уровень гемоглобина в первый день после рождения был связан с нарушением неврологического функционирования на 8-й день, что измерялось с точки зрения качества GM, включая подробные характеристики этих движений. В первый день церебральная оксигенация, тесно связанная с гемоглобином, как правило, связана с ранним неврологическим функционированием. Церебральное повреждение, связанное с низким уровнем гемоглобина в 1-й день, может быть опосредовано более низким уровнем r9.0075 c SO 2 независимо от тяжести заболевания.
Как мы и предполагали, низкий уровень Hb после рождения негативно влиял на неврологическое состояние недоношенных детей на 8-й день. Ранние GM оценивались только через 1 неделю, что подтверждало представление о причинно-следственной связи между Hb на 1-й день и плохим неврологическим функционированием на 8-й день. У младенцев не было в анамнезе других заболеваний, которые также могли бы повлиять на неврологическое функционирование: уровень гемоглобина оставался тесно связанным с неврологическим функционированием после поправки на тяжесть заболевания. Частично связь между Hb и GM может быть опосредована низким уровнем r c SO 2 в первый день, видя, что r c SO 2 сильно коррелирует с гемоглобином. Однако низкий уровень Hb в большей степени, чем r c SO 2 , способствовал как аномальным GM, так и более низкому уровню GMOS. Это может быть объяснено тем, что не только церебральная гипоксия, но и церебральная гипероксия связаны с худшими исходами [6], уменьшая линейную, статистически значимую зависимость между r c SO 2 и GMA. В частности, гипероксия и окислительный стресс связаны с повреждением белого вещества и нейронов [17, 18]. Наши результаты показывают, что анемическая гипоксия в первый день может быть вредна для мозга недоношенных.
У младенцев не было в анамнезе других заболеваний, которые также могли бы повлиять на неврологическое функционирование: уровень гемоглобина оставался тесно связанным с неврологическим функционированием после поправки на тяжесть заболевания. Частично связь между Hb и GM может быть опосредована низким уровнем r c SO 2 в первый день, видя, что r c SO 2 сильно коррелирует с гемоглобином. Однако низкий уровень Hb в большей степени, чем r c SO 2 , способствовал как аномальным GM, так и более низкому уровню GMOS. Это может быть объяснено тем, что не только церебральная гипоксия, но и церебральная гипероксия связаны с худшими исходами [6], уменьшая линейную, статистически значимую зависимость между r c SO 2 и GMA. В частности, гипероксия и окислительный стресс связаны с повреждением белого вещества и нейронов [17, 18]. Наши результаты показывают, что анемическая гипоксия в первый день может быть вредна для мозга недоношенных. В соответствии с нашими результатами предыдущие отчеты показали, что увеличение компенсаторного мозгового кровотока при анемии кажется недостаточным для нормализации церебральной оксигенации [4].
В соответствии с нашими результатами предыдущие отчеты показали, что увеличение компенсаторного мозгового кровотока при анемии кажется недостаточным для нормализации церебральной оксигенации [4].
Еще одним объяснением связи между низким уровнем гемоглобина и плохим неврологическим функционированием может быть то, что анемия часто связана с более плохой гемодинамической стабильностью и повышенной тяжестью сердечно-легочных заболеваний и более плохими краткосрочными результатами [19]. Это подтверждается тем фактом, что ранняя тяжесть заболевания также была связана с GMA на 8-й день. Учитывая, что мы исключили младенцев с тяжелым ВЖК (≥III степени), это не могло исказить наши результаты. Всем новорожденным с анемией было проведено переливание эритроцитарной массы. Трансфузии также связаны с более плохими неврологическими исходами у недоношенных детей [20]. Ранние переливания эритроцитарной массы могут, по крайней мере частично, объяснить любое повреждение головного мозга, которое могло развиться в течение первой недели после рождения. Предполагаемыми патофизиологическими механизмами могут быть воспалительная реакция, ишемически-реперфузионное повреждение и/или окислительный стресс [21].
Предполагаемыми патофизиологическими механизмами могут быть воспалительная реакция, ишемически-реперфузионное повреждение и/или окислительный стресс [21].
Мы продемонстрировали, что гемоглобин на 8-й день не был связан с неврологическим функционированием на 8-й день. Это позволяет предположить, что наиболее чувствительный период для связанного с анемией повреждения головного мозга наступает вскоре после рождения. В предыдущем исследовании также сообщалось, что низкий уровень гемоглобина сразу после рождения был связан с повышенным риском смертности и краткосрочной заболеваемости [2]. Кроме того, материнский гемоглобин в оптимальном диапазоне во время беременности полезен для развития крупной моторики младенцев [22] и поддерживает эту теорию.
Мы провели GMA в конце первой недели. Качество СЖ и их детальная характеристика являются надежным индикатором неврологического функционирования у недоношенных детей с первой недели после рождения [14]. Хотя прогностическое значение аномальных GM в течение первой недели для долгосрочного исхода может быть ограниченным, на сегодняшний день в нескольких исследованиях сообщается, что ранние аномальные GM уже выявляют недоношенных детей с риском неврологических последствий [23] и когнитивного дефицита [24]. Дальнейшие исследования должны показать, относится ли это также к ассоциации GMs с Hb.
Дальнейшие исследования должны показать, относится ли это также к ассоциации GMs с Hb.
Наши результаты показывают, что развитию головного мозга препятствует гипоксия после ранней анемии у недоношенных детей. Однако остается неясным, при каком уровне церебральной анемической гипоксии преимущества переливания эритроцитов перевешивают его недостатки. Результаты исследования SafeBoosC II не подтвердили преимущества снижения бремени церебральной гипоксии для развития нервной системы [25]. Это исследование, однако, не было направлено на выявление различий в нарушениях развития нервной системы и не ограничивало определение церебральной гипоксии первыми сутками, как это сделали мы. Ранее сообщалось, что церебральная гипоксия в 1-е сутки связана с нарушением развития нервной системы [6, 9].].
Мы признаем некоторые ограничения нашего исследования. Во-первых, ретроспективный дизайн мог вызвать систематическую ошибку отбора. Количество непригодных для наших целей видеозаписей было достаточно велико, учитывая, что 7 детей были отнесены к категории гипокинетических вследствие сепсиса.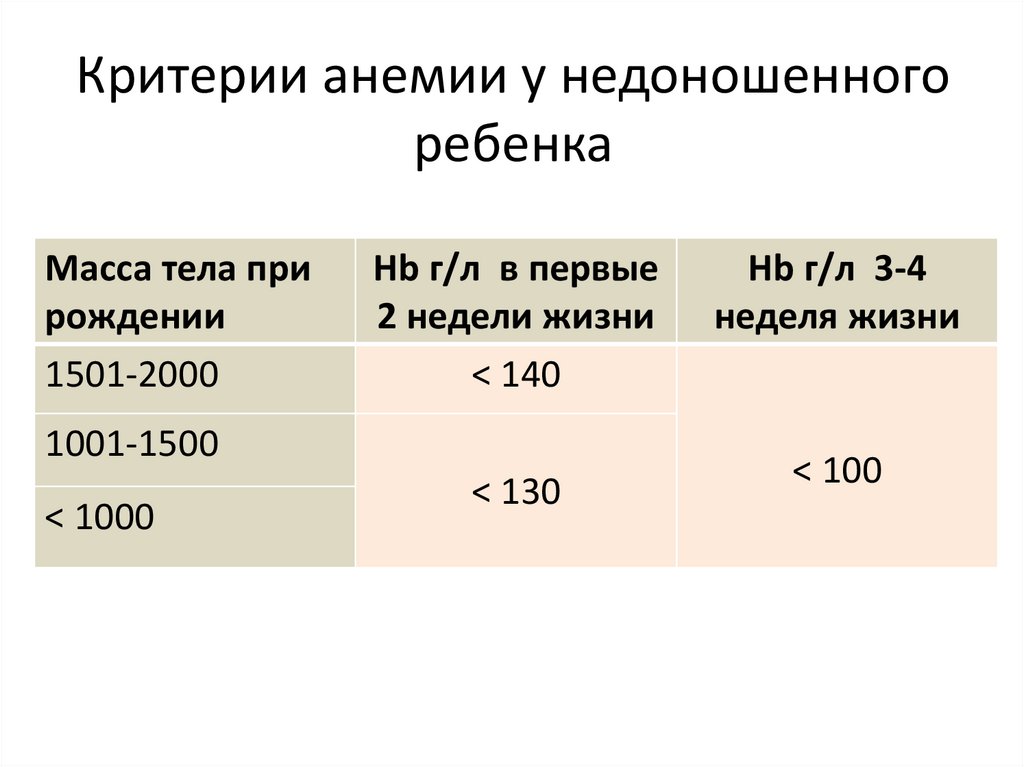 Это могло исказить наши результаты, так как сепсис был одним из механизмов, связанных с повреждением белого вещества. Кроме того, включенная выборка состояла в основном из недоношенных детей со сроком гестации >27 недель. Во-вторых, мы использовали данные, собранные в течение 3 разных периодов из 3 разных обсервационных исследований. Это могло привести к различной клинической практике, хотя год рождения не был связан с неврологическим функционированием в нашей когорте. Кроме того, рекомендации по переливанию крови оставались одинаковыми в течение всего периода времени. В-третьих, поскольку низкий уровень гемоглобина и трансфузии сильно взаимосвязаны, мы не смогли связать их отдельные эффекты на раннее неврологическое функционирование. Однако при проведении анализов только у детей раннего возраста, которым не проводилась трансфузия, связь между низким уровнем гемоглобина и плохим неврологическим функционированием сохранялась. В-четвертых, младенцы, рожденные после задержки роста плода, были чрезмерно представлены в нашей когорте.
Это могло исказить наши результаты, так как сепсис был одним из механизмов, связанных с повреждением белого вещества. Кроме того, включенная выборка состояла в основном из недоношенных детей со сроком гестации >27 недель. Во-вторых, мы использовали данные, собранные в течение 3 разных периодов из 3 разных обсервационных исследований. Это могло привести к различной клинической практике, хотя год рождения не был связан с неврологическим функционированием в нашей когорте. Кроме того, рекомендации по переливанию крови оставались одинаковыми в течение всего периода времени. В-третьих, поскольку низкий уровень гемоглобина и трансфузии сильно взаимосвязаны, мы не смогли связать их отдельные эффекты на раннее неврологическое функционирование. Однако при проведении анализов только у детей раннего возраста, которым не проводилась трансфузия, связь между низким уровнем гемоглобина и плохим неврологическим функционированием сохранялась. В-четвертых, младенцы, рожденные после задержки роста плода, были чрезмерно представлены в нашей когорте. Однако ограничение роста плода существенно не повлияло на результаты неврологического функционирования.
Однако ограничение роста плода существенно не повлияло на результаты неврологического функционирования.
Заключение
Это исследование было направлено на изучение влияния неонатального гемоглобина на раннее неврологическое состояние детей, рожденных до 32 недель беременности. В этой группе недоношенных новорожденных низкий уровень гемоглобина на 1-й день действительно был связан с ухудшением неврологического функционирования на 8-й день. Корреляция между низким уровнем гемоглобина и низкой церебральной оксигенацией может отражать основной механизм гипоксического повреждения или дисфункции церебральной анемии. Дальнейшие проспективные исследования должны пролить свет на вопрос, диктует ли церебральная оксигенация необходимость переливания эритроцитов.
Благодарности
Мы благодарим г-жу А.Дж. Olthuis и Ms. D.H. Baptist за их помощь в записи основных движений. Мы также благодарим г-жу Т. ван Вульфтен Палте, доктора философии, за исправление английской рукописи. Это исследование было частью исследовательской программы Высшей школы медицинских наук Научно-исследовательского института SHARE Гронингенского университета.
Это исследование было частью исследовательской программы Высшей школы медицинских наук Научно-исследовательского института SHARE Гронингенского университета.
Заявление об этике
Исследование было одобрено Наблюдательным советом по медицинской этике Университетского медицинского центра Гронингена в соответствии с Хельсинкской декларацией (METc 2004/232, METc 2012/055 и METc 2013/263). Все родители или опекуны новорожденных дали письменное информированное согласие на использование клинических данных и на ведение видеозаписи.
Заявление о конфликте интересов
Все авторы заявляют, что им нечего раскрывать ни в финансовом, ни в ином отношении. Там нет конфликта интересов.
Источники финансирования
Г-жа В.С. Калтерен получил финансовую поддержку от младшего научного мастер-класса Гронингенского университета.
Вклад авторов
Бос, Калтерен и Кои участвовали в разработке концепции и дизайна исследования; Калтерен и Мебиус участвовали в сборе данных; Калтерен и Мебиус занимались анализом и интерпретацией данных; Танис и Верхаген провели проспективные исследования; Калтерен составил рукопись; Бос, Калтерен, Кои, Мебиус, Танис и Верхаген критически отредактировали рукопись на предмет важного интеллектуального содержания; Бос и Кои осуществляли руководство исследованиями, как текущими, так и предыдущими. Все авторы одобрили окончательный вариант рукописи в представленном виде и соглашаются нести ответственность за все аспекты работы.
Все авторы одобрили окончательный вариант рукописи в представленном виде и соглашаются нести ответственность за все аспекты работы.
Заявление о доступности данных
В эту статью включены все данные, полученные или проанализированные в ходе этого исследования. Дальнейшие запросы можно направлять соответствующему автору.
Эта статья находится под лицензией Creative Commons Attribution-NonCommercial 4.0 International License (CC BY-NC). Использование и распространение в коммерческих целях требует письменного разрешения. Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений.