БИБЛИОТЕКА
Значение опухолевых маркеров в клинике герминогенных опухолей яичка.
З.Г.Кадагидзе, В.М.Шелепова, А.В.Соколов
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Общеизвестно, что за последние 15 лет достигнуты большие успехи в лечении трофобластических неоплазм и герминогенных опухолей. В онкологических центрах, специализирующихся на лечении этих заболеваний, частота излеченности больных превышает 90%. Главными причинами наблюдаемого значительного прогресса являются, наряду с внедрением новых лекарств — цисплатина, VP16-213 и др., — также и рациональное использование опухолевых маркёров.
Наиболее информативными при герминогенных опухолях считаются a-фетопротеин (АФП) и хорионический гонадотропин человека, b-субъединица (b-ХГЧ).
АФП представляет собой гликопротеин с молекулярной массой 70 кД. Он является физиологическим продуктом желточного мешка, печени и желудочно-кишечного тракта плода. Повышенный уровень сывороточного АФП у пациентов с герминогенными опухолями яичка был впервые обнаружен Абелевым в 1997 г. В герминогенных опухолях АФП продуцируется элементами эндодермального синуса (желточного мешка). У детей старше года, как и у взрослых, сывороточный АФП имеет верхнюю границу нормы 15 нг/мл (~10kE/л). Его концентрация может быть повышенной при доброкачественных заболеваниях печени и некоторых злокачественных новообразованиях. Наиболее часто повышенные уровни наблюдаются при герминогенных опухолях и гепатоклеточной карциноме, но иногда также — при раке желудка, кишечника, желчного пузыря, поджелудочной железы и лёгких (приблизительно у 20% пациентов). Полупериод жизни сывороточного АФП после орхэктомии составляет 4-5 дней.
Он является физиологическим продуктом желточного мешка, печени и желудочно-кишечного тракта плода. Повышенный уровень сывороточного АФП у пациентов с герминогенными опухолями яичка был впервые обнаружен Абелевым в 1997 г. В герминогенных опухолях АФП продуцируется элементами эндодермального синуса (желточного мешка). У детей старше года, как и у взрослых, сывороточный АФП имеет верхнюю границу нормы 15 нг/мл (~10kE/л). Его концентрация может быть повышенной при доброкачественных заболеваниях печени и некоторых злокачественных новообразованиях. Наиболее часто повышенные уровни наблюдаются при герминогенных опухолях и гепатоклеточной карциноме, но иногда также — при раке желудка, кишечника, желчного пузыря, поджелудочной железы и лёгких (приблизительно у 20% пациентов). Полупериод жизни сывороточного АФП после орхэктомии составляет 4-5 дней.
ХГЧ относится к гликопротеиновым гормонам, м.м. 46 kД. Он состоит из двух нековалентно связанных субъединиц — a и b, из которых последняя определяет его уникальные иммунологические свойства. Физиологически ХГЧ продуцируется в синцитиотрофобластах плаценты. В герминомах он образуется трофобластическими структурами или синцитиотрофобластическими гигантскими клетками. Концентрация сывороточного ХГЧ находится в прямой зависимости от массы опухоли и может достигать нескольких миллионов E/л при распространённом заболевании. Подсчитано, что концентрация 1 Е/л соответствует приблизительно 10000 опухолевых клеток. Некоторые нетрофобластические опухоли также синтезируют ХГЧ. Очень высокие концентрации сывороточного ХГЧ наблюдаются при пузырных заносах («молярная» беременность) и хорионкарциномах (97%). Уровни сывороточного ХГЧ могут быть повышенными при аденокарциномах поджелудочной железы и островково-клеточных опухолях, опухолях толстой и тонкой кишки, печени, желудка, лёгких, яичника, молочной железы и почек. При использовании ХГЧ в качестве опухолевого маркёра весьма желательно определение его свободной b-субъединицы (b-ХГЧ), поскольку большинство герминогенных опухолей способны продуцировать лишь b-ХГЧ.
Физиологически ХГЧ продуцируется в синцитиотрофобластах плаценты. В герминомах он образуется трофобластическими структурами или синцитиотрофобластическими гигантскими клетками. Концентрация сывороточного ХГЧ находится в прямой зависимости от массы опухоли и может достигать нескольких миллионов E/л при распространённом заболевании. Подсчитано, что концентрация 1 Е/л соответствует приблизительно 10000 опухолевых клеток. Некоторые нетрофобластические опухоли также синтезируют ХГЧ. Очень высокие концентрации сывороточного ХГЧ наблюдаются при пузырных заносах («молярная» беременность) и хорионкарциномах (97%). Уровни сывороточного ХГЧ могут быть повышенными при аденокарциномах поджелудочной железы и островково-клеточных опухолях, опухолях толстой и тонкой кишки, печени, желудка, лёгких, яичника, молочной железы и почек. При использовании ХГЧ в качестве опухолевого маркёра весьма желательно определение его свободной b-субъединицы (b-ХГЧ), поскольку большинство герминогенных опухолей способны продуцировать лишь b-ХГЧ.
В клинической практике эти маркёры используются для диагностики, мониторинга и прогноза герминогенных опухолей яичка.
Роль АФП и b-ХГЧ в диагностике.
Скрининг на наличие герминогенных опухолей по биохимическим тестам в общей популяции проводить не рекомендуется. При клиническом подозрении герминогенной опухоли (основанном на данных пальпации и УЗИ яичка) определение опухолевых маркёров может быть иногда полезным в дифференциальной диагностике злокачественной опухоли и эпидидимитов у пациентов с безболезненным опуханием одного из яичек. Использование маркёров в дополнение к рентгенологическому и ультразвуковому исследованию брюшной полости повышает диагностическую чувствительность в отношении как гонадных, так и внегонадных (медиастинальных, забрюшинных, центральной нервной системы) герминогенных опухолей.
Связь маркёров с патологией. Проблема диагностики рака яичка состояла, прежде всего, в дифференциации семиномных и несеминомных герминогенных опухолей. В настоящее время эта проблема в большой мере решена благодаря использованию АФП и b-ХГЧ. (таблица 1).
Таблица 1.
Наличие АФП и b-ХГЧ в сыворотке в зависимости от гистологического строения опухоли.
| Гистологическое строение опухоли | АФП | b-ХГЧ |
| Семинома чистого типа | — | - |
| Эмбриональный рак чистого типа | — | - |
| Тератомы незрелые | — | - |
| Тератокарциномы | + | + |
| Опухоли желточного мешка (из эндодермального синуса) | + | - |
| Желточный мешок + другие | + | +/- |
| Хорионкарциномы | — | + |
| Хорионкарциномы + другие | +/- | + |
| Низкодифференцированный рак | +/- | +/- |
Как можно видеть из представленных данных, все больные с герминогенными опухолями яичка в зависимости от наличия маркёров могут быть разделены на две группы.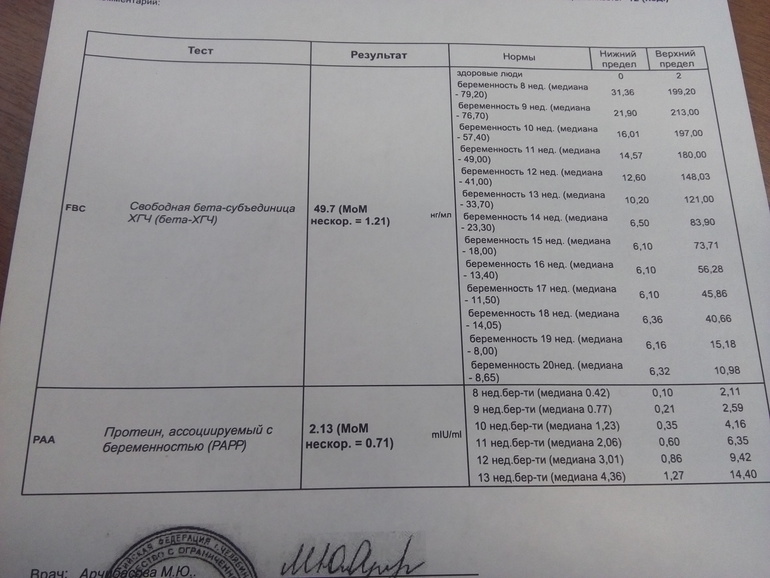
Таблица 2
Частота герминогенных опухолей яичка с АФП>10kE/л, b-ХГЧ>5E/л.
| Гистологическое строение | АФП+ | ХГЧ+ |
| Несеминомные опухоли | ||
|---|---|---|
| Низко- и средне-дифференцированная злокачественная тератома | 70-72% | 55-60% |
| Зрелая тератома | 0% | 0% |
| Желточный мешок | 64% | 0% |
| Трофобластическая дифференцировка | 0% | 100% |
| Смешанные опухоли | 50-80% | 50-60% |
| Все | 60-80% | |
| Семинома | ||
| Семинома | 0% | 15-20% |
Поскольку подходы к лечению семиномных и несеминомных герминогенных опухолей различаются, определение АФП и b-ХГЧ имеет очень важное практическое значение, и часто эти маркёры оказываются более информативными, чем патоморфологическое заключение.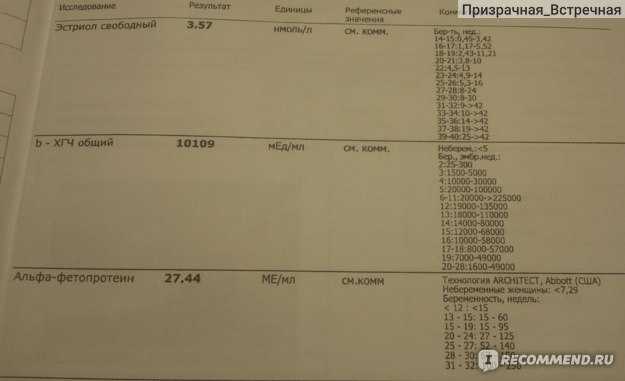 Так, по совокупным литературным данным, высокие уровни ХГЧ позволяют распознать трофобластические структуры, нераспознанные в рутинном патогистологическом рапорте, примерно в 10% семином и приблизительно в 30% несеминомных герминогенных опухолей. Практически не вызывает сомнения, что, если у пациентов с семиномой уровень ХГЧ повышен, то в опухоли имеют место быть несеминомные элементы, которые влияют на эффективность лечения и выживаемость.
Так, по совокупным литературным данным, высокие уровни ХГЧ позволяют распознать трофобластические структуры, нераспознанные в рутинном патогистологическом рапорте, примерно в 10% семином и приблизительно в 30% несеминомных герминогенных опухолей. Практически не вызывает сомнения, что, если у пациентов с семиномой уровень ХГЧ повышен, то в опухоли имеют место быть несеминомные элементы, которые влияют на эффективность лечения и выживаемость.
Использование маркёров для стадирования. При клинической стадии I показано оперативное лечение. Второе определение маркёров проводят через 5-6 дней после операции, чтобы вычислить полупериод жизни соответствующего маркёра. Таким образом, установленная клинически стадия заболевания может быть подтверждена ретроспективно, если концентрация маркёра снижается в соответствии с полупериодом его жизни. До 1997 г. клиническое и патологическое стадирование герминогенных опухолей основывалось только на распространённости заболевания в соответствии с системой ТNM.
Роль маркёров в лечении и наблюдении за больными.
Рациональное использование маркёров находится в соответствии со стадией заболевания.
Стадии 1А и 1В. После проведения паховой орхэктомии более предпочтительным, чем диссекция забрюшинных лимфоузлов, является наблюдение за больным. Наряду с клиническим обследованием и рентгенологическим исследованием органов грудной клетки должно проводиться рутинное определение опухолевых маркёров: ежемесячно в течение первого года после орхэктомии, а затем каждые 6 месяцев во второй и третий годы. Если после орхэктомии уровни АФП и b-ХГЧ остаются повышенными, и полупериод жизни маркёров увеличен, то, несмотря на то, что, по данным компьютерной томографии, остаточная опухоль не обнаруживается, существует высокая вероятность отдалённых метастазов; при этом системная химиотерапия будет предпочтительнее по сравнению с диссекцией забрюшинных лимфоузлов.
После проведения паховой орхэктомии более предпочтительным, чем диссекция забрюшинных лимфоузлов, является наблюдение за больным. Наряду с клиническим обследованием и рентгенологическим исследованием органов грудной клетки должно проводиться рутинное определение опухолевых маркёров: ежемесячно в течение первого года после орхэктомии, а затем каждые 6 месяцев во второй и третий годы. Если после орхэктомии уровни АФП и b-ХГЧ остаются повышенными, и полупериод жизни маркёров увеличен, то, несмотря на то, что, по данным компьютерной томографии, остаточная опухоль не обнаруживается, существует высокая вероятность отдалённых метастазов; при этом системная химиотерапия будет предпочтительнее по сравнению с диссекцией забрюшинных лимфоузлов.
Стадия II. После удаления забрюшинных лимфоузлов и либо а) проведения 3-4 циклов химиотерапии, либо б) проведения 2-х циклов адъювантной химиотерапии непосредственно после диссекции — в обоих этих случаях мониторинг больных должен включать, наряду с физикальным и рентгенологическим обследованием, определение опухолевых маркёров: ежемесячно в течение первого года, каждые 3 месяца на протяжении второго года и 1 раз в 6 месяцев на протяжении 3-го года.
Распространённые стадии II и III. Скорость снижения опухолевых маркёров после химиотерапии прогнозирует ответ на лечение. Устойчивое повышение уровня маркёра или удлинение полупериода его жизни в первые 6 недель после специфической химиотерапии указывают на резистентность опухоли и плохой прогноз. Пациенты с остаточной опухолевой массой после проведения химиотерапии могут быть подвергнуты оперативному лечению. Однако, в тех случаях, когда уровни маркёров устойчиво повышаются, пациенты чаще всего оказываются иноперабельными, и вместо операции им показана химиотерапия.
Несеминомные герминогенные опухоли содержат различные типы клеток. Помимо этого, опухоль, которая синтезировала оба маркёра, в ходе лечения может переключиться на продукцию лишь одного из них. Случается, что безмаркёрная до лечения опухоль при рецидиве начинает продуцировать один или оба маркёра в больших количествах. Поэтому необходимо вести мониторинг с использованием обоих маркёров — как АФП, так и b-ХГЧ. Следует также учитывать, что в опухолях со смешанным типом клеток снижение концентрации АФП и b- ХГЧ после резекции отражает соответствующее уменьшение опухолевой массы, в то время как снижение уровней маркёров после химиотерапии отражает лишь поведение маркёр-положительного типа клеток.
Следует также учитывать, что в опухолях со смешанным типом клеток снижение концентрации АФП и b- ХГЧ после резекции отражает соответствующее уменьшение опухолевой массы, в то время как снижение уровней маркёров после химиотерапии отражает лишь поведение маркёр-положительного типа клеток.
После полного удаления опухоли уровни маркёров должны снижаться до нормальных значений в соответствии с их полупериодами жизни: для АФП <5 дней, для ХГЧ — 1- 2 дня. При стадии I в случае несеминомных опухолей рецидив после операции наблюдается с частотой примерно 30%; поэтому требуется тщательное наблюдение за пациентом. При наблюдении, если маркёры в норме, заболевание отсутствует. Если же наблюдается выход клиренса маркёров на плато или его замедление, то это свидетельствует об остаточной активной болезни. Устойчивое повышение уровней АФП и ХГЧ после орхэктомии показывает, что опухоль не ограничена яичком, и необходимо проведение первой линии химиотерапии. Общепризнанно, что повышенные концентрации опухолевых маркёров несовместимы с ремиссией и свидетельствуют о прогрессировании заболевания задолго до клинического диагностирования рецидива (за 1-6 месяцев). «Положительные» маркёры или нарастание маркёров даже в отсутствии клинических или радиологических находок подразумевают активную болезнь. Повышение маркёров является основанием для начала лечения. При мониторинге больных повышение АФП и /или ХГЧ является первым индикатором рецидива приблизительно в 50% случаев. Параллельное определение АФП (верхняя граница нормы 10 кЕ/л) и ХГЧ (верхняя граница нормы 5 Е/л) даёт диагностическую чувствительность в отношении рецидива 86% при специфичности 100%; положительное прогностическое значение 100%.
«Положительные» маркёры или нарастание маркёров даже в отсутствии клинических или радиологических находок подразумевают активную болезнь. Повышение маркёров является основанием для начала лечения. При мониторинге больных повышение АФП и /или ХГЧ является первым индикатором рецидива приблизительно в 50% случаев. Параллельное определение АФП (верхняя граница нормы 10 кЕ/л) и ХГЧ (верхняя граница нормы 5 Е/л) даёт диагностическую чувствительность в отношении рецидива 86% при специфичности 100%; положительное прогностическое значение 100%.
Однако, уровни маркёров, находящиеся в пределах нормальных значений, не всегда исключают прогрессирование. Рецидивная опухоль может приобретать другие биологические особенности, поэтому первоначально маркёр-положительная опухоль может становиться маркёр-отрицательной. При очень небольшом объёме опухоли, микрометастазе или зрелой тератоме также могут быть получены ложноотрицательные результаты. Неадекватное поведение (снижение уровня опухолевых маркёров при увеличении опухолевой массы) объясняется селективным разрушением маркёр-продуцирующих клеток под воздействием химиотерапии. Отрицательное прогностическое значение составляет 87%.
Отрицательное прогностическое значение составляет 87%.
Наблюдаются также и ложно-положительные результаты маркёров. Чаще всего они связаны с лизисом опухолевых клеток в ответ на интенсивную терапию и носят транзиторный характер. Повышение уровня АФП может иметь место также при печёночной недостаточности.
Роль маркёров в прогнозе.
Находки в забрюшинных лимфоузлах означают плохой прогноз, включающий метастазы в печень, кости и мозг, АФП > 1000 кЕ/л, ХГЧ >10000 МЕ/л, опухолевые массы в средостении более 5 см в диаметре и 20 и более метастатических узлов в лёгких. IGCTCG предлагает использовать систему стадирования для метастатических герминогенных опухолей (как семиномных, так и несеминомных), основанную на факторах прогноза. Это позволяет подразделить опухоли на 3 группы — с хорошим, средним и плохим прогнозом — в зависимости от концентрации опухолевых маркёров, как показано в табл.3.
Таблица 3.
Вклад опухолевых маркёров в классификацию прогноза метастатических герминогенных опухолей
| Концентрация опухолевых маркёров | |||
| Группа прогноза1 | АФП (кЕ/л) ХГЧ (Е/л) ЛДГ (х RR)2 | ||
| Хороший (S1) | |||
| Cредний (S2) | От 1 000 до 10 000 От 5 000 до 50 000 От 1. 5x(RR) до 10x (RR) 5x(RR) до 10x (RR) |
||
| Плохой (S3) | >10 000 >50 000 >10 x (RR) | ||
1) — S, сывороточный уровень маркёра
2) — концентрация ЛДГ выражена как произведение соответствующего значения на верхний предел референс-границы (RR- Reference Range).
Предлагаемая система учитывает также расположение опухоли (яичко, забрюшинная область, средостение) и наличие или отсутствие внелёгочных висцеральных метастазов. Для этих трёх прогностических групп частота безрецидивного периода и средней выживаемости составляет, соответственно: для S1 — 89% и 92%, для S2 — 75% и 80%, для S3 — 41% и 48%.
При лечебном мониторинге рекомендуется определять полупериод жизни АФП и ХГЧ; нормализация обоих маркёров (АФП за 5 дней, ХГЧ за 1-2 дня) предполагает благоприятный прогноз. У пациентов с полупериодом жизни АФП более 7 дней и/или ХГЧ более 3 дней частота выживаемости значительно ниже. Система прогноза распространённых герминогенных опухолей была значительно улучшена за счёт использования разработанных в Великобритании United Kingdom Medical Research Council — MRC — комбинированных прогностических критериев, включающих анализ полупериода жизни маркёров (табл.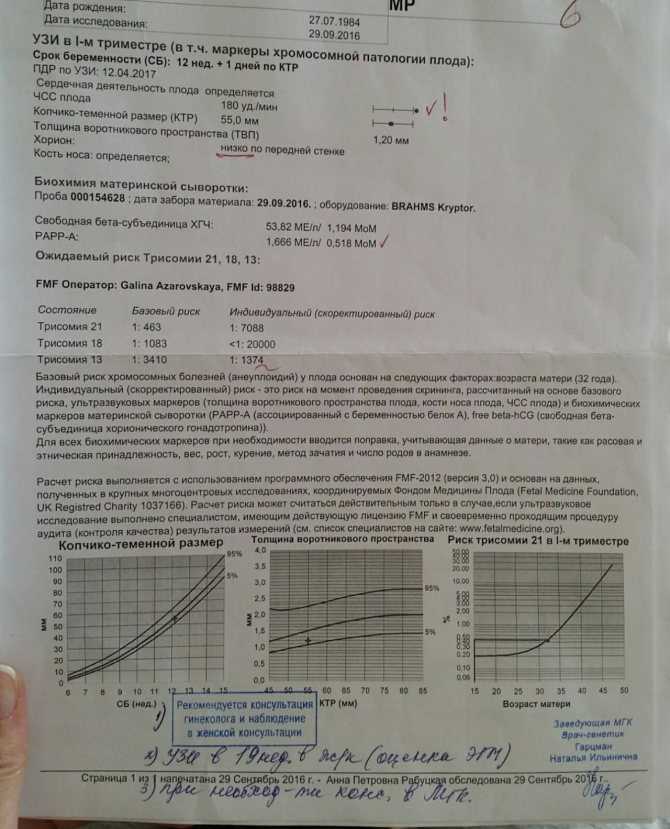 4). На основании этого пациенты также подразделяются на 3 группы риска.
4). На основании этого пациенты также подразделяются на 3 группы риска.
Таблица 4.
Прогностическая классификация для метастазирующих герминогенных опухолей, основанная на прогностических критериях UK MRC и измерении опухолевых маркёров.
| Классификация на основе | 10-летняя выживаемость | ||
| Группа прогноза | Прогностические критерии UK MRC | Полупериод жизни маркёров | |
| Хороший | Good risk | Нормальный («good») | 96% |
| Средний | Good risk | Нормальный полупериод жизни («good») | 64% |
| Poor risk | Увеличенный полупериод жизни («bad») | ||
| Плохой | Poor risk | Увеличенный («bad») | 28% |
Итак, герминогенные опухоли являются уникальным примером интеграции опухолевых маркёров в диагностику, стадирование и мониторинг терапии. При дифференциальной диагностике чистых семином и опухолей с трофобластическими элементами повышенные уровни ХГЧ более доказательны, чем гистологическое заключение, что имеет значение для выбора терапии. Помимо этого, определение опухолевых маркёров позволяет более аккуратно поставить стадию заболевания. Кинетика маркёров на протяжении первых 6 недель химиотерапии обеспечивает важную прогностическую информацию. У пациентов в ремиссии повышение уровней АФП и ХГЧ может прогнозировать рецидив за несколько месяцев до его клинического диагностирования. Определение маркёров показано при оценке ответа на терапию, а их нормализация является предпосылкой для успешной операции после воздействия химиотерапии.
При дифференциальной диагностике чистых семином и опухолей с трофобластическими элементами повышенные уровни ХГЧ более доказательны, чем гистологическое заключение, что имеет значение для выбора терапии. Помимо этого, определение опухолевых маркёров позволяет более аккуратно поставить стадию заболевания. Кинетика маркёров на протяжении первых 6 недель химиотерапии обеспечивает важную прогностическую информацию. У пациентов в ремиссии повышение уровней АФП и ХГЧ может прогнозировать рецидив за несколько месяцев до его клинического диагностирования. Определение маркёров показано при оценке ответа на терапию, а их нормализация является предпосылкой для успешной операции после воздействия химиотерапии.
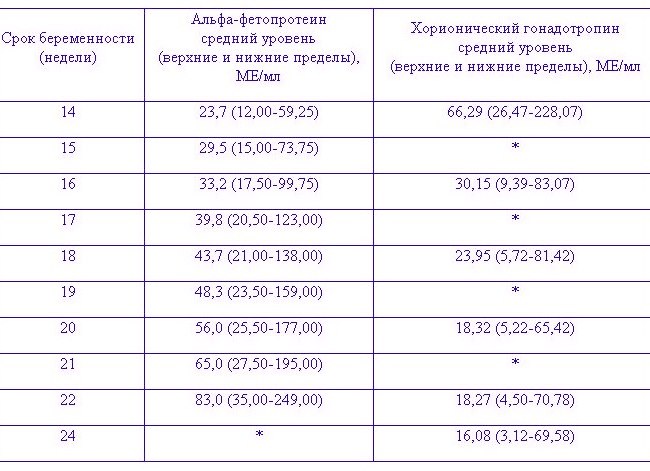
Пренатальный скрининг
А я читала, что в тройном тесте могут быть и + и — ошибки!
Достоверность тройного теста по разным институтам достигает 87% . Это достаточно эффективный метод неинвазивной пренатальной диагностики, позволяющий определить группу высокого риска по хромосомным аномалиям, которым будет рекомендовано проведение инвазивной пренатальной диагностики.
Большое спасибо за такой замечательный сайт!!!
Не могли бы Вы прокомментироать результат тройного теста, который я сдала на 18 неделе беременности: АФП 43,3 Ед/мл, Бета-ХГЧ 57575 мЕд/мл, Эстриол свободный 19,6 нмоль/л.
Здравствуйте. Спасибо за теплые слова.
Прокоментировать результат тройного теста сложно. Судя по всему тройной тест в норме, но, к сожалению, Вы не указываете нормы лаборатории, проводившей исследование (т.к в разных лабораториях для оценки одного и того же показателя могут быть использованы различные тест-системы).
В 16,7 сдала тест на АФП: 50,14 Ме/мл и 1,28 МоМ при норме 0,6-3,0 МоМ. С моим малышом значит все нормально Прокомментируйте значения в Ме/мл.
Оценка АФП во время беременности осуществляется не в абсолютных значениях, а относительно медиан (средних значений , соответствующих данному сроку беременности). В Вашем случае уровень АФП находится в пределах нормы.
Но я бы рекомендовала проводить обследование на маркеры патологии беременности полноценно, а именно совместно с ХГЧ, нЕ3 (тройной тест), только в этом случае возможно исключить (совместно с УЗИ плода в 11-13 недель) на 87% хромосомную патологию у плода, пороки развития ЦНС.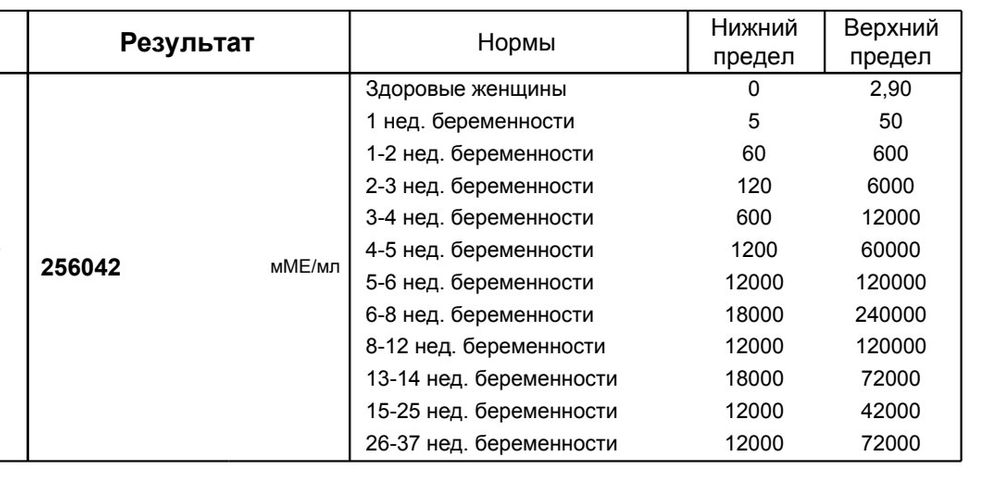
Здравствуйте! Подскажите , пожалуйста, как быть! В 17 нед беременности сделала в ЖК анализ на АФП и на ХГЧ — все в норме, В 19 недель сделала еще раз, но уже в другом учреждении и В-ХГ при норме от 10000 до 35000 у меня 7582. Врач говорит: «У Вас все хорошо, не беспокойся, маленькая фетоплацентарная недостаточность (диагноз только по результатам В-ХГ), но лучше сделать 3 капельницы иммуноглобулина нормального человеческого и сдать анализ на в-хг еще раз. Результаты анализов долго не забирала, так как хорошие результаты были на 16 нед и в 21 неделю сделал УЗИ — все хорошо (и малыш и плацента). Возникло много вопросов:
1. Как влияет иммуноглобулин на плод?
2. Может ли возникнуть аллергия у меня?
3. Если я, например, сделаю капельницы, то анализ на в-хг буду сдавать на 23нед. Информативен ли будет этот анализ?
4. Как можно еще определить фетоплацентарн. недост-ть, как ее отслеживать?
5. Как Вы отнесетесь к такому моему решению:завтра 1-й день 23нед, я делаю анализ,послезавтра забираю, если что-то не так, я иду к врачу в жк, и она мне назначает как всем беременным лекарства для улучшения кровообращения мать-плод мне почему-то страшно делать эти капельницы.
Добрый день.
Гормоны беременности в разные сроки имеют различную диагностическую ценность. В период 16-18 недель (тройной тест) уровни гормонов и их взаимное отношение с учетом возраста, региона проживания и конституциональных особенностей позволяет их использовать в качестве маркеров хромосомных аномалий плода. В не скрининговые сроки изменение уровня гормонов свидетельствует о патологическом течении беременности ( дисфункция фетоплацентарного комплекса, угроза прерывания беременности, врожденные пороки развития плода и т.д.). Причем изменения гормонов беременности предшествуют клиническим проявлениям за 2 -4 недели , что позволяет провести раннюю коррекцию. В 16-18 недель плацента заканчивает формирование и полностью берет на себя функции по жизнеобеспечению, росту плода, поэтому сбои в этот период наиболее часты. Введение иммуноглобулина позволит исключить отрицательную стимуляцию иммунной системы матери на фетоплацентарный комплекс. Иммуноглобулин белковый препарат, на введение которого возможно развитие аллергической реакции (как и на любой другой лекарственный препарат). Введение иммуноглобулина не повлияет на информативность уровня В-субъединицы ХГЧ в крови. Диагностика фетоплацентарной недостаточности возможна по данным клинического обследования, изменению гормонов беременности, по УЗИ, доплерометрии, пренатальный скрининг) на дефекты нервной трубки и хромосомные заболевания плода. Рекомендуется делать в 16-20 недель беременности. При УЗИ во II триместре (20 недель) также можно диагностировать дефекты нервной трубки и признаки хромосомных аномалий плода.
Введение иммуноглобулина не повлияет на информативность уровня В-субъединицы ХГЧ в крови. Диагностика фетоплацентарной недостаточности возможна по данным клинического обследования, изменению гормонов беременности, по УЗИ, доплерометрии, пренатальный скрининг) на дефекты нервной трубки и хромосомные заболевания плода. Рекомендуется делать в 16-20 недель беременности. При УЗИ во II триместре (20 недель) также можно диагностировать дефекты нервной трубки и признаки хромосомных аномалий плода.
Беленко Н.В., акушер-гинеколог ЦИР.
Сдавала на 15-16 неделе тройной тест. Показатели теста — в пределах нормы. Сейчас нам уже 25 недель, но мне все не давет покоя то, что кровь для анализа брали НЕ НА ГОЛОДНЫЙ ЖЕЛУДОК. Я предупредила сестру о легком завтраке, но та сказала, что это не отразится на результатх. Так ли это? Сдают ли кровь из вены — не на голодный желудок?
Общепринятым считается сдавать анализы из вены на голодный желудок, однако на результаты тройного теста это не оказывает существенного влияния, показатели тройного теста (ХГ, свободный эстриол и альфафетопротеин) говорят о гормональной функции плаценты и рисках развития патологии плода. Если все показатели были в норме и результаты УЗИ и других анализов также хорошими, повода для беспокойства быть не должно.
Если все показатели были в норме и результаты УЗИ и других анализов также хорошими, повода для беспокойства быть не должно.
Хочу узнать Ваше мнение по информативности тройного теста, если он был сделан следующим образом. Кровь взяли в ЖК, а на сам анализ отправили в областной центр. Разница в заборе крови и когда сам анализ проводился, составил две недели . Читала на вашем сайте, что большое значение имеет возраст и вес беременной, так вот дата рождения стояла в направлении, а вес никто не указывал. Собственно вопрос, насколько получится достоверный анализ, на Ваш взгляд, учитывая, что кровь хранилась в ЖК и анализ не проводился сразу (читала, что должно пройти не больше суток, так ли?) и что нет ссылки на вес. Может быть, стоит пересдать в платном центре?
Если были соблюдены условия хранения и транспортировки крови, то временной промежуток между забором крови и исследованием на качество анализа не повлияет.
Возраст, срок беременности, вес — имеют значение уже на этапе интерпретации полученных результатов.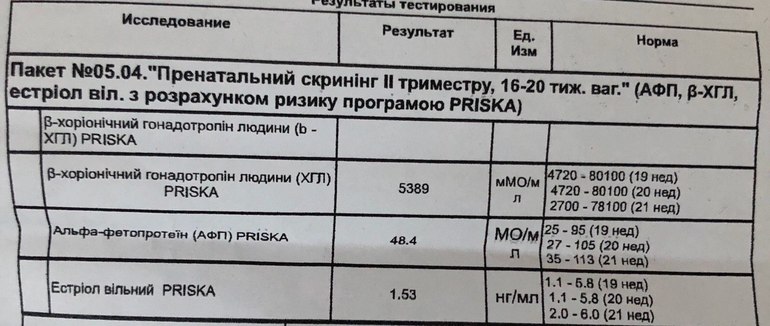
Но если есть возможность повторить тройной тест — это стоит сделать, т.к. повысит точность диагностики.
Что за функция у альфафетопротеинов? Что может вызвать повышение его уровня?
АФП — белок, синтезируемый клетками печени плода. Во время беременности определение АФП используется для оценки течения беременности и исключения риска рождения ребенка с пороками развития.
Вне беременности определение АФП используется для диагностики ряда опухолей (например, печени, у мужчин — яичек).
Что означает такой показатель, как Ulm Index (0,3) и отдельных это значений (AFP 71.9%, HGC 18.4%, uE3 9.7%)? Какой смысл этого индекса и что значат эти процентные соотношения. Интересен именно смысл этого показателя, так как то, что он в норме, видно из диаграммы. И почему критическое значение этого показателя 8,1 — как оно получается?
Все компьютерные программы для оценки результатов тройного теста основаны на данных статистики.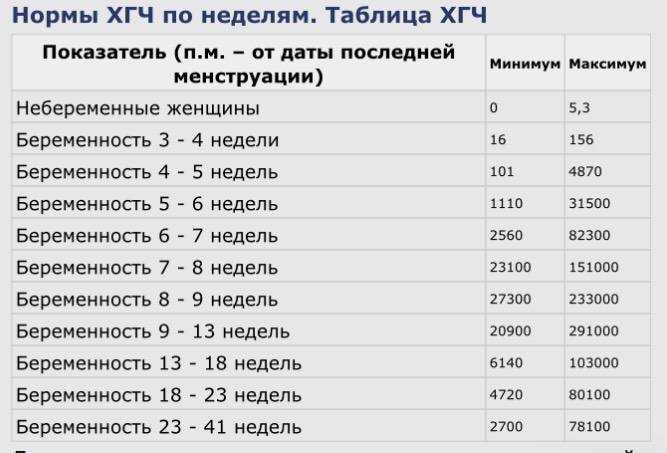 И нормы или пограничные (критические) величины также получены в результате статистических исследований.
И нормы или пограничные (критические) величины также получены в результате статистических исследований.
Ульмский индекс — рассчет риска синдрома Дауна независимо от возраста. % АФП, ХГЧ и эстриола показывают вклад каждого из показателей в значение Ulm Index. Анализ процетного соотношения имеет важное значение, если ульмский индекс превышает норму. Для веса допустима погрешность 1-2 кг.
С уважением, Охтырская Т.А.
Я делала УЗИ в крупном диагностическом центре на сроке беременности 22,5 недели. И врач сказала мне, что ей важно рассмотреть профиль малыша, а мой ребеночек все время отворачивался. Все остальные параметры врач увидела и сказала что все в норме. Она мне велела походить и снова посмотрела и написала: длина костной части спинки носа 8мм, она сказала все хорошо. Я ей задала вопрос, почему этот показатель так важен, она мне ответила что по последним данным это является одним из хромосомных маркеров. Не могли бы вы мне пояснить каких именно. И есть ли еще какие-то маркеры, выявляемые на УЗИ?
Заключение о хромосомной патологии, пороках развития плода делают на основании совокупности всех данных УЗИ.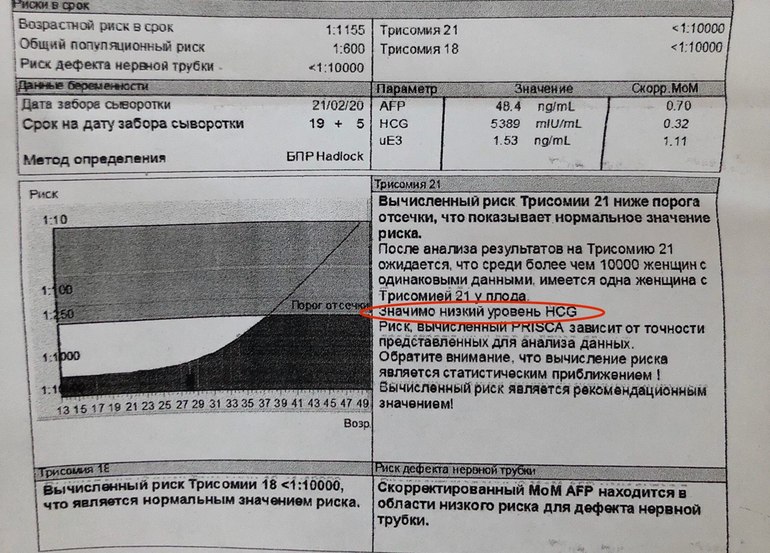
В настоящее время известно очень много аномалий развития плода и соответственно значительное число их ультразвуковых маркеров (ультразвуковых признаков). И перечислить их всех в рамках форума нереально. Например, одним из наиболее известных и ранних маркеров является ширина воротниковой зоны, определяемая на сроке 11-12 недель. Расширение воротникового пространства до 7 мм практически в 100% наблюдений — синдром Дауна. На разных сроках беременности существует возможности выявления разных маркеров. С увеличением срока беременности информативность и точность диагностики повышается. Срок 21-23 недели наиболее оптимальный для пренатальной диагностики. Т.к. к этому сроку сформированы все органы плода и с вероятностью 98-100% можно исключить пороки развития.
Исследование профиля лица плода позволяет исключить пороки черепа и нервной системы и является обязательным этапом УЗ-исследования.
На сроке 22-23 недели длина костной части спинки носа в норме 7-9 мм.
Помимо данного измерения обязательно обращают внимание на форму носа, лба, верхней и нижней челюсти и т.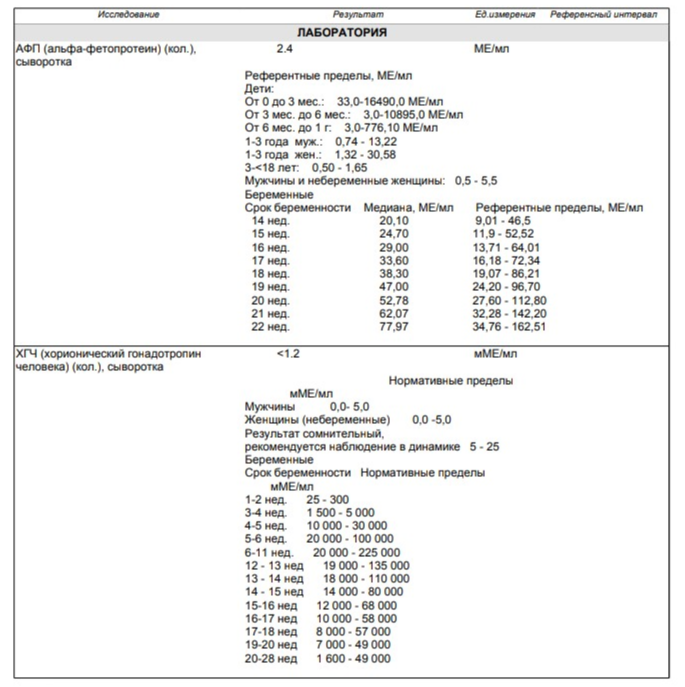 д. Например, наличие вдавления в области переносицы (в сочетании с рядом других признаков) может указывать на аномалии костной системы. Недоразвитие носа — ряд пороков головного мозга, и лицевой части черепа. При синдроме Дауна также наблюдаются изменения в строении лица плода.
д. Например, наличие вдавления в области переносицы (в сочетании с рядом других признаков) может указывать на аномалии костной системы. Недоразвитие носа — ряд пороков головного мозга, и лицевой части черепа. При синдроме Дауна также наблюдаются изменения в строении лица плода.
Онкомаркеры: альфа-фетопротеин (АФП) и хорионический гонадотропин человека (ХГЧ)
Автор: Ян Чжан // Дата: 13 марта 2013 г. // Источник: Совет стажеров на английском языке
Темы:
- Аналиты,
- Онкомаркеры
СЛАЙДЫ
Загрузить слайды (pdf)
СТЕНОК
Скачать стенограмму (pdf)
Слайд 1: Введение
Здравствуйте, меня зовут доктор Ян Чжан. Я доцент кафедры патологии и лабораторной медицины в Медицинском центре Университета Рочестера и заместитель директора лабораторий клинической химии и токсикологии в Мемориальной больнице Стронг. Добро пожаловать в эту жемчужину лабораторной медицины на «Опухолевые маркеры: альфа-фетопротеин (АФП) и хорионический гонадотропин человека (ХГЧ)».
Я доцент кафедры патологии и лабораторной медицины в Медицинском центре Университета Рочестера и заместитель директора лабораторий клинической химии и токсикологии в Мемориальной больнице Стронг. Добро пожаловать в эту жемчужину лабораторной медицины на «Опухолевые маркеры: альфа-фетопротеин (АФП) и хорионический гонадотропин человека (ХГЧ)».
Слайд 2: Альфа-фетопротеин (АФП)
Альфа-фетопротеин или АФП является основным белком в кровотоке плода и тесно связан с альбумином как генетически, так и структурно. Это один из онкофетальных антигенов, продуцируемых во время внутриутробного развития и имеющий высокую концентрацию в сыворотке плода. Эта концентрация снижается до низкого уровня или становится неопределяемой после рождения, хотя она может увеличиваться при некоторых злокачественных новообразованиях, таких как гепатоцеллюлярная карцинома.
АФП представляет собой одноцепочечный гликопротеин с молекулярной массой около 70 кДа и содержанием углеводов 4%.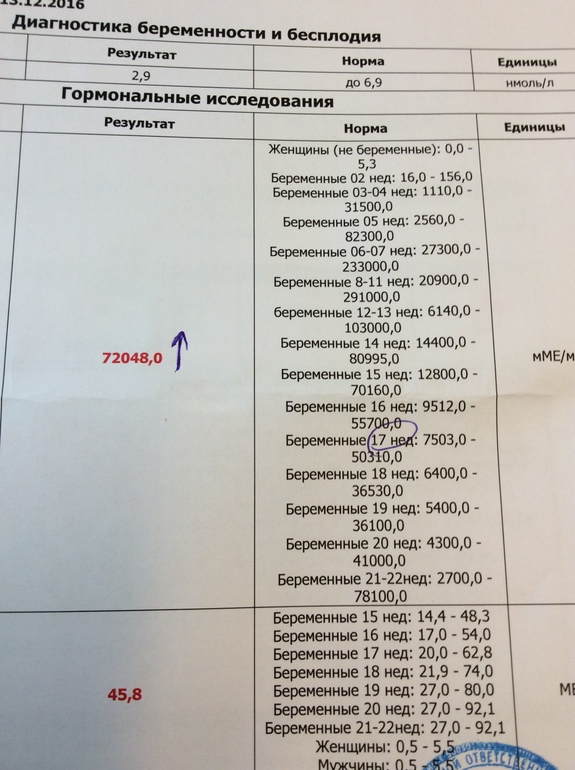 Однако АФП, полученный из опухолевых клеток, имеет различные углеводные композиции в зависимости от активности сахаридтрансферазы в опухолевых клетках.
Однако АФП, полученный из опухолевых клеток, имеет различные углеводные композиции в зависимости от активности сахаридтрансферазы в опухолевых клетках.
Слайд 3: Хорионический гонадотропин человека (ХГЧ)
Хорионический гонадотропин человека (ХГЧ) также является гликопротеином, секретируемым синцитиотрофобластическими клетками нормальной плаценты. Его концентрация сильно повышается во время беременности. Для получения подробной информации о его специфической функции во время беременности, пожалуйста, обратитесь к «Жемчужине лабораторной медицины о ХГЧ» доктора Дэвида 9.0029 Гренаш. Эта сессия будет посвящена функциям ХГЧ как онкомаркера.
Слайд 4: АФП и ХГЧ как опухолевые маркеры
На этом слайде кратко показано, как АФП и ХГЧ функционируют как опухолевые маркеры. АФП и ХГЧ обычно используются в качестве маркеров гепатоцеллюлярной карциномы и трофобластической болезни соответственно. Кроме того, АФП и ХГЧ используются вместе в качестве маркеров герминогенной карциномы. На следующих нескольких слайдах мы рассмотрим их функции при этих различных типах опухолей.
На следующих нескольких слайдах мы рассмотрим их функции при этих различных типах опухолей.
Слайд 5: АФП при гепатоцеллюлярной карциноме
АФП часто повышается при раке, особенно при уровне АФП > 1000 мкг/л, при котором можно обнаружить около 50% гепатоцеллюлярной карциномы (ГЦК). Еще 50% пациентов с ГЦК имеют нормальные или более низкие концентрации АФП. Как правило, уровень АФП > 500 мкг/л является пороговым значением, которое указывает на необходимость биопсии. Концентрация АФП в сыворотке слабо связана с размером опухолей ГЦР. Для выявления ранних стадий или небольших опухолей размером менее 5 см пороговое значение АФП обычно устанавливают на уровне 10–20 мкг/л.
Не проводилось рандомизированных клинических испытаний, показывающих снижение риска смертности при использовании АФП в качестве инструмента скрининга ГЦК. Однако ретроспективные исследования, проведенные в Азии, показали улучшение выживаемости при скрининге на АФП. Не рекомендуется для целей клинического скрининга. АФП использовался в качестве диагностического инструмента в районах высокого риска, таких как Китай, Африка, Япония и Аляска, где высока распространенность гепатоцеллюлярной карциномы.
АФП использовался в качестве диагностического инструмента в районах высокого риска, таких как Китай, Африка, Япония и Аляска, где высока распространенность гепатоцеллюлярной карциномы.
Слайд 6: АФП при гепатоцеллюлярной карциноме
АФП также можно использовать для прогноза и мониторинга лечения ГЦК. Было показано, что повышенный уровень АФП > 10 мкг/л и повышенный уровень билирубина в сыворотке > 2 мг/дл связаны с более коротким временем выживания.
Ожидается, что после операции по удалению опухоли концентрация АФП снизится. Стойко высокий уровень АФП после операции может свидетельствовать о неполном удалении опухоли или наличии метастазов. Значительное повышение АФП у пациентов без опухоли после операции также может указывать на метастазирование. В связи с низкой чувствительностью АФП и большим процентом пациентов с ГЦК, у которых нет сильно повышенного АФП, последующие изменения концентрации АФП лучше всего использовать для выявления рецидива у тех, у кого был повышен АФП до лечения.
Слайд 7: Специфичность АФП для ГЦК
Специфичность АФП для ГЦК низкая, что ограничивает использование АФП для общих целей скрининга. Повышенный уровень АФП также наблюдается при доброкачественных заболеваниях печени, таких как гепатит и цирроз, а также при других видах рака, таких как рак желудка, толстой кишки, легких, рак молочной железы и лимфома. Однако концентрации
AFP в этих условиях обычно составляют <200 мкг/л.
Слайд 8: ХГЧ в трофобластных опухолях
Трофобластная опухоль представляет собой пролиферацию клеток, происходящих из плаценты. Трофобластные опухоли могут продуцировать очень повышенные концентрации ХГЧ в сыворотке, которые могут превышать 1 миллион МЕ/л. Концентрация ХГЧ в сыворотке коррелирует с размером опухоли, хотя ХГЧ не является особенно специфичным для трофобластических опухолей. Повышенный ХГЧ также можно наблюдать у 70% пациентов с несеминоматозными герминогенными опухолями яичка, у 45–60% пациентов с раком желчевыводящих путей и поджелудочной железы и у 10–30% рака мочевого пузыря, почек, предстательной железы, печени, колоректального рака, легких, груди, головы и раки шеи. Поэтому ХГЧ не рекомендуется для общего скрининга трофобластических опухолей.
Поэтому ХГЧ не рекомендуется для общего скрининга трофобластических опухолей.
Слайд 9: ХГЧ при трофобластических опухолях
ХГЧ также полезен для определения прогноза трофобластических опухолей. Его концентрация в сыворотке коррелирует с размером опухоли и прогнозом опухоли. В частности, концентрация гипергликозилированной формы может помочь в прогнозировании опухоли. Гипергликозилированная форма также может помочь в раннем выявлении новых или рецидивирующих трофобластических новообразований, а также различить активную трофобластическую неоплазию от покоящейся.
Обратите внимание, что ХГЧ не может проникнуть через гематоэнцефалический барьер. Повышенный уровень ХГЧ в спинномозговой жидкости может указывать на метастазирование в головной мозг.
Слайд 10: ХГЧ при трофобластических опухолях
Наиболее полезной функцией ХГЧ при трофобластических опухолях является мониторинг лечения и прогрессирования заболевания. Во время химиотерапии рекомендуется еженедельно контролировать уровень ХГЧ.
После ремиссии следует ежегодно контролировать уровень ХГЧ для выявления возможного рецидива.
Концентрация ХГЧ коррелирует с объемом и прогрессированием опухоли. Начальная концентрация ХГЧ более 400 000 МЕ/л может указывать на высокий риск неэффективности лечения. Кроме того, медленное снижение ХГЧ после операции может указывать на остаточное заболевание.
Слайд 11: Анализ ХГЧ
Поскольку опухолевые клетки могут секретировать только свободные бета-субъединицы ХГЧ, важно измерять общий бета-ХГЧ при подозрении на наличие опухоли. Также важно, чтобы анализ имел одинаковое молярное распознавание интактных субъединиц ХГЧ и бета-субъединиц ХГЧ, чтобы концентрации интактных или бета-субъединиц не были занижены в образцах. Анализы ХГЧ должны иметь менее 2% перекрестной реактивности с лютеинизирующим гормоном. Хотя это является проблемой для большинства коммерческих анализов, желательно, чтобы анализы ХГЧ достигали предела обнаружения менее 1 МЕ / л для обнаружения опухоли, как это рекомендовано Национальной академией клинической биохимии.
Слайд 12: АФП и ХГЧ для опухолей яичка
АФП и ХГЧ использовались в качестве маркеров классификации и стадирования герминогенных опухолей. На этом занятии опухоли яичек будут использоваться в качестве примера для иллюстрации этих функций, поскольку около 95% случаев рака яичек имеют герминогенное происхождение. Подводя итог, АФП и ХГЧ можно использовать для диагностики, стадирования, стратификации риска и мониторинга ответа на терапию у пациентов с раком яичка.
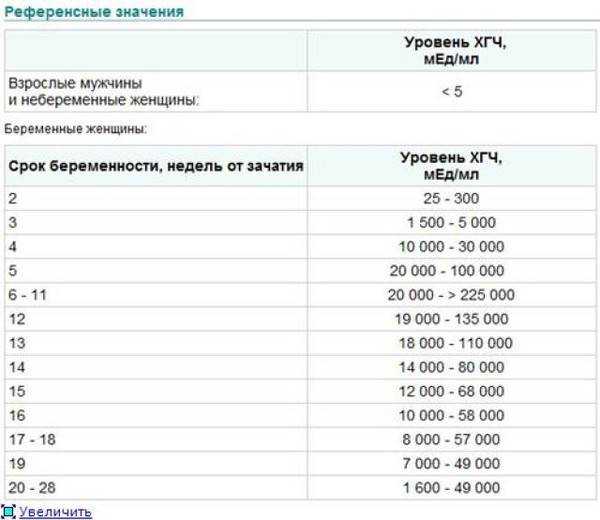
При подозрении на рак яичка перед лечением необходимо измерить АФП и ХГЧ. У пациентов с семиномой уровень ХГЧ обычно < 300 МЕ/л, тогда как при несеминоматозных герминогенных опухолях он составляет > 1000 МЕ/л. Обратите внимание, что если АФП также повышен, опухоли реклассифицируются как несеминоматозные опухоли зародышевых клеток.
Что касается их функции в прогнозе рака яичка, ХГЧ < 5000 МЕ/л и АФП
< 1000 мкг/л предполагают хороший прогноз. Однако сильно повышенные уровни ХГЧ и АФП, когда ХГЧ > 50 000 МЕ/л и АФП > 10 000 мкг/л, указывают на неблагоприятный прогноз. Любые цифры между ними указывают на промежуточный прогноз.
Любые цифры между ними указывают на промежуточный прогноз.
Слайд 13: АФП и ХГЧ при опухолях яичка
Если уровни АФП и/или ХГЧ повышены до терапии, скорость снижения концентрации онкомаркеров отражает реакцию пациента на терапию. Поэтому рекомендуется еженедельный мониторинг уровня АФП и/или ХГЧ после терапии до тех пор, пока уровни не попадут в референсные интервалы. Стойкое повышение опухолевых маркеров после химиотерапии указывает на остаточное заболевание и потенциальную необходимость дальнейшего лечения. Периоды полувыведения также следует определять, когда это возможно, во время курса терапии. При отсутствии остаточной болезни периоды полувыведения ХГЧ и АФП составляют 1,5 дня и 5 дней соответственно. Во время химиотерапии удлиненные периоды полувыведения ХГЧ и АФП, такие как 3,5 дня и 7 дней соответственно, могут указывать на рецидив и неблагоприятный прогноз.
После успешной начальной терапии для наблюдения рекомендуется серийный мониторинг. Рецидив чаще всего возникает в течение первого года и очень редко через два года. Однако у больных через 10 лет после терапии наблюдался рецидив. Частота наблюдения определяется типом опухоли, стадией роста, лечением и вероятностью рецидива. Например, пациенты с несеминоматозными герминогенными опухолями после паховой орхиэктомии должны находиться под наблюдением каждые один-два месяца в течение первых двух лет. Частоту следует постепенно снижать до одного раза в шесть месяцев в течение третьего года, а затем ежегодно, начиная с пятого года.
Однако у больных через 10 лет после терапии наблюдался рецидив. Частота наблюдения определяется типом опухоли, стадией роста, лечением и вероятностью рецидива. Например, пациенты с несеминоматозными герминогенными опухолями после паховой орхиэктомии должны находиться под наблюдением каждые один-два месяца в течение первых двух лет. Частоту следует постепенно снижать до одного раза в шесть месяцев в течение третьего года, а затем ежегодно, начиная с пятого года.
Следует иметь в виду, что лактатдегидрогеназа также использовалась в качестве онкомаркера для рака яичка с функциями, аналогичными АФП и ХГЧ, в диагностике заболеваний, прогнозировании, мониторинге терапии и наблюдении.
Слайд 14: Ссылки
Слайд 15: Раскрытие информации
Слайд 16: Спасибо от www.TraineeCouncil.org
Спасибо, что присоединились ко мне в этой жемчужине лабораторной медицины: «Опухолевые маркеры: альфа-фетопротеин (АФП) и хорионический гонадотропин человека (ХГЧ)». Я Ян Чжан.
Я Ян Чжан.
Диагностическое значение альфа-1-фетопротеина и бета-хорионического гонадотропина человека в грудном и детском возрасте
Обзор
. 2001 янв-февраль;18(1):11-26.
дои: 10.1080/088800101750059828.
ДТ Шнайдер 1 , G Calaminus, U Göbel
принадлежность
- 1 Клиника детской гематологии и онкологии Университета Генриха Гейне, Медицинский центр, Moorenstr. 5, D-40225 Дюссельдорф, Германия. [email protected]
- PMID: 11205836
- DOI:
10.
 1080/088800101750059828
1080/088800101750059828
Обзор
D T Schneider et al. Педиатр Гематол Онкол. 2001 январь-февраль.
. 2001 янв-февраль;18(1):11-26.
дои: 10.1080/088800101750059828.
Авторы
ДТ Шнайдер 1 , Г Каламинус, У Гёбель
принадлежность
- 1 Клиника детской гематологии и онкологии Университета Генриха Гейне, Медицинский центр, Moorenstr. 5, D-40225 Дюссельдорф, Германия. [email protected]
- PMID: 11205836
- DOI:
10.
 1080/088800101750059828
1080/088800101750059828
Абстрактный
В этой статье представлен всесторонний обзор современной литературы и обобщен опыт немецких совместных протоколов для нетестикулярных герминогенных опухолей (MAKEI) по использованию альфа-1-фетопротеина (АФП) и бета-хорионического гонадотропина человека (бета-ХГЧ) для диагностика в детской онкологии. Основываясь на этой оценке, в этом обзоре предлагаются рекомендации по начальной диагностической обработке детей с клинически подозреваемыми секретирующими опухолями. АФП и бета-ХГЧ представляют собой характерные онкомаркеры злокачественных эпителиальных опухолей печени и злокачественных герминогенных опухолей (ЗГТ). Они играют важную роль в начальной диагностической оценке, а также в последующем обследовании во время терапии. Текущие терапевтические стратегии для обоих типов опухолей включают предоперационную химиотерапию с последующей отсроченной резекцией опухоли. Поэтому важно, чтобы ответственный педиатр был осведомлен о широкой дифференциальной диагностике повышенного уровня АФП и бета-ХГЧ. В четко определенных клинических условиях эти онкомаркеры позволяют поставить клинический диагноз без гистологического подтверждения, но физиологически повышенные уровни АФП в сыворотке в младенчестве или нераспознанные доброкачественные состояния, такие как заболевания печени или наследственные заболевания, также должны рассматриваться как дифференциальные диагнозы. Поэтому лабораторные исследования должны включать параметры печени у всех пациентов, чтобы исключить заболевание печени. Кроме того, у подростков необходимо исключить беременность. Тщательный сбор анамнеза и клиническое обследование помогут исключить метаболические нарушения или атаксию, телеангиэктазию, связанные с повышенным уровнем АФП. При исключении этих состояний повышение уровня АФП выше возрастной нормы (с высоким уровнем бета-ХГЧ или без него) свидетельствует о злокачественных эпителиальных опухолях печени при первичном поражении печени.
Поэтому важно, чтобы ответственный педиатр был осведомлен о широкой дифференциальной диагностике повышенного уровня АФП и бета-ХГЧ. В четко определенных клинических условиях эти онкомаркеры позволяют поставить клинический диагноз без гистологического подтверждения, но физиологически повышенные уровни АФП в сыворотке в младенчестве или нераспознанные доброкачественные состояния, такие как заболевания печени или наследственные заболевания, также должны рассматриваться как дифференциальные диагнозы. Поэтому лабораторные исследования должны включать параметры печени у всех пациентов, чтобы исключить заболевание печени. Кроме того, у подростков необходимо исключить беременность. Тщательный сбор анамнеза и клиническое обследование помогут исключить метаболические нарушения или атаксию, телеангиэктазию, связанные с повышенным уровнем АФП. При исключении этих состояний повышение уровня АФП выше возрастной нормы (с высоким уровнем бета-ХГЧ или без него) свидетельствует о злокачественных эпителиальных опухолях печени при первичном поражении печени. Практически во всех других локализациях может быть установлен диагноз злокачественной ГКО с выраженной опухолью желточного мешка и/или компонентом хориокарциномы. При дифференциальной диагностике опухолей верхних отделов живота следует учитывать панкреатикобластому и выполнять биопсию. Другие детские опухоли редко связаны с продукцией АФП или бета-ХГЧ, обычно лишь при умеренно повышенных уровнях в сыворотке, и у большинства пациентов эти опухоли можно исключить при клиническом и рентгенологическом исследовании.
Практически во всех других локализациях может быть установлен диагноз злокачественной ГКО с выраженной опухолью желточного мешка и/или компонентом хориокарциномы. При дифференциальной диагностике опухолей верхних отделов живота следует учитывать панкреатикобластому и выполнять биопсию. Другие детские опухоли редко связаны с продукцией АФП или бета-ХГЧ, обычно лишь при умеренно повышенных уровнях в сыворотке, и у большинства пациентов эти опухоли можно исключить при клиническом и рентгенологическом исследовании.
Похожие статьи
Значение повышенного предоперационного альфа-фетопротеина при резекции остаточной опухоли после химиотерапии при диссеминированных герминогенных опухолях.
Кобаяши Т., Кавакита М., Терачи Т., Хабучи Т., Огава О., Камото Т. Кобаяши Т. и др. Дж. Хирург Онкол. 2006 Декабрь 1; 94 (7): 619-23. дои: 10.1002/jso.20418.
 Дж. Хирург Онкол. 2006.
PMID: 17111392
Дж. Хирург Онкол. 2006.
PMID: 17111392Прогностическое значение онкомаркеров у впервые выявленных больных первичными герминогенными опухолями центральной нервной системы.
Ким А., Джи Л., Бальмаседа С., Диез Б., Келли С.Дж., Дункель И.Дж., Гарднер С.Л., Спосто Р., Финлей Д.Л. Ким А и др. Детский рак крови. 2008 декабрь; 51(6):768-73. doi: 10.1002/pbc.21741. Детский рак крови. 2008. PMID: 18802946
Факторы, влияющие на результаты спасительной хирургии у пациентов с химиофракционными герминогенными карциномами с повышенными онкомаркерами.
Хабучи Т., Камото Т., Хара И., Каваи К., Накао М., Нономура Н., Кобаяши Т., Огава О., Камидоно С., Аказа Х., Окуяма А., Като Т., Мики Т. Хабучи Т. и др. Рак.
 2003 15 октября; 98 (8): 1635-42. doi: 10.1002/cncr.11711.
Рак. 2003.
PMID: 14534879
2003 15 октября; 98 (8): 1635-42. doi: 10.1002/cncr.11711.
Рак. 2003.
PMID: 14534879Опухоли печени плода и новорожденного.
Исаакс Х. мл. Исаакс Х. мл. J Pediatr Surg. 2007 ноябрь; 42 (11): 1797-803. doi: 10.1016/j.jpedsurg.2007.07.047. J Pediatr Surg. 2007. PMID: 18022426 Обзор.
[Первичная внутричерепная злокачественная герминогенная опухоль, связанная с аномально высоким значением альфа-фетопротеина и хорионического гонадотропина человека].
Нишияма К., Нисида К., Кусака К., Моризуми Х. Нишияма К. и др. Нет Синкей Гека. 1987 Декабрь; 15 (12): 1337-42. Нет Синкей Гека. 1987. PMID: 2452372 Обзор. Японский язык.
Посмотреть все похожие статьи
Цитируется
Профили экспрессии мРНК и днРНК в тканях печени у детей с атрезией желчевыводящих путей.

Ву В, Ву В, Е И, Ли Т, Ван Б. Ву В и др. Эксперт Тер Мед. 2022 22 августа; 24 (4): 634. doi: 10.3892/etm.2022.11571. Электронная коллекция 2022 окт. Эксперт Тер Мед. 2022. PMID: 36160912 Бесплатная статья ЧВК.
Отчет о клиническом случае: колебания онкомаркеров у мальчика с независимым от гонадотропин-рилизинг-гормона преждевременным половым созреванием, вызванным опухолью зародышевых клеток шишковидной железы.
Каттони А., Альбанезе А. Каттони А. и др. Фронт Педиатр. 2022 авг 23;10:940656. doi: 10.3389/fped.2022.940656. Электронная коллекция 2022. Фронт Педиатр. 2022. PMID: 36081625 Бесплатная статья ЧВК.
Визуализация педиатрических опухолей яичек и паратестикулярных опухолей: графический обзор.

Герман А.Л., Л’Эрмине-Кулон А., Иртан С., Одри Г., Кардоен Л., Брис Х.Дж., Ванде Перре С., Пуэнт ЛДЛ. Герман А.Л. и соавт. Раков (Базель). 2022 29 июня; 14 (13): 3180. doi: 10.3390/раки14133180. Раков (Базель). 2022. PMID: 35804952 Бесплатная статья ЧВК. Обзор.
Случай детской гемангиоэндотелиомы/гемангиомы печени в больнице Махараджа Накорна в Чиангмае.
Ваннасай К., Сеттакорн Дж., Вишрутаратна П., Сатитсамитфонг Л., Корана Дж., Варункун С. Ваннасай К. и др. Куреус. 2022 23 мая; 14 (5): e25240. doi: 10.7759/cureus.25240. Электронная коллекция 2022 май. Куреус. 2022. PMID: 35755522 Бесплатная статья ЧВК.
Диагностические, прогностические и прогностические маркеры в педиатрических опухолях зародышевых клеток — прошлое, настоящее и будущее.


 1080/088800101750059828
1080/088800101750059828 1080/088800101750059828
1080/088800101750059828 Дж. Хирург Онкол. 2006.
PMID: 17111392
Дж. Хирург Онкол. 2006.
PMID: 17111392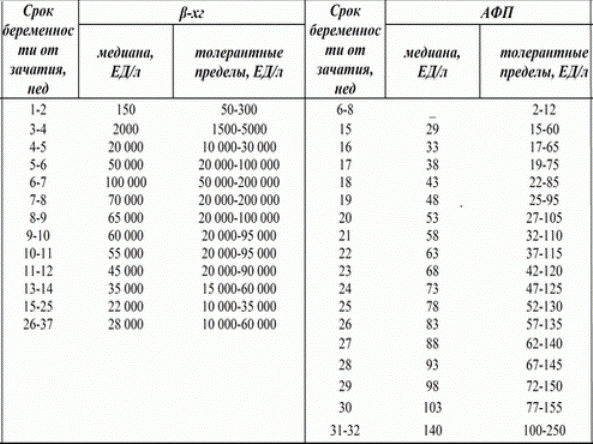 2003 15 октября; 98 (8): 1635-42. doi: 10.1002/cncr.11711.
Рак. 2003.
PMID: 14534879
2003 15 октября; 98 (8): 1635-42. doi: 10.1002/cncr.11711.
Рак. 2003.
PMID: 14534879