Заменить «живую» вакцину от полиомиелита на «убитую»
С 2011 года возобновился закон о введении «живой» вакцины от полиомиелита для детей.
Существует два вида вакцины от полиомиелита.
«Убитая» или ИПВ – инактивированной полиомиелитной вакциной. Инактивированная значит обезвреженная химическим или физическим способом. Это, в свою очередь, означает, что вирус из вакцины не может вызвать заболевание. Его задача – сформировать иммунитет против заболевания.
«Живая» вакцина (ОПВ – оральная полиомиелитная вакцина) тоже содержит вирус, но не убитый, а сильно ослабленный. Именно это позволяет говорить о потенциальной опасности живой вакцины, ведь в ней вирус фактически жив. Прививать детей в шесть месяцев Минздрав предписало именно этой вакциной. «Любая живая вакцина – это болезнь, — комментирует Александр Саверский, президент «Лиги пациентов». И как поведет себя эта недобитая зверюшка в организме ребенка – неизвестно». Кроме того, отмечает эксперт, об этой вакцине ничего неизвестно: «Были ли клинические испытания, каковы их результаты, мы ничего не знаем, и это совершенно естественно вызывает опасения».
Есть огромный риск заразиться от ребенка, вакцинированного «Живой» вакциной людям с ослабленным иммунитетом, а именно —
а. Детям, еще не сделавшим вакцину или вакцинированным только «убитой» вакциной.
б. Беременным женщинам
в. Пожилым людям
г. Людям с ослабленным иммунитетом.
Таким образом живая вакцина является намеренным источником заражения категории людей выше.
Практический результат
Прекратиться намеренное распространение вируса от полиомиелита и заражение категории людей с ослабленным иммунитетом (детей, беременных женщин и пожилых людей) через «Живую» вакцину (ОПВ – орально полиомиелитную вакцину).
Уменьшиться количество осложнений (в т.ч. скрываемой статистикой) после прививок.
Переход на «живую» вакцину необходим для того, чтобы у детей выработался кишечный иммунитет — Российская газета
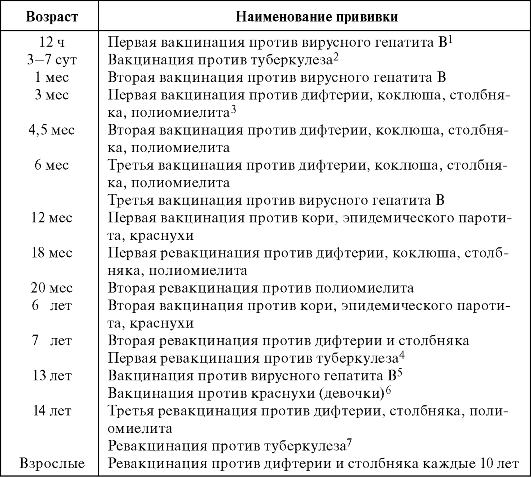
На первом году жизни ребенка иммунизация против полиомиелита проводится в три, четыре с половиной и шесть месяцев.
комментарий
Сусанны Харит, ведущего специалиста по вакцинопрофилактике НИИ детских инфекций Федерального медико-биологического агентства России:
— Различие между «живой» и инактивированной вакциной простое — «живая» капается в рот, убитая применяется в виде инъекции. В этом году третью прививку шестимесячным детям в нашей стране делают «живой» вакциной в связи с тем, что существует угроза распространения дикого полиомиелита, в частности из Таджикистана.
Переход на «живую» вакцину необходим для того, чтобы у детей выработался кишечный иммунитет именно на «дикий» штамм полиовируса. Такая схема по рекомендации ВОЗ многие годы применяется во многих странах. Она показала свою безопасность. Дети, которые в 2011 году будут прививаться «живой» вакциной от полиомиелита, получат надежную защиту от «дикого» штамма полиовируса, который был обнаружен в Таджикистане в 2010 году, и занесен на территорию России. При этом риск заболеть вакциноассоциированным полиомиелитом после такой прививки отсутствует.
Такая схема по рекомендации ВОЗ многие годы применяется во многих странах. Она показала свою безопасность. Дети, которые в 2011 году будут прививаться «живой» вакциной от полиомиелита, получат надежную защиту от «дикого» штамма полиовируса, который был обнаружен в Таджикистане в 2010 году, и занесен на территорию России. При этом риск заболеть вакциноассоциированным полиомиелитом после такой прививки отсутствует.
В очень редких случаях при применении «живой вакцины» может возникнуть вакциноассоциированный полиомиелит, но только если это первая или вторая вакцинация, когда еще не сформирован иммунитет к трем типам вируса, и вирус может вести себя как живой возбудитель. В соответствии с действующим с 2011 года Национальным календарем прививок, две первые прививки проводятся с применением инактивированных или «убитых» штаммов. Это обеспечивает защиту от развития вакциноассоциированного полиомиелита.
У детей после двух введений инактивированной вакцины сформируется иммунитет ко всем трем типам полиомиелитного вируса, входящего в «живую» вакцину. И когда мы «наслаиваем» третью вакцину, у нас, у врачей, нет опасений по поводу вакциноассоциированного полиомиелита.
И когда мы «наслаиваем» третью вакцину, у нас, у врачей, нет опасений по поводу вакциноассоциированного полиомиелита.
Очень важно, чтобы педиатры в поликлиниках объясняли родителям, какую вакцину вводят ребенку — «живую» или инактивированную, а мамы в свою очередь должны не стесняться спрашивать врача о всех плюсах и минусах той или иной вакцины.
«Живой» вакциной не прививаются дети из групп риска — ВИЧ-инфицированные или чьи родители ВИЧ-инфицированы, а также дети, находящиеся в закрытых коллективах (например, в домах ребенка). Эту прививку нельзя делать детям с первичным иммунодефицитом, то есть: родился ребенок, а у него сразу пневмония, сепсис или менингит, или иное тяжелое заболевание. Но, например, если у матери просто были тяжелые роды или перинатальная энцефалопатия, таких детей можно прививать «живой» полиовакциной.
Полимилекс
Производитель: совместное производство Билтховен Биолоджикалз Б.В., Нидерланды и ООО «Нанолек», Россия
Полимилекс цена
| Услуга | Цена | Примечание |
|---|---|---|
| Полимилекс (Нидерланды) | 3000 | с 3 месяцев жизни |
Описание препарата
Вакцина Полимилекс — инактивированная («неживая») вакцина против полиомиелита. Вакцина успешно применяется в клинической практике и отвечает всем требованиям ВОЗ к производству биологических веществ.
Вакцина успешно применяется в клинической практике и отвечает всем требованиям ВОЗ к производству биологических веществ.
Прививка Полимилекс применяется для профилактики полиомиелита у детей с 3 месяцев жизни в соответствии с Национальным календарем прививок, т.е. в 3-4,5-6 месяцев и ревакцинация в 18-20 месяцев и 14 лет. В составе вакцины 3 инактивированных вируса полиомиелита (1, 2 и 3 типов).
Вакцина представляет собой суспензию в виде прозрачной жидкости с оттенками от оранжево-желтого до оранжево-красного цвета. После введения 2 дозы препарата резко увеличивается уровень антител, что уже формирует иммунологическую память.
Показания к применению
Активная иммунизация в целях профилактики полиомиелита.
Особенности применения вакцины в том, что вакцину можно применять во время беременности при явном риске инфекции, также в период грудного вскармливания.
Способ применения и дозы
Объем одной дозы составляет 0,5 мл вакцины как для детей, так и для взрослых. Вакцина вводится подкожно или внутримышечно.
Вакцина вводится подкожно или внутримышечно.
У детей в возрасте до 2-х лет введение вакцины осуществляют о верхненаружную поверхность средней части бедра.
Вакцина ПОЛИМИЛЕКС® может вводиться одновременно с другими вакцинами Национального календаря профилактических прививок в разные участки тела (за исключением вакцин БЦЖ и БЦЖ-М).
Схема вакцинации
Первичная вакцинация проводится согласно календарю профилактических прививок РФ в 3, в 4,5 и 6 месяцев, ревакцинация в 18 месяцев. Третья вакцинация и последующие ревакцинации против полиомиелита проводятся детям вакциной для профилактики полиомиелита (живой), возможно также применение инактививрованной вакцины (в составе комбинированных вакцин или вакциной ПОЛИМИЛЕКС®).
Вакцинацию и последующую ревакцинацию детей с ВИЧ-инфекцией, детей, рождённых от матерей с ВИЧ-инфекцией, детей, находящихся в домах ребенка, проводят инактивированными вакцинами для профилактики полиомиелита (включая ПОЛИМИЛЕКС®) в соответствии с возрастом и интервалами между вакцинациями и ревакцинациями, указанными в Национальном календаре профилактических прививок (вакцинация 3; 4,5; 6 месяцев, ревакцинация 18; 20 мес.
Побочные действия
Вакцинация против полиомиелита вакциной Полимилекс переносится очень хорошо, побочные реакции крайне редки. После вакцинации редко встречается беспокойный плач, повышение температуры до субфебрильных цифр, болезненность, отек и покраснение в месте инъекции.
Как проходит вакцинация?
Вакцинация проводится в прививочном кабинете, с соблюдением всех требований санитарного режима. Все препараты сертифицированы. Сертификат на препарат предоставляется по первому требованию.
Без напоминаний, в обязательном порядке перед прививкой медицинский работник показывает препарат, срок годности вакцины.
Используется только стерильный и одноразовый инструментарий. Обязательно прививка проводится в одноразовых медицинских перчатках.
В день вакцинации ребенка осматривает врач-педиатр, измеряется температура. При отсутствии противопоказаний проводится прививка. Данные о проведенной прививке заносятся в карту, прививочный сертификат, а также даются подробные рекомендации по уходу за ребенком в поствакцинальном периоде.
Перед прививкой доктор ответит на все волнующие Вас вопросы. Обязательно возьмите на прием данные о предыдущих вакцинациях!
Пожалуйста, обратите внимание, что вакцинация ребенка, постановка реакции Манту, Диаскинтеста могут быть проведены только в присутствии родителей или законных представителей ребенка (опекунов), или при наличии у сопровождающего лица НОТАРИАЛЬНО заверенную доверенность на проведение манипуляции (с указанием препарата, планируемого к введению). В ином случае — в вакцинации будет отказано. Мы соблюдаем законы РФ.
Только у нас!
Мы осуществляем поствакцинальное сопровождение: если Вы связываете недомогание с проведенной у нас прививкой, Вы всегда можете нам позвонить или обратиться в клинику на прием к врачу-вакцинологу БЕСПЛАТНО!
«Лучшая вакцина та, до которой вы можете дотянуться» – Новости – Вышка для своих – Национальный исследовательский университет «Высшая школа экономики»
Профессор Университета Джорджа Мейсона (Вирджиния, США) Анча Баранова известна широкой публике своими лекциями на YouTube о COVID-19. В связи с началом вакцинации в Вышке ученый-биолог рассказала «Вышке для своих» о том, что в последнее время стало известно науке о вакцинах от коронавируса.
В связи с началом вакцинации в Вышке ученый-биолог рассказала «Вышке для своих» о том, что в последнее время стало известно науке о вакцинах от коронавируса.
— Какая вакцина из тех, что сейчас существуют в мире, лучшая?
— Сейчас лучшая вакцина та, до которой вы можете дотянуться. В мире есть вакцины, которые, к сожалению, показали не очень хорошие результаты клинических испытаний. Например, китайская вакцина «Синовак» фактически провалилась, там по факту иммунный ответ только у 50% в группах исследований. У вакцины «АстраЗенека» защита получше, но средненькая. Но такие вакцины, как «Пфайзер», «Модерна», «Новавакс», «Спутник V», — это нормальные, адекватные вакцины. Если у вас есть возможность вакцинироваться «Спутником» — делайте это немедленно, не ждите других вакцин. Пока ждете, можете заболеть, и последствия могут быть предсказуемо нехорошие.
— Говорят, что «Спутник» еще не прошел всех необходимых испытаний. Что это значит и чем это может грозить?
Что это значит и чем это может грозить?
— У «Спутника» драматически проходила третья фаза испытаний, но это понятно: вслепую проводить испытания было уже очень трудно. Но теперь третья фаза закончена, производители отчитались по международным стандартам. Еще не обнародованы цифры по испытаниям на новых типах коронавируса, а также по отдельным группам, например по онкобольным после химиотерапии. «Модерна», «Пфайзер», «АстраЗенека» и «Новавакс» опубликовали данные по новым штаммам — кто по английскому, а кто и по южноафриканскому. Эффективность этих вакцин на новых вариантах вируса существенно ниже. «Спутник» таких данных еще не опубликовал, задерживается. Но я думаю, что чудес не бывает, у него тоже будет эффективность на них ниже. Что же касается обычного коронавируса, у «Спутника» очень хорошие показатели. У «АстраЗенека», например, однозначно показатели хуже: иммунный ответ ниже в среднем и продолжительность иммунного ответа ниже. Та же история с «Джонсон и Джонсон».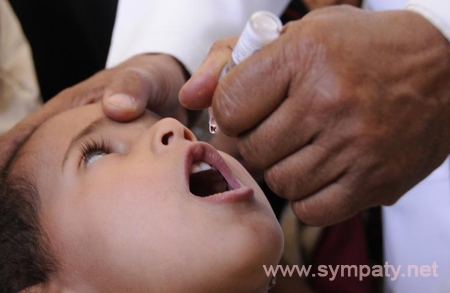 Эта вакцина представляет собой просто первый укол «Спутника», такой «Спутник лайт», протекция у нее ниже.
Эта вакцина представляет собой просто первый укол «Спутника», такой «Спутник лайт», протекция у нее ниже.
— Как долго человек, получивший вакцину, будет защищен от заболевания?
— Этого никто сказать не может. Более того, не факт, что человек вообще получит антитела: я видела анализы людей, у которых после прививки «Модерной», «Пфайзером» не было вообще никакого иммунного ответа. Такой неудачный исход возможен с любой прививкой. Он может быть обусловлен либо нарушением условий хранения вакцины (что в случае вакцины «Пфайзер» вполне можно себе представить), либо индивидуальными свойствами человека. Чем старше человек, тем ниже иммунный ответ. В случае уже имеющихся аутоиммунных заболеваний на супрессивной терапии — то же самое.
— Я слышала, что, если после вакцинации повышается температура, это хорошо и говорит о том, что иммунный ответ происходит. Это так?
— Это, с одной стороны, хорошо, а с другой — плохо. Действительно, повышение температуры является одним из признаков того, что идет иммунный ответ. Но высокая температура может вредить человеку. У пожилых людей высокая температура в течение нескольких дней может иметь разрушительные последствия. Опять же есть данные, что жаропонижающие средства, такие как ибупрофен, и уж тем более антигистаминные понижают и иммунный ответ. Но надо соблюдать баланс, исходить из каждой конкретной ситуации: молодой человек может перетерпеть, а пожилому терпеть не нужно, высокую температуру (выше 38) нужно сбивать.
Действительно, повышение температуры является одним из признаков того, что идет иммунный ответ. Но высокая температура может вредить человеку. У пожилых людей высокая температура в течение нескольких дней может иметь разрушительные последствия. Опять же есть данные, что жаропонижающие средства, такие как ибупрофен, и уж тем более антигистаминные понижают и иммунный ответ. Но надо соблюдать баланс, исходить из каждой конкретной ситуации: молодой человек может перетерпеть, а пожилому терпеть не нужно, высокую температуру (выше 38) нужно сбивать.
— После того как переболел, когда нужно делать прививку?
— После того как вы переболели, нужно сделать тесты на антитела IgM/IgG, и если у вас тест IgM положительный, то однозначно вам прививку делать нельзя, а если у вас и IgG высокий, то прививку можно будет еще долго не делать, до тех пор, пока эти показатели не упадут. Срок жизни антител после заболевания у всех разный. Следует делать тест раз в месяц и смотреть динамику, а прививку делать тогда, когда антитела резко пойдут вниз.
— Какие есть противопоказания к вакцинации от ковида? Например, пожилому человеку с диабетом и онкологией в анамнезе нужно делать прививку?
— Это должен лечащий врач решать, но я бы советовала делать. Людям с диабетом коронавирус страшнее, чем другим, а дремлющих невыявленных опухолей у нас у всех полно. Пожилой человек с онкологией в анамнезе чаще всего отличается от своих сверстников только уровнем информированности о заболевании. Я бы сказала, что реальными противопоказаниями являются инфекционные заболевания на момент прививки, первичный (врожденный) иммунодефицит, всякие редкие и тяжелые аутоиммунные заболевания, но не стандартные локальные проблемы с аутоиммунными реакциями типа тиреоидита Хашимото. У нас он есть у 4% населения, и не надо его мести под одну гребенку с обострениями системной красной волчанки.
— Если я сделала прививку и у меня высокий уровень антител, означает ли это, что я не могу заболеть и не могу заразить близких?
— Хотела бы я сказать, что да, но, к сожалению, это не так. Уже исследовали, насколько основные вакцины — «АстраЗенека», «Пфайзер», «Модерна» и «Новавакс» — защищают от новых вариантов вируса — бразильского, южноафриканского и британского, и падение налицо. Это может означать, что вакцинированный человек может заболеть, но все же не просто при разговоре через маску, а только если ему чихнут прямо в лицо. В обычной ситуации – всё же нет. Скорее всего, симптоматически не заболеет.
Уже исследовали, насколько основные вакцины — «АстраЗенека», «Пфайзер», «Модерна» и «Новавакс» — защищают от новых вариантов вируса — бразильского, южноафриканского и британского, и падение налицо. Это может означать, что вакцинированный человек может заболеть, но все же не просто при разговоре через маску, а только если ему чихнут прямо в лицо. В обычной ситуации – всё же нет. Скорее всего, симптоматически не заболеет.
Что касается носительства вируса без симптомов — тут всё хуже. Дело в том, что антитела находятся в крови, а слизистые, на которых может поселиться вирус, практически не защищены. То есть привитому человеку вирус может прилететь на слизистые, и сам он не заболеет, но носителем-распространителем станет. Но я подчеркну, что этот вопрос еще не изучен до конца, это только наши догадки. Производители вакцин уже предупредили, что они ничего не гарантируют, а «АстраЗенека» прямо так и сказала: будете распространять.
— В нашей стране к этому времени остро встанет вопрос с ревакцинацией, «Спутником» ведь нельзя прививаться второй раз?
— Можно, но, скорее всего, у аденовирусных прививок иммунный ответ при ревакцинации будет ниже. Для первого раза «Спутник» — отличный вариант, во второй раз может и не потянуть. Вопрос действительно сложный, и, наверное, ответ на него будет получен «в среднем по популяции». «Пфайзером» и «Модерной» точно можно ревакцинироваться, но появятся ли они или их аналоги в России вовремя — большой вопрос. Вполне перспективная многоразовая вакцина «ЭпивакКорона», но хотелось бы увидеть данные по защите, потому что данные по антителам у привитых этой вакциной не вдохновляют. То же касается вакцины Центра Чумакова — там третьей фазы тоже нет пока, результаты еще предстоит увидеть. Скорее всего, лидером так и останется «Спутник», а чумаковская вакцина и «Эпивак» подойдут для тех, кому по каким-то причинам нельзя прививаться «Спутником», и тогда нужна хоть какая-то защита, чтобы не было тяжелого заболевания.
Для первого раза «Спутник» — отличный вариант, во второй раз может и не потянуть. Вопрос действительно сложный, и, наверное, ответ на него будет получен «в среднем по популяции». «Пфайзером» и «Модерной» точно можно ревакцинироваться, но появятся ли они или их аналоги в России вовремя — большой вопрос. Вполне перспективная многоразовая вакцина «ЭпивакКорона», но хотелось бы увидеть данные по защите, потому что данные по антителам у привитых этой вакциной не вдохновляют. То же касается вакцины Центра Чумакова — там третьей фазы тоже нет пока, результаты еще предстоит увидеть. Скорее всего, лидером так и останется «Спутник», а чумаковская вакцина и «Эпивак» подойдут для тех, кому по каким-то причинам нельзя прививаться «Спутником», и тогда нужна хоть какая-то защита, чтобы не было тяжелого заболевания.
— Центр Чумакова делает «живую» вакцину. Этого следует бояться?
— Центр Чумакова делает две вакцины. Первая, которая уже поступила в производство, — это не «живая», это убитая вакцина наподобие китайского «Синовака»: на основе коронавируса, который размножен в культуре, а потом инактивирован. Не могу сказать, что у нас большие ожидания по поводу этой вакцины: скорее всего, ее эффективность будет между 50 и 60%. Вторую вакцину, действительно многообещающую, делать там начали, но далеко не закончили. Вообще, «живая» вакцина — это очень долго, не случайно вакцину от полиомиелита делали двадцать лет.
Не могу сказать, что у нас большие ожидания по поводу этой вакцины: скорее всего, ее эффективность будет между 50 и 60%. Вторую вакцину, действительно многообещающую, делать там начали, но далеко не закончили. Вообще, «живая» вакцина — это очень долго, не случайно вакцину от полиомиелита делали двадцать лет.
Насчет страшно это или не страшно, я считаю — страшно. Но не в смысле того, что страшно уколоться, — страшно производить. Инактивированную вакцину сейчас решились делать всего четыре страны: Китай, Россия, Индия и Казахстан. Для того чтобы сделать инактивированную вакцину, нужно взять человеческие клетки, которые хорошо заражаются коронавирусом. Посадить их в реактор и там выращивать, потом заразить, создавая для вируса лучшие условия, чтобы он размножился прямо-таки до космических концентраций. Случись какая-то техническая неполадка, вырвется концентрированный вирус наружу — и мало не покажется: тем, кто подхватит такое облако, никакая вакцина не поможет. Вирус любит холод. В Индии жарко. Может, на улице он долго и не протянет, а вот зимой в Подмосковье — совсем другая ситуация…
В Индии жарко. Может, на улице он долго и не протянет, а вот зимой в Подмосковье — совсем другая ситуация…
— С учетом того, что во многих странах началась вакцинация, каков ваш прогноз по поводу окончания эпидемии?
— Мой ответ вам не понравится. С учетом того, как идет дело, эпидемия будет длиться не менее года. Ведь развитые страны получат вакцину, но такие страны, как Пакистан, Афганистан, получат вакцину в достаточном количестве, по прогнозам, только в 2023 году. Мир-то единый, глобализация — не шутка.
Напоминаем, что в Вышке преподаватели и студенты могут сделать прививку в здании на Покровском бульваре. Прививочный пункт работает с 9:00 до 18:00 по будням. День и временной слот, в который вам удобно прийти на вакцинацию, можно выбрать, заполнив форму для записи. Сейчас открыта запись до 10 февраля.
Стоит ли отказываться от вакцинации из страха перед осложнениями
«Прививки губят иммунитет ребенка», «вакцины содержат живые вирусы, которые вредят организму», «ребенок может умереть от побочных эффектов вакцины» — такие аргументы можно услышать от родителей, которые отказываются от вакцинации своих детей. Отдел науки «Газеты.Ru» разбирался, так ли опасны прививки и стоит ли отказываться от них из-за риска осложнений.
Отдел науки «Газеты.Ru» разбирался, так ли опасны прививки и стоит ли отказываться от них из-за риска осложнений.
Немного истории
Первая вакцина в истории человечества была создана английским врачом Эдвардом Дженнером, который 14 мая 1796 года привил мальчику коровью оспу — болезнь, неопасную для человека. Коровья оспа оставляла на коже рук человека лишь едва заметные следы пузырьков, однако, как показывали наблюдения, «человеческой» оспой этот человек уже не заболевал.
Спустя полтора месяца после вакцинации Дженнер ввел мальчику вирус натуральной оспы — и ребенок действительно остался здоров.
Однако в этом случае успех врача стал возможен лишь потому, что оспа существует в двух формах, одна из которых действительно безопасна для человека. Создать полноценную вакцину путем ослабления других вирусов и приготовить из них препараты для прививок удалось лишь спустя сто лет. Сделал это Луи Пастер, который в 1881 году создал прививку против сибирской язвы, а в 1885 году — против бешенства.
Создать полноценную вакцину путем ослабления других вирусов и приготовить из них препараты для прививок удалось лишь спустя сто лет. Сделал это Луи Пастер, который в 1881 году создал прививку против сибирской язвы, а в 1885 году — против бешенства.
Как прививают сейчас
В настоящее время в России вакцинация проводится в рамках Национального календаря профилактических прививок. В течение первых нескольких недель или даже дней родителям родившегося в России ребенка предлагается сделать младенцу несколько так называемых детских прививок. Первая — от гепатита В — делается, когда новорожденному исполняется 12 часов, а повторяется она в возрасте одного месяца и полугода. С третьего по седьмой день жизни ребенка прививают вакциной БЦЖ (бацилла Кальметта — Герена), которая защищает от туберкулеза. В три месяца ребенок получает либо одну прививку (под названием «тетракок»), либо две: вакцину АКДС (против коклюша, дифтерии и столбняка), а также вакцину от полиомиелита. Эти прививки также повторяются в более позднем возрасте. В возрасте одного года наступает время делать одну комбинированную прививку от кори, краснухи и паротита (известного также под названием «свинка»).
В возрасте одного года наступает время делать одну комбинированную прививку от кори, краснухи и паротита (известного также под названием «свинка»).
Иногда возникают случаи, когда вакцинация несет за собой негативные, а иногда даже трагические последствия, вплоть до гибели ребенка. Обычно такие ситуации широко освещаются в СМИ и влекут за собой проверки в больницах и наказание виновных врачей, однако вопрос о том, насколько прививки безопасны, остается открытым.
Выступающие против прививок родители обычно руководствуются следующими аргументами:
прививки убивают «врожденный иммунитет» ребенка, они создаются на основе живых вирусов, а значит, могут повредить организму. Противники вакцины БЦЖ утверждают, что риск заболеть туберкулезом во многом зависит от условий жизни ребенка:
так, развитые европейские страны (Франция, Германия, Бельгия, Австрия, Италия, Испания и другие) отказались от обязательной вакцинации против туберкулеза, прививая лишь детей из низших социальных слоев — групп риска.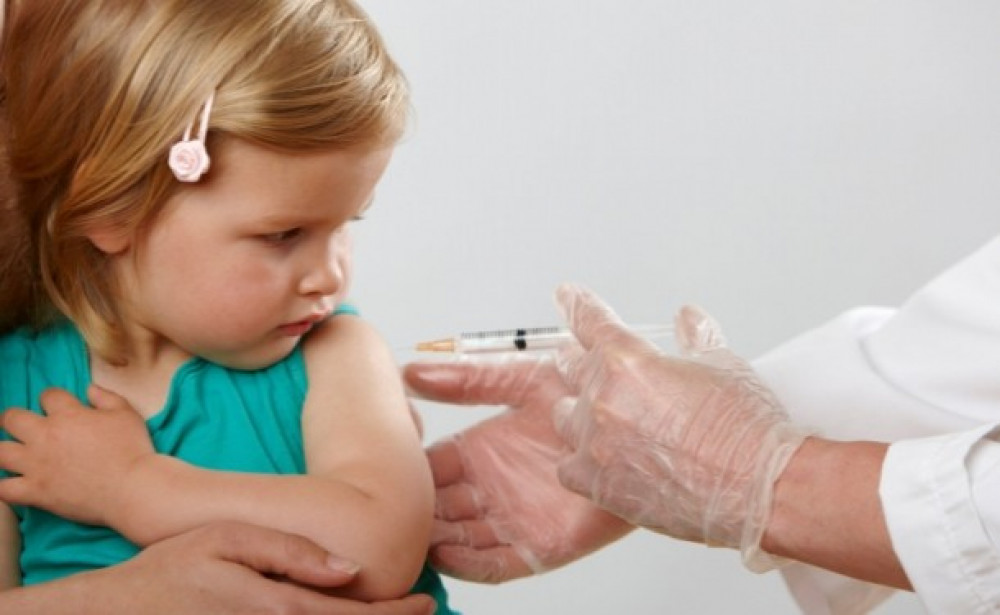 Впрочем, не стоит забывать, что Национальные календари прививок в этих странах тоже существуют: так, в Великобритании и США календарь предполагает вакцинацию от 14 заболеваний, во Франции и Германии — от 12. От стольких же болезней прививают и в России: в наш календарь включены вакцины против 12 инфекционных заболеваний (туберкулез, гепатит В, пневмококковая инфекция, дифтерия, коклюш, столбняк, полиомиелит, гемофильная инфекция, корь, краснуха, паротит, грипп).
Впрочем, не стоит забывать, что Национальные календари прививок в этих странах тоже существуют: так, в Великобритании и США календарь предполагает вакцинацию от 14 заболеваний, во Франции и Германии — от 12. От стольких же болезней прививают и в России: в наш календарь включены вакцины против 12 инфекционных заболеваний (туберкулез, гепатит В, пневмококковая инфекция, дифтерия, коклюш, столбняк, полиомиелит, гемофильная инфекция, корь, краснуха, паротит, грипп).
Какие могут быть осложнения?
Неблагоприятные состояния, возникающие после вакцинации, могут быть разными по тяжести: от непродолжительной лихорадки, головной боли, тошноты или покраснения в месте инъекции до вакциноассоциированного полиомиелита после применения живой полиовирусной вакцины. «Побочные реакции и осложнения у вакцинированных возникали от момента появления вакцинопрофилактики и до наших дней, — комментирует Айдар Ишмухаметов, директор ФГУП «Предприятие по производству бактерийных и вирусных препаратов Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН».
М.П. Чумакова РАМН».
— Эти эпизоды возникают из-за проблем с созданием вакцинных препаратов, связанных с недостаточным развитием биомедицинских технологий производства и контроля, недостаточными знаниями о природе возбудителя. Кроме того, осложнения могут возникать из-за индивидуальных особенностей организма вакцинируемого, о которых не знали прежде».
Впрочем, серьезные последствия, такие как вакциноассоциированный полиомиелит или осложнения после прививки БЦЖ от туберкулеза, чрезвычайно редки. Так, в случае с БЦЖ причинами осложнений являются биологические свойства самого штамма, а также нарушения техники введения вакцины и неправильный отбор детей на вакцинацию. По словам Айдара Ишмухаметова, «анализ причин осложнений, которые возникали при использовании вакцины БЦЖ в России, показал, что у детей с осложнениями после вакцинации в 77,3% случаев сопутствующая патология была еще до прививки.
У детей с осложнениями, развившимися после ревакцинации, в 67% случаев выявлено нарушение техники внутрикожного введения вакцины. Использование вакцины БЦЖ-М снизило риск возникновения осложнений в два раза.
Число осложнений на 100 тыс. привитых в настоящее время колеблется от 0,028% при первичной вакцинации до 0,004% после второй вакцинации. Все осложнения носили в основном местный характер: так, генерализованная БЦЖ-инфекция встречалась лишь в 0,2 случая из 100 тыс».
Несмотря на то что туберкулез действительно распространен в основном в странах с неблагоприятными условиями жизни, не стоит забывать, что Россия, по данным Всемирной организации здравоохранения (ВОЗ), все же находится в группе риска:
close
100%
Если говорить о вакциноассоциированном полиомиелите, то, по данным ВОЗ, частота его возникновения составляет примерно один случай на 2,7 млн первых доз вакцины. Обзор данных разных стран мира о случаях этого заболевания позволил оценить
Обзор данных разных стран мира о случаях этого заболевания позволил оценить
риск его возникновения как 4,7 случая на 1 млн новорожденных, вследствие чего в мире ежегодно должно возникать примерно 498 случаев вакциноассоциированного полиомиелита. В России в период с 1998 по 2005 год этот показатель составил один случай на 1,6 млн доз вакцин.
Успешно снижать частоту возникновения этого осложнения помогает использование инактивированной полиомиелитной вакцины (ИПВ). Она отличается от живой вакцины тем, что содержит не ослабленный живой вирус, а убитый. При этом в организме привитого ИПВ ребенка формируются соответствующие антитела, однако сам вирус не размножается. В США после перехода на вакцинацию только с помощью инактивированной вакцины в 2000 году не было зарегистрировано ни одного случая вакциноассоциированного полиомиелита.
В России после введения первичной вакцинации с помощью ИПВ в 2008 году ежегодное количество случаев подобных осложнений снизилось в 5,9 раза. Впрочем, в 2011 году Минздрав вновь вернул живую вакцину в Национальный календарь прививок — используется она теперь на третьем этапе вакцинации детей. Эксперты ВОЗ отмечали, что это нецелесообразно, так как устойчивый иммунитет формируется уже после первых двух (инактивированных) прививок от полиомиелита.
Впрочем, в 2011 году Минздрав вновь вернул живую вакцину в Национальный календарь прививок — используется она теперь на третьем этапе вакцинации детей. Эксперты ВОЗ отмечали, что это нецелесообразно, так как устойчивый иммунитет формируется уже после первых двух (инактивированных) прививок от полиомиелита.
Может ли прививка быть безопасной?
«Современная вакцинопрофилактика опирается на концепцию безопасной иммунизации.
Безопасная иммунизация — это интегрированный показатель, который свидетельствует о применении качественных, эффективных, безопасных вакцин и безопасного инструментария для их введения, а также о правильной организации системы вакцинопрофилактики.
Она включает в себя обеспечение сохранности и качества вакцин при транспортировке, хранении и применении, порядок и условия проведения иммунизации (место проведения иммунизации, отбор пациентов с учетом медицинских противопоказаний, подготовку вакцинного препарата для введения) с учетом действующих нормативных документов, а также обеспечение безопасности медицинского работника и населения при проведении иммунизации и даже порядок расследования поствакцинальных осложнений» — так ответил Айдар Ишмухаметов на вопрос о том, как можно сделать прививку более безопасной.
Кроме того, несмотря на существующий риск осложнений, вакцинация по-прежнему остается самым эффективным способом борьбы с инфекционными заболеваниями. Так, согласно опубликованному ВОЗ в 2011 году Плану глобальных действий по иммунизации на 2011–2020 годы, прививки способны эффективно контролировать распространение 25% инфекций.
По данным «Краткого отчета об иммунизации» ВОЗ и Детского фонда Организации Объединенных Наций (ЮНИСЕФ) за 2007 год, благодаря вакцинации против четырех болезней — коклюша, дифтерии, столбняка (КДС) и кори — за год было предотвращено более 2,5 млн случаев смерти во всех возрастных группах.
close
100%
Вероятность заболеть или получить осложнения после заболевания в случае с вакцинированными и невакцинированными людьми.
А. Ишмухаметов В настоящее время ведутся разработки вакцин от таких заболеваний, как лихорадка Эбола и ближневосточный респираторный синдром (вызываемый вирусом MERS). Кроме того, ученые ведут разработку вакцин, помогающих организму бороться с вирусом иммунодефицита человека и даже некоторыми видами рака. Статьи об этом были опубликованы в престижных научных журналах PNAS и Science.
Кроме того, ученые ведут разработку вакцин, помогающих организму бороться с вирусом иммунодефицита человека и даже некоторыми видами рака. Статьи об этом были опубликованы в престижных научных журналах PNAS и Science.
Ответ противникам прививок
«Антипривовочное лобби, действующее во всем мире, опирается на ряд мифов об опасности вакцинации, — комментирует Айрат Ишмухаметов. — Один из них —
миф о высокой частоте и тяжести поствакцинальных осложнений. Миф опровергается реальными данными о частоте осложнений после вакцинации и частоте осложнений после перенесенного заболевания.
Второй миф — это наличие высокотоксичных веществ в вакцинах (фенол, формальдегид, гидроксид алюминия, твин-80, мертиолят). На самом деле современные вакцины содержат эти вещества или в крайне низких концентрациях, которые не могут причинить вред ребенку, или же доказано, что они не оказывают негативного воздействия на здоровье человека. Наличие связи между вакцинацией и синдромом внезапной детской смертности научно не подтверждено.
Есть еще миф о влиянии содержащихся в живых вакцинах иных возбудителей, например вируса SV-40 в живой полиовирусной вакцине, полученной на культуре клеток почек обезьян. Но современные вакцины производятся на перевиваемых культурах клеток, свободных от этого вируса. Кроме того, наблюдения за привитыми в конце 1950-х годов также не выявили этой связи.
Лозунг «Врожденный иммунитет против инфекционных заболеваний» — тоже антинаучный миф. Ребенок защищен материнскими антителами, но очень короткое время — несколько месяцев после рождения. Затем нужна стимуляция его собственной «наивной» иммунной системы, что и достигается путем вакцинации. Проверить наличие так называемого врожденного иммунитета можно только лабораторными методами с помощью определения уровня антител к тому или иному возбудителю или эмпирическим путем — послать ребенка в очаг инфекционного заболевания и посмотреть, что с ним будет, — этого, разумеется, никто не делает.
Незаболевшие непривитые дети обязаны своим благополучием тем детям и их родителям, которые прививают своих детей и обеспечивают тем самым коллективное эпидемиологическое благополучие. Но стоит попасть в такую популяцию инфекционному агенту, как он непременно находит свою жертву — непривитого ребенка.
Но стоит попасть в такую популяцию инфекционному агенту, как он непременно находит свою жертву — непривитого ребенка.
Существует масса примеров таких ситуаций. Даже в хорошо вакцинированной против полиомиелита популяции России нашлось 14 человек, которые заболели паралитическим полиомиелитом во время заноса дикого вируса во время «таджикской вспышки» в 2010 году. В благополучнейшей и чистейшей Голландии в 1992–1993 годах возникла вспышка (71 случай) полиомиелита в невакцинированной по религиозным причинам группе, в результате которой два человека умерли, 59 — были парализованы».
Впрочем, ничто не мешает опасающимся некоторых вакцин родителям делать прививки своему ребенку по индивидуальной схеме: так, можно заменить живую вакцину от полиомиелита на инактивированную или отказаться от вакцинации против, например, свинки или краснухи до определенного возраста.
Воспалительные заболевания кишечника (ВЗК) и прививки / Блог / Клиника ЭКСПЕРТ
Как защитить пациента с воспалительным заболеванием кишечника (ВЗК – язвенный колит, болезнь Крона) от особо опасных инфекций?
Несмотря на повышенный риск инфекций у пациентов с ВЗК, зачастую они не вакцинированы надлежащим образом. Обычно это связано с несколькими факторами:
Обычно это связано с несколькими факторами:
- врач не задумывается/забывает/ не знает про надлежащую вакцинацию
- врач боится обострения заболевания после прививки (совершенно напрасно — не доказана связь прививок и обострения ВЗК)
- врач знает, что живые вакцины нельзя использовать во время иммуносупрессии (а какие из них живые — поди их разбери 🙂 ) и на всякий случай запрещает все
- пациент забывает или не хочет прививаться.
В опросе 108 гастроэнтерологов в Соединенных Штатах, проведенном в 2009 году: 20-30% ошибочно давали бы живые вакцины пациентам с подавленным иммунитетом, в то время как 25-35% ошибочно отказывали бы в живых вакцинах пациентам, не получающим иммуносупрессоры.
1. Все прививки лучше сделать до начала иммуносупрессивной терапии (азатиоприн, 6-меркаптопурин, метотрексат, биологические препараты, преднизолон, будесонид)
v Конечно же это не всегда возможно, так как промедление с назначением лечения может привести к ухудшению состояния больного.
2. В случае если пациент в течение последних 3-6 месяцев не принимал иммуносупрессоры и не планируется их назначение в ближайшие 30 дней, то возможно выполнение любых видов прививок.
v Месалазин, Сульфасалазин не являются иммуносупрессорами — делаем любые прививки.
v Доза Будесонида (Буденофальк, Кортимент) менее 6 мг считается безопасной для проведения любой вакцинации. Но решение здесь будет зависеть от того назначалась ли бОльшая доза, как давно и как длительно.
3. Если пациент принимал менее 3-6 месяцев назад/ принимает сейчас или планируется назначение в ближайшие 30 дней иммуносупрессивных препаратов, то ЖИВЫЕ вакцины использовать нельзя!
Связано это с тем, что есть риск активизации в организме пациента введенного вируса.
4. НЕЖИВЫЕ вакцины вводить пациентам на иммуносупрессии МОЖНО и НУЖНО, но возможна выработка менее стойкого иммунитета после прививки.
1. Живые вакцины (НЕ вводим на иммуносупрессии): прививка против
- Кори
- Краснухи
- Паротита
- Ветряной Оспы (возможно введение если пациент получает 20 мг или менее преднизолона в течение менее 2-х недель; Азатиоприн в дозе 3 мг/кг и менее; Меркаптопурин в дозе 1,5 мг/кг и менее; на фоне биологической терапии данную вакцину не вводим)
- Опоясывающего герпеса (в РФ не зарегистрирована)
- Полиомиелита (живая в виде капель в рот, есть вариант неживой в виде инъекции)
- Гриппа (в виде спрея в нос — в РФ не зарегистрирована, есть вариант неживой в виде инъекции)
2. Неживые вакцины (вводим на иммуносупрессии): прививка против
Неживые вакцины (вводим на иммуносупрессии): прививка против
- Гепатита А
- Гепатита В
- Гриппа (в виде внутримышечного укола)
- Пневмококка
- Полиомиелита (неживая вводится посредством укола, а не капель в рот)
- Менингококка
- Папилломавируса
- Дифтерии/коклюша/столбняка (АКДС)
- Ковид-19
Корь, краснуха, паротит (живые вакцины) – возможно введение 1 комплексной вакцины от всех 3-х вирусов.
Прививаться не нужно если болели этими инфекциями или есть документация о 2-х кратной вакцинации. Если не прививались, делалась только 1 прививка или вы точно не знаете прививались ли, то вам показана 2-х кратная вакцинация с интервалом 3-6 месяцев. Хорошим вариантом будет оценить уровень защитных антител для решения вопроса о вакцинации.
Ветряная оспа (живая): если точно болели ею, то прививаться не нужно. Если не болел или проводилась вакцинация, то нужно оценить уровень антител.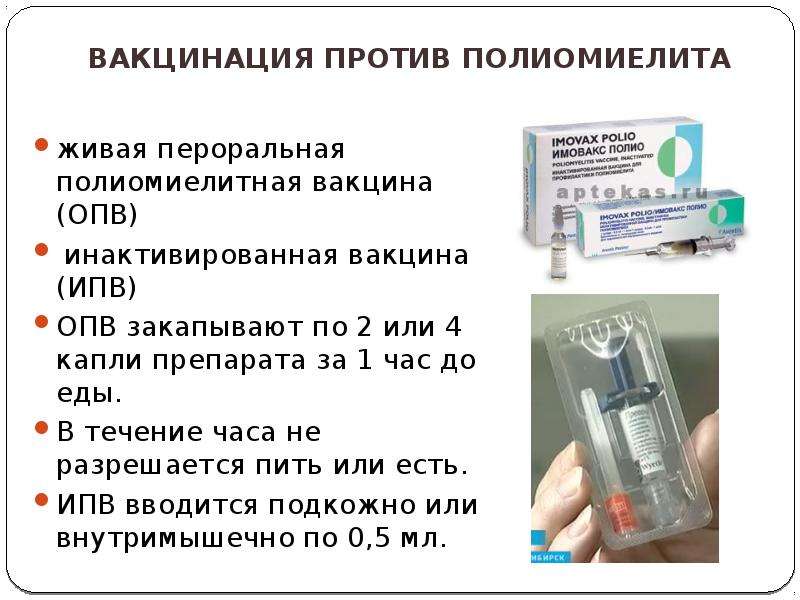
Полиомиелит (неживая): Если в детстве не прививались, то во взрослом возрасте используется НЕ живая вакцина, обычно 3-х кратно.
Дифтерия/коклюш/ столбняк(АКДС) (неживая): вводится если никогда ранее не вводилась или нет сведений. Для ревакцинация каждые 10 лет используется вакцина АДС-М (дифтерия и столбняк).
Гепатит А (неживая): Если не болели, уточняем уровень антител. Прививка вводится 2 раза с интервалом 6 месяцев.
Гепатит В (неживая): Необходимо уточнить титр антител и исключить текущую инфекцию. Вводится 3 дозы, через месяц после последней дозы — контроль титра защитных антител. При их отсутствии необходима повторная вакцинация.
Грипп (неживая): вводится ежегодно.
Пневмококк (неживая) сначала вводится ПКВ13, далее через 2-12 месяцев ПКВ23, далее ПКВ23 через 5 лет.
Менингококк (неживая): предпочтительна вакцина против 4-х серотипов, вводимая 1 раз в 10 лет.
Папилломавирус (неживая): в возрасте от 9 до 26 лет и мужчинам и женщинам. Женщинам может быть проведена вакцинация с 26 до 45 лет если ожидается возможность появления нового полового партнера. Тесты на наличие/отсутствия папилломавируса до вакцинации проходить не нужно.
Семья пациента с ВЗК и прививки:
Ближайшему окружению рекомендовано также привиться от основных инфекций — «стратегия кокона». Однако! Осторожность соблюдаем с живой прививкой от полиомиелита (капельки в рот). В течение 60 дней необходимо избегать контактов с людьми, привитыми ею. В РФ живую полиовакцину обычно 2-3 раза вводят детям в возрасте примерно 1-2 года, после чего они в течение месяца выделяют полиовирус с калом (он конечно супер-слабый, но все же живой). Поэтому! Если человек, осуществляющий уход за ребенком этого возраста, принимает иммуносупрессоры — сказать об этом педиатру. Человеку на иммуносупрессии потребуется либо исключить на 60 дней контакты с ребенком, привитым живой вакциной, либо заменить вакцину на неживую.
О вакцинации
Подробно с информацией обо всех аспектах вакцинации (календарь прививок, прививки во время беременности и лактации, вакцинация путешественников, поствакцинальные осложнения, документы по вакцинопрофилактике, правила подготовки и поведения при проведении вакцинации и многое другое) Вы можете получить информацию на сайте: http://www.privivka.ru
Вакцины — это иммунобиологические препараты, при введении которых в организм формируется активный, специфический иммунитет против определенной инфекции.
Активный потому, что организм сам вырабатывает защиту (специальные белки — антитела и клеточную защиту), искусственный потому, что нужно искусственно ввести вакцину в организм, специфический, так как иммунитет формируется против той конкретной инфекции, против которой проводится вакцинация.
Помимо искусственного, человек может иметь активный естественный иммунитет, который развивается после перенесенной инфекции. Кроме активного, существует пассивный иммунитет против инфекции. Естественный пассивный иммунитет ребенок приобретает внутриутробно при передаче от матери через плаценту готовых антител и при естественном вскармливании через грудное молоко. Искусственный пассивный иммунитет можно создать путем введения иммуноглобулинов (препаратов крови) или лечебных сывороток, которые содержат готовые антитела. Пассивный иммунитет, в отличие от активного, не длительный и обычно через 1-2 месяца пропадает, так как введенные антитела чужеродны для организма и постепенно разрушаются.
Естественный пассивный иммунитет ребенок приобретает внутриутробно при передаче от матери через плаценту готовых антител и при естественном вскармливании через грудное молоко. Искусственный пассивный иммунитет можно создать путем введения иммуноглобулинов (препаратов крови) или лечебных сывороток, которые содержат готовые антитела. Пассивный иммунитет, в отличие от активного, не длительный и обычно через 1-2 месяца пропадает, так как введенные антитела чужеродны для организма и постепенно разрушаются.
Вакцинные препараты получают из бактерий, вирусов или продуктов их жизнедеятельности. В зависимости от того, что является основным действующим началом (антигеном) выделяют вакцины инактивированные (неживые), живые и анатоксины. Антигенами называют любые вещества чужеродные для организма, способные вызвать реакцию клеток иммунной системы с последующим образованием антител и (или) специфической клеточной защиты.
Инактивированные (убитые, не живые) вакцины.
Это вакцины, в состав которых входит целиком инактивированный химическим или физическим воздействием микроорганизм (бактерия или вирус). Для химической обработки бактерий или вирусов используют формалин, спирт или фенол. Для физической — температурное воздействие или ультрафиолетовое облучение. Примером убитой, бактериальной вакцины, содержащей целиком весь микроорганизм является коклюшная вакцина, входящая в состав препарата АКДС. Примером вакцин, содержащих убитые вирусы, могут служить вакцины против гепатита А, клещевого энцефалита.
Для химической обработки бактерий или вирусов используют формалин, спирт или фенол. Для физической — температурное воздействие или ультрафиолетовое облучение. Примером убитой, бактериальной вакцины, содержащей целиком весь микроорганизм является коклюшная вакцина, входящая в состав препарата АКДС. Примером вакцин, содержащих убитые вирусы, могут служить вакцины против гепатита А, клещевого энцефалита.
Вариантом неживых вакцин являются химические вакцины, в которых использованы отдельные части микроорганизма (антигены), отвечающие за выработку иммунитета к инфекции. К таким вакцинам относят безклеточную коклюшную вакцину и полисахаридные вакцины, содержащие полисахариды клеточной стенки микробов (вакцины против менингококков групп А и С, пневмококков, гемофильной инфекции типа b). Полисахариды низкомолекулярные вещества, иммунная система детей до 18 мес. не способна распознать такие антигены , поэтому их рекомендуют применять в возрасте старше18 месяцев. Чтобы можно было защитить от менингококковой, пневмококковой и гемофильной тип В инфекции маленьких детей до 1 года, необходимо их сделать крупными молекулами. Это достигается «сшиванием» полисахаридов белками (протеинами), такие вакцины уже называют конъюгированными и их можно применять с 2-х месячного возраста. В нашей стране зарегистрированы две конъюгированные вакцины против гемофильной инфекции тип В – Акт-Хиб и Хиберикс.
Это достигается «сшиванием» полисахаридов белками (протеинами), такие вакцины уже называют конъюгированными и их можно применять с 2-х месячного возраста. В нашей стране зарегистрированы две конъюгированные вакцины против гемофильной инфекции тип В – Акт-Хиб и Хиберикс.
К неживым вакцинам относятся и рекомбинантные вакцины, которые производят генноинженерным путем. Эти вакцины не содержат никаких элементов вирусов или бактерий, так как действующий антиген построен дрожжевыми клетками.
Еще одним вариантом неживых вакцин являются анатоксины — это обезвреженные экзотоксины бактерий, обработанные формалином при повышенной температуре, а затем очищенные от балластных веществ. Пример – дифтерийный, столбнячный анатоксины, которые могут применяться раздельно или совместно.
Большинство неживых вакцин содержит дополнительные вещества – адсорбенты (адъюванты) и консерванты (стабилизаторы).
Адъюванты (адсорбенты) усиливают иммунный ответ на вакцину, но на них могут развиваться местные реакции в виде отека и гиперемии. В качестве адъювантов можно использовать различные вещества. Чаще всего в применяют гидроксид алюминия и полиоксидоний.
В качестве адъювантов можно использовать различные вещества. Чаще всего в применяют гидроксид алюминия и полиоксидоний.
Консерванты обеспечивают длительное сохранение свойств вакцины. В качестве консервантов используют мертиолят (соль ртути) и формальдегид.
Важным общим свойством неживых вакцин является то, что они не размножаются в организме, не вызывают никаких вакциноассоциированных заболеваний и могут быть использованы даже у пациентов с иммунодефицитными состояниями. Следует знать и об особенности формирования иммунитета при применении инактивированных вакцин. Для создания полноценной защиты требуются повторные двух- или трехкратные введения препарата и последующие ревакцинации, проводимые через определенные интервалы. Такие схемы введения длительно поддерживают защиту на высоком уровне, но если сроки ревакцинаций нарушаются, иммунитет может снизиться или даже исчезнуть.
Живые вакцины
Живые вакцины производят из возбудителей, не вызывающих заболевания у человека, но создающих защиту к инфекции человека. Так, например, вакцина БЦЖ сделана на основе бычьих микобактерий, но иммунитет к ним защищает от туберкулеза человека.
Так, например, вакцина БЦЖ сделана на основе бычьих микобактерий, но иммунитет к ним защищает от туберкулеза человека.
Вторым вариантом получения живых вакцин является ослабление (аттенуация) диких микроорганизмов (например, вирусные вакцины против кори, свинки, краснухи, желтой лихорадки, живая, оральная вакцина против полиомиелита).
Ослабленные микроорганизмы обладают сниженной вирулентностью (заражающей способностью), но сохраняют антигенные свойства. После однократного введения в организм человека живые вакцины некоторое время размножаются, что создает как бы «легкую болезнь», благодаря чему стимулируют выработку напряженного и длительного защитного иммунитета до 10-15 лет. Поэтому живые вакцины не нужно вводить много раз, как неживые. Считают, что двукратное введение живых вакцин против кори, паротита, краснухи защищает практически на всю жизнь.
регистратура 905-899, 905-898 кабинет вакцинопрофилактики 905-897.
| < Предыдущая | Следующая > |
|---|
Полиомиелитная вакцина – обзор
Испытание последовательного календаря цИПВ с последующим введением ОПВ клинические испытания с несколькими вакцинами, содержащими цИПВ (отдельно или комбинациями wP/aP [бесклеточный коклюш]) в восьми странах (Бразилия, Китай, Франция, Гватемала, Мексика, Тайвань, Великобритания и США) с 1986 г.
 (Sanofi Pasteur, исследования HE9812 и IPV33-EXT, неопубликованные, данные в файле). 143,144,146,148,149,207,218–231 Эти испытания были либо нерандомизированными открытыми исследованиями, либо РКИ между последовательными схемами введения цИПВ с последующей тОПВ и схемами только цИПВ и/или только тОПВ. Результаты этих исследований показывают, что введение по крайней мере одной дозы цИПВ в начале календаря повышает уровень антител в сыворотке после первичной серии по сравнению со схемами, включающими только тОПВ, а также индуцирует определенную степень защиты слизистой оболочки кишечника (см. Иммунитет слизистых оболочек/защита, индуцированная инактивированной вакциной против полиомиелита» далее).С 1997 по 1999 год в Соединенных Штатах применялся последовательный график введения цИПВ, а затем тОПВ, при котором две дозы цИПВ вводились в возрасте 2 и 4 месяцев, а затем две дозы тОПВ вводились в возрасте от 6 до 18 месяцев. и снова при поступлении в школу. В табл. 48.5 обобщена превосходная иммуногенность этой схемы.
(Sanofi Pasteur, исследования HE9812 и IPV33-EXT, неопубликованные, данные в файле). 143,144,146,148,149,207,218–231 Эти испытания были либо нерандомизированными открытыми исследованиями, либо РКИ между последовательными схемами введения цИПВ с последующей тОПВ и схемами только цИПВ и/или только тОПВ. Результаты этих исследований показывают, что введение по крайней мере одной дозы цИПВ в начале календаря повышает уровень антител в сыворотке после первичной серии по сравнению со схемами, включающими только тОПВ, а также индуцирует определенную степень защиты слизистой оболочки кишечника (см. Иммунитет слизистых оболочек/защита, индуцированная инактивированной вакциной против полиомиелита» далее).С 1997 по 1999 год в Соединенных Штатах применялся последовательный график введения цИПВ, а затем тОПВ, при котором две дозы цИПВ вводились в возрасте 2 и 4 месяцев, а затем две дозы тОПВ вводились в возрасте от 6 до 18 месяцев. и снова при поступлении в школу. В табл. 48.5 обобщена превосходная иммуногенность этой схемы. 143–149 Израиль и Дания также некоторое время использовали такие последовательные графики с успешными результатами. В Израиле используются две схемы: цИПВ в возрасте 2, 4, 6 и 12 месяцев с введением тОПВ в возрасте 7 и 13 месяцев или цИПВ в возрасте 2, 4 и 12 месяцев плюс тОПВ в возрасте 4, 6 лет. , и в возрасте 12 мес.Стойкий полиомиелит в секторе Газа, несмотря на широкое использование тОПВ, побудил власти перейти на смешанный последовательный график, что привело к резкому сокращению выделения диких штаммов. 232 Исследование, проведенное в Соединенном Королевстве, показало преимущества последовательного режима введения одной дозы цИПВ, за которым следуют две дозы тОПВ, с точки зрения иммуногенности. 222
143–149 Израиль и Дания также некоторое время использовали такие последовательные графики с успешными результатами. В Израиле используются две схемы: цИПВ в возрасте 2, 4, 6 и 12 месяцев с введением тОПВ в возрасте 7 и 13 месяцев или цИПВ в возрасте 2, 4 и 12 месяцев плюс тОПВ в возрасте 4, 6 лет. , и в возрасте 12 мес.Стойкий полиомиелит в секторе Газа, несмотря на широкое использование тОПВ, побудил власти перейти на смешанный последовательный график, что привело к резкому сокращению выделения диких штаммов. 232 Исследование, проведенное в Соединенном Королевстве, показало преимущества последовательного режима введения одной дозы цИПВ, за которым следуют две дозы тОПВ, с точки зрения иммуногенности. 222 В частности, этот последовательный график был предпринят в Румынии из-за необычно высокого уровня ВАПП, вызванного одновременными внутримышечными инъекциями. 233 В течение ограниченного времени младенцы в одной из провинций Румынии получали циИПВ в возрасте 2, 3 и 4 месяцев вместе с тОПВ в возрасте 4 и 9 месяцев. 234 Схема хорошо переносилась и обладала высокой иммуногенностью. В дальнейшем случаев полиомиелита в этом регионе не было, но было задействовано слишком мало детей, чтобы делать выводы о профилактике ВАПП.
234 Схема хорошо переносилась и обладала высокой иммуногенностью. В дальнейшем случаев полиомиелита в этом регионе не было, но было задействовано слишком мало детей, чтобы делать выводы о профилактике ВАПП.
Завершенное исследование в Чили 235 с использованием бОПВ 1 и 3 сравнивали гуморальный и кишечный иммунитет после введения трех доз цИПВ против двух последовательных цИПВ с последующим введением бОПВ 1 и 3 -бОПВ 1&3 -бОПВ 1&3 ) в возрасте 8, 16 и 24 недель.Все получали пероральную мОПВ 2 на 28-й неделе. На 28-й неделе более 98% субъектов во всех группах сероконверсировали по типам 1 и 3, а сероконверсия по типу 2 превысила 96% после трех или двух доз цИПВ. Интересно, что в группе цИПВ-бОПВ 1&3 -бОПВ 1&3 была достигнута 77,6% сероконверсия к типу 2. Важно отметить, что у двух третей неответивших на тип 2 через 28 недель в этой группе сероконверсия произошла в течение 1 недели после заражения мОПВ 2 , что указывает на праймирование против типа 2, что дает в совокупности 92% уровень защиты/примирования цИПВ-бОПВ типа 2. 1&3 -бОПВ 1&3 последовательный режим.Как и ожидалось, антитела материнского происхождения значительно влияли на иммунный ответ. Ключевым наблюдением этого испытания было то, что бОПВ 1 и 3 , по-видимому, повышала уровни антител (а также кишечный иммунитет, измеряемый выделением антител типа 2 после заражения мОПВ 2 ) против типа 2, что предполагает некоторый перекрестный (гетеротипический) бустерный эффект против типа 2. 2 (у субъектов, примированных одной дозой цИПВ) двумя другими серотипами, включенными в бОПВ 1 и 3 .
1&3 -бОПВ 1&3 последовательный режим.Как и ожидалось, антитела материнского происхождения значительно влияли на иммунный ответ. Ключевым наблюдением этого испытания было то, что бОПВ 1 и 3 , по-видимому, повышала уровни антител (а также кишечный иммунитет, измеряемый выделением антител типа 2 после заражения мОПВ 2 ) против типа 2, что предполагает некоторый перекрестный (гетеротипический) бустерный эффект против типа 2. 2 (у субъектов, примированных одной дозой цИПВ) двумя другими серотипами, включенными в бОПВ 1 и 3 .
Ключевым преимуществом последовательной схемы введения цИПВ, предшествующей ОПВ, является снижение риска ВАПП, поскольку в настоящее время хорошо задокументировано, что начало иммунизации против полиомиелита цИПВ может исключить возникновение ВАПП, связанное с первыми дозами ОПВ.Это оказалось очень успешной стратегией в Соединенных Штатах 236 и в Венгрии. 154 С 1992 по 2006 год Венгрия перешла от трех ежегодных кампаний мОПВ к последовательному графику введения одной дозы цИПВ с последующим введением тОПВ и добилась полного прекращения ВАПП.
С последними данными, описанными выше, этот тип календаря может быть выгоден в контексте, когда бОПВ 1 и 3 будет использоваться исключительно в качестве вакцины ОПВ и где будет крайне важно гарантировать, что иммунитет против полиомиелита типа 2 будет столь же высоким как это возможно в популяциях в случае реинтродукции полиовируса типа 2 в этих общинах.
Инактивированная поддержка вакцины против полиомиелита
Выпуск
Нет лекарства от полиомиелита, но он может быть предотвращен вакциной
КАЛЕЧЕНИЕ, ПОТЕНЦИАЛЬНО СМЕРТЕЛЬНОЕ
полиомиелита — это очень заразная вирусная инфекция, в основном, влияющая на детей в возрасте до пяти лет, что может привести к параличу или даже смерти. Многие зараженные люди не имеют симптомов, но все еще выделяют вирус, передавая инфекцию другим. В районах с плохой санитарией вирус легко распространяется через загрязненную воду или еду.
Одна из 200 инфекций приводит к необратимому параличу, обычно в ногах. Среди парализованных от 5 до 10% жертв умирают, когда их дыхательные мышцы обездвиживаются. Полиомиелит можно предотвратить только с помощью вакцины, так как лекарства не существует. Требуются многократные дозы, обычно обеспечивающие пожизненную защиту.
Среди парализованных от 5 до 10% жертв умирают, когда их дыхательные мышцы обездвиживаются. Полиомиелит можно предотвратить только с помощью вакцины, так как лекарства не существует. Требуются многократные дозы, обычно обеспечивающие пожизненную защиту.
УЛУЧШЕНИЕ ПОСТАВКИ ИПВ ВАКЦИНЫ
Огромные темпы и масштабы внедрения инактивированной полиовакцины (ИПВ) в сочетании с техническими трудностями увеличения производственных мощностей привели к серьезным ограничениям поставок в предыдущие годы.На пике проблемы SAGE рекомендовала странам рассмотреть возможность перехода на дробные дозы ИПВ. Этот подход, принятый Бангладеш, Кубой, Индией, Непалом и Шри-Ланкой, обеспечивает защиту при сокращении количества используемых вакцин. Однако 2018 г. стал первым годом, когда имелось достаточное количество инактивированного полиовируса, и почти все внедрения, которые были отложены или прерваны из-за проблем с поставками, были возобновлены в течение года. Хотя проблемы с поставками продолжают вызывать дисбаланс между спросом и предложением на рынках, мы наблюдаем улучшения.
В 2018 г. 14 стран внедрили ИПВ в свои системы плановой иммунизации, а 12 стран возобновили вакцинацию ИПВ после перерыва в поставках в начале 2016 г. Последние две страны, Монголия и Зимбабве, внедрили ИПВ в апреле 2019 г., что означает, что все 126 стран использовали только ОПВ. в 2014 году ввели ИПВ.
ПОСЛЕДНЯЯ МИЛЬ ПОЛИОМИЕЛИТА
В то время как Афганистан и Пакистан несут бремя случаев дикого полиовируса, в 2019 г. было зарегистрировано более 200 случаев полиовируса вакцинного происхождения в Восточной, Центральной и Западной Африке, а также в Юго-Восточной Азии.Это явные признаки слабости систем здравоохранения и того, что постоянно низкие показатели охвата иммунизацией могут быстро свести на нет достигнутые успехи.
ГИЛП отточила проверенные стратегии доставки вакцин против полиомиелита детям во всем мире, в том числе в самых сложных условиях мира. Работая с национальными правительствами, которые являются основными владельцами и бенефициарами усилий по ликвидации полиомиелита, ГИЛП ежегодно охватывает более 400 миллионов детей и отслеживает вирус в более чем 70 странах для быстрого выявления вспышек и реагирования на них. Новая стратегия инициативы по ликвидации полиомиелита на 2019–2023 годы основана на этих проверенных стратегиях и предлагает инновационные решения, адаптированные к потребностям сообществ. Кроме того, он направлен на улучшение здоровья в более широком смысле путем тесного сотрудничества с мировым медицинским сообществом, чтобы охватить больше детей плановыми вакцинациями и базовыми услугами здравоохранения. Эта невероятная работа опирается на разностороннюю и преданную делу глобальную команду, включающую от передовых медицинских работников и сотрудников программ борьбы с полиомиелитом до доноров и политических лидеров в пострадавших странах.
Новая стратегия инициативы по ликвидации полиомиелита на 2019–2023 годы основана на этих проверенных стратегиях и предлагает инновационные решения, адаптированные к потребностям сообществ. Кроме того, он направлен на улучшение здоровья в более широком смысле путем тесного сотрудничества с мировым медицинским сообществом, чтобы охватить больше детей плановыми вакцинациями и базовыми услугами здравоохранения. Эта невероятная работа опирается на разностороннюю и преданную делу глобальную команду, включающую от передовых медицинских работников и сотрудников программ борьбы с полиомиелитом до доноров и политических лидеров в пострадавших странах.
Перенос сроков ликвидации полиомиелита в сочетании с глобальной нехваткой ИПВ побудил Правление Гави расширить поддержку ИПВ после 2020 г. в рамках инвестиционной стратегии Гави в области вакцин (VIS), признавая важность вакцины как глобальное общественное благо для достижения и поддержания ликвидации полиомиелита.
Вакцина против полиомиелита ИПВ Сэбин — Прецизионные вакцинации
Вакцина ИПВ Сэбин Описание
Инактивированная полиовирусная вакцина Сэбина (ИПВ) представляет собой жидкую трехвалентную вакцину, полученную из штаммов полиовируса Сэбина типов 1, 2 и 3, выращенных на клетках Vero.
В 1988 г. Всемирная ассамблея здравоохранения поставила цель глобальной ликвидации полиомиелита. С тех пор заболеваемость полиомиелитом снизилась более чем на 99% благодаря использованию пероральной полиомиелитной вакцины (ОПВ, вакцина Сэбина) и ИПВ для прерывания передачи.
ОПВ имеет преимущества более низкой стоимости по сравнению с ИПВ и лучшей индукции кишечного/слизистого иммунитета. Он также связан с вакциноассоциированным паралитическим полиомиелитом и полиовирусными инфекциями вакцинного происхождения, число которых в последние годы превысило количество инфекций, вызванных полиомиелитом дикого типа.
Индикация вакцины Sabin IPV
Эта вакцина показана для предотвращения дикого вируса полиомиелита в надежде на полное искоренение болезни.
Дозировка вакцины Sabin IPV
Вакцину вводят в виде трех внутримышечных инъекций (0,5 мл) в День 0, День 30 и День 60 соответственно и однократную внутримышечную инъекцию вакцины (0,5 мл) в возрасте 18 месяцев.
Новости о вакцине Sabin IPV
19 июля 2021 г. — SINOVAC Biotech Ltd.объявила, что 12 июля 2021 года получила разрешение на регистрацию лекарственного средства от Национального управления медицинской продукции Китая («NMPA») для своей инактивированной вакцины против полиомиелита на основе штамма Сэбина (клетки Vero) («sIPV»). Ожидается, что вакцина будет появится на рынке к концу 2021 г. Компания SINOVAC также подала заявку на предварительную квалификацию (PQ) во Всемирную организацию здравоохранения («ВОЗ») в начале 2020 г., а ВОЗ провела выездную инспекцию в феврале 2021 г.
19 февраля 2021 г. — Двадцать седьмое совещание Комитета ВОЗ по чрезвычайной ситуации в соответствии с Международными медико-санитарными правилами (2005 г.) (ММСП), посвященное международному распространению полиовируса, было созвано Генеральным директором ВОЗ 1 февраля 2021 г. с членами комитета и советники, участвующие в видеоконференции при поддержке Секретариата ВОЗ. Комитет по чрезвычайной ситуации рассмотрел данные о диком полиовирусе (ДПВ1) и циркулирующих полиовирусах вакцинного происхождения (цПВВП).
Комитет по чрезвычайной ситуации рассмотрел данные о диком полиовирусе (ДПВ1) и циркулирующих полиовирусах вакцинного происхождения (цПВВП).
7 января 2021 г. — Южнокорейская биотехнологическая компания объявила о том, что ее вакцина против полиомиелита, инактивированная Сабином (Sabin-IPV) Eupolio™, является первой вакциной, прошедшей предварительную квалификацию Всемирной организации здравоохранения для поставок по всему миру.
1 сентября 2019 г. — sIPV не уступает IPV. Оба демонстрируют хороший профиль безопасности.
8 апреля 2019 г. — Результаты этого исследования опубликованы в The Journal for Infectious Diseases. Этот анализ показал, что исследуемая sIPV продемонстрировала профиль иммуногенности, не уступающий таковому у обычной ИПВ, и хороший профиль безопасности.
Клинические испытания вакцины Sabin IPV
Вакцина Sabin IPV прошла более 38 клинических испытаний на протяжении многих лет.
Вакцины (иммунизация): Медицинская энциклопедия MedlinePlus
КАК РАБОТАЮТ ВАКЦИНЫ
Вакцины «учат» ваш организм защищаться, когда в него проникают микробы, такие как вирусы или бактерии:
- Вакцины подвергают вас воздействию очень малых, очень безопасное количество ослабленных или убитых вирусов или бактерий.
- Затем ваша иммунная система учится распознавать инфекцию и атаковать ее, если вы столкнетесь с ней в более позднем возрасте.
- В результате вы не заболеете или у вас может быть более легкая инфекция. Это естественный способ борьбы с инфекционными заболеваниями.
В настоящее время доступны четыре типа вакцин:
- Живые вирусные вакцины используют ослабленную (аттенуированную) форму вируса. Примерами являются вакцина против кори, эпидемического паротита и краснухи (MMR) и вакцина против ветряной оспы (ветрянки).
- Убитые (инактивированные) вакцины изготавливаются из белка или других мелких частиц, взятых из вируса или бактерии.
 Примером является вакцина против коклюша (коклюша).
Примером является вакцина против коклюша (коклюша). - Токсоидные вакцины содержат токсин или химическое вещество, вырабатываемое бактериями или вирусами. Они делают вас невосприимчивыми к вредному воздействию инфекции, а не к самой инфекции. Примерами являются вакцины против дифтерии и столбняка.
- Биосинтетические вакцины содержат искусственные вещества, очень похожие на кусочки вируса или бактерии.Например, вакцина против гепатита В.
ПОЧЕМУ НАМ НУЖНЫ ВАКЦИНЫ
В течение нескольких недель после рождения дети имеют некоторую защиту от микробов, вызывающих заболевания. Эта защита передается от матери через плаценту еще до рождения. Через короткий промежуток времени эта естественная защита уходит.
Вакцины помогают защитить от многих болезней, которые раньше были гораздо более распространены. Примеры включают столбняк, дифтерию, эпидемический паротит, корь, коклюш (коклюш), менингит и полиомиелит.Многие из этих инфекций могут вызывать серьезные или опасные для жизни заболевания и могут привести к пожизненным проблемам со здоровьем. Благодаря вакцинам многие из этих болезней стали редкостью.
Благодаря вакцинам многие из этих болезней стали редкостью.
БЕЗОПАСНОСТЬ ВАКЦИН
Некоторые люди обеспокоены тем, что вакцины небезопасны и могут быть вредными, особенно для детей. Они могут попросить своего поставщика медицинских услуг подождать или даже отказаться от вакцинации. Но преимущества вакцин намного перевешивают их риски.
Американская академия педиатрии, Центры по контролю и профилактике заболеваний (CDC) и Национальная медицинская академия пришли к выводу, что преимущества вакцин перевешивают их риски.
Вакцины, такие как вакцины против кори, эпидемического паротита, краснухи, ветрянки и назальный спрей против гриппа, содержат живые, но ослабленные вирусы:
- Если иммунная система человека не ослаблена, маловероятно, что вакцина заразит человека . Люди с ослабленной иммунной системой не должны получать эти живые вакцины.
- Эти живые вакцины могут быть опасны для плода беременной женщины. Во избежание вреда для ребенка беременным женщинам не следует делать какие-либо из этих вакцин.
 Поставщик может сообщить вам подходящее время для получения этих вакцин.
Поставщик может сообщить вам подходящее время для получения этих вакцин.
Тимеросал — это консервант, который в прошлом содержался в большинстве вакцин. Но сейчас:
- Существуют вакцины против гриппа для младенцев и детей, не содержащие тимеросал.
- НИКАКИЕ другие вакцины, обычно используемые для детей или взрослых, не содержат тимеросал.
- Исследования, проведенные в течение многих лет, НЕ выявили никакой связи между тимеросалом и аутизмом или другими медицинскими проблемами.
Аллергические реакции редки и обычно связаны с какой-либо частью (компонентом) вакцины.
РАСПИСАНИЕ ВАКЦИН
Рекомендуемый график вакцинации (иммунизации) обновляется каждые 12 месяцев Центрами США по контролю и профилактике заболеваний (CDC). Поговорите со своим врачом о конкретных прививках для вас или вашего ребенка. Текущие рекомендации доступны на веб-сайте CDC: www.cdc.gov/vaccines/schedules.
ПУТЕШЕСТВЕННИКИ
На веб-сайте CDC (wwwnc.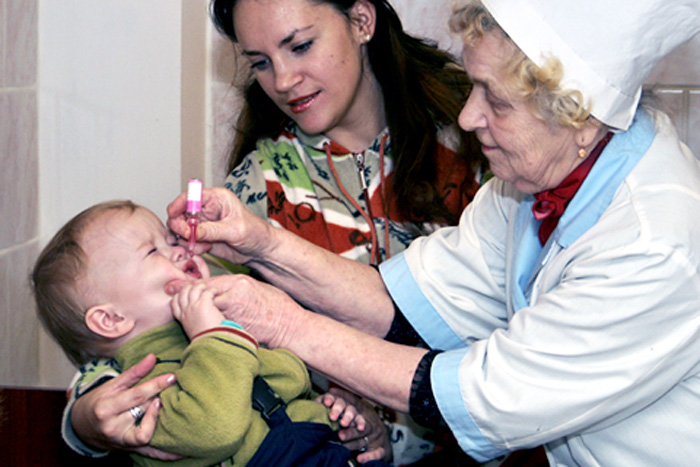 cdc.gov/travel) есть подробная информация о прививках и других мерах предосторожности для лиц, выезжающих в другие страны.Многие прививки должны быть сделаны по крайней мере за 1 месяц до поездки.
cdc.gov/travel) есть подробная информация о прививках и других мерах предосторожности для лиц, выезжающих в другие страны.Многие прививки должны быть сделаны по крайней мере за 1 месяц до поездки.
Берите с собой карту прививок, когда отправляетесь в другие страны. В некоторых странах требуется эта запись.
ОБЩИЕ ВАКЦИНЫ
Экономический анализ здравоохранения для оральной вакцины против полиомиелита для профилактики COVID-19 в США – Томпсон – 2021 – Анализ рисков
1 ВВЕДЕНИЕ
За последние 20 лет в обширном комплексе комплексного динамического моделирования передачи полиовируса и анализа экономической политики в области здравоохранения были изучены преимущества, риски и затраты на различные полиовирусные вакцины (Thompson & Kalkowska, 2020b, 2020c).В предшествующем моделировании учитывались различия в иммунитете, индуцированном различными составами оральной полиовакцины (ОПВ) и инактивированной полиовакцины (ИПВ) (Thompson & Duintjer Tebbens, 2012). ОПВ, в которой используются аттенуированные живые штаммы полиовируса, выпускается в жидкой форме, что позволяет легко вводить две капли внутрь. Введение ИПВ требует инъекций, проводимых обученными медицинскими работниками, хотя недавние исследования (Edens, Dybdahl-Sissoko, Weldon, Oberste, & Prausnitz, 2015; Muller et al., 2017) изучает возможность доставки ИПВ с помощью вакцинного пластыря (Badizadegan, Goodson, Rota, & Thompson, 2020). В Соединенных Штатах (США) исторические и продолжающиеся усилия по борьбе с полиомиелитом и его ликвидации принесли существенную пользу для здоровья и экономики (Thompson & Duintjer Tebbens, 2006).
ОПВ, в которой используются аттенуированные живые штаммы полиовируса, выпускается в жидкой форме, что позволяет легко вводить две капли внутрь. Введение ИПВ требует инъекций, проводимых обученными медицинскими работниками, хотя недавние исследования (Edens, Dybdahl-Sissoko, Weldon, Oberste, & Prausnitz, 2015; Muller et al., 2017) изучает возможность доставки ИПВ с помощью вакцинного пластыря (Badizadegan, Goodson, Rota, & Thompson, 2020). В Соединенных Штатах (США) исторические и продолжающиеся усилия по борьбе с полиомиелитом и его ликвидации принесли существенную пользу для здоровья и экономики (Thompson & Duintjer Tebbens, 2006).
До внедрения полиовирусных вакцин передача диких полиовирусов приводила к разрушительным вспышкам, которые вызывали паралич примерно от 1 из 200 до 1 из 2000 случаев инфицирования полностью восприимчивых лиц в зависимости от серотипа полиовируса (серотип 1 > 3 > 2), с общий показатель составляет примерно 1 случай паралича на 150 инфекций, вызванных полиовирусом (Nathanson & Kew, 2010). В середине 1900-х годов в больницах США были «полиомиелитные палаты», в которых оперировали «железные легкие», и страх, вызванный вспышками полиомиелита, побудил американцев посылать десять центов на поддержку разработки вакцин против полиомиелита (Ошинский, 2005). Ужас полиомиелита, который в настоящее время в значительной степени недооценивается всеми, кроме некоторых самых старых американцев, побудил родителей ограничить деятельность своих детей, потому что полиомиелит парализовал лишь некоторых людей, в то время как большинство инфекций протекало бессимптомно (Ошинский, 2005). Внедрение ИПВ в 1954 году, за которым последовал переход на ОПВ в начале 1960-х годов, резко сократило передачу дикого полиовируса (ДПВ) и число случаев паралича в США.С. (Томпсон и Дуинтьер Теббенс, 2006 г.). Использование вакцины против полиомиелита в США (и других странах, добившихся высокого уровня охвата иммунизацией ОПВ) устранило национальную передачу местного дикого полиовируса за счет инфицирования восприимчивых людей менее заразными и менее нейровирулентными живыми штаммами полиовируса.
В середине 1900-х годов в больницах США были «полиомиелитные палаты», в которых оперировали «железные легкие», и страх, вызванный вспышками полиомиелита, побудил американцев посылать десять центов на поддержку разработки вакцин против полиомиелита (Ошинский, 2005). Ужас полиомиелита, который в настоящее время в значительной степени недооценивается всеми, кроме некоторых самых старых американцев, побудил родителей ограничить деятельность своих детей, потому что полиомиелит парализовал лишь некоторых людей, в то время как большинство инфекций протекало бессимптомно (Ошинский, 2005). Внедрение ИПВ в 1954 году, за которым последовал переход на ОПВ в начале 1960-х годов, резко сократило передачу дикого полиовируса (ДПВ) и число случаев паралича в США.С. (Томпсон и Дуинтьер Теббенс, 2006 г.). Использование вакцины против полиомиелита в США (и других странах, добившихся высокого уровня охвата иммунизацией ОПВ) устранило национальную передачу местного дикого полиовируса за счет инфицирования восприимчивых людей менее заразными и менее нейровирулентными живыми штаммами полиовируса.
Несмотря на ее эффективность в качестве вакцины против полиомиелита, риски использования ОПВ включают вакциноассоциированный паралитический полиомиелит (ВАПП), который встречается примерно в 1 случае на миллион инфекций у полностью восприимчивых лиц (т.д., те, кто никогда не контактировал с живым полиовирусом или не был вакцинирован против полиомиелита). ВАПП представляет прямой риск для реципиентов вакцины ОПВ, а также косвенно для тех, кто вступает в контакт с лицами, инфицированными ОПВ, до тех пор, пока вирусы вакцинного происхождения продолжают передаваться вторично (Platt, Estivariz, & Sutter, 2014; Duintjer Tebbens et al. др., 2006). Кроме того, у лиц с В-клеточным первичным иммунодефицитом (ПИД) может наблюдаться длительная или хроническая инфекция ОПВ (т. е. полиовирус вакцинного происхождения, ассоциированный с иммунодефицитом длительного действия, или иПВВП), что может привести к параличу этих лиц с ВАПП (называемой iVAPP из-за ассоциации с PID) (Duintjer Tebbens, Pallansch, & Thompson, 2015; Kalkowska, Pallansch, & Thompson, 2019; Duintjer Tebbens et al.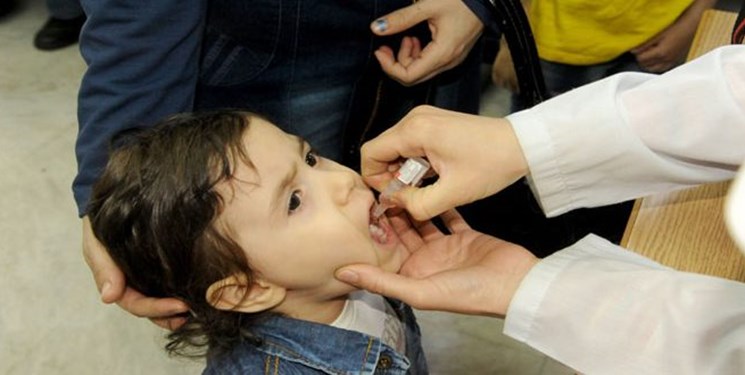 , 2006). Наконец, в популяциях с относительно низким охватом ОПВ родственные ОПВ вирусы могут мутировать и терять свои аттенуирующие мутации по мере передачи в популяции. По мере эволюции этих полиовирусов вакцинного происхождения (ПВВП) они могут становиться циркулирующими ПВВП (т. е. цПВВП), которые ведут себя как дикие полиовирусы в отношении потенциала передачи и нейровирулентности (Duintjer Tebbens et al., 2013; Kew et al., 2002; Duintjer Tebbens et al., 2006). В отсутствие случаев полиомиелита, вызванных дикими полиовирусами, начиная с 1994 г., единственные зарегистрированные случаи полиомиелита в США.S. были вызваны ВАПП (т. е. отсутствие случаев дикого полиовируса) (Thompson, 2015). В США до 2000 г. не было зарегистрировано ни одного случая ПВВП при использовании ОПВ из-за очень высокого охвата иммунизацией и условий, которые привели к относительно низкому потенциалу передачи живых полиовирусов.
, 2006). Наконец, в популяциях с относительно низким охватом ОПВ родственные ОПВ вирусы могут мутировать и терять свои аттенуирующие мутации по мере передачи в популяции. По мере эволюции этих полиовирусов вакцинного происхождения (ПВВП) они могут становиться циркулирующими ПВВП (т. е. цПВВП), которые ведут себя как дикие полиовирусы в отношении потенциала передачи и нейровирулентности (Duintjer Tebbens et al., 2013; Kew et al., 2002; Duintjer Tebbens et al., 2006). В отсутствие случаев полиомиелита, вызванных дикими полиовирусами, начиная с 1994 г., единственные зарегистрированные случаи полиомиелита в США.S. были вызваны ВАПП (т. е. отсутствие случаев дикого полиовируса) (Thompson, 2015). В США до 2000 г. не было зарегистрировано ни одного случая ПВВП при использовании ОПВ из-за очень высокого охвата иммунизацией и условий, которые привели к относительно низкому потенциалу передачи живых полиовирусов.
Несмотря на то, что к 1980 г. в США была ликвидирована местная передача дикого полиовируса (Thompson & Duintjer Tebbens, 2006), полиовирусная вакцинация в США продолжается с высоким охватом из-за риска завоза. В частности, несмотря на продолжающиеся усилия Глобальной инициативы по ликвидации полиомиелита (ГИЛП), дикий полиовирус серотипа 1 (ДПВ1) остается эндемичным в некоторых частях Пакистана и Афганистана, и недавнее моделирование предполагает его дальнейшую передачу в обозримом будущем (Калковска, Василак, Кочи, Палланш). и Томпсон, 2020 г.). В США и большинстве стран с высоким уровнем дохода национальные программы иммунизации в настоящее время рекомендуют ИПВ в качестве единственной вакцины против полиомиелита в своих плановых календарях иммунизации (т., 2020). Как инактивированная вакцина, ИПВ не вызывает инфекции и не распространяется вторично. В США рекомендации Консультативного комитета по практике иммунизации (ACIP) определяют график вакцинации в США и право на закупку по программе «Вакцины для детей», которая гарантирует полный доступ ко всем детским вакцинам. ACIP оценивает безопасность вакцин, а также их риски и преимущества в рамках своих рекомендаций, которые меняются по мере развития условий и вакцинных продуктов с течением времени.
В частности, несмотря на продолжающиеся усилия Глобальной инициативы по ликвидации полиомиелита (ГИЛП), дикий полиовирус серотипа 1 (ДПВ1) остается эндемичным в некоторых частях Пакистана и Афганистана, и недавнее моделирование предполагает его дальнейшую передачу в обозримом будущем (Калковска, Василак, Кочи, Палланш). и Томпсон, 2020 г.). В США и большинстве стран с высоким уровнем дохода национальные программы иммунизации в настоящее время рекомендуют ИПВ в качестве единственной вакцины против полиомиелита в своих плановых календарях иммунизации (т., 2020). Как инактивированная вакцина, ИПВ не вызывает инфекции и не распространяется вторично. В США рекомендации Консультативного комитета по практике иммунизации (ACIP) определяют график вакцинации в США и право на закупку по программе «Вакцины для детей», которая гарантирует полный доступ ко всем детским вакцинам. ACIP оценивает безопасность вакцин, а также их риски и преимущества в рамках своих рекомендаций, которые меняются по мере развития условий и вакцинных продуктов с течением времени.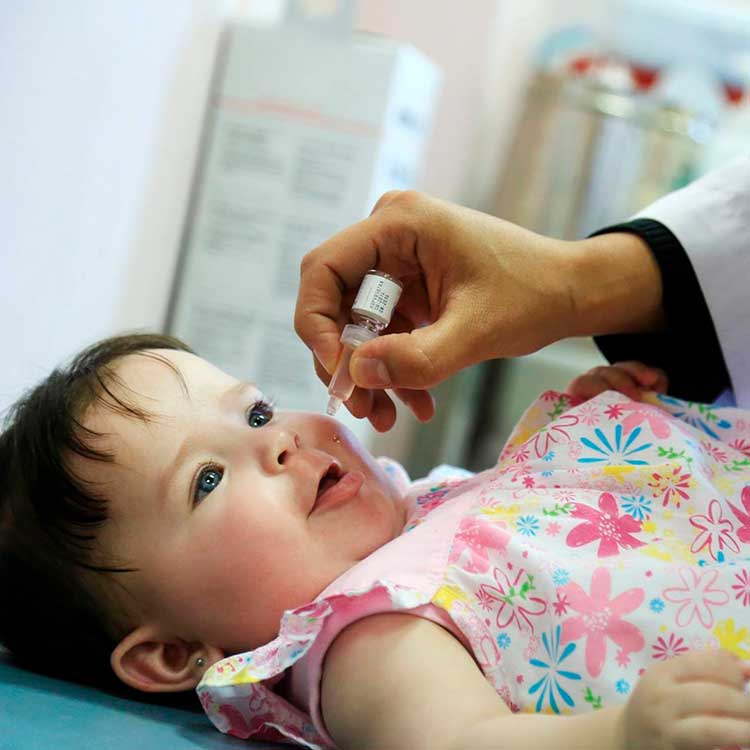 Рекомендации ACIP также определяют список вакцин, включенных в компенсацию без вины за травмы, связанные с рекомендуемыми вакцинами в рамках Программы компенсации ущерба от вакцин (VICP) (Thompson, Orenstein, & Hinman, 2020). Ранний опыт применения вакцин против полиомиелита в США привел к некоторым основополагающим судебным прецедентам, связанным с компенсацией ущерба от вакцин (Offit, 2005), а компенсация за ВАПП в рамках VICP помогла производителям ОПВ оставаться на рынке США до 2000 г.
Рекомендации ACIP также определяют список вакцин, включенных в компенсацию без вины за травмы, связанные с рекомендуемыми вакцинами в рамках Программы компенсации ущерба от вакцин (VICP) (Thompson, Orenstein, & Hinman, 2020). Ранний опыт применения вакцин против полиомиелита в США привел к некоторым основополагающим судебным прецедентам, связанным с компенсацией ущерба от вакцин (Offit, 2005), а компенсация за ВАПП в рамках VICP помогла производителям ОПВ оставаться на рынке США до 2000 г.
Использование ИПВ только для иммунизации против полиомиелита за последние 20 лет в США.S. обеспечил достаточную защиту, чтобы предотвратить перезапуск цепочек передачи живого полиовируса при любом завозе живых полиовирусов (Thompson et al., 2012; Thompson, Kalkowska, & Duintjer Tebbens, 2015), и риски возобновления передачи в США остаются очень низкими. . Однако Израиль, принявший в 2005 г. график использования только ИПВ, столкнулся с другими рисками завоза и передачи, и в 2013 г. была обнаружена широко распространенная бессимптомная передача ДПВ1, завезенного из Сирии (Anis et al., 2013). После того, как попытки остановить передачу ДПВ1 с помощью ИПВ не увенчались успехом, Израиль повторно внедрил ОПВ, используя последовательный график ИПВ/ОПВ, что положило конец передаче ДПВ1 (Kalkowska et al., 2015).
была обнаружена широко распространенная бессимптомная передача ДПВ1, завезенного из Сирии (Anis et al., 2013). После того, как попытки остановить передачу ДПВ1 с помощью ИПВ не увенчались успехом, Израиль повторно внедрил ОПВ, используя последовательный график ИПВ/ОПВ, что положило конец передаче ДПВ1 (Kalkowska et al., 2015).
В 1982 г. ACIP рекомендовал «пациентам с иммунодефицитными заболеваниями, такими как комбинированный иммунодефицит, гипогаммаглобулинемия и агаммаглобулинемия, не назначать ОПВ из-за существенно повышенного риска вакциноассоциированного заболевания» (Centers for Disease Control and Prevention, 1982).К середине 1990-х ACIP пришел к выводу, что риски ВАПП превышают преимущества использования ОПВ в США, учитывая доступность ИПВ, и, следовательно, ACIP изменил свои рекомендации, чтобы рекомендовать исключительно использование ИПВ (Centers for Disease Control and Prevention, 2000). ). Таким образом, несмотря на долгую историю безопасности использования ОПВ, ликвидация всей местной передачи ДПВ в США изменила национальный допустимый риск для ВАПП, учитывая доступность ИПВ в качестве опции. Это решение далось нелегко, потому что ИПВ не индуцирует тот же тип иммунологической защиты, что и ОПВ, и ее производство и введение обходятся гораздо дороже (Centers for Disease Control and Prevention, 2000; Miller, Sutter, Strebel, & Hadler, 1996). .С 2000 года ни один производитель вакцин не предлагал лицензированную ОПВ для рынка США. Продолжающееся использование ОПВ на мировых рынках поддержало рекомендацию ACIP в 2000 г., позволяющую потенциально использовать ОПВ для массовой вакцинации в случае вспышки полиомиелита в США (Centers for Disease Control and Prevention, 2000). Однако на момент проведения в 2006 г. анализа решений, связанных с реагированием на вспышки в США, в котором рекомендовалось хранить запасы ОПВ (Jenkins & Modlin, 2006), запасов ОПВ в США не существовало, и ни один производитель вакцин не желал повторно лицензировать ОПВ в США.S. Эти условия остаются неизменными.
Это решение далось нелегко, потому что ИПВ не индуцирует тот же тип иммунологической защиты, что и ОПВ, и ее производство и введение обходятся гораздо дороже (Centers for Disease Control and Prevention, 2000; Miller, Sutter, Strebel, & Hadler, 1996). .С 2000 года ни один производитель вакцин не предлагал лицензированную ОПВ для рынка США. Продолжающееся использование ОПВ на мировых рынках поддержало рекомендацию ACIP в 2000 г., позволяющую потенциально использовать ОПВ для массовой вакцинации в случае вспышки полиомиелита в США (Centers for Disease Control and Prevention, 2000). Однако на момент проведения в 2006 г. анализа решений, связанных с реагированием на вспышки в США, в котором рекомендовалось хранить запасы ОПВ (Jenkins & Modlin, 2006), запасов ОПВ в США не существовало, и ни один производитель вакцин не желал повторно лицензировать ОПВ в США.S. Эти условия остаются неизменными.
В целом, из-за того, что ИПВ используется только в течение многих лет (например, 20 лет в США), страны с высоким уровнем дохода, предоставляющие спасательную терапию лицам с ПИД, сталкиваются с низким и снижающимся риском случаев иВАПП или иПВВП (Kalkowska et al.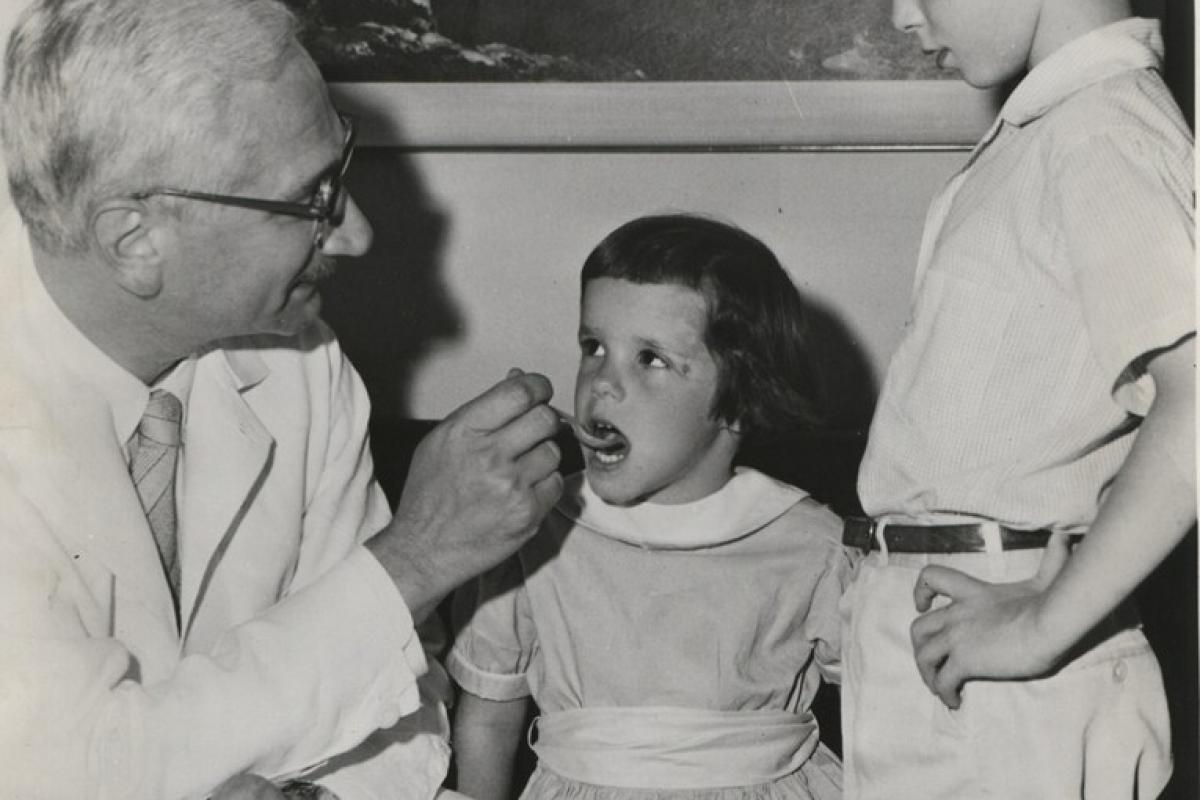 ., 2019). Любое решение об использовании ОПВ в США (или других странах с высоким уровнем дохода, которые используют исключительно ИПВ) должно приниматься после тщательного рассмотрения рисков, связанных с использованием ОПВ, включая повторное заражение живым полиовирусом у лиц с ослабленным иммунитетом и возможность передачи, а также ожидаемые затраты и выгоды.
., 2019). Любое решение об использовании ОПВ в США (или других странах с высоким уровнем дохода, которые используют исключительно ИПВ) должно приниматься после тщательного рассмотрения рисков, связанных с использованием ОПВ, включая повторное заражение живым полиовирусом у лиц с ослабленным иммунитетом и возможность передачи, а также ожидаемые затраты и выгоды.
Недавно пандемия коронавирусной болезни 2019 (COVID-19) привела к предложению повторно ввести ОПВ сначала в рамках клинических испытаний (исследование NCT04540185, начало которого запланировано на 1 ноября 2020 г.) и, возможно, в массовом масштабе в США (Чумаков, Бенн , Ааби, Коттилил и Галло, 2020 г.). Медицинские и экономические последствия такого использования остаются неохарактеризованными. Учитывая широкую известность предложения, которое включало смету расходов порядка «13 миллионов долларов на вакцинацию всего населения США.S. населения» (Sullivan, 2020), который «выглядит как бесплатный» вариант (Gallo & Arbess, 2020), и возможность «повторной вакцинации» (Gallo & Arbess, 2020), которая может включать в себя введение ее «снова и снова и снова» (Кон, 2020), мы характеризуем последствия этого предложения для здоровья и экономики.
2 МЕТОДЫ
Мы изучаем текущее состояние и доступность ОПВ для потенциального использования на рынке США. Используя информацию о стоимости полиовирусных вакцин (Thompson & Kalkowska, 2020a) и информацию о VICP (Thompson et al., 2020), мы характеризуем ожидаемые затраты на дозу в рамках предложения (Чумаков и др., 2020; Салливан, 2020) по закупке и введению ОПВ всему населению США, которое оценивается в 331 миллион человек, в долларах США ($) 2019 года. Мы систематически просматриваем литературу, связанную с потенциальными неспецифическими эффектами использования ОПВ, связанными с COVID-19, чтобы охарактеризовать потенциальные преимущества использования ОПВ среди населения США в 2020 году для целей экономического моделирования здравоохранения, связанного с COVID-19. Используя модели, ранее разработанные для передачи полиовируса в США.S. населения (Kalkowska et al., 2020; Duintjer Tebbens et al., 2013; Thompson & Duintjer Tebbens, 2006; Thompson et al.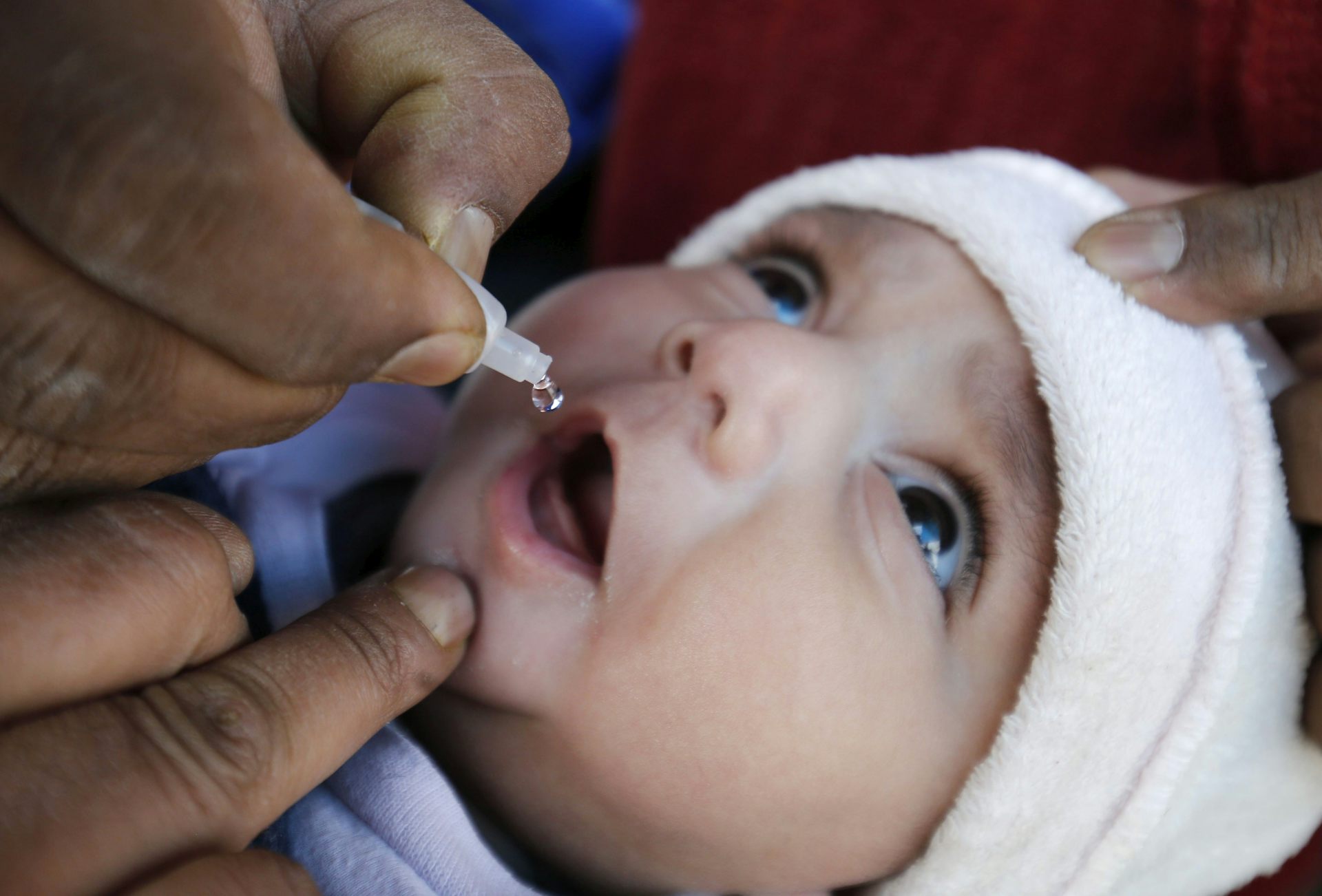 , 2015; Thompson et al., 2012), мы оцениваем ожидаемые результаты для здоровья, связанные с введением ОПВ всему населению США, которое в настоящее время включает 20 когорт новорожденных, которые не контактировали с живыми полиовирусами или имели очень ограниченный контакт с ними. Мы оцениваем количество случаев ВАПП, которые могут возникнуть, и ожидаемые новые инфекции иПВВП, которые могут возникнуть, если эти люди заразятся ОПВ.
, 2015; Thompson et al., 2012), мы оцениваем ожидаемые результаты для здоровья, связанные с введением ОПВ всему населению США, которое в настоящее время включает 20 когорт новорожденных, которые не контактировали с живыми полиовирусами или имели очень ограниченный контакт с ними. Мы оцениваем количество случаев ВАПП, которые могут возникнуть, и ожидаемые новые инфекции иПВВП, которые могут возникнуть, если эти люди заразятся ОПВ.
3 РЕЗУЛЬТАТА
3.1 Наличие лицензированной ОПВ для США
В соответствии с рекомендациями ACIP (Centers for Disease Control and Prevention, 2000), ни один из производителей вакцин в настоящее время не предлагает лицензированную ОПВ для использования в США. Следовательно, любой потенциально заинтересованный производитель ОПВ должен будет выполнить все необходимые нормативные и лицензионные действия до предложение ОПВ в США Для этого, вероятно, потребуется 18–24 месяца существующему производителю ОПВ, из которых лишь немногие в настоящее время продолжают поставлять какие-либо ОПВ на мировой рынок. По нашим оценкам, стоимость только шагов по регулированию и лицензированию, скорее всего, превысит 13 миллионов долларов, предложенных в популярных средствах массовой информации в качестве стоимости введения ОПВ всем американцам (Sullivan, 2020), по крайней мере в три раза, а возможно, и больше. если какой-либо производитель ОПВ даже рассмотрит возможность повторного выхода ОПВ на рынок США.
По нашим оценкам, стоимость только шагов по регулированию и лицензированию, скорее всего, превысит 13 миллионов долларов, предложенных в популярных средствах массовой информации в качестве стоимости введения ОПВ всем американцам (Sullivan, 2020), по крайней мере в три раза, а возможно, и больше. если какой-либо производитель ОПВ даже рассмотрит возможность повторного выхода ОПВ на рынок США.
Если США смогут обеспечить достаточное количество ОПВ для использования вне зарегистрированных показаний для всех американцев, это будет происходить за счет ограниченного глобального предложения, производимого на основе заказов стран, использующих ОПВ, или ГИЛП для поддержки ликвидации полиомиелита.В связи с запланированным скоординированным прекращением использования всех ОПВ после успешной ликвидации ДПВ (Thompson & Duintjer Tebbens, 2008; Всемирная ассамблея здравоохранения, 2008 г.) и завершенным поэтапным отказом от всех ОПВ, содержащих серотип 2, в 2016 г. вспышка серотипа 2) (Farrell et al. , 2017), страны, использующие ОПВ, в настоящее время используют бивалентную ОПВ (бОПВ), содержащую серотипы 1 и 3, для плановой иммунизации. Следовательно, в настоящее время бОПВ остается лицензированным продуктом ОПВ с наибольшим мировым предложением.Из-за опасений по поводу проведения кампаний иммунизации ОПВ, которые могут непреднамеренно увеличить количество контактов и, таким образом, увеличить передачу SARS-CoV-2, ГИЛП отменила некоторые мероприятия по иммунизации против полиомиелита в 2020 г. и отдала приоритет использованию финансируемых ГИЛП сотрудников для поддержки национальных мероприятий по реагированию на COVID-19. Это действие может означать некоторый неожиданный избыток бОПВ в дополнение к избыточному предложению, вызванному незапланированной отменой мероприятий по иммунизации в 2019 г. (ЮНИСЕФ, 2019 г.), хотя страны сообщают о дефиците бОПВ (Глобальная инициатива Всемирной организации здравоохранения по ликвидации полиомиелита, 2020 г.) .Теоретически США могли бы также попытаться использовать моновалентную ОПВ (мОПВ) из глобальных запасов, созданных для поддержки реагирования на вспышки (Thompson & Duintjer Tebbens, 2008), хотя эти запасы существуют для борьбы со вспышками полиомиелита и остаются под жестким контролем.
, 2017), страны, использующие ОПВ, в настоящее время используют бивалентную ОПВ (бОПВ), содержащую серотипы 1 и 3, для плановой иммунизации. Следовательно, в настоящее время бОПВ остается лицензированным продуктом ОПВ с наибольшим мировым предложением.Из-за опасений по поводу проведения кампаний иммунизации ОПВ, которые могут непреднамеренно увеличить количество контактов и, таким образом, увеличить передачу SARS-CoV-2, ГИЛП отменила некоторые мероприятия по иммунизации против полиомиелита в 2020 г. и отдала приоритет использованию финансируемых ГИЛП сотрудников для поддержки национальных мероприятий по реагированию на COVID-19. Это действие может означать некоторый неожиданный избыток бОПВ в дополнение к избыточному предложению, вызванному незапланированной отменой мероприятий по иммунизации в 2019 г. (ЮНИСЕФ, 2019 г.), хотя страны сообщают о дефиците бОПВ (Глобальная инициатива Всемирной организации здравоохранения по ликвидации полиомиелита, 2020 г.) .Теоретически США могли бы также попытаться использовать моновалентную ОПВ (мОПВ) из глобальных запасов, созданных для поддержки реагирования на вспышки (Thompson & Duintjer Tebbens, 2008), хотя эти запасы существуют для борьбы со вспышками полиомиелита и остаются под жестким контролем. В целом любое незапланированное использование больших количеств вакцин создает проблемы для цепочки поставок, а крупные заказы стран с высоким уровнем доходов могут существенно исказить доступ к вакцинам для стран с относительно низкими доходами.
В целом любое незапланированное использование больших количеств вакцин создает проблемы для цепочки поставок, а крупные заказы стран с высоким уровнем доходов могут существенно исказить доступ к вакцинам для стран с относительно низкими доходами.
3.2 сметы расходов
Следуя предложению о одновременном введении ОПВ всему населению США (Чумаков и др., 2020) (при условии положительного результата клинического испытания) и на основе неявного гипотетического предположения о неограниченном предложении лицензированной партии ОПВ, которую США могут закупить, мы предполагаем необходимость закупки 331 млн доз для однократного тура вакцинации. Платежи за VICP будут стоить 0,75 доллара США за дозу (Thompson et al., 2020), что приводит к затратам в размере 248 миллионов долларов только на страхование, чтобы компенсировать идентифицируемых лиц, которые будут обращаться с VAPP.Мы оцениваем минимальную среднюю цену в 8,75 долларов США за дозу на основе недавней предварительной оценки для стран с высоким уровнем дохода (Thompson & Kalkowska, 2020a). Это будет означать более 2,9 миллиардов долларов для самой OPV. Эта оценка может оказаться низкой, поскольку стоимость одной дозы ОПВ до ее прекращения в США превышала приблизительно 4 и 17 долларов США за дозу для государственного и частного секторов, соответственно (цены указаны в других источниках (Miller et al., 1996; Thompson & Duintjer Tebbens, 2006 г.) конвертирован в доллары США 2019 г., а также см. Dreazen, 1999).Если предположить, что 50 % государственного и частного секторов (Miller et al., 1996; Thompson & Duintjer Tebbens, 2006), то это подразумевает более 10 долларов США за дозу в среднем на основе исторических цен в США. Наконец, мы оцениваем административные расходы как минимум в 4 доллара на дозу, что означает 1,3 миллиарда долларов на введение ОПВ. В сумме это оценивается в более чем 4,4 миллиарда долларов США для одного раунда вакцинации ОПВ для всего населения США, что превышает 13 миллионов долларов, предложенных в популярных средствах массовой информации (Sullivan, 2020), в 342 раза.
Это будет означать более 2,9 миллиардов долларов для самой OPV. Эта оценка может оказаться низкой, поскольку стоимость одной дозы ОПВ до ее прекращения в США превышала приблизительно 4 и 17 долларов США за дозу для государственного и частного секторов, соответственно (цены указаны в других источниках (Miller et al., 1996; Thompson & Duintjer Tebbens, 2006 г.) конвертирован в доллары США 2019 г., а также см. Dreazen, 1999).Если предположить, что 50 % государственного и частного секторов (Miller et al., 1996; Thompson & Duintjer Tebbens, 2006), то это подразумевает более 10 долларов США за дозу в среднем на основе исторических цен в США. Наконец, мы оцениваем административные расходы как минимум в 4 доллара на дозу, что означает 1,3 миллиарда долларов на введение ОПВ. В сумме это оценивается в более чем 4,4 миллиарда долларов США для одного раунда вакцинации ОПВ для всего населения США, что превышает 13 миллионов долларов, предложенных в популярных средствах массовой информации (Sullivan, 2020), в 342 раза.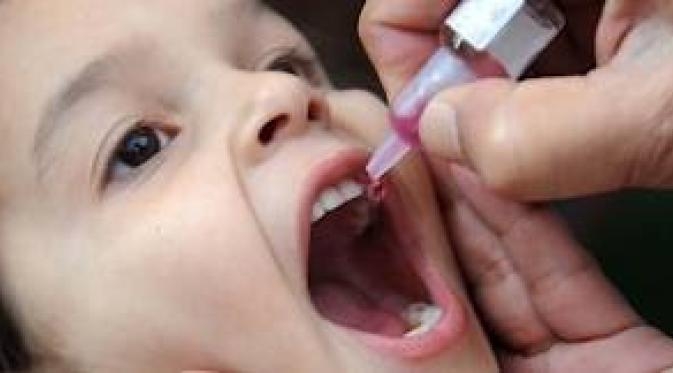 Эти затраты будут повторяться для каждой дозы ОПВ, введенной населению США для получения временных эффектов. Авторы перспективы (Чумаков и др., 2020) предположили, что США будут закупать и вводить ОПВ по цене менее 0,15 доллара США за дозу (Cohn, 2020; Sullivan, 2020) (т. цена для стран с низким уровнем дохода), без учета фактических цен на вакцины в США или затрат на доставку и страхование. Многоуровневое ценообразование на вакцины поддерживает гораздо более низкие цены на ОПВ в странах с низким уровнем доходов, но мы не ожидаем, что какие-либо производители ОПВ согласятся лицензировать и продавать ОПВ в США.S. по ценам значительно ниже тех, которые действовали до прекращения использования ОПВ в США в 2000 году. Как отмечалось выше, наша оценка цен на вакцины, скорее всего, представляет собой нижнюю границу.
Эти затраты будут повторяться для каждой дозы ОПВ, введенной населению США для получения временных эффектов. Авторы перспективы (Чумаков и др., 2020) предположили, что США будут закупать и вводить ОПВ по цене менее 0,15 доллара США за дозу (Cohn, 2020; Sullivan, 2020) (т. цена для стран с низким уровнем дохода), без учета фактических цен на вакцины в США или затрат на доставку и страхование. Многоуровневое ценообразование на вакцины поддерживает гораздо более низкие цены на ОПВ в странах с низким уровнем доходов, но мы не ожидаем, что какие-либо производители ОПВ согласятся лицензировать и продавать ОПВ в США.S. по ценам значительно ниже тех, которые действовали до прекращения использования ОПВ в США в 2000 году. Как отмечалось выше, наша оценка цен на вакцины, скорее всего, представляет собой нижнюю границу.
Признавая противопоказания для введения ОПВ всем американцам (Центры по контролю и профилактике заболеваний, 1982, 2000), мы неявно предполагаем, что дозы, приобретенные для этих людей, компенсируют любые потери вакцины. Мы также не учитываем затраты, связанные с тем, что люди берут перерыв в производственной деятельности и/или едут за ОПВ, любые дополнительные расходы системы здравоохранения на средства индивидуальной защиты и обучение, а также любые затраты на изоляцию, понесенные лицами с противопоказаниями к ОПВ (особенно ВЗОМТ), чтобы свести к минимуму риск заражения родственными ОПВ вирусами, выделяемыми реципиентами вакцины, передающими вторично.
Мы также не учитываем затраты, связанные с тем, что люди берут перерыв в производственной деятельности и/или едут за ОПВ, любые дополнительные расходы системы здравоохранения на средства индивидуальной защиты и обучение, а также любые затраты на изоляцию, понесенные лицами с противопоказаниями к ОПВ (особенно ВЗОМТ), чтобы свести к минимуму риск заражения родственными ОПВ вирусами, выделяемыми реципиентами вакцины, передающими вторично.
3.3 Медицинские последствия повторного внедрения ОПВ в США
Используя существующие модели передачи полиовируса, применяемые в США (Kalkowska et al., 2020; Duintjer Tebbens et al., 2013; Thompson & Duintjer Tebbens, 2006; Thompson et al., 2015; Thompson et al., 2012), Таблица I показывает оценки процента всего населения США, которое остается полностью восприимчивым по серотипу. В соответствии с серологическими данными национального исследования 2009–2010 годов (Wallace, Curns, Weldon, & Oberste, 2016) в Таблице I показаны различия по серотипам (3 > 1 > 2), которые отражают разные уровни вакцинации против полиомиелита и потенциал передачи для серотипы.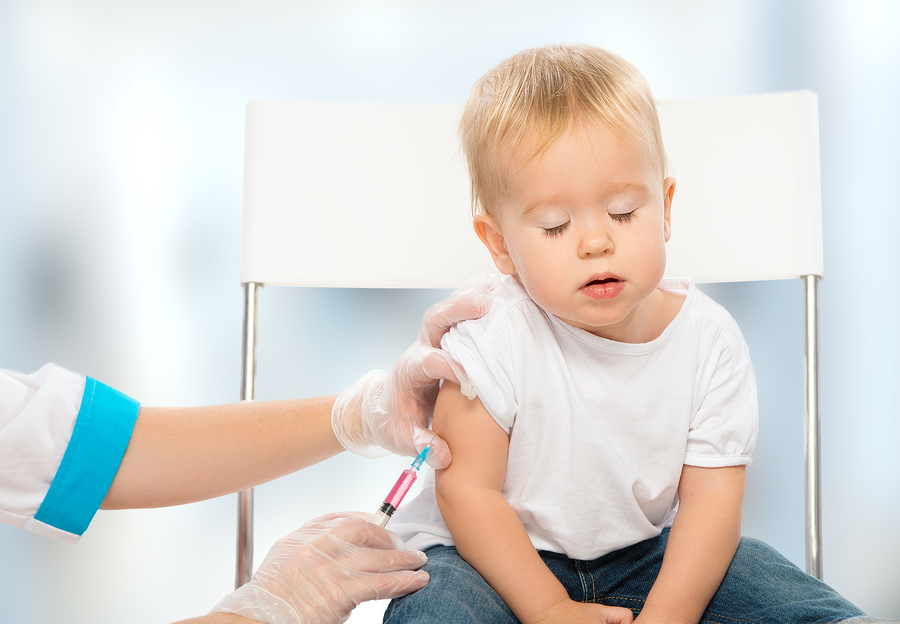 Наши оценки полностью восприимчивых лиц не соответствуют оценкам, полученным простым предположением о серологических измерениях 2009–2010 гг. (Wallace et al., 2016). Мы приписываем наши более высокие оценки иммунитета (и, следовательно, более низкие оценки полностью восприимчивых лиц) большему количеству когорт новорожденных, получающих ИПВ, с более высокими показателями прививок и высоким охватом с момента сбора данных более десяти лет назад, а также уровням обнаружения, примененным в интерпретации. результатов серологического исследования.
Наши оценки полностью восприимчивых лиц не соответствуют оценкам, полученным простым предположением о серологических измерениях 2009–2010 гг. (Wallace et al., 2016). Мы приписываем наши более высокие оценки иммунитета (и, следовательно, более низкие оценки полностью восприимчивых лиц) большему количеству когорт новорожденных, получающих ИПВ, с более высокими показателями прививок и высоким охватом с момента сбора данных более десяти лет назад, а также уровням обнаружения, примененным в интерпретации. результатов серологического исследования.
| Вакцина, серотип | Процент полностью восприимчивого населения США (%) | Скорость взятия | Уровень ВАПП на полностью восприимчивого человека | Ожидаемые случаи ВАПП |
|---|---|---|---|---|
| бОПВ, серотип 1 | 5. 4 4 | 0,80 | 7.40E-08 | 1 |
| бОПВ, серотип 3 | 11,3 | 0,80 | 1.30Е-06 | 39 |
| Итого по бОПВ | 40 | |||
| мОПВ, серотип 1 | 5. 4 4 | 0,90 | 7.40E-08 | 1 |
| мОПВ, серотип 2 | 4,0 | 0,95 | 6.20Е-07 | 8 |
| мОПВ, серотип 3 | 11,3 | 0,85 | 1.30E-06 | 41 |
В Таблице I также показаны наши предположения относительно частоты взятия проб для каждого серотипа для бОПВ или мОПВ, а также наша предполагаемая частота ВАПП на полностью восприимчивого индивидуума по серотипу. Мы предполагаем, что только полностью восприимчивые люди могут стать парализованными, поскольку любое предшествующее воздействие живых полиовирусов (включая ОПВ) или иммунизация ИПВ обеспечивают пожизненную защиту от паралича (Kalkowska et al., 2020). Количество случаев ВАПП зависит от серотипа(ов) ОПВ, включенного в дозу вакцины. По нашим оценкам, введение бОПВ 331 миллиону американцев в середине 2020 г. приведет к ожидаемому 40 случаям ВАПП, что, в свою очередь, приведет к требованиям по программе VICP, по которым потребуется компенсация.Для контекста в Таблицу I также включены оценки случаев ВАПП в случае применения мОПВ в 2020 году в разбивке по серотипам. Лица, парализованные ОПВ и родственными ОПВ вирусами, будут встречаться преимущественно у молодых американцев и их можно будет идентифицировать (Schudel, 2018), что контрастирует с любой статистической пользой для здоровья, связанной с использованием ОПВ для профилактики инфекции SARS-CoV-2. Из-за высокого охвата ИПВ ранее индуцированный иммунитет предотвратит паралич у большинства американцев в возрасте до 21 года, но мы по-прежнему ожидаем, что почти все молодые американцы могут широко участвовать в бессимптомной передаче, при этом динамика передачи зависит от фактического охвата.
Мы предполагаем, что только полностью восприимчивые люди могут стать парализованными, поскольку любое предшествующее воздействие живых полиовирусов (включая ОПВ) или иммунизация ИПВ обеспечивают пожизненную защиту от паралича (Kalkowska et al., 2020). Количество случаев ВАПП зависит от серотипа(ов) ОПВ, включенного в дозу вакцины. По нашим оценкам, введение бОПВ 331 миллиону американцев в середине 2020 г. приведет к ожидаемому 40 случаям ВАПП, что, в свою очередь, приведет к требованиям по программе VICP, по которым потребуется компенсация.Для контекста в Таблицу I также включены оценки случаев ВАПП в случае применения мОПВ в 2020 году в разбивке по серотипам. Лица, парализованные ОПВ и родственными ОПВ вирусами, будут встречаться преимущественно у молодых американцев и их можно будет идентифицировать (Schudel, 2018), что контрастирует с любой статистической пользой для здоровья, связанной с использованием ОПВ для профилактики инфекции SARS-CoV-2. Из-за высокого охвата ИПВ ранее индуцированный иммунитет предотвратит паралич у большинства американцев в возрасте до 21 года, но мы по-прежнему ожидаем, что почти все молодые американцы могут широко участвовать в бессимптомной передаче, при этом динамика передачи зависит от фактического охвата. Неспособность полностью изолировать и исключить лиц с противопоказаниями, в том числе с недиагностированными в настоящее время ВЗОМТ, может также привести к появлению новых экскретеров иПВВП, которые могут оставаться хронически и бессимптомно инфицированными до тех пор, пока у них не исчезнет инфекция или не разовьется иВАПП. Основываясь на нашем предыдущем моделировании иПВВП (Kalkowska et al., 2019) и доступных данных опроса (Modell, Orange, Quinn, & Modell, 2018), мы оцениваем распространенность более 10 000 американцев с ПИД, связанными с В-клетками, которые потенциально могут стать иПВВП, если они инфицированы ОПВ или родственными ОПВ вирусами.В сентябре 2020 года клиническое испытание, в котором предлагалось использовать ОПВ в США (NCT04540185), предусматривало явное исключение лиц с ослабленным иммунитетом, но не исключало лиц, которые могут лично или профессионально взаимодействовать с людьми с ослабленным иммунитетом.
Неспособность полностью изолировать и исключить лиц с противопоказаниями, в том числе с недиагностированными в настоящее время ВЗОМТ, может также привести к появлению новых экскретеров иПВВП, которые могут оставаться хронически и бессимптомно инфицированными до тех пор, пока у них не исчезнет инфекция или не разовьется иВАПП. Основываясь на нашем предыдущем моделировании иПВВП (Kalkowska et al., 2019) и доступных данных опроса (Modell, Orange, Quinn, & Modell, 2018), мы оцениваем распространенность более 10 000 американцев с ПИД, связанными с В-клетками, которые потенциально могут стать иПВВП, если они инфицированы ОПВ или родственными ОПВ вирусами.В сентябре 2020 года клиническое испытание, в котором предлагалось использовать ОПВ в США (NCT04540185), предусматривало явное исключение лиц с ослабленным иммунитетом, но не исключало лиц, которые могут лично или профессионально взаимодействовать с людьми с ослабленным иммунитетом.
3.4 Неспецифические эффекты ОПВ
Мы провели поиск в PubMed® и систематических обзорах по заказу Всемирной организации здравоохранения (ВОЗ) (Higgins et al. , 2016; Kandasamy et al., 2016) исследований, связанных с ОПВ и ее потенциальными неспецифическими эффектами.Мы выявили два рандомизированных клинических испытания (Lund et al., 2015; Upfill-Brown et al., 2017) и множество других исследований.
, 2016; Kandasamy et al., 2016) исследований, связанных с ОПВ и ее потенциальными неспецифическими эффектами.Мы выявили два рандомизированных клинических испытания (Lund et al., 2015; Upfill-Brown et al., 2017) и множество других исследований.
Лунд и соавт. (2015) описывают рандомизированное неслепое клиническое исследование, в котором сравнивали эффекты вакцины против бациллы Кальметта-Герена (БЦЖ) и БЦЖ + ОПВ, введенных группе детей в Гвинее-Бисау в течение первого месяца жизни. В течение 12 месяцев наблюдения 73 из 3494 (2%) детей в группе БЦЖ + ОПВ и 88 из 3467 (2,5%) детей в группе только БЦЖ умерли, все от инфекционных заболеваний.Этот анализ привел к выводу, что ОПВ при рождении защищает от младенческой смертности. Однако эффект не был значительным, за исключением (1) случаев, когда результаты были ограничены ОПВ, введенной в течение первых 2 дней жизни, или (2) для младенцев мужского пола только тогда, когда данные были подвергнуты цензуре во время первой национальной кампании ОПВ. Это исследование основано на показателях смертности от всех причин в регионе с высокой младенческой смертностью, и не приводится никаких подробностей о каких-либо механистических или иммунологических эффектах, связанных с ОПВ.
Это исследование основано на показателях смертности от всех причин в регионе с высокой младенческой смертностью, и не приводится никаких подробностей о каких-либо механистических или иммунологических эффектах, связанных с ОПВ.
Апфилл-Браун и др.(2017) сообщают о рандомизированном клиническом исследовании в Бангладеш. После вакцинации ОПВ в возрасте 6, 10 и 14 недель младенцы получали либо ОПВ ( n = 315, что, как мы отметили, не согласуется с n = 307 для этой группы, полученным в исследовании связанных методов (Mychaleckyj et al. , 2016)) или ИПВ ( n = 299) в 39 недель, при этом эпизоды диареи наблюдались в течение следующих 12 недель. Результаты показывают меньше эпизодов диареи у младенцев, получавших ИПВ, чем в группе ОПВ (57% против 63%), но сообщалось о меньшем количестве дней диареи на эпизод (6.7 дней против 5,9) для детей грудного возраста с диареей не менее 1 дня в группе ОПВ. Таким образом, защитный эффект ОПВ (если таковой имеется) заключается в уменьшении примерно на 10% (менее 1 дня) среднего числа дней с диареей, но при этом увеличивается заболеваемость диареей и отсутствует информация о тяжести диареи. В исследовании сообщалось о значительном влиянии ОПВ на бактериальные инфекции у младенцев мужского пола, но не на вирусные или протозойные инфекции или на младенцев женского пола. Кроме того, исследование проводилось на фоне значительного диарейного заболевания в популяции с участием большинства младенцев в течение 12-недельного периода наблюдения.Несмотря на выводы исследования о защитном действии ОПВ на младенческую смертность, данные о младенческой смертности не анализируются. Исследование Upfill-Brown страдает от двух существенных методологических проблем в отношении использования в экономическом моделировании здравоохранения (Upfill-Brown et al., 2017). Во-первых, путем расчета p значений для дней и эпизодов диареи с использованием модели Пуассона с усечением до нуля, результаты исключают из сравнения пациентов с менее чем одним полным днем диареи. Это смещает выводы в сторону эффекта ОПВ.Во-вторых, младенцы, участвовавшие в исследовании, получали вакцины против кори и краснухи в период наблюдения (на 40-й неделе), и в результате любые преимущества ОПВ смешиваются с потенциальными эффектами этих дополнительных живых вакцин.
В исследовании сообщалось о значительном влиянии ОПВ на бактериальные инфекции у младенцев мужского пола, но не на вирусные или протозойные инфекции или на младенцев женского пола. Кроме того, исследование проводилось на фоне значительного диарейного заболевания в популяции с участием большинства младенцев в течение 12-недельного периода наблюдения.Несмотря на выводы исследования о защитном действии ОПВ на младенческую смертность, данные о младенческой смертности не анализируются. Исследование Upfill-Brown страдает от двух существенных методологических проблем в отношении использования в экономическом моделировании здравоохранения (Upfill-Brown et al., 2017). Во-первых, путем расчета p значений для дней и эпизодов диареи с использованием модели Пуассона с усечением до нуля, результаты исключают из сравнения пациентов с менее чем одним полным днем диареи. Это смещает выводы в сторону эффекта ОПВ.Во-вторых, младенцы, участвовавшие в исследовании, получали вакцины против кори и краснухи в период наблюдения (на 40-й неделе), и в результате любые преимущества ОПВ смешиваются с потенциальными эффектами этих дополнительных живых вакцин.
В дополнение к вышеупомянутым двум рандомизированным клиническим испытаниям, разработанным специально для изучения неспецифических иммунологических эффектов ОПВ, мы обнаружили ряд других исследований, относящихся к трем основным категориям: (1) «натуральные эксперименты» у детей, получающих различные уровни помощи (Aaby et др., 2005; Ааби и др., 2004 г.; Андерсен и др., 2018 г.; Mogensen, Andersen, Rodrigues, Benn, & Aaby, 2017), (2) исследования случай-контроль или обсервационные исследования в ответ на вспышки заболеваний среди населения в целом (Чумаков и др., 1992; Шиндаров и др., 1979; Ворошилова, 1989) и (3) обсервационные исследования во время поэтапного отказа от ОПВ в развитых странах (Seppala et al., 2011; Sørup et al., 2016). Хотя подробный систематический анализ этой литературы выходит за рамки данной рукописи, и существуют другие систематические обзоры (Higgins et al., 2016; Kandasamy et al., 2016), взятые вместе, эти исследования не показывают последовательного или универсального защитного эффекта ОПВ. Педиатрические исследования показывают гетерогенный набор исходов, обычно характеризующийся определенным защитным эффектом у одной когорты детей, но не у других (например, Aaby et al., 2005), или положительным эффектом ОПВ, вводимой до 36-месячного возраста, но не после. (например, Sørup et al., 2016), или вредное воздействие на мальчиков (Benn et al., 2008), которое противоречит положительному эффекту у мальчиков, о котором сообщают другие (Upfill-Brown et al., 2017). Исследования взрослых либо показывают наблюдения корреляции без доказательства причинно-следственной связи (Шиндаров и др., 1979), либо говорят о замечательных эффектах, при которых ОПВ, введенная в течение нескольких часов после появления респираторных симптомов, эффективно излечивает грипп или острую респираторную недостаточность менее чем за год. день (Чумаков и др., 1992). Наконец, мы отмечаем устоявшееся признание того, что факторы хозяина влияют на тип и тяжесть иммунного ответа на антигены, при этом некоторые исследования демонстрируют это специально для ОПВ (например,г.
Педиатрические исследования показывают гетерогенный набор исходов, обычно характеризующийся определенным защитным эффектом у одной когорты детей, но не у других (например, Aaby et al., 2005), или положительным эффектом ОПВ, вводимой до 36-месячного возраста, но не после. (например, Sørup et al., 2016), или вредное воздействие на мальчиков (Benn et al., 2008), которое противоречит положительному эффекту у мальчиков, о котором сообщают другие (Upfill-Brown et al., 2017). Исследования взрослых либо показывают наблюдения корреляции без доказательства причинно-следственной связи (Шиндаров и др., 1979), либо говорят о замечательных эффектах, при которых ОПВ, введенная в течение нескольких часов после появления респираторных симптомов, эффективно излечивает грипп или острую респираторную недостаточность менее чем за год. день (Чумаков и др., 1992). Наконец, мы отмечаем устоявшееся признание того, что факторы хозяина влияют на тип и тяжесть иммунного ответа на антигены, при этом некоторые исследования демонстрируют это специально для ОПВ (например,г. , Мальдонадо и др., 1997). Такие различия в реакции хозяина необходимо изучить и смоделировать, прежде чем можно будет распространить неспецифические эффекты ОПВ на здоровье населения.
, Мальдонадо и др., 1997). Такие различия в реакции хозяина необходимо изучить и смоделировать, прежде чем можно будет распространить неспецифические эффекты ОПВ на здоровье населения.
Таким образом, два контролируемых исследования, специально разработанные для измерения положительного эффекта ОПВ (Lund et al., 2015; Upfill-Brown et al., 2017), не предоставляют доказательств, свидетельствующих об измеримом воздействии на население США. Многочисленные другие клинические отчеты указывают на противоречивые и гетерогенные результаты в предвзятых или высокоизбирательных популяциях, которые не поддаются обобщению.В совокупности эти клинические исследования подтверждают общую концепцию иммунологического разнообразия, связанного с факторами хозяина, включая предшествующие инфекции в анамнезе. Однако гипотеза о том, что ОПВ специфически повышает иммунитет таким образом, что это приносит пользу здоровью человека (помимо индукции специфического иммунитета против полиомиелита), остается недоказанной. Этот вывод согласуется с результатами систематических обзоров аналогичных исследований других вакцин, проведенных по заказу ВОЗ. Примечательно, что в одном из обзоров был сделан вывод о том, что «качество доказательств, однако, не дает уверенности ни в характере, величине или сроках неспецифических иммунологических эффектов после вакцинации БЦЖ, вакцинами против дифтерии, коклюша, столбняка или кори, ни в клинической значимости вакцин. находки» (Kandasamy et al., 2016). Мы также отмечаем, что страны, которые отказались от ОПВ в прошлом, не сообщали об увеличении младенческой смертности или госпитализаций, поэтому любые опасения по поводу того, что поэтапный отказ от ОПВ может привести к потенциально более высокой младенческой смертности или неблагоприятным последствиям для здоровья человека, не подтверждаются в недостаточной мере. имеющиеся доказательства на сегодняшний день. Таким образом, для целей экономического анализа здравоохранения мы не видим достаточных доказательств пользы модели (т.
Этот вывод согласуется с результатами систематических обзоров аналогичных исследований других вакцин, проведенных по заказу ВОЗ. Примечательно, что в одном из обзоров был сделан вывод о том, что «качество доказательств, однако, не дает уверенности ни в характере, величине или сроках неспецифических иммунологических эффектов после вакцинации БЦЖ, вакцинами против дифтерии, коклюша, столбняка или кори, ни в клинической значимости вакцин. находки» (Kandasamy et al., 2016). Мы также отмечаем, что страны, которые отказались от ОПВ в прошлом, не сообщали об увеличении младенческой смертности или госпитализаций, поэтому любые опасения по поводу того, что поэтапный отказ от ОПВ может привести к потенциально более высокой младенческой смертности или неблагоприятным последствиям для здоровья человека, не подтверждаются в недостаточной мере. имеющиеся доказательства на сегодняшний день. Таким образом, для целей экономического анализа здравоохранения мы не видим достаточных доказательств пользы модели (т. е. никаких положительных внешних эффектов, имеющих отношение к потенциальному включению в экономический анализ здоровья в отношении полиомиелита или COVID-19).
е. никаких положительных внешних эффектов, имеющих отношение к потенциальному включению в экономический анализ здоровья в отношении полиомиелита или COVID-19).
Мы также отмечаем, что недавнее предложение о внедрении ОПВ среди населения в целом предполагает, что временное усиление врожденного иммунитета от ОПВ у всего населения США может привести к нарушению передачи SARS-CoV-2 (Чумаков К. и соавт. , 2020). Хотя это может представлять собой теоретическую возможность, практическая реальность совершенно иная. Что касается передачи SARS-CoV-2, неспецифические эффекты (если таковые имеются) временного повышения врожденного иммунитета будут ослабевать, и, таким образом, реципиенты ОПВ будут подвергаться риску заражения SARS-CoV-2, поскольку он продолжает передавать через население.В частности, в отличие от вакцины, которая индуцирует специфический иммунитет к SARS-CoV-2, любое преимущество ОПВ будет зависеть от воздействия SARS-CoV-2, возникающего после индуцированного ОПВ врожденного иммунитета, что происходит только у некоторых людей. Получение ОПВ может привести к одновременному заражению ОПВ лиц, уже инфицированных SARS-CoV-2, что может непредсказуемым образом повлиять на течение одного или обоих заболеваний.
Получение ОПВ может привести к одновременному заражению ОПВ лиц, уже инфицированных SARS-CoV-2, что может непредсказуемым образом повлиять на течение одного или обоих заболеваний.
3.5 Логистика и компромисс между рисками
Логистика введения вакцины, даже пероральной, всем (или большинству) американцев в течение короткого периода времени, вероятно, окажется неразрешимой из-за отсутствия существующих механизмов доставки доз отдельным лицам, что мы должны признать как важным аспектом развертывания любых будущих вакцин против SARS-CoV-2.Кроме того, риски приведения людей в контакт для введения доз ОПВ, которые поставляются в многодозовых флаконах, подразумевают риск потенциальной передачи SARS-CoV-2 в местах введения ОПВ.
В соответствии с глобальным обязательством по сдерживанию распространения живых полиовирусов (Всемирная ассамблея здравоохранения, 2018 г.) и встречами с производителями полиовирусных вакцин (Всемирная организация здравоохранения и ЮНИСЕФ, 2018 г. ) США создали свой Национальный орган по сдерживанию распространения (НАС) (Центры по контролю за заболеваниями и профилактика, 2020 г.).NAC США «настоятельно рекомендует учреждениям уничтожать все образцы, содержащие полиовирусы, которые не считаются необходимыми», включая вирусы, связанные с ОПВ.
) США создали свой Национальный орган по сдерживанию распространения (НАС) (Центры по контролю за заболеваниями и профилактика, 2020 г.).NAC США «настоятельно рекомендует учреждениям уничтожать все образцы, содержащие полиовирусы, которые не считаются необходимыми», включая вирусы, связанные с ОПВ.
4 ОБСУЖДЕНИЕ
Этот анализ показывает, что медицинские и финансовые ресурсы для повторного внедрения ОПВ среди населения США могут привести к значительным медицинским и финансовым затратам без ожидаемых идентифицируемых преимуществ. Должностные лица общественного здравоохранения США должны учитывать риски и затраты на использование ОПВ в США.S. и признать альтернативные издержки использования более чем 4,4 миллиарда долларов США для неспецифических преимуществ ОПВ вместо разработки конкретных вакцин и стратегий доставки вакцин против SARS-CoV-2.
Любое решение о возобновлении использования ОПВ в США должно учитывать логистику и реалистичные оценки ожидаемых затрат и выгод, и мы предлагаем, чтобы они были рассмотрены ACIP./cdn.vox-cdn.com/uploads/chorus_image/image/64323231/486502.0.jpg) Повторное внедрение ОПВ среди населения США при значительно менее чем 100-процентном охвате может привести к неожиданной и бессимптомной передаче родственных ОПВ вирусов из-за того, что значительное число молодых американцев ранее не контактировали с живыми полиовирусами (Thompson et al., 2015; Томпсон и др., 2012). Из-за нынешнего уровня доверия к вакцинам (Национальный консультативный комитет по вакцинам, 2015 г.) не все американцы, вероятно, даже примут 100% эффективную вакцину против COVID-19. Следует ожидать еще более низкого уровня соблюдения ОПВ, поскольку она не обеспечивает ожидаемого эффективного или устойчивого иммунитета против SARS-CoV-2. Любое внедрение ОПВ в США без надлежащего контроля изоляции, даже в контексте небольшого количества доз, потенциально предпочтительнее для лиц с высоким риском заражения COVID-19 в рамках клинических испытаний, может привести к перезапуску цепочки передачи ОПВ. .Такие цепочки передачи, которые, как и в Израиле, протекают бессимптомно, могут привести к передаче ПВВП на уровне, который может привести к предполагаемой или фактической необходимости более широкого использования ОПВ.
Повторное внедрение ОПВ среди населения США при значительно менее чем 100-процентном охвате может привести к неожиданной и бессимптомной передаче родственных ОПВ вирусов из-за того, что значительное число молодых американцев ранее не контактировали с живыми полиовирусами (Thompson et al., 2015; Томпсон и др., 2012). Из-за нынешнего уровня доверия к вакцинам (Национальный консультативный комитет по вакцинам, 2015 г.) не все американцы, вероятно, даже примут 100% эффективную вакцину против COVID-19. Следует ожидать еще более низкого уровня соблюдения ОПВ, поскольку она не обеспечивает ожидаемого эффективного или устойчивого иммунитета против SARS-CoV-2. Любое внедрение ОПВ в США без надлежащего контроля изоляции, даже в контексте небольшого количества доз, потенциально предпочтительнее для лиц с высоким риском заражения COVID-19 в рамках клинических испытаний, может привести к перезапуску цепочки передачи ОПВ. .Такие цепочки передачи, которые, как и в Израиле, протекают бессимптомно, могут привести к передаче ПВВП на уровне, который может привести к предполагаемой или фактической необходимости более широкого использования ОПВ. Мы не видим оправдания для каких-либо рисков или затрат, связанных с внедрением ОПВ для получения временных неспецифических эффектов (если таковые имеются) против SARS-CoV-2.
Мы не видим оправдания для каких-либо рисков или затрат, связанных с внедрением ОПВ для получения временных неспецифических эффектов (если таковые имеются) против SARS-CoV-2.
Ситуация в США существенно отличается от ситуации в большинстве стран, которые в настоящее время используют лицензированную бОПВ в своих национальных программах иммунизации.Из-за условий в этих странах (например, повышенный риск завоза, относительно низкий уровень охвата вакцинацией, скученность, гигиена и т. д.) ИПВ не останавливает и не предотвращает передачу живых полиовирусов (диких или связанных с ОПВ). Таким образом, в большинстве стран национальные программы иммунизации должны использовать ОПВ для остановки и предотвращения передачи диких полиовирусов и цПВВП (Thompson et al., 2015). Стратегия ГИЛП требует, чтобы для каждого из трех серотипов полиовируса страны, использующие ОПВ, достигли и поддерживали высокий уровень охвата ОПВ, чтобы одновременно повсеместно положить конец всей передаче ДПВ, после чего может быть подтверждена успешная глобальная ликвидация местной передачи серотипа ДПВ (как произошло для серотипа 2 в 2015 г. и серотипа 3 в 2019 г. (Всемирная организация здравоохранения, 2015, 2019)).После сертификации план ГИЛП включает глобально скоординированное прекращение использования серотипа ОПВ для ликвидации всех ПВВП (т. е. за исключением любого экстренного применения ОПВ), как это произошло в отношении серотипа 2 в 2016 г. (Farrell et al, 2017).
и серотипа 3 в 2019 г. (Всемирная организация здравоохранения, 2015, 2019)).После сертификации план ГИЛП включает глобально скоординированное прекращение использования серотипа ОПВ для ликвидации всех ПВВП (т. е. за исключением любого экстренного применения ОПВ), как это произошло в отношении серотипа 2 в 2016 г. (Farrell et al, 2017).
Причина того, что глобальная ликвидация полиомиелита по-прежнему занимает так много времени, заключается в том, что вакцинировать почти всех (или, по крайней мере, достаточное количество) восприимчивых людей во всем мире сложно. Новые дети, рождающиеся каждый день, требуют постоянных усилий по охвату новых когорт рождений, и странам также необходимо наверстать упущенное в прошлом.В странах, использующих ОПВ, ОПВ выполняет часть работы по выявлению пропущенных детей из-за вторичного распространения, но, как уже отмечалось, вторичное распространение сопряжено с некоторыми рисками. Тем не менее, в странах, использующих ОПВ, любые преимущества неспецифического усиления иммунитета от использования ОПВ будут вторичными по сравнению с преимуществами достижения и поддержания высокого уровня охвата ОПВ, что необходимо для ликвидации полиомиелита. Для этих стран, если довод о неспецифических эффектах использования ОПВ в отношении предотвращения некоторых случаев COVID-19 обеспечивает средства для увеличения охвата вакцинацией против полиомиелита, то любые выгоды будут соответствовать существующей национальной политике и стратегиям.
Для этих стран, если довод о неспецифических эффектах использования ОПВ в отношении предотвращения некоторых случаев COVID-19 обеспечивает средства для увеличения охвата вакцинацией против полиомиелита, то любые выгоды будут соответствовать существующей национальной политике и стратегиям.
ГИЛП продолжает выполнять свою миссию по окончательному прекращению передачи диких полиовирусов и остановке всех случаев полиомиелита, и любые рекомендации, касающиеся использования ОПВ, должны даваться в контексте полной осведомленности о текущей глобальной ситуации. Ситуация с продолжающейся передачей серотипа 2 в Африке в то время, когда передача должна была прекратиться в соответствии с глобальной стратегией (Kalkowska et al., 2020), указывает на необходимость разработки более эффективных стратегий и/или более эффективных вакцин ОПВ, которые не поставляются с одинаковыми Риски ВАПП и ПВВП (если возможно) (Thompson, 2019).Такие усилия по разработке новых штаммов ОПВ (Van Damme et al.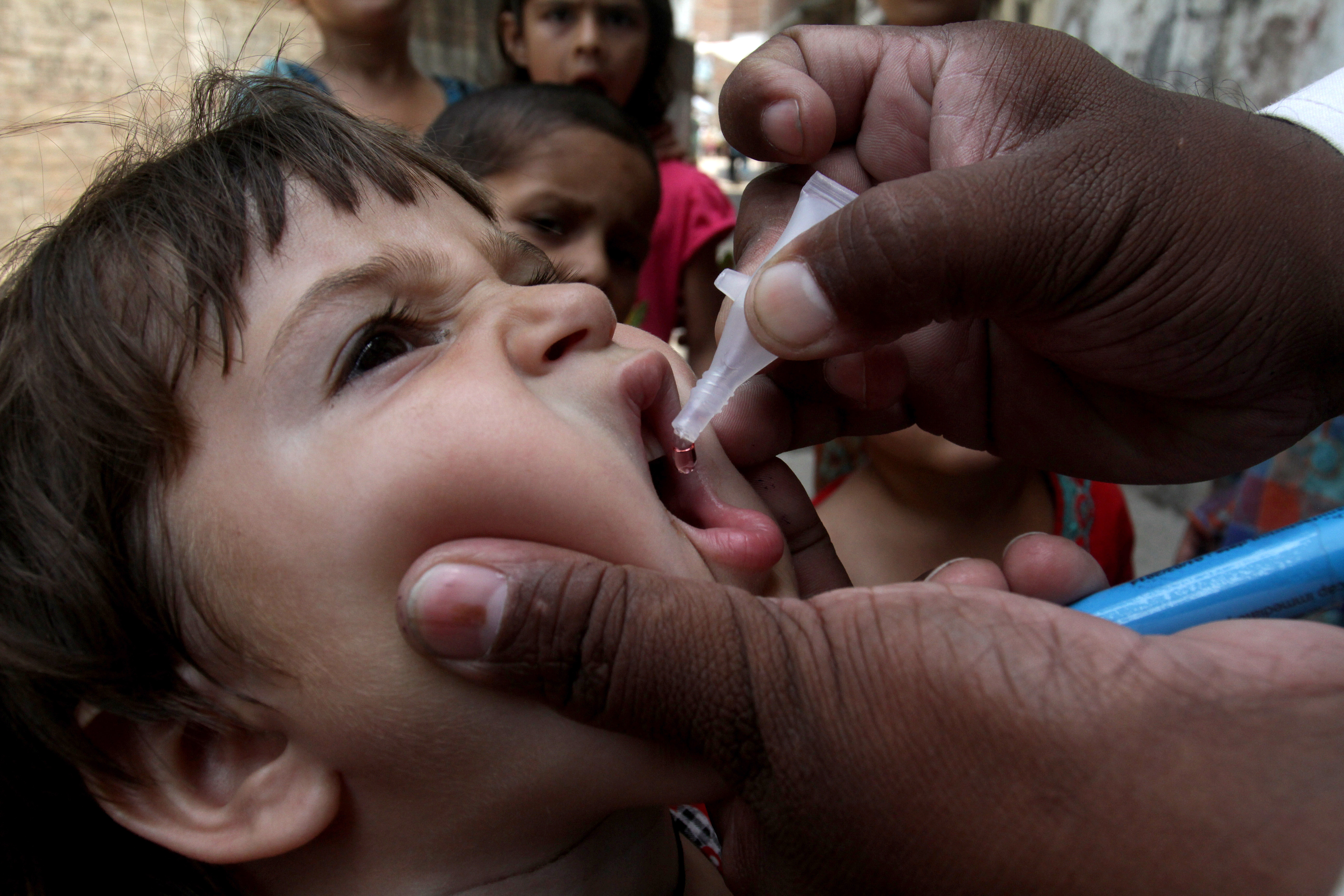 , 2019) уже предпринимаются, и их клинические испытания, вероятно, покажут, в какой степени они снижают или устраняют риски, связанные с ОПВ, а также в какой степени они сохраняют преимущества. .
, 2019) уже предпринимаются, и их клинические испытания, вероятно, покажут, в какой степени они снижают или устраняют риски, связанные с ОПВ, а также в какой степени они сохраняют преимущества. .
Ликвидация полиомиелита по-прежнему может представлять собой один из самых успешных примеров сотрудничества в области общественного здравоохранения в глобальном масштабе, но только в том случае, если национальные и глобальные лидеры в области здравоохранения сосредоточатся на достижении высокой эффективности рентабельных стратегий, позволяющих достичь цели.Лидеры национальной политики в области здравоохранения сталкиваются с множеством вариантов выбора полиомиелитной вакцины (вакцин) для использования в своих национальных программах иммунизации, а также способов их оптимального администрирования и финансирования (Thompson & Kalkowska, 2020a).
Признавая логистические проблемы доставки любой вакцины всему населению США в ответ на пандемию, мы ожидаем, что государственные инвестиции в стратегии, основанные на неспецифических эффектах, могут привести к непредвиденным последствиям. Например, если ОПВ является первой вакциной, введенной американскому населению против SARS-CoV-2, то это может повлиять на готовность принять вакцины, вызывающие специфический иммунитет против SARS-CoV-2.Мы предлагаем, чтобы любые усилия по индукции неспецифического врожденного иммунитета в США начинались с существующих лицензированных живых вакцин (например, MMR) (Fidel & Noverr, 2020) вместо вакцин, которые уже исключены из действующих стандартов лечения в США (например, ОПВ). , БЦЖ). Все вакцины, используемые в США, также должны продолжать проходить проверку ACIP, поскольку рекомендации ACIP играют решающую роль в государственном финансировании и обеспечении компенсации любых повреждений, связанных с рекомендуемыми вакцинами.
Например, если ОПВ является первой вакциной, введенной американскому населению против SARS-CoV-2, то это может повлиять на готовность принять вакцины, вызывающие специфический иммунитет против SARS-CoV-2.Мы предлагаем, чтобы любые усилия по индукции неспецифического врожденного иммунитета в США начинались с существующих лицензированных живых вакцин (например, MMR) (Fidel & Noverr, 2020) вместо вакцин, которые уже исключены из действующих стандартов лечения в США (например, ОПВ). , БЦЖ). Все вакцины, используемые в США, также должны продолжать проходить проверку ACIP, поскольку рекомендации ACIP играют решающую роль в государственном финансировании и обеспечении компенсации любых повреждений, связанных с рекомендуемыми вакцинами.
БЛАГОДАРНОСТЬ
Авторы благодарят Фонд Билла и Мелинды Гейтс за поддержку завершения этой работы [INV-009333] и благодарят Джона Модлина и Марка Палланша за полезные обсуждения.
Информационный бюллетень о полиомиелите
Полиомиелит, также известный как полиомиелит или детский паралич, представляет собой системную вирусную инфекцию, которую можно предотвратить с помощью вакцин, поражающую двигательные нейроны центральной нервной системы (ЦНС). Исторически полиомиелит был основной причиной смертности, острого паралича и пожизненной инвалидности, но крупномасштабные программы иммунизации позволили ликвидировать полиомиелит в большинстве регионов мира. Болезнь в настоящее время ограничена несколькими эндемичными районами, и предпринимаются попытки искоренить дикий полиовирус (ДПВ) во всем мире. Последнее заражение ДПВ в Европе произошло в 1998 г., а Всемирная организация здравоохранения (ВОЗ) объявила Европейский регион свободным от полиомиелита в 2002 г.
Исторически полиомиелит был основной причиной смертности, острого паралича и пожизненной инвалидности, но крупномасштабные программы иммунизации позволили ликвидировать полиомиелит в большинстве регионов мира. Болезнь в настоящее время ограничена несколькими эндемичными районами, и предпринимаются попытки искоренить дикий полиовирус (ДПВ) во всем мире. Последнее заражение ДПВ в Европе произошло в 1998 г., а Всемирная организация здравоохранения (ВОЗ) объявила Европейский регион свободным от полиомиелита в 2002 г.
- Полиовирусы представляют собой небольшие одноцепочечные РНК-содержащие вирусы, принадлежащие к подгруппе Enterovirus семейства Picornaviridae .Человек является единственным резервуаром вируса полиомиелита.
- Существует три различных серотипа дикого полиовируса (ДПВ), типы 1, 2 и 3, и заражение или иммунизация одним серотипом не вызывает иммунитет против двух других серотипов.
- Полиовирус типа 1 исторически был основной причиной полиомиелита во всем мире и продолжает передаваться в эндемичных районах.
 Передача как ДПВ2, так и ДПВ3 была успешно прервана во всем мире, и последние случаи были зарегистрированы в 1999 и 2012 годах соответственно.
Передача как ДПВ2, так и ДПВ3 была успешно прервана во всем мире, и последние случаи были зарегистрированы в 1999 и 2012 годах соответственно. - Пероральная полиомиелитная вакцина (ОПВ) производится из живых аттенуированных ДПВ. В очень редких случаях, если население серьезно недостаточно иммунизировано, вирус может трансформироваться в патогенные штаммы, известные как вирус полиомиелита вакцинного происхождения (ВРПВ), и циркулировать в обществе. Эти вирусы называются циркулирующими полиовирусами вакцинного происхождения (цПВВП).
- Полиовирусные инфекции могут приводить к целому ряду клинических проявлений, от субклинической инфекции до паралича и смерти.Большинство полиовирусных инфекций протекают бессимптомно; до 70% инфицированных людей не имеют симптомов, а около 25% имеют легкие симптомы.
- Паралитический полиомиелит встречается менее чем в 1% всех инфекций. Заболевание традиционно классифицируют на спинальный, бульбарный и бульбоспинальный типы в зависимости от локализации пораженных мотонейронов.

- Спинальный полиомиелит начинается с симптомов менингита, за которыми следуют выраженная миалгия и локальные сенсорные (гиперестезия, парестезии) и моторные (спазмы, фасцикуляции) симптомы.Через один-два дня наступает слабость и паралич.
- Слабость классически представляет собой асимметричный вялый паралич, пик которого приходится на 48 часов после начала заболевания. Это классифицируется как острый вялый паралич (ОВП). Проксимальные группы мышц поражаются больше, чем дистальные. Любая комбинация конечностей может быть парализована, хотя преимущественно поражаются нижние конечности.
- Бульбарный полиомиелит — тяжелая форма заболевания, возникающая в результате паралича мышц, иннервируемых черепными нервами, что может привести к дисфагии, гнусавости, застою выделений и одышке.В редких случаях полиомиелит может проявляться в виде энцефалита, клинически неотличимого от других причин вирусного энцефалита.
- Уровень смертности от острого паралитического полиомиелита колеблется от 5 до 15%.
- Паралич может прогрессировать до одной недели. Постоянная слабость наблюдается у двух третей больных паралитическим полиомиелитом. Через 30 дней большая часть обратимых повреждений исчезнет, и можно ожидать некоторого восстановления функции на срок до девяти месяцев.
- Постполиомиелитный синдром — плохо изученное состояние, характеризующееся появлением усталости, мышечной слабости и истощения у пациентов, выздоровевших от паралитического полиомиелита.Она может начаться через несколько лет после острого заболевания. Постполиомиелитный синдром не является инфекционным заболеванием, и дальнейшее обсуждение этого состояния выходит за рамки данного информационного бюллетеня. Текущие общеевропейские рекомендации по диагностике и лечению постполиомиелитного синдрома доступны в Европейской федерации неврологических обществ.
- В довакцинальную эпоху практически все дети были инфицированы вирусом полиомиелита в раннем возрасте.
- Иммунизация пероральными полиовакцинами (ОПВ) и инактивированными полиовакцинами (ИПВ) началась в конце 1950-х годов и значительно снизила заболеваемость полиомиелитом.
- С тех пор как в 1988 г. была запущена Глобальная инициатива по ликвидации полиомиелита (ГИЛП) с целью искоренения всех вирусов полиомиелита, глобальная заболеваемость снизилась более чем на 99 % с оценочных 350 000 случаев в 1988 г. в более чем 125 эндемичных странах до 140 случаев, зарегистрированных в двух странах в 2020.
- Из трех серотипов дикого полиовируса остается только ДПВ1.ДПВ2 был объявлен ликвидированным в сентябре 2015 г., а последний случай был выявлен в Индии в 1999 г. Последний случай ДПВ3 был обнаружен в ноябре 2012 г. в Нигерии, а в октябре 2019 г. он был объявлен ликвидированным.
- В 1994 г. регион ВОЗ стран Америки был сертифицирован как свободный от полиомиелита, за ним последовали Регион ВОЗ Западной части Тихого океана в 2000 г., Европейский регион ВОЗ в 2002 г. и Регион ВОЗ Юго-Восточной Азии в 2014 г. В августе 2020 г. Африканский регион ВОЗ Регион был объявлен свободным от дикого полиовируса после четырех лет отсутствия новых случаев.
- Вспышки циркулирующих полиовирусов вакцинного происхождения (цПВВП) редки, но число случаев увеличивается из-за недостаточной иммунизации населения. В 2020 г. было зарегистрировано 1 106 случаев цПВВП в 27 странах четырех регионов ВОЗ (Юго-Восточной Азии, Западной части Тихого океана, Восточного Средиземноморья и Африки) по сравнению с пятью случаями в трех странах трех регионов ВОЗ (Западная часть Тихого океана, Восточное Средиземноморье). и африканские регионы) в 2016 г. и 378 случаев цПВВП из 20 стран в 2019 г., соответственно.
- Данные по эпиднадзору за полиомиелитом и заболеваемости приводятся в Ежегодном эпидемиологическом отчете ECDC об инфекционных заболеваниях в Европе, доступном здесь.
- Интерактивная карта, показывающая случаи заболевания полиовирусом во всем мире, регулярно обновляемая ECDC, доступна здесь.
- Определение случая паралитического полиомиелита в ЕС для целей сообщения об инфекционных заболеваниях в сети сообщества можно найти здесь.
Трансмиссия
- Люди являются единственным известным резервуаром вируса полиомиелита.
- Вирус передается воздушно-капельным или аэрозольным путем из глотки и фекальным загрязнением рук, посуды, продуктов питания и воды. Большинство случаев передачи происходит через контакт от человека к человеку или фекально-оральным путем, хотя возможен и рото-оральный путь.
- Определены следующие факторы, способствующие продолжению передачи полиомиелита: высокая плотность населения; плохая инфраструктура медицинского обслуживания; плохая санитария; высокая заболеваемость диарейными заболеваниями; и низкий охват оральной вакциной против полиомиелита.
- Инкубационный период составляет примерно 7–10 дней (от 4 до 35 дней), и примерно у 25% инфицированных лиц развиваются легкие клинические симптомы, включая лихорадку, головную боль и боль в горле.
- Инфицированные лица наиболее заразны в течение 7-10 дней до и после появления симптомов. Однако полиовирус выделяется с калом до шести недель.
- В редких случаях пациенты с иммунодефицитом могут стать бессимптомными хроническими носителями ДПВ и ВРПВ.
- Полиовирус может выживать при комнатной температуре в течение нескольких недель.Было показано, что почва, сточные воды и зараженная вода содержат вирус.
- Инфекции подвержены все непривитые лица. Младенцы в первые шесть месяцев могут иметь некоторую защиту от пассивно передаваемого материнского иммунитета. Дети до пяти лет подвергаются наибольшему риску заражения инфекцией.
- Полиовирус очень заразен, уровень сероконверсии среди бытовых контактов составляет 90–100%.
- Предоставление чистой воды, улучшение гигиены и санитарии важны для снижения риска передачи инфекции в эндемичных странах.
- Иммунизация является краеугольным камнем ликвидации полиомиелита. Доступны два типа вакцины: инактивированная полиомиелитная вакцина (ИПВ) и живая аттенуированная оральная полиомиелитная вакцина (ОПВ).
- В прошлом пероральная вакцина против полиомиелита была преобладающей вакциной в глобальных кампаниях, и она до сих пор используется в эндемичных районах. Его преимущества заключаются в индукции как гуморального, так и кишечного иммунитета, а также в том, что он дешев и прост в применении. Недостатком является небольшой риск вакциноассоциированного паралитического полиомиелита (ВАПП), который встречается примерно у четырех из каждых 1 000 000 вакцинированных детей и невакцинированных контактов.
- Инактивированная вакцина против полиомиелита вводится внутримышечно и не несет никакого риска ВАПП. Недостатком является то, что он не дает кишечного иммунитета.
- В последние десятилетия европейские страны постепенно перешли от ОПВ к ИПВ, и сегодня все государства-члены ЕС используют ИПВ в своих программах иммунизации детей. Вакцина применяется в качестве комбинированной вакцины совместно с другими вакцинами. Национальные графики и политика иммунизации доступны в Календаре вакцин ECDC и на национальных веб-сайтах вакцинации. Эпиднадзор
- за ОВП является золотым стандартом выявления случаев полиомиелита и необходим для глобальной ликвидации полиомиелита. Это включает в себя выявление случаев заболевания, сбор образцов, лабораторный анализ и картирование вируса для определения происхождения штамма вируса. Для обеспечения чувствительности эпиднадзора необходимо ежегодно выявлять как минимум один случай неполиомиелитного ОВП на 100 000 населения в возрасте до 15 лет. В эндемичных регионах, чтобы обеспечить еще более высокую чувствительность, этот показатель должен составлять два на 100 000.
- Исследование смешанных проб человеческих фекалий с помощью надзора за окружающей средой связывает изоляты полиовируса от неизвестных лиц с населением, обслуживаемым системой сточных вод.Тестирование на ДПВ и ПВВП в сточных водах может предоставить ценную дополнительную информацию, особенно среди городского населения, где эпиднадзор за ОВП отсутствует или вызывает сомнения, подозревается постоянная циркуляция вируса или выявлена частая реинтродукция вируса (см. рекомендации ВОЗ). Несколько государств-членов в Европейском регионе ВОЗ усилили эпиднадзор за полиовирусами, внедрив эпиднадзор за энтеровирусами и окружающей средой.
- Европейская региональная комиссия по сертификации ликвидации полиомиелита (РКЦ) запрашивает ежегодный отчет о ходе работы (подробные сведения об остром вялом параличе (ОВП), микробиологические данные надзора за окружающей средой, охват плановой иммунизацией, наличие групп высокого риска или очагов восприимчивых лиц и наличие плана обеспечения готовности) от каждого государства-члена Европейского региона ВОЗ.В нем также сообщается о состоянии глобальной ликвидации полиомиелита, усилиях по поддержанию статуса страны, свободной от полиомиелита, в Европейском регионе, а также о выводах оценок рисков и необходимых мерах по снижению рисков.
- Все случаи ОВП должны быть исследованы на полиомиелит.
- Специального лечения острого полиомиелита не существует, и случаи лечат поддерживающе и симптоматически.
- Даже единичный случай полиомиелита считается вспышкой и требует неотложных действий.В соответствии с Международными медико-санитарными правилами 2005 г. (ММСП) любое обнаружение полиовируса, будь то ДПВ, ПВВП (типа 1, 2 или 3) или вируса Сэбина* типа 2, более чем через четыре месяца после применения моновалентной пероральной полиомиелитной вакцины типа 2 (мОПВ2) , должны быть оценены в течение 48 часов, а затем уведомлены ВОЗ в течение 24 часов. Стандартные операционные процедуры («Реагирование на вспышку полиовируса») предоставлены Глобальной инициативой по ликвидации полиомиелита.
Примечание. Информация, содержащаяся в этом информационном бюллетене, предназначена для общего ознакомления и не должна использоваться в качестве замены индивидуального опыта медицинских работников.
*Так называемый вирус Сэбина типа 2 представляет собой живой аттенуированный вакцинный штамм полиовируса типа 2.
Библиографияhttps://apps.who.int/iris/bitstream/handle/10665/67854/WHO_V-B_03.03_eng.pdf
https://www.who.int/news-room/fact-sheets/detail/poliomyelitis
https://www.who.int/news-room/feature-stories/detail/two-out-of-three-wild-poliovirus-strains-eradicated
https://polioeradication.org/
https://polioeradication.org/polio-today/polio-now/surveillance-indicators/
http://polioeradication.org/wp-content/uploads/2016/07/sop-polio-outbreak-response-version-20193101.pdf
«2020 год был ужасным годом»: козы и газировка: NPR
Многомиллиардные глобальные усилия по искоренению полиомиелита не просто остановились. Он движется назад.
Когда в 1988 году началась Глобальная инициатива по ликвидации полиомиелита, примерно 350 000 детей в год были парализованы вирусом. К 2016 году это число сократилось до 42 случаев любого типа полиомиелита в любой точке мира.
Но сейчас число случаев растет, и в ближайшие месяцы ожидается еще больший рост. На данный момент в этом году официальные лица зарегистрировали более 200 случаев дикого полиомиелита и почти 600 случаев болезни, вызванной вакциной. Большинство вакцинных штаммов полиомиелита находится в Афганистане и Пакистане, но теперь эти штаммы-изгои полиомиелита также обнаруживаются в большинстве стран Африки к югу от Сахары, Йемене, Малайзии и на Филиппинах.
Полиомиелит вакцинного происхождения вызывается остатками более ранних версий живого вируса, использовавшегося в оральной вакцине против полиомиелита.Вакцина может выделяться через фекалии. В местах с плохой санитарией вакцина может распространяться через сточные воды. Со временем вирус пероральной вакцины может размножаться, восстанавливать силу и становиться таким же вирулентным, как исходный вирус, от которого он должен защищать.
И, что хуже всего, большинство детей, рожденных после 2016 года, не имеют иммунитета к наиболее известному штамму полиомиелита вакцинного происхождения, поскольку считалось, что этот штамм находится на грани ликвидации и больше не включен в первичную пероральную вакцину, которую они должны были бы вводить получила.
Более того, миллионы детей не получили вакцины из-за конфликта и отсутствия доступа в районах Афганистана и Пакистана, контролируемых талибами, а также из-за пандемии.
«2020 год был ужасным и останется ужасным годом», — говорит Мишель Заффран, глава Глобальной инициативы по ликвидации полиомиелита Всемирной организации здравоохранения в Женеве.
Пандемия — часть проблемы. В марте ВОЗ приказала приостановить все кампании по ликвидации полиомиелита, чтобы убедиться, что вакцинаторы, идущие от дома к дому, невольно способствуют распространению COVID-19.Летом этот приказ был отменен, но «в результате от 30 до 40 стран не проводили кампании массовой иммунизации», — говорит Заффран. «За этот период до 80 миллионов детей остались незащищенными от полиомиелита».
Есть опасения, что сейчас, когда так много детей восприимчивы к полиомиелиту, могут возникнуть вспышки, особенно в районах с плохими санитарными условиями, где вирус может процветать.
И еще роль талибов в срыве усилий по вакцинации.«Последние 28 месяцев деятельность полиомиелита была запрещена в южных провинциях, контролируемых талибами, — говорит Мохаммеди Мохаммед, глава отдела иммунизации ЮНИСЕФ в Афганистане.
«Двадцать восемь месяцев! Это огромно», — говорит он о количестве времени, в течение которого талибы не позволяли вакцинаторам проводить поквартирные кампании вакцинации от полиомиелита. «Если мы будем продолжать в том же духе, вскоре у нас будут трехлетние дети, которые родились, но не были вакцинированы. Таким образом, мы создаем восприимчивых людей для мегавспышки.» И нет никаких признаков того, что талибы собираются снять запрет.
Заболеваемость растет настолько резко в Афганистане и Пакистане, что ВОЗ санкционировала повторное введение трехвалентной оральной полиомиелитной вакцины, которая была изъята из обращения — с большой помпой — в 2016 г. Трехвалентная оральная полиомиелитная вакцина также известна как «вакцина Сэбина». ,» для его разработчика Альберта Сабина.
Вакцина Сэбина содержит живые ослабленные вирусные частицы трех штаммов полиомиелита: типа 1, типа 2 и типа 3.Его легко принимать — всего две капли в рот ребенку. Это первая рабочая лошадка глобальной кампании по ликвидации полиомиелита, которая позволила работникам здравоохранения уничтожить болезнь во многих частях мира во второй половине 20-го века.
Медицинский работник делает прививку от полиомиелита ребенку в афганской провинции Кандагар. Оппозиция талибов кампаниям вакцинации оставила миллионы детей без защиты от вируса. Джавед Танвир/AFP через Getty Images скрыть заголовок
переключить заголовок Джавед Танвир/AFP через Getty ImagesМедицинский работник делает прививку от полиомиелита ребенку в афганской провинции Кандагар.Оппозиция талибов кампаниям вакцинации оставила миллионы детей без защиты от вируса.
Джавед Танвир/AFP через Getty ImagesНо к 2016 году вакцина Сэбина, похоже, изжила себя. Дикие формы полиомиелита 2-го и 3-го типов больше не встречались в природе. Более того, часть вакцины типа 2 является источником большинства новых штаммов вируса, полученных из вакцины, которые в настоящее время вызывают больше параличей, чем первоначальные дикие формы полиомиелита.Таким образом, в апреле 2016 года вакцина Сэбина должна была быть изъята из обращения во всех странах мира одновременно. Сложный процесс получил название «Переключатель».
В соответствии с этой новой стратегией в некоторых странах по-прежнему будут применяться пероральные вакцины без типа 2 – проведение кампаний массовой вакцинации, в ходе которых каждый ребенок должен получить прививку, гораздо сложнее, чем просто закапывание двух капель вакцины Сэбина в рот ребенка.
В целом, однако, странам с низким уровнем доходов будет рекомендовано начать иммунизацию детей инъекционной формой вакцины.Инъекционный препарат известен как «вакцина Солка» по имени его разработчика Джонаса Солка. Это то, что используется в Соединенных Штатах и других богатых странах. Он защищает от всех трех типов полиомиелита. Он не содержит живого вируса и, таким образом, не представляет угрозы создания штаммов болезней вакцинного происхождения.
Но сразу после The Switch возникла глобальная нехватка инъекционной версии.
Независимо от типа используемой вакцины, основным препятствием для того, чтобы сделать полиомиелит второй болезнью человека (после оспы), подлежащей ликвидации, является то, что передача полиомиелита никогда не останавливалась в афгано-пакистанском регионе.Каждой другой стране мира удалось свести к нулю случаи заболевания, даже если некоторые из этих стран продолжают сталкиваться со случайными вспышками, вызванными вакцинами.
В Афганистане правительство вместе с ЮНИСЕФ и другими агентствами по оказанию помощи пытается найти новые способы получить доступ к районам талибов. Они запускают расширенные медицинские услуги в клиниках в провинциях Гильменд, Кандагар и Урузган, чтобы вакцинировать детей не только от полиомиелита, но и от многих других заболеваний.
«Люди в этих трех провинциях действительно являются самыми малообеспеченными людьми во всей стране», — говорит Мохаммед из ЮНИСЕФ в Кабуле. «Нет проектов по водоснабжению. Нет школ. Питание — это катастрофа».
Полиомиелит не является приоритетом ни для талибов, ни для многих местных жителей, говорит он. «Сообщество начинает говорить, но почему вы всегда предлагаете две [полиомиелитные] капли? А что насчет остальных? Я имею в виду, что мы не умираем от полиомиелита.Мы умираем от кори.

 Примером является вакцина против коклюша (коклюша).
Примером является вакцина против коклюша (коклюша). Поставщик может сообщить вам подходящее время для получения этих вакцин.
Поставщик может сообщить вам подходящее время для получения этих вакцин. Передача как ДПВ2, так и ДПВ3 была успешно прервана во всем мире, и последние случаи были зарегистрированы в 1999 и 2012 годах соответственно.
Передача как ДПВ2, так и ДПВ3 была успешно прервана во всем мире, и последние случаи были зарегистрированы в 1999 и 2012 годах соответственно.