Инструкция по применению Утрожестан капсулы 200 мг 14 шт
Действующие вещества
Форма выпуска
Капсулы
Состав
Действующее вещество: Прогестерон (Progesterone)Концентрация действующего вещества: 200 мг
Фармакологический эффект
Гестагенный препарат. Прогестерон, активное вещество препарата Утрожестан, является гормоном желтого тела. Связываясь с рецепторами на поверхности клеток органов-мишеней, проникает в ядро, где активируя ДНК, стимулирует синтез РНК.
Способствует переходу слизистой оболочки матки из фазы пролиферации, вызываемой фолликулярным гормоном, в секреторную фазу. После оплодотворения способствует переходу в состояние, необходимое для развития оплодотворенной яйцеклетки. Уменьшает возбудимость и сократимость мускулатуры матки и маточных труб, стимулирует развитие концевых элементов молочной железы.
Уменьшает возбудимость и сократимость мускулатуры матки и маточных труб, стимулирует развитие концевых элементов молочной железы.
Стимулируя протеинлипазу, увеличивает запасы жира, повышает утилизацию глюкозы. Увеличивая концентрацию базального и стимулированного инсулина, способствует накоплению в печени гликогена, повышает выработку гонадотропных гормонов гипофиза, уменьшает азотемию, увеличивает выведение азота с мочой.
Активирует рост секреторного отдела ацинусов молочных желез, индуцирует лактацию.
Способствует образованию нормального эндометрия.
Фармакокинетика
При приеме внутрь
Всасывание Микронизированный прогестерон абсорбируется из ЖКТ. Концентрация прогестерона в плазме крови постепенно повышается в течение первого часа, Cmax отмечается через 1-3 ч после приема.Концентрация прогестерона в плазме крови увеличивается от 0.13 нг/мл до 4.25 нг/мл через 1 ч, до 11.75 нг/мл — через 2 ч и составляет 8.
Выведение
Выводится с мочой в виде метаболитов, 95% из них составляют глюкуронконъюгированные метаболиты, в основном 3-альфа, 5-бета-прегнанедиол (прегнандион).Указанные метаболиты, которые определяются в плазме крови и в моче, аналогичны веществам, образующимся при физиологической секреции желтого тела.При интравагинальном введении
Всасывание
Абсорбция происходит быстро, прогестерон накапливается в матке. Высокий уровень прогестерона наблюдается через 1 ч после введения. Cmax прогестерона в плазме крови достигается через 2-6 ч после введения. При введении препарата по 100 мг 2 раза/сут средняя концентрация сохраняется на уровне 9.7 нг/мл в течение 24 ч.При введении в дозах более 200 мг/сут концентрация прогестерона соответствует I триместру беременности.
Метаболизм
Метаболизируется с образованием преимущественно 3-альфа, 5-бета-прегнанедиола. Уровень 5-бета-прегнанолона в плазме не увеличивается.
Выведение
Выводится с мочой в виде метаболитов, основную часть составляет 3-альфа, 5-бета-прегнанедиол (прегнандион). Это подтверждается постоянным повышением его концентрации (Cmax 142 нг/мл через 6 ч).
Показания
Нарушения, связанные с недостатком прогестерона.
Противопоказания
Пероральный путь введения в случае выраженных нарушений функций печени.
Меры предосторожности
Препарат Утрожестан следует принимать с осторожностью у пациенток с заболеваниями и состояниями, которые могут усугубляться при задержке жидкости (артериальная гипертензия, сердечно-сосудистые заболевания, хроническая почечная недостаточность, эпилепсия, мигрень, бронхиальная астма), у пациенток с сахарным диабетом, нарушениями функции печени легкой и средней степени тяжести, фоточувствительностью.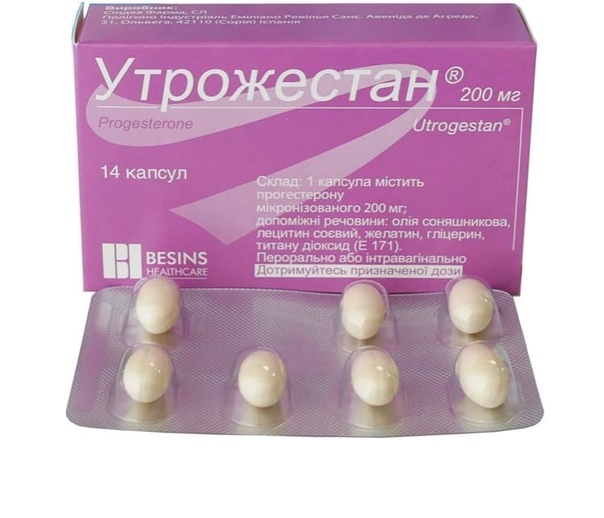
Применение при беременности и кормлении грудью
При беременности препарат можно применять только интравагинально.
Препарат следует применять с осторожностью во II и III триместрах беременности из-за риска развития холестаза.
Прогестерон проникает в грудное молоко, поэтому применение препарата противопоказано в период грудного вскармливания.
Способ применения и дозы
Пероральный путь введения, вагинальный путь введения.
Побочные действия
Сонливость или скоропреходящее головокружение, появляющиеся через 1 — 3 часа после приема препарата.
Сокращение менструального цикла и межменструальные кровянистые выделения. Эти побочные эффекты наблюдались только при приеме препарата внутрь.
Передозировка
Симптомы: сонливость, преходящее головокружение, эйфория, укорочение менструального цикла, дисменорея.
У некоторых пациенток средняя терапевтическая доза может оказаться чрезмерной из-за имеющейся или возникшей нестабильной эндогенной секреции прогестерона, особой чувствительности к препарату или слишком низкой концентрации эстрадиола.
Лечение:- в случае возникновения сонливости или головокружения необходимо уменьшить суточную дозу или назначить прием препарата перед сном на протяжении 10 дней менструального цикла,- в случае укорочения менструального цикла или мажущих кровянистых выделений рекомендуется начало лечения перенести на более поздний день цикла (например, на 19-й вместо 17-го),- в перименопаузе и при ЗГТ в постменопаузе необходимо убедиться в том, что концентрация эстрадиола является оптимальной.
При передозировке при необходимости проводят симптоматическое лечение.
Взаимодействие с другими препаратами
При пероральном применении Прогестерон усиливает действие диуретиков, гипотензивных лекарственных средств, иммунодепрессантов, антикоагулянтов. Уменьшает лактогенный эффект окситоцина.
Уменьшает лактогенный эффект окситоцина.
Одновременное применение с препаратами-индукторами микросомальных ферментов печени CYP3A4, такими как барбитураты, противоэпилептические препараты (фенитоин), рифампицин, фенилбутазон, спиронолактон, гризеофульвин, сопровождается ускорением метаболизма прогестерона в печени.
Одновременный прием прогестерона с некоторыми антибиотиками (пенициллины, тетрациклины) может привести к снижению его эффективности из-за нарушения кишечно-печеночной рециркуляции половых гормонов вследствие изменения кишечной микрофлоры.
Степень выраженности указанных взаимодействий может варьировать у разных пациенток, поэтому прогноз клинических эффектов перечисленных взаимодействий затруднен.Кетоконазол может увеличить биодоступность прогестерона.Прогестерон может повышать концентрацию кетоконазола и циклоспорина.
Прогестерон может снизить эффективность бромокриптина.
Прогестерон может вызвать снижение толерантности к глюкозе, вследствие чего — увеличить потребность в инсулине или других гипогликемических препаратах у пациенток с сахарным диабетом.
Биодоступность прогестерона может быть снижена у курящих пациенток и при чрезмерном употреблении алкоголя.При интравагинальном применении
Взаимодействие прогестерона с другими лекарственными средствами при интравагинальном применении не оценивалось. Следует избегать одновременного применения других лекарственных средств, применяемых интравагинально, во избежание нарушения высвобождения и абсорбции прогестерона.
Особые указания
Препарат Утрожестан нельзя применять с целью контрацепции.
Препарат нельзя принимать вместе с пищей, т.к. прием пищи увеличивает биодоступность прогестерона.
Необходимо наблюдать за пациентками с депрессией в анамнезе, и в случае развития депрессии тяжелой степени, необходимо отменить препарат.
Пациентки с сопутствующими сердечно-сосудистыми заболеваниями или наличием их в анамнезе должны также периодически наблюдаться врачом.
Применение препарата Утрожестан после I триместра беременности может вызвать развитие холестаза.
При длительном лечении прогестероном необходимо регулярно проводить медицинские осмотры (включая исследование функции печени), лечение необходимо отменить в случае возникновения отклонений от нормальных показателей функциональных проб печени или холестатической желтухи.
При применении прогестерона возможно снижение толерантности к глюкозе и увеличение потребности в инсулине и других гипогликемических препаратах у пациенток с сахарным диабетом.
В случае появления аменореи в процессе лечения, необходимо исключить наличие беременности.
Если курс лечения начинается слишком рано в начале менструального цикла, особенно до 15-го дня цикла, возможны укорочение цикла и/или ациклические кровотечения. В случае ациклических кровотечений не следует применять препарат до выяснения их причины, включая проведение гистологического исследования эндометрия.
При наличии в анамнезе хлоазмы или склонности к ее развитию пациенткам рекомендуется избегать УФ-облучения.Более 50% случаев самопроизвольных абортов на ранних сроках беременности обусловлено генетическими нарушениями. Кроме того, причиной самопроизвольных абортов на ранних сроках беременности могут быть инфекционные процессы и механические повреждения. Применение препарата Утрожестан в этих случаях может привести лишь к задержке отторжения и эвакуации нежизнеспособного плодного яйца.
Кроме того, причиной самопроизвольных абортов на ранних сроках беременности могут быть инфекционные процессы и механические повреждения. Применение препарата Утрожестан в этих случаях может привести лишь к задержке отторжения и эвакуации нежизнеспособного плодного яйца.
Применение препарата Утрожестан с целью предупреждения угрожающего аборта оправдано лишь в случаях недостаточности прогестерона.
В состав препарата Утрожестан входит соевый лецитин, который может вызвать реакции гиперчувствительности (крапивницу и анафилактический шок).
При проведении ЗГТ эстрогенами в период перименопаузы рекомендуется применение препарата Утрожестан в течение не менее чем 12 дней менструального цикла.
При непрерывном режиме ЗГТ в постменопаузе рекомендуется применение препарата с первого дня приема эстрогенов.
При проведении ЗГТ повышается риск развития венозной тромбоэмболии (тромбоза глубоких вен или тромбоэмболии легочной артерии), риск развития ишемического инсульта, ИБС. Из-за риска развития тромбоэмболических осложнений следует прекратить применение препарата в случае возникновения:- зрительных нарушений, таких как потеря зрения, экзофтальм, двоение в глазах, сосудистые поражения сетчатки, мигрени,- венозной тромбоэмболии или тромботических осложнений, независимо от их локализации.
Из-за риска развития тромбоэмболических осложнений следует прекратить применение препарата в случае возникновения:- зрительных нарушений, таких как потеря зрения, экзофтальм, двоение в глазах, сосудистые поражения сетчатки, мигрени,- венозной тромбоэмболии или тромботических осложнений, независимо от их локализации.
При наличии тромбофлебита в анамнезе, пациентка должна находиться под тщательным наблюдением.
При применении препарата Утрожестан с эстрогенсодержащими препаратами необходимо обращаться к инструкциям по их применению относительно рисков венозной тромбоэмболии.Результаты клинического исследования Women Health Initiative Study (WHI) свидетельствуют о небольшом повышении риска рака молочной железы при длительном, более 5 лет, совместном применении эстрогенсодержащих препаратов с синтетическими гестагенами. Не известно, имеется ли повышение риска рака молочной железы у женщин в постменопаузе при проведении ЗГТ эстрогенсодержащими препаратами в сочетании с прогестероном. Результаты исследования WHI также выявили повышение риска развития деменции при начале ЗГТ в возрасте старше 65 лет.Перед началом ЗГТ и регулярно во время ее проведения женщина должна быть обследована для выявления противопоказаний к ее проведению. При наличии клинических показаний должно быть проведено обследование молочных желез и гинекологический осмотр.
Результаты исследования WHI также выявили повышение риска развития деменции при начале ЗГТ в возрасте старше 65 лет.Перед началом ЗГТ и регулярно во время ее проведения женщина должна быть обследована для выявления противопоказаний к ее проведению. При наличии клинических показаний должно быть проведено обследование молочных желез и гинекологический осмотр.
Применение прогестерона может влиять на результаты некоторых лабораторных анализов, включая показатели функции печени, щитовидной железы, параметры коагуляции, концентрацию прегнандиола.
Влияние на способность к вождению автотранспорта и управлению механизмами
При пероральном применении препарата необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Отпуск по рецепту
Да
Утрожестан® – прогестерон с доказанной безопасностью для матери и плода
Авторы: А. Г. Резников, С.Н. Занько
Г. Резников, С.Н. Занько
Статья в формате PDF.
Среди факторов, определяющих демографическую ситуацию, важнейшую роль играют уровень и качество медицинских услуг и специализированной помощи в области гинекологии, акушерства и перинатологии. По официальным данным Европейского общества репродукции человека и эмбриологии (ESHRE), в Украине 15-17% супружеских пар страдают бесплодием, в Беларуси наблюдается схожая ситуация. Это обстоятельство в сочетании с современной тенденцией к позднему материнству обусловливает все более широкое использование вспомогательных репродуктивных технологий в решении проблемы бесплодия. Не менее актуальна проблема самопроизвольных абортов и невынашивания беременности, одной из причин которых является недостаточная выработка прогестерона желтым телом и плацентой наряду с другими факторами (растяжение матки, короткая шейка матки и т. п.).
п.).
Необычайно широкое применение прогестерона и других прогестагенов в современной медицине сопровождается незатухающим интересом к изучению их эффективности и безопасности. Особенного внимания заслуживают исследования возможных побочных эффектов прогестагенов, применяемых в программах вспомогательных репродуктивных технологий (ВРТ) и практике ведения и сохранения беременности. В Украине с этой целью применяются прогестерон и дидрогестерон. Последний относится к ксенобиотикам и по химическому строению несколько отличается от прогестерона. Наиболее высоким профилем безопасности априори должен обладать препарат, который имеет максимальное структурное сходство с молекулой эндогенного гормона желтого тела и, как следствие, является биоидентичным стероидом по отношению к природному для человека и других млекопитающих. В данном аналитическом обзоре приведены результаты клинических наблюдений, которые подтверждают это положение применительно к препарату Утрожестан® (микронизированный прогестерон в форме мягких капсул для интравагинального и перорального применения).
Уникальные свойства биоидентичного прогестерона
Прогестерон, являющийся действующей субстанцией препарата Утрожестан®, получают путем трансформации диосгенина, выделяемого методами экстракции из дикого мексиканского ямса или сои с последующим использованием технологии микронизации. Вместе с тем определение «натуральный», часто добавляемое к названию данного препарата, указывает совсем не на источник получения сырья, а на его сходство с молекулой эндогенного яичникового гормона.
Натуральный прогестерон имеет идентичную формулу и пространственную структуру, что и гормон, синтезируемый в организме человека. Поэтому в этом случае наиболее подходящим является термин «биоидентичный» (рис. 1).
Биоидентичность означает, что данный препарат имеет аналогичный метаболизм и воспроизводит все биологические и фармакологические эффекты природного прогестерона.
Общеизвестна роль прогестерона в регуляции овариально-менструального цикла, в секреторной трансформации эндометрия, сохранении беременности, регуляции полового поведения и других физиологических процессов. В Украине Утрожестан® разрешено применять при прегравидарной подготовке (частичная или полная недостаточность лютеиновой фазы), для поддержки лютеиновой фазы в индуцированных и спонтанных менструальных циклах, в программах инсеминации и экстракорпорального оплодотворения, при угрозе выкидыша, для профилактики привычных выкидышей и преждевременных родов у женщин с короткой шейкой матки или при наличии преждевременных родов в анамнезе. Не все препараты микронизированного прогестерона, зарегистрированные в Украине, имеют аналогичные показания, в частности, показаны для профилактики преждевременных родов (ПР) у женщин с короткой шейкой и ПР в анамнезе. Например, такие препараты, как Крайнон®, Эндометрин®, Лютеина®, подобного показания не имеют. В Украине, согласно инструкции по медицинскому применению, Утрожестан® разрешено применять на протяжении всего срока беременности вплоть до 36-й недели, что обеспечивает преемственность лечения.
В Украине Утрожестан® разрешено применять при прегравидарной подготовке (частичная или полная недостаточность лютеиновой фазы), для поддержки лютеиновой фазы в индуцированных и спонтанных менструальных циклах, в программах инсеминации и экстракорпорального оплодотворения, при угрозе выкидыша, для профилактики привычных выкидышей и преждевременных родов у женщин с короткой шейкой матки или при наличии преждевременных родов в анамнезе. Не все препараты микронизированного прогестерона, зарегистрированные в Украине, имеют аналогичные показания, в частности, показаны для профилактики преждевременных родов (ПР) у женщин с короткой шейкой и ПР в анамнезе. Например, такие препараты, как Крайнон®, Эндометрин®, Лютеина®, подобного показания не имеют. В Украине, согласно инструкции по медицинскому применению, Утрожестан® разрешено применять на протяжении всего срока беременности вплоть до 36-й недели, что обеспечивает преемственность лечения. В Белоруссии продолжительность лечения препаратом Утрожестан® определяется врачом по медицинским показаниям. Следует подчеркнуть, что официальные медицинские инструкции для других лекарственных форм микронизированного прогестерона, а также дидрогестерона ограничивают их применение только ранними сроками беременности.
В Белоруссии продолжительность лечения препаратом Утрожестан® определяется врачом по медицинским показаниям. Следует подчеркнуть, что официальные медицинские инструкции для других лекарственных форм микронизированного прогестерона, а также дидрогестерона ограничивают их применение только ранними сроками беременности.
Роль прогестерона в сохранении беременности характеризуется разнообразием фармакодинамических механизмов, ряд из которых специфическим образом обеспечивают его восстановленные 5-α- и 5-β-метаболиты.
Одним из основных является иммуномодулирующий эффект, благодаря которому предотвращается конфликт между иммунной системой матери и плода – носителя не только материнских, но и отцовских антигенов. Прогестерон взаимодействует с комплементарными рецепторами, которые экспрессируются на поверхности лимфоцитов и децидуальных клеток, в результате чего эти клетки начинают синтезировать белок, модулирующий иммунную систему матери, – PIBF (Progesterone Induced Blocking Factor). С увеличением срока беременности содержание PIBF в крови матери растет параллельно с увеличением концентрации прогестерона. Под влиянием PIBF снижается активность лимфоцитов типа Th‑1, что приводит к уменьшению синтеза провоспалительных цитокинов и стимулируемых ими Т-киллеров, а также уменьшению продукции В-лимфоцитами цитотоксичных симметричных антител. Одновременно PIBF стимулирует активность лимфоцитов типа Th‑2, которые способствуют синтезу противовоспалительных цитокинов и снижению активности естественных Т-киллеров, а также образованию асимметричных антител. Последние конкурируют с симметричными антителами, вытесняя их из мест связывания с эмбриональными антигенами (FAB-структурами). В итоге воспалительно-цитотоксические процессы блокируются, и плод не отторгается. Поэтому прогестерон назначают с целью сохранения беременности не только при недостаточной выработке его желтым телом и плацентой, но и при наличии неблагоприятных иммунных факторов в организме женщины.
С увеличением срока беременности содержание PIBF в крови матери растет параллельно с увеличением концентрации прогестерона. Под влиянием PIBF снижается активность лимфоцитов типа Th‑1, что приводит к уменьшению синтеза провоспалительных цитокинов и стимулируемых ими Т-киллеров, а также уменьшению продукции В-лимфоцитами цитотоксичных симметричных антител. Одновременно PIBF стимулирует активность лимфоцитов типа Th‑2, которые способствуют синтезу противовоспалительных цитокинов и снижению активности естественных Т-киллеров, а также образованию асимметричных антител. Последние конкурируют с симметричными антителами, вытесняя их из мест связывания с эмбриональными антигенами (FAB-структурами). В итоге воспалительно-цитотоксические процессы блокируются, и плод не отторгается. Поэтому прогестерон назначают с целью сохранения беременности не только при недостаточной выработке его желтым телом и плацентой, но и при наличии неблагоприятных иммунных факторов в организме женщины.
Кроме того, натуральный прогестерон обладает рядом уникальных свойств, которые детерминируются его восстановленными метаболитами и не воспроизводятся ни одним из синтетических прогестинов (рис. 2).
2).
Интересно, что сравнительно непродолжительное время нахождения прогестерона в системной циркуляции нивелируется тем, что его активные метаболиты – 20-α-гидроксипрогестерон и 17-α-гидроксипрогестерон продлевают физиологическое действие гормона. В тканях головного мозга прогестерон превращается в физиологические нейростероиды – прегнанолон и аллопрегнанолон, которые конкурентно взаимодействуют с рецепторами тормозного нейромедиатора – гамма-аминомасляной кислоты (ГАМК), проявляя свойства агонистов ГАМК. Этим объясняется анксиолитическое действие прогестерона и его седативный эффект, способствующие формированию доминанты беременности и охранительного режима психоэмоционального состояния женщины.
На поздних сроках беременности восстановленные 5-α- и 5-β-метаболиты прогестерона могут оказывать значительное влияние на стабильность беременности, обеспечивать защиту против эксайтотоксичности вследствие острого гипоксического стресса, а также на восприятие боли у матери и плода (M. Hill et al., 2011).
Hill et al., 2011).
Снижение тонуса миометрия под влиянием прогестерона происходит в результате вызываемого им изменения проводимости мембранных каналов ионов калия и закрытия кальциевых каналов. Связанная с этим гиперполяризация мембраны миоцита повышает порог возбудимости миометрия. Релаксация матки происходит также благодаря конкуренции с окситоцином, уменьшению синтеза простагландинов, антагонизму прогестерона с эстрогенами за счет усиления их метаболизма. Утеротоническое действие окситоцина блокируется также благодаря его конкурентному вытеснению из мембран миоцитов другим уникальным метаболитом 5-β-прегнандионом.
В целом токолитическое действие прогестерона определяется комплексом вышеперечисленных и других факторов.
Конкурируя с рецепторами альдостерона в почечных канальцах, прогестерон препятствует избыточному накоплению жидкости в организме беременной, что является важным аргументом в пользу выбора препарата при лечении пациенток с гестозами. Еще одним полезным эффектом натурального прогестерона, такого как Утрожестан®, является контроль уровня и биологического действия андрогенов, реализуемый посредством его конкуренции с тестостероном за фермент 5-α-редуктазу стероидов, а также конкурентных отношений тестостерона и активного метаболита 5-α-прегнандиона за клеточные рецепторы андрогенов. Антиандрогенная активность прогестерона достаточно мягкая, чтобы не вызвать феминизацию плода мужского пола, и в то же время она весьма полезна в случае избыточного андрогенного фона в организме женщины (например, при синдроме склерополикистозных яичников), беременной плодом женского пола. В одной из своих работ известный французский ученый Б. де Линьер, экс-руководитель отделения эндокринологии и репродуктивной медицины госпиталя Неккер (г. Париж), отметил, что в физиологических концентрациях прогестерон и его 5-α- и 5-β-метаболиты необходимы для развития плода как мужского, так и женского пола.
Антиандрогенная активность прогестерона достаточно мягкая, чтобы не вызвать феминизацию плода мужского пола, и в то же время она весьма полезна в случае избыточного андрогенного фона в организме женщины (например, при синдроме склерополикистозных яичников), беременной плодом женского пола. В одной из своих работ известный французский ученый Б. де Линьер, экс-руководитель отделения эндокринологии и репродуктивной медицины госпиталя Неккер (г. Париж), отметил, что в физиологических концентрациях прогестерон и его 5-α- и 5-β-метаболиты необходимы для развития плода как мужского, так и женского пола.
Следует подчеркнуть, что контроль уровня андрогенов, анксиолитический, антиминералокортикоидный и токолитический эффект биоидентичного прогестерона и его метаболитов не присущи синтетическим прогестагенам, в том числе дидрогестерону (табл.). Именно «природностью» прогестерона обусловлено его успешное использование в медицине матери и плода (Hassan et al., 2011; M. Di Renzo, 2012).
Безопасность препарата Утрожестан® в аспекте современных данных
Незыблемое правило клинической фармакологии гласит, что применение лекарственных средств во время беременности является оправданным только в том случае, если потенциальная польза от его использования превышает потенциальный риск побочных эффектов для матери и плода. Наибольшую актуальность для практикующего врача имеет выбор препарата, назначаемого в первом триместре беременности, поскольку именно в первые 8 нед происходит формирование органов и систем будущего ребенка и, следовательно, существует высокий риск аномалий развития.
Наибольшую актуальность для практикующего врача имеет выбор препарата, назначаемого в первом триместре беременности, поскольку именно в первые 8 нед происходит формирование органов и систем будущего ребенка и, следовательно, существует высокий риск аномалий развития.
В контексте дискуссионных вопросов, касающихся эффективности применения прогестагенов на ранних сроках беременности, представляется важным указать на следующее обстоятельство. На сегодняшний день медицинские источники (PubMed, Medline) не содержат ни одного прямого сравнительного исследования, оценивающего эффективность микронизированного прогестерона и дидрогестерона в лечении пациенток с высоким риском прерывания беременности и объективно подтверждающего преимущество одного из препаратов над другим. При этом результаты независимого аналитического опроса, обобщившие статистические данные, полученные из 408 ВРТ-клиник в 82 странах мира, однозначно свидетельствуют, что именно вагинальный микронизированный прогестерон является лидером поддержки лютеиновой фазы в циклах экстракорпорального оплодотворения (IVF), в то время как доля пероральных прогестинов имеет тенденцию к снижению и составляет ≤0,5% (E. Vaisbuch et al., 2014).
Vaisbuch et al., 2014).
При этом с точки зрения безопасности Утрожестан® является одним из наиболее изученных прогестагенов, опыт применения которого в клинической практике насчитывает более 35 лет и охватывает 90 стран мира. Окончательным подтверждением безопасности применения препарата в отношении неонатальных исходов стали данные мультицентрового рандомизированного плацебо-контролируемого исследования, опубликованного в престижном международном издании The New England Journal of Medicine (Commorasamy, 2015). В рамках утвержденного протокола пациенткам с привычным невынашиванием неустановленного генеза Утрожестан® назначался интравагинально в дозе 800 мг в сутки с момента получения положительного теста на беременность до 12 нед. С позиций доказательной медицины было продемонстрировано (уровень доказательности I), что применение препарата Утрожестан® в I триместре беременности не было связано с риском врожденных аномалий по сравнению с плацебо.
Ни в одном из когда-либо проводимых рандомизированных контролируемых клинических исследований не было установлено негативного влияния микронизированного прогестерона на неонатальную заболеваемость и смертность. Напротив, по ряду показателей отмечено улучшение исходов. Так, по данным крупномасштабного исследования OPPTIMUM, поражение головного мозга плода в группе женщин, получавших Утрожестан® 200 мг с целью профилактики ПР, встречалось вдвое реже по сравнению с группой плацебо.
Наблюдение за детьми до двухлетнего возраста не изменило выводов о безопасности прогестерона (Norman et al., 2016).
В контексте обсуждаемой темы представляется важным упомянуть также и о попытках поставить под сомнение безопасность натурального прогестерона для плода. Диссонансом с общепринятым мнением выглядит публикация о повышенной частоте (в 2 раза) развития гипоспадии у новорожденных в результате применения матерью прогестагенов незадолго до (для лечения бесплодия) или в первые 14 нед беременности (Carmichael et al. , 2005). Уровень доказательности в данном исследовании, проведенном в США, следует признать чрезвычайно низким, что отмечают и сами авторы. Выводы исследователей опирались на данные телефонного опроса матерей больных детей. Прогестагены назначались в связи с кровотечением во время беременности или по другим показаниям, которые интервьюируемые не могли даже идентифицировать. В 2/3 случаев выявленной гипоспадии пациентки применяли прогестерон. Женщины не всегда могли ответить на вопросы о том, какой именно препарат применялся, в какой дозе, лекарственной форме и какой способ введения они использовали. Анализ усложняло также то, что данные о фертильности родителей оказались недоступны. Данное обстоятельство представляется крайне существенным, так как предполагается, что сам факт наличия бесплодия, как мужского, так и женского, вносит свой вклад в повышение риска развития гипоспадии у новорожденных (L.S. Baskin, 2007).
, 2005). Уровень доказательности в данном исследовании, проведенном в США, следует признать чрезвычайно низким, что отмечают и сами авторы. Выводы исследователей опирались на данные телефонного опроса матерей больных детей. Прогестагены назначались в связи с кровотечением во время беременности или по другим показаниям, которые интервьюируемые не могли даже идентифицировать. В 2/3 случаев выявленной гипоспадии пациентки применяли прогестерон. Женщины не всегда могли ответить на вопросы о том, какой именно препарат применялся, в какой дозе, лекарственной форме и какой способ введения они использовали. Анализ усложняло также то, что данные о фертильности родителей оказались недоступны. Данное обстоятельство представляется крайне существенным, так как предполагается, что сам факт наличия бесплодия, как мужского, так и женского, вносит свой вклад в повышение риска развития гипоспадии у новорожденных (L.S. Baskin, 2007).
Тем не менее в 2013 г. результаты данного исследования послужили основанием для внесения информации в официальный файл SPC (Summary of Product Characteristics) в Швейцарии, доступный на сайте www.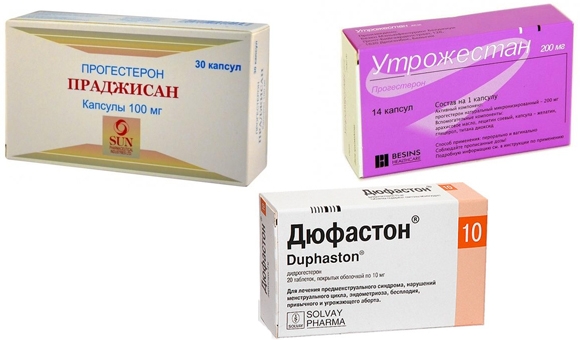 swissmedicinfo.ch. В нем, вслед за авторами исследования, указывается, что причины повышенного риска окончательно не ясны, а также отмечается: «В частности, неизвестно, связано ли повышение уровня гипоспадии после IVF с проведением гестагенной терапии или обусловлено эндокринными аномалиями матери, которые явились причиной бесплодия. Данных для оценки тератогенного риска для плода недостаточно. Также недостаточно данных исследований на животных для оценки потенциального тератогенного эффекта».
swissmedicinfo.ch. В нем, вслед за авторами исследования, указывается, что причины повышенного риска окончательно не ясны, а также отмечается: «В частности, неизвестно, связано ли повышение уровня гипоспадии после IVF с проведением гестагенной терапии или обусловлено эндокринными аномалиями матери, которые явились причиной бесплодия. Данных для оценки тератогенного риска для плода недостаточно. Также недостаточно данных исследований на животных для оценки потенциального тератогенного эффекта».
Учитывая вышеупомянутую публикацию, в том же 2013 г. Государственный экспертный центр Минздрава Украины (ГЭЦ) признал необходимым включать во все инструкции по применению прогестагенов во время беременности (включая дидрогестерон) с целью профилактики привычного невынашивания или при угрозе выкидыша в связи с лютеиновой недостаточностью упоминание о наличии единичных и неубедительных данных о риске развития гипоспадии и обязал информировать об этом пациенток. Разумеется, риск развития гипоспадии сводится к нулю, если применение прогестагена начато после 20-й недели беременности, когда завершается формирование головки полового члена. Информация о том, что решение ГЭЦ касалось только препаратов микронизированного прогестерона (Современный взгляд на гестагены, 2014), не соответствует действительности.
Информация о том, что решение ГЭЦ касалось только препаратов микронизированного прогестерона (Современный взгляд на гестагены, 2014), не соответствует действительности.
Утрожестан® характеризуется хорошей местной и системной переносимостью. При пероральном приеме единственным часто встречающимся (>1/100; <1/10) побочным эффектом является головная боль, к нечастым (>1/1000; <1/100) относятся сонливость, вялость, тошнота, рвота, диспепсия, холестатическая желтуха, зуд кожи, акне. Крайне редко (<1/10 000) возникают депрессия, крапивница, хлоазма. Интравагинальное введение может сопровождаться маслянистыми выделениями, местным зудом.
Общие вопросы системной безопасности препарата Утрожестан® при его использовании по различным медицинским показаниям освещены в многочисленных научных публикациях. В частности, было показано, что Утрожестан® не оказывает негативного влияния на массу тела, жировой и углеводный обмен, коагуляционный потенциал крови и артериальное давление.
Утрожестан® и холестатический гепатоз беременных
Поводом для обсуждения данного вопроса послужило сообщение кандидата медицинских наук В.А. Шостака (Беларусь) на конференции в г. Киеве (25-26 сентября 2014 г.) о резком увеличении частоты холестатического гепатоза у беременных и его возможной связи с гепатотоксичностью микронизированного прогестерона (Холестатический гепатоз беременных, 2014). В связи с этим нельзя не напомнить крылатое изречение Парацельса о том, что все есть яд и все лекарство, то или другое – зависит от дозы. В свою очередь добавим, что зависит также от лекарственной формы и способа применения.
В организме беременной происходят сложные анатомо-топографические, нейроэндокринные и метаболические изменения, приводящие к изменению деятельности всех органов и систем организма. При этом заболевания пищеварительной системы, особенно печени, занимают наибольший удельный вес, являясь самыми распространенными хроническими болезнями у беременных (В. А. Петухов, 1998).
А. Петухов, 1998).
Особое место среди них занимают хронические заболевания печени, которые у беременных могут быть непосредственно связаны с влиянием беременности и сопутствовать ей. При беременности часто возникают физиологические изменения желчевыводящей системы, обусловленные целым комплексом сложных метаболических и гормональных сдвигов.
Патогенез внутрипеченочного холестаза беременных (ВПХБ) пока точно не установлен. Предполагают, что избыток эндогенных половых гормонов, свойственный периоду беременности, оказывает стимулирующее влияние на процессы желчеобразования и ингибирующее – на желчевыделение (М.М. Шехтман, 1987).
Обнаружено, что до 15% случаев ВПХБ могут быть связаны с мутациями гена MDR3 (ABCB4) (J.E. Hay, 2008).
Введение экзогенного прогестерона в III триместре также может ускорить развитие ВПХБ у женщин с генетическими мутациями и врожденной предрасположенностью (приблизительно в 1% случаев). Несколько исследований свидетельствуют о том, что половые гормоны играют роль в этиологии ВПХБ. Болезнь чаще встречается при многоплодных беременностях (20,9 против 4,7% в одном исследовании), и симптомы могут повториться в подгруппе женщин, принимавших комбинированные противозачаточные препараты перорально. Кроме того, большинство женщин имеют симптомы ВПХБ в III триместре, когда уровни эстрогена и прогестерона самые высокие. Однако в большинстве исследований основное внимание уделяется эстрогенам, а не прогестерону. Существует только несколько исследований in vitro, посвященных изучению механизма развития холестаза, индуцированного метаболитом прогестерона.
Болезнь чаще встречается при многоплодных беременностях (20,9 против 4,7% в одном исследовании), и симптомы могут повториться в подгруппе женщин, принимавших комбинированные противозачаточные препараты перорально. Кроме того, большинство женщин имеют симптомы ВПХБ в III триместре, когда уровни эстрогена и прогестерона самые высокие. Однако в большинстве исследований основное внимание уделяется эстрогенам, а не прогестерону. Существует только несколько исследований in vitro, посвященных изучению механизма развития холестаза, индуцированного метаболитом прогестерона.
Прежде всего следует отметить, что общепризнанным стандартом современной репродуктивной медицины является интравагинальное применение микронизированного прогестерона, которое позволяет избежать эффекта первичного прохождения через печень и нивелировать возможное неблагоприятное воздействие у пациенток с выраженными нарушениями функции печени (Buletti et al., 1997; Cicinelli et al., 2000).
В соответствии с действующей инструкцией Республики Беларусь с целью профилактики привычного невынашивания и при угрозе выкидыша Утрожестан® назначают интравагинально или внутрь в суточной дозе 200-400 мг до 16-й недели беременности.
Целесообразность дальнейшего применения препарата определяет лечащий врач на основании клинической картины беременности, лабораторных данных и уровня прогестерона в крови.
В Украине при угрозе преждевременных родов на фоне проводимого токолиза разрешено увеличивать суточную дозу до 1200-1600 мг в сутки до исчезновения симптомов, после чего доза снижается до 200 мг 3 р/сут с пролонгацией терапии до 36 нед и возможностью перейти на вагинальный путь введения, что существенно снижает риск развития холестаза и печеночного цитолиза на протяжении II и III триместров беременности. С целью профилактики преждевременных родов у женщин с короткой шейкой матки или при наличии спонтанных преждевременных родов в анамнезе Утрожестан® разрешен к применению в суточной дозе 200 мг с 22-й до 36-й недели беременности.
Вызывает недоумение тот факт, что в своем выступлении В.А. Шостак (2014) ссылается на информационное письмо компании Besins Healthcare 20-летней давности, акцентируя внимание на том, что еще в 1998 г. компания-производитель признавала факт развития холестаза у пациенток, принимавших микронизированный прогестерон перорально в течение II и III триместра для предотвращения преждевременных родов, и в связи с этим была вынуждена ограничить срок применения препарата 12 неделями беременности. Так ли это на самом деле?
компания-производитель признавала факт развития холестаза у пациенток, принимавших микронизированный прогестерон перорально в течение II и III триместра для предотвращения преждевременных родов, и в связи с этим была вынуждена ограничить срок применения препарата 12 неделями беременности. Так ли это на самом деле?
Действительно, в медицинской литературе того периода имеются сведения о риске холестаза беременных при пероральном приеме высоких доз прогестерона во II и III триместрах беременности (Bacq et al., 1997; Benifla et al., 1997). Согласно опубликованной в 1999 г. корпоративной информации (Утрожестан® – натуральный микронизированный прогестерон, 1999), «за исключением применения во II и III триместрах беременности (пероральном. – Авт.), токсического воздействия препарата на печень не отмечалось, включая широкое применение в Европе с 1980 г., в том числе и у женщин в I триместре беременности (вагинальный путь введения)».
Основываясь на данных этих двух исследований, органы здравоохранения Франции внесли изменения в официальную информацию о препарате (SPC), в связи с чем компания известила акушерско-гинекологическое сообщество об изменениях дозировки преперата Утрожестан® (1998), распространив упомянутое ранее информационное письмо.
Еще раз напомним, что речь идет о событиях 1998 года, когда доказательная база о применении вагинального прогестерона с целью профилактики ПР еще не была сформирована (до публикации метаанализа Роберто Ромеро и рекомендаций Международной федерации гинекологии и акушерства (FIGO) оставалось долгих 14-17 лет). Не имея никакого практического руководства или клинического протокола, врачи назначали Утрожестан® эмпирически, используя различные дозы и пути введения. Осознавая все связанные с этим риски, ответственные органы здравоохранения пошли на вынужденные меры по обеспечению безопасности применения данного препарата.
Поэтому в настоящее время в разделе «Противопоказания» четко указано, что Утрожестан® не следует использовать в случаях серьезных изменений функций печени. В документе было также отмечено, что применение препарата Утрожестан® 200 мг во время беременности не является средством предупреждения ПР и что поражения печени цитолитического типа и холестаз беременных были отмечены в крайне редких случаях во время применения микронизированного прогестерона во II и III триместрах беременности.
С этого времени прошло около 20 лет, и накопленный клинический опыт убеждает нас в том, что польза от применения препарата Утрожестан® как препарата выбора сохраняющей терапии беременности значительно превышает возможные риски. Тем не менее назначение этого препарата при тяжелых поражениях печени и холестатическом гепатозе беременных не является оправданным, что однозначно отражено в инструкции по медицинскому применению. Применение препарата Утрожестан® во II и III триместрах беременности должно сопровождаться контролем функции печени.
В качестве заключения следует отметить, что ВПХБ является многофакторным и очень редким осложнением беременности (1-2% от всех беременностей), а перорально вводимый прогестерон может быть экзогенным фактором, вызывающим ВПХБ у некоторых предрасположенных или очень чувствительных к стероидным гормонам женщин, усугубляемый высоким уровнем эстрадиола и прогестерона на поздних сроках беременности.
Список литературы находится в редакции.
Тематичний номер «Гінекологія, Акушерство, Репродуктологія» № 2 (26), червень-липень 2017 р.
СТАТТІ ЗА ТЕМОЮ Акушерство/гінекологія
23.11.2021 Акушерство/гінекологія Синдром полікістозних яєчників: лікувати не можна спостерігатиВересень традиційно вважається місяцем обізнаності про синдром полікістозних яєчників (СПКЯ). Із цієї нагоди 17 вересня в Києві професійною спільнотою гінекологів України було проведено онлайн захід «СПКЯ-челендж», на якому провідні експерти галузі висвітлили сучасні тенденції ведення пацієнток із цим діагнозом. …
…
10 вересня під науковим керівництвом Асоціації акушерів-гінекологів України за підтримки компанії Амакса відбулася науково-практична конференція «Актуальні питання гінекології». Під час заходу провідні вітчизняні спеціалісти висвітлили найбільш актуальні для сьогодення проблеми сучасного акушерства й гінекології та оптимальну тактику ведення пацієнтів із цими захворюваннями. Захід проходив у форматі живого спілкування та обміну досвідом, який дав змогу кожному присутньому по закінченні доповідей отримати вичерпні відповіді від експертів на конкретні питання, що виникають у рутинній клінічній практиці лікаря, а отже, вдосконалити свою майстерність. …
…
ФАС России | ФАС признала рекламу Утрожестана ненадлежащей
ФАС признала рекламу Утрожестана ненадлежащей
На страницах медицинских журналов реклама препарата гарантировала его безопасность для матери и плода, а также содержала несоответствующие действительности сведения о природе и характеристиках лекарства
Законом о рекламе установлены требования к рекламе лекарственных препаратов, однако ООО «Безен Хелскеа РУС» при рекламировании лекарства «Утрожестан» в специализированных медицинских изданиях «Акушерство и гинекология»[1] и «Вопросы репродукции»[2] пренебрегло ими. В результате Комиссия ФАС России признала рекламу «Утрожестана» ненадлежащей, поскольку в ней содержится гарантия безопасности и эффективности, а информация о природе препарата и его характеристиках не соответствует действительности, что является нарушением Закона о рекламе[3].
В рекламе сообщается:
«…С «Утрожестаном» вы получаете больше! <…> Эффективное сохранение беременности <…> Безопасен для матери и плода…»
Сообщения «эффективное сохранение беременности» и «безопасен для матери и плода» дают основание полагать, что реклама гарантирует положительное действие, безопасность средства для матери и плода, что прямо запрещено Законом о рекламе[4].
Далее в рекламе приведена краткая инструкция по применению лекарственного препарата, предупреждение о наличии противопоказаний, изображения упаковок, а также сообщение о том, что активным веществом препарата является прогестерон натуральный микронизированный.
Вместе с тем согласно инструкции по медицинскому применению лекарственного препарата «Утрожестан», его активным веществом является прогестерон микронизированный, кроме того применение данного препарата противопоказано в период грудного вскармливания. То есть реклама содержит несоответствующие действительности сведения о природе препарата, что также нарушает требования Закона о рекламе[5].
То есть реклама содержит несоответствующие действительности сведения о природе препарата, что также нарушает требования Закона о рекламе[5].
Комиссия ФАС России выдала ООО «Безен Хелскеа РУС» как рекламодателю предписание об устранении нарушений, которые путем недостоверной рекламы вводили потребителей препарата в заблуждение, а также гарантировали его эффективность.
Документы разбирательства переданы для возбуждения дела об административном правонарушении.
Справка:
Согласно пункту 8 части 1 статьи 24 Федерального закона «О рекламе» реклама лекарственных средств не должна гарантировать положительное действие объекта рекламирования, его безопасность, эффективность и отсутствие побочных действий.
Согласно пункту 2 части 3 статьи 5 Федерального закона «О рекламе» недостоверной признается реклама, которая содержит несоответствующие действительности сведения о любых характеристиках товара, в том числе о его природе, составе, способе и дате изготовления, назначении, потребительских свойствах, об условиях применения товара, о месте его происхождения, наличии сертификата соответствия или декларации о соответствии, знаков соответствия и знаков обращения на рынке, сроках службы, сроках годности товара.
В соответствии с регистрационным удостоверением № ЛС-000186 от 13.10.2009 «Утрожестан» зарегистрирован в качестве лекарственного препарата.
В соответствии с частью 6 статьи 38 Федерального закона «О рекламе» рекламодатель несет ответственность за нарушение требований, установленных частью 3 статьи 5, частью 1 статьи 24 Федерального закона «О рекламе».
[1] № 8 от 2018 г.
[2] № 3 от 2018 г.
[3] пункта 8 части 1 статьи 24 и пункта 2 части 3 статьи 5
[4] пункта 8 части 1 статьи 24
[5] пункта 2 части 3 статьи 5
Поддержка лютеиновой фазы при вспомогательной репродукции
Вопрос обзора
Было изучено множество различных способов вмешательства, дозирования и тактик ведения лютеиновой фазы. Мы сравнили семь различных способов и подготовили полный обзор по этой теме.
Актуальность
После овуляции начинается лютеиновая фаза менструального цикла и продолжается до следующей менструации. Остатки овулировавшей яйцеклетки в яичнике известны как ‘corpus luteum’ или желтое тело. Желтое тело вырабатывает гормоны, в том числе прогестерон. Прогестерон стимулирует пролиферацию слизистой оболочки матки для подготовки к имплантации.
Остатки овулировавшей яйцеклетки в яичнике известны как ‘corpus luteum’ или желтое тело. Желтое тело вырабатывает гормоны, в том числе прогестерон. Прогестерон стимулирует пролиферацию слизистой оболочки матки для подготовки к имплантации.
Во время осуществления вспомогательной репродукции женский гипофиз десенсибилизируется лекарственными препаратами, что позволяет контролировать стимуляцию яичников. Это способствует образованию более зрелых яйцеклеток, которые могут быть отобраны и оплодотворены вне тела женщины. Гиперстимуляция яичников вызывает дефект лютеиновой фазы, так как желтое тело не способно производить достаточное количество прогестерона.
Поскольку низкий уровень прогестерона может снизить вероятность имплантации, необходимо осуществлять поддержку лютеиновой фазы. Это может включать оральный, вагинальный или внутримышечный прием прогестерона, хорионического гонадотропина человека (ХГЧ) (который стимулирует выработку прогестерона) или агонистов гонадотропин-рилизинг-гормона (ГнРГ). Агонисты ГнРГ стимулируют выработку ГнРГ, гормона, ответственного за фолликулостимулирующий гормон (ФСГ), и лютеинизирующего гормона (ЛГ), который способствует овуляции и развитию желтого тела. Считается, что агонисты ГнРГ восстанавливают уровень ЛГ и естественным образом поддерживают лютеиновую фазу.
Агонисты ГнРГ стимулируют выработку ГнРГ, гормона, ответственного за фолликулостимулирующий гормон (ФСГ), и лютеинизирующего гормона (ЛГ), который способствует овуляции и развитию желтого тела. Считается, что агонисты ГнРГ восстанавливают уровень ЛГ и естественным образом поддерживают лютеиновую фазу.
Характеристика исследований
Мы нашли 94 рандомизированных контролируемых испытания, в которых сравнивали различные режимы поддержки лютеиновой фазы, в общей сложности, у 26 198 женщин. По нашим наблюдениям, первичным исходом было живорождение или продолжающаяся беременность. Другими исходами были клиническая беременность, синдром гиперстимуляции яичников (СГЯ), выкидыш и многоплодная беременность. Доказательства актуальны на август 2015 года.
Основные результаты
ХГЧ или прогестерон, полученный во время лютеиновой фазы, может быть связан с более высокой частотой живорождения или продолжающейся беременности, по сравнению с плацебо или отсутствием лечения, но доказательства неоднозначны. Добавление ГнРГ к прогестерону, по всей видимости, улучшает исходы. ХГЧ может увеличить риск СГЯ, по сравнению с плацебо. Более того, ХГЧ, с прогестероном или без, связан с более высокой частотой развития СГЯ, чем прогестерон в одиночку. Ни добавление эстрогена, ни способ введения прогестерона не связаны с улучшением исходов.
Добавление ГнРГ к прогестерону, по всей видимости, улучшает исходы. ХГЧ может увеличить риск СГЯ, по сравнению с плацебо. Более того, ХГЧ, с прогестероном или без, связан с более высокой частотой развития СГЯ, чем прогестерон в одиночку. Ни добавление эстрогена, ни способ введения прогестерона не связаны с улучшением исходов.
Качество доказательств
Доказательства большинства сравнений были низкого или очень низкого качества. Основными ограничениями в доказательствах были неудовлетворительные отчеты о методах исследования и неточности из-за небольших размеров выборки.
Угроза преждевременных родов и препараты прогестерона. Дюфастон или Утрожестан?
Вопрос: «Здравствуйте! Ответьте, пожалуйста! Если в анамнезе были преждевременные роды, а сейчас зашита шейка матки, имеет ли значение Утрожестан или Дюфастон? С раннего срока пью Дюфастон по 3 таблетки, с 22 недель по 2 таблетки, на Утрожестан не перевели.»
Ответы на ваши вопросы в передаче «В ЦИРе и в мире». Отвечает Игорь Иванович Гузов, акушер-гинеколог, к.м.н., основатель Центра иммунологии и репродукции.
Отвечает Игорь Иванович Гузов, акушер-гинеколог, к.м.н., основатель Центра иммунологии и репродукции.
Вы знаете, что я Дюфастон, как препарат при беременности, не очень люблю. Потому что это все-таки не чистый прогестерон, а модифицированный препарат, и Утрожестан лучше. Но механически зашитая шейка матки, то есть зашитая шейка матки механически, будет держать и не давать выпячиваться плодному пузырю в случае, если сама матка ведет себя спокойно.
То есть вот зашивание шейки матки, либо введении внутривлагалищного силиконового кольца, которое концентрически охватывает шейку матки (пессарий), это, безусловно, снижает риск того, что начнет механически пролабировать плодный пузырь, и возникнет эта ситуация, но если начнутся преждевременные роды — они прорвут эти швы полностью.
То есть зашивание шейки матки не защищает от развития преждевременной родовой деятельности, когда матка начинает активно сокращаться и пытаться раскрыться. Если начнется регулярная родовая деятельность, эти швы не помогут. Если начинутся роды, врачи снимут вам эти швы, иначе матка просто порвется. Представьте, когда вы «с мясом» вырываете пуговицу — также рвется и шейка матки, когда начинается родовая деятельность.
Если начнется регулярная родовая деятельность, эти швы не помогут. Если начинутся роды, врачи снимут вам эти швы, иначе матка просто порвется. Представьте, когда вы «с мясом» вырываете пуговицу — также рвется и шейка матки, когда начинается родовая деятельность.
И вот назначение препаратов прогестерона снижает риск именно развития преждевременной родовой деятельности. На эту тему сейчас уже достаточно много исследований, потому что в начале, когда появились эти рекомендации несколько лет назад (пропагандировал их фонд фетальной медицины FMF Fetal Medicine Foundtion во главе с Кипрасом Николаидосом), я к этому отнесся с достаточно большой осторожностью, и начал смотреть материалы. Публикации указывали на то, что влагалищное введение прогестерона (утрожестана) снижает риски проблем. И мы начали это сразу делать,хотя, в общем-то, отношение у меня было к этому достаточно осторожное, потому что я не понимал механизмов действия. Сейчас, когда уже прошло несколько лет, и на эту тему существует много публикации, я являюсь сторонником того, что все-таки назначать прогестерон, прежде всего влагалищно. Потому что прогестерон в повышенных концентрациях, которые идут на уровне шейки матки, блокирует целый ряд процессов, которые приводят к запуску преждевременно родовой деятельности.
Потому что прогестерон в повышенных концентрациях, которые идут на уровне шейки матки, блокирует целый ряд процессов, которые приводят к запуску преждевременно родовой деятельности.
Поэтому мой ответ: да, нужно продолжать препараты прогестерона. Потому что эти препараты прогестерона будут снижать риск развития преждевременно родовой деятельности, а швы на шейки матки будут чисто механически блокировать. Допустим, шейка матки просто дряблая, она плохо смыкается, мышечный аппарат шейки матки нарушен, и при этом получается никакой родовой деятельности нет. Но плодный пузырь начинает выпячиваться внутрь канала шейки матки, здесь присоединяется как бы вторичная воспалительная реакция, потому что во влагалище у женщины всегда живет большое количество микроорганизмов, их легко активировать. Если начинается воспалительная реакция, то возникает активация протеолитических ферментов, так называемых металлопротеиназ, и она приводит к тому, что соединительнотканная основа хориона — этой наружной оболочки плода, которая обеспечивает прочность этой оболочки — становится более мягкой и легко растяжимой. И тогда легко изливаются околоплодные воды, и уже начинаются преждевременные роды.
И тогда легко изливаются околоплодные воды, и уже начинаются преждевременные роды.
И вот это как раз блокируют швы. Швы запирают шейку матки, и не дает плотному пузырю выпячивается наружу, но они не блокируют риск преждевременной родовой деятельности. И вот для блокирования преждевременной родовой деятельности и назначаются дополнительно препараты прогестерона, обычно внутривлагалищно (в некоторых случаях назначаются системы, я уж не буду вмешиваться в тактику ведения Вашей беременности).
Собственно говоря, такой ответ. Поэтому я надеюсь, что всё будет хорошо. Я желаю Вам всего самого хорошего, чтобы эта беременность прошла благополучно, и я не стал бы прерывать препараты прогестерона, особенно если было были преждевременные роды в анамнезе.
Ведение беременности является одним из основных направлений работы ЦИР. За развитием вашего малыша на протяжении всей беременности будет следить команда врачей-профессионалов. Для определения индивидуальной программы обследования и профилактики невынашивания беременности требуется консультация врача акушера-гинеколога.
Утрожестан при беременности. Применение и отмена Утрожестана
Утрожестан
Утрожестан – это препарат, действующим веществом которого является натуральный микронизированный прогестерон (натуральный прогестерон плохо всасывается в желудочно-кишечном тракте, поэтому в настоящее время применяется в микронизированной форме).
Утрожестан в отличие от синтетических аналогов имеет выгодные преимущества, заключающиеся в первую очередь в том, что входящий в его состав микронизированный прогестерон полностью идентичен натуральному, что обусловливает практически полное отсутствие побочных эффектов.
Для чего назначают Утрожестан
Утрожестан назначается в случаях прогестерон-дефицитного состояния:
При ПМС (предменструальный синдром). Применение препарата во второй половине менструального цикла способствует повышению уровня прогестерона в плазме крови, достижению антиэстрогенного эффекта, достаточного для устранения предменструальных расстройств, в частности нагрубания и болезненности молочных желез.
А также его применяют: при нарушении менструального цикла вследствие нарушения овуляции; при фиброзно-кистозной мастопатии; во время предклиматического периода и в период климакса; для профилактики эндометриоза и профилактика миомы матки.
Утрожестан при беременности назначается в том случае, если у будущей мамы снижен уровень прогестерона, что является угрозой прерывания беременности. Также этот лекарственное средство назначают после ЭКО до 20-й недели беременности.
Свечи Утрожестан
Утрожестан НЕ выпускается в виде свечей или таблеток, только в капсулах. Капсулы по 100 мг имеют круглую форму, в капсулах по 200 мг – овальные. Но эти капсулы можно применять как перорально (внутрь), запивая водой, так и интравагинально (во влагалище, как вагинальные свечи).
Прием Утрожестана при беременности: инструкция
Безопасность для матери и плода делают Утрожестан практически незаменимым препаратом для применения в период беременности, особенно на ранних этапах. При пероральном применении побочным действием лекарства может быть сонливость, головокружение, проходящее через 1-3 часа. Утрожестан обладает седативным эффектом (то есть успокаивает нервную систему). Этим свойством натуральный прогестерон выгодно отличается от многих синтетических аналогов, способных вызывать эмоциональные расстройства. В отличие от большинства синтетических гестагенов Утрожестан также не влияет негативно на артериальное давление и не увеличивает массу тела.
При пероральном применении побочным действием лекарства может быть сонливость, головокружение, проходящее через 1-3 часа. Утрожестан обладает седативным эффектом (то есть успокаивает нервную систему). Этим свойством натуральный прогестерон выгодно отличается от многих синтетических аналогов, способных вызывать эмоциональные расстройства. В отличие от большинства синтетических гестагенов Утрожестан также не влияет негативно на артериальное давление и не увеличивает массу тела.
При беременности, как правило, препарат назначается вагинально по 200-400 мг ежедневно в 2 приема (утром и вечером) в I и II триместрах беременности. Капсулы вводят глубоко во влагалище. Эффективность Утрожестана при вагинальном введении выше, чем при пероральном его применении. При использовании Утрожестана вагинально у женщины не возникают сонливость или головокружение, наблюдаемые при пероральном способе введения. Но при таком приеме возможны аллергические реакции. Длительность лечения препаратом определяется врачом.
Особые указания:
Утрожестан с осторожностью применяют в III триместре беременности из-за риска нарушения функции печени.
Противопоказания
Утрожестан противопоказан если у женщины есть склонности к тромбозам и тромбофлебитам, при кровотечениях из половых путей неясного происхождения. При пероральном введении препарат противопоказан при выраженных нарушениях функций печени. Данный препарат не применяется у лиц, склонных к аллергическим реакциям, в том числе к арахисовому маслу и сое.
Отмена Утрожестана при беременности
Отмена препарата должна происходить постепенно, согласно рекомендации врача. Обычно Утрожестан отменяют по 100 мг в неделю. Во время снижения дозировки необходимо внимательно следить за своим состоянием, если постепенное снижение дозировки препарата повлекло за собой появление кровянистых выделений и/или тянущих болей внизу живота, то скорей всего, врач вернет прежнюю дозировку.
Дюфастон или Утрожестан — что лучше?
В настоящее время в России применяются два лекарственных средства для лечения угрозы прерывания: микронизированный прогестерон и дидрогестерон — Дюфастон. Утрожестан – это натуральный прогестерон, Дюфастон – аналог природного прогестерона, по химическому составу близок к натуральному прогестерону. По эффективности эти препараты сравнимы, но по показателям переносимости в I и II триместре Утрожестан предпочтительнее.
Утрожестан – это натуральный прогестерон, Дюфастон – аналог природного прогестерона, по химическому составу близок к натуральному прогестерону. По эффективности эти препараты сравнимы, но по показателям переносимости в I и II триместре Утрожестан предпочтительнее.
Перечень лекарственных средств дан в ознакомительных целях и не предназначен для самостоятельного лечения.
© Copyright: kukuzya.ru
инструкция по применению и противопоказания
Нормальное течение беременности обеспечивается рядом гормонов, которые синтезируются яичниками, гипофизом и плацентой. Вследствие недугов репродуктивной системы или отклонений в функционировании эндокринных желез у будущей мамочки может образоваться нехватка гормонов, например прогестерона, что приводит к риску самопроизвольного аборта. В таких случаях медики прописывают препараты, включающие в себя природные или синтетические аналоги гормонов. Одним из таких средств является Утрожестан.
Утрожестан — состав и действиео
Прогестерон – это действующий компонент препарата Утрожестан. Он считается «гормоном беременности». Именно он обеспечивает благополучное зачатие и вынашивание младенца, а также готовит тело женщины к рождению ребенка и кормлению грудью. Прогестерон, содержащийся в медикаменте, идентичен тому, который вырабатывается желтым телом.
Он считается «гормоном беременности». Именно он обеспечивает благополучное зачатие и вынашивание младенца, а также готовит тело женщины к рождению ребенка и кормлению грудью. Прогестерон, содержащийся в медикаменте, идентичен тому, который вырабатывается желтым телом.
Воздействие прогестерона на разных этапах вынашивания плода:
- В первые дни после зачатия гормон готовит эндометрий матки к имплантации бластоцисты. Одновременно с этим он делает вагинальный эпителий плотнее, а цервикальную слизь гуще – впоследствии она образует пробку, защищающую эмбрион.
- Когда бластоциста имплантирована в эндометрий, прогестерон снижает иммунитет женщины, чтобы организм не отторг эмбрион как чужеродный элемент. Кроме того, уменьшается сократительная активность гладкой маточной мускулатуры, что уменьшает вероятность выкидыша.
- Прогестерон помогает развитию молочных желез, а также их протоков. Это нужно для синтеза молока и возможности кормить новорожденного грудью.
Форма выпуска препарата
Фармкомпании производят Утрожестан в виде капсул. Они отличаются по содержанию активного компонента: бывают капсулы со 100 мг прогестерона и с 200 мг вещества. На аптечных прилавках продаются капсулы в упаковках по 14 и 28 штук.
Они отличаются по содержанию активного компонента: бывают капсулы со 100 мг прогестерона и с 200 мг вещества. На аптечных прилавках продаются капсулы в упаковках по 14 и 28 штук.
На вид они овальные. Если их пощупать – они мягкие, желатиновые. Внутри капсул – маслянистая бледно-желтая суспензия. В качестве дополнительных компонентов суспензия содержит растительное масло и соевый лецитин. Оболочка состоит из желатина, глицерола и диоксида титана.
Некоторые женщины, услышав, что Утрожестан нужно ставить в вагину, спрашивают в аптеках свечи. Однако фармкомпании не делают это лекарство в виде суппозиториев. Капсулы разрешается пить как таблетки и вставлять в вагину как свечи.
Для чего назначают?
Когда доктор выписывает прием прогестеронсодержащего средства? Утрожестан выписывают как мамам, вынашивающим ребенка, так и тем, кто только планирует беременность или имеет проблемы с репродуктивной системой. Прогестерон играет важную роль в менструальном цикле, поэтому он необходим не только будущим мамам, но и женщинам, которые пока не собираются зачинать младенца.
В таблице представлена информация о показаниях для назначения Утрожестана:
| При беременности | При планировании оплодотворения | Для терапии недугов репродуктивной сферы |
| Риск самопроизвольного аборта при тонусе матки из-за низкой выработки прогестерона желтым телом. | Невозможность зачать из-за лютеиновой недостаточности, которая обусловлена гипофункцией желтого тела. Причиной может быть дисфункция гипоталамо-гипофизарной системы, гиперандрогения или воспаления придатков. | Синдром предменструального напряжения. |
| Риск преждевременного родоразрешения у женщин, имеющих аномалии родовых путей, например укороченную шейку матки, а также при преждевременном разрыве оболочек плода (подробнее в статье: чем опасна укороченная шейка матки при беременности?). | Подготовительные мероприятия к искусственному зачатию. | Сбои месячных из-за нарушения овуляции. |
| Кистозное разрастание ткани молочной железы | ||
| Заместительное гормональное лечение в пре- и постменопаузе, преждевременной менопаузе, при удаленных яичниках. |
Можно ли принимать при беременности?
Прием медикаментозного средства Утрожестан не только разрешен, но и необходим при проблемах с вынашиванием ребенка. Однако не нужно принимать его самостоятельно. Гормональная терапия может причинить непоправимый ущерб здоровью, если заниматься самолечением.
Утрожестан при беременности разрешено употреблять только под пристальным вниманием гинекологов и эндокринологов. Доктор планирует схему лечения с учетом недуга и индивидуальных особенностей беременной.
youtube.com/embed/qUkz0NPnnyU?wmode=transparent&autohide=1&controls=1&disablekb=0&showinfo=1&fs=1&iv_load_policy=3&modestbranding=1&rel=0&autoplay=0″ sandbox=»allow-scripts allow-same-origin allow-presentation allow-popups»/>
Как Утрожестан воздействует на плод?
Исследования безопасности Утрожестана показали, что патологического действия, угрожающего развитию плода, нет. Врачи считают, что этот медикамент не опасен для ребенка и не вызывает внутриутробные аномалии.
Существует мнение, что если мама длительное время пила прогестерон во время беременности, это может сказаться на здоровье репродуктивной сферы в будущем. Например, у девочек в период пубертата увеличивается риск появления кисты яичника. Эти данные требуют всестороннего исследования и подтверждения либо опровержения.
Инструкция по применению и правила приема в разных формах выпуска
Способ применения Утрожестана отличается в зависимости от срока беременности. Также разница присутствует, если принимать лекарство перорально и интравагинально. Несмотря на то, что в упаковке содержится инструкция по применению, лечащий доктор может самостоятельно составить схему терапии, которую женщине придется соблюдать. Как же необходимо употреблять Утрожестан в разных триместрах?
Также разница присутствует, если принимать лекарство перорально и интравагинально. Несмотря на то, что в упаковке содержится инструкция по применению, лечащий доктор может самостоятельно составить схему терапии, которую женщине придется соблюдать. Как же необходимо употреблять Утрожестан в разных триместрах?
1 триместр
Для чего прописывают гормоны на ранних сроках? В первом триместре лекарство назначают для устранения тонуса матки и предупреждения выкидыша. Его часто выписывают мамам, у которых предыдущие беременности заканчивались самопроизвольными абортами. Его назначают преимущественно на 5 неделе вынашивания, когда возможно появление кровяных выделений из вагины.
На ранних этапах Утрожестан при угрозе выкидыша применяют в виде свечей. Их помещают в вагину и оставляют до полного рассасывания. Лучше всего вводить суппозиторий на ночь, прикрепив на белье прокладку. Таким образом женщина будет защищена от неприятных казусов, если лекарственная суспензия испачкает белье.
Дозировка – 200 – 400 мг/сутки. Свечи необходимо вставлять 2 раза в сутки в одно и то же время. Сколько требуется лежать после введения капсулы? Как правило, около часа, поэтому лучше вводить их на ночь. Если интравагинальный прием не подходит, можно употреблять лекарство как таблетки. Нельзя пить их вместе с едой, лучше употребить на голодный желудок.
2 триместр
Во втором триместре беременность может оказаться под угрозой из-за резкого снижения выработки прогестерона организмом и повышения тонуса матки. Это происходит в период между 13 и 22 неделями вынашивания плода. Нехватка гормона определяется по данным анализов. Иногда уровень настолько низок, что даже того количества, которое вырабатывается плацентой, не хватает для успешного и безопасного вынашивания. В зону риска попадают будущие мамочки, зачавшие с помощью экстракорпорального оплодотворения, а также с патологическим состоянием шейки матки.
При риске выкидыша схема терапии такая же, как и в 1 триместре. Употреблять Утрожестан можно перорально и вагинально по 2 капсулы в дозе 200 – 400 мг/сутки. Если беременность произошла с помощью искусственного зачатия, дозировку увеличивают до 600 мг/сутки.
Употреблять Утрожестан можно перорально и вагинально по 2 капсулы в дозе 200 – 400 мг/сутки. Если беременность произошла с помощью искусственного зачатия, дозировку увеличивают до 600 мг/сутки.
3 триместр
Зачем назначают гормоны в конце срока? В третьем триместре Утрожестан вагинально выписывают при укорочении шейки, если плод опустился низко в полости матки, для профилактики преждевременных родов. Обычно прием назначают с 30 недели.
Лекарство вставляют в вагину 1 раз в день. Для минимизации дискомфорта это можно делать перед сном, вводя суппозиторий на ночь. Дозировка – 200 мг/сутки.
Через сколько всасывается и как выводится?
Утрожестан всасывается довольно быстро. Если использовать его в качестве таблеток, он быстро абсорбируется в пищеварительной системе, а максимальная концентрация в плазме крови наблюдается через 1 – 3 часа.
При введении во влагалище лекарство начинает действовать немного медленнее. Максимальное содержание прогестерона обнаруживается через 2 – 6 после введения. Действие сохраняется на протяжении 24 часов.
Действие сохраняется на протяжении 24 часов.
Препарат выводится через почки с уриной. В моче обнаруживаются метаболиты прогестерона, в основном прегнандион. Они аналогичны тем веществам, которые секретируются желтым телом в естественных условиях.
Как отменять?
Резкое прекращение приема медикаментозного средства может привести к тяжелым последствиям для беременности. Женскому организму необходимо время, чтобы постепенно привыкнуть к уменьшению дозы прогестерона. Для этого врачи разрабатывают индивидуальную схему отмены.
Как правильно отменить лекарство? Если суточная доза составляет 400 мг, схема отмены Утрожестана при беременности может быть следующей:
- доза снижается до 300 мг, длительность приема составляет 2 недели;
- следующие две недели дозировка уменьшается до 200 мг;
- 100 мг в течение следующих 7 дней;
- абсолютная отмена препарата.
Как долго отменять препарат? Отмена длится 1 – 1,5 месяца, в зависимости от изначальной дозы и индивидуальных особенностей женщины. При снижении количества капсул необходимо следить, чтобы не началось кровотечение. При появлении кровянистых выделений нужно временно увеличить дозу гормона.
При снижении количества капсул необходимо следить, чтобы не началось кровотечение. При появлении кровянистых выделений нужно временно увеличить дозу гормона.
При больших дозировках прогестерона разрешено снижать количество употребляемого препарата на 100 мг в неделю. Если доза изначально была небольшой, уменьшать ее необходимо по 50 мг в неделю.
Противопоказания и побочные эффекты
В каких случаях прием Утрожестана запрещен? К противопоказаниям относятся следующие недуги:
- тромбоз, воспаление стенок вен, образование тромба, закрывающего просвет сосуда, тромбоэмболия, приведшая к инфаркту или инсульту;
- кровотечения из вагины;
- онкологические образования половых органов или молочных желез;
- порфирия – генетическое отклонение, характеризующееся нарушением пигментного обмена и высоким содержанием порфирина в крови и тканях;
- недуги печени: желтуха, гепатит, онкозаболевания, наследственный синдром Дабина-Джонсона и синдром Ротора.
Какие побочные действия у Утрожестана? Вопреки расхожему мнению, от употребления этого гормонального препарата женщина не набирает вес, у нее не наблюдается повышенное оволосение. При пероральном употреблении Утрожестана в клинической практике отмечались следующие побочные явления:
При пероральном употреблении Утрожестана в клинической практике отмечались следующие побочные явления:
- болевые ощущения в груди, увеличение и повышенная чувствительность;
- сонливость, головокружение, головная боль;
- тошнота и рвота, запор или диарея, вздутие живота;
- появление прыщей, зуд, сыпь.
Для уменьшения побочных эффектов рекомендуется или подкорректировать дозу, или перейти на вагинальный способ применения лекарства. При приеме вагинально побочных эффектов почти не наблюдается. Изредка может возникнуть индивидуальная реакция в виде зуда половых органов, обильных выделений из влагалища.
Чем может навредить передозировка?
Опасна ли передозировка? С гормональными препаратами следует быть предельно внимательными, ведь они влияют на весь организм женщины и на течение беременности.
Зафиксированными последствиями разовой передозировки являются головокружение, сонливость и эйфория. Такое состояние легко лечится, достаточно всего лишь снизить дозу прогестерона или принимать лекарство перед сном, когда сонливость только пойдет на пользу.
Аналог препарата
В фармацевтике существует несколько аналогов Утрожестана с действующим веществом прогестероном. Каждый из них обладает рядом преимуществ или недостатков сравнительно с Утрожестаном – основываясь на них, доктора подбирают препарат, который подойдет каждой конкретной пациентке.
В таблице представлены аналоги Утрожестана:
| № п/п | Наименование | Форма | Отличия |
| 1 | Дюфастон | Таблетки | Используется не прогестерон, а синтетический аналог натурального гормона – дидрогестерон. |
| 2 | Праджисан | Капсулы, вагинальный гель | Многим удобней вводить гель интравагинально, с помощью специального аппликатора. |
| 3 | Крайнон | Вагинальный гель (подробнее в статье: Крайнон: инструкция по применению геля) | Гель содержится в одноразовых аппликаторах. Полимерный способ доставки обеспечивает хорошее связывание со слизистой стенок влагалища, благодаря чему прогестерон высвобождается непрерывно в течение 3 дней. |
| 4 | Ипрожин | Капсулы | Женщины отмечают, что препарат практически не вытекает из вагины, в отличие от Утрожестана. |
Утрожестан – эффективное гормональное средство, которое позволяет многим женщинам сохранить долгожданного ребенка. Некоторые мамочки, опасаясь угрозы выкидыша, могут назначить себе прогестероновые препараты самостоятельно – делать это категорически запрещено, потому что это рецептурный медикамент, который назначают только доктора после ряда необходимых анализов.
youtube.com/embed/mxPgHtMZkNU?wmode=transparent&autohide=1&controls=1&disablekb=0&showinfo=1&fs=1&iv_load_policy=3&modestbranding=1&rel=0&autoplay=0″ sandbox=»allow-scripts allow-same-origin allow-presentation allow-popups»/>
Врач акушер-гинеколог, репродуктолог, консультант по грудному вскармливанию, окончила ЧГУ им. Ульянова со специализацией гинекология, маммология Подробнее »Поделитесь с друьями!
Прогестерон (пероральное введение) Использование по назначению
Использование по назначению
Информация о лекарствах предоставлена: IBM Micromedex
Очень важно использовать это лекарство только по назначению врача. Не используйте его больше, не используйте его чаще и не используйте его дольше, чем прописал ваш врач. Это может вызвать нежелательные побочные эффекты.
К этому лекарству прилагается информационный буклет для пациента. Внимательно прочтите инструкции в буклете и следуйте им.Спросите своего врача, если у вас есть какие-либо вопросы.
Женщинам, принимающим это лекарство после менопаузы, его назначают вместе с лекарством эстрогена. Тщательно соблюдайте график приема обоих лекарств, который назначит вам врач.
Если у вас возникли проблемы с проглатыванием этого лекарства, запейте его стаканом воды, стоя. Если это не поможет, проконсультируйтесь со своим врачом или фармацевтом.
Дозирование
Доза этого лекарства будет разной для разных пациентов.Следуйте указаниям врача или указаниям на этикетке. Следующая информация включает только средние дозы этого лекарства. Если ваша доза отличается, не меняйте ее, если это вам не скажет врач.
Количество лекарства, которое вы принимаете, зависит от его силы. Кроме того, количество доз, которые вы принимаете каждый день, время между приемами и продолжительность приема лекарства зависят от медицинской проблемы, для которой вы принимаете лекарство.
- Для пероральной лекарственной формы (капсулы):
- Для предотвращения утолщения слизистой оболочки матки (гиперплазии эндометрия):
- Взрослые? 200 миллиграммов (мг) в день в виде однократной дозы перед сном в течение 12 дней подряд в течение 28-дневного менструального цикла.

- Дети? Использование не рекомендуется.
- Взрослые? 200 миллиграммов (мг) в день в виде однократной дозы перед сном в течение 12 дней подряд в течение 28-дневного менструального цикла.
- Для лечения необычного прекращения менструального цикла (аменореи):
- Взрослые? 400 миллиграммов (мг) в день в виде однократной дозы перед сном в течение 10 дней.
- Дети? Использование не рекомендуется.
- Для предотвращения утолщения слизистой оболочки матки (гиперплазии эндометрия):
Пропущенная доза
Если вы пропустите прием этого лекарства, примите его как можно скорее. Однако, если уже почти пришло время для вашей следующей дозы, пропустите пропущенную дозу и вернитесь к своему обычному графику дозирования. Не принимайте двойные дозы.
Хранилище
Храните лекарство в закрытом контейнере при комнатной температуре, вдали от источников тепла, влаги и прямого света.Беречь от замерзания.
Хранить в недоступном для детей месте.
Не храните устаревшие лекарства или лекарства, которые больше не нужны.
Спросите у лечащего врача, как следует утилизировать любое лекарство, которое вы не используете.
Получите самую свежую информацию о здоровье от экспертов Mayo Clinic.
Зарегистрируйтесь бесплатно и будьте в курсе достижений в области исследований, советов по здоровью и актуальных тем, связанных со здоровьем, таких как COVID-19, а также опыта в области управления здоровьем.
Узнайте больше об использовании данных Mayo Clinic. Чтобы предоставить вам наиболее актуальную и полезную информацию и понять, какие
информация полезна, мы можем объединить вашу электронную почту и информацию об использовании веб-сайта с
другая имеющаяся у нас информация о вас. Если вы пациент клиники Мэйо, это может
включать защищенную медицинскую информацию.Если мы объединим эту информацию с вашими защищенными
информация о здоровье, мы будем рассматривать всю эту информацию как защищенную
информацию и будет использовать или раскрывать эту информацию только в соответствии с нашим уведомлением о
политика конфиденциальности. Вы можете отказаться от рассылки по электронной почте в любое время, нажав на
ссылку для отказа от подписки в электронном письме.
Если вы пациент клиники Мэйо, это может
включать защищенную медицинскую информацию.Если мы объединим эту информацию с вашими защищенными
информация о здоровье, мы будем рассматривать всю эту информацию как защищенную
информацию и будет использовать или раскрывать эту информацию только в соответствии с нашим уведомлением о
политика конфиденциальности. Вы можете отказаться от рассылки по электронной почте в любое время, нажав на
ссылку для отказа от подписки в электронном письме.
Подписаться!
Спасибо за подписку
Наш электронный информационный бюллетень Housecall будет держать вас в курсе самой последней информации о здоровье.
Извините, что-то пошло не так с вашей подпиской
Повторите попытку через пару минут
Повторить
Последнее обновление частей этого документа: дек.01, 2021
Авторские права © IBM Watson Health, 2021 г. Все права защищены. Информация предназначена только для использования Конечным пользователем и не может быть продана, распространена или иным образом использована в коммерческих целях.
.
Прогестин (пероральный, парентеральный, вагинальный) Использование по назначению
Использование по назначению
Информация о лекарствах предоставлена: IBM Micromedex
Чтобы использование прогестина было максимально безопасным и надежным, вы должны понимать, как и когда его принимать и какие эффекты можно ожидать. Прогестины обычно поставляются с указанием пациента. Внимательно прочтите их, прежде чем принимать или использовать это лекарство.
Прогестины обычно поставляются с указанием пациента. Внимательно прочтите их, прежде чем принимать или использовать это лекарство.
Принимайте это лекарство только по назначению врача. Не принимайте больше и не принимайте дольше, чем прописал врач. Это может увеличить вероятность побочных эффектов. Старайтесь принимать лекарство каждый день в одно и то же время, чтобы снизить вероятность побочных эффектов и дать ему возможность лучше подействовать.
Прогестины часто назначают вместе с некоторыми лекарствами.Если вы используете комбинацию лекарств, убедитесь, что вы принимаете каждое из них в нужное время, и не смешивайте их. Попросите своего лечащего врача помочь вам спланировать, как не забыть принимать лекарства в нужное время.
Дозирование
Дозы лекарств этого класса будут разными для разных пациентов. Следуйте указаниям врача или указаниям на этикетке. Следующая информация включает только средние дозы этих лекарств. Если ваша доза отличается, не меняйте ее, если это вам не скажет врач.
Количество лекарства, которое вы принимаете, зависит от его силы. Кроме того, количество доз, которые вы принимаете каждый день, время между приемами и продолжительность приема лекарства зависят от медицинской проблемы, для которой вы принимаете лекарство.
Для медроксипрогестерона
- Для пероральной лекарственной формы (таблеток):
- Для остановки необычного и обильного кровотечения из матки (дисфункциональное маточное кровотечение) или лечения необычного прекращения менструального цикла (аменорея):
- Взрослые и подростки? От 5 до 10 миллиграммов (мг) в день в течение пяти-десяти дней по указанию врача.
- Для подготовки матки к менструальному периоду:
- Взрослые и подростки? 10 миллиграммов (мг) в день в течение пяти или десяти дней по указанию врача.
- Для предотвращения утолщения слизистой оболочки матки эстрогеном (гиперплазия эндометрия) при приеме эстрогена для гормональной терапии яичников у женщин в постменопаузе:
- Взрослые? При приеме эстрогена каждый день в дни с 1 по 25: перорально, от 5 до 10 миллиграммов (мг) медроксипрогестерона в день в течение десяти-четырнадцати или более дней каждый месяц в соответствии с указаниями врача.
 Или ваш врач может посоветовать вам принимать 2,5 или 5 мг в день без перерыва. Ваш врач поможет решить, какое количество таблеток вам лучше всего подходит и когда их принимать.
Или ваш врач может посоветовать вам принимать 2,5 или 5 мг в день без перерыва. Ваш врач поможет решить, какое количество таблеток вам лучше всего подходит и когда их принимать.
- Взрослые? При приеме эстрогена каждый день в дни с 1 по 25: перорально, от 5 до 10 миллиграммов (мг) медроксипрогестерона в день в течение десяти-четырнадцати или более дней каждый месяц в соответствии с указаниями врача.
- Для остановки необычного и обильного кровотечения из матки (дисфункциональное маточное кровотечение) или лечения необычного прекращения менструального цикла (аменорея):
- Лекарственная форма для внутримышечного введения:
- Для лечения рака почек или матки:
- Взрослые и подростки? Сначала от 400 до 1000 миллиграммов (мг) вводят в мышцу разовой дозой один раз в неделю. Затем ваш врач может снизить дозу до 400 мг или чаще один раз в месяц.
- Для лечения рака почек или матки:
- Лекарственная форма для подкожных инъекций:
- Для лечения боли, связанной с эндометриозом:
- Взрослые и подростки? 104 миллиграмма (мг) вводят под кожу передней части бедра или живота каждые три месяца (от 12 до 14 недель) в течение не более 2 лет.
- Для лечения боли, связанной с эндометриозом:
для мегестрола
- Для пероральной лекарственной формы (суспензии):
- Для лечения потери аппетита (анорексия), мышц (кахексия) или веса, вызванных синдромом приобретенного иммунодефицита (СПИД):
- Взрослые и подростки? 800 миллиграммов (мг) в день в течение первого месяца.
 Затем ваш врач может посоветовать вам принимать 400 или 800 мг в день в течение еще трех месяцев.
Затем ваш врач может посоветовать вам принимать 400 или 800 мг в день в течение еще трех месяцев.
- Взрослые и подростки? 800 миллиграммов (мг) в день в течение первого месяца.
- Для лечения потери аппетита (анорексия), мышц (кахексия) или веса, вызванных синдромом приобретенного иммунодефицита (СПИД):
- Для пероральной лекарственной формы (таблеток):
- Для лечения рака груди:
- Взрослые и подростки? 160 миллиграммов (мг) в день в виде разовой дозы или в несколько приемов в течение двух или более месяцев.
- Для лечения рака матки:
- Взрослые и подростки? От 40 до 320 миллиграммов (мг) в день в течение двух или более месяцев.
- Для лечения потери аппетита (анорексия), потери мышц (кахексия) или веса, вызванных раком:
- Взрослые и подростки? 400-800 миллиграммов (мг) в день.
- Для лечения рака груди:
Для норэтиндрона
- Для пероральной лекарственной формы (таблеток):
- Для остановки необычного и обильного кровотечения из матки (дисфункциональное маточное кровотечение) или лечения необычного прекращения менструального цикла (аменорея):
- Взрослые и подростки — 2.
 От 5 до 10 миллиграммов (мг) в день с 5 по 25 день (считая с первого дня последнего менструального цикла). Или ваш врач может попросить вас принимать лекарство только в течение пяти-десяти дней в соответствии с указаниями.
От 5 до 10 миллиграммов (мг) в день с 5 по 25 день (считая с первого дня последнего менструального цикла). Или ваш врач может попросить вас принимать лекарство только в течение пяти-десяти дней в соответствии с указаниями.
- Взрослые и подростки — 2.
- Для лечения эндометриоза:
- Взрослые и подростки? Сначала 5 миллиграммов (мг) в день в течение двух недель. Затем ваш врач может медленно увеличить дозу до 15 мг в день в течение шести-девяти месяцев. Сообщите своему врачу, если у вас начнется менструальный цикл.Ваш врач может попросить вас принять еще лекарство или прекратить прием лекарства на короткий период времени.
- Для остановки необычного и обильного кровотечения из матки (дисфункциональное маточное кровотечение) или лечения необычного прекращения менструального цикла (аменорея):
Для прогестерона
- Для пероральной лекарственной формы (капсулы):
- Для предотвращения утолщения слизистой оболочки матки эстрогеном (гиперплазия эндометрия) при приеме эстрогена для гормональной терапии яичников у женщин в постменопаузе:
- Взрослые? 200 миллиграммов (мг) в день перед сном в течение 12 дней подряд на 28-дневный цикл лечения эстрогенами каждый месяц.

- Взрослые? 200 миллиграммов (мг) в день перед сном в течение 12 дней подряд на 28-дневный цикл лечения эстрогенами каждый месяц.
- Для лечения необычного прекращения менструального цикла (аменореи):
- Взрослые? 400 миллиграммов (мг) в день перед сном в течение десяти дней.
- Для предотвращения утолщения слизистой оболочки матки эстрогеном (гиперплазия эндометрия) при приеме эстрогена для гормональной терапии яичников у женщин в постменопаузе:
- Для вагинальной лекарственной формы (гель):
- Для лечения необычного прекращения менструального цикла (аменореи):
- Взрослые и подростки? 45 миллиграммов (мг) (один аппликатор 4% геля) один раз через день до шести доз.Дозу можно увеличить до 90 мг (один аппликатор с 8% гелем) один раз через день до шести доз, если необходимо.
- Для лечения бесплодия:
- Взрослые и подростки? 90 миллиграммов (мг) (один аппликатор 8% геля) один или два раза в день. В случае наступления беременности лечение можно продолжать до десяти-двенадцати недель.
- Для лечения необычного прекращения менструального цикла (аменореи):
- Для инъекционной лекарственной формы:
- Для остановки необычного и обильного кровотечения из матки (дисфункциональное маточное кровотечение) или лечения необычного прекращения менструального цикла (аменорея):
- Взрослые и подростки? От 5 до 10 миллиграммов (мг) в день, вводимые в мышцу в течение шести-десяти дней.
 Или ваш врач может назначить вам однократную инъекцию 100 или 150 мг в мышцу. Иногда ваш врач может попросить вас сначала принять другой гормон, называемый эстрогеном. Если у вас начался менструальный цикл, ваш врач попросит вас прекратить прием лекарства.
Или ваш врач может назначить вам однократную инъекцию 100 или 150 мг в мышцу. Иногда ваш врач может попросить вас сначала принять другой гормон, называемый эстрогеном. Если у вас начался менструальный цикл, ваш врач попросит вас прекратить прием лекарства.
- Взрослые и подростки? От 5 до 10 миллиграммов (мг) в день, вводимые в мышцу в течение шести-десяти дней.
- Для остановки необычного и обильного кровотечения из матки (дисфункциональное маточное кровотечение) или лечения необычного прекращения менструального цикла (аменорея):
- Для вагинальной лекарственной формы (суппозиториев):
- Для сохранения беременности (при овуляции и в начале беременности):
- Взрослые и подростки? 25 мг до 100 миллиграммов (мг) (один суппозиторий), вводимый во влагалище один или два раза в день, начиная с момента овуляции.Ваш врач может потребовать, чтобы вы принимали лекарство на срок до одиннадцати недель.
- Для сохранения беременности (при овуляции и в начале беременности):
Пропущенная доза
Если вы пропустите прием этого лекарства, примите его как можно скорее. Однако, если уже почти пришло время для вашей следующей дозы, пропустите пропущенную дозу и вернитесь к своему обычному графику дозирования. Не принимайте двойные дозы.
Для всех прогестинов, кроме капсул прогестерона для женщин в постменопаузе: если вы пропустили прием этого лекарства, примите пропущенную дозу как можно скорее.Однако, если уже почти пришло время для вашей следующей дозы, пропустите пропущенную дозу и вернитесь к своему обычному графику дозирования. Не принимайте двойные дозы.
Для капсул с прогестероном для женщин в постменопаузе: если вы пропустите дозу 200 мг капсул прогестерона перед сном, примите 100 мг утром, а затем вернитесь к своему обычному графику дозирования. Если вы принимаете 300 мг прогестерона в день и пропускаете утреннюю и вечернюю дозу, не принимайте пропущенную дозу. Вернитесь к своему обычному графику дозирования.
Хранилище
Хранить в недоступном для детей месте.
Храните лекарство в закрытом контейнере при комнатной температуре, вдали от источников тепла, влаги и прямого света. Беречь от замерзания.
Не храните устаревшие лекарства или лекарства, которые больше не нужны.
Последнее обновление частей этого документа: 1 декабря 2021 г.
Авторские права © IBM Watson Health, 2021 г. Все права защищены. Информация предназначена только для использования Конечным пользователем и не может быть продана, распространена или иным образом использована в коммерческих целях.
.
Дневные колебания прогестерона в сыворотке крови в середине лютеиновой фазы у женщин, подвергающихся экстракорпоральному оплодотворению.
Фронт-эндокринол (Лозанна). 2018; 9: 92.
Lise Haaber Thomsen
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Отделение клинической медицины, Орхусский университет, Орхус, Дания
Ulrik Schiøler Kesmodel 9007
Клиника репродуктивной медицины, больница Херлев, Херлев, Дания
4 Кафедра клинической медицины, Копенгагенский университет, Копенгаген, Дания
Клаус Йдинг Андерсен
5 Лаборатория репродуктивной биологии, Женский центр Джулиан Мари, Дети и репродукция, Университетская больница Копенгагена, Копенгагенский университет, Копенгаген, Дания
Питер Хумайдан
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Департамент клинической медицины, Орхусский университет, Орхус , Дания
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Кафедра клинической медицины, Орхусский университет, Орхус, Дания
3 Клиника репродуктивной медицины, больница Херлев, Херлев, Дания
4 Кафедра клинической медицины Копенгагенского университета, Копенгаген, Дания
5 Лаборатория репродуктивной биологии, Центр женщин, детей и репродукции Джулиан Мари, Университетская больница Копенгагена, Университет Копенгагена, Копенгаген, Дания
Отредактировал: Sandro C. Эстевес, Андроферт, Клиника андрологии и репродукции человека, Бразилия
Эстевес, Андроферт, Клиника андрологии и репродукции человека, Бразилия
Рецензент: Эвангелос Г. Папаниколау, Университет Аристотеля в Салониках, Греция; Джон Луи Йович, Медицинский центр Пивет, Австралия
Специальный раздел: Эта статья была отправлена в репродукцию, раздел журнала «Границы эндокринологии»
Поступила в редакцию 17 декабря 2017 г .; Принято 26 февраля 2018 г.
Copyright © 2018 Thomsen, Kesmodel, Andersen and Humaidan.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY).Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) и правообладателя и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.- Заявление о доступности данных
Необработанные данные, подтверждающие заключение этой рукописи, будут предоставлены авторами без необоснованных оговорок любому квалифицированному исследователю.

Реферат
Цель
Изучить, проявляет ли средне-лютеиновый прогестерон сыворотки (P 4 ) значительные колебания в течение 12-часового дневного периода у женщин, перенесших оплодотворение in vitro (ЭКО), и выяснить, могут ли Степень этих колебаний может повлиять на интерпретацию уровней лютеинового прогестерона в клинических условиях.
Дизайн
Пилотно-разведочное исследование.
Учреждение
Отделение репродуктивной медицины при государственной больнице.
Пациенты
Десять женщин проходят курс ЭКО.
Вмешательство
Через семь дней после забора ооцитов у пациентов часто проводился повторный забор крови (каждые 60 минут в течение 12 часов и в течение двух из этих часов каждые 15 минут). Образцы сыворотки крови анализировали на прогестерон, эстрадиол и лютеинизирующий гормон (ЛГ).
Основные критерии оценки результатов
Дневные колебания s-прогестерона и s-эстрадиола.
Результаты
Наблюдалась значимая положительная корреляция между медианными уровнями P 4 и величиной вариаций P 4 — женщины со средним значением P 4 <60 нмоль / л имели клинически стабильные уровни P 4 на протяжении всего периода исследования. день, в то время как пациенты со средним значением P 4 > 250 нмоль / л демонстрировали периодические пики P 4 в несколько сотен наномолей на литр.Эти эндогенные колебания P 4 наблюдались независимо от типа протокола стимуляции или режима запуска окончательного созревания ооцитов и несмотря на тот факт, что LH был ниже предела обнаружения во время измерения. Одновременно наблюдались большие колебания s-эстрадиола.
Заключение
Мониторинг раннего и среднего лютеинового уровня P 4 в циклах ЭКО может быть ценным при планировании индивидуальной поддержки лютеиновой фазы в попытке улучшить репродуктивные результаты. Однако предварительным условием для мониторинга лютеиновой фазы является достоверность единственного измеренного значения P 4 . Мы впервые показываем, что одно измерение P 4 у пациента с низким уровнем прогестерона достаточно точно отражает функцию желтого тела и что это измерение может быть использовано для выявления пациентов с ЭКО, которым необходимо дополнительное введение экзогенного лютеина P 4 .
Однако предварительным условием для мониторинга лютеиновой фазы является достоверность единственного измеренного значения P 4 . Мы впервые показываем, что одно измерение P 4 у пациента с низким уровнем прогестерона достаточно точно отражает функцию желтого тела и что это измерение может быть использовано для выявления пациентов с ЭКО, которым необходимо дополнительное введение экзогенного лютеина P 4 .
Ключевые слова: сывороточный прогестерон, in vitro оплодотворение , сывороточный эстрадиол, лютеиновая фаза, дневная вариация
Введение
Желтое тело человека (ХТ) является транзиторной эндокринной железой яичников, которая активна во время лютеиновой фазы менструальный цикл и на ранних сроках беременности до 8 недели гестации.CL производит значительные количества прогестерона (P 4 ), эстрадиола (E 2 ) и андрогенов, а также факторов роста и нестероидных гормонов. Общее поддержание функции CL критически зависит от регулярной стимуляции лютеинизирующим гормоном гипофиза (ЛГ) или хорионическим гонадотропином человека (ХГЧ) для поддержания стероидогенеза лютеинизированной гранулезой и клетками теки (1). Достаточное производство P 4 из CL является абсолютной необходимостью для децидуализации эндометрия перед имплантацией и установления ранней беременности.Секреция прогестерона из КЛ максимальна в середине лютеиновой фазы, вызывая в естественном цикле сывороточный уровень P 4 примерно 40–60 нмоль / л (2, 3).
Достаточное производство P 4 из CL является абсолютной необходимостью для децидуализации эндометрия перед имплантацией и установления ранней беременности.Секреция прогестерона из КЛ максимальна в середине лютеиновой фазы, вызывая в естественном цикле сывороточный уровень P 4 примерно 40–60 нмоль / л (2, 3).
Во время стимуляции яичников для in vitro оплодотворение (ЭКО) получают надфизиологические уровни E 2 во время поздней фолликулярной фазы в результате мультифолликулярного роста. Это гиперэстрогенное состояние должно уравновешиваться в лютеиновой фазе повышенной нагрузкой P 4 для достижения восприимчивого эндометрия к моменту переноса эмбриона.Ранее Хумайдан и его коллеги показали, что использование триггера агониста ГнРГ в циклах ЭКО с последующей поддержкой стандартной вагинальной лютеиновой фазы приводило к среднему лютеиновому уровню P 4 , сравнимому с уровнями, наблюдаемыми в естественном цикле (39 нмоль / л). (4). Однако, в отличие от того, что ожидалось, этот уровень P 4 был слишком низким для обеспечения успешной имплантации и беременности, в результате чего частота продолжающихся беременностей при ЭКО составила только 6%. Таким образом, подчеркивая тот факт, что потребность в P 4 во время лютеиновой фазы стимулированного цикла больше, чем у естественного цикла.Когда поддержка лютеиновой фазы была изменена путем добавления болюса 1500 МЕ ХГЧ в день извлечения ооцитов, срединно-лютеиновый уровень P 4 запускаемого цикла GnRHa увеличился до 74 нмоль / л, в результате чего скорость доставки составила 24%. за перевод (5). Похоже, что пороговое значение P 4 в средне-лютеиновой сыворотке составляет примерно 80–100 нмоль / л после лечения ЭКО с последующим переносом свежего эмбриона, и что этот порог должен быть превышен для обеспечения успешного репродуктивного результата (6).Традиционная поддержка лютеиновой фазы в циклах искусственного ЭКО с введением микронизированного влагалища P 4 индуцирует уровень P 4 в лютеиновой сыворотке примерно 40 нмоль / л (7–9).
(4). Однако, в отличие от того, что ожидалось, этот уровень P 4 был слишком низким для обеспечения успешной имплантации и беременности, в результате чего частота продолжающихся беременностей при ЭКО составила только 6%. Таким образом, подчеркивая тот факт, что потребность в P 4 во время лютеиновой фазы стимулированного цикла больше, чем у естественного цикла.Когда поддержка лютеиновой фазы была изменена путем добавления болюса 1500 МЕ ХГЧ в день извлечения ооцитов, срединно-лютеиновый уровень P 4 запускаемого цикла GnRHa увеличился до 74 нмоль / л, в результате чего скорость доставки составила 24%. за перевод (5). Похоже, что пороговое значение P 4 в средне-лютеиновой сыворотке составляет примерно 80–100 нмоль / л после лечения ЭКО с последующим переносом свежего эмбриона, и что этот порог должен быть превышен для обеспечения успешного репродуктивного результата (6).Традиционная поддержка лютеиновой фазы в циклах искусственного ЭКО с введением микронизированного влагалища P 4 индуцирует уровень P 4 в лютеиновой сыворотке примерно 40 нмоль / л (7–9). Таким образом, существенная дополнительная эндогенная продукция P 4 CL является обязательной для превышения порогового значения P 4 , чтобы впоследствии оптимизировать вероятность беременности после лечения ЭКО. Традиционно врачи не контролируют уровни P 4 в лютеиновой фазе, будучи твердо уверены, что поддержка лютеиновой фазы покроет потребность цикла в P 4 .Однако ранее мы видели, что более 25% пациентов ЭКО в группе, запускаемой как ХГЧ, так и ГнРГ, имеют средне-лютеиновую сыворотку P 4 ниже 60 нмоль / л, несмотря на поддержку лютеиновой фазы и тот факт, что у них было более 14 фолликулы в день аспирации (10). Кроме того, данные не относящихся к человеку видов (11, 12) и данные циклов замораживания / оттаивания эмбрионов человека (13, 14) показали, что существует оптимальный диапазон лютеинового P 4 и что исход беременности снижается не только ниже, но и выше этого оптимального уровня P 4 .Так ли это и после ЭКО и переноса свежих эмбрионов, еще предстоит выяснить.
Таким образом, существенная дополнительная эндогенная продукция P 4 CL является обязательной для превышения порогового значения P 4 , чтобы впоследствии оптимизировать вероятность беременности после лечения ЭКО. Традиционно врачи не контролируют уровни P 4 в лютеиновой фазе, будучи твердо уверены, что поддержка лютеиновой фазы покроет потребность цикла в P 4 .Однако ранее мы видели, что более 25% пациентов ЭКО в группе, запускаемой как ХГЧ, так и ГнРГ, имеют средне-лютеиновую сыворотку P 4 ниже 60 нмоль / л, несмотря на поддержку лютеиновой фазы и тот факт, что у них было более 14 фолликулы в день аспирации (10). Кроме того, данные не относящихся к человеку видов (11, 12) и данные циклов замораживания / оттаивания эмбрионов человека (13, 14) показали, что существует оптимальный диапазон лютеинового P 4 и что исход беременности снижается не только ниже, но и выше этого оптимального уровня P 4 .Так ли это и после ЭКО и переноса свежих эмбрионов, еще предстоит выяснить. В этом случае мониторинг уровней лютеина P 4 может помочь улучшить репродуктивный результат в циклах ЭКО, позволяя индивидуализировать лечение на основе измерений P 4 в сыворотке.
В этом случае мониторинг уровней лютеина P 4 может помочь улучшить репродуктивный результат в циклах ЭКО, позволяя индивидуализировать лечение на основе измерений P 4 в сыворотке.
Однако измерения среднего лютеинового P 4 осложняются пульсирующим характером секреции гормона из CL. Filicori с соавторами (15) показали, что концентрации P 4 в плазме демонстрируют большие и быстрые колебания в течение средней лютеиновой фазы у женщин, ведущих естественный цикл.Таким образом, уровни P 4 варьировались от значений всего 7 нмоль / л до пиков 128 нмоль / л в течение нескольких минут в течение 24-часового периода исследования. В естественном цикле существуют два различных типа импульсов P 4 во время средней лютеиновой фазы: импульсы, которым предшествует импульс LH, и другие, возникающие во время покоя LH; последнее является результатом автономной секреции стероидов CL независимо от активности ЛГ. Во время средней лютеиновой фазы стимулированного цикла ЭКО гипофиз подавляется отрицательной обратной связью с надфизиологическими уровнями стероидов, и s-LH значительно снижается до уровней намного ниже (0. 5–0,7 МЕ / л), чем в середине лютеиновой фазы естественного цикла (5–7 МЕ / л) (16–18). Как эта пониженная пульсовая активность ЛГ влияет на секреторный паттерн стероидогенеза яичников в середине лютеиновой фазы цикла ЭКО, до сих пор неизвестно.
5–0,7 МЕ / л), чем в середине лютеиновой фазы естественного цикла (5–7 МЕ / л) (16–18). Как эта пониженная пульсовая активность ЛГ влияет на секреторный паттерн стероидогенеза яичников в середине лютеиновой фазы цикла ЭКО, до сих пор неизвестно.
Настоящее исследование было проведено для изучения того, демонстрируют ли уровни P 4 в средне-лютеиновой сыворотке в цикле ЭКО такой же высокопульсирующий паттерн, как в естественном цикле, зная, что пульсовая активность ЛГ заметно снижена.С клинической точки зрения мы хотели выяснить, обеспечивает ли однократное утреннее измерение P 4 надежный показатель средне-лютеиновой функции ХЛ после ЭКО.
Материалы и методы
Популяция исследования
Десять пациенток, перенесших ЭКО / ИКСИ в клинике репродуктивной медицины в Скиве, Дания, с декабря 2014 г. по декабрь 2015 г. добровольно вызвались принять участие в исследовании. Регистрировалась клиническая информация, касающаяся возраста, индекса массы тела (ИМТ), привычек курения, биохимического репродуктивного профиля, причины бесплодия, предыдущих попыток ЭКО, курса стимуляции и лабораторных результатов.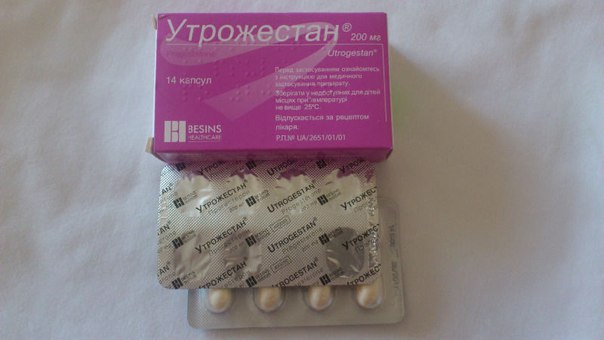 Исходные характеристики участников представлены в таблице. Письменное информированное согласие было получено от всех пациентов до участия в исследовании. Участники были выбраны так, чтобы они представляли как длинный цикл агонистов GnRH, так и цикл антагонистов GnRH, и различные типы запуска для окончательного созревания ооцитов (hCG или агонист GnRH).
Исходные характеристики участников представлены в таблице. Письменное информированное согласие было получено от всех пациентов до участия в исследовании. Участники были выбраны так, чтобы они представляли как длинный цикл агонистов GnRH, так и цикл антагонистов GnRH, и различные типы запуска для окончательного созревания ооцитов (hCG или агонист GnRH).
Таблица 1
Описание демографических данных, стимуляции яичников, поддержки лютеиновой фазы и уровней прогестерона у исследуемых пациенток.
| Пациент | Возраст (лет) | Индекс массы тела (кг / м 2 ) | Базальный ФСГ (МЕ / л) | Причина бесплодия | Протокол | Общая сумма ФСГ (МЕ) | Продолжительность стимуляции ФСГ (дни) | Триггер овуляции | Поддержка лютеиновой фазы | No. фолликулов> 14 мм фолликулов> 14 мм | Кол-во ооцитов | Кол-во MII | Средне-лютеиновый P 4 (нмоль / л) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 38 | 24,4 | 6,5 905 Мужской фактор | Long GnRHa | 3,225 | 11 | ХГЧ 10 000 МЕ | Лютинус 300 мг ежедневно | 5 | 5 | 1 | 89 | 26 | Отсутствие мужского партнера / эндометриоз | Антагонист ГнРГ | 1,725 | 9 | Супрефакт 0,5 мг | Лютинус 300 мг в день + 1500 ХГЧ (OPU) + 1000 ХГЧ (OPU + 5) | 10 | 10 | 283 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 39 | 30,0 | 6,4 | Отсутствует партнер-мужчина | Long GnRHa | 3,450 | 12 | Ivitrelle | Ivitrelle 90 мг / сутки 12 | 12 | 277 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 34 | 22. 2 2 | 14,7 | Необъяснимый | Длинный ГнРГ | 3,600 | 12 | ХГЧ 10 000 МЕ | Лутинус 300 мг ежедневно | 9 | 8 | 905 905 905 905 905 905 905 905 19,95,9 | Мужской фактор | Long GnRHa | 2,925 | 11 | ХГЧ 10 000 МЕ | Лютинус 300 мг в день | 9 | 6 | 905 | 25. 3 3 | 8,3 | Необъяснимый | Long GnRHa | 3,600 | 12 | Овитрелл 6,500 МЕ | Лутинус 300 мг ежедневно | 11 | 841 | 905 905 905 905 905 905 905 905 905 31,83,9 | Эндометриоз | Антагонист ГнРГ | 2,025 | 9 | Супрефакт 0,5 мг | Кринон 180 ежедневно + 1,500 ХГЧ (OPU) | 17 | 11 905 43 17 | 11 905 43 17 | 11 905 43 17 | 11 905 | 36 | 25. 6 6 | 4,9 | Тубальный фактор | Антагонист ГнРГ | 1,913 | 9 | Супрефакт 0,5 мг | Кринон 180 ежедневно + 1,500 ХГЧ (OPU) | 19 | 13 905 9 | 40 | 34,5 | 7,2 | Необъяснимая | Long GnRHa | 2,250 | 9 | hCG 10,000 IU | Lutinus 300 мг ежедневно | 905 905 | 7 905 10 | 36 | 29. 4 4 | 7,2 | Мужской фактор | Антагонист ГнРГ | 3,938 | 15 | Супрефакт 0,5 мг | Лютинус 300 мг в день + 1000 ХГЧ (OPU) + 500 (OPU + 5) | 14 905 8 | 161 |
Протоколы стимуляции яичников
Шесть пациентов лечились в рамках длительного цикла агонистов гонадолиберин с подавлением гипофиза с помощью подкожной инъекции бусерелина 0,8 мг (Suprefact ® ; Sanofi, Дания), начиная с середины 20-го века. лютеиновая фаза предыдущего цикла. Суточная доза бусерелина 0,4 мг вводилась до дня, предшествующего началу овуляции. На 2-й день цикла было проведено трансвагинальное ультразвуковое исследование, и в случае толщины эндометрия <4 мм началась стимуляция яичников с помощью корифоллитропина-альфа (Elonva ® ; MSD, Дания) в сочетании с любым r-ФСГ. / рЛГ (Pergoveris ® ; Merck Biopharma, Дания) или чМГ (Menopur ® , Ferring Pharmaceuticals, Дания). Дозировка гонадотропина определялась индивидуально на основании возраста пациента, ИМТ, исходного уровня ФСГ, предыдущей реакции на гонадотропины и количества антральных фолликулов и корректировалась путем мониторинга размера фолликулов с помощью трансвагинального ультразвукового исследования во время лечения.Окончательное созревание ооцитов индуцировали либо 10000 МЕ п / к ХГЧ (прегнил ® , MSD, Дания), либо п / к 6 500 МЕ (Ovitrelle ® , Merck Biopharma, Дания), когда два или более ведущих фолликула достигли среднего диаметра 17 мм.
Суточная доза бусерелина 0,4 мг вводилась до дня, предшествующего началу овуляции. На 2-й день цикла было проведено трансвагинальное ультразвуковое исследование, и в случае толщины эндометрия <4 мм началась стимуляция яичников с помощью корифоллитропина-альфа (Elonva ® ; MSD, Дания) в сочетании с любым r-ФСГ. / рЛГ (Pergoveris ® ; Merck Biopharma, Дания) или чМГ (Menopur ® , Ferring Pharmaceuticals, Дания). Дозировка гонадотропина определялась индивидуально на основании возраста пациента, ИМТ, исходного уровня ФСГ, предыдущей реакции на гонадотропины и количества антральных фолликулов и корректировалась путем мониторинга размера фолликулов с помощью трансвагинального ультразвукового исследования во время лечения.Окончательное созревание ооцитов индуцировали либо 10000 МЕ п / к ХГЧ (прегнил ® , MSD, Дания), либо п / к 6 500 МЕ (Ovitrelle ® , Merck Biopharma, Дания), когда два или более ведущих фолликула достигли среднего диаметра 17 мм. Забор ооцитов проводили через 36 ч после введения ХГЧ. Процедуры ЭКО / ИКСИ и культивирование эмбрионов проводились в соответствии с обычной клинической практикой. На 3 или 5 день после извлечения ооцитов было перенесено не более двух эмбрионов. Поддержка лютеиновой фазы вводилась в виде микронизированного влагалища P 4 (Lutinus ® 300 мг в день, Ferring Pharmaceutical, Дания или Crinone ® 180 мг в день, Merck Biopharma, Дания), начиная с 1 дня после забора ооцитов (OPU) .
Забор ооцитов проводили через 36 ч после введения ХГЧ. Процедуры ЭКО / ИКСИ и культивирование эмбрионов проводились в соответствии с обычной клинической практикой. На 3 или 5 день после извлечения ооцитов было перенесено не более двух эмбрионов. Поддержка лютеиновой фазы вводилась в виде микронизированного влагалища P 4 (Lutinus ® 300 мг в день, Ferring Pharmaceutical, Дания или Crinone ® 180 мг в день, Merck Biopharma, Дания), начиная с 1 дня после забора ооцитов (OPU) .
У четырех пациентов использовался протокол антагонистов ГнРГ. На 2 день цикла началась стимуляция яичников с помощью r-FSH (Gonal-F ® ; Merck Biopharma, Дания) или hMG (Menopur ® , Ferring Pharmaceuticals, Дания) после ультразвукового исследования влагалища. Ежедневная совместная обработка антагонистами ГнРГ (Оргалутран ® 0,25 мг / день, MSD, Дания) добавлялась при размере фолликула 12 мм. Дозу ФСГ подбирали индивидуально в соответствии с ответом яичников. Окончательное созревание ооцитов индуцировали SC Buserelin 0.5 мг (Suprefact ® ; Sanofi, Дания) при наличии двух или более фолликулов размером ≥17 мм. Забор ооцитов проводили через 36 часов. Максимум два эмбриона были перенесены на 3 или 5 день после OPU. Поддержка лютеиновой фазы проводилась по индивидуальному режиму, состоящему из вагинального введения 300 мг микронизированного P 4 ежедневно (Lutinus ® , Ferring Pharmaceuticals, Дания) в сочетании с болюсным введением ХГЧ (1000–1500 МЕ) в день приема. извлечение ооцитов (5, 10).В зависимости от индивидуальной реакции яичников на стимуляцию некоторым пациентам вводили дополнительный болюс ХГЧ на OPU + 5 (500–1000 МЕ) (10). См. Подробную информацию в таблице. Вагинальное введение P 4 продолжалось до дня тестирования на беременность (триггер ХГЧ) или до седьмой недели гестации (триггер ГнРГ).
Окончательное созревание ооцитов индуцировали SC Buserelin 0.5 мг (Suprefact ® ; Sanofi, Дания) при наличии двух или более фолликулов размером ≥17 мм. Забор ооцитов проводили через 36 часов. Максимум два эмбриона были перенесены на 3 или 5 день после OPU. Поддержка лютеиновой фазы проводилась по индивидуальному режиму, состоящему из вагинального введения 300 мг микронизированного P 4 ежедневно (Lutinus ® , Ferring Pharmaceuticals, Дания) в сочетании с болюсным введением ХГЧ (1000–1500 МЕ) в день приема. извлечение ооцитов (5, 10).В зависимости от индивидуальной реакции яичников на стимуляцию некоторым пациентам вводили дополнительный болюс ХГЧ на OPU + 5 (500–1000 МЕ) (10). См. Подробную информацию в таблице. Вагинальное введение P 4 продолжалось до дня тестирования на беременность (триггер ХГЧ) или до седьмой недели гестации (триггер ГнРГ).
Забор крови
Забор крови проводился в середине лютеиновой фазы, то есть через 7 дней после OPU (OPU + 7). Пациенты были доставлены в отделение репродуктивной медицины рано утром и оставались в клинике в течение последующих 12 часов.Время начала забора крови для всех пациентов было с 6 до 9 часов утра. В течение периода исследования участникам была разрешена нормальная повседневная деятельность.
Пациенты были доставлены в отделение репродуктивной медицины рано утром и оставались в клинике в течение последующих 12 часов.Время начала забора крови для всех пациентов было с 6 до 9 часов утра. В течение периода исследования участникам была разрешена нормальная повседневная деятельность.
Внутривенную канюлю вводили в вену в антекубитальной ямке, и образцы крови (4 мл) отбирали каждые 60 минут в течение 12 часов ( n = 10) и в течение двух из этих часов каждые 15 минут ( n = 8 из-за затрудненного венозного доступа у двух пациентов). После коагуляции при комнатной температуре образцы крови центрифугировали, выделяли сыворотку и хранили при -80 ° C до анализа.
Измерение гормонов
Сыворотка P 4 (нмоль / л), E 2 (пмоль / л) и концентрации ЛГ (МЕ / л) измеряли с помощью автоматизированных электрохемилюминесцентных иммуноанализов (Cobas ® Modular analytics E170 , Roche Diagnostics, Швейцария) обычно используется для анализа в отделении биохимии региональной больницы Выборга, Дания. Все измерения были выполнены в соответствии с инструкциями производителя с использованием имеющегося в продаже набора для хемилюминесцентного иммуноанализа, предназначенного для измерений в сыворотке.
Все измерения были выполнены в соответствии с инструкциями производителя с использованием имеющегося в продаже набора для хемилюминесцентного иммуноанализа, предназначенного для измерений в сыворотке.
Предел обнаружения гормонов составлял 0,2 нмоль / л, 18,4 пмоль / л и 0,1 МЕ / л для P 4 , E 2 и ЛГ соответственно. Все образцы сыворотки от каждого пациента были измерены в рамках одного цикла анализа. Все концентрации гормонов, превышающие предел обнаружения анализа, измеряли в двух экземплярах. Все коэффициенты вариации для P 4 , E 2 и LH были ниже 4%.
Статистика
Данные представлены в виде среднего значения ± стандартное отклонение или медианы и диапазона, когда это необходимо.Максимальное абсолютное изменение (MAV) в сыворотке P 4 за 12-часовой период дается как максимальная концентрация P 4 — минимальная концентрация P 4 во время отбора проб для каждого пациента.
Коэффициент корреляции Спирмена ( r ) был рассчитан для корреляции медианного уровня стероидов с максимальным абсолютным изменением гормона в течение дня (MAV). Значение p <0,05 считалось статистически значимым. Все анализы были выполнены с использованием STATA версии 13.
Значение p <0,05 считалось статистически значимым. Все анализы были выполнены с использованием STATA версии 13.
Результаты
Характеристики пациентов
Пациенты имели средний возраст 35,3 ± 4,2 года, средний ИМТ 26,6 ± 4,7 кг / м 2 и 1,9 ± 2,0 до попыток ЭКО. Средний уровень ФСГ для всех пациентов составил 6,55 МЕ / л (межквартильный размах 5,9; 7,2 МЕ / л). Все участники были некурящими. У четырех пациентов причиной бесплодия была не женщина (мужской фактор или отсутствие партнера-мужчины), у трех пациентов причина была женщина (трубный фактор или эндометриоз), а у трех пациентов причина бесплодия была идиопатической (необъяснимой).См. Подробную информацию в таблице.
Общие значения средне-лютеинового прогестерона
У трех пациентов средний уровень средне-лютеинового P 4 был ниже 60 нмоль / л. Двое из этих пациентов (№7 и №8) были запущены агонистом ГнРГ и получили поддержку лютеиновой фазы с помощью 1500 МЕ ХГЧ (OPU) и вагинального P 4 (Кринон 180 мг в день). Несмотря на то, что в день OPU было извлечено 19 и 17 фолликулов размером ≥ 14 мм и 11-13 зрелых ооцитов, они показали средне-лютеиновый P 4 всего 55 и 36 нмоль / л соответственно.Другой пациент (№ 9) с P 4 <60 нмоль / л был запущен с помощью 10000 МЕ ХГЧ и имел семь фолликулов> 14 мм в день аспирации.
Несмотря на то, что в день OPU было извлечено 19 и 17 фолликулов размером ≥ 14 мм и 11-13 зрелых ооцитов, они показали средне-лютеиновый P 4 всего 55 и 36 нмоль / л соответственно.Другой пациент (№ 9) с P 4 <60 нмоль / л был запущен с помощью 10000 МЕ ХГЧ и имел семь фолликулов> 14 мм в день аспирации.
Общие средне-лютеиновые значения ЛГ
Ни у одного из пациентов с пониженной регуляцией по протоколу длинного агониста ГнРГ ( n = 6) уровни s-LH превышали предел обнаружения анализа в любой момент во время измерения (т. Е. LH < 0,1 МЕ / л). У трех из четырех пациентов, стимулированных по протоколу антагониста ГнРГ, наблюдалась умеренная импульсная активность ЛГ с амплитудами ЛГ от 0.От 2 до 2,8 ЕД / л. У всех пациентов за пиком ЛГ следовало повышение P 4 в сыворотке от 4 до 36 нмоль / л.
Дневные колебания сывороточного прогестерона
Как видно во время естественного цикла, большие колебания среднего лютеинового P 4 также присутствовали в дневное время у некоторых женщин, подвергающихся лечению ЭКО (рисунок). Колебания лютеиновых стероидов наблюдались независимо от выбора протокола стимуляции, режима окончательного созревания ооцитов и типа поддержки лютеиновой фазы.
Колебания лютеиновых стероидов наблюдались независимо от выбора протокола стимуляции, режима окончательного созревания ооцитов и типа поддержки лютеиновой фазы.
Индивидуальные профили прогестерона в средне-лютеиновой сыворотке в течение 12-часового интервала у 10 пациентов, подвергшихся контролируемой стимуляции яичников для лечения оплодотворением in vitro .
Наибольшая вариация уровней P 4 наблюдалась у пациентов со средним значением P 4 > 250 нмоль / л. У пациента № 2 со средним значением P 4 , равным 283 нмоль / л, значение P 4 колебалось от 293 нмоль / л в 11 часов утра до 448 нмоль / л в 12 часов вечера, т. Е. Увеличение на 155 нмоль / л в течение 1 часа. часЭто колебание уровня P 4 присутствовало даже при том, что s-LH был ниже уровня обнаружения в течение дня (Рисунок A). Увеличение P 4 сопровождалось сопоставимым увеличением E 2 (Рисунок A). Концентрация P 4 в сыворотке в течение 12-часового периода для этого конкретного пациента варьировала от 183 нмоль / л рано утром до 448 нмоль / л в течение дня — таким образом, MAV во время периода исследования Δ265 нмоль / л. У пациента № 6 (медиана P 4 376 нмоль / л) и № 3 (медиана P 4 277 нмоль / л) наблюдалось быстрое повышение уровней P 4 (Δ 70–75 нмоль / л, соответственно). наблюдается в течение всего 15 минут без какой-либо сопутствующей активности ЛГ (ЛГ <0.1 МЕ / л). Для сравнения, у пациента № 7 медиана P 4 составляла всего 36 нмоль / л и наблюдались лишь незначительные колебания в течение дня с уровнями P 4 в диапазоне от 25 до 48 нмоль / л после небольшого обнаруживаемого увеличения секреции ЛГ ( полные дневные значения P 4 см. в таблице).
У пациента № 6 (медиана P 4 376 нмоль / л) и № 3 (медиана P 4 277 нмоль / л) наблюдалось быстрое повышение уровней P 4 (Δ 70–75 нмоль / л, соответственно). наблюдается в течение всего 15 минут без какой-либо сопутствующей активности ЛГ (ЛГ <0.1 МЕ / л). Для сравнения, у пациента № 7 медиана P 4 составляла всего 36 нмоль / л и наблюдались лишь незначительные колебания в течение дня с уровнями P 4 в диапазоне от 25 до 48 нмоль / л после небольшого обнаруживаемого увеличения секреции ЛГ ( полные дневные значения P 4 см. в таблице).
(A) Дневные изменения среднего лютеинового s-прогестерона и s-LH у пациента № 2. Медиана P 4 = 283 нмоль / л. Максимальная вариация P 4 /12 ч = 265 нмоль / л. (B) Дневные колебания уровней s-прогестерона и s-эстрадиола в средней части лютеина у пациента № 2. Медиана E 2 = 3471 пмоль / л. Максимальная вариация E 2 /12 ч = 1,481 пмоль / л.
Таблица 2
Средне-лютеиновые концентрации прогестерона в сыворотке в дневное время у 10 женщин, перенесших лечение оплодотворением in vitro .
| Пациент | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
8. 00.00 00.00 | 9.00 | 9.15 | 9.30 | 9.45 | 10.00 | 11.00 | 12.00 | 13.00 | 14.00 | ||||||||||||
| P 4 нмоль / л | 126 | 106 | 91 | 93 | 88 | 97 | 87 | 93 | 99 905 905 905 905 905 905 | 15 стр. м. м. | 16 часов | 17 часов | 17.15 | 17.30 | 17.45 | 18 часов | 19 часов | 20:00 | 89 (63–126) | ||
| 102 | 89 | 69 | 72 | 78 | 78 | 73 | 67 | 63 | |||||||||||||
| 2 | |||||||||||||||||||||
| Время | 8. 00.00 00.00 | 9.00 | 10.00 | 10.15 | 10.30 | 10.45 | 11.00 | 12.00 | 13.00 | 14.00 | |||||||||||
| P 4 нмоль / л | 183 | 224 | 283 | 271 | 266 | 283 | 293 | 448 905 905 905 432 905 904 905 905 | 15. 00 вечера 00 вечера | 15.15 | 15.30 | 15.45 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 | 283 (183–448) | |||
| 262 | 258 | 345 | 328 | 342 | 331 | 348 | 905 | 905 | 265 | ||||||||||||
| 3 | |||||||||||||||||||||
| Время | 6. 00.00 00.00 | 7.00 | 7.15 | 7.30 | 7.45 | 8.00 | 9.00 | 10.00 | 11.00 | 12.00 | |||||||||||
| P 4 нмоль / л | 370 | 320 | 323 | 301 | 272 | 347 | 281 | 244 905 905 905 905 905 905 905 905 | 12. 15 часов вечера 15 часов вечера | 12.30 | 12:45 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 277 (225–370) | |||
| 283 | 269 | 277 | 278 | 230 | 225 | 251 | 255 | 255 43 | 255 | 145||||||||||||
| 4 | |||||||||||||||||||||
| Время | 8. 00:00 00:00 | 8,15 | 8:30 | 8,45 | 9:00 | 10:00 | 11:00 | 12:00 | 13.00 | 14.00 | |||||||||||
| P 4 нмоль / л | 216 | 228 | 224 | 228 | 216 | 226 | 202 | 240 905 905 905 905 905 905 905 | 14. 15 часов вечера 15 часов вечера | 14.30 | 14.45 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 | 213 (171–240) | |||
| 208 | 205 | 200 | 201 | 228 | 204 | 188 | 1905 905 905 43 905 905 905 905 69 | ||||||||||||||
| 5 | |||||||||||||||||||||
| Время | 9. 00:00 00:00 | 10:00 | 11:00 | 12:00 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | |||||||||||
| P 4 нмоль / л | 131 | 122 | 110 | 119 | 136 | 97 | 92 | 89 | 70 905 905 | 19. 00 вечера 00 вечера | 20.00 | 21.00 | 97 (70–136) | ||||||||
| 70 | 96 | 71 | 905 905 | ΔP 4 : 66 | |||||||||||||||||
| 6 | |||||||||||||||||||||
| Время | 7. 00.00 00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 11.15 | 11.30 | 11.45 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 416 | 296 | 311 | 299 | 365 | 314 | 312 | 314 | 312 | 382 905 905 434 905 905 435 905 435 4 905 434 | 13. 15 часов вечера 15 часов вечера | 13.30 | 13.45 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 376 (275–440) | |
| 416 | 395 | 307 | 275 | 366 | 438 | 395 | 905 434 905 434 905 434 905 434 905 434 165 | ||||||||||||||
| 7 | |||||||||||||||||||||
| Время | 7. 00.00 00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 12.00 | 13.00 | 14.00 | 15.00 | 16.00 | |||||||||||
| P 4 нмоль / л | 27 | 25 | 32 | 36 | 40 | 39 | 36 | 34 | 29 905 905 905 905 905 905 905 | 17. 00 вечера 00 вечера | 18.00 | 19.00 | 36 (25–48) | ||||||||
| 39 | 48 | 37 | 905 905 905 905 905 905 905 905 905 905 905 | ΔP 4 : 23 | |||||||||||||||||
| 8 | |||||||||||||||||||||
| Время | 7. 00.00 00.00 | 8.00 | 9.00 | 9.15 | 9.30 | 9.45 | 10.00 | 11.00 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 51 | 55 | 50 | 50 | 50 | 49 | 50 | 53 | 59 905 905 42 905 905 905 | 14. 00 вечера 00 вечера | 15.00 | 16.00 | 16.15 | 16.30 | 16.45 | 17.00 | 18.00 | 19.00 | 55 (49–62) | ||
| 52 | 53 | 61 | 59 | 60 | 59 | 62 | 58 | 56 13 | |||||||||||||
| 9 | |||||||||||||||||||||
| Время | 7. 00.00 00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 11.15 | 11.30 | 11.45 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 65 | 64 | 63 | 58 | 52 | 52 | 50 | 51 | 595 905 905 905 905 | 14. 00 вечера 00 вечера | 15.00 | 16.00 | 17.00 | 18.00 | 18.15 | 18.30 | 18.45 | 19.00 | 54 (51–65) | ||
| 54 | 58 | 55 | 58 | 56 | 53 | 53 | 53 | 4 14 | |||||||||||||
| 10 | |||||||||||||||||||||
| Время | 7. 00 утра 00 утра | 8,00 утра | 8,15 утра | 8,30 утра | 8,45 утра | 9,00 утра | 10,00 утра | 10,15 утра | 10,30 утра | 10,45 утра | 185 | 178 | 187 | 182 | 181 | 180 | 112 | 108 | 117 | 124 | |
11905. 00:00 00:00 | 12:00 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 161 (108–189) | ||||||||||||
| 122 | 140 | 155 | 153 | 172 | 189 | 18 | 161 146 | 161 | 905 81|||||||||||||
Была положительная корреляция между медианными уровнями P 4 и MAV в P 4 в дневное время ( r Спирмена = 0. 9273, p = 0,0001). Величина импульса P 4 и, таким образом, максимальное изменение зависит от средней средне-лютеиновой концентрации P 4 (рисунок). У пациентов со средним значением P 4 > 250 нмоль / л в дневное время наблюдались очень большие колебания уровня P 4 в сыворотке со средним MAV 165 нмоль / л (диапазон 145–265 нмоль / л). Пациенты со средним значением P 4 от 89 до 213 нмоль / л имели среднее значение MAV 68 нмоль / л (диапазон 63–81 нмоль / л), тогда как пациенты с очень низким средне-лютеиновым уровнем P 4 (медиана P 4 <60 нмоль / л) имели довольно постоянные уровни P 4 в сыворотке в течение дня (медиана MAV 14 нмоль / л, диапазон 13–23 нмоль / л).
9273, p = 0,0001). Величина импульса P 4 и, таким образом, максимальное изменение зависит от средней средне-лютеиновой концентрации P 4 (рисунок). У пациентов со средним значением P 4 > 250 нмоль / л в дневное время наблюдались очень большие колебания уровня P 4 в сыворотке со средним MAV 165 нмоль / л (диапазон 145–265 нмоль / л). Пациенты со средним значением P 4 от 89 до 213 нмоль / л имели среднее значение MAV 68 нмоль / л (диапазон 63–81 нмоль / л), тогда как пациенты с очень низким средне-лютеиновым уровнем P 4 (медиана P 4 <60 нмоль / л) имели довольно постоянные уровни P 4 в сыворотке в течение дня (медиана MAV 14 нмоль / л, диапазон 13–23 нмоль / л).
Максимальный абсолютный разброс s-прогестерона = P 4 максимум — P 4 минимум (нмоль / л) у 10 пациентов, подвергшихся лечению оплодотворением in vitro . Спирмена r = 0,9273, p = 0,0001.
Не было общего общего дневного ритма для P 4 у 10 обследованных женщин, что позволяет предположить, что лютеиновая фаза зависит от пациента. У некоторых пациентов самый высокий уровень гормонов наблюдался утром, у других — днем или ранним вечером (см. Рисунок).Время акрофазы (зенит) P 4 и надира P 4 было до полудня у половины пациентов и после полудня у другой половины пациентов (рисунок).
Время достижения максимальной концентрации P 4 (акрофаза) у 10 женщин, подвергающихся лечению ЭКО. Как видно, у пяти женщин была акрофаза P 4 до полудня и у пяти женщин после полудня. Такая же картина наблюдалась для надира P 4 .
Дневные колебания в сыворотке эстрадиола
Большие колебания средней лютеиновой сыворотки E 2 также наблюдались во время 12-часового отбора проб.У пациента № 2 E 2 увеличился с 3480 до 4664 пмоль / л за 1 час (Δ1 184 нмоль / л) (Рисунок B). У пациентов был индивидуальный максимум E 2 вариации (Max E 2 — Min E 2 ) в течение 12 часов в диапазоне от Δ404 до Δ1,481 пмоль / л. Не было корреляции между медианными уровнями E 2 и MAV в средне-лютеиновой E 2 (Спирмена r = 0,4424, p = 0,20).
У пациентов был индивидуальный максимум E 2 вариации (Max E 2 — Min E 2 ) в течение 12 часов в диапазоне от Δ404 до Δ1,481 пмоль / л. Не было корреляции между медианными уровнями E 2 и MAV в средне-лютеиновой E 2 (Спирмена r = 0,4424, p = 0,20).
Как и ожидалось, P 4 и E 2 , по-видимому, совместно секретируются из CL, демонстрируя аналогичные модели колебаний во времени (рисунок).Пациенты со средним значением P 4 <60 нмоль / л имели E 2 в диапазоне от 541 до 1552 пмоль / л (медиана E 2 1457 пмоль / л), тогда как пациенты со средним значением P 4 от 89 до 213 нмоль / л. У меня были уровни E 2 от 659 до 4884 пмоль / л (медиана E 2 2843 пмоль / л). У пациентов со средним значением P 4 > 250 нмоль / л значение E 2 колебалось от 3471 до 3919 пмоль / л (медиана E 2 3874 пмоль / л). Обнаружилась значимая корреляция между медианными уровнями P 4 и медианными уровнями E 2 во время средней лютеиновой фазы стимулированного цикла ( r Спирмена = 0.8424, p = 0,002).
Обнаружилась значимая корреляция между медианными уровнями P 4 и медианными уровнями E 2 во время средней лютеиновой фазы стимулированного цикла ( r Спирмена = 0.8424, p = 0,002).
(A) Дневные изменения среднего лютеинового s-прогестерона и s-эстрадиола у пациента № 10. Медиана P 4 = 161 нмоль / л, медиана E 2 = 3606 пмоль / л. (B) Дневные колебания уровней s-прогестерона и s-эстрадиола в средней части лютеина у пациента № 1. Медиана P 4 = 89 нмоль / л, медиана E 2 = 659 пмоль / л.
Обсуждение
Насколько нам известно, это первое исследование, в котором изучаются возможные дневные изменения секреции P 4 в середине лютеиновой фазы в группе женщин, проходящих лечение ЭКО.
Мы обнаружили, что величина средне-лютеиновых колебаний P 4 после лечения ЭКО зависела от среднего уровня P 4 . Наибольшие вариации P 4 наблюдались у пациентов, у которых медиана P 4 превышала 250 нмоль / л (медиана MAV 165 нмоль / л), тогда как пациенты в группе с низким P 4 (медиана P 4 <60 нмоль) / л) имели относительно постоянные уровни P 4 в течение дня (медиана MAV 14 нмоль / л). Пациенты показали очень индивидуальный паттерн секреции гормонов без какого-либо очевидного общего дневного ритма в секреции P 4 .Сыворотка E 2 показала аналогичные колебания в средней лютеиновой фазе с пациентами, имеющими индивидуальные вариации E 2 в диапазоне от Δ404 до Δ1 481 пмоль / л в течение 12 часов исследования.
Пациенты показали очень индивидуальный паттерн секреции гормонов без какого-либо очевидного общего дневного ритма в секреции P 4 .Сыворотка E 2 показала аналогичные колебания в средней лютеиновой фазе с пациентами, имеющими индивидуальные вариации E 2 в диапазоне от Δ404 до Δ1 481 пмоль / л в течение 12 часов исследования.
В более ранних исследованиях описан весьма изменчивый паттерн секреции P 4 во время средней лютеиновой фазы у женщин, ведущих естественный цикл (15, 19, 20). В этих исследованиях сообщалось о наличии двух различных типов импульсов лютеина P 4 — некоторым предшествовал импульс ЛГ, а другим не сопутствовал ЛГ, наблюдаемым во время покоя гипофиза.Последнее, по-видимому, является результатом автономной секреции P 4 из CL, запускаемой и поддерживаемой внутриовариальными концентрациями E 2 , окситоцина и PGF 2α (21, 22). CL состоит из двух типов стероидогенных клеток, то есть малых лютеиновых клеток (SLC), происходящих из клеток фолликулярной теки, и больших лютеиновых клеток (LLC), происходящих из клеток фолликулярной гранулезы. И маленькие, и большие элементы обладают большой производительностью для производства P 4 .Более того, обе клетки обладают уникальными стероидогенными функциями, и «двухклеточный» механизм биосинтеза E 2 , по-видимому, действует в человеческом CL аналогично преовуляторному фолликулу (23). Таким образом, LLC содержат P450-ароматазу, необходимую для синтеза E 2 , тогда как SLC экспрессируют P450c17 для продукции андрогенов (24, 25). Оба типа лютеиновых клеток экспрессируют рецепторы E 2 (26), а стимуляция E 2 является мощным триггером высвобождения P 4 из любого типа клеток (27).
И маленькие, и большие элементы обладают большой производительностью для производства P 4 .Более того, обе клетки обладают уникальными стероидогенными функциями, и «двухклеточный» механизм биосинтеза E 2 , по-видимому, действует в человеческом CL аналогично преовуляторному фолликулу (23). Таким образом, LLC содержат P450-ароматазу, необходимую для синтеза E 2 , тогда как SLC экспрессируют P450c17 для продукции андрогенов (24, 25). Оба типа лютеиновых клеток экспрессируют рецепторы E 2 (26), а стимуляция E 2 является мощным триггером высвобождения P 4 из любого типа клеток (27).
Выделение больших и SLC из желтого тела человека показало, что, будучи индуцированными пиком LH, LLC демонстрируют наибольшую базальную продукцию P 4 (28) и что эта продукция не увеличивается при дальнейшей стимуляции LH (29). LLC продуцируют P 4 с постоянной скоростью и являются доминирующим источником P 4 во время ранней лютеиновой фазы (30). В течение этого периода уровни P 4 демонстрируют непульсирующий паттерн как в естественном (15), так и в стимулированном цикле (OPU + 2) (31).Чувствительность SLC к LH / hCG развивается во время ранней средней лютеиновой фазы, когда клетки отвечают выраженным увеличением секреции P 4 в ответ на импульсы LH. Вклад лютеинового P 4 от SLC увеличивается во время средней и поздней лютеиновой фазы, во время которой секреция P 4 становится очень пульсирующей (32).
В течение этого периода уровни P 4 демонстрируют непульсирующий паттерн как в естественном (15), так и в стимулированном цикле (OPU + 2) (31).Чувствительность SLC к LH / hCG развивается во время ранней средней лютеиновой фазы, когда клетки отвечают выраженным увеличением секреции P 4 в ответ на импульсы LH. Вклад лютеинового P 4 от SLC увеличивается во время средней и поздней лютеиновой фазы, во время которой секреция P 4 становится очень пульсирующей (32).
Таким образом, эндогенный средне-лютеиновый уровень P 4 состоит из трех частей: базальная продукция P 4 LLC, импульсы P 4 от SLC, запускаемые гипофизарным ЛГ, и автономные P 4 колебания, не зависящие от лютеотрофных раздражителей.
Ранее Wuttke et al. предложили модель, объясняющую независимые от ЛГ колебания уровней P 4 в средней части лютеина, основанные на аутокринных и паракринных механизмах в лютеиновой ткани (21). При стимуляции ЛГ во время средней лютеиновой фазы SLC начинают секрецию P 4 , а также андростендиона — последний впоследствии превращается в E 2 в LLC под действием P450-ароматазы. Повышенная концентрация E 2 действует аутокринным образом в LLC, увеличивая высвобождение как P 4 , так и окситоцина.Окситоцин стимулирует фибробласты к высвобождению PGF 2α , который, в свою очередь, стимулирует дальнейшую секрецию окситоцина, а также секрецию E 2 лютеиновыми клетками. Изолированный эффект окситоцина и PGF 2α на линии лютеиновых клеток представляет собой снижение секреции P 4 , но этот эффект перекрывается сопутствующим повышением E 2 , которое вызывает выраженное высвобождение P 4 . Таким образом, импульс ЛГ будет стимулировать внутрилютеиновый контур, включающий ауто- и паракринные эффекты E 2 , окситоцина, PGF 2α — и, возможно, множество других регуляторных пептидов, т.
При стимуляции ЛГ во время средней лютеиновой фазы SLC начинают секрецию P 4 , а также андростендиона — последний впоследствии превращается в E 2 в LLC под действием P450-ароматазы. Повышенная концентрация E 2 действует аутокринным образом в LLC, увеличивая высвобождение как P 4 , так и окситоцина.Окситоцин стимулирует фибробласты к высвобождению PGF 2α , который, в свою очередь, стимулирует дальнейшую секрецию окситоцина, а также секрецию E 2 лютеиновыми клетками. Изолированный эффект окситоцина и PGF 2α на линии лютеиновых клеток представляет собой снижение секреции P 4 , но этот эффект перекрывается сопутствующим повышением E 2 , которое вызывает выраженное высвобождение P 4 . Таким образом, импульс ЛГ будет стимулировать внутрилютеиновый контур, включающий ауто- и паракринные эффекты E 2 , окситоцина, PGF 2α — и, возможно, множество других регуляторных пептидов, т. е.е., Вещество P — и конечный эффект — генерация импульса P 4 . Этот контур функционирует часами без дальнейшей гонадотропной поддержки, таким образом генерируя несколько импульсов P 4 с постепенно уменьшающейся амплитудой, пока следующий импульс LH не запустит внутри лютеиновый цикл E 2 / P 4 снова. Напротив, у женщин с гипоталамической недостаточностью с подавленным уровнем ЛГ и отсутствием импульсов ЛГ средний лютеиновый P 4 показывает непульсирующий характер, подчеркивая необходимость начальной высокой нагрузки ЛГ / ХГЧ для запуска цепи P 4 (21).Вызванное окситоцином высвобождение P 4 можно предотвратить обработкой CL тамоксифеном — агентом, блокирующим рецепторы эстрогена — подчеркивая регуляцию E 2 автономных импульсов P 4 (27). Этот независимый внутрилютеиновый генератор импульсов P 4 может служить дополнительным механизмом биологической безопасности, предотвращающим снижение уровней P 4 между импульсами ЛГ, и может объяснять функцию значительной продукции E 2 во время лютеиновой фазы у людей.
е.е., Вещество P — и конечный эффект — генерация импульса P 4 . Этот контур функционирует часами без дальнейшей гонадотропной поддержки, таким образом генерируя несколько импульсов P 4 с постепенно уменьшающейся амплитудой, пока следующий импульс LH не запустит внутри лютеиновый цикл E 2 / P 4 снова. Напротив, у женщин с гипоталамической недостаточностью с подавленным уровнем ЛГ и отсутствием импульсов ЛГ средний лютеиновый P 4 показывает непульсирующий характер, подчеркивая необходимость начальной высокой нагрузки ЛГ / ХГЧ для запуска цепи P 4 (21).Вызванное окситоцином высвобождение P 4 можно предотвратить обработкой CL тамоксифеном — агентом, блокирующим рецепторы эстрогена — подчеркивая регуляцию E 2 автономных импульсов P 4 (27). Этот независимый внутрилютеиновый генератор импульсов P 4 может служить дополнительным механизмом биологической безопасности, предотвращающим снижение уровней P 4 между импульсами ЛГ, и может объяснять функцию значительной продукции E 2 во время лютеиновой фазы у людей.
В цикле стимулированного ЭКО импульсы ЛГ отсутствуют в середине лютеиновой фазы, а уровни ЛГ в сыворотке явно подавлены (33). Болюс ХГЧ, вводимый для индукции овуляции или поддержки лютеиновой фазы, оказывает тонизирующее и постоянное раздражение лютеиновой ткани из-за длительного периода полувыведения ХГЧ и, следовательно, не может объяснить быстрые колебания P 4 , наблюдаемые в середине лютеиновая фаза в данном исследовании. Стандартная вагинальная добавка P 4 достигает устойчивого состояния во время ранней лютеиновой фазы и способствует удивительно постоянному уровню P 4 в сыворотке крови в течение всего дня, несмотря на многократные ежедневные вагинальные дозы (34).Таким образом, очень большие колебания уровня P 4 в сыворотке, наблюдаемые в настоящем исследовании, вероятно, являются результатом автономного внутриовариального цикла P 4 . Это дополнительно подчеркивается тем фактом, что пики P 4 сопровождаются сопутствующими подъемами E 2 , а экзогенный E 2 не был обеспечен как часть поддержки лютеиновой фазы.
Нам не удалось обнаружить общую картину секреции P 4 в дневное время у 10 обследованных пациентов.Пик и надир уровня P 4 у разных пациентов наблюдались в разное время, а курс гормонов в течение дня демонстрировал сугубо индивидуальные ритмы. Это согласуется с исследованиями, проведенными в середине лютеиновой фазы естественного цикла (3, 19). В исследовании семи женщин, изучавшихся в течение 24 часов в середине лютеиновой фазы естественного цикла, акрофаза P 4 изменялась с 10.31 до 23.33. (16). Из-за отсутствия суточного воспроизводимого шаблона для средне-лютеинового P 4 в цикле ЭКО точность измерения P 4 не улучшается за счет фиксированного времени забора крови и, таким образом, измерения P 4 можно провести в любое время в часы работы клиники.
В течение естественного цикла оба уровня поздних фолликулов E 2 , диаметр фолликула во время овуляции, а также площадь под кривой выброса ЛГ плохо коррелируют с уровнем P 4 последующей лютеиновой фазы (3). Таким образом, прогнозирование пациентов с недостаточным уровнем лютеина P 4 затруднительно на основании развития фолликулов, поскольку аномальные лютеиновые фазы можно увидеть в циклах, характеризующихся нормальным фолликулогенезом (35). В настоящем исследовании у двух пациентов с самыми низкими уровнями P 4 (36 и 55 нмоль / л) в день OPU было 17 и 19 фолликулов, соответственно, что показывает, что большое количество CL не гарантирует высокий уровень P 4 Выход в лютеиновой фазе.По этой причине мониторинг лютеиновой фазы P 4 может иметь значение для выявления пациентов с низким уровнем P 4 , которым может помочь дополнительная экзогенная терапия P 4 . Тем не менее, предварительным условием для легкого мониторинга лютеиновой фазы является то, что достоверность одного измеренного значения P 4 является надежным и дает разумную оценку емкости ХЛ пациента.
Мы признаем, что небольшой размер выборки этого исследования может ограничить обоснованность общих интерпретаций.Тем не менее, мы считаем это предварительное исследовательское исследование новаторским в рамках фундаментальных исследований и, что немаловажно, первым исследованием средне-лютеиновых колебаний P 4 при различных типах циклов ЭКО. Автономные LH-независимые выбросы P 4 из яичников во время средней лютеиновой фазы наблюдались для обоих типов аналогов GnRH (антагонист GnRH и протокол длительного GnRHa), а также после различных типов запуска окончательного созревания ооцитов (hCG или GnRH). агонист). Таким образом, кажется, что эти автономные эпизодические лютеиновые пики P 4 генерируются независимо от выбора схемы лечения и, следовательно, могут также применяться к другим протоколам стимуляции ЭКО.
Заключение
На основании 10 женщин, обследованных в этом исследовании, мы заявляем, что точность единичного измерения прогестерона в средне-лютеиновой сыворотке как приблизительного среднего уровня P 4 в течение дня зависит от концентрации P 4 и что женщины с низким уровнем P 4 (P 4 <60 нмоль / л) демонстрируют клинически стабильные уровни P 4 в дневное время. Таким образом, единичное измерение P 4 у пациента с низким уровнем прогестерона довольно точно отражает функцию CL, и измеренное низкое значение P 4 , следовательно, можно рассматривать как «истинно низкое значение».Будущие исследования должны прояснить, может ли дополнительная экзогенная поддержка P 4 , вводимая группе пациентов с низким лютеиновым P 4 , улучшить репродуктивный результат.
Доступность данных
Необработанные данные, подтверждающие заключение этой рукописи, будут предоставлены авторами без излишних оговорок любому квалифицированному исследователю.
Заявление об этике
Исследование было проведено в соответствии с Хельсинкской декларацией о медицинских исследованиях и одобрено местным комитетом по этике Центрального региона Дании.Все пациенты дали письменное информированное согласие на участие в исследовании.
Вклад авторов
LT разработал и провел исследование. LT подготовил рукопись, а Великобритания, Калифорния и PH — все внесли свой вклад в интерпретацию данных и критически рассмотрели рукопись. Все соавторы приняли окончательный вариант.
Заявление о конфликте интересов
LT получил неограниченный исследовательский грант от Ferring Pharmaceuticals вне рамок этой работы. PH получила неограниченные исследовательские гранты от MSD, Merck и Ferring Pharmaceuticals, а также гонорары за лекции от MSD, Merck и Finox вне рамок этой работы.Великобритания получила гонорары за лекции от MSD и Ferring Pharmaceuticals, помимо этой работы. CA получила неограниченные исследовательские гранты от MSD, IBSA и Ferring Pharmaceuticals, а также гонорары за лекции от MSD и IBSA вне рамок этой работы.
Благодарности
Авторы хотели бы поблагодарить участвующих пациентов клиники репродуктивной медицины в Скиве, Дания, которые любезно использовали свое время, чтобы сделать это исследование возможным.
Сноски
Финансирование. Грант от «Фонда медицинских исследований региона Центральной Дании» и «Исследовательского фонда больницы Центральной Ютландии» поддержал проведение этого исследования. Финансирующие организации не участвовали ни в проведении исследования, ни в написании научного отчета.
Ссылки
1. Wiltbank MC, Salih SM, Atli MO, Luo W., Bormann CL, Ottobre JS, et al. Сравнение эндокринных и клеточных механизмов, регулирующих желтое тело приматов и жвачных животных.Anim Reprod (2012) 9 (3): 242–59. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Россманиф В.Г., Лафлин Г.А., Мортола Дж.Ф., Йен СС. Секреторная динамика эстрадиола (E2) и прогестерона (P4) в периоды относительного покоя гипофизарного ЛГ в средней ягодичной фазе менструального цикла. Clin Endocrinol (Oxf) (1990) 32 (1): 13–23.10.1111 / j.1365-2265.1990.tb03745.x [PubMed] [CrossRef] [Google Scholar] 3. Соулз М.Р., Клифтон Д.К., Штайнер Р.А., Коэн Н.Л., Бремнер В.Дж. Желтое тело: детерминанты секреции прогестерона в нормальном менструальном цикле.Obstet Gynecol (1988) 71 (5): 659–66. [PubMed] [Google Scholar] 4. Humaidan P, Bungum L, Bungum M, Hald F, Agerholm I, Blaabjerg J и др. Репродуктивные результаты с использованием антагониста ГнРГ (Цетрореликс) для лютеолиза и фолликулярной синхронизации у пациентов с плохим ответом на ЭКО / ИКСИ, получавших гибкий протокол антагонистов ГнРГ. Reprod Biomed Online (2005) 11 (6): 679–84.10.1016 / S1472-6483 (10) 61685-9 [PubMed] [CrossRef] [Google Scholar] 5. Humaidan P, Ejdrup Bredkjaer H, Westergaard LG, Yding Andersen C.1500 МЕ хорионического гонадотропина человека, вводимого при извлечении ооцитов, восстанавливают лютеиновую фазу, когда агонист гонадотропин-рилизинг-гормона используется для индукции овуляции: проспективное, рандомизированное, контролируемое исследование. Fertil Steril (2010) 93 (3): 847–54.10.1016 / j.fertnstert.2008.12.042 [PubMed] [CrossRef] [Google Scholar] 6. Йдинг Андерсен К., Вилбур Андерсен К. Улучшение лютеиновой фазы после стимуляции яичников: обзор новых возможностей. Reprod Biomed Online (2014) 28 (5): 552–9.10.1016 / j.rbmo.2014.01.012 [PubMed] [CrossRef] [Google Scholar] 7. Блейк Э.Дж., Норрис П.М., Дорфман С.Ф., Лонгстрет Дж., Янков В.И.. Одно- и многодозовое фармакокинетическое исследование вагинального микронизированного прогестерона (эндометрина) по сравнению с вагинальным гелем у здоровых женщин репродуктивного возраста. Fertil Steril (2010) 94 (4): 1296–301.10.1016 / j.fertnstert.2009.06.014 [PubMed] [CrossRef] [Google Scholar] 10. Хумайдан П., Полизос Н.П., Альсбьерг Б., Эрб К., Миккельсен А.Л., Эльбаек Х.О. и др. Триггер ГнРГ и индивидуальная поддержка ХГЧ в лютеиновой фазе в соответствии с реакцией яичников на стимуляцию: два проспективных рандомизированных контролируемых многоцентровых исследования у пациенток ЭКО.Hum Reprod (2013) 28 (9): 2511–21.10.1093 / humrep / det249 [PubMed] [CrossRef] [Google Scholar] 11. Ниманн Х., Захер Б., Эльзессер Ф. Частота наступления беременности относительно уровней прогестерона в плазме реципиента в день нехирургического переноса замороженных / размороженных эмбрионов крупного рогатого скота. Териогенология (1985) 23 (4): 631–9.10.1016 / 0093-691X (85)-9 [PubMed] [CrossRef] [Google Scholar] 12. Ногейра М.Ф., Мело Д.С., Карвалью Л.М., Fuck EJ, Тринка Л.А., Баррос С.М. Уменьшают ли высокие концентрации прогестерона частоту наступления беременности у реципиентов-эмбрионов, синхронизированных с PGF2alpha и eCG? Териогенология (2004) 61 (7–8): 1283–90.10.1016 / j.theriogenology.2003.07.012 [PubMed] [CrossRef] [Google Scholar] 13. Йович Дж. Л., Консейсао Дж. Л., Стангер Дж. Д., Хинчлифф П. М., Кин К. Н.. Средне-лютеиновые концентрации прогестерона в сыворотке определяют скорость имплантации криоконсервированных переносов эмбрионов, проводимых в условиях заместительной гормональной терапии. Reprod Biomed Online (2015) 31 (2): 180–91.10.1016 / j.rbmo.2015.05.005 [PubMed] [CrossRef] [Google Scholar] 14. Labarta E, Mariani G, Holtmann N, Celada P, Remohi J, Bosch E. Низкий уровень прогестерона в сыворотке в день переноса эмбриона связан с уменьшением продолжающейся беременности в циклах донорства ооцитов после искусственной подготовки эндометрия: проспективное исследование.Hum Reprod (2017) 32 (12): 2437–42.10.1093 / humrep / dex316 [PubMed] [CrossRef] [Google Scholar] 15. Филикори М., Батлер Дж. П., Кроули В. Ф., младший. Нейроэндокринная регуляция желтого тела у человека. Доказательства пульсирующей секреции прогестерона. J. Clin Invest (1984) 73 (6): 1638–47.10.1172 / JCI111370 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Велдхейс Дж. Д., Кристиансен Э., Эванс В. С., Колп Л. А., Рогол А. Д., Джонсон М. Л.. Физиологические профили эпизодического высвобождения прогестерона во время средней ягодичной фазы менструального цикла человека: анализ циркадных и ультрадианных ритмов, дискретных свойств пульса и корреляции с одновременным высвобождением лютеинизирующего гормона.J. Clin Endocrinol Metab (1988) 66 (2): 414–21.10.1210 / jcem-66-2-414 [PubMed] [CrossRef] [Google Scholar] 17. Reame N, Sauder SE, Kelch RP, Marshall JC. Пульсирующая секреция гонадотропина во время менструального цикла человека: данные об изменении частоты секреции гонадотропин-рилизинг-гормона. J. Clin Endocrinol Metab (1984) 59 (2): 328–37.10.1210 / jcem-59-2-328 [PubMed] [CrossRef] [Google Scholar] 18. Tavaniotou A, Albano C, Smitz J, Devroey P. Сравнение концентраций ЛГ в ранней и средней лютеиновой фазе в циклах ЭКО после лечения только ГМГ или в сочетании с антагонистом ГнРГ Цетрореликсом.Hum Reprod (2001) 16 (4): 663–7.10.1093 / humrep / 16.4.663 [PubMed] [CrossRef] [Google Scholar] 19. Фудзимото В.Ю., Клифтон Д.К., Коэн Н.Л., Соулз МР. Вариабельность уровней пролактина и прогестерона в сыворотке крови у здоровых женщин: важность измерения одного гормона в клинических условиях. Obstet Gynecol (1990) 76 (1): 71–8. [PubMed] [Google Scholar] 20. Россманиф В.Г., Лафлин Г.А., Мортола Дж. Ф., Джонсон М.Л., Велдхейс Дж. Д., Йен СС. Пульсирующая секреция эстрадиола и прогестерона в средней ягодичной фазе желтого тела: временная связь с импульсами лютеинизирующего гормона.J. Clin Endocrinol Metab (1990) 70 (4): 990–5.10.1210 / jcem-70-4-990 [PubMed] [CrossRef] [Google Scholar] 21. Wuttke W, Theiling K, Hinney B, Pitzel L. Регулирование производства стероидов и его функция в желтом теле. Стероиды (1998) 63 (5–6): 299–305.10.1016 / S0039-128X (98) 00037-3 [PubMed] [CrossRef] [Google Scholar] 22. Bah MM, Acosta TJ, Pilawski W, Deptula K, Okuda K, Skarzynski DJ. Роль простагландина F (2альфа), прогестерона и окситоцина в базальном и пульсирующем высвобождении прогестерона из развивающегося желтого тела крупного рогатого скота.Простагландины — другие липидные средства (2006) 79 (3–4): 218–29.10.1016 / j.prostaglandins.2006.01.002 [PubMed] [CrossRef] [Google Scholar] 23. Фиш Б., Маргара Р. А., Уинстон Р. М., Хиллиер С. Г.. Клеточные основы лютеинового стероидогенеза в яичнике человека. J Endocrinol (1989) 122 (1): 303–11.10.1677 / joe.0.1220303 [PubMed] [CrossRef] [Google Scholar] 24. Мэйбин JA, Дункан WC. Желтое тело человека: какие клетки имеют рецепторы прогестерона? Репродукция (2004) 128 (4): 423–31.10.1530 / rep.1.00051 [PubMed] [CrossRef] [Google Scholar] 25.Девото Л., Фуэнтес А., Коэн П., Сеспедес П., Паломино А., Поммер Р. и др. Желтое тело человека: жизненный цикл и функции в естественных циклах. Fertil Steril (2009) 92 (3): 1067–79.10.1016 / j.fertnstert.2008.07.1745 [PubMed] [CrossRef] [Google Scholar] 26. ван ден Дрише С., Смит В. М., Майерс М., Дункан В. Экспрессия и регуляция рецепторов эстрогена в желтом теле человека. Репродукция (2008) 135 (4): 509–17.10.1530 / REP-07-0427 [PubMed] [CrossRef] [Google Scholar] 27. Маас С., Джарри Х., Тайхманн А., Рат В., Кун В., Вуттке В.Паракринное действие окситоцина, простагландина F2 альфа и эстрадиола в желтом теле человека. J. Clin Endocrinol Metab (1992) 74 (2): 306–12.10.1210 / jc.74.2.306 [PubMed] [CrossRef] [Google Scholar] 28. Friden BE, Hagstrom H, Lindblom B, Sjoblom P, Wallin A, Brannstrom M, et al. Характеристики клеток и функции двух обогащенных фракций пролонгированных лютеиновых клеток человека. Мол Хум Репрод (1999) 5 (8): 714–9.10.1093 / мольхр / 5.8.714 [PubMed] [CrossRef] [Google Scholar] 29. Охара А., Мори Т., Тайи С., Бан С., Наримото К.Функциональная дифференциация в стероидогенезе двух типов лютеиновых клеток, выделенных из зрелых желтых тел человека менструального цикла. J. Clin Endocrinol Metab (1987) 65 (6): 1192–200.10.1210 / jcem-65-6-1192 [PubMed] [CrossRef] [Google Scholar] 30. Джонс Г.С. Желтое тело: состав и функции. Fertil Steril (1990) 54 (1): 21–6.10.1016 / S0015-0282 (16) 53630-9 [PubMed] [CrossRef] [Google Scholar] 31. Tannus S, Burke Y, McCartney CR, Kol S. Запуск агониста GnRH для окончательного созревания ооцитов в циклах ЭКО-антагониста GnRH вызывает снижение частоты и амплитуды пульса LH в ранней лютеиновой фазе: возможный механизм лютеолиза.Gynecol Endocrinol (2017) 5: 1–5.10.1080 / 0Изменение уровня прогестерона в сыворотке в дневное время в средней лютеиновой фазе у женщин, подвергающихся Экстракорпоральное оплодотворение
Фронт-эндокринол (Лозанна).2018; 9: 92.
Lise Haaber Thomsen
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Отделение клинической медицины, Орхусский университет, Орхус, Дания
Ulrik Schiøler Kesmodel 9007
Клиника репродуктивной медицины, больница Херлев, Херлев, Дания
4 Кафедра клинической медицины, Копенгагенский университет, Копенгаген, Дания
Клаус Йдинг Андерсен
5 Лаборатория репродуктивной биологии, Женский центр Джулиан Мари, Дети и репродукция, Университетская больница Копенгагена, Копенгагенский университет, Копенгаген, Дания
Питер Хумайдан
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Департамент клинической медицины, Орхусский университет, Орхус , Дания
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Кафедра клинической медицины, Орхусский университет, Орхус, Дания
3 Клиника репродуктивной медицины, больница Херлев, Херлев, Дания
4 Кафедра клинической медицины Копенгагенского университета, Копенгаген, Дания
5 Лаборатория репродуктивной биологии, Центр женщин, детей и репродукции Джулиан Мари, Университетская больница Копенгагена, Университет Копенгагена, Копенгаген, Дания
Отредактировал: Sandro C.Эстевес, Андроферт, Клиника андрологии и репродукции человека, Бразилия
Рецензент: Эвангелос Г. Папаниколау, Университет Аристотеля в Салониках, Греция; Джон Луи Йович, Медицинский центр Пивет, Австралия
Специальный раздел: Эта статья была отправлена в репродукцию, раздел журнала «Границы эндокринологии»
Поступила в редакцию 17 декабря 2017 г .; Принято 26 февраля 2018 г.
Copyright © 2018 Thomsen, Kesmodel, Andersen and Humaidan.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY).Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) и правообладателя и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.- Заявление о доступности данных
Необработанные данные, подтверждающие заключение этой рукописи, будут предоставлены авторами без необоснованных оговорок любому квалифицированному исследователю.
Реферат
Цель
Изучить, проявляет ли средне-лютеиновый прогестерон сыворотки (P 4 ) значительные колебания в течение 12-часового дневного периода у женщин, перенесших оплодотворение in vitro (ЭКО), и выяснить, могут ли Степень этих колебаний может повлиять на интерпретацию уровней лютеинового прогестерона в клинических условиях.
Дизайн
Пилотно-разведочное исследование.
Учреждение
Отделение репродуктивной медицины при государственной больнице.
Пациенты
Десять женщин проходят курс ЭКО.
Вмешательство
Через семь дней после забора ооцитов у пациентов часто проводился повторный забор крови (каждые 60 минут в течение 12 часов и в течение двух из этих часов каждые 15 минут). Образцы сыворотки крови анализировали на прогестерон, эстрадиол и лютеинизирующий гормон (ЛГ).
Основные критерии оценки результатов
Дневные колебания s-прогестерона и s-эстрадиола.
Результаты
Наблюдалась значимая положительная корреляция между медианными уровнями P 4 и величиной вариаций P 4 — женщины со средним значением P 4 <60 нмоль / л имели клинически стабильные уровни P 4 на протяжении всего периода исследования. день, в то время как пациенты со средним значением P 4 > 250 нмоль / л демонстрировали периодические пики P 4 в несколько сотен наномолей на литр.Эти эндогенные колебания P 4 наблюдались независимо от типа протокола стимуляции или режима запуска окончательного созревания ооцитов и несмотря на тот факт, что LH был ниже предела обнаружения во время измерения. Одновременно наблюдались большие колебания s-эстрадиола.
Заключение
Мониторинг раннего и среднего лютеинового уровня P 4 в циклах ЭКО может быть ценным при планировании индивидуальной поддержки лютеиновой фазы в попытке улучшить репродуктивные результаты.Однако предварительным условием для мониторинга лютеиновой фазы является достоверность единственного измеренного значения P 4 . Мы впервые показываем, что одно измерение P 4 у пациента с низким уровнем прогестерона достаточно точно отражает функцию желтого тела и что это измерение может быть использовано для выявления пациентов с ЭКО, которым необходимо дополнительное введение экзогенного лютеина P 4 .
Ключевые слова: сывороточный прогестерон, in vitro оплодотворение , сывороточный эстрадиол, лютеиновая фаза, дневная вариация
Введение
Желтое тело человека (ХТ) является транзиторной эндокринной железой яичников, которая активна во время лютеиновой фазы менструальный цикл и на ранних сроках беременности до 8 недели гестации.CL производит значительные количества прогестерона (P 4 ), эстрадиола (E 2 ) и андрогенов, а также факторов роста и нестероидных гормонов. Общее поддержание функции CL критически зависит от регулярной стимуляции лютеинизирующим гормоном гипофиза (ЛГ) или хорионическим гонадотропином человека (ХГЧ) для поддержания стероидогенеза лютеинизированной гранулезой и клетками теки (1). Достаточное производство P 4 из CL является абсолютной необходимостью для децидуализации эндометрия перед имплантацией и установления ранней беременности.Секреция прогестерона из КЛ максимальна в середине лютеиновой фазы, вызывая в естественном цикле сывороточный уровень P 4 примерно 40–60 нмоль / л (2, 3).
Во время стимуляции яичников для in vitro оплодотворение (ЭКО) получают надфизиологические уровни E 2 во время поздней фолликулярной фазы в результате мультифолликулярного роста. Это гиперэстрогенное состояние должно уравновешиваться в лютеиновой фазе повышенной нагрузкой P 4 для достижения восприимчивого эндометрия к моменту переноса эмбриона.Ранее Хумайдан и его коллеги показали, что использование триггера агониста ГнРГ в циклах ЭКО с последующей поддержкой стандартной вагинальной лютеиновой фазы приводило к среднему лютеиновому уровню P 4 , сравнимому с уровнями, наблюдаемыми в естественном цикле (39 нмоль / л). (4). Однако, в отличие от того, что ожидалось, этот уровень P 4 был слишком низким для обеспечения успешной имплантации и беременности, в результате чего частота продолжающихся беременностей при ЭКО составила только 6%. Таким образом, подчеркивая тот факт, что потребность в P 4 во время лютеиновой фазы стимулированного цикла больше, чем у естественного цикла.Когда поддержка лютеиновой фазы была изменена путем добавления болюса 1500 МЕ ХГЧ в день извлечения ооцитов, срединно-лютеиновый уровень P 4 запускаемого цикла GnRHa увеличился до 74 нмоль / л, в результате чего скорость доставки составила 24%. за перевод (5). Похоже, что пороговое значение P 4 в средне-лютеиновой сыворотке составляет примерно 80–100 нмоль / л после лечения ЭКО с последующим переносом свежего эмбриона, и что этот порог должен быть превышен для обеспечения успешного репродуктивного результата (6).Традиционная поддержка лютеиновой фазы в циклах искусственного ЭКО с введением микронизированного влагалища P 4 индуцирует уровень P 4 в лютеиновой сыворотке примерно 40 нмоль / л (7–9). Таким образом, существенная дополнительная эндогенная продукция P 4 CL является обязательной для превышения порогового значения P 4 , чтобы впоследствии оптимизировать вероятность беременности после лечения ЭКО. Традиционно врачи не контролируют уровни P 4 в лютеиновой фазе, будучи твердо уверены, что поддержка лютеиновой фазы покроет потребность цикла в P 4 .Однако ранее мы видели, что более 25% пациентов ЭКО в группе, запускаемой как ХГЧ, так и ГнРГ, имеют средне-лютеиновую сыворотку P 4 ниже 60 нмоль / л, несмотря на поддержку лютеиновой фазы и тот факт, что у них было более 14 фолликулы в день аспирации (10). Кроме того, данные не относящихся к человеку видов (11, 12) и данные циклов замораживания / оттаивания эмбрионов человека (13, 14) показали, что существует оптимальный диапазон лютеинового P 4 и что исход беременности снижается не только ниже, но и выше этого оптимального уровня P 4 .Так ли это и после ЭКО и переноса свежих эмбрионов, еще предстоит выяснить. В этом случае мониторинг уровней лютеина P 4 может помочь улучшить репродуктивный результат в циклах ЭКО, позволяя индивидуализировать лечение на основе измерений P 4 в сыворотке.
Однако измерения среднего лютеинового P 4 осложняются пульсирующим характером секреции гормона из CL. Filicori с соавторами (15) показали, что концентрации P 4 в плазме демонстрируют большие и быстрые колебания в течение средней лютеиновой фазы у женщин, ведущих естественный цикл.Таким образом, уровни P 4 варьировались от значений всего 7 нмоль / л до пиков 128 нмоль / л в течение нескольких минут в течение 24-часового периода исследования. В естественном цикле существуют два различных типа импульсов P 4 во время средней лютеиновой фазы: импульсы, которым предшествует импульс LH, и другие, возникающие во время покоя LH; последнее является результатом автономной секреции стероидов CL независимо от активности ЛГ. Во время средней лютеиновой фазы стимулированного цикла ЭКО гипофиз подавляется отрицательной обратной связью с надфизиологическими уровнями стероидов, и s-LH значительно снижается до уровней намного ниже (0.5–0,7 МЕ / л), чем в середине лютеиновой фазы естественного цикла (5–7 МЕ / л) (16–18). Как эта пониженная пульсовая активность ЛГ влияет на секреторный паттерн стероидогенеза яичников в середине лютеиновой фазы цикла ЭКО, до сих пор неизвестно.
Настоящее исследование было проведено для изучения того, демонстрируют ли уровни P 4 в средне-лютеиновой сыворотке в цикле ЭКО такой же высокопульсирующий паттерн, как в естественном цикле, зная, что пульсовая активность ЛГ заметно снижена.С клинической точки зрения мы хотели выяснить, обеспечивает ли однократное утреннее измерение P 4 надежный показатель средне-лютеиновой функции ХЛ после ЭКО.
Материалы и методы
Популяция исследования
Десять пациенток, перенесших ЭКО / ИКСИ в клинике репродуктивной медицины в Скиве, Дания, с декабря 2014 г. по декабрь 2015 г. добровольно вызвались принять участие в исследовании. Регистрировалась клиническая информация, касающаяся возраста, индекса массы тела (ИМТ), привычек курения, биохимического репродуктивного профиля, причины бесплодия, предыдущих попыток ЭКО, курса стимуляции и лабораторных результатов.Исходные характеристики участников представлены в таблице. Письменное информированное согласие было получено от всех пациентов до участия в исследовании. Участники были выбраны так, чтобы они представляли как длинный цикл агонистов GnRH, так и цикл антагонистов GnRH, и различные типы запуска для окончательного созревания ооцитов (hCG или агонист GnRH).
Таблица 1
Описание демографических данных, стимуляции яичников, поддержки лютеиновой фазы и уровней прогестерона у исследуемых пациенток.
| Пациент | Возраст (лет) | Индекс массы тела (кг / м 2 ) | Базальный ФСГ (МЕ / л) | Причина бесплодия | Протокол | Общая сумма ФСГ (МЕ) | Продолжительность стимуляции ФСГ (дни) | Триггер овуляции | Поддержка лютеиновой фазы | No.фолликулов> 14 мм | Кол-во ооцитов | Кол-во MII | Средне-лютеиновый P 4 (нмоль / л) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 38 | 24,4 | 6,5 905 Мужской фактор | Long GnRHa | 3,225 | 11 | ХГЧ 10 000 МЕ | Лютинус 300 мг ежедневно | 5 | 5 | 1 | 89 | 26 | Отсутствие мужского партнера / эндометриоз | Антагонист ГнРГ | 1,725 | 9 | Супрефакт 0,5 мг | Лютинус 300 мг в день + 1500 ХГЧ (OPU) + 1000 ХГЧ (OPU + 5) | 10 | 10 | 283 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 39 | 30,0 | 6,4 | Отсутствует партнер-мужчина | Long GnRHa | 3,450 | 12 | Ivitrelle | Ivitrelle 90 мг / сутки 12 | 12 | 277 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 34 | 22.2 | 14,7 | Необъяснимый | Длинный ГнРГ | 3,600 | 12 | ХГЧ 10 000 МЕ | Лутинус 300 мг ежедневно | 9 | 8 | 905 905 905 905 905 905 905 905 19,95,9 | Мужской фактор | Long GnRHa | 2,925 | 11 | ХГЧ 10 000 МЕ | Лютинус 300 мг в день | 9 | 6 | 905 | 25.3 | 8,3 | Необъяснимый | Long GnRHa | 3,600 | 12 | Овитрелл 6,500 МЕ | Лутинус 300 мг ежедневно | 11 | 841 | 905 905 905 905 905 905 905 905 905 31,83,9 | Эндометриоз | Антагонист ГнРГ | 2,025 | 9 | Супрефакт 0,5 мг | Кринон 180 ежедневно + 1,500 ХГЧ (OPU) | 17 | 11 905 43 17 | 11 905 43 17 | 11 905 43 17 | 11 905 | 36 | 25.6 | 4,9 | Тубальный фактор | Антагонист ГнРГ | 1,913 | 9 | Супрефакт 0,5 мг | Кринон 180 ежедневно + 1,500 ХГЧ (OPU) | 19 | 13 905 9 | 40 | 34,5 | 7,2 | Необъяснимая | Long GnRHa | 2,250 | 9 | hCG 10,000 IU | Lutinus 300 мг ежедневно | 905 905 | 7 905 10 | 36 | 29.4 | 7,2 | Мужской фактор | Антагонист ГнРГ | 3,938 | 15 | Супрефакт 0,5 мг | Лютинус 300 мг в день + 1000 ХГЧ (OPU) + 500 (OPU + 5) | 14 905 8 | 161 |
Протоколы стимуляции яичников
Шесть пациентов лечились в рамках длительного цикла агонистов гонадолиберин с подавлением гипофиза с помощью подкожной инъекции бусерелина 0,8 мг (Suprefact ® ; Sanofi, Дания), начиная с середины 20-го века. лютеиновая фаза предыдущего цикла.Суточная доза бусерелина 0,4 мг вводилась до дня, предшествующего началу овуляции. На 2-й день цикла было проведено трансвагинальное ультразвуковое исследование, и в случае толщины эндометрия <4 мм началась стимуляция яичников с помощью корифоллитропина-альфа (Elonva ® ; MSD, Дания) в сочетании с любым r-ФСГ. / рЛГ (Pergoveris ® ; Merck Biopharma, Дания) или чМГ (Menopur ® , Ferring Pharmaceuticals, Дания). Дозировка гонадотропина определялась индивидуально на основании возраста пациента, ИМТ, исходного уровня ФСГ, предыдущей реакции на гонадотропины и количества антральных фолликулов и корректировалась путем мониторинга размера фолликулов с помощью трансвагинального ультразвукового исследования во время лечения.Окончательное созревание ооцитов индуцировали либо 10000 МЕ п / к ХГЧ (прегнил ® , MSD, Дания), либо п / к 6 500 МЕ (Ovitrelle ® , Merck Biopharma, Дания), когда два или более ведущих фолликула достигли среднего диаметра 17 мм. Забор ооцитов проводили через 36 ч после введения ХГЧ. Процедуры ЭКО / ИКСИ и культивирование эмбрионов проводились в соответствии с обычной клинической практикой. На 3 или 5 день после извлечения ооцитов было перенесено не более двух эмбрионов. Поддержка лютеиновой фазы вводилась в виде микронизированного влагалища P 4 (Lutinus ® 300 мг в день, Ferring Pharmaceutical, Дания или Crinone ® 180 мг в день, Merck Biopharma, Дания), начиная с 1 дня после забора ооцитов (OPU) .
У четырех пациентов использовался протокол антагонистов ГнРГ. На 2 день цикла началась стимуляция яичников с помощью r-FSH (Gonal-F ® ; Merck Biopharma, Дания) или hMG (Menopur ® , Ferring Pharmaceuticals, Дания) после ультразвукового исследования влагалища. Ежедневная совместная обработка антагонистами ГнРГ (Оргалутран ® 0,25 мг / день, MSD, Дания) добавлялась при размере фолликула 12 мм. Дозу ФСГ подбирали индивидуально в соответствии с ответом яичников. Окончательное созревание ооцитов индуцировали SC Buserelin 0.5 мг (Suprefact ® ; Sanofi, Дания) при наличии двух или более фолликулов размером ≥17 мм. Забор ооцитов проводили через 36 часов. Максимум два эмбриона были перенесены на 3 или 5 день после OPU. Поддержка лютеиновой фазы проводилась по индивидуальному режиму, состоящему из вагинального введения 300 мг микронизированного P 4 ежедневно (Lutinus ® , Ferring Pharmaceuticals, Дания) в сочетании с болюсным введением ХГЧ (1000–1500 МЕ) в день приема. извлечение ооцитов (5, 10).В зависимости от индивидуальной реакции яичников на стимуляцию некоторым пациентам вводили дополнительный болюс ХГЧ на OPU + 5 (500–1000 МЕ) (10). См. Подробную информацию в таблице. Вагинальное введение P 4 продолжалось до дня тестирования на беременность (триггер ХГЧ) или до седьмой недели гестации (триггер ГнРГ).
Забор крови
Забор крови проводился в середине лютеиновой фазы, то есть через 7 дней после OPU (OPU + 7). Пациенты были доставлены в отделение репродуктивной медицины рано утром и оставались в клинике в течение последующих 12 часов.Время начала забора крови для всех пациентов было с 6 до 9 часов утра. В течение периода исследования участникам была разрешена нормальная повседневная деятельность.
Внутривенную канюлю вводили в вену в антекубитальной ямке, и образцы крови (4 мл) отбирали каждые 60 минут в течение 12 часов ( n = 10) и в течение двух из этих часов каждые 15 минут ( n = 8 из-за затрудненного венозного доступа у двух пациентов). После коагуляции при комнатной температуре образцы крови центрифугировали, выделяли сыворотку и хранили при -80 ° C до анализа.
Измерение гормонов
Сыворотка P 4 (нмоль / л), E 2 (пмоль / л) и концентрации ЛГ (МЕ / л) измеряли с помощью автоматизированных электрохемилюминесцентных иммуноанализов (Cobas ® Modular analytics E170 , Roche Diagnostics, Швейцария) обычно используется для анализа в отделении биохимии региональной больницы Выборга, Дания. Все измерения были выполнены в соответствии с инструкциями производителя с использованием имеющегося в продаже набора для хемилюминесцентного иммуноанализа, предназначенного для измерений в сыворотке.
Предел обнаружения гормонов составлял 0,2 нмоль / л, 18,4 пмоль / л и 0,1 МЕ / л для P 4 , E 2 и ЛГ соответственно. Все образцы сыворотки от каждого пациента были измерены в рамках одного цикла анализа. Все концентрации гормонов, превышающие предел обнаружения анализа, измеряли в двух экземплярах. Все коэффициенты вариации для P 4 , E 2 и LH были ниже 4%.
Статистика
Данные представлены в виде среднего значения ± стандартное отклонение или медианы и диапазона, когда это необходимо.Максимальное абсолютное изменение (MAV) в сыворотке P 4 за 12-часовой период дается как максимальная концентрация P 4 — минимальная концентрация P 4 во время отбора проб для каждого пациента.
Коэффициент корреляции Спирмена ( r ) был рассчитан для корреляции медианного уровня стероидов с максимальным абсолютным изменением гормона в течение дня (MAV). Значение p <0,05 считалось статистически значимым. Все анализы были выполнены с использованием STATA версии 13.
Результаты
Характеристики пациентов
Пациенты имели средний возраст 35,3 ± 4,2 года, средний ИМТ 26,6 ± 4,7 кг / м 2 и 1,9 ± 2,0 до попыток ЭКО. Средний уровень ФСГ для всех пациентов составил 6,55 МЕ / л (межквартильный размах 5,9; 7,2 МЕ / л). Все участники были некурящими. У четырех пациентов причиной бесплодия была не женщина (мужской фактор или отсутствие партнера-мужчины), у трех пациентов причина была женщина (трубный фактор или эндометриоз), а у трех пациентов причина бесплодия была идиопатической (необъяснимой).См. Подробную информацию в таблице.
Общие значения средне-лютеинового прогестерона
У трех пациентов средний уровень средне-лютеинового P 4 был ниже 60 нмоль / л. Двое из этих пациентов (№7 и №8) были запущены агонистом ГнРГ и получили поддержку лютеиновой фазы с помощью 1500 МЕ ХГЧ (OPU) и вагинального P 4 (Кринон 180 мг в день). Несмотря на то, что в день OPU было извлечено 19 и 17 фолликулов размером ≥ 14 мм и 11-13 зрелых ооцитов, они показали средне-лютеиновый P 4 всего 55 и 36 нмоль / л соответственно.Другой пациент (№ 9) с P 4 <60 нмоль / л был запущен с помощью 10000 МЕ ХГЧ и имел семь фолликулов> 14 мм в день аспирации.
Общие средне-лютеиновые значения ЛГ
Ни у одного из пациентов с пониженной регуляцией по протоколу длинного агониста ГнРГ ( n = 6) уровни s-LH превышали предел обнаружения анализа в любой момент во время измерения (т. Е. LH < 0,1 МЕ / л). У трех из четырех пациентов, стимулированных по протоколу антагониста ГнРГ, наблюдалась умеренная импульсная активность ЛГ с амплитудами ЛГ от 0.От 2 до 2,8 ЕД / л. У всех пациентов за пиком ЛГ следовало повышение P 4 в сыворотке от 4 до 36 нмоль / л.
Дневные колебания сывороточного прогестерона
Как видно во время естественного цикла, большие колебания среднего лютеинового P 4 также присутствовали в дневное время у некоторых женщин, подвергающихся лечению ЭКО (рисунок). Колебания лютеиновых стероидов наблюдались независимо от выбора протокола стимуляции, режима окончательного созревания ооцитов и типа поддержки лютеиновой фазы.
Индивидуальные профили прогестерона в средне-лютеиновой сыворотке в течение 12-часового интервала у 10 пациентов, подвергшихся контролируемой стимуляции яичников для лечения оплодотворением in vitro .
Наибольшая вариация уровней P 4 наблюдалась у пациентов со средним значением P 4 > 250 нмоль / л. У пациента № 2 со средним значением P 4 , равным 283 нмоль / л, значение P 4 колебалось от 293 нмоль / л в 11 часов утра до 448 нмоль / л в 12 часов вечера, т. Е. Увеличение на 155 нмоль / л в течение 1 часа. часЭто колебание уровня P 4 присутствовало даже при том, что s-LH был ниже уровня обнаружения в течение дня (Рисунок A). Увеличение P 4 сопровождалось сопоставимым увеличением E 2 (Рисунок A). Концентрация P 4 в сыворотке в течение 12-часового периода для этого конкретного пациента варьировала от 183 нмоль / л рано утром до 448 нмоль / л в течение дня — таким образом, MAV во время периода исследования Δ265 нмоль / л. У пациента № 6 (медиана P 4 376 нмоль / л) и № 3 (медиана P 4 277 нмоль / л) наблюдалось быстрое повышение уровней P 4 (Δ 70–75 нмоль / л, соответственно). наблюдается в течение всего 15 минут без какой-либо сопутствующей активности ЛГ (ЛГ <0.1 МЕ / л). Для сравнения, у пациента № 7 медиана P 4 составляла всего 36 нмоль / л и наблюдались лишь незначительные колебания в течение дня с уровнями P 4 в диапазоне от 25 до 48 нмоль / л после небольшого обнаруживаемого увеличения секреции ЛГ ( полные дневные значения P 4 см. в таблице).
(A) Дневные изменения среднего лютеинового s-прогестерона и s-LH у пациента № 2. Медиана P 4 = 283 нмоль / л. Максимальная вариация P 4 /12 ч = 265 нмоль / л. (B) Дневные колебания уровней s-прогестерона и s-эстрадиола в средней части лютеина у пациента № 2. Медиана E 2 = 3471 пмоль / л. Максимальная вариация E 2 /12 ч = 1,481 пмоль / л.
Таблица 2
Средне-лютеиновые концентрации прогестерона в сыворотке в дневное время у 10 женщин, перенесших лечение оплодотворением in vitro .
| Пациент | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 8.00.00 | 9.00 | 9.15 | 9.30 | 9.45 | 10.00 | 11.00 | 12.00 | 13.00 | 14.00 | ||||||||||||
| P 4 нмоль / л | 126 | 106 | 91 | 93 | 88 | 97 | 87 | 93 | 99 905 905 905 905 905 905 | 15 стр.м. | 16 часов | 17 часов | 17.15 | 17.30 | 17.45 | 18 часов | 19 часов | 20:00 | 89 (63–126) | ||
| 102 | 89 | 69 | 72 | 78 | 78 | 73 | 67 | 63 | |||||||||||||
| 2 | |||||||||||||||||||||
| Время | 8.00.00 | 9.00 | 10.00 | 10.15 | 10.30 | 10.45 | 11.00 | 12.00 | 13.00 | 14.00 | |||||||||||
| P 4 нмоль / л | 183 | 224 | 283 | 271 | 266 | 283 | 293 | 448 905 905 905 432 905 904 905 905 | 15.00 вечера | 15.15 | 15.30 | 15.45 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 | 283 (183–448) | |||
| 262 | 258 | 345 | 328 | 342 | 331 | 348 | 905 | 905 | 265 | ||||||||||||
| 3 | |||||||||||||||||||||
| Время | 6.00.00 | 7.00 | 7.15 | 7.30 | 7.45 | 8.00 | 9.00 | 10.00 | 11.00 | 12.00 | |||||||||||
| P 4 нмоль / л | 370 | 320 | 323 | 301 | 272 | 347 | 281 | 244 905 905 905 905 905 905 905 905 | 12.15 часов вечера | 12.30 | 12:45 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 277 (225–370) | |||
| 283 | 269 | 277 | 278 | 230 | 225 | 251 | 255 | 255 43 | 255 | 145||||||||||||
| 4 | |||||||||||||||||||||
| Время | 8.00:00 | 8,15 | 8:30 | 8,45 | 9:00 | 10:00 | 11:00 | 12:00 | 13.00 | 14.00 | |||||||||||
| P 4 нмоль / л | 216 | 228 | 224 | 228 | 216 | 226 | 202 | 240 905 905 905 905 905 905 905 | 14.15 часов вечера | 14.30 | 14.45 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 | 213 (171–240) | |||
| 208 | 205 | 200 | 201 | 228 | 204 | 188 | 1905 905 905 43 905 905 905 905 69 | ||||||||||||||
| 5 | |||||||||||||||||||||
| Время | 9.00:00 | 10:00 | 11:00 | 12:00 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | |||||||||||
| P 4 нмоль / л | 131 | 122 | 110 | 119 | 136 | 97 | 92 | 89 | 70 905 905 | 19.00 вечера | 20.00 | 21.00 | 97 (70–136) | ||||||||
| 70 | 96 | 71 | 905 905 | ΔP 4 : 66 | |||||||||||||||||
| 6 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 11.15 | 11.30 | 11.45 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 416 | 296 | 311 | 299 | 365 | 314 | 312 | 314 | 312 | 382 905 905 434 905 905 435 905 435 4 905 434 | 13.15 часов вечера | 13.30 | 13.45 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 376 (275–440) | |
| 416 | 395 | 307 | 275 | 366 | 438 | 395 | 905 434 905 434 905 434 905 434 905 434 165 | ||||||||||||||
| 7 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 12.00 | 13.00 | 14.00 | 15.00 | 16.00 | |||||||||||
| P 4 нмоль / л | 27 | 25 | 32 | 36 | 40 | 39 | 36 | 34 | 29 905 905 905 905 905 905 905 | 17.00 вечера | 18.00 | 19.00 | 36 (25–48) | ||||||||
| 39 | 48 | 37 | 905 905 905 905 905 905 905 905 905 905 905 | ΔP 4 : 23 | |||||||||||||||||
| 8 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 9.15 | 9.30 | 9.45 | 10.00 | 11.00 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 51 | 55 | 50 | 50 | 50 | 49 | 50 | 53 | 59 905 905 42 905 905 905 | 14.00 вечера | 15.00 | 16.00 | 16.15 | 16.30 | 16.45 | 17.00 | 18.00 | 19.00 | 55 (49–62) | ||
| 52 | 53 | 61 | 59 | 60 | 59 | 62 | 58 | 56 13 | |||||||||||||
| 9 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 11.15 | 11.30 | 11.45 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 65 | 64 | 63 | 58 | 52 | 52 | 50 | 51 | 595 905 905 905 905 | 14.00 вечера | 15.00 | 16.00 | 17.00 | 18.00 | 18.15 | 18.30 | 18.45 | 19.00 | 54 (51–65) | ||
| 54 | 58 | 55 | 58 | 56 | 53 | 53 | 53 | 4 14 | |||||||||||||
| 10 | |||||||||||||||||||||
| Время | 7.00 утра | 8,00 утра | 8,15 утра | 8,30 утра | 8,45 утра | 9,00 утра | 10,00 утра | 10,15 утра | 10,30 утра | 10,45 утра | 185 | 178 | 187 | 182 | 181 | 180 | 112 | 108 | 117 | 124 | |
| 11905.00:00 | 12:00 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 161 (108–189) | ||||||||||||
| 122 | 140 | 155 | 153 | 172 | 189 | 18 | 161 146 | 161 | 905 81|||||||||||||
Была положительная корреляция между медианными уровнями P 4 и MAV в P 4 в дневное время ( r Спирмена = 0.9273, p = 0,0001). Величина импульса P 4 и, таким образом, максимальное изменение зависит от средней средне-лютеиновой концентрации P 4 (рисунок). У пациентов со средним значением P 4 > 250 нмоль / л в дневное время наблюдались очень большие колебания уровня P 4 в сыворотке со средним MAV 165 нмоль / л (диапазон 145–265 нмоль / л). Пациенты со средним значением P 4 от 89 до 213 нмоль / л имели среднее значение MAV 68 нмоль / л (диапазон 63–81 нмоль / л), тогда как пациенты с очень низким средне-лютеиновым уровнем P 4 (медиана P 4 <60 нмоль / л) имели довольно постоянные уровни P 4 в сыворотке в течение дня (медиана MAV 14 нмоль / л, диапазон 13–23 нмоль / л).
Максимальный абсолютный разброс s-прогестерона = P 4 максимум — P 4 минимум (нмоль / л) у 10 пациентов, подвергшихся лечению оплодотворением in vitro . Спирмена r = 0,9273, p = 0,0001.
Не было общего общего дневного ритма для P 4 у 10 обследованных женщин, что позволяет предположить, что лютеиновая фаза зависит от пациента. У некоторых пациентов самый высокий уровень гормонов наблюдался утром, у других — днем или ранним вечером (см. Рисунок).Время акрофазы (зенит) P 4 и надира P 4 было до полудня у половины пациентов и после полудня у другой половины пациентов (рисунок).
Время достижения максимальной концентрации P 4 (акрофаза) у 10 женщин, подвергающихся лечению ЭКО. Как видно, у пяти женщин была акрофаза P 4 до полудня и у пяти женщин после полудня. Такая же картина наблюдалась для надира P 4 .
Дневные колебания в сыворотке эстрадиола
Большие колебания средней лютеиновой сыворотки E 2 также наблюдались во время 12-часового отбора проб.У пациента № 2 E 2 увеличился с 3480 до 4664 пмоль / л за 1 час (Δ1 184 нмоль / л) (Рисунок B). У пациентов был индивидуальный максимум E 2 вариации (Max E 2 — Min E 2 ) в течение 12 часов в диапазоне от Δ404 до Δ1,481 пмоль / л. Не было корреляции между медианными уровнями E 2 и MAV в средне-лютеиновой E 2 (Спирмена r = 0,4424, p = 0,20).
Как и ожидалось, P 4 и E 2 , по-видимому, совместно секретируются из CL, демонстрируя аналогичные модели колебаний во времени (рисунок).Пациенты со средним значением P 4 <60 нмоль / л имели E 2 в диапазоне от 541 до 1552 пмоль / л (медиана E 2 1457 пмоль / л), тогда как пациенты со средним значением P 4 от 89 до 213 нмоль / л. У меня были уровни E 2 от 659 до 4884 пмоль / л (медиана E 2 2843 пмоль / л). У пациентов со средним значением P 4 > 250 нмоль / л значение E 2 колебалось от 3471 до 3919 пмоль / л (медиана E 2 3874 пмоль / л). Обнаружилась значимая корреляция между медианными уровнями P 4 и медианными уровнями E 2 во время средней лютеиновой фазы стимулированного цикла ( r Спирмена = 0.8424, p = 0,002).
(A) Дневные изменения среднего лютеинового s-прогестерона и s-эстрадиола у пациента № 10. Медиана P 4 = 161 нмоль / л, медиана E 2 = 3606 пмоль / л. (B) Дневные колебания уровней s-прогестерона и s-эстрадиола в средней части лютеина у пациента № 1. Медиана P 4 = 89 нмоль / л, медиана E 2 = 659 пмоль / л.
Обсуждение
Насколько нам известно, это первое исследование, в котором изучаются возможные дневные изменения секреции P 4 в середине лютеиновой фазы в группе женщин, проходящих лечение ЭКО.
Мы обнаружили, что величина средне-лютеиновых колебаний P 4 после лечения ЭКО зависела от среднего уровня P 4 . Наибольшие вариации P 4 наблюдались у пациентов, у которых медиана P 4 превышала 250 нмоль / л (медиана MAV 165 нмоль / л), тогда как пациенты в группе с низким P 4 (медиана P 4 <60 нмоль) / л) имели относительно постоянные уровни P 4 в течение дня (медиана MAV 14 нмоль / л). Пациенты показали очень индивидуальный паттерн секреции гормонов без какого-либо очевидного общего дневного ритма в секреции P 4 .Сыворотка E 2 показала аналогичные колебания в средней лютеиновой фазе с пациентами, имеющими индивидуальные вариации E 2 в диапазоне от Δ404 до Δ1 481 пмоль / л в течение 12 часов исследования.
В более ранних исследованиях описан весьма изменчивый паттерн секреции P 4 во время средней лютеиновой фазы у женщин, ведущих естественный цикл (15, 19, 20). В этих исследованиях сообщалось о наличии двух различных типов импульсов лютеина P 4 — некоторым предшествовал импульс ЛГ, а другим не сопутствовал ЛГ, наблюдаемым во время покоя гипофиза.Последнее, по-видимому, является результатом автономной секреции P 4 из CL, запускаемой и поддерживаемой внутриовариальными концентрациями E 2 , окситоцина и PGF 2α (21, 22). CL состоит из двух типов стероидогенных клеток, то есть малых лютеиновых клеток (SLC), происходящих из клеток фолликулярной теки, и больших лютеиновых клеток (LLC), происходящих из клеток фолликулярной гранулезы. И маленькие, и большие элементы обладают большой производительностью для производства P 4 .Более того, обе клетки обладают уникальными стероидогенными функциями, и «двухклеточный» механизм биосинтеза E 2 , по-видимому, действует в человеческом CL аналогично преовуляторному фолликулу (23). Таким образом, LLC содержат P450-ароматазу, необходимую для синтеза E 2 , тогда как SLC экспрессируют P450c17 для продукции андрогенов (24, 25). Оба типа лютеиновых клеток экспрессируют рецепторы E 2 (26), а стимуляция E 2 является мощным триггером высвобождения P 4 из любого типа клеток (27).
Выделение больших и SLC из желтого тела человека показало, что, будучи индуцированными пиком LH, LLC демонстрируют наибольшую базальную продукцию P 4 (28) и что эта продукция не увеличивается при дальнейшей стимуляции LH (29). LLC продуцируют P 4 с постоянной скоростью и являются доминирующим источником P 4 во время ранней лютеиновой фазы (30). В течение этого периода уровни P 4 демонстрируют непульсирующий паттерн как в естественном (15), так и в стимулированном цикле (OPU + 2) (31).Чувствительность SLC к LH / hCG развивается во время ранней средней лютеиновой фазы, когда клетки отвечают выраженным увеличением секреции P 4 в ответ на импульсы LH. Вклад лютеинового P 4 от SLC увеличивается во время средней и поздней лютеиновой фазы, во время которой секреция P 4 становится очень пульсирующей (32).
Таким образом, эндогенный средне-лютеиновый уровень P 4 состоит из трех частей: базальная продукция P 4 LLC, импульсы P 4 от SLC, запускаемые гипофизарным ЛГ, и автономные P 4 колебания, не зависящие от лютеотрофных раздражителей.
Ранее Wuttke et al. предложили модель, объясняющую независимые от ЛГ колебания уровней P 4 в средней части лютеина, основанные на аутокринных и паракринных механизмах в лютеиновой ткани (21). При стимуляции ЛГ во время средней лютеиновой фазы SLC начинают секрецию P 4 , а также андростендиона — последний впоследствии превращается в E 2 в LLC под действием P450-ароматазы. Повышенная концентрация E 2 действует аутокринным образом в LLC, увеличивая высвобождение как P 4 , так и окситоцина.Окситоцин стимулирует фибробласты к высвобождению PGF 2α , который, в свою очередь, стимулирует дальнейшую секрецию окситоцина, а также секрецию E 2 лютеиновыми клетками. Изолированный эффект окситоцина и PGF 2α на линии лютеиновых клеток представляет собой снижение секреции P 4 , но этот эффект перекрывается сопутствующим повышением E 2 , которое вызывает выраженное высвобождение P 4 . Таким образом, импульс ЛГ будет стимулировать внутрилютеиновый контур, включающий ауто- и паракринные эффекты E 2 , окситоцина, PGF 2α — и, возможно, множество других регуляторных пептидов, т.е.е., Вещество P — и конечный эффект — генерация импульса P 4 . Этот контур функционирует часами без дальнейшей гонадотропной поддержки, таким образом генерируя несколько импульсов P 4 с постепенно уменьшающейся амплитудой, пока следующий импульс LH не запустит внутри лютеиновый цикл E 2 / P 4 снова. Напротив, у женщин с гипоталамической недостаточностью с подавленным уровнем ЛГ и отсутствием импульсов ЛГ средний лютеиновый P 4 показывает непульсирующий характер, подчеркивая необходимость начальной высокой нагрузки ЛГ / ХГЧ для запуска цепи P 4 (21).Вызванное окситоцином высвобождение P 4 можно предотвратить обработкой CL тамоксифеном — агентом, блокирующим рецепторы эстрогена — подчеркивая регуляцию E 2 автономных импульсов P 4 (27). Этот независимый внутрилютеиновый генератор импульсов P 4 может служить дополнительным механизмом биологической безопасности, предотвращающим снижение уровней P 4 между импульсами ЛГ, и может объяснять функцию значительной продукции E 2 во время лютеиновой фазы у людей.
В цикле стимулированного ЭКО импульсы ЛГ отсутствуют в середине лютеиновой фазы, а уровни ЛГ в сыворотке явно подавлены (33). Болюс ХГЧ, вводимый для индукции овуляции или поддержки лютеиновой фазы, оказывает тонизирующее и постоянное раздражение лютеиновой ткани из-за длительного периода полувыведения ХГЧ и, следовательно, не может объяснить быстрые колебания P 4 , наблюдаемые в середине лютеиновая фаза в данном исследовании. Стандартная вагинальная добавка P 4 достигает устойчивого состояния во время ранней лютеиновой фазы и способствует удивительно постоянному уровню P 4 в сыворотке крови в течение всего дня, несмотря на многократные ежедневные вагинальные дозы (34).Таким образом, очень большие колебания уровня P 4 в сыворотке, наблюдаемые в настоящем исследовании, вероятно, являются результатом автономного внутриовариального цикла P 4 . Это дополнительно подчеркивается тем фактом, что пики P 4 сопровождаются сопутствующими подъемами E 2 , а экзогенный E 2 не был обеспечен как часть поддержки лютеиновой фазы.
Нам не удалось обнаружить общую картину секреции P 4 в дневное время у 10 обследованных пациентов.Пик и надир уровня P 4 у разных пациентов наблюдались в разное время, а курс гормонов в течение дня демонстрировал сугубо индивидуальные ритмы. Это согласуется с исследованиями, проведенными в середине лютеиновой фазы естественного цикла (3, 19). В исследовании семи женщин, изучавшихся в течение 24 часов в середине лютеиновой фазы естественного цикла, акрофаза P 4 изменялась с 10.31 до 23.33. (16). Из-за отсутствия суточного воспроизводимого шаблона для средне-лютеинового P 4 в цикле ЭКО точность измерения P 4 не улучшается за счет фиксированного времени забора крови и, таким образом, измерения P 4 можно провести в любое время в часы работы клиники.
В течение естественного цикла оба уровня поздних фолликулов E 2 , диаметр фолликула во время овуляции, а также площадь под кривой выброса ЛГ плохо коррелируют с уровнем P 4 последующей лютеиновой фазы (3). Таким образом, прогнозирование пациентов с недостаточным уровнем лютеина P 4 затруднительно на основании развития фолликулов, поскольку аномальные лютеиновые фазы можно увидеть в циклах, характеризующихся нормальным фолликулогенезом (35). В настоящем исследовании у двух пациентов с самыми низкими уровнями P 4 (36 и 55 нмоль / л) в день OPU было 17 и 19 фолликулов, соответственно, что показывает, что большое количество CL не гарантирует высокий уровень P 4 Выход в лютеиновой фазе.По этой причине мониторинг лютеиновой фазы P 4 может иметь значение для выявления пациентов с низким уровнем P 4 , которым может помочь дополнительная экзогенная терапия P 4 . Тем не менее, предварительным условием для легкого мониторинга лютеиновой фазы является то, что достоверность одного измеренного значения P 4 является надежным и дает разумную оценку емкости ХЛ пациента.
Мы признаем, что небольшой размер выборки этого исследования может ограничить обоснованность общих интерпретаций.Тем не менее, мы считаем это предварительное исследовательское исследование новаторским в рамках фундаментальных исследований и, что немаловажно, первым исследованием средне-лютеиновых колебаний P 4 при различных типах циклов ЭКО. Автономные LH-независимые выбросы P 4 из яичников во время средней лютеиновой фазы наблюдались для обоих типов аналогов GnRH (антагонист GnRH и протокол длительного GnRHa), а также после различных типов запуска окончательного созревания ооцитов (hCG или GnRH). агонист). Таким образом, кажется, что эти автономные эпизодические лютеиновые пики P 4 генерируются независимо от выбора схемы лечения и, следовательно, могут также применяться к другим протоколам стимуляции ЭКО.
Заключение
На основании 10 женщин, обследованных в этом исследовании, мы заявляем, что точность единичного измерения прогестерона в средне-лютеиновой сыворотке как приблизительного среднего уровня P 4 в течение дня зависит от концентрации P 4 и что женщины с низким уровнем P 4 (P 4 <60 нмоль / л) демонстрируют клинически стабильные уровни P 4 в дневное время. Таким образом, единичное измерение P 4 у пациента с низким уровнем прогестерона довольно точно отражает функцию CL, и измеренное низкое значение P 4 , следовательно, можно рассматривать как «истинно низкое значение».Будущие исследования должны прояснить, может ли дополнительная экзогенная поддержка P 4 , вводимая группе пациентов с низким лютеиновым P 4 , улучшить репродуктивный результат.
Доступность данных
Необработанные данные, подтверждающие заключение этой рукописи, будут предоставлены авторами без излишних оговорок любому квалифицированному исследователю.
Заявление об этике
Исследование было проведено в соответствии с Хельсинкской декларацией о медицинских исследованиях и одобрено местным комитетом по этике Центрального региона Дании.Все пациенты дали письменное информированное согласие на участие в исследовании.
Вклад авторов
LT разработал и провел исследование. LT подготовил рукопись, а Великобритания, Калифорния и PH — все внесли свой вклад в интерпретацию данных и критически рассмотрели рукопись. Все соавторы приняли окончательный вариант.
Заявление о конфликте интересов
LT получил неограниченный исследовательский грант от Ferring Pharmaceuticals вне рамок этой работы. PH получила неограниченные исследовательские гранты от MSD, Merck и Ferring Pharmaceuticals, а также гонорары за лекции от MSD, Merck и Finox вне рамок этой работы.Великобритания получила гонорары за лекции от MSD и Ferring Pharmaceuticals, помимо этой работы. CA получила неограниченные исследовательские гранты от MSD, IBSA и Ferring Pharmaceuticals, а также гонорары за лекции от MSD и IBSA вне рамок этой работы.
Благодарности
Авторы хотели бы поблагодарить участвующих пациентов клиники репродуктивной медицины в Скиве, Дания, которые любезно использовали свое время, чтобы сделать это исследование возможным.
Сноски
Финансирование. Грант от «Фонда медицинских исследований региона Центральной Дании» и «Исследовательского фонда больницы Центральной Ютландии» поддержал проведение этого исследования. Финансирующие организации не участвовали ни в проведении исследования, ни в написании научного отчета.
Ссылки
1. Wiltbank MC, Salih SM, Atli MO, Luo W., Bormann CL, Ottobre JS, et al. Сравнение эндокринных и клеточных механизмов, регулирующих желтое тело приматов и жвачных животных.Anim Reprod (2012) 9 (3): 242–59. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Россманиф В.Г., Лафлин Г.А., Мортола Дж.Ф., Йен СС. Секреторная динамика эстрадиола (E2) и прогестерона (P4) в периоды относительного покоя гипофизарного ЛГ в средней ягодичной фазе менструального цикла. Clin Endocrinol (Oxf) (1990) 32 (1): 13–23.10.1111 / j.1365-2265.1990.tb03745.x [PubMed] [CrossRef] [Google Scholar] 3. Соулз М.Р., Клифтон Д.К., Штайнер Р.А., Коэн Н.Л., Бремнер В.Дж. Желтое тело: детерминанты секреции прогестерона в нормальном менструальном цикле.Obstet Gynecol (1988) 71 (5): 659–66. [PubMed] [Google Scholar] 4. Humaidan P, Bungum L, Bungum M, Hald F, Agerholm I, Blaabjerg J и др. Репродуктивные результаты с использованием антагониста ГнРГ (Цетрореликс) для лютеолиза и фолликулярной синхронизации у пациентов с плохим ответом на ЭКО / ИКСИ, получавших гибкий протокол антагонистов ГнРГ. Reprod Biomed Online (2005) 11 (6): 679–84.10.1016 / S1472-6483 (10) 61685-9 [PubMed] [CrossRef] [Google Scholar] 5. Humaidan P, Ejdrup Bredkjaer H, Westergaard LG, Yding Andersen C.1500 МЕ хорионического гонадотропина человека, вводимого при извлечении ооцитов, восстанавливают лютеиновую фазу, когда агонист гонадотропин-рилизинг-гормона используется для индукции овуляции: проспективное, рандомизированное, контролируемое исследование. Fertil Steril (2010) 93 (3): 847–54.10.1016 / j.fertnstert.2008.12.042 [PubMed] [CrossRef] [Google Scholar] 6. Йдинг Андерсен К., Вилбур Андерсен К. Улучшение лютеиновой фазы после стимуляции яичников: обзор новых возможностей. Reprod Biomed Online (2014) 28 (5): 552–9.10.1016 / j.rbmo.2014.01.012 [PubMed] [CrossRef] [Google Scholar] 7. Блейк Э.Дж., Норрис П.М., Дорфман С.Ф., Лонгстрет Дж., Янков В.И.. Одно- и многодозовое фармакокинетическое исследование вагинального микронизированного прогестерона (эндометрина) по сравнению с вагинальным гелем у здоровых женщин репродуктивного возраста. Fertil Steril (2010) 94 (4): 1296–301.10.1016 / j.fertnstert.2009.06.014 [PubMed] [CrossRef] [Google Scholar] 10. Хумайдан П., Полизос Н.П., Альсбьерг Б., Эрб К., Миккельсен А.Л., Эльбаек Х.О. и др. Триггер ГнРГ и индивидуальная поддержка ХГЧ в лютеиновой фазе в соответствии с реакцией яичников на стимуляцию: два проспективных рандомизированных контролируемых многоцентровых исследования у пациенток ЭКО.Hum Reprod (2013) 28 (9): 2511–21.10.1093 / humrep / det249 [PubMed] [CrossRef] [Google Scholar] 11. Ниманн Х., Захер Б., Эльзессер Ф. Частота наступления беременности относительно уровней прогестерона в плазме реципиента в день нехирургического переноса замороженных / размороженных эмбрионов крупного рогатого скота. Териогенология (1985) 23 (4): 631–9.10.1016 / 0093-691X (85)-9 [PubMed] [CrossRef] [Google Scholar] 12. Ногейра М.Ф., Мело Д.С., Карвалью Л.М., Fuck EJ, Тринка Л.А., Баррос С.М. Уменьшают ли высокие концентрации прогестерона частоту наступления беременности у реципиентов-эмбрионов, синхронизированных с PGF2alpha и eCG? Териогенология (2004) 61 (7–8): 1283–90.10.1016 / j.theriogenology.2003.07.012 [PubMed] [CrossRef] [Google Scholar] 13. Йович Дж. Л., Консейсао Дж. Л., Стангер Дж. Д., Хинчлифф П. М., Кин К. Н.. Средне-лютеиновые концентрации прогестерона в сыворотке определяют скорость имплантации криоконсервированных переносов эмбрионов, проводимых в условиях заместительной гормональной терапии. Reprod Biomed Online (2015) 31 (2): 180–91.10.1016 / j.rbmo.2015.05.005 [PubMed] [CrossRef] [Google Scholar] 14. Labarta E, Mariani G, Holtmann N, Celada P, Remohi J, Bosch E. Низкий уровень прогестерона в сыворотке в день переноса эмбриона связан с уменьшением продолжающейся беременности в циклах донорства ооцитов после искусственной подготовки эндометрия: проспективное исследование.Hum Reprod (2017) 32 (12): 2437–42.10.1093 / humrep / dex316 [PubMed] [CrossRef] [Google Scholar] 15. Филикори М., Батлер Дж. П., Кроули В. Ф., младший. Нейроэндокринная регуляция желтого тела у человека. Доказательства пульсирующей секреции прогестерона. J. Clin Invest (1984) 73 (6): 1638–47.10.1172 / JCI111370 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Велдхейс Дж. Д., Кристиансен Э., Эванс В. С., Колп Л. А., Рогол А. Д., Джонсон М. Л.. Физиологические профили эпизодического высвобождения прогестерона во время средней ягодичной фазы менструального цикла человека: анализ циркадных и ультрадианных ритмов, дискретных свойств пульса и корреляции с одновременным высвобождением лютеинизирующего гормона.J. Clin Endocrinol Metab (1988) 66 (2): 414–21.10.1210 / jcem-66-2-414 [PubMed] [CrossRef] [Google Scholar] 17. Reame N, Sauder SE, Kelch RP, Marshall JC. Пульсирующая секреция гонадотропина во время менструального цикла человека: данные об изменении частоты секреции гонадотропин-рилизинг-гормона. J. Clin Endocrinol Metab (1984) 59 (2): 328–37.10.1210 / jcem-59-2-328 [PubMed] [CrossRef] [Google Scholar] 18. Tavaniotou A, Albano C, Smitz J, Devroey P. Сравнение концентраций ЛГ в ранней и средней лютеиновой фазе в циклах ЭКО после лечения только ГМГ или в сочетании с антагонистом ГнРГ Цетрореликсом.Hum Reprod (2001) 16 (4): 663–7.10.1093 / humrep / 16.4.663 [PubMed] [CrossRef] [Google Scholar] 19. Фудзимото В.Ю., Клифтон Д.К., Коэн Н.Л., Соулз МР. Вариабельность уровней пролактина и прогестерона в сыворотке крови у здоровых женщин: важность измерения одного гормона в клинических условиях. Obstet Gynecol (1990) 76 (1): 71–8. [PubMed] [Google Scholar] 20. Россманиф В.Г., Лафлин Г.А., Мортола Дж. Ф., Джонсон М.Л., Велдхейс Дж. Д., Йен СС. Пульсирующая секреция эстрадиола и прогестерона в средней ягодичной фазе желтого тела: временная связь с импульсами лютеинизирующего гормона.J. Clin Endocrinol Metab (1990) 70 (4): 990–5.10.1210 / jcem-70-4-990 [PubMed] [CrossRef] [Google Scholar] 21. Wuttke W, Theiling K, Hinney B, Pitzel L. Регулирование производства стероидов и его функция в желтом теле. Стероиды (1998) 63 (5–6): 299–305.10.1016 / S0039-128X (98) 00037-3 [PubMed] [CrossRef] [Google Scholar] 22. Bah MM, Acosta TJ, Pilawski W, Deptula K, Okuda K, Skarzynski DJ. Роль простагландина F (2альфа), прогестерона и окситоцина в базальном и пульсирующем высвобождении прогестерона из развивающегося желтого тела крупного рогатого скота.Простагландины — другие липидные средства (2006) 79 (3–4): 218–29.10.1016 / j.prostaglandins.2006.01.002 [PubMed] [CrossRef] [Google Scholar] 23. Фиш Б., Маргара Р. А., Уинстон Р. М., Хиллиер С. Г.. Клеточные основы лютеинового стероидогенеза в яичнике человека. J Endocrinol (1989) 122 (1): 303–11.10.1677 / joe.0.1220303 [PubMed] [CrossRef] [Google Scholar] 24. Мэйбин JA, Дункан WC. Желтое тело человека: какие клетки имеют рецепторы прогестерона? Репродукция (2004) 128 (4): 423–31.10.1530 / rep.1.00051 [PubMed] [CrossRef] [Google Scholar] 25.Девото Л., Фуэнтес А., Коэн П., Сеспедес П., Паломино А., Поммер Р. и др. Желтое тело человека: жизненный цикл и функции в естественных циклах. Fertil Steril (2009) 92 (3): 1067–79.10.1016 / j.fertnstert.2008.07.1745 [PubMed] [CrossRef] [Google Scholar] 26. ван ден Дрише С., Смит В. М., Майерс М., Дункан В. Экспрессия и регуляция рецепторов эстрогена в желтом теле человека. Репродукция (2008) 135 (4): 509–17.10.1530 / REP-07-0427 [PubMed] [CrossRef] [Google Scholar] 27. Маас С., Джарри Х., Тайхманн А., Рат В., Кун В., Вуттке В.Паракринное действие окситоцина, простагландина F2 альфа и эстрадиола в желтом теле человека. J. Clin Endocrinol Metab (1992) 74 (2): 306–12.10.1210 / jc.74.2.306 [PubMed] [CrossRef] [Google Scholar] 28. Friden BE, Hagstrom H, Lindblom B, Sjoblom P, Wallin A, Brannstrom M, et al. Характеристики клеток и функции двух обогащенных фракций пролонгированных лютеиновых клеток человека. Мол Хум Репрод (1999) 5 (8): 714–9.10.1093 / мольхр / 5.8.714 [PubMed] [CrossRef] [Google Scholar] 29. Охара А., Мори Т., Тайи С., Бан С., Наримото К.Функциональная дифференциация в стероидогенезе двух типов лютеиновых клеток, выделенных из зрелых желтых тел человека менструального цикла. J. Clin Endocrinol Metab (1987) 65 (6): 1192–200.10.1210 / jcem-65-6-1192 [PubMed] [CrossRef] [Google Scholar] 30. Джонс Г.С. Желтое тело: состав и функции. Fertil Steril (1990) 54 (1): 21–6.10.1016 / S0015-0282 (16) 53630-9 [PubMed] [CrossRef] [Google Scholar] 31. Tannus S, Burke Y, McCartney CR, Kol S. Запуск агониста GnRH для окончательного созревания ооцитов в циклах ЭКО-антагониста GnRH вызывает снижение частоты и амплитуды пульса LH в ранней лютеиновой фазе: возможный механизм лютеолиза.Gynecol Endocrinol (2017) 5: 1–5.10.1080 / 0Изменение уровня прогестерона в сыворотке в дневное время в средней лютеиновой фазе у женщин, подвергающихся Экстракорпоральное оплодотворение
Фронт-эндокринол (Лозанна).2018; 9: 92.
Lise Haaber Thomsen
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Отделение клинической медицины, Орхусский университет, Орхус, Дания
Ulrik Schiøler Kesmodel 9007
Клиника репродуктивной медицины, больница Херлев, Херлев, Дания
4 Кафедра клинической медицины, Копенгагенский университет, Копенгаген, Дания
Клаус Йдинг Андерсен
5 Лаборатория репродуктивной биологии, Женский центр Джулиан Мари, Дети и репродукция, Университетская больница Копенгагена, Копенгагенский университет, Копенгаген, Дания
Питер Хумайдан
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Департамент клинической медицины, Орхусский университет, Орхус , Дания
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Кафедра клинической медицины, Орхусский университет, Орхус, Дания
3 Клиника репродуктивной медицины, больница Херлев, Херлев, Дания
4 Кафедра клинической медицины Копенгагенского университета, Копенгаген, Дания
5 Лаборатория репродуктивной биологии, Центр женщин, детей и репродукции Джулиан Мари, Университетская больница Копенгагена, Университет Копенгагена, Копенгаген, Дания
Отредактировал: Sandro C.Эстевес, Андроферт, Клиника андрологии и репродукции человека, Бразилия
Рецензент: Эвангелос Г. Папаниколау, Университет Аристотеля в Салониках, Греция; Джон Луи Йович, Медицинский центр Пивет, Австралия
Специальный раздел: Эта статья была отправлена в репродукцию, раздел журнала «Границы эндокринологии»
Поступила в редакцию 17 декабря 2017 г .; Принято 26 февраля 2018 г.
Copyright © 2018 Thomsen, Kesmodel, Andersen and Humaidan.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY).Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) и правообладателя и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.- Заявление о доступности данных
Необработанные данные, подтверждающие заключение этой рукописи, будут предоставлены авторами без необоснованных оговорок любому квалифицированному исследователю.
Реферат
Цель
Изучить, проявляет ли средне-лютеиновый прогестерон сыворотки (P 4 ) значительные колебания в течение 12-часового дневного периода у женщин, перенесших оплодотворение in vitro (ЭКО), и выяснить, могут ли Степень этих колебаний может повлиять на интерпретацию уровней лютеинового прогестерона в клинических условиях.
Дизайн
Пилотно-разведочное исследование.
Учреждение
Отделение репродуктивной медицины при государственной больнице.
Пациенты
Десять женщин проходят курс ЭКО.
Вмешательство
Через семь дней после забора ооцитов у пациентов часто проводился повторный забор крови (каждые 60 минут в течение 12 часов и в течение двух из этих часов каждые 15 минут). Образцы сыворотки крови анализировали на прогестерон, эстрадиол и лютеинизирующий гормон (ЛГ).
Основные критерии оценки результатов
Дневные колебания s-прогестерона и s-эстрадиола.
Результаты
Наблюдалась значимая положительная корреляция между медианными уровнями P 4 и величиной вариаций P 4 — женщины со средним значением P 4 <60 нмоль / л имели клинически стабильные уровни P 4 на протяжении всего периода исследования. день, в то время как пациенты со средним значением P 4 > 250 нмоль / л демонстрировали периодические пики P 4 в несколько сотен наномолей на литр.Эти эндогенные колебания P 4 наблюдались независимо от типа протокола стимуляции или режима запуска окончательного созревания ооцитов и несмотря на тот факт, что LH был ниже предела обнаружения во время измерения. Одновременно наблюдались большие колебания s-эстрадиола.
Заключение
Мониторинг раннего и среднего лютеинового уровня P 4 в циклах ЭКО может быть ценным при планировании индивидуальной поддержки лютеиновой фазы в попытке улучшить репродуктивные результаты.Однако предварительным условием для мониторинга лютеиновой фазы является достоверность единственного измеренного значения P 4 . Мы впервые показываем, что одно измерение P 4 у пациента с низким уровнем прогестерона достаточно точно отражает функцию желтого тела и что это измерение может быть использовано для выявления пациентов с ЭКО, которым необходимо дополнительное введение экзогенного лютеина P 4 .
Ключевые слова: сывороточный прогестерон, in vitro оплодотворение , сывороточный эстрадиол, лютеиновая фаза, дневная вариация
Введение
Желтое тело человека (ХТ) является транзиторной эндокринной железой яичников, которая активна во время лютеиновой фазы менструальный цикл и на ранних сроках беременности до 8 недели гестации.CL производит значительные количества прогестерона (P 4 ), эстрадиола (E 2 ) и андрогенов, а также факторов роста и нестероидных гормонов. Общее поддержание функции CL критически зависит от регулярной стимуляции лютеинизирующим гормоном гипофиза (ЛГ) или хорионическим гонадотропином человека (ХГЧ) для поддержания стероидогенеза лютеинизированной гранулезой и клетками теки (1). Достаточное производство P 4 из CL является абсолютной необходимостью для децидуализации эндометрия перед имплантацией и установления ранней беременности.Секреция прогестерона из КЛ максимальна в середине лютеиновой фазы, вызывая в естественном цикле сывороточный уровень P 4 примерно 40–60 нмоль / л (2, 3).
Во время стимуляции яичников для in vitro оплодотворение (ЭКО) получают надфизиологические уровни E 2 во время поздней фолликулярной фазы в результате мультифолликулярного роста. Это гиперэстрогенное состояние должно уравновешиваться в лютеиновой фазе повышенной нагрузкой P 4 для достижения восприимчивого эндометрия к моменту переноса эмбриона.Ранее Хумайдан и его коллеги показали, что использование триггера агониста ГнРГ в циклах ЭКО с последующей поддержкой стандартной вагинальной лютеиновой фазы приводило к среднему лютеиновому уровню P 4 , сравнимому с уровнями, наблюдаемыми в естественном цикле (39 нмоль / л). (4). Однако, в отличие от того, что ожидалось, этот уровень P 4 был слишком низким для обеспечения успешной имплантации и беременности, в результате чего частота продолжающихся беременностей при ЭКО составила только 6%. Таким образом, подчеркивая тот факт, что потребность в P 4 во время лютеиновой фазы стимулированного цикла больше, чем у естественного цикла.Когда поддержка лютеиновой фазы была изменена путем добавления болюса 1500 МЕ ХГЧ в день извлечения ооцитов, срединно-лютеиновый уровень P 4 запускаемого цикла GnRHa увеличился до 74 нмоль / л, в результате чего скорость доставки составила 24%. за перевод (5). Похоже, что пороговое значение P 4 в средне-лютеиновой сыворотке составляет примерно 80–100 нмоль / л после лечения ЭКО с последующим переносом свежего эмбриона, и что этот порог должен быть превышен для обеспечения успешного репродуктивного результата (6).Традиционная поддержка лютеиновой фазы в циклах искусственного ЭКО с введением микронизированного влагалища P 4 индуцирует уровень P 4 в лютеиновой сыворотке примерно 40 нмоль / л (7–9). Таким образом, существенная дополнительная эндогенная продукция P 4 CL является обязательной для превышения порогового значения P 4 , чтобы впоследствии оптимизировать вероятность беременности после лечения ЭКО. Традиционно врачи не контролируют уровни P 4 в лютеиновой фазе, будучи твердо уверены, что поддержка лютеиновой фазы покроет потребность цикла в P 4 .Однако ранее мы видели, что более 25% пациентов ЭКО в группе, запускаемой как ХГЧ, так и ГнРГ, имеют средне-лютеиновую сыворотку P 4 ниже 60 нмоль / л, несмотря на поддержку лютеиновой фазы и тот факт, что у них было более 14 фолликулы в день аспирации (10). Кроме того, данные не относящихся к человеку видов (11, 12) и данные циклов замораживания / оттаивания эмбрионов человека (13, 14) показали, что существует оптимальный диапазон лютеинового P 4 и что исход беременности снижается не только ниже, но и выше этого оптимального уровня P 4 .Так ли это и после ЭКО и переноса свежих эмбрионов, еще предстоит выяснить. В этом случае мониторинг уровней лютеина P 4 может помочь улучшить репродуктивный результат в циклах ЭКО, позволяя индивидуализировать лечение на основе измерений P 4 в сыворотке.
Однако измерения среднего лютеинового P 4 осложняются пульсирующим характером секреции гормона из CL. Filicori с соавторами (15) показали, что концентрации P 4 в плазме демонстрируют большие и быстрые колебания в течение средней лютеиновой фазы у женщин, ведущих естественный цикл.Таким образом, уровни P 4 варьировались от значений всего 7 нмоль / л до пиков 128 нмоль / л в течение нескольких минут в течение 24-часового периода исследования. В естественном цикле существуют два различных типа импульсов P 4 во время средней лютеиновой фазы: импульсы, которым предшествует импульс LH, и другие, возникающие во время покоя LH; последнее является результатом автономной секреции стероидов CL независимо от активности ЛГ. Во время средней лютеиновой фазы стимулированного цикла ЭКО гипофиз подавляется отрицательной обратной связью с надфизиологическими уровнями стероидов, и s-LH значительно снижается до уровней намного ниже (0.5–0,7 МЕ / л), чем в середине лютеиновой фазы естественного цикла (5–7 МЕ / л) (16–18). Как эта пониженная пульсовая активность ЛГ влияет на секреторный паттерн стероидогенеза яичников в середине лютеиновой фазы цикла ЭКО, до сих пор неизвестно.
Настоящее исследование было проведено для изучения того, демонстрируют ли уровни P 4 в средне-лютеиновой сыворотке в цикле ЭКО такой же высокопульсирующий паттерн, как в естественном цикле, зная, что пульсовая активность ЛГ заметно снижена.С клинической точки зрения мы хотели выяснить, обеспечивает ли однократное утреннее измерение P 4 надежный показатель средне-лютеиновой функции ХЛ после ЭКО.
Материалы и методы
Популяция исследования
Десять пациенток, перенесших ЭКО / ИКСИ в клинике репродуктивной медицины в Скиве, Дания, с декабря 2014 г. по декабрь 2015 г. добровольно вызвались принять участие в исследовании. Регистрировалась клиническая информация, касающаяся возраста, индекса массы тела (ИМТ), привычек курения, биохимического репродуктивного профиля, причины бесплодия, предыдущих попыток ЭКО, курса стимуляции и лабораторных результатов.Исходные характеристики участников представлены в таблице. Письменное информированное согласие было получено от всех пациентов до участия в исследовании. Участники были выбраны так, чтобы они представляли как длинный цикл агонистов GnRH, так и цикл антагонистов GnRH, и различные типы запуска для окончательного созревания ооцитов (hCG или агонист GnRH).
Таблица 1
Описание демографических данных, стимуляции яичников, поддержки лютеиновой фазы и уровней прогестерона у исследуемых пациенток.
| Пациент | Возраст (лет) | Индекс массы тела (кг / м 2 ) | Базальный ФСГ (МЕ / л) | Причина бесплодия | Протокол | Общая сумма ФСГ (МЕ) | Продолжительность стимуляции ФСГ (дни) | Триггер овуляции | Поддержка лютеиновой фазы | No.фолликулов> 14 мм | Кол-во ооцитов | Кол-во MII | Средне-лютеиновый P 4 (нмоль / л) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 38 | 24,4 | 6,5 905 Мужской фактор | Long GnRHa | 3,225 | 11 | ХГЧ 10 000 МЕ | Лютинус 300 мг ежедневно | 5 | 5 | 1 | 89 | 26 | Отсутствие мужского партнера / эндометриоз | Антагонист ГнРГ | 1,725 | 9 | Супрефакт 0,5 мг | Лютинус 300 мг в день + 1500 ХГЧ (OPU) + 1000 ХГЧ (OPU + 5) | 10 | 10 | 283 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 39 | 30,0 | 6,4 | Отсутствует партнер-мужчина | Long GnRHa | 3,450 | 12 | Ivitrelle | Ivitrelle 90 мг / сутки 12 | 12 | 277 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 34 | 22.2 | 14,7 | Необъяснимый | Длинный ГнРГ | 3,600 | 12 | ХГЧ 10 000 МЕ | Лутинус 300 мг ежедневно | 9 | 8 | 905 905 905 905 905 905 905 905 19,95,9 | Мужской фактор | Long GnRHa | 2,925 | 11 | ХГЧ 10 000 МЕ | Лютинус 300 мг в день | 9 | 6 | 905 | 25.3 | 8,3 | Необъяснимый | Long GnRHa | 3,600 | 12 | Овитрелл 6,500 МЕ | Лутинус 300 мг ежедневно | 11 | 841 | 905 905 905 905 905 905 905 905 905 31,83,9 | Эндометриоз | Антагонист ГнРГ | 2,025 | 9 | Супрефакт 0,5 мг | Кринон 180 ежедневно + 1,500 ХГЧ (OPU) | 17 | 11 905 43 17 | 11 905 43 17 | 11 905 43 17 | 11 905 | 36 | 25.6 | 4,9 | Тубальный фактор | Антагонист ГнРГ | 1,913 | 9 | Супрефакт 0,5 мг | Кринон 180 ежедневно + 1,500 ХГЧ (OPU) | 19 | 13 905 9 | 40 | 34,5 | 7,2 | Необъяснимая | Long GnRHa | 2,250 | 9 | hCG 10,000 IU | Lutinus 300 мг ежедневно | 905 905 | 7 905 10 | 36 | 29.4 | 7,2 | Мужской фактор | Антагонист ГнРГ | 3,938 | 15 | Супрефакт 0,5 мг | Лютинус 300 мг в день + 1000 ХГЧ (OPU) + 500 (OPU + 5) | 14 905 8 | 161 |
Протоколы стимуляции яичников
Шесть пациентов лечились в рамках длительного цикла агонистов гонадолиберин с подавлением гипофиза с помощью подкожной инъекции бусерелина 0,8 мг (Suprefact ® ; Sanofi, Дания), начиная с середины 20-го века. лютеиновая фаза предыдущего цикла.Суточная доза бусерелина 0,4 мг вводилась до дня, предшествующего началу овуляции. На 2-й день цикла было проведено трансвагинальное ультразвуковое исследование, и в случае толщины эндометрия <4 мм началась стимуляция яичников с помощью корифоллитропина-альфа (Elonva ® ; MSD, Дания) в сочетании с любым r-ФСГ. / рЛГ (Pergoveris ® ; Merck Biopharma, Дания) или чМГ (Menopur ® , Ferring Pharmaceuticals, Дания). Дозировка гонадотропина определялась индивидуально на основании возраста пациента, ИМТ, исходного уровня ФСГ, предыдущей реакции на гонадотропины и количества антральных фолликулов и корректировалась путем мониторинга размера фолликулов с помощью трансвагинального ультразвукового исследования во время лечения.Окончательное созревание ооцитов индуцировали либо 10000 МЕ п / к ХГЧ (прегнил ® , MSD, Дания), либо п / к 6 500 МЕ (Ovitrelle ® , Merck Biopharma, Дания), когда два или более ведущих фолликула достигли среднего диаметра 17 мм. Забор ооцитов проводили через 36 ч после введения ХГЧ. Процедуры ЭКО / ИКСИ и культивирование эмбрионов проводились в соответствии с обычной клинической практикой. На 3 или 5 день после извлечения ооцитов было перенесено не более двух эмбрионов. Поддержка лютеиновой фазы вводилась в виде микронизированного влагалища P 4 (Lutinus ® 300 мг в день, Ferring Pharmaceutical, Дания или Crinone ® 180 мг в день, Merck Biopharma, Дания), начиная с 1 дня после забора ооцитов (OPU) .
У четырех пациентов использовался протокол антагонистов ГнРГ. На 2 день цикла началась стимуляция яичников с помощью r-FSH (Gonal-F ® ; Merck Biopharma, Дания) или hMG (Menopur ® , Ferring Pharmaceuticals, Дания) после ультразвукового исследования влагалища. Ежедневная совместная обработка антагонистами ГнРГ (Оргалутран ® 0,25 мг / день, MSD, Дания) добавлялась при размере фолликула 12 мм. Дозу ФСГ подбирали индивидуально в соответствии с ответом яичников. Окончательное созревание ооцитов индуцировали SC Buserelin 0.5 мг (Suprefact ® ; Sanofi, Дания) при наличии двух или более фолликулов размером ≥17 мм. Забор ооцитов проводили через 36 часов. Максимум два эмбриона были перенесены на 3 или 5 день после OPU. Поддержка лютеиновой фазы проводилась по индивидуальному режиму, состоящему из вагинального введения 300 мг микронизированного P 4 ежедневно (Lutinus ® , Ferring Pharmaceuticals, Дания) в сочетании с болюсным введением ХГЧ (1000–1500 МЕ) в день приема. извлечение ооцитов (5, 10).В зависимости от индивидуальной реакции яичников на стимуляцию некоторым пациентам вводили дополнительный болюс ХГЧ на OPU + 5 (500–1000 МЕ) (10). См. Подробную информацию в таблице. Вагинальное введение P 4 продолжалось до дня тестирования на беременность (триггер ХГЧ) или до седьмой недели гестации (триггер ГнРГ).
Забор крови
Забор крови проводился в середине лютеиновой фазы, то есть через 7 дней после OPU (OPU + 7). Пациенты были доставлены в отделение репродуктивной медицины рано утром и оставались в клинике в течение последующих 12 часов.Время начала забора крови для всех пациентов было с 6 до 9 часов утра. В течение периода исследования участникам была разрешена нормальная повседневная деятельность.
Внутривенную канюлю вводили в вену в антекубитальной ямке, и образцы крови (4 мл) отбирали каждые 60 минут в течение 12 часов ( n = 10) и в течение двух из этих часов каждые 15 минут ( n = 8 из-за затрудненного венозного доступа у двух пациентов). После коагуляции при комнатной температуре образцы крови центрифугировали, выделяли сыворотку и хранили при -80 ° C до анализа.
Измерение гормонов
Сыворотка P 4 (нмоль / л), E 2 (пмоль / л) и концентрации ЛГ (МЕ / л) измеряли с помощью автоматизированных электрохемилюминесцентных иммуноанализов (Cobas ® Modular analytics E170 , Roche Diagnostics, Швейцария) обычно используется для анализа в отделении биохимии региональной больницы Выборга, Дания. Все измерения были выполнены в соответствии с инструкциями производителя с использованием имеющегося в продаже набора для хемилюминесцентного иммуноанализа, предназначенного для измерений в сыворотке.
Предел обнаружения гормонов составлял 0,2 нмоль / л, 18,4 пмоль / л и 0,1 МЕ / л для P 4 , E 2 и ЛГ соответственно. Все образцы сыворотки от каждого пациента были измерены в рамках одного цикла анализа. Все концентрации гормонов, превышающие предел обнаружения анализа, измеряли в двух экземплярах. Все коэффициенты вариации для P 4 , E 2 и LH были ниже 4%.
Статистика
Данные представлены в виде среднего значения ± стандартное отклонение или медианы и диапазона, когда это необходимо.Максимальное абсолютное изменение (MAV) в сыворотке P 4 за 12-часовой период дается как максимальная концентрация P 4 — минимальная концентрация P 4 во время отбора проб для каждого пациента.
Коэффициент корреляции Спирмена ( r ) был рассчитан для корреляции медианного уровня стероидов с максимальным абсолютным изменением гормона в течение дня (MAV). Значение p <0,05 считалось статистически значимым. Все анализы были выполнены с использованием STATA версии 13.
Результаты
Характеристики пациентов
Пациенты имели средний возраст 35,3 ± 4,2 года, средний ИМТ 26,6 ± 4,7 кг / м 2 и 1,9 ± 2,0 до попыток ЭКО. Средний уровень ФСГ для всех пациентов составил 6,55 МЕ / л (межквартильный размах 5,9; 7,2 МЕ / л). Все участники были некурящими. У четырех пациентов причиной бесплодия была не женщина (мужской фактор или отсутствие партнера-мужчины), у трех пациентов причина была женщина (трубный фактор или эндометриоз), а у трех пациентов причина бесплодия была идиопатической (необъяснимой).См. Подробную информацию в таблице.
Общие значения средне-лютеинового прогестерона
У трех пациентов средний уровень средне-лютеинового P 4 был ниже 60 нмоль / л. Двое из этих пациентов (№7 и №8) были запущены агонистом ГнРГ и получили поддержку лютеиновой фазы с помощью 1500 МЕ ХГЧ (OPU) и вагинального P 4 (Кринон 180 мг в день). Несмотря на то, что в день OPU было извлечено 19 и 17 фолликулов размером ≥ 14 мм и 11-13 зрелых ооцитов, они показали средне-лютеиновый P 4 всего 55 и 36 нмоль / л соответственно.Другой пациент (№ 9) с P 4 <60 нмоль / л был запущен с помощью 10000 МЕ ХГЧ и имел семь фолликулов> 14 мм в день аспирации.
Общие средне-лютеиновые значения ЛГ
Ни у одного из пациентов с пониженной регуляцией по протоколу длинного агониста ГнРГ ( n = 6) уровни s-LH превышали предел обнаружения анализа в любой момент во время измерения (т. Е. LH < 0,1 МЕ / л). У трех из четырех пациентов, стимулированных по протоколу антагониста ГнРГ, наблюдалась умеренная импульсная активность ЛГ с амплитудами ЛГ от 0.От 2 до 2,8 ЕД / л. У всех пациентов за пиком ЛГ следовало повышение P 4 в сыворотке от 4 до 36 нмоль / л.
Дневные колебания сывороточного прогестерона
Как видно во время естественного цикла, большие колебания среднего лютеинового P 4 также присутствовали в дневное время у некоторых женщин, подвергающихся лечению ЭКО (рисунок). Колебания лютеиновых стероидов наблюдались независимо от выбора протокола стимуляции, режима окончательного созревания ооцитов и типа поддержки лютеиновой фазы.
Индивидуальные профили прогестерона в средне-лютеиновой сыворотке в течение 12-часового интервала у 10 пациентов, подвергшихся контролируемой стимуляции яичников для лечения оплодотворением in vitro .
Наибольшая вариация уровней P 4 наблюдалась у пациентов со средним значением P 4 > 250 нмоль / л. У пациента № 2 со средним значением P 4 , равным 283 нмоль / л, значение P 4 колебалось от 293 нмоль / л в 11 часов утра до 448 нмоль / л в 12 часов вечера, т. Е. Увеличение на 155 нмоль / л в течение 1 часа. часЭто колебание уровня P 4 присутствовало даже при том, что s-LH был ниже уровня обнаружения в течение дня (Рисунок A). Увеличение P 4 сопровождалось сопоставимым увеличением E 2 (Рисунок A). Концентрация P 4 в сыворотке в течение 12-часового периода для этого конкретного пациента варьировала от 183 нмоль / л рано утром до 448 нмоль / л в течение дня — таким образом, MAV во время периода исследования Δ265 нмоль / л. У пациента № 6 (медиана P 4 376 нмоль / л) и № 3 (медиана P 4 277 нмоль / л) наблюдалось быстрое повышение уровней P 4 (Δ 70–75 нмоль / л, соответственно). наблюдается в течение всего 15 минут без какой-либо сопутствующей активности ЛГ (ЛГ <0.1 МЕ / л). Для сравнения, у пациента № 7 медиана P 4 составляла всего 36 нмоль / л и наблюдались лишь незначительные колебания в течение дня с уровнями P 4 в диапазоне от 25 до 48 нмоль / л после небольшого обнаруживаемого увеличения секреции ЛГ ( полные дневные значения P 4 см. в таблице).
(A) Дневные изменения среднего лютеинового s-прогестерона и s-LH у пациента № 2. Медиана P 4 = 283 нмоль / л. Максимальная вариация P 4 /12 ч = 265 нмоль / л. (B) Дневные колебания уровней s-прогестерона и s-эстрадиола в средней части лютеина у пациента № 2. Медиана E 2 = 3471 пмоль / л. Максимальная вариация E 2 /12 ч = 1,481 пмоль / л.
Таблица 2
Средне-лютеиновые концентрации прогестерона в сыворотке в дневное время у 10 женщин, перенесших лечение оплодотворением in vitro .
| Пациент | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 8.00.00 | 9.00 | 9.15 | 9.30 | 9.45 | 10.00 | 11.00 | 12.00 | 13.00 | 14.00 | ||||||||||||
| P 4 нмоль / л | 126 | 106 | 91 | 93 | 88 | 97 | 87 | 93 | 99 905 905 905 905 905 905 | 15 стр.м. | 16 часов | 17 часов | 17.15 | 17.30 | 17.45 | 18 часов | 19 часов | 20:00 | 89 (63–126) | ||
| 102 | 89 | 69 | 72 | 78 | 78 | 73 | 67 | 63 | |||||||||||||
| 2 | |||||||||||||||||||||
| Время | 8.00.00 | 9.00 | 10.00 | 10.15 | 10.30 | 10.45 | 11.00 | 12.00 | 13.00 | 14.00 | |||||||||||
| P 4 нмоль / л | 183 | 224 | 283 | 271 | 266 | 283 | 293 | 448 905 905 905 432 905 904 905 905 | 15.00 вечера | 15.15 | 15.30 | 15.45 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 | 283 (183–448) | |||
| 262 | 258 | 345 | 328 | 342 | 331 | 348 | 905 | 905 | 265 | ||||||||||||
| 3 | |||||||||||||||||||||
| Время | 6.00.00 | 7.00 | 7.15 | 7.30 | 7.45 | 8.00 | 9.00 | 10.00 | 11.00 | 12.00 | |||||||||||
| P 4 нмоль / л | 370 | 320 | 323 | 301 | 272 | 347 | 281 | 244 905 905 905 905 905 905 905 905 | 12.15 часов вечера | 12.30 | 12:45 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 277 (225–370) | |||
| 283 | 269 | 277 | 278 | 230 | 225 | 251 | 255 | 255 43 | 255 | 145||||||||||||
| 4 | |||||||||||||||||||||
| Время | 8.00:00 | 8,15 | 8:30 | 8,45 | 9:00 | 10:00 | 11:00 | 12:00 | 13.00 | 14.00 | |||||||||||
| P 4 нмоль / л | 216 | 228 | 224 | 228 | 216 | 226 | 202 | 240 905 905 905 905 905 905 905 | 14.15 часов вечера | 14.30 | 14.45 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 | 213 (171–240) | |||
| 208 | 205 | 200 | 201 | 228 | 204 | 188 | 1905 905 905 43 905 905 905 905 69 | ||||||||||||||
| 5 | |||||||||||||||||||||
| Время | 9.00:00 | 10:00 | 11:00 | 12:00 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | |||||||||||
| P 4 нмоль / л | 131 | 122 | 110 | 119 | 136 | 97 | 92 | 89 | 70 905 905 | 19.00 вечера | 20.00 | 21.00 | 97 (70–136) | ||||||||
| 70 | 96 | 71 | 905 905 | ΔP 4 : 66 | |||||||||||||||||
| 6 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 11.15 | 11.30 | 11.45 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 416 | 296 | 311 | 299 | 365 | 314 | 312 | 314 | 312 | 382 905 905 434 905 905 435 905 435 4 905 434 | 13.15 часов вечера | 13.30 | 13.45 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 376 (275–440) | |
| 416 | 395 | 307 | 275 | 366 | 438 | 395 | 905 434 905 434 905 434 905 434 905 434 165 | ||||||||||||||
| 7 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 12.00 | 13.00 | 14.00 | 15.00 | 16.00 | |||||||||||
| P 4 нмоль / л | 27 | 25 | 32 | 36 | 40 | 39 | 36 | 34 | 29 905 905 905 905 905 905 905 | 17.00 вечера | 18.00 | 19.00 | 36 (25–48) | ||||||||
| 39 | 48 | 37 | 905 905 905 905 905 905 905 905 905 905 905 | ΔP 4 : 23 | |||||||||||||||||
| 8 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 9.15 | 9.30 | 9.45 | 10.00 | 11.00 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 51 | 55 | 50 | 50 | 50 | 49 | 50 | 53 | 59 905 905 42 905 905 905 | 14.00 вечера | 15.00 | 16.00 | 16.15 | 16.30 | 16.45 | 17.00 | 18.00 | 19.00 | 55 (49–62) | ||
| 52 | 53 | 61 | 59 | 60 | 59 | 62 | 58 | 56 13 | |||||||||||||
| 9 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 11.15 | 11.30 | 11.45 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 65 | 64 | 63 | 58 | 52 | 52 | 50 | 51 | 595 905 905 905 905 | 14.00 вечера | 15.00 | 16.00 | 17.00 | 18.00 | 18.15 | 18.30 | 18.45 | 19.00 | 54 (51–65) | ||
| 54 | 58 | 55 | 58 | 56 | 53 | 53 | 53 | 4 14 | |||||||||||||
| 10 | |||||||||||||||||||||
| Время | 7.00 утра | 8,00 утра | 8,15 утра | 8,30 утра | 8,45 утра | 9,00 утра | 10,00 утра | 10,15 утра | 10,30 утра | 10,45 утра | 185 | 178 | 187 | 182 | 181 | 180 | 112 | 108 | 117 | 124 | |
| 11905.00:00 | 12:00 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 161 (108–189) | ||||||||||||
| 122 | 140 | 155 | 153 | 172 | 189 | 18 | 161 146 | 161 | 905 81|||||||||||||
Была положительная корреляция между медианными уровнями P 4 и MAV в P 4 в дневное время ( r Спирмена = 0.9273, p = 0,0001). Величина импульса P 4 и, таким образом, максимальное изменение зависит от средней средне-лютеиновой концентрации P 4 (рисунок). У пациентов со средним значением P 4 > 250 нмоль / л в дневное время наблюдались очень большие колебания уровня P 4 в сыворотке со средним MAV 165 нмоль / л (диапазон 145–265 нмоль / л). Пациенты со средним значением P 4 от 89 до 213 нмоль / л имели среднее значение MAV 68 нмоль / л (диапазон 63–81 нмоль / л), тогда как пациенты с очень низким средне-лютеиновым уровнем P 4 (медиана P 4 <60 нмоль / л) имели довольно постоянные уровни P 4 в сыворотке в течение дня (медиана MAV 14 нмоль / л, диапазон 13–23 нмоль / л).
Максимальный абсолютный разброс s-прогестерона = P 4 максимум — P 4 минимум (нмоль / л) у 10 пациентов, подвергшихся лечению оплодотворением in vitro . Спирмена r = 0,9273, p = 0,0001.
Не было общего общего дневного ритма для P 4 у 10 обследованных женщин, что позволяет предположить, что лютеиновая фаза зависит от пациента. У некоторых пациентов самый высокий уровень гормонов наблюдался утром, у других — днем или ранним вечером (см. Рисунок).Время акрофазы (зенит) P 4 и надира P 4 было до полудня у половины пациентов и после полудня у другой половины пациентов (рисунок).
Время достижения максимальной концентрации P 4 (акрофаза) у 10 женщин, подвергающихся лечению ЭКО. Как видно, у пяти женщин была акрофаза P 4 до полудня и у пяти женщин после полудня. Такая же картина наблюдалась для надира P 4 .
Дневные колебания в сыворотке эстрадиола
Большие колебания средней лютеиновой сыворотки E 2 также наблюдались во время 12-часового отбора проб.У пациента № 2 E 2 увеличился с 3480 до 4664 пмоль / л за 1 час (Δ1 184 нмоль / л) (Рисунок B). У пациентов был индивидуальный максимум E 2 вариации (Max E 2 — Min E 2 ) в течение 12 часов в диапазоне от Δ404 до Δ1,481 пмоль / л. Не было корреляции между медианными уровнями E 2 и MAV в средне-лютеиновой E 2 (Спирмена r = 0,4424, p = 0,20).
Как и ожидалось, P 4 и E 2 , по-видимому, совместно секретируются из CL, демонстрируя аналогичные модели колебаний во времени (рисунок).Пациенты со средним значением P 4 <60 нмоль / л имели E 2 в диапазоне от 541 до 1552 пмоль / л (медиана E 2 1457 пмоль / л), тогда как пациенты со средним значением P 4 от 89 до 213 нмоль / л. У меня были уровни E 2 от 659 до 4884 пмоль / л (медиана E 2 2843 пмоль / л). У пациентов со средним значением P 4 > 250 нмоль / л значение E 2 колебалось от 3471 до 3919 пмоль / л (медиана E 2 3874 пмоль / л). Обнаружилась значимая корреляция между медианными уровнями P 4 и медианными уровнями E 2 во время средней лютеиновой фазы стимулированного цикла ( r Спирмена = 0.8424, p = 0,002).
(A) Дневные изменения среднего лютеинового s-прогестерона и s-эстрадиола у пациента № 10. Медиана P 4 = 161 нмоль / л, медиана E 2 = 3606 пмоль / л. (B) Дневные колебания уровней s-прогестерона и s-эстрадиола в средней части лютеина у пациента № 1. Медиана P 4 = 89 нмоль / л, медиана E 2 = 659 пмоль / л.
Обсуждение
Насколько нам известно, это первое исследование, в котором изучаются возможные дневные изменения секреции P 4 в середине лютеиновой фазы в группе женщин, проходящих лечение ЭКО.
Мы обнаружили, что величина средне-лютеиновых колебаний P 4 после лечения ЭКО зависела от среднего уровня P 4 . Наибольшие вариации P 4 наблюдались у пациентов, у которых медиана P 4 превышала 250 нмоль / л (медиана MAV 165 нмоль / л), тогда как пациенты в группе с низким P 4 (медиана P 4 <60 нмоль) / л) имели относительно постоянные уровни P 4 в течение дня (медиана MAV 14 нмоль / л). Пациенты показали очень индивидуальный паттерн секреции гормонов без какого-либо очевидного общего дневного ритма в секреции P 4 .Сыворотка E 2 показала аналогичные колебания в средней лютеиновой фазе с пациентами, имеющими индивидуальные вариации E 2 в диапазоне от Δ404 до Δ1 481 пмоль / л в течение 12 часов исследования.
В более ранних исследованиях описан весьма изменчивый паттерн секреции P 4 во время средней лютеиновой фазы у женщин, ведущих естественный цикл (15, 19, 20). В этих исследованиях сообщалось о наличии двух различных типов импульсов лютеина P 4 — некоторым предшествовал импульс ЛГ, а другим не сопутствовал ЛГ, наблюдаемым во время покоя гипофиза.Последнее, по-видимому, является результатом автономной секреции P 4 из CL, запускаемой и поддерживаемой внутриовариальными концентрациями E 2 , окситоцина и PGF 2α (21, 22). CL состоит из двух типов стероидогенных клеток, то есть малых лютеиновых клеток (SLC), происходящих из клеток фолликулярной теки, и больших лютеиновых клеток (LLC), происходящих из клеток фолликулярной гранулезы. И маленькие, и большие элементы обладают большой производительностью для производства P 4 .Более того, обе клетки обладают уникальными стероидогенными функциями, и «двухклеточный» механизм биосинтеза E 2 , по-видимому, действует в человеческом CL аналогично преовуляторному фолликулу (23). Таким образом, LLC содержат P450-ароматазу, необходимую для синтеза E 2 , тогда как SLC экспрессируют P450c17 для продукции андрогенов (24, 25). Оба типа лютеиновых клеток экспрессируют рецепторы E 2 (26), а стимуляция E 2 является мощным триггером высвобождения P 4 из любого типа клеток (27).
Выделение больших и SLC из желтого тела человека показало, что, будучи индуцированными пиком LH, LLC демонстрируют наибольшую базальную продукцию P 4 (28) и что эта продукция не увеличивается при дальнейшей стимуляции LH (29). LLC продуцируют P 4 с постоянной скоростью и являются доминирующим источником P 4 во время ранней лютеиновой фазы (30). В течение этого периода уровни P 4 демонстрируют непульсирующий паттерн как в естественном (15), так и в стимулированном цикле (OPU + 2) (31).Чувствительность SLC к LH / hCG развивается во время ранней средней лютеиновой фазы, когда клетки отвечают выраженным увеличением секреции P 4 в ответ на импульсы LH. Вклад лютеинового P 4 от SLC увеличивается во время средней и поздней лютеиновой фазы, во время которой секреция P 4 становится очень пульсирующей (32).
Таким образом, эндогенный средне-лютеиновый уровень P 4 состоит из трех частей: базальная продукция P 4 LLC, импульсы P 4 от SLC, запускаемые гипофизарным ЛГ, и автономные P 4 колебания, не зависящие от лютеотрофных раздражителей.
Ранее Wuttke et al. предложили модель, объясняющую независимые от ЛГ колебания уровней P 4 в средней части лютеина, основанные на аутокринных и паракринных механизмах в лютеиновой ткани (21). При стимуляции ЛГ во время средней лютеиновой фазы SLC начинают секрецию P 4 , а также андростендиона — последний впоследствии превращается в E 2 в LLC под действием P450-ароматазы. Повышенная концентрация E 2 действует аутокринным образом в LLC, увеличивая высвобождение как P 4 , так и окситоцина.Окситоцин стимулирует фибробласты к высвобождению PGF 2α , который, в свою очередь, стимулирует дальнейшую секрецию окситоцина, а также секрецию E 2 лютеиновыми клетками. Изолированный эффект окситоцина и PGF 2α на линии лютеиновых клеток представляет собой снижение секреции P 4 , но этот эффект перекрывается сопутствующим повышением E 2 , которое вызывает выраженное высвобождение P 4 . Таким образом, импульс ЛГ будет стимулировать внутрилютеиновый контур, включающий ауто- и паракринные эффекты E 2 , окситоцина, PGF 2α — и, возможно, множество других регуляторных пептидов, т.е.е., Вещество P — и конечный эффект — генерация импульса P 4 . Этот контур функционирует часами без дальнейшей гонадотропной поддержки, таким образом генерируя несколько импульсов P 4 с постепенно уменьшающейся амплитудой, пока следующий импульс LH не запустит внутри лютеиновый цикл E 2 / P 4 снова. Напротив, у женщин с гипоталамической недостаточностью с подавленным уровнем ЛГ и отсутствием импульсов ЛГ средний лютеиновый P 4 показывает непульсирующий характер, подчеркивая необходимость начальной высокой нагрузки ЛГ / ХГЧ для запуска цепи P 4 (21).Вызванное окситоцином высвобождение P 4 можно предотвратить обработкой CL тамоксифеном — агентом, блокирующим рецепторы эстрогена — подчеркивая регуляцию E 2 автономных импульсов P 4 (27). Этот независимый внутрилютеиновый генератор импульсов P 4 может служить дополнительным механизмом биологической безопасности, предотвращающим снижение уровней P 4 между импульсами ЛГ, и может объяснять функцию значительной продукции E 2 во время лютеиновой фазы у людей.
В цикле стимулированного ЭКО импульсы ЛГ отсутствуют в середине лютеиновой фазы, а уровни ЛГ в сыворотке явно подавлены (33). Болюс ХГЧ, вводимый для индукции овуляции или поддержки лютеиновой фазы, оказывает тонизирующее и постоянное раздражение лютеиновой ткани из-за длительного периода полувыведения ХГЧ и, следовательно, не может объяснить быстрые колебания P 4 , наблюдаемые в середине лютеиновая фаза в данном исследовании. Стандартная вагинальная добавка P 4 достигает устойчивого состояния во время ранней лютеиновой фазы и способствует удивительно постоянному уровню P 4 в сыворотке крови в течение всего дня, несмотря на многократные ежедневные вагинальные дозы (34).Таким образом, очень большие колебания уровня P 4 в сыворотке, наблюдаемые в настоящем исследовании, вероятно, являются результатом автономного внутриовариального цикла P 4 . Это дополнительно подчеркивается тем фактом, что пики P 4 сопровождаются сопутствующими подъемами E 2 , а экзогенный E 2 не был обеспечен как часть поддержки лютеиновой фазы.
Нам не удалось обнаружить общую картину секреции P 4 в дневное время у 10 обследованных пациентов.Пик и надир уровня P 4 у разных пациентов наблюдались в разное время, а курс гормонов в течение дня демонстрировал сугубо индивидуальные ритмы. Это согласуется с исследованиями, проведенными в середине лютеиновой фазы естественного цикла (3, 19). В исследовании семи женщин, изучавшихся в течение 24 часов в середине лютеиновой фазы естественного цикла, акрофаза P 4 изменялась с 10.31 до 23.33. (16). Из-за отсутствия суточного воспроизводимого шаблона для средне-лютеинового P 4 в цикле ЭКО точность измерения P 4 не улучшается за счет фиксированного времени забора крови и, таким образом, измерения P 4 можно провести в любое время в часы работы клиники.
В течение естественного цикла оба уровня поздних фолликулов E 2 , диаметр фолликула во время овуляции, а также площадь под кривой выброса ЛГ плохо коррелируют с уровнем P 4 последующей лютеиновой фазы (3). Таким образом, прогнозирование пациентов с недостаточным уровнем лютеина P 4 затруднительно на основании развития фолликулов, поскольку аномальные лютеиновые фазы можно увидеть в циклах, характеризующихся нормальным фолликулогенезом (35). В настоящем исследовании у двух пациентов с самыми низкими уровнями P 4 (36 и 55 нмоль / л) в день OPU было 17 и 19 фолликулов, соответственно, что показывает, что большое количество CL не гарантирует высокий уровень P 4 Выход в лютеиновой фазе.По этой причине мониторинг лютеиновой фазы P 4 может иметь значение для выявления пациентов с низким уровнем P 4 , которым может помочь дополнительная экзогенная терапия P 4 . Тем не менее, предварительным условием для легкого мониторинга лютеиновой фазы является то, что достоверность одного измеренного значения P 4 является надежным и дает разумную оценку емкости ХЛ пациента.
Мы признаем, что небольшой размер выборки этого исследования может ограничить обоснованность общих интерпретаций.Тем не менее, мы считаем это предварительное исследовательское исследование новаторским в рамках фундаментальных исследований и, что немаловажно, первым исследованием средне-лютеиновых колебаний P 4 при различных типах циклов ЭКО. Автономные LH-независимые выбросы P 4 из яичников во время средней лютеиновой фазы наблюдались для обоих типов аналогов GnRH (антагонист GnRH и протокол длительного GnRHa), а также после различных типов запуска окончательного созревания ооцитов (hCG или GnRH). агонист). Таким образом, кажется, что эти автономные эпизодические лютеиновые пики P 4 генерируются независимо от выбора схемы лечения и, следовательно, могут также применяться к другим протоколам стимуляции ЭКО.
Заключение
На основании 10 женщин, обследованных в этом исследовании, мы заявляем, что точность единичного измерения прогестерона в средне-лютеиновой сыворотке как приблизительного среднего уровня P 4 в течение дня зависит от концентрации P 4 и что женщины с низким уровнем P 4 (P 4 <60 нмоль / л) демонстрируют клинически стабильные уровни P 4 в дневное время. Таким образом, единичное измерение P 4 у пациента с низким уровнем прогестерона довольно точно отражает функцию CL, и измеренное низкое значение P 4 , следовательно, можно рассматривать как «истинно низкое значение».Будущие исследования должны прояснить, может ли дополнительная экзогенная поддержка P 4 , вводимая группе пациентов с низким лютеиновым P 4 , улучшить репродуктивный результат.
Доступность данных
Необработанные данные, подтверждающие заключение этой рукописи, будут предоставлены авторами без излишних оговорок любому квалифицированному исследователю.
Заявление об этике
Исследование было проведено в соответствии с Хельсинкской декларацией о медицинских исследованиях и одобрено местным комитетом по этике Центрального региона Дании.Все пациенты дали письменное информированное согласие на участие в исследовании.
Вклад авторов
LT разработал и провел исследование. LT подготовил рукопись, а Великобритания, Калифорния и PH — все внесли свой вклад в интерпретацию данных и критически рассмотрели рукопись. Все соавторы приняли окончательный вариант.
Заявление о конфликте интересов
LT получил неограниченный исследовательский грант от Ferring Pharmaceuticals вне рамок этой работы. PH получила неограниченные исследовательские гранты от MSD, Merck и Ferring Pharmaceuticals, а также гонорары за лекции от MSD, Merck и Finox вне рамок этой работы.Великобритания получила гонорары за лекции от MSD и Ferring Pharmaceuticals, помимо этой работы. CA получила неограниченные исследовательские гранты от MSD, IBSA и Ferring Pharmaceuticals, а также гонорары за лекции от MSD и IBSA вне рамок этой работы.
Благодарности
Авторы хотели бы поблагодарить участвующих пациентов клиники репродуктивной медицины в Скиве, Дания, которые любезно использовали свое время, чтобы сделать это исследование возможным.
Сноски
Финансирование. Грант от «Фонда медицинских исследований региона Центральной Дании» и «Исследовательского фонда больницы Центральной Ютландии» поддержал проведение этого исследования. Финансирующие организации не участвовали ни в проведении исследования, ни в написании научного отчета.
Ссылки
1. Wiltbank MC, Salih SM, Atli MO, Luo W., Bormann CL, Ottobre JS, et al. Сравнение эндокринных и клеточных механизмов, регулирующих желтое тело приматов и жвачных животных.Anim Reprod (2012) 9 (3): 242–59. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Россманиф В.Г., Лафлин Г.А., Мортола Дж.Ф., Йен СС. Секреторная динамика эстрадиола (E2) и прогестерона (P4) в периоды относительного покоя гипофизарного ЛГ в средней ягодичной фазе менструального цикла. Clin Endocrinol (Oxf) (1990) 32 (1): 13–23.10.1111 / j.1365-2265.1990.tb03745.x [PubMed] [CrossRef] [Google Scholar] 3. Соулз М.Р., Клифтон Д.К., Штайнер Р.А., Коэн Н.Л., Бремнер В.Дж. Желтое тело: детерминанты секреции прогестерона в нормальном менструальном цикле.Obstet Gynecol (1988) 71 (5): 659–66. [PubMed] [Google Scholar] 4. Humaidan P, Bungum L, Bungum M, Hald F, Agerholm I, Blaabjerg J и др. Репродуктивные результаты с использованием антагониста ГнРГ (Цетрореликс) для лютеолиза и фолликулярной синхронизации у пациентов с плохим ответом на ЭКО / ИКСИ, получавших гибкий протокол антагонистов ГнРГ. Reprod Biomed Online (2005) 11 (6): 679–84.10.1016 / S1472-6483 (10) 61685-9 [PubMed] [CrossRef] [Google Scholar] 5. Humaidan P, Ejdrup Bredkjaer H, Westergaard LG, Yding Andersen C.1500 МЕ хорионического гонадотропина человека, вводимого при извлечении ооцитов, восстанавливают лютеиновую фазу, когда агонист гонадотропин-рилизинг-гормона используется для индукции овуляции: проспективное, рандомизированное, контролируемое исследование. Fertil Steril (2010) 93 (3): 847–54.10.1016 / j.fertnstert.2008.12.042 [PubMed] [CrossRef] [Google Scholar] 6. Йдинг Андерсен К., Вилбур Андерсен К. Улучшение лютеиновой фазы после стимуляции яичников: обзор новых возможностей. Reprod Biomed Online (2014) 28 (5): 552–9.10.1016 / j.rbmo.2014.01.012 [PubMed] [CrossRef] [Google Scholar] 7. Блейк Э.Дж., Норрис П.М., Дорфман С.Ф., Лонгстрет Дж., Янков В.И.. Одно- и многодозовое фармакокинетическое исследование вагинального микронизированного прогестерона (эндометрина) по сравнению с вагинальным гелем у здоровых женщин репродуктивного возраста. Fertil Steril (2010) 94 (4): 1296–301.10.1016 / j.fertnstert.2009.06.014 [PubMed] [CrossRef] [Google Scholar] 10. Хумайдан П., Полизос Н.П., Альсбьерг Б., Эрб К., Миккельсен А.Л., Эльбаек Х.О. и др. Триггер ГнРГ и индивидуальная поддержка ХГЧ в лютеиновой фазе в соответствии с реакцией яичников на стимуляцию: два проспективных рандомизированных контролируемых многоцентровых исследования у пациенток ЭКО.Hum Reprod (2013) 28 (9): 2511–21.10.1093 / humrep / det249 [PubMed] [CrossRef] [Google Scholar] 11. Ниманн Х., Захер Б., Эльзессер Ф. Частота наступления беременности относительно уровней прогестерона в плазме реципиента в день нехирургического переноса замороженных / размороженных эмбрионов крупного рогатого скота. Териогенология (1985) 23 (4): 631–9.10.1016 / 0093-691X (85)-9 [PubMed] [CrossRef] [Google Scholar] 12. Ногейра М.Ф., Мело Д.С., Карвалью Л.М., Fuck EJ, Тринка Л.А., Баррос С.М. Уменьшают ли высокие концентрации прогестерона частоту наступления беременности у реципиентов-эмбрионов, синхронизированных с PGF2alpha и eCG? Териогенология (2004) 61 (7–8): 1283–90.10.1016 / j.theriogenology.2003.07.012 [PubMed] [CrossRef] [Google Scholar] 13. Йович Дж. Л., Консейсао Дж. Л., Стангер Дж. Д., Хинчлифф П. М., Кин К. Н.. Средне-лютеиновые концентрации прогестерона в сыворотке определяют скорость имплантации криоконсервированных переносов эмбрионов, проводимых в условиях заместительной гормональной терапии. Reprod Biomed Online (2015) 31 (2): 180–91.10.1016 / j.rbmo.2015.05.005 [PubMed] [CrossRef] [Google Scholar] 14. Labarta E, Mariani G, Holtmann N, Celada P, Remohi J, Bosch E. Низкий уровень прогестерона в сыворотке в день переноса эмбриона связан с уменьшением продолжающейся беременности в циклах донорства ооцитов после искусственной подготовки эндометрия: проспективное исследование.Hum Reprod (2017) 32 (12): 2437–42.10.1093 / humrep / dex316 [PubMed] [CrossRef] [Google Scholar] 15. Филикори М., Батлер Дж. П., Кроули В. Ф., младший. Нейроэндокринная регуляция желтого тела у человека. Доказательства пульсирующей секреции прогестерона. J. Clin Invest (1984) 73 (6): 1638–47.10.1172 / JCI111370 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Велдхейс Дж. Д., Кристиансен Э., Эванс В. С., Колп Л. А., Рогол А. Д., Джонсон М. Л.. Физиологические профили эпизодического высвобождения прогестерона во время средней ягодичной фазы менструального цикла человека: анализ циркадных и ультрадианных ритмов, дискретных свойств пульса и корреляции с одновременным высвобождением лютеинизирующего гормона.J. Clin Endocrinol Metab (1988) 66 (2): 414–21.10.1210 / jcem-66-2-414 [PubMed] [CrossRef] [Google Scholar] 17. Reame N, Sauder SE, Kelch RP, Marshall JC. Пульсирующая секреция гонадотропина во время менструального цикла человека: данные об изменении частоты секреции гонадотропин-рилизинг-гормона. J. Clin Endocrinol Metab (1984) 59 (2): 328–37.10.1210 / jcem-59-2-328 [PubMed] [CrossRef] [Google Scholar] 18. Tavaniotou A, Albano C, Smitz J, Devroey P. Сравнение концентраций ЛГ в ранней и средней лютеиновой фазе в циклах ЭКО после лечения только ГМГ или в сочетании с антагонистом ГнРГ Цетрореликсом.Hum Reprod (2001) 16 (4): 663–7.10.1093 / humrep / 16.4.663 [PubMed] [CrossRef] [Google Scholar] 19. Фудзимото В.Ю., Клифтон Д.К., Коэн Н.Л., Соулз МР. Вариабельность уровней пролактина и прогестерона в сыворотке крови у здоровых женщин: важность измерения одного гормона в клинических условиях. Obstet Gynecol (1990) 76 (1): 71–8. [PubMed] [Google Scholar] 20. Россманиф В.Г., Лафлин Г.А., Мортола Дж. Ф., Джонсон М.Л., Велдхейс Дж. Д., Йен СС. Пульсирующая секреция эстрадиола и прогестерона в средней ягодичной фазе желтого тела: временная связь с импульсами лютеинизирующего гормона.J. Clin Endocrinol Metab (1990) 70 (4): 990–5.10.1210 / jcem-70-4-990 [PubMed] [CrossRef] [Google Scholar] 21. Wuttke W, Theiling K, Hinney B, Pitzel L. Регулирование производства стероидов и его функция в желтом теле. Стероиды (1998) 63 (5–6): 299–305.10.1016 / S0039-128X (98) 00037-3 [PubMed] [CrossRef] [Google Scholar] 22. Bah MM, Acosta TJ, Pilawski W, Deptula K, Okuda K, Skarzynski DJ. Роль простагландина F (2альфа), прогестерона и окситоцина в базальном и пульсирующем высвобождении прогестерона из развивающегося желтого тела крупного рогатого скота.Простагландины — другие липидные средства (2006) 79 (3–4): 218–29.10.1016 / j.prostaglandins.2006.01.002 [PubMed] [CrossRef] [Google Scholar] 23. Фиш Б., Маргара Р. А., Уинстон Р. М., Хиллиер С. Г.. Клеточные основы лютеинового стероидогенеза в яичнике человека. J Endocrinol (1989) 122 (1): 303–11.10.1677 / joe.0.1220303 [PubMed] [CrossRef] [Google Scholar] 24. Мэйбин JA, Дункан WC. Желтое тело человека: какие клетки имеют рецепторы прогестерона? Репродукция (2004) 128 (4): 423–31.10.1530 / rep.1.00051 [PubMed] [CrossRef] [Google Scholar] 25.Девото Л., Фуэнтес А., Коэн П., Сеспедес П., Паломино А., Поммер Р. и др. Желтое тело человека: жизненный цикл и функции в естественных циклах. Fertil Steril (2009) 92 (3): 1067–79.10.1016 / j.fertnstert.2008.07.1745 [PubMed] [CrossRef] [Google Scholar] 26. ван ден Дрише С., Смит В. М., Майерс М., Дункан В. Экспрессия и регуляция рецепторов эстрогена в желтом теле человека. Репродукция (2008) 135 (4): 509–17.10.1530 / REP-07-0427 [PubMed] [CrossRef] [Google Scholar] 27. Маас С., Джарри Х., Тайхманн А., Рат В., Кун В., Вуттке В.Паракринное действие окситоцина, простагландина F2 альфа и эстрадиола в желтом теле человека. J. Clin Endocrinol Metab (1992) 74 (2): 306–12.10.1210 / jc.74.2.306 [PubMed] [CrossRef] [Google Scholar] 28. Friden BE, Hagstrom H, Lindblom B, Sjoblom P, Wallin A, Brannstrom M, et al. Характеристики клеток и функции двух обогащенных фракций пролонгированных лютеиновых клеток человека. Мол Хум Репрод (1999) 5 (8): 714–9.10.1093 / мольхр / 5.8.714 [PubMed] [CrossRef] [Google Scholar] 29. Охара А., Мори Т., Тайи С., Бан С., Наримото К.Функциональная дифференциация в стероидогенезе двух типов лютеиновых клеток, выделенных из зрелых желтых тел человека менструального цикла. J. Clin Endocrinol Metab (1987) 65 (6): 1192–200.10.1210 / jcem-65-6-1192 [PubMed] [CrossRef] [Google Scholar] 30. Джонс Г.С. Желтое тело: состав и функции. Fertil Steril (1990) 54 (1): 21–6.10.1016 / S0015-0282 (16) 53630-9 [PubMed] [CrossRef] [Google Scholar] 31. Tannus S, Burke Y, McCartney CR, Kol S. Запуск агониста GnRH для окончательного созревания ооцитов в циклах ЭКО-антагониста GnRH вызывает снижение частоты и амплитуды пульса LH в ранней лютеиновой фазе: возможный механизм лютеолиза.Gynecol Endocrinol (2017) 5: 1–5.10.1080 / 0Изменение уровня прогестерона в сыворотке в дневное время в средней лютеиновой фазе у женщин, подвергающихся Экстракорпоральное оплодотворение
Фронт-эндокринол (Лозанна).2018; 9: 92.
Lise Haaber Thomsen
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Отделение клинической медицины, Орхусский университет, Орхус, Дания
Ulrik Schiøler Kesmodel 9007
Клиника репродуктивной медицины, больница Херлев, Херлев, Дания
4 Кафедра клинической медицины, Копенгагенский университет, Копенгаген, Дания
Клаус Йдинг Андерсен
5 Лаборатория репродуктивной биологии, Женский центр Джулиан Мари, Дети и репродукция, Университетская больница Копенгагена, Копенгагенский университет, Копенгаген, Дания
Питер Хумайдан
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Департамент клинической медицины, Орхусский университет, Орхус , Дания
1 Клиника репродуктивной медицины, Региональная больница Скиве, Скиве, Дания
2 Кафедра клинической медицины, Орхусский университет, Орхус, Дания
3 Клиника репродуктивной медицины, больница Херлев, Херлев, Дания
4 Кафедра клинической медицины Копенгагенского университета, Копенгаген, Дания
5 Лаборатория репродуктивной биологии, Центр женщин, детей и репродукции Джулиан Мари, Университетская больница Копенгагена, Университет Копенгагена, Копенгаген, Дания
Отредактировал: Sandro C.Эстевес, Андроферт, Клиника андрологии и репродукции человека, Бразилия
Рецензент: Эвангелос Г. Папаниколау, Университет Аристотеля в Салониках, Греция; Джон Луи Йович, Медицинский центр Пивет, Австралия
Специальный раздел: Эта статья была отправлена в репродукцию, раздел журнала «Границы эндокринологии»
Поступила в редакцию 17 декабря 2017 г .; Принято 26 февраля 2018 г.
Copyright © 2018 Thomsen, Kesmodel, Andersen and Humaidan.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (CC BY).Использование, распространение или воспроизведение на других форумах разрешено при условии указания автора (авторов) и правообладателя и ссылки на оригинальную публикацию в этом журнале в соответствии с принятой академической практикой. Запрещается использование, распространение или воспроизведение без соблюдения этих условий.
Эта статья цитируется в других статьях в PMC.- Заявление о доступности данных
Необработанные данные, подтверждающие заключение этой рукописи, будут предоставлены авторами без необоснованных оговорок любому квалифицированному исследователю.
Реферат
Цель
Изучить, проявляет ли средне-лютеиновый прогестерон сыворотки (P 4 ) значительные колебания в течение 12-часового дневного периода у женщин, перенесших оплодотворение in vitro (ЭКО), и выяснить, могут ли Степень этих колебаний может повлиять на интерпретацию уровней лютеинового прогестерона в клинических условиях.
Дизайн
Пилотно-разведочное исследование.
Учреждение
Отделение репродуктивной медицины при государственной больнице.
Пациенты
Десять женщин проходят курс ЭКО.
Вмешательство
Через семь дней после забора ооцитов у пациентов часто проводился повторный забор крови (каждые 60 минут в течение 12 часов и в течение двух из этих часов каждые 15 минут). Образцы сыворотки крови анализировали на прогестерон, эстрадиол и лютеинизирующий гормон (ЛГ).
Основные критерии оценки результатов
Дневные колебания s-прогестерона и s-эстрадиола.
Результаты
Наблюдалась значимая положительная корреляция между медианными уровнями P 4 и величиной вариаций P 4 — женщины со средним значением P 4 <60 нмоль / л имели клинически стабильные уровни P 4 на протяжении всего периода исследования. день, в то время как пациенты со средним значением P 4 > 250 нмоль / л демонстрировали периодические пики P 4 в несколько сотен наномолей на литр.Эти эндогенные колебания P 4 наблюдались независимо от типа протокола стимуляции или режима запуска окончательного созревания ооцитов и несмотря на тот факт, что LH был ниже предела обнаружения во время измерения. Одновременно наблюдались большие колебания s-эстрадиола.
Заключение
Мониторинг раннего и среднего лютеинового уровня P 4 в циклах ЭКО может быть ценным при планировании индивидуальной поддержки лютеиновой фазы в попытке улучшить репродуктивные результаты.Однако предварительным условием для мониторинга лютеиновой фазы является достоверность единственного измеренного значения P 4 . Мы впервые показываем, что одно измерение P 4 у пациента с низким уровнем прогестерона достаточно точно отражает функцию желтого тела и что это измерение может быть использовано для выявления пациентов с ЭКО, которым необходимо дополнительное введение экзогенного лютеина P 4 .
Ключевые слова: сывороточный прогестерон, in vitro оплодотворение , сывороточный эстрадиол, лютеиновая фаза, дневная вариация
Введение
Желтое тело человека (ХТ) является транзиторной эндокринной железой яичников, которая активна во время лютеиновой фазы менструальный цикл и на ранних сроках беременности до 8 недели гестации.CL производит значительные количества прогестерона (P 4 ), эстрадиола (E 2 ) и андрогенов, а также факторов роста и нестероидных гормонов. Общее поддержание функции CL критически зависит от регулярной стимуляции лютеинизирующим гормоном гипофиза (ЛГ) или хорионическим гонадотропином человека (ХГЧ) для поддержания стероидогенеза лютеинизированной гранулезой и клетками теки (1). Достаточное производство P 4 из CL является абсолютной необходимостью для децидуализации эндометрия перед имплантацией и установления ранней беременности.Секреция прогестерона из КЛ максимальна в середине лютеиновой фазы, вызывая в естественном цикле сывороточный уровень P 4 примерно 40–60 нмоль / л (2, 3).
Во время стимуляции яичников для in vitro оплодотворение (ЭКО) получают надфизиологические уровни E 2 во время поздней фолликулярной фазы в результате мультифолликулярного роста. Это гиперэстрогенное состояние должно уравновешиваться в лютеиновой фазе повышенной нагрузкой P 4 для достижения восприимчивого эндометрия к моменту переноса эмбриона.Ранее Хумайдан и его коллеги показали, что использование триггера агониста ГнРГ в циклах ЭКО с последующей поддержкой стандартной вагинальной лютеиновой фазы приводило к среднему лютеиновому уровню P 4 , сравнимому с уровнями, наблюдаемыми в естественном цикле (39 нмоль / л). (4). Однако, в отличие от того, что ожидалось, этот уровень P 4 был слишком низким для обеспечения успешной имплантации и беременности, в результате чего частота продолжающихся беременностей при ЭКО составила только 6%. Таким образом, подчеркивая тот факт, что потребность в P 4 во время лютеиновой фазы стимулированного цикла больше, чем у естественного цикла.Когда поддержка лютеиновой фазы была изменена путем добавления болюса 1500 МЕ ХГЧ в день извлечения ооцитов, срединно-лютеиновый уровень P 4 запускаемого цикла GnRHa увеличился до 74 нмоль / л, в результате чего скорость доставки составила 24%. за перевод (5). Похоже, что пороговое значение P 4 в средне-лютеиновой сыворотке составляет примерно 80–100 нмоль / л после лечения ЭКО с последующим переносом свежего эмбриона, и что этот порог должен быть превышен для обеспечения успешного репродуктивного результата (6).Традиционная поддержка лютеиновой фазы в циклах искусственного ЭКО с введением микронизированного влагалища P 4 индуцирует уровень P 4 в лютеиновой сыворотке примерно 40 нмоль / л (7–9). Таким образом, существенная дополнительная эндогенная продукция P 4 CL является обязательной для превышения порогового значения P 4 , чтобы впоследствии оптимизировать вероятность беременности после лечения ЭКО. Традиционно врачи не контролируют уровни P 4 в лютеиновой фазе, будучи твердо уверены, что поддержка лютеиновой фазы покроет потребность цикла в P 4 .Однако ранее мы видели, что более 25% пациентов ЭКО в группе, запускаемой как ХГЧ, так и ГнРГ, имеют средне-лютеиновую сыворотку P 4 ниже 60 нмоль / л, несмотря на поддержку лютеиновой фазы и тот факт, что у них было более 14 фолликулы в день аспирации (10). Кроме того, данные не относящихся к человеку видов (11, 12) и данные циклов замораживания / оттаивания эмбрионов человека (13, 14) показали, что существует оптимальный диапазон лютеинового P 4 и что исход беременности снижается не только ниже, но и выше этого оптимального уровня P 4 .Так ли это и после ЭКО и переноса свежих эмбрионов, еще предстоит выяснить. В этом случае мониторинг уровней лютеина P 4 может помочь улучшить репродуктивный результат в циклах ЭКО, позволяя индивидуализировать лечение на основе измерений P 4 в сыворотке.
Однако измерения среднего лютеинового P 4 осложняются пульсирующим характером секреции гормона из CL. Filicori с соавторами (15) показали, что концентрации P 4 в плазме демонстрируют большие и быстрые колебания в течение средней лютеиновой фазы у женщин, ведущих естественный цикл.Таким образом, уровни P 4 варьировались от значений всего 7 нмоль / л до пиков 128 нмоль / л в течение нескольких минут в течение 24-часового периода исследования. В естественном цикле существуют два различных типа импульсов P 4 во время средней лютеиновой фазы: импульсы, которым предшествует импульс LH, и другие, возникающие во время покоя LH; последнее является результатом автономной секреции стероидов CL независимо от активности ЛГ. Во время средней лютеиновой фазы стимулированного цикла ЭКО гипофиз подавляется отрицательной обратной связью с надфизиологическими уровнями стероидов, и s-LH значительно снижается до уровней намного ниже (0.5–0,7 МЕ / л), чем в середине лютеиновой фазы естественного цикла (5–7 МЕ / л) (16–18). Как эта пониженная пульсовая активность ЛГ влияет на секреторный паттерн стероидогенеза яичников в середине лютеиновой фазы цикла ЭКО, до сих пор неизвестно.
Настоящее исследование было проведено для изучения того, демонстрируют ли уровни P 4 в средне-лютеиновой сыворотке в цикле ЭКО такой же высокопульсирующий паттерн, как в естественном цикле, зная, что пульсовая активность ЛГ заметно снижена.С клинической точки зрения мы хотели выяснить, обеспечивает ли однократное утреннее измерение P 4 надежный показатель средне-лютеиновой функции ХЛ после ЭКО.
Материалы и методы
Популяция исследования
Десять пациенток, перенесших ЭКО / ИКСИ в клинике репродуктивной медицины в Скиве, Дания, с декабря 2014 г. по декабрь 2015 г. добровольно вызвались принять участие в исследовании. Регистрировалась клиническая информация, касающаяся возраста, индекса массы тела (ИМТ), привычек курения, биохимического репродуктивного профиля, причины бесплодия, предыдущих попыток ЭКО, курса стимуляции и лабораторных результатов.Исходные характеристики участников представлены в таблице. Письменное информированное согласие было получено от всех пациентов до участия в исследовании. Участники были выбраны так, чтобы они представляли как длинный цикл агонистов GnRH, так и цикл антагонистов GnRH, и различные типы запуска для окончательного созревания ооцитов (hCG или агонист GnRH).
Таблица 1
Описание демографических данных, стимуляции яичников, поддержки лютеиновой фазы и уровней прогестерона у исследуемых пациенток.
| Пациент | Возраст (лет) | Индекс массы тела (кг / м 2 ) | Базальный ФСГ (МЕ / л) | Причина бесплодия | Протокол | Общая сумма ФСГ (МЕ) | Продолжительность стимуляции ФСГ (дни) | Триггер овуляции | Поддержка лютеиновой фазы | No.фолликулов> 14 мм | Кол-во ооцитов | Кол-во MII | Средне-лютеиновый P 4 (нмоль / л) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 38 | 24,4 | 6,5 905 Мужской фактор | Long GnRHa | 3,225 | 11 | ХГЧ 10 000 МЕ | Лютинус 300 мг ежедневно | 5 | 5 | 1 | 89 | 26 | Отсутствие мужского партнера / эндометриоз | Антагонист ГнРГ | 1,725 | 9 | Супрефакт 0,5 мг | Лютинус 300 мг в день + 1500 ХГЧ (OPU) + 1000 ХГЧ (OPU + 5) | 10 | 10 | 283 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 39 | 30,0 | 6,4 | Отсутствует партнер-мужчина | Long GnRHa | 3,450 | 12 | Ivitrelle | Ivitrelle 90 мг / сутки 12 | 12 | 277 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 34 | 22.2 | 14,7 | Необъяснимый | Длинный ГнРГ | 3,600 | 12 | ХГЧ 10 000 МЕ | Лутинус 300 мг ежедневно | 9 | 8 | 905 905 905 905 905 905 905 905 19,95,9 | Мужской фактор | Long GnRHa | 2,925 | 11 | ХГЧ 10 000 МЕ | Лютинус 300 мг в день | 9 | 6 | 905 | 25.3 | 8,3 | Необъяснимый | Long GnRHa | 3,600 | 12 | Овитрелл 6,500 МЕ | Лутинус 300 мг ежедневно | 11 | 841 | 905 905 905 905 905 905 905 905 905 31,83,9 | Эндометриоз | Антагонист ГнРГ | 2,025 | 9 | Супрефакт 0,5 мг | Кринон 180 ежедневно + 1,500 ХГЧ (OPU) | 17 | 11 905 43 17 | 11 905 43 17 | 11 905 43 17 | 11 905 | 36 | 25.6 | 4,9 | Тубальный фактор | Антагонист ГнРГ | 1,913 | 9 | Супрефакт 0,5 мг | Кринон 180 ежедневно + 1,500 ХГЧ (OPU) | 19 | 13 905 9 | 40 | 34,5 | 7,2 | Необъяснимая | Long GnRHa | 2,250 | 9 | hCG 10,000 IU | Lutinus 300 мг ежедневно | 905 905 | 7 905 10 | 36 | 29.4 | 7,2 | Мужской фактор | Антагонист ГнРГ | 3,938 | 15 | Супрефакт 0,5 мг | Лютинус 300 мг в день + 1000 ХГЧ (OPU) + 500 (OPU + 5) | 14 905 8 | 161 |
Протоколы стимуляции яичников
Шесть пациентов лечились в рамках длительного цикла агонистов гонадолиберин с подавлением гипофиза с помощью подкожной инъекции бусерелина 0,8 мг (Suprefact ® ; Sanofi, Дания), начиная с середины 20-го века. лютеиновая фаза предыдущего цикла.Суточная доза бусерелина 0,4 мг вводилась до дня, предшествующего началу овуляции. На 2-й день цикла было проведено трансвагинальное ультразвуковое исследование, и в случае толщины эндометрия <4 мм началась стимуляция яичников с помощью корифоллитропина-альфа (Elonva ® ; MSD, Дания) в сочетании с любым r-ФСГ. / рЛГ (Pergoveris ® ; Merck Biopharma, Дания) или чМГ (Menopur ® , Ferring Pharmaceuticals, Дания). Дозировка гонадотропина определялась индивидуально на основании возраста пациента, ИМТ, исходного уровня ФСГ, предыдущей реакции на гонадотропины и количества антральных фолликулов и корректировалась путем мониторинга размера фолликулов с помощью трансвагинального ультразвукового исследования во время лечения.Окончательное созревание ооцитов индуцировали либо 10000 МЕ п / к ХГЧ (прегнил ® , MSD, Дания), либо п / к 6 500 МЕ (Ovitrelle ® , Merck Biopharma, Дания), когда два или более ведущих фолликула достигли среднего диаметра 17 мм. Забор ооцитов проводили через 36 ч после введения ХГЧ. Процедуры ЭКО / ИКСИ и культивирование эмбрионов проводились в соответствии с обычной клинической практикой. На 3 или 5 день после извлечения ооцитов было перенесено не более двух эмбрионов. Поддержка лютеиновой фазы вводилась в виде микронизированного влагалища P 4 (Lutinus ® 300 мг в день, Ferring Pharmaceutical, Дания или Crinone ® 180 мг в день, Merck Biopharma, Дания), начиная с 1 дня после забора ооцитов (OPU) .
У четырех пациентов использовался протокол антагонистов ГнРГ. На 2 день цикла началась стимуляция яичников с помощью r-FSH (Gonal-F ® ; Merck Biopharma, Дания) или hMG (Menopur ® , Ferring Pharmaceuticals, Дания) после ультразвукового исследования влагалища. Ежедневная совместная обработка антагонистами ГнРГ (Оргалутран ® 0,25 мг / день, MSD, Дания) добавлялась при размере фолликула 12 мм. Дозу ФСГ подбирали индивидуально в соответствии с ответом яичников. Окончательное созревание ооцитов индуцировали SC Buserelin 0.5 мг (Suprefact ® ; Sanofi, Дания) при наличии двух или более фолликулов размером ≥17 мм. Забор ооцитов проводили через 36 часов. Максимум два эмбриона были перенесены на 3 или 5 день после OPU. Поддержка лютеиновой фазы проводилась по индивидуальному режиму, состоящему из вагинального введения 300 мг микронизированного P 4 ежедневно (Lutinus ® , Ferring Pharmaceuticals, Дания) в сочетании с болюсным введением ХГЧ (1000–1500 МЕ) в день приема. извлечение ооцитов (5, 10).В зависимости от индивидуальной реакции яичников на стимуляцию некоторым пациентам вводили дополнительный болюс ХГЧ на OPU + 5 (500–1000 МЕ) (10). См. Подробную информацию в таблице. Вагинальное введение P 4 продолжалось до дня тестирования на беременность (триггер ХГЧ) или до седьмой недели гестации (триггер ГнРГ).
Забор крови
Забор крови проводился в середине лютеиновой фазы, то есть через 7 дней после OPU (OPU + 7). Пациенты были доставлены в отделение репродуктивной медицины рано утром и оставались в клинике в течение последующих 12 часов.Время начала забора крови для всех пациентов было с 6 до 9 часов утра. В течение периода исследования участникам была разрешена нормальная повседневная деятельность.
Внутривенную канюлю вводили в вену в антекубитальной ямке, и образцы крови (4 мл) отбирали каждые 60 минут в течение 12 часов ( n = 10) и в течение двух из этих часов каждые 15 минут ( n = 8 из-за затрудненного венозного доступа у двух пациентов). После коагуляции при комнатной температуре образцы крови центрифугировали, выделяли сыворотку и хранили при -80 ° C до анализа.
Измерение гормонов
Сыворотка P 4 (нмоль / л), E 2 (пмоль / л) и концентрации ЛГ (МЕ / л) измеряли с помощью автоматизированных электрохемилюминесцентных иммуноанализов (Cobas ® Modular analytics E170 , Roche Diagnostics, Швейцария) обычно используется для анализа в отделении биохимии региональной больницы Выборга, Дания. Все измерения были выполнены в соответствии с инструкциями производителя с использованием имеющегося в продаже набора для хемилюминесцентного иммуноанализа, предназначенного для измерений в сыворотке.
Предел обнаружения гормонов составлял 0,2 нмоль / л, 18,4 пмоль / л и 0,1 МЕ / л для P 4 , E 2 и ЛГ соответственно. Все образцы сыворотки от каждого пациента были измерены в рамках одного цикла анализа. Все концентрации гормонов, превышающие предел обнаружения анализа, измеряли в двух экземплярах. Все коэффициенты вариации для P 4 , E 2 и LH были ниже 4%.
Статистика
Данные представлены в виде среднего значения ± стандартное отклонение или медианы и диапазона, когда это необходимо.Максимальное абсолютное изменение (MAV) в сыворотке P 4 за 12-часовой период дается как максимальная концентрация P 4 — минимальная концентрация P 4 во время отбора проб для каждого пациента.
Коэффициент корреляции Спирмена ( r ) был рассчитан для корреляции медианного уровня стероидов с максимальным абсолютным изменением гормона в течение дня (MAV). Значение p <0,05 считалось статистически значимым. Все анализы были выполнены с использованием STATA версии 13.
Результаты
Характеристики пациентов
Пациенты имели средний возраст 35,3 ± 4,2 года, средний ИМТ 26,6 ± 4,7 кг / м 2 и 1,9 ± 2,0 до попыток ЭКО. Средний уровень ФСГ для всех пациентов составил 6,55 МЕ / л (межквартильный размах 5,9; 7,2 МЕ / л). Все участники были некурящими. У четырех пациентов причиной бесплодия была не женщина (мужской фактор или отсутствие партнера-мужчины), у трех пациентов причина была женщина (трубный фактор или эндометриоз), а у трех пациентов причина бесплодия была идиопатической (необъяснимой).См. Подробную информацию в таблице.
Общие значения средне-лютеинового прогестерона
У трех пациентов средний уровень средне-лютеинового P 4 был ниже 60 нмоль / л. Двое из этих пациентов (№7 и №8) были запущены агонистом ГнРГ и получили поддержку лютеиновой фазы с помощью 1500 МЕ ХГЧ (OPU) и вагинального P 4 (Кринон 180 мг в день). Несмотря на то, что в день OPU было извлечено 19 и 17 фолликулов размером ≥ 14 мм и 11-13 зрелых ооцитов, они показали средне-лютеиновый P 4 всего 55 и 36 нмоль / л соответственно.Другой пациент (№ 9) с P 4 <60 нмоль / л был запущен с помощью 10000 МЕ ХГЧ и имел семь фолликулов> 14 мм в день аспирации.
Общие средне-лютеиновые значения ЛГ
Ни у одного из пациентов с пониженной регуляцией по протоколу длинного агониста ГнРГ ( n = 6) уровни s-LH превышали предел обнаружения анализа в любой момент во время измерения (т. Е. LH < 0,1 МЕ / л). У трех из четырех пациентов, стимулированных по протоколу антагониста ГнРГ, наблюдалась умеренная импульсная активность ЛГ с амплитудами ЛГ от 0.От 2 до 2,8 ЕД / л. У всех пациентов за пиком ЛГ следовало повышение P 4 в сыворотке от 4 до 36 нмоль / л.
Дневные колебания сывороточного прогестерона
Как видно во время естественного цикла, большие колебания среднего лютеинового P 4 также присутствовали в дневное время у некоторых женщин, подвергающихся лечению ЭКО (рисунок). Колебания лютеиновых стероидов наблюдались независимо от выбора протокола стимуляции, режима окончательного созревания ооцитов и типа поддержки лютеиновой фазы.
Индивидуальные профили прогестерона в средне-лютеиновой сыворотке в течение 12-часового интервала у 10 пациентов, подвергшихся контролируемой стимуляции яичников для лечения оплодотворением in vitro .
Наибольшая вариация уровней P 4 наблюдалась у пациентов со средним значением P 4 > 250 нмоль / л. У пациента № 2 со средним значением P 4 , равным 283 нмоль / л, значение P 4 колебалось от 293 нмоль / л в 11 часов утра до 448 нмоль / л в 12 часов вечера, т. Е. Увеличение на 155 нмоль / л в течение 1 часа. часЭто колебание уровня P 4 присутствовало даже при том, что s-LH был ниже уровня обнаружения в течение дня (Рисунок A). Увеличение P 4 сопровождалось сопоставимым увеличением E 2 (Рисунок A). Концентрация P 4 в сыворотке в течение 12-часового периода для этого конкретного пациента варьировала от 183 нмоль / л рано утром до 448 нмоль / л в течение дня — таким образом, MAV во время периода исследования Δ265 нмоль / л. У пациента № 6 (медиана P 4 376 нмоль / л) и № 3 (медиана P 4 277 нмоль / л) наблюдалось быстрое повышение уровней P 4 (Δ 70–75 нмоль / л, соответственно). наблюдается в течение всего 15 минут без какой-либо сопутствующей активности ЛГ (ЛГ <0.1 МЕ / л). Для сравнения, у пациента № 7 медиана P 4 составляла всего 36 нмоль / л и наблюдались лишь незначительные колебания в течение дня с уровнями P 4 в диапазоне от 25 до 48 нмоль / л после небольшого обнаруживаемого увеличения секреции ЛГ ( полные дневные значения P 4 см. в таблице).
(A) Дневные изменения среднего лютеинового s-прогестерона и s-LH у пациента № 2. Медиана P 4 = 283 нмоль / л. Максимальная вариация P 4 /12 ч = 265 нмоль / л. (B) Дневные колебания уровней s-прогестерона и s-эстрадиола в средней части лютеина у пациента № 2. Медиана E 2 = 3471 пмоль / л. Максимальная вариация E 2 /12 ч = 1,481 пмоль / л.
Таблица 2
Средне-лютеиновые концентрации прогестерона в сыворотке в дневное время у 10 женщин, перенесших лечение оплодотворением in vitro .
| Пациент | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 8.00.00 | 9.00 | 9.15 | 9.30 | 9.45 | 10.00 | 11.00 | 12.00 | 13.00 | 14.00 | ||||||||||||
| P 4 нмоль / л | 126 | 106 | 91 | 93 | 88 | 97 | 87 | 93 | 99 905 905 905 905 905 905 | 15 стр.м. | 16 часов | 17 часов | 17.15 | 17.30 | 17.45 | 18 часов | 19 часов | 20:00 | 89 (63–126) | ||
| 102 | 89 | 69 | 72 | 78 | 78 | 73 | 67 | 63 | |||||||||||||
| 2 | |||||||||||||||||||||
| Время | 8.00.00 | 9.00 | 10.00 | 10.15 | 10.30 | 10.45 | 11.00 | 12.00 | 13.00 | 14.00 | |||||||||||
| P 4 нмоль / л | 183 | 224 | 283 | 271 | 266 | 283 | 293 | 448 905 905 905 432 905 904 905 905 | 15.00 вечера | 15.15 | 15.30 | 15.45 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 | 283 (183–448) | |||
| 262 | 258 | 345 | 328 | 342 | 331 | 348 | 905 | 905 | 265 | ||||||||||||
| 3 | |||||||||||||||||||||
| Время | 6.00.00 | 7.00 | 7.15 | 7.30 | 7.45 | 8.00 | 9.00 | 10.00 | 11.00 | 12.00 | |||||||||||
| P 4 нмоль / л | 370 | 320 | 323 | 301 | 272 | 347 | 281 | 244 905 905 905 905 905 905 905 905 | 12.15 часов вечера | 12.30 | 12:45 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 277 (225–370) | |||
| 283 | 269 | 277 | 278 | 230 | 225 | 251 | 255 | 255 43 | 255 | 145||||||||||||
| 4 | |||||||||||||||||||||
| Время | 8.00:00 | 8,15 | 8:30 | 8,45 | 9:00 | 10:00 | 11:00 | 12:00 | 13.00 | 14.00 | |||||||||||
| P 4 нмоль / л | 216 | 228 | 224 | 228 | 216 | 226 | 202 | 240 905 905 905 905 905 905 905 | 14.15 часов вечера | 14.30 | 14.45 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 20.00 | 213 (171–240) | |||
| 208 | 205 | 200 | 201 | 228 | 204 | 188 | 1905 905 905 43 905 905 905 905 69 | ||||||||||||||
| 5 | |||||||||||||||||||||
| Время | 9.00:00 | 10:00 | 11:00 | 12:00 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | |||||||||||
| P 4 нмоль / л | 131 | 122 | 110 | 119 | 136 | 97 | 92 | 89 | 70 905 905 | 19.00 вечера | 20.00 | 21.00 | 97 (70–136) | ||||||||
| 70 | 96 | 71 | 905 905 | ΔP 4 : 66 | |||||||||||||||||
| 6 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 11.15 | 11.30 | 11.45 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 416 | 296 | 311 | 299 | 365 | 314 | 312 | 314 | 312 | 382 905 905 434 905 905 435 905 435 4 905 434 | 13.15 часов вечера | 13.30 | 13.45 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 376 (275–440) | |
| 416 | 395 | 307 | 275 | 366 | 438 | 395 | 905 434 905 434 905 434 905 434 905 434 165 | ||||||||||||||
| 7 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 12.00 | 13.00 | 14.00 | 15.00 | 16.00 | |||||||||||
| P 4 нмоль / л | 27 | 25 | 32 | 36 | 40 | 39 | 36 | 34 | 29 905 905 905 905 905 905 905 | 17.00 вечера | 18.00 | 19.00 | 36 (25–48) | ||||||||
| 39 | 48 | 37 | 905 905 905 905 905 905 905 905 905 905 905 | ΔP 4 : 23 | |||||||||||||||||
| 8 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 9.15 | 9.30 | 9.45 | 10.00 | 11.00 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 51 | 55 | 50 | 50 | 50 | 49 | 50 | 53 | 59 905 905 42 905 905 905 | 14.00 вечера | 15.00 | 16.00 | 16.15 | 16.30 | 16.45 | 17.00 | 18.00 | 19.00 | 55 (49–62) | ||
| 52 | 53 | 61 | 59 | 60 | 59 | 62 | 58 | 56 13 | |||||||||||||
| 9 | |||||||||||||||||||||
| Время | 7.00.00 | 8.00 | 9.00 | 10.00 | 11.00 | 11.15 | 11.30 | 11.45 | 12.00 | 13.00 | |||||||||||
| P 4 нмоль / л | 65 | 64 | 63 | 58 | 52 | 52 | 50 | 51 | 595 905 905 905 905 | 14.00 вечера | 15.00 | 16.00 | 17.00 | 18.00 | 18.15 | 18.30 | 18.45 | 19.00 | 54 (51–65) | ||
| 54 | 58 | 55 | 58 | 56 | 53 | 53 | 53 | 4 14 | |||||||||||||
| 10 | |||||||||||||||||||||
| Время | 7.00 утра | 8,00 утра | 8,15 утра | 8,30 утра | 8,45 утра | 9,00 утра | 10,00 утра | 10,15 утра | 10,30 утра | 10,45 утра | 185 | 178 | 187 | 182 | 181 | 180 | 112 | 108 | 117 | 124 | |
| 11905.00:00 | 12:00 | 13.00 | 14.00 | 15.00 | 16.00 | 17.00 | 18.00 | 19.00 | 161 (108–189) | ||||||||||||
| 122 | 140 | 155 | 153 | 172 | 189 | 18 | 161 146 | 161 | 905 81|||||||||||||
Была положительная корреляция между медианными уровнями P 4 и MAV в P 4 в дневное время ( r Спирмена = 0.9273, p = 0,0001). Величина импульса P 4 и, таким образом, максимальное изменение зависит от средней средне-лютеиновой концентрации P 4 (рисунок). У пациентов со средним значением P 4 > 250 нмоль / л в дневное время наблюдались очень большие колебания уровня P 4 в сыворотке со средним MAV 165 нмоль / л (диапазон 145–265 нмоль / л). Пациенты со средним значением P 4 от 89 до 213 нмоль / л имели среднее значение MAV 68 нмоль / л (диапазон 63–81 нмоль / л), тогда как пациенты с очень низким средне-лютеиновым уровнем P 4 (медиана P 4 <60 нмоль / л) имели довольно постоянные уровни P 4 в сыворотке в течение дня (медиана MAV 14 нмоль / л, диапазон 13–23 нмоль / л).
Максимальный абсолютный разброс s-прогестерона = P 4 максимум — P 4 минимум (нмоль / л) у 10 пациентов, подвергшихся лечению оплодотворением in vitro . Спирмена r = 0,9273, p = 0,0001.
Не было общего общего дневного ритма для P 4 у 10 обследованных женщин, что позволяет предположить, что лютеиновая фаза зависит от пациента. У некоторых пациентов самый высокий уровень гормонов наблюдался утром, у других — днем или ранним вечером (см. Рисунок).Время акрофазы (зенит) P 4 и надира P 4 было до полудня у половины пациентов и после полудня у другой половины пациентов (рисунок).
Время достижения максимальной концентрации P 4 (акрофаза) у 10 женщин, подвергающихся лечению ЭКО. Как видно, у пяти женщин была акрофаза P 4 до полудня и у пяти женщин после полудня. Такая же картина наблюдалась для надира P 4 .
Дневные колебания в сыворотке эстрадиола
Большие колебания средней лютеиновой сыворотки E 2 также наблюдались во время 12-часового отбора проб.У пациента № 2 E 2 увеличился с 3480 до 4664 пмоль / л за 1 час (Δ1 184 нмоль / л) (Рисунок B). У пациентов был индивидуальный максимум E 2 вариации (Max E 2 — Min E 2 ) в течение 12 часов в диапазоне от Δ404 до Δ1,481 пмоль / л. Не было корреляции между медианными уровнями E 2 и MAV в средне-лютеиновой E 2 (Спирмена r = 0,4424, p = 0,20).
Как и ожидалось, P 4 и E 2 , по-видимому, совместно секретируются из CL, демонстрируя аналогичные модели колебаний во времени (рисунок).Пациенты со средним значением P 4 <60 нмоль / л имели E 2 в диапазоне от 541 до 1552 пмоль / л (медиана E 2 1457 пмоль / л), тогда как пациенты со средним значением P 4 от 89 до 213 нмоль / л. У меня были уровни E 2 от 659 до 4884 пмоль / л (медиана E 2 2843 пмоль / л). У пациентов со средним значением P 4 > 250 нмоль / л значение E 2 колебалось от 3471 до 3919 пмоль / л (медиана E 2 3874 пмоль / л). Обнаружилась значимая корреляция между медианными уровнями P 4 и медианными уровнями E 2 во время средней лютеиновой фазы стимулированного цикла ( r Спирмена = 0.8424, p = 0,002).
(A) Дневные изменения среднего лютеинового s-прогестерона и s-эстрадиола у пациента № 10. Медиана P 4 = 161 нмоль / л, медиана E 2 = 3606 пмоль / л. (B) Дневные колебания уровней s-прогестерона и s-эстрадиола в средней части лютеина у пациента № 1. Медиана P 4 = 89 нмоль / л, медиана E 2 = 659 пмоль / л.
Обсуждение
Насколько нам известно, это первое исследование, в котором изучаются возможные дневные изменения секреции P 4 в середине лютеиновой фазы в группе женщин, проходящих лечение ЭКО.
Мы обнаружили, что величина средне-лютеиновых колебаний P 4 после лечения ЭКО зависела от среднего уровня P 4 . Наибольшие вариации P 4 наблюдались у пациентов, у которых медиана P 4 превышала 250 нмоль / л (медиана MAV 165 нмоль / л), тогда как пациенты в группе с низким P 4 (медиана P 4 <60 нмоль) / л) имели относительно постоянные уровни P 4 в течение дня (медиана MAV 14 нмоль / л). Пациенты показали очень индивидуальный паттерн секреции гормонов без какого-либо очевидного общего дневного ритма в секреции P 4 .Сыворотка E 2 показала аналогичные колебания в средней лютеиновой фазе с пациентами, имеющими индивидуальные вариации E 2 в диапазоне от Δ404 до Δ1 481 пмоль / л в течение 12 часов исследования.
В более ранних исследованиях описан весьма изменчивый паттерн секреции P 4 во время средней лютеиновой фазы у женщин, ведущих естественный цикл (15, 19, 20). В этих исследованиях сообщалось о наличии двух различных типов импульсов лютеина P 4 — некоторым предшествовал импульс ЛГ, а другим не сопутствовал ЛГ, наблюдаемым во время покоя гипофиза.Последнее, по-видимому, является результатом автономной секреции P 4 из CL, запускаемой и поддерживаемой внутриовариальными концентрациями E 2 , окситоцина и PGF 2α (21, 22). CL состоит из двух типов стероидогенных клеток, то есть малых лютеиновых клеток (SLC), происходящих из клеток фолликулярной теки, и больших лютеиновых клеток (LLC), происходящих из клеток фолликулярной гранулезы. И маленькие, и большие элементы обладают большой производительностью для производства P 4 .Более того, обе клетки обладают уникальными стероидогенными функциями, и «двухклеточный» механизм биосинтеза E 2 , по-видимому, действует в человеческом CL аналогично преовуляторному фолликулу (23). Таким образом, LLC содержат P450-ароматазу, необходимую для синтеза E 2 , тогда как SLC экспрессируют P450c17 для продукции андрогенов (24, 25). Оба типа лютеиновых клеток экспрессируют рецепторы E 2 (26), а стимуляция E 2 является мощным триггером высвобождения P 4 из любого типа клеток (27).
Выделение больших и SLC из желтого тела человека показало, что, будучи индуцированными пиком LH, LLC демонстрируют наибольшую базальную продукцию P 4 (28) и что эта продукция не увеличивается при дальнейшей стимуляции LH (29). LLC продуцируют P 4 с постоянной скоростью и являются доминирующим источником P 4 во время ранней лютеиновой фазы (30). В течение этого периода уровни P 4 демонстрируют непульсирующий паттерн как в естественном (15), так и в стимулированном цикле (OPU + 2) (31).Чувствительность SLC к LH / hCG развивается во время ранней средней лютеиновой фазы, когда клетки отвечают выраженным увеличением секреции P 4 в ответ на импульсы LH. Вклад лютеинового P 4 от SLC увеличивается во время средней и поздней лютеиновой фазы, во время которой секреция P 4 становится очень пульсирующей (32).
Таким образом, эндогенный средне-лютеиновый уровень P 4 состоит из трех частей: базальная продукция P 4 LLC, импульсы P 4 от SLC, запускаемые гипофизарным ЛГ, и автономные P 4 колебания, не зависящие от лютеотрофных раздражителей.
Ранее Wuttke et al. предложили модель, объясняющую независимые от ЛГ колебания уровней P 4 в средней части лютеина, основанные на аутокринных и паракринных механизмах в лютеиновой ткани (21). При стимуляции ЛГ во время средней лютеиновой фазы SLC начинают секрецию P 4 , а также андростендиона — последний впоследствии превращается в E 2 в LLC под действием P450-ароматазы. Повышенная концентрация E 2 действует аутокринным образом в LLC, увеличивая высвобождение как P 4 , так и окситоцина.Окситоцин стимулирует фибробласты к высвобождению PGF 2α , который, в свою очередь, стимулирует дальнейшую секрецию окситоцина, а также секрецию E 2 лютеиновыми клетками. Изолированный эффект окситоцина и PGF 2α на линии лютеиновых клеток представляет собой снижение секреции P 4 , но этот эффект перекрывается сопутствующим повышением E 2 , которое вызывает выраженное высвобождение P 4 . Таким образом, импульс ЛГ будет стимулировать внутрилютеиновый контур, включающий ауто- и паракринные эффекты E 2 , окситоцина, PGF 2α — и, возможно, множество других регуляторных пептидов, т.е.е., Вещество P — и конечный эффект — генерация импульса P 4 . Этот контур функционирует часами без дальнейшей гонадотропной поддержки, таким образом генерируя несколько импульсов P 4 с постепенно уменьшающейся амплитудой, пока следующий импульс LH не запустит внутри лютеиновый цикл E 2 / P 4 снова. Напротив, у женщин с гипоталамической недостаточностью с подавленным уровнем ЛГ и отсутствием импульсов ЛГ средний лютеиновый P 4 показывает непульсирующий характер, подчеркивая необходимость начальной высокой нагрузки ЛГ / ХГЧ для запуска цепи P 4 (21).Вызванное окситоцином высвобождение P 4 можно предотвратить обработкой CL тамоксифеном — агентом, блокирующим рецепторы эстрогена — подчеркивая регуляцию E 2 автономных импульсов P 4 (27). Этот независимый внутрилютеиновый генератор импульсов P 4 может служить дополнительным механизмом биологической безопасности, предотвращающим снижение уровней P 4 между импульсами ЛГ, и может объяснять функцию значительной продукции E 2 во время лютеиновой фазы у людей.
В цикле стимулированного ЭКО импульсы ЛГ отсутствуют в середине лютеиновой фазы, а уровни ЛГ в сыворотке явно подавлены (33). Болюс ХГЧ, вводимый для индукции овуляции или поддержки лютеиновой фазы, оказывает тонизирующее и постоянное раздражение лютеиновой ткани из-за длительного периода полувыведения ХГЧ и, следовательно, не может объяснить быстрые колебания P 4 , наблюдаемые в середине лютеиновая фаза в данном исследовании. Стандартная вагинальная добавка P 4 достигает устойчивого состояния во время ранней лютеиновой фазы и способствует удивительно постоянному уровню P 4 в сыворотке крови в течение всего дня, несмотря на многократные ежедневные вагинальные дозы (34).Таким образом, очень большие колебания уровня P 4 в сыворотке, наблюдаемые в настоящем исследовании, вероятно, являются результатом автономного внутриовариального цикла P 4 . Это дополнительно подчеркивается тем фактом, что пики P 4 сопровождаются сопутствующими подъемами E 2 , а экзогенный E 2 не был обеспечен как часть поддержки лютеиновой фазы.
Нам не удалось обнаружить общую картину секреции P 4 в дневное время у 10 обследованных пациентов.Пик и надир уровня P 4 у разных пациентов наблюдались в разное время, а курс гормонов в течение дня демонстрировал сугубо индивидуальные ритмы. Это согласуется с исследованиями, проведенными в середине лютеиновой фазы естественного цикла (3, 19). В исследовании семи женщин, изучавшихся в течение 24 часов в середине лютеиновой фазы естественного цикла, акрофаза P 4 изменялась с 10.31 до 23.33. (16). Из-за отсутствия суточного воспроизводимого шаблона для средне-лютеинового P 4 в цикле ЭКО точность измерения P 4 не улучшается за счет фиксированного времени забора крови и, таким образом, измерения P 4 можно провести в любое время в часы работы клиники.
В течение естественного цикла оба уровня поздних фолликулов E 2 , диаметр фолликула во время овуляции, а также площадь под кривой выброса ЛГ плохо коррелируют с уровнем P 4 последующей лютеиновой фазы (3). Таким образом, прогнозирование пациентов с недостаточным уровнем лютеина P 4 затруднительно на основании развития фолликулов, поскольку аномальные лютеиновые фазы можно увидеть в циклах, характеризующихся нормальным фолликулогенезом (35). В настоящем исследовании у двух пациентов с самыми низкими уровнями P 4 (36 и 55 нмоль / л) в день OPU было 17 и 19 фолликулов, соответственно, что показывает, что большое количество CL не гарантирует высокий уровень P 4 Выход в лютеиновой фазе.По этой причине мониторинг лютеиновой фазы P 4 может иметь значение для выявления пациентов с низким уровнем P 4 , которым может помочь дополнительная экзогенная терапия P 4 . Тем не менее, предварительным условием для легкого мониторинга лютеиновой фазы является то, что достоверность одного измеренного значения P 4 является надежным и дает разумную оценку емкости ХЛ пациента.
Мы признаем, что небольшой размер выборки этого исследования может ограничить обоснованность общих интерпретаций.Тем не менее, мы считаем это предварительное исследовательское исследование новаторским в рамках фундаментальных исследований и, что немаловажно, первым исследованием средне-лютеиновых колебаний P 4 при различных типах циклов ЭКО. Автономные LH-независимые выбросы P 4 из яичников во время средней лютеиновой фазы наблюдались для обоих типов аналогов GnRH (антагонист GnRH и протокол длительного GnRHa), а также после различных типов запуска окончательного созревания ооцитов (hCG или GnRH). агонист). Таким образом, кажется, что эти автономные эпизодические лютеиновые пики P 4 генерируются независимо от выбора схемы лечения и, следовательно, могут также применяться к другим протоколам стимуляции ЭКО.
Заключение
На основании 10 женщин, обследованных в этом исследовании, мы заявляем, что точность единичного измерения прогестерона в средне-лютеиновой сыворотке как приблизительного среднего уровня P 4 в течение дня зависит от концентрации P 4 и что женщины с низким уровнем P 4 (P 4 <60 нмоль / л) демонстрируют клинически стабильные уровни P 4 в дневное время. Таким образом, единичное измерение P 4 у пациента с низким уровнем прогестерона довольно точно отражает функцию CL, и измеренное низкое значение P 4 , следовательно, можно рассматривать как «истинно низкое значение».Будущие исследования должны прояснить, может ли дополнительная экзогенная поддержка P 4 , вводимая группе пациентов с низким лютеиновым P 4 , улучшить репродуктивный результат.
Доступность данных
Необработанные данные, подтверждающие заключение этой рукописи, будут предоставлены авторами без излишних оговорок любому квалифицированному исследователю.
Заявление об этике
Исследование было проведено в соответствии с Хельсинкской декларацией о медицинских исследованиях и одобрено местным комитетом по этике Центрального региона Дании.Все пациенты дали письменное информированное согласие на участие в исследовании.
Вклад авторов
LT разработал и провел исследование. LT подготовил рукопись, а Великобритания, Калифорния и PH — все внесли свой вклад в интерпретацию данных и критически рассмотрели рукопись. Все соавторы приняли окончательный вариант.
Заявление о конфликте интересов
LT получил неограниченный исследовательский грант от Ferring Pharmaceuticals вне рамок этой работы. PH получила неограниченные исследовательские гранты от MSD, Merck и Ferring Pharmaceuticals, а также гонорары за лекции от MSD, Merck и Finox вне рамок этой работы.Великобритания получила гонорары за лекции от MSD и Ferring Pharmaceuticals, помимо этой работы. CA получила неограниченные исследовательские гранты от MSD, IBSA и Ferring Pharmaceuticals, а также гонорары за лекции от MSD и IBSA вне рамок этой работы.
Благодарности
Авторы хотели бы поблагодарить участвующих пациентов клиники репродуктивной медицины в Скиве, Дания, которые любезно использовали свое время, чтобы сделать это исследование возможным.
Сноски
Финансирование. Грант от «Фонда медицинских исследований региона Центральной Дании» и «Исследовательского фонда больницы Центральной Ютландии» поддержал проведение этого исследования. Финансирующие организации не участвовали ни в проведении исследования, ни в написании научного отчета.
Ссылки
1. Wiltbank MC, Salih SM, Atli MO, Luo W., Bormann CL, Ottobre JS, et al. Сравнение эндокринных и клеточных механизмов, регулирующих желтое тело приматов и жвачных животных.Anim Reprod (2012) 9 (3): 242–59. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Россманиф В.Г., Лафлин Г.А., Мортола Дж.Ф., Йен СС. Секреторная динамика эстрадиола (E2) и прогестерона (P4) в периоды относительного покоя гипофизарного ЛГ в средней ягодичной фазе менструального цикла. Clin Endocrinol (Oxf) (1990) 32 (1): 13–23.10.1111 / j.1365-2265.1990.tb03745.x [PubMed] [CrossRef] [Google Scholar] 3. Соулз М.Р., Клифтон Д.К., Штайнер Р.А., Коэн Н.Л., Бремнер В.Дж. Желтое тело: детерминанты секреции прогестерона в нормальном менструальном цикле.Obstet Gynecol (1988) 71 (5): 659–66. [PubMed] [Google Scholar] 4. Humaidan P, Bungum L, Bungum M, Hald F, Agerholm I, Blaabjerg J и др. Репродуктивные результаты с использованием антагониста ГнРГ (Цетрореликс) для лютеолиза и фолликулярной синхронизации у пациентов с плохим ответом на ЭКО / ИКСИ, получавших гибкий протокол антагонистов ГнРГ. Reprod Biomed Online (2005) 11 (6): 679–84.10.1016 / S1472-6483 (10) 61685-9 [PubMed] [CrossRef] [Google Scholar] 5. Humaidan P, Ejdrup Bredkjaer H, Westergaard LG, Yding Andersen C.1500 МЕ хорионического гонадотропина человека, вводимого при извлечении ооцитов, восстанавливают лютеиновую фазу, когда агонист гонадотропин-рилизинг-гормона используется для индукции овуляции: проспективное, рандомизированное, контролируемое исследование. Fertil Steril (2010) 93 (3): 847–54.10.1016 / j.fertnstert.2008.12.042 [PubMed] [CrossRef] [Google Scholar] 6. Йдинг Андерсен К., Вилбур Андерсен К. Улучшение лютеиновой фазы после стимуляции яичников: обзор новых возможностей. Reprod Biomed Online (2014) 28 (5): 552–9.10.1016 / j.rbmo.2014.01.012 [PubMed] [CrossRef] [Google Scholar] 7. Блейк Э.Дж., Норрис П.М., Дорфман С.Ф., Лонгстрет Дж., Янков В.И.. Одно- и многодозовое фармакокинетическое исследование вагинального микронизированного прогестерона (эндометрина) по сравнению с вагинальным гелем у здоровых женщин репродуктивного возраста. Fertil Steril (2010) 94 (4): 1296–301.10.1016 / j.fertnstert.2009.06.014 [PubMed] [CrossRef] [Google Scholar] 10. Хумайдан П., Полизос Н.П., Альсбьерг Б., Эрб К., Миккельсен А.Л., Эльбаек Х.О. и др. Триггер ГнРГ и индивидуальная поддержка ХГЧ в лютеиновой фазе в соответствии с реакцией яичников на стимуляцию: два проспективных рандомизированных контролируемых многоцентровых исследования у пациенток ЭКО.Hum Reprod (2013) 28 (9): 2511–21.10.1093 / humrep / det249 [PubMed] [CrossRef] [Google Scholar] 11. Ниманн Х., Захер Б., Эльзессер Ф. Частота наступления беременности относительно уровней прогестерона в плазме реципиента в день нехирургического переноса замороженных / размороженных эмбрионов крупного рогатого скота. Териогенология (1985) 23 (4): 631–9.10.1016 / 0093-691X (85)-9 [PubMed] [CrossRef] [Google Scholar] 12. Ногейра М.Ф., Мело Д.С., Карвалью Л.М., Fuck EJ, Тринка Л.А., Баррос С.М. Уменьшают ли высокие концентрации прогестерона частоту наступления беременности у реципиентов-эмбрионов, синхронизированных с PGF2alpha и eCG? Териогенология (2004) 61 (7–8): 1283–90.10.1016 / j.theriogenology.2003.07.012 [PubMed] [CrossRef] [Google Scholar] 13. Йович Дж. Л., Консейсао Дж. Л., Стангер Дж. Д., Хинчлифф П. М., Кин К. Н.. Средне-лютеиновые концентрации прогестерона в сыворотке определяют скорость имплантации криоконсервированных переносов эмбрионов, проводимых в условиях заместительной гормональной терапии. Reprod Biomed Online (2015) 31 (2): 180–91.10.1016 / j.rbmo.2015.05.005 [PubMed] [CrossRef] [Google Scholar] 14. Labarta E, Mariani G, Holtmann N, Celada P, Remohi J, Bosch E. Низкий уровень прогестерона в сыворотке в день переноса эмбриона связан с уменьшением продолжающейся беременности в циклах донорства ооцитов после искусственной подготовки эндометрия: проспективное исследование.Hum Reprod (2017) 32 (12): 2437–42.10.1093 / humrep / dex316 [PubMed] [CrossRef] [Google Scholar] 15. Филикори М., Батлер Дж. П., Кроули В. Ф., младший. Нейроэндокринная регуляция желтого тела у человека. Доказательства пульсирующей секреции прогестерона. J. Clin Invest (1984) 73 (6): 1638–47.10.1172 / JCI111370 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Велдхейс Дж. Д., Кристиансен Э., Эванс В. С., Колп Л. А., Рогол А. Д., Джонсон М. Л.. Физиологические профили эпизодического высвобождения прогестерона во время средней ягодичной фазы менструального цикла человека: анализ циркадных и ультрадианных ритмов, дискретных свойств пульса и корреляции с одновременным высвобождением лютеинизирующего гормона.J. Clin Endocrinol Metab (1988) 66 (2): 414–21.10.1210 / jcem-66-2-414 [PubMed] [CrossRef] [Google Scholar] 17. Reame N, Sauder SE, Kelch RP, Marshall JC. Пульсирующая секреция гонадотропина во время менструального цикла человека: данные об изменении частоты секреции гонадотропин-рилизинг-гормона. J. Clin Endocrinol Metab (1984) 59 (2): 328–37.10.1210 / jcem-59-2-328 [PubMed] [CrossRef] [Google Scholar] 18. Tavaniotou A, Albano C, Smitz J, Devroey P. Сравнение концентраций ЛГ в ранней и средней лютеиновой фазе в циклах ЭКО после лечения только ГМГ или в сочетании с антагонистом ГнРГ Цетрореликсом.Hum Reprod (2001) 16 (4): 663–7.10.1093 / humrep / 16.4.663 [PubMed] [CrossRef] [Google Scholar] 19. Фудзимото В.Ю., Клифтон Д.К., Коэн Н.Л., Соулз МР. Вариабельность уровней пролактина и прогестерона в сыворотке крови у здоровых женщин: важность измерения одного гормона в клинических условиях. Obstet Gynecol (1990) 76 (1): 71–8. [PubMed] [Google Scholar] 20. Россманиф В.Г., Лафлин Г.А., Мортола Дж. Ф., Джонсон М.Л., Велдхейс Дж. Д., Йен СС. Пульсирующая секреция эстрадиола и прогестерона в средней ягодичной фазе желтого тела: временная связь с импульсами лютеинизирующего гормона.J. Clin Endocrinol Metab (1990) 70 (4): 990–5.10.1210 / jcem-70-4-990 [PubMed] [CrossRef] [Google Scholar] 21. Wuttke W, Theiling K, Hinney B, Pitzel L. Регулирование производства стероидов и его функция в желтом теле. Стероиды (1998) 63 (5–6): 299–305.10.1016 / S0039-128X (98) 00037-3 [PubMed] [CrossRef] [Google Scholar] 22. Bah MM, Acosta TJ, Pilawski W, Deptula K, Okuda K, Skarzynski DJ. Роль простагландина F (2альфа), прогестерона и окситоцина в базальном и пульсирующем высвобождении прогестерона из развивающегося желтого тела крупного рогатого скота.Простагландины — другие липидные средства (2006) 79 (3–4): 218–29.10.1016 / j.prostaglandins.2006.01.002 [PubMed] [CrossRef] [Google Scholar] 23. Фиш Б., Маргара Р. А., Уинстон Р. М., Хиллиер С. Г.. Клеточные основы лютеинового стероидогенеза в яичнике человека. J Endocrinol (1989) 122 (1): 303–11.10.1677 / joe.0.1220303 [PubMed] [CrossRef] [Google Scholar] 24. Мэйбин JA, Дункан WC. Желтое тело человека: какие клетки имеют рецепторы прогестерона? Репродукция (2004) 128 (4): 423–31.10.1530 / rep.1.00051 [PubMed] [CrossRef] [Google Scholar] 25.Девото Л., Фуэнтес А., Коэн П., Сеспедес П., Паломино А., Поммер Р. и др. Желтое тело человека: жизненный цикл и функции в естественных циклах. Fertil Steril (2009) 92 (3): 1067–79.10.1016 / j.fertnstert.2008.07.1745 [PubMed] [CrossRef] [Google Scholar] 26. ван ден Дрише С., Смит В. М., Майерс М., Дункан В. Экспрессия и регуляция рецепторов эстрогена в желтом теле человека. Репродукция (2008) 135 (4): 509–17.10.1530 / REP-07-0427 [PubMed] [CrossRef] [Google Scholar] 27. Маас С., Джарри Х., Тайхманн А., Рат В., Кун В., Вуттке В.Паракринное действие окситоцина, простагландина F2 альфа и эстрадиола в желтом теле человека. J. Clin Endocrinol Metab (1992) 74 (2): 306–12.10.1210 / jc.74.2.306 [PubMed] [CrossRef] [Google Scholar] 28. Friden BE, Hagstrom H, Lindblom B, Sjoblom P, Wallin A, Brannstrom M, et al. Характеристики клеток и функции двух обогащенных фракций пролонгированных лютеиновых клеток человека. Мол Хум Репрод (1999) 5 (8): 714–9.10.1093 / мольхр / 5.8.714 [PubMed] [CrossRef] [Google Scholar] 29. Охара А., Мори Т., Тайи С., Бан С., Наримото К.Функциональная дифференциация в стероидогенезе двух типов лютеиновых клеток, выделенных из зрелых желтых тел человека менструального цикла. J. Clin Endocrinol Metab (1987) 65 (6): 1192–200.10.1210 / jcem-65-6-1192 [PubMed] [CrossRef] [Google Scholar] 30. Джонс Г.С. Желтое тело: состав и функции. Fertil Steril (1990) 54 (1): 21–6.10.1016 / S0015-0282 (16) 53630-9 [PubMed] [CrossRef] [Google Scholar] 31. Tannus S, Burke Y, McCartney CR, Kol S. Запуск агониста GnRH для окончательного созревания ооцитов в циклах ЭКО-антагониста GnRH вызывает снижение частоты и амплитуды пульса LH в ранней лютеиновой фазе: возможный механизм лютеолиза.Gynecol Endocrinol (2017) 5: 1–5.10.1080 / 024 часа в жизни гормона: какое время подходит время для проверки функции гипофиза?
Пульсирующий характер и ритмичный характер секреции гормонов могут иметь важное значение для измерения уровней циркулирующих гормонов.
Поскольку многие больницы в Великобритании переходят на электронные карты пациентов и системы заказов, очень легко щелкнуть предварительно заказанные панели патологии и не останавливаться, чтобы обдумать то, что на самом деле запрашивается. Патологические тесты, проводимые в неподходящее время дня, тратят ресурсы, вызывают неудобства и могут вызвать беспокойство как у медицинских работников, так и у пациентов, пытающихся интерпретировать бесполезные результаты.
Понимание характера секреции гормона гипофиза поможет нам определить оптимальное время для проведения этих исследований.Здесь я обобщаю вопросы, связанные с некоторыми распространенными эндокринными анализами крови, чтобы напоминать «подумайте, прежде чем щелкнуть» при заказе анализов.
ГОРМОН РОСТА
Обычно заказывать произвольный уровень гормона роста (GH) бесполезно; результаты будет сложно интерпретировать. Частые методы отбора проб крови продемонстрировали пульсирующий характер секреции GH с примерно восемью пиками за 24-часовой период, преимущественно в ночное время.Между импульсами концентрация ГР в сыворотке может не определяться. 1
Множество других эндогенных и экзогенных факторов (например, возраст, пол, вес, сон, еда, стресс и упражнения) влияют на сложный регуляторный механизм оси GH. 2,3 Учитывая, что отбор проб в течение 5–20 минут в течение 24 часов нецелесообразен, мы обычно полагаемся на динамическое тестирование для исследования избытка или дефицита GH (пероральный тест на толерантность к глюкозе) или дефицита (например, тест на толерантность к инсулину или стресс-тест на глюкагон).
ТЕСТЫ НА ФУНКЦИЮ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Время проведения флеботомии обычно не учитывается при назначении тестов функции щитовидной железы. Циркадные колебания уровней тиреотропного гормона (ТТГ) хорошо описаны, при этом секреция частично пульсирующая, а частично базальная. Концентрация ТТГ максимальна ночью и минимальна в конце полудня до раннего вечера. 4,5 Несмотря на это, уровни гормонов щитовидной железы не повышаются значительно после ночного всплеска ТТГ, возможно, потому, что ночные молекулы ТТГ менее биологически активны, чем те, которые циркулируют в течение дня. 6
Было показано, что измерение ТТГ в 09.00 сильно коррелирует с общей 24-часовой секрецией ТТГ, взятой с 10-минутными интервалами. 7 Циркадные различия в секреции могут вызывать небольшое изменение уровней ТТГ — в более ранней литературе среднее значение 0,95–2 мМЕ / л — хотя, как правило, это не приводит к выходу значений ТТГ за пределы нормального эталонного диапазона. 8
Таким образом, время взятия пробы ТТГ может иметь значение только в том случае, если решения о лечении основаны на незначительных изменениях уровня ТТГ.
ЖЕНСКИЕ РЕПРОДУКТИВНЫЕ ГОРМОНЫ
Колебания женских репродуктивных гормонов в течение одного дня обычно не учитываются при интерпретации результатов анализов, но эти гормоны действительно проявляют эндогенную циркадную регуляцию. Эстрадиол, прогестерон, фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ) демонстрируют значительные 24-часовые ритмы во время фолликулярной фазы менструального цикла. Напротив, только ФСГ значительно ритмичен во время лютеиновой фазы. Было обнаружено, что гормональные пики происходят утром для прогестерона, днем для ФСГ и ЛГ и ночью для эстрадиола. 9
Эти результаты вряд ли повлияют на время суток, когда мы заказываем измерения женских репродуктивных гормонов. Однако их полезно учитывать при интерпретации результатов тестов наряду с факторами, которые мы регулярно принимаем во внимание, такими как фаза менструального цикла или статус менопаузы.
ТЕСТОСТЕРОН
Секреция тестостерона имеет суточный характер секреции. Пиковые уровни достигаются утром между 07.00 и 10.00, вечером наблюдается спад, а затем уровни снова начинают повышаться ночью. 10 Одно исследование показало, что у молодых мужчин (30–40 лет) средний уровень тестостерона (как свободный, так и общий) составляет 08,00, что на 30–35% выше, чем уровни, измеренные в середине или ближе к вечеру. Эта разница уменьшалась с возрастом, упав примерно до 10% в возрасте 70 лет. 11 Это притупление циркадной ритмики тестостерона при нормальном старении хорошо описано. 12
Отбор проб тестостерона утром может ограничить влияние суточных колебаний, поэтому в настоящее время рекомендуется проверять значение 08.00−09.00 Уровень тестостерона вместе с глобулином, связывающим половые гормоны.
Что касается мониторинга замещения тестостерона, это зависит от используемого продукта. Рекомендации из информационного листа продукта отличаются от клинических рекомендаций. Например, в таблицах продуктов предлагается проверять уровни тестостерона перед нанесением Testogel® и Testim® и через 2 часа после нанесения Tostran®. В клинической практике часто рекомендуется проверять концентрацию тестостерона через 4–6 часов после нанесения.
КОРТИЗОЛ
Хорошо известно, что кортизол имеет циркадный ритм с пиком уровня утром между 08.00 и 09.00 и меньшими вторичными пиками после еды. 13,14 На этот суточный ритм может влиять сон и ночные смены.
С момента появления новых тестов на кортизол мы часто видим низкий уровень кортизола во второй половине дня, и эндокринологов часто просят оценить функцию гипоталамуса, гипофиза и надпочечников (HPA). Хорошее соответствие с 09.00 кортизола в качестве стартера для определения функции HPA, поэтому мы обычно советуем сначала провести стандартизированное измерение кортизола 09.00. 15 Однако, если это не дает ответа, может потребоваться перейти к стимулирующим тестам, таким как синактеновый тест или тест на толерантность к инсулину.
ПРОЛАКТИН
При интерпретации одного образца, показывающего умеренно повышенный уровень пролактина, мы часто принимаем во внимание внешние факторы (например, стресс или прием определенных лекарств), но редко — суточные колебания секреции пролактина.
Пролактин секретируется в циркадном и пульсирующем режиме с большим подъемом в ночное время. Начало сна быстро сопровождается увеличением секреции пролактина, а пробуждение совпадает с немедленным прекращением секреции. 16,17 Следовательно, самые высокие уровни наблюдаются в ранние утренние часы. Образец, взятый первым делом утром, может все еще отражать ночной пик пролактина, а повторение образца позже в тот же день может дать другой результат.
Аннеке Граф , Отделение эндокринологии, Университетский колледж, Лондонские больницы, Фонд NHS Trust
ССЫЛКИ
- Plotkick LP et al. 1975 Журнал клинической эндокринологии и метаболизма 40 240−247.
- Veldheis JD et al. 2008 Эндокринные обзоры 29 823-864.
- Мюррей PG et al. 2015 Эндокринологический журнал 226 T123 − T140.
- Брабант G и др. 1990 Журнал клинической эндокринологии и метаболизма 70 403–409.
- Ehrenkranz J et al. 2015 Щитовидная железа 25 954–961.
- Persani L et al. 1995 Журнал клинической эндокринологии и метаболизма 80 2722−2728.
- Roelfsema F et al. 2014 Журнал клинической эндокринологии и метаболизма 99 570−578.
- Кеффер Дж. Х. 1996 Клиническая химия 42 125-134.
- Rahman SA et al. 2019 Журнал клинической эндокринологии и метаболизма 104 6049-6059.
- Gall H et al.

 Или ваш врач может посоветовать вам принимать 2,5 или 5 мг в день без перерыва. Ваш врач поможет решить, какое количество таблеток вам лучше всего подходит и когда их принимать.
Или ваш врач может посоветовать вам принимать 2,5 или 5 мг в день без перерыва. Ваш врач поможет решить, какое количество таблеток вам лучше всего подходит и когда их принимать. Затем ваш врач может посоветовать вам принимать 400 или 800 мг в день в течение еще трех месяцев.
Затем ваш врач может посоветовать вам принимать 400 или 800 мг в день в течение еще трех месяцев. От 5 до 10 миллиграммов (мг) в день с 5 по 25 день (считая с первого дня последнего менструального цикла). Или ваш врач может попросить вас принимать лекарство только в течение пяти-десяти дней в соответствии с указаниями.
От 5 до 10 миллиграммов (мг) в день с 5 по 25 день (считая с первого дня последнего менструального цикла). Или ваш врач может попросить вас принимать лекарство только в течение пяти-десяти дней в соответствии с указаниями.
 Или ваш врач может назначить вам однократную инъекцию 100 или 150 мг в мышцу. Иногда ваш врач может попросить вас сначала принять другой гормон, называемый эстрогеном. Если у вас начался менструальный цикл, ваш врач попросит вас прекратить прием лекарства.
Или ваш врач может назначить вам однократную инъекцию 100 или 150 мг в мышцу. Иногда ваш врач может попросить вас сначала принять другой гормон, называемый эстрогеном. Если у вас начался менструальный цикл, ваш врач попросит вас прекратить прием лекарства.