Препараты от кашля в амбулаторной практике педиатра | Ключников С.О.
По данным ВОЗ, ежегодно острыми респираторными вирусными инфекциями болеет каждый третий житель планеты. В России регистрируется 27,3–41,2 млн. случаев ОРВИ. Например, по данным за период с января по август 2010 г. в России зарегистрировано 18 186278 случаев ОРВИ, при этом среди детей – 12 219811 случаев. В США число заболевших гриппом составляет около 30 млн. человек в год.
Уже исходя из приведенной статистики становится очевидным, что участковым врачам, в том числе педиатрам, прежде всего приходится решать вопросы лечения и профилактики именно данной группы заболеваний. Значимым с практических позиций является риск развития различных осложнений ОВРИ. К их числу в первую очередь необходимо отнести:
• Пневмонию и синусит, развитие которых, например, при риновирусной инфекции наблюдается до 85% случаев
• Стенозирующий ларинготрахеит
• Средний отит
• Обострение бронхиальной астмы
Сложность ситуации усугубляется еще и многочисленностью возбудителей (более 300 вирусов), что исключает возможность создания и реализации специфической иммунопрофилактики всей группы ОРВИ и обусловливает неполноценность специфического иммунитета к возбудителям респираторных инфекций, способствуя многократному развитию заболеваний одной и той же этиологии.
 При этом постоянная антигенная изменчивость вирусов гриппа создает и возможность несоответствия штаммового состава гриппозных вакцин реально циркулирующим вирусам.
При этом постоянная антигенная изменчивость вирусов гриппа создает и возможность несоответствия штаммового состава гриппозных вакцин реально циркулирующим вирусам. Данные обстоятельства вынуждают врачей применять весь арсенал средств симптоматической терапии. И, действительно, что же мы сегодня лечим при ОРВИ? Как правило, это три «состояния»: лихорадка, насморк и кашель. Не секрет, что количество лекарственных и нелекарственных средств, которые в невероятных объемах применяются на практике, исчисляется сотнями. Некоторые аспекты этой проблемы мы уже обсуждали [1, 2]. Например, на основании анализа записей в амбулаторных картах было показано, что по частоте назначений самыми востребованными являются 3 группы препаратов – антибиотики, антигистаминные препараты и иммуномодулирующие средства. Результаты проведенного нами анализа записей в амбулаторных картах показали, что из общего числа детей первого года жизни каждому пятому из них (20,5%) назначались антибактериальные препараты.

Достаточно сложным представляется и вопрос о назначении антигистаминных препаратов. По данным проведенного анализа, число детей первого года жизни, в лечении которых использовались эти средства, составило 40,9%, к трем годам – 56% и достигает 70,8% к семи годам. В среднем число курсов антигистаминных препаратов варьировало от 1,6 до 3,2 на одного ребенка. При этом не представляется возможным найти каких–либо иных обоснований для назначения антигистаминных препаратов, кроме как лечение ОРВИ. Так, у детей в возрасте от 1 года до 3 лет хлорпирамин назначался в 61% случаев, клемастин – в 26%, в группе детей до 7 лет хлорпирамин назначался уже в 100% случаев, а клемастин – только в 19%. В то же время именно для данной группы ЛС достаточно хорошо известны негативные эффекты, возникающие при их применении у детей, в частности, сонливость, чувство усталости, сухость во рту, тошнота, запоры, возможны также повышение аппетита и увеличение массы тела [3, 4].

Особого внимания заслуживает обнаруженный нами факт популярности разнообразных иммуномодулирующих средств, превышающей таковую у антибиотиков и антигистаминных препаратов. Безусловно, вызывает определенные сомнения целесообразность столь широкого применения иммуномодулирующих средств, особенно у детей первого года жизни – 47,7%. Необходимо подчеркнуть, что дети первого года жизни имеют незрелую, только формирующуюся иммунную систему, которая испытывает колоссальную антигенную нагрузку, и при этом в каждом втором случае подвергаются дополнительно активной «модуляции». Анализ медицинской документации наводит на мысль, что педиатры назначают данные препараты вообще без каких–либо обоснований, «на всякий случай», или, что значительно чаще, для лечения острых проявлений ОРВИ. Достаточно детально изученные особенности реакций иммунной системы на антигенную, в частности, вирусную агрессию, свидетельствуют, как минимум, о неэффективности модуляции или стимуляции организма иммунотропными средствами в острый период респираторного заболевания, поскольку ощутимые изменения ответа могут выявляться только к 14–21–му дню от начала воздействия.

К 3–летнему возрасту число детей, получивших иммуномодулирующие препараты, увеличивается до 64% и достигает к 7 годам 66,7%. При этом среднее число курсов иммуномодулирующих препаратов варьировало в анализируемых группах от 1,3 до 3,0 на одного ребенка.
Обсуждая вопросы лекарственной «нагрузки» необходимо принимать во внимание и многочисленные факты использования для лечения детей гомеопатических средств и фитопрепаратов, суммарно отмеченные в амбулаторных картах у 46,5% детей (т.е. практически у каждого второго ребенка). Здесь уместно напомнить, что сегодня отсутствуют не только убедительные данные доказательной медицины об эффективности большинства из этих средств, но практически не изучены вопросы взаимовлияния и взаимодействия столь принципиально отличных друг от друга категорий препаратов. При этом активно тиражируемая «безопасность» гомеопатических средств способствует бесконтрольности их использования даже при развитии острых заболеваний у детей.

 Невольно возникает вопрос: какие и сколько же суммарно получает ребенок из числа основных и дополнительных препаратов при лечении кашля? Оказалось, что даже чаще, чем все вместе взятые противокашлевые и муколитические средства, при кашле у детей используются иммуномодуляторы – в 82% случаев.
Невольно возникает вопрос: какие и сколько же суммарно получает ребенок из числа основных и дополнительных препаратов при лечении кашля? Оказалось, что даже чаще, чем все вместе взятые противокашлевые и муколитические средства, при кашле у детей используются иммуномодуляторы – в 82% случаев.Напомним, что если при продуктивном кашле целесообразно использование муколитиков и отхаркивающих препаратов, то при лечении ребенка с сухим кашлем требуется иной подход. При повышенной чувствительности дыхательных путей кашель теряет свою защитную функцию и не только не способствует выздоровлению, но и приводит к развитию осложнений. При сухом, интенсивном, мучительном кашле, нарушающем качество жизни пациента, показано симптоматическое лечение, то есть назначение противокашлевых средств.

Противокашлевые препараты отличаются по локализации своего действия – периферической или центральной. Чтобы снять приступ сухого раздражающего кашля, необходимо воздействовать на кашлевой центр, который находится в продолговатом мозге. Наркотические противокашлевые препараты обладают выраженным противокашлевым эффектом, но имеют низкий профиль безопасности, т.к. характеризуются серьезными побочными явлениями: вызывают привыкание, угнетают дыхательный центр и могут уменьшать дыхательный объем. Негативными эффектами опиатов являются также возможность замедления моторики кишечника и возникновения запоров, сонливость, нарушение когнитивных функций. С учетом перечисленных эффектов наркотические препараты центрального действия крайне редко применяются у детей.

Установлено, кроме того, что Синекод обладает отхаркивающим, умеренным бронходилатирующим и противовоспалительным действием, улучшает показатели спирометрии, снижая сопротивление дыхательных путей, а также насыщение крови кислородом. После приема внутрь бутамират быстро и полностью всасывается из желудочно–кишечного тракта, при этом его максимальная концентрация в плазме достигается примерно через 1,5 часа.
 При повторном назначении препарата концентрация в крови остается линейной, то есть не происходит накопления активного вещества. Кроме того, стоит отметить такое немаловажное свойство Синекода, нехарактерное для наркотических противокашлевых средств, как быстрое наступление максимального эффекта препарата: по данным нескольких клинических исследований уже через 2 часа после однократного применения Синекода наступает максимальный противокашлевый эффект, и полностью подавляется сухой кашель у 75–86% пациентов [6]. Кроме того, стоит отметить, что длительный прием препарата Синекод не влияет на функцию внешнего дыхания, а при хронических воспалительных заболеваниях верхних дыхательных путей может значительно улучшать спирометрические показатели [7].
При повторном назначении препарата концентрация в крови остается линейной, то есть не происходит накопления активного вещества. Кроме того, стоит отметить такое немаловажное свойство Синекода, нехарактерное для наркотических противокашлевых средств, как быстрое наступление максимального эффекта препарата: по данным нескольких клинических исследований уже через 2 часа после однократного применения Синекода наступает максимальный противокашлевый эффект, и полностью подавляется сухой кашель у 75–86% пациентов [6]. Кроме того, стоит отметить, что длительный прием препарата Синекод не влияет на функцию внешнего дыхания, а при хронических воспалительных заболеваниях верхних дыхательных путей может значительно улучшать спирометрические показатели [7].Среди хорошо известных свойств данного препарата наряду с высокой клинической эффективностью важно отметить безопасность применения. Именно данная характеристика препарата – «безопасность» была убедительно доказана при использовании у детей, начиная с 2–месячного возраста.

Среди редких побочных проявлений, которые не превышают 1%, были отмечены: со стороны центральной нервной системы – головокружение, проходящее после снижения дозы препарата; со стороны желудочно–кишечного тракта – тошнота и диарея; аллергические реакции: возможны кожная сыпь и зуд.
К показаниям по применению препарата Синекода относятся: сухой кашель, коклюш, подавление кашля при хирургических вмешательствах и бронхоскопии, подавление кашля в пред– и послеоперационном периоде.
Для педиатров важное значение имеет удобная форма выпуска препарата. Так, Синекод выпускается для детей в виде капель для приема внутрь и в виде сиропа [8]. Режим дозирования Синекода зависит от возраста ребенка. При этом Синекод в виде раствора–капель назначают: детям от 2 мес до 1 года – по 10 кап 4 раза в сутки; детям от 1 года до 3 лет – по 15 кап 4 раза в сутки; детям 3 лет и старше – по 25 кап 4 раза в сутки. При использовании Синекода в виде сиропа рекомендуют следующие дозировки: детям 3–6 лет – по 5 мл 3 раза в сутки; детям 6–12 лет – по 10 мл 3 раза в сутки; детям 12 лет и старше – по 15 мл 3 раза в сутки.
 Препарат назначают перед едой. Особо следует подчеркнуть, что при соблюдении рекомендуемых режимов дозирования Синекод характеризуется хорошей переносимостью и высоким профилем безопасности.
Препарат назначают перед едой. Особо следует подчеркнуть, что при соблюдении рекомендуемых режимов дозирования Синекод характеризуется хорошей переносимостью и высоким профилем безопасности.Литература
1. Ключников С.О., Барсукова М.В., Суюндукова А.С., Дубович Е.Г. «Лекарственная нагрузка» у детей в амбулаторных условиях. Матер. объединенного форума детских врачей. г. Орел. Вестник РГМУ, №4 (63), 2008, стр. 182.
2. Ключников С.О., Барсукова М.В., Кантимирова Е.А., Нечаева Н.Л. Часто болеющие дети. Лекции по педиатрии. Иммунология. Том 9, РГМУ, стр. 127–144. 2010.
3. Малахов А.Б., Волков И.К., Малахова–Капанадзе М.А. Антигистаминные препараты и их место в терапии аллергических заболеваний. Справочник поликлинического врача, 2007, № 1.
4. Пампура А.Н., Кожевников С.А. Антигистаминные препараты в лечении аллергических заболеваний у детей. Вестник педиатрической фармакологии и нутрициологии. 2008, №1, стр. 7–12.
5. Козлов И.Г. Ренессанс иммуностимулирующей терапии. Вестник педиатрической фармакологии и нутрициологии. 2008, №2, стр. 4–13.
Вестник педиатрической фармакологии и нутрициологии. 2008, №2, стр. 4–13.
6. Materazzi F., Capano P., D’Urso B., Visco A.: Note terapeutiche sul butamirato citrato. Gazz. med. ital. 143,4, 229–232. 1984.
7. Santos A. and Nacpil N. (1994) Comparative clinical evaluation of the antitussive activity of butamirate citrate versus dextromethorphan. Manilla (Philippines): Lung Center of the Philippines.
8. Государственный реестр лекарственных средств. – М.: МЗ РФ, 2010.
Тактика выбора и особенности применения противокашлевых, отхаркивающих и муколитических лекарственных средств в педиатрической практике | Захарова И.Н., Коровина Н.А., Заплатников
Кашель – рефлекторная, защитно–приспособительная реакция организма, направленная на выведение из дыхательных путей инородных веществ и/или патологически измененного трахеобронхиального секрета. Раздражение чувствительных окончаний n.vagus, расположенных в органах дыхания, приводит к передаче нервных импульсов в кашлевой центр продолговатого мозга. В результате возбуждения кашлевого центра формируется ответная реакция – глубокий вдох, а затем синхронное сокращение мышц гортани, бронхов, грудной клетки, живота и диафрагмы при закрытой голосовой щели с последующим ее открытием и коротким, форсированным толчкообразным выдохом [4,8,9].
В результате возбуждения кашлевого центра формируется ответная реакция – глубокий вдох, а затем синхронное сокращение мышц гортани, бронхов, грудной клетки, живота и диафрагмы при закрытой голосовой щели с последующим ее открытием и коротким, форсированным толчкообразным выдохом [4,8,9].
Следует отметить, что в физиологических условиях кашель играет лишь вспомогательную роль в процессах очищения дыхательных путей, т.к. основными механизмами санации являются мукоцилиарный клиренс и перистальтика мелких бронхов [8,12,13]. Мукоцилиарный клиренс обеспечивается адекватной работой мерцательного эпителия слизистых, реснички которого постоянными колебательными движениями «выталкивают» слизь из воздухоносных путей в проксимальном направлении. При этом скорость выведения трахеобронхиальной слизи из нижних дыхательных путей зависит не только от функциональной активности мерцательного эпителия, но и от реологических свойств самого секрета. Так, если в нормальных условиях трахеобронхиальная слизь характеризуется низкой вязкостью и хорошей текучестью, то при развитии воспалительных процессов отмечается значительное ухудшение ее реологических параметров и, как следствие, – затрудненное выведение. Причиной этого является изменение качественного состава слизи при воспалении (увеличение концентрации нейтральных и кислых гликопротеинов и др.). В результате уменьшения содержания в составе слизи воды и увеличения концентрации муцинов, слизь становится вязкой, что значительно ухудшает ее текучесть. Одновременно отмечается гиперпродукция слизи. Кроме этого в результате воспаления развиваются функциональные или структурные нарушения мерцательного эпителия, что приводит к снижению мукоцилиарной активности. Все это обуславливает неадекватный мукоцилиарный клиренс и способствует накоплению мокроты [4,10,11]. В этих условиях кашель становится единственным эффективным механизмом санации трахеобронхиального дерева [8].
Причиной этого является изменение качественного состава слизи при воспалении (увеличение концентрации нейтральных и кислых гликопротеинов и др.). В результате уменьшения содержания в составе слизи воды и увеличения концентрации муцинов, слизь становится вязкой, что значительно ухудшает ее текучесть. Одновременно отмечается гиперпродукция слизи. Кроме этого в результате воспаления развиваются функциональные или структурные нарушения мерцательного эпителия, что приводит к снижению мукоцилиарной активности. Все это обуславливает неадекватный мукоцилиарный клиренс и способствует накоплению мокроты [4,10,11]. В этих условиях кашель становится единственным эффективным механизмом санации трахеобронхиального дерева [8].
Таким образом появление у ребенка кашля должно рассматриваться как проявление несостоятельности физиологических механизмов санации трахеобронхиального дерева. При этом наиболее частыми причинами кашля являются патологические изменения в органах дыхания (воспаление, инородное тело и др. ). Однако в ряде случаев кашель может быть связан с заболеваниями других органов и систем (центральной нервной системы, органов средостения и др.). Так, при патологическом возбуждении кашлевого центра в ЦНС развивается кашель центрального генеза. В ряде случаев кашель может отмечаться при невротических реакциях, психо–эмоциональном напряжении и стрессе. Кроме этого при заболеваниях сердца, пищевода, ЛОР–органов в результате раздражения периферических рецепторов n.vagus может возникать рефлекторный кашель [4,8].
). Однако в ряде случаев кашель может быть связан с заболеваниями других органов и систем (центральной нервной системы, органов средостения и др.). Так, при патологическом возбуждении кашлевого центра в ЦНС развивается кашель центрального генеза. В ряде случаев кашель может отмечаться при невротических реакциях, психо–эмоциональном напряжении и стрессе. Кроме этого при заболеваниях сердца, пищевода, ЛОР–органов в результате раздражения периферических рецепторов n.vagus может возникать рефлекторный кашель [4,8].
Детальная характеристика симптома кашля (частота, интенсивность, тембр, периодичность, болезненность, продуктивность, характер мокроты, время появления и его продолжительность и др.), наряду с уточнением анамнеза и адекватной оценкой результатов клинического обследования позволяют установить правильный диагноз и назначить адекватную терапию [1,5,9]. В качестве симптоматического лечения при этом нередко используются препараты, влияющие на частоту, интенсивность и характер кашля [3,4,7]. В зависимости от фармакодинамики среди них выделяют противокашлевые, муколитические и отхаркивающих лекарственные средства (табл. 1). При этом рациональное их применение требует строго дифференцированного подхода к каждой клинической ситуации. Выбор конкретных лекарственных средств зависит от клинических и патогенетических особенностей заболевания, индивидуальных особенностей ребенка, а также от фармакологических характеристик самих препаратов [1,3–7].
В зависимости от фармакодинамики среди них выделяют противокашлевые, муколитические и отхаркивающих лекарственные средства (табл. 1). При этом рациональное их применение требует строго дифференцированного подхода к каждой клинической ситуации. Выбор конкретных лекарственных средств зависит от клинических и патогенетических особенностей заболевания, индивидуальных особенностей ребенка, а также от фармакологических характеристик самих препаратов [1,3–7].
Противокашлевые лекарственные средства
В основе механизма действия противокашлевых лекарственных средств лежит подавление кашлевого рефлекса. При этом эффект достигается либо за счет снижения чувствительности рецепторов чувствительных окончаний n.vagus, представленных в органах дыхания, или в результате угнетения кашлевого центра продолговатого мозга.
В основе механизма действия противокашлевых лекарственных средств лежит подавление кашлевого рефлекса. При этом эффект достигается либо за счет снижения чувствительности рецепторов чувствительных окончаний n.vagus, представленных в органах дыхания, или в результате угнетения кашлевого центра продолговатого мозга.
При этом эффект достигается либо за счет снижения чувствительности рецепторов чувствительных окончаний n.vagus, представленных в органах дыхания, или в результате угнетения кашлевого центра продолговатого мозга.
Показаниями к применению противокашлевых лекарственных средств являются те клинические состояния, при которых отмечается сухой, частый кашель, приводящий к рвоте, нарушению сна и аппетита («мучительный», «истощающий» кашель). Поэтому при гриппе, остром ларингите, трахеите, бронхите и др. заболеваниях органов дыхания, сопровождающихся «истощающим» непродуктивным кашлем, применение антитуссивных препаратов может быть признано целесообразным. Частый болезненный кашель при сухом плеврите также является показанием для назначения данных лекарственных средств.
Все противокашлевые лекарственные средства, в зависимости от фармакодинамических особенностей, делят на препараты центрального и периферического действия (табл. 1). В свою очередь среди противокашлевых лекарственных средств центрального действия выделяют наркотические и ненаркотические препараты [2,4].
Наркотические противокашлевые препараты (агонисты опиоидных рецепторов) в педиатрической практике используются крайне редко из–за возможного угнетения дыхательного центра и риска развития наркотической зависимости. Следует все же отметить, что в ряде случаев у детей старшего возраста и подростков данные лекарственные средства могут применяться в составе комбинированных препаратов (кодипронт, кодтерпин, нео–кодион и др.), однако для этого должны быть веские основания (упорный, «истощающий» непродуктивный кашель, некупирующийся при использовании других антитуссивных средств).
Ненаркотические противокашлевые препараты центрального действия (бутамират, глауцин, окселадин и др.) также, как и агонисты опиоидных рецепторов подавляют кашлевой рефлекс за счет угнетения кашлевого центра. Отличительной особенностью данных препаратов является то, что они не вызывают привыкания и лекарственной зависимости, и поэтому могут чаще использоваться у детей.
Противокашлевые препараты периферического действия (преноксиндиазин и др. ) угнетают кашлевой рефлекс за счет снижения чувствительности рецепторов нервных окончаний блуждающего нерва, расположенных в органах дыхания. Это приводит к уменьшению частоты и интенсивности кашля. Следует отметить, что по выраженности терапевтического эффекта данные лекарственные средства уступают препаратам центрального действия.
) угнетают кашлевой рефлекс за счет снижения чувствительности рецепторов нервных окончаний блуждающего нерва, расположенных в органах дыхания. Это приводит к уменьшению частоты и интенсивности кашля. Следует отметить, что по выраженности терапевтического эффекта данные лекарственные средства уступают препаратам центрального действия.
Противокашлевые препараты, независимо от их механизма действия, противопоказаны при легочных кровотечениях, бронхообструктивных состояниях и во всех случаях гиперпродукции трахеобронхиального секрета. Особо следует подчеркнуть, что данные лекарственные средства нельзя использовать при наличии у ребенка продуктивного кашля. Необходимо также отметить, что недопустимо одновременное назначение противокашлевых и муколитических препаратов из–за возможного развития синдрома «заболоченных бронхов» [1–4].
Муколитические лекарственные средства (муколитики)
К муколитикам относятся производные амброксола, бромгексина, ацетилцистеина, карбоцистеина, а также редко используемые в педиатрической практике месна и некоторые протеолитические ферменты (трипсин, химотрипсин, химопсин, ДНК–аза, РНК–аза) (табл. 1). Основной терапевтический эффект муколитических лекарственных средств заключается в непосредственном разжижении патологически вязких секретов организма. Поэтому показаниями для применения муколитиков являются клинические состояния, при которых отмечается кашель с густой, вязкой, трудноотделяемой мокротой.
1). Основной терапевтический эффект муколитических лекарственных средств заключается в непосредственном разжижении патологически вязких секретов организма. Поэтому показаниями для применения муколитиков являются клинические состояния, при которых отмечается кашель с густой, вязкой, трудноотделяемой мокротой.
Муколитический эффект ацетилцистеина обусловлен способностью его сульфгидрильных групп разрывать дисульфидные связи кислых мукополисахаридов мокроты, что приводит к их деполяризации и уменьшению вязкости слизи. Кроме этого, участвуя в синтезе глутатиона, ацетилцистеин повышает защиту клеток от повреждающего воздействия продуктов свободно–радикального окисления. Следует помнить, что при одновременном назначении ацетилцистеина с тетрациклином, ампициллином и амфотерицином В возможно их взаимодействие и уменьшение терапевтической эффективности [2].
Карбоцистеин также разрушает дисульфидные связи мукополисахаридов мокроты. Улучшение реологические параметров бронхиального секрета происходит также благодаря нормализации количественных соотношений кислых и нейтральных сиаломуцинов в составе слизи. Одновременно восстанавливается структура слизистой трахеобронхиального дерева. Все это приводит к стимуляции моторной функции мерцательного эпителия и способствует улучшению мукоцилиарного транспорта. Карбоцистеин потенцирует эффективность теофиллина и антибактериальных препаратов. При одновременном применении карбоцистеина с атропиноподобными средствами возможно ослабление терапевтического эффекта [2].
Одновременно восстанавливается структура слизистой трахеобронхиального дерева. Все это приводит к стимуляции моторной функции мерцательного эпителия и способствует улучшению мукоцилиарного транспорта. Карбоцистеин потенцирует эффективность теофиллина и антибактериальных препаратов. При одновременном применении карбоцистеина с атропиноподобными средствами возможно ослабление терапевтического эффекта [2].
Амброксол (Амбробене) обладает выраженным муколитическим и отхаркивающим действием. При этом терапевтический эффект связан с деполимеризацией мукопротеиновых и мукополисахаридных молекул мокроты, нормализацией функции секреторных клеток и мерцательного эпителия слизистой бронхов, а также стимуляцией синтеза и секреции сурфактанта. Благодаря этому восстанавливается эффективный уровень мукоцилиарного транспорта, что способствует адекватному выведению мокроты [2]. Установлено, что амброксол стимулирует местный иммунитет (способствует увеличению активности макрофагов и повышению концентрации s–IgА). При этом одновременное применение амброксола с антибиотиками способствует увеличению их альвеолярной концентрации. Следует отметить, что в последние годы в педиатрической практике предпочтение отдается амброксолу, что обусловлено его высокой терапевтической эффективностью и хорошей переносимостью.
При этом одновременное применение амброксола с антибиотиками способствует увеличению их альвеолярной концентрации. Следует отметить, что в последние годы в педиатрической практике предпочтение отдается амброксолу, что обусловлено его высокой терапевтической эффективностью и хорошей переносимостью.
Общими противопоказаниями для назначения муколитических препаратов являются язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения, а также состояния, при которых отмечается легочное кровотечение. Как уже указывалось ранее недопустимо одновременное использование противокашлевых и муколитических препаратов.
Отхаркивающие лекарственные средства
Отхаркивающие лекарственные средства в подавляющем большинстве случаев представлены препаратами растительного происхождения. Основными показаниями для их применения являются те клинические состояния, при которых имеется малопродуктивный кашель, но мокрота при этом не отличается высокой вязкостью. Среди отхаркивающих лекарственных средств можно выделить препараты рефлекторного и резорбтивного действия (табл. 1).
1).
К отхаркивающим препаратам резорбтивного действия относятся йодиды, гидрокарбонат натрия и др. Всасываясь в желудочно–кишечном тракте, они затем выделяются слизистой оболочкой бронхов, разжижая при этом бронхиальный секрет и увеличивая его количество. В последние годы препараты этой группы используются все реже.
Отхаркивающие лекарственные средства рефлекторного действия – это препараты, содержащие алкалоиды или сапонины, возбуждающие рецепторы нервных окончаний в желудке с последующей активацией центров рвоты и кашля в продолговатом мозге и развитием гастропульмонарного рефлекса. В результате этого усиливается перистальтика бронхиол и активизируется продвижение мокроты из нижних отделов дыхательных путей. Ряд препаратов одновременно способствуют некоторому усилению секреции бронхиальных желез, что увеличивает жидкий (нижний) слой слизи и, тем самым, косвенно повышает активность мерцательного эпителия. Многие препараты этой группы входят в состав комбинированных лекарственных средств (фитосборы, микстуры и т. д.). У детей раннего возраста отхаркивающие препараты применять нужно с большой осторожностью, т.к. избыточная стимуляция рвотного и кашлевого центров может привести к аспирации, особенно если ребенок имеет поражение ЦНС.
д.). У детей раннего возраста отхаркивающие препараты применять нужно с большой осторожностью, т.к. избыточная стимуляция рвотного и кашлевого центров может привести к аспирации, особенно если ребенок имеет поражение ЦНС.
Суммируя представленные сведения, для практического использования можно предложить следующий алгоритм выбора препаратов, влияющих на кашель:
Противокашлевые лекарственные средства показаны только в тех случаях, когда заболевание сопровождается непродуктивным, частым, мучительным, болезненным кашлем, приводящим к нарушению сна и аппетита.
Муколитические препараты показаны при заболеваниях органов дыхания, сопровождающихся продуктивным кашлем с густой, вязкой, трудноотделяемой мокротой. Муколитические препараты нельзя комбинировать с противокашлевыми лекарственными средствами (рис. 1).
Отхаркивающие лекарственные средства показаны в тех случаях острых и хронических воспалительных заболеваний органов дыхания, когда кашель не сопровождается наличием густой, вязкой, трудноотделимой мокроты.
Таким образом, выбор лекарственных средств, влияющих на кашель, зависит от клинических проявлений заболевания и индивидуальных особенностей пациента, а рациональное их использование может существенно повысить эффективность базисного лечения.
1. Геппе Н.А., Малахов А.Б. Муколитические и противокашлевые средства в практике педиатра (лекция) // Детский доктор.– №4.–1999.– С. 42–45.
2. Государственный реестр лекарственных средств. МЗ РФ – Москва, 2000.
3. Делягин В.М., Быстрова Н.Ю. Антибактериальные и мукоактивные препараты (краткое руководство для педиатра).– М.:Алтус, 1999.– 70 с.
4. Замотаев И.П. Клиническая фармакология противокашлевых средств и тактика их применения. – Москва, 1983.
5. Коровина Н.А., Захарова И.Н., Заплатников А.Л., Овсянникова Е.М. Кашель у детей. Противокашлевые и отхаркиваюшие лекарственные средства в педиатрической практике (пособие для врачей). – М.: Посад, 2000. – 53 с.
– М.: Посад, 2000. – 53 с.
6. Острые респираторные заболевания у детей: лечение и профилактика / Научно–практическая программа Союза педиатров России. – М.: Международный Фонд охраны здоровья матери и ребенка, 2002.
7. Самсыгина Г.А., Зайцева О.В., Корнюшин М.А. Бронхиты у детей. Отхаркивающая и муколитическая терапия.– Москва, 1999.
8. Физиология дыхания /Отв.ред. И.С.Бреслав, Г.Г.Исаев. – СПб.:Наука, 1994. – 680 с.
9. Хертл М. Кашель и чихание /Дифференциальная диагностика в педиатрии. В 2–х т. (пер. с нем.). – Новосибирск: Академ–пресс, 1998. – Т.2. – С.284–286.
10. Dulfano M.J., Adler K.B. Phisical properties of sputum// Amer.Rev.Resp.Dis. 1975, Vol.112, P.341.
11. Konietzko N. Der mukoziliare transport und dessen therapeutische beeinflussarbeit// Atemwegs– und Lungen–Kr, 1985. Bd11. S. 145–150.
12. Lucas A.M., Douglas L.C. Principles underlying ciliary activity in the respiratory tract// Arch. Otolaryngol. 1934, Vol. 20. P.518–524.
Otolaryngol. 1934, Vol. 20. P.518–524.
13. Morgenroht K. Morphologie der bronchialen clearence// Fortschr. Med., 1984, Bd 102. S. 971–976.
По данным профессора О.В. Зайцевой (РГМУ), к наиболее часто используемым в педиатрии препаратам относится Амбробене, являющийся производным амброксола. Амбробене имеет широкий выбор лекарственных форм: таблетки, раствор для приема внутрь, сироп, капсулы ретард, раствор для ингаляций и эндобронхиального введения, раствор для инъекций. Доза препарата для детей до 5 лет составляет 7,5 мг 2-3 раза в день, детям старше 5 лет — 15 мг 3 раза в день. Пациентам старше 12 лет Амбробене назначают по 30 мг 3 раза в сутки или 1 капсулу ретард в сутки. Применение капсул ретард особенно оправдано при хронических болезнях органов дыхания. Длительность курса лечения составляет от 1 до 3-4 недель в зависимости от эффекта и характера процесса.
В проведенном рандомизированном мультицентровом открытом сравнительное исследовании проф. О.В. Зайцевой и соавт. было показано, что Амбробене обладает высокой терапевтической эффективностью у детей с острыми и хроническими заболеваниями дыхательных путей. Положительный результат лечения был подтвержден клиническими и лабораторными тестами, а также бронхоскопией, проведенной в динамике. У детей с бронхиальной астмой наилучший эффект отмечен при сочетании ингаляций Амбробене через небулайзер и приема препарата внутрь. Инъекционное введение Амбробене эффективно в комплексной терапии тяжелых осложненных пневмоний, при наличии заболеваний органов дыхания у новорожденных и после интубационного наркоза у часто болеющих респираторными инфекциями детей. РМЖ 2003, т. 11, № 1 с. 49-54 |
Лечение острого кашля у детей раннего возраста
Чтобы помочь устранить путаницу в отношении использования противокашлевых препаратов у детей, в JACEP был опубликован структурированный литературный обзор . Открыто, чтобы предложить клиницистам взвешенную, информированную информацию о передовом опыте, касающуюся места в терапии. противокашлевых препаратов у маленьких детей с острым кашлем, когда нет причин для беспокойства, что это связано с основным заболеванием или состоянием здоровья.
Открыто, чтобы предложить клиницистам взвешенную, информированную информацию о передовом опыте, касающуюся места в терапии. противокашлевых препаратов у маленьких детей с острым кашлем, когда нет причин для беспокойства, что это связано с основным заболеванием или состоянием здоровья.
В январе 2008 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выпустило рекомендации по общественному здравоохранению, предостерегающие родителей детей в возрасте до 2 лет от использования безрецептурных лекарств от простуды и кашля (CCM) из-за опасений по поводу «серьезных и опасных для жизни побочных эффектов». (Эта рекомендация больше не доступна на веб-сайте FDA.)
Затем, в июле 2015 года, FDA нацелилось на рецептурные CCM, опубликовав объявление о безопасности относительно потенциального риска использования кодеинсодержащих средств от кашля у детей. Впоследствии на встрече экспертов FDA за круглым столом участники указали, что кашель не следует подавлять, если он не вызывает клинических последствий, таких как плохой сон и/или рвота, переломы ребер или гипоксия.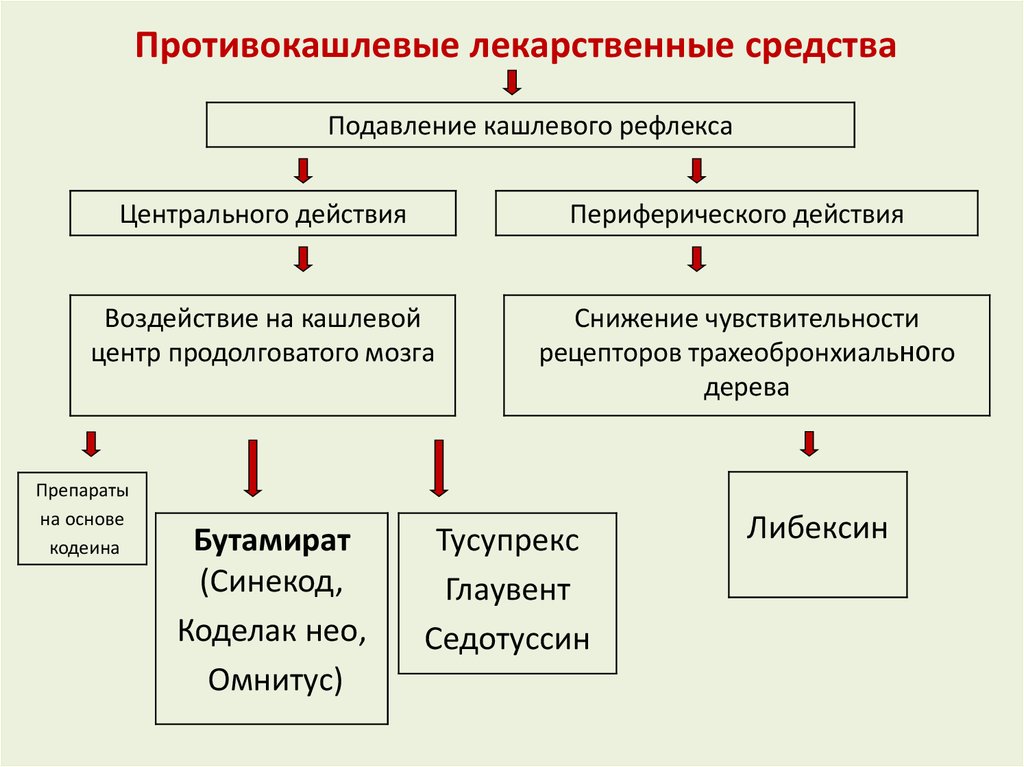
За этой встречей в январе 2018 года последовало еще одно объявление, в котором говорилось, что FDA «требует изменения маркировки безопасности рецептурных лекарств от кашля и простуды, содержащих кодеин или гидрокодон, чтобы ограничить использование этих продуктов взрослыми 18 лет и старше, поскольку риски этих лекарства перевешивают их пользу для детей младше 18 лет».
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов также сообщило, что после добровольного отзыва безрецептурных КМС для детей младше 2 лет производители добровольно изменили маркировку этих продуктов, чтобы указать, что их не следует использовать у детей в возрасте до 4 лет. Кроме того, Американская академия педиатрии также заявила, что дети в возрасте от 4 до 6 лет должны использовать безрецептурные СКК только с разрешения своего врача.
Авторы статьи JACEP Open описывают роль декстрометорфана, антигистаминных препаратов, растительных лекарственных средств (т. е. Echinacea purpurea , Pelargonium sidoides ), паровые растирания, мед, отпускаемые по рецепту лекарства (например, кодеин, прометазин, бензонатат и ингаляционные кортикостероиды) с точки зрения эффективности, безопасности и возможности злоупотребления.
е. Echinacea purpurea , Pelargonium sidoides ), паровые растирания, мед, отпускаемые по рецепту лекарства (например, кодеин, прометазин, бензонатат и ингаляционные кортикостероиды) с точки зрения эффективности, безопасности и возможности злоупотребления.
В этом обзоре также рассматриваются причины использования противокашлевых препаратов у детей младшего возраста, в том числе устранение беспокойства родителей по поводу кашля у ребенка, а также относительная безопасность и плацебо-эффект этих безрецептурных препаратов при правильном дозировании. Авторы также описывают причины против использования этих средств у этой группы населения, ссылаясь на доброкачественный характер острого кашля, отсутствие доказательств, подтверждающих использование этих продуктов, рекомендации и предупреждения как государственных органов, так и профессиональных обществ против использования этих продуктов. , и потенциал их злоупотребления.
Авторы усиливают меры предосторожности, согласно которым противокашлевые средства, содержащие кодеин, не следует использовать у детей младшего возраста. Было обнаружено, что мед полезен при кашле, но его следует использовать только детям старше 1 года из-за опасности младенческого ботулизма. Дети старшего возраста и взрослые могут нейтрализовать вредное воздействие спор ботулина в кишечнике.
Было обнаружено, что мед полезен при кашле, но его следует использовать только детям старше 1 года из-за опасности младенческого ботулизма. Дети старшего возраста и взрослые могут нейтрализовать вредное воздействие спор ботулина в кишечнике.
В обзоре также рекомендуется использовать назальные спреи с солевым раствором, отсасывание из носа и паровые растирания, а также увлажнение и использование жаропонижающих средств, когда это уместно. Авторы подчеркивают, что родители должны следовать рекомендациям по дозировке и возрасту, указанным на маркировке ККМ, и что эти продукты следует использовать только кратковременно.
У местных фармацевтов, работающих на переднем крае, часто спрашивают совета по использованию СКК у педиатрических пациентов. В этом документе представлены рекомендации по использованию противокашлевых средств у детей раннего возраста, при этом подчеркивается важность обсуждения вариантов лечения с педиатрами пациентов, чтобы избежать каких-либо неблагоприятных эффектов от этих продуктов.
Содержимое этой статьи предназначено только для информационных целей. Содержимое не предназначено для замены профессиональной консультации. Вы полагаетесь на любую информацию, представленную в этой статье, исключительно на свой страх и риск.
«Нажмите здесь, чтобы вернуться к обновлению о простуде и гриппе.
=m
Леводропропизин для лечения кашля у взрослых и детей: метаанализ опубликованных исследований | Мультидисциплинарная респираторная медицина
- Оригинальная исследовательская статья
- Открытый доступ
- Опубликовано:
- Alessandro Zanasi 1 ,
- Luigi Lanata 3 ,
- Giovanni Fontana 2 ,
- Federico Saibene 3 ,
- Peter Dicpinigaitis 5 &
- …
- Francesco De Blasio 4
Многопрофильная респираторная медицина том 10 , Номер статьи: 19 (2015) Процитировать эту статью
23 тыс.
 обращений
обращений17 цитирований
14 Альтметрический
Детали показателей
Abstract
История вопроса
Кашель является одним из наиболее частых симптомов, по поводу которого пациенты обращаются за медицинской помощью к врачам первичной медико-санитарной помощи и пульмонологам. Около 40% населения в любой момент времени сообщают о кашле.
Кашель связан со значительным ухудшением качества жизни, связанного со здоровьем.
Леводропропизин является эффективным и очень хорошо переносимым периферическим противокашлевым препаратом. Мы хотим сравнить его с эффективностью средств, подавляющих кашель центрального действия (опиоидов и неопиоидов), которые могут быть связаны с побочными эффектами, ограничивающими их использование.
Методы
После всестороннего поиска литературы был проведен метаанализ 7 клинических исследований леводропропизина по сравнению с контролем, включавший в общей сложности 1178 пациентов, с целью оценки общей сравнительной эффективности леводропропизина у детей и взрослых. Население.
Для поиска исследований, в которых оценивалась эффективность леводропропизина для лечения кашля у детей и взрослых, использовались три электронные базы данных и список ссылок с использованием в качестве стандартизированных параметров эффективности частоты и тяжести кашля, а также количества ночных пробуждений в качестве исходных параметров.
Результаты
Мета-анализ всех стандартизированных параметров эффективности показал статистически значимое различие в общей противокашлевой эффективности в пользу леводропропизина по сравнению с контрольным лечением (p = 0,0015).
Тест на гетерогенность исхода эффективности не был статистически значимым (p = 0,0534).
Семь исследований соответствовали критериям включения. Метаанализ подходящих пациентов показал статистически значимую разницу в общем противокашлевом эффекте леводропропизина по сравнению с контролем (p = 0,0015).
Выводы
Этот анализ показывает, что леводропропизин является эффективным противокашлевым препаратом у детей и взрослых со статистически значимыми лучшими общими результатами эффективности по сравнению с центральными противокашлевыми препаратами (кодеин, клоперастин, декстрометорфан) с точки зрения уменьшения интенсивности и частоты кашля, а также ночного кашля. пробуждения. Этот результат еще больше подтверждает благоприятное соотношение пользы и риска леводропропизина при лечении кашля. Эффективность левопропизина при лечении кашля у детей и взрослых выше, чем у обычных противокашлевых средств центрального действия.
Исходная информация
Кашель является одним из наиболее частых симптомов, по поводу которого пациенты обращаются за медицинской помощью к врачам первичной медико-санитарной помощи и пульмонологам [1]. В эпидемиологических исследованиях до 40% людей одновременно сообщают о кашле [2].
В эпидемиологических исследованиях до 40% людей одновременно сообщают о кашле [2].
Клинически этиологию кашля можно в общих чертах разделить на острую и хроническую, исходя из продолжительности его персистенции, острого кашля, длящегося от 1 до 3 недель, и хронического кашля, длящегося более 8 недель. Наиболее частыми причинами острого кашля являются вирусные или бактериальные инфекции верхних дыхательных путей (ИВДП), тогда как причинами хронического кашля являются астма, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), хронический ринит, хронический бронхит, хроническая обструктивная болезнь легких (ХОБЛ), Лечение ингибиторами АПФ [3].
Независимо от того, является ли он острым или хроническим, кашель связан со значительным ухудшением качества жизни, связанного со здоровьем, поскольку часто возникают нарушение сна, тошнота, боль в груди и вялость [2].
Общий подход к лечению любого кашля начинается с поиска причины кашля и лечения основной причины. Однако распознать происхождение кашля не всегда легко, и даже выявленный кашель у значительного числа пациентов не поддается специфической терапии [1]. Кроме того, часто требуется эмпирическое лечение противокашлевыми средствами, особенно при ухудшении качества жизни [1, 2].
Кроме того, часто требуется эмпирическое лечение противокашлевыми средствами, особенно при ухудшении качества жизни [1, 2].
Этиология кашля у детей отличается от таковой у взрослых: часто причиной кашля у детей являются вирусные ОРВИ, затяжной бактериальный бронхит и астма [2]. Таким образом, эмпирический подход, обычно используемый у взрослых, непригоден для детей. Клиническая оценка кашля у детей должна также включать оценку факторов окружающей среды, особенно табачного дыма, опасений и ожиданий родителей [4].
Для лечения кашля в основном доступны два типа противокашлевых препаратов: средства для подавления кашля центрального действия (опиоиды и неопиоиды) и периферические противокашлевые средства. Кодеин, декстрометорфан и клоперастин являются одними из наиболее распространенных средств центрального действия, подавляющих кашель главным образом за счет их воздействия на центр кашля. Леводропропизин является неопиоидным средством, периферическое противокашлевое действие которого может быть результатом его модуляции уровней сенсорных нейропептидов в дыхательных путях [5]. В частности, леводропропизин оказывает противокашлевое действие за счет ингибирующего действия на уровне сенсорных нервов дыхательных путей, и было показано, что он способен ингибировать in vitro высвобождение нейропептидов из С-волокон [6]. Кроме того, у кошек под анестезией он заметно снижает активацию С-волокон и отменяет связанные с ними рефлексы [7]. Действие левопропизина на другие сенсорные единицы дыхательных путей, кроме С-волокон, не изучалось.
В частности, леводропропизин оказывает противокашлевое действие за счет ингибирующего действия на уровне сенсорных нервов дыхательных путей, и было показано, что он способен ингибировать in vitro высвобождение нейропептидов из С-волокон [6]. Кроме того, у кошек под анестезией он заметно снижает активацию С-волокон и отменяет связанные с ними рефлексы [7]. Действие левопропизина на другие сенсорные единицы дыхательных путей, кроме С-волокон, не изучалось.
Средства от кашля центрального действия, хотя и широко используемые, могут оказывать противокашлевое действие за счет неприятных или невыносимых побочных эффектов у взрослых и серьезных побочных эффектов у детей: побочные эффекты, такие как сонливость, зависимость, потеря сознания, бессонница и затрудненное дыхание [ 2].
Кроме того, недавно была поставлена под сомнение эффективность большинства противокашлевых препаратов, особенно препаратов для лечения ОРВИ; фактически, Американский колледж пульмонологов (ACCP) не рекомендует использовать противокашлевые препараты при ОРВИ [2].
Таким образом, целью настоящего исследования было проведение метаанализа клинических исследований леводропропизина по сравнению с контрольными препаратами для оценки общей сравнительной эффективности леводропропизина у детей и взрослых.
Методы
Поиск литературы и выбор исследований
Был проведен всесторонний систематический поиск литературы в основных научных электронных базах данных (PubMed/MEDLINE, EMBASE и Cochrane Library) с момента их создания в течение мая 2014 г. для выявления оригинальных клинических исследований леводропропизина для лечения кашля у детей и взрослых. Мы искали дополнительные статьи из справочных списков обзорных статей.
Были установлены критерии включения, использованные для отбора исследований априори . Были отобраны только исследования с контролируемым дизайном (по сравнению как с активным контролем, так и с плацебо), включающие детей и взрослых и оценивающие конечные точки эффективности, связанные с исходами от кашля.
Из всех исследований, выявленных с помощью нашего систематического поиска литературы, в общей сложности 7 опубликованных клинических исследований, проведенных с леводропропизином у взрослых или детей, соответствовали критериям приемлемости и были отобраны для нашего метаанализа.
Эти исследования включали 1178 пациентов в общей популяции: четыре исследования включали 789дети и три исследования включали в общей сложности 389 взрослых.
Леводропропизин сравнивали с центральным противокашлевым средством в пяти исследованиях [8–12] и с плацебо в двух исследованиях [13, 14].
Анализ данных
В связи с небольшим количеством клинических исследований среди детей и взрослых и различными клиническими конечными точками результаты эффективности выбранных исследований были стандартизированы для сравнения общей эффективности леводропропизина с контрольными группами. Таким образом, метаанализ был выполнен после стандартизации общих переменных эффективности, оцениваемых как конечные точки в соответствующих исследованиях (т. е. снижение частоты и тяжести кашля и количества ночных пробуждений). Для всех исследований исходная абсолютная средняя дельта рассчитывалась как средние различия между исходными и конечными значениями параметров эффективности в обеих группах с соответствующими (приблизительными) стандартными отклонениями (SD) и числом случаев (N), изученных при отдельном лечении. группы [15]. Стандартизированная средняя дельта рассчитывалась с помощью исходной абсолютной средней дельты (с их SD и N) и указывает долю или кратность унитарных стандартных отклонений, выраженных в стандартизированных единицах [16, 17].
е. снижение частоты и тяжести кашля и количества ночных пробуждений). Для всех исследований исходная абсолютная средняя дельта рассчитывалась как средние различия между исходными и конечными значениями параметров эффективности в обеих группах с соответствующими (приблизительными) стандартными отклонениями (SD) и числом случаев (N), изученных при отдельном лечении. группы [15]. Стандартизированная средняя дельта рассчитывалась с помощью исходной абсолютной средней дельты (с их SD и N) и указывает долю или кратность унитарных стандартных отклонений, выраженных в стандартизированных единицах [16, 17].
Характеристики включенных исследований
Исследование De Blasio et al. [10] было обсервационным, проведенным у 433 детей (средний возраст 6 лет), целью которого была оценка эффективности противокашлевых препаратов в снижении тяжести острого кашля, связанного с ИВДП. Подгруппа из 161 ребенка получала противокашлевое лечение леводропропизином (N = 101) или препаратами, подавляющими центральный кашель (кодеин или клоперастин, N = 60).
В двойном слепом рандомизированном исследовании двух параллельных групп, проведенном Kim et al. [11], эффективность леводропропизина сравнивали с центральным противокашлевым средством декстрометорфаном у 77 детей (средний возраст 3 года) с острым или хроническим бронхитом с нерецидивирующим или слегка рецидивирующим кашлем, получавших лечение в течение 2–3 дней (пероральное введение три раза в день). В двойном слепом, двойном фиктивном, двух параллельных группах рандомизированном исследовании Banderali et al. [8] оценили эффективность леводропропизина по сравнению с дропропизином, вводимым перорально 3 раза в день. в течение 3 дней при лечении непродуктивного кашля у 267 детей (2–14 лет).
Эффективность леводропропизина по сравнению с плацебо в однократной пероральной дозе в течение 4 недель при ночном кашле была исследована Fiocchi et al. в небольшом двойном слепом рандомизированном исследовании у 12 детей с астмой [14]. В двойном слепом, двух параллельных группах, рандомизированном исследовании [12], Luporini et al. оценили эффективность леводропропизина по сравнению с дигидрокодеином (пероральное введение три раза в день в течение 7 дней) при лечении непродуктивного кашля у 140 взрослых с первичным раком легких или метастатическим раком легких. Двойное слепое, двойное фиктивное, параллельные группы, рандомизированное исследование Catena et al. [9] оценивали терапевтическую эффективность левопропизина по сравнению с декстрометрорфаном, вводимым перорально три раза в день. в течение 5 дней у 209 взрослых с умеренным непродуктивным кашлем. Эффективность леводропропизина по сравнению с плацебо (пероральное введение три раза в день в течение 3 дней) в отношении тяжести кашля у 40 взрослых пациентов с бронхитом оценивалась в двойном слепом рандомизированном клиническом исследовании, проведенном Allegra et al. [13]. Основные характеристики опубликованных исследований, оценивающих противокашлевую эффективность леводропропизина по сравнению с контролем у детей и взрослых, обобщены в таблицах 1 и 2 соответственно.
оценили эффективность леводропропизина по сравнению с дигидрокодеином (пероральное введение три раза в день в течение 7 дней) при лечении непродуктивного кашля у 140 взрослых с первичным раком легких или метастатическим раком легких. Двойное слепое, двойное фиктивное, параллельные группы, рандомизированное исследование Catena et al. [9] оценивали терапевтическую эффективность левопропизина по сравнению с декстрометрорфаном, вводимым перорально три раза в день. в течение 5 дней у 209 взрослых с умеренным непродуктивным кашлем. Эффективность леводропропизина по сравнению с плацебо (пероральное введение три раза в день в течение 3 дней) в отношении тяжести кашля у 40 взрослых пациентов с бронхитом оценивалась в двойном слепом рандомизированном клиническом исследовании, проведенном Allegra et al. [13]. Основные характеристики опубликованных исследований, оценивающих противокашлевую эффективность леводропропизина по сравнению с контролем у детей и взрослых, обобщены в таблицах 1 и 2 соответственно.
Полноразмерный стол
Стол 2 Характеристики клинических исследований, сравнивающих леводропропизин с контролем у взрослыхПолноразмерная таблица
Результаты
В таблице 3 показана исходная дельта абсолютного среднего значения (с SD и N), рассчитанная для каждого параметра эффективности (частота кашля, тяжесть кашля и количество ночных пробуждений), оцененных в каждом из соответствующих критериям клинических исследований, оба в группе леводропропизина и в контрольной группе у детей и взрослых пациентов.
Таблица 3 Абсолютная и стандартизированная средняя дельта ( леводропропизин по сравнению с контрольной группой )Полноразмерная таблица
Результаты стандартизации различных переменных эффективности, чтобы сделать их сопоставимыми, также показаны в Таблице 3 как стандартизированная средняя дельта ( с 95% ДИ и p между группами лечения).
Результаты мета-анализа всех стандартизированных параметров, представляющих общую противокашлевую эффективность, показали высокостатистически значимую разницу в эффективности в пользу леводропропизина по сравнению с контрольным лечением (включая средства, подавляющие центральный кашель), с p = 0,0015 (таблица 4). Величина противокашлевого эффекта леводропропизина по сравнению с контрольным лечением у детей и взрослых показана на диаграмме метаанализа общей эффективности (рис. 1).
Таблица 4 Meta — анализ общей противокашлевой эффективности ( леводропропизин по сравнению с контролем )Полноразмерная таблица
Рисунок 1Meta — анализ эффективности леводропропизина по сравнению с контрольной группой в педиатрических и взрослых исследованиях.
Изображение в натуральную величину
Что касается ожидаемых исходов эффективности, леводропропизин превосходил или был равен контролю во всех 7 клинических исследованиях, также достигая статистически значимой разницы (p < 0,05) в 4 исследованиях.
В нашем мета-анализе критерий гетерогенности исхода эффективности не был статистически значимым (p = 0,0534).
Обсуждение
Кашель остается серьезной нерешенной клинической проблемой [2]. Это симптом ряда заболеваний, таких как астма, хроническая обструктивная болезнь легких, ГЭРБ или других состояний неизвестного происхождения [2].
Лечение симптома кашля, независимо от того, известна ли его этиология, также является проблемой даже для самого опытного медицинского работника [1].
Руководство Американского колледжа пульмонологов (ACCP) также рекомендует использовать препараты для подавления периферического кашля, такие как леводропропизин, у взрослых пациентов с кашлем, вызванным острым или хроническим бронхитом, для краткосрочного облегчения симптомов. В этих рекомендациях указано, что леводропропизин, связанный с терапией острого или хронического бронхита, имеет наивысший уровень пользы, в то время как центральные противокашлевые препараты, такие как кодеин и декстрометорфан, демонстрируют более низкий уровень пользы [18].
Недавно Европейское агентство по лекарственным средствам (EMA) начало рассмотрение препаратов, содержащих кодеин, для лечения кашля и простуды у детей. Фактически кодеин превращается в морфин ферментом CYP2D6. Хорошо известно, что некоторые пациенты, определяемые как «сверхбыстрые метаболизаторы CYP2D6», преобразуют кодеин в морфин с большей скоростью, что приводит к повышению уровня морфина в их крови, что приводит к токсическим эффектам, таким как затрудненное дыхание. EMA все еще оценивает имеющиеся данные о соотношении пользы и риска кодеиносодержащих препаратов при их применении у детей при кашле и простуде [19].]. FDA и MHRA рекомендовали не использовать безрецептурные препараты для лечения кашля и простуды в качестве центральных противокашлевых средств у младенцев и детей младшего возраста, а Американская академия педиатрии рекомендовала не использовать декстрометорфан и кодеин для лечения кашля у детей [20].
Большая эффективность леводропропизина по сравнению с центральными противокашлевыми препаратами недавно была продемонстрирована в метаанализе только у детей с кашлем различной этиологии (10).
Этот стандартизированный метаанализ 7 опубликованных клинических исследований, несмотря на некоторые ограничения, в основном связанные с небольшим количеством исследований, включенных в анализ, и различными оцениваемыми переменными эффективности, представляет собой обзор основных сравнительных исследований леводропропизина с точки зрения эффективности как в педиатрических и взрослых условиях, демонстрируя более высокую эффективность леводропропизина.
Выводы
Леводропропизин является эффективным противокашлевым препаратом как у детей, так и у взрослых, показывая статистически значимые лучшие результаты по сравнению с центральными противокашлевыми препаратами с точки зрения общей эффективности в снижении интенсивности кашля, частоты и ночных пробуждений.
Эти положительные результаты особенно важны, учитывая, что леводропропизин является очень хорошо переносимым периферическим противокашлевым препаратом, в то время как средства от кашля центрального действия могут быть связаны с серьезными побочными эффектами, которые ограничивают их использование, тем самым еще больше усиливая благоприятный профиль пользы/риска леводропропизина в лечение кашля.
Ссылки
De Blasio F, Virchow JC, Polverino M, Zanasi A, Behrakis PK, Kilinç G, et al. Лечение кашля: практический подход. Кашель. 2011;7:7.
Артикул ПабМед Центральный пабмед Google Scholar
Дикпинигайтис П.В., Морис А.Х., Бирринг С.С., МакГарви Л., Смит Дж.А., Каннинг Б.Дж. и др. Противокашлевые препараты – прошлое, настоящее и будущее. Pharmacol Rev. 2014;66:468–512.
Артикул КАС пабмед Google Scholar
Насра Дж., Белвизи М.Г. Модуляция функции сенсорного нерва и кашлевого рефлекса: понимание патогенеза заболевания. Фармакол Тер. 2009; 124:354–75.
Артикул КАС пабмед Google Scholar
De Blasio F, Lanata L, Dicpingaitis PV, Saibene F, Balsamo R, Zanasi A.
 Эффективность леводропропизина в педиатрии: метаанализ опубликованных исследований. Тренды Мед. 2013; 13:9–14.
Эффективность леводропропизина в педиатрии: метаанализ опубликованных исследований. Тренды Мед. 2013; 13:9–14.Google Scholar
Дикпинигайтис П.В. Современные и перспективные противокашлевые препараты периферического действия. Респ Физиол Нейробиол. 2006; 152: 356–62.
Артикул КАС Google Scholar
Lavezzo A, Melillo G, Clavenna G, Omini C. Периферический участок действия леводропропизина при экспериментально индуцированном кашле: роль сенсорных нейропептидов. Пульм Фармакол. 1992; 5: 143–147.
Артикул КАС пабмед Google Scholar
Мелилло Г., Маландрино С., Россони Г., Казелли Г., Бестетти А., Борса М. и др. Общая фармакология нового противокашлевого леводропропизина. Арцнаймиттельфоршун. 1998; 38:1144–50.
Google Scholar
«>Catena E, Daffonchio L. Эффективность и переносимость леводропропизина у взрослых пациентов с непродуктивным кашлем, сравнение с декстрометорфаном. Пульм Фармакол Тер. 1997;10(2):89–96.
Артикул КАС пабмед Google Scholar
Де Блазио Ф., Дикпинигайтис П.В., Де Даниэли Г., Ланата Л., Занаси А. Эффективность леводропропизина при кашле у детей. Пульм Фармакол Тер. 2012;25:337–42.
Артикул пабмед Google Scholar
Kim DS, Sohn MHMD, Jang GC. Леводропропизин у детей с бронхитом. Диагноз Лечить. 2002; 22:9.
Google Scholar
«>Allegra L, Bossi R. Клинические испытания нового противокашлевого леводропропизина у взрослых пациентов с бронхитом. Арцнаймиттельфоршунг. 1988;38(8):1163–6.
КАС пабмед Google Scholar
Fiocchi A, Arancio R, Murgo P, Banderali G. Эффективность леводропропизина при ночном кашле у детей-астматиков. Евр Рес Дж. 1991;4(14):594.
Google Scholar
Саттон А.Дж., Абрамс К.Р., Джонс Д.Р., Шелдон Т.А., Сонг Ф. Методы метаанализа в медицинских исследованиях. Чичестер, Великобритания: John Wiley & Sons Ltd.
 ; 2000.
; 2000.Google Scholar
Армитидж П., Берри Г., Мэтьюз Дж.Н.С. Статистические методы в медицинских исследованиях. 4-е изд. Оксфорд, Англия: Blakwell Scientific Publications; 2002.
Книга Google Scholar
Хеджес Л.В., Олкин И. Статистические методы метаанализа. Нью-Йорк: Академическая пресса; 1985.
Google Scholar
Американская академия педиатрии. Комитет по наркотикам: Использование кодеина и декстрометорфан-содержащих средств от кашля у детей. Педиатрия. 1997; 99: 918–20.
Артикул Google Scholar
Начало обзора препаратов, содержащих кодеин, при применении при кашле и простуде у детей .
Irwin RS, Baumann MH, Bolser DC , Boulet LP, Braman SS, Brightling CE и др.
 Американский колледж пульмонологов (ACCP): Диагностика и лечение кашля. Резюме: Руководство по клинической практике ACCP, основанное на фактических данных. Грудь. 2006; 129:1С–23С.
Американский колледж пульмонологов (ACCP): Диагностика и лечение кашля. Резюме: Руководство по клинической практике ACCP, основанное на фактических данных. Грудь. 2006; 129:1С–23С.Артикул ПабМед Центральный пабмед Google Scholar
Бандерали Г., Рива Э., Фиокки А., Кордаро К.И., Джованнини. Эффективность и переносимость леводропропизина и дропропизина у детей с непродуктивным кашлем. J Int Med Res. 1995;23:175–83
Luporini G, Barni S, Marchi E, Daffonchio L. Эффективность и безопасность леводропропизина и дигидрокодеина при непродуктивном кашле при первичном и метастатическом раке легкого. Eur Res J. 1998;12(1):97–101.
Артикул КАС Google Scholar
Ссылки на скачивание
Благодарности
Авторы хотели бы поблагодарить Б. Чайна, Д. Феррари (Ibis Informatica srl) за статистическую поддержку.
Информация о авторе
Авторы и принадлежности
Пневмология Отдел Университета Болонья, С. Орсола Мальпиги больница, Болонья, Италия
, Florsandro Zanasi
University Careggi, Flor0006
Medical Department, Dompé SPA, Milan, Italy
Luigi Lanata & Federico Saibene
Respiratory Medicine and Pulmonary Rehabilitation Section, Clinic Center, Private Hospital, Naples, Italy
Francesco De Blasio
Department Медицинский колледж Альберта Эйнштейна и Медицинский центр Монтефиоре, Бронкс, штат Нью-Йорк, США
Peter Dicpinigaitis
Авторы
- Alessandro Zanasi
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Luigi Lanata
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Giovanni Fontana
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Федерико Сайбене
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Peter Dicpinigaitis
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Francesco De Blasio
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за переписку
Связь с
Алессандро Занаси.
Дополнительная информация
Конкурирующие интересы
Ланата и Сайбене являются сотрудниками медицинского отдела Dompé SpA. Dompé SpA — компания, которая производит и продает леводропропизин. Дикпинигайтис работал консультантом Dompe. Де Блазио был членом Международной консультативной группы, поддерживаемой неограниченным образовательным грантом Dompé SpA. Кроме того, он получил гонорары за выступления от Dompé SpA на национальных и международных встречах. Джованни Фонтана получил исследовательские гранты или гонорары от Menarini, Edmond Pharma, Dompé Vertona Pharma, AMD.
Вклад авторов
Все авторы выполнили обзор литературы. Все авторы выполнили черновой вариант статьи. Все авторы прочитали и одобрили окончательный вариант рукописи.
Права и разрешения
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by/4.0), которая разрешает неограниченное использование, распространение и воспроизведение в любых средний, при условии, что оригинальная работа правильно указана.

 обращений
обращений Эффективность леводропропизина в педиатрии: метаанализ опубликованных исследований. Тренды Мед. 2013; 13:9–14.
Эффективность леводропропизина в педиатрии: метаанализ опубликованных исследований. Тренды Мед. 2013; 13:9–14. ; 2000.
; 2000. Американский колледж пульмонологов (ACCP): Диагностика и лечение кашля. Резюме: Руководство по клинической практике ACCP, основанное на фактических данных. Грудь. 2006; 129:1С–23С.
Американский колледж пульмонологов (ACCP): Диагностика и лечение кашля. Резюме: Руководство по клинической практике ACCP, основанное на фактических данных. Грудь. 2006; 129:1С–23С.